[0001] Данная заявка заявляет приоритет предварительной заявки на патент США с серийным номером 62/773132, поданной 29 ноября 2018 г., которая полностью включена в настоящую заявку посредством ссылки.
Предпосылки создания изобретения
1. Область техники, к которой относится изобретение
[0002] Настоящее изобретение в целом относится к области клеточной биологии, молекулярной биологии, иммунологии и медицины. В частности, это касается способов экспансии естественных клеток-киллеров (NK) и их применения.
2. Описание предшествующего уровня техники
[0003] Естественные киллерные (NK) клетки оказываются перспективным источником клеточной иммунотерапии для пациентов с несколькими различными гематологическими злокачественными новообразованиями и солидными опухолями; однако большинство исследований с использованием адоптивно перенесенных NK-клеток было ограничено необходимостью в аутологичном доноре, совместимом по человеческому лейкоцитарному антигену (HLA), или идентичном по гаплотипу доноре; длительными и сложными процедурами экспансии; недостаточной стойкостью и плохим размножением инфузированных клеток in vivo; и разочаровывающей противоопухолевой активностью.
[0004] Идеальный источник клеток для генерации NK-клеток еще недостаточно изучен. Чаще всего используются NK-клетки периферической крови (PB-NK-клетки) от пациента (т.е. аутологичные) или от взрослых аллогенных доноров; однако этот подход требует совместимости согласного донора минимум по 3 из 6 HLA молекул с реципиентом для прохождения лейкафереза. Другим недостатком взрослых PB NK-клеток является субоптимальная пролиферация и устойчивость in vivo после адоптивного переноса. Таким образом, пуповинная кровь (CB) является привлекательным источником гематопоэтических клеток для генерации NK-клеток, учитывая большой глобальный запас более миллиона единиц CB, замороженных и готовых к использованию в банках CB по всему миру.
[0005] Было показано, что CB-NK-клетки обладают присущими им свойствами, которые делают их превосходящими NK-клетки, размноженные из периферической крови для адоптивной терапии, включая более высокую экспрессию генов, связанных с клеточным циклом, делением клеток и репликацией ДНК. Препятствием для широкого использования CB является сложность размножения функциональных NK-клеток из замороженных CB единиц в клинически значимых дозах. Таким образом, существует неудовлетворенная потребность в улучшенных способах экспансии NK-клеток из CB.
Сущность изобретения
[0006] В одном варианте осуществления настоящее изобретение обеспечивает ex vivo способ экспансии естественных клеток-киллеров (NK), включающий: стимуляцию мононуклеарных клеток (MNC) из пуповинной крови в присутствии антигенпрезентирующих клеток (APC) и IL-2; и повторную стимуляцию клеток при помощи APC с получением размноженных NK-клеток, при этом по меньшей мере в некоторых случаях способ осуществляют в биореакторе. Стадия стимуляции может направить MNC на NK-клетки. Стадия повторной стимуляции может включать или не включать присутствие IL-2. В конкретных аспектах способ не включает удаление или добавление любых компонентов среды на стадии стимуляции. В конкретных аспектах способ осуществляют в течение определенного периода времени, такого как меньше чем 15 дней, например в течение 14 дней.
[0007] В определенном варианте осуществления настоящее изобретение обеспечивает ex vivo способ экспансии естественных клеток-киллеров (NK), включающий: (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляцию MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторную стимуляцию клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, и он соответствует правилам производства и контроля качества лекарственных средств (GMP). Стимуляция стадии (b) может направить MNC на NK-клетки. Стадия (c) может включать или не включать присутствие IL-2. В конкретных аспектах способ не включает удаление или добавление любых компонентов среды на стадии (b). В конкретных аспектах способ осуществляют в течение меньше чем 15 дней, например в течение 14 дней.
[0008] В некоторых аспектах способ дополнительно включает истощение клеток, положительных в отношении одного или нескольких конкретных маркеров, таких как CD3, например. В некоторых аспектах стадию истощения осуществляют между стадиями (b) и (c). В некоторых аспектах клетки удаляют из биореактора для CD3 истощения и помещают в биореактор для стадии (c).
[0009] В некоторых аспектах получение исходной популяции MNC из пуповинной крови включает размораживание пуповинной крови в присутствии декстрана, человеческого сывороточного альбумина (HSA), ДНКазы и/или хлорида магния. В конкретных аспектах получение исходной популяции MNC из пуповинной крови включает размораживание пуповинной крови в присутствии декстрана и/или ДНКазы. В конкретных аспектах пуповинную кровь промывают в присутствии 5-20%, например 10%, декстрана. В некоторых аспектах пуповинную кровь суспендируют в присутствии хлорида магния, например при концентрации 100-300 мМ, в частности 200 мМ. В некоторых аспектах получение включает осуществление центрифугирования в градиенте плотности фиколла с получением мононуклеарных клеток (MNC).
[0010] В некоторых аспектах биореактор представляет собой газопроницаемый биореактор. В конкретных аспектах газопроницаемый биореактор представляет собой G-Rex100M или G-Rex100. В некоторых аспектах стимуляцию стадии (b) осуществляют в 3-5 л среды, например 3, 3,5, 4, 4,5 или 5 л.
[0011] В некоторых аспектах APC подвергаются гамма-облучению. В некоторых аспектах APC сконструированы для экспрессии мембраносвязанного IL-21 (mbIL-21). В конкретных аспектах APC сконструированы для экспрессии IL-21, IL-15, и/или IL-2. В некоторых аспектах MNC и APC культивируют при соотношении 1:2. В некоторых аспектах IL-2 присутствует при концентрации 50-200 МЕ/мл, такой как 100 МЕ/мл. В конкретных аспектах IL-2 пополняют через каждые 2-3 дня.
[0012] В конкретных аспектах стадию (b) осуществляют в течение 6-8 дней, например 7 дней. В некоторых аспектах стадию (c) осуществляют в течение 6-8 дней, например 7 дней. В некоторых аспектах стадия (c) не включает расщепление клеток. В конкретных аспектах к клеткам два раза добавляют IL-2 на стадии (c), и в особых случаях никакие другие компоненты среды не добавляются и не удаляются на стадии (c).
[0013] В некоторых аспектах способ включает использование 3, 4, 5 или 6 биореакторов. В конкретных аспектах способ включает использование менее 10 биореакторов.
[0014] В конкретных аспектах NK-клетки размножаются по меньшей мере 500-кратно, 800-кратно, 1000-кратно, 1200-кратно, 1500-кратно, 2000-кратно, 2500-кратно, 3000-кратно или 5000-кратно. В конкретных аспектах культивирование NK-клеток в биореакторе дает более чем 1000-кратное количество NK-клеток по сравнению с статической жидкой культурой.
[0015] В некоторых аспектах способ не включает типирование человеческих лейкоцитарных антигенов (HLA). В некоторых аспектах исходную популяцию NK-клеток получают от не идентичного по гаплотипу донора.
[0016] В некоторых аспектах размноженные NK-клетки обладают повышенной противоопухолевой активностью по сравнению с NK-клетками, размноженными из периферической крови. В некоторых аспектах размноженные NK-клетки имеют более высокую экспрессию одного или нескольких генов клеточного цикла, одного или нескольких генов клеточного деления и/или одного или нескольких генов репликации ДНК, по сравнению с NK-клетками, размноженными из периферической крови. В некоторых аспектах размноженные NK-клетки имеют более высокий пролиферативный потенциал по сравнению с NK-клетками, размноженными из периферической крови. В некоторых аспектах размноженные NK-клетки не демонстрируют истощения. В некоторых аспектах истощение определяют путем измерения экспрессии перфорина, гранзима, CD57, KLRG1 и/или PD1. В некоторых аспектах размноженные NK-клетки имеют высокую экспрессию перфорина и/или гранзима. В некоторых аспектах размноженные NK-клетки имеют низкую или отсутствие экспрессии CD57, KLRG1 и/или PD1.
[0017] В некоторых аспектах размноженные NK-клетки включают клинически релевантную дозу. В некоторых аспектах пуповинная кровь представляет собой замороженную пуповинную кровь. В конкретных аспектах замороженная пуповинная кровь была протестирована для одного или нескольких инфекционных заболеваний, таких как гепатит A, гепатит B, гепатит C, Trypanosoma cruzi, ВИЧ, T-лимфотропный вирус человека, сифилис, вирус зика и т.п. В некоторых аспектах пуповинная кровь представляет собой объединенную пуповинную кровь, например из 3, 4, 5, 6, 7 или 8 отдельных единиц пуповинной крови.
[0018] В некоторых аспектах NK-клетки не являются аутологичными, например по отношению к конкретному реципиенту. В некоторых аспектах NK-клетки не являются аллогенными, например по отношению к конкретному реципиенту.
[0019] В некоторых аспектах APC представляют собой универсальные антигенпрезентирующие клетки (uAPC). В некоторых аспектах uAPC сконструированы для экспрессии (1) CD48 и/или CS1 (CD319), (2) мембраносвязанного интерлейкина-21 (mbIL-21) и (3) 41BB лиганда (41BBL). В некоторых аспектах uAPC экспрессируют CD48. В некоторых аспектах uAPC экспрессируют CS1. В конкретных аспектах uAPC экспрессируют CD48 и CS1. В некоторых аспектах uAPC по существу не экспрессируют эндогенные молекулы HLA класса I, II и/или CD1d. В некоторых аспектах uAPC экспрессируют ICAM-1 (CD54) и/или LFA-3 (CD58). В конкретных аспектах uAPC также определены как происходящие из лейкозных клеток aAPC, таких как K562 клетки.
[0020] В дополнительных аспектах способ также включает криоконсервирование размноженных NK-клеток.
[0021] Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую популяцию NK-клеток, полученную с использованием вариантов осуществления (например, (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляция MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторная стимуляция клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, и он соответствует правилам GMP), и фармацевтически приемлемый носитель.
[0022] Еще один вариант осуществления обеспечивает композицию, включающую эффективное количество NK-клеток, полученных с использованием вариантов осуществления (например, (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляция MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторная стимуляция клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, и он соответствует правилам GMP) для применения в лечении заболевания или расстройства у субъекта.
[0023] Еще один вариант осуществления обеспечивает применение композиции, содержащей эффективное количество NK-клеток, полученных с использованием вариантов осуществления (например, (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляция MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторная стимуляция клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, и он соответствует правилам GMP) для лечения иммуноопосредованного расстройства у субъекта.
[0024] Еще в одном варианте осуществления обеспечивается способ лечения заболевания или расстройства, включающий введение субъекту эффективного количества размноженных NK-клеток в соответствии с вариантами осуществления (например, (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляция MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторная стимуляция клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, и он соответствует правилам GMP).
[0025] В дополнительных аспектах способ также включает введение химиотерапии. В некоторых аспектах химиотерапию вводят до введения размноженных NK-клеток. В конкретных аспектах химиотерапи является миелоаблативной. В других аспектах химиотерапия не является миелоаблативной. В некоторых аспектах химиотерапи представляет собой лимфоистощающую химиотерапию. В конкретных аспектах лимфоистощающая химиотерапия представляет собой лимфоистощающую химиотерапию на основе флударабина. В конкретных аспектах химиотерапия представляет собой леналидомид.
[0026] В конкретных аспектах способ не включает осуществления HLA-типирования. В конкретных аспектах у субъекта не развивается болезнь «трансплантат против хозяина» или другая токсичность.
[0027] В некоторых аспектах заболевани или расстройств представляет собой иммуноопосредованное расстройство. В некоторых аспектах иммуноопосредованное расстройство представляет собой аутоиммунное расстройство, болезнь «трансплантат против хозяина», отторжение аллотрансплантата или воспалительное состояние. В некоторых аспектах заболевание или расстройство представляет собой рак, такой как множественная миелома.
[0028] В дополнительных аспектах способ также включает введение по меньшей мере еще одного терапевтического средства. В некоторых аспектах по меньшей мере еще одно терапевтическое средство включает химиотерапию, иммунотерапию, хирургическую операцию, лучевую терапию или биотерапию. В некоторых аспектах NK-клетки и/или по меньшей мере еще одно терапевтическое средство вводят внутривенно, интраперитонеально, интратрахеально, интратуморально, внутримышечно, эндоскопически, внутриочагово, чрескожно, подкожно, регионарно или путем прямой инъекции или перфузии.
[0029] Другие цели, особенности и преимущества настоящего изобретения станут очевидными из следующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, хотя они представляют предпочтительные варианты осуществления изобретения, даны только для иллюстрации, поскольку различные изменения и модификации в рамках сущности и объема изобретения станут очевидны для квалифицированных специалистов в данной области техники из этого подробного описания.
Краткое описание чертежей
[0030] Следующие чертежи составляют часть настоящего описания и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Способы и композиции по настоящему изобретению можно лучше понять при обращении к одному или нескольким из этих чертежей в сочетании с подробным описанием конкретных вариантов осуществления, представленных в настоящей заявке.
[0031] Фиг. 1A-1E: Более высокая экспрессия генов, связанных с клеточной пролиферацией (Фиг. 1A), клеточной активацией (Фиг. 1B), клеточной адгезией (Фиг. 1C), клеточным циклом (Фиг. 1D) и репликациией ДНК (Фиг. 1E), в NK-клетках пуповинной крови (CB) по сравнению с периферической кровью (PB).
[0032] Фиг. 2: CB NK-клетки имеют более высокий пролиферативный потенциал по сравнению с PB-NK-клетками.
[0033] Фиг. 3: Быстро ex vivo размноженные CB NK-клетки (RE-CB NK-клетки) не демонстрируют фенотипических признаков истощения.
[0034] Фиг. 4: RE-CB NK-клетки индуцируют устойчивую противоопухолевую активность в иммунодефицитной мышиной модели множественной миеломы (MM), как показывают данные BLI визуализации (правая панель) и выживаемости (левая панель).
Описание иллюстративных вариантов осуществления
[0035] В некоторых вариантах осуществления настоящее изобретение обеспечивает способы для ex vivo экспансии NK-клеток. Способы по настоящему изобретению обеспечивают протокол устойчивой и быстрой экспансии для получения высокофункциональных NK-клеток в соответствии с правилами производства и контроля качества лекарственных средств (GMP), из CB единиц, таких как замороженные CB единицы. Таким образом, настоящие способы можно осуществлять без живого донора. Устойчивые NK-клетки также могут быть получены из свежих или замороженных клеток периферической крови. Способ может включать экспансию в присутствии антигенпрезентирующих клеток (APC), таких как универсальные антигенпрезентирующие клетки (uAPC), которые могут обладать или не обладать способностями к специфической в отношении NK-клеток экспансии. Быстро размноженные ex vivo NK-клетки CB (NK-клетки RE-CB) можно вводить инфузией в свежем виде, или они могут быть криоконсервированы с использованием оптимизированных условий, чтобы их можно было использовать позднее. Важно отметить, что способ обеспечивает крупномасштабную экспансию NK-клеток при клинических дозах.
[0036] Размножение NK-клеток можно осуществлять в закрытой системе, такой как биореактор. Настоящие исследования показали, что CB-NK клетки могут быть получены с более надежной и устойчивой экспансией, например более чем 1000-кратной, чем в статических жидких культуральных системах.
[0037] В некоторых аспектах представленная процедура, соответствующая GMP, включает использование конкретных условий культивирования, которые были оптимизированы для первой и второй недель культивирования NK-клеток. Увеличение объема среды и, таким образом, снижение концентрации клеток в культурах имело впечатляющий эффект на величину экспансии, время и логистику, необходимые для осуществления культивирования, а также стоимость процедуры. Как показано в Таблице 2A для первых семи дней культивирования и в Таблице 2B для второй недели культивирования, значительно лучшее кратное увеличение экспансии достигается при большем объеме среды и сниженной концентрации клеток (G-Rex100M) по сравнению с меньшим количеством среды и более высокой концентрацией клеток (G-Rex100). Меньшее количество биореакторов необходимо для оптимизированной процедуры, и меньше клеток необходимо для генерации такой же или более высокой дозы NK-клеток. Это показано, например, в день 7, когда требовалось в четыре раза меньше клеток для засева каждой G-Rex 100M для достижения той же дозы. В день 0-7 не требуется никакого вмешательства в культуры, например, никакой подпитки клеток, как в предыдущих методах. При оптимизированной процедуре в дни 7-14 клетки не требуют разделения, а только подпитки два раза (хотя в альтернативных вариантах их подпитывают один, три или четыре или более раз). Используют меньше среды и цитокинов, а также требуется меньше времени для технолога, что экономит деньги и улучшает логистику. Важно отметить, что в дни 7-14 культивирования требуется минимальное вмешательство (например, только IL2 добавляется дважды), что не только экономит технологическое время, но и значительно снижает вероятность микробного заражения. Это контрастирует с существующими процедурами экспансии NK-клеток, которые используются сегодня, когда культуры часто разделяют через день с многократной подпиткой, что увеличивает риск микробного заражения. Как показано в Таблице 2C, оптимизированный подход сокращает технологическое время на 29%.
[0038] Настоящие исследования показали, что быстро размноженные ex vivo CB NK-клетки (RE-CB NK) можно безопасно вводить путем инфузии без какой-либо токсичности или риска реакции «трансплантат против хозяина» даже в отсутствие какой-либо HLA-совместимости. Также было показано, что введение химиотерапии, такой как миелоаблативная, немиелоаблативная или пониженной интенсивности, с использованием или без терапии спасения стволовыми клетками или лимфодеплецирующей химиотерапии, до инфузии RE-CB NK-клеток промотирует рост и активацию CB-NK-клеток in vivo, связанные с регрессией опухоли на животных моделях опухоли, а также у пациентов. Таким образом, эти клетки представляют собой действительно «пригодный к использованию» иммунотерапевтический продукт, обеспечивающий максимальную гибкость для пациентов, которым может потребоваться дополнительная терапия перед инфузией.
[0039] Соответственно, настоящее изобретение также обеспечивает способы лечения рака, такого как гематологические злокачественные новообразования и солидные опухоли. Лечение может включать введение NK-клеток с химиотерапией, такой как миелоаблативная, немиелоаблативная или с пониженной интенсивностью, с использованием или без терапии спасения стволовыми клетками или лимфодеплецирующей химиотерапии. Химиотерапию можно вводить до инфузии NK-клеток. NK-клетки можно вводить в сочетании с терапиями, нацеленными на рецепторы NK-клеток, такие как CD16, для перенаправления клеток на мишень, таким образом увеличивая ответ против различных опухолей. Терапия, нацеленная на рецепторы NK-клеток, такие как CD16, может представлять собой моноклональные антитела, биспецифические антитела или триспецифические антитела. В определенных случаях NK-клетки не комбинируют с химиотерапией и/или другими иммунотерапиями.
I. Определения
[0040] В контексте настоящей заявки термин «по существу не содержит» в отношении указанного компонента используется для обозначения того, что ни один из указанных компонентов не был целенаправленно включен в композицию и/или присутствует только в виде загрязняющего вещества или в следовых количествах. Таким образом, общее количество указанного компонента в результате любого непреднамеренного загрязнения композиции значительно ниже 0,05%, предпочтительно ниже 0,01%. В определенных случаях существует композиция, в которой количество указанного компонента не может быть обнаружено стандартными аналитическими методами.
[0041] В контексте настоящей заявки артикли «a» или «an» могут означать один или несколько. При использовании в формуле изобретения, когда они используются вместе со словом «включающий», «а» или «an» могут означать один или несколько.
[0042] Использование термина «или» в формуле изобретения используют для обозначения «и/или», если явно не указано, что он относится только к альтернативам или альтернативы являются взаимоисключающими, хотя раскрытие поддерживает определение, которое относится только к альтернативам и «и/или». В контексте настоящей заявки термин «еще один» может означать по меньшей мере еще один или более. Термины «около», «по существу» и «приблизительно» означают, как правило, указанное значение плюс или минус 5%.
[0043] «Иммунное расстройство» или «иммуноопосредованное расстройство» относится к расстройству, при котором иммунный ответ играет ключевую роль в развитии или прогрессировании заболевания. Иммуноопосредованные расстройства включают аутоиммунные расстройства, отторжение аллотрансплантата, болезнь «трансплантат против хозяина», а также воспалительные и аллергические состояния.
[0044] «Лечение» или лечение заболевания или состояния относится к выполнению протокола, который может включать введение пациенту одного или нескольких лекарственных средств с целью облегчения признаков или симптомов заболевания. Желательные эффекты лечения включают снижение скорости прогрессирования заболевания, улучшение или облегчение болезненного состояния, а также ремиссию или улучшенный прогноз. Облегчение может произойти до появления признаков или симптомов заболевания или состояния, а также после их появления. Таким образом, «лечащий» или «лечение» может включать «предотвращение» или «профилактику» заболевания или нежелательного состояния. Кроме того, «лечащий» или «лечение» не требует полного облегчения признаков или симптомов, не требует излечения и, в частности, включает протоколы, которые имеют лишь незначительный эффект на пациента.
[0045] Термин «терапевтическая польза» или «терапевтически эффективный», в контексте настоящей заявки относится ко всему, что способствует или улучшает благополучие субъекта в отношении медицинского лечения этого состояния. Это включает, помимо прочего, снижение частоты или тяжести признаков или симптомов заболевания. Например, лечение рака может включать, например, уменьшение размера опухоли, снижение инвазивности опухоли, снижение скорости роста рака или предотвращение метастазирования. Лечение рака может также относиться к продлению выживаемости субъекта с раком.
[0046] «Субъект» и «пациент» относятся либо к человеку, либо к отличным от человека животным, например приматам, млекопитающим и позвоночным. В конкретных вариантах осуществления субъект представляет собой человека.
[0047] Фраза «фармацевтически или фармакологически приемлемый» относится к химическим соединениям и композициям, которые не вызывают неблагоприятных, аллергических или других нежелательных реакций при введении животному, например человеку, в зависимости от ситуации. Получение фармацевтической композиции, содержащей антитело или дополнительный активный ингредиент, будет известно специалистам в данной области в свете настоящего раскрытия. Кроме того, должно быть понятно, что для введения животным (например, человеку) препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, как того требует Управление биологических стандартов FDA частности, включает протоколы, которые имеют лишь незначительный эффект на пациента.
[0045] Термин «терапевтическая польза» или «терапевтически эффективный», в контексте настоящей заявки относится ко всему, что способствует или улучшает благополучие субъекта в отношении медицинского лечения этого состояния. Это включает, помимо прочего, снижение частоты или тяжести признаков или симптомов заболевания. Например, лечение рака может включать, например, уменьшение размера опухоли, снижение инвазивности опухоли, снижение скорости роста рака или предотвращение метастазирования. Лечение рака может также относиться к продлению выживаемости субъекта с раком.
[0046] «Субъект» и «пациент» относятся либо к человеку, либо к отличным от человека животным, например приматам, млекопитающим и позвоночным. В конкретных вариантах осуществления субъект представляет собой человека.
[0047] Фраза «фармацевтически или фармакологически приемлемый» относится к химическим соединениям и композициям, которые не вызывают неблагоприятных, аллергических или других нежелательных реакций при введении животному, например человеку, в зависимости от ситуации. Получение фармацевтической композиции, содержащей антитело или дополнительный активный ингредиент, будет известно специалистам в данной области в свете настоящего раскрытия. Кроме того, должно быть понятно, что для введения животным (например, человеку) препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, как того требует Управление биологических стандартов FDA.

[0048] В контексте настоящей заявки термин «фармацевтически приемлемый носитель» включает любые и все водные растворители (например, воду, спиртовые/водные растворы, физиологические растворы, парентеральные носители, такие как хлорид натрия, декстроза Рингера и т.д.), неводные растворители (например, пропиленгликоль, полиэтиленгликоль, растительное масло и органические сложные эфиры для инъекций, такие как этилолеат), дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные или противогрибковые агенты, антиоксиданты, хелатирующие агенты и инертные газы), изотонические агенты, агенты, замедляющие абсорбцию, соли, лекарственные средства, стабилизаторы лекарств, гели, связующие, эксципиенты, дезинтегрирующие агенты, лубриканты, подсластители, ароматизаторы, красители, жидкости и пополнители питательных веществ, такие как вещества и их комбинации, которые должны быть известны обычным специалистам в данной области. pH и точная концентрация различных компонентов в фармацевтической композиции регулируются в соответствии с хорошо известными параметрами.
[0049] Термин «гаплотипирование», «HLA-типирование» или «тканевое типирование» относится к методу, используемому для идентификации гаплотипа или типов ткани субъекта, например, путем определения, какой ΗLA локус (или локусы) экспрессируется на лимфоцитах конкретного субъекта. Однако в конкретных вариантах осуществления способ не включает типирование человеческих лейкоцитарных антигенов (HLA). Гены ΗLA расположены в главном комплексе гистосовместимости (MΗC), области на коротком плече хромосомы 6, и участвуют в межклеточном взаимодействии, иммунном ответе, трансплантации органов, развитии рака и восприимчивости к болезням. Существует шесть генетических локусов, важных для трансплантации, обозначенных HLA-A, HLA-B, HLA-C и HLA-DR, HLA-DP и HLA-DQ. В каждом локусе может быть несколько разных аллелей. Широко используемый метод гаплотипирования использует полимеразную цепную реакцию (ПЦР) для сравнения ДНК субъекта с известными сегментами генов, кодирующих антигены MHC. Вариабельность этих областей генов определяет тип ткани или гаплотип субъекта. Серологические методы также используются для обнаружения серологически определенных антигенов на поверхности клеток. Детерминанты HLA-A, -B и -C можно измерить известными серологическими методами. Вкратце, лимфоциты субъекта (выделенные из свежей периферической крови) инкубируют с антисывороткой, распознающей все известные антигены HLA. Клетки распределяют в лотке с микроскопическими лунками, содержащими различные виды антисывороток. Клетки инкубируют в течение 30 минут, после чего следует дополнительная 60-минутная инкубация комплемента. Если лимфоциты имеют на своей поверхности антигены, распознаваемые антителами в антисыворотке, лимфоциты лизируются. Можно добавить краситель, чтобы показать изменения проницаемости клеточной мембраны и гибель клеток. Структура клеток, разрушенных лизисом, указывает на степень гистологической несовместимости. Если, например, лимфоциты человека, тестируемого на HLA-A3, разрушаются в лунке, содержащей антисыворотку для HLA-A3, тест является положительным на эту группу антигенов.
[0050] Термин «антигенпрезентирующие клетки (APC)» относится к классу клеток, способных представлять один или несколько антигенов в форме комплекса пептид-MHC, распознаваемого специфическими эффекторными клетками иммунной системы, и тем самым индуцируя эффективный клеточный иммунный ответ против представленного антигена или антигенов. Термин «APC» охватывает интактные целые клетки, такие как макрофаги, B-клетки, эндотелиальные клетки, активированные T-клетки и дендритные клетки, или молекулы, встречающиеся в природе или синтетические, способные представлять антиген, такие как очищенные молекулы MHC класса I, связанные в комплекс с бета2-микроглобулином.
[0051] Термин «функционально закрытая» относится к системе, герметичной для обеспечения стерильности жидкости либо путем герметичного закрытия всей системы, либо путем обеспечения стерильных барьерных фильтров на всех соединениях с системой сбора.
[0052] Термин «биореактор» относится к крупномасштабной системе культивирования клеток, которая обеспечивает клетки питательными веществами и удаляет метаболиты, а также обеспечивает физико-химические условия, способствующие росту клеток, в закрытой стерильной системе. В конкретных аспектах биологические и/или биохимические процессы развиваются в отслеживаемых и контролируемых окружающих и рабочих условиях, например pH, температуры, давления, подачи питательных веществ и удаления отходов. В соответствии с настоящим изобретением, основной класс биореакторов, подходящих для использования в способах по настоящему изобретению, включает биореакторы из полого волокна.
II. Экспансия NK-клеток
[0053] В некоторых аспектах настоящее изобретение относится к экспансии NK-клеток из CB. NK-клетки могут иметь уникальное преимущество, связанное с более высокой экспрессией генов, вовлеченных в регуляцию клеточного цикла, клеточное деление и репликацию ДНК (как показанно на Фиг. 1A-1E). Таким образом, способы по изобретению обеспечивают протокол быстрой и соответствующей GMP экспансии для размножения NK-клеток, происходящих из CB.
[0054] В иллюстративном протоколе единицу пуповинной крови (например, 20% или полную) размораживают и NK-клетки получают путем отделения мононуклеарных клеток с использованием центрифугировани в градиенте плотности фиколла. Промывки можно осуществить после размораживания и после отделения мононуклеарных клеток. Клетки затем инкубируют с IL-2 (100 Ед./мл) и APC, такими как гамма-облученные (100 Гр) aAPC (например, Клон 9 мембраносвязанного IL-21 (mbIL-21) aAPC или uAPC. Соотношение NK-клеток и aAPC может быть 2:1 в биореакторе, таком как G-Rex биореактор. В день 2 клеточную культуру подпитывают IL-2 и контролируют скорость экспансии. В день 6 или 7 CD3+ клетки могут быть истощены, например с использованием колонки Miltenyi XS и сепаратора SuperMACS™. Клетки затем инкубируют с IL-2 (100 Ед./мл) с IL-2 подпиткой и затем собирают в день 14.
[0055] Размораживание можно осуществить в стерильных условиях на водяной бане при 37°C. Среда может включать RPMI 1640 с L-глутамином, среду Клика и человеческую АВ (например, 10%) сыворотку. Промывку можно осуществить центрифугированием при 450 × G в течение 10 минут. Промывочный раствор может включать 0,1-10%, например 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% HSA DPBS, 10% декстрана DPBS, ДНКазу и хлорид магния.
[0056] Отделение мононуклеарных клеток может быть выполнено путем наслоения ровной части промытых клеток CB на фиколл-пак в пробирках. Затем клетки можно центрифугировать и удалить загрязняющий плазму верхний слой и плазму. Клетки можно дополнительно центрифугировать, удалить супернатант и ресуспендировать клетки в среде.
[0057] В конкретных аспектах контроль качества осуществляется на протяжении всего процесса путем подсчета клеток, определения жизнеспособности, химеризма, иммунофенотипирования, стерильности, ПЦР микоплазмы, окрашивания по Граму, эндотоксина, анализа хрома и анализа цитокинов.
[0058] NK-клетки могут быть экспандированы в присутствии сконструированных клеток-фидеров, таких как APC. APC могут экспрессировать лиганды для активации NK костимулирующих молекул и цитокинов. Например, APC могут представлять собой UAPC, которые экспрессируют CD48, CS1, IL-21, IL-2 и/или IL15.
[0059] В некоторых вариантах осуществления NK-клетки получают из пуповинной крови способами, хорошо известными в данной области. В конкретных вариантах осуществления иммунные клетки выделяют из CB, например из объединенной CB. В частности, представленный протокол быстрой экспансии может включать выделение и экспансию NK-клеток из замороженного и размороженной CB единицы или из свежей CB единицы, выбранной из клинического банка CB. CB может состоять из 2, 3, 4, 5, 6, 7, 8, 10 или более единиц. NK-клетки могут быть аутологичными или аллогенными. Выделенные NK-клетки могут соответствовать гаплотипу субъекта, которому вводят клеточную терапию. Однако в конкретных аспектах NK-клетки не являются аутологичными или HLA-совместимыми. NK-клетки могут быть обнаружены при помощи специфических поверхностных маркеров, таких как CD16, CD56 и CD8 у человека.
[0060] В некоторых аспектах исходную популяцию NK-клеток получают путем выделения мононуклеарных клеток с использованием центрифугирования в градиенте плотности фиколла. Культура клеток может быть лишена любых клеток, экспрессирующих CD3, CD14 и/или CD19 клетки, и может быть охарактеризована для определения процентного содержания клеток CD56+/CD3- или NK-клеток.
[0061] Клетки могут быть размножены в присутствии указанных APC, таких как UAPC. Экспансия может происходить в течение примерно 2-30 дней, например 3-20 дней, в частности 12-16 дней, например 12, 13, 14, 15, 16, 17, 18 или 19 дней, в частности примерно 14 дней. NK-клетки и APC могут присутствовать при соотношении около 3:1-1:3, таком как 2:1, 1:1, 1:2, в частности около 1:2. Культура для экспансии может также включать цитокины для промотирования экспансии, такие как IL-2, IL-21 и/или IL-18. Цитокины могут присутствовать при концентрации около 10-500 Ед./мл, такой как 100-300 Ед./мл, в частности около 200 Ед./мл. Можно пополнять уровень цитокинов в культуре для экспансии, например каждые 2-3 дня. APC можно добавить к культуре по меньшей мере еще один раз, например после трансдукции CAR.
[0062] После экспансии NK-клетки можно сразу вводить путем инфузии или можно хранить, например путем криоконсервирования. В некоторых аспектах NK-клетки можно размножать в течение нескольких дней, недель или месяцев ex vivo в виде суммарной популяции за примерно 1, 2, 3, 4, 5 дней.
[0063] Размноженные NK-клетки могут секретировать цитокины типа I, такие как интерферон-γ, фактор некроза опухоли-α и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), которые активируют как врожденные, так и адаптивные иммунные клетки, а также другие цитокины и хемокины. Измерение этих цитокинов можно использовать для определения статуса активации NK-клеток. Кроме того, другие способы, известные в данной области техники для определения активации NK-клеток, можно использовать для характеристики NK-клеток по настоящему изобретению.
А. Биореактор
[0064] NK-клетки можно размножить в функционально закрытой системе, такой как биореактор. Размножение можно осуществить в газопроницаемом биореакторе, таком как устройство для культивирования клеток G-Rex. Биореактор может поддерживать от 1×109 до 3×109 клеток в среднем объеме 450 мл.
[0065] Биореакторы можно сгруппировать по общим категориям, включающим: статические биореакторы, биореакторы с мешалкой, биореакторы с вращающимися стенками, половолоконные биореакторы и биореакторы с прямой перфузией. В биореакторах клетки могут быть свободными или иммобилизованными, засеянные на пористых трехмерных каркасах (гидрогеле).
[0066] Половолоконные биореакторы можно использовать для увеличения массопереноса во время культивирования. Половолоконный биореактор представляет собой трехмерную систему для культивирования клеток, основанную на полых волокнах, которые представляют собой небольшие полупроницаемые капиллярные мембраны, расположенные параллельными рядами с типичным диапазоном отсечки молекулярной массы (MWCO) 10-30 кДа. Эти половолоконные мембраны часто связывают и помещают в трубчатые поликарбонатные оболочки для создания половолоконных картриджей биореакторов. Внутри картриджей, которые также снабжены впускным и выпускным портами, есть два отсека: внутрикапиллярное (IC) пространство внутри полых волокон и экстракапиллярное (EC) пространство, окружающее полые волокна.
[0067] Таким образом, для настоящего описания биореактор может представлять собой половолоконный биореактор. В половолоконных биореакторах клетки могут внедряться в просвет волокон, при этом среда перфузирует внепросветное пространство или, альтернативно, может обеспечивать перфузию газа и среды через полые волокна, при этом клетки растут во внепросветном пространстве.
[0068] Полые волокна должны подходить для доставки питательных веществ и удаления отходов в биореакторе. Полые волокна могут иметь любую форму, например, они могут быть круглыми и трубчатыми или иметь форму концентрических колец. Полые волокна могут состоять из рассасывающейся или не рассасывающейся мембраны. Например, подходящие компоненты полых волокон включают полидиоксанон, полилактид, полиглактин, полигликолевую кислоту, полимолочную кислоту, полигликолевую кислоту/триметиленкарбонат, целлюлозу, метилцеллюлозу, целлюлозные полимеры, сложный эфир целлюлозы, регенерированную целлюлозу, плюроник, коллаген, эластин и их смеси.
[0069] Биореактор можно подготовить перед посевом клеток. Подготовка может включать промывку буфером, например PBS. Подготовка может также включать покрытие биореактора белком внеклеточного матрикса, таким как фибронектин. Затем биореактор можно промыть средой, такой как альфа-МЕМ.
[0070] В конкретных вариантах осуществления в способах по настоящему изобретению используют биореактор GRex. Основание колбы GRex представляет собой газопроницаемую мембрану, на которой находятся клетки. Следовательно, клетки находятся в среде с высоким содержанием кислорода, что позволяет им расти до высокой плотности. Система легко масштабируется и требует менее частых манипуляций с культурой. Колбы GRex совместимы со стандартными инкубаторами для культивирования тканей и клеточным лабораторным оборудованием, что снижает потребность в специализированном оборудовании и капиталовложениях, необходимых для запуска программы адоптивной клеточной терапии (ACT).
[0071] Клетки можно засевать в биореактор при плотности около 100-1000 клеток/см2, например около 150 клеток/см2, около 200 клеток/см2, около 250 клеток/см2, около 300 клеток/см2, например около 350 клеток/см2, например около 400 клеток/см2, например около 450 клеток/см2, например около 500 клеток/см2, например около 550 клеток/см2, например около 600 клеток/см2, например около 650 клеток/см2, например около 700 клеток/см2, например около 750 клеток/см2, например около 800 клеток/см2, например около 850 клеток/см2, например около 900 клеток/см2, например около 950 клеток/см2 или около 1000 клеток/см2. В частности, клетки можно высевать при плотности клеток около 400-500 клеток/см2, например около 450 клеток/см2.
[0072] Общее количество клеток, засеваемых в биореактор, может быть от около 1,0×106 до около 1,0×108 клеток, например от около 1,0×106 до 5,0,0×106, от 5,0×106 до 1,0×107, от 1,0×107 до 5,0×107, от 5,0×107 до 1,0×108 клеток. В конкретных аспектах общее количество клеток, высеваемых в биореактор, составляет от около 1,0×107 до около 3,0×107, например около 2,0×107 клеток.
[0073] Клетки можно засевать в любые подходящие среды для культивирования клеток, многие из которых являются коммерчески доступными. Иллюстративные среды включают DMEM, RPMI, MEM, Среду 199, HAMS и т.п. В одном варианте осуществления среда представляет собой альфа MEM среду, в частности альфа MEM, дополненную L-глутамином. Среда может быть дополнена одним или более из следующих: факторы роста, цитокины, гормоны или B27, антибиотики, витамины и/или низкомолекулярные лекарственные средства. В частности, среда может быть бессывороточной.
[0074] В некоторых вариантах осуществления клетки можно инкубировать при комнатной температуре. Инкубатор может быть увлажненным и иметь атмосферу около 5% CO2 и около 1% O2. В некоторых вариантах осуществления концентрация CO2 может быть в пределах около 1-20%, 2-10% или 3-5%. В некоторых вариантах осуществления концентрация O2 может быть в пределах около 1-20%, 2-10% или 3-5%.
В. Антигенпрезентирующие клетки
[0075] Антигенпрезентирующие клетки, которые включают макрофаги, В-лимфоциты и дендритные клетки, различаются по экспрессии конкретной молекулы MHC. APC интернализируют антиген и повторно экспрессируют часть этого антигена вместе с молекулой MHC на своей внешней клеточной мембране. MHC представляет собой большой генетический комплекс с множеством локусов. Локусы MHC кодируют два основных класса мембранных молекул MHC, называемых MHC класса I и класса II. Т-хелперные лимфоциты обычно распознают антиген, связанный с молекулами МНС класса II, а Т-цитотоксические лимфоциты распознают антиген, связанный с молекулами МНС класса I. У людей MHC называют комплексом HLA, а у мышей - комплексом H-2
[0076] В некоторых случаях aAPC полезны в получении терапевтических композиций и продуктов для клеточной терапии вариантов осуществления. Общее руководство, касающееся получения и применения антигенпрезентирующих систем, см., например, в Патентах США №№ 6225042, 6355479, 6362001 и 6790662; Патентных заявках США №№ 2009/0017000 и 2009/0004142; и Международной публикации № WO2007/103009.
[0077] aAPC системы могут включать по меньшей мере одну экзогенную вспомогательную молекулу. Можно использовать любое подходящее количество и комбинацию вспомогательных молекул. Вспомогательную молекулу можно выбрать из вспомогательных молекул, таких как костимулирующие молекулы и молекулы адгезии. Иллюстративные костимулирующие молекулы включают CD86, CD64 (FcγRI), 41BB лиганд и IL-21. Молекулы адгезии могут включать углевод-связывающие гликопротеины, такие как селектины, трансмембраные связывающие гликопротеины, такие как интегрины, кальций-зависимые белки, такие как кадгерины и однопроходные трансмембранные белки суперсемейства иммуноглобулинов (Ig), такие как молекулы межклеточной адгезии (ICAM), которые промотируют, например, контакт клетка-клетка или клетка-матрикс. Иллюстративные молекулы адгезии включают LFA-3 и ICAM, такие как ICAM-1. Процедуры, способы и реагенты, полезные для выбора, клонирования, получения и экспрессии иллюстративных вспомогательных молекул, включая костимулирующие молекулы и молекулы адгезии, представлены, например, в Патентах США №№ 6225042, 6355479 и 6362001.
С. Универсальные антигенпрезентирующие клетки
[0078] Некоторые варианты осуществления по настоящему изобретению относятся к получению и применению универсальных антигенпрезентирующих клеток (UAPC). UAPC можно использовать для экспансии иммунных клеток, таких как NK-клетки и T-клетки. UAPC могут быть сконструированы для экспрессии мембраносвязанного IL-21 (mbIL-21) и 41BBL (CD137 лиганд).
[0079] UAPC могут быть сконструированы для экспрессии CD137 лиганда и/или мембраносвязанного цитокина. Мембраносвязанный цитокин может представлять собой mIL-21 или mIL-15. В конкретных вариантах осуществления UAPC сконструированы для экспрессии CD137 лиганда и mIL-21. APC могут происходить из раковых клеток, таких как лейкозные клетки. APC могут не экспрессировать эндогенные молекулы HLA класса I, II или CD1d. Они могут экспрессировать ICAM-1 (CD54) и LFA-3 (CD58). В частности, APC могут представлять собой K562 клетки, такие как K562 клетки, сконструированные для экспрессии CD137 лиганда и mIL-21. APC могут быть облученными. Конструирование можно осуществить любым способом, известным в данной области техники, таким как ретровирусная трансдукция.
[0080] Цитокины осуществляют жесткий контроль над всеми классами иммунных клеток (включая NK-клетки), влияя на судьбу клеток, активность и эффективность клеточных ответов. Способность цитокиновой стимуляции активировать NK-клетки подтверждает, что их «естественные» эффекторные функции очень чувствительны к воздействию окружающей среды, и что праймирование может регулировать поведение NK-клеток in vivo.
[0081] Для решения проблемы получения клинически значимых количеств NK-клеток в способах по настоящему изобретению используется интерлейкин (IL-21) в качестве драйвера для экспансии NK-клеток в существующей технологии платформы UAPC. У людей стимуляция NK-клеток посредством IL-10 и IL-21 индуцирует экспрессию NKG2D STAT3-зависимым образом. В то время как рецепторы цитокинов имеют сходные клеточные сигнальные компоненты во многих иммунных клетках, специфическая для NK-клеток сигнализация зависит от связи рецептор IL-21-STAT3 для пролиферации.
[0082] Передача сигналов цитокинов имеет решающее значение для поддержания выживания и пролиферации лимфоцитов. In vivo, введение IL-2 является единственным одобренным FDA методом размножения NK-клеток. IL-15, еще один сильный активатор NK-клеток, проходит фазу I клинических испытаний в качестве возможной альтернативы IL-2, но ожидается, что он будет обладать значительной токсичностью после системного введения. Помимо значительной токсичности, эти цитокины также индуцируют пролиферацию Т-клеток, ограничивая при этом устойчивость NK-клеток. Несмотря на то, что для передачи сигнала используется один и тот же рецептор, рецепторы IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21 обладают различными и специфическими эффектами на разные клетки.
1. Мембраносвязанный IL-21
[0083] В некоторых вариантах осуществления для специфической активации NK-клеток может использоваться IL-21 для продуцирования существующих UAPC. Рецептор IL-21 (IL21R), близкородственный бета-цепи рецептора IL-2, способный передавать сигналы посредством его димеризации с гамма-цепью общего цитокинового рецептора (гамма(c), активируется в активированных NK-клетках человека (клетки, готовые к стимуляции). Хотя IL-21, цитокин типа I, может модулировать функции T-, B- и NK-клеток, авторы изобретения обнаружили, что только человеческие NK-клетки испытывают значительную экспансию за счет активации сигнального пути рецептора IL21 (1000-кратно за 21 день). Напротив, IL21 играет важную роль в сокращении CD8+ve Т-клеток1.
[0084] Передача сигналов IL21R обеспечивается главным образом STAT3, мощным активатором клеточной пролиферации. Связь IL21R-STAT3 управляется IL-21-индуцированным связыванием ДНК STAT3 с GAS и цис-индуцибельными элементами, что подтверждается иммунопреципитацией и вестерн-блоттингом с антифосфотирозиновым антителом2. Молекулярную основу IL21-опосредованной пролиферации можно конкретно проследить до тирозина 510(Y510) на IL21R, который опосредует IL-21-индуцированное фосфорилирование STAT1 и STAT33. Этот механизм подтверждается ослабленными ответами IL-21 у мышей с двойным нокаутом Stat1/Stat3.
[0085] Передача сигналов IL21R важна для цитотоксичности NK. Дефицит человеческого IL21R связан с нарушением цитолиза 51Cr-меченных клеток-мишеней K562, в то время как антитело-зависимая клеточная цитотоксичность не изменяется. Моногенный неэмбриональный летальный дефект (мутация с потерей функции в IL21R) представляет прекрасную возможность для определения и, таким образом, полезен для моделирования, усиления и формирования врожденных цитолитических ответов NK.
[0086] Передача сигналов IL-21 избирательно формирует субпопуляции NK-клеток, даже несмотря на то, что популяции клеток CD56dim и CD56bright несут схожее количество поверхностного IL21R. IL-21-индуцируемое фосфорилирование STAT1 и STAT3 выше в CD56bright по сравнению с CD56dim NK-клетками. Напротив, IL-21 не имеет никакого эффекта на активацию STAT5, путь активации IL-2, который также управляет экспансией Т-клеток. Помимо активации STAT3, передача сигналов IL-21 также включает пути MAPK и PI3K и индуцирует экспрессию генов, отвечающих за врожденный иммунитет, включая IFN-гамма, T-bet, IL-12Rбета2 и IL-18R в NK-клетках, стимулируя их к киллингу опухолевых клеток.
[0087] Для эффективного использования IL-21 можно использовать экспрессию mbIL-21 для концентрации и локализации транс-взаимодействия с IL21R на NK-клетках. Близость к мембране mbIL21 обеспечивает легкую доступность там, где это необходимо, таким образом, он может поддерживать оптимальную пролиферацию клеток без больших количеств и концентраций экзогенно поставляемого IL-21. Совместное культивирование с облученным K562-mb15-41BBL индуцировало в среднем 21,6-кратную экспансию CD56+CD3- NK-клеток периферической крови. Эта экспансия выше по сравнению со стимуляцией только растворимыми цитокинами из общего семейства γc, включая IL-2, IL-12, IL-15, IL-21 по отдельности или в комбинациях. Для сравнения, представленные UAPC могут увеличивать количество NK-клеток по меньшей мере 1000-кратно (3-log) за 14-21 день. Экспрессия mbIL21 на UAPC также может устранить необходимость в экзогенном цитокине клинического типа.
2. 4-1BBL (4-1BB лиганд, CD137 лиганд, CD137L, TNFSF9)
[0088] В дополнение к понятию цитокиновой стимуляции функции NK-клеток, прямые физические взаимодействия с активирующими молекулами в NK-клетках приводят к усиленным клеточным пролиферативным ответам. CD137 (4-1BB) является членом семейства генов рецептора некроза опухоли (TNF-R), который опосредует пролиферацию, дифференцировку и запрограммированную гибель клеток (апоптоз). Сначала был охарактеризован мышиный рецептор, а затем человеческий гомолог, который имеет 60% идентичность на аминокислотном уровне, со значительной консервацией в цитоплазматическом/сигнальном домене. CD137 в основном экспрессируется в активированных Т-клетках и NK-клетках с различными уровнями, обнаруживаемыми в тимоцитах, миелоидных клетках и эндотелиальных клетках в очагах воспаления. Физиологическая передача сигнала CD137 опосредуется через 1) NF-κB, который способствует выживанию за счет активации Bcl-XL, и 2) путь PI3K/ERK1/2, который специфически управляет прогрессией клеточного цикла.
[0089] В активированных NK-клетках CD137 представляет собой цитокин-индуцируемую костимулирующую молекулу, которая, в свою очередь, направляет противоопухолевые ответы в NK-клетках за счет увеличения клеточной пролиферации и секреции IFN-γ. Исследования с использованием мышей с нокаутом CD137L-/- выяснили важность передачи сигналов CD137/CD137L в развитии противоопухолевых иммунных клеток. У мышей с нокаутом CD137-/- частота метастазов опухоли в 4 раза выше, чем у контрольных мышей.
[0090] Лиганд CD137 (CD137L, лиганд 4-1BB), гликопротеин 34 кДа, член суперсемейства TNF, обнаруживается в основном на активированных антигенпрезентирующих клетках (APC), включая B-клетки, макрофаги и дендритные клетки, а также транзиентно экспрессируется на низких уровнях на активированных Т-клетках. CD137L человека только на 36% гомологичен по сравнению с мышиным аналогом10. В соответствии с противоопухолевой эффективностью агонистических антител CD137, связывание CD137L, как было показано, вызывает CTL и противоопухолевую активность.
[0091] Соответственно, представленные UAPC могут быть сконструированы для экспрессии лиганда 4-1BB, физиологического контррецептора CD137 для оптимальной стимуляции.
3. SLAM/CD48
[0092] Помимо кондиционирования цитокинов и костимуляции 4-1BBL, прямые физические взаимодействия между NK и клетками-мишенями также влияют на клеточные ответы, то есть на уничтожение клеток-мишеней. Семейство сигнальных лимфоцитарных активирующих молекул (SLAM, ранее также известных как суперсемейство CD2) гомологичных рецепторов иммуноглобулинов, которые широко экспрессируются и играют критическую роль в иммунной системе, играет особенно важную роль с точки зрения межклеточных взаимодействий.
[0093] Соответственно, UAPC по настоящему изобретению могут экспрессировать один или несколько антигенов семейства SLAM. Члены семейства SLAM включают CD2, CD48, CD58 (LFA-3), CD244 (2B4), CD229 (Ly9), CD319 (CS1 (CD2 подгруппа 1); CRACC (CD2-подобный рецептор-активирующие цитотоксические клетки)) и CD352 (NTB-A (NK-T-B антиген)). В конкретных аспектах UAPC экспрессируют CD48 и/или CS1. NK-клетки экспрессируют по меньшей мере три члена семейства SLAM (SLAMF). Они представляют собой 2B4, NK, Т- и В-клеточный антиген (NTB-A) и CD2-подобный рецептор-активирующие цитотоксические клетки (CRACC), которые распознают свои соответствующие лиганды CD48, NTB-A и CRACC на клетках-мишенях и, возможно, на других NK-клетках. В то время как SLAMF1, 3, 5, 6, 7, 8 и 9 являются гомофильными (самолигандными) рецепторами, SLAMF2 и SLAMF4 являются контррецепторами (гетерофильными) друг другу. Широкий диапазон (три порядка величины) известных гомофильных аффинностей (константа диссоциации, Kd, от <1 мкМ до 200 мкМ) указывает на механистическую основу перекрывающихся, но различающихся, сигнальных механизмов для SLAM гликопротеинов.
Аффинности связывания членов семейства SLAM
[0095] В конкретных вариантах осуществления представленные UAPC сконструированы для экспрессии CD48 для содействия межклеточному взаимодействию для усиления NK-клеточных ответов. CD48 представляет собой гликозилфосфатидилинозитол-заякоренный белок (GPI-AP), обнаруженный на поверхности NK-клеток, T-клеток, моноцитов и базофилов, и участвует в путях адгезии и активации в этих клетках. Несмотря на то, что он не содержит внутриклеточный домен, стимуляция CD48 индуцирует перегруппировку сигнальных факторов в липидных рафтах, Lck-киназную активность и фосфорилирование тирозина. В качестве молекулы адгезии и костимулирующей молекулы, CD48 индуцирует различные эффекты в B- и T-лимфоцитах, NK-клетках, тучных клетках и эозинофилах. В человеческих NK-клетках CD48 является контррецептором для 2B426, важного активатора NK-клеток. Гетерофильное взаимодействие, как считается, конкурирует за CD244 взаимодействие с MHC-I. 2B4/CD48 взаимодействие, таким образом, индуцирует сигналы активации в человеческих NK-клетках, тогда как в мышиных NK-клетках оно посылает ингибиторные сигналы.
[0096] В то время как 2B4-CD48 взаимодействия между клетками одной и той же популяции, т.е. взаимодействия NK-клетка-NK-клетка или взаимодействия T-клетка-T-клетка, приводит к повышенной активации за счет экспрессии CD48 на APC, таких как K562 миелоидная клеточная линия, которая обычно лишена CD48, UAPC могут включать сильный 2B4 сигнальный путь на NK-клетках в транс.
4. SLAM/CS1
[0097] В некоторых вариантах осуществления представленные UAPC сконструированы для экспрессии CS1, другого члена семейства SLAM, в качестве костимулирующей молекулы для включения убивающей способности NK-клеток. В отличие от CD48, который контрсвязывается с 2B4, взаимодействия CS1 являются гомофильными и могут быть охарактеризованы в контексте цис vs транс взаимодействий. Клетки K562, которые обычно не содержат CS1, могут быть сконструированы для экспрессии CS1.
III. Генно-инженерные антигенные рецепторы
[0098] NK-клетки по настоящему изобретению могут быть генетически сконструированы для экспрессии антигенных рецепторов, таких как сконструированные TCR и/или CAR. Например, NK-клетки модифицируют для экспрессии TCR, обладающего антигенной специфичностью в отношении ракового антигена. Множественные CAR и/или TCR, такие как к различным антигенам, могут быть добавлены к NK-клеткам.
[0099] Подходящие способы модификации известны в данной области. См., например, Sambrook and Ausubel, выше. Например, клетки можно трансдуктировать для экспрессии TCR, обладающего антигенной специфичностью в отношении ракового антигена, с использованием методов трансдукции, описанных в Heemskerk et al., 2008, и Johnson et al., 2009.
[00100] Электропорация РНК, кодирующей полноразмерные цепи α и β (или γ и δ) TCR, может использоваться в качестве альтернативы для преодоления долгосрочных проблем с аутореактивностью, вызванной спариванием ретровирусно трансдуцированных и эндогенных цепей TCR. Даже если такое альтернативное спаривание имеет место в стратегии транзиентной трансфекции, возможно генерированные аутореактивные Т-клетки потеряют эту аутореактивность через некоторое время, поскольку введенные α- и β-цепи TCR только транзиентно экспрессируются. Когда экспрессия введенных TCR α и β цепей снижается, остаются только нормальные аутологичные Т-клетки. Это не тот случай, когда полноразмерные цепи TCR вводятся посредством стабильной ретровирусной трансдукции, которая никогда не теряет введенные цепи TCR, вызывая постоянно присутствующую аутореактивность у пациента.
[00101] В некоторых вариантах осуществления клетки включают одну или несколько нуклеиновых кислот, введенных методом генетического конструирования, которые кодируют один или несколько антигенных рецепторов, и генетически сконструированные продукты таких нуклеиновых кислот. В некоторых вариантах осуществления нуклеиновые кислоты являются гетерологичными, т.е. обычно не присутствуют в клетке или образце, полученном из клетки,
В некоторых вариантах реализации нуклеиновые кислоты являются гетерологичными, т.е. обычно не присутствуют в клетке или образце, полученном из клетки, например, полученная из другого организма или клетки, которая, например, обычно не обнаруживаются в клетке, являющейся сконструированный и/или организме, из которого получена такая клетка. В некоторых вариантах осуществления нуклеиновые кислоты не встречаются в природе, такие как нуклеиновая кислота, не встречающаяся в природе (например, химерная).
[00102] В некоторых вариантах осуществления CAR содержит внеклеточный антиген-распознающий домен, который специфически связывается с антигеном. В некоторых вариантах осуществления антиген представляет собой белок, экспрессируемый на поверхности клеток. В некоторых вариантах осуществления CAR представляет собой TCR-подобный CAR, а антиген представляет собой процессированный пептидный антиген, такой как пептидный антиген внутриклеточного белка, который, подобно TCR, распознается на поверхности клетки в контексте молекулы главного комплекса гистосовместимости (MHC).
[00103] Примеры антигенных рецепторов, включая CAR и рекомбинантные TCR, а также способы конструирования и введения рецепторов в клетки, включают такие, которые описаны, например, в публикациях международных патентных заявок №№ WO200014257, WO2013126726, WO2012/129514, WO2014031687, WO2013/166321, WO2013/071154, WO2013/123061, публикациях патентных заявок США №№ US2002131960, US2013287748, US20130149337, Патентах США №№: 6451995, 7446190, 8252592, 8339645, 8398282, 7446179, 6410319, 7070995, 7265209, 7354762, 7446191, 8324353 и 8479118 и в Европейской патентной заявке № EP2537416, и/или описанные в Sadelain et al., 2013; Davila et al., 2013; Turtle et al., 2012; Wu et al., 2012. В некоторых аспектах генетически сконструированные антигенные рецепторы включают CAR, описанный в Патенте США №: 7446190, а также описанные в публикации международной патентной заявки №: WO/2014055668 Al.
А. Химерные антигенные рецепторы
[00104] В некоторых вариантах осуществления CAR включает: a) внутриклеточный сигнальный домен, b) трансмембранный домен и c) внеклеточный домен, включающий антиген-связывающую область.
[00105] В некоторых вариантах осуществления сконструированные антигенные рецепторы включают CAR, включая активирующие или стимулирующие CAR, костимулирующие CAR (см. WO2014/055668) и/или ингибирующие CAR (iCAR, см. Fedorov et al., 2013). CAR, как правило, включают внеклеточный антиген (или лиганд)-связывающий домен, связанный с одним или несколькими внутриклеточными сигнальными компонентами, в некоторых аспектах через линкеры и/или трансмембранный домен(домены). Такие молекулы типично имитируют или аппроксимируют сигнал через естественный антигенный рецептор, сигнал через такой рецептор в комбинации с костимулирующим рецептором и/или сигнал только через костимулирующий рецептор.
[00106] Некоторые варианты осуществления настоящего изобретения относятся к использованию нуклеиновых кислот, включая нуклеиновые кислоты, кодирующие антиген-специфический полипептид CAR, включая CAR, который был гуманизирован для снижения иммуногенности (hCAR), содержащий внутриклеточный сигнальный домен, трансмембранный домен и внеклеточный домен, включающий один или несколько сигнальных мотивов. В некоторых вариантах осуществления CAR может распознавать эпитоп, включающий совместно используемое пространство для одного или нескольких антигенов. В некоторых вариантах осуществления связывающая область может включать определяющие комплементарность области моноклонального антитела, вариабельные области моноклонального антитела и/или его антиген-связывающие фрагменты. В другом варианте эта специфичность происходит от пептида (например, цитокина), который связывается с рецептором.
[00107] Предполагается, что нуклеиновые кислоты CAR человека могут быть человеческими генами, используемыми для усиления клеточной иммунотерапии пациентов-людей. В конкретном варианте осуществления изобретение включает полноразмерную кДНК или кодирующую область CAR. Антиген-связывающие области или домен могут включать фрагмент цепей VH и VL одноцепочечного вариабельного фрагмента (scFv), полученного из конкретного человеческого моноклонального антитела, такого как антитела, описанные в патенте США № 7109304, включенном в настоящую заявку посредством ссылки. Фрагмент также может представлять собой любое количество различных антиген-связывающих доменов человеческого антиген-специфического антитела. В более конкретном варианте осуществления фрагмент представляет собой антиген-специфический scFv, кодируемый последовательностью, оптимизированной для использования человеческих кодонов для экспрессии в человеческих клетках.
[00108] Структура может быть мультимерной, такой как диатело или мультимеры. Мультимеры, скорее всего, образуются путем перекрестного спаривания вариабельной части легкой и тяжелой цепей в диатело. Шарнирная часть конструкции может иметь несколько альтернатив: от полностью делетированной до сохранения первого цистеина, до замены пролина, а не серина, до усечения до первого цистеина. Fc часть может быть делетирована. Этой цели может служить любой белок, который является стабильным и/или димеризуется. Можно использовать только один из Fc доменов, например, домен CH2 или CH3 иммуноглобулина человека. Можно также использовать шарнир, CH2 и CH3 область иммуноглобулина человека, который был модифицирован для улучшения димеризации. Можно также использовать только шарнирную часть иммуноглобулина. Можно также использовать части CD8alpha.
[00109] В некоторых вариантах осуществления нуклеиновая кислота CAR включает последовательность, кодирующую другие костимулирующие рецепторы, такие как трансмембранный домен и модифицированный внутриклеточный сигнальный домен CD28. Другие костимулирующие рецепторы включают, но не ограничиваются этим, один или несколько из CD28, CD27, OX-40 (CD134), DAP10, DAP12 и 4-1BB (CD137). В дополнение к первичному сигналу, инициированному CD3ζ, дополнительный сигнал, обеспечиваемый человеческим костимулирующим рецептором, встроенным в CAR человека, важен для полной активации NK-клеток и может помочь улучшить устойчивость in vivo и терапевтический успех адоптивной иммунотерапии.
[00110] В некоторых вариантах осуществления CAR сконструирован со специфичностью в отношении конкретного антигена (или маркера, или лиганда), такого как антиген, экспрессируемый в конкретном типе клеток, который является мишенью для адоптивной терапии, например маркер рака, и/или антиген, предназначенный для индукции подавляющего ответа, такой как антиген, экспрессируемый на нормальном или не пораженном заболеванием типе клеток. Таким образом, CAR обычно включает в своей внеклеточной части одну или несколько антиген-связывающих молекул, таких как один или несколько антиген-связывающих фрагментов, доменов или частей, или один или несколько вариабельных доменов антитела и/или молекул антитела. В некоторых вариантах осуществления CAR включает антиген-связывающую часть или части молекулы антитела, такие как одноцепочечный фрагмент антитела (scFv), полученный из вариабельной тяжелой (VH) и вариабельной легкой (VL) цепей моноклонального антитела (mAb).
[00111] В некоторых вариантах осуществления химерного антигенного рецептора антиген-специфическая часть рецептора (которая может называться внеклеточным доменом, включающим антиген-связывающую область) включает опухоль-ассоциированный антиген или патоген-специфический антиген-связывающий домен. Антигены включают углеводные антигены, распознаваемые паттерн-распознающими рецепторами, такими как Дектин-1. Опухоль-ассоциированный антиген может быть любого вида при условии, что он экспрессируется на клеточной поверхности опухолевых клеток. Типичные варианты осуществления опухоль-ассоциированных антигенов включают CD19, CD20, карциноэмбриональный антиген, альфафетопротеин, CA-125, MUC-1, CD56, EGFR, c-Met, AKT, Her2, Her3, эпителиальный опухолевый антиген, меланома-ассоциированный антиген, мутантный p53, мутантный ras и т.д. В некоторых вариантах осуществления CAR может коэкспрессироваться с цитокином для улучшения устойчивости, когда имеется низкое количество опухоль-ассоциированного антигена. Например, CAR может коэкспрессироваться с IL-15.
[00112] Последовательность открытой рамки считывания, кодирующая химерный рецептор, может быть получена из источника геномной ДНК, источника кДНК или может быть синтезирована (например, методом ПЦР), или путем комбинации вышеуказанных. В зависимости от размера геномной ДНК и количества интронов может быть желательно использовать кДНК или ее комбинацию, поскольку обнаружено, что интроны стабилизируют мРНК. Кроме того, для стабилизации мРНК дополнительным преимуществом может быть использование эндогенных или экзогенных некодирующих областей.
[00113] Предполагается, что химерная конструкция может быть введена в иммунные клетки в виде «голой» ДНК или в подходящем векторе. Способы стабильной трансфекции клеток электропорацией с использованием голой ДНК известны в данной области. См., например, патент США № 6410319. Голая ДНК обычно относится к ДНК, кодирующей химерный рецептор, содержащийся в плазмидном векторе экспрессии в правильной ориентации для экспрессии.
[00114] Альтернативно, вирусный вектор (например, ретровирусный вектор, аденовирусный вектор, аденоассоциированный вирусный вектор или лентивирусный вектор) можно использовать для введения химерной конструкции в иммунные клетки. Подходящие векторы для использования в соответствии со способом по настоящему изобретению не реплицируются в иммунных клетках. Известно большое количество векторов, основанных на вирусах, где количество копий вируса, поддерживаемого в клетке, достаточно низкое для поддержания жизнеспособности клетки, например, векторы на основе ВИЧ, SV40, EBV, HSV или BPV.
[00115] В некоторых аспектах антиген-специфический связывающий или распознающий компонент связан с одним или несколькими трансмембранными и внутриклеточными сигнальными доменами. В некоторых вариантах осуществления CAR включает трансмембранный домен, слитый с внеклеточным доменом CAR. В одном варианте осуществления используется трансмембранный домен, который естественным образом связан с одним из доменов в CAR. В некоторых случаях трансмембранный домен выбирают или модифицируют путем аминокислотной замены, чтобы избежать связывания таких доменов с трансмембранными доменами того же или других поверхностных мембранных белков, чтобы минимизировать взаимодействия с другими членами рецепторного комплекса.
[00116] Трансмембранный домен в некоторых вариантах осуществления происходит либо из природного, либо из синтетического источника. Если источник является природным, домен в некоторых аспектах происходит из любого мембраносвязанного или трансмембранного белка. Трансмембранные области включают области, происходящие из (т.е. которые содержат по меньшей мере трансмембранную область (области)) альфа-, бета- или зета цепи Т-клеточного рецептора, CD28, CD3-зета, CD3-эпсилон, CD3-гамма, CD3-дельта, CD45, CD4, CD5, CD8, CD9, CD 16, CD22, CD33, CD37, CD64, CD80, CD86, CD 134, CD137, CD154, ICOS/CD278, GITR/CD357, NKG2D и DAP молекул. Альтернативно трансмембранный домен в некоторых вариантах осуществления является синтетическим. В некоторых аспектах синтетический трансмембранный домен содержит преимущественно гидрофобные остатки, такие как лейцин и валин. В некоторых аспектах триплет фенилаланина, триптофана и валина будет обнаружен на каждом конце синтетического трансмембранного домена.
[00117] В некоторых вариантах осуществления платформенные технологии, раскрытые в настоящей заявке для генетической модификации иммунных клеток, таких как NK-клетки, включают (i) перенос невирусного гена с использованием устройства электропорации (например, нуклеофектора), (ii) CAR, которые передают сигнал через эндодомены (например, CD28/CD3-ζ, CD137/CD3-ζ или другие комбинации), (iii) CAR с различными длинами внеклеточных доменов, соединяющими домен распознавания антигена с поверхностью клетки, и, в некоторых случаях, (iv) искусственные антигенпредставляющие клетки (aAPC), полученные из K562, чтобы иметь возможность надежно и численно увеличивать CAR+ иммунные клетки (Singh et al., 2008; Singh et al., 2011).
B. T-клеточный рецептор (TCR)
[00118] В некоторых вариантах осуществления генно-инженерные антигенные рецепторы включают рекомбинантные TCR и/или TCR, клонированные из природных Т-клеток. «Т-клеточный рецептор» или «TCR» относится к молекуле, которая содержит вариабельные α и β цепи (также известные как TCRα и TCRβ, соответственно) или вариабельные γ и δ цепи (также известные как TCRγ и TCRδ, соответственно) и которая способна специфически связываться с антигенным пептидом, связанным с рецептором MHC. В некоторых вариантах осуществления TCR находится в форме αβ.
[00119] Как правило, TCR, которые существуют в формах αβ и γδ, обычно структурно схожи, но экспрессирующие их Т-клетки могут иметь различные анатомические местоположения или функции. TCR может присутствовать на поверхности клетки или в растворимой форме. Как правило, TCR находится на поверхности Т-клеток (или Т-лимфоцитов), где он обычно отвечает за распознавание антигенов, связанных с молекулами главного комплекса гистосовместимости (MHC). В некоторых вариантах осуществления TCR также может содержать константный домен, трансмембранный домен и/или короткий цитоплазматический хвост (см., например, Janeway et al, 1997). Например, в некоторых аспектах каждая цепь TCR может иметь один N-концевой вариабельный домен иммуноглобулина, один константный домен иммуноглобулина, трансмембранную область и короткий цитоплазматический хвост на С-конце. В некоторых вариантах осуществления TCR связан с инвариантными белками комплекса CD3, участвующими в опосредовании сигнальной трансдукции. Если не указано иное, термин «TCR» следует понимать как охватывающий функциональные фрагменты TCR. Термин также включает интактные или полноразмерные TCR, включая TCR в форме αβ или форме γδ.
[00120] Таким образом, для целей настоящего изобретения ссылка на TCR включает любой TCR или функциональный фрагмент, такой как антиген-связывающая часть TCR, которая связывается со специфическим антигенным пептидом, связанным в молекуле MHC, т.е. комплексом MHC-пептид. «Антиген-связывающая часть» или антиген-связывающий фрагмент» TCR, которые могут использоваться взаимозаменяемо, относится к молекуле, которая содержит часть структурных доменов TCR, но которая связывает антиген (например, комплекс MHC-пептид), с которым связывается полный TCR. В некоторых случаях антиген-связывающая часть содержит вариабельные домены TCR, такие как вариабельная α цепь и вариабельная β цепь TCR, достаточные для образования сайта связывания для связывания с конкретным MHC-пептидным комплексом, например, в основном, где каждая цепь содержит три определяющие комплементарность области.
[00121] В некоторых вариантах осуществления вариабельные домены цепей TCR связываются с образованием петель или определяющих комплементарность областей (CDR), аналогичных иммуноглобулинам, которые обеспечивают распознавание антигена и определяют специфичность пептида путем формирования сайта связывания молекулы TCR и определения специфичности пептида. Обычно, подобно иммуноглобулинам, CDR разделены каркасными областями (FR) (см., например, Jores et al., 1990; Chothia et al., 1988; Lefranc et al., 2003). В некоторых вариантах осуществления CDR3 является основным CDR, ответственным за распознавание процессированного антигена, хотя также было показано, что CDR1 альфа-цепи взаимодействует с N-концевой частью антигенного пептида, тогда как CDR1 бета-цепи взаимодействует с C-концевой частью пептида. Считается, что CDR2 распознает молекулу MHC. В некоторых вариантах осуществления вариабельная область β-цепи может содержать дополнительную область гипервариабельности (HV4).
[00122] В некоторых вариантах осуществления цепи TCR содержат константный домен. Например, как и иммуноглобулины, внеклеточная часть цепей TCR (например, α-цепь, β-цепь) может содержать два иммуноглобулиновых домена, вариабельный домен (например, Va или Vp; обычно аминокислоты от 1 до 116 на основе нумерации Kabat (Kabat et al., "Sequences of Proteins of Immunological Interest, US Dept. Health and Human Services, Public Health Service National Institutes of Health, 1991, 5th ed.) на N-конце и один константный домен (например, константный домен а-цепи или Ca, обычно аминокислоты 117-259 на основе нумерации Kabat, константный домен β-цепи или Cp, обычно аминокислоты 117-295 на основе нумерации Kabat, расположенные рядом с клеточной мембраной. Например, в некоторых случаях внеклеточная часть TCR, образованный двумя цепями, содержит два мембрана-проксимальных константных доменаи два мембрана-дистальных вариабельных домена, содержащих CDR. Константный домен TCR домена содержит короткие соединительные последовательности, в которых цистеиновый остаток образует дисульфидную связь, создавая связь между двумя цепями. В некоторых вариантах осуществления TCR может иметь дополнительный цистеиновый остаток в каждой из α и β цепей, так что TCR содержит две дисульфидные связи в константных доменах.
[00123] В некоторых вариантах осуществления TCR цепи могут содержать трансмембранный домен. В некоторых вариантах осуществления трансмембранный домен заряжен положительно. В некоторых случаях цепи TCR содержат цитоплазматический хвост. В некоторых случаях структура позволяет TCR связываться с другими молекулами, такими как CD3. Например, TCR, содержащий константные домены с трансмембранной областью, может заякорить белок в клеточной мембране и связываться с инвариантными субъединицами сигнального аппарата или комплекса CD3.
[00124] Как правило, CD3 представляет собой мультибелковый комплекс, который может иметь три отдельные цепи (γ, δ и ε) у млекопитающих и ζ-цепь. Например, у млекопитающих комплекс может содержать CD3γ цепь, CD3δ цепь, две CD3ε цепи и гомодимер цепей CD3ζ. Цепи CD3γ, CD3δ и CD3ε представляют собой высокородственные белки клеточной поверхности суперсемейства иммуноглобулинов, содержащие единственный домен иммуноглобулина. Трансмембранные области цепей CD3γ, CD3δ и CD3ε заряжены отрицательно, что является характеристикой, позволяющей этим цепям связываться с положительно заряженными цепями Т-клеточных рецепторов. Внутриклеточные хвосты цепей CD3γ, CD3δ и CD3ε содержат по одному консервативному мотиву, известному как иммунорецепторный тирозиновый активирующий мотив, или ITAM, тогда как каждая CD3ζ цепь имеет три. Как правило, ITAM участвуют в сигнальной способности комплекса TCR. Эти вспомогательные молекулы имеют отрицательно заряженные трансмембранные области и играют роль в распространении сигнала от TCR в клетку. CD3- и ζ-цепи вместе с TCR образуют так называемый Т-клеточный рецепторный комплекс.
[00125] В некоторых вариантах осуществления TCR может быть гетеродимером из двух цепей α и β (или необязательно γ и δ) или может быть одноцепочечной TCR конструкцией. В некоторых вариантах осуществления TCR представляет собой гетеродимер, содержащий две отдельные цепи (α и β цепи или γ и δ цепи), которые связаны, например, дисульфидной связью или дисульфидными связями. В некоторых вариантах осуществления TCR для антигена-мишени (например, ракового антигена) идентифицируют и вводят в клетки. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая TCR, может быть получена из множества источников, таких как амплификация общедоступных последовательностей ДНК TCR с использованием полимеразной цепной реакции (ПЦР). В некоторых вариантах осуществления TCR получают из биологического источника, такого как клетки, такие как Т-клетки (например, цитотоксические Т-клетки), Т-клеточные гибридомы или другой общедоступный источник. В некоторых вариантах осуществления Т-клетки могут быть получены из клеток, выделенных in vivo. В некоторых вариантах осуществления клон высокоаффинных Т-клеток можно получить от пациента и выделить TCR. В некоторых вариантах осуществления Т-клетки могут представлять собой культивированную Т-клеточную гибридому или клон. В некоторых вариантах осуществления TCR клон для антигена-мишени получен у трансгенных мышей, сконструированных с использованием генов иммунной системы человека (например, системы лейкоцитарных антигенов человека, или HLA). См., например, опухолевые антигены (см., например, Parkhurst et al., 2009, и Cohen et al., 2005). В некоторых вариантах осуществления изобретения фаговый дисплей используют для выделения TCR против целевого антигена (см., например, Varela-Rohena et al., 2008, и Li, 2005). В некоторых вариантах осуществления TCR или его антиген-связывающая часть может быть получена синтетически на основе знания последовательности TCR.
С. Антигены
[00126] Среди антигенов, на которые нацелены генно-инженерные антигенные рецепторы, есть антигены, экспрессируемые в контексте заболевания, состояния или типа клеток, на которые нацелена адоптивная клеточная терапия. К заболеваниям и состояниям относятся пролиферативные, неопластические и злокачественные заболевания и расстройства, включая рак и опухоли, включая гематологический рак, рак иммунной системы, такой как лимфомы, лейкозы и/или миеломы, такие как B, T и миелоидные лейкозы, лимфомы и множественные миеломы. В некоторых вариантах осуществления антиген избирательно экспрессируется или сверхэкспрессируется на клетках заболевания или состояния, например, опухолевых или патогенных клетках, по сравнению с нормальными или нецелевыми клетками или тканями. В других вариантах осуществления антиген экспрессируется на нормальных клетках и/или экспрессируется на сконструированных клетках.
[00127] Любой подходящий антиген можно использовать в способе по настоящему изобретению. Иллюстративные антигены включают, но не ограничиваются этим, антигенные молекулы из инфекционных агентов, ауто-/эндо-антигены, опухоль-/рак-ассоциированные антигены и опухолевые неоантигены (Linnemann et al., 2015). В конкретных аспектах антигены включают NY-ESO, EGFRvIII, Muc-1, Her2, CA-125, WT-1, Mage-A3, Mage-A4, Mage-A10, TRAIL/DR4 и CEA. В конкретных аспектах антигены для двух или более антигенных рецепторов включают, но не ограничиваются этим, CD19, EBNA, WT1, CD123, NY-ESO, EGFRvIII, MUC1, HER2, CA-125, WT1, Mage-A3, Mage-A4, Mage-A10, TRAIL/DR4 и/или CEA. Последовательности для этих антигенов известны в данной области техники, например (все номера доступа для GenBank®), CD19 (номер доступа NG_007275.1), EBNA (номер доступа NG_002392.2), WT1 (номер доступа NG_009272.1), CD123 (номер доступа NC_000023.11), NY-ESO (номер доступа NC_000023.11), EGFRvIII (номер доступа NG_007726.3), MUC1 (номер доступа NG_029383.1), HER2 (номер доступа NG_007503.1), CA-125 (номер доступа NG_055257.1), WT1 (номер доступа NG_009272.1), Mage-A3 (номер доступа NG_013244.1), Mage-A4 (номер доступа NG_013245.1), Mage-A10 (номер доступа NC_000023.11), TRAIL/DR4 (номер доступа NC_000003.12), и/или CEA (номер доступа NC_000019.10).
[00128] Опухоль-ассоциированные антигены могут происходить из рака простаты, молочной железы, колоректального рака, рака легкого, поджелудочной железы, почки, мезотелиомы, рака яичника или меланомы. Иллюстративные опухоль-ассоциированные антигены или происходящие из опухолевых клеток антигены включают MAGE 1, 3 и MAGE 4 (или другие MAGE антигены, такие как раскрытые в международной патентной публикации № WO99/40188); PRAME; BAGE; RAGE, Lage (также известный как NY ESO 1); SAGE; и HAGE или GAGE. Эти неограничивающие примеры опухолевых антигенов экспрессируются в различных типах опухолей, таких как меланома, карцинома легкого, саркома и карцинома мочевого пузыря. См., например, патент США № 6544518. Ассоциированные с раком простаты антигены включают, например, простат-специфический мембранный антиген (PSMA), простат-специфический антиген (PSA), простатическую кислую фосфатазу, NKX3.1 и шесть трансмембранных эпителиальных антигенов простаты (STEAP).
[00129] Другие опухоль-ассоциированные антигены включают Plu-1, HASH-1, HasH-2, Cripto и Criptin. Кроме того, опухолевый антиген может представлять собой аутопептидный гормон, такой как полноразмерный гонадотропин-релизинг гормон (GnRH), короткий состоящий из 10 аминокислот пептид, полезный в лечении многих раковых заболеваний.
[00130] Опухолевые антигены включают опухолевые антигены, происходящие из раков, которые характеризуются экспрессией опухоль-ассоциированных антигенов, такой как экспрессия HER-2/neu. Опухоль-ассоциированные антигены, представляющие интерес, включают линиеспецифические опухолевые антигены, такие как антигены меланоцит-меланомной линии MART-1/Melan-A, gp100, gp75, mda-7, тирозиназа и тирозиназа-связанный белок. Иллюстративные опухоль-ассоциированные антигены включают, но не ограничиваются этим, опухолевые антигены, происходящие из, или включающие, любого одного или нескольких из следующих: p53, Ras, c-Myc, цитоплазматическиие серин/треонин киназы (например, A-Raf, B-Raf и C-Raf, циклин-зависимые киназы), MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, MART-1, BAGE, DAM-6, -10, GAGE-1, -2, -8, GAGE-3, -4, -5, -6, -7B, NA88-A, MART-1, MC1R, Gp100, PSA, PSM, Тирозиназа, TRP-1, TRP-2, ART-4, CAMEL, CEA, Cyp-B, hTERT, hTRT, iCE, MUC1, MUC2, Фосфоинозитид 3-киназы (PI3K), TRK рецепторы, PRAME, P15, RU1, RU2, SART-1, SART-3, антиген опухоли Вильмса (WT1), AFP, -катенин/m, Каспаза-8/m, CEA, CDK-4/m, ELF2M, GnT-V, G250, HSP70-2M, HST-2, KIAA0205, MUM-1, MUM-2, MUM-3, Миозин/m, RAGE, SART-2, TRP-2/INT2, 707-AP, Аннексин II, CDC27/m, TPI/mbcr-abl, BCR-ABL, интерферон-регулирующий фактор 4 (IRF4), ETV6/AML, LDLR/FUT, Pml/RAR, Опухоль-ассоциированный кальциевый сигнальный трансдуктор 1 (TACSTD1) TACSTD2, рецепторные тирозинкиназы (например, рецептор эпидермального фактора роста (EGFR) (в частности, EGFRvIII), рецептор фактор роста тромбоцитов (PDGFR), рецептор фактора роста эндотелия сосудов (VEGFR)), цитоплазматические тирозинкиназы (например, src-семейство, syk-ZAP70 семейство), интегрин-связанная киназа (ILK), сигнальные трансдукторы и активаторы транскрипции STAT3, STATS и STATE, гипоксия-индуцируемые факторы (например, HIF-1 и HIF-2), Ядерный Фактор-Kappa B (NF-B), Notch рецепторы (например, Notch1-4), c-Met, мишени рапамицина в клетках млекопитающих (mTOR), WNT, регулируемые внеклеточными сигналами киназы (ERK) и их регуляторные субъединицы, PMSA, PR-3, MDM2, Мезотелин, почечноклеточная карцинома-5T4, SM22-альфа, карбонангидразы I (CAI) и IX (CAIX) (также известные как G250), STEAD, TEL/AML1, GD2, протеиназа3, hTERT, точки разрыва транслокации саркомы, EphA2, ML-IAP, EpCAM, ERG (TMPRSS2 ETS слитый ген), NA17, PAX3, ALK, андрогеновый рецептор, циклин B1, полисиаловая кислота, MYCN, RhoC, GD3, фукозил GM1, мезотелин, PSCA, sLe, PLAC1, GM3, BORIS, Tn, GLoboH, NY-BR-1, RGsS, SART3, STn, PAX5, OY-TES1, белок сперматозоидов 17, LCK, HMWMAA, AKAP-4, SSX2, XAGE 1, B7H3, legumain, TIE2, Page4, MAD-CT-1, FAP, MAD-CT-2, fos-связанный антиген 1, CBX2, CLDN6, SPANX, TPTE, ACTL8, ANKRD30A, CDKN2A, MAD2L1, CTAG1B, SUNC1, LRRN1 и идиотип.
[00131] Антигены могут включать эпитопные области или эпитопные пептиды, происходящие из генов, мутировавших в опухолевых клетках, или из генов, транскрибируемых на разных уровнях в опухолевых клетках по сравнению с нормальными клетками, таких как фермент теломераза, сурвивин, мезотелин, мутированный ras, реаранжировка bcr/abl, Her2/neu, мутированный р53 или р53 дикого типа, цитохром P450 1B1 и аномально экспрессируемые интронные последовательности, такие как N-ацетилглюкозаминилтрансфераза-V; клональные перестройки генов иммуноглобулинов, порождающие уникальные идиотипы миеломы и В-клеточных лимфом; опухолевые антигены, которые включают эпитопные области или эпитопные пептиды, происходящие из онковирусных процессов, такие как белки вируса папилломы человека E6 и E7; белок вируса Эпштейна-Барра LMP2; немутантные онкофетальные белки с опухоль-селективной экспрессией, такие как карциноэмбриональный антиген и альфа-фетопротеин.
[00132] В других вариантах осуществления антиген получен или происходит из патогенного микроорганизма или из условно-патогенного микроорганизма (также называемого инфекционным микроорганизмом), такого как вирус, гриб, паразит и бактерия. В некоторых вариантах осуществления антигены, происходящие из такого микроорганизма, включают полноразмерные белки.
[00133] Иллюстративные патогенные организмы, антигены которых предполагается использовать в описанном способе, включают вирус иммунодефицита человека (ВИЧ), вирус простого герпеса (HSV), респираторно-синцитиальный вирус (RSV), цитомегаловирус (CMV), вирус Эпштейна-Барра (EBV), грипп A, B и C, вирус везикулярного стоматита (VSV), полиомавирус (например, вирус BK и вирус JC), аденовирус, вид Staphylococcus, включая метициллин-резистентный Staphylococcus aureus (MRSA), и вид Streptococcus, включая Streptococcus pneumoniae. Как будет понятно специалисту, белки, полученные из этих и других патогенных микроорганизмов для использования в качестве антигена, как описано в настоящей заявке, и нуклеотидные последовательности, кодирующие белки, могут быть идентифицированы в публикациях и в общедоступных базах данных, таких как GENBANK®, SWISS-PROT® и TREMBL®.
[00134] Антигены, происходящие из вируса иммунодефицита человека (ВИЧ), включают любой из структурных белков вириона ВИЧ (например, gp120, gp41, p17, p24), протеазу, обратную транскриптазу или белки ВИЧ, кодируемые tat, rev, nef, vif, vpr и vpu.
[00135] Антигены, происходящие из вируса простого герпеса (например, HSV 1 и HSV2), включают, но не ограничиваются этим, белки, экспрессируемые поздними генами HSV. Поздняя группа генов преимущественно кодирует белки, образующие частицу вириона. Такие белки включают пять белков из (UL), которые образуют вирусный капсид: UL6, UL18, UL35, UL38 и основной капсидный белок UL19, UL45 и UL27, каждый из которых может использоваться в качестве антигена, как описано в настоящей заявке. Другие иллюстративные белки HSV, рассматриваемые для использования в качестве антигенов, включают белки ICP27 (H1, H2), гликопротеин B (gB) и гликопротеин D (gD). Геном HSV включает по меньшей мере 74 гена, каждый из которых кодирует белок, который потенциально может быть использован в качестве антигена.
[00136] Антигены, происходящие из цитомегаловируса (CMV), включают структурные белки CMV, вирусные антигены, экспрессируемые во время непосредственной ранней и ранней фаз репликации вируса, гликопротеины I и III, капсидный белок, белок оболочки, небольшой матриксный белок pp65 (ppUL83), p52 (ppUL44), IE1 и 1E2 (UL123 и UL122), белковые продукты из кластера генов из UL128-UL150 (Rykman, et al., 2006), оболочечный гликопротеин B (gB), gH, gN и pp150. Как будет понятно специалисту, белки CMV для использования в качестве антигенов, описанных в настоящей заявке, могут быть идентифицированы в общедоступных базах данных, таких как GENBANK®, SWISS-PROT® и TREMBL® (см., например, Bennekov et al., 2004; Loewendorf et al., 2010; Marschall et al., 2009).
[00137] Антигены, происходящие из вируса Эпштейна-Бана (EBV), которые предполагается использовать в определенных вариантах осуществления, включают EBV литические белки gp350 и gp110, EBV белки, продуцируемые во время латентного цикла инфекции, включая ядерный антиген Эпштейна-Бана (EBNA)-1, EBNA-2, EBNA-3A, EBNA-3B, EBNA-3C, EBNA-лидерный белок (EBNA-LP) и латентные мембранные белки (LMP)-1, LMP-2A и LMP-2B (см., например, Lockey et al., 2008 г.).
[00138] Антигены, происходящие из респираторно-синцитиального вируса (RSV), которые предполагается использовать в настоящем изобретении, включают любой из одиннадцати белков, кодируемых геномом RSV, или его антигенные фрагменты: NS 1, NS2, N (нуклеокапсидный белок), M (матриксный белок) SH, G и F (белки вирусной оболочки), M2 (второй матричный белок), M2-1 (фактор элонгации), M2-2 (регуляция транскрипции), РНК-полимераза и фосфопротеин P.
[00139] Антигены, происходящие из вируса везикулярного стоматита (VSV), которые предполагается использовать, включают любой из пяти основных белков, кодируемых геномом VSV, и его антигенные фрагменты: большой белок (L), гликопротеин (G), нуклеопротеин (N), фосфопротеин (P) и матриксный белок (M) (см., например, Rieder et al., 1999).
[00140] Антигены, происходящие из вируса гриппа, которые предполагается использовать в некоторых вариантах осуществления, включают гемагглютинин (HA), нейраминидазу (NA), нуклеопротеин (NP), матриксные белки M1 и M2, NS1, NS2 (NEP), PA, PB1, PB1-F2 и PB2.
[00141] Примеры вирусных антигенов также включают, но не ограничиваются этим, аденовирусные полипептиды, альфавирусные полипептиды, калицивирусные полипептиды (например, калицивирусный капсидный антиген), коронавирусные полипептиды, вирусные полипептиды чумки, полипептиды вируса Эбола, энтеровирусные полипептиды, флавивирусные полипептиды, полипептиды вируса гепатита (AE) (коровый или поверхностный антиген гепатита B, E1 или E2 гликопротеины вируса гепатита C, коровые или неструктурные белки), герпесвирусные полипептиды (включая вирусный гликопротеин вируса простого герпеса или varicella zoster), вирусные полипептиды инфекционного перитонита, лейкозные вирусные полипептиды, Marburg вирусные полипептиды, ортомиксовирусные полипептиды, папилломавирусные полипептиды, вирусные полипептиды парагриппа (например, the полипептиды гемагглютинина и нейраминидазы), парамиксовирусные полипептиды, парвовирусные полипептиды, пестивирусные полипептиды, пикорнавирусные полипептиды (например, полиовирусный капсидный полипептид), поксвирусные полипептиды (например, вирусный полипептид коровьей оспы), полипептиды вируса бешенства (например, гликопротеин G вируса бешенства), реовирусные полипептиды, ретровирусные полипептиды и ротавирусные полипептиды.
[00141] В некоторых вариантах осуществления антиген может представлять собой бактериальный антиген. В некоторых вариантах осуществления бактериальный антиген, представляющие интерес, может представлять собой секретированный полипептид. В других определенных вариантах осуществления бактериальные антигены включают антигены, которые имеют часть или части полипептида, находящегося на внешней клеточной поверхности бактерий.
[00143] Антигены, происходящие из вида Staphylococcus, включая Метициллин-резистентный Staphylococcus aureus (MRSA), которые предусматриваются для применения, включают регуляторы вирулентности, такие как Agr система, Sar и Sae, Arl система, Sar гомологи (Rot, MgrA, SarS, SarR, SarT, SarU, SarV, SarX, SarZ и TcaR), Srr система и TRAP. Другие белки Staphylococcus, которые могут служить в качестве антигенов, включают Clp белки, HtrA, MsrR, аконитазу, CcpA, SvrA, Msa, CfvA и CfvB (см., например, Staphylococcus: Molecular Genetics, 2008 Caister Academic Press, Ed. Jodi Lindsay). Геномы для двух видов Staphylococcus aureus (N315 и Mu50) были секвенированы, и они общедоступны, например в PATRIC (PATRIC: The VBI PathoSystems Resource Integration Center, Snyder et al., 2007). Как должно быть понятно специалистам, белки Staphylococcus для применения в качестве антигенов также могут быть идентифицированы в других общедоступных базах данных, таких как GenBank®, Swiss-Prot® и TrEMBL®.
[00144] Антигены, происходящие из Streptococcus pneumoniae, которые предусматриваются для применения в некоторых вариантах осуществления, описанных в настоящей заявке, включают пневмолизин, PspA, холин-связывающий белок A (CbpA), NanA, NanB, SpnHL, PavA, LytA, Pht и пилиновые белки (RrgA; RrgB; RrgC). Антигенные белки Streptococcus pneumoniae также известны в данной области техники, и их можно использовать в качестве антигена в некоторых вариантах осуществления (см., например, Zysk et al., 2000). Полная геномная последовательность вирулентного штамма Streptococcus pneumoniae была секвенирована, и, как должно быть понятно специалистам, белки S. pneumoniae для применения в настоящей заявке также могут быть идентифицированы в других общедоступных базах данных, таких как GENBANK®, SWISS-PROT® и TREMBL®. Представляющие особый интерес белки для антигенов в соответствии с настоящим изобретением включают факторы вирулентности и белки, которые, как предполагают, должны экспонироваться на поверхности пневмококков (см., например, Frolet et al., 2010).
[00145] Примеры бактериальных антигенов, которые можно использовать в качестве антигенов, включают, но не ограничиваются этим, Actinomyces полипептиды, Bacillus полипептиды, Bacteroides полипептиды, Bordetella полипептиды, Bartonella полипептиды, Borrelia полипептиды (например, B. burgdorferi OspA), Brucella полипептиды, Campylobacter полипептиды, Capnocytophaga полипептиды, Chlamydia полипептиды, Corynebacterium полипептиды, Coxiella полипептиды, Dermatophilus полипептиды, Enterococcus полипептиды, Ehrlichia полипептиды, Escherichia полипептиды, Francisella полипептиды, Fusobacterium полипептиды, Haemobartonella полипептиды, Haemophilus полипептиды (например, белок внешней мембраны H. influenzae типа b), Helicobacter полипептиды, Klebsiella полипептиды, полипептиды L-формы бактерий, Leptospira полипептиды, Listeria полипептиды, Mycobacteria полипептиды, Mycoplasma полипептиды, Neisseria полипептиды, Neorickettsia полипептиды, Nocardia полипептиды, Pasteurella полипептиды, Peptococcus полипептиды, Peptostreptococcus полипептиды, Pneumococcus полипептиды (т.е. S. pneumoniae полипептиды) (см. описание в настоящей заявке), Proteus полипептиды, Pseudomonas полипептиды, Rickettsia полипептиды, Rochalimaea полипептиды, Salmonella полипептиды, Shigella полипептиды, Staphylococcus полипептиды, полипептиды streptococcus группы A (например, S. pyogenes M белки), полипептиды streptococcus группы B (S. agalactiae), Treponema полипептиды и Yersinia полипептиды (например, Y pestis F1 и V антигены).
[00146] Примеры грибковых антигенов включают, но не ограничиваются этим, Absidia полипептиды, Acremonium полипептиды, Alternaria полипептиды, Aspergillus полипептиды, Basidiobolus полипептиды, Bipolaris полипептиды, Blastomyces полипептиды, Candida полипептиды, Coccidioides полипептиды, Conidiobolus полипептиды, Cryptococcus полипептиды, Curvalaria полипептиды, Epidermophyton полипептиды, Exophiala полипептиды, Geotrichum полипептиды, Histoplasma полипептиды, Madurella полипептиды, Malassezia полипептиды, Microsporum полипептиды, Moniliella полипептиды, Mortierella полипептиды, Mucor полипептиды, Paecilomyces полипептиды, Penicillium полипептиды, Phialemonium полипептиды, Phialophora полипептиды, Prototheca полипептиды, Pseudallescheria полипептиды, Pseudomicrodochium полипептиды, Pythium полипептиды, Rhinosporidium полипептиды, Rhizopus полипептиды, Scolecobasidium полипептиды, Sporothrix полипептиды, Stemphylium полипептиды, Trichophyton полипептиды, Trichosporon полипептиды и Xylohypha полипептиды.
[00147] Примеры протозойных антигенов включают, но не ограничиваются этим, Babesia полипептиды, Balantidium полипептиды, Besnoitia полипептиды, Cryptosporidium полипептиды, Eimeria полипептиды, Encephalitozoon полипептиды, Entamoeba полипептиды, Giardia полипептиды, Hammondia полипептиды, Hepatozoon полипептиды, Isospora полипептиды, Leishmania полипептиды, Microsporidia полипептиды, Neospora полипептиды, Nosema полипептиды, Pentatrichomonas полипептиды, Plasmodium полипептиды. Примеры антигенов гельминтов-паразитов включают, но не ограничиваются этим, Acanthocheilonema полипептиды, Aelurostrongylus полипептиды, Ancylostoma полипептиды, Angiostrongylus полипептиды, Ascaris полипептиды, Brugia полипептиды, Bunostomum полипептиды, Capillaria полипептиды, Chabertia полипептиды, Cooperia полипептиды, Crenosoma полипептиды, Dictyocaulus полипептиды, Dioctophyme полипептиды, Dipetalonema полипептиды, Diphyllobothrium полипептиды, Diplydium полипептиды, Dirofilaria полипептиды, Dracunculus полипептиды, Enterobius полипептиды, Filaroides полипептиды, Haemonchus полипептиды, Lagochilascaris полипептиды, Loa полипептиды, Mansonella полипептиды, Muellerius полипептиды, Nanophyetus полипептиды, Necator полипептиды, Nematodirus полипептиды, Oesophagostomum полипептиды, Onchocerca полипептиды, Opisthorchis полипептиды, Ostertagia полипептиды, Parafilaria полипептиды, Paragonimus полипептиды, Parascaris полипептиды, Physaloptera полипептиды, Protostrongylus полипептиды, Setaria полипептиды, Spirocerca полипептиды Spirometra полипептиды, Stephanofilaria полипептиды, Strongyloides полипептиды, Strongylus полипептиды, Thelazia полипептиды, Toxascaris полипептиды, Toxocara полипептиды, Trichinella полипептиды, Trichostrongylus полипептиды, Trichuris полипептиды, Uncinaria полипептиды и Wuchereria полипептиды (например, P. falciparum циркумспорозоит (PfCSP)), спорозоитный поверхностный белок 2 (PfSSP2), карбокси-конец печеночного антигена 1 (PfLSA1 c-term) и белок экспорта 1 (PfExp-1), Pneumocystis полипептиды, Sarcocystis полипептиды, Schistosoma полипептиды, Theileria полипептиды, Toxoplasma полипептиды и Trypanosoma полипептиды.
[00148] Примеры антигенов эктопаразитов включают, но не ограничиваются этим, полипептиды (включая антигены, а также аллергены) блох; клещей, включая твердых и мягких клещей; мух, таких как звонцы, комары, москиты, мошки, слепни, роговые мухи, олени, мухи цеце, стойловые мухи, мухи, вызывающие миаз, и кусающие мошки; муравьи; пауки, вши; клещи; и настоящие клопы, такие как постельные клопы и конусоносные клопы.
D. Суицидальные гены
[00149] CAR иммунных клеток по настоящему изобретению может содержать один или несколько суицидальных генов. Используемый термин «суицидальный ген» определяется как ген, который при введении пролекарства вызывает переход продукта гена в соединение, которое убивает его клетку-хозяина. Примерами комбинаций суицидального гена/пролекарства, которые можно использовать, являются тимидинкиназа вируса простого герпеса (HSV-tk) и ганцикловир, ацикловир или FIAU; оксидоредуктаза и циклогексимид; цитозиндезаминаза и 5-фторцитозин; тимидинкиназа, тимидилаткиназа (Tdk::Tmk) и AZT; и дезоксицитидинкиназа и цитозинарабинозид.
[00150] Пуриннуклеозидфосфорилаза E.coli, так называемый суицидальный ген, который превращает пролекарство 6-метилпуриндезоксирибозид в токсичный пурин-6-метилпурин. Другими примерами суицидальных генов, используемых с пролекарственной терапией, являются ген цитозиндезаминазы E. coli и ген тимидинкиназы HSV.
[00151] Примеры суицидальных генов включают CD20, CD52, EGFRv3, римидуцид или индуцибельную каспазу 9. В одном варианте осуществления укороченная версия EGFR варианта III (EGFRv3) может использоваться в качестве суицидального антигена, который может удаляться цетуксимабом. Другие суицидальные гены, известные в данной области, которые можно использовать в настоящем изобретении, включают пуриннуклеозидфосфорилазу (PNP), ферменты Цитохром p450 (CYP), карбоксипептидазы (CP), карбоксилэстеразу (CE), нитроредуктазу (NTR), гуанин-рибозилтрансферазу (XGRTP), ферменты гликозидазы, метионин-α,γ-лиазу (MET) и тимидинфосфорилазу (TP).
Е. Способы доставки
[00152] Специалист в данной области будет хорошо вооружен для конструирования вектора стандартным рекомбинантным методом (см., например, Sambrook et al., 2001 и Ausubel et al., 1996, оба включены в настоящую заявку в качестве ссылки) для экспрессии антигенных рецепторов по настоящему изобретению. Векторы включают, но не ограничиваются этим, плазмиды, космиды, вирусы (бактериофаги, вирусы животных и вирусы растений) и искусственные хромосомы (например, YAC), такие как ретровирусные векторы (например, полученные из векторов на основе вируса мышиного лейкоза Молони (MoMLV), MSCV, SFFV, MPSV, SNV и т.д.), лентивирусные векторы (например, полученные из ВИЧ-1, ВИЧ-2, SIV, BIV, FIV и т.д.), аденовирусные (Ad) векторы, включая их репликационно-компетентные, репликационно-дефицитные и “выпотрошенные” формы, адено-ассоциированные вирусные (AAV) векторы, векторы на основе обезьяньего вируса 40 (SV-40), векторы на основе вируса папилломы крупного рогатого скота, векторы на основе вируса Эпштейна-Барра, векторы на основе вируса герпеса, векторы на основе вируса коровьей оспы, векторы на основе вируса мышиной саркомы Харви, векторы на основе вируса опухоли молочной железы мышей, векторы на основе вируса саркомы Рауса, векторы на основе парвовируса, векторы на основе вируса полиомиелита, векторы на основе вируса везикулярного стоматита, векторы на основе вируса Мараба и векторы на основе аденовируса группы B.
а. Вирусные векторы
[00153] В некоторых аспектах настоящего изобретения могут быть предусмотрены вирусные векторы, кодирующие антигенный рецептор. При создании рекомбинантных вирусных векторов несущественные гены обычно заменяют геном или кодирующей последовательностью для гетерологичного (или ненативного) белка. Вирусный вектор представляет собой своего рода экспрессирующую конструкцию, которая использует вирусные последовательности для введения нуклеиновой кислоты и, возможно, белков в клетку. Способность некоторых вирусов инфицировать клетки или проникать в клетки посредством рецепторно-опосредованного эндоцитоза, а также интегрироваться в геномы клеток-хозяев и стабильно и эффективно экспрессировать вирусные гены сделала их привлекательными кандидатами для переноса чужеродных нуклеиновых кислот в клетки (например, клетки млекопитающих). Неограничивающие примеры вирусных векторов, которые можно использовать для доставки нуклеиновой кислоты определенных аспектов настоящего изобретения, описаны ниже.
[00154] Лентивирусы представляют собой сложные ретровирусы, которые, помимо обычных ретровирусных генов gag, pol и env, содержат другие гены с регуляторной или структурной функцией. Лентивирусные векторы хорошо известны в данной области (см., например, патенты США 6013516 и 5994136).
[00155] Рекомбинантные лентивирусные векторы способны инфицировать неделящиеся клетки и могут использоваться как для переноса генов in vivo, так и ex vivo и экспрессии последовательностей нуклеиновых кислот. Например, рекомбинантный лентивирус, способный инфицировать неделящуюся клетку, где подходящая клетка-хозяин трансфицируется двумя или более векторами, несущими функции упаковки, а именно gag, pol и env, а также rev и tat, описан в патенте США № 5994136, включенном в настоящую заявку посредством ссылки.
b. Регуляторные элементы
[00156] Кассеты экспрессии, включенные в векторы, используемые в настоящем изобретении, в частности, содержат (в направлении от 5' к 3') эукариотический промотор транскрипции, функционально связанный с кодирующей белок последовательностью, сигналы сплайсинга, включая промежуточные последовательности, и последовательность терминации транскрипции/полиаденилирования. Промоторы и энхансеры, контролирующие транскрипцию кодирующих белок генов, в эукариотических клетках состоят из множества генетических элементов. Клеточный аппарат способен собирать и интегрировать регуляторную информацию, передаваемую каждым элементом, позволяя различным генам развивать различные, часто сложные паттерны регуляции транскрипции. Промотор, используемый в контексте настоящего изобретения, включает конститутивные, индуцибельные и тканеспецифические промоторы.
(i) Промотор/энхансеры
[00157] Предлагаемые в настоящей заявке конструкции экспрессии содержат промотор для управления экспрессией антигенного рецептора. Промотор обычно включает последовательность, которая функционирует, чтобы позиционировать сайт начала для синтеза РНК. Наиболее известным примером этого является ТАТА-бокс, но в некоторых промоторах без ТАТА-бокса, таких как, например, промотор для гена терминальной дезоксинуклеотидилтрансферазы млекопитающих и промотор для поздних генов SV40, дискретный элемент, лежащий выше сайта начала, сам помогает фиксировать место инициации. Дополнительные промоторные элементы регулируют частоту инициации транскрипции. Обычно они расположены в области 30-110 п.н. выше сайта начала, хотя было показано, что ряд промоторов также содержат функциональные элементы ниже сайта начала. Чтобы поставить кодирующую последовательность «под контроль» промотора, нужно позиционировать 5'-конец сайта инициации транскрипции рамки считывания транскрипции «ниже» (т.е. 3' от) выбранного промотора. «Расположенный выше» промотор стимулирует транскрипцию ДНК и промотирует экспрессию кодируемой РНК.
[00158] Пространство между элементами промотора часто бывает гибким, так что функция промотора сохраняется, когда элементы инвертируются или перемещаются относительно друг друга. В tk промоторе расстояние между элементами промотора может быть увеличено до 50 п.н., прежде чем активность начнет снижаться. В зависимости от промотора оказывается, что отдельные элементы могут функционировать либо совместно, либо независимо, чтобы активировать транскрипцию. Промотор можно использовать, но необязательно, вместе с «энхансером», который относится к цис-действующей регуляторной последовательности, участвующей в активации транскрипции нуклеиновокислотной последовательности.
[00159] Промотор может быть естественным образом связанным с нуклеиновокислотной последовательностью, что может быть получено путем выделения 5'-некодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Такой промотор можно назвать «эндогенным». Точно так же энхансер может быть энхансером, естественно связанным с нуклеиновокислотной последовательностью, расположенным ниже или выше этой последовательности. Альтернативно, определенные преимущества будут получены путем расположения кодирующего сегмента нуклеиновой кислоты под контролем рекомбинантного или гетерологичного промотора, который относится к промотору, который обычно не связан с нуклеиновокислотной последовательностью в ее естественном окружении. Рекомбинантный или гетерологичный энхансер также относится к энхансеру, обычно не связанному с нуклеиновокислотной последовательностью в ее естественном окружении. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов, и промоторы или энхансеры, выделенные из любого другого вируса или прокариотической или эукариотической клетки, и промоторы или энхансеры, не «встречающиеся в природе», т.е. содержащие различные элементы различных регуляторных областей транскрипции и/или мутации, изменяющие экспрессию. Например, промоторы, которые чаще всего используются при конструировании рекомбинантной ДНК, включают промоторные системы лактамазы (пенициллиназы), лактозы и триптофана (trp). Помимо получения нуклеиновокислотных последовательностей промоторов и энхансеров синтетическим путем, последовательности могут быть получены с использованием технологии рекомбинантного клонирования и/или амплификации нуклеиновых кислот, включая PCR™, в связи с композициями, раскрытыми в настоящей заявке. Кроме того, предполагается, что также можно использовать контрольные последовательности, которые управляют транскрипцией и/или экспрессией последовательностей в неядерных органеллах, таких как митохондрии, хлоропласты и т.п.
[00160] Естественно, будет важно использовать промотор и/или энхансер, который эффективно управляет экспрессией сегмента ДНК в органелле, типе клеток, ткани, органе или организме, выбранных для экспрессии. Специалистам в области молекулярной биологии, как правило, известно использование промоторов, энхансеров и комбинаций типов клеток для экспрессии белка (см., например, Sambrook et al. 1989, включенный в настоящую заявку в качестве ссылки). Используемые промоторы могут быть конститутивными, тканеспецифичными, индуцибельными и/или полезными в соответствующих условиях для управления высоким уровнем экспрессии введенного сегмента ДНК, например, что является преимуществом при крупномасштабном производстве рекомбинантных белков и/или пептидов. Промотор может быть гетерологичным или эндогенным.
[00161] Кроме того, любую комбинацию промотор/энхансер (согласно, например, базе данных эукариотических промоторов EPDB, размещенной в Интернете по адресу epd.isb-sib.ch/) также можно использовать для управления экспрессией. Другим возможным вариантом осуществления является использование системы цитоплазматической экспрессии Т3, Т7 или SP6. Эукариотические клетки могут поддерживать цитоплазматическую транскрипцию с определенных бактериальных промоторов, если имеется соответствующая бактериальная полимераза, либо как часть комплекса доставки, либо как дополнительная конструкция генетической экспрессии.
[00162] Неограничивающие примеры промоторов включают ранние или поздние вирусные промоторы, такие как ранние или поздние промоторы SV40, немедленные ранние промоторы цитомегаловируса (CMV), ранние промоторы вируса саркомы Рауса (RSV); промоторы эукариотических клеток, такие как, например, промотор бета-актина, промотор GADPH, промотор металлотионеина; и конкатенированные промоторы элемента ответа, такие как промоторы элемента ответа циклического AMP (cre), промотор элемента ответа сыворотки (sre), промотор сложного эфира форбола (TPA) и промоторы элемента ответа (tre) рядом с минимальным TATA боксом. Также возможно использовать промоторные последовательности человеческого гормона роста (например, минимальный промотор человеческого гормона роста, описанный в Genbank, номер доступа X05244, нуклеотид 283-341) или промотор опухоли молочной железы мыши (доступный от ATCC, кат. № ATCC 45007). В некоторых вариантах осуществления промотор представляет собой CMV IE, дектин-1, дектин-2, человеческий CD11c, F4/80, SM22, RSV, SV40, Ad MLP, бета-актин, промотор MHC класса I или MHC класса II, однако любой другой промотор, который полезен для управления экспрессией терапевтического гена, применим для осуществления на практике настоящего изобретения.
[00163] В определенных аспектах способы настоящего изобретения также касаются энхансерных последовательностей, т.е. нуклеиновокислотных последовательностей, которые повышают активность промотора и которые обладают потенциалом действовать в цис-, независимо от их ориентации, даже на относительно больших расстояниях (вплоть до нескольких т.п.н. от целевого промотора). Однако функция энхансеров не обязательно ограничивается такими большими расстояниями, поскольку они также могут функционировать в непосредственной близости от данного промотора.
(ii) Сигналы инициации и связанная экспрессия
[00164] Специфический сигнал инициации также можно использовать в экспрессирующих конструкциях, представленных в настоящем изобретении, для эффективной трансляции кодирующих последовательностей. Эти сигналы включают кодон инициации ATG или смежные последовательности. Может потребоваться обеспечение экзогенных сигналов контроля трансляции, включая кодон инициации ATG. Специалист в данной области техники легко сможет определить это и обеспечить необходимые сигналы. Хорошо известно, что кодон инициации должен находиться «в рамке» с рамкой считывания желаемой кодирующей последовательности, чтобы гарантировать трансляцию всей вставки. Экзогенные сигналы контроля трансляции и кодоны инициации могут быть природными или синтетическими. Эффективность экспрессии может быть повышена путем включения соответствующих элементов энхансера транскрипции.
[00165] В некоторых вариантах осуществления для создания мультигенных или полицистронных сообщений используются элементы внутренних участок посадки рибосомы (IRES). Элементы IRES способны обходить модель сканирования рибосом 5'-метилированной Cap-зависимой трансляции и начинать трансляцию на внутренних сайтах. Были описаны элементы IRES из двух членов семейства пикорнавирусов (полиомиелит и энцефаломиокардит), а также IRES из информационной последовательности млекопитающих. Элементы IRES могут быть связаны с гетерологичными открытыми рамками считывания. Несколько открытых рамок считывания могут быть расшифрованы вместе, каждая из которых разделена IRES, создавая полицистронные транскрипты. Благодаря элементу IRES каждая открытая рамка считывания доступна рибосомам для эффективной трансляции. Несколько генов могут быть эффективно экспрессированы с использованием одного промотора/энхансера для транскрипции одной информационной последовательности.
[00166] Кроме того, определенные элементы последовательности 2А можно использовать для создания связанной или коэкспрессии генов в конструкциях, представленных в настоящем изобретении. Например, последовательности расщепления можно использовать для коэкспрессии генов путем связывания открытых рамок считывания с образованием единого цистрона. Примером последовательности расщепления является F2A (вирус ящура 2A) или «2A-подобная» последовательность (например, вирус Thosea asigna 2A; T2A)
(iii) Ориджины репликации
Для размножения вектора в клетке-хозяине он может содержать один или несколько ориджинов репликации (часто называемых «ori»), например, нуклеиновокислотную последовательность, соответствующую oriP EBV, как описано выше, или генно-инженерный oriP с аналогичной или повышенной функцией при программировании, который представляет собой конкретную нуклеиновокислотную последовательность, с которой начинается репликация. Альтернативно, можно использовать ориджин репликации другого внехромосомно реплицирующегося вируса, как описано выше, или автономно реплицирующуюся последовательность (ARS).
с. Селектируемые и скринабельные маркеры
[00167] В некоторых вариантах осуществления клетки, содержащие конструкцию по настоящему изобретению, можно идентифицировать in vitro или in vivo путем включения маркера в вектор экспрессии. Такие маркеры могли бы придавать идентифицируемое изменение клетке, позволяя легко идентифицировать клетки, содержащие вектор экспрессии. Как правило, селектируемый маркер представляет собой маркер, который придает свойство, допускающее выбор. Положительный селектируемый маркер является таким, что присутствие маркера делает возможным его выбор, в то время как отрицательный селектируемый маркер является таким, что присутствие маркера его присутствие препятствует его выбору. Примером положительного селектируемого маркера является маркер лекарственной резистентности.
[00168] Обычно включение селектируемого маркера лекарственной резистентности помогает при клонировании и идентификации трансформантов, например гены, которые придают резистентность к неомицину, пуромицину, гигромицину, DHFR, GPT, зеоцину и гистидинолу, являются полезными селектируемыми маркерами. Помимо маркеров, придающих фенотип, который позволяет различать трансформанты на основе выполнения условий, также рассматриваются другие типы маркеров, включая скринабельные маркеры, такие как GFP, основой которого является колориметрический анализ. Альтернативно, можно использовать скринабельные ферменты в качестве отрицательных селектируемых маркеров, такие как тимидинкиназа вируса простого герпеса (tk) или хлорамфениколацетилтрансфераза (CAT). Специалист в данной области также знает, как использовать иммунологические маркеры, возможно, в сочетании с анализом FACS. Используемый маркер не считается важным при условии, что он способен экспрессироваться одновременно с нуклеиновой кислотой, кодирующей генный продукт. Дополнительные примеры селектируемых и скринабельных маркеров хорошо известны специалистам в данной области.
d. Другие способы доставки нуклеиновых кислот
[00169] В дополнение к вирусной доставке нуклеиновых кислот, кодирующих антигенный рецептор, следующие способы являются дополнительными способами доставки рекомбинантного гена в данную клетку-хозяин и, таким образом, рассматриваются в настоящем раскрытии.
[00170] Для введения нуклеиновой кислоты, такой как ДНК или РНК, в иммунные клетки по настоящему изобретению, можно использовать любые подходящие методы доставки нуклеиновой кислоты для трансформации клетки, как описано в настоящей заявке или как должно быть известно среднему специалисту в данной области. Такие методы включают, но не ограничиваются этим, прямую доставку ДНК, например, путем трансфекции ex vivo, путем инъекции, включая микроинъекцию); электропорацией; осаждением фосфата кальция; с использованием DEAE-декстрана, а затем полиэтиленгликоля; прямой акустической нагрузкой; липосомально-опосредованной трансфекцией и рецептор-опосредованной трансфекцией; бомбардировкой микрочастицами; перемешиванием с волокнами карбида кремния; Agrobacterium-опосредованной трансформацией; дессикация/ингибирование-опосредованным поглощением ДНК и любой комбинации таких методов. Посредством применения таких методов, органелла(органеллы), клетка(клетки), ткань(ткани) или организм(организмы) могут быть стабильно или транзиентно трансформированы.
IV. Способы лечения
[00171] Способы по изобретению могут способствовать генерированию большого количества высокофункциональных NK-клеток из пуповинной крови или периферической крови для NK-клеточной иммунотерапии. Способы по изобретению также можно использовать для повышения функциональности CAR-NK-клеточной терапии. Таким образом, в настоящей заявке представлены способы лечения заболеваний путем адоптивной инфузии только NK-клеток или в комбинации с моноклональными, биспецифическими и триспецифическими антителами, которые связывают CD16 или другие рецепторы на NK-клетках и перенаправляют клетки на мишень, тем самым увеличивая ответ против различных опухолей.
[00172] В некоторых вариантах осуществления настоящее изобретение обеспечивает способы иммунотерапии, включающие введение эффективного количества NK-клеток по настоящему изобретению. В одном варианте осуществления медицинское заболевание или расстройство лечат путем переноса популяции NK-клеток, которая вызывает иммунный ответ. В некоторых вариантах осуществления настоящего изобретения рак или инфекцию лечат путем переноса популяции NK-клеток, которая вызывает иммунный ответ. В настоящей заявке представлены способы лечения или замедления прогрессирования рака у индивидуума, включающие введение индивиду эффективного количества NK-клеточной терапии. Способы по изобретению можно применять для лечения иммунных расстройств, солидных злокачественных опухолей, гематологических злокачественных опухолей и вирусных инфекций.
[00173] Опухоли, для которых применимы способы лечения по изобретению, включают любой тип злокачественных клеток, например те, которые обнаруживаются в солидной опухоли или гематологической опухоли. Примеры солидных опухолей могут включать, но не ограничиваются этим, опухоль органа, выбранного из группы, состоящей из поджелудочной железы, толстой кишки, слепой кишки, желудка, головного мозга, головы, шеи, яичника, почки, гортани, саркомы, легкого, мочевого пузыря, меланомы, предстательной железы и молочной железы. Примеры гематологических опухолей включают опухоли костного мозга, Т- или В-клеточные злокачественные новообразования, лейкозы, лимфомы, бластомы, миеломы и т.п. Дополнительные примеры рака, который можно лечить с использованием способов, в настоящей заявке, включают, но не ограничиваются этим, рак легких (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, гастральный рак желудка или рак желудка (включая рак желудочно-кишечного тракта и рак стромы желудочно-кишечного тракта), рак поджелудочной железы, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки или почечно-клеточный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, различные типы рака головы и шеи и меланому.
[00174] Рак, в частности, может быть следующего гистологического типа, но не ограничивается этим: новообразование, злокачественное; карцинома; карцинома недифференцированная; гигантоклеточная и веретено-клеточная карцинома; мелкоклеточная карцинома; папиллярная карцинома; плоскоклеточная карцинома; лимфоэпителиальная карцинома; базально-клеточная карцинома; пиломатриксная карцинома; переходно-клеточная карцинома; папиллярная переходно-клеточная карцинома; аденокарцинома; гастринома, злокачественная; холангиокарцинома; гепатоцеллюлярная карцинома; комбинированная гепатоцеллюлярная карцинома и холангиокарцинома; трабекулярная аденокарцинома; аденоидно-кистозная карцинома; аденокарцинома при аденоматозном полипе; аденокарцинома, семейный полипоз кишечной палочки; солидная карцинома; карциноидная опухоль, злокачественная; бранхиоло-альвеолярная аденокарцинома; папиллярная аденокарцинома; хромофобная карцинома; ацидофильная карцинома; оксифильная аденокарцинома; базофильная карцинома; светлоклеточная аденокарцинома; гранулярно-клеточная карцинома; фолликулярная аденокарцинома; папиллярно-фолликулярная аденокарцинома; неинкапсулирующая склерозирующая карцинома; карцинома коры надпочечников; эндометроидная карцинома; рак придатков кожи; апокринная аденокарцинома; аденокарцинома сальной железы; церуминозная аденокарцинома; мукоэпидермоидная карцинома; цистаденокарцинома; папиллярная цистаденокарцинома; папиллярная серозная цистаденокарцинома; муцинозная цистаденокарцинома; муцинозная аденокарцинома; карцинома из перстневых клеток; инфильтрирующая дуктальная карцинома; медуллярная карцинома; лобулярная карцинома; воспалительная карцинома; болезнь Педжета, молочной железы; ацинарно-клеточная карцинома; аденосквамозная карцинома; аденокарцинома с плоскоклеточной метаплазией; тимома, злокачественная; опухоль стромы яичника, злокачественная; текома, злокачественная; гранулезно-клеточная опухоль, злокачественная; андробластома, злокачественная; карцинома из клеток Сертоли; опухоль из клеток Лейдига, злокачественная; липидоклеточная опухоль, злокачественная; параганглиома, злокачественная; экстрамаммарная параганглиома, злокачественная; феохромоцитома; гломангиосаркома; злокачественная меланома; амеланотическая меланома; меланома поверхностного распространения; злокачественная меланома лентиго; акральные лентигинозные меланомы; нодулярные меланомы; злокачественная меланома в гигантском пигментном невусе; меланома из эпителиоидных клеток; голубой невус, злокачественный; саркома; фибросаркома; фиброзная гистиоцитома злокачественная; миксосаркома; липосаркома; лейомиосаркома; рабдомиосаркома; эмбриональная рабдомиосаркома; альвеолярная рабдомиосаркома; стромальная саркома; смешанная опухоль, злокачественная; смешанная мюллерова опухоль; нефробластома; гепатобластома; карциносаркома; мезенхимома, злокачественная; опухоль Бреннера, злокачественная; филлодная опухоль, злокачественная; синовиальная саркома; мезотелиома, злокачественная; дисгерминома; эмбриональная карцинома; тератома, злокачественная; зоб яичников, злокачественный; хориокарцинома; мезонефрома, злокачественная; гемангиосаркома; гемангиоэндотелиома, злокачественная; саркома Капоши; гемангиоперицитома, злокачественная; лимфангиосаркома; остеосаркома; юкстакортикальная остеосаркома; хондросаркома; хондробластома, злокачественная; мезенхимальная хондросаркома; гигантоклеточная опухоль кости; саркома Юинга; одонтогенная опухоль, злокачественная; амелобластная одонтосаркома; амелобластома, злокачественная; амелобластная фибросаркома; пинеалома, злокачественная; хордома; глиома, злокачественная; эпендимома; астроцитома; протоплазматическая астроцитома; фибриллярная астроцитома; астробластома; глиобластома; олигодендроглиома; олигодендробластома; примитивные нейроэктодермальные опухоли; саркома мозжечка; ганглионевробластома; нейробластома; ретинобластома; обонятельная нейрогенная опухоль; менингиома, злокачественная; нейрофибросаркома; неврилеммома, злокачественная; гранулярно-клеточная опухоль, злокачественная; злокачественная лимфома; болезнь Ходжкина; парагранулема; злокачественная лимфома, мелкая лимфоцитарная; злокачественная лимфома, крупноклеточная, диффузная; злокачественная лимфома, фолликулярная; грибовидный микоз; другие известные неходжкинские лимфомы; В-клеточная лимфома; низкой степени/фолликулярная неходжкинская лимфома (NHL); малые лимфоцитарные (SL) NHL; средней степени/фолликулярная NHL; диффузная NHL средней степени тяжести; иммунобластная NHL высокой степени злокачественности; лимфобластная NHL высокой степени злокачественности; NHL мелких нерасщепленных клеток высокой степени злокачественности; массивное поражение NHL; лимфома из клеток мантии; лимфома, связанная со СПИДом; макроглобулинемия Вальденстрема; злокачественный гистиоцитоз; множественная миелома; саркома тучных клеток; иммунопролиферативное заболевание тонкого кишечника; лейкоз; лимфолейкоз; лейкоз плазматических клеток; эритролейкоз; лимфосаркома клеточный лейкоз; миелоидный лейкоз; базофильный лейкоз; эозинофильный лейкоз; моноцитарный лейкоз; лейкоз тучных клеток; мегакариобластный лейкоз; миелоидная саркома; волосистоклеточный лейкоз; хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); острый миелоидный лейкоз (AML); и хронический миелобластный лейкоз.
[00175] Конкретные варианты осуществления относятся к способам лечения лейкоза. Лейкоз представляет собой рак крови или костного мозга, который характеризуется аномальной пролиферацией (продукцией путем размножения) клеток крови, обычно белых кровяных телец (лейкоцитов). Это часть широкой группы заболеваний, называемых гематологическими новообразованиями. Лейкоз - это широкий термин, охватывающий спектр заболеваний. Клинически и патологически лейкоз подразделяется на острую и хроническую формы.
[00176] В некоторых вариантах осуществления настоящего изобретения NK-клетки доставляют нуждающемуся в этом индивидууму, например, индивидууму, у которого есть рак или инфекция. Затем клетки усиливают иммунную систему человека, чтобы атаковать соответствующие раковые или патогенные клетки. В некоторых случаях человеку вводят одну или несколько доз иммунных клеток. В случаях, когда пациенту вводят две или более доз иммунных клеток, продолжительность между введениями должна быть достаточной, чтобы дать время для размножения у индивидуума, а в конкретных вариантах осуществления интервал между дозами составляет 1, 2, 3, 4, 5, 6, 7 или более дней.
[00177] Некоторые варианты осуществления настоящего изобретения предоставляют способы лечения или профилактики иммуноопосредованного расстройства. В одном из вариантов осуществления субъект страдает аутоиммунным заболеванием. Неограничивающие примеры аутоиммунных заболеваний включают очаговую алопецию, анкилозирующий спондилит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, аутоиммунные заболевания надпочечников, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунный оофорит и орхит, аутоиммунную тромбоцитопению, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, глютеновый дерматит, синдром хронической усталости и иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полинейропатия, синдром Чарджа-Стросса, рубцовый пемфигоид, CREST-синдром, болезнь холодовых агглютининов, болезнь Крона, дискоидную волчанку, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, гломерулонефрит, болезнь Грейвса, Гийена-Барре, тиреоидит Хашимото, идиопатический фиброз легких, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA нейропатию, ювенильный артрит, красный плоский лишай, красную волчанку, болезнь Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, сахарный диабет 1 типа или иммуноопосредованный сахарный диабет, тяжелую миастению, нефротический синдром (например, болезнь минимальных изменений, фокальный гломерулосклероз или мебранозная нефропатия), обыкновенную пузырчатку, пернициозную анемию, узелковый полиартериит, полихондрит, полигландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемия, первичный билиарный цирроз, псориаз, псориатический артрит, феномен Рейно, синдром Рейтера, ревматоидный артрит, саркоидоз, склеродерму, синдром Шегрена, синдром скованного человека, системную красную волчанку, красную волчанку, язвенный колит, увеит, васкулиты (такие как узелковый полиартериит, артериит Такаясу, височный артериит/гигантоклеточный артериит или герпетиформный дерматит васкулит), витилиго и гранулематоз Вегенера. Таким образом, некоторые примеры аутоиммунного заболевания, которое можно лечить с использованием описанных способов, включают, но не ограничиваются этим, рассеянный склероз, ревматоидный артрит, системную красную волчанку, сахарный диабет I типа, болезнь Крона; язвенный колит, тяжелую миастению, гломерулонефрит, анкилозирующий спондилит, васкулит или псориаз. Субъект также может иметь аллергическое заболевание, такое как астма.
[00178] В еще одном варианте осуществления субъект является реципиентом трансплантированного органа или стволовых клеток, и NK-клетки используются для предотвращения и/или лечения отторжения. Трансплантат может представлять собой композитный трансплантат, например ткани лица. NK-клетки можно вводить до трансплантации, одновременно с трансплантацией или после трансплантации. В некоторых вариантах осуществления NK-клетки вводят до трансплантации, например, по меньшей мере за 1 час, по меньшей мере за 12 часов, по меньшей мере за 1 день, по меньшей мере за 2 дня, по меньшей мере за 3 дня, по меньшей мере за 4 дня, по меньшей мере за 5 дней, по меньшей мере за 6 дней, по меньшей мере за 1 неделю, по меньшей мере за 2 недели, по меньшей мере за 3 недели, по меньшей мере за 4 недели или по меньшей мере за за 1 месяц до трансплантации. В одном конкретном неограничивающем примере введение терапевтически эффективного количества NK-клеток происходит за 3-5 дней до трансплантации.
[00179] В некоторых вариантах осуществления субъекту может быть назначена немиелоаблативная лимфодеплетирующая химиотерапия перед терапией NK-клетками. Немиелоаблативная лимфодеплетирующая химиотерапия может быть любой подходящей такой терапией, которую можно вводить любым подходящим путем. Немиелоаблативная лимфодеплецирующая химиотерапия может включать, например, введение циклофосфамида и флударабина, особенно если рак представляет собой меланому, которая может быть метастатической. Типичным способом введения циклофосфамида и флударабина является внутривенный. Подобным образом можно вводить любую подходящую дозу циклофосфамида и флударабина. В конкретных аспектах примерно 60 мг/кг циклофосфамида вводят в течение двух дней, после чего примерно 25 мг/м2 флударабина вводят в течение пяти дней.
[00180] В некоторых вариантах осуществления фактор роста, который способствует росту и активации NK-клеток, вводят субъекту либо одновременно с NK-клетками, либо после NK-клеток. Фактором роста иммунных клеток может быть любой подходящий фактор роста, который способствует росту и активации NK-клеток. Примеры подходящих факторов роста иммунных клеток включают интерлейкин (IL)-2, IL-7, IL-15 и IL-12, которые можно использовать отдельно или в различных комбинациях, таких как IL-2 и IL-7, IL-2 и IL-15, IL-7 и IL-15, IL-2, IL-7 и IL-15, IL-12 и IL-7, IL-12 и IL-15 или IL-12 и IL2.
[00181] Терапевтически эффективные количества NK-клеток можно вводить несколькими путями, включая парентеральное введение, например внутривенную, внутрибрюшинную, внутримышечную, интрастернальную и интраартикулярную инъекцию или инфузию.
[00182] Терапевтически эффективное количество NK-клеток для использования в адоптивной клеточной терапии представляет собой такое количество, которое обеспечивает желаемый эффект у субъекта, подвергаемого лечению. Например, это может быть количество NK-клеток, необходимое для подавления развития или для индукции регрессии аутоиммунного или аллоиммунного заболевания, или которое способно облегчить симптомы, вызванные аутоиммунным заболеванием, такие как боль и воспаление. Это может быть количество, необходимое для облегчения симптомов, связанных с воспалением, таких как боль, отек и повышенная температура. Это также может быть количество, необходимое для уменьшения или предотвращения отторжения трансплантированного органа.
[00183] Популяцию NK-клеток можно вводить в схемах лечения, соответствующих заболеванию, например, одной или несколькими дозами в течение от одного до нескольких дней для улучшения болезненного состояния или периодическими дозами в течение длительного времени для подавления прогрессирования заболевания и предотвращения рецидива заболевания. Точная используемая доза композиции также будет зависеть от пути введения и серьезности заболевания или расстройства, и она должна определяться в соответствии с мнением практикующего врача и обстоятельствами каждого пациента. Терапевтически эффективное количество NK-клеток будет зависеть от субъекта, которого лечат, серьезности и типа расстройства и способа введения. В некоторых вариантах осуществления дозы, которые можно использовать в лечении человека, составляют по меньшей мере 3,8×104, по меньшей мере 3,8×105, по меньшей мере 3,8×106, по меньшей мере 3,8×107, по меньшей мере 3,8×108, по меньшей мере 3,8×109 или по меньшей мере 3,8×1010 NK клеток/м2. В определенном варианте осуществления доза, используемая для лечениия человека, находится в пределах от около 3,8×109 до около 3,8×1010 NK-клеток/м2. В дополнительных вариантах осуществления терапевтически эффективное количество NK-клеток может варьироваться от около 5×106 клеток на кг массы тела до около 7,5×108 клеток на кг массы тела, например от около 2×107 клеток до около 5×108 клеток на кг массы тела или от около 5×107 клеток до около 2×108 клеток на кг массы тела. Точное количество NK-клеток легко определяет специалист в данной области на основании возраста, массы тела, пола и физиологического состояния субъекта. Эффективные дозы можно экстраполировать из кривых доза-ответ, полученных из тест-систем in vitro или на моделях животных.
[00184] NK-клетки можно вводить в комбинации с одним или несколькими другими терапевтическими средствами для лечения иммуноопосредованного расстройства. Комбинированная терапия может включать, но не ограничивается этим, одно или несколько антимикробных средств (например, антибиотики, противовирусные средства и противогрибковые средства), противоопухолевых средств (например, фторурацил, метотрексат, паклитаксел, флударабин, этопозид, доксорубицин или винкристин), иммуннодеплетирующих средств (например, флударабин, этопозид, доксорубицин или винкристин), иммунодепрессантов (например, азатиоприн или глюкокортикоиды, такие как дексаметазон или преднизон), противовоспалительных средств (например, глюкокортикоиды, такие как гидрокортизон, дексаметазон или преднизон, или нестероидные противовоспалительные средства, такие как ацетилсалициловая кислота, ибупрофен или напроксен натрия), цитокинов (например, интерлейкин-10 или трансформирующий фактор роста бета), гормонов (например, эстроген) или вакцину. Кроме того, можно вводить иммуносупрессорные или толерогенные средства, включая, но не ограничиваясь этим, ингибиторы кальциневрина (например, циклоспорин и такролимус); ингибиторы mTOR (например, рапамицин); микофенолят мофетил, антитела (например, распознающие CD3, CD4, CD40, CD154, CD45, IVIG или В-клетки); химиотерапевтические средства (например, метотрексат, треосульфан, бусульфан); облучение; или хемокины, интерлейкины или их ингибиторы (например, BAFF, IL-2, анти-IL-2R, IL-4, ингибиторы киназы JAK). Такие дополнительные лекарственные средства можно вводить до, во время или после введения NK-клеток, в зависимости от желаемого эффекта. Это введение клеток и такого средства можно осуществлять одним и тем же путем или разными путями, и либо в одном месте, либо в разных местах.
В. Фармацевтические композиции
[00185] Также в настоящей заявке представлены фармацевтические композиции и составы, содержащие NK-клетки и фармацевтически приемлемый носитель.
[00186] Фармацевтические композиции и составы, описанные в настоящей заявке, могут быть получены путем смешивания активных ингредиентов (таких как антитело или полипептид), имеющих желаемую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 22nd edition, 2012) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители обычно нетоксичны для реципиентов в используемых дозировках и концентрациях и включают, но не ограничиваются этим: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (PEG). Примеры фармацевтически приемлемых носителей дополнительно включают агенты, диспергирующие лекарственные средства, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например растворимые гликопротеины гиалуронидазы PH-20 человека, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые иллюстративные sHASEGP и способы использования, включая rHuPH20, описаны в патентных публикациях США №№ 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP комбинируют с одной или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
С. Комбинированные терапии
[00187] В некоторых вариантах осуществления композиции и способы вариантов осуществления изобретения включают NK-клеточную популяцию в комбинации с по меньшей мере одной дополнительной терапией. Дополнительная терапия модут представлять собой лучевую терапию, хирургическую операцию (например, лампэктомию и мастэктомию), химиотерапию, генную терапию, ДНК терапию, вирусную терапию, РНК терапию, иммунотерапию, трансплантацию костного мозга, нанотерапию, терапию на основе моноклональных антител или комбинацию вышеуказанных. Дополнительная терапия может быть в форме адъювантной или неоадъювантной терапии.
[00188] В некоторых вариантах осуществления дополнительная терапия представляет собой введение низкомолекулярного ферментативного ингибитора или антиметастатического средства. В некоторых вариантах осуществления дополнительная терапия представляет собой введение средств, ограничивающих побочные эффекты (например, средств, предназначенных для уменьшения возникновения и/или тяжести побочных эффектов лечения, таких как средства против тошноты и т.д.). В некоторых вариантах осуществления дополнительная терапия представляет собой лучевую терапию. В некоторых вариантах осуществления дополнительная терапия представляет собой хирургическое вмешательство. В некоторых вариантах осуществления дополнительная терапия представляет собой комбинацию лучевой терапии и хирургического вмешательства. В некоторых вариантах осуществления дополнительная терапия представляет собой гамма-облучение. В некоторых вариантах осуществления дополнительная терапия представляет собой терапию, таргетирующую PBK/AKT/mTOR путь, ингибитор HSP90, ингибитор тубулина, ингибитор апоптоза и/или химиопрофилактическое средство. Дополнительная терапия может представлять собой одно или несколько химиотерапевтических средств, известных в данной области.
[00189] NK-клеточную терапию можно вводить до, во время, после или в различных комбинациях относительно дополнительной терапии рака, такой как терапия иммунных контрольных точек. Введение можно осуществлять одновременного или с интервалами от нескольких минут, до нескольких дней и недель. В вариантах осуществления, где иммунную клеточную терапию вводят пациенту отдельно от дополнительного терапевтического средства, обычно можно убедиться, что не истек значительный период времени между каждой доставкой, чтобы два соединения все еще были способны к обеспечению полезного комбинированного эффекта для пациента. В таких случаях предполагается, что можно обеспечить пациенту терапию антителами и противораковую терапию с интервалом в пределах около 12 до 24 или 72 часов друг от друга и, более конкретно, в пределах около 6-12 часов друг от друга. В некоторых ситуациях может быть желательно значительно продлить период лечения, когда делают перерыв от нескольких дней (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8) между соответствующими введениями.
[00190] Можно использовать различные комбинации. Ниже представлен пример, где NK клеточная терапия обозначена как “A”, а противораковая терапия обозначена как “B”:
A/B/A B/A/B B/B/A A/A/B A/B/B B/A/A A/B/B/B B/A/B/B
B/B/B/A B/B/A/B A/A/B/B A/B/A/B A/B/B/A B/B/A/A
B/A/B/A B/A/A/B A/A/A/B B/A/A/A A/B/A/A A/A/B/A
[00191] Для введения пациенту любого соединения или терапии в соответствии с вариантами осуществления изобретения следуют общим протоколам для введения таких соединений, принимая во внимание токсичность, если она имеется, таких средств. Поэтому в некоторых вариантах осуществления присутствует стадия мониторинга токсичности, связанной с комбинированной терапией.
1. Химиотерапия
[00192] В соответствии с вариантами осуществления изобретения, можно использовать широкий спектр химиотерапевтических средств. Термин «химиотерапия» относится к применению лекарственных средств для лечения рака. «Химиотерапевтическое средство» используется для обозначения соединения или композиции, которые вводят для лечения рака. Эти средства или лекарственные средства классифицируются по способу их активности в клетке, например, влияют ли они на клеточный цикл и на какой стадии. Альтернативно, средство может быть охарактеризовано на основании его способности непосредственно сшивать ДНК, интеркалировать в ДНК или вызывать хромосомные и митотические аберрации, влияя на синтез нуклеиновых кислот.
[00193] Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбохон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (особенно криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; а саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамин оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид и урацилиприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как эндииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма lI и калихеамицин омега I1); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарзиностатина и родственные хромопротеин ендиин антибиотические хромофоры, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаларницин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин и зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, птероптерин и триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн и тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин и флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан и тестолактон; антиадренергические средства, такие как митотан и трилостан; восполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK полисахаридный комплекс; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (особенно токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ара-С»); циклофосфамид; таксоиды, например паклитаксел и доцетаксел гемцитабин; 6-тиогуанин; меркаптопурин; координационные комплексы платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (например, CPT-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; карбоплатин, прокарбазин, пликомицин, гемцитабиен, навелбин, ингибиторы фарнезилпротеинтансферазы, трансплатина и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных.
2. Лучевая терапия
[00194] Другие факторы, которые вызывают повреждение ДНК и широко используются, включают так называемые гамма-лучи, рентгеновские лучи и/или направленную доставку радиоизотопов к опухолевым клеткам. Также рассматриваются другие формы ДНК- повреждающих факторов, такие как микроволны, облучение протонным пучком (патенты США №№ 5760395 и 4870287) и УФ-облучение. Наиболее вероятно, что все эти факторы вызывают широкий спектр повреждений ДНК, предшественников ДНК, репликации и репарации ДНК, а также сборки и поддержания хромосом. Диапазоны дозировки рентгеновских лучей варьируются от ежедневных доз от 50 до 200 рентген в течение продолжительных периодов времени (от 3 до 4 недель) до разовых доз от 2000 до 6000 рентген. Диапазоны дозировки радиоизотопов широко варьируются и зависят от периода полураспада изотопа, силы и типа испускаемого излучения, а также от поглощения неопластическими клетками.
3. Иммунотерапия
[00195] Квалифицированный специалист поймет, что дополнительные иммунотерапии можно использовать в комбинации или в сочетании со способами вариантов осуществления. В контексте лечения рака иммунотерапия, как правило, полагается на использование иммунных эффекторных клеток и молекул для таргетирования и разрушения раковых клеток. Ритуксимаб (RITUXAN®) является таким примером. Иммунный эффектор может представлять собой, например, антитело, специфическое в отношении некоторого маркера на поверхности опухолевой клетки. Антитело как таковое может служить в качестве эффектора терапии или может рекрутировать другие клетки, чтобы реально влиять на киллинг клеток. Антитело также может быть конъюгировано с лекарственным средством или токсином (химиотерапевтическим средством, радионуклидом, цепью рицина A, холерным токсином, коклюшевым токсином и т.д.) и служить в качестве нацеливающего агента. Альтернативно, эффектором может быть лимфоцит, несущий поверхностную молекулу, которая непосредственно или опосредованно взаимодействует с опухолевой клеткой-мишенью. Различные эффекторные клетки включают цитотоксические Т-клетки и NK-клетки.
[00196] Конъюгаты антитело-лекарственное средство стали революционным подходом к разработке терапевтических средств против рака. Рак является одной из основных причин смерти в мире. Конъюгаты антитело-лекарство (ADC) содержат моноклональные антитела (MAb), которые ковалентно связаны с лекарственными средствами, убивающими клетки. Этот подход сочетает в себе высокую специфичность MAb против их антигенных мишеней с высокоэффективными цитотоксическими лекарственными средствами, в результате чего получают «вооруженные» MAb, которые доставляют полезную нагрузку (лекарство) к опухолевым клеткам с повышенными уровнями антигена. Целенаправленная доставка лекарственного средства также сводит к минимуму его воздействие на нормальные ткани, что приводит к снижению токсичности и улучшению терапевтического индекса. Одобрение FDA двух ADC препаратов, ADCETRIS® (брентуксимаб ведотин) в 2011 году и KADCYLA® (трастузумаб эмтанзин или T-DM1) в 2013 году, подтвердило правильность этого подхода. В настоящее время существует более 30 ADC лекарственных средств-кандидатов на различных стадиях клинических испытаний для лечения рака (Leal et al., 2014). По мере развития инженерных методов создания антител и оптимизации линкер-полезная нагрузка открытие и разработка новых ADC все больше зависит от идентификации и валидации новых мишеней, которые подходят для этого подхода, и создания таргетирующих MAb. Двумя критериями для ADC мишеней являются повышенная регуляция/высокий уровень экспрессии в опухолевых клетках и стабильная интернализация.
[00197] В одном аспекте иммунотерапии опухолевая клетка должна нести какой-либо маркер, подлежащий таргетированию, т.е. который не присутствует на большинстве других клеток. Существует множество опухолевых маркеров, и любой из них может подходить для таргетирования в контексте представленных вариантов осуществления. Обычные опухолевые маркеры включают CD20, карциноэмбриональный антиген, тирозиназу (p97), gp68, TAG-72, HMFG, сиалил-антиген Льюиса, MucA, MucB, PLAP, рецептор ламинина, erb B и p155. Альтернативным аспектом иммунотерапии является сочетание противоопухолевых эффектов с иммуностимулирующими эффектами. Также существуют иммуностимулирующие молекулы, включающие цитокины, такие как IL-2, IL-4, IL-12, GM-CSF, гамма-IFN, хемокины, такие как MIP-1, MCP-1, IL-8 и факторы роста, такие как FLT3 лиганд.
[00198] Примеры иммунотерапий, которые в настоящее время находятся на стадии исследования или уже применяются, включают иммунные адъюванты, например, Mycobacterium bovis, Plasmodium falciparum, динитрохлорбензол и ароматические соединения (Патенты США №№ 5801005 и 5739169; Hui and Hashimoto, 1998; Christodoulides et al., 1998); цитокиновую терапию, например, интерфероны α, β и γ, IL-1, GM-CSF и TNF (Bukowski et al., 1998; Davidson et al., 1998; Hellstrand et al., 1998); генную терапию, например, TNF, IL-1, IL-2 и p53 (Qin et al., 1998; Austin-Ward and Villaseca, 1998; Патенты США №№ 5830880 и 5846945); и моноклональные антитела, например, анти-CD20, анти-ганглиозид GM2 и анти-p185 (Hollander, 2012; Hanibuchi et al., 1998; Патент США № 5824311). Предусматривается, что одну или несколько противораковых терапий можно использовать с терапиями на основе антител, описанными в настоящей заявке.
[00199] В некоторых вариантах осуществления иммунотерапия может представлять собой ингибитор иммунных контрольных точек. Иммунные контрольные точки либо активируют сигнал (например, костимулирующие молекулы), либо уменьшают сигнал. Ингибирующие иммунные контрольные точки, которые можно таргетировать, блокируя иммунные контрольные точки, включают аденозиновый рецептор A2A (A2AR), B7-H3 (также известный как CD276), аттенюатор B- и T-лимфоцитов (BTLA), цитотоксический T-лимфоцит-ассоциированный белок 4 (CTLA-4), также известный как CD152), индоламин-2,3-диоксигеназу (IDO), иммуноглобулин киллерных клеток (KIR), ген активации лимфоцитов-3 (LAG3), белок 1 запрограммированной гибели клетки (PD-1), домен Т-клеточного иммуноглобулина и муциновый домен 3 (TIM-3) и V-домен Ig супрессор активации Т-клеток (VISTA). В частности, ингибиторы иммунных контрольных точек таргетируют PD-1 ось и/или CTLA-4.
[00200] Ингибиторы иммунных контрольных точек могут представлять собой лекарственные ссредства, такие как малые молекулы, рекомбинантные формы лиганда или рецепторов, или, в частности, антитела, такие как человеческие антитела (например, международная патентная публикация WO2015016718; Pardoll, Nat Rev Cancer, 12 (4): 252-64, 2012; оба включены в настоящую заявку посредством ссылки). Можно использовать известные ингибиторы белков иммунных контрольных точек или их аналоги, в частности, можно использовать химеризованные, гуманизированные или человеческие формы антител. Как известно специалистам, для определенных антител, указанных в настоящем описании, могут использоваться альтернативные и/или эквивалентные названия. Такие альтернативные и/или эквивалентные названия взаимозаменяемы в контексте настоящего раскрытия. Например, известно, что ламбролизумаб также известен под альтернативными и эквивалентными названиями MK-3475 и пембролизумаб.
[00201] В некоторых вариантах осуществления антагонист связывания PD-1 представляет собой молекулу, которая ингибирует связывание PD-1 с его лиганд-связывающими партнерами. В конкретном аспекте PD-1 лиганд-связывающими партнерами являются PDL1 и/или PDL2. В другом варианте осуществления антагонист связывания PDL1 представляет собой молекулу, которая ингибирует связывание PDL1 с его партнерами по связыванию. В конкретном аспекте партнерами по связыванию PDL1 являются PD-1 и/или B7-1. В другом варианте осуществления антагонист связывания PDL2 представляет собой молекулу, которая ингибирует связывание PDL2 с его партнерами по связыванию. В конкретном аспекте партнером по связыванию PDL2 является PD-1. Антагонист может представлять собой антитело, его антиген-связывающий фрагмент, иммуноадгезин, слитый белок или олигопептид. Типичные антитела описаны в патентах США №№ US8735553, US8354509 и US8008449, все они включены в настоящую заявку посредством ссылки. Другие антагонисты оси PD-1 для использования в способах, представленных в настоящей заявке, известны в данной области, например, описанные в патентных заявках США № US 20140294898, US 2014022021 и US20110008369, все они включены в настоящую заявку посредством ссылки.
[00202] В некоторых вариантах осуществления антагонист связывания PD-1 представляет собой анти-PD-1 антитело (например, человеческое антитело, гуманизированное антитело или химерное антитело). В некоторых вариантах осуществления анти-PD-1 антитело выбрано из группы, состоящей из ниволумаба, пембролизумаба и CT-011. В некоторых вариантах осуществления антагонист связывания PD-1 представляет собой иммуноадгезин (например, иммуноадгезин, содержащий внеклеточную или связывающую PD-1 часть PDL1 или PDL2, слитую с константной областью (например, Fc областью последовательности иммуноглобулина). В некоторых вариантах осуществления изобретения антагонист связывания PD-1 представляет собой AMP-224. Ниволумаб, также известный как MDX-1106-04, MDX-1106, ONO-4538, BMS-936558 и OPDIVO®, представляет собой анти-PD-1 антитело, описанное в WO2006/121168. Пембролизумаб, также известный как MK-3475, Merck 3475, ламбролизумаб, KEYTRUDA® и SCH-900475, представляет собой анти-PD-1 антитело, описанное в WO2009/114335. CT-011, также известный как hBAT или hBAT-1, представляет собой анти-PD-1 антитело, описанное в WO2009/101611. AMP-224, также известный как B7-DCIg, представляет собой растворимый слитый рецептор PDL2-Fc, описанный в WO2010/027827 и WO2011/066342.
[00203] Другой иммунной контрольной точкой, которую можно таргетировать в способах, представленных в настоящей заявке, является цитотоксический T-лимфоцит-ассоциированный белок 4 (CTLA-4), также известный как CD152. Полная последовательность кДНК человеческого CTLA-4 имеет регистрационный номер в Genbank L15006. CTLA-4 находится на поверхности Т-клеток и действует как «выключатель» при связывании с CD80 или CD86 на поверхности антигенпрезентирующих клеток. CTLA4 является членом суперсемейства иммуноглобулинов, которое экспрессируется на поверхности Т-хелперов и передает тормозящий сигнал Т-клеткам. CTLA4 подобен костимулирующему белку Т-клеток, CD28, и обе молекулы связываются с CD80 и CD86, также называемыми B7-1 и B7-2 соответственно, на антигенпрезентирующих клетках. CTLA4 передает ингибиторный сигнал Т-клеткам, тогда как CD28 передает стимулирующий сигнал. Внутриклеточный CTLA4 также обнаруживается в регуляторных Т-клетках и может иметь важное значение для их функции. Активация Т-клеток через Т-клеточный рецептор и CD28 приводит к повышенной экспрессии CTLA-4, ингибиторного рецептора для молекул B7.
[00204] В некоторых вариантах осуществления ингибитор иммунной контрольной точки представляет собой анти-CTLA-4 антитело (например, человеческое антитело, гуманизированное антитело или химерное антитело), его антигенсвязывающий фрагмент, иммуноадгезин, слитый белок или олигопептид
[00205] Антитела против человеческого CTLA-4 (или происходящие из них домены VH и/или VL), подходящие для использования в способах по изобретению, можно получить с использованием способов, хорошо известных в данной области. Альтернативно, можно использовать признанные в данной области анти-CTLA-4 антитела. Например, анти-CTLA-4 антитела, раскрытые в US 8119129, WO 01/14424, WO 98/42752; WO 00/37504 (CP675206, также известное как тремелимумаб; ранее тицилимумаб), патенте США №6207156; Hurwitz et al. (1998) Proc Natl Acad Sci USA 95 (17): 10067-10071; Camacho et al. (2004) J Clin Oncology 22(145): Abstract No. 2505, можно использовать в способах, раскрытых в настоящей заявке. Раскрытие каждой из вышеуказанных публикаций включено в настоящую заявку посредством ссылки. Также можно использовать антитела, которые конкурируют с любыми из этих признанных в данной области антител за связывание с CTLA-4. Например, гуманизированное антитело к CTLA-4 описано в международной патентной заявке № WO2001014424, WO2000037504 и патенте США № 8017114; все включены в настоящую заявку посредством ссылки.
[00206] Примером анти-CTLA-4 антитела является ипилимумаб (также известный как 10D1, MDX-010, MDX-101 и Yervoy®) или его антигенсвязывающие фрагменты и их варианты (см., например, WO 01/14424). В других вариантах осуществления антитело включает CDR или VR тяжелой и легкой цепей ипилимумаба. Соответственно, в одном варианте осуществления антитело включает домены CDR1, CDR2 и CDR3 области VH ипилимумаба и домены CDR1, CDR2 и CDR3 области VL ипилимумаба. В другом варианте осуществления антитело конкурирует за связывание и/или связывается с тем же эпитопом на CTLA-4, что и вышеуказанные антитела. В другом варианте осуществления антитело имеет по меньшей мере около 90% идентичности аминокислотной последовательности вариабельной области с вышеуказанными антителами (например, по меньшей мере около 90%, 95% или 99% идентичности вариабельной области с ипилимумабом).
[00207] Другие молекулы для модуляции CTLA-4 включают лиганды и рецепторы CTLA-4, такие как описанные в патентах США №№ US5844905, US5885796 и международных патентных заявках WO1995001994 и WO1998042752; все включены в настоящую заявку посредством ссылки, и иммуноадгезины, такие как описанные в патенте США № US8329867, включенном в настоящую заявку посредством ссылки.
4. Хирургическое вмешательство
[00208] Приблизительно 60% людей с раком должны подвергаться хирургическому вмешательству того или иного типа, которое включает профилактическую, диагностическую или стадийную, лечебную и паллиативную хирургию. Лечебная хирургия включает резекцию, при которой вся или часть раковой ткани физически удаляется, иссекается и/или разрушается, и может использоваться в сочетании с другими методами лечения, такими как лечение в соответствии с вариантами осуществления настоящего изобретения, химиотерапия, лучевая терапия, гормональная терапия, генная терапия, иммунотерапия и/или альтернативные методы лечения. Резекция опухоли означает физическое удаление по меньшей мере части опухоли. Помимо резекции опухоли, хирургическое лечение включает лазерную хирургию, криохирургию, электрохирургию и хирургию под микроскопом (хирургия Мооса).
[00209] После удаления части или всех раковых клеток, ткани или опухоли в теле может образоваться полость. Лечение можно осуществлять путем перфузии, прямой инъекции или местного нанесения на область с дополнительной противораковой терапией. Такое лечение можно повторять, например, через каждые 1, 2, 3, 4, 5, 6 или 7 дней, или через каждые 1, 2, 3, 4 и 5 недель, или через каждые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев. Эти лечения также можно применять в различных дозировках.
5. Другие средства
[00210] Предполагается, что можно использовать другие средства в комбинации с некоторыми аспектами представленных вариантов осуществления для улучшения терапевтической эффективности лечения. Эти дополнительные средства включают средства, которые влияют на активацию рецепторов клеточной поверхности и щелевые соединения клеток, цитостатические и дифференцирующие средства, ингибиторы клеточной адгезии, средства, повышающие чувствительность гиперпролиферативных клеток к индукторам апоптоза, или другие биологические средства. Усиление межклеточной передачи сигналов за счет увеличения числа щелевых соединений клеток может усиливать антигиперпролиферативные эффекты на соседнюю популяцию гиперпролиферативных клеток. В других вариантах осуществления цитостатические или дифференцирующие средства можно использовать в сочетании с некоторыми аспектами представленных вариантов осуществления для улучшения антигиперпролиферативной эффективности лечения. Предполагается, что ингибиторы клеточной адгезии улучшат эффективность вариантов осуществления настоящего изобретения. Примерами ингибиторов клеточной адгезии являются ингибиторы киназы фокальной адгезии (FAK) и ловастатин. Также предполагается, что другие средства, которые повышают чувствительность гиперпролиферативной клетки к апоптозу, такие как антитело c225, можно использовать в сочетании с некоторыми аспектами вариантов осуществления настоящего изобретения для повышения эффективности лечения.
V. Готовые изделия или наборы
[00211] В настоящей заявке также представлены готовое изделие или набор, включающие NK-клетки. Изделие или набор могут дополнительно содержать вкладыш в упаковку, содержащий инструкции по применению NK-клеток для лечения или замедления прогрессирования рака у индивидуума или для усиления иммунной функции индивидуума, страдающего раком. Любые антиген-специфические NK-клетки, описанные в настоящей заявке, могут быть включены в изделие или наборы. Подходящие контейнеры включают, например, бутыли, флаконы, пакеты и шприцы. Контейнер может быть изготовлен из различных материалов, таких как стекло, пластик (например, поливинилхлорид или полиолефин) или металлический сплав (например, нержавеющая сталь или хастеллой). В некоторых вариантах осуществления контейнер содержит препарат, и этикетка на контейнере или связанная с ним может содержать указания по применению. Изделие или набор могут дополнительно включать другие материалы, желательные с коммерческой точки зрения и с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши в упаковки с инструкциями по применению. В некоторых вариантах осуществления изделие дополнительно включает одно или несколько других средств (например, химиотерапевтическое средство и противоопухолевое средство). Подходящие контейнеры для одного или нескольких средств включают, например, бутыли, флаконы, пакеты и шприцы.
VI. Примеры
[00212] Следующие примеры включены для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам в данной области техники должно быть понятно, что способы, раскрытые в примерах, которые следуют ниже, представляют способами, обнаруженные автором изобретения как хорошо функционирующие при практическом применении изобретения, и, таким образом, могут рассматриваться как составляющие предпочтительные способы для его осуществления. Однако специалистам в данной области техники, в свете настоящего раскрытия, должно быть понятно, что многие изменения могут быть внесены в конкретные раскрытые варианты осуществления с получением при этом такого же или аналогичного результата без отступления от сущности и объема изобретения.
Пример 1 - Экспансия NK-клеток
[00213] NK-клетки были изучены как потенциальные противоопухолевые эффекторы, однако ряд барьеров ограничивает их терапевтическое применение, в основном из-за их небольшого количества, требующего экспансии ex vivo для адоптивной иммунотерапии. Чаще всего используются NK-клетки периферической крови (PB-NK-клетки) пациента или взрослых аллогенных доноров; однако этот подход требует совместимости согласного донора минимум по 3 из 6 HLA молекул с реципиентом для прохождения лейкафереза. Другим недостатком взрослых PB NK-клеток является субоптимальная пролиферация и устойчивость in vivo после адоптивного переноса.
[00214] Настоящие исследования показали, что NK-клетки, полученные из CB, могут иметь уникальные преимущества, связанные с более высокой экспрессией генов, вовлеченных в клеточную пролиферацию, клеточную активацию, клеточную адгезию, клеточный цикл и репликацию ДНК (Фиг. 1A-1E). Таким образом, был разработан протокол быстрой экспансии, совместимый с GMP, для размножения NK-клеток, происходящих из CB, с использованием сконструированных фидерных клеток, таких как фидерные клетки, экспрессирующие 4-1 лиганд BB, IL21 или IL-15, и лигандов для активации NK костимулирующих молекул, таких как CD48 или CSI.
[00215] NK-клетки выделяли и размножали из замороженной и размороженной единицы CB или из свежей единицы CB, выбранной из клинического банка CB. Уникальным аспектом настоящей стратегии является то, что нет необходимости в HLA совместимости между донором и реципиентом, что позволяет получить действительно готовый продукт для клеточной терапии. По возможности, CB единицу выбирают на основании несовместимости KIR-лиганда с реципиентом.
Как показано на фиг. 2, в течение 2-недельного периода культивирования была достигнута медианная 803-кратная экспансия (диапазон 346-5547), что значительно выше, чем экспансия, достигаемая с использованием PB NK-клеток (медианное значение 380, диапазон 99-1515; P=0,036), указывая на собственные пролиферативные свойства CB-NK-клеток. RE-CB NK-клетки демонстрируют функциональный фенотип (Фиг. 3) без признаков истощения, о чем свидетельствует высокая экспрессия перфорина и гранзима и отсутствие экспрессии CD57, KLRG1 и PD1.
[00217] NK-клетки RE-CB были высоко цитотоксичными против опухолевых клеточных линий in vitro и индуцировали сильную противоопухолевую активность у иммунодефицитных мышей после облучения, Фиг. 4. Кроме того, продукты RE-CB NK-клеток (совместимые по 1-5 из 6 HLA аллелей) вводили более чем 60 пациентам с гематологическими злокачественными заболеваниями после химиотерапии высокими дозами с использованием терапии спасения аутологичными стволовыми клетками, миелоаблативной, немиелоаблативной или пониженной интенсивности химиотерапии с трансплантацией аллогенных стволовых клеток и последующей лимфодеплецирующей химиотерапией на основе флударабина, и не было выявлено болезни трансплантат против хозяина или другой токсичности.
[00218] Способы по настоящему изобретению были оптимизированы для сокращения времени и логистики, необходимых для культивирования, и снижения стоимости процедур. Оптимизация включала увеличение объема среды и, таким образом, снижение концентрации клеток. Как показано в Таблице 2A для первых семи дней культивирования и в Таблице 2B для второй недели культивирования, значительно лучшее кратное увеличение было достигнуто с большим объемом среды и пониженной концентрацией клеток (G-Rex100M) по сравнению с меньшим количеством среды и более высокой концентрацией клеток (G-Rex100). Для оптимизированной процедуры требовалось меньше биореакторов и меньше клеток для генерации такой же или более высокой дозы NK-клеток. Это показано в день 7, когда для засева каждой G-Rex 100M для достижения той же дозы требовалось в четыре раза меньше клеток. В день 0-7 не требовалось никакого вмешательства в культуры (по сравнению с подпиткой по меньшей мере два раза при использовании предыдущей процедуры).
[00219] При оптимизированной процедуре в дни 7-14 клетки не требовали разделения, и подпитку осуществляли только два раза. Использовали меньше сред и цитокинов, и технологическое время сокращалось, что позволило сэкономить деньги и улучшить логистику. Кроме того, потребность во вмешательстве в культивирование в дни 7-14 была минимальной (только IL2 добавляли дважды), что не только экономит технологическое время, но и заметно снижает вероятность микробного заражения. Это контрастировало с большинством существующих процедур размножения NK-клеток, используемых в настоящее время, когда культуры часто разделяют через день с многократной подпиткой, что увеличивает риск микробного заражения. Как показано в Таблице 2C, оптимизированный подход сокращал технологическое время на 29%.
День 0-7 (CB-NK)
День 7-14
[00220] В дополнение к оптимизированной логистике культивирования, стоимости и снижению риска микробного заражения, предлагаемый способ имеет несколько других новых и важных особенностей. Как показано на Фиг. 2, в течение 2-недельного периода культивирования было достигнуто медианное 803-кратное увеличение (диапазон 346-5547), что было значительно выше, чем при использовании PB NK-клеток (медианное значение 380, диапазон 99-1515; P=0,036), что указывает на присущие клеткам CB-NK пролиферативные свойства. RE-CB NK-клетки проявляли функциональный фенотип Фиг. 3, без признаков «истощения», о чем свидетельствует высокая экспрессия перфорина и гранзима и отсутствие экспрессии CD57, KLRG1 и PD1. RE-CB NK-клетки были высоко цитотоксичными против опухолевых клеточных линий in vitro и индуцировали сильную противоопухолевую активность у иммунодефицитных мышей после облучения (Фиг. 4). Кроме того, быстрорастущие (RE)-CB NK-клеточные продукты (совместимые по 1-5 из 6 HLA аллелей) вводили более чем 80 пациентам с гематологическими злокачественными заболеваниями после химиотерапии высокими дозами с использованием терапии спасения аутологичными стволовыми клетками, миелоаблативной, немиелоаблативной или пониженной интенсивности химиотерапии с трансплантацией аллогенных стволовых клеток и последующей лимфодеплецирующей химиотерапией на основе флударабина, и не было выявлено болезни трансплантат против хозяина или другой токсичности. В частности, 60 пациентов с множественной миеломой безопасно получили клетки CB-NK в сочетании с химиотерапией (мелфалан и леналидомид) и аутологичной трансплантацией. Как показано в Таблице 3, у 42 пациентов с множественной миеломой (ММ) и пациентов с ММ высокого риска, которые получали CB NK-клетки (включенные в исследование 2011-0379), наблюдали более высокий≥очень хороший частичный ответ (VGPR) и полный ответ (CR) по сравнению с 153 пациентами с MM и HRMM, которые получали стандартное лечение (SOC) с мелфаланом и аутотрансплантацией.
Доля положительно отвечающих пациентов с множественной миеломой (MM) и множественной миеломой высокого риска (HRMM)
(2011-0379 vs. SOC)
(2011-0379 vs. SOC)
Моноклональное антитело элотузамаб стимулирует NK-клетки, а также нацеливает их на клетки множественной миеломы, как показано ниже:
• Элотузумаб усиливает антитело-зависимую клеточную цитотоксичность NK-клеток (ADCC) посредством CD16 связывания и прямого лигирования SLAMF7 на NK-клетках
• Ex vivo размноженные NK-клетки показывают более высокую элотузумаб-опосредованную цитотоксичность по сравнению с неразмноженными клетками
• Добавление элотузумаба к леналидомиду еще более усиливает CB-NK ADCC против SLAMF7hi NK-клеточно-резистентных миеломных клеточных линий
[00222] На основании этих данных элотузамаб добавляли к химиотерапевтическому препарату (мелфалан и ленолидамид), и еще 15 пациентов с HRMM принимали лечение CB NK-клетками. Как показано в Таблице 4, по сравнению с пациентами, которые не получали NK-клетки, ≥VGPR и CR уровни были выше для этих пациентов с высоким риском, получавших NK-клетки, и даже выше для тех, кто получал NK-клетки плюс элотузамаб. Процент отрицательного ответа в отношении минимальной остаточной болезни (MRD) на 100-й день при биопсии костного мозга также был выше для обеих групп, получавших NK-клетки. На сегодняшний день все 15 пациентов живы, и только у одного есть признаки прогрессирующей миеломы через год после трансплантации; это был один из немногих пациентов, которые были MRD-положительными в костном мозге на 100-й день. У четырнадцати из 15 пациентов не было прогрессирования. Очевидно, что терапия на основе CB NK в соответствии с настоящим изобретением эффективна для пациентов с множественной миеломой высокого риска.
Доля положительно отвечающих пациентов, принимающих NK-клетки с или без элотузамаба
D100
(n=66)
без Elo (n=15)
с Elo (n=15)
[00223] В другом исследовании (2015-0751) 14 пациентов с рефрактерной/рецидивирующей неходжкинской лимфомой получали размноженные CB NK-клетки без учета HLA-совместимости с пациентом. Все эти пациенты получили CB NK-клетки безопасно, без инфузионной или другой токсичности и без GVHD. Более половины из этих рефрактерных пациентов (57%) достигли полной ремиссии и остаются без прогрессирования в течение года после этого лечения. Эти результаты подчеркивают тот факт, что эти CB NK-клетки можно использовать в качестве готовых продуктов без необходимости трудоемкого и дорогостоящего HLA-типирования пациента или CB единиц. В третьем испытании (2012-0819) 19 пациентов получали CB NK-клетки в сочетании с аллотрансплантатом. Эти пациенты очень хорошо переносили эти клеточные продукты и, по-видимому, имели меньше рецидивов лейкоза, чем пациенты, которых лечили аналогичным образом, но без CB NK-клеток. Эти данные демонстрируют безопасность и эффективность размноженных CB NK-клеток в нескольких различных клинических условиях.
[00224] Таким образом, способы по настоящему изобретению можно использовать для размножения NK-клеток из пуповинной крови для достижения клинической дозы, соответствующей GMP.
[00225] Все способы, раскрытые и заявленные в настоящей заявке, могут быть реализованы и осуществлены без излишнего экспериментирования в свете настоящего раскрытия. Хотя композиции и способы по настоящему изобретению были описаны на примере предпочтительных вариантов осуществления, специалистам в данной области будет очевидно, что возможны изменения способов и стадий или последовательности стадий способа, описанного в настоящей заявке, без отклонения от концепции, сущности и объема изобретения. Более конкретно, должно быть очевидно, что некоторые вещества, которые являются как химически, так и физиологически родственными, могут быть заменены веществами, описанными в настоящей заявке, с достижением при этом таких же или аналогичных результатов. Все такие аналогичные замены и модификации, очевидные для специалистов в данной области техники, считаются находящимися в пределах сущности, объема и концепции изобретения, определенного прилагаемой формулой изобретения.
Литература
Следующие ссылочные документы в той степени, в которой они обеспечивают иллюстративные процедуры или другие детали дополнительно к тем, которые описаны в настоящей заявке, специально включены в настоящую заявку посредством ссылки.
Austin-Ward and Villaseca, Revista Medica de Chile, 126(7):838-845, 1998.
Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, NY, 1994.
Bennekov et al., Mt. Sinai J. Med. 71 (2): 86-93, 2004.
Bukowski et al., Clinical Cancer Res., 4(10):2337-2347, 1998.
Camacho et al. J Clin Oncology 22(145): Abstract No. 2505 (antibody CP-675206), 2004.
Chothia et al., EMBO J. 7:3745, 1988.
Christodoulides et al., Microbiology, 144(Pt 11):3027-3037, 1998.
Cohen et al. J Immunol. 175:5799-5808, 2005.
Davidson et al., J. Immunother., 21(5):389-398, 1998.
Davila et al. PLoS ONE 8(4): e61338, 2013.
Европейская патентная заявка № EP2537416
Fedorov et al., Sci. Transl. Medicine, 5(215), 2013.
Frolet et al., BMC Microbiol. 10:190 (2010).
Gaj et al., Trends in Biotechnology 31(7), 397-405, 2013.
Hanibuchi et al., Int. J. Cancer, 78(4):480-485, 1998.
Heemskerk et al. Hum Gene Ther. 19:496-510, 2008.
Hellstrand et al., Acta Oncologica, 37(4):347-353, 1998.
Hollander, Front. Immun., 3:3, 2012.
Hui and Hashimoto, Infection Immun., 66(11):5329-5336, 1998.
Hurwitz et al. Proc Natl Acad Sci USA 95(17): 10067-10071, 1998.
Международная патентная публикация № WO1995001994.
Международная патентная публикация № WO1998042752.
Международная патентная публикация № WO2000037504.
Международная патентная публикация № WO200014257.
Международная патентная публикация № WO2001014424.
Международная патентная публикация № WO2006/121168.
Международная патентная публикация № WO2007/103009.
Международная патентная публикация № WO2009/101611.
Международная патентная публикация № WO2009/114335.
Международная патентная публикация № WO2010/027827.
Международная патентная публикация № WO2011/066342.
Международная патентная публикация № WO2012/129514.
Международная патентная публикация № WO2013/071154.
Международная патентная публикация № WO2013/123061.
Международная патентная публикация № WO2013/166321.
Международная патентная публикация № WO2013126726.
Международная патентная публикация № WO2014/055668.
Международная патентная публикация № WO2014031687.
Международная патентная публикация № WO2015016718.
Международная патентная публикация № WO99/40188.
Janeway et al, Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 433, 1997.
Johnson et al. Blood 114:535-46, 2009.
Jores et al., PNAS U.S.A. 87:9138, 1990.
Kim et al., Nature Biotechnology 31, 251-258, 2013.
Leal, M., Ann N Y Acad Sci 1321, 41-54, 2014.
Lefranc et al., Dev. Comp. Immunol. 27:55, 2003.
Linnemann, C. et al. Nat Med 21, 81-85, 2015.
Lockey et al., Front. Biosci. 13:5916-27, 2008.
Loewendorf et al., J. Intern. Med. 267(5):483-501, 2010.
Marschall et al., Future Microbiol. 4:731-42, 2009.
Mokyr et al. Cancer Res 58:5301-5304, 1998.
Pardoll, Nat Rev Cancer, 12(4): 252-64, 2012
Parkhurst et al. Clin Cancer Res. 15: 169-180, 2009.
Qin et al., Proc. Natl. Acad. Sci. USA, 95(24):14411-14416, 1998.
Rieder et al., J. Interferon Cytokine Res. (9):499-509, 2009.
Rykman, et al., J. Virol. 80(2):710-22, 2006.
Sadelain et al., Cancer Discov. 3(4): 388-398, 2013.
Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor, N.Y. 2001.
Singh et al., Cancer Research, 68:2961-2971, 2008.
Singh et al., Cancer Research, 71:3516-3527, 2011.
Turtle et al., Curr. Opin. Immunol., 24(5): 633-39, 2012.
Патент США № 4870287.
Патент США № 5739169.
Патент США № 5760395.
Патент США № 5801005.
Патент США № 5824311.
Патент США № 5830880.
Патент США № 5844905.
Патент США № 5846945.
Патент США № 5885796.
Патент США № 5994136.
Патент США № 6013516.
Патент США № 6103470.
Патент США № 6207156.
Патент США № 6225042.
Патент США № 6355479.
Патент США № 6362001.
Патент США № 6410319.
Патент США № 6416998.
Патент США № 6544518.
Патент США № 6790662.
Патент США № 7109304.
Патент США № 7442548.
Патент США № 7446190.
Патент США № 7598364.
Патент США № 7989425.
Патент США № 8008449.
Патент США № 8017114.
Патент США № 8058065.
Патент США № 8071369.
Патент США № 8119129.
Патент США № 8129187.
Патент США № 8183038.
Патент США № 8268620.
Патент США № 8329867.
Патент США № 8354509.
Патент США № 8546140.
Патент США № 8691574.
Патент США № 8735553.
Патент США № 8741648.
Патент США № 8900871.
Патент США № 9175268.
Патентная публикация США № 2010/0210014.
Патентная публикация США № 12/478,154.
Патентная публикация США № 2002131960.
Патентная публикация США № 2003/0211603.
Патентная публикация США № 2005/0260186.
Патентная публикация США № 2006/0104968.
Патентная публикация США № 2009/0004142.
Патентная публикация США № 2009/0017000.
Патентная публикация США № 2009/0246875.
Патентная публикация США № 2011/0104125.
Патентная публикация США № 2011/0301073.
Патентная публикация США № 20110008369.
Патентная публикация США № 2012/0276636.
Патентная публикация США № 2013/0315884.
Патентная публикация США № 20130149337.
Патентная публикация США № 2013287748.
Патентная публикация США № 2014/0120622.
Патентная публикация США № 2014022021.
Патентная публикация США № 20140294898.
Varela-Rohena et al. Nat Med. 14: 1390-1395, 2008.
Wu et al., Cancer , 18(2): 160-75, 2012.
Zysk et al., Infect. Immun. 68(6):3740-43, 2000.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИДЫ ТРАНСПОЗАЗЫ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2735700C2 |
| УНИВЕРСАЛЬНЫЕ АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809113C2 |
| КОМПОЗИЦИИ Т-КЛЕТОК С НЕДОСТАТОЧНОСТЬЮ РЕЦЕПТОРОВ Т-КЛЕТОК | 2013 |
|
RU2653761C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |
| СИСТЕМА И СПОСОБ ПОЛУЧЕНИЯ И ХРАНЕНИЯ АКТИВИРОВАННЫХ ЗРЕЛЫХ ДЕНДРИТНЫХ КЛЕТОК | 2011 |
|
RU2575978C2 |
| МОДИФИЦИРОВАННЫЕ МОНОЦИТЫ/МАКРОФАГИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2766690C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |
| КОМПОЗИЦИИ ДЛЯ Т-КЛЕТОЧНОЙ ТЕРАПИИ С ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2819805C2 |
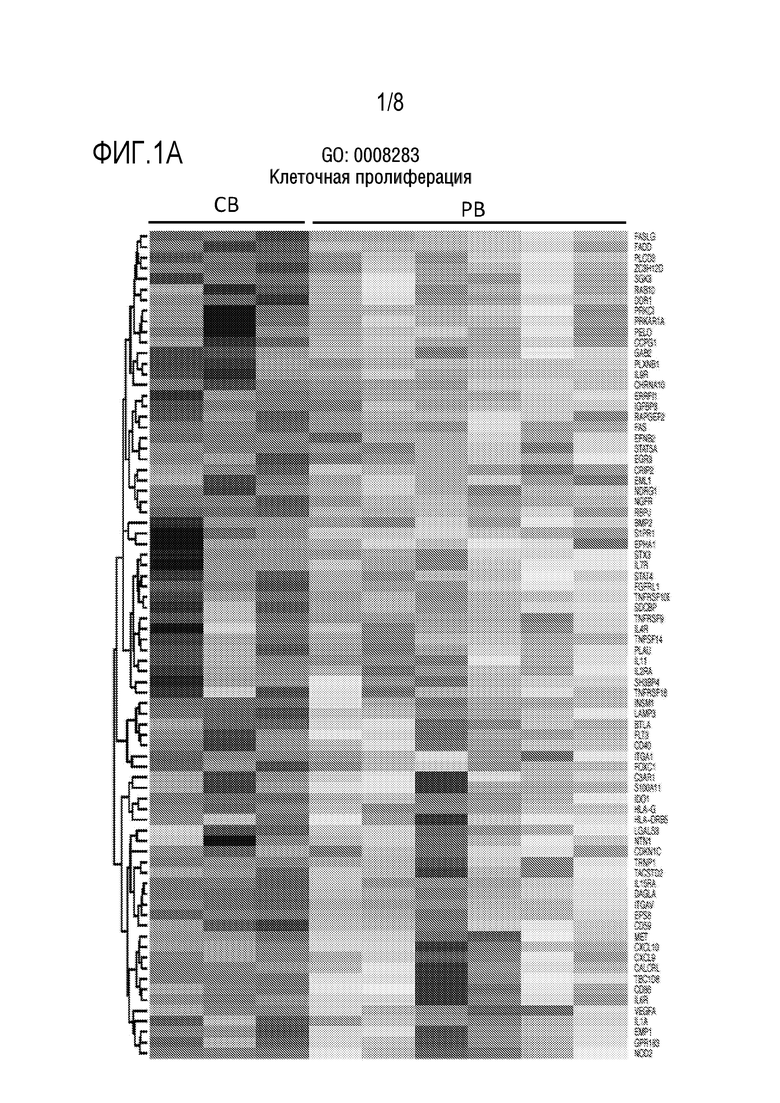



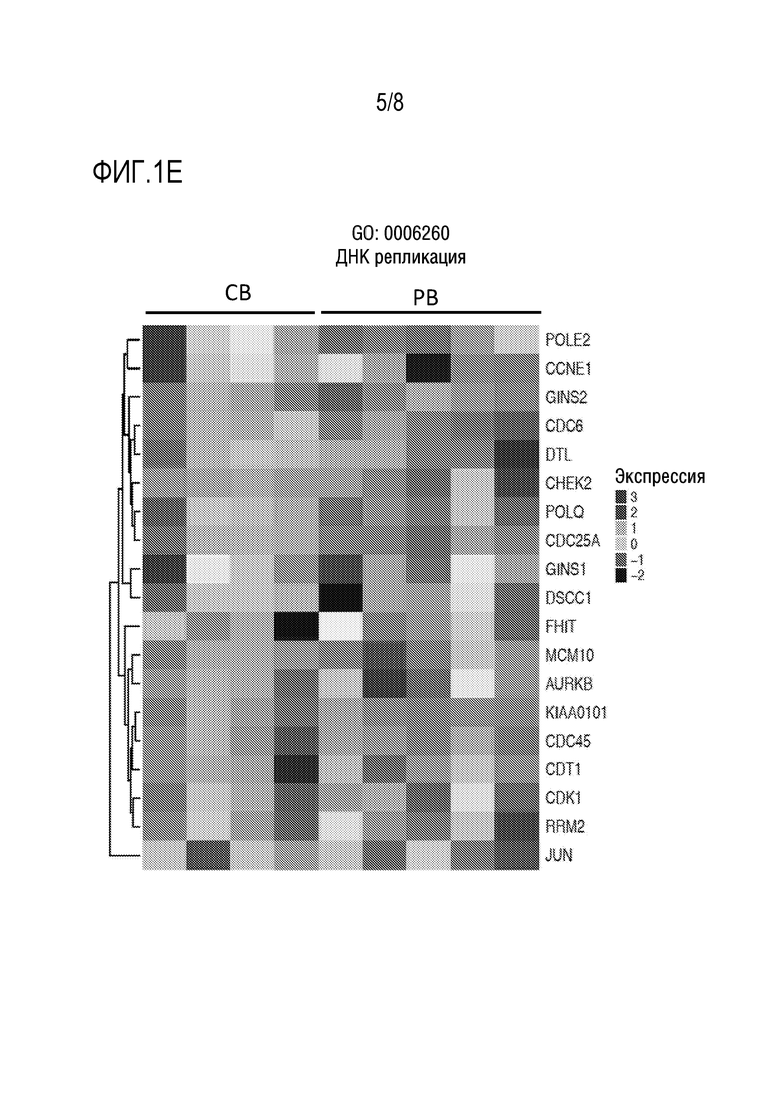

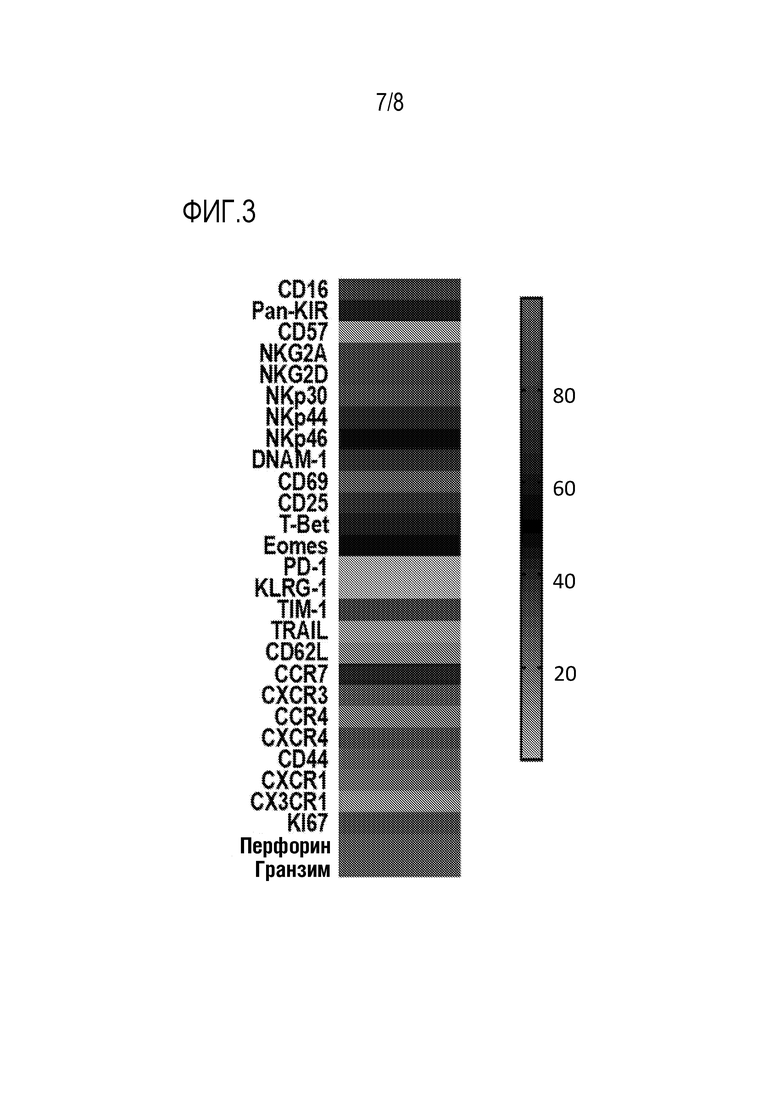
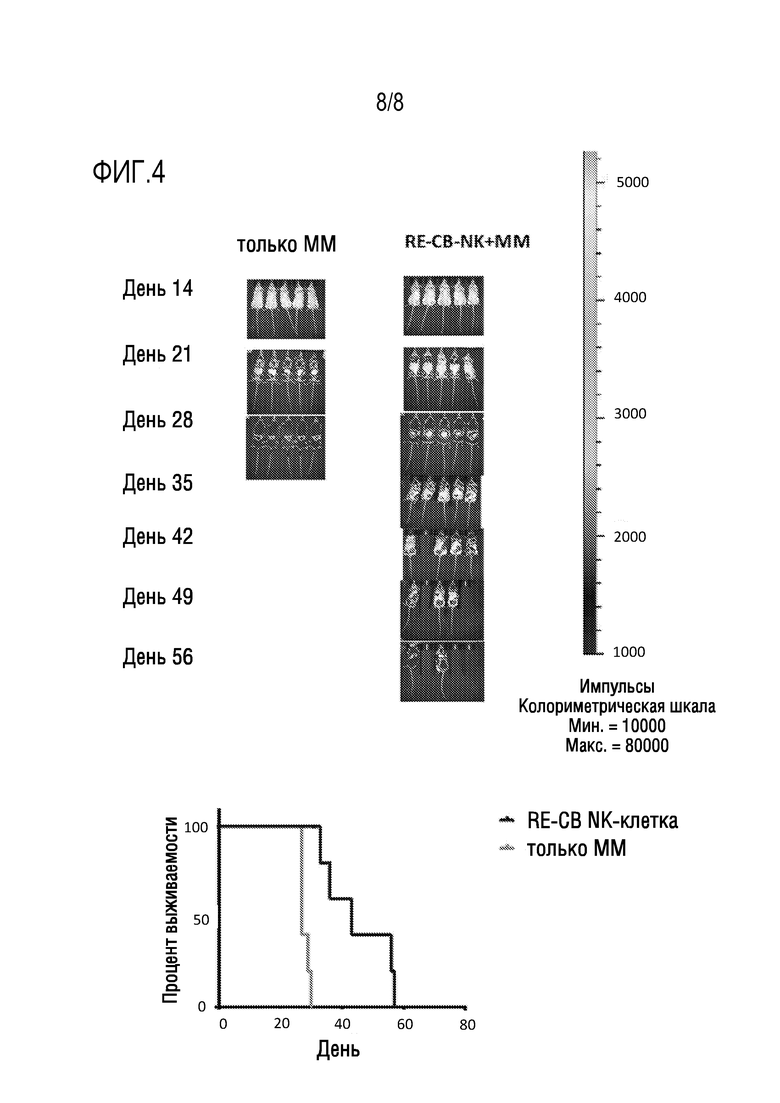
Изобретение относится к биотехнологии, а именно к способу ex vivo экспансии естественных клеток-киллеров (NK). Указанный способ включает (a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови; (b) стимуляцию MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2; и (c) повторную стимуляцию клеток с использованием APC с получением размноженных NK-клеток. Способ осуществляют в биореакторе. Используемые APC сконструированы для экспрессии мембраносвязанного IL-21 (mbIL-21) и представляют собой универсальные антигенпрезентирующие клетки (uAPC), сконструированные для экспрессии (1) CD48 и/или CS1 (CD319), (2) мембраносвязанного интерлейкина-21 (mbIL-21) и (3) 41BB лиганда (41BBL). Изобретение обеспечивает быструю экспансию естественных киллерных клеток из пуповинной крови в клинически значимых дозах и без необходимости в HLA совместимости между донором и реципиентом для лечения миеломы и лимфомы. 53 з.п. ф-лы, 4 ил., 4 табл., 1 пр.
1. Способ ex vivo экспансии естественных клеток-киллеров (NK), включающий:
(a) получение исходной популяции мононуклеарных клеток (MNC) из пуповинной крови;
(b) стимуляцию MNC в присутствии антигенпрезентирующих клеток (APC) и IL-2, где APC сконструированы для экспрессии мембраносвязанного IL-21 (mbIL-21); и
(c) повторную стимуляцию клеток с использованием APC с получением размноженных NK-клеток, при этом способ осуществляют в биореакторе, где APC представляют собой универсальные антигенпрезентирующие клетки (uAPC), и uAPC сконструированы для экспрессии (1) CD48 и/или CS1 (CD319), (2) мембраносвязанного интерлейкина-21 (mbIL-21) и (3) 41BB лиганда (41BBL).
2. Способ по п. 1, где APC сконструированы для экспрессии IL-21, IL-15, IL-7, IL-18 и/или IL-2.
3. Способ по п. 1, где uAPC экспрессируют CD48.
4. Способ по п. 1, где uAPC экспрессируют CS1.
5. Способ по п. 1, где uAPC экспрессируют CD48 и CS1.
6. Способ по п. 1, при этом способ:
(i) соответствует правилам производства и контроля качества лекарственных средств (GMP); и/или
(ii) дополнительно включает истощение клеток, положительных в отношении CD3.
7. Способ по п. 6, где истощение осуществляют между стадиями (b) и (c).
8. Способ по п. 7, где клетки удаляют из биореактора.
9. Способ по п. 1, где получение исходной популяции MNC из пуповинной крови включает размораживание пуповинной крови в присутствии декстрана, человеческого сывороточного альбумина (HSA), ДНКазы и/или хлорида магния.
10. Способ по п. 1, где получение исходной популяции MNC из пуповинной крови включает размораживание пуповинной крови в присутствии декстрана и ДНКазы.
11. Способ по п. 9, где пуповинную кровь промывают в присутствии 10% декстрана.
12. Способ по п. 9, где пуповинную кровь суспендируют в присутствии хлорида магния.
13. Способ по п. 12, где хлорид магния присутствует при концентрации 200 мМ.
14. Способ по п. 1, где получение включает осуществление центрифугирования в градиенте плотности фиколла с получением мононуклеарных клеток (MNC).
15. Способ по любому из пп. 1-14, при этом способ не включает удаление или добавление каких-либо компонентов среды на стадии (b).
16. Способ по п. 1, где биореактор представляет собой газопроницаемый биореактор.
17. Способ по п. 16, где газопроницаемый биореактор представляет собой G-Rex100M.
18. Способ по п. 17, где стимуляцию на стадии (b) осуществляют в 3-5 л среды.
19. Способ по п. 1, где APC подвергают гамма-облучению.
20. Способ по п. 1, где MNC и APC культивируют при соотношении 1:2.
21. Способ по п. 1, где IL-2 присутствует при концентрации 50-200 МЕ/мл.
22. Способ по п. 21, где IL-2 присутствует при концентрации 100 МЕ/мл.
23. Способ по п. 1, где IL-2 пополняют через каждые 2-3 дня.
24. Способ по п. 1, где стадию (b) осуществляют в течение 6-8 дней.
25. Способ по п. 24, где стадию (b) осуществляют в течение 7 дней.
26. Способ по п. 1, где стадия (b) не включает расщепление клеток.
27. Способ по п. 26, где к клеткам два раза добавляют IL-2.
28. Способ по п. 1, при этом способ включает использование 3, 4, 5 или 6 биореакторов.
29. Способ по п. 28, при этом способ включает использование меньше чем 10 биореакторов.
30. Способ по п. 1, где NK-клетки размножаются по меньшей мере 500-кратно, 800-кратно, 1000-кратно, 3000-кратно или 5000-кратно.
31. Способ по п. 1, где культивирование NK-клеток в биореакторе дает более чем 1000-кратное количество NK-клеток по сравнению с статической жидкой культурой.
32. Способ по п. 1, при этом способ не включает совместимость по человеческому лейкоцитарному антигену (HLA).
33. Способ по п. 32, где исходную популяцию NK-клеток не получают от идентичного по гаплотипу донора.
34. Способ по п. 1, при этом способ осуществляют за меньше чем 15 дней.
35. Способ по п. 34, при этом способ осуществляют за 14 дней.
36. Способ по п. 1, где размноженные NK-клетки обладают повышенной противоопухолевой активностью по сравнению с NK-клетками, размноженными из периферической крови.
37. Способ по п. 36, где размноженные NK-клетки имеют более высокую экспрессию генов клеточного цикла, клеточного деления, и/или репликации ДНК по сравнению с NK-клетками, размноженными из периферической крови.
38. Способ по п. 1, где размноженные NK-клетки имеют более высокий пролиферативный потенциал по сравнению с NK-клетками, размноженными из периферической крови.
39. Способ по п. 1, где размноженные NK-клетки не демонстрируют истощения.
40. Способ по п. 39, где истощение определяют путем измерения экспрессии перфорина, гранзима, CD57, KLRG1 и PD1.
41. Способ по п. 40, где размноженные NK-клетки имеют высокую экспрессию перфорина и гранзима.
42. Способ по п. 40, где размноженные NK-клетки имеют низкую экспрессию или отсутствие экспрессии CD57, KLRG1 и PD1.
43. Способ по п. 1, где размноженные NK-клетки включают клинически релевантную дозу.
44. Способ по п. 1, где пуповинная кровь представляет собой замороженную пуповинную кровь.
45. Способ по п. 44, где замороженная пуповинная кровь была протестирована на инфекционное заболевание.
46. Способ по п. 1, где пуповинная кровь представляет собой объединенную пуповинную кровь.
47. Способ по п. 46, где пуповинная кровь является объединенной из 3, 4, 5, 6, 7 или 8 отдельных единиц пуповинной крови.
48. Способ по п. 1, где NK-клетки не являются аутологичными.
49. Способ по п. 1, где NK-клетки не являются аллогенными.
50. Способ по п. 1, где uAPC по существу не имеют экспрессии эндогенных молекул HLA класса I, II или CD1d.
51. Способ по п. 1, где uAPC экспрессируют ICAM-1 (CD54) и LFA-3 (CD58).
52. Способ по п. 1, где uAPC также определены как aAPC, происходящие из лейкозных клеток.
53. Способ по п. 52, где происходящие из лейкозных клеток aAPC также определены как K562 клетки.
54. Способ по п. 1, дополнительно включающий криоконсервирование размноженных NK-клеток.
| WO2007136673 A2, 29.11.2007 | |||
| AYELLO J | |||
| et al | |||
| Регенеративный приемник | 1923 |
|
SU562A1 |
| Способ изготовления звездочек для французской бороны-катка | 1922 |
|
SU46A1 |
| ANUSHRUTI S | |||
| et al | |||
| Umbilical Cord Blood Natural Killer Cells, Their Characteristics, and Potential Clinical Applications, | |||
Авторы
Даты
2024-02-21—Публикация
2019-11-21—Подача