УРОВЕНЬ ТЕХНИКИ
[001] Рак поджелудочной железы является четвертой ведущей причиной смерти от рака, согласно оценкам в США в 2015 году было зарегистрировано примерно 48960 новых случаев (3% всех новых случаев рака) и приблизительно 40560 (6,9% всех случаев рака) смертей. Большинство случаев (приблизительно 99%) возникает в экзокринном компоненте поджелудочной железы. Существует несколько подтипов экзокринного рака поджелудочной железы, однако их диагностика и лечение имеют много общего. Небольшое количество видов рака, которые возникают в эндокринной ткани поджелудочной железы, имеют разные клинические характеристики. Обе группы поражают главным образом (но не исключительно) людей старше 40 лет и несколько чаще встречаются у мужчин, но некоторые редкие подтипы встречаются в основном у женщин или детей.
[002] Рак поджелудочной железы является агрессивным заболеванием, которое проявляется лишь несколькими симптомами, до момента перехода рака в позднюю стадию. Симптомы могут включать боль в животе, потерю массы тела, диарею и желтуху. Рак поджелудочной железы имеет очень неблагоприятный прогноз, поскольку обычно диагностируется на поздней стадии, когда указанный рак уже является местно-распространенным или распространился на другие части тела.
[003] Аденокарцинома протоков поджелудочной железы (PDAC) является преобладающей формой рака поджелудочной железы, которая составляет приблизительно 85% всех случаев рака поджелудочной железы. В большинстве случаев это заболевание является смертельным. Ежегодное количество смертей равно количеству вновь диагностированных случаев, несмотря на интенсивное лечение. Общая 5-летняя выживаемость, составляющая лишь 5%, не изменилась за последние 30 лет, несмотря на огромные усилия, предпринятые в доклинических и клинических исследованиях.
[004] Белки RAS являются протоонкогенами, которые часто мутируют при раковых заболеваниях человека. Эти белки кодируются тремя повсеместно экспрессируемыми генами: HRAS, KRAS и NRAS. Недавнее секвенирование экзома выявило, что KRAS является наиболее часто мутированным геном при PDAC (95%). Три гена RAS человека, HRAS, NRAS и KRAS, кодируют четыре высоко гомологичные (идентичность последовательностей 83-90%), малые ГТФазы молекулярной массой 21 кДа, функционирующие в цикле ГТФ-связанного «включенного» состояния и ГТФ-связанного «выключенного» состояния, которые регулируют пути, ответственные за пролиферацию и выживаемость клеток (Bryant et al. Trends Biochem Sci. 2014 Feb;39(2):91-100.). Белки RAS обычно строго регулируются факторами обмена гуаниновых нуклеотидов (GEF), которые усиливают диссоциацию ГДФ и связывание ГТФ, и ГТФаза-активирующими белками (GAP), стимулирующими нативную ГТФазную активность белков RAS, направленную на остановку передачи сигналов. Нарушение функции белков RAS связано с гиперпролиферативными нарушениями развития и раком. Активирующие мутации KRAS, обнаруженные при PDAC человека (точечные мутации в кодоне G12 (98% всех мутаций KRAS при PDAC), G13 и Q61), нарушают инактивацию KRAS, приводя тем самым к конститутивной активации KRAS и постоянному стимулированию нисходящих путей передачи сигналов, которые вызывают развитие многих признаков рака, устойчивой пролиферации, метаболическому перепрограммированию, антиапоптозу, ремоделированию микроокружения опухоли, уклонению от иммунного ответа, миграции клеток и метастазированию (Eser et al. Br J Cancer. 2014 Aug 26;111(5):817-22). Важно отметить, что мутация KRAS также является ранним и инициирующим событием, поскольку было показано, что более 90% высокодифференцированных панкреатических интраэпителиальных неопластических (PanIN) поражений несут онкогенные мутации KRAS (Bryant et al., loc. cit.). Активирующие мутации HRAS также были обнаружены при PDAC человека (точечные мутации в кодоне G12D, 49,7% (1312 мутаций в 2639 образцах опухолей) и в кодоне G12V, 30,8% (812 мутаций в 2639 образцах опухолей). Доступный в настоящее время каталог соматических мутаций при раке (COSMIC), который представляет собой наиболее полную базу данных о мутациях в опухолях человека (Forbes S.A. et al. Nucleic Acids Res. 2011, 39 (Database issue): D945-950), несмотря на относительно небольшой размер выборки, выявил устойчивую тенденцию, указывающую на то, что KRAS является наиболее часто мутированной изоформой при раке поджелудочной железы с 61% мутаций (3127 мутаций в 5169 образцах опухолей), затем следует NRAS с 2% мутаций (5 мутаций в 248 образцах опухолей) и HRAS с 0% (мутации не обнаружены в 221 образце опухолей).
[005] На сегодняшний день хирургическое вмешательство является единственным способом лечения рака поджелудочной железы и, в частности, PDAC. Однако хирургическое вмешательство показано только в 20% новых случаев. Существующий стандарт ухода за пациентами с PDAC также включает использование гемцитабина, аналога нуклеозида, который, без дополнительного хирургического вмешательства, продлевает продолжительность жизни лишь на несколько недель. Химиотерапевтическая схема FOLFIRINOX с использованием четырех препаратов была более эффективна, чем гемцитабин, но имеет значительные побочные эффекты. Это справедливо и для паклитаксела, связанного с белками (наб-паклитаксела) (von Hoff et al. N Engl J Med. 2013 Oct 31;369(18):1691-703).
[006] Вследствие наличия существенных экспериментальных доказательств роли мутированных вариантов KRAS и HRAS в качестве факторов, стимулирующих развитие и прогрессирование рака в большой субпопуляции пациентов с PDAC, были предприняты значительные усилия для разработки непосредственных ингибиторов KRAS или HRAS. Однако все клинические попытки прямого ингибирования активности KRAS или HRAS потерпели неудачу, и KRAS или HRAS до сих пор повсеместно рассматриваются как не поддающиеся воздействию с помощью лекарственных препаратов (Eser et al., loc. cit.).
[007] Роль других путей передачи сигналов в прогрессировании PanIN и поддержании PDAC является предметом текущего исследования. В работе, проведенной Moore et al. J Clin Oncol. 2007 May 20;25(15):1960-6, сообщается, что лечение с использованием ингибитора EGFR, эрлотиниба (Erlotinib), приводило к терапевтическому эффекту у приблизительно 10% пациентов с PDAC, однако в исследовании не удалось определить основные характеристики, которые позволили бы отличить пациентов с надлежащим клиническим ответом от пациентов, не восприимчивых к лечению.
[008] Однако на сегодняшний день перечисленные стратегии не привели к внедрению какого-либо эффективного способа лечения PDAC в клиническую практику. Всесторонний генетический анализ выявил, что PDAC представляет собой чрезвычайно сложное и гетерогенное заболевание с по меньшей мере тремя различными подтипами, которые различаются по многим важным аспектам биологии раковых клеток, включая морфологию клеток, экспрессию генов и ответ на лечение в условиях in vitro (Bryant et al., loc. cit). Безусловно, существует безотлагательная потребность в новых терапевтических средствах для лечения PDAC, которые позволят учесть различия в подтипах PDAC и, в частности, обеспечат специфичное нацеленное воздействие на субпопуляции PDAC. Вследствие большого количества типов PDAC, характеризующихся экспрессией мутированного KRAS или HRAS, исследование и разработка новых терапевтических средств для лечения PDAC в основном сосредоточена на тех же мишенях, тогда как по-прежнему существует неотложная потребность в индивидуальном лечении других подтипов PDAC, в частности, подтипов, экспрессирующих KRAS, HRAS или NRAS дикого типа.
[009] Цель настоящего изобретения заключалась в удовлетворении потребностей предшествующего уровня техники, как изложено в настоящем документе.
[0010]
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0011] Согласно первому аспекту в настоящем изобретении предложен способ лечения популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), причем аденокарцинома протоков поджелудочной железы экспрессирует белок дикого типа по меньшей мере одного члена семейства генов RAS, выбранного из KRAS дикого типа, HRAS дикого типа или NRAS дикого типа, причем указанный способ включает введение пациенту моноклонального антитела или его антигенсвязывающего фрагмента или пептида, который специфично связывается с рецептором эпидермального фактора роста (EGFR), при этом указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое содержит следующие определяющие комплементарность участки (CDR):
CDR1 легкой цепи: RSSQNIVHSNGNTYLD (SEQ ID NO: 1),
CDR2 легкой цепи: KVSNRFS (SEQ ID NO: 2),
CDR3 легкой цепи: FQYSHVPWT (SEQ ID NO: 3),
CDR1 легкой цепи: NYYIY (SEQ ID NO: 4),
CDR2 тяжелой цепи: GINPTSGGSNFNEKFKT (SEQ ID NO: 5),
CDR3 тяжелой цепи: QGLWFDSDGRGFDF (SEQ ID NO: 6).
[0012] Согласно одному варианту реализации настоящего изобретения моноклональное антитело или его антигенсвязывающий фрагмент вырабатывается клетками линии h-R3, депонированной под номером доступа ЕСАСС 951110101. В частности, моноклональное антитело может представлять собой нимотузумаб (Ramakrishnan et al. MAbs. 2009 Jan-Feb;1(1): 41-48), аминокислотная последовательность которого также описана в европейском патенте ЕР 0712863 В1.
[0013] Популяция пациентов может быть выбрана путем определения наличия или отсутствия мутированного варианта KRAS и/или KRAS дикого типа, мутированного варианта HRAS или HRAS дикого типа, мутированного варианта NRAS или NRAS дикого типа в образце опухоли PDAC каждого пациента. Пациентов, в образцах опухолей которых детектируют мутированные варианты KRAS, HRAS или NRAS и/или не детектируют KRAS, HRAS или NRAS дикого типа, не отбирают для лечения, тогда как пациентов, у которых детектируют KRAS, HRAS или NRAS дикого типа и/или не детектируют мутированные варианты KRAS, HRAS или NRAS, отбирают для лечения.
[0014] Согласно дополнительному аспекту в настоящем изобретении предложена фармацевтическая композиция, содержащая моноклональное антитело или его антигенсвязывающий фрагмент или пептид, определенный в настоящем документе, причем указанная фармацевтическая композиция предназначена для лечения популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), при этом указанная аденокарцинома протоков поджелудочной железы экспрессирует белок дикого типа по меньшей мере одного члена семейства генов RAS, выбранного из KRAS дикого типа, NRAS дикого типа и HRAS дикого типа.
[0015] Согласно другому аспекту в настоящем изобретении предложено моноклональное антитело или его антигенсвязывающий фрагмент или пептид, который специфично связывается с рецептором эпидермального фактора роста (EGFR), для применения в лечении популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), причем указанная аденокарцинома протоков поджелудочной железы экспрессирует белок дикого типа по меньшей мере одного члена семейства генов RAS, выбранного из группы, состоящей из KRAS дикого типа, NRAS дикого типа и HRAS дикого типа, и при этом указанное антитело представляет собой химерное или гуманизированное антитело, которое содержит следующие определяющие комплементарность участки (CDR):
CDR1 легкой цепи: RSSQNIVHSNGNTYLD (SEQ ID NO: 1),
CDR2 легкой цепи: KVSNRFS (SEQ ID NO: 2),
CDR3 легкой цепи: FQYSHVPWT (SEQ ID NO: 3),
CDR1 тяжелой цепи: NYYIY (SEQ ID NO: 4),
CDR2 тяжелой цепи: GINPTSGGSNFNEKFKT (SEQ ID NO: 5),
CDR3 тяжелой цепи: QGLWFDSDGRGFDF (SEQ ID NO: 6).
[0016] В настоящем изобретении также предложен способ прогнозирования невосприимчивости пациента, страдающего аденокарциномой протоков поджелудочной железы (PDAC), к лечению с использованием моноклонального антитела или его антигенсвязывающего фрагмента, определенного в настоящем документе. Согласно указанному способу в опухоли PDAC у пациента детектируют наличие или отсутствие мутации KRAS, HRAS или NRAS. Наличие мутации KRAS, HRAS или NRAS указывает на то, что пациент не будет восприимчив к лечению с использованием указанного антитела.
[0017] В настоящем изобретении также предложен способ прогнозирования невосприимчивости аденокарциномы протоков поджелудочной железы (PDAC) к лечению с использованием моноклонального антитела или его антигенсвязывающего фрагмента или пептида, определенного в настоящем документе. Прогноз получают путем определения наличия или отсутствия мутации KRAS, HRAS или NRAS в указанной опухоли PDAC. Наличие мутации KRAS, HRAS или NRAS указывает на то, что опухоль не будет восприимчива к лечению с использованием указанного антитела.
[0018] Согласно другому аспекту в настоящем изобретении предложен способ лечения популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), причем указанная аденокарцинома протоков поджелудочной железы экспрессирует белок дикого типа по меньшей мере одного члена семейства генов RAS, выбранного из KRAS дикого типа, HRAS дикого типа или NRAS дикого типа, причем указанный способ включает введение пациенту нуклеиновой последовательности, кодирующей моноклональное антитело или его антигенсвязывающий фрагмент или пептид, который специфично связывается с рецептором эпидермального фактора роста (EGFR), при этом указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое содержит следующие определяющие комплементарность участки (CDR):
CDR1 легкой цепи: RSSQNIVHSNGNTYLD (SEQ ID NO: 1),
CDR2 легкой цепи: KVSNRFS (SEQ ID NO: 2),
CDR3 легкой цепи: FQYSHVPWT (SEQ ID NO: 3),
CDR1 тяжелой цепи: NYYIY (SEQ ID NO: 4),
CDR2 тяжелой цепи: GINPTSGGSNFNEKFKT (SEQ ID NO: 5),
CDR3 тяжелой цепи: QGLWFDSDGRGFDF (SEQ ID NO: 6).
ОПИСАНИЕ ФИГУР
[0019] Настоящее изобретение будет более понято со ссылкой на подробное описание, если рассматривать его в сочетании с неограничивающими примерами и прилагаемыми чертежами. Фигуры иллюстрируют варианты реализации способов согласно настоящему изобретению.
[0020] На Фигуре 1 показана полипептидная последовательность KRAS, NRAS и HRAS дикого типа: подчеркнутым жирным курсивом выделены мутации, влияющие на восприимчивость пациента, страдающего аденокарциномой протоков поджелудочной железы (PDAC), к лечению с использованием моноклонального антитела, которое специфично связывается с рецептором эпидермального фактора роста (EGFR), или его антигенсвязывающего фрагмента или пептида, описанного в настоящем документе.
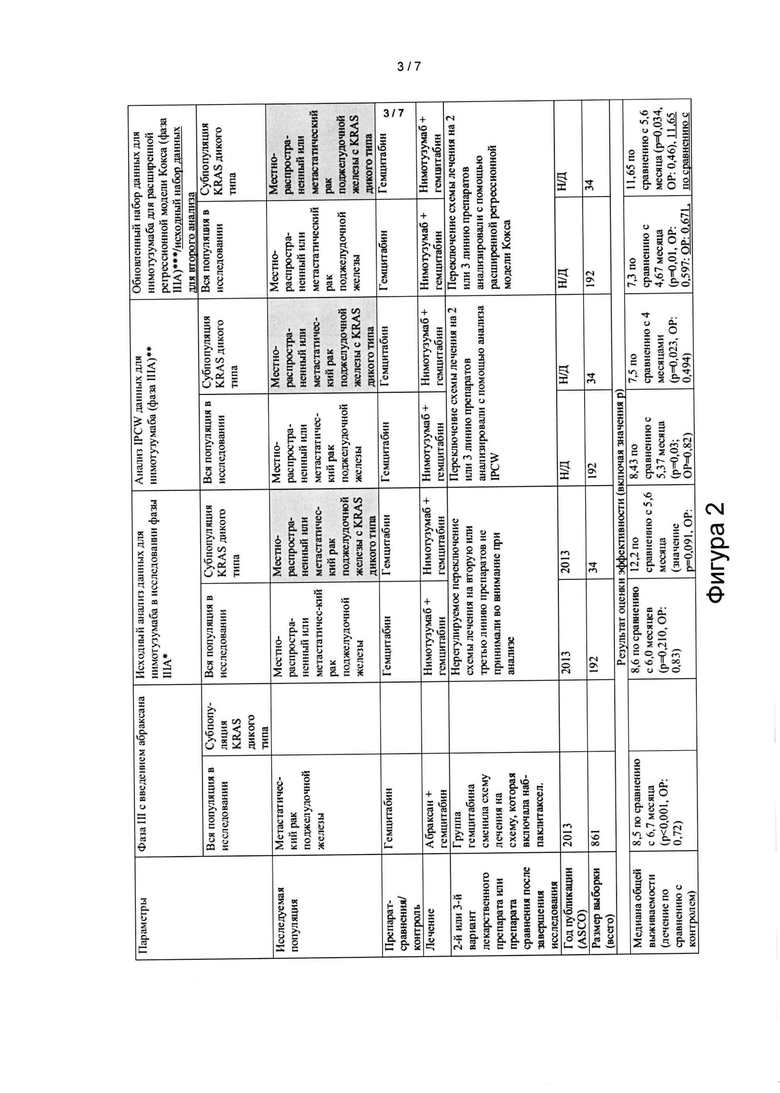
[0021] На Фигуре 2 представлен результат оценки клинического исследования. В данном клиническом исследовании пациенты с ранее не подвергавшейся лечению, неоперабельной, местно-распространенной или метастатической аденокарциномой поджелудочной железы получали гемцитабин (1000 мг/м2/30 мин внутривенно (в/в) один раз в неделю (d1, 8, 15, q28)) и нимотузумаб (400 мг 30 мин в/в один раз в неделю) или плацебо до прогрессирования заболевания или развития неконтролируемой токсичности. Первичная конечная точка в данном исследовании представляла собой общую выживаемость (ОВ) при анализе данных популяции рандомизированных пациентов (ITT-популяция). Вторичные конечные точки включали выживаемость без прогрессирования заболевания (ВБП), клиническую безопасность, частоту объективного ответа (ЧОО) и качество жизни (QoL).
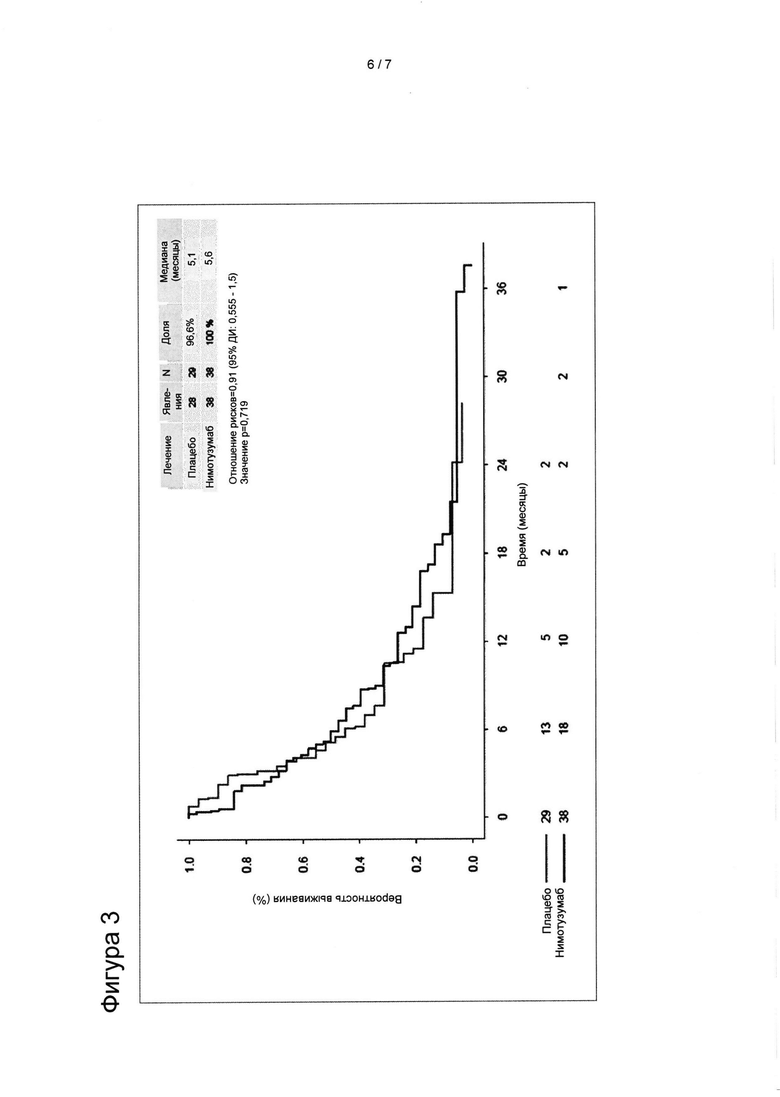
[0022] На Фигуре 3 представлены кривые выживаемости, полученные по методу Каплана-Мейера, для пациентов с местно-распространенным или метастатическим раком поджелудочной железы, экспрессирующим мутированный белок KRAS, которые получали плацебо-гемцитабин, по сравнению с пациентами, получавшими нимотузумаб-гемцитабин.
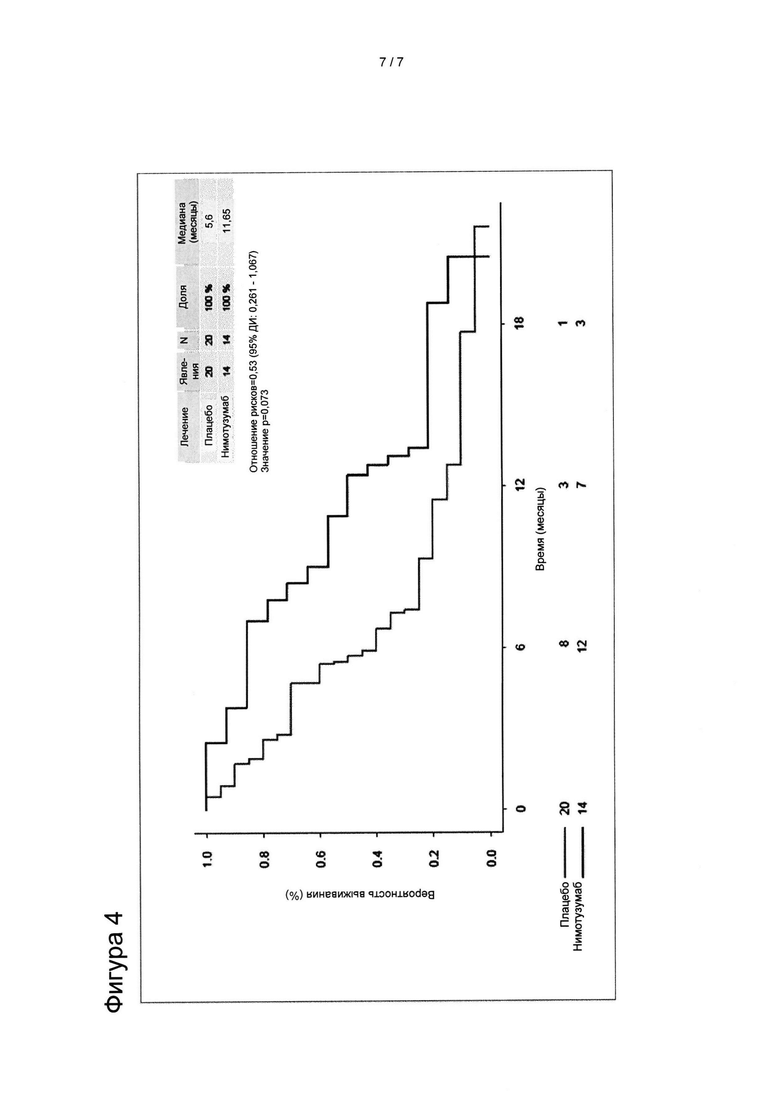
[0023] На Фигуре 4 представлены кривые выживаемости, полученные по методу Каплана-Мейера, для пациентов с местно-распространенным или метастатическим раком поджелудочной железы, экспрессирующим KRAS дикого типа, получивших плацебо-гемцитабин, по сравнению с пациентами, получившими нимотузумаб-гемцитабин. Лечение пациентов с KRAS дикого типа с использованием нимотузумаба-гемцитабина привело к значительному улучшению показателей выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (ОВ).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0024] Авторы настоящего изобретения впервые предложили в настоящем изобретении специфичный и эффективный способ лечения для популяции пациентов с PDAC, который ранее не был рассмотрен в предыдущих подходах к лечению. В настоящем изобретении предложен новый способ лечения пациентов с PDAC, у которых опухоли экспрессируют KRAS дикого типа, HRAS дикого типа или NRAS дикого типа. Авторы настоящего изобретения обнаружили неожиданный факт, что антитело к EGFR, нимотузумаб, имеет благоприятное терапевтическое действие у пациентов, страдающих указанными опухолями PDAC. Данный факт был неожиданным, поскольку у пациентов, опухоли PDAC которых экспрессируют мутированные белки KRAS (HRAS, NRAS), которые на сегодняшний день составляют большинство пациентов с PDAC, не было обнаружено благоприятного терапевтического действия или оно было лишь минимальным. Не желая быть связанными соответствием какой-либо теории, авторы настоящего изобретения полагают, что пациенты, несущие мутированные варианты генов KRAS, HRAS или NRAS, не будут отвечать на лечение с использованием моноклонального антитела к EGFR, нимотузумаба, вследствие активации гена, тогда как пациенты, несущие ген KRAS, HRAS или NRAS дикого типа, будут отвечать на лечение с использованием моноклонального антитела к EGFR, нимотузумаба.
[0025] В соответствии с вышесказанным в настоящем изобретении предложен способ лечения популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), причем указанная аденокарцинома протоков поджелудочной железы экспрессирует белок дикого типа по меньшей мере одного члена семейства генов RAS, выбранного из KRAS дикого типа, HRAS дикого типа или NRAS дикого типа, причем указанный способ включает введение пациенту моноклонального антитела или его антигенсвязывающего фрагмента или пептида, который специфично связывается с рецептором эпидермального фактора роста (EGFR), при этом указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое содержит следующие определяющие комплементарность участки (CDR):
CDR1 легкой цепи: RSSQNIVHSNGNTYLD (SEQ ID NO: 1),
CDR2 легкой цепи: KVSNRFS (SEQ ID NO: 2),
CDR3 легкой цепи: FQYSHVPWT (SEQ ID NO: 3),
CDR1 тяжелой цепи: NYYIY (SEQ ID NO: 4),
CDR2 тяжелой цепи: GINPTSGGSNFNEKFKT (SEQ ID NO: 5),
CDR3 тяжелой цепи: QGLWFDSDGRGFDF (SEQ ID NO: 6).
[0026] В настоящем изобретении предложен способ лечения указанной популяции пациентов с PDAC, включающий введение нуклеиновой кислоты, кодирующей моноклональное антитело или его антигенсвязывающий фрагмент или пептид, описанный в настоящем документе, т.е. который специфично связывается с рецептором эпидермального фактора роста (EGFR), при этом указанное антитело представляет собой химерное или гуманизированное моноклональное антитело, которое содержит следующие определяющие комплементарность участки (CDR):
CDR1 легкой цепи: RSSQNIVHSNGNTYLD (SEQ ID NO: 1),
CDR2 легкой цепи: KVSNRFS (SEQ ID NO: 2),
CDR3 легкой цепи: FQYSHVPWT (SEQ ID NO: 3),
CDR1 тяжелой цепи: NYYIY (SEQ ID NO: 4),
CDR2 тяжелой цепи: GINPTSGGSNFNEKFKT (SEQ ID NO: 5),
CDR3 тяжелой цепи: QGLWFDSDGRGFDF (SEQ ID NO: 6).
[0027] Представленное ниже описание, относящееся к лечению пациентов с использованием моноклонального антитела (фрагмента/пептида), также относится к лечению с использованием нуклеиновой кислоты, кодирующей указанное моноклональное антитело (фрагмент/пептид), с соответствующими поправками.
PDAC
Способы согласно настоящему изобретению относятся к лечению аденокарциномы протоков поджелудочной железы, раку поджелудочной железы. «Рак поджелудочной железы» обычно характеризуется наличием раковых клеток поджелудочной железы и/или ростом опухолевой массы в поджелудочной железе. Следовательно, это физиологическое состояние у субъекта, которое, как правило, характеризуется размножением злокачественных клеток в поджелудочной железе. «Злокачественные» клетки не способны к самоограничению своего размножения, могут вторгаться в смежные ткани и могут быть способны распространяться в отдаленные ткани (метастазирование). В настоящей заявке термин «злокачественный» является синонимом термина «раковый». «PDAC» или «аденокарцинома протоков поджелудочной железы» представляет собой форму рака поджелудочной железы, которая характеризуется злокачественными клетками, происходящими из эпителия протоков поджелудочной железы.
KRAS
[0028] Способы и способы применения согласно настоящему изобретению предназначены для лечения и/или стратификации пациентов с PDAC, у которых опухоли PDAC экспрессируют белок дикого типа по меньшей мере одного члена семейства генов RAS. Указанный белок может представлять собой KRAS «дикого типа». Термин «KRAS» дикого типа относится к природным изоформам KRAS (номер доступа в Uniprot Р01116, версия 190 от 22 июля 2015 г.). В частности, в соответствии с настоящим изобретением KRAS дикого типа содержит последовательность, соответствующую SEQ ID NO: 7 или SEQ ID NO: 24. KRAS дикого типа может состоять из последовательности, соответствующей SEQ ID NO: 7 или SEQ ID NO: 24.
[0029] Термин «KRAS дикого типа» обычно также включает полипептиды KRAS, содержащие мутации по сравнению с эталонной последовательностью, представленной в SEQ ID NO: 7 (KRAS4A) или SEQ ID NO: 24 (KRAS4B), а также включает полипептиды, содержащие аминокислотную последовательность, которая имеет определенную степень идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 7 (KRAS4A, номер доступа в Uniprot Р01116-1) или SEQ ID NO: 24 (KRAS4B, номер доступа в Uniprot Р01116-2), как описано в настоящем документе. Более конкретно, «KRAS дикого типа» включает полипептиды KRAS, последовательности которых по меньшей мере на 80%, 85%, 90%, 95% или 100% идентичны последовательности, представленной в SEQ ID NO: 7 (KRAS4A) или SEQ ID NO: 24 (KRAS4B). В частности, термин «KRAS дикого типа» включает изоформы KRAS 4А и 4В. Предпочтительно «KRAS дикого типа» не содержит мутации в своей аминокислотной последовательности по сравнению с последовательностями, представленными в SEQ ID NO: 7 или SEQ ID NO: 24, соответственно. Предпочтительно KRAS дикого типа не содержит мутации в любом из аминокислотных остатков кодона G12, G13, Q61, А146 или D154 последовательности, представленной в SEQ ID NO: 7 или SEQ ID NO: 24. Отсутствие мутации, то есть мутация не присутствует в аминокислотной последовательности KRAS дикого типа, может представлять собой в частности G12D, G12A, G12R, G12C, G12S, G12V и G13D.
[0030] KRAS дикого типа предпочтительно характеризуется тем, что он способен ингибировать путь передачи сигнала, катализируя гидролиз гуанозинтрифосфатов (ГТФ) до гуанозиндифосфатов. ГТФазная активность (т.е. способность гидролизовать ГТФ до гуанозиндифосфатов) может быть легко оценена с использованием коммерчески доступных наборов для количественного исследования ГТФаз.
HRAS
[0031] Опухоли PDAC пациентов, подлежащих лечению и/или стратификации в соответствии со способами и способами применения согласно настоящему изобретению, могут экспрессировать «HRAS» дикого типа. Термин «HRAS» дикого типа относится к природному HRAS (номер доступа в Uniprot Р01112, версия 202 от 22 июля 2015 года). В частности, согласно настоящему изобретению HRAS дикого типа содержит последовательность, соответствующую SEQ ID NO: 8 или SEQ ID NO: 25. HRAS дикого типа может состоять из последовательности, соответствующей SEQ ID NO: 8 или SEQ ID NO: 25.
Термин «HRAS дикого типа» также обычно включает полипептиды HRAS, содержащие мутации по сравнению с эталонной последовательностью, представленной в SEQ ID NO: 8 или SEQ ID NO: 25, а также включает полипептиды, содержащие аминокислотную последовательность, которая имеет определенную степень идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 8 или SEQ ID NO: 25, раскрытой в настоящем документе. Более конкретно, «HRAS» дикого типа включает полипептиды HRAS, последовательности которых по меньшей мере на 80%, 85%, 90%, 95% или 100% идентичны последовательности, представленной в SEQ ID NO: 8 или SEQ ID NO: 25. В частности, термин «HRAS» дикого типа включает изоформы H-Ras4A (номер доступа в Uniprot Р01112-1) и H-RAS (номер доступа в Uniprot Р01112-2). Предпочтительно, «HRAS» дикого типа не содержит мутации ни в одном из аминокислотных остатков кодона G12, G13 или Q61 последовательности, представленной в SEQ ID NO: 8 или SEQ ID NO: 25.
NRAS
[0032] Член семейства генов RAS, который экспрессируется как белок «дикого типа» в опухолях PDAC пациентов, подлежащих лечению и/или стратифицированных в соответствии со способами или способами применения согласно настоящему изобретению, может, дополнительно или альтернативно, представлять собой NRAS. Термин «дикий тип» NRAS относится к природному NRAS (номер доступа в Uniprot Р01111, версия 182 от 22 июля 2015 г.). В частности, согласно настоящему изобретению NRAS дикого типа содержит последовательность, соответствующую SEQ ID NO: 9. NRAS дикого типа может состоять из последовательности, соответствующей SEQ ID NO: 9.
[0033] Термин «NRAS дикого типа» обычно также включает полипептиды NRAS, содержащие мутации по сравнению с эталонной последовательностью, представленной в SEQ ID NO: 9, а также включает полипептиды, содержащие аминокислотную последовательность с определенной степенью идентичности с указанной аминокислотной последовательностью, представленной в SEQ ID NO: 9, описанной в настоящем документе. Более конкретно, «NRAS дикого типа» включает полипептиды NRAS, имеющие по меньшей мере 80%, 85%, 90%, 95% или 100% идентичность с SEQ ID NO: 9. Предпочтительно, «NRAS дикого типа» не содержит мутации ни в одном из аминокислотных остатков кодона G12, G13 или Q61 последовательности, представленной в SEQ ID NO: 9.
[0034] «Идентичность последовательности» или «% идентичности» относится к проценту совпадений остатков между по меньшей мере двумя полипептидными или полинуклеотидными последовательностями, сопоставленными с использованием стандартизованного алгоритма. Такой алгоритм может вводить, стандартизованным и воспроизводимым образом, пропуски в сравниваемые последовательности для оптимизации сопоставления двух последовательностей и, следовательно, для более значимого сравнения двух последовательностей. Сравнения последовательностей могут быть выполнены с использованием стандартных компьютерных программ, таких как программа BLAST NCBI.
[0035] Применительно к настоящему изобретению выражение «положение, соответствующее другому положению» (например, участки, фрагменты, положения нуклеотидов или аминокислот или тому подобное) основано на соглашении о нумерации в соответствии с номером положения нуклеотида или аминокислоты с последующим сопоставлением последовательностей так, чтобы максимизировать процент идентичности последовательностей. Поскольку не все положения в конкретном «соответствующем участке» должны быть идентичны, то несовпадающие положения в соответствующем участке могут рассматриваться как «соответствующие положения». Соответственно, в настоящем изобретении ссылка на «положение аминокислоты, соответствующее положению аминокислоты [X]» конкретной последовательности белка, представляет собой, помимо ссылки на положения аминокислот указанной последовательности белка, ссылку на совокупность эквивалентных положений в других установленных белковых и структурных гомологах и семействах.
Антитело к EGFR
[0036] Авторы настоящего изобретения обнаружили терапевтический эффект лечения пациентов с опухолью PDAC, экспрессирующей KRAS, HRAS или NRAS дикого типа, с использованием моноклонального антитела (или его антигенсвязывающего фрагмента или пептида), определенного в настоящем документе.
[0037] Как хорошо известно в данной области техники, антитело представляет собой молекулу иммуноглобулина, способную специфично связываться с мишенью посредством по меньшей мере одного сайта распознавания эпитопа, расположенного в вариабельной области молекулы иммуноглобулина. Антигенсвязывающие фрагменты также предложены для применения в соответствии со способами согласно настоящему изобретению. В настоящей заявке термин «антигенсвязывающий фрагмент» относится к полипептидному фрагменту, который содержит все 6 CDR вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), описанных в настоящем документе, из моноклональных антител, которые специфично связываются с EGFR. Термин включает dAb, Fab, Fab', F(ab')2, Fv, одноцепочечные Fvs (ScFv), диатела и мини-антитела, содержащие scFv, присоединенный к домену СН3. Указанный термин также включает синтетические варианты, природные варианты, гибридные белки, содержащие часть антитела с антигенсвязывающим фрагментом требуемой специфичности, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенсвязывающий сайт или фрагмент (сайт распознавания эпитопа), имеющий требуемую специфичность.
[0038] Моноклональное антитело (или его антигенсвязывающий фрагмент), используемый в соответствии со способами согласно настоящему изобретению, также называют в настоящем документе «антитело к EGFR». В настоящей заявке термин «антитело к EGFR» используется для обозначения способности антител специфично связываться с EGFR. В настоящей заявке выражение «антитело (фрагмент/пептид)» используется как аббревиатура для обозначения моноклонального антитела или его антигенсвязывающего фрагмента или пептида, применяемого в способах согласно настоящему изобретению. Термин «EGFR» или «EGF- R» относится к рецептору эпидермального фактора роста.
[0039] Согласно настоящему изобретению моноклональное антитело или его антигенсвязывающий фрагмент или пептид для применения в соответствии со способами и способами применения согласно настоящему изобретению специфично связывается с рецептором эпидермального фактора роста (EGFR). Связывание с EGFR можно оценивать стандартными способами, например, путем добавления антитела (фрагмента/пептида) к планшетам, покрытым (частично) очищенным EGFR, и детектирования связывания антитела (фрагмента/пептида) с EGFR методом непрямого твердофазного иммуноферментного анализа (ИФА), кратко описанного в европейском патенте ЕР 0586002 В2. «Специфичное связывание» относится к способности специфичного связывающего агента (в настоящем документе: антитело к EGFR или его антигенсвязывающий фрагмент или пептид) связываться со своей мишенью (в настоящем документе: EGFR) с большей аффинностью, чем он связывается с нецелевой мишенью. Аффинность связывания может быть определена, например, с помощью аффинного ИФА, количественного исследования с помощью платформы BIAcore, кинетического исследования или способов, основанных на достижении равновесия в растворе. Антитело к EGFR (фрагмент/пептид) можно определить как «специфично связывающееся» с EGFR, когда константа диссоциации между антителом и его распознанным эпитопом составляет менее 1 мкМ, предпочтительно менее 100 нМ и более предпочтительно менее 10 нМ. Предпочтительно EGFR-связывающие характеристики антитела (фрагмента/пептида), используемого в способах согласно настоящему изобретению, сравнимы или аналогичны характеристикам EGFR-связывающего антитела, раскрытого в европейском патенте ЕР 0586002 В1, определенным с помощью непрямого ИФА, описанного в указанном патенте.
[0040] Согласно настоящему изобретению антитело к EGFR (фрагмент/пептид) может распознавать или связываться с EGFR человека, присутствующим в нормальных, т.е. неопухолевых клетках («нормальный EGFR»), и EGFR, присутствующим в опухолевых клетках («опухолевый EGFR»). Связывание с нормальным и опухолевым EGFR можно легко оценить, используя растворимый EGFR, полученный из незлокачественных клеток, и EGFR, полученный из злокачественных клеток, с помощью непрямого ИФА, описанного в европейском патенте ЕР 0586002 В1, соответственно.
Химерное антитело
[0041] Моноклональное антитело, применяемое в способах согласно настоящему изобретению, может быть химерным антителом (или его антигенсвязывающим фрагментом или пептидом). Термин «химерное антитело» относится к антителу, в котором часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенного вида или принадлежащих к определенному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также к фрагментам таких антител, если они проявляют желаемую биологическую активность, т.е. (специфично) связываются с EGFR.
[0042] Согласно настоящему изобретению химерные антитела могут содержать вариабельную область легкой цепи, соответствующую  и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую 
Гуманизированное антитело
[0043] «Гуманизированные антитела» содержат минимальную последовательность, полученную из антител из вида, отличного от человека. В целом гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки из определяющего комплементарность участка реципиента заменены остатками из определяющего комплементарность участка из видов, отличных от человека, таких как мышь, крыса, кролик или примат, отличный от человека, имеющего желательное биологическое действие, т.е. способного специфично связываться с EGFR применительно к настоящему изобретению. В некоторых случаях остатки каркасных участков (FR) иммуноглобулина человека заменяют соответствующими остатками из видов, отличных от человека. Помимо этого гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорском антителе. Подходящие модификации вносят для дополнительного улучшения характеристик антител. В целом гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все определяющие комплементарность петли соответствуют иммуноглобулину из вида, отличного от человека, и все или по существу все FR представляют собой каркасные участки из последовательности иммуноглобулина человека. Гуманизированное антитело также необязательно будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека.
[0044] В частности, согласно настоящему изобретению гуманизированные моноклональные антитела (или антигенсвязывающие фрагменты) для применения в способах согласно настоящему изобретению содержат следующие вариабельные области: вариабельную область легкой цепи, соответствующую 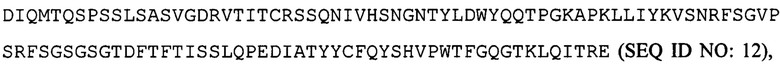 и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую  в которой X1 представляет собой R или K; X2 представляет собой V или А; X3 представляет собой Т или S; X4 представляет собой N или Т; и X5 представляет собой А или Т (SEQ ID NO: 13); или
в которой X1 представляет собой R или K; X2 представляет собой V или А; X3 представляет собой Т или S; X4 представляет собой N или Т; и X5 представляет собой А или Т (SEQ ID NO: 13); или
вариабельную область легкой цепи, соответствующую  и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую 
вариабельную область легкой цепи, соответствующую 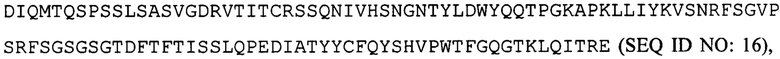 и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую 
вариабельную область легкой цепи, соответствующую 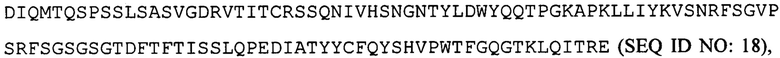 и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую 
вариабельную область легкой цепи, соответствующую 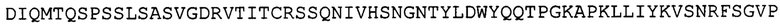
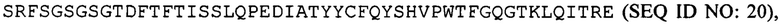 и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую  вариабельную область легкой цепи, соответствующую
вариабельную область легкой цепи, соответствующую 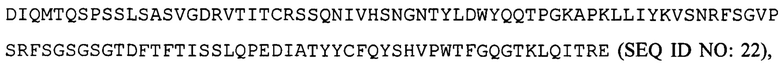 и вариабельную область тяжелой цепи, соответствующую
и вариабельную область тяжелой цепи, соответствующую 
[0045] Также согласно настоящему изобретению все моноклональные антитела (и, где это применимо, их антигенсвязывающие фрагменты или пептиды), описанные в настоящем документе, содержат константные области тяжелой цепи, содержащие аминокислотную последовательность гамма-1 цепи иммуноглобулина человека, и константные области легкой цепи указанного антитела, содержащие аминокислотную последовательность каппа-цепи иммуноглобулина человека.
Нимотузумаб
[0046] Авторы настоящего изобретения обнаружили, что моноклональное антитело (или его антигенсвязывающий фрагмент), вырабатываемое клеточной линией h-R3, депонированной под номером доступа ЕСАСС 951110101, является особенно полезным для применения в способах согласно настоящему изобретению. В частности, моноклональное антитело может представлять собой нимотузумаб ((Ramakrishnan et al. MAbs. 2009 Jan-Feb; 1(1): 41-48.).
Модификации
[0047] Антитела и антигенсвязывающие фрагменты, применяемые в способах согласно настоящему изобретению, могут быть модифицированы. Типичные модификации, пригодные согласно настоящему изобретению, включают, например, химические модификации, описанные ниже.
[0048] В целом подходящими являются все виды модификаций до тех пор, пока они не изменяют последовательности CDR указанного антитела или его антигенсвязывающего фрагмента, определенного в настоящем документе, и в дальнейшем не устраняют способность моноклонального антитела (или его антигенсвязывающего фрагмента или пептида) специфично связываться с EGFR.
[0049] Возможные химические модификации моноклонального антитела (или его антигенсвязывающего фрагмента) включают ацилирование или ацетилирование амино-конца или амидирование или этерификацию карбокси-конца или, в другом варианте, на обоих концах. Модификации также могут затрагивать аминогруппу в боковой цепи лизина или гидроксильную группу треонина. Другие подходящие модификации включают, например, удлинение аминогруппы с помощью полипептидных цепей различной длины (например, технология XTEN или PASylation®), N-гликозилирование, О-гликозилирование и химическое конъюгирование углеводов, таких как гидроксиэтилкрахмал (например, HESylation®) или полисиаловая кислота (например, технология PolyXen®). Химические модификации, такие как алкилирование (например, метилирование, пропилирование, бутилирование), арилирование и этерификация, могут быть подходящими и также предусмотрены согласно настоящему изобретению.
Функциональные признаки
[0050] Согласно настоящему изобретению моноклональное антитело (или его антигенсвязывающий фрагмент или пептид) может иметь одну или более из следующих способностей:
[0051] Антитело к EGFR (фрагмент/пептид) может быть способно ингибировать связывание EGF с рецептором, как может быть легко установлено в количественном исследовании конкурентного связывания с использованием радиолиганда, описанного в Mateo et al. Immunotechnology. 1997 Mar;3(1):71-81.
[0052] Антитело к EGFR (фрагмент/пептид) может быть способно ингибировать размножение EGF-зависимых опухолевых клеток, как может быть легко установлено, например, с помощью культивирования EGF-зависимых линий опухолевых клеток (например, U-1752 и H125) в присутствии антитела (фрагмента/пептида), и, по истечению заданного периода времени, подсчета общего количества клеток, например, путем определения общего белка. Примерный способ описан в ЕР 0586002.
[0053] Антитело к EGFR (фрагмент/пептид) может вызывать антитело-зависимую клеточную цитотоксичность (ADCC). Существует несколько стандартных способов определения эффективности индукции ADCC антителами (фрагментами), включая количественное исследование высвобождения хрома-51, количественное исследование высвобождения европия и количественное исследование высвобождения серы-35. В общих чертах, линию меченых клеток-мишеней, экспрессирующих EGFR, инкубируют с антителом к EGFR (фрагментом/пептидом). После промывки эффекторные клетки (например, мононуклеарные клетки периферической крови (МКПК), полученные от доноров), экспрессирующие рецептор Fc, CD16, инкубируют совместно с клетками-мишенями, мечеными антителами. Лизис клеток-мишеней впоследствии оценивают по высвобождению внутриклеточной метки с помощью сцинтилляционного счетчика или спектрофотометрии. Примерный протокол описан в ЕР 0586002 В1.
[0054] Антитело к EGFR (фрагмент/пептид) может иметь противоангиогенное действие. Средства и способы оценки ангиогенеза в условиях in vitro и в условиях in vivo были рассмотрены Staton et al. Int J Exp Pathol. 2004 Oct; 85(5): 233-248. Например, количественные способы исследований пролиферации эндотелиальных клеток легко доступны и просты в применении. В общих чертах, эндотелиальные клетки, например, инкубировали с антителом-кандидатом к EGFR (фрагментом/пептидом). После инкубации общее количество клеток определяют с использованием, например, электронного счетчика, такого как счетчик Coulter, и сравнивают с необработанными контрольными образцами.
[0055] Антитело к EGFR (фрагмент/пептид) может иметь противоапоптозное действие. Различные наборы для исследования апоптоза коммерчески доступны от различных производителей и позволяют оценить, например, активную каспазу-3, -7 или -9, фрагментацию ДНК, фосфатидилсерин (PS) на цитоплазматической поверхности клеточной мембраны, целостность мембраны и другие маркеры апоптоза.
[0056] Антитело к EGFR (фрагмент/пептид) может влиять на CD133-положительные раковые стволовые клетки. CD133-положительные клетки обладают многими характеристиками раковых стволовых клеток, такими как способность формировать опухолевые сфероиды, экспрессия маркеров ранних стадий развития, высокая инвазивность, повышенная способность инициировать опухоли и устойчивость к лечению химиотерапевтическим препаратом цисплатином. В настоящем изобретении предусмотрено, что антитело к EGFR (пептид/фрагмент) согласно настоящему изобретению может уменьшить или устранить любые свойства раковых стволовых клеток.
[0057] Антитело к EGFR (фрагмент/пептид) может вызвать опосредованную комплементом цитотоксическую активность, которую можно оценить аналогично ADCC, как описано выше. Однако, вместо эффекторных клеток, к клеткам-мишеням добавляют источник комплемента (например, сыворотку кролика) и измеряют лизис клеток-мишеней с помощью количественного исследования высвобождения внутриклеточной метки, как описано в ЕР 0586002.
[0058] Антитело к EGFR (фрагмент/пептид) может индуцировать арест клеточного цикла, что может быть легко установлено с использованием проточной цитометрии. В общих чертах, клетки пермеабилизуют и обрабатывают флуоресцентным красителем, который количественно окрашивает ДНК, обычно йодидом пропидия (PI). Поскольку содержание ДНК в клетках удваивается во время фазы S клеточного цикла, то относительное количество клеток в фазе G0 и фазе G1 (перед фазой S), в фазе S и в фазе G2 и фазе М (после фазы S) может быть определено, поскольку интенсивность флуоресценции клеток в фазе G2/M будет в два раза выше, чем у клеток в фазе G0/G1.
[0059] Антитело к EGFR (фрагмент/пептид) может быть способно оказывать синергетическое действие при ингибировании пролиферации опухолевых клеток в комбинации с GM3 N-ацетилганглиозидом, как может быть легко установлено путем культивирования EGFR-экспрессирующих клеточных линий (например, Н-125) в присутствии антитела к EGFR (фрагмента/пептида) и GM3 N-ацетилганглиозида и определения общего количества клеток (например, путем оценки концентрации общего белка) после заранее определенного периода времени, по отношению к необработанным контрольным образцам. Согласно настоящему изобретению синергическое действие антитела к EGFR (фрагмента/пептида) и GM3 N-ацетилганглиозида приводит к ингибированию пролиферации опухолевых клеток, экспрессирующих EGFR. Аналогично, протокол для оценки указанного синергического действия представлен в ЕР 0586002.
[0060] Антитело к EGFR (фрагмент/пептид) может быть способно оказывать синергетическое действие при ингибировании пролиферации опухолевых клеток в комбинации с моноклональным антителом к EGF, что можно легко оценить с использованием аналогичного протокола, как и протокол для определения синергического действия антитела к EGFR (фрагмента/пептида) и GM3 N-ацетилганглиозида; за исключением того, что клетки культивируют в присутствии антитела к EGF вместо GM3 N-ацетилганглиозида. Аналогичным образом, согласно настоящему изобретению синергическое действие антитела к EGFR (фрагмента/пептида) и антитела к EGF приводит к ингибированию пролиферации опухолевых клеток, экспрессирующих EGFR.
[0061] Антитело к EGFR (фрагмент/пептид) может быть способно восстанавливать микросателлитную нестабильность опухоли, вызванную радиотерапией. Микросателлитная нестабильность (MSI) представляет собой гипермутаторный фенотип, вызванный потерей активности, направленной на репарацию ошибочных спариваний в ДНК, и может быть оценена путем исследования микросателлитных маркеров, как это было предложено Dietmaier et al. Cancer Res. 1997 Nov 1;57(21):4749-56.
Пациенты
[0062] В то время как большинство исследований PDAC относится к пациентам с мутированными вариантами KRAS, авторы настоящего изобретения впервые разработали эффективное лечение для популяции пациентов с PDAC, экспрессирующей KRAS, HRAS или NRAS дикого типа. Термин «пациент» относится к пациенту-человеку, у которого предпочтительно был поставлен предварительный диагноз PDAC, в частности местно-распространенная и/или метастатическая PDAC.
[0063] Независимо от принадлежности конкретного пациента к популяции пациентов, подлежащих лечению с помощью способа согласно настоящему изобретению, он может пройти оценки с помощью стандартных экспериментов, известных в данной области техники. Например, чтобы определить, экспрессирует ли опухоль PDAC белок KRAS, HRAS или NRAS дикого типа, образец опухоли, как правило, получают от пациента, данные которого оценивают, и последовательность нуклеиновой кислоты KRAS, HRAS или NRAS, соответственно, получают из образца, амплифицируют и секвенируют.
[0064] Другой способ относится к образцам плазмы или сыворотки крови, в которых циркулирующие опухолевые клетки, несущие онкоген KRAS, HRAS или NRAS, могут быть детектированы с помощью мембранных микрочипов. В этом отношении положительная мутация KRAS, HRAS или NRAS в образцах плазмы или сыворотки крови указывает на мутацию KRAS, HRAS или NRAS в опухоли, тогда как отсутствие мутации KRAS, HRAS или NRAS в образцах плазмы или сыворотки крови не обязательно доказывает отсутствие аналогичной мутации в ткани опухоли поджелудочной железы.
[0065] Дополнительно или в качестве альтернативы, экспрессия KRAS, HRAS или NRAS дикого типа может быть определена путем детектирования мутированных вариантов и/или полипептидов KRAS, HRAS или NRAS дикого типа в образце опухоли, например, с использованием специфичных антител, связывающихся с эпитопами, специфичными для дикого типа или мутированных вариантов KRAS, HRAS или NRAS, соответственно. Согласно настоящему изобретению пациенты с опухолями PDAC, экспрессирующими KRAS, HRAS или NRAS дикого типа, выбраны для лечения, тогда как пациенты с опухолями, экспрессирующими мутированный ген KRAS, HRAS или NRAS, не выбраны для лечения.
[0066] Полагают, что пациенты с опухолями PDAC, экспрессирующими мутированные варианты KRAS, HRAS или NRAS, и, в частности, KRAS, HRAS или NRAS, несущие одну или более мутаций, как изложено в настоящем документе, будут менее восприимчивы к лечению или будут невосприимчивы к лечению с использованием моноклонального антитела (фрагмента/пептида), используемого в способах согласно настоящему изобретению. Следовательно, в настоящем изобретении также предложен способ стратификации пациентов с PDAC. В настоящей заявке термин «стратификация» означает сортировку пациентов с PDAC на тех, кто может получить терапевтический эффект от лечения с использованием антитела к EGFR (или его антигенсвязывающего фрагмента или пептида), определенного в настоящем документе, и тех, кто не может получить терапевтический эффект от лечения. Согласно настоящему изобретению пациенты, у которых опухоли PDAC не экспрессируют KRAS, HRAS или NRAS дикого типа, и, в частности, пациенты, у которых опухоли PDAC экспрессируют мутированные варианты KRAS, HRAS или NRAS, маловероятно получат терапевтический эффект (ответят на лечение) от лечения с использованием антитела к EGFR (или его антигенсвязывающего фрагмента или пептида). Указанные мутации, присутствие которых, как полагают, явно указывает на неспособность отвечать на лечение с использованием антитела к EGFR (фрагмента/пептида) в соответствии с настоящим изобретением, включают G12, G13, Q61, А146 или D154 последовательности, представленной в SEQ ID NO: 7 или SEQ ID NO: 24 (KRAS); G12, G13 или Q61 последовательности, представленной в SEQ ID NO: 8 или SEQ ID NO: 25 (HRAS), или G12, G13 или Q61 последовательности, представленной в SEQ ID NO: 9 (NRAS).
[0067] В ином случае пациенты, у которых опухоль PDAC экспрессирует KRAS, HRAS или NRAS дикого типа, определенный в настоящем документе в другом месте, вероятно, будут иметь терапевтический эффект (ответят на лечение) от лечения, описанного в настоящем документе. Указанный KRAS «дикого типа» предпочтительно содержит последовательность, соответствующую SEQ ID NO: 7 или SEQ ID NO: 24, и предпочтительно не содержит мутации в аминокислотных остатках G12, G13, Q61, А146 или D154 в последовательности, представленной в SEQ ID NO: 7 или SEQ ID NO: 24, указанный HRAS «дикого типа» предпочтительно содержит последовательность, соответствующую последовательности, представленной в SEQ ID NO: 8 или SEQ ID NO: 25, и предпочтительно не содержит мутации в аминокислотных остатках G12, G13 или Q61 в последовательности, представленной в SEQ ID NO: 8 или SEQ ID NO: 25, и/или указанный NRAS «дикого типа» предпочтительно содержит последовательность, соответствующую последовательности, представленной в SEQ ID NO: 9, и предпочтительно не содержит мутации в аминокислотных остатках G12, G13 или Q61 в последовательности, представленной в SEQ ID NO: 9.
[0068] Термин «восприимчивость», применительно к способу лечения, предложенному в настоящем изобретении, означает, что пациент, или опухоль, имеет полный ответ или частичный ответ после введения антитела к EGFR (фрагмента/пептида), определенного в настоящем документе, в соответствии с Критериями оценки ответа солидных опухолей (RECIST). В настоящей заявке термин «невосприимчивость» означает, что пациент или опухоль проявляет стабильное заболевание или прогрессирующее заболевание после введения антитела к EGFR (фрагмента/пептида), определенного в настоящем документе, в соответствии с RECIST. RECIST описан, например, в Eisenhauer et al.: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur. J. Cancer. 45, Nr. 2, 2009, 228-47.
[0069] В настоящем изобретении также предложен, следовательно, способ отбора пациента или популяции пациентов, подлежащих лечению. Такой отбор осуществляют путем определения наличия или отсутствия мутированного белка и/или белка дикого типа KRAS, HRAS или NRAS в образце опухоли PDAC каждого пациента. Пациенты, в образцах опухолей которых детектируют мутированные варианты KRAS, HRAS или NRAS и/или не детектируют KRAS, HRAS или NRAS дикого типа, не рассматриваются как удовлетворяющие критериям для получения лечения в соответствии с настоящим изобретением, тогда как пациенты, в образцах опухолей которых детектируют KRAS, HRAS или NRAS дикого типа и/или не детектируют мутированные варианты KRAS, HRAS или NRAS, рассматриваются как удовлетворяющие критериям для получения лечения в соответствии с настоящим изобретением.
[0070] Помимо этого, как было описано выше, в настоящем изобретении предложен способ прогнозирования восприимчивости или невосприимчивости пациента, страдающего PDAC, или опухоли PDAC, к лечению с использованием антитела к EGFR (фрагмента/пептида), описанного в настоящем документе. Как указано ранее, отсутствие или наличие мутированного белка и/или белка дикого типа KRAS, HRAS или NRAS в образце опухоли пациента можно оценить с использованием стандартных способов, известных в данной области техники и описанных в настоящем документе в другом месте. Экспрессия мутированного белка KRAS, HRAS или NRAS в опухоли PDAC указывает на то, что пациент, или опухоль PDAC, будет невосприимчив к лечению, тогда как экспрессия KRAS, HRAS или NRAS дикого типа в опухоли PDAC указывает на то, что пациент будет восприимчив к лечению с использованием антитела (фрагмента/пептида), описанного в настоящем документе.
Лечение
[0071] Термин «лечение» во всех своих грамматических формах включает терапевтическое или профилактическое лечение PDAC. Термин «терапевтическое или профилактическое лечение» включает профилактические способы лечения, направленные на полное предотвращение клинических и/или патологических проявлений, или терапевтическое лечение, направленное на улучшение или ремиссию клинических и/или патологических проявлений. Термин «лечение», следовательно, также включает улучшение или предотвращение PDAC.
[0072] Применительно к настоящему изобретению термин «терапевтический эффект» в целом относится к желательному или полезному действию лечения, например, улучшению или ремиссии проявлений заболевания. В настоящей заявке термин «проявление» заболевания описывает ощутимое проявление заболевания и включает клинические проявления, в дальнейшем обозначенные как признаки заболевания, которые можно детектировать во время физического обследования и/или которые ощущаются пациентом (т.е. симптомы), и патологические проявления, означающие проявления заболевания на клеточном и молекулярном уровне. Терапевтический эффект лечения с использованием антитела к EGFR (фрагмента/пептида) можно оценить с помощью RECIST, как описано в настоящем документе в другом месте. Дополнительно или в качестве альтернативы, также возможно оценить общий внешний вид соответствующего пациента (например, хорошее физическое состояние, хорошее самочувствие), что также сможет помочь специалисту в данной области техники оценить наличие терапевтического эффекта. Специалисту в данной области техники известны другие многочисленные способы, которые пригодны для наблюдения терапевтического эффекта соединений согласно настоящему изобретению.
Доза
[0073] Предпочтительно вводят терапевтически эффективное количество антитела к EGFR (фрагмента/пептида). Под «терапевтически эффективным количеством» подразумевают количество моноклонального антитела (или его антигенсвязывающего фрагмента или фрагмента), которое вызывает терапевтический эффект, описанный в настоящем документе. Точная доза антитела к EGFR (фрагмента/пептида) будет зависеть от цели лечения (например, поддержания ремиссии в отношении острого роста опухоли или метастатического распространения), и будет определена специалистом в данной области техники с использованием известных методик. Корректировки для пути введения, возраста, массы тела, общего состояния здоровья, пола, рациона питания, времени введения, взаимодействия с лекарственными средствами и тяжести состояния могут быть необходимы и будут определены с помощью стандартных экспериментов специалистами в данной области техники.
[0074] В настоящем изобретении также предложена схема лечения пациентов с PDAC с использованием моноклонального антитела (фрагмента/пептида), причем указанное антитело предпочтительно представляет собой нимотузумаб. Согласно настоящему изобретению пациентов лечат нимотузумабом в диапазоне дозировок от 200 до 400 мг один раз в неделю. Предусмотренный диапазон дозировок «от 200 мг до 400 мг» включает, например, 200 мг, 250 мг, 300 мг, 350 мг и 400 мг и дозировки, величина которых находится в пределах указанного диапазона. Согласно настоящему изобретению еженедельное введение дозировки нимотузумаба от 200 до 400 мг можно осуществлять в течение периода времени в 12, 24 или 36 недель. После указанного еженедельного лечения пациенты могут получить лечение нимотузумабом в дозировке от 200 до 400 мг один раз каждые 2-3 недели.
Введение
[0075] Различные пути пригодны для введения моноклонального антитела (пептида/фрагмента) согласно настоящему изобретению, включая, но не ограничиваясь ими, пероральный, местный, чрескожный, подкожный, внутривенный, внутрибрюшинный, внутримышечный или внутриглазной пути введения. Однако любой другой путь введения легко может быть выбран специалистом в данной области техники, при необходимости. Внутривенная инфузия указанного антитела (пептида/фрагмента) является особенно предпочтительной согласно настоящему изобретению.
Противораковые агенты
[0076] В настоящем изобретении также предложено дополнительное введение (совместное введение) противораковых агентов пациентам с PDAC. Указанные противораковые агенты могут быть введены до, одновременно и/или последовательно с антителом (фрагментом/пептидом), описанным в настоящем документе.
[0077] Применительно к настоящему изобретению термин «противораковый агент» включает любой агент, который можно применять для лечения PDAC, включая химиотерапевтические агенты, антинеопластические агенты и биологические молекулы. Агенты, включенные в определение противораковых агентов, включают, но не ограничиваются ими, алкилирующие агенты, например, мехлорэтамин, циклофосфамид, мелфалан, хлорамбуцил, ифосфамид, бусульфан, N-нитрозо-N-метилмочевину (НММ), кармустин (BCNU), ломустин (CCNU), семустин (MeCCNU), фотемустин, стрептозотоцин, дакарбазин, митозоломид, темозоломид, тиотепа, митомицин, диазиквон (AZQ), цисплатин, карбоплатин, оксалиплатин, прокарбазин и гексаметилмеламин; антиметаболиты, например, метотрексат, пеметрексед, фторурацил, капецитабин, цитарабин, гемцитабин, децитабин, видаза, флударабин, неларабин, кладрибин, клофарабин, пентостатин, тиогуанин, меркаптопурин; нацеленные на микротрубочки агенты, например, винкристин, винбластин, винорелбин, виндезин, винфлунин, паклитаксел, доцетаксел, подофиллотоксин; ингибиторы топоизомеразы, например, иринотекан, топотекан, этопозид, доксорубицин, митоксантрон, тенипозид, новобиоцин, мербарон, акларубицин; цитотоксические антибиотики, например, актиномицин, блеомицин, пликамицин, митомицин, доксорубицин, даунорубицин, эпирубицин, идаруцибин, пирарубицин, акларубицин и митоксантрон. В частности, подходящие агенты включают гемцитабин, FOLFIRINOX, эрлотиниб, 5-фторурацил, паклитаксел, наб-паклитаксел, доцетаксел, капецитабин, оксалиплатин, цисплатин, FOLFOXIRI, абраксан, антитела к CD40, ореговомаб, нелфинавир, цетуксимаб, тегафур, лейковорин и их комбинации.
[0078] В настоящем изобретении также предусмотрено дополнительное введение паллиативных агентов для снижения или контроля побочных эффектов лечения PDAC и симптомов PDAC, включая боль, тошноту, одышку, бессонницу и другие физические симптомы, вызванные раком или его лечением.
Композиция
[0079] В настоящем изобретении предложено введение антитела к EGFR (фрагмента/пептида) или нуклеиновой кислоты, кодирующей указанное антитело к EGFR или его антигенсвязывающий фрагмент или пептид, в виде фармацевтической композиции. Предпочтительно указанное антитело к EGFR (фрагмент/пептид) или нуклеиновая кислота присутствует в фармацевтической композиции в терапевтически эффективном количестве. Термин «фармацевтическая композиция», в частности, относится к композиции, пригодной для введения человеку, т.е. композиции, содержащей компоненты, которые являются фармацевтически приемлемыми. Предпочтительно фармацевтическая композиция содержит моноклональное антитело (или его антигенсвязывающий фрагмент или пептид) или нуклеиновую кислоту, описанную в настоящем документе, вместе с одним или более фармацевтическими вспомогательными веществами. Композиция также может содержать дополнительные противораковые агенты, описанные в настоящем документе в другом месте. Термин «вспомогательное вещество» включает наполнители, связующие вещества, разрыхлители, покрытия, сорбенты, антиадгезивные агенты, вещества, способствующие скольжению, консерванты, антиоксиданты, ароматизаторы, красители, подсластители, растворители, сорастворители, буферные агенты, хелатирующие агенты, агенты, придающие вязкость, поверхностно-активные агенты, разбавители, увлажнители, носители, разбавители, консерванты, эмульгаторы, стабилизаторы или модификаторы тоничности. Фармацевтические композиции согласно настоящему изобретению предпочтительно содержат терапевтически эффективное количество моноклонального антитела (или его антигенсвязывающего фрагмента или пептида) и могут быть изготовлены в различных формах, например, в твердой, жидкой, газообразной или лиофилизированной форме, и могут быть, помимо прочего, в форме мази, крема, трансдермальных пластырей, геля, порошка, таблетки, раствора, аэрозоля, гранул, пилюль, суспензий, эмульсий, капсул, сиропов, жидкостей, эликсиров, экстрактов, настоек или экстрактов жидкостей, или в форме, которая является особенно подходящей для желательного способа введения.
[0080] Фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать один или более дополнительных противораковых агентов. Предпочтительно указанные агенты являются терапевтически эффективными для лечения PDAC. Особенно подходящие противораковые агенты были описаны применительно к совместному введению. Примеры, которые можно применять в фармацевтической композиции согласно настоящему изобретению, включают, но не ограничиваются ими, гемцитабин, FOLFIRINOX, эрлотиниб, 5-фторурацил, паклитаксел, наб-паклитаксел, доцетаксел, капецитабин, оксалиплатин цисплатин, FOLFOXIRI, абраксан, антитело к CD40, ореговомаб, нелфинавир, цетуксимаб, тегафур, лейковорин и их комбинации.
[0081] Ввиду вышеизложенного в настоящем изобретении, следовательно, также предложена фармацевтическая композиция, содержащая моноклональное антитело (или его антигенсвязывающий фрагмент или пептид), описанное в настоящем документе, или нуклеиновую кислоту, кодирующую указанное антитело, для применения в лечении популяции пациентов с диагнозом аденокарцинома протоков поджелудочной железы (PDAC), причем указанная PDAC экспрессирует KRAS, HRAS или NRAS дикого типа. В частности, антитело может представлять собой нимотузумаб.
[0082] Фармацевтическая композиция, как предполагается, содержит дозировку активного агента в диапазоне от 200 до 400 мг. Термин «дозировка (…) от 200 до 400 мг» включает дозировки, например, 200 мг, 250 мг, 300 мг, 350 мг и 400 мг активного агента, а также дозировки в пределах указанного диапазона. Активный агент, т.е. моноклональное антитело (или его антигенсвязывающий фрагмент или пептид), в частности может представлять собой нимотузумаб.
[0083] Нижеследующие примеры, представленные исключительно в иллюстративных целях, предложены для лучшего понимания настоящего изобретения и его преимуществ. Указанные примеры не предназначены для ограничения объема настоящего изобретения каким-либо образом.
[0084] Следует отметить, что в настоящей заявке формы единственного числа «а», «an» и «the» включают ссылки на множественное число, если из контекста явно не следует иное. Следовательно, например, ссылка на «реагент» включает один или более из указанных различных реагентов, и ссылка на «способ» включает ссылку на эквивалентные стадии и способы, известные специалистам в данной области техники, которые могут быть модифицированы или заменены способами, описанными в настоящей заявке.
[0085] Если не указано иное, термин «по меньшей мере», предшествующий ряду элементов, следует понимать как относящийся к каждому элементу в ряду. Специалисты в данной области техники поймут, или смогут определить, с помощью исключительно стандартных экспериментов, многие эквиваленты конкретных вариантов реализации настоящего изобретения, описанного в настоящем документе. Такие эквиваленты включены в область настоящего изобретения.
[0086] В настоящей заявке термин «и/или» включает значение «и», «или» и «все или любая другая комбинация элементов, соединенных указанным термином».
[0087] В настоящей заявке термин «примерно» или «приблизительно» означает в пределах 20%, предпочтительно в пределах 10% и более предпочтительно в пределах 5% от заданного значения или диапазона. Указанный термин также включает, однако, конкретное число, например, «приблизительно 20» включает 20.
[0088] Термин «менее чем» или «более чем» включает конкретное число. Например, менее чем 20 означает менее чем или равно. Аналогичным образом, более чем или больше чем означает более чем или равно, или больше чем или равно, соответственно.
[0089] В данном описании и нижеследующей формуле изобретения, если из контекста не следует иное, слово «содержат» и его варианты, такие как «содержит» и «содержащий», следует понимать как подразумевающие включение указанного целого или этапа, или группы целых чисел или этапов, но не исключение любого другого целого числа или этапа, или группы целых чисел или этапов. В настоящей заявке термин «содержащий» может быть заменен термином «состоящий из» или «включающий» или иногда, при использовании в настоящем описании, термином «имеющий».
[0090] В настоящей заявке термин «состоящий из» исключает любой элемент, этап или ингредиент, не упомянутый в указанном элементе. В настоящей заявке термин «состоящий по существу из» не исключает материалы или этапы, которые не оказывают существенного влияния на основные и новые характеристики объекта настоящего изобретения.
[0091] Следует понимать, что настоящее изобретение не ограничено конкретной методологией, протоколами, материалами, реагентами и веществами и т.д., описанными в настоящем документе, и которые могут варьироваться как таковые. В настоящей заявке терминология предназначена для описания конкретных вариантов реализации и не предназначена для ограничения объема настоящего изобретения, который определен исключительно формулой изобретения.
[0092] Все публикации и патенты, цитируемые в тексте настоящего описания (включая все патенты, заявки на патенты, научные публикации, спецификации производителя, инструкции и т.д.), как вышеуказанные, так и нижеуказанные, полностью включены в настоящую заявку посредством ссылки. Ничто из содержащегося в настоящем документе не должно быть истолковано как допущение того, что изобретение не имеет права предшествовать такому раскрытию на основании предшествующего изобретения. В тех случаях, когда материал, упомянутый посредством ссылки, противоречит или не согласуется с данным описанием, описание превалирует над любым таким материалом.
ПРИМЕРЫ
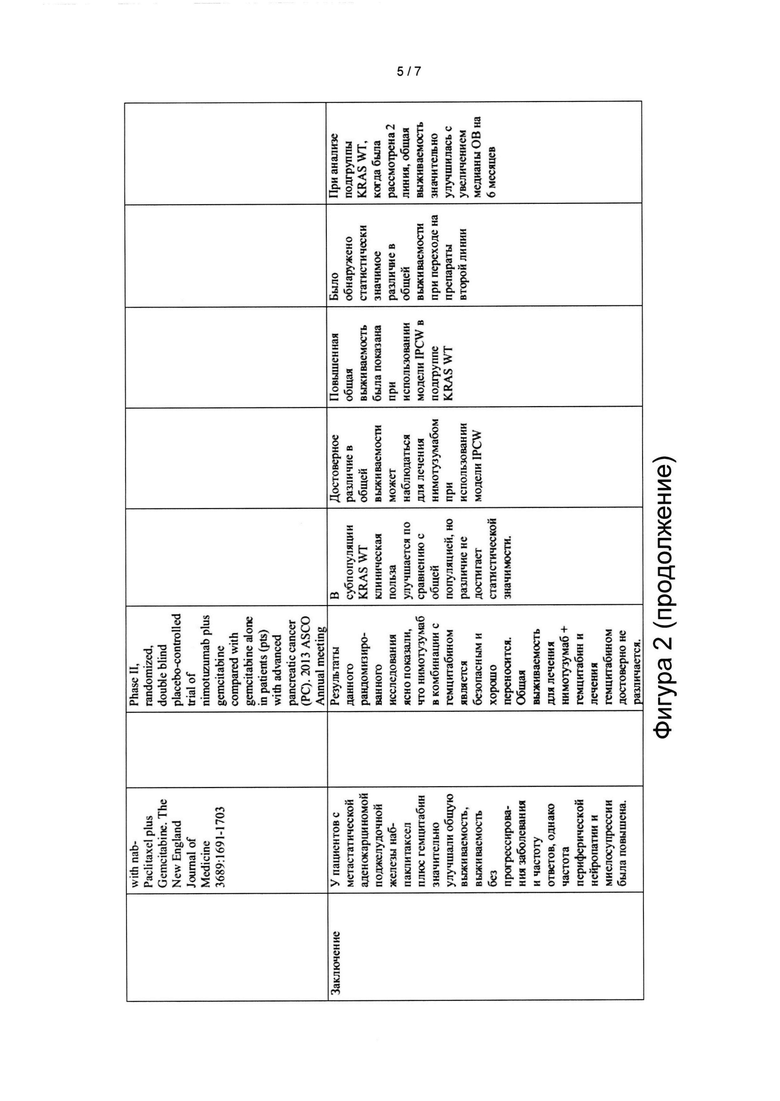
[0093] FOLFIRINOX значительно увеличивает выживаемость при метастатической карциноме поджелудочной железы (КПЖ) по сравнению с гемцитабином, однако его можно применять только у ограниченного количества пациентов, вследствие высокой токсичности. В большинстве случаев гемцитабин (гем.) остается основой паллиативного лечения, несмотря на незначительное влияние на выживаемость и выживаемость без прогрессирования заболевания. Добавление ингибитора тирозиновой киназы EGFR, эрлотиниба, увеличивает медиану выживаемости только на 2 недели. Данное исследование было направлено на изучение эффекта добавления нимотузумаба (nimo), моноклонального антитела к EGFR, к лекарственному препарату первой линии, гемцитабину, у пациентов с раком поджелудочной железы (РСР).
ПРИМЕР 1: Ответ местно-распространенного или метастатического рака поджелудочной железы на комбинацию гемцитабин плюс нимотузумаб
Лечение
[0094] Сто девяносто двух (192) пациентов с впервые диагностированным местно-распространенным или метастатическим раком поджелудочной железы рандомизировали и зачисляли в 2 группы, при этом пациентам в группе лечения вводили внутривенно (в/в) нимотузумаб в дозе 400 мг один раз в неделю до момента прогрессирования заболевания или возникновения неприемлемой токсичности, и гемцитабин в дозе 1000 мг/м2 один раз в неделю в течение 3 недель, с последующим 1-недельным перерывом во введении препаратов (d1, 8, 15; q28), и пациентам в контрольной группе вводили внутривенно плацебо один раз в неделю до момента прогрессирования заболевания или возникновения неприемлемой токсичности, и гемцитабин в дозе 1000 мг/м2 один раз в неделю в течение 3 недель, с последующим 1-недельным перерывом во введении препаратов (d1, 8, 15; q28).
[0095] Ответ опухоли оценивали с помощью КТ (компьютерной томографии) или МРТ (магнитно-резонансной томографии) и подвергали статистическому анализу с использованием RECIST (Критерии оценки ответа солидных опухолей), который содержит рекомендации по определению полного ответа, частичного ответа, стабильного заболевания или прогрессирующего заболевания на основании размера опухоли (см., например, Therasse et al., February 2000, "New Guidelines to Evaluate the Response to Treatment in Solid Tumors," J. Natl. Cancer Inst. 92(3): 205-216), и общую выживаемость оценивали на основании последнего визита, смерти или потери пациента для последующего наблюдения.
ПРИМЕР 2: Исследование мутаций KRAS у пациентов с местно-распространенным или метастатическим раком поджелудочной железы и взаимосвязь с выживанием.
[0096] Из 192 пациентов, которые были рандомизированы в 2 группы, образцы опухоли брали у 101 пациента (49 из контрольной группы и 52 из группы лечения).
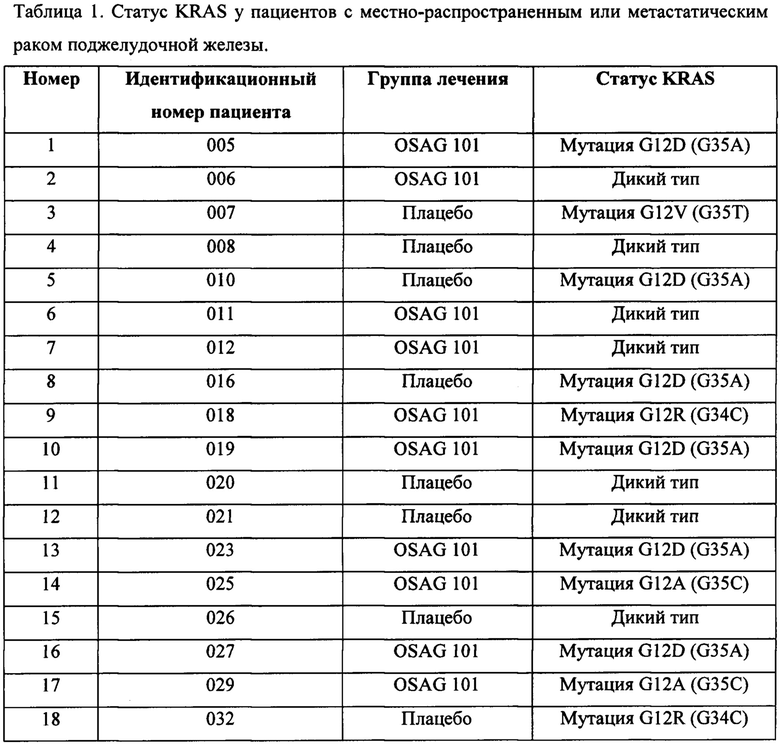
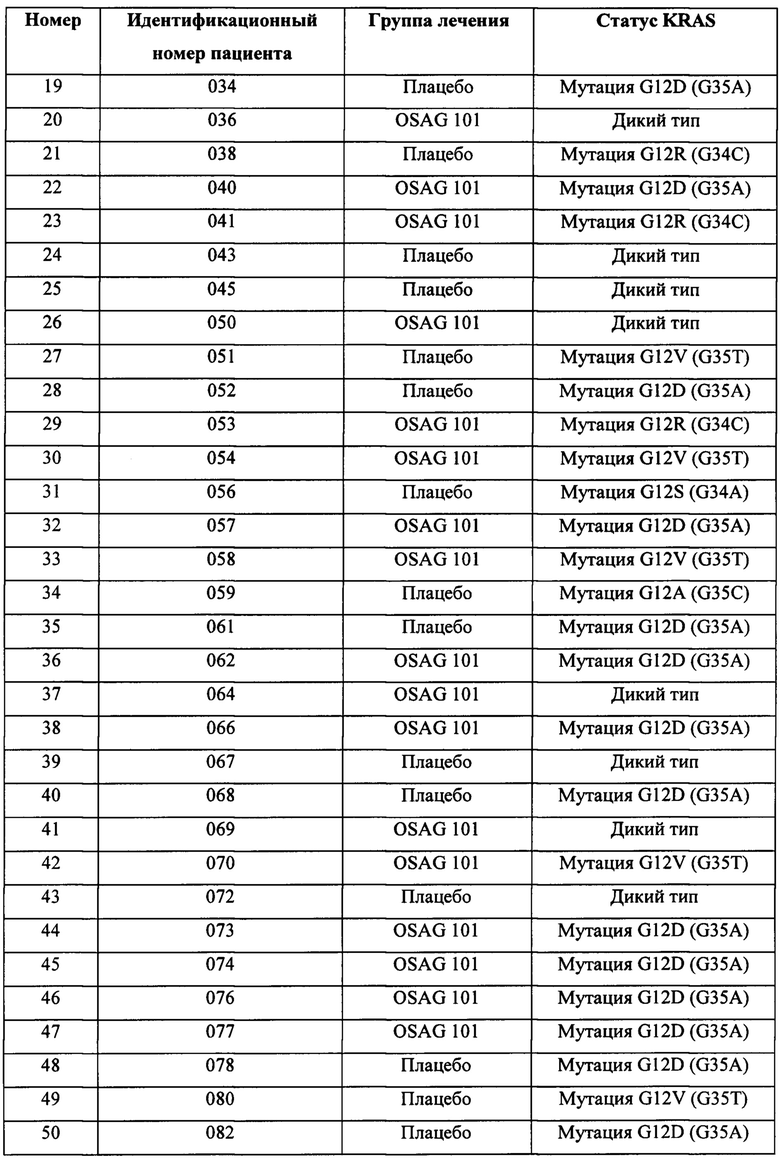
[0097] Чтобы определить корреляцию статуса KRAS с выживаемостью, исследовали 101 образец. На основании исследования KRAS в 101 образце было установлено, что 34 образца содержали KRAS дикого типа (20 из контрольной группы и 14 из группы лечения), и 67 образцов содержали мутацию KRAS (29 из контрольной группы и 38 из группы лечения). В таблице 1 представлен статус KRAS пациентов, включенных в клиническое исследование, приведенный по группам лечения.

[0098] Кривые выживаемости, полученные по методу Каплана-Мейера, для пациентов с местно-распространенным или метастатическим раком поджелудочной железы, несущим мутированный KRAS, из группы, получавшей плацебо-гемцитабин, по сравнению с пациентами из группы, получавшей нимотузумаб-гемцитабин, не имели достоверных различий в отношении выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (ОВ) (Фигура 3).
[0099] Кривые выживаемости, полученные по методу Каплана-Мейера, для пациентов с местно-распространенным или метастатическим раком поджелудочной железы, несущим KRAS дикого типа, из группы, получавшей плацебо-гемцитабин, по сравнению с пациентами, получавшими нимотузумаб-гемцитабин, статистически достоверно различались в группе лечения в отношении выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (ОВ) (Фигура 4).
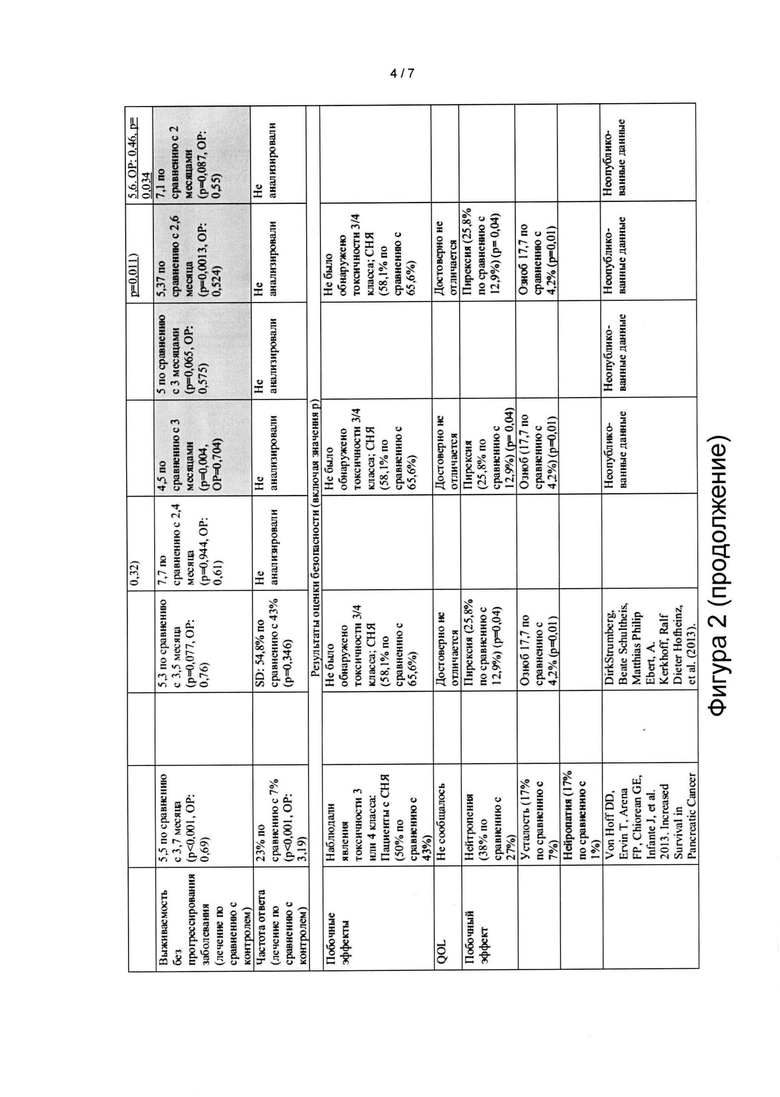
Клиническая безопасность
[00100] В общей сложности 212 серьезных нежелательных явлений (СНЯ) было зарегистрировано у 115 пациентов, 104 СНЯ в контрольной группе, получавшей плацебо-гемцитабин, были зарегистрированы у 61/93 (65,6%) пациентов, и 108 СНЯ в группе, получавшей нимотузумаб плюс гемцитабин, были зарегистрированы у 54/93 (58,1%) пациентов. Из 108 СНЯ, зарегистрированных в группе, получавшей нимотузумаб, 26 СНЯ у 15/93 (16,1%) пациентов были связаны с исследуемым препаратом. Наиболее распространенные СНЯ, которые, как сообщалось, были связаны с исследуемым препаратом, включали ухудшение общего физического состояния (3 субъекта, 3,23%), тошноту (2 субъекта, 2,15%), рвоту (2 субъекта, 2,15%) и тромбоцитопению (2 субъекта, 2,15%).
РЕЗУЛЬТАТЫ
[00101] В качестве первичной конечной точки оценивали общую выживаемость (ОВ) в популяции рандомизированных пациентов (ITT). ОВ оценивали по дате последнего визита, смерти или потере для последующего врачебного наблюдения. Первоначально ОВ рассчитывали для всей популяции и затем проводили анализ подгрупп с учетом статуса KRAS каждого из пациентов в каждой группе лечения. Вторичные конечные точки включали выживаемость без прогрессирования заболевания (ВБП), оцениваемую на день прогрессирования заболевания или смерти, клиническую безопасность, оцениваемую по частоте нежелательных явлений (НЯ) или серьезных нежелательных явлений (СНЯ), частоту объективного ответа (ЧОО), оцениваемую по количеству пациентов в каждой группе лечения с полным ответом (ПО) и частичным ответом (ЧО) на лечение ((ПО+40)/N, N - количество пациентов в группе)), и качество жизни (КЖ), оцениваемое с использованием анкеты по оценке качества жизни EORTC QLQ-C30, редакция 2.0 (EORTC, NL).
[00102] Выживаемость без прогрессирования заболевания (ВБП) определяют как период времени в ходе и после лечения заболевания, такого как рак, в течение которого пациент живет с заболеванием без ухудшения симптомов, и который измеряется со дня рандомизации до начала прогрессирования заболевания или смерти или даты последнего наблюдения без прогрессирования заболевания.
[00103] Полный ответ определяют как исчезновение всех целевых раковых поражений, данный показатель измеряли через 8, 16 и 24 недели.
[00104] Частичный ответ (ЧО) определяют как по меньшей мере 30% уменьшение суммы наибольших размеров целевых поражений, принимая в качестве эталонного значения сумму наибольших размеров в начальных условиях, данный показатель измеряли через 8, 16 и 24 недели.
[00105] Качество жизни оценивали с использованием модуля EORTC QLQ-C30, рассмотренного в Fayers et al. Eur J Cancer. 2002 Mar;38 Suppl 4:S125-33, и измеряли в следующих временных точках: (1) в начальных условиях в течение 7 дней до начала первого введения исследуемых лекарственных средств на 1 день, (2) на 6, 14 неделе, и затем через каждые 8 недель, и (3) в конце лечения.
[00106] При анализе подгруппы KRAS WT общая выживаемость была значительно улучшена у пациентов с местно-распространенным или метастатическим раком поджелудочной железы, которые получили лечение нимотузумабом и гемцитабином, с увеличением медианы общей выживаемости на 6 месяцев, при сравнении с контрольной группой, которая получила плацебо-гемцитабин. (см. фиг. 2).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКСНАЯ ТЕРАПИЯ | 2013 |
|
RU2677245C2 |
| ПЕПТИДНАЯ ВАКЦИНА, ВКЛЮЧАЮЩАЯ ПЕПТИД RAS, СОДЕРЖАЩИЙ МУТАЦИИ, И ХИМИОТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2700929C2 |
| СПОСОБЫ И НАБОРЫ, ИМЕЮЩИЕ ОТНОШЕНИЕ К ЗАХВАТУ CA-IX-ПОЗИТИВНЫХ ЭКЗОСОМ | 2018 |
|
RU2770592C2 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПЕЦИФИЧНЫЕ ПО ОТНОШЕНИЮ К HER3, И ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2620068C2 |
| Комбинация ингибитора EGFR и ингибитора MEK для применения в лечении рака, вызванного мутировавшим NRAS | 2015 |
|
RU2683276C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА-18 ДЛЯ ЛЕЧЕНИЯ РАКА | 2008 |
|
RU2571923C2 |
| БЕЛКИ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2549678C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕ RET, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2821548C2 |
| БЕЛКИ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2673724C2 |















Группа изобретений относится к медицине, а именно к области иммунотерапии рака, в частности аденокарциномы протоков поджелудочной железы (PDAC). Предложены средства и способы лечения популяции пациентов, страдающих опухолями PDAC экспрессирующими белок KRAS дикого типа. Варианты осуществления изобретения включают введение нимотузумаба пациенту с PDAC, экспрессирующей KRAS дикого типа, который имеет последовательность, соответствующую SEQ ID NO: 7 или SEQ ID NO: 24 и не содержит мутацию в аминокислотном остатке кодона G12. Способ может включать дополнительное введение других противораковых агентов. Также заявлен способ прогнозирования невосприимчивости пациента, страдающего PDAC, к лечению нимотузумабом на основании наличия мутации KRAS в опухоли; при этом наличие мутации KRAS в аминокислотном остатке кодона G12 последовательности SEQ ID NO: 7 или SEQ ID NO: 24 указывает на то, что указанный пациент будет невосприимчив к лечению нимотузумабом. Группа изобретений позволяет увеличивать выживаемость пациентов с PDAC. 4 н. и 19 з.п. ф-лы, 4 ил., 1 табл., 2 пр.
1. Способ лечения популяции пациентов с диагнозом аденокарцинома протоков поджелудочной железы (PDAC), причем указанная аденокарцинома протоков поджелудочной железы экспрессирует белок KRAS дикого типа, причем указанный способ включает введение указанному пациенту нимотузумаба в эффективном количестве.
2. Способ по п. 1, отличающийся тем, что указанный KRAS дикого типа характеризуется тем, что он имеет последовательность, соответствующую SEQ ID NO: 7 или SEQ ID NO: 24.
3. Способ по п. 2, отличающийся тем, что указанный KRAS дикого типа не содержит мутацию в аминокислотном остатке кодона G12.
4. Способ по любому из предшествующих пунктов, отличающийся тем, что указанную популяцию пациентов выбирают путем определения наличия или отсутствия мутированного варианта KRAS и/или KRAS дикого типа в образце опухоли PDAC каждого пациента, причем пациентов, в образцах опухолей которых детектируют мутированные варианты KRAS и/или не детектируют KRAS дикого типа, не отбирают для лечения, тогда как пациентов, в образцах опухолей которых детектируют KRAS дикого типа и/или не детектируют мутированные варианты KRAS, отбирают для лечения.
5. Способ по п. 4, отличающийся тем, что определение экспрессии KRAS дикого типа в образце опухоли PDAC включает амплификацию нуклеиновой кислоты KRAS из указанной опухоли и секвенирование указанной нуклеиновой кислоты и/или включает детектирование мутированного варианта полипептида и/или полипептида дикого типа KRAS в образце указанной опухоли PDAC.
6. Способ по любому из предшествующих пунктов, дополнительно включающий совместное введение противоракового агента.
7. Способ по п. 6, отличающийся тем, что указанный противораковый агент выбран из группы, состоящей из химиотерапевтического агента, антинеопластического агента и биологической молекулы.
8. Способ по любому из пп. 6-7, отличающийся тем, что указанный противораковый агент вводят до, одновременно и/или после совместного введения антитела.
9. Способ по любому из пп. 6-8, отличающийся тем, что указанный противораковый агент выбран из гемтабицина, FOLFIRINOX, эрлотиниба, 5-фторурацила, паклитаксела, наб-паклитаксела, доцетаксела, капецитабина, оксалиплатина, цисплатина, FOLFOXIRI, абраксана, антитела к CD40, ореговомаба, нелфинавира, цетуксимаба, тегафура, лейковорина.
10. Способ по любому из предшествующих пунктов, отличающийся тем, что у указанных пациентов была диагностирована местнораспространенная и/или метастатическая аденокарцинома протоков поджелудочной железы (PDAC).
11. Способ по любому из предшествующих пунктов, отличающийся тем, что указанное антитело представляет собой нимотузумаб и указанных пациентов лечат с использованием нимотузумаба в диапазоне дозировок от 200 до 400 мг один раз в неделю.
12. Способ по п. 11, отличающийся тем, что еженедельное лечение с использованием дозировок нимотузумаба от 200 до 400 мг осуществляют в течение периода времени в 12, 24 или 36 недель.
13. Способ по п. 12, отличающийся тем, что после еженедельного лечения в течение 12, 24 или 36 недель указанный пациент получает нимотузумаб в дозировке от 200 до 400 мг один раз каждые 3 недели.
14. Способ по любому из предшествующих пунктов, отличающийся тем, что указанный нимотузумаб вводят путем внутривенной инфузии.
15. Применение фармацевтической композиции, содержащей в эффективном количестве нимотузумаб, для лечения популяции пациентов, у которых была диагностирована аденокарцинома протоков поджелудочной железы (PDAC), причем указанная аденокарцинома протоков поджелудочной железы экспрессирует белок KRAS дикого типа.
16. Применение п. 15, отличающееся тем, что указанная фармацевтическая композиция дополнительно содержит по меньшей мере одно фармацевтическое вспомогательное вещество и/или по меньшей мере один противораковый агент.
17. Применение по п. 16, отличающееся тем, что указанный по меньшей мере один противораковый агент выбран из группы, состоящей из химиотерапевтического агента, антинеопластического агента и биологической молекулы.
18. Применение по п. 16 или 17, отличающееся тем, что указанный противораковый агент выбран из гемтабицина, FOLFIRINOX, эрлотиниба, 5-фторурацила, паклитаксела, наб-паклитаксела, доцетаксела, капецитабина, оксалиплатина, цисплатина, FOLFOXIRI, абраксана, антитела к CD40, ореговомаба, нелфинавира, цетуксимаба, тегафура, лейковорина.
19. Применение по любому из пп. 16-18, отличающееся тем, что указанная композиция содержит нимотузумаб в дозировке от 200 до 400 мг.
20. Способ прогнозирования невосприимчивости пациента, страдающего аденокарциномой протоков поджелудочной железы (PDAC), к лечению нимотузумабом, включающий определение наличия или отсутствия мутации KRAS в опухоли PDAC у указанного пациента; при этом наличие мутации KRAS указывает на то, что указанный пациент будет невосприимчив к лечению нимотузумабом, при этом указанная мутация KRAS находится в кодоне аминокислотного остатка G12 последовательности SEQ ID NO: 7 или SEQ ID NO: 24.
21. Способ по п. 20, отличающийся тем, что у указанного пациента была диагностирована местнораспространенная и/или метастатическая аденокарцинома протоков поджелудочной железы (PDAC).
22. Способ прогнозирования невосприимчивости аденокарциномы протоков поджелудочной железы (PDAC) к лечению нимотузумабом, включающий определение наличия или отсутствия мутации KRAS в указанной опухоли PDAC; при этом наличие мутации KRAS указывает на то, что указанная опухоль будет невосприимчива к лечению нимотузумабом, при этом указанная мутация KRAS находится в кодоне аминокислотного остатка G12 последовательности SEQ ID NO: 7 или SEQ ID NO: 24.
23. Способ по любому из пп. 21-22, отличающийся тем, что определение наличия или отсутствия мутации KRAS в опухоли PDAC включает амплификацию нуклеиновой кислоты KRAS из указанной опухоли и секвенирование указанной нуклеиновой кислоты и/или включает детектирование мутированного варианта полипептида KRAS в образце указанной опухоли.
| WO 2013138371 A1, 19.09.2013 | |||
| Двухвходовое устройство управления электромагнитом | 1978 |
|
SU712863A1 |
| WO 2014095766 A1, 26.06.2014 | |||
| WANG H | |||
| et al | |||
| NIMOTUZUMAB COMBINED WITH GEMCITABINE AND CISPLATIN AS SECOND‐LINE CHEMOTHERAPY FOR ADVANCED NON‐SMALL‐CELL LUNG CANCER // Thorac Cancer | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| HEINEMANN V | |||
| et al | |||
| CLINICAL RELEVANCE OF EGFR- AND KRAS-STATUS IN COLORECTAL CANCER | |||
Авторы
Даты
2020-07-30—Публикация
2016-07-27—Подача