ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка истребует приоритет по предварительной заявке на патент США, серийный номер 61/613,046, поданной 20 марта 2012 года, и предварительной заявке на патент США, серийный номер 61/763,767, поданной 12 февраля 2013 года, которые обе включены в данный документ в виде ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к фармацевтической комбинации, содержащей ингибитор МЕК, представляющий собой соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты или его фармацевтически приемлемую соль, и ингибитор IGF1R, представляющий собой АНТИТЕЛО А, к фармацевтической композиции, содержащей такую комбинацию; к способам лечения рака, включающим введение терапевтически эффективного количества такой комбинации субъекту, который в нем нуждается, и к использованию такой комбинации для лечения рака.
УРОВЕНЬ ТЕХНИКИ
Путь RAS/RAF/MEK/ERK участвует в фактор-опосредованной пролиферативной сигнализации роста. Данный путь включает эволюционно консервативный сигнальный каскад, активируемый малой гуанидинтрифосфатазой (ГТФаза) RAS, которая, в свою очередь, активирует RAF, которая, в свою очередь, фосфорилирует и активирует МЕК, и которая, в свою очередь, активирует внеклеточную сигнал-регулируемую киназу (ERK). ERK-опосредованное фосфорилирование различных транскрипционных факторов регулирует несколько ключевых клеточных активностей, в том числе пролиферацию, дифференцировку, миграцию, выживание и ангиогенез.
Аберрантная сигнализация в пути RAS/RAF/MEK/ERK приводит к неограниченному росту клеток и трансформации клеток, а также является характерной чертой многих онкологических заболеваний. Ненадлежащая активация пути RAS может произойти из-за нескольких отдельных механизмов, в том числе активирующих мутаций в KRAS, активирующих мутаций в NRAS и серин/треониновой киназы BRAF. Около 15% онкологических заболеваний человека несут активирующие мутации RAS, в том числе рака ободочной и прямой кишки (CRC) (40% мутаций KRAS), рака поджелудочной железы (70-90% мутаций KRAS) и немелкоклеточного рака легкого (NSCLC) (30% мутаций KRAS). Активирующие мутации в BRAF встречаются в 7-8% всех солидных опухолей и в 60% злокачественных меланом, в 8-15% CRC и в 3% случаев карциномы поджелудочной железы. Соматические мутации в BRAF и NRAS встречаются в 50-60% и 15-20% меланом кожи, соответственно. Как правило, такие активирующие мутации KRAS, NRAS и BRAF считаются критическими провоцирующими факторами злокачественной опухоли.
Дополнительно, рецептор инсулиноподобного фактора роста 1 (IGF1R), трансмембранная тирозинкиназа, широко экспрессируется в нормальных тканях. Данный рецептор активируется посредством связывания природных лигандов IGF1 и IGF2, и приводит к активации пути PI3K/AKT и RAS/RAF/MEK/ERK. Сигнализация через фосфатидилинозитол-3-киназы (PI3K) регулирует разнообразные клеточные функции, в том числе синтез белка и метаболизм глюкозы, выживание и рост клеток, пролиферацию, устойчивость и восстановление клеток, миграцию клеток и ангиогенез. После активации PI3K образует PIP3, липидный "вторичный посредник", который, в свою очередь, активирует АКТ (РКВ), серин/треониновую киназу, которая, вероятно, представляет собой более понятный нижележащий эффектор PI3K. Сигнализация PI3K негативно регулируется действием протеинфосфатаз/3-PI фосфатаз двойной специфичности, а именно супрессором опухоли PTEN.
Активация пути PI3K/AKT, связанного с повышенной сигнализацией IGF1R, как известно, встречается в различных онкологических заболеваниях, таких как карцинома поджелудочной железы, рак ободочной и прямой кишки и меланома. Оказывается, что IGF1R зачастую сверхэкспрессируется в раковых клеточных линиях и онкологических заболеваниях человека, и многие раковые клеточные линии митогенетически чутко реагируют на физиологические концентрации IGF. Тем не менее, оказывается, что сверхэкспрессия IGF1R, в отличие от других рецепторов рецепторной тирозинкиназы, не связана с амплификацией гена или мутацией гена. Оказывается, что IGF1R обеспечивает устойчивость к ингибиторам рецептора эпидермального фактора роста (EGFR) в EGFR амплифицированных опухолях за счет потери экспрессии белка, связывающего инсулиноподобный фактор роста.
Многие онкологические заболевания, в особенности те, которые несут амплификации EGFR, KRAS-мутации или BRAF-мутации, поддаются лечению ингибиторами рецептора эпидермального фактора роста (EGFR), ингибиторами IGF1R и/или BRAF-ингибиторами, соответственно. Тем не менее, во многих случаях данные онкологические заболевания приобретают устойчивость к данным выбранным терапевтическим средствам и в конечном итоге становятся невосприимчивыми к лечению.
Несмотря на многочисленные варианты лечения для больных раком, остается необходимость в эффективных и безопасных терапевтических агентах, а также необходимость их преимущественного использования в комплексной терапии. В частности, в данной области техники существует необходимость в новых способах лечения онкологических заболеваний, в частности тех, которые несут амплификацию EGFR, активирующие мутации EGFR, сопровождающуюся активацией IGFR1 сигнатуру (например, сверхэкспрессия IGF1R, высокие уровни циркулирующего в крови IGF-1 или высокие уровни IGFBP1), KRAS-мутантные, NRAS-мутантные или BRAF-мутированные онкологические заболевания, в особенности тех онкологических заболеваний, которые были устойчивы и/или невосприимчивы к текущей терапии.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторой степени настоящее изобретение относится, в частности, к фармацевтической комбинации, содержащей (а) соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (СОЕДИНЕНИЕ А) или его фармацевтически приемлемую соль и (b) ингибитор IGF1R, представляющий собой АНТИТЕЛО А, содержащее аминокислотную последовательность тяжелой цепи, приведенную в SEQ ID NO: 1, и аминокислотную последовательность легкой цепи, приведенную в SEQ ID NO: 2 в данном документе.
В одном варианте реализации в настоящем изобретении предлагается фармацевтическая комбинация, содержащая соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты или его фармацевтически приемлемую соль и ингибитор IGF1R, представляющий собой АНТИТЕЛО А, для использования в лечении рака у субъекта, который в нем нуждается. Комбинация по настоящему изобретению может быть использована для лечения субъектов, страдающих, например, от онкологических заболеваний с амплификацией EGFR, активирующими мутациями EGFR, сопровождающейся активацией IGFR1 сигнатурой (например, сверхэкспрессия IGF1R, высокие уровни циркулирующего в крови IGF-1 или высокие уровни IGFBP1), KRAS-мутациями, NRAS-мутациями или BRAF-мутациями. Подходящие онкологические заболевания включают, без ограничения ими, рак поджелудочной железы, например, местнораспространенный рак поджелудочной железы и KRAS-мутированный рак поджелудочной железы.
В дополнительном варианте реализации в настоящем изобретении предлагается фармацевтическая комбинация, содержащая соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты или его фармацевтически приемлемую соль и ингибитор IGF1R, представляющий собой АНТИТЕЛО А, для использования в лечении онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к существующим терапиям, например, амплифицированных EGFR, KRAS-мутированных онкологических заболеваний, NRAS-мутантных и BRAF-мутированных онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к ингибиторам EGFR, ингибиторам IGF1R или ингибиторам BRAF, у субъекта, который в нем нуждается.
В дополнительном варианте реализации в настоящем изобретении предлагается комбинация (2-гидроксиэтокси)-амида 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (СОЕДИНЕНИЕ А) или его фармацевтически приемлемой соли и АНТИТЕЛА А, представляющая синергетический эффект.
Настоящее изобретение относится к способу лечения рака у субъекта (например, пациента) посредством введения субъекту, который нуждается в таком лечении, терапевтически эффективного количества или дозы комбинации СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А.
В одном варианте реализации настоящее изобретение относится к способу лечения рака посредством введения субъекту, который нуждается в таком лечении, количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А, что является совместно терапевтически эффективным для указанного лечения.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и АНТИТЕЛО А находятся в единой композиции или стандартной лекарственной форме. В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и АНТИТЕЛО А находятся в раздельных композициях или стандартных лекарственных формах.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и/или АНТИТЕЛО А вводят, по сути, одновременно. В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и/или АНТИТЕЛО А вводят в разные моменты времени.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А вводят субъекту перед введением АНТИТЕЛА А. В дополнительном варианте реализации изобретения АНТИТЕЛО А вводят субъекту перед введением СОЕДИНЕНИЯ А.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А вводят в дозе от около 15 до 60 мг, например, от 15 до 60 мг. В дополнительном варианте реализации изобретения МОНОКЛОНАЛЬНОЕ АНТИТЕЛО А вводят в дозе от около 9 до 20 мг/кг, например, от 9 до 20 мг/кг.
Настоящее изобретение относится к способу лечения рака, который является устойчивым или невосприимчивым к предшествующему лечению модулятором EGFR, ингибитором IGF1R или ингибитором BRAF, включающему введение терапевтически эффективного количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А субъекту, который в нем нуждается.
Настоящее изобретение дополнительно относится к способу лечения рака, который является устойчивым или невосприимчивым к лечению ингибитором IGF1R, представляющим собой АНТИТЕЛО А, посредством введения терапевтически эффективного количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли.
Настоящее изобретение относится к применению фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и АНТИТЕЛО А, для изготовления фармацевтического препарата или лекарственного средства для лечения рака.
Настоящее изобретение дополнительно относится к применению фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и АНТИТЕЛО А, для изготовления фармацевтического препарата или лекарственного средства для лечения рака, который является устойчивым или невосприимчивым к лечению модулятором EGFR, ингибитором IGF1R или ингибитором BRAF.
Настоящее изобретение дополнительно относится к применению СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли для лечения рака, который является устойчивым или невосприимчивым к лечению ингибитором IGF1R, представляющим собой АНТИТЕЛО А.
В одном варианте реализации настоящее изобретение относится к фармацевтической композиции или фармацевтическому препарату, содержащему (а) СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и (b) АНТИТЕЛО А, и, необязательно, один или более фармацевтически приемлемых носителей.
В дополнительном варианте реализации настоящее изобретение дополнительно относится к фармацевтической композиции или фармацевтическому препарату, содержащему (а) СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и (b) АНТИТЕЛО А, и, необязательно, один или более фармацевтически приемлемых носителей для использования в лечении рака.
В дополнительном варианте реализации настоящее изобретение относится к (а) фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и к (b) фармацевтической композиции, содержащей АНТИТЕЛО А, которые вводят в раздельных фармацевтических композициях субъекту, который в этом нуждается.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 иллюстрирует результаты опытов для определения воздействия комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А на пролиферацию клеток Miapaca-2 и AsPC-1 при отсутствии или в присутствии 100 нг/мл IGF1.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтической комбинации, содержащей соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (СОЕДИНЕНИЕ А) или его фармацевтически приемлемую соль и ингибитор IGF1R, представляющий собой АНТИТЕЛО А.
Некоторые термины, используемые в данном документе, описаны ниже. Соединения и антитела по настоящему изобретению описаны с применением стандартной номенклатуры. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится настоящее изобретение.
Термин "фармацевтическая комбинация", как применяют в данном документе, относится либо к фиксированной комбинации в одной стандартной лекарственной форме, либо к нефиксированной комбинации или набору компонентов для комбинированного введения, при которых два или более терапевтических агента можно вводить независимо друг от друга одновременно или раздельно с определенными интервалами времени, особенно когда эти интервалы времени позволяют, чтобы компоненты комбинации демонстрировали совместное действие, например, синергетический эффект.
Термин "комплексная терапия" относится к введению двух или более терапевтических агентов для лечения терапевтического состояния или заболевания, описанного в настоящем изобретении. Такое введение охватывает совместное введение этих терапевтических агентов, по сути, одновременно, например, в одной капсуле с фиксированным отношением действующих веществ или в нескольких, или в раздельных контейнерах (например, капсулах и/или внутривенных композициях) для каждого действующего вещества. Помимо этого, такое введение также охватывает использование каждого типа терапевтического агента в последовательном порядке, либо примерно в то же время, либо в разные моменты времени. В любом случае схема лечения будет оказывать положительный эффект комбинации лекарственных средств при лечении состояний или заболеваний, описанных в данном документе.
Термин "ингибитор МЕК", как применяют в данном документе, относится к соединению, которое направлено на, уменьшает или ингибирует по меньшей мере одну активность МЕК серинкиназы. Иллюстративные ингибиторы МЕК раскрыты в международной заявке РСТ WO 2003/0077914, которая включена в настоящее описание в виде ссылки во всей своей полноте.
Термин "ингибитор IGF1R", как применяют в данном документе, относится к соединению, которое направлено на, уменьшает или ингибирует по меньшей мере одну активность Рецептора Инсулиноподобного Фактора Роста 1. Иллюстративные ингибиторы IGFIR раскрыты в патенте США №7,871,611, который включен в настоящее описание в виде ссылки во всей своей полноте.
Термин "фармацевтически приемлемый", как применяют в данном документе, относится к таким соединениям, антителам, материалам, композициям и/или лекарственным формам, которые в пределах медицинской оценки подходят для контакта с тканями теплокровного животного, например, млекопитающего или человека, без чрезмерной токсичности, раздражения аллергической реакции и других проблемных осложнений, соразмерных с приемлемым соотношением польза/риск.
Термины "фиксированная комбинация", "фиксированная доза" и "единая композиция", как применяют в данном документе, относятся к единому носителю или основе, или лекарственной форме, приготовленным для доставки пациенту обоих терапевтических агентов в количестве, которое является совместно терапевтически эффективным для лечения рака. Единая основа предназначена для доставки количества каждого из агентов наряду с любыми фармацевтически приемлемыми носителями или вспомогательными веществами. В некоторых вариантах реализации изобретения основа представляет собой таблетку, капсулу, драже или пластырь. В других вариантах реализации изобретения основа представляет собой раствор или суспензию.
Термин "нефиксированная комбинация" или "набор компонентов" означает, что действующие вещества, например, СОЕДИНЕНИЕ А и АНТИТЕЛО А, оба вводят пациенту в виде раздельных компонентов либо одновременно, совместно, либо последовательно без определенных ограничений по времени, причем такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме теплокровного животного, которое в них нуждается. Последнее также относится к коктейльной терапии, например, к введению трех или более действующих веществ.
Термин "стандартная доза" используют в данном документе для обозначения одновременного введения двух агентов вместе в одной лекарственной форме пациенту, который получает лечение. В некоторых вариантах реализации изобретения стандартная доза представляет собой единую композицию. В некоторых вариантах реализации изобретения стандартная доза содержит одну или более основ, таких, чтобы каждая основа содержала эффективное количество по меньшей мере одного из агентов наряду с фармацевтически приемлемыми носителями и вспомогательными веществами. В некоторых вариантах реализации изобретения стандартная доза представляет собой одну или более таблеток, капсул, драже или пластырей, которые вводят пациенту одновременно.
"Лекарственная форма для перорального применения" включает стандартную лекарственную форму, предписанную или предназначенную для перорального введения.
Термин "лечение" используют в данном документе для обозначения облегчения, уменьшения или смягчения по меньшей мере одного симптома заболевания у субъекта. В контексте настоящего изобретения термин "лечение" также означает приостановку, задержку дебюта (например, периода до клинического проявления заболевания или симптома заболевания) и/или снижение риска развития или обострения симптома заболевания.
Термин "эффективное количество" или "терапевтически эффективное количество" комбинации терапевтических агентов представляет собой количество, достаточное для того, чтобы обеспечить заметное улучшение по сравнению с исходными клинически наблюдаемыми признаками и симптомами заболеваний, подлежащих лечению комбинацией.
Термин "совместно терапевтически активный" или "совместный терапевтический эффект", как применяют в данном документе, означает, что терапевтические агенты могут быть введены теплокровным животным, в особенности человеку, подлежащему лечению, по отдельности (в хронологическом шахматном порядке, особенно последовательно-специфическим образом) с такими временными интервалами, которые предпочтительно для них по-прежнему демонстрируют (предпочтительно синергетическое) взаимодействие (совместный терапевтический эффект). В частности, определить, является ли этот случай таковым, можно при помощи показателей крови, демонстрирующих, что оба соединения присутствуют в крови человека, подлежащего лечению, по меньшей мере в течение определенных интервалов времени.
Термин "субъект" предназначен для того, чтобы включать животных. Примеры субъектов включают млекопитающих, например, людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс, а также трансгенных животных нечеловеческого происхождения. В некоторых вариантах реализации изобретения данный субъект представляет собой человека, например, человека, больного, подверженного риску заболевания или потенциально способного болеть онкологическими заболеваниями.
Термины "содержащий" и "включающий" используют в данном документе в своем неограничивающем и не имеющем ограничительного характера смысле, если не указано иное.
Формы единственного числа (которые в языке оригинала передаются с помощью артиклей "а" и "an", и "the") и аналогичные ссылки в контексте описания изобретения (особенно в контексте нижеследующей формулы изобретения) должны толковаться как охватывающее как единственное, так и множественное число, если в данном документе не указано иное, или нет явного противоречия контексту. В случае если для соединений, солей и тому подобного используется форма множественного числа, это следует также понимать как форму единственного числа соединения, соли или тому подобного.
Термин "около" или "примерно", как правило, означает в пределах 20%, более предпочтительно - в пределах 10% и наиболее предпочтительно все же - в пределах 5% от заданного значения или диапазона. В альтернативном варианте, в особенности в биологических системах, термин "около" означает в пределах около логарифма (то есть, порядка величин), предпочтительно - в пределах фактора двух из заданных значений.
Фармацевтическая комбинация по настоящему изобретению содержит ингибитор МЕК, представляющий собой соединение с приведенной ниже химической формулой (А):
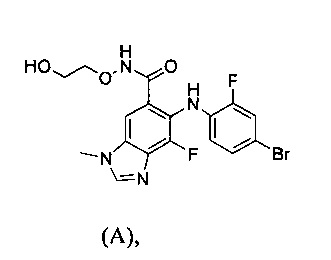
или его фармацевтически приемлемые соли. Соединение формулы (А) также известно как химическое соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (далее называемое как "СОЕДИНЕНИЕ А"). СОЕДИНЕНИЕ А описано в заявке РСТ № WO 03/077914, которая включена в настоящее описание в виде ссылки во всей своей полноте, а также способы его получения описаны, например, в Примере 18 данного документа.
Как применяют в данном документе, термин "фармацевтически приемлемые соли" относится к солям нетоксичных кислот или щелочных и щелочноземельных металлов СОЕДИНЕНИЯ А. Данные соли могут быть получены in situ во время конечного выделения и очистки соединения или посредством раздельного взаимодействия функций основания или кислоты с подходящей органической или неорганической кислотой или основанием, соответственно.
Кислоты, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей СОЕДИНЕНИЯ А представляют собой кислоты, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармацевтически приемлемые анионы, например, соли, содержащие такие вещества, как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальций, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдизилат, эстолат, эзилат, этилсукцинат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, йодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодод и валерат.
В отношении кислотных остатков предпочтительными неорганическими солями являются соли, которые образованы со щелочными и щелочноземельными металлами, такими как литий, натрий, калий, барий и кальций. Предпочтительные соли органических оснований включают, например, соли аммония, дибензиламмония, бензиламмония, 2-гидроксиэтиламмония, бис(2-гидроксиэтил)аммония, фенилэтилбензиламина, дибензил-этилендиамина и тому подобное соли. Другие соли кислотных остатков могут включать, например, соли, образованные с прокаином, хинином и N-метилглюкозамином, а также соли, образованные с основными аминокислотами, такими как глицин, орнитин, гистидин, фенилглицин, лизин и аргинин. Особенно предпочтительной солью является соль натрия или калия соединения по настоящему изобретению.
В отношении основных остатков предпочтительными неорганическими солями являются соли, которые образованы с кислотным соединением, в частности, с неорганической кислотой, такой как соляная, бромистоводородная, йодистоводородная, серная, фосфорная или подобные соли. Предпочтительные органические соли этого типа могут включать, например, соли, образованные с муравьиной, уксусной, янтарной, лимонной, молочной, малеиновой, фумаровой, пальмитиновой, холевой, памоевой, муциновой, D-глутаминовой, D-камфорной, глутаровой, гликолевой, фталевой, винной, лауриновой, стеариновой, салициловой, метансульфоновой, бензолсульфоновой, паратолуолсульфоновой, сорбиновой, пуриновой, бензойной, коричной и тому подобными органическими кислотами. Особенно предпочтительной солью этого типа является хлористоводородная соль или соль серной кислоты.
Если не указано иное или четко не указано в тексте, ссылка на соединения, используемые в комплексной терапии по настоящему изобретению, включает как свободное основание СОЕДИНЕНИЯ А, так и все фармацевтически приемлемые соли СОЕДИНЕНИЯ А.
Фармацевтическая комбинация по настоящему изобретению дополнительно содержит ингибирующее IGF1R антитело, представляющее собой АНТИТЕЛО А, раскрытое в патенте США №7,871,611, который включен в данное описание в виде ссылки во всей своей полноте. В частности, АНТИТЕЛО А содержит аминокислотную последовательность тяжелой цепи, приведенную в SEQ ID NO: 1, и аминокислотную последовательность легкой цепи, приведенную в SEQ ID NO: 2, в данном документе.
АНТИТЕЛО А тяжелой цепи

АНТИТЕЛО А легкой цепи

Варианты АНТИТЕЛА А также могут быть использованы в комплексной терапии и способах, раскрытых в данном документе. В одном варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, приведенную в SEQ ID NO: 3. В другом варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотную последовательность вариабельной области легкой цепи, приведенную в SEQ ID NO: 4. В другом варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотные последовательности вариабельной области тяжелой цепи и легкой цепи, приведенные в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно. В еще одном варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотные последовательности CDR1, 2 и 3 тяжелой цепи, приведенные в SEQ ID NO: 5, 6 и 7, соответственно. В другом варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотные последовательности CDR1, 2 и 3 легкой цепи, приведенные в SEQ ID NO: 8, 9 и 10, соответственно. В дополнительном варианте реализации изобретения данный вариант представляет собой антитело, содержащее аминокислотные последовательности CDR1, 2 и 3 тяжелой цепи, приведенные в SEQ ID NO: 5, 6 и 7, соответственно, а также аминокислотные последовательности CDR1, 2 и 3 легкой цепи, приведенные в SEQ ID NO: 8, 9 и 10, соответственно.
Аминокислотные последовательности вариабельной области и CDR антитела иллюстративных вариантов АНТИТЕЛА А приведены ниже:

Как применяют в данном документе, "комбинация агентов", "комбинация по настоящему изобретению" и подобные термины относятся к комбинации двух типов агентов: (1) ингибитора МЕК, представляющего собой СОЕДИНЕНИЕ А или его фармацевтически приемлемые соли, и (2) ингибитора IGF1R, представляющего собой АНТИТЕЛО А.
В данном документе предлагается комплексная терапия, содержащая ингибитор МЕК (например, СОЕДИНЕНИЕ А) и ингибитор IGF1R (например, АНТИТЕЛО А). Введение комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А включает введение комбинации в единой композиции или стандартной лекарственной форме, введение раздельных агентов комбинации совместно, но по отдельности, или введение раздельных агентов комбинации последовательно любым подходящим образом. Дозировка раздельных агентов комбинации может потребовать более частого введения одного агента (агентов) по сравнению с другим агентом (агентами) в комбинации. Таким образом, чтобы обеспечить соответствующую дозировку, упакованные фармацевтические препараты могут содержать одну или более лекарственных форм, которые содержат комбинацию агентов, а также одну или более лекарственных форм, которые содержат одну из комбинаций агентов, но не другой агент (агенты) комбинации.
В одном варианте реализации в настоящем изобретении предлагается фармацевтическая комбинация, содержащая соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты или его фармацевтически приемлемую соль и ингибитор IGFIR, представляющий собой АНТИТЕЛО А, для использования в лечении рака у субъекта, который в нем нуждается. Комбинация по настоящему изобретению может быть использована для лечения субъектов, страдающих, например, онкологическими заболеваниями с амплификацией EGFR, активирующими мутациями EGFR, сопровождающейся активацией IGFR1 сигнатурой (например, сверхэкспрессия IGF1R, высокие уровни циркулирующего в крови IGF-1 или высокие уровни IGFBP1), KRAS-мутациями, NRAS-мутациями или BRAF-мутациями.
В дополнительном варианте реализации настоящее изобретение относится к фармацевтической комбинации, содержащей соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты или его фармацевтически приемлемую соль и ингибитор IGF1R, представляющий собой АНТИТЕЛО А, для использования в лечении онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к существующим терапиям, например, амплифицированных EGFR, KRAS-мутированных онкологических заболеваний, NRAS-мутантных и BRAF-мутированных онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к ингибиторам EGFR, ингибиторам IGF1R или ингибиторам BRAF, у субъекта, который в нем нуждается.
В одном варианте реализации изобретения комбинация (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (СОЕДИНЕНИЕ А) или его фармацевтически приемлемая соль и АНТИТЕЛО А, описанные в данном документе, демонстрируют синергетический эффект. Термин "синергетический эффект", как применяют в данном документе, относится к действию двух агентов, таких как, например, СОЕДИНЕНИЕ А или его фармацевтически приемлемая соль и АНТИТЕЛО А, производя эффект, например, замедляющий симптоматическое развитие рака или его симптомов, которое является большим, чем простое добавление эффектов каждого лекарственного средства, вводимого самостоятельно. Синергетический эффект можно рассчитать, например, с применением подходящих способов, таких как сигмоидальное уравнение для вычисления максимальной эффективности (Holford, N.Н.G. и Scheiner, L.В., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности Лоэва (Loewe, S. и Muischnek, Н., Arch. Exp. Pathol Pharmacol. 114: 313-326 (1926)) и уравнение медианного эффекта (Chou, Т.С. и Talalay, P., Adv. Enzyme Regul. 22: 27-55 (1984)). Каждое уравнение, о котором идет речь выше, может быть применено к экспериментальным данным для получения соответствующего графика, чтобы облегчить оценку действий комбинации лекарственных средств. Соответствующие графики, связанные с уравнениями, о которых идет речь выше, представляют собой кривую "концентрация-эффект", кривую изоболограммы и кривую показателей комбинации, соответственно.
Способы Лечения с Применением Комбинации Ингибитора МЕК и Ингибитора IGF1R
Настоящее изобретение относится к способу лечения рака у субъекта, который в нем нуждается, посредством введения комбинации СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А субъекту, который в нем нуждается.
В одном варианте реализации изобретения настоящее изобретение относится к способу лечения рака у субъекта (например, пациента) посредством введения субъекту, который нуждается в таком лечении, терапевтически эффективного количества или дозы комбинации СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А.
В дополнительном варианте реализации настоящее изобретение относится к способу лечения рака посредством введения субъекту, который нуждается в таком лечении, количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А, что является совместно терапевтически эффективным для указанного лечения.
Примеры типов рака, которые можно лечить с помощью комбинации по настоящему изобретению включают, без ограничения ими, рак легкого, рак кости, хронический миеломоноцитарный лейкоз (CMML), рак поджелудочной железы, рак кожи, рак головы и шеи, кожную или внутриглазную меланому, рак матки, рак центральной нервной системы (ЦНС), рак яичников, рак прямой кишки, рак заднепроходной области, рак желудка, рак толстой кишки, рак молочной железы, меланому, рак ободочной и прямой кишки, рак яичка, гинекологические опухоли (например, саркома матки, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища или карцинома вульвы), болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы (например, рак щитовидной железы, паращитовидной железы или надпочечников), саркомы мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, детские солидные опухоли, лимфоцитарные лимфомы, рак мочевого пузыря, рак почки или мочеточника (например, почечно-клеточная карцинома, карцинома почечной лоханки). В некоторых вариантах реализации изобретения рак представляет собой солидную опухоль.
Дополнительные примеры типов рака, которые можно лечить с помощью комбинации по настоящему изобретению включают, без ограничения ими, карциному коры надпочечников, связанные со СПИДом онкологические заболевания, детскую астроцитому мозжечка, детскую астроцитому головного мозга, базальноклеточную карциному, внепеченочный рак желчных протоков, остеосаркому/злокачественную фиброзную гистиоцитому кости, опухоли головного мозга (например, глиома ствола головного мозга, астроцитома мозжечка, астроцитома головного мозга/злокачественная глиома, эпендимальная глиома, медуллобластома, супратенториальные примитивные нейроэктодермальные опухоли, глиома зрительного пути и гипоталамической области), бронхиальные аденомы/карциноиды, карциноидную опухоль, карциноидную опухоль желудочно-кишечного тракта, основной центральной нервной системы, астроцитому мозжечка, астроцитому головного мозга/злокачественную глиому, рак шейки матки, детские онкологические заболевания, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, хронические миелопролиферативные заболевания, эпендимальную глиому, опухоли семейства Юинга, экстракраниальную герминогенную опухоль, внегонадную герминогенную опухоль, внепеченочный рак желчных протоков, рак глаза в виде внутриглазной меланомы, рак глаза в виде ретинобластомы, рак желчного пузыря, карциноидную опухоль желудочно-кишечного тракта, герминогенные опухоли (например, экстракраниальная, внегонадная и яичников), гестационную трофобластическую опухоль, глиому (например, взрослая, детская ствола головного мозга, детская астроцитома головного мозга, детская зрительного пути и гипоталамической области), лейкоз ворсистых клеток, гепатоцеллюлярный рак, гипофарингеальный рак, глиому зрительного пути и гипоталамической области, карциному островковых клеток (эндокринная часть поджелудочной железы), саркому Капоши, рак гортани, лейкоз (например, острый лимфобластный, острый миелоидный, хронический лимфоцитарный, хронический миелогенный и волосатоклеточный), рак губ и ротовой полости, немелкоклеточный рак легкого, мелкоклеточный рак легкого, лимфому (например, связанную со СПИДом, Беркитта, Т-клеточную лимфому кожи, неходжкинскую и первичную лимфома центральной нервной системы), макроглобулинемию Вальденстрема, злокачественную фиброзную гистиоцитому кости/остеосаркому, медуллобластому, карциному из клеток Меркеля, мезотелиому, метастатический плоскоклеточный рак шеи с синдромом бессимптомной первичной, множественной эндокринной неоплазии, множественную миелому/плазмоклеточную неоплазию, фунгоидный микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, миелогенный лейкоз, рак носовой полости и околоносовых пазух, рак носоглотки, нейробластому, рак ротовой полости, рак ротоглотки, эпителиальный рак яичников, герминогенную опухоль яичников, пограничную опухоль яичника, рак поджелудочной железы, рак островковых клеток поджелудочной железы, рак паращитовидной железы, феохромоцитому, пинеобластому, опухоль гипофиза, плевролегочную бластому, переходно-клеточный рак мочеточника, ретинобластому, рабдомиосаркому, рак слюнных желез, синдром Сезари, немеланоцитарный рак кожи, карциному кожи из клеток Меркеля, плоскоклеточную карциному, рак яичка, тимому, гестационную трофобластическую опухоль и опухоль Вильмса.
В предпочтительном варианте реализации изобретения онкологические заболевания, которые можно лечить с помощью комбинации по настоящему изобретению, включают, без ограничения ими, рак ободочной и прямой кишки, рак поджелудочной железы, рак яичников и меланому.
Рак, подлежащий лечению, может иметь генетическое изменение в пути сигнальной трансдукции RAS/ RAF/MEK, такое как, например, мутация или амплификация гена HRAS, KRAS, NRAS или BRAF. В одном варианте реализации изобретения рак, подлежащий лечению, обладает мутацией KRAS, например, KRAS-мутированный рак ободочной и прямой кишки, рак поджелудочной железы, рак яичников и меланома. В дополнительном варианте реализации изобретения рак, подлежащий лечению, обладает мутацией BRAF (например, BRAFV600), например, меланомы.
В некоторых вариантах реализации изобретения рак представляет собой EGFR-амплифицированный, KRAS-мутированный, NRAS-мутированный или BRAF-мутированный рак. Подходящие KRAS-мутированные, NRAS-мутированные и BRAF-мутированные (например, BRAFV600) онкологические заболевания включают, без ограничения ими, рак ободочной и прямой кишки, рак поджелудочной железы, рак яичников и меланому.
В некоторых вариантах реализации изобретения рак выбирают из группы, состоящей из KRAS-мутированной аденокарциномы ободочной и прямой кишки, метастатической аденокарциномы поджелудочной железы и/или BRAFV600 мутантной меланомы.
Термин "Kras-мутированный рак" относится к раку, в котором раковые клетки содержат активирующую мутацию в малой гуанидинтрифосфатазе (ГТФаза) семейства RAS, KRAS.
Термин "NRAS-мутированный рак" относится к раку, в котором раковые клетки содержат активирующую мутацию в малой гуанидинтрифосфатазе (ГТФаза) киназы семейства RAS, NRAS. NRAS также известен как гомолог вирусного RAS (v-ras) нейробластомы.
Термин "BRAF-мутированный рак" относится к раку, в котором раковые клетки содержат активирующую мутацию в серин/треониновой протеинкиназе, B-Raf.
Термин "ингибитор BRAF" относится к соединению или агенту, который ингибирует, уменьшает, снижает или сокращает по меньшей мере одну активность любых изоформ или мутантов киназы BRAF. Примеры ингибиторов BRAF включают, без ограничения ими, GSK2118436, PLX4720 и PLX4032.
Термин "EGFR-амплифицированный рак" относится к раку, в котором раковые клетки содержат амплификацию домена тирозинкиназы рецептора эпидермального фактора роста (EGFR), например, EGFR1, EGFR2 или EGFR3.
Термин "ингибитор EGFR" относится к соединению, которое ингибирует, уменьшает, снижает или сокращает по меньшей мере одну активность рецептора эпидермального фактора роста (EGFR). Примеры ингибиторов EGFR включают, без ограничения ими, [6,7-бис(2-метоксиэтокси)-4-хиназолин-4-ил]-(3-этинилфенил) амин (также известный как OSI-774), эрлотиниб, CI-1033 (ранее известный как PD183805), AG-1478, CGP-59326, PKI-166, ЕКВ-569, лапатиниб или лапатиниба дитозилат; и гефитиниб, AG490 (тирфостин), ARRY-334543, BIBW-2992, ЕКВ-569, ZD6474, BMS-599626 (производства Bristol-Myers Squibb), цетуксимаб и MDX-447.
Структуру действующих веществ, определяемых по кодовым номерам, международному непатентованному наименованию или торговому наименованию, можно взять из действующего издания стандартного каталога "Merck Index" или из баз данных, например, Международных Патентов (например, IMS World Publications). Их соответствующее содержание включено в виде ссылки.
В одном варианте реализации настоящее изобретение относится к способу лечения рака посредством введения субъекту, который нуждается в таком лечении, количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А, что является совместно терапевтически эффективным для указанного лечения.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и АНТИТЕЛО А находятся в единой композиции или стандартной лекарственной форме. В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и АНТИТЕЛО А находятся в раздельных композициях или стандартных лекарственных формах.
В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и/или АНТИТЕЛО А вводят, по сути, одновременно. В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А и/или АНТИТЕЛО А вводят в разные моменты времени. В дополнительном варианте реализации изобретения СОЕДИНЕНИЕ А вводят субъекту перед введением АНТИТЕЛА А. В дополнительном варианте реализации изобретения АНТИТЕЛО А вводят субъекту перед введением СОЕДИНЕНИЯ А.
Настоящее изобретение дополнительно относится к способу лечения рака, который является устойчивым или невосприимчивым к лечению модулятором EGFR, ингибитором IGF1R или ингибитором BRAF, включающему введение терапевтически эффективного количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли и АНТИТЕЛА А субъекту, который в нем нуждается.
В одном варианте реализации настоящее изобретение относится к способу лечения рака, который является устойчивым или невосприимчивым к лечению ингибитором IGF1R, представляющим собой АНТИТЕЛО А, включающему введение терапевтически эффективного количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли субъекту, который в нем нуждается.
Настоящее изобретение дополнительно относится к способу лечения рака, который является устойчивым или невосприимчивым к лечению ингибитором IGF1R, представляющим собой АНТИТЕЛО А, посредством введения терапевтически эффективного количества СОЕДИНЕНИЯ А или его фармацевтически приемлемой соли.
Настоящее изобретение дополнительно относится к применению фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и АНТИТЕЛО А, для изготовления фармацевтического препарата или лекарственного средства для лечения рака. В одном варианте реализации изобретения рак, подлежащий лечению, представляет собой рак, определенный выше, который включен в данное описание в виде ссылки во всей своей полноте.
Настоящее изобретение дополнительно относится к применению фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и АНТИТЕЛО А для изготовления фармацевтического препарата или лекарственного средства для лечения рака, который является устойчивым или невосприимчивым к лечению модулятором EGFR, ингибитором IGF1R или ингибитором BRAF. В одном варианте реализации изобретения рак, подлежащий лечению, представляет собой рак, определенный выше, который включен в данное описание в виде ссылки во всей своей полноте.
Настоящее изобретение дополнительно относится к применению СОЕДИНЕНИЯ А для лечения рака, который является устойчивым или невосприимчивым к лечению ингибитором IGF1R, представляющим собой АНТИТЕЛО А.
Настоящее изобретение относится к фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и ингибитор IGF1R, представляющий собой АНТИТЕЛО А, для использования в лечении онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к существующим терапиям, например, амплифицированных EGFR, KRAS-мутированных онкологических заболеваний, NRAS-мутантных и BRAF-мутированных онкологических заболеваний, которые являются устойчивыми или невосприимчивыми к ингибиторам EGFR, ингибиторам IGF1R или ингибиторам BRAF, у субъекта, который в нем нуждается.
Дозы
Оптимальная доза комбинации агентов для лечения заболевания может быть определена эмпирически для каждого индивидуума с использованием известных способов и будет зависеть от множества факторов, в том числе, без ограничения ими, от степени прогресса развития заболевания; возраста, массы тела, общего состояния здоровья, пола и диеты индивидуума; времени и способа введения; а также других лекарственных средств, принимаемых индивидуумом. Оптимальные дозы могут быть установлены с помощью обычного исследования и процедур, которые хорошо известны в данной области техники.
Количество комбинации агентов, которые могут быть объединены с материалами-носителями для получения единой лекарственной формы, будет варьироваться в зависимости от индивидуума, подлежащего лечению, и конкретного способа введения. В некоторых вариантах реализации изобретения стандартные лекарственные формы, содержащие комбинацию агентов, как описано в данном документе, будут содержать количества каждого агента комбинации, которые обычно вводят, когда вводят только агенты.
Частота дозы может варьироваться в зависимости от используемого соединения и конкретного состояния, подлежащего лечению или профилактике. В целом, предпочтительным является использование минимальной дозы, которая является достаточной для обеспечения эффективной терапии. Пациентов, как правило, можно обследовать на предмет терапевтической эффективности с использованием анализов, подходящих для состояния, подлежащего лечению или профилактике, которые будут известны средним специалистам в данной области техники.
Лекарственная форма может быть получена посредством различных обычных методов смешивания, измельчения и изготовления, очевидно выраженных для специалистов в области химии технологии приготовления лекарственных средств.
Лекарственная форма для перорального применения, содержащая комбинацию агентов или раздельных агентов комбинации агентов, может быть в виде микротаблеток, заключенных в капсулу, например, в желатиновую капсулу. Для этого можно использовать желатиновую капсулу, которая используется в фармацевтических композициях, такую как твердая желатиновая капсула, известная как CAPSUGEL производства компании Pfizer.
Многие из лекарственных форм для перорального применения, используемых по настоящему изобретению, содержат комбинацию агентов или раздельных агентов комбинации агентов в форме частиц. Такие частицы могут быть спрессованы в таблетку, присутствовать в основном элементе покрытой лекарственной формы, такой как лекарственная форма со вкусовой маскировкой, лекарственная форма с пресс покрытием или лекарственная форма, покрытая кишечнорастворимой оболочкой, или может содержаться в капсуле, лекарственной форме с осмотическим насосом или другой лекарственной форме.
Соединения лекарственного средства по настоящему изобретению (например, СОЕДИНЕНИЕ А или его фармацевтически приемлемая соль и АНТИТЕЛО А) присутствуют в комбинациях (фиксированной или нефиксированной), лекарственных формах, фармацевтических композициях и фармацевтических препаратах, описанных в данном документе, в соотношении в диапазоне от 100:1 до 1:100. Например, соотношение СОЕДИНЕНИЯ А к АНТИТЕЛУ А может быть в диапазоне от 1:100 до 1:1, например, 1:100, 1:90, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:5, 1:2 или 1:1. В другом примере соотношение АНТИТЕЛА А к СОЕДИНЕНИЮ А может быть в диапазоне от 1: 00 до 1:1, например, 1:100, 1:90, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:5, 1:2 или 1:1.
Оптимальные соотношения, раздельные и комбинированные дозы, а также концентрации соединений лекарственных средств, которые приводят к эффективности без токсичности, основаны на кинетике способности действующих веществ достигать цели, и определяются с использованием способов, известных специалистам в данной области техники.
Фармацевтические композиции или комбинации, предлагаемые в данном документе (то есть, СОЕДИНЕНИЕ А или его фармацевтически приемлемая соль и АНТИТЕЛО А), могут быть испытаны в ходе клинических исследований. Подходящие клинические исследования могут представлять собой, например, открытые исследования, исследования с увеличением дозы у пациентов, больных раком. Такие исследования доказывают, в частности, синергизм действующих веществ комбинации по настоящему изобретению. Положительные воздействия на рак можно определить непосредственно по результатам таких исследований, которые известны, как таковые, специалисту в данной области техники. Такие исследования могут, в частности, подходить для сравнения эффектов монотерапии с использованием действующих веществ и комбинации по настоящему изобретению. В одном варианте реализации изобретения дозу СОЕДИНЕНИЯ А увеличивают до тех пор, пока не будет достигнута максимальная переносимая доза, а АНТИТЕЛО А вводят в фиксированной дозе. В альтернативном варианте СОЕДИНЕНИЕ А можно вводить в фиксированной дозе, а дозу АНТИТЕЛА А можно увеличивать. Каждый пациент может получать дозы соединений либо раз в сутки, либо с промежутками. Эффективность лечения может быть определена в таких исследованиях, например, спустя 12, 18 или 24 недели посредством оценки шкал симптомов каждые 6 недель.
Введение комплексной терапии по настоящему изобретению может привести не только к положительному эффекту, например, к синергетическому терапевтическому эффекту, например, по отношению к смягчению, задержке прогресса развития или ингибированию симптомов, но также и к дополнительным неожиданным положительным эффектам, например, к меньшему количеству побочных эффектов, улучшенному качеству жизни или снижению заболеваемости по сравнению с монотерапией, при которой применяют только одно из фармацевтически действующих веществ, используемых в комбинации по настоящему изобретению.
Дополнительным преимуществом может быть то, что можно применять более низкие дозы действующих веществ комбинации по настоящему изобретению, например, то, что дозы зачастую могут быть не только меньше, но и могут применяться реже, что может снизить частоту и тяжесть побочных эффектов. Это зависит от желаний и требований пациентов, подлежащих лечению.
Одной из задач настоящего изобретения является получение фармацевтической комбинации, содержащей количество, которое может быть совместно терапевтически эффективным в плане воздействия на рак или его профилактики, например, на EGFR-амплифицированный, KRAS-мутированный, NRAS-мутированный или BRAF-мутированный рак. В данной комбинации СОЕДИНЕНИЕ А и АНТИТЕЛО А можно вводить вместе, один за другим или по отдельности в одной комбинированной стандартной лекарственной форме или в двух раздельных стандартных лекарственных формах. Стандартная лекарственная форма может также представлять собой фиксированную комбинацию.
Фармацевтические композиции для раздельного введения (или нефиксированная доза) обоих соединений или для введения в виде фиксированной комбинации, то есть единой композиции, содержащей оба соединения в соответствии с настоящим изобретением, могут быть получены, по сути, известным способом, и быть пригодными для энтерального, такого как пероральное или ректальное, и парентерального введения млекопитающим (теплокровным животным), в том числе людям, могут содержать терапевтически эффективное количество по меньшей мере только одного фармакологически активного компонента комбинации, например, как указано выше, или находиться в комбинации с одним или более фармацевтически приемлемыми носителями или разбавителями, особенно подходящими для энтерального или парентерального применения.
В одном варианте реализации настоящее изобретение относится к фармацевтической композиции или фармацевтическому препарату, содержащему (а) СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и (b) АНТИТЕЛО А, и, необязательно, один или более фармацевтически приемлемых носителей.
В дополнительном варианте реализации настоящее изобретение дополнительно относится к фармацевтической композиции или фармацевтическому препарату, содержащему (а) СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и (b) АНТИТЕЛО А, и, необязательно, один или более фармацевтически приемлемых носителей для использования в лечении рака.
В дополнительном варианте реализации настоящее изобретение относится к (а) фармацевтической комбинации, содержащей СОЕДИНЕНИЕ А или его фармацевтически приемлемую соль и к (b) фармацевтической композиции, содержащей АНТИТЕЛО А, которые вводят в раздельных фармацевтических композициях субъекту, который в них нуждается.
Композиции
Комбинации лекарственных средств, представленные в данном документе, могут быть приготовлены с помощью различных способов, очевидных для специалистов в данной области техники изготовления фармацевтических композиций. Как обсуждалось выше, СОЕДИНЕНИЕ А и АНТИТЕЛО А могут быть составлены в одну и ту же фармацевтическую композицию или в раздельные фармацевтические композиции для раздельного введения. Подходящие композиции включают, например, таблетки, капсулы, композиции с пресс покрытием, внутривенные растворы или суспензии, а также другие легко вводимые композиции.
Один или оба компонента комбинации можно вводить в виде фармацевтической композиции, содержащей один или более фармацевтически приемлемых носителей. Термин "носитель" относится к разбавителю, адъюванту, вспомогательному веществу или основе, с которыми вводят данное соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, в том числе получаемые из нефти, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Воду или водный раствор, солевой раствор и водные растворы декстрозы и глицерина предпочтительно используют в качестве носителей, в частности, для инъекционных растворов. Подходящие фармацевтические носители описаны у Е.W. Martin в "Remington's Pharmaceutical Sciences".
Подходящие фармацевтические композиции могут содержать, например, от около 0,1% до около 99,9%, предпочтительно - от около 1% до около 60%, действующего вещества (веществ). Фармацевтические композиции для комплексной терапии для энтерального или парентерального введения представляют собой, например, композиции, которые находятся в стандартных лекарственных формах, таких как таблетки, покрытые сахарной оболочкой, таблетки, капсулы или суппозитории, или ампулы. Если не указано иное, их получают, по сути, известным способом, например, с помощью обычных способов смешения, грануляции, нанесения сахарной оболочки, растворения или лиофилизации. Следует принимать во внимание, что стандартное содержание компонента комбинации, содержащееся в отдельной дозе каждой лекарственной формы, не должно само по себе представлять собой эффективное количество, так как необходимое эффективное количество может быть достигнуто посредством введения множества единиц дозирования.
В соответствии с настоящим изобретением терапевтически эффективное количество каждого из компонентов комбинации в комбинации по настоящему изобретению может быть введено одновременно или последовательно и в любом порядке, и компоненты могут быть введены по отдельности или в виде фиксированной комбинации. В альтернативном варианте количество, которое является совместно терапевтически эффективным для лечения рака, в отношении каждого компонента комбинации в комбинации по настоящему изобретению, можно вводить одновременно или последовательно и в любом порядке, и компоненты могут быть введены по отдельности или в виде фиксированной комбинации.
Например, способ лечения заболевания в соответствии с настоящим изобретением может включать (i) введение первого агента в свободной форме или в форме фармацевтически приемлемой соли и (ii) введение второго агента в свободной форме или в форме фармацевтически приемлемой соли, одновременно или последовательно в любом порядке, в совместно терапевтически эффективных количествах, предпочтительно - в синергически эффективных количествах, например, в виде суточной дозы или с промежутками, что соответствует количествам, описанным в данном документе. Раздельные компоненты комбинации в комбинации по настоящему изобретению могут быть введены раздельно в разное время в течение курса терапии или одновременно в раздельных или единых комбинированных формах. Кроме того, термин введение также охватывает применение депо-формы компонента комбинации, которая превращается in vivo в компонент комбинации, как таковой. Таким образом, настоящее изобретение следует понимать как охватывающее все подобные схемы одновременного или чередующегося лечения, и термин "введение" следует интерпретировать соответственно.
Эффективная доза каждого из компонентов комбинации, используемых в комбинации по настоящему изобретению, может варьироваться в зависимости от используемого конкретного соединения или фармацевтической композиции, способа введения, подлежащего лечению состояния, тяжести состояния, подлежащего лечению. Таким образом, схему приема комбинации по настоящему изобретению выбирают в соответствии с различными факторами, в том числе в зависимости от способа введения и функции почек и печени пациента. Практикующий врач или врач обычной квалификации может легко определить и прописать эффективное количество раздельных действующих веществ, необходимых для того, чтобы смягчить, противодействовать или приостановить прогресс развития заболевания. Практикующий врач или врач обычной квалификации может также легко определить эффективную дозу с использованием руководства (смотри, например, публикацию Therasse с соавторами 2000, JNCI 92:2, 205, которая включена в данный документ в виде ссылки во всей своей полноте) Критерии Оценки Ответа при Солидных Опухолях (RECIST).
Подходящие дозы для СОЕДИНЕНИЯ А, используемые в способах, описанных в данном документе, составляют порядка от около 0,1 мг до около 200 мг (например, около 0,1, 0,3, 0,5, 0,7, 1, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90, 95, 100, 120, 140, 160, 180, 200 или 220 мг). В предпочтительном варианте реализации изобретения СОЕДИНЕНИЕ А вводят субъекту в дозе около 15 мг, 30 мг, 45 мг или 60 мг.
Подходящие дозы для АНТИТЕЛА А, используемые в способах, описанных в данном документе, составляют порядка от около 1 мг/кг до около 100 мг/кг, (например, около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90, 95 или 100 мг/кг). В предпочтительном варианте реализации изобретения АНТИТЕЛО А вводят субъекту в дозе около 9, 12 или 20 мг/кг.
Подходящие частоты введения для СОЕДИНЕНИЯ А или АНТИТЕЛА А, используемые в способах, описанных в данном документе, составляют порядка от около 10 раз в сутки до около одного раза в месяц (например, от около 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 раз в сутки до около 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 раз в месяц).
В одном варианте реализации изобретения субъекту вводят от около 15 до около 60 мг СОЕДИНЕНИЯ А перорально два раза в сутки. В другом варианте реализации изобретения АНТИТЕЛО А вводят внутривенно два раза в месяц в пределах от около 9 до около 20 мг/кг.
Далее настоящее изобретение иллюстрируется следующими примерами. Примеры не должны быть истолкованы как дальнейшее ограничение. Положительные эффекты комбинации по настоящему изобретению также могут быть определены посредством других моделей испытаний, известных специалистам в данной области техники.
Пример 1. Синтез СОЕДИНЕНИЯ А
Синтез СОЕДИНЕНИЯ А описан в международной заявке на патент WO 03/077914 (PCT/US03/07864), которая включена в данный документ в виде ссылки во всей своей полноте. Синтез данного соединения описан ниже.
2,3,4-Трифтор-5-нитро-бензойной кислоты 2
В трехгорлую круглодонную колбу емкостью 3 литра загружают 125 мл H2SO4. Добавляют дымящую азотную кислоту (8,4 мл, 199 ммоль) и аккуратно перемешивают смесь. Добавляют 2,3,4-трифторбензойной кислоты 1 (25 г, 142 ммоль) порциями по 5 г в течение 90 минут. Темный коричневато-желтый раствор перемешивают в течение 60 минут, после чего реакция завершается. Реакционную смесь вливают в 1 литр смеси лед:вода и экстрагируют диэтиловым эфиром (3×600 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении с получением желтого твердого вещества. Твердое вещество суспендируют в гексанах и перемешивают в течение 30 мин, после чего его отфильтровывают с получением 29 г (92%) чистого целевого продукта в виде не совсем желтого твердого вещества: МС ХИАД (масс-спектрометрия с химической ионизацией при атмосферном давлении) (-), обнаружено m/z 220 (М-1).
4-Амино-2,3-дифтор-5-нитро-бензойной кислоты 3
Раствор гидроксида аммония (-30% в воде) (35 мл, 271 ммоль) добавляют к раствору 2,3,4-трифтор-5-нитро-бензойной кислоты 2 (15 г, 67,8 ммоль) в 30 мл воды при 0°С при перемешивании. После завершения добавления гидроксида аммония реакционную смесь нагревают до комнатной температуры при перемешивании. Через 2,5 ч реакционную смесь охлаждают до 0°С и осторожно добавляют концентрированную НС1 до тех пор, пока рН реакционной смеси не станет равным около 0. Реакционную смесь разбавляют водой (30 мл) и экстрагируют диэтиловым эфиром (3×50 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют при пониженном давлении с получением 14 г (95%) чистого целевого продукта: МС ХИАД (-), обнаружено m/z 217 (М-1).
Метиловый эфир 4-амино-2,3-дифтор-5-нитро-бензойной кислоты 4
2 М раствор тетраметилсилана (ТМС) диазометана в гексанах (6,88 мл, 13,75 ммоль) добавляют к суспензии 4-амино-2,3-дифтор-5-нитро-бензойной кислоты 3 (2,00 г, 9,17 ммоль) в 25 мл смеси тетрагидрофуран (ТГФ):МеОН (4:1) при 0°С в атмосфере азота. По завершении добавления реакционную смесь нагревают до комнатной температуры. Через 0,5 ч избыток ТМС диазометана разрушают посредством осторожного добавления уксусной кислоты. Затем реакционную смесь концентрируют при пониженном давлении и сушат in vacuo (в вакууме) с получением 1,95 г (92%) чистого целевого продукта: МС ХИАД (-), обнаружено m/z 231 (М-1).
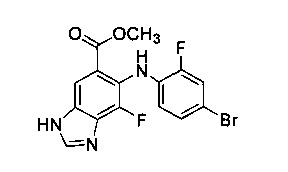
Метиловый эфир 6-(4-бром-2-фтор-фениламино)-7-фтор-3Н-бензоимидазол-5-карбоновой кислоты (8d)
Стадия А: Метиловый эфир 4-амино-3-фтор-2-(2-фтор-фениламино)-5-нитро-бензойной кислоты 5b
Метиловый эфир 4-амино-2,3-дифтор-5-нитро-бензойной кислоты 4 (1,50 г, 6,46 ммоль) суспендируют в ксилолах (7,5 мл) и добавляют 2-фтор-фениламин (6,24 мл, 64,6 ммоль). Реакционную смесь перемешивают при 140°С в атмосфере N2. После перемешивания в течение 6 дней реакция завершается. Реакционную смесь охлаждают до комнатной температуры и разбавляют метиленхлоридом, и отфильтровывают через слой силикагеля, элюируя метиленхлоридом (1 л), с получением оранжевого фильтрата. Фильтрат концентрируют досуха и затем растирают с диэтиловым эфиром с получением ярко-желтого твердого вещества. Растирание повторяют.Желтое твердое вещество собирают с получением 1,08 г (52%) чистого целевого продукта. МС ХИАД (-), обнаружено m/z 322 (М-1).
Стадия В: Метиловый эфир 6-(4-бром-2-фтор-фениламино)-7-фтор-3Н-бензоимидазол-5-карбоновой кислоты 8d
Метиловый эфир 4-амино-3-фтор-2-(2-фтор-фениламино)-5-нитро-бензойной кислоты 5b преобразуют посредством способов сокращения/циклизации и бромирования с получением желаемого продукта. МС ИЭР (масс-спектрометрия с ионизацией электрораспылением) (+), обнаружено m/z 382, 384 (М+, Вr образец).
(2-Гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты
Раствор метилового эфира 6-(4-бром-2-фтор-фениламино)-7-фтор-3Н-бензоимидазол-5-карбоновой кислоты (8d), йодметана и карбоната калия в диметилформамиде перемешивают при 75°С в течение одного часа. Реакционную смесь разбавляют этилацетатом, промывают насыщенным водным раствором карбоната калия (2х), рассолом и сушат (Na2SO4). После колоночной флэш-хроматографии (20:1 метиленхлорид/этилацетат) получают соединение 3-метил-3Н-бензоимидазол.
Соединение 3-метил-3Н-бензоимидазол растворяют в смеси 2:1 ТГФ/вода и добавляют NaOH (1,0 М водный раствор). После перемешивания в течение двух часов объем реакционной смеси снижают до одной четверти от исходного объема с помощью роторного испарителя, а остаток разбавляют водой. Водный раствор подкисляют до рН 2 посредством добавления 1,0 М водной НСl и экстрагируют смесью 1:1 тетрагидрофуран/этилацетат (3х), сушат (Na2SO4) и концентрируют при пониженном давлении с получением чистой карбоновой кислоты в виде не совсем белого твердого вещества.
Карбоновую кислоту, O-(2-винилокси-этил)-гидроксиламин, HOBt, триэтиламин и EDCI растворяют в диметилформамиде и перемешивают при комнатной температуре в течение 48 часов. Реакционную смесь разбавляют этилацетатом, промывают водой (3х), насыщенным раствором карбоната калия (2х), насыщенным раствором хлорида аммония (2х), рассолом, сушат (Na2SO4) и концентрируют при пониженном давлении до не совсем белого твердого вещества (2-винилокси-этокси)-амид 6-(4-бром-2-фтор-фениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты.
Соляную кислоту (14 мл, 1,0 М водного раствора, 14 ммоль) добавляют к суспензии полученного ранее соединения в этаноле и реакционную смесь перемешивают в течение 24 часов. Реакционную смесь концентрируют досуха с помощью роторного испарителя, и твердые вещества распределяют между смесью 3:1 этилацетат/тетрагидрофуран и насыщенным раствором карбоната калия. Водную фазу экстрагируют смесью 3:1 этилацетат/тетрагидрофуран (3х), объединенные органические экстракты сушат (Na2SO) и концентрируют до (2-гидрокси-этокси)-амида 6-(4-бром-2-фтор-фениламино)-7-фтор-3-метил 3Н-бензоимидазол-5-карбоновой кислоты в виде не совсем белого твердого вещества.
Пример 2. Фаза Ib/ II открытого, многоцентрового исследования комбинации ингибитора МЕК, представляющего собой СОЕДИНЕНИЕ А, и ингибитора рецептора инсулиноподобного фактора роста 1 (IGF1R), представляющего собой АНТИТЕЛО А, у взрослых пациентов с выбранными солидными опухолями на поздней стадии
Фазу Ib/ II многоцентрового, открытого исследования проводят, оценивая эффективность и безопасность комбинации ингибитора МЕК, представляющего собой СОЕДИНЕНИЕ А, и ингибитора рецептора инсулиноподобного фактора роста 1 (IGF1R), представляющего собой АНТИТЕЛО А, у взрослых пациентов с выбранными солидными опухолями на поздней стадии. Во-первых, Фазу Ib исследования с увеличением дозы проводят с целью оценки максимальной переносимой дозы (доз) (MTD) и/или с целью выявления рекомендуемой дозы (доз) Фазы II (RP2D) для комбинации ингибитора МЕК, представляющего собой СОЕДИНЕНИЕ А, и ингибитора рецептора инсулиноподобного фактора роста 1 (IGF1R), представляющего собой АНТИТЕЛО А, у пациентов. Во-вторых, Фазу II проводят с целью оценки клинической эффективности и дальнейшей оценки безопасности этой комбинации у отдельных пациентов.
Исследование с Увеличением Дозы
Включают пациентов с точно установленными KRAS- или BRAF-мутантными онкологическими заболеваниями на поздней стадии, такими как рак ободочной и прямой кишки (CRC), рак поджелудочной железы и меланома или другими солидными опухолями на поздней стадии, или раком поджелудочной железы (независимо от мутационного статуса KRAS- или BRAFV600). Соответствие каждого включенного пациента определяют посредством проверки того, удовлетворяет ли он конкретные критерии включения/исключения, приведенные ниже. Для этого исследования с увеличением дозы брали примерно 15-25 пациентов.
В этом исследовании СОЕДИНЕНИЕ А вводят в виде таблеток для перорального приема два раза в сутки (BID) при 28-дневных циклах. АНТИТЕЛО А вводят в виде раствора для внутривенной инфузии каждую вторую неделю (Q2W) на 1 и 15 день каждого цикла.
Всем пациентам вводят начальную дозу для комбинации из 30 мг BID СОЕДИНЕНИЯ А и 12 мг/кг Q2W АНТИТЕЛА А. Дозу постоянно увеличивают до тех пор, пока не будет/будут достигнуты MTD/RP2D9. СОЕДИНЕНИЕ А пациентам дозируют по плоской шкале, а АНТИТЕЛО А пациентам дозируют в соответствии с массой тела. Во время увеличения дозу во времени только у одного исследуемого препарата увеличивают следующим образом:
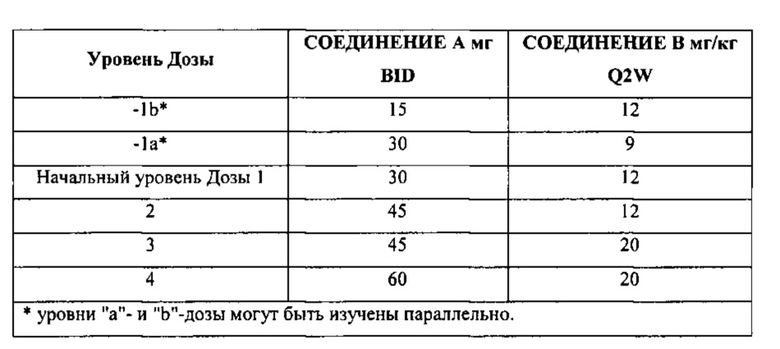
Часть исследования, в которой происходит увеличение дозы, выполняют, руководствуясь байесовской регрессионной логистической моделью (BLRM). Во всех точках принятия решений адаптивная BLRM позволяет изменения с увеличением дозы, основанные на наблюдаемых ограничивающих дозу токсичностях (DLT). Дозы ниже 15 мг BID СОЕДИНЕНИЯ А или 9 мг/кг Q2W АНТИТЕЛА А не допускают.
DLT оценивают с использованием Общих Критериев Токсичности для обозначения Нежелательных Явлений (СТСАЕ) Национального института рака (NCI), версии 4.03. Параметрами, которые подлежат мониторингу у пациентов, являются, например, клиническое обследование, заболевания крови и лимфатической системы, расстройства сердечной деятельности, нарушения деятельности сердечно-сосудистой системы, общие нарушения и нарушения в месте введения, заболевания кожи и подкожных тканей (например, сыпь или светочувствительность), гипергликемия, нарушения со стороны желудочно-кишечного тракта, уровни билирубина в крови, ACT или АлАТ, щелочная фосфатаза сыворотки крови, липаза сыворотки крови и/или амилаза (бессимптомно) сыворотки крови, креатинин сыворотки крови, СК/КФК сыворотки крови, АКН, количество тромбоцитов, ЭКГ с интервалом QT, нарушения со стороны органа зрения (например, ретинопатия, расфокусированное зрение, вспышки света, мушки перед глазами), нарушение слуха и другие гематологические и негематологические токсичности.
MTD определяют как самую высокую дозу комбинированного лекарственного средства, которая не вызывает медицински неприемлемой DLT у более чем 35% пациентов, подлежащих лечению, в течение первого цикла лечения. Так как этому определению может соответствовать несколько комбинаций, можно выявить более одной MTD с различными дозами исследуемых препаратов. Применяемая адаптивная байесовская методика позволяет выполнить оценку комбинаций СОЕДИНЕНИЯ А и АНТИТЕЛА А, которые не превышают MTD. Как правило, MTD представляет собой испытываемую дозу с максимальной вероятностью токсичности направленного действия (уровень DLT составляет от 16%-35%). Использование принципа EWOC (увеличение дозы с контролем передозировки) ограничивает риск того, что потенциальная следующая доза превысит MTD (Раздел 10.4.2).
Пациентов исключают из исследования в случае: (а) приостановки приема СОЕДИНЕНИЯ А>21 дня подряд и/или более, чем 2 доз подряд АНТИТЕЛА А от предполагаемого дня следующей запланированной дозы, или в случае (b) нежелательных явлений или ненормальных данных лабораторных анализов. Любые пациенты, лечение которых прерывают или окончательно прекращают в связи с нежелательным явлением или клинически значимым результатом лабораторных анализов, который наблюдается по меньшей мере один раз в неделю в течение 4 недель. Допускают максимум два (2) уменьшения дозы, а после уменьшения дозы не допускают повторного увеличения дозы.
Критерии включения и исключения:
Критериями включения пациентов являются следующие:
- Возраст ≥18 лет
- Пациенты мужского или женского пола либо с (а) солидными опухолями на поздней стадии (в том числе, без ограничения ими, рак ободочной и прямой кишки (CRC), рак поджелудочной железы и меланома, а также другие солидные опухоли на поздней стадии) с точно установленными соматическими KRAS- или BRAFV600 мутациями в опухолевой ткани, либо (b) с метастатической аденокарциномой поджелудочной железы независимо от мутационного статуса KRAS или BRAFV600. На Фазе II данный критерий изменяют следующим образом: (а) Только для Группы 1 - Пациенты с KRAS-мутантной аденокарциномой ободочной и прямой кишки, (b) Только для Группы 2 - Пациенты с метастатической аденокарциномой поджелудочной железы (аденокарцинома независимо от мутационного статуса KRAS или BRAFV600), и (с) Только для Группы 3 - Пациенты с BRAFV600 мутантной меланомой.
- Пациент с рецидивом или прогрессирующим развитием после стандартной терапии или пациенты, для которых согласно оценке врачом-исследователем, не существует стандартной противоопухолевой терапии.
- Измеряемые проявления болезни, как определено с помощью RECIST версии 1.1. Всемирной организации здравоохранения (ВОЗ) Показатель Состояния Больного (PS)≤2. Целевые опухолевые очаги в ранее облученных областях не следует выбирать, если нет четких доказательств прогресса развития в таких очагах.
- Адекватная функция органов и лабораторные показатели, как определено с помощью: Абсолютного количества нейтрофилов (АКН)≥1,5×109/л; Гемоглобина (Hgb)≥9 г/дл; Тромбоцитов (PLT)≥100×109/л без переливания в течение 21 дней до первого сеанса лечения; АСТ/СГОТ и/или АлАТ/СГПТ≤2,5 × ULN (верхняя граница нормы) или ≤5 × ULN, если присутствуют метастазы в печени; Билирубина сыворотки крови ≤2 × ULN; Креатинина сыворотки крови ≤ 1,5 × ULN или расчетной, или непосредственно измеренной LLN (нижняя граница нормы) CrCl (клиренс креатинина) ≥ 50%; Отрицательный анализ крови на беременность.
- Восстановление после всех НЯ (нежелательных явлений) предыдущих противоопухолевых терапий, в том числе хирургического вмешательства и лучевой терапии, до исходного уровня или до степени ≤ 1 по СТСАЕ, за исключением алопеции.
- Отрицательный анализ крови на беременность (β ХГЧ) в течение 72 часов до начала лечения в программе исследования у всех женщин в пременопаузе и женщин <12 месяцев после наступления менопаузы.
Критериями исключения для пациентов являются следующие:
- Предшествующая терапия любым ингибитором МЕК или ингибитором IGF1R.
- Предыдущие или текущие симптомы центральной серозной ретинопатии (CSR), окклюзии вены сетчатки (RVO) или дегенеративного заболевания сетчатки.
- Пациенты с известным анамнезом сильных инфузионных реакций на моноклональные антитела.
- Пациенты с первичной опухолью ЦНС или поражением ЦНС опухолью, если пациент не страдает от метастатической опухоли ЦНС и не удовлетворены следующие дополнительные критерии: (а) 4 недели с момента завершения предшествующей терапии (в том числе облучения и/или хирургического вмешательства), (b) клиническая стабильность по отношению к опухоли ЦНС на момент включения в исследование, (с) неполучение стероидной терапии и (d) неполучение спазмолитических препаратов (начатые для метастазов в головной мозг).
- Пациенты, которые получили предварительную системную противоопухолевую терапию в пределах следующих интервалов времени: (а) Циклическую химиотерапию в течение определенного периода времени, который короче, чем длина цикла, используемого для этого лечения (например, 6 недель для нитрозомочевины, митомицина-С) до начала лечения в программе исследования, и (b) биологическую терапию (например, антитела), непрерывные или периодические низкомолекулярные терапевтические средства, или любые другие экспериментальные препараты в течение периода времени, который ≤ 5 Т1/2 или ≤ 4 недель (в зависимости от того, который короче) до начала лечения в программе исследования.
- Пациенты, получившие лучевую терапию за ≤ 4 недель до начала исследования лекарственного средства, которые не восстановились от побочных эффектов такой терапии и/или у которых было облучено ≥ 30% костного мозга.
- Пациенты, которые пережили обширное оперативное вмешательство за ≤ 4 недель до начала лечения в программе исследования или которые не оправились от побочных эффектов такой процедуры.
- Анамнез тромбоэмболического осложнения, требующий полнодозовой антикоагуляционной терапии в любое время до включения в исследование.
- Клинически значительное кардиологическое заболевание или нарушение сердечной функции.
Пациенты с сахарным диабетом, нуждающиеся в лечении инсулином, и/или с клиническими признаками или с уровнем глюкозы натощак, составляющим > 160 мг/дл (8,9 ммоль/л).
- Пациенты с периферической нейропатией Степени ≥ 2 по СТСАЕ.
- Пациенты с диареей Степени ≥ 2 по СТСАЕ.
- Пациенты с острым или хроническим панкреатитом.
- Пациенты с наружной холангиостомией.
- Любое другое состояние, которое по мнению исследователя является противопоказанием для участия пациента в клиническом исследовании из соображений безопасности или соответствия процедурам клинического исследования, например, инфекция/воспаление, непроходимость кишечника, неспособность принимать пероральные лекарственные средства, социальные/психологические осложнения.
- Нарушение функции ЖКТ или заболевание ЖКТ, которое может существенно изменить всасывание перорального СОЕДИНЕНИЯ А (например, язвенная болезнь, неконтролируемая тошнота, рвота, диарея, синдром мальабсорбции или резекция тонкого кишечника).
- Пациенты, получавшие гематопоэтические колониестимулирующие факторы роста (например, Г-КСФ, ГМ-КСФ, М-КСФ) за ≤ 2 недель до начала исследования лекарственного средства. Эритропоэтин или дарбэпоэтин разрешают при условии остановки приема по меньшей мере за 2 недели до включения в исследование.
- Пациенты, получившие системные кортикостероиды за ≤ 2 недель до начала исследования лекарственного средства, или пациенты, которые не полностью восстановились от побочных эффектов такого лечения.
- Анамнез другой злокачественной опухоли в течение 2 лет, за исключением излеченной базальноклеточной карциномы кожи или удаленной оперативным путем in situ карциномы шейки матки.
- Существующая положительная серологическая реакция на инфекцию ВИЧ, активного гепатита В и/или активного гепатита С.
- Беременные и кормящие (с грудным вскармливанием) женщины, когда беременность определяют как состояние женщины после зачатия и до прекращения беременности, подтвержденное положительным лабораторным тестом ХГЧ (>5 мМЕ/мл).
- Женщинам детородного возраста, которых определяют как всех женщин, физиологически способных забеременеть, не разрешено участвовать в данном исследовании, ЕСЛИ они НЕ используют высокоэффективные способы контрацепции на протяжении всего исследования и в течение 30 дней после отмены исследуемого препарата.
Исследование Эффективности
После декларации MTD/RP2D пациентов включают в три группы Фазы II для оценки эффективности комбинации: (а) Группа 1 состоит из пациентов с KRAS-мутантной аденокарциномой ободочной и прямой кишки, (b) Группа 2 состоит из пациентов с метастатической аденокарциномой поджелудочной железы и (с) Группа 3 состоит из пациентов с BRAFV600 мутантной меланомой. В каждую из Групп 1, 2 и 3 включают порядка 20-30 пациентов.
Пациентам вводят подходящую дозу комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А, как определено в Фазе Ib исследования с увеличением дозы.
Эффективность введенной комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А оценивают сравнением прогресса развития опухоли с исходным уровнем/скринингом. Все потенциальные участки опухолевых очагов оценивают на исходном уровне/скрининге с помощью радиологических методов (например, визуализации КТ или МРТ) или медицинского осмотра (например, подкожных узелков и измеримых кожных поражений). Способы измерения следуют критериям RECIST версии 1.1 для солидных опухолей. При включении в исследование последующие оценки опухоли выполняют по завершении 6 недель лечения (Цикл 2, День 15), 10 недель лечения (Цикл 3, День 15), 16 недель лечения (Цикл 5, День 1), 22 недель лечения (Цикл 6, День 15), 28 недель лечения (Цикл 14, День 1) и каждые 12 недель после этого (начало каждого третьего цикла), и в конце курса лечения.
Пациентов лечат до прогресса развития заболевания, развития недопустимой токсичности или отзыва информированного согласия, в зависимости от того, что произойдет раньше. За всеми пациентами ведется последующее врачебное наблюдение - как минимум, пациенты должны завершить оценку последующего врачебного наблюдения безопасности через 30 дней после последней дозы лечения в программе исследования. За пациентами, которые не прогрессируют на момент досрочного завершения лечения в программе исследования, ведется радиологическое наблюдение на предмет статуса заболевания, а за пациентами фазы II ведется наблюдение на предмет выживания. Исследование заканчивают после завершения периода последующего врачебного наблюдения последнего пациента, которого лечили комбинацией. Тем не менее, безопасность и эффективность комбинации оценивают с помощью данных клинических исследований, полученных до конца исследования.
Пример 3. Влияние комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А на пролиферацию KRAS мутантных клеточных линий рака поджелудочной железы
Анализ клеточной пролиферации выполняли, чтобы исследовать активность комбинации СОЕДИНЕНИЯ А и АНТИТЕЛА А на инсулиноподобный фактор роста 1 (IGF1)-индуцированную пролиферацию KRAS мутантных клеточных линий Miapaca-2 и AsPC-1. Чтобы объективно оценить эффект комбинации и выявить синергетические эффекты при различных концентрациях, исследование выполняли с использованием схемы "матрица доз" (которая более подробно описана ниже). Результаты этих экспериментов, изложенных ниже, показали, что комбинация СОЕДИНЕНИЯ А и АНТИТЕЛА А синергически ингибирует IGF1-индуцированную пролиферацию Miapaca-2 и AsPC-1 при отсутствии IGF1, по сравнению с каждым агентом, действующим по отдельности.
Получение Растворов Соединения
СОЕДИНЕНИЕ А (10 мМ) хранили в аликвотах при -20°С. АНТИТЕЛО А (0,2 мМ в 1% BSA) хранили в аликвотах при температуре 4°С. Инсулиноподобный фактор роста 1 ((IGF1; R&D System, Cat #291-G1) восстанавливали при 100 мкг/мл в стерильном фосфатно-солевом буферном растворе (PBS).
Клеточная Культура
KRAS мутантные клеточные линии Miapaca-2 и AsPC-1 рака поджелудочной железы культивировали в среде DMEM (минимальная эссенциальная среда Игла, модифицированная по способу Дульбекко) (АТСС Cat #30-2002) и RPMI-1640 (АТСС Cat #30-2001) с добавлением 10% фетальной бычьей сыворотки (FBS; Invitrogen Cat #10099-141) в соответствии с рекомендациями поставщика. Клетки культивировали в колбах Т-150 с использованием стандартных методов культивирования клеток и рассаживали по достижении 80% конфлюентности. Для диссоциации всех клеток использовали TryPLE Express (Invitrogen # 12604-013, без фенолового красного). Количество клеток и жизнеспособность измеряли с помощью счетчика ViCell (Beckman-Coulture) методом исключения трипанового красителя. Определяли, что клетки свободны от микоплазмы с использованием ПЦР метода обнаружения (www.radil.missouri.edu).
Анализ Жизнеспособности Клеток и Анализ Клеточной Пролиферации
Клетки Miapaca-2 и AsPC-1 трипсинизировали с помощью TryPLE Express и высевали (1200 клеток/лунка) в черные 384-луночные планшеты (Greiner) с прозрачным дном в трех повторностях (30 мкл/лунка в культуральной среде). На ночь клеткам давали возможность прикрепиться, затем инкубировали их в течение 120 часов с различными концентрациями агентов-ингибиторов или комбинаций агентов (10 мкл/лунка) в присутствии или при отсутствии IGF1. Жизнеспособность клеток определяли посредством измерения клеточного содержимого АТФ с использованием CellTiter-Glo® (CTG), люминесцентного анализа жизнеспособности клеток (Promega). Каждый раздельный агент и комплексное лечение сравнивали с контрольными или клетками, обработанными эквивалентным объемом среды. Равный объем реагентов CTG добавляли в каждую лунку в конце лечения соединением и люминесценцию записывали на сканирующий спектрофотометр для прочтения планшетов Envision (Perkin Elmer). Ослабленные и усиленные значения люминесцентных сигналов (отклики) рассчитывали по отношению к необработанным (контрольным) клеткам.
Метод Расчета Эффективности Комбинаций СОЕДИНЕНИЯ А и АНТИТЕЛА А
Для объективной оценки антипролиферативной активности СОЕДИНЕНИЯ А с АНТИТЕЛОМ А, а также для выявления синергетических эффектов в различных концентрациях исследования выполняли с использованием "матрицы доз". Данная матрица доз использует различные пермутации серийно разведенных раздельных агентов (например, СОЕДИНЕНИЯ А и АНТИТЕЛА А). В анализах комбинации агенты применяли одновременно и оценивали в присутствии и при отсутствии IGF1.7 доз СОЕДИНЕНИЯ А подвергали ЗХ серийному разведению с высокой дозой, равной 2,6 мкм, и низкой дозой, равной около 3,5 нМ. 6 доз АНТИТЕЛА А подвергали ЗХ серийному разведению с высокой дозой, равной 566 нМ, низкой дозой, равной около 2,3 нМ.
Синергетическое взаимодействие СОЕДИНЕНИЯ А с АНТИТЕЛОМ А (проанализированное с использованием программного обеспечения Chalice [CombinatoRx, Кембридж, штат Массачусетс]) рассчитывали посредством сравнения отклика от комбинации с откликом от действия только одного агента по сравнению с использованием базовой модели добавочных доз для случая взаимодействия препарата с самим собой. Отклонения от добавлений дозы оценивали в числовом отношении с помощью показателя аддитивности (CI), который количественно определяет общую эффективность эффекта комбинации. Данный расчет (по сути, показатель объема) выглядит следующим образом: VHSA=ΣX,Y lnfX lnfY (Iданные-IHSA). CI рассчитывали как разницу между данными и самой высокой поверхностью раздельного агента, нормированную для кратности разведения раздельных агентов (смотри, например, Lehar J с соавторами (2009), Synergistic drug combinations tend to improve therapeutically relevant selectivity", Nature Biotechnology 27: 659 - 66 (2009)).
Все оценки данных и получение графика выполняли с использованием программного обеспечения Microsoft Excel и программного обеспечения Chalice.
Результаты
Процент ингибирования IGF1-индуцированной пролиферации клеток Miapaca-2 и AsPC-1 по каждому условию матрицы доз проиллюстрирован на Фигуре 1. СОЕДИНЕНИЕ А демонстрирует, что антипролиферативная активность зависит от концентрации как в присутствии, так и при отсутствии IGF1, а добавление IGF1, по-видимому, слегка ослабляет активность раздельного агента, представляющего собой СОЕДИНЕНИЕ А. АНТИТЕЛО А было почти полностью неактивным в присутствии или при отсутствии IGF1. Комбинация СОЕДИНЕНИЯ А и АНТИТЕЛА А демонстрирует синергетический эффект при применении к клеткам Miapaca-2 при отсутствии IGF1, о чем свидетельствует разница в ингибировании пролиферации клеток, демонстрируемая каждым агентом по отдельности. Улучшение ингибирования роста наблюдалось, когда 288 нМ-2,6 мкМ СОЕДИНЕНИЯ А комбинировали с 189 нМ-566 нМ АНТИТЕЛА А (смотри Фигуру 1). И, наоборот, в присутствии IGF1 не наблюдалось синергии или улучшения ингибирования роста.
Эти данные показывают, что комбинация СОЕДИНЕНИЯ А и АНТИТЕЛА А синергетически ингибирует рост KRAS мутантных онкологических заболеваний поджелудочной железы при отсутствии сигнализации IGF1. Таким образом, комбинация СОЕДИНЕНИЯ А и АНТИТЕЛА А представляет собой улучшенное лечение для KRAS мутантных онкологических заболеваний поджелудочной железы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтические комбинации | 2017 |
|
RU2759669C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ИНГИБИТОР RAF И ИНГИБИТОР ERK | 2017 |
|
RU2774612C2 |
| СИНЕРГИЧЕСКИЕ КОМПОЗИЦИИ ИНГИБИТОРОВ PI3K И МЕК | 2012 |
|
RU2607944C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СОЕДИНЕНИЕ | 2018 |
|
RU2786994C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2018 |
|
RU2815400C2 |
| НОВЫЕ МАЛЫЕ МОЛЕКУЛЫ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО РАСЩЕПЛЕНИЯ НЕ ПОДДАЮЩЕГОСЯ ЦЕЛЕНАПРАВЛЕННОМУ ВОЗДЕЙСТВИЮ KRAS В ТЕРАПИИ РАКА | 2021 |
|
RU2839932C1 |
| ИНГИБИТОРЫ MDM2 И ИХ КОМБИНАЦИИ | 2016 |
|
RU2740091C2 |
| СПОСОБ ЛЕЧЕНИЯ РАКА, НЕСУЩЕГО МУТАЦИИ EGFR | 2007 |
|
RU2492864C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ, СОДЕРЖАЩАЯ TNO155 И РИБОЦИКЛИБ | 2020 |
|
RU2813111C2 |
| ТЕТРАГИДРОФОЛАТЫ В КОМБИНАЦИИ С ИНГИБИТОРАМИ EGFR | 2013 |
|
RU2619335C2 |






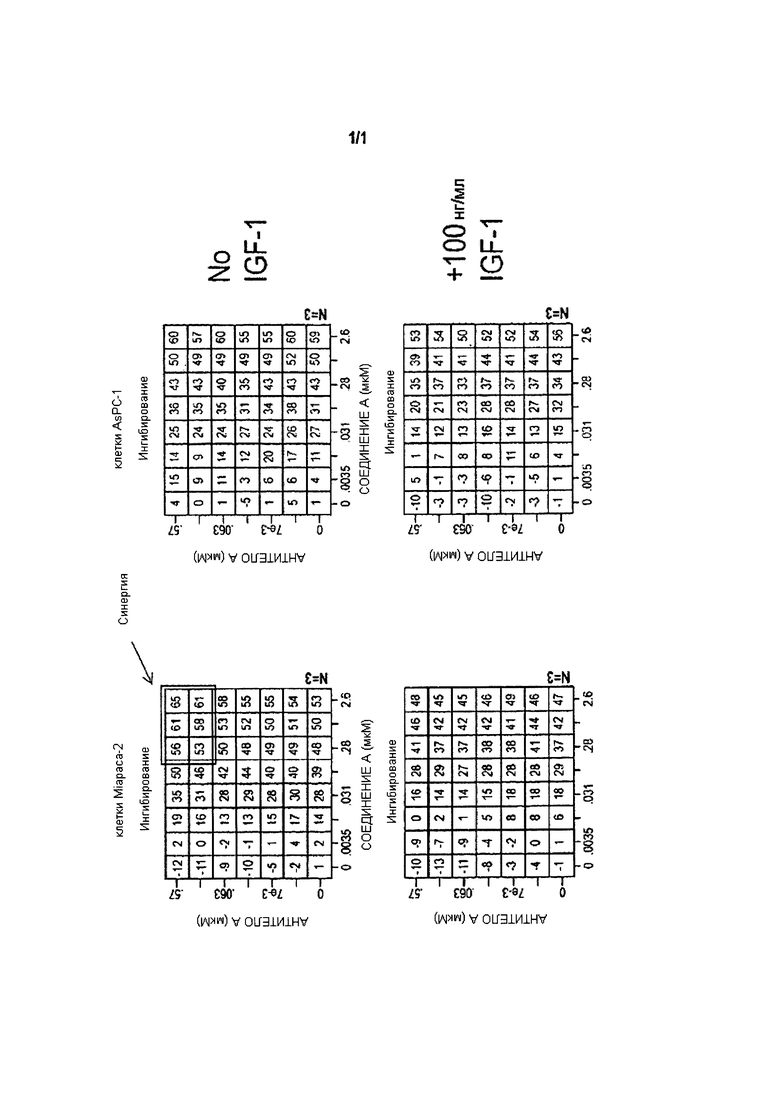
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения рака. Фармацевтическая комбинация, способ, применение и фармацевтическая композиция по изобретению предназначены для лечения рака и предусматривают введение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (соединение А) и антитела А, содержащего аминокислотные последовательности тяжелой и легкой цепей, представленные в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. Использование изобретений позволяет лечить рак за счет синергетического эффекта комбинации соединения А и антитела А в отношении клеточной пролиферации. 4 н. и 16 з.п. ф-лы, 1 ил., 3 пр.
1. Фармацевтическая комбинация для лечения рака, содержащая: соединение (2-гидроксиэтокси)-амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (соединение А) или его фармацевтически приемлемую соль и Антитело А, где антитело А представляет собой антитело, которое специфически связывается с рецептором инсулиноподобного фактора роста 1 (IGF1R), где антитело содержит аминокислотные последовательности тяжелой и легкой цепи, представленные в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно.
2. Фармацевтическая комбинация по п. 1 для применения в лечении рака у субъекта, нуждающегося в нем.
3. Фармацевтическая комбинация по п. 2, отличающаяся тем, что рак выбирают из группы, состоящей из рака легкого, рака кости, CMML, рака поджелудочной железы, рака кожи, рака головы и шеи, рака матки, рака центральной нервной системы (ЦНС), рака яичников, рака прямой кишки, рака заднепроходной области, рака желудка, рака молочной железы, меланомы, рака ободочной и прямой кишки, яичек, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, саркомы мягких тканей, рака уретры, рака полового члена, рака предстательной железы, хронического или острого лейкоза, лимфоцитарных лимфом, рака мочевого пузыря, рака почки или мочеточника, карциномы коры надпочечников, связанных со СПИДом онкологических заболеваний, базальноклеточной карциномы, внепеченочного рака желчных протоков, опухолей головного мозга, карциноидной опухоли, карциноидной опухоли желудочно-кишечного тракта, детских онкологических заболеваний, хронических миелопролиферативных заболеваний, эпендимальной глиомы, опухолей семейства Юинга, рака глаза в виде ретинобластомы, рака желчного пузыря, герминогенных опухолей, гестационной трофобластической опухоли, глиомы, гепатоцеллюлярного рака, гипофарингеального рака, глиомы зрительного пути и гипоталамической области, саркомы Капоши, рака гортани, рака губ и ротовой полости, макроглобулинемии Вальденстрема, карциномы из клеток Меркеля, мезотелиомы, множественной эндокринной неоплазии, множественной миеломы/плазмоклеточной неоплазии, фунгоидного микоза, рака носовой полости и околоносовых пазух, рака носоглотки, рака ротоглотки, плевролегочной бластомы, рабдомиосаркомы, рака слюнных желез, синдрома Сезари, плоскоклеточной карциномы, тимомы и опухоли Вильмса, необязательно, где рак выбирают из группы, состоящей из рака ободочной и прямой кишки, рака поджелудочной железы, рака яичников и меланомы, необязательно, где рак представляет собой рак поджелудочной железы, необязательно, где рак поджелудочной железы представляет собой местнораспространенный рак поджелудочной железы или KRAS-мутированный рак поджелудочной железы.
4. Фармацевтическая комбинация по п. 2, отличающаяся тем, что рак выбирают из группы, состоящей из рака ободочной и прямой кишки, рака поджелудочной железы, рака яичников и меланомы.
5. Фармацевтическая комбинация по п. 4, отличающаяся тем, что рак представляет собой рак поджелудочной железы.
6. Фармацевтическая комбинация по п. 5, отличающаяся тем, что рак поджелудочной железы представляет собой местнораспространенный рак поджелудочной железы.
7. Фармацевтическая комбинация по п. 5, отличающаяся тем, что рак поджелудочной железы представляет собой KRAS-мутированный рак поджелудочной железы.
8. Способ лечения рака у субъекта, который в нем нуждается, включающий введение данному субъекту терапевтически эффективного количества соединения (2-гидроксиэтокси) амид 6-(4-бром-2-фторфениламино)-7-фтор-3-метил-3Н-бензоимидазол-5-карбоновой кислоты (соединение А) или его фармацевтически приемлемой соли и антитела А, где антитело А представляет собой антитело, которое специфически связывается с рецептором инсулиноподобного фактора роста 1 (IGF1R), где антитело содержит аминокислотные последовательности тяжелой и легкой цепи, представленные в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно.
9. Способ по п. 8, отличающийся тем, что соединение А или его фармацевтически приемлемая соль и антитело А находятся в единой композиции или стандартной лекарственной форме.
10. Способ по п. 8, отличающийся тем, что соединение А или его фармацевтически приемлемая соль и антитело А находятся в раздельных композициях или стандартных лекарственных формах.
11. Способ по п. 8, отличающийся тем, что соединение А или его фармацевтически приемлемую соль и/или антитело А вводят, по сути, одновременно.
12. Способ по п. 8, отличающийся тем, что соединение А или его фармацевтически приемлемую соль и/или антитело А вводят в разные моменты времени.
13. Способ по любому из пп. 8-12, отличающийся тем, что рак представляет собой рак, который определен в пп. 3-7.
14. Способ по любому из пп. 8-12, отличающийся тем, что рак является устойчивым или не восприимчивым к лечению ингибитором EGFR, ингибитором IGF1R или ингибитором BRAF.
15. Применение фармацевтической комбинации по п. 1 для изготовления фармацевтического препарата или лекарственного средства для лечения рака.
16. Фармацевтическая композиция для лечения рака, содержащая соединение А или его фармацевтически приемлемую соль и антитело A, где антитело А представляет собой антитело, которое специфически связывается с рецептором инсулиноподобного фактора роста 1 (IGF1R), где антитело содержит аминокислотные последовательности тяжелой и легкой цепи, представленные в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно, и, необязательно, один или более фармацевтически приемлемых носителей.
17. Способ по любому из пп. 8-12, отличающийся тем, что соединение А вводят в дозе от около 15 до 60 мг.
18. Способ по любому из пп. 8-12, отличающийся тем, что соединение А вводят в дозе от 15 до 60 мг.
19. Способ по любому из пп. 8-12, отличающийся тем, что антитело А вводят в дозе от около 9 до 20 мг/кг.
20. Способ по любому из пп. 8-12, отличающийся тем, что антитело А вводят в дозе от 9 до 20 мг/кг.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| СПОСОБ ИНГИБИРОВАНИЯ РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ С ПОМОЩЬЮ ВНЕКЛЕТОЧНОГО АНТАГОНИСТА И ВНУТРИКЛЕТОЧНОГО АНТАГОНИСТА | 2004 |
|
RU2431500C2 |
Авторы
Даты
2019-01-16—Публикация
2013-03-13—Подача