ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет на основании предварительной заявки на выдачу патента США № 61/802118, поданной 15 марта 2013 года, содержание которой включено в настоящее описание путем ссылки в полном объеме.
ВВЕДЕНИЕ
Настоящее изобретение относится к иммунореактивным клеткам, содержащим антигенраспознающий рецептор, который связывает первый антиген, и ингибирующий химерный рецептор антигена (iCAR), который связывает второй антиген, при этом связывание антигенраспознающего рецептора с первым антигеном активирует иммунореактивную клетку, а связывание iCAR со вторым антигеном ингибирует иммунореактивную клетку. Настоящее изобретение также относится к способам получения иммунореактивных клеток и способам лечения злокачественных опухолей с применением иммунореактивных клеток.
УРОВЕНЬ ТЕХНИКИ
Основанные на T-клетках способы терапии обеспечивают потенциальные лечебные возможности в случае трансплантации костного мозга и органов, иммунотерапии злокачественных опухолей, вирусных инфекций и аутоиммунных заболеваний. Однако основные связанные с лечение осложнения обусловлены непредусмотренной реактивностью T-клеток, направленной против нормальных тканей, такой как болезнь «трансплантат против хозяина» (GVHD) после инфузии лимфоцитов донора или «реактивность в месте мишени вне опухоли» при целенаправленной терапии аутологичными T-клетками.
Применение инфузии лимфоцитов донора (DLI) в случае аллогенных трансплантатов костного мозга (BMT; 25000 ежегодно по всему миру) привело к значительным успехам в лечении некоторых подгрупп пациентов. Недавно в ходе испытаний, проводимых в настоящее время с целью лечения метастатических солидных опухолей, было показано, что DLI позволяет осуществлять эффективную терапию пациентов с метастатической почечноклеточной карциномой, раком молочной железы, ободочной кишки и яичника при испытаниях. Ключевая эффективность DLI, называемая «трансплантат против лейкоза» (GVL) в контексте гематологических злокачественных новообразований, ограничена индукцией как острой, так и хронической болезни «трансплантат против хозяина» (GVHD) (частота более 40%) в такой степени, что несколько групп пришли к заключению, что современная схема DLI не сможет повысить выживаемость, если не будет достигнуто снижение индукции GVHD.
Подобным образом, на основании испытаний иммунотерапии злокачественных опухолей сообщалось о неблагоприятных эффектах «в месте мишени, но вне ткани» при действии T-клеток с сконструированными TCR и CAR, включая, например, B-клеточную аплазию у пациентов с хроническим лимфоцитарным лейкозом (CLL), которых лечили клетками, экспрессирующими анти-CD19-CAR, острый респираторный дистресс-синдром (ARDS) с летальным исходом в результате перекрестной реактивности анти-ERBB2-CAR T-клеток в эпителии легкого и смертельные исходы вследствие некроза сердечной мышцы у пациентов с меланомой и миеломой, которых лечили Mage-A3-TCR.
В настоящее время неспецифичная иммуносупрессия и элиминация T-клеток являются единственными средствами контролирования нежелательных T-клеточных ответов ценой отмены терапевтической пользы и вызывания серьезных вторичных осложнений. Они обусловлены появлением симптомов, которые могут быть тяжелыми и иногда неуправляемыми, что ограничивает применение клеточного лечения, которое без учета такого обстоятельства является эффективным.
Существует острая потребность в методиках предотвращения последствий клеточных побочных эффектов. Современные подходы не могут использовать T-клеточную терапию более высокого порядка сложности, которая обеспечивает преимущество в контролировании нежелательных побочных эффектов. Соответственно экстренно необходимы новые терапевтические методики.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в общем, относится к иммунореактивным клеткам (например, T-клеткам, клеткам природным киллерам (NK), цитотоксическим T-лифоцитам (CTL) и регуляторным T-клеткам), экспрессирующим антигенсвязывающий рецептор (например, CAR или TCR), обладающий активностью в активации иммунных клеток, и ингибирующий химерный рецептор антигена (iCAR), который избирательно снижает или исключает иммунную активность иммунореактивной клетки. Таким образом, снижается нецелевое влияние иммунореактивной клетки вне мишени. В некоторых вариантах снижение иммунной активности обратимо. Соответственно, изобретение относится к способам применения таких иммунореактивных клеток для лечения неоплазии, инфекционных болезней и других патологий.
В одном аспекте изобретение относится к изолированной иммунореактивной клетке, содержащей антигенраспознающий рецептор, который связывает первый антиген, при этом связывание активирует иммунореактивную клетку, и ингибирующий химерный рецептор антигена, который связывает второй антиген, при этом связывание ингибирует иммунореактивную клетку.
В другом аспекте изобретение относится к способу снижения опухолевой нагрузки у субъекта, при этом способ включает введение эффективного количества иммунореактивных клеток, содержащих антигенраспознающий рецептор, который связывает первый антиген, при этом связывание активирует иммунореактивную клетку, и ингибирующий химерный рецептор антигена, который связывает второй антиген, при этом связывание ингибирует иммунореактивную клетку, с индукцией таким образом гибели опухолевых клеток у субъекта. Способ может обеспечить избирательное целенаправленное воздействие на опухолевые клетки по сравнению с неопухолевыми клетками. В некоторых вариантах способ уменьшает количество опухолевых клеток. В некоторых вариантах способ уменьшает размер опухоли. В других вариантах способ полностью уничтожает опухоль у субъекта.
В другом аспекте изобретение относится к способу повышения выживаемости субъекта, имеющего неоплазию, при этом способ включает введение эффективного количества иммунореактивных клеток, содержащих антигенраспознающий рецептор, который связывает первый антиген, при этом связывание активирует иммунореактивную клетку, и ингибирующий химерный рецептор антигена, который связывает второй антиген, при этом связывание ингибирует иммунореактивную клетку, таким образом осуществляя лечение или профилактику неоплазии у субъекта. В некоторых вариантах неоплазия выбрана из группы, состоящей из рака крови, B-клеточного лейкоза, множественной миеломы, лимфобластного лейкоза (ALL), хронического лимфоцитарного лейкоза, неходжкинской лимфомы, рака яичника, рака простаты, рака поджелудочной железы, рака легкого, рака молочной железы, саркомы и острого миелоидного лейкоза (AML).
В другом аспекте изобретение относится к способу получения антигенспецифичной иммунореактивной клетки, которая содержит антигенраспознающий рецептор, который связывает первый антиген, при этом способ включает введение в иммунореактивную клетку последовательности нуклеиновой кислоты, которая кодирует ингибирующий химерный рецептор антигена, который связывает второй антиген, при этом связывание ингибирует иммунореактивную клетку.
В другом аспекте изобретение относится к ингибирующему химерному рецептору антигена (iCAR), содержащему внеклеточный домен, который связывает антиген; трансмембранный домен, функционально связанный с внеклеточным доменом; и внутриклеточный домен, который активирует внутриклеточную передачу сигнала для снижения иммунного ответа, при этом внутриклеточный домен функционально связан с трансмембранным доменом. В некоторых вариантах домен внутриклеточной передачи сигнала выбран из группы, состоящей из полипептида CTLA-4, полипептида PD-1, полипептида LAG-3, полипептида 2B4 и полипептида BTLA. В некоторых вариантах трансмембранный домен выбран из группы, состоящей из полипептида CD4, полипептида CD8, полипептида CTLA-4, полипептида PD-1, полипептида LAG-3, полипептида 2B4 и полипептида BTLA. Кроме того, ингибирующий химерный рецептор антигена (iCAR) может дополнительно содержать Fab, scFv, лиганд, специфичный лиганд или поливалентный лиганд. В некоторых вариантах связывание антигена с iCAR активирует домен внутриклеточной передачи сигнала, который снижает иммунный ответ.
В родственном аспекте изобретение относится к последовательности нуклеиновой кислоты, кодирующей ингибирующий химерный рецептор антигена, который связывает антиген, при этом связывание активирует внутриклеточный домен передачи сигнала, который снижает иммунный ответ.
В другом родственном аспекте изобретение относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую ингибирующий химерный рецептор антигена, который связывает антиген, при этом связывание активирует внутриклеточный домен передачи сигнала, который снижает иммунный ответ.
В родственном аспекте изобретение относится к фармацевтической композиции (для лечения неоплазии или инфекции патогенами), содержащей эффективное количество иммунореактивных клеток согласно изобретению в фармацевтически приемлемом эксципиенте.
В другом аспекте изобретение относится к набору для лечения неоплазии, инфекции патогеном, аутоиммунного расстройства или аллогенного трансплантата, при этом набор включает иммунореактивную клетку, которая содержит антигенраспознающий рецептор, который связывает первый антиген и активирует иммунореактивную клетку, и ингибирующий химерный рецептор антигена, который связывает второй антиген и ингибирует иммунореактивную клетку. В различных вариантах набор дополнительно содержит письменные инструкции по применению указанной клетки для лечения субъекта, имеющего неоплазию, инфекцию патогеном, аутоиммунное расстройство или аллогенный трансплантат.
В другом аспекте изобретение относится к способу модулирования ответа трансплантат против лейкоза или ответа трансплантат против опухоли у субъекта, при этом способ включает введение эффективного количества иммунореактивных клеток, аллогенных по отношению к субъекту, содержащих ингибирующий химерный рецептор антигена, который связывает антиген, при этом связывание ингибирует аллогенную иммунореактивную клетку, таким образом осуществляя модулирование ответа трансплантат против лейкоза или ответа трансплантат против опухоли у субъекта. В некоторых вариантах субъект имеет метастатический рак молочной железы, гематологическое злокачественное новообразование или солидную опухоль, и лейкоцитарным антигеном человека (HLA) является HLA-I. В некоторых вариантах субъект имеет опухоль, которая подверглась эпителиально-мезенхимальному переходу (EMT), и антигеном является один или несколько из следующих антигенов: антиген эпителиально-мезенхимального перехода (EMT), E-кадгерин и цитокератин. В различных вариантах связывание ингибирующего химерного рецептора антигена и антигена снижает гибель клеток среди клеток, содержащих антиген. Способ может ослаблять у субъекта болезнь трансплантат против хозяина (GVHD) или ее симптом.
В различных вариантах аспектов, определенных в настоящем описании, первый антиген или антиген антигенраспознающего рецептора является опухолевым антигеном или антигеном патогена. В конкретных вариантах антиген антигенраспознающего рецептора представляет собой один или несколько опухолевых антигенов, выбранных из следующей группы, состоящей из CD19, CAIX, CEA, CD5, CD7, CD10, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD123, CD133, CD138, антигена клетки, инфицированной цитомегаловирусом (CMV), EGP-2, EGP-40, EpCAM, erb-B2,3,4, F8P, фетального рецептора ацетилхолина, рецептора-a фолата, GD2, GD3, HER-2, hTERT, IL-13R-α2, κ-легкой цепи, KDR, LeY, молекулы клеточной адгезии L1, MAGE-A1, мезотелина, Muc-1, Muc-16, лигандов NKG2D, NY-ESO-1, онкоэмбрионального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2 и WT-1.
В различных вариантах аспектов, определенных в настоящем описании, вторым антигеном или антигеном ингибирующего химерного рецептора антигена является CD33, CD38, лейкоцитарный антиген человека (HLA), специфичный для органа антиген, антиген, специфичный для гематоэнцефалического барьера, антиген эпителиально-мезенхимального перехода (EMT), E-кадгерин, цитокератин, связывающий опиоиды белок/молекула клеточной адгезии (OPCML), HYLA2, отсутствующий антиген при карциноме прямой и ободочной кишки (DCC), белок 1, связывающий область прикрепления к каркасу/матриксу (SMAR1), углевод клеточной поверхности или O-гликан муцинового типа. В различных вариантах аспектов, определенных в настоящем описании, связывание антигена с iCAR активирует внутриклеточный домен передачи сигнала, который снижает иммунный ответ.
В различных вариантах аспектов, определенных в настоящем описании, ингибирующий химерный рецептор антигена экспрессируется рекомбинантно. В различных вариантах аспектов, определенных в настоящем описании, ингибирующий химерный рецептор антигена экспрессируется с вектора. В различных вариантах аспектов, определенных в настоящем описании, ингибирующий химерный рецептор антигена (iCAR) содержит внутриклеточный домен передачи сигнала, выбранный из группы, состоящей из полипептида CTLA-4, полипептида PD-1, полипептида LAG-3, полипептида 2B4 и полипептида BTLA. В различных вариантах аспектов, определенных в настоящем описании, ингибирующий химерный рецептор антигена (iCAR) содержит трансмембранный домен, выбранный из группы, состоящей из полипептида CD4, полипептида CD8, полипептида CTLA-4, полипептида PD-1, полипептида LAG-3, полипептида 2B4 и полипептида BTLA. В различных вариантах аспектов, определенных в настоящем описании, ингибирующий химерный рецептор антигена (iCAR) включает Fab, scFv, лиганд, специфичный лиганд или поливалентный лиганд. В некоторых вариантах клетка экспрессирует рекомбинантный или эндогенный рецептор антигена, который выбран из группы, состоящей из 19-28z, P28z, M28z и 56-28z.
В различных вариантах аспектов, определенных в настоящем описании, антигенраспознающий рецептор представляет собой T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR). В различных вариантах аспектов, определенных в настоящем описании, антигенраспознающий рецептор является экзогенным или эндогенным. В различных вариантах аспектов, определенных в настоящем описании, антигенраспознающий рецептор экспрессируется рекомбинантно. В различных вариантах аспектов, определенных в настоящем описании, антигенраспознающий рецептор экспрессируется с вектора. В различных вариантах любых аспектов, определенных в настоящем описании, аллогенная клетка имеет эндогенный T-клеточный рецептор.
В различных вариантах аспектов, определенных в настоящем описании, клетка представляет собой одну или несколько из следующих клеток: T-клетку, клетку природного киллера (NK), цитотоксический T-лимфоцит (CTL), регуляторную T-клетку, эмбриональную стволовую клетку человека, клетку врожденной иммунной системы и плюрипотентную стволовую клетку, из которой могут дифференцироваться лимфоидные клетки. В некоторых вариантах иммунореактивная клетка является аутологичной. В других вариантах иммунореактивная клетка не является аутологичной.
ОПРЕДЕЛЕНИЯ
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют значение, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. В следующих публикациях специалист может найти общие определения многих из терминов, используемых в описании изобретения: Singleton et al., Dictionary of Microbiology и Molecular Biology (2nd ed. 1994); The Cam bridge Dictionary of Science и Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, The Harper Collins Dictionary of Biology (1991). В используемом в настоящем описании смысле следующие термины имеют значения, которые объяснены ниже, если не указано иное.
Под термином «активирует иммунореактивную клетку» подразумевают индукцию сигнальной трансдукции или изменения экспрессии белков в клетке, приводящие к инициации иммунного ответа. Например, когда цепи CD3 образуют кластеры в ответ на связывание лиганда и тирозинсодержащие мотивы активации иммунорецепторов (ITAM), образуется каскад сигнальной трансдукции. В некоторых вариантах, когда эндогенный TCR или экзогенный CAR связывает антиген, происходит образование иммунологического синапса, который включает кластеризацию множества молекул вблизи связанного рецептора (например, CD4 или CD8, CD3γ/δ/ε/ζ и т.д.). Такая кластеризация связанных с мембраной сигнальных молекул обеспечивает возможность фосфорилирования мотивов ITAM, находящихся в цепях CD3. Такое фосфорилирование в свою очередь инициирует путь активации T-клеток, в конце концов активирующий факторы транскрипции, такие как NF-κB и AP-1. Такие факторы транскрипции индуцируют глобальную экспрессию генов T-клетки, повышая продукцию IL-2 для пролиферации, и экспрессию основных регуляторных T-клеточных белков, инициируя опосредованный T-клетками иммунный ответ. Выражение «стимулирует иммунореактивную клетку» означает сигнал, который приводит к сильному и длительному иммунному ответу. В различных вариантах он возникает после активации иммунной клетки (например, T-клетки) или одновременно и опосредован рецепторами, включая без ограничения CD28, CD137 (4-1BB), OX40 и ICOS. Не имея намерения быть связанными с конкретной теорией полагают, что получение множественных стимулирующих сигналов важно для формирования сильного и долговременного опосредованного T-клетками иммунного ответа. Без получения таких стимулирующих сигналов T-клетка быстро становится ингибированной и не отвечающей на антиген. Хотя эффекты таких костимулирующих сигналов варьируют и все еще только частично выяснены, обычно они приводят к повышению экспрессии генов для генерации долгоживущих, пролиферирующих и антиапоптозных T-клеток, которые сильно реагируют на антиген для осуществления полной и устойчивой ликвидации.
Термин «антигенраспознающий рецептор» в используемом в настоящем описании смысле относится к рецептору, который способен активировать иммунную клетку (например, T-клетку) в ответ на связывание антигена. Примеры антигенраспознающих рецепторов могут быть нативные или эндогенные T-клеточные рецепторы, экзогенные T-клеточные рецепторы, введенные в клетку, и/или химерные рецепторы антигенов, в которых домен связывания опухолевого антигена слит с внутриклеточным доменом передачи сигнала, способного активировать иммунную клетку (например, T-клетку).
В используемом в настоящем описании смысле термин «антитело» означает не только интактные молекулы антител, но также фрагменты молекул антител, которые сохраняют способность связывать иммуноген. Такие фрагменты также хорошо известны в данной области, и их обычно применяют как in vitro, так и in vivo. Соответственно, в используемом в настоящем описании смысле термин «антитело» означает не только интактные молекулы иммуноглобулинов, но также хорошо известные активные фрагменты F(ab')2 и Fab. Фрагменты F(ab')2 и Fab, в которых отсутствует Fc-фрагмент интактного антитела, быстрее выводятся из циркуляции и меньше неспецифично связываются с тканью, чем интактное антитело (Wahl et al., J Nucl. Med. 24:316-325 (1983)). Антитела согласно изобретению включают целые нативные антитела, биспецифичные антитела; химерные антитела; фрагменты Fab, Fab', одноцепочечную V-область (scFv), слитые полипептиды и необычные антитела.
Термин «аффинность» означает меру силы связывания. Не имея намерения быть связанными с какой-либо теорией, полагают, что аффинность зависит от того, насколько близко стереохимически подходят друг к другу антигенсвязывающие участки антитела и антигенные детерминанты, от размера площади контакта между ними и от распределения заряженных и гидрофобных групп. Аффинность также включает термин «авидность», который относится к силе связи антиген-антитело после образования обратимых комплексов. Способы расчета аффинности антитела по отношению к антигену известны в данной области, включая использованием экспериментов по связыванию, чтобы вычислить аффинность. Активность антител в функциональных анализах (например, в проточно-цитометрическом анализе) также отражает аффинность антитела. Антитела и аффинности можно фенотипически охарактеризовать и сравнить, используя функциональные анализы (например, проточно-цитометрический анализ).
Термин «химерный рецептор антигена» или «CAR» в используемом в настоящем описании смысле относится к антигенсвязывающему домену, который слит с внутриклеточным доменом передачи сигнала, способным активировать или стимулировать иммунную клетку. Обычно внеклеточный связывающий домен CAR состоит из одноцепочечного вариабельного фрагмента (scFv), полученного в результате слияния вариабельных областей тяжелой и легкой цепей мышиного или гуманизированного моноклонального антитела. Альтернативно можно использовать scFv, которые получены из Fab' (а не из антитела, например, получены из библиотек Fab). В различных вариантах такой scFv сливают с трансмембранным доменом и затем с внутриклеточным доменом передачи сигнала. CAR «первого поколения» включают CAR, которые обеспечивают только сигналы CD3ζ при связывании антигена. CAR «второго поколения» включают CAR, которые обеспечивают как костимуляцию (например, CD28 или CD137), так и активацию (CD3ζ). CAR «третьего поколения» включают CAR, которые обеспечивают множественную костимуляцию (например, CD28 и CD137) и активацию (CD3ζ). В различных вариантах CAR выбирают так, чтобы он имел высокую аффинность или авидность по отношению к антигену.
Термин «ингибирующий химерный рецептор антигена» или «iCAR» в используемом в настоящем описании смысле относится к антигенсвязывающему домену, который слит с внутриклеточным доменом передачи сигнала, способным ингибировать или подавлять иммунную активность иммунной клетки. iCAR обладают ингибирующим иммунные клетки потенциалом и являются разными и отличаются от CAR, которые представляют собой рецепторы с активирующим иммунные клетки потенциалом. Например, CAR являются активирующими рецепторами, так как они содержат CD3ζ, iCAR не содержат активирующих доменов. Таким образом, iCAR отличаются от CAR и не относятся к подгруппе CAR. В некоторых вариантах антигенсвязывающий домен слит с трансмембранным доменом и внутриклеточным доменом(ами) иммуноингибирующего рецептора. Трансмембранный домен iCAR может представлять собой полипептид CD8, полипептид CD4, полипептид CTLA-4, полипептид PD-1, полипептид LAG-3, полипептид 2B4 или полипептид BTLA. Внутриклеточным доменом iCAR может быть полипептид CTLA-4, полипептид PD-1, полипептид LAG-3, полипептид 2B4 или полипептид BTLA. В различных вариантах внеклеточный связывающий домен iCAR состоит из одноцепочечного вариабельного фрагмента (scFv), полученного в результате слияния вариабельных областей тяжелой и легкой цепей мышиного или гуманизированного моноклонального антитела. В некоторых вариантах scFV представляет собой scFV, специфичный для мембранного антигена, специфичного для простаты (PSMA). Альтернативно, можно использовать scFv, которые получены из Fab (а не из антитела, например, получены из библиотек Fab). iCAR обладают иммуносупрессирующей активностью, которая специфично ингибирует функцию T-клеток при распознавании антигена.
Выражение «ингибирует иммунореактивную клетку» или «подавляет иммунореактивную клетку» означает индукцию сигнальной трансдукции или изменения экспрессии белков в клетке, приводящих к супрессии иммунного ответа (например, к снижению продукции цитокинов). В предпочтительных вариантах ингибирование или супрессия иммунореактивной клеткой является избирательной и/или обратимой.
Термин «иммуносупрессирующая активность» означает индукцию сигнальной трансдукции или изменений в экспрессии белков в клетке (например, активированной иммунореактивной клетке), приводящих к снижению иммунного ответа. Полипептиды, которые, как известно, подавляют или снижают иммунный ответ, включают без ограничения полипептиды CTLA-4, полипептиды PD-1, полипептиды LAG-3, полипептиды 2B4 или полипептиды BTLA (например, посредством их связывания с соответствующими лигандами). Как минимум, при передаче сигнала iCAR используются внутриклеточные части таких молекул, и также при необходимости могут быть включены части трансмембранного домена и/или внеклеточного домена указанных молекул для получения функционального iCAR. Термин «иммуностимулирующая активность» означает индукцию сигнальной трансдукции или изменений в экспрессии белков в клетке (например, активированной иммунореактивной клетке), приводящих к повышению иммунного ответа. Иммуностимулирующая активность может включать провоспалительную активность. Полипептиды, которые, как известно, стимулируют или повышают иммунный ответ посредством их связывания, включают CD28, OX-40, 4-1BB и их соответствующие лиганды, включая B7-1, B7-2, OX-40L и 4-1BBL. Такие полипептиды присутствуют в микроокружении опухоли и активируют иммунные ответы на неопластические клетки. В различных вариантах промоция, стимуляция или агонизм провоспалительных полипептидов и/или их лигандов усиливает иммунный ответ иммунореактивной клетки.
Термин «полипептид CD3ζ» означает белок, имеющий, по меньшей мере, 85, 90, 95, 96, 97, 98, 99 или 100% идентичность с эталоном NCBI №: NP_932170 или его фрагментом, который обладает активирующей или стимулирующей активностью. Пример CD3ζ приведен ниже [SEQ ID NO: 1].

Термин «молекула нуклеиновой кислоты CD3ζ» означает полинуклеотид, кодирующий полипептид CD3ζ.
Термин «полипептид CD28» означает белок, имеющий, по меньшей мере, 85, 90, 95, 96, 97, 98, 99 или 100% идентичность с эталоном NCBI №: NP_006130 или его фрагментом, который обладает стимулирующей активностью. Пример CD28 приведен ниже [SEQ ID NO:2].

Термин «молекула нуклеиновой кислоты CD28» означает полинуклеотид, кодирующий полипептид CD28.
Термин «19-28z» означает белок, имеющий, по меньшей мере, 85, 90, 95, 96, 97, 98, 99 или 100% идентичность с последовательностью, приведенной ниже [SEQ ID NO:3], который содержит лидерную последовательность в положениях аминокислот 1-18 и способен связывать CD19.


Пример последовательности нуклеиновой кислоты, кодирующей полипептид 19-28z, включая лидерную последовательность, приведен ниже [SEQ ID NO:4].

Молекулы нуклеиновых кислот, применимые в способах согласно изобретению, включают любую молекулу нуклеиновой кислоты, которая кодирует полипептид согласно изобретению или его фрагмент. Такие молекулы нуклеиновых кислот не должны быть на 100% идентичными эндогенной последовательности нуклеиновой кислоты, но обычно будут иметь значительную степень идентичности. Полинуклеотиды, имеющие «значительную степень идентичности» с эндогенной последовательностью, обычно способны гибридизоваться, по меньшей мере, с одной нитью двунитевой молекулы нуклеиновой кислоты. Термин «гибридизоваться» означает спаривание с образованием двунитевой молекулы между комплементарными полинуклеотидными последовательностями (например, гена, описанного в настоящей публикации) или их частями в разных условиях жесткости (смотри, например, Wahl, G. M. and S. L. Berger (1987) Methods Enzymol. 152:399; Kimmel, A. R. (1987) Methods Enzymol. 152: 507).
Например, жесткая концентрация соли обычно будет составлять менее чем примерно 750 мМ NaCl и 75 мМ цитрата тринатрия, предпочтительно менее чем примерно 500 мМ NaCl и 50 мМ цитрата тринатрия и более предпочтительно менее чем примерно 250 мМ NaCl и 25 мМ цитрата тринатрия. Гибридизация в условиях низкой жесткости может быть получена в отсутствие органического растворителя, например, формамида, тогда как гибридизация в условиях высокой жесткости может быть получена в присутствии, по меньшей мере, примерно 35% формамида и более предпочтительно, по меньшей мере, примерно 50% формамида. Жесткие температурные условия обычно будут включать температуру, по меньшей мере, примерно 30°C, более предпочтительно, по меньшей мере, примерно 37°C и наиболее предпочтительно, по меньшей мере, примерно 42°C. Варьирование дополнительных параметров, таких как время гибридизации, концентрация детергента, например, додецилсульфата натрия (SDS) и включение или исключение ДНК-носителя, хорошо известно специалистам в данной области. Различные уровни жесткости достигают, комбинируя при необходимости такие различные условия. В предпочтительном варианте гибридизация будет происходить при 30°C в 750 мМ NaCl, 75 мМ цитрате тринатрия и 1% SDS. В более предпочтительном варианте гибридизация будет происходить при 37°C в 500 мМ NaCl, 50 мМ цитрате тринатрия, 1% SDS, 35% формамиде и 100 мкг/мл денатурированной ДНК спермы лосося (ss-ДНК). В наиболее предпочтительном варианте гибридизация будет происходить при 42°C в 250 мМ NaCl, 25 мМ цитрате тринатрия, 1% SDS, 50% формамиде и 200 мкг/мл ss-ДНК. Полезные изменения таких условий легко понятны специалистам в данной области.
В случае большинства применений стадии промывки, которые следуют за гибридизацией, также будут варьировать по жесткости. Условия жесткости при промывке могут определяться концентрацией соли и температурой. Как указано выше, жесткость промывки можно повысить за счет снижения концентрации соли или повышения температуры. Например, жесткая концентрация соли для стадий промывки предпочтительно может быть менее чем примерно 30 мМ NaCl и 3 мМ цитрата тринатрия и наиболее предпочтительно менее чем примерно 15 мМ NaCl и 1,5 мМ цитрата тринатрия. Жесткие температурные условия для стадий промывки обычно будут включать температуру, составляющую, по меньшей мере, примерно 25°C, более предпочтительно, по меньшей мере, примерно 42°C и еще более предпочтительно, по меньшей мере, примерно 68°C. В предпочтительном варианте стадии промывки можно осуществлять при 25°C в 30 мМ NaCl, 3 мМ цитрате тринатрия и 0,1% SDS. В более предпочтительном варианте стадии промывки можно осуществлять при 42°C в 15 мМ NaCl, 1,5 мМ цитрате тринатрия и 0,1% SDS. В более предпочтительном варианте стадии промывки можно осуществлять при 68 C в 15 мМ NaCl, 1,5 мМ цитрате тринатрия и 0,1% SDS. Дополнительные изменения таких условий легко могут определить специалисты в данной области. Способы гибридизации хорошо известны специалистам в данной области и описаны, например, в публикациях Benton и Davis (Science 196: 180, 1977); Grunstein и Hogness (Proc. Natl. Acad. Sci., USA 72:3961, 1975); Ausubel с соавторами (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger и Kimmel (Guide to Molecular Cloning Techniques, 1987, Academic Press, New York); и Sambrook с соавторами (Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York).
Термин «в значительной степени идентичный» означает полипептид или молекулу нуклеиновой кислоты, имеющие, по меньшей мере, 50% идентичность с эталонной аминокислотной последовательностью (например, любой из аминокислотных последовательностей, описанных в настоящей публикации) или последовательностью нуклеиновой кислоты (например, любой из последовательностей нуклеиновых кислот, описанных в настоящей публикации). Предпочтительно такая последовательность, по меньшей мере, на 60%, более предпочтительно на 80% или 85% и более предпочтительно на 90%, 95% или даже 99% идентична на аминокислотном уровне или на уровне нуклеиновой кислоты последовательности, используемой для сравнения.
Идентичность последовательностей обычно измеряют, используя компьютерную программу для анализа последовательностей (например, пакет компьютерных программ для анализа последовательностей из Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, программы BLAST, BESTFIT, GAP, или PILEUP/PRETTYBOX). Такая компьютерная программа сопоставляет идентичные или сходные последовательности за счет оценивания степени гомологии с различными заменами, делециями и/или другими модификациями. Консервативные замены обычно включают замены в следующих группах: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В приведенном в качестве примера способе определения степени идентичности можно использовать программу BLAST с оценкой вероятности от e-3 до e-100, свидетельствующей о близком родстве последовательности.
Термин «аналог» означает структурно родственный полипептид или молекулу нуклеиновой кислоты, обладающие функцией эталонного полипептида или молекулы нуклеиновой кислоты.
Термин «лиганд» в используемом в настоящем описании смысле относится к молекуле, которая связывается с рецептором. В частности, лиганд связывает рецептор на другой клетке, обеспечивая распознавание и/или взаимодействие между клетками.
Термин «конститутивная экспрессия» в используемом в настоящем описании смысле относится к экспрессии при всех физиологических состояниях.
Термин «заболевание» означает состояние или расстройство, которое повреждает или мешает нормальной функции клетки, ткани или органа. Примеры заболеваний включают неоплазию или инфекцию клетки патогеном.
Термин «эффективное количество» означает количество, достаточное для терапевтического эффекта. В одном варианте «эффективное количество» представляет собой количество, достаточное для задержки, ослабления или ингибирования протекающей пролиферации, роста или метастазов (например, инвазии или миграции) неоплазии.
Термин «эндогенные» означает молекулу нуклеиновой кислоты или полипептид, которые в норме экспрессируются в клетке или ткани.
Термин «принудительная толерантность» означает предотвращение активности аутореактивных клеток или иммунореактивных клеток, мишенью которых являются трансплантированные органы или ткани.
Термин «экзогенные» означает молекулу нуклеиновой кислоты или полипептид, которые не присутствуют эндогенно в клетке или не присутствуют на уровне, достаточном для достижения функциональных эффектов, получаемых в случае сверхэкспрессии. Таким образом, термин «экзогенные» может охватывать любую рекомбинантную молекулу нуклеиновой кислоты или полипептид, экспрессируемые в клетке, такие как чужеродные, гетерологичные и сверхэкспрессированные молекулы нуклеиновых кислот и полипептиды.
Выражение «гетерологичная молекула нуклеиновой кислоты или гетерологичный полипептид» означает молекулу нуклеиновой кислоты (например, молекулу кДНК, ДНК или РНК) или полипептид, который в норме не присутствует в клетке или образце, полученном из клетки. Такая нуклеиновая кислота может быть из другого организма, или она может представлять собой, например, молекулу мРНК, которая в норме не экспрессируется в клетке или образце.
Термин «иммунореактивная клетка» означает клетку, которая функционирует в иммунном ответе, или ее предшественник или потомок.
«Увеличение» означает положительное изменение, по меньшей мере, на 5%. Изменение может быть на 5%, 10%, 25%, 30%, 50%, 75% или даже на 100%.
«Изолированная клетка» означает клетку, которая отделена от молекулярных и/или клеточных компонентов, которые в природе сопровождают клетку.
Термины «изолированный», «очищенный» или «биологически чистый» относятся к материалу, который в разной степени освобожден от компонентов, которые обычно сопровождают его, когда он встречается в своем природном состоянии. «Изолированный» означает степень выделения из исходного источника или окружения. «Чистота» означает степень выделения, которая выше, чем изоляция. «Очищенный» или «биологически чистый» белок в достаточной степени освобожден от других веществ, так что какие-либо примеси фактически не влияют на биологические свойства белка или не вызывают других неблагоприятных последствий. То есть, нуклеиновая кислота или пептид согласно настоящему изобретению очищены, если они по существу не содержат клеточного материала, вирусного материала или культуральной среды, если их получают способами, основанными на рекомбинантной ДНК, или химических предшественников или других химических веществ в случае химического синтеза. Чистоту и гомогенность обычно определяют, используя способы аналитической химии, например, электрофорез в полиакриламидном геле или высокоэффективную жидкостную хроматографию. Термин «очищенный» может означать, что нуклеиновая кислота или белок дает по существу одну полосу в электрофоретическом геле. В случае белка, который может быть подвергнут модификациям, например, фосфорилированию или гликозилированию, разные модификации могут приводить к получению разных изолированных белков, которые могут быть по отдельности очищены.
Термин «домен, связывающий опухолевый антиген» в используемом в настоящем описании смысле относится к домену, способному специфично связывать конкретную антигенную детерминанту или группу антигенных детерминант, присутствующих на опухоли.
Предполагается, что термин «получение» как в случае «получение средства» включает приобретение, синтез или иное получение средства (или указанного вещества или материала)
«Линкер» в используемом в настоящем описании смысле должен означать функциональную группу (например, химическую группу или полипептид), которая ковалентно связывает два или больше полипептидов или нуклеиновых кислот, так что они становятся связанными друг с другом. В используемом в настоящем описании смысле «пептидный линкер» относится к одной или нескольким аминокислотам, используемым для связывания двух белков вместе (например, для связывания доменов VH и VL). Примером линкерной последовательности, используемой в изобретении, является GGGGSGGGGSGGGGS [SEQ ID NO: 10].
«Модулировать» означает позитивно или негативно изменять. Примеры модификаций включают изменение на 1%, 2%, 5%, 10%, 25%, 50%, 75% или 100%.
«Неоплазия» означает заболевание, характеризуемое патологической пролиферацией клетки или ткани и их последующая миграция или инвазия в другие ткани или органы. Неопластический рост обычно является неконтролируемым и прогрессирующим и происходит в условиях, которые могут не вызывать или могут вызывать прекращение размножения нормальных клеток. Неоплазии могут поражать множество типов клеток, тканей или органов, включая без ограничения орган, выбранный из группы, состоящей из мочевого пузыря, кости, головного мозга, молочной железы, хряща, глии, пищевода, фаллопиевой трубы, желчного пузыря, сердца, кишечника, почки, печени, легкого, лимфатического узла, нервной ткани, яичника, поджелудочной железы, простаты, скелетной мышцы, кожи, спинного мозга, селезенки, желудка, семенников, тимуса, щитовидной железы, трахеи, мочеполового пути, мочеточника, уретры, матки и влагалища или их ткани или клетки. Неоплазии включают злокачественные опухоли, такие как саркомы, карциномы или плазмацитомы (злокачественная опухоль плазматических клеток). Иллюстративные неоплазмы, в случае которых может быть применимо настоящее изобретение, включают без ограничения лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинскую болезнь) макроглобулинемию Вальденстрема, болезнь тяжелых цепей и солидные опухоли, такие как саркомы и карциномы (например, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак простаты, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильма, рак шейки матки, рак матки, рак семенников, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, нейрому слухового нерва, олигодендроглиому, шванному, менингиому, меланому, нейробластому и ретинобластому).
Термин «функционально связанный» в используемом в настоящем описании смысле означает связь двух или более биомолекул, так что биологические функции, активности и/или структура, ассоциированные с биомолекулами, по меньшей мере, сохраняются. В отношении полипептидов термин означает, что связывание двух или более полипептидов приводит к образованию слитого полипептида, который сохраняет, по меньшей мере, некоторые соответствующие отдельные активности каждого полипептидного компонента. Два или более полипептидов могут быть связаны непосредственно или через линкер. В отношении нуклеиновых кислот термин означает, что первый полинуклеотид расположен вблизи второго полинуклеотида, который управляет транскрипцией первого полинуклеотида, когда соответствующие молекулы (например, белки-активаторы транскрипции) связываются со вторым полинуклеотидом.
«Патоген» означает вирус, бактерию, гриб, паразит или простейшее, способные вызывать заболевание.
Примеры вирусов включают без ограничения Retroviridae (например, вирусы иммунодефицита человека, такие как ВИЧ-1 (также называемые HDTV-III, LAVE или HTLV-III/LAV или HIV-III); и другие изоляты, такие как ВИЧ-LP; Picornaviridae (например, полиовирусы, вирус гепатита A; энтеровирусы, вирусы Коксаки человека, риновирусы, эховирусы); Calciviridae (например, штаммы, которые вызывают гастроэнтерит); Togaviridae (например, вирусы конского энцефалита, вирусы краснухи); Flaviridae (например, вирусы денге, вирусы энцефалита, вирусы желтой лихорадки); Coronoviridae (например, коронавирусы); Rhabdoviridae (например, вирусы везикулярного стоматита, вирусы бешенства); Filoviridae (например, вирусы эбола); Paramyxoviridae (например, вирусы парагриппа, вирус эпидемического паротита, вирус кори, респираторно-синцитиальный вирус); Orthomyxoviridae (например, вирусы гриппа); Bungaviridae (например, вирусы Хантаан, вирусы бунга, флебовирусы и найровирусы); Arenaviridae (вирусы геморрагической лихорадки); Reoviridae (например, реовирусы, орбивирусы и ротавирусы); Birnaviridae; Hepadnaviridae (вирус гепатита B); Parvovirida (парвовирусы); Papovaviridae (вирусы папиллоы, полиомавирусы); Adenoviridae (большинство аденовирусов); Herpesviridae (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV), вирус герпеса; Poxviridae (вирусы натуральной оспы, вирусы вакцинии, поксвирусы); и Iridoviridae (например, вирус африканской лихорадки свиней); и неклассифицированные вирусы (например, возбудитель гепатита дельта (считается дефектным спутником вируса гепатита B), возбудители не-A, не-B-гепатита (класс 1=переносится при попадании во внутрь; класс 2=парентерально передаваемые (т.е. гепатит C); вирус Норуолк и родственные вирусы и астровирусы).
Примеры бактерий включают без ограничения виды Pasteurella, Staphylococci, Streptococcus, Escherichia coli, Pseudomonas species и Salmonella. Конкретные примеры инфекционных бактерий включают без ограничения Helicobacter pyloris, Borelia burgdoiferi, Legionella pneumophilia, Mycobacteria sps (например, M. tuberculosis, M. avium, M. intracellulare, M. kansaii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcuspyogenes (Streptococcus группы A), Streptococcus agalactiae (Streptococcus группы B), Streptococcus (группа вириданс), Streptococcus faecalis, Streptococcus hovis, Streptococcus (анаэробные виды), Streptococcus pneumoniae, патогенные виды Campylobacter, виды Enterococcus, Haemophilus influenzae, Bacillus antracis, Corynebacterium diphtheriae, виды Corynebacterium, Erysipelothrix rhusiopathiae, Clostridium perfringers, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, виды Bacteroides, Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelli.
«Рецептор» означает полипептид или его часть, присутствующую на клеточной мембране, которая избирательно связывает один или несколько лигандов.
«Уменьшение» означает отрицательное изменение, по меньшей мере, на 5%. Изменение может быть на 5%, 10%, 25%, 30%,50%, 75%, или даже на 100%.
«Распознает» означает «избирательно связывает мишень». T-клетка, которая распознает вирус, обычно экспрессирует рецептор, который связывает антиген, экспрессируемый вирусом.
«Эталон» или «контроль» означает стандарт для сравнения. Например, иммунный ответ клетки, экспрессирующей CAR и iCAR, можно сравнить с иммунным ответом соответствующей клетки, экспрессирующей только CAR.
В используемом в настоящем описании смысле термин «одноцепочечный вариабельный фрагмент» или «scFv» означает слитый белок из вариабельных областей тяжелой (VH) и легкой цепей (VL) иммуноглобулина, ковалентно связанных с образованием гетеродимера VH::VL. Тяжелая (VH) и легкая цепи (VL) либо связаны непосредственно, либо связаны кодирующим пептид линкером (например, 10, 15, 20, 25 аминокислот), который связывает N-конец VH с Cконцом VL или C-конец VH с N-концом VL. Линкер обычно богат глицином для гибкости, а также серином или треонином для растворимости. Несмотря на удаление константных областей и введение линкера белки scFv сохраняют специфичность исходного иммуноглобулина. Антитела в виде одноцепочечного полипептида Fv могут экспрессироваться с нуклеиновой кислотой, содержащей последовательности, кодирующие VH и VL, которые описаны Huston с соавторами (Proc. Nat. Acad. Sci. USA, 85: 5879-5883, 1988). Также смотри патенты США № 5091513, 5132405 и 4956778; и публикации патентов США № 20050196754 и 20050196754.
«Секретируемый» означает полипептид, который высвобождается из клетки в секреторном пути через эндоплазматический ретикулум, комплекс Гольджи и в виде пузырьков, которые временно сливаются с цитоплазматической мембраной, высвобождая белки во внешнюю среду клетки.
«Сигнальная последовательность» или «лидерная последовательность» означает пептидную последовательность (длиной 5, 10, 15, 20, 25, 30 аминокислот), присутствующую на N-конце новосинтезированного белка, которая управляет его вхождением в секреторный путь.
«Растворимый» означает полипептид, который свободно диффундирует в водной среде (например, не связан с мембраной).
«Специфично связывает» означает полипептид или его фрагмент, который распознает и связывает представляющую интерес биологическую молекулу (например, полипептид), но который по существу не распознает и не связывает другие молекулы в образце, например, в биологическом образце, который в природных условиях содержит полипептид согласно изобретению.
Термин «опухолевый антиген» в используемом в настоящем описании смысле относится к антигену (например, полипептиду, гликопротеиду или гликолипиду), который уникально или дифференциально экспрессируется на опухолевой клетке, по сравнению с нормальной или ненеопластической клеткой. В связи с изобретением опухолевый антиген включает любой полипептид, экспрессируемый опухолью, который может распознаваться антигенраспознающим рецептором (например, CD19, Muc-1) или способный супрессировать иммунный ответ в результате связывания рецептор-лиганд (например, CD47, PD-L1/L2, 87.112).
«Тканевой антиген» означает антиген (например, полипептид или гликопротеид или гликолипид), который уникально или дифференциально экспрессируется на нормальной или ненеопластической клетке или ткани по сравнению с опухолевой клеткой.
«Вирусный антиген» означает полипептид, экспрессируемый вирусом, который способен индуцировать иммунный ответ.
Подразумевается, что термины «содержит», «содержащий» имеют широкий смысл, приписываемый им в патентном законе США, и могут означать «включает », «включающий» и тому подобное.
В используемом в настоящем описании смысле «лечение» относится к клиническому вмешательству, при котором стремятся изменить ход заболевания у индивидуума или в клетке, подвергаемой лечению, и оно может быть осуществлено либо с целью профилактики, либо во время наличия клинической патологии. Терапевтические эффекты лечения включают без ограничения предотвращение появления или рецидива заболевания, ослабление симптомов, уменьшение каких-либо прямых или косвенных патологических последствий заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, улучшение или облегчение состояния при заболевании и ремиссию или улучшенный прогноз. Благодаря предотвращению прогрессирования заболевания или расстройства лечение может предотвращать ухудшение состояния вследствие расстройства у субъекта, пораженного заболеванием, или субъекта, у которого диагностировано заболевание, или у субъекта, у которого предполагается наличие расстройства, а также лечение может предотвращать появление расстройства или симптома расстройства у субъекта, подверженного риску развития расстройства, или у субъекта, у которого предполагается наличие расстройства.
Термин «субъект» в используемом в настоящем описании смысле относится к позвоночному, предпочтительно млекопитающему, более предпочтительно, к человеку.
Термин «с ослабленным иммунитетом» в используемом в настоящем описании смысле относится к субъекту, имеющему иммунодефицит. Такой субъект очень уязвим к оппортунистическим инфекциям, инфекциям, вызываемым организмами, которые обычно не вызывают заболевание у человека со здоровой иммунной системой, но могут поражать людей с плохо функционирующей или подавленной иммунной системой.
Другие аспекты изобретения, описаны в публикации далее и входят в сферу изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Следующее далее подробное описание, приведенное в качестве примера, но не предназначенное для ограничения изобретения конкретными описанными вариантами его осуществления, может быть понятным в связи с сопровождающими чертежами.
На фигурах 1A-1D представлена методика, дизайн и экспрессия iCAR в первичных T-клетках человека. (A) T-клетки, обладающие специфичностью по отношению как к опухоли, так и к нецелевым тканям вне мишени, могут быть ограничены только опухолью с использованием антигенспецифичного iCAR, введенного в T-клетки, чтобы защитить ткань вне мишени. (B) Схематичная диаграмма бицистронных векторов, используемых для iCAR и Pdel. iCAR-P: спейсер, трансмембранный домен и внутриклеточный хвост каждого ингибирующего рецептора клонировали в ранее описанном ретровирусном векторе, имеющем лидерную последовательность (LS) CD8. IRES, внутренний сайт связывания рибосомы; hrGFP, репортерный гуманизированный зеленый флуоресцирующий белок Renilla. Контрольный вектор Pdel конструировали с использованием спейсера и трансмембранного (TM) домена CD8 и без внутриклеточного хвоста. (C) Экспрессию iCAR на клеточной поверхности оценивали, используя проточную цитометрию, в трансдуцированных первичных T-клетках человека. Точечные диаграммы представляют данные, полученные для восьми разных доноров. GAM, антитело козы против F(ab')2 иммуноглобулина G мыши, которое связывается с полученным от мыши внеклеточным доменом CAR. На фигурах D изображен проточно-цитометрический анализ экспрессии iCAR на клеточной поверхности с использованием окрашивания антитела козы против Ig мыши (GAM) в трансдуцированных первичных T-клетках человека.
На фигурах 2A-2F показано, что iCAR защищали iPS-fib от TCR-опосредованных аллогенных реакций. Контрольные Pdel- или iCAR-трансдуцированные T-клетки, праймированные аллогенными moDC, инкубировали с полученными из iPS фибробластами (iPS-fib), экспрессирующими люциферазу жука-щелкуна (CBL), изогенными moDC, используя определенный диапазон соотношений E/T. (A) Pdel-, PD-1- или mutCTLA-4 iCAR-P-трансдуцированные T-клетки, взаимодействующие с мишенью iPS-fib (n=3 при каждом условии). Гибель iPS-fib количественно оценивали, используя систему анализа Bright-Glo. (B) Секрецию цитокинов в надосадках культуральной среды, полученных как показано на фигуре (A), в соотношении E/T 4:1 оценивали во временной точке 18 часов. GM-CSF, колониестимулирующий фактор гранулофитов-макрофагов; IFN-γ, интерферон-g; TNF-α, фактор некроза опухолей-a. (C) Pdel- или iCAR-позитивные T-клетки инкубировали в течение 24 часов с нецелевыми iPS-fib, экспрессирующими PSMA (iPS-fib-PSMA) и сигнал люциферазы (слева) количественно оценивали (справа) (n=3 для каждого условия). (D-F) Секреция цитокинов, измеренная во временной точке 24 часа в надосадках культур клеток, показанных на фигуре (C). Планки погрешностей представляют ±SEM. *P<0,01, ***P<0,001 в случае дисперсионного анализа (ANOVA), в котором сравнивали iCAR и Pdel, и апостериорном анализе с использованием множественных t-критериев с корректировкой способом Холма-Сидака. Первичные данные и P-значения приведены на фигурах 19A-19E.
На фигурах 3A-3D показано, что iCAR функционировали стехиометрическим образом. (A) Pdel- или PD-1 iCAR-P-трансдуцированные аллореактивные T-клетки сортировали на основании высокой или низкой экспрессии каждого соответствующего рецептора, как показано на фигуре 13A, и высевали на iPS-fib-PSMA, экспрессирующие CBL. Гибель iPS-fib-PSMA по сравнению с необработанными клетками оценивали, используя систему для анализа Bright-Glo (n=3 для каждого условия). (B) Секреция цитокинов, измеряемая во временной точке 24 часа в надосадке культуры клеток, указанной на фигуре (A) в соотношении 4:1 E/T. (C) PD-1 iCAR-P-трансдуцированные аллореактивные T-клетки инкубировали с iPS-fib-PSMA, отсортированными на основании высоких или низких уровней экспрессии PSMA, как показано на фигуре 13B. Гибель каждой популяции по сравнению с необработанными клетками количественно оценивали, используя систему анализа Bright-Glo (n=3 в случае каждого условия). D) Цитокины, полученные из (C), оценивали во временной точке 24 часа. Планки погрешностей представляют ±SEM. ***P<0,001 при использовании критерия Стьюдента. Планки погрешностей представляют ±SEM. *P<0,01, ***P<0,001 на основании анализа ANOVA, сравнивающего с группой с высоким уровнем Pdel и апостериорного анализа с использованием множественных t-критериев с корректировкой способом Холма-Сидака. Первичные данные и P-значения приведены на фигурах 20A и 20B.
На фигурах 4A и 4B показано, что iCAR ограничивали аллогенные ответы in vivo. Мышам NOD/SCID/γc- внутрибрюшинно инъецировали 1×106 полученных из iPS фибробластов, экспрессирующих CBL/PSMA (iPS-fib-PSMA), и спустя 7 дней обрабатывали внутрибрюшинно 5×105 PD-1 iCAR-P- или Pdel-трансдуцированными отсортированными аллореактивными T-клетками. Необработанных мышей (без применения T-клеток) использовали в качестве контроля. (A) Жизнеспособность iPS-fib-PSMA оценивали с использованием BLI до и в выбранных временных точках после инфузии T-клеток. Показаны изображения четырех типичных мышей из каждой группы. (B) Количественно оценивали поток от всего тела (фотонов в секунду) для каждой мыши и получали средние значения для группы (n=5 на группу). Планки погрешностей представляют ±SEM. *P<0,05, **P<0,01 при использовании ANOVA, в котором сравнивали с Pdel, и апостериорного анализа с использованием множественных t-критериев с корректировкой способом Холма-Сидака. Первичные данные и P-значения приведены на фигурах 21A и 21B.
На фигурах 5A-5F показано, что iCAR ингибировали высвобождение цитокинов T-клетками человека, пролиферацию и элиминацию клеток-мишеней, управляемую 19-28z CAR. (A) Мультиплексный анализ цитокинов Luminex в надосадке культуры через 24 часа после посева отсортированных по двум параметрам 19-28z/Pdel- или 19-28z/iCAR-трансдуцированных T-клеток человека на 3T3-CD19- (мишени) или 3T3-CD19-PSMA- (нецелевые) AAPC. Данные представляли в виде отношения значений для нецелевых/мишеней и объединяли из трех независимых экспериментов (n=6 лунок для каждого условия). Планки погрешностей представляют ±SEM. **P<0,01, ***P<0,001 при анализе ANOVA, в котором сравнивали iCAR с Pdel, и апостериорном анализе с использованием множественных t-критериев с корректировкой способом Холма-Сидака. (B) Подсчет абсолютного количества 19-28z/Pdel- или 19-28z/iCAR-T-клеток, стимулированных в 0 и 7 день с использованием нецелевых AAPC. Экзогенных цитокинов не добавляли. Представлены данные, полученные в шести независимых экспериментах. (C) Пролиферация 19-28z/Pdel- или 19-28z/iCAR-T-клеток, стимулированных в 0 и 7 дни с использованием нецелевых AAPC, по сравнению с пролиферацией на AAPC-мишенях. Экзогенных цитокинов не добавляли. Представлены данные, полученные в шести независимых экспериментах. (D) T-клетки, посеянные в соотношении 1:1 на являющихся мишенями и нецелевых mCherry+-AAPC. Показаны изображения во временных точках 38 часов и 5 дней из одного из пяти независимых экспериментов. Масштабные планки, 0,5 мм. (E и F) Количественная оценка сигнала mCherry клеток, показанных на фигуре (D), против CD19-T-клеток-мишеней (E) или нецелевых CD19-PSMA-T-клеток (F), которые описаны в разделе «Материалы и способы». Планки погрешностей представляют ±SEM. **P<0,01, ***P<0,001 при использовании t-критерия Стьюдента. Первичные данные и P-значения приведены на фигурах 22A-22C.
На фигурах 6A-6F показано, что iCAR ограничивали специфичность к клеткам-мишеням 19-28z CAR in vivo. (A) BLI-изображение прогрессирования опухолей NALM/6 или NALM/6-PSMA у мышей NOD/SCID/γc-, обработанных отсортированными 19-28z/PD-1-iCAR-P-T-клетками. Необработанных мышей (без применения T-клеток) использовали в качестве контроля. (B) Опухолевую нагрузку для каждой мыши оценивали количественно, и показан средний суммарный поток на группу. (C) Масса селезенки у мышей, описанных на фигуре (A), умерщвленных на 21 день. Каждая точка представляет одну реципиентную мышь. (D) Проточно-цитометрический анализ костного мозга из бедренной кости мышей, описанных на фигуре (C), в отношении присутствия опухолевых клеток (CD19+GFP+) и T-клеток (CD19-19-28z/GFP+CD4+CD8+). Экспрессию 19-28z оценивали по окрашиванию LNGFR-рецептора, комплементарная ДНК (кДНК) которого связана с 19-28z, и использовали в качестве регистрируемого маркера. (E и F) Абсолютные количества опухолевых клеток (E) и T-клеток CD19-19-28z/GFP+CD4+CD8+ (F) в селезенках, описанных на фигуре (C), оценивали, используя проточную цитометрию с шариками CountBright (n=4). Планки погрешностей представляют ±SEM. **P<0,01, ***P<0,001 при использовании t-критерия Стьюдента.
На фигурах 7A-7D показано, что функция iCAR является временной и обратимой. (A) T-клетки 19-28z/Pdel или 19-28z/PD-1 iCAR-P инкубировали с AAPC-мишенями (T) или нецелевыми (O) AAPC для первой стимуляции. Через 3 или 7 дней клетки из каждой группы повторно стимулировали либо AAPC-мишенями [T→T (1) или O→T (2)] или нецелевыми [T→O (3) или O→O (4)] AAPC перекрестно, чтобы проанализировать влияние первой стимуляции на последующее функционирование T-клеток. (B) Гибель AAPC-мишеней (T) или нецелевых (O) AAPC через 24 часа после инкубации с каждой группой T-клеток (вторая стимуляция) анализировали с использованием системы анализа Bright-Glo (n=3 для каждого условия). (C) Секрецию эффекторных цитокинов в надосадке культуры клеток, описанной на фигуре (B), анализировали через 24 часа после второй стимуляции, и показан интерферон-g (IFN-g) в качестве типичного результата (n=3 для каждого условия). (D) Пролиферация T-клеток на 7 день после второй стимуляции (n=3 для каждого условия). Планки погрешностей представляют ±SEM. Статистическое сравнение осуществляли в пределах каждого условия (то есть, T→T Pdel по сравнению с PD-1 iCAR-P). ***P<0,001 при использовании t-критерия Стьюдента.
На фигурах 8A-8E показано, что iCAR- и CAR-экспрессирующие T-клетки различали мишени in vitro и vivo. (A) T-клетки 19-28z/Pdel или 19-28z/PD-1 iCAR-P инкубировали со смесью 1:1 AAPC-мишеней (CD19+GFP+, зеленые) и нецелевых (CD19+PSMA+mCherry+, красные) AAPC и использовали цейтраферную микроскопию, чтобы визуализировать гибель в реальном времени каждой популяции в течение 38 часов. Показаны типичные изображения и сняты полнометражные фильмы. Масштабные планки, 0,1 мм. (B) Как и в случае (A), T-клетки 19-28z/Pdel или 19-28z/PD-1 iCAR-P инкубировали со смесью 1:1 AAPC-мишеней (CD19+) и нецелевых AAPC (CD19+PSMA+). Гибель каждой популяции AAPC оценивали в параллельных экспериментах, в которых один из каждого типа AAPC метили, используя CBL (смесь CD19+CBL+/CD19+PSMA+ или смесь CD19+/CD19+PSMA+CBL+). Гибель количественно оценивали, используя систему анализа Bright-Glo, во временной точке 38 часов (n=3 для каждого условия). (C-E) Мышам NOD/SCID/γc- инъецировали смесь 1:1 клеток NALM/6 и NALM/6-PSMA и обрабатывали T-клетками 19-28z или 19-28z/PD-1 iCAR-P. (C) После умерщвления анализировали присутствие клеток-мишеней и нецелевых клеток NALM/6 в костном мозге, используя проточную цитометрию. (D) Соотношение клеток-мишеней/нецелевых клеток NALM/6 в костном мозге умерщвленных мышей количественно оценивали, используя проточную цитометрию. (E) Массу селезенки обработанных мышей также регистрировали пи умерщвлении. Планки погрешностей представляют ±SEM. ***P<0,001 при использовании t-критерия Стьюдента.
На фигурах 9A-C показано, что экспрессия на клеточной поверхности CTLA-4 iCAR возрастала после активации T-клеток. (A) Экспрессия на клеточной поверхности и внутриклеточная экспрессия CTLA4 iCAR-P в трансдуцированных первичных T-клетках человека. (B) Вестерн-блот-анализ с использованием антитела, специфичного по отношению к внутриклеточному домену CTLA4 в нетрансдуцированных (2) и CTLA4 iCAR-P-трансдуцированных (1) первичных T-клетках человека. Мышиные клетки EL4 (3) служили в качестве негативного контроля. (C) T-клетки 1928z/CTLA4 iCAR активировали, используя 3T3-19 AAPC, и анализировали в отношении экспрессии CTLA4 iCAR на клеточной поверхности через 7 часов и 30 часов после активации (n=3).
На фигуре 10 показано, что iCAR-P связан с клетками, экспрессирующими PSMA. Клетки EL4-wt или EL4-PSMA, меченые липофильным красителем DiD, инкубировали с T-клетками, экспрессирующими iCAR/GFP, в анализе конъюгации клеток. Конъюгаты выявляли, используя проточную цитометрию в виде двойных позитивных событий DiD/GFP.
На фигурах 11A-11D представлена модель аллогенной реактивности с использованием полученных из iPS фибробластов и изогенных moDC. (A) Индуцированные плюрипотентные стволовые (iPS) клетки получали из PBMC донора 1 и использовали для получения фибробластов. PBMC донора 1 также использовали для получения moDC, на которые импульсно воздействовали лизатами фибробластов и которые могли праймировать аллогенную реакцию PBMC второго донора. (B) Микроскопическая картина, показывающая морфологию полученных из тератомы iPS-фибробластов, выращенных в культуре. (C) В iPS-fib отсутствовала экспрессия маркером плюрипотентности, они имели морфологию фибробластов и окрашивались позитивно в отношении нескольких маркеров клеточной поверхности фибробластов, включая CD90, PDGFr-b2 и CD10 (КРАСНЫЙ=изотипический контроль; СИНИЙ и ЗЕЛЕНЫЙ представляют две независимых изолированных линии). (D) iPS-fib базально позитивно окрашенные в отношении HLA класса I, но не класса II, и подвергаемая быстрой повышающей регуляции экспрессия обоих при обработке рекомбинантным INF-гамма.
На фигурах 12A-12C представлена высокая реактивность iCAR-трансдуцированных первичных T-клеток человека против аллогенных полученных из iPS фибробластов. (A) iCAR-трансдуцированные T-клетки от одного донора праймировали, используя moDC, импульсно обработанные лизатами iPS-fib другого донора, и окрашенные спустя 6 дней в отношении маркеров активации CD25 и HLA-DR. (B) Дважды праймированные iCAR-трансдуцированные T-клетки инкубировали в течение 18 часов с iPS-fib-luc и гибель количественно оценивали, используя систему анализа Bright-Glo (n=3 для каждого условия). (C) Цитокины измеряли во временной точке 18 часов в надосадке культуры клеток, описанных на фигуре (B), в случае соотношении E:T, равном 4:1. Планки погрешностей представляют +/-SEM. Статистическое сравнение осуществляли в пределах каждого условия (т.е., TıT). ***p<0,001 при использовании t-критерия Стьюдента.
На фигурах 13A и 13B представлена методика трансдукции и сортировки iCAR- или 19-28z/iCAR-T-клеток. (A) PD1-iCAR(GFP)- или Pdel (GFP)-трансдуцированные T-клетки сортировали по экспрессии трансгена на основании уровня экспрессии GFP. Каждый донор представляет отдельный эксперимент. Анализ после сортировки осуществляли для подтверждения чистоты. (B) 19-28z (LNGFR)/iCAR(GFP)- или 19-28z/Pdel/GFP-трансдуцированные T-клетки сортировали по экспрессии трансгена на основании уровня экспрессии GFP и LNGFR. Каждый донор представляет отдельный эксперимент. Анализ после сортировки осуществляли для подтверждения чистоты и экспрессии iCAR.
На фигурах 14A и 14B представлена методика сортировки T-клеток с низкой/высокой экспрессией iCAR и PSMA-экспрессирующих iPS-фибробластов. (A) PD1-iCAR/GFP- или Pdel/GFP-трансдуцированные T-клетки сортировали в отношении низкой или высокой экспрессии трансгена на основе уровня экспрессии GFP. (B) Полученные из iPS фибробласты (iPS-fib) трансдуцировали так, чтобы они экспрессировали PSMA, и сортировали, используя анти-PSMA-антитело (iPS-fib-PSMA sort bulk+). Такие клетки использовали для экспериментов, показанных на фигурах 2 и 4. Вторую отдельную сортировку использовали для очистки iPS-fib с низкой или высокой поверхностной экспрессией PSMA, используя анти-PSMA-антитело, и такие клетки применяли в экспериментах, показанных на фигуре 3.
На фигурах 15A-15D показано, что iCAR ингибировали 19-28z-управляемое высвобождение цитокинов и пролиферацию T-клеток человека. (A) Пролиферация T-клеток человека в искусственных антигенпрезентирующих клетках (AAPC), экспрессирующих CD19 или экспрессирующих и CD19 и PSMA. (B) Типичный анализ цитокина INFγ в надосадках через 24 часа и 48 часов после посева 19-28z/Pdel- или iCAR-трансдуцированных T-клеток человека, подвергнутых двойной сортировке, на CD19- (мишенях) или CD19/PSMA (нецелевых)-позитивных AAPC. Данные представлены в виде отношения значений для нецелевых клеток/мишеней и объединены из трех независимых экспериментов (n=6 лунок для каждого условия). Планки погрешностей представляют +/-SEM. (C) Подсвет абсолютного количества дважды позитивных 19-28z/Pdel- или iCAR-T-клеток, стимулированных в 0 и 7 день с использованием CD19+ AAPC (мишень). (D) Сравнение терапевтических ответов T-клеток с клетками NALM/6 и NALM/6-PSMA в мышиной модели ксенотрансплантатов NOD/SCID/γc-.
На фигурах 16A-16I показано, что базальная экспрессия iCAR не влияет на функцию первичных T-клеток человека. (A, B) Через семь дней после трансдукции с использованием 1928z/iCAR T-клетки активировали, используя CD3/CD28-шарики, и оценивали уровни IL-2/INFγ через 24 часа (C). На восьмой день после активации шариками оценивали размножение в виде абсолютного количества T-клеток, используя шарики CountBright (D), и изменение в процентном содержании GFP-позитивных клеток в каждой группе iCAR нормализовали относительно нестимулированных клеток. (E) T-клетки 1928z/iCAR культивировали совместно в течение пяти дней с облученными клетками EL4-WT или EL4-PSMA и подвергали иммунофенотипированию с использованием проточной цитометрии. На фигуре (F) изображен анализ конъюгации клеток EL4-wt или EL4- PSMA, меченых липофильным красителем DiD и инкубированных с iCAR-экспрессирующими Tклетками. На фигуре (G) представлены графики, на которых изображены уровни IL-2/INFγ в T-клетках через 24 часа после активации с CD3/CD28-шариками, через семь дней после трансдукции 1928z/iCAR. Фигура (H) представляет собой график, изображающий количественную оценку размножения T-клеток в абсолютных количествах с использованием шариков CountBright на восьмой день после активации шариками. Фигура (I) представляет собой график, изображающий изменение процентного содержания GFP-позитивных клеток в каждой группе iCAR, вычисляемого относительно нестимулированных клеток.
На фигурах 17A-17C представлена характеристика пути передачи сигнала и биохимического пути PD-1 iCAR. Клетки 19-28z/PD-1 iCAR подвергали воздействию AAPC, не экспрессирующих антигена (WT), экспрессирующих CD19 (мишени) или CD19 и PSMA (нецелевые) в соотношении E:T, равном 4:1, в течение 60 минут. (A) Матрицу фосфо-иммунорецепторов человека инкубировали с 100 мкг лизата T-клеток 19-28z/PD-1 iCAR и соответствующими AAPC. Все блоты регистрировали, используя хемилюминесценцию, на одной и той же рентгеновской пленке, чтобы стандартизовать уровни экспозиции. (B, C) Количественная оценка матриц, описанных на фигуре (A), с использованием сканированных изображений рентгеновской пленки, анализируемых с применением компьютерной программы для анализа изображений. Во всех случаях плотность пикселей нормализовали на каждой матрице, используя внутренние контроли pY. (B) Состояния фосфорилирования SHP1 и SHP2 в AAPC-мишенях, нецелевых или контрольных AAPC. (C) Количественная оценка уровней фосфорилирования 59 ITAM/ITIM-ассоциированных иммунорецепторов.
На фигуре 18 показано, что iCAR непосредственно действовал на стимулирующий рецептор, блокируя передачу его сигнала.
На фигурах 19A-19E представлены первичные данные и проверка статистической значимости для фигур 2A-2F. (A) Гибель iPS-фибробластов количественно оценивали, используя систему анализа Bright-Glo для Pdel-, PD-1- или mutCTLA-4 iCAR-P-трансдуцированных T-клеток. (B) Секрецию цитокинов в надосадках культур клеток, описанных на фигуре (A) в соотношении 4:1 E:T оценивали во временной точке 18 часов. (C) Pdel- или iCAR-позитивные T-клетки инкубировали в течение 24 часов с нецелевыми iPS-fib, экспрессирующими PSMA (iPS-fib-PSMA), и количественно оценивали сигнал люциферазы. (D) Апостериорный анализ для случая, описанного на фигуре (C), осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака. (E) Секреция цитокинов, измеренная во временной точке 24 часа в надосадках культур клеток, описанных на фигуре (C). Представлены первичные значения для GM-CSF. Отношение E:T, отношение эффектор: мишень.
На фигурах 20A и 20B представлены первичные данные и проверка статистической значимости для фигур 3A-3D. (A) Гибель iPSfib-PSMA относительно необработанных клеток оценивали, используя систему анализа Bright-Glo для сортированных в отношении высоких и низких уровней Pdel- или PD1 iCAR-P-трансдуцированных аллореактивных T-клеток. Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака. (B) Убивание PD1 iCAR-P-трансдуцированными аллореактивными T-клетками iPS-fib-PSMA, отсортированных в отношении высоких или низких уровней экспрессии PSMA, количественно оценивали, используя систему анализа Bright-Glo. Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака.
На фигурах 21A и 21B представлены первичные данные и проверка статистической значимости для фигур 4A и 4B. (A) Биолюминесцентная визуализация (BLI) iPS-fib-PSMA до и выбранных временных точках после инфузии T-клеток. (B) Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака.
На фигурах 22A-22C представлены первичные данные и проверка статистической значимости для фигур 5A-5F. (A) Мультиплексный анализ цитокинов Luminex в надосадке культуры во временной точке 24 часа, данные представлены в виде соотношения значения для нецелевых клеток/мишеней и объединены из трех независимых экспериментов (n=6 лунок для каждого условия). Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака. (B) Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака для фигуры 5B, где проведено сравнение пролиферации 19-28z/Pdel и 19-28z/PD1 iCAR. (C) Количественная оценка сигнала mCherry против CD19- мишеней или нецелевых CD19-PSMA-T-клеток, которая описана в разделе «Способы». Апостериорный анализ осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака.
Фигура 23 является схематичным представлением отбора антигена-мишени для iCAR и CAR.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в общем, относится к клеткам, включая генетически модифицированные иммунореактивные клетки (например, T-клетки (включая все подгруппы, такие как CD4-, CD8-, клетки памяти, наивные, эффекторные, T-рег. и т.д.), клетки врожденной иммунной системы, природные клетки-киллеры (NK), цитотоксические T-лимфоциты (CTL)), экспрессирующие, по меньшей мере, сочетание антигенраспознающего рецептора (например, TCR или CAR) и ингибирующего химерного рецептора антигена (iCAR), который избирательно снижает или исключает иммунную активность иммунореактивной клетки, и к способам применения таких клеток для лечения неоплазии и других патологий, при которых требуется снижение иммунных ответов «вне мишени». Изобретение основано, по меньшей мере, отчасти на открытии того, что ингибирующие химерные рецепторы антигенов (iCAR), которые связывают антиген-мишень (например, PSMA, который показан в настоящем описании), применимы для избирательного ингибирования и супрессии иммунореактивной клетки. В частности, iCAR согласно изобретению снижают или предотвращают активацию иммунного ответа иммунореактивной клетки. Данный способ относится к избирательной иммуногенности для уничтожения опухоли, при этом оберегая неопухолевые ткани от иммунного ответа. Соответственно, T-клетки, экспрессирующие антигенраспознающий рецептор и iCAR, обеспечивают значительный прогресс по сравнению с обычной адоптивной T-клеточной терапией.
Широкому применению инфузии лейкоцитов донора для лечения злокачественной опухоли препятствует невозможность отделять терапевтическую эффективность эффекта «трансплантат против опухоли» (GVT) от потенциально летальных эффектов болезни «трансплантат против хозяина» (GVHD). Использовали два общих подхода для контроля побочных эффектов T-клеточной терапии. В первом используют иммунодепрессивные лекарственные средства, которые работают неспецифично, блокируя деление клеток (цитостатики) и широко ограничивают иммунные ответы (глюкокортикоиды, иммунофилины и т.д.) или целенаправленно действуя на T-клетки, вызывая клиренс/гибель (антитела). Несмотря на свою действенность, такие подходы являются неспецифичными в отношении разделения терапевтически функционирующих T-клеток и T-клеток, вызывающих вредные побочные эффекты. Кроме того, все указанные лекарственные средства вызывают значимые вторичные побочные эффекты (чувствительность к инфекциям, поражения сердца, почек и неврологические поражения).
В случае второго подхода конструируют T-клетки с суицидными генами/переключателями гибели. Такие способы являются генетическими способами, которые приводят к гибели сконструированной клетки после предоставления подходящего сигнала. Некоторые из способов основаны на введении избирательных ферментативных метаболизаторов токсических агентов, таких как тимидинкиназа вируса простого герпеса (HSV-tk). Кроме того, применение индуцируемого белка каспазы-9, который активируют, используя специфичный химический индуктор димеризации, был многообещающим способом активной индукции гибели широкого круга клеток. Основным ограничением в случае указанных способов является то, что они индуцируют клеточную гибель среди всех клеток-мишеней (приводя при этом к элиминации полезных клеток). Подобно обычной иммуносупрессии они обычно требуют появления симптомов перед применением (и следовательно, возможных серьезных повреждений у пациента).
Напротив, методика iCAR, описанная в настоящей публикации, избирательно фильтрует действия T-клеток, ограничивая активность в местах вне мишени, при этом сберегая терапевтическую функциональность, направленную против предполагаемой мишени. Как показано в настоящем описании, iCAR способны ингибировать «атаку» аллореактивных T-клеток человека на ткань «хозяина» в новой модели in vitro и in vivo, в которой использованы полученные из iPS фибробласты человека. Уникальные поверхностные антигены, присутствующие в тканях-мишенях GVHD (например, CD33 для миелоидной линии или специфичные для органов антигены), но отсутствующие в являющемся мишенью злокачественном новообразовании, являются кандидатами на мишени iCAR, чтобы отличать GVHD от GVT. Подобным образом, результаты, описанные в настоящей публикации, показывают, что iCAR-опосредованное ингибирование успешно ограничивает эффекты «в месте мишени, но вне ткани» T-клеток с сконструированными CAR, примеры которых включают B-клеточную аплазию у пациентов с лейкозом, подвергаемых лечению T-клетками, экспрессирующими CD19-специфичный CAR (Kalos et al., Science translational medicine, 2011. 3(95): 95ra73), фатальный острый респираторный дистресс-синдром (ARDS) предположительно в результате перекрестной реактивности анти-ERBB2 CAR-T-клеток в легочном эпителии (Morgan et al., Mol. Ther., 2010. 18(4): 843-51), и смертельные исходы в результате некроза сердечной мышцы у пациентов с меланомой и миеломой, которых лечили Mage-A3 TCR (June, Update on Immunotherapy Trials for HIV and Cancer, in Recombinant DNA Advisory Committee, 2012). Благодаря распознаванию поверхностного антигена, который экспрессируется на клетках сердца или легочном эпителии, но отсутствует на опухолевых клетках, iCAR потенциально можно применять для защиты от перекрестной реактивности Mage-A3 TCR или анти-ERBB2 CAR, таким образом позволяя возродить во всем остальном многообещающие терапевтические средства. Альтернативно, так как во многих опухолях активно происходит понижающая регуляция молекул HLA для избегания иммунного распознавания, нацеленные на HLA iCAR потенциально способны обеспечить одновременную защиту нескольких тканей.
Важным требованием для клинической применимости iCAR является сохранение T-клеточной функциональности, несмотря на предшествующую передачу сигнала iCAR. Интересно, что было обнаружено, что iCAR-трансдуцированные T-клетки все еще дают ответ, направленный против антигена-мишени после экспозиции с ингибирующим антигеном. Такая обратимость имитирует поведение клеток природных киллеров, при котором состояние фосфорилирования сигнальных молекул, а не состояние транскрипции контролирует быстрые функциональные ответы, такие как цитотоксичность. АнтиPD-1- и анти-CTLA4-антитела способны восстанавливать нарушенную функцию анергичных или истощенных T-клеток, что опять-таки свидетельствует о возможности временно регулировать T-клеточные ответы. Кроме того, биохимические анализы эффектов PD-1 и CTLA-4 на TCR-комплекс показали, что они зависят от состояния фосфорилирования, ниже расположенных в каскаде киназ и подвижности, а не апоптоза. Результаты, полученные как in vitro, так и in vivo, продемонстрировали ингибирование в ответ на нецелевые клетки с длительной терапевтической функциональностью, хотя существует вероятность, что некоторые из клеток могут быть анергичными. Кроме функционирования в T-клетках, CTLA4 и PD-1 также работают в B-клетках, макрофагах и дендритных клетках. Таким образом, iCAR также обладают потенциальной возможностью влиять на другие иммунологические явления.
iCAR согласно настоящему изобретению можно применять в качестве смягчающего средства, чтобы ограничить системные цитокиновые бури или ответы иммунных клеток, например, посредством введения антигена к iCAR - такого как рекомбинантный PSMA-Ig, инфузируемый пациенту. PSMA-Ig может связывать и активировать iCAR и, таким образом, может временно ингибировать активацию T-клеток. Это может временно нарушать циклическую спираль, которая вызывает цитокиновые бури и позволяет T-клеткам активироваться с ограниченными системными побочными эффектами. iCAR обладают такой функциональностью, как показано при перекрестном связывании iCAR.
В настоящем изобретении использован физиологический механизм ограничения побочных эффектов T-клеток. Такой способ имитирует ограничение T-клеточной реактивности, которая имеет место в естественных условиях, и следовательно не требует элиминации терапевтически ценных жизнеспособных клеток. Настоящий способ, в котором использованы преимущества разносторонней функциональности клеток, применяемых в качестве лекарственных средств, с использованием синтетических рецепторов, которые направляют и управляют осуществлением T-клетками только требуемых функций. В заключение, антигенспецифичные ингибирующие рецепторы успешно ограничивали Tклеточную пролиферацию, секрецию цитокинов и цитотоксичность после осуществления контакта со специфичными антигенами клеточной поверхности, таким образом обеспечивая защиту нормальной ткани с сохранением при этом важных опосредованных TCR или CAR терапевтических функций. Таким образом, iCAR обеспечивают новую методику разработки безопасных и более эффективных способов T-клеточной терапии как в аутологичных, так и в аллогенных условиях.
ЭФФЕКТ «ТРАНСПЛАНТАТ ПРОТИВ ЛЕЙКОЗА» (GVL) И БОЛЕЗНЬ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА» (GVHD)
Начиная с первого применения аллогенных трансплантатов костного мозга было понятно, что устранение лейкоза зависело от происходящего от донора иммунного ответа. Эффект «трансплантат против лейкоза» (GVL) дополнительно выясняли и оценивали после успешной инфузии лимфоцитов донора после аллогенной трансплантации костного мозга (BMT). Инфузия лимфоцитов донора (DLI) является наиболее разработанным и широко распространенным применением адоптивной иммунотерапии злокачественных новообразований. К сожалению, основной причиной заболеваемости и смертности после DLI является появление болезни «трансплантат против хозяина» (GVHD). Снижение его частоты и тяжести является важным ограничением для более широкого и потенциально целебного применения DLI в случае солидных и гематологических опухолей. Методика iCAR направлена на решение указанной проблемы за счет разделения полезных эффектов GVL от опасных последствий GVHD. GVHD главным образом воздействует на кожу, печень и кишечный тракт, места, которые имеют уникальные антигены, такие как минорные антигены alia, которые могут отсутствовать в злокачественном новообразовании-мишени. Такие явления подтверждают возможную роль iCAR в разделении эффектов GVL и GVHD.
При адоптивной терапии было показано, что нацеленные на новую мишень T-клетки играют лечебную роль при нескольких злокачественных новообразованиях. Тем не менее, такой преобразовательный способ ограничен из-за перекрестной реактивности и последующей токсичности, направленной против важных нормальных тканей (сердца, легкого). Таким образом, существует настоятельная потребность в разработке путей осуществления контроля за реактивностью T-клеток без ослабления их терапевтических функций, и как осуществить такой контроль указывает методика iCAR. Благодаря распознаванию поверхностного антигена, который экспрессируется на клетках сердца или эпителии легкого, но отсутствует на опухолевых клетках, iCAR потенциально могут быть использованы для защиты от перекрестной реактивности Mage-A3 TCR или анти-ERBB2 CAR, таким образом, можно возродить во всем остальном многообещающие терапевтические средства. Альтернативно, так как во многих опухолях активно происходит понижающая регуляция молекул HLA для избегания иммунного распознавания, нацеленные на HLA iCAR потенциально способны обеспечить одновременную защиту нескольких тканей.
В одном варианте конструируют аллогенные лимфоциты (с определенной степенью иммунологического совпадения) так, чтобы они экспрессировали iCAR, мишенью которого является HLA-I, антиген, универсально экспрессируемый в разных тканях, для лечения метастатического рака молочной железы (типа злокачественной опухоли с чрезвычайно активной понижающей регуляцией HLA-I). Пациенту инфузируют клетки. iCAR защищает все нормальные или ненеопластические ткани, которые экспрессируют HLA-1, при этом опухоль элиминируется вследствие негативной или чрезвычайно низкой экспрессии HLA-I.
В другом варианте пациента подвергают HSCT для лечения гематологического злокачественного новообразования или в качестве адъювантного лечения солидной опухоли. Пациент имеет рецидив или имеет остаточное заболевание, которое при анализе оказывается негативным по HLA-I или имеет понижающую регуляцию HLA-I. Конструируют лимфоциты донора с iCAR, мишенью которых является HLA-I. Пациенту инфузируют клетки. iCAR защищает все нормальные или ненеопластические ткани, которые экспрессируют HLA-I, при этом опухоль элиминируется вследствие негативной или чрезвычайно низкой экспрессии HLA-I.
В еще одном варианте пациент имеет опухоль, возникшую в месте, которое не связано с клетками кожи, печени или кишечника (основных мест связанной с GVHD смертности). Конструируют лимфоцитарные клетки донора с iCAR, мишенью которых являются антигены, экспрессируемые в коже, печени или кишечнике или всех трех местах. Например, было показано, что если опухоль подверглась эпителиально-мезенхимальному переходу (EMT), который встречается в случае прогрессирования опухолей и метастатических опухолей, E-кадгерин и цитокератин подвергаются понижающей регуляции в виде части такого процесса. E-кадгерин экспрессируется на высоком уровне в нормальной коже, печени и кишечнике (Tsuchiya et al., Arch. Histol. Cytol., 69(2): 135-145(2006)). Таким образом, лимфоциты донора, экспрессирующие iCAR против E-кадгерина, реагируют GVL-образом против опухоли, но ограничены в отношении их способности атаковать кожу, печень или кишечник.
ОТБОР АНТИГЕНА-МИШЕНИ ДЛЯ iCAR И CAR
Изобретение относится к способу и набору новых реагентов для контроля ответов T-клеток или других иммуномодулирующих клеток с использованием синтетических рецепторов, в которых использованы домены передачи сигналов иммуноингибирующих рецепторов (iCAR). В случае выбора подходящего антигена для iCAR иногда может быть использован способ персонифицированной медицины из-за природной изменчивости опухолей. В то же время, в зависимости от применения и типа iCAR, несколько возможных «классов» антигенов могут обеспечить защиту нескольких тканей одновременно. Такие антигены включают: (1) повсеместно экспрессируемые иммуногенные антигены, которые подвергаются понижающей регуляции в опухолях, но не в нормальных тканях, такие как лейкоцитарные антигены человека (HLA); (2) антигены, подвергаемые понижающей регуляции при прогрессировании опухолей, особенно при достижении метастатического фенотипа, но сохраняются в некоторых нормальных тканях. Такие антигены включают: (3) EMT-антигены клеточной поверхности (такие как E-кадгерин и цитокератины); (4) опухолевые супрессорные антигены клеточной поверхности, такие как OPCML (Cui et al., PLoS ONE. 2008; 3(8): e2990); и (6) другие сходные антигены, такие как HYAL2, DCC, SMAR1 и тому подобные. OPCML-v1 широко экспрессируется на разных уровнях во всех нормальных тканях взрослого организма и плода (за исключением плаценты и мононуклеарных клеток периферической крови). (7) Углеводы, липиды клеточной поверхности и посттрансляционные модификации, такие как O-гликаны муцинового типа (коровые 3 O-гликаны) (Lee and Fukuda, Methods Enzymol. 2010; 479: 143-54; Suzuki-Anekoji et al., J. Biol. Chem. 2011 Sep. 16; 286(37): 32824-33; Bao and Fukuda, Methods Enzymol. 2010; 479: 387-96). (8) Кроме того, существует множество других процессов, нарушенных в опухолях (метаболизм, апоптоз, миграция, дифференцировка и тому подобные), каждый из которых приводит к понижающей регуляции поверхностных антигенов, любой из них можно использовать в качестве потенциальных антигенов-мишеней iCAR.
В общем, изобретение относится к персональному способу, который может быть применен к каждому пациенту. Как описано в настоящей публикации, антиген iCAR может быть выбран в ходе алгоритмического процесса, после которого лечащий врач может предложить специфичный рецептор, подходящий для опухоли пациента. Затем такой рецептор вводят совместно со стимулирующим рецептором (т.е. TCR или CAR или сигналы GVL), чтобы обеспечить защиту выбранной ткани.
Важно отметить, что iCAR могут связывать тот же самый антиген, что и активирующий CAR. Например, может быть ситуация, когда не найдены антигены, которые имеют двоякую экспрессию в опухолевой и в нормальной ткани (т.е., полностью отсутствуют в одной и присутствуют в другой). Тем не менее, если антиген на опухоли экспрессируется на уровне, намного превышающем уровень в нормальной ткани, то мишенью и стимулирующего CAR и рецептора iCAR может быть один и тот же антиген. В случае опухоли, так как имеется большое количество антигена, стимулирующий CAR, может доминировать и вызывать элиминацию опухоли. В случае нормальной ткани, так как уровень экспрессии антигена является низким, iCAR может обеспечивать адекватное ингибирование. Это действительно так, поскольку уровни обоих/или одного антигена-мишени и уровни стимулирующего и iCAR могут влиять на конечный ответ иммунореактивной клетки (фигура 23). Кроме того, изменение аффинности каждого рецептора можно использовать для модулирования и тонкой настройки ответа.
Расхождение по антигенам между мишенью и тканью вне мишени может быть ограничено, главным образом, различиями в уровне экспрессии, а не абсолютным отсутствием экспрессии. Кроме того, можно ожидать разные уровни экспрессии, если представлено несколько тканей с одним общим антигеном для защиты с использованием iCAR. Одним из таких примеров является экспрессия молекул HLA, которые широко распространены на большинстве типов клеток, но часто с разными уровнями экспрессии. Интересно, что понижающая регуляция молекул HLA представляет собой основной механизм, посредством которого опухоль избегает иммунных ответов T-клеток. В таком сценарии DLI T-клеток, сконструированных с iCAR против молекулы HLA, которая подвергается понижающей регуляции в злокачественном новообразовании, может обеспечивать широкую защиту для множества разнообразных типов тканей от GVHD, при этом сохраняя эффект GVL.
Комбинаторные возможности такого отбора антигенов ограничены только доступными антителами, профилем поверхностных антигенов на опухоли и известными тканеспецифичными антигенами.
АНТИГЕН 4 ЦИТОТОКСИЧЕСКИХ T-ЛИМФОЦИТОВ (CTLA-4)
CTLA-4 является ингибирующим рецептором, экспрессируемым активированными T-клетками, который при контакте с соответствующими лигандами (CD80 и CD86; B7-1 и B7-2, соответственно) опосредует ингибирование или анергию активированных T-клеток. Как в доклинических, так и в клинических исследованиях блокада CTLA-4 в результате системной инфузии антител усиливала эндогенный противоопухолевый ответ, хотя и со значительно непредусмотренной токсичностью в клинических условиях.
CTLA-4 содержит внеклеточный V-домен, трансмембранный домен и цитоплазматический хвост. Были охарактеризованы варианты альтернативного сплайсинга, кодирующие разные изоформы. Связанная с мембраной изоформа функционирует в виде гомодимера, связанного дисульфидной связью, тогда как растворимая изоформа функционирует в виде мономера. Внутриклеточный домен сходен с внутриклеточным доменом CD28 тем, что он не обладает присущей ему каталитической активностью и содержит один мотив YVKM, способный связывать PI3K, PP2A и SHP-2, и один богатый пролином мотив, способный связывать SH3-содержащие белки. Одна из ролей CTLA-4 в ингибировании T-клеточных ответов, по-видимому, осуществляется непосредственно через дефосфорилирование SHP-2 и PP2A белков передачи сигналов, проксимальных по отношению к TCR, таких как CD3 и LAT. CTLA-4 также может влиять на передачу сигнала опосредованно в результате конкуренции с CD28 за связывание CD80/86. Также было показано, что CTLA-4 связывается и/или взаимодействует с PI3K, CD80, AP2M1 и PPP2R5A.
CTLA-4 может иметь аминокислотную последовательность, которая указана в SEQ ID NO: 5.

Согласно настоящему изобретению полипептид CTLA-4 может иметь аминокислотную последовательность, которая, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологична последовательности SEQ ID NO: 5 (гомология согласно изобретению может быть определена с использованием стандартной компьютерной программы, такой как BLAST или FASTA). В не ограничивающих вариантах полипептид CTLA-4 может иметь аминокислотную последовательность, которая является непрерывной частью последовательности SEQ ID NO: 5, которая имеет длину, по меньшей мере, 20 или, по меньшей мере, 30 или, по меньшей мере, 40 или, по меньшей мере, 50 и вплоть до 222 аминокислот. Альтернативно или дополнительно в различных не ограничивающих вариантах полипептид CTLA-4 имеет аминокислотную последовательность, состоящую из аминокислот 1-223, 1-50, 50-100, 100-140, 141-161, 162-182, 183-223, 141-223, 162-223 или 183-223 последовательности SEQ ID NO: 5. В одном варианте полипептид CTLA-4 имеет аминокислотную последовательность, состоящую из аминокислот 183-223 последовательности SEQ ID NO: 5. В некоторых вариантах внутриклеточный домен передачи сигнала iCAR содержит полипептид CTLA-4, имеющий аминокислотную последовательность, состоящую из аминокислот 183-223 последовательности SEQ ID NO: 5. В некоторых вариантах трансмембранный домен iCAR содержит полипептид CTLA-4, имеющий аминокислотную последовательность, состоящую из аминокислот 162-182 последовательности SEQ ID NO: 5.
Согласно настоящему изобретению термин «молекула нуклеиновой кислоты CTLA-4» относится к полинуклеотиду, кодирующему полипептид CTLA-4.
БЕЛОК ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК 1 (PD-1)
PD-1 является негативным иммунным регулятором активированных T-клеток при контакте с его соответствующими лигандами PD-L1 и PD-L2, экспрессируемыми на эндогенных макрофагах и дендритных клетках. PD-1 является мембранным белком типа I, состоящим из 268 аминокислот. PD-1 имеет два лиганда, PD-L1 и PD-L2, которые являются представителями семейства B7. Структура белка включает внеклеточный IgV-домен, за которым следует трансмембранная область и внутриклеточный хвост. Внутриклеточный хвост содержит два сайта фосфорилирования, локализованных в основанном на тирозине ингибирующем мотиве иммунорецептора и основанном на тирозине мотиве переключения иммунорецептора, и такой PD-1 негативно регулирует сигналы TCR. Фосфатазы SHP-I и SHP-2 связываются с цитоплазматическим хвостом PD-1 при связывании лиганда. Повышающая регуляция PD-L1 является одним из механизмов, посредством которого опухолевые клетки могут ускользать от иммунной системы хозяина. В доклинических и клинических испытаниях блокада PD-1 антагонистическими антителами индуцировала противоопухолевые ответы, опосредованные эндогенной иммунной системой хозяина.
PD-1 может иметь аминокислотную последовательность, которая указана в SEQ ID NO: 6.

Согласно настоящему изобретению полипептид PD-1 может иметь аминокислотную последовательность, которая, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологична последовательности SEQ ID NO: 6. В не ограничивающих вариантах полипептид PD-1 может иметь аминокислотную последовательность, которая является непрерывной частью последовательности SEQ ID NO: 6, которая имеет длину, по меньшей мере, 20 или, по меньшей мере, 30 или, по меньшей мере, 40 или, по меньшей мере, 50 и вплоть до 287 аминокислот. Альтернативно или дополнительно в различных не ограничивающих вариантах полипептид PD-1 имеет аминокислотную последовательность, состоящую из аминокислот 1-288, 1-50, 50-100, 100-144, 145-170, 171-191, 192-288, 145-288, 171-288 или 192-288 последовательности SEQ ID NO: 6. В одном варианте полипептид PD-1 имеет аминокислотную последовательность, состоящую из аминокислот 192-288 последовательности SEQ ID NO: 6. В некоторых вариантах внутриклеточный домен передачи сигнала iCAR включает полипептид PD-1, имеющий аминокислотную последовательность, состоящую из аминокислот 192-288 последовательности SEQ ID NO: 6. В некоторых вариантах трансмембранный домен iCAR включает полипептид PD-1, имеющий аминокислотную последовательность, состоящую из аминокислот 171-191 последовательности SEQ ID NO: 6.
Согласно настоящему изобретению термин «молекула нуклеиновой кислоты PD-1» относится к полинуклеотиду, кодирующему полипептид PD-1.
ГЕН АКТИВАЦИИ ЛИМФОЦИТОВ 3 (LAG-3)
Белок активации лимфоцитов 3 (LAG-3) является негативным иммунным регулятором иммунных клеток. LAG-3 относится к надсемейству иммуноглобулинов (Ig) и содержит 4 внеклеточных Ig-подобных домена. Ген LAG3 содержит 8 экзонов. Все данные о последовательности организации экзонов/интронов и хромосомной локализации указывают на близкое родство LAG3 с CD4. LAG3 также был назван CD223 (кластер дифференцировки 223).
LAG-3 может иметь аминокислотную последовательность, которая указана в SEQ ID NO: 7.

Согласно настоящему изобретению полипептид LAG-3 может иметь аминокислотную последовательность, которая, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологична последовательности SEQ ID NO: 7. В не ограничивающих вариантах полипептид LAG-3 может иметь аминокислотную последовательность, которая является непрерывной частью последовательности SEQ ID NO: 7, которая имеет длину, по меньшей мере, 20 или, по меньшей мере, 30 или, по меньшей мере, 40 или, по меньшей мере, 50 и вплоть до 524 аминокислот. Альтернативно или дополнительно в различных не ограничивающих вариантах полипептид LAG-3 имеет аминокислотную последовательность, состоящую из аминокислот 1-525, 1-50, 50-100, 100-150, 150-200, 200-250, 250-300, 300-350, 350-400, 400-420, 421-450, 451-471, 472-525, 421-525, 451-525 или 472-525 последовательности SEQ ID NO: 7. В одном варианте полипептид LAG-3 имеет аминокислотную последовательность, состоящую из аминокислот 472-525 последовательности SEQ ID NO: 7. В некоторых вариантах внутриклеточный домен передачи сигнала iCAR включает полипептид LAG-3, имеющий аминокислотную последовательность, состоящую из аминокислот 472-525 последовательности SEQ ID NO: 7. В некоторых вариантах трансмембранный домен iCAR включает полипептид LAG-3, имеющий аминокислотную последовательность, состоящую из аминокислот 451-471 последовательности SEQ ID NO: 7.
Согласно настоящему изобретению термин «молекула нуклеиновой кислоты LAG-3» относится к полинуклеотиду, кодирующему полипептид LAG-3.
РЕЦЕПТОР КЛЕТОК ПРИРОДНЫХ КИЛЛЕРОВ 2B4 (2B4)
Рецептор клеток природных киллеров 2B4 (2B4) опосредует не ограниченную MHC клеточную гибель в клетках NK и подгруппах T-клеток. До настоящего времени функция 2B4 все еще исследуется, при этом полагают, что изоформа 2B4-S является активирующим рецептором, а изоформа 2B4-L, как полагают, является негативным иммунорегулятором иммунных клеток. 2B4 становится занятым при связывании своего высоко аффинного лиганда, CD48. 2B4 содержит основанный на тирозине мотив переключения, молекулярный переключатель, который обеспечивает возможность для ассоциации белка с различными фосфатазами. 2B4 также был назван CD244 (кластер дифференцировки 244).
2B4 может иметь аминокислотную последовательность, которая указана в SEQ ID NO:8.

Согласно настоящему изобретению полипептид 2B4 может иметь аминокислотную последовательность, которая, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологичны последовательности SEQ ID NO: 8. В не ограничивающих вариантах полипептид 2B4 может иметь аминокислотную последовательность, которая является непрерывной частью последовательности SEQ ID NO: 8, которая имеет длину, по меньшей мере, 20 или, по меньшей мере, 30 или, по меньшей мере, 40 или, по меньшей мере, 50 и вплоть до 369 аминокислот. Альтернативно или дополнительно в различных не ограничивающих вариантах полипептид 2B4 имеет аминокислотную последовательность, состоящую из аминокислот 1-370, 1-50, 50-100, 100-150, 150-215, 216-229, 230-250, 251-370, 216-370, 230-370 или 251-370 последовательности SEQ ID NO: 8. В одном варианте полипептид 2B4 имеет аминокислотную последовательность, состоящую из аминокислот 251-370 последовательности SEQ ID NO: 8. В некоторых вариантах внутриклеточный домен передачи сигнала iCAR включает полипептид 2B4, имеющий аминокислотную последовательность, состоящую из аминокислот 251-370 последовательности SEQ ID NO: 8. В некоторых вариантах трансмембранный домен iCAR включает полипептид 2B4, имеющий аминокислотную последовательность, состоящую из аминокислот 230-250 последовательности SEQ ID NO: 8.
Согласно настоящему изобретению термин «молекула нуклеиновой кислоты 2B4» относится к полинуклеотиду, кодирующему полипептид 2B4.
B- И T-ЛИМФОЦИТАРНЫЙ АТТЕНЮАТОР (BTLA)
Экспрессия B- и T-лимфоцитарного аттенюатора (BTLA) индуцируется во время активации T-клеток, и BTLA продолжает экспрессироваться на Th1-клетках, но не на Th2-клетках. Подобно PD1 и CTLA4, BTLA взаимодействует с гомологом B7, B7H4. Однако в отличие от PD-1 и CTLA-4, BTLA приводит к ингибированию T-клеток в результате взаимодействия с рецепторами из семейства фактором некроза опухолей (TNF-R), не только с семейством B7 рецепторов клеточной поверхности. BTLA является лигандом представителя 14 (TNFRSF14) надсемейства (рецепторов) факторов некроза опухолей, также известного как медиатор проникновения вируса герпеса (HVEM). Комплексы BTLA-HVEM негативно регулируют T-клеточные иммунные ответы. Было показано, что активация BTLA ингибирует функцию специфичных для злокачественной опухоли T-клеток CD8+ человека. BTLA также был назван CD272 (кластер дифференцировки 272).
BTLA может иметь аминокислотную последовательность, указанную в SEQ ID NO: 9.

Согласно настоящему изобретению полипептид BTLA может иметь аминокислотную последовательность, которая, по меньшей мере, на 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% гомологична последовательности SEQ ID NO: 9. В не ограничивающих вариантах полипептид BTLA может иметь аминокислотную последовательность, которая является непрерывной частью последовательности SEQ ID NO: 9, которая имеет длину, по меньшей мере, 20 или, по меньшей мере, 30 или, по меньшей мере, 40 или, по меньшей мере, 50 и вплоть до 288 аминокислот. Альтернативно или дополнительно в различных не ограничивающих вариантах полипептид BTLA имеет аминокислотную последовательность, состоящую из аминокислот 1-289, 1-50, 50-100, 100-134, 135-157, 158-178, 179-289, 135-289, 158-289 или 179-289 последовательности SEQ ID NO: 9. В одном варианте полипептид BTLA имеет аминокислотную последовательность, состоящую из аминокислот 179-289 последовательности SEQ ID NO: 9. В некоторых вариантах внутриклеточный домен передачи сигнала iCAR включает полипептид BTLA, имеющий аминокислотную последовательность, состоящую из аминокислот 179-289 последовательности SEQ ID NO: 9. В некоторых вариантах трансмембранный домен iCAR включает полипептид BTLA, имеющий аминокислотную последовательность, состоящую из аминокислот 158-178 последовательности SEQ ID NO:9.
Согласно настоящему изобретению термин «молекула нуклеиновой кислоты BTLA» относится к полинуклеотиду, кодирующему полипептид BTLA.
ЛИНИИ ГЕМАТОПОЭТИЧЕСКИХ КЛЕТОК
Гематопоэтические клетки (клетки крови) млекопитающих имеют разнообразный диапазон физиологических активностей. Гематопоэтические клетки делят на лимфоидные, миелоидные и эритроидные линии. Лимфоидная линия, содержащая B-клетки, T-клетки и клетки природные киллеры (NK), обеспечивает продукцию антител, регуляцию клеточной иммунной системы, выявление чужеродных агентом в крови, выявление клеток, чужеродных для организма хозяина и тому подобное. Термин «T-клетки» в используемом в настоящем описании смысле относится к лимфоцитам, которые созревают в тимусе и главным образом ответственны за опосредованный клетками иммунитет. T-клетки вовлечены в адаптивную иммунную систему. Термин «клетки природные киллеры (NK)» в используемом в настоящем описании смысле относится к лимфоцитам, которые являются частью опосредованного клетками иммунитета и действуют во время врожденного иммунного ответа. Они не требуют предварительной активации для осуществления своего цитотоксического действия на клетки-мишени. Цитотоксические T-клетки (CTL или T-клетки-киллеры) представляют собой подгруппу T-лимфоцитов, способных индуцировать гибель инфицированных соматических или опухолевых клеток.
КЛЕТКИ ДЛЯ ПРИМЕНЕНИЯ В СПОСОБАХ СОГЛАСНО ИЗОБРЕТЕНИЮ
Настоящее изобретение относится к клеткам, экспрессирующим сочетание антигенраспознающего рецептора, который активирует иммунореактивную клетку (например, TCR, CAR), и ингибирующего химерного рецептора антигена (iCAR), и к способам применения таких клеток для лечения заболевания, при котором требуется усиленный иммунный ответ. В одном способе специфичные для опухолевого антигена T-клетки (все подгруппы, включая CD4, CD8, клетки памяти, наивные, эффекторные, T-рег. и т.д.), клетки врожденной иммунной системы, NK-клетки, CTL-клетки или другие иммунореактивные клетки используют для экспрессии iCAR, который связывает антиген на неопухолевой ткани, для лечения или профилактики неоплазии. Например, T-клетку, экспрессирующую химерный рецептор антигена 19-28z, который распознает CD19 и коэкспрессируется в T-клетке, которая экспрессирует iCAR, который связывает CD33. Такие клетки вводят человеку, нуждающемуся в таком введении, для лечения или профилактики рака крови (например, лейкозов, лимфом и миелом). В другом способе могут быть использованы специфичные для вирусного антигена T-клетки, NK-клетки, CTL-клетки для лечения вирусных болезней. Клетки могут экспрессировать рекомбинантный или эндогенный рецептор антигена, который может представлять собой 19-28z, который специфичен по отношению к CD19, P28z, который специфичен по отношению к PSMA, M28z, который специфичен по отношению к мезотелину, или 56-28z, который специфичен по отношению к CD56.
Собственные T-клетки пациента могут быть генетически модифицированы, чтобы нацелить их на опухоли, посредством введения генов, кодирующих искусственные T-клеточные рецепторы, называемые химерными рецепторами антигенов (CAR). CAR включают CAR, которые активируют иммунный ответ, и iCAR, которые подавляют иммунный ответ.
Специфичные для опухолевых антигенов T-лимфоциты (и NK-клетки)
Типы специфичных для опухолевых антигенов лимфоцитов человека, которые можно применять в способах согласно изобретению, включают без ограничения периферические лимфоциты донора, генетически модифицированные так, чтобы они экспрессировали химерные рецепторы антигенов (CAR) (Sadelain, M., et al. 2003 Nat. Rev. Cancer 3: 35-45), периферические лимфоциты донор, генетически модифицированные так, чтобы они экспрессировали полноразмерный распознающий опухолевый антиген T-клеточный рецепторный комплекс, содержащий гетеродимер (Morgan, R.A., et al. 2006 Science 314: 126-129), культуры лимфоцитов, полученные из инфильтрующих опухоль лимфоцитов (TIL) при биопсии опухолей (Panelli, M.C., et al. 2000 J. Immunol. 164: 495-504; Panelli, M.C., et al. 2000 J. Immunol. 164: 4382-4392) и избирательно размножаемые in vitro антигенспецифичные лейкоциты периферической крови с использованием искусственных антигенпрезентирующих клеток (AAPC) или подвергнутые импульсному воздействию дендритные клетки (Dupont, J., et al. 2005 Cancer Res. 65: 5417-5427; Papanicolaou, G.A., et al. 2003 Blood 102: 2498-2505). T-клетки могут быть аутологичными, неаутологичными (например, аллогенными) или полученными in vitro из сконструированных клеток-предшественников или стволовых клеток. T-клетки могут быть получены в большом объеме, как обычно получают с использованием лимфоцитов периферической крови (PBL) или инфильтрующих опухоль лимфоцитов (TILs), T-клетки могут быть очищены с использованием, например, CD4, CD8, CD62L.
Любой подходящий опухолевый антиген (антигенный пептид) подходит для применения в вариантах, связанных с опухолями, описанных в настоящей публикации. Источники активирующих иммунный ответ антигенов включают без ограничения белки злокачественных опухолей. Антиген может экспрессироваться в виде пептида или в виде интактного белка или его части. Интактный белок или его часть могут быть нативными или подвергнутыми мутагенезу. Подходящие активирующие иммунный ответ антигены включают специфичный для простаты мембранный антиген (PSMA) и антиген стволовых клеток простаты (PCSA).
Специфичные для вирусных антигенов T-лимфоциты (и NK-клетки)
Подходящие антигены для применения при лечении инфекции патогеном или другой инфекционной болезни, например, у субъекта с иммунодефицитом, включают без ограничения вирусные антигены, имеющиеся у цитомегаловируса (CMV), вируса Эпштейн-Барр (EBV), вируса иммунодефицита человека (ВИЧ) и вируса гриппа.
Неочищенным источником CTL может быть любой известный в данной области источник, такой как костный мозг, источник гематопоэтических клеток в организме плода, новорожденный или взрослого организма или другой источник гематопоэтических клеток, например, печень плода, периферическая кровь или пуповинная кровь. Можно применять различные способы для разделения клеток. Например, сначала можно извлечь не-CTL способами негативной селекции. мАт особенно применимы для идентификации маркеров, ассоциированных с конкретными клеточными линиями и/или стадиями дифференцировки в случае как позитивной, так и негативной селекции.
Большая часть терминально дифференцированных клеток может быть сначала удалена посредством относительно грубого разделения. Например, можно применять разделение с использованием магнитных шариков, чтобы удалить большое количество нерелевантных клеток. Предпочтительно, по меньшей мере, примерно 80%, обычно, по меньшей мере, 70% от общего количества гематопоэтических клеток может быть извлечено перед выделением клеток.
Способы разделения включают без ограничения центрифугирование в градиенте плотности; розеткообразование; связывание с частицами, которые модифицируют плотность клеток; магнитное разделение с использованием покрытых антителами магнитных шариков; аффинную хроматографию; цитотоксические средства, связанные или используемые вместе с мАт, включая без ограничения комплемент и цитотоксины; и пэннинг с использованием антитела, связанного с твердым матриксом, например, планшетом, чипом, элютриацию или любую другую обычную методику.
Способы разделения и анализа включают без ограничения проточную цитометрию, которая может иметь разные степени сложности, например, множество цветовых каналов, каналы регистрации малоуглового и большеуглового светорассеяния, каналы сопротивления.
Клетки могут быть отобраны от мертвых клеток с использованием красителей, которые связываются с мертвыми клетками, такими как йодид пропидия (PI). Предпочтительно клетки собирают в среде, содержащей 2% фетальной сыворотки теленка (FCS) или 0,2% бычьего сывороточного альбумина (БСА) или любой другой подходящей, предпочтительно стерильной изотоничной среде.
Соответственно, изобретение, в общем, относится к иммунореактивной клетке, такой как специфичная для вируса или специфичная для опухоли T-клетка, содержащая рецептор, который связывает первый антиген и активирует иммунореактивную клетку, рецептор, который связывает второй антиген и ингибирует иммунореактивную клетку.
ВЕКТОРЫ
Генетическая модификация иммунореактивных клеток (например, T-клеток, CTL-клеток, NK-клеток) может быть осуществлена посредством трансдукции по существу гомогенного состава клеток рекомбинантной конструкцией ДНК или РНК. Предпочтительно используют ретровирусный вектор (либо гамма-ретровирусный, либо лентивирусный) для введения конструкции ДНК или РНК в геном клетки-хозяина. Например, полинуклеотид, кодирующий рецептор, который связывает антиген (например, опухолевый антиген или его вариант или фрагмент), может быть клонирован в ретровирусном векторе, и экспрессия может управляться его эндогенным промотором ретровирусного длинного концевого повтора или альтернативным внутренним промотором. Также могут быть использованы невирусные векторы или РНК. Можно использовать случайную хромосомную интеграцию или целенаправленную интеграцию (например, с использованием нуклеазы, эффекторных нуклеаз подобных активатору транскрипции (TALEN), нуклеаз с цинковыми пальцами (ZFN) и/или расположенные регулярными кластерами короткие палиндромные повторы (CRISPR) или экспрессию трансгенов (например, с использованием природной или химически модифицированной РНК).
Для начальной генетической модификации клеток с целью получения специфичных для опухолевых или вирусных антигенов клеток обычно для трансдукции используют ретровирусный вектор, однако можно использовать любой другой подходящий вирусный вектор или невирусную систему доставки. Для последующей генетической модификации клеток с целью получения клеток, содержащих антигенпрезентирующий комплекс, содержащий, по меньшей мере, два костимулирующих лиганда, также оказывается эффективным ретровирусный перенос генов (трансдукция). Также подходящими являются сочетания ретровирусного вектора и соответствующей пакующей линии, при этом капсидные белки могут быть функциональными в отношении инфицирования клеток человека. Известны различные амфотропные продуцирующие вирусы клеточные линии, включая без ограничения PA12 (Miller, et al. (1985) Mol. Cell. Biol. 5: 431-437); PA317 (Miller, et al. (1986) Mol. Cell. Biol. 6: 2895-2902); и CRIP (Danos, et al. (1988) Proc. Natl. Acad. Sci. USA 85: 6460-6464). Также подходящими являются неамфотропные частицы, например, частицы, псевдотипированные белками оболочки VSVG, RD114 или GALV и любыми другими известными в данной области.
Возможные способы трансдукции также включают прямое совместное культивирование клеток с клетками-продуцентами, например, способом, описанным Bregni с соавторами ((1992) Blood 80: 1418-1422), или культивирование с вирусным надосадком отдельно или концентрированными исходными растворами векторов в присутствии или в отсутствие подходящих факторов роста и поликатионов, например, способом, описанным Xu с соавторами ((1994) Exp. Hemat. 22: 223-230) и Hughes с соавторами ((1992) J. Clin. Invest. 89: 1817).
Трансдукцию вирусных векторов можно использовать для экспрессии костимулирующего лиганда в иммунореактивной клетке. Предпочтительно выбранный вектор имеет высокую эффективность инфекции и стабильную интеграцию и экспрессию (смотри, например, Cayouette et al., Human Gene Therapy 8: 423-430, 1997; Kido et al., Current Eye Research 15: 833-844, 1996; Bloomer et al., Journal of Virology 71: 6641-6649, 1997; Naldini et al., Science 272: 263 267, 1996; и Miyoshi et al., Proc. Natl. Acad. Sci. U.S.A. 94: 10319, 1997). Другие вирусные векторы, которые можно использовать, включают, например, аденовирусные, лентивирусные векторы и векторы на основе аденоассоциированных вирусов, вирус вакцинии, вирус папилломы крупного рогатого скота или вирус герпеса, такой как вирус Эпштейн-Барр (также смотри, например, векторы, описанные в публикациях Miller, Human Gene Therapy 15-14, 1990; Friedman, Science 244: 1275-1281, 1989; Eglitis et al., BioTechniques 6: 608-614, 1988; Tolstoshev et al., Current Opinion in Biotechnology 1: 55-61, 1990; Sharp, The Lancet 337: 1277-1278, 1991; Cornetta et al., Nucleic Acid Research and Molecular Biology 36: 311-322, 1987; Anderson, Science 226: 401-409, 1984; Moen, Blood Cells 17: 407-416, 1991; Miller et al., Biotechnology 7: 980-990, 1989; Le Gal La Salle et al., Science 259: 988-990, 1993; и Johnson, Chest 107: 77S-83S, 1995). Ретровирусные векторы особенно хорошо разработаны и были использованы в клинических условиях (Rosenberg et al., N. Engl. J. Med 323: 370, 1990; Anderson et al., U.S. Pat. No. 5399346).
Также можно использовать невирусные способы для экспрессии белка в клетке. Например, молекула нуклеиновой кислоты может быть внедрена в клетку посредством введения нуклеиновой кислоты в присутствии липофектина (Feigner et al., Proc. Natl. Acad. Sci. U.S.A. 84: 7413, 1987; Ono et al., Neuroscience Letters 17: 259, 1990; Brigham et al., Am. J. Med. Sci. 298: 278, 1989; Staubinger et al., Methods in Enzymology 101: 512, 1983), с использованием конъюгации асиалоорозомукоид-полилизин (Wu et al., Journal of Biological Chemistry 263: 14621, 1988; Wu et al., Journal of Biological Chemistry 264: 16985, 1989), или посредством микроинъекции в условиях операции (Wolff et al., Science 247: 1465, 1990). Другие невирусные способы переноса генов включают трансфекцию in vitro с использованием фосфата кальция, DEAE-декстрана, электропорации и слияние протопластов. Липосомы также могут быть полезными для доставки ДНК в клетку. Трансплантация нормальных генов в пораженные ткани субъекта также может быть осуществлена посредством переноса нормальной нуклеиновой кислоты в клетки культивируемого ex vivo типа (например, в аутологичную или гетерологичную первичную клетку или ее потомство), после чего клетку (или ее потомство) инъецируют в ткань-мишень или инъецируют системно. Рекомбинантные рецепторы также могут быть произведены или получены с использованием транспозаз или целевых нуклеаз (например, нуклеаз с цинковыми пальцами, мегануклеаз или TALE-нуклеаз). Временная экспрессия может быть получена в результате электропорации РНК.
Экспрессия кДНК для применения в способах терапии полинуклеотидами, может управляться с любого подходящего промотора (например, промоторов цитомегаловирусов человека (CMV), вируса обезьян 40 (SV40) или металлотионеиона) и регулироваться любым подходящим регуляторным элементом или интроном млекопитающих (например, структурой энхансер/промотор/интрон фактора элонгации 1α). Например, в случае необходимости можно использовать энхансеры, которые, как известно, предпочтительно управляют экспрессией генов в конкретных типах клеток, управляя экспрессией нуклеиновой кислоты. Используемые энхансеры могут включать без ограничения энхансеры, которые характеризуются как тканеспецифичные или специфичные для клеток энхансеры. Альтернативно, если в качестве терапевтической конструкции используют геномный клон, регуляция может быть опосредована родственными регуляторными последовательностями или, при необходимости, регуляторными последовательностями, полученными из гетерологичного источника, включая любой из промоторов или регуляторных элементов, описанных выше.
Полученные в результате клетки могут быть выращены в условиях, сходных с условиями для немодифицированных клеток, при этом модифицированные клетки могут быть размножены и использованы для различных целей.
ПОЛИПЕПТИДЫ И АНАЛОГИ
Также в изобретение включены полипептиды αCD19, αPSMA, CD28, CD3ζ, CTLA-4, PD-1 и 19-28z или их фрагменты, которые модифицируют таким образом, чтобы усилить их антинеопластическую активность (например, гуманизированное моноклональное антитело) или ингибировать их цитотоксическую активность (например, iCAR) при экспрессии в иммунореактивной клетке. Изобретение относится к способам оптимизации аминокислотной последовательности или последовательности нуклеиновой кислоты за счет создания изменения в последовательности. Такие изменения могут включать некоторые мутации, делеции, инсерции или посттрансляционные модификации. Изобретение, кроме того, относится к аналогам любого встречающегося в природе полипептида согласно изобретению. Аналоги могут отличаться от встречающегося в природе полипептида согласно изобретению различиями в аминокислотных последовательностях, посттрансляционными модификациями или и тем и другим. Аналоги согласно изобретению, в общем, могут иметь, по меньшей мере, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большую идентичность со всей или частью встречающейся в природе аминокислотной последовательностью согласно изобретению. Длина сравниваемой последовательности составляет, по меньшей мере, 5, 10, 15 или 20 аминокислотных остатков, предпочтительно, по меньшей мере, 25, 50 или 75 аминокислотных остатков и более предпочтительно более 100 аминокислотных остатков. И в иллюстративном способе определения степени идентичности можно использовать программу BLAST с оценкой вероятности от e-3 до e-100, свидетельствующей о близкородственной последовательности. Модификации включают химическую дериватизацию полипептидов in vivo и in vitro, например, ацетилирование, карбоксилирование, фосфорилирование или гликозилирование; такие модификации могут происходить во время синтеза или процессинга полипептида или после обработки изолированным модифицирующими ферментами. Аналоги также могут отличаться от встречающихся в природе полипептидов согласно изобретению изменениями в первичной последовательности. Такие изменения включают генетические варианты, как природные, так и индуцированные (например, в результате случайного мутагенеза под действием излучения или воздействия этанметилсульфоната или в результате сайт-специфичного мутагенеза, как описано в публикации Sambrook, Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual (2d ed.), CSH Press, 1989, или Ausubel et al., выше). Также включены циклизованные пептиды, молекулы и аналоги, которые содержат остатки, отличные от L-аминокислот, например, D-аминокислоты или не встречающиеся в природе или синтетические аминокислоты, например, бета- или гамма-аминокислоты.
Кроме полноразмерных полипептидов изобретение также относится к фрагментам любого из полипептидов или пептидным доменам согласно изобретению. В используемом в настоящем описании смысле термин «фрагмент» означает, по меньшей мере, 5, 10, 13 или 15 аминокислот. В других вариантах фрагмент представляет собой, по меньшей мере, 20 следующих друг за другом аминокислот, по меньшей мере, 30 следующих друг за другом аминокислот или, по меньшей мере, 50 следующих друг за другом аминокислот, и в других вариантах, по меньшей мере, 60-80, 100, 200, 300 или больше следующих друг за другом аминокислот. Фрагменты согласно изобретению могут быть получены способами, известными специалистам в данной области, или могут быть образованы в результате нормального процессинга белка (например, удаления аминокислот из образующегося полипептида, которые не требуются для биологической активности, или удаления аминокислот в результате событий альтернативного сплайсинга мРНК или альтернативного процессинга белка).
Небелковые аналоги имеют химическую структуру, предназначенную для имитации функциональной активности белка согласно изобретению. Такие аналоги вводят способами согласно изобретению. Такие аналоги могут обладать более высокой физиологической активностью, чем исходный полипептид. Способы конструирования аналогов хорошо известны в данной области, и синтез аналогов может быть осуществлен согласно таким способам посредством модификации химических структур таким образом, чтобы полученные в результате аналоги обладали более высокой антинеопластической активностью, чем исходный полипептид, при экспрессии в иммунореактивной клетке. Такие химические модификации включают без ограничения замещающие альтернативные R-группы и различные степени насыщения у конкретных атомов углерода по сравнению с эталонным полипептидом. Предпочтительно аналоги белков относительно резистентны к разрушению in vivo, что приводит к более длительному терапевтическому действию при введении. Анализы для измерения функциональной активности включают без ограничения анализы, описанные в примерах ниже.
КОСТИМУЛИРУЮЩИЕ ЛИГАНДЫ
Взаимодействие, по меньшей мере, с одним костимулирующим лигандом дает неспецифичный для антигена сигнал, важный для полной активации иммунной клетки (например, T-клетки). Костимулирующие лиганды включают без ограничения лиганды фактора некроза опухолей (TNF), цитокины (такие как IL-2, IL-12, IL-15 или IL21) и лиганды надсемейства иммуноглобулинов (Ig). Фактор некроза опухолей (TNF) является цитокином, вовлеченным в системное воспаление, и стимулирует реакцию острой фазы. Его основанная роль заключается в регуляции иммунных клеток. Лиганды фактора некроза опухолей (TNF) имеют ряд общих признаков. Большинство лигандов синтезируются в виде трансмембранных белков типа II (внеклеточный C-конец), содержащих короткий цитоплазматический участок и относительно длинную внеклеточную область. Лиганды TNF включают без ограничения фактор роста нервов (NGF), CD40L (CD40L)/CD154, CDI137L/4-1BBL, фактор некроза опухолей альфа (TNFα), CD134L/OX40L/CD252, CD27L/CD70, лиганд Fas (FasL), CD30L/CD153, фактор некроза опухолей бета (TNFβ)/лимфотоксин-альфа (LTα), лимфотоксин-бета (LTβ), CD257/активирующий B-клетки фактор (BAFF)/Biys/THANK/Tall-1, лиганд индуцируемого глюкокортикоидами рецептора TNF (GITRL) и TNF-родственный индуцирующий апоптоз лиганд (TRAIL), LIGHT (TNFSF14). Надсемейство иммуноглобулинов (Ig) представляет собой большую группу белков клеточной поверхности и растворимых белков, которые вовлечены в процессы распознавания, связывания или адгезии клеток. Такие белки имеют общие с иммуноглобулинами структурные признаки - они имеют иммуноглобулиновый домен (складчатый). Лиганды надсемейства иммуноглобулинов включают без ограничения, CD80, CD86 и ICOS, оба лиганда для CD28.
ВВЕДЕНИЕ
Композиции, содержащие генетически модифицированные иммунореактивные клетки согласно изобретению (например, T-клетки, клетки врожденной иммунной системы, NK-клетки, CTL-клетки или их предшественники), могут быть получены субъектом системно или непосредственно для лечения неоплазии, инфекции патогеном или инфекционной болезни. В одном варианте клетки согласно изобретению непосредственно инъецируют в представляющий интерес орган (например, орган, пораженный неоплазией). Альтернативно композиции, содержащие генетически модифицированные иммунореактивные клетки, доставляют в представляющий интерес орган опосредованно, например, в результате введения в систему кровообращения (например, в сосуды опухоли). Могут быть доставлены средства для размножения и дифференцировки до, во время или после введения клеток, чтобы повысить продукцию T-клеток, клеток врожденной иммунной системы, NK-клеток или CTL-клеток in vitro или in vivo.
Модифицированные клетки могут быть введены в любом физиологическом приемлемом наполнителе, обычно внутрисосудисто, хотя их также можно вводить в кость или другое подходящее место, в котором клетки могут найти подходящее место для регенерации и дифференцировки (например, тимус). Обычно может быть введено, по меньшей мере, 1×105 клеток, впоследствии достигающих 1×l010 или больше. Генетически модифицированные иммунореактивные клетки согласно изобретению могут содержать очищенную популяцию клеток. Специалисты в данной области легко могут определить процентное содержание генетически модифицированных иммунореактивных клеток в популяции, используя различные хорошо известные способы, такие как активируемая флуоресценцией сортировка клеток (FACS). Предпочтительные диапазоны чистоты популяций, содержащих генетически модифицированные иммунореактивные клетки, составляет примерно от 50 до примерно 55%, примерно от 55 до примерно 60% и примерно от 65 до примерно 70%. Более предпочтительно чистота составляет примерно от 70 до примерно 75%, примерно от 75 до примерно 80%, примерно от 80 до примерно 85%; и еще более предпочтительно чистота составляет примерно от 85 до примерно 90%, примерно от 90 до примерно 95% и примерно от 95 до примерно 100%. Дозы легко могут быть скорректированы специалистами в данной области (например, уменьшение чистоты может требовать повышения дозы). Клетки могут быть введены путем инъекции, с использованием катетера или тому подобного. При необходимости также могут быть добавлены факторы, включая без ограничения интерлейкины, например, IL-2, IL-3, IL 6, IL-11, IL7, IL12, IL15, IL21, а также другие интерлейкины, колониестимулирующие факторы, такие как G-, M- и GM-CSF, интерфероны, например, гамма-интерферон и эритропоэтин.
Композиции согласно изобретению включают фармацевтические композиции, содержащие генетически модифицированные иммунореактивные клетки или их предшественники и фармацевтически приемлемый носитель. Введение может быть аутологичным или гетерологичным. Например, иммунореактивные клетки или предшественники могут быть получены от одного субъекта и введены тому же субъекту или другому совместимому субъекту. Полученные из периферической крови иммунореактивные клетки согласно изобретению или их потомки (например, полученные in vivo, ex vivo или in vitro) могут быть введены посредством локализованной инъекции, включая введение через катетер, системной инъекции, локализованной инъекции, внутривенной инъекции или с использованием парентерального введения. Для введения терапевтическая композиция согласно настоящему изобретению (например, фармацевтическая композиция, содержащая генетически модифицированную иммунореактивную клетку), обычно может быть приготовлена в стандартной инъекционной форме (в виде раствора, суспензии, эмульсии).
ПРЕПАРАТЫ
Композиции согласно изобретению, содержащие генетически модифицированные иммунореактивные клетки обычно могут быть приготовлены в виде стерильных жидких препаратов, например, изотоничных водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые могут быть забуферены до достижения выбранного pH. Жидкие препараты обычно легче приготовить, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции немного более удобны для введения, особенно путем инъекции. С другой стороны, вязкие композиции могут быть приготовлены в соответствующем диапазоне вязкости, чтобы обеспечить более длительные периоды контакта с конкретными тканями. Жидкие и вязкие композиции могут содержать носители, которые могут представлять собой растворитель или дисперсионную среду, содержащую воду, раствор соли, фосфатно-солевой буфер, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобное) и их соответствующие смеси.
Стерильные инъекционные растворы могут быть приготовлены введение генетически модифицированных иммунореактивных клеток, используемых при практическом осуществлении настоящего изобретения, в требуемом количестве подходящего растворителя, при необходимости с разными количествами других ингредиентов. Такие композиции могут быть в смеси с подходящим носителем, разбавителем или эксципиентом, таким как стерильная вода, физиологический раствор соли, глюкоза, декстроза или тому подобное. Композиции также могут быть лиофилизированными. Композиции могут содержать вспомогательные вещества, такие как увлажнители, диспергирующие или эмульгирующие средства (например, метилцеллюлоза), средства для pH-буферов, желатинизирующие или повышающие вязкость добавки, консерванты, корригенты, красители и тому подобное, в зависимости от пути введения и требуемого препарата. В стандартных публикациях, таких как «REMINGTON'S PHARMACEUTICAL SCIENCE», 17th edition, 1985, включенная в настоящее описание путем ссылки, можно найти рекомендации по приготовлению подходящих препаратов без излишнего экспериментирования.
Могут быть добавлены различные добавки, которые повышают стабильность и стерильность композиций, включая противомикробные консерванты, антиоксиданты, хелатирующие средства и буферы. Предотвращение действия микроорганизмов могут обеспечить различные антибактериальные и противогрибковые средства, например, парабены, хлорбутанол, фенол, сорбиновая кислота и тому подобное. Длительное всасывание инъекционной фармацевтической формы может быть осуществлено благодаря использованию средств, замедляющих всасывание, например, моностеарата алюминия и желатина. Однако согласно настоящему изобретению любой используемый наполнитель, разбавитель или добавка должны быть совместимыми с генетически модифицированными иммунореактивными клетками или их предшественниками.
Композиции могут быть изотоничными, т.е., они могут иметь такое же осмотическое давление, что и кровь и слезная жидкость. Требуемая изотоничность композиций согласно настоящему изобретению может быть достигнута с использованием хлорида натрия или других фармацевтически приемлемых средств, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль или другие неорганические или органические растворенные компоненты. Хлорид натрия является особенно предпочтительным в случае буферов, содержащих ионы натрия.
Вязкость композиции, при необходимости, можно поддерживать на выбранном уровне с использованием фармацевтически приемлемого загустителя. Предпочтительной является метилцеллюлоза, так как она легко и экономически доступна и с ней легко работать. Другие подходящие загустители включают, например, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и тому подобное. Предпочтительная концентрация загустителя будет зависеть от выбранного средства. Важным моментом является использование такого количества, которое позволит достичь выбранной вязкости. Очевидно выбор подходящих носителей и других добавок будет зависеть от точного пути введения и природы конкретной дозированной формы, например, жидкой дозированной формы (например, независимо от того необходимо ли приготовить композицию в форме раствора, суспензии, геля или в другой жидкой форме, такой как форма замедленного высвобождения или наполняемая жидкостью форма).
Специалистам в данной области будет понятно, что компоненты композиции следует выбирать так, чтобы они были химически инертными и не влияли на жизнеспособность или эффективность генетически модифицированных иммунореактивных клеток, которые описаны в настоящем изобретении. Для специалистов в области основных принципов химии и фармацевтики не будет проблем или такие проблемы они могут легко избежать при обращении к стандартным руководствам или с использованием простых экспериментов (не привлекая излишнего экспериментирования) на основании настоящего описания и цитированных в нем документов.
Одним из рассматриваемых вопросов, касающихся терапевтического применения генетически модифицированных иммунореактивных клеток согласно изобретению, является количество клеток, необходимых для достижения оптимального эффекта. Количество вводимых клеток будет варьировать в зависимости от субъекта, подвергаемого лечению. В одном варианте человеку вводят от 104 до 1010, от 105 до 109 или от 106 до 108 генетически модифицированных иммунореактивных клеток согласно изобретению. Более эффективные клетки можно вводить в еще меньших количествах. В некоторых вариантах человеку вводят, по меньшей мере, примерно 1×108, 2×108, 3×108, 4×108 и 5×108 генетически модифицированных иммунореактивных клеток. Точное определение того, что следует эффективной дозой, может быть основано на факторах, индивидуальных для каждого субъекта, включая размер, возраст, пол, массу и состояние конкретного субъекта. Дозы легко могут быть определены специалистами в данной области на основании настоящего описания и данных, известных в данной области.
Специалист в данной области легко может определить количество клеток и оптимальные добавки, наполнители и/или носители, находящиеся в композициях и вводимые способами согласно изобретению. Обычно любые добавки (в дополнение к активной клетке(ам) и/или средству(ам)) присутствуют в количестве, составляющем от 0,001 до 50% (масс.) от раствора в фосфатно-солевом буфере, и активный ингредиент присутствует в диапазоне порядка миллиграмм, таком как примерно от 0,0001 до примерно 5% масс., предпочтительно примерно от 0,0001 до примерно 1% масс., еще более предпочтительно примерно от 0,0001 до примерно 0,05% масс. или примерно от 0,001 до примерно 20% масс., предпочтительно примерно от 0,01 до примерно 10% масс. и еще более предпочтительно примерно от 0,05 до примерно 5% масс.. Конечно в случае любой композиции, вводимой животному или человеку, и следовательно, в случае любого конкретного способа введения предпочтительно определить: токсичность, например, путем определения летальной дозы (LD) и LD50 в подходящей животной модели, например, на грызунах, таких как мыши; и дозу композиции(ий), концентрацию компонентов в ней и время введения композиции(ий), которые оказывают соответствующее действие. Такие определения не требуют чрезмерного экспериментирования на основании данных, известных специалисту в данной области, приведенных в настоящем описании и в документах, цитированных в описании. И время последовательных введений может быть установлено без чрезмерного экспериментирования.
СПОСОБЫ ЛЕЧЕНИЯ
Предлагаются способы лечения неоплазии у субъекта. Также в настоящей публикации рассматриваются способы лечения инфекции патогеном или другой инфекционной болезни у субъекта, такого как человек с иммунодефицитом. Способы включают введение T-клетки, клетки врожденной иммунной системы, NK-клетки или CTL-клетки согласно изобретению в количестве, эффективном для достижения требуемого эффекта, будь то облечение существующего состояния или предотвращение рецидивов. В случае лечения вводимое количество представляет собой количество, эффективное для получения требуемого эффекта. Эффективное количество может быть доставлено в виде одного или серии введений. Эффективное количество может быть доставлено в виде болюса или в виде непрерывной инфузии.
«Эффективное количество» (или «терапевтически эффективное количество») представляет собой количество, достаточное для получения полезного или требуемого клинического результата при лечении. Эффективное количество может быть введено субъекту в виде одной или нескольких доз. Что касается лечения, то эффективное количество представляет собой количество, которое достаточно для облегчения, ослабления, стабилизации, восстановления или замедления прогрессирования заболевания или иного уменьшения патологических последствий заболевания. Эффективное количество обычно определяет лечащий врач в каждом конкретном случае и это находится в компетенции специалиста в данной области. Обычно учитывают несколько факторов при определении соответствующей дозы с целью достижения эффективного количества. Такие факторы включают возраст, пол и массу субъекта, состояние, подвергаемое лечению, тяжесть состояния и форму и эффективную концентрацию вводимого антигенсвязывающего фрагмента.
В случае адоптивной иммунотерапии с использованием антигенспецифичных T-клеток обычно инфузируют дозы клеток в диапазоне 106-1010 (например, 109). После введения генетически модифицированных клеток хозяину и последующей дифференцировки индуцируют T-клетки, которые специфично направлены против конкретного антигена. «Индукция» T-клеток может включать инактивацию антигенспецифичных T-клеток, например, в результате удаления или анергии. Инактивация особенно применима для установления и восстановления толерантности, например, при аутоиммунных расстройствах. Модифицированные клетки можно вводить любым способом, известным в данной области, включая без ограничения внутривенное, подкожное, интранодального, внутриопухолевого, интратекального, интраплеврального, внутрибрюшинного введения и введения непосредственно в тимус.
ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ
Изобретение относится к способам повышения иммунного ответа у субъекта, нуждающегося в таком повышении. В одном варианте изобретение относится к способам лечения или профилактики неоплазии у субъекта. Изобретение относится к способам терапии, которые особенно применимы для лечения субъектов, имеющих рак крови (например, лейкозы, лимфомы и меланомы) или рак яичника, которые не поддаются обычному терапевтическому вмешательству. Подходящие пациенты для терапии обычно относятся к двум группам лечения, которые можно отличить по клиническим критериям. Субъектами с «заболеванием на поздней стадии» или с “высокой опухолевой нагрузкой» являются субъекты, которые имеют клинически измеряемую опухоль. Клинически измеряемая опухоль представляет собой опухоль, которая может быть выявлена на основе массы опухоли (например, с использованием пальпации, компьютерной томографии, сонограммы, маммограммы или рентгеновского излучения; позитивные биохимические или гистопатологические маркеры сами по себе недостаточны для идентификации такой популяции). Таким субъектам вводят фармацевтическую композицию, предлагаемую в настоящем изобретении, чтобы вызвать противоопухолевый ответ с целью облегчения их состояния. В идеале, в результате происходит снижение массы опухоли, но любой клиническое улучшение является полезным. Клиническое улучшение включает пониженный риск или уменьшенную скорость прогрессирования или снижение патологических последствий опухоли.
Вторая группа подходящих субъектов известна в данной области как «группа адъювантного лечения». К такой группе относятся индивидуумы, которые имеют в анамнезе неоплазию, но отвечали на другой способ терапии. Предыдущая терапия может включать без ограничения хирургическое удаление, лучевую терапию и традиционную химиотерапию. В результате такие индивидуумы не имеют клинически измеряемой опухоли. Однако предположительно для них существует риск прогрессирования заболевания, либо вблизи места исходной опухоли, либо из-за метастазов. Такую группу можно дополнительно подразделить на индивидуумов с высоким риском и низким риском. Подразделение осуществляют на основе признаков, наблюдаемых до или после начального лечения. Такие признаки известны в клинических областях, и их соответствующим образом определяют в случае каждой из различных форм неоплазии. Признаками, типичными для подгруппы высокого риска, являются признаки, свидетельствующие, что опухоль проросла в соседней ткани, или что вовлечены лимфатические узлы.
Другая группа имеет генетическую предрасположенность к неоплазии, но еще не имеет явных клинических признаков неоплазии. Например, женщины, которые при тестировании оценены позитивно в отношении генетической мутации, ассоциированной с раком молочной железы, но еще детородного возраста, могут захотеть получать один или несколько антигенсвязывающих фрагментов, описанных в настоящей публикации, для профилактического лечения, чтобы предотвратить возникновение неоплазии вплоть до подходящего момента для проведения превентивной операции.
Особенно подходящими субъектами являются люди с неоплазией, имеющие любую из следующих форм неоплазии: глиобластому, меланому, нейробластому, аденокарциному, глиому, саркому мягких тканей и различные карциномы (включая рак простаты и мелкоклеточный рак легкого). Подходящие карциномы дополнительно включают любую известную область онкологии, включая без ограничения астроцитому, фибросаркому, миксосаркому, липосаркому, олигодендроглиому, эпендимому, медуллобластому, примитивную нейроэктодермальную опухоль (PNET), хондросаркому, остеогенную саркому, аденокарциному протоков поджелудочной железы, мелкоклеточную и крупноклеточную аденокарциномы легкого, хордому, ангиосаркому, эндотелиосаркому, плоскоклеточную карциному, бронхоальвеолярную карциному, эпителиальную аденокарциному и их метастазы в печени, лимфангиосаркому, лимфангиоэндотелиосаркому, гепатому, холангиокарциному, синовиому, мезотелиому, опухоль Юинга, рабдомиосаркому, карциному ободочной кишки, базальноклеточную карциному, карциному слюнных желез, папиллярную карциному, карциному сальных желез, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, карциному желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильма, опухоль семенников, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, нейрому слухового нерва, олигодендроглиому, менингиому, нейробластому, ретинобластому, лейкоз, множественную миелому, макроглобулинемию Вальденстрема и болезнь тяжелых цепей, опухоли молочной железы, такие как протоковая и дольковая аденокарцинома, плоскоклеточные аденокарциномы шейки матки, эпителиальную карциному матки и яичников, аденокарциномы простаты, переходную плоскоклеточную карциному мочевого пузыря, B- и T-клеточные лимфомы, (узловую и диффузную) плазмацитому, острый и хронический лейкозы, злокачественную меланому, саркомы мягких тканей и лейомиосаркомы.
Субъекты могут иметь запущенную форму заболевания, и в таком случае целью лечения может быть ослабление или реверсия прогрессирования заболевания и/или ослабление побочных эффектов. Субъекты могут иметь в анамнезе состояние, по поводу которого они уже подвергались лечению, и в таком случае целью терапии обычно будет снижение или задержка риска рецидивов.
Соответственно изобретение относится к способу лечения или профилактики неоплазии у субъекта, и такой способ включает введение эффективного количества иммунореактивных клеток, содержащих рецептор, который связывает опухолевый антиген и активирует иммунореактивную клетку (например, TCR, CAR), и вектор, кодирующий ингибирующий химерный рецептор антигена (iCAR), который связывает антиген-мишень и подавляет иммунореактивную клетку. В качестве последствия поверхностной экспрессии рецептора, который связывает опухолевый антиген и активирует иммунореактивную клетку (например, TCR, CAR), и вектора, кодирующего ингибирующий химерный рецептор антигена (iCAR), который связывает антиген-мишень и подавляет иммунореактивную клетку, адоптивно переносимый T-клетки или NK-клетки человека наделены избирательной цитолитической активностью.
В одном варианте неоплазия выбрана из группы, состоящей из рака крови (например, лейкозов, лимфом и миелом), рака яичника, саркомы и острого миелоидного лейкоза (AML), рака простаты, рака молочной железы, рака мочевого пузыря, рака головного мозга, рака ободочной кишки, рака кишечника, рака печени, рака легкого, рака поджелудочной железы, рака простаты, рака кожи, рака желудка, глиобластомы и рака горла. В другом варианте опухолевым антигеном является один или несколько из следующих антигенов: карбонангидраза IX (CAIX), раковоэмбриональный антиген (CEA), CD5, CD7, CD10, CD19, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD123, CD133, CD138, антиген инфицированной цитомегаловирусом (CMV) клетки (например, антиген клеточной поверхности), эпителиальный гликопротеид 2 (EGP 2), эпителиальный гликопротеид-40 (EGP-40), молекулы адгезии эпителиальных клеток (EpCAM), рецепторные тирозиновые протеинкиназы erbB2,3,4, фолат-связывающий белок (FBP), ацетилхолиновый рецептор плода (AChR), рецептор фолата a, ганглиозид G2 (GD2), ганглиозид G3 (GD3), рецептор 2 эпидермального фактора роста человека (HER-2), обратная транскриптаза-теломераза человека (hTERT), субъединица альфа-2 рецептора интерлейкина-13 (IL-13Rα2), κ-легкая цепь, рецептор, имеющий в составе домен, содержащий киназу (KDR), антиген Льюис Y (LeY), молекула клеточной адгезии L1 (L1CAM), семейство антигенов меланомы A, 1 (MAGE-AI), муцин 16 (Muc-16), муцин 1 (Muc-1), мезотелин (MSLN), лиганды NKG2D, раковый антиген/антиген семенников NY-ESO-1, онкофетальный антиген (h5T4), антиген стволовых клеток простаты (PSCA), специфичный для простаты мембранный антиген (PSMA), ассоциированный с опухолью гликопротеид 72 (TAG-72), фактор роста эндотелиальных клеток сосудов R2 (VEGFR2) или белок опухоли Вильма (WT-1).
В других вариантах изобретение относится к способу лечения субъектов с инфекцией патогеном (например, вирусной инфекцией, бактериальной инфекцией, грибковой инфекцией, паразитарной инфекцией или протозойной инфекцией). Изобретение особенно применимо для усиления иммунного ответа у субъекта с иммунодефицитом. Примеры вирусных инфекций, чувствительных к лечению с использованием способа согласно изобретению, включают без ограничения инфекции цитомегаловирусом (CMV), вирусом Эпштейн-Барр (EBV), вирусом иммунодефицита человека (HIV) и вирусом гриппа. Соответственно, изобретение относится к способу лечения или профилактики инфекции патогеном у субъекта, при этом способ включает введение эффективного количества иммунореактивной клетки, которая описана в настоящей публикации.
НАБОРЫ
Изобретение относится к наборам для лечения или профилактики неоплазии, инфекции патогеном, иммунного расстройства или аллогенного трансплантата. В одном варианте набор содержит терапевтическую или профилактическую композицию, содержащую эффективное количество иммунореактивных клеток, содержащих активирующий рецептор антигена и ингибирующий химерный рецептор антигена (iCAR), в стандартной дозированной форме. В некоторых вариантах набор включает стерильную емкость, которая содержит терапевтическую или профилактическую вакцину; такие емкости могут представлять собой коробки, ампулы, бутылки, флаконы, пробирки, мешки, саше, блистер-упаковки или другие подходящие формы емкостей, известные в данной области. Такие емкости могут быть изготовлены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, подходящих для хранения лекарственных средств.
При необходимости иммунореактивная клетка поставляется вместе с инструкциями по введению клетки субъекту, имеющему или подвергаемому риску развития неоплазии, инфекции патогеном, иммунного расстройства или аллогенного трансплантата. Инструкции, как правило, будут содержать информацию о применении композиции для лечения или профилактики неоплазии, инфекции патогеном, иммунного расстройства или аллогенного трансплантата. В других вариантах инструкции содержат, по меньшей мере, одно из следующего: описание терапевтического средства; схему дозирования и введение для лечения или профилактики неоплазии, инфекции патогеном, иммунного расстройства или аллогенного трансплантата или их симптомов; меры предосторожности; предупреждения; показания; противопоказания; информацию о передозировке; неблагоприятные реакции; фармакологию у животных; клинические исследования и/или ссылки. Инструкции могут быть напечатаны непосредственно на емкости (если имеется) или предоставлены в виде этикетки на емкости или в виде отдельного листа, брошюры, карточки или папки, поставляемой в емкости или вместе с емкостью.
ПРИМЕРЫ
При практическом осуществлении настоящего изобретения используют, если не указано иное, обычные способы молекулярной биологии (включая способы рекомбинации), микробиологии, клеточной биологии, биохимии и иммунологии, которые входят в компетенцию специалиста в данной области. Такие способы полностью объяснены в литературе, например, в «Molecular Cloning: A Laboratory Manual”, second edition (Sambrook, 1989); “Oligonucleotide Synthesis” (Gait, 1984); “Animal Cell Culture” (Freshney, 1987); “Methods in Enzymology” “Handbook of Experimental Immunology” (Weir, I 996); “Gene Transfer Vectors for Mammalian Cells” (Miller and Calos, 1987); “Current Protocols in Molecular Biology” (Ausubel, 1987); “PCR: The Polymerase Chain Reaction”, (Mullis, 1994); “Current Protocols in Immunology” (Coligan, 1991). Указанные способы применимы для получения полинуклеотидов и полипептидов согласно изобретению, и, как таковые могут быть приняты во внимание при осуществлении и практической реализации настоящего изобретения. Особенно полезные способы для конкретных вариантов осуществления изобретения будут обсуждаться в разделах, которые следуют ниже.
Следующие ниже примеры приведены таким образом, чтобы предоставить специалистам в данной области полное раскрытие и описание того, как осуществить и применить способы анализа, скрининга и терапии согласно изобретению, и не предназначены для ограничения объема того, что авторы считают своим изобретением.
ПРИМЕР 1. Ингибирующий Химерный рецептор антигена (iCAR) отклоняет ответы вне мишени.
СУЩНОСТЬ
В случае T-клеточной терапии наблюдали длительную эффективность и целебные возможности в отношении лечения злокачественных опухолей. Однако их применение ограничено повреждением неспецифичных соседних тканей, которое наблюдается при болезни «трансплантат против хозяина» после инфузии лимфоцитов донора, или токсичностью «в месте мишени вне опухоли», возникающей в некоторых случаях терапии сконструированными T-клетками. Неспецифичная иммуносупрессия и необратимая элиминация T-клеток являются в настоящее время единственными способами контроля таких вредных ответов, но ценой отмены терапевтической пользы и вызывания серьезных вторичных осложнений. На основе физиологической парадигмы иммуноингибирующих рецепторов были сконструированы антигенспецифичные ингибирующие химерные рецепторы антигенов (iCAR), чтобы превентивно сдерживать T-клеточные ответы. Результаты, которые представлены ниже, демонстрируют, что основанные на CTLA-4 или PD-1 iCAR могут избирательно ограничивать секрецию цитокинов, цитотоксичность и пролиферацию, индуцированные посредством эндогенного T-клеточного рецептора или активирующего химерного рецептора. Начальный эффект iCAR является временным, что позволяет T-клеткам функционировать при последующем столкновении с антигеном, узнаваемым их активирующим рецептором. Таким образом, iCAR обеспечивают динамичный саморегулирующийся аварийный переключатель для предотвращения, а не для лечения последствий неадекватной специфичности T-клеток.
ВВЕДЕНИЕ
Было показано, что T-клеточная терапия клинически эффективна при трансплантации костного мозга и органов, иммунотерапии злокачественных опухолей, вирусных инфекциях и аутоиммунных заболеваниях (1-6). К сожалению, T-клетки также могут принимать участие во вредных побочных эффектах. Сообщалось о неблагоприятных явлениях «в месте мишени, но вне опухоли» при клинических испытаниях иммунотерапии злокачественных опухолей с использованием сконструированных T-клеток с T-клеточным рецептором (TCR) и химерным рецептором антигена (CAR). Такие явления включают B-клеточную аплазию у пациентов с хроническим лимфоцитарным лейкозом, которых лечили T-клетками, экспрессирующими анти-CD19 CAR (7-9), летальный острый респираторный дистресс-синдром после инфузии анти-ERBB2 CAR T-клеток, как полагают, в результате перекрестной реактивности в эпителии легкого (10), и TCR-индуцированные смертельные исходы вследствие некроза сердечной мышцы или неврологической токсичности, возникающей у пациентов, которых лечили TCR, распознающими раковые антигены-антигены семенников (11-13). Подобным образом, успехам в лечении с использованием инфузии лимфоцитов донора (DLI) при аллогенной трансплантации костного мозга мешает индукция как острой, так и хронической болезни «трансплантат против хозяина» (GVHD) и аплазии костного мозга (14). Методики отделения полезных эффектов «трансплантат против опухоли» (GVT) от GVHD в настоящее время достигли ограниченного успеха (15).
Современный способ сдерживания опосредованной T-клетками токсичности основан на применении иммуноподавляющих схем, таких как терапия высокими дозами кортикостероидов, которые оказывают цитостатическое или цитотоксическое действие на T-клетки, ограничивая иммунные ответы (16). Несмотря на эффективность, такой способ не позволяет различать полезные и вредные функции T-клеток. Кроме того, иммунодепрессанты вызывают значительные вторичные побочные эффекты, такие как чувствительность к инфекциям и поражение сердца, почек и неврологические поражения (14). Методики конструирования суицидных генов, при которых могут быть использованы избирательные ферментативные метаболизаторы токсических агентов, такие как тимидинкиназа вируса простого герпеса (17) или индуцируемая каспаза-9 (18), или методики опосредованного антителами истощения, нацеленные на эктопические эпитопы, сконструированные в T-клетках (19, 20), также элиминируют T-клетки, независимо от их терапевтической эффективности. Кроме того, такие способы являются ответными, так как их осуществляют после наблюдения вредных побочных эффектов. Таким образом, существует большая потребность в способах предотвращения нежелательной T-клеточной реактивности.
Физиологическая регуляция активации T-клеток осуществляется посредством нескольких механизмов, которые включают иммуноингибирующие рецепторы, которые играют ключевую роль в ослаблении или остановке T-клеточных ответов (21, 22). Ингибирующие рецепторы могут подвергаться повышающей регуляции во время праймирования T-клеток, что ослабляет иммунные ответы, или могут экспрессироваться на базовом уровне, регулируя пороги активации. Поэтому у мышей с недостаточностью ингибирующего рецептора CTLA-4 наблюдают массивную активацию и пролиферацию T-клеток и в конце концов они подвергаются тяжелому системному аутоиммуному заболеванию с инфильтрацией активированных T-клеток (23). Подобным образом, утрата PD-1, другого ингибирующего рецептора, специфично экспрессируемого на активированных T-клетках, вызывает прогрессирующий артрит и гломерулонефрит у мышей C57BL/6 и ускоренный инсулит у мышей с диабетом но без ожирения (NOD) (24, 25). Модулирование таких рецепторов и нижележащих путей передачи их сигнала оказывает существенное влияние на функции T-клеток. Лигирование in vitro CTLA-4 или PD-1 во время стимуляции T-клеток блокирует активацию, высвобождение цитокинов и пролиферацию (26). В частности, было показано, что анти-CTLA-4- и анти-PD-1-антитела являются клинически многообещающими за счет повторной активации анти-T-клеточных ответов у некоторых пациентов с меланомой, раком легкого и почек (22, 27, 28). Блокада CTLA-4 и PD-1 также активно исследуется в отношении восстановления после иммунной дисфункции и персистенции вирусов при хроническом гепатите B и ВИЧ-инфекции (29, 30). Однако подобно неспецифичной иммуносупрессии опосредованная антителами блокада иммунных точек ингибирующим рецептором не является специфичной для антигена и поэтому не различает полезные и вредные популяции T-клеток.
Методику генетической инженерии применяли для того, чтобы приспособить природную физиологию ингибирования T-клеток и регулировать T-клеточные ответы специфичным для антигена образом. Сконструировали ингибирующий химерный рецептор антигена (CAR (iCAR), имеющий домен распознавания поверхностного антигена, объединенный с мощным доменом острого ингибирования доменом передачи сигнала, чтобы ограничить T-клеточную реактивность, несмотря на одновременное вовлечение активирующего рецептора (фигура 1A). Как показано ниже, в первичных T-клетках человека такие iCAR на основе PD-1 и CTLA-4 обратимо ограничивают важные функции TCR или активирующего CAR, и таким образом позволяют различать клетки-мишени и нецелевые клетки in vitro и in vivo.
МАТЕРИАЛЫ И СПОСОБЫ
Дизайн исследования
Целью настоящего исследования было создание синтетического рецептора, который может ограничивать T-клеточную токсичность по отношению к клетке-мишени зависимым от антигена и обратимым образом. Были сконструированы два таких рецептора с использованием внутриклеточных хвостов CTLA-4 или PD-1 и направляющего к мишени домена scFv (против PSMA) и был проведен анализ того, могут ли они блокировать (i) TCR- или (ii) CAR-управляемую T-клеточную функциональность in vitro и in vivo. In vitro исследования были сфокусированы на анализе (i) цитотоксичности, (ii) секреции цитокинов и (iii) пролиферации T-клеток. В экспериментах in vivo анализировали интегративную способность iCAR защищать клеточную мишень, используя прямую визуализацию и анализ конечных результатов (определенных на необработанной группе мышей). Экспериментальные процедуры были одобрены институциональным комитетом по содержанию и использованию животных Мемориального онкологического центра Слоана-Кеттеринга (MSKCC). Общий дизайн экспериментов заключался в воздействии на T-клетки (экспрессирующие iCAR или контрольный рецептор Pdel) клеток-мишеней (которые экспрессировали или не содержали PSMA) и сравнении групп, чтобы попытаться подробно исследовать функцию iCAR, всегда в присутствии внутренних контролей. T-клетки, не содержащие iCAR, были ограждены от засорения с целью получения чистых результатов за счет сортировки T-клетки на iCAR- или iCAR/CAR-дважды позитивные (с использованием репортерных генов). Каждый эксперимент осуществляли несколько раз, используя T-клетки разных доноров (T-клетки никогда не объединяли). В большинстве случаев представляли данные, полученные с использованием типичного эксперимента (с повторами образцов более трех раз), чтобы избежать искажающих факторов, таких как различия в следствие эффективности трансдукции и сортировки, вариабельность, связанная с донорами и соотношения E/T.
Конструирование ингибирующего химерного рецептора антигена (iCAR)
Каждый ингибирующий химерный рецептор антигена (iCAR) конструировали с использованием аннотации последовательностей UniProt двумя способами. Во-первых, используя коммерческий синтез генов или кДНК, внутриклеточный домен каждого рецептора клонировали вместо домена CD28/CD3ζ ранее описанного рецептора Pz1 (Stephan et al., Nature medicine, 2007. 13(12): 1440-9), используя при этом трансмембранный и шарнирный домены CD8. Полипептид CD8 полипептид может иметь аминокислотную последовательность, указанную ниже:
MALPVTALLLPLALLLHAARPSQFRVSPLDRTWNLGETVELKCQVLLSNPTSGCSWLFQPRGAAASPTFLLYLSQNKPKAAEGLDTQRFSGKRLGDTFVLTLSDFRRENEGYYFCSALSNSIMYFSHFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRNRRRVCKCPRPVVKSGDKPSLSARYV [SEQ ID NO:11].
Трансмембранный и шарнирные домены CD8 могут иметь аминокислотную последовательность, состоящую из аминокислот 137-209 последовательности SEQ ID NO: 11. Альтернативно или дополнительно также могут быть использованы трансмембранный и шарнирный домены CD4, и они были тестированы. Последовательности нуклеиновых кислот и аминокислотные последовательности конструкций iCAR представлены в приложении A. Альтернативно включали трансмембранные домены и аминокислоты вплоть до первого аннотированного внеклеточного топологического домена (в случае PD-l аминокислоты 145-288; в случае CTLA4 аминокислоты 161-223), для того чтобы использовать эндогенную шарнирную область каждого рецептора. Такие конструкции клонировали в векторе P28z после PSMA-scFv. Не наблюдали значимых функциональных различий между рецепторами, созданными двумя способами. Кроме того, создавали варианты каждого iCAR, в которых отсутствовал какой-либо направляющий к мишени домен, но сохранялись трансмембранная и внутриклеточная части каждого рецептора. Контрольный рецептор Pdel конструировали, вырезая домен CD28/CD3ζ из P-28z(34). iCAR следует четко отличать от CAR, которые все запускают активацию T-клеток, что кардинально отличается от iCAR. Последовательность нуклеиновой кислоты PSMA-scFv представлена ниже:
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcA [SEQ ID NO: 12].
Аминокислотная последовательность PSMA-scFv приведена ниже:
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAA [SEQ ID NO: 13].
Рецепторы, например, PD-1, CTLA-4, 2B4, LAG-3 и BTLA-4, также тестировали с использованием мишени CD19-scFV. Последовательность нуклеиновой кислоты CD19-scFV приведена ниже:
ATGGCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGAAGCTGCAGCAGTCTGGGGCTGAGCTGGTGAGGCCTGGGTCCTCAGTGAAGATTTCCTGCAAGGCTTCTGGCTATGCATTCAGTAGCTACTGGATGAACTGGGTGAAGCAGAGGCCTGGACAGGGTCTTGAGTGGATTGGACAGATTTATCCTGGAGATGGTGATACTAACTACAATGGAAAGTTCAAGGGTCAAGCCACACTGACTGCAGACAAATCCTCCAGCACAGCCTACATGCAGCTCAGCGGCCTAACATCTGAGGACTCTGCGGTCTATTTCTGTGCAAGAAAGACCATTAGTTCGGTAGTAGATTTCTACTTTGACTACTGGGGCCAAGGGACCACGGTCACCGTCTCCTCAGGTGGAGGTGGATCAGGTGGAGGTGGATCTGGTGGAGGTGGATCTGACATTGAGCTCACCCAGTCTCCAAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCGTCACCTGCAAGGCCAGTCAGAATGTGGGTACTAATGTAGCCTGGTATCAACAGAAACCAGGACAATCTCCTAAACCACTGATTTACTCGGCAACCTACCGGAACAGTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCACTAACGTGCAGTCTAAAGACTTGGCAGACTATTTCTGTCAACAATATAACAGGTATCCGTACACGTCCGGAGGGGGGACCAAGCTGGAGATCAAACGGgcggccgcA [SEQ ID NO: 14].
Аминокислотная последовательность CD19-scFV приведена ниже:
MALPVTALLLPLALLLHAEVKLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIYPGDGDTNYNGKFKGQATLTADKSSSTAYMQLSGLTSEDSAVYFCARKTISSVVDFYFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIELTQSPKFMSTSVGDRVSVTCKASQNVGTNVAWYQQKPGQSPKPLIYSATYRNSGVPDRFTGSGSGTDFTLTITNVQSKDLADYFCQQYNRYPYTSGGGTKLEIKRAAAMALPVTALLLPLALLLHAEVKLQQSGAELVRPGSSVKISCKASGYAFSSYWMNWVKQRPGQGLEWIGQIYPGDGDTNYNGKFKGQATLTADKSSSTAYMQLSGLTSEDSAVYFCARKTISSVVDFYFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIELTQSPKFMSTSVGDRVSVTCKASQNVGTNVAWYQQKPGQSPKPLIYSATYRNSGVPDRFTGSGSGTDFTLTITNVQSKDLADYFCQQYNRYPYTSGGGTKLEIKRAAA [SEQ ID NO: 15].
PSMA-scFV-мишень и CD19-scFV-мишень можно взаимно заменять благодаря модульной природе iCAR, при условии, что учтены соответствующие структурные факторы.
Анализ конъюгации, Вестерн-блоты и окраска GAM
Экспрессию iCAR на клеточной поверхности анализировали, используя ранее описанный протокол окрашивания антителами козы против Ig мыши (Markley et al., Blood, 2010. 115(17): 3508-19). Анализ конъюгации клеток осуществляли, как описано ранее (Burshtyn and Davidson, Natural killer cell conjugate assay using two-color flow cytometry. Methods in molecular biology, 2010. 612: 89-96). Кратко, клетки EL4 или EL4-PSMA метили липофильным красителем DiD (Invitrogen) и смешивали в соотношении 1:1 с T-клетками в пробирках для FACS, инкубировали при 37°C в течение 5 минут и анализировали на проточном цитометре. Вестерн-блот-анализ осуществляли, используя стандартные протоколы с помощью системы Bio-rad Mini-PROTEAN Tetra. Внутриклеточный хвост CTLA-4 выявляли, используя поликлональное антитело C-19, которое распознает конец CTLA-4 (Santa Cruz Biotechnology).
Ретровирусные векторы и продукция вирусов
Плазмиды, кодирующие онкоретровирусный вектор SFG, получали, используя стандартные способы молекулярной биологии. Синтез векторов 19-28z-IRES-LNGFR, CD19, PSMA, GFP, mCherry и люциферазу жука-щелкуна (CBL), были описаны (Markley et al., Blood, 2010. 115(17): 3508-19; Stephan et al., Nature medicine, 2007. 13(12): 1440-9; Brentjens et al., Clin. Cancer Res., 2007. 13(18: 1): 5426-35). Продуценты ретровирусов получали из надосадка трансфицированных плазмидами клеток H29 (Stephan et al., Nature medicine, 2007. 13(12): 1440-9).
Линии клеток
Клетки EL4-CD19, EL4-PSMA и клетки, презентирующие искусственный антиген (AAPC) NIH3T3-CD19 и NIH3T3-PSMA, были описаны (Gade (2005); Stephan et al., Nature medicine, 2007. 13(12): 1440-9; Maher et al., Nature Biotechnology, 2002. 20(1): 70-75; Markley et al., Blood, 2010. 115(17): 3508-19; Brentjens et al., Clin. Cancer Res., 2007. 13(18:1): 5426-35). NIH3T3-CD19-PSMA, NIH3T3-CD19-mCherry, NIH3T3-CD19-GFP и NIH3T3-CD19-CBL, а также NALM/6-CBL и NALM/6-PSMA-CBL получали после трансдукции соответствующими содержащими ретровирусы надосадками клеток-продуцентов H29. Все сравниваемые группы линий клеток сортировали в отношении эквивалентной экспрессии CD19, GFP или mCherry, используя сортировщик MoFlo.
Сбор лейкоцитов периферической крови (PBL) и трансдукция ретровирусами
Периферическую кровь получали от здоровых доноров после информированного согласия по протоколу, одобренному институтским экспертным советом Мемориального онкологического центра Слоана-Кеттеринга (MSKCC). PBL выделяли, используя фикол-пак, и активировали фитогемагглютинином (ФГА) в течение 48 часов. Активированные T-клетки трансдуцировали в течение трех последующих дней, центрифугируя в покрытых ретронектином (Takara) планшетах со связанным ретровирусным вектором. Клетки подпитывали каждые 3 дня средой RPMI с добавлением 20 единиц IL-2. Через десять дней после трансдукции использовали FACS-селекцию, основанную на усиленном GFP (маркировка iCAR) и LNGFR (маркировка 19-28z), чтобы выделить позитивные клетки на сортировщике клеток MoFlo. После сортировки осуществляли анализ, чтобы убедиться в эквивалентной экспрессии обоих репортеров.
Создание полученных из iPS фибробластов
Лимфоциты периферической крови активировали ФГА, трансдуцировали содержащими ретровирусы надосадками (f-citrine-P2A-Myc-E2A-Sox2 и f-vexGFP-P2A-Okt4-T2AKlf4) и высевали спустя 24 часа на питающие клетки MEF (Themeli (2013)). Среду заменяли на среду ES для клеток человека с фактором роста фибробластов (FGF) (8 нг/мл) на 5 день после трансдукции и половину среду заменяли каждый день после этого. Колонии T-iPS появлялись примерно через 22-25 дней после трансдукции. Анализ подкожного трансплантата тератомы осуществляли, используя линию клеток T-iPS-1.10. Через три месяца тератому извлекали и обрабатывали 100 ед./мл коллагеназы (Invitrogen) и 2 ед./мл диспазы (Invitrogen) в течение двух часов при 37°C, получая суспензию отдельных клеток. Клетки сортировали в отношении HLA-ABC-позитивных клеток и после культивирования в течение одной недели в RPMI с добавлением 1% L-глутамина, 1% пенициллина, 1% стрептомицина и 10% фетальной сыворотки теленка (FBS) в них воспроизводимо спонтанно образовывались iPS-fib.
Проточная цитометрия
Все анализы с использованием проточной цитометрии осуществляли на цитометре LSRII (BD Biosciences) и анализировали с помощью компьютерной программы FlowJo, версия 9.6 (TreeStar). Антитела против LNGFR, CD45, CD140b, CD10, HLA-ABC, HLA-DR, CD80, CD86 и CD62L человека получали из BD Biosciences; антитела против CD4, CD8, CD3, CD19, CD90 человека и 4',6-диамидино-2-фенилиндол (DAPI) получали из Invitrogen; антитела против PSMA человека получали из Medical and Biological Laboratories; антитела против CCR7 человека получали из R&D; антитела против Foxp3 человека (236A/E7) и изотипа Foxp3 получали из eBioscience.
Анализы T-клеток in vitro
В общем, для анализов пролиферации, продукции эффекторных цитокинов и анализов цитотоксичности серийные разведения отсортированных очищенных T-клеток высевали на соответствующих AAPC (облученных в дозе 40-50 Гр и посеянных раньше на 24 часа по 3×104/лунку) в 96-луночные планшеты с плоским дном (при этом крайние лунки планшета содержали только среду, чтобы минимизировать эффекты испарения). iPS-фибробласты не облучали в случае использования в качестве мишеней. Свежую среду добавляли каждые 3-4 дня или после изменения окраски среды. Продукцию цитокинов количественно оценивали либо с использованием наборов для твердофазного иммуноферментного анализа (ELISA) (eBioscience) или в анализах Luminex (Invitrogen), как указано в тексте согласно инструкциям производителя. Количество T-клеток подсчитывали, используя количество живых клеток (DAPI) и шарики CountBright (Invitrogen) на проточном цитометре LSR II (BD), собирая полное содержимое лунок. Все эксперименты по культивированию in vitro осуществляли в RPMI с добавлением 1% L-глутамина, 1% пенициллина, 1% стрептомицина и 10% FBS. Не вводили экзогенных цитокинов ни в одной из временных точек, если четко не указано.
Анализ CTL с использованием люциферазы
Анализы цитотоксических T-лимфоцитов (CTL) с использованием биолюминесценции в качестве показателя осуществляли, как описано ранее (Fu et al., PloS one, 2010. 5(7): e11867). Кратко, все анализы люциферазы in vitro осуществляли с использованием системы анализа люциферазы Bright-Glo (Promega) и черных 96-луночных микропланшетов с оптически прозрачным дном (Nunc) и проводили согласно протоколу производителя с небольшими корректировками. Все клетки-мишени конструировали так, чтобы они экспрессировали CBL с aGFP-репортером и чтобы обеспечить эквивалентные уровни экспрессии. Культуральную среду извлекали до 50 мкл на лунку, добавляли 50 мкл приготовленного реагента люциферазы в каждую лунку 96-луночных планшетов и планшеты инкубировали в течение 5 минут до полного лизиса клеток. Измерения осуществляли с использованием системы визуализации IVIS серии 100 (Xenogen). Компьютерную программу для живых изображений в версии 2.6 (Xenogen) использовали для количественной оценки интенсивности излучения фотонов.
Цейтраферная и флуоресцентная микроскопия CTL
Всю микроскопическую визуализацию осуществляли, используя Zeiss AxioVert 200M, оборудованный системой прямой визуализации. Покадровое видео получали и составляли, используя многомерный захват в компьютерной программе MetaMorph (Molecular Devices). В случае экспериментов с CTL сигнал от mCherry-позитивных AAPC количественно оценивали, используя функцию интегрированного морфометрического анализа в MetaMorph.
moDC и праймирование
Происходящие из моноцитов дендритные клетки получали, используя набор для получения Mo-DC (Miltenyi), от того же донора, что и клетки T-iPS. На moDC импульсно воздействовали в течение 24 часов в незрелом состоянии (5-6 день) лизатами iPS-Fib, которые были получены в результате шести циклов замораживания-размораживания. Созревание DC подтверждали проточной цитометрией CD8O, CD86 и HLA-DR. Праймирование осуществляли, как описано ранее (Yuan et al., Journal of immunology, 2005. 174(2): 758-66). Кратко, первый раунд праймирования осуществляли, используя соотношение 1:30 T-клетки/moDC, при этом во втором раунде использовали соотношение от 1:10 до 1:30. Использовали RPMI с добавлением 1% L-глутамина, 1% пенициллина, 1% стрептомицина, 10% сыворотки AB человека (CellGro) и 5 нг/мл IL-15 человека (R&D Systems). На третий день добавляли 20 ед./мл IL-2.
Матрица для создания протеомного профиля
T-клетки экспонировали с AAPC, используя соотношение E/T 4:1, в течение 60 минут, промывали, лизировали и инкубировали (100 мкг) с матрицей фосфоиммунорецепторов человека согласно протоколу производителя (R&DSystems). Все блоты регистрировали, используя хемилюминесценцию, на одной и той же рентгеновской пленке, чтобы стандартизовать уровни экспозиции. Сканированные изображения на рентгеновской пленке анализировали с использованием компьютерной программы для анализа изображений. Все плотности пикселей нормализовали на каждой матрице с использованием внутренних pY-контролей.
Мышиные модели и количественная биолюминесценция
Для исследований NALM/6 самцам мышей 6-12-недельного возраста NOD/SCID/γc- (Jackson Laboratory) внутривенно инокулировали 5×105 опухолевых клеток (одна и та же доза в случае экспериментов как с одной опухолью, так и смешанными опухолями). Клетки NALM/6 конструировали так, чтобы они экспрессировали CBL с GFP-репортером. Через четыре дня 3×105 отсортированных T-клеток инфузировали внутривенно; доза клеток была основана на процентном содержании GFP+ 19-28z+, которое подтверждали в анализе после сортировки. Мышей умерщвляли на 21 день (в контролях без T-клеток наблюдали паралич задних конечностей). Для исследований iPS-fib самцам мышей 6-12-недельного возраста NOD/SCID/γc (ноль) внутрибрюшинно инокулировали 1×106 клеток, приготовленных в смеси 1:1 охлажденной на льду RPMI и смеси Matrigel (BD Biosciences). Через восемь дней 5×105 дважды moDC-праймированные отсортированные по GFP T-клетки инфузировали внутрибрюшинно; доза клеток была основана на процентном содержании GFP+, которое подтверждали в анализе после сортировки. Кроме того, осуществляли анализ люцифераза-TCL in vitro, чтобы установить эквивалентную аллогенную реактивность во всех группах, используя iPS-Fib в качестве мишени. В обеих моделях использовали D-люциферин (Xenogen, 150 мг/кг внутрибрюшинно) в качестве субстрата для люциферазы жука-щелкуна, и изображения биолюминесценции получали с использованием системы визуализации IVIS 100. Компьютерную программу для живых изображений в версии 2.6 использовали, чтобы получить и количественно оценить наборы данных, полученных при визуализации биолюминесценции, как описано ранее (Markley et al., Blood, 2010. 115(17): 3508-19). Уход за мышами осуществляли в соответствии с институтским руководством Мемориального онкологического центра Слоана-Кеттеринга (MSKCC).
Статистические способы
Данные представлены в виде среднего ± стандартное отклонение/стандартная ошибка среднего, которые указаны в текстовом файле. Результаты анализировали с использованием t-критерия Стьюдента для независимых выборок (двустороннего) или с использованием ANOVA, как указано в тексте, и статистическую значимость определяли при p<0,05. Попарные множественные сравнения осуществляли, используя множественные t-критерии с корректировкой способом Холма-Сидака. Приведены все точные P-значения. Все статистические анализы осуществляли с использованием компьютерной программы Prism в версии 6.0 (GraphPad).
РЕЗУЛЬТАТЫ
1. iCAR хорошо экспрессируются на клеточной поверхности первичных T-клеток человека.
Не имея намерения быть связанными с конкретной теорией, авторы высказали гипотезу о том, что одноцепочечный вариабельный фрагмент (scFv) или Fab, специфичный для антигена, слитого с доменами передачи сигнала иммуноингибирующих рецепторов (CTLA-4, PD-1, LAG-3, 2B4 или BTLA) через трансмембранную область, могут специфично ингибировать функцию T-клеток при узнавании антигена. Такие рецепторы названы iCAR, так как они обладают ингибирующим иммунные клетки потенциалом, являются химерными рецепторами, которые связывают специфичный антиген, и отличаются от CAR, термина, используемого для описания рецепторов с активирующим иммунные клетки потенциалом.
scFv, специфичный по отношению к мембранному антигену, специфичному для простаты человека (PSMA), использовали в качестве модельного поверхностного антигена (31). Такой scFv был широко исследован и в настоящее время проходит фазу 1 испытаний по поводу иммунотерапии рака простаты (32). PSMA сверхэкспрессируется в случае метастатического рака простаты, а также встречается в нормальной почке, печени, ободочной кишке и астроцитах головного мозга (33). Были созданы пять разных iCAR, специфичных для PSMA (названных iCAR-P), имеющих внутриклеточные домены CTLA-4, PD-1, LAG-3, 2B4 и BTLA, соответственно. Был создан контрольный рецептор, Pdel, который имел только направляющий к мишени scFv и трансмембранный домен, но не имел цитоплазматического домена (фигура (1B). Каждый iCAR клонировали в бицистронном ретровирусном векторе с репортерным модулем IRES-GFP (фигура 1B). После трансдукции первичных T-клеток человека из мононуклеарных клеток периферической крови CTLA4-iCAR хорошо экспрессировались на клеточной поверхности, и PD-1-iCAR-P и Pdel экспрессировались на клеточной поверхности на сходных уровнях с рецептором P28z (34), основанным на CD28/CD3ζ PSMA-специфичным рецепторе с двойной передачей сигнала, который в настоящее время используют в клиническом испытании (фигуры 1C и 1D). Фосфо-матрицы использовали для исследования того, трансдуцирует ли PD1-iCAR сигнал при контактировании рецептора. Состояние фосфорилирования анализировали, используя матрицу фосфо-иммунорецепторов человека RnD, после экспозиции с 3t3-D по сравнению с мишенью 3T3-S. Клетки 1928z-P-PD1 инкубировали с клетками либо 3T3 WT, либо 3T3-S, либо 3T3-D. Давали возможность рецепторам контактировать в течение двух часов и затем анализировали лизаты клеток в отношении состояния фосфорилирования. Клетки, на которые воздействовали 3T3-D, имели значимое повышение фосфорилирования SHP-l, SHP-2, а также 2B4, которые все являются нижележащими мишенями в пути передачи сигнала PD1, важно, что в случае воздействия 3t3-S все три имели снижение силы сигнала (фигура 18). В случае CTLA4-iCAR наблюдали высокую внутриклеточную экспрессию при использовании Вестерн-блота и внутриклеточной проточной цитометрии, но ограниченную экспрессию на клеточной поверхности (фигуры 1C, 1D и 9A-C). Поверхностная экспрессия восстанавливалась при использовании CTLA4-хвоста с мутацией Y165G, ключевого остатка для миграции на клеточную поверхность при конструировании mutCTLA4-iCAR (фигуры 1C, 1D и 9A-C). Полученные данные согласуются с данными о физиологической миграции CTLA-4, который конститутивно интернализуется в покоящихся T-клетках и разрушается в результате взаимодействия с эндоцитозным адапторным комплексом AP-2 посредством его тирозинового мотива YVKM (35). Действительно, была обнаружена повышающая регуляция CTLA-4-iCAR-P на клеточной поверхности после активации T-клеток (фигура 9C) и восстановленная конститутивная поверхностная экспрессия при использовании мутанта по тирозиновому мотиву Y165G при конструировании mutCTLA-4-iCAR-P, в случае которого наблюдали экспрессию на поверхности покоящихся клеток (фигура 1C). Распознавание PSMA рецепторами iCAR было продемонстрировано с использованием анализа конъюгации клеток, в котором iCAR-экспрессирующие T-клетки связывали клетки тимомы мышей EL4, экспрессирующие PSMA (фигура 10A).
2. iCAR ограничивают ответы TCR ограниченным антигеном образом
В дополнение к применению на аутологичных T-клетках-мишенях iCAR применимы для профилактики GVHD в случае посттрансплантационной инфузии лимфоцитов донора. Поэтому оценивали эффективность iCAR в защите нетрансформированной суррогатной нормальной ткани в контексте аллореактивности, мощного иммунного ответа, который лежит в основе отторжения трансплантата, GVHD и терапевтических ответов трансплантат против опухоли (GVT). Кроме того, чтобы исследовать влияние iCAR на эндогенные управляемые TCR ответы первичных T-клеток человека, разработали модель аллореактивности (фигура 11A) с использованием аллогенных дендритных клеток (DC) в качестве праймирующих антигенпрезентирующих клеток и фибробластов, изогенных для DC, в качестве мишеней (фигура 11A). В такой модели сконструированные T-клетки с iCAR или Pdel праймировали полученными из моноцитов дендритными клетками (moDC), которые являются чрезвычайно сильными стимуляторами эндогенного T-клеточного рецептора (TCR), и затем оценивали против фибробластов, экспрессирующих или не экспрессирующих антиген PSMA. Чтобы получить пополняемые популяции фибробластов, изогенных по отношению к DC, без необходимости многократной биопсии кожи, получили индуцируемые плюрипотентные стволовые клетки (iPSC); стабильные линии клеток фибробластов, названные iPS-fib, получали из iPSC (фигуры 11B-D). В случае iPS-fib наблюдали репликативное старение и контактное ингибирование, и их можно было легко трансдуцировать, пересевать и имплантировать мышам NOD/с тяжелым комбинированным иммунодефицитом (SCID)/γc-, где они персистировали в течение недель без образования опухолей. Чтобы получить эффективные аллореактивные T-клетки с эндогенной TCR-специфичностью против iPS-fib, moDC импульсно экспонировали с лизатами изогенных iPS-fib. Такая система праймированных культур стимулировала мощную цитотоксичность и секрецию цитокинов в случае нескольких доноров T-клеток, продуцируя как CD4-, таки и CD8-управляемые ответы (фигуры 12A-C).
Чтобы исследовать способность iCAR ограничивать аллореактивность против клеток PSMA+, iCAR- или Pdel-экспрессирующие T-клетки, праймированные в двух раундах подвергнутыми импульсному воздействию moDC, сортировали и затем инкубировали совместно с iPS-fib или iPS-fib, экспрессирующими PSMA (фигура 13A) (36). Все группы T-клеток эффективно убивали iPS-fib, проявляя аллогенную цитотоксичность (фигуры 2A и 2B), но iCAR-позитивные T-клетки значимо ингибировали их способность убивать клетки iPS-fib-PSMA+ (фигура 2C). Цитотоксичность, обусловленная T-клетками, экспрессирующими основанный на PD-1 iCAR, снижалась вплоть до снижения на 95% при низких соотношениях эффектор/мишень (E/T). Так как цитотоксичность проявляется быстро и имеет низкий порог активации по сравнению с другими T-клеточными ответами, также анализировали секрецию цитокинов. PD-1-iCAR вызывали более сильное ингибирование секреции цитокинов (снижение от 79 до 88%), тогда как mutCTLA-4-iCAR вызывали снижение на 55-71% (фигура 2D-F). Полученные результаты свидетельствуют, что iCAR могут ограничивать реактивность зависимым от антигена образом.
3. iCAR функционирует стехиометрическим образом.
Исследовали, может ли PD-1 iCAR-P обеспечивать дифференциальные уровни ингибирования в зависимости от его уровня экспрессии или от уровня экспрессии антигена-мишени. Праймированные T-клетки сортировали в отношении высоких или низких уровней экспрессии PD-1 iCAR-P или Pdel и подвергали воздействию iPS-fib-PSMA (фигура 14A). Была обнаружена стехиометрическая взаимосвязь между T-клеточным цитолизом, высвобождением цитокинов и уровнем экспрессированного iCAR. T-клетки, отсортированные по низким уровням экспрессия PD-1 iCAR-P могут обеспечивать 50% ингибирование только до соотношений E/T 1:1, а высокие уровни экспрессии PD-1 iCAR-P обеспечивали возможность 80% ингибирования вплоть до соотношений E/T 8:1 и даже 50% ингибирование в случае соотношения 16:1 (фигуры 3A и 3B). Чтобы исследовать влияние уровня экспрессии антигена iCAR, iPS-fib сортировали в отношении высокой или низкой экспрессии PSMA и подвергали воздействию отсортированных T-клеток PD-1 iCAR-P (фигура 14B). iPS-fib с высокой экспрессией PSMA ингибировали, по меньшей мере, на 80% цитолиз и секрецию цитокинов T-клетками PD-1 iCAR-P в диапазоне соотношений E/T (от 1:1 до 4:1), тогда как iPS-fib с низкой экспрессией PSMA не могли обеспечить такой же уровень ингибирования (фигуры 3C и 3D).
4. iCAR ограничивают аллогенные ответы in vivo.
Чтобы исследовать, могут ли iCAR защищать ткань от опосредованной T-клетками элиминации in vivo, клетки iPS-fib-PSMA+ (которые также экспрессировали CBL) инъецировали внутрибрюшинно мышам NOD/SCID/γc- (фигура 14B). Клетки образовывали узелки, которые можно наблюдать с использованием визуализации биолюминесценции (BLI). Через пять дней после инъекции 1×106 клеток iPS-fib-PSMA+ мышей обрабатывали, используя 5×105 moDC-праймированных Pdel- или PD-1-iCAR-P-экспрессирующих T-клеток. В группе Pdel клетки iPS-fib-PSMA+ элиминировались со значимым снижением сигнала BLI (от 7- до 22-кратного), тогда как группа PD-1-iCAR-P была не способна избавиться от узелков с BLI, сходной с контрольными мышами, не обработанными T-клетками (фигуры 4A и 4B). Полученные результаты являются доказательством того, что iCAR могут ограничивать TCR-управляемый ответ специфичным для антигена образом in vivo.
5. iCAR могут ингибировать активирующие химерные рецепторы антигенов.
Чтобы исследовать влияние iCAR на модулирование активирующих CAR, использовали 19-28z, всесторонне охарактеризованный CAR второго поколения, используемый в настоящее время в клинических испытаниях; 19-28z обеспечивает активацию и костимуляцию CD28 в ответ на антиген CD19 (9, 34). Первичные T-клетки трансдуцировали рецепторами 19-28z CAR и iCAR-P, сортировали в отношении двойной экспрессии и высевали на ранее описанные искусственные антигенпрезентирующие клетки (AAPC), экспрессирующие CD19 или и CD19 и PSMA, соответственно, модельные ткани-мишени и нецелевые ткани (фигуры 13B и 15A). Химерный рецептор антигена 19-28z (CAR), который в настоящее время подвергается всесторонней характеристике в клинических испытаниях, использовали для получения сигналов активации и костимуляции в ответ на антиген CD19 (Brentjens et al., Blood, 2011. 118(18): 4817-28; Maher et al., Nature Biotechnology, 2002. 20(1): 70-75). Хотя в T-клетках из контрольных групп (отдельно 19-28z или 19-28z/Pdel) наблюдали сходную секрецию цитокинов на обоих AAPC, в случае iCAR-экспрессирующих T-клеток наблюдали заметное снижение секреции цитокинов при воздействии клеток по сравнению с целевыми клетками-мишенями (фигура 5A и 15B). PD-1 iCAR-P давали наиболее сильное снижение уровней цитокинов (от 71 до 89%), тогда как mutCTLA-4 iCAR-P вызывали меньшее снижение (от 48 до 67%), и LAG-3-, BTLA- и 2B4 iCAR-P вызывали ингибирование на 30%.
19-28z обеспечивает сильный сигнал к пролиферации CD19-экспрессирующими AAPC. Хотя T-клетки 19-28z/Pdel размножались сходным образом на любых AAPC, в случае T-клеток, экспрессирующих mutCTLA-4- или PD-1-iCAR, наблюдали пониженное накопление в присутствии нецелевых AAPC, при этом PD-1 iCAR-P вызывали суммарное снижение на 90% накопления T-клеток после второй стимуляции AAPC (фигуры 5B, 5C и 15C). Так как была показана способность iCAR блокировать секрецию цитокинов и пролиферацию T-клеток, iCAR оценивали в отношении их влияния на цитотоксичность, которая осуществляется быстро и имеет более низкий порог активации, чем другие T-клеточные функции. В такой системе совместного культивирования с использованием количественной микроскопии исследовали судьбу таких AAPC, которые были модифицированы для дополнительной экспрессии mCherry (фигура 5D). В течение периода времени, составляющего 38 часов, все группы 19-28z/iCAR-P и контрольных дважды позитивных T-клеток лизировали клетки-мишени (фигура 5E). При экспозиции с нецелевыми клетками CD19+PSMA+ основанные на mutCTLA-4 и PD-1 iCAR вызывали 67 и 91% снижение цитотоксичности, соответственно (фигура 5F). В случае PD-1 клетки AAPC персистировали в течение 5 дней, тогда как влияние mutCTLA-4 iCAR было более ограниченным (фигура 5D). Поэтому основанные на PD-1 iCAR были выбраны для дальнейшей оценки in vivo.
Чтобы оценить функцию PD-1 iCAR in vivo, оценивали NALM/6, линию клеток B-клеточного лейкоза CD19+, с PSMA, и терапевтические T-клеточные ответы сравнивали с клетками NALM/6 и NALM/6-PSMA в ранее разработанной мышиной модели ксенотрасплантатов NOD/SCID/γc- (Markley et al., Blood, 2010. 115(17): 3508-19; Brentjens et al., Clin. Cancer Res., 2007. 13(18:1): 5426-35) (фигура 15D). Через пять дней после системной инфузии опухоли мышей обрабатывали одной дозой 3×105 отсортированных по 19-28z/PD-1-iCARP дважды позитивных T-клеток. Биолюминесцентная визуализация (BLI) опухолевой нагрузки показала значимые различия (снижение в 3-10 раз) в уничтожении NALM/6-PSMA (нецелевые) по сравнению с NALM/6 (целевые) (фигуры 6A и 6B). Хотя NALM/6-лейкоз исходно ограничен костным мозгом, в конечном счете он проникает в селезенку, масса которой является показателем поздней стадии патологической нагрузки. После обработки T-клетками 19-28z/PD-1-iCAR-P у мышей NALM/6-PSMA не наблюдали значимых различий в массе селезенки по сравнению с контрольной группой «без T-клеток», но массы селезенки у мышей с NALM/6 были в 2,6 раза меньше (фигура 6C). Проточно-цитометрические анализы подтвердили уменьшенное количество NALM/6-клеток в селезенке и костном мозге, в отличие от группы NALM/6-PSMA (фигуры 6D и 6E). Параллельно была обнаружена более длительная персистенция T-клеток в группе NALM/6, чем в группе NALM/6-PSMA (фигуры 6D и 6F). Полученные данные свидетельствуют, что основанный на PD-1 iCAR избирательно предотвращает элиминацию «нецелевых» клеток NALM/6-PSMA in vivo, при этом обеспечивая возможность осуществления терапевтического ответа против «целевых» клеток NALM/6.
6. iCAR функционируют временным и обратимым образом
Привлекательным аспектом клинического применения iCAR является функциональная обратимость, то есть, вновь появление T-клеточной функциональности после предыдущего контакта с ингибирующей нецелевой тканью. Эффективное распознавание PSMA рецепторами iCAR было показано на основании образования конъюгата iCAR-экспрессирующих T-клеток с клетками EL4, экспрессирующими PSMA, но не с клетками EL4 дикого типа (фигура 16FA). Конститутивная экспрессия iCAR не ослабляет пролиферативную способность T-клеток (активация после CD3/CD28-шариков или DC), секрецию цитокинов или экспрессию поверхностных маркеров по сравнению с контрольными T-клетками (фигуры 16A-E и 16G-I). Чтобы оценить временные характеристики iCAR-опосредованного ингибирования осуществляли последовательную стимуляцию T-клеток целевыми и нецелевыми клетками, чтобы проанализировать эффективность убивания, секреции цитокинов и пролиферации в четырех разных последовательностях. На T-клетки 19-28z/Pdel или 19-28z/PD-1-iCAR-P воздействовали либо целевыми (CD19+), либо нецелевыми (CD19+PSMA+) AAPC в качестве первой стимуляции, затем экспонировали с любыми из AAPC при второй стимуляции (фигура 7A). После второй стимуляции обе группы T-клеток убивали клетки-мишени одинаково хорошо, независимо от мишени при первой стимуляции (фигура 7B), подтверждая, что T-клетки 19-28z/iCAR-P, экспонированные с нецелевыми клетками при первой стимуляции убивали клетки-мишени и пролиферировали во время второй стимуляции также, как T-клетки, которые были экспонированы с клетками-мишенями при обоих случаях стимуляции. Контрольные T-клетки, экспрессирующие 19-28z/Pdel, не проявляли пониженной функциональности в таких же условиях. Кроме того, T-клетки, которые были активированы при первой стимуляции, все еще могли быть ингибированы при воздействии лиганда iCAR, презентируемого нецелевыми AAPC при второй стимуляции, что свидетельствует о том, что iCAR могут регулировать активированную T-клетку. Также наблюдали, что T-клетки, на которые воздействовали нецелевыми клетками, в обоих случаях стимуляции подвергались более высокой степени ингибирования их киллерной способности при второй экспозиции (фигуры 7C и 7D).
Подтверждая полученные функциональные данные, авторы обнаружили, что в PD-1 iCAR, 19-28z/Pdel и 19-28z/PD-1-iCAR-P дважды позитивных T-клетках дифферециально фосфорилировались регуляторные фосфатазы SHP-1 и SHP-2 (фигуры 17A-C). При воздействии целевыми AAPC CD19+ наблюдали более низкие уровни фосфорилирования SHP-1 и SHP-2 по сравнению с базовыми уровнями, наблюдаемыми после воздействия AAPC, в которых отсутствует CD19, что согласуется с более ранними исследованиями, демонстрирующими дефосфорилирование и последующую блокаду супрессирующих эффектов SHP-1/2 при активации T-клеток (39, 40). Напротив, после экспозиции с нецелевыми AAPC, экспрессирующими CD19 и PSMA, наблюдали повышенные уровни фосфорилирования SHP-1 и SHP-2, что свидетельствует о том, что PD-1 iCAR привлекает такие же биохимические пути, что и эндогенная молекула PD-1.
7. T-клетки с двойной экспрессией iCAR и CAR различают мишени in vitro и in vivo.
Оценивали, могут ли T-клетки, экспрессирующие основанный на PD-1 iCAR отличать клетки-мишени in vitro и особенно in vivo, защищая нецелевые клетки в присутствии клеток-мишеней в одном и том же организме. Такая программа действий сначала была направлена на систему совместного культивирования in vitro, в которой смешивали APCC-мишени GFP+CD19+ и нецелевые AAPC mCherry+CD19+PSMA+ в соотношении 1:1. Осуществляли цейтраферную микроскопию, чтобы проанализировать влияние T-клеток 19-28z/Pdel или 19-28z/iCAR-P. И клетки-мишени и нецелевые клетки подвергались элиминации со сходной скоростью T-клетками 19-28z/Pdel, но T-клетки 19-28z/iCAR-P предпочтительно элиминировали клетки-мишени, щадя нецелевые клетки (фигура 8A). Перекрестные эксперименты с использованием трансдуцированных люциферазой жука-щелкуна (CBL) вариантов AAPC применяли для количественной оценки такой избирательности. Во временной точке 38 часов T-клетки 19-28z/iCAR-P элиминировали большинство (85%) AAPC-мишеней и только небольшую часть (10%) нецелевых клеток, подтверждая результаты цейтраферной микроскопии (фигура 8B).
Чтобы проанализировать, может ли быть достигнута такая же избирательность in vivo, мышам NOD/SCID/γc- инъецировали смесь опухолевых клеток NALM/6 и NALM/6-PSMA, и таких животных обрабатывали 19-28z- или 19-28z/iCAR-P-трансдуцированными T-клетками. После умерщвления у мышей, обработанных T-клетками 19-28z, наблюдали трехкратное снижение количества клеток PSMA+ в селезенке и костном мозге по сравнению с мышами, обработанными T-клетками 19-28z/iCAR-P (фигуры 8C и 8D). Соответственно, iCAR-обработанная группа имела увеличение массы селезенки в 3,3 раза и общую повышенную опухолевую нагрузку (фигура 8E). Описанные эксперименты демонстрируют, что в присутствии смеси целевых и нецелевых клеток iCAR может избирательно защищать нецелевые клетки, не отменяя отторжение целевых клеток, как in vivo, так и in vitro.
ОБСУЖДЕНИЕ
В данном примере был выбран генетический способ для ограничения специфичности T-клеток, и было показано, что могут быть сконструированы T-клетки, имеющие эндогенный регуляторный направляющий к мишени механизм для доставки специфичного для опухоли иммунотерапевтического средства. Домен распознавания антигена успешно объединяли с доменами передачи сигналов иммуноингибирующих рецепторов CTLA-4 и PD-1, чтобы добиться специфичной для антигена супрессии цитотоксичности, высвобождения цитокинов и пролиферации T-клеток. Такое исследование для доказательства правильности концепции демонстрирует возможности применения iCAR в качестве методики ограничения функции T-клеток в местах вне мишени и таким образом отвлечения иммунных ответов от непредусмотренных тканей-мишеней.
Ключевой момент в методике iCAR основан на трех важных свойства. Первой заключается в том, что базовая экспрессия iCAR не ингибирует функцию T-клеток в отсутствие антигена. Эндогенная передача сигнала CTLA-4 или PD-1 требует присутствия соответствующих лигандов для проявления их действия. Подобным образом, было обнаружено, что экспрессия iCAR, описанных в настоящей публикации, не влияет на базовые функции T-клеток. Другие ингибирующие рецепторы, которые ограничены подгруппами T-клеток, могут действовать совместно, осуществляя тонкую настройку регуляции T-клеточных ответов (21, 22). Такие рецепторы, как LAG-3, 2B4, и BTLA и их сочетания (например, в виде одного iCAR второго поколения с несколькими объединенными цитоплазматическими доменами) требуют дальнейшего исследования.
Вторым ключевым свойством является сохранение T-клеточной функциональности, несмотря на предыдущий контакт iCAR. Было обнаружено, что iCAR-трансдуцированные T-клетки все еще могут формировать ответ против антигена-мишени после предварительного воздействия ингибирующего антигена. Такая обратимость напоминает поведение клеток природных киллеров, при котором состояние фосфорилирования молекул передачи сигналов, а не изменения транскрипции регулируют быстрые функциональные ответы, такие как цитотоксичность (41). Анти-PD-1- и анти-CTLA-4-антитела способны обратимо изменять нарушенную функцию анергизованных или истощенных T-клеток, что также свидетельствует в пользу возможности временно регулировать T-клеточные ответы (22). Кроме того, биохимические анализы показали, что влияние PD-1 и CTLA-4 на комплекс TCR зависит от состояния фосфорилирования, лежащих ниже киназ и подвижности, а не апоптоза (40, 42-44). Хотя результаты, полученные как in vitro, так и in vivo, продемонстрировали ингибирование в ответ на нецелевые клетки с длительной терапевтической функциональностью, все еще существует вероятность, что некоторые из клеток могут становиться анергичными с течением времени (42). В конечном итоге, T-клеточная инфузия является стохастической, при этом некоторые T-клетки быстро сталкиваются со своей мишенью и элиминируют ее, тогда как другие T-клетки будут сначала сталкиваться с ингибирующими клеткам. Вполне возможно, что T-клетки, которые неоднократно сталкиваются с нецелевыми клетками, не будут размножаться для получения удовлетворительного результата в случае методики iCAR, целью которой является обеспечение возможности осуществления терапевтических ответов при снижении иммунной атаки, направленной против нормальных тканей. Общая экспансия популяции инфузированных T-клеток будет интегрировать такие разные пути, имеющие место на клональном уровне, при этом некоторые T-клетки будут подвергаться размножению, тогда как другие будут подавлены, что вероятно приведет к исчезновению всех инфузированных T-клеток с течением времени. В экспериментальных условиях достаточное количество T-клеток персистировало в течение 3 недель, чтобы элиминировать опухоль-мишень. В таком случае, при необходимости может быть осуществлена вторая или третья инфузия T-клеток, которые могут клинически полезными, как обсуждается в другой публикации (9). Конечную индукцию анергии и элиминации клонов в качестве средства защиты нецелевых тканей при обеспечении возможности протекания элиминации опухоли следует противопоставить методике на основе суицидных генов, при которой неблагоприятная реактивность должна проявляться сама по себе до запуска T-клеточной элиминации, что также приводит к прекращению терапевтических ответов.
iCAR-опосредованный иммунный ответ полезен для того, чтобы контролировать болезнь трансплантат против хозяина после инфузии лимфоцитов донора в случае лечения злокачественной опухоли и хронических инфекций (в частности, с учетом полезных свойств DLI с ограниченной токсичностью). Кроме того, iCAR полезны для осуществления контроля токсичности на мишени/вне ткани сконструированных адоптивных T-клеток в случае лечения злокачественной опухоли и хронических инфекций. Это повышает возможность возрождения перспективных терапевтических средств, которые имеют неприемлемые профили токсичности, такие как непредусмотренное распознавание в сердце и легком после адоптивной T-клеточной терапии. Таким образом, iCAR обеспечивают новую методику разработки безопасных и эффективных T-клеточных терапевтических средств как в аутологичных, так и в аллогенных условиях.
В-третьих, основанный на iCAR способ является специфичным для антигена и поэтому требует наличия способности идентифицировать тканеспецифичные антигены-мишени, которые отсутствуют или подвергаются понижающей регуляции в опухоли, но экспрессируются нецелевыми тканями вне мишени. Такой вопрос не так широко исследован, как поиск опухолевых антигенов, хотя делаются попытки охарактеризовать репертуар поверхностных белков «surfaceome» всех тканей человека, например база данных «Атлас белков» (Protein Atlas) (45). Одной из методик является применение широкого класса поверхностных антигенов, которые подвергаются понижающей регуляции на опухолевых клетках. Один пример представляют молекулы лейкоцитарных антигенов человека (HLA), которые встречаются практически во всех типах клеток, но подвергаются понижающей регуляции в опухолях в качестве механизма ускользания от T-клеточных иммунных ответов (46). Таким образом, аллогенные T-клетки, экспрессирующие iCAR против молекулы HLA хозяина, которая подвергается понижающей регуляции в опухоли, может избирательно стимулировать GVT-эффект. Способ на основе iCAR может представлять особый интерес в условиях DLI в качестве средства защиты тканей-мишеней GVHD без нарушения GVT-ответов. Другой класс антигенов, привлекательных для сходной методики включает супрессирующие опухоль антигены клеточной поверхности, такие как OPCML, HYAL2, DCC, и SMAR1 (47-49). OPCML-v1, например, широко экспрессируется во всех нормальных тканях взрослого организма и плода, но подвергается понижающей регуляции в лимфомах и злокачественной опухоли молочной железы и простаты. Было показано, что углеводы, липиды клеточной поверхности и посттрансляционные модификации, такие как O-гликаны муцинового типа (коровые 3 O-гликаны) подвергаются понижающей регуляции опухолями (50). Другим кандидатом-мишенью является E-кадгерин, который на высоком уровне экспрессируется в нормальной коже, печени и кишечнике, основным мишенях GVHD (51), но подвергается понижающей регуляции в опухолевых клетках, подвергающихся эпителиально-мезенхимальному переходу, свидетельствующему о прогрессировании и метастазировании опухоли (52).
Основным ограничением данного исследования является отсутствие надежно клинически значимой модели «нормальной ткани» человека, особенно такой, которая позволяет использовать клетки человека, антигены человека и TCR, CAR и iCAR человека. Была предпринята попытка восполнить такой пробел путем создания клеток iPS в сочетании с DC о того же донора, чтобы получить реакцию аллореактивности с использованием T-клеток человека, антигенов-мишеней человека и iCAR человека. Простое совместное культивирование совпадающих по HLA аллогенных T-клеток с клетками iPS или iPS-fib не давало аллореактивности. Использованием изогенных DC имело решающее значение для получения мощной аллореактивности. Природа такой аллореактивности не была определена, и следовательно возможно, что ответы, которые были заблокированы, не имеют отношения к механизмам, вовлеченным в GVHD.
Было показано, что уровень экспрессии iCAR имеет решающее значение. В условиях высокого уровня экспрессия активирующего рецептора или антигена и/или низкой экспрессии iCAR или являющегося мишенью iCAR антигена, достаточная блокада не может быть достигнута. На основании результатов большинства анализов iCAR снижал функцию T-клеток, но не отменял ее, редко превышая 90% ингибирование в любом из анализов. В случае применения методики iCAR в клинических условиях функциональность каждого iCAR необходимо оптимизировать на основе аффинности рецептора, уровня экспрессии рецептора (то есть силы промотора) и выбора подходящих антигенов-мишеней, отчасти на основе их уровня экспрессии. Также необходим баланс по отношению к активирующему рецептору, чтобы добиться ингибирования в местах вне мишени. В случае целенаправленной CAR-терапии, оптимизированное соотношение CAR/iCAR может быть достигнуто благодаря тщательному конструированию вектора.
В заключение, представлено доказательство концепции о том, что антиген-специфичные ингибирующие рецепторы могут успешно переключить пролиферацию, секрецию цитокинов и цитотоксичность T-клеток при контакте со специфичными антигенами клеточной поверхности, так, чтобы отвлечь T-клеточную цитотоксичность от одной ткани, при этом сохраняя важную эффекторную функцию, направленную против другой ткани, экспрессирующей такой же антиген. Это было показано на ответах, опосредованных либо TCR, либо CAR. Такой способ предотвращает или, по меньшей мере, снижает повреждение непредусмотренных тканей-мишеней и поэтому устраняет необходимость необратимой элиминации терапевтических T-клеток после развития неприемлемой токсичности. Такой способ влечет за собой смену парадигмы, и в способе использованы преимущества многогранной функциональности клеток в качестве лекарственных средств за счет применения синтетических рецепторов, которые направляют и обучают T-клетки осуществлять только полезные функции. Такой динамический переключатель предохранительный переключатель может иметь полезные применения в рамках терапии аутологичными и аллогенными T-клетками.
ССЫЛКИ
1. J. N. Blattman, P. D. Greenberg, Cancer immunotherapy: A treatment for the masses. Science 305, 200-205 (2004).
2. N. P. Restifo, M. E. Dudley, S. A. Rosenberg, Adoptive immunotherapy for cancer: Harnessing the T cell response. Nat. Rev. Immunol. 12, 269-281 (2012).
3. M. Sadelain, R. Brentjens, I. Rivière, The promise and potential pitfalls of chimeric antigen receptors. Curr. Opin. Immunol. 21, 215-223 (2009).
4. C. J. Turtle, M. Hudecek, M. C. Jensen, S. R. Riddell, Engineered T-cells for anti-cancer therapy. Curr. Opin. Immunol. 24, 633-639 (2012).
5. B. R. Blazar, W. J. Murphy, M. Abedi, Advances in graft-versus-host disease biology and therapy. Nat. Rev. Immunol. 12, 443-458 (2012).
6. T. M. Brusko, A. L. Putnam, J. A. Bluestone, Human regulatory T-cells: Role in autoimmune disease and therapeutic opportunities. Immunol. Rev. 223, 371-390 (2008).
7. M. Kalos, B. L. Levine, D. L. Porter, S. Katz, S. A. Grupp, A. Bagg, C. H. June, T-cells with chimeric receptor antigens have potent antitumor effects and can establish memory in patients with advanced leukemia. Sci. Transl. Med. 3, 95ra73 (2011).
8. R. J. Brentjens, I. Rivière, J. H. Park, M. L. Davila, X. Wang, J. Stefanski, C. Taylor, R. Yeh, S. Bartido, O. Borquez-Ojeda, M. Olszewska, Y. Bernal, H. Pegram, M. Przybylowski, D. Hollyman, Y. Usachenko, D. Pirraglia, J. Hosey, E. Santos, E. Halton, P. Maslak, D. Scheinberg, J. Jurcic, M. Heaney, G. Heller, M. Frattini, M. Sadelain, Safety and persistence of adoptively transferred autologous CD19-targeted T-cells in patients with relapsed или chemotherapy refractory B-cell leukemias. Blood 118, 4817-4828 (2011).
9. R. J. Brentjens, M. L. Davila, I. Riviere, J. Park, X. Wang, L. G. Cowell, S. Bartido, J. Stefanski, C. Taylor, M. Olszewska, O. Borquez-Ojeda, J. Qu, T. Wasielewska, Q. He, Y. Bernal, I. V. Rijo, C. Hedvat, R. Kobos, K. Curran, P. Steinherz, J. Jurcic, T. Rosenblat, P. Maslak, M. Frattini, M. Sadelain, CD19-targeted T-cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci. Transl. Med. 5, 177ra38 (2013).
10. R. A. Morgan, J. C. Yang, M. Kitano, M. E. Dudley, C. M. Laurencot, S. A. Rosenberg, Case report of a serious adverse event following the administration of T-cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol. Ther. 18, 843-851 (2010).
11. R. A. Morgan, N. Chinnasamy, D. Abate-Daga, A. Gros, P. F. Robbins, Z. Zheng, M. E. Dudley, S. A. Feldman, J. C. Yang, R. M. Sherry, G. Q. Phan, M. S. Hughes, U. S. Kammula, A. D. Miller, C. J. Hessman, A. A. Stewart, N. P. Restifo, M. M. Quezado, M. Alimchandani, A. Z. Rosenberg, A. Nath, T. Wang, B. Bielekova, S. C. Wuest, N. Akula, F. J. McMahon, S. Wilde, B. Mosetter, D. J. Schendel, C. M. Laurencot, S. A. Rosenberg, Cancer regression and neurological toxicity following anti-MAGE-A3 TCR gene therapy. J. Immunother. 36, 133-151 (2013).
12. B. J. Cameron, A. B. Gerry, J. Dukes, J. V. Harper, V. Kannan, F. C. Bianchi, F. Grand, J. E. Brewer, M. Gupta, G. Plesa, G. Bossi, A. Vuidepot, A. S. Powlesland, A. Legg, K. J. Adams, A. D. Bennett, N. J. Pumphrey, D. D. Williams, G. Binder-Scholl, I. Kulikovskaya, B. L. Levine, J. L. Riley, A. Varela-Rohena, E. A. Stadtmauer, A. P. Rapoport, G. P. Linette, C. H. June, N. J. Hassan, M. Kalos, B. K. Jakobsen, Identification of a Titin-derived HLA-A1-presented peptide as a cross-reactive target for engineered MAGE A3-directed T-cells. Sci. Transl. Med. 5, 197ra103 (2013).
13. G. P. Linette, E. A. Stadtmauer, M. V. Maus, A. P. Rapoport, B. L. Levine, L. Emery, L. Litzky, A. Bagg, B. M. Carreno, P. J. Cimino, G. K. Binder-Scholl, D. P. Smethurst, A. B. Gerry, N. J. Pumphrey, A. D. Bennett, J. E. Brewer, J. Dukes, J. Harper, H. K. Tayton-Martin, B. K. Jakobsen, N. J. Hassan, M. Kalos, C. H. June, Cardiovascular toxicity and titin cross-reactivity of affinity-enhanced T-cells in myeloma and melanoma. Blood 122, 863-871 (2013).
14. J. L. Ferrara, J. E. Levine, P. Reddy, E. Holler, Graft-versus-host disease. Lancet 373, 1550-1561 (2009).
15. E. Kotsiou, J. K. Davies, New ways to separate graft-versus-host disease and graft-versus tumour effects after allogeneic haematopoietic stem cell transplantation. Br. J. Haematol. 160, 133-145 (2013).
16. G. Akpek, S. M. Lee, V. Anders, G. B. Vogelsang, A high-dose pulse steroid regimen for controlling active chronic graft-versus-host disease. Biol. Blood Marrow Transplant. 7, 495-502 (2001).
17. M. T. Lupo-Stanghellini, E. Provasi, A. Bondanza, F. Ciceri, C. Bordignon, C. Bonini, Clinical impact of suicide gene therapy in allogeneic hematopoietic stem cell transplantation. Hum. Gene Ther. 21, 241-250 (2010).
18. A. Di Stasi, S. K. Tey, G. Dotti, Y. Fujita, A. Kennedy-Nasser, C. Martinez, K. Straathof, E. Liu, A. G. Durett, B. Grilley, H. Liu, C. R. Cruz, B. Savoldo, A. P. Gee, J. Schindler, R. A. Krance, H. E. Heslop, D. M. Spencer, C. M. Rooney, M. K. Brenner, Inducible apoptosis as a safety switch for adoptive cell therapy. N. Engl. J. Med. 365, 1673-1683 (2011).
19. I. Vogler, S. Newrzela, S. Hartmann, N. Schneider, D. von Laer, U. Koehl,M. Grez, An improved bicistronic CD20/tCD34 vector for efficient purification and in vivo depletion of gene-modified T-cells for adoptive immunotherapy. Mol. Ther. 18, 1330-1338 (2010).
20. E. Kieback, J. Charo, D. Sommermeyer, T. Blankenstein, W. Uckert, A safeguard eliminates T cell receptor gene-modified autoreactive T-cells after adoptive transfer. Proc. Natl. Acad. Sci. U.S.A. 105, 623-628 (2008).
21. D. M. Pardoll, The blockade of immune checkpoints in cancer Immunotherapy. Nat. Rev. Cancer 12, 252-264 (2012).
22. P. Sharma, K. Wagner, J. D. Wolchok, J. P. Allison, Novel cancer immunotherapy agents with survival benefit: Recent successes and next steps. Nat. Rev. Cancer 11, 805-812 (2011).
23. E. A. Tivol, F. Borriello, A. N. Schweitzer, W. P. Lynch, J. A. Bluestone, A. H. Sharpe, Loss of CTLA-4 leads to massive lymphoproliferation and fatalmultiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity 3, 541-547 (1995).
24. H. Nishimura, M. Nose, H. Hiai, N. Minato, T. Honjo, Development of lupus-like autoimmune diseases by disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity 11, 141-151 (1999).
25. J. Wang, T. Yoshida, F. Nakaki, H. Hiai, T. Okazaki, T. Honjo, Establishment of NOD-Pdcd1-/-mice as an efficient animal model of type I diabetes. Proc. Natl. Acad. Sci. U.S.A. 102, 11823-11828 (2005).
26. R. V. Parry, J. M. Chemnitz, K. A. Frauwirth, A. R. Lanfranco, I. Braunstein, S. V. Kobayashi, P. S. Linsley, C. B. Thompson, J. L. Riley, CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Mol. Cell. Biol. 25, 9543-9553 (2005).
27. S. L. Topalian, F. S.Hodi, J. R. Brahmer, S. N. Gettinger, D. C. Smith,D. F. McDermott, J. D. Powderly, R. D. Carvajal, J. A. Sosman, M. B. Atkins, P. D. Leming, D. R. Spigel, S. J. Antonia, L. Horn, C. G. Drake, D. M. Pardoll, L. Chen, W. H. Sharfman, R. A. Anders, J. M. Taube, T. L. McMiller, H. Xu, A. J. Korman, M. Jure-Kunkel, S. Agrawal, D. McDonald,G. D. Kollia, A. Gupta, J. M. Wigginton, M. Sznol, Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N. Engl. J. Med. 366, 2443-2454 (2012).
28. F. S. Hodi, S. J. O'Day, D. F. McDermott, R. W. Weber, J. A. Sosman, J. B. Haanen, R. Gonzalez, C. Robert, D. Schadendorf, J. C. Hassel, W. Akerley, A. J. van den Eertwegh, J. Lutzky, P. Lorigan, J. M. Vaubel, G. P. Linette, D. Hogg, C. H. Ottensmeier, C. Lebbé, C. Peschel, I. Quirt, J. I. Clark, J. D. Wolchok, J. S. Weber, J. Tian, M. J. Yellin, G. M. Nichol, A. Hoos, W. J. Urba, Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med. 363, 711-723 (2010).
29. V. A. Pedicord, W. Montalvo, I. M. Leiner, J. P. Allison, Single dose of anti-CTLA-4 enhances CD8+ T-cell memory formation, function, and maintenance. Proc. Natl. Acad. Sci. U.S.A. 108, 266-271 (2011).
30. V. Velu, K. Titanji, B. Zhu, S. Husain, A. Pladevega, L. Lai, T. H. Vanderford, L. Chennareddi, G. Silvestri, G. J. Freeman, R. Ahmed, R. R. Amara, Enhancing SIV-specific immunity in vivo by PD-1 blockade. Nature 458, 206-210 (2009).
31. T. P. Gade, W. Hassen, E. Santos, G. Gunset, A. Saudemont, M. C. Gong, R. Brentjens, X. S. Zhong, M. Stephan, J. Stefanski, C. Lyddane, J. R. Osborne, I. M. Buchanan, S. J. Hall, W. D. Heston, I. Rivière, S. M. Larson, J. A. Koutcher, M. Sadelain, Targeted elimination of prostate cancer by genetically directed human T lymphocytes. Cancer Res. 65, 9080-9088 (2005).
32. M. Sadelain, R. Brentjens, I. Rivière, The basic principles of chimeric antigen receptor design. Cancer Discov. 3, 388-398 (2013).
33. Y. Kinoshita, K. Kuratsukuri, S. Landas, K. Imaida, P. M. Rovito Jr., C. Y. Wang, G. P. Haas, Expression of prostate-specific membrane antigen in normal and malignant human tissues. World J. Surg. 30, 628-636 (2006).
34. J. Maher, R. J. Brentjens, G. Gunset, I. Rivière, M. Sadelain, Human T- lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRz/CD28 receptor. Nat. Biotechnol. 20, 70-75 (2002).
35. W. A. Teft, M. G. Kirchhof, J. Madrenas, A molecular perspective of CTLA-4 function. Annu. Rev. Immunol. 24, 65-97 (2006).
36. X. Fu, L. Tao, A. Rivera, S. Williamson, X. T. Song, N. Ahmed, X. Zhang, A simple and sensitive method for measuring tumor-specific T cell cytotoxicity. PLOS One 5, e11867 (2010).
37. R. J. Brentjens, E. Santos, Y. Nikhamin, R. Yeh, M. Matsushita, K. La Perle, A. QuintásCardama, S. M. Larson, M. Sadelain, Genetically targeted T-cells eradicate systemic acute lymphoblastic leukemia xenografts. Clin. Cancer Res. 13, 5426-5435 (2007).
38. J. C. Markley, M. Sadelain, IL-7 and IL-21 are superior to IL-2 and IL-15 in promoting human T cell-mediated rejection of systemic lymphoma in immunodeficient mice. Blood 115, 3508-3519 (2010).
39. J. M. Chemnitz, R. V. Parry, K. E. Nichols, C. H. June, J. L. Riley, SHP-1 and SHP-2 associate with immunoreceptor tyrosine-based switch motif of programmed death 1 upon primary human T cell stimulation, but only vector ligation prevents T cell ctivation. J. Immunol. 173, 945-954 (2004).
40. T. Yokosuka, M. Takamatsu, W. Kobayashi-Imanishi, A. Hashimoto-Tane, M. Azuma, T. Saito, Programmed cell death 1 forms negative costimulatory microclusters that directly inhibit T cell receptor signaling by recruiting phosphatase SHP2. J. Exp. Med. 209, 1201-1217 (2012).
41. Y. T. Bryceson, E. O. Long, Line of attack: NK cell specificity and integration of signals. Curr. Opin. Immunol. 20, 344-352 (2008).
42. S. Amarnath, C. W. Mangus, J. C. Wang, F. Wei, A. He, V. Kapoor, J. E. Foley, P. R. Massey, T. C. Felizardo, J. L. Riley, B. L. Levine, C. H. June, J. A. Medin, D. H. Fowler, The PDL1-PD1 axis converts human TH1 cells into regulatory T-cells. Sci. Transl. Med. 3, 111ra120 (2011).
43. K. S. Peggs, S. A. Quezada, J. P. Allison, Cell intrinsic mechanisms of T-cell inhibition and application to cancer therapy. Immunol. Rev. 224, 141-165 (2008).
44. C. E. Rudd, The reverse stop-signal model for CTLA4 function. Nat. Rev. Immunol. 8, 153-160 (2008).
45. M. Uhlen, P. Oksvold, L. Fagerberg, E. Lundberg, K. Jonasson, M. Forsberg, M. Zwahlen, C. Kampf, K. Wester, S. Hober, H. Wernerus, L. Björling, F. Ponten, Towards a knowledge-based Human Protein Atlas. Nat. Biotechnol. 28, 1248-1250 (2010).
46. M. Campoli, S. Ferrone, HLA antigen changes in malignant-cells: Epigenetic mechanisms and biologic significance. Oncogene 27, 5869-5885 (2008).
47. Y. Cui, Y. Ying, A. van Hasselt, K. M. Ng, J. Yu, Q. Zhang, J. Jin, D. Liu, J. S. Rhim, S. Y. Rha, M. Loyo, A. T. Chan, G. Srivastava, G. S. Tsao, G. C. Sellar, J. J. Sung, D. Sidransky, Q. Tao, OPCML is a broad tumor suppressor for multiple carcinomas and lymphomas with frequently epigenetic inactivation. PLOS One 3, e2990 (2008).
48. K. Singh, D. Mogare, R. O. Giridharagopalan, R. Gogiraju, G. Pande, S. Chattopadhyay, p53 target gene SMAR1 is dysregulated in breast cancer: Its role in cancer cell migration and invasion. PLOS One 2, e660 (2007).
49. L. Meimei, L. Peiling, L. Baoxin, L. Changmin, Z. Rujin, H. Chunjie, Lost expression of DCC gene in ovarian cancer and its inhibition in ovarian cancer cells. Med. Oncol. 28, 282-289 (2011).
50. S. Tsuboi, S. Hatakeyama, C. Ohyama, M. Fukuda, Two opposing roles of O-glycans in tumor metastasis. Trends Mol. Med. 18, 224-232 (2012).
51. B. Tsuchiya, Y. Sato, T. Kameya, I. Okayasu, K. Mukai, Differential expression of N-cadherin and E-cadherin in normal human tissues. Arch. Histol. Cytol. 69, 135-145 (2006).
52. C. L. Chaffer, R. A. Weinberg, A perspective on cancer cell metastasis. Science 331, 1559-1564 (2011).
53. M. T. Stephan, V. Ponomarev, R. J. Brentjens, A. H. Chang, K. V. Dobrenkov, G. Heller, M. Sadelain, T cell-encoded CD80 and 4-1BBL induce auto- and transcostimulation, resulting in potent tumor rejection. Nat. Med. 13, 1440-1449 (2007).
54. D. N. Burshtyn, C. Davidson, Natural killer cell conjugate assay using two-color flow cytometry. Methods Mol. Biol. 612, 89-96 (2010).
55. M. Themeli, C. C. Kloss, G. Ciriello, V. D. Fedorov, F. Perna, M. Gonen, M. Sadelain, Generation of tumor-targeted human T lymphocytes from induced pluripotent stem cells for cancer therapy. Nat. Biotechnol. 31, 928-933 (2013).
56. J. Yuan, J. B. Latouche, J. L. Reagan, G. Heller, I. Riviere, M. Sadelain, J. W. Young, Langerhans cells derived from genetically modified human CD34+ hemopoietic progenitors are more potent than peptide-pulsed Langerhans cells for inducing antigen-specific CD8+ cytolytic T lymphocyte responses. J. Immunol. 174, 758-766 (2005).
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Исходя из приведенного выше описания будет понятно, что могут быть осуществлены изменения и модификации изобретения, описанного в настоящей публикации, чтобы адаптировать его к различным применениям и условиям. Такие варианты осуществления также входят в объем следующей далее формулы изобретения.
Перечисление списка элементов в любом определении переменной в настоящем описании включает определения такой переменной как любого одного элемента или сочетания (или субкомбинаций) перечисленных элементов. Указание варианта осуществления в настоящем описании включает такой вариант в виде одного варианта или в виде сочетания с любыми другими вариантами или их частями.
Некоторые из предметов настоящей заявки могут быть связаны с заявкой на выдачу патента США № 12/593751, которая является заявкой США, переведенной на национальную фазу согласно 35 U.S.C. §371, международной заявки на выдачу патента №: PCT/US2008/004251, поданной 8 марта 2010 г., которая притязает на приоритет на основании предварительной заявки на выдачу патента США № 60/921144, поданной 30 марта 2007 г., описание которых включено в настоящее описание путем ссылки в полном объеме.
Все патенты и публикации, упоминаемые в настоящем описании, включены в описание путем ссылки в такой же степени, как в случае, когда специально и отдельно указано, что каждый независимый патент и публикация включены путем ссылки.
ПРИЛОЖЕНИЕ A
Последовательность нуклеиновой кислоты «P-PD1tm-PD1». «P-PD1tm-PD1» является iCAR, содержащим трансмембранный домен PD-1, цитоплазматический домен PD-1 и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcAgagagaagggcagaagtgcccacagcccaccccagcccctcacccaggccagccggccagttccaaaccctggtggttggtgtcgtgggcggcctgctgggcagcctggtgctgctagtctgggtcctggccgtcatctgctcccgggccgcacgagggacaataggagccaggcgcaccggccagcccctgaaggaggacccctcagccgtgcctgtgttctctgtggactatggggagctggatttccagtggcgagagaagaccccggagccccccgtgccctgtgtccctgagcagacggagtatgccaccattgtctttcctagcggaatgggcacctcatcccccgcccgcaggggctcagccgacggccctcggagtgcccagccactgaggcctgaggatggacactgctcttggcccctctga [SEQ ID NO: 16].
Аминокислотная последовательность «P-PD1tm-PD1»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAAERRAEVPTAHPSPSPRPAGQFQTLVVGVVGGLLGSLVLLVWVLAVICSRAARGTIGARRTGQPLKEDPSAVPVFSVDYGELDFQWREKTPEPPVPCVPEQTEYATIVFPSGMGTSSPARRGSADGPRSAQPLRPEDGHCSWPL [SEQ ID NO: 17].
Последовательность нуклеиновой кислоты «P-CTLA-4tm-CTLA-4wt». «P-CTLA-4tm-CTLA-4wt» является iCAR, содержащим трансмембранный домен CTLA-4, цитоплазматический домен CTLA-4 дикого типа и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACTGGGCATAGGCAACGGAACCCAGATTTATGTAATTGATCCAGAACCGTGCCCAGATTCTGACTTCCTCCTCTGGATCCTTGCAGCAGTTAGTTCGGGGTTGTTTTTTTATAGCTTTCTCCTCACAGCTGTTTCTTTGAGCAAAATGCTAAAGAAAAGAAGCCCTCTTACAACAGGGGTCTATGTGAAAATGCCCCCAACAGAGCCAGAATGTGAAAAGCAATTTCAGCCTTATTTTATTCCCATCAATTGA [SEQ ID NO: 18].
Аминокислотная последовательность «P-CTLA-4tm-CTLA-4wt»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAALGIGNGTQIYVIDPEPCPDSDFLLWILAAVSSGLFFYSFLLTAVSLSKMLKKRSPLTTGVYVKMPPTEPECEKQFQPYFIPIN [SEQ ID NO: 19].
Последовательность нуклеиновой кислоты «P-CTLA-4tm-CTLA-4mut». «P-CTLA-4tm-CTLA-4mut» является iCAR, содержащим мутантный трансмембранный домен CTLA-4 (Y165G-мутант), цитоплазматический домен CTLA-1 и целевой svFV PSMA. Также получены два других мутантных варианта CTLA-4: Y182G-мутант и Y165G- и Y182G-мутант
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACTGGGCATAGGCAACGGAACCCAGATTTATGTAATTGATCCAGAACCGTGCCCAGATTCTGACTTCCTCCTCTGGATCCTTGCAGCAGTTAGTTCGGGGTTGTTTTTTTATAGCTTTCTCCTCACAGCTGTTTCTTTGAGCAAAATGCTAAAGAAAAGAAGCCCTCTTACAACAGGGGTCGGTGTGAAAATGCCCCCAACAGAGCCAGAATGTGAAAAGCAATTTCAGCCTTATTTTATTCCCATCAATTGA [SEQ ID NO: 20].
Аминокислотная последовательность «P-CTLA-4tm-CTLA-4mut»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAALGIGNGTQIYVIDPEPCPDSDFLLWILAAVSSGLFFYSFLLTAVSLSKMLKKRSPLTTGVGVKMPPTEPECEKQFQPYFIPIN [SEQ ID NO:21].
Последовательность нуклеиновой кислоты «P-LAG3tm-LAG3». «P-LAG3tm-LAG3» является iCAR, содержащим трансмембранный домен LAG3, цитоплазматический домен LAG3 и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACTTGGAGCAGCAGTGTACTTCACAGAGCTGTCTAGCCCAGGTGCCCAACGCTCTGGGAGAGCCCCAGGTGCCCTCCCAGCAGGCCACCTCCTGCTGTTTCTCATCCTTGGTGTCCTTTCTCTGCTCCTTTTGGTGACTGGAGCCTTTGGCTTTCACCTTTGGAGAAGACAGTGGCGACCAAGACGATTTTCTGCCTTAGAGCAAGGGATTCACCCTCCGCAGGCTCAGAGCAAGATAGAGGAGCTGGAGCAAGAACCGGAGCCGGAGCCGGAGCCGGAACCGGAGCCCGAGCCCGAGCCCGAGCCGGAGCAGCTCTGA [SEQ ID NO:22].
Аминокислотная последовательность «P-LAG3tm-LAG3»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAALGAAVYFTELSSPGAQRSGRAPGALPAGHLLLFLILGVLSLLLLVTGAFGFHLWRRQWRPRRFSALEQGIHPPQAQSKIEELEQEPEPEPEPEPEPEPEPEPEQL [SEQ ID NO: 23].
Последовательность нуклеиновой кислоты «P-BTLAtm-BTLA». «P-BTLAtm-BTLA» является iCAR, содержащим трансмембранный домен BTLA, цитоплазматический домен BTLA и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcAGATGTAAAAAGTGCCTCAGAACGACCCTCCAAGGACGAAATGGCAAGCAGACCCTGGCTCCTGTATAGTTTACTTCCTTTGGGGGGATTGCCTCTACTCATCACTACCTGTTTCTGCCTGTTCTGCTGCCTGAGAAGGCACCAAGGAAAGCAAAATGAACTCTCTGACACAGCAGGAAGGGAAATTAACCTGGTTGATGCTCACCTTAAGAGTGAGCAAACAGAAGCAAGCACCAGGCAAAATTCCCAAGTACTGCTATCAGAAACTGGAATTTATGATAATGACCCTGACCTTTGTTTCAGGATGCAGGAAGGGTCTGAAGTTTATTCTAATCCATGCCTGGAAGAAAACAAACCAGGCATTGTTTATGCTTCCCTGAACCATTCTGTCATTGGACCGAACTCAAGACTGGCAAGAAATGTAAAAGAAGCACCAACAGAATATGCATCCATATGTGTGAGGAGTTAA [SEQ ID NO: 24].
Аминокислотная последовательность «P-BTLAtm-BTLA»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAADVKSASERPSKDEMASRPWLLYSLLPLGGLPLLITTCFCLFCCLRRHQGKQNELSDTAGREINLVDAHLKSEQTEASTRQNSQVLLSETGIYDNDPDLCFRMQEGSEVYSNPCLEENKPGIVYASLNHSVIGPNSRLARNVKEAPTEYASICVRS [SEQ ID NO:25].
Последовательность нуклеиновой кислоты «P-2B4tm-2B4». «P-2B4tm-2B4» является iCAR, содержащим трансмембранный домен 2B4, цитоплазматический домен 2B4 и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACAGGACTGTCAGAATGCCCATCAGGAATTCAGATTTTGGCCGTTTTTGGTGATCATCGTGATTCTAAGCGCACTGTTCCTTGGCACCCTTGCCTGCTTCTGTGTGTGGAGGAGAAAGAGGAAGGAGAAGCAGTCAGAGACCAGTCCCAAGGAATTTTTGACAATTTACGAAGATGTCAAGGATCTGAAAACCAGGAGAAATCACGAGCAGGAGCAGACTTTTCCTGGAGGGGGGAGCACCATCTACTCTATGATCCAGTCCCAGTCTTCTGCTCCCACGTCACAAGAACCTGCATATACATTATATTCATTAATTCAGCCTTCCAGGAAGTCTGGATCCAGGAAGAGGAACCACAGCCCTTCCTTCAATAGCACTATCTATGAAGTGATTGGAAAGAGTCAACCTAAAGCCCAGAACCCTGCTCGATTGAGCCGCAAAGAGCTGGAGAACTTTGATGTTTATTCCTAG [SEQ ID NO: 26].
Аминокислотная последовательность «P-2B4tm-2B4»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAAQDCQNAHQEFRFWPFLVIIVILSALFLGTLACFCVWRRKRKEKQSETSPKEFLTIYEDVKDLKTRRNHEQEQTFPGGGSTIYSMIQSQSSAPTSQEPAYTLYSLIQPSRKSGSRKRNHSPSFNSTIYEVIGKSQPKAQNPARLSRKELENFDVYS [SEQ ID NO: 27].
Последовательность нуклеиновой кислоты «Full CTLA4 tail CD8 hindge and tm», который является iCAR, содержащим шарнир и трансмембранные домены CD8, внутриклеточный хвост CTLA-4 и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACCCACCACGACGCCAGCGCCGCGACCACCAACCCCGGCGCCCACGATCGCGTCGCAGCCCctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatatctacatctgggcgcccCtggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaccacagagcaccggcgGTTTCTTTGAGCAAAATGCTAAAGAAAAGAAGCCCTCTTACAACAGGGGTCGGTGTGAAAATGCCCCCAACAGAGCCAGAATGTGAAAAGCAATTTCAGCCTTATTTTATTCCCATCAATTGA [SEQ ID NO: 28].
Аминокислотная последовательность «Full CTLA4 tail CD8 hindge and tm»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAAPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRAPAVSLSKMLKKRSPLTTGVGVKMPPTEPECEKQFQPYFIPIN [SEQ ID NO: 29].
Последовательность нуклеиновой кислоты «P-CD8tm-PD1». «P-CD8tm-PD1» является iCAR, содержащим трансмембранный домен CD8, цитоплазматический домен PD-1 и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACCCACCACGACGCCAGCGCCGCGACCACCAACCCCGGCGCCCACGATCGCGTCGCAGCCCctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatatctacatctgggcgcccCtggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaccacagaatgcattgctcccgggccgcacgagggacaataggagccaggcgcaccggccagcccctgaaggaggacccctcagccgtgcctgtgttctctgtggactatggggagctggatttccagtggcgagagaagaccccggagccccccgtgccctgtgtccctgagcagacggagtatgccaccattgtctttcctagcggaatgggcacctcatcccccgcccgcaggggctcagccgacggccctcggagtgcccagccactgaggcctgaggatggacactgctcttggcccctctga [SEQ ID NO: 30].
Аминокислотная последовательность «P-CD8tm-PD1»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAAPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRMHCSRAARGTIGARRTGQPLKEDPSAVPVFSVDYGELDFQWREKTPEPPVPCVPEQTEYATIVFPSGMGTSSPARRGSADGPRSAQPLRPEDGHCSWPL [SEQ ID NO: 31].
Последовательность нуклеиновой кислоты «P-CD8tm-CTLA4wt». «P-CD8tm-CTLA4wt» является iCAR, содержащим трансмембранные домены CD8, цитоплазматический домен CTLA-4 дикого типа и PSMA svFV
atggCTCTCCCAGTGACTGCCCTACTGCTTCCCCTAGCGCTTCTCCTGCATGCAGAGGTGCAGCTGCAGcagtcaggacctgaactggtgaagcctgggacttcagtgaggatatcctgcaagacttctggatacacattcactgaatataccatacactgggtgaagcagagccatggaaagagccttgagtggattggaaacatcaatcctaacaatggtggtaccacctacaatcagaagttcgaggacaaggccacattgactgtagacaagtcctccagtacagcctacatggagctccgcagcctaacatctgaggattctgcagtctattattgtgcagctggttggaactttgactactggggccaagggaccacGGTCACCgtctcctcaggtggaggTggAtcaggTggaggtggAtctggTggAggTggatcTGACATTGTGATGACCCAGTCTCACAAATTCATGTCCACATCAGTAGGAGACAGGGTCAGCATCATCTGTAAGGCCAGTCAAGATGTGGGTACTGCTGTAGACTGGTATCAACAGAAACCAGGACAATCTCCTAAACTACTGATTTATTGGGCATCCACTCGGCACACTGGAGTCCCTGATCGCTTCACAGGCAGTGGATCTGGGACAGACTTCACTCTCACCATTACTAATGTTCAGTCTGAAGACTTGGCAGATTATTTCTGTCAGCAATATAACAGCTATCCCCTCACGTTCGGTGCTGGGACCATGCTGGACCTGAAACGGgcggccgcACCCACCACGACGCCAGCGCCGCGACCACCAACCCCGGCGCCCACGATCGCGTCGCAGCCCctgtccctgcgcccagaggcgtgccggccagcggcggggggcgcagtgcacacgagggggctggacttcgcctgtgatatctacatctgggcgcccCtggccgggacttgtggggtccttctcctgtcactggttatcaccctttactgcaaccacagagcaccggcgATGCTAAAGAAAAGAAGCCCTCTTACAACAGGGGTCTATGTGAAAATGCCCCCAACAGAGCCAGAATGTGAAAAGCAATTTCAGCCTTATTTTATTCCCATCAATTGA [SEQ ID NO: 32].
Аминокислотная последовательность «P-CD8tm-CTLA4wt»
MALPVTALLLPLALLLHAEVQLQQSGPELVKPGTSVRISCKTSGYTFTEYTIHWVKQSHGKSLEWIGNINPNNGGTTYNQKFEDKATLTVDKSSSTAYMELRSLTSEDSAVYYCAAGWNFDYWGQGTTVTVSSGGGGSGGGGSGGGGSDIVMTQSHKFMSTSVGDRVSIICKASQDVGTAVDWYQQKPGQSPKLLIYWASTRHTGVPDRFTGSGSGTDFTLTITNVQSEDLADYFCQQYNSYPLTFGAGTMLDLKRAAAPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRAPAMLKKRSPLTTGVYVKMPPTEPECEKQFQPYFIPIN [SEQ ID NO: 33].
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MEMORIAL SLOAN-KETTERING CANCER CENTER
<120> КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ
<130> 072734.0154
<140> PCT/US2014/030671
<141> 2014-03-17
<150> 61/802,118
<151> 2013-03-15
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 164
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg
<210> 2
<211> 220
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly
145 150 155 160
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
165 170 175
Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met
180 185 190
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
195 200 205
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215 220
<210> 3
<211> 486
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<220>
<221> МОДИФИЦИРОВАННЫЙ ОСТАТОК
<222> (486)..(486)
<223> Любая аминокислота
<400> 3
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro
20 25 30
Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser
35 40 45
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu
50 55 60
Trp Ile Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly
65 70 75 80
Lys Phe Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Phe Cys Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr
145 150 155 160
Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val
165 170 175
Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr
195 200 205
Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Arg Ala Ala Ala Ile Glu Val Met Tyr Pro
260 265 270
Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val
275 280 285
Lys Gly Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys
290 295 300
Pro Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
305 310 315 320
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg
325 330 335
Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro
340 345 350
Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe
355 360 365
Ala Ala Tyr Arg Ser Arg Val Lys Phe Ser Arg Ser Ala Glu Pro Pro
370 375 380
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
385 390 395 400
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
405 410 415
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
420 425 430
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
435 440 445
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
450 455 460
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
465 470 475 480
Ala Leu Pro Pro Arg Xaa
485
<210> 4
<211> 1458
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 4
ccatggctct cccagtgact gccctactgc ttcccctagc gcttctcctg catgcagagg 60
tgaagctgca gcagtctggg gctgagctgg tgaggcctgg gtcctcagtg aagatttcct 120
gcaaggcttc tggctatgca ttcagtagct actggatgaa ctgggtgaag cagaggcctg 180
gacagggtct tgagtggatt ggacagattt atcctggaga tggtgatact aactacaatg 240
gaaagttcaa gggtcaagcc acactgactg cagacaaatc ctccagcaca gcctacatgc 300
agctcagcgg cctaacatct gaggactctg cggtctattt ctgtgcaaga aagaccatta 360
gttcggtagt agatttctac tttgactact ggggccaagg gaccacggtc accgtctcct 420
caggtggagg tggatcaggt ggaggtggat ctggtggagg tggatctgac attgagctca 480
cccagtctcc aaaattcatg tccacatcag taggagacag ggtcagcgtc acctgcaagg 540
ccagtcagaa tgtgggtact aatgtagcct ggtatcaaca gaaaccagga caatctccta 600
aaccactgat ttactcggca acctaccgga acagtggagt ccctgatcgc ttcacaggca 660
gtggatctgg gacagatttc actctcacca tcactaacgt gcagtctaaa gacttggcag 720
actatttctg tcaacaatat aacaggtatc cgtacacgtc cggagggggg accaagctgg 780
agatcaaacg ggcggccgca attgaagtta tgtatcctcc tccttaccta gacaatgaga 840
agagcaatgg aaccattatc catgtgaaag ggaaacacct ttgtccaagt cccctatttc 900
ccggaccttc taagcccttt tgggtgctgg tggtggttgg tggagtcctg gcttgctata 960
gcttgctagt aacagtggcc tttattattt tctgggtgag gagtaagagg agcaggctcc 1020
tgcacagtga ctacatgaac atgactcccc gccgccccgg gcccacccgc aagcattacc 1080
agccctatgc cccaccacgc gacttcgcag cctatcgctc cagagtgaag ttcagcagga 1140
gcgcagagcc ccccgcgtac cagcagggcc agaaccagct ctataacgag ctcaatctag 1200
gacgaagaga ggagtacgat gttttggaca agagacgtgg ccgggaccct gagatggggg 1260
gaaagccgag aaggaagaac cctcaggaag gcctgtacaa tgaactgcag aaagataaga 1320
tggcggaggc ctacagtgag attgggatga aaggcgagcg ccggaggggc aaggggcacg 1380
atggccttta ccagggtctc agtacagcca ccaaggacac ctacgacgcc cttcacatgc 1440
aggccctgcc ccctcgcg 1458
<210> 5
<211> 223
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Met Ala Cys Leu Gly Phe Gln Arg His Lys Ala Gln Leu Asn Leu Ala
1 5 10 15
Thr Arg Thr Trp Pro Cys Thr Leu Leu Phe Phe Leu Leu Phe Ile Pro
20 25 30
Val Phe Cys Lys Ala Met His Val Ala Gln Pro Ala Val Val Leu Ala
35 40 45
Ser Ser Arg Gly Ile Ala Ser Phe Val Cys Glu Tyr Ala Ser Pro Gly
50 55 60
Lys Ala Thr Glu Val Arg Val Thr Val Leu Arg Gln Ala Asp Ser Gln
65 70 75 80
Val Thr Glu Val Cys Ala Ala Thr Tyr Met Met Gly Asn Glu Leu Thr
85 90 95
Phe Leu Asp Asp Ser Ile Cys Thr Gly Thr Ser Ser Gly Asn Gln Val
100 105 110
Asn Leu Thr Ile Gln Gly Leu Arg Ala Met Asp Thr Gly Leu Tyr Ile
115 120 125
Cys Lys Val Glu Leu Met Tyr Pro Pro Pro Tyr Tyr Leu Gly Ile Gly
130 135 140
Asn Gly Thr Gln Ile Tyr Val Ile Asp Pro Glu Pro Cys Pro Asp Ser
145 150 155 160
Asp Phe Leu Leu Trp Ile Leu Ala Ala Val Ser Ser Gly Leu Phe Phe
165 170 175
Tyr Ser Phe Leu Leu Thr Ala Val Ser Leu Ser Lys Met Leu Lys Lys
180 185 190
Arg Ser Pro Leu Thr Thr Gly Val Tyr Val Lys Met Pro Pro Thr Glu
195 200 205
Pro Glu Cys Glu Lys Gln Phe Gln Pro Tyr Phe Ile Pro Ile Asn
210 215 220
<210> 6
<211> 288
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 7
<211> 525
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Met Trp Glu Ala Gln Phe Leu Gly Leu Leu Phe Leu Gln Pro Leu Trp
1 5 10 15
Val Ala Pro Val Lys Pro Leu Gln Pro Gly Ala Glu Val Pro Val Val
20 25 30
Trp Ala Gln Glu Gly Ala Pro Ala Gln Leu Pro Cys Ser Pro Thr Ile
35 40 45
Pro Leu Gln Asp Leu Ser Leu Leu Arg Arg Ala Gly Val Thr Trp Gln
50 55 60
His Gln Pro Asp Ser Gly Pro Pro Ala Ala Ala Pro Gly His Pro Leu
65 70 75 80
Ala Pro Gly Pro His Pro Ala Ala Pro Ser Ser Trp Gly Pro Arg Pro
85 90 95
Arg Arg Tyr Thr Val Leu Ser Val Gly Pro Gly Gly Leu Arg Ser Gly
100 105 110
Arg Leu Pro Leu Gln Pro Arg Val Gln Leu Asp Glu Arg Gly Arg Gln
115 120 125
Arg Gly Asp Phe Ser Leu Trp Leu Arg Pro Ala Arg Arg Ala Asp Ala
130 135 140
Gly Glu Tyr Arg Ala Ala Val His Leu Arg Asp Arg Ala Leu Ser Cys
145 150 155 160
Arg Leu Arg Leu Arg Leu Gly Gln Ala Ser Met Thr Ala Ser Pro Pro
165 170 175
Gly Ser Leu Arg Ala Ser Asp Trp Val Ile Leu Asn Cys Ser Phe Ser
180 185 190
Arg Pro Asp Arg Pro Ala Ser Val His Trp Phe Arg Asn Arg Gly Gln
195 200 205
Gly Arg Val Pro Val Arg Glu Ser Pro His His His Leu Ala Glu Ser
210 215 220
Phe Leu Phe Leu Pro Gln Val Ser Pro Met Asp Ser Gly Pro Trp Gly
225 230 235 240
Cys Ile Leu Thr Tyr Arg Asp Gly Phe Asn Val Ser Ile Met Tyr Asn
245 250 255
Leu Thr Val Leu Gly Leu Glu Pro Pro Thr Pro Leu Thr Val Tyr Ala
260 265 270
Gly Ala Gly Ser Arg Val Gly Leu Pro Cys Arg Leu Pro Ala Gly Val
275 280 285
Gly Thr Arg Ser Phe Leu Thr Ala Lys Trp Thr Pro Pro Gly Gly Gly
290 295 300
Pro Asp Leu Leu Val Thr Gly Asp Asn Gly Asp Phe Thr Leu Arg Leu
305 310 315 320
Glu Asp Val Ser Gln Ala Gln Ala Gly Thr Tyr Thr Cys His Ile His
325 330 335
Leu Gln Glu Gln Gln Leu Asn Ala Thr Val Thr Leu Ala Ile Ile Thr
340 345 350
Val Thr Pro Lys Ser Phe Gly Ser Pro Gly Ser Leu Gly Lys Leu Leu
355 360 365
Cys Glu Val Thr Pro Val Ser Gly Gln Glu Arg Phe Val Trp Ser Ser
370 375 380
Leu Asp Thr Pro Ser Gln Arg Ser Phe Ser Gly Pro Trp Leu Glu Ala
385 390 395 400
Gln Glu Ala Gln Leu Leu Ser Gln Pro Trp Gln Cys Gln Leu Tyr Gln
405 410 415
Gly Glu Arg Leu Leu Gly Ala Ala Val Tyr Phe Thr Glu Leu Ser Ser
420 425 430
Pro Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala Leu Pro Ala Gly
435 440 445
His Leu Leu Leu Phe Leu Ile Leu Gly Val Leu Ser Leu Leu Leu Leu
450 455 460
Val Thr Gly Ala Phe Gly Phe His Leu Trp Arg Arg Gln Trp Arg Pro
465 470 475 480
Arg Arg Phe Ser Ala Leu Glu Gln Gly Ile His Pro Pro Gln Ala Gln
485 490 495
Ser Lys Ile Glu Glu Leu Glu Gln Glu Pro Glu Pro Glu Pro Glu Pro
500 505 510
Glu Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Gln Leu
515 520 525
<210> 8
<211> 370
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Leu Gly Gln Val Val Thr Leu Ile Leu Leu Leu Leu Leu Lys Val
1 5 10 15
Tyr Gln Gly Lys Gly Cys Gln Gly Ser Ala Asp His Val Val Ser Ile
20 25 30
Ser Gly Val Pro Leu Gln Leu Gln Pro Asn Ser Ile Gln Thr Lys Val
35 40 45
Asp Ser Ile Ala Trp Lys Lys Leu Leu Pro Ser Gln Asn Gly Phe His
50 55 60
His Ile Leu Lys Trp Glu Asn Gly Ser Leu Pro Ser Asn Thr Ser Asn
65 70 75 80
Asp Arg Phe Ser Phe Ile Val Lys Asn Leu Ser Leu Leu Ile Lys Ala
85 90 95
Ala Gln Gln Gln Asp Ser Gly Leu Tyr Cys Leu Glu Val Thr Ser Ile
100 105 110
Ser Gly Lys Val Gln Thr Ala Thr Phe Gln Val Phe Val Phe Glu Ser
115 120 125
Leu Leu Pro Asp Lys Val Glu Lys Pro Arg Leu Gln Gly Gln Gly Lys
130 135 140
Ile Leu Asp Arg Gly Arg Cys Gln Val Ala Leu Ser Cys Leu Val Ser
145 150 155 160
Arg Asp Gly Asn Val Ser Tyr Ala Trp Tyr Arg Gly Ser Lys Leu Ile
165 170 175
Gln Thr Ala Gly Asn Leu Thr Tyr Leu Asp Glu Glu Val Asp Ile Asn
180 185 190
Gly Thr His Thr Tyr Thr Cys Asn Val Ser Asn Pro Val Ser Trp Glu
195 200 205
Ser His Thr Leu Asn Leu Thr Gln Asp Cys Gln Asn Ala His Gln Glu
210 215 220
Phe Arg Phe Trp Pro Phe Leu Val Ile Ile Val Ile Leu Ser Ala Leu
225 230 235 240
Phe Leu Gly Thr Leu Ala Cys Phe Cys Val Trp Arg Arg Lys Arg Lys
245 250 255
Glu Lys Gln Ser Glu Thr Ser Pro Lys Glu Phe Leu Thr Ile Tyr Glu
260 265 270
Asp Val Lys Asp Leu Lys Thr Arg Arg Asn His Glu Gln Glu Gln Thr
275 280 285
Phe Pro Gly Gly Gly Ser Thr Ile Tyr Ser Met Ile Gln Ser Gln Ser
290 295 300
Ser Ala Pro Thr Ser Gln Glu Pro Ala Tyr Thr Leu Tyr Ser Leu Ile
305 310 315 320
Gln Pro Ser Arg Lys Ser Gly Ser Arg Lys Arg Asn His Ser Pro Ser
325 330 335
Phe Asn Ser Thr Ile Tyr Glu Val Ile Gly Lys Ser Gln Pro Lys Ala
340 345 350
Gln Asn Pro Ala Arg Leu Ser Arg Lys Glu Leu Glu Asn Phe Asp Val
355 360 365
Tyr Ser
370
<210> 9
<211> 289
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Met Lys Thr Leu Pro Ala Met Leu Gly Thr Gly Lys Leu Phe Trp Val
1 5 10 15
Phe Phe Leu Ile Pro Tyr Leu Asp Ile Trp Asn Ile His Gly Lys Glu
20 25 30
Ser Cys Asp Val Gln Leu Tyr Ile Lys Arg Gln Ser Glu His Ser Ile
35 40 45
Leu Ala Gly Asp Pro Phe Glu Leu Glu Cys Pro Val Lys Tyr Cys Ala
50 55 60
Asn Arg Pro His Val Thr Trp Cys Lys Leu Asn Gly Thr Thr Cys Val
65 70 75 80
Lys Leu Glu Asp Arg Gln Thr Ser Trp Lys Glu Glu Lys Asn Ile Ser
85 90 95
Phe Phe Ile Leu His Phe Glu Pro Val Leu Pro Asn Asp Asn Gly Ser
100 105 110
Tyr Arg Cys Ser Ala Asn Phe Gln Ser Asn Leu Ile Glu Ser His Ser
115 120 125
Thr Thr Leu Tyr Val Thr Asp Val Lys Ser Ala Ser Glu Arg Pro Ser
130 135 140
Lys Asp Glu Met Ala Ser Arg Pro Trp Leu Leu Tyr Ser Leu Leu Pro
145 150 155 160
Leu Gly Gly Leu Pro Leu Leu Ile Thr Thr Cys Phe Cys Leu Phe Cys
165 170 175
Cys Leu Arg Arg His Gln Gly Lys Gln Asn Glu Leu Ser Asp Thr Ala
180 185 190
Gly Arg Glu Ile Asn Leu Val Asp Ala His Leu Lys Ser Glu Gln Thr
195 200 205
Glu Ala Ser Thr Arg Gln Asn Ser Gln Val Leu Leu Ser Glu Thr Gly
210 215 220
Ile Tyr Asp Asn Asp Pro Asp Leu Cys Phe Arg Met Gln Glu Gly Ser
225 230 235 240
Glu Val Tyr Ser Asn Pro Cys Leu Glu Glu Asn Lys Pro Gly Ile Val
245 250 255
Tyr Ala Ser Leu Asn His Ser Val Ile Gly Pro Asn Ser Arg Leu Ala
260 265 270
Arg Asn Val Lys Glu Ala Pro Thr Glu Tyr Ala Ser Ile Cys Val Arg
275 280 285
Ser
<210> 10
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический пептид»
<400> 10
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 11
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 11
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr
20 25 30
Trp Asn Leu Gly Glu Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser
35 40 45
Asn Pro Thr Ser Gly Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala
50 55 60
Ala Ser Pro Thr Phe Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala
65 70 75 80
Ala Glu Gly Leu Asp Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp
85 90 95
Thr Phe Val Leu Thr Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr
100 105 110
Tyr Phe Cys Ser Ala Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe
115 120 125
Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His
195 200 205
Arg Asn Arg Arg Arg Val Cys Lys Cys Pro Arg Pro Val Val Lys Ser
210 215 220
Gly Asp Lys Pro Ser Leu Ser Ala Arg Tyr Val
225 230 235
<210> 12
<211> 777
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 12
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgca 777
<210> 13
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 13
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala
<210> 14
<211> 798
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид"
<400> 14
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
aagctgcagc agtctggggc tgagctggtg aggcctgggt cctcagtgaa gatttcctgc 120
aaggcttctg gctatgcatt cagtagctac tggatgaact gggtgaagca gaggcctgga 180
cagggtcttg agtggattgg acagatttat cctggagatg gtgatactaa ctacaatgga 240
aagttcaagg gtcaagccac actgactgca gacaaatcct ccagcacagc ctacatgcag 300
ctcagcggcc taacatctga ggactctgcg gtctatttct gtgcaagaaa gaccattagt 360
tcggtagtag atttctactt tgactactgg ggccaaggga ccacggtcac cgtctcctca 420
ggtggaggtg gatcaggtgg aggtggatct ggtggaggtg gatctgacat tgagctcacc 480
cagtctccaa aattcatgtc cacatcagta ggagacaggg tcagcgtcac ctgcaaggcc 540
agtcagaatg tgggtactaa tgtagcctgg tatcaacaga aaccaggaca atctcctaaa 600
ccactgattt actcggcaac ctaccggaac agtggagtcc ctgatcgctt cacaggcagt 660
ggatctggga cagatttcac tctcaccatc actaacgtgc agtctaaaga cttggcagac 720
tatttctgtc aacaatataa caggtatccg tacacgtccg gaggggggac caagctggag 780
atcaaacggg cggccgca 798
<210> 15
<211> 532
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 15
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro
20 25 30
Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser
35 40 45
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu
50 55 60
Trp Ile Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly
65 70 75 80
Lys Phe Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Phe Cys Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr
145 150 155 160
Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val
165 170 175
Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr
195 200 205
Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Arg Ala Ala Ala Met Ala Leu Pro Val Thr
260 265 270
Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu His Ala Glu Val Lys Leu
275 280 285
Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser Ser Val Lys Ile
290 295 300
Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr Trp Met Asn Trp
305 310 315 320
Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Gln Ile Tyr
325 330 335
Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe Lys Gly Gln Ala
340 345 350
Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser
355 360 365
Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ala Arg Lys Thr
370 375 380
Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
385 390 395 400
Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
405 410 415
Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Lys Phe Met
420 425 430
Ser Thr Ser Val Gly Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln
435 440 445
Asn Val Gly Thr Asn Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser
450 455 460
Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr Arg Asn Ser Gly Val Pro
465 470 475 480
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
485 490 495
Thr Asn Val Gln Ser Lys Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr
500 505 510
Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly Thr Lys Leu Glu Ile Lys
515 520 525
Arg Ala Ala Ala
530
<210> 16
<211> 1209
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 16
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcagag 780
agaagggcag aagtgcccac agcccacccc agcccctcac ccaggccagc cggccagttc 840
caaaccctgg tggttggtgt cgtgggcggc ctgctgggca gcctggtgct gctagtctgg 900
gtcctggccg tcatctgctc ccgggccgca cgagggacaa taggagccag gcgcaccggc 960
cagcccctga aggaggaccc ctcagccgtg cctgtgttct ctgtggacta tggggagctg 1020
gatttccagt ggcgagagaa gaccccggag ccccccgtgc cctgtgtccc tgagcagacg 1080
gagtatgcca ccattgtctt tcctagcgga atgggcacct catcccccgc ccgcaggggc 1140
tcagccgacg gccctcggag tgcccagcca ctgaggcctg aggatggaca ctgctcttgg 1200
cccctctga 1209
<210> 17
<211> 402
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 17
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro
260 265 270
Ser Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val
275 280 285
Gly Gly Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val
290 295 300
Ile Cys Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly
305 310 315 320
Gln Pro Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp
325 330 335
Tyr Gly Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro
340 345 350
Val Pro Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro
355 360 365
Ser Gly Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly
370 375 380
Pro Arg Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp
385 390 395 400
Pro Leu
<210> 18
<211> 1029
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 18
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcactg 780
ggcataggca acggaaccca gatttatgta attgatccag aaccgtgccc agattctgac 840
ttcctcctct ggatccttgc agcagttagt tcggggttgt ttttttatag ctttctcctc 900
acagctgttt ctttgagcaa aatgctaaag aaaagaagcc ctcttacaac aggggtctat 960
gtgaaaatgc ccccaacaga gccagaatgt gaaaagcaat ttcagcctta ttttattccc 1020
atcaattga 1029
<210> 19
<211> 342
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 19
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Leu Gly Ile Gly Asn Gly Thr Gln Ile Tyr Val Ile Asp
260 265 270
Pro Glu Pro Cys Pro Asp Ser Asp Phe Leu Leu Trp Ile Leu Ala Ala
275 280 285
Val Ser Ser Gly Leu Phe Phe Tyr Ser Phe Leu Leu Thr Ala Val Ser
290 295 300
Leu Ser Lys Met Leu Lys Lys Arg Ser Pro Leu Thr Thr Gly Val Tyr
305 310 315 320
Val Lys Met Pro Pro Thr Glu Pro Glu Cys Glu Lys Gln Phe Gln Pro
325 330 335
Tyr Phe Ile Pro Ile Asn
340
<210> 20
<211> 1029
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 20
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcactg 780
ggcataggca acggaaccca gatttatgta attgatccag aaccgtgccc agattctgac 840
ttcctcctct ggatccttgc agcagttagt tcggggttgt ttttttatag ctttctcctc 900
acagctgttt ctttgagcaa aatgctaaag aaaagaagcc ctcttacaac aggggtcggt 960
gtgaaaatgc ccccaacaga gccagaatgt gaaaagcaat ttcagcctta ttttattccc 1020
atcaattga 1029
<210> 21
<211> 342
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 21
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Leu Gly Ile Gly Asn Gly Thr Gln Ile Tyr Val Ile Asp
260 265 270
Pro Glu Pro Cys Pro Asp Ser Asp Phe Leu Leu Trp Ile Leu Ala Ala
275 280 285
Val Ser Ser Gly Leu Phe Phe Tyr Ser Phe Leu Leu Thr Ala Val Ser
290 295 300
Leu Ser Lys Met Leu Lys Lys Arg Ser Pro Leu Thr Thr Gly Val Gly
305 310 315 320
Val Lys Met Pro Pro Thr Glu Pro Glu Cys Glu Lys Gln Phe Gln Pro
325 330 335
Tyr Phe Ile Pro Ile Asn
340
<210> 22
<211> 1095
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 22
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcactt 780
ggagcagcag tgtacttcac agagctgtct agcccaggtg cccaacgctc tgggagagcc 840
ccaggtgccc tcccagcagg ccacctcctg ctgtttctca tccttggtgt cctttctctg 900
ctccttttgg tgactggagc ctttggcttt cacctttgga gaagacagtg gcgaccaaga 960
cgattttctg ccttagagca agggattcac cctccgcagg ctcagagcaa gatagaggag 1020
ctggagcaag aaccggagcc ggagccggag ccggaaccgg agcccgagcc cgagcccgag 1080
ccggagcagc tctga 1095
<210> 23
<211> 364
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 23
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Leu Gly Ala Ala Val Tyr Phe Thr Glu Leu Ser Ser Pro
260 265 270
Gly Ala Gln Arg Ser Gly Arg Ala Pro Gly Ala Leu Pro Ala Gly His
275 280 285
Leu Leu Leu Phe Leu Ile Leu Gly Val Leu Ser Leu Leu Leu Leu Val
290 295 300
Thr Gly Ala Phe Gly Phe His Leu Trp Arg Arg Gln Trp Arg Pro Arg
305 310 315 320
Arg Phe Ser Ala Leu Glu Gln Gly Ile His Pro Pro Gln Ala Gln Ser
325 330 335
Lys Ile Glu Glu Leu Glu Gln Glu Pro Glu Pro Glu Pro Glu Pro Glu
340 345 350
Pro Glu Pro Glu Pro Glu Pro Glu Pro Glu Gln Leu
355 360
<210> 24
<211> 1245
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 24
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcagat 780
gtaaaaagtg cctcagaacg accctccaag gacgaaatgg caagcagacc ctggctcctg 840
tatagtttac ttcctttggg gggattgcct ctactcatca ctacctgttt ctgcctgttc 900
tgctgcctga gaaggcacca aggaaagcaa aatgaactct ctgacacagc aggaagggaa 960
attaacctgg ttgatgctca ccttaagagt gagcaaacag aagcaagcac caggcaaaat 1020
tcccaagtac tgctatcaga aactggaatt tatgataatg accctgacct ttgtttcagg 1080
atgcaggaag ggtctgaagt ttattctaat ccatgcctgg aagaaaacaa accaggcatt 1140
gtttatgctt ccctgaacca ttctgtcatt ggaccgaact caagactggc aagaaatgta 1200
aaagaagcac caacagaata tgcatccata tgtgtgagga gttaa 1245
<210> 25
<211> 414
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 25
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Asp Val Lys Ser Ala Ser Glu Arg Pro Ser Lys Asp Glu
260 265 270
Met Ala Ser Arg Pro Trp Leu Leu Tyr Ser Leu Leu Pro Leu Gly Gly
275 280 285
Leu Pro Leu Leu Ile Thr Thr Cys Phe Cys Leu Phe Cys Cys Leu Arg
290 295 300
Arg His Gln Gly Lys Gln Asn Glu Leu Ser Asp Thr Ala Gly Arg Glu
305 310 315 320
Ile Asn Leu Val Asp Ala His Leu Lys Ser Glu Gln Thr Glu Ala Ser
325 330 335
Thr Arg Gln Asn Ser Gln Val Leu Leu Ser Glu Thr Gly Ile Tyr Asp
340 345 350
Asn Asp Pro Asp Leu Cys Phe Arg Met Gln Glu Gly Ser Glu Val Tyr
355 360 365
Ser Asn Pro Cys Leu Glu Glu Asn Lys Pro Gly Ile Val Tyr Ala Ser
370 375 380
Leu Asn His Ser Val Ile Gly Pro Asn Ser Arg Leu Ala Arg Asn Val
385 390 395 400
Lys Glu Ala Pro Thr Glu Tyr Ala Ser Ile Cys Val Arg Ser
405 410
<210> 26
<211> 1245
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 26
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcacag 780
gactgtcaga atgcccatca ggaattcaga ttttggccgt ttttggtgat catcgtgatt 840
ctaagcgcac tgttccttgg cacccttgcc tgcttctgtg tgtggaggag aaagaggaag 900
gagaagcagt cagagaccag tcccaaggaa tttttgacaa tttacgaaga tgtcaaggat 960
ctgaaaacca ggagaaatca cgagcaggag cagacttttc ctggaggggg gagcaccatc 1020
tactctatga tccagtccca gtcttctgct cccacgtcac aagaacctgc atatacatta 1080
tattcattaa ttcagccttc caggaagtct ggatccagga agaggaacca cagcccttcc 1140
ttcaatagca ctatctatga agtgattgga aagagtcaac ctaaagccca gaaccctgct 1200
cgattgagcc gcaaagagct ggagaacttt gatgtttatt cctag 1245
<210> 27
<211> 414
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 27
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Gln Asp Cys Gln Asn Ala His Gln Glu Phe Arg Phe Trp
260 265 270
Pro Phe Leu Val Ile Ile Val Ile Leu Ser Ala Leu Phe Leu Gly Thr
275 280 285
Leu Ala Cys Phe Cys Val Trp Arg Arg Lys Arg Lys Glu Lys Gln Ser
290 295 300
Glu Thr Ser Pro Lys Glu Phe Leu Thr Ile Tyr Glu Asp Val Lys Asp
305 310 315 320
Leu Lys Thr Arg Arg Asn His Glu Gln Glu Gln Thr Phe Pro Gly Gly
325 330 335
Gly Ser Thr Ile Tyr Ser Met Ile Gln Ser Gln Ser Ser Ala Pro Thr
340 345 350
Ser Gln Glu Pro Ala Tyr Thr Leu Tyr Ser Leu Ile Gln Pro Ser Arg
355 360 365
Lys Ser Gly Ser Arg Lys Arg Asn His Ser Pro Ser Phe Asn Ser Thr
370 375 380
Ile Tyr Glu Val Ile Gly Lys Ser Gln Pro Lys Ala Gln Asn Pro Ala
385 390 395 400
Arg Leu Ser Arg Lys Glu Leu Glu Asn Phe Asp Val Tyr Ser
405 410
<210> 28
<211> 1128
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 28
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcaccc 780
accacgacgc cagcgccgcg accaccaacc ccggcgccca cgatcgcgtc gcagcccctg 840
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 900
gacttcgcct gtgatatcta catctgggcg cccctggccg ggacttgtgg ggtccttctc 960
ctgtcactgg ttatcaccct ttactgcaac cacagagcac cggcggtttc tttgagcaaa 1020
atgctaaaga aaagaagccc tcttacaaca ggggtcggtg tgaaaatgcc cccaacagag 1080
ccagaatgtg aaaagcaatt tcagccttat tttattccca tcaattga 1128
<210> 29
<211> 375
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 29
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His Arg Ala Pro Ala Val
325 330 335
Ser Leu Ser Lys Met Leu Lys Lys Arg Ser Pro Leu Thr Thr Gly Val
340 345 350
Gly Val Lys Met Pro Pro Thr Glu Pro Glu Cys Glu Lys Gln Phe Gln
355 360 365
Pro Tyr Phe Ile Pro Ile Asn
370 375
<210> 30
<211> 1296
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 30
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcaccc 780
accacgacgc cagcgccgcg accaccaacc ccggcgccca cgatcgcgtc gcagcccctg 840
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 900
gacttcgcct gtgatatcta catctgggcg cccctggccg ggacttgtgg ggtccttctc 960
ctgtcactgg ttatcaccct ttactgcaac cacagaatgc attgctcccg ggccgcacga 1020
gggacaatag gagccaggcg caccggccag cccctgaagg aggacccctc agccgtgcct 1080
gtgttctctg tggactatgg ggagctggat ttccagtggc gagagaagac cccggagccc 1140
cccgtgccct gtgtccctga gcagacggag tatgccacca ttgtctttcc tagcggaatg 1200
ggcacctcat cccccgcccg caggggctca gccgacggcc ctcggagtgc ccagccactg 1260
aggcctgagg atggacactg ctcttggccc ctctga 1296
<210> 31
<211> 431
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 31
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His Arg Met His Cys Ser
325 330 335
Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro Leu
340 345 350
Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly Glu
355 360 365
Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro Cys
370 375 380
Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly Met
385 390 395 400
Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg Ser
405 410 415
Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
420 425 430
<210> 32
<211> 1113
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полинуклеотид»
<400> 32
atggctctcc cagtgactgc cctactgctt cccctagcgc ttctcctgca tgcagaggtg 60
cagctgcagc agtcaggacc tgaactggtg aagcctggga cttcagtgag gatatcctgc 120
aagacttctg gatacacatt cactgaatat accatacact gggtgaagca gagccatgga 180
aagagccttg agtggattgg aaacatcaat cctaacaatg gtggtaccac ctacaatcag 240
aagttcgagg acaaggccac attgactgta gacaagtcct ccagtacagc ctacatggag 300
ctccgcagcc taacatctga ggattctgca gtctattatt gtgcagctgg ttggaacttt 360
gactactggg gccaagggac cacggtcacc gtctcctcag gtggaggtgg atcaggtgga 420
ggtggatctg gtggaggtgg atctgacatt gtgatgaccc agtctcacaa attcatgtcc 480
acatcagtag gagacagggt cagcatcatc tgtaaggcca gtcaagatgt gggtactgct 540
gtagactggt atcaacagaa accaggacaa tctcctaaac tactgattta ttgggcatcc 600
actcggcaca ctggagtccc tgatcgcttc acaggcagtg gatctgggac agacttcact 660
ctcaccatta ctaatgttca gtctgaagac ttggcagatt atttctgtca gcaatataac 720
agctatcccc tcacgttcgg tgctgggacc atgctggacc tgaaacgggc ggccgcaccc 780
accacgacgc cagcgccgcg accaccaacc ccggcgccca cgatcgcgtc gcagcccctg 840
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 900
gacttcgcct gtgatatcta catctgggcg cccctggccg ggacttgtgg ggtccttctc 960
ctgtcactgg ttatcaccct ttactgcaac cacagagcac cggcgatgct aaagaaaaga 1020
agccctctta caacaggggt ctatgtgaaa atgcccccaa cagagccaga atgtgaaaag 1080
caatttcagc cttattttat tcccatcaat tga 1113
<210> 33
<211> 370
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=«Описание искусственной последовательности: синтетический полипептид»
<400> 33
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Pro Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
260 265 270
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
275 280 285
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
290 295 300
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
305 310 315 320
Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His Arg Ala Pro Ala Met
325 330 335
Leu Lys Lys Arg Ser Pro Leu Thr Thr Gly Val Tyr Val Lys Met Pro
340 345 350
Pro Thr Glu Pro Glu Cys Glu Lys Gln Phe Gln Pro Tyr Phe Ile Pro
355 360 365
Ile Asn
370
<210> 34
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 34
Tyr Val Lys Met
1
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНОТЕРАПИИ | 2013 |
|
RU2832516C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНОТЕРАПИИ | 2013 |
|
RU2729401C2 |
| ХИМЕРНЫЙ ЦИТОКИНОВЫЙ РЕЦЕПТОР | 2016 |
|
RU2826122C1 |
| Векторы для экспрессии простатоассоциированных антигенов | 2014 |
|
RU2650860C2 |
| БЕЛКИ УПРАВЛЕНИЯ, НАВИГАЦИИ И КОНТРОЛЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2811457C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ PSMA | 2019 |
|
RU2794450C2 |
| КЛЕТКА | 2014 |
|
RU2717984C2 |
| ИММУННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ОБРАТНЫЙ УНИВЕРСАЛЬНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР, ДЛЯ НАЦЕЛИВАНИЯ НА РАЗЛИЧНЫЕ МНОГОЧИСЛЕННЫЕ АНТИГЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ИНФЕКЦИЙ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2824391C2 |
| КЛЕТКА | 2014 |
|
RU2732236C2 |
| NK-клеточная линия, экспрессирующая PSMA-специфический химерный антигенный рецептор и секретирующая блокатор взаимодействия CD47/SIRPa | 2020 |
|
RU2757353C1 |
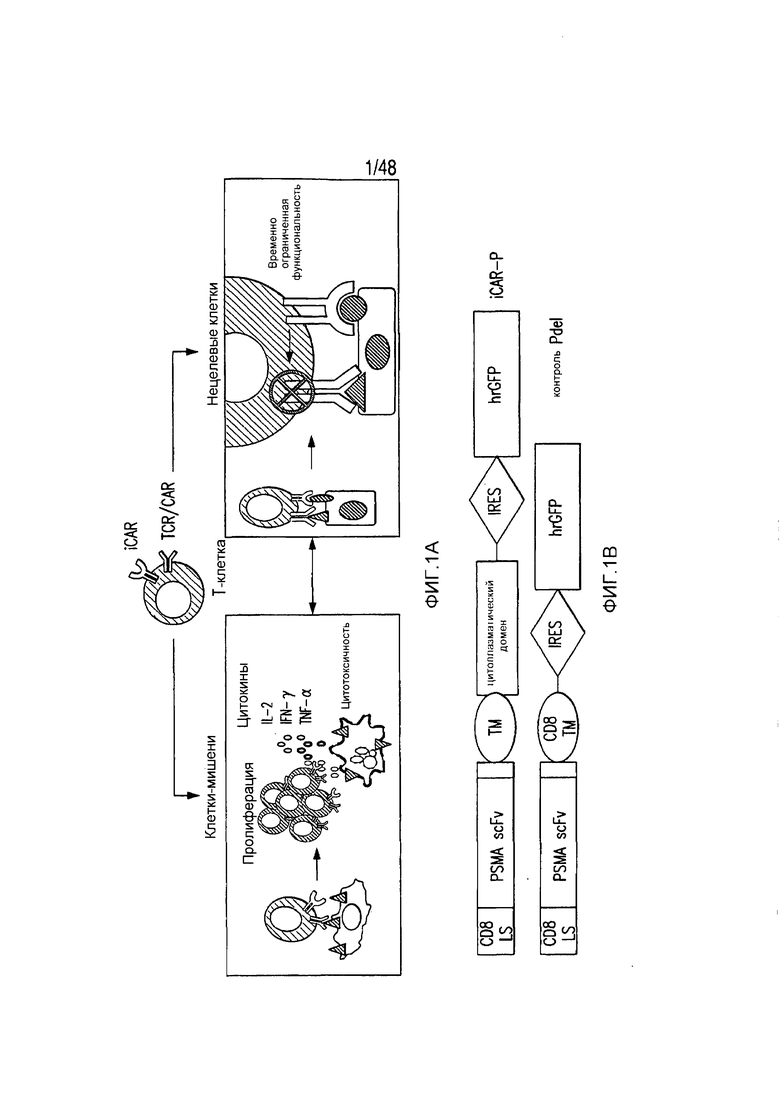
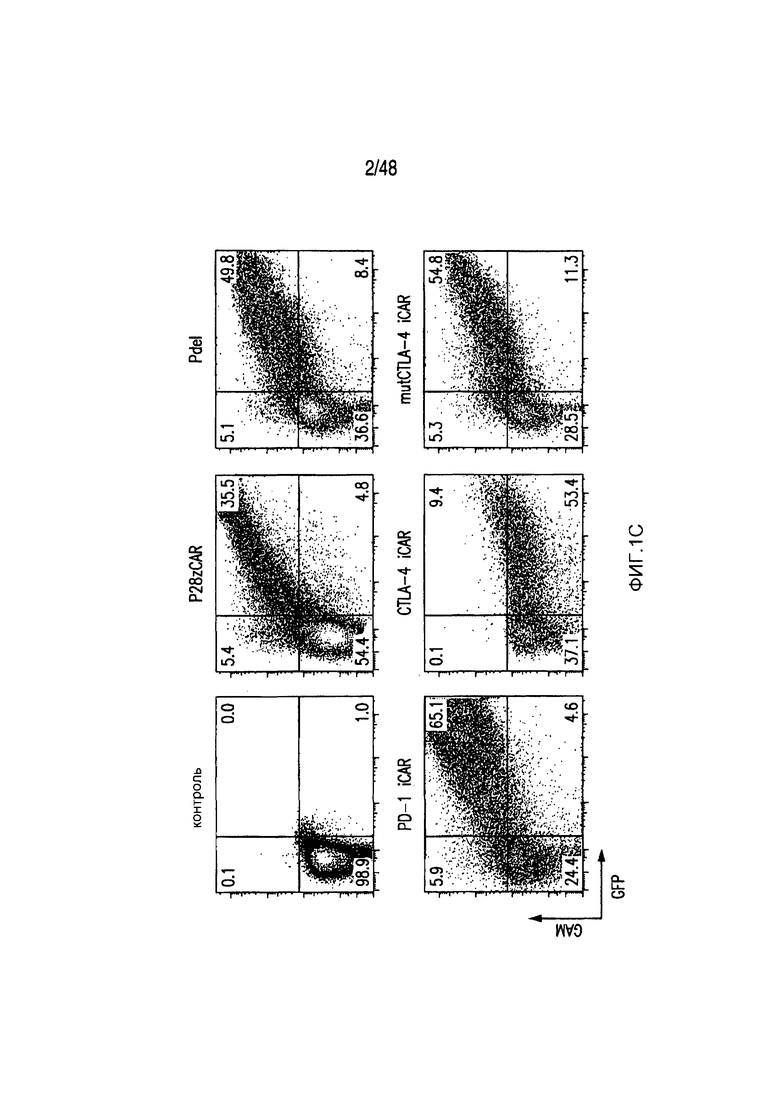
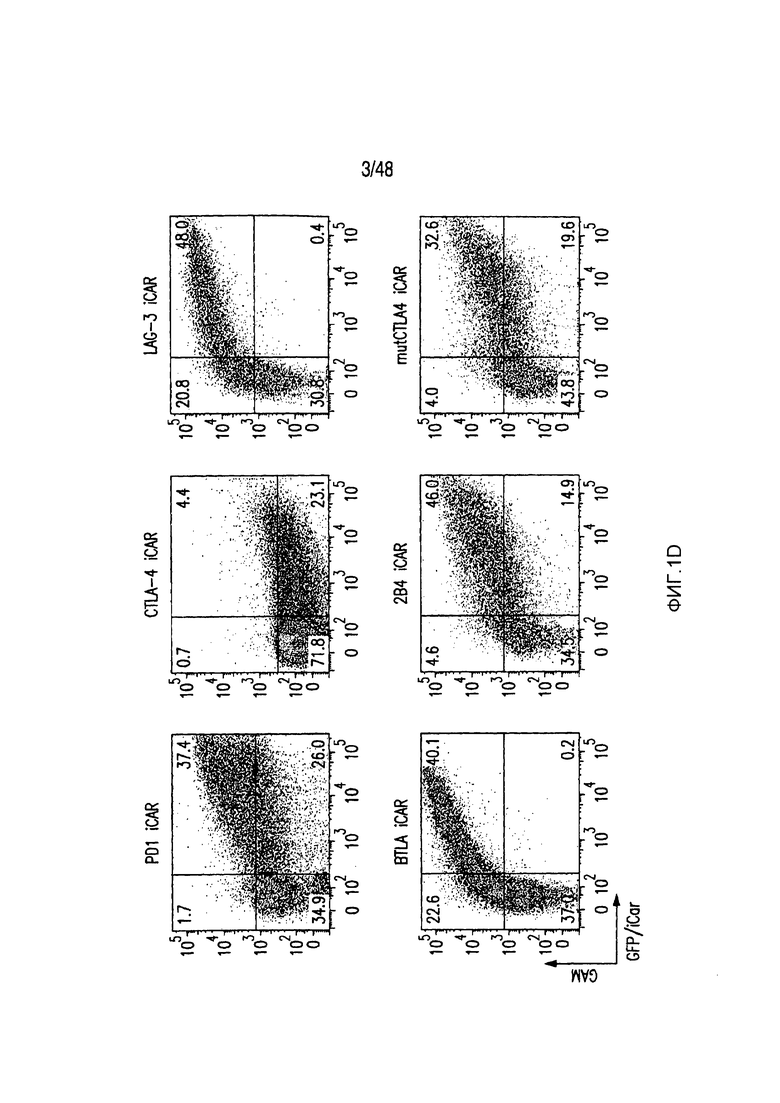
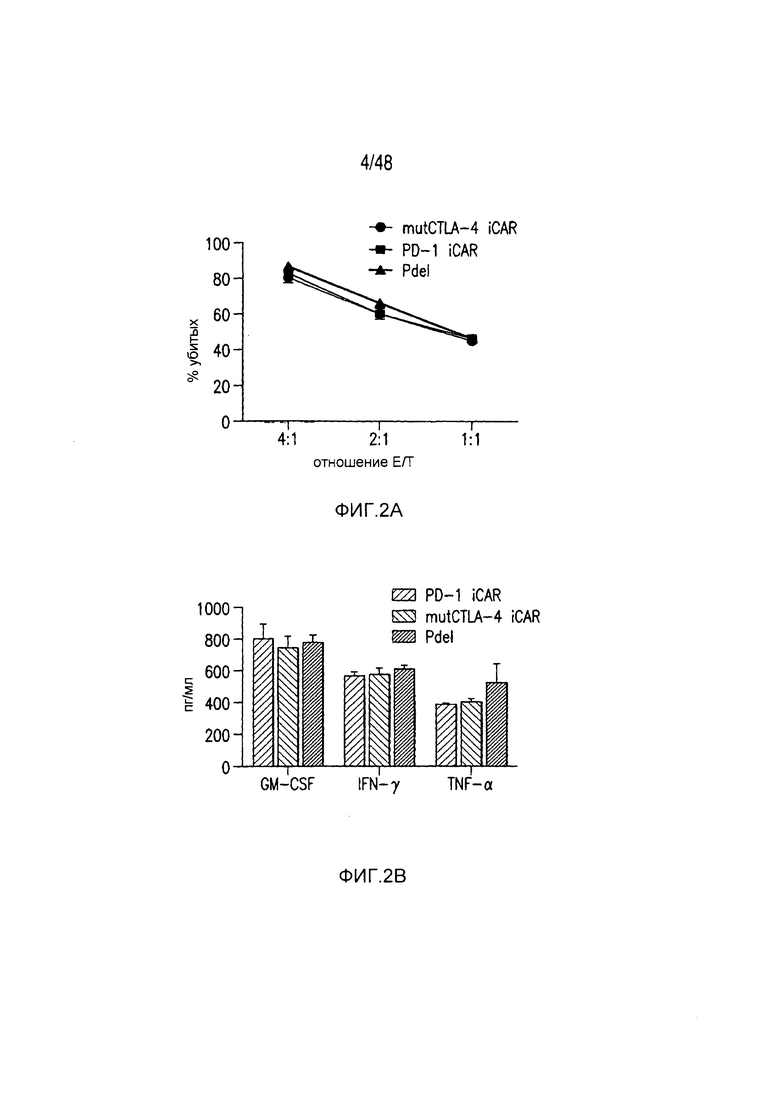
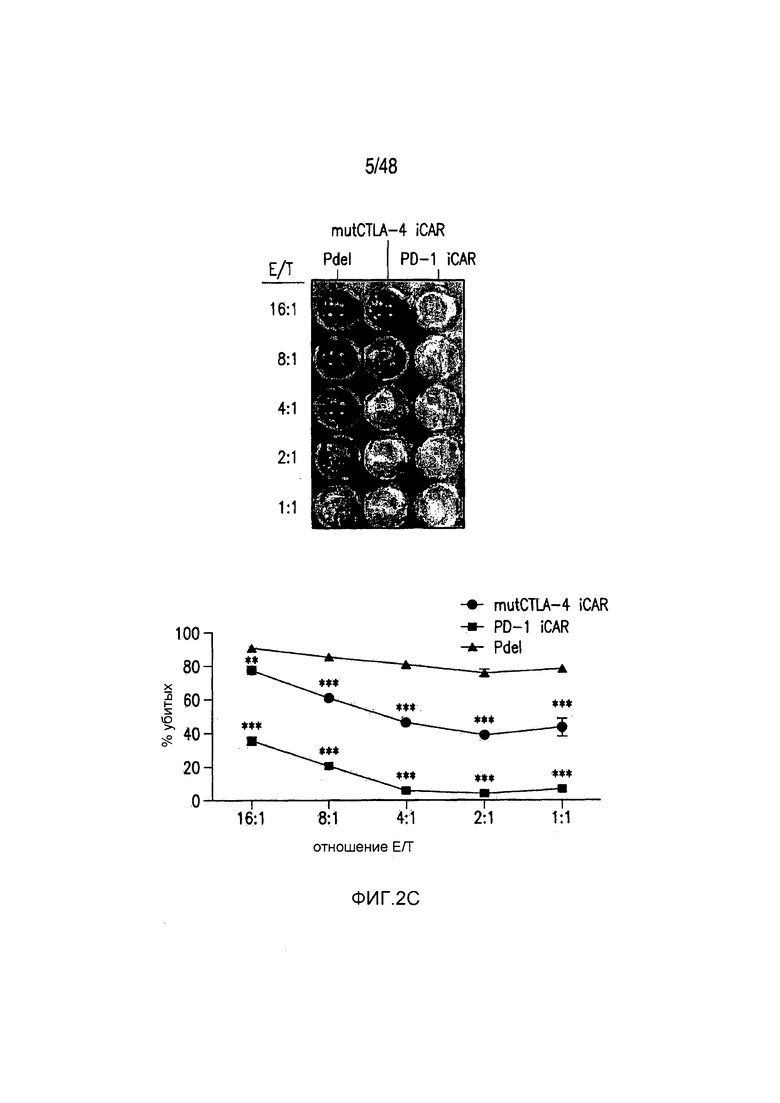
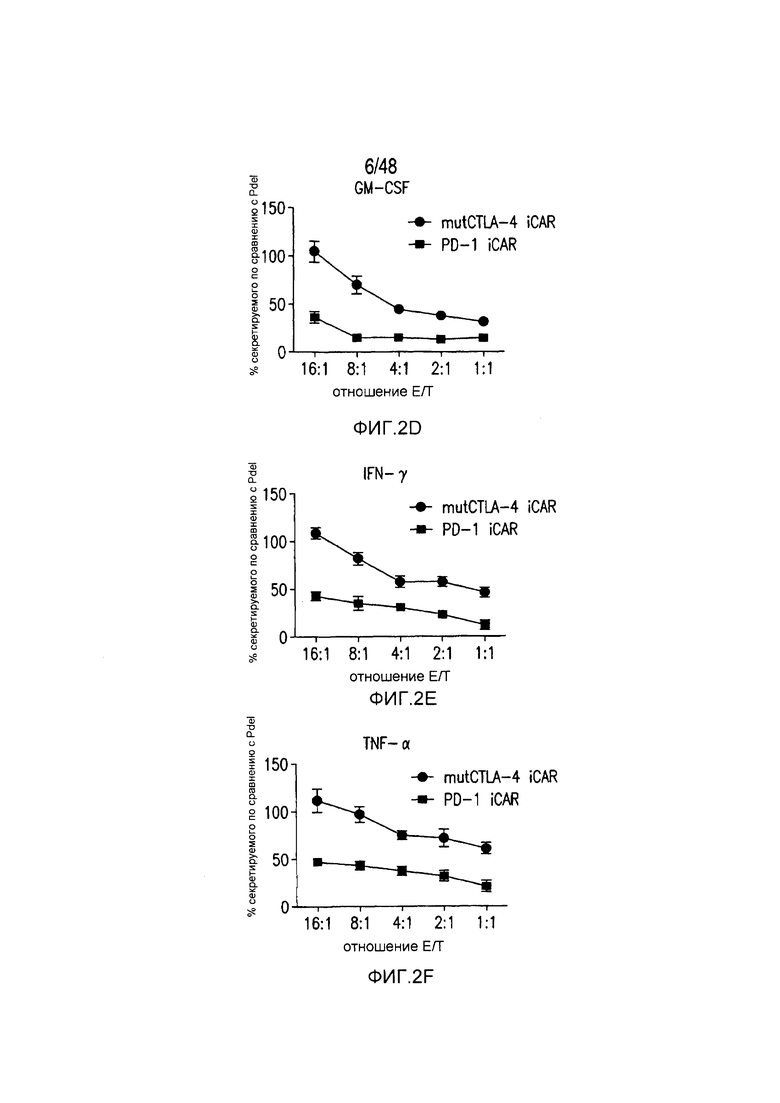
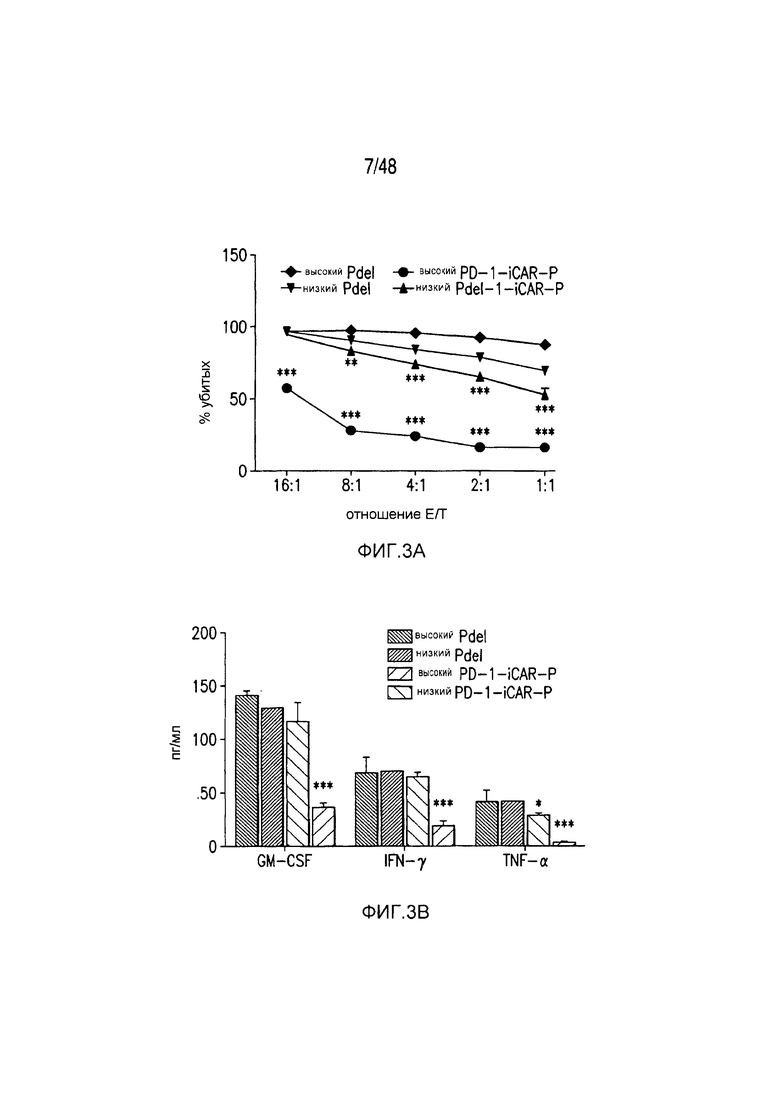
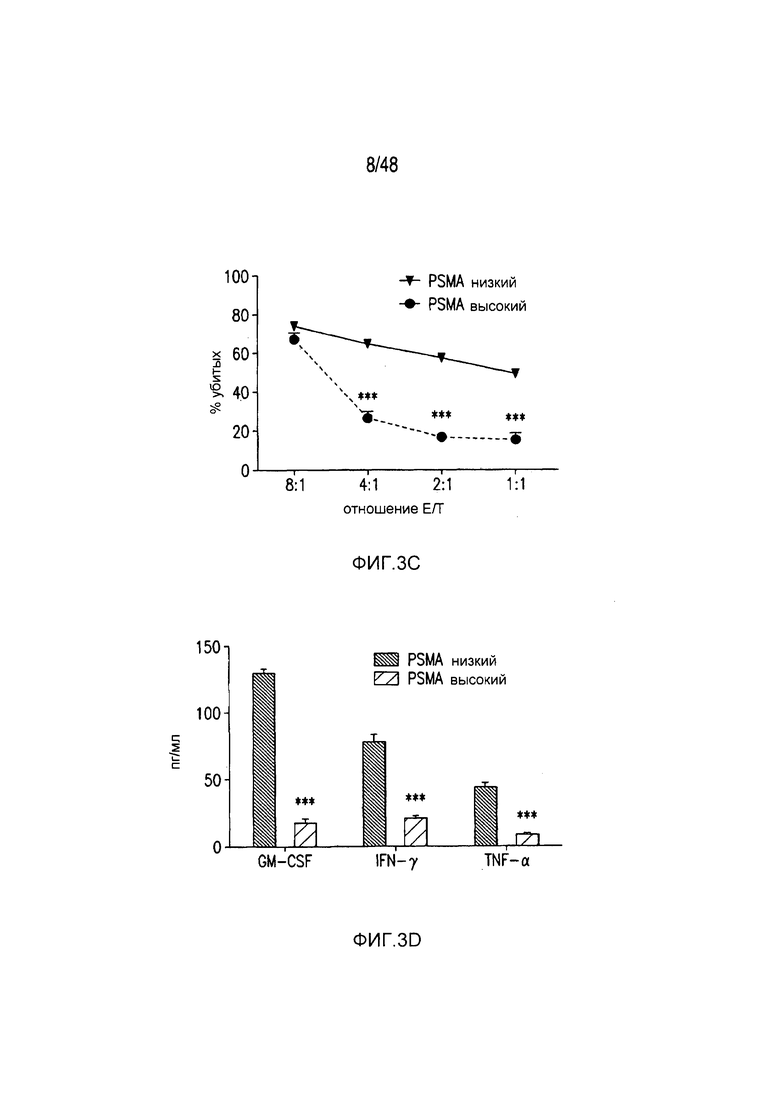
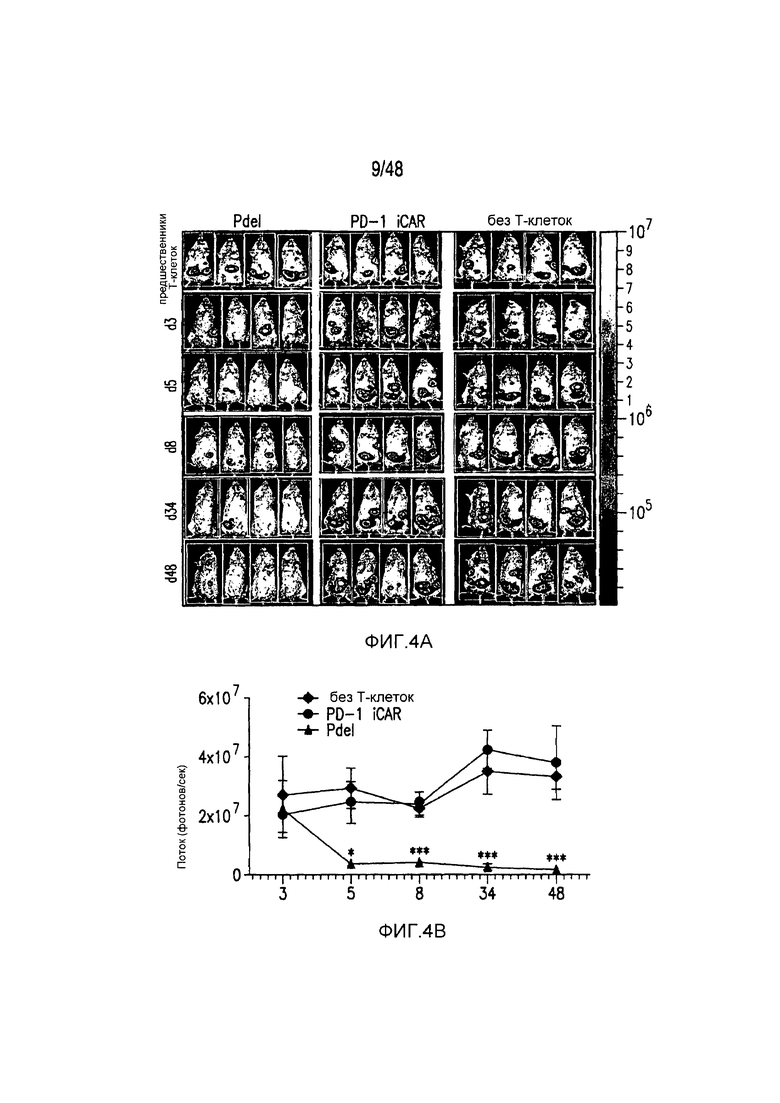
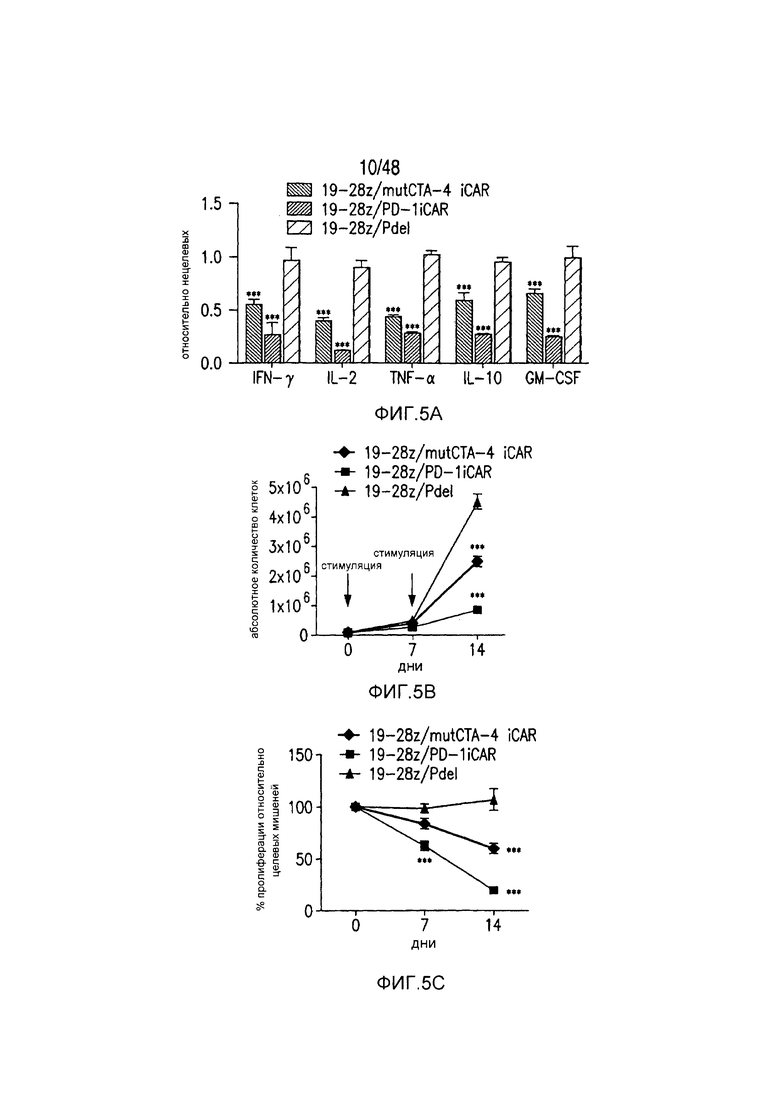
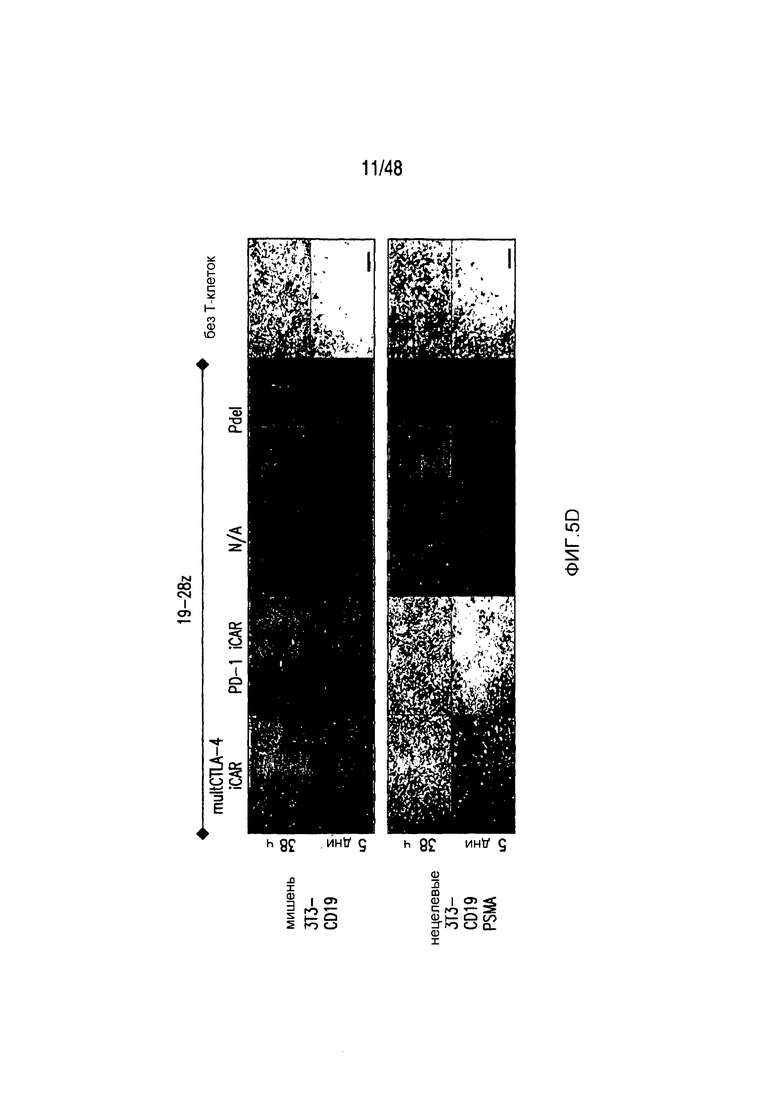
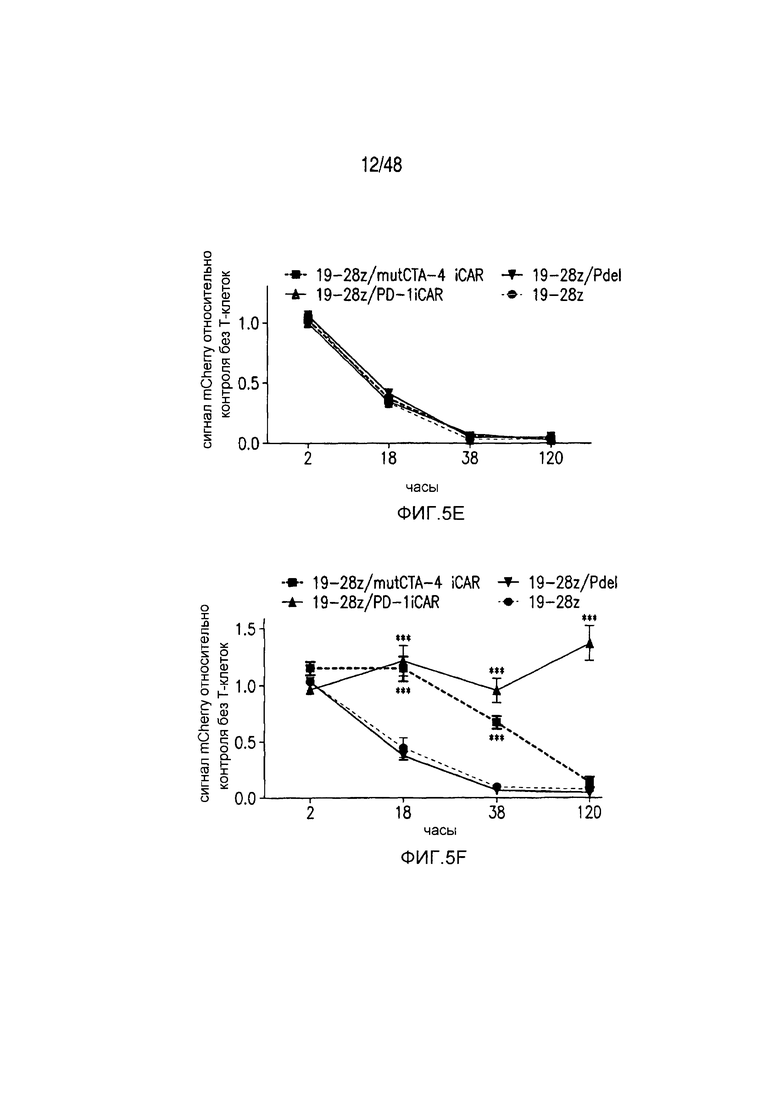
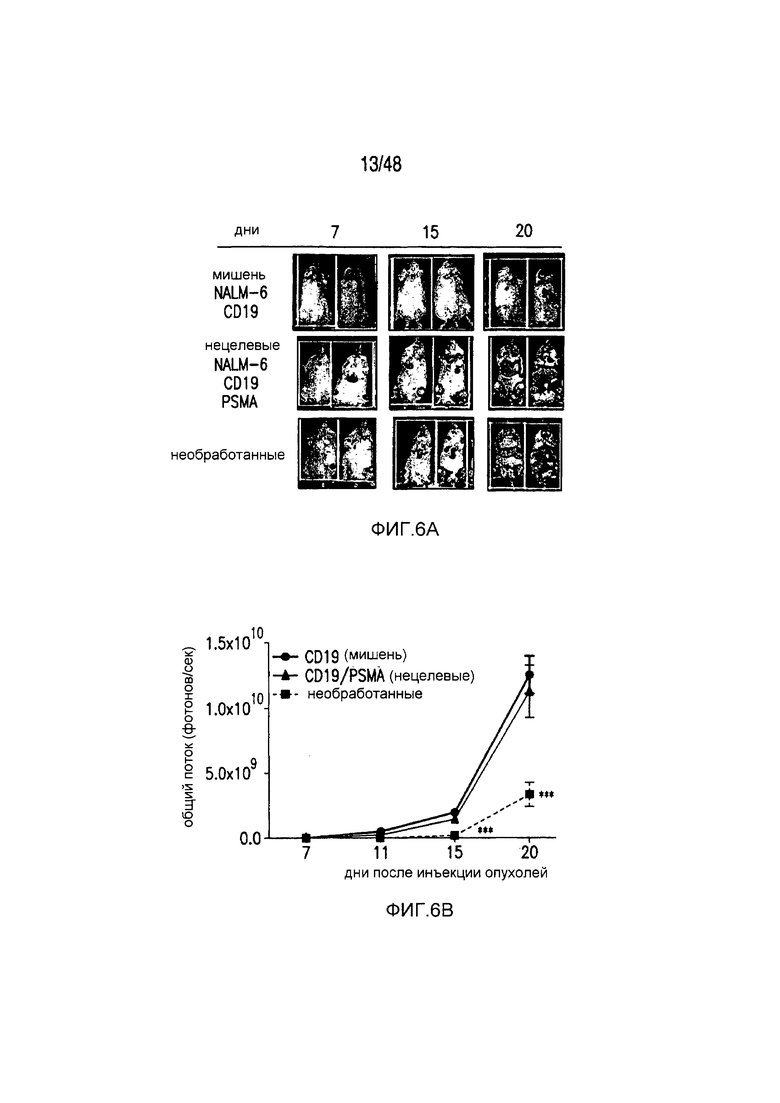
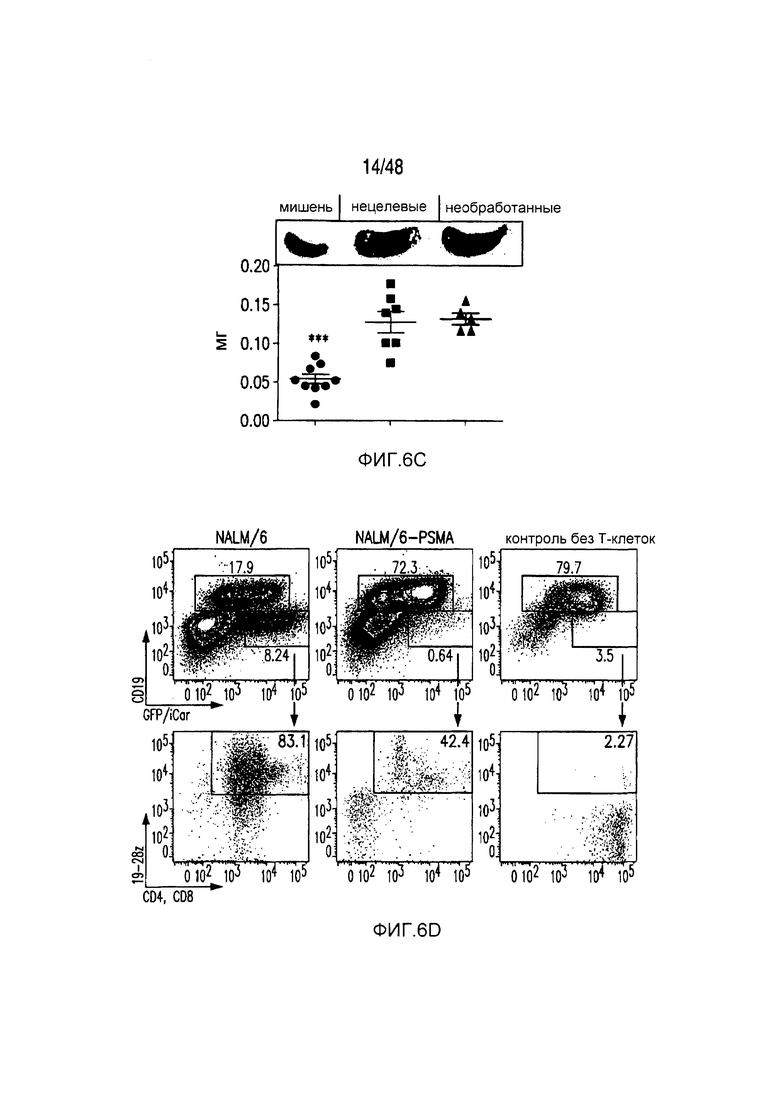
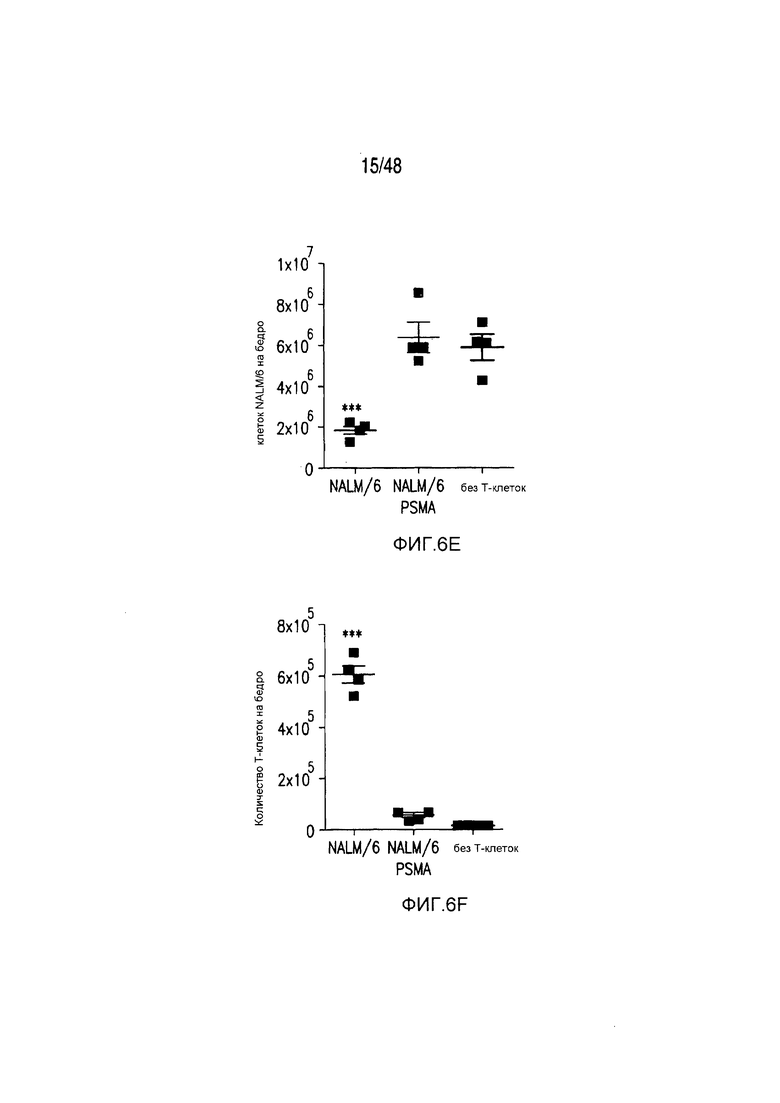
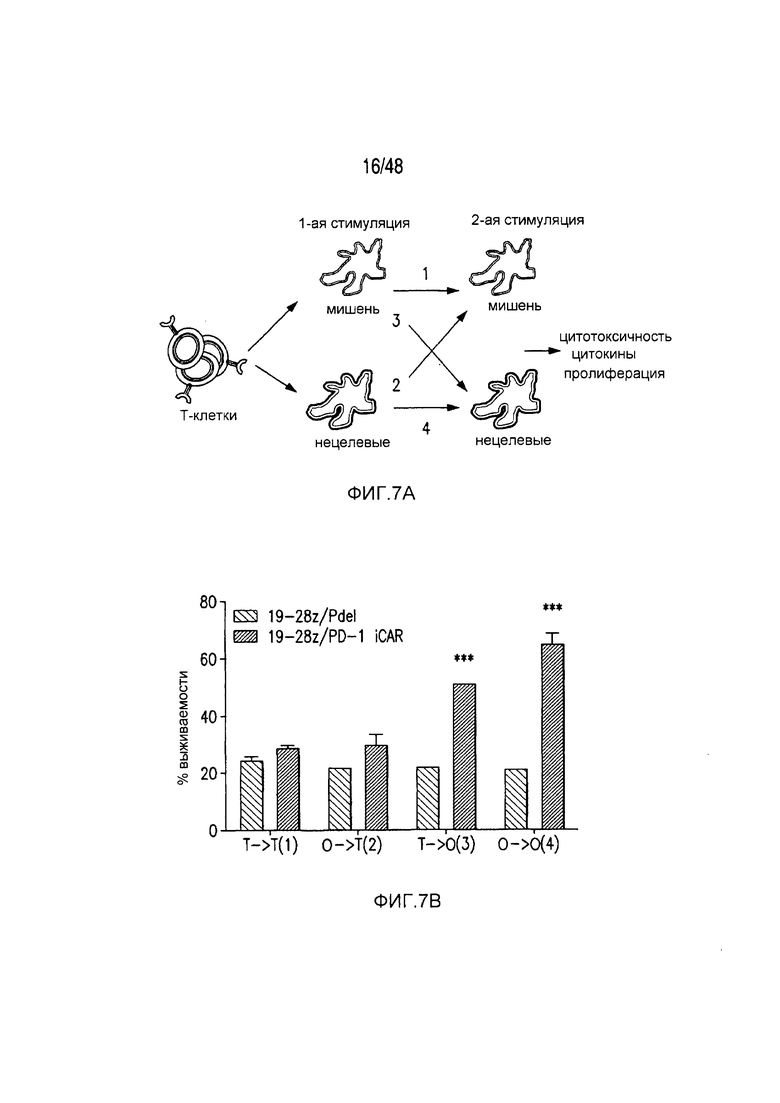
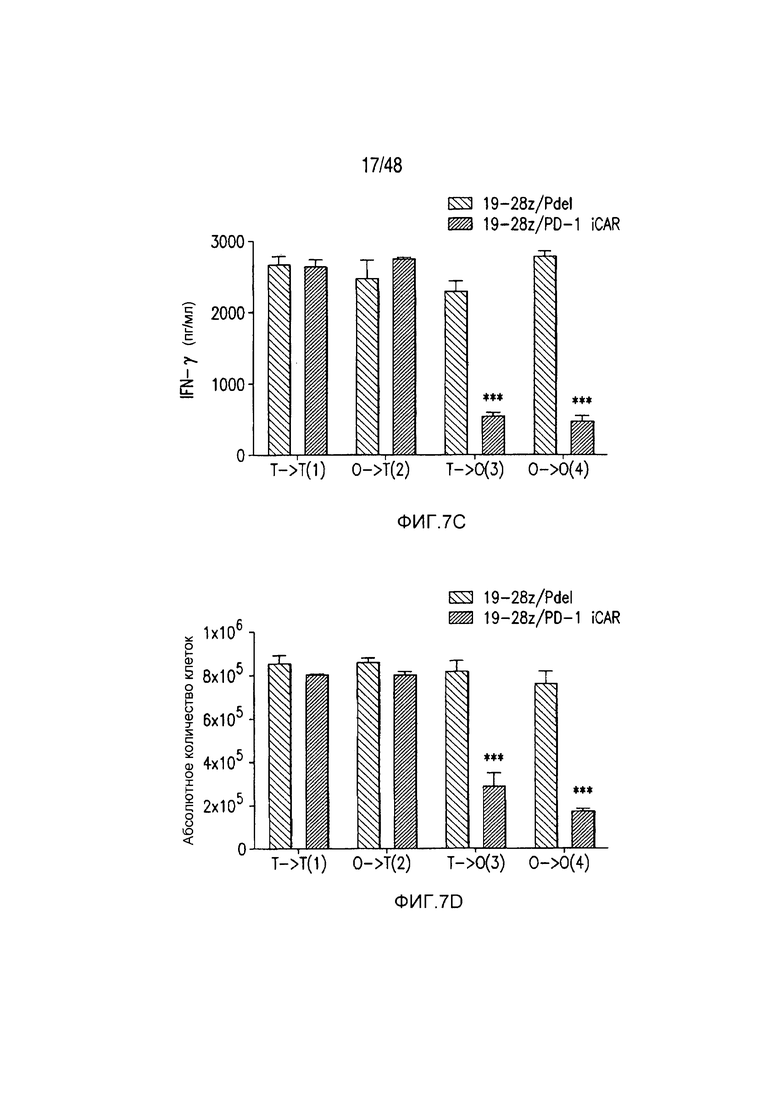
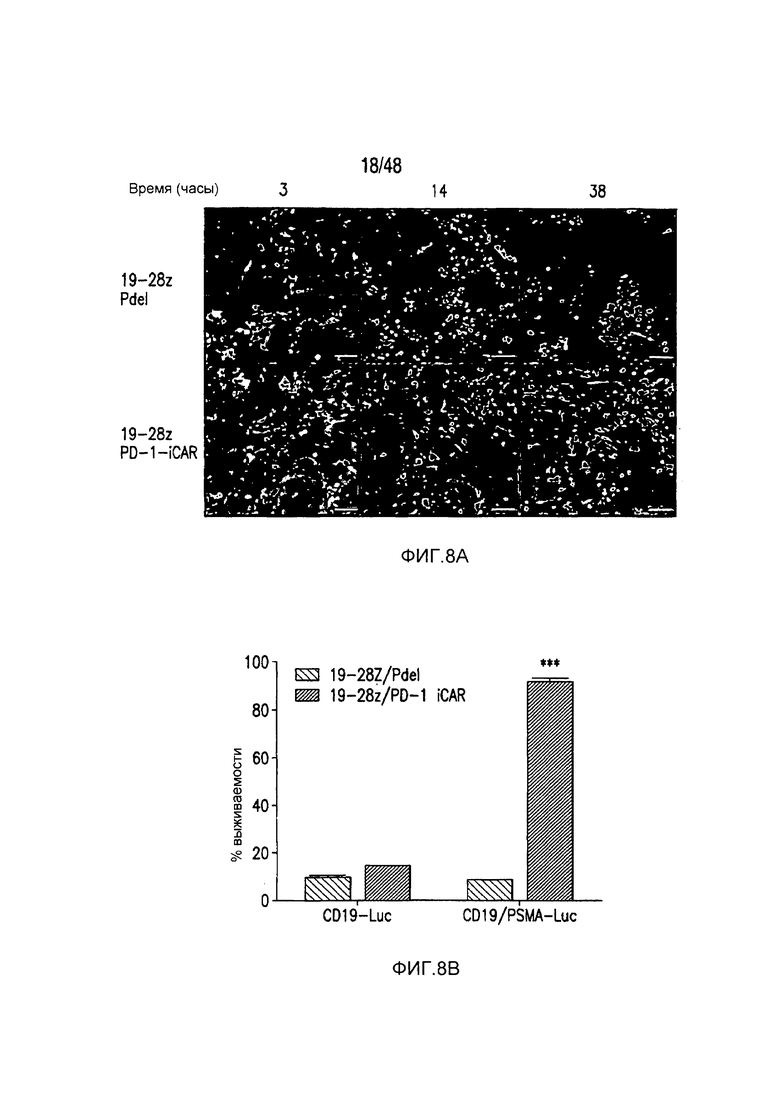
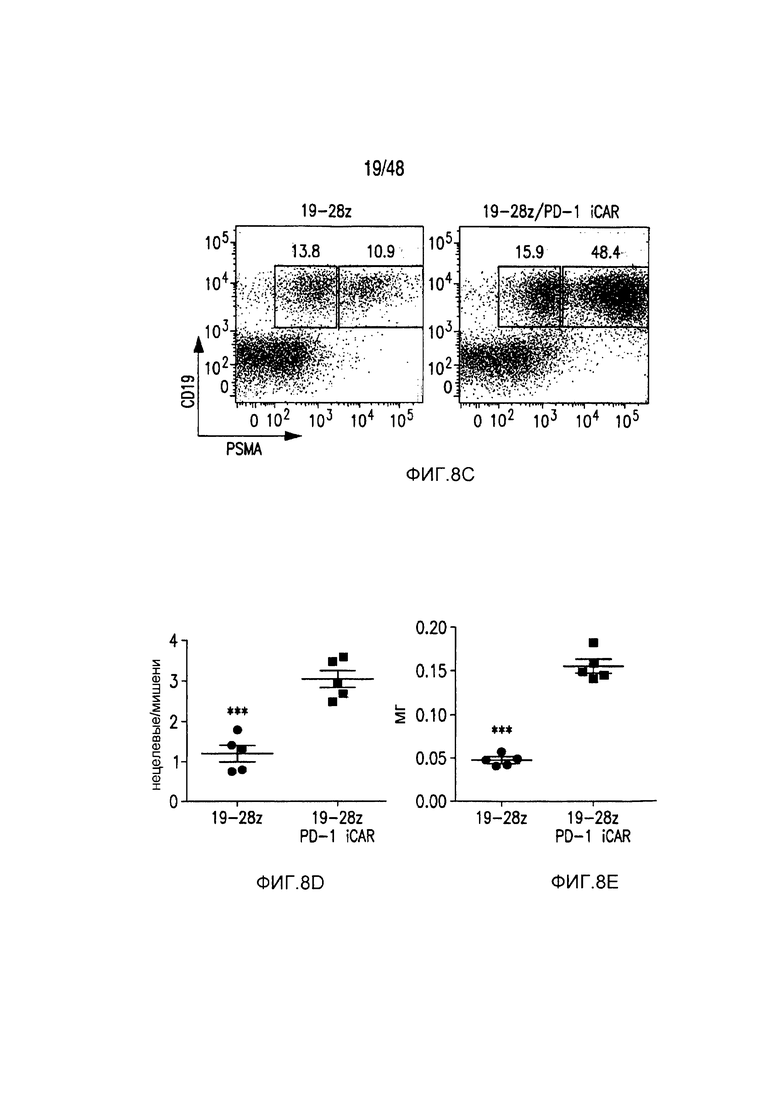
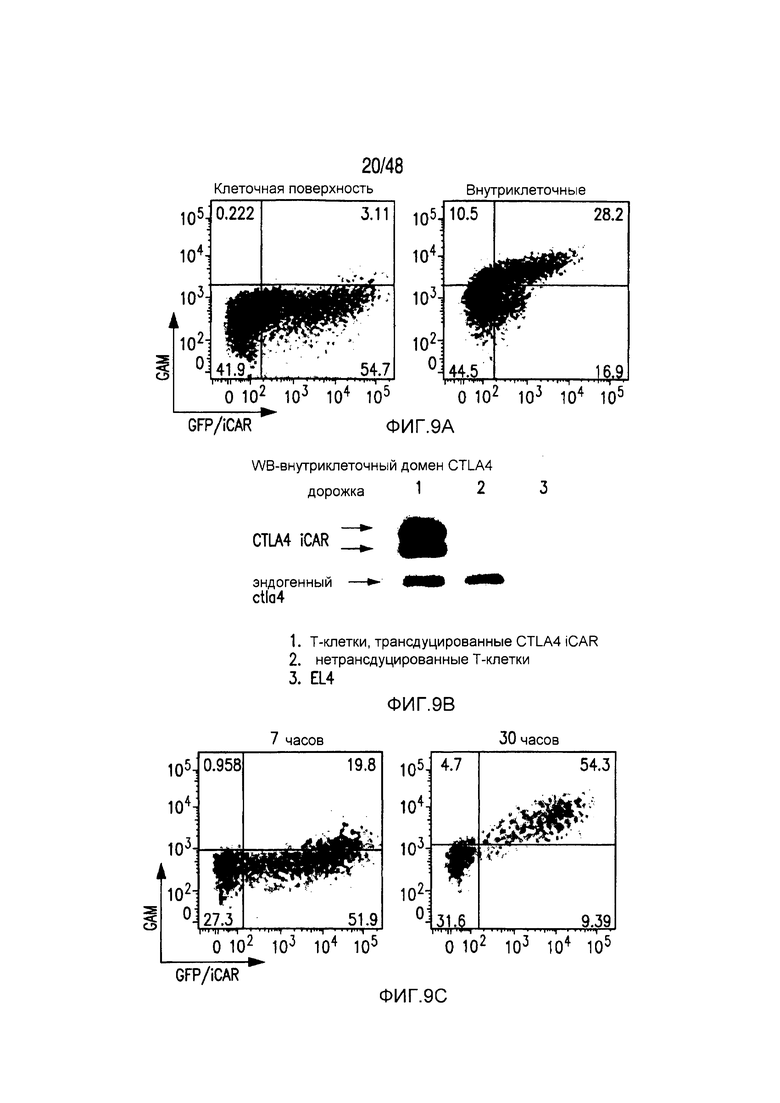
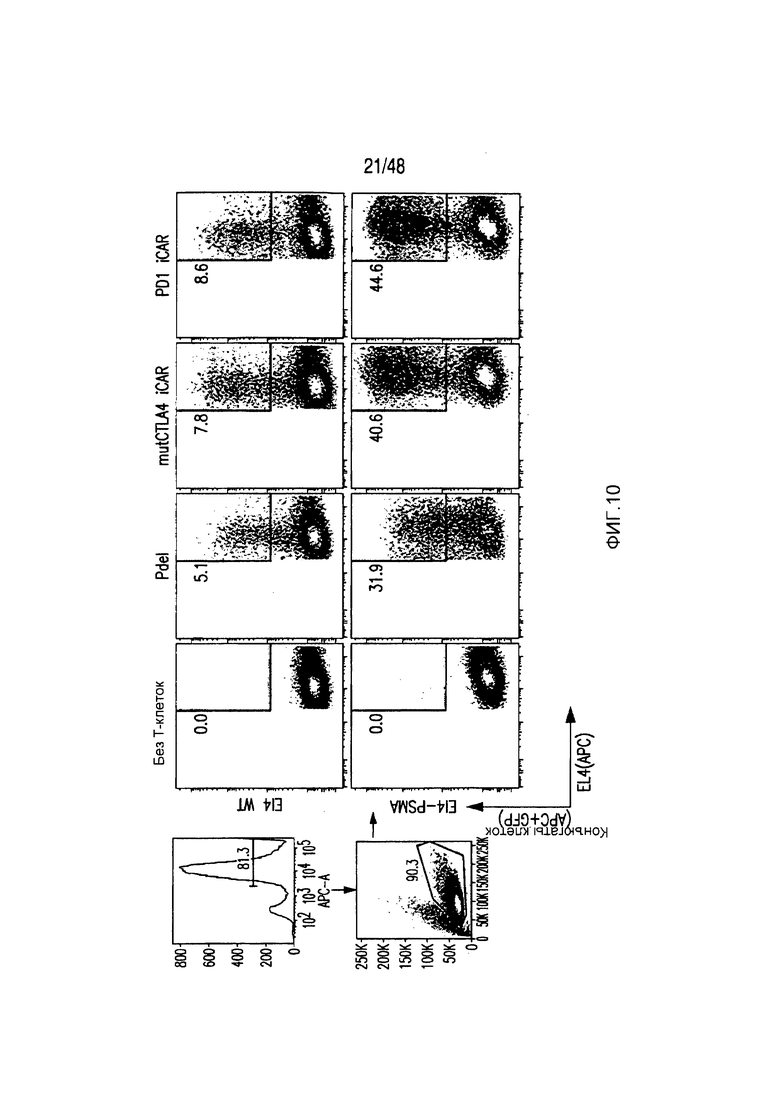
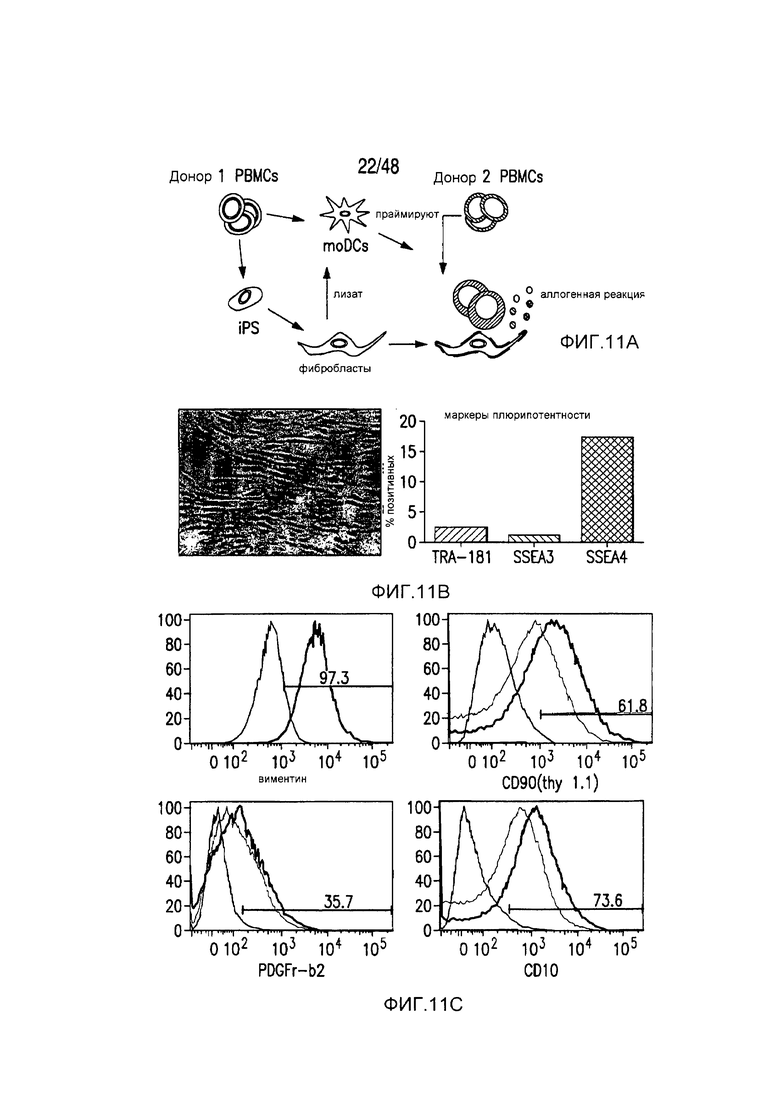
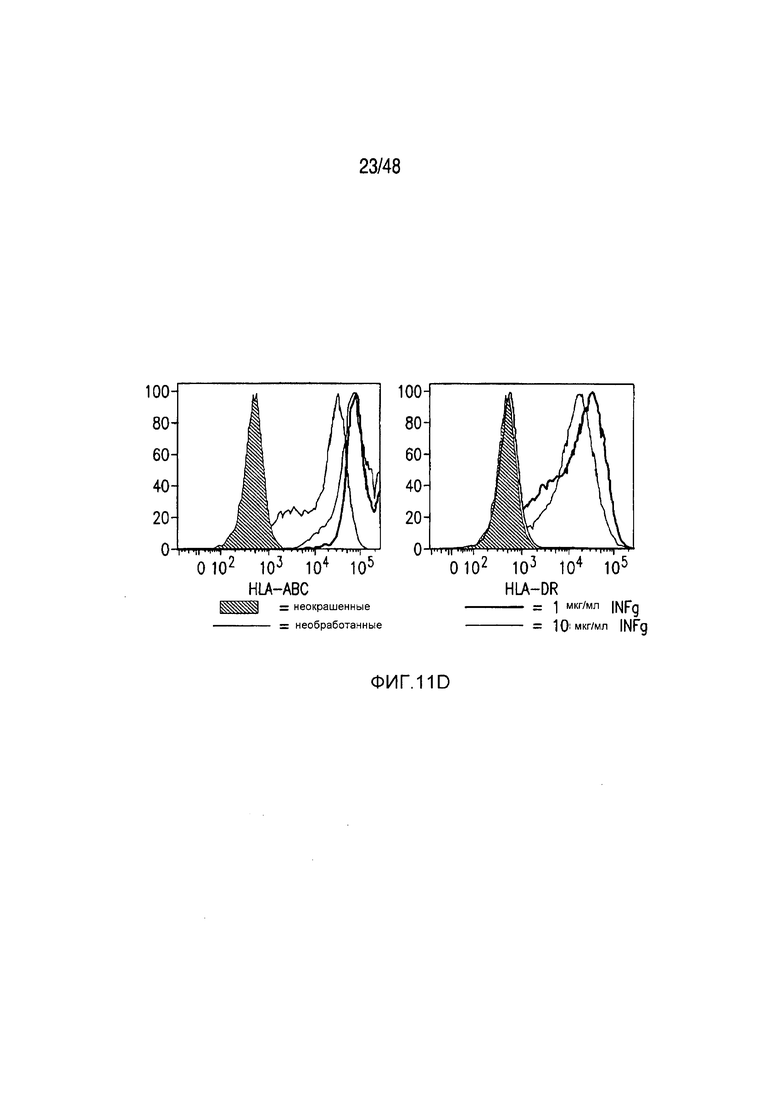
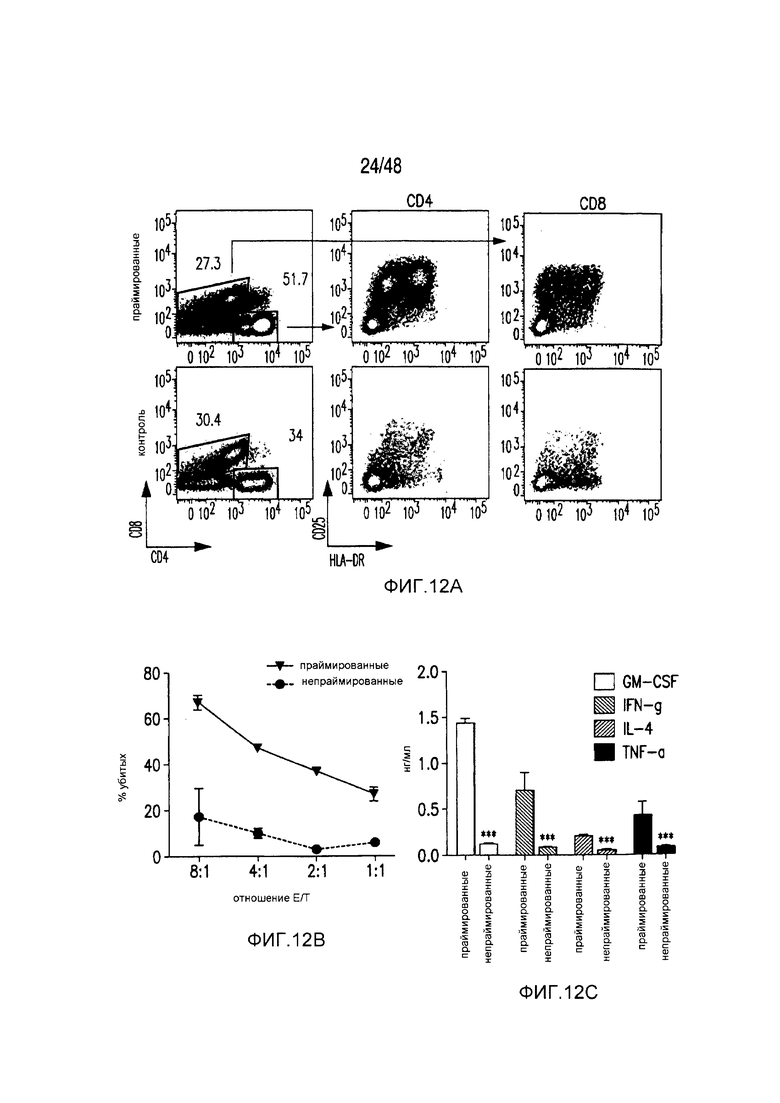
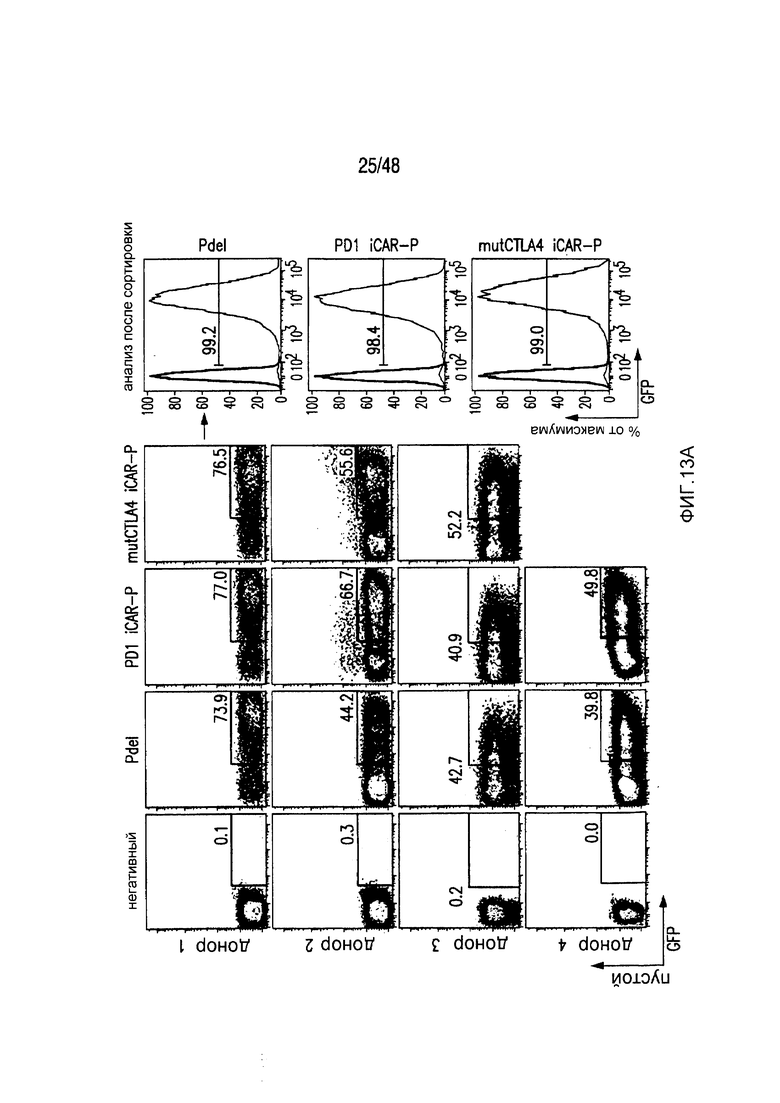
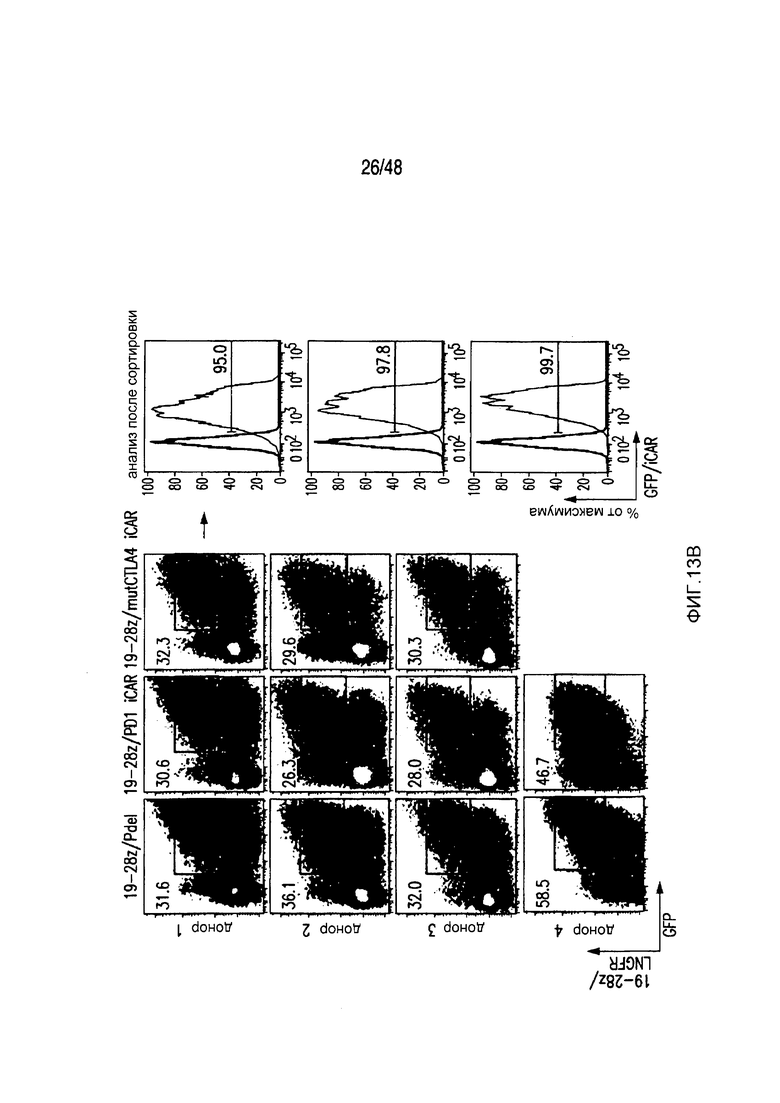
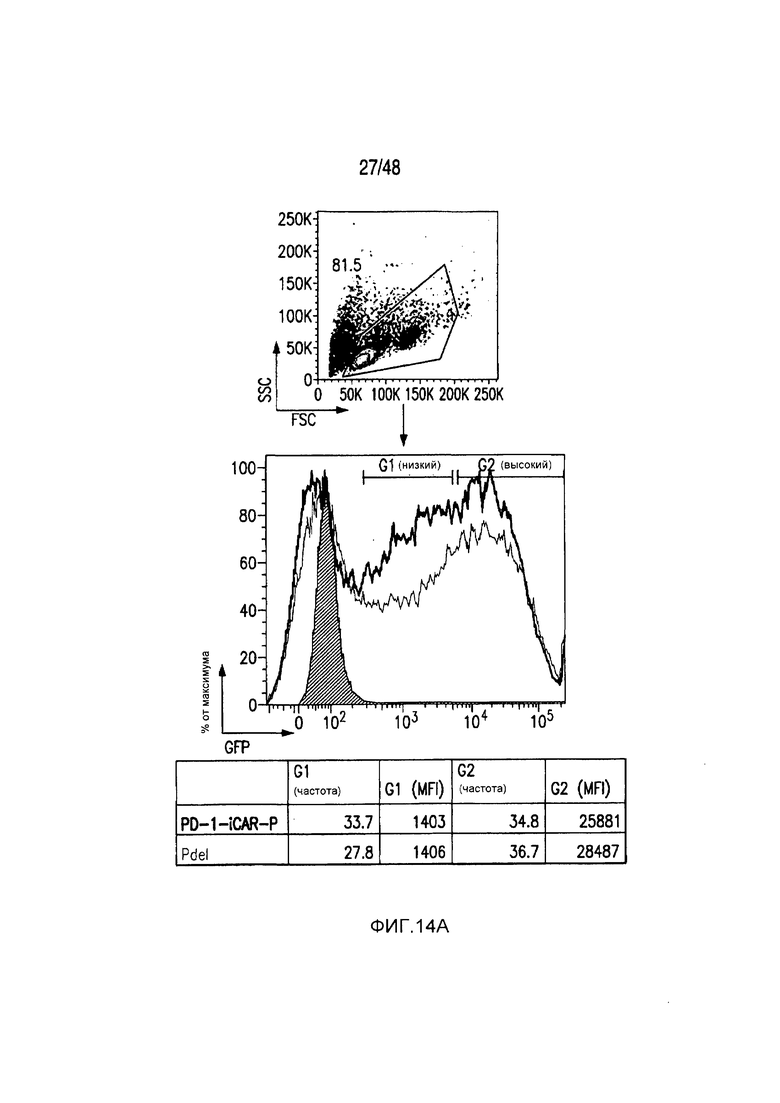
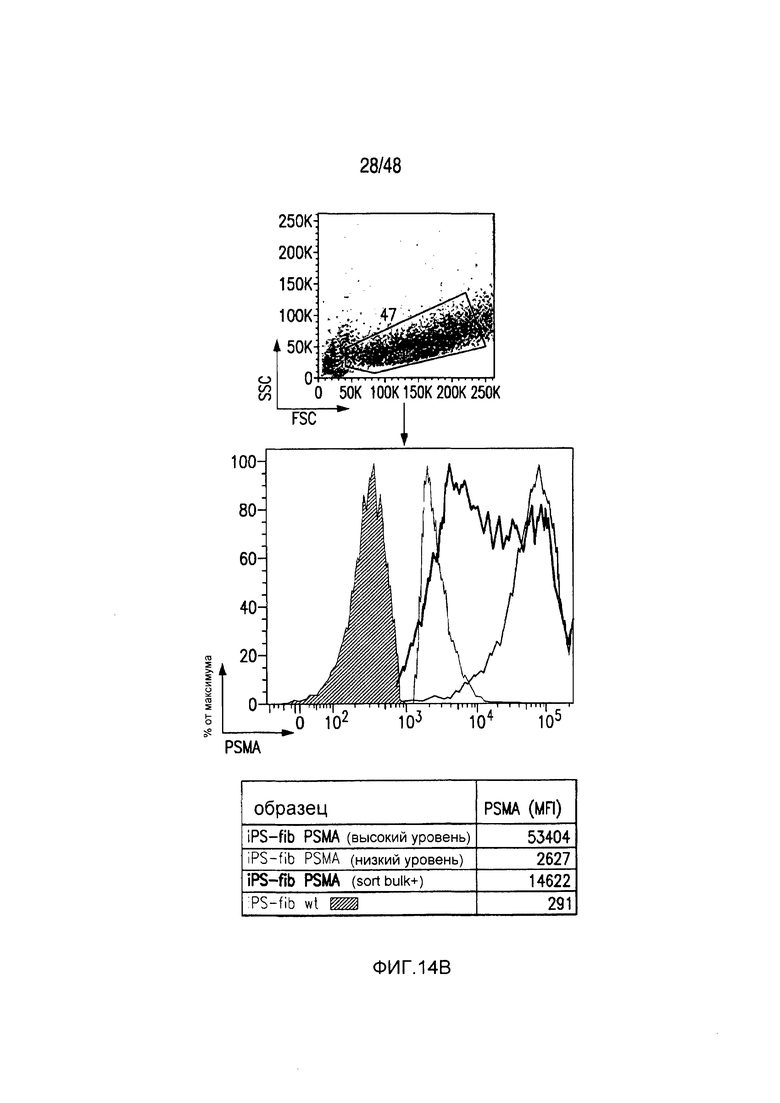
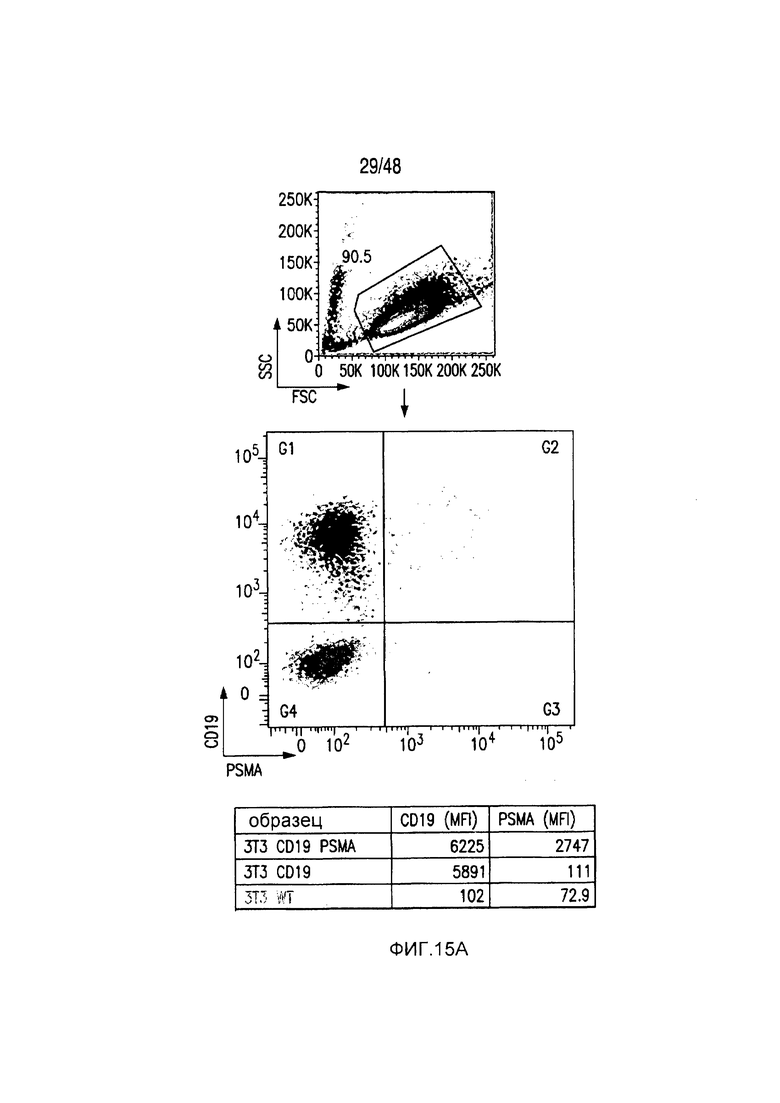
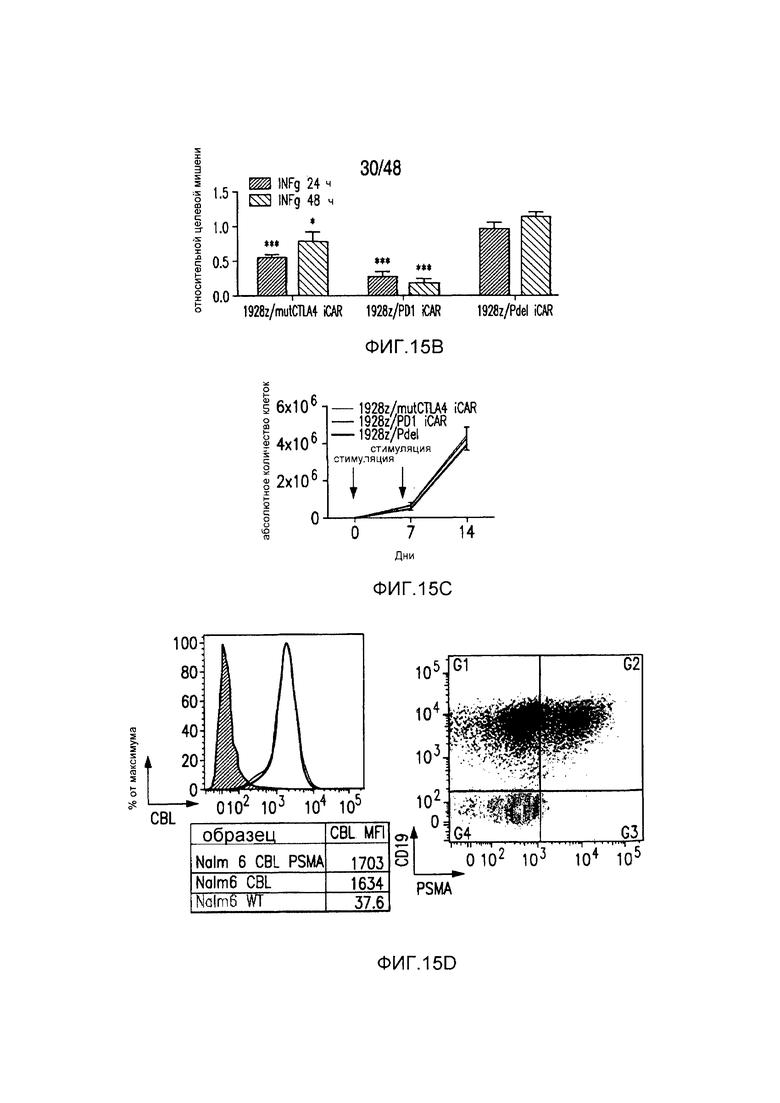
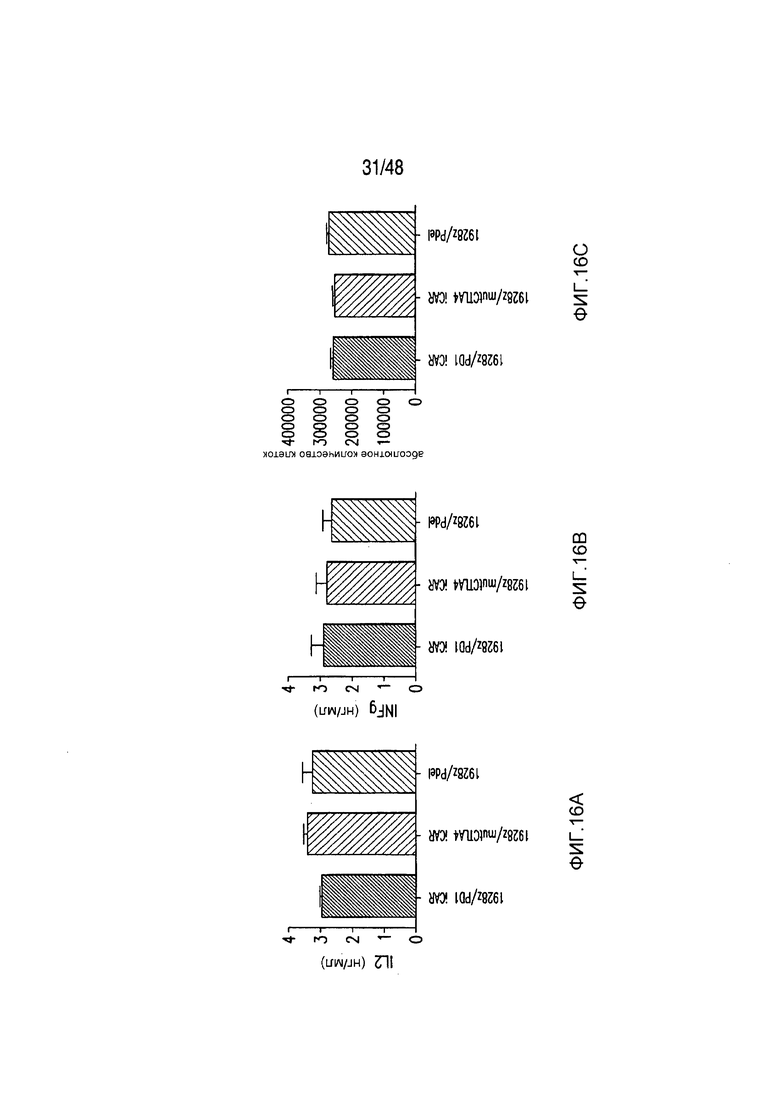

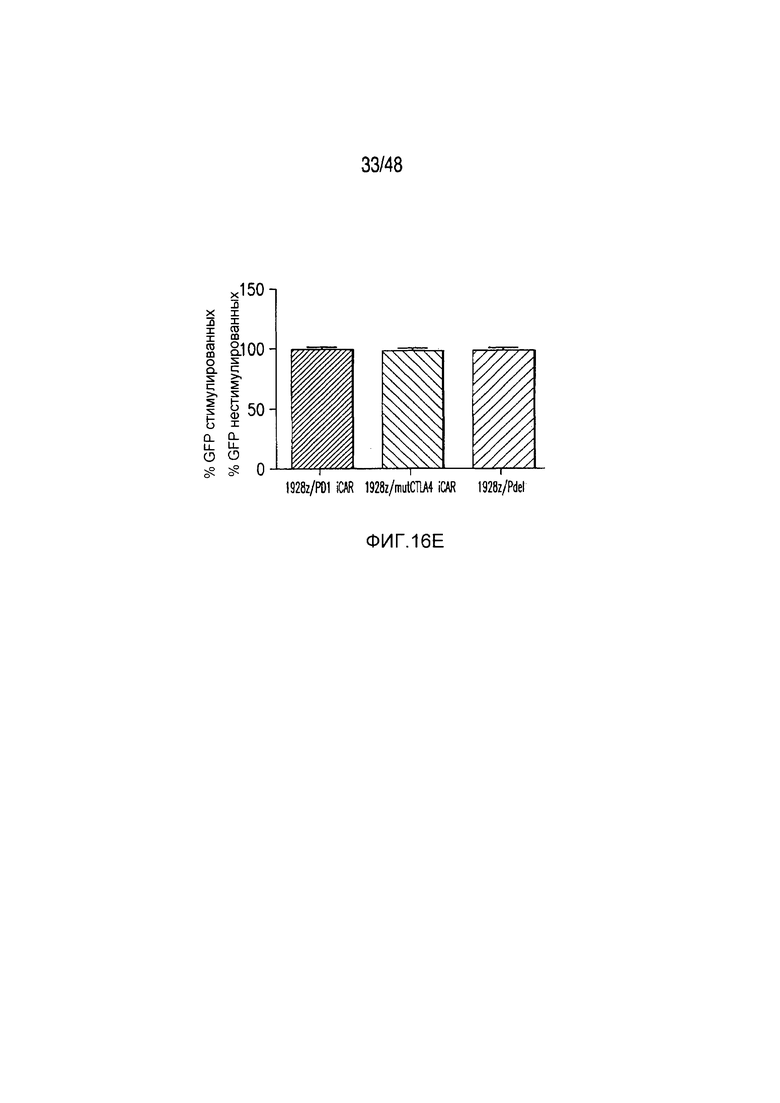
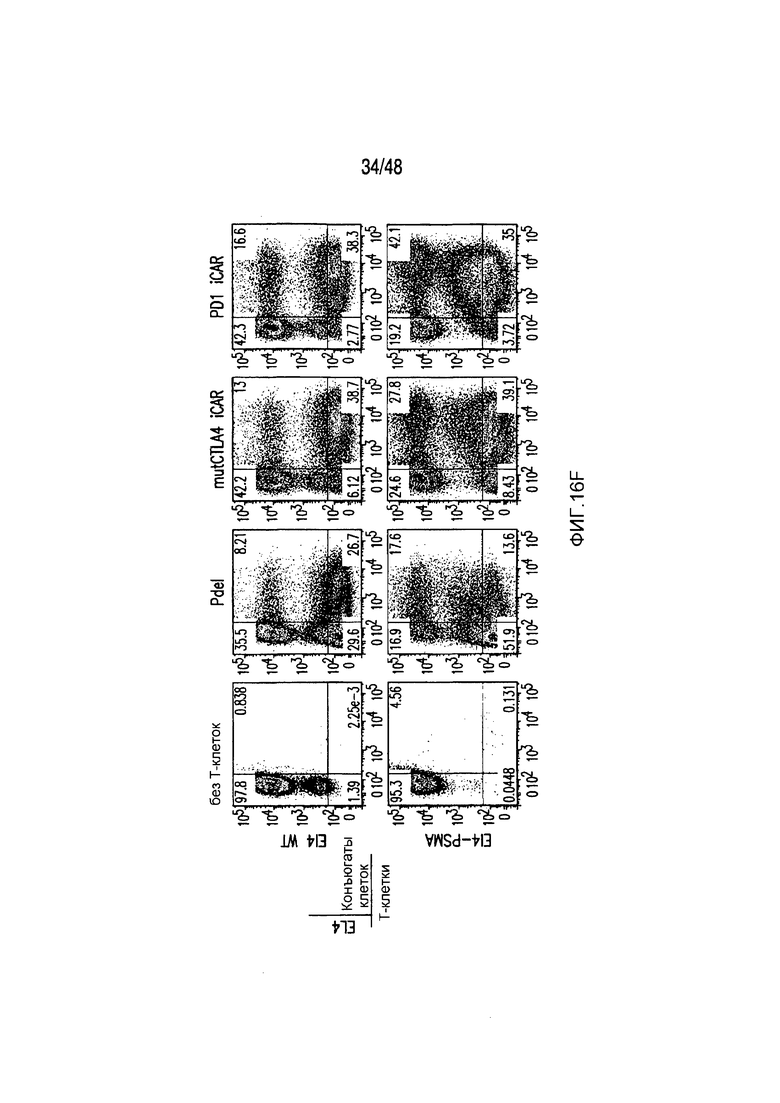
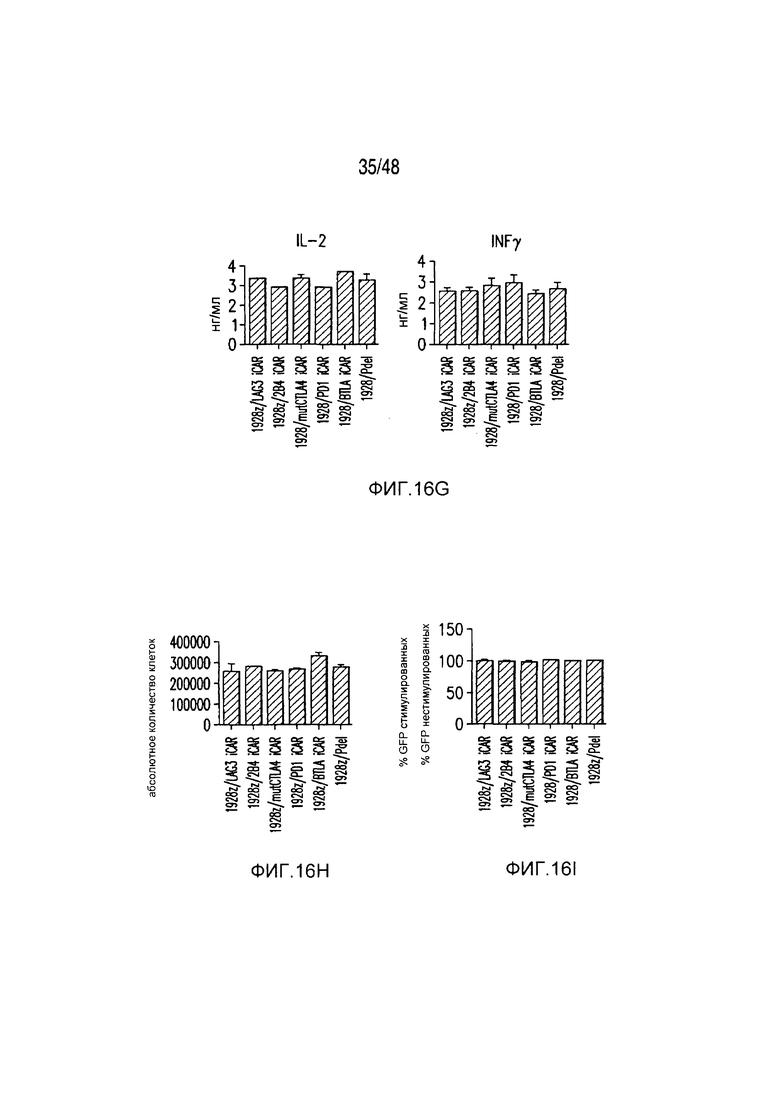
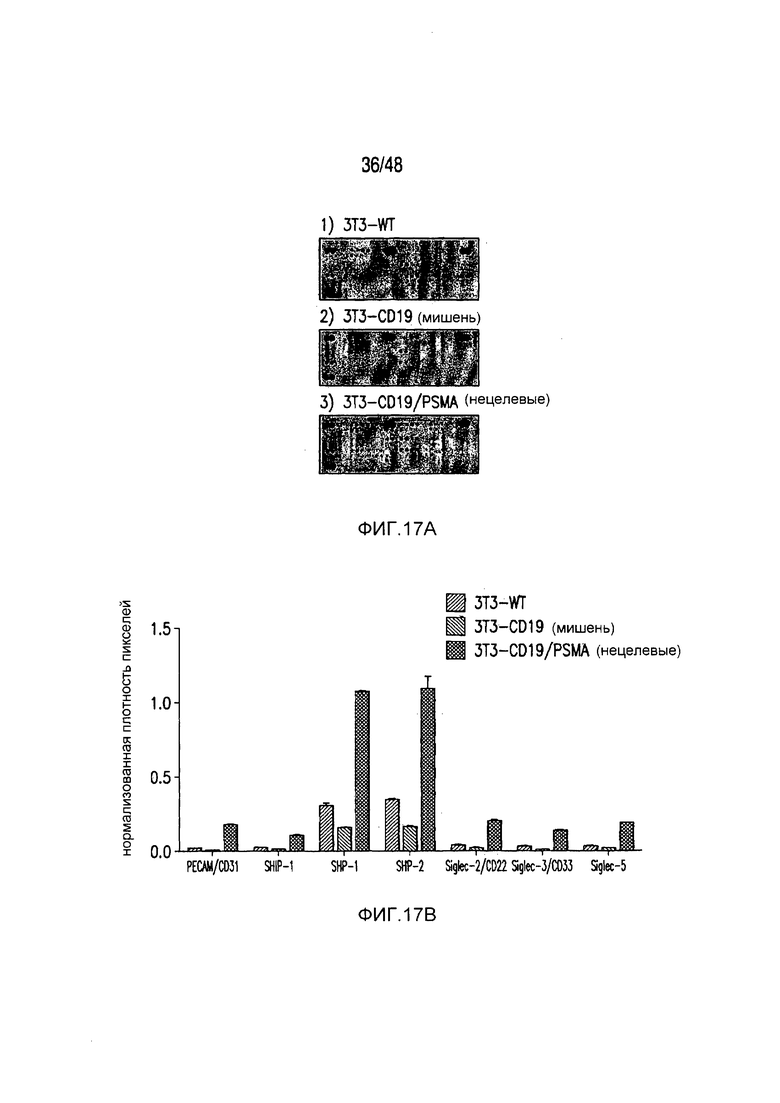
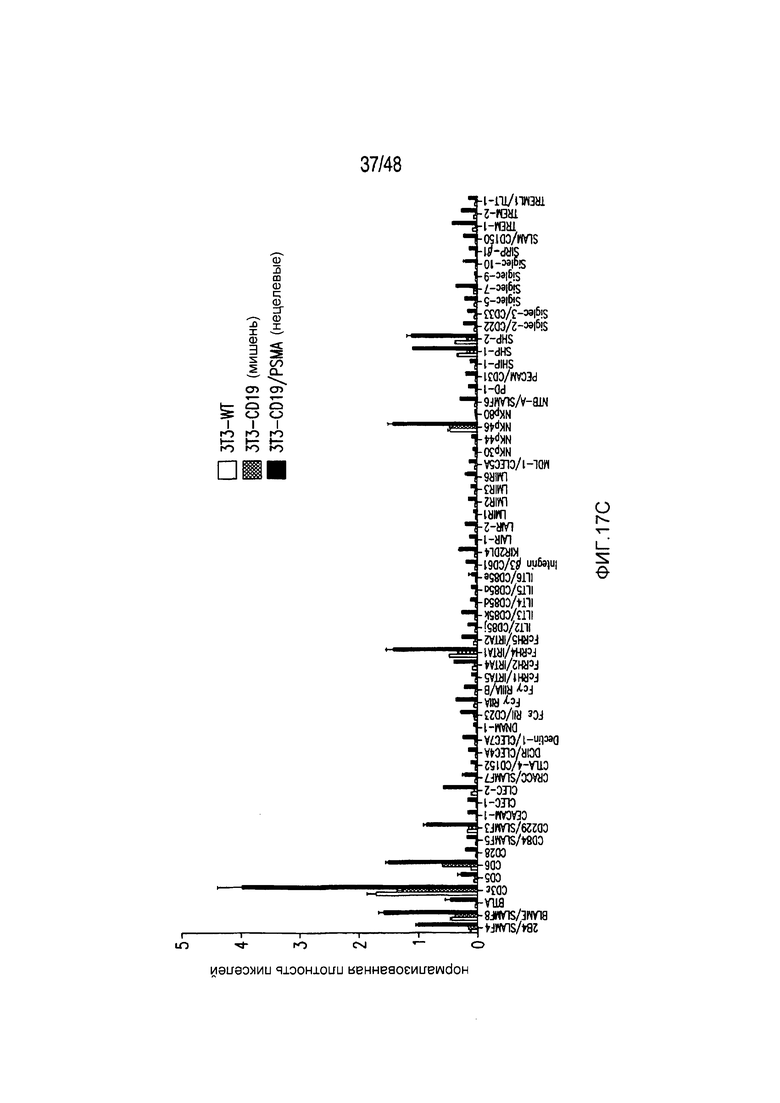
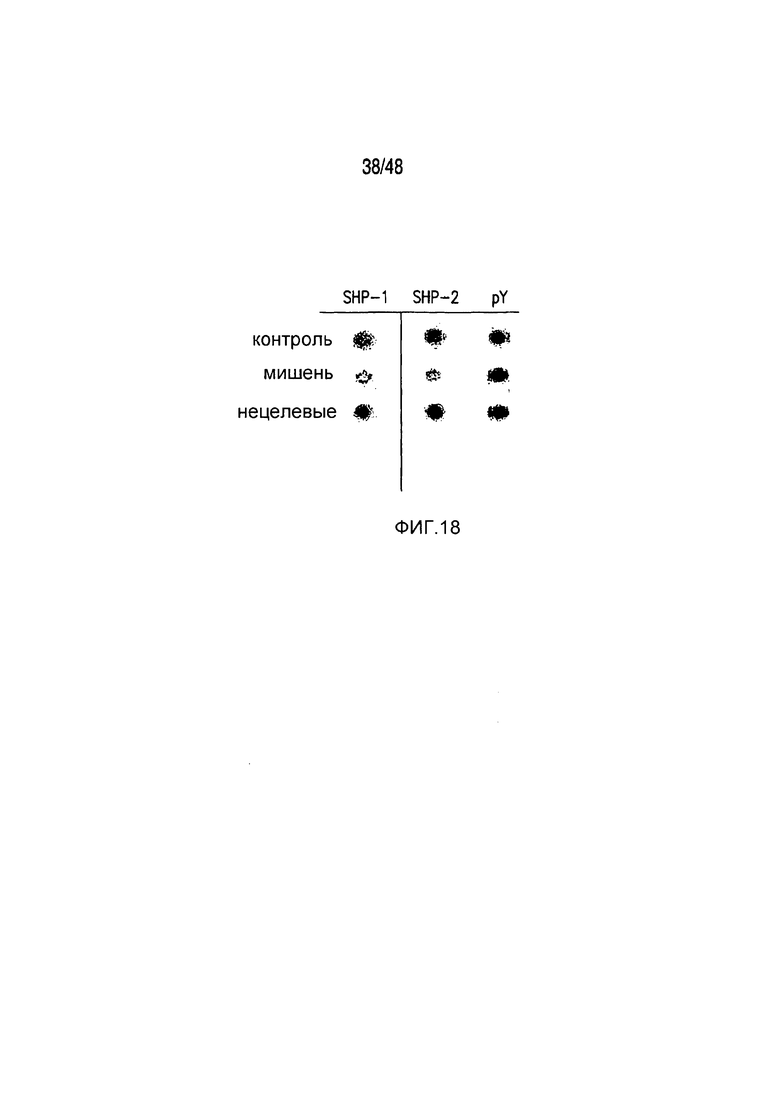
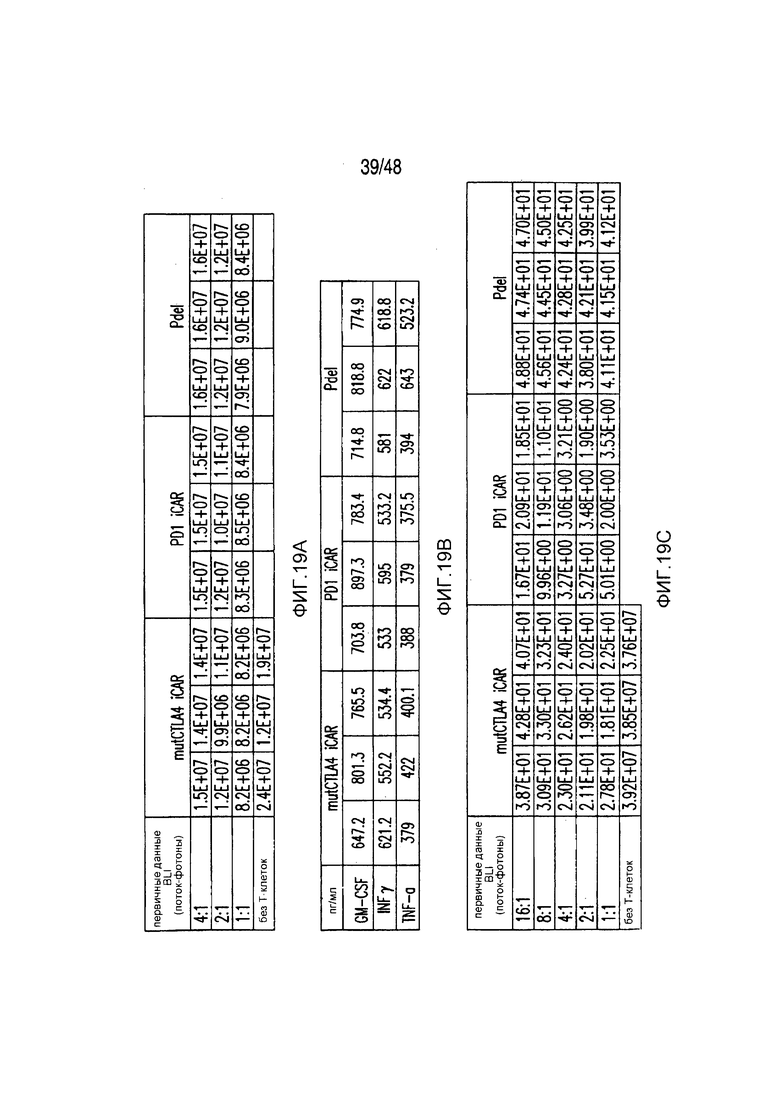
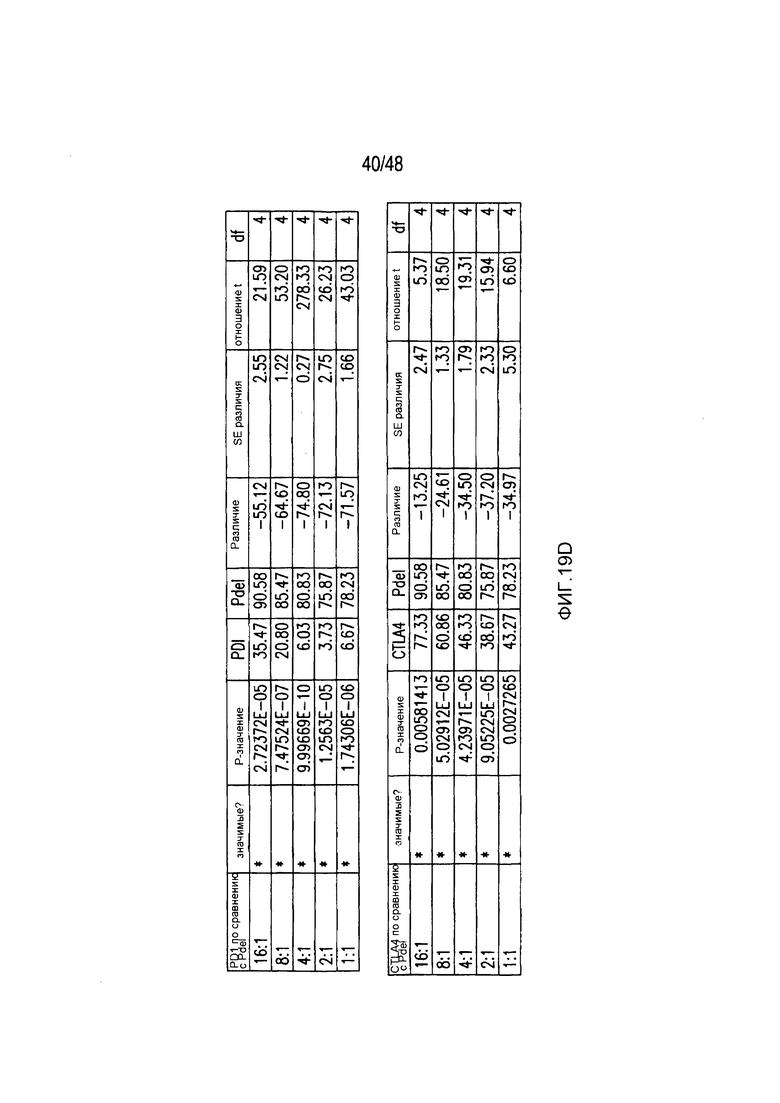
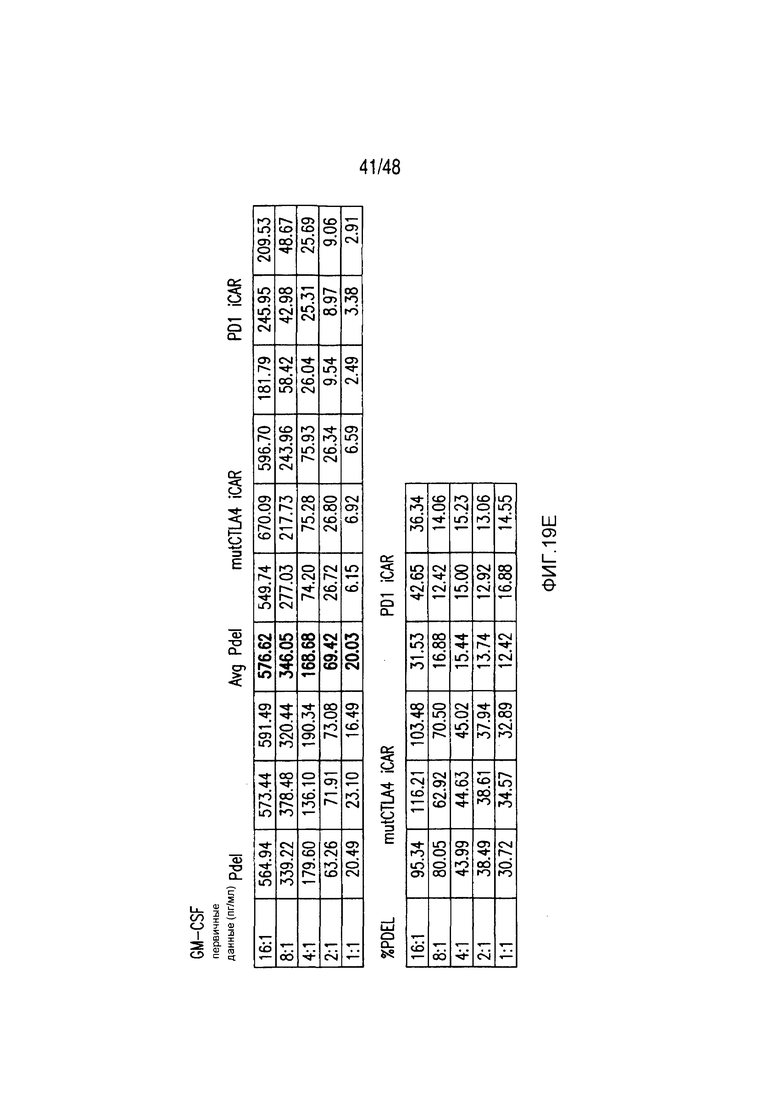
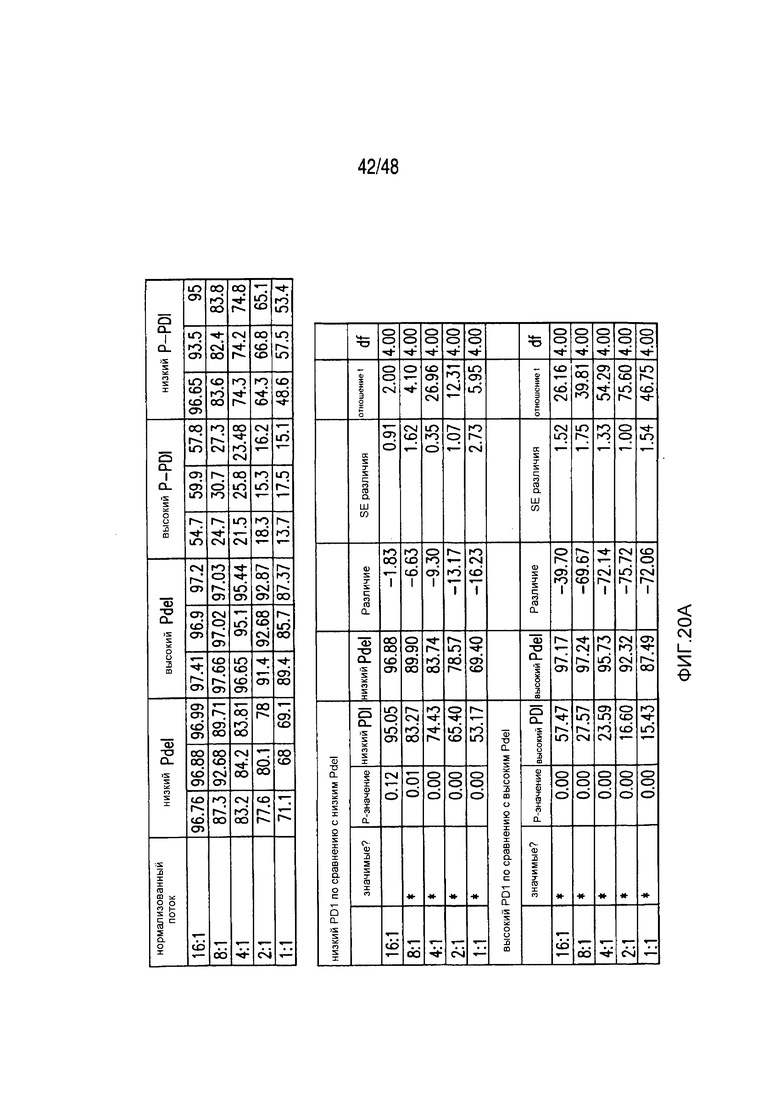
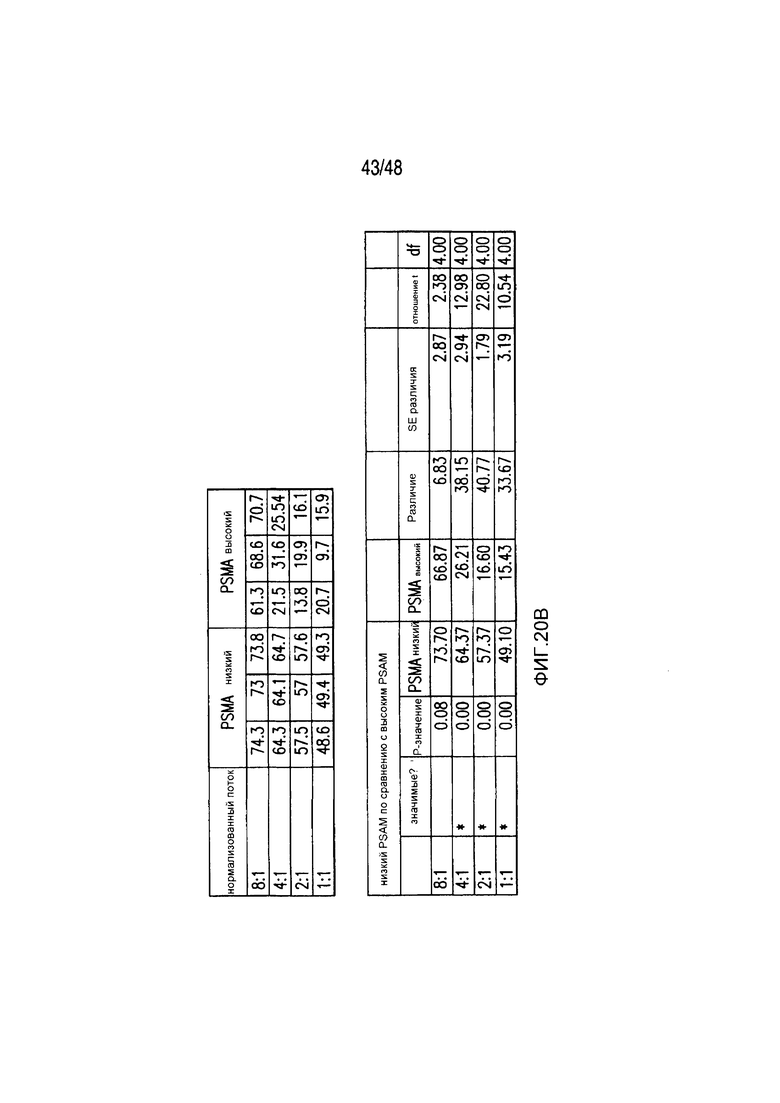
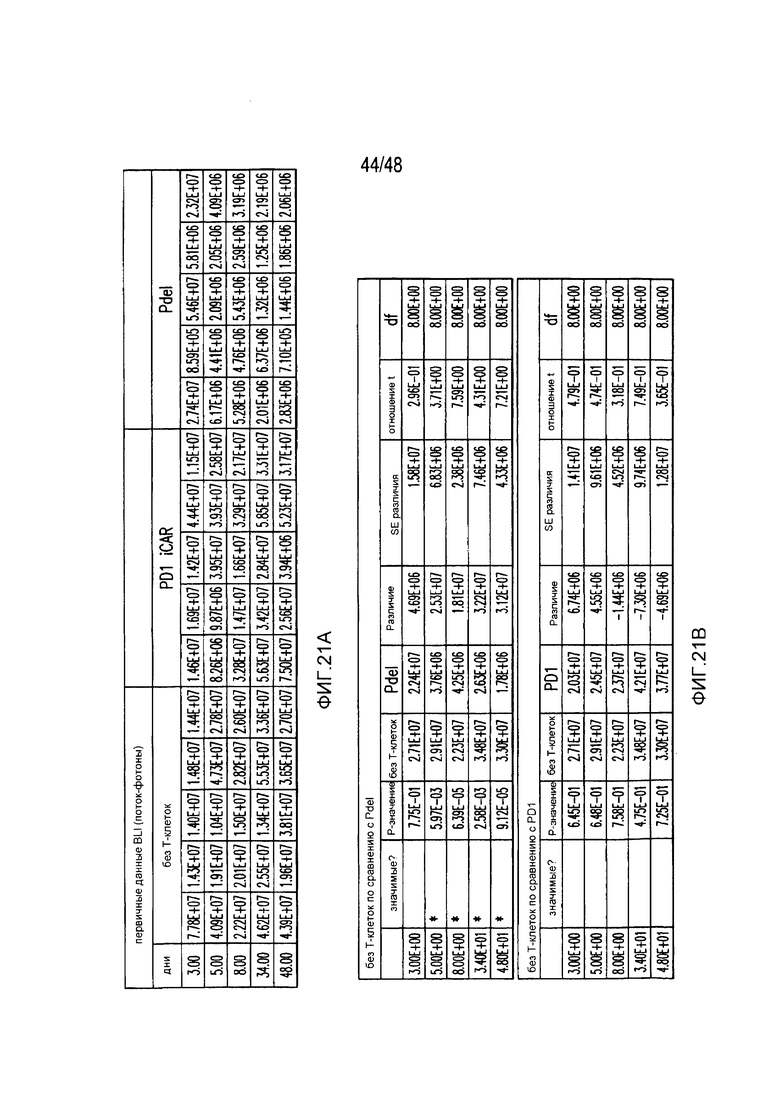
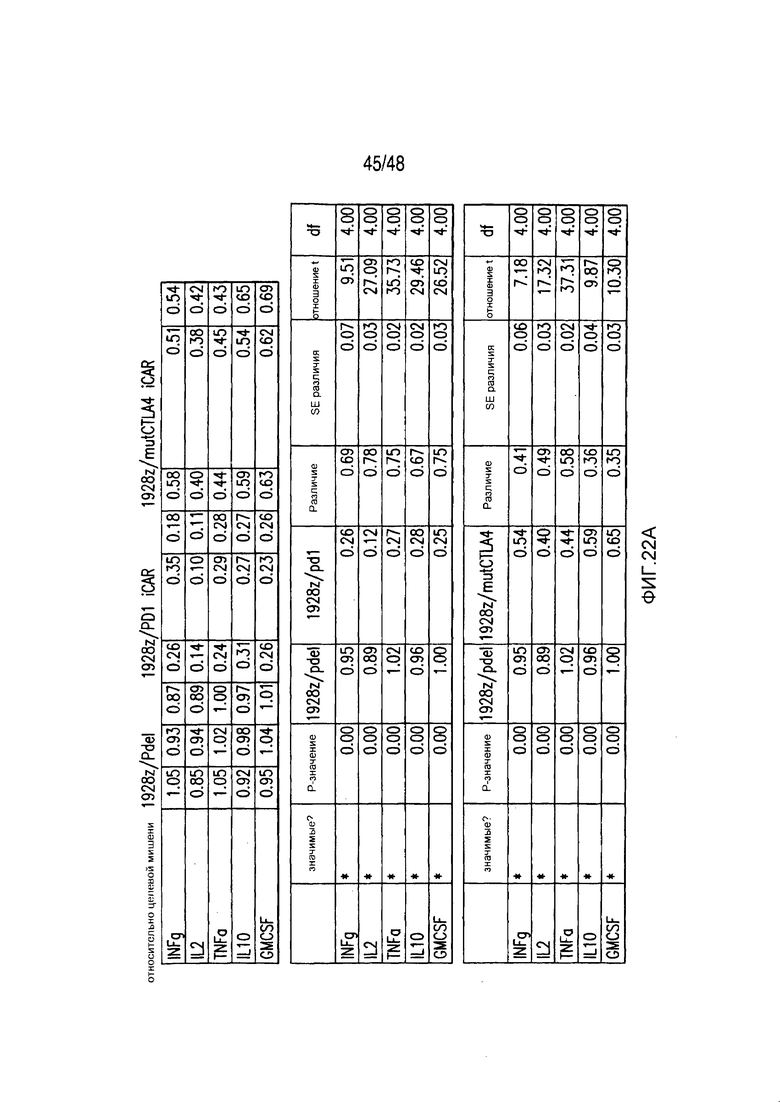
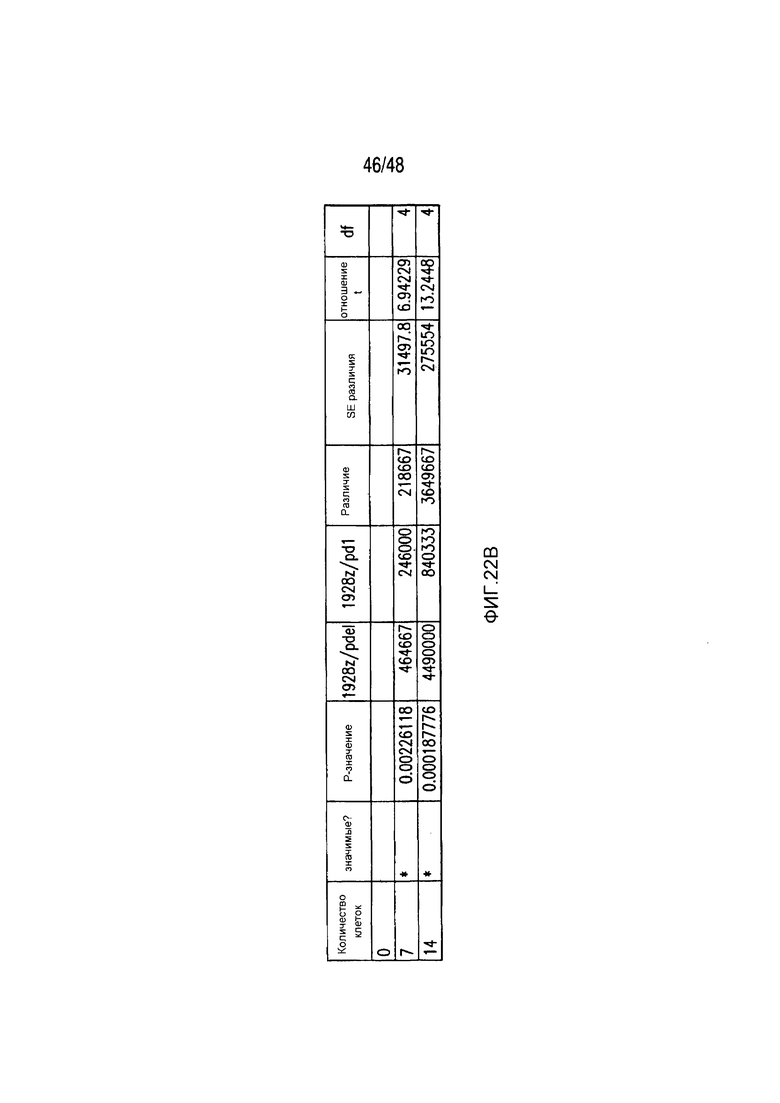
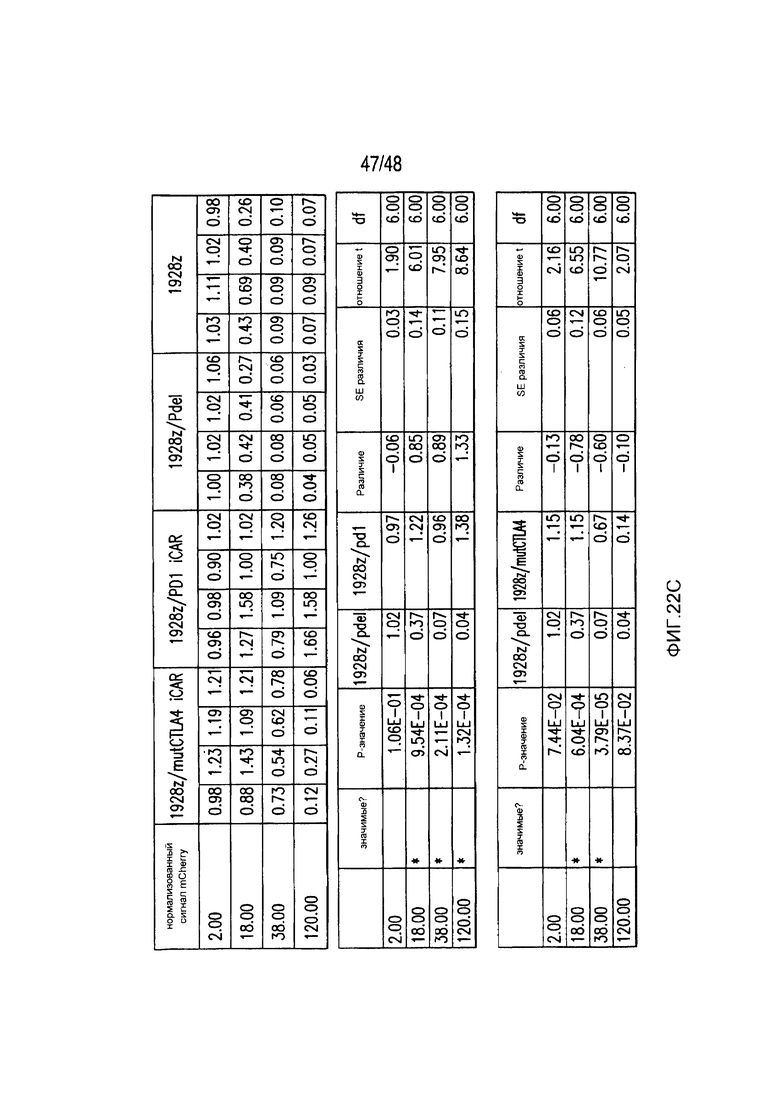
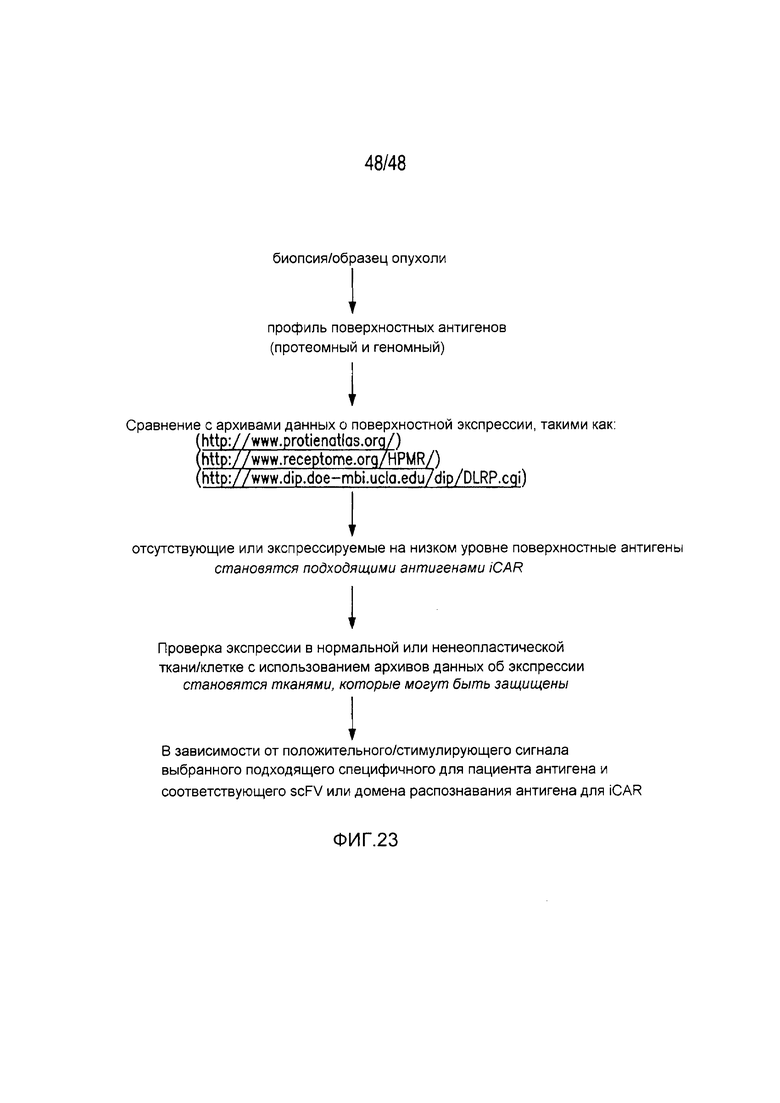
Настоящее изобретение относится к иммунологии. Предложена Т-клетка для снижения опухолевой нагрузки и/или лечения неоплазии, содержащая T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR), который связывается с антигеном В-клеточного лейкоза, и ингибирующий химерный рецептор антигена (iCAR), который содержит домен внутриклеточной передачи сигнала CTLA-4 или PD-1. Кроме того, описано применение такой Т-клетки для снижения опухолевой нагрузки и/или размера опухоли и фармацевтическая композиция. Также представлены вектор, композиция и способ получения Т-клетки. Использование iCAR позволяет снизить цитотоксичность Т-клетки в отношении клеток ненеопластической ткани. 8 н. и 10 з.п. ф-лы, 23 ил., 1 пр.
1. Т-клетка для снижения опухолевой нагрузки и/или лечения неоплазии, содержащая:
а) антигенраспознающий рецептор, который связывается с первым антигеном, который экспрессируется на ткани В-клеточного лейкоза, где антигенраспознающий рецептор представляет собой T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR), и
b) ингибирующий химерный рецептор антигена (iCAR), который содержит i) антигенсвязывающий домен, который связывается с вторым антигеном, который экспрессируется на ненеопластической ткани, но не на ткани В-клеточного лейкоза, и ii) домен внутриклеточной передачи сигнала CTLA-4 или домен внутриклеточной передачи сигнала PD-1, при этом связывание iCAR со вторым антигеном снижает цитотоксичность указанной Т-клетки в отношении клеток, которые являются положительными как по первому антигену, так и по второму антигену.
2. Т-клетка по п. 1, где вторым антигеном является лейкоцитарный антиген человека (HLA), антиген эпителиально-мезенхимального перехода (FMT), специфичный для органа антиген, антиген, специфичный для гематоэнцефалического барьера, E-кадгерин, цитокератин, связывающий опиоиды белок/молекула клеточной адгезии (OPCML), HYLA2, антиген, отсутствующий при карциноме прямой и ободочной кишки (DCC), белок 1, связывающий область прикрепления к каркасу/матриксу (SMAR1), углевод клеточной поверхности или O-гликан муцинового типа.
3. Т-клетка по п. 1 или 2, где указанный ингибирующий химерный рецептор антигена экспрессируется рекомбинантно.
4. Т-клетка по п. 1 или 2, где ингибирующий химерный рецептор антигена экспрессируется с вектора и/или где антигенраспознающий рецептор экспрессируется с вектора.
5. Т-клетка по п. l или 2, где указанный первый антиген является опухолевым антигеном, выбранным из группы, состоящей из CD19, CD7, CD10, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD123, CD133 и CD138.
6. Т-клетка по п. 1 или 2, где указанный ингибирующий химерный рецептор антигена (iCAR) дополнительно содержит трансмембранный домен.
7. Т-клетка по п. 6, где трансмембранный домен содержит полипептид CD4, полипептид CD8, полипептид CTLA-4, полипептид PD-1, полипептид LAG-3, полипептид 2B4 или полипептид BTLA.
8. Т-клетка по п. l или 2, где антигенсвязывающий домен указанного ингибирующего химерного рецептора антигена (iCAR) содержит Fab или scFv.
9. Т-клетка по п. 1 или 2, где антигенраспознающий рецептор содержит химерный рецептор антигена (CAR).
10. Т-клетка по п. 9, где химерный рецептор антигена (CAR) связывается с CD19 и содержит домен внутриклеточной передачи сигнала, содержащий полипептид CD28.
11. Применение Т-клетки по любому из пп. 1-10 для снижения опухолевой нагрузки и/или размера опухоли у субъекта или для повышения выживаемости субъекта, имеющего неоплазию.
12. Применение по п. 11, в котором опухоль и/или неоплазия выбрана из группы, состоящей из рака крови, B-клеточного лейкоза, множественной миеломы, острого лимфобластного лейкоза (ALL), хронического лимфобластного лейкоза, неходжкинской лимфомы и острого миелоидного лейкоза (AML).
13. Способ получения Т-клетки, включающий:
введение в Т-клетку первой нуклеиновой кислоты, содержащей первую последовательность нуклеиновой кислоты, которая кодирует антигенраспознающий рецептор, который связывается с первым антигеном, который экспрессируется на ткани В-клеточного лейкоз, где антигенсвязывающий рецептор представляет собой T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR); и
введение в Т-клетку второй нуклеиновой кислоты, содержащей вторую последовательность нуклеиновой кислоты, которая кодирует ингибирующий химерный рецептор антигена (iCAR), который содержит i) антигенсвязывающий домен, который связывается со вторым антигеном, который экспрессируется на ненеопластической ткани, но не на ткани В-клеточного лейкоза, и ii) домен внутриклеточной передачи сигнала CTLA-4 или домен внутриклеточной передачи сигнала PD-1, при этом связывание iCAR со вторым антигеном снижает цитотоксичность Т-клетки в отношении клеток, которые являются положительными как по первому антигену, так и по второму антигену.
14. Вектор для получения Т-клетки по любому из пп. 1-10, содержащий (а) первую последовательность нуклеиновой кислоты, кодирующую антигенраспознающий рецептор, который связывается с первым антигеном, который экспрессируется на ткани В-клеточного лейкоза, где антигенраспознающий рецептор представляет собой Т-клеточный рецептор (TCR) или химерный рецептор антигена (CAR), и (b) вторую последовательность нуклеиновой кислоты, кодирующую ингибирующий химерный рецептор антигена (iCAR), который содержит i) антигенсвязывающий домен, который связывается с вторым антигеном, который экспрессируется на ненеопластической ткани, но не на ткани В-клеточного лейкоза, и ii) домен внутриклеточной передачи сигнала CTLA-4 или домен внутриклеточной передачи сигнала PD-1, где связывание iCAR со вторым антигеном снижает цитотоксичность иммунореактивной клетки, содержащей указанный вектор, в отношении клеток, которые являются положительными как по первому антигену, так и по второму антигену.
15. Композиция для получения Т-клетки по любому из пп. 1-10, содержащая а) первую нуклеиновую кислоту, кодирующую антигенраспознающий рецептор, который связывается с первым антигеном, который экспрессируется на ткани В-клеточного лейкоза, где антигенраспознающий рецептор представляет собой Т-клеточный рецептор (TCR) или химерный рецептор антигена (CAR), и (b) вторую нуклеиновую кислоту, кодирующую ингибирующий химерный рецептор антигена (iCAR), который содержит i) антигенсвязывающий домен, который связывается со вторым антигеном, который экспрессируется на ненеопластической ткани, но не на ткани В-клеточного лейкоза, и ii) домен внутриклеточной передачи сигнала CTLA-4 или домен внутриклеточной передачи сигнала PD-1, где связывание iCAR со вторым антигеном снижает цитотоксичность иммунореактивной клетки, содержащей указанную композицию, в отношении клеток, которые являются положительными как по первому антигену, так и по второму антигену.
16. Т-клетка для снижения опухолевой нагрузки и/или лечения неоплазии, содержащая вектор по п. 16.
17. Т-клетка для снижения опухолевой нагрузки и/или лечения неоплазии, содержащая композицию по п. 15.
18. Фармацевтическая композиция для снижения опухолевой нагрузки и/или лечения неоплазии, содержащая эффективное количество Т-клетки по любому из пп. 1-10, и фармацевтически приемлемый эксципиент.
| CHICAYBAM L | |||
| et al., "P60: A conditional system for the activation of lymphocytes expressing activating and inhibitory CARs", HUMAN GENE THERAPY, 21:1358-1396, - XVIII Annual Congress of the European Society of Gene and Cell Therapy (ESGCT), October 22-25, 2010 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| WILKIE S | |||
| et al | |||
| "Dual | |||
Авторы
Даты
2020-08-04—Публикация
2014-03-17—Подача