Перекрестная ссылка на родственные заявки
[0001] Эта заявка представляет собой непредварительную заявку, по которой испрашивается приоритет предварительной заявки США серийный no. 61/709072, поданной 2 октября 2012 г., полное содержание которой, таким образом, приведено в настоящей заявке путем ссылки.
Список последовательностей
[0002] Эта заявка содержит список последовательностей, созданный 30 сентября 2013 г.; файл, в формате ASCII, обозначен 3314040AWO_Sequence Listing_ST25.txt и имеет размер 27,5 килобайт. Полное содержание файла списка последовательностей таким образом приведено в заявке путем ссылки.
Предпосылки изобретения
[0003] Рак предстательной железы является наиболее частой злокачественной опухолью у мужчин в Соединенных Штатах и вызывает около 31000 смертей в год. При ранней диагностике, злокачественную опухоль можно эффективно лечить посредством хирургической операции или облучения. Послеоперационное остаточное заболевание требует облучения и/или гормональной терапии, которые могут предотвращать прогрессирование и метастазирование опухоли. В настоящее время не существует излечивающего лечения для невосприимчивого к гормонам, метастазирующего рака предстательной железы. Иммунотерапия представляет собой направленную терапию, которая в принципе обеспечивает лечение таких злокачественных опухолей.
[0004] Для видов направленной T-клеточной терапии, использующей генетически модифицированные аутологичные T-клетки, начали показывать доказательства терапевтической эффективности при меланоме и медленно растущих В-клеточных злокачественных новообразованиях. Современные способы конструирования T-клеток перенаправляют T-клетки пациента на антигены опухолей через трансдуцированый T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR). Вновь обнаруженная способность индуцировать сильные иммунные ответы, однако, вызывает необходимость ограничивать иммунные атаки опухолью и избегать реакций против нормальных тканей, которые могут экспрессировать антиген-мишень. К сожалению, ограниченная доступность действительно ограниченных опухолью антигенов часто препятствует достижению высоко специфического нацеливания. Среди ограничений, препятствующих достижению высоко специфического нацеливания, присутствует ограниченная доступность действительно ограниченных опухолью антигенов. Соответственно, срочно необходимы новые способы лечения неоплазии.
Краткое изложение сущности изобретения
[0005] Настоящее изобретение в общем относится к иммунореактивным клеткам, включая T-клетки и клетки естественные киллеры (NK), экспрессирующим антигенсвязывающий рецептор (например, CAR или TCR), обладающий активностью активации иммуноцитов, и химерный костимулирующий рецептор (CCR), и к способам их использования таким образом для лечения неоплазии, инфекционного заболевания и других патологий.
[0006] В одном аспекте изобретение относится к выделенной иммунореактивной клетке, имеющей узнающий антиген рецептор, который связывает первый антиген с низкой аффинностью, где связывание активирует иммунореактивную клетку, и химерный костимулирующий рецептор (CCR), который связывает второй антиген и стимулирует иммунореактивную клетку.
[0007] В другом аспекте изобретение относится к способу индукции гибели клетки опухоли у субъекта, где способ включает в себя введение эффективного количества иммунореактивных клеток, содержащих узнающий антиген рецептор, который связывает первый антиген с низкой аффинностью, где связывание активирует иммунореактивную клетку, и химерный костимулирующий рецептор (CCR), который связывает второй антиген и стимулирует иммунореактивную клетку, таким образом, индуцируя гибель клетки опухоли у субъекта.
[0008] В другом аспекте изобретение относится к способу лечения или предотвращения неоплазии у субъекта, где способ включает в себя введение эффективного количества иммунореактивных клеток, содержащих узнающий антиген рецептор, который связывает первый антиген с низкой аффинностью, где связывание активирует иммунореактивную клетку, и химерный костимулирующий рецептор (CCR), который связывает второй антиген и стимулирует иммунореактивную клетку, таким образом, излечивая или предотвращая неоплазию у субъекта.
[0009] В другом аспекте изобретение относится к способу лечения рака предстательной железы у нуждающегося в этом субъекта, где способ включает в себя введение субъекту терапевтически эффективного количества T-клеток, содержащих узнающий антиген рецептор, который связывает PSCA или CD19 с низкой аффинностью, где связывание активирует иммунореактивную клетку, и химерный костимулирующий рецептор (CCR), который связывает PSMA и стимулирует иммунореактивную клетку, таким образом излечивая рак предстательной железы у субъекта.
[0010] В другом аспекте изобретение относится к способу получения антигенспецифической иммунореактивной клетки, где способ включает в себя введение в иммунореактивную клетку последовательности нуклеиновой кислоты, кодирующей химерный костимулирующий рецептор (CCR), где химерный костимулирующий рецептор имеет антигенсвязывающий домен, соединенный с внутриклеточным сигнальным доменом, стимулирующим иммунореактивнкю клетку, где иммунореактивная клетка имеет узнающий антиген рецептор, который связывает первый антиген с низкой аффинностью, где связывание активирует иммунореактивную клетку.
[0011] В связанном аспекте изобретение относится к фармацевтической композиции, содержащей эффективное количество иммунореактивных клеток по изобретению (например, специфических для антигенов опухоли T-клеток в фармацевтической композиции для лечения неоплазии) в фармацевтически приемлемом наполнителе.
[0012] В дополнительном аспекте изобретение относится к набору для лечения неоплазии, инфекции патогеном, аутоиммунного нарушения или аллогенного трансплантата, где набор содержит иммунореактивную клетку, имеющую узнающий антиген рецептор, который связывает первый антиген и активирует иммунореактивную клетку, и химерный костимулирующий рецептор (CCR), который связывает второй вирусный антиген и стимулирует иммунореактивную клетку. Набор может дополнительно содержать письменные инструкции для использования иммунореактивных клеток для лечения субъекта, имеющего неоплазию, инфекцию патогеном, аутоиммунное нарушение или аллогенный трансплантат.
[0013] В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, иммунореактивную клетку отбирают как имеющую узнающий антиген рецептор с низкой аффинностью. Это может включать в себя отбор иммунореактивной клетки как имеющей узнающий антиген рецептор, который связывает первый антиген с низкой аффинностью. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, узнающий антиген рецептор отбирают как имеющий низкую аффинность, для экспрессии в клетке. Это может включать в себя введение второй последовательности нуклеиновой кислоты, кодирующей химерный рецептор антигена, где химерный рецептор антигена содержит второй антигенсвязывающий домен, соединенный со вторым внутриклеточным сигнальным доменом, активирующим иммунореактивную клетку. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, узнающий антиген рецептор представляет собой T-клеточный рецептор (TCR) или химерный рецептор антигена (CAR). В различных вариантах осуществления внутриклеточный сигнальный домен указанного узнающего антиген рецептора представляет собой сигнальный домен CD3-цепи. В различных вариантах осуществления внутриклеточный сигнальный домен химерного костимулирующего рецептора (CCR) представляет собой сигнальный домен CD97, CD11a-CD18, CD2, ICOS, CD27, CD154, CD5, OX40, 4-1BB или CD28.
[0014] В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, узнающий антиген рецептор является экзогенным или эндогенным. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, узнающий антиген рецептор экспрессирован рекомбинантным способом. В различных вариантах осуществления узнающий антиген рецептор экспрессирован с вектора. В различных вариантах осуществления химерный костимулирующий рецептор (CCR) экспрессирован с вектора. В конкретных вариантах осуществления иммунореактивная клетка экспрессирует рекомбинантный или эндогенный рецептор антигена, представляющий собой 19z1 или Pz1.
[0015] В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, иммунореактивная клетка представляет собой T-клетку, клетку естественный киллер (NK), цитотоксический T-лимфоцит (CTL), регуляторную T-клетку, человеческую эмбриональную стволовую клетку или плюрипотентную стволовую клетку, которые можно дифференцировать в лимфоидные клетки. Различные варианты осуществления любого из аспектов, описанных в настоящем документе, относятся к иммунореактивной клетке из любого из пунктов формулы изобретения 1-9, где указанная иммунореактивная клетка является аутологичной.
[0016] В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, антиген представляет собой антиген опухоли или патогена. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, один или более антигенсвязывающих доменов представляют собой связывающие антиген опухоли домены. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, антигены или антигены опухоли выбраны из CAIX, CEA, CD5, CD7, CD10, CD19, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, erb-B2,3,4, FBP, фетального рецептора ацетилхолина, рецептора-a фолата, GD2, GD3, HER-2, hTERT, IL13R-a2, x-легкой цепи, KDR, LeY, молекулы адгезии клеток LI, MAGE-AI, MUC1, мезотелина, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2 и WT-1. В различных вариантах осуществления первый и второй антигены выбраны из CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, erbB2, KDR мезотелина, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), PSCA, PSMA, CD19, VEGF-R2 и WT-1. В конкретных вариантах осуществления первый и второй антигены выбраны из HER2, MUC1, CD44, CD49f, EpCAM, CEA, CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, erb-B2,3,4, FBP, KDR, мезотелина, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), PSCA, PSMA, VEGF-R2 или WT-1. В конкретных вариантах осуществления первый и второй антигены выбраны из CD10 и CD19. В других вариантах осуществления первый и второй антигены выбраны из CD56 и CD138. В конкретных вариантах осуществления первый и второй антигены выбраны из мезотелина, рецептора-a фолата, CD44 и CD133.
[0017] В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, неоплазия выбрана из группы, состоящей из рака предстательной железы, рака молочной железы, В-клеточного лейкоза, множественной миеломы и рака яичника. В различных вариантах осуществления любого из аспектов, описанных в настоящем документе, способ уменьшает количество клеток опухолей, уменьшает размер опухоли и/или уничтожает опухоль у субъекта.
[0018] В различных вариантах осуществления неоплазия представляет собой рак предстательной железы, и первый и второй антигены опухоли представляют собой различные антигены, выбранные из PSCA, PSMA, CD19, CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, erb-B2, KDR мезотелина, лигандов NKG2D, NY-ES0-1, онкофетального антигена (h5T4), VEGF-R2 и WT-I. В различных вариантах осуществления неоплазия представляет собой рак молочной железы, и первый и второй антигены опухоли представляют собой различные антигены, выбранные из HER2, MUC1, CD44, CD49f, EpCAM, CEA, CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, erb-B2,3,4, FBP, KDR, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, VEGF-R2 или WT-1. В конкретных вариантах осуществления неоплазия представляет собой В-клеточный лейкоз, и первый и второй антигены опухоли выбраны из CDIO и CD19. В конкретных вариантах осуществления неоплазия представляет собой множественную миелому, и первый и второй антигены опухоли выбраны из CD56 и CD138. В различных вариантах осуществления неоплазия представляет собой рак яичника, и первый и второй антигены опухоли представляют собой различные антигены, выбранные из мезотелина, рецептора-a фолата, CD44 и CD133.
[0019] Изобретение относится к композициям и способам, обеспечивающим нацеливание T-клеток на клетки опухолей. Композиции и изделия, определенные по изобретению, были выделены или иным способом изготовлены в соответствии с примерами, представленными ниже. Другие признаки и преимущества изобретения очевидны из подробного описания и из формулы изобретения.
Краткое описание фигур
[0020] Фиг. 1A-C представляют собой графики, изображающие дизайн векторов и экспрессию посредством трансдукции первичных T-клеток человека для химерного рецептора антигена (CAR) и химерного костимулирующего рецептора (CCR). На (A) изображено получение CAR посредством слияния тяжелых и легких цепей вариабельных доменов иммуноглобулинов с трансмембранным доменом CD8, который слит с цитозольными сигнальными доменами CD3. Посредством использования внутреннего участка связывания рибосомы (IRES) для обеспечения бицистронной экспрессии, экспрессию CAR можно легко детектировать посредством корреляции с флуоресценцией dsRED (данные не представлены). CCR получали посредством слияния scFv с трансмембранным и сигнальным доменом CD2815, слитым с цитозольным сигнальным доменом 4-1BB (известным также как CD137)21. Экспрессию CCR можно коррелировать с бицистронной экспрессией hrGFP (данные не представлены). Сокращения: LTR - Длинный концевой повтор; SD - Донорный участок сплайсинга; SA - Акцепторный участок сплайсинга; VH или VL - Вариабельные домены тяжелой или легкой цепи, соответственно; EC - Внеклеточный домен; TM - Трансмембранный домен; С - Цитозольный домен; IRES - Внутренний участок связывания рибосомы; dsRED - Красный флуоресцентный белок Discosoma sp., hrGFP - Человеческий рекомбинантный зеленый флуоресцентный белок. На (B) изображена репрезентативная эффективность трансдукций первичных T-клеток человека с использованием этих ретровирусных векторов. На (C) изображена трансдукция CTL различными и многими CAR для настоящих исследований.
[0021] На фиг. 2A-D показано, что опосредованная двойным рецептором, CAR/CCR, активация T-клеток человека обеспечивает активную функцию CTL, долговременную пролиферацию и усиленное уничтожение опухоли при связывании двух антигенов. На (A) показано, что T-клетки, экспрессирующие химерные рецепторы, лизировали клетки, положительные по антигену, когда CAR, специфический для CD19, экспрессирован T-клетками, в анализах CTL, по сравнению с нетрансдуцированными или трансдуцированными P28BB T-клетками. Графики являются репрезентативными для n>4 экспериментов, где планки погрешностей представляют стандартное отклонение от среднего из 3 повторов. На (B) показана долговременная пролиферация T-клеток по абсолютному количеству T-клеток через 31 сутки для T-клеток, не экспрессирующих, экспрессирующих один или оба химерных рецептора, которые совместно культивировали с линиями клеток опухолей человека, экспрессирующих оба антигена или любой антиген отдельно. Стрелками указана повторная стимуляция T-клеток с использованием только что облученных клеток опухолей. Только когда экспрессирующие двойной рецептор T-клетки встречают оба антигена, наблюдают сильную долговременную пролиферацию. Графики являются репрезентативными для n>4 экспериментов, где планки погрешностей представляют стандартное отклонение от среднего из 3 повторов. На (C) изображена эффективность системного уничтожения опухоли посредством чувствительных к опухоли T-клеток (TTS), оцененного посредством инфузии 1,0×106 T-клеток внутривенно (IV) мышам NSG, несущим экспрессирующую люциферазу CD19+PSMA+ опухоль предстательной железы человека PC3. Опухолевую нагрузку измеряли количественно еженедельно с использованием BLI. Показаны изображения двух репрезентативных мышей из каждой группы, где интенсивность пикселей от люминесценции опухолей представлена цветом. Среднее от опухолевой нагрузки нанесено на график с планками погрешностей, представляющими стандартное отклонение от среднего из значений для 6 мышей на группу. На (D) изображено избирательное уничтожение DP опухолей с использованием модели на мышах с тремя опухолями посредством подкожной инъекции 1×106 клеток каждой из опухолей PC3, клеток, положительных только по CD19, в левые бока, клеток, положительных только по PSMA, в правые бока, и клеток, положительных как по CD19, так и по PSMA, в спины мышей. T-клетки, экспрессирующие любой из 19z1, P28BB, или оба 19z1 + P28BB из химерных рецепторов, вводили внутривенной инфузией через 7 суток после инфузии опухоли. Показаны репрезентативные изображения 2 мышей на группу, несущих эти опухоли, где люминесценция опухолей представлена цветом. Опухоли количественно измеряли с использованием штангенциркуля, и объемы опухолей наносили на график в зависимости от времени для каждой опухоли. Планки погрешностей представляют собой стандартное отклонение от среднего для 6 мышей. Статистическую значимость определяли с использованием двухсторонних t-критериев для независимых выборок для сравнения значений, полученных для 19z1 T-клеток и 19z1 + P28BB T-клеток, и значения p представлены как * для <0,05 или ** для <0,01.
[0022] На фиг. 3A-E изображено, что чувствительные к опухоли T-клетки (TTS) избирательно уничтожали опухоли предстательной железы человека при нацеливании на два антигена опухоли предстательной железы. На (A) изображена оценка трех различных scFv, специфических для PSCA, по их сборке в биспецифические антитела, обладающие также специфичностью для CD3. T-клетки совместно культивировали при соотношении 20:1 с PSCA+ клетками опухолей PC3, и антитела добавляли в различных количествах, и измеряли специфический лизис. На (B) изображено получение CAR с использованием анти-PSCA scFv, проявляющих различную эффективность в анализах цитотоксичности. Опосредованный CAR специфический лизис клеток-мишеней, экспрессирующих PSCA, подтвердил пониженную эффективность scFv Lz1 посредством необходимости в 50 раз более высокого соотношения эффектор:мишень для достижения того же самого уровня их лизиса либо для Hz1, либо для Mz1. На (C) и (D) изображено, как избирательное уничтожение системных опухолей предстательной железы, экспрессирующих PSCA и PSMA, исследовали с использованием этих неэффективных scFv. Опухоли (фиг. 5) приживались, и их лечили, как описано на фиг. 2. Через 14 суток, 1,0×106 положительных по химерному рецептору T-клеток для Mz1 +P28BB (фиг. 3C) или Lz1 + P28BB (фиг. 3D) вводили внутривенной инфузией. Показаны изображения двух репрезентативных мышей из каждой группы, где люминесценция опухолей показана цветом (от синего = 5×105 до красного = 2×107 фотонов). Среднюю опухолевую нагрузку оценивали количественно по люминесценции и наносили на график с планками погрешностей, представляющими стандартное отклонение от среднего из значений для 5 мышей на группу. Две мыши после введения опухоли PSMA (зеленая линия) умерли после суток 49, и таким образом, среднее значение для люминесценции усреднено из 3 значений для суток 56 и 63. Фиг. 3E Избирательных противоопухолевых ответов только на PSCA+PSMA+ опухоли достигали посредством Lz1 + P28BB T-клеток у мышей, имеющих также PSCA-PSMA+ и PSCA+PSMA- опухоли, подобно фиг. 2D. Статистическую значимость определяли с использованием двухсторонних t-критериев для независимых выборок для сравнения значений, полученных для Lz1 T-клеток и Lz1 + P28BB T-клеток, и значения p представлены как * для <0,05 или ** для <0,01.
[0023] На фиг. 4A-D показано, что усиленная секреция цитокинов и экспрессия Bc1хL обнаружена для клеток TTS при совместном культивировании на DP опухолях. На (A) изображен мультиплексный анализ цитокинов для нетрансдуцированных T-клеток или T-клеток, трансдуцированных 19z1, P28BB, или обоими через 48 часов после стимуляции первым антигеном с использованием либо нетрансдуцированных клеток PC3 (Пустые), либо CD19+PSMA+ клеток PC3. Планки погрешностей представляют стандартное отклонение от среднего для 2 биологических повторов. На (B-D) изображен мультиплексный анализ цитокинов для нетрансдуцированных T-клеток или T-клеток, трансдуцированных Hz] (B), Mz1 (C) и Lz1 (D) анти-PSCA CAR, P28BB CCR или обоими CAR + CCR, показанный через 48 часов после стимуляции вторым антигеном с использованием либо пустых клеток, либо PSCA+PSMA+ клеток PC3. На (E) изображен анализ Вестерн-блоттингом для Bc1xL, проведенный с использованием клеточных лизатов нетрансдуцированных T-клеток или T-клеток, трансдуцированных 19z1, P28BB или обоими через 24 часа после первоначальной стимуляции антигеном. Общее количество Akt использовали в качестве контроля нанесения.
[0024] На фиг. 5 показано получение клеток опухолей для экспрессии слитого белка GFP-люцифераза светляка (GFP/Luc) и антигенов опухолей. Нетрансдуцированные клетки PC3 (пустые) трансдуцировали GFP/Luc и либо CD19, PSMA, PSCA, либо комбинацией двух антигенов с использованием ретровирусных экспрессирующих конструкций. Клетки очищали посредством двойной очистки FACS для GFP/Luc, CD19, PSMA и/или PSCA.
[0025] Фиг. 6A-C иллюстрируют концепцию чувствительных к опухолям T-клеток. На (A) показано, что клетки TTS, экспрессирующие эффективный CAR, становятся сильно стимулированными посредством A+113+ клеток, чтобы способствовать иммунному ответу против A+ клеток. CAR+CCR+ клетки могут связывать клетки с антигеном опухоли A+ с CAR, подающим сигналы активации CD3. Это может приводить к кратковременному лизису клеток. CAR+CCR+ клетки могут связывать клетки с антигеном опухоли B+ с CCR, подающим сигналы CD28 и CD137. Одного этого сигнала недостаточно для индукции лизиса или пролиферации. Только когда CAR+CCR+ клетки связывают клетки с антигенами опухоли A+B+ с CAR и CCR, можно обеспечивать как активацию, так и стимуляцию. Это приводит к сильному лизису, пролиферации T-клеток, усиленной секреции цитокинов, повышающей регуляции BcIхL и способности избирательно уничтожать опухоли in vivo. Однако, в зависимости от эффективности CAR, эти CAR+CCR+ клетки могут потенциально рециркулировать для лизиса клеток, положительных только по одному антигену, специфическому для CAR. На фиг. 6B показано, что посредством снижения эффективности CAR, можно восстанавливать функциональность клеток TTs посредством связывания CCR при встрече с клетками A+B+, чтобы избирательно отвечать и уничтожать A+13+ клетки, в то же время избегая ответа на A+ клетки. На (C) показано, что посредством совместной экспрессии одного CAR, обеспечивающего сигнал активации TCR после связывания с антигеном опухоли, и второго CAR, обеспечивающего сигналы стимуляции после связывания с другим антигеном опухоли, T лимфоциты могут уничтожать только опухоли, экспрессирующие оба антигена, но не опухоли, экспрессирующие любой антиген отдельно.
Подробное описание изобретения
[0026] Содержание всех патентов, опубликованных заявок и других ссылок, упомянутых в этой заявке, приведено в настоящем документе в качестве ссылки в настоящем описании.
[0027] Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, имеют значение, являющееся общепринятым для специалиста в области, к которой относится это изобретение. Следующие ссылки предоставляют специалисту в данной области общие определения многих из терминов, используемых в этом изобретении: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991); и Hale & Marham, The Harper Collins Dictionary of Biology (1991). Как применяют в настоящем документе, следующие термины имеют значения, приписанные им ниже, если не указано иначе.
[0028] Под «активирует иммунореактивную клетку» понимают индукцию передачи сигнала или изменения экспрессии белка в клетке, приводящие к инициации иммунного ответа. Например, когда цепи CD3 кластеризуются в ответ на связывание лиганда и иммунорецепторных связывающих тирозин ингибирующих мотивов (ITAM), образуется каскад передачи сигнала. В конкретных вариантах осуществления, когда эндогенный TCR или экзогенный CAR связывает антиген, происходит формирование иммунологического синапса, который индуцирует кластеризацию множества молекул около связанного рецептора (например, CD4 или CD8, CD3 / / / и т.д.) Эта кластеризация связанных с мембраной сигнальных молекул позволяет мотивам ITAM, содержащимся внутри цепей CD3, становиться фосфорилированными. Это фосфорилирование, в свою очередь, инициирует путь активации T-клеток, в конечном счете активирующий факторы транскрипции, такие как NF-KB и AP-1. Эти факторы транскрипции индуцируют глобальную экспрессию генов T-клеток для увеличения продукции IL-2 для пролиферации и экспрессии главных регуляторных белков T-клеток, чтобы инициировать опосредованный T-клетками иммунный ответ. Под «стимулирует иммунореактивную клетку» понимают сигнал, приводящий к сильному и постоянному иммунному ответу. В различных вариантах осуществления это происходит после активации иммуноцита (например, T-клетки) или параллельно опосредовано через рецепторы, включая, но без ограничения, CD28, CD137 (4-1BB), OX40 и ICOS. Без связи с конкретной теорией, получение множества стимулирующих сигналов является важным для установления сильного и долговременного опосредованного T-клетками иммунного ответа. Без получения этих стимулирующих сигналов, T-клетки быстро становятся ингибированными и не отвечающими на антиген. В то время как эффекты этих костимулирующих сигналов изменчивы и остаются частично понятыми, они, как правило, приводят к увеличению экспрессии гена для получения долго живущих, пролиферативных и антиапоптотических T-клеток, которые активно отвечают на антиген для полного и постоянного уничтожения.
[0029] Термин «узнающий антиген рецептор», как применяют в настоящем документе, относится к рецептору, который является способным активировать иммуноцит (например, T-клетку) в ответ на связывание антигена. Иллюстративные узнающие антигены рецепторы могут представлять собой нативные или эндогенные T-клеточные рецепторы или химерные рецепторы антигенов, в которых связывающий антиген опухоли домен слит с внутриклеточным сигнальным доменом, способным активировать иммуноцит (например, T-клетку). В различных вариантах осуществления выбирают узнающий антиген рецептор, имеющий низкую или минимальную аффинность или авидность для антигена.
[0030] Под «аффинностью» понимают меру силы связывания между антителом и простой гаптенной или антигенной детерминантой. Без связи с теорией, аффинность зависит от близости стереохимического соответствия между связывающими участками антитела и антигенными детерминантами, от размера области контакта между ними, и от распределения заряженных и гидрофобных групп. Аффинность включает также термин «авидность», который относится к силе связи антиген-антитело после формирования обратимых комплексов. Способы расчета аффинности антитела для антигена известны в данной области, включая использование экспериментов по связыванию для расчета аффинности. В случае связывания антитела (Ab) с антигеном (Ag), используют константу аффинности (выраженную как инвертированная константа диссоциации).
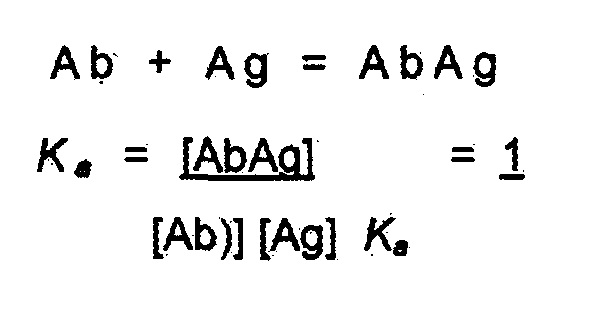
Химическое равновесие связывания антитела представляет собой также соотношение констант скорости связывания (k прямой реакции) и скорости диссоциации (k обратной реакции). Два антитела могут иметь одинаковую аффинность, но одно может иметь обе высокие константы скорости связывания и скорости диссоциации, в то время как другое может иметь обе низкие константы скорости связывания и скорости диссоциации.
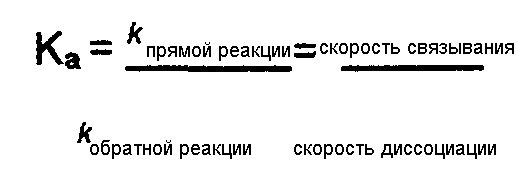
Активность антитела в функциональных анализах (например, анализе лизиса клеток) также отражает аффинность антитела. В различных вариантах осуществления изобретения узнающий антиген рецептор имеет низкую аффинность. Низкая аффинность включает в себя микромолярные и наномолярные аффинности (например, 10-5, 50-6, 10-6, 5×10-7, 10-7, 5×10-8, 10-8, 5×10-9, 10-9 M). Антитело и аффинности можно фенотипически характеризовать и сравнивать с использованием функционального анализа (например, анализа лизиса клеток).
[0031] Под «аффинностью» понимают меру силы связывания между антителом и образцом. Термин «химерный костимулирующий рецептор» (CCR), как применяют в настоящем документе, относится к специфическому типу химерного рецептора антигена (CAR), который опосредует костимуляцию независимо от активации. При экспрессии на иммунореактивных клетках в комбинации с узнающим антиген рецептором (например, CAR или TCR, который активирует клетку), CCR нацелен на второй антиген. В конкретных вариантах осуществления CCR имеет среднюю или высокую аффинность для его антигена-мишени.
[0032] Термин «химерный рецептор антигена» (CAR), как применяют в настоящем документе, относится к связывающему антиген опухоли домену, слитому с внутриклеточным сигнальным доменом, способным к активации или стимуляции T-клеток. Чаще всего, внеклеточный связывающий домен CAR состоит из одноцепочечного вариабельного фрагмента (scFv), полученного в результате слияния вариабельных тяжелых и легких областей мышиного или гуманизированного моноклонального антитела. Альтернативно, можно использовать scFv, полученные из Fab (вместо получения из антитела, например, полученные из библиотек Fab). В различных вариантах осуществления эти scFv сливают с трансмембранным доменом и затем с внутриклеточным сигнальным доменом. CAR «первого поколения» включают в себя CAR, обеспечивающие исключительно сигналы CD3 при связывании антигена, CAR «второго поколения» включают в себя CAR, обеспечивающие как костимуляцию (например, CD28 или CD137), так и активацию (CD3). CAR «третьего поколения» включают в себя CAR, обеспечивающие множественную костимуляцию (например, CD28 и CD137) и активацию (CD3). В применениях CAR до настоящего времени, выбирают CAR, имеющие высокую аффинность или авидность для антигена, что является отдельным и отличительным от изобретения, описанного в настоящем документе.
[0033] Под «полипептидом CD3» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: NP_932170, или его фрагмент, обладающий активирующей или стимулирующей активностью. Иллюстративный CD3 представлен в таблице 1 ниже. Под «молекулой нуклеиновой кислоты CD3» понимают полинуклеотид, кодирующий полипептид CD3.
[0034] Под «полипептидом CD8» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: NP_001759 или его фрагмент, обладающий стимулирующей активностью. Иллюстративный CD8 представлен в таблице 1 ниже. Под «молекулой нуклеиновой кислоты CD8» понимают полинуклеотид, кодирующий полипептид CD8.
[0035] Под «полипептидом CD28» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: NP_006130, или его фрагмент, обладающий стимулирующей активностью. Иллюстративный CD28 представлен в таблице 1 ниже. Под «молекулой нуклеиновой кислоты CD28» понимают полинуклеотид, кодирующий полипептид CD28.
[0036] Под «полипептидом 4-1BB» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: P41273 или NP_001552, или его фрагмент, действующий как лиганд фактора некроза опухоли (TNF). Иллюстративный 4-1BB представлен в таблице 1 ниже. Под «молекулой нуклеиновой кислоты 4-1BBL» понимают полинуклеотид, кодирующий полипептид 4-1 BBL.
[0037] Под «полипептидом CD80» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: NP_005182, или его фрагмент, действующий как лиганд суперсемейства Ig. Иллюстративный полипептид CD80 представлен в таблице 1 ниже.
[0038] Под «молекулой нуклеиновой кислоты CD80» понимают любой полинуклеотид, кодирующий полипептид CD80. Иллюстративной молекулой CD80 нуклеиновой кислоты является NM_005191.
[0039] Под «полипептидом OX4OL» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с No ссылки в NCBI: BAB18304 или NP_003317 или его фрагмент, представляющий собой лиганд фактора некроза опухоли (TNF). Под «молекулой нуклеиновой кислоты OX40L» понимают полинуклеотид, кодирующий полипептид OX4OL.
[0040] Под «полипептидом 19z1» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с последовательностью, представленной ниже, и обладающий активирующей активностью при связывании с CD19.
[0041] Под «полипептидом P28z» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с последовательностью, представленной ниже.
[0042] Под «CD19» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с последовательностью, представленной ниже и способный связывать CD19.
[0043] Под «PSMA» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с последовательностью, представленной ниже, и способный связывать PSMA.
[0044] Под «P28BB» понимают белок, обладающий по меньшей мере 85, 90, 95, 96, 97, 98, 99 или 100% идентичностью с последовательностью, представленной ниже, и обладающий активирующей активностью при связывании с PSMA.
qalppr
[0045] Молекулы нуклеиновой кислоты, пригодные в способах по изобретению, включают в себя любую молекулу нуклеиновой кислоты, кодирующую полипептид по изобретению или его фрагмент. Такие молекулы нуклеиновой кислоты не обязательно должны быть на 100% идентичными эндогенной последовательности нуклеиновой кислоты, но обычно обладают существенной идентичностью. Полинуклеотиды, обладающие «существенной идентичностью» с эндогенной последовательностью, как правило, являются способными гибридизоваться по меньшей мере с одной цепью двухцепочечной молекулы нуклеиновой кислоты. Под «гибридизоваться» понимают спариваться с формированием двухцепочечной молекулы между комплементарными полинуклеотидными последовательностями (например, ген, описанный в настоящем документе), или их частями, в условиях различной строгости. (См., например, Wahl, G.M. и S.L. Berger (1987) Methods Enzymol. 152:399; Kimmel, A.R. (1987) Methods Enzymol. 152:507).
[0046] Например, строгая концентрация соли обычно составляет менее приблизительно 750 мМ NaCl и 75 мМ цитрат тринатрия, предпочтительно, менее приблизительно 500 мМ NaCl и 50 мМ цитрат тринатрия, и более предпочтительно, менее приблизительно 250 мМ NaCl и 25 мМ цитрат тринатрия. Гибридизацию низкой строгости можно получать в отсутствие органического растворителя, например, формамида, в то время как гибридизацию высокой строгости можно получать в присутствии по меньшей мере приблизительно 35% формамида, и более предпочтительно, по меньшей мере приблизительно 50% формамида. Строгие условия температуры обычно включают в себя температуры по меньшей мере приблизительно 30°C, более предпочтительно, по меньшей мере приблизительно 37°C, и наиболее предпочтительно, по меньшей мере приблизительно 42°C. Изменение дополнительных параметров, таких как время гибридизации, концентрация детергента, например, додецилсульфата натрия (SDS), и включение или исключение ДНК-носителя, хорошо известно специалистам в данной области. Различных уровней строгости достигают посредством комбинации этих различных условий по необходимости. В предпочтительном варианте осуществления, гибридизация происходит при 30°С в 750 мМ NaCl, 75 мМ цитрате тринатрия и 1% SDS. В более предпочтительном варианте осуществления, гибридизация происходит при 37°С в 500 мМ NaCl, 50 мМ цитрате тринатрия, 1% SDS, 35% формамиде и 1001,1 г/мл денатурированной ДНК спермы лосося (оцДНК). В наиболее предпочтительном варианте осуществления гибридизация происходит при 42°С в 250 мМ NaCl, 25 мМ цитрате тринатрия, 1% SDS, 50% формамиде и 200 пг/мл оцДНК. Пригодные варианты этих условий явно очевидны специалистам в данной области.
[0047] Для большинства применений стадии отмывки, следующие за гибридизацией можно также менять по строгости. Условия строгости отмывки можно определять посредством концентрации соли и посредством температуры. Как выше, строгость отмывки можно увеличивать посредством уменьшения концентрации соли или посредством увеличения температуры. Например, строгая концентрация соли для стадий отмывки предпочтительно составляет менее приблизительно 30 мМ NaCl и 3 мМ цитрат тринатрия, и наиболее предпочтительно, менее приблизительно 15 мМ NaCl и 1,5 мМ цитрат тринатрия. Строгие условия температуры для стадий отмывки обычно включают в себя температуру по меньшей мере приблизительно 25°C, более предпочтительно, по меньшей мере приблизительно 42°C, и даже более предпочтительно, по меньшей мере приблизительно 68°C. В предпочтительном варианте осуществления стадии отмывки происходят при 25°C в 30 мМ NaCl, 3 мМ цитрате тринатрия и 0,1% SDS. В более предпочтительном варианте осуществления стадии отмывки происходят при 42 градусах C в 15 мМ NaCl, 1,5 мМ цитрате тринатрия и 0,1% SDS. В другом варианте осуществления стадии отмывки происходят при 68°С в 15 мМ NaCl, 1,5 мМ цитрате тринатрия, и 0,1% SDS. Дополнительные варианты этих условий явно очевидны специалистам в данной области.
[0048] Способы гибридизации хорошо известны специалистам в данной области и описаны, например, в Benton and Davis (Science 196:180, 1977); Grunstein and Hogness (Proc. Natl. Acad.Sci., USA 72:3961, 1975); Ausubel et al. (Current Protocols in Molecular Biology, Wiley Interscience, New York, 2001); Berger and Kimmei (Guide to Molecular Cloning Techniques, 1987, Academic Press, New York); и Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York.
[0049] Под «по существу идентичный» понимают полипептид или молекулу нуклеиновой кислоты, обладающие по меньшей мере 50% идентичностью с эталонной аминокислотной последовательностью (например, любой из аминокислотных последовательностей, описанных в настоящем документе) или последовательностью нуклеиновой кислоты (например, любой из последовательностей нуклеиновой кислоты, описанных в настоящем документе). Предпочтительно, такая последовательность является по меньшей мере на 60%, более предпочтительно, на 80% или 85%, и более предпочтительно, на 90%, 95% или даже 99% идентичной на уровне аминокислот или нуклеиновой кислоты с последовательностью, использованной для сравнения.
[0050] Идентичность последовательности, как правило, измеряют с использованием программного обеспечения для анализа последовательностей (например, пакета программного обеспечения для анализа последовательностей из Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wis. 53705, программы BLAST, BESTFIT, GAP или PILEUP/PRETTYBOX). Такое программное обеспечение приводит в соответствие идентичные или сходные последовательности посредством приписывания степеней гомологии различным заменам, делециям и/или другим модификациям. Консервативные замены, как правило, включают в себя замены внутри следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В иллюстративном способе для определения степени идентичности можно использовать программу BLAST, где вероятность между e-3 и e-100 указывает на близко родственную последовательность.
[0051] Под «аналогом» понимают структурно родственные полипептид или молекулу нуклеиновой кислоты, обладающие функцией эталонного полипептида или молекулы нуклеиновой кислоты.
[0052] Термин «лиганд», как применяют в настоящем документе, относится к молекуле, связывающейся с рецептором. В частности, лиганд связывает рецептор на другой клетке, позволяя узнавание клетка-клетка.
[0053] Термин «конститутивная экспрессия», как применяют в настоящем документе, относится к экспрессии при всех физиологических условиях.
[0054] Под «заболеванием» понимают любое состояние или нарушение, которое повреждает клетку, ткань или орган, или мешает их нормальному функционированию. Примеры заболеваний включают в себя неоплазию или инфекцию клетки патогеном.
[0055] Под «эффективным количеством» понимают количество, достаточное для ареста, облегчения или ингибирования продолжающихся пролиферации, роста или метастазирования (например, инвазии или миграции) неоплазии.
[0056] Под «вынужденной устойчивостью» понимают предотвращение активности аутореактивных клеток или иммунореактивных клеток, нацеленных на трансплантированные органы или ткани.
[0057] Под «экзогенным» понимают молекулу нуклеиновой кислоты или полипептид, которые не присутствуют эндогенно в клетке, или не присутствуют на уровне, достаточном для достижения функциональных эффектов, полученных при сверхэкспрессии. Термин «экзогенный», таким образом, охватывает любую молекулу рекомбинантной нуклеиновой кислоты или полипептид, экспрессированные в клетке, такую как чужеродные, гетерологичные и сверхэкспрессированные нуклеиновая кислота и полипептиды.
[0058] Под «гетерологичной молекулой нуклеиновой кислоты или полипептидом» понимают молекулу нуклеиновой кислоты (например, молекулу кДНК, ДНК или РНК) или полипептид, которые в норме не присутствуют в клетке или образце, полученном из клетки. Эта нуклеиновая кислота может происходить из другого организма, или она может представлять собой, например, молекулу мРНК, которая в норме не экспрессирована в клетке или образце.
[0059] Под «иммунореактивной клеткой» понимают клетку, функционирующую в иммунном ответе, или ее предшественник или потомство.
[0060] Под «выделенной клеткой» понимают клетку, отделенную от молекулярных и/или клеточных компонентов, естественным образом сопровождающих клетку.
[0061] Термины «выделенный», «очищенный» или «биологически чистый» относятся к материалу, который является свободным до различных степеней от компонентов, в норме сопровождающих его, как обнаружено в его природном состоянии. «Выделение» обозначает степень отделения от исходного источника или окружения. «Очистка» обозначает степень отделения, более высокую, чем выделение. «Очищенный» или «биологически чистый» белок является достаточно свободным от других материалов, так что любые примеси существенно не влияют на биологические свойства белка или не вызывают других неблагоприятных последствий. То есть, нуклеиновая кислота или пептид по этому изобретению являются очищенными, если они являются в основном свободными от клеточного материала, вирусного материала или культуральной среды при получении способами рекомбинантной ДНК, или химических предшественников или других химических веществ при химическом синтезе. Чистоту и гомогенность, как правило, определяют с использованием способов аналитической химии, например, электрофореза в полиакриламидном геле или высокоэффективной жидкостной хроматографии. Термин «очищенный» может обозначать, что нуклеиновая кислота или белок образует в основном одну полосу в электрофоретическом геле. Для белка, который можно подвергать модификациям, например, фосфорилированию или гликозилированию, различные модификации могут образовывать различные выделенные белки, которые можно очищать отдельно.
[0062] Термин «связывающий антиген опухоли домен», как применяют в настоящем документе, относится к домену, способному специфически связывать конкретную антигенную детерминанту или набор антигенных детерминант, присутствующие на опухоли.
[0063] Под «модулировать» понимают изменять положительно или отрицательно. Иллюстративные модуляции включают в себя изменение на 1%, 2%, 5%, 10%, 25%, 50%, 75% или 100%.
[0064] Под «неоплазией» понимают заболевание, характеризующееся патологической пролиферацией клеток или тканей и их последующей миграцией к другим тканям или органам, или инвазией в них. Рост неоплазии является, как правило, неконтролируемым и прогрессирующим, и происходит в условиях, которые не вызывают размножения или вызывают остановку размножения нормальных клеток. Неоплазии могут поражать множество типов клеток, тканей или органов, включая, но без ограничения, орган, выбранный из группы, состоящей из мочевого пузыря, кости, головного мозга, молочной железы, хряща, глии, пищевода, фаллопиевой трубы, желчного пузыря, сердца, кишечника, почки, печени, легкого, лимфатического узла, нервной ткани, яичников, поджелудочной железы, предстательной железы, скелетной мышцы, кожи, спинного мозга, селезенки, желудка, яичек, тимуса, щитовидной железы, трахеи, мочеполового тракта, мочеточника, уретры, матки и влагалища, или их ткани или типа клеток. Неоплазии включают в себя злокачественные опухоли, такие как саркомы, карциномы, или плазмацитомы {злокачественные опухоли плазматических клеток). Иллюстративные неоплазии, для которых можно использовать изобретение, включают в себя, но без ограничения, лейкозы (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелобластный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, острый эритролейкоз, хронический лейкоз, хронический миелоцитарный лейкоз, хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому (болезнь Ходжкина, неходжкинскую лимфому), макроглобулинемию Вальденстрема, болезнь тяжелых цепей, и солидные опухоли, такие как саркомы и карциномы (например, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, карциному потовой железы, карциному сальной железы, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциномы, медуллярную карциному, бронхогенную карциному, почечноклеточную карциному, гепатому, карциному желчного протока, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, рак шейки матки, рак тела матки, рак яичка, карциному легкого, мелкоклеточную карциному легкого, карциному мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, шванному, менингиому, меланому, нейробластому и ретинобластому). В одном варианте осуществления способами скрининга по изобретению идентифицируют композиции, пригодные для лечения рака молочной железы или легкого.
[0065] Под «рецептором» понимают полипептид или его часть, присутствующие на мембране клетки, которые избирательно связывают один или несколько лигандов.
[0066] Под «узнает» понимают избирательно связывает мишень. T-клетка, которая узнает вирус, как правило, экспрессирует рецептор, связывающий антиген, экспрессированный вирусом.
[0067] Под «патогеном» понимают вирус, бактерию, гриб, паразита или простейшее, способные вызывать заболевание. Иллюстративные вирусы включают в себя, но без ограничения, Retroviridae (например, вирусы иммунодефицита человека, такие как HIV-1 (обозначаемый также как HDTV-III, LAVE или HTLV-III/LAV, или HIV-III; и другие изоляты, такие как HIV-LP; Picornaviridae (например, полиовирусы, вирус гепатита A; энтеровирусы, вирусы Коксаки человека, риновирусы, эховирусы); Calciviridae (например, штаммы, вызывающие гастроэнтерит); Togaviridae (например, вирусы энцефалита лошадей, вирусы краснухи); Flaviridae (например, вирусы лихорадки Денге, вирусы энцефалита, вирусы желтой лихорадки); Coronoviridae (например, коронавирусы); Rhabdoviridae (например, вирусы везикулярного стоматита, вирусы бешенства); Filoviridae (например, вирусы лихорадки Эбола); Paramyxoviridae (например, вирусы парагриппа, вирус свинки, вирус кори, респираторно-синцитиальный вирус); Orthomyxoviridae (например, вирусы гриппа); Bungaviridae (например, вирусы Хантаан, бунгавирусы, флебовирусы и наировирусы); Arena Viridae (вирусы геморрагической лихорадки); Reoviridae (например, реовирусы, орбивирусы и ротавирусы); Birnaviridae; Hepadnaviridae (вирус гепатита В); Parvovirida (парвовирусы); Papovaviridae (вирусы папилломы, вирусы полиомы); Adenoviridae (большинство аденовирусов); Herpesviridae (вирус простого герпеса (HSV) 1 и 2, вирус ветряной оспы, цитомегаловирус (CMV), вирус герпеса; Poxviridae (вирусы натуральной оспы, вирусы осповакцины, поксвирусы); и Iridoviridae (например, вирус лихорадки африканских свиней); и неклассифицированные вирусы (например, агент гепатита дельта (предположительно, являющийся дефектным сателлитом вируса гепатита B), агенты гепатита не-A, не-B (класс 1 = передающийся внутренним путем; класс 2 = передающийся парентерально (т.е. гепатит C); вирус Норволк и родственные вирусы и астровирусы).
[0068] Иллюстративные бактерии включают в себя, но без ограничения, Pasteurella, Staphylococci, Streptococcus, Escherichia coli, виды Pseudomonas и виды Salmonella. Конкретные примеры инфекционных бактерий включают в себя, но без ограничения, Helicobacter pyloris, Borelia burgdoiferi, Legionella pneumophilia, виды Mycobacteria (например, M.tuberculosis, M. avium, M. intracellulare, M. kansaii, M. gordonae), Staphylococcus aureus, Neisseria gonorrhoeae, Neisseria meningitidis, Listeria monocytogenes, Streptococcus pyogenes (Streptococcus группы A), Streptococcus agalactiae (Streptococcus группы В), Streptococcus (группы вириданс), Streptococcus faecalis, Streptococcus bovis, Streptococcus (анаэробные виды), Streptococcus pneumoniae, патогенные Campylobacter sp., Enterococcus sp, Haemophilus influenzae, Bacillus antracis, corynebacterium diphtheriae, corynebacterium sp., Erysipelothrix rhusiopathiae, Clostridium perfringers, Clostridium tetani, Enterobacter aerogenes, Klebsiella pneumoniae, Pasturella multocida, Bacteroides sp., Fusobacterium nucleatum, Streptobacillus moniliformis, Treponema pallidium, Treponema pertenue, Leptospira, Rickettsia и Actinomyces israelii.
[0069] Под «специфически связывает» понимают полипептид или его фрагмент, который узнает и связывает интересующий полипептид, но который в основном не узнает и не связывает другие молекулы в образце, например, в биологическом образце, естественным образом включающем полипептид по изобретению.
[0070] Термин «антиген опухоли», как применяют в настоящем документе, относится к любому полипептиду, экспрессированному опухолью, который способен индуцировать иммунный ответ.
[0071] Под «вирусным антигеном» понимают полипептид, экспрессированный вирусом, который способен индуцировать иммунный ответ.
[0072] Термины «содержит», «содержащий» предназначены, чтобы иметь широкое значение, приписываемое им Патентным законодательством США и могут означать «включает», «включающий» и т.п.
[0073] Как применяют в настоящем документе, «лечение» относится к клиническому вмешательству в попытке изменить течение заболевания индивидуума или клетки, подвергаемой лечению, и его можно проводить либо для профилактики, либо в ходе течения клинической патологии. Терапевтические эффекты лечения включают в себя, без ограничения, предотвращение возникновения или рецидива заболевания, облегчения симптомов, уменьшение любых прямых или непрямых патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, уменьшение или облегчение состояния заболевания и ремиссию или улучшение прогноза. Посредством предотвращения прогрессирования заболевания или нарушения, лечение может предотвращать ухудшение, обусловленное нарушением, у пораженного или имеющего диагноз субъекта или у субъекта, предположительно имеющего нарушение, но также лечение может предотвращать начало нарушения или симптом нарушения у субъекта, подверженного риску нарушения или предположительно имеющего нарушение.
[0074] Термин «субъект», как применяют в настоящем документе, относится к позвоночному, предпочтительно, млекопитающему, более предпочтительно, человеку.
[0075] Термин «с иммунной недостаточностью», как применяют в настоящем документе, относится к субъекту, страдающему иммунодефицитом. Субъект является очень подверженным оппортунистическим инфекциям, инфекциям, вызванным организмами, которые обычно не вызывают заболевания у лица со здоровой иммунной системой, но могут поражать людей с плохо функционирующей или супрессированной иммунной системой.
[0076] Другие аспекты изобретения описаны в следующем описании и входят в объем изобретения.
[0077] Настоящее изобретение в общем относится к клеткам, включая генетически модифицированные иммунореактивные клетки (например, T-клетки, клетки естественные киллеры (NK), клетки цитотоксические T-лимфоциты (CTL)), экспрессирующие по меньшей мере комбинацию узнающего антиген рецептора (например, TCR или CAR) и химерного костимулирующего рецептора (CCR), и к способам их использования, таким образом, для лечения неоплазии и других патологий, где является желательным увеличение антигенспецифического иммунного ответа. Изобретение основано, по меньшей мере, частично, на открытии, что одновременное вовлечение двух антигенов, совместно экспрессируемых клеткой опухоли, посредством узнающего антиген рецептора и химерного костимулирующего рецептора, является пригодным для активации и стимуляции иммунореактивных клеток без системных эффектов. В частности, реактивность против тканей, экспрессирующих любой из антигенов отдельно, предпочтительно является минимальной, включая активацию T-клеток в присутствии обоих антигенов, но не любого из них отдельно. Активация T-клеток является опосредованной посредством TCR или CAR, нацеленных на антиген (например, CD19 или антиген стволовых клеток предстательной железы, PSCA). Костимуляция независимо опосредована «химерным костимулирующим рецептором» (CCR)12,13, нацеленным на второй антиген (например, специфический для предстательной железы мембранный антиген, PSMA). Такой способ приводит к увеличенной реактивности против положительных по двум антигенам (DP) опухолей, но не в состоянии предотвращать усиленную реактивность против положительных по одному антигену (SP) опухолей. Обнаружено, что чувствительные к опухолям T-клетки можно заставить дифференцировать DP опухоли от SP опухолей посредством уменьшения активации T-клеток до уровня, когда активация T-клеток является неэффективной сама по себе, но функционально восстанавливается в месте опухоли посредством CCR, вовлеченного посредством независимого, совместно экспрессированного антигена. Этот способ обеспечивает иммуногенность внутри микроокружения опухоли для уничтожения опухоли, в то же время не затрагивая SP клетки, которые являются нормальными или не неопластическими, и предоставляет значительный прогресс по сравнению с общепринятыми видами адоптивной Т-клеточной терапии.
[0078] Более того, этот способ не является ограниченным лечением неоплазий, но является пригодным для широкого ряда применений, в которых желательно увеличение антигенспецифического иммунного ответа, где такие применения включают в себя не только лечение неоплазий, то также усиление иммунного ответа против инфекции патогеном или инфекционного заболевания и усиление иммунной устойчивости регуляторных T-клеток в контексте аутоиммунитета или аллогенной трансплантации.
Линии гематопоэтических клеток
[0079] Гематопоэтические (кровяные) клетки обеспечивают широкое разнообразие физиологической активности. Гематопоэтические клетки делятся на лимфоидные, миелоидные и эритроидные линии. Лимфоидная линия, содержащая клетки В, T и естественные киллеры (NK), обеспечивает продукцию антител, регуляцию клеточной иммунной системы, детекцию чужеродных антигенов в крови, детекцию клеток, чужеродных для хозяина, и т.п. Термин «T-клетки», как применяют в настоящем документе, относится к лимфоцитам, которые созревают в тимусе и являются в основном ответственными за опосредованный клетками иммунитет. T-клетки вовлечены в приобретенную иммунную систему. Термин «клетки естественные киллеры (NK)», как применяют в настоящем документе, относится к лимфоцитам, которые являются частью опосредованного клетками иммунитета и действуют в ходе врожденного иммунного ответа. Они не требуют предварительной активации, чтобы оказывать их цитотоксический эффект на клетки-мишени. Цитотоксические T-клетки (CTL или T-клетки-киллеры) представляют собой подгруппу T-лимфоцитов, способных индуцировать гибель инфицированных соматических клеток или клеток опухолей.
Клетки для использования в способах по изобретению
[0080] Настоящее изобретение относится к клеткам, экспрессирующим комбинацию узнающего антиген рецептора, активирующего иммунореактивную клетку (например, TCR, CAR), и химерного костимулирующего рецептора (CCR), и к способам использования таких клеток для лечения заболевания, требующего усиленного иммунного ответа. По одному способу, специфические для антигенов опухоли T-клетки, клетки NK, клетки CTL или другие иммунореактивные клетки используют в качестве челноков для селективного обогащения по одному или нескольким костимулирующим лигандам для лечения или предотвращения неоплазии. Например, T-клетка, экспрессирующая химерный рецептор антигена 19z1, узнающий CD19, совместно экспрессированный в T-клетке, экспрессирующей химерный костимулирующий рецептор P28BB, который узнает и связывает специфический для предстательной железы мембранный антиген (PSMA). Такие клетки вводят нуждающемуся в этом субъекту-человеку для лечения или предотвращения рака предстательной железы. По другому способу, специфические для вирусного антигена T-клетки, клетки NK, клетки CTL можно использовать для лечения вирусных заболеваний. Например, химерный костимулирующий рецептор антигена, который узнает первый антиген CMV, и химерный рецептор антигена, который узнает и связывает второй антиген CMV, совместно экспрессируют на цитотоксических T-лимфоцитах для лечения CMV.
Специфические для антигенов опухоли T лимфоциты (и клетки NK)
[0081] Типы специфических для антигенов опухоли лимфоцитов человека, которые можно использовать в способах по изобретению, включают в себя, без ограничения, периферические донорные лимфоциты, генетически модифицированные для экспрессии химерных рецепторов антигенов (CAR) (Sadelain, M., et al. 2003 Nat Rev Cancer 3:35-45), периферические донорные лимфоциты, генетически модифицированные для экспрессии полноразмерного узнающего антиген опухоли комплекса T-клеточного рецептора, содержащего гетеродимер a и p (Morgan, R.A., et al. 2006 Science 314:126-129), культуры лимфоцитов, полученные из инфильтрующих опухоль лимфоцитов (TIL) в биоптатах опухолей (Panelli, M.C., et al. 2000 J Immunol 164:495-504; Panelli, M.C., et al. 2000 J Immunol 164:4382-4392), и селективно размноженных in vitro антигенспецифических лейкоцитов периферической крови с использованием искусственных антигенпредставляющих клеток (AAPC) или сенсибилизированных дендритных клеток (Dupont, J., et al. 2005 Cancer Res 65:5417-5427; Papanicolaou, G.A., etal. 2003 Blood 102:2498-2505). T-клетки могут являться аутологичными, аллогенными или полученными in vitro из сконструированных клеток-предшественников или стволовых клеток.
[0082] Любой пригодный антиген опухоли (антигенный пептид) является пригодным для использования в связанных с опухолями вариантах осуществления, описанных в настоящем документе. Источники антигена включают в себя, но без ограничения, белки злокачественных опухолей. Антиген можно экспрессировать в форме пептида или в форме интактного белка или его части. Интактный белок или его часть могут являться природными или подвергнутыми мутагенезу. Пригодные антигены включают в себя специфический для предстательной железы мембранный антиген (PSMA) и антиген стволовых клеток предстательной железы (PCSA).
Специфические для вирусного антигена T-лимфоциты (и клетки NK)
[0083] Пригодные антигены для использования в лечении инфекции патогеном или другого инфекционного заболевания, например, у субъекта с иммунной недостаточностью, включают в себя, без ограничения, вирусные антигены, присутствующие в цитомегаловирусе (CMV), вирусе Эпштейна-Барр (EBV), вирусе иммунодефицита человека (HIV) и вирусе гриппа.
[0084] Неочищенным источником CTL может являться любой источник, известный в данной области, такой как костный мозг, источник фетальных, неонатальных или взрослых, или других гематопоэтических клеток, например, фетальная печень, периферическая кровь или пуповинная кровь. Различные способы можно использовать для разделения клеток. Например, способами отрицательного отбора можно сначала удалять не относящиеся к CTL клетки. mAb являются особенно пригодными для идентификации маркеров, ассоциированных с конкретными линиями клеток и/или стадиями дифференцировки как для положительного, так и для отрицательного отборов.
[0085] Большой процент терминально дифференцированных клеток можно первоначально удалять посредством относительно грубого разделения. Например, разделения на магнитных бусинах можно использовать первоначально для удаления больших количеств не имеющих отношения к делу клеток. Предпочтительно, по меньшей мере приблизительно 80%, обычно по меньшей мере 70% тотальных гематопоэтических клеток удаляют перед выделением клеток.
[0086] Способы разделения включают в себя, но без ограничения, центрифугирование в градиенте плотности; розеткообразование; присоединение к частицам, модифицирующим плотность клеток; магнитное разделение с помощью покрытых антителами магнитных бусин; аффинную хроматографию; цитотоксические средства, присоединенные к mAb или используемые в сочетании с mAb, включая, но без ограничения, комплемент и цитотоксины; и пэннинг с помощью антитела, присоединенного к твердой матрице, например, планшету, чипу, отстаивание или любой другой удобный способ.
[0087] Способы разделения и анализа включают в себя, но без ограничения, проточную цитометрию, которая может иметь различные степени сложности, например, множество цветовых каналов, каналы малого угла и детекции приглушенного светорассеяния, сопротивления.
[0088] Клетки можно отбирать от мертвых клеток, посредством использования красителей, связанных с мертвыми клетками, таких как иодид пропидия (PI). Предпочтительно, клетки собирают в среде, содержащей 2% эмбриональную телячью сыворотку (FCS) или 0,2% бычий сывороточный альбумин (BSA) или в любой другой пригодной, предпочтительно стерильной, изотонической среде.
[0089] Соответственно, изобретение в общем относится к иммунореактивной клетке, такой как специфическая для вируса или специфическая для опухоли T-клетка, содержащей рецептор, который связывает первый антиген и активирует иммунореактивную клетку и рецептор, который связывает второй антиген и стимулирует иммунореактивную клетку.
Векторы
[0090] Генетическую модификацию иммунореактивных клеток (например, T-клеток, клеток CTL, клеток NK) можно осуществлять посредством трансдукции по существу гомогенной композиции клеток конструкцией рекомбинантной ДНК. Предпочтительно, ретровирусный вектор (либо гамма-ретровирусный, либо лентивирусный) используют для введения конструкции ДНК в клетку. Например, полинуклеотид, кодирующий рецептор, который связывает антиген (например, антиген опухоли, или его вариант или фрагмент), можно клонировать в ретровирусный вектор, и экспрессией можно управлять с его эндогенного промотора, с ретровирусного длинного концевого повтора или с промотора, специфического для представляющего интерес типа клетки-мишени. Невирусные векторы также можно использовать.
[0091] Для исходной генетической модификации клеток для получения специфических для опухоли или вирусного антигена клеток, ретровирусный вектор, как правило, используют для трансдукции, однако, можно использовать любой другой пригодный вирусный вектор или систему невирусной доставки. Для последующей генетической модификации клеток для получения клеток, содержащих антигенпредставляющий комплекс, содержащий по меньшей мере два костимулирующих лиганда, подобным образом доказана эффективность ретровирусного переноса генов (трансдукции). Комбинации ретровирусного вектора и подходящей упаковывающей линии также являются пригодными, где белки капсида становятся функциональными для инфекции клеток человека. Известны различные линии клеток, производящие амфотропные вирусы, включая, но без ограничения, PA12 (Miller, et al. (1985) Mol. Cell. Biol. 5:431-437); PA317 (Miller, et al. (1986) Mol. Cell. Biol. 6:2895-2902); и CRIP (Danos, et al. (1988) Proc. Natl. Acad. Sci. USA 85:6460-6464). Неамфотропные частицы также являются пригодными, например, частицы, псевдотипированные с оболочкой VSVG, RD114 или GALV, и любые другие, известные в данной области.
[0092] Возможные способы трансдукции включают в себя также прямое совместное культивирование клеток с клетками-продуцентами, например, способом Bregni, et al. (1992) Blood 80:1418-1422, или культивирование только с вирусным супернатантом или концентрированными препаратами вектора из хранилища в присутствии или в отсутствие подходящих факторов роста и поликатионов, например, способом Xu, et al. (1994) Exp. Hemat. 22:223-230; и Hughes, et al. (1992) J. Clin. Invest. 89:1817.
[0093] Другие трансдуцирующие вирусные векторы можно использовать для экспрессии костимулирующего лиганда по изобретению в иммунореактивной клетке. Предпочтительно, для выбранного вектора показывают высокую эффективность инфекции и стабильную интеграцию и экспрессию (см., например, Cayouette et al., Human Gene Therapy 8:423-430, 1997; Kido et al., Current Eye Research 15:833-844, 1996; Bloomer et al., Journal of Virology 71:6641-6649, 1997; Naldini et al., Science 272:263-267, 1996; и Miyoshi et al., Proc. Natl. Acad. Sci. U.S.A. 94:10319,1997). Другие вирусные векторы, которые можно использовать, включают в себя, например, аденовирусные, лентивирусные и аденоассоциированные вирусные векторы, вирус осповакцины, вирус папилломы крупного рогатого скота или вирус герпеса, такой как вирус Эпштейна-Барр (см. также, например, векторы из Miller, Human Gene Therapy 15-14, 1990; Friedman, Science 244:1275-1281, 1989; Eglitis et al., BioTechniques 6:608-614, 1988; Tolstoshev et al., Current Opinion in Biotechnology 1:55-61, 1990; Sharp, The Lancet 337:1277-1278, 1991; Cornetta et al., Nucleic Acid Research and Molecular Biology 36:311-322, 1987; Anderson, Science 226:401-409,1984; Moen, Blood Cells 17:407-416, 1991; Miller et al., Biotechnology 7:980-990, 1989; Le Gal La Salle et al., Science 259:988-990, 1993; и Johnson, Chest 107:77S-83S, 1995). Ретровирусные векторы особенно хорошо разработаны, и их использовали в клинических условиях (Rosenberg et al., N. Engl. J. Med 323:370, 1990; Anderson et al., Патент США No. 5399346).
[0094] Невирусные способы также можно использовать для экспрессии белка в клетке. Например, молекулу нуклеиновой кислоты можно вводить в клетку посредством введения нуклеиновой кислоты в присутствии липофекции (Feigner et al., Proc. Natl. Acad. Sci. U.S.A. 84:7413, 1987; Ono et al., Neuroscience Letters 17:259, 1990; Brigham et al., Am. J. Med. Sci. 298:278, 1989; Staubinger et al., Methods in Enzymology 101:512,1983), асиалоорозомукоид-полилизиновой конъюгации (Wu et al., Journal of Biological Chemistry 263:14621, 1988; Wu et al., Journal of Biological Chemistry 264:16985, 1989), или посредством микроинъекции в хирургических условиях (Wolff et al., Science 247:1465,1990).
[0095] Другие невирусные способы переноса генов включают в себя трансфекцию in vitro с использованием фосфата кальция, DEAE декстрана, электропорации и слияния протопластов. Липосомы также могут потенциально предоставлять преимущества для доставки ДНК в клетку. Трансплантацию нормальных генов в пораженные ткани субъекта также можно осуществлять посредством переноса нормальной нуклеиновой кислоты в поддающийся культивированию тип клеток ex vivo (например, аутологичные или гетерологичные первичные клетки или их потомство), после чего клетку (или ее потомство) инъецируют в ткань-мишень или инъецируют системно. Рекомбинантные рецепторы также могут быть выведены или получены с использованием транспозаз или направленных нуклеаз (например, нуклеаз с цинковыми пальцами, мегануклеаз или нуклеаз TALE). Временную экспрессию можно получать посредством электропорации РНК. Экспрессией кДНК для использования в способах терапии полинуклеотидами можно управлять с любого пригодного промотора (например, промоторов цитомегаловируса человека (CMV), вируса обезьян 40 (SV40) или металлотионеина), и ее можно регулировать посредством любого пригодного регуляторного элемента или интрона млекопитающих (например, структуры фактора элонгации 1c энхансер/промотор/интрон). Например, если желательно, энхансеры, известные для предпочтительного управления экспрессией гена в конкретных типах клеток, можно использовать для управления экспрессией нуклеиновой кислоты. Энхансеры могут включать в себя, без ограничения, энхансеры, охарактеризованные как специфические для ткани или клетки энхансеры. Альтернативно, если геномный клон используют в качестве терапевтической конструкции, регуляция может быть опосредована родственными регуляторными последовательностями или, если желательно, регуляторными последовательностями, полученными из гетерологичного источника, включая любой из промоторов или регуляторных элементов, описанных выше.
[0096] Полученные клетки, которые можно затем выращивать в условиях, сходных с условиями для немодифицированных клеток, посредством чего модифицированные клетки можно размножать и использовать для множества целей.
[0097] Изобретение относится также к полипептидам 19z1, CD19, CD8, CD3, dsRed, P28BB, PSMA, CD28, 4-1BB, GFP или их фрагментам, модифицированным способами, усиливающими их антинеопластическую активность при экспрессии в иммунореактивной клетке. Изобретение относится к способам оптимизации аминокислотной последовательности или последовательности нуклеиновой кислоты посредством получения изменений в последовательности. Такие изменения могут включать в себя конкретные мутации, делеции, вставки или посттрансляционные модификации. Изобретение, кроме того, относится к аналогам любого природного полипептида по изобретению. Аналоги могут отличаться от природного полипептида по изобретению по различиям в аминокислотной последовательности, по посттрансляционным модификациям, или по тому и другому. Аналоги по изобретению, как правило, обладают по меньшей мере 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичностью со всей или частью природной аминокислотной последовательности по изобретению. Длина сравнения последовательности составляет по меньшей мере 5, 10, 15 или 20 аминокислотных остатков, предпочтительно, по меньшей мере 25, 50 или 75 аминокислотных остатков, и более предпочтительно, более 100 аминокислотных остатков. И снова, в качестве иллюстративного способа для определения степени идентичности, можно использовать программу BLAST, со значением вероятности между e3 и e-100, указывающим на близко родственную последовательность. Модификации включают в себя химическую дериватизацию полипептидов in vivo и in vitro, например, ацетилирование, карбоксилирование, фосфорилирование или гликозилирование; такие модификации могут происходить в ходе синтеза или процессинга полипептидов или последующей обработки выделенными модифицирующими ферментами. Аналоги могут также отличаться от природных полипептидов по изобретению по изменениям в первичной последовательности. Они включают в себя генетические варианты, как природные, так и индуцированные (например, возникшие в результате случайного мутагенеза посредством облучения или воздействия этанметилсульфата, или посредством сайт-специфического мутагенеза, как описано в Sambrook, Fritsch and Maniatis, Molecular Cloning: A Laboratory Manual (2d ed.), CSH Press, 1989, или Ausubel et al., выше). Включены также циклизованные пептиды, молекулы и аналоги, содержащие остатки, отличные от L-аминокислот, например, D-аминокислоты или неприродные или синтетические аминокислоты, например, - или - аминокислоты.
[0098] В дополнение к полноразмерным полипептидам, изобретение относится также к фрагментам любого из доменов полипептидов или пептидов по изобретению. Как применяют в настоящем документе, термин «фрагмент» означает по меньшей мере 5, 10, 13 или 15 аминокислот. В других вариантах осуществления фрагмент представляет собой по меньшей мере 20 непрерывных аминокислот, по меньшей мере 30 непрерывных аминокислот или по меньшей мере 50 непрерывных аминокислот, и в других вариантах осуществления по меньшей мере 60-80, 100, 200, 300 или более непрерывных аминокислот. Фрагменты по изобретению могут быть получены способами, известными специалистам в данной области, или могут быть получены в результате нормального процессинга белка (например, удаления из образующегося полипептида аминокислот, не требующихся для биологической активности, или удаления аминокислот посредством событий альтернативного сплайсинга мРНК, или альтернативного процессинга белка).
[0099] Небелковые аналоги имеют химическую структуру, разработанную для имитации функциональной активности белка по изобретению. Такие аналоги вводят способами по изобретению. Такие аналоги могут превосходить физиологическую активность исходного полипептида. Способы разработки аналогов хорошо известны в данной области, и синтез аналогов можно проводить в соответствии с такими способами посредством модификации химических структур, так что полученные аналоги увеличивают антинеопластическую активность исходного полипептида при экспрессии в иммунореактивной клетке. Эти химические модификации включают в себя, но без ограничения, замену альтернативных групп R и изменение степени насыщения атомов углерода эталонного полипептида. Предпочтительно, аналоги белка являются относительно устойчивыми к деградации in vivo, что приводит в результате к более длительному терапевтическому эффекту после введения. Анализы для измерения функциональной активности включают в себя, но без ограничения, анализы, описанные в примерах ниже.
Костимулирующие лиганды
[00100] Взаимодействие по меньшей мере с одним костимулирующим лигандом обеспечивает не специфический для антигенов сигнал, важный для полной активации иммунных клеток (например, T-клеток). Костимулирующие лиганды включают в себя, без ограничения, лиганды фактора некроза опухоли (TNF), цитокины (такие как IL-2, IL-12, IL-15 или IL21), и лиганды суперсемейства иммуноглобулинов (Ig).
[00101] Фактор некроза опухоли (TNF) представляет собой цитокин, вовлеченный в системное воспаление, и стимулирует реакцию острой фазы. Его первоочередной ролью является регуляция иммуноцитов. Лиганды фактора некроза опухоли (TNF) разделяют ряд общих признаков. Большинство лигандов синтезируют в форме трансмембранных белков типа II (с внеклеточным C-концом), содержащих короткий цитоплазматический фрагмент и относительно длинную внеклеточную область. Лиганды TNF включают в себя, без ограничения, фактор роста нервов (NGF), CD4ОL (CD4ОL)/CD154, CD137L/4-1BBL, фактор некроза опухоли альфа (TNFa), CD134L/OX4OL/CD252, CD27L/CD70, лиганд Fas (FasL), CD3ОL/CD153, фактор некроза опухоли бета (TNF(3)/лимфотоксин-альфа (LTa), лимфотоксин-бета (ur(3), CD257/ фактор активации B-клеток (BAFF)/Blys/THANK/Ta11-1, лиганд индуцируемого глюкокортикоидами рецептора TNF (GITRL) и родственный TNF индуцирующий апоптоз лиганд (TRAIL), LIGHT (TNFSF14). Суперсемейство иммуноглобулинов (Ig) представляет собой большую группу белков поверхности клеток и растворимых белков, которые вовлечены в процессы узнавания, связывания или адгезии клеток. Эти белки разделяют структурные свойства с иммуноглобулинами - они обладают иммуноглобулиновым доменом (свернутым). Лиганды суперсемейства иммуноглобулинов включают в себя, без ограничения, CD80 и CD86, оба лиганды для CD28.
[00102] Композиции, содержащие генетически модифицированные иммунореактивные клетки по изобретению (например, T-клетки, клетки NK, клетки CTL или их предшественники), можно вводить системно или напрямую субъекту для лечения неоплазии, инфекции патогеном или инфекционного заболевания. В одном варианте осуществления клетки по изобретению напрямую вводят в представляющий интерес орган (например, орган, пораженный неоплазией). Альтернативно, композиции, содержащие генетически модифицированные иммунореактивные клетки, вводят опосредованно в представляющий интерес орган, например, посредством введения в систему кровообращения (например, сосудистую сеть опухоли). Средства для размножения и дифференцировки можно предоставлять до, во время или после введения клеток для увеличения продукции T-клеток, клеток NK или клеток CTL in vitro или in vivo.
[00103] Модифицированные клетки можно вводить в любом физиологически приемлемом носителе, обычно внутрь сосудов, хотя их можно также вводить в кость или другой удобный участок, где клетки могут найти подходящий участок для регенерации и дифференцировки (например, тимус). Обычно, вводят по меньшей мере 1×105 клеток, в конечном счете достигающих 1×1010 или более. Генетически модифицированные иммунореактивные клетки по изобретению могут содержать очищенную популяцию клеток. Специалисты в данной области могут легко определять процент генетически модифицированных иммунореактивных клеток в популяции с использованием различных хорошо известных способов, таких как активированная флуоресценцией сортировка клеток (FACS). Предпочтительные диапазоны чистоты в популяциях, содержащих генетически модифицированные иммунореактивные клетки, составляют от приблизительно 50 до приблизительно 55%, от приблизительно 55 до приблизительно 60% и от приблизительно 65 до приблизительно 70%. Более предпочтительно, чистота составляет от приблизительно 70 до приблизительно 75%, от приблизительно 75 до приблизительно 80%, от приблизительно 80 до приблизительно 85%; и еще более предпочтительно, чистота составляет от приблизительно 85 до приблизительно 90%, от приблизительно 90 до приблизительно 95%, и от приблизительно 95 до приблизительно 100%. Специалисты в данной области могут легко корректировать дозы (например, уменьшение чистоты может требовать увеличения дозы). Клетки можно вводить посредством инъекции, катетера или т.п. Если желательно, можно включать также факторы, включая, но без ограничения, интерлейкины, например, IL-2, IL-3, IL-6 и IL-11, так же как другие интерлейкины, колониестимулирующие факторы, такие как G-, M- и GM-CSF, интерфероны, например, гамма-интерферон и эритропоэтин.
[00104] Композиции по изобретению включают в себя фармацевтические композиции, содержащие генетически модифицированные иммунореактивные клетки или их предшественники и фармацевтически приемлемый носитель. Введение может являться аутологичным или гетерологичным. Например, иммунореактивные клетки или предшественники можно получать от одного субъекта и вводить тому же самому субъекту или другому, совместимому субъекту. Полученные из периферической крови иммунореактивные клетки по изобретению или их потомство (например, полученные in vivo, ex vivo или in vitro) можно вводить посредством локализованной инъекции, включая введение через катетер, системную инъекцию, локализованную инъекцию, внутривенную инъекцию или парентеральное введение. При введении терапевтической композиции по настоящему изобретению (например, фармацевтической композиции, содержащей генетически модифицированные иммунореактивные клетки), ее, как правило, составляют в пригодной для инъекции форме единичной дозы (раствор, суспензия, эмульсия).
Составы
[00105] Композиции по изобретению, содержащие генетически модифицированные иммунореактивные клетки, можно удобно предоставлять в форме стерильных жидких препаратов, например, изотонических водных растворов, суспензий, эмульсий, дисперсий или вязких композиций, которые могут быть забуферены до избранного pH. Жидкие препараты обычно легче получать, чем гели, другие вязкие композиции и твердые композиции. Кроме того, жидкие композиции несколько более удобны для введения, особенно посредством инъекции. Вязкие композиции, с другой стороны, можно составлять в пределах подходящего диапазона вязкости для обеспечения более длительных периодов контакта с конкретными тканями. Жидкие или вязкие композиции могут содержать носители, которые могут представлять собой растворитель или диспергирующую среду, например, воду, солевой раствор, фосфатно-солевой буфер, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.) и их пригодные смеси.
[00106] Стерильные пригодные для инъекции растворы можно получать посредством включения генетически модифицированных иммунореактивных клеток, используемых в практике настоящего изобретения, в необходимом количестве в пригодном растворителе с различными количествами других ингредиентов, как желательно. Такие композиции могут присутствовать в смеси с пригодным носителем, разбавителем или наполнителем, таким как стерильная вода, физиологический солевой раствор, глюкоза, декстроза или т.п. Композиции могут также является лиофилизированными. Композиции могут содержать вспомогательные вещества, такие как увлажняющие, диспергирующие или эмульгирующие средства (например, метилцеллюлозу), забуферивающие pH средтсва, гелеобразующие или увеличивающие вязкость добавки, консерванты, придающие вкус средства, красители и т.п., в зависимости от желательного способа введения и препарата. Можно консультироваться со стандартными текстами, такими как «REMINGTON'S PHARMACEUTICAL SCIENCE», 17th edition, 1985, содержание которого приведено в настоящем документе в качестве ссылки, для получения пригодных препаратов, без излишнего экспериментирования.
[00107] Можно добавлять различные добавки, увеличивающие стабильность и стерильность композиций, включая противомикробные консерванты, антиоксиданты, хелатирующие агенты и буферы. Предотвращение действия микроорганизмов можно обеспечивать посредством различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и т.п. Продленную абсорбцию пригодной для инъекции фармацевтической формы можно обеспечивать посредством средств, замедляющих адсорбцию, например, моностеарата алюминия и желатина. В соответствии с настоящим изобретением, однако, любые используемые носитель, разбавитель или добавка должны являться совместимыми с генетически модифицироанныи иммунореактивными клетками или их потомством.
[00108] Композиции могут являться изотоническими, т.е., они могут иметь такое же осмотическое давление, как кровь и слезная жидкость. Желательной изотоничности композиций по этому изобретению можно достигать с использованием хлорида натрия или других фармацевтически приемлемых средств, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль или другие неорганические или органические растворенные вещества. Хлорид натрия является предпочтительным, особенно для буферов, содержащих ионы натрия.
[00109] Вязкость композиций, если желательно, можно поддерживать на избранном уровне с использованием фармацевтически приемлемого загустителя. Метилцеллюлоза является предпочтительной, поскольку она является легко и экономически доступной, и с ней легко работать. Другие пригодные загустители включают в себя, например, ксантановую смолу, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и т.п. Предпочтительная концентрация загустителя зависит от избранного средства. Важным пунктом является использование количества, с которым можно достигать избранной вязкости. Очевидно, что выбор пригодных носителей и других добавок может зависеть от точного способа введения и характера конкретной лекарственной формы, например, жидкой лекарственной формы (например, предназначена ли композиция для составления в растворе, суспензии, геле или другой жидкой форме, такой как форма с замедленным высвобождением или заполненная жидкостью форма).
[00110] Специалистам в данной области понятно, что компоненты композиций следует выбирать, чтобы они являлись химически инертными и не влияли на жизнеспособность или эффективность генетически модифицированных иммунореактивных клеток, как описано по настоящему изобретению. Это не представляет проблемы для специалистов в области химических и фармацевтических принципов, или проблем можно легко избежать посредством обращения к стандартным текстам или посредством простых экспериментов (не включающих в себя излишнего экспериментирования) из этого описания и документов, процитированных в настоящем документе. Одним из соображений относительно терапевтического использования генетически модифицированных иммунореактивных клеток по изобретению является количество клеток, необходимое для достижения оптимального эффекта. Количество клеток, подлежащее введению, может меняться для субъекта, подлежащего лечению. В одном из вариантов осуществления, между 104 и 1010, между 105 и 109, или между 106 и 108 генетически модифицированных иммунореактивных клеток по изобретению вводят субъекту-человеку. Более эффективные клетки можно вводить даже в меньших количествах. В некоторых вариантах осуществления по меньшей мере приблизительно 1×108, 2×108, 3×108, 4×108 и 5×108 генетически модифицированных иммунореактивных клеток по изобретению вводят субъекту-человеку. Точное определение того, что можно рассматривать как эффективную дозу, может быть основано на факторах, индивидуальных для каждого субъекта, включая его рост, возраст, пол, массу и состояние конкретного субъекта. Специалисты в данной области могут легко определять дозы из этого описания и знаний в данной области.
[00111] Специалист в данной области может легко определять количество клеток и необязательных добавок, основ и/или носителей в композициях и для введения способами по изобретению. Как правило, любые добавки (в дополнение к активной клетке (клетках) и/или средству (средствам)) присутствуют в количестве 0,001-50% (массы) раствора в фосфатно-солевом буфере, и активный ингредиент присутствует в порядке от микрограммов до миллиграммов, например, от приблизительно 0,0001 до приблизительно 5% масс., предпочтительно, от приблизительно 0,0001 до приблизительно 1% масс., еще более предпочтительно, от приблизительно 0,0001 до приблизительно 0,05% масс. или от приблизительно 0,001 до приблизительно 20% масс., предпочтительно, от приблизительно 0,01 до приблизительно 10% масс., и еще более предпочтительно, от приблизительно 0,05 до приблизительно 5% масс. Разумеется, для любой композиции, подлежащей введению животному или человеку, и для любого конкретного способа введения, является предпочтительным определять, таким образом: токсичность, например, посредством определения летальной дозы (LD) и LD50 в пригодной модели на животных, например, грызунах, таких как мыши; и дозу композиции (композиций), концентрацию компонентов в ней и расписание введения композиции (композиций), вызывающие пригодный ответ. Такие определения не требуют излишнего экспериментирования благодаря знаниям специалиста в данной области, этому описанию и документам, процитированным в настоящем документе. И время для последующих введений можно определять без излишнего экспериментирования.
Способы лечения
[00112] В настоящем документе представлены способы лечения неоплазии у субъекта. В настоящем документе предусмотрены также способы лечения инфекции патогеном или другого инфекционного заболевания у субъекта, такого как субъект-человек с иммунной недостаточностью. Способы включают в себя введение T-клеток, клеток NK или клеток CTL по изобретению в количестве, эффективном для достижения желательного эффекта, будь то облегчение существующего состояния или предотвращение рецидива. Для лечения, вводимое количество представляет собой количество, эффективное для получения желательного эффекта. Эффективное количество можно предоставлять в одном введении или в серии введений. Эффективное количество можно предоставлять в болюсе или посредством непрерывной перфузии.
[00113] «Эффективное количество» (или «терапевтически эффективное количество») представляет собой количество, достаточное для получения эффекта преимущественного или желательного клинического результата при лечении. Эффективное количество можно вводить субъекту в одной или нескольких дозах. В отношении лечения, эффективное количество представляет собой количество, являющееся достаточным для ослабления, облегчения, стабилизации, обращения или замедления прогрессирования заболевания, или иным образом уменьшения патологических последствий заболевания. Эффективное количество, как правило, определяет терапевт в каждом конкретном случае, и это находится в компетенции специалиста в данной области. Несколько факторов, как правило, принимают во внимание при определении подходящей дозы для достижения эффективного количества. Эти факторы включают в себя возраст, пол и массу субъекта, подлежащее лечению состояние, тяжесть состояния и форму и эффективную концентрацию вводимого антигенсвязывающего фрагмента.
[00114] Для адоптивной иммунотерапии с использованием антигенспецифических T-клеток, как правило, проводят инфузию доз клеток в диапазоне 106-1010 (например, 109). При введении генетически модифицированных клеток хозяину и последующей дифференцировке, индуцируют T-клетки, специфически направленные против специфического антигена. «Индукция» T-клеток может включать в себя инактивацию антигенспецифических T-клеток, например, посредством делеции или анергии. Инактивация является в частности пригодной для развития или восстановления устойчивости, например, такой как при аутоиммунных нарушениях. Модифицированные клетки можно вводить любым способом, известным в данной области, включая, но без ограничения, внутривенный, подкожный, внутриузловой, внутриопухолевый, интратекальный, интраплевральный, внутрибрюшинный и непосредственно в тимус.
[00115] Изобретение относится к способам увеличения иммунного ответа у нуждающегося в этом субъекта. В одном варианте осуществления изобретение относится к способам лечения или предотвращения неоплазии у субъекта. Изобретение относится к способам терапии, которые являются в частности пригодными для лечения субъектов, страдающих раком предстательной железы, или метастазирующим раком предстательной железы, которые не поддаются общепринятым терапевтическим вмешательствам. Подходящие субъекты-люди для терапии, как правило, содержат две группы лечения, которые можно различать по клиническим критериям. Субъекты с «заболеванием на поздних стадиях» или «высокой опухолевой нагрузкой» представляют собой субъектов, несущих поддающуюся клиническому измерению опухоль. Поддающаяся клиническому измерению опухоль представляет собой опухоль, которую можно детектировать на основании массы опухоли (например, посредством пальпации, сканирования CAT, сонограммы, маммограммы или рентгеновского излучения; положительные биохимические или гистопатологические маркеры сами по себе являются недостаточными для идентификации этой популяции). Фармацевтическую композицию, охваченную этим изобретением, вводят этим субъектам для вызова противоопухолевого ответа, с целью облегчения их состояния. В идеале, в результате происходит уменьшение массы опухоли, но любое клиническое улучшение составляет преимущество. Клиническое улучшение включает в себя уменьшенный риск или скорость прогрессирования или уменьшение патологических последствий опухоли.
[00116] Вторая группа пригодных субъектов известна в данной области как «вспомогательная группа». Они представляют собой индивидуумов, которые имеют неоплазию в анамнезе, но которые отвечали на другой способ терапии. Предшествующая терапия могла включать в себя, но без ограничения, хирургическое удаление, радиотерапию и общепринятую химиотерапию. В результате, эти индивидуумы не имеют поддающейся клиническому измерению опухоли. Однако, подозревают, что они подвержены риску прогрессирования заболевания, либо около исходного участка опухоли, либо из-за метастазирования. Эту группу можно далее подразделять на индивидуумов с высоким риском и низким риском. Подразделение выполняют на основании признаков, наблюдаемых до или после первоначальной терапии. Эти признаки известны в области клиники и подходящим образом определены для каждой различной неоплазии. Признаки, типичные для подгрупп высокого риска, представляют собой признаки, по которым опухоль инвазировала соседние ткани, или которые показывают вовлечение лимфатических узлов.
[00117] Другая группа обладает генетической предрасположенностью к неоплазии, но еще не имеет доказанных клинических признаков неоплазии. Например, женщины, тестированные как положительные по генетической мутации, ассоциированной с раком молочной железы, но все еще в детородном возрасте, могут пожелать введения одного или нескольких из антигенсвязывающих фрагментов, описанных в настоящем документе, в профилактическом лечении для предотвращения возникновения неоплазии, пока не станет целесообразным проведение превентивной хирургической операции.
[00118] Субъекты-люди с неоплазией, страдающие любой из следующих неоплазий: глиобластома, меланома, нейробластома, аденокарцинома, глиома, саркома мягких тканей и различные карциномы (включая рак предстательной железы и мелкоклеточный рак легкого), являются особенно подходящими субъектами. Пригодные карциномы дополнительно включают в себя любые известные в области онкологии, включая, но без ограничения, астроцитому, фибросаркому, миксосаркому, липосаркому, олигодендроглиому, эпендимому, медуллобластому, примитивную нейроэктодермальную опухоль (PNET), хондросаркому, остеогенную саркому, аденокарциному протоков поджелудочной железы, мелко- и крупноклеточные аденокарциномы легких, хордому, ангиосаркому, эндотелиосаркому, плоскоклеточную карциному, бронхоальвеолярную карциному, эпителиальную аденокарциному и ее метастазы в печени, лимфангиосаркому, лимфангиоэндотелиосаркому, гепатому, холангиокарциному, синовиому, мезотелиому, опухоль Юинга, рабдомиосаркому, карциному ободочной кишки, базально-клеточную карциному, карциному потовой железы, папиллярную карциному, карциному сальной железы, папиллярную аденокарциному, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечноклеточный рак, карциномы желчных протоков, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, опухоль яичка, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, нейробластому, ретинобластому, лейкоз, множественную миелому, макроглобулинемию Вальденстрема и болезнь тяжелых цепей, опухоли молочной железы такие как протоковая и лобулярная аденокарцинома, плоскоклеточные и аденокарциномы шейки матки, эпителиальные карциномы матки и яичников, аденокарциномы предстательной железы, переходную плоскоклеточную карциному мочевого пузыря, В- и T-клеточные лимфомы (нодулярные и диффузные), плазмацитому, острые и хронические лейкозы, злокачественную меланому, саркомы мягких тканей и лейомиосаркомы.
[00119] Субъекты могут страдать формой заболевания на поздних стадиях, в этом случае цель лечения может включать в себя снижение или обращение прогрессирования заболевания, и/или облегчение побочных эффектов. Субъекты могут иметь в анамнезе состояние, от которого их уже лечили, в этом случае цель терапии, как правило, может включать в себя уменьшение или задержку риска рецидива.
[00120] Соответственно, изобретение относится к способу лечения или предотвращения неоплазии у субъекта, где способ включает в себя введение эффективного количества иммунореактивных клеток, содержащих рецептор, который связывает антиген опухоли и активирует иммунореактивную клетку (например, TCR, CAR), и вектор, кодирующий рецептор, который связывает другой антиген опухоли и стимулирует иммунореактивную клетку. В одном варианте осуществления неоплазия выбрана из группы, состоящей из рака предстательной железы, рака молочной железы, злокачественных опухолей клеток крови (например, лейкозов, лимфом и миелом), рака яичника, злокачественной опухоли мочевого пузыря, злокачественной опухоли мозга, рака толстого кишечника, злокачественной опухоли кишечника, рака печени, рака легкого, рака поджелудочной железы, рака предстательной железы, рака кожи, рака желудка, глиобластомы и злокачественной опухоли горла. В другом варианте осуществления, антиген опухоли представляет собой один или несколько из карбоангидразы IX (CAIX), карциноэмбрионального антигена (CEA), CD5, CD7, CD10, CD19, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, антигена инфицированных цитомегаловирусом (CMV) клеток (например, антиген поверхности клеток), эпителиального гликопротеина-2 (EGP-2), эпителиального гликопротеина-40 (EGP-40), молекулы адгезии эпителиальных клеток (EpCAM), рецепторной тирозин-протеинкиназы erb-B2,3,4, связывающего фолат белка (FBP), фетального рецептора ацетилхолина (AChR), рецептора-a фолата, ганглиозида G2 (GD2), ганглиозида G3 (GD3), рецептора 2 эпидермального фактора роста человека (HER-2), обратной транскриптазы теломеразы человека (hTERT), субъединицы альфа-2 рецептора интерлейкина-13 (IL-13Ra2), ic-легкой цепи, рецептора, содержащего домен вставки киназы (KDR), антигена Льюиса Y (LeY), молекулы адгезии клеток LI (L1CAM), антигена меланомы семейства A, 1 (MAGE-A1), муцина 1 (MUC1), мезотелина (MSLN), лигандов NKG2D, антигена злокачественной опухоли яичка NY-ES0-1, онкофетального антигена (h5T4), антигена стволовых клеток предстательной железы (PSCA), специфического для предстательной железы мембранного антигена (PSMA), опухолеассоциированного гликопротеина 72 (TAG-72), фактора роста эндотелия сосудов R2 (VEGF-R2) или белка опухоли Вильмса (WT-1).
[00121] В качестве последствия экспрессии на поверхности рецептора, который связывает антиген опухоли и активирует иммунореактивную клетку (например, TCR, CAR) и вектор, кодирующий рецептор, который связывает другой антиген опухоли и стимулирует иммунореактивную клетку (например, CCR), адоптивно перенесенные T- или NK клетки человека приобретают усиленную и избирательную цитолитическую активность в участке опухоли. Более того, после их локализации на опухоли или вирусной инфекции и их пролиферации, костимулирующие лигандэкспрессирующие T-клетки превращают участок опухоли или вирусной инфекции в высокопроводящее окружение для широкого диапазона иммунных клеток, вовлеченных в физиологический противоопухолевый или противовирусный ответ (инфильтрирующих в опухоль лимфоцитов, NK-, NKT-клеток, дендритных клеток и макрофагов).
[00122] В других вариантах осуществления изобретение относится к способам лечения субъектов с инфекцией патогеном (например, вирусной инфекцией, бактериальной инфекцией, грибковой инфекцией, паразитарной инфекцией или инфекцией простейших). Изобретение является особенно применимым для усиления иммунного ответа у субъекта с иммунной недостаточностью. Иллюстративные вирусные инфекции, чувствительные к лечению с использованием способа по изобретению, включают в себя, но без ограничения, инфекции цитомегаловируса (CMV), вируса Эпштейна-Барр (EBV), вируса иммунодефицита человека (HIV) и вируса гриппа.
[00123] Соответственно, изобретение относится к способу лечения или предотвращения инфекции патогеном у субъекта, где способ включает в себя введение эффективного количества иммунореактивных клеток, как описано в настоящем документе.
Наборы
[00124] Изобретение относится к наборам для лечения или предотвращения неоплазии, инфекции патогеном, иммунного нарушения или аллогенного трансплантата. В одном варианте осуществления набор включает в себя терапевтическую или профилактическую композицию, содержащую эффективное количество иммунореактивных клеток, содержащих активирующий рецептор антигена и костимулирующий рецептор антигена, в единичной дозированной форме. В конкретных вариантах осуществления клетки дополнительно содержат костимулирующий лиганд. В некоторых вариантах осуществления набор содержит стерильный контейнер, содержащий терапевтическую или профилактическую вакцину; такие контейнеры могут представлять собой коробки, ампулы, бутыли, флаконы, пробирки, мешки, пакеты, блистерные упаковки или другие пригодные формы контейнеров, известные в данной области. Такие контейнеры могут быть изготовлены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, пригодных для содержания лекарственных средств.
[00125] Если желательно, иммунореактивные клетки предоставляют вместе с инструкциями для введения клеток субъекту, имеющему неоплазию, инфекцию патогеном, иммунное нарушение или аллогенный трансплантат или подверженному риску их развития. Инструкции, как правило, включают информацию об использовании композиции для лечения или предотвращения неоплазии, инфекции патогеном, иммунного нарушения или аллогенного трансплантата. В других вариантах осуществления инструкции включают по меньшей мере одно из следующего: описание лекарственного средства; расписание дозирования и введения для лечения или предотвращения неоплазии, инфекции патогеном, иммунного нарушения или аллогенного трансплантата или их симптомов; меры предосторожности; предупреждения; показания; противопоказания; информацию о передозировке; побочные реакции; фармакологию для животных; клинические исследования; и/или ссылки. Инструкции могут быть напечатаны непосредственно на контейнере (когда он присутствует), или в форме ярлыка, приложенного к контейнеру, или в форме отдельного листа, брошюры, карты или папки, поставленных в контейнере или с контейнером.
ПРИМЕРЫ
[00126] В практике настоящего изобретения используют, если не указано иначе, общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, полностью находящиеся в компетенции специалиста в данной области. Такие способы полностью объяснены в литературе, такой как «Molecular Cloning: A Laboratory Manual», second edition (Sambrook, 1989); «Oligonucleotide Synthesis» (Gait, 1984); «Animal Cell Culture» (Freshney, 1987); «Methods in Enzymology» «Handbook of Experimental Immunology» (Weir, 1996); «Gene Transfer Vectors for Mammalian Cells» (Miller and Calos, 1987); «Current Protocols in Molecular Biology» (Ausubel, 1987); «PCR: The Polymerase Chain Reaction», (Mullis, 1994); «Current Protocols in Immunology» (Coligan, 1991). Эти способы являются применимыми для получения полинуклеотидов и полипептидов по изобретению, и, в этом качестве, могут быть предусмотрены для осуществления и практики изобретения. Особенно пригодные способы для конкретных вариантов осуществления обсуждают в следующих ниже разделах.
[00127] Следующие примеры приведены, чтобы обеспечить специалиста в данной области полным раскрытием и описанием того, как выполнять и использовать способы анализа, скрининга и терапевтические способы по изобретению, и не предназначены для ограничения объема того, что авторы изобретения рассматривают как свое изобретение.
Пример 1. T-клетки, совместно экспрессирующие химерный рецептор антигена (CAR) и химерный костимулирующий рецептор (CCR), уничтожали прижившиеся опухоли.
[00128] Изобретение относится к «чувствительным к опухолям T-клеткам», которые одновременно вовлекают два антигена, совместно экспрессированные клеткой опухоли. Важно, обнаружено, что реактивность против тканей, экспрессирующих любой антиген отдельно, должна быть незначительной, запуская только активацию T-клетки в присутствии обоих антигенов, но не любого антигена отдельно. Изобретение, по меньшей мере частично, основано на открытиях, что комбинация обеспечивает избирательную иммунореактивность T-клеток, и, таким образом, делает этот способ клинически значимым. Во-первых, следует направить активацию T-клеток на один антиген (например, CD19 или антиген стволовых клеток предстательной железы, PSCA), что может быть опосредовано T-клеточным рецептором (TCR) или химерным рецептором антигена (CAR). Костимуляция независимо опосредована «химерным костимулирующим рецептором» (CCR)12,13, нацеленным на второй антиген (например, специфический для предстательной железы мембранный антиген, PSMA). Этот способ приводит к увеличенной иммунореактивности против положительных по двум антигенам (DP) опухолей, но не в состоянии предотвращать усиленную иммунореактивность против положительных по одному антигену (SP) опухолей. Вторым принципом, важным для чувствительных к опухолям T-клеток для дифференциации DP опухолей от SP опухолей, является уменьшение активации T-клеток до уровня, когда она является неэффективной сама по себе, но функционально восстанавливается в месте опухоли посредством CCR, вовлеченных посредством независимого, совместно экспрессируемого антигена. Поскольку CAR и CCR узнают антигены поверхности клеток, а не комплексы HLA-пептид, T-клетки, сконструированные таким образом, нацелены непосредственно на опухоль, и не могут быть костимулированы посредством взаимодействия с клетками, перекрестно представляющими антигены-мишени. Как показано в настоящем документе, этот способ приводит к избирательному уничтожению опухолей у несущих множество опухолей мышей.
[00129] Для демонстрации того, что сигналы как активации, так и костимуляции T-клеток можно обеспечивать in vivo с использованием двух отдельных антигенспецифических рецепторов, оценивали комбинацию CAR, обеспечивающего сигнал активации CD3 при узнавании маркера В-клеток CD1914 и CCR, специфического для PSMA12,15. Из-за синергизма между CD28 и 4-1BB16,17, включая тандемные цитоплазматические домены18,21, цитоплазматический домен 4-1BB добавляли к CCR PSMA P2815, как описано2 (фиг. 1A). Первичные T-клетки периферической крови человека трансдуцировали рецепторами 19z1 и/или P28BB и показали легко поддающуюся детекции экспрессию обоих рецепторов, с эффективностью трансдукции в диапазоне 45-70% (фиг. 1B). Четыре группы T-клеток анализировали во всех последующих исследованиях, включая анти-CD19 CAR (19z1), анти-PSMA CCR (P28BB), оба анти-CD19 CAR, и анти-PSMA CCR в комбинации (19z1+P28BB), и контрольную группу с ложной трансдукцией (ложная) (фиг. 1С). Цитотоксический и пролиферативный ответ in vitro при воздействии CD19 и/или PSMA показал, что цитотоксичность, направленная против CD19, являлась, как ожидали, приданной посредством 19z1 и неизменной в присутствии PSMA.
[00130] Количественное сравнение групп T-клеток, нормализованное по фракции трансдуцированных 19z1 T-клеток для групп 19z1 и 19z1+P28BB, и по трансдуцированной P28BB фракции в группе P28BB, показало, что 19z1 и 19z1+P28BB T-клетки специфически лизировали 40-47% CD19+ мишеней при соотношении 50:1 E:T, в то время как трансдуцированные P28BB T-клетки являлись неспособными лизировать PSMA+ мишени (фиг. 2A). Однако, при повторном воздействии этих антигенов в отсутствие экзогенного цитокина, только для 19z1+P28BB T-клеток показали активную пролиферацию с увеличением в 58 раз в течение 31 суток при совместном культивировании на искусственных антигенпредставляющих клетках (AAPC), экспрессирующих оба антигена. Для сравнения, для 19z1 или P28BB T-клеток показано только умеренное увеличение в течение первых 14 суток, как для 19z1+P28BB T-клеток на CD19+PSMA- APC (фиг. 2B). Дополнительное доказательство более сильной активации T-клеток в присутствии обоих антигенов получено посредством количественной оценки продукции цитокинов и индукции антиапоптотической молекулы BclxL в 19z1+P28BB T-клетках, которые были определенно выше в присутствии CD19+PSMA+ APC, чем в присутствии любого из антигенов отдельно (фиг. 4A, 4E).
[00131] Сначала тестировали способность in vivo этих экспрессирующих двойной рецептор T-клеток уничтожать прижившиеся системные опухоли предстательной железы человека у мышей с иммунной недостаточностью NOD/SCID-yC КО (NSG), несущих двойные положительные (CD19+PSMA+) клетки опухолей. Мышам NSG системно прививали 2,0×106 экспрессирующих люциферазу светляка клеток опухолей PC3, экспрессирующих как CD19, так и PSMA (фиг. 5), и лечили через 19 суток с помощью однократной внутривенной инфузии 1,0×106 19z1, 19z1+P28BB, P28BB или контрольных T-клеток. Через тридцать пять суток мышей, которым вводили P28BB T-клетки или контрольные T-клетки, умерщвляли из-за опухолевой нагрузки. В отличие от этого, мыши после лечения 19z1 T-клетками обладали заметным снижением опухолевой нагрузки. Удивительно, но мыши после лечения 19z1+P28BB T-клетками обладали не поддающейся детекции опухолевой нагрузкой (фиг. 2C). На протяжении 70 суток мониторирования после инфузии, CD19+ опухоли в конечном счете рецидивировали у мышей, которым вводили 19z1 T-клетки, в то время как полная ремиссия продолжалась у всех мышей, которым вводили 19z1+P28BB T-клетки (фиг. 2C). Этот результат явно указывал на то, что уничтожение опухоли достигнуто.
[00132] Эти обнаружения, однако, вызывали опасение из-за потенциального фонового уничтожения CD19+PSMA- опухолей 19z1+P28BB T-клетками. Существовала вероятность, что иммунореактивность T-клеток может нежелательно усиливаться у реципиентов, несущих двойные положительные CD19+PSMA+ опухоли, из-за рециркуляции T-клеток. Для тестирования этой гипотезы, мышам проводили подкожную инфузию CD19+PSMA- опухолей в левые бока, CD19-PSMA+ опухолей в правые бока, и CD19+PSMA+ опухолей в спины. Через одну неделю мышам вводили одни из 19z1, P28BB или 19z1+P28BB T-клеток (1,0×106 клеток) внутривенно. Мыши, которым вводили P28BB T-клетки, имели прогрессирование всех трех опухолей, и их необходимо было умерщвлять в пределах 35 суток (фиг. 2D). У мышей после лечения 19z1 T-клетками, CD19+PSMA- и CD19+PSMA+ опухоли подвергались значительному уменьшению по сравнению с их прогрессированием у реципиентов P28BB T-клеток, перед прогрессированием в конечном счете. В соответствии с предварительными результатами, для мышей после лечения 19z1+P28BB T-клетками показали полное уничтожение CD19+PSMA+ опухолей. Однако, как выдвинули гипотезу, отторжение CD19+PSMA- опухолей было также существенно усилено и превосходило отторжение, наблюдаемое у реципиентов 19z1 T-клеток (фиг. 2D, нижние панели). Таким образом, способом разделения сигнала, нацеленного на два антигена, не удалось рестрицировать реактивность T-клеток и защитить опухоли с одним антигеном.
[00133] Для решения проблемы реактивности одного антигена, предположили, что активацию T-клеток можно минимизировать, почти до точки торможения, для восстановления только в участке экспрессии двойного антигена посредством вовлечения правильного CCR. Таким образом, размышляли о CAR со сниженной активностью. Для этих экспериментов использовали клинически значимую комбинацию антигенов, нацеленных на PSCA и PSMA. Оценивали три специфических для PSCA scFv с различной аффинностью связывания для PSCA (фиг. ЗА). В то время как scFv HzI эффективно лизировал клетки опухолей со снижением до пикограммового диапазона, для scFv Lz1 требовалось в 1000-10000 раз больше антитела для достижения сходной эффективности специфического лизиса. Эти scFv использовали для получения трех основанных на CD3 CAR с различной активностью в анализах цитотоксичности (фиг. 3B). Два из этих CAR, HzI и MzI, направляли умеренную литическую активность против PSCA+ мишеней (20% специфического лизиса при соотношении E:T 50:1). В отличие от этого, для третьего CAR, Lz1, достигали только 10%, квалифицировав его как неэффективный рецептор антигена. Эту иерархию далее подтвердили в анализах высвобождения цитокинов, в которых показали усиленную секрецию цитокинов 19z1+P28BB T-клетками (фиг. 4A) и Hz1+P28BB T-клетками (фиг. 4B) по сравнению с клетками с каждым рецептором отдельно. Это усиление было меньшим в Mz1+P28BB T-клетках (фиг. 4C) и даже дополнительно уменьшенным в Lz1+P28BB T-клетках (фиг. 4D).
[00134] Для оценки терапевтической эффективности и профиля нацеливания PSCA+PSMA- реактивных T-клеток, противоопухолевую активность этих T-клеток тестировали у животных, несущих PSCA+PSMA- и/или PSCA+PSMA+ опухоли. Во-первых, для тестирования способности Mz1+P28BB и Lz1+P28BB T-клеток избирательно уничтожать PSCA+PSMA+ клетки, мышам инокулировали внутривенно 2×106 экспрессирующих FFLuc клеток PC3, положительных по PSMA, PSCA, или обоим (фиг. 5). Через четырнадцать суток, в одной группе мышей вводили 1×106 Mz1+P28BB CAR+ T-клеток внутривенной инфузией, и в другой группе вводили 1×106 Lz1+P28BB CARP T-клеток. Для мышей, несущих PSCA+PSMA клетки опухолей, которых лечили более эффективными MzI+P28BB T-клетками, показали большую регрессию опухолей, чем для мышей, которых лечили Lz1+PBB T-клетками (фиг. 3C). Подобно эксперименту с CD19 (фиг. 2C), эти опухоли в конечном счете рецидивировали и прогрессировали. Однако, у мышей, несущих PSCA+PSMA+ клетки опухоли, Mz1+P28BB T-клетки индуцировали активное и долговременное уничтожение опухоли. В соответствии с меньшей активностью LzI+P28BB T-клеток, уничтожение опухолей у мышей, несущих PSCA+PSMA+ клетки опухолей, которых лечили Lz1+P28BB T-клетками, было более медленным, но тем не менее в равной степени успешным, приводя к сильному уничтожению опухолей и долговременной выживаемости всех подвергнутых лечению мышей (фиг. 3C). Уничтожение опухоли не усиливалось у контрольных мышей, несущих либо PSCAVSMA-, либо PSCA-PSMA+ опухоли (фиг. 3C). Для более строгой оценки фоновой активности против PSCAVSMA- опухоли тестировали в контексте мышей, несущих также PSCA+PSMA+ и PSCAPSMA+ опухоли. Lz1+P28BB T-клетки опосредовали уничтожение PSCA+PSMA+ опухолей без увеличения уничтожения PSCA+PSMA опухолей (фиг. 3E), что не отличалось от уничтожения, индуцированного Lz1 T-клетками.
[00135] Таким образом, эти результаты показывают целесообразность уменьшения активации T-клеток до точки предотвращения иммунореактивности против тканей, экспрессирующих один антиген-мишень, и сохранения активации T-клеток в участке опухоли, где два антигена совместно экспрессированы, без подвергания риску возбуждения реактивности против экспрессирующих один антиген тканей. При этом, результаты показывают правильность принципов для достижения двух взаимодополняющих исходов, определяющих специфичность и безопасность: 1) возможность создавать намеченную специфичность в отсутствие уникального антигена-мишени посредством узнавания комбинированного антигена; и 2) защита клеток, экспрессирующих только один из антигенов посредством титрования сигналов активации и костимуляции, так чтобы практически ограничивать активацию участкам совместной экспрессии антигенов-мишеней.
[00136] Виды направленной T-клеточной терапии обладают потенциалом обеспечивать излечивающее лечение, но их применимость ограничена небольшим количеством подтвержденных специфических для опухоли мишеней. Экспрессия вне опухолей действительно приводит к эффектам «точного отключения опухолей», которые2-4 иногда могут являться переносимыми, но в конечном счете являются летальными11. Способ, описанный в настоящем документе, обеспечивает улучшенное нацеливание посредством обеспечения титрованных сигналов активации и костимуляции посредством узнавания комбинированного антигена (фиг. 6A-6C).
[00137] При физиологическом представлении антигена22 T-клетки примируются в лимфатических узлах посредством получения активирующих и костимулирующих сигналов и мигрируют к периферическим участкам, где эффекторные функции T-клеток не так зависят от костимуляции. Подобным образом, T-клетки, вовлеченные посредством рецептора антигена и CCR, могут рециркулировать к другим периферическим участкам и демонстрировать повышенную цитолитическую активность против тканей, экспрессирующих только один из антигенов-мишеней (фиг. 6A). Таким образом, настоящий способ разработан для преодоления этой проблемы потенциального системного эффекта, чтобы обойти клетки, положительные по одному антигену, включая не относящиеся к опухолям клетки (фиг. 6B). В модели трех опухолей на мышах (PSCA+, PSMA+ и PSCA+PSMA+), достигали уничтожения PSCAVSMA+, в то же время обходя PSCA+PSMA- и PSCA-PSMA+ опухоли (фиг. 3E).
[00138] Как показано посредством настоящих исследований, этой избирательности для DP опухолей можно достигать посредством снижения эффективности CAR, которое создает клетки, которые являются менее цитотоксическими (фиг. 3B) и которые обладают пониженными уровнями секреции цитокинов (фиг. 4A-4D). В то время как уровни как THI, так и TH2 цитокинов являются относительно высокими как для 19z1, так и для HzI CAR, использование менее эффективных CAR MzI и LzI привело к снижению этих уровней. Увеличение уровней цитокинов в Lz1+P28BB T-клетках по сравнению с T-клетками с LzI являлось минимальным, за исключением IL-2 и IL-13. В то время как IL-2 индуцирует пролиферацию и может стимулировать либо TH1, либо TH2 ответ23, IL-13 ассоциирован с TH2 ответом, специфическим для передачи сигнала 4-1BB/CD13724,25.
[00139] PSCA и PSMA являются многообещающими мишенями для лечения метастазирующего рака предстательной железы26,27, хотя ни один не является абсолютно специфическим для предстательной железы. У субъектов-людей экспрессия PSCA обнаружена при раке предстательной железы и в почечной лоханке, мочеточнике, мочевом пузыре и уретре28. Экспрессия PSMA сильно коррелирует с первичным раком предстательной железы, метастазированием, так же как с астроцитами типа II, проксимальными канальцами почек и щеточной каймой кишечника29. Таким образом, ожидают, что двойное нацеливание на PSCA/PSMA увеличивает нацеливание на рак предстательной железы и снижает реактивность против этих нормальных тканей. Следует понимать, что этот принцип можно распространять на другие типы опухолей, экспрессирующих пару антигенов, особенно тех, которые придают истинную специфичность для опухолей. Например, HER2, MUC1, CD44, CD49f и/или EpCAM можно использовать в этом способе для лечения рака молочной железы31. Подобным образом, мезотелин, рецептор-a фолата, CD44 и/или CD133 можно использовать для лечения рака яичника32,33. Нацеливание на инициирующие опухоль клетки или стволовые клетки опухоли, для которых уникальные антигены/структуры - мишени еще явно не идентифицированы34,35, может быть особенно привлекательным использованием этого способа.
[00140] Важным аспектом этого способа является ограничение и почти прекращение активации T-клеток в ответ на один антиген. Обнаружено, что CAR с низкой аффинностью или низкой авидностью, обеспечивающие только слабый сигнал активации, являются пригодными для достижения этого эффекта. Альтернативно, эндогенный TCR с низкой аффинностью или низкой авидностью можно использовать в комбинации с CCR для обеспечения антигенспецифической костимуляции. Вместе, результаты указывают на преимущества ограничения активности сконструированных T-клеток, сочетающих активность с безопасностью посредством узнавания комбинированного антигена чувствительными к опухолям T-клетками.
Конструирование гамма-ретровирусного вектора и продукция вируса
[00141] Гамма-ретровирусный вектор SFG-19z1 подробно описан14. Этот остов конструкции использовали для замены scFv для получения SFG-HzI, SFG-MzI и SFG-LzI посредством прямого клонирования с использованием участка NcoI, локализованного на 5' scFv, и участка Nod, локализованного на 3' scFv. Для получения SFG-P28BB слитые домены CD28 и CD137 амплифицировали с помощью ПЦР с SFG-P28BBz1 и лигировали на 3' scFv PSMA с использованием 5'-участка NcoI и 3'-участка BamHI для включения стоп-кодона на 3' домена BB, в то время как домен CD3 удаляли21. Бицистронной экспрессии гена для CAR для совместной экспрессии с dsRED и для CCR для совместной экспрессии с hrGFP достигали посредством использования внутреннего участка связывания рибосомы, как описано ранее. Векторы использовали для временной трансфекции линий клеток для получения стабильно продуцирующих вирус линий, как описано ранее.
Получение анти-PSCA scFv
[00142] Три новых специфических для PSCA scFv, названные HzI, MzI и LzI, получали посредством амплификации вариабельного тяжелого (VH) и вариабельного легкого (VL) доменов, придающих специфичность к антигену PSCA для не перекрывающихся эпитопов, с использованием вырожденных праймеров, с гибридом, как описано ранее36. Эти домены VH и VL сливали вместе с использованием линкера и использовали для замены scFv CD19 в остове SFG-19z1 с использованием участков 5'-SphI - 3'-NotI.
Выделение, трансдукция ретровирусами и культивирование первичных T-клеток человека
[00143] Лейкоциты периферической крови выделяли с использованием градиентов фиколла и подвергали трансдукции, как описано ранее. Кратко, после 48-часовой активации с помощью 2 мкг/мл фитогемагглютинина, клетки дважды подвергали трансдукции посредством инокуляции при центрифугировании в течение 1 часа на покрытых ретронектином планшетах в течение следующих 48 часов, и добавляли 20 Ед./мл IL-2. После того, как позволяли экспрессию вектора в течение 3 суток, эффективность трансдукции определяли посредством проточной цитометрии и тотальные несортированные клетки использовали для различных анализов или адоптивных переносов.
Получение экспрессирующих антиген линий клеток опухоли
[00144] Линию опухоли предстательной железы человека PC3 получали из ATCC и с помощью ретровирусов16 подвергали трансдукции для получения PC3-GFP/Luc, которые затем использовали для получения 10 PC3-CD19, PC3-PSMA, PC3-CD19-PSMA, PC3-PSCA и PC3-PSCA-PSMA посредством ретровирусной трансдукции.
Анализы уничтожения CTL с высвобождением хрома
[00145] Клетки-мишени, экспрессирующие желательный антиген, метили 51Cr и совместно культивировали с T-клетками в уменьшающихся соотношениях эффектор:мишень. Через 4 часа культивирования супернатант удаляли и использовали для измерения радиоактивности, высвобожденной из хрома. Специфический лизис определяли посредством вычитания фоновой радиоактивности клеток-мишеней, не культивированных с T-клетками, и деления на радиоактивность, измеренную для клеток-мишеней, полностью лизированных с использованием 0,2% тритона X-100.
Анализы долговременной пролиферации T-клеток
[00146] Клетки опухоли, экспрессирующие желательный антиген, облучали 30 Гр перед совместным культивированием с 1,0×106 T-клеток при соотношении эффектор:мишень 5:1. T-клетки подсчитывали еженедельно с использованием счетчика клеток Invitrogen Countess и затем повторно стимулировали с помощью облученных клеток опухолей. Экзогенных цитокинов не добавляли к этим совместным культурам.
Получение моделей опухолей на мышах
[00147] Клетки опухолей PC3 вводили инфузией мышам NOD/SCID-IL2Ry, полученным либо из Jackson Laboratories, либо собственным разведением по протоколу 04-10-024, одобренному комитетом по содержанию и использованию лабораторных животных MSKCC. Для экспериментов с системными опухолями, 2,0×106 клеток опухоли вводили инфузией мышам с 1,0×106 положительных по химерному рецептору T-клеток, введенных инфузией через 14 суток. Для экспериментов с подкожными опухолями, 1,0×106 клеток опухолей инъецировали на участок опухоли, позволяли прижиться в течение 7 суток, после чего 1,0×106 химерных положительных T-клеток вводили инфузией IV.
Количественное определение опухолевой нагрузки
[00148] Для экспериментов с системными опухолями, получение биолюминесцентных изображений (BLI) использовали для количественного измерения опухолевой нагрузки посредством корреляции количества опухолевой нагрузки с люминесценцией с использованием системы MS 100 (Caliper Life Sciences), как описано ранее. Для подкожных опухолей, штангенциркуль использовали для измерения размера опухоли. Объем опухоли рассчитывали посредством умножения длины, ширины и высоты каждой опухоли.
Опосредованный биспецифическими антителами лизис опухоли
[00149] Биспецифические антитела, содержащие специфические для PSCA scFv, слитые со специфическими для CD3 scFv, добавляли в различных количествах к нетрансдуцированным T-клеткам, совместно культивированным с PSCA+ PC3 в соотношении 20:1, соответственно, в стандартных 4-часовых анализах высвобождения хрома.
Проточная цитометрия
[00150] Клетки анализировали с использованием проточного цитометра LSRII или сортировали с использованием сортировщика клеток FACSAria (BD Biosciences), как описано ранее16. Детекции химерного рецептора на поверхности клеток можно достигать непосредственно с использованием конъюгированного с AF647 антитела козы против антител мыши (Invitrogen). Антитела для CD4-PE-Cy7, CD8-Pacific Blue и CD19-APC получали из Invitrogen, в то время как антитела против PSCA очищали из супернатантов гибридомы, и антитела против PSMA получали из MBL Interantional.
Анализ цитокинов
[00151] Супернатанты собирали через 48 часов после второй стимуляции опухоли из экспериментов долговременной пролиферации T-клеток и использовали для анализа цитокинов с использованием сделанной на заказ мультиплексной системы HCYTMAG-60K (Miilipore), и анализировали с использованием устройства Luminex 100 (Luminex), как описано ранее21.
Анализ Вестерн-блоттингом
[00152] Клетки собирали через 24 часа после первоначальной стимуляции опухоли из экспериментов долговременной пролиферации T-клеток для использования для анализа Вестерн-блоттингом экспрессии BclxL. Вестерн-блоттинг проводили, как описано ранее21, с использованием первичных антител против BclxL и Akt (Ceil Signaling Technology).
[00153] Из приведенного выше описания очевидно, что изменения и модификации можно выполнять для изобретения, описанного в настоящем документе, для его адаптации к различным применениям и условиям. Такие варианты осуществления также входят в объем следующей формулы изобретения.
[00154] Перечисление списка элементов в любом определении переменной в настоящем документе включает в себя определения этой переменной как любого отдельного элемента или комбинации (или субкомбинации) перечисленных элементов. Ссылка на вариант осуществления в настоящем документе включает в себя этот вариант осуществления как любой отдельный вариант осуществления или в комбинации с любыми другими вариантами осуществления или их частями.
[00155] Эта заявка может являться родственной Патентной заявке США No. 12/593751, представляющей собой заявку национальной фазы США, в соответствии с 35 U.S.C. §371, Международной патентной заявке No.: PCT/US 2008/004251, поданной 8 марта 2010 г., по которой испрашивается приоритет Предварительной заявки США серийный No. 60/921144, поданной 30 марта 2007 г., полные содержания которых, таким образом, приведены в настоящем документе в качестве ссылки.
Список литературы
1. Robbins, P.F. et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 29, 917-924 (2011).
2. Kalos, M. et al. T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia. Sci Transl Med3, 95ra73 (2011).
3. Brentjens, R.J. et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood 118, 4817-4828 (2011).
4. Kochenderfer, J.N. et al. B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood 119, 2709-2720 (2012).
5. Sadelain, M., Riviere, I. & Brentjens, R. Targeting tumours with genetically enhanced T lymphocytes. Nat Rev Cancer 3, 35-45 (2003).
6. Ho, W.Y., Biattman, J.N., Dossett, M.L., Yee, C. & Greenberg, P.D. Adoptive immunotherapy: engineering T cell responses as biologic weapons for tumor mass destruction. Cancer cell 3, 431-437 (2003).
7. Rosenberg, S.A., Restifo, N.P., Yang, J.C., Morgan, R.A. & Dudley, M.E. Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nature reviews. Cancer 8, 299-308 (2008).
8. Sadelain, M., Brentjens, R. & Riviere, I. The promise and potential pitfalls of chimeric antigen receptors. Curr Opin Immunol 21, 215-223 (2009).
9. Jorritsma, A., Schotte, R., Coccoris, M., de Witte, M.A. & Schumacher, T.N. Prospects and limitations of T cell receptor gene therapy. Current gene therapy 11, 276-287 (2011).
10. Johnson, L.A. et al. Gene therapy with human and mouse T, cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. Blood 114, 535-546 (2009).
11. Morgan, R.A. et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Molecular therapy: the journal of the American Society of Gene Therapy 18, 843-851 (2010).
12. Krause, A. et al. Antigen-dependent CD28 signaling selectively enhances survival and proliferation in genetically modified activated human primary T lymphocytes. J Exp Med 188,619-626(1998).
13. Wilkie, S. et al. Dual Targeting of ErbB2 and MUC1 in Breast Cancer Using Chimeric Antigen Receptors Engineered to Provide Complementary Signaling. Journal of clinical immunology (2012).
14. Brentjens, R.J. et al. Eradication of systemic B-ceil tumors by genetically targeted human T lymphocytes co-stimulated by CD80 and interleukin-15. Nature medicine 9, 279-286 (2003).
15. Maher, J., Brentjens, R.J., Gunset, G., Riviere, I. & Sadelain, M. Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta /CD28 receptor. Nat Bio technol. 20, 70-75 (2002).
16. Stephan, M T. et al. T cell-encoded CD80 and 4-1 BBL induce auto-and transcostimulation, resulting in potent tumor rejection. Nature medicine 13, 1440-1449 (2007).
17. Watts, Т.Н. TNF/TNFR family members in costimulation of T cell responses. Annual review of immunology 23, 23-68 (2005).
18. Wang, J. et al. Optimizing adoptive polyclonal T cell immunotherapy of lymphomas, using a chimeric T cell receptor possessing CD28 and CD 137 costimuiatory domains. Human gene therapy 18, 712-725 (2007).
19. Carpenito, С. et al. Control of large, established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains. Proceedings of the National Academy of Sciences of the United States of America 106, 3360-3365 (2009).
20. Tammana, S. et al. 4-1BB and CD28 signaling plays a synergistic role in redirecting umbilical cord blood T cells against B-cell malignancies. Hum Gene Ther 2 1,75-86 (2010).
21. Zhong, X.S., Matsushita, M., Piotkin, J., Riviere, I. & Sadelain, M. Chimeric antigen receptors combining 4-1BB and CD28 signaling domains augment PI3kinase/AKT/Bc1-XL activation and СD8+ T cell-mediated tumor eradication. Molecular therapy: the journal of the American Society of Gene Therapy 18, 413-420 (2010).
22. Schwartz, R.H. T cell a n e rgy. Annual review of immunology 21, 305-334 (2003).
23. Liao, W., Lin, J.X. & Leonard, W.J. IL-2 family cytokines: new insights into the complex roles of IL-2 as a broad regulator of T helper ceil differentiation. Current opinion in immunology 23, 598-604 (2011).
24. Nam, K.O., Shin, S.M. & Lee, H.W. Cross-linking of 4-IBB up-regulates IL-13 expression in CD8(+) T lymphocytes. Cytokine 33, 87-94 (2006).
25. Shin, S M. et al. 4- IBB triggers IL-13 production from T cells to limit the polarized, ThI-mediated inflammation. Journal of leukocyte biology 81, 1455-1465 (2007).
26. Saeki, N.. Gu, J., Yoshida, T. & Wu, X. Prostate stem cell antigen: a Jekyil and Hyde molecule? Clinical cancer research: an official journal of the American Association for Cancer Research 16, 3533-3538 (2010).
27. Olson, W.C., Heston, W.D. & Rajasekaran, A.K. Clinical trials of cancer therapies targeting prostate-specific membrane antigen. Reviews on recent clinical trials 2, 182-190 30 (2007).
28. Lam, J.S. et al. Prostate stem cell antigen is overexpressed in prostate cancer metastases. Clinicai cancer research: an official journal of the American Association for Cancer Research 11, 2591-2596 (2005).
29. Silver, D.A., Pellicer, I., Fair, W.R., Heston, W.D. & Cordon-Cardo, C. Prostate-specific membrane antigen expression in normal and malignant human tissues. Ciinicai cancer research: an official journal of the American Association for Cancer Research 3, 81-85 (1997).
30. Liu, J.C. et al. Seventeen-gene signature from enriched Her2/Neu mammary tumor-initiating cells predicts clinical outcome for human HER2+:ERalpha-breast cancer. Proceedings of the National Academy of Sciences of the United States of America 109, 58325837 (2012).
31. Meyer, M.J. et al. CD44posCD49fhiCD133/2hi defines xenograft-initiating cells in estrogen receptor-negative breast cancer. Cancer research 70, 4624-4633 (2010).
32. Strauss, R. et al. Analysis of epithelial and mesenchymal markers in ovarian cancer reveals phenotypic heterogeneity and plasticity. PioS one 6, el 6186 (2011).
33. Shihle, M. & Davidson, B. Pathogenesis of ovarian cancer: clues from selected overexpressed genes. Future Oncol 5, 1641-1657 (2009).
34. Nguyen, L.V., Vanner, R., Dirks, P. & Eaves, C.J. Cancer stem cells: an evolving concept. Nature reviews. Cancer 12, 133-143 (2012).
35. Маgее, J.A., Piskounova, E. & Morrison, S.J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer cell 21, 283-296 (2012). 36. Orlandi, R., Gussow, D.H., Jones, P.T. & Winter, G. Cloning immunoglobulin variable domains for expression by the polymerase chain reaction. Proceedings of the National Academy of Sciences of the United States of America 86, 3833-3837 (1989).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Memorial Sloan-Kettering Cancer Center
Sadelain, Michel
Kloss, Christopher C
<120> КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНОТЕРАПИИ
<130> 3314.040AWO
<150> US61/709,072
<151> 2012-10-02
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 164
<212> PRT
<213> Homo sapiens
<400> 1
Met Lys Trp Lys Ala Leu Phe Thr Ala Ala Ile Leu Gln Ala Gln Leu
1 5 10 15
Pro Ile Thr Glu Ala Gln Ser Phe Gly Leu Leu Asp Pro Lys Leu Cys
20 25 30
Tyr Leu Leu Asp Gly Ile Leu Phe Ile Tyr Gly Val Ile Leu Thr Ala
35 40 45
Leu Phe Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
50 55 60
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
65 70 75 80
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
85 90 95
Gly Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
100 105 110
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
115 120 125
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
130 135 140
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
145 150 155 160
Leu Pro Pro Arg
<210> 2
<211> 235
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Phe Arg Val Ser Pro Leu Asp Arg Thr
20 25 30
Trp Asn Leu Gly Glu Thr Val Glu Leu Lys Cys Gln Val Leu Leu Ser
35 40 45
Asn Pro Thr Ser Gly Cys Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala
50 55 60
Ala Ser Pro Thr Phe Leu Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala
65 70 75 80
Ala Glu Gly Leu Asp Thr Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp
85 90 95
Thr Phe Val Leu Thr Leu Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr
100 105 110
Tyr Phe Cys Ser Ala Leu Ser Asn Ser Ile Met Tyr Phe Ser His Phe
115 120 125
Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr Pro Ala Pro Arg
130 135 140
Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg
145 150 155 160
Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly
165 170 175
Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
180 185 190
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Asn His
195 200 205
Arg Asn Arg Arg Arg Val Cys Lys Cys Pro Arg Pro Val Val Lys Ser
210 215 220
Gly Asp Lys Pro Ser Leu Ser Ala Arg Tyr Val
225 230 235
<210> 3
<211> 220
<212> PRT
<213> Homo sapiens
<400> 3
Met Leu Arg Leu Leu Leu Ala Leu Asn Leu Phe Pro Ser Ile Gln Val
1 5 10 15
Thr Gly Asn Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr
20 25 30
Asp Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser
35 40 45
Arg Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu
50 55 60
Val Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser
65 70 75 80
Lys Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr
85 90 95
Phe Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys
100 105 110
Lys Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser
115 120 125
Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro
130 135 140
Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly
145 150 155 160
Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile
165 170 175
Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met
180 185 190
Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro
195 200 205
Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
210 215 220
<210> 4
<211> 255
<212> PRT
<213> Homo sapiens
<400> 4
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Ser Phe Phe Leu
180 185 190
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
195 200 205
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250 255
<210> 5
<211> 288
<212> PRT
<213> Homo sapiens
<400> 5
Met Gly His Thr Arg Arg Gln Gly Thr Ser Pro Ser Lys Cys Pro Tyr
1 5 10 15
Leu Asn Phe Phe Gln Leu Leu Val Leu Ala Gly Leu Ser His Phe Cys
20 25 30
Ser Gly Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu
35 40 45
Ser Cys Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile
50 55 60
Tyr Trp Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp
65 70 75 80
Met Asn Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr
85 90 95
Asn Asn Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly
100 105 110
Thr Tyr Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg
115 120 125
Glu His Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr
130 135 140
Pro Ser Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile
145 150 155 160
Ile Cys Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu
165 170 175
Glu Asn Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp
180 185 190
Pro Glu Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met
195 200 205
Thr Thr Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg
210 215 220
Val Asn Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro
225 230 235 240
Asp Asn Leu Leu Pro Ser Trp Ala Ile Thr Leu Ile Ser Val Asn Gly
245 250 255
Ile Phe Val Ile Cys Cys Leu Thr Tyr Cys Phe Ala Pro Arg Cys Arg
260 265 270
Glu Arg Arg Arg Asn Glu Arg Leu Arg Arg Glu Ser Val Arg Pro Val
275 280 285
<210> 6
<211> 182
<212> PRT
<213> Homo sapiens
<400> 6
Met Glu Arg Val Gln Pro Leu Glu Glu Asn Val Gly Asn Ala Ala Arg
1 5 10 15
Pro Arg Phe Glu Arg Asn Lys Leu Leu Leu Val Ala Ser Val Ile Gly
20 25 30
Gly Leu Gly Leu Leu Leu Cys Phe Thr Tyr Ile Cys Leu His Phe Ser
35 40 45
Ala Leu Gln Val Ser His Arg Tyr Pro Arg Ile Gln Ser Ile Lys Val
50 55 60
Gln Phe Thr Glu Tyr Lys Lys Glu Lys Gly Phe Ile Leu Thr Ser Gln
65 70 75 80
Lys Glu Asp Glu Ile Met Lys Val Gln Asn Asn Ser Val Ile Ile Asn
85 90 95
Cys Asp Gly Phe Tyr Leu Ile Ser Leu Lys Gly Tyr Phe Ser Gln Glu
100 105 110
Val Asn Ile Ser Leu His Tyr Gln Asp Glu Glu Pro Leu Phe Gln Leu
115 120 125
Lys Lys Val Arg Ser Val Asn Ser Leu Met Val Ala Ser Leu Thr Tyr
130 135 140
Lys Asp Lys Val Tyr Leu Asn Tyr Thr Thr Asp Asn Thr Ser Leu Asp
145 150 155 160
Asp Phe His Val Asn Gly Gly Glu Leu Ile Leu Ile His Gln Asn Pro
165 170 175
Gly Glu Phe Cys Val Leu
180
<210> 7
<211> 451
<212> PRT
<213> Homo sapiens
<400> 7
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro
20 25 30
Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser
35 40 45
Ser Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu
50 55 60
Trp Ile Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly
65 70 75 80
Lys Phe Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Glu Cys Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr
145 150 155 160
Gln Ser Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val
165 170 175
Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr
195 200 205
Arg Asn Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp
225 230 235 240
Tyr Phe Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly
245 250 255
Thr Lys Leu Glu Ile Lys Arg Ala Ala Ala Pro Thr Thr Thr Pro Ala
260 265 270
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
275 280 285
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
290 295 300
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
305 310 315 320
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
325 330 335
Asn Phe Ile Arg Val Lys Glu Ser Arg Ser Ala Glu Pro Pro Ala Tyr
340 345 350
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
355 360 365
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
370 375 380
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
385 390 395 400
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
405 410 415
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
420 425 430
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
435 440 445
Pro Pro Arg
450
<210> 8
<211> 478
<212> PRT
<213> Homo sapiens
<400> 8
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu
260 265 270
Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro
275 280 285
Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val
290 295 300
Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Glu
305 310 315 320
Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp
325 330 335
Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr
340 345 350
Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Val
355 360 365
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
370 375 380
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
385 390 395 400
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
405 410 415
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
420 425 430
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
435 440 445
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
450 455 460
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
465 470 475
<210> 9
<211> 245
<212> PRT
<213> Homo sapiens
<400> 9
Glu Val Lys Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Glu Ser Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Gln Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Lys Thr Ile Ser Ser Val Val Asp Phe Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser
130 135 140
Pro Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Ser Val Thr Cys
145 150 155 160
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Ser Pro Lys Pro Leu Ile Tyr Ser Ala Thr Tyr Arg Asn
180 185 190
Ser Gly Val Pro Asp Arg Glu Thr Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Leu Thr Ile Thr Asn Val Gln Ser Lys Asp Leu Ala Asp Tyr Phe
210 215 220
Cys Gln Gln Tyr Asn Arg Tyr Pro Tyr Thr Ser Gly Gly Gly Thr Lys
225 230 235 240
Leu Glu Ile Lys Arg
245
<210> 10
<211> 257
<212> PRT
<213> Homo sapiens
<400> 10
Met Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu
1 5 10 15
Leu His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe
35 40 45
Thr Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn
65 70 75 80
Gln Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr
115 120 125
Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met
145 150 155 160
Ser Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln
165 170 175
Asp Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser
180 185 190
Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro
195 200 205
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
210 215 220
Thr Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr
225 230 235 240
Asn Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys
245 250 255
Arg
<210> 11
<211> 412
<212> PRT
<213> Homo sapiens
<400> 11
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro
20 25 30
Gly Thr Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr
35 40 45
Glu Tyr Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu
50 55 60
Trp Ile Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln
65 70 75 80
Lys Phe Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr
85 90 95
Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr
100 105 110
Tyr Cys Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr
115 120 125
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser
145 150 155 160
Thr Ser Val Gly Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp
165 170 175
Val Gly Thr Ala Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
180 185 190
Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp
195 200 205
Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr
210 215 220
Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn
225 230 235 240
Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys Arg
245 250 255
Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu
260 265 270
Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro
275 280 285
Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val
290 295 300
Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe
305 310 315 320
Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp
325 330 335
Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr
340 345 350
Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Phe
355 360 365
Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
370 375 380
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
385 390 395 400
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
405 410
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНОТЕРАПИИ | 2013 |
|
RU2832516C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИММУНОТЕРАПИИ | 2014 |
|
RU2729118C2 |
| ХИМЕРНЫЙ ЦИТОКИНОВЫЙ РЕЦЕПТОР | 2016 |
|
RU2826122C1 |
| КЛЕТКА | 2014 |
|
RU2717984C2 |
| NK-клеточная линия, экспрессирующая PSMA-специфический химерный антигенный рецептор и секретирующая блокатор взаимодействия CD47/SIRPa | 2020 |
|
RU2757353C1 |
| КЛЕТКА | 2014 |
|
RU2732236C2 |
| ИММУННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ОБРАТНЫЙ УНИВЕРСАЛЬНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР, ДЛЯ НАЦЕЛИВАНИЯ НА РАЗЛИЧНЫЕ МНОГОЧИСЛЕННЫЕ АНТИГЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ИНФЕКЦИЙ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2824391C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2018 |
|
RU2770002C2 |
| СОЧЕТАНИЕ КЛЕТОЧНОЙ ТЕРАПИИ И ИММУНОМОДУЛЯТОРНОГО СОЕДИНЕНИЯ | 2018 |
|
RU2777911C2 |
| Выделенный альтернативный внутриклеточный сигнальный домен химерного антигенного рецептора и включающий его химерный антигенный рецептор | 2019 |
|
RU2742000C2 |
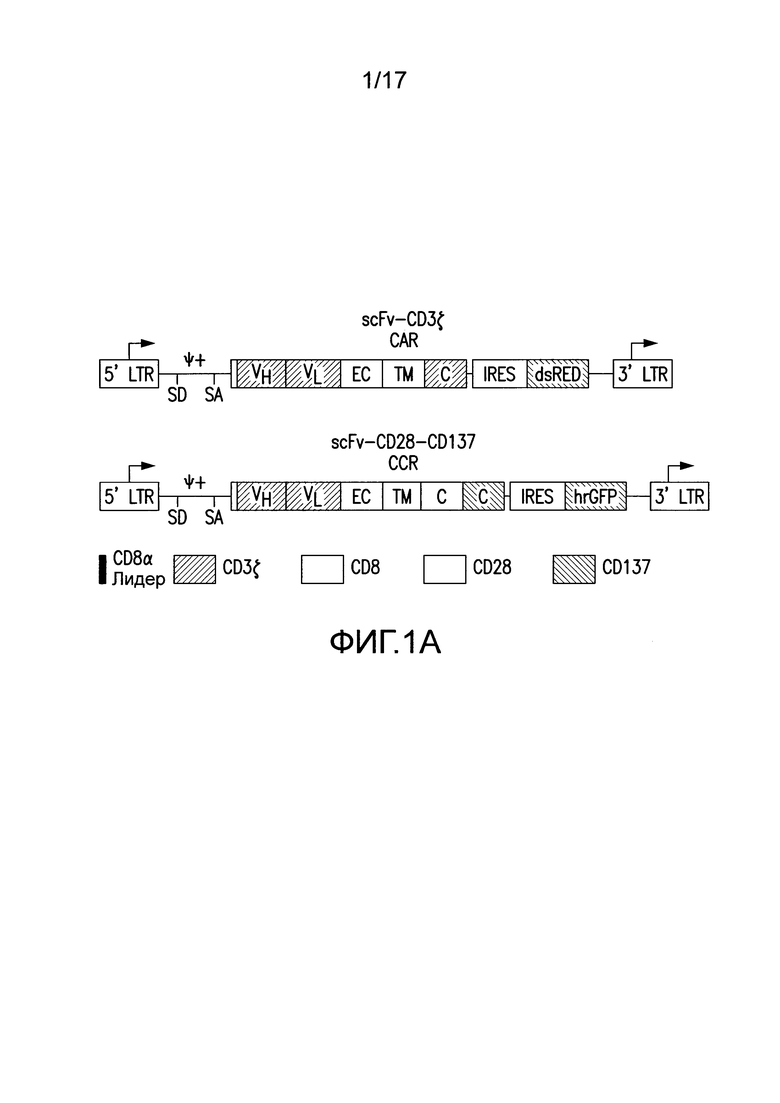
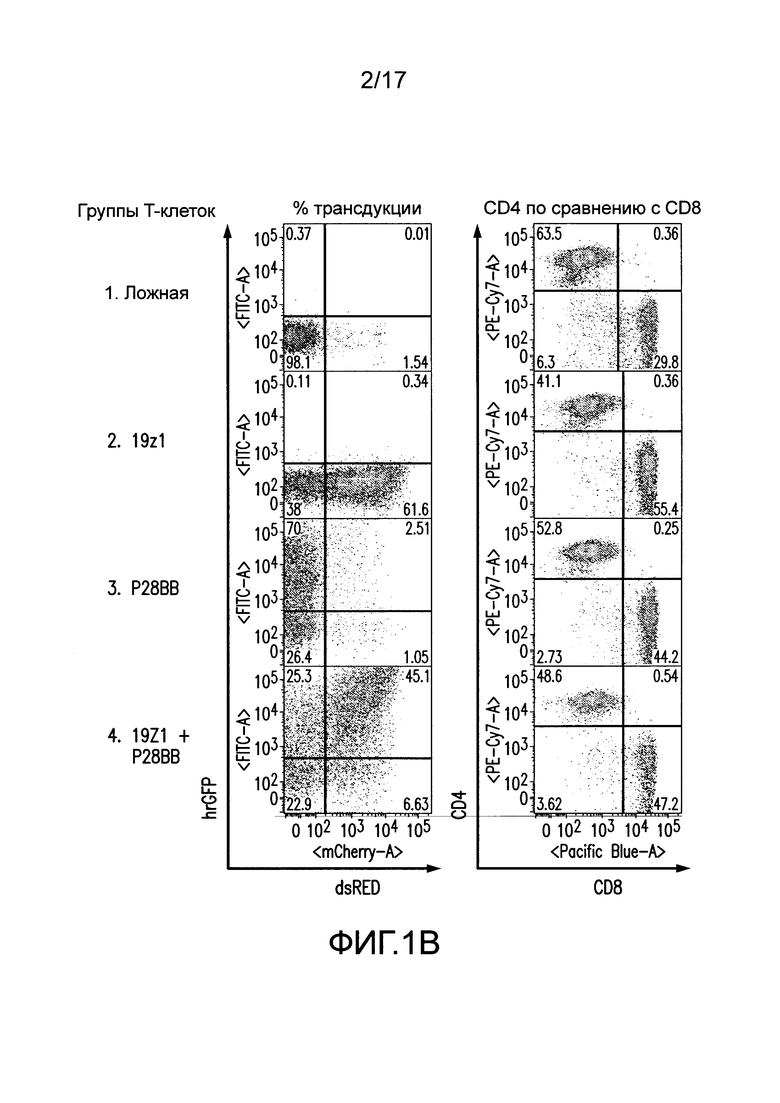

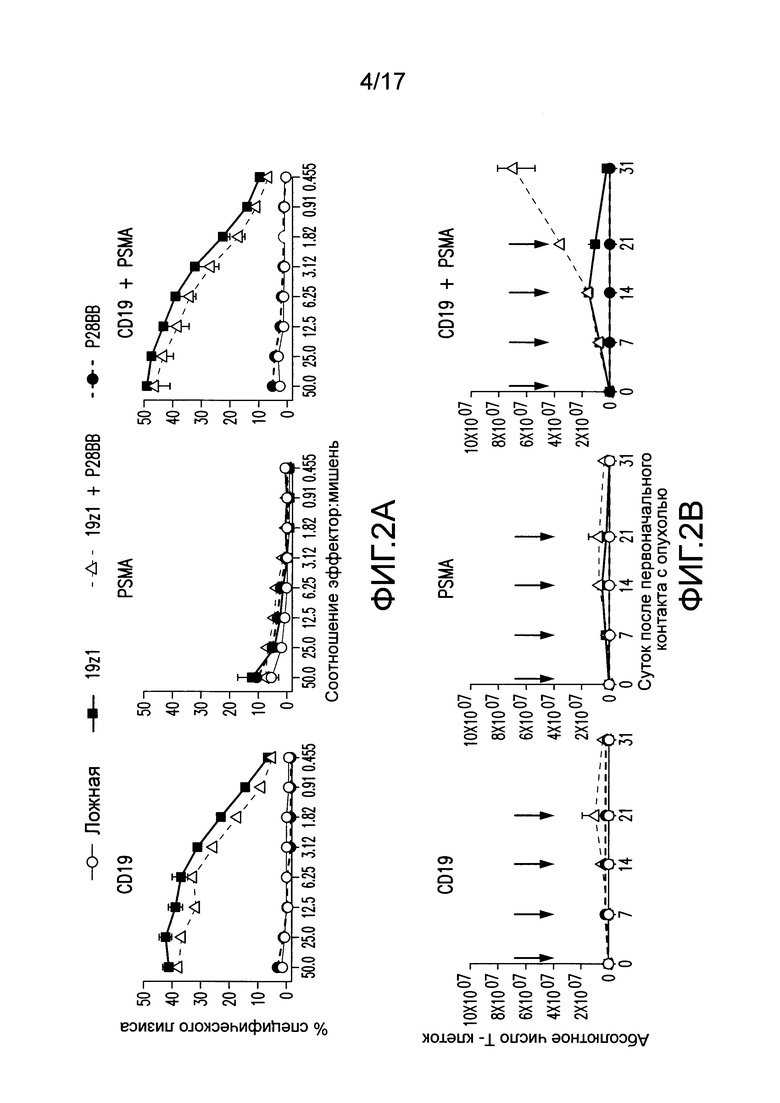
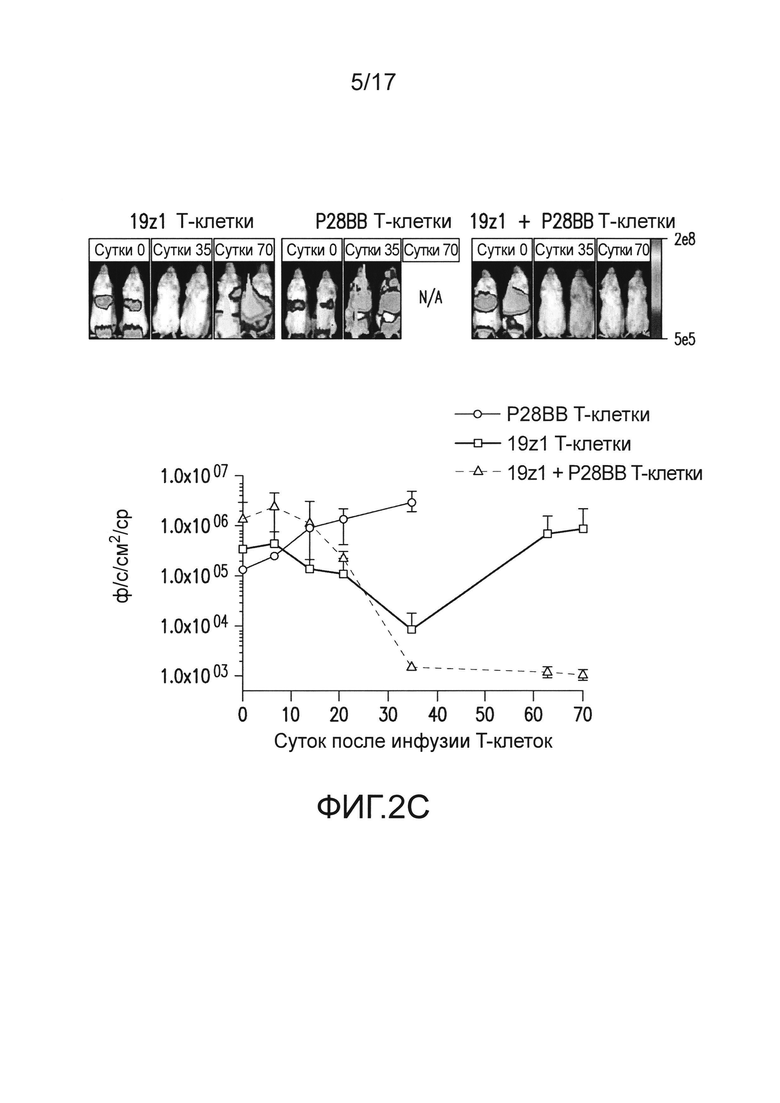
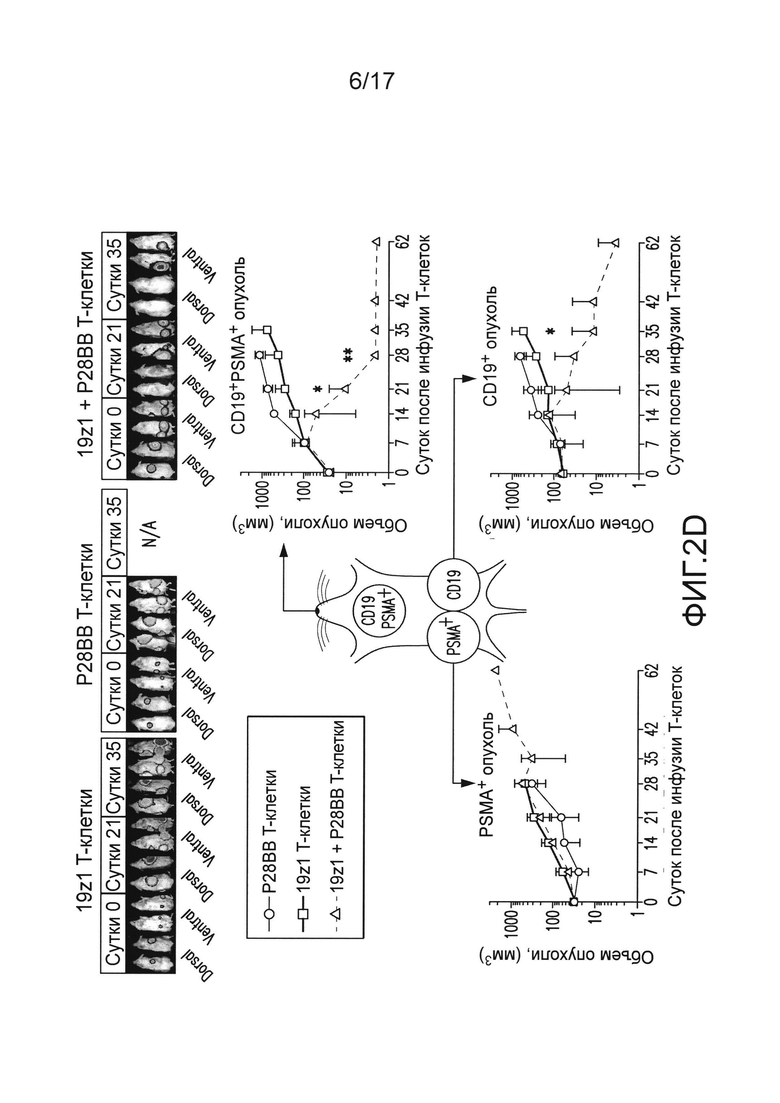
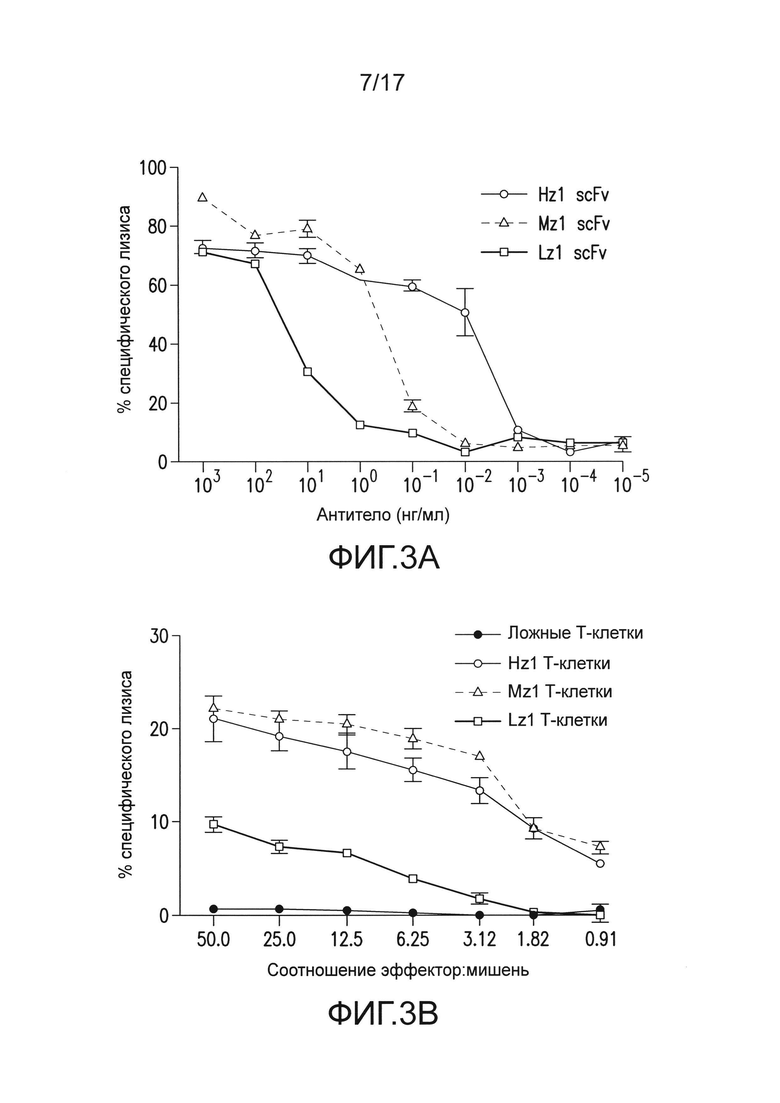
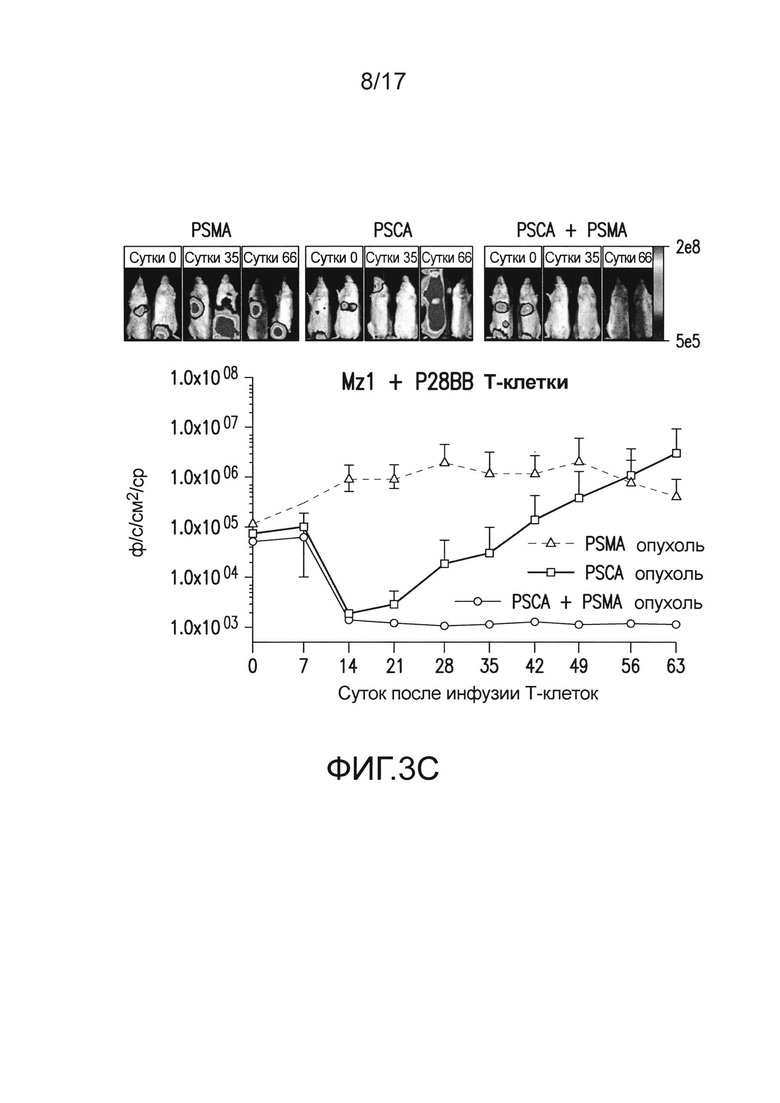
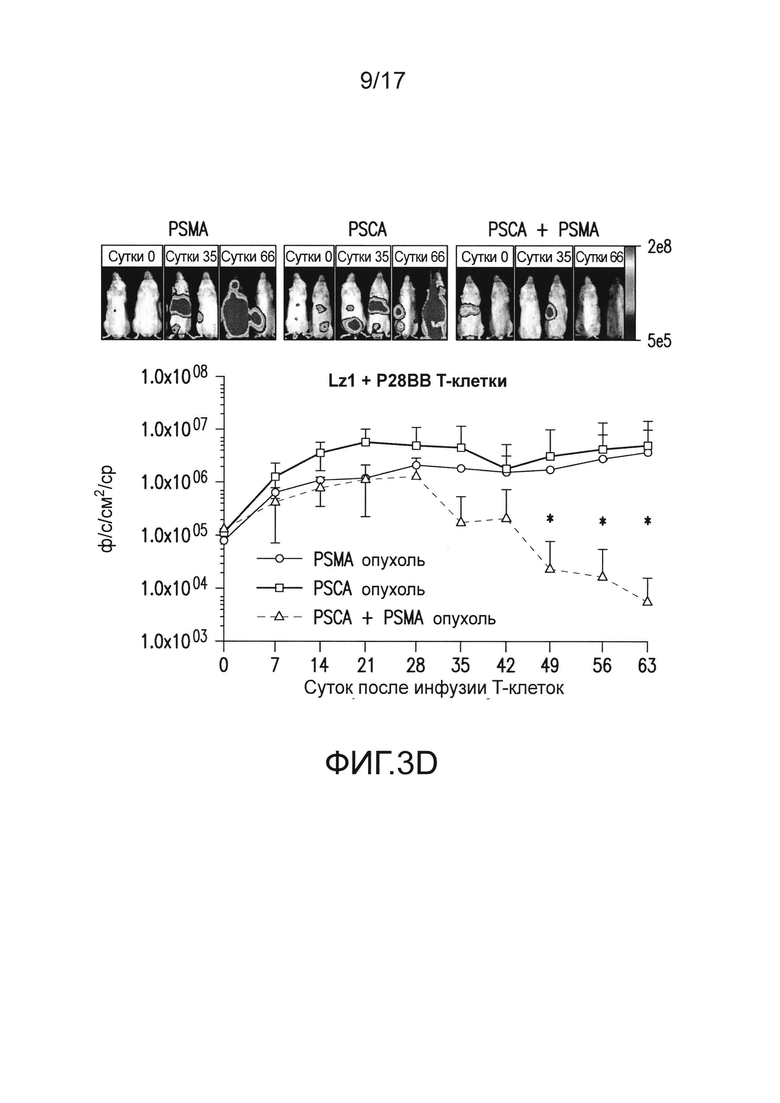
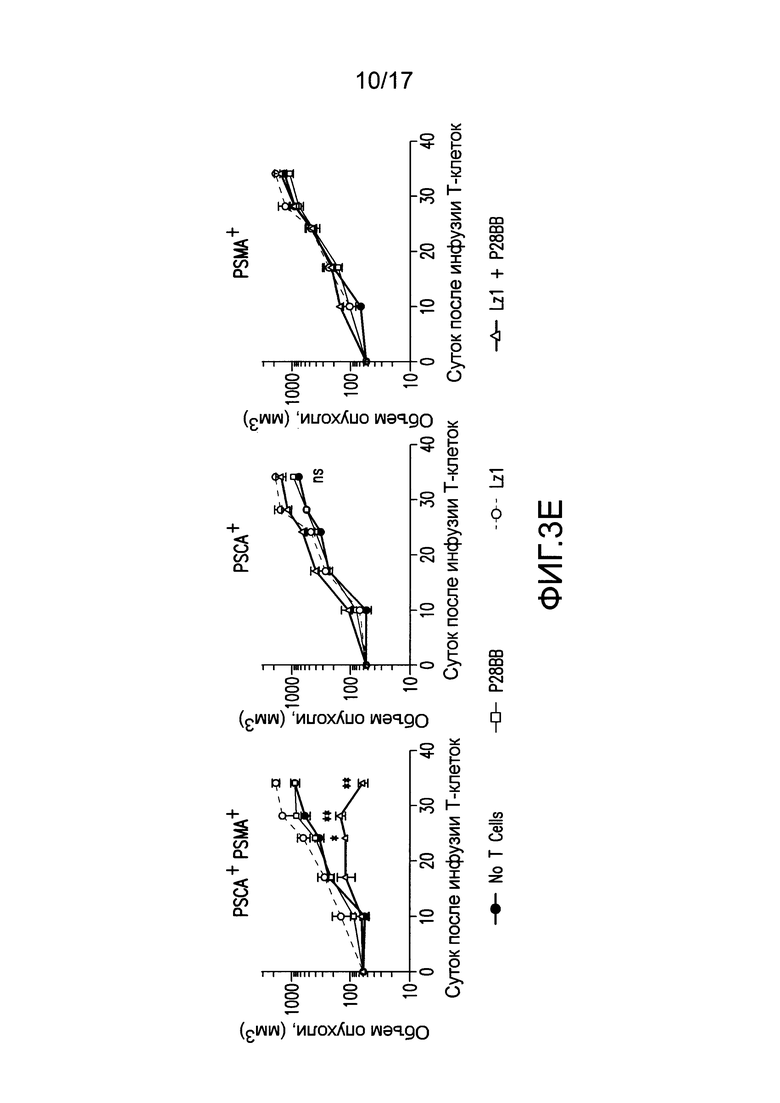
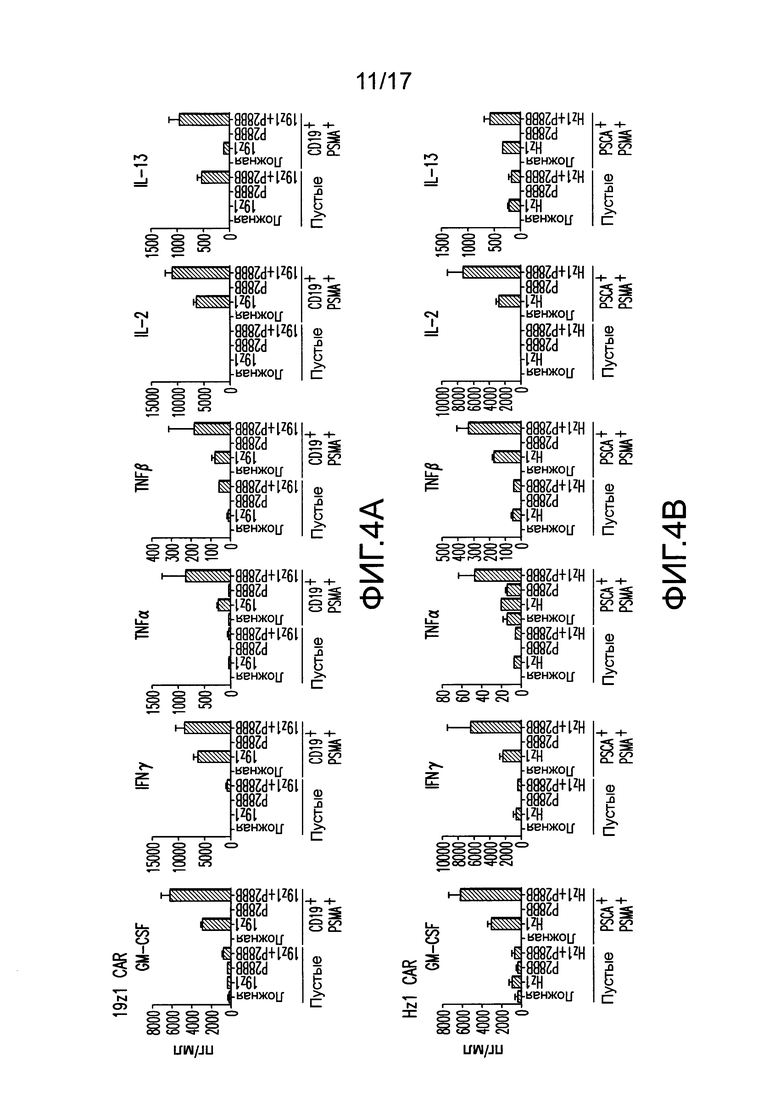
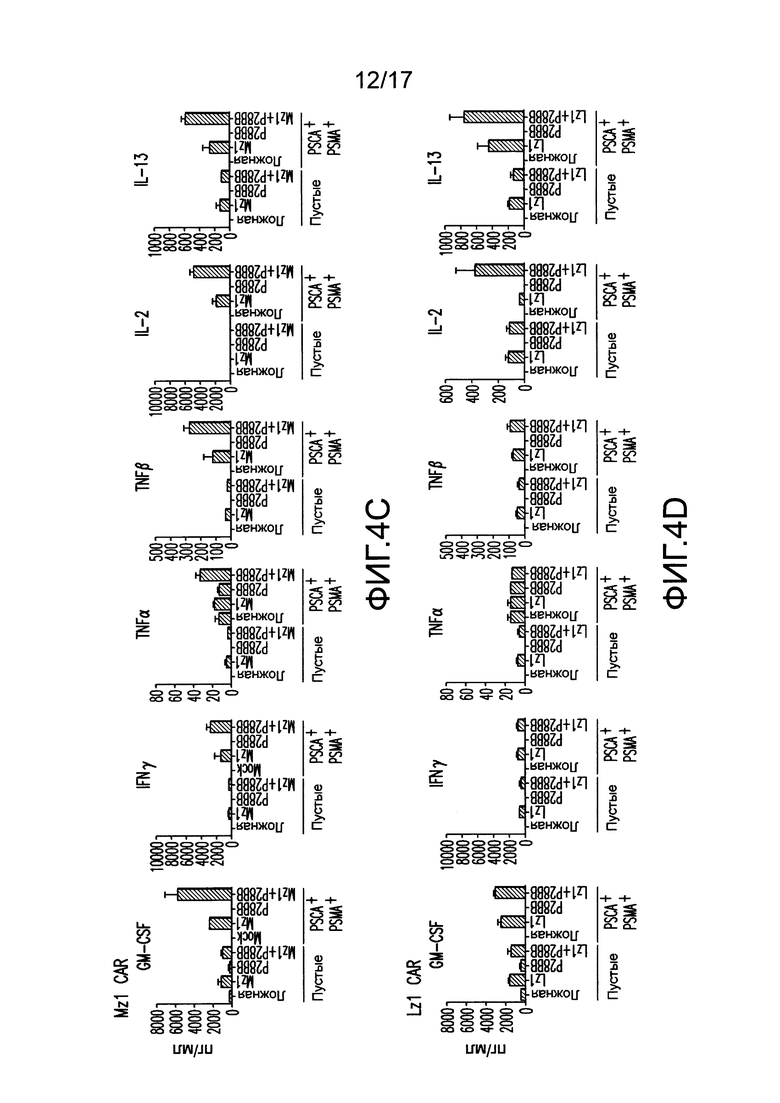
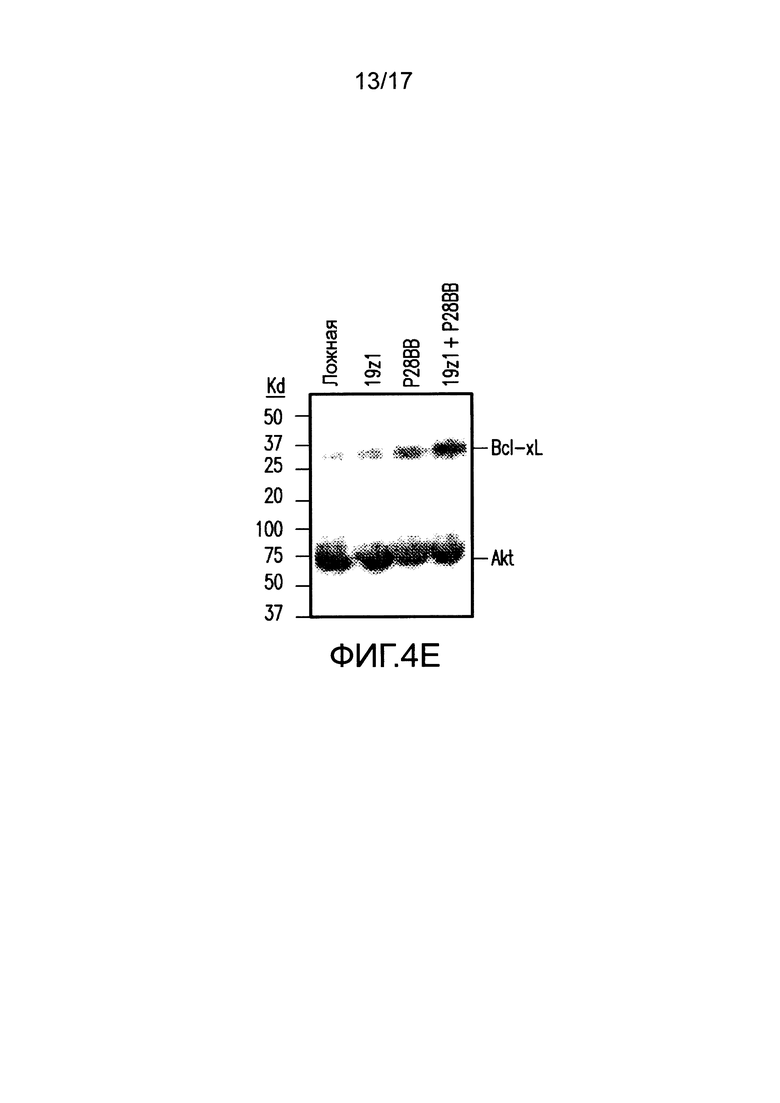
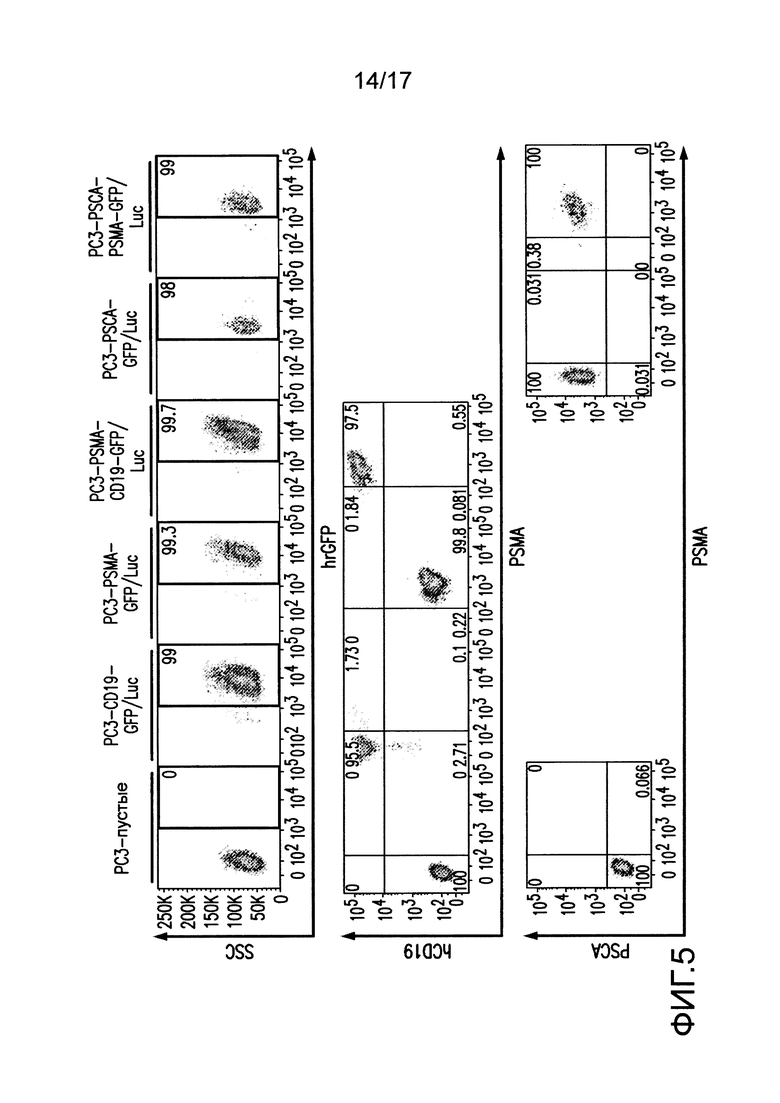
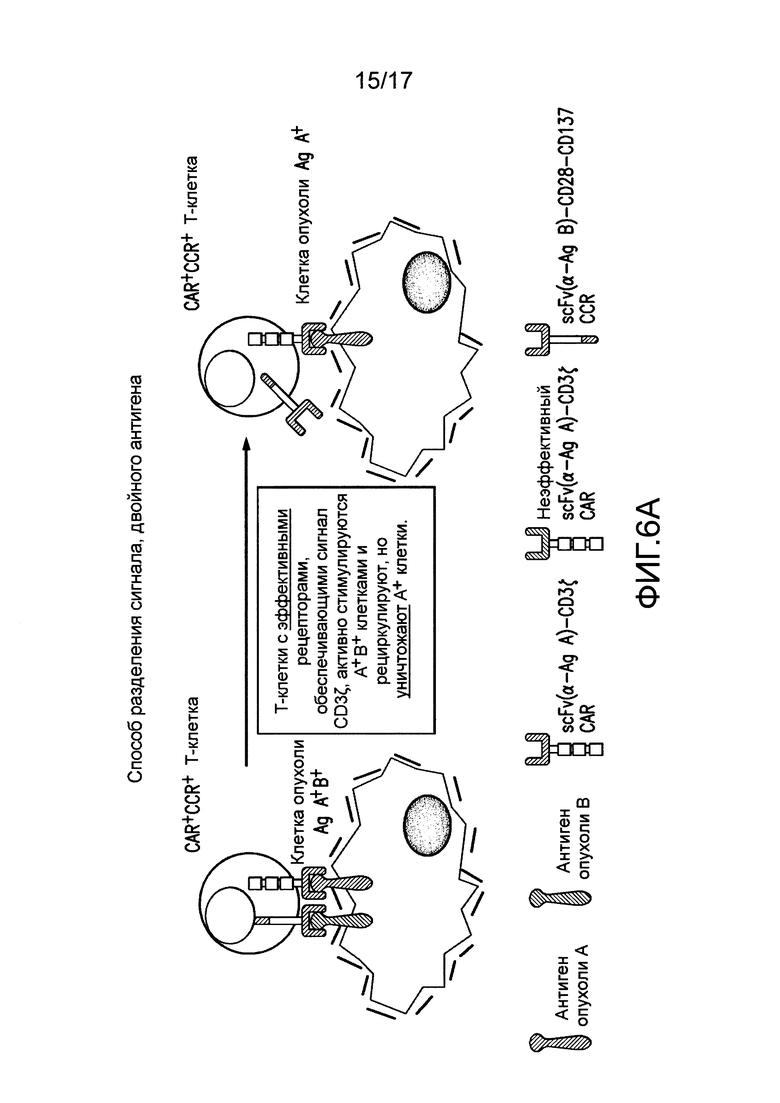
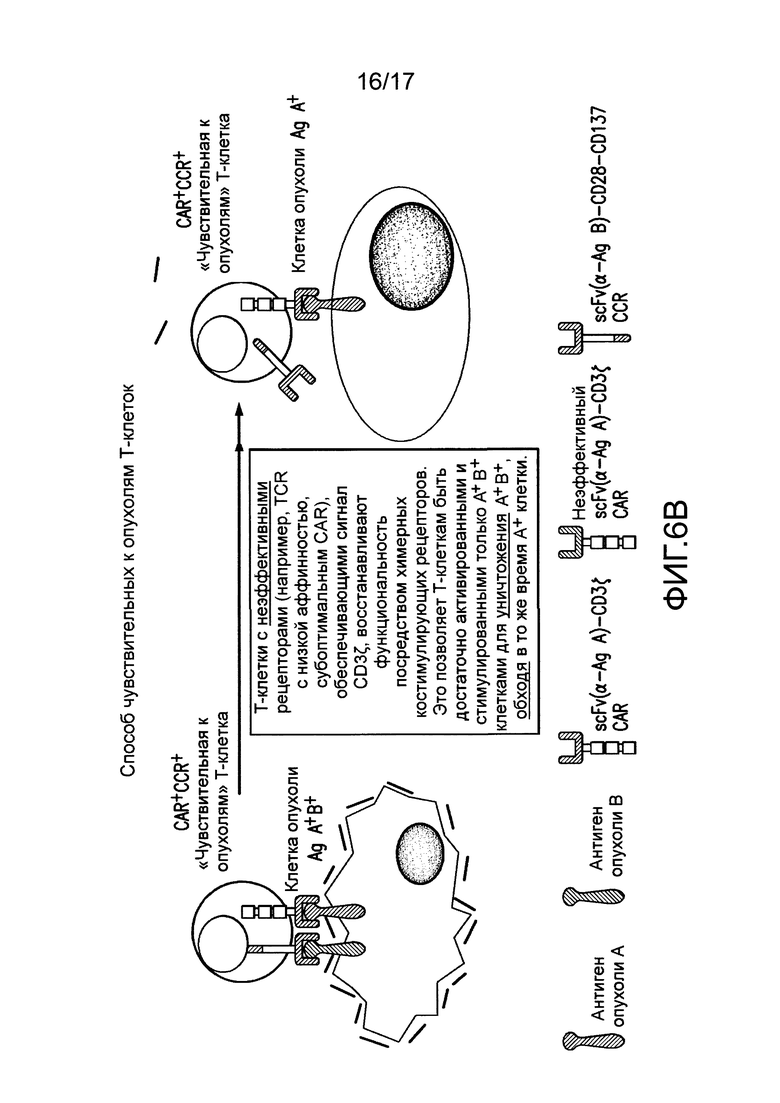
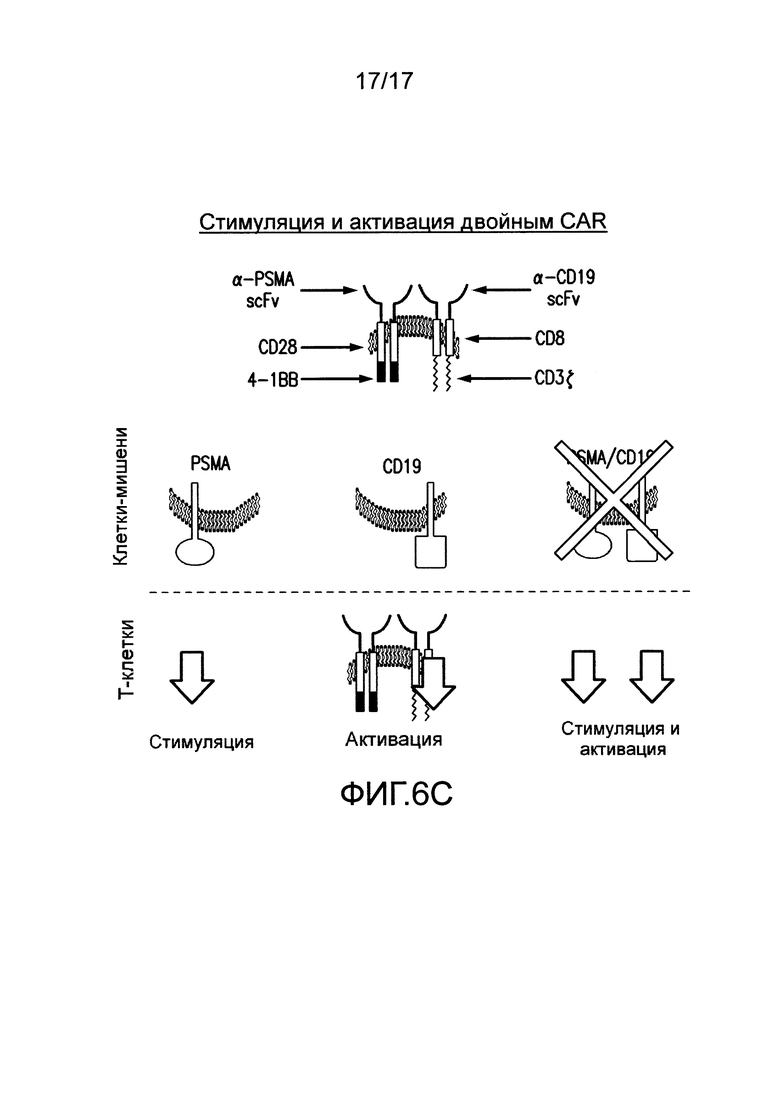
Настоящее изобретение относится к иммунологии. Предложена Т-клетка, содержащая химерный рецептор антигена (CAR) и химерный костимулирующий рецептор (CCR), а также способ получения такой клетки. Описаны способы индукции гибели клеток опухоли, лечения и предотвращения неоплазмы, фармацевтическая композиция и набор для иммунотерапии. Связывание CCR с антигеном обеспечивает доставку костимулирующего сигнала к Т-клетке, что обеспечивает более высокую степень цитолитической активности. 7 н. и 44 з.п. ф-лы, 6 ил., 1 табл., 1 пр.
1. Т-клетка, содержащая:
a. химерный рецептор антигена (CAR), который связывается с первым антигеном c Kd от около 1×10-8 M до около 1×10-5 М, где связывание CAR с первым антигеном обеспечивает доставку сигнала активации к Т-клетке, и
b. химерный костимулирующий рецептор (CCR), содержащий (i) антигенсвязывающий домен, который связывается со вторым антигеном, и (ii) внутриклеточный сигнальный домен, где связывание CCR со вторым антигеном обеспечивает доставку костимулирующего сигнала к Т-клетке, но само по себе не обеспечивает доставку сигнала активации к Т-клетке,
где Т-клетка демонстрирует более высокую степень цитолитической активности по отношению к клеткам, которые положительны как по первому антигену, так и второму антигену, по сравнению с активностью в отношении клеток, которые положительны по одному первому антигену, и
где Т-клетка демонстрирует по существу отсутствующую или незначительную долговременную или постоянную цитолитическую активность в отношении клеток, которые положительны по одному первому антигену.
2. T-клетка по п. 1, где CAR связывается с первым антигеном с Kd около 5×10-8 M или более.
3. T-клетка по п. 1, где CAR связывается с первым антигеном с Kd около 1×10-7 M или более.
4. T-клетка по п. 1, где CAR связывается с первым антигеном с Kd около 1×10-6 M или более.
5. Т-клетка по п. 1, где CAR связывается с первым антигеном с аффинностью связывания, которая более низкая по сравнению с аффиностью связывания, с которой CCR связывается со вторым антигеном.
6. Т-клетка по любому из пп. 1-5, где антиген представляет собой антиген опухоли или патогена.
7. Т-клетка по любому из пп. 1-5, где указанный CAR экспрессирован рекомбинантным способом.
8. Т-клетка по любому из пп. 1-5, где CAR экспрессирован с вектора.
9. Т-клетка по любому из пп. 1-5, где CCR экспрессирован с вектора.
10. Т-клетка по любому из пп. 1-5, где указанная Т-клетка является аутологичной.
11. Т-клетка по любому из пп. 1-5, где указанный первый и второй антигены выбраны из группы, состоящей из CAIX, CEA, CD5, CD7, CD10, CD19, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, Erb-B2, Erb-B3, Erb-B4, FBP, фетального рецептора ацетилхолина, рецептора-a фолата, GD2, GD3, HER-2, hTERT, IL-13R-a2, x-легкой цепи, KDR, LeY, молекулы адгезии клеток LI, MAGE-AI, MUC1, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2 и WT-1.
12. Т-клетка по любому из пп. 1-5, где указанные первый и второй антигены представляют собой различные антигены, выбранные из группы, состоящей из CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, Erb-B2 KDR, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, CD19, VEGF-R2 и WT-1.
13. Т-клетка по любому из пп. 1-5, где указанные первый и второй антигены выбраны из группы, состоящей из HER2, MUC1, CD44, CD49f, EpCAM, CEA, CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, Erb-B2, Erb-B3, Erb-B4, FBP, KDR, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, VEGF-R2 и WT-1.
14. Т-клетка по п. 11, где указанные первый и второй антигены представляют собой CD10 и CD19.
15. Т-клетка по п. 11, где указанные первый и второй антигены представляют собой CD56 и CD138.
16. Т-клетка по п. 11, где указанные первый и второй антигены представляют собой PSCA и PSMA.
17. Т-клетка по п. 11, где указанные первый и второй антигены представляют собой различные антигены, выбранные из группы, состоящей из мезотелина, рецептора-a фолата, CD44 и CD133.
18. Т-клетка по любому из пп. 1-5, где CAR содержит внутриклеточный сигнальный домен, который содержит сигнальный домен CD3ζ-цепи.
19. Т-клетка по любому из пп. 1-5, где внутриклеточный сигнальный домен CCR представляет собой сигнальный домен CD97, сигнальный домен CD11a-CD18, сигнальный домен CD2, сигнальный домен ICOS, сигнальный домен CD27, сигнальный домен CD154, сигнальный домен CD5, сигнальный домен OX40, сигнальный домен 4-1BB или сигнальный домен CD28.
20. Способ индукции гибели клеток опухоли в опухоли, где способ включает контакт указанной клетки опухоли с эффективным количеством Т-клеток по любому из пп. 1-5.
21. Способ по п. 20, где способ уменьшает количество клеток опухоли.
22. Способ по п. 20, где способ уменьшает размер опухоли.
23. Способ по п. 20, где способ уничтожает опухоль.
24. Способ лечения или предотвращения неоплазмы у субъекта, где способ включает введение эффективного количества Т-клеток по любому из пп. 1-5.
25. Способ по п. 24, где неоплазма выбрана из группы, состоящей из рака предстательной железы, рака молочной железы, В-клеточного лейкоза, множественной миеломы и рака яичника.
26. Способ по п. 25, где неоплазма представляет собой рак предстательной железы.
27. Способ по п. 26, где первым антигеном является PSCA, и вторым антигеном является PSMA.
28. Способ по любому из пп. 24-27, где неоплазма представляет собой рак молочной железы, и первый и второй антигены опухоли представляют собой различные антигены, выбранные из группы, состоящей из HER2, MUC1, CD44, CD49f, CEA, CD133, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, Erb-B2, Erb-B3, Erb-B4 FBP, KDR, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, VEGF-R2 и WT-1.
29. Способ по любому из пп. 24-27, где неоплазма представляет собой В-клеточный лейкоз, и первый и второй антигены опухоли представляют собой CD10 и CD19.
30. Способ по любому из пп. 24-27, где неоплазма представляет собой множественную миелому, и первый и второй антигены опухоли представляют собой CD56 и CD138.
31. Способ по любому из пп. 24-27, где неоплазма представляет собой рак яичника, и первый и второй антигены опухоли представляют собой различные антигены, выбранные из группы, состоящей из мезотелина, рецептора-a фолата, CD44 и CD133.
32. Способ по любому из пп. 24-27, где узнающий антиген рецептор экспрессирован с вектора.
33. Способ по любому из пп. 24-27, где CCR экспрессирован с вектора.
34. Способ по любому из пп. 24-27, где указанная клетка выбрана из группы, состоящей из цитотоксического T-лимфоцита (CTL), регуляторной T-клетки и их комбинации.
35. Способ по любому из пп. 24-27, где способ снижает или уничтожает опухолевую нагрузку у субъекта.
36. Способ индукции гибели клетки опухоли, где способ включает в себя введение эффективного количества Т-клеток по любому из пп. 1-5.
37. Способ получения антигенспецифической Т-клетки, где способ включает в себя введение в Т-клетку:
а) первой последовательности нуклеиновой кислоты, которая кодирует химерный рецептор антигена (CAR), который связывается с первым антигеном c Kd от около 1×10-8 M до около 1×10-5 М, где связывание CAR с первым антигеном обеспечивает доставку сигнала активации к Т-клетке; и
b) второй последовательности нуклеиновой кислоты, кодирующей химерный костимулирующий рецептор (CCR), где химерный костимулирующий рецептор содержит антигенсвязывающий домен, который связывается со вторым антигеном, где антигенсвязывающий домен соединен с внутриклеточным сигнальным доменом, стимулирующим Т-клетку, но который сам по себе не обеспечивает доставку сигнала активации к Т-клетке,
где Т-клетка демонстрирует более высокую степень цитолитической активности по отношению к клеткам, которые положительны как по первому антигену, так и второму антигену, по сравнению с активностью в отношении клеток, которые положительны по одному первому антигену, и
где Т-клетка демонстрирует по существу отсутствующую или незначительную долговременную или постоянную цитолитическую активность в отношении клеток, которые положительны по одному первому антигену.
38. Способ по п. 36 или 37, где первый и второй антигены представляют собой различные антигены, выбранные из списка, состоящего из CAIX, CEA, CD5, CD7, CDIO, CD19, CD20, CD22, CD30, CD33, CD34, CD38, CD41, CD44, CD49f, CD56, CD74, CD133, CD138, антигена инфицированных цитомегаловирусом (CMV) клеток, EGP-2, EGP-40, EpCAM, Erb-B2, Erb-B3, Erb-B4, FBP, фетального рецептора ацетилхолина, рецептора-a фолата, GD2, GD3, HER-2, hTERT, IL-13R-a2, x-легкой цепи, KDR, LeY, молекулы адгезии клеток LI, MAGE-AI, MUC1, мезотелина, лигандов NKG2D, NY-ESO-1, онкофетального антигена (h5T4), PSCA, PSMA, ROR1, TAG-72, VEGF-R2 и WT-1.
39. Способ по п. 36 или 37, где указанный CAR экспрессирован рекомбинантным способом.
40. Способ по п. 36 или 37, где CAR экспрессирован с вектора.
41. Способ по п. 36 или 37, где CCR экспрессирован с вектора.
42. Способ по п. 36 или 37, где Т-клетка выбрана из группы, состоящей из цитотоксического T-лимфоцита (CTL), регуляторной T-клетки и их комбинации.
43. Способ по п. 36, 37, где CAR содержит внутриклеточный сигнальный домен, который содержит сигнальный домен CD3ζ-цепи.
44. Способ по п. 36 или 37, где внутриклеточный сигнальный домен CCR представляет собой сигнальный домен CD97, сигнальный домен CD11a-CD18, сигнальный домен CD2, сигнальный домен ICOS, сигнальный домен CD27, сигнальный домен CD154, сигнальный домен CD5, сигнальный домен OX40, сигнальный домен 4-1BB или сигнальный домен CD28.
45. Фармацевтическая композиция для иммунотерапии, содержащая эффективное количество Т-клеток по любому из пп. 1-5 и фармацевтически приемлемый наполнитель.
46. Фармацевтическая композиция по п. 45, где количество Т-клеток составляет по меньшей мере около 1×104.
47. Фармацевтическая композиция по п. 45, где количество Т-клеток составляет по меньшей мере около 1×108.
48. Фармацевтическая композиция по п. 45, где количество Т-клеток составляет между около 1×104 и около 1×1010.
49. Фармацевтическая композиция по п. 45, где количество Т-клеток составляет между около 1×105 и около 1×109.
50. Фармацевтическая композиция по п. 45, где количество Т-клеток составляет между около 1×106 и около 1×108.
51. Набор для иммунотерапии, содержащий Т-клетку по любому из пп. 1-5.
| WILKIE S | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| KUMAR S | |||
| et al., "Immunophenotyping in multiple myeloma and related plasma cell disorders." Best | |||
Авторы
Даты
2020-08-06—Публикация
2013-10-02—Подача