Настоящее изобретение относится к терапевтическим средствам на основе иммунных клеток и способам применения терапевтических средств в лечении рака, инфекций и аутоиммунных нарушений.
Химерные антигенные рецепторы (CAR) представляют собой искусственные рецепторы, состоящие из связывающего фрагмента, который обеспечивает антигенспецифичность, и одной или более сигнальных цепей, полученных из иммунных рецепторов (Cartellieri et al., J. Biomed. Biotechnol. Doi: 10.1155/2010/956304 (2010)). Данные два основных домена CAR соединены связывающей пептидной цепью, включающей трансмембранный домен, который «заякоривает» CAR в плазматической мембране клетки. Иммунные клетки, в частности Т-клетки и NK-лимфоциты, можно генетически модифицировать для экспрессии CAR, встроенных в их плазматическую мембрану. Если такая CAR-модифицированная иммунная клетка встречается с другими клетками или тканевыми структурами, экспрессирующие или «декорированные» соответствующей мишенью связывающего фрагмента CAR, то после связывания связывающего фрагмента CAR с антигеном-мишенью CAR-модифицированная иммунная клетка поперечно сшивается с мишенью. Поперечное сшивание приводит к индукции сигнальных путей через сигнальные цепи CAR, что будет изменять биологические свойства CAR привитой-иммунной клетки. Например, запуск CAR в эффекторных CD4+ и CD8+ Т-клетках активирует типичные эффекторные функции, такие как секреция литических соединений и цитокинов, что в конечном итоге приводит к гибели соответствующей клетки-мишени. Адоптивный перенос иммунных клеток, сконструированных с помощью химерных антигенных рецепторов (CAR), в настоящее время рассматривается в качестве многообещающего терапевтического способа лечения в ином случае неизлечимых злокачественных, инфекционных или аутоиммунных заболеваний. На сегодняшний день два терапевтических средства на основе CAR-T-клеток получили разрешение для применения на фармацевтическом рынке для лечения злокачественных новообразований, происходящих из B-клеток, что доказывает клиническую осуществимость данного подхода.
Однако традиционная технология CAR сопряжена с рядом критических проблем, которые необходимо решить, прежде чем данный способ лечения сможет широко применяться для клинического лечения. Прежде всего, необходимо решить несколько проблем, связанных с безопасностью. Пока что иммунные ответы Т-клеток, сконструированных с помощью обычных CAR, трудно контролировать после инфузии пациенту. В частности, неожиданная экспрессия гена-мишени в здоровой ткани может спровоцировать быструю и сильную иммунную реакцию сконструированных Т-клеток против здоровых клеток, что может вызвать серьезные побочные эффекты (Lamers et al., J. Clin. Oncol., 24 e20-e22 (2006), Morgan et al., Mol. Ther. 18: p.843-851 (2010)). Повреждение органа также может быть вызвано неожиданной перекрестной реактивностью связывающего домена CAR с антигенами, которые экспрессируются в здоровой ткани. Несмотря на то, что до сих пор об этом не сообщалось для CAR-T-клеток, поскольку многие испытания находятся еще на ранней стадии, такие наблюдения имели место в клинических испытаниях с Т-клетками, генетически сконструированными для экспрессии рекомбинантных Т-клеточных рецепторов (Linette et al., Blood, 2013, Morgan et al., J. Immunother., 2013). Более того, поскольку CAR-T-клетки представляют собой новый класс самоамплифицирующихся клеточных препаратов, то инфузированные Т-клетки могут подвергаться интенсивной экспансии при наличии тяжелой опухолевой нагрузки, что приводит к синдрому лизиса опухоли и синдрому высвобождения цитокинов (Brudno and Kochenderfer, Blood, 2016; Maude et al., Cancer J. 2014). Еще одним недостатком традиционной CAR технологии является ограничение перенацеливания сконструированных Т-клеток к одному антигену. Такой монотерапевтический подход подразумевает риск развития вариантов ускользания опухолей, которые потеряли антиген-мишень во время лечения. Появление вариантов ускользания опухолей при традиционной CAR Т-клеточной терапии через несколько месяцев уже наблюдали в клинических испытаниях (Grupp et al., N. Engl. J. Med., 368: 1509-1518 (2013)). В совокупности такие препятствия сводят применение CAR-T-клеток к очень небольшому количеству показаний. Фактически, до настоящего времени примеры клинической эффективности ограничивались только CD19+ CAR-T-клетками.
Mardiros et al. раскрывают Т-клетки, экспрессирующие CD123-специфические химерные антигенные рецепторы против острого миелоидного лейкоза человека (AML) (Mardiros et al., Blood, 122: 3138-3148 (2014)). Альфа-цепь рецептора интерлейкина-3 (CD123) описывается как потенциальная иммунотерапевтическая мишень, поскольку она сверхэкспрессируется при AML по сравнению с нормальными гемопоэтическими стволовыми клетками.
Lee et al. раскрывают химерный антигенный рецептор (ACAR) на основе «лиганда, индуцирующего пролиферацию клеток» (APRIL) для двойного нацеливания на антиген созревания B-клеток (BCMA) и трансмембранный активатор, и модулятор кальция и лиганд циклофилина (TACI) при множественной миеломе (Lee et al., Blood, 131: 746-758 (2018)). Для применения в CAR конструкции использовали усеченную форму APRIL (остатки от 116 до 250).
В WO 2016154621 A1 раскрывается «переключаемый» химерный рецептор, содержащий внеклеточный домен, отличный от антитела, который взаимодействует с партнером по связыванию химерного рецептора, представленным на «переключателе». «Переключатель» включает партнера по связыванию химерного рецептора, предпочтительно белок или пептид, более предпочтительно антитело или фрагмент антитела, и нацеливающий фрагмент.
Подходы с модульными «универсальными» CAR-T (UniCAR) могут преодолеть эти ограничения, разделив антиген-распознающий и активирующий домен CAR на две отдельные функциональные единицы. Сконструированы Т-клетки для экспрессии CAR с универсальным связывающим доменом, распознающим метку (Cartellieri et al., Blood Cancer J., 2016; Rodgers et al., 2016, PNAS). Антиген-специфичность обеспечивается растворимыми адаптерными белками, которые состоят из антигенсвязывающего домена, слитого с меткой, распознаваемой универсальным CAR.
В международной заявке WO 2012082841 A2 раскрываются Т-клетки, экспрессирующие универсальный химерный антигенный рецептор против метки, и способы лечения связанных с клетками заболеваний, например, рака.
Кроме того, в WO 2013044225 A1 раскрыт универсальный иммунный рецептор, экспрессированный Т-клетками, для нацеливания на различные и многочисленные антигены.
В обоих способах описано применение модифицированных Т-клеток, экспрессирующих универсальные иммунные рецепторы против метки. Данные Т-клетки могут быть перенацелены на поверхностные антигены, ассоциированные с заболеванием, посредством дополнительного применения модулей, связывающих эти поверхностные антигены и несущих соответствующую метку. Проблема, возникающая при использовании вышеуказанных способов, состоит в том, что перенацеливание генетически модифицированных Т-клеток с использованием экзогенных меток, вероятно, будет иммуногенным, что подвергнет пациентов опасности и отрицательно скажется на эффективности лечения.
В международной заявке WO 2017112784 A1 описывается SpyCatcher и SpyTag для применения в универсальных иммунных рецепторах для Т-клеток, в частности последовательности нуклеиновых кислот, кодирующие универсальный иммунный рецептор, где универсальный иммунный рецептор включает SpyCatcher или внеклеточный связывающий домен SpyTag, связанный с внеклеточной шарнирной областью, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора, вектор и клетка, содержащие последовательность нуклеиновой кислоты, и выделенный универсальный иммунный рецептор, содержащий SpyCatcher или SpyTag.
В международной заявке WO 2016030414 A1 обеспечивается генетически модифицированная иммунная клетка, которая обеспечивает перенацеливание против различных заболеваний безопасным и эффективным способом с использованием эндогенных меток на основе ядерных белков.
Mitwasi et al. раскрывают новые целевые модули (TM) для перенацеливания UniCAR Т-клеток на дисиалоганглиозид GD2-позитивные опухолевые клетки (Mitwasi et al., Oncotarget, 8: 108584-108603 (2017)). GD2-специфичческие TM были сконструированы посредством слияния UniCAR эпитопа E5B9 с соответствующим анти-GD2 scFv, где исследовали in vitro и in vivo различные ориентации (VL-VH или VH-VL) и спейсерные пептиды. UniCAR содержит scFv против La 5B9, шарнирный домен, трансмембранный и сигнальный домен.
Однако связывающие фрагменты этих UniCAR Т-клеток все еще представляют одноцепочечные вариабельные фрагменты (scFv) и, таким образом, являются активными связывающими доменами. Такой активный связывающий домен имеет несколько недостатков. Во-первых, он по-прежнему имеет риск проявления активности на мишени/вне опухоли, если метка-мишень находится в здоровой ткани. Во-вторых, существует теоретический риск перекрестной реактивности связывающего домена по отношению к белкам нецелевой клеточной поверхности, что приводит к отключению активации опухоли и потенциально может вызвать серьезное повреждение ткани. Наконец, кодирующая последовательность scFv довольно длинная, что является недостатком для получения генетически сконструированных клеток.
Таким образом, целью настоящего изобретения является обеспечение генетически модифицированной иммунной клетки, которая обеспечивает безопасное и эффективное перенацеливание на различные нарушения с использованием небольшого фрагмента, связывающегося с поверхностью клетки, что минимизирует риск перекрестной реактивности CAR-модифицированной иммунной клетки и значительно укорачивает кодирующую последовательность, обеспечивая генетическую модификацию иммунной клетки с помощью нескольких CAR-конструкций. Еще одна цель настоящего изобретения заключается в обеспечении способа лечения различных связанных с клетками заболеваний, где продолжительность и интенсивность лечения легко регулируются в зависимости от клинических потребностей.
Настоящее изобретение обеспечивает обратную универсальную модульную систему химерного антигенного рецептора (RevCAR), которая обеспечивает перенацеливание RevCAR привитых-иммунных клеток против многочисленных антигенов. В системе используется платформа для генной терапии для создания иммунных клеток, способных распознавать различные антигены и имеющих широкое и ценное клиническое значение для применения в терапии на основе иммунных клеток, в частности терапии на основе Т-клеток и NK-клеток.
В первом аспекте настоящее изобретение обеспечивает последовательность выделенной нуклеиновой кислоты, кодирующую обратный универсальный химерный антигенный рецептор, где рецептор содержит три домена, где первый домен представляет собой пептидную эпитопную метку, служащую доменом связывания с клеточной поверхностью, второй домен представляет связывающую пептидную цепь, включающую внеклеточный шарнир и трансмембранный домен, и третий домен представляет домен трансдукции сигнала, где пептидная эпитопная метка, служащая доменом связывания с клеточной поверхностью, представляет линейный или конформационный эпитоп.
Пептидная эпитопная метка по изобретению нековалентно связана с доменом связывания метки, которым может быть антитело или лиганд. Предпочтительно пептидная эпитопная метка содержит от 10 до 20 аминокислот.
Особенно подходящими пептидными эпитопными метками клеточной поверхности являются пептидные последовательности человека, особенно пептидные последовательности, полученные из ядерных белков человека (т. е. La-белка), особенно пептидные последовательности, о которых известно, что они не являются мишенью для аутоантител у пациентов с аутоиммунным заболеванием (например, эпитоп 5B9 La-белка), делая маловероятным, что метка будет иммуногенной в контексте обратного универсального химерного рецептора.
Предпочтительно нуклеиновая кислота по изобретению представляет нуклеиновую кислоту, кодирующую обратный универсальный химерный антигенный рецептор в соответствии с одной из последовательностей SEQ ID NO: 24-27.
Более предпочтительно нуклеиновая кислота по изобретению представляет собой последовательность SEQ ID NO: 1, 8, 10 или 12.
Необязательный четвертый домен представляет короткий пептидный линкер во внеклеточной части RevCAR, который образует линейный эпитоп для моноклонального антитела (mab), специфически связывающегося с четвертым доменом. Данный дополнительный домен не требуется для функционирования системы RevCAR, но он может добавить изобретению дополнительные клинические преимущества. Предпочтительно настоящее изобретение обеспечивает последовательность выделенной нуклеиновой кислоты, кодирующую обратный универсальный химерный антигенный рецептор по настоящему изобретению, где последовательность нуклеиновой кислоты кодирует искусственный химерный слитый белок, и где последовательность нуклеиновой кислоты представлена в виде кДНК.
В еще одном аспекте настоящее изобретение обеспечивает адаптерный модуль (AdMo), состоящий из связывающего фрагмента, специфичного для определенного белка или белкового комплекса на поверхности человеческой клетки, и связывающего фрагмента, специфичного для пептидной эпитопной метки, служащего в качестве домена, связывающего RevCAR с поверхностью клетки, по изобретению.
В еще одном аспекте настоящее изобретение обеспечивает нуклеиновую кислоту, кодирующую адаптерный модуль по настоящему изобретению. Предпочтительно настоящее изобретение обеспечивает последовательность выделенной нуклеиновой кислоты, кодирующей адаптерный модуль по настоящему изобретению, где выделенная нуклеиновая кислота представлена в виде кДНК.
В еще одном аспекте настоящее изобретение относится к клетке, содержащей нуклеиновую кислоту, кодирующую обратный универсальный химерный антигенный рецептор по настоящему изобретению, содержащий три домена, где первый домен представляет пептидную эпитопную метку, служащую доменом связывания с клеточной поверхностью, второй домен представляет связывающую пептидную цепь, включающую внеклеточный шарнир и трансмембранный домен, и третий домен представляет домен трансдукции сигнала.
В еще одном аспекте настоящее изобретение относится к клетке, содержащей нуклеиновые кислоты, кодирующие два или более обратных универсальных химерных антигенных рецептора по настоящему изобретению, где каждый содержит три домена, где первый домен представляет пептидную эпитопную метку, служащую доменом связывания с клеточной поверхностью, второй домен представляет связывающую пептидную цепь, включающую внеклеточный шарнир и трансмембранный домен, и третий домен представляет домен трансдукции сигнала.
В еще одном аспекте настоящее изобретение обеспечивает вектор, содержащий нуклеиновую кислоту, кодирующую обратный универсальный химерный антигенный рецептор по настоящему изобретению, где обратный универсальный химерный антигенный рецептор содержит три домена, где первый домен представляет пептидную эпитопную метку, служащую связывающим доменом с поверхностностью клетки, второй домен представляет связывающую пептидную цепь, включающую внеклеточный шарнир и трансмембранный домен, и третий домен представляет домен трансдукции сигнала.
В еще одном аспекте настоящее изобретение обеспечивает набор, содержащий вектор по настоящему изобретению, содержащий последовательность нуклеиновой кислоты, кодирующей обратный универсальный химерный антигенный рецептор по настоящему изобретению, и адаптерный модуль по настоящему изобретению и/или вектор, кодирующий последовательность выделенной нуклеиновой кислоты, кодирующей адаптерный модуль по настоящему изобретению.
Кроме того, изобретение включает фармацевтическую композицию, которая содержит клетки и адаптерные модули по изобретению в сочетании с фармацевтически приемлемым разбавителем или носителем. Предпочтительно фармацевтическая композиция находится в форме, подходящей для внутривенного введения.
Предпочтительно композиция содержит клетки, содержащие нуклеиновую кислоту, кодирующую обратный универсальный химерный антигенный рецептор по настоящему изобретению, и адаптерные модули по настоящему изобретению.
Фармацевтическая композиция по изобретению включает формы для различного введения. Фармацевтические композиции предпочтительно вводят парентерально, особенно предпочтительно внутривенно. В одном варианте осуществления изобретения фармацевтическая композиция для парентерального введения находится в форме для введения, подходящей для инъекции. Следовательно, особенно предпочтительными композициями являются растворы, эмульсии или суспензии клеток и адаптерного модуля, которые находятся в фармацевтически приемлемом разбавителе или носителе.
В качестве носителя предпочтительно используются вода, забуференная вода, 0,9% физиологический раствор, раствор глицина и аналогичные растворители. Растворы являются стерильными. Фармацевтические композиции стерилизуют с использованием обычных хорошо известных методов. Композиции предпочтительно содержат фармацевтически приемлемые эксципиенты, например, такие, которые требуются для обеспечения условий, близких к физиологическим, и/или повышения стабильности адаптерных модулей, таких как агенты для регуляции значения pH и буферные агенты, предпочтительно выбранные из ацетата натрия, хлорида натрия, цитрата натрия, фосфата калия, хлорида калия, хлорида кальция, лактата натрия и гистидина. Концентрации адаптерных модулей по изобретению в этих составах варьируются в зависимости от области применения; предпочтительно они составляют менее 0,01 мас.%, предпочтительно, по меньшей мере, 0,1 мас.%, более предпочтительно от 1 до 5 мас.%, и их выбирают, прежде всего, на основе объемов жидкости, вязкости и т. д. или в соответствии с соответствующим режимом введения.
Фармацевтические композиции должны быть стерильными и стабильными в условиях производства и хранения. Композицию можно формулировать в виде раствора, микроэмульсии, дисперсии, в липосомах или в других упорядоченных структурах, которые подходят для этой цели и известны специалистам в данной области.
Клетки и адаптерные модули по изобретению предпочтительно включают в композицию, подходящую для парентерального введения. Предпочтительно фармацевтическая композиция представляет буферный раствор для инъекций, который содержит от 1 нг/мл до 500 мг/мл AdMo, особенно предпочтительно от 5 нг/мл до 250 мг/ мл адаптерного модуля, в частности, вместе с 1-500 ммоль/мл, особенно предпочтительно от 5 до 20 мМ. Раствор для инъекций может находиться в жидкой форме. Буфер предпочтительно может представлять гистидиновый буфер (предпочтительно с концентрацией от 1 до 50 мМ, в частности, предпочтительно от 5 до 20 мМ) со значением pH от 5,0 до 7,0 (особенно предпочтительно с pH 6,0).
Другие подходящие буферы включают, но точно не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Для жидкой формы для введения предпочтительно используется хлорид натрия от 0 до 300 мМ, особенно предпочтительно 150 мМ. В жидких формах для введения предпочтительно используются стабилизаторы, предпочтительно полисорбат-80 на уровне от 0,0001% (мас./об.) до 1% (мас./об.), особенно предпочтительно от 0,001% (мас./об.) до 0,1% (мас./об.).
Типичный уровень дозы, вводимой пациенту в день, составляет от 1 нг до 1000 мг, предпочтительно от 3 нг до 3 мг, с дозами, вводимыми один или более раз в день или неделю, или постоянно в течение периода до нескольких недель.
В еще одном аспекте изобретение обеспечивает применение клеток по настоящему изобретению, содержащих нуклеиновую кислоту, кодирующую универсальный химерный антигенный рецептор по настоящему изобретению, и адаптерные модули по настоящему изобретению, для стимуляции иммунного ответа, опосредованного универсальным химерным антигенным рецептором, у млекопитающих. Предпочтительно изобретение обеспечивает применение клеток по настоящему изобретению, содержащих нуклеиновую кислоту, кодирующую обратный универсальный химерный антигенный рецептор по настоящему изобретению, и адаптерные модули по настоящему изобретению, в качестве лекарственного средства, более предпочтительно в качестве лекарственного средства для лечения рака или аутоиммунного заболевания. Аутоиммунное заболевание развивается в результате аномального иммунного ответа организма на вещества и ткани, которые обычно присутствуют в организме (аутоиммунитет).
Изобретение дополнительно включает применение клеток и адаптерных модулей по изобретению для приготовления лекарственного средства для терапевтического и/или диагностического применения в случае рака или аутоиммунного заболевания.
Изобретение также включает способ лечения человека, страдающего раком, инфекционным, воспалительным или аутоиммунным заболеванием, введением клеток и адаптерных модулей по изобретению.
Для терапевтического применения стерильная фармацевтическая композиция, содержащая фармакологически эффективное количество клеток и адаптерных модулей по изобретению, вводится пациенту с целью лечения вышеуказанных заболеваний.
Изобретение будет пояснено более подробно с помощью следующих фигур и вариантов осуществления, не ограничивая ими изобретение.
На фиг. 1 представлено схематическое изображение обратного универсального химерного антигенного рецептор (RevCAR). LP, лидерный пептид для трансляции в эндоплазматический ретикулум и транспорта в клеточную мембрану; PE, пептидный эпитоп в виде пассивного связывающего домена RevCAR; PL; необязательный четвертый домен для распознавания и/или очистки; ECD, внеклеточный домен в виде шарнирного домена; TM, трансмембранный домен; ICD 1 и ICD 2, внутриклеточные сигнальные домены, которые могут состоять из одного домена или двух или более доменов.
На фиг. 2 представлено схематическое изображение платформы обратного универсального химерного антигенного рецептора (RevCAR) для перенацеливания антигенспецифических иммунных клеток. В данном примере иммунная клетка представляет Т-клетку (Т). AdMo, адаптерная молекула, сконструированная из двух одноцепочечных вариабельных фрагментов в данном примере; PE, пептидный эпитоп в виде пассивного связывающего домена RevCAR; RevCAR, обратный универсальный химерный антигенный рецептор; TCR, эндогенный Т-клеточный рецептор.
На фиг. 3 представлено схематическое изображение двух адаптерных модулей, которые специфически связываются с CD123, антигеном, обычно экспрессируемым при лейкозах. Адаптерные модули сконструированы таким образом, что они могут вызывать рекрутмент RevCAR, несущих эпитопную метку La5B9 (AdMo CD123-La5B9) или несущих метку La7B6 (AdMo CD123-La7B6).
На фиг.4 показана аффинность двух CD123-специфических адаптерных модулей к антигену-мишени CD123, как определено с помощью анализа связывания на бластах OCI-AML3, экспрессирующих CD123 (A), и к их метке RevCAR, которая представляет собой метку La 5B9 или La 7B6 соответственно (В).
На фиг. 5 показан специфический лизис CD123-положительных бластов AML первичными Т-клетками человека, генетически сконструированными для экспрессии RevCAR, несущего метку La5B9 (A) или метку La7B6 (B). Специфический лизис индуцируется в зависимости от концентрации в присутствии соответствующих CD123-специфических адаптерных модулей, распознающих метку La5B9 (AdMo CD123-La5B9) или метку La7B6 (AdMo CD123-La7B6).
На фиг. 6 представлена схематическая карта лентивирусного вектора pLVX-EF1α-IRES-ZsGreen1.
На фиг.7 показана схематическая карта упаковочной лентивирусной плазмиды psPAX2.
На фиг. 8 показана схематическая карта оболочки плазмиды pMD2.G.
На фиг. 9 суммировано количество молекул на клетку для конструкций RevCAR 1-4 на клеточной поверхности Т-клеток, трансдуцированных лентивирусом. Количество молекул определяли количественно с использованием QIFIKIT (Agilent, Санта-Клара, Калифорния, США) с моноклональными антителами против La 5B9 или 7B6 соответственно.
Эффекторные клетки
Эффекторные клетки, использованные в способах по настоящему изобретению, могут быть аутологичными, сингенными или аллогенными, где выбор зависит от заболевания, подлежащего лечению, и доступных средств для этого. Подходящие популяции эффекторных клеток, которые можно использовать в способах, включают любые иммунные клетки с цитолитической, фагоцитарной или иммуносупрессивной активностью, такие как Т-клетки, включая регуляторные Т-клетки, NK-клетки и макрофаги. В одном аспекте эффекторные клетки происходят из определенного HLA-фенотипа и используются в аутологичной или аллогенной системе. Эффекторные клетки можно выделить из любого источника, в том числе из опухолевого эксплантата субъекта, который подвергается лечению, или внутриопухолевых клеток субъекта, который подвергается лечению. В одном варианте осуществления эффекторные клетки можно получить дифференцировкой in vitro из плюри- или мультипотентных стволовых клеток или клеток-предшественников до или после генетических манипуляций с соответствующими клетками для экспрессии RevCAR. В дальнейшем по тексту термин «эффекторная клетка» относится к любому виду вышеуказанных иммунных клеток, генетически измененных для экспрессии RevCAR на их клеточной поверхности.
Обратный универсальный химерный антигенный рецептор (RevCAR)
RevCAR, экспрессированный эффекторными клетками, используемыми в способах по настоящему изобретению, позволяет осуществлять модульное, очень гибкое и строго контролируемое перенацеливание иммунных клеток, экспрессирующих RevCAR, антигенспецифическим образом. Единственными требованиями для RevCAR, используемых в способах, являются (i) чтобы RevCAR через свою пептидную эпитопную метку клеточной поверхности обладал специфичностью связывания с конкретным связывающим фрагментом метки, который может быть конъюгирован с адаптерным модулем, который, в свою очередь, связывается с белком клеточной поверхности или внеклеточной структурой клетки-мишени, и (ii) чтобы иммунные клетки можно было сконструировать для экспрессии RevCAR.
RevCAR состоит из трех доменов (фиг. 1). Первый домен представляет собой пептидную эпитопную метку клеточной поверхности. Данная пептидная эпитопная метка клеточной поверхности обычно находится на аминоконце полипептида, который включает RevCAR. Расположение пептидной эпитопной метки клеточной поверхности на аминоконце обеспечивает пептидную эпитопную метку клеточной поверхности беспрепятственным доступом к адаптерному модулю, который связан с клеткой-мишенью. Пептидная эпитопная метка клеточной поверхности обычно представляет линейный пептидный эпитоп.
В предпочтительном варианте осуществления пептидная эпитопная метка клеточной поверхности представляет короткий линейный пептидный эпитоп, полученный из человеческого белка.
В более предпочтительном варианте осуществления пептидная эпитопная метка клеточной поверхности представляет короткий линейный пептидный эпитоп, полученный из ядерного белка человека.
Предпочтительно нуклеиновая кислота, кодирующая пептидную эпитопную метку, представляет нуклеиновую кислоту, кодирующую пептидную эпитопную метку в соответствии с последовательностью SEQ ID NO: 28 или 29, более предпочтительно, нуклеиновая кислота, кодирующая пептидную эпитопную метку, представляет нуклеиновую кислоту в соответствии с последовательностью SEQ ID NO: 3 или 11.
В наиболее предпочтительном варианте осуществления пептидная эпитопная метка клеточной поверхности представляет короткий линейный пептидный эпитоп, полученный из ядерного La-белка человека. Предпочтительно метка выбрана из эпитопов La E5B9 или E7B6 человека. Использование эпитопов La E5B9 и E7B6 в системе RevCAR преимущественно за счет того факта, что scFv против E5B9 и против E7B6 не взаимодействуют с нативным La-белком, связанным с поверхностью клеток в нормальных физиологических условиях, и не наблюдали продукции аутоантител против этих эпитопов у пациентов с аутоиммунными заболеваниями, которые, как сообщается, часто имеют аутоантитела против La-белка.
Второй домен RevCAR представляет внеклеточный шарнирный домен и трансмембранный (TM) домен. Шарнирный домен позволяет RevCAR выступать за поверхность эффекторной клетки для оптимального связывания с соответствующим ей scFv. Домен TM «заякоривает» RevCAR в клеточной мембране эффекторной клетки. Примеры шарнирных доменов и TM-доменов включают, не ограничиваясь этим, шарнирные и трансмембранные области молекулы CD28 человека, цепь CD8a, рецепторы NK-клеток, такие как группа естественных киллеров 2D (NKG2D), DAP12 или участки константной области антитела, а также комбинации различных шарниров и TM-доменов.
В еще одних вариантах осуществления шарнирная и трансмембранная области выбраны из шарнирных и трансмембранных областей молекулы CD28 человека, цепи CD8a, рецепторов NK-клеток, предпочтительно группы естественных киллеров NKG2D, DAP12, Fc или участков константной области антитела, а также комбинации различных шарниров и их трансмембранных доменов, где шарнирная область является частью внеклеточной области.
Третий домен, если он присутствует, представляет домен трансдукции сигнала. Данный домен передает клеточный сигнал в RevCAR-несущую эффекторную клетку, после перекрестного связывания эффекторной клетки с клеткой или внеклеточной структурой. Перекрестное связывание эффекторной клетки и клетки-мишени является опосредованным и зависит от присутствия (i) адаптерного модуля, который связывается со своим конкретным связывающим фрагментом на клетке-мишени или внеклеточной структуре-мишени и несет связывающий фрагмент RevCAR, и (ii) RevCAR, экспрессированного на поверхности эффекторной клетки, представляющей пептидную эпитопную метку, которая может распознаваться и связываться адаптерным модулем. Активация эффекторной клетки включает индукцию синтеза цитокинов или хемокинов, а также активацию цитолитической, фагоцитарной или супрессивной активности эффекторной клетки. Примеры доменов трансдукции сигнала эффекторных клеток включают, не ограничиваясь этим, цитоплазматические области CD28, CD137 (41BB), CD134 (OX40), DAP10 и CD27, которые служат для повышения выживаемости и пролиферации Т-клеток; ингибиторные рецепторы, такие как белок запрограммированной гибели клеток-1 (PD-1) и цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4), а также цитоплазматические области цепей CD3 (например, CD3zeta), DAP12 и Fc-рецепторы, которые индуцируют активацию Т-клеток и NK-клеток. В RevCAR может быть включен один или более доменов трансдукции сигнала, например два, три, четыре или более доменов, активирующих иммунные клетки или костимуляторных доменов.
В еще одних вариантах осуществления домен трансдукции сигнала выбран из цитоплазматических областей CD28, CD137 (41BB), CD134 (OX40), DAP10 и CD27, белка запрограммированной гибели клеток-1 (PD-1), цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4) и цитоплазматических областей цепей CD3, DAP12 и Fc-рецепторов активации Т-клеток, где домен трансдукции сигнала и цитоплазматические области являются сигнальными доменами.
В еще одном варианте осуществления RevCAR содержит четвертый домен, который представляет собой короткий пептидный линкер во внеклеточной части RevCAR (фиг. 1). Для его функционирования требуется, чтобы данный четвертый домен образовывал линейный эпитоп, который обеспечивает связывание с конкретным моноклональным антителом с соответствующей аффинностью. Один или более линейных эпитопов могут быть включены в четвертый домен, и они могут быть расположены в виде линкера в домене связывания метки, между доменом связывания метки и внеклеточным линкером, или могут быть составляющей частью внеклеточного шарнирного домена. С помощью необязательного четвертого домена RevCAR-привитые иммунные клетки могут подвергаться специфической стимуляции, так что в результате RevCAR привитые-иммунные клетки преимущественно пролиферируют и сохраняются дольше по сравнению с непривитыми иммунными клетками in vitro или in vivo. Четвертый домен также можно использовать для выделения RevCAR-привитых иммунных клеток из смешанных популяций клеток. Его также можно использовать для подавления иммунного ответа, опосредованного RevCAR привитыми-иммунными клетками, и для элиминации RevCAR привитых-иммунных клеток in vivo.
Для того, чтобы обеспечить экспрессию на клеточной поверхности эффекторной клетки, сигнальный пептид (иногда также называемый сигнальной последовательностью, нацеливающим сигналом или лидерным пептидом) помещается перед пептидным эпитопом, служащим внеклеточным связывающим доменом на 5'-конце последовательности нуклеиновой кислоты RevCAR, кодирующей ее N-конец. Сигнальные пептиды нацелены на белки секреторного пути либо котрансляционно, либо посттрансляционно. Для этой цели можно использовать сигнальные пептиды из белков различных видов, однако предпочтительно использовать лидерные пептиды из белков, подобных CD28, CD8alpha, IL-2 или тяжелой или легкой цепи антител человека, чтобы избежать иммуногенных реакций.
Адаптерные модули
Адаптерные модули состоят из связывающего фрагмента, специфичного для определенного белка или белкового комплекса на поверхности человеческой клетки, и связывающего фрагмента, который связывается с пептидным эпитопом клеточной поверхности рецепторов RevCAR по настоящему изобретению. Адаптерные модули вводят субъекту до, одновременно или после введения эффекторных клеток, экспрессирующих RevCAR. В качестве альтернативы, эффекторные клетки, экспрессирующие RevCAR, можно «декорировать» адаптерными модулями перед инфузией реципиенту. Потенциальные связывающие фрагменты адаптерных модулей включают, не ограничиваясь этим, антитела или их фрагменты, которые связываются с поверхностными антигенами, такими как CD2, CD3, CD4, CD8, CD10, CD19, CD20, CD22, CD25, CD23, CD30, CD33, CD38, CD44, CD52, CD90, CD99, CD123, CD223, CD269 (антиген созревания В-клеток, BCMA), CD274, CD276, CD279 и CD366, члены семейства рецепторов эпидермального фактора роста (ErbB1, ErbB2, ErbB3, ErbB4 и их мутанты), рецептор эпидермального фактора роста (EGFR), члены суперсемейства рецепторов фактора некроза опухолей, члены семейства рецепторов эфринов (EphA1-10, EphB1-6), так называемые простатспецифические антигены (например, антиген стволовых клеток предстательной железы PSCA, простатспецифической мембранный антиген PSMA), эмбриональные антигены (например, карциноэмбриональный антиген CEA, фетальный ацетилхолиновый рецептор), члены семейства факторов роста эндотелия сосудов (VEGFR 1-3), молекула адгезии эпителиальных клеток EpCAM, альфа-фетопротеин AFP, члены семейства белков муцинов (например, MUC1, MUC16), рецептор фолликулостимулирующего гормона (FSHR), высокомолекулярный ассоциированный с меланомой антиген человека (HMW-MAA), фолат-связывающий белок FBP, рецептор α-фолата, лиганды рецептора NKG2D, рецепторы цитокинов [например, IL-8Rα(CXCR1), IL-8Rβ (CXCR2), IL-11Rα, IL-11Rβ, IL-13Rα1 и 2, CXCR4], члены семейства гликопротеинов эпителия (например, EGP-2, EGP-4), диасиалоганглиозиды (например, GD2, GD3), члены семейства карбоангидраз (например, CAIX), члены семейства углеводных антигенов (например, Ley), лиганды Notch (например, Delta-подобные 1 и 4), меланома-ассоциированный хондроитинсульфат протеогликан (MCSP), гликопротеин A33 и опухолеспецифические гликаны [например, серин- или треонин-связанный N-ацетилгалактозамин (Tn) или производные, такие как сиалил-Tn], включая мутанты названных белков и белковых семейств. Кроме того, связывающий фрагмент адаптерных модулей включает, не ограничиваясь этим, антитела или их фрагменты, которые связываются с цитоплазматическими или ядерными антигенами, такими как антиген La/SSB, членами семейства Rho GTPаз, членами группы белков с высокой подвижностью и другими. Аналогичным образом связывающий фрагмент адаптерного модуля может состоять из альфа- и бета- или гамма- и дельта-цепей Т-клеточного рецептора (TCR) или их фрагментов. Такие связывающие фрагменты, происходящие от TCR, распознают и связываются с пептидами, представленными белковыми комплексами лейкоцитарных антигенов класса I и II человека (HLA). Примерами являются, не ограничиваясь этим, TCR, специфичные для пептидов, происходящих от белков, подобных семейству EGFR, сурвивин, семейство sry-подобных белков с высокой подвижностью (SOX), меланома-ассциированные антигены (например, аутоиммуногенный раково-тестикулярный антиген NY-ESO-1, члены семейства антигенов меланомы A (MAGEA), предпочтительно экспрессированный в меланоме антиген (PRAME) и ассоциированные с лейкозом антигены (например, ген опухоли Вильмса 1 WT1). Связывающий фрагмент адаптерных модулей также может включать лиганды белков и белковых комплексов, далее называемых рецепторами, или их фрагменты. Такие лиганды могут связываться, не ограничиваясь этим, с рецепторами цитокинов (например, рецептором IL-13), лиганды рецептора NKG2D, лиганды членов семейства EGFR, лиганды молекул иммунных контрольных точек, такие как PD-1, CTLA-4, геном активации 3 лимфоцитов (LAG-3) или Т-клеточным иммуноглобулином и доменом муцина-3 (TIM-3), или аутореактивными TCR. Кроме того, связывающиеся метку фрагменты также могут представлять химически синтезированные пептидные производные, которые слиты со связывающим метку фрагментом посредством химической реакции (т.е. клик-химии). В предпочтительном варианте осуществления пептиды со специфичностью связывания с мембранными рецепторами обладают специфичностью связывания с мембранными рецепторами, выбранными из CD2, CD3, CD4, CD8, CD10, CD19, CD20, CD22, CD25, CD23, CD30, CD33, CD38, CD44, CD52, CD90, CD99, CD123, CD223, CD269, CD274, CD276, CD279 и CD366, рецепторов интерлейкина, особенно предпочтительных IL-8Rα (CXCR1), IL-8Rβ (CXCR2), IL-11Rα, IL-11Rβ, IL-13Rα1 и 2, CXCR4; c-Met, рецепторов трансформирующего фактора роста β, erbB1, erbB2, erbB3, erbB4 и их мутантов, членов суперсемейства рецепторов фактора некроза опухолей, рецепторов эфринов, особенно предпочтительных EphA1-10, EphA5 или EphB1-6; антигена стволовых клеток предстательной железы PSCA, простатспецифического мембранного антигена PSMA, карциноэмбрионального антигена CEA, фетального ацетилхолинового рецептора, онкофетальных антигенов, опухолеспецифических гликанов [например, серин- или треонин-связанного N-ацетилгалактозамина (Tn) или производных, таких как сиалил-Tn]; VEGFR 1, VEGFR 2 или VEGFR 3, нейропилина-1, молекулы адгезии эпителиальных клеток (EpCAM), рецептора эпидермального фактора роста (EGFR), альфа-фетопротеина (AFP), муцинов, особенно предпочтительных MUC1, MUC16 или MUC18; рецептора фолликулостимулирующего гормона (FSHR), высокомолекулярного ассоциированного с меланомой антигена человека (HMW-MAA), фолат-связывающего белка FBP, рецептора фолата, NKG2D, молекулы главного комплекса гистосовместимости класса I (MHC), особенно предпочтительной цепи MHC класса I-связанной с геном A (MICA) или B (MICB), UL16-связывающего белка (ULPB) 1, ULPB 2, ULPB 3, членов семейства экспорта рибонуклеиновой кислоты 1 (Rae-1) или гистосовместимости 60 (H-60); шаперонов и белков теплового шока, особенно предпочтительного белка теплового шока (HSP) 90 или глюкозо-регулируемого 78 кДа (GRP78); EGP-2 или EGP-4, диасиалоганглиозида 2 (GD2) или GD3, карбоангидразы 9 (CAIX), антигена Y Льюиса (LeY), лектин-подобной молекулы-1 C-типа (CLL-1), рецептора лиганда фактора некроза опухолей, индуцированного апоптозом (TRAIL), апоптозного антигена 1 (APO-1, Fas, CD95), членов семейства кератинов или интегринов, особенно предпочтительных avβ3 или avβ5, аминопептидазы A, аминопептидазы N или невро/глиального антигена 2 (NG2).
Связывающие фрагменты адаптерных модулей могут иметь одну антигенную специфичность (моноспецифичность), две, три или более антигенных специфичностей (би- и полиспецифичность). Примеры би- и полиспецифических антигенных специфичностей включают, не ограничиваясь этим, адаптерные модули, связывающиеся с антигеном PSCA и PSMA, антигеном CD19 и CD20, антигеном CD19, CD20 и CD22, антигеном CD33 и CD123, CD33 и CD99, CD33 и TIM-3, ErbB-1 и -2, PSCA и ErbB-2 и другими комбинациями. Предпочтительные примеры би- и мультиспецифической антигенной специфичности включают связывание адаптерных модулей с PSCA и PSMA, CD19 и CD20, CD19 и CD22, CD19, CD20 и CD22, CD19 и CD123, CD33 и CD123, CD33 и CD99, CD33 и TIM-3, ErbB-1 и -2, PSCA и ErbB-2, IL-13Rα2 и ErbB-2, CD38 и CD269. Связывающие фрагменты адаптерных модулей также могут включать сайт моновалентного связывания, а также сайты би- и поливалентного связывания. Примеры би- и поливалентных нацеливающих стратегий включают, не ограничиваясь этим, адаптерные модули, включающие два scFv, распознающие разные эпитопы PSCA, CEA, CD19 и CD33, и комбинации лиганд-scFv, распознающие разные эпитопы рецептора ErbB1.
Адаптерные модули также могут нести дополнительные лиганды, которые не участвуют в связывании антигена-мишени, далее называемые полезными грузами. Такие полезные грузы могут включать, не ограничиваясь этим, костимуляторные лиганды или цитокины, слитые с N- или C-концом адаптерного модуля, в частности внеклеточный домен CD28, CD137 (41BB), CD134 (OX40) и CD27, а также IL-2, IL-7, IL-12, IL-15, IL-17 и IL-21, которые все стимулируют различные виды иммунных клеток. Другим полезным грузом могут быть радионуклиды или химические соединения, которые индуцируют гибель клеток-мишеней и соседних клеток.
В вариантах осуществления изобретения пептидная эпитопная метка клеточной поверхности рецепторов RevCAR представляет собой определенную метку. Идентичность метки ограничивается только идентичностью связывающего домена соответствующего адаптерного модуля. Метка может происходить из любой структуры, против которой имеется антитело или другой связывающий домен. Антитело, специфичное для метки, может быть получено от любого вида животных, хотя предпочтительно от млекопитающего, такого как человек, обезьяна, мышь, крыса, кролик, морская свинка, лошадь, корова, овца, коза, свинья, собака или кошка. Предпочтительно антитела представляют человеческие или гуманизированные антитела. Также отсутствуют ограничения в отношении конкретного класса антител, которые можно использовать, включая IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE антитела. Фрагменты антител включают одноцепочечный вариабельный фрагмент (scFv), одноцепочечные антитела, фрагменты F(ab')2, фрагменты Fab и фрагменты, продуцированные библиотекой экспрессии Fab, с единственным ограничением, заключающимся в том, что фрагменты антитела должны сохранять способность связываться с выбранной меткой. Антитела также могут быть поликлональными, моноклональными или химерными антителами, например, когда антигенсвязывающая область (например, F(ab')2 или гипервариабельная область) «нечеловеческого» антитела переносится на каркас человеческого антитела с помощью методов рекомбинантной ДНК с получением по существу человеческой молекулы. Из них могут быть получены антигенсвязывающие фрагменты, такие как scFv. Антитела к выбранной метке можно получить иммунизацией различных хозяев, включая, не ограничиваясь ими, коз, кроликов, крыс, мышей, людей, посредством инъекции определенного белка или любой части, фрагмента или олигопептида, который сохраняет иммуногенные свойства белка.
В зависимости от вида хозяина для усиления иммунного ответа можно использовать различные адъюванты. Такие адъюванты включают, не ограничиваясь этим, детоксифицированный термолабильный токсин из E. coli, адъювант Фрейнда, минеральные гели, такие как гидроксид алюминия, и поверхностно-активные вещества, такие как лизолецитин, полиолы типа плуроник, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. БЦЖ (бацилла Кальметта-Герена) и Corynebacterium parvum также являются потенциально пригодными адъювантами. Антитела и их фрагменты можно получить с использованием любой методики, которая обеспечивает продукцию молекул антител, например, с помощью непрерывных клеточных линий в культуре для продукции моноклональных антител. Такие методы включают, не ограничиваясь этим, гибридомную технологию, первоначально описанную Koehler и Milstein (Nature 256: 495-497 (1975)), метод гибридомы B-клеток человека (Kosbor et al., Immunol. Today, 4:72 (1983); Cote et al., Proc Natl. Acad. Sci., 80: 2026-2030 (1983)) и метод гибридомы EBV (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss Inc, New York NY, стр 77-96 (1985)). Также можно использовать методы, разработанные для получения «химерных антител», т. е. сплайсинга генов мышиных антител с генами антител человека c получением молекулы с соответствующей антигенной специфичностью и биологической активностью (Morrison et al., Proc Natl. Acad. Sci., 81: 6851-6855 (1984); Neuberger et al., Nature, 312: 604-608 (1984); Takeda et al., Nature, 314: 452-454 (1985)). В качестве альтернативы, методы, описанные для получения одноцепочечных антител, можно адаптировать для получения одноцепочечных антител, специфичных к метке.
В одном аспекте связывающий метку домен представляет одноцепочечный вариабельный фрагмент (scFv). ScFv включает вариабельные области тяжелой (VH) и легкой цепей (VL) антитела, обычно связанные через короткий пептид из 5-25 аминокислот. Линкер может либо соединить N-конец VH с C-концом VL, или наоборот.
В предпочтительном варианте осуществления пептидная эпитопная метка клеточной поверхности рецептора RevCAR (метка) представляет короткий линейный эпитоп ядерного La-белка человека. Связывающий метку домен адаптерного модуля может представлять собой антитело или полученный из антитела антигенсвязывающий фрагмент, например, одноцепочечный вариабельный фрагмент (scFv), связывающийся с соответствующим La-эпитопом.
Предпочтительно метка выбрана из человеческого La-эпитопа E5B9 или E7B6.
Способ стимуляции иммунного ответа, опосредованного обратным универсальным химерным антигенным рецептором, у млекопитающего, где способ включает:
- введение млекопитающему эффективного количества эффекторной клетки, генетически модифицированной для экспрессии одного или более обратных универсальных химерных антигенных рецепторов, где обратные универсальные химерные антигенные рецепторы содержат три домена, где первый домен представляет пептидную эпитопную метку, второй домен представляет внеклеточный шарнир и трансмембранный домен, и третий домен представляет домен трансдукции сигнала, где метка распознается связывающим доменом, подходящим для генерации растворимого адаптерного модуля (фиг. 2).
- введение одного или более адаптерных модулей, состоящих из связывающего фрагмента, специфичного для определенного белка или белкового комплекса на поверхности человеческой клетки, и связывающего домена, где последний связывающий домен распознает пептидную эпитопную метку клеточной поверхности RevCAR (фиг. 2);
где адаптерные модули вводят субъекту до, одновременно или после введения эффекторных клеток, экспрессирующих обратные универсальные химерные антигенные рецепторы.
В предпочтительном варианте осуществления эффекторные клетки и адаптерные модули вводят человеку.
Получение RevCAR эффекторных клеток
В одном варианте осуществления изобретения иммунные клетки могут быть генетически сконструированы для экспрессии RevCAR различными способами. Как правило, полинуклеотидный вектор, кодирующий RevCAR, и все необходимые элементы, обеспечивающие его экспрессию в генетически сконструированной иммунной клетке, переносятся в клетку. Перенос вектора может выполняться, не ограничиваясь этим, электропорацией или трансфекцией нуклеиновых кислот или с помощью вирусных векторных систем, таких как, не ограничиваясь ими, перенос гена аденовирусом, аденоассоциированным вирусом, ретровирусом, пенистым вирусом или лентивирусом.
В еще одном варианте осуществления опосредованный лентивирусом перенос гена можно использовать для стабильной экспрессии RevCAR в иммунных клетках сначала конструированием лентивирусного вектора, кодирующего выбранный RevCAR. Типичный лентивирусный вектор включает, не ограничиваясь этим, вектор pLVX-EF1alpha RevCAR 28/α, как показано на фиг. 6, где лентивирусные участки вектора происходят из вируса иммунодефицита человека (ВИЧ).
Для описанной заявки часть MSC/IRES/ZxGreenI была заменена конструктом RevCAR. В отношении фиг. 6, то используются следующие сокращения:
5'LTR: 5' длинный концевой повтор, PBS: сайт связывания праймера, Ψ: сигнал упаковки, RRE: элемент Rev-ответа, cPPT/ CTS: (центральный полипуриновый тракт/центральная терминирующая последовательность, PEF1α: промотор фактора элонгации альфа 1 человека, MCS: сайт множественного клонирования, IRES: внутренний сайт входа рибосомы, ZsGreen1: кодон-оптимизированный для человека, WPRE: посттранскрипционный регуляторный элемент вируса гепатита сурка, 3'LTR: 3' длинный концевой повтор, pUC: ориджин репликации, Ampr: ген устойчивости к ампициллину; β-лактамаза.
Лентивирусные частицы обычно получают транзиентной трансфекцией клеток эмбриональной почки человека (HEK) 293T (ACC 635) с помощью RevCAR-кодирующей лентивирусной векторной плазмиды, и котрансфекцией с группоспецифическим антигеном (gag) и плазмиды, кодирующей полимеразу (pol) (например, psPAX2, addgene плазмида 12260), как показано на фиг. 7, плюс плазмида, кодирующая оболочку (например, pMD2.G, плазмида addgene 12259), как показано на фиг. 8. После трансфекции упаковочная плазмида экспрессирует белки Gag и Pol ВИЧ-1. На фиг. 7 использованы следующие сокращения: CMVenh: CMV энхансер и промотор, SD: донорные сайты сплайсинга, SA: акцепторные сайты сплайсинга, Gag: группоспецифический антиген, Pro: кодирует белок-предшественник, белок протеазы, Pol: кодирует белок обратной транскриптазы и интегразы, RRE: реактивный элемент rev, Amp: ампициллин. Плазмида MD2.G (фиг. 8) кодирует гликопротеин вируса везикулярного стоматита (VSV-G). Белок VSV-G используется в лентивирусных векторах для трансдукции широкого спектра клеток млекопитающих. На фиг. 8 использованы следующие сокращения: CMV: CMV энхансер и промотор, beta-globin intror: бета-глобиновый интрон, beta-globin pA: полиадениловый хвост бета-глобина.
Для этой цели можно использовать различные оболочки от разных видов вирусов. Лентивирусные векторы можно успешно псевдотипировать, не ограничиваясь этим, гликопротеинами оболочки (Env) амфотропного вируса мышиного лейкоза (MLV) или белком G вируса везикулярного стоматита (VSV-G), модифицированной оболочкой прототипического пенистого вируса (PFV) или вариантами химерного гликопротеина оболочки, полученными из вируса лейкемии обезьян гиббонов (GaLV) и MLV. Супернатанты трансфектированных клеток HEK293T можно собрать через 24-96 ч после трансфекции, и вирусные частицы можно, но не обязательно, концентрировать из супернатанта ультрацентрифугированием или другими методами. Для лентивирусной трансдукции иммунных клеток можно применять различные признанные протоколы. В одном аспекте мононуклеарные клетки периферической крови (PBMC) или выделенные Т-клетки можно активировать mab, специфичными для комплекса CD3, например клон OKT3 или UCHT1, введенное в растворе или нанесенное на пластиковые чашки для культивирования клеток или магнитные шарики. Активация PBMC или выделенных Т-клеток может быть дополнительно усилена стимуляцией костимуляторных путей с помощью моноклональных антител или лигандов, специфичных, не ограничиваясь этим, к CD27, CD28, CD134 или CD137, по отдельности или в различных комбинациях, и добавлением экзогенных рекомбинантных цитокинов, таких как, не ограничиваясь этим, интерлейкин (IL)-2, IL-7, IL-12, IL-15 и IL-21. Концентрированные или неконцентрированные вирусные частицы добавляют к культурам PBMC или Т-клеток через 24-96 ч после первоначального введения активирующих антител против CD3 и/или рекомбинантных цитокинов в виде однократных или многократных доз. Стабильную трансдукцию Т-клеток можно определить с помощью проточной цитометрии после окрашивания антителами против метки на поверхностную экспрессию RevCAR или mab, направленными против четвертого домена RevCAR, начиная с суток 3 после последнего введения вирусного супернатанта. Трансдуцированные RevCAR Т-клетки можно размножить in vitro их культивированием в условиях поставки рекомбинантных цитокинов и активации моноклональных анти-CD3-антител.
В еще одном варианте осуществления иммунные клетки можно генетически сконструировать с использованием методов редактирования генов, таких как эффекторные нуклеазы, подобные активатору транскрипции (TALEN), или кластеризованные регулярно распределенные короткие палиндромные повторы (CRISPR/Cas) для стабильной интеграции кодирующих последовательностей для RevCAR в геном клетки-хозяина и для облегчения поверхностной экспрессии RevCAR.
В случае, когда RevCAR содержит необязательный четвертый домен, пептидную последовательность, образующую линейный эпитоп для mab, то иммунные клетки, генетически модифицированные для экспрессии RevCAR, можно специфически размножить in vitro покрытием mab или фрагментами антитела, связывающихся с меткой RevCAR или с необязательным четвертым доменом RevCAR, на поверхность чашек для культивирования или на шарики любого типа, которые добавляют к культуре клеток в определенном соотношении, например, не ограничиваясь этим, 1 шарик на 1-4 RevCAR привитых-эффекторных клеток. Связывание mab на покрытой поверхности с меткой RevCAR или четвертым доменом индуцирует перекрестное связывание RevCAR, экспрессированных на клеточной поверхности, и образование иммунного синапса, что приводит к активации сигнальных путей, специфически запускаемых сигнальным доменом RevCAR. В зависимости от индуцированных сигнальных путей это может привести к усиленной пролиферации и устойчивой резистентности против вызванной активацией гибели RevCAR-несущих иммунных клеток, и, следовательно, к обогащению RevCAR- генетически модифицированных иммунных клеток в смешанной популяции.
Метку RevCAR или необязательный четвертый домен можно дополнительно использовать для обогащения и выделения иммунных клеток, экспрессирующих RevCAR, из смешанных популяций. Обогащение и выделение можно выполнить с помощью связывания mab или его фрагментов антител с меткой RevCAR или четвертым доменом RevCAR, чтобы либо пометить клетки, экспрессирующие RevCAR, для сортинга клеток, либо временно связать иммунные клетки, экспрессирующие RevCAR, с небольшими частицами, которые могут использоваться для выделения клеток. В одном аспекте RevCAR привитые-иммунные клетки инкубируют с mab, распознающим метку RevCAR или четвертый домен. Затем добавляют магнитные шарики, которые конъюгированы с антителами или их фрагментами, направленными против видоспецифичных и изотипических тяжелых и легких цепей mab, связывающегося с необязательным четвертым доменом. Таким образом иммунные клетки, экспрессирующие RevCAR, и магнитные шарики, связываются и могут быть захвачены и отделены от других иммунных клеток в магнитном поле.
В еще одном варианте осуществления изобретения метку RevCAR или необязательный четвертый домен можно использовать для детектирования поверхностной экспрессии UniCAR (Фиг. 9). На Фигуре 9 показано, что поверхностную экспрессию RevCAR можно детектировать с помощью моноклонального антитела, направленного против метки RevCAR, и последующим окрашиванием вторичным антивидовым антителом, конъюгированным с флуорохромом.
Популяции иммунных клеток, экспрессирующих RevCAR, можно формулировать для введения субъекту с использованием методик, известных специалисту в данной области.
Составы, содержащие популяции иммунных клеток, экспрессирующих RevCAR, могут включать фармацевтически приемлемые эксципиенты. Эксципиенты, включенные в составы, будут иметь разные функции в зависимости, например, от природы метки, содержащей RevCAR, используемой популяции иммунных клеток и способа введения. Примеры обычно используемых эксципиентов включают, без ограничения: физиологический раствор, забуференный физиологический раствор, декстрозу, воду для инъекций, глицерин, этанол и их комбинации, стабилизирующие агенты, солюбилизирующие агенты и поверхностно-активные вещества, буферы и консерванты, агенты тоничности, наполнители и смазывающие агенты. Составы, содержащие популяции иммунных клеток, экспрессирующих RevCAR, обычно получали и культивировали в отсутствие каких-либо компонентов, не относящихся к человеческим, таких как сыворотка животного (например, бычий сывороточный альбумин).
Состав может включать одну популяцию или более одной, например, две, три, четыре, пять, шесть или более популяций иммунных клеток, экспрессирующих RevCAR. Различные популяции RevCAR привитых-иммунных клеток могут варьироваться в зависимости от идентичности домена метки, идентичности домена сигнальной трансдукции, идентичности субпопуляций, режима генерации и культивирования или их комбинации. Например, композиция может включать популяции RevCAR-экспрессирующих T-клеток и NK-клеток, которые распознают и связываются с одним или более чем одним, например, двумя, тремя, четырьмя, пятью, шестью или более различными адаптерными модулями.
Составы, содержащие популяцию(и) иммунных клеток RevCAR, можно вводить субъекту с использованием способов и методик, известных специалисту в данной области. Примеры режимов введения включают внутривенную инъекцию, не ограничиваясь этим. Другие режимы включают, без ограничения, внутриопухолевый, внутрикожный, подкожный (s.c., s.q., sub-Q, Hypo), внутримышечный (в/м), внутрибрюшинный (в/б), внутриартериальный, интрамедулярный, внутрисердечный, внутрисуставной (сустав), внутрисиновиальный (в область суставной жидкости), внутрикраниальный, интраспинальный и интратекальный (в спинномозговую жидкость) путь введения. Любое известное устройство, пригодное для парентеральной инъекции или инфузии составов, можно использовать для осуществления такого введения. Инъекции могут выполняться как объемные, так и непрерывные.
Составы, содержащие популяцию(и) иммунных клеток, экспрессирующих RevCAR, которые вводят субъекту, содержат ряд RevCAR-экспрессирующих иммунных клеток, которые эффективны для лечения и/или профилактики конкретного показания или заболевания. Таким образом, терапевтически эффективные популяции иммунных клеток, экспрессирующих RevCAR, вводят субъектам при практическом применении способов по настоящему изобретению. Количество иммунных клеток, экспрессирующих RevCAR, вводимых субъекту, будет варьироваться в широких пределах, в зависимости от локализации, источника, идентичности, степени и тяжести заболевания, возраста и состояния здоровья пациента, подлежащего лечению, и т.д. В общем, вводят составы, которые содержат от примерно 1×104 до примерно 1×1010 иммунных клеток, экспрессирующих RevCAR. В большинстве случаев состав будет содержать примерно от 1×105 до примерно 1×109 иммунных клеток, экспрессирующих RevCAR, примерно от 5×105 до примерно 5×108 иммунных клеток, экспрессирующих RevCAR, или примерно от 1×106 до примерно 1×109 иммунных клеток, экспрессирующих RevCAR. В конечном итоге врач определит подходящие дозировки, которые следует использовать. В случае нежелательных явлений RevCAR привитые-иммунные клетки можно удалить из организма человека введением mab, направленным против метки RevCAR или четвертого домена, если он присутствует.
Получение адаптерных модулей
Адаптерные модули содержат два домена: связывающий фрагмент, специфичный для определенного белка или белкового комплекса на поверхности человеческой клетки, и домен связывания с меткой, который направлен против пептидной эпитопной метки поверхности клетки RevCAR. Адаптерные модули можно получить способами, известными специалистам в данной области. Данные способы включают, не ограничиваясь этим, рекомбинантную экспрессию в прокариотических или эукариотических клетках, искусственный синтез полипептидных цепей или химический синтез.
В одном аспекте адаптерный модуль можно экспрессировать в клетках яичника китайского хомячка (CHO, ACC-110), которые подходят для синтеза большого количества рекомбинантных белков в биологически активных формах. Последовательность нуклеиновой кислоты, кодирующая адаптерный модуль, может быть перенесена в клетки CHO с помощью принятых методов генной инженерии, таких как, среди прочего, трансфекция «голой» нуклеиновой кислоты, электропорация или вирусный перенос гена. Высокопродуктивные одноклеточные клоны могут быть выбраны из родительских линий с использованием, например, системы селекции на основе дигидрофолатредуктазы (DHFR). В данной системе DHFR-дефицитные мутанты клеток CHO (например, сублиния CHO DXB11 или DG44) генетически модифицируют котрансфекцией функциональной копии гена DHFR в дополнение к последовательности нуклеиновой кислоты, кодирующей адаптерный модуль. Затем проводят клональную селекцию культивированием в среде, не содержащей глицина, гипоксантина и тимидина. Высокопродуктивные клоны могут быть дополнительно отобрать культивированием клеток в среде с высокими уровнями метотрексата (MTX), аналога фолиевой кислоты, который блокирует активность DHFR. Поскольку модифицированные геном клетки должны «справляться» со снижением активности DHFR, которое не может быть устранено простым присутствием одной копии DHFR, то в этих условиях выживают клоны с амплифицированными копиями гена DHFR. Генетическая связь между DHFR и геном, представляющим интерес, гарантирует, что трансген также коамплифицируется, что повышает вероятность получения высокопродуктивного клеточного клона. Отобранные клеточные клоны культивируют в условиях надлежащей производственной практики, предпочтительно в отсутствии сыворотки животных. Адаптерные модули могут быть выделены из супернатантов клеточных культур с помощью принятых методов препаративной очистки белков, включая предварительные стадии, такие как осаждение или ультрацентрифугирование, и различные методы очистки, такие как, не ограничиваясь этим, эксклюзионная хроматография, аффинная или ионообменная хроматография. В одном аспекте последовательность нуклеиновой кислоты адаптерного модуля несет кодирующую последовательность для шести-десяти последовательных аминокислотных остатков гистидина, которые образуют полигистидиновую метку. Полигистидин прочно связывается с ионами двухвалентных металлов, таких как никель и кобальт. Супернатант клеточной культуры можно пропустить через колонку, содержащую иммобилизованные ионы никеля, которые связывают полигистидиновую метку, тогда как все немеченные белки проходят через колонку. Адаптерный модуль можно элюировать имидазолом, который конкурирует с полигистидиновой меткой за связывание с колонкой, или за счет снижения pH, что снижает аффинность метки к смоле. В одном аспекте адаптерный модуль подходит для аффинной хроматографии на основе L-белка (например, Capto L). В еще одном аспекте адаптерные молекулы могут нести вариабельную область семейства тяжелой цепи 3, что делает возможной очистку на колонке со смолами, включая специфический домен стафилококкового белка A (например, MabSelect).
Введение адаптерного модуля
Один или более адаптерных модулей, например два, три, четыре или более адаптерных модулей, могут быть формулированы для введения субъекту с использованием методик, известных специалистам в данной области.
Составы, содержащие один или более адаптерных модулей, могут включать фармацевтически приемлемый эксципиент(ы). Эксципиенты, включенные в составы, будут иметь разные функции в зависимости, например, от природы адаптерных модулей и способа введения. Примеры обычно используемых эксципиентов включают, без ограничения: физиологический раствор, забуференный физиологический раствор, декстрозу, воду для инъекций, глицерин, этанол и их комбинации, стабилизирующие агенты, солюбилизирующие агенты и поверхностно-активные вещества, буферы и консерванты, агенты тоничности, наполнители и смазывающие агенты. Составы, содержащие адаптерные модули, обычно готовят и культивируют в отсутствии каких-либо компонентов, не относящихся к человеческим, таких как сыворотка животных (например, бычий сывороточный альбумин).
Состав может включать один адаптерный модуль или более одного, например, два, три, четыре, пять, шесть или более адаптерных модулей, количество адаптерных модулей может варьироваться в зависимости от идентичности связывающего фрагмента, идентичности метки, режима генерации или их комбинации. Например, состав может содержать адаптерные модули, которые распознают и связываются с одним или более чем одним, например, с двумя, тремя, четырьмя, пятью, шестью или более различными белками поверхности человеческих клеток, белковыми комплексами или структурами внеклеточного матрикса.
Составы, содержащие популяцию(и) иммунных клеток, экспрессирующих RevCAR, можно инкубировать с составом, включающим один или более адаптерных модулей ex vivo, для «декорирования» иммунных клеток, экспрессирующих RevCAR, адаптерными модулями перед введением субъекту. Альтернативно, составы, включающие один или более адаптерных модулей, можно вводить непосредственно субъекту или можно выбрать комбинацию обеих стратегий. Путь и дозировка будут варьироваться в широких пределах, в зависимости от локализации, источника, идентичности, степени и тяжести заболевания, возраста и состояния здоровья пациента, подлежащего лечению, и т. д. В конечном итоге врач определит подходящие пути применения и дозировки для применения.
Составы, содержащие адаптерный модуль, вводятся субъекту в количестве, которое эффективно для лечения и/или профилактики конкретного показания или заболевания. Типичная доза, доставляемая на м2 поверхности тела в сутки, составляет от 1 нг до 1000 мг, предпочтительно от 5 нг до 1 мг, с дозами, которые вводят один или несколько раз в день или неделю или непрерывно в течение периода нескольких недель. Однако количество адаптерных модулей в составах, вводимых субъекту, будет варьироваться в широких пределах, в зависимости от локализации, источника, идентичности, степени и тяжести рака, возраста и состояния здоровья пациента, подлежащего лечению, и т. д. Врач в конечном итоге определит соответствующие дозировки, которые будут использоваться.
Настоящее изобретение относится к способам лечения субъекта, страдающего раком, инфекциями или аутоиммунными заболеваниями, включающим введение субъекту, нуждающемуся в лечении, одного или более составов адаптерного модуля, где адаптерный модуль связывается с раковой клеткой, и введение одной или более терапевтически эффективных популяций иммунных клеток, экспрессирующих RevCAR, где иммунные клетки, экспрессирующие RevCAR, связываются с адаптерным модулем и вызывают гибель клеток.
Термин «рак» предназначен для широкого толкования и охватывает все аспекты аномального роста клеток и/или деления клеток. Примеры включают: карциному, включая, помимо прочего, аденокарциному, плоскоклеточную карциному, аденоплоскоклеточную карциному, анапластическую карциному, крупноклеточную карциному, мелкоклеточную карциному и рак кожи, молочной железы, предстательной железы, мочевого пузыря, влагалища, шейки матки, матки, печени, почки, поджелудочной железы, селезенки, легкого, трахеи, бронхов, толстого кишечника, тонкого кишечника, желудка, пищевода, желчного пузыря; саркому, включая, помимо прочего, хондросаркому, саркому Юинга, злокачественную гемангиоэндотелиому, злокачественную шванному, остеосаркому, саркому мягких тканей и злокачественные опухоли костей, хрящей, жира, мышц, сосудов и кроветворных тканей; лимфому и лейкоз, включая, помимо прочего, новообразования из зрелых B-клеток, такие как хронический лимфолейкоз/малую лимфоцитарную лимфому, B-клеточный пролимфоцитарный лейкоз, лимфомы и новообразования из плазматических клеток, включая множественную миелому, новообразования из зрелых T-клеток и естественные клеток-киллеров (NK), такие как Т-клеточный пролимфоцитарный лейкоз, Т-клеточный крупногранулярный лимфоцитарный лейкоз, агрессивный NK-клеточный лейкоз и Т-клеточный лейкоз/лимфому взрослых, лимфомы Ходжкина и лимфопролиферативные нарушения, связанные с иммунодефицитом; эмбрионально-клеточные опухоли, включая, помимо прочего, рак яичка и яичника; бластому, включая, без ограничения, гепатобластому, медуллобластому, нефробластому, нейробластому, панкреатобластому, плевропульмональную бластому и ретинобластому. Данный термин также включает доброкачественные опухоли.
Как здесь используется, термины «лечить», «лечение» и «проводить лечение» имеют свои обычные и общепринятые значения и включают одно или более из следующего: блокирование, ослабление или снижение тяжести и/или частоты проявления симптомов рака у субъекта, и/или ингибирование роста, деления, распространения или пролиферации раковых клеток или прогрессирования рака (например, появления новых опухолей) у субъекта. Лечение означает блокирование, ослабление, снижение или ингибирование примерно на 1%-100% по сравнению с субъектом, для которого способы по настоящему изобретению не применялись на практике. Предпочтительно, блокирование, ослабление, снижение или ингибирование составляет примерно 100%, 99%, 98%, 97%, 96%, 95%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10%, 5% или 1% по сравнению с субъектом, для которого способы по настоящему изобретению не применялись на практике.
Частота введения обоих составов, содержащих популяции иммунных клеток, экспрессирующих RevCAR, и составов адаптерных модулей будет варьироваться в зависимости от факторов, которые включают заболевание, подлежащее лечению, элементы, содержащие иммунные клетки, экспрессирующие RevCAR, и адаптерные модули, а также способы введения. Каждый состав можно вводить независимо 4, 3, 2 или один раз в день, через день, один раз в три дня, один раз в четыре дня, один раз в пять дней, один раз в шесть дней, один раз в неделю, один раз в восемь дней, один раз в девять, один раз в десять дней, раз в две недели, месяц и два раза в месяц.
Продолжительность лечения зависит от заболевания, которое лечится, и лучше всего определяется лечащим врачом. Однако предполагается, что лечение будет продолжаться несколько дней, недель или месяцев.
Настоящее изобретение обеспечивает гибкость в способах лечения, и в результате состав(ы) адаптерных модулей и популяция(и) иммунных клеток, экспрессирующих RevCAR, можно вводить субъекту в любом порядке. Таким образом, состав(ы) адаптерных модулей можно вводить субъекту до, после или одновременно с популяцией(ями) иммунных клеток, экспрессирующих RevCAR. Альтернативно, если субъекту вводят более одного состава адаптерных модулей и/или более одной популяции иммунных клеток, экспрессирующих RevCAR, введение может быть чередующимся. Например, может быть введен первый состав адаптерных модулей, за которым следует первая популяция иммунных клеток, экспрессирующих RevCAR, за которым затем следует второй состав меченных белков, и затем вторая популяция иммунных клеток, экспрессирующих RevCAR.
Настоящее изобретение также включает способы, посредством которых популяцию иммунных клеток, экспрессирующих RevCAR, покрывают адаптерными модулями до введения субъекту иммунных клеток, экспрессирующих RevCAR.
В каждом из вариантов осуществления настоящего изобретения субъект, получающий лечение, представляет человека или животное, отличное от человека, например, примата, отличного от человека, птицу, лошадь, корову, козу, овцу, домашнее животное, такое как собака, кошка, или грызуна, или другое млекопитающее.
В одном варианте осуществления генетически сконструированные Т-клетки RevCAR могут быть специфически перенацелены против опухолевых клеток, экспрессирующих CD123, поверхностного маркера, часто обнаруживаемого в > 80% случаев острого миелоидного лейкоза (AML) и почти в 100% случаев острого лимфобластного лейкоза (ALL). Для этой цели были сконструированы два CD123-специфических адаптера, как показано на фиг. 3, синтезирована кДНК и клонирована в лентивирусный вектор и получена стабильная линия продуцирующих клеток СНО посредством лентивирусного переноса гена. Адаптерные модули выделяли из клеточного супернатанта с помощью С-концевой His-метки с использованием стандартной аффинной хроматографии с иммобилизованным металлом (IMAC). Один вариант адаптерного модуля содержал активный связывающий домен scFv, распознающий эпитоп La 5B9; в качестве альтернативы другой адаптерный модуль содержал scFv, распознающий эпитоп La 7B6 (фиг. 3). Оба модуля связывались с CD123-экспрессирующими клетками AML со сравнимой аффинностью 15 пМ и 11 пМ соответственно (фиг. 4A). Связывание с метками RevCAR можно также подтвердить экспериментами по связыванию с клетками-мишенями, экспрессирующими RevCAR (фиг. 4B). Аффинность обоих адаптерных модулей к их конкретной метке RevCAR была сопоставима с KD 12 пМ для метки La5B9 RevCAR и 14 пМ для метки La7B6 RevCAR (фиг. 4B).
Для перенаправления иммунных клеток с помощью CD123-специфических адаптерных модулей были сконструированы два RevCAR, содержащие эпитоп La 5B9 или La 7B6 в качестве метки RevCAR. Нативные Т-клетки человека были генетически сконструированы для экспрессии любого из двух RevCAR посредством лентивирусного переноса гена. После инкубации с бластом AML, экспрессирующим CD123, первичные Т-клетки RevCAR человека опосредовали специфический лизис бласта AML в присутствии соответствующей адаптерной молекулы в зависимости от концентрации (фиг. 5).
В дополнительном варианте осуществления обеспечивается нуклеиновая кислота, кодирующая обратный универсальный химерный антигенный рецептор, обозначенный как RevCAR1, в соответствии с SEQ ID NO: 1. Последовательность нуклеиновой кислоты кодирует лидерный пептид человеческого IL-2m в соответствии с SEQ ID NO: 2, эпитоп La 5B9 человека в соответствии с SEQ ID NO: 3, часть человеческого CD28 в соответствии с SEQ ID NO:D 4-6, включая внеклеточную часть человеческого CD28 с мутантным связывающим мотивом в соответствии с SEQ ID NO: 4, трансмембранный домен CD28 в соответствии с SEQ ID NO: 5, и внутриклеточная часть человеческого CD28, включающая мутированный мотив интернализации в соответствии с SEQ ID NO: 6, и дзета-домен CD3 человека в соответствии с SEQ ID NO: 7.
Продукт экспрессии белка из нуклеиновой кислоты в соответствии с SEQ ID NO: 1 можно получить в виде SEQ ID NO: 24.
Последовательность нуклеиновой кислоты эпитопа La 5B9 человека в соответствии с SEQ ID NO: 3 кодирует белковый домен в соответствии с SEQ ID NO: 28.
В дополнительном варианте осуществления обеспечивается последовательность нуклеиновой кислоты, кодирующая обратный универсальный химерный антигенный рецептор, обозначенная как RevCAR2 в соответствии с SEQ ID NO: 8. Последовательность нуклеиновой кислоты кодирует лидерный пептид человеческого IL-2m в соответствии с SEQ ID NO: 2, эпитоп La 5B9 человека в соответствии с SEQ ID NO: 3, внеклеточный шарнир и трансмембранную область цепи CD28 человека в соответствии с SEQ ID NO: 4 и 5, внутриклеточный сигнальный домен CD137 человека в соответствии с SEQ ID NO: 9, и внутриклеточный домен человеческого CD3дзета в соответствии с SEQ ID NO: 7.
Продукт экспрессии белка из выделенной последовательности нуклеиновой кислоты в соответствии с SEQ ID NO: 8 можно получить в виде SEQ ID NO: 25.
В еще одном варианте осуществления обеспечивается последовательность нуклеиновой кислоты, кодирующая обратный универсальный химерный антигенный рецептор, обозначенный как RevCAR3 в соответствии с SEQ ID NO: 10. Последовательность нуклеиновой кислоты кодирует лидерный пептид человеческого IL-2m в соответствии с SEQ ID NO: 2, эпитоп La 7B6 человека в соответствии с SEQ ID NO: 11, часть человеческого CD28 в соответствии с SEQ ID NO: 4-6, включая внеклеточную часть человеческого CD28 с мутантным связывающим мотивом в соответствии с SEQ ID NO:4, трансмембранный домен CD28 в соответствии с SEQ ID NO: 5, и внутриклеточную часть человеческого CD28, включающую мутированный мотив интернализации в соответствии с SEQ ID NO: 6, и внутриклеточный домен CD3дзета человека в соответствии с SEQ ID NO: 7.
Продукт экспрессии белка последовательности выделенной нуклеиновой кислоты в соответствии с SEQ ID NO: 10 можно получить в виде SEQ ID NO: 26.
Последовательность нуклеиновой кислоты эпитопа La 7B6 человека в соответствии с SEQ ID NO: 11 кодирует белковый домен в соответствии с SEQ ID NO: 29.
В еще одном варианте осуществления обеспечивается последовательность нуклеиновой кислоты, кодирующая обратный универсальный химерный антигенный рецептор, обозначенный как RevCAR4 в соответствии с SEQ ID NO: 12. Последовательность нуклеиновой кислоты кодирует лидерный пептид человеческого IL-2m в соответствии с SEQ ID NO: 2, эпитоп La 7B6 человека в соответствии с SEQ ID NO: 11, внеклеточный шарнир и трансмембранную область цепи CD28 человека в соответствии с SEQ ID NO: 4 и 5, внутриклеточный сигнальный домен CD137 человека в соответствии с SEQ ID NO: 9, и внутриклеточный домен человеческого CD3дзета в соответствии с SEQ ID NO: 7.
Продукт экспрессии белка последовательности выделенной нуклеиновой кислоты в соответствии с SEQ ID NO: 12 можно получить в виде SEQ ID NO: 27.
В дополнительных вариантах осуществления изобретения обеспечивается нуклеиновая кислота, кодирующая адаптерный модуль, где связывающие метку фрагменты адаптерных модулей включают антитела или их фрагменты, которые связываются с эпитопами 5B9 или 7B6 антигена La/SSB, предпочтительно в соответствии с SEQ ID NO: 14 и 15 или 18 и 19.
В дополнительных вариантах осуществления изобретения обеспечивается нуклеиновая кислота, кодирующая адаптерный модуль, где связывающие метку фрагменты адаптерных модулей включают антитела или их фрагменты, которые связываются с PSMA или CD123, предпочтительно в соответствии с SEQ ID NO: 20 и 21 или 22 и 23.
В еще одном варианте осуществления изобретения обеспечивается адаптерный модуль со связывающим фрагментом для простатспецифического мембранного антигена PSMA. Нуклеиновая кислота, кодирующая данный адаптерный модуль, содержит последовательности, кодирующие лидерный пептид IgG каппа в соответствии с SEQ ID NO: 13, гуманизированную тяжелую цепь scFv против La 5B9 в соответствии с SEQ ID NO: 14, гуманизированную легкую цепь scFv против La 5B9 в соответствии с SEQ ID NO: 15, гуманизированную тяжелую цепь scFv против PSMA в соответствии с SEQ ID NO: 20, гуманизированную легкую цепь scFv против PSMA в соответствии с SEQ ID NO: 21, myc-метку в соответствии с SEQ ID NO: 16 и his-метку в соответствии с SEQ ID NO: 17.
В еще одном варианте осуществления изобретения обеспечивается адаптерный модуль со связывающим фрагментом для простатспецифического мембранного антигена PSMA. Нуклеиновая кислота, кодирующая данный адаптерный модуль, содержит последовательности, кодирующие лидерный пептид IgG каппа в соответствии с SEQ ID NO: 13, гуманизированную тяжелую цепь scFv против La 7B6 в соответствии с SEQ ID NO: 18, гуманизированную легкую цепь scFv против La 7B6 в соответствии с SEQ ID NO: 19, гуманизированную тяжелую цепь scFv против PSMA в соответствии с SEQ ID NO: 20, гуманизированную легкую цепь scFv против PSMA в соответствии с SEQ ID NO: 21, myc-метку в соответствии с SEQ ID NO: 16 и his-метку в соответствии с SEQ ID NO: 17.
В еще одном варианте осуществления изобретения обеспечивается адаптерный модуль со связывающим фрагментом для лейкозного антигена CD123. Нуклеиновая кислота, кодирующая этот адаптерный модуль, содержит последовательности, кодирующие лидерный пептид IgG каппа в соответствии с SEQ ID NO: 13, гуманизированную тяжелую цепь scFv против La 5B9 в соответствии с SEQ ID NO: 14, гуманизированную легкую цепь scFv против La 5B9 в соответствии с SEQ ID NO: 15, гуманизированную тяжелую цепь scFv против CD123 в соответствии с SEQ ID NO: 22, гуманизированную легкую цепь scFv против CD123 в соответствии с SEQ ID NO: 23, myc-метку в соответствии с SEQ ID NO: 16 и his- метку в соответствии с SEQ ID NO: 17.
В дополнительном варианте осуществления изобретения обеспечивается адаптерный модуль со связывающим фрагментом для лейкозного антигена CD123. Нуклеиновая кислота, кодирующая этот адаптерный модуль, содержит последовательности, кодирующие лидерный пептид IgG каппа в соответствии с SEQ ID NO: 13, гуманизированную тяжелую цепь scFv против La 7B6 в соответствии с SEQ ID NO: 18, гуманизированную легкую цепь scFv против La 7B6 в соответствии с SEQ ID NO: 19, гуманизированную тяжелую цепь scFv против CD123 в соответствии с SEQ ID NO: 22, гуманизированную легкую цепь scFv против CD123 в соответствии с SEQ ID NO: 23, myc-метку в соответствии с SEQ ID NO: 16 и his- метку в соответствии с SEQ ID NO: 17.
Последовательность нуклеиновой кислоты гуманизированной тяжелой цепи вариабельной области против La 5B9 в соответствии с SEQ ID NO: 14 кодирует белок в соответствии с SEQ ID NO: 30, тогда как последовательность нуклеиновой кислоты гуманизированной легкой цепи вариабельной области против La 5B9 в соответствии с SEQ ID NO: 15 кодирует белок в соответствии с SEQ ID NO: 31.
Последовательность нуклеиновой кислоты myc-метки в соответствии с SEQ ID NO: 16 кодирует белок в соответствии с SEQ ID NO: 32, тогда как последовательность нуклеиновой кислоты his-метки в соответствии с SEQ ID NO: 17 кодирует белок в соответствии с SEQ ID NO: 33.
Последовательность нуклеиновой кислоты гуманизированной тяжелой цепи вариабельной области против 7B6 в соответствии с SEQ ID NO: 18 кодирует белок в соответствии с SEQ ID NO: 34, тогда как последовательность нуклеиновой кислоты гуманизированной вариабельной области легкой цепи против 7B6 в соответствии с SEQ ID NO: 19 кодирует белок в соответствии с SEQ ID NO: 35.
Последовательность нуклеиновой кислоты гуманизированной тяжелой цепи вариабельной области против PSMA в соответствии с SEQ ID NO: 20 кодирует белок в соответствии с SEQ ID NO: 36, тогда как последовательность нуклеиновой кислоты гуманизированной легкой цепи вариабельной области против PSMA в соответствии с SEQ ID NO: 21 кодирует белок в соответствии с SEQ ID NO: 37.
Последовательность нуклеиновой кислоты гуманизированной тяжелой цепи вариабельной области против CD123 в соответствии с SEQ ID NO: 22 кодирует белок в соответствии с SEQ ID NO: 38, тогда как последовательность нуклеиновой кислоты гуманизированной вариабельной области легкой цепи против CD123 в соответствии с SEQ ID NO: 23 кодирует белок в соответствии с SEQ ID NO: 39.
--->
Список последовательностей
<110> GEMoaB Monoclonals GmbH
<120> ИММУННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ОБРАТНЫЙ УНИВЕРСАЛЬНЫЙ ХИМЕРНЫЙ
АНТИГЕННЫЙ РЕЦЕПТОР, ДЛЯ НАЦЕЛИВАНИЯ НА РАЗЛИЧНЫЕ МНОГОЧИСЛЕННЫЕ АНТИГЕНЫ, И
СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ИНФЕКЦИЙ И АУТОИММУННЫХ
ЗАБОЛЕВАНИЙ
<130> 01281P0017EPWO
<150> 18 177 502.4
<151> 2018-06-13
<160> 39
<170> PatentIn version 3.5
<210> 1
<211> 1101
<212> ДНК
<213> ИСКУССТВЕННАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ
<220>
<223> Homo sapiens
<400> 1
atgcgccgca tgcagctgct gcttctgatc gctctgagcc tggctcttgt gaccaactct 60
gaattcaaac ccctacctga agtgactgat gagtatgctg ccgctgggcc cggaggaggc 120
ggcagcaaga tcctggtcaa acagtcccct atgctggtcg cttacgacaa cgccgttaat 180
ctgagttgca aatatagtta caacctgttt agccgggaat ttcgcgcatc tctccacaag 240
ggactggatt ctgcggttga ggtttgtgtg gtctatggca attatagcca gcaactgcaa 300
gtgtacagca aaacaggctt taactgcgac gggaaactcg ggaacgaatc agtgaccttc 360
tatctgcaga acctgtacgt taaccaaaca gatatttact tctgcaagat agaggtgatg 420
gctccaccgc cagcactgga taacgagaag tccaatggaa ccatcattca cgtcaagggg 480
aagcatctgt gtccttcccc gttgttccct gggccgagca aacccttttg ggtgcttgtg 540
gtagttggcg gggtattggc ctgctattcc cttctcgtaa ctgtggcctt catcatcttc 600
tgggtcagat ctaagaggtc taggggcggg catagcgact acatgaacat gacacccagg 660
cggcctggcc ccactcgcaa acactaccag ccatacgcac caccaagaga ctttgccgca 720
tatcggagtg gtggcggcgg gtcaggaggt ggagctagcg gtggaggagg ttccttctct 780
aggtcagctg atgctcccgc ctatcagcaa ggtcagaacc agctctacaa tgagctgaat 840
ctgggacgtc gggaggagta cgacgtgctg gataaacgaa gaggacgcga tcccgagatg 900
ggtgggaagc ctaggcgcaa gaatccccag gaaggcctct acaatgaact gcagaaagac 960
aagatggccg aagcctacag cgagattggc atgaaagggg agcgacggag aggaaaggga 1020
catgacgggt tgtatcaggg tctttccact gcgacaaagg atacctatgg ggctctgcac 1080
atgcaagcac tgccacctag a 1101
<210> 2
<211> 60
<212> ДНК
<213> Homo sapiens
<400> 2
atgcgccgca tgcagctgct gcttctgatc gctctgagcc tggctcttgt gaccaactct 60
<210> 3
<211> 30
<212> ДНК
<213> Homo sapiens
<400> 3
aaacccctac ctgaagtgac tgatgagtat 30
<210> 4
<211> 399
<212> ДНК
<213> Homo sapiens
<400> 4
aagatcctgg tcaaacagtc ccctatgctg gtcgcttacg acaacgccgt taatctgagt 60
tgcaaatata gttacaacct gtttagccgg gaatttcgcg catctctcca caagggactg 120
gattctgcgg ttgaggtttg tgtggtctat ggcaattata gccagcaact gcaagtgtac 180
agcaaaacag gctttaactg cgacgggaaa ctcgggaacg aatcagtgac cttctatctg 240
cagaacctgt acgttaacca aacagatatt tacttctgca agatagaggt gatggctcca 300
ccgccagcac tggataacga gaagtccaat ggaaccatca ttcacgtcaa ggggaagcat 360
ctgtgtcctt ccccgttgtt ccctgggccg agcaaaccc 399
<210> 5
<211> 81
<212> ДНК
<213> Homo sapiens
<400> 5
ttttgggtgc ttgtggtagt tggcggggta ttggcctgct attcccttct cgtaactgtg 60
gccttcatca tcttctgggt c 81
<210> 6
<211> 123
<212> ДНК
<213> Homo sapiens
<400> 6
agatctaaga ggtctagggg cgggcatagc gactacatga acatgacacc caggcggcct 60
ggccccactc gcaaacacta ccagccatac gcaccaccaa gagactttgc cgcatatcgg 120
agt 123
<210> 7
<211> 327
<212> ДНК
<213> Homo sapiens
<400> 7
ttctctaggt cagctgatgc tcccgcctat cagcaaggtc agaaccagct ctacaatgag 60
ctgaatctgg gacgtcggga ggagtacgac gtgctggata aacgaagagg acgcgatccc 120
gagatgggtg ggaagcctag gcgcaagaat ccccaggaag gcctctacaa tgaactgcag 180
aaagacaaga tggccgaagc ctacagcgag attggcatga aaggggagcg acggagagga 240
aagggacatg acgggttgta tcagggtctt tccactgcga caaaggatac ctatggggct 300
ctgcacatgc aagcactgcc acctaga 327
<210> 8
<211> 1137
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 8
atgcgccgca tgcagctgct gcttctgatc gctctgagcc tggctcttgt gaccaactct 60
gaattcaaac ccctacctga agtgactgat gagtatgctg ccgctgggcc cggaggaggc 120
ggcagcaaga tcctggtcaa acagtcccct atgctggtcg cttacgacaa cgccgttaat 180
ctgagttgca aatatagtta caacctgttt agccgggaat ttcgcgcatc tctccacaag 240
ggactggatt ctgcggttga ggtttgtgtg gtctatggca attatagcca gcaactgcaa 300
gtgtacagca aaacaggctt taactgcgac gggaaactcg ggaacgaatc agtgaccttc 360
tatctgcaga acctgtacgt taaccaaaca gatatttact tctgcaagat agaggtgatg 420
gctccaccgc cagcactgga taacgagaag tccaatggaa ccatcattca cgtcaagggg 480
aagcatctgt gtccttcccc gttgttccct gggccgagca aacccttttg ggtgcttgtg 540
gtagttggcg gggtattggc ctgctattcc cttctcgtaa ctgtggcctt catcatcttc 600
tgggtcagat ctaagaggtc taggggcggg ggcgggtcaa aacgcggacg gaagaaactg 660
ctgtacatct tcaagcagcc cttcatgcgc cccgtgcaga caacacagga agaggacggt 720
tgcagctgcc gatttcccga agaggaggag ggaggctgtg aattgggtgg cggcgggtca 780
ggaggtggag ctagcggtgg aggaggttcc ttctctaggt cagctgatgc tcccgcctat 840
cagcaaggtc agaaccagct ctacaatgag ctgaatctgg gacgtcggga ggagtacgac 900
gtgctggata aacgaagagg acgcgatccc gagatgggtg ggaagcctag gcgcaagaat 960
ccccaggaag gcctctacaa tgaactgcag aaagacaaga tggccgaagc ctacagcgag 1020
attggcatga aaggggagcg acggagagga aagggacatg acgggttgta tcagggtctt 1080
tccactgcga caaaggatac ctatggggct ctgcacatgc aagcactgcc acctaga 1137
<210> 9
<211> 126
<212> ДНК
<213> Homo sapiens
<400> 9
aaacgcggac ggaagaaact gctgtacatc ttcaagcagc ccttcatgcg ccccgtgcag 60
acaacacagg aagaggacgg ttgcagctgc cgatttcccg aagaggagga gggaggctgt 120
gaattg 126
<210> 10
<211> 1125
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 10
atgcgccgca tgcagctgct gcttctgatc gctctgagcc tggctcttgt gaccaactct 60
gaattcgaga aagaagcact gaagaaaata atagaagacc aacaagaatc cctaaacaaa 120
gctgccgctg ggcccggagg aggcggcagc aagatcctgg tcaaacagtc ccctatgctg 180
gtcgcttacg acaacgccgt taatctgagt tgcaaatata gttacaacct gtttagccgg 240
gaatttcgcg catctctcca caagggactg gattctgcgg ttgaggtttg tgtggtctat 300
ggcaattata gccagcaact gcaagtgtac agcaaaacag gctttaactg cgacgggaaa 360
ctcgggaacg aatcagtgac cttctatctg cagaacctgt acgttaacca aacagatatt 420
tacttctgca agatagaggt gatggctcca ccgccagcac tggataacga gaagtccaat 480
ggaaccatca ttcacgtcaa ggggaagcat ctgtgtcctt ccccgttgtt ccctgggccg 540
agcaaaccct tttgggtgct tgtggtagtt ggcggggtat tggcctgcta ttcccttctc 600
gtaactgtgg ccttcatcat cttctgggtc agatctaaga ggtctagggg cgggcatagc 660
gactacatga acatgacacc caggcggcct ggccccactc gcaaacacta ccagccatac 720
gcaccaccaa gagactttgc cgcatatcgg agtggtggcg gcgggtcagg aggtggagct 780
agcggtggag gaggttcctt ctctaggtca gctgatgctc ccgcctatca gcaaggtcag 840
aaccagctct acaatgagct gaatctggga cgtcgggagg agtacgacgt gctggataaa 900
cgaagaggac gcgatcccga gatgggtggg aagcctaggc gcaagaatcc ccaggaaggc 960
ctctacaatg aactgcagaa agacaagatg gccgaagcct acagcgagat tggcatgaaa 1020
ggggagcgac ggagaggaaa gggacatgac gggttgtatc agggtctttc cactgcgaca 1080
aaggatacct atggggctct gcacatgcaa gcactgccac ctaga 1125
<210> 11
<211> 54
<212> ДНК
<213> Homo sapiens
<400> 11
gagaaagaag cactgaagaa aataatagaa gaccaacaag aatccctaaa caaa 54
<210> 12
<211> 1161
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 12
atgcgccgca tgcagctgct gcttctgatc gctctgagcc tggctcttgt gaccaactct 60
gaattcgaga aagaagcact gaagaaaata atagaagacc aacaagaatc cctaaacaaa 120
gctgccgctg ggcccggagg aggcggcagc aagatcctgg tcaaacagtc ccctatgctg 180
gtcgcttacg acaacgccgt taatctgagt tgcaaatata gttacaacct gtttagccgg 240
gaatttcgcg catctctcca caagggactg gattctgcgg ttgaggtttg tgtggtctat 300
ggcaattata gccagcaact gcaagtgtac agcaaaacag gctttaactg cgacgggaaa 360
ctcgggaacg aatcagtgac cttctatctg cagaacctgt acgttaacca aacagatatt 420
tacttctgca agatagaggt gatggctcca ccgccagcac tggataacga gaagtccaat 480
ggaaccatca ttcacgtcaa ggggaagcat ctgtgtcctt ccccgttgtt ccctgggccg 540
agcaaaccct tttgggtgct tgtggtagtt ggcggggtat tggcctgcta ttcccttctc 600
gtaactgtgg ccttcatcat cttctgggtc agatctaaga ggtctagggg cgggggcggg 660
tcaaaacgcg gacggaagaa actgctgtac atcttcaagc agcccttcat gcgccccgtg 720
cagacaacac aggaagagga cggttgcagc tgccgatttc ccgaagagga ggagggaggc 780
tgtgaattgg gtggcggcgg gtcaggaggt ggagctagcg gtggaggagg ttccttctct 840
aggtcagctg atgctcccgc ctatcagcaa ggtcagaacc agctctacaa tgagctgaat 900
ctgggacgtc gggaggagta cgacgtgctg gataaacgaa gaggacgcga tcccgagatg 960
ggtgggaagc ctaggcgcaa gaatccccag gaaggcctct acaatgaact gcagaaagac 1020
aagatggccg aagcctacag cgagattggc atgaaagggg agcgacggag aggaaaggga 1080
catgacgggt tgtatcaggg tctttccact gcgacaaagg atacctatgg ggctctgcac 1140
atgcaagcac tgccacctag a 1161
<210> 13
<211> 63
<212> ДНК
<213> Homo sapiens
<400> 13
atggagacag acacactcct gctatgggta ctgctgctct gggttccagg ttccactggt 60
gac 63
<210> 14
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 14
caggtgcagc tggtgcagag cggagccgag gtgaagaagc ctggagcctc tgtgaaggtg 60
agctgcaagg cttctggcta caccttcacc cactactaca tctactgggt gagacaggct 120
cccggacagg gcctggagtg gatgggaggc gtgaacccca gcaacggagg cacccacttc 180
aacgagaagt tcaagtctcg cgtgaccatg acccgcgaca ccagcatctc taccgcttac 240
atggagctga gccgcctgcg ctctgatgat accgctgtgt actactgcgc tcgcagcgag 300
tacgattacg gactgggctt cgcctactgg ggccagggaa ccctggtgac cgtgagctct 360
<210> 15
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 15
gatatcgtga tgacccagtc tcctgatagc ctggctgtga gcctgggcga gagagctacc 60
atcaactgca agagcagcca gagcctgctg aactctcgca cccctaagaa ctaccttgct 120
tggtaccagc agaagcctgg acagccccct aagctgctga tctactgggc ttctacccgc 180
aagagcggcg tgcccgacag attctctggc agcggaagcg gcaccgattt caccctgacc 240
atcagcagcc tgcaggctga ggacgtggcc gtgtactact gcaagcagtc ttacaacctg 300
ctgaccttcg gaggcggaac caaggtggag atcaag 336
<210> 16
<211> 30
<212> ДНК
<213> Homo sapiens
<400> 16
gaacaaaaac tcatctcaga agaggatctg 30
<210> 17
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гексагистидин
<400> 17
catcatcatc atcatcat 18
<210> 18
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 18
gacattgtta tgacccagag cccggactct ctcgctgtta gtcttggtga gcgagcgact 60
attaactgcc ggagcagtca gagtttgttg gactctcgga cgaaaaagaa ctacctggca 120
tggtaccagc agaagccggg ccaaccacct aaattactga tatattgggc gtcgactcgt 180
gagtcagggg taccggacag gttttctgga agcggatcag gaacagactt cactttgacg 240
atctcttcgc ttcaagccga ggacgttgcg gtttattatt gtaagcaaag ctataatctg 300
ccgacatttg gtggcggcac caaggttgaa attaag 336
<210> 19
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 19
gaggtgcaac tggtcgaaag tggcggtggt ttagttcagc ctggtggaag tctacggctt 60
agctgcgcag catccggttt cacctttagc gacttttgga tgaactgggt tcggcaggct 120
ccgggcaaag gactggagtg ggttgggcaa atccgcaaca aaccgaataa ctacgaaact 180
tattactcag atagcctgaa gggtcgattc accatcagca gggatgattc aaagtcaatc 240
acttacctac agatgaactc attaagagcg gaggatactg cggtgtatta ctgtacacta 300
ggtaactcct ggttcgcgta ttggggacag ggcacccttg taaccgtctc cagc 354
<210> 20
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 20
gaggtgcagc tgcagcagtc aggacctgaa ctggtgaagc ctgggacttc agtgaggata 60
tcctgcaaga cttctggata cacattcact gaatatacca tacactgggt gaagcagagc 120
catggaaaga gccttgagtg gattggaaac atcaatccta acaatggtgg taccacctac 180
aatcagaagt tcgaggacaa ggccacattg actgtagaca agtcctccag tacagcctac 240
atggagctcc gcagcctaac atctgaggat tctgcagtct attattgtgc agctggttgg 300
aactttgact actggggcca agggaccacg gtcaccgtct cctca 345
<210> 21
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 21
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcatctgta aggccagtca agatgtgggt actgctgtag actggtatca acagaaacca 120
ggacaatctc ctaaactact gatttattgg gcatccactc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagac ttcactctca ccattactaa tgttcagtct 240
gaagacttgg cagattattt ctgtcagcaa tataacagct atcccctcac gttcggtgct 300
gggaccatgc tggacctgaa a 321
<210> 22
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 22
gaagtgcagc tgcagcagtc tggccccgag ctggtcaaac caggcgccag cgtgaagatg 60
agctgcaagg ccagcggcta caccttcacc gactactaca tgaagtgggt caagcagagc 120
cacggcaaga gcctggaatg gatcggcgac atcatcccca gcaacggcgc caccttctac 180
aaccagaagt tcaagggcaa ggccaccctg accgtggaca gaagcagcag caccgcctac 240
atgcacctga acagcctgac cagcgaggac agcgccgtgt actactgcac cagaagccat 300
ctgctgcggg ccagttggtt cgcttattgg ggccagggca ccctggtcac agtgtct 357
<210> 23
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 23
gacttcgtga tgacccagag ccctagcagc ctgaccgtga cagccggcga gaaagtgacc 60
atgagctgca agagcagcca gagcctgctg aactccggca accagaagaa ctacctgacc 120
tggtatctgc agaagcccgg acagcccccc aagctgctga tctactgggc cagcaccaga 180
gaaagcggcg tgcccgatag attcacaggc agcggcagcg gcaccgactt caccctgaca 240
atcagcagcg tgcaggccga ggacctggcc gtgtactatt gccagaacga ctacagctac 300
ccctacacct tcggaggcgg gaccaagctg gaaatcaag 339
<210> 24
<211> 367
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 24
Met Arg Arg Met Gln Leu Leu Leu Leu Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Glu Phe Lys Pro Leu Pro Glu Val Thr Asp Glu Tyr
20 25 30
Ala Ala Ala Gly Pro Gly Gly Gly Gly Ser Lys Ile Leu Val Lys Gln
35 40 45
Ser Pro Met Leu Val Ala Tyr Asp Asn Ala Val Asn Leu Ser Cys Lys
50 55 60
Tyr Ser Tyr Asn Leu Phe Ser Arg Glu Phe Arg Ala Ser Leu His Lys
65 70 75 80
Gly Leu Asp Ser Ala Val Glu Val Cys Val Val Tyr Gly Asn Tyr Ser
85 90 95
Gln Gln Leu Gln Val Tyr Ser Lys Thr Gly Phe Asn Cys Asp Gly Lys
100 105 110
Leu Gly Asn Glu Ser Val Thr Phe Tyr Leu Gln Asn Leu Tyr Val Asn
115 120 125
Gln Thr Asp Ile Tyr Phe Cys Lys Ile Glu Val Met Ala Pro Pro Pro
130 135 140
Ala Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly
145 150 155 160
Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe
165 170 175
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
180 185 190
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
195 200 205
Gly Gly His Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro
210 215 220
Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala
225 230 235 240
Tyr Arg Ser Gly Gly Gly Gly Ser Gly Gly Gly Ala Ser Gly Gly Gly
245 250 255
Gly Ser Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
260 265 270
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
275 280 285
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
290 295 300
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
305 310 315 320
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
325 330 335
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
340 345 350
Lys Asp Thr Tyr Gly Ala Leu His Met Gln Ala Leu Pro Pro Arg
355 360 365
<210> 25
<211> 379
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 25
Met Arg Arg Met Gln Leu Leu Leu Leu Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Glu Phe Lys Pro Leu Pro Glu Val Thr Asp Glu Tyr
20 25 30
Ala Ala Ala Gly Pro Gly Gly Gly Gly Ser Lys Ile Leu Val Lys Gln
35 40 45
Ser Pro Met Leu Val Ala Tyr Asp Asn Ala Val Asn Leu Ser Cys Lys
50 55 60
Tyr Ser Tyr Asn Leu Phe Ser Arg Glu Phe Arg Ala Ser Leu His Lys
65 70 75 80
Gly Leu Asp Ser Ala Val Glu Val Cys Val Val Tyr Gly Asn Tyr Ser
85 90 95
Gln Gln Leu Gln Val Tyr Ser Lys Thr Gly Phe Asn Cys Asp Gly Lys
100 105 110
Leu Gly Asn Glu Ser Val Thr Phe Tyr Leu Gln Asn Leu Tyr Val Asn
115 120 125
Gln Thr Asp Ile Tyr Phe Cys Lys Ile Glu Val Met Ala Pro Pro Pro
130 135 140
Ala Leu Asp Asn Glu Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly
145 150 155 160
Lys His Leu Cys Pro Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe
165 170 175
Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu
180 185 190
Val Thr Val Ala Phe Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg
195 200 205
Gly Gly Gly Gly Ser Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Gly
245 250 255
Gly Gly Gly Ser Gly Gly Gly Ala Ser Gly Gly Gly Gly Ser Phe Ser
260 265 270
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
275 280 285
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
290 295 300
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
305 310 315 320
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
325 330 335
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
340 345 350
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
355 360 365
Gly Ala Leu His Met Gln Ala Leu Pro Pro Arg
370 375
<210> 26
<211> 375
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 26
Met Arg Arg Met Gln Leu Leu Leu Leu Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Glu Phe Glu Lys Glu Ala Leu Lys Lys Ile Ile Glu
20 25 30
Asp Gln Gln Glu Ser Leu Asn Lys Ala Ala Ala Gly Pro Gly Gly Gly
35 40 45
Gly Ser Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr Asp
50 55 60
Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser Arg
65 70 75 80
Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu Val
85 90 95
Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser Lys
100 105 110
Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr Phe
115 120 125
Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys Lys
130 135 140
Ile Glu Val Met Ala Pro Pro Pro Ala Leu Asp Asn Glu Lys Ser Asn
145 150 155 160
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
165 170 175
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
180 185 190
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
195 200 205
Trp Val Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn
210 215 220
Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr
225 230 235 240
Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Gly Gly Gly Gly Ser
245 250 255
Gly Gly Gly Ala Ser Gly Gly Gly Gly Ser Phe Ser Arg Ser Ala Asp
260 265 270
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
275 280 285
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
290 295 300
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
305 310 315 320
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
325 330 335
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
340 345 350
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Gly Ala Leu His
355 360 365
Met Gln Ala Leu Pro Pro Arg
370 375
<210> 27
<211> 387
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Homo sapiens
<400> 27
Met Arg Arg Met Gln Leu Leu Leu Leu Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Glu Phe Glu Lys Glu Ala Leu Lys Lys Ile Ile Glu
20 25 30
Asp Gln Gln Glu Ser Leu Asn Lys Ala Ala Ala Gly Pro Gly Gly Gly
35 40 45
Gly Ser Lys Ile Leu Val Lys Gln Ser Pro Met Leu Val Ala Tyr Asp
50 55 60
Asn Ala Val Asn Leu Ser Cys Lys Tyr Ser Tyr Asn Leu Phe Ser Arg
65 70 75 80
Glu Phe Arg Ala Ser Leu His Lys Gly Leu Asp Ser Ala Val Glu Val
85 90 95
Cys Val Val Tyr Gly Asn Tyr Ser Gln Gln Leu Gln Val Tyr Ser Lys
100 105 110
Thr Gly Phe Asn Cys Asp Gly Lys Leu Gly Asn Glu Ser Val Thr Phe
115 120 125
Tyr Leu Gln Asn Leu Tyr Val Asn Gln Thr Asp Ile Tyr Phe Cys Lys
130 135 140
Ile Glu Val Met Ala Pro Pro Pro Ala Leu Asp Asn Glu Lys Ser Asn
145 150 155 160
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
165 170 175
Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val Val Gly Gly
180 185 190
Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe Ile Ile Phe
195 200 205
Trp Val Arg Ser Lys Arg Ser Arg Gly Gly Gly Gly Ser Lys Arg Gly
210 215 220
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
225 230 235 240
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
245 250 255
Glu Glu Gly Gly Cys Glu Leu Gly Gly Gly Gly Ser Gly Gly Gly Ala
260 265 270
Ser Gly Gly Gly Gly Ser Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
275 280 285
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
290 295 300
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
305 310 315 320
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
325 330 335
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
340 345 350
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
355 360 365
Ser Thr Ala Thr Lys Asp Thr Tyr Gly Ala Leu His Met Gln Ala Leu
370 375 380
Pro Pro Arg
385
<210> 28
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 28
Lys Pro Leu Pro Glu Val Thr Asp Glu Tyr
1 5 10
<210> 29
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 29
Glu Lys Glu Ala Leu Lys Lys Ile Ile Glu Asp Gln Gln Glu Ser Leu
1 5 10 15
Asn
<210> 30
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 30
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr His Tyr
20 25 30
Tyr Ile Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Val Asn Pro Ser Asn Gly Gly Thr His Phe Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Glu Tyr Asp Tyr Gly Leu Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 31
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 31
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Pro Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asn Leu Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 32
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 32
Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
1 5 10
<210> 33
<211> 6
<212> БЕЛОК
<213> Homo sapiens
<400> 33
His His His His His His
1 5
<210> 34
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Arg Thr Lys Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asn Leu Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 35
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мышиная-человеческая химерная конструкция
<400> 35
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Gln Ile Arg Asn Lys Pro Asn Asn Tyr Glu Thr Tyr Tyr Ser Asp
50 55 60
Ser Leu Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Leu Gly Asn Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 36
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 36
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Glu Tyr
20 25 30
Thr Ile His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Glu Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Gly Trp Asn Phe Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 37
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 37
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Ile Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Asp Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Met Leu Asp Leu Lys
100 105
<210> 38
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 38
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser
115
<210> 39
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Человеческая-мышиная химерная конструкция
<400> 39
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ РЕЦЕПТОРЫ | 2018 |
|
RU2825816C2 |
| РЕКОМБИНАНТНЫЕ ВИРУСНЫЕ ЧАСТИЦЫ С МОДИФИЦИРОВАННЫМ ТРОПИЗМОМ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛЕННОГО ВВЕДЕНИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА В КЛЕТКИ ЧЕЛОВЕКА | 2018 |
|
RU2811426C2 |
| Т-КЛЕТКИ С ДВУМЯ ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ CAR | 2021 |
|
RU2839662C1 |
| СПЕЦИФИЧНЫЕ К MUC16 ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795198C2 |
| НОВЫЕ КОНСТРУКЦИИ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА, СОДЕРЖАЩИЕ ДОМЕНЫ TNFR2 | 2019 |
|
RU2808254C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ ДОМЕНЫ ПРОТИВ TRBC1 | 2018 |
|
RU2791327C2 |
| АНТИТЕЛА К ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРАМ, ПОЛУЧЕННЫМ ИЗ 4G7 | 2020 |
|
RU2826051C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2019 |
|
RU2810092C2 |
| Выделенный альтернативный внутриклеточный сигнальный домен химерного антигенного рецептора и включающий его химерный антигенный рецептор | 2019 |
|
RU2742000C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА FLT3 | 2018 |
|
RU2820859C2 |
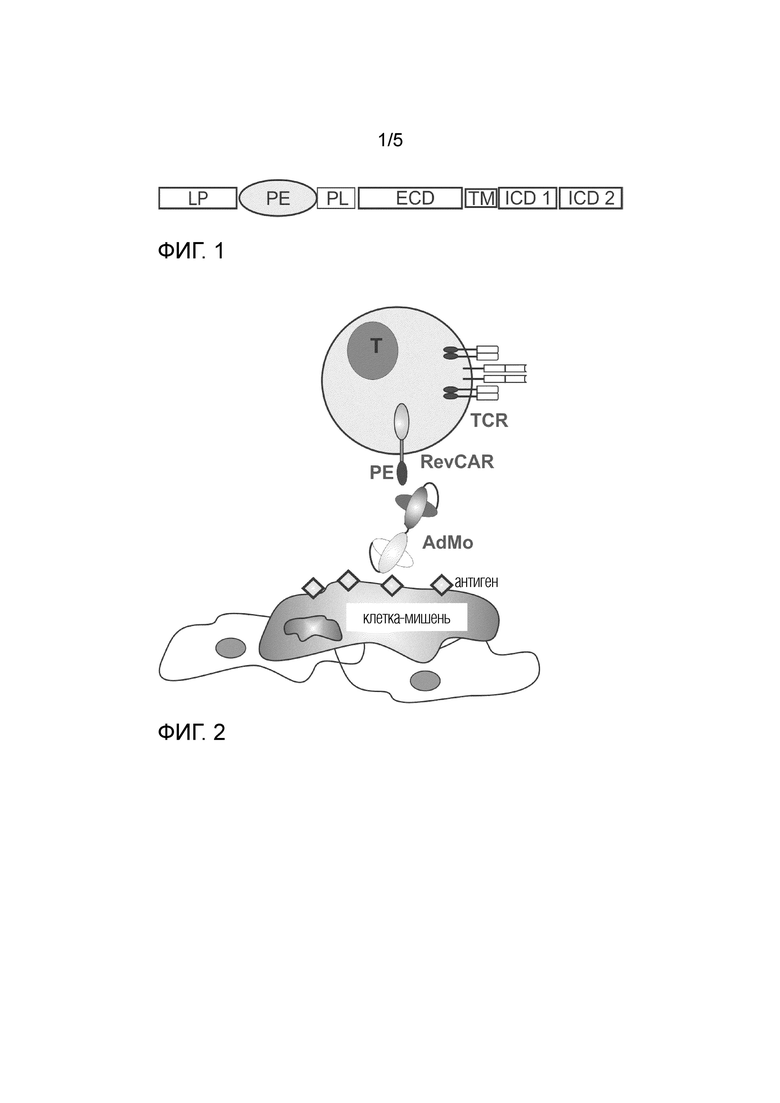

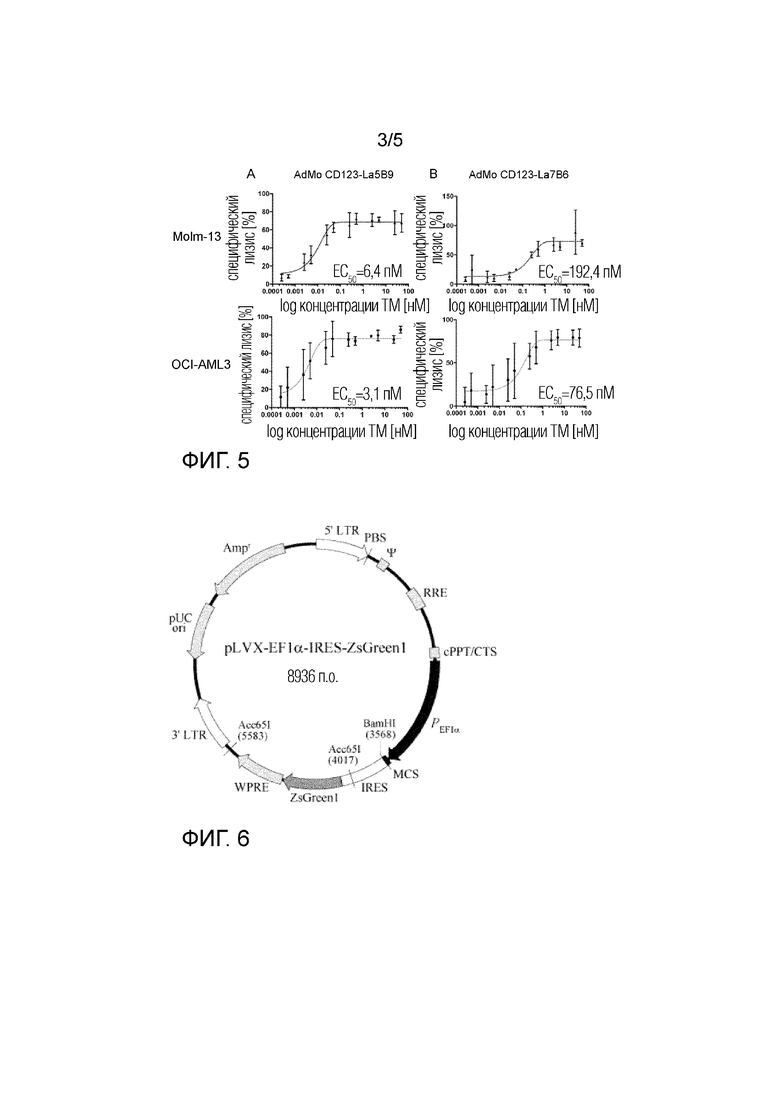

Изобретение относится к биотехнологии и медицине. Предложена нуклеиновая кислота, кодирующая обратный универсальный химерный антигенный рецептор (RevCAR), где рецептор содержит три домена, где первый домен представляет пептидную эпитопную метку, второй домен представляет связывающую пептидную цепь и третий домен представляет домен трансдукции сигнала, где пептидная эпитопная метка, служащая доменом связывания с клеточной поверхностью, представляет линейный или конформационный эпитоп. Также предложен адаптерный модуль, состоящий из связывающего фрагмента, специфичного для определенного белка или белкового комплекса на поверхности человеческой клетки, и связывающего фрагмента, специфичного для пептидной эпитопной метки, в качестве домена, связывающего RevCAR с поверхностью клетки. Изобретение обеспечивает обратную универсальную модульную систему RevCAR, которая обеспечивает перенацеливание RevCAR-привитых иммунных клеток против многочисленных антигенов. 7 н. и 12 з.п. ф-лы, 9 ил.
1. Нуклеиновая кислота, кодирующая обратный универсальный химерный антигенный рецептор, где рецептор содержит три домена, где
- первый домен представляет пептидную эпитопную метку в соответствии с последовательностью SEQ ID NO: 28 или SEQ ID NO: 29,
- второй домен представляет внеклеточный шарнир и трансмембранный домен и
- третий домен представляет домен трансдукции сигнала,
где пептидная эпитопная метка связывается с доменом связывания метки, где домен связывания метки представляет собой антитело или антигенсвязывающий фрагмент.
2. Нуклеиновая кислота по п.1, содержащая нуклеиновую кислоту в соответствии с последовательностью SEQ ID NO: 3 или SEQ ID NO: 11, кодирующей пептидную эпитопную метку.
3. Нуклеиновая кислота по любому из пп.1, 2, где шарнирная и трансмембранная области выбраны из шарнирных и трансмембранных областей молекулы человеческого CD28, цепи CD8a, рецепторов NK-клеток, предпочтительно группы естественных киллеров NKG2D, DAP12, Fc-рецепторов или участков константной области антитела, а также комбинаций их различных шарнирных и трансмембранных доменов, где шарнирная область является частью внеклеточной области.
4. Нуклеиновая кислота по любому из пп.1-3, где домен трансдукции сигнала выбран из цитоплазматических областей CD28, CD137 (41BB), CD134 (OX40), DAP10 и CD27, белка запрограммированной гибели клеток-1 (PD-1), цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4) и цитоплазматических областей цепей CD3, DAP12 и Fc-рецепторов, индуцирующих активацию Т-клеток, где домен трансдукции сигнала и цитоплазматические области являются сигнальными доменами.
5. Нуклеиновая кислота по любому из пп.1-4, кодирующая обратный универсальный химерный антигенный рецептор в соответствии с одной из последовательностей SEQ ID NO: 24-27.
6. Нуклеиновая кислота по любому из пп.1-4, где рецептор содержит четвертый домен, который представляет короткий пептидный линкер во внеклеточной части рецептора.
7. Нуклеиновая кислота по любому из пп.1-5 в соответствии с одной из последовательностей SEQ ID NO: 1, 8, 10 или 12.
8. Адаптерный модуль для применения при стимуляции иммунного ответа, опосредованного обратным универсальным химерным антигенным рецептором, у млекопитающего, состоящий из
- связывающего фрагмента, специфичного для определенного белка или белкового комплекса поверхности человеческой клетки, и
где связывающий фрагмент включает антитело или его фрагмент или альфа и бета или гамма и дельта цепи рецептора Т-клеток (TCR) или их фрагменты, или лиганд, связанный с белком или белковым комплексом, или химически синтезированное пептидное производное,
- связывающего метку домена, который направлен против пептидной эпитопной метки, где пептидная эпитопная метка представляет собой последовательность в соответствии с последовательностью SEQ ID NO: 28 или SEQ ID NO: 29,
где домен связывания метки представляет собой антитело или антигенсвязывающий фрагмент, содержащее SEQ ID NO: 30 и SEQ ID NO: 31 или SEQ ID NO: 34 и SEQ ID NO: 35.
9. Адаптерный модуль по п.8, где связывающий фрагмент адаптерного модуля включает антитело или его фрагмент, которые связываются с поверхностными антигенами CD2, CD3, CD4, CD8, CD10, CD19, CD20, CD22, CD23, CD25, CD30, CD33, CD38, CD44, CD52, CD90, CD99, CD123, CD181, CD182, CD184, CD223, CD269 (BCMA), CD274, CD276, CD279 и CD366, рецепторами интерлейкина, особенно предпочтительными IL-8Rα (CXCR1), IL-8Rβ (CXCR2), IL-11Rα, IL-11Rβ, IL-13Rα1 и 2, CXCR4, членами семейства рецепторов эпидермального фактора роста, особенно предпочтительными ErbB1, ErbB2, ErbB3, ErbB4 и их мутантами, членами суперсемейства рецепторов фактора некроза опухолей, рецепторами эфринов, особенно предпочтительными EphA1-10, EphA5 или EphB1-6, антигеном стволовых клеток предстательной железы (PSCA) и простатспецифическим мембранным антигеном (PSMA), эмбриональными антигенами, карциноэмбриональным антигеном (CEA) и фетальным ацетилхолиновым рецептором, членами семейства факторов роста эндотелия сосудов, молекулой адгезии эпителиальных клеток EpCAM, альфа-фетопротеином AFP, членами семейства белков муцинов, рецептором фолликулостимулирующего гормона (FSHR), высокомолекулярным ассоциированным с меланомой антигеном человека (HMW-MAA), фолат-связывающим белком FBP, рецептором α-фолата, лигандами рецептора NKG2D, рецепторами цитокинов, членами семейства гликопротеинов эпителия, диасиалоганглиозидами, членами семейства карбоангидраз, членами семейства углеводных антигенов, лигандами Notch, меланома-ассоциированным хондроитинсульфатом протеогликаном (MCSP), гликопротеином A33 и опухолеспецифическими гликанами, включая мутанты названных белков и белковых семейств, также связывающий фрагмент адаптерных модулей включает, не ограничиваясь этим, антитела или их фрагменты, которые связываются с цитоплазматическими или ядерными антигенами, такими как антиген La/SSB, члены семейства Rho GTPаз, члены группы белков с высокой подвижностью и другие.
10. Адаптерный модуль по п.8, где связывающий фрагмент адаптерного модуля состоит из альфа- и бета-цепей или гамма- и дельта-цепей Т-клеточного рецептора (TCR) или их фрагментов, такие связывающие фрагменты, происходящие от TCR, распознают и связываются с пептидами, представленными белковыми комплексами лейкоцитарного антигена человека класса I и II (HLA), где примерами являются, не ограничиваясь этим, TCR, специфичные для пептидов, происходящих от белков, таких как семейство EGFR, сурвивин, семейство sry-подобных белков с высокой подвижностью (SOX), меланома-ассоциированные антигены и антигены, ассоциированные с лейкозом.
11. Адаптерный модуль по п.8, где связывающий фрагмент адаптерного модуля содержит лиганд белка или белкового комплекса, далее называемого рецептором, или его фрагмент, где такие лиганды могут связываться, не ограничиваясь этим, с рецепторами цитокинов, лигандами рецептора NKG2D, лигандами членов семейства EGFR, лигандами молекул иммунных контрольных точек, такие как PD-1, CTLA-4, геном активации 3 лимфоцитов (LAG-3) или Т-клеточным иммуноглобулином и доменом муцина-3 (TIM-3), или аутореактивными TCR.
12. Адаптерный модуль по п.8, где связывающий фрагмент адаптерного модуля включает химически синтезированное производное пептида, слитое со связывающим метку фрагментом посредством химической реакции, где связывающий фрагмент связывается с CD2, CD3, CD4, CD8, CD10, CD19, CD20, CD22, CD25, CD23, CD30, CD33, CD38, CD44, CD52, CD90, CD99, CD123, CD181, CD182, CD184, CD223, CD269, CD274, CD276, CD279 и CD366, рецепторами интерлейкина, особенно предпочтительными IL-8Rα (CXCR1), IL-8Rβ (CXCR2), IL-11Rα, IL-11Rβ, IL-13Rα1 и 2, CXCR4; c-Met, рецепторами трансформирующего фактора роста β, членами семейства рецепторов эпидермального фактора особенно предпочтительными ErbB1, ErbB2, ErbB3, ErbB4 и их мутантами, членами суперсемейства рецепторов фактора некроза опухолей, рецепторами эфринов, особенно предпочтительными EphA1-10, EphA5 или EphB1-6; антигеном стволовых клеток предстательной железы PSCA, простатспецифическим мембранным антигеном PSMA, карциноэмбриональным антигеном CEA, фетальным ацетилхолиновым рецептором, онкофетальными антигенами, опухолеспецифическими гликанами, особенно предпочтительными Tn или сиалил-Tn (sTn); VEGFR 1, VEGFR 2 или VEGFR 3, нейропилином-1, молекулой адгезии эпителиальных клеток (EpCAM), рецептором эпидермального фактора роста (EGFR), альфа-фетопротеином (AFP), муцинами, особенно предпочтительными MUC1, MUC16 или MUC18; рецептором фолликулостимулирующего гормона (FSHR), высокомолекулярным ассоциированным с меланомой антигеном человека (HMW-MAA), фолат-связывающим белком FBP, рецептором фолата, NKG2D, молекулами главного комплекса гистосовместимости класса I (MHC), особенно предпочтительной цепью MHC класса I-связанной геном A (MICA) или B (MICB), UL16-связывающим белком (ULPB) 1, ULPB 2, ULPB 3, членами семейства экспорта рибонуклеиновой кислоты 1 (Rae-1) или гистосовместимости 60 (H-60); шаперонами и белками теплового шока, особенно предпочтительным белком теплового шока (HSP) 90 или глюкозо-регулируемым 78 кДа (GRP78); EGP-2 или EGP-4, диасиалоганглиозидом 2 (GD2) или GD3, карбоангидразой 9 (CAIX), антигеном Y Льюиса (LeY), лектин-подобной молекулой-1 C-типа (CLL-1), рецептором лиганда фактора некроза опухолей, индуцированного апоптозом (TRAIL), апоптозным антигеном 1 (APO-1, Fas, CD95), членами семейства кератинов или интегринов, особенно предпочтительными avβ3 или avβ5, аминопептидазой A, аминопептидазой N или невро/глиальным антигеном 2 (NG2), лигандами Notch.
13. Адаптерный модуль по любому из пп.8-12, где связывающий фрагмент адаптерных модулей включает би- и полиспецифические антигенные специфичности, включая связывание с PSCA и PSMA, CD19 и CD20, CD19 и CD22, CD19, CD20 и CD22, CD19 и CD123, CD33 и CD123, CD33 и CD99, CD33 и TIM-3, ErbB-1 и -2, PSCA и ErbB-2, IL-13Rα2 и ErbB-2, CD38 и CD269.
14. Нуклеиновая кислота, кодирующая адаптерный модуль по любому из пп.8-13, где связывающий метку домен адаптерного модуля включает антитела или их фрагменты в соответствии с SEQ ID NO: 14 и 15 или SEQ ID NO: 18 и 19.
15. Нуклеиновая кислота по п.14, где связывающие метку фрагменты адаптерных модулей включают антитела или их фрагменты, которые связываются с PSMA или CD123 в соответствии с SEQ ID NO: 20 и 21 или 22 и 23.
16. Экспресионный вектор, содержащий нуклеиновую кислоту по любому из пп.1-7.
17. Набор для лечения рака, содержащий:
- вектор по п.16 и
- адаптерный модуль по любому из пп.8-13.
18. Состав для лечения рака, содержащий Т-клетки, экспрессирующие обратный универсальный химерный антигенный рецептор, содержащие нуклеиновую кислоту по любому из пп.1-7 и/или адаптерный модуль по любому из пп.8-13.
19. Т-клетка для лечения рака, содержащая нуклеиновую кислоту по любому из пп.1-7 и адаптерный модуль по любому из пп.8-13.
| WO 2016154621 A1, 29.09.2016 | |||
| URBANSKA K | |||
| et al., A universal strategy for adoptive immunotherapy of cancer through use of a novel T-cell antigen receptor | |||
| Cancer Res | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Vol | |||
| Термосно-паровая кухня | 1921 |
|
SU72A1 |
| No | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Pp | |||
| Прибор для указания трамвайных и железнодорожных станций | 1923 |
|
SU1844A1 |
| CARTELLIERI M | |||
| et al | |||
| Switching CAR T cells on and off: a novel modular platform for retargeting of T cells to AML blasts | |||
| Blood Cancer J | |||
Авторы
Даты
2024-08-07—Публикация
2019-06-12—Подача