Изобретение относится к области тканевой биоинженерии. Предлагаемое изобретение, позволяющее создавать направленные связи между популяциями нейрональных клеток in vitro, может быть использовано в экспериментальном моделировании в биологических лабораториях для воссоздания различных участков ткани мозга со сложной структурой связей. Контроль роста аксонов для однонаправленного соединения является одним из основных методов для конструирования гетерогенной сетевой структуры. Нейронные сети со структурой, близкой к структуре локальных сетей мозга, могут длительное время поддерживаться в условиях in vitro для изучения механизмов пластичности, обучения, памяти, кодирования информации на нейросетевом уровне. В перспективе способ может использоваться для конструирования сложных схем обработки информации на основе живых нейронов и в медицине для неврологической имплантации, чтобы восстановить поврежденные части мозга.
Известен метод манипуляции направлением и силой связи между популяциями нервных клеток (Pan, L. An in vitro method to manipulate the direction and functional strength between neural populations / L. Pan, S. Alagapan, E. Franca, S.S. Leondopulos, T.B. DeMarse, G.J. Brewer, B.C. Wheeler // Frontiers in Neural Circuits. - 2015. - Vol.9. - P. 1-14), в котором устройство для создания направленной связи представляет микрофлюидный чип из биосовместимого силикона полидиметилсилоксана (ПДМС). Чип включает две камеры для культивирования клеток, и микроканалы между камерами, в которые прорастают отростки нейронов. Длина микроканалов более 200 мкм позволяет прорасти через них только аксонам, но не дендритам нейронов. Для создания направленной связи требуется высаживать клетки мозга сначала в одну камеру чипа, являющуюся камерой-источником. После 3-5 дней, когда аксоны прорастают через микроканалы в пустую вторую камеру, являющуюся камерой-приемником, в нее высаживают новые клетки мозга. Посадка клеток с задержкой в несколько дней существенно ограничивает возможности для конструирования различных экспериментальных моделей in vitro.
Известно устройство для создания направленной связи, представляющее собой микрофлюидный ПДМС чип с двумя камерами для культивирования клеток, соединенных микроканалами воронкообразной формы (Renault, R. Combining Microfluidics, Optogenetics and Calcium Imaging to Study Neuronal Communication In Vitro / Renault R, Sukenik N, Descroix S, Malaquin L, Viovy JL, Peyrin JM, et al. // PLoS ONE - 2015. - 10(4): e0120680. doi:10.1371/journal. pone.0120680). Клетки высаживаются в две камеры одновременно. Конструкция канала препятствовала росту аксонов в нежелательном направлении, о чем свидетельствует отсутствие кальциевого ответа на стимул в камере источнике при стимуляции камеры-приемника в одной трети экспериментов. В остальных случаях распространение сигналов от камеры-приемника в камеру-источник случалось. Это говорит о не высокой селективности однонаправленного соединения (передачи сигналов в одном направлении). Направление функциональных связей между камерами не характеризовалось электрофизиологически, поэтому не возможно было определить временную характеристику соединений из-за медленной природы сигналов кальция.
Известно устройство для создания направленной связи, представляющее собой микрофлюидный ПДМС чип с двумя камерами для культивирования клеток, соединенных микроканалами в виде повторяющихся треугольных секций (Gladkov, A. Design of Cultured Neuron Networks in vitro with Predefined Connectivity Using Asymmetric Microfluidic Channels / A. Gladkov, Y. Pigareva, D. Kutyina, V. Kolpakov, A. Bukatin, I. Mukhina, V. Kazantsev, A. Pimashkin // Scientific Reports. - 2017. T.7, №1. - P. 15625). Передача импульсных сигналов между двумя популяциями нейронов в противоположном заданному направлении наблюдается приблизительно в 10% случаев, тогда как в заданном направлении сигнал распространяется приблизительно в 40% случаев. Это говорит о не высокой селективности однонаправленной передачи сигналов между популяциями нервных клеток.
Известно устройство для создания направленной связи, представляющее собой микрофлюидный ПДМС чип с двумя камерами для культивирования клеток, соединенных микроканалами с U-образными соединениями (Josquin Courte, Renaud Renault, Audric Jan, Jean-Louis Viovy, Jean-Michel Peyrin, Catherine Villard. Reconstruction of directed neuronal networks in a microfluidic device with asymmetric microchannels. Chapter in Methods in cell biology January 2018 DOI: 10.1016fts.mcb.2018.07.002). Устройство обеспечивает высокую селективность роста аксонов в одном направлении (около 100%) до 11 дня развития in vitro. Недостатком способа является то, что клеточные отростки неконтролируемо переплетаются, прорастая из одного микроканала в другой, что не позволяет контролировать место формирования синаптических контактов. Направление связей между камерами не характеризовалось функционально, то есть не оценивалась селективность распространение сигналов нервных клеток между двумя популяциями.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является устройство, представляющее собой микрофлюидный ПДМС чип с двумя камерами для культивирования клеток, соединенных микроканалами с зубцами (Feber, J. Le. Barbed channels enhance unidirectional connectivity between neuronal networks cultured on multi electrode arrays / J. Le Feber, W. Postma, E. de Weerd, M. Weusthof, W.L.C. Rutten // Frontiers in Neuroscience. - 2015. - Vol.9. - P. 1-10. doi: 10.3389/fhins.2015.00412), который выбран в качестве прототипа. Клетки неокортекса мышей (Е18) культивируются в двух камерах ПДМС чипа, которые связаны микроканалами, в которых однонаправленность связи достигается за счет зубцов внутри микроканала, которые образуют острый угол в сторону заданного направления роста отростков. ПДМС чип совмещается с микроэлектродной матрицей (МЕА), при этом микроканалы чипа выравниваются так, чтобы часть электродов располагалась в камере источнике, часть в камере приемнике и часть в микроканалах. Высота микроканалов не позволяет попасть в них телам клеток, но позволяет пропасти клеточным отросткам. Способ позволяет определить приблизительное расположение синаптических контактов между двумя популяциями клеток мозга in vitro и воздействовать на отдельные группы аксонов. Отмечается отсутствие значительного ответа на стимул в камере-приемнике при стимуляции клеток в камере-источнике. Для оценки направленности связи между двумя популяциями нейрональных клеток использовали анализ спонтанной биоэлектрической активности методом кросскорреляции. Лишь в 5 каналах (35% зарегистрированных каналов) максимум кросскорреляции отдельных импульсов, зарегистрированных в микроканале разными электродами, был найден на положительной задержке, что указывало на направление распространения потенциала действия от камеры источника в камеру приемник. В остальных случаях направление распространения сигнала было либо неопределенно (58%), либо было от камеры приемника в камеру источник (7%). Четкий пик кросс-корреляции для огибающих общей частоты импульсов в камере источнике и камере приемнике был обнаружен лишь в 71% экспериментов. В среднем задержка, на которой был достигнут максимум кросс-корреляции, составила 7-10 мс (отставание в приемной камере), что указывало на тенденцию того, что активность в камере источнике предшествовала активности в камере приемнике. Таким образом, принципиальным недостатком способа по прототипу является не высокая селективность однонаправленного соединения.
Техническим результатом от использования предлагаемого изобретения является: высокое качество направленной функциональной связи между популяциями нейрональных клеток, низкая вероятность передачи биоэлектрических импульсных сигналов в противоположном заданному направлении, возможность определения приблизительного расположения синаптических контактов между двумя популяциями клеток мозга in vitro, соединенных заданной направленной связью, возможность воздействия на отдельные группы аксонов электрическими стимулами, при этом селективность направленной связи должна сохраняться до поздних этапов развития культуры (до 30 дней), возможность конструирования сложных нейронных схем из нескольких блоков, так как посадка клеток в разные камеры осуществляется в течение одного дня.
Для достижения технического результата была применена стратегия манипуляции скоростью роста аксонов в микроканале в двух направлениях, что в свою очередь используется для закупорки узких мест микроканалов аксонами, растущими в заданном направлении, и предотвращения роста аксонов в противоположном направлении. Скорость роста аксонов усиливают в заданном направлении (от популяции-источника к популяции-приемнику) и замедляют в противоположном направлении. Различие в скорости роста аксонов в заданном и обратном направлениях достигается с помощью разной ширины формы участков микроканалов, примыкающих к разным популяциям нейрональных клеток (асимметрия вдоль микроканала). Дополнительно замедляют прорастание отростков нейронов из популяции-приемника вдоль микроканала за счет тупиковых ответвлений микроканалов, служащих в качестве ловушек.
Эта стратегия была воплощена в устройстве для создания направленной связи между популяциями нейрональных клеток, включающее камеры чипа, одна из которых является камерой-источником, а другая является камерой-приемником, связанных между собой микроканалами. Каждый из микроканалов выполнен из нескольких секций треугольной формы таким образом, что середины вершин треугольников предыдущих секций соединены с центрами оснований последующих секций, и основания направлены в сторону камеры-источника, а вершины треугольников направлены в сторону камеры-приемника. При этом расстояние между боковыми сторонами секций треугольной формы сужены вдоль секций по направлению к камере-приемнику, образуя узкие места микроканалов шириной w, причем ширина секций вдоль микроканала, ближайшей к камере-источнику, уже ширины секций, ближайшей к камере-приемнику,
Устройство дополнительно снабжено короткими секциями треугольной формы, одна из которых, непосредственно соединенная с камерой-источником, выполнена в виде воронки, размеры основания которой сопоставимы с размерами оснований соединенных с ней узких секций, а другая в виде двух загнутых ловушек, непосредственно соединенная с камерой-приемником, выполнена с шириной, сопоставимой по размерам с широкой секцией, с вершиной которой она соединена.
В основании каждой треугольной секции по обе стороны от соединения с предыдущей секцией расположены ловушки треугольной формы.
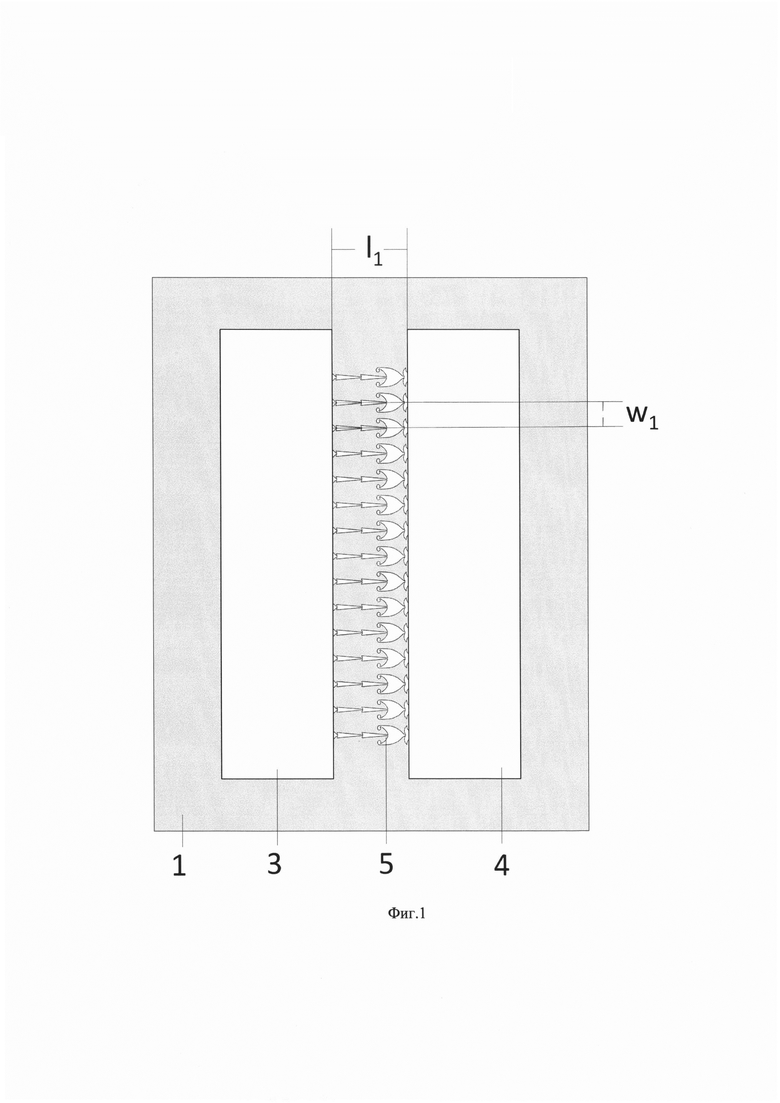
На Фиг. 1 приведен вид сверху устройства с двумя камерами и микроканалами.
На Фиг. 2 приведен вид сбоку сечения вдоль области микроканала устройства на фиг. .
На Фиг. 3 приведен вид сверху отдельного микароканала.
На Фиг. 4 приведена соответствующая микрофотография микроканалов с проросшими в них аксонами культивируемых нейронов. Масштаб 100 мкм.
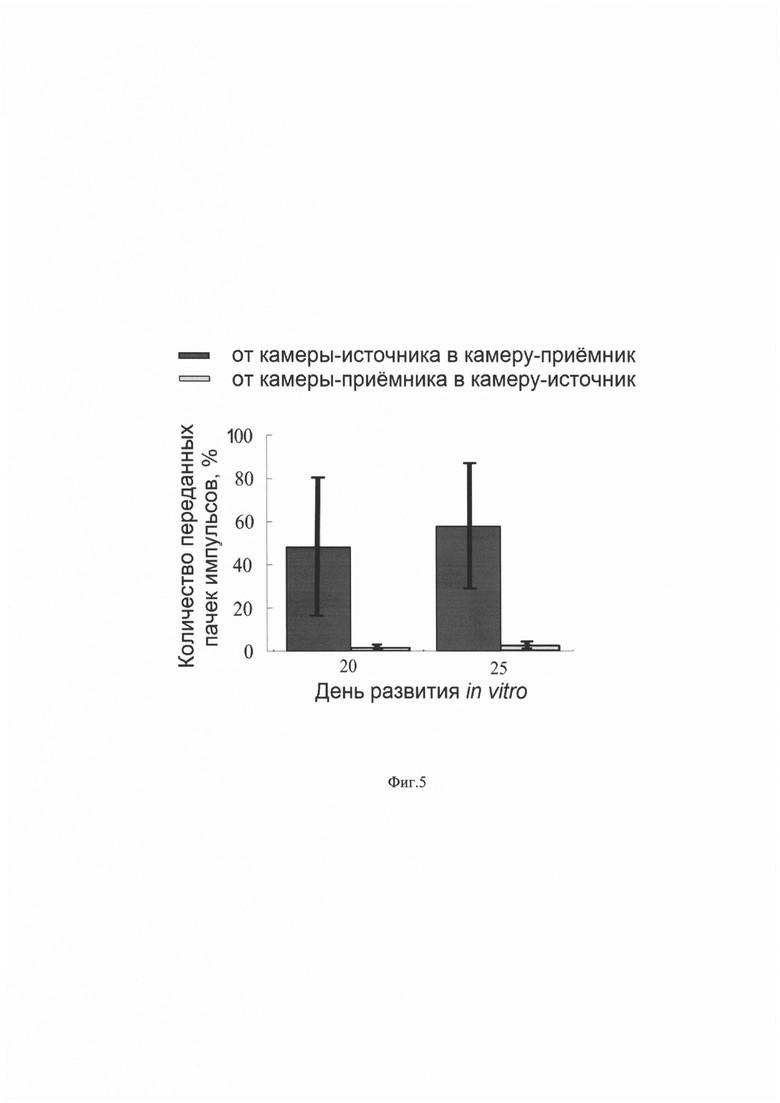
На Фиг. 5 приведены диаграммы средних значений количества переданных пачек импульсов из камеры-источника в камеру-приемник и из камеры-приемника в камеру-источник в зрелой культуре клеток гиппокампа мышей (Е18) на 20 и 25 день развития in vitro (n=5 культур, планками показано - стандартное отклонение).
В устройство для создания однонаправленной связи между популяциями культивируемых нервных клеток, входят (см. Фиг. 1, 2, 3):
1 - устройство, представляющее собой микрофлюидный чип, выполненный из полидиметилсилоксана (ПДМС);
2 - подложка с матрицей микроэлектродов для культивирования нервных клеток;
3 - камера-источник;
4 - камера-приемник;
5 - микроканалы;
6 - узкие секции микроканалов;
7 - широкие секции микроканалов;
8 - узкие места секций микроканалов;
9 - боковые ловушки;
10 - первая секция микроканала;
11 - последняя секция микроканала,
Микрофлюидный чип 1 изготавливается из биосовместимого полимера полидиметилсилоксана (ПДМС) и совмещается с чистой ровной поверхностью подложки для культивирования нервных клеток, например, покровное стекло, предметное стекло или матрица микроэлектродов 2. Матрица микроэлектродов 2 представляет собой стеклянную подложку, на дне которой расположены плоские электроды, регистрирующие наведенные электрические сигналы от активности нервных клеток. Микрофлюидный чип 1 включает в себя две камеры для культивирования клеток мозга: камеру-источник 3 и камеру-приемник 4. Камеры разделены перегородкой, на дне которой находятся микроканалы 5, соединяющие камеры. Высота микроканалов выполнена такой, которая позволяет прорастать в них отросткам нейронов, но препятствует проникать в них телам клеток. Микроканалы 5 выравниваются относительно матрицы микроэлектродов 2 таким образом, чтобы несколько электродов находилось вдоль длины микроканала 5, часть электродов матрицы находилась в камере-источнике 3, часть электродов - в камере-приемнике 4. Камеру-источник 3 и камеру-приемник 4 могут соединять ~16 микроканалов. Каждый микроканал 5 (фиг. 3) состоит из узких треугольных секций 6 и широкой секции 7, имеющей видоизмененную треугольную форму. Вершина треугольника одной секции соединяется с основанием треугольника соседней секции, образуя узкое место 8 микроканала 5. Широкая секция 7 содержит две боковые ловушки аксонов 9 в области основания видоизмененного треугольника, соответствующего форме секции. Боковые ловушки 9 широкой секции 7 предназначены для препятствования прорастанию аксонов до узкого места микроканала 8, соединяющего узкую 6 и широкую 7 секции. Первая секция микроканала 10 выполнена в виде воронки с основанием, соединенным с камерой-источником 3. Последняя секция 11 микроканала 5, непосредственно соединенная с камерой-приемником 4, выполнена в форме загнутых ловушек. Вершина последней секции 11 соединяется с камерой-приемником 4.
Стратегия создания направленной связи заключается в том, что создают условия, при которых аксоны в области микроканала 5, близкой к камере-источнику 3, растут быстрее, чем в области, близкой к камере-приемнику 4, поэтому аксоны от клеток в камере-источнике 3, растущие в заданном направлении, достигают критических наиболее узких участков 8 микроканалов 5 раньше, чем аксоны от клеток в камере-приемнике 4. Несколько проросших через узкое место 8 узких секций 6 аксонов от клеток в камере-источнике 3 полностью закупоривают микроканал 5, что предотвращает прорастание аксонов в противоположном направлении - от камеры-приемника 4 в камеру-источник 3.
Рост аксонов в направлении, противоположном заданному, замедляют за счет широкой секции 7, которую располагают в непосредственной близости к камере-приемнику 4 и снабжают ловушками 9. Форма широкой секции 7 и близость к камере-приемнику 4 позволяет полностью заполнить широкую секцию дендритами клеток из камеры-приемника 4. Таким образом, в широкой секции 7 задают приблизительное место формирования синаптических связей между аксонами клеток, расположенными в камере-источнике 3, и дендритами клеток, расположенных в камере-приемнике 4.
Росту клеточных отростков из камеры-приемника 4, растущих вдоль микроканала 5 в направлении, противоположном заданному, препятствует наличие последней секции 11, граничащей с камерой-приемником 4 и формирующей ловушки в виде тупиковых ответвлений.
Прорастанию аксонов нейронов из камеры-приемника 4 до узкого места 8, соединяющего узкую 6 и широкую 7 секции микроканала, препятствует наличие специальных боковых ловушек 9 широкой секции 7, расположенных у ее основания. Боковые ловушки 9 широкой секции 7 представляют собой тупиковые треугольные области с округлым расширением в области вершины.
Увеличение скорости роста аксонов в заданном направлении стимулируют узкие секции 6, которые располагаются ближе к камере-источнику 3.
Заполнение пространства в узких местах 8 микроканалов 5 аксонами из камеры-источника 3 предотвращает рост аксонов клеток из камеры-приемника 4 в противоположном заданному направлении вдоль проросших в заданном направлении аксонов нейронов из камеры-источника 3. Аксоны, растущие в противоположном заданному направлении, достигают узких участков 8 микроканалов 5 позже, когда в них уже нет достаточного места для прорастания.
Для подтверждения заявленного технического результата был изготовлен образец, при изготовлении которого для создания мастер-формы для отливки микрофлюидного чипа 1 был использован метод стандартной двухслойной оптической литографии. На подложку из кремния наносили первый слой негативного фоторезиста SU-8 2025, разбавленного растворителем Т thinner (MicroChem, США), толщиной 4,5 мкм (MicroChem, США). Экспонирование проводили через хромовый фотошаблон на установке MJB4 (SUSS MicroTec, Германия) с УФ-фильтром PL-360-LP (Omega Optics, США). После экспонирования первого слоя проводили термообработку (95°С) в течение 4 мин. Затем наносили второй слой SU-8 2075 толщиной ~200 мкм. После экспонирования второго слоя проводили термообработку (95°С) в течение 7 мин. После этого мастер-формы обрабатывали термически при температуре 200°С в течение 7 мин.
Микрофлюидный чип 1 изготавливали с использованием полидиметилсилоксана (ПДМС) методом «мягкой» литографии. Два компонента «Sylgard 184 silicone elastomer base» и «Sylgard 184 silicone elastomer curing agent» (DowCorning, США) смешивали в соотношении 10:1. Неотвержденный ПДМС тщательно перемешивали и дегазировали в эксикаторе, откачивая воздух с помощью медицинского отсасывателя ("Утес" МО-1, Россия) до удаления видимых пузырьков воздуха. Затем ПДМС заливали на мастер-форму и отверждали при температуре 100°С в течение 14 ч. После отделения слоя отвержденного ПДМС от мастер-формы в боковых участках камер пробивали отверстия пробойником с диаметром около 2 мм (по 2 отверстия на каждую камеру). Остатки ПДМС, возникшие при пробивании отверстия, тщательно удаляли с помощью скотча 3М (Scotch, Magic 810, США).
Для совмещения и выравнивания микрофлюидного чипа и микроэлектродной матрицы (Multichannel Systems, Германия) с 59 плоскими электродами диаметром 30 мкм и межэлектродным расстоянием 200 мкм на поверхность матрицы добавляли каплю (около 50 мкл) водного раствора этилового спирта (70%). Микрофлюидный чип помещали в каплю микроканалами вниз. Под бинокуляром пинцетом выравнивали микроэлектроды матрицы и микроканалы чипа, затем каплю высушивали. Прикрепленный чип заливали водой и дегазировали в эксикаторе, откачивая воздух с помощью медицинского отсасывателя ("Утес" МО-1, Россия) до удаления видимых пузырьков воздуха из микроканалов. Затем дезинфецировали с помощью раствора этилового спирта (70%) и покрывали чип полиэтиленимином (Sigma Р3143, США). Клетки гиппокампа получали из эмбрионов мышей (Е18), диссоциировали и помещали в камеры ПДМС-чипа на матрице с плотностью около 8000 кл/мм2 в среде Neurobasal (Invitrogen 21103-049) с 2% биоактивной добавкой В-27 (Invitrogen 17504-044), 0,5% глутамином (Invitrogen 25030-024), 5% эмбриональной телячьей сывороткой (PanEco К055) и гентамицином 10 мкл/мл. Спустя 24 ч половину питательной среды заменяли средой Neurobasal, содержащей 1% глутамина, 2% В-27 и 0,4% эмбриональной телячьей сыворотки. Половину среды меняли каждые 2 дня. Клетки культивировали при постоянных условиях: 35,5°С, 5% CO2 в увлажненном инкубаторе для культур клеток (MCO-18AIC; SANYO Electric Co., Япония).
Камеры 3 и 4 выполняли с высотой h1=210 мкм. Высота h2 микроканалов 5 составляла около 5 мкм, что позволяла прорастать в них отросткам нейронов, но препятствовала проникновению в них телам клеток. Расстояние l1 между камерами 3 и 4 составляло 600 мкм. Микроканалы 5 выравнивали относительно матрицы микроэлектродов 2 таким образом, чтобы несколько электродов находилось вдоль длины микроканала 5, часть электродов матрицы находилась в камере-источнике 3, часть электродов - в камере-приемнике 4. Камеру-источник 3 и камеру-приемник 4 соединяли 16 микроканалов 5, расстояние между которыми w1 было равно 200 мкм. Каждый микроканал 5 состоял из двух узких треугольных секций 6, каждая из которых была длиной l2, равной 200 мкм, и широкой секции 7, имеющей видоизмененную треугольную форму. Длина l3 широкой секции составляло 140 мкм. Суммарная длина узких секций 400 мкм. Вершина треугольника одной секции соединялась с основанием треугольника соседней секции, образуя узкое место микроканала 8. Ширина узкого места микроканала 8 w2 составляла 7 мкм. Ширина узкой секции 6 w3 достигала 40 мкм. В основании каждой узкой секции 6 по обе стороны от соединения с предыдущей секцией располагались треугольные боковые ловушки 9 длиной l4, равной 7 мкм, предназначенные для дополнительного препятствования росту аксонов нейронов из камеры-приемника 4 в случае, если они прорастут в узкие секции. Ширина широкой секции 7 w4 достигала 150 мкм. Широкая секция 7 содержала две боковые ловушки аксонов 9 в области основания видоизмененного треугольника, соответствующего форме секции. Боковые ловушки 9 широкой секции 7, заканчивающиеся округлым расширением диаметром d (25 мкм), были предназначены для препятствования прорастанию аксонов до узкого места микроканала 8, соединяющего узкую 6 и широкую 7 секции. Длина боковых ловушек 9 широкой секции 7 l5 составляла 85 мкм. Первая секция 10 микроканала 5 длиной l6, равной 34 мкм, была выполнена в виде воронки с основанием шириной w5, равной 52 мкм, соединенным с камерой-источником 3. Последняя секция 11 микроканала 5, непосредственно соединенная с камерой-приемником 4, была выполнена в форме двух загнутых ловушек шириной, равной ширине широкой секции 7 w4. Длина последней секции 11 l7 составляла 85 мкм. Вершина последней секции 11 шириной w6, равной 70 мкм, соединялась с камерой-приемником 4.
Запись биоэлектрической активности культуры производилось спустя 20 дней после посадки клеток in vitro с помощью системы USB-MEA120-2-Inv-ВС (Multichannel Systems, Германия) и повторялось на 25 сутки развития in vitro. Биоэлектрические импульсы регистрировались с использованием метода порогового детектирования (Pimashkin A., Kastalskiy I., Simonov А., Koryagina Е., Mukhina I. & Kazantsev V. Spiking signatures of spontaneous activity bursts in hippocampal cultures // Frontiers in computational neuroscience. - 2011. - T. 5:46. - C. 1-12) в каждом канале отдельно. Пачки импульсов в спонтанной активности детектировались отдельно в каждой камере 3 и 4 согласно опубликованному алгоритму (Pimashkin A., Kastalskiy I., Simonov A., Koryagina Е., Mukhina I. & Kazantsev V. Spiking signatures of spontaneous activity bursts in hippocampal cultures // Frontiers in computational neuroscience. - 2011. - T. 5:46. - C. 1-12). Весь статистический анализ сигналов выполняли с использованием авторского программного обеспечения Meaman (Пимашкин А.С. Свидетельство №2012611190 от 27.01.2012).
Рассчитывали процент спонтанных пачек в камере-источнике 3, вызвавших пачку импульсов в камере-приемнике 4 и наоборот процент спонтанных пачек в камере-приемнике 4, вызвавших пачку импульсов в камере-источнике 4. Для этого использовали опубликованный алгоритм (Gladkov, A. Design of Cultured Neuron Networks in vitro with Predefined Connectivity Using Asymmetric Microfluidic Channels / A. Gladkov, Y. Pigareva, D. Kutyina, V. Kolpakov, A. Bukatin, I. Mukhina, V. Kazantsev, A. Pimashkin // Scientific Reports. - 2017a. T.7, №1. - P. 15625). Данные показатели использовали для оценки качества (селективности) однонаправленной связи между популяциями клеток мозга в культуре. Высокое количество спонтанных пачек в камере-источнике 3, вызвавших пачку импульсов в камере-приемнике 4 и низкое количество спонтанных пачек в камере-приемнике 4, вызвавших пачку импульсов в камере-источнике 3 свидетельствовало о высоком качестве (селективности) однонаправленной связи.
На 20 день развития среднее количество спонтанных пачек в камере-источнике 3, вызвавших пачку импульсов в камере-приемнике 4 составило около 50%, тогда как среднее количество спонтанных пачек в камере-приемнике 4, вызвавших пачку импульсов в камере-источнике 3 было менее 5%, что близко к статистической погрешности (см. фиг. 5). На 25 день развития среднее количество спонтанных пачек в камере-источнике 3, вызвавших пачку импульсов в камере-приемнике 4, составило около 60%, тогда как среднее количество спонтанных пачек в камере-приемнике 4, вызвавших пачку импульсов в камере-источнике 3 также не превышало 5%. Это свидетельствует о том, что использование данного изобретения позволяет создать однонаправленная функциональную связь между двумя зрелыми популяциями культивируемых клеток мозга с высокой селективностью при посадке в один день и используя микроканалы для изолированного воздействия на отдельные группы аксонов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И УСТРОЙСТВО ДЛЯ ИНТЕГРАЦИИ НЕЙРОНАЛЬНЫХ КЛЕТОК В СФОРМИРОВАННУЮ НЕЙРОННУЮ СЕТЬ С НАПРАВЛЕННОЙ СВЯЗЬЮ IN VITRO | 2021 |
|
RU2814623C2 |
| Способ обучения биологической нейронной сети (в эксперименте) | 2016 |
|
RU2637391C1 |
| МИКРОФЛЮИДНОЕ УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ ВЛИЯНИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ НА КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2016 |
|
RU2672581C2 |
| ДЕМПФИРУЮЩИЙ ЭЛЕМЕНТ МИКРОФЛЮИДНОГО ЧИПА И МИКРОФЛЮИДНЫЙ ЧИП | 2016 |
|
RU2648444C1 |
| УСТРОЙСТВО ПНЕВМАТИЧЕСКОГО УПРАВЛЕНИЯ КЛАПАНАМИ МИКРОФЛЮИДНОЙ СИСТЕМЫ | 2015 |
|
RU2592687C1 |
| Способ культивирования и исследования гетерогенной культуры опухолевых клеток и устройство для его осуществления | 2024 |
|
RU2837629C1 |
| СПОСОБ ОЦЕНКИ ГЕРМЕТИЧНОСТИ И ЦЕЛОСТНОСТИ СИСТЕМЫ КЛАПАНОВ МИКРОФЛЮИДНОЙ СИСТЕМЫ | 2015 |
|
RU2585804C1 |
| МИКРОФЛЮИДНЫЙ ЧИП ДЛЯ КУЛЬТИВИРОВАНИЯ И/ИЛИ ИССЛЕДОВАНИЯ КЛЕТОК И ЗАГОТОВКА МИКРОФЛЮИДНОГО ЧИПА | 2018 |
|
RU2675998C1 |
| ОСНАСТКА ДЛЯ ИЗГОТОВЛЕНИЯ ЗАГОТОВКИ МИКРОФЛЮИДНОГО ЧИПА, ЗАГОТОВКА МИКРОФЛЮИДНОГО ЧИПА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, МИКРОФЛЮИДНЫЙ ЧИП И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2658495C1 |
| Способ детекции ионов меди в окружающей среде и биосенсор для его осуществления | 2015 |
|
RU2628704C2 |



Изобретение относится к области биотехнологии. Предложено устройство для создания направленной связи между популяциями нейрональных клеток. Устройство включает связанных между собой микроканалами камеру-источник и камеру-приемник. Микроканал выполнен из нескольких секций треугольной формы, причём вершины треугольников предыдущих секций соединены с центрами оснований последующих секций, основания направлены в сторону камеры-источника, а вершины треугольников направлены в сторону камеры-приемника. Изобретение обеспечивает высокое качество направленной функциональной связи между популяциями нейрональных клеток, низкую вероятность передачи биоэлектрических импульсных сигналов в противоположном заданному направлении, возможность определения приблизительного расположения синаптических контактов между двумя соединенных заданной направленной связью популяциями клеток мозга in vitro и воздействия на отдельные группы аксонов электрическими стимулами. 3 з.п. ф-лы, 5 ил.
1. Устройство для создания направленной связи между популяциями нейрональных клеток, включающее камеры чипа, связанных между собой микроканалами, отличающийся тем, что микроканал выполнен из нескольких секций треугольной формы таким образом, что вершины треугольников предыдущих секций соединены с центрами оснований последующих секций, и основания направлены в сторону одной из камер, являющейся камерой-источником, а вершины треугольников направлены в сторону другой камеры, являющейся камерой-приемником, при этом расстояние между боковыми сторонами секций треугольной формы сужены вдоль секций по направлению к камере-приемнику, образуя узкие места микроканалов шириной w, причем ширина секций вдоль микроканала, ближайшей к камере-источнику, уже ширины секций, ближайшей к камере-приемнику,
2. Устройство по п. 1, отличающееся тем, что дополнительно снабжено короткими секциями, одна из которых непосредственно соединенная с камерой-источником, выполнена в виде воронки, размеры основания которой сопоставимы с размерами оснований соединенных с ней узких секций, а другая, непосредственно соединенная с камерой-приемником, выполнена шириной, сопоставимой по размерам с широкой секцией, с вершиной которой она соединена.
3. Устройство по п. 1, отличающееся тем, что в основании каждой треугольной секции по обе стороны от соединения с предыдущей секцией расположены ловушки треугольной формы.
4. Устройство по п. 2, отличающееся тем, что секция, ближайшая к камере-источнику, выполнена с шириной, составляющей ~5w, а секция ближайшая к камере-приемнику, выполнена с шириной, составляющей ~20w.
| GLADKOV A | |||
| et al, Design of Cultured Neuron Networks in vitro with Predefned Connectivity Using Asymmetric Microfuidic Channels // SCIENTIFIC REPORTS, 2017, 7:15625, p.1-14 | |||
| FEBER J | |||
| et al, Barbed channels enhance unidirectional connectivity between neuronal networks cultured on multi electrode arrays // Frontiers in Neuroscience, 2015, Vol.9, |
Авторы
Даты
2020-08-12—Публикация
2019-12-27—Подача