Область техники, к которой относится изобретение
Настоящее изобретение относится к области терапевтического лечения. В частности, данное изобретение относится к новым противовирусным агентам и их применению в лечении заболевания или состояния, вызванного вирусной инфекцией.
Сведения о предшествующем уровне техники
Любая ссылка в настоящем документе на предшествующий уровень техники не должна истолковываться как допущение того, что такой предшествующий уровень представляет общеизвестное знание в Австралии или где-либо еще.
Вирусы являются причиной широкого спектра заболеваний у млекопитающих, что представляет большую проблему для общества. Эффекты вирусной инфекции могут варьировать от симптомов обычного гриппа до серьезных респираторных проблем и могут приводить к смерти, особенно среди молодых, пожилых и иммунокомпрометированных членов общества.
Вирусы семейства Orthomyxoviridae, включая вирус гриппа типов А, В и С, и семейства Paramyxoviridae представляют собой патогенные организмы, ответственные за значительное количество возникающих ежегодно инфекций у человека.
Если взять в качестве примера семейство Paramyxoviridae, вирусы парагриппа типов 1-3 (hPIV-1, 2 и 3) являются ведущей причиной заболевания верхних и нижних дыхательных путей у детей грудного и младшего возраста, а также поражают пожилых и иммунокомпромизированных людей. Примечательно, что по имеющимся оценкам, только в США каждый год возникает до пяти миллионов инфекций нижних дыхательных путей у детей в возрасте до 5 лет, и hPIV был выделен приблизительно в одной трети этих случаев. Несмотря на непрекращающиеся усилия, в настоящее время отсутствуют вакцины или специфическая противовирусная терапия для предупреждения или лечения инфекций, вызванных вирусом hPIV. Некоторые из современных подходов нацелены на блокирование проникновения и инициирование преждевременного слияния вируса с помощью малой молекулы.
Начальное взаимодействие вируса парагриппа с клеткой-хозяином происходит посредством его поверхностного гликопротеина, гемагглютинин-нейраминидазы (HN), и включает распознавание гликоконъюгатов, содержащих N-ацетилнейраминовую кислоту. Белок HN вируса парагриппа представляет собой мультифункциональный белок, который охватывает функции связывания рецептора (для клеточной адгезии) и разрушения рецептора (содействуя высвобождению вируса), не только в пределах одного белка, но, по-видимому, в одном участке связывания. Кроме того, белок HN вовлечен в активацию вирусного поверхностного белка слияния (F), необходимого для инициации инфеции клетки-мишени хозяина. Таким образом, ингибирование ферментов гемагглютинина и/или нейраминидазы может обеспечить мишень для противовирусных препаратов.
Краткое описание изобретения
В соответствии с первым аспектом изобретения предлагается соединение формулы (I) или его фармацевтически приемлемая соль:
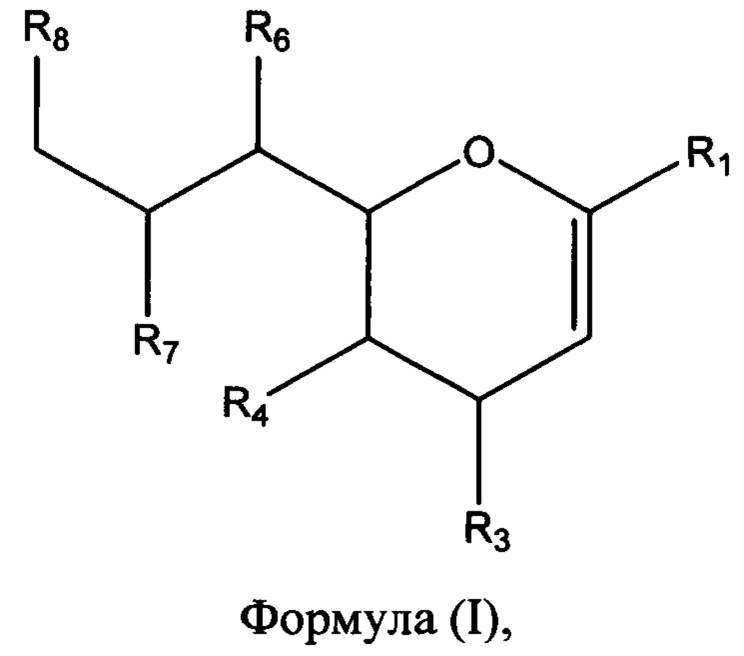
в которой R1 выбран из группы, состоящей из СООН или его соли, C(O)NR9R10, C(O)OR11, где R9, R10 и R11 независимо выбраны из группы, состоящей из водорода и необязательно замещенного C1-C6алкила;
R3 выбран из группы, состоящей из N-связанного триазола, замещенного по одному или обоим атомам углерода кольца, необязательно замещенного N-связанного тетразола, необязательно замещенного N-связанного индола, необязательно замещенного N-связанного изоиндола и необязательно замещенного N-связанного бензотриазола;
R4 представляет собой NHC(O)R17, где R17 выбран из группы, состоящей из C1-C6алкила, C1-C6галогеналкила и C3-C6циклоалкила;
R6, R7 и R8 независимо выбраны из группы, состоящей из ОН, NH2, C1-C6алкила, NR18R18', C1-C6алкокси, -OC(O)R18, -NH(C=O)R18 и S(O)nR18, где n=0-2, и R18 и R18' каждый, независимо представляют собой водород или необязательно замещенный C1-C6алкил.
В одном варианте осуществления первого аспекта соединение формулы (I) представляет собой соединение формулы (II):
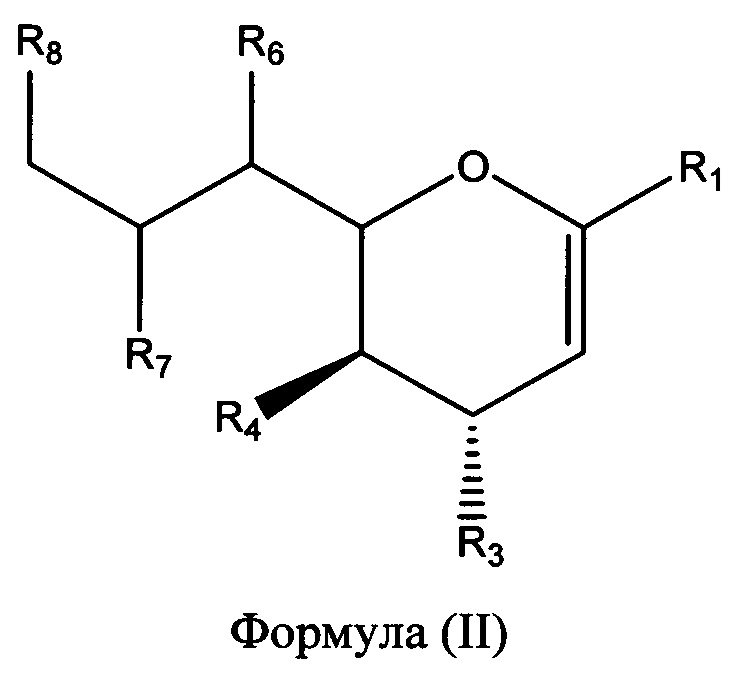
в которой R1, R3, R4, R6, R7 и R8 являются такими, как описано выше.
В соответствии со вторым аспектом изобретения предлагается фармацевтическая композиция, содержащая эффективное количество соединения согласно первому аспекту или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество.
Предпочтительно фармацевтическая композиция предназначена для лечения или профилактики заболевания, нарушения или состояния, вызванного вирусной инфекцией.
В третьем аспекте изобретения предлагается способ лечения заболевания, нарушения или состояния, вызванного вирусной инфекцией, у пациента, включающий стадию введения эффективного количества соединения согласно первому аспекту или его фармацевтически приемлемой соли, или фармацевтической композиции согласно второму аспекту изобретения.
В четвертом аспекте изобретения предлагается соединение согласно первому аспекту или его фармацевтически приемлемая соль, или фармацевтическая композиция согласно второму аспекту для применения в лечении заболевания, нарушения или состояния, вызванного вирусной инфекцией, у пациента.
В пятом аспекте изобретения предлагается применение соединения согласно первому аспекту или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболевания, нарушения или состояния, вызванного вирусной инфекцией.
В одном варианте осуществления третьего, четвертого или пятого аспектов заболевание, нарушение или состояние представляет собой грипп.
Грипп может представлять собой грипп А, В или С, или парагрипп.
В одном варианте осуществления парагрипп представляет собой вирус hPIV-1, -2 или -3.
Предпочтительно пациент представляет собой домашнее или сельскохозяйственное животное, или человека.
В шестом аспекте изобретения предлагается способ модулирования активности вирусного фермента гемагглютинина и/или нейраминидазы, включающий стадию приведения в контакт фермента с соединением согласно первому аспекту.
Различные признаки и варианты осуществления настоящего изобретения, относящиеся к отдельным разделам, указанным выше, применяются соответствующим образом для других разделов, mutatis mutandis. Таким образом, признаки, указанные в одном разделе, могут быть соответствующим образом комбинированы с признаками, указанными в других разделах.
Другие признаки и преимущества настоящего изобретения станут очевидными из следующего далее подробного описания.
Краткое описание чертежей
Для более полного понимания изобретения и достижения практического эффекта, предпочтительные варианты осуществления будут описаны в качестве примера со ссылками на сопровождающие чертежи, на которых:
на фигуре 1 показаны структуры N-ацетилнейраминовой кислоты (1), ингибитора сиалидазы Neu5Ac2en (2), 4-азидо-4-дезокси-Neu5Ac2en (3), занамивира (4), С-5 изобутирамидо аналога Neu5Ac2en (5), референсного ингибитора ВСХ 2798 вируса hPIV (6) и новых ингибиторов 7-10;
на фигуре 2 показано сравнение значений IC50 ингибиторов 6 и 10 в отношении HI с использованием эритроцитов морских свинок (gp RBC, сплошной столбец) и эритроцитов человека (h RBC, штрихованный столбец);
на фигуре 3 в графическом виде показаны значения IC50 производных 2, 3, 5-10 Neu5Ac2en в отношении NI (сплошные) и HI (штрихованные). Ингибиторы 2, 3, 7, 8 с С5 ацетамидо группой (левая панель, группа 1) и ингибиторы 5, 6, 9, 10 с С5 изобутирамидо группой (правая панель, группа 2). Значения представляют собой средние значения из 3 независимых экспериментов и планки погрешностей соответствуют рассчитанным стандартным отклонениям;
на фигуре 4А-С в графическом виде показано сравнение значений IC50 выбранных ингибиторов в отношении NI (сплошной столбец) и HI (штрихованный столбец). (А) Сравнение значений IC50 соединений 3, 6-10 и их С-4 гидроксильных аналогов (2 и 5) в отношении NI и HI. (В) Сравнение значений IC50 соединений 7-10 и их С-4 азидо аналогов в отношении NI и HI (3 и 6). (С) Сравнение значений IC50 соединений 6, 9 и 10 и их С-5 ацетамидо аналогов (3, 7 и 8, соответственно) в отношении NI и HI;
на фигуре 5 показано (а) Титрование (анализ бляшкообразования) вирусного потомства через 48 ч после анализа ингибирования роста вирусов. Иллюстративные результаты титрования вирусного потомства. Вирус собирали через 48 ч амплификации в присутствии 2 мкМ соединений 8, 10 или 6. Собранные супернатанты вирусных культур разбавляли в соотношении по меньшей мере 1:1000 для гарантирования того, что оставшееся соединение не имеет эффекта на образование очагов. (b) Ингибирование роста вирусов референсным ингибитором 6 и ингибитором 10. Ингибирование роста вирусов определяли путем титрования потомства из инфицированного при низкой множественности инфицирования (MOI) конфлюэнтного монослоя клеток LLC-MK2 в присутствии 2 мкМ ингибитора. При этой концентрации ингибитор 10 показал 94% ингибирования по сравнению с 14% ингибирования для 6. Эти результаты являются иллюстрацией 2 независимых экспериментов, проводимых в двух повторах, и планки погрешностей соответствуют рассчитанному стандартному отклонению;
на фигуре 6 показано ингибирование роста вируса референсным ингибитором 6  и ингибитором 10
и ингибитором 10  в различных клеточных линиях. Значения IC50 соединений 6
в различных клеточных линиях. Значения IC50 соединений 6  и 10
и 10  в отношении роста вируса определяли с помощью метода in situ ELISA против обеих линий клеток человека (A549 и NHBE) и линии клеток почек обезьяны (LLC-MK2). Значения IC50, равные 54,6±3,8 мкМ и 2,1±0,6 мкМ (LLC-MK2); 130,6±13,0 мкМ и 10,3±0,3 мкМ (A549); 79,3±1,0 мкМ и 13,9±0,7 мкМ (NHBE) были определены для соединений 6 и 10, соответственно. Эти значения определяли по меньшей мере из 2 независимых экспериментов, выполняемых в трех повторах, и планки погрешностей соответствуют рассчитанному стандартному отклонению;
в отношении роста вируса определяли с помощью метода in situ ELISA против обеих линий клеток человека (A549 и NHBE) и линии клеток почек обезьяны (LLC-MK2). Значения IC50, равные 54,6±3,8 мкМ и 2,1±0,6 мкМ (LLC-MK2); 130,6±13,0 мкМ и 10,3±0,3 мкМ (A549); 79,3±1,0 мкМ и 13,9±0,7 мкМ (NHBE) были определены для соединений 6 и 10, соответственно. Эти значения определяли по меньшей мере из 2 независимых экспериментов, выполняемых в трех повторах, и планки погрешностей соответствуют рассчитанному стандартному отклонению;
на фигуре 7 показаны 1Н и STD ЯМР-спектры 8 в комплексе с hPIV-3 HN. (a) 1Н ЯМР-спектр 8 и (b) STD ЯМР-спектр 8 в присутствии 20 мкМ hPIV-3 ΗΝ при соотношении белок-лиганд 1:100 (2 мМ 8). (с) 1Н ЯМР-спектр области Н7, Н8, Н9 и Н9'. Сигналы от остаточного глицерина отмечены  (d) STD ЯМР-спектр области Н7, Н8, Н9 и Н9'. (е) Предполагаемое связывание эпитопа 8;
(d) STD ЯМР-спектр области Н7, Н8, Н9 и Н9'. (е) Предполагаемое связывание эпитопа 8;
на фигуре 8 показаны 1Н и STD ЯМР-спектры и картирование эпитопа 10 в комплексе с hPIV-3 ΗΝ. (а) 1Н ЯМР-спектр 10. (b) STD ЯМР-спектр 10 в присутствии 20 мкМ hPIV-3 ΗΝ при соотношении белок-лиганд 1:100 (2 мМ 10). (с) 1Н ЯМР-спектр области Н7, Н8, Н9 и Н9'. (d) STD ЯМР-спектр области Н7, Н8, Н9 и Н9'. (е) предлагаемое картирование связывающего эпитопа ингибитора 10;
на фигуре 9 показано сравнение STD ЯМР-спектров 10 в комплексе с интактным вирусом hPIV-3 или рекомбинантным HN. (а) 1H ЯМР-спектр 10 в присутствии hPIV-3 HN, (b) STD ЯМР-спектр 10 в присутствии интактного вируса hPIV-3 и (с) STD ЯМР-спектр 10 в присутствии hPIV-3 ΗΝ;
на фигуре 10 показано наложение сигнала протонов фенила из 10 в комплексе с интактным вирусом или рекомбинантным HN. (а) 1H ЯМР-спектр 10 и (b) наложения STD ЯМР-спектров из 10 в присутствии вируса hPIV-3 (черный) или рекомбинантного hPIV-3 ΗΝ (красный);
на фигуре 11 показано графическое изображение результатов тестов на клеточную цитотоксичность в отношении клеток A549; и
на фигуре 12 показаны результаты анализов ингибирования Neu2 для выбранных фторированных или нефторированных соединений.
Подробное описание изобретения
Настоящее изобретение основывается, по меньшей мере частично, на обнаружении того, что определенные производные нейраминовой кислоты проявляют полезную эффективность при лечении заболеваний, вызванных вирусной инфекцией. В частности, соединения согласно изобретению являются полезными в отношении ингибирования ферментов парагриппа гемагглютинина и/или нейраминидазы.
Определения
В данном описании изобретения термины «содержит», «содержащий», «включает», «включающий» или аналогичные термины относятся к неэксклюзивному включению, так что способ или композиция, содержащие ряд элементов, необязательно ограничены только этими элементами, но могут также включать другие, не перечисленные элементы.
Если не определено иное, все использованные здесь технические и научные термины имеют те же самые значения, что и общепринятые для специалистов в той области, к которой относится данное изобретение.
Используемое здесь «эффективное количество» относится к введению некоторого количества соответствующего активного агента, которое достаточно для предотвращения появления симптомов состояния, подвергаемого лечению, или для снижения в два раза ухудшения симптомов, или для лечения и ослабления, или по меньшей мере уменьшения тяжести симптомов. Эффективное количество будет различаться, как это будет понятно для специалиста в данной области, в зависимости от возраста, пола, массы и т.п. Подходящая доза или режим дозирования могут быть определены посредством простых экспериментов.
Используемый здесь термин «фармацевтически приемлемая соль» относится к солям, которые являются токсикологически безопасными для системного или локального введения, таким как соли, полученные из фармацевтически приемлемых нетоксичных оснований или кислот, включая неорганические или органические основания, и неорганические или органические кислоты. Фармацевтически приемлемые соли могут быть выбраны из группы, включающей соли щелочных и щелочноземельных металлов, аммониевые соли, соли алюминия, железа, амин, глюкозамин, хлорид, сульфат, сульфонат, бисульфат, нитрат, цитрат, тартрат, битартрат, фосфат, карбонат, бикарбонат, малат, малеат, напсилат, фумарат, сукцинат, ацетат, бензоат, терефлатал, пальмоат, пиперазин, пектинат и S-метил метионин и т.п.
Термины «замещенный» и «необязательно замещенный», в каждом случае их использования в настоящем документе и в случае отсутствия подробного перечня для любого конкретного фрагмента, относится к замещению соответствующего фрагмента, например, алкильной цепи или кольцевой структуры, одной или несколькими группами, выбранными из C1-C6алкила, C1-C6галогеналкила, C1-C6алкокси, CN, ОН, оксо, NH2, Cl, F, Br, I, арила и гетероциклила, при этом две последние группы сами могут быть необязательно замещенными. Когда термин используется перед указанием количества функциональных групп, он применяется ко всем перечисленным функциональным группами, если не указано иное. Например, «необязательно замещенный амино, гетероциклическая группа, арил» означает, что все амино, гетероциклические и арильные группы могут быть необязательно замещенными.
Термин «алкил» относится к алкильному заместителю с прямой или разветвленной цепью, содержащему, например, от 1 до около 12 атомов углерода, предпочтительно от 1 до около 8 атомов углерода, более предпочтительно от 1 до около 6 атомов углерода, даже более предпочтительно от 1 до около 4 атомов углерода, еще более предпочтительно от 1 до 2 атомов углерода. Примеры таких заместителей включают метил, этил, пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, пентил, изоамил, 2-метилбутил, 3-метилбутил, гексил, гептил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-этилбутил, 3-этилбутил, октил, нонил, децил, ундецил, додецил и т.п. Некоторое число атомов углерода, на которое делается ссылка, относится к углеродному остову и разветвлению углеродной цепи, но не включает атомы углерода, принадлежащие любому из заместителей, например, атомы углерода алкокси-заместителя, ответвляющиеся от основной углеродной цепи.
Термин «циклоалкил» относится к необязательно замещенным насыщенным моноциклическим, бициклическим или трициклическим углеродным группам. В случае необходимости циклоалкильная группа может иметь указанное число атомов углерода, например, C3-C6циклоалкил представляет собой карбоциклическую группу, имеющую 3, 4, 5 или 6 атомов углерода. Неограничивающие примеры могут включать циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил и т.п.
Термин «арил» относится к незамещенному или замещенному ароматическому карбоциклическому заместителю, как обычно понимается в данной области. Предполагается, что термин «арил» применяется к циклическим заместителям, которые являются планарными и содержат 4n+2 π-электронов согласно правилу Хюккеля. Предпочтительным является С-6 арил.
Термины «гетероциклический» и «гетероциклил», используемые здесь, в частности, в отношении определенных ‘R’-групп, относятся к неароматическому кольцу, имеющему от 5 до 7 атомов в кольце, и из этих атомов от 1 до 4 атомов являются гетероатомами, при этом указанное кольцо является изолированным или конденсированным со вторым кольцом, при этом указанные гетероатомы независимо выбраны из О, N и S. Гетероциклическая группа включает частично и полностью насыщенные гетероциклические группы. Гетероциклические системы могут быть присоединены к другому фрагменту посредством любого числа атомов углерода или гетероатомов радикала, и могут быть как насыщенными, так и ненасыщенными. Неограничивающие примеры гетероциклической группы могут быть выбраны из пиразола, имидазола, индола, изоиндола, триазола, бензотриазола, тетразола, пиримидина, пиридина, пиразина, диазина, триазина, тетразина, пирролидинила, пирролинила, пиранила, пиперидинила, пиперазинила, морфолинила, тетрагидрофуранила, тетрагидротиофенила, пиразолинила, дитиолила, оксатиолила, диоксанила, диоксинила, оксазинила, азепинила, диазепинила. тиазепинила, оксепинила и тиапинила, имидазолинила, тиоморфолинила и т.п.
Термин «защищенная OH» или «защищенная гидрокси» относится к гидроксильной группе, которая защищена типичной защитной группой, такой как ацильная группа, эфирная группа или сложноэфирная группа, включая (C1-C3)ацильные, (С1-С4)алкильные группы для образования эфира или арила, такие как бензил, образуя эфир или (С1-С4)сложный эфир.
Термин «N-связанный», используемый здесь в отношении соединений согласно первому аспекту, включая соединения формулы (I) и (II), например, «N-связанный триазол» или «N-связанный гетероцикл», относится к фрагменту, присоединенному в положении С4 остова нейраминовой кислоты (R3 в формуле (I) и (II)), что ограничивает прямое соединение между кольцевым углеродом и атомом азота. Предпочтительно он относится к фрагменту R3, связанному с остовом нейраминовой кислоты посредством атома азота, входящего в состав соответствующего гетероцикла, такого как один из атомов азота триазольного кольца, тетразола, индола и т.п. В отношении «дифтор» соединений формулы (III) и (IIIа) термин N-связанный относится к фрагменту R3, связанному с остовом посредством промежуточного атома азота или, в случае гетероциклического фрагмента, посредством атома азота, входящего в состав самого гетероцикла, такого как один из атомов азота триазольного кольца.
В случаях, когда указан диапазон числа атомов в структуре (например, C1-C12, C1-C10, C1-C9, C1-C6, C1-C4, алкил, и т.д.), предполагается, что может быть использован любой поддиапазон или индивидуальное число атомов углерода, подпадающих в указанный диапазон. Так, например, указание диапазона из 1-12 атомов углерода (например, C1-C12), 1-9 атомов углерода (например, C1-C9), 1-6 атомов углерода (например, C1-C6), 1-4 атомов углерода (например, C1-C4), 1-3 атомов углерода (например, C1-C3) или 2-8 атомов углерода (например, C2-C8), используемого в отношении любой упоминаемой в настоящем документе химической группы (например, алкил, и т.п.), охватывает и, в частности, описывает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и/или 12 атомов углерода, по необходимости, а также любой его поддиапазон (например, 1-2 атома углерода, 1-3 атома углерода, 1-4 атома углерода, 1-5 атомов углерода, 1-6 атомов углерода, 1-7 атомов углерода, 1-8 атомов углерода, 1-9 атомов углерода, 1-10 атомов углерода, 1-11 атомов углерода, 1-12 атомов углерода, 2-3 атома углерода, 2-4 атома углерода, 2-5 атомов углерода, 2-6 атомов углерода, 2-7 атомов углерода, 2-8 атомов углерода, 2-9 атомов углерода, 2-10 атомов углерода, 2-11 атомов углерода, 2-12 атомов углерода, 3-4 атома углерода, 3-5 атомов углерода, 3-6 атомов углерода, 3-7 атомов углерода, 3-8 атомов углерода, 3-9 атомов углерода, 3-10 атомов углерода, 3-11 атомов углерода, 3-12 атомов углерода, 4-5 атомов углерода, 4-6 атомов углерода, 4-7 атомов углерода, 4-8 атомов углерода, 4-9 атомов углерода, 4-10 атомов углерода, 4-11 атомов углерода и/или 4-12 атомов углерода, и т.д., по необходимости.
Используемые здесь термины «субъект» или «индивидуум», или «пациент», относятся к любому субъекту, в частности, субъекту-позвоночному и даже более предпочтительно субъекту-млекопитающему, для которого терапия является желательной. Подходящие животные-позвоночные включают, но без ограничения, приматов, сельскохозяйственных животных (например, овец, коров, лошадей, ослов, свиней), животных для лабораторных испытаний (например, кроликов, мышей, крыс, морских свинок, хомяков), домашних животных (например, кошек, собак) и живущих в неволе диких животных (например, лис, оленей, собак динго). Предпочтительным субъектом является человек, нуждающийся в лечении заболевания или состояния, вызванного вирусной инфекцией. Однако следует понимать, что указанные выше термины не подразумевают обязательное присутствие симптомов.
В соответствии с первым аспектом изобретения предлагается соединение формулы (I) или его фармацевтически приемлемая соль:
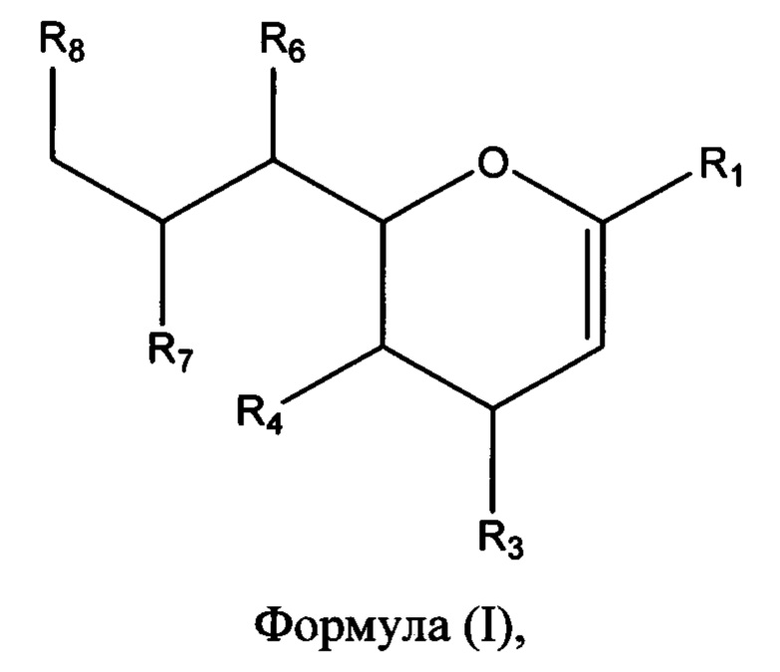
в которой R1 выбран из группы, состоящей из СООН или его соли, C(O)NR9R10, C(O)OR11, где R9, R10 и R11 независимо выбраны из группы, состоящей из водорода и необязательно замещенного C1-C6алкила;
R3 выбран из группы, состоящей из N-связанного триазола, замещенного по одному или обоим кольцевым атомам углерода, необязательно замещенного N-связанного тетразола, необязательно замещенного N-связанного индола, необязательно замещенного N-связанного изоиндола и необязательно замещенного N-связанного бензотриазола;
R4 представляет собой NHC(O)R17, где R17 выбран из группы, состоящей из C1-C6алкила, C1-C6галогеналкила и C3-C6циклоалкила; и
R6, R7 и R8 независимо выбраны из группы, состоящей из ОН, NH2, C1-C6алкила, NR18R18', C1-C6алкокси, -OC(O)R18, -NH(C=O)R18 и S(O)nR18, где n=0-2 и R18 и R18', каждый, независимо представляют собой водород или необязательно замещенный C1-C6алкил.
В одном варианте осуществления первого аспекта соединение формулы (I) представляет собой соединение формулы (II):
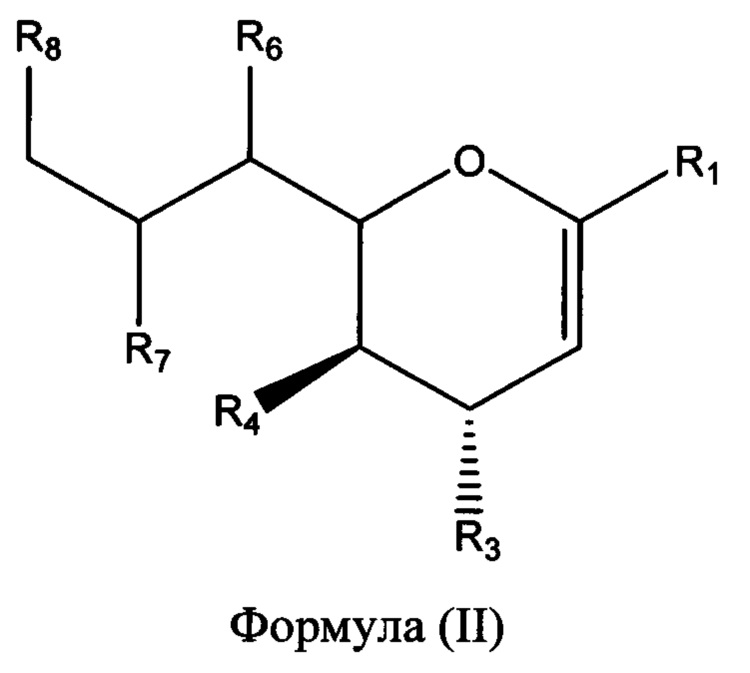
в которой R1, R3, R4, R6, R7 и R8 являются такими, как описано выше.
Предпочтительно триазол представляет собой 1,2,3-триазольное кольцо, непосредственно соединенное с атомом углерода нейраминовой кислоты в положении N-1.
В одном варианте осуществления, в котором тетразол является замещенным, он замещен только по кольцевому атому углерода.
В одном варианте осуществления соединения формулы (I) или (II) R1 представляет собой СООН или его соль, или C(O)OR11, где R11 выбран из метила, этила и пропила.
В определенных специфических вариантах осуществления R1 выбран из группы, состоящей из СООН, COONa и С(O)ОМе.
В одном варианте осуществления соединения формулы (I) или (II) R3 выбран из группы, состоящей из:
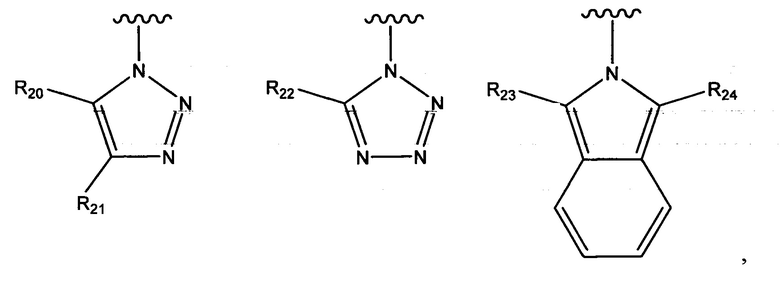
где R20 и R21 независимо выбраны из группы, состоящей из водорода, гидроксильной группы, циано, галогено, C1-C6алкила, C1-C6галогеналкила, C1-C6алкилового эфира, необязательно замещенного пиридила и необязательно замещенного фенила, и при этом по меньшей мере один из R20 и R21 не представляет собой водород;
R22 выбран из группы, состоящей из водорода, C1-C6алкила и необязательно замещенного фенила; и
R23 и R24 независимо выбраны из группы, состоящей из водорода, гидроксильной группы, циано, галогено, C1-C6алкила и C1-C6галогеналкила.
В определенных предпочтительных вариантах осуществления R20 и R21 выбраны из C1-C6алкила, C1-C6гидроксиалкила, C1-C6алкокси, необязательно замещенного пиридила и необязательно замещенного фенила.
В одном варианте осуществления, в котором, когда R20, R21 или R22 представляют собой необязательно замещенный пиридил или необязательно замещенный фенил, по необходимости, замещение может быть осуществлено фрагментом, выбранным из группы, состоящей из C1-C6алкила, C1-C6галогеналкила, C1-C6алкилгидрокси, C1-C6алкокси, галогено, -С(O)ОМе и -СН2ОСН3.
В определенных вариантах осуществления R3 может быть выбран из группы, состоящей из:
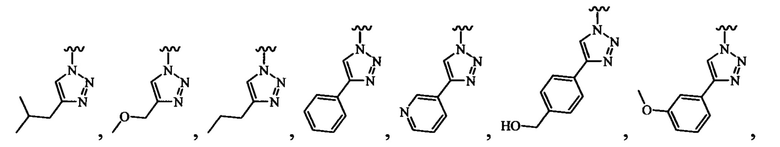
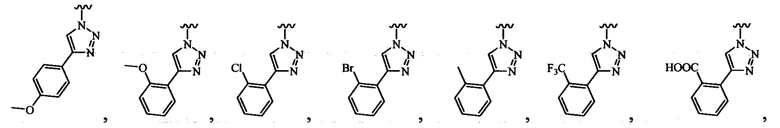
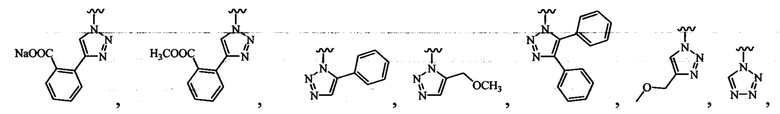
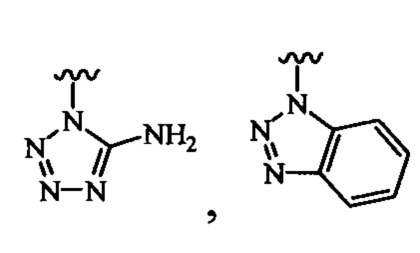 и
и 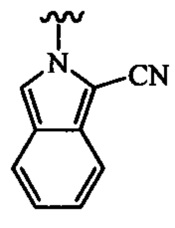 .
.
Специфические фрагменты, указанные выше, могут быть комбинированы с любым раскрытием описанной здесь группы R1, R4, R6, R7 или R8.
В любом из вышеописанных вариантов осуществления R4 может быть выбран из группы, состоящей из:
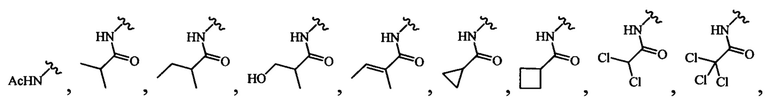
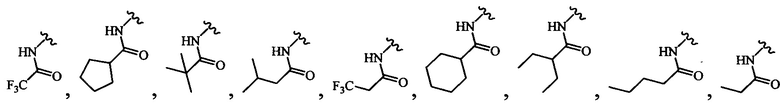
и 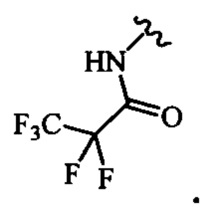
В определенных вариантах осуществления R4 выбран из группы, состоящей из-NHAc, -NHC(O)CH2(СН3)2, -NHC(O)CF3 и -NHC(O)CH2CH3.
В любом варианте осуществления соединений формулы (I) или (II), R6, R7 и R8 могут быть независимо выбраны из группы, состоящей из OH, (C1-C3)алкокси и -OC(O)R18, где R18 представляет собой необязательно замещенный (C1-C3)алкил.
В любом одном или нескольких предшествующих вариантах осуществления R6, R7 и R8 могут быть независимо выбраны из OH и OAc.
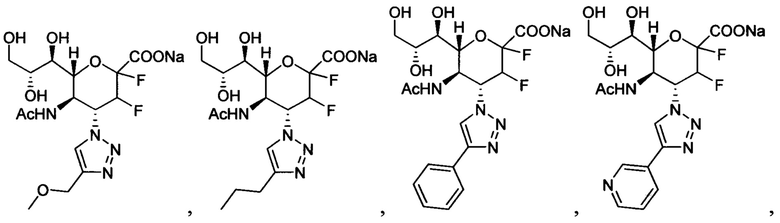
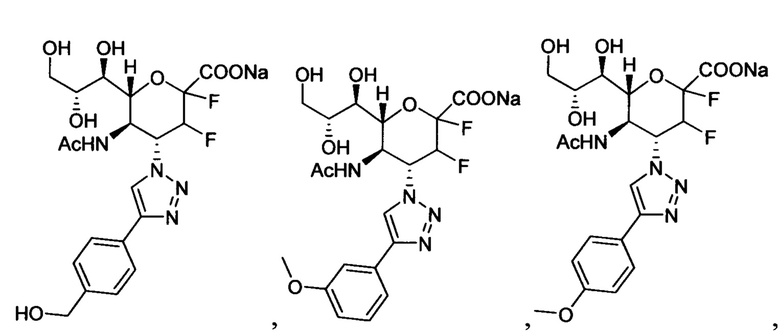
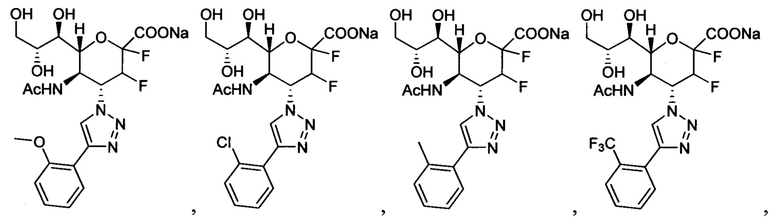
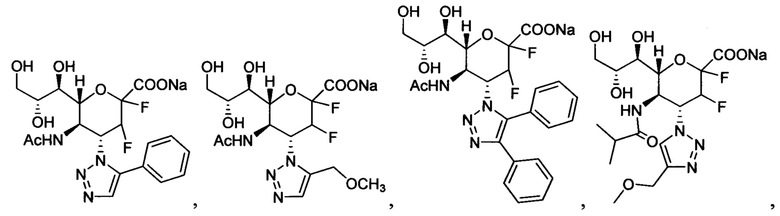
В вариантах осуществления формулы (I) и формулы (II) соединение может быть выбрано из группы, состоящей из:
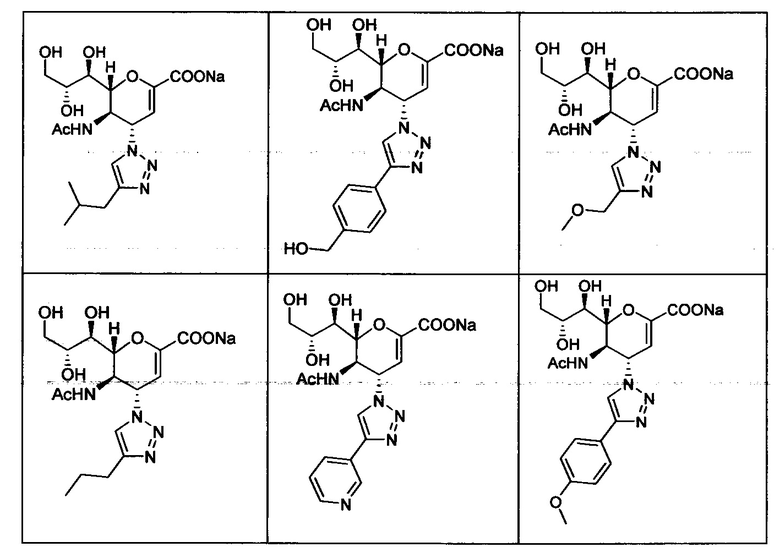
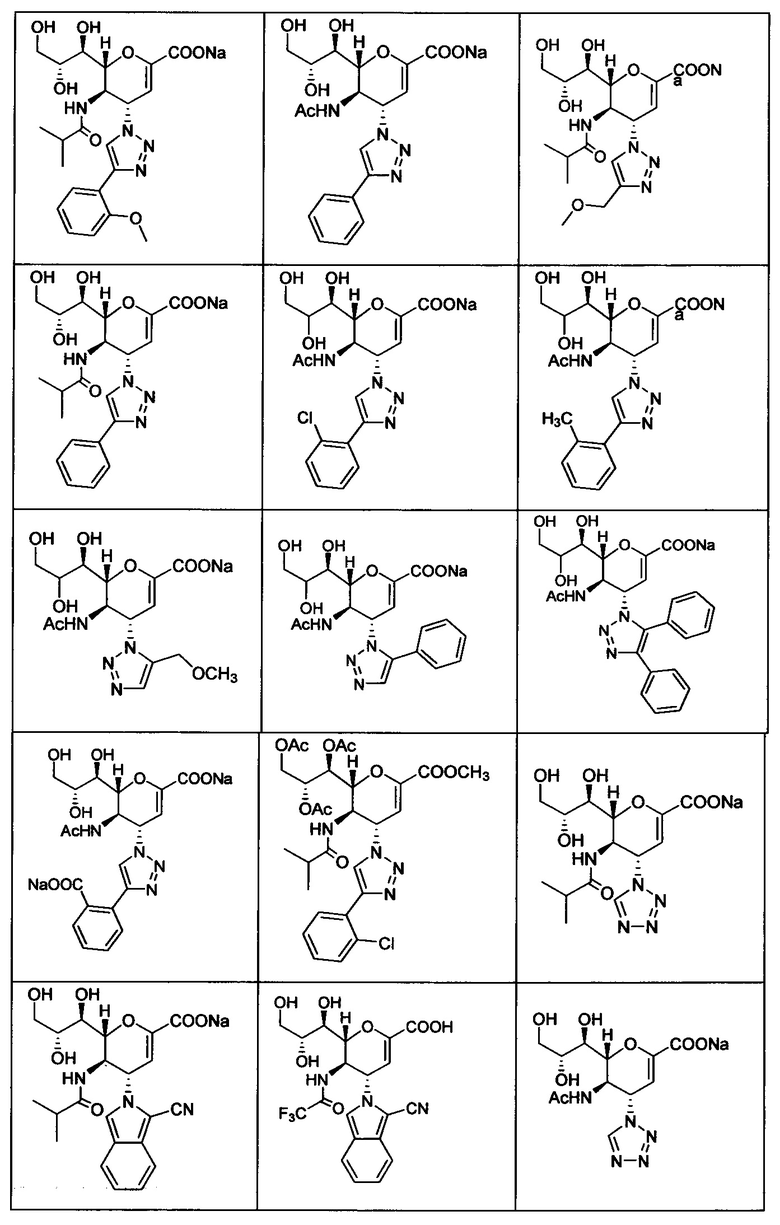
и всех их С-2 аналогов, при этом С-2 карбоксигруппа находится в протонированной форме, в форме соли натрия или в форме (C1-C3)сложноэфирного пролекарства и при этом каждое соединение может иметь описанные близкие аналоги, где положение R4 напрямую заменено любой группой -NHC(O)R, где R представляет собой (C1-C4)алкил или галогеналкил.
Специалисту в области синтетической химии будет известно, что СООН-группа может быть легко заменена на солевую форму или сложноэфирную защитную группу, например, метальную сложноэфирную группу и, таким образом, все такие формы считаются раскрытыми в настоящем документе в отношении указанных выше соединений.
В одном конкретном варианте осуществления формулы (I) или формулы (II), в которой R4 представляет собой NHAc и R3 представляет собой замещенный триазол, указанный триазол не замещен карбоксильной группой.
В следующем конкретном варианте осуществления формулы (I) или формулы (II), в которой R4 представляет собой NHAc и R3 представляет собой триазол, замещенный только в 4-положении триазольного кольца (положение 1 представляет собой кольцевой атом азота, присоединенный к остову нейраминовой кислоты), указанный триазол не замещен пропилом, замещенным пропилом, замещенным трет-бутилом или диэтоксиалкилом.
В одном варианте осуществления соединение согласно первому аспекту представляет собой модулятор гемагглютинина и/или нейраминидазы. Предпочтительно соединение представляет собой ингибитор гемагглютинина и/или нейраминидазы.
В одном варианте осуществления может быть предпочтительным, чтобы ингибитор гемагглютинина и/или нейраминидазы представлял собой ингибитор гемагглютинина и/или нейраминидазы гриппа или парагриппа.
В одном альтернативном аспекте, называемом здесь как «дифтор»-аспект, в изобретении предлагается соединение формулы (III) или (IIIа), или его фармацевтически приемлемая соль:
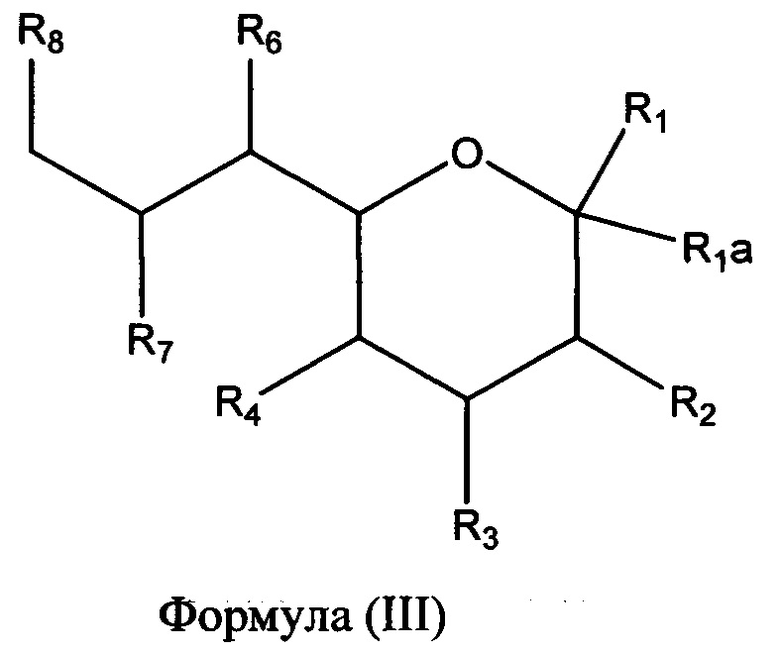
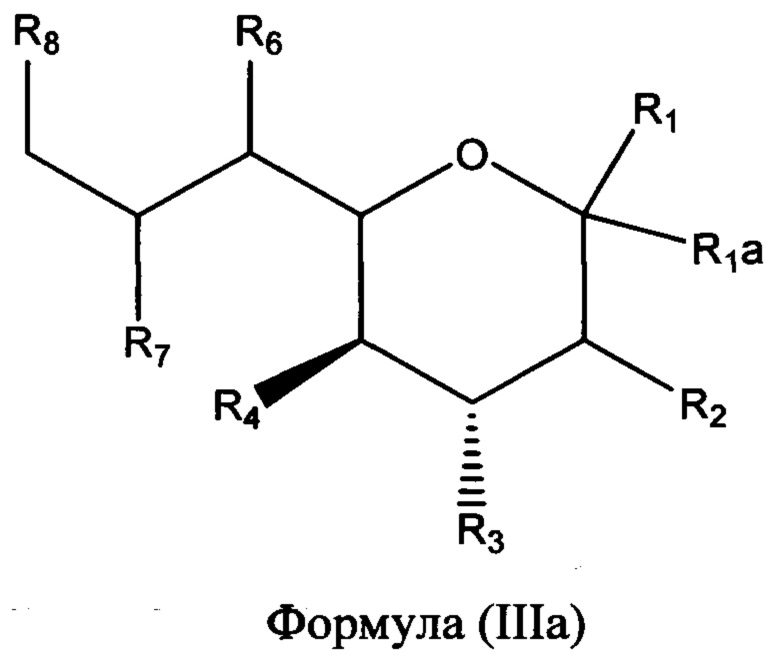
в которой R1 выбран из группы, состоящей из СООН или его соли, C(O)NR9R10, C(O)OR11, Р(O)(ОН)2 и P(O)(OR11)2;
R1a и R2 представляют собой фтор;
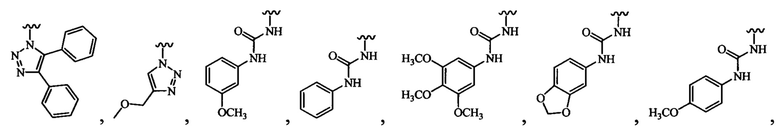
R3 выбран из группы, состоящей из необязательно замещенной N-связанной гетероциклической группы, -NHC(O)NHR12, -NHC(O)R13 и -NHS(O)2R14;
R4 выбран из группы, состоящей из NR15R16 и NHC(O)R17; и
R6, R7 и R8 независимо выбраны из группы, состоящей из ОН, NH2, C1-C6алкила, NR18R18', C1-C6алкокси, -OC(O)R18, -NH(C=O)R18 и S(O)nR18, где n=0-2 и R18 и R18', каждый, независимо представляют собой водород и необязательно замещенный C1-C6алкил.
В одном варианте осуществления формулы (III) или формулы (IIIа) R1 выбран из группы, состоящей из СООН или его соли, и COOR11, где R11 представляет собой необязательно замещенный C1-C6алкил.
В одном варианте осуществления формулы (III) или формулы (IIIа) R11 выбран из метила, этила, пропила, изопропила, н-бутила, втор-бутила, изобутила, трет-бутила и пентила.
В одном варианте осуществления формулы (III) или формулы (IIIа) R12, R13 и R14 независимо выбраны из группы, состоящей из необязательно замещенного бензила и фенила.
В одном варианте осуществления формулы (III) или формулы (IIIа) R3 выбран из группы, состоящей из пиразола, имидазола, индола, изоиндола, триазола, бензотриазола, тетразола, пиримидина, пиридина, пиразина, диазина, триазина и тетразина, все из которых могут быть необязательно замещенными, и которые связаны с остовом посредством кольцевого атома азота.
В одном варианте осуществления формулы (III) или формулы (IIIа) R3 выбран из группы, состоящей из:
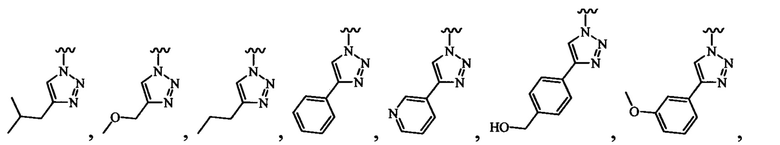
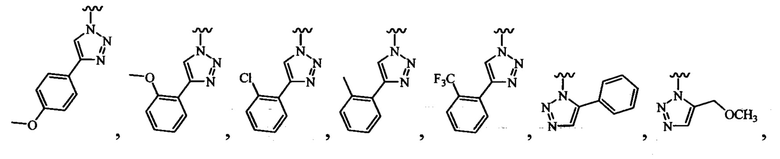
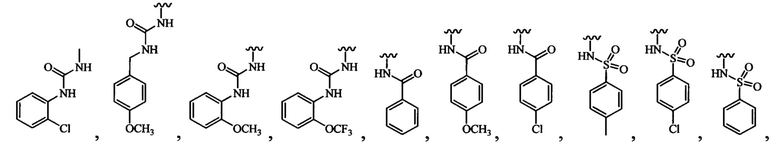
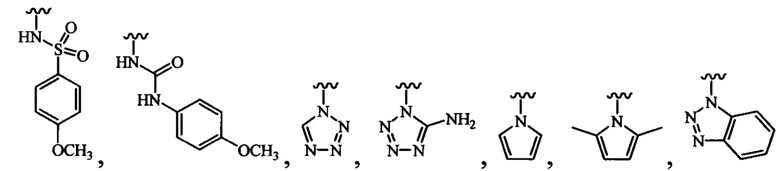 и
и 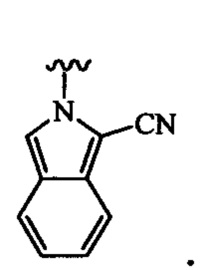
В одном варианте осуществления формулы (III) или формулы (IIIа) R4 выбран из группы, состоящей из NR15R16 и NHC(O)R17, и где R15, R16 и R17 независимо выбраны из группы, состоящей из необязательно замещенного C1-C6алкила, C1-C6галогеналкила, C1-C6алкенила и C3-C6циклоалкила.
В одном варианте осуществления формулы (III) или формулы (IIIа) R4 представляет собой NHC(O) R17 и где R17 выбран из группы, состоящей из необязательно замещенного C1-C6алкила, C1-C6галогеналкила и C3-C6циклоалкила.
В одном варианте осуществления формулы (III) или формулы (IIIа) R4 выбран из группы, состоящей из:
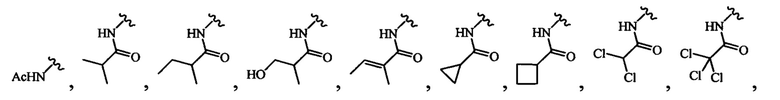
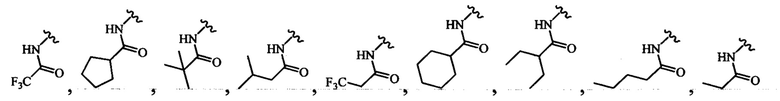
и 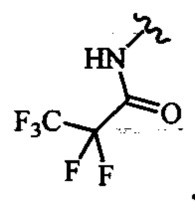
В одном варианте осуществления формулы (III) или формулы (IIIа) R4 выбран из -NHC(O)-метила, -NHC(O)-этила, -NHC(O)-пропила, -NHC(O)-изопропила, -NHC(O)- н-бутила, -NHC(O)-втор-бутила, -NHC(O)-изобутила, -NHC(O)-трет-6утила и -NHC(O)-пентила.
В одном варианте осуществления формулы (III) или формулы (IIIа) R5 представляет собой C1-C6алкил или C1-C6алкенил, каждый из которых может быть необязательно замещенным.
В одном варианте осуществления формулы (III) или формулы (IIIа) R5 представляет собой C1-C6алкил, замещенный гидроксильной группой или защищенной гидроксильной группой.
В одном варианте осуществления формулы (III) или формулы (IIIа) R6, R7 и R8 независимо выбраны из ОН, (C1-C10)алкокси и -OC(O)R18, где R18 представляет собой (C1-C10)алкил.
В одном варианте осуществления формулы (III) или формулы (IIIа) R6, R7 и R8 независимо выбраны из ОН и ОАс.
В одном варианте осуществления дифтор-аспекта соединение формулы (III) или формулы (IIIа), или его фармацевтически приемлемая соль выбраны из группы, состоящей из: 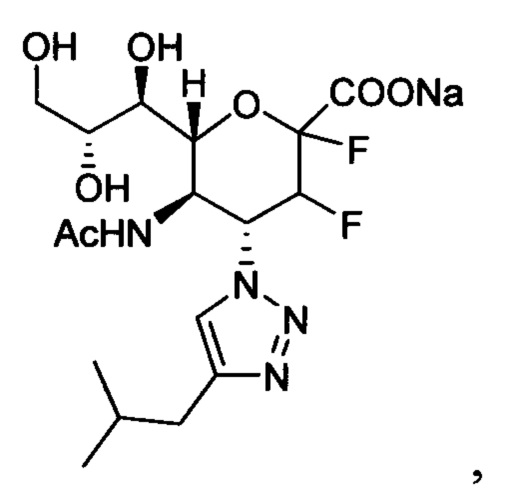
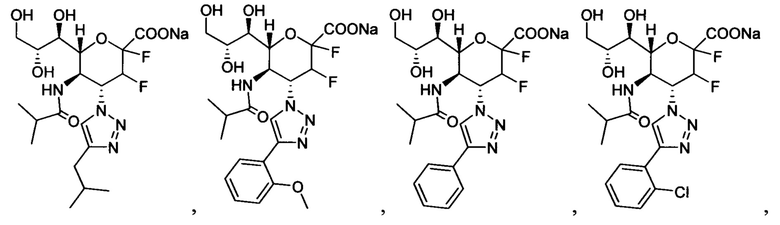
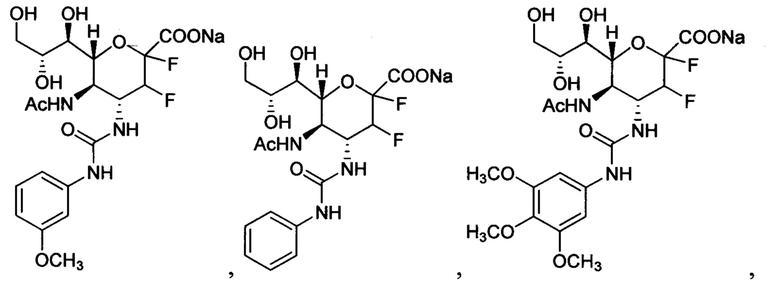
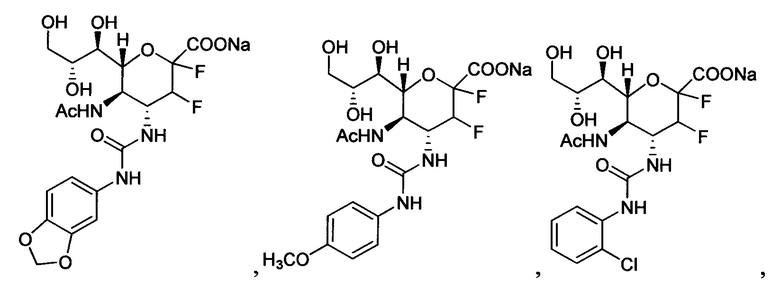
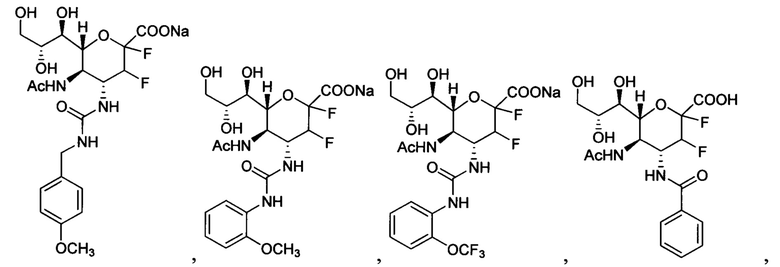

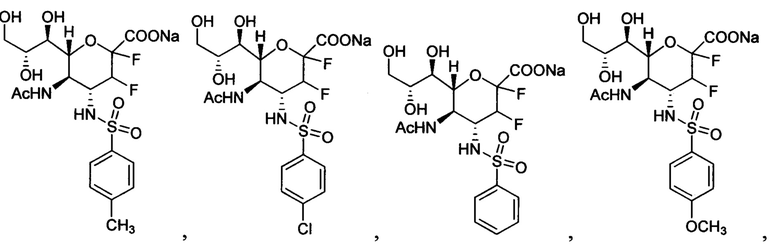
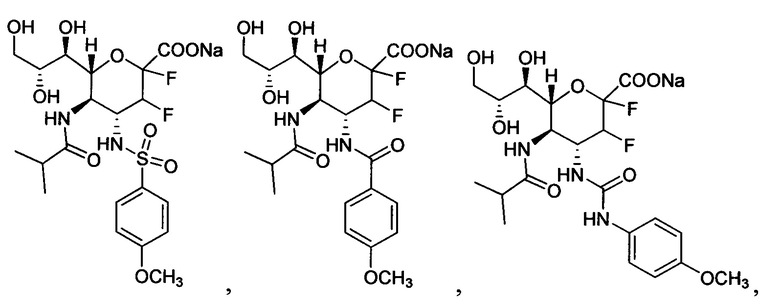
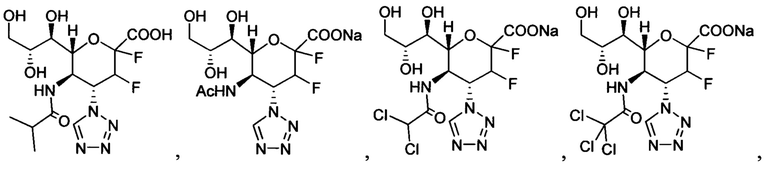
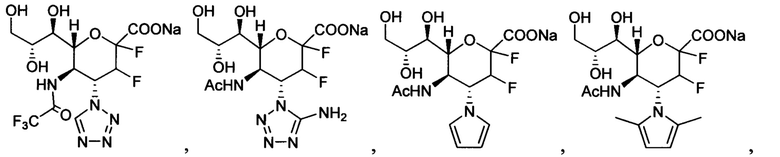
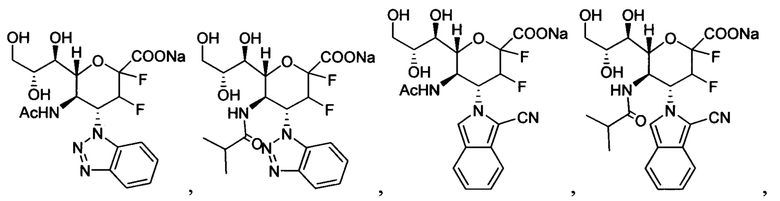
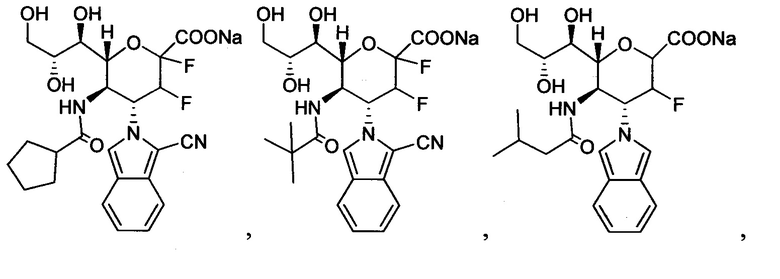
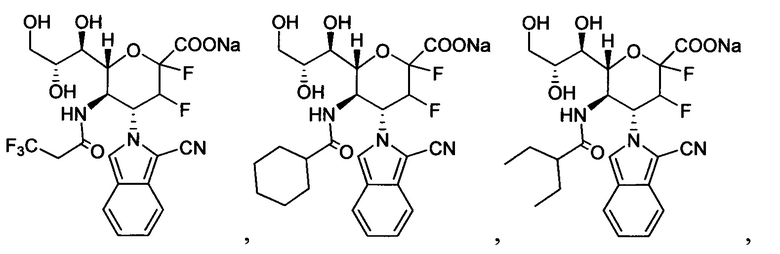
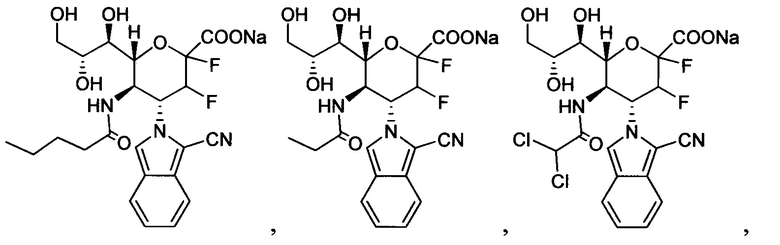
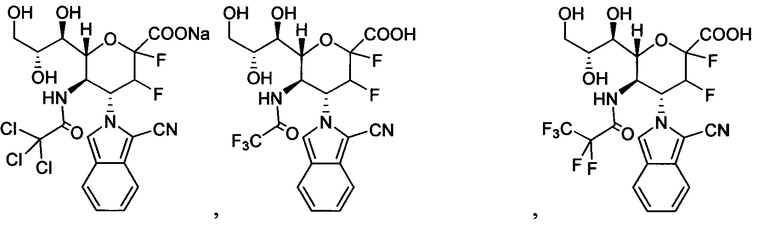 и
и
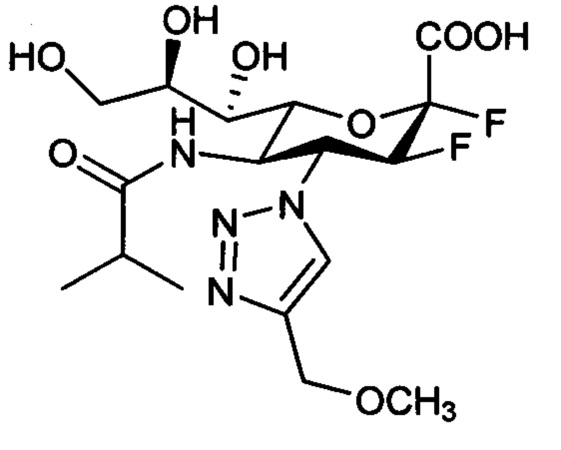 ,
,
где СООН при каждом появлении может быть использован взаимозаменяемо с COONa, и vice versa.
В любом из вышеуказанных вариантов осуществления формулы (III) или формулы (IIIа) R3 может не представлять собой N-связанный арил, то есть арильное кольцо, связанное с остовом посредством промежуточного атома азота.
Можно предположить, что соединения, такие как соединения, представленные формулами (III) и (IIIа), в которых присутствует паттерн С-2 и -3 фтор-замещения, могут быть особенно эффективными против штаммов гриппа. Без привязки к какой-либо теории полагают, что такие соединения являются активными, поскольку являются эффективными ингибиторами вирусной нейраминидазы.
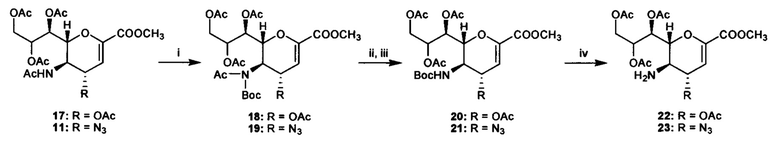
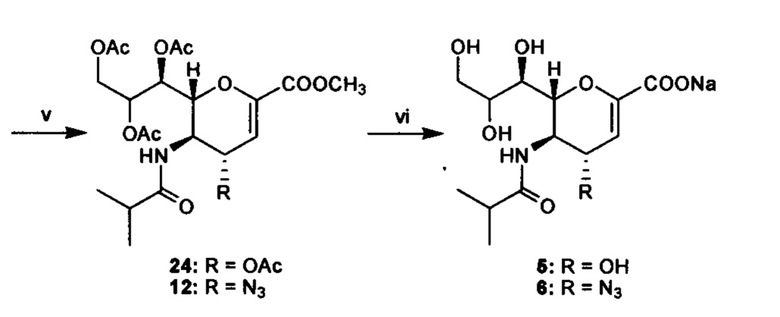
Схема 1: i) (Boc)2O, DMAP, THF, 60°C, в течение ночи, (18, 71%; 19, 96%); (ii) NaOCH3/CH3OH, комнатная температуре, 1 ч; (iii) Ac2O, пиридин, комнатная температура, в течение ночи (20, 81%; 21, 63% за 2 стадии); (iv) TFA, DCM, комнатная температуре, в течение ночи, (22, 90%; 23, 85%); (v) Изобутирилхлорид, Et3N, DCM, комнатная температуре, 4 ч (24, 84%; 12, 91%); (vi) NaOH, MeOH/H2O (1:1), комнатная температура, в течение ночи (5, 94%; 6, 82%).
Несколько способов синтеза может быть использовано для получения соединений согласно изобретению. На представленной ниже схеме 1 показан один из способов, с помощью которого могут быть синтезированы некоторые известные ингибиторы нейраминидазы для применения в качестве референсных соединений. Подходящие методики, которые могут быть использованы для синтеза соединений согласно первому аспекту, описаны в Carbohydr. Res. 244, 181-185 (1993); Carbohydr. Res. 342, 1636-1650 (2007); Bioorg. Med. Chem. Lett. 16, 5009-5013 (2006); и PCT заявке WO 2002076971.
На представленной ниже схеме 2 показан способ синтеза, используемый для получения соединений 7-10, которые являются предпочтительными соединениями согласно первому аспекту.
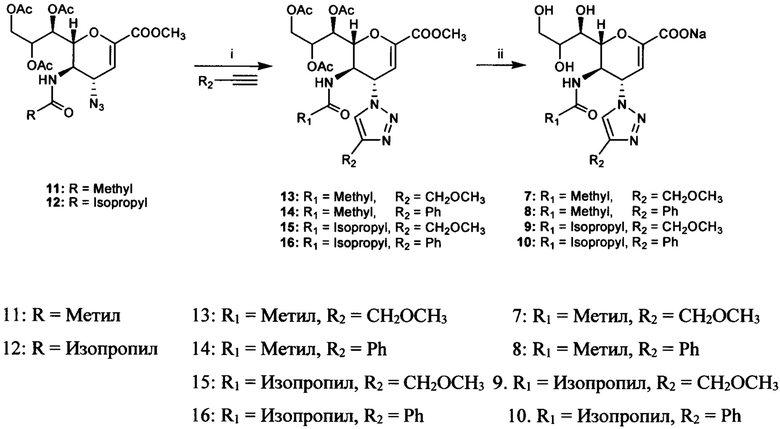
Схема 2: (i) CuSO4, Na-аскорбат, трет-бутанол/H2O (1:1), 45°C, 6 ч (13, 78%; 14, 82%; 15, 71%; 16, 84%); (ii) NaOH, MeOH/H2O (1:1), комнатная температура, в течение ночи (7, 85%; 8, 96%; 9, 92%; 10, 89%).
Вкратце, синтез триазолов 7-10 осуществляли с использованием известных промежуточных соединений 11 и 12 на основе 4-азидо-дезокси-Neu5Ac2en. Каждое из двух промежуточных соединений подвергали воздействию метилпропаргилового эфира или этинилбензола в условиях типичной клик-реакции азид-алкинового циклоприсоединения (нагревание смеси производного 4-азидо-4-дезокси-Neu5Ac2en, алкина, CuSO4 и аскорбата натрия в смеси (1:1) воды и трет-бутанола в течение 6 ч) с получением производного триазола (фигура 1). Триазолы 13 и 14 (начиная с 11) и производные триазола 15 и 16 (начиная с 12) выделяли с выходами 78%, 82%, 71% и 84%, соответственно. Затем с полученных 13-16 пер-О-ацетилированных производных триазола снимали защиту путем обработки водным раствором метанола (50%), доводили до рН 13-14 при комнатной температуре в течение 24 ч с получением конечных продуктов 7-10 в виде солей натрия с выходами 85%, 96%, 92% и 89%, соответственно.
Мишени для синтеза отчасти связаны с информацией, полученной в результате молекулярного моделирования кристаллической структуры hPIV-3 HN. В частности, петля 216 hPIV-3 HN указывает на значительную гибкость и поэтому было сделано предположение о том, что производные Neu5Ac2en с довольно объемными С4 заместителями могут располагаться внутри и блокировать в открытом положении полость 216 в пределах активного участка. Симуляции молекулярной динамики (MD) использовали для разработки и оценки производных Neu5Ac2en, которые содержат С4-функционализированные триазолы, в качестве основы для проверки теории. Исходя из начального исследования гибкости петли 216 и конечных размеров полости 216 стало понятно, что относительно объемные С4 заместители на темплате на основе ненасыщенной нейраминовой кислоты (соединения 7-10, показанные на фигуре 1) могут хорошо переноситься в пределах открытой полости 216. Кроме того, моделирование этих С4 триазол-замещенных ингибиторов в комплексе с hPIV-3 ΗΝ указывает на то, что оба фрагмента, ацетамидо (7, 8) и изобутирамидо (9, 10) у С5 на темплате также могут располагаться одновременно в пределах С5-связывающего домена. С использованием симуляций MD была оценена способность более объемных соединений триазола (8 и 10) эффективно блокировать открытие петли 216 в hPIV-3 ΗΝ. В заключение, определяли относительные энергии взаимодействия 8 и 10 в комплексе с hPIV-3 ΗΝ для прогнозирования вероятности того, что более объемный С5 ацетиламино фрагмент в комбинации с объемным С4 заместителем будет улучшать аффинность ингибитора.
Методология моделирования и биологическая оценка подробно описаны в экспериментальном разделе, но вкратце, приводят к некоторым выводам, касающимся влияния С4/С5 заместителей на активность ингибитора. В каждой из двух подвергнутых скринингу групп, то есть в группе 1 (С5-ацетамидо) и в группе 2 (С5-изобутирамидо), был обнаружен следующий порядок активности на основе заместителя у С4: гидроксильная группа < азидо ≤ 4-метоксиметилтриазол < 4-фенилтриазол. Самое слабое ингибирование в обеих группах наблюдалось для 4-гидроксильных производных 2 и 5. Этот результат поддерживает концепцию, согласно которой С4 связывающий домен, который содержит С4 гидроксильную группу на Neu5Ac2en (2), имеет значительно гидрофобный характер и, следовательно, не способствует взаимодействию с полярной гидрофильной группой, включая гидроксильную группу. Гидрофобная природа кармана, наряду с большим размером полости 216, созданной путем открытия петли 216, содействует ингибиторам, включая ингибиторы 8 и 10, которые имеют С4 гидроксильную группу, замененную на объемные гидрофобные заместители.
Сравнение значений IC50 для обеих групп показало, что замена С5 ацетамидо группы на изобутирамидо группу во всех полученных ингибиторах приводит к общей повышенной активности. Как правило, наблюдалось улучшение примерно на порядок, за исключением наиболее активного ингибитора 10. Кроме того, анализ значений IC50 поддерживает концепцию, согласно которой усиление активности лучших ингибиторов 8 и 10 происходит в первую очередь в результате введения С4 заместителя, при этом С5 заместитель оказывает влияние в гораздо меньшей степени. Эта концепция также подтверждается данными анализа STD ЯМР, с помощью которого была получена карта эпитопов ингибитора 10, в котором протоны 4-фенилтриазольного фрагмента показали наиболее значительный вклад в событие связывания 10 в комплексе с hPIV-3 ΗΝ, тогда как относительные взаимодействия, наблюдаемые для изобутирамидо группы, были меньше (~50%).
Сильное ингибирование функций обоих ΗΝ (NI и HI) ингибитором 10 показывает, что соединение проявляет свой противовирусный эффект против hPIV-3 путем воздействия на ключевой вирусный белок HN. Эти обнаружения дополнительно подтверждаются экспериментами STD ЯМР, проводимыми на 10 в комплексе с интактным вирусом или рекомбинантным белком HN, которые четко показали идентичные интенсивности сигналов STD ЯМР для С4 триазольного ароматического фрагмента ингибитора. Кроме того, рассчитанное связывание с эпитопом для 10 в комплексе с hPIV-3 ΗΝ высоко соответствует симуляциям MD, которые четко прогнозируют тесный контакт Н3 производного Neu5Ac2en и протонов фенила С4 триазоло фрагмента с белковой поверхностью.
Кроме того, результаты анализа in situ ELISA хорошо согласуются с данными анализа NI и HI. Клеточные анализы LLC-MK2 демонстрируют, что 10 является даже более сильным на клеточном уровне по сравнению с белковыми анализами NI и HI. В этом клеточном анализе было обнаружено, что 10 был примерно в 26 раз более сильным, чем 6, тогда как анализы ингибирования белка показали только примерно 8-кратное и 11 -кратное улучшение в анализах NI и HI, соответственно. Это в высокой степени подтверждает, что 10 является сильным ингибитором двойного действия, который приобретает эффективный синергизм благодаря ингибированию активностей обоих белков, нейраминидазы и гемагглютинина. Это отличается от известного ингибитора 6, который приобретает меньший синергический эффект в результате его значительно более слабого ингибирования активности гемагглютинина. И наконец, степень ингибирования роста вирусов в обеих клеточных линиях для ингибитора 10 по сравнению с 6 ясно демонстрирует превосходство разработанного лиганда 10.
Следует учесть, что соединения согласно первому аспекту обладают эффективностью в отношении не только hPIV-3 ΗΝ. Было обнаружено, как указано в экспериментальном разделе, что вариации в структуре соединения могут регулировать активность в отношении нейраминидаз другого hPIV или гриппа в целом. Например, дифтор-производные, описанные здесь, могут быть преимущественного активными против определенных нейраминидаз гриппа.
В частности, результаты указывают на то, что не только соединение 10 является значительно более сильным ингибитором, чем соединение предшествующего уровня техники BCX-2798 (референсное соединение 6) в анализе ингибирования, проводимом для сравнения их способности ингибировать инфекцию вирусом hPIV-3 и распространение в клетках LLC-MK2, путем сокращения на 94% и 14%, соответственно, но было показано, что и другие соединения согласно первому аспекту обладают даже большей силой, чем 10 или 6. Например, авторы изобретения разработали, синтезировали и биологически оценили соединения IE1398-33 и IE927-99. Эти соединения имеют значения IC50 для hPIV-3 ΗΝ, равные 1,97 мкмоль и 0,27 мкмоль, соответственно. Это улучшение на 1-2 порядка превышает улучшение, наблюдаемое для референсного соединения предшествующего уровня техники BCX-2798. Эти результаты демонстрируют удивительный уровень эффективности соединений согласно изобретению и поэтому ценность ингибитора, имеющего структуру согласно настоящему изобретению.
В соответствии со вторым аспектом изобретения предлагается фармацевтическая композиция, содержащая эффективное количество соединения формулы (I), (II), (III) или (IIIа), или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество.
Предпочтительно фармацевтическая композиция предназначена для лечения или профилактики заболевания, нарушения или состояния, вызванного вирусной инфекцией.
Фармацевтическая композиция может включать более одного соединения формулы (I), (II), (III) или (IIIа). Когда композиция включает более одного соединения, соединения могут содержаться в любом соотношении. Кроме того, композиция может содержать любые известные активные вещества, носители или адъюванты.
Соединение формулы (I), (II), (III) или (IIIа) присутствует в фармацевтической композиции в количестве, достаточном для ингибирования или ослабления заболевания, нарушения или состояния, которое подвергается лечению. Подходящие лекарственные формы и частота дозирования соединений и фармацевтических композиций, содержащих такие соединения, могут быть легко определены специалистами в данной области.
Лекарственные формы могут включать таблетки, дисперсии, суспензии, инъекции, растворы, сиропы, пастилки, капсулы и т.п. Эти лекарственные формы могут также включать устройства для инъекции или имплантации, разработанные или модифицированные специально для гарантированного помещения в участок деградации соединительной ткани. Гидрогель является предпочтительной формой доставки.
Третий аспект изобретения относится к способу лечения заболевания, нарушения или состояния, вызванного вирусной инфекцией у пациента, включающему стадию введения эффективного количества соединения формулы (I), (II), (III) или (IIIа), или его фармацевтически приемлемой соли, или фармацевтической композиции согласно второму аспекту пациенту.
В четвертом аспекте изобретения предлагается соединение формулы (I), (II), (III) или (IIIа), или его фармацевтически эффективная соль, или фармацевтическая композиция согласно второму аспекту для применения в лечении заболевания, нарушения или состояния, вызванного вирусной инфекцией у пациента.
В пятом аспекте изобретения предлагается применение соединения формулы (I), (II), (III) или (IIIа), или его фармацевтически эффективной соли в изготовлении лекарственного средства для лечения заболевания, нарушения или состояния, вызванного вирусной инфекцией.
В одном варианте осуществления третьего, четвертого или пятого аспектов заболевание, нарушение или состояние представляет собой инфекцию, вызванную вирусом гриппа или парагриппа.
Инфекция может быть вызвана вирусом гриппа А, В или С, или парагриппом.
В одном варианте осуществления парагрипп представляет собой вирус hPIV-1, 2, 3 или 4.
Предпочтительно пациент представляет собой домашнее или сельскохозяйственное животное, или человека.
В шестом аспекте изобретения предлагается способ модулирования активности вирусного фермента гемагглютинина и/или нейраминидазы, включающий стадию приведения в контакт фермента с соединением формулы (I), (II), (III) или (IIIа).
Предпочтительно модулирование включает ингибирование вирусного фермента гемагглютинина и/или нейраминидазы.
В следующем далее экспериментальном разделе более подробно охарактеризованы некоторые соединения согласно изобретению и их противовирусная активность. В изобретении проиллюстрированы некоторые определенные варианты осуществления соединений согласно изобретению и их эффективность без ограничения изобретения каким-либо образом.
Экспериментальная часть
Вычислительная химия
Симуляции молекулярной динамики выполняли с помощью программного пакета GROMOS с использованием набора параметров силового поля 54А4 (ref 39). Начальные координаты брали из рентгеновской структуры (PDB код доступа 1V3E) hPIV-3 ΗΝ в комплексе с 4 (фигура 1). Соединение 8 накладывали на атомы кольца занамивира (4) из кристаллической структуры. Параметры для 8 генерировали аналогично имеющимся параметрам в силовом поле GROMOS. Число атомов в конечной композиционной системе для 1V3E-4 и IV3E-8 составило 78253 и 78084, соответственно. Состояния ионизации аминокислотных остатков задавали при рН 7,0. Гистидиновые боковые цепи были протонированы по Nε-атому. Молекулы воды, связанные с рентгеновской структурой, удаляли и заменяли заданным растворителем с использованием модели воды «Simple-point-charge» (SPC) и периодических граничных условий, согласующихся с ранее опубликованной методологией. В симуляциях молекулы воды добавляли вокруг белка в пределах усеченного восьмигранника с минимальным расстоянием 1,4 нм между атомами белка и квадратными стенками периодического ящика. Все связи были ограничены с геометрическим допуском 10-4 с использованием алгоритма SHAKE.
Алгоритм минимизации энергии системы «steepest-descent (крутой спуск)» выполняли для релаксации контактов растворенное вещество-растворитель, при этом позиционно ограничивая атомы растворенного вещества с использованием гармонического взаимодействия с константой силы 2,5×104 кДж моль-1нм-2. Затем минимизацию энергии системы «steepest-descent» без каких-либо ограничений выполняли для устранения любого остаточного напряжения. Минимизации энергии прекращали, когда изменение энергии на шаг становилось меньше, чем 0,1 кДж моль-1. Для несвязанных взаимодействий использовали метод «triple-range method» с радиусом обрезания («cut-off radii») 0,8/1,4 нм. Ван-дер-ваальсовы и электростатические взаимодействия малого радиуса действия оценивали в каждый временной шаг на основе «charge-group pair-list». Ван-дер-ваальсовы и электростатические взаимодействия среднего радиуса действия между парами (заряженными группами) на расстоянии больше 0,8 нм и меньше 1,4 нм оценивали на каждый пятый временной шаг, и в этот момент обновляли список пар. Снаружи более длинного радиуса обрезания аппроксимацию поля реакции использовали с относительной диэлектрической проницаемостью 78,5. Движение центра масс всей системы удаляли каждые 1000 временных шагов. Растворитель и растворенное вещество независимо слабо взаимодействовали с термостатом при 295 К с временем релаксации 0,1 пс.
Системы также слабо взаимодействовали с баростатом при давлении 1 атм, с временем релаксации 0,5 пс и изотермической сжимаемостью 0,7513×10-3 (кДж моль-1 нм-3)-1. Симуляции МД с периодами 20 пс с гармоническим расположением, удерживающим атомы растворенного вещества, и константами силы 2,5×104 кДж моль-1 нм-2, 2,5×103 кДж моль-1 нм-2, 2,5×102 кДж моль-1 нм-2, 2,5×101 кДж моль-1 нм-2 выполняли для последующего уравновешивания систем при 50 К, 120 К, 1800 К, 240 К и 300 К, соответственно. Каждую симуляцию проводили в течение 30 нс. Координаты траекторий и значения энергий сохраняли каждые 0,5 пс для анализа. Траектории симуляций для hPIV-3 ΗΝ в комплексе с 4 получали аналогично способу, описанному выше, и использовали для анализа и сравнения с результатами, полученными для hPIV-3 ΗΝ в комплексе с 8.
Анализы проводили с использованием программного пакета GROMOS++. Среднеквадратичное отклонение (Root-Mean-Square Differences, RMSD) координат атомов между структурами рассчитывали для остатков, содержащих петлю 216 (остатки 210-221), путем выполнения ротационной и трансляционной подгонки методом наименьших квадратов координат атомов одной структуры ко второй (референсной) структуре с использованием заданного набора атомов (N, Сα, С). Среднеквадратичные отклонения (RMSD) координат атомов рассчитывали как среднее значение за период симуляции 30 не путем выполнения ротационной и трансляционной подгонки методом наименьших квадратов координат Cα-атомов структур траектории к референсной. структуре. RMSD рассчитывали для всех остатков, включая 216-петлю (остатки 210-221). Для получения уменьшенных, репрезентативных структурных ансамблей для симуляций выполняли кластеризацию конформаций на основе RMSD.
Структуры, извлекаемые каждые 10 пс в результате симуляций, накладывались на Сα-атомы остова для удаления общей ротации и трансляции. Кластеризацию всех атомов остатков, которые формируют участок связывания (остатки 190-198, 210-221, 251-259,274-280, 320-326, 334-339, 369-377, 407-413, 474-480, 529-533), выполняли для сравнения родственных структурных популяций белка hPIV-3 ΗΝ из различных траекторий симуляций. Применяли аналогичный критерий RMSD всех атомов этих остатков с радиусом обрезания 0,13 нм. Извлекали конечные структуры, полученные в результате 30 нс МД симуляций. Энергии взаимодействия между hPIV-3 ΗΝ и ингибиторами 8 и 10 рассчитывали с использованием генерированных GROMOS энергий, λ-производных свободной энергии и среднего числа блоков в качестве отдельных файлов траекторий, называемых как траектория энергии. Программу ene_ana использовали для извлечения индивидуальных значений энергии взаимодействия, например, несвязанных взаимодействий, то есть ван-дер-ваальсовых и кулоновских взаимодействий, из этих файлов. Таким образом, эти взаимодействия между лигандом и белком извлекали из траектории энергии в результате симуляции и рассчитывали энергии взаимодействия. Погрешность оценки рассчитывали из средней величины растущих размеров, экстраполируя до неопределенных средних значений. Анализировали гидрофобные взаимодействия и карту взаимодействий между ингибитором 10 и hPIV-3 ΗΝ создавали с использованием LIGPLOT. Для измерения степени открытия полости для выбранных структур объем кармана анализировали с использованием POVME. Важно, что увеличение времени симуляции до 80 нс показало результаты, полностью согласующиеся с представленными данными.
Соединение 8 в качестве модели ингибитора hPIV-3 ΗΝ на основе Neu5Ac2en с объемным С4-заместителем
Симуляция доступной кристаллической структуры hPIV-3 ΗΝ (код доступа PDB 1V3E) в комплексе с 8 позволила провести анализ динамического поведения белка относительно занамивир (4)-связанной структуры. Среднеквадратичные отклонения (RMSD) координат атомов (Сα, N, С) остова hPIV-3 ΗΝ для 216-петли в результате симуляций комплексов hPIV-3 HN-4 и -8 показали, что 216-петля имеет более значительные отклонения от кристаллической структуры в случае комплекса hPIV-3 HN-8. Значения RMSD, составляющие больше, чем 0,5 нм, наблюдались для симуляции комплекса hPiV-3 HN-8, тогда как структура отклонялась в меньшей степени (0,4 нм) для комплекса hPFV-3 HN-4. Это наблюдение дополнительно подтверждается среднеквадратичными отклонениями (RMSF), наблюдаемыми для Са-атомов остова для остатков, связанных с 216-петлей (остатки 205-225). Увеличенные отклонения RMS наблюдались для остатков второй половины 216-петли (215-220), где были достигнуты значения, равные ~0,3 нм, что указывает на значительную конформационную реорганизацию в пределах этого домена по сравнению с исходной рентгеновской референсной структурой hPiV-3 ΗΝ (код доступа PDB IV3E). В таблице 1 показан отбор значений RMSF остатков, содержащихся в 216-петле.
Данные дают основание предполагать, что гибкость петли, присутствующая в условиях физиологической симуляции, была значительно недооцененной в кристаллических структурах и обеспечивает возможность для обнаружения лекарственного средства против вируса парагриппа. Сравнение симуляций комплекса hPIV-3 HN-4 и комплекса hPIV-3 HN-8 показало, что С4-заместитель на 8 индуцирует значительное движение в 216-петле hPIV-3 ΗΝ. Индуцированное раскрытие петли можно наблюдать из графиков площади поверхности, доступной растворителю, конечных структур, полученных в результате 10 нс симуляций комплекса hPIV-3 HN-4 и 8.
Идентифицировали наиболее населенные конформационные кластеры в результате МД симуляций hPIV-3 ΗΝ в комплексе с 4 и 8, и генерировали наложение конечных конформаций в результате симуляций hPIV-3 ΗΝ в комплексе с 4 и 8. Наблюдается очевидна отличие в конформаций -216-петли. Полость 216-петли допускает более открытую конформацию в случае комплекса с более стерически-затрудненным ингибитором 8. В целом, более широкая полость наблюдается для симуляции комплекса hPIV-3 HN-8. Наиболее населенный кластер в результате симуляции комплекса hPIV-3 HN-4 имеет немного меньший объем полости (654  по сравнению с симулированным комплексом hPIV-3-8 (717
по сравнению с симулированным комплексом hPIV-3-8 (717 
Для оценки, будет ли более объемный С5-ацетиламино фрагмент размещаться в присутствии С4-функционализированного триазола, проводили идентичный анализ 10 в комплексе с hPIV-3 ΗΝ. Этот анализ показал, что С5-изобутирамидо фрагмент хорошо размещается в пределах С5-связывающего домена в присутствии С4-функционализированного триазола.
Относительные энергии взаимодействия 8 и 10 в комплексе с hPIV-3 ΗΝ
Для количественной оценки степени взаимодействия ингибитора с hPIV-3 ΗΝ использовали подход на основе МД симуляций для определения теоретических усредненных энергий взаимодействия для известного ингибитора 2, а также новых С5-ацетамидо и С5-изобутирамидо ингибиторов 8 и 10, соответственно. Определяли значения усредненной энергии взаимодействия (Eavl), которые составили -609,38±10,92 кДж моль-1, -733,96±15,49 кДж моль-1 и -821,88±10,93 кДж моль-1 для 2, 8 и 10, соответственно в комплексе с hPIV-3 HN (1V3E)25. Эти расчеты подтверждают концепцию, согласно которой замена ацетамидо-фрагмента в 8 на изобутирамидо-фрагмент в 10 значительно улучшает абсолютное значение Eavl ингибитора в комплексе с белком. Таким образом, ожидается, что 10 будет более сильным ингибитором hPIV-3 ΗΝ, чем 8. Дополнительный анализ МД симуляции и извлечение структуры 10 с самой низкой энергией взаимодействия (-1078,13 кДж моль-1) в комплексе с hPIV-3 ΗΝ (1V3E) выявил, что 10 осуществляет несколько ключевых взаимодействий в пределах связывающего кармана (фигура 3d). Заслуживает внимание электростатическое взаимодействие между карбоксилатом лиганда и триаргинильным кластером (Arg192, Arg424, Arg502), взаимодействия при образовании водородной связи между С7-гидроксильной группой и Glu276, и С5-изобутирамидо NH и Tyr337 и Glu409. Кроме того, дополнительные гидрофобные взаимодействия наблюдаются для обеих С4-ароматической и С5-изобутильной функциональных групп, в частности, с пептидным остовом, в пределах С4- и С5-связывающих доменов, соответственно.
Химия
Общие способы
Реагенты и сухие растворители получали от коммерческих поставщиков и использовали без дополнительной очистки. Безводные реакции проводили в атмосфере аргона в высушенной в печи стеклянной посуде. Протекание реакций контролировали с использованием тонкослойной хроматографии (TLC) на алюминиевых пластинах, предварительно покрытых силикагелем Silica Gel 60 F254 (Ε. Merck). После хроматографирования пластины просматривали в УФ-свете при длине волны 254 нм, а затем визуализировали после нанесения раствора H2SO4 в EtOH (5% об/об) с последующим обжигом. Флэш-хроматографию выполняли на силикагеле Silica Gel 60 (0,040-0,063 мм) с использованием летучих растворителей. 1Н и 13С ЯМР-спектры записывали при 300 МГц и 75,5 МГц, соответственно на спектрометре BrukerAvance 300 МГц. Химические сдвиги (δ) представлены в частях на миллион относительно пика остаточного растворителя в качестве внутреннего стандарта [CDCl3: 7.26 (с) для 1Н, 77.0 (т) для 13С; DMSO: 2.50 (пент) для 1Н, 39.51 (гепт) для 13С; D2O: 4.79 (с) для 1Н]. Эксперименты 2D COSY и HSQC выполняли для поддержки оценок. Масс-спектры низкого разрешения (LRMS) снимали в режиме ионизации электрораспылением на спектрометре BrukerDaltonics Esquire 3000 ESI с использованием положительного режима. Масс-спектры высокого разрешения (HRMS) снимали для защищенных или незащищенных конечных производных в University of Queensland FTMS Facility на BrukerDaltonics Apex III 4.7e Fourier Transform micrOTOF-Q70 MS или в Griffith University FTMS Facility на BrukerDaltonics Apex III 4.7e Fourier Transform MS, снабженных источником Apollo ESI.
Конечные незащищенные производные сиаловой кислоты очищали на колонке GracePure™ SPE C18-Aq (5000 мг/20 мл) с использованием в качестве растворителя смеси 2% ацетонитрил/H2O. Чистота всех синтезированных промежуточных соединений после хроматографической очистки составила >90% по данным 1Н и 13С ЯМР-спектроскопии, и чистота референсных соединений, синтезированных в скрининговых целях (2, 3, 5, 6), а также новых конечных продуктов 7-10 составила ≥95%.
Синтез
Синтез промежуточных соединений 11, 12 и 17-24 и референсных ингибиторов 2, 3, 5 и 6 осуществляли с помощью процедур, описанных в литературе. Общие способы показаны на схемах 1 и 2, которые обеспечивают доступ ко всем соединениям, описанным и синтезированным в настоящем документе.
Общая процедура синтеза 18 и 19: Смесь 17 или 11 (0,42 ммоль), Boc2O (275 мг, 1,27 ммоль) и DMAP (50 мг, 0,42 ммоль) в безводном THF (5 мл) перемешивали в атмосфере аргона при 60°C в течение ночи. После охлаждения до комнатной температуры растворитель выпаривали под вакуумом и остаток поглощали в дихлорметане (DCM) для хроматографического разделения на колонке с силикагелем с использованием смеси этилацетат:гексан (1:2) в качестве растворителя с получением чистого 18 (170 мг, 71%) или 19 (225 мг, 96%).
Общая процедура синтеза 20 и 2: В раствор NaOMe в метаноле, свежеприготовленный путем растворения металлического натрия (0,39 ммоль, 9 мг) в безводном МеОН (5 мл), добавляли соединение 18 или 19 (0,26 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, а затем гасили смолой Amberlite® IR-120 (Н+) (до рН=5). Смолу отфильтровывали, промывали МеОН (5 мл × 3) и объединенные фильтрат и промывные жидкости выпаривали под вакуумом. Остаток повторно растворяли в пиридине (2 мл) и добавляли уксусный ангидрид (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи, а затем растворитель и избыточное количество Ac2O удаляли под вакуумом. В заключение, остаток поглощали DCM для хроматографического разделения на колонке с силикагелем с использованием смеси этилацетат : гексан (1:2) в качестве растворителя с получением чистого 20 (112, мг, 81%) или 21 (84 мг, 63%).
Общая процедура синтеза 22 и 23: В раствор соединения 20 или 21 (0,15 ммоль) в безводном DCM (2 мл) добавляли TFA (230 мкл, 3,0 ммоль) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Реакционную смесь разбавляли DCM (20 мл) и гасили насыщенным водным раствором NaHCO3 (20 мл). Слой DCM промывали водой, солевым раствором, затем сушили над безводным Na2SO4. Высушенный органический растворитель концентрировали под вакуумом и очищали хроматографией на силикагеле с использованием подходящей системы растворителей с получением чистого 22 (58 мг, 90%) или 23 (53 мг, 85%).
Общая процедура синтеза 24 и 12: В раствор 22 или 23 (0,116 ммоль) в DCM (2 мл) в атмосфере аргона добавляли Et3N (82 мкл, 0,58 ммоль) и изобутирилхлорид (18 мкл, 0,17 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч, а затем наносили на колонку с силикагелем для хроматографического разделения с использованием смеси этилацетат:гексан (1:1) в качестве растворителя с получением чистого 24 (50 мг, 84%) или 12 (51 мг, 91%).
Общая процедура синтеза 5 и 6. В суспензию соединения 24 или 12 (0,08 ммоль) в смеси 1:1 МеОН:H2O (2 мл) при 0°C по каплям добавляли раствор NaOH (1,0 Μ) до достижения рН~14. Температуру постепенно повышали до комнатной температуры, и смесь перемешивали при комнатной температуре в течение ночи. Затем раствор подкисляли смолой Amberlite® IR-120 (Н+) (до рН=5), фильтровали и промывали МеОН (10 мл) и H2O (10 мл). Затем объединенные фильтрат и промывные жидкости концентрировали под вакуумом, остаток разбавляли дистиллированной водой (5 мл) и доводили до рН=8,0 с использованием 0,05М NaOH для перевода соединения в форму соли. Затем соединения очищали на картридже C18-GracePure™ с использованием в качестве растворителя смеси 2% ацетонитрил/вода с получением чистого соединения 5 (26 мг, 94%) или 6 (24 мг, 82%) в виде рыхлых белых порошков.
Общая процедура синтеза 13-16: Подходящее производное 4-азидо-4-дезокси-Neu5Ac2en (11 или 12, 0,22 ммоль) и соответствующее производное этинила (0,33 ммоль) растворяли в смеси 1:1 трет-бутанол:H2O (4 мл). В смесь добавляли меди (II) сульфат пентагидрат (4 мг, 0,015 ммоль) с последующим аскорбатом натрия (0,1 мл свежеприготовленного 1М раствора в H2O). Смесь перемешивали при 45°C в течение 6 ч, а затем оставляли охлаждаться до комнатной температуры. Затем смесь разбавляли DCM (100 мл), промывали 10% NH4OH (50 мл) с последующим солевым раствором (50 мл). Органический слой сушили над безводным Na2SO4 и концентрировали под вакуумом с получением сырых продуктов 13-16, которые очищали хроматографией на силикагеле с использованием подходящей системы растворителей.
Общая процедура синтеза 7-10: В суспензию защищенного производного триазола 13-16 в смеси 1:1 МеОН:H2O (2 мл) при 0°C по каплям добавляли раствор NaOH (1,0М) до достижения рН~14. Температуру постепенно повышали до комнатной температуры, и смесь перемешивали при комнатной температуре в течение ночи. Затем раствор подкисляли смолой Amberlite® IR-120 (Н+) (до рН=5), фильтровали и промывали МеОН (10 мл) и H2O (10 мл). Объединенные фильтрат и промывные жидкости затем концентрировали под вакуумом, после чего разбавляли дистиллированной водой (5 мл) и доводили до рН=8,0 с помощью 0,05 Μ NaOH для перевода соединения в форму соли. В заключение, соединение очищали на картридже C18-GracePure™ с использованием в качестве растворителя смеси 2% ацетонитрил/вода с получением чистых продуктов 7-10.
Характеристика синтезированных соединений
Метил 5-ацетамидо-7,8,9-три-О-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-метоксиметил-[1,2,3,]триазол-1 -ил)-D-глицеро-D-галакто-нон-2-енонат (13)
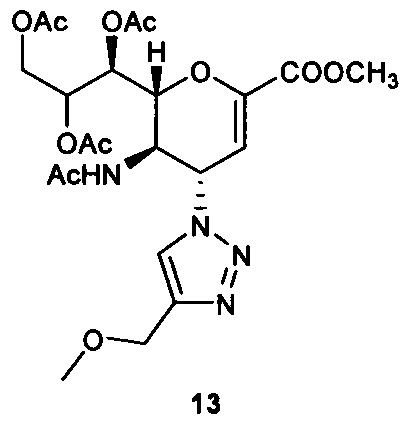
Очистка хроматографией на силикагеле с использованием смеси этилацетат:ацетон (6:1) обеспечила получение чистого соединения 13 (90 мг, 78%). 1H ЯМР (300 МГц, CDCl3): δ 1.81 (с, 3H, NAc), 2.05 (с, 6Н, 2OAc), 2.06 (с, 3H, ОАс), 3.36 (с, 3H, ОСН3), 3.80 (с, 3Н, СООСН3), 4.17 (дд, J=12.5, 7.2 Гц, 1Н, Н-9), 4.29 (м, 1Н, Н-5), 4.50 (с, 2Н, ОСН2), 4.68-4,79 (м, 2Н, Н-9', Н-6), 5.40 (ддд, J=7.4, 4.9, 2.5 Гц, 1Н, Н-8), 5.53 (дд, J=5.1, 1.8 Гц, 1Н, Н-7), 5.78 (дд, J=10.0, 2.5 Гц, 1Н, Н-4), 6.00 (д, J=2.3 Гц, 1Н, Н-3), 7.05 (д, J=9.1 Гц, 1Н, NH), 7.64 (s, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3) δ 20.71, 20.79, 20.91 (3 ОСОСН3), 22.80 (NHCOCH3), 48.39 (С-5), 52.71 (СООСН3), 58.16 (ОСН3), 58.38 (С-4), 62.21 (С-9), 65.68 (ОСН2), 67.73 (С-7), 70.90 (С-8), 76.71 (С-6), 107.18 (С-3), 121.50 (триазол-С-5), 145.24 (триазол-С-4), 145.92 (С-2), 161.27 (СООСН3), 170.06, 170.27, 170.81, 170.88 (NHCOCH3, 3 ОСОСН3), LRMS [C22H30N4O11] (m/z): (режим регистрации положительно заряженных ионов) 549,1 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C22H30N4NaO11 [M+Na]+ 549,1803; найдено 549,1805.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (15)
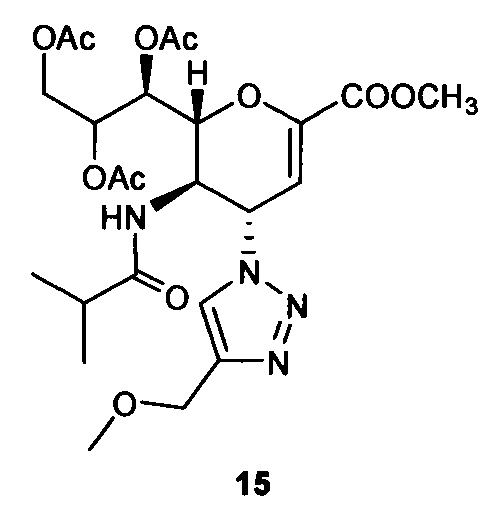
Очистка хроматографией на силикагеле с использованием смеси этилацетат:ацетон (9:1) обеспечила получение чистого соединения 15 (65 мг, 71%). 1H ЯМР (300 МГц, CDCl3): δ 0.97 (д, J=6.9 Гц, 3H, изобут-СН3), 1.01 (д, J=6.8 Гц, 3H, изобут-СН3), 2.05 (с, 3H, ОАс), 2.08 (с, 6Н, 2OAc), 2.24 (м, 1Н, изобут-СН), 3.37 (с, 3H, ОСН3), 3.81 (с, 3H, СООСН3), 4.14-4.29 (м, 2Н, Н-9, Н-5), 4.51 (с, 2Н, ОСН2), 4.68 (дд, J=12.5, 2.6 Гц, 1Н, Н-9'), 4.84 (дд, J=10.5, 1.7 Гц, 1H, Н-6), 5.38 (ддд, J=6.6, 5.5, 2.5 Гц, 1Н, Н-8), 5.48 (дд, J=5.5, 1.7 Гц, 1Н, Н-7), 5.91 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.02 (д, J=2.4 Гц, 1Н, Н-3), 6.44 (д, J=8.7 Гц, 1Н, NH), 7.59 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3): δ 18.81, 19.30 (изобут-2СН3), 20.74, 20.90 (3 ОСОСН3), 35.51 (изобут-СН), 48.79 (С-5), 52.69 (СООСН3), 57.59 (С-4), 58.38 (ОСН3), 62.08 (С-9), 65.73 (ОСН2), 67.66 (С-7), 70.79 (С-8), 76.24 (С-6), 107.07 (С-3), 121.54 (триазол-С-5), 145.39 (триазол-С-4), 145.82 (С-2),161.30 (СООСН3), 170.15, 170.23, 170.69 (3 ОСОСН3), 177.87 (изобут-СО). LRMS [C24H34N4O11] (m/z): (режим регистрации положительно заряженных ионов) 577,2 [M+Na]+ .
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-фенил-[ 1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (16)
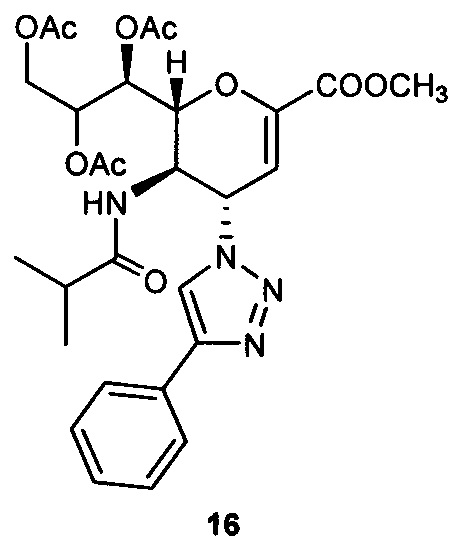
Очистка хроматографией на силикагеле с использованием смеси этилацетат : гексан (4:1) обеспечила получение чистого соединения 16 (82 мг, 82%). 1H ЯМР (300 МГц, CDCl3): δ 0.95 (д, J=6.8 Гц, 3H, изобут-СН3), 0.99 (д, J=6.9 Гц, 3H, изобут-СН3), 2.06 (с, 3H, ОАс), 2.09 (с, 6Н, 2OAc), 2.20-2.27 (м, 1Н, изобут-СН), 3.83 (с, 3H, СООСН3), 4.16-4.39 (м, 2Н, Н-9, Н-5), 4.70 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 4.88 (дд, J=10.5, 1.7 Гц, 1H, Н-6), 5.40 (м, 1Н, Н-8), 5.52 (дд, J=5.4, 1.7 Гц, 1H, Н-7), 5.99 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.08 (д, J=2.4 Гц, 1Н, Н-3), 6.51 (д, J=8.7 Гц, 1Н, NH), 7.26-7.43 (м, 3H, Ph-H-3', Ph-H-4', Ph-H-5'), 7.74 (д, J=7.2 Гц, 2Н, Ph-H-2', Ph-H-6'), 7.81 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3): δ 18.83, 19.31 (изобут-2СН3), 20.76, 20.92 (3 ОСОСН3), 35.55 (изобут-СН), 48.74 (С-5), 52.72 (СООСН3), 57.67 (С-4), 62.12 (С-9), 67.72 (С-7), 70.84 (С-8), 76.39 (С-6), 107.25 (С-3), 118.84 (триазол-С-5), 125.83 (Ph), 128.47 (Ph), 128.89 (Ph), 129.97 (Ph q углерод), 145.81 (С-2), 148.19 (триазол-С-4), 161.35 (СООСН3), 170.18, 170.26, 170.71 (3 ОСОСН3), 178.00 (изобут-СО). LRMS [C28H34N4O10] (m/z): (режим регистрации положительно заряженных ионов) 608,9 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (7)
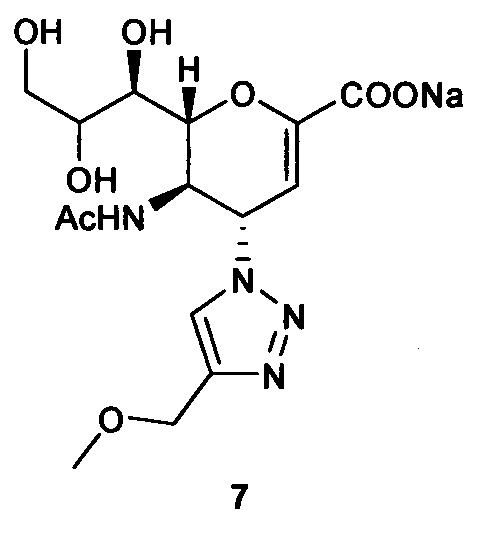
Выход = 85%. 1H ЯМР (300 МГц, D2O): δ 1.84 (с, 3H, NAc), 3.31 (с, 3H, ОСН3), 3.52-3.71 (м, 2Н, Н-9 & Н-7), 3.85 (дд, J=11.9, 2.6 Гц, 1Н, Н-9'), 3.95 (ддд, J=9.3, 6.2, 2.5 Гц, 1Н, Н-8), 4.33 (м, 1Н, Н-5), 4.51 (дд, J=10.9, 1.2 Гц, 1H, Н-6), 4.56 (с, 2Н, ОСН2), 5.48 (дд, J=9.6, 2.3 Гц, 1Н, Н-4), 5.80 (д, J=2.2 Гц, 1Н, Н-3), 8.08 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.65 (NHCOCH3), 48.68 (С-5), 57.15 (ОСН3), 59.94 (С-4), 63.06 (С-9), 64.22 (ОСН2), 68.05 (С-7), 69.71 (С-8), 75.34 (С-6), 101.80 (С-3), 123.54 (триазол-С-5), 144.08 (триазол-С-4), 150.43 (С-2), 168.75 (COONa), 173.57 (NHCOCH3); LRMS [C15H21N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 432,1 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-фенил- [ 1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (8)
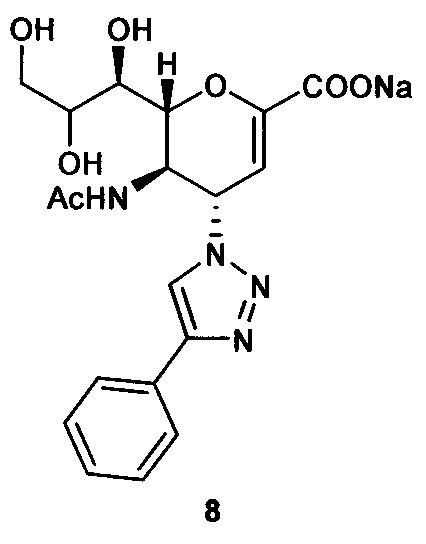
Выход = 96%. 1Н ЯМР (300 МГц, D2O): δ 1.87 (с, 3H, NAc), 3.64 (дд, J=12.1, 6.4 Гц, 1Н, Н-9), 3.69 (дд, J=9.6, 1.4 Гц, 1Н, Н-7), 3.89 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.00 (ддд, J=9.3, 6.3, 2.7 Гц, 1H, Н-8), 4.39 (м, 1Н, Н-5), 4.56 (дд, J=10.8, 1.4 Гц, 1Н, Н-6), 5.49 (дд, J=9.7, 2.3 Гц, 1H, Н-4), 5.83 (д, J=2.2 Гц, 1H, Н-3), 7.40 (м, 1Н, Ph-H4'), 7.46 (дд, J=8.4, 6.9 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.71 (д, J=7.1 Гц, 2Н, Ph-H-2', Ph-H-6'), 8.28 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.63 (NHCOCH3), 48.70 (С-5), 59.96 (С-4), 63.05 (С-9), 68.03 (С-7), 69.69 (С-8), 75.31 (С-6), 101.75 (С-3), 120.41 (Ph), 125.61 (Ph), 128.77 (триазол-С-5), 129.10 (Ph), 129.28 (Ph q углерод), 147.74 (триазол-С-4), 150.48 (С-2), 168.75 (COONa), 173.58 (NHCOCH3). LRMS [C19H21N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 463,1 [M+Na]+ ; HRMS (API) (m/z): [M+l]+рассчитано для C19H22N4NaO7 [М+Na]+441,138070; найдено 441,140189.
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (9)
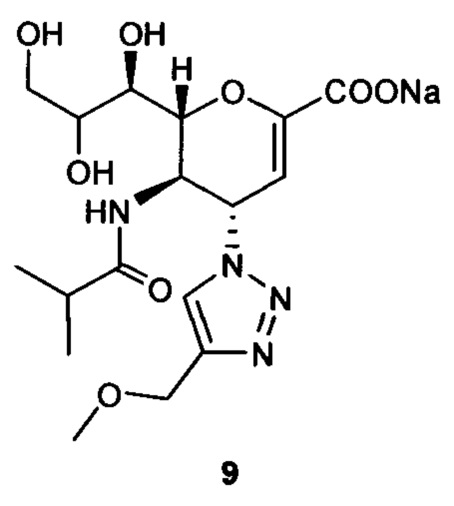
Выход = 92%. 1Н ЯМР (300 МГц, D2O): δ 0.98 (д, J=7.0 Гц, 3H, изобут-СН3), 1.03 (д, J=6.9 Гц, 3H, изобут-СН3), 2.46 (м, 1Н, изобут-СН), 3.39 (с, 3H, ОСН3), 3.65-3.76 (м, 2Н, Н-9, Н-7), 3.94 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.49 (м, 1Н, Н-5), 4.60-4.65 (м, 3H, Н-6, ОСН2), 5.61 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.87 (д, J=2.2 Гц, 1Н, Н-3), 8.18 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.43 (изобут-СН3), 18.64 (изобут-СН3), 35.10 (изобут-СН), 48.19 (С-5), 57.24 (ОСН3), 59.86 (С-4), 63.07 (С-9), 64.24 (ОСН2), 68.13 (С-7), 69.82 (С-8), 75.43 (С-6), 102.02 (С-3), 123.65 (триазол-С-5), 144.07 (триазол-С-4), 150.30 (С-2), 168.81 (COONa), 180.66 (изобут-СО). LRMS [C17H25N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 459,0 [M+Na]+; HRMS (API) (m/z): [M+Na]+ рассчитано для C17H25N4Na2O8 [M+Na]+ 459,1462; найдено 459,1458.
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (10)
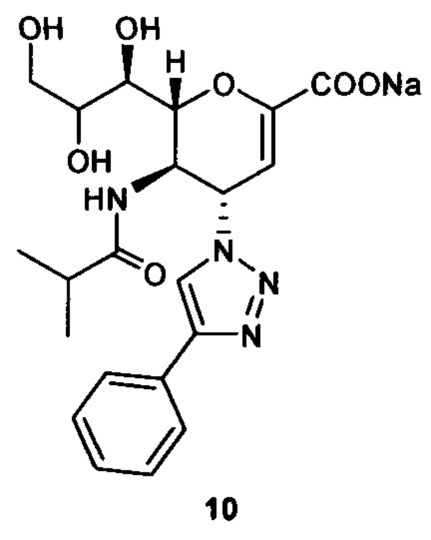
Выход = 89%. 1Н ЯМР (300 МГц, D2O): δ 0.94 (д, J=6.9 Гц, 3H, изобут-СН3), 0.99 (д, J=6.9 Гц, 3H, изобут-СН3), 2.43 (м, 1Н, изобут-СН), 3.60-3.76 (м, 2Н, Н-9, Н-7), 3.93 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.2, 6.3, 2.6 Гц, 1Н, Н-8), 4.51 (м, 1H, Н-5), 4.62 (д, J=11.0 Гц, 1H, Н6), 5.58 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.88 (д, J=2.2 Гц, 1H, Н-3), 7.42-7.54 (м, 3H, Ph-H-3', Ph-H-4', Ph-H-5'), 7.78 (д, J=7.1 Гц, 2Н, Ph-H-2', Ph-H-6'), 8.36 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.38 (изобут-СН3), 18.65 (изобут-СН3), 35.10 (изобут-СН), 48.23 (С-5), 59.91 (С-4), 63.07 (С-9), 68.15 (С-7), 69.76 (С-8), 75.41 (С-6), 101.96 (С-3), 120.66 (Ph), 125.67 (Ph), 128.81 (триазол-С-5), 129.16 (Ph), 129.36 (Ph q углерод), 147.71 (триазол-С-4), 150.32 (С-2), 168.80 (COONa), 180.67 (изобут-СО). LRMS [C21H25N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 491,2 [M+Na]+; HRMS (API) (m/z): [M+Na]+ рассчитано для C21H25N4Na2O7 [M+Na]+ 491,1513; найдено 491,1515.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-изобутил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-6)
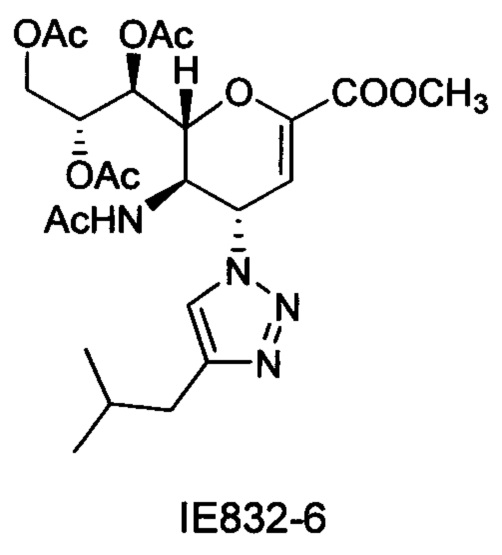
Очистка хроматографией на силикагеле с использованием этилацетата обеспечила получение чистого соединения IE832-6 (93 мг, 66%). 1H ЯМР (300 МГц, CDCl3): δ 0.89 (д, J=6.6 Гц, 6Н, изобутил-2СН3), 1.81 (с, 3H, NAc), 1.93 (м, 1Н, изобутил-СН), 2.06 (с, 6Н, 2OAc), 2.09 (с, 3H, ОАс), 2.58 (д, J=6.9 Гц, 2Н, изобутил-СН2), 3.82 (с, 3H, СООСН3), 4.17 (дд, J=12.5, 6.7 Гц, 1Н, Н-9), 4.38 (м, 1H, Н-5), 4.67 (дд, J=12.4, 2.3 Гц, 1Н, Н-9'), 4.77 (д, J=10.5 Гц, 1Н, Н-6), 5.40 (м, 1Н, Н-8), 5.55 (д, J=5.4 Гц, 1Н, Н-7), 5.88 (д, J=9.9 Гц, 1H, Н-4), 6.03 (с, 1Н, Н-3), 7.07 (уш.с, 1Н, NH), 7.49 (с, 1Н, триазол-СН); 13Н ЯМР (75 МГц, CDCl3): δ 20.74, 20.81, 20.93 (3 ОСОСН3), 22.12, 22.84 (2 изобутил-СН3 + NHCOCH3), 28.60 (изобутил-CH), 34.17 (изобутил-CH2), 48.04 (С-5), 52.76 (СООСН3), 58.62 (С-4), 62.06 (С-9), 67.56 (С-7), 70.55 (С-8), 76.57 (С-6), 106.82 (С-3), 120.94 (триазол-С-5), 146.03 (С-2), 146.83 (триазол-С-4), 161.30 (СООСН3), 169.99, 170.00 170.13, 170.78 (NHCOCH3, 3 ОСОСН3), LRMS [C24H34N4O10] (m/z): (режим регистрации положительно заряженных ионов) 561,2 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-изобутил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-8)
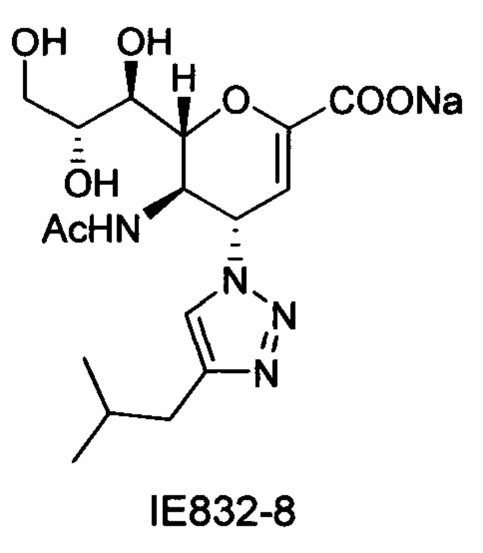
Выход = 79%. lH ЯМР (300 МГц, D2O): δ 0.82 (д, J=6.6 Гц, 6Н, изобутил-2СН3), 1.81-1.86 (м, 4Н, NAc & изобутил-CH), 2.53 (д, J=6.9 Гц, 2Н, изобутил-CH2), 3.54-3.68 (м, 2Н, Н-9 & Н-7), 3.85 (дд, J=11.9, 2.6 Гц, 1Н, Н9'), 3.94 (ддд, J=9.3, 6.3, 2.5 Гц, 1Н, Н-8), 4.33 (м, 1Н, Н-5), 4.49 (дд, J=10.9, 1.2 Гц, 1H Н-6), 5.40 (дд, J=9.7, 2.2 Гц, 1Н, Н-4), 5.78 (д, J=2.2 Гц, 1Н, Н-3), 7.80 (с, 1Н, триазол-CH); 13С ЯМР (75 МГц, D2O): δ 21.15 (изобутил-2СН3), 21.54 (NHCOCH3), 28.09 (изобутил-CH), 33.42 (изобутил-СН2), 48.53 (С-5), 59.65 (С-4), 62.99 (С-9), 67.98 (С-7), 69.63 (С-8), 75.29 (С-6), 102.06 (С-3), 122.01 (триазол-С-5), 147.74 (триазол-С-4), 150.12 (С-2), 168.81 (COONa), 173.28 (NHCOCH3), LRMS [C17H25N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 443,1 [M+Na]+ ; HRMS (API) (m/z): [M+l]+ рассчитано для C17H26N4NaO7 [M+l]+ 421,169370; найдено 421,170091.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(4-гидроксиметилфенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE932-10)
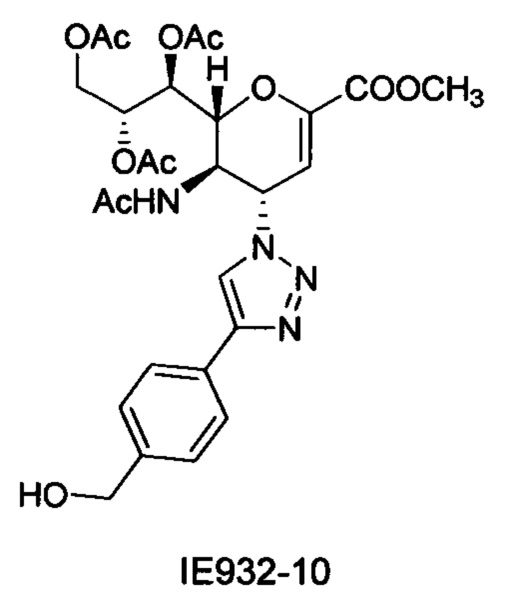
1H ЯМР (300 МГц, CDCl3): δ 1H ЯМР (300 МГц, Хлороформ-d) δ 1.86 (с, 3H, NAc), 2.07 (с, 3H, ОАс), 2.09 (с, 3H, ОАс), 2.10 (с, 3H, ОАс), 3.84 (с, 3H, СООСН3), 4.19 (дд, J=12.5, 6.6 Гц, 1Н, Н-9), 4.31 (м, 1Н, Н-5), 4.60-4.74 (м, 3H, Н-9', СН2), 4.80 (д, J=10.4 Гц, 1Н, Н-6), 5.40 (м, 1Н, Н-8), 5.54 (дд, J=5.8, 1.7 Гц, 1H, Н-7), 5.93 (д, J=10.1 Гц, 1Н, Н-4), 6.07 (д, J=2.2 Гц, 1H, Н-3), 6.74 (уш.с, 1H NH), 7.38 (д, J=7.9 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.74 (д, J=7.7 Гц, 2Н, Ph-H-2', Ph-H-6'), 7.96 (с, 1Н, триазол-СН); 13Н ЯМР (75 МГц, CDCl3): δ 20.74, 20.85, 20.98 (3 OCOCH3), 22.90 (NHCOCH3), 48.31 (С-5), 52.83 (СООСН3), 58.49 (С-4), 62.19 (С-9), 64.66 (СН2), 67.72 (С-7), 70.93 (С-8), 76.78 (С-6), 107.12 (С-3), 119.00 (триазол-С-5), 125.91 (Ph), 127.47 (Ph), 128.61 (Ph q углерод), 141.59 (Ph q углерод), 146.01 (С-2), 147.65 (триазол-С-4), 161.37 (СООСН3), 170.13, 170.41, 170.92, 171.26 (NHCOCH3, 3 ОСОСН3), LRMS [C27H32N4O11] (m/z): (режим регистрации положительно заряженных ионов) 611,2 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(4-гидроксиметилфенил)-[1,2,3]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-12)
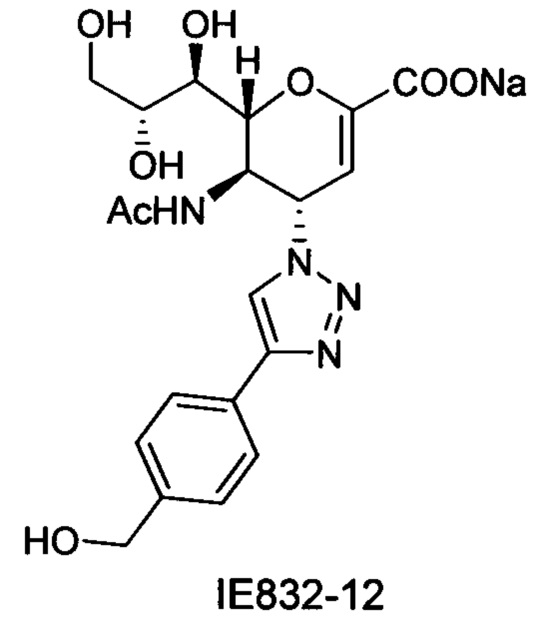
1Н ЯМР (300 МГц, D2O): δ 1.85 (с, 3H, NAc), 3.54-3.71 (м, 2Н, Н-9, Н-7), 3.86 (дд, J=11.9, 2.5 Гц, 1Н, Н-9'), 3.96 (ддд, J=9.3, 6.3, 2.4 Гц, 1Н, Н-8), 4.37 (м, 1Н, Н-5), 4.54 (д, J=10.9 Гц, 1Н, Н-6), 4.62 (с, 2Н, СН2), 5.50 (дд, J=9.6, 2.1 Гц, 1Н, Н-4), 5.83 (д, J=2.1 Гц, 1Н, Н-3), 7.44 (д, J=8.2 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.75 (д, J=8.2 Гц, 2Н, Ph-H-2', Ph-H-6'), 8.38 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.70 (NHCOCH3), 48.78 (С-5), 60.04 (С-4), 63.12 (С-9), 63.55 (СН2), 68.11 (С-7), 69.77 (С-8), 75.39 (С-6), 101.78 (С-3), 120.53 (триазол-С-5), 125.90 (Ph), 128.06 (Ph), 128.77 (Ph q углерод), 140.80 (Ph q углерод), 147.60 (С-2), 150.57 (триазол-С-4), 168.77 (COONa), 173.66 (NHCOCH3). LRMS [C20H23N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 493,1 [M+Na]+ ; HRMS (API) (m/z): [M+l]+ рассчитано для C20H24N4NaO8 [M+l]+ 471,148635; найдено 471,147973.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-13)
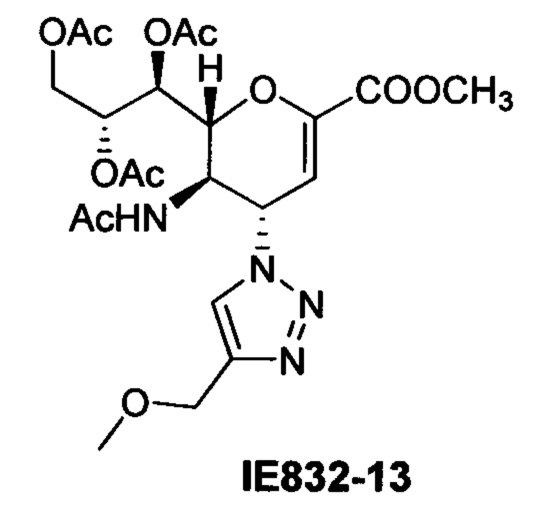
Очистка хроматографией на силикагеле с использованием смеси этилацетет:ацетон (6:1) обеспечила получение чистого соединения IE832-13 (67 мг, 58%). 1H ЯМР (300 МГц, CDCl3): δ 1.81 (с, 3H, NAc), 2.05 (с, 6Н, 2OAc), 2.06 (с, 3H, ОАс), 3.36 (с, 3H, ОСН3), 3.80 (с, 3H, СООСН3), 4.17 (дд, J=12.5, 7.2 Гц, 1Н, Н-9), 4.29 (м, 1Н, Н-5), 4.50 (с, 2Н, ОСН2), 4.68-4.79 (м, 2Н, Н-9', Н-6), 5.40 (ддд, J=7.4, 4.9, 2.5 Гц, 1H Н-8), 5.53 (дд, J=5.1, 1.8 Гц, 1H, Н-7), 5.78 (дд, J=10.0, 2.5 Гц, 1H, Н-4), 6.00 (д, J=2.3 Гц, 1Н, Н-3), 7.05 (д, J=9.1 Гц, 1Н, NH), 7.64 (с, 1H, триазол-СН); 13С ЯМР (75 МГц, CDCl3) δ 20.71, 20.79, 20.91 (3 ОСОСН3), 22.80 (NHCOCH3), 48.39 (С-5), 52.71 (СООСН3), 58.16 (ОСН3), 58.38 (С-4), 62.21 (С-9), 65.68 (OCH2), 67.73 (С-7), 70.90 (С-8), 76.71 (С-6), 107.18 (С-3), 121.50 (триазол-С-5), 145.24 (триазол-С-4), 145.92 (С-2), 161.27 (СООСН3), 170.06, 170.27, 170.81, 170.88 (NHCOCH3, 3 ОСОСН3), LRMS [C22H30N4O11] (m/z): (режим регистрации положительно заряженных ионов) 549,1[M+Na]+ . HRMS (API) (m/z): [M+Na]+ рассчитано для C22H30N4NaO11 [M+Na]+ 549,1803; найдено 549,1805.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-17)
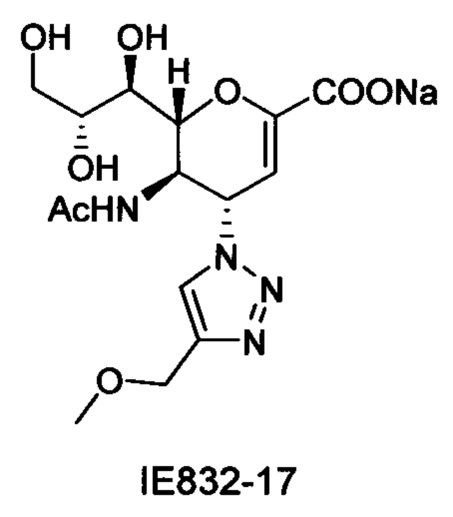
Выход = 85%. 1Н ЯМР (300 МГц, D2O): δ 1.84 (с, 3H, NAc), 3.31 (с, 3H, ОСН3), 3.52-3.71 (м, 2Н, Н-9 & Н-7), 3.85 (дд, J=11.9, 2.6 Гц, 1H, Н-9'), 3.95 (ддд, J=9.3, 6.2, 2.5 Гц, 1H, Н-8), 4.33 (м, 1Н, Н-5), 4.51 (дд, J=10.9, 1.2 Гц, 1Н, Н-6), 4.56 (с, 2Н, ОСН2), 5.48 (дд, J=9.6, 2.3 Гц, 1Н, Н-4), 5.80 (д, J=2.2 Гц, 1Н, Н-3), 8.08 (с, 1H, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.65 (NHCOCH3). 48.68 (С-5), 57.15 (ОСН3), 59.94 (С-4), 63.06 (С-9), 64.22 (ОСН2), 68.05 (С-7), 69.71 (С-8), 75.34 (С-6), 101.80 (С-3), 123.54 (триазол-С-5), 144.08 (С-2), 150.43 (триазол-С-4), 168.75 (COONa), 173.57 (NHCOCH3); LRMS [C15H21N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 432,1 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(3-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-18)
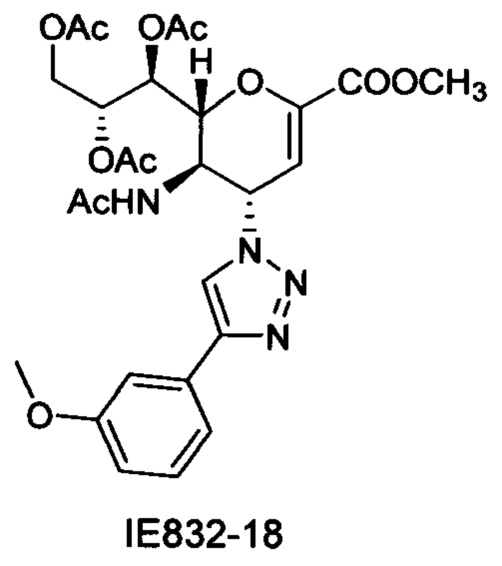
1Η ЯМР (300 МГц, CDCl3): δ 1.84 (с, 3H, NAc), 2.05 (с, 3H, ОАс), 2.06 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 3.83 (с, 3H, СООСН3), 3.84 (с, 3H, ОСН3), 4.20 (дд, J=12.5, 7.0 Гц, 1Н, Н-9), 4.32 (м, 1Н, Н-5), 4.71 (дд, J=12.5, 2.7 Гц, 1Н, Н9'), 4.83 (дд, J=10.5, 1.9 Гц, 1Н, Н-6), 5.43 (ддд, J=6.9, 5.4, 2.6 Гц, 1H, Н-8), 5.57 (дд, J=5.4, 1.9 Гц, 1Н, Н-7), 5.87 (дд,J=10.0, 2.5 Гц, 1Н, Н-4), 6.05 (д, J=2.4 Гц, 1Н, Н-3), 6.79-6.92 (м, 2Н, NH, Ph-H-4'), 7.23-7.38 (м, 3H, Ph-H-2', Ph-H-5', Ph-H-6'), 7.84 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3) δ 20.73, 20.79, 20.92 (3 ОСОСН3), 22.98 (NHCOCH3), 48.79 (С-5), 52.74 (СООСН3), 55.35 (Ar-ОСН3), 58.04 (С-4), 62.18 (С-9), 67.74 (С-7), 70.78 (С-8), 76.63 (С-6), 107.19 (С-3), 110.94 (Ph), 114.43 (Ph), 118.20 (Ph), 118.93 (триазол-С-5), 129.97 (Ph), 131.17 (Ph q углерод), 146.02 (C2), 148.03 (триазол-С-4), 160.02 (Ph q углерод), 161.31 (СООСН3), 170.12, 170.24, 170.81, 170.99 (NHCOCH3, 3 ОСОСН3), LRMS [C27H32N4O11] (m/z): (режим регистрации положительно заряженных ионов) 611,2 [M+Na]+.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(3-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-20).
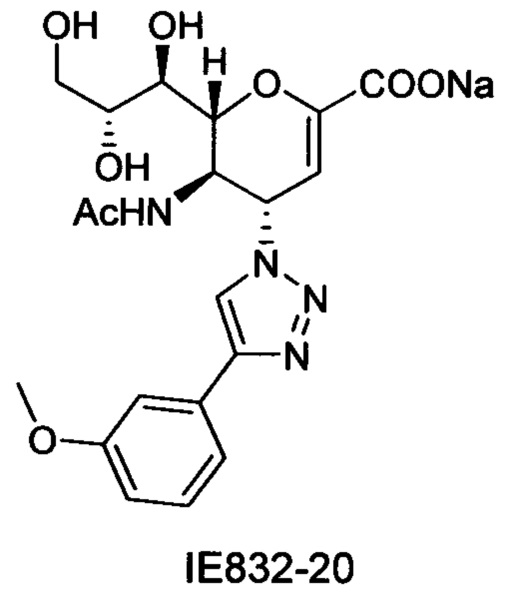
1H ЯМР (300 МГц, D2O): δ 1.86 (м, 3H, NAc), 3.52-3.74 (м, 2Н, Н-9, Н-7), 3.77-3.92 (м, 4Н, ОСН3, Н-9'), 3.97 (м, 1H Н-8), 4.37 (м, 1H, Н-5), 4.54 (д, J=10.9 Гц, 1Н, Н-6), 5.49 (дд, J=9.6, 2.4 Гц, 1Н, Н-4), 5.84 (с, 1Н, Н-3), 6.96 (м, 1H, Ph-H-4'), 7.23-7.48 (м, 3H, Ph-H-2', Ph-H-5', Ph-H-6'), 8.35 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.71 (NHCOCH3), 48.80 (С-5), 55.39 (ОСН3), 60.03 (С-4), 63.12 (С-9), 68.11 (С-7), 69.77 (С-8), 75.39 (С-6), 101.73 (С-3), 110.89 (Ph), 114.54 (Ph), 118.49 (Ph), 120.66 (триазол-С-5), 130.49 (Ph), 130.85 (Ph q углерод), 147.51 (C2), 150.62 (триазол-С-4), 159.29 (Ph q углерод), 168.77 (COONa), 173.65 (NHCOCH3). LRMS [C20H23N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 493,0 [M+l]+; HRMS (API) (m/z): [М+1]+ рассчитано для C20H24N4NaO8 [М+1]+ 471,148635; найдено 471,148177.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-пропил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-24)
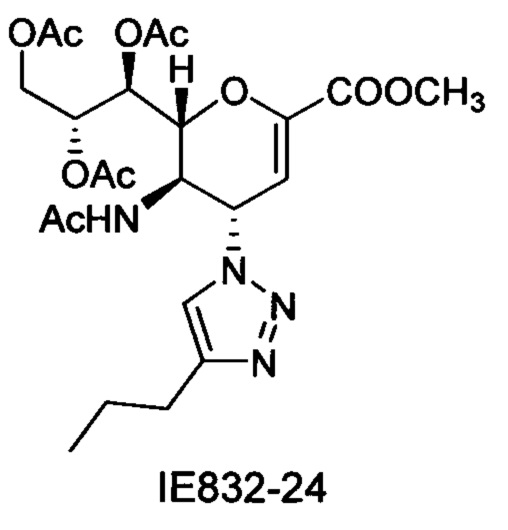
1H ЯМР (300 МГц, CDCl3): δ 0.97 (т, J=7.3 Гц, 3H, пропил-СН3), 1.73 (м, 2Н, пропил-2'-СН2), 1.83 (с, 3H, NAc), 2.07 (с, 6Н, 2OAc), 2.10 (с, 3H, ОАс), 2.77 (т, J=7.6 Гц, 2Н, пропил-1'-СН2), 3.83 (с, 3H, СООСН3), 4.16 (дд, J=12.5, 6.0 Гц, 1Н, Н-9), 4.38 (м, 1Н, Н-5), 4.58 (дд, J=12.6, 2.6 Гц, 1Н, Н-9'), 4.85 (д, J=10.6 Гц, 1H, Н-6), 5.42 (м, 1Н, Н-8), 5.56 (д, J=6.5 Гц, 1Н, Н-7), 6.01 (с, 1Н, Н-3), 6.11 (д, J=10.1 Гц, 1Н, Н-4), 7.37 (уш.с, 1Н, NH), 7.68 (с, 1Н, триазол-СН); LRMS [C23H32N4O10] (m/z): (режим регистрации положительно заряженных ионов) 547,2 [M+Na]+
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-пропил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-26)
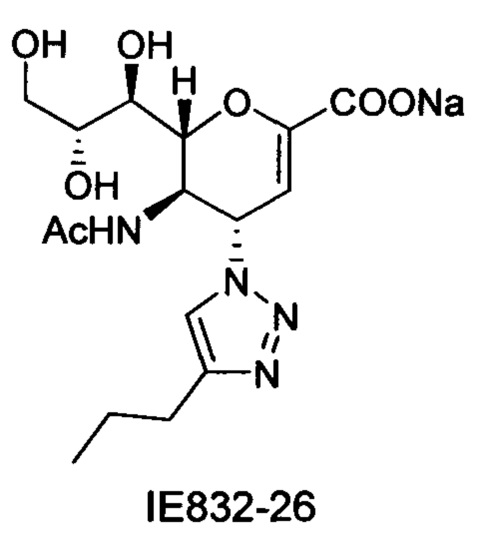
1H ЯМР (300 МГц, D2O): δ 0.92 (т, J=7.4 Гц, 3H, пропил-СН3), 1.57-1.76 (м, 2Н, пропил-2'-СН2), 1.93 (с, 3H, NAc), 2.71 (т, J=7.3 Гц, 2Н, пропил-1'-СН2), 3.62-3.77 (м, 2Н, Н-9, Н-7), 3.94 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.2, 6.3, 2.7 Гц, 1Н, Н-8), 4.41 (м, 1Н, Н-5), 4.58 (дд, J=10.9, 1.3 Гц, 1Н, Н-6), 5.50 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.87 (д, J=2.3 Гц, 1Н, Н-3), 7.89 (с, 1H, триазол-СН). LRMS [C16H23N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 429,0 [M+Na]+; HRMS (API) (m/z): [M+Na]+ рассчитано для C16H23N4Na2O7 [M+l]+ 429,1357; найдено 429,1361.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(пиридин-3-ил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-25)
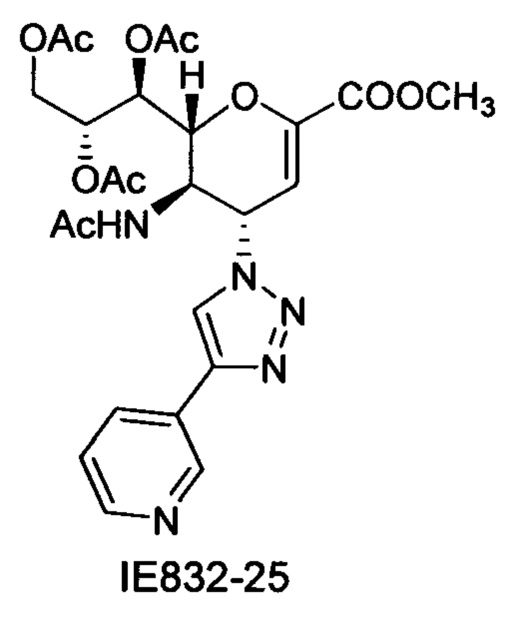
1H ЯМР (300 МГц, CDCl3): δ 1.82 (с, 3H, NAc), 2.06 (с, 6Н, 2OAc), 2.08 (с, 3H, ОАс), 3.82 (с, 3H, СООСН3), 4.19 (дд, J=12.5, 7.2 Гц, 1H, Н-9), 4.40 (к, J=9.9 Гц, 1H, Н-5), 4.64-4.88 (м, 2Н, Н-7, Н-9'), 5.38 (м, 1H, Н-8), 5.57 (дд, J=4.8, 1.9 Гц, 1Н, Н-7), 5.86 (дд, J=9.9, 2.4 Гц, 1Н, Н-4), 6.08 (д, J=2.4 Гц, 1H, Н-3), 7.08 (д, J=9.1 Гц, 1H, NH), 7.36 (дд, J=7.9, 4.8 Гц, 1Н, Pyr-Н5'), 8.04 (с, 1H, триазол-СН), 8.14 (д, J=7.8 Гц, 1Н, Pyr-Н4'), 8.54 (д, J=4.8 Гц, 1Н, Pyr-Н-6'), 8.96 (с, 1H, Pyr-Н-2'); 13С ЯМР (75 МГц, CDCl3) δ 20.69, 20.79, 20.94 (3 ОСОСН3), 22.89 (NHCOCH3), 48.35 (С-5), 52.81 (СООСН3), 58.57 (С-4), 62.14 (С-9), 67.77 (С-7), 71.17 (С-8), 76.85 (С-6), 106.88 (С-3), 119.07 (триазол-С-5), 123.89 (Pyr), 126.33 (Pyr q углерод), 133.20 (Pyr), 145.13 (триазол-C4), 146.17 (С2), 146.88 (Pyr), 149.31 (Pyr), 161.25 (СООСН3), 170.16, 170.49, 170.80, 170.95 (NHCOCH3, 3 ОСОСН3): LRMS [C25H29N5O10] (m/z): (режим регистрации положительно заряженных ионов) 582,2 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(пиридин-3-ил) [1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-27)
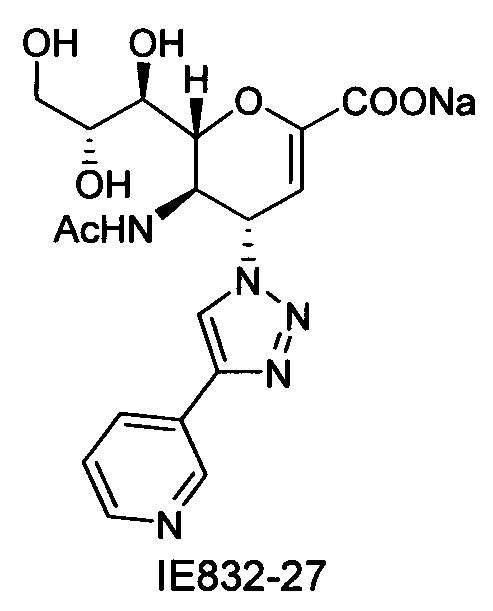
1H ЯМР (300 МГц, D2O): δ 1.92 (с, 3H, NAc), 3.62-3.78 (м, 2Н, Н-9, Н-7), 3.93 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.3, 6.3, 2.6 Гц, 1H, Н-8), 4.44 (м, 1Н, Н-5), 4.61 (дд, J=10.9, 1.3 Гц, 1H, Н-6), 5.59 (дд, J=9.6, 2.3 Гц, 1Н, Н-4), 5.90 (д, J=2.3 Гц, 1H, Н-3), 7.53 (м, 1Н, Pyr-Н-5'), 8.17 (д, J=8.0 Гц, 1Н, Pyr-Н-4'), 8.49-8.60 (м, 2Н, триазол-СН, Phyr-H-6'), 8.87 (уш.с, 1H, Pyr-Н-2'); 13С ЯМР (75 МГц, D2O): δ 21.67 (NHCOCH3) 48.77 (С-5), 60.17 (С-4), 63.08 (С-9), 68.06 (С-7), 69.73 (С-8), 75.36 (С-6), 101.61 (С-3) 121.13 (триазол-С-5), 134.31 (Pyr), 144.68 (С-2), 145.64 (Pyr), 148.42 (Pyr), 150.6: (триазол-С-4), 168.72 (COONa), 173.65 (NHCOCH3). LRMS [C18H20N5NaO7] (m/z) (режим регистрации положительно заряженных ионов) 463.7 [M+l]+; HRMS (API (m/z): [М+1]+ рассчитано для C18H21N5NaO7 [М+1]+ 442,133319; найдено 442,133358.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(4 метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-29)
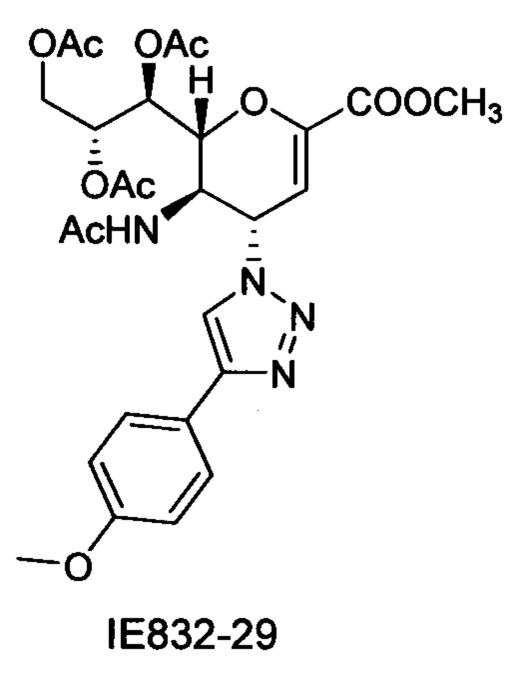
1H ЯМР (300 МГц, CDCl3): δ 1.88 (с, 3H, NAc), 2.06 (с, 3H, ОАс), 2.10 (с, 6Н, 2OAc), 3.83 (с, 3H, СООСН3), 3.84 (с, 3H, ОСН3), 4.13-4.30 (м, 2Н, Н-9, Н-5), 4.66 (дд, J=12.5, 2.6 Гц, 1Н, Н-9'), 4.83 (дд, J=10.6, 1.9 Гц, 1Н, Н-6), 5.41 (м, 1Н, Н-8), 5.52 (дд, J=5.8, 1.8 Гц, 1Н, Н-7), 5.93 (дд, J=10.0, 2.5 Гц, 1H, Н-4), 6.01-6.16 (м, 2Н, Н-3, NH), 6.94 (д, J=8.6 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.61-7.83 (м, 3H, триазол-СН, Ph-H-2', Ph-H-6'); 13С ЯМР (75 МГц, CDCl3) δ 20.71, 20.78, 20.90 (3 ОСОСН3), 22.90 (NHCOCH3), 48.45 (С-5), 52.70 (СООСН3), 55.31 (Ph-ОСН3), 58.17 (С-4), 62.23 (С-9), 67.80 (С-7), 70.92 (С-8), 76.83 (С-6), 107.40 (С-3), 114.32 (Ph), 117.88 (триазол-С-5), 122.57 (Ph q углерод), 127.13 (Ph), 145.93 (С-2), 148.07 (триазол-С-4), 159.87 (Ph q углерод), 161.33 (СООСН3), 170.10, 170.27, 170.81, 170.99 (NHCOCH3. 3 OCOCH3), LRMS [C27H32N4O11] (m/z): (режим регистрации положительно заряженных ионов) 611,3 [M+Na]+.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(4-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-31)
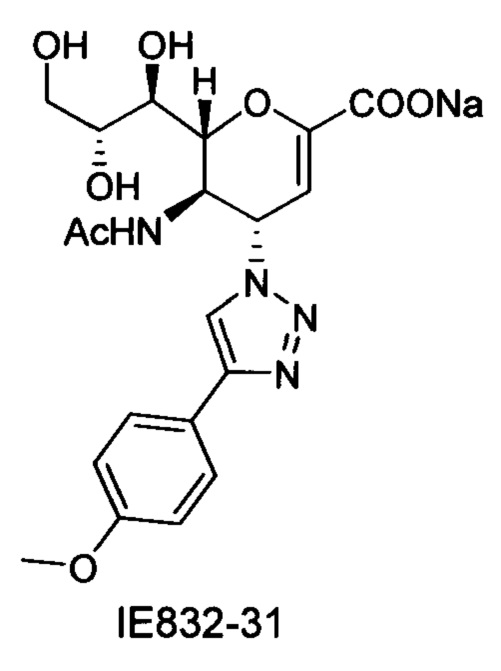
1H ЯМР (300 МГц, D2O): δ 1.92 (с, 3H, NAc), 3.63-3.77 (м, 2Н, Н-9, Н-7), 3.85 (с, 3H, ОСН3), 3.93 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.03 (ддд, J=9.6, 6.3, 2.6 Гц, 1H, Н-8), 4.42 (м, 1H, Н-5), 4.59 (дд, J=10.9, 1.3 Гц, 1Н, Н-6), 5.52 (дд, J=9.6, 2.3 Гц, 1H, Н-4), 5.87 (д, J=2.2 Гц, 1Н, Н-3), 7.05 (д, J=9.0 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.68 (д, J=9.0 Гц, 1Н, Ph-H-2', Ph-H-6'), 8.26 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.65 (NHCOCH3), 48.75 (С-5), 55.39 (ОСН3), 60.01 (С-4), 63.08 (С-9), 68.07 (С-7), 69.72 (С-8), 75.35 (С-6), 101.82 (С-3), 114.60 (Ph), 119.78 (триазол-С-5), 122.49 (Ph q углерод), 127.21 (Ph), 147.65 (С-2), 150.49 (триазол-С-4), 159.23 (Ph q углерод), 168.78 (COONa), 173.62 (NHCOCH3). LRMS [C20H23N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 492,6 [M+l]+; HRMS (API) (m/z): [М+1]+ рассчитано для C20H24N4NaO8 [М+1]+ 471,148635; найдено 471,147452.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-30)
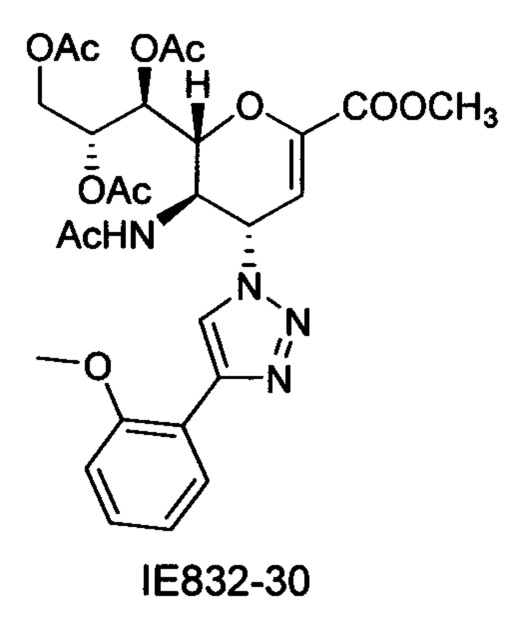
Очистка хроматографией на силикагеле с использованием смеси этилацетат : гексан (7:1) обеспечила получение чистого соединения IE832-30 (81 мг, 62%). 1H ЯМР (300 МГц, CDCl3): δ 1.84 (с, 3H, NAc), 2.05 (с, 3H, ОАс), 2.06 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 3.83 (с, 3H, СООСН3), 3.88 (с, 3H, ОСН3), 4.20 (дд, J=12.4, 7.0 Гц, 1Н, Н-9), 4.37 (м, 1Н, Н-5), 4.71 (дд, J=12.4, 2.7 Гц, 1H, Н-9'), 4.89 (дд, J=10.5, 1.9 Гц, 1Н, Н-6), 5.45 (м, 1Н, Н-8), 5.59 (дд, J=5.4, 1.9 Гц, 1Н, Н-7), 5.87 (дд, J=9.9, 2.5 Гц, 1H, Н-4), 6.07 (д, J=2.4 Гц, 1Н, Н-3), 6.91 (д, J=8.3 Гц, 1Н, Ph-H-3'), 7.03 (м, 1Н, Ph-H-5'), 7.22-7.30 (м, 2Н, Ph-H-4', NH), 8.07 (с, 1Н, триазол-СН), 8.17 (дд, J=7.8, 1.8 Гц, 1Н, Ph-H-6'); 13С ЯМР (75 МГц, CDCl3) δ 20.71, 20.76, 20.88 (3 ОСОСН3), 22.90 (NHCOCH3), 48.84 (С-5), 52.64 (СООСН3), 55.36 (Ph-OCH3), 57.83 (С-4), 62.24 (С-9), 67.85 (С-7), 70.79 (С-8), 76.75 (С-6), 107.72 (С-3), 110.87 (Ph), 118.66 (Ph q углерод), 120.88 (Ph), 122.32 (триазол-С-5), 127.37 (Ph), 129.24 (Ph), 143.40 (триазол-С4), 145.82 (С-2), 155.68 (Ph q углерод), 161.44 (СООСН3), 170.06, 170.19, 170.75, 171.04 (NHCOCH3. 3 ОСОСН3), LRMS [C27H32N4O11] (m/z): (режим регистрации положительно заряженных ионов) 611,2 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C27H32N4NaO11 [M+Na]+ 611,195979; найдено 611,196049.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-37)
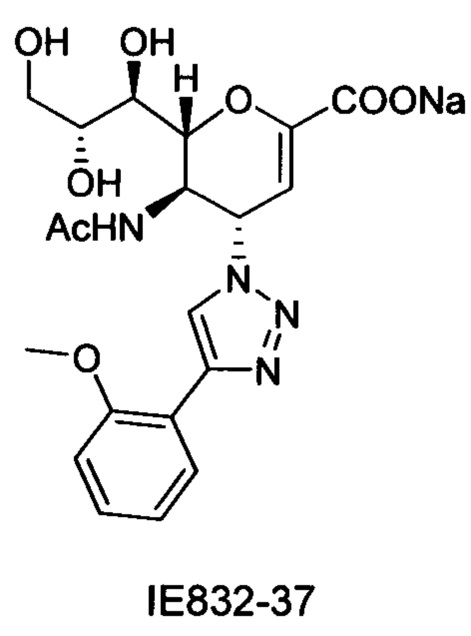
Выход = 91%. 1Н ЯМР (300 МГц, D2O): δ 1.91 (с, 3H, NAc), 3.63-3.77 (м, 2Н, Н-9, Н-7), 3.86-3.97 (m, 4Н, Н-9', ОСН3), 4.04 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.45 (м, 1Н, Н-5), 4.60 (дд, J=10.9, 1.2 Гц, 1H, Н-6), 5.53 (дд, J=9.6, 2.3 Гц, 1Н, Н-4), 5.90 (д, J=2.2 Гц, 1Н, Н-3), 7.08-7.14 (м, 2Н, Ph-H-3', Ph-H-5'), 7.34-7.49 (м, 1Н, Ph-H-4'), 7.92 (дд, 7=8.0, 1.7 Гц, Н-6'), 8.32 (с, 1H, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.67 (NHCOCH3), 48.59 (С-5), 55.38 (ОСН3), 59.81 (С-4), 63.09 (С-9), 68.11 (С-7), 69.74 (С-8), 75.40 (С-6), 101.95 (С-3), 111.84 (Ph), 117.87 (Ph q углерод), 121.00 (Ph), 123.12 (триазол-С-5), 127.27 (Ph), 130.05 (Ph), 143.23 (триазол-С-4), 150.33 (С-2), 155.70 (Ph q углерод), 168.81 (COONa), 173.59 (NHCOCH3). LRMS [C20H23N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 493,2 [М+1]+ .
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-(2-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-23)
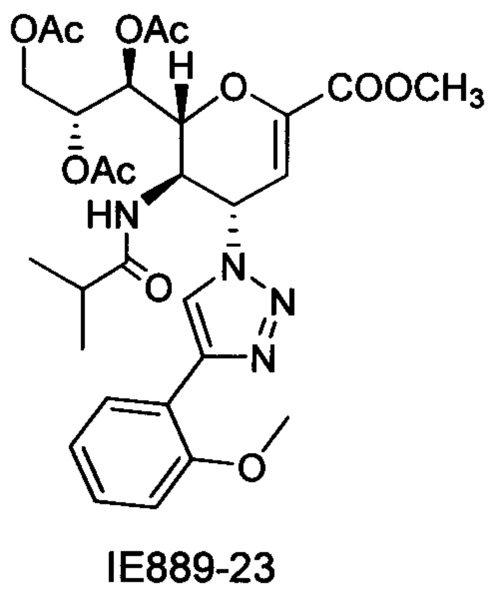
1H ЯМР (300 МГц, CDCl3): δ 1.00-1.04 (m, 6Н, изобутирил-2СН3), 2.08 (с, 6Н, 2OAc), 2.10 (с, 3H, ОАс), 2.25-2.34 (м, 1Н, изобутирил-СН), 3.84 (с, 3H, СООСН3), 3.88 (с, 3H, Ph-ОСН3), 4.20-4.28 (м, 2Н, Н-9, Н-5), 4.71 (дд, J=12.5, 2.6 Гц, 1Н, Н-9), 4.99 (д, J=10.5 Гц, 1Н, Н-6), 5.43 (м, 1H, Н-8), 5.55 (дд, J=5.4, 1.6 Гц, 1Н, Н-7), 6.03 (дд, J=10.1, 2.4 Гц, 1Н, Н-4), 6.11 (д, J=2.3 Гц, 1Н, Н-3), 6.79 (д, J=8.3 Гц, 1H, NH), 6.93 (д, J=8.3 Гц, 1Н, Ph-H-3'), 7.05 (м, 1H, Ph-H-5'), 7.29 (м, 1Н, Ph-H-4'), 8.04 (с, 1Н, триазол-СН), 8.2 (д, J=7.9 Гц, 1Н, Ph-H-6'); 13С ЯМР (75 МГц, CDCl3): δ 18.86, 19.34, 20.80, 20.95 (3 ОСОСН3, изобутирил-2СН3), 35.42 (изобутирил-СН), 49.31 (С-5), 52.68 (СООСН3), 55.29 (Ph-ОСН3), 57.12 (С-4), 62.19 (С-9), 67.74 (С-7), 70.75 (С-8), 76.30 (С-6), 107.73 (С-3), 110.71 (Ph), 118.68 (Ph q углерод), 120.89 (Ph), 122.62 (триазол-С-5), 127.51 (Ph), 129.21 (Ph), 143.30 (триазол-С-5), 145.68 (С-2), 155.68 (Ph q углерод), 161.56 (СООСН3), 170.10, 170.20, 170.68 (3 ОСОСН3), 178.05 (изобутирил-СО). LRMS [C29H36N4O11] (m/z): (режим регистрации положительно заряженных ионов) 639,1 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C29H36N4NaO11 [M+Na]+ 639,227279; найдено 639,225897.
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-(2-метоксифенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-34)
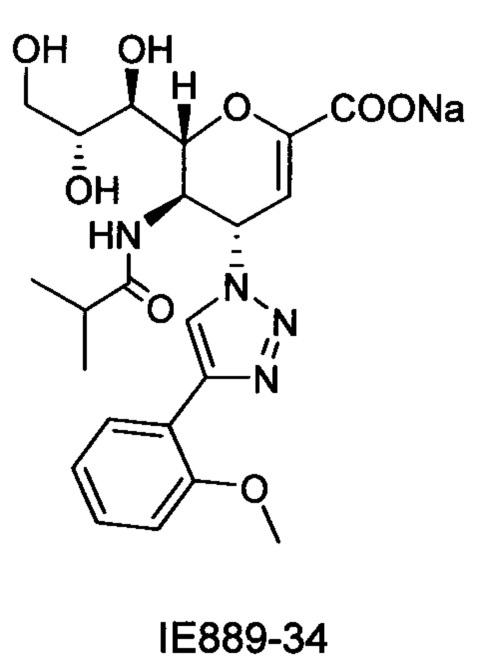
1H ЯМР (300 МГц, D2O): δ 0.90 (д, J=6.9 Гц, 3H, изобутирил-СН3), 0.97 (д, J=6.9 Гц, 3H, изобутирил-СН3), 2.31 (м, 1Н, изобутирил-СН), 3.53 (д, J=9.4 Гц, 1Н, Н-7), 3.60 (дд, J=11.5, 5.4 Гц, 1H, Н-9), 3.79 (дд, J=11.4, 3.0 Гц, 1Н, Н-9'), 3.85-3.91 (м, 4Н, Н-8, Ph-ОСН3), 4.39-4.55 (м, 2Н, Н-5, Н-6), 5.61 (дд, J=9.7, 2.2 Гц, 1H, Н-4), 5.72 (д, J=2.2 Гц, 1H, Н-3), 6.89-7.10 (м, 2Н, Ph-H-3', Ph-H-5'), 7.27 (ддд, J=8.7, 7.4, 1.7 Гц, 1H, Н-4'), 8.02 (дд, J=7.7, 1.7 Гц, 1Н, Ph-H-6'), 8.23 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.38, 18.53 (изобутирил-2СН3), 35.09 (изобутирил-СН), 48.18 (С-5), 55.34 (ОСН3), 59.66 (С-4), 63.08 (С-9), 68.18 (С-7), 69.76 (С-8), 75.44 (С-6), 102.15 (С-3), 111.80 (Ph), 117.86 (Ph q углерод), 121.00 (Ph), 123.47 (триазол-С-5), 127.21 (Ph), 130.05 (Ph), 143.12 (триазол-С-4), 150.16 (С-2), 155.70 (Ph q углерод), 168.84 (COONa), 180.64 (NHCOCH3); LRMS [C22H28N4O8] (m/z): (режим регистрации положительно заряженных ионов) 499,1 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C22H28N4NaO8 [M+Na]+ 499,179935; найдено 499,179943.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-45)
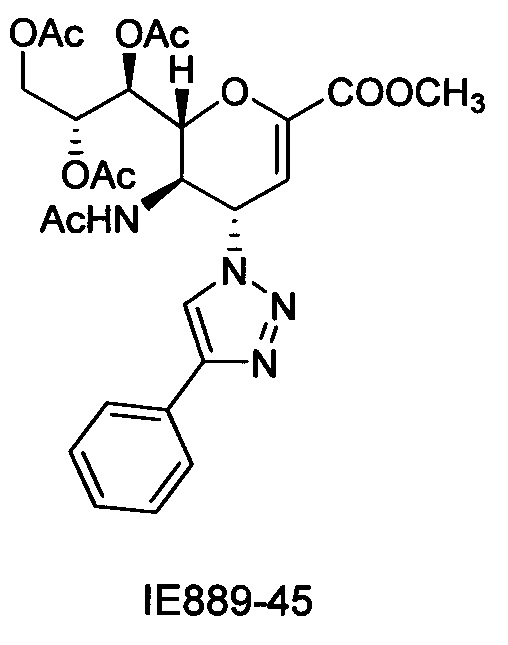
Очистка хроматографией на силикагеле с использованием смеси этилацетат:гексан (5:1) обеспечила получение чистого соединения IE889-45 (88 мг, 70%). 1H ЯМР (300 МГц, CDCl3): δ 1.79 (с, 3H, NAc), 2.04 (с, 3H, ОАс), 2.05 (с, 3H, ОАс), 2.06 (с, 3H, ОАс), 3.81 (с, 3H, СООСН3), 4.18 (дд, J=12.4, 7.2 Гц, 1Н, Н-9), 4.42 (м, 1Н, Н-5), 4.72 (дд, J=12.6, 2.7 Гц, 1Н, Н-9'), 4.79 (дд, J=10.5, 1.6 Гц, 1Н, Н-6), 5.42 (м, 1Н, Н-8), 5.58 (дд, J=5.1, 1.8 Гц, 1Н, Н-7), 5.83 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.04 (д, J=2.3 Гц, 1Н, Н-3), 7.20-7.42 (м, 4Н, NH, Ph-H-3', Ph-H-4', Ph-H-5'), 7.72 (дд, J=8.2, 1.3 Гц, 2Н, Ph-H-2', Ph-H-6'), 7.88 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3) δ 20.70, 20.80, 20.90 (3 ОСОСН3), 22.85 (NHCOCH3), 48.26 (С-5), 52.71 (СООСН3), 58.41 (С-4), 62.26 (С-9), 67.80 (С-7), 70.97 (С-8), 76.95 (С-6), 107.37 (С-3), 118.76 (триазол-С-5), 125.77 (Ph), 128.51 (Ph), 128.91 (Ph), 129.85 (Ph, q углерод), 145.95 (С-2), 148.13 (триазол-С-4), 161.32 (СООСН3), 170.04, 170.30, 170.84, 170.99 (NHCOCH3, 3 ОСОСН3), LRMS [C26H30N4O10] (m/z): (режим регистрации положительно заряженных ионов) 581,0 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C26H30N4NaO10 [M+Na]+ 581,185414; найдено 581,184724.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-52)
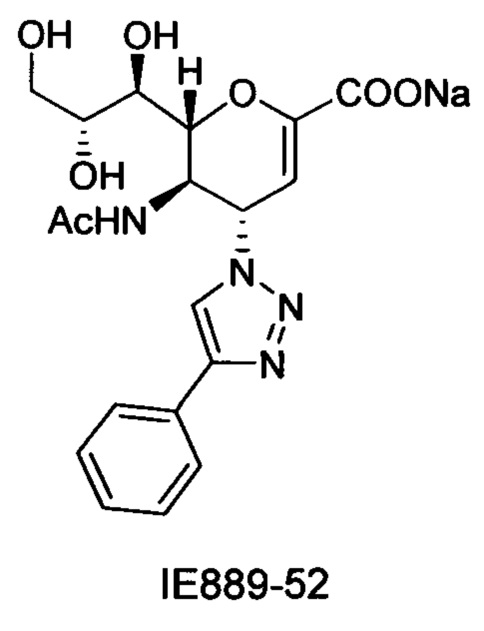
Выход = 96%. 1H ЯМР (300 МГц, D2O): δ 1.87 (с, 3H, NAc), 3.64 (дд, J=12.1, 6.4 Гц, 1Н, Н-9), 3.69 (дд, J=9.6, 1.4 Гц, 1H, Н-7), 3.89 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.00 (ддд, J=9.3, 6.3, 2.7 Гц, 1Н, Н-8), 4.39 (м, 1H, Н-5), 4.56 (дд, J=10.8, 1.4 Гц, 1Н, Н-6), 5.49 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.83 (д, J=2.2 Гц, 1H Н-3), 7.40 (м, 1Н, Ph-H4'), 7.46 (дд, J=8.4, 6.9 Гц, 2Н, Ph-H-3', Ph-H-5'), 7.71 (д, J=7.1 Гц, 2Н, Ph-H-2', Ph-H-6'), 8.28 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 21.63 (NHCOCH3), 48.70 (С-5), 59.96 (С-4), 63.05 (С-9), 68.03 (С-7), 69.69 (С-8), 75.31 (С-6), 101.75 (С-3), 120.41 (Ph), 125.61 (Ph), 128.77 (триазол-С-5), 129.10 (Ph), 129.28 (Ph q углерод), 147.74 (триазол-С-4), 150.48 (С-2), 168.75 (COONa), 173.58 (NHCOCH3). LRMS [C19H21N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 463,1 [M+Na]+ ; HRMS (API) (m/z): [M+l]+ рассчитано для C19H22N4NaO7 [М+Н]+441.138070; найдено 441,140189.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE927-57)
Очистка хроматографией на силикагеле с использованием смеси этилацетат:ацетон (9:1) обеспечила получение чистого соединения IE927-57 (60 мг, 66%). 1H ЯМР (300 МГц, CDCl3): δ 0.97 (д, J=6.9 Гц, 3H, изобут-СН3), 1.01 (д, J=6.8 Гц, 3H, изобут-СН3), 2.05 (с, 3H, ОАс), 2.08 (с, 6Н, 2OAc), 2.24 (м, 1Н, изобут-СН), 3.37 (с, 3H, ОСН3), 3.81 (с, 3H, СООСН3), 4.14-4.29 (м, 2Н, Н-9, Н-5), 4.51 (с, 2Н, ОСН2), 4.68 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 4.84 (дд, J=10.5, 1.7 Гц, 1H, Н-6), 5.38 (ддд, J=6.6, 5.5, 2.5 Гц, 1H, Н-8), 5.48 (дд, J=5.5, 1.7 Гц, 1Н, Н-7), 5.91 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.02 (д, J=2.4 Гц, 1Н, Н-3), 6.44 (д, J=8.7 Гц, 1H, NH), 7.59 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3): δ 18.81, 19.30, 20.74, 20.90 (3 ОСОСН3, изобут-2СН3), 35.51 (изобут-СН), 48.79 (С-5), 52.69 (СООСН3), 57.59 (С-4), 58.38 (ОСН3), 62.08 (С-9), 65.73 (ОСН2), 67.66 (С-7), 70.79 (С-8), 76.24 (С-6), 107.07 (С-3), 121.54 (триазол-С-5), 145.39 (триазол-С-4), 145.82 (С-2), 161.30 (СООСН3), 170.15, 170.23, 170.69 (3 ОСОСН3), 177.87 (изобут-СО). LRMS [C24H34N4O11] (m/z): (режим регистрации положительно заряженных ионов) 577,2 [M+Na]+ .
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE927-60)
Выход = 92%. 1H ЯМР (300 МГц, D2O): δ 0.98 (д, J=7.0 Гц, 3H, изобут-СН3), 1.03 (д, J=6.9 Гц, 3H, изобут-СН3), 2.46 (м, 1Н, изобут-СН), 3.39 (с, 3H,ОСН3), 3.65-3.76 (м, 2Н, Н-9, Н-7), 3.94 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.3, 6.3, 2.6 Гц, 1H, Н-8), 4.49 (м, 1H, Н-5), 4.60-4.65 (м, 3H, Н-6, ОСН2), 5.61 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.87 (д, J=2.2 Гц, 1H, Н-3), 8.18 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.43 (изобут-СН3), 18.64 (изобут-СН3), 35.10 (изобут-СН), 48.19 (С-5), 57.24 (ОСН3), 59.86 (С-4), 63.07 (С-9), 64.24 (ОСН2), 68.13 (С-7), 69.82 (С-8), 75.43 (С-6), 102.02 (С-3), 123.65 (триазол-С-5), 144.07 (триазол-С-4), 150.30 (С-2), 168.81 (COONa), 180.66 (изобут-СО). LRMS [C17H25N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 459,0 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C17H25N4Na2O8 [M+Na]+ 459,1462; найдено 459,1458.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-изобутил-[1,2,3,]триазол-1-ил)-5-изобутирамидо-D-глицеро-D-галакто-нон-2-енонат (IE927-58)
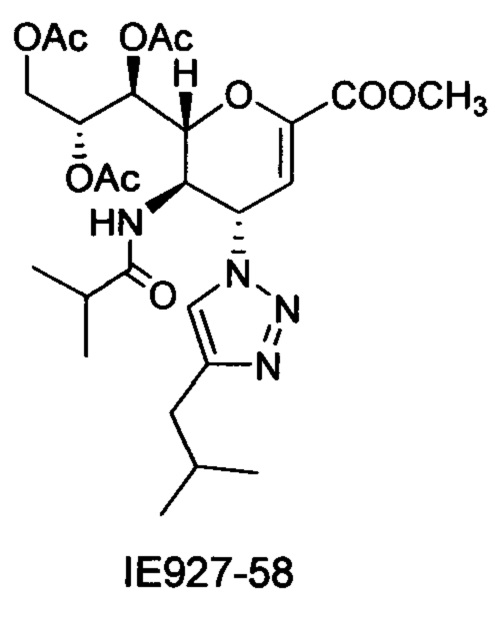
1H ЯМР (300 МГц, CDCl3): δ 0.90 (д, J=6.6 Гц, 6Н, изобутил-2СН3), 0.96 (д, J=6.9 Гц, 3H, изобутирил-СН3), 1.00 (д, J=6.8 Гц, 3H, изобутирил-СН3), 1.90 (м, 1Н, изобутил-СН), 2.05 (с, 3H, ОАс), 2.08 (с, 6Н, 2OAc), 2.22 (м, 1Н, изобутирил-СН), 2.53 (д, J=7.0 Гц, 2Н, изобутил-СН2), 3.82 (с, 3H, СООСН3), 4.13-4.36 (м, 2Н, Н-9, Н-5), 4.70 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 4.81 (дд, J=10.5, 1.7 Гц, 1Н, Н-6), 5.38 (ддд, J=6.6, 5.4, 2.5 Гц, 1Н, Н-8), 5.49 (дд, J=5.5, 1.7 Гц, 1Н, Н-7), 5.87 (дд, J=10.1, 2.4 Гц, 1Н, Н-4), 6.02 (д, J=2.4 Гц, 1Н, Н-3), 6.41 (д, J=8.8 Гц, 1Н, ΝΗ), 7.32 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, CDCl3): δ 18.83, 19.29, 20.76, 20.92 (3 ОСОСН3 + изобутирил-2СН3), 22.23 (изобутил-2СН3), 28.70 (изобутил-СН), 34.68 (изобутил-СН2), 35.55 (изобутирил-СН), 48.48 (С-5), 52.68 (СООСН3), 57.47 (С-4), 62.11 (С-9), 67.69 (С-7), 70.89 (С-8), 76.44 (С-6), 107.53 (С-3), 120.36 (триазол-С-5), 145.56 (С-2), 147.53 (триазол-С-4), 161.40 (СООСН3), 170.15, 170.24, 170.70 (3 ОСОСН3), 177.74 (изобутирил-СО). LRMS [C26H38N4O10] (m/z): (режим регистрации положительно заряженных ионов) 589,3 [M+Na]+ .
Натрий 2,6-ангидро-3,4,5-тридезокси-4-(4-изобутил-[1,2,3,]триазол-1-ил)-5-изобутирамидо-D-глицеро-D-галакто-нон-2-енонат
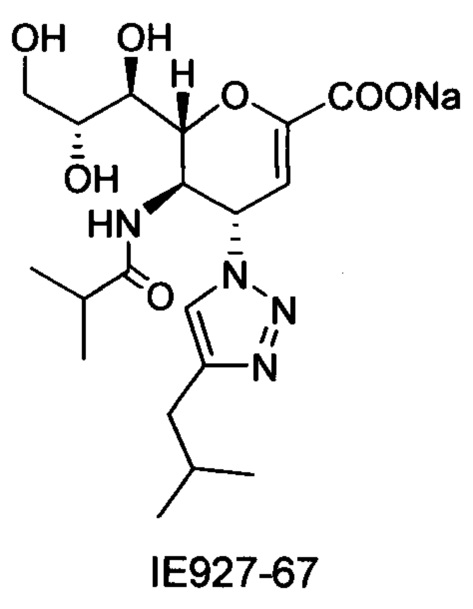
1H ЯМР (300 МГц, D2O): δ 0.90 (д, J=6.6 Гц, 6Н, изобутил-2СН3), 0.97 (д, J=6.9 Гц, 3H, изобутирил-СН3), 1.02 (д, J=6.9 Гц, 3H, изобутирил-СН3), 1.92 (м, 1H изобутил-СН), 2.43 (м, 1H изобутирил-СН), 2.60 (д, J=6.9 Гц, 2Н, изобутил-СН2), 3.62-3.74 (м, 2Н, Н-9, Н-7), 3.93 (дд, J=11.9, 2.7 Гц, 1H, Н-9'), 4.02 (ддд, J=9.3, 6.3, 2.6 Гц, 1H, Н-8), 4.47 (м, 1Н, Н-5), 4.56 (д, J=11.1 Гц, 1Н, Н-6), 5.53 (дд, J=9.7, 2.2 Гц, 1Н, Н-4), 5.84 (д, J=2.2 Гц, 1Н, Н-3), 7.88 (с, 1Н, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.45 (изобутирил-СН3), 18.61 (изобутирил-СН3), 21.31 (изобутил-2СН3), 28.17 (изобутил-СН), 33.54 (изобутил-СН2), 35.12 (изобутирил-СН), 48.09 (С-5), 59.53 (С-4), 63.07 (С-9), 68.14 (С-7), 69.78 (С-8), 75.47 (С-6), 102.30 (С-3), 121.99 (триазол-С-5), 147.82 (триазол-С-4), 150.05 (С-2), 168.88 (COONa), 180.46 (изобутирил-СО). LRMS [C19H29N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 471,2 [M+Na]+ , 449.2; HRMS (API) (m/z): [M+Na]+ рассчитано для C19H29N4Na2O7 [M+Na]+ 471,1826; найдено 471,1823.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE984-4)
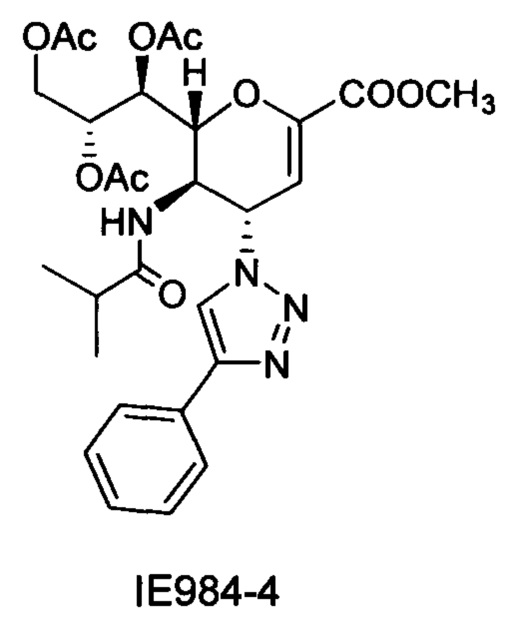
Очистка хроматографией на силикагеле с использованием смеси этилацетат : гексан (4:1) обеспечила получение чистого соединения IE984-4 (72 мг, 74%). 1H ЯМР (300 МГц, CDCl3): δ 0.95 (д, J=6.8 Гц, 3H, изобут-СН3), 0.99 (д, J=6.9 Гц, 3H, изобут-СН3), 2.06 (с, 3H, ОАс), 2.09 (с, 6Н, 2OAc), 2.20-2.27 (м, 1Н, изобут-СН), 3.83 (с, 3H, СООСН3), 4.16-4.39 (м, 2Н, Н-9, Н-5), 4.70 (дд, J=12.5, 2.6 Гц, 1Н, Н-9'), 4.88 (дд, J=10.5, 1.7 Гц, 1Н, Н-6), 5.40 (м, 1Н, Н-8), 5.52 (дд, J=5.4, 1.7 Гц, 1Н, Н-7), 5.99 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.08 (д, J=2.4 Гц, 1Н, Н-3), 6.51 (д, J=8.7 Гц, 1Н, NH), 7.26-7.43 (м, 3H, Ph-H-3', Ph-H-4', Ph-H-5'), 7.74 (д, J=7.2 Гц, 2Н, Ph-H-2', Ph-H-5'), 7.81 (с, 1H, триазол-СН); 13С ЯМР (75 МГц, CDCl3): δ 18.83, 19.31, 20.76, 20.92 (3 ОСОСН3, изобут-2СН3), 35.55 (изобут-СН), 48.74 (С-5), 52.72 (СООСН3), 57.67 (С-4), 62.12 (С-9), 67.72 (С-7), 70.84 (С-8), 76.39 (С-6), 107.25 (С-3), 118.84 (триазол-С-5), 125.83 (Ph), 128.47 (Ph), 128.89 (Ph), 129.97 (Ph q углерод), 145.81 (С-2), 148.19 (триазол-С-4), 161.35 (СООСН3), 170.18, 170.26, 170.71 (3 ОСОСН3), 178.00 (изобут-СО). LRMS [C28H34N4O10] (m/z): (режим регистрации положительно заряженных ионов) 608,9 [M+Na]+.
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(4-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE984-5)
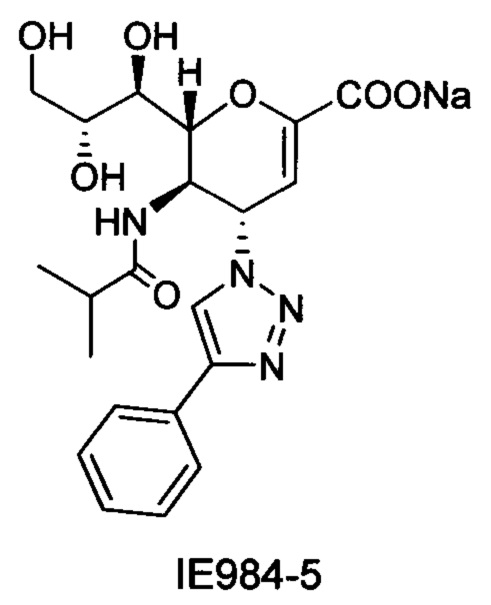
Выход = 89%. 1H ЯМР (300 МГц, D2O): δ 0.94 (д, J=6.9 Гц, 3H, изобут-СН3), 0.99 (д, J=6.9 Гц, 3H, изобут-СН3), 2.43 (м, 1H, изобут-СН), 3.60-3.76 (м, 2Н, Н-9, Н-7), 3.93 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.2, 6.3, 2.6 Гц, 1H, Н-8), 4.51 (м, 1Н, Н-5), 4.62 (д, J=11.0 Гц, 1Н, Н6), 5.58 (дд, J=9.7, 2.3 Гц, 1H, Н-4), 5.88 (д, J=2.2 Гц, 1Н, Н-3), 7.42-7.54 (м, 3H, Ph-H-3', Ph-H-4', Ph-H-5'), 7.78 (д, J=7.1 Гц, 2Н, Ph-H-2', Ph-H-6'), 8.36 (с, 1H, триазол-СН); 13С ЯМР (75 МГц, D2O): δ 18.38 (изобут-СН3), 18.65 (изобут-СН3), 35.10 (изобут-СН), 48.23 (С-5), 59.91 (С-4), 63.07 (С-9), 68.15 (С-7), 69.76 (С-8), 75.41 (С-6), 101.96 (С-3), 120.66 (Ph), 125.67 (Ph), 128.81 (триазол-С-5), 129.16 (Ph), 129.36 (Ph q углерод), 147.71 (триазол-С-4), 150.32 (С-2), 168.80 (COONa), 180.67 (изобут-СО). LRMS [C21H25N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 491,2 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C21H25N4Na2O7 [M+Na]+ 491,1513; найдено 491,1515.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-4-(4-(2-хлорфенил)-[1,2,3,]триазол-1-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE1172-70)
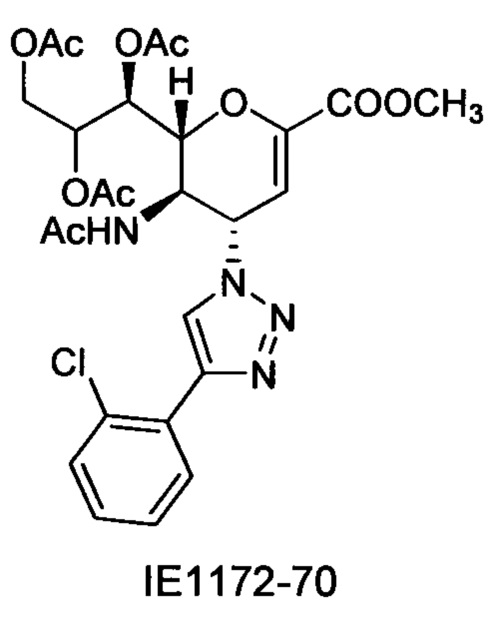
Очистка хроматографией на силикагеле с использованием смеси ацетон:гексан (3:2) обеспечила получение чистого соединения IE1172-70 (76%). 1H ЯМР (400 МГц, CDCl3): δ 1.81 (с, 3H, NAc), 2.05 (с, 6Н, 2 ОАс), 2.07 (с, 3H, ОАс), 3.82 (с, 3H, СООСН3), 4.20 (дд, J=12.5, 7.0 Гц, 1Н, Н-9), 4.30 (к, J=9.8 Гц, 1Н, Н-5), 4.71 (дд, J=12.5, 2.7 Гц, 1Н, Н-9'), 4.86 (дд, J=10.7, 1.9 Гц, 1H, Н-6), 5.42 (ддд, J=6.8, 5.4, 2.6 Гц, 1Н, Н-8), 5.55 (дд, J=5.3, 1.9 Гц, 1Н, Н-7), 5.91 (дд, J=10.0, 2.4 Гц, 1Н, Н-4), 6.09 (д, J=2.3 Гц, 1H, Н-3), 6.93 (д, J=8.8 Гц, 1Н, NH), 7.26 (тд, J=7.8, 1.8 Гц, 1Н, Ph-H), 7.34 (тд, J=7.6, 1.4 Гц, 1Н, Ph-H), 7.41 (дд, J=8.0, 1.3 Гц, 1H, Ph-H), 8.05 (дд, J=7.9, 1.7 Гц, 1Н, Ph-H), 8.19 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.75, 20.80, 20.93 (3 ОСОСН3), 22.94 (NHCOCH3), 49.00 (С-5), 52.74 (СООСН3), 57.92 (С-4), 62.18 (С-9), 67.81 (С-7), 70.86 (С-8), 76.48 (С-6), 107.11 (С-3), 122.63 (триазол-С-5), 127.22 (Ph), 128.62 (Ph, q углерод), 129.44 (Ph), 129.80 (Ph), 130.28 (Ph), 131.42 (Ph, q углерод), 144.31 (триазол-С-4), 145.96 (С-2), 161.34 (СООСН3), 170.20, 170.28, 170.79, 171.01 (NHCOCH3, 3 ОСОСН3): LRMS [C26H26ClN4O10] (m/z): (режим регистрации положительно заряженных ионов) 615,1 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-4-(4-(2-хлорфенил)-[1,2,3,]триазол-1-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE1172-78)
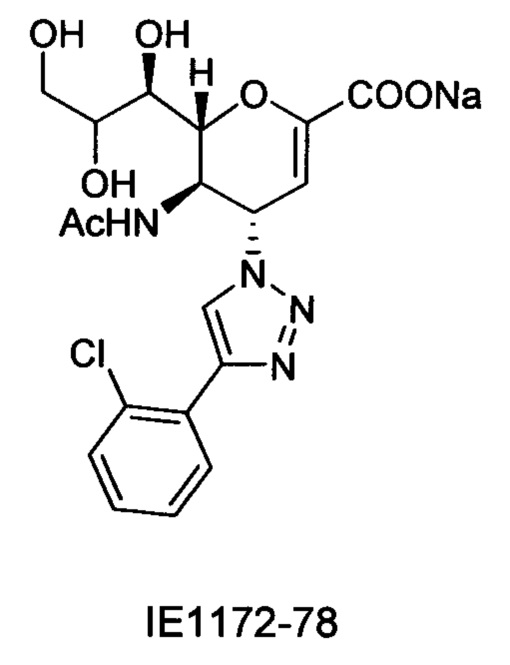
Выход = 89%. 1H ЯМР (400 МГц, D2O): δ 1.93 (с, 3H, NAc), 3.68 (дд, J=12.0, 6.4 Гц, 1Н, Н-9), 3.73 (дд, J=9.7, 1.3 Гц, 1Н, Н-7), 3.93 (дд, J=12.0, 2.7 Гц, 1H, Н-9'), 4.03 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.48 (т, J=10.3 Гц, 1Н, Н-5), 4.61 (дд, J=11.1, 1.3 Гц, 1Н, Н-6), 5.58 (дд, J=9.7, 2.3 Гц, 1H, Н-4), 5.93 (д, J=2.2 Гц, 1Н, Н-3), 7.37-7.51 (м, 2Н, 2Ph-H), 7.58 (дд, J=7.5, 1.9 Гц, 1Н, Ph-H), 7.81 (дд, J=7.0, 2.5 Гц, 1Н, Ph-H), 8.49 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, D2O): δ 21.70 (NHCOCH3), 48.67 (С-5), 60.10 (С-4), 63.09 (С-9), 68.10 (С-7), 69.74 (С-8), 75.39 (С-6), 101.87 (С-3), 123.78 (триазол-С-5), 127.36 (Ph), 128.03 (Ph q углерод), 129.94 (Ph), 130.10 (Ph), 130.19 (Ph), 131.50 (Ph q углерод), 144.37 (триазол-С-4), 150.41 (С-2), 168.78 (COONa), 173.56 (NHCOCH3); LRMS [C19H20ClN4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 497,1 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метилфенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-72)
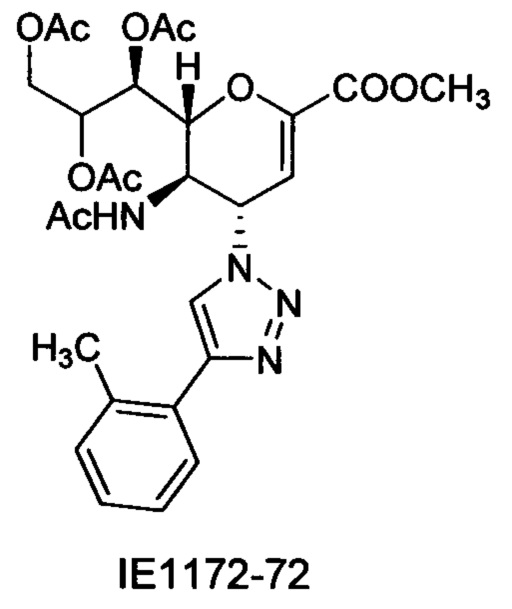
Очистка хроматографией на силикагеле с использованием смеси ацетон:гексан (4:3) обеспечила получение чистого соединения IE1172-72 (81%). 1H ЯМР (400 МГц, CDCl3): δ 1.76 (с, 3H, NAc), 2.04 (с, 3H, ОАс), 2.06 (с, 3H, ОАс), 2.07 (с, 3H, ОАс), 2.33 (с, 3H, Ph-СН3), 3.82 (с, 3H, СООСН3), 4.19 (дд, J=12.5, 7.1 Гц, 1Н, Н-9), 4.39 (к, J=9.9 Гц, 1H, Н-5), 4.71 (дд, J=12.4, 2.7 Гц, 1Н, Н-9'), 4.82 (дд, J=10.4, 2.0 Гц, 1Н, Н-6), 5.41 (ддд, J=7.6, 5.1, 2.7 Гц, 1Н, Н-8), 5.57 (дд, J=5.2, 1.9 Гц, 1Н, Н-7), 5.86 (дд, J=10.2, 2.4 Гц, 1Н, Н-4), 6.07 (д, J=2.3 Гц, 1H, Н-3), 7.16-7.30 (m, 4Н, NH, 3РН-Н), 7.60 (м, 1Н, Ph-H), 7.70 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.72, 20.81, 20.93 (3 ОСОСН3), 21.09 (Ph-СН3), 22.82 (NHCOCH3), 48.63 (С-5), 52.73 (СООСН3), 58.03 (С-4), 62.21 (С-9), 67.76 (С-7), 70.93 (С-8), 76.72 (С-6), 107.38 (С-3), 121.28 (триазол-С-5), 126.16 (Ph), 128.58 (Ph), 128.94 (Ph), 129.23 (Ph, q углерод), 130.90 (Ph), 135.64 (Ph, q углерод), 145.85 (C-2), 147.15 (триазол-С-4), 161.37 (СООСН3), 170.07, 170.30, 170.80, 171.06 (NHCOCH3, 3 ОСОСН3); LRMS [C27H32N4O10] (m/z): (режим регистрации положительно заряженных ионов) 595,2 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метилфенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-82)
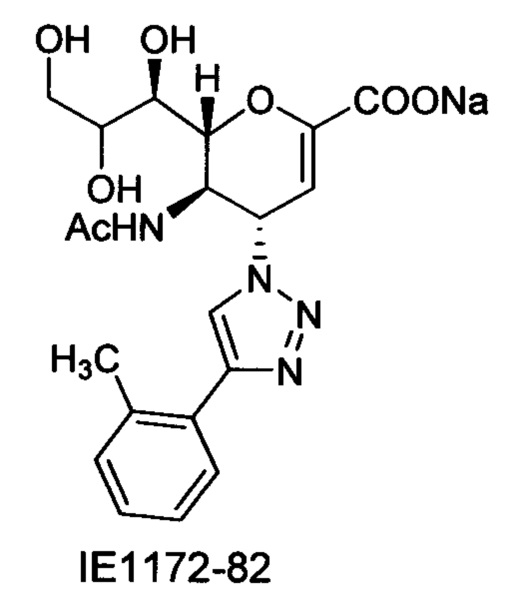
Выход = 85%. 1Н ЯМР (400 МГц, D2O): δ 1.93 (с, 3H, NAc), 2.36 (с, 3H, Ph-СН3), 3.68 (дд, J=11.9, 6.3 Гц, 1H Н-9), 3.74 (д, J=9.7 Гц, 1Н, Н-7), 3.93 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 4.03 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.48 (т, J=10.3 Гц, 1H, Н-5), 4.60 (дд, J=10.8, 1.3 Гц, 1Н, Н-6), 5.58 (дд, J=9.7, 2.3 Гц, 1H, Н-4), 5.92 (д, J=2.3 Гц, 1Н, Н-3), 7.29-7.46 (м, 3H, 3Ph-H), 7.58 (д, J=7.4 Гц, 1Н, Ph-H), 8.19 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, D2O): δ 19.77 (Ph-СН3), 21.67 (NHCOCH3), 48.69 (С-5), 60.06 (С-4), 63.09 (С-9), 68.10 (С-7), 69.74 (С-8), 75.39 (С-6), 101.92 (С-3), 122.60 (триазол-С-5), 126.17 (Ph), 128.94 (Ph q углерод), 129.01 (Ph), 129.03 (Ph), 130.76 (Ph), 136.45 (Ph q углерод), 146.87 (триазол-С-4), 150.42 (С-2), 168.80 (COONa), 173.52 (NHCOCH3); LRMS [C20H23N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 477,2 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-(трифторметил)фенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-74)
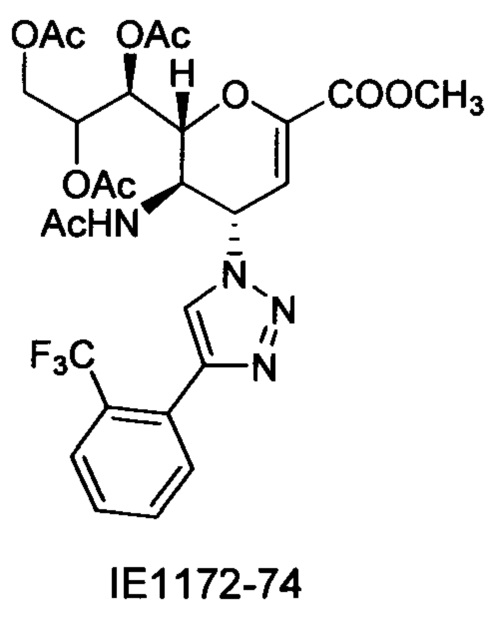
Очистка хроматографией на силикагеле с использованием смеси ацетон:гексан (3:2) обеспечила получение чистого соединения IE1172-74 (90%). 1H ЯМР (400 МГц, CDCl3): δ 1.75 (с, 3H, NAc), 2.04 (с, 3H, ОАс), 2.05 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 3.83 (с, 3H, СООСН3), 4.14-4.35 (м, 2Н, Н-9, Н-5), 4.70 (дд, J=12.4, 2.6 Гц, 1Н, Н-9'), 4.92 (дд, J=10.6, 1.8 Гц, 1H, Н-6), 5.42 (ддд, J=6.8, 5.4, 2.6 Гц, 1Н, Н-8), 5.54 (дд, J=5.5, 1.8 Гц, 1H, Н-7), 5.97 (дд, J=10.1, 2.4 Гц, 1H, Н-4), 6.08 (д, J=2.3 Гц, 1Н, Н-3), 6.99 (д, J=8.5 Гц, 1Н, NH), 7.48 (т, J=7.7 Гц, 1Н, Ph-H), 7.61 (тд, J=7.7, 1.4 Гц, 1Н, Ph-H), 7.72 (дд, J=8.1, 1.4 Гц, 1H, Ph-H), 7.75-7.84 (м, 2Н, Ph-H, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.76, 20.79, 20.92 (3 ОСОСН3), 22.73 (NHCOCH3), 49.38 (С-5), 52.74 (СООСН3), 57.48 (С-4), 62.16 (С-9), 67.80 (С-7), 70.79 (С-8), 76.25 (С-6), 107.09 (С-3), 122.58 (Ph, q углерод), 122.82 (к, J=5.1, 4.6 Гц, триазол-С-5), 125.29 (Ph, q углерод), 126.22 (к, J=5.5 Гц, Ph), 127.61 (к, J=30.4 Гц, CF3), 128.71 (Ph), 131.79 (Ph), 132.09 (Ph), 144.40 (триазол-С-4), 145.84 (С-2), 161.35 (СООСН3), 170.20, 170.26, 170.75, 171.19 (NHCOCH3, 3 ОСОСН3); LRMS [C27H29F3N4O10] (m/z): (режим регистрации положительно заряженных ионов) 649,1 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-(трифторметил)фенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-83)
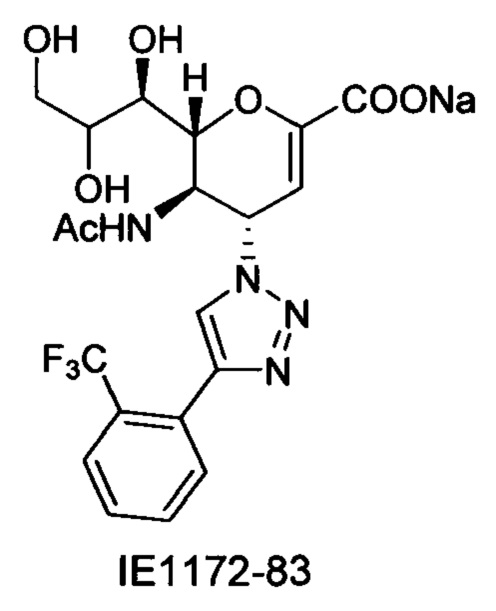
Выход = 77%. 1H ЯМР (400 МГц, D2O): δ 1.94 (с, 3H, NAc), 3.68 (дд, J=11.8, 6.3 Гц, 1Н, Н-9), 3.73 (д, J=9.6 Гц, 1Н, Н-7), 3.93 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.03 (ддд, J=9.3, 6.2, 2.6 Гц, 1H, Н-8), 4.51 (т, J=10.2 Гц, 1H, Н-5), 4.59 (д, J=10.9 Гц, 1Н, Н-6), 5.61 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.93 (д, J=2.2 Гц, 1H, Н-3), 7.61-7.70 (м, 2Н, 2Ph- Η), 7.75 (т, J=7.6 Гц, 1H, Ph-H), 7.90 (д, J=7.8 Гц, 1H, Ph-H), 8.23 (с, 1H, триазол-СН); 13C ЯМР (101 МГц, D2O): δ 21.61 (NHCOCH3), 48.62 (C-5), 59.96 (C-4), 63.09 (C-9), 68.10 (C-7), 69.73 (C-8), 75.48 (C-6), 101.96 (C-3), 122.49 (Ph q углерод), 123.77 (к, J=3.0 Гц, триазол-С-5), 125.20 (Ph q углерод), 126.32 (к, J=5.4 Гц, Ph), 127.39-128.51 (м, CF3), 129.38 (Ph), 131.99 (Ph), 132.27 (Ph), 144.83 (триазол-С-4), 150.33 (C-2), 168.75 (COONa), 173.52 (NHCOCH3); LRMS [C20H20F3N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 531,2 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(5-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-79)
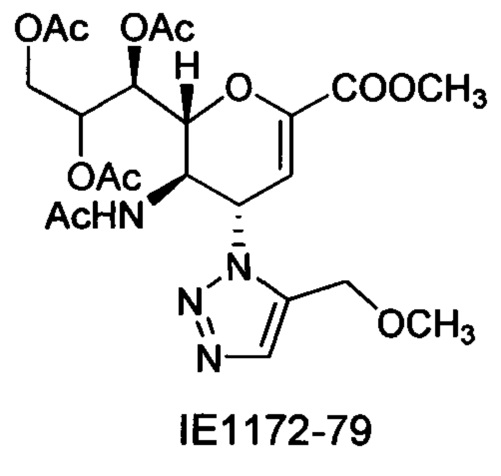
Очистка хроматографией на силикагеле с использованием смеси этилацетат:ацетон (6:1) обеспечила получение чистого соединения IE1172-79 (68%). 1H ЯМР (400 МГц, CDCl3): δ 1.87 (с, 3H, NAc), 2.01 (с, 3H, ОАс), 2.03 (с, 3H, ОАс), 2.07 (с, 3H, ОАс), 3.34 (с, 3H, СН2ОСН3), 3.79 (с, 3H, СООСН3), 4.15-4.27 (м, 2Н, Н-5, Н-9), 4.34-4.50 (м, 2Н, CH2O), 4.60 (дд, J=12.5, 2.6 Гц, 1H Н-9'), 5.09 (дд, J=10.7, 1.8 Гц, 1Н, Н-6), 5.42 (тд, J=6.2, 2.6 Гц, 1Н, Н-8), 5.49 (дд, J=6.3, 1.8 Гц, 1H, Н-7), 5.91 (д, J=2.4 Гц, 1H, Н-3), 6.05 (дд, J=9.9, 2.5 Гц, 1Н, Н-4), 7.26 (д, J=7.8 Гц, 1H, NH), 7.46 (с, 1H, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.71, 20.76, 20.92 (3 ОСОСН3), 23.04 (NHCOCH3), 50.03 (С-5), 52.60 (СООСН3), 55.20 (С-4), 58.59 (СН2ОСН3), 61.94 (СН2ОСН3), 62.10 (С-9), 67.74 (С-7), 70.25 (С-8), 75.54 (С-6), 107.87 (С-3), 133.48 (триазол-С-4), 134.46 (триазол-С-5), 145.50 (С-2), 161.55 (СООСН3), 169.96, 170.21, 170.66, 171.54 (NHCOCH3, 3 ОСОСН3); LRMS [C22H30N4O11] (m/z): (режим регистрации положительно заряженных ионов) 549,3 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(5-метоксиметил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-87)
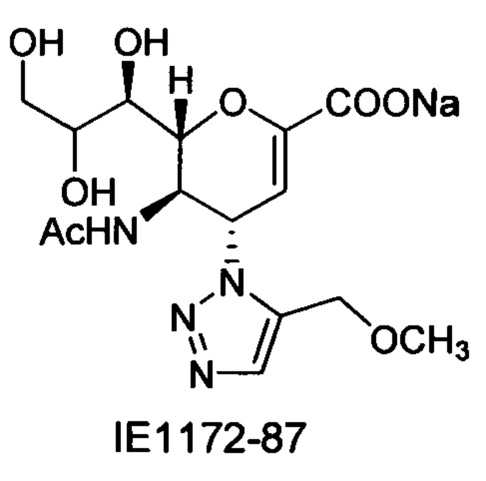
Выход = 83%. 1H ЯМР (400 МГц, D2O): δ 1.89 (с, 3H, NAc), 3.40 (с, 3H, ОСН3), 3.65-3.74 (м, 2Н, Н-9, Н-7), 3.93 (дд, J=12.0, 2.7 Гц, 1H, Н-9'), 4.03 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.57 (д, J=10.9 Гц, 1Н, Н-6), 4.61-4.73 (м, 3H, Н-5, ОСН2), 5.62 (дд, J=9.6, 2.4 Гц, 1Н, Н-4), 5.85 (д, J=2.4 Гц, 1Н, Н-3), 7.81 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, D2O): δ 21.73 (NHCOCH3), 47.97 (С-5), 57.87 (ОСН3), 58.92 (С-4), 61.34 (ОСН2), 63.08 (С-9), 68.08 (С-7), 69.70 (С-8), 75.34 (С-6), 102.36 (С-3), 134.66 (триазол-С-5), 134.73 (триазол-С-4), 150.02 (С-2), 168.75 (COONa), 173.61 (NHCOCH3); LRMS [C15H21N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 431,2 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(5-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-39)
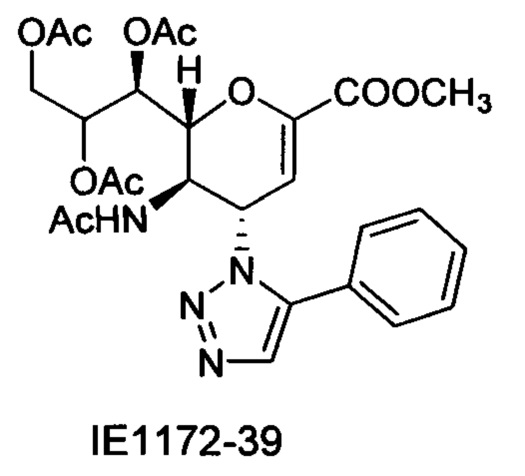
Очистка хроматографией на силикагеле с использованием смеси гексан:ацетон (4:3) обеспечила получение чистого соединения IE1172-39 (82%). 1H ЯМР (400 МГц, CDCl3): δ 1.74 (с, 3H, NAc), 2.02 (с, 3H, ОАс), 2.04 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 3.80 (с, 3H, СООСН3), 4.04 (тд, J=10.1, 7.3 Гц, 1H Н-5), 4.21 (м, 1Н, Н-9), 4.51 (м, 1Н, Н-9'), 5.05 (д, J=10.5 Гц, 1Н, Н-6), 5.31-5.46 (м, 2Н, Н-7, Н-8), 5.98 (д, J=2.5 Гц, 1Н, Н-3), 6.09 (дд, J=9.7, 2.5 Гц, 1Н, Н-4), 6.75 (д, J=7.4 Гц, 1Н, NH), 7.30-7.32 (м, 2Н, 2Ph-H), 7.47-7.53 (м, 3H, 3Ph-H), 7.58 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.73, 20.79, 20.89 (3 ОСОСН3), 23.03 (NHCOCH3), 50.85 (С-5), 52.58 (СООСН3), 54.24 (С-4), 62.01 (С-9), 67.63 (С-7), 69.87 (С-8), 74.78 (С-6), 108.02 (С-3), 126.01 (Ph q углерод), 129.07 (Ph), 129.23 (Ph), 130.07 (Ph), 132.70 (триазол-С-4), 139.35 (триазол-С-5), 145.49 (С-2), 161.49 (СООСН3), 169.79, 170.40, 170.58, 171.03 (NHCOCH3, 3 ОСОСН3); LRMS [C26H30N4O10] (m/z): (режим регистрации положительно заряженных ионов) 581,1 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(5-фенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енотат (IE1172-45)
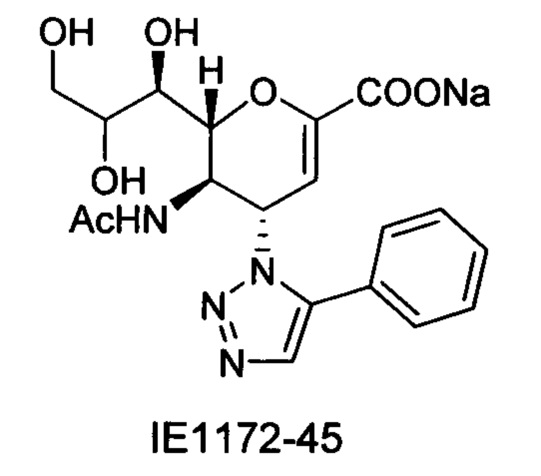
Выход = 88%. 1H ЯМР (400 МГц, D2O): δ 1.72 (с, 3H, NAc), 3.55 (д, J=9.7 Гц, 1Н, Н-7), 3.62 (дд, J=12.0, 6.3 Гц, 1H Н-9), 3.87 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 3.95 (ддд, J=9.3, 6.2, 2.7 Гц, 1Н, Н-8), 4.33-4.51 (м, 2Н, Н-5, Н-6), 5.63 (дд, J=9.3, 2.2 Гц, 1H, Н-4), 5.98 (д, J=2.3 Гц, 1Н, Н-3), 7.46-7.56 (м, 2Н, 2Ph-H), 7.57-7.61 (м, 3H, 3Ph-H), 7.85 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, D2O): δ 21.88 (NHCOCH3), 48.83 (С-5), 57.52 (С-4), 63.00 (С-9), 67.95 (С-7), 69.64 (С-8), 75.01 (С-6), 103.14 (С-3), 125.71 (Ph q углерод), 129.13 (Ph), 129.28 (Ph), 130.10 (Ph), 133.02 (триазол-С-4), 139.88 (триазол-С-5), 149.90 (С-2), 168.80 (COONa), 173.30 (NHCOCH3): LRMS [C19H21N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 462,6 [M+Na]+ .
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4,5-дифенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-90)
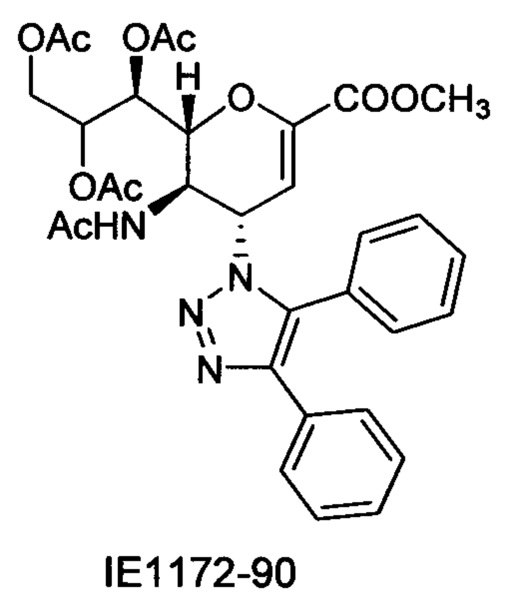
Очистка хроматографией на силикагеле с использованием смеси гексан:ацетон (3:2) обеспечила получение чистого соединения IE1172-90 (79%). 1H ЯМР (400 МГц, CDCl3): δ 1.82 (с, 3H, NAc), 2.03 (с, 6Н, 2OAc), 2.10 (с, 3H, ОАс), 3.78 (с, 3H, СООСН3), 4.17-4.27 (м, 2Н, Н-5, Н-9), 4.52 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 5.07 (д, J=10.4 Гц, 1Н, Н-6), 5.40 (тд, J=6.3, 2.5 Гц, 1Н, Н-8), 5.45 (дд, J=6.8, 1.7 Гц, 1Н, Н-7), 5.79-5.93 (м, 2Н, Н-3, Н-4), 7.13-7.27 (м, 6Н, NH, 5Ph-H), 7.28-7.34 (м, 2Н, 2Ph-H), 7.38-7.48 (м, 3H, 3Ph-H); 13С ЯМР (101 МГц, CDCl3) δ 20.75, 20.76, 20.89 (3 ОСОСН3), 23.33 (NHCOCH3), 50.56 (С-5), 52.54 (СООСН3), 54.97 (С-4), 62.09 (С-9), 67.54 (С-7), 69.93 (С-8), 75.13 (С-6), 108.41 (С-3), 126.48 (Ph q углерод), 127.15 (Ph), 128.09 (Ph), 128.44 (Ph), 129.31 (Ph), 130.11 (Ph), 130.14 (Ph), 130.18 (Ph q углерод), 135.11 (триазол-С), 144.35 (триазол-С), 145.49 (С-2), 161.50 (СООСН3), 169.80, 170.27, 170.63, 171.37 (NHCOCH3, 3 ОСОСН3); LRMS [C32H34N4O10] (m/z): (режим регистрации положительно заряженных ионов) 657,3 [M+Na]+.
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4,5-дифенил-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1172-102)
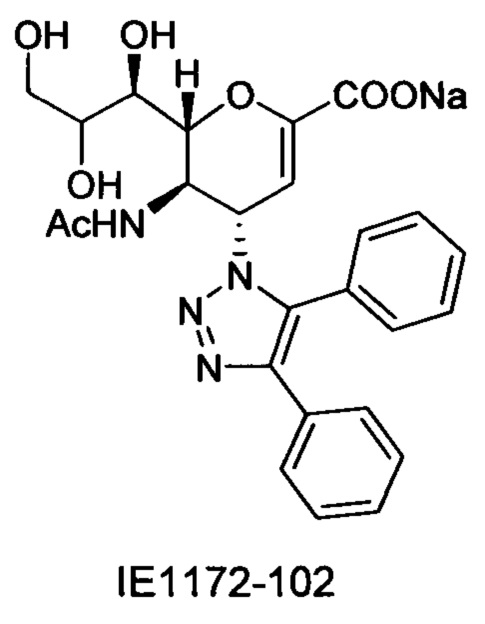
Выход = 84%. 1Н ЯМР (400 МГц, D2O): δ 1.83 (с, 3H, NAc), 3.58 (д, J=9.7 Гц, 1Н, Н-7), 3.63 (дд, J=12.0, 6.2 Гц, 1H, Н-9), 3.88 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 3.94 (ддд, J=9.4, 6.2, 2.7 Гц, 1H, Н-8), 4.37 (д, J=11.0 Гц, 1H, Н-6), 4.59 (дд, J= 11.2, 9.2 Гц, 1H, Н-5), 5.48 (д, J=9.7 Гц, 1Н, Н-4), 5.90 (с, 1H, Н-3), 7.36-7.59 (м, 10Н, Ph-H); 13С ЯМР (101 МГц, D2O): δ 21.94 (NHCOCH3), 48.33 (С-5), 58.44 (С-4), 63.01 (С-9), 67.98 (С-7), 69.61 (С-8), 74.96 (С-6), 103.15 (С-3), 126.05 (Ph q углерод), 127.31 (Ph), 128.55 (Ph), 128.80 (Ph), 129.21 (Ph), 129.63 (Ph q углерод), 130.25 (Ph), 130.42 (Ph), 135.79 (триазол-С), 144.67 (триазол-С), 149.71 (С-2), 168.67 (COONa), 173.41 (NHCOCH3); LRMS [C25H25N4NaO7] (m/z): (режим регистрации положительно заряженных ионов) 539,2 [M+Na]+.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-4-(4-(2-бромфенил)-[1,2,3,]триазол-1-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE1257-75)
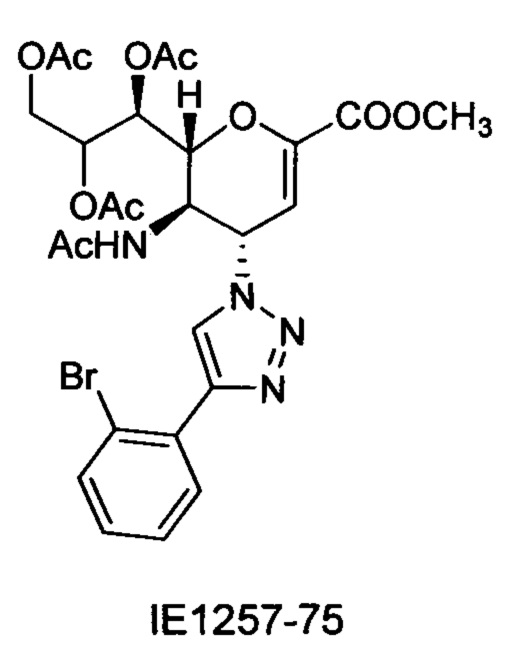
Очистка хроматографией на силикагеле с использованием смеси гексангацетон (3:2) обеспечила получение чистого соединения IE1257-75 (88%). 1H ЯМР (400 МГц, CDCl3): δ 1.85 (с, 3H, NAc), 2.06 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 2.09 (с, 3H, ОАс), 3.84 (с, 3H, СООСН3), 4.16-4.28 (м, 2Н, Н-5, Н-9), 4.68 (дд, J=12.5, 2.6 Гц, 1Н, Н-9'), 4.91 (дд, J=10.7, 1.8 Гц, 1H, Н-6), 5.43 (ддд, J=6.7, 5.6, 2.6 Гц, 1H, Н-8), 5.53 (дд, J=5.8, 1.7 Гц, 1Н, Н-7), 6.00 (дд, J=9.9, 2.5 Гц, 1Н, Н-4), 6.11 (д, J=2.2 Гц, 1H, Н-3), 6.59 (д, J=8.4 Гц, 1H, NH), 7.20 (ддд, J=8.1, 7.3, 1.6 Гц, 1Н, РН-Н), 7.40 (тд, J=7.5, 1.3 Гц, 1Н, Ph-H), 7.63 (дд, J=8.0, 1.2 Гц, 1Н, Ph-H), 7.96 (дд, J=7.9, 1.7 Гц, 1H, Ph-H), 8.22 (с, 1H, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.80, 20.95 (3 ОСОСН3), 23.13 (NHCOCH3), 49.56 (С-5), 52.75 (СООСН3), 57.49 (С-4), 62.10 (С-9), 67.81 (С-7), 70.62 (С-8), 76.10 (С-6), 107.03 (С-3), 121.42 (Ph q углерод), 122.66 (Ph), 127.76 (Ph), 129.75 (Ph), 130.65 (Ph), 133.59 (триазол-С5), 145.61 (триазол-С4), 145.94 (С-2), 161.33 (СООСН3), 170.15, 170.29, 170.71, 171.09 (NHCOCH3, 3 ОСОСН3).
Натрий 5-ацетамидо-2,6-ангидро-4-(4-(2-бромфенил)-[1,2,3,]триазол-1-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE1257-84)
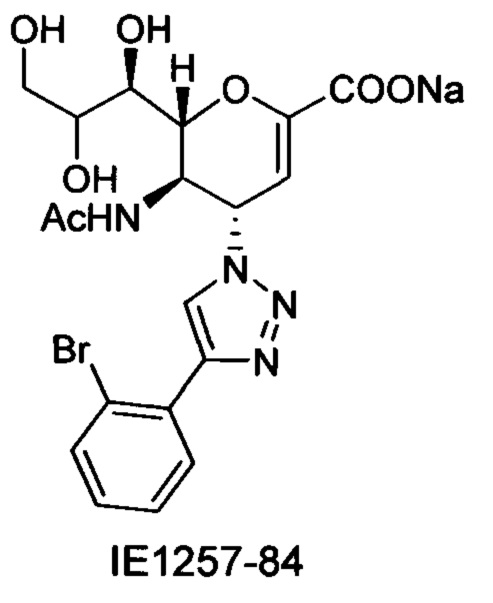
Выход = 89%. 1H ЯМР (400 МГц, D2O): δ 1.93 (с, 3H, NAc), 3.62-3.77 (м, 2Н, Н-7, Н-9), 3.92 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 4.02 (ддд, J=9.2, 6.2, 2.7 Гц, 1Н, Н-8), 4.49 (дд, J=10.9, 9.6 Гц, 1H, Н-5), 4.60 (дд, J=10.9, 1.3 Гц, 1Н, Н-6), 5.58 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.92 (д, J=2.3 Гц, 1H, Н-3), 7.36 (ддд, J=7.9, 7.3, 1.7 Гц, 1H, Ph-H), 7.49 (тд, J=7.6, 1.3 Гц, 1H Ph-H), 7.69 (дд, J=7.8, 1.7 Гц, 1H, Ph-H), 7.77 (дд, J=8.1, 1.2 Гц, 1H, Ph-H), 8.45 (с, 1H, триазол-СН); 13C ЯМР (101 МГц, D2O): δ 21.77 (NHCOCH3), 48.68 (C-5), 60.07 (C-4), 63.10 (C-9), 68.11 (C-7), 69.75 (C-8), 75.42 (C-6), 101.91 (C-3), 121.49 (Ph q углерод), 123.72 (Ph), 127.90 (Ph), 129.16 (Ph), 130.16 (Ph q углерод), 130.42 (Ph), 130.71 (Ph), 133.42 (триазол-С5), 145.89 (триазол-С4), 150.39 (С-2), 168.78 (COONa), 173.54 (NHCOCH3).
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метоксикарбонил)фенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1398-25)
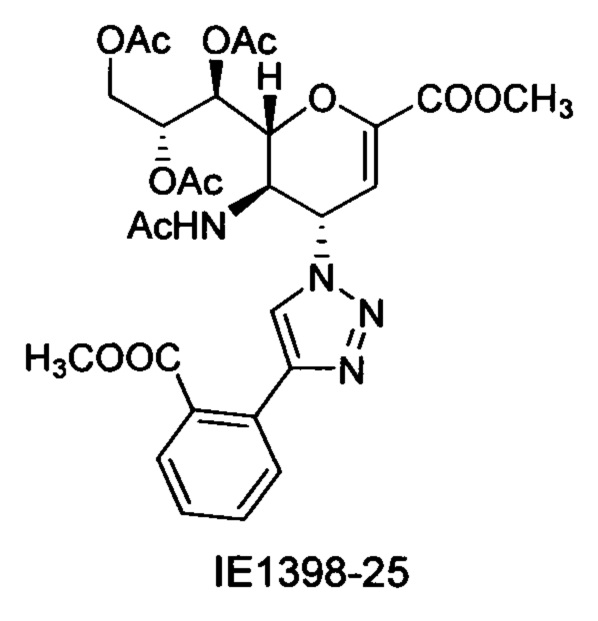
Очистка хроматографией на силикагеле с использованием смеси гексан:ацетон (4:3) обеспечила получение чистого соединения IE1398-25 (91%). 1H ЯМР (400 МГц, CDCl3): δ 1.76 (с, 3H, NAc), 2.02 (с, 3H, ОАс), 2.04 (с, 3H, ОАс), 2.05 (с, 3H, ОАс), 3.75 (с, 3H, Ph-COOCH3), 3.80 (с, 3H, С2-СООСН3), 4.17 (дд, J=12.4, 7.1 Гц, 1H, Н-9), 4.31 (к, J=9.8 Гц, 1Н, Н-5), 4.69 (дд, J=12.5, 2.8 Гц, 1Н, Н-9'), 4.78 (д, J=10.3 Гц, 1Н, Н-6), 5.38 (ддд, J=7.6, 5.4, 2.8 Гц, 1Н, Н-8), 5.52 (дд, J=5.0, 1.9 Гц, 1Н, Н-7), 5.78 (дд, J=10.2, 2.5 Гц, 1Н, Н-4), 6.03 (д, J=2.4 Гц, 1Н, Н-3), 7.13 (д, J=8.9 Гц, 1Н, NH), 7.38 (т, J=7.8 Гц, 1H, Ph-H), 7.50 (тд, J=7.7, 1.4 Гц, 1Н, Ph-H), 7.65 (д, J=7.7 Гц, 1Н, Ph-H), 7.76 (д, J=7.6 Гц, 1H, Ph-H), 7.84 (с, 1H, триазол-СН); 13С ЯМР (101 МГц, CDCl3) δ 20.72, 20.79, 20.91 (3 ОСОСН3), 22.80 (NHCOCH3), 48.65 (С-5), 52.29, 52.66 (2 СООСН3), 57.96 (С-4), 62.23 (С-9), 67.78 (С-7), 70.91 (С-8), 76.66 (С-6), 107.37 (С-3), 122.06 (Ph), 128.35 (Ph), 129.85 (Ph), 129.99 (Ph q углерод), 130.15 (Ph q углерод), 130.35 (Ph), 131.62 (триазол-С5), 145.79 (триазол-С4), 145.89(C-2), 161.36 (С2-СООСН3), 168.39 (Ph-СООСН3), 170.07, 170.27, 170.76, 171.02 (NHCOCH3, 3 ОСОСН3); LRMS [C28H32N4O12] (m/z): (режим регистрации положительно заряженных ионов) 639,3 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(4-(2-метоксикарбонил)фенил)-[1,2,3,]триазол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE1398-33)
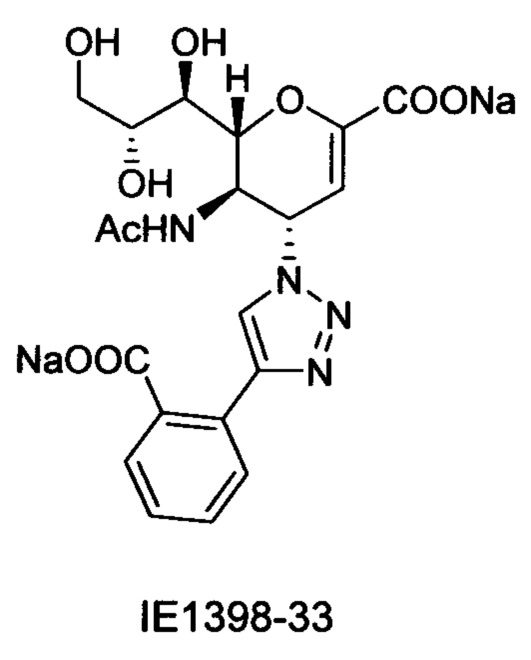
Выход = 68%. 1H ЯМР (400 МГц, D2O): δ 1.94 (с, 3H, NAc), 3.66 (дд, J=12.2, 6.0 Гц, 1Н, Н-9), 3.72 (дд, J=9.8, 1.4 Гц, 1Н, Н-7), 3.93 (дд, J=12.0, 2.9 Гц, 1Н, Н-9'), 4.03 (ддд, J=9.4, 6.4, 2.7 Гц, 1H, Н-8), 4.47 (т, J=10.3 Гц, 1Н, Н-5), 4.61 (дд, J=10.9, 1.4 Гц, 1Н, Н-6), 5.59 (дд, J=9.5, 2.1 Гц, 1Н, Н-4), 5.95 (д, J=2.2 Гц, 1H, Н-3), 7.43-7.55 (м, 3H, 3 Ph-H), 7.75 (дд, J=6.6, 1.5 Гц, 1H, Ph-H), 8.18 (с, 1Н, триазол-СН); 13С ЯМР (101 МГц, D2O): δ 21.76 (NHCOCH3), 48.80 (С-5), 59.69 (С-4), 63.10 (С-9), 68.13 (С-7), 69.77 (С-8), 75.40 (С-6), 102.22 (С-3), 122.33 (триазол-С5), 125.00 (Ph q углерод), 126.44 (Ph), 128.30 (Ph), 128.57 (Ph), 128.79 (Ph), 138.95 (Ph q углерод), 146.15 (триазол-С4), 150.22 (С-2), 168.85 (C2-COONa), 173.80 (NHCOCH3), 178.10 (Ph-COONa); LRMS [C20H20N4Na2O9] (m/z): (режим регистрации положительно заряженных ионов) 528,8 [M+Na]+.
Метил 7,8,9-три-O-ацетил-3,4,5-тридезокси-3-фтор-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-эритро-β-L-глюко-нон-2-улопираносилонат фторид (IE1257-22)
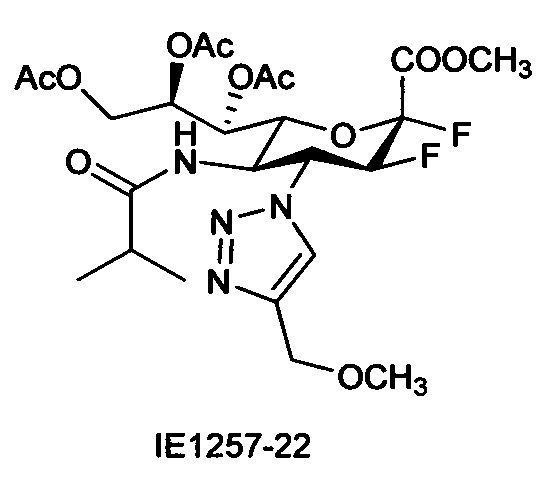
Очистка хроматографией на силикагеле с использованием смеси гексан:ацетон (3:2) обеспечила получение чистого соединения 10 (57 мг, 81%). 1H ЯМР (400 МГц, CDCl3): δ 0.96-1.01 (м, 6Н, изобут-2СН3), 2.01 (с, 3H, ОАс), 2.09 (с, 3H, ОАс), 2.13 (с, 3H, ОАс), 2.23 (дк, J=13.0, 6.8 Гц, 1Н, изобут-СН), 3.36 (с, 3H, ОСН3), 3.90-3.96 (м, 4Н, СООСН3, Н-5), 4.19 (дд, J=12.6, 4.6 Гц, 1Н, Н-9), 4.27 (дд, J=12.6, 2.5 Гц, 1H, Н-9'), 4.54 (с, 2Н, ОСН2), 4.99-5.30 (м, 3H, Н-3, Н-6, Н-7), 5.37 (ддд, J=8.6, 4.6, 2.4 Гц, 1H, Н-8), 6.19-6.29 (м, 2Н, Н-4, NH), 7.60 (с, 1Н, триазол-СН); 13С ЯМР (100 МГц, CDCl3): δ 18.86 (изобут-СН3), 19.32 (изобут-СН3), 20.59, 20.75, 20.79 (3 ОСОСН3), 35.53 (изобут-СН), 50.84 (д, J=5.8 Гц, С-5), 53.62 (СООСН3), 58.34 (ОСН3), 59.00-59.40 (м, С-4), 61.86 (С-9), 65.50 (ОСН2), 67.08 (С-7), 68.29 (С-8), 71.51 (С-6), 90.64 (дд, J=196.1, 30.3 Гц, С-3), 105.58 (дд, J=230.3, 26.8 Гц, С-2), 124.52 (триазол-СН), 144.83 (триазол-q углерод), 164.51 (д, J=32.9 Гц, СООСН3), 169.56, 170.41, 170.69 (3 ОСОСН3), 178.35 (изобут-СО); 19F ЯМР (376 МГц, CDCl3): δ - 118.67 (д, J=14.0 Гц, F-2α), -197.42 (д, J=13.2 Гц, F-3β); LRMS [C24H34F2N4O11] (m/z): (режим регистрации положительно заряженных ионов) 615,3 [M+Na]+ .
3,4,5-Тридезокси-3-фтор-5-изобутирамидо-4-(4-метоксиметил-[1,2,3,]триазол-1-ил)-D-эритро-β-L-глюко-нон-2-улопиранозоновой кислоты фторид (IE1257-24)
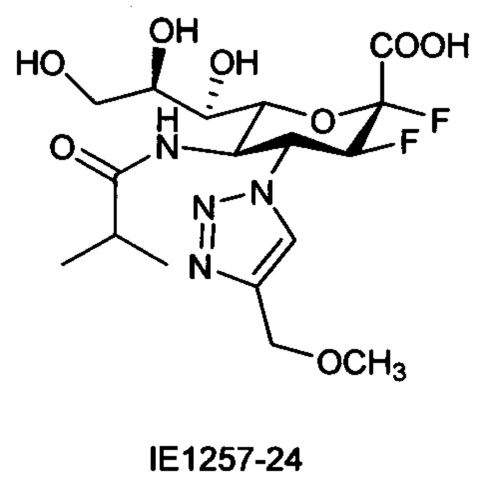
1H ЯМР (400 МГц, D2O): δ 0.81 (д, J=6.9 Гц, 3H, изобут-СН3), 0.94 (д, J=6.9 Гц, 3H, изобут-СН3), 2.35 (п, J=6.9 Гц, 1H, изобут-СН), 3.38 (с, 3H, ОСН3), 3.54 (д, J=9.2 Гц, 1H, Н-7), 3.61 (м, 1Н, Н-9), 3.78-3.91 (м, 2Н, Н-8, Н-9'), 4.52-4.76 (м, 3H, ОСН2, Н-6), 4.85 (м, 1Н, Н-5), 5.32 (ддд, J=49.5, 13.7, 9.7 Гц, 1H, Н-3), 5.75 (к, J=11.2 Гц, 1Н, Н-4), 8.28 (с, 1Н, триазол-СН); 13С ЯМР (100 МГц, D2O): δ 18.11 (изобут-СН3), 18.65 (изобут-СН3), 34.87 (изобут-СН), 48.15 (д, J=6.1 Гц, С-5), 57.26 (ОСН3), 63.16 (С-9), 63.18-63.58 (м, С-4), 64.13 (ОСН2), 67.85 (С-7), 69.83 (С-8), 73.73 (д, J=3.3 Гц, С-6), 90.22 (дд, J=190.9, 32.6 Гц, С-3), 106.79 (дд, J=224.1, 27.8 Гц, С-2), 124.89 (триазол-СН), 144.09 (триазол-q С), 169.21 (д, J=30.7 Гц, СООН), 180.88 (изобут-СО); 19F ЯМР (376 МГц, D2O): δ - 112.75 (д, J=13.8 Гц, F-2α), -199.41 (д, J=14.3 Гц, F-3β); LRMS [C17H25F2N4NaO8] (m/z): (режим регистрации положительно заряженных ионов) 496,8 [M+Na]+ ; HRMS (API) (m/z): [M+l]+ рассчитано для C17H26F2N4O8 [M+l]+ 453,1791; найдено 453,1810.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-4-(1-циано-2Н-изоиндол-2-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE889-76)
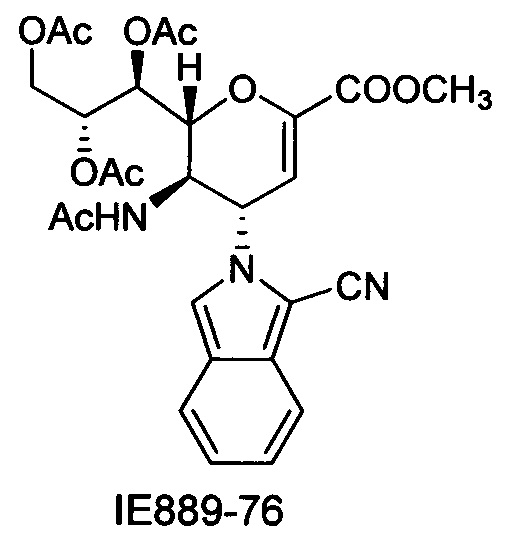
1Н ЯМР (300 МГц, CDCl3): δ 1.60 (с, 3H, NAc), 1.82 (с, 6Н, 2ОАс), 1.84 (с, 3H, ОАс), 3.60 (с, 3H, СООСН3), 3.96 (дд, J=12.7, 7.0 Гц, 1Н, Н-9), 4.19 (к, J=9.9 Гц, 1Н, Н-5), 4.40-4.50 (м, 2Н, Н-6, Н-9'), 5.16 (ддд, J=7.5, 6.0, 2.4 Гц, 1Н, Н-8); 5.22-5.33 (м, 2Н, Н-4, Н-7), 5.86 (д, J=1.6 Гц, 1Н, Н-3), 6.20 (д, J=9.6 Гц, 1H, NHAc), 6.84 (м, 1H, Ar-Н), 6.99 (м, 1Н, Ar-Н), 7.26 (с, 1H, Ar-Н-3'), 7.37 (м, 2Н, Ar-Н-4', Ar-Н-7'); 13Н ЯМР (75 МГц, CDCl3): δ 20.76, 20.92 (3 ОСОСН3), 22.97 (NHCOCH3), 49.26 (С-5), 52.79 (СООСН3), 58.00 (С-4), 62.08 (С-9), 67.67 (С-7), 70.86 (С-8), 77.06 (С-6), 93.82 (Ar-C-CN), 107.66 (С-3), 114.69 (CN), 117.55 (Ar), 117.78 (Ar), 121.14 (Ar), 123.23 (Ar), 124.63 (Ar q углерод), 126.08 (Ar), 131.60 (Ar q углерод), 146.63 (С-2), 161.29 (СООСН3), 170.17, 170.30, 170.63 (NHCOCH3, 3 ОСОСН3); LRMS [C27H29N3O10] (m/z): (режим регистрации положительно заряженных ионов) 578,1 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-4-(1-циано-2H-изоиндол-2-ил)-3,4,5-тридезокси-D-глицеро-D-галакто-нон-2-енонат (IE889-80)
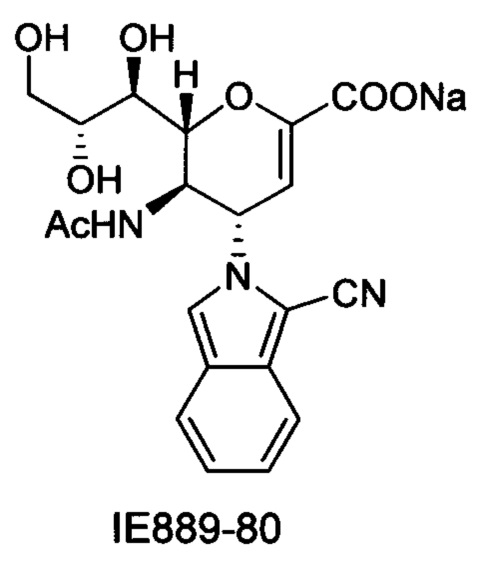
1H ЯМР (300 МГц, D2O): δ 1.91 (с, 3H, NAc), 3.61-3.77 (м, 2Н, Н-7, Н-9), 3.94 (дд, J=11.9, 2.6 Гц, 1Н, Н-9'), 4.05 (ддд, J=9.2, 6.2, 2.6 Гц, 1Н, Н-8), 4.50 (м, 1H, Н-5), 4.64 (д, J=11.0 Гц, 1Н, Н-6), 5.47 (дд, 7= 9.4, 2.3 Гц, 1H, Н-4), 5.96 (д, J=2.3 Гц, 1Н, Н-3), 7.21 (м, 1Н, Ar-Н), 7.37 (ддд, J=8.9, 6.7, 1.1 Гц, 1Н, Ar-Н), 7.65-7.87 (м, 3H, Ar-Н-3', Ar-Н-4', Ar-Н-7'); 13С ЯМР (75 МГц, D2O): δ 21.77 (NHCOCH3), 49.83 (С-5), 59.20 (С-4), 63.08 (С-9), 68.09 (С-7), 69.77 (С-8), 75.41 (С-6), 92.08 (Ar-C-CN), 103.30 (С-3), 115.30 (CN), 117.35 (Ar), 119.65 (Ar), 121.36 (Ar), 122.82 (Ar), 124.09 (Ar q углерод), 125.99 (Ar), 132.03 (Ar q углерод), 150.56 (С-2), 168.78 (COONa), 173.36 (NHCOCH3): LRMS [C20H20N3NaO7] (m/z): (режим регистрации положительно заряженных ионов) 460,1 [M+Na]+; HRMS (API) (m/z): [M+Na]+ рассчитано для C20H20N3Na2O7 [M+Na]+ 460,1091; найдено 460,1097.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-4-(1-циано-2Н-изоиндол-2-ил)-3,4,5-тридезокси-5-изобутирамидо-D-глицеро-D-галакто-нон-2-енонат (IE889-92)
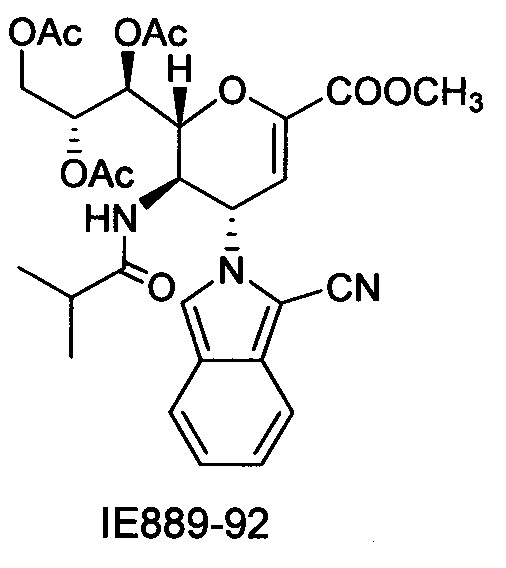
1H ЯМР (300 МГц, CDCl3): δ 0.92 (д, J=6.8 Гц, 3H, изобутирил-СН3), 1.00 (д, J=6.8 Гц, 3H, изобутирил-СН3), 2.07 (с, 3H, ОАс), 2.09 (с, 3H, ОАс), 2.10 (с, 3H, ОАс), 2.27 (м, 1Н, изобутирил-СН), 3.86 (с, 3H, СООСН3), 4.23 (дд, J=12.4, 6.6 Гц, 1Н, Н-9), 4.50 (м, 1Н, Н-5), 4.68 (дд, J=12.5, 2.7 Гц, 1Н, Н-9'), 4.77 (д, J=10.6 Гц, 1Н, Н-6), 5.40 (м, 1Н, Н-8), 5.51 (дд, J=5.6, 1.6 Гц, 1Н, Н-7), 5.62 (дд, J=9.7, 2.4 Гц, 1Н, Н-4), 6.15 (д, J=2.4 Гц, 1H, Н-3), 6.24 (д, J=9.4 Гц, 1H, NH), 7.11 (дд, J=8.6, 6.7 Гц, 1Н, Ar-Н), 7.28 (дд, J=8.4, 6.6 Гц, 1Н, Ar-Н), 7.50 (с, 1Н, Ar-Н-3'), 7.60-7.64 (м, 2Н, Ar-Н-4', Ar-Н-7'); 13Н ЯМР (75 МГц, CDCl3): δ 18.77, 19.05 (изобутирил-2СН3), 20.69, 20.73, 20.90 (3 ОСОСН3), 35.51 (изобутирил-СН), 49.11 (С-5), 52.78 (СООСН3), 57.88 (С-4), 62.05 (С-9), 67.61 (С-7), 70.80 (С-8), 77.01 (С-6), 93.83 (Ar-C-CN), 107.56 (С-3), 114.80 (CN), 117.58 (Ar), 117.81 (Ar), 121.20 (Ar), 123.22 (Ar), 124.66 (Ar q углерод), 126.15 (Ar), 131.56 (Ar q углерод), 146.50 (С-2), 161.31 (СООСН3), 170.10, 170.14, 170.57 (3 ОСОСН3), 177.07 (изобутирил-СО); LRMS [C29H33N3O10] (m/z): (режим регистрации положительно заряженных ионов) 606,4 [M+Na]+ .
Натрий 2,6-ангидро-4-(1-циано-2Н-изоиндол-2-ил)-3,4,5-тридезокси-5-изобутирамидо-D-глицеро-D-галакто-нон-2-енонат (IE889-99)
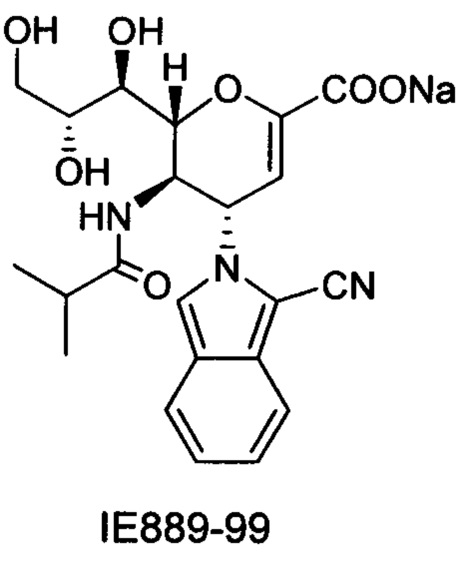
1H ЯМР (300 МГц, D2O): δ 0.88 (д, J=6.9 Гц, 3H, изобутирил-СН3), 0.97 (д, J=6.9 Гц, 3H, изобутирил-СН3), 2.44 (м, 1Н, изобутирил-СН), 3.62-3.75 (м, 2Н, Н-7, Н-9), 3.93 (дд, J=12.0, 2.7 Гц, 1Н, Н-9'), 4.04 (ддд, J=9.3, 6.3, 2.6 Гц, 1Н, Н-8), 4.56-4.66 (м, 2Н, Н-5, Н-6), 5.47 (дд, J=9.6, 2.4 Гц, 1H, Н-4), 5.95 (д, J=2.2 Гц, 1Н, Н-3), 7.20 (ддд, J=7.8, 6.8, 1.0 Гц, 1Н, Ar-Н), 7.36 (ддд, J=8.3, 6.8, 1.0 Гц, 1Н, Ar-Н), 7.70 (дд, J=8.6, 1.1 Гц, 1H Ar-Н), 7.74-7.87 (м, 2Н, 2 Ar-Н); 13С ЯМР (75 МГц, D2O): δ 18.16, 18.59 (изобутирил-2СН3), 35.06 (изобутирил-СН), 49.13 (С-5), 59.30 (С-4), 63.07 (С-9), 68.20 (С-7), 69.81 (С-8), 75.45 (С-6), 92.08 (Ar-C-CN), 103.34 (С-3), 115.47 (CN), 117.33 (Ar), 120.04 (Ar), 121.38 (Ar), 122.81 (Ar), 124.04 (Ar q углерод), 126.01 (Ar), 132.04 (Ar q углерод), 150.37 (С-2), 168.87 (COONa), 180.37 (изобутирил-СО); LRMS [C22H24N3NaO7] (m/z): (режим регистрации положительно заряженных ионов) 488,1 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C22H24N3Na2O7 [M+Na]+ 488,1404; найдено 488,1400.
Метил 7,8,9-три-0-ацетил-2,6-ангидро-4-(l-циано-2Н-изоиндол-2-ил)-3,4,5-тридезокси-5-(2,2,2-трифторацетамидо)-D-глицеро-D-галакто-нон-2-енонат (IE927-93)
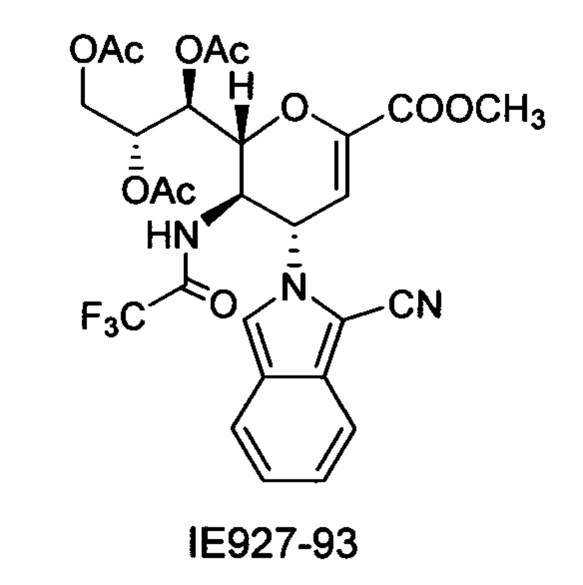
1H ЯМР (300 МГц, CDCl3): δ 2.07 (с, 3H, ОАс), 2.08 (с, 3H, ОАс), 2.10 (с, 3H, ОАс), 3.86 (с, 3H, СООСН3), 4.22 (дд, J=12.5, 6.6 Гц, 1Н, Н-9), 4.54 (к, J=9.9 Гц, 1H, Н-5), 4.68 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 4.82 (дд, J=10.6, 1.9 Гц, 1Н, Н-6), 5.43 (тд, J=6.0, 5.5, 2.6 Гц, 1Н, Н-8), 5.52 (дд, J=5.6, 1.8 Гц, 1Н, Н-7), 5.62 (дд, J=9.7, 2.4 Гц, 1Н, Н-4), 6.17 (д, J=2.4 Гц, 1H, Н-3), 7.13 (ддд, J=7.9, 6.8, 1.0 Гц, 1H, Ar-Н), 7.28 (ддд, J=8.4, 6.7, 1.0 Гц, 1H, Ar-Н), 7.52 (с, 1Н, Ar-Н-3'), 7.58-7.69 (м, 2Н, Ar-Н-4', Ar-Н-7'), 7.91 (д, J=9.6 Гц, 1Н, NH); 13Н ЯМР (75 МГц, CDCl3): δ 20.50, 20.71, 20.91 (3 ОСОСН3), 49.81 (С-5), 52.93 (СООСН3), 57.45 (С-4), 61.93 (С-9), 67.46 (С-7), 70.64 (С-8), 76.40 (С-6), 93.61 (Ar-C-CN), 107.14 (С-3), 113.24-117.05 (CF3), 114.37 (CN), 117.73 (Ar), 117.80 (Ar), 121.08 (Ar), 123.65 (Ar), 124.93 (Ar q углерод), 126.55 (Ar), 131.85 (Ar q углерод), 146.73 (С-2), 157.56 (q, JC,F=38.8 Гц, COCF3), 161.03 (СООСН3), 169.91, 170.38, 170.71 (3 ОСОСН3); LRMS [C27H26F3N3O10] (m/z): (режим регистрации положительно заряженных ионов) 632,1 [M+Na]+ .
Натрий 2,6-ангидро-4-(1-циано-2H-изоиндол-2-ил)-3,4,5-тридезокси-5-(2,2,2-трифторацетамидо)-D-глицеро-D-галакто-нон-2-енонат (IE927-99)
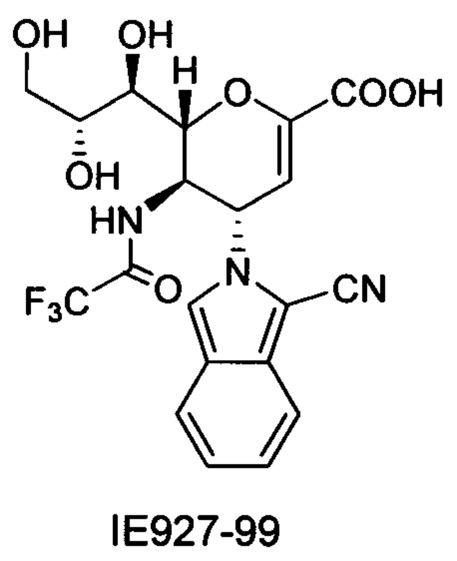
1H ЯМР (300 МГц, D2O): δ 3.60-3.75 (м, 2Н, Н-7, Н-9), 3.93 (дд, J=11.9, 2.7 Гц, 1Н, Н-9'), 4.07 (ддд, J=9.4, 6.4, 2.6 Гц, 1Н, Н-8), 4.64-4.74 (м, 2Н, Н-5, Н-6), 5.57 (дд, J=9.4, 2.3 Гц, 1Н, Н-4), 6.00 (д, J=2.3 Гц, 1Н, Н-3), 7.21 (м, 1Н, Ar-Н), 7.36 (м, 1Н, Ar-Н), 7.69 (д, J=8.6 Гц, 1Н, Ar-Н), 7.77 (д, J=8.5 Гц, 1Н, Ar-Н), 7.84 (с, 1Н, Ar-Н-3'); 13С ЯМР (75 МГц, D2O): δ 50.48 (С-5), 58.73 (С-4), 63.00 (С-9), 68.08 (С-7), 69.66 (С-8), 75.05 (С-6), 91.94 (Ar-C-CN), 103.21 (С-3), 109.60-118.88 (CF3), 115.01 (CN), 117.34 (Ar), 121.36 (Ar), 123.02 (Ar), 124.19 (Ar q углерод), 126.23 (Ar), 132.12 (Ar q углерод), 150.62 (С-2), 158.20 (q, JC,F=38.8 Гц, COCF3), 168.44 (COONa); LRMS [C20H17F3N3NaO7] (m/z): (режим регистрации положительно заряженных ионов) 514,1 [M+Na]+ , 492.2; HRMS (API) (m/z): [M+Na]+ рассчитано для C20H17F3N3Na2O7 [M+Na]+ 514,0830; найдено 514,0836.
Метил 5-ацетамидо-7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-4-(1H-тетразол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-86)
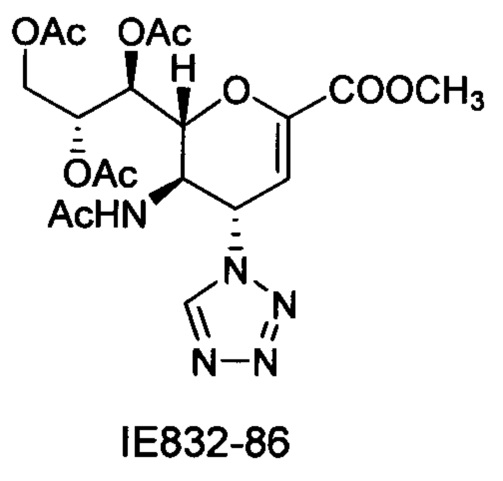
1H ЯМР (300 МГц, CDCl3): δ 1.95 (с, 3H, NAc), 2.06 (с, 3H, ОАс), 2.09 (с, 3H, ОАс), 2.10 (с, 3H, ОАс), 3.84 (с, 3H, СООСН3), 4.02 (м, 1H, Н-5), 4.22 (дд, J=12.6, 6.4 Гц, 1Н, Н-9), 4.63 (дд, J=12.5, 2.6 Гц, 1H, Н-9'), 4.95 (дд, J=10.5, 1.8 Гц, 1Н, Н-6), 5.38 (тд, J=6.2, 2.6 Гц, 1H, Н-8), 5.49 (дд, J=5.9, 1.8 Гц, 1H, Н-7), 6.05 (д, J=2.5 Гц, 1Н, Н-3), 6.11 (дд, J=9.8, 2.5 Гц, 1H, Н-4), 6.67 (д, J=8.2 Гц, 1Н, NH), 8.70 (с, 1H тетразол-СН); 13Н ЯМР (75 МГц, CDCl3): δ 20.72, 20.75, 20.91 (3 ОСОСН3), 23.13 (NHCOCH3), 49.72 (С-5), 52.87 (СООСН3), 55.92 (С-4), 61.93 (С-9), 67.62 (С-7), 70.50 (С-8), 75.70 (С-6), 105.19 (С-3), 140.84 (тетразол-С5), 146.64 (С-2), 161.07 (СООСН3), 170.17, 170.27, 170.63, 171.54 (NHCOCH3, 3 ОСОСН3); LRMS [C19H25N5O10] (m/z): (режим регистрации положительно заряженных ионов) 506,5 [M+Na]+ .
Натрий 5-ацетамидо-2,6-ангидро-3,4,5-тридезокси-4-(1H-тетразол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE832-98)
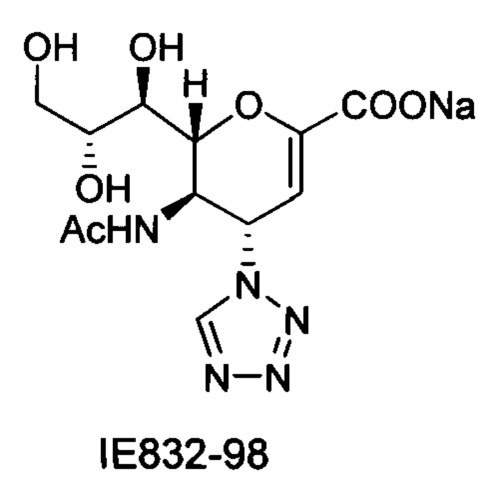
1H ЯМР (300 МГц, D2O): δ 1.94 (с, 3H, NAc), 3.65-3.74 (м, 2Н, Н-7, Н-9), 3.92 (дд, J=11.9, 2.7 Гц, 1H, Н-9'), 4.02 (ддд, J=9.3, 6.2, 2.7 Гц, 1Н, Н-8), 4.44 (дд, J=10.9, 9.7 Гц, 1H, Н-5), 4.62 (дд, J=11.0, 1.4 Гц, 1H, Н-6), 5.73 (дд, J=9.6, 2.3 Гц, 1Н, Н-4), 5.88 (д, J=2.3 Гц, 1Н, Н-3); 13С ЯМР (75 МГц, D2O): δ 21.63 (NHCOCH3), 48.44 (С-5), 58.77 (С-4), 63.04 (С-9), 67.99 (С-7), 69.67 (С-8), 75.29 (С-6), 100.61 (С-3), 143.99 (тетразол-С5), 150.85 (С-2), 168.53 (СООСН3), 173.82 (NHCOCH3); LRMS [C12H16N5NaO7] (m/z): (режим регистрации положительно заряженных ионов) 388,4 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C12H16N5Na2O7 [M+Na]+ 388,083964; найдено 388,084945.
Метил 7,8,9-три-O-ацетил-2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(1H-тетразол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-36)
1H ЯМР (300 МГц, CDCl3): δ 1.05 (д, J=6.9 Гц, 6H, изобутирамидо-2СН3), 2.01 (с, 3H, ОАс), 2.05 (с, 6Н, 2OAc), 2.34 (м, 1H изобутирамидо-СН), 3.81 (с, 3H, СООСН3), 4.01 (м, 1Н, Н-5), 4.18 (дд, J=12.5, 6.3 Гц, 1Н, Н-9), 4.60 (дд, J=12.6, 2.6 Гц, 1H, Н-9'), 5.03 (дд, J=10.5, 1.7 Гц, 1Н, Н-6), 5.32 (тд, J=6.1, 2.5 Гц, 1Н, Н-8), 5.46 (дд, J=5.9, 1.8 Гц, 1H, Н-7), 6.03 (д, J=2.4 Гц, 1Н, Н-3), 6.14 (дд, J=9.8, 2.5 Гц, 1Н, Н-4), 6.94 (д, J=8.1 Гц, 1H, NH), 8.65 (с, 1H тетразол-СН); 13Н ЯМР (75 МГц, CDCl3): δ 18.85, 19.27 (изобутирамидо-2СН3), 20.66, 20.84 (3 ОСОСН3), 35.56 (изобутирамидо-СН), 49.69 (С-5), 52.79 (СООСН3), 55.77 (С-4), 61.91 (С-9), 67.49 (С-7), 70.51 (С-8), 75.64 (С-6), 105.15 (С-3), 140.81 (тетразол-С5), 146.70 (С-2), 161.18 (СООСН3), 170.04, 170.15, 170.58 (3 ОСОСН3), 178.53 (изобутирамидо-СО); LRMS [C21H29N5O10] (m/z): (режим регистрации положительно заряженных ионов) 534,3 [M+Na]+ ; HRMS (API) (m/z): [M+Na]+ рассчитано для C21H29N5NaO10 [M+Na]+ 534,180663; найдено 543,1788531.
Натрий 2,6-ангидро-3,4,5-тридезокси-5-изобутирамидо-4-(1H-тетразол-1-ил)-D-глицеро-D-галакто-нон-2-енонат (IE889-42)
1H ЯМР (300 МГц, D2O): δ 0.99-1.04 (м, 6Н, изобутирамидо-2СН3), 2.46 (м, 1Н, изобутирамидо-СН), 3.59-3.75 (м, 2Н, Н-7, Н-9), 3.93 (дд, J=12.0, 2.6 Гц, 1H, Н-9'), 4.03 (ддд, J=9.7, 6.2, 2.6 Гц, 1Н, Н-8), 4.49 (дд, J=10.9, 9.7 Гц, 1Н, Н-5), 4.65 (дд, J=10.9, 1.2 Гц, 1Н, Н-6), 5.76 (дд, J=9.7, 2.3 Гц, 1Н, Н-4), 5.88 (д, J=2.2 Гц, 1Н, Н-3), 9.38 (с, 1Н, тетразол-СН); LRMS [C14H20N5NaO7] (m/z): (режим регистрации положительно заряженных ионов) 416,0 [M+Na]+; HRMS (API) (m/z): [M+Na]+ рассчитано для C14H20N5Na2O7 [M+Na]+ 416,115264; найдено 416,116886.
Биология Клетки и вирус:
Клетки А549 (базальные эпителиальные клетки аденокарциномы альвеол человека) получали из Европейской коллекцией клеточных культур (European Collection of Cell Cultures) (86012804-1VL, Sigma Aldrich). Клетки размножали в модифицированной по способу Дульбекко среде Игла (Dulbecco's Modified Eagle Medium, DMEM), дополненной 1% глутамином (200 мМ) и 5% фетальной бычьей сывороткой. Во время процедур инфицирования и процедур, проводимых после инфицирования, клетки А549 поддерживали в среде DMEM, дополненной только 1% глутамином. Нормальные человеческие эпителиальные бронхиальные/трахеальные клетки (NHBE) (СС-2540, партия 313831, Lonza) амплифицировали в ростовой среде В-ALI™ (Lonza) и эту же среду использовали для исследований, проводимых во время и после инфицирования. Клетки LLC-MK2 (клетки почек макак резус, АТСС CCL-7) культивировали в минимальной эссенциальной среде Игла (Eagle's minimal essential medium, ЕМЕМ) (Lonza), дополненной 1% глутамином (200 мМ) и инактивированной нагреванием 2% фетальной бычьей сывороткой. При инкубации во время и после инфицирования hPIV-3 клетки LLC-MK2 поддерживали в среде ЕМЕМ, дополненной 1% глутамином. Все клеточные линии инкубировали при 37°C в увлажненной атмосфере 5% СО2.
hPIV-3 (штамм С-243) получали из Американской коллекции типовых культур (American Type Culture Collection, АТСС, Manassas, VA). Вирус размножали в клетках LLC-MK2 в среде ЕМЕМ, дополненной глутамином (EMEMinf), при 35°C в увлажненной атмосфере 5% СО2. Содержащие вирус супернатанты культур собирали через 3-4 дня после инфицирования, осуществляя при этом мониторинг цитопатических эффектов, и отделяли от клеточного дебриса путем центрифугирования (в течение 15 мин при относительном центробежном ускорении (RCF) 3000 g). Вирус концентрировали по меньшей мере 10 раз с помощью устройства для ультрафильтрации Amicon Ultra filter unit (30 kDa, Millipore, Billerica, MA) для использования в анализах задержки гемагглютинации (Haemagglutination Inhibition, HI). В анализах ингибирования нейраминидазы (NI) и экспериментах STD-ЯМР использовали вирус, который осаждали полиэтиленгликолем (PEG), а затем очищали, как описано выше.
Осветленный супернатант hPIV-З смешивали с PEG6000 (конечная концентрация 8%) и NaCl (конечная концентрация 0,4М), затем инкубировали в течение ночи при 4°C при легком перемешивании. Комплекс PEG6000/hPIV-3 осаждали центрифугированием при RCF 3000 g в течение 30 мин при 4°C. Супернатант удаляли, и буфер GNTE (200 мМ глицина, 200 мМ NaCl, 20 мМ Tris-HCl, 2 мМ EDTA, рН 7,4) в объеме, соответствующем по меньшей мере 1:40 объема исходной вирусной суспензии, использовали для ресуспендирования осадка в течение ночи при 4°C. Вирусную суспензию гомогенизировали путем перемешивания в пипетке с последующим механическим разрушением оставшихся вирусных агрегатов с использованием гомогенизатора Даунса с плотно-прилегающим пестиком. Гомогенат hPIV-3 наносили поверх нелинейного градиента сахарозы 30%-60%, приготовленного в буфере GNTE, и центрифугировали при RCF 100000 g в течение 2 ч 30 мин при 4°C без торможения. Вирус концентрировали в градиенте сахарозы 30%-60%, а затем собирали и хранили при -80°C для анализов ингибирования нейраминидазы (NI) или при 4°C для экспериментов STD-ЯМР.
Ингибиторы hPIV-3 ΗΝ: Соединения 2, 3, 5-10, каждое, получали в виде лиофилизированного порошка, а затем солюбилизировали в стерильной воде с образованием 10 мМ базового раствора. Растворы подвергали действию ультразвука в течение 15 мин для обеспечения полного растворения, а затем стерилизовали посредством фильтрации. Базовый раствор хранили в стеклянных колбах при -20°C и разбавляли в соответствующем буфере непосредственно перед использованием. Для экспериментов STD ЯМР базовые растворы готовили в D2O при 100 мМ. Растворы обрабатывали и хранили, как описано выше.
Экспрессия и очистка рекомбинантного ΗΝ: Белок ΗΝ экспрессировали с использованием экспрессионной системы на основе бакуловируса Bac-to-Bac® (Invitrogen, Carlsbad, СА) с использованием значительно модифицированной процедуры, описанной в литературе. Так, нуклеотидную последовательность для сигнального пептида мелиттина, выделенного из пчелиного яда (НВМ), добавляли ниже (в положении даунстрим) последовательности, кодирующей эктодомен HN (аминокислоты с 125 по 572). Эта последовательность (HBM+HN) была кодон-оптимизирована для экспрессии в клетках Spodoptera frugiperda (Sf9) и заказана напрямую через службу синтеза генов DNA2.0 (DNA2.0, Menlo Park, СА) в виде гена под названием HBM-HNhPIV-3opt. HBM-HNhPIV-3opt амплифицировали с помощью PCR и лигировали в вектор pFastBac/CT-TOPO®, обеспечивая дополнительную С-концевую 6-гистидиновую метку (His-Tag) для очистки и детекции.
Генерирование и амплификацию рекомбинантного бакуловируса, содержащего HBM-HNhPIV-3opt, выполняли в соответствии с инструкциями изготовителя. Клетки Sf9 (Invitrogen), культивированные в безбелковой среде Insect-XPRESS (Lonza) для культивирования клеток насекомых, инфицировали бакуловирусом HBM-HNhPIV-3opt с высокой множественностью заражения (MOI). Через четыре дня после инфицирования собирали супернатант, содержащий рекомбинантный HN, с получением самой высокой экспрессии белка. Супернатант осветляли путем центрифугирования (RCF 3000 g в течение 15 мин) для удаления клеточного дебриса, а затем очищали на колонке HisTrap excel 5 мл (GE Healthcare life sciences, Buckinghamshire, England), следуя протоколу изготовителя. Рекомбинантный ΗΝ элюировали 500 мМ раствором имидазола и собранные фракции оценивали с помощью анализа активности нейраминидазы (ΝΑ) (смотри ниже). Наиболее активные фракции объединяли и концентрировали с использованием устройства для ультрафильтрации Amicon Ultra filter unit (10 kDa, Millipore) до конечного объема 800 мкл. Дополнительную стадию очистки выполняли с использовали жидкостной экспресс-хроматографии белков (Amersham Biosciences) на колонке для гель-фильтрации Superdex 75 (GE Healthcare) при 4°C, и фракции объемом 1 мл собирали с помощью коллектора фракций Frac-920. Содержащие белок фракции, по данным мониторинга коллекции фракций при 280 нм, оценивали в анализе NA, а также подвергали SDS-PAGE. Очищенный и концентрированный рекомбинантный белок HN хранили при 4°C.
Анализ ингибирования гемагглютинации: Ингибиторы HN оценивали в двух повторах на 96-луночном планшете с U-образным дном. Соединения разбавляли PBS в виде раствора 4Х для каждой тестируемой концентрации (25 мкл/лунка, конечная концентрация IX). Каждое разведение смешивали с 4 гемагглютинирующими единицами (HAU) hPIV-3 (25 мкл/лунка, конечная концентрация 1 HAU) и инкубировали в течение 20 мин при комнатной температуре. Планшет переносили на лед и в каждую лунку добавляли эквивалентный объем (50 мкл) охлажденных на льду 0,75% эритроцитов морских свинок (Gp-RBC) или 1% человеческих эритроцитов (h-RBC). Затем планшет инкубировали в течение 1 ч 30 мин при 4°C перед считыванием степени гемагглютинации. Значение IC50 HI определяется как концентрация ингибитора, которая снижает активность гемагглютинина (агглютинацию) на 50% по сравнению с не подвергнутой обработке вирусной суспензией.
Анализ ингибирования нейраминидазы
Очищенный hPIV-3, ингибиторы и MUN готовили и разбавляли в реакционном буфере для проведения анализа нейраминидазы (NA Reaction Buffer) (50 мМ NaOAc, 5 мМ CaCl2, рН 4,6). Сначала измеряли NA с использованием различных разведений hPIV-3 для определения самой низкой концентрации вируса, подлежащей использованию в анализах. Анализы NA выполняли с очищенным в достаточной степени вирусом для получения максимального флуоресцентного сигнала, который по меньшей мере в 5 раз превышал фоновый сигнал для того, чтобы результаты эксперимента считались статистически значимыми. Анализы ингибирования нейраминидазы (NI) выполняли в трех повторах. Для каждой тестируемой концентрации в каждую лунку добавляли 2 мкл очищенного hPIV-3 и 4 мкл 2,5Х раствора ингибитора (конечная концентрация 1X). Планшет выдерживали при комнатной температуре в течение 20 мин перед добавлением в каждую лунку 4 мкл 5 мМ 2'-(4-метилумбеллиферил)-α-D-N-ацетилнейраминида (MUN) (конечная концентрация 2 мМ), и затем планшет инкубировали при 37°C в течение 30 мин при перемешивании (1000 об/мин). Ферментативную реакцию останавливали путем добавления в каждую лунку 190 мкл глицинового буфера (0,25М глицин, рН 10,4). Отрицательный контроль включали путем добавления MUN в вирус, а затем ферментативную реакцию останавливали при t=0. Относительную флуоресценцию (RF) измеряли с помощью ридера Victor 3 Multilabel Reader (PerkinElmer, Waltham, MA). Данные обрабатывали путем вычитания фона (отрицательный контроль RF) и затем анализировали с помощью программного обеспечения GraphPadPrism 4 (GraphPad Software Inc., La Jolla, СА) для расчета значений IC50 (нелинейная регрессия (аппроксимирующая кривая), эффект дозы - ингибирование, 3-параметрическая логистическая модель). Концентрация ингибитора, которая понижала активность нейраминидазы (относительная флуоресценция) на 50% по сравнению с необработанной вирусной суспензией, определялась как значение IC50NI. Значения Ki ингибиторов 6 и 10 определяли с помощью экспериментов по ферментативной кинетике с использованием цельного вируса hPIV-3 на основе ранее опубликованных процедур. Таким образом, активность нейраминидазы измеряли каждые 5 мин в течение периода 20 мин при пяти концентрациях субстрата [S]: 2, 4, 8, 10 и 16 мМ, и четырех концентрациях ингибиторов [I]: 0, 0,5, 2,5 и 5 мкМ для 10 или 0, 10, 20 и 60 мкМ для 6. Все анализы выполняли в трех повторах, и конечные данные подгоняли к уравнению Михаэлиса-Ментена для конкурентного ингибирования с использованием программного обеспечения GraphPadPrism 4 (GraphPad Software Inc., La Jolla, СА) для определения константы Михаэлиса-Ментена (Km) с использованием данных из экспериментов [I] = 0 мкМ и переменной концентрации субстрата [S], и значений Ki.
Анализ ингибирования роста вирусов: Перед оценкой лучших ингибиторов в клеточных анализах выполняли МТТ анализ для оценки цитотоксичности соединений. Цитотоксического эффекта не наблюдалось после инкубации в течение 48 ч клеток LLC-MK2 с 6, 8 и 10 при 303 мкМ, самой высокой тестируемой концентрации. Ингибирование роста вирусов оценивали с использованием анализа бляшкообразования («focus-forming assay») путем титрования потомства в присутствии 2 мкМ 6, 8 и 10 в среде EMEMinf из инфицированного при низкой величине MOI конфлюэнтного монослоя LLC-MK2 в планшете 48-луночного формата. Инокулят вируса (100 FFU/лунка) предварительно инкубировали с 6, 8 и 10 в течение 20 мин. Инфицирование выполняли в двух повторах и инкубацию продолжали в течение 1 ч при 37°C при легком перемешивании каждые 15 мин. Инокулят удаляли и заменяли соответствующим разведением соединения при концентрации 2 мкМ в объеме 500 мкл/лунку каждого (в среде EMEMinf).
Положительный контроль инфицирования включали с использованием тех же самых условий за исключением соединения. Вирусную пролиферацию на инфицированных клеточных монослоях поддерживали в течение 48 ч при 37°C, 5% СО2. Супернатанты культур из сдвоенных лунок собирали, объединяли и осветляли при RCF 15000 g в течение 10 мин и хранили при -80°C. Супернатанты разбавляли в среде EMEMinf с разведением 10-3, 10-4 и 10-5 для того, чтобы избежать эффекта какого-либо оставшегося соединения на последующее титрование вируса. Титрования вирусов выполняли в двух повторах с использованием ранее описанных условий для вирусной инфекции. Через 1 ч Avicel (FMC BioPolymer, Philadelphia, РА) в среде EMEMinf напрямую добавляли в инокулят (конечная концентрация 1%) для ограничения и локализации вирусной пролиферации. Планшет инкубировали в течение 36-40 ч при 37°C, 5% СО2 для обеспечения бляшкообразования. Avicel осторожно удаляли и заменяли на смесь 3,7% параформальдегид/PBS, а затем планшет выдерживали в течение 15 мин при комнатной температуре для инактивации вирусов и фиксации клеток. Клеточные монослои промывали три раза по 5 мин PBS, а затем эндогенную пероксидазу инактивировали смесью 0,3% H2O2/PBS в течение 30 мин при 37 °C. Планшет снова промывали три раза по 5 мин PBS и инкубировали с мышиным моноклональным IgG анти-hPIV-3 HN (Fitzgerald, клон М02122321, 2,0 мг/мл) при 1 мкг/мл в смеси 5% молоко/PBS в течение 1 ч при 37°C. Клеточные монослои промывали 3 раза по 5 мин смесью 0,02% Tween20/PBS. В каждую лунку добавляли конъюгат козьего анти-мышиного-IgG(H+L)-HRP (BioRad, ref# 170-6516) в разведении 1:1000 в смеси 5% молоко/PBS и инкубировали в течение 1 ч при 37°C. Клеточные монослои промывали, как описано ранее, смесью 0,02% Tween20/PBS, а затем дважды споласкивали PBS. Очаги выявляли путем добавления раствора TrueBlue (субстрат HRP) на каждую лунку и инкубации планшета в течение 1 ч при 37°C. Раствор TrueBlue удаляли и планшет дважды споласкивали водой, затем сушили перед сканированием (фигура 2) и подсчетом очагов. Значение IC50 определялось как концентрация ингибитора, которая снижала титр вирусного потомства на 50% по сравнению с необработанным инфицированным монослоем LLC-MK2.
In situ ELISA: Анализ in situ ELISA представляет собой полезную методику для оценки ингибирования роста вирусов. Этот метод позволяет измерить за одну стадию уровень экспрессии HN hPIV-3 на клеточной поверхности инфицированного клеточного монослоя. Уровень экспрессии напрямую коррелирует со способностью неиммобилизованного вируса инфицировать и повторно инфицировать клетки-мишени. Инфицирование выполняли на конфлюэнтном монослое клеток, засеянных в 96-луночный планшет. Вирус (40 FFU/лунка) предварительно инкубировали в течение 20 мин с соединением 6 и 10 при конечной концентрации от 1000 мкМ до 0,001 мкМ в виде серий 10-кратных разведений. Инфицирование выполняли в трех повторах и инкубацию продолжали в течение 1 ч при 37°C при легком перемешивании каждые 15 мин. Инокулят удаляли и заменяли 200 мкл/лунку каждого соответствующего разведения соединения. Положительный контроль инфицирования включали путем использования идентичных экспериментальных условий за исключением ингибитора. Инфицированные монослои клеток выдерживали в течение 36-40 ч при 37°C, 5% СО2 для пролиферации вируса. Вирус инактивировали, и клетки фиксировали путем прямого добавления 100 мкл смеси 11,1% параформальдегид/PBS. Планшет выдерживали при комнатной температуре в течение 15 мин, после чего промывали 3 раза по 5 мин PBS, а затем эндогенные пероксидазы инактивировали путем обработки смесью 0,3% H2O2/PBS в течение 30 мин при 37°C. Клеточные монослои промывали и инкубировали с мышиным моноклональным IgG анти-hPIV-3HN (Fitzgerald, клон М02122321, 2,0 мг/мл) при 1 мкг/мл в смеси 5% молоко/PBS в течение 1 ч при 37°C. Лунки промывали 3 раза по 5 мин смесью 0,02% Tween20/PBS. Конъюгат козьего антимышиного IgG(H+L)-HRP (BioRad, ref# 170-6516) в разведении 1:2000 в смеси 5% молоко/PBS добавляли в каждую лунку и инкубировали в течение 1 ч при 37°C. Клеточные монослои промывали смесью 0,02% Tween20/PBS, а затем дважды споласкивали PBS. В каждую лунку добавляли субстрат BD OptEIATMB (BD Biosciences, San Jose, СА, 100 мкл) и затем планшет инкубировали при 37°C. Через 3-5 мин ферментативную реакцию останавливали путем добавления 50 мкл на лунку 0,6М H2SO4. Исходные данные получали путем считывания поглощения (OD) каждой лунки при 450 нм в течение 0,1 сек с помощью ридера Victor 3 multilabel reader (PerkinElmer, Waltham, MA). Конечные значения OD получали путем вычитания OD отрицательного контроля (неинфицированных клеток) из начальных значений считывания OD и данные анализировали с помощью программного обеспечения GraphPadPrism4 (GraphPad Software Inc., La Jolla, СА) для расчета значений IC50 (нелинейная регрессия (аппроксимирующая кривая), эффект дозы - ингибирование, 4 - параметрическая логистическая модель). Значение IC50 определяли как концентрацию ингибитора, которая снижала поглощение при 450 нм на 50% по сравнению с необработанным инфицированным клеточным монослоем.
Соединения согласно настоящему изобретению могут быть тестированы в анализе ингибирования hPIV-3 на хорошо дифференцированных эпителиальных клетках дыхательных путей (НАЕ) человека с использованием опубликованной модели. Вкратце, процедура тестирования представляет собой следующую: Человеческие эпителиальные клетки дыхательных путей (НАЕ) выделяли, культивировали и дифференцировали, как описано ранее ( et al., 2013). Вкратце, человеческие клетки назального эпителия выделяли, размножали и высевали на покрытые коллагеном подложки с проницаемыми мембранами. После достижения клетками конфлюэнтности апикальную среду удаляли, и клетки поддерживали на поверхности раздела воздух-жидкость в течение приблизительно 4-6 недель для обеспечения дифференцировки эпителиальных клеток. Культуры, содержащие реснитчатые клетки, инокулировали через люминальную поверхность 5000 бляшкообразующих единиц hPIV-3 на лунку в течение 1 часа. Тестируемые соединения формулы (I), (II), (III) и (IIIа) при различных концентрациях добавляли в базолатеральную среду сразу же после инфицирования клеток вирусом. Уменьшение вирусной нагрузки оценивали через 1, 3 и 6 дней после инфицирования путем титрования вируса с использованием анализа бляшкообразования или. in situ ELISA в клетках А549 или LLC-MK2, как описано ранее (Guillon et al., 2014). Можно произвести сравнение этих результатов с референсным соединением предшествующего уровня техники, таким как соединение ВСХ, включая BCX-2855, для получения показателя относительной активности (Guillon, P., Dirr, L., El-Deeb, I.M., Winger, Μ., Bailly, В., Haselhorst, Т., Dyason, J.C., and von Itzstein, M. (2014). Structure-guided discovery of potent and dual-acting human parainfluenza virus haemagglutinin-neuraminidase inhibitors. Nat. Commun. 5.; and
et al., 2013). Вкратце, человеческие клетки назального эпителия выделяли, размножали и высевали на покрытые коллагеном подложки с проницаемыми мембранами. После достижения клетками конфлюэнтности апикальную среду удаляли, и клетки поддерживали на поверхности раздела воздух-жидкость в течение приблизительно 4-6 недель для обеспечения дифференцировки эпителиальных клеток. Культуры, содержащие реснитчатые клетки, инокулировали через люминальную поверхность 5000 бляшкообразующих единиц hPIV-3 на лунку в течение 1 часа. Тестируемые соединения формулы (I), (II), (III) и (IIIа) при различных концентрациях добавляли в базолатеральную среду сразу же после инфицирования клеток вирусом. Уменьшение вирусной нагрузки оценивали через 1, 3 и 6 дней после инфицирования путем титрования вируса с использованием анализа бляшкообразования или. in situ ELISA в клетках А549 или LLC-MK2, как описано ранее (Guillon et al., 2014). Можно произвести сравнение этих результатов с референсным соединением предшествующего уровня техники, таким как соединение ВСХ, включая BCX-2855, для получения показателя относительной активности (Guillon, P., Dirr, L., El-Deeb, I.M., Winger, Μ., Bailly, В., Haselhorst, Т., Dyason, J.C., and von Itzstein, M. (2014). Structure-guided discovery of potent and dual-acting human parainfluenza virus haemagglutinin-neuraminidase inhibitors. Nat. Commun. 5.; and  , L., Brighton, L.E., Carson, J.L., Fischer, W.A., and Jaspers, I. (2013). Culturing of Human Nasal Epithelial Cells at Air Liquid Interface. J. Vis. Exp.).
, L., Brighton, L.E., Carson, J.L., Fischer, W.A., and Jaspers, I. (2013). Culturing of Human Nasal Epithelial Cells at Air Liquid Interface. J. Vis. Exp.).
Результаты
Проводили сравнение активности синтезированных С4-модифицированных производных Neu5Ac2en против hPiV-3 ΗΝ и для удобства значения IC50 разделяли на две группы на основе ацетиламиногруппы, присутствующей при С5. Ингибиторы группы 1 имели С5 ацетамидо функциональную группу, а ингибиторы группы 2 имели С5 изобутирамидо функциональную группу (фигура 3 и фигура 4А-С). Эталонный и хорошо охарактеризованный ингибитор нейраминидазы широкого спектра Neu5Ac2en (2) показал самое слабое ингибирование со значениями IC50, равными 1565 мкМ и 1438 мкМ, соответственно, для NI и HI hPIV-3 ΗΝ. Ингибирование, наблюдаемое для 3, С5 ацетамидо аналога ВСХ 2798 (6), улучшилось по сравнению с 2, хотя все еще находилось в высоком микромолекулярном диапазоне со значениями IC50, равными 138 мкМ и 210 мкМ, соответственно, для NI и HI hPIV-3 ΗΝ. Эти значения IC50 были сходными со значениями, наблюдаемыми для нового ингибитора 7, С4 метоксиметил-функционализированного триазольного производного Neu5Ac2en, при этом экспериментально определенные значения IC50 составили 154 мкМ и 313 мкМ, соответственно, для NI и HI hPIV-3 ΗΝ. Значительное улучшение активности наблюдалось при замене С4-метоксиметильного фрагмента триазола (7) на более объемную фенильную группу (8). Значения IC50 для 8 составили 6,5 мкМ и 4,6 мкМ, соответственно, для NI и HI hPIV-3 ΗΝ. Данные приведены в обобщенном виде в таблице 2.
Во второй группе ингибиторов, которые содержали С5 изобутирамидо функциональную группу, наблюдалось, что аффинность каждого ингибитора улучшилась по сравнению с его С5 ацетамидо аналогом. Порядок активности, что не являлось неожиданным, был идентичным в пределах одной группы. Таким образом, самое слабое ингибирование было обнаружено для 5, С5 изобутирамидо аналога Neu5Ac2en, со значениями IC50, равными 188 мкМ и 358 мкМ для NI и HI, соответственно, и значения IC50, равные 21,5 мкМ и 16,1 мкМ для NI и HI, соответственно, были определены для референсного ингибитора hPIV ВСХ 2798 (6). Ингибитор 9, со сравнительно малым метоксиметильным заместителем на триазольном кольце, имел значения IC50, близкие к значениям, определенным для С4 азидо аналога 6 (IC50 = 14,2 мкМ и 13,8 мкМ, соответственно, для NI и HI). Аналогично наблюдаемому в группе 1 ингибиторов, содержащих С5 ацетамидо, увеличение размера заместителя из метоксиметильной группы в ингибиторе 9 до более объемного фенильного фрагмента, как в ингибиторе 10, привело к значительному улучшению активности со значениями IC50, равными 2,7 мкМ и 1,5 мкМ, соответственно, для NI и HI. Примечательно, что улучшение значений IC50 HI наблюдалось при использовании человеческих эритроцитов вместо эритроцитов морских свинок (фигура 2). Это улучшение вероятнее всего отражает различия в содержании сиаловой кислоты и/или презентации связей между эритроцитами человека и морских свинок. Например, хорошо известно, что человеческие ткани и клетки, включая эритроциты, экспрессируют только рецепторы гликоконъюгаты, содержащие N-ацетилнейраминовую кислоту, тогда как другие животные экспрессируют также рецепторы на основе N-гликолилнейраминовой кислоты. Тем не менее, независимо от используемых специфических эритроцитов, разработанный авторами настоящего изобретения ингибитор 10 обладал значительно более высокой активностью по сравнению с эталонным соединением 6. Значение Km для MUN составило 5,1 мМ, и значения Ki составили 1,3 мкМ и 16 мкМ, соответственно, для ингибитора 10 и 6.
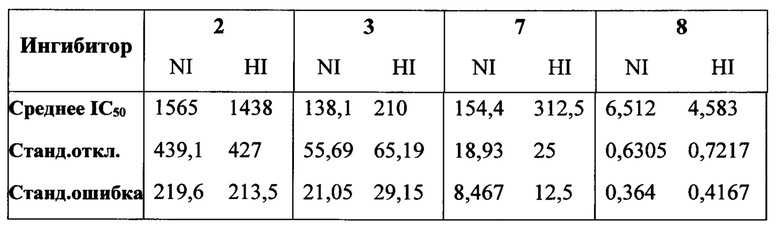
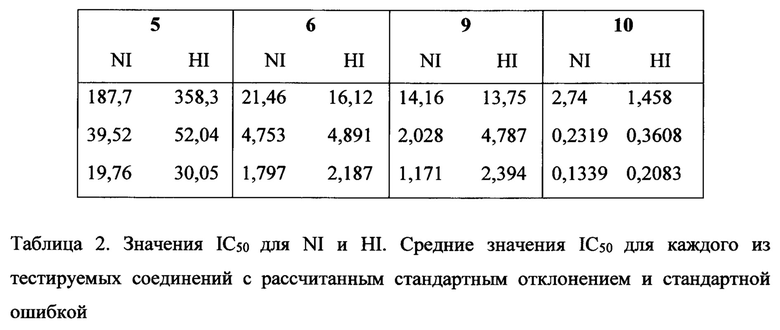
Клеточные анализы
После начального ферментативного скрининга наиболее активный ингибитор 10 и референсный ингибитор hPIV (ВСХ 2798, 6) оценивали в анализе ингибирования роста для сравнения их способности ингибировать инфекцию, вызванную вирусом hPIV-3, и распространение в клетках LLC-MK2 (фигура 5А и В). Соединение 6 выбирали в качестве референсного ингибитора, поскольку он является самым охарактеризованным ингибитором hPIV-3 на основе Neu5Ac2en и обладает приемлемой активностью in vitro против вируса hPIV-3. В начальном анализе при концентрации ингибитора, равной 2 мкМ, вирус размножали в течение 48 ч в присутствии 6 или 10, и определяли титры вируса. При этой концентрации ингибитора рассчитанное уменьшение титра вируса с помощью 6 и 10 составило, соответственно, 14% и 94% (фигура 5В). Затем определяли значения IC50 для ингибирования роста вируса для двух ингибиторов в общепринятом методе in situ ELISA с использованием трех различных клеточных линий. Выбирали клеточную линию LLC-MK2 (почечные клетки макак-резус), поскольку ее широко используют в клеточных исследованиях инфекций, вызванных вирусом hPIV-3, а также линии клеток дыхательных путей А549 человека, чувствительные к вирусу hPIV-3 (эпителиальные клетки аденокарциномы легких), и нормальные первичные клетки человеческого эпителия бронхов (NHBE) для изучения ингибирования роста вирусов в клетках, относящихся к естественной ткани. Сам по себе способ обладает полезными преимуществами перед методом титрования вируса, поскольку является более быстрым, выполняемым за одну стадию, несубъективным методом, который приводит в соответствие рост неммобилизованного вируса к уровням экспрессии HN в монослое клеток, инфицированном при низкой множественности инфекции (MOI). Примечательно, что немного более низкие значения IC50 для ингибирования роста вируса были определены для 10 и 6 при использовании полученной в лаборатории клеточной линией LLC-MK2 по сравнению с человеческими клеточными линиями. В целом, такая же тенденция наблюдалась для всех трех клеточных линий, в отношении которых был обнаружен значительно более сильный противовирусный эффект ингибитора 10 (IC50=2,1-13,9 мкМ) по сравнению с ингибитором 6 (IC50=54,6-130,6 мкМ) (фигура 6).
Структурная биология
Подготовка образцов и эксперименты 1Н ЯМР: Все эксперименты ЯМР проводили на ЯМР-спектрометре Bruker 600 МГц с 5 мм датчиком TXI-геометрии с XYZ-градиентами. Суспензию интактного вируса или рекомбинантного hPIV-3 ΗΝ подвергали замене буфера 50 мМ дейтерированным ацетатом натрия, 5 мМ CaCl2 в D2O при рН 4,6 путем ультрафильтрации с использованием устройства Amicon Filter Unit (Millipore) с порогом отсечения 30 кДа или 10 кДа, соответственно. Для каждого эксперимента использовали 20 мкМ белка hPIV-3 ΗΝ и молярное соотношение белокглиганд 1:100 в конечном объеме 200 мкл.
1H ЯМР-спектры регистрировали, проводя 32 сканирования при 283К, с задержкой релаксации («relaxation delay») 2 сек по ширине спектра 6000 Гц. Благодаря более безопасному и простому обращению с белком по сравнению с вирусом и для обеспечения одинаковой концентрации белка в каждом эксперименте, начальный эксперимент STD ЯМР проводили для соединения 10 в комплексе с интактным вирусом hPIV-3, тогда как все последующие эксперименты проводили с использованием рекомбинантного белка HN.
Эксперименты по разностной ЯМР-спектроскопии на переносе насыщения (Saturation Transfer Difference (STD) NMR): Белок насыщали в условиях on-резонанса при -1,0 ppm и off-резонанса при 300 ppm с каскадом из 60 селективных импульсов Гаусса продолжительностью по 50 мс, что привело к общему времени насыщения 3 сек, и задержка релаксации была установлена равной 4 сек. В каждом эксперименте STD ЯМР проводили всего 1056 сканирований (рекомбинантный hPIV-3 ΗΝ) или 1512 сканирований (интактный вирус) и последовательность WATERGATE использовали для подавления остаточного сигнала HDO. Для подавления фонового сигнала белка применяли фильтр спин-блокировки («Spin-lock filter») при частоте 5 кГц и продолжительности 10 мс. Контрольные эксперименты STD ЯМР выполняли при идентичных экспериментальных установочных параметрах и такой же концентрации лиганда, но при отсутствии белка. Спектры в условиях on- и off-резонанса хранили и обрабатывали отдельно и конечные спектры STD ЯМР получали путем вычитания спектра в условиях оп-резонанса из спектра в условиях off-резонанса. Все STD эффекты количественно оценивали с использованием уравнения ASTD=(I0-Isat)/I0=ISTD/I0. Таким образом, интенсивности сигналов STD ЯМР-спектров (ISTD) сравнивали с соответствующими интенсивностями сигналов референсного спектра (Ι0). Самый сильный STD-сигнал в спектре принимали за 100%, и использовали в качестве эталона для расчета относительных эффектов STD соответствующим образом.
Эксперименты по разностной ЯМР-спектроскопии на переносе насыщения проводили на соединении 8 в комплексе с рекомбинантно-экспрессируемым hPIV-3 ΗΝ (фигура 7) и на наиболее сильном ингибиторе 10 в комлексе с рекомбинантно-экспрессируемым hPIV-3 ΗΝ (фигура 8) или инактным вирусом hPIV-3 (фигура 9) для дополнительного подтверждения компьютерных и биологических исследований, которые продемонстрировали специфическое связывание и ингибирование.
Интенсивности сигналов STD ЯМР для всех протонов, связанных с 8 или 10, отчетливо наблюдались в различной степени, когда ингибитор находился в комплексе с интактным вирусом или рекомбинантным hPIV-3 ΗΝ, и наглядно показали, что лиганд связывается в обоих случаях. Незначительные сигналы, наблюдаемые при 3,25, 3,5 и 4,0 ppm на 1H ЯМР-спектре 10, снятом в присутствии частиц интактного вируса, относились к примесям, образовавшимся в процессе очистки вируса, и не принадлежали ни вирусным частицам, ни 10. Как и ожидалось, ни один из этих сигналов не наблюдался на спектрах STD ЯМР и наглядно показано, что примеси не связываются с вирусом (фигура 9). Эти эксперименты наглядно показывают специфическое связывание 10 с интактным вирусом hPIV-3 и hPIV-3 ΗΝ, дополнительно подтверждая биологическую пользу и потенциал ингибитора.
Важно, что наложение сигналов протонов ароматического фенила, наблюдаемых при 7,1-7,7 ppm на STD ЯМР-спектре для обоих, интактного вируса и рекомбинантного белка ΗΝ, также свидетельствует о том, что связывающийся эпитоп ингибитора 10 является сходным или даже идентичным при связывании с интактным вирусом hPIV-3 или рекомбинантным белком hPIV-3 ΗΝ (фигура 10).
Картирование эпитопа ингибитора 10
Полный лиганд-связывающий эпитоп определяли с помощью анализа STD ЯМР-спектра (фигура 8) белка hPIV-3 ΗΝ в комплексе с 10. Все STD ЯМР-сигналы 10 нормализовали относительно наиболее сильного наблюдаемого STD ЯМР-сигнала, протона Н4' ингибитора при 7,18 ppm. Затем рассчитывали относительные эффекты STD ЯМР для всех протонов ингибитора (таблица 2). Степень интенсивности STD ЯМР-сигнала сильно зависит от близости протона к поверхности белка и показывает, как разработанный ингибитор 10 взаимодействует с участком связывания белка ΗΝ.
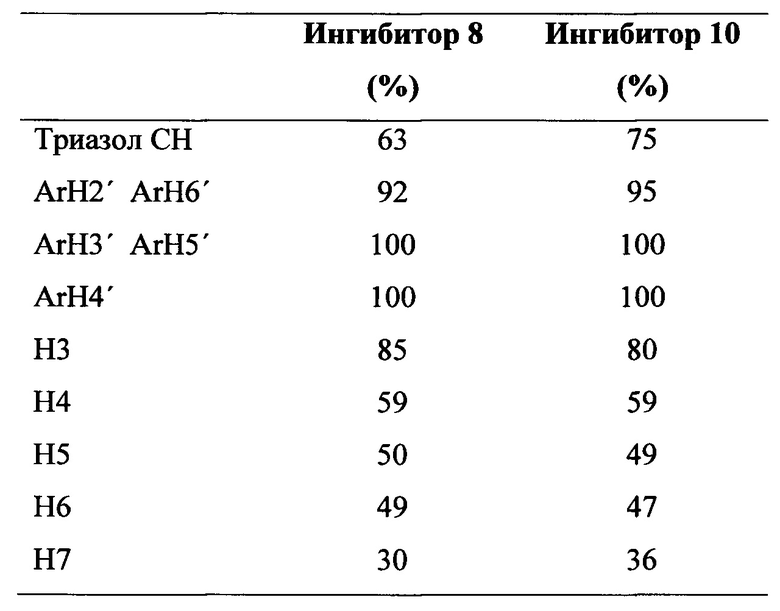

В частности, очень сильные относительные эффекты STD ЯМР наблюдались для протонов фенильной группы Η2', Η3', Н4', Н5'и Н6' в интервале между 7,1 ppm и 7,6 ppm, наглядно свидетельствуя о тесном контакте молекулы с белковой поверхностью в этой области. Кроме того, значительный STD ЯМР-эффект был также обнаружен для СН триазольного фрагмента. Напротив, протоны С5-изобутирамидо фрагмента ингибитора показали меньший эффект (относительные интенсивности STD ЯМР-сигнала в диапазоне 42-54%).
Протоны, связанные с структурой остова Neu5Ac2en 10, показали переменные относительные эффекты STD ЯМР. Значительная относительная интенсивность (80%) STD ЯМР-сигнала Н3 свидетельствует о сильном взаимодействии этой части молекулы с hPIV-3 ΗΝ. Кроме того, относительные интенсивности STD ЯМР-сигналов для Н4, Н5 и Н6, составляющие, соответственно, 59%, 50% и 49%, демонстрируют, что протоны кольца структуры остова Neu5Ac2en также вовлечены в связывание ингибитора с белком.
И наконец, более слабые относительные эффекты STD ЯМР, составляющие 36%, 35%, 24% и 21%, наблюдались, соответственно, для протонов Н7, Н8, Н9 и Н9' боковой цепи глицерола, позволяя предположить, что боковая цепь глицерола вносит меньший вклад в событие связывания ингибитора по сравнению с С4 триазоло функциональной группой и кольцевой структурой ингибитора (фигура 8). Карта эпитопа ингибитора 8 (фигура 7) для всех намерений и целей была идентична карте эпитопа ингибитора 10, при этом С4 триазоло фрагмент находился в тесном контакте с белковой поверхностью.
Дифтор-аналоги
Соединения могут включать дифторированные соединения, и тестирование выполняли на выбранных членах этого класса (I-170, I-179 и I-104, показанные ниже). Мишенью таких соединений является гемагглютинин-нейраминидаза hPIV-3 и hPIV-1. Получали сокристаллическую структуру hPIV-3 ΗΝ в комплексе с Ι-Ι70. Все представленные ниже соединения тестировали (i) в ферментных анализах NI против hPIV-3 (а также 170 против hPIV-1); (ii) в клеточных анализах, проводимых на клетках линии А549 человека (базальные эпителиальные клетки аденокарциномы альвеол человека) с использованием hPIV-3; (iii) тестах на клеточную цитотоксичность соединений против клеток А549; и (iv) в ферментных анализах NI против человеческой нейраминидазы 2, в которых не проявили активности. Как показано на фигуре 11, клеточной цитотоксичности не наблюдалось ни для одного из соединений при концентрации 150 мкМ с использованием клеток А549. Как показано на фигуре 12, активности против человеческой Neu2 не наблюдалось.
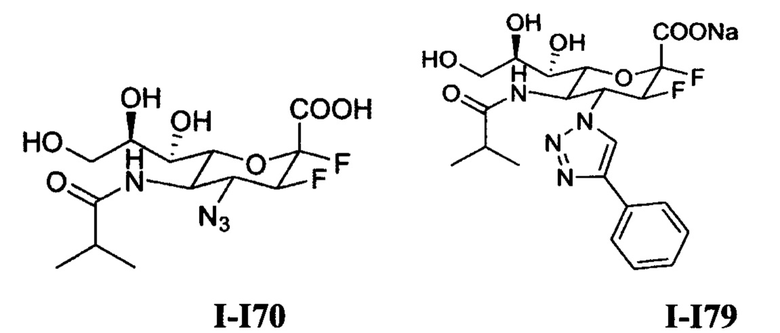
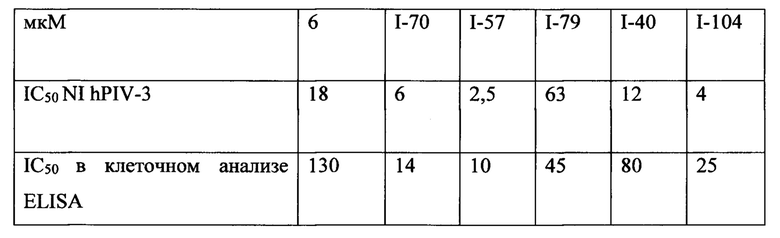

Анализ активности сиалидазы вируса гриппа
В стандартном планшете 96-луночного формата путем использования сиалидазы от гриппа А и В синтезированные соединения могут быть оценены на их способность ингибировать сиалидазу вируса гриппа с помощью модифицированного (Biochim. Biophys. Acta 1991, 10, 65-71) флуорометрического метода Potier et al. (Anal. Biochem. 1979, 94, 287-296) с использованием флуорогенного субстрата 4-метилумбеллиферил N-ацетил-α-D-нейраминида (MUN). Все анализы ингибирования проводили в трех повторах по шести концентрациям ингибитора и с 0,1 мМ MUN. В частности, 7 мкл буфера, содержащего 50 мМ ацетата натрия - 6 мМ CaCl2 (рН 5,5), добавляли в каждую лунку 96-луночного черного планшета на льду с последующим 1 мкл ингибитора, 1 мкл сиалидазы и, наконец, 1 мкл субстрата MUN. Затем планшет недолго центрифугировали при 1000 об/мин в течение приблизительно 10 сек для перемешивания всех компонентов и смесь инкубировали при 37°C при встряхивании при 900 об/мин в течение 20 мин. Для остановки реакции в каждую лунку добавляли 250 мкл 0,25М глицина, рН 10, и флуоресценцию считывали (1 сек на лунку) при возбуждении 355 нм и излучении 460 нм с помощью ридера Victor 3 multilabel reader (PerkinElmer, Waltham, MA). Данные обрабатывали путем вычитания фона (отрицательный контроль RF), а затем анализировали с помощью программного обеспечения GraphPadPrism 4 (GraphPad Software Inc., La Jolla, СА) для расчета значений IC50 (нелинейная регрессия (аппроксимирующая кривая), эффект дозы - ингибирование, 3-параметрическая логистическая модель).
Клеточный анализ in situ ELISA для гриппа А и В
Для оценки синтезированных соединений в отношении ингибирования роста вирусов гриппа А и гриппа В клетки MDCK инфицировали вирусом гриппа А или вирусом гриппа В в клеточном анализе in situ ELISA, разработанном на основе принципов, описанных Berkowitz and Levin, 1985 (Antimicrob. Agents Chemother, 28, 207-210) и адаптированных к IAV Мус et al, 1999 (J. Virol. Methods 77, 165-177 (1999)). Клетки MDCK в 100 мкл минимальной эссенциальной среды Игла (Eagle's Minimum Essential Medium, ЕМЕМ), дополненной 2 мМ глутамина и 10% FBS, высевали на 96-луночные микротитровальные планшеты с плоским дном и инкубировали в течение ночи. На следующий день культуральную среду удаляли и клетки промывали средой. В лунки добавляли вирусный инокулят в общем количестве 50 мкл (40 FFU/лунку) и инкубировали при 37 °C, 5% СО2 в течение 1 ч при легком перемешивании каждые 15 минут. Затем вирусный инокулят удаляли и заменяли 100 мкл инфекционной среды (среда ЕМЕМ, дополненная 2 мМ глутамином и 3,0 мкг/мл TPCK-обработанного трипсина). Инфицированные клетки MDCK инкубировали дополнительно в течение 12-20 ч, по необходимости, и среду аспирировали. Клетки фиксировали 3,7% параформальдегидом в PBS. В день анализа фиксированные клетки промывали и эндогенные пероксидазы инактивировали смесью 0,35% H2O2/PBS в течение 30 минут при 37°C. Лунки снова промывали и инкубировали с 50 мкл 1,5 мг/мл мышиного моноклонального антитела к белку гемагглютинину вируса гриппа А или вируса гриппа В в течение 45 мин при 37°C. Клетки промывали четыре раза промывочным буфером (PBS и 0,02% Tween-20) и инкубировали с 50 мкл конъюгированного с HRP козьего анти-мышиного IgG (H+L) в разведении 1:2000 (BioRad, ref. 170-6516) в течение 45 мин при 37°C. Планшеты промывали, как и ранее, с помощью промывочного буфера и в каждую лунку добавляли 100 мкл субстрата BD OptEIATMB (BD Biosciences, San Jose, СА), а затем планшет инкубировали при 37°C.
Ферментативную реакцию останавливали через 3-5 мин путем добавления 50 мкл 1М H2SO4 на лунку. Исходные данные получали путем считывания поглощения (OD) каждой лунки при 450 нм в течение 0,1 сек с помощью ридера Victor 3 multilabel reader (PerkinElmer, Waltham, MA). Конечные значения OD получали путем вычитания OD отрицательного контроля (неинфицированные клетки) из исходных данных считывания OD и данные анализировали с помощью программного обеспечения GraphPadPrism4 (GraphPad Software Inc., La Jolla, СА) для расчета значений IC50 (нелинейная регрессия (аппроксимирующая кривая), эффект дозы - ингибирование, 3-параметрическая логистическая модель). Значение IC50 определяли как концентрацию ингибитора, которая снижает поглощение при 450 нм на 50% по сравнению с необработанным инфицированным клеточным монослоем
Клеточный анализ in situ ELISA выполняли так же, как для hPIV-3, с незначительными изменениями, включая различия между тестами hPIV-1 и 3, например:
Первичное антитело: мышиное моноклональное антитело против hPIV-3 ΗΝ (Fitzgerald, клон М02122321); мышиное моноклональное антитело против hPIV-1 ΗΝ (LSbio, ref LS-C74109); инфекционная среда hPIV-3: ЕМЕМ + 2 мМ глутамина; инфекционная среда hPIV-1: ЕМЕМ + 2 мМ глутамина + TrypLE Select 1,2%.
Значения IC50 для соединений согласно изобретению в отношении hPIV-3 NI и hPIV-1 NI
Значения IC50 для ряда соединений согласно первому аспекту определяли с помощью стандартных аналитических методов, описанных ранее в работе Guillon, Ρ et al, Nature Communications (2014). В таблицах ниже показаны значения IC50 для полученных соединений, при этом ID химии соответствует ссылкам и структурами соединений, представленным в разделе описания экспериментов.
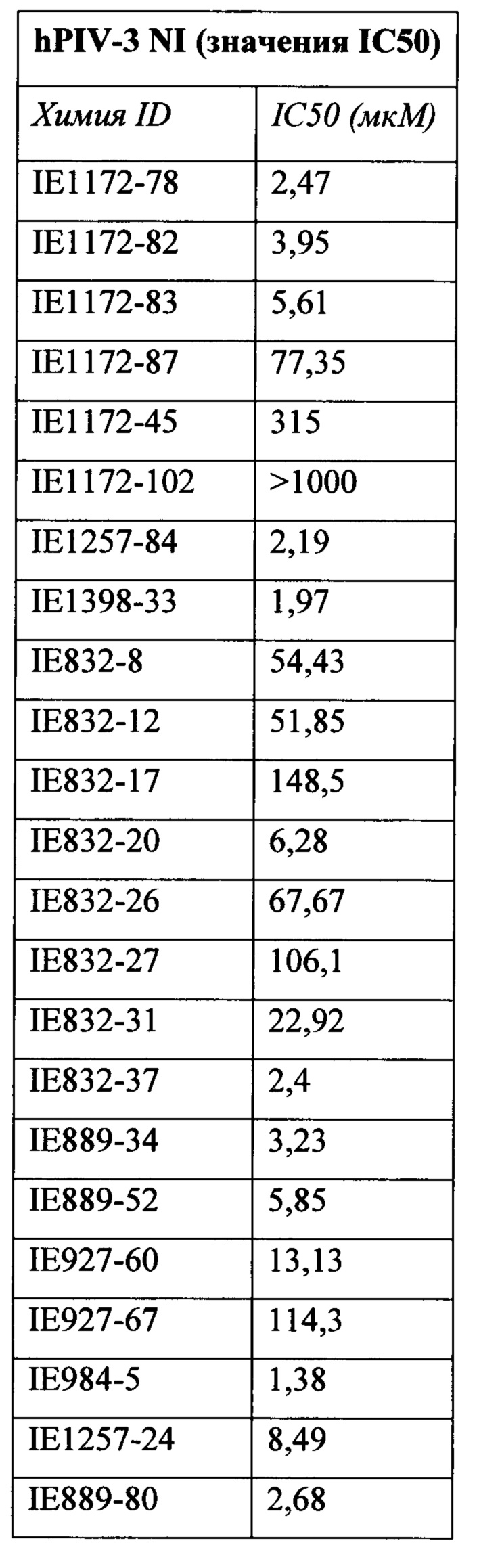
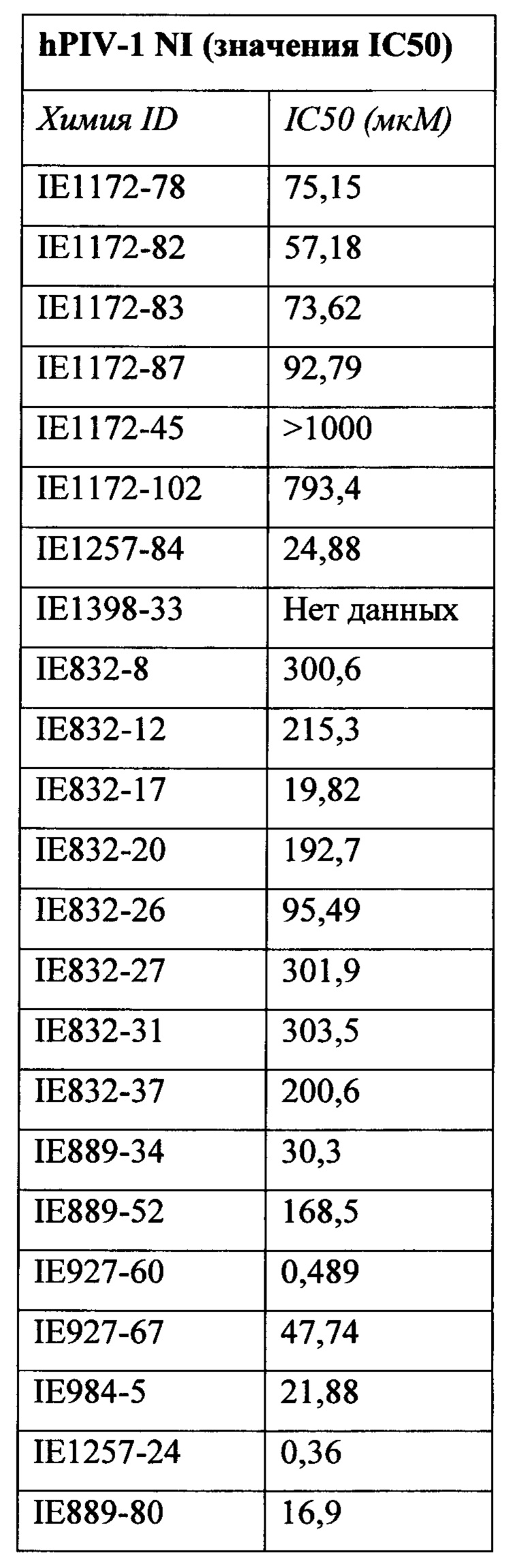

| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 1,2,4-ТРИАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ СИГМА РЕЦЕПТОРА | 2007 |
|
RU2451015C2 |
| ПРОИЗВОДНЫЕ 2-ДЕЗОКСИ-2,3-ДИДЕГИДРО-N-АЦЕТИЛНЕУРАМИНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1991 |
|
RU2119487C1 |
| ПРЕДШЕСТВЕННИКИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2000 |
|
RU2247710C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
| ПИРАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ FSHR И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2663898C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2596946C2 |
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610275C2 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2610276C1 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610274C2 |
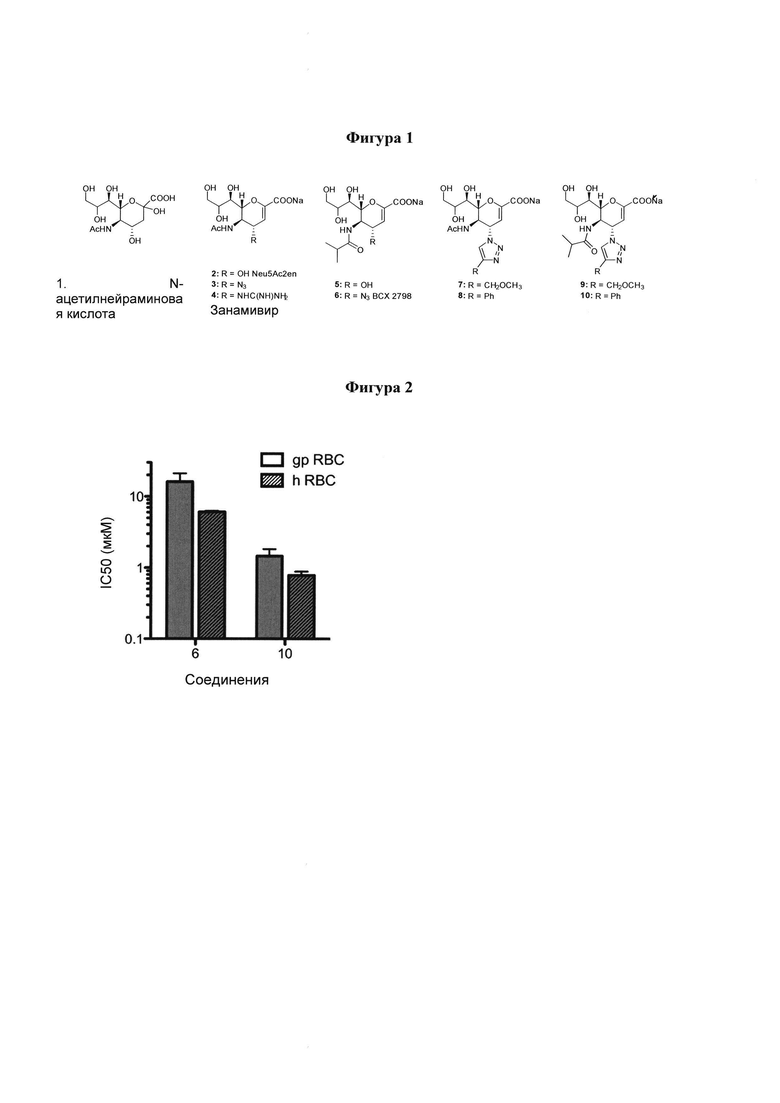
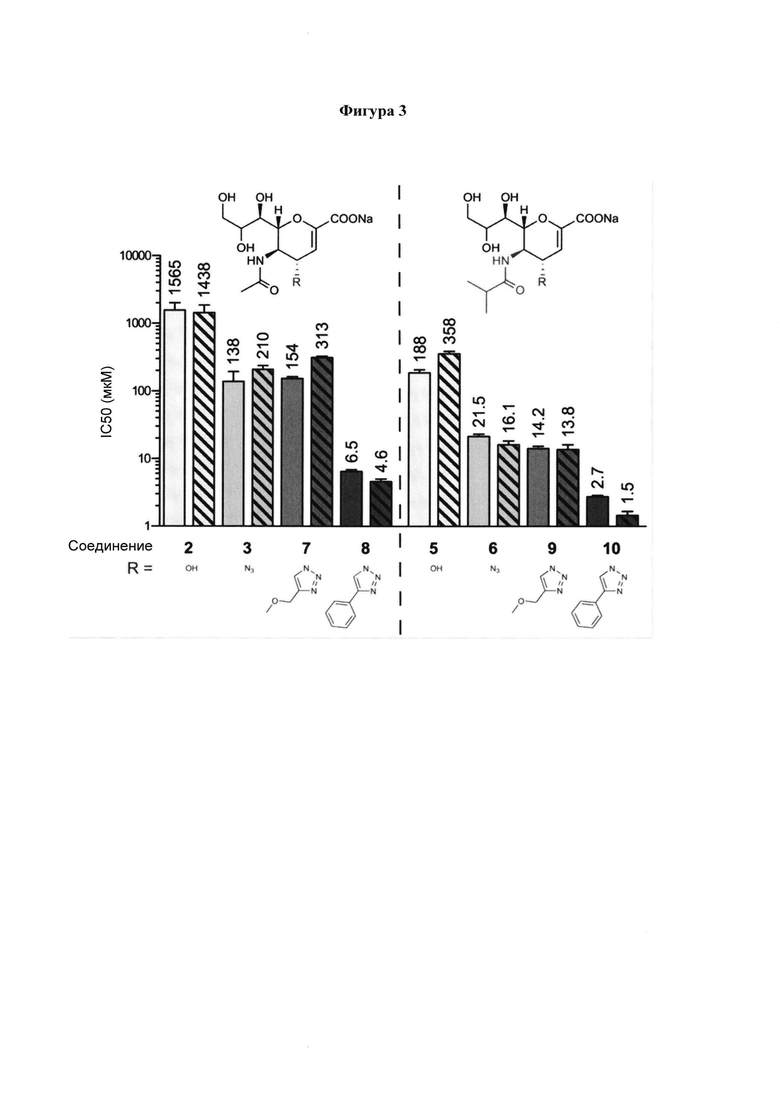
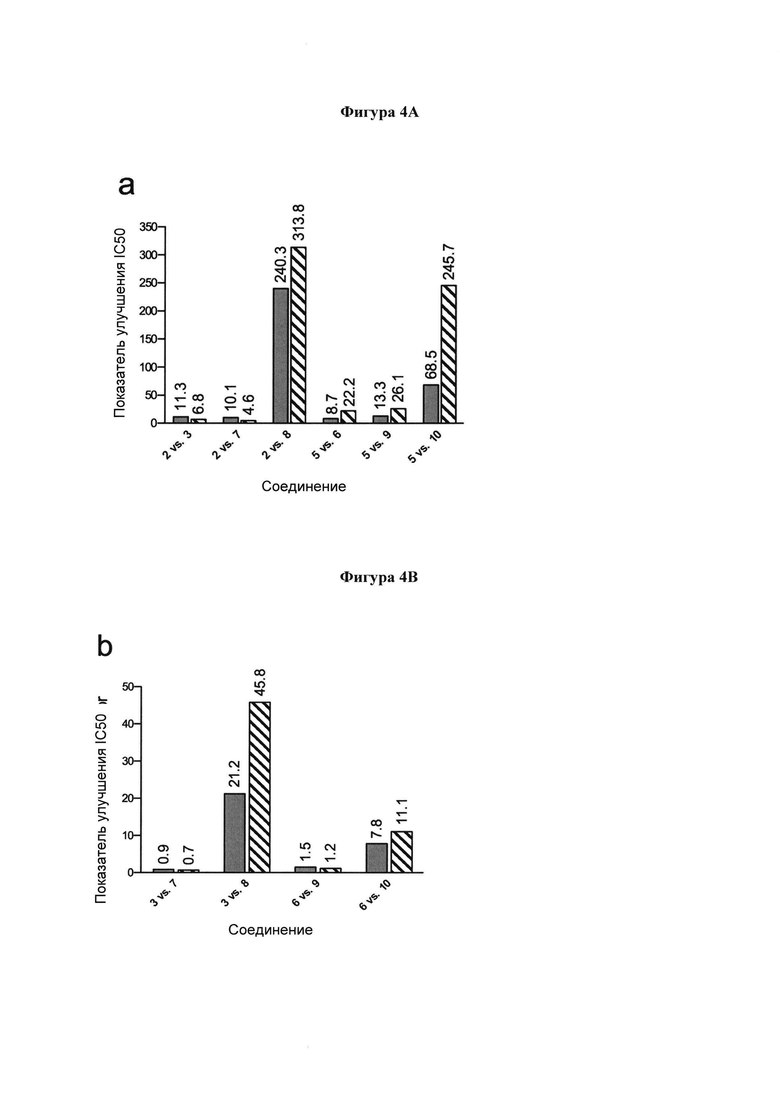
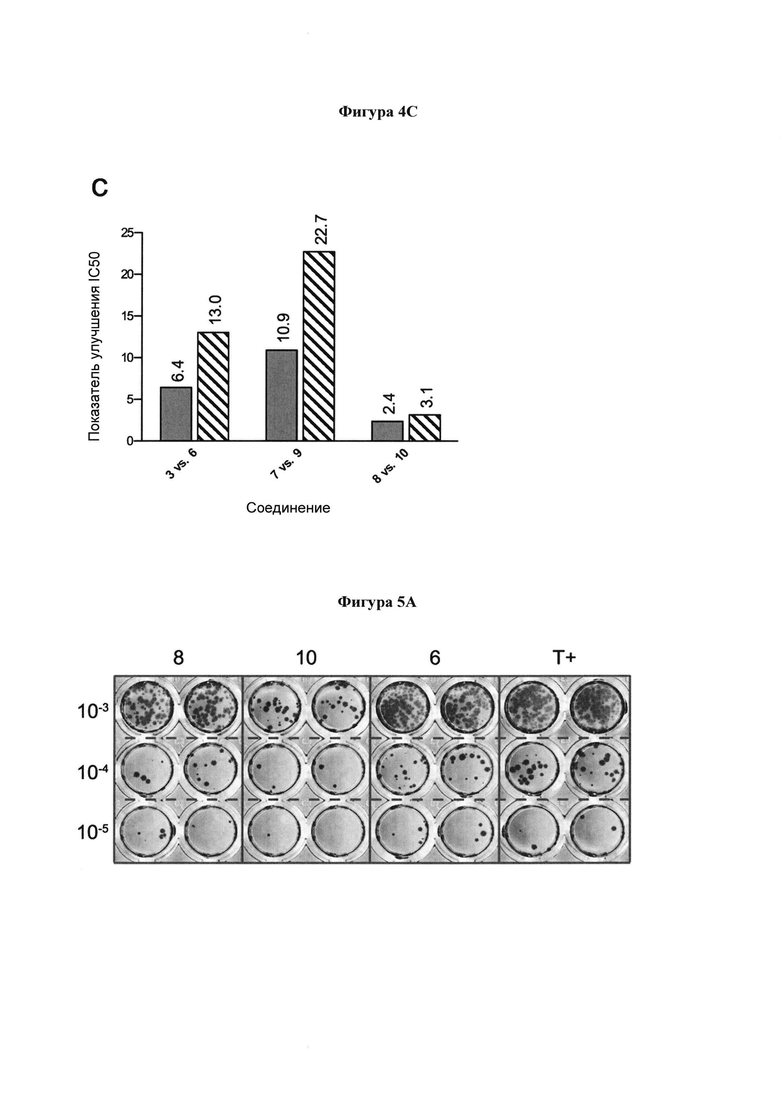
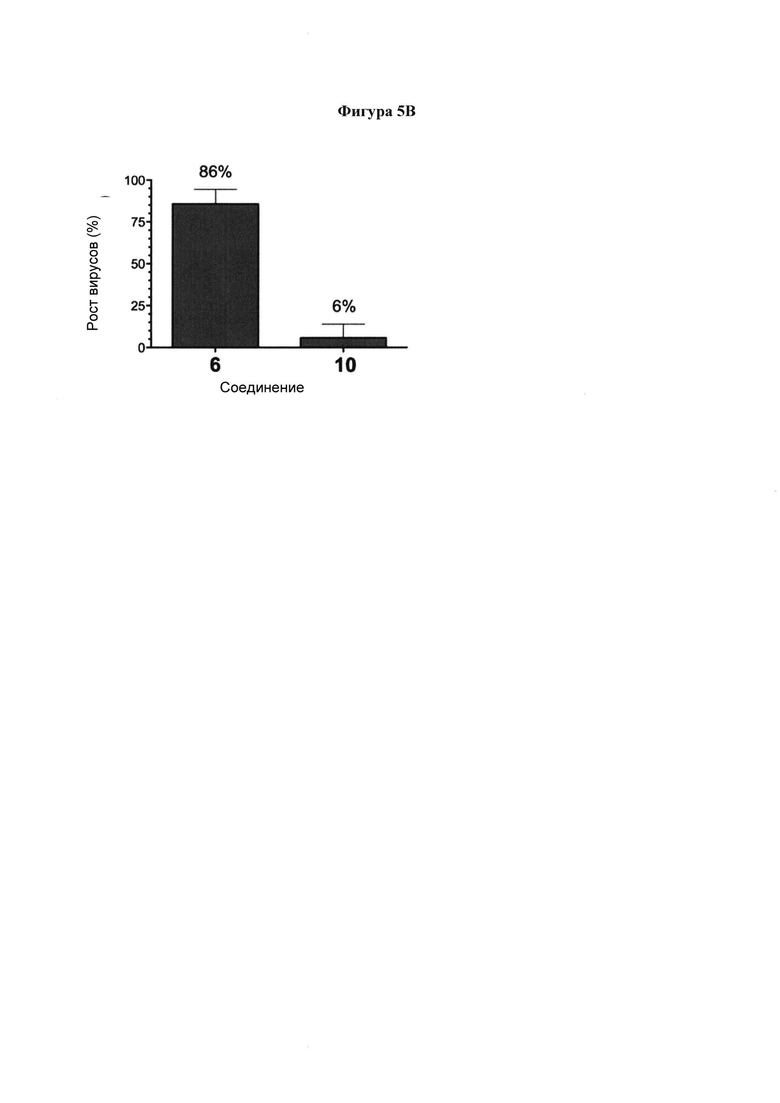
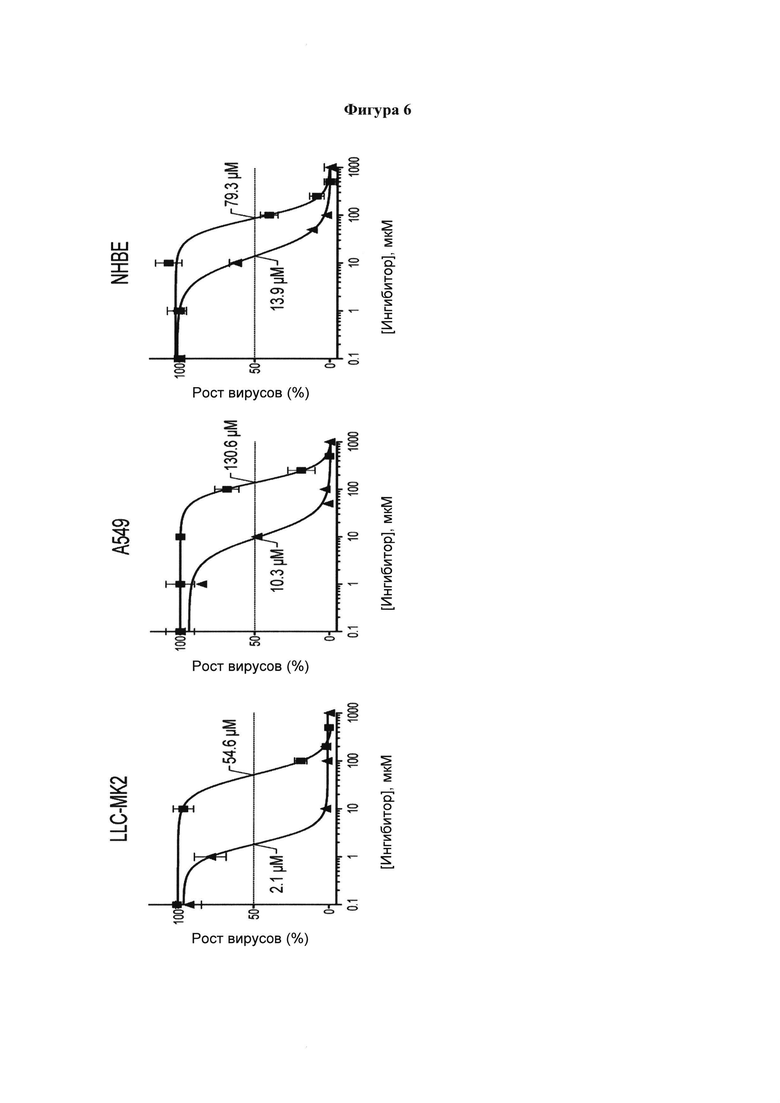
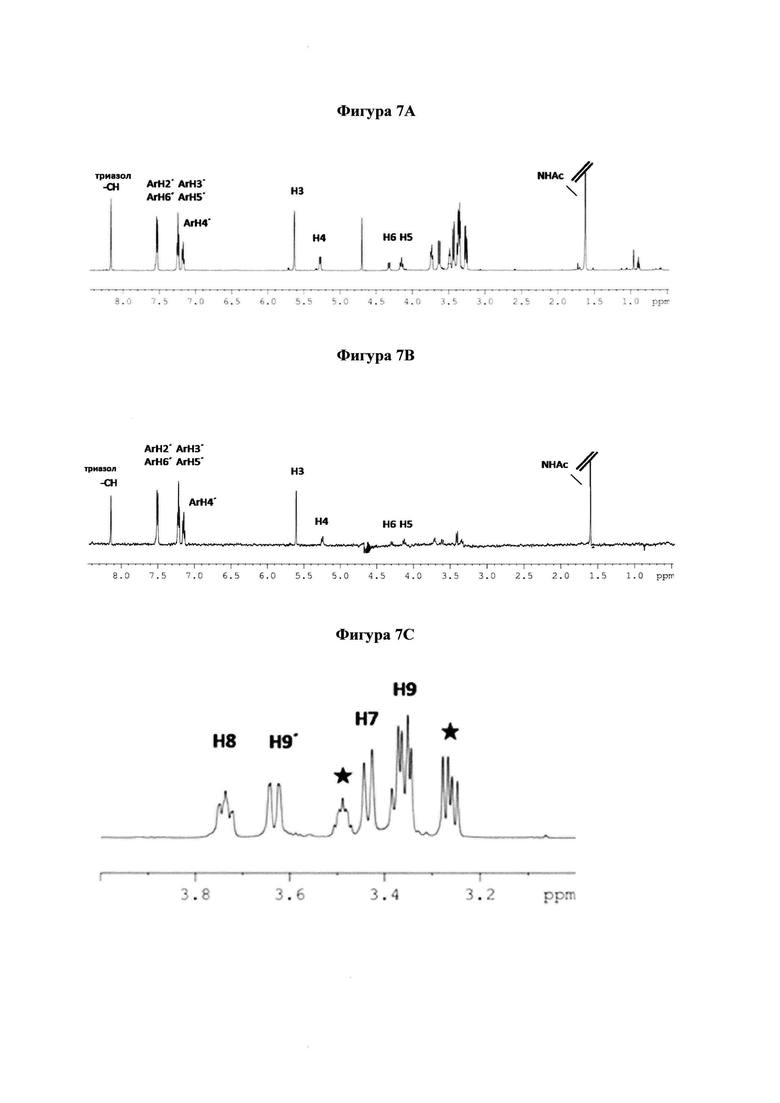
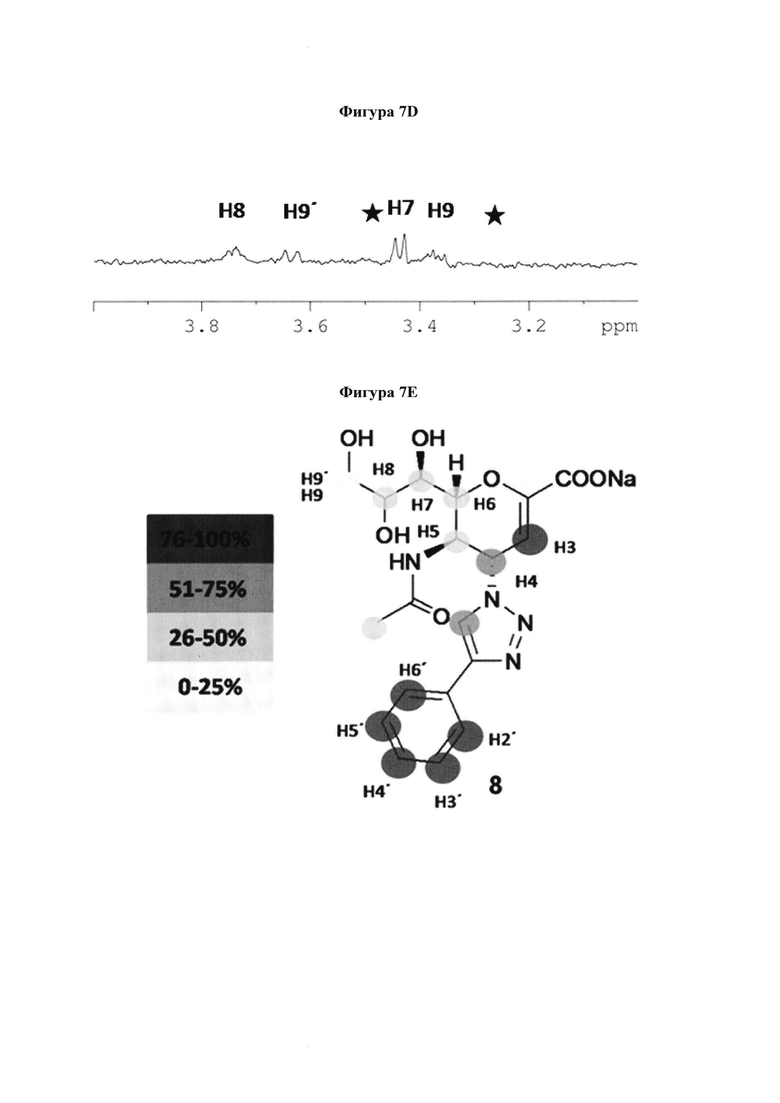
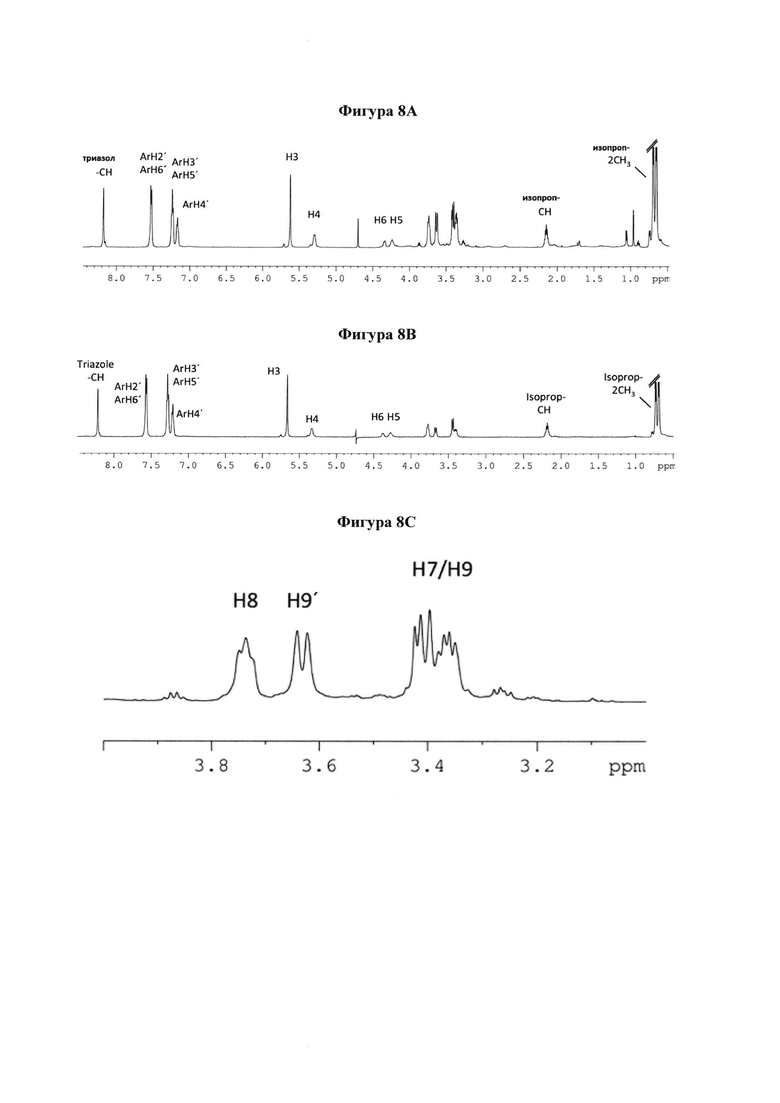
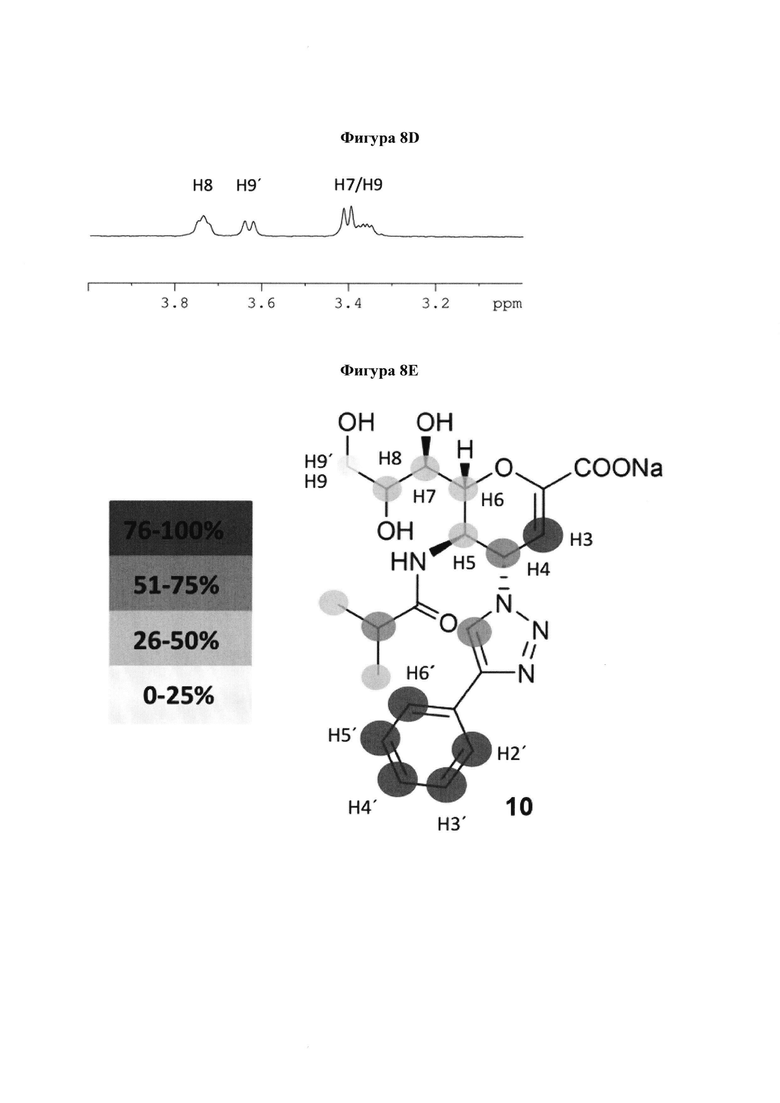
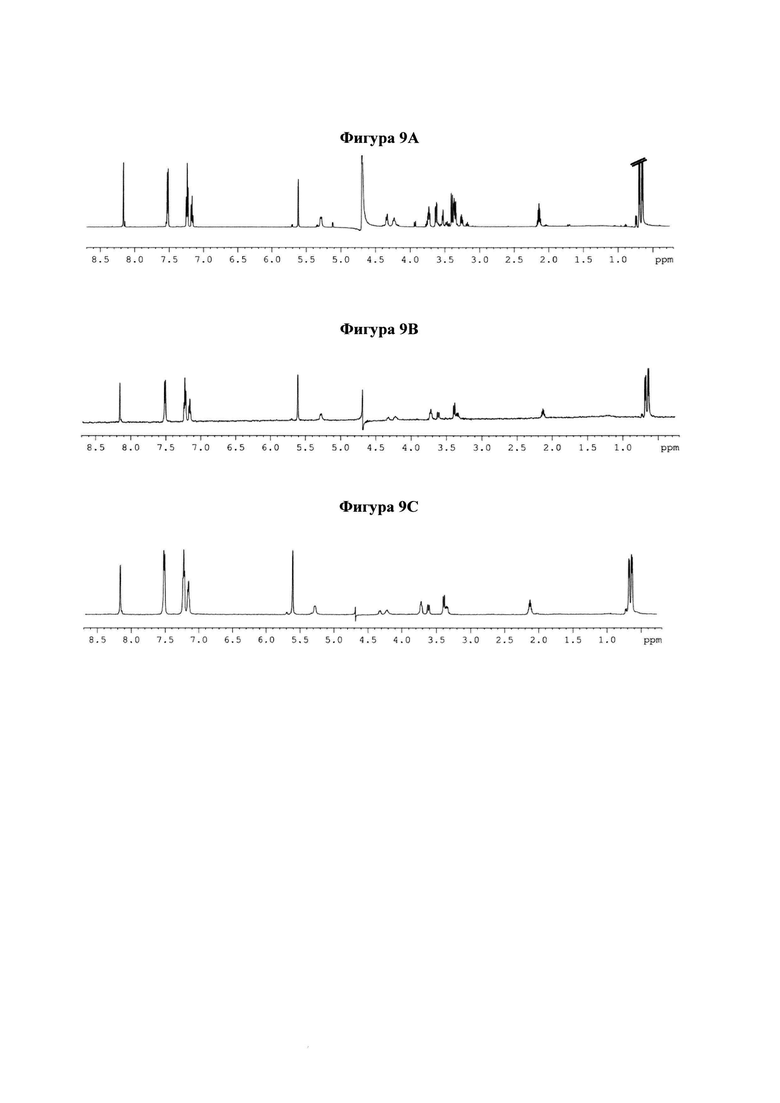
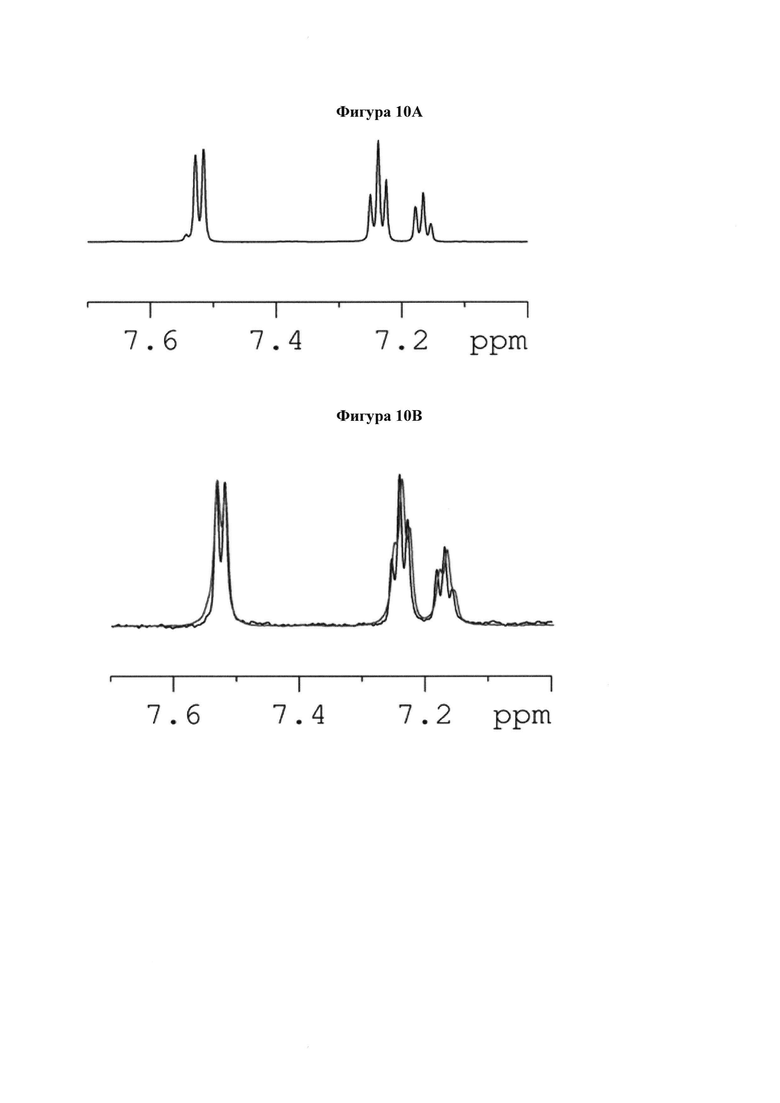
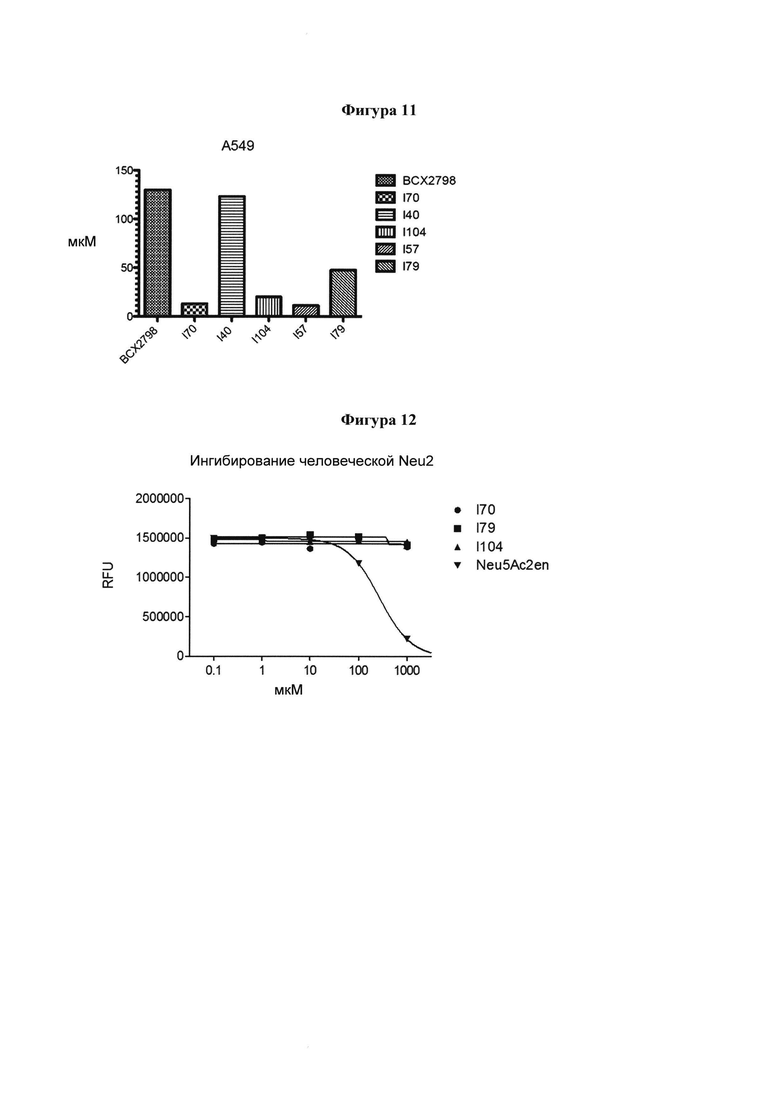
Изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, где R1 выбран из группы, состоящей из СООН или его соли и C(O)OR11, где R11 независимо выбран из группы, состоящей из водорода и C1-С6алкила; R3 выбран из группы, состоящей из N-связанного тетразола, необязательно замещенного необязательно замещенным NH2, необязательно замещенного N-связанного изоиндола, необязательно замещенного N-связанного бензотриазола и N-связанного триазола, замещенного по одному или обоим атомам углерода кольца, имеющего следующую структуру:
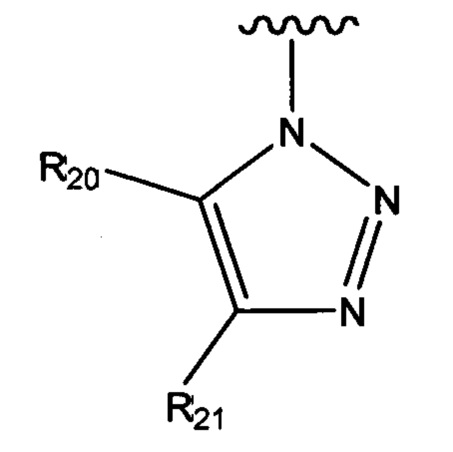 ,
,
где R20 и R21 выбраны из группы, состоящей из водорода, C1-С6алкила, -СН2ОСН3, пиридила и необязательно замещенного фенила и где необязательно замещенный означает необязательное замещение одной или несколькими группами, выбранными из C1-С6алкила, C1-С6галогеналкила, C1-С6алкокси, NH2, Cl, F, Br и I, при условии, что, когда R20 представляет собой водород и R4 представляет собой AcHN, тогда R21 выбран из группы, состоящей из водорода, C1-С6алкила и замещенного фенила, где замещение фенила независимо заместителем, выбранным из группы, состоящей из метила, н-бутила, втор-бутила, изобутила, трет-бутила, пентила, 2-метилбутила, 3-метилбутила, гексила, C1-С6галогеналкила, C1-С6алкилгидрокси, СООН, О, Br и I, и где по меньшей мере один из R20 и R21 не является водородом; R4 представляет собой NHC(O)R17, где R17 выбран из группы, состоящей из C1-С6алкила и C1-С6алогеналкила; R6, R7 и R8 независимо выбраны из группы, состоящей из ОН и -OC(O)R18, и R18 представляет собой C1-С6алкил, и при условии, что, когда R4 представляет собой NHAc и R3 представляет собой триазол, замещенный только в положении R21, тогда триазол не замещен пропилом, замещенным пропилом, замещенным трет-бутилом или диэтоксиалкилом. Изобретение также относится к фармацевтической композиции на основе указанных соединений формулы (I). Технический результат – получено новое соединение и фармацевтическая композиция на его основе, которые могут найти применение в медицине в качестве модуляторов активности вирусных ферментов гемагглютинина и/или нейраминидазы для лечения заболеваний, нарушений или состояний, вызванных вирусом парагриппа. 4 н. и 11 з.п. ф-лы, 5 табл., 26 ил.
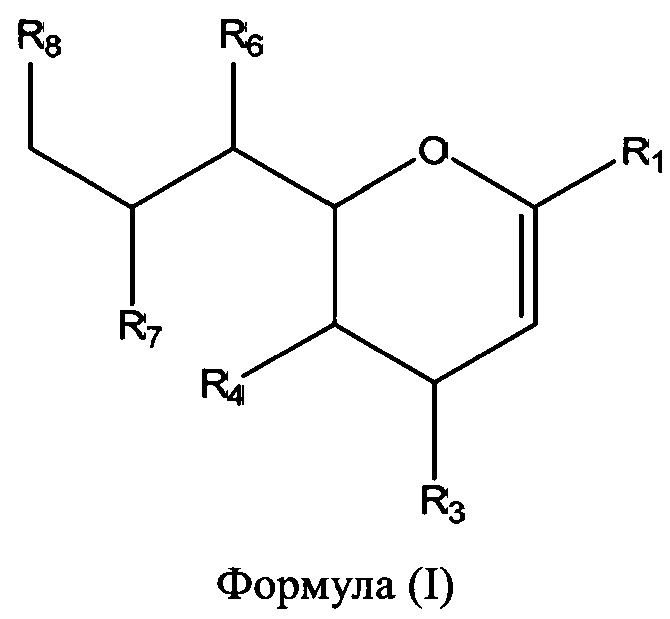
1. Соединение формулы (I) или его фармацевтически приемлемая соль:
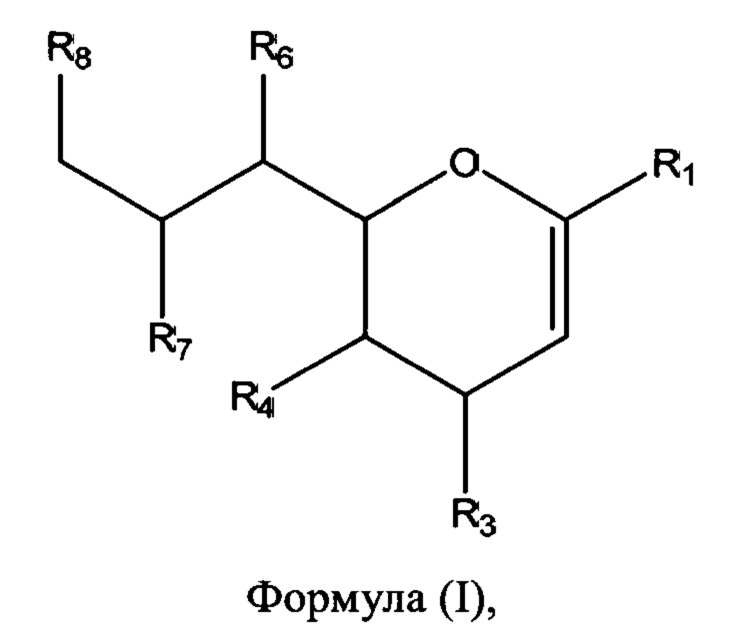
в которой R1 выбран из группы, состоящей из СООН или его соли и C(O)OR11, где R11 независимо выбран из группы, состоящей из водорода и C1-С6алкила;
R3 выбран из группы, состоящей из N-связанного тетразола, необязательно замещенного необязательно замещенным NH2, необязательно замещенного N-связанного изоиндола, необязательно замещенного N-связанного бензотриазола и N-связанного триазола, замещенного по одному или обоим атомам углерода кольца, имеющего следующую структуру:
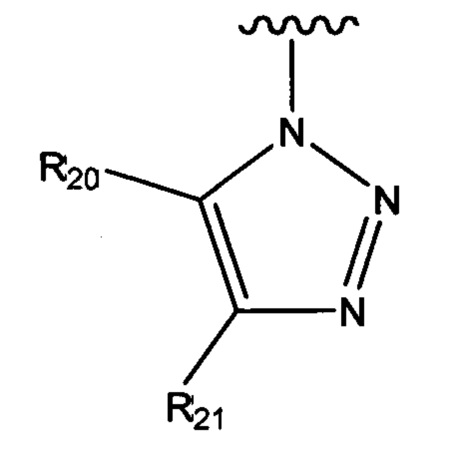
где R20 и R21 выбраны из группы, состоящей из водорода, C1-С6-алкила, -СН2ОСН3, пиридила и необязательно замещенного фенила и где необязательно замещенный означает необязательное замещение одной или несколькими группами, выбранными из C1-С6алкила, C1-С6галогеналкила, C1-С6алкокси, NH2, Cl, F, Br и I,
при условии, что, когда R20 представляет собой водород и R4 представляет собой AcHN, тогда R21 выбран из группы, состоящей из водорода, C1-С6алкила и замещенного фенила, где замещение фенила независимо заместителем, выбранным из группы, состоящей из метила, н-бутила, втор-бутила, изобутила, трет-бутила, пентила, 2-метилбутила, 3-метилбутила, гексила, C1-С6галогеналкила, C1-С6алкилгидрокси, СООН, Cl, Br и I,
и где по меньшей мере один из R20 и R21 не является водородом;
R4 представляет собой NHC(O)R17, где R17 выбран из группы, состоящей из C1-С6алкила и C1-С6алогеналкила;
R6, R7 и R8 независимо выбраны из группы, состоящей из ОН и -OC(O)R18, и R18 представляет собой C1-С6алкил,
и при условии, что, когда R4 представляет собой NHAc и R3 представляет собой триазол, замещенный только в положении R21, тогда триазол не замещен пропилом, замещенным пропилом, замещенным трет-бутилом или диэтоксиалкилом.
2. Соединение по п. 1, отличающееся тем, что R1 представляет собой СООН или его соль или C(O)OR11, где R11 выбран из метила, этила и пропила.
3. Соединение по п. 1, отличающееся тем, что R3 выбран из группы, состоящей из:
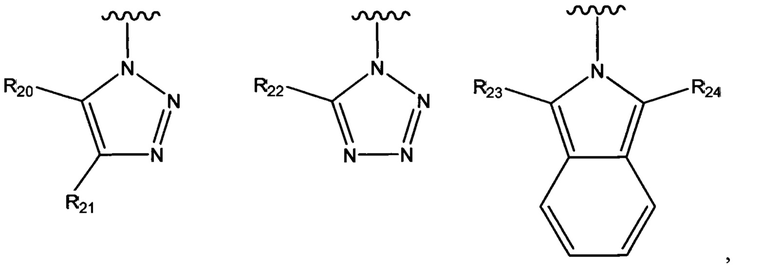
где R20 и R21 такие, как определены в п. 1;
R22 выбран из группы, состоящей из водорода и NH2; и
R23 и R24 независимо выбраны из группы, состоящей из водорода, CN и оксо.
4. Соединение по п. 1, отличающееся тем, что R3 выбран из группы, состоящей из:
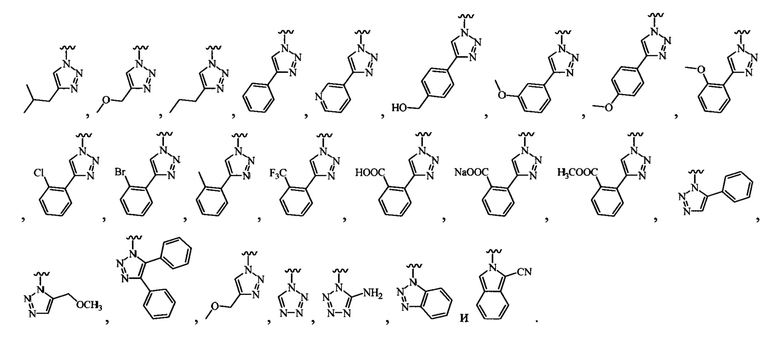
5. Соединение по п. 1, отличающееся тем, что R4 выбран из группы, состоящей из:
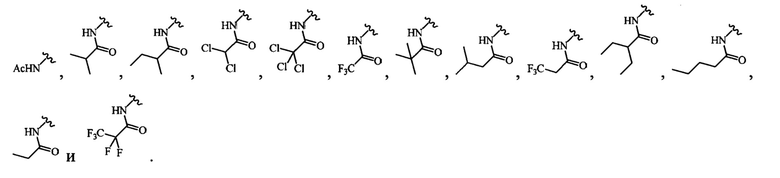
6. Соединение по п. 1, отличающееся тем, что R4 выбран из группы, состоящей из -NHAc, -NHC(O)CH2(CH3)2, -NHC(O)CF3 и -NHC(O)CH2CH3.
7. Соединение по п. 1, отличающееся тем, что R6, R7 и R8 независимо выбраны из ОН и ОАс.
8. Соединение по п. 1, отличающееся тем, что соединение формулы (I) представляет собой соединение формулы (II)
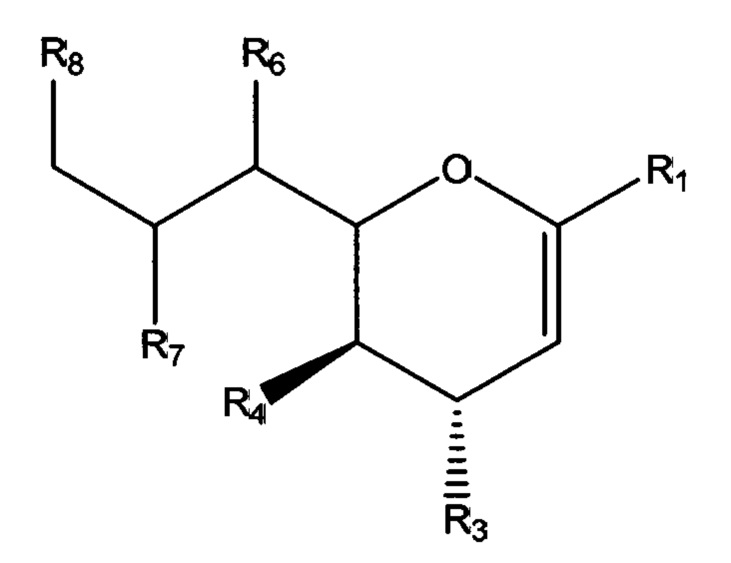

в которой R1, R3, R4, R6, R7 и R8 являются такими, как описано в любом из предшествующих пунктов.
9. Соединение по п. 1, отличающееся тем, что соединение формулы (I) представляет собой соединение, выбранное из группы, состоящей из:
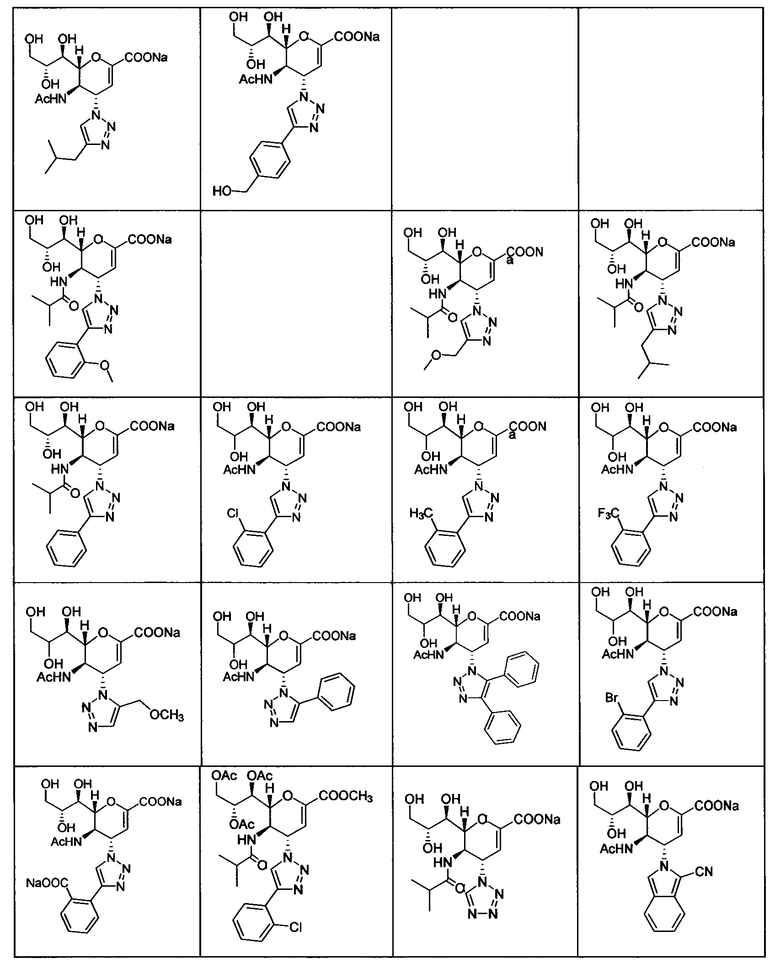
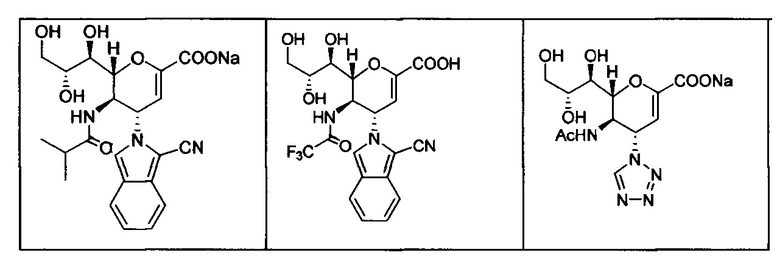
10. Фармацевтическая композиция для лечения или профилактики заболевания, нарушения или состояния, вызванного вирусом парагриппа, содержащая эффективное количество соединения по любому из пп. 1-9 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, разбавитель и/или вспомогательное вещество.
11. Способ лечения заболевания, нарушения или состояния, вызванного вирусом парагриппа, у пациента, включающий стадию введения пациенту эффективного количества соединения по любому из пп. 1-9.
12. Способ по п. 11, отличающийся тем, что вирус парагриппа выбран из группы, состоящей из вируса hPIV-1, 2 и 3.
13. Способ по п. 11, отличающийся тем, что пациент представляет собой домашнее или сельскохозяйственное животное или человека.
15. Способ ингибирования активности гемагглютинина вируса парагриппа и/или фермента нейраминидазы посредством приведения в контакт фермента с соединением по любому из пп. 1-9 или его фармацевтически эффективной солью.
Авторы
Даты
2020-08-24—Публикация
2015-09-07—Подача