Перекрестная ссылка на родственные заявки
Данная заявка испрашивает приоритет Предварительной заявки США № 62/146938, поданной 13 апреля 2015 года; 62/148667, поданной 16.04.2015; и 62/287842, поданной 27 января 2016 года, раскрытие каждой из которых включено в данный документ посредством ссылки в полном объеме.
Область техники
Изобретение относится к области генномодифицированных животных, не относящихся к человеку.
Уровень техники
Генетически модифицированные животные, не относящиеся к человеку, такие как гуманизированные мыши, имеют большие перспективы для трансляционных исследований, поскольку они позволяют моделировать и изучать заболевания человека in vivo. В течение последнего десятилетия был достигнут значительный прогресс в создании гуманизированных мышей путем генетической инсерции генов человека, которые необходимы для надлежащего развития и функционирования иммунных клеток человека в организме мыши. Однако некоторые ограничения по-прежнему ограничивают пригодность гуманизированных мышей для трансляционных исследований. В частности, развитие и выживание Т-клеток человека является субоптимальным.
Хотя было показано, что модель костного мозга-печени-тимуса (BLT) улучшает восстановление кишечных Т-клеток у мышей NS/NSG-BLT (Denton PW, Nochi T, Lim A et al. Mucosal Immunol 2012, 5: 555-566, Nochi T, Denton PW, Wahl A et al. Cell Rep 2013, 3: 1874-1884), также было показано, что у таких мышей развивается болезнь «трансплантат против хозяина», что приводит к массовой инфильтрации иммунными клетками нескольких видов тканей (Greenblatt MB, Vrbanac V, Tivey T et al. PLoS One 2012; 7: e44664). Поэтому современные гуманизированные мышиные модели по-прежнему не обеспечивают надлежащего развития и функционирования Т-клеток человека. В частности, отсутствие ткане-резидентных Т-клеток человека, обладающих памятью, препятствует использованию гуманизированных мышей в качестве инструмента для доклинической разработки и тестирования более эффективных стратегий иммунизации, которые направленно действуют для индукции долговременного иммунитета слизистой оболочки к патогенам, таким как ВИЧ.
Чтобы лучше понять развитие и выживаемость ткане-резидентных Т-клеток человека, и обеспечить модель для тестирования новых стратегий иммунизации с целью индукции долговременного иммунитета слизистой оболочки, зависящего от Т-клеток, было бы полезно иметь генномодифицированное животное, не относящееся к человеку, у которого развиваются ткане-резидентные Т-клетки человека. Такую мышиную модель дополнительно можно применять для изучения взаимодействия ткане-резидентных иммунных клеток человека с микрофлорой кишечника, например, каким образом микрофлора может формировать развитие и выживание иммунных клеток человека в тонком кишечнике и толстой кишке.
Кроме того, в уровне техники существует потребность в не относящихся к человеку животных моделях развития и функционирования природных клеток- киллеров (ПК) человека.
Краткое описание сущности изобретения
Предлагаются генномодифицированные животные, не относящиеся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку. Также представлены способы получения животных, не относящихся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку, и способы использования животных, не относящихся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку. Указанные животные и способы находят множество применений в данной области, в том числе, например, при моделировании развития и функционирования Т-клеток человека и/или природных клеток-киллеров (ПК); при моделировании инфицирования патогеном человека Т-клеток человека и/или ПК-клеток; при скрининге in vivo агентов, которые подавляют инфицирование патогеном, который активирует, индуцирует и/или направленно действует на Т-клетки и/или ПК-клетки; при скрининге in vivo агентов, которые модулируют развитие и/или функционирование Т-клеток человека и/или ПК-клеток, например, в здоровом или больном состоянии; при скрининге in vivo агентов, которые являются токсичными для Т-клеток человека и/или ПК-клеток; при скрининге in vivo агентов, которые предотвращают, смягчают или обращают токсические эффекты токсичных агентов на Т-клетки человека и/или ПК-клетки; при скрининге in vivo потенциальных вакцин, индуцирующих Т-клетки; и при скрининге in vivo и in vitro агентов, которые подавляют рост опухоли и/или инфицирование, активируя опосредованные ПК-клетками процессы антителозависимой клеточной цитотоксичности (АЗКЦ).
В первом аспекте настоящее изобретение относится к генномодифицированному животному, не относящемуся к человеку, включая: последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα; и последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека.
Промотор гена SIRPα может быть эндогенным промотором гена SIRPα, не относящимся к человеку. Например, промотор гена SIRPα может быть эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. Если промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку, то генномодифицированное животное, не относящееся к человеку, может содержать нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека. В одном из таких вариантов реализации изобретения функциональный фрагмент содержит внеклеточный домен SIRPα человека, например, внеклеточный домен, который содержит по меньшей мере аминокислоты 28-362 из SEQ ID NO: 12.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является иммунодефицитным. Например, в одном варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2. В другом варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg или как нокаут гена Rag2, так и нокаут гена IL2rg.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения животное, не относящееся к человеку, является млекопитающим. В одном из таких вариантов реализации изобретения млекопитающее является грызуном, например, мышью.
В другом варианте реализации первого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит трансплантат гемопоэтических клеток человека. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека. В одном варианте реализации изобретения, в котором генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, патоген человека активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры (ПК). В другом варианте реализации изобретения, в котором генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, патоген человека является патогеном, который поражает (например, инфицирует) кишечник человека. В одном из таких вариантов реализации изобретения патоген человека является ротавирусом человека. В другом варианте реализации изобретения, в котором генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, патоген поражает (например, инфицирует) легкое человека. В одном из таких вариантов реализации изобретения патоген человека является вирусом гриппа. В другом варианте реализации изобретения, в котором генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, патоген поражает (например, инфицирует) печень человека. В еще одном варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит трансплантат гемопоэтических клеток человека и опухоль, например, опухоль человека, например, трансплантированную опухоль человека.
Во втором аспекте настоящего документа предлагается модель in vivo, включающая генномодифицированное животное, не относящееся к человеку, которое содержит: последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα; последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15; и трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в тонком кишечнике и пейеровых бляшках генномодифицированного животного, не относящегося к человеку.
В одном варианте реализации второго аспекта изобретения генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, например, кишечным патогеном. В одном таком варианте реализации изобретения кишечный патоген выбран из: Campylobacter jejuni, Clostridium difficile, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, ротавируса человека, Listeria monocytogenes, вируса Норуолка, Salmonella enterica, Shigella flexneri, Shigella sonnei, Shigella dysenteriae, Yersinia pestis, Yersinia enterocolitica и Helicobacter pylori.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку. В одном из таких вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеприведенных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения, белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека. В одном из таких вариантов реализации изобретения функциональный фрагмент содержит внеклеточный домен SIRPα человека, например, внеклеточный домен, который содержит аминокислоты 28-362 из SEQ ID NO: 12.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения, промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном таком варианте реализации изобретения, генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является иммунодефицитным. Например, в одном варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2. В другом варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg или как нокаут гена Rag2, так и нокаут гена IL2rg.
В другом варианте реализации второго аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения, животное, не относящееся к человеку, является млекопитающим. В одном из таких вариантов реализации изобретения млекопитающее является грызуном, например, мышью.
В третьем аспекте настоящего документа предлагается модель in vivo, включающая генномодифицированное животное, не относящееся к человеку, которое содержит: последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα; последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15; и трансплантат гемопоэтических клеток человека, притом, что генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в легком генномодифицированного животного, не относящегося к человеку.
В одном варианте реализации третьего аспекта изобретения генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, например, легочным патогеном. В одном из таких вариантов реализации изобретения легочный патоген выбран из: Streptococcus pyogenes, Haemophilus influenza, Corynebacterium diphtheria, коронавируса атипичной пневмонии, Bordetella pertussis, Moraxella catarrhalis, вируса гриппа (A, B, C), коронавируса, аденовируса, респираторного синцитиального вируса, вируса парагриппа, вируса свинки, Streptococcus pneumoniae, Staphylococcus aureus, Legionella pneumophila, Klebsiella pneumoniae, Pseudomonas aeruginosa, Mycoplasma pneumonia, Mycobacterium tuberculosis, Chlamydia pneumoniae, Blastomyces dermatitidis, Cryptococcus neoformans и Aspergillus fumigatus.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку. В одном из таких вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека . В одном из таких вариантов реализации изобретения функциональный фрагмент содержит внеклеточный домен SIRPα человека, например, внеклеточный домен, содержащий по меньшей мере аминокислоты 28-362 из SEQ ID NO: 12.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
В одном варианте реализации изобретения, в котором промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку, в локусе гена IL-15 животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является иммунодефицитным. Например, в одном варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2. В другом варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg или как нокаут гена Rag2, так и нокаут гена IL2rg.
В другом варианте реализации третьего аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения животное, не относящееся к человеку, является млекопитающим. В одном из таких вариантов реализации изобретения млекопитающее является грызуном, например, мышью.
В четвертом аспекте настоящего документа предлагается способ определения эффективности потенциальной вакцины, индуцирующей Т-клетки, причем способ включает: введение потенциальной вакцины, индуцирующей Т-клетки, генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и: (i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, (ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и (iii) трансплантат гемопоэтических клеток человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; нагрузка генномодифицированного животного, не относящегося к человеку, патогеном человека; и определение того, будет ли потенциальная вакцина, индуцирующая Т-клетки, вызывать опосредованный Т-клетками иммунный ответ у генномодифицированного животного, не относящегося к человеку.
В одном варианте реализации четвертого аспекта изобретения промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека. В одном из таких вариантов реализации изобретения функциональный фрагмент содержит внеклеточный домен SIRPα человека, например, внеклеточный домен, содержащий по меньшей мере аминокислоты 28-362 из SEQ ID NO: 12.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок IL-15 человека представляет собой функциональный фрагмент полноразмерного белка IL-15 человека.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
В другом варианте реализации четвертого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, представляет собой млекопитающее, такое как грызун, например, мышь.
В пятом аспекте настоящее изобретение относится к способу идентификации агента, подавляющего инфекцию патогеном, который активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры (ПК) человека, причем способ включает: введение агента генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и: (i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, (ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, (iii) трансплантат гемопоэтических клеток человека и (iv) инфекция патогеном, который активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и определение того, будет ли агент уменьшать количество патогена у инфицированного патогеном животного, не относящегося к человеку.
В одном варианте реализации пятого аспекта изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку. В одном из таких вариантов реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека. В одном из таких вариантов реализации изобретения функциональный фрагмент содержит внеклеточный домен SIRPα человека, например, внеклеточный домен, который содержит аминокислоты 28-362 из SEQ ID NO: 12.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В одном из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном варианте реализации изобретения, в котором промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку, генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В одном из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека. В другом таком варианте реализации изобретения генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
В другом варианте реализации пятого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, представляет собой млекопитающее, такое как грызун, например, мышь.
В шестом аспекте настоящее изобретение относится к способу получения животного, не относящегося к человеку, которое экспрессирует белок IL-15 человека и белок SIRPα человека, причем способ включает: введение в геном первого животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека, причем последовательность, кодирующая белок IL-15 человека, функционально связана с последовательностью промотора гена IL-15; введение в геном второго животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека, причем последовательность, кодирующая белок SIRPα человека, функционально связана с последовательностью промотора SIRPα; и получение третьего животного, не относящегося к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, притом, что третье животное, не относящееся к человеку, экспрессирует белок IL-15 человека и белок SIRPα человека.
В одном варианте реализации шестого аспекта изобретения стадии введения включают получение животного, не относящегося к человеку, из плюрипотентной стволовой клетки, содержащей нуклеиновую кислоту, кодирующую IL-15 человека или SIRPα человека.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения первое животное является отличным от второго животного, а стадия получения третьего животного включает разведение первого и второго животного.
В другом варианте реализации шестого аспекта изобретения первое животное и второе животное являются одинаковыми, стадия введения в геном первого животного включает приведение в контакт первой плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок IL-15 человека, с получением второй плюрипотентной стволовой клетки, стадия введения в геном второго животного включает приведение в контакт второй плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок SIRPα человека, для получения третьей плюрипотентной стволовой клетки, а третье животное, не относящееся к человеку, получают из третьей плюрипотентной стволовой клетки.
В альтернативном варианте реализации шестого аспекта настоящего изобретения предлагается способ получения животного, не относящегося к человеку, которое экспрессирует белок IL-15 человека и белок SIRPα человека, причем способ включает: введение в геном первого животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека, и, при этом, последовательность, кодирующая белок SIRPα человека, функционально связана с последовательностью промотора гена SIRPα; введение в геном второго животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека, притом, что последовательность, кодирующая белок IL-15 человека, функционально связана с последовательностью промотора IL-15; и получение третьего животного, не относящегося к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, причем третье животное, не относящееся к человеку, экспрессирует белок IL-15 человека и белок SIRPα человека.
В еще одном варианте реализации шестого аспекта изобретения первое животное и второе животное являются одинаковыми, стадия введения в геном первого животного включает приведение в контакт первой плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок SIRPα человека, для получения второй плюрипотентной стволовой клетки, стадия введения в геном второго животного включает приведение в контакт второй плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок IL-15 человека, для получения третьей плюрипотентной стволовой клетки, причем третье животное, не относящееся к человеку, получают из третьей плюрипотентной стволовой клетки.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения плюрипотентная стволовая клетка является эмбриональной стволовой (ЭС)-клеткой или индуцированной плюрипотентной стволовой (иПС)-клеткой.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения в плюрипотентной стволовой клетке присутствует дефицит Rag2.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения в плюрипотентной стволовой клетке присутствует дефицит IL2rg.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения у третьего животного, не относящегося к человеку, присутствует дефицит одного или обоих из Rag2 и IL2rg.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность промотора IL-15 представляет собой последовательность промотора IL-15 человека.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность промотора IL-15 представляет собой последовательность эндогенного промотора IL-15 животного, не относящегося к человеку.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения интеграция приводит к замене гена IL-15, не относящегося к человеку, в локусе гена IL-15, не относящемся к человеку.
В другом варианте реализации шестого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
В седьмом аспекте настоящего документа предлагается способ пересадки трансплантата генномодифицированному животному, не относящемуся к человеку, которое экспрессирует белок IL-15 человека, причем способ включает: трансплантацию популяции клеток, включая гемопоэтические клетки человека, генномодифицированному животному, не относящемуся к человеку, которое получено по способу в соответствии с шестым аспектом изобретения или любым его вариантом реализации. В одном из таких вариантов реализации изобретения трансплантация включает инъекцию в хвостовую вену, инъекцию в печень плода или ретроорбитальную инъекцию.
В другом варианте реализации седьмого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, перед трансплантацией подвергают облучению сублетальными дозами.
В другом варианте реализации седьмого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения гемопоэтические клетки человека являются клетками CD34+.
В другом варианте реализации седьмого аспекта изобретения или в дополнительном варианте реализации любого из вышеуказанных вариантов реализации изобретения гемопоэтические клетки человека получены из печени плода, костного мозга взрослого человека или пуповинной крови.
В восьмом аспекте настоящего документа предлагается способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при уничтожении клетки-мишени, причем способ включает: введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и: (i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, (ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и (iii) трансплантат гемопоэтических клеток человека, притом, что генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и определение того, будет ли потенциальное терапевтическое антитело или антигенсвязывающий белок модулировать опосредованную ПК-клетками антителозависимую клеточную цитотоксичность в отношении клетки-мишени у генномодифицированного животного, не относящегося к человеку.
В девятом аспекте настоящего документа предлагается способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при уничтожении клетки-мишени, причем способ включает: выделение ПК-клетки из организма генномодифицированного животного, не относящегося к человеку, и, при этом, у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и: (i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, (ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и (iii) трансплантат гемопоэтических клеток человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; приведение в контакт изолированной ПК-клетки с потенциальным терапевтическим антителом или антигенсвязывающим белком и клеткой-мишенью; и определение антителозависимой или зависимой от антигенсвязывающего белка цитолитической активности выделенной ПК-клетки против клетки-мишени.
В десятом аспекте настоящего документа предлагается способ скрининга потенциального терапевтического антитела или антигенсвязывающего белка на предмет улучшенной эффективности при уничтожении клетки-мишени, причем способ включает: введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и: (i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, (ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и (iii) трансплантат гемопоэтических клеток человека, притом, что генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и определение того, будет ли проявлять потенциальное терапевтическое антитело или антигенсвязывающий белок улучшенную эффективность при уничтожении клетки-мишени в организме генномодифицированного животного, не относящегося к человеку.
В варианте реализации любого из восьмого, девятого и десятого аспектов изобретения клетка-мишень представляет собой одну или несколько из: опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки или паразитарной клетки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Файл патентной заявки содержит по меньшей мере одну фигуру, выполненную в цвете. Копии настоящего патента или публикации патентной заявки с цветными фигурами будут предоставлены Ведомством по запросу и с оплатой необходимой пошлины.
На Фиг. 1 представлено схематическое представление замены гена SIRPα мыши последовательностью SIRPα человека. Фиг. 1 (вверху) иллюстрирует локус Sirpα мыши с указанием относительного расположения экзонов 1-8. Фиг. 1 (внизу) иллюстрирует схематическое представление конечного целевого аллеля с экзонами 2-4 человека. Кодируемый химерный белок содержит внеклеточный домен, соответствующий аминокислотам 28-362 белка SIRPα дикого типа человека, слитых с внутриклеточной частью белка SIRPα мыши. Формы с диагональными полосами представляют вставленную последовательность человека.
На Фиг. 2 представлено схематическое изображение, показывающее направленную геномную замену гена IL-15 мыши, достигнутой для мыши 2. Пустые формы представляют вставленную последовательность человека.
На Фиг. 3А представлены графики, показывающие экспрессию гена hIL-15 в различных тканях нетрансплантированного SRG (SIRPα человека, Rag KO, IL-2rg KO) и SRG-15 (SIRPα человека, Rag KO, IL-2rg KO, IL-15 человека (мышь 1)) мышей. По оси Y приведен уровень мРНК hIL-15 по отношению к конститутивному гену Hprt.
На Фиг. 3В представлены графики, показывающие экспрессию гена hIL-15 человека в различных тканях, мышей RG (Rag KO, IL-2rg KO) без трансплантата и мышей SRG-15 без трансплантата (SIRPα человека, Rag KO, IL-2rg KO, IL-15 человека) (мышь №1 и мышь №2, как указано).
Фиг. 4 показывает уровни в сыворотке белка IL-15 человека у SRG, SRG IL-15h/m (мышь 2) и SRG 1L-I5h/h (мышь 2) мышей после нагрузки поли (I:C).
На Фиг. 5А представлен график, показывающий эффективную трансплантацию гемопоэтических клеток человека в крови мышей NSG, SRG и SRG-15 (мышь 2) через 12-14 недель после трансплантации. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*P < 0,05, **P < 0,01, ****P < 0,0001).
На Фиг. 5B представлены графики, показывающие количество клеток CD45+ человека в костном мозге (КМ), селезенке, лимфатических узлах (ЛУ), печени и легком SRG и SRG-15 (мышь 2) через 14 недель после трансплантации.
На Фиг. 6А представлены диаграммы, показывающие частоту встречаемости T- и ПК-клеток человека у мышей SRG и SRG-15 (мышь 1) в костном мозге (КМ), печени и легком.
На Фиг. 6В представлены графики, показывающие частоту встречаемости ПК-клеток человека у мышей SRG и SRG-15 (мышь 1) в различных тканях.
На Фиг. 6С представлены диаграммы и графики, показывающие созревание ПК-клеток человека в печени мышей SRG и SRG-15 (мышь 1).
На Фиг. 6D представлены графики, показывающие что клетки CD56dim CD16+ ПК экспрессируют высокие уровни рецепторов подавления цитотоксичности человека в селезенке мышей SRG-15.
На Фиг. 7А приведен график, показывающий частоту встречаемости ПК-клеток человека в крови мышей NSG, SRG и SRG-15 (мышь 2) через 10-12 недель после трансплантации. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*P < 0,05, **P < 0,01, ****P < 0,0001).
На Фиг. 7В представлен график, показывающий процент клеток NKp46+ человека в селезенке через 14 недель после трансплантации для SRG, SRG-15h/m и SRG-15h/h. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (* P < 0,05, ** P < 0,01, **** P < 0,0001).
На Фиг. 7C представлены графики, показывающие частоту встречаемости ПК-клеток человека в крови, селезенке (СЗ), печени и легком мышей SRG и SRG-15 (мышь 2) через 14 недель после трансплантации. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*P < 0,05, **P < 0,01, ****P < 0,0001).
На Фиг. 7D представлены графики, показывающие частоту встречаемости ПК-клеток человека в селезенке (СЗ), печени и легком мышей SRG и SRG-15 (мышь 2) через 14 недель после трансплантации. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*P < 0,05, **P < 0,01, **** P < 0,0001).
На Фиг. 8 представлены графики (слева), показывающие распределение Т- и ПК-клеток человека у мышей SRG и SRG-15 (мышь 2) в крови (гейтированные по клеткам CD45+ человека (гемопоэтические клетки) и клеткам NKp46+ (ПК-клетки)); и график (справа), показывающий процент клеток hCD45+, которые являются клетками NKp46+, в крови мышей SRG-15 с трансплантатом.
На Фиг. 9А представлены графики, показывающие распределение ПК-клеток и Т-клеток в селезенке, и графики, показывающие процент и количество NKp46+ клеток в селезенке мышей SRG-15 (мышь 2), несущих трансплантаты CD34+ huHSC, по сравнению с мышами SRG, несущими трансплантаты CD34+ huHSC.
На Фиг. 9В представлен график, показывающий состав иммунных клеток человека в крови мышей NSG (n = 5), SRG (n = 19) и SRG-15 (мышь 2) (n = 39) через 10-12 недель после трансплантации.
На Фиг. 9C представлено количество клеток CD45+ человека в тимусе мышей SRG и SRG-15 (мышь 2) через 14 недель после трансплантации.
На Фиг. 9D представлены типичные графики проточной цитометрии клеток hCD45+ в тимусе мыши SRG и SRG-15 (мышь 2).
На Фиг. 9E представлен график, показывающий состав клеток hCD45+ в тимусе мышей SRG (n = 8) и SRG-15 (мышь 2) (n = 4) через 14 недель после трансплантации.
На Фиг. 10А представлены графики, показывающие частоту встречаемости подмножеств ПК-клеток CD56bright CD16- и CD56dim CD16+ в крови и селезенке мышей SRG и SRG-15 (мышь 2) через семь недель после трансплантации.
На Фиг. 10В представлены графики, показывающие частоту встречаемости подмножеств ПК-клеток CD56bright CD16- и CD56dim CD16+ в крови и селезенке мышей SRG и SRG-15 (мышь 2) через семь недель после трансплантации.
На Фиг. 10C представлены диаграммы и графики, показывающие экспрессию киллерных ингибиторных рецепторов (КИР) на подмножествах ПК-клеток у человека и мышей SRG-15 (мышь 2).
На Фиг. 11 представлено два графика (вверху слева и вверху справа), показывающие распределение CD16+ против CD16- ПК-клеток в крови мышей SRG-15 (мышь 2) по отношению к образцу МКПК. Кроме того, на Фиг. 11 представлен график (внизу), показывающий процент клеток NKp46+, которые представляют собой CD16+, против CD16- в крови, полученной от мышей SRG-15 (мышь 2), или образце, полученном из МКПК.
На Фиг. 12 представлены графики, показывающие развитие ПК-клеток человека в костном мозге мышей SRG и SRG-15 (мышь 2) через семь недель после трансплантации. Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*P < 0,05, **P < 0,01, ****P < 0,0001).
На Фиг. 13А представлены графики, показывающие частоту встречаемости Т-клеток человека у мышей SRG и SRG-15 (мышь 1) в различных тканях. (K/мкл = тысяча клеток на мкл).
На Фиг. 13B представлены диаграммы и графики, показывающие фенотип CD8+ Т-клеток человека в крови и печени для мышей SRG и SRG-15 (мышь 1).
На Фиг. 14А представлены диаграммы и график, показывающие экспрессию ткане-резидентного маркера CD69 в CD8+ Т-клетках легкого мышей SRG и SRG-15 (мышь 1).
На Фиг. 14В представлены диаграмма и график, показывающие экспрессию ткане-резидентного маркера CD69 в CD8+ Т-клетках печени мышей SRG и SRG-15 (мышь 1).
На Фиг. 15А представлены графики, показывающие частоту встречаемости hCD3+ Т-клеток в селезенке, легком и печени мышей SRG и SRG-15 (мышь 2) через 16 недель после трансплантации.
На Фиг. 15B представлены графики, показывающие соотношение CD4/CD8 в селезенке, легком и печени мышей SRG и SRG-15 (мышь 2) через 16 недель после трансплантации.
На Фиг. 16А представлены графики, показывающие частоту встречаемости лимфоцитов собственной пластинки слизистой оболочки человека (ЛСП) в толстой кишке мышей SRG и SRG-15 (мышь 1).
На Фиг. 16В представлены графики, показывающие частоту встречаемости лимфоцитов собственной пластинки слизистой оболочки человека (ЛСП) в толстой кишке мышей SRG и SRG-15 (мышь 1).
Фиг. 17А вместе с Фиг. 17B-17C показывает эффективную трансплантацию внутриэпителиальных лимфоцитов (ВЭЛ) человека в тонком кишечнике 16-недельных мышей SRG-15 (мышь 1). На Фиг. 17А представлены диаграммы и графики, показывающие клетки CD45+ и CD8+ Т-клетки человека во фракции ВЭЛ мышей SRG и SRG-15 (мышь 1).
На Фиг. 17В представлены изображения иммуногистохимического окрашивания hCD45 в тонком кишечнике 16-недельных мышей SRG и SRG-15 (мышь 1).
На Фиг. 17С представлены графики, показывающие фенотипические характеристики CD8+ Т-клеток человека в селезенке и тонком кишечнике мышей SRG-15 (мышь 1).
На Фиг. 18А представлены типичные графики сортировки клеток с активацией флуоресценции (СКАФ), показывающие клетки CD45+ мыши и человека во фракции ВЭЛ мышей SRG и SRG-15 (мыши 2) через 16 недель после трансплантации.
На Фиг. 18В представлены графики, показывающие количество ВЭЛ человека в тонком кишечнике мышей SRG по сравнению с SRG-15 (мышь 2) и количество ЛСП человека в толстом кишечнике мышей SRG по сравнению с SRG-15 (мышь 2). Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*** P < 0,001).
На Фиг. 18С представлен график, показывающий состав клеток hCD3+ в тонком кишечнике мышей SRG-15 (мышь 2). Один типичный график СКАФ для восьми мышей SRG-15 (мышь 2).
На Фиг. 18D представлены графики, демонстрирующие фенотипические характеристики hCD3 + hCD8 + Т-клеток в селезенке и тонком кишечнике мышей SRG-15 (мышь 2).
На Фиг. 18E представлены изображения иммуногистохимического окрашивания hCD8 в тонком кишечнике мышей SRG и SRG-15 (мышь 2). Стрелки указывают на hCD8+ ВЭЛ. Изображения являются типичными для трех мышей на группу.
На Фиг. 19А представлены диаграммы и графики, показывающие распределение и количество клеток hCD45+ в популяциях внутриэпителиальных лимфоцитов мышей SRG и SRG-15 и относительные значения процентов ПК-клеток и T-клеток в популяциях клеток hCD45+ в популяциях внутриэпителиальных лимфоцитов мышей SRG и SRG-15 (мышь 2).
На Фиг. 19B представлены диаграммы и графики, показывающие распределение и процент CD16+ и CD16- ПК-клеток во внутриэпителиальных лимфоцитах мышей SRG-15 (мышь 2) по сравнению с кровью и селезенкой.
На Фиг. 19C представлены диаграммы и графики, показывающие распределение и количество ВЭЛ человека и лимфоцитов собственной пластинки слизистой оболочки человека (ЛСП) у мышей SRG и SRG-15 (мышь 2).
На Фиг. 20А и 20В представлены диаграммы и графики, демонстрирующие наличие заметных пейеровых бляшек, содержащих преимущественно клетки hCD45+ у мышей SRG-15 (мышь 2).
На Фиг. 21А представлена временная шкала расселения и отбора образцов фекалий для секвенирования микрофлоры кишечника.
На Фиг. 21В приведена диаграмма, показывающая относительную распространенность мышиных бактерий в кишечнике мышей SRG и SRG-15 без трансплантата и с трансплантатом (мышь 1).
На Фиг. 22 проиллюстрирована функциональная значимость ткане-резидентных Т-клеток человека, у мышей SRG-15. Более конкретно, на Фиг. 22 представлен график, демонстрирующий функциональную значимость ВЭЛ человека при клиренсе острой ротавирусной инфекции.
На Фиг. 23А представлены графики ViSNE, показывающие анализ на основе CyTOF для 42 параметров CD56bright CD16- и CD56dim CD16+ ПК-клеток у человека (n = 20) и мышей SRG-15 (мышь 2) (n = 9). Каждая точка представляет одну клетку.
На Фиг. 23В представлены графики ViSNE, показывающие интенсивность экспрессии восьми выбранных маркеров на CD56bright CD16- ПК-клетках у человека (n = 20) и мышей SRG-15 (мышь 2) (n = 9).
На Фиг. 23C представлены графики ViSNE, показывающие интенсивность экспрессии восьми выбранных маркеров на CD56dim CD16+ ПК-клетках у человека (n = 20) и мышей SRG-15 (n = 9).
На Фиг. 24А приведен график, показывающий процентное содержание у мышей SRG против SRG-15 (мышь 2) ПК-клеток крови, которые представляют собой CD69+, до и после инъекции поли-IC.
На Фиг. 24В представлены графики, показывающие выработку IFNγ ПК-клетками, полученными от SRG и SRG-15 (мышь 2) после стимуляции in vitro поли I:C или IL-12p70 человека. ПК-клетки мышей сравнивали с ПК-клетками, полученными из здоровых МКПК человека. Все образцы нормированы по количеству ПК.
На Фиг. 24C представлены графики, показывающие цитолитическую способность ПК-клеток селезенки мышей SRG и SRG-15 (мышь 2) против клеток K562 без лимфоцитарного антигена человека (HLA) класса I (слева), либо против клеток Raji в отсутствие (вверху справа) или присутствии (внизу справа) антитела против CD20. SRG-15 №1 и SRG-15 №2 представляют два разных препарата ПК-клеток, полученных от однопометных SRG-15 (мышь 2).
На Фиг. 25А приведен график, показывающий подавление роста опухоли ПК-клетками человека у мышей SRG-15 (мышь 2) после лечения ритуксимабом (RTX). Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (*** P < 0,001).
На Фиг. 25В представлены диаграммы и график, показывающие частоту встречаемости ПК-клеток и Т-клеток человека в ксенотрансплантатах опухоли человека у нелеченных (n = 5) и леченных RTX мышей SRG-15 (n = 1). Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (***P < 0,001).
На Фиг. 25C представлены диаграммы и графики, показывающие подмножества ПК-клеток человека в крови и опухоли нелеченных (n = 2) и леченных RTX мышей SRG-15 (n = 1). Все данные приведены как среднее значение ± с.о.с. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни (***P < 0,001).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Перед тем, как описывать способы и композиции по настоящему изобретению, следует понимать, что настоящее изобретение не ограничивается конкретным описанным способом или композицией, поскольку таковые могут варьироваться. Кроме того, необходимо понимать, что используемая в настоящем документе терминология предназначена только для описания конкретных вариантов реализации изобретения и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое им обычно придает специалист в области техники, к которой относится настоящее изобретение. Хотя любые способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, могут применяться в практике или тестах согласно настоящему изобретению, в настоящем документе описаны конкретные способы и материалы. Все публикации, процитированные в настоящем документе, включены в настоящий документ посредством ссылки для раскрытия и описания способов и/или материалов, в связи с которыми цитируются публикации. Необходимо понимать, что настоящий документ преобладает над содержанием любой включенной публикации в той степени, в которой существует противоречие.
Как будет очевидно для специалистов в данной области техники после прочтения настоящего документа, каждому из отдельных вариантов реализации изобретения, описанных и проиллюстрированных в настоящем документе, присущи дискретные компоненты и признаки, которые могут быть легко отделены или объединены с признаками любого из других вариантов реализации изобретения без выхода за пределы объема настоящего изобретения. Любой упомянутый метод может быть выполнен в указанном порядке событий или в любом другом порядке, который является возможным с логической точки зрения.
Необходимо отметить, что в настоящем документе и в прилагаемой формуле изобретения, формы единственного числа включают ссылки на множественное число, если контекст явно не диктует иного. Так, например, ссылка на «клетку» включает множество таких клеток, а ссылка на «белок» включает ссылку на один или более белков и их эквивалентов, известных специалистам в данной области техники, и т.д.
Публикации, обсуждаемые в настоящем документе, предоставляются исключительно по причине их раскрытия до даты подачи настоящей заявки. Ничто в настоящем документе не должно толковаться как признание того, что настоящее изобретение не имеет права быть отнесено к более ранней дате, чем такая публикация.
Предлагаются генномодифицированные животные, не относящиеся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку. Кроме того, предлагаются способы получения животных, не относящихся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку, и способы использования животных, не относящихся к человеку, которые экспрессируют SIRPα человека и IL-15 человека из генома животного, не относящегося к человеку. Указанные животные и способы находят множество применений в данной области техники, в том числе, например, при моделировании развития и функционирования Т-клеток человека и/или природных клеток-киллеров (ПК) человека; при моделировании инфекции патогеном человека, например, инфекции патогеном человека в конкретных тканях, например, инфекции кишечника, легких или печени человека; при моделировании инфекции патогеном человека Т-клеток и/или ПК-клеток человека; при скрининге in vivo на предмет агентов, подавляющих инфекцию патогеном, который активирует, индуцирует и/или направленно действует на Т-клетки и/или ПК-клетки; при скрининге in vivo на предмет агентов, модулирующих развитие и/или функционирование Т-клеток и/или ПК-клеток человека, например, в здоровом или больном состоянии; при скрининге in vivo на предмет агентов, которые являются токсичными для Т-клеток и/или ПК-клеток человека; при скрининге in vivo на предмет агентов, которые предотвращают, смягчают или устраняют токсические эффекты токсичных агентов на Т-клетки и/или ПК-клетки человека; при скрининге in vivo на предмет потенциальных вакцин, индуцирующих Т-клетки; и при скрининге in vivo и in vitro на предмет агентов, которые подавляют рост опухоли и/или инфекцию, активируя процессы опосредованной ПК-клетками антителозависимой клеточной цитотоксичности (АЗКЦ).
Гуманизированные sirpα животные, не относящиеся к человеку
В некоторых аспектах настоящего изобретения предлагается гуманизированное животное SIRPα, не относящееся к человеку. Под гуманизированным SIRPα животным, не относящимся к человеку, или «SIRPα животным, не относящимся к человеку» подразумевается животное, не относящееся к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека. В настоящем документе термин «белок SIRPα человека» означает белок, который представляет собой белок SIRPα дикого типа (или нативный) человека или вариант белка SIRPα дикого типа (или нативного) человека, который сохраняет одну или более сигнальных и/или рецепторных функций белка SIRPα дикого типа человека. В настоящем документе термин «вариант» определяет выделенный природный генетический мутант полипептида человека или последовательность нуклеиновой кислоты или полученную рекомбинантным способом модификацию последовательности полипептида или нуклеиновой кислоты человека, каждый из которых содержит одну или более мутаций по сравнению с соответствующей последовательностью нуклеиновой кислоты или полипептида дикого типа. Например, такие мутации могут представлять собой одну или более аминокислотных замен, инсерций и/или делеций. Термин «вариант» дополнительно включает гомологи и ортологи человека. В некоторых вариантах реализации изобретения вариант полипептида по настоящему изобретению обладает идентичностью 70% или более, например, идентичностью 75%, 80% или 85% или более полипептиду дикого типа человека, например, идентичностью 90%, 91%, 92%, 93 %, 94%, 95%, 96%, 97%, 98% или 99% полипептиду дикого типа человека.
Процент идентичности двух последовательностей может быть определен с применением любого подходящего способа из уровня техники, например, выравнивания последовательностей с применением, например, общедоступного программного обеспечения. Мутации могут быть введены с применением стандартных методов молекулярной биологии, таких как сайт-направленный мутагенез, ПЦР-опосредованный мутагенез, направленная эволюция и т.п. Специалисту в данной области техники будет понятно, что одна или более замен нуклеиновой кислоты могут быть введены без изменения аминокислотной последовательности, и что одна или более аминокислотных мутаций могут быть введены без изменения функциональных свойств белка человека.
Консервативные аминокислотные замены могут быть осуществлены в белках человека для получения вариантов белка человека. Под консервативными аминокислотными заменами понимаются признанные в уровне техники замены одной аминокислоты другой аминокислотой, имеющей сходные характеристики. Например, каждая аминокислота может быть описана как имеющая одну или более из следующих характеристик: электроположительная, электроотрицательная, алифатическая, ароматическая, полярная, гидрофобная и гидрофильная. Консервативная замена представляет собой замену одной аминокислоты, обладающей указанным структурным или функциональным признаком, другой аминокислотой, обладающей такой же характеристикой. Кислые аминокислоты включают аспартат, глутамат; основные аминокислоты включают гистидин, лизин, аргинин; алифатические аминокислоты включают изолейцин, лейцин и валин; ароматические аминокислоты включают фенилаланин, глицин, тирозин и триптофан; полярные аминокислоты включают аспартат, глутамат, гистидин, лизин, аспарагин, глутамин, аргинин, серин, треонин и тирозин; и гидрофобные аминокислоты включают аланин, цистеин, фенилаланин, глицин, изолейцин, лейцин, метионин, пролин, валин и триптофан; причем консервативные замены включают замены аминокислотами из той же группы. Кроме того, аминокислоты могут быть описаны с точки зрения относительного размера, притом, что аланин, цистеин, аспартат, глицин, аспарагин, пролин, треонин, серин, валин обычно считаются малыми.
Варианты человека могут содержать синтетические аналоги аминокислот, производные аминокислот и/или нестандартные аминокислоты, в качестве примера включающие, без ограничения, альфа-аминомасляную кислоту, цитруллин, канаванин, цианоаланин, диаминомасляную кислоту, диаминопимелиновую кислоту, дигидроксифенилаланин, дьенколовую кислоту, гомоаргинин, гидроксипролин, норлейцин, норвалин, 3-фосфосерин, гомосерин, 5-гидрокситриптофан, 1-метилгистидин, метилгистидин и орнитин.
Варианты человека обычно кодируются нуклеиновыми кислотами, обладающими высокой степенью идентичности нуклеиновой кислоте, кодирующей белок дикого типа человека. Молекула, комплементарная нуклеиновой кислоте, кодирующей вариант человека, специфично гибридизуется с нуклеиновой кислотой, кодирующей вариант человека дикого типа, в условиях высокой строгости. Нуклеиновые кислоты, кодирующие вариант, человека могут быть выделены или получены рекомбинантным, или синтетическим способом с применением хорошо известной методологии. Кроме того, термин «белок SIRPα человека» включает фрагменты белка SIRPα дикого типа человека (или его варианта), которые сохраняют одну или более сигнальных и/или рецепторных функций белка SIRPα дикого типа человека, например, внеклеточный домен белка SIRPα человека.
Термин «белок SIRPα человека» дополнительно включает химерные белки, т.е. химерные белки, которые содержат один или более фрагментов белка SIRPα дикого типа человека (или его варианта) и которые сохраняют одну или более сигнальных и/или рецепторных функций белка SIRPα дикого типа человека. Химерный белок, который содержит один или более фрагментов белка SIRPα дикого типа человека (или его варианта), например, в сочетании с одним или несколькими пептидами, или полипептидами, отличными от человеческого, в настоящем документе дополнительно может называться гуманизированным белком SIRPα. Так, например, белок, который содержит аминокислотную последовательность внеклеточного домена белка SIRPα дикого типа человека, слитую с сигнальным доменом белка SIRPα дикого типа мыши, охватывается термином «белок SIRPα человека».
В некоторых случаях белок SIRPα человека, соответствующий настоящему описанию, содержит аминокислотную последовательность, по меньшей мере на около 70%, по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95%, по меньшей мере на около 98%, по меньшей мере на около 99% или 100% идентичную аминокислотной последовательности аминокислот 28-362 из SEQ ID NO: 12.
Последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, является, следовательно, полинуклеотидом, который содержит кодирующую последовательность для белка SIRPα человека, например, белка SIRPα дикого типа человека, варианта белка SIRPα дикого типа человека, фрагмента белка SIRPα дикого типа человека (или его варианта), который сохраняет одну или более сигнальных и/или рецепторных функций белка SIRPα дикого типа человека или химерных белков, т.е. химерных белков, которые содержат один или больше фрагментов белка SIRPα дикого типа человека (или его варианта) и которые сохраняют одну или более сигнальных и/или рецепторных функций белка SIRPα дикого типа человека.
SIRPα (также известный как «сигнальный регуляторный белок α» и «CD172A» у человека) является членом семейства сигнально-регуляторных белков (SIRP), а также относится к суперсемейству иммуноглобулина. Было показано, что SIRPα улучшает приживление клеточных трансплантатов у иммунодефицитных мышей (Strowig et al., Proc Natl Acad Sci USA 2011, 108: 13218-13223). Полипептидная последовательность SIRPα дикого типа человека и последовательность нуклеиновой кислоты, которая кодирует SIRPα дикого типа человека, можно найти в Genbank, учетный номер NM_001040022.1 (вариант 1), NM_001040023.1 (вариант 2) и NM_080792.2 (вариант 3). Ген SIRPα сохраняется, по крайней мере, у шимпанзе, макаки-резус, собаки, коровы, мыши, крысы и курицы. Геномный локус, кодирующий белок SIRPα дикого типа человека, можно найти в геноме человека в хромосоме 20; NC_000020.11 (1894117-1939896). Последовательность белка кодируется экзонами с 1 по 8 в указанном локусе. По существу, в некоторых вариантах реализации изобретения последовательность нуклеиновой кислоты, содержащая кодирующую последовательность для SIRPα человека, содержит один или более экзонов 1-8 гена SIRPα человека. В некоторых случаях последовательность нуклеиновой кислоты дополнительно содержит аспекты геномного локуса SIRPα человека, например, интроны, 3' и/или 5' нетранслируемые последовательности (НТУ). В некоторых случаях последовательность нуклеиновой кислоты содержит полноразмерные участки геномного локуса SIRPα человека. В некоторых случаях последовательность нуклеиновой кислоты содержит экзоны 2-4 геномного локуса SIRPα человека.
В организме гуманизированного SIRPα животного, не относящегося к человеку, согласно настоящей заявке последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, функционально связана с одной или несколькими регуляторными последовательностями гена SIRPα, например, регуляторной последовательностью гена SIRPα животного, не относящегося к человеку. Регуляторными последовательностями SIRPα, не относящимися к человеку, например, мышиными, являются те последовательности геномного локуса SIRPα животного, не относящегося к человеку, которые регулируют экспрессию SIRPα у животного, не относящегося к человеку, например, 5'-регуляторные последовательности, например, промотор SIRPα, 5'-нетранслируемый участок SIRPα (НТУ) и т.д.; 3'-регуляторные последовательности, например, 3' НТУ; и энхансеры и т.д.
«Промотор» или «промоторная последовательность» относится к регуляторному участку ДНК, способному связываться с РНК-полимеразой в клетке и инициировать транскрипцию кодирующей последовательности в направлении по ходу транскрипции (направление 3'). Последовательность промотора ограничена на 3'-конце сайтом инициации транскрипции и удлиняется в направлении против хода транскрипции (направление 5'), чтобы включать минимальное количество оснований или элементов, необходимых для инициации транскрипции на уровнях, обнаруживаемых выше фонового. Внутри промоторной последовательности будет найден сайт инициации транскрипции, а также связывающие белок домены, ответственные за связывание с РНК-полимеразой. Эукариотические промоторы часто, но не всегда, содержат фрагменты «TATA» и «CAT». Особый интерес для настоящего изобретения представляют регуляторные элементы ДНК, например, промоторы, которые способствуют транскрипции белка человека с одним и тем же характером пространственной и временной экспрессии, т.е. в одних и тех же клетках и тканях и в одно и то же время, что наблюдалось бы для соответствующего эндогенного белка.
SIRPα мыши расположен на хромосоме 2; NC 000068,7 (129592606-129632228), и кодирующую последовательность мыши SIRPα можно найти в Genbank, учетный номер NM_007547.4 (изоформа 1), NM_001177647.2 (изоформа 2), NM_001291019.1 (изоформа 3), NM_001291020.1 (изоформа 3), NM 001291021.1 (изоформа 4), NM_001291022.1 (изоформа 5). Регуляторные последовательности SIRPα мыши хорошо известны из уровня техники и могут быть легко идентифицированы с применением методов in silico, например, путем ссылки на вышеуказанные учетные номера Genbank в браузере UCSC Genome во всемирной паутине или экспериментальными методами, такими как описаны в уровне техники. В некоторых случаях, например, если последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, находится в геномном локусе мыши SIRPα, регуляторные последовательности, функционально связанные с кодирующей последовательностью SIRPα человека, являются эндогенными или нативными для генома мыши, т.е., они присутствовали в геноме мыши до интеграции последовательностей нуклеиновой кислоты человека.
В некоторых случаях гуманизированное SIRPα животное, не относящееся к человеку, например, мышь, получают путем случайной интеграции или инсерции последовательности нуклеиновой кислоты человека, кодирующей белок SIRPα человека (включая фрагменты, описанные выше), т.е., «последовательности нуклеиновой кислоты SIRPα человека» или «последовательности SIRPα человека» в геном. Как правило, в таких вариантах реализации изобретения местоположение последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека, в геноме неизвестно. В других случаях гуманизированное SIRPα животное, не относящееся к человеку, получают путем целенаправленной интеграции или инсерции последовательности нуклеиновой кислоты SIRPα человека в геном путем, например, гомологичной рекомбинации. При гомологичной рекомбинации полинуклеотид вводят в геном хозяина в целевом локусе, одновременно удаляя геномный материал хозяина, например, 50 пар оснований (п.о.) или более, 100 п.о. или более, 200 п.о. или более, 500 п.о. или более, 1 тыс. п.о. или более, 2 тыс. п.о. или более, 5 тыс. п.о. или более, 10 тыс. п.о. или более, 15 тыс. п.о. или более, 20 тыс. п.о. или более или 50 тыс. п.о. или более геномного материала, из целевого локуса. Так, например, у гуманизированной мыши SIRPα, содержащей последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, полученной путем направленного действия последовательности нуклеиновой кислоты SIRPα человека на локус SIRPα мыши, последовательность нуклеиновой кислоты SIRPα человека может заменить часть или всю последовательность мыши, например, экзоны и/или интроны, в локусе SIRPα. В некоторых из таких случаев последовательность нуклеиновой кислоты SIRPα человека интегрируется в локус SIRPα мыши таким образом, что экспрессия последовательности SIRPα человека регулируется нативными или эндогенными регуляторными последовательностями в локусе SIRPα мыши. Другими словами, регуляторная(ые) последовательность(ти), с которой функционально связана последовательность нуклеиновой кислоты, кодирующая белок SIRPα человека, является нативной регуляторной последовательностью SIRPα в локусе SIRPα мыши.
В некоторых случаях интеграция последовательности SIRPα человека не влияет на транскрипцию гена, в который интегрирована последовательность SIRPα человека. Например, если последовательность SIRPα человека интегрируется в кодирующую последовательность в виде интеина, или последовательность SIRPα человека содержит пептид 2A, то последовательность SIRPα человека будет транскрибироваться и транслироваться одновременно с геном, в который интегрирована последовательность SIRPα человека. В других случаях интеграция последовательности SIRPα человека прерывает транскрипцию гена, в который интегрирована последовательность SIRPα человека. Например, после интеграции последовательности SIRPα человека посредством гомологичной рекомбинации, часть или вся кодирующая последовательность в локусе интеграции может быть удалена таким образом, что вместо этого транскрибируется последовательность SIRPα человека. В некоторых из таких случаев интеграция последовательности SIRPα человека создает нулевую мутацию и, следовательно, нулевой аллель. Нулевой аллель представляет собой мутантную копию гена, которая полностью лишена нормальной функции этого гена. Это может быть результатом полного отсутствия генного продукта (белка, РНК) на молекулярном уровне или экспрессии нефункционального генного продукта. На фенотипическом уровне нулевой аллель неотличим от удаления всего локуса.
В некоторых случаях гуманизированное SIRPα животное, не относящееся к человеку, например, мышь, содержит одну копию последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека. Например, животное, не относящееся к человеку, может быть гетерозиготным по указанной последовательности нуклеиновой кислоты. Другими словами, один аллель в локусе будет содержать указанную последовательность нуклеиновой кислоты, в то время как другой будет эндогенным аллелем. Например, как обсуждалось выше, в некоторых случаях последовательность нуклеиновой кислоты SIRPα человека интегрирована в организм животного, не относящегося к человеку, например, мыши, в локус SIRPα, таким образом, что возникает нулевой аллель для SIRPα животного, не относящегося к человеку. В некоторых таких вариантах реализации изобретения гуманизированное SIRPα животное, не относящееся к человеку, может быть гетерозиготным по последовательности нуклеиновой кислоты, кодирующей SIRPα человека, т.е., гуманизированное животное SIRPα, не относящееся к человеку, содержит один нулевой аллель для SIRPα животного, не относящегося к человеку (аллель, содержащий указанную последовательность нуклеиновой кислоты) и один эндогенный аллель SIRPα (дикого типа или иной). Другими словами, животное, не относящееся к человеку, представляет собой SIRPαh/m животное, не относящееся к человеку, где «h» представляет аллель, содержащий последовательность человека, а «m» представляет эндогенный аллель. В других случаях гуманизированный SIRPα содержит две копии указанной последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека. Например, животное, не относящееся к человеку, например, мышь, может быть гомозиготным по указанной последовательности нуклеиновой кислоты, т.е., оба аллеля для локуса в диплоидном геноме будут содержать указанную последовательность нуклеиновой кислоты, т.е. гуманизированное SIRPα животное, не относящееся к человеку, содержит два нулевых аллеля для SIRPα животного, не относящегося к человеку (аллель, содержащий указанную последовательность нуклеиновой кислоты). Другими словами, животное, не относящееся к человеку, представляет собой SIRPαh/h животное, не относящееся к человеку.
В некоторых вариантах реализации изобретения гуманизированное SIRPα животное, не относящееся к человеку, например, мышь, содержит другие генетические модификации. В некоторых вариантах реализации изобретения гуманизированное SIRPα животное, не относящееся к человеку, является животным с ослабленным иммунитетом. Например, гуманизированное SIRPα животное, не относящееся к человеку, может содержать по меньшей мере один нулевой аллель для гена Rag2 («активирующий рекомбинацию ген 2», причем кодирующая последовательность для гена мыши может быть найдена в Genbank, учетный номер NM_009020.3). В некоторых вариантах реализации изобретения гуманизированное SIRPα животное, не относящееся к человеку, содержит два нулевых аллеля для Rag2. Другими словами, гуманизированное SIRPα животное, не относящееся к человеку, является гомозиготно нулевым по Rag2. В другом примере гуманизированное SIRPα животное, не относящееся к человеку, содержит по меньшей мере один нулевой аллель для гена IL2rg («рецептор интерлейкина 2, гамма», также известный как общая гамма-цепь или γC, причем кодирующая последовательность для гена мыши может быть найдена в Genbank, учетный номер NM_013563.3). В некоторых вариантах реализации изобретения гуманизированное животное SIRPα, не относящееся к человеку, содержит два нулевых аллеля для IL2rg. Другими словами, гуманизированное SIRPα животное, не относящееся к человеку, является гомозиготно нулевым по IL2rg, т.е. оно ,является IL2rg-/- (или IL2rgY/-, где ген IL2rg расположен на Х-хромосоме, как у мыши). В некоторых вариантах реализации изобретения SIRPα животное, не относящееся к человеку, содержит нулевой аллель как для Rag2, так и для IL2rg, т.е. Rag2-/- IL2rg-/- (или Rag2-/- IL2rgY/-, где ген IL2rg расположен на Х-хромосоме, как у мыши). Дополнительно предусматриваются другие генетические модификации. Например, гуманизированное SIRPα животное, не относящееся к человеку, может содержать модификации в других генах, связанных с развитием и/или функционированием гемопоэтических клеток и иммунной системы, например, замену одного или нескольких других генов животного, не относящегося к человеку, последовательностью нуклеиновой кислоты, кодирующей ортолог человека. Дополнительно или в качестве альтернативы, гуманизированное SIRPα животное, не относящееся к человеку, может содержать модификации генов, связанных с развитием и/или функцией других клеток и тканей, например, генов, связанных с нарушениями или заболеваниями человека, или генов, которые при модификации у животного, не относящегося к человеку, например, мыши, обеспечивают модели расстройств и заболеваний человека.
Гуманизированные il-15 животные, не относящиеся к человеку
В некоторых аспектах настоящего изобретения представлено гуманизированное IL-15 животное, не относящееся к человеку. Под гуманизированным IL-15 животным, не относящимся к человеку, или «IL-15 животным, не относящимся к человеку», подразумевается животное, не относящееся к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека. В настоящем документе термин «белок IL-15 человека» означает белок, который представляет собой белок IL-15 дикого типа (или нативный) человека или вариант белка IL-15 дикого типа (или нативного) человека, который сохраняет одну или более сигнальных функций белка IL-15 дикого типа (или нативного) человека, например, который позволяет стимулировать (или проводить сигнал через) рецептор IL-15 человека и/или который способен связываться с альфа-субъединицей рецептора IL-15 человека рецептора IL-15 человека и/или который способен связываться с IL-2R бета/IL-15R бета и общей γ-цепью (γc). Кроме того, термин «белок IL-15 человека» включает фрагменты белка IL-15 дикого типа человека (или его вариантов), которые сохраняют одну или более сигнальных функций белка IL-15 дикого типа человека, например, фрагмент белка IL-15 человека, который позволяет стимулировать (или проводить сигнал через) рецептор IL-15 человека и/или который способен связываться с альфа-субъединицей рецептора IL-15 человека рецептора IL-15 человека и/или который способен связываться с IL-2R бета/IL-15R бета и общей γ-цепью (γc).
Термин «белок IL-15 человека» дополнительно включает химерные белки, т.е., химерные белки, которые содержат один или более фрагментов белка IL-15 дикого типа человека (или его варианта) и которые сохраняют одну или более сигнальных функций белка IL-15 дикого типа человека, например, как описано выше. Химерный белок, который содержит один или более фрагментов белка IL-15 дикого типа человека (или его варианта) дополнительно может упоминаться в настоящем документе как гуманизированный белок IL-15.
Последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, является, следовательно, полинуклеотидом, который содержит кодирующую последовательность для белка IL-15 человека, т.е., белка IL-15 дикого типа человека, варианта белка IL-15 дикого типа человека, фрагмента белка IL-15 дикого типа человека (или его варианта), который сохраняет одну или более сигнальных функций белка IL-15 дикого типа человека, или химерных белков, т.е., химерных белков, которые содержат один или более фрагментов белка IL-15 дикого типа человека (или его варианта) и которые сохраняют одну или более сигнальных функций белка IL-15 дикого типа человека, например, как описано выше.
IL-15 (также известный как «интерлейкин 15») представляет собой цитокин, который стимулирует пролиферацию Т-лимфоцитов. Полипептидная последовательность IL-15 дикого типа человека и последовательность нуклеиновой кислоты, которая кодирует IL-15 дикого типа человека, могут быть найдены в Genbank, учетный номер NM_000585.4; NP_000576.1 (изоформа 1), NM_172175.2; NP_751915.1 (изоформа 2). Геномный локус, кодирующий белок IL-15 дикого типа человека, можно найти в геноме человека на хромосоме 4; NC_000004.12 (141636596-141733987). Локус IL-15 человека содержит 8 экзонов, причем экзоны 3-8 являются кодирующими экзонами. Таким образом, в некоторых вариантах реализации изобретения последовательность нуклеиновой кислоты, содержащая кодирующую последовательность для IL-15 человека, содержит один или более экзонов 3-8 гена IL-15 человека (т.е., кодирующие экзоны 1-6, см. Фиг. 2). Например, были идентифицированы различные изоформы мРНК IL-15, которые продуцируются с применением следующих комбинаций экзонов: Экзоны 1-2-3-4-5-6-7-8; Экзоны 1-3-4-5-6-7-8 или Экзоны 1-3-4-(альтернативный экзон 5)-5-6-7-8). В некоторых случаях последовательность нуклеиновой кислоты дополнительно содержит аспекты геномного локуса IL-15 человека, например, интроны, 3 'и/или 5' нетранслируемые последовательности (НТУ). В некоторых случаях последовательность нуклеиновой кислоты содержит полноразмерные участки геномного локуса IL-15 человека. В некоторых случаях последовательность нуклеиновой кислоты содержит экзоны 5-8 геномного локуса IL-15 человека (т.е., кодирующие экзоны 3-6).
В некоторых случаях белок IL-15 человека согласно настоящему документу содержит аминокислотную последовательность, по меньшей мере на около 70%, по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90%, по меньшей мере на около 95%, по меньшей мере на около 98%, по меньшей мере на около 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 31.
В организме гуманизированного IL-15 животного, не относящегося к человеку, которое является объектом заявки, последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, функционально связана с одной или несколькими регуляторными последовательностями гена IL-15, например, регуляторной последовательностью гена IL-15 животного, не относящегося к человеку. Регуляторные последовательности животного, не относящегося к человеку, например, регуляторные последовательности IL-15 мыши, являются такими последовательностями геномного локуса IL-15 животного, не относящегося к человеку, которые регулируют экспрессию IL-15 у животного, не относящегося к человеку, например, 5'-регуляторные последовательности, например, промотор IL-15, 5’ нетранслируемый участок IL-15 (НТУ) и т.д.; 3'-регуляторные последовательности, например, 3' НТУ; и энхансеры и т.д. IL-15 мыши расположен на Хромосоме 8, NC_000074.6 (82331624-82403227, комплементарный), а кодирующая последовательность IL-15 мыши может быть найдена в Genbank, учетный номер NM_008357.2 (вариант 1); NM_001254747.1 (вариант 2). Регуляторные последовательности IL-15 мыши хорошо известны из уровня техники и могут быть легко идентифицированы с применением методов in silico, например, путем ссылки на вышеупомянутые номера доступа Genbank в браузере UCSC Genome во всемирной паутине на genome.ucsc.edu, или экспериментальными методами, как описано в уровне техники. В некоторых случаях, например, если последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, находится в геномном локусе IL-15 мыши, то регуляторные последовательности, функционально связанные с кодирующей последовательностью IL-15 человека, являются эндогенными или нативными для генома мыши, т.е., они присутствовали в геноме мыши до интеграции последовательностей нуклеиновой кислоты человека.
В некоторых случаях гуманизированное IL-15 животное, не относящееся к человеку, например, мышь, получают случайной интеграцией или инсерцией последовательности нуклеиновой кислоты человека, кодирующей белок IL-15 человека (включая фрагменты, как описано выше), т.е., «последовательности нуклеиновой кислоты IL-15 человека» или «последовательности IL-15 человека», в геном. Как правило, в таких вариантах реализации изобретения местоположение последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека, в геноме неизвестно. В других случаях гуманизированное IL-15 животное, не относящееся к человеку, получают путем направленной интеграции или инсерции последовательности нуклеиновой кислоты IL-15 человека в геном, например, путем гомологичной рекомбинации. При гомологичной рекомбинации полинуклеотид вводят в геном хозяина в целевом локусе, одновременно удаляя геномный материал хозяина, например, 50 пар оснований (п.о.) или более, 100 п.о. или более, 200 п.о. или более, 500 п.о. или более, 1 тыс. п.о. или более, 2 тыс. п.о. или более, 5 тыс. п.о. или более, 10 тыс. п.о. или более, 15 тыс. п.о. или более, 20 тыс. п.о. или более, или 50 тыс. п.о. или более геномного материала, из целевого локуса. Так, например, у гуманизированной IL-15 мыши, содержащей последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, созданный путем направленного действия последовательности нуклеиновой кислоты IL-15 человека на локус IL-15 мыши, последовательность нуклеиновой кислоты IL-15 человека может заменить часть или всю последовательность мыши, например, экзоны и/или интроны, в локусе IL-15. В некоторых из таких случаев последовательность нуклеиновой кислоты IL-15 человека интегрируется в локус IL-15 мыши таким образом, что экспрессия последовательности IL-15 человека регулируется нативными или эндогенными регуляторными последовательностями в локусе IL-15 мыши. Другими словами, регуляторная(ые) последовательность(ти), с которой функционально связана последовательность нуклеиновой кислоты, кодирующая белок IL-15 человека, является нативной регуляторной последовательностью IL-15 в локусе IL-15 мыши.
В некоторых случаях интеграция последовательности IL-15 человека не влияет на транскрипцию гена, в который интегрирована последовательность IL-15 человека. Например, если последовательность IL-15 человека интегрируется в кодирующую последовательность в виде интеина, или последовательность IL-15 человека содержит пептид 2А, то последовательность IL-15 человека будет транскрибироваться и транслироваться одновременно с геном, в который последовательность IL-15 человека интегрирована. В других случаях интеграция последовательности IL-15 человека прерывает транскрипцию гена, в который последовательность IL-15 человека интегрирована. Например, после интеграции последовательности IL-15 человека посредством гомологичной рекомбинации, часть или вся кодирующая последовательность в локусе интеграции может быть удалена, таким образом, что вместо этого транскрибируется последовательность IL-15 человека. В некоторых из таких случаев интеграция последовательности IL-15 человека создает нулевую мутацию и, следовательно, нулевой аллель. Нулевой аллель представляет собой мутантную копию гена, которая полностью лишена нормальной функции этого гена. Это может быть результатом полного отсутствия генного продукта (белка, РНК) на молекулярном уровне или экспрессии нефункционального генного продукта. На фенотипическом уровне нулевой аллель неотличим от удаления всего локуса.
В некоторых случаях гуманизированное IL-15 животное, не относящееся к человеку, например, мышь, содержит одну копию последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека. Например, животное, не относящееся к человеку, может быть гетерозиготным по указанной последовательности нуклеиновой кислоты. Другими словами, один аллель в локусе будет содержать указанную последовательность нуклеиновой кислоты, в то время как другой будет эндогенным аллелем. Например, как обсуждалось выше, в некоторых случаях последовательность нуклеиновой кислоты IL-15 человека интегрирована в организм животного, не относящегося к человеку, например, локус IL-15 мыши, таким образом, что возникает нулевой аллель для IL-15 животного, не относящегося к человеку. В некоторых таких вариантах реализации изобретения гуманизированное IL-15 животное, не относящееся к человеку, может быть гетерозиготным по последовательности нуклеиновой кислоты, кодирующей IL-15 человека, т.е., гуманизированное IL-15 животное, не относящееся к человеку, содержит один нулевой аллель для IL-15 животного, не относящегося к человеку (аллель, содержащий указанную последовательность нуклеиновой кислоты) и один эндогенный аллель IL-15 (дикого типа или иной). Другими словами, животное, не относящееся к человеку, представляет собой IL-15h/m животное, не относящееся к человеку, где «h» представляет аллель, содержащий последовательность человека, а «m» представляет собой эндогенный аллель. В других случаях гуманизированный IL-15 содержит две копии последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека. Например, животное, не относящееся к человеку, например, мышь, может быть гомозиготным по указанной последовательности нуклеиновой кислоты, т.е., оба аллеля для локуса в диплоидном геноме будут содержать указанную последовательность нуклеиновой кислоты, т.е. гуманизированное IL-15 животное, не относящееся к человеку, содержит два нулевых аллеля для IL-15 животного, не относящегося к человеку (аллель, содержащий указанную последовательность нуклеиновой кислоты). Другими словами, животное, не относящееся к человеку, представляет собой IL-15h/h животное, не относящееся к человеку.
Гуманизированные sirpα-il-15 животные, не относящиеся к человеку
Путем скрещивания гуманизированных IL-15 животных, не относящихся к человеку, как описано выше, с гуманизированными SIRPα животными, не относящимися к человеку, такого же вида, как описано выше, можно получить генномодифицированных животных, не относящихся к человеку, которые экспрессируют как SIRPα человека, так и IL-15 человека. В некоторых вариантах реализации изобретения у таких генномодифицированных животных, не относящихся к человеку, имеется недостаточность эндогенной иммунной системы, например, у иммунокомпрометированных животных, например, в результате нулевого аллеля для одного или обоих из Rag2 и IL2rg. Например, в некоторых вариантах реализации изобретения животное, не относящееся к человеку, в соответствии с настоящим изобретением, представляет собой Rag2-/- и/или IL2rg-/- (или Rag2-/- и/или IL2rgY/-, где ген IL2rg расположен на Х-хромосоме, как у мыши). В некоторых вариантах реализации изобретения предлагается генномодифицированное животное, не относящееся к человеку, например, мышь, причем генномодифицированное животное, не относящееся к человеку, например, мышь, представляет собой SIRPαh/m IL-15h/m Rag2-/- IL2rgY/-, SIRPαh/h IL-15h/m Rag2-/- IL2rgY/- или SIRPαh/m IL-15h/h Rag2-/- IL2rgY/-.
В некоторых вариантах реализации изобретения предлагается генномодифицированное животное, не относящееся к человеку, например, мышь, которое содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα; и последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека.
В некоторых вариантах реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα человека, не относящимся к человеку. В некоторых таких вариантах реализации изобретения промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку. В другом варианте реализации изобретения промотор гена SIRPα является промотором SIRPα человека.
В некоторых вариантах реализации изобретения промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку. В некоторых из таких вариантов реализации изобретения промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку. В другом варианте реализации изобретения промотор IL-15 представляет собой промотор IL-15 человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, описанное в настоящем документе, экспрессирует мРНК IL-15 человека в печени, легком, костном мозге (КМ), тонком кишечнике (ТК) и толстой кишке.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, после трансплантации гемопоэтических клеток человека, например, клеток CD45+, демонстрирует более высокий процент и количество Т-клеток и ПК-клеток человека, чем генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует только SIRPα человека. В некоторых вариантах реализации изобретения, генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, демонстрирует более высокий процент и количество ПК-клеток в крови и селезенке. В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, содержит оба подмножества ПК-клеток человека, CD56bright CD16- и CD56dim CD16+, в крови, селезенке и печени, после трансплантации гемопоэтических клеток человека, например, клеток CD45+. В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, демонстрирует сходное распределение CD16+ против CD16- ПК-клеток в крови по сравнению с распределением CD16+ против CD16- ПК-клеток в МПК, полученных от субъектов-людей.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, после трансплантации гемопоэтических клеток человека, например, клеток CD45+, содержит в печени генномодифицированного животного, не относящегося к человеку, ПК-клетки с более высоким уровнем экспрессии CD16 и CD56, что указывает на усиление созревания ПК-клеток по сравнению с генномодифицированным животным, не относящимся к человеку, например, мышью, которое экспрессирует только SIRPα человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, например, клеток CD45+, содержит в селезенке ПК-клетки, которые проявляют четко выраженный уровень экспрессии киллерных ингибиторных рецепторов, причем популяция CD56dim CD16+ ПК-клеток содержит более высокий процент CD158-экспрессирующих клеток, сходный с найденным в подмножествах ПК-клеток в крови человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, например, клеток CD45+, демонстрирует более высокую частоту распространенности CD45+ и CD8+ Т-клеток человека в популяции внутриэпителиальных лимфоцитов относительно генномодифицированного животного, не относящегося к человеку, например, мыши, которое экспрессирует только SIRPα человека. В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, демонстрирует сопоставимое распределение CD16+ против CD16- ПК-клеток в ВЭЛ, и большее количество CD16+, чем CD16- ПК-клеток в крови и селезенке, что отражает нормальную физиологию человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, например, клеток CD45+, демонстрирует повышенное количество T-клеток человека в легком по сравнению с генномодифицированным животным, не относящимся к человеку, например, мышью, которое экспрессирует только SIRPα человека. В некоторых из таких вариантов реализации изобретения такое генномодифицированное животное, не относящееся к человеку, например, мышь, демонстрирует более высокий уровень экспрессии CD69 на CD8+ Т-клетках человека в легком по сравнению с генномодифицированным животным, не относящимся к человеку, например, мышью, которое экспрессирует только SIRPα человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, например, клеток CD45+, демонстрирует повышенный уровень экспрессии CD69 на CD8+ Т-клетках человека в печени по сравнению с генномодифицированным животным, не относящимся к человеку, например, мышью, которое экспрессирует только SIRPα человека.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, например, мышь, которое экспрессирует как SIRPα человека, так и IL-15 человека, как описано в настоящем документе, и содержит трансплантат гемопоэтических клеток человека, демонстрирует хорошо различимые пейеровы бляшки, которые преимущественно представляют собой CD45+ человека.
Любое млекопитающее животное, не относящееся к человеку, может быть генетически модифицировано в соответствии с настоящим изобретением. Неограничивающие примеры включают лабораторных животных, домашних животных, сельскохозяйственных животных и т.д., например, такие виды, как мышевидные, грызуны, псовые, кошачьи, свиноподобные, лошадиные, жвачные животные, мелкие жвачные животные, приматы, не относящиеся к человеку, и т.д.; например, мыши, крысы, кролики, хомяки, морские свинки, крупный рогатый скот, свиньи, овцы, козы и другие виды трансгенных животных, особенно виды млекопитающих, как известно из уровня техники. В других вариантах реализации изобретения животное, не относящееся к человеку, может быть птицей, например, отряда Galliformes (курообразные), например, курицей, индейкой, перепелом, фазаном или куропаткой; например, отряда Anseriformes (гусеобразные), например, уткой, гусем или лебедем, например, отряда Columbiformes (голубеобразные), например, представитель семейства голубиных или голубь. В различных вариантах реализации изобретения генномодифицированное животное по изобретению является мышью, крысой или кроликом.
В некоторых вариантах реализации изобретения животное, не относящееся к человеку, является млекопитающим. В некоторых из таких вариантов реализации изобретения животное, не относящееся к человеку, является небольшим млекопитающим, например, из суперсемейства Dipodoidea или Muroidea. В одном варианте реализации изобретения генномодифицированное животное является грызуном. В одном варианте реализации изобретения грызун выбран из мыши, крысы и хомяка. В одном варианте реализации изобретения грызун выбран из суперсемейства Muroidea. В одном варианте реализации изобретения генномодифицированное животное относится к семейству, выбранному из Calomyscidae (например, мышевидные хомяки), Cricetidae (например, хомяк, крысы и мыши из Нового Света, мыши-полевки), Muridae (настоящие мыши и крысы, песчанки, иглистые мыши, косматые хомяки), Nesomyidae (рипидомисы, скальные мыши, белохвостые крысы, мадагаскарские крысы и мыши), Platacanthomyidae (например, колючий соневидный хомяк) и Spalacidae (например, голые землекопы, бамбуковые крысы и цокоры). В конкретном варианте реализации изобретения генномодифицированный грызун выбран из настоящей мыши или крысы (семейство Muridae), песчанки, иглистой мыши и косматого хомяка.
В одном варианте реализации изобретения генномодифицированным животным по изобретению, не относящимся к человеку, является крыса. В одном из таких вариантов реализации изобретения крыса выбрана из крысы Вистар, породы LEA, породы Спрег-Доули, породы Фишер, F344, F6 и Dark Agouti. В другом варианте реализации изобретения порода крысы представляет собой гибрид двух или более пород, выбранных из группы, состоящей из Вистар, LEA, Спрег-Доули, Фишер, F344, F6 и Dark Agouti.
В другом варианте реализации изобретения генномодифицированным животным по изобретению, не относящимся к человеку, является мышь, например, мышь породы C57BL (например, C57BL/A, C57BL/An, C57BL/GrFa, C57BL/KaLwN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr, C57BL/Ola и т.д.); мышь породы 129 (например, 129P1, 129P2, 129P3, 129X1, 129S1 (например, 129S1/SV, 129Sl/SvIm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129T1, 129T2); мышь породы BALB; например, BALB/c; и т.п. См., например, Festing et al. (1999) Mammalian Genome 10: 836, а также см. Auerbach et al (2000) Establishment and Chimera Analysis of 129/SvEv- and C57BL/6-Derived Mouse Embryonic Stem Cell Lines). В другом варианте реализации изобретения мышь представляет собой гибрид вышеуказанных пород.
В некоторых вариантах реализации изобретения генномодифицированное животное по изобретению, не относящееся к человеку, дополнительно является иммунодефицитным. «Иммунодефицитный» включает недостаточность одного или более аспектов природной или эндогенной иммунной системы животного, например, у животного имеется недостаточность одного или нескольких типов функционирующих иммунных клеток хозяина, например, недостаточное количество и/или функциональность В-клеток, не относящихся к человеку, недостаточное количество и/или функциональность Т-клеток, не относящихся к человеку, недостаточное количество и/или функциональность ПК-клеток, не относящихся к человеку, и т.д.
Одним из способов индукции иммунодефицита у субъектов-животных является облучение сублетальными дозами. Например, новорожденных генномодифицированных детенышей мыши можно облучать сублетальными дозами, например, 2 x 200 сГр с четырехчасовым промежутком. В качестве альтернативы, иммунодефицит может быть индуцирован с помощью одной из нескольких мутаций генов, известных из уровня техники, любую из которых можно разводить отдельно или в сочетании в организме генномодифицированных животных по настоящему изобретению, не относящихся к человеку, или которые можно использовать в качестве источника стволовых клеток, в которые могут быть введены генетические модификации по изобретению. Неограничивающие примеры включают X-связанные мутации SCID, связанные с мутациями гена IL2rg и характеризующиеся фенотипом лимфоцитов T(-) B(+) ПК(-); аутосомно-рецессивный SCID, связанный с мутациями гена Jak3 и характеризующийся фенотипом лимфоцитов T(-) B(+) ПК(-); мутации гена ADA, характеризующиеся фенотипом лимфоцитов T(-) B(-) ПК(-); мутации альфа-цепи IL-7R, характеризующиеся фенотипом лимфоцитов T(-) B(+) ПК(+); мутации CD3-дельта или -эпсилон, характеризующиеся фенотипом лимфоцитов T(-) B(+) ПK(+); мутации RAG1 и RAG2, характеризующиеся фенотипом лимфоцитов T(-) B(-) ПК(+); мутации гена Artemis, характеризующиеся фенотипом лимфоцитов T(-) B(-) ПК(+), мутации гена CD45, характеризующимися фенотипом лимфоцитов T(-) B(+) ПК(+); и мутации Prkdcscid, характеризующиеся фенотипом лимфоцитов T(-), B(-). Таким образом, в некоторых вариантах реализации изобретения иммунодефицитное генномодифицированное животное, не относящееся к человеку, имеет один или более дефицитов, выбранных из недостаточности гамма-цепи рецептора IL2 (I12rgy/-), недостаточности Jak3, недостаточности ADA, недостаточности IL7R, недостаточности CD3, недостаточности RAG1 и/или RAG2, недостаточности Artemis, недостаточности CD45 и недостаточности Prkdc. Эти и другие животные модели иммунодефицита будут известны обычному специалисту, причем любую из них можно применять для получения иммунодефицитных животных по настоящему изобретению.
В некоторых вариантах реализации изобретения генномодифицированные животные по изобретению, не относящиеся к человеку, находят применение в качестве реципиентов гемопоэтических клеток человека, которые способны развивать иммунные клетки человека из трансплантированных гемопоэтических клеток человека. Таким образом, в некоторых аспектах изобретения генномодифицированным животным по изобретению является генномодифицированное, иммунодефицитное, животное, не относящееся к человеку, которое содержит трансплантат гемопоэтических клеток человека.
Трансплантация гуманизованным sirpα-il-15 животным, не относящимся к человеку
Как обсуждалось выше, в некоторых аспектах изобретения гуманизированному SIRPα-IL-15 животному, не относящемуся к человеку, например, мыши, например, мыши Rag2-/- IL2rgY/- hSIRPα hIL-15 или облученной сублетальными дозами hSIRPα hIL-15 мыши пересаживают или трансплантируют клетки. Клетки могут быть митотическими клетками или постмитотическими клетками и включать такие клетки, представляющие интерес, как плюрипотентные стволовые клетки, например, ЭС-клетки, иПС-клетки и эмбриональные зародышевые клетки; и соматические клетки, например, фибробласты, гемопоэтические клетки, нейроны, мышечные клетки, костные клетки, сосудистые эндотелиальные клетки, клетки кишечника и т.п., а также их предшественники и прекурсоры, ограниченные по линии дифференцировки. Клеточные популяции, представляющие особый интерес, включают такие, которые содержат гемопоэтические стволовые клетки или клетки-предшественники, которые будут способствовать или восстанавливать систему кроветворения гуманизированного SIRPα-IL-15 животного, не относящегося к человеку, например, лейкоциты периферической крови, клетки печени плода, кость плода, тимус плода, лимфатические узлы плода, васкуляризированную кожу, сегменты артерии и очищенные гемопоэтические стволовые клетки, например, мобилизованные стволовые клетки человека (СКЧ) или СКЧ пуповинной крови.
Любой источник гемопоэтических клеток человека, гемопоэтических стволовых клеток человека (СКЧ) и/или гемопоэтических стволовых клеток-предшественников (ГСКП), известный из уровня техники или описанный в настоящем документе, может быть трансплантирован иммунодефицитным генномодифицированным животным по настоящему изобретению, не относящимся к человеку. Одним из подходящих источников гемопоэтических клеток человека, известных из уровня техники, являются клетки пуповинной крови человека, в частности CD34-положительные (CD34+) клетки. Другим источником гемопоэтических клеток человека является эмбриональная печень человека. Другим источником является костный мозг человека. Дополнительно включены индуцированные плюрипотентные стволовые клетки (иПСК) и индуцированные гемопоэтические стволовые клетки (иГСК), которые получают дедифференцировкой соматических клеток, например, способами, известными из уровня техники.
Клетки могут быть получены от любых видов млекопитающих, например, мышевидных, грызунов, собачьих, кошачьих, лошадиных, жвачных животных, мелких жвачных животных, приматов, человека и т.д. Клетки могут быть получены из культивируемых клеточных линий или могут быть первичными клетками, причем «первичные клетки», «первичные клеточные линии» и «первичные культуры» используются в настоящем документе взаимозаменяемо для обозначения клеток и культур клеток, которые были получены от субъекта и выращивались in vitro на протяжении ограниченного количества пассажей, т.е., перевивания культуры. Например, первичными культурами являются культуры, которые могли быть перевиты 0 раз, 1 раз, 2 раза, 4 раза, 5 раз, 10 раз или 15 раз, но количество пассажей было недостаточным для прохода через кризисную стадию. Как правило, первичные клеточные линии по настоящему изобретению перевивались in vitro менее 10 раз.
Если клетки являются первичными клетками, они могут быть получены от индивидуума любым удобным способом. Например, клетки, например, клетки крови, например, лейкоциты, могут быть получены путем афереза, лейкоцитафереза, разделения по градиенту плотности и т.д. В качестве другого примера клетки, например, ткани,, кожной, мышечной, костного мозга, селезенки, печени, поджелудочной железы, легкого, кишечника, желудка и т.д. могут быть получены биопсией. Подходящий раствор может быть применен для диспергирования или суспендирования полученных клеток. Такой раствор, как правило, представляет собой сбалансированный солевой раствор, например, физиологический раствор, ФСБ, сбалансированный солевой раствор Хэнка и т.д., обычно с добавлением фетальной телячьей сыворотки или других природных факторов в сочетании с приемлемым буфером в низкой концентрации, обычно 5-25 мМ. Типичные буферы включают ГЭПЭС, фосфатные буферы, лактатные буферы и т.д.
В некоторых случаях гуманизированному животному, не относящемуся к человеку, например, мыши, будет трансплантирована гетерогенная популяция клеток. В других случаях гуманизированному животному, не относящемуся к человеку, например, мыши, будет трансплантирована популяция клеток, обогащенная клетками определенного типа, например, клетками-предшественниками, например, гемопоэтическими клетками-предшественниками. Обогащение популяции клеток, представляющей интерес, может быть проведено с помощью любого обычного способа разделения. Например, клетки, представляющие интерес, могут быть обогащены с помощью способов культивирования. В таких способах культивирования к культуре обычно добавляют конкретные факторы роста и питательные вещества, которые способствуют преимущественному выживанию и/или пролиферации одной популяции клеток по сравнению с другими. Другие условия культивирования, которые влияют на выживаемость и/или пролиферацию, включают рост на адгезивных или неадгезивных субстратах, культивирование в определенные периоды времени и т.д. Такие условия культивирования хорошо известны из уровня техники. В качестве другого примера клетки, представляющие интерес, могут быть обогащены путем выделения клеток, представляющих интерес, из начальной популяции методами аффинного разделения. Аффинные способы разделения могут включать магнитное разделение с применением магнитных гранул, покрытых аффинным реагентом, аффинную хроматографию, «пэннинг» с аффинным реагентом, прикрепленным к твердой матрице, например, планшету, цитотоксичные агенты, связанные с аффинным реагентом или применяемые в сочетании с аффинный реагентом, например, комплементом и цитотоксинами, или другой традиционный способ. Методы, обеспечивающие точное разделение, включают устройства для сортировки клеток с активированной флуоресценцией, которые могут иметь различную степень сложности, например, множественные цветовые каналы, каналы обнаружения рассеяния низкого угла и приглушенного света, каналы импеданса и т.д. Клетки могут отбираться против мертвых клеток с применением красителей, которые связываются с мертвыми клетками (например, пропидия йодида). Можно применять любую технику, которая не наносит чрезмерного ущерба жизнеспособности представляющих интерес клеток.
Например, с применением аффинных способов разделения, клетки, которые не являются клетками, представляющими интерес для трансплантации, могут быть истощены в популяции путем приведения популяции в контакт с аффинными реагентами, которые специфично распознают и избирательно связываются с маркерами, которые не экспрессируются на представляющих интерес клетках. Например, чтобы обогатить популяцию гемопоэтическими клетками-предшественниками, можно истощить клетки, экспрессирующие маркеры зрелой гемопоэтической клетки. Кроме того, или в качестве альтернативы, положительный отбор и разделение могут быть выполнены с помощью приведения популяции в контакт с аффинными реагентами, которые специфично распознают и избирательно связываются с маркерами, которые ассоциируются с гемопоэтическими клетками-предшественниками, например, CD34, CD133 и т.д. Под «избирательным связыванием» подразумевается, что молекула предпочтительно связывается с представляющей интерес мишенью или связывается с мишенью с большей аффинностью, чем с другими молекулами. Например, антитело будет связываться с молекулой, содержащей эпитоп, в отношении которого оно является специфичным, а не с неродственными эпитопами. В некоторых вариантах реализации изобретения аффинный реагент может быть антителом, т.е., антителом, специфичным в отношении CD34, CD133 и т.д. В некоторых вариантах реализации изобретения аффинный реагент может быть специфичным рецептором или лигандом для CD34, CD133 и т.д., например, пептидным лигандом и рецептором; эффекторными и рецепторными молекулами, Т-клеточным рецептором, специфичным в отношении CD34, CD133 и т.д., и тому подобным. В некоторых вариантах реализации изобретения можно применять множественные аффинные реагенты, специфичные в отношении представляющего интерес маркера.
Антитела и Т-клеточные рецепторы, которые находят применение в качестве аффинных реагентов, могут быть моноклональными или поликлональными и могут вырабатываться трансгенными животными, иммунизированными животными, иммортализованными В-клетками человека или животного, клетками, которые трансфицированы векторами ДНК, кодирующими антитело или Т-клеточный рецептор и т.д. Детали получения антител и их пригодность для применения в качестве конкретных элементов связывания хорошо известны специалистам из уровня техники. Особый интерес представляет применение меченых антител в качестве аффинных реагентов. Традиционно, такие антитела конъюгированы с меткой для применения при разделении. Метки включают магнитные гранулы, которые обеспечивают прямое разделение; биотин, который можно удалить авидином или стрептавидином, связанным с подложкой; флуорохромы, которые можно применять с устройством для сортировки клеток с активированной флуоресценцией; и т.п., чтобы обеспечить простоту отделения конкретного типа клеток. Флуорохромы, которые находят применение, включают фикобилибелки, например, фикоэритрин и аллофикоцианины, флуоресцеин и Техасский красный. Часто в каждое антитело вводят отличную флуорохромную метку, чтобы обеспечить независимую сортировку для каждого маркера.
Начальную популяцию клеток приводят в контакт с аффинным(и) реагентом(ами) и инкубируют в течение периода времени, достаточного для связывания доступных поверхностных антигенов клеток. Инкубация обычно длится не менее 5 минут и обычно менее 60 минут. Желательно присутствие достаточной концентрации антител в реакционной смеси, таким образом, чтобы эффективность разделения не ограничивалась отсутствием антитела. Подходящую концентрацию определяют титрованием, но обычно она представляет собой разведение антитела в объеме клеточной суспензии, которое составляет около 1:50 (т.е., 1 часть антитела на 50 частей реакционного объема), около 1:100, около 1:150, около 1:200, около 1:250, около 1:500, около 1:1000, около 1:2000 или около 1:5000. Среда, в которой суспендированы клетки, будет любой средой, которая поддерживает жизнеспособность клеток. Предпочтительной средой является буферизованный фосфатом физиологический раствор, содержащий от 0,1 до 0,5% БСА или 1-4% козьей сыворотки. Различные среды коммерчески доступны и могут применяться в соответствии с природой клеток, включая модифицированную Дульбекко среду Игла (МДСИ), основной солевой раствор Хэнкса (ОСРХ), буферизованный фосфатом физиологический раствор Дульбекко (ФБРД), RPMI, среду Искова, ФСБ с 5 мМ ЭДТА и т.д., часто с добавлением фетальной телячьей сыворотки, БСА, ЧСА, козьей сыворотки и т.д.
Клетки в популяции, приведенной в контакт, к которым присоединяется метка в форме аффинного реагента, отбирают с помощью любого традиционного способа аффинного разделения, например, как описано выше или как известно из уровня техники. После разделения отделенные клетки могут быть собраны в любой подходящей среде, которая поддерживает жизнеспособность клеток, обычно содержащей сывороточный демпфер на дне пробирки для сбора. Различные среды коммерчески доступны и могут применяться в соответствии с природой клеток, включая МДСИ, ОСРХ, ФБРД, RPMI, среду Искова и т.д., часто с добавлением фетальной телячьей сыворотки.
Таким образом можно получить композиции, в высокой степени обогащенные клетками интересующего типа, например, гемопоэтическими клетками. Клетки будут составлять около 70%, около 75%, около 80%, около 85%, около 90% или более от композиции клеток, около 95% или более от обогащенной композиции клеток и предпочтительно будут составлять около 95% или более от обогащенной композиции клеток. Другими словами, композиция будет представлять собой по существу чистую композицию представляющих интерес клеток.
Клетки, подлежащие трансплантации гуманизированным SIRPα-IL-15 животным, не относящимся к человеку, например, мышам, будь то гетерогенная популяция клеток или обогащенная популяция клеток, могут быть трансплантированы немедленно. В качестве альтернативы, клетки могут быть заморожены при температуре жидкого азота и храниться в течение длительного времени, после размораживания будучи пригодными для повторного использования. В таких случаях клетки обычно замораживают в 10% ДМСО, 50% сыворотки, 40% буферной среды или какого-либо другого такого раствора, который обычно применяется в данной области для хранения клеток при таких температурах замерзания, и оттаивают общеизвестным из уровня техники способом оттаивания замороженных клеток культуры. Дополнительно или в качестве альтернативы, клетки могут быть культивированы in vitro при различных условиях культивирования. Питательная среда может быть жидкой или полутвердой, например, содержащей агар, метилцеллюлозу и т.д. Популяцию клеток можно традиционно суспендировать в подходящей питательной среде, такой как модифицированная Исковым МДСИ или RPMI-1640, обычно с добавлением фетальной телячьей сыворотки (около 5-10%), L-глутамина, тиола, особенно 2-меркаптоэтанола и антибиотиков, например, пенициллина и стрептомицина. Культура может содержать факторы роста, к которым чувствительны клетки. Факторы роста, как определено в настоящем документе, представляют собой молекулы, способные стимулировать выживание, рост и/или дифференцировку клеток, как в культуре, так и в интактной ткани, посредством специфического воздействия на трансмембранный рецептор. Факторы роста включают полипептиды и неполипептидные факторы.
Клетки могут быть генетически модифицированы перед трансплантацией SIRPα-IL-15 животным, не относящимся к человеку, например, мышам, например, для обеспечения селективного или отслеживаемого маркера, чтобы индуцировать генетический дефект в клетках (например, для моделирования заболеваний), для восстановления генетического дефекта или эктопической экспрессии гена в клетках (например, для определения, будут ли такие модификации влиять на течение заболевания) и т.д. Клетки могут быть генетически модифицированы путем трансфекции или трансдукции подходящим вектором, гомологичной рекомбинации или другой подходящей методики, таким образом, что они экспрессируют представляющий интерес ген или антисмысловой мРНК, миРНК или рибозимами для блокирования экспрессии нежелательного гена. Из уровня техники известны различные способы введения нуклеиновых кислот в клетки-мишени. Для доказательства факта генетической модификации клеток можно применять различные способы. Геном клеток может быть расщеплен рестриктазами и использован с амплификацией или без нее. Полимеразная цепная реакция; гель-электрофорез; рестрикционный анализ; Саузерн-, Нозерн- и Вестерн-блоты; секвенирование; и т.п., все могут применяться. Общие методы молекулярной и клеточной биохимии для этих и других целей, описанных в настоящей заявке, можно найти в таких стандартных руководствах, как Molecular Cloning: A Laboratory Manual, 3rd Ed. (Sambrook et al., Cold Spring Harbor Laboratory Press 2001); Short Protocols in Molecular Biology, 4th Ed. (Ausubel et al. eds., John Wiley & Sons 1999); Protein Methods (Bollag et al., John Wiley & Sons 1996); Nonviral Vectors for Gene Therapy (Wagner et al. eds., Academic Press 1999); Viral Vectors (Kaplift & Loewy eds., Academic Press 1995); Immunology Methods Manual (I. Lefkovits ed., Academic Press 1997); и Cell and Tissue Culture: Laboratory Procedures in Biotechnology (Doyle & Griffiths, John Wiley & Sons 1998), содержание которых включено в настоящий документ посредством ссылки. Реагенты, векторы клонирования и наборы для генетических манипуляций, упомянутые в настоящем документе, доступны от коммерческих поставщиков, таких как BioRad, Stratagene, Invitrogen, Sigma-Aldrich и ClonTech.
Клетки могут быть трансплантированы гуманизированным SIRPα-IL-15 животным, не относящимся к человеку, например, мышам, любым традиционным способом, включая, например, внутрипеченочную инъекцию, инъекцию в хвостовую вену, ретроорбитальную инъекцию и т.п. Обычно трансплантируют около 0,5 × 105 - 2 × 106 плюрипотентных клеток или клеток-предшественников, например, около 1 × 105 - 1 × 106 клеток или около 2 × 105 - 5 × 105 клеток. В некоторых случаях животное, не относящееся к человеку, например, мышь, подвергают облучению сублетальными дозами перед трансплантацией клеток человека. Другими словами, животное, не относящееся к человеку, например, мышь, подвергают облучению сублетальными дозами, например, как хорошо известно из уровня техники. Затем несущих трансплантат гуманизированных SIRPα-IL-15 животных, не относящихся к человеку, например, мышей, содержат в лабораторных условиях вивария в течение по меньшей мере 1 недели, например, 1 неделю или более, или две недели или более, иногда 4 недели или более, и в некоторых случаях 6 недель или более, например, 10 недель или более или 15 недель или более, давая возможность в достаточной степени восстановить иммунную систему с трансплантированными клетками.
Гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, например, мыши, и гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, например, мыши, несущие трансплантат гемопоэтических клеток человека, например, несущие трансплантат Rag2-/-IL2rgY/- hSIRPα hIL-15 мыши, и, возможно, другие генетические модификации полезны во многих сферах использования. Например, такие животные, не относящиеся к человеку, например, мыши, обеспечивают полезную систему для моделирования иммунных заболеваний человека и патогенов человека. Например, животные по изобретению, не относящиеся к человеку, например, мыши, подходят для моделирования, например, развития и функции Т-клеток и/или природных клеток-киллеров (ПК) человека, инфицирования патогеном человека конкретных тканей и/или клеток, например, инфицирования кишечным или легочным патогеном человека, и/или инфицирования патогеном человека или ответа на Т-клетки и/или ПК-клетки человека. Кроме того, такие животные, не относящиеся к человеку, находят применение при скрининге in vivo на предмет агентов, подавляющих инфекцию патогеном, например, патогеном, который поражает (например, путем инфицирования) определенного типа ткань или клетку, например, патогеном человека, поражающим кишечник или легкое, например, патогеном человека, который активирует, индуцирует и/или направленно действует на Т-клетки и/или ПК-клетки; при скрининге in vivo на предмет агентов, модулирующих развитие и/или функцию Т-клеток и/или ПК-клеток человека, например, в здоровом или больном состоянии; при скрининге in vivo на предмет агентов, которые являются токсичными для Т-клеток и/или ПК-клеток человека; при скрининге in vivo на предмет агентов, которые предотвращают, смягчают или устраняют токсическое воздействие токсичных агентов на Т-клетки и/или ПК-клетки человека; при скрининге in vivo потенциальных индуцирующих Т-клетки вакцин; и при скрининге in vivo и in vitro на предмет агентов, подавляющих рост опухоли и/или инфекцию путем активации процессов опосредованной ПК-клетками антителозависимой клеточной цитотоксичности (АЗКЦ).
В настоящем документе представлены неожиданные результаты, демонстрирующие, что у гуманизированных SIRPα-IL-15 животных, не относящихся к человеку, например, мышей, несущих трансплантат гемопоэтических клеток человека, например, трансплантат Rag2-/- IL2rgY/-hSIRPα hIL-15 мыши, в кишечнике и легких развиваются ткане-резидентные лимфоциты, например, внутриэпителиальные лимфоциты. Соответственно, в настоящем документе предлагаются ранее недоступные модели животных, которые позволяют контролировать и тестировать такие ткане-резидентные лимфоциты. Такие модели на животных особенно полезны при моделировании иммунного ответа ткане-резидентных лимфоцитов, например, Т-клеток и ПК-клеток, на патогены человека, которые поражают (например, путем инфицирования) кишечник и/или легкое, а также при скрининге терапевтических средств и вакцин, которые направленно действуют на такие патогены и/или индуцируют или улучшают ответ ткане-резидентного лимфоцита. Кроме того, присутствие указанных ткане-резидентных лимфоцитов позволяет моделировать аутоиммунные заболевания, связанные с иммунными клетками человека, которые поражают желудочно-кишечный тракт, такие как целиакия и синдром раздраженного кишечника (СРК).
Соответственно, в некоторых вариантах реализации изобретения в настоящем документе предлагается модель in vivo, включающая генномодифицированное животное, не относящееся к человеку, которое содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα. Кроме того, генномодифицированное животное, не относящееся к человеку, содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок IL-15 человека и функционально связана с промотором гена IL-15. Наконец, генномодифицированное животное, не относящееся к человеку, содержит трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку (i) экспрессирует белок SIRPα человека и белок IL-15 человека и (ii) содержит ткане-резидентные лимфоциты человека, например, внутриэпителиальные лимфоциты (ВЭЛ), в кишечнике генномодифицированного животного, не относящегося к человеку. В некоторых из таких вариантов реализации изобретения генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, например, патогеном человека, который поражает (например, инфицирует) кишечник.
Патогены человека, которые могут поражать кишечник (например, путем инфицирования), включают, но не ограничиваясь этим, Campylobacter jejuni, Clostridium difficile, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, ротавирус человека, Listeria monocytogenes, вирус Норуолка, Salmonella enterica, Shigella flexneri, Shigella sonnei, Shigella dysenteriae, Yersinia pestis, Yersinia enterocolitica и Helicobacter pylori.
В других вариантах реализации изобретения в настоящем документе предлагается модель in vivo, включающая генномодифицированное животное, не относящееся к человеку, которое содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα. Кроме того, генномодифицированное животное, не относящееся к человеку, содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, которая кодирует белок IL-15 человека и функционально связана с промотором гена IL-15. Наконец, генномодифицированное животное, не относящееся к человеку, содержит трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека и (ii) содержит ткане-резидентные лимфоциты человека, например, внутриэпителиальные лимфоциты (ВЭЛ), в легком генномодифицированного животного, не относящегося к человеку. В некоторых таких вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека, например, патогеном человека, который поражает (например, инфицирует) легкое.
Патогены человека, которые могут поражать легкое (например, путем инфицирования), включают, но не ограничиваясь этим, Streptococcus pyogenes, Haemophilus influenza, Corynebacterium diphtheria, коронавирус атипичной пневмонии, Bordetella pertussis, Moraxella catarrhalis, вирус гриппа (A, B, C), коронавирус, аденовирус, респираторный синцитиальный вирус, вирус парагриппа, вирус свинки, Streptococcus pneumoniae, Staphylococcus aureus, Legionella pneumophila, Klebsiella pneumoniae, Pseudomonas aeruginosa, Mycoplasma pneumonia, Mycobacterium tuberculosis, Chlamydia pneumoniae, Blastomyces dermatitidis, Cryptococcus neoformans и Aspergillus fumigatus.
Необходимы новые терапевтические средства, новые вакцины и новые способы тестирования эффективности терапевтических средств и вакцин. Например, животное, не относящееся к человеку, например, мышь, которая содержит эффективно прижившийся трансплантат T-клеток и ПК-клеток человека, было бы полезным для идентификации новых терапевтических средств и новых вакцин, особенно против патогена человека, который инфицирует Т-клетки и/или ПК-клетки человека. Новые терапевтические средства и новые вакцины могут быть протестированы на таком животном, не относящемся к человеку, например, мыши, путем, например, определения количества патогена человека, например, вируса, у животного, не относящегося к человеку (в крови или конкретной ткани) в ответ на лечение предполагаемым противовирусным агентом, или путем прививки мыши предполагаемой вакциной, с последующим воздействием введенного инфекционного патогена человека, например, ВИЧ, и наблюдения за любым изменением инфекционных свойств в результате прививки предполагаемой вакциной, по сравнению с контролем, не привитым вакциной, но инфицированным ВИЧ.
Такие модели патогенной инфекции на животных, не относящихся к человеку, например, мыши, полезны для исследований, например, для лучшего понимания прогрессирования инфекции у человека. Кроме того, такие мышиные модели инфекции полезны при создании лекарственного средства, например, для идентификации потенциальных агентов, которые защищают от или лечат инфекцию.
Несущие трансплантат генномодифицированные животные по настоящему изобретению находят применение при скрининге потенциальных агентов для идентификации тех из них, которые будут лечить инфекции патогенами человека, например, патогенами человека, которые направленно действуют на Т- и/или ПК-клетки человека. Термины «лечить», «лечение», «терапия» и т.п. в общем используются в настоящем документе для обозначения получения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения заболевания или его симптома и/или может быть терапевтическим с точки зрения частичного или полного излечения заболевания и/или побочного эффекта, связанного с заболеванием. «Лечение» в настоящем документе включает любое лечение заболевания у млекопитающего и включает: (а) предотвращение развития заболевания у субъекта, который может быть предрасположен к заболеванию, но которому еще не был поставлен диагноз; (b) подавление заболевания, т.е., остановка его развития; или (c) облегчение заболевания, т.е., индукция регрессии заболевания.
Термины «индивидуум», «субъект», «хозяин» и «пациент» используются в настоящем документе взаимозаменяемо и включают любого млекопитающего субъекта, который нуждается в диагностике, лечении или терапии, особенно человека.
Гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, например, мыши, несущие трансплантат гемопоэтических клеток человека, дополнительно обеспечивают полезную систему для скрининга на предмет потенциальных агентов для других желаемых действий in vivo, например, на предмет агентов, которые способны модулировать (т.е., содействовать или подавлять) развитие и/или активность Т-клеток и ПК-клеток человека, например, в здоровом или больном состоянии, например, для идентификации новых терапевтических средств и/или для лучшего понимания молекулярной основы развития и функционирования иммунной системы; на предмет агентов, которые являются токсичными для Т-клеток и/или ПК-клеток и их предшественников; и на предмет агентов, которые предотвращают, уменьшают или нейтрализуют токсическое воздействие токсичных агентов на Т-клетки, ПК-клетки и их предшественников; на предмет антител или антигенсвязывающих белков, которые опосредуют ПК-зависимые процессы АЗКЦ и т.д. Еще в одном примере генномодифицированные мыши, описанные в настоящем документе, обеспечивают полезную систему для прогнозирования восприимчивости индивидуума к терапии заболевания, например, обеспечивая in vivo платформы для скрининга восприимчивости иммунной системы индивидуума к агенту, например, терапевтическому агенту, с целью прогнозирования восприимчивости индивидуума к указанному агенту.
В скрининговых анализах биологически активных агентов гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, например, мыши, например, Rag2-/- IL2rgY/- hSIRPα hIL-15 мыши, несущие трансплантат гемопоэтических клеток человека, и в некоторых случаях, инфицированные патогенами человека, или клетки для трансплантации гуманизированному SIRPα-IL-15 животному, не являющемуся человеком, например, мыши, приводят в контакт с представляющим интерес потенциальным агентом и оценивают влияние потенциального агента путем мониторинга одного или нескольких параметров на выходе. Такие параметры на выходе могут отражать жизнеспособность клеток, например, общее количество гемопоэтических клеток или количество гемопоэтических клеток конкретного типа или апоптотическое состояние клеток, например, количественная оценка фрагментации ДНК, количественная оценка пузырения клеток, количественная оценка фосфатидилсерина на поверхности клетки и т.п., способами, которые хорошо известны из уровня техники. В качестве альтернативы или дополнительно, параметры на выходе могут быть отражением способности клеток к дифференцировке, например, доля дифференцированных клеток и дифференцированных типов клеток, например, Т-клеток и/или ПК-клеток. В качестве альтернативы или дополнительно, параметры на выходе могут быть отражением функции клеток, например, цитокинов и хемокинов, вырабатываемых клетками, способности клеток к хомингу и экстравазации к месту нагрузки, способности клеток модулировать, т.е., стимулировать или подавлять активность других клеток in vitro или in vivo и т.д. Другие параметры на выходе могут быть отражением степени инфицирования животного патогенами, например, титра патогена у животного, не относящегося к человеку, например, мыши и т.д.
Параметры представляют собой количественно определяемые компоненты клеток, в частности компоненты, которые могут быть точно измерены, желательно в высокопроизводительной системе. Параметром может быть любой элемент клетки или клеточный продукт, включая детерминант клеточной поверхности, рецептор, белок или конформационную, или посттрансляционную его модификацию, липид, углевод, органическую или неорганическую молекулу, нуклеиновую кислоту, например, мРНК, ДНК и т.д., или часть, полученную из такого клеточного компонента или их комбинацию. Хотя большинство параметров будут обеспечивать количественное измерение, в некоторых случаях приемлемым будет полуколичественный или качественный результат. Показатели могут включать одно определенное значение или могут включать среднее значение, медиану или дисперсию и т.д. Характерно, что для каждого параметра будет получен диапазон значений считывания параметров из множества одинаковых анализов. Ожидается вариабельность, и диапазон значений для каждого из множества тестовых параметров будет получен с применением стандартных статистических методов, причем общий статистический метод применяется для обеспечения одиночных значений.
Потенциальные агенты, представляющие интерес для скрининга, включают известные и неизвестные соединения, которые охватывают многочисленные химические классы, прежде всего органические молекулы, которые могут включать металлоорганические молекулы, неорганические молекулы, генетические последовательности, вакцины, антибиотики или другие агенты, у которых предполагается наличие антибиотических свойств, пептиды, полипептиды, антитела, антигенсвязывающие белки, агенты, которые представляют собой одобренные фармацевтические средства для применения у человека и т.д. Важным аспектом изобретения является оценка потенциальных лекарственных средств, включая испытание на токсичность; и т.п.
Потенциальные агенты включают органические молекулы, в том числе функциональные группы, необходимые для структурных взаимодействий, в частности образования водородных связей, и обычно включают по меньшей мере аминную, карбонильную, гидроксильную или карбоксильную группу, часто по меньшей мере две химические функциональные группы. Потенциальные агенты часто включают циклические углеродные или гетероциклические структуры и/или ароматические или полиароматические структуры, замещенные одной или несколькими из вышеуказанных функциональных групп. Кроме того, потенциальные агенты встречаются среди биомолекул, включая пептиды, полинуклеотиды, сахариды, жирные кислоты, стероиды, пурины, пиримидины, производные, структурные аналоги или их комбинации. Включены фармакологически активные лекарственные средства, генетически активные молекулы и т.д. Соединения, представляющие интерес, включают химиотерапевтические агенты, гормоны или антагонисты гормонов и т.д. Примерами фармацевтических агентов, подходящих для этого изобретения, являются те, которые описаны в «The Pharmacological Basis of Therapeutics», Goodman and Gilman, McGraw-Hill, New York, N.Y., (1996), девятое издание. Кроме того, включены токсины, а также биологические и химические боевые агенты, например, см. Somani, SM (Ed.), «Chemical Warfare Agents», Academic Press, New York, (1992).
Потенциальные агенты, представляющие интерес для скрининга, дополнительно включают нуклеиновые кислоты, например, нуклеиновые кислоты, которые кодируют миРНК, кшРНК, антисмысловые молекулы или микроРНК или нуклеиновые кислоты, которые кодируют полипептиды. Доступны многие векторы, пригодные для переноса нуклеиновых кислот в клетки-мишени. Векторы могут поддерживаться эписомально, например, в виде плазмид, мини-кольца ДНК, вирусных векторов, таких как цитомегаловирусный, аденовирусный и т.д., или они могут быть интегрированы в геном клетки-мишени посредством гомологичной рекомбинации или случайной интеграции, например, векторы, полученные из ретровирусов, такие как MMLV, ВИЧ-1, ALV и т.д. Векторы могут быть доставлены непосредственно в целевые клетки. Другими словами, плюрипотентные клетки приводят в контакт с векторами, содержащими представляющую интерес нуклеиновую кислоту, таким образом, что векторы поглощаются клетками.
Способы приведения клеток в контакт, например, клеток в культуре или клеток в организме животного, не относящегося к человеку, например, мыши, с векторами нуклеиновой кислоты, такие как электропорация, трансфекция с помощью хлорида кальция и липофекция, хорошо известны из уровня техники. В качестве альтернативы, нуклеиновая кислота, представляющая интерес, может быть доставлена в клетки с помощью вируса. Другими словами, клетки приводят в контакт с вирусными частицами, содержащими представляющую интерес нуклеиновую кислоту. Ретровирусы, например, лентивирусы, особенно пригодны для способа по изобретению. Обычно применяемые ретровирусные векторы являются «дефектными», т.е., неспособны продуцировать вирусные белки, необходимые для продуктивной инфекции. Скорее, репликация вектора требует роста в линии упаковывающих клеток. Для получения вирусных частиц, содержащих представляющие интерес нуклеиновые кислоты, ретровирусные нуклеиновые кислоты, включая указанную нуклеиновую кислоту, упаковывают в вирусные капсиды с помощью упаковывающей клеточной линии. Различные упаковывающие клеточные линии обеспечивают разный белок оболочки, который должен быть встроен в капсид, при этом указанный белок оболочки определяет специфичность вирусной частицы в отношении клеток. Белки оболочки делятся по меньшей мере на три типа: экотропные, амфотропные и ксенотропные. Ретровирусы, упакованные с экотропным белком оболочки, например, MMLV, способны инфицировать большинство типов клеток мышей и крыс и генерируются с применением экотропных упаковывающих клеточных линий, таких как BOSC23 (Pear et al. (1993) P.N.A.S. 90:8392-8396). Ретровирусы, содержащие амфотропный белок оболочки, например, 4070A (Danos et al., выше), способны инфицировать большинство типов клеток млекопитающих, включая человека, собаку и мышь, и генерируются с использованием амфотропных упаковывающих клеточных линий, таких как PA12 (Miller et al. (1985) Mol. Cell, Biol., 5: 431-437); PA317 (Miller et al., 1986) Mol. Cell, Biol., 6: 2895-2902); GRIP (Danos et al., 1988) PNAS 85: 6460-6464). Ретровирусы, упакованные с ксенотропным белком оболочки, например, AKR env, способны инфицировать большинство типов клеток млекопитающих, за исключением мышиных клеток. Соответствующую упаковывающую клеточную линию можно применять для обеспечения того, что вирусные частицы будут направленно действовать на представляющие интерес клетки - в некоторых случаях трансплантированные клетки, в некоторых случаях клетки хозяина, т.е., гуманизированного SIRPα-IL-15.
Векторы, применяемые для доставки нуклеиновой кислоты, представляющей интерес, в клетки по изобретению, обычно содержат подходящие промоторы для направления экспрессии, т.е., активации транскрипции, представляющей интерес нуклеиновой кислоты. Это может включать повсеместно действующие промоторы, например, промотор CMV-b-актина, или индуцируемые промоторы, такие как промоторы, которые активны в конкретных популяциях клеток или которые реагируют на присутствие лекарственных средств, таких как тетрациклин. При активации транскрипции предполагается, что транскрипция будет увеличена выше базальных уровней в клетке-мишени по меньшей мере примерно в 10 раз, по меньшей мере примерно в 100 раз, чаще по меньшей мере примерно в 1000 раз. Кроме того, векторы, применяемые для доставки факторов перепрограммирования в клетки по изобретению, могут включать гены, которые впоследствии должны быть удалены, например, с применением рекомбинантной системы, такой как Cre/Lox, или уничтожением клеток, которые экспрессируют их, например, путем включения генов, которые делают возможной избирательную токсичность, таких как TK герпесвируса, bcl-xs и т.д.
Потенциальные агенты, представляющие интерес для скрининга, дополнительно включают полипептиды. Такие полипептиды могут быть необязательно слиты с полипептидным доменом, который повышает растворимость продукта. Домен может быть связан с полипептидом через определенный сайт расщепления протеазой, например, последовательность TEV, которая расщепляется TEV протеазой. Кроме того, линкер может содержать одну или более гибких последовательностей, например, от 1 до 10 остатков глицина. В некоторых вариантах реализации изобретения расщепление химерного белка осуществляют в буфере, который поддерживает растворимость продукта, например, в присутствии от 0,5 до 2 М мочевины, в присутствии полипептидов и/или полинуклеотидов, которые повышают растворимость, и т.п. Домены, представляющие интерес, включают эндосомолитические домены, например, домен HA гриппа; и другие полипептиды, которые содействуют выработке, например, домен IF2, домен GST, домен GRPE и т.п. Дополнительно или в качестве альтернативы, такие полипептиды могут быть составлены для улучшения стабильности. Например, пептиды могут быть ПЭГилированными, причем полиэтиленоксигруппа обеспечивает увеличенный период полувыведения из кровотока. Полипептид может быть слит с другим полипептидом для обеспечения дополнительной функциональности, например, для повышения стабильности in vivo. Как правило, такие партнеры по слиянию представляют собой стабильный белок плазмы, который может, например, продлевать период полувыведения полипептида из плазмы in vivo, если он присутствует в форме слияния, в частности, если такой стабильный белок плазмы является константным доменом иммуноглобулина. Кроме того, в большинстве случаев, если стабильный белок плазмы обычно находится в мультимерной форме, например, иммуноглобулины или липопротеины, в которых одинаковые или различные полипептидные цепи обычно связаны дисульфидными и/или нековалентными связями с образованием собранного многоцепочечного полипептида, слияния по настоящему изобретению, содержащие полипептид, будут получены и применены в качестве мультимера, имеющего, по существу, такую же структуру, что и стабильный предшественник белка плазмы. Указанные мультимеры будут гомогенными по отношению к полипептидному агенту, который они содержат, или же они могут содержать более одного полипептидного агента.
Потенциальный полипептидный агент может быть получен из эукариотических клеток или может вырабатываться прокариотическими клетками. Он может быть дополнительно обработан путем разворачивания, например, термической денатурации, восстановления дитиотрейтолом (ДТТ) и т.д., и может быть дополнительно подвергнут рефолдингу с применением способов, известных из уровня техники. Представляющие интерес модификации, которые не изменяют первичную последовательность, включают химическую дериватизацию полипептидов, например, ацилирование, ацетилирование, карбоксилирование, амидирование и т.д. Кроме того, включены модификации в форме гликозилирования, например, модификации характера гликозилирования полипептида во время его синтеза и процессинга или на последующих стадиях процессинга; например, путем воздействия на полипептид ферментов, которые влияют на гликозилирование, таких как гликозилирующие или дегликозилирующие ферменты млекопитающих. Дополнительно включены последовательности, содержащие фосфорилированные аминокислотные остатки, например, фосфотирозин, фосфосерин или фосфотреонин. Полипептиды могут быть модифицированы с применением обычных методов молекулярной биологии и синтетической химии, чтобы улучшить их устойчивость к протеолитическому расщеплению или оптимизировать растворимость, или сделать их более подходящими в качестве терапевтического агента. Аналоги таких полипептидов включают такие, которые содержат остатки, отличные от встречающихся в природе L-аминокислот, например, D-аминокислоты или неприродные синтетические аминокислоты. Некоторые или все аминокислотные остатки могут быть замещены D-аминокислотами.
Потенциальный полипептидный агент может быть получен синтезом in vitro с применением общепринятых способов, известных из уровня техники. Доступны различные коммерческие устройства для синтеза, например, автоматизированные синтезаторы Applied Biosystems, Inc., Beckman и т.д. С помощью синтезаторов, встречающиеся в природе аминокислоты могут быть замещены неприродными аминокислотами. Конкретная последовательность и способ получения будут определяться удобством, экономией, требуемой чистотой и т.п. В качестве альтернативы, потенциальный полипептидный агент может быть выделен и очищен в соответствии с традиционными методами рекомбинантного синтеза. Лизат может быть получен из организма хозяина экспрессии и очищен с применением ВЭЖХ, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии или другой методики очистки. По большей части применяемые композиции будут содержать по меньшей мере 20 % масс. желаемого продукта, чаще по меньшей мере около 75 % масс., предпочтительно по меньшей мере около 95 % масс. и в терапевтических целях обычно не менее около 99,5% масс. по отношению к загрязняющим веществам, связанным со способом получения продукта и его очистки. Обычно значения процентов будут основываться на общем содержании белка.
В некоторых случаях потенциальные полипептидные агенты, подлежащие скринингу, представляют собой антитела или антигенсвязывающие белки. Термин «антитело» или «фрагмент антитела» включает любую молекулярную структуру, содержащую полипептидную цепь определенной формы, которая соответствует и распознает эпитоп, причем одно или более нековалентных связывающих взаимодействий стабилизируют комплекс между молекулярной структурой и эпитопом. Специфичное или избирательное соответствие конкретной структуры ее специфичному эпитопу иногда называют «замком и ключом». Архетипической молекулой антитела является иммуноглобулин, и все типы иммуноглобулинов, IgG, IgM, IgA, IgE, IgD и т.д. из всех источников, например, человека, грызуна, кролика, коровы, овцы, свиньи, собаки, других млекопитающих, курицы, других птиц и т.д., считаются «антителами». Антитела, применяемые в настоящем изобретении, могут быть поликлональными антителами или моноклональными антителами. Антитела обычно находятся в среде, в которой культивируют клетки. Помимо антител, антигенсвязывающие белки включают полипептиды, которые также предназначены для связывания с представляющим интерес антигеном и вызывают ответ, например, иммунологическую реакцию. Антигенсвязывающие фрагменты, известные из уровня техники (включая, например, Fab, Fab', F(ab')2, Fabc и scFv), дополнительно обозначаются термином «антигенсвязывающий белок». Кроме того, термины «антитело» и «антигенсвязывающий белок» включают одну или более цепей или фрагментов иммуноглобулина, которые могут быть химически конъюгированы или экспрессированы в виде химерных белков с другими белками, одноцепочечными антителами и биспецифичными антителами.
Потенциальные агенты могут быть получены из широкого круга источников, включая библиотеки синтетических или природных соединений. Например, существуют многочисленные средства для случайного и направленного синтеза широкого спектра органических соединений, в том числе биомолекул, включая экспрессию рандомизированных олигонуклеотидов и олигопептидов. В качестве альтернативы, библиотеки природных соединений в форме бактериальных, грибковых, растительных и животных экстрактов доступны или их можно с легкостью получить. Кроме того, природные или полученные синтетическим способом библиотеки и соединения легко модифицировать с помощью обычных химических, физических и биохимических средств и можно применять для получения комбинаторных библиотек. Известные фармакологические агенты могут быть подвергнуты направленным или случайным химическим модификациям, таким как ацилирование, алкилирование, этерификация, амидирование и т.д., с целью получения структурных аналогов.
Потенциальные агенты подвергают скринингу на предмет биологической активности путем введения агента по меньшей мере в один и, как правило, в несколько образцов, иногда в сочетании с образцами без агента. Измеряют изменение параметров в ответ на агент, и результат оценивают путем сравнения с эталонными культурами, например, в присутствии и отсутствии агента, полученными с другими агентами и т.д. В случаях, когда проводится скрининг с целью идентификации потенциальных агентов, которые будут предотвращать, смягчать или устранять действие токсичного агента, скрининг обычно проводят в присутствии токсичного агента, где токсичный агент добавляют в момент, наиболее подходящий для результатов, которые следует определить. Например, в тех случаях, когда тестируется защитная/профилактическая способность потенциального агента, потенциальный агент может быть добавлен перед токсичным агентом, одновременно с потенциальным агентом или после лечения с помощью потенциального агента. В качестве другого примера, в тех случаях, когда тестируется способность потенциального агента устранять эффекты токсичного агента, потенциальный агент может быть добавлен после обработки потенциальным агентом. Как упоминалось выше, в некоторых случаях образец представляет собой гуманизированное SIRPα-IL-15 животное, которое не является человеком, например, мышь, которой были трансплантированы клетки, т.е., потенциальный агент вводится гуманизированному SIRPα-IL-15, животному, не относящемуся к человеку, например, мыши, которой были трансплантированы клетки. В некоторых случаях образец представляет собой клетки, подлежащие трансплантации, т.е. потенциальный агент приводится в контакт с клетками до трансплантации.
Если потенциальный агент должен вводиться непосредственно животному, не относящемуся к человеку, например, мыши, то агент можно вводить любым из ряда способов введения пептидов, молекул небольшого размера и нуклеиновых кислот, известных из уровня техники. Например, агент можно вводить перорально, через слизистую, наносить местно, вводить внутрикожно или путем инъекции, например, внутрибрюшинной, подкожной, внутримышечной, внутривенной или внутричерепной инъекции и т.п. Агент можно вводить в буферном растворе или он может быть введен в любую из множества композиций, например, путем сочетания с соответствующим фармацевтически приемлемым носителем. «Фармацевтически приемлемые носители» могут быть носителями, одобренными регуляторным органом федерального правительства или правительства штата, или перечисленными в Фармакопее США или другой общепризнанной фармакопее для применения у млекопитающих, таких как человек. Термин «носитель» относится к разбавителю, адъюванту, вспомогательному веществу или носителю, с которым составлена смесь соединения по изобретению для введения млекопитающему. Такими фармацевтическими носителями могут быть липиды, например, липосомы, например, липосомные дендримеры; жидкости, такие как вода и масла, в том числе полученные из нефти, а также животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п., физиологический раствор; аравийская камедь, желатин, крахмальная паста, тальк, кератин, коллоидный кремния диоксид, мочевина и т.п. Кроме того, могут применяться вспомогательные вещества, стабилизаторы, загустители, смазывающие агенты и красители. Фармацевтические композиции могут быть составлены в виде препаратов в твердых, полутвердых, жидких или газообразных формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, инъекции, препараты для ингаляций, гели, микросферы и аэрозоли. После введения агент может действовать системно или может быть локализован с применением регионарного введения, внутримышечного введения или с применением имплантанта, который удерживает активную дозу в месте имплантации. Активный агент может быть составлен для немедленного действия или может быть составлен для замедленного высвобождения. При некоторых состояниях, особенно центральной нервной системы, может потребоваться составлять агенты таким образом, чтобы они проникали сквозь гематоэнцефалический барьер (ГЭБ). Одна из стратегий доставки лекарственного средства через гематоэнцефалический барьер (ГЭБ) включает нарушение целостности ГЭБ с помощью осмотических средств, таких как маннит, лейкотриены или биохимический способ с применением вазоактивных веществ, таких как брадикинин. Агент, нарушающий целостность ГЭБ, можно вводить совместно с агентом, если композиции вводят путем внутрисосудистой инъекции. Другие стратегии проникновения сквозь ГЭБ могут включать применение эндогенных транспортных систем, включая опосредованный Кавеолином-1 трансцитоз, опосредуемые носителями переносчики, такие как глюкоза и аминокислотные носители, опосредованный рецепторами трансцитоз для инсулина или трансферрина и активные эффлюксные переносчики, такие как р-гликопротеин. Кроме того, активные транспортные фрагменты можно конъюгировать с терапевтическими соединениями для применения в изобретении с целью облегчения переноса сквозь эндотелиальную стенку кровеносного сосуда. В качестве альтернативы, доставка лекарственного средства в форме агентов сквозь ГЭБ может осуществляться путем локального введения, например, путем интратекального введения, например, через резервуар Оммайя (см., например, патенты США №№ 5222982 и 5385582, включенные в настоящий документ посредством ссылки); путем инъекции болюса, например, с помощью шприца, например, интравитреально или интракраниально; путем непрерывной инфузии, например, с помощью канюли, например, с конвекцией (см., например, заявку США № 20070254842, включенную в настоящий документ посредством ссылки); или путем имплантации устройства, с которым агент обратимо соединен (см., например, заявки США №№ 20080081064 и 20090196903, включенные в настоящий документ посредством ссылки).
Если агент(ы) доставляется в клетки до трансплантации, то агенты удобно добавлять в виде раствора или легко растворимой формы в среду клеточной культуры. Агенты можно добавлять в проточной системе в виде потока, прерывистого или непрерывного или, в качестве альтернативы, добавления болюса соединения, однократно или постадийно, к статическому в других отношениях раствору. В проточной системе применяются две жидкости, причем одна представляет собой физиологически нейтральный раствор, а другая - такой же раствор с добавлением исследуемого соединения. Первая жидкость пропускается через клетки, затем вторая. В способе с одним раствором болюс исследуемого соединения добавляют к объему среды, окружающей клетки. Общие концентрации компонентов питательной среды не должны существенно изменяться с добавлением болюса или в промежутке между двумя растворами в проточном способе.
Множество анализов можно проводить параллельно с различными концентрациями агентов для получения дифференциального ответа на различные концентрации. Как известно из уровня техники, для определения эффективной концентрации агента обычно применяется диапазон концентраций, полученных в результате разведения 1:10 или других логарифмических разведений. При необходимости. концентрации могут быть дополнительно уточнены с помощью второй серии разведений. Как правило, одна из этих концентраций служит отрицательным контролем, т.е., при нулевой концентрации или ниже уровня обнаружения агента или при концентрации, или ниже концентрации агента, которая не дает обнаружимого изменения фенотипа.
Анализ ответа клеток в организме гуманизированного SIRPα-IL-15 животного, не являющегося человеком, например, мыши, на потенциальный агент может быть осуществлен в любое время после обработки агентом. Например, клетки можно анализировать через 1, 2 или 3 дня, иногда через 4, 5 или 6 дней, иногда через 8, 9 или 10 дней, иногда через 14 дней, иногда через 21 день, иногда через 28 дней, иногда через 1 месяц или более после контакта с потенциальным агентом, например, через 2 месяца, 4 месяца, 6 месяцев и более. В некоторых вариантах реализации изобретения, анализ включает анализ в нескольких временных точках. Выбор времени для анализа будет основываться на типе проводимого анализа, что будет понятно обычному специалисту.
Анализ может включать в себя измерение любого из параметров, описанных в настоящем документе или известного из уровня техники для измерения жизнеспособности клеток, клеточной пролиферации, идентичности клеток, клеточной морфологии и функции клеток, в частности, поскольку они могут принадлежать к клеткам иммунной системы, например, Т-клетки и/или ПК-клетки. Например, проточную цитометрию можно применять для определения общего количества гемопоэтических клеток или количества гемопоэтических клеток определенного типа. Для определения апоптотического состояния клеток может быть проведен гистохимический или иммуногистохимический анализ, например, терминальное дезоксиуридиновое dUTP мечение концов (ТДМК (TUNEL)) для измерения фрагментации ДНК или иммуногистохимический анализ для обнаружения связывания аннексина V с фосфатидилсерином на поверхности клетки. Кроме того, проточную цитометрию можно применять для оценки пропорций дифференцированных клеток и дифференцированных типов клеток, например, для определения способности гемопоэтических клеток дифференцироваться в присутствии агента. Твердофазный ИФА, Вестерн- и Нозерн-блоты могут быть получены для определения уровней цитокинов, хемокинов, иммуноглобулинов и т.д., экспрессируемых в организме несущего трансплантат гуманизированного SIRPα-IL-15 животного, не являющегося человеком, например, мыши, например, для оценки функционирования трансплантированных клеток. Кроме того, могут быть проведены анализы in vivo для тестирования функции иммунных клеток, а также анализы, относящиеся к конкретным заболеваниям или расстройствам, таким как диабет, аутоиммунное заболевание, болезнь «трансплантат против хозяина», возрастная дегенерация желтого пятна (ВДЖП) и т.д. См., например, Current Protocols in Immunology (Richard Coico, ed. John Wiley & Sons, Inc., 2012) и Immunology Methods Manual (I. Lefkovits ed., Academic Press 1997), содержание которых включено в настоящий документ посредством ссылки.
Таким образом, например, предлагается способ определения влияния агента на патоген человека, включающий воздействие на несущее трансплантат гуманизированное SIRPα-IL-15 животное, не относящееся к человеку, например, мышь, например, несущая трансплантат мышь Rag2-/-IL2rgY/- hSIRPα hIL-15, эффективного количества патогена человека, причем эффективное количество патогена представляет собой количество патогена, необходимого, чтобы вызвать инфекцию у мыши; создание условий для инфицирования мыши патогеном; измерение параметра инфекции во времени в присутствии агента; и сравнение результатов измерения с результатами измерения для несущего трансплантат гуманизированного SIRPα-IL-15 животного, не относящегося к человеку, например, мыши, которое не подвергалось воздействию агента. Агент определяется как антипатогенный, если он уменьшает количество агента в крови или ткани животного, не относящегося к человеку, например, мыши, по меньшей мере вдвое после однократного введения или введения двух, или более доз агента на протяжении выбранного периода времени.
В качестве другого примера предлагается способ определения наличия устойчивости к лекарственному средству у изолята или штамма патогена, представляющего интерес, например, устойчивости ко многим лекарственным средствам. В таких способах несущее трансплантат гуманизированное SIRPα-IL-15 животное, не относящееся к человеку, например, мышь, например, несущую трансплантат мышь Rag2-/-IL2rgY/- hSIRPα hIL-15, подвергают воздействию эффективного количества представляющего интерес изолята или штамма патогена человека, причем эффективное количество патогена представляет собой количество патогена, необходимое, чтобы вызвать инфекцию у животного, не относящегося к человеку, например, мыши; создают условия для инфицирования патогеном животного, не относящегося к человеку; измеряют параметр инфекции, например, титра изолята или штамма, представляющего интерес, в крови или ткани животного, не относящегося к человеку, способность изолята или штамма, представляющего интерес, поддерживать инфекцию у животного, не относящегося к человеку, или способность изолята или штамма, представляющего интерес, к размножению в организме животного, не относящегося к человеку в определенный момент времени после введения лекарственного средства, в присутствии лекарственного средства; и сравнивают результаты измерения с результатами измерения для несущего трансплантат гуманизированного SIRPα-IL-15 животного, не относящегося к человеку, например, мыши, инфицированного патогеном, который не подвергался воздействию агента. Примеры препаратов, представляющих интерес, включают амоксициллин, ампициллин, цефотаксим, цефтриаксон, цефтазидим, хлорамфеникол, ципрофлоксацин, котримоксазол, эртапенем, имипенем, фторхинолоны (например, ципрофлоксацин, гатифлоксацин, офлоксацин), стрептомицин, сульфадиазин, сульфаметоксазол, тетрациклин и их комбинацию. В конкретном варианте реализации изобретения введение лекарственного средства или комбинации лекарственных средств длится по меньшей мере неделю, 10 дней, две недели, три недели или четыре недели после инфицирования вызывающим инфекцию изолятом или штаммом, который представляет интерес.
Кроме того, гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку (например, мыши), и гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку (например, мыши), несущие трансплантат гемопоэтических клеток человека, например, несущие трансплантат мыши Rag2-/-IL2rgY/- hSIRPα hIL-15, и, возможно, содержащие другие генетические модификации, полезны при исследовании антителозависимой клеточной цитотоксичности (АЗКЦ), опосредованной ПК-клетками (например, ПК-клетками человека). Кроме того, такие животные обеспечивают полезные модели для тестирования способности потенциальных терапевтических лекарственных средств, например, антигенсвязывающих белков или антител, сконструированных для направленного действия на различные клетки (например, опухоли или инфицированные клетки) или инфекционные агенты, к активации путей ПК-клеток, участвующих в уничтожении таких клеток или инфекционных агентов.
Широко известно, что одним из механизмов, лежащих в основе терапии моноклональным антителом, является активация им ПК-клеток путем связывания с рецептором Fc CD16 ПК-клеток (Fc-гамма-рецептор IIIA). Были предприняты попытки увеличить аффинность различных известных моноклональных потенциальных агентов (например, ритуксимаба) к Fc-гамма RIIIA для улучшения АЗКЦ (например, Bowles et al., Blood, 2006: 108: 2648-2654; Garff-Tavernier et al., Leukemia 2011; 25: 202-209). Как показано в настоящем документе, несущие трансплантат гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, вырабатывают ПК-клетки человека, которые способны опосредовать АЗКЦ; и, таким образом, указанные животные обеспечивают полезную модель in vivo для изучения механизмов АЗКЦ и скрининга различных потенциальных терапевтических средств.
Таким образом, несущие трансплантат гуманизированные SIRPα-IL-15 животные, не относящиеся к человеку, и клетки, например, полученные от таких животных ПК-клетки человека, можно применять в способах скрининга, предназначенных для идентификации агентов, которые улучшают активность антителозависимой клеточной цитотоксичности (АЗКЦ) трансплантированного типа клеток в организме гуманизированного животного, не относящегося к человеку, или клетках, например, ПК-клетках человека. Например, подходящий способ может включать введение агента несущему трансплантат гуманизированному SIRPα-IL-15 животному, не относящемуся к человеку, и определение влияния агента на активность антителозависимой клеточной цитотоксичности (АЗКЦ) трансплантированного типа клеток in vivo в организме гуманизированного животного, не относящегося к человеку. В одном варианте реализации изобретения такой эффект приводит к улучшению уничтожения опухоли, например, трансплантированной опухоли, например, опухоли человека. В другом варианте реализации изобретения такой эффект приводит к улучшению уничтожения инфицированной клетки, например, инфицированной вирусом клетки или инфицированной бактерией клетки. В еще одном варианте реализации изобретения такой эффект приводит к улучшению уничтожения бактерии, гриба или паразита. В различных вариантах реализации изобретения агент представляет собой антитело или антигенсвязывающий белок. В некоторых вариантах реализации изобретения антитело или антигенсвязывающий белок сконструированы для направленного действия на антиген, экспрессируемый в опухолевой клетке человека. В некоторых вариантах реализации изобретения, антитело или антигенсвязывающий белок сконструированы для направленного действия на антиген, экспрессируемый в инфицированной вирусом клетке или инфицированной бактерией клетке. В некоторых вариантах реализации изобретения антитело или антигенсвязывающий белок сконструированы для направленного действия на бактериальный, грибковый или паразитарный антиген. В некоторых вариантах реализации изобретения предлагается способ in vitro, в котором клетки человека, например, ПК-клетки человека, выделяют из организма несущего трансплантат гуманизированного SIRPα-IL-15 животного, не относящегося к человеку, и приводят в контакт in vitro с агентом, таким как антитело или антиген- связывающий белок, и клеткой-мишенью (например, опухолевой клеткой) с целью определения эффективности агента с точки зрения опосредования уничтожения клетки-мишени. В дальнейшем можно определить влияние агента на цитолитическую активность клеток человека, например, ПК-клеток человека.
Другие примеры использования мышей по изобретению приведены в других местах настоящего документа Дополнительные сферы использования генномодифицированных и несущих трансплантат мышей, описанных в настоящем документе, будут очевидными для специалистов в данной области техники после прочтения настоящего документа.
Способы получения генетически модифицированных животных по изобретению, не относящихся к человеку
В некоторых аспектах изобретения предлагаются способы получения животных по настоящему изобретению, не относящихся к человеку. При практике способов по изобретению получают животное, не относящееся к человеку, которое содержит последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα, например, эндогенным промотором гена SIRPα, не относящимся к человеку; и последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, например, эндогенным промотором гена IL-15, не относящимся к человеку.
Получение животного, не относящегося к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека и функционально связанную с промотором SIRPα, и/или последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека и функционально связанную с промотором гена IL-15, может быть осуществлено с применением любого удобного способа получения генномодифицированных животных, например, известного из уровня техники или описанного в настоящем документе.
Например, нуклеиновая кислота, кодирующая белок SIRPα человека или белок IL-15 человека, может быть введена в рекомбинантный вектор в форме, подходящей для инсерции в геном клетки-хозяина и экспрессии белка человека в клетке-хозяине, не относящейся к человеку. В различных вариантах реализации изобретения рекомбинантный вектор содержит одну или более регуляторных последовательностей, функционально связанных с нуклеиновой кислотой, кодирующей белок человека, таким образом, что это позволяет транскрибировать нуклеиновую кислоту в мРНК и транслировать мРНК в белок человека, как описано выше. Необходимо понимать, что конструкция вектора может зависеть от таких факторов, как выбор клетки-хозяина, подлежащей трансфекции, и/или количество белка человека, которое должно быть экспрессировано.
Любой из различных способов может в дальнейшем применяться для введения последовательности нуклеиновой кислоты человека в клетку животного для получения генномодифицированного животного, которое экспрессирует ген человека. Такие способы хорошо известны в данной области техники и включают, но не ограничиваясь этим, пронуклеарную микроинъекцию, трансформацию эмбриональных стволовых клеток, гомологичную рекомбинацию и нокин-методики. Способы получения генномодифицированных животных, которые можно применять, включают, но не ограничиваясь этим, описанные Sundberg и Ichiki (2006, Genetically Engineered Mice Handbook, CRC Press), Hofker и van Deursen (2002, Genetically modified Mouse Methods and Protocols, Humana Press), Joyner (2000, Gene Targeting: A Practical Approach, Oxford University Press), Turksen (2002, Embryonic stem cells: Methods and Protocols in Methods Mol Biol., Humana Press), Meyer et al. (2010, Proc. Nat. Acad. Sci. USA 107: 15022-15026) и Gibson (2004, A Primer of Genome Science 2nd ed. Sunderland, Massachusetts: Sinauer), в патенте США № 6586251, Rathinam et al. (2011, Blood 118:3119-28), Willinger et al. (2011, Proc Natl Acad Sci USA, 108:2390-2395), Rongvaux et al. (2011, Proc Natl Acad Sci USA, 108:2378-83) и Valenzuela et al. (2003, Nat Biot 21:652-659).
Например, генномодифицированные животные по изобретению могут быть получены путем введения нуклеиновой кислоты, кодирующей белок человека, в яйцеклетку, например, путем микроинъекции, и создания условий развития яйцеклетки в организме суррогатной самки животного. В предпочтительных вариантах реализации изобретения нуклеиновую кислоту вводят в оплодотворенные яйцеклетки. Оплодотворенные яйцеклетки могут быть получены у суперовулирующих самок на следующий день после спаривания и инъецированы экспрессионной конструкцией. Инъецированные яйцеклетки культивируют в течение ночи или переносят непосредственно в яйцеводы псевдобеременных самок через 0,5 дня после спаривания. Способы суперовуляции, получения яйцеклеток, инъекции экспрессионной конструкции и переноса эмбрионов известны из уровня техники и описаны в Manipulating the Mouse Embryo (2002, A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press). Потомство может быть оценено на предмет наличия введенной нуклеиновой кислоты путем анализа ДНК (например, ПЦР, Саузерн-блоттинг, секвенирование ДНК и т.д.) или путем анализа белка (например, твердофазный ИФА, Вестерн-блот и т.д.).
В качестве другого примера конструкция, содержащая последовательность нуклеиновой кислоты, которая кодирует белок человека, может быть трансфецирована в стволовые клетки (например, ЭС-клетки или иПС-клетки) с применением хорошо известных способов, таких как электропорация, осаждение кальция фосфатом, липофекция, и т.д. Клетки могут быть оценены на предмет наличия введенной нуклеиновой кислоты путем анализа ДНК (например, ПЦР, Саузерн-блоттинг, секвенирование ДНК и т.д.) или путем анализа белка (например, твердофазный ИФА, Вестерн-блот и т.д.). Клетки, которые определены как содержащие экспрессионную конструкцию, в дальнейшем могут быть введены в предимплантационные эмбрионы. Подробное описание способов, известных из уровня техники и пригодных для композиций и способов по изобретению, см. в Nagy et al., (2002, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory Press), Nagy et al. (1990, Development 110:815-821), патенте США № 7576259, патенте США № 7659442, патенте США № 7294754 и Kraus et al. (2010, Genesis 48:394-399).
В предпочтительном варианте реализации изобретения в способе получения генномодифицированного животного, описанного в настоящем документе, применяют конструкцию направленного действия, полученную с применением технологии VELOCIGENE®, вводят конструкцию в ЭС-клетки и вводят целевые клоны ЭС-клеток в эмбрион мыши с применением технологии VELOCIMOUSE®, как описано в Примерах.
Генетически модифицированные животные-основатели могут быть разведены с получением дополнительных животных, несущих указанную генетическую модификацию. Например, гуманизированные SIRPα животные, не относящиеся к человеку, могут быть разведены с использованием гуманизированных IL-15 животных, не относящихся к человеку, того же вида с целью получения описанных в настоящем документе hSIRPa-hIL-15 животных, не относящихся к человеку. Генетически модифицированные животные, содержащие нуклеиновую кислоту, кодирующую белок(ки) человека по настоящему изобретению, могут быть дополнительно разведены с получением нокаутных животных, например, животного, не относящегося к человеку, у которого присутствует дефицит одного или нескольких белков, например, которое не экспрессирует один или более из своих генов, например, Rag2-дефицитное животное и/или I12rg-дефицитное животное.
Как обсуждалось выше, в некоторых вариантах реализации изобретения, генномодифицированное животное по изобретению, не относящиеся к человеку, является иммунодефицитным животным. Генетически модифицированные животные, не относящиеся к человеку, которые являются иммунодефицитными и несут один или более белков человека, например, hSIRPα и/или hIL-15, могут быть получены с применением любого удобного способа получения генномодифицированных животных, например, известного из уровня техники или описанного в настоящем документе. Например, получение генномодифицированного иммунодефицитного животного может быть осуществлено путем введения нуклеиновой кислоты, кодирующей белок человека, в яйцеклетку или стволовые клетки, содержащие мутантный аллель гена SCID, который, будучи гомозиготным, приведет к иммунодефициту, как описано более подробно выше и в рабочих примерах в настоящем документе. Затем получают мышей из модифицированной яйцеклетки или ЭС-клеток, применяя, например, способы, описанные в настоящем документе и известные из уровня техники, и спаривают с получением иммунодефицитных мышей, содержащих желаемую генетическую модификацию. В качестве другого примера, генномодифицированные животные, не относящиеся к человеку, могут быть получены в иммунокомпетентном генетическом фоне и скрещены с животным, несущим мутантный аллель гена, который, будучи гемизиготным или гомозиготным, приводит к иммунодефициту, а потомство спаривают с получением иммунодефицитного животного, экспрессирующего по меньшей мере один белок человека, представляющий интерес.
В некоторых вариантах реализации изобретения генномодифицированное животное, не относящееся к человеку, обрабатывают таким образом, чтобы элиминировать эндогенные гемопоэтические клетки, которые могут присутствовать у генномодифицированного животного, не относящегося к человеку. В одном варианте реализации изобретения лечение включает облучение генномодифицированного животного, не относящегося к человеку. В конкретном варианте реализации изобретения новорожденных генномодифицированных детенышей мыши подвергают облучению сублетальными дозами. В конкретном варианте реализации изобретения новорожденных детенышей облучают 2 x 200 сГр с четырехчасовым промежутком.
В различных вариантах реализации изобретения предлагаются генномодифицированные животные, которые содержат нуклеиновую кислоту человека по существу во всех своих клетках, а также генномодифицированные животные, которые содержат нуклеиновую кислоту человека в некоторых из их клеток, но не во всех. В некоторых случаях, например, при целенаправленной рекомбинации, в геном генномодифицированных животных будет интегрирована одна копия нуклеиновой кислоты человека. В других случаях, например, при случайной интеграции, множественные копии нуклеиновой кислоты человека, смежные или отдаленные друг от друга, могут быть интегрированы в геном генномодифицированных животных.
Таким образом, в некоторых вариантах реализации изобретения генномодифицированное животное по изобретению, не относящееся к человеку, может быть иммунодефицитным животным, несущим геном, который содержит нуклеиновую кислоту, кодирующую полипептид человека, функционально связанный с соответствующим промотором животного, не относящегося к человеку, причем животное экспрессирует кодируемый полипептид человека. Другими словами, генномодифицированное иммунодефицитное животное по изобретению, не относящееся к человеку, содержит геном, который содержит нуклеиновую кислоту, кодирующую по меньшей мере один полипептид человека, причем нуклеиновая кислота функционально связана с соответствующим промотором, не относящимся к человеку, и сигналом полиаденилирования, и, при этом, животное экспрессирует кодируемый полипептид человека.
Реагенты, устройства и наборы
Дополнительно предлагаются реагенты, устройства и наборы для применения одного или нескольких из вышеописанных способов. Реагенты, устройства и наборы по изобретению могут в существенной степени варьировать.
В некоторых вариантах реализации изобретения реагенты или наборы будут включать одно или более агентов для применения в описанных в настоящем документе способах. Например, набор может включать гуманизированное SIRPα-IL-15 животное, не являющееся человеком, например, мышь, например, мышь Rag2-/-IL2rgY/- hSIRPα hIL-15. Набор может включать реагенты для разведения гуманизированных SIRPα-IL-15 животных, не относящихся к человеку, например, мышей, например, праймеры и, в некоторых случаях, реагенты для генотипирования гуманизированных SIRPα-IL-15 животных, не относящихся к человеку, например, мышей. Набор может включать гемопоэтические клетки человека или обогащенную популяцию гемопоэтических клеток-предшественников человека для трансплантации гуманизированному SIRPα-IL-15 животному, не относящемуся к человеку, например, мыши, или реагенты для получения популяции гемопоэтических клеток или обогащенной популяции гемопоэтических клеток человека для трансплантации гуманизированному SIRPα-IL-15 животному, не относящемуся к человеку, например, мыши. Другие реагенты могут включать реагенты для определения жизнеспособности и/или функции гемопоэтических клеток или дифференцированных иммунных клеток (например, Т-клеток и/или ПК-клеток), например, в присутствии/отсутствие потенциального агента, например, одного или более антител, специфичных в отношении маркеров, экспрессируемых различными типами гемопоэтических клеток или дифференцированных иммунных клеток (например, Т-клеток и/или ПК-клеток), или реагенты для обнаружения конкретных цитокинов, хемокина и т.д. Другие реагенты могут включать питательную среду, добавки к питательной среде, композиции матрикса и т.п.
В дополнение к вышеуказанным компонентам, наборы по изобретению дополнительно будут включать инструкции по применению способов по изобретению. Указанные инструкции могут присутствовать в наборах по изобретению в различных формах, одна или более из которых могут присутствовать в наборе. Одна из форм, в которых указанные инструкции могут присутствовать, представляет собой печатную информацию на подходящем носителе или подложке, например, лист или листы бумаги, на которых напечатана информация, на упаковке набора, на листке-вкладыше в упаковку и т.д. Другим средством будет компьютерный носитель, например, дискета, компакт-диск и т.д., на котором записана информация. Еще одно средство, которое может присутствовать, представляет собой адрес веб-сайта, к которому можно подключиться через Интернет для доступа к информации на удаленном сайте. Любые удобные средства могут присутствовать в наборах.
Типичные неограничивающие аспекты настоящего изобретения
Аспекты, включая варианты реализации изобретения в соответствии с объектом настоящего изобретения, описанным выше, могут быть полезными по отдельности или в сочетании с одним или несколькими другими аспектами или вариантами реализации изобретения. Без ограничения вышеприведенным описанием, ниже приведены некоторые неограничивающие аспекты настоящего документа, пронумерованные от 1 до 167. Как будет очевидно для специалистов в данной области техники после прочтения этого раскрытия, каждый из индивидуально пронумерованных аспектов может применяться или сочетаться с любым из предшествующих или последующих индивидуально пронумерованных аспектов. Это предназначено для поддержки всех таких комбинаций аспектов и не ограничивается комбинациями аспектов, явно указанными ниже:
1. Генномодифицированное животное, не относящееся к человеку, которое содержит:
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα; а также
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека.
2. Генномодифицированное животное, не относящееся к человеку, по п. 1, отличающееся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку.
3. Генномодифицированное животное, не относящееся к человеку, по п. 2, отличающееся тем, что промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
4. Генномодифицированное животное, не относящееся к человеку, по п. 3, содержащее нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
5. Генномодифицированное животное, не относящееся к человеку, по п. 4, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши.
6. Генномодифицированное животное, не относящееся к человеку, по п. 4, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
7. Генномодифицированное животное, не относящееся к человеку, по п. 4, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
8. Генномодифицированное животное, не относящееся к человеку, по любому из пп. 1-7, отличающееся тем, что последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
9. Генномодифицированное животное, не относящееся к человеку, по любому из пп. 1-8, отличающееся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
10. Генномодифицированное животное, не относящееся к человеку, по п. 9, отличающееся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
11. Генномодифицированное животное, не относящееся к человеку, по п. 10, отличающееся тем, что внеклеточный домен содержит аминокислоты 28-362 из SEQ ID NO: 12.
12. Генномодифицированное животное, не относящееся к человеку, по любому из 1-11, отличающееся тем, что промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку.
13. Генномодифицированное животное, не относящееся к человеку, по п. 12, отличающееся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
14. Генномодифицированное животное, не относящееся к человеку, по п. 13, отличающееся тем, что содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
15. Генномодифицированное животное, не относящееся к человеку, по п. 14, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
16. Генномодифицированное животное, не относящееся к человеку, по п. 14, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
17. Генномодифицированное животное, не относящееся к человеку, по п. 14, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
18. Генномодифицированное животное, не относящееся к человеку, по любому из пп. 1-17, отличающееся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
19. Генномодифицированное животное, не относящееся к человеку, по любому из 1-18, отличающееся тем, что белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
20. Генномодифицированное животное, не относящееся к человеку, по любому из пп. 1-19, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, является иммунодефицитным.
21. Генномодифицированное животное, не относящееся к человеку, по п. 20, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
22. Генномодифицированное животное, не относящееся к человеку, по п. 20 или п. 21, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
23. Генномодифицированное животное, не относящееся к человеку, по любому из пп. 1-22, отличающееся тем, что животное, не относящееся к человеку, является млекопитающим.
24. Генномодифицированное животное, не относящееся к человеку, по п. 23, отличающееся тем, что млекопитающее является грызуном.
25. Генномодифицированное животное, не относящееся к человеку, по п. 24, отличающееся тем, что грызун является мышью.
26. Генномодифицированное животное, не относящееся к человеку, по любому из 1-25, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, содержит трансплантат гемопоэтических клеток человека.
27. Генномодифицированное животное, не относящееся к человеку, по п. 26, отличающееся тем, что генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека.
28. Генномодифицированное животное, не относящееся к человеку, по п. 27, отличающееся тем, что патоген человека активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры (ПК).
29. Генномодифицированное животное, не относящееся к человеку, по п. 27, отличающееся тем, что патоген человека является патогеном, который инфицирует кишечник человека.
30. Генномодифицированное животное, не относящееся к человеку, по п. 29, отличающееся тем, что патоген человека является ротавирусом человека.
31. Генномодифицированное животное, не относящееся к человеку, по п. 27, отличающееся тем, что патоген инфицирует легкое человека.
32. Генномодифицированное животное, не относящееся к человеку, по п. 31, отличающееся тем, что патоген человека является вирусом гриппа.
33. Животная модель трансплантации, включающая генномодифицированное животное, не относящееся к человеку, которое содержит:
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα;
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15; и
трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в тонком кишечнике и пейеровых бляшках генномодифицированного животного, не относящегося к человеку.
34. Модель по п. 33, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека.
35. Модель по 34, отличающаяся тем, что патоген человека представляет собой кишечный патоген.
36. Модель по 35, отличающаяся тем, что кишечный патоген выбран из: Campylobacter jejuni, Clostridium difficile, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, ротавируса человека, Listeria monocytogenes, вируса Норуолка, Salmonella enterica, Shigella flexneri, Shigella sonnei, Shigella dysenteriae, Yersinia pestis, Yersinia enterocolitica и Helicobacter pylori.
37. Модель по любому из пп. 33-36, отличающаяся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку.
38. Модель по 37, отличающаяся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
39. Модель по 38, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
40. Модель по п. 39, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши.
41. Модель по п. 39, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
42. Модель по п. 39, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
43. Модель по любому из пп. 33-42, отличающаяся тем, что последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
44. Модель по любому из пп. 33-43, отличающаяся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
45. Модель по 44, отличающаяся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
46. Модель по 45, отличающаяся тем, что внеклеточный домен содержит аминокислоты 28-362 из SEQ ID NO: 12.
47. Модель по любому из 33-46, отличающаяся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку.
48. Модель по п. 47, отличающаяся тем, что промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
49. Модель по п. 48, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
50. Модель по п. 49, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
51. Модель по п. 48, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
52. Модель по п. 48, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
53. Модель по любому из пп. 33-52, отличающаяся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
54. Модель по любому из пп. 33-53, отличающаяся тем, что белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
55. Модель по любому из пп. 33-54, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является иммунодефицитным.
56. Модель по п. 55, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
57. Модель по п. 55 или п. 56, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
58. Модель по любому из пп. 33-57, отличающаяся тем, что животное, не относящееся к человеку, является млекопитающим.
59. Модель по 58, отличающаяся тем, что млекопитающее является грызуном.
60. Модель по п. 59, отличающаяся тем, что грызун является мышью.
61. Животная модель трансплантации, включающая генномодифицированное животное, не относящееся к человеку, которое содержит:
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα;
последовательность нуклеиновой кислоты, встроенную в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15; и
трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в легком генномодифицированного животного, не относящегося к человеку.
62. Модель по п. 61, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, инфицировано патогеном человека.
63. Модель по п. 62, отличающаяся тем, что патоген человека является легочным патогеном.
64. Модель по п. 63, отличающаяся тем, что легочный патоген выбран из: Streptococcus pyogenes, Haemophilus influenza, Corynebacterium diphtheria, коронавируса атипичной пневмонии, Bordetella pertussis, Moraxella catarrhalis, вируса гриппа (A, B, C), коронавируса, аденовируса, респираторного синцитиального вируса, вируса парагриппа, вируса свинки, Streptococcus pneumoniae, Staphylococcus aureus, Legionella pneumophila, Klebsiella pneumoniae, Pseudomonas aeruginosa, Mycoplasma pneumonia, Mycobacterium tuberculosis, Chlamydia pneumoniae, Blastomyces dermatitidis, Cryptococcus neoformans и Aspergillus fumigatus.
65. Модель по любому из пп. 61-64, отличающаяся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку.
66. Модель по п. 65, отличающаяся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
67. Модель по п. 66, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
68. Модель по п. 67, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши.
69. Модель по п. 67, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
70. Модель по п. 67, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
71. Модель по любому из пп. 61-70, отличающаяся тем, что последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
72. Модель по любому из пп. 61-71, отличающаяся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
73. Модель по п. 72, отличающаяся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
74. Модель по п. 73, отличающаяся тем, что внеклеточный домен содержит аминокислоты 28-362 из SEQ ID NO: 12.
75. Модель по любому из пп. 61-74, отличающаяся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку.
76. Модель по п. 75, отличающаяся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
77. Модель по п. 76, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
78. Модель по п. 77, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
79. Модель по п. 77, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
80. Модель по п. 77, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
81. Модель по любому из пп. 61-80, отличающаяся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
82. Модель по любому из пп. 61-80, отличающаяся тем, что белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
83. Модель по любому из пп. 61-82, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, является иммунодефицитным.
84. Модель по п. 83, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
85. Модель по п. 83 или п. 84, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
86. Модель по любому из пп. 61-85, отличающаяся тем, что животное, не относящееся к человеку, является млекопитающим.
87. Модель по п. 86, отличающаяся тем, что млекопитающее является грызуном.
88. Модель по 87, отличающаяся тем, что грызун является мышью.
89. Способ определения эффективности потенциальной вакцины, индуцирующей Т-клетки, включающий:
введение потенциальной вакцины, индуцирующей Т-клетки, генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15, и
(iii) трансплантат гемопоэтических клеток человека, притом, что генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека;
нагрузку генномодифицированного животного, не относящегося к человеку, патогеном человека; и
определение того, будет ли потенциальная вакцина, индуцирующая Т-клетки, вызывать опосредованный Т-клетками иммунный ответ у генномодифицированного животного, не относящегося к человеку.
90. Способ по п. 89, отличающийся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку.
91. Способ по п. 90, отличающийся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
92. Способ по п. 91, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
93. Способ по п. 92, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по крайней мере экзонов 2-4 SIRPα мыши.
94. Способ по п. 92, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
95. Способ по п. 92, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
96. Способ по любому из пп. 89-95, отличающийся тем, что последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
97. Способ по любому из пп. 89-96, отличающийся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
98. Способ по п. 97, отличающийся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
99. Способ по п. 98, отличающийся тем, что внеклеточный домен содержит аминокислоты 28-362 из SEQ ID NO: 12.
100. Способ по любому из пп. 89-99, отличающийся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку.
101. Способ по п. 100, отличающийся тем, что промотор гена IL-15 является эндогенным промотором гена IL-15, не относящимся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
102. Способ по п. 101, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
103. Способ по п. 102, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
104. Способ по п. 101, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
105. Способ по п. 101, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
106. Способ по любому из пп. 89-105, отличающийся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
107. Способ по любому из пп. 89-106, отличающийся тем, что белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
108. Способ по любому из пп. 89-107, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
109. Способ по любому из пп. 89-108, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
110. Способ по любому из пп. 89-109, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является млекопитающим.
111. Способ по п. 110, отличающийся тем, что млекопитающее является грызуном.
112. Способ по п. 111, отличающийся тем, что грызун является мышью.
113. Способ идентификации агента, который подавляет инфицирование патогеном, активирующим, индуцирующим и/или направленно действующим на Т-клетки и/или природные клетки-киллеры (ПК) человека, причем способ включает:
введение агента генномодифицированному животному, не относящемуся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15,
(iii) трансплантат гемопоэтических клеток человека, и
{iv} инфекция патогеном, который активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, будет ли агент уменьшать количество патогена у инфицированного патогеном животного, не относящегося к человеку.
114. Способ по п. 113, отличающийся тем, что промотор гена SIRPα представляет собой эндогенный промотор гена SIRPα, не относящийся к человеку.
115. Способ по п. 114, отличающийся тем, что промотор гена SIRPα является эндогенным промотором гена SIRPα, не относящимся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
116. Способ по п. 115, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене SIRPα, не относящемся к человеку, в локусе гена SIRPα животного, не относящегося к человеку.
117. Способ по п. 116, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 2-4 SIRPα мыши.
118. Способ по п. 116, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
119. Способ по п. 116, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
120. Способ по любому из пп. 113-119, отличающийся тем, что последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека, содержит геномную кодирующую и некодирующую последовательность SIRPα человека.
121. Способ по любому из пп. 113-120, отличающийся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
122. Способ по п. 121, отличающийся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
123. Способ по п. 122, отличающийся тем, что внеклеточный домен содержит аминокислоты 28-362 из SEQ ID NO: 12.
124. Способ по любому из пп. 113-123, отличающийся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку.
125. Способ по п. 124, отличающийся тем, что промотор гена IL-15 представляет собой эндогенный промотор гена IL-15, не относящийся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
126. Способ по п. 125, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нулевую мутацию в гене IL-15, не относящемся к человеку, в локусе гена IL-15 животного, не относящегося к человеку.
127. Способ по п. 126, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является мышью, а нулевая мутация является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
128. Способ по п. 125, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гетерозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
129. Способ по п. 125, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
130. Способ по любому из пп. 113-129, отличающийся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
131. Способ по любому из пп. 113-130, отличающийся тем, что белок IL-15 человека представляет собой функциональный фрагмент полноразмерного белка IL-15 человека.
132. Способ по любому из пп. 113-131, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена Rag2.
133. Способ по любому из пп. 113-132, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, содержит нокаут гена IL2rg.
134. Способ по любому из пп. 113-133, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, является млекопитающим.
135. Способ по п. 134, отличающийся тем, что млекопитающее является грызуном.
136. Способ по 135, отличающийся тем, что грызун является мышью.
137. Способ получения животного, не относящегося к человеку, которое экспрессирует белок IL-15 человека и белок SIRPα человека, причем способ включает:
введение в геном первого животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека, и, при этом, последовательность, кодирующая белок SIRPα человека, функционально связана с последовательностью промотора гена SIRPα;
введение в геном второго животного, не относящегося к человеку, последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека, причем последовательность, кодирующая белок IL-15 человека, функционально связана с последовательностью промотора IL-15; и
получение третьего животного, не относящегося к человеку, которое содержит последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, притом, что третье животное, не относящееся к человеку, экспрессирует белок IL-15 человека и белок SIRPα человека.
138. Способ по п. 137, отличающийся тем, что стадии введения включают получение животного, не относящегося к человеку, из плюрипотентной стволовой клетки, содержащей нуклеиновую кислоту, кодирующую IL-15 человека или SIRPα человека.
139. Способ по п. 137 или п. 138, отличающийся тем, что первое животное отличается от второго животного, а на стадии получения третьего животного происходит скрещивание первого и второго животных.
140. Способ по п. 137, отличающийся тем, что первое животное и второе животное являются одинаковыми, стадия введения в геном первого животного включает приведение в контакт первой плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок SIRPα человека, с получением второй плюрипотентной стволовой клетки, стадия введения в геном второго животного включает приведение в контакт второй плюрипотентной стволовой клетки с последовательностью нуклеиновой кислоты, кодирующей белок SIRPα человека, с получением третьей плюрипотентной стволовой клетки, и третье животное, не относящееся к человеку, получают из третьей плюрипотентной стволовой клетки.
141. Способ по любому из пп. 137-140, отличающийся тем, что плюрипотентная стволовая клетка представляет собой эмбриональную стволовую (ЭС)-клетку или индуцированную плюрипотентную стволовую (иПС)-клетку.
142. Способ по любому из пп. 137-140, отличающийся тем, что в плюрипотентной стволовой клетке присутствует дефицит Rag2.
143. Способ по любому из пп. 137-142, отличающийся тем, что в плюрипотентной стволовой клетке присутствует дефицит IL2rg.
144. Способ по любому из пп. 137-143, отличающийся тем, что у третьего животного, не относящегося к человеку, присутствует дефицит одного или обоих из Rag2 и IL2rg.
145. Способ по любому из пп. 137-144, отличающийся тем, что последовательность промотора IL-15 представляет собой последовательность промотора IL-15 человека.
146. Способ по любому из пп. 137-144, отличающийся тем, что последовательность промотора IL-15 представляет собой эндогенную последовательность промотора IL-15 животного, не относящегося к человеку.
147. Способ по любому из пп. 137-144, отличающийся тем, что интеграция приводит к замене гена IL-15, не относящегося к человеку, в локусе гена IL-15, не относящемся к человеку.
148. Способ по любому из пп. 137-147, отличающийся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
149. Способ трансплантации генномодифицированному животному, не относящемуся к человеку, которое экспрессирует белок IL-15 человека, включающий:
трансплантацию популяции клеток, содержащей гемопоэтические клетки человека, генномодифицированному животному, не относящемуся к человеку, которое получено способом по любому из пп. 137-148.
150. Способ по п. 149, отличающийся тем, что трансплантация включает инъекцию в хвостовую вену, инъекцию в печень плода или ретроорбитальную инъекцию.
151. Способ по п. 149 или п. 150, отличающийся тем, что генномодифицированное животное, не относящееся к человеку, перед трансплантацией подвергают облучению сублетальными дозами.
152. Способ по любому из пп. 149-151, отличающийся тем, что гемопоэтические клетки человека являются клетками CD34+.
153. Способ по любому из пп. 149-151, отличающийся тем, что гемопоэтические клетки человека получены из печени плода, костного мозга взрослого человека или пуповинной крови.
154. Способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при уничтожении клетки-мишени, причем способ включает:
введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированному животному, не относящемуся к человеку, и, при этом, у генномодифицированного животного, не относящегося к человеку, присутствует дефицит эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15 и
(iii) трансплантат гемопоэтических клеток человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, будет ли потенциальное терапевтическое антитело или антигенсвязывающий белок модулировать опосредованную ПК-клетками антителозависимую клеточную цитотоксичность в отношении клетки-мишени у генномодифицированного животного, не относящегося к человеку.
155. Способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при уничтожении клетки-мишени, причем способ содержит:
выделение ПК-клетки из организма генномодифицированного животного, не относящегося к человеку, притом, что у генномодифицированного животного, не относящегося к человеку, присутствует дефицит эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15 и
(iii) трансплантат гемопоэтических клеток человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека;
приведение в контакт изолированной ПК-клетки с потенциальным терапевтическим антителом или антигенсвязывающим белком и клеткой-мишенью; и
определение зависимой от антитела или антигенсвязывающего белка цитолитической активности выделенной ПК-клетки против клетки-мишени.
156. Способ скрининга потенциального терапевтического антитела или антигенсвязывающего белка на предмет улучшенной эффективности при уничтожении клетки-мишени, причем способ включает:
введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированному животному, не относящемуся к человеку, и, при этом, у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15 и
(iii) трансплантат гемопоэтических клеток человека, и, при этом, генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, проявляет ли потенциальное терапевтическое антитело или антигенсвязывающий белок улучшенную эффективность при уничтожении клетки-мишени у генномодифицированного животного, не относящегося к человеку.
157. Способ по любому из пп. 154-156, отличающийся тем, что клетка-мишень выбрана из группы, состоящей из опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки и паразитарной клетки.
158. Способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при опосредованном ПК-клеткой уничтожении клетки-мишени, причем способ включает:
введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированному животному, не относящемуся к человеку, и, при этом, у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и:
(i) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, притом, что указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα,
(ii) последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15 и
(iii) трансплантат гемопоэтических клеток человека, причем генномодифицированное животное, не относящееся к человеку, экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, будет ли потенциальное терапевтическое антитело или антигенсвязывающий белок модулировать (например, активировать) опосредованную ПК-клеткой антителозависимую клеточную цитотоксичность в отношении клетки-мишени в организме генномодифицированного неживотного, не относящегося к человеку.
159. Способ по п. 158, отличающийся тем, что клетка-мишень выбрана из группы, состоящей из опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки и паразитарной клетки.
160. Способ по п. 159, отличающийся тем, что клетка-мишень является опухолевой клеткой.
161. Способ по п. 160, отличающийся тем, что опухолевая клетка является клеткой В-клеточной лимфомы.
162. Модель опосредованной ПК-клеткой антителозависимой клеточной цитотоксичности, включающая генномодифицированное животное, не относящееся к человеку, причем у генномодифицированного животного, не относящегося к человеку, имеется недостаточность эндогенной иммунной системы и:
последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с промотором гена SIRPα;
последовательность нуклеиновой кислоты, встроенная в геном генномодифицированного животного, не относящегося к человеку, и, при этом, указанная последовательность кодирует белок IL-15 человека и функционально связана с промотором гена IL-15; и
трансплантат гемопоэтических клеток человека, притом, что генномодифицированное животное, не относящееся к человеку, (i) экспрессирует белок SIRPα человека и белок IL-15 человека, (ii) содержит лимфоциты человека и (iii) содержит клетку-мишень, выбранную из группы, состоящей из опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки и паразитарной клетки.
163. Модель по п. 162, отличающаяся тем, что клетка-мишень является опухолевой клеткой.
164. Модель по п. 163, отличающаяся тем, что опухолевая клетка представляет собой клетку В-клеточной лимфомы.
165. Модель по п. 163 или п. 164, отличающаяся тем, что модель включает экзогенное потенциальное терапевтическое антитело или антигенсвязывающий белок.
166. Модель по любому из пп. 162-165, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в тонком кишечнике и пейровых бляшках- генномодифицированного животного, не относящегося к человеку.
167. Модель по любому из пп. 162-166, отличающаяся тем, что генномодифицированное животное, не относящееся к человеку, содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в легком генномодифицированного животного, не относящегося к человеку.
ПРИМЕРЫ
Следующие примеры приведены для того, чтобы предоставить обычным специалистам в данной области техники полное раскрытие и описание способов внедрения и применения настоящего изобретения и не предназначены для ограничения объема того, что изобретатели считают своим изобретением, а также не предназначены для представления того, что приведенные ниже эксперименты являются исчерпывающим перечнем или единственными выполненными экспериментами. Были предприняты усилия для обеспечения точности в отношении используемых чисел (например, количества, температура и т.д.), однако следует учитывать некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой части по массе, молекулярная масса представляет собой среднюю молекулярную массу, температура выражена в градусах Цельсия, а давление равно атмосферному или близко к атмосферному.
Пример 1: Получение гуманизированных SIRPα (SRG) нокин-мышей
Получена нокин-мышь с SIRPα человека, которая экспрессирует внеклеточный домен SIRPα человека, функционально связанный с промотором SIRPα мыши (см. Фиг. 1). Известно, что SIRPα человека существует по меньшей мере в 10 аллельных формах. В данном конкретном примере применяется вариант 1 SIRPα человека для гуманизации эндогенного гена SIRPα мыши.
Материалы и методы
Получение нокин-мышей, кодирующих SIRPα человека в генетическом фоне Rag2-/- I12rgY/- 129xBalb/c (N2) осуществляли с применением технологии VELOCIGENE®, как описано более подробно ниже. Мышей содержали в особых условиях без патогенов, с непрерывным введением энрофлоксацина в питьевую воду (Baytril, 0,27 мг/мл).
Вектор направленного действия для гуманизации внеклеточного участка гена SIRP (например, SIRPα) был сконструирован с применением технологии VELOCIGENE® (см., например, патент США № 6586251 и Valenzuela et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nature Biotech. 21 (6): 652-659).
Вкратце, мышиный клон искусственной бактериальной хромосомы (ИБХ) bMQ-261H14 был модифицирован для делеции последовательности, содержащей экзоны со 2 по 4 эндогенного гена SIRPα, и инсерции экзонов 2-4 гена SIRPα человека с применением клона человека ИБХ CTD-3035H21. Геномную ДНК, соответствующую экзонам 2-4 эндогенного гена SIRPα (~8555 п.о.), заменяли в клоне ИБХ bMQ-261H14 фрагментом ДНК ~8581 п.о., содержащим экзоны 2-4 гена SIRPα человека из клона ИБХ CTD-3035H21. Анализ последовательности аллеля SIRPα человека, содержащегося в клоне ИБХ CTD-3035H21, выявил аллель, соответствующий варианту 1 человека. Кассета неомицина, фланкированная сайтами loxP, была добавлена к концу фрагмента ДНК человека ~8581 п.о., содержащего экзоны со 2 по 4 гена SIRPα человека (Фиг. 1 (внизу)).
Гомологичные плечи против хода и по ходу транскрипции были получены из ДНК ИБХ мыши в положениях 5' и 3' экзонов 2 и 4 соответственно и добавлены к кассете человеческого фрагмента -8581 п.о.-неомицина, чтобы создать конечный вектор направленного действия для гуманизации эндогенного гена SIRPα, который содержал в направлении от 5' к 3' 5'-гомологичное плечо, содержащее 19 тыс. п.о. 5' экзона 2 мышиной ДНК эндогенного гена SIRPα, фрагмент ДНК ~8581 п.о., содержащий экзоны со 2 по 4 гена SIRPα человека, кассету неомицина, фланкированную сайтами loxP, и 3'-гомологичное плечо, содержащее 21 тыс. п.о. 3' экзона 4 мышиной ДНК эндогенного гена SIRPα. Направленная инсерция вектора направленного действия, размещала кассету неомицина в пятом интроне гена SIRPα мыши между экзонами 4 и 5. Вектор направленного действия линеаризировали путем расщепления с помощью Swal и затем применяли в гомологичной рекомбинации в бактериальных клетках для обеспечения целенаправленной замены экзонов 2-4 в гене SIRPαA мыши экзонами со 2 по 4 гена SIRPα человека (Фиг.1 (снизу)).
ДНК ИБХ направленного действия (описанную выше) применяли для электропорации ЭС-клеток Rag2-/- IL2rgY/- мыши для создания модифицированных ЭС-клеток, содержащих замену экзонов 2-4 в эндогенном гене SIRPα мыши геномным фрагментом, содержащим экзоны со 2 по 4 гена SIRPα человека. Положительные ЭС-клетки, содержащие геномный фрагмент, включающий экзоны со 2 по 4 гена SIRPα человека, идентифицировали с помощью количественной ПЦР с применением зондов TAQMAN™ (Lie and Petropoulos, 1998. Curr. Opin. Biotechnology 9:43-48). Нуклеотидная последовательность в направлении против хода транскрипции по отношению к точке инсерции включала следующее, что указывает на эндогенную последовательность мыши в направлении против хода транскрипции по отношению к точке инсерции (приведена в скобках ниже), смежную с геномной последовательностью SIRPα человека, присутствующей в точке инсерции:
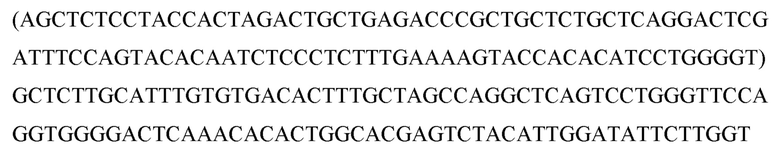
(SEQ ID NO: 1). Нуклеотидная последовательность по ходу транскрипции по отношению к точке инсерции на 5'-конце кассеты неомицина включала следующее, что указывает на геномную последовательность SIRPα человека, смежную с последовательностью кассеты ниже точки инсерции (приведена в скобках ниже, последовательность loxP выделена курсивом):
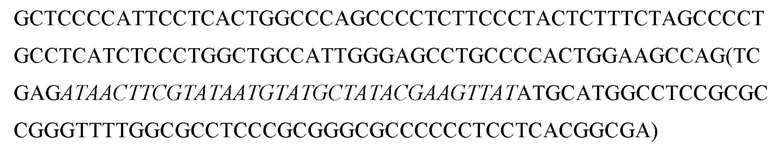
(SEQ ID NO: 2). Нуклеотидная последовательность по ходу транскрипции по отношению к точке инсерции на 3'-конце кассеты неомицина включала следующее, что указывает на последовательность кассеты, смежную с геномной последовательностью 3' экзона 4 эндогенного гена SIRPα мыши (приведена в скобках ниже):
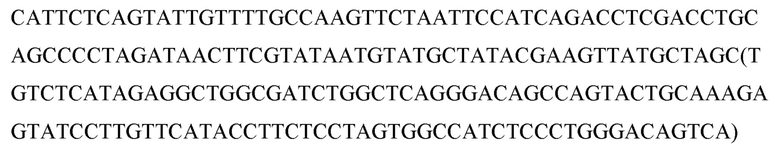
(SEQ ID NO: 3). Положительные клоны ЭС-клетки в дальнейшем применяли для имплантации самкам мышей с применением метода VELOCIMOUSE® (см., например, патент США № 7294754 и Poueymirou et al., 2007, F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses, Nature Biotech 25(1):91-99) для получения помета детенышей, несущих инсерцию экзонов 2-4 гена SIRPα человека в эндогенном гене SIRPα мыши.
Целевые ЭС-клетки, описанные выше, применяли в качестве донорных ЭС-клеток и вводили в эмбрион мыши на стадии 8 клеток методом VELOCIMOUSE® (см. выше). Мышей, несущих гуманизированные экзоны 2-4 эндогенного гена SIRPα, идентифицировали путем генотипирования с применением модификации аллельного анализа (Valenzuela et al., выше), который обнаруживал присутствие последовательностей генов SIRPα человека.
Мыши, несущие гуманизированную конструкцию гена SIRPα (т.е., содержащие экзоны со 2 по 4 SIRPα человека в гене SIRPα мыши), могут быть разведены с получением породы делеторных мышей Cre (см., например, публикацию Международной патентной заявки № WO 2009/114400), чтобы удалить любую lox-ированную кассету неомицина, введенную вектором направленного действия, которая не удаляется, например, на стадии ЭС-клетки или в эмбрионе. Необязательно, кассета неомицина сохраняется у мышей. Для получения гомозиготных мышей Sirpα разводят гетерозиготных особей.
Результаты
Мыши, содержащие нуклеиновую кислоту, которая кодирует гуманизированную версию гена SIRPα мыши, как описано выше (мыши SRG), демонстрируют физиологическую экспрессию гуманизированного белка SIRPα (данные не показаны). Кроме того, указанные мыши демонстрируют трансплантированные иммунные клетки человека в селезенке, периферических лимфатических узлах (ЛУ) и тимусе, по сравнению с мышами NOD scid гамма (NSG) (данные не показаны).
Пример 2: Получение гуманизированных нокин-мышей SRG IL-15h/h (SRG-15).
Было показано, что цитокин IL-15 играет важную роль в развитии ПК-клеток мыши, а также в дифференцировке и поддержании памяти CD8+ Т-клеток. Для изучения влияния IL-15 человека на развитие, дифференцировку и поддержание иммунных клеток человека в контексте животной модели были получены нокин-мыши, содержащие IL-15 человека и SIRPα человека, как описано более подробно ниже. На Фиг. 2 приведено схематическое изображение нокин-конструкции IL-15.
Материалы и методы
ЭС-клетки мыши были модифицированы для замены последовательности гена IL-15 мыши последовательностью гена IL-15 человека в эндогенном локусе IL-15 мыши под контролем регуляторных элементов IL-15 мыши с применением технологии генной инженерии VELOCIGENE®, с целью получения гуманизированного локуса, как проиллюстрировано на Фиг. 2. Нокин-мыши, содержащие IL-15 человека, были получены в генетическом фоне Rag2-/- I12rgY/- 129xBalb/c. На Фиг. 2 не приведены 5'-нетранслируемые экзоны гена мыши (экзоны 1 и 2), расположенные против хода транскрипции (относительно направления транскрипции гена IL-15); кодирующий экзон 1 (экзон 3) на Фиг. 2 демонстрирует небольшой нетранслируемый участок (незаштрихованный) в направлении против хода транскрипции относительно кодирующего экзона. За исключением описанного ниже для мыши 1, как проиллюстрировано для случая гуманизации в нижней части Фиг. 2, кодирующие экзоны 1 и 2 мыши (экзоны 3 и 4) были сохранены, тогда как кодирующие экзоны с 3 по 6 мыши (экзоны 5-8) были заменены кодирующими экзонами с 3 по 6 человека (экзоны 5-8). На 3’ конце за кодирующим экзоном 6 человека (экзон 8) следует стоп-кодон и 3'-НТУ человека, и далее последовательность человека, найденная в направлении по ходу транскрипции относительно 3'-НТУ человека. Для целей селекции была введена кассета селекции (фланкированная loxP для удаления Cre). Гуманизированный локус на Фиг. 2 экспрессирует зрелый белок IL-15, который полностью является белком человека.
Конкретно, бактериальная гомологичная рекомбинация (БГР) была выполнена с применением стандартных методов БГР с целью получения вектора направленного действия большого размера (БВНД), содержащего последовательности гена IL-15 человека, для направленного действия на локус IL-15 мыши (см., например, Valenzuela et al. (2003), см. выше) и восстановления промежутка БГР. Линейные фрагменты были получены путем лигирования полученных в результате ПЦР гомологичных боксов с клонированными кассетами, с последующим выделением продуктов лигирования на геле и введением электропорацией в БГР-компетентные бактерии, содержащие целевую искусственную бактериальную хромосому (ИБХ). Мышиную ИБХ PRCI23-203P7 использовали в качестве источника последовательности мыши; ИБХ человека RP11-103B12 применяли в качестве источника генной последовательности IL-15 человека. После стадии селекции правильно рекомбинированные клоны идентифицировали с помощью ПЦР в новых соединениях и путем рестрикционного анализа. Были получены БВНД, содержащие гомологические плечи и последовательности гена IL-15 человека.
Ген IL-15 мыши (мышь GenelD: 103014, транскрипт RefSeq: NM 008357.2, ensemble eID: 16168) модифицировали с применением геномных координат для делеции GRCM38: ch 8: 82331173-82343471 (минус цепь); геномных координат для замены GRCh37: ch4: 142642924-142655819 (плюс цепь). 12299 нуклеотидов в последовательности мыши были заменены 12896 нуклеотидами последовательности человека. Замена последовательности IL-15 мыши, описанная выше, графически представлена на Фиг. 2.
БВНД, содержащий гуманизированный ген IL-15, содержит в направлении против хода транскрипции мышиное нацеливающее плечо, размером 13 тыс. п.о., фланкированое на 5' конце сайтом Mlul, и в направлении по ходу транскрипции содержит мышиное нацеливающее плечо размером 27 тыс. п.о., фланкированное на 3' конце сайтом Ascl. БВНД линеаризован с помощью Mlul и Ascl для целей электропорации.
После конструирования БВНД нуклеотидная последовательность БВНД с учетом 5'-соединения мыши/человека и 3'-соединения человека/мыши является такой, как приведено в Табл. 1 ниже. В SEQ ID NO: 4 представлено верхнее (по отношению к направлению хода транскрипции гена IL-15) соединение между последовательностью мыши и последовательностью человека; приведенная последовательность начинается с последовательности мыши в верхнем регистре, за которой следует рестрикционный сайт Asisl в нижнем регистре, и далее последовательность нуклеиновой кислоты IL-15 человека в верхнем регистре. В SEQ ID NO: 5 приведены кодирующая и некодирующая последовательность IL-15 человека в верхнем регистре (3'НТУ человека выделен полужирным курсивом), затем сайт Xhol в нижнем регистре, за которым следует сайт lox (верхний регистр, полужирный курсив), а затем последовательность селекционной кассеты neo (верхний регистр), которая расположена по ходу транскрипции и имеет размер 2,6 тыс. п.о. (не показана). SEQ ID NO: 6 представляет собой последовательность нуклеиновой кислоты, которая отображает соединение между расположенной в направлении по ходу транскрипции частью селекционной кассеты neo (верхний регистр), и сайтом lox (верхний регистр и полужирный курсив), за которым следует сайт Nhel (нижний регистр), и далее последовательность мыши после гуманизации в направлении по ходу транскрипции (верхний регистр); селекционная кассета имеет размер 2,6 тыс. п.о. и расположена в направлении против хода транскрипции.
Таблица 1: Последовательности соединений гуманизированного локуса IL-15


В ЭС-клетки мыши электропорацией вводили конструкции БВНД, выращивали их на селекционной среде и использовали в качестве донорных ЭС-клеток для получения гуманизированных мышей IL-15, имеющих замену в эндогенном локусе IL-15 мыши последовательностью человека, как проиллюстрировано на Фиг. 2. После электропорации ЭС-клетки выполняли анализ утраты нативного аллеля (см., например, Valenzuela et al. (2003), выше) с целью выявления утраты эндогенной последовательности IL-15 в результате направленного воздействия.
Надлежащим образом нацеленные ЕС-клетки дополнительно подвергали электропорации с введением вектора для временной экспрессии Cre с целью удаления кассеты селекции с помощью лекарственного средства Neo.
Донорные ЭС-клетки мыши, содержащие гуманизированный локус IL-15, вводили на ранних стадиях в мышиные эмбрионы с помощью метода VELOCIMOUSE® (Poueymirou et al. (2007) F0 generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses, Nat Biotechnol 25:91-99). Получали гетерозиготных мышей, которых разводили для получения гомозиготных по отношению к гуманизированному IL-15. Были получены две версии гуманизированных IL-15 мышей (называемые в настоящем документе мышь 1 и мышь 2). В результате дальнейшего анализа было обнаружено, что версия мышь 1 содержит в геноме дубликат экзона. У мыши 2 эндогенный локус IL-15 мыши был заменен последовательностью человека, как проиллюстрировано на Фиг. 2.
Уровни мРНК IL-15 человека определяли следующим образом. Осуществляли обратную транскрипцию (ОТ)-кПЦР с применением системы быстрой ПЦР в реальном времени 7500 (Applied Biosystems) и универсального набора для кПЦР SYBR® FAST (KAPA Biosystems). Специфичные для последовательности олигонуклеотидные праймеры были сконструированы с применением программного обеспечения Primer3 и синтезированы Sigma-Aldrich. Применяли следующие праймеры: мышиный Hprt прямой: 5'-AGGGATTTGAATCACGTTTG-3 '(SEQ ID NO: 7), мышиный Hprt обратный: 5'-TTTACTGGCAACATCAACAG-3 '(SEQ ID NO: 8); человеческий Il15 прямой: 5'-GCCCAGGGAAATCAAAAGAT-3' (SEQ ID NO: 9), человеческий Il15 обратный: 5'-TGGCTCCAACAAATCAACAG-3 '(SEQ ID NO: 10). Значения относительной экспрессии были вычислены с применением метода сравнительного порогового цикла и нормированы на мышиный Hprt.
Мышей SRG-15 получают путем (1) скрещивания мышей, содержащих замену SIRPα человека, с мышами, содержащими замену IL-15 человека, обе в генетическом фоне Rag2-/- I12rgY/-, или (2) введения вектора направленного действия большого размера, содержащего IL-15 человека, в ЭС-клетку, содержащую замену SIRPα человека в генетическом фоне Rag2-/- I12rgY/- (описана в Примере 1) с получением мышей из ЭС-клеток, содержащих замену генами человека как для IL-15, так и для SIRPα, а также Rag2-/- I12rgY/-, с применением метода VELOCIMOUSE®. Гетерозиготных мышей разводят до гомозиготного состояния.
Результаты
Как проиллюстрировано на Фиг. 3A и 3B, высокие уровни экспрессии мРНК IL-15 человека были обнаружены в печени, легком, костном мозге (КМ), тонком кишечнике (ТК) и толстой кишке SRG-15 мыши 1, не несущей трансплантата. Аналогично, высокие уровни мРНК IL-15 человека были обнаружены в печени, легком и тонком кишечнике SRG-15 мыши 2, не несущей трансплантата (Фиг. 3В). Как проиллюстрировано на Фиг. 4, при стимуляции поли (I:C) в сыворотке SRG-15 мыши 2 дополнительно могут быть обнаружены высокие уровни белка IL-15 человека, в котором эндогенные мышиные экзоны заменены экзонами 5-8 человека.
Пример 3: Трансплантация мышам SRG-15
Материалы и методы
Мышам SRG и SRG-15 проводили трансплантацию, как описано ниже. Новорожденных мышей облучали сублетальными дозами без анестезии через 3-5 дней после рождения в дозе 160 сГр и возвращали к матерям для отдыха. Через 4-12 часов после облучения новорожденным трансплантировали CD34+ huHSC в 25 мкл ФСБ внутрипеченочно (в/п) с применением иглы 30G.
Результаты
Для оценки влияния IL-15 человека на развитие иммунных клеток проводили сравнение трансплантата клеток CD45+ у мышей NSG, SRG и SRG-15. Эффективное приживление гемопоэтических клеток человека в крови мышей NSG, SRG и SRG-15 (мышь 2) наблюдалось через 12-14 недель после трансплантации, как проиллюстрировано на Фиг. 5A. Сравнение, демонстрирующее приживление по данным количества клеток CD45+ человека в КМ, селезенке, ЛУ, печени и легком SRG и SRG-15 (мышь 2), спустя 14 недель после трансплантации, приведено на Фиг. 5В.
У мыши 1, хотя приживление клеток CD45+ человека не отличалось, более высокий процент и количество ПК-клеток человека были обнаружены в различных тканях мышей SRG-15 по сравнению с мышами SRG, как проиллюстрировано на Фиг. 6А и 6В. IL-15 не только важен для развития и выживания ПК-клеток, но и для их созревания. Как проиллюстрировано на Фиг. 6C, ПК-клетки человека в печени мышей SRG-15 (мышь 1) демонстрировали более высокий уровень экспрессии CD16 и CD56, что указывает на усиленное созревание ПК-клеток у мышей SRG-15 по сравнению с мышами SRG. Оба подмножества ПК-клеток человека, CD56bright CD16- и CD56dim CD16+ были найдены в крови; селезенке и печени мышей SRG-15, как проиллюстрировано на Фиг. 6D (селезенка) (и данные не показаны). Кроме того, как проиллюстрировано на Фиг. 6D, анализ двух подмножеств ПК-клеток человека в селезенке мышей SRG-15 (мышь 1) продемонстрировал другой уровень экспрессии киллерных ингибиторных рецепторов, причем популяция CD56dim CD16+ ПК-клеток содержит более высокий процент клеток, экспрессирующих CD158. Это напоминает результаты, найденные для подмножеств ПК-клеток в крови человека (данные не показаны).
У SRG-15 мыши 2 было продемонстрировано эффективное приживление ПК-клеток человека в лимфоидных и нелимфоидных тканях, как проиллюстрировано на Фиг. 7A-7D. На Фиг. 7А и 7В приведено процентное содержание ПК-клеток в крови и селезенке, соответственно. На Фиг. 7C и 7D приведена частота встречаемости ПК-клеток человека в крови, селезенке (СЗ), печени и легком мышей SRG и SRG-15 (мышь 2) через 14 недель после трансплантации. Дополнительные данные, демонстрирующие распределение ПК-клеток и процентное содержание в крови и селезенке мышей SRG и SRG-15 (мышь 2) из разных экспериментов, представлены на Фиг. 8 и 9А, соответственно. Увеличение фрагмента hNКp46 клеток hCD45+ в крови мышей SRG-15 (мышь 2) проиллюстрировано на Фиг. 9В. На Фиг. 9C-9E проиллюстрированы относительные количества, распределение и состав клеток hCD45+ в тимусе мышей SRG и SRG-15 (мышь 2).
Охарактеризованы подмножества ПК-клеток у людей и мышей SRG-15 (мышь 2). Как проиллюстрировано на Фиг. 10А и 10В, повышенные уровни как hCD-56bright hCD16-, так и hCD56dim hCD16+ наблюдались в крови и селезенке мышей SRG-15 по сравнению с мышами SRG. Как и у человека, наблюдалась экспрессия киллерных ингибиторных рецепторов (КИР) на подмножествах ПК-клеток у мышей SRG-15 (мышь 2) (Фиг. 10C). На Фиг. 10C проиллюстрированы CD56bright CD16- ПК-клетки (прямоугольник слева на каждом графике) и CD56dim CD16+ ПК-клетки (прямоугольник справа на каждом графике). Гистограмма внизу показывает экспрессию CD158 в указанных подмножествах. CD158 (KIR2D) на подмножествах ПК-клеток у мышей SRG-15 сходен с наблюдаемым на ПК-клетках, полученных из МКПК человека.
Распределение ПК-клеток человека в крови мышей SRG-15 сравнивали с распределением в крови, полученной от двух здоровых доноров. Мононуклеарные клетки периферической крови (МКПК) выделяли из лейкотромбоцитарного слоя двух отдельных доноров (получены от BioreclamationIVT, Уэстбури, Нью-Йорк) над Ficoll-Paque; хотя более высокий процент ПК-клеток крови наблюдался у несущих трансплантат мышей SRG-15, чем в МКПК от доноров-людей, наблюдалось физиологически сопоставимое распределение цитотоксичных (CD16+) ПК-клеток по сравнению с вырабатывающими IFN-g (CD16-) ПК-клетками (Фиг. 11).
Наконец, анализ костного мозга SRG и SRG-15 (мышь 2) показал усиленное развитие ПК-клеток человека у мышей SRG-15 по сравнению с мышами SRG (Фиг. 12).
Кроме того, было оценено влияние IL-15 человека на развитие Т-клеток человека у мышей SRG-15. Сравнение мышей SRG-15 (мышь 1) и мышей SRG показало, что влияние IL-15 человека на процент, количество и/или соотношение Т-клеток варьируется в зависимости от ткани (Фиг. 13А). Размер и количество лимфатических узлов на 16-й неделе после трансплантации не отличались у мышей SRG и SRG-15, подтверждая полученные результаты об аналогичном количестве Т-клеток человека в лимфатических узлах мышей SRG и SRG-15 (мышь 1) (Фиг. 13А). На Фиг. 13В проиллюстрирован фенотип CD8+ Т-клеток человека в крови и печени для мышей SRG и SRG-15 (мышь 1) с увеличением количества клеток hCD62L- у мышей SRG-15 (мышь 1) по сравнению с мышами SRG как для крови, так и для печени Дополнительные данные, характеризующие Т-клетки мышей SRG-15 (мышь 1) относительно мышей SRG, представлены на Фиг. 14А и 14В, на которых проиллюстрирована экспрессия ткане-резидентного маркера CD69 на CD8+ Т-клетках легкого ( 14A) и печени (14B) мышей SRG и SRG-15. Приведенные выше данные свидетельствуют об увеличении количества эффекторных, ткане-резидентных Т-клеток у мышей SRG-15.
Частоту встречаемости hCD3+ Т-клеток в селезенке, легком и печени мыши 2 по сравнению с мышами SRG оценивали через 16 недель после трансплантации, как проиллюстрировано на Фиг. 15А и 15В.
Пример 4. Развитие ткане-резидентных лимфоцитов человека у мышей SRG-15
Поскольку было показано, что IL-15 вырабатывается эпителиальными клетками в кишечнике и легком и может играть важную роль в развитии и выживаемости ткане-резидентных Т- и ПК-клеток и тканей человека, ткане-резидентные Т- и ПК-клетки человека анализировали у мышей SRG и SRG-15.
Материалы и методы
Новорожденных мышей облучали сублетальными дозами без анестезии через 3-5 дней после рождения в дозе 160 сГр и возвращали к матерям для отдыха. Через 4-12 часов после облучения указанным новорожденным животным трансплантировали CD34+ huHSC в 25 мкл ФСБ внутрипеченочно (в/п) с применением иглы 30G.
Результаты
Как проиллюстрировано на Фиг. 17 A, выделение популяции внутриэпителиальных лимфоцитов из тонкого кишечника в условиях стационарной фазы у мыши 1 выявило более высокую частоту встречаемости CD45+ клеток человека у мышей SRG-15 по сравнению с мышами SRG. Как проиллюстрировано на Фиг. 17B, иммуногистохимический анализ показал, что CD45+ ПК-клетки человека были расположены в слое эпителиальных клеток тонкого кишечника мышей SRG-15 (мышь 1) (как обозначено стрелками на Фиг. 17B), в то время как у SRG мышей было обнаружено очень мало внутриэпителиальных лимфоцитов. CD8+ ВЭЛ человека у мышей SRG-15 продемонстрироваали высокий уровень экспрессии CD69, типичного маркера ткане-резидентных Т-клеток. В противоположность ВЭЛ человека (Sathaliyawala T, Kubota M, Yudanin N. et al. Immunity 2013, 38: 187-197), только субпопуляция CD8+ ВЭЛ человека у мышей SRG-15 экспрессировала ткане-резидентный маркер CD103 (Фиг. 17C). Как проиллюстрировано на Фиг. 16А и 16В, фенотип повышенного количества CD8+ ВЭЛ человека у мышей SRG-15 (мышь 1) был специфичным, поскольку было немного отличий между мышами SRG и SRG-15 в количестве клеток собственной пластинки слизистой оболочки в толстой кишке в условиях стационарной фазы. В дополнение к увеличению количества Т-клеток человека в легком SRG-15 мыши 1, как проиллюстрировано на Фиг. 13А, дополнительно наблюдался более высокий уровень экспрессии CD69 на CD8+ Т-клетках человека в легком мышей SRG-15 по сравнению с мышами SRG, как проиллюстрировано на Фиг. 14А. Кроме того, на Фиг. 14В проиллюстрирован более высокий уровень экспрессирующих hCD69 CD8+ Т-клеток в печени SRG-15 мыши 1 по сравнению с мышью SRG.
Подобно несущей трансплантат SRG-15 мыши 1, у несущей трансплантат SRG-15 мыши 2 анализ СКАФ показал более высокую долю CD45+ клеток человека во фракции ВЭЛ мышей SRG-15 по сравнению с мышами SRG (Фиг. 18А). Кроме того, хотя количество ЛСП существенно не отличалось между мышами SRG и SRG-15 (мышь 2), значительное увеличение количества ВЭЛ наблюдалось у мышей SRG-15 (мышь 2) по сравнению с мышами SRG (Фиг. 18В). Состав клеток hCD3+ в тонком кишечнике мышей SRG-15 (мышь 2) представлен на Фиг. 18C и демонстрирует большую долю клеток hCD8+ относительно hCD4+. Фенотипические характеристики hCD3+ hCD8+ Т-клеток в селезенке и тонком кишечнике мышей SRG-15 (мышь 2) представлены на Фиг. 18D. Как проиллюстрировано на Фиг. 18Е, иммуногистохимический анализ продемонстрировал, что CD8+ ВЭЛ человека были расположены в слое эпителиальных клеток тонкого кишечника мышей SRG-15 (мышь 2) (как обозначено стрелками на Фиг. 18Е), в то время как у мышей SRG было обнаружено очень мало внутриэпителиальных лимфоцитов.
Как обсуждалось выше в отношении Фиг. 18А и 18В, у несущей трансплантат SRG-15 мыши 2 наблюдалось повышенное воспроизведение резидентных для связанной с кишечником лимфоидной ткани (СКЛТ) внутриэпителиальных лимфоцитов человека (ВЭЛ) по сравнению с мышами SRG (Фиг. 19А и 19С). Интересно, что большинство наблюдаемых лимфоцитов человека были ПК-клетками человека. Как и ожидалось для нормальной физиологии СКЛТ человека, большинство ПК-клеток у SRG-15 мыши 2 в крови и селезенке были цитотоксичными ПК-клетками (CD 16+), тогда как в ВЭЛ присутствовало сопоставимое распределение CD16+ против CD16- ПК-клеток (Фиг. 19В). Отсутствовали различия в количестве лимфоцитов собственной пластинки слизистой оболочки между несущими трансплантат SRG и SRG-15 мышами (Фиг. 19C). В отличие от несущей трансплантат SRG-15 мыши 1, у несущей трансплантат SRG-15 мыши 2 большая доля CD3+ CD8+ ВЭЛ человека экспрессировала маркер CD103 человека. Пейеровы бляшки полностью отсутствовали у мышей SRG, но они присутствовали у SRG-15 мыши 2 и были заполнены лимфоцитами, человека как проиллюстрировано на Фиг. 20А и 20В.
Пример 5: Определение функциональной роли ткане-резидентных Т-клеток человека у мышей SRG-15 во время вирусных инфекций
Чтобы проверить, обладают ли ткане-резидентные Т-клетки у мышей SRG-15 функциональной значимостью во время гомеостаза, определяли, будет ли повышенное количество CD8+ ВЭЛ у мышей SRG-15 вызывать характерные изменения в составе микрофлоры кишечника мыши.
Материалы и методы
Новорожденных мышей облучали сублетальными дозами без анестезии через 3-5 дней после рождения в дозе 160 сГр и возвращали к матерям для отдыха. Через 4-12 часов после облучения указанным новорожденным животным трансплантировали CD34+ huHSC в 25 мкл ФСБ внутрипеченочно (в/п) с применением иглы 30G.
Через четыре недели после трансплантации мышам SRG-15 на четыре недели их поселяли совместно с SRG и донорами Balb/c для выравнивания микрофлоры кишечника у разных пород. Затем мышей разделяли, и образцы фекалий собирали и анализировали с помощью секвенирования 16S рРНК. На Фиг. 21A представлена временная шкала совместного поселения и отбора проб фекалий для секвенирования микрофлоры кишечника.
Результаты
Как проиллюстрировано на Фиг. 21B для мыши 1, результаты показывают, что после совместного поселения у несущих трансплантат SRG-15 и SRG мышей не наблюдалось значительных изменений, указывая на то, что развивающиеся CD8+ ВЭЛ человека не вызывают серьезных изменений в условиях стационарной фазы. Были проведены дополнительные эксперименты, чтобы определить, могут ли CD8+ ВЭЛ, достаточные для клиренса острой ротавирусной инфекции, осуществить клиренс ротавирусной инфекции у несущих трансплантат мышей SRG-15. Как проиллюстрировано на Фиг. 22, результаты показали, что клиренс острой ротавирусной инфекции может быть достигнут у несущих трансплантат мышей SRG-15, но не у мышей SRG без трансплантата.
Пример 6. Анализ подмножеств ПК-клеток у мышей SRG-15 (мышь 2) и человека
Подмножества ПК-клеток у мышей SRG-15 (мышь 2) были охарактеризованы на предмет различных фенотипических маркеров и в сравнении с человеком.
Материалы и методы
Подмножества ПК-клеток обнаруживали посредством времяпролетной цитометрии (ВПЦМ), как в общем описано в Yao et al. J. of Immunological Methods 415 (2014) 1-5, и анализировали с применением ViSNE (el-AD et al. Nat. Biotechnol., 2013 Jun, 31 (6): 545-52doi: 10.1038 / nbt.2594. Epub 2013 May 19.
Результаты
На Фиг. 23A представлены графики ViSNE, показывающие анализ на основе ВПЦМ 33 параметров CD56bright CD16- и CD56dim CD16+ подмножества ПК-клеток у человека (n = 20) и мышей SRG-15 (мышь 2) (n = 9). Каждая точка представляет одну клетку.
На Фиг. 23В представлены графики ViSNE, показывающие интенсивность экспрессии восьми выбранных маркеров на CD56bright CD16- ПК-клетках у человека (n = 20) и мышей SRG-15 (мышь 2) (n = 9).
На Фиг. 23C представлены графики ViSNE, показывающие интенсивность экспрессии восьми выбранных маркеров на CD56dim CD16+ ПК-клетках у человека (n = 20) и мышей SRG-15 (n = 9). Данный многомерный одноклеточный анализ 33 ключевых молекул ПК-клеток человека указывает на то, что ПК-клетки человека, которые развиваются у мышей SRG-15, в высокой степени сопоставимы с ПК-клетками человека у здоровых людей.
Пример 7: Цитотоксическая способность ПК-клеток у мышей SRG-15
Материалы и методы
Для исследований цитотоксичности ПК in vitro ПК-клетки селезенки, выделенные у несущих трансплантат гемопоэтических стволовых клеток (ГСК) человека мышей SRG и SRG-15 (мышь 2) обрабатывали в течение ночи IL-2 человека. На следующий день ПК-клетки культивировали с мечеными сукцинимидиловым эфиром карбоксифлуоресцеина (СЭКФ) ПК-чувствительными клетками-мишенями K562 при различных соотношениях эффектора и мишени (Э:М). После 5-часового совместного культивирования гибель клеток K562 измеряли с помощью анализа СКАФ по захвату красителя Topro3, указывающего на жизнеспособность, клетками K562 (гейтированными на клетках СЭКФ+, чтобы отличить K562, а затем определить процент Topro3-положительных).
Кроме того, для исследований антителозависимой клеточной цитотоксичности (АЗКЦ) in vitro, выделенные ПК-клетки селезенки у несущих трансплантат ГСК человека мышей SRG и SRG-15 обрабатывали IL-2 человека на протяжении ночи. На следующий день ПК-клетки культивировали с мечеными СЭКФ клетками-мишенями Raji при различных соотношениях эффектора и мишени (Э:М). Клетки Raji предварительно обрабатывали анти-CD20 (ритуксимабом) или контрольным IgG. После 5-часового совместного культивирования гибель клеток Raji измеряли с помощью анализа СКАФ по захвату красителя Topro3, указывающего на жизнеспособность, клетками Raji (гейтированными на клетках СЭКФ+, чтобы затем определить процент Topro3-положительных).
Для исследований активации ПК-клеток in vivo, несущих трансплантат ГСК человека мышам SRG и SRG-15 (мышь 2) вводили внутрибрюшинной инъекцией 50 мкг поли IC. Предварительно у мышей отбирали образцы крови (до инъекции поли IC), а затем через 18 часов после инъекции поли IC. CD45+ NKp46+ человека (ПК-клетки) анализировали на предмет экспрессии маркера активации CD69 с помощью СКАФ до и после введения поли IC.
Результаты
В классическом исследовании ПК-цитотоксичности, классические клетки-мишени ПК K562 с дефицитом HLA антигена класса I погибали под воздействием активированных ПК-клеток у мышей SRG или SRG-15 (мышь 2). Как проиллюстрировано на Фиг. 24C (слева) ПК-клетки селезенки у мышей SRG и SRG-15 продемонстрировали сравнимую цитолитическую способность по отношению к клеткам K562 при нормировании на количество.
ПК-клетки, как правило, ответственны за опосредованную анти-CD20 антителом АЗКЦ против B-клеточных лейкозов и лимфом (см., например, J. Golay et al. Haematologica, 2003; 88: 1002-12). Для того чтобы продемонстрировать способность ПК-клеток несущих трансплантат SRG-15 мышей облегчать опосредованную анти-CD20 АЗКЦ, были исследованы ПК-клетки селезенки мышей SRG и SRG-15, которые продемонстрировали сравнимую при нормировании на количество клеток активность в форме антителозависимой клеточной токсичности (АЗКЦ) против клеток Raji, обработанных анти-CD20 (Фиг.24C (справа)).
Как проиллюстрировано, например, на Фиг. 8 и 9, наблюдается значительная активизация ПК-клеток как в селезенке, так и в крови SRG-15 животных. Способность к активации ПК-клеток у мышей SRG-15 тестировали путем измерения маркера активации CD69 после инъекции поли-IC. Как проиллюстрировано на Фиг. 24А процент положительных ПК-клеток по маркеру активации CD69 был повышен у мышей SRG-15 по сравнению с мышами SRG. Поскольку было показано, что ПК-клетки SRG-15 опосредуют АЗКЦ сопоставимо с ПК-клетками SRG in vitro, в нормализованных условиях, способность ПК-клеток SRG-15 демонстрируют в большей степени активированный фенотип in vivo, а также большее количество ПК-клеток у мышей SRG-15 наводят на мысль о том, что мыши SRG-15 могут быть подходящей моделью для исследования in vivo опосредованной ПК-клетками человека АЗКЦ.
Пример 8: Получение IFNγ из ПК-клеток, полученных от SRG и SRG-15
Материалы и методы
ПК-клетки выделяли из пула спленоцитов мышей SRG или SRG-15 (по 3 селезенки на группу) с помощью набора для обогащения ПК человека EasySep (StemCell Technologies, кат. № 19055).
Кроме того, ПК-клетки выделяли из МКПК здорового человека. ПК-клетки обрабатывали на протяжении ночи 10 нг/мл IL-2 человека. На следующий день клетки стимулировали на протяжении ночи 10 нг/мл IL-12p70 человека или 2 мг/мл поли I:C или оставляли без обработки. На следующий день собирали супернатант и оценивали уровни IFNg с помощью набора для твердофазного ИФА IFNg человека Quantikine (R&D systems, кат. № DIF50). Чистоту ПК-клеток определяли на основе уровней СКАФ и IFNg, нормированных на пикограммы (пг), вырабатываемых отдельными ПК-клетками. Статистический анализ проводили с применением дисперсионного анализа.
Результаты
Как проиллюстрировано на Фиг. 24В, ПК-клетки, полученные от SRG и SRG-15, демонстрируют сопоставимую секрецию IFNγ, которая была меньше, чем у ПК-клеток человека, полученных из МКПК, после обработки IL-12p70.
Пример 9: ПК-клетки человека подавляют рост опухоли у мышей SRG-15
Исследовали способность ПК-клеток человека к инфильтрации ксенотрансплантатов опухоли человека и подавлению роста опухоли у мышей SRG-15 (мышь 2).
Материалы и методы
Ритуксимаб вводили в/б через день (начиная с 14-го дня после п/к введения 5 миллионов клеток Raji). Рост опухоли оценивали кавернометрией, объем вычисляли по следующей формуле: объем опухоли = 0,5 х (длина х ширина^2). Были объединены данные двух независимых экспериментов. Статистический анализ проводили с применением непарного двухстороннего U-теста Манна-Уитни, сравнивая несущих трансплантат, нелеченных SRG-15 и несущих трансплантат, леченных RTX SRG-15 мышей (*P < 0,05).
П/к опухоль измельчали и расщепляли с помощью коллагеназы D (1 час, 37°С). Выделенные клетки, включая опухолевые и иммунные клетки, анализировали с помощью проточного цитометра LSRII.
Результаты
Как проиллюстрировано на Фиг. 25А, ПК-клетки человека у мышей SRG-15 подавляют рост опухоли после лечения ритуксимабом (RTX). На Фиг. 25В представлена частота встречаемости ПК-клеток и Т-клеток человека в ксенотрансплантатах опухолей человека нелеченных (n = 5) и леченных RTX мышей SRG-15 (n = 1). На Фиг. 25C представлены подмножества ПК-клеток человека в крови и опухоли нелеченных (n = 2) и леченных RTX мышей SRG-15 (n = 1).
Пример 10: Дополнительные материалы и методы, применяемые в сочетании с вышеприведенными примерами
Выделение и инъекция клеток CD34+ человека. Выделение и инъекцию клеток CD34+ человека проводили в соответствии со способами, описанными, например, в Rongvaux A, Willinger T, Martinek J et al. Nat Biotechnol 2014; 32: 364-372.
Проточный цитометрический анализ популяций клеток человека. Проточный цитометрический анализ популяций клеток человека проводили, как описано в Strowig T, Rongvaux A, Rathinam C et al. Proc Natl Acad Sci USA 2011; 108: 13218-13223, и в Rongvaux A, Willinger T, Martinek J et al. Nat Biotechnol 2014; 32: 364-372.
Гистология. Ткань фиксировали на протяжении ночи в 4 % параформальдегиде, переносили в 70 % этанол и заливали парафином.
Количественная ОТ-ПЦР. Количественную ОТ-ПЦР проводили, как описано в Rongvaux A, Willinger T, Martinek J et al. Nat Biotechnol 2014; 32: 364-372.
Секвенирование 16S рРНК. Секвенирование 16S рРНК выполняли, как описано в Palm NW, Zoete MR, Cullen TW et al. Cell 2014; 158: 1000-1010.
Вирусные инфекции. Ротавирус и вирус гриппа получали и применяли в способах по изобретению.
Статистический анализ. Статистическую значимость определяли с помощью программного обеспечения Prism 6 (GraphPad), с применением двухстороннего непарного t-теста Стьюдента.
СКАФ антитела были получены от BD Biosciences и BioLegend.
Вышеизложенное только показывает принципы изобретения. Необходимо понимать, что специалисты в данной области техники смогут разработать различные комбинации, которые, хотя и не описаны или не проиллюстрированы явно в настоящем документе, воплощают принципы изобретения и находятся в пределах его объема. Кроме того, все примеры и условное наклонение, приведенные в настоящем документе, в основном предназначены для того, чтобы помочь читателю понять принципы изобретения и концепции, предоставленные изобретателями для развития уровня техники, и их следует интерпретировать, как неограничивающие в отношении таких конкретно приведенных примеров и условий. Кроме того, все заявления в настоящем документе, в которых излагаются принципы, аспекты и варианты реализации изобретения, а также их конкретные примеры, включают их структурные и функциональные эквиваленты. Кроме того, такие эквиваленты включают как известные в настоящее время эквиваленты, так и эквиваленты, которые будет созданы в будущем, т.е., любые созданные элементы, которые выполняют такую же функцию независимо от структуры. Следовательно, объем настоящего изобретения не ограничивается представленными и описанными в настоящем документе типичными вариантами реализации изобретения. Скорее, объем и концепция настоящего изобретения воплощены в прилагаемой формуле изобретения.
Дополнительная информация о последовательностях













































| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ МЫШИ С НОКИНОМ SIRPA-IL15 И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2822370C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ЭКСПРЕССИРУЮЩИЕ EPO ЧЕЛОВЕКА | 2015 |
|
RU2711744C1 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ЭКСПРЕССИРУЮЩИЕ EPO ЧЕЛОВЕКА | 2015 |
|
RU2799086C2 |
| ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ С ГУМАНИЗИРОВАННЫМ ГЕНОМ СИГНАЛЬНОГО РЕГУЛЯТОРНОГО БЕЛКА | 2014 |
|
RU2671166C2 |
| ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕЧЕСКОМУ РОДУ ЖИВОТНЫЕ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2673156C2 |
| ЖИВОТНЫЕ С ГУМАНИЗИРОВАННЫМ ГЕНОМ IL-15 | 2014 |
|
RU2674910C2 |
| ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ИМЕЮЩИЕ ГУМАНИЗИРОВАННЫЙ ГЕН КЛАСТЕРА ДИФФЕРЕНЦИРОВКИ 47 | 2015 |
|
RU2728412C2 |
| ЖИВОТНЫЕ, ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА, ИМЕЮЩИЕ ГУМАНИЗИРОВАННЫЙ ГЕН КЛАСТЕРА ДИФФЕРЕНЦИРОВКИ 47 | 2015 |
|
RU2827833C1 |
| НЕ ОТНОСЯЩИЕСЯ К ЧЕЛОВЕКУ ЖИВОТНЫЕ, ИМЕЮЩИЕ ГУМАНИЗИРОВАННЫЕ FC-ГАММА-РЕЦЕПТОРЫ | 2015 |
|
RU2700484C2 |
| ГРЫЗУНЫ С ГУМАНИЗИРОВАННЫМ IL-7 | 2013 |
|
RU2654565C2 |
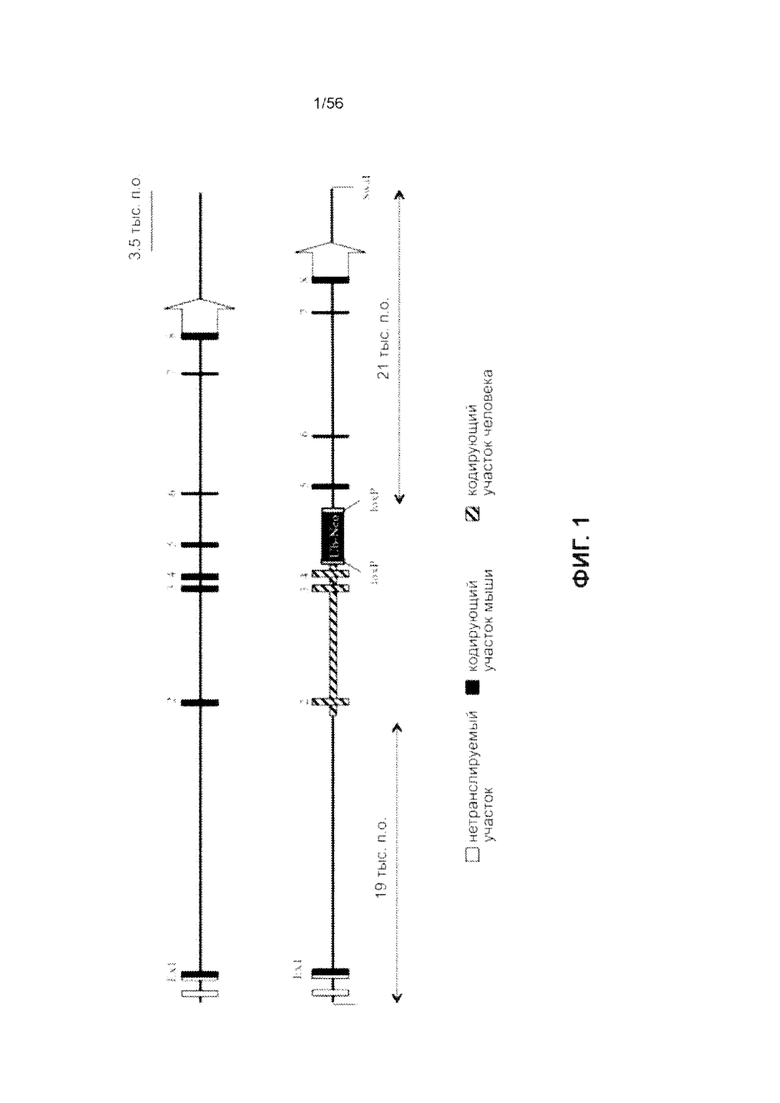
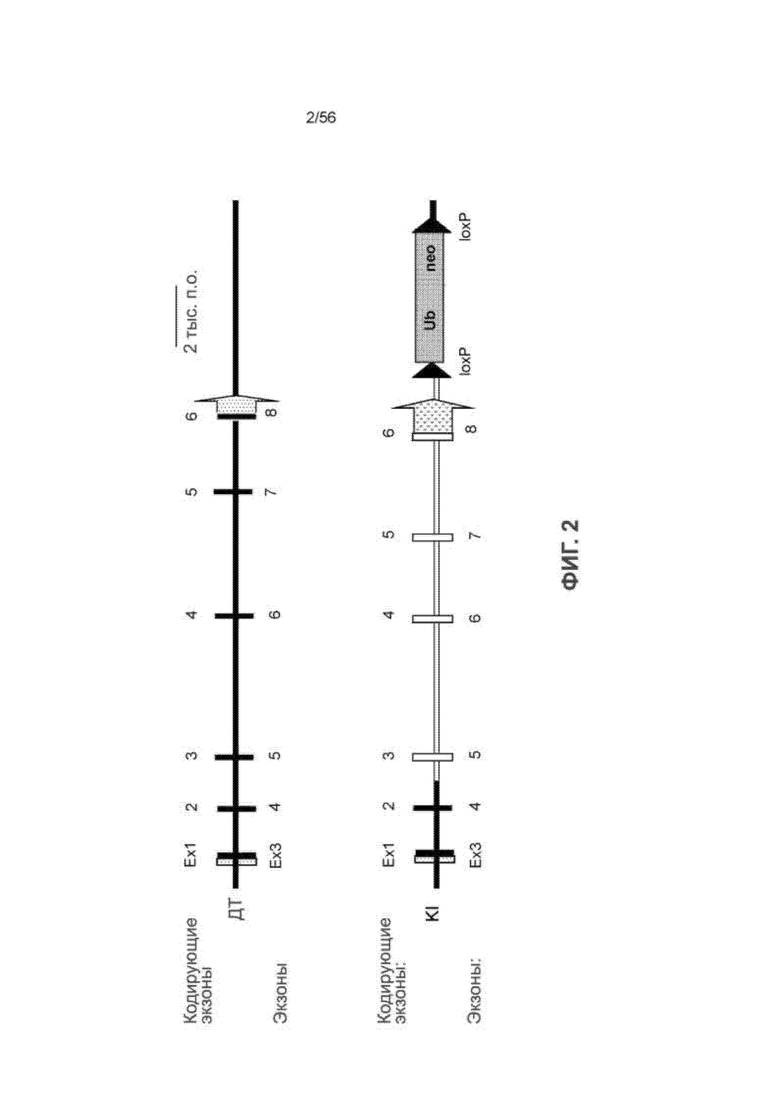
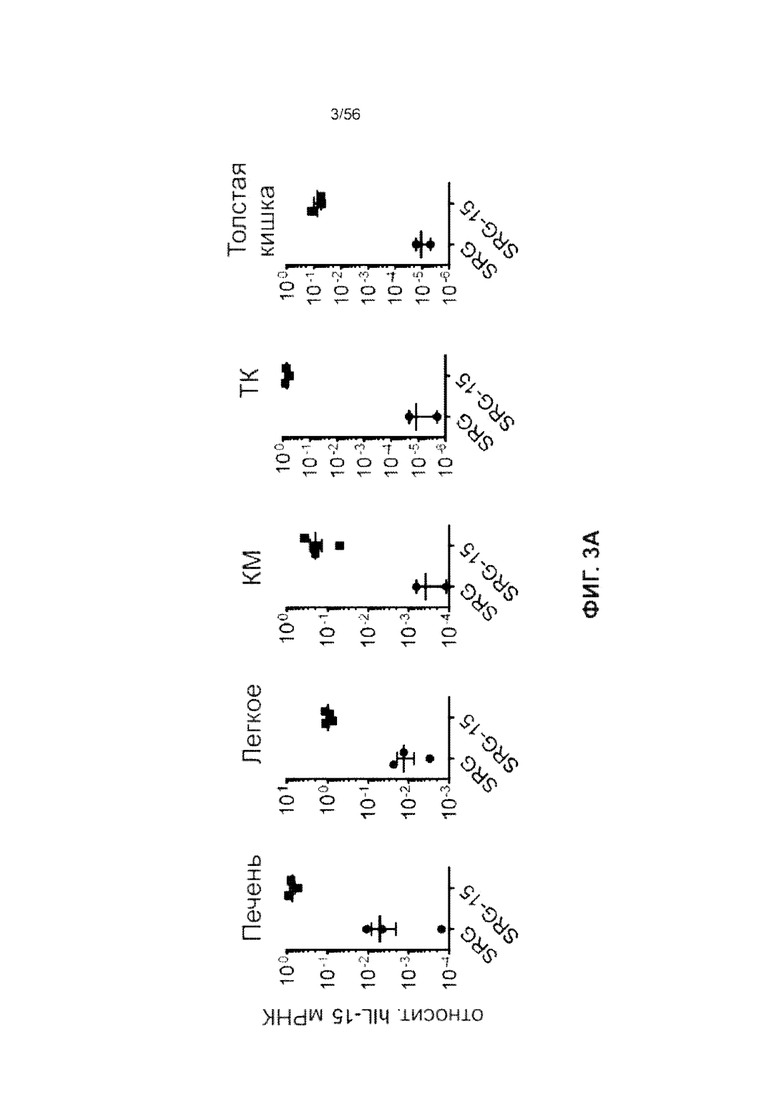
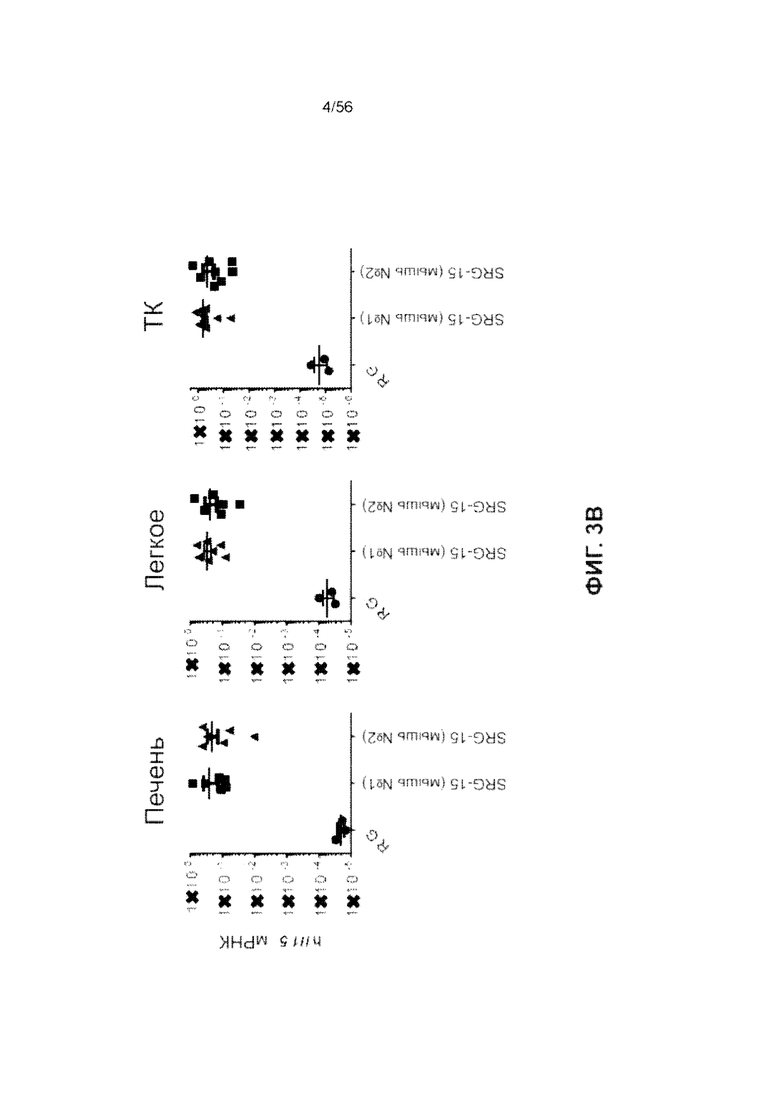
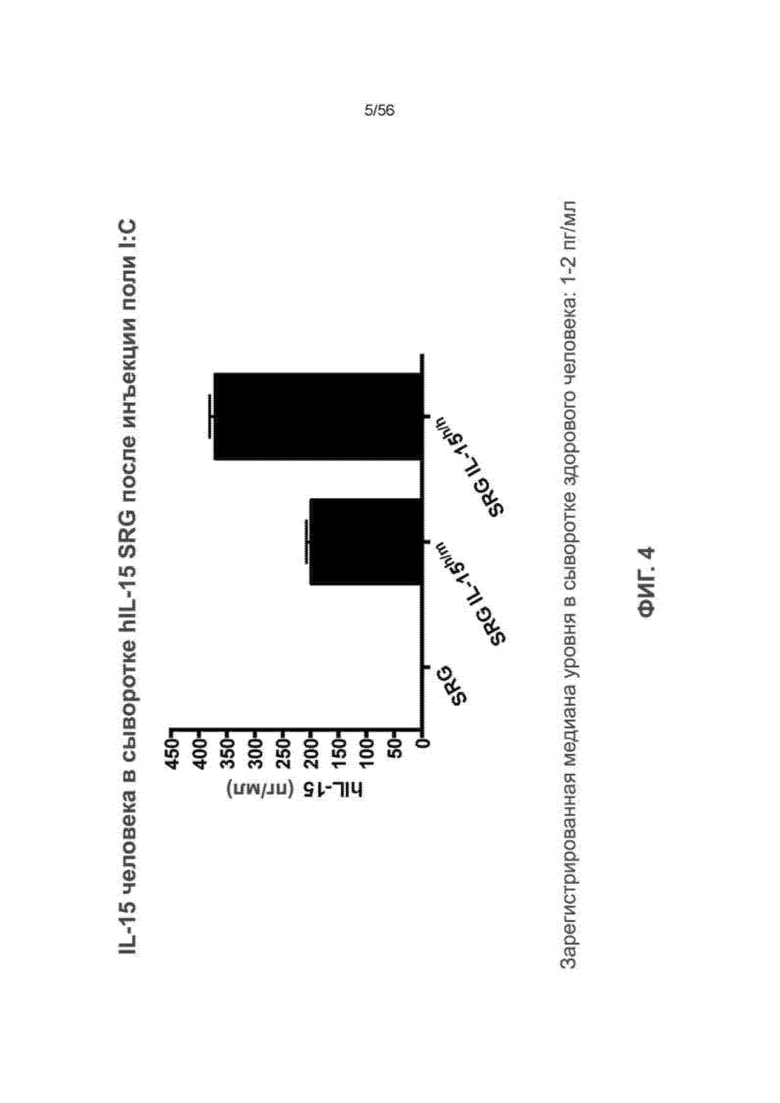

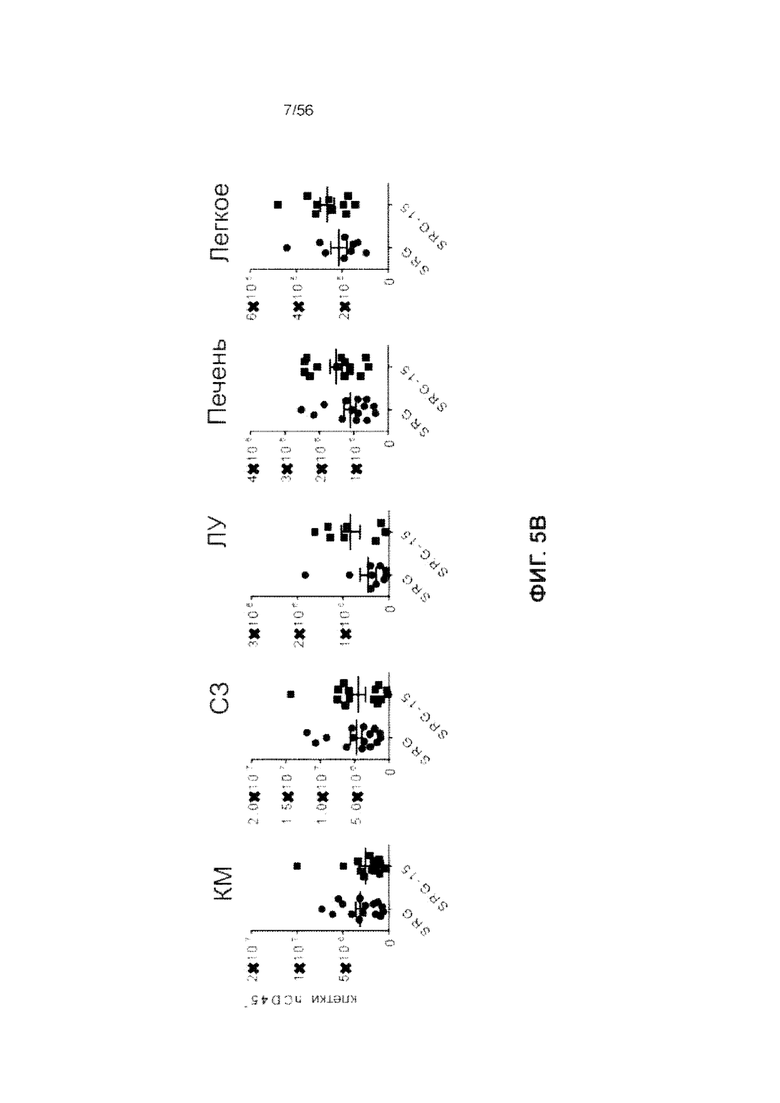
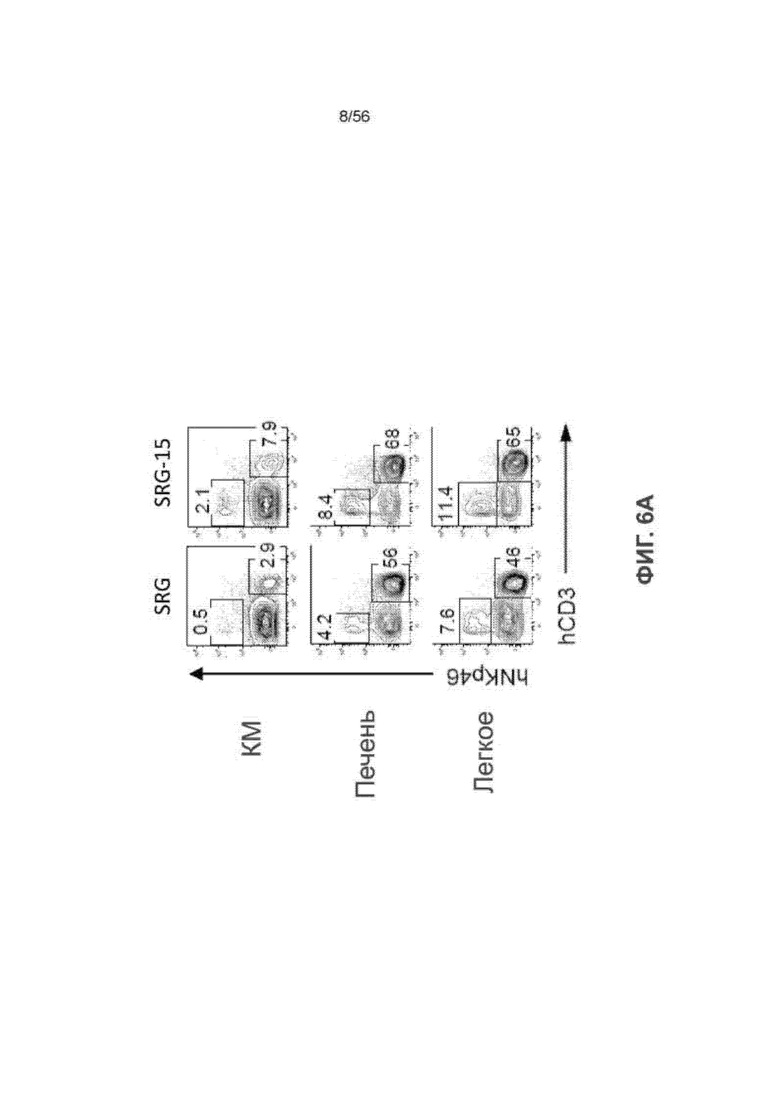
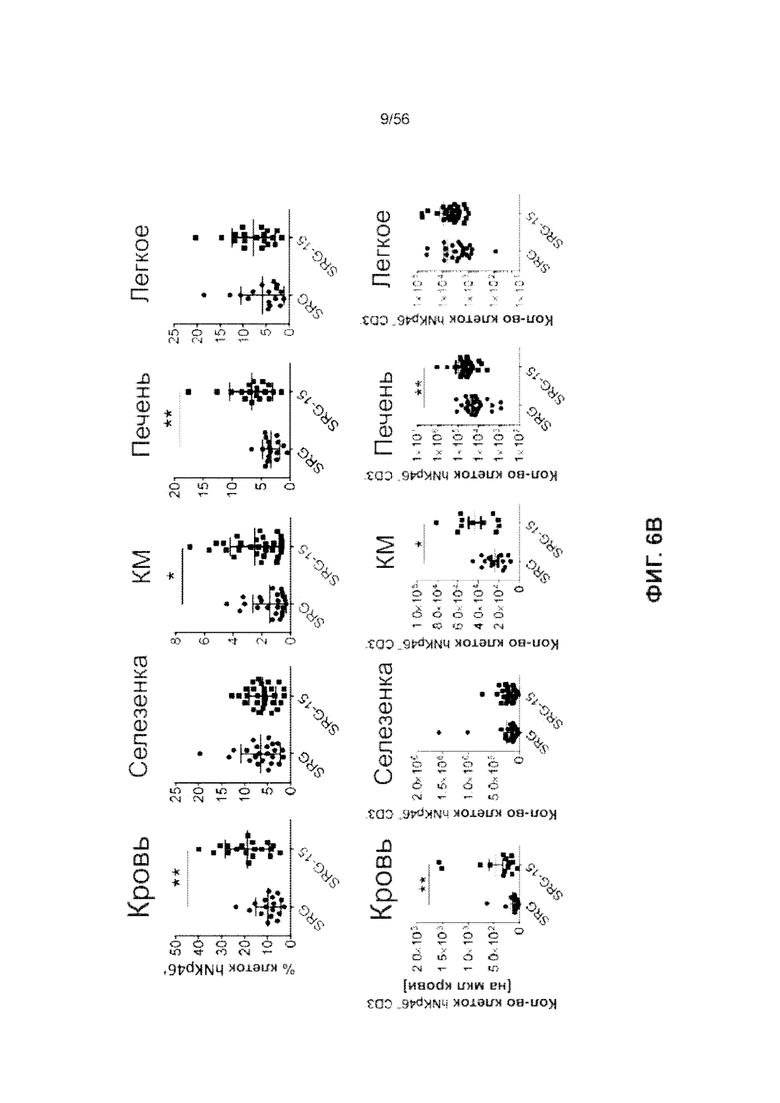
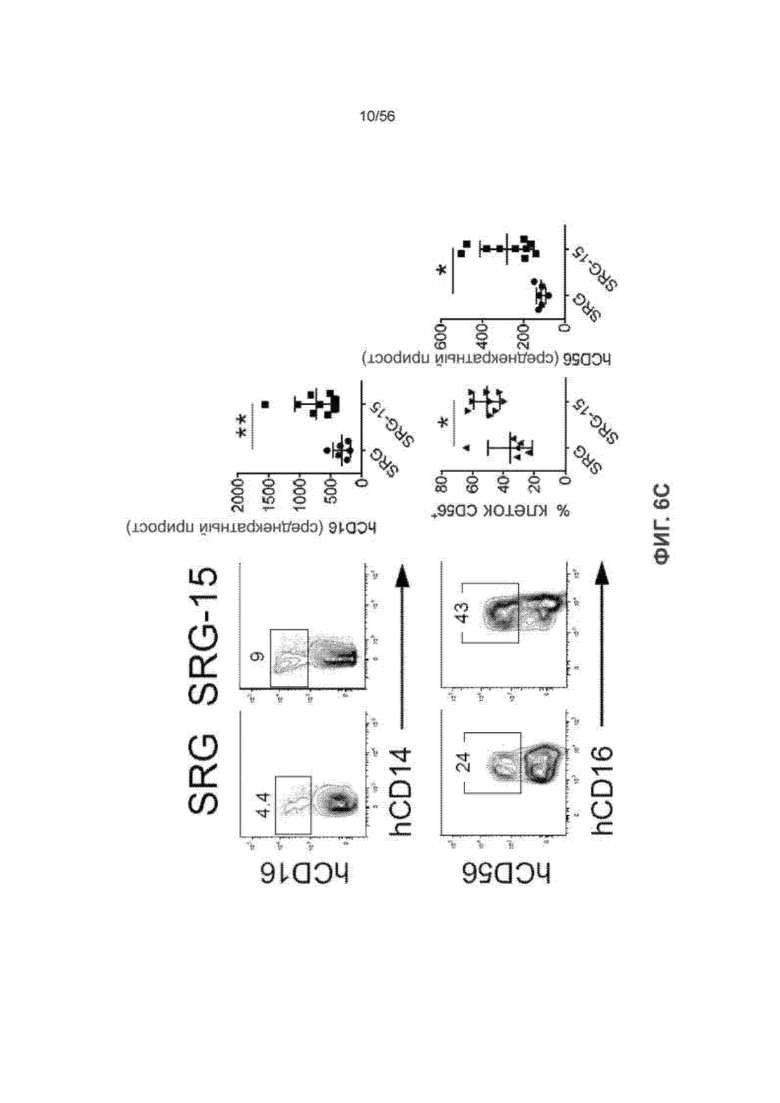
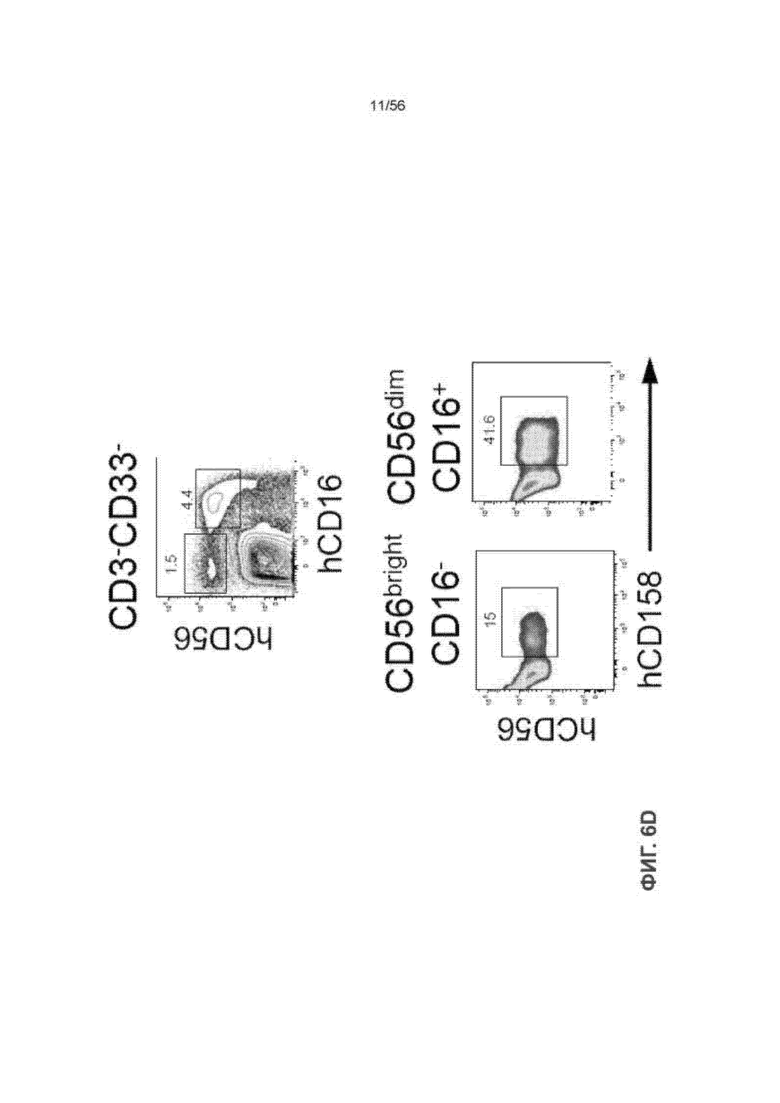

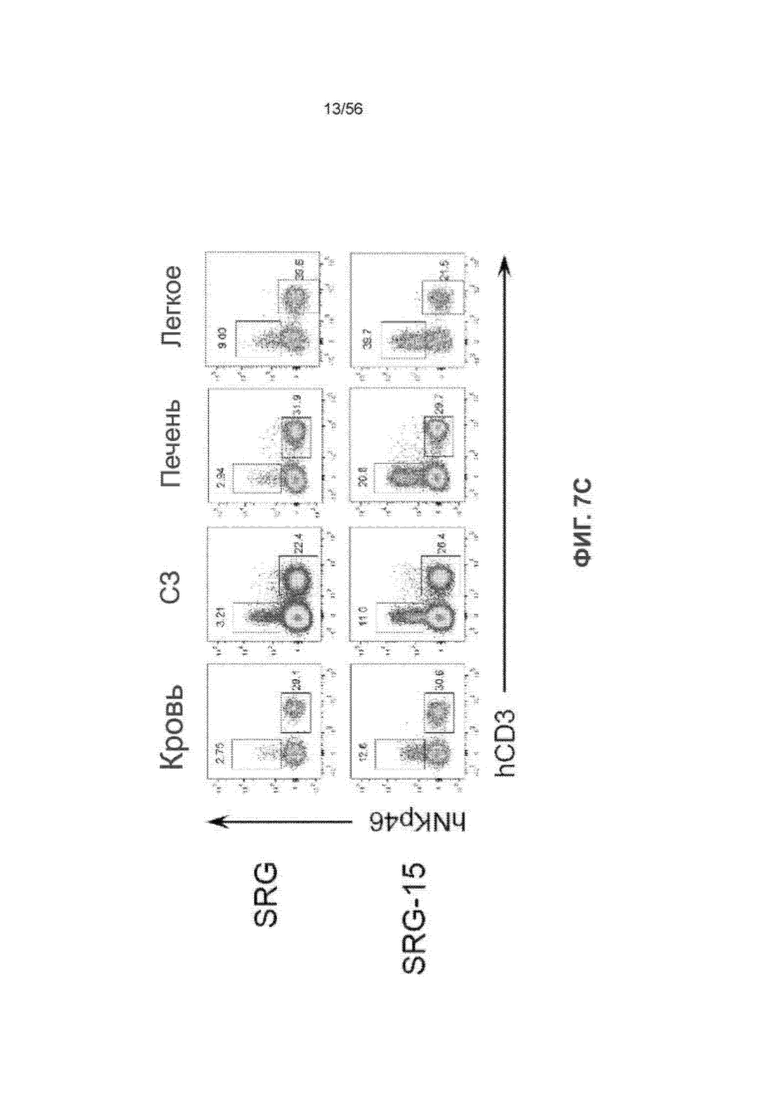
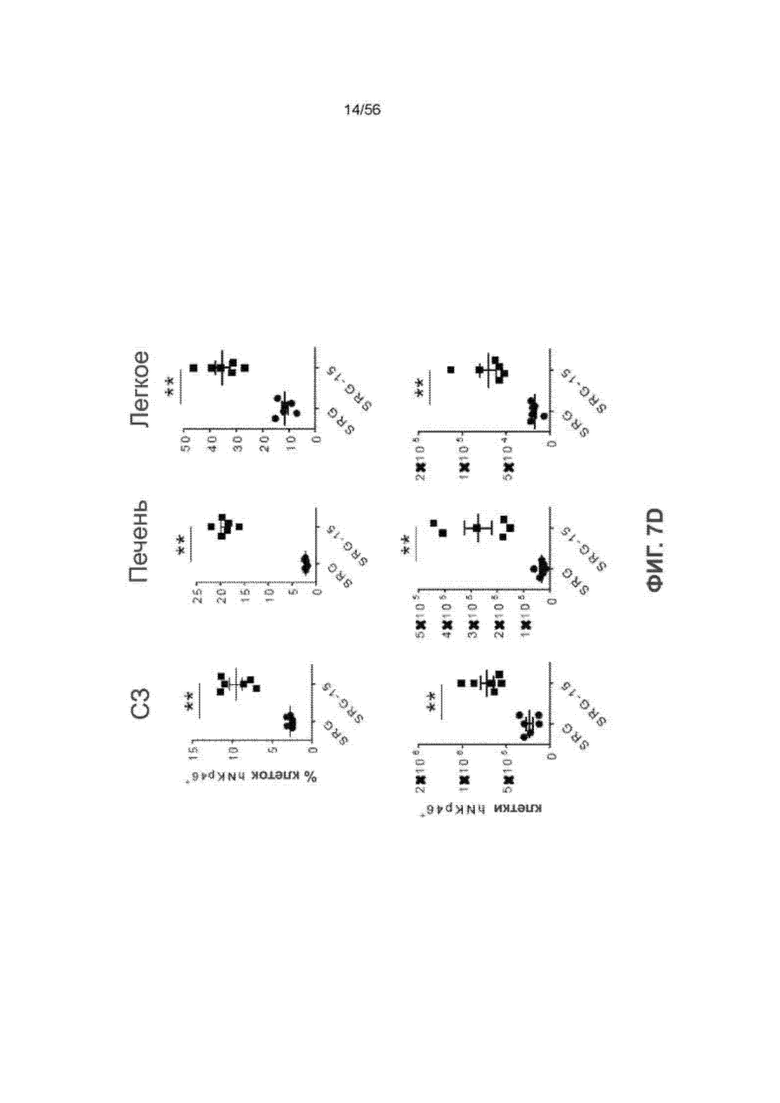
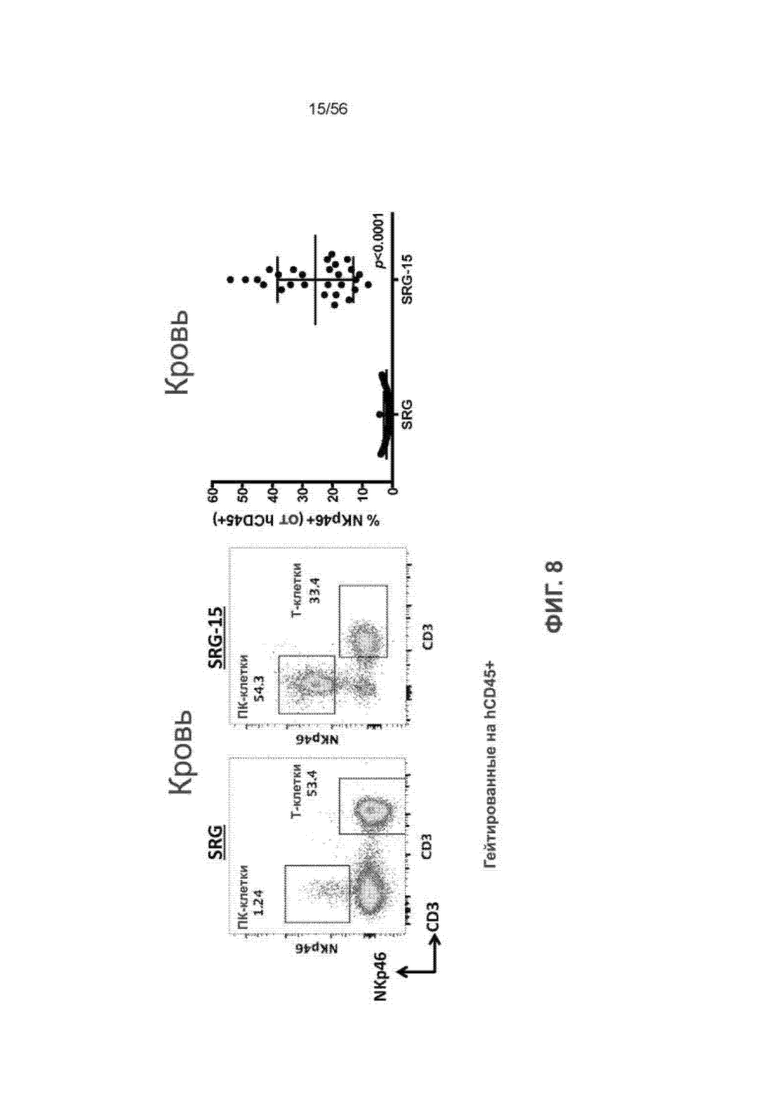
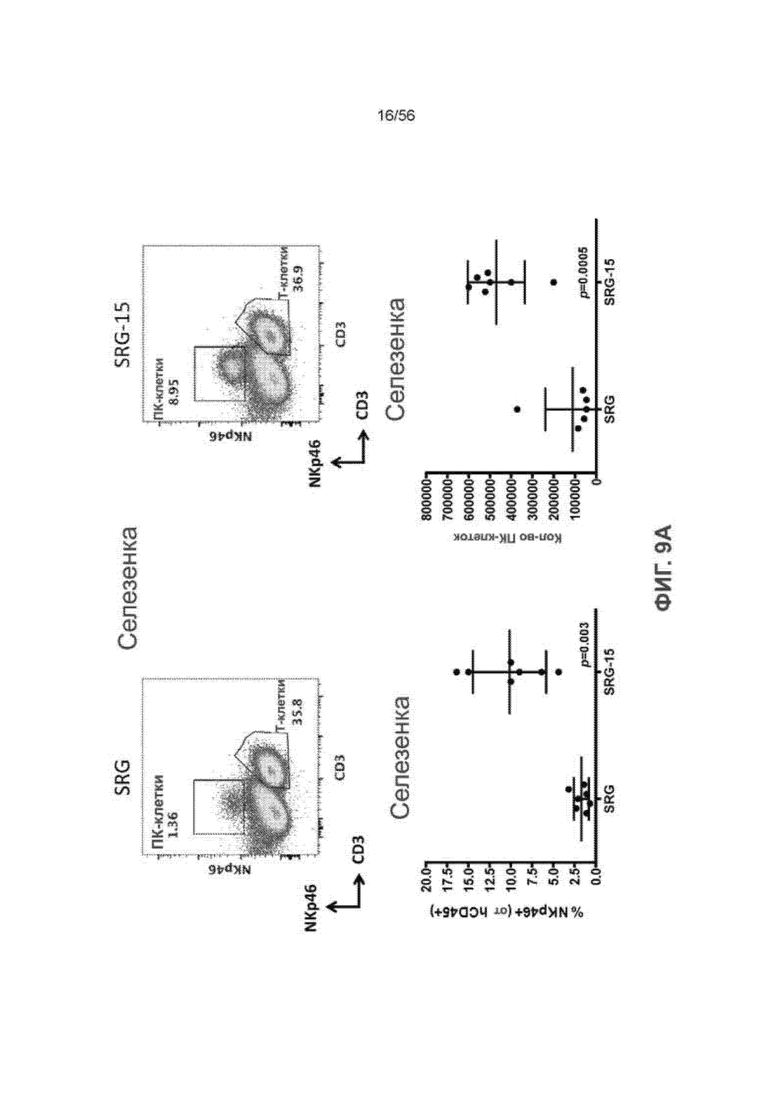
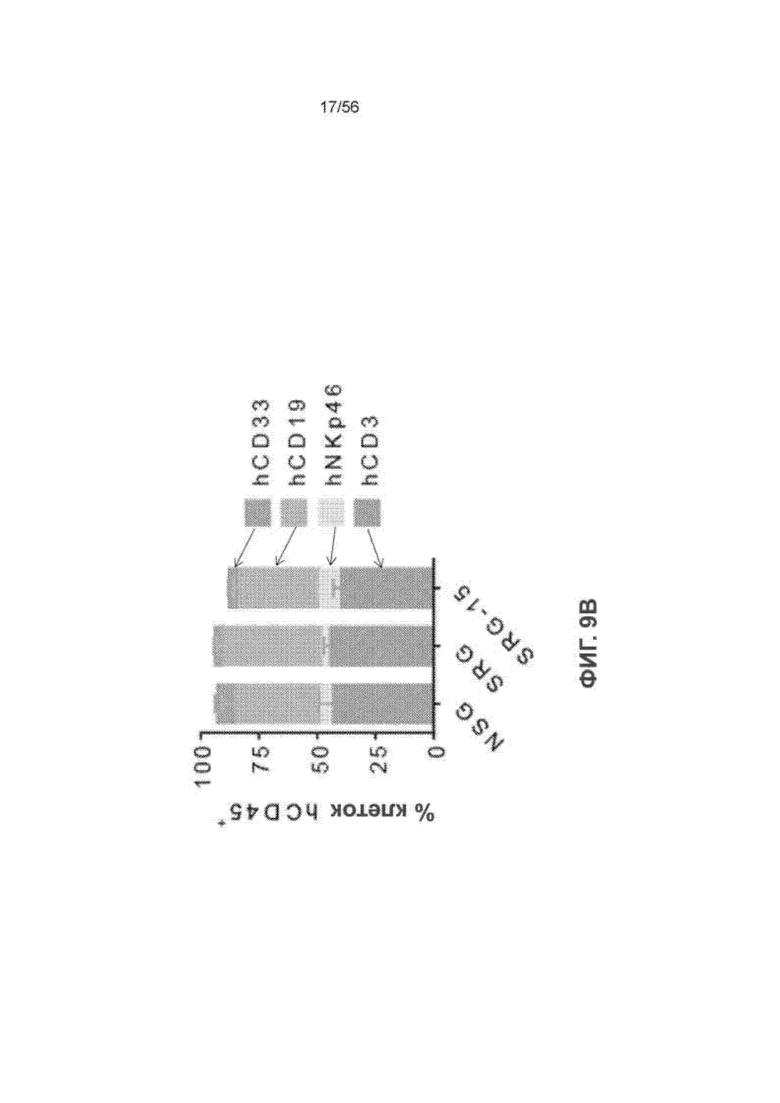
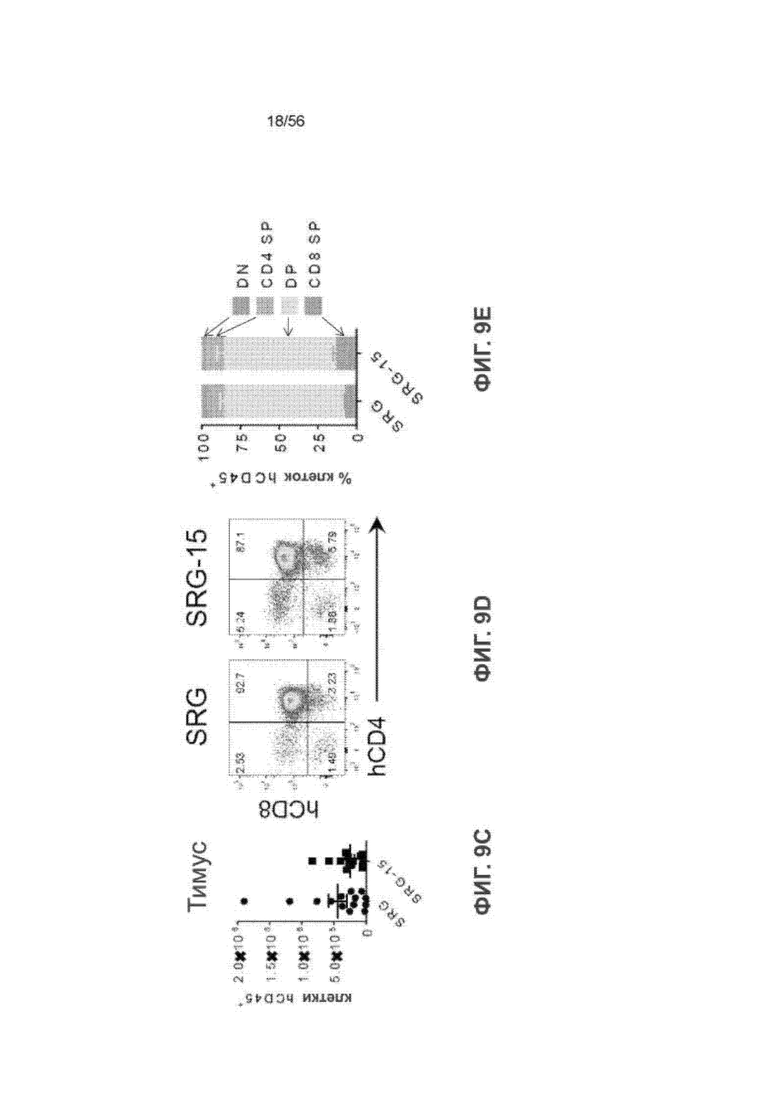
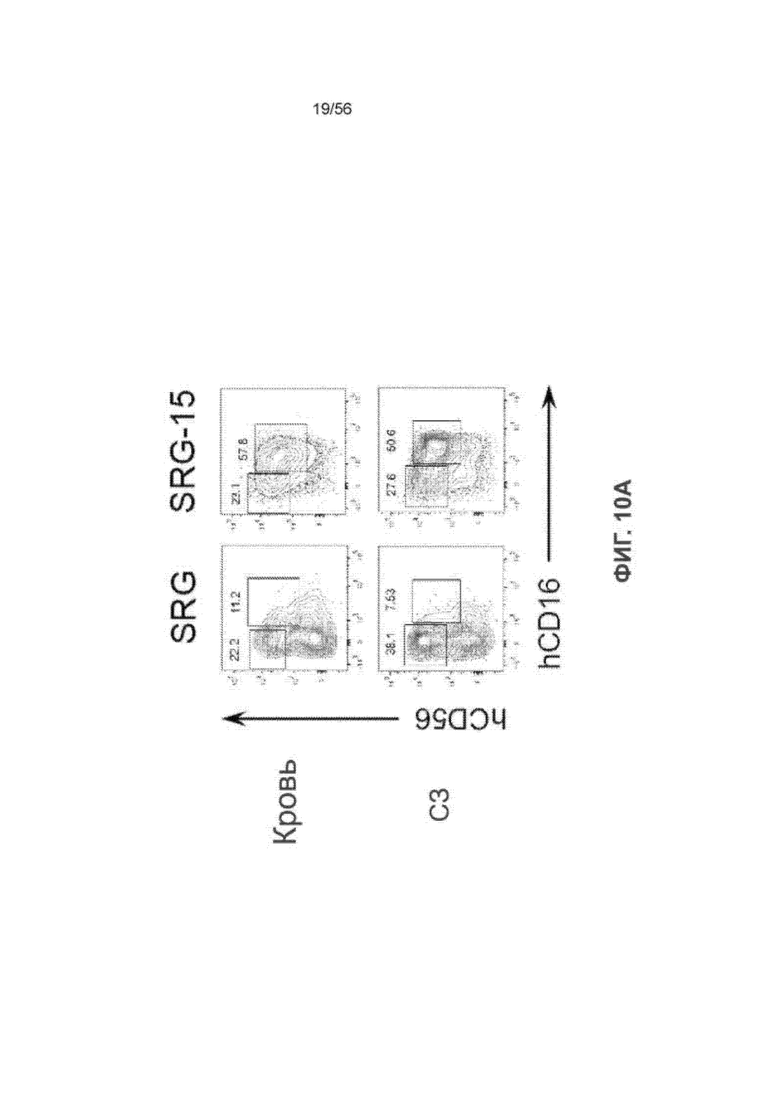

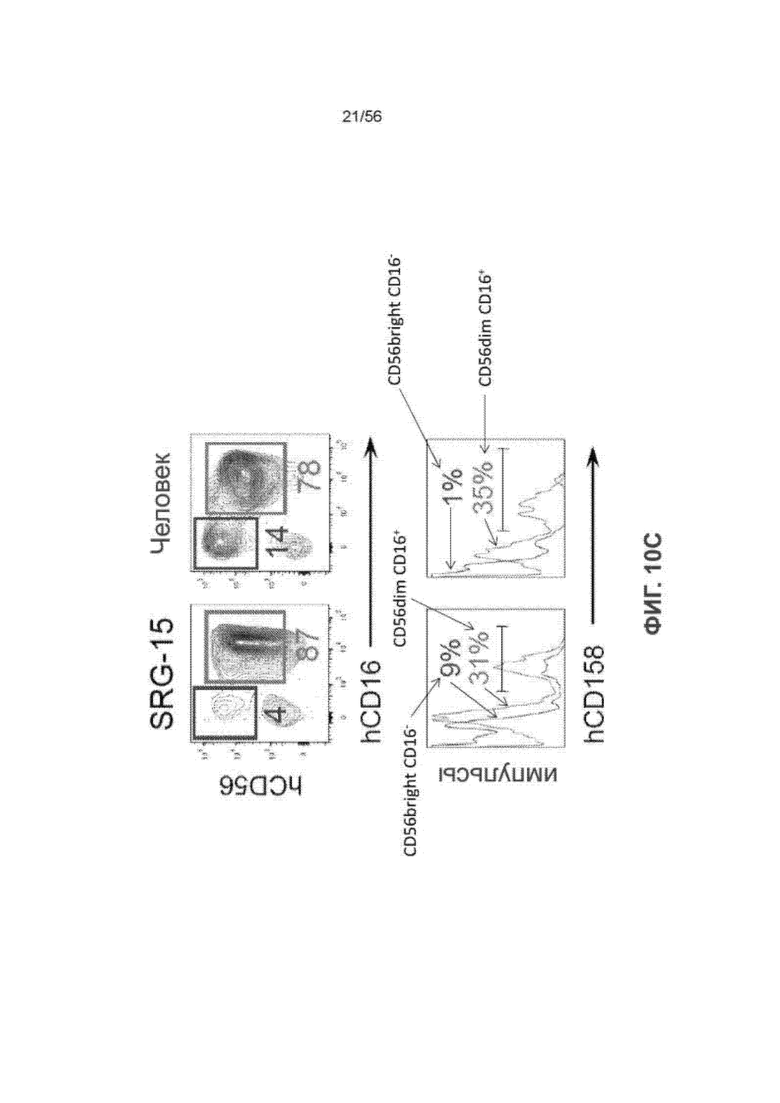
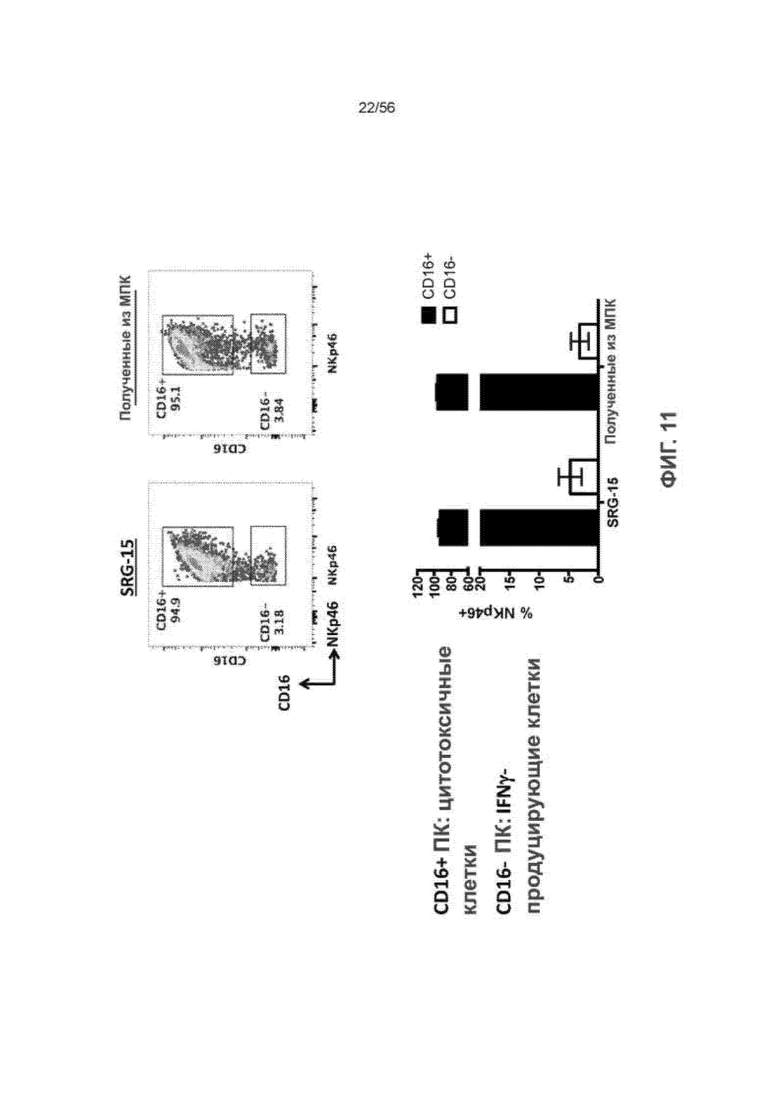
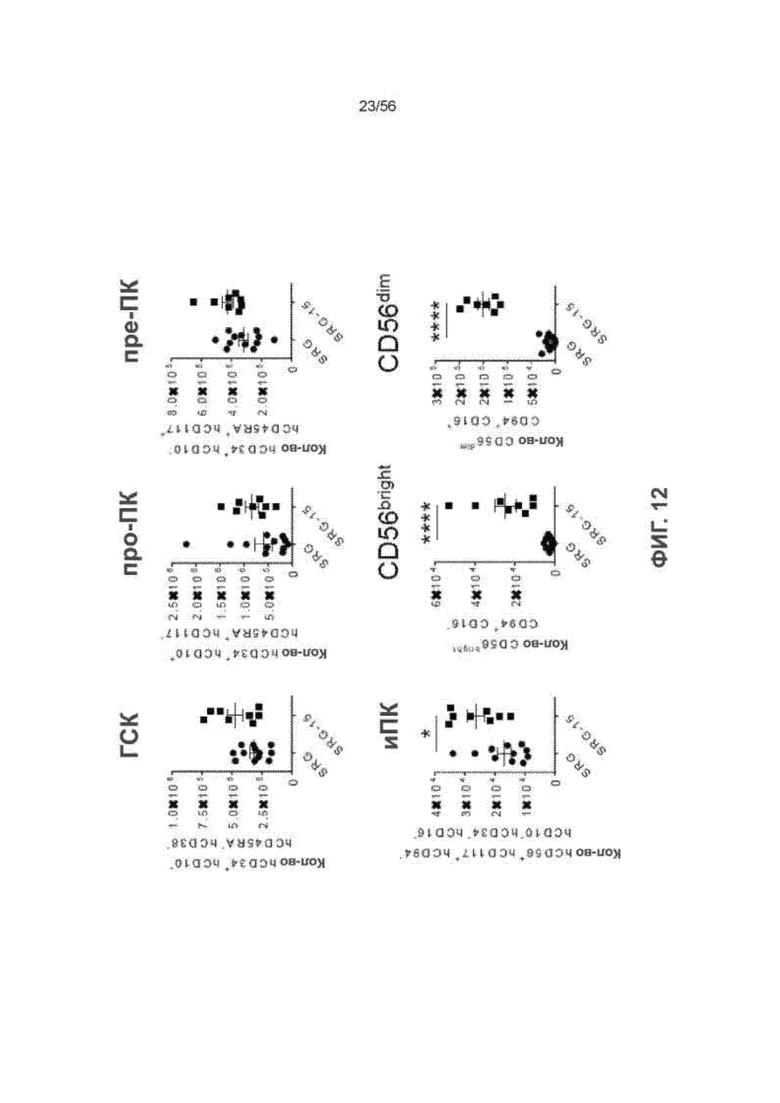
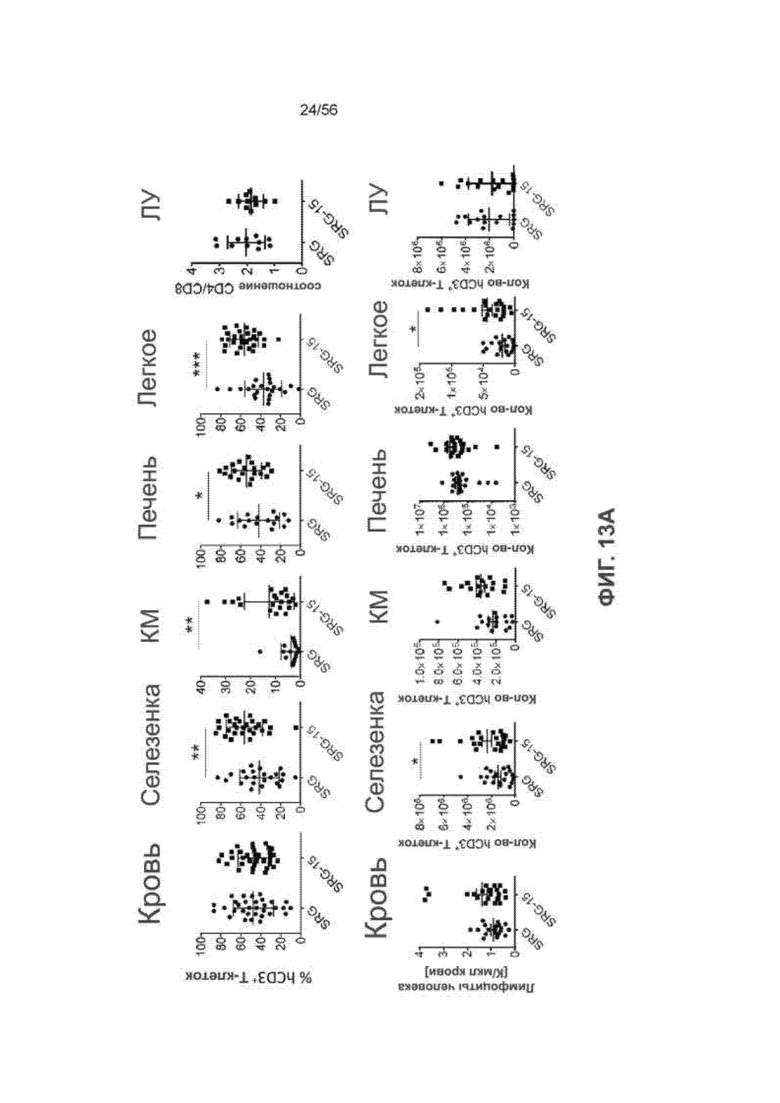
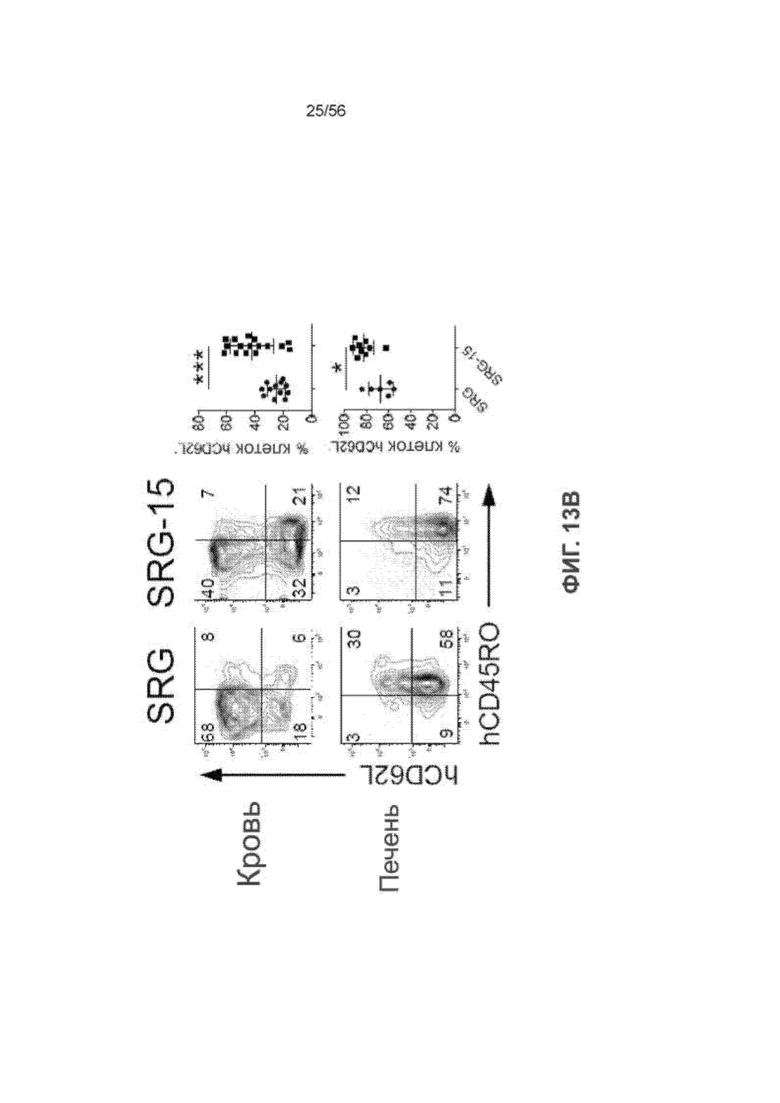
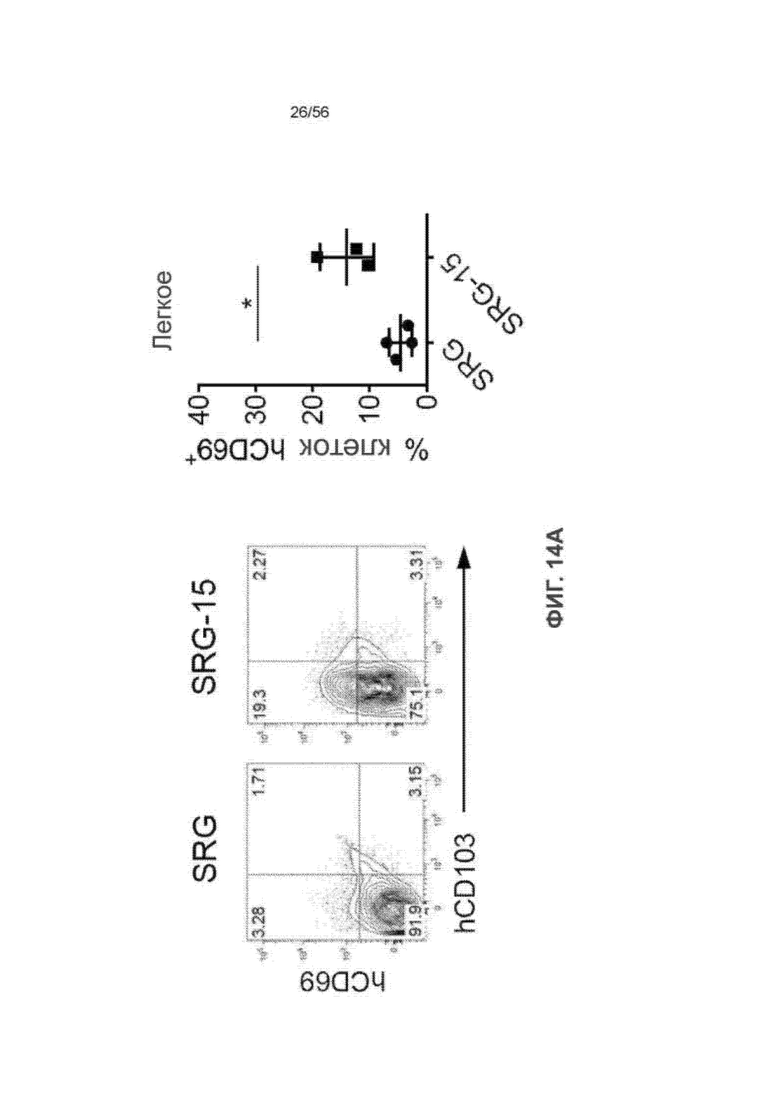
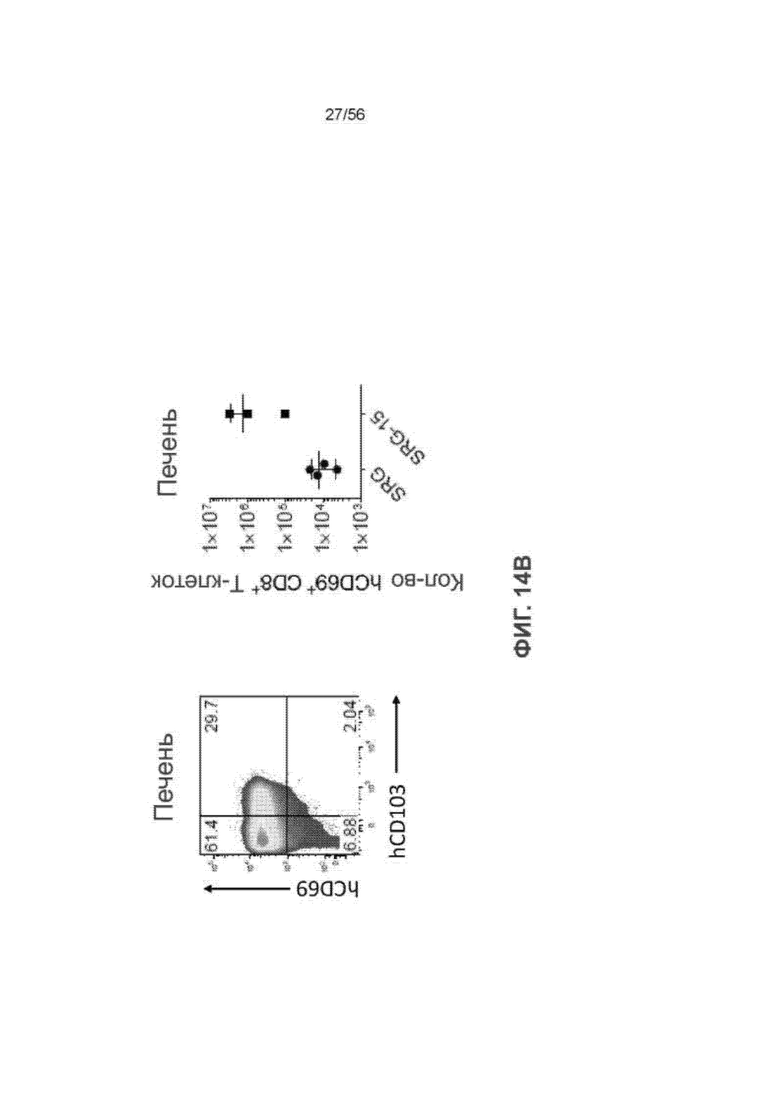
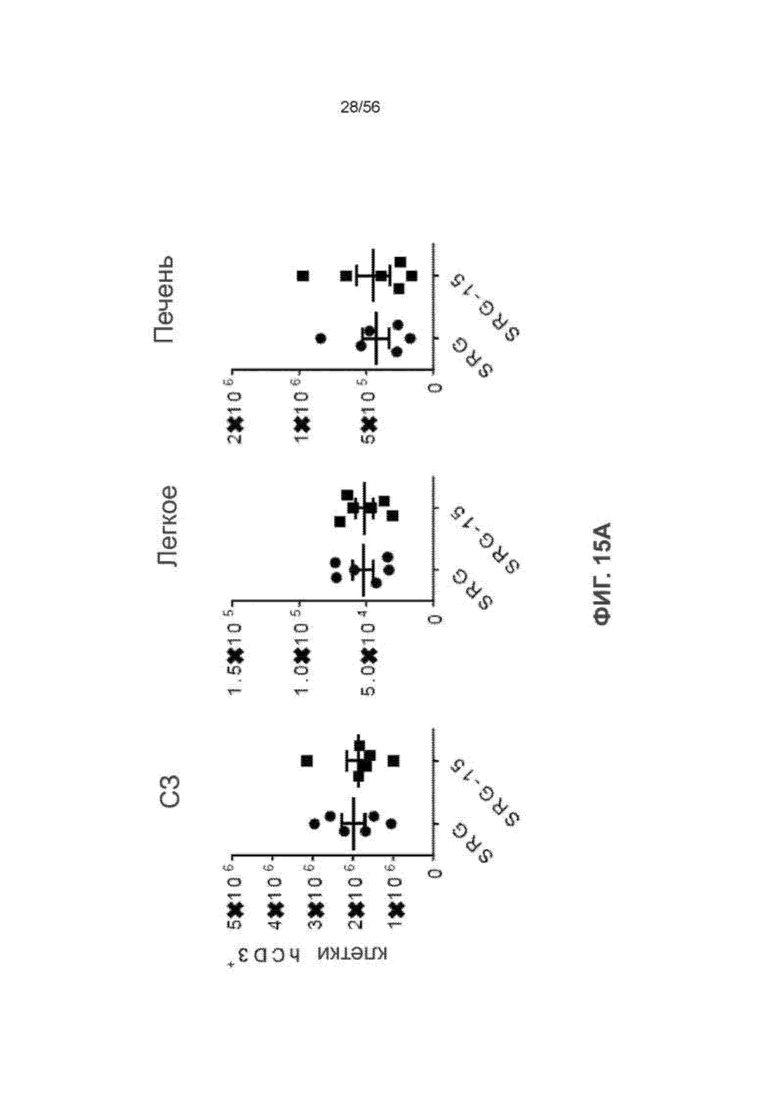
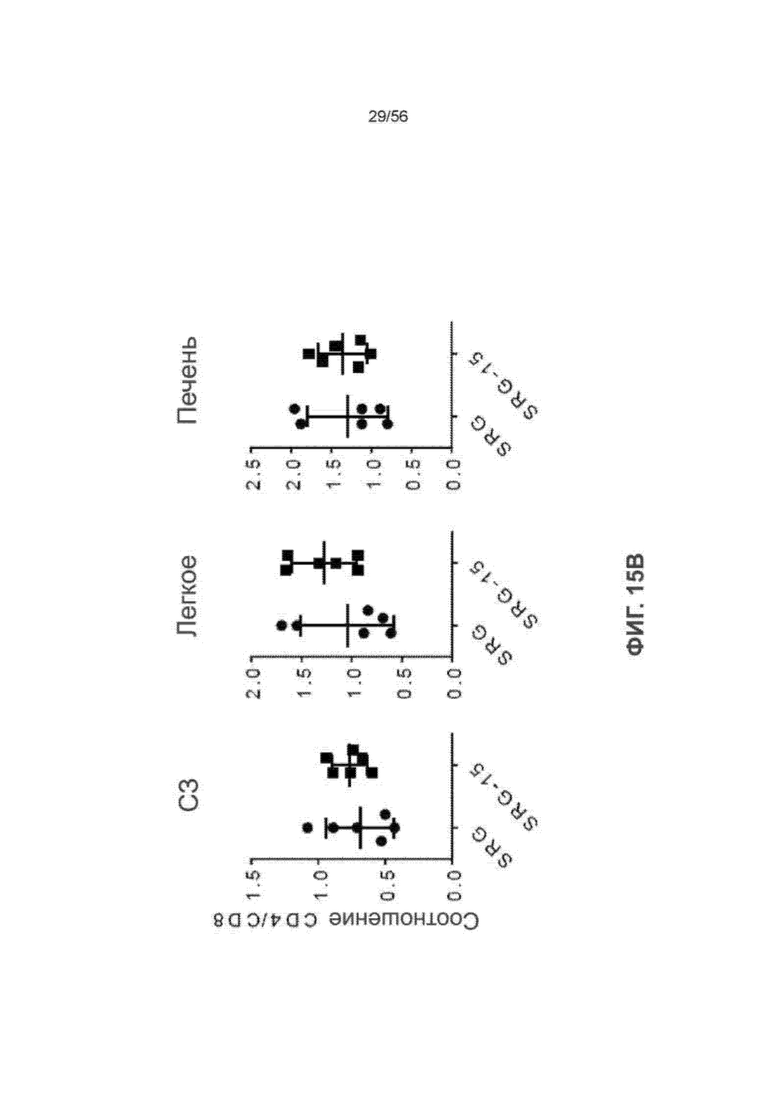
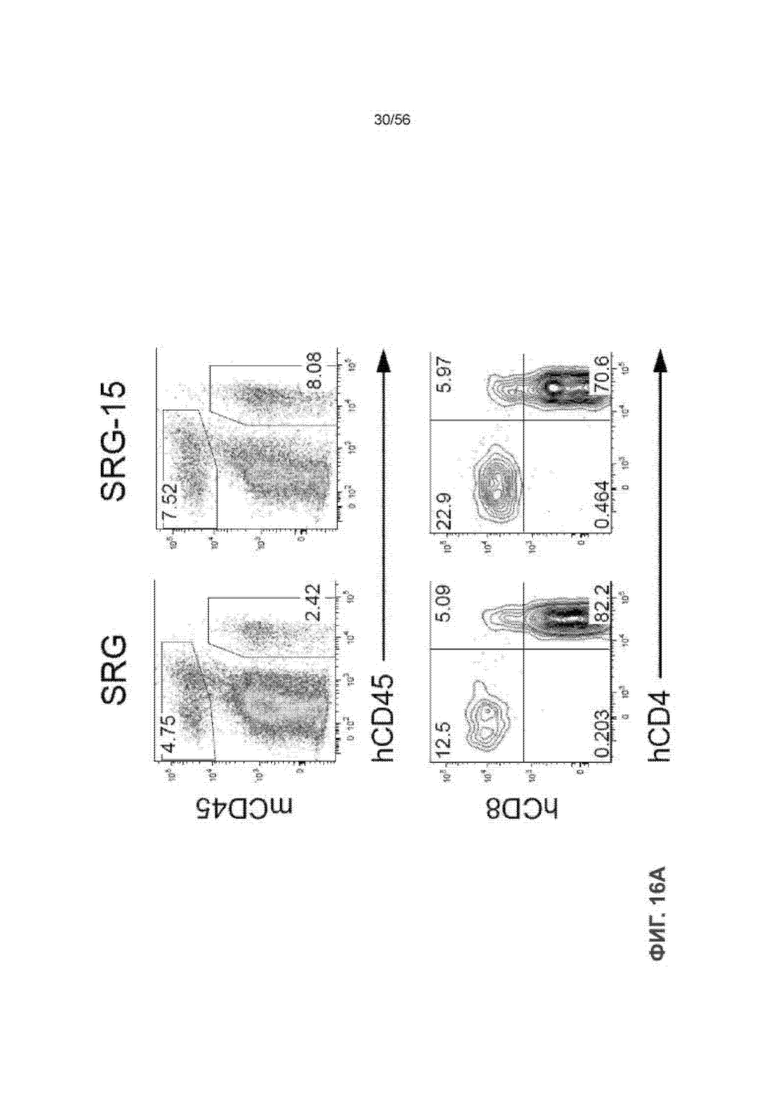

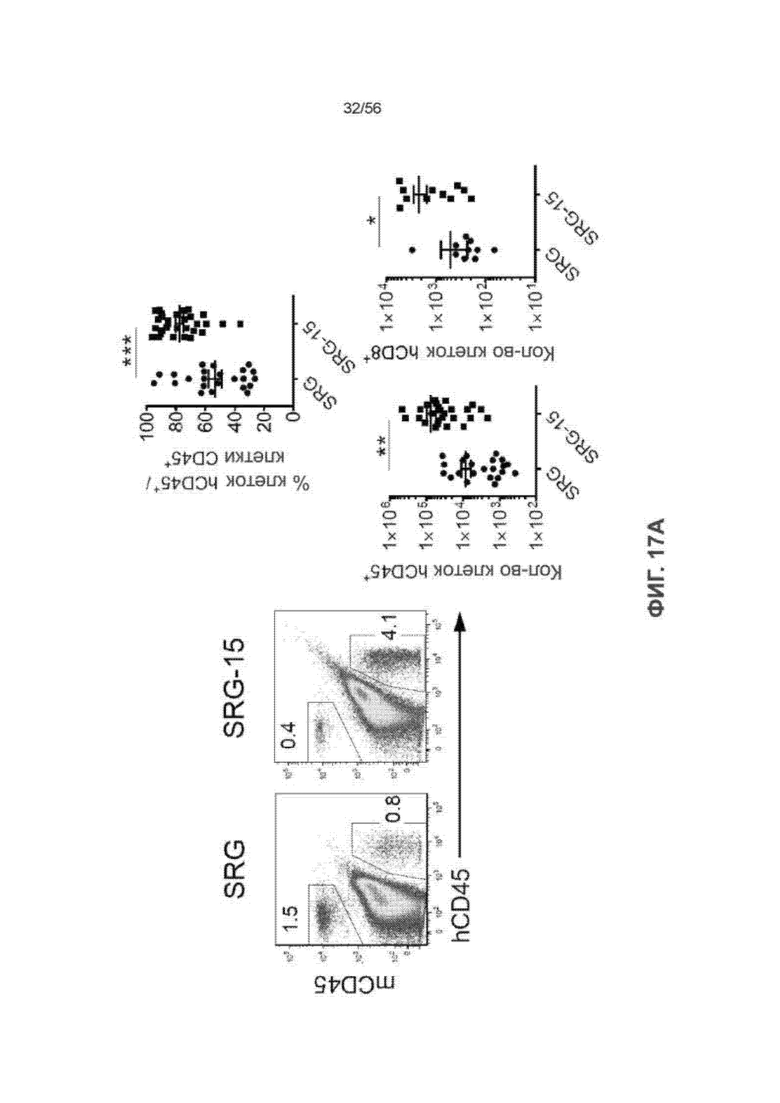
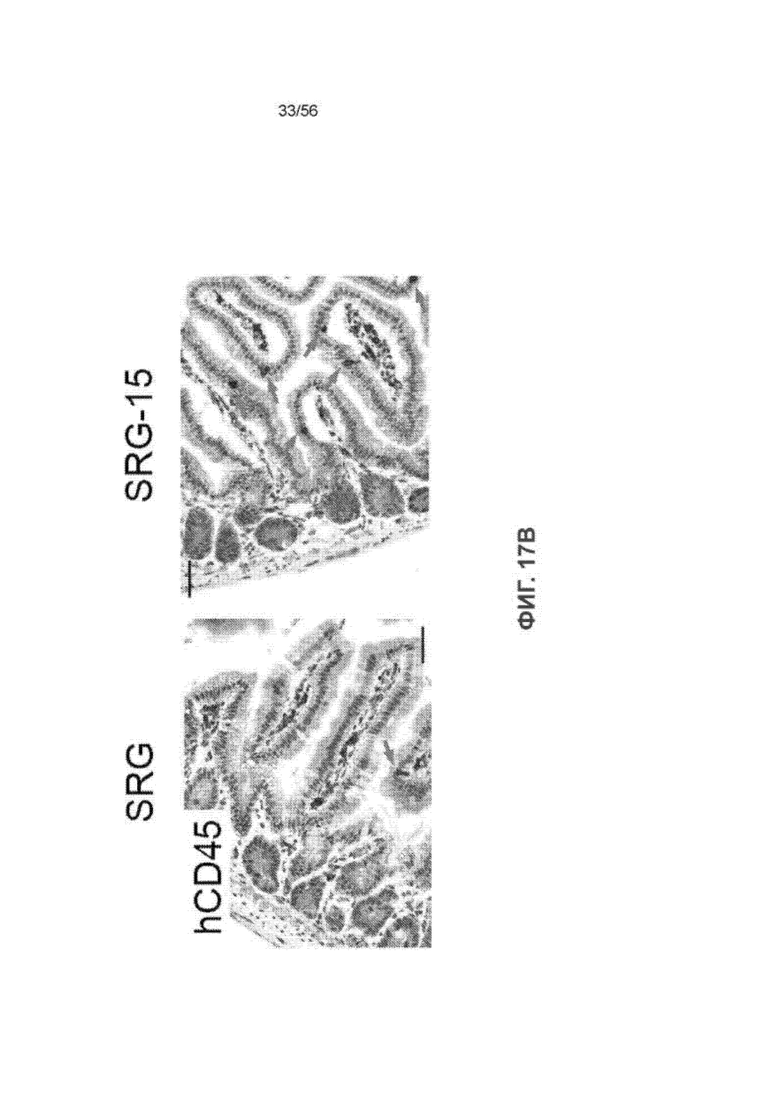
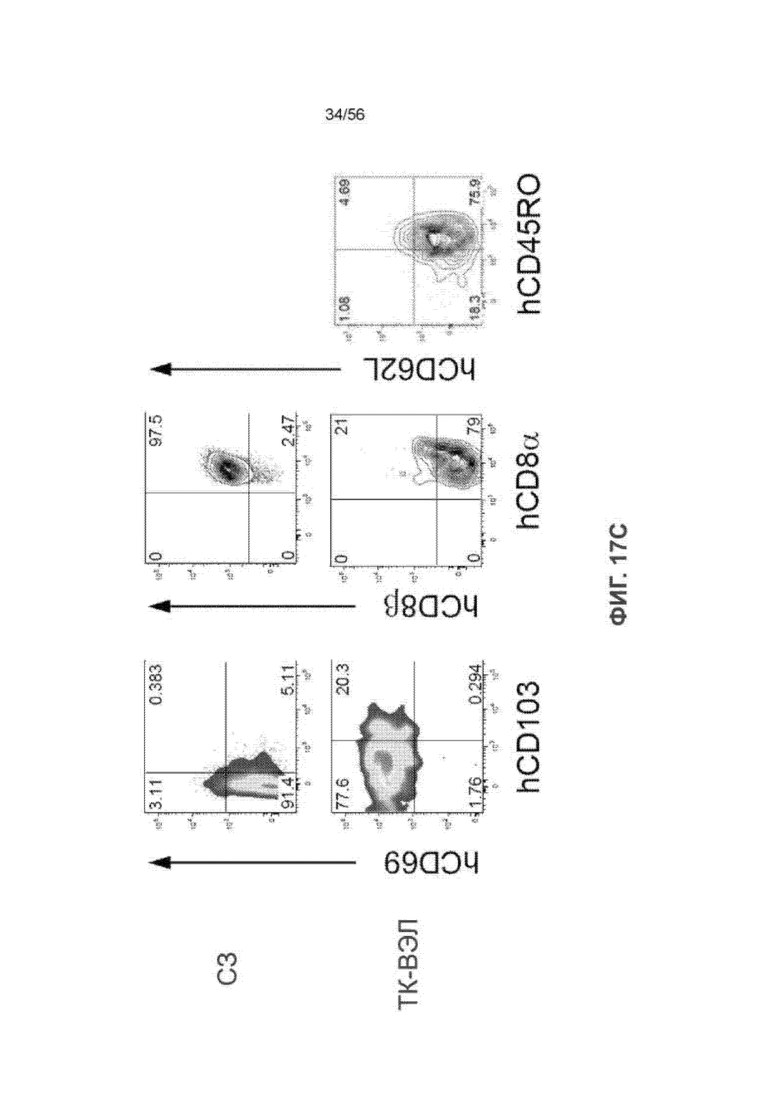
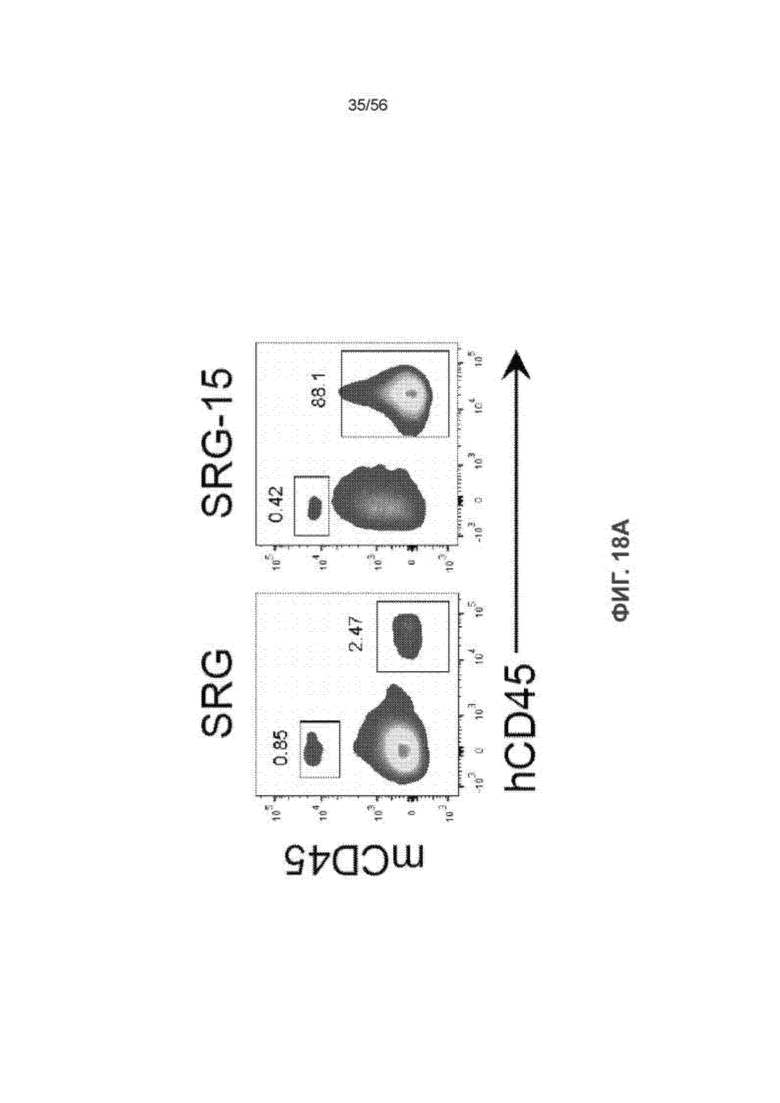
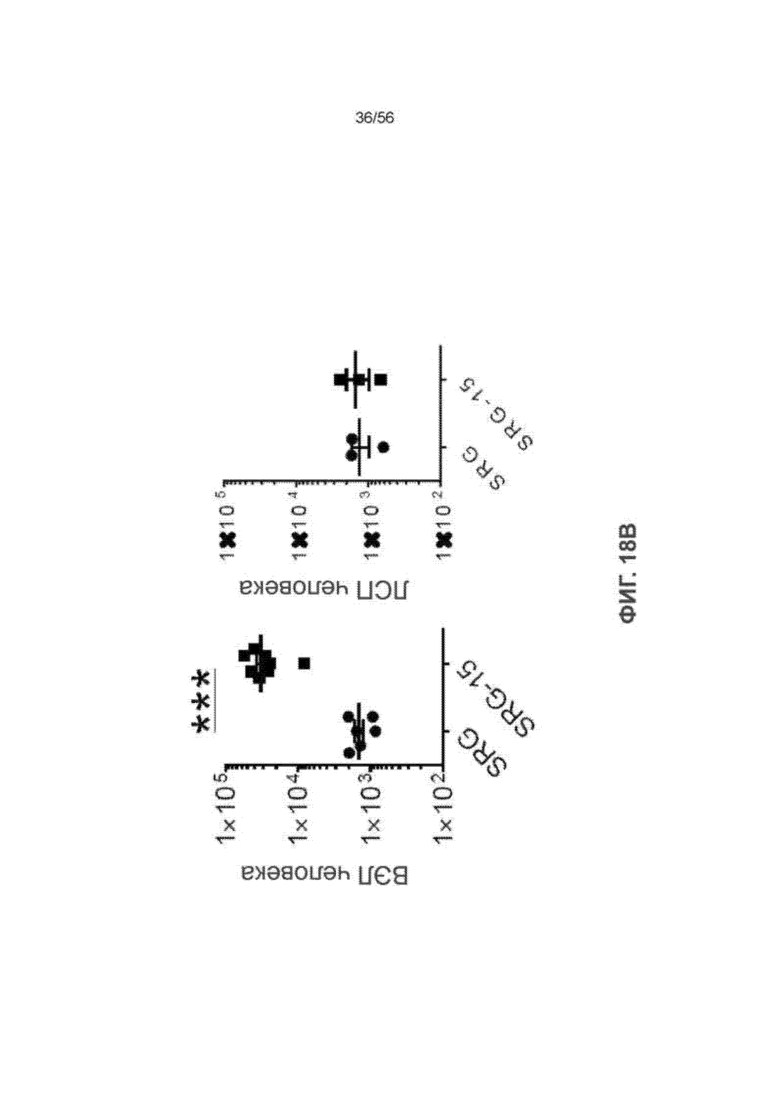
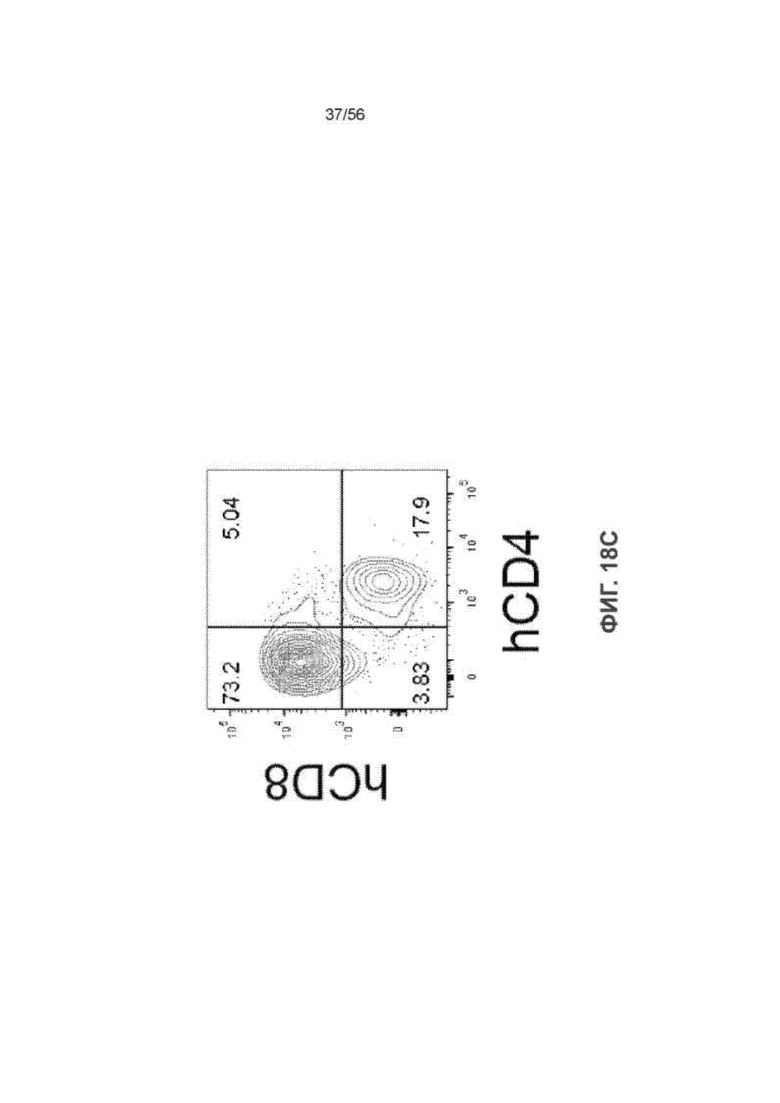
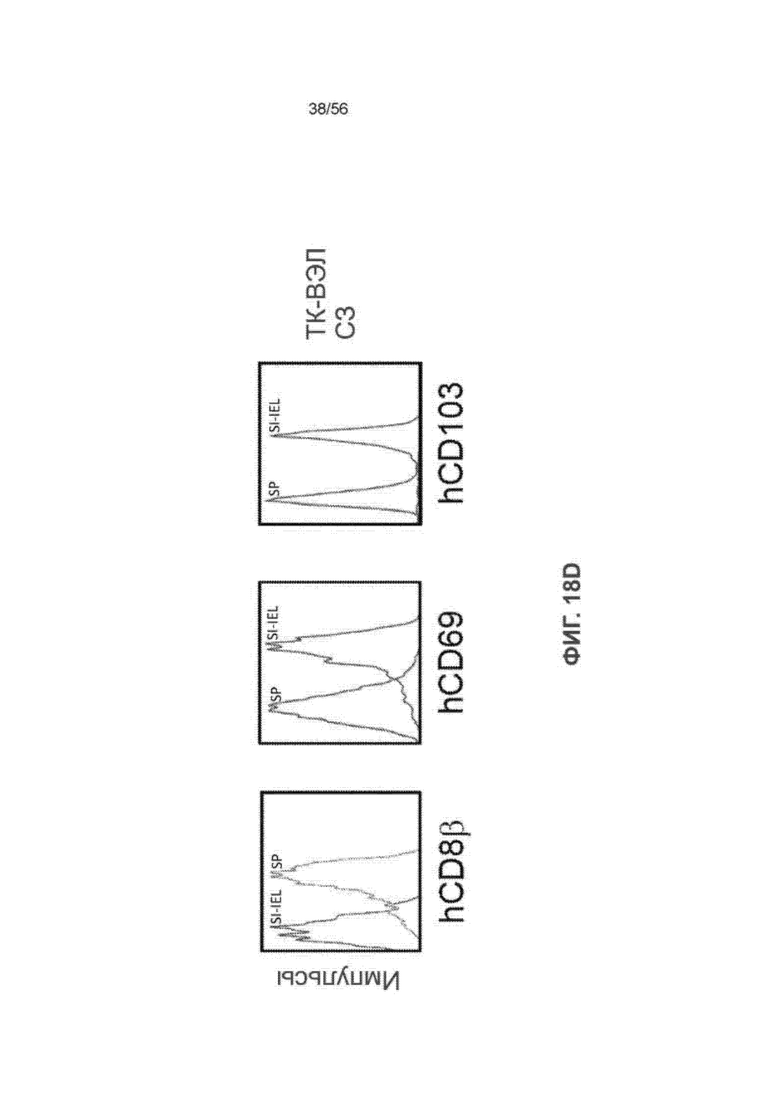

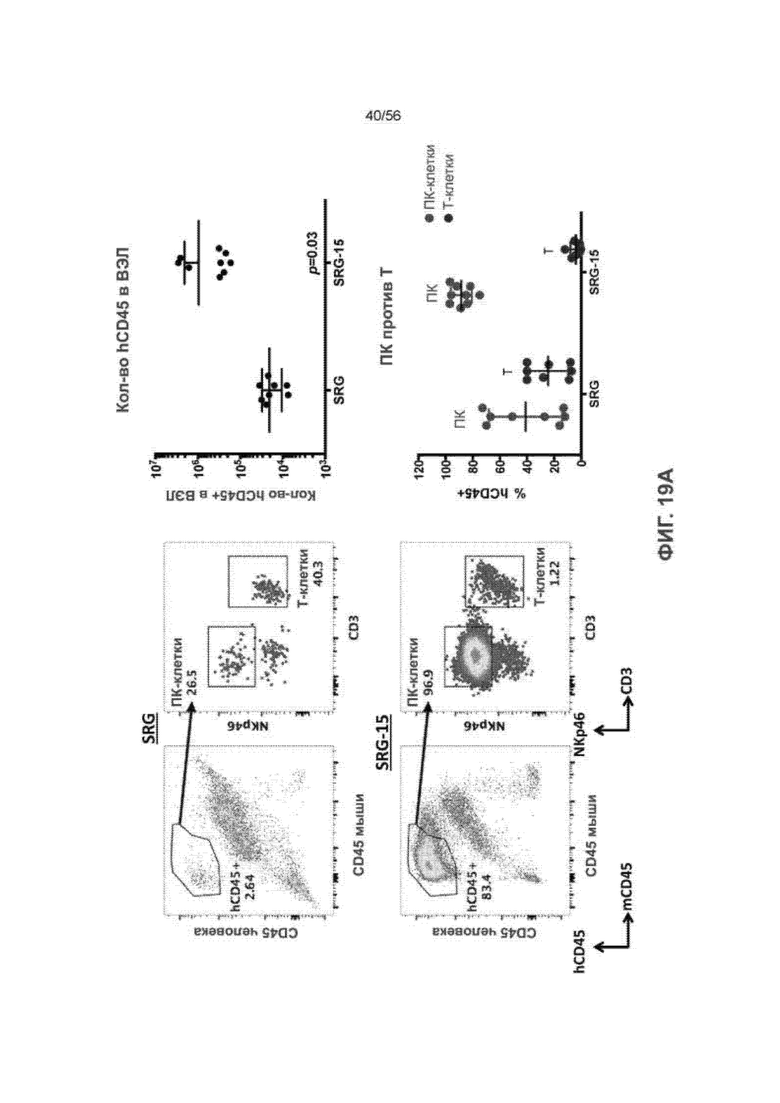
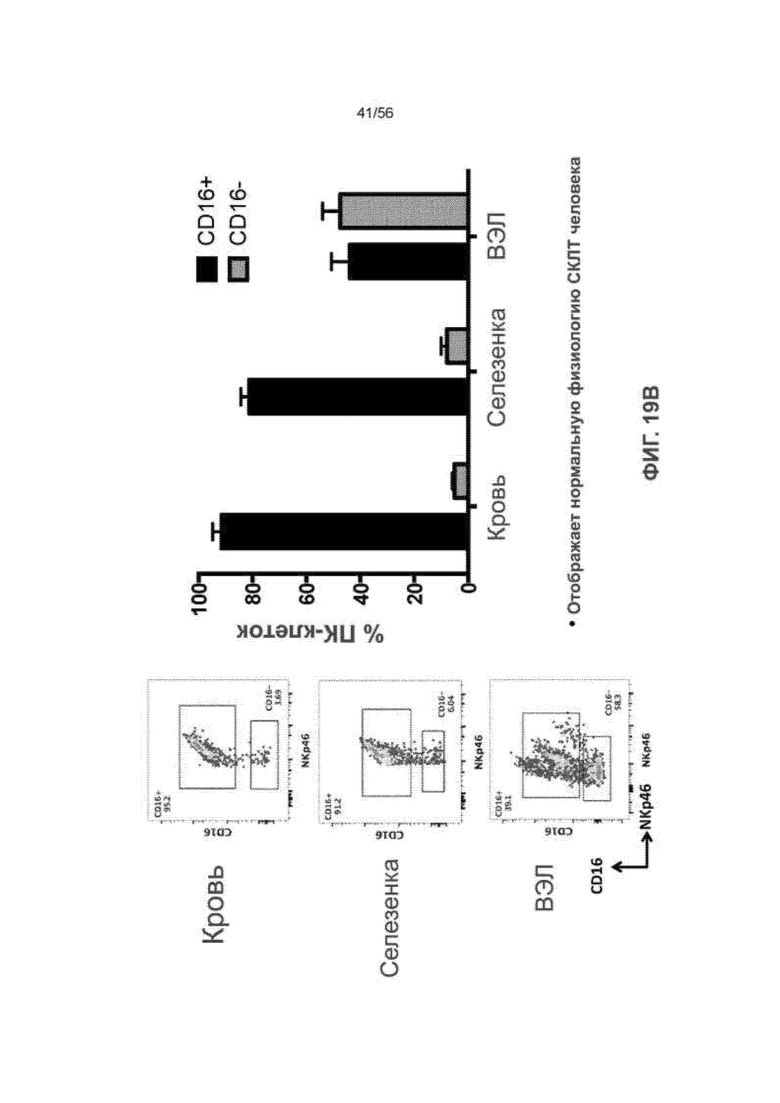
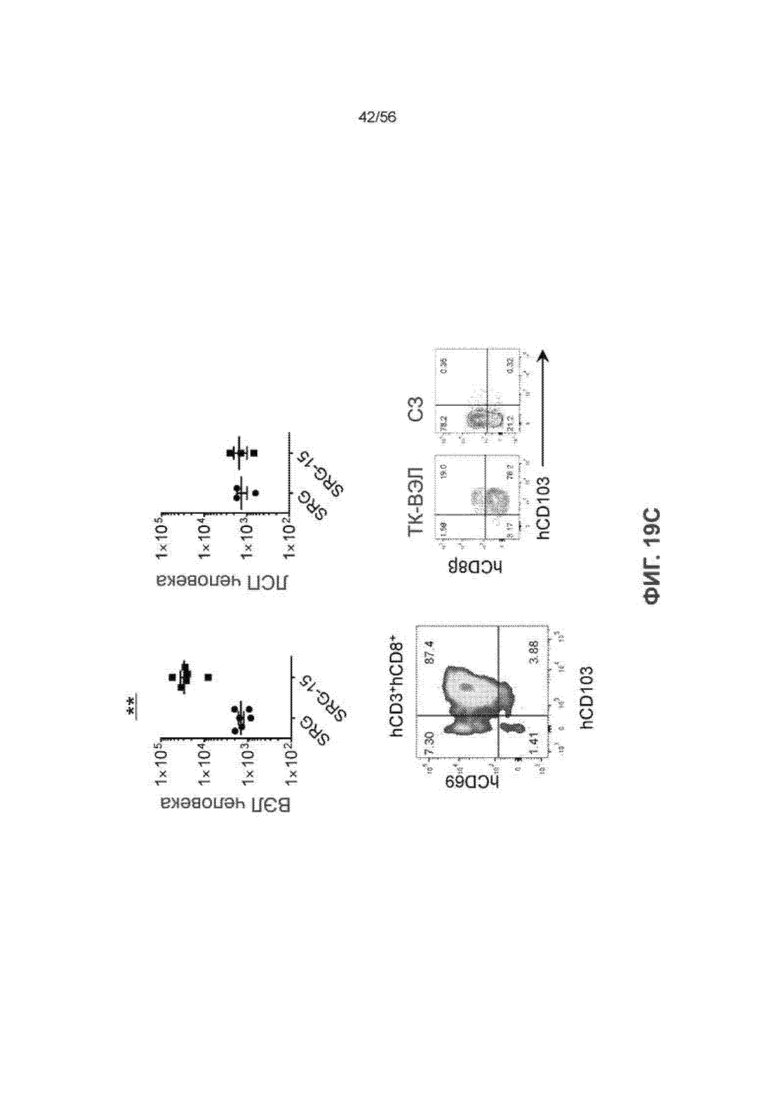
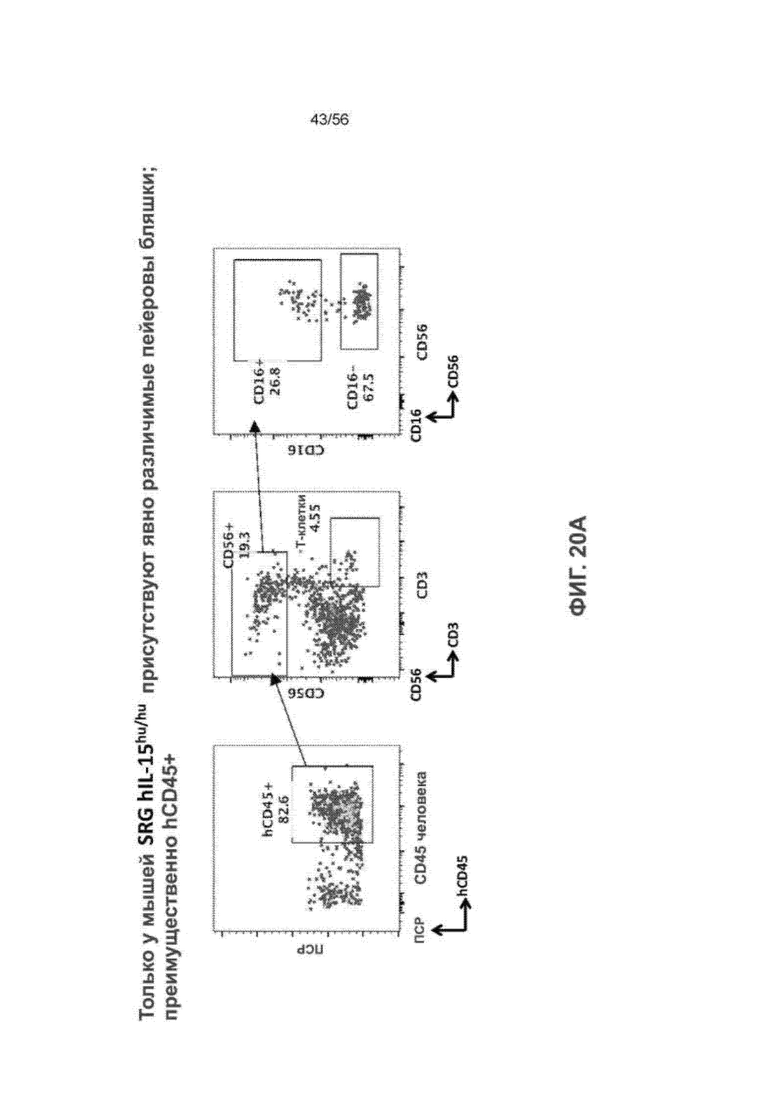
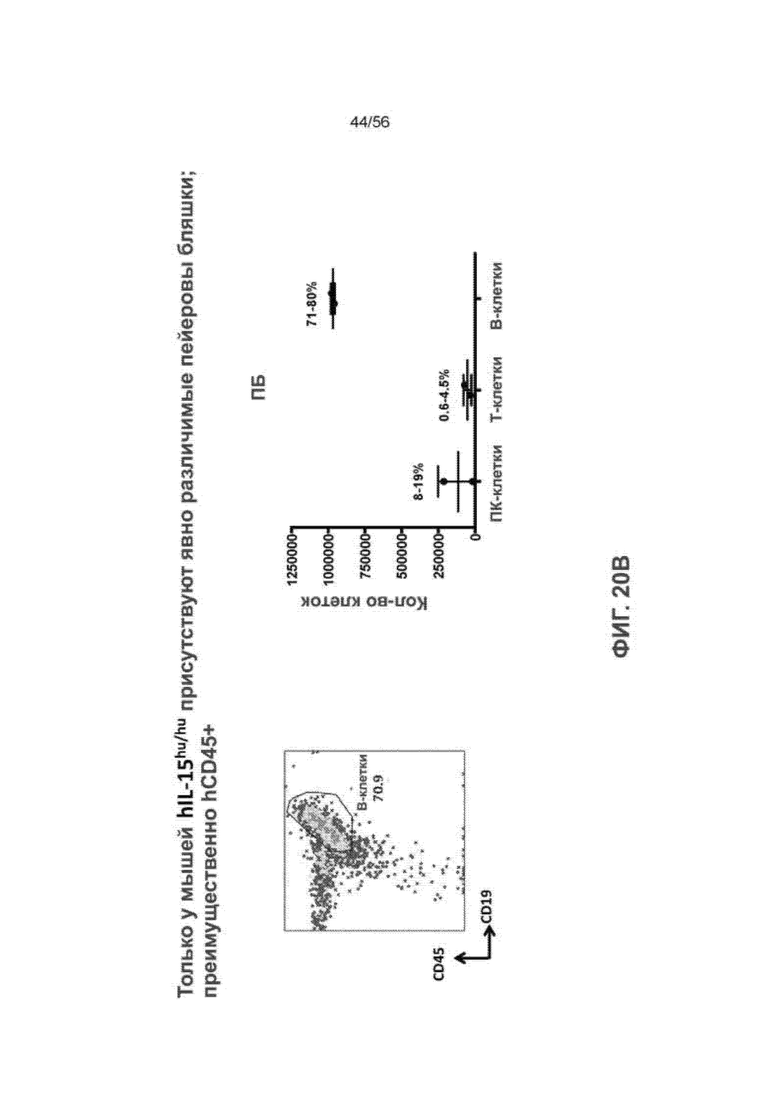
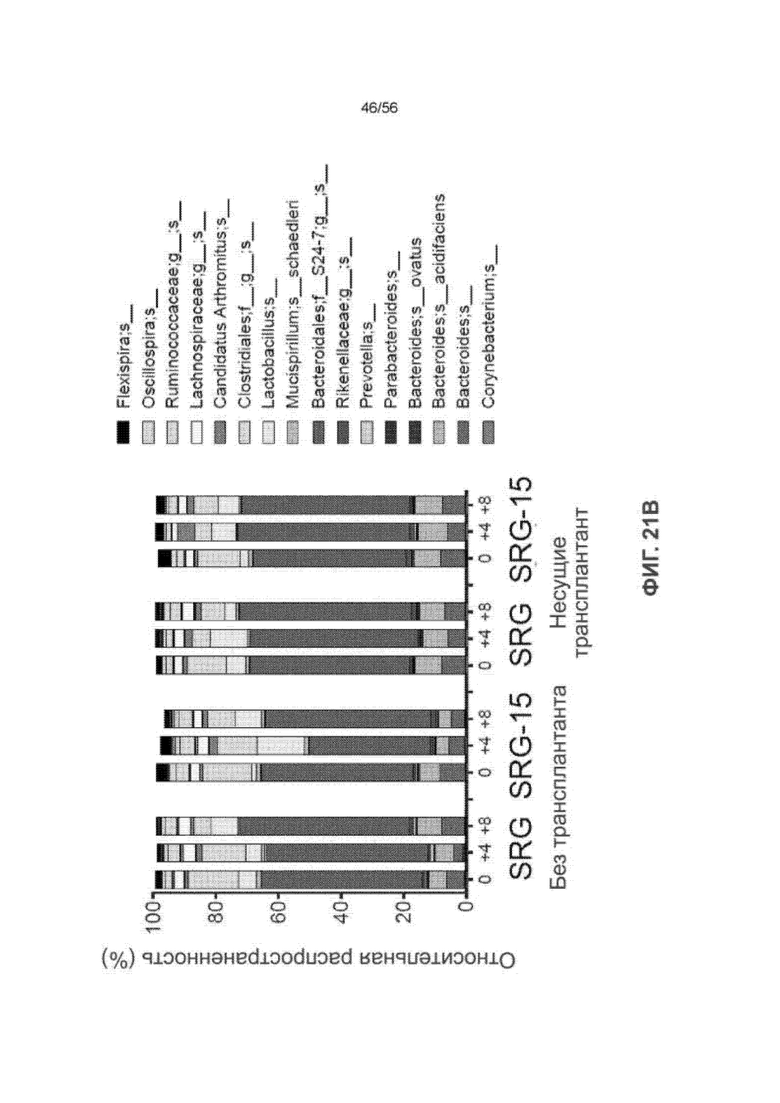
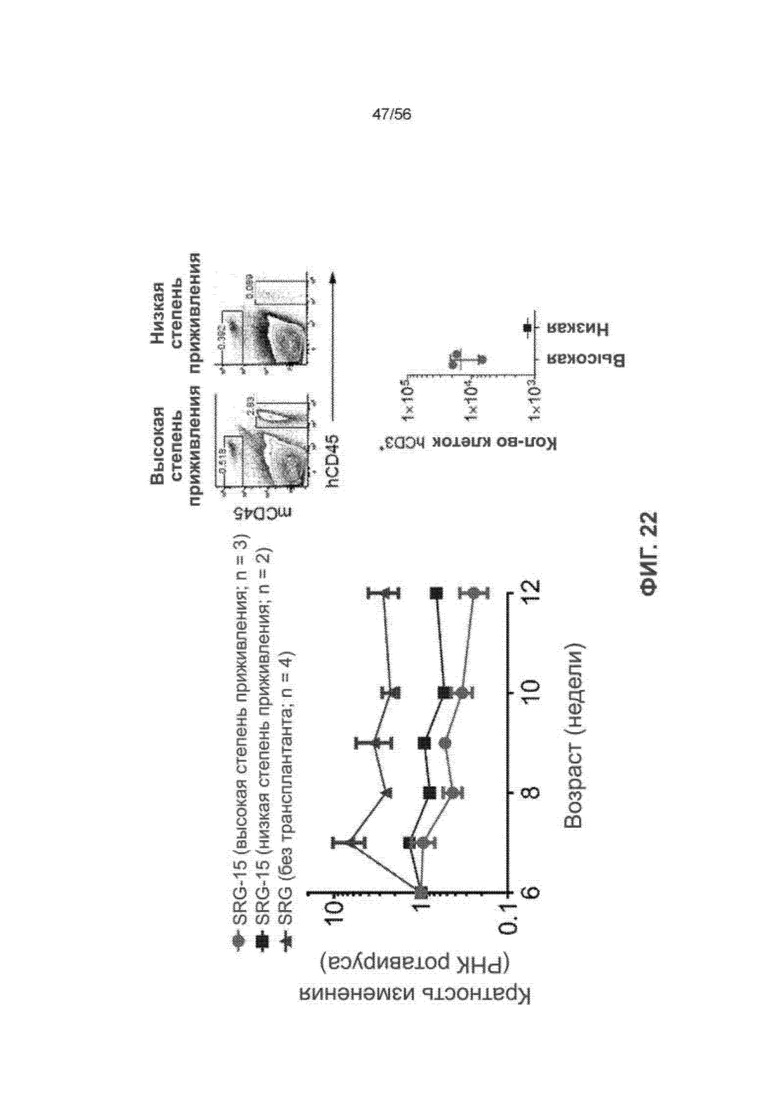
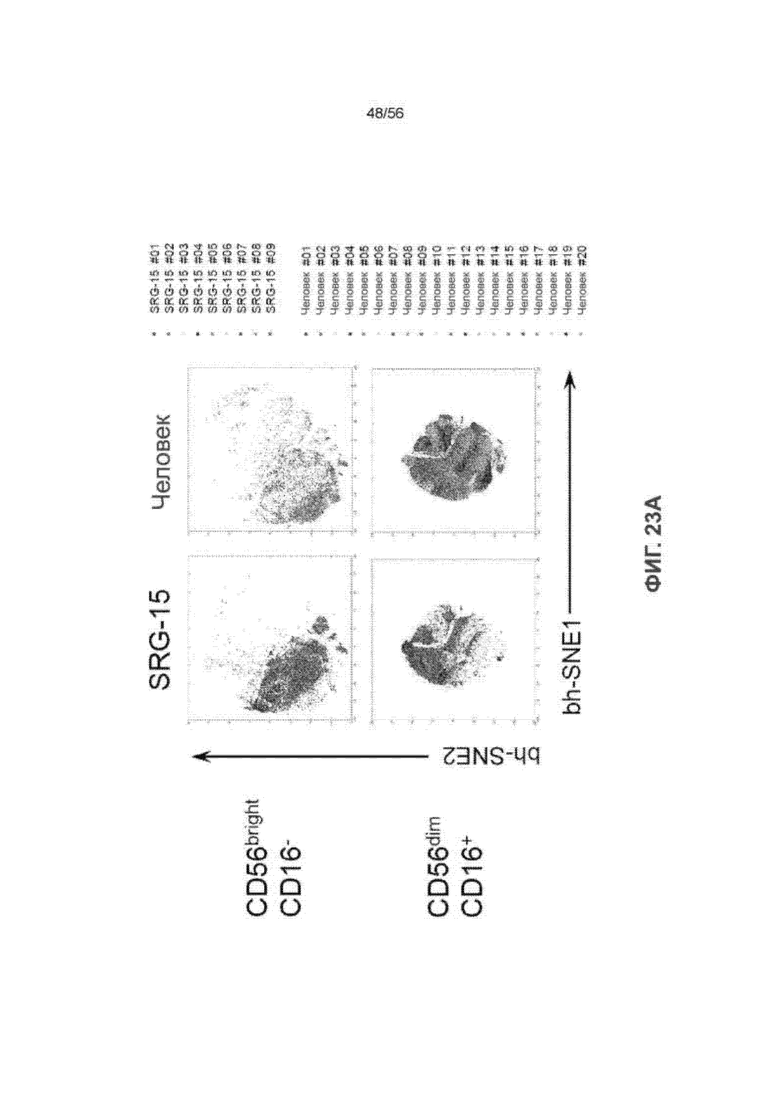
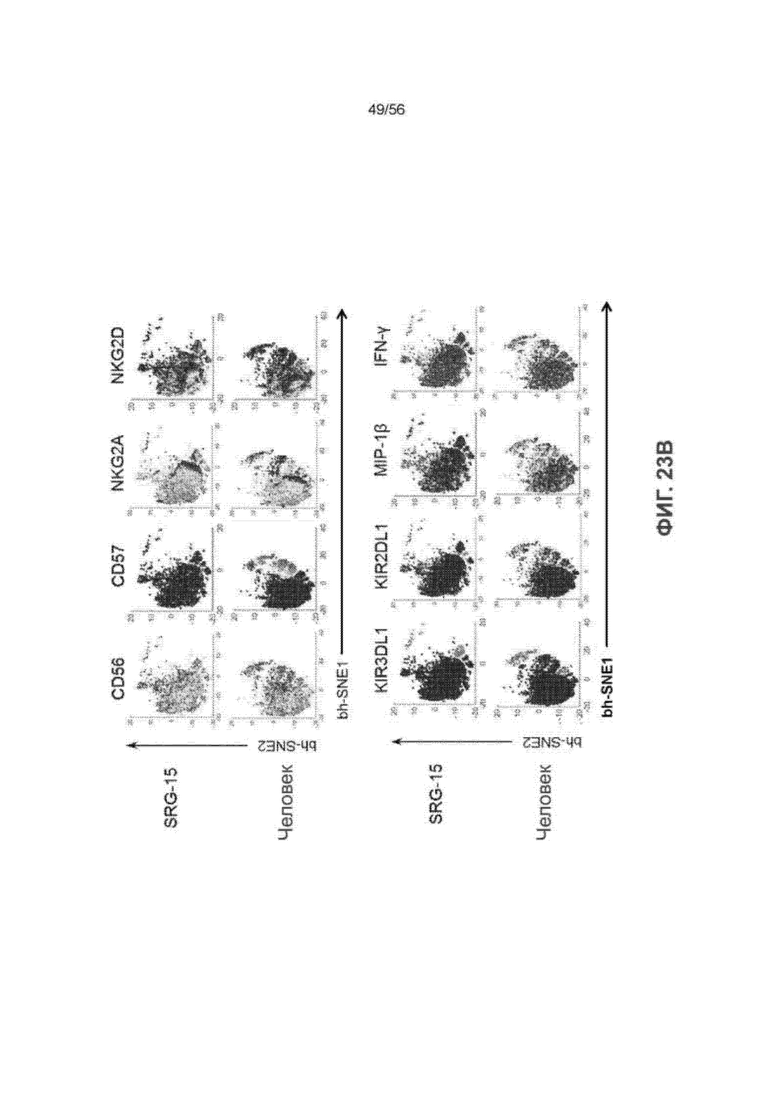

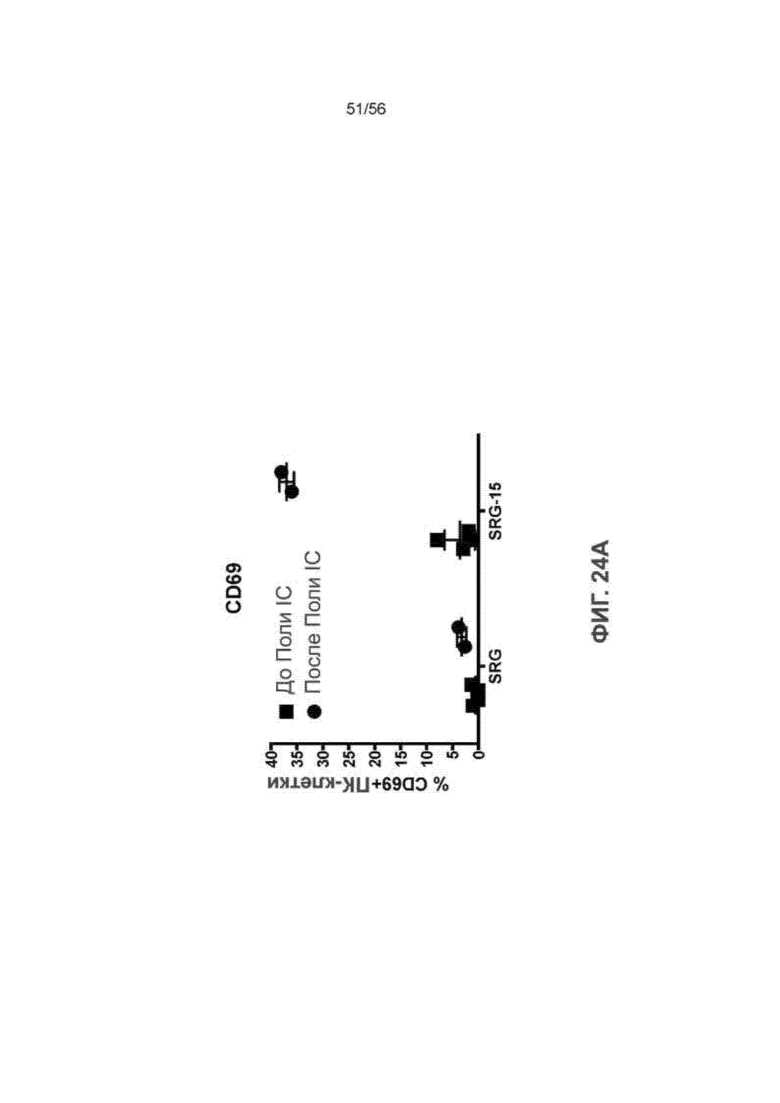
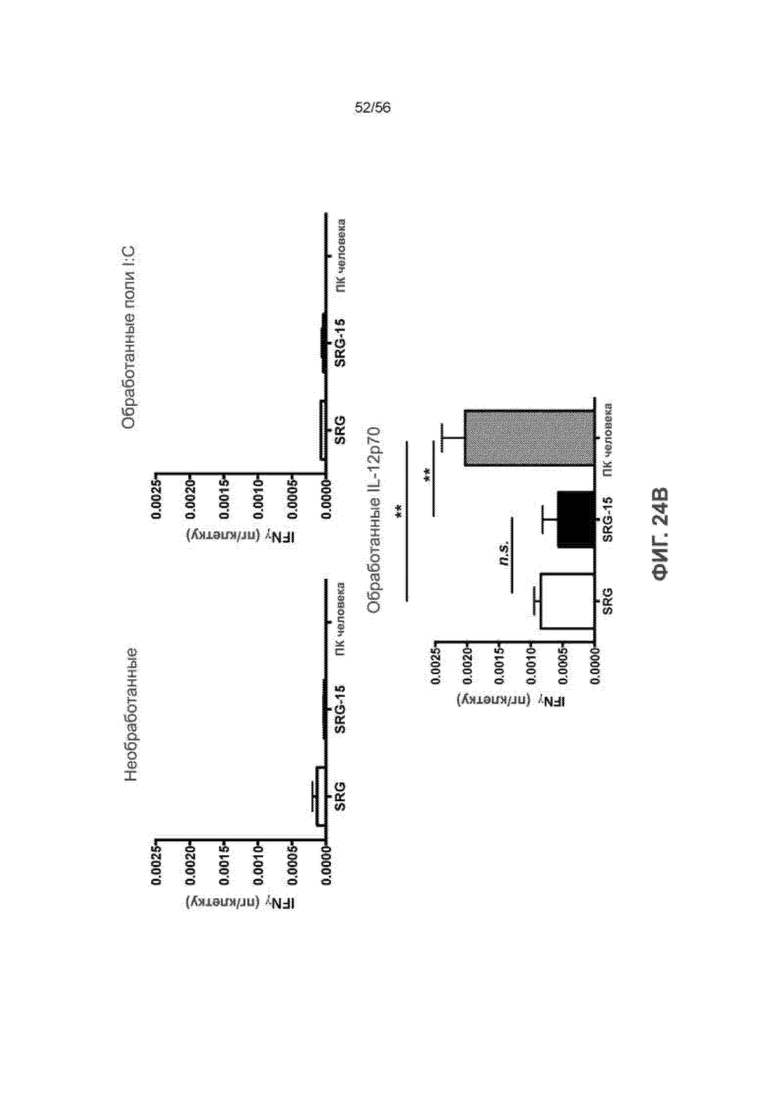
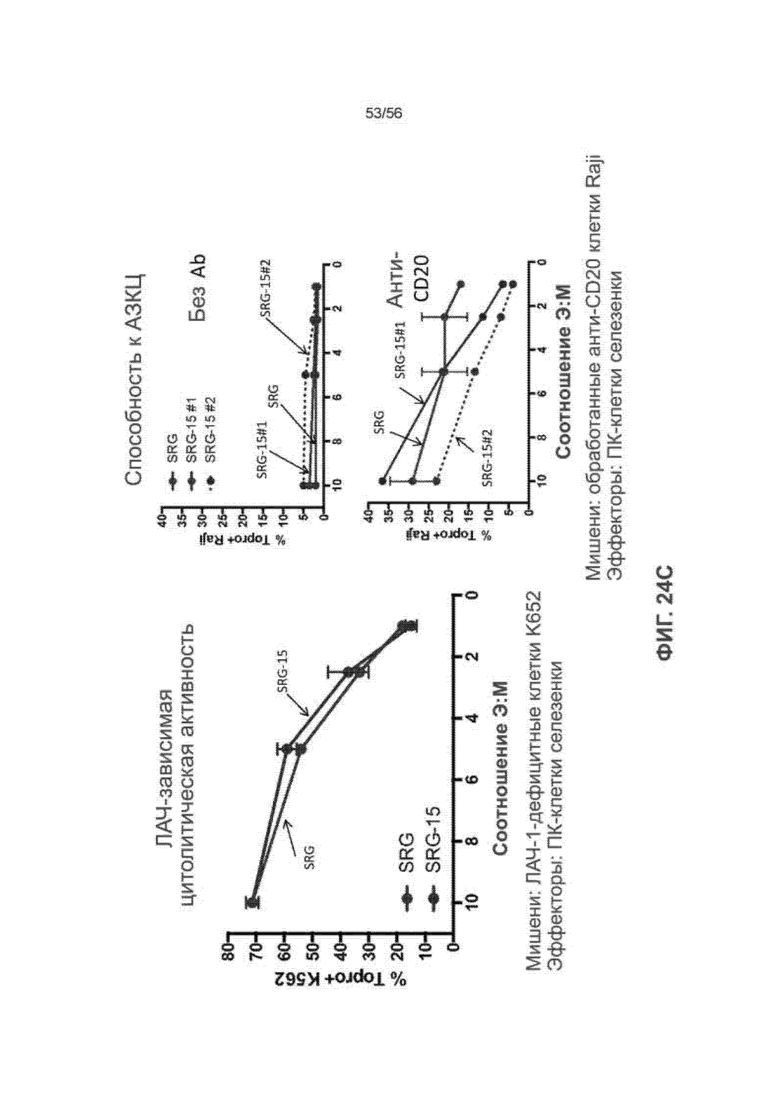
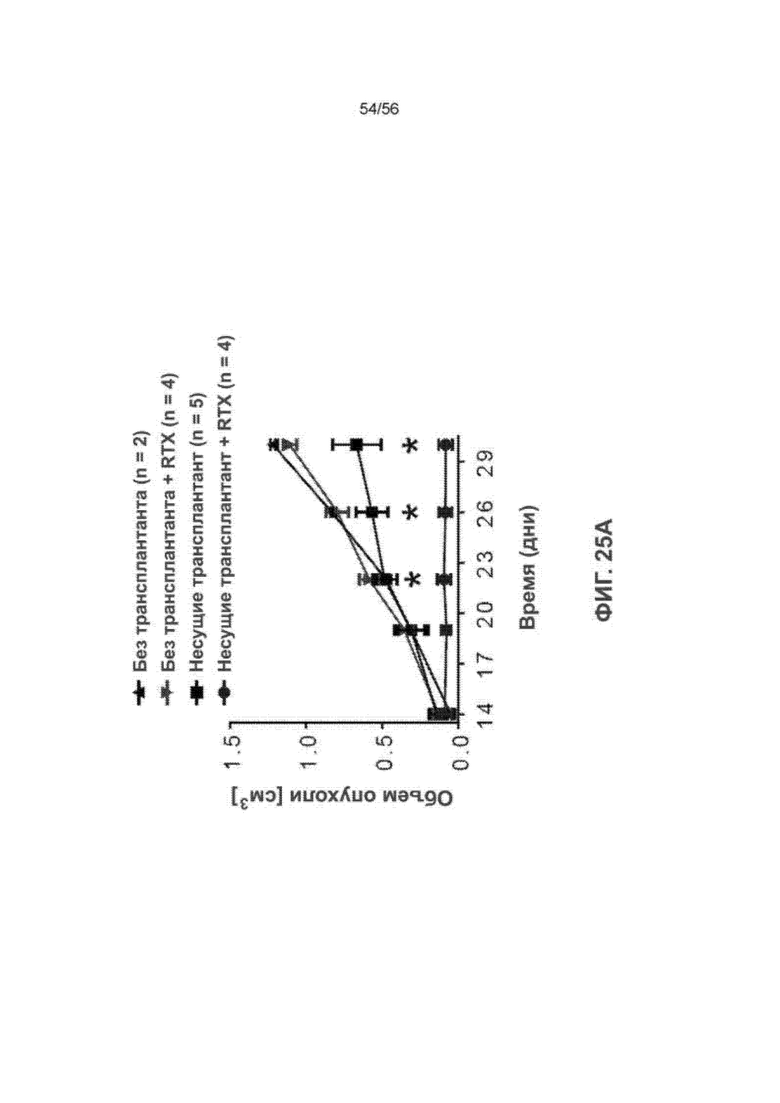
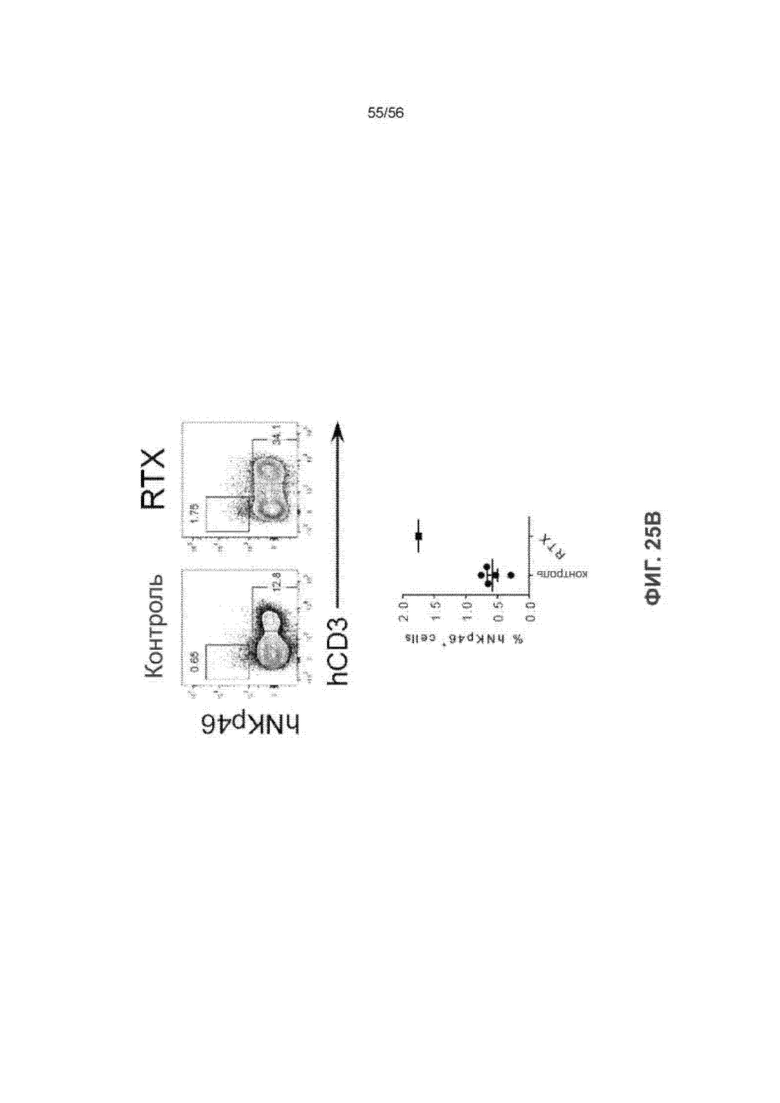
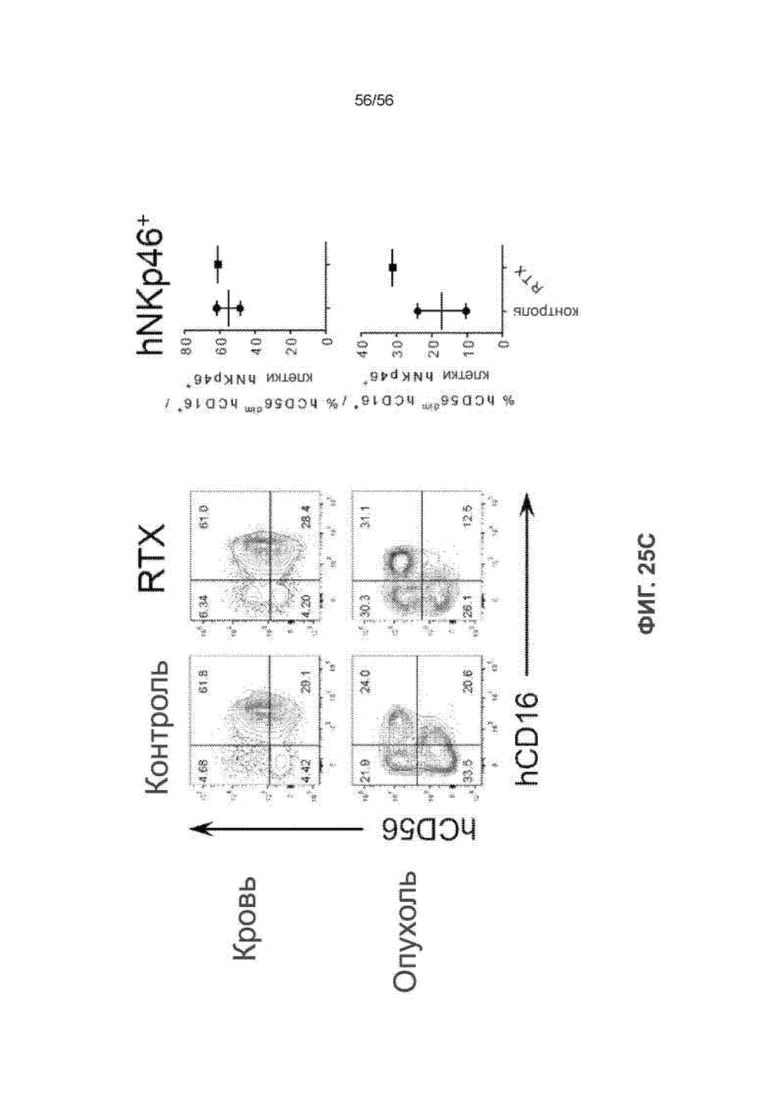
Изобретение относится к области биохимии, в частности к генномодифицированной мыши, которая экспрессирует белок SIRPα человека и белок IL-15 человека, а также к способу ее получения. Также раскрыт способ приживления гемопоэтических клеток человека вышеуказанной генномодифицированной мыши. Изобретение также относится к способу идентификации агента, подавляющего инфекцию патогеном, а также к способу определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при опосредованном ПК-клеткой уничтожении клетки-мишени, предусматривающим использование вышеуказанной мыши. Изобретение позволяет эффективно моделировать развитие и функционирование природных клеток-киллеров (ПК) человека. 8 н. и 38 з.п. ф-лы, 25 ил., 1 табл., 10 пр.
1. Генномодифицированная мышь, которая содержит:
нулевую мутацию в мышином гене SIRPα и последовательность нуклеиновой кислоты, встроенную в геном генномодифицированной мыши, причем указанная последовательность кодирует белок SIRPα человека и функционально связана с эндогенным промотором гена SIRPα в локусе гена SIRPα мыши; а также
нулевую мутацию в мышином гене IL-15 в локусе гена IL-15 мыши и последовательность нуклеиновой кислоты, встроенную в геном генномодифицированной мыши, причем указанная последовательность кодирует белок IL-15 человека и функционально связана с эндогенным промотором гена IL-15 мыши в локусе гена IL-15 мыши, и при этом генномодифицированная мышь экспрессирует белок SIRPα человека и белок IL-15 человека.
2. Генномодифицированная мышь по п. 1, отличающаяся тем, что нулевая мутация в гене SIRPα мыши является делецией по меньшей мере экзонов 2-4 SIRPα мыши.
3. Генномодифицированная мышь по п. 1, отличающаяся тем, что генномодифицированная мышь является гетерозиготной по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
4. Генномодифицированная мышь по п. 1, отличающаяся тем, что генномодифицированная мышь является гомозиготным по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок SIRPα человека.
5. Генномодифицированная мышь по любому из пп. 1-4, отличающаяся тем, что белок SIRPα человека является функциональным фрагментом полноразмерного белка SIRPα человека.
6. Генномодифицированная мышь по п. 5, отличающаяся тем, что функциональный фрагмент содержит внеклеточный домен SIRPα человека.
7. Генномодифицированная мышь по п. 6, отличающаяся тем, что нулевая мутация в мышином гене IL-15 является делецией по меньшей мере экзонов 5-8 IL-15 мыши.
8. Генномодифицированная мышь по п. 1, отличающаяся тем, что генномодифицированная мышь является гетерозиготной по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
9. Генномодифицированная мышь по п. 1, отличающаяся тем, что генномодифицированная мышь является гомозиготной по аллелю, содержащему последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека.
10. Генномодифицированная мышь по любому из пп. 1-9, отличающаяся тем, что последовательность нуклеиновой кислоты, которая кодирует белок IL-15 человека, содержит геномную кодирующую и некодирующую последовательность IL-15 человека.
11. Генномодифицированная мышь по любому из пп. 1-10, отличающаяся тем, что белок IL-15 человека является функциональным фрагментом полноразмерного белка IL-15 человека.
12. Генномодифицированная мышь по любому из пп. 1-11, отличающаяся тем, что генномодифицированная мышь является иммунодефицитной.
13. Генномодифицированная мышь по п. 12, отличающаяся тем, что генномодифицированная мышь содержит нокаут гена Rag2.
14. Генномодифицированная мышь по п. 12 или 13, отличающаяся тем, что генномодифицированная мышь содержит нокаут гена IL2rg.
15. Генномодифицированная мышь по любому из пп. 1-14, отличающаяся тем, что генномодифицированная мышь дополнительно содержит трансплантат гемопоэтических клеток человека.
16. Генномодифицированная мышь по п. 15, отличающаяся тем, что генномодифицированная мышь инфицирована патогеном человека.
17. Генномодифицированная мышь по п. 16, отличающаяся тем, что патоген человека активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры (ПК).
18. Генномодифицированная мышь по п. 16, отличающаяся тем, что патоген человека является патогеном, который инфицирует кишечник человека.
19. Генномодифицированная мышь по п. 18, отличающаяся тем, что патоген человека представляет собой ротавирус человека.
20. Генномодифицированная мышь по п. 16, отличающаяся тем, что патоген инфицирует легкое человека.
21. Генномодифицированная мышь по п. 20, отличающаяся тем, что патоген человека является вирусом гриппа.
22. Способ получения мыши, которая экспрессирует белок IL-15 человека и белок SIRPα человека, который включает:
введение в геном первой плюрипотентной стволовой клетки мыши последовательности нуклеиновой кислоты, кодирующей белок IL-15 человека, при этом введение функционально связывает последовательность с эндогенным промотором гена IL-15 мыши в локусе гена IL-15, что приводит к нулевой мутации в гене IL-15 мыши;
получение гуманизированных IL-15 мышей из первой плюрипотентной стволовой клетки мыши, где гуманизированные мыши включают нулевую мутацию в гене мыши IL-15, а последовательность, кодирующая белок IL-15 человека, функционально связана с эндогенным промотором IL-15 в локусе гена мыши IL-15, где гуманизированные IL-15 мыши экспрессируют белок IL-15 человека;
введение в геном второй плюрипотентной стволовой клетки мыши последовательности нуклеиновой кислоты, кодирующей белок SIRPα человека, при этом введение функционально связывает последовательность с эндогенным промотором гена SIRPα мыши в локусе гена SIRPα, что приводит к нулевой мутации в гене SIRPα мыши;
получение гуманизированных SIRP мышей из второй плюрипотентной стволовой клетки мыши, где гуманизированные SIRPα мыши включают нулевую мутацию в гене мыши, а последовательность, кодирующая белок SIRPα человека, функционально связана с эндогенным промотором гена SIRPα мыши в локусе гена мыши, где гуманизированные SIRPα мыши экспрессируют белок SIRP человека;
скрещивание гуманизированной IL-15 мыши, полученных гуманизированных мышей IL-15 с гуманизированной SIRPα мышью, полученных гуманизированных мышей SIRPα для получения мыши, экспрессирующей белок IL-15 человека и белок SIRPα человека, где мышь, экспрессирующая белок IL-15 человека и белок SIRPα человека, включает:
нулевую мутацию в гене IL-15 мыши в локусе гена IL-15 мыши и последовательность нуклеиновой кислоты, включенную в геном генетически модифицированной мыши, которая кодирует белок IL-15 человека и функционально связана с эндогенным промотором гена IL-15 мыши в локусе гена IL-15 мыши; и
нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, включенную в геном генетически модифицированной мыши, которая кодирует белок SIRPα человека и функционально связана с эндогенным промотором гена SIRPα в локусе гена SIRPα мыши.
23. Способ приживления гемопоэтических клеток человека у генномодифицированной мыши по любому из пп. 1-21, который включает:
получение генномодифицированной мыши способом по п. 22 и
трансплантацию популяции клеток, содержащей гемопоэтические клетки человека, полученной генномодифицированной мыши.
24. Способ по п. 23, отличающийся тем, что трансплантация включает инъекцию в хвостовую вену, инъекцию в печень плода или ретроорбитальную инъекцию.
25. Способ по п. 23 или 24, отличающийся тем, что генномодифицированную мышь перед трансплантацией подвергают облучению сублетальными дозами.
26. Способ по любому из пп. 23-25, отличающийся тем, что гемопоэтические клетки человека являются клетками CD34+.
27. Способ по любому из пп. 23-25, отличающийся тем, что гемопоэтические клетки человека получены из печени плода, костного мозга взрослого человека или пуповинной крови.
28. Генномодифицированная мышь, которая содержит:
нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного гена SIRPα в локусе гена SIRPα; и
нулевую мутацию в гене мышиного IL-15 и последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного мышиного гена IL-15 в локусе гена IL-15 мыши; и
трансплантат гемопоэтических клеток человека, причем генномодифицированная мышь (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в тонком кишечнике и пейеровых бляшках генномодифицированной мыши.
29. Генномодифицированная мышь по п. 28, отличающаяся тем, что генномодифицированная мышь инфицировано патогеном человека.
30. Генномодифицированная мышь по п. 29, отличающаяся тем, что патоген человека является кишечным патогеном.
31. Генномодифицированная мышь по п. 30, отличающаяся тем, что кишечный патоген выбран из: Campylobacter jejuni, Clostridium difficile, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, ротавируса человека, Listeria monocytogenes, вируса Норуолка, Salmonella enterica, Shigella flexneri, Shigella sonnei, Shigella dysenteriae, Yersinia pestis, Yersinia enterocolitica и Helicobacter pylori.
32. Генномодифицированная мышь, которая содержит:
нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного гена SIRPα в локусе гена SIRPα; и
нулевую мутацию в гене мышиного IL-15 и последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного мышиного гена IL-15 в локусе гена IL-15 мыши
; и
трансплантат гемопоэтических клеток человека, причем генномодифицированная мышь (i) экспрессирует белок SIRPα человека и белок IL-15 человека, и (ii) содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в легком генномодифицированной мыши.
33. Генномодифицированная мышь по п. 32, отличающаяся тем, что генномодифицированная мышь инфицирована патогеном человека.
34. Генномодифицированная мышь по п. 33, отличающаяся тем, что патоген человека является легочным патогеном.
35. Генномодифицированная мышь по п. 34, отличающаяся тем, что легочный патоген выбран из: Streptococcus pyogenes, Haemophilus influenza, Corynebacterium diphtheria, коронавируса атипичной пневмонии, Bordetella pertussis, Moraxella catarrhalis, вируса гриппа (A, B, C), коронавируса, аденовируса, респираторного синцитиального вируса, вируса парагриппа, вируса свинки, Streptococcus pneumoniae, Staphylococcus aureus, Legionella pneumophila, Klebsiella pneumoniae, Pseudomonas aeruginosa, Mycoplasma pneumonia, Mycobacterium tuberculosis, Chlamydia pneumoniae, Blastomyces dermatitidis, Cryptococcus neoformans и Aspergillus fumigatus.
36. Способ идентификации агента, подавляющего инфекцию патогеном, причем способ включает:
введение агента генномодифицированной мыши, при этом у генномодифицированная мышь включает нулевой аллель для одного или обоих из числа Rag2 и IL2rg и включает:
(i) нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, кодирующая белок SIRPα человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного гена SIRPα в локусе гена SIRPα,
(ii) нулевую мутацию в гене мышиного IL-15 и последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного мышиного гена IL-15 в локусе гена IL-15 мыши,
(iii) трансплантат гемопоэтических клеток человека, и
(iv) инфекцию патогеном, где патоген активирует, индуцирует и/или направленно действует на Т-клетки и/или природные клетки-киллеры человека, при этом генномодифицированная мышь экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, будет ли агент уменьшать количество патогена в организме инфицированной патогеном мыши, где уменьшение количества патогена идентифицирует агент, который ингибирует инфекцию патогеном.
37. Способ определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка при опосредованном ПК-клеткой уничтожении клетки-мишени, включающий:
введение потенциального терапевтического антитела или антигенсвязывающего белка генномодифицированной мыши, при этом генномодифицированная мышь включает нулевой аллель для одного или обоих из числа Rag2 и IL2rg, и:
(i) нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного гена SIRPα в локусе гена SIRPα,
(ii) нулевую мутацию в гене мышиного IL-15 и последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного мышиного гена IL-15 в локусе гена IL-15 мыши,
(iii) трансплантат гемопоэтических клеток человека, и
(iv) клетку-мишень, при этом генномодифицированная мышь экспрессирует белок SIRPα человека и белок IL-15 человека; и
определение того, будет ли потенциальное терапевтическое антитело или антигенсвязывающий белок активировать опосредованную ПК-клеткой антителозависимую клеточную цитотоксичность в отношении клетки-мишени в организме генномодифицированной мыши для определения эффективности потенциального терапевтического антитела или антигенсвязывающего белка в уничтожении ПК-клетками клетки-мишени.
38. Способ по п. 37, отличающийся тем, что клетка-мишень выбрана из группы, состоящей из опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки и паразитарной клетки.
39. Способ по п. 38, отличающийся тем, что клетка-мишень является опухолевой клеткой.
40. Способ по п. 39, отличающийся тем, что опухолевая клетка является клеткой В-клеточной лимфомы.
41. Генномодифицированная мышь, причем генномодифицированная мышь включает нулевой аллель для одного или обоих из числа Rag2 и IL2rg, и:
нулевую мутацию в гене SIRPα мыши и последовательность нуклеиновой кислоты, кодирующую белок SIRPα человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного гена SIRPα в локусе гена SIRPα;
нулевую мутацию в гене мышиного IL-15 и последовательность нуклеиновой кислоты, кодирующую белок IL-15 человека, включенную в геном генетически модифицированной мыши и функционально связанную с промотором эндогенного мышиного гена IL-15 в локусе гена IL-15 мыши; и
трансплантат гемопоэтических клеток человека, при этом генномодифицированная мышь (i) экспрессирует белок SIRPα человека и белок IL-15 человека, (ii) содержит лимфоциты человека и (iii) содержит клетку-мишень, выбранную из группы, состоящей из опухолевой клетки, инфицированной вирусом клетки, инфицированной бактерией клетки, бактериальной клетки, грибковой клетки и паразитарной клетки.
42. Генномодифицированная мышь по п. 41, отличающаяся тем, что клетка-мишень является опухолевой клеткой.
43. Генномодифицированная мышь по п. 42, отличающаяся тем, что опухолевая клетка представляет собой клетку В-клеточной лимфомы.
44. Генномодифицированная мышь по п. 41 или 42, отличающаяся тем, что генетически модифицированная мышь содержит экзогенное потенциальное терапевтическое антитело или антигенсвязывающий белок.
45. Генномодифицированная мышь по любому из пп. 41-44, отличающаяся тем, что генномодифицированная мышь содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в тонком кишечнике и пейеровых бляшках генномодифицированной мыши.
46. Генномодифицированная мышь по любому из пп. 41-45, отличающаяся тем, что генномодифицированная мышь содержит внутриэпителиальные лимфоциты (ВЭЛ) человека в легком генномодифицированной мыши.
| WO 2012040207 A2, 29.03.2012 | |||
| WO 2015042557 A1, 26.03.2015 | |||
| WO 2014071397 A2, 08.05.2014 | |||
| ANTHONY RONGVAUX et al., Development and function of human innate immune cells in a humanized mouse model, Nature Biotechnology, 2014, Vol.32, N.4, pp.364-372 | |||
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ МЫШЕЙ | 2009 |
|
RU2425880C2 |
Авторы
Даты
2020-08-24—Публикация
2016-04-12—Подача