Изобретение относится к микробиологии и биотехнологии, а именно к генетической инженерии, и может быть использовано в ветеринарной практике для выявления генетического материала (ДНК) микроорганизмов вида Listeria monocytogenes в пробах биоматериала от птицы, в кормах, образцах биоматериала от животных для диагностики заболевания, выявления микроорганизма в объектах внешней среды, а также решения научно исследовательских и практических задач по изучению эпизоотической ситуации по листериозу на сельскохозяйственных предприятиях.
Использование специфичных праймеров и зонда позволяет выявлять генетический материал микроорганизмов вида Listeria monocytogenes, обладающих фактором патогенности и вирулентности листериолизином О в исследуемых образцах методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени. Listeria monocytogenes - это аэробные, факультативно анаэробные, подвижные, полиморфные грамположительные палочки (длиной 0.5-2.0 нм; шириной 0.3-0.5 нм) с закругленными концами, спор и капсул не образуют. Микроорганизмы вызывают инфекционное заболевание - листериоз, которому подвержены человек, животные и птицы. Болезнь протекает с признаками поражения центральной нервной системы или в виде общего лихорадочного заболевания, а также в форме бессимптомного носительства. Заражение происходит чаще всего при употреблении пищи зараженной листериями.
В настоящее время род Listeria насчитывает 16 видов, однако особо опасным для человека и животных является Listeria monocytogenes, так как она обладает фактором патогенности - листериолизином О (за это отвечает ген холестерин-зависимого цитолизина - ген hly), который необходим для выхода фагосом в цитоплазму и является основным фактором вирулентности. (Cossart, P. The listeriolysin О gene: a chromosomal locus crucial for the virulence of Listeria monocytogenes / P. Cossart // Infection. - 1988/ - №16, Suppl 2. C. 157-159.).
Источником листерий могут являться больные животные и люди, в том числе носители. Большую роль в распространении играют грызуны, птицы, членистоногие, в том числе насекомые (мухи, слепни). Листерий устойчивы во внешней среде и обладают высокими адаптационными способностями, благодаря чему очаги листериоза носят стационарный характер.
В условиях промышленных животноводческих предприятий имеющих полный комплекс переработки, листерий могут встречаться и размножаться на всех этапах - от цехов содержания животных и птиц, до помещений для убоя животных, цехов переработки и получения готовой продукции, а также этапов упаковки и транспортировки готовой продукции.
Листерий сохраняются в почве до 12 дней, в несменяемой подстилке до 30 дней. При низких температурах в почве, воде, соломе, зерне листерий могут сохраняться до нескольких лет. Кроме того, листерий могут активно размножаться в мясе, после забоя животных, на мясной продукции проходящей разные стадии производственного процесса, в условиях хранения при температурах 4-6°С, на технологических поверхностях оборудования и инвентаря, а также в отходах производства и местах их накопления.
Таким образом, профилактика листериоза, на предприятиях представляет собой систему мер по контролю на всех этапах производства. Важным этапом этих мероприятий является выявление листерий в биологических образцах и санитарных смывах.
В настоящее время выявление листерий основано на бактериологических исследованиях методом посева проб биоматериала на питательные среды. Процесс состоит из двух этапов - посев на жидкие питательные среды накопления и с последующим пересевом на твердые питательные среды с дальнейшим определением морфологии колоний, микроскопией бактерий и определением биохимических свойств и факторов патогенности на лабораторных животных (белых мышах) (ГОСТ 32031-2012 Продукты пищевые. Методы выявления бактерий Listeria monocytogenes. - Москва: Стандартинформ, 2014. - 26 с.).
Альтернативой этапу пересева на твердые питательные среды, с последующим выявлением листерий биохимическими методами является выявление ДНК микроорганизмов методом полимеразной цепной реакции.
Использование ПНР обладает рядом преимуществ так как, повышает точность и сокращает сроки выявления листерий.
Известными аналогами являются ПЦР-тест системы для детекции листерий: ВАХ System PCR assay for L. Monocytogenes, BAX System PCR assay for L. monocytogenes 24E; TaqMan Listeria monocytogenes Detection Kit и PrepMan Ultra Sample Preparation Reagent; Foodproof Listeria
monocytogenes Detection Kit, 5'nuclease, российские аналоги производства «Интерлабсервис» (Набор реагентов для определения ДНК Listeria monocytogenes в биологическом материале методом полимеразной цепной реакции (ПЦР) "АмплиСенс® Listeria monocytogenes-скрин/монитор-FL"); Генлаб (Листерия моноцитогенес, Листерия специес); IDS (Листериоз (Listeria monocytogenes) - тест-система ПЦР «Ветскрин. ЛИСТЕРОПОЛ» в режиме реального времени и другие.
Наиболее близким аналогом (прототипом) является ПЦР-тест система для выявления Listeria monocytogenes «Ветскрин. ЛИСТЕРОПОЛ» в режиме реального времени.
Однако посредством вышеперечисленных тест систем (аналогов и прототипа) невозможно выявить фактор патогенности и вирулентности листерий - листериолизин О.
Технической задачей являлась подбор олигонуклеотидных праймеров и зонда для идентификации генетического материала Listeria monocytogenes в жидких питательных средах, мазках и отпечатках с твердых питательных сред, пробах биоматериала, методом ПЦР с использованием гибридизационно-флуоресцентной детекции в режиме реального времени.
Сущность изобретения заключается в том, что подобраны и синтезированы синтетические олигонуклеотидные праймеры и зонд для выявления патогенных микроорганизмов вида Listeria monocytogenes, согласно изобретению, праймеры имеют нуклеотидные последовательности:
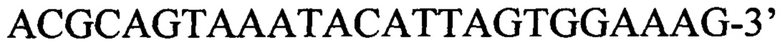 и
и 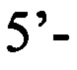
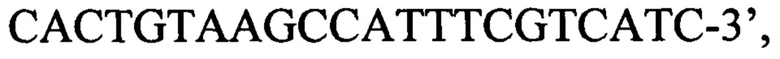 зонд имеет нуклеотидную последовательность
зонд имеет нуклеотидную последовательность 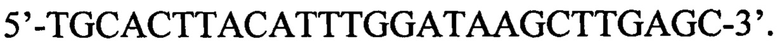
Сущность изобретения заключается в том, что в способе выявления патогенных микроорганизмов вида Listeria monocytogenes в пробах биоматериала, в пробах кормов, в объектах внешней среды, включающий проведение полимеразной цепной реакции в режиме реального времени, согласно изобретению, используют синтетические олигонуклеотидные праймеры: 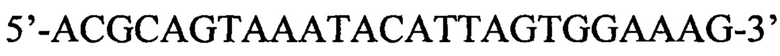 и
и 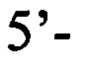
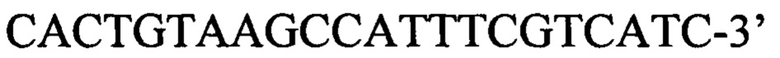 и зонд с нуклеотидной последовательностью
и зонд с нуклеотидной последовательностью 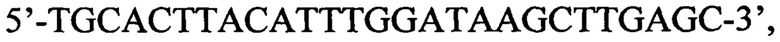 полимеразную цепную реакцию проводят в один раунд, при получении фрагмента соответствующего размеру 102 п.н. и соответствующего сигнала флуоресценции выявляют наличие патогенных микроорганизмов вида Listeria monocytogenes.
полимеразную цепную реакцию проводят в один раунд, при получении фрагмента соответствующего размеру 102 п.н. и соответствующего сигнала флуоресценции выявляют наличие патогенных микроорганизмов вида Listeria monocytogenes.
Пример 1. Получение синтетических олигонуклеотидных праймеров.
Поиск новых синтетических олигонуклеотидных праймеров для выявления микроорганизмов рода Listeria monocytogenes осуществляли на основании анализа нуклеотидных последовательностей микроорганизма Listeria monocytogenes из базы данных NCBI (https://www.ncbi.nlm.nih.gov). Анализ свойств олигонуклеотидных праймеров и зондов проводился с использованием программ «Primer-BLAST».
Для идентификации генетического материала методом ПЦР были подобраны праймеры и зонд, представленные в таблице 1.
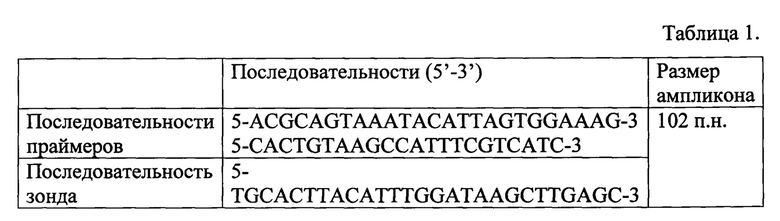
Пример 2. Способ выявления патогенных вариантов бактерии Listeria monocytogenes с помощью синтетических олигонуклеотидных праймеров в ПЦР в режиме реального времени.
Способ осуществляется в несколько этапов.
Этап 1. Выделение Listeria monocytogenes из проб биологического материала.
Данным методом исследования можно производить выделение микроорганизма из образцов:
1. Корм. Отбор проб для бактериологического исследования производится согласно ГОСТ 13496.0, ГОСТ 13586.3, ГОСТ 13979.0.
2. Патологический материал. Масса отбираемой пробы должна быть не менее 25 г. Пробу необходимо отбирать из наиболее кровоснабженных тканей (бедро, сердце, печень). Патологический материал для бактериологического исследования берут от животных и птицы не позднее 2 ч после их гибели. Клинический материал необходимо отбирать с соблюдениями правил асептики и антисептики.
3. Вода. Отбор проб воды осуществляют по ГОСТ 31861-2012.
Для работы используют следующие питательные среды: Бульон Фразера полуконцентрированный, Питательный бульон для выделения и культивирования листерий (ПБЛ I).
Подготовленную для исследований пробу вносят в пробирку с жидкой селективной питательной средой из соотношения проба/среда 25 г/250 см3. Культивируют в термостате при 37°С в течении 18-24 ч.
По завершению культивирования на жидких питательных средах посевной материал пересевают на плотные питательные среды (Агар Оттавиани и Агости (ALOA), Бриллианс Listeria monocytogenes агар (BRILLIANCE LISTERIA MONOCYTOGENE Sagar), Оксфорд агар, Палкам агар, Питательный агар для выделения листерий (ПАЛ). Пересев выполняют микробиологической петлей, так, чтобы получить изолированные колонии.
Засеянные чашки Петри культивируют вверх дном в термостате при 37°С в течении 24-48 ч. По завершению культивирования осматривают чашки Петри на наличие специфичных для листерий колоний.
Этап 2. Выделение ДНК.
На жидких питательных средах выделение ДНК проводиться после первичного наращивания. Для этого отбирается по 20 см3 взвеси бактериальной массы и бульона в подготовленные для исследований пробирки. Центрифугируются при 8000 об/мин в течение 10 минут.Осторожно сливается надосадочная жидкость. К осадку добавляется 1-5 см3 (в зависимости от объема осадка) физиологического раствора. Полученная проба готова для выделения ДНК.
Из биоматериала отобранного из органов и тканей вырезают кусочки размером 1×1 см, растирают в отдельных фарфоровых ступках со стерильным песком пестиком, добавляют 5-10 мл стерильного физиологического раствора и тщательно перемешивают. Смесь переносят в пластиковые пробирки емкостью 1,5 мл, центрифугируют при 10×103 об/мин в течение 5 минут. Для выделения ДНК используют 100 мкл осветленной надосадочной жидкости.
Процедуру выделения ДНК из исследуемого материала проводили с использованием набора реагентов ДНК-сорб В, производство Интерлабсервис, в соответствии с инструкцией по применению.
Этап 3. Амплификация участка ДНК Listeria monocytogenes, кодирующего участок гена hly.
Условия проведения амплификации оптимизировались по следующим параметрам: концентрация праймеров и зондов в реакционной смеси; температура отжига праймеров.
Оптимизированный состав реакционной смеси включал следующие компоненты: «SE-буфер Hot Start Taq ДНК Полимераза» (10 кратный буфер, производства ООО "СибЭнзим", Россия) в конечной концентрации 1:10; 0,5 тМ раствор дезоксинуклеотидтрифосфатов (dNTP) - конечная концентрация каждого 0,4 mM; смесь праймеров - конечная концентрация каждого 0,15 mM; зонд - конечная концентрация 0,2 mM; «Hot Start Taq ДНК полимераза» (10 кратный буфер, производства ООО "СибЭнзим", Россия) - конечная концентрация 1,0 е.а; вода для ПЦР. Общий объем реакционной смеси составлял 25 мкл.
ПЦР в режиме реального времени проводили в реакционной смеси следующего состава (таблица 2):
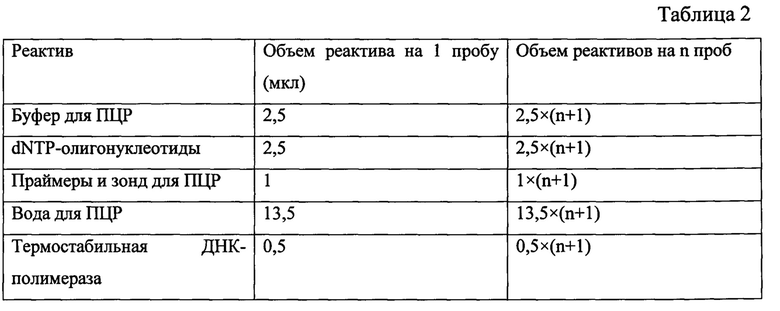
Полученную реакционную смесь разносят в планшет для проведения ПЦР по 20 мкл. Затем вносят пробы ДНК по 5 мкл. Пробы вносят аккуратно, не допуская контаминации соседних лунок, наконечники для пипеток должны быть снабжены фильтрами и индивидуальны для каждой пробы. Планшет заклеивается специальной клейкой пленкой и помешается в амплификатор.
ПЦР в режиме реального времени проводили в приборе, используя следующие параметры амплификации (таблица 3).

Учет реакции проводится на основании графиков флуоресценции. На рисунке 1 изображены графики, иллюстрирующие положительные и отрицательные реакции. Два восходящих графика - это графики накопления ДНК, специфичных для бактерий рода Listeria monocytogenes, пороговый цикл в данном случае равен 23, остальные графики на рисунке 1 лежат ниже значений порогового цикла такие реакции считаются отрицательными.
Пример 3. Проверка аналитической чувствительности и специфичности ПЦР на ген hly.
Для определения аналитической чувствительности предложенной ПЦР в режиме реального времени для детекции листериоза на первом этапе был наработан специфический ампликон, соответствующий гену hly, кодирующему листериолизин О.
Аналитическую чувствительность метода определяли постановкой ПЦР в режиме реального времени, где в качестве исследуемых образцов использовались 10-кратные разведения положительного контрольного образца. Результаты определения аналитической активности приведены в таблице 4.

За аналитическую чувствительность принимали последнее разведение ПКО, с которым результат ПЦР-анализа интерпретировался как положительный. Положительными считались образцы со значением Ct не превышающим 40.
В результате проведенных испытаний была выявлена минимальная концентрация ДНК при которой визуализируется специфический ампликон равный 1 копиям на реакцию (200 копий/см3).
Для подтверждения специфичности полученного фрагмента ДНК определяли его нуклеотидную последовательность, которую сравнивали с последовательностями базы данных NCBI BLAST (http://www.ncbi.nlm.nih.gov). Данный фрагмент ДНК, использованный для получения ПКО, являлся целевым и соответствовал участку гена hly, кодирующий листериолизин О, микроорганизма Listeria monocytogenes.
Результаты опытов по определению специфичности реакции по заявленному способу представленных в таблице 5.
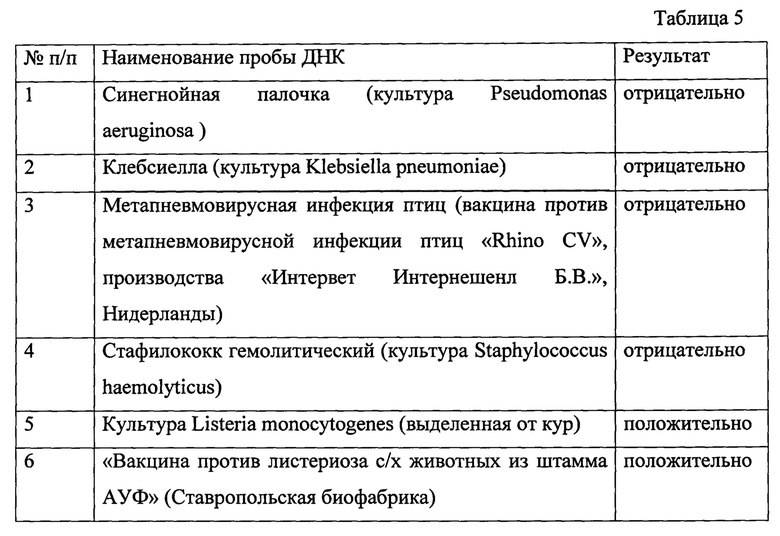
Таким образом, заявленный способ обладает высокой специфичностью при выявлении ДНК микроорганизма Listeria monocytogenes.
Пример 4. Сравнение эффективности разработанного метода перед стандартной методикой определения патогенности выделенных культур.
Преимущества разработанного метода перед стандартной методикой представлены в таблице 6.
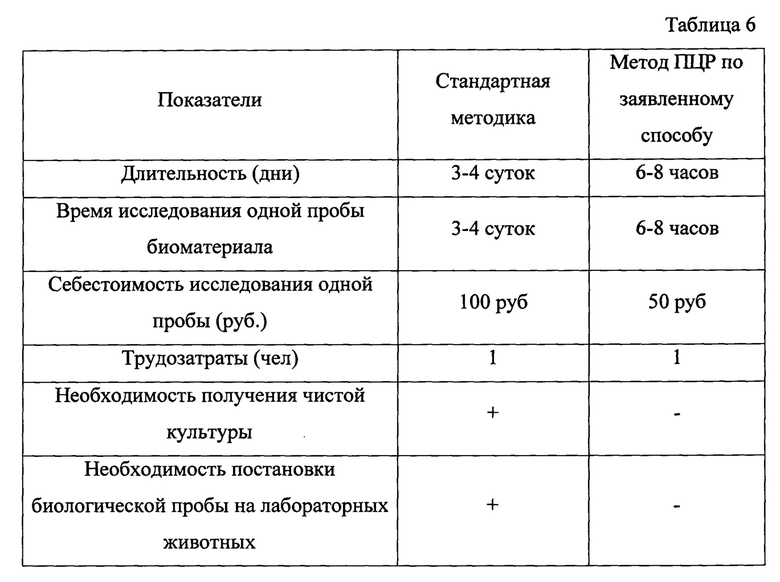
Таким образом, предлагаемый нами способ позволяет проводить эффективное выделение патогенных штаммов и изолятов бактерии вида Listeria monocytogenes на ранних стадиях культивирования, а также сократить сроки проведения исследований до одного рабочего дня (6-8 часов), снизить себестоимость диагностики в два раза, исключить необходимость выделения чистой культуры.
Пример 5. Использование разработанного метода в лабораторной практике.
Диагностика листериоза должна производиться комплексно, и складываться из микробиологических исследований, ПЦР, эпизоотического анализа.
Результаты опытов по определению эффективности реакции при исследовании проб биоматериал от птицы скота по заявленному способу представлены в таблице 7.
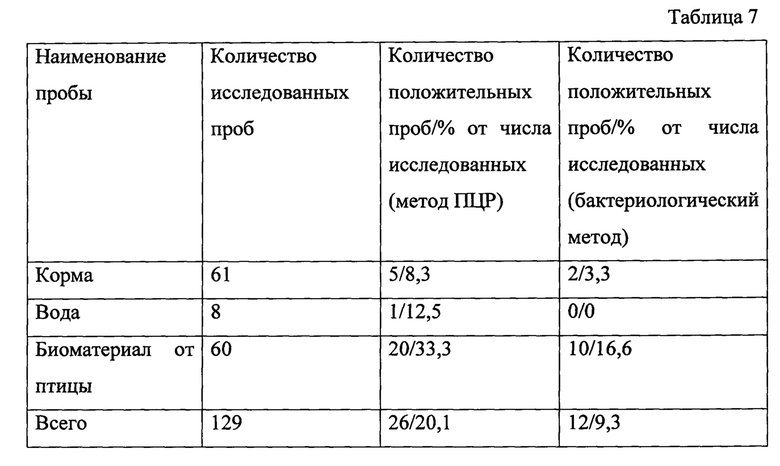
По заявленному способу количество положительных проб, исследуемых
методом ПЦР составило 20,1%, а бактериологическим методом 9,3%.
Для подтверждения специфичности полученных фрагментов ДНК определяли их нуклеотидную последовательность как описано в примере 1. Результаты секвенирования показали, что все полученные ампликоны соответствуют исследованному участку гена hly микроорганизма Listeria monocytogenes.
Таким образом, предлагаемый способ обладает высокой чувствительностью (1 копия на реакцию), специфичностью и эффективностью при выявлении ДНК Listeria monocytogenes в образцах биологического материала от птицы, кормов, воды.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ГЕНОВ, ДЕТЕРМИНИРУЮЩИХ АДГЕЗИНЫ, ГЕМОЛИЗИНЫ, МАННОЗА-РЕЗИСТЕНТНЫЕ ГЕМАГГЛЮТИНИНЫ У ГЕНИТАЛЬНЫХ ШТАММОВ Escherichia coli | 2012 |
|
RU2483114C1 |
| Система олигонуклеотидных праймеров и зонда для выявления ДНК Mycoplasma bovigenitalium | 2019 |
|
RU2732626C1 |
| Способ дифференциации Listeria monocytogenes от других видов Listeria spp. методом дот-блоттинга с использованием конъюгированных антител против фактора патогенности InlB | 2023 |
|
RU2812147C1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ ДНК ВИРУСА ИНФЕКЦИОННОЙ АНЕМИИ ЦЫПЛЯТ С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2011 |
|
RU2481403C1 |
| Способ выявления ДНК сальмонелл (Salmonella spp.) в биологическом материале животных, продуктах питания и кормах животного и растительного происхождения | 2018 |
|
RU2700476C1 |
| Набор олигонуклеотидных праймеров и зонда для выявления вируса герпеса крупного рогатого скота 4-го типа (BHV-4) в пробах биоматериала | 2018 |
|
RU2700750C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МИКРООРГАНИЗМОВ РОДА Pasteurella И/ИЛИ Pseudomonas aeruginosa | 2008 |
|
RU2391409C1 |
| Тест-система для выявления РНК вируса болезни Шмалленберга у сельскохозяйственных животных | 2018 |
|
RU2694719C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ПАТОГЕННЫХ ШТАММОВ И ИЗОЛЯТОВ БАКТЕРИИ PASTEURELLA MULTOCIDA | 2012 |
|
RU2477321C1 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда к фрагменту ДНК гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales (Ureaplasma spp.) класса Mollicutes для детекции патогенных уреаплазм кошек и собак | 2022 |
|
RU2799416C1 |


Изобретение относится к области биотехнологии, в частности к генетической инженерии, и может быть использовано в ветеринарной практике для выявления генетического материала (ДНК) микроорганизмов Listeria monocytogenes в пробах биоматериала от птицы, в кормах, образцах биоматериала от животных, смывах с поверхностей, а также для решения научно-исследовательских задач по изучению свойств возбудителя, изучения его роли при обеспечении ветеринарно-санитарных мероприятий на промышленных птицеводческих предприятиях, по оценке эффективности моющих и дезинфицирующих препаратов. Использование специфичных праймеров и зонда позволяет выявлять генетический материал микроорганизма Listeria monocytogenes в исследуемых образцах методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени. Изобретение позволяет идентифицировать генетический материал микроорганизма Listeria monocytogenes с использованием гибридизационно-флуоресцентной детекции в режиме реального времени в пробах жидких питательных сред предварительного накопления. 2 н.п. ф-лы, 1 ил., 7 табл., 2 пр.
1. Набор для выявления патогенных микроорганизмов вида Listeria monocytogenes, включающий синтетические олигонуклеотидные праймеры и зонд, отличающийся тем, что праймеры имеют нуклеотидные последовательности: 5'-ACGCAGTAAATACATTAGTGGAAAG-3' и 5'-CACTGTAAGCCATTTCGTCATC-3', зонд имеет нуклеотидную последовательность 5'-TGCACTTACATTTGGATAAGCTTGAGC-3'.
2. Способ выявления патогенных микроорганизмов вида Listeria monocytogenes в пробах биоматериала, в пробах кормов, в объектах внешней среды, включающий проведение полимеразной цепной реакции в режиме реального времени, отличающийся тем, что используют синтетические олигонуклеотидные праймеры: 5'-ACGCAGTAAATACATTAGTGGAAAG-3' и 5'-CACTGTAAGCCATTTCGTCATC-3' и зонд с нуклеотидной последовательностью 5'-TGCACTTACATTTGGATAAGCTTGAGC-3', полимеразную цепную реакцию проводят в один раунд, при получении фрагмента соответствующего размеру 102 п.н. и соответствующего сигнала флуоресценции выявляют наличие патогенных микроорганизмов вида Listeria monocytogenes.
| ВАСИЛЬЕВ Д.А | |||
| и др | |||
| Разработка системы молекулярно-генетической детекции бактерий видов Listeria monocytogenes и Lieteria ivanovii, Вестник ульяновской государственной сельскохозяйственной академии, 2014, (45) с.43-46 | |||
| ALBAN LE MONNIER, et al, Diagnosis of Listeria monocytogenes meningoencephalitis by real-time PCR for the hly gene, jof clinical |
Авторы
Даты
2020-08-24—Публикация
2019-10-30—Подача