Область техники
Изобретение относится к области биотехнологии и микробиологии и касается способа идентификации Listeria monocytogenes методом дот-блоттинга. Изобретение позволяет дифференцировать колонии Listeria monocytogenes от других микроорганизмов и представителей рода Listeria и может быть использовано для санитарно-эпидемиологического контроля зараженности продуктов.
Уровень техники
Тема микробиологической безопасности пищевых продуктов активно изучается на протяжении нескольких десятков лет. В последние годы, стандарты пищевой безопасности стали значительно строже во многих странах (Van Kreijl et al., 2006). Среди многих патогенных и потенциально патогенных бактерий, вызывающих пищевые токсикоинфекции, особое внимание привлекают грамотрицательные микроорганизмы Yersiniaspp., Salmonelaspp., Shigellaspp., а из грамположительных бактерий - Listeria spp.
Род Listeria состоит из семнадцати видов, среди которых толькоштаммы вида L. monocytogenes являются патогенными для человека, в частности для людей с ослабленной иммунной системой, а также для пожилых людей и беременных женщин(Vázquez-Boland et al., 2001). Клинически генерализованный листериоз, чаще всего проявляется бактериемией, менингитом или менингоэнцефалитом, а также инфекциями, связанными с беременностью, проявляющимися выкидышем или неонатальным сепсисом. Инвазивный листериоз опасен для жизни и является основной причиной болезней пищевого происхождения, приводящих к госпитализации в европейских странах (Koopmans et al., 2022). Заражение листериозом часто вызывается употреблением контаминированных пищевых продуктов, в частности,мягких сыров, мяса и овощей.
Поскольку вид Listeria monocytogenes является единственным патогенным для человека представителем рода Listeria, необходимо четко дифференцировать этот вид от близкородственных. Известно о разнообразных способах обнаружения L. monocytogenes. Традиционные методы обнаружения L. monocytogenes включают предварительное концентрирование и последующее выделение колоний на селективных средах (Lovettetal., 1987; McClainandLee, 1988). Отдельные колонии исследуют на предмет их морфологии, с последующей биохимической или серологическойидентификацией. Анализ может занимать до 6-8 дней. В настоящее время традиционным методом обнаружения L. monocytogenes в продуктах является метод культивирования, который включает: (1) добавление первичного и вторичного обогащения к образцу; (2) серию биохимических тестов, которые различают различные виды листерий. При этом многочисленные сходства L. monocytogenes с L. innocua и другими непатогенными видами листерий делают обнаружение L. monocytogenes в образцах пищевых продуктов очень сложной задачей. Селективные среды, такие как PALCAM или Оксфорд агар, не являются специфичными для L. monocytogenes, поскольку они также поддерживают рост других видов Listeria и некоторых других родов бактерий. Известен способ дифференциации L. monocytogenesc (RU 2196827 C1), заключающийся в определении гидролиза лецитина на питательной среде, с добавлением и без добавления активированного угля. В 100 мл среды ГРМ-1 (Оболенск) добавляют 5 мл 10% суспензии желтка яичного яйца в физиологическом растворе и определяют гидролиз лецитина без дополнительных добавок и в присутствии 0,5% активированного угля. L. monocytogenes показывает гидролитическую активность в отношении лецитина только в присутствии активированного угля в отличие от других видов листерий Несмотря на относительную быстроту и дешевизну, данный метод требует выделения чистой культуры с последующим пересевом на специфическую среду и инкубацией в течение 48 часов для получения результата. Известен более быстрый метод (RU 2444567 C1), который также основан на лецитиназной активности и занимает 16-18 часов, однако также требует предварительного выделения чистой культуры микроорганизмов. Поскольку легко портящиеся пищевые продукты часто контаминируются L. monocytogenes, возникла необходимость в разработке экспресс-методов обнаружения L. monocytogenes. Среди существующих техник известны методы, основанные на ПЦР и MALDI-TOF, которые обеспечивают наилучший вариант для дифференциации Listeria spp. Однако эти методы являются дорогостоящими и требуют специализированного оборудования. Существуют методы идентификации L. Monocytogenes с использованием олигонуклеотидных зондов, при этом детекцию осуществляют путем прямой гибридизации зондов со специфичной для микроба ДНК или РНК (Datta et al., 1987), (RU2730658). Недостатком этих методов является низкая чувствительность, поскольку требуется по меньшей мере 105 - 106 копий целевой нуклеиновой кислоты. Это может быть компенсировано комбинацией с амплификацией последовательности-мишени, например, с использованием полимеразной цепной реакции (ПЦР). Множество методов ПЦР для выявления L. monocytogenes были описаны в литературе (Norton, 2002) (патенты US4683195; US4683202 и US4965188). Кроме того, лигазная цепная реакция (патент WO 89/09835), самоподдерживающаяся репликация последовательностей (ЕР 329822), система амплификации на основе транскрипции (ЕР 310229). Однако все эти методы требуют специфического оборудования, а также наличие нуклеиновых кислот в образцах не всегда соответствуют наличию жизнеспособных возбудителей.
Еще одним подходом для идентификации L. monocytogenes от близкородственных видов является использование иммунологических методов, основанных на реакции антиген-антитело. Иммунологические методы обнаружения, описанные для L. monocytogenes, основаны, главным образом, на тех мишенях, которые играют роль в патогенности L. monocytogenes. Известно, что некоторые из этих генов расположены на хромосоме рядом друг с другом в островках патогенности. Поскольку листериолизин О (ген hlyA) был впервые описан как необходимый для патогенности, то большинство методов генотипической детекции основаны на этом гене. Также использованы антитела против p60 в разных форматах ИФА-тест систем (Yu et al., 2004) (CN105527441A, CN104099299A), дот-блоттинга (Wi̧ckowska -Szakiel et al., 2002; Yu et al., 2004) и ПЦР (Патент US5932415). Некоторые тест-наборы для выявления с помощью антител уже имеются в продаже. Однако большинство из этих тестов демонстрируют низкую чувствительность и специфичность. В обзоре (BanadaandBhunia, 2008) (Banada&Bhunia, 2008) описаны некоторые из них. Известно использование антител против белка InlB и ActA в комбинации с иммуномагнитными шариками (CN114574448A) или в иммуноблотинге (Lathrop et al., 2008).Однако при выращивании в стандартных средах, InlB и ActA продуцируется на низком уровне, поэтому использующие антитела против InlB наборы имеют низкую чувствительность. Другие иммунологические методы, часто ограничены разделением антигенов клеточной поверхности с другими видами Listeriaspp., что не позволяет дифференцировать L. monocytogenes от непатогенных видов, часто встречающихся в образцах пищевых продуктов.
Таким образом в уровне техники существует потребность в разработке нового экспресс-метода идентификации L. monocytogenes, который будет лишен указанных недостатков. Новый метод идентификации направлен на устранение этапов накопления и выделения чистой культуры, которые занимают несколько дней, характеризуется относительной дешевизной, а также обеспечивает чувствительность и специфичности по отношению к штаммам L. Monocytogenes. В предлагаемом методе дифференциации традиционные микробиологические методы, характеризующиеся надежностью, сочетаются с иммунологическим анализом, предоставляющем специфичность. При этом мишенями для иммунологического анализа являются поверхностные белки, отсутствующие у других видов Listeria spp. Специфические поверхностные белки L. monocytogenes, отсутствующие у других видов Listeria, в основном представлены факторами вирулентности. Поверхностный белок интерналин В (InlB), является фактором вирулентности, опосредующим бактериальную инвазию в непрофессиональные фагоциты, и отсутствует у других видов Listeria. InlB представляет собой секретируемый белок, который может быть закреплен на поверхности клетки посредством нековалентных взаимодействий его С-концевые GW-доменов с тейхоевыми кислотами клеточной стенки (Braun et al., 1997). Как и многие другие факторы вирулентности L. monocytogenes, ген InlB, является частью островка патогенности, контролируемого главным регулятором PrfA(delasHerasetal., 2011). Активность PrfA снижается при культивировании L. monocytogenes на богатой среде, если только среда не дополнена активированным углем или другим гидрофобным адсорбентом. Гидрофобные адсорбенты активируют PrfA и индуцируют экспрессию PrfA-контролируемых факторов вирулентности, включая InlB (Ermolaevaetal., 2004; Krypotouetal., 2019).
Раскрытие сущности изобретения
Технической задачей заявленного изобретения недорого и быстрого способа идентификации L. Monocytogenes.
Технический результат заключается в создании способа дифференциации L. monocytogenes от других видов Listeria spp. методом дот-блоттинга, который позволяет получить результат через 12-26 часов от поступления образцов продуктов питания в лабораторию и не требует предварительного накопления и выделения чистой культуры и примени.
Указанный технический результат достигается тем, что создан способ дифференциации культуры Listeria monocytogenes от других видов Listeria spp., включающий в себя выращивание испытуемых бактерий на твердой питательной среде, содержащей активированный уголь, получение отпечатка колоний на нитроцеллюлозную мембрану, последующую фиксацию мембраны в хлороформе, инкубацию с поликлональными моноспецифическими антителами против интерналина В, конъюгированными с пероксидазой и визуализацию активности в присутствии субстрата. При этом в твердую питательную среду сердечно-мозгового экстракта для выращивания бактерий добавлено 0,02% активированного угля. Кроме того качестве пероксидазы использована пероксидаза хрена (HRP).
Кроме того указанный технический результат достигается тем, что разработано применение способа дифференциации культуры Listeria monocytogenes от от других видов Listeria spp. для оценки обсемененности продуктов питания и клинических образцов.
Краткое описание чертежей
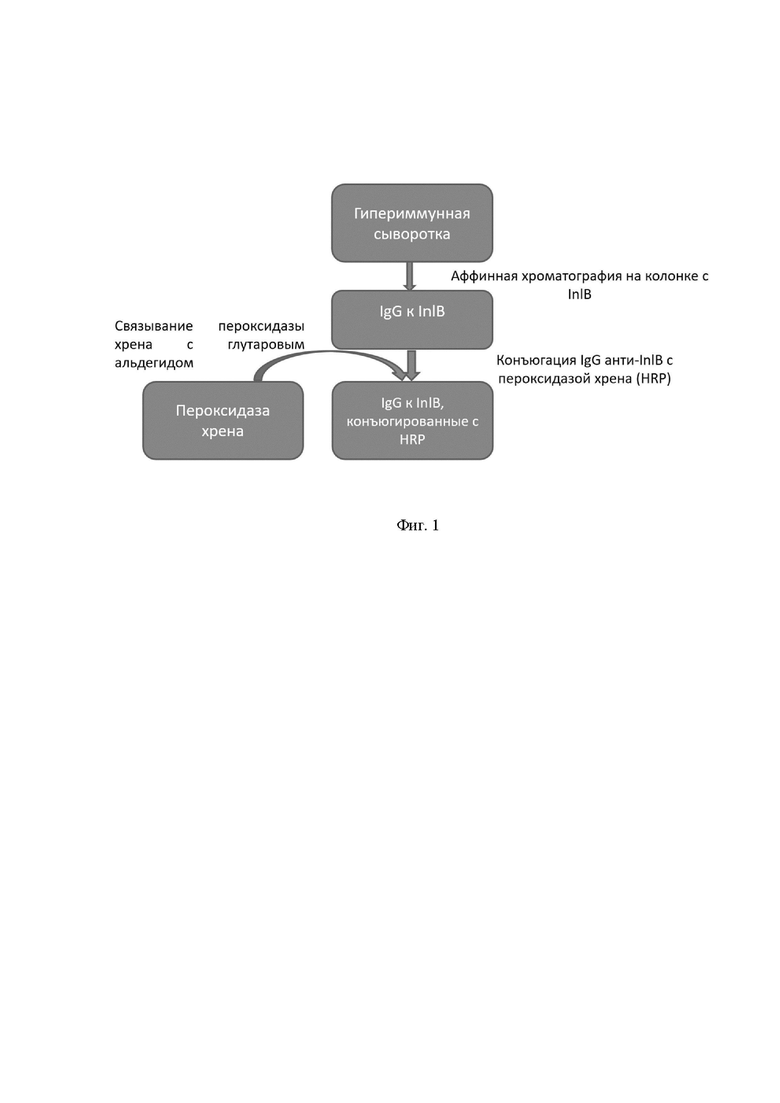
На фиг. 1 схема получения поликлональных моноспецифичных антител против InlB, конъюгированных с пероксидазой хрена.
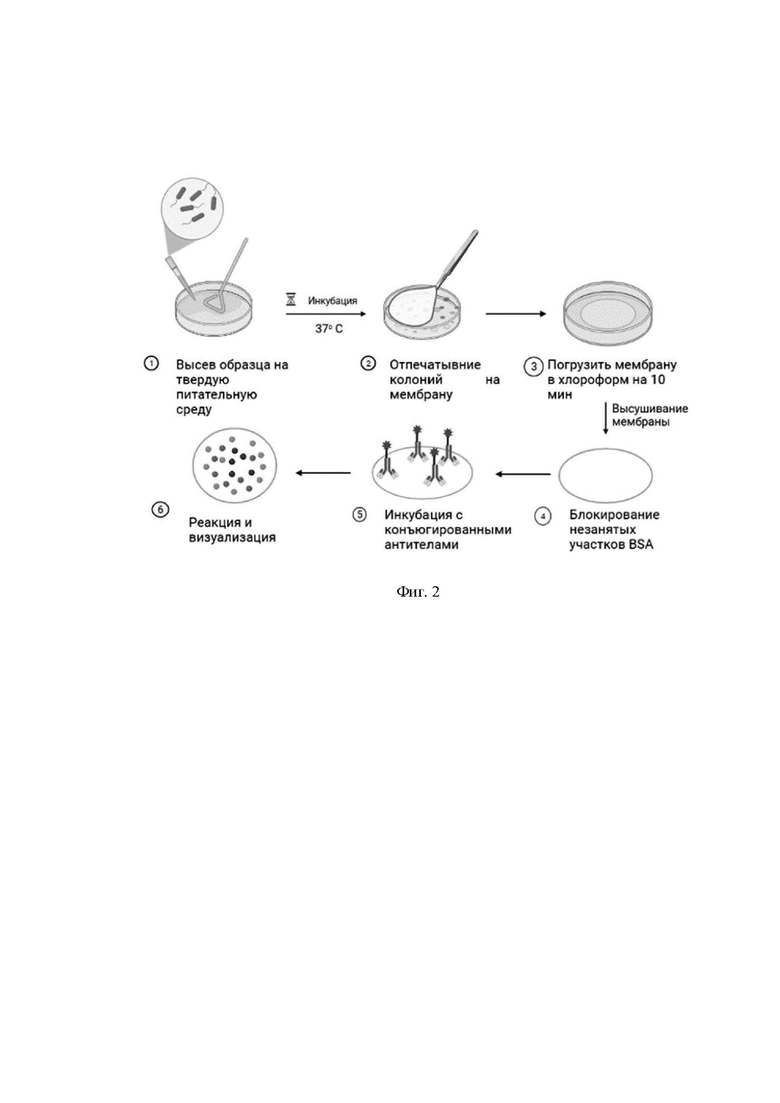
На фиг. 2 представлена схема определения Listeria monocytogenes в пищевых образцах методом дот-блоттинга.
На фиг.3 представлен дот-иммуноанализ с конъюгатом a-InlB-IgG-HRP (очищенные InlB-специфические IgG, конъюгированные HRP).
А - отпечатки мембран колоний L. monocytogenes EGDe, выращенных на агаре BHI (с добавлением 0,2 % угля);
Б - дот-иммуноанализ мембраны с конъюгатом a-InlB-IgG-HRP.
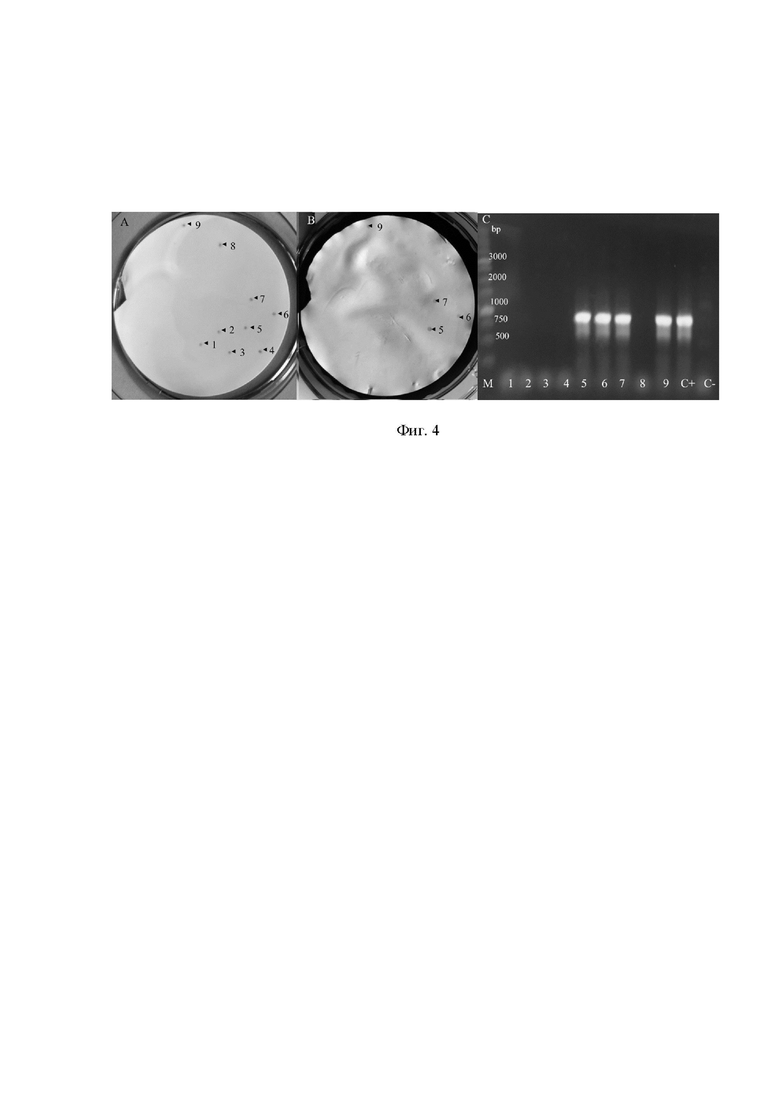
На фиг. 4 представлена проверка результатов дот-блоттинга.
L. monocytogenes EGDe и L. innocua SLCC 3379 взяты в соотношении 1:1 и выращены на агаре BHIC в течение 24 ч. Отпечатанные колонии отбирали перед отмывкой, затем мембрану обрабатывали конъюгатом a-InlB-IgG-HRP, как описано выше. Для идентификации L. monocytogenes была проведена ПЦР с использованием праймеров, специфичных к гену inlB.
А - отпечатки колоний, выращенных на BHIC-агаре;
Б - результаты дот-иммуноанализа перед отпечатыванием на мембране;
В - продукты ПЦР были разделены на 1 % агарозном геле, фрагмент гена inlB имеет размер 872 п.н. Цифрами обозначены отдельные колонии.
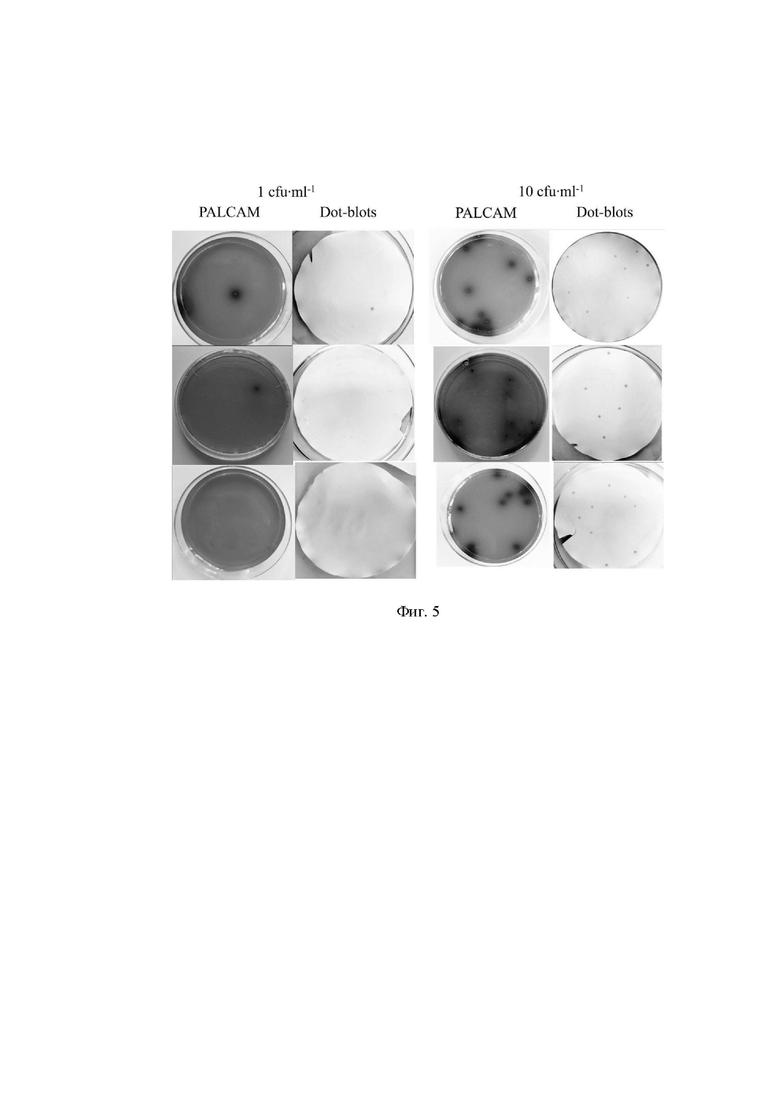
На фиг. 5 представлено обнаружение L. monocytogenes в образцах искусственно инокулированного молока.
Образцы сырого молока инокулировали L. Monocytogenes EGDe до указанных концентраций. Образцы объемом 100 мкл наносили на селективный среду PALCAM и неселективный BHIC-агар.
Принадлежность к виду L. monocytogenes была подтверждена методом ПЦР для бактерий, выращенных на агаре PALCAM, и разработанным методом дот-блот-иммуноанализа для бактерий, выращенных на агаре BHIC.
Реализация изобретения
Предлагаемый авторами способ дифференциации L. monocytogenes в пищевых продуктах заключается в следующем:
1. Производят высевы из образцов продуктов питания на твердую питательную средусердечно-мозгового экстракта, содержащую 0,02% активированного угля, что позволяет увеличить экспрессию InlB в среду и таким образом отличить патогенный вид листерий L.monocytogenes не только от бактерий другого рода, но и от непатогенных листерий, таких например, как Listeriainnocua и Listeriaivanovii.
2. Далее с твердой питательной среды делается отпечаток колоний на нитроцеллюлозную мембрану, с последующей фиксацией в хлороформе.
3. Затем нитроцеллюлозную мембрану инкубируют с поликлональными моноспецифичными антителами против InlB, конъюгированными с пероксидазой хрена (HRP).
4. Далее проводят серию отмывок для удаления избытка антител и визуализацию с использованием субстрата для пероксидары хрена (TMB).
Дот-блот с одной стороны совмещает технику иммуноблоттинга (использование мембраны в качестве носителя антигена и возможность оценить все колонии на твердой питательной среде), с другой стороны простоту иммуноферментного анализа, так как исчезает необходимость специальной подготовки образца, проведения белкового электрофореза и последующего блотирования анализируемых белковых смесей. Таким образом, применяемый метод упростит как пробоподготовку образцов, так как есть возможность анализировать сразу все колонии на твердой питательной среде, так и последующие процедуры скрининга.
Предлагаемый способ дифференциации может быть использован как независимый метод для идентификации и дифференциации Listeria monocytogenes, так и в сочетании с другими методами идентификации, например в сочетании с методами ПЦР или биохимической идентификацией.
Изобретение может быть выполнено в виде тест-системы, содержащей, специфические конъюгированные с HRP антитела против InlB.
Осуществление изобретения подтверждается примерами
Пример 1. Получение гипериммунных сывороток.
Для получения гиппериммунных сывороток в качестве антигена использовался рекомбинантный idInlB (аминокислотные остатки 36-321). Иммунизировали трех кроликов породы «Советская шиншилла» с массой порядка 3-4 кг. Первую иммунизацию проводили внутривенно (0,25 мг антигена), подкожно (0,375 мг + 0,5 мл полного адъюванта Фрейнда (ПАФ), внутримышечно в лапки (0,375 мг + 0,5 мл неполного адъюванта Фрейнда (НАФ)). Через месяц и две недели повторяли цикл иммунизации, но без внутримышечной инъекции. Через два месяца осуществляли внутривенную и внутримышечную инъекцию. Оценивали титр сывороток в иммуноферментном анализе. Схема иммунизации кроликов для получения гипериммунных сывороток с указанием количества антигена представлена в таблице 1.
Пример 2. Получение поликлональных моноспецифичных антител против InlB.
Для получения специфического иммуносорбента очищенный белок, соответствующий области интерналинового домена интерналина В(idInlB), иммобилизовали на BrCN-сефарозе ® 4B. Гипериммунную сыворотку кролика наносилина колонку симмуносорбентом. Колонку промывали фосфатно-солевым буфером с 0,3 М NaCl для удаления несвязанных примесей. InlB-специфические антитела элюировали 4,5 М MgCl2 и подвергали диализу в фосфатно-солевом буфере,рН 7,4 (PBS). Очищенные InlB-специфичные IgG-антитела растворяли до концентрации 5 мг/мл в PBS и хранили в 50% глицерине при -20°C. Схема получения отражена на фиг. 1.
Пример 3. Получение конъюгата анти-InlB IgGHRP.
В дальнейшем анти-InlB IgG конъюгировали пероксидазой хрена с использованием двухстадийного метода и глутарового альдегида в качестве сшивающего агента. 1 стадия. Связывание пероксидазы хрена с глутаровым альдегидом. 10 мг пероксидазы хрена растворяли в 0,2 мл 0,1 М фосфатного буфера, содержащего 0,15 М NaCl и 1,25% глутарового альдегида, рН 6,8, путем перемешивания в течение ночи при комнатной температуре. Избыток глутарового альдегида удаляли диализом против 0,15 М NaCl. 2 стадия. Связывание конъюгатапероксидазы хрена-глутаровый альдегид с IgG. Полученный раствор пероксидазы хрена разбавляли до 1 мл с использованием 0,15 М NaCl. Затем добавляли 1 мл раствора IgG (5 мг/мл), содержащего 0,15 М NaCl и 0,1 мл 1 М карбонатного буфера, рН 9,5. Смесь инкубировали при 4 °C в течение 24 часов, затем добавляли 0,1 мл 0,2 М раствора лизина для остановки реакции. Смесь инкубировали в течение 2 часов при комнатной температуре и диализовалив течение ночи против PBS. Конъюгат a-InlB-IgG - пероксидазы хрена (a-InlB-IgG-HRP) осаждали эквивалентным объемом насыщенного раствора NH4(SO4)2 и растворяли в 1 мл фосфатного буфера. Раствор подвергали диализу против фосфатно-солевого буфера (PBS). Отдиализованный раствор центрифугировали при 10000 g в течение 30 мин, удаляли осадок, добавляли БСА доконцентрации 1% и фильтровали через фильтр с диаметром пор 0,2 мкм. Полученный конъюгат a-InlB-IgG - HRP хранят при -20 °C.
Пример 4. Определение Listeria monocytogenes методом дот-блоттинга.
С чашки с чистой культурой L. monocytogenes петлейпересевают единичную колонию в жидкую среду BHI. Инкубируют при 37 °С в термостатируемом шейкере при 180 об/мин 18 ч. Из полученных ночных культур делают десятикратные разведения. Высевают 100 мкл шестого, седьмого и восьмого разведения на чашках с агаром BHI, содержащий 0,2 % активированный уголь (BHIC) в течение 24 ч. Отпечатывают выращенные колонии на нитроцеллюлозной мембране (Bio-Rad, США). Мембрану высушивают, после погружают в хлороформ на 15 минут для фиксации. Затем мембрану высушивают от остатков хлороформа и инкубируют в течение 30 минут в блокирующем буфере, который содержит 2% бычий сывороточный альбумин в фосфатно-солевом буфере, pH 7.4 (PBS) при комнатной температуре. Разработанный конъюгат a-InlB-IgG-HRP разбавляют 1:4000 в трис-буферном физиологическом растворе с добавлением 0,05% неионогенного ПАВ Твин-20 (TTBS) и инкубируют в нем мембрану при комнатной температуре в течение 1 часа, используя шейкер со скоростью 150 оборотов в минуту. Мембрану промывают 3 раза, каждый в течение 5 минут с помощью TTBS. Колонии обнаруживаются с помощью TMB-субстрата. Реакцию останавливают промыванием мембран дистиллированной водой. Общая схема определения представлена на фиг. 2. Изменение цвета от светло- до темно-фиолетового указывает на положительную реакцию и наличие колоний вида L. monocytogenes (фиг. 3).
Пример 5. Оценка эффективности предлагаемого метода в смешанных культурах.
Наиболее близким к L. monocytogenes видом является L. innocua, который также часто встречается в молочных продуктах. Чтобы оценить потенциал InlB в качестве маркера для дифференциации L. monocytogenes от L. innocua в смешанной культуре, мы брали ночные культуры L. monocytogenesEGDe и L. innocua SLCC3379 в соотношениях 1:1, 1:5, 1:10 и наносили смешанные культуры на BHI-агар, содержащие 0,02 % уголь. Колонии двух видов были морфологически неразличимы, но дот-иммуноанализ с конъюгатом a-InlB-IgG-HRP, нанесенным на отпечатки колоний, позволил однозначно идентифицировать колонии как положительные. Доля положительных колоний соответствовала процентному содержанию L. monocytogenes в смешанной культуре. Для подтверждения результатов положительные и отрицательные колонии были протестированы при помощи ПЦР с праймерами InlBF (5'-aca-agc-gga-tcc-tat-cac-tgt-gcc-3') и InlBR (5'-tgt-aaa-gct-ttt-tca-gtg-gtt-ggg-3'). Только колонии, которые были положительными в дот-иммуноанализе, давали сигнал в ПЦР-анализе, что подтверждает специфичность анализа (фиг. 4).
Пример 6. Оценка эффективности предлагаемого подхода с использованием искусственно инокулированного молока.
Ночную культуру штамма L. monocytogenesEGDe концентрируют центрифугированием, промывают и ресуспендируют в фосфатно-солевом буфере (PBS). Суспензию, взятую в концентрации 109 КОЕ/мл в соответствии со стандартом Макфарланда, разбавляли до 103 и 104 КОЕ/мл в PBS. Бактериальные суспензии смешивали с образцами сырого молока в соотношении 1:9 (бактериальная суспензия:молоко). Образцы пересевают на агар BHI, содержащий 0,2 % уголь. Дот-иммуноанализ проводят, как описано в примере 4. В качестве контроля используются образцы неинокулированного молока. Отсутствие в молоке L. monocytogenes подтверждаются высевом на среду PALCAM-агар (фиг. 5).
Промышленная применимость
Все приведенные примеры подтверждают эффективность предложенного способа дифференциации L. monocytogenes и его промышленную применимость.
Литература:
1. Egor V. Kalinin, Yaroslava M. Chalenko, Parfait Kezimana, Yaroslav M. Stanishevskyi, Svetlana A. Ermolaeva. Combination of growth conditions and InlB-specific dot-immunoassay for rapid detection of Listeria monocytogenes in raw milk. Journal of Dairy Science,2023, https://doi.org/10.3168/jds.2022-21997.
2. Banada, P. P., and Bhunia, A. K. (2008). Antibodies and Immunoassays for Detection of Bacterial Pathogens. Princ. Bact. Detect. Biosensors, Recognit. Recept. Microsystems, 567–602. doi:10.1007/978-0-387-75113-9_21.
3. Braun, L., Dramsi, S., Dehoux, P., Bierne, H., Lindahl, G., and Cossart, P. (1997). InlB: an invasion protein of Listeria monocytogenes with a novel type of surface association. Mol. Microbiol. 25, 285–294. doi:10.1046/J.1365-2958.1997.4621825.X.
4. Datta, A. R., Wentz, B. A., and Hill, W. E. (1987). Detection of hemolytic Listeria monocytogenes by using DNA colony hybridization. Appl. Environ. Microbiol. 53, 2256–2259. doi:10.1128/AEM.53.9.2256-2259.1987.
5. de las Heras, A., Cain, R. J., Bielecka, M. K., and Vázquez-Boland, J. A. (2011). Regulation of Listeria virulence: PrfA master and commander. Curr. Opin. Microbiol. 14, 118–127. doi:10.1016/J.MIB.2011.01.005.
6. Ermolaeva, S., Novella, S., Vega, Y., Ripio, M.-T., Scortti, M., and Vázquez-Boland, J. A. (2004). Negative control of Listeria monocytogenes virulence genes by a diffusible autorepressor. Mol. Microbiol. 52, 601–611. doi:10.1111/J.1365-2958.2004.04003.X.
7. Koopmans, M. M., Brouwer, M. C., Vázquez-Boland, J. A., and van de Beek, D. (2022). Human Listeriosis. Clin. Microbiol. Rev. doi:10.1128/CMR.00060-19.
8. Krypotou, E., Scortti, M., Grundström, C., Oelker, M., Luisi, B. F., Sauer-Eriksson, A. E., et al. (2019). Control of Bacterial Virulence through the Peptide Signature of the Habitat. Cell Rep.26, 1815-1827.e5. doi:10.1016/J.CELREP.2019.01.073.
9. Lathrop, A. A., Banada, P. P., and Bhunia, A. K. (2008). Differential expression of InlB and ActA in Listeria monocytogenes in selective and nonselective enrichment broths. J. Appl. Microbiol. 104, 627–639. doi:10.1111/J.1365-2672.2007.03574.X.
10. Lovett, J., Francis, D. W., and Hunt, J. M. (1987). Listeria monocytogenes in Raw Milk: Detection, Incidence, and Pathogenicity. J. Food Prot. 50, 188–192. Available at: http://meridian.allenpress.com/jfp/article-pdf/50/3/188/1654024/0362-028x-50_3_188.pdf [Accessed January 17, 2023].
11. McClain, D., and Lee, W. (1988). Development of USDA-FSIS method for isolation of Listeria monocytogenes from raw meat and poultry - PubMed. Available at: https://pubmed.ncbi.nlm.nih.gov/3134339/ [Accessed January 17, 2023].
12. Norton, D. (2002). Polymerase chain reaction-based methods for detection of Listeria monocytogenes: toward real-time screening for food and environmental samples - PubMed. Available at: https://pubmed.ncbi.nlm.nih.gov/11990039/ [Accessed January 18, 2023].
13. Van Kreijl, C., Knaap, A., and Van Raaij, J. (2006). Our food, our health-Healthy diet and safe food in the Netherlands. Available at: https://www.researchgate.net/publication/27451618_Our_food_our_health-Healthy_diet_and_safe_food_in_the_Netherlands [Accessed January 16, 2023].
14. Vázquez-Boland, J. A., Kuhn, M., Berche, P., Chakraborty, T., Domínguez-Bernal, G., Goebel, W., et al. (2001). Listeria pathogenesis and molecular virulence determinants. Clin. Microbiol. Rev. 14, 584–640. doi:10.1128/CMR.14.3.584-640.2001.
15. Wįçkowska-Szakiel, M., Bubert, A., Róalski, M., Krajewska, U., Rudnicka, W., and Róalska, B. (2002). Colony-blot assay with anti-p60 antibodies as a method for quick identification of Listeria in food. Int. J. Food Microbiol. 72, 63–71. doi:10.1016/S0168-1605(01)00606-7.
16. Yu, K. Y., Noh, Y., Chung, M., Park, H. J., Lee, N., Youn, M., et al. (2004). Use of monoclonal antibodies that recognize p60 for identification of Listeria monocytogenes. Clin. Diagn. Lab. Immunol. 11, 446–451. doi:10.1128/CDLI.11.3.446-451.2004.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциации вирулентных штаммов Listeria monocytogenes от авирулентных штаммов с использованием поликлональных антител против факторов патогенности интерналина А (InlA) и интерналина В (InlB). | 2023 |
|
RU2808590C1 |
| Штаммы-продуценты вариантов рекомбинантного белка Интерналин 321, агониста рецептора фактора роста | 2017 |
|
RU2634416C1 |
| Рекомбинантный интерналин В 321, полученный с помощью штамма Escherichia coli | 2018 |
|
RU2688422C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ КУЛЬТУРЫ LISTERIA MONOCYTOGENES | 2001 |
|
RU2196827C1 |
| Штамм культивируемых гибридных клеток животных Mus. musculus - продуцент моноклональных антител к мембранному белку, общему для типичных и атипичных холерных вибрионов 01 серогруппы | 2022 |
|
RU2785463C1 |
| Способ получения секреторного рекомбинантного белка ORF2 цирковируса свиней второго типа в дрожжах Komagataella phaffii BG11/ pPic-CV2-7 в форме вирусоподобных частиц | 2023 |
|
RU2832292C1 |
| Штамм бактерий Enterococcus faecium, обладающий антагонистической активностью в отношении бактерий вида E. coli, родов Enterococcus и Listeria | 2019 |
|
RU2739427C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS-ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К МЕМБРАННОМУ БЕЛКУ, ОБЩЕМУ ДЛЯ ТСР+ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ О1 И О139 СЕРОГРУПП | 2017 |
|
RU2663003C1 |
| ШТАММ БАКТЕРИЙ Enterococcus faecium, ОБЛАДАЮЩИЙ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ БАКТЕРИЙ РОДА Listeria И ВИДА Enterococcus faecalis | 2014 |
|
RU2571852C2 |
| СПОСОБ БИОЛОГИЧЕСКОГО КОНТРОЛЯ ЛИСТЕРИЙ | 2012 |
|
RU2575998C1 |

Изобретение относится к области биотехнологии и микробиологии. Описан способ идентификации и дифференциации Listeria monocytogenes. Выращивают микроорганизмы на агаризованной питательной среде, содержащей 0,02% активированного угля. Получают отпечатки колоний на нитроцеллюлозной мембране. Визуализируют отпечатки колоний с использованием поликлональных моноспецифических антител против интерналина В, конъюгированных с пероксидазой хрена. Изобретение может быть использовано для санитарно-эпидемиологического контроля зараженности продуктов. Изобретение позволяет дифференцировать колонии Listeria monocytogenes от других микроорганизмов и представителей рода Listeria. 2 н. и 5 з.п. ф-лы, 5 ил, 1 табл., 6 пр.
1. Способ дифференциации культуры Listeria monocytogenes от других видов Listeria spp., включающий в себя выращивание испытуемых бактерий на твердой питательной среде, содержащей активированный уголь, получение отпечатка колоний на мембрану, последующую фиксацию мембраны в хлороформе, инкубацию с поликлональными моноспецифическими антителами и визуализацию активности HRP в присутствии субстрата.
2. Способ дифференциации по п.1, отличающийся тем, что включает в себя рост Listeria monocytogenes на твердой питательной среде сердечно-мозгового экстракта с добавлением 0,02% активированного угля.
3. Способ дифференциации по п.2, отличающийся тем, что для идентификации Listeria monocytogenes производятся отпечатки на нитроцеллюлозную мембрану.
4. Способ дифференциации по п.3, отличающийся тем, что при инкубации с поликлональными моноспецифическими антителами происходит реакция антиген-антитело.
5. Способ дифференциации по п.4, отличающийся тем, что выполнен с использованием антител против интерналина В.
6. Способ дифференциации по п.5, отличающийся тем, выполнен с использованием конъюгированных с HRP поликлональных моноспецифичных антител против интерналина В.
7. Применение способа дифференциации по п.1 для оценки обсемененности продуктов питания.
| СПОСОБ ДИФФЕРЕНЦИАЦИИ КУЛЬТУРЫ LISTERIA MONOCYTOGENES | 2001 |
|
RU2196827C1 |
| Способ идентификации и количественной оценки патогенных и условно-патогенных бактерий в пищевых субстратах с использованием высокопроизводительного секвенирования | 2018 |
|
RU2716115C1 |
| ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ, ИДЕНТИФИКАЦИЯ И ДИФФЕРЕНЦИАЦИЯ ЭУБАКТЕРИАЛЬНЫХ ТАКСОНОВ С ПОМОЩЬЮ ГИБРИДИЗАЦИОННОГО АНАЛИЗА | 1995 |
|
RU2154106C2 |
| WO 2017084754 A1, 26.05.2017 | |||
| WO 2020223259 A1, 05.11.2020. | |||
Авторы
Даты
2024-01-23—Публикация
2023-04-12—Подача