Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и касается набора праймеров для выявления генетического материала (ДНК) фрагменту гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) для детекции патогенных уреаплазм кошек и собак. Представленный набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого ДНК-зонда содержит пару олигонуклеотидов, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также один флуоресцентно-меченый ДНК-зонд. Представленное изобретение позволяет проводить более достоверное и надежное выявление генетического материала (ДНК) фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) и может быть использовано в ветеринарии. Способ позволяет детектировать фрагмент высоко консервативной области (ДНК) фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), общий для всех вариантов рода Уреаплазмы Ureaplasma spp.), что позволяет выявлять животных, инфицированных любым видом Ureaplasma spp. на любых стадиях заболевания.
Изобретение относится к наборам праймеров для выявления генетического материала (ДНК) фрагменту гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) для детекции патогенных уреаплазм кошек и собак в клинических образцах, секционных пробах, культуральных жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач свойств патогенных уреаплазм кошек и собак семейства рода Уреаплазмы Ureaplasma spp.), и может быть использовано в ветеринарии.
Уреаплазмозы - комплексные болезни домашних и диких животных, птиц и человека, вызываемые различными видами уреаплазм, сопровождающиеся патологией половой, мочевыделительной, респираторной, иммунокомпетентной систем, поражением глаз, воспалением желудочно-кишечного тракта, анемией и желтухой, а также артритами и артрозами.
Уреаплазма - одноклеточный полиморфный микроорганизм (прокариот) с трехслойной цитоплазматической мембраной вместо клеточной стенки, имеющий нетипичную ДНК.
Спектр восприимчивых биологических объектов: коровы, козы, овцы, свиньи, кошки, собаки, крысы, хомяки, птицы (куры, индейки и др.), человек.
Инкубационный период уреаплазмоза длится около одного месяца, зависит от исходного состояния здоровья животного или человека. Уреаплазма относится к внутриклеточным микроорганизмам.
Уреаплазмы имеют ряд особенностей, уникальных для прокариот: простая организация клетки с минимальным количеством органелл; отсутствие клеточной стенки; самое низкое соотношение гуанин + цитозин пар оснований в ДНК и наименьший среди прокариот размер генома (0,5-1,0 МДа).
Уреаплазмы не имеют клеточной стенки, а значит рецепторов и некоторых «индивидуальных» структурных особенностей клеточной мембраны, благодаря которым организм животных, человека и птиц может формировать против них полноценный иммунитет.
Значительный полиморфизм паразитов способствует очень частому образованию новых форм, что так же затрудняет развитие иммунного ответа.
Иммунодефициты, обусловленные уреаплазмами, связаны и с нетрадиционным поведением бактериофагов, которые, поглотив их, вместо переваривания и нейтрализации разносят по всему организму, способствуя развитию патологических процессов, отдаленных от первичного очага поражения, в т. ч. в почках, суставах. Уреаплазмы поражают и гемолизируют эритроциты. Благодаря отсутствию оболочки, могут сливаться с клетками макроорганизма и встраивать в их генетический аппарат фрагменты своей ДНК с образованием генетически чужеродных для макроорганизма структур – антигенов.
Уреаплазмоз собак и кошек, как правило, протекает бессимптомно. Возбудители находятся в теле до 80% обследованных собак, часто без клинического проявления болезни. Но при снижении иммунитета, вызванном неполноценным кормлением, переохлаждением, заболеванием какой-либо этиологии, беременностью, родами, абортом или иным стрессом может развиться клинически выраженное острое течение болезни. Возникают проблемы с глазами, органами репродуктивной системы и дыхания, реже артриты и артрозы, воспаление ЖКТ.
Промежуточные стадии уреаплазм развиваются в эритроцитах и разрушают последних с появлением тяжелой анемии и желтухи. Симптомы уреаплазмоза зависят от конкретного вида возбудителя, его «локализации», состояния иммунной системы зараженного животного.
Если уреаплазма первоначально поразила репродуктивную систему, то у животных могут наблюдаться эндометриты, уретриты, возможно развитие пиометры и т.д.
Микроскопическое выявление уреаплазм, имеющих очень маленькие размеры, не эффективно.
Микробиологическое выделение возбудителя из материала на искусственной питательной среде позволяет с максимальной вероятностью определить точный вид возбудителя и «протестировать» его на чувствительность к антибактериальным препаратам.
Способность уреаплазм секретировать уреазу позволяет легко дифференцировать их от прочих микоплазм. В настоящее время метод определения уреазной активности (образование аммиака из мочевины) - один из основных способов диагностики уреаплазмозов. Этиологическая диагностика, т.е. выделение возбудителя, приобретает особое значение в связи с невозможностью отличить по клинической картине уреаплазмоз от хронической гонореи.
ПЦР (полимеразная цепная реакция) отличается высокой чувствительностью и позволяет точно выявить наличие ДНК возбудителя в патматериале и определить персистирующие, некультивируемые формы уреаплазм. Положительный результат соответствует выявлению диагностического количества (концентрация мико/уреаплазм более 104 кл/мл свидетельствует о возможном развитии уреаплазмоза). В случае подозрения на персистенцию мико/уреаплазм для установления диагноза рекомендуется проводить ПЦР-определение до 3-х раз с определенным интервалом. Это связано с тем, что численность мико/уреаплазм при персистенции в организме невелика и колеблется от 103 до 105 кл/мл (в зависимости от напряженности иммунитета, стрессов, переохлаждения и пр.). Чувствительность ПЦР-тест-систем - 104 кл/мл, поэтому в пробах, взятых у одного пациента в разное время, без лечения, уреаплазмы могут обнаруживаться, или отсутствовать, либо снова выявляться. В связи с высокой генетической изменчивостью мико/уреаплазм для выбора праймеров при создании ПЦР-тест-систем используется наиболее консервативный участок генома - гены рибосомальной РНК (16S rRNA). Чувствительность тест-систем для выявления мико/уреаплазм составляет не менее 10 000 кл/мл пробы биоматериала (не менее 100 молекул ДНК в 5 мкл обработанной пробы, вносимых в амплификационную смесь), а специфичность - 99%. Перспективным направлением лабораторной диагностики мико/уреаплазм является молекулярная диагностика - детекция активности генов, ответственных за фенотипическое проявление факторов патогенности. Положительный результат в ПЦР-исследовании и отрицательный в посеве может свидетельствовать о персистенции возбудителя. ПЦР не выявляет количество возбудителя в исследуемом материале, поэтому положительный результат при ПЦР не является основанием для назначения лечения, а сам метод не может использоваться для контроля его эффективности после завершения лечения.
Серологические методы имеют лишь ориентировочное значение, т.к. выявляют только наличие антител к инфекционному агенту, а зависимость между титром специфических антител и присутствием возбудителя отсутствует. Серологическое типирование уреаплазм не нашло широкого распространения, поскольку многие серовары перекрестно реагируют с антисыворотками и от одного пациента можно выделить микроорганизмы различных серовариантов. ИФА и МФА выявляют лишь присутствие антител, их диагностическая ценность пока лишь 50-75%. Окончательный диагноз ставится только на основании полного клинического обследования, включая анализы крови, мочи и кала.
Уровень техники
При разработке набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для диагностики ДНК фрагмента гена 16S рибосомальной РНК рода Уреаплазмы Ureaplasma spp.) был проведён сравнительный анализ структуры сиквенсов фрагментов геномов гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), размещенных на web-ресурсе NCBI https://www.ncbi.nlm.nih.gov/nucleotide/, и затем проведено конструирование праймеров и флуоресцентно-меченого зонда методом компьютерного моделирования с применением компьютерных программ Beacon Designer v. 8.14 PREMIER Biosoft International (San Francisco, CA 94131-2175, США) и Vector NTI 11 (Invitrogen, США). Выравнивание геномных последовательностей осуществлялось методом Clustal W, филогенетический анализ выполняли методом невзвешенного попарного среднего - UPGMA. Проверку качества и термодинамический анализ выбранных праймеров и флуоресцентно-меченого зонда выполняли с помощью программы OLIGO DNA/RNA primer analysis software, v.5.0 и BLAST https://blast.ncbi.nlm.nih.gov/Blast.cgi (США).
Амплифицируемый участок ДНК, являясь маркерным, позволяет выявить вирусный агент в исследуемом образце. Для эффективного проведения ПЦР в режиме реального времени необходимы флуоресцентно-меченый ДНК-зонд и ДНК-затравки - праймеры (синтетические олигонуклеотиды) - строго специфичные к ДНК вирусного генома. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. Праймеры должны быть комплементарны нуклеотидным последовательностям ДНК, ограничивая амлифицируемый участок справа и слева таким образом, чтобы синтез ДНК ДНК-полимеразой проходил строго в выбранном регионе. Флуоресцентно-меченый ДНК-зонд, в свою очередь, должен лежать внутри участка ДНК, ограниченного праймерами. Правильный выбор праймеров позволяет осуществить экспоненциальное увеличение количества копий целевого участка ДНК. Правильный выбор сочетания пары праймеров и ДНК-зонда позволяет осуществлять детекцию накопления продуктов амплификации в режиме реального времени. В целом от правильности выбора олигодезоксирибонуклеотидных праймеров и зондов зависит специфичность проводимой ОТ-ПЦР, а значит, и достоверность исследования.
При компьютерном дизайне праймеров и флуоресцентно-меченого ДНК-зонда главными критериями были: абсолютная степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков в структуре праймеров и комплементарности их друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); максимальная близость значений температуры отжига праймеров.
Раскрытие сущности изобретения
Техническим результатом заявляемого изобретения является создание набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда, позволяющего идентифицировать в реальном времени ДНК фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) и обладающего более высокой гомологией к циркулирующим в настоящее время патогенным уреаплазмам кошек и собак, что повышает достоверность и надежность анализов.
Указанный технический результат достигается разработкой набора олигодезоксирибонуклеотидных праймеров для детекции ДНК фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), содержащего пару олигонуклеотидов, обладающих активностью прямого и обратного праймеров в полимеразной цепной реакции, а также флуоресцентно-меченый ДНК-зонд. Указанные олигонуклеотиды имеют следующую структуру:
Последовательности олигонуклеотидов для выявления генетического материала (ДНК) фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) патогенных уреаплазм кошек и собак
Прямой праймер (Forward primer)
VT-URPL-F 5'- GGAGCAAATAGGATTAGA -3'
Обратный (Reverse primer)
VT-URPL-R 5'- CAGGCASATCATTTAATG -3'
Флуоресцентно-меченый ДНК-зонд (Probe) 5'→3'
VT-URPL-P 5'- (R6G)- CCTAGTAGTCCACACCGTAAACGA -(BHQ2) -3'
Дизайн предлагаемых к патентованию праймеров и зонда включает все данные международной базы GenBank о нуклеотидных последовательностях фрагмента гена 16S рибосомальной РНК патогенных уреаплазм кошек и собак рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), по состоянию на май 2022 года. Используемые в работе праймеры и зонд обладают большей гомологией к циркулирующим в настоящее время патогенных уреаплазм кошек и собак семейства рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.),, что в свою очередь повышает чувствительность заявляемого набора диагностических праймеров и зонда. Мишенью для используемых в работе праймеров и зонда является высококонсервативная область гена 16S рибосомальной РНК.
Представляемые к патентованию олигодезоксирибонуклеотидные праймеры и флуорсцентно-меченый ДНК-зонд позволяют выявить в образце ДНК фрагмента гена 16S рибосомальной РНК патогенных уреаплазм кошек и собак рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), в режиме реального времени, а также амплифицировать фрагмент ДНК, что дает возможность секвенировать полученный ампликон, с которым можно проводить молекулярно-биологические работы, а следовательно, и более глубокое изучение свойств вируса. Помимо этого, использование в качестве положительного контроля плазмидной конструкции несущей специфическую вставку (как описано ниже) позволяет разработать количественную ПЦР, что в свою очередь дает возможность оценить вирусную нагрузку в исследуемом образце.
Апробация праймеров была осуществлена с использованием биотехнологической конструкции, в основе которой лежит плазмида со вставкой специфического ДНК-фрагмента. Экспериментально было показано, что выбранные праймеры и ДНК-зонд обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Положительные контрольные образцы были получены методом ТОРО-Т/А клонирования вирусспецифических ДНК-дуплексов в плазмиду PC DNA 3.1 (Invitrogen, США). После чего компетентные клетки E. coli линии TOP 10 (Invitrogen, США) были трансформированы полученной плазмидой, несущими типоспецифический фрагмент гена 16S рибосомальной РНК патогенных уреаплазм кошек и собак рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.).
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов коммерчески доступных реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстрое и надежное применение данного изобретения в медицинских и научно-исследовательских лабораториях.
Анализ эффективности проведенной трансформации осуществляли проведением ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×ТЕ-буфер, содержащий рекомбинантные плазмиды, со встройкой вирусспецифического синтезированного ДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×ТЕ-буфер.
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, температуре отжига праймеров.
Состав реакционной смеси моделировали таким образом, чтобы концентрация ионов MgCl2 обеспечивала оптимальную скорость и точность работы фермента Taq-полимеразы Mut-3, концентрация дНТФ не превышала 0,4 мМ, концентрация праймеров была 10 пмоль/мкл, флуоресцентно-меченого ДНК-зонда 5 пмоль/мкл, а объем пробы составлял 5 мкл (для повышения специфичности реакции).
Отработку условий ПЦР с использованием разработанных праймеров и флуоресцентно-меченого ДНК-зонда осуществляли на амплификаторах планшетного типа «ДТ-96», «ДТ-Прайм», «ДТ-Лайт» («ДНК-Технология», Россия) и роторного типа «Rotor Gene Q» (QIAGEN, ФРГ).
Для определения чувствительности способа выделенные пробы ДНК (мазки и смывы) подвергали десятикратным разведениям от 10-1 до 10-5. Полученные разведения исследовали методом ПЦР с применением разработанных специфических олигонуклеотидных праймеров и флуоресцентно-меченого ДНК-зонда.
Специфичность разработанного способа проверяли на образцах патогенных уреаплазм кошек и собак рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.)., а также на образцах биологического материала, полученных от интактных и серонегативных животных в отношении представителей семейства Микоплазмы (Micoplasma spp.) класса Mollicutes, а также с помощью метода секвенирования по Сэнгеру на автоматическом секвенаторе ABI PRISM 3500 (США) фиг. 1, фиг. 2, фиг. 3 в приложении «Схема».
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="ВЕТТЕСТ-Ureaplasma
spp..xml" softwareName="WIPO Sequence" softwareVersion="2.2.0"
productionDate="2022-12-15">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022132654</ApplicationNumberText>
<FilingDate>2022-12-13</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>W22071194</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022132654</ApplicationNumberText>
<FilingDate>2022-12-13</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru"> Исаев Сергей
Александрович</ApplicantName>
<ApplicantNameLatin> Isaev Sergey
Aleksandrovich</ApplicantNameLatin>
<InventionTitle languageCode="ru">Набор олигодезоксирибонуклеотидных
праймеров и флуоресцентно-меченого зонда к фрагменту гена 16S
рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка
Mycoplasmatales класса Mollicutes (Ureaplasma spp.) для детекции
патогенных уреаплазм кошек и собак.</InventionTitle>
<SequenceTotalQuantity>4</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Ureaplasma sp.</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ggagcaaataggattaga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>18</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..18</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Ureaplasma sp.</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>caggcasatcatttaatg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>24</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..24</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Ureaplasma sp.</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cctagtagtccacaccgtaaacga</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>121</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..121</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Ureaplasma sp.</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtggggagcaaatagcattagataccctagtagtccacaccgtaaacga
tcatcattaaatgtcggcccgaaatgggtcgggtgttgtagctaacgcattaaatgatstgcctgggtag
ta</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
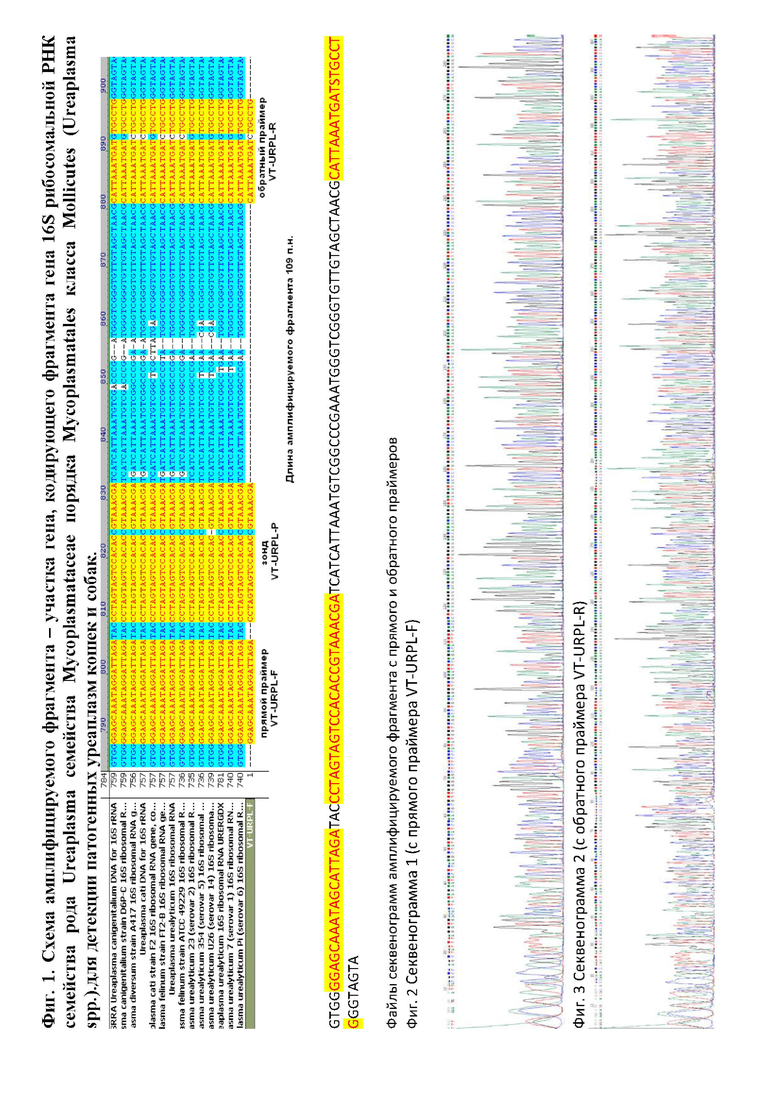
Изобретение относится к биотехнологии и ветеринарии. Представлен набор праймеров к фрагменту гена 16S рибосомальной РНК семейства рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) для детекции патогенных уреаплазм кошек и собак в клинических образцах, секционных пробах, культуральных жидкостях и прочих биопрепаратах с целью постановки диагноза, коррекции лечения, эпидемиологического расследования, а также для решения научно-исследовательских задач свойств патогенных уреаплазм кошек и собак. Изобретение позволяет идентифицировать в реальном времени ДНК фрагмента гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.), обладающего более высокой гомологией к циркулирующим в настоящее время патогенным уреаплазмам кошек и собак, что повышает достоверность и надежность анализов. 3 табл., 3 ил.
Набор олигодезоксирибонуклеотидных праймеров VT-URPL-F 5'- GGAGCAAATAGGATTAGA -3', VT-URPL-R 5'- CAGGCASATCATTTAATG -3' и флуоресцентно-меченого зонда VT-URPL-P 5'- (R6G)- CCTAGTAGTCCACACCGTAA-ACGA -(BHQ2) -3' к фрагменту гена 16S рибосомальной РНК рода Ureaplasma семейства Mycoplasmataceae порядка Mycoplasmatales класса Mollicutes (Ureaplasma spp.) для детекции патогенных уреаплазм кошек и собак.
| ВАГАНОВА А | |||
| Н., Ген 16s ррнка метилтрансферазы как мишень для выявления ureaplasma diversum в биологическом материале, журнал "Известия Санкт-Петербургского государственного технологического института (технического университета)", 2018, N 47, с | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| СПОСОБ ОБНАРУЖЕНИЯ МИКРООРГАНИЗМОВ, ПРИНАДЛЕЖАЩИХ ВИДУ MYCOPLASMA PNEUMONIAE И/ИЛИ MYCOPLASMA GENITALIUM | 2010 |
|
RU2575075C2 |
| Уреаплазмоз домашних животных | |||
| Классификация, диагностика, лечение | |||
Даты
2023-07-05—Публикация
2022-12-13—Подача