Отсылки к родственным заявкам
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США № 62/170,933, озаглавленной «Способы ПЭГилирования по аминогруппам для получения сайт-специфичных конъюгатов белков» (авторы Mary S. Rosendahl et al.), поданной 4 июня 2015 г., которая родственна предварительной заявке на патент США № 62/086,294, озаглавленной «Белки и белковые конъюгаты с повышенной гидрофобностью» (авторы Mary S. Rosendahl et al.), поданной 2 декабря 2014 г., содержание которых полностью включено в настоящую заявку посредством отсылки во всех отношениях, как если бы они были непосредственно включены в текст настоящего документа.
Уровень техники
Задача попадания лекарственного вещества, гормона, белка или иного медицински активного агента в организм пациента сталкивается с рядом трудностей. Медицински активный агент должен показаться в организме больного. Для этого есть два пути – проглатывание и инъекция. В том случае, когда медицински активный агент проглатывается, он, прежде чем попадет в кровеносное русло или в тот участок организма, который является мишенью лечебного воздействия, должен пройти через пищеварительную систему. Введенный путем инъекции, медицински активный агент может оказаться в кровотоке или в участке-мишени быстро или впрямую, однако инъекции могут причинять пациенту боль и дискомфорт. Коль скоро медицински активный агент оказался в организме, его концентрация изменяется во времени в зависимости от природы данного агента, наличия в нем различных функциональных групп, его инкапсулированности или других факторов. Если концентрация медицински активного агента становится ниже некоторого уровня, его может быть необходимо ввести снова. Многие медицински активные агенты приходится вводить часто, например несколько раз в сутки. Чем чаще нужно делать инъекции, тем больше дискомфорта это приносит пациенту, из-за чего он может хуже выполнять предписания врача и в итоге лечение не достигнет оптимального результата. При введении медицински активного агента путем инъекций каждый следующий укол причиняет новую боль, повышает риск инфекции и вероятность иммунологической реакции в организме пациента. Таким образом, имеется настоятельная нужда в медицински активных агентах, изменение концентрации которых со временем в организме больного отвечало бы терапевтической потребности. Способы и композиции, описанные в настоящем документе, предлагают решение этой и других проблем.
Раскрытие изобретения
Медицински активный агент можно присоединить к полиэтиленгликолю (PEG). В результате присоединения полиэтиленгликоля (ПЭГилирования) увеличивается молекулярная масса медицински активного агента, что может привести к увеличению времени его полужизни в организме пациента. Также в результате присоединения полиэтиленгликоля, в том числе небольших молекул PEG, медицински активный агент может стать более гидрофобным и амфифильным. Наличие полиэтиленгликоля может облегчить растворение медицински активного агента в органическом растворителе с полимером, способным к биологической деградации. Медицински активный агент может быть инкапсулирован в микросферу из такого полимера. Инкапсулирование медицински активного агента продлевает время его полужизни. Из описанных в настоящем документе препаратов медицински активный агент высвобождается медленно и равномерно на протяжении некоторого периода времени. Такой профиль высвобождения и обеспечивает сохранение определенного уровень введенного белка практически без пика концентрации на протяжении предполагаемого периода лечения даже без помощи эксципиентов. Благодаря получающемуся в результате профилю концентрации медицински активного агента в организме пациента достигается оптимальный клинический результат его воздействия. Препараты, описанные в настоящем документе вводят пациентам достаточно редко – один раз в месяц.
В частности, введению медицински активного агента пациентам может способствовать его сайт-специфичная модификация гидрофильными белками. В одном из примеров используются ПЭГилированные производные инсулина, в которых сайтом замещения является преимущественно остаток фенилаланина PheB1 (N-конец B-цепи). Эти производные физически стабильнее нативного инсулина и меньше подвержены ферментативной деградации. Также эти производные обладают большей, чем нативный инсулин, растворимостью в водных/органических системах. Кроме того они менее иммуногенны и дольше циркулируют в кровотоке (более продолжительное время полужизни). С помощью способов, описанных в настоящем документе, сайт-специфично ПЭГилированные белки можно получать с высоким выходом. Эти и другие преимущества позволяют добиться большей эффективности лечения диабета и других заболеваний. При высоком выходе продукта процесс изготовления более эффективен, выгоднее по стоимости и его производство может быть масштабируемым.
Примеры по изобретению включают способ получения конъюгата белка с полиэтиленгликолем. В этом способе используется водный раствор белка. Водный раствор белка может содержать белок, буферный раствор с нужным рН и хелатирующий агент. Хелатирующий агент, используемый по изобретению, выбирают из группы, состоящей из аминополикарбоновых кислот, гидроксиаминокарбоновых кислот, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF). Способ по изобретению может также включать добавление в водный белковый раствор борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида. Способ по изобретению может также включать взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белка с полиэтиленгликолем.
В некоторых примерах по изобретению борсодержащий восстанавливающий агент может быть представлен цианборгидридом натрия. Цианборгидрид натрия и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от около 5:1 до около 1,5:1. Буферный раствор берут таким, чтобы он в процессе реакции обеспечивал рН водного белкового раствора от около 4,0 до 4,4. В примерах по изобретению рН водного белкового раствора может варьировать от 3,8 до 4,0; от 4,0 до 4,2 или от 4,2 до 4,4.
В некоторых примерах по изобретению борсодержащий восстанавливающий агент включает диметиламиноборан (Met2NHBH3), триметиламиноборан (Met3NBH3), 2-пиколинборан (2-метилпиридинборан C6H7NBH3), триацетоксиборгидрид натрия (NaBH(OAc)3), триэтиламиноборан (Et3NBH3), морфолинборан (C4H9ONBH), трет-бутиламиноборан (C4H11NBH3) или 5-этил-2-метил-пиридинборан (C8H11NBH3). При использовании этих борсодержащих восстанавливающих агентов в процессе реакции не выделяется газообразный цианид, что является преимуществом в производстве. Борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от около 25:1 до около 1,5:1. Буферный раствор берут таким, чтобы он в процессе реакции обеспечивал рН водного белкового раствора от 4,0 до 6,0. В некоторых примерах по изобретению рН водного белкового раствора может варьировать от 4,0 до 4,4; от 4,4 до 4,8 или от 4,8 до 5,2, от 5,2 до 5,6; от 5,6 до 6,0.
Примеры по изобретению могут включать способ получения конъюгата инсулина с полиэтиленгликолем. В этом способе используется водный раствор инсулина. Водный раствор инсулина может содержать инсулин, буферный раствор с нужным рН, органический растворитель и хелатирующий агент. Хелатирующий агент, используемый по изобретению, может включать этилендиаминтетрауксусную кислоту (EDTA). Способ по изобретению может также включать добавление в водный раствор инсулина борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида. Борсодержащий восстанавливающий агент в способе по изобретению может быть любым из борсодержащих восстанавливающих агентов, описанных в настоящем документе. Борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от около 5:1 до около 1:1 или в любом из молярных соотношений, описанных в настоящем документе. Способ по изобретению также включает взаимодействие метоксиполиэтиленгликоля альдегида и инсулина с образованием конъюгата инсулина с полиэтиленгликолем. Буферный раствор берут таким, чтобы он в процессе реакции обеспечивал рН водного раствора инсулина в любом из диапазонов, описанных в настоящем документе. В результате взаимодействия метоксиполиэтиленгликоля альдегида и инсулина образуется конъюгат PEG-PheB1-инсулин, составляющий более 75% всех образующихся конъюгатов инсулина с полиэтиленгликолем.
Примеры по изобретению включают способ получения микросфер, содержащих конъюгат белка с полиэтиленгликолем, которые обеспечивают его замедленное высвобождение. Этот способ включает использование водного белкового раствора, содержащего белок, буферный раствор с нужным рН и хелатирующий агент. Хелатирующий агент, используемый по изобретению, выбирают из группы, состоящей из аминополикарбоновых кислот, гидроксиаминокарбоновых кислот, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF). Способ по изобретению может также включать добавление в водный белковый раствор борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида. Борсодержащий восстанавливающий агент в способе по изобретению может быть любым из борсодержащих восстанавливающих агентов, описанных в настоящем документе. Борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в любом из молярных соотношений, описанных в настоящем документе. Этот способ также включает взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белок-полиэтиленгликоль, причем буферный раствор в процессе реакции обеспечивает рН водного белкового раствора от 4,0 до 6,0. Кроме того, указанный способ может включать смешивание конъюгата белок-полиэтиленгликоль в органическом растворителе с полимером, способным к биологической деградации. Также этот способ может включать эмульгирование смеси конъюгата белок-полиэтиленгликоль с биоразлагаемым полимером в водном растворе. Этот способ может включать отверждение эмульгированной смеси конъюгата белок-полиэтиленгликоль и биоразлагаемого полимера с образованием микросфер, обеспечивающих замедленное высвобождение.
Краткое описание чертежей
Описание изложенной в настоящем документе технологии иллюстрируется прилагаемыми фигурами.
Фигура 1 изображает функциональную схему способа получения конъюгатов белок-полиэтиленгликоль по примерам изобретения.
Фигура 2 изображает функциональную схему способа получения конъюгата инсулин-полиэтиленгликоль по примерам изобретения.
Фигура 3 изображает функциональную схему способа получения микросфер, содержащих конъюгаты белок-полиэтиленгликоль и обеспечивающих их замедленное высвобождение, по примерам изобретения.
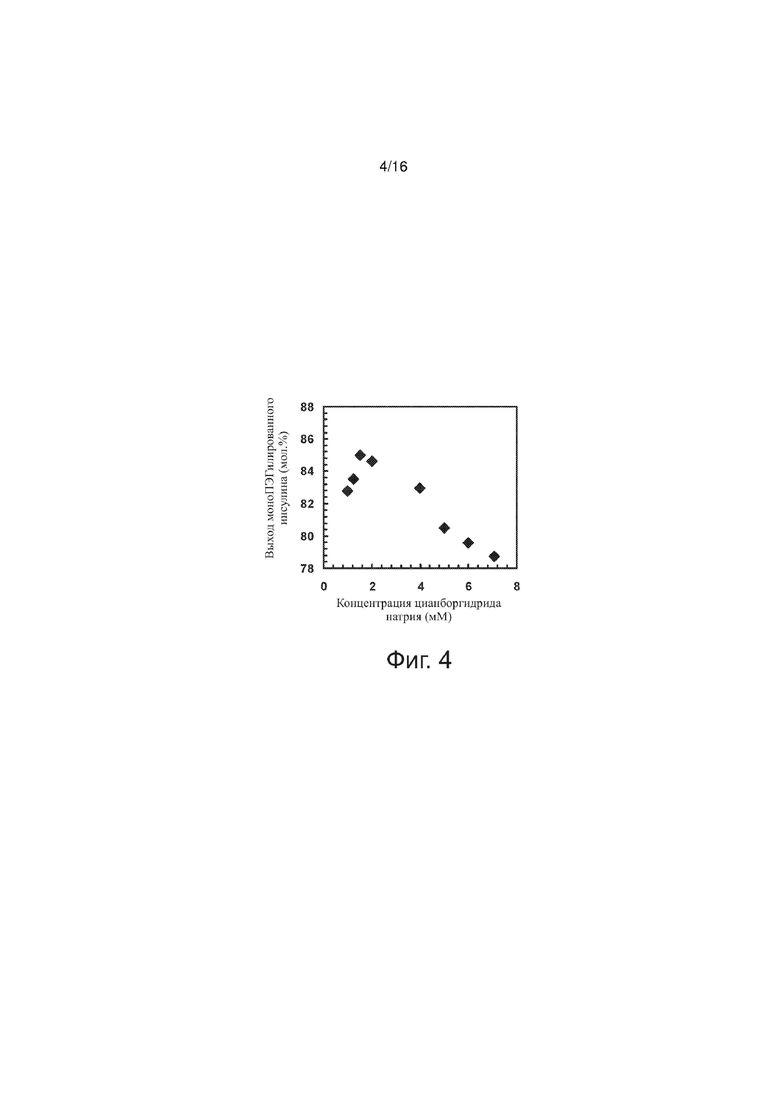
Фигура 4 – точечный график, представляющий выход моноПЭГилированного инсулина как функцию концентрации цианборгидрида натрия по примерам изобретения.
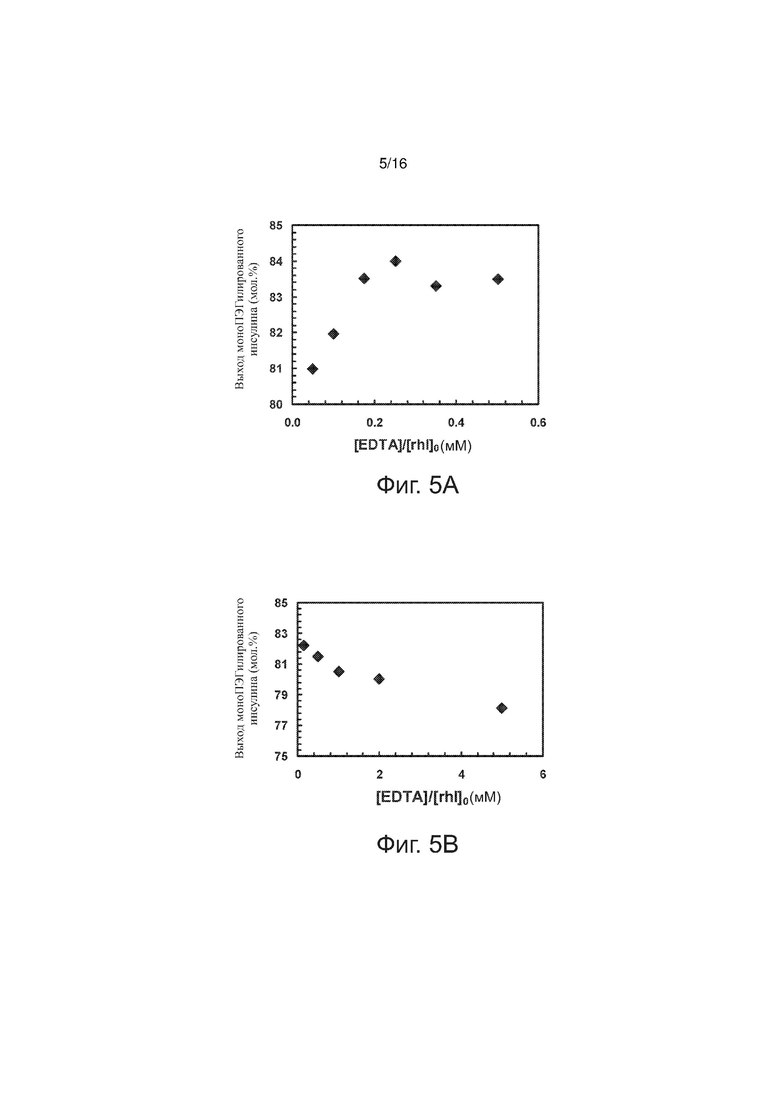
Фигуры 5A и 5B - точечные графики, представляющие выход моноПЭГилированного инсулина как функцию отношения концентрации хелатирующего агента и исходной концентрации инсулина, по примерам изобретения.
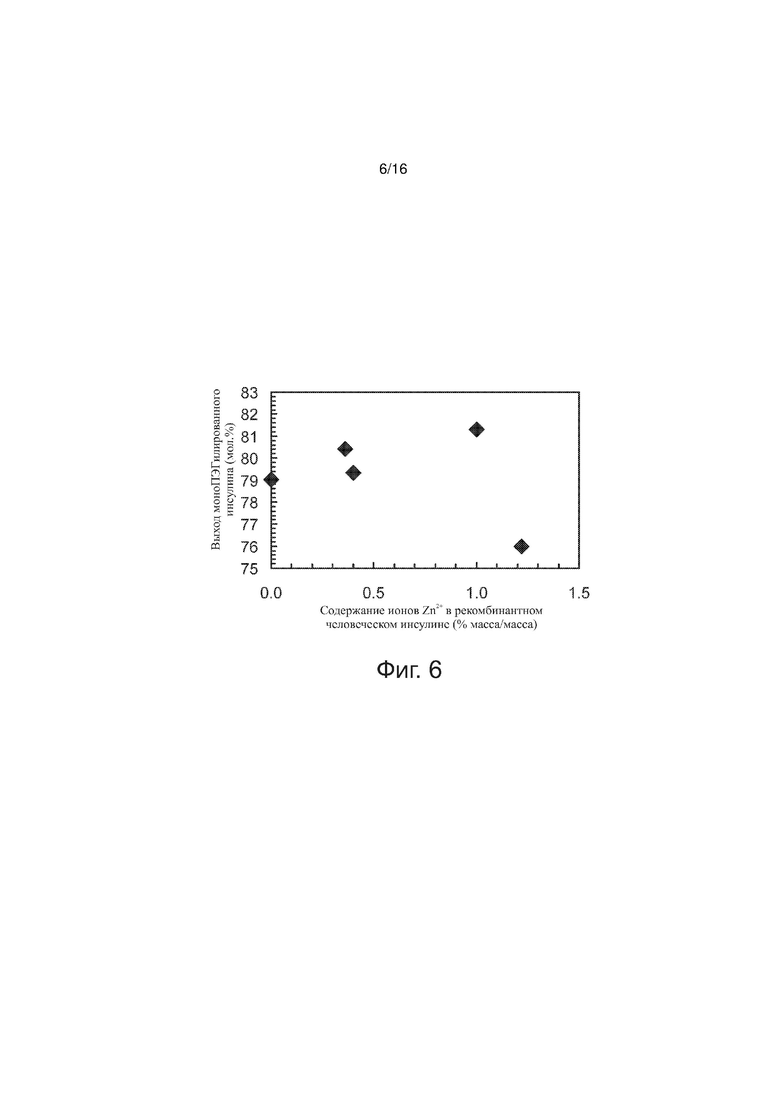
Фигура 6 - точечный график, представляющий выход моноПЭГилированного инсулина как функцию относительного содержания (в процентах) ионов цинка, по примерам изобретения.
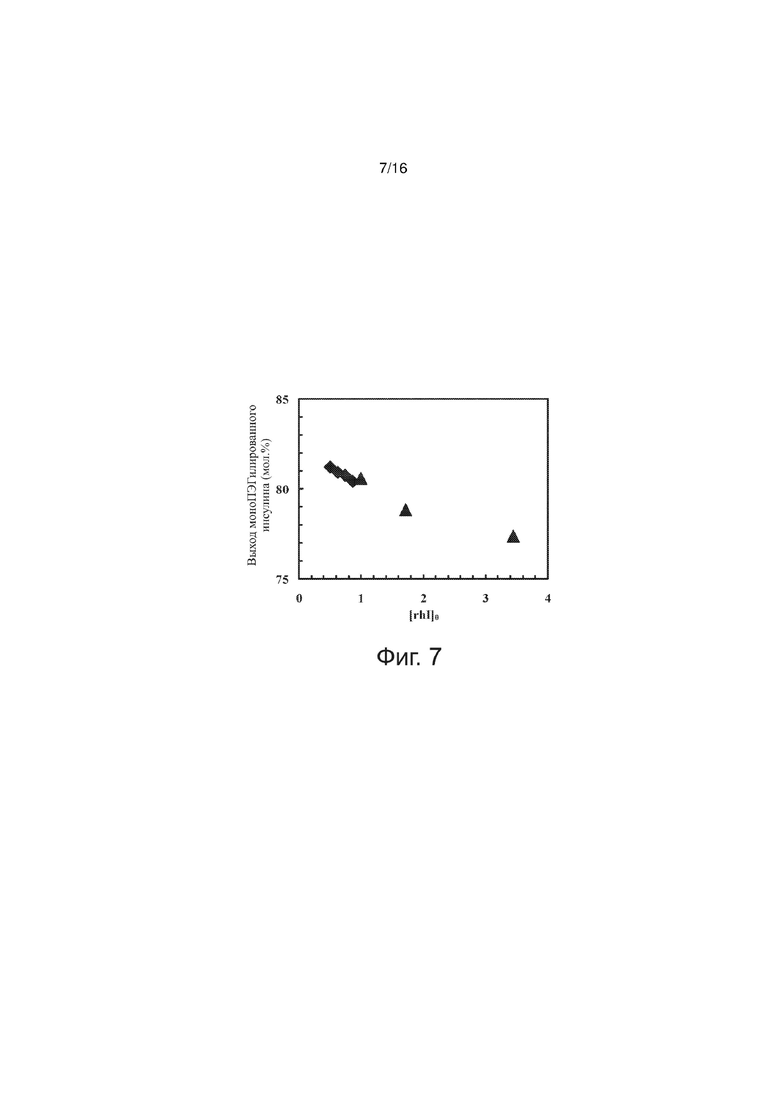
Фигура 7 точечный график, представляющий выход моноПЭГилированного инсулина как функцию исходной концентрации инсулина, по примерам изобретения.
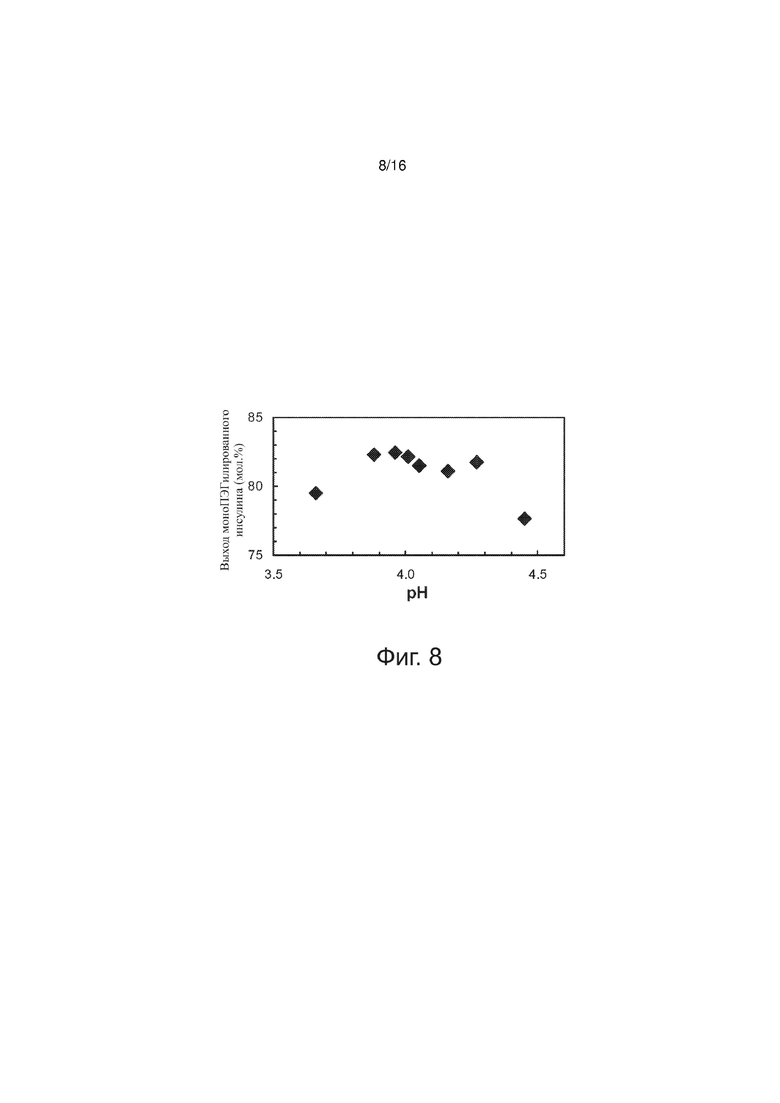
Фигура 8 точечный график, представляющий выход моноПЭГилированного инсулина как функцию рН, по примерам изобретения.
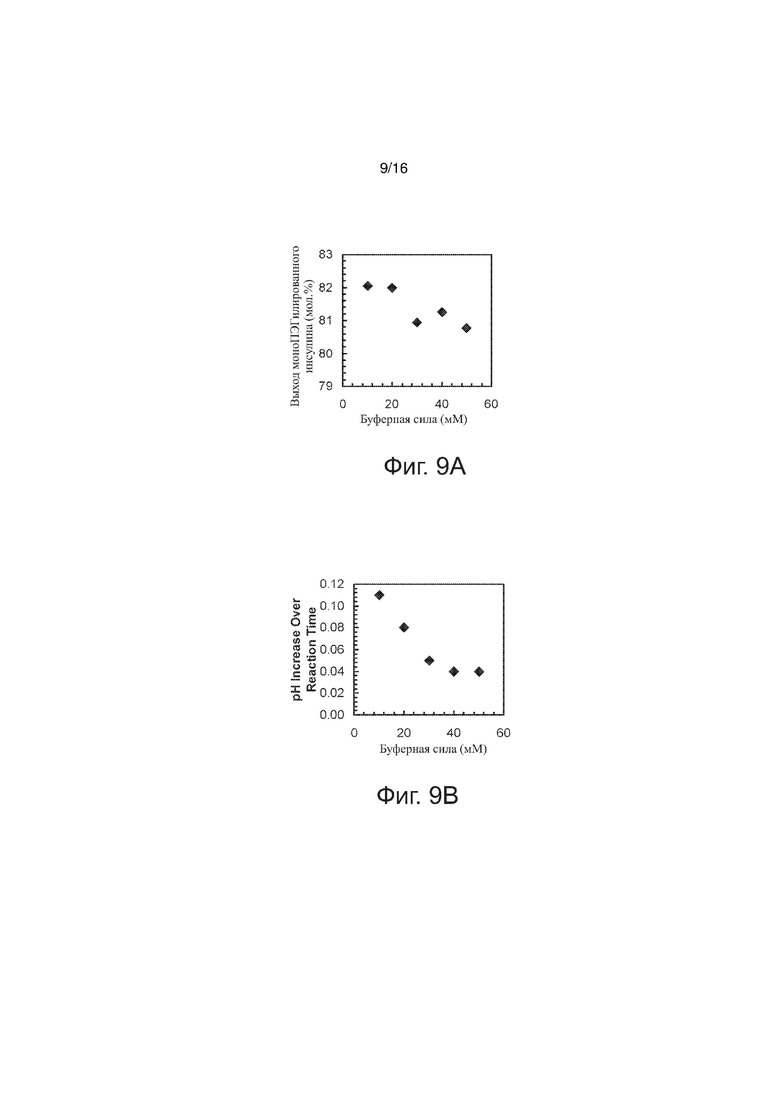
Фигуры 9A и 9B точечные графики, представляющие выход моноПЭГилированного инсулина как функцию буферной силы, по примерам изобретения.
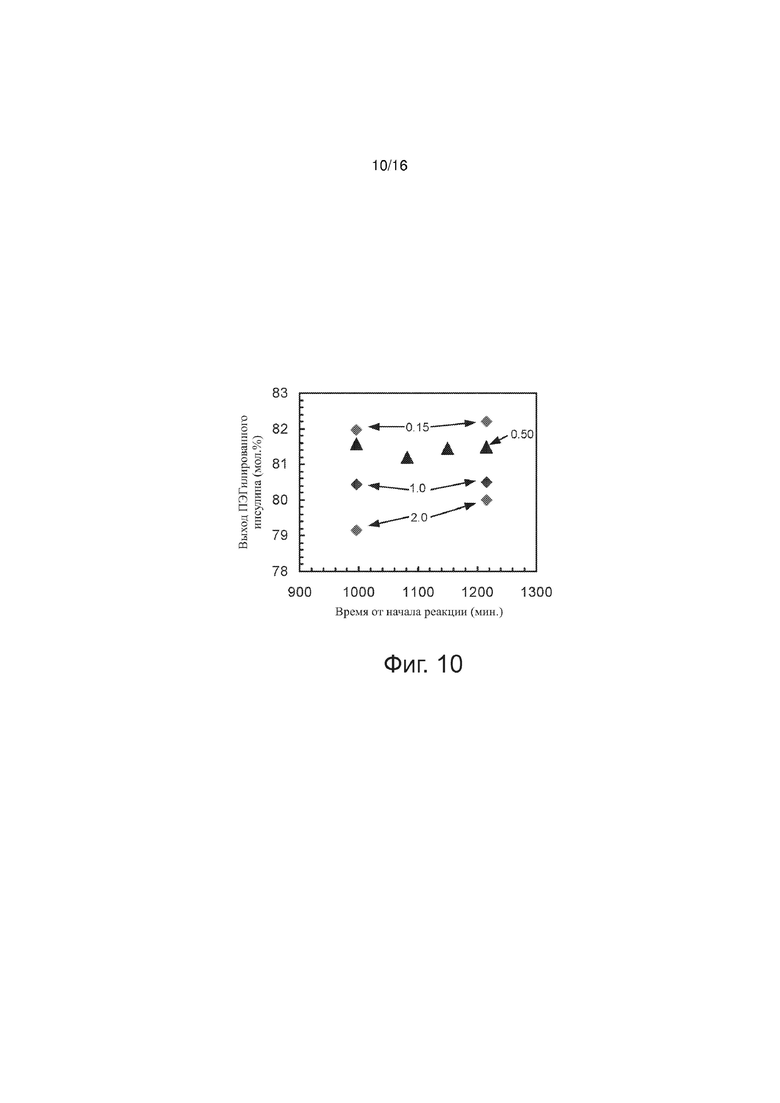
Фигура 10 точечный график, представляющий выход моноПЭГилированного инсулина как функцию времени, прошедшего с момента начала реакции ПЭГилирования, при различных соотношениях концентрации хелатирующего агента и исходной концентрации инсулина, по примерам изобретения.
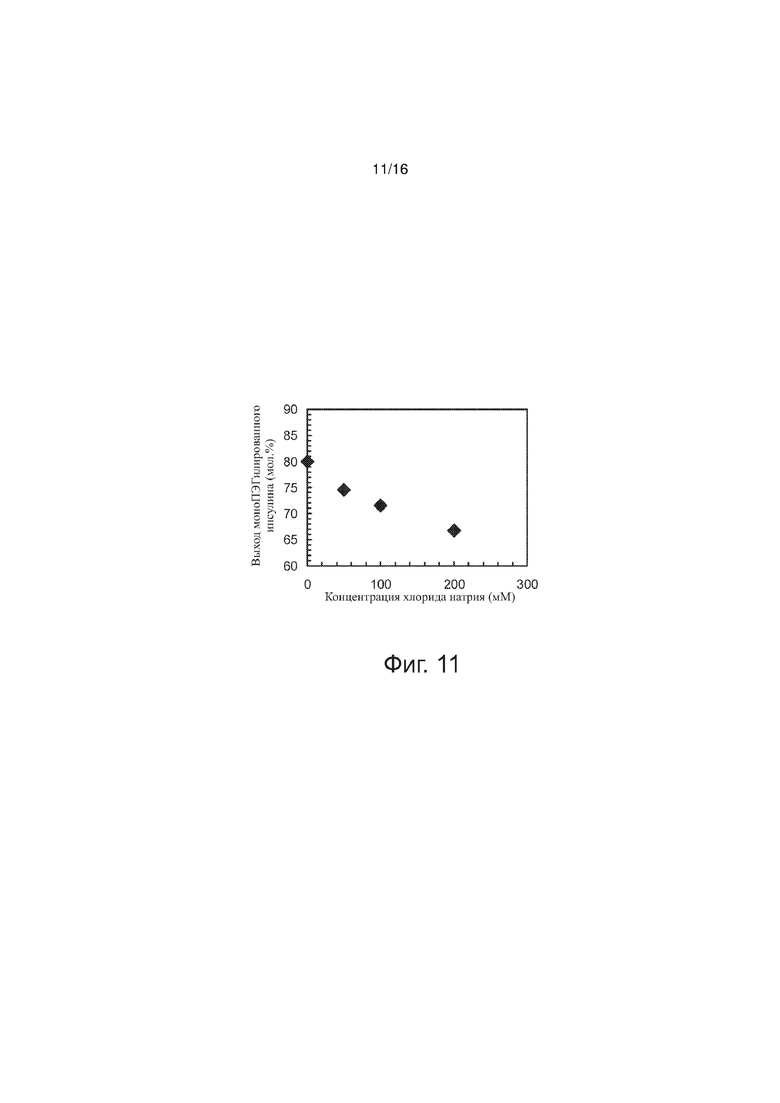
Фигура 11 - точечный график, представляющий выход моноПЭГилированного инсулина как функцию концентрации хлорида натрия, по примерам изобретения.
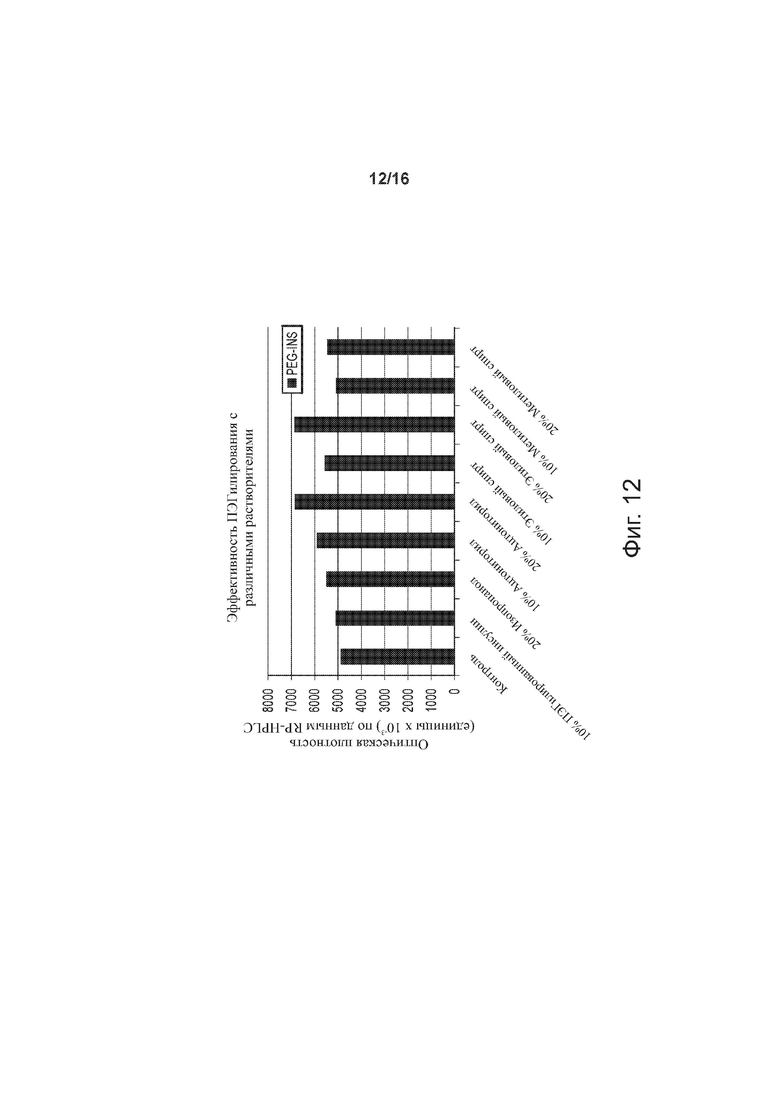
Фигура 12 – диаграмма, демонстрирующая эффективность ПЭГилирования при использовании различных растворителей, по примерам изобретения.
Фигура 13 диаграмма, демонстрирующая эффективность ПЭГилирования при различных рН и концентрациях восстанавливающего агента, по примерам изобретения.
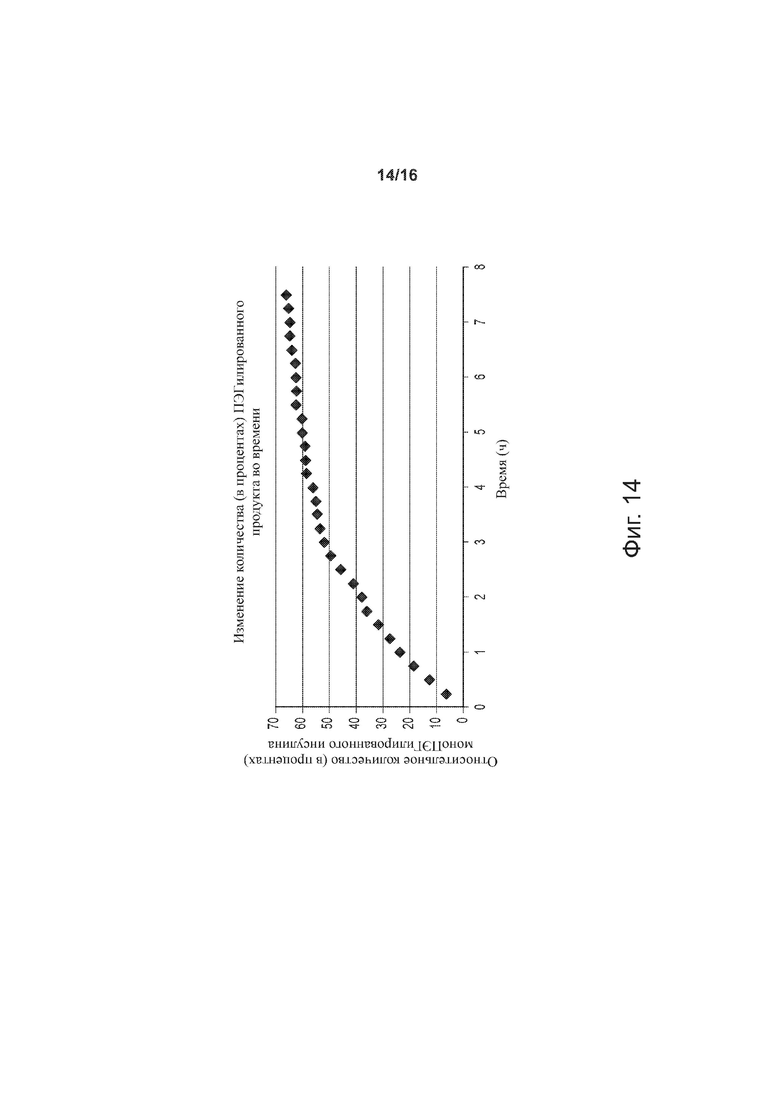
Фигура 14 - точечный график, представляющий относительное количество (в процентах) моноПЭГилированного инсулина как функцию времени, по примерам изобретения.
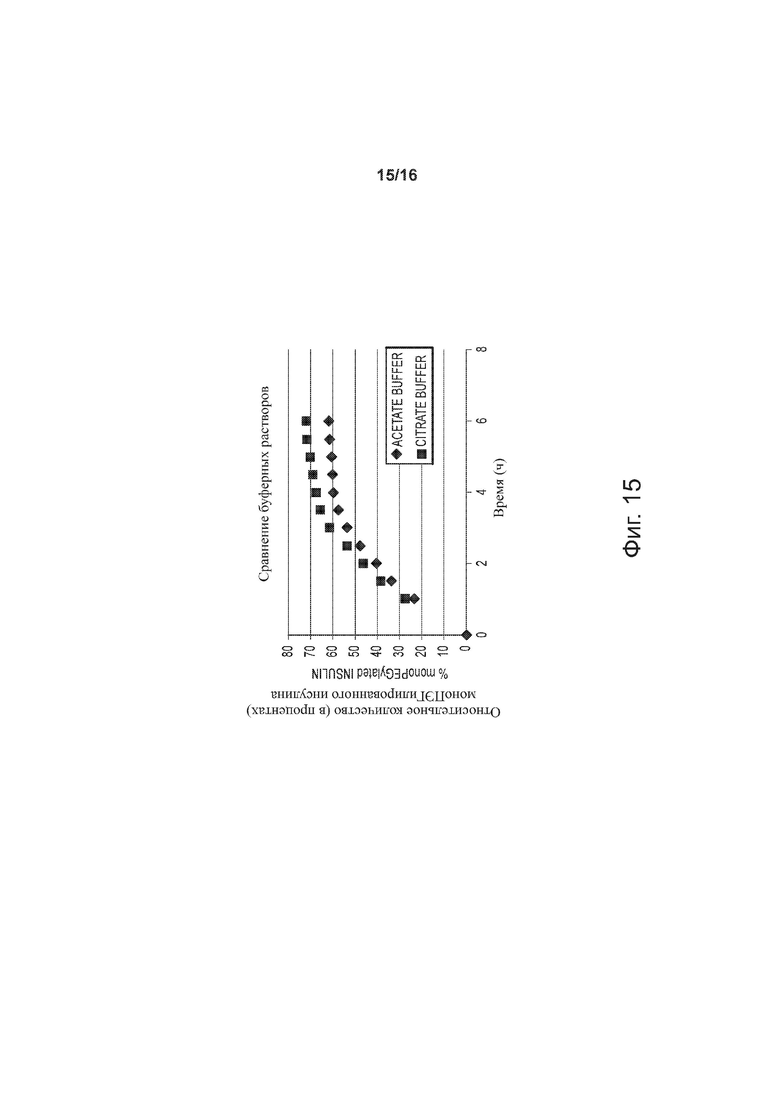
Фигура 15 – точечные графики, представляющие относительное количество (в процентах) моноПЭГилированного инсулина как функцию времени при использовании двух разных буферных растворов по примерам изобретения.
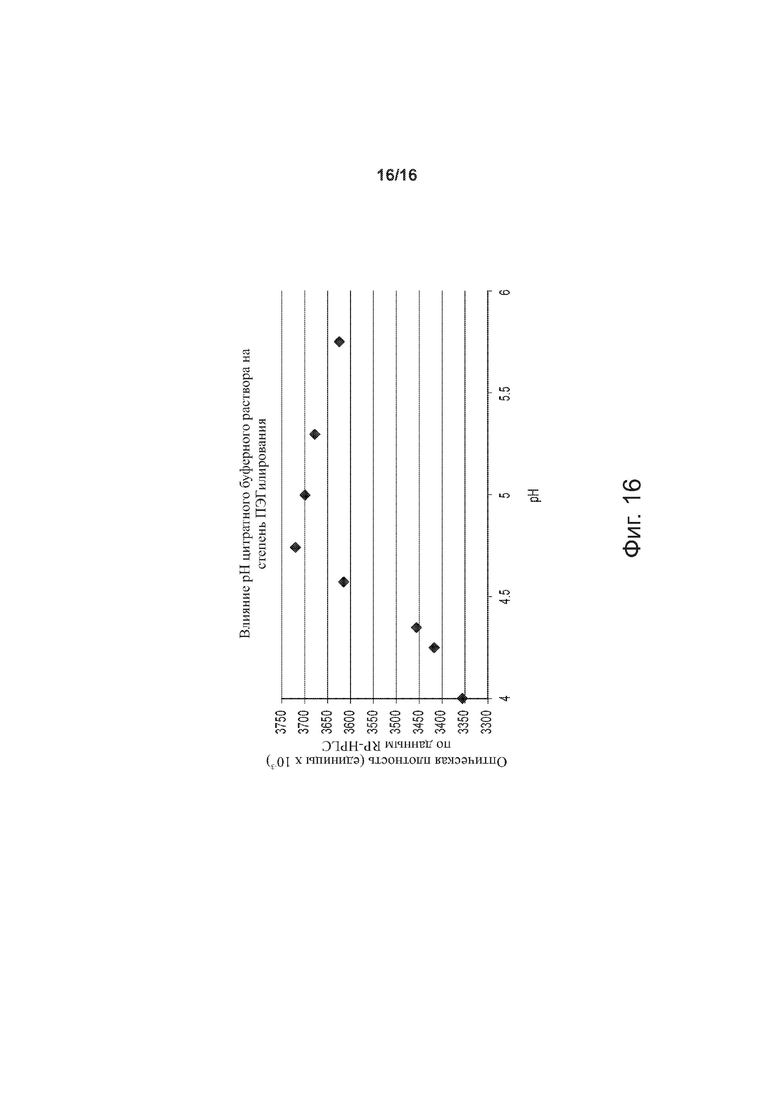
Фигура 16 – точечный график, демонстрирующий влияние рН цитратного буферного раствора на эффективность ПЭГилирования, по примерам изобретения.
Осуществление изобретения
Нативные белки, предполагаемые на роль медицински активного агента, не обязательно обладают желаемым концентрационным профилем и другими свойствами, ценными для такого агента. В результате ПЭГилирования, то есть присоединения к белковой молекуле полиэтиленгликоля (PEG), может способствовать введению пептидов и белков в организм пациента, что ведет к улучшению фармакологических свойств и повышению эффективности терапевтического воздействия. Полиэтиленгликоль - это неразветвленный полимер, субъединицами которого являются молекулы этиленгликоля; он растворим как в воде, так и во многих органических растворителях. Полиэтиленгликоль как материал гибкий, не токсичный и способен к биологической деградации. Благодаря свойствам полиэтиленгликоля увеличиваются растворимость и/или время полужизни белка или пептида в организме пациента.
Обычно применяемые методы получения сайт-специфичных конъюгатов белков с полиэтиленгликолем не отличаются высоким выходом, который оставляет лишь около 50%. Кроме того, эти методы предполагают больше этапов для защиты белковой молекулы от присоединения полиэтиленгликоля по менее предпочтительным сайтам или аминокислотным остаткам. В обычных методах ПЭГилирования белок должен претерпевать реакции в неблагоприятной для белковых молекул среде (высокие или низкие значения рН) в течение относительно продолжительного времени. Из-за низкого выхода и негативной для белков среды возрастает стоимость процесса и снижается клиническая эффективность воздействия.
Но при получении сайт-специфичных конъюгатов белок-полиэтиленгликоль возможно достигнуть более высокого выхода, чем обычными методами. При использовании альдегидов полиэтиленгликоля выход выше, чем при использовании эфиров полиэтиленгликоля. Более низкие рН способствуют специфичности в отношении N-концевого остатка фенилаланина цепи В инсулина. Что касается цианборгидрида натрия, то предпочтительны более низкие его концентрации, так как при более высоких концентрациях этого восстанавливающего агента может происходить восстановление альдегидной группы полиэтиленгликоля. Концентрации или соотношения различных компонентов выбирают так, чтобы максимально повысить выход реакции образования сайт-специфичного конъюгата белок-полиэтиленгликоль. Значения этих концентраций и соотношений могут быть в диапазонах, которые нельзя предсказать, исходя из данных о выходе реакции в условиях вне такого диапазона.
Примеры по изобретению включают способ получения конъюгатов белок-полиэтиленгликоль, изображенный на фиг. 1. Способ 100 включает приготовление водного раствора белка 102. Этот водный белковый раствор содержит белок, буферный раствор, обеспечивающий нужный рН, и хелатирующий агент. Белок, входящий в состав этого раствора, выбирают из группы, состоящей из инсулина, паратиреоидного гормона (PTH), фрагмента паратиреоидного гормона, гормона роста (например, человеческого гормона роста (hGH)), глюкагоноподобного пептида-1 (GLP-1), энфувиртида (Fuzeon®), и октреотида (Sandostatin®). Инсулин здесь включает человеческий инсулин. Буферный раствор включает неорганическую соль фосфорной кислоты.
Хелатирующий агент по изобретению выбирают из группы, состоящей из аминополикарбоновых кислот, гидроксиаминокарбоновых кислот, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF). Аминополикарбоновую кислоту выбирают из группы, состоящей из этилендиаминтетрауксусной кислоты (EDTA), диэтилентриаминпентауксусной кислоты (DTPA), нитрилотриуксусной кислоты (NTA), N-2-ацетамидо-2-иминодиуксусной кислоты (ADA), бис(аминоэтил)гликолевого эфира N,N,N’,N’-тетрауксусной кислоты (EGTA), транс-диаминоциклогексантетрауксусной кислоты (DCTA), глутаминовой кислоты и аспарагиновой кислоты. Аминополикарбоновые кислоты могут и не включать любое из этих соединений или любую группу этих соединений. Гидроксиаминокарбоновую кислоту выбирают из группы, состоящей из N-гидроксиэтилиминодиуксусной кислоты (HIMDA), N,N-бис-гидроксиэтилглицина и N-трис (гидроксиметил)метилглицина (трицина). N-замещенный глицин включает глицилглицин.
В способ 100 входит добавление борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида в водный белковый раствор. Восстанавливающий агент включает цианборгидрид натрия (NaCNBH3), диметиламинборан (Met2NHBH3), триметиламиноборан (Met3NBH3), 2-пиколинборан (2-метилпиридинборан C6H7NBH3), триацетоксиборгидрид натрия (NaBH(OAc)3), триэтиламиноборан (Et3NBH3), морфолинборан (C4H9ONBH), трет-бутиламиноборан (C4H11NBH3) или 5-этил-2-метил-пиридинборан (C8H11NBH3). В примерах по изобретению борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от около 25:1 до около 1,5:1; от около 22:1 до около 5,5:1; от около 22:1 до около 1,6:1 или от около 10:1 до около 5,5:1.
Восстанавливающим агентом может служить цианборгидрид натрия. В некоторых примерах по изобретению метод 100 также включает добавление цианборгидрида натрия и метоксиполиэтиленгликоля альдегида в водный раствор белка. В примерах по изобретению цианборгидрид натрия и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от около 5:1 до около 1,5:1; от около 4:1 до около 1,5:1; от около 5:1 до около 2:1 или от около 5:1 до около 3:1.
Также метод 100 может не включать взаимодействие эфира полиэтиленгликоля с белком. Полиэтиленгликоля альдегиды избирательно реагируют с первичными аминами, тогда как полиэтиленгликоля эфиры способны взаимодействовать с другими функциональными группами и с аминокислотами. В случае полиэтиленгликоля эфиров для желаемой реакции могут требоваться более высокие значения рН, чем в случае полиэтиленгликоля альдегидов.
Способ 100 также включает взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белок-полиэтиленгликоль. В этой реакции между альдегидной и аминогруппами может образовываться промежуточный продукт – имин. Эти реакции могут катализироваться кислотами и зависят от рН. В молекуле инсулина имеются три аминогруппы, доступные для присоединения полиэтиленгликоля. У каждой из этих групп свое значение pKa. Для аминогруппы в боковой цепи остатка лизина pKa = 10,5, для аминогруппы N-концевого остатка глицина pKa = 9,78, для N-концевого остатка фенилаланина pKa = 9,31. На избирательность аминогруппы в реакции с альдегидом может влиять pH. Буферный раствор обеспечивает поддержание pH водного белкового раствора во время реакции в диапазоне от 4,0 дo 6,0. Когда восстанавливающим агентом служит цианборгидрид, в процессе реакции pH может составлять от 4,0 дo 4,4.
В результате взаимодействия метоксиполиэтиленгликоля альдегида и белка образуется сайт-специфичный моноПЭГилированный белок в относительном количестве более 75%, более 85% или более 90% от всех конъюгатов белка с полиэтиленгликолем, полученных в примерах по изобретению. Например, белок может быть представлен инсулином, а сайт-специфичный моноПЭГилированный белок может включать конъюгат, в котором полиэтиленгликоль присоединен к инсулину по концевому остатку фенилаланина цепи В. Реакция с метоксиполиэтиленгликоля может происходить без перемешивания. Реакция с метоксиполиэтиленгликолем не требует этапов защиты одного или обоих остатков GlyA1 и LysB29. И можно не добавлять хлорид натрия или другие соли, увеличивающие проводимость смеси до тех пор, пока реакция не завершится или в основном не завершится.
Как показано на фиг. 2, примеры по изобретению включают способ 200 получения конъюгата инсулин-полиэтиленгликоль. Метод 200 включает приготовление водного раствора инсулина 202. Этот водный раствор инсулина содержит инсулин, буферный раствор, обеспечивающий нужный рН, органический растворитель и хелатирующий агент. Используемый в способе 202 хелатирующий агент включает этилендиаминтетрауксусную кислоту (EDTA) или любой из хелатирующих агентов, описанных в настоящем документе. Органический растворитель, используемый при этом, выбирают из группы, состоящей из этилового спирта, метилового спирта, диметилсульфоксида (DMSO), диоксана, ацетонитрила, диметилформамида (DMF) и N-метилпирролидона(NMP).
Способ 200 также включает добавление борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида 204 к водному раствору инсулина. Борсодержащий восстанавливающий агент включает любой из описанных в настоящем документе восстанавливающих агентов. Борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в любом из молярных соотношений, описанных в настоящем документе.
Способ 200 также включает взаимодействие метоксиполиэтиленгликоля альдегида и инсулина с образованием конъюгата инсулин-полиэтиленгликоль 206. В ходе этой реакции буферный раствор обеспечивает поддержание рН водного раствора инсулина в любом из описанных в настоящем документе диапазонов. В этих и других примерах по изобретению рН водного раствора инсулина в процессе указанной реакции может быть около 4,0 или иметь любое значение из диапазона рН, описанного в настоящем документе. В момент начала реакции метоксиполиэтиленгликоля альдегид и инсулин находятся в молярном соотношении от около 10:1 до около 1:1, или от около 8:1 до около 3:1, или от около 6:1 до около 4:1, или от около 5:1 до около 1:1 согласно примерам по изобретению.
В результате взаимодействия метоксиполиэтиленглколя альдегида с инсулином образуется конъюгат PEG-PheB1-инсулин в количестве более 75% или от 75% до 85% всех конъюгатов полиэтиленгликоля с инсулином, образующихся согласно примерам по изобретению.
Как изображено на фиг. 3, примеры по изобретению включают способ 300 получения микросфер, содержащих конъюгат инсулин-полиэтиленгликоль и обеспечивающих его замедленное высвобождение. Способ 300 включает приготовление водного белкового раствора 302, содержащего белок, буферный раствор с нужным рН и хелатирующий агент. Белок здесь может быть любым из белков, описанных ранее. Буферный раствор может быть любым из буферных растворов, описанных в настоящем документе. Хелатирующий агент может быть любым из хелатирующих агентов, описанных в настоящем документе.
[0001] Способ 300 также включает добавление борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида 304 к водному раствору инсулина. При этом борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в любом из молярных соотношений, описанных в настоящем документе.
Способ 300 включает также взаимодействие метоксиполиэтиленгликоля альдегида с белком, в результате чего образуется конъюгат белок-полиэтиленгликоль 306, причем в процессе этой реакции буферный раствор обеспечивает поддержание рН в любом из диапазонов pH, описанных в настоящем документе. Конъюгат белок-полиэтиленгликоль может быть сайт-специфично моноПЭГилированным белком – сайт-специфичным конъюгатом белок-полиэтиленгликоль, включая конъюгат PheB1-инсулин. Выход конъюгата PEG-PheB1-инсулин может составлять 75% - 85% или более 75% от всех конъюгатов инсулин-полиэтиленгликоль, образующихся согласно примерам по изобретению.
Также способ 300 включает смешивание конъюгата белко-полиэтиленгликоль в органическом растворителе с биоразлагаемым полимером 308. Используемый при этом органический растворитель может включать метиленхлорид (дихлорметан). Биоразлагаемый полимер выбирают из группы, состоящей из полилактида, полигликолида, поли(d,1-лактид-ко-гликолида); поликапролактона, полиортоэфира, сополимера простого и сложного эфиров и сополимера полилактида и полиэтиленгликоля. Здесь биоразлагаемый полимер может не включать какой-либо из описанных полимеров или групп полимеров.
Также способ 300 включает эмульгирование смеси конъюгата белко-полиэтиленгликоль и биоразлагаемого полимера 310 в водном растворе. Способ 300 включает отверждение эмульгированной смеси 312 конъюгата белок-полиэтиленгликоль и биоразлагаемого полимера с образованием микросфер, обеспечивающих замедленное высвобождение.
Примеры
Пример 1
Были проведены эксперименты в некотором диапазоне концентраций цианборгидрида натрия ([NaBH3CN]) для того, чтобы определить рабочие условия и границы использования цианборгидрида натрия для достижения стабильного выхода моноПЭГилированного инсулина (конъюгата инсулин-полиэтиленгликоль). В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,04), [EDTA]/[rhI]0 (0,17 – 0,18), температура (28°C), буферная сила (30 мМ), pH (4,0); здесь [rhI]0 – исходная концентрация человеческого рекомбинантного инсулина, [mPEGpropald]0 - исходная концентрация метоксипропиленгликоля альдегида; [EDTA] – концентрация этилендиаминтетрауксусной кислоты. Во всех экспериментах исходные реагенты были одинаковые. На фиг. 4 выход моноПЭГилированного инсулина (конъюгата полиэтиленгликоль-инсулин) представлен как функция концентрации цианборгидрида натрия. При взятом для этого значении [rhI]0, оптимальной с точки зрения выхода моноПЭГилированного инсулина является концентрация [NaBH3CN] от 1,0 мМ до 1,5 мМ. Но при концентрациях цианборгидрида натрия выше 2 мМ выход конъюгата полиэтиленгликоль-инсулин снижается. Разница между выходом указанного конъюгата при [NaBH3CN] = 1,0 мМ и при [NaBH3CN] = 1,5 мМ составляет приблизительно 2 молярных %. Если верхний предел концентрации цианборгидрида натрия должен позволять такие вариации выхода желаемого конъюгата, то верхнее значение диапазона [NaBH3CN] можно брать 4,0 мМ. Наибольшему наблюдавшемуся выходу моноПЭГилированного инсулина соответствовала концентрация NaBH3CN 1,5 мМ.
Пример 2
EDTA, будучи хелатирующим агентом, связывает ионы Zn2+, присутствующие в исходном реагенте – рекомбинантном человеческом инсулине и тем самым его солюбилизирует. Чтобы соответствовать Фармакопее США (USP), исходный реагент rhI должен содержать не более 1,00% (масса/масса) Zn2+. Концентрацию Zn2+ имитировали, заменяя в буферном растворе для реакции небольшую часть ацетата натрия соответствующим количеством ацетата цинка.
Был изучен узкий диапазон соотношения концентраций этилендиаминтетрауксусной кислоты и рекомбинантного человеческого инсулина ([EDTA]/[rhI]0). В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86-0,88 мМ), [mPEGpropald]0/[rhI]0 (1,04), [NaBH3CN] (1,2 мМ), температура (28°C), буферная сила (30 мМ), pH (4,0). В каждом опыте определяли выход моноПЭГилированного инсулина путем высокоэффективной жидкостной хроматографии с обращенной фазой (RPHPLC); на фиг. 5А полученные данные представлены как функция [EDTA]/[rhI]0. Эти результаты показывают, что максимальный выход желаемого конъюгата инсулина с полиэтиленгликолем достигается при [EDTA]/[rhI]0 = 0,25. При значениях [EDTA]/[rhI]0 больше 0,175 выход моноПЭГилированного инсулина колеблется вокруг значения 83,5%. При снижении уровня [EDTA]/[rhI]0 до 0,05 выход моноПЭГилированного инсулина уменьшается лишь немного (~ 3 молярных %).
Пример 3
Эксперимент, описанный в примере 2, повторили в более широком диапазоне значений соотношения [EDTA]/[rhI]0. В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,07), [NaBH3CN] (2,0 мМ), температура (28°C), буферная сила (40 мМ), pH (4,0). На фиг. 5В представлен выход моноПЭГилированного инсулина как функция [EDTA]/[rhI]0. В диапазоне, отраженном на фиг. 5В, наблюдалось снижение выхода желаемого конъюгата с увеличением [EDTA]/[rhI]0.
В примерах 2 и 3 опыты проводились с рекомбинантным человеческим инсулином, содержащим 0,36% (масса/масса) ионов Zn2+. Судя по фиг. 5A в диапазоне значений [EDTA]/[rhI]0 от 0,175 дo 0,50, выход конъюгата полэтиленгликоль-инсулин приблизительно одинаковый. Если рассматривать содержание ионов Zn2+, то этому диапазону соответствует диапазон значений [EDTA]/[Zn2+] от 0,55 до 1,56. При [EDTA]/[rhI]0 = 0,48 соответственно [EDTA]/[Zn2+] = 0,55. Исходя из данных, представленных на фиг. 5B, верхняя граница диапазона [EDTA]/[Zn2+] составляет 2,0. Однако с учетом времени реакции (см. пример 8) верхняя граница диапазона [EDTA]/[Zn2+] составляет 1,0.
Пример 4
Изучали влияние содержания ионов Zn2+ в рекомбинантном человеческом инсулине на выход моноПЭГилированного инсулина. Чтобы имитировать 0,0% (масса/масса) Zn2+ и 0,40% (масса/масса) Zn2+ в реакционную смесь с выделенным рекомбинантным человеческим инсулином добавляли ацетат цинка. Ацетат цинка добавляли к рекомбинантному человеческому инсулину производства компании Diosynth (лот # SIHR010-121306A) с содержанием ионов Zn2+ = 0.36% (масса/масса), чтобы получить 0,36% (масса/масса), 1,00% (масса/масса) и 1,22% (масса/масса) Zn2+. В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05-1,07), [NaBH3CN] (2,0 мМ), температура (28°C), pH (4,0). На фиг. 6 выход моноПЭГилированного инсулина представлен как функция содержания ионов Zn2+ в указанных препаратах инсулина. Данные, изображенные на фиг. 6, согласуются с тем, что показывают фиг. 5A и 5B. Значение [EDTA]/[rhI]0 брали близким к минимальному значению, нужному для стабильного выхода при содержании ионов Zn2+ в рекомбинантном человеческом инсулине, равном 1,0% (масса/масса), поэтому концентрация EDTA должна была быть соответственной этому минимуму при содержании ионов Zn2+ в области от 1,0% (масса/масса) до 1,2% (масса/масса). Как видно на фиг. 6, когда содержание ионов Zn2+ оказывается в области от 1,0% (масса/масса) до 1,2% (масса/масса), наблюдается относительно резкий спад выхода моноПЭГилированного инсулина. При снижении содержания ионов Zn2+ от 1,0% (масса/масса) до 0,0% (масса/масса) имеет место постепенное уменьшение выхода этого конъюгата. Это постепенное уменьшение выхода конъюгата инсулин-полиэтиленгликоль сходно с эффектом, демонстрируемым фиг. 5B – снижение выхода при увеличении количества EDTA, приходящегося на rhI/Zn2+. В этом примере наблюдалось, что изменения содержание ионов Zn2+ в диапазоне от 0,0% (масса/масса) до 1,0% (масса/масса) приводят к изменениям в выходе моноПЭГилированного инсулина, составляющим приблизительно 2,5 мол.% от rhI.
Пример 5
Были проведены эксперименты для диапазона исходной концентрации рекомбинантного человеческого инсулина ([rhI]0). Выход моноПЭГилированного инсулина определяли путем хроматографии RP-HPLC; на фиг. 7 выход реакции ПЭГилирования представлен как функция [rhI]0. С уменьшением исходной концентрации инсулина увеличивался выход его конъюгата с полиэтиленгликолем. Уменьшение [rhI]0 с 0,86 мМ дo 0,50 м сопровождается возрастанием выхода моноПЭГилированного инсулина всего лишь на 0,8 мол.%. Но при некоторой очень низкой исходной концентрации инсулина [rhI]0 реакция просто прекращается. По недавно собранным данным, это критическое значение [rhI]0 находится в диапазоне от 0,00 мМ до 0,50 мМ,
Значению [rhI]0 = 0,86 мМ отвечает 50 г рекомбинантного человеческого инсулина на 10 л реакционной смеси. Если загрузка постоянная, то всякому снижению исходной концентрации инсулина соответствует увеличение объема реакционной смеси. При большем ее объеме для достижения той же концентрации цианборгидрида натрия NaBH3CN его нужно больше по массе, а также требуется больше времени для очистки конъюгата инсулина с полиэтиленгликолем путем ионообменной хроматографии. Поскольку наблюдаемое влияние исходной концентрации инсулина [rhI]0 на выход его конъюгата с пеолиэтиленгликолем невелико в интервале концентраций 0,50 - 0,86 мМ, и соображений удобства и безопасности, описанных выше, рекомендуемая исходная концентрация [rhI]0 составляет 0,86 мМ, с нижним и верхним пределами 0,50 мМ и 1,0 мМ соответственно.
Пример 6
Были проведены эксперименты в диапазоне pH. В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,04), [NaBH3CN] (2,0 мМ), [EDTA]/[rhI]0 (0,175), температура (28°C), буферная сила (30 мМ). На фиг. 8 выход реакции ПЭГилирования представлен как функция pH. В диапазоне рН от 3,88 до 4,27 выход моноПЭГилированного инсулина варьировал от минимального значения до максимального менее чем на 1,5 мол.%. За пределами этого диапазона значения выхода варьировали гораздо значительнее. Искомое значение pH составляет 4,0; в области этого рН выход конъюгата инсулин-полиэтиленгликоль был максимальным.
Пример 7
Были проведены эксперименты по варьированию силы ацетатного буферного раствора. В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,07), [NaBH3CN] (2,0 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), pH (4,0). На фиг. 9A выход моноПЭГилированного инсулина представлен как функция силы ацетатного буферного раствора. Общая тенденция – чем ниже буферная сила, тем выше выход желаемого конъюгата, однако при изменении буферной силы с 10 мМ до 50 мМ выход указанного конъюгата изменяется лишь чуть больше чем на 1 мол.%. В реакционной смеси измеряли pH в начале и в конце реакции; на фиг. 9В изменение рН представлено как функция силы ацетатного буферного раствора. При буферной силе не менее 40 мМ, изменение рН за время протекания реакции, по-видимому, достигает плато. Чтобы изменение рН не выходило за пределы пределах 0,1 единицы pH, нижний предел буферной силы должен быть 20 мМ. Для стабильного ограничения рН реакционной смеси в разных партиях реагентов, искомое значение буферной силы составляет 30 мМ.
Пример 8
Выход моноПЭГилированного инсулина значительно увеличиваются в период между приблизительно 3 и 20 часами протекания реакции. Был проведен эксперимент, в котором в различные моменты времени в ходе реакции ПЭГилирования, в том числе через 16,6; 18,0; 19,2 и 20,3 часа после начала реакции, отбирали образцы из реакционной смеси. Соотношение [EDTA]/[rhI]0 варьировал: брали значения 0,15; 0,50; 1,0 и 2,0. В этом эксперименте соблюдалось постоянство следующих параметров: [rhI]0 = 0,86 мМ, [mPEGpropald]0/[rhI]0 = 1,07; [NaBH3CN] = 2,0 мМ; температура 28°C; буферная сила 30 мМ; pH 4,0. На фиг. 10 выход моноПЭГилированного инсулина представлен как функция времени от начала реакции; приведены данные для образцов, взятых в каждый из указанных четырех моментов времени. Цифрами на рисунке указаны различные значения [EDTA]/[rhI]0. Выход конъюгата инсулин-полиэтиленгликоль при [EDTA]/[rhI]0 = 0,50 несколько варьирует между моментами времени 16,6 ч и 20,3 ч. Вряд ли выход продукта снижается с увеличением времени реакции, поэтому его вариации отражают, скорее всего, вариабельность измерения и анализа, а не реальные изменения выхода конъюгата. В случае [EDTA]/[rhI]0 = 0,50 данные, представленные на фиг. 10, показывают, что после 16,6 ч от начала реакции и до 20,3 ч (максимальное время) большая продолжительность реакции не улучшает выход моноПЭГилированного инсулина по сравнению с моментом времени 16,6 ч. То же (то есть практически отсутствие изменений в промежутке времени от 16,6 ч после начала реакции до 20,3 ч) имеет место, по-видимому, при [EDTA]/[rhI]0 = 0,15 и 1,0, но не при [EDTA]/[rhI]0 = 2,0. При [EDTA]/[rhI]0 = 2,0 выход моноПЭГилированного инсулина возрастал приблизительно на 1мол.% за промежуток времени от 16,6 ч до 20,3 ч. Для того, чтобы выход конъюгата инсулин-полиэтиленгликоль через 16,6 ч после начала реакции достиг плато, верхний предел величины [EDTA]/[rhI]0 должен быть, по наблюдениям, 1,0.
Пример 9
Проверяли влияние изменения концентрации NaCl в реакционной смеси на выход моноПЭГилированного инсулина. В серии опытов соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [NaBH3CN] (1,5 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), буферная сила (30 мМ), pH (4,0). На фиг. 10 выход моноПЭГилированного инсулина представлен как функция [NaCl]. Степень превращения рекомбинантного человеческого инсулина отражает тенденцию, наблюдаемую в данных по выходу конъюгата (не показано). При концентрации хлорида натрия [NaCl] = 100 мМ или более в реакционной смеси перед добавлением цианборгидрида натрия присутствовал заметный осадок. (не показано). По этому примеру выход конъюгата инсулин-полиэтиленгликоль снижался в присутствии NaCl даже при концентрации 50 мМ; поэтому добавлять хлорид натрия для регуляции проводимости раствора следует после протекания реакции.
Пример 10
ПЭГилирование инсулина проводили с использованием 2-метилпиридинборана; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [2-метилпиридинборан] (1,5 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), сила ацетатного буферного раствора (30 мМ), pH (4,0). Эффективность присоединения полиэтиленгликоля по данным RP-HPLC составила 55% моноПЭГилирования B-цепи инсулина, причем моноПЭГилирования по N-концу А-цепи инсулина не выявлялось.
Пример 11
Оценивали влияние добавления растворителя на эффективность ПЭГилирования; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [2-метилпиридинборан] (20 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), сила ацетатного буферного раствора (30 мМ), pH (4,0). Результаты, представленные на фиг. 12, показывают, что наиболее благоприятный эффект в отношении выхода ПЭГилированного инсулина имели ацетонитрил (ACN) и этилацетат (EtAC), предположительно благодаря повышению растворимости инсулина. На фиг. 12 представлены также данные по изопропанолу (IPA) и метиловому спирту (MeOH).
Пример 12
Определяли влияние pH и концентрации 2-метилпиридинборана на эффективность присоединения полиэтиленгликоля к инсулину; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [EDTA]/[rhI]0 (0,5), температура (28°C), [ацетонитрил] (20%), сила ацетатного буферного раствора (30 мМ). Для определения концентрации конъюгата инсулин-полиэтиленгликоль в реакционной смеси применяли метод RP-HPLC. Результаты, представленные на фиг. 13, показывают, что при использовании в качестве восстановителя 2-метилпиридинборана в концентрации 5 мМ оптимальны значения pH в области 5.
Пример 13
Определяли степень ПЭГилирования инсулина; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [2-метилпиридинборан] (5 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), [ацетонитрил] (20%), сила ацетатного буферного раствора (30 мМ), pH 5. Для определения концентрации конъюгата инсулин-полиэтиленгликоль в реакционной смеси применяли метод RP-HPLC. На фиг. 14 представлены данные по относительному количеству (в процентах) моноПЭГилированного инсулина во времени. Реакции давали протекать в течение 16 часов; по истечении этого времени степень моноПЭГилирования составляла около 75% и считалась окончательной.
Пример 14
Определяли влияние состава забуферивающего агента на степень ПЭГилирования; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [2-метилпиридинборан] (5 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), [ацетонитрил] (20%), буферная сила (30 мМ), рН 5. Полученные результаты представлены на фиг. 15. Для определения концентрации конъюгата инсулин-полиэтиленгликоль в реакционной смеси применяли метод RP-HPLC. При использовании ацетатного буферного раствора степень ПЭГилирования была выше, чем в случае цитратного буферного раствора.
Пример 15
Определяли влияние рН цитратного буферного раствора на степень ПЭГилирования; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEGpropald]0/[rhI]0 (1,05), [2-метилпиридинборан] (5 мМ), [EDTA]/[rhI]0 (0,5), температура (28°C), [ацетонитрил] (20%), сила цитратного буферного раствора (30 мМ). Для определения концентрации конъюгата инсулин-полиэтиленгликоль в реакционной смеси через 3 часа после начала реакции применяли метод RP-HPLC. Полученные результаты представлены на фиг. 16.
Пример 16
Определяли влияние замены метоксиполиэтиленгликоля пропионового альдегида с молекулярной массой 5 кДа на метоксиполиэтиленгликоля N-гидроксисукцинимидный (NHS) эфир с молекулярной массой 5 кДа; при этом соблюдалось постоянство следующих параметров (значения указаны в скобках): [rhI]0 (0,86 мМ), [mPEG-NHSэфир]0/[rhI]0 (1,05), [EDTA]/[rhI]0 (0,5), температура (28°C), натрий-фосфатный буферный раствор 100 мМ; рН 6,5. Чрез 30 минут и через 1 час после начала реакции проводили анализ методом RP-HPLC, результаты которого показали, что реакция заканчивалась на том, что приблизительно 72% исходного инсулина оставалось не ПЭГилированным, 23% инсулина было ПЭГилировано по N-концу цепи B и 5% приходилось на другие формы ПЭГилированного инсулина. Этот пример показывает, что для ПЭГилирования инсулина по N-концу цепи В NHS-эфир метоксиполиэтиленгликоля менее эффективен, чем его пропионовый альдегид.
Пример 17
Были проведены эксперименты по ПЭГилированию с глюкагоноподобным пептидом 1 (GLP-1) в следующих условиях протекания реакции: [GLP-1]0 (1-2,5 мг/мл), [mPEGpropald]0/[GLP-1]0 (1,2), [NaCNBH3] (5 мМ), температура (25°C), сила ацетатного буферного раствора (10 мМ), pH (4,5). Через 16 после начала реакции ПЭГилирования реакционную смесь анализировали методом RP-HPLC. МоноПЭГилированный GLP-1 составлял 90-95%, не прореагировавший GLP-1 5-10% и диПЭГилированный GLP-1 1-2%. МоноПЭГилированный GLP-1 очищали путем катионообменной хроматографии, заменяли буферный раствор на 0,02%-ный раствор бикарбоната аммония и лиофилизировали. Получали микрочастицы, содержащие конъюгат PEG–GLP-1, применяя метод одинарной эмульсии типа «масло в воде» с экстракцией и выпариванием растворителя. Масляная фаза состояла из 8,5% (масса/объем) полимера PLGA (полилактид-ко-гликолида) и 5 мг/мл PEG–GLP-1, растворенных в дихлорметане (MeCl2). Масляную фазу эмульгировали путем вихревого перемешивания с 2,5-кратным избытком по объему 1%-ного (масса/объем) поливинилового спирта (PVA), и первичную эмульсию добавляли к 15-кратному избытку 0,3%-ного поливинилового спирта при перемешивании со скоростью 300 об/мин. Затем, примерно через 10 минут, прибавляли 30-кратный избыток 2%-ного изопропанола (IPA) и суспензию перемешивали, чтобы ускорить отверждение микросфер при испарении растворителя. Через 3 часа отвержденные микросферы отфильтровывали, промывали большим объемом дважды дистиллированной воды и лиофилизировали.
Пример 18
Были проведены эксперименты по ПЭГилированию с паратиреоидным гормоном (PTH 1-34) в следующих условиях протекания реакции: [PTH]0 (2,5 мг/мл), [mPEGpropald]0/[PTH]0 (1,2), [NaCNBH3] (20 мМ), температура (25°C), сила ацетатного буферного раствора (30 мМ), pH (4,5). Через 16 после начала реакции ПЭГилирования реакционную смесь анализировали методом RP-HPLC. МоноПЭГилированный паратиреоидный гормон составлял 68%, не прореагировавший РТН 24% и другие ПЭГилированные формы 8%. МоноПЭГилированный паратиреоидный гормон очищали путем катионообменной хроматографии, заменяли буферный раствор на 0,02%-ный раствор бикарбоната аммония и лиофилизировали. Получали микрочастицы, содержащие конъюгат PEG–РТН, применяя метод одинарной эмульсии типа «масло в воде» с экстракцией и выпариванием растворителя. Масляная фаза состояла из 8,5% (масса/объем) полимера PLGA и 1 мг/мл PEG–РТН, растворенных в дихлорметане (MeCl2). Масляную фазу эмульгировали путем вихревого перемешивания с 2,5-кратным избытком по объему 1%-ного (масса/объем) поливинилового спирта (PVA), и первичную эмульсию добавляли к 15-кратному избытку 0,3%-ного поливинилового спирта при перемешивании со скоростью 300 об/мин. Затем, примерно через 10 минут, прибавляли 30-кратный избыток 2%-ного изопропанола (IPA) и суспензию перемешивали, чтобы ускорить отверждение микросфер при испарении растворителя. Через 3 часа отвержденные микросферы отфильтровывали, промывали большим объемом дважды дистиллированной воды и лиофилизировали.
Пример 19
Были проведены эксперименты по ПЭГилированию с человеческим гормоном роста (hGH) в следующих условиях протекания реакции: [hGH]0 (2,5 мг/мл), [mPEGpropald]0/[ hGH]0 (3), [NaCNBH3] (20 мМ), температура (25°C), сила ацетатного буферного раствора (30 мМ), pH (5,5). Через 16 после начала реакции ПЭГилирования реакционную смесь анализировали методом RP-HPLC. МоноПЭГилированный человеческий гормон роста составлял 65%, не прореагировавший hGH 30% и другие ПЭГилированные формы 5%. МоноПЭГилированный человеческий гормон роста очищали путем анионообменной хроматографии, заменяли буферный раствор на 0,02%-ный раствор бикарбоната аммония и лиофилизировали. Получали микрочастицы, содержащие конъюгат PEG–hGH, применяя метод одинарной эмульсии типа «масло в воде» с экстракцией и выпариванием растворителя. Масляная фаза состояла из 8,5% (масса/объем) полимера PLGA и 1 мг/мл PEG–hGH, растворенных в дихлорметане (MeCl2). Масляную фазу эмульгировали путем вихревого перемешивания с 2,5-кратным избытком по объему 1%-ного (масса/объем) поливинилового спирта (PVA), и первичную эмульсию добавляли к 15-кратному избытку 0,3%-ного поливинилового спирта при перемешивании со скоростью 300 об/мин. Затем, примерно через 10 минут, прибавляли 30-кратный избыток 2%-ного изопропанола (IPA) и суспензию перемешивали, чтобы ускорить отверждение микросфер при испарении растворителя. Через 3 часа отвержденные микросферы отфильтровывали, промывали большим объемом дважды дистиллированной воды и лиофилизировали.
В настоящем описании с целью пояснения приведены многочисленные детали, чтобы обеспечить понимание различных примеров предлагаемой технологии. Специалистам в данной области техники должно быть понятно, что определенные примеры можно осуществить на практике без некоторых из этих деталей или с дополнительными деталями.
По ознакомлении с рядом описанных в настоящем документе примеров специалисту в данной области техники будет очевидно, что можно использовать различные модификации, альтернативные конструкции и эквиваленты без отступления от сущности изобретения. Кроме того, в настоящем документе не описан ряд хорошо известных способов и элементов во избежание излишнего загромождения изложения изобретения. Также детали какого-либо конкретного примера не всегда наличествуют в вариантах этого примера или могут быть добавлены в другие примеры.
Там, где в настоящем документе приводятся диапазоны величин, следует учесть, что каждое значение до десятой доли единицы нижней границы диапазона, промежуточное между его нижней и верхней границами, также конкретно включается в настоящее описание, если только из контекста не очевидно иное. Также включаются каждый более узкий диапазон между любыми указанными или промежуточными значениями данного диапазона и любое другое указанное или промежуточное значение в данном диапазоне. Верхние и нижние границы этих более узких диапазонов могут независимо включаться в данный диапазон или исключаться из него, а каждый диапазон, в котором одна из границ или обе, или ни одна из границ (не) включаются в указанные более узкие диапазоны, тоже охватываются изобретением при наличии какой-либо конкретно исключенной границы в указанном диапазоне. Когда указанный диапазон включает одну или обе границы, диапазоны, исключающие одну из или обе этих границы, тоже охватываются изобретением.
В настоящем документе и в прилагаемой формуле изобретения единственное число включает значение множественного числа, если из контекста не следует иного. Так, например, если написано «способ», то подразумевается множество таких способов; если написано «белок», то подразумеваются один или более белков и их эквивалентов, известных специалистам в данной области техники; и т.п. В настоящем документе изобретение описано в деталях с целью ясности и понятности изложения. Однако очевидно, что при практическом его осуществлении возможны определенные изменения и модификации в пределах объема прилагаемой формулы изобретения.


Группа изобретений относится к области медицины, а именно к способу получения конъюгата белок-полиэтиленгликоль. Способ включает в себя приготовление водного раствора белка, содержащего белок, буферный раствор, обеспечивающий нужный рН, и хелатирующий агент, где указанный белок является инсулином, указанный буферный раствор, обеспечивающий нужный рН, является ацетатным или цитратным, и указанный хелатирующий агент выбирают из группы, состоящей из аминополикарбоновой кислоты, гидроксиаминокарбоновой кислоты, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF); добавление в водный белковый раствор борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида, причем борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 25:1 до 1,5:1; и взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белок-полиэтиленгликоль, причем буферный раствор в процессе реакции обеспечивает рН водного белкового раствора от 3,88 до 4,27, и в результате указанного взаимодействия метоксиполиэтиленгликоля альдегида с указанным белком образуется конъюгат ПЭГ и белка, пэгилированного в одном положении. Группа изобретений также относится к способу получения конъюгата инсулин-полиэтиленгликоль и к способу получения микросфер замедленного высвобождения, содержащих конъюгат белка с полиэтиленгликолем. Группа изобретений обеспечивает получение пэгилированных белков с высоким выходом, а также большую эффективность лечения диабета и других заболеваний. 3 н. и 32 з.п. ф-лы, 16 ил., 19 пр.
1. Способ получения конъюгата белок-полиэтиленгликоль, включающий
- приготовление водного раствора белка, содержащего белок, буферный раствор, обеспечивающий нужный рН, и хелатирующий агент, где:
указанный белок является инсулином,
указанный буферный раствор, обеспечивающий нужный рН, является ацетатным или цитратным, и
указанный хелатирующий агент выбирают из группы, состоящей из аминополикарбоновой кислоты, гидроксиаминокарбоновой кислоты, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF);
- добавление в водный белковый раствор борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида, причем борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 25:1 до 1,5:1; и
- взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белок-полиэтиленгликоль, причем:
буферный раствор в процессе реакции обеспечивает рН водного белкового раствора от 3,88 до 4,27, и
в результате указанного взаимодействия метоксиполиэтиленгликоля альдегида с указанным белком образуется конъюгат ПЭГ и белка, пэгилированного в одном положении.
2. Способ по п. 1, в котором борсодержащий восстанавливающий агент выбирают из группы, состоящей из цианборгидрида натрия, диметиламиноборана, триметиламиноборана, 2-метилпиридинборана, триацетоксиборгидрида натрия, триэтиламиноборана, морфолинборана, трет-бутиламиноборана и 5-этил-2-метил-пиридинборана.
3. Способ по п. 1, в котором борсодержащий восстанавливающий агент является 2-метилпиридинбораном.
4. Способ по п. 1, в котором конъюгат ПЭГ и белка, пэгилированного в одном положении, представляет собой конъюгат PEG-PheB1-инсулин.
5. Способ по п. 1, в котором указанный хелатирующий агент является аминополикарбоновой кислотой, выбираной из группы, состоящей из этилендиаминтетрауксусной кислоты (EDTA), диэтилентриаминпентауксусной кислоты (DTPA), нитрилотриуксусной кислоты (NTA), N-2-ацетамидо-2-иминодиуксусной кислоты (ADA), бис(аминоэтил)гликолевого эфира N,N,N’,N’-тетрауксусной кислоты (EGTA), транс-диаминоциклогексантетрауксусной кислоты (DCTA), глутаминовой кислоты и аспарагиновой кислоты.
6. Способ по п. 1, в котором указанный хелатирующий агент является аминополикарбоновой кислотой и указанная аминополикарбоновая кислота является этилендиаминтетрауксусной кислотой (EDTA).
7. Способ по п. 1, в котором гидроксиаминокарбоновую кислоту выбирают из группы, состоящей из N-гидроксиэтилиминодиуксусной кислоты (HIMDA), N,N-бис-гидроксиэтилглицина и N-трис(гидроксиметил)метилглицина.
8. Способ по п. 1, в котором N-замещенный глицин представляет собой глицилглицин.
9. Способ по п. 1, в котором указанное молярное соотношение варьируется в диапазоне от 22:1 до 5,5:1.
10. Способ по п. 1, который исключает взаимодействие эфира полиэтиленгликоля с указанным белком.
11. Способ по п. 1, в котором рН водного раствора белка варьирует от 4,0 до 4,2.
12. Способ по п. 1, в котором указанный буферный раствор, обеспечивающий нужный рН, является ацетатным.
13. Способ по п. 1, в котором указанный буферный раствор, обеспечивающий нужный рН, является цитратным.
14. Способ по п. 1, в котором указанное молярное соотношение варьируется в диапазоне от 5:1 до 1,5:1.
15. Способ получения конъюгата инсулин-полиэтиленгликоль, включающий
- приготовление водного раствора инсулина, содержащего инсулин, буферный раствор, обеспечивающий нужный рН, органический растворитель и хелатирующий агент, представляющий собой этилендиаминтетрауксусную кислоту (EDTA);
- добавление в водный раствор инсулина борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида, причем борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 25:1 до 1,5:1; и
- взаимодействие метоксиполиэтиленгликоля альдегида и инсулина с образованием конъюгата инсулин-полиэтиленгликоль, причем:
буферный раствор в процессе реакции обеспечивает рН водного раствора инсулина от 3,88 до 4,27,
указанный буферный раствор, обеспечивающий нужный рН, является ацетатным или цитратным, и
в результате взаимодействия метоксиполиэтиленгликоля альдегида с инсулином образуется конъюгат ПЭГ и инсулина, пэгилированного в одном положении.
16. Способ по п. 15, в котором борсодержащий восстанавливающий агент выбирают из группы, состоящей из цианборгидрида натрия, диметиламиноборана, триметиламиноборана, 2-метилпиридинборана, триацетоксиборгидрида натрия, триэтиламиноборана, морфолинборана, трет-бутиламиноборана и 5-этил-2-метил-пиридинборана.
17. Способ по п. 15, в котором борсодержащий восстанавливающий агент является 2-метилпиридинбораном.
18. Способ по п. 15, в котором в момент начала реакции метоксиполиэтиленгликоля альдегид и инсулин присутствуют в молярном соотношении от 10:1 до 1:1.
19. Способ по п. 15, в котором борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 22:1 до 5,5:1.
20. Способ по п. 15, в котором органический растворитель выбирают из группы, состоящей из этилового спирта, метилового спирта, диметилсульфоксида (DMSO), диоксана, ацетонитрила, диметилформамида (DMF) и N-метилпирролидона (NMP).
21. Способ по п. 15, в котором органический растворитель является диоксаном.
22. Способ по п. 15, в котором инсулин является человеческим.
23. Способ по п. 15, в котором в результате взаимодействия метоксиполиэтиленгликоля альдегида с инсулином образуется конъюгат PEG-PheB1-инсулин, составляющий 75-85% всех образовавшихся конъюгатов инсулин-полиэтиленгликоль.
24. Способ по п. 15, в котором рН водного раствора белка варьирует от 4,0 до 4,2.
25. Способ по п. 15, в котором указанный буферный раствор, обеспечивающий нужный рН, является ацетатным.
26. Способ по п. 15, в котором указанный буферный раствор, обеспечивающий нужный рН, является цитратным.
27. Способ получения микросфер замедленного высвобождения, содержащих конъюгат белка с полиэтиленгликолем, включающий:
- приготовление водного белкового раствора, содержащего белок, буферный раствор, обеспечивающий нужный рН, и хелатирующий агент, где
указанный белок является инсулином,
указанный буферный раствор, обеспечивающий нужный рН, является ацетатным или цитратным, и
этот хелатирующий агент выбирают из группы, состоящей из аминополикарбоновой кислоты, гидроксиаминокарбоновой кислоты, N-замещенного глицина, 2-(2-aминo-2-oксоэтил)aминoэтансульфоновой кислоты (BES) и дефероксамина (DEF);
- добавление в водный белковый раствор борсодержащего восстанавливающего агента и метоксиполиэтиленгликоля альдегида, причем борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 25:1 до 1,5:1;
- взаимодействие метоксиполиэтиленгликоля альдегида и белка с образованием конъюгата белок-полиэтиленгликоль, причем буферный раствор в процессе реакции обеспечивает рН водного белкового раствора от 3,88 до 4,27;
- смешивание конъюгата белок-полиэтиленгликоль в органическом растворителе с полимером, способным к биологической деградации, с образованием смеси; и
- эмульгирование смеси конъюгата белок-полиэтиленгликоль и биоразлагаемого полимера в водном растворе с образованием эмульгированной смеси; и
- отверждение эмульгированной смеси конъюгата белок-полиэтиленгликоль и биоразлагаемого полимера с образованием микросфер замедленного высвобождения, где:
в результате указанного взаимодействия метоксиполиэтиленгликоля альдегида с указанным белком образуется конъюгат ПЭГ и белка, пэгилированного в одном положении, и
указанные микросферы замедленного высвобождения обеспечивают контролируемое высвобождение этого конъюгата белок-полиэтиленгликоль.
28. Способ по п. 27, в котором борсодержащий восстанавливающий агент выбирают из группы, состоящей из цианборгидрида натрия, диметиламиноборана, триметиламиноборана, 2-метилпиридинборана, триацетоксиборгидрида натрия, триэтиламиноборана, морфолинборана, трет-бутиламиноборана и 5-этил-2-метил-пиридинборана.
29. Способ по п. 27, в котором борсодержащий восстанавливающий агент является 2-метилпиридинбораном.
30. Способ по п. 27, в котором белок представляет собой инсулин, а конъюгат белок-полиэтиленгликоль представляет собой конъюгат ПЭГ и белка, сайт-специфично пэгилированного в одном положении, и указанный конъюгат ПЭГ и белка, сайт-специфично пэгилированного в одном положении, представляет собой конъюгат PEG-PheB1-инсулин.
31. Способ по п. 27, в котором хелатирующий агент представляет собой этилендиаминтетрауксусную кислоту (EDTA).
32. Способ по п. 27, в котором борсодержащий восстанавливающий агент и метоксиполиэтиленгликоля альдегид берут в молярном соотношении от 25:1 до 5:1.
33. Способ по п. 27, в котором органический растворитель является дихлорметаном.
34. Способ по п. 27, в котором биоразлагаемый полимер выбирают из группы, состоящей из полилактида, полигликолида, поли(d,1-лактид-ко-гликолида), поликапролактона, полиортоэфира, сополимера простого и сложного эфиров и сополимера полилактида и полиэтиленгликоля.
35. Способ по п. 27, в котором биоразлагаемый полимер является поли(d,1-лактид-ко-гликолидом).
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| RUHAAK L | |||
| R | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| - Т | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| - No | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| - С | |||
| Металлическая печь | 1924 |
|
SU2330A1 |
| NA D | |||
| H., Lee K | |||
| C | |||
| Capillary electrophoretic characterization of PEGylated human parathyroid hormone with matrix-assisted laser | |||
Авторы
Даты
2020-08-26—Публикация
2016-05-19—Подача