[0001] Настоящая заявка включает посредством ссылки перечень последовательностей, поданный с настоящей заявкой через EFS-Web в виде текстового файла под названием "IFNAR-350WO1_SL.txt", созданного 18 августа 2016 г. и имеющего размер 2490 байт.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к стабильному низковязкому составу на основе антител, где состав содержит высокую концентрацию антитела, которое специфически связывается с рецептором интерферона альфа 1 (IFNAR1), или его антигенсвязывающего фрагмента. В вариантах осуществления состав на основе антител содержит анифролумаб или его антигенсвязывающий фрагмент.
[0003] В некоторых вариантах осуществления настоящее изобретение относится к стабильному составу на основе антител, содержащему от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его фрагмента, которые специфически связываются с IFNAR1, от приблизительно 25 мM до приблизительно 130 мМ лизина или лизиновой соли; незаряженное вспомогательное вещество; поверхностно-активное вещество и буфер для составления. В некоторых вариантах осуществления настоящее изобретение относится к контейнеру, лекарственной форме и набору. В некоторых вариантах осуществления настоящее изобретение относится к способу получения и применения стабильного состава на основе антитела.
Предпосылки изобретения
[0004] Антитела применяли в лечении различных заболеваний и состояний вследствие их специфичности к распознаванию мишени, получая, таким образом, высокоизбирательные результаты после системного введения. Для того чтобы сохранить эффективность антител, нужно поддерживать их биологическую активность в ходе их
получения, очистки, транспортировки и хранения. Новые методики получения и очистки были разработаны для обеспечения возможности получения больших количеств моноклональных антител высокой степени очистки. Тем не менее, все еще существуют трудности со стабилизацией таких антител с целью транспортировки и хранения, и даже еще больше трудностей существует с получением антител в лекарственной форме, подходящей для введения.
[0005] Значительными препятствиями при составлении и хранении антител может быть денатурация, агрегация, загрязнение и образование частиц. Вследствие широкого разнообразия антител не существует универсальных составов или условий, подходящих для хранения всех видов антител. Оптимальные составы одного антитела часто специфичны только для данного антитела. Кроме того, составы на основе антитела могут нуждаться в дальнейшей подгонке к специфичному антителу, в зависимости от концентрации антитела и/или желаемого физического свойства, например, вязкости, состава на основе антитела. Составы для хранения антител часто представляют собой значительную часть процесса исследования и разработки коммерческого антитела.
[0006] Для преодоления трудностей, связанных со стабильностью антител, были предложены различные способы. Например, в некоторых случаях, антитело часто лиофилизируют, а затем разбавляют непосредственно перед введением. Однако, восстановление привносит дополнительную стадию в способ введения и может предусматривать введение загрязняющих веществ в состав. Кроме того, растворенные антитела могут подвергаться агрегации и образованию частиц. Следовательно, существует потребность в получении стабильных составов на основе антител, с которыми можно преодолеть трудности, связанные с транспортировкой и хранением.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] Настоящее изобретение относится к стабильному низковязкому составу на основе антител, где состав содержит высокую концентрацию антитела к рецептору интерферона альфа 1 или его антигенсвязывающему фрагменту. В некоторых вариантах осуществления настоящее изобретение относится, в целом, к стабильному составу на основе антител, содержащему от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела, которое специфически связывается с IFNAR1, или его фрагмента, от приблизительно 25 мМ до приблизительно 130 мМ лизина или лизиновой соли; незаряженное вспомогательное вещество, поверхностно-активное вещество и буфер для составления.
[0008] В вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему от приблизительно 100 мг/мл до приблизительно 200 мг/мл анифролумаба или его антигенсвязывающего фрагмента; от приблизительно 40 мМ до приблизительно 60 мМ лизина-HCl; от приблизительно 100 мМ до приблизительно 160 мМ дигидрата трегалозы; от приблизительно 0,02% до приблизительно 0,1% полисорбата-80; от приблизительно 15 мМ до приблизительно 35 мМ гистидина/гистидина-HCl, где состав характеризуется рН от приблизительно 5,5 до 6,5.
[0009] В дополнительных вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему от приблизительно 145 мг/мл до приблизительно 155 мг/мл анифролумаба или его антигенсвязывающего фрагмента; от приблизительно 45 мМ до приблизительно 55 мМ лизина-HCl; от приблизительно 120 мМ до приблизительно 140 мМ дигидрата трегалозы; от приблизительно 0,04% до приблизительно 0,08% полисорбата-80; и от приблизительно 20 мМ до приблизительно 30 мМ гистидина/гистидина-HCl, где состав характеризуется рН от приблизительно 5,8 до приблизительно 6,1.
[0010] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему приблизительно 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента; приблизительно 50 мМ лизина-HCl; приблизительно 130 мМ дигидрата трегалозы; приблизительно 0,05% полисорбата-80 и приблизительно 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН приблизительно 5,9.
[0011] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента; 50 мМ лизина-HCl; 130 мМ дигидрата трегалозы; 0,05% полисорбата-80; 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН приблизительно 5,9.
[0012] В дополнительных вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба; 50 мМ лизина-HCl; 130 мМ дигидрата трегалозы; 0,05% полисорбата-80; 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН 5,9.
[0013] В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической стандартной лекарственной форме, подходящей для парентерального введения человеку, которая содержит любой из описанных в данном документе составов на основе антитела в подходящем контейнере.
[0014] В некоторых вариантах осуществления настоящее изобретение относится к набору, содержащему любой описанный в данном документе состав на основе антитела, описанный в данном документе контейнер, описанную в данном документе стандартную лекарственную форму или предварительно заполненный шприц, описанный в данном документе.
[0015] В некоторых вариантах осуществления настоящее изобретение относится к способу получения стабильного состава на основе антител, при этом способ предусматривает очистку антитела до концентрации от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела к IFNAR или его антигенсвязывающего фрагмента, помещение выделенного антитела в стабилизирующий состав с получением стабильного состава на основе антител, где полученный в результате стабильный состав на основе антител содержит от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела; от приблизительно 25 мМ до приблизительно 130 мМ лизина или лизиновой соли; от приблизительно 100 мМ до приблизительно 150 мМ незаряженного вспомогательного вещества; от приблизительно 0,02% до приблизительно 0,1% поверхностно-активного вещества и буфер для составления.
[0016] В некоторых вариантах осуществления настоящее изобретение относится к способу лечения опосредованного IFN I типа заболевания или нарушения у нуждающегося в этом субъекта, при этом способ предусматривает введение терапевтически эффективного количества состава на основе антител любого из описанных в данном документе составов на основе антител.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0017] С целью иллюстрации изобретения, в графических материалах показаны некоторые варианты осуществления настоящего изобретения. Тем не менее, настоящее изобретение не ограничено точными схемами и средствами из вариантов осуществления, изображенных на графических материалах.
[0018] На фигуре 1 показана вязкость в зависимости от рН в высокопроизводительном способе скрининга на основе гранул.
[0019] На фигуре 2 показана вязкость в зависимости от концентрации лизина-HCl с применением высокопроизводительного способа скрининга на основе гранул.
[0020] На фигуре 3 показана вязкость в зависимости от концентрации антитела (анифролумаба) составов, содержащих 25 мМ гистидина/гистидина-HCl, 25 мМ лизина, 130 мМ трегалозы при рН 6,0 (круги) и 25 мМ гистидина/гистидина-HCL, 50 мМ лизина, 130 мМ трегалозы при рН 6,0 (ромбы).
[0021] На фигуре 4 показана вязкость в зависимости от концентрации антитела (анифролумаба) растворов, содержащих 0 мМ лизина (ромбы); 5 мМ лизина (квардаты); 12,5 мМ лизина (треугольники); 25 мМ лизина (иксы) и 50 мМ лизина (звездочки).
[0022] На фигуре 5 показана вязкость в зависимости от концентрации лизина-HCl растворов, содержащих 135 мг/мл анифролумаба (ромбы); 150 мг/мл анифролумаба (квардаты) и 180 мг/мл анифролумаба (треугольники).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0023] Прежде чем подробно описывать настоящее изобретение, следует понимать, что настоящее изобретение не ограничивается конкретными композициями или стадиями способов, поскольку таковые могут изменяться. Следует отметить, что используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают определяемые объекты во множественном числе, если из контекста явно не следует иное. Термины "один или несколько" и "по меньшей мере один" можно использовать в данном документе взаимозаменяемо.
[0024] Кроме того, выражение "и/или", если оно используется в данном документе, следует рассматривать как конкретное раскрытие каждого из двух указанных признаков или компонентов с другим или без другого. Таким образом, выражение "и/или" при употреблении в данном документе в такой фразе, как "А и/или В", должно включать "А и В", "А или В", "А" (отдельно) и "В" (отдельно). Аналогично, подразумевается, что термин "и/или", при употреблении в такой фразе, как "А, В и/или С", охватывает каждый из следующих вариантов осуществления: А, В и С; А, В или С; А или С; А или В; В или С; А и С; А и В; В и С; А (отдельно); В (отдельно) и С (отдельно).
[0025] В настоящем раскрытии все выражения процентного содержания, соотношения и т.п.указаны "по весу", если не указано иное. Используемое в данном документе выражение "по весу" является синонимичным с термином "по массе" и указывает на то, что соотношение или процентное соотношение, определенные в данном документе, получают исходя из веса, а не объема, толщины или какой-либо другой меры.
[0026] Используемый в данном документе термин "приблизительно" означает примерно, порядка, ориентировочно или около. Если термин "приблизительно" используется совместно с числовым диапазоном, то он модифицирует данный диапазон, расширяя границы выше и ниже изложенных числовых значений. В целом, термин "приблизительно" используется в данном документе для изменения числового значения выше и ниже приведенного значения с отклонением на 10%.
[0027] Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники, к которой относится настоящее изобретение. Например, Concise Dictionary of Biomedicine and Molecular Biology, Juo, Pei-Show, 2nd ed., 2002, CRC Press; The Dictionary of Cell and Molecular Biology, 3rd ed., 1999, Academic Press и Oxford Dictionary Of Biochemistry And Molecular Biology, Revised, 2000, Oxford University Press, обеспечивают специалиста общим словарем многих терминов и выражений, используемых в настоящем изобретении.
[0028] Единицы измерения, префиксы и символы обозначены в их форме, принятой согласно Международной системе единиц (SI). Числовые диапазоны включают числа, определяющие диапазон. Если не указано иное, то аминокислотные последовательности записаны слева направо в направлении от амино- к карбокси-концу. Приведенные в данном документе заголовки не ограничивают различные аспекты или варианты осуществления настоящего изобретения, которые могут обеспечиваться ссылкой на описание в целом. Соответственно, термины, приведенные непосредственно ниже, более полно определены посредством ссылки на описание во всей своей полноте.
[0029] Ясно, что какие бы варианты осуществления ни описывались в данном документе формулировкой "содержащий", другие аналогичные варианты осуществления, описываемые терминами "состоящий из" и/или "состоящий главным образом из", также предусмотрены.
[0030] В данном документе аминокислоты обозначены либо с помощью их общеизвестных трехбуквенных символов, либо с помощью однобуквенных символов, рекомендованных Комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично, нуклеотиды обозначены с помощью их общепринятых однобуквенных кодов.
[0031] Используемый в данном документе термин "усилие нагнетания" представляет собой величину давления (в ньютонах), необходимого для пропускания состава на основе антител через иглу.
[0032] Используемый в данном документе термин "аутоиммунное заболевание" обозначает нарушение, болезненное состояние или состояние, связанное с образованием аутоантител, реагирующих с собственными клетками пациента с образованием комплексов антиген-антитело. Термин "аутоиммунное заболевание" включает состояния, такие как, например, системная красная волчанка, а также те нарушения, которые вызваны определенным внешним фактором, например, острая ревматическая лихорадка. Примеры аутоиммунных нарушений включают без ограничения аутоиммунную гемолитическую анемию, аутоиммунный гепатит, болезнь Бергера, синдром хронической усталости, болезнь Крона, дерматомиозит, фибромиалгию, болезнь Грейвса, тиреоидит Хашимото, идиопатическую тромбоцитопеническую пурпуру, красный плоский лишай, рассеянный склероз, тяжелую миастению, псориаз, ревматическую лихорадку, ревматоидный артрит, склеродермию, синдром Шегрена, системную красную волчанку, сахарный диабет 1 типа, язвенный колит и витилиго. В определенных аспектах аутоиммунное заболевание представляет собой системную красную волчанку (SLE), склеродермию (SSe), миозит или волчаночный нефрит.
[0033] Термины "рецептор интерферона альфа-1," "IFNARI" и "IFNAR" используют взаимозаменяемо, и они включают варианты, изоформы, виды-гомологи IFNAR1 человека и аналоги, имеющие по меньшей мере один общий эпитоп с IFNARI. См., например, de Weerd et al., J. Bioi. Chern. 282:20053-20057 (2007). Соответственно, антитела человека, специфические в отношении IFNARI человека, в определенных случаях, перекрестно реагируют с IFNARI от других видов, отличных от человека, или другими белками, которые являются родственными по структуре IFNAR1 человека (например, гомологам IFNAR1 человека). В других случаях антитела могут являться полностью специфическими в отношении IFNARI человека и не проявляют видов или других типов перекрестной реактивности. Полная последовательность кДНК IFNAR1 человека имеет номер доступа в GenBank NM 000629.
[0034] Термины "интерферон I типа" или "IFN I типа", используемые в данном документе, относятся к представителям семейства интерферона I типа молекул, которые являются лигандами для IFNARI (т.е. представителям семейства интерферона I типа молекул, которые способны связываться с IFNAR1). Примерами лигандов интерферона I типа являются интерферон альфа 1, 2а, 2b, 4, 5, 6, 7, S, 10, 14, 16, 17, 21, интерферон бета и интерферон омега.
[0035] Термин "опосредованное IFN I типа заболевание или нарушение" относится к любому заболеванию, нарушению или состоянию, индуцируемым IFN I типа или IFN-a, которые проявляют профиль экспрессии фармакодинамического ("PD") маркера или генную сигнатуру IFN I типа (GS IFN I типа). Следует понимать, что профиль экспрессии PD маркера и генная сигнатура являются эквивалентными. Данные заболевания, нарушения или состояния включают таковые с аутоиммунным компонентом, такие как системная красная волчанка (SLE), склеродермия, волчаночный нефрит или миозит. Опосредованные IFN I типа заболевание или нарушение можно лечить посредством введения малой молекулы или биологического средства, например, антитела или его антигенсвязывающего фрагмента. Если терапевтическое средство представляет собой биологическое средство, оно может представлять собой антитело, специфическое в отношении любого подтипа(подтипов) IFN I типа или IFNα. Например, антитело может являться специфическим в отношении любого из IFNα1, IFNα2, IFNα4, IFNα5, IFNα6, IFNα7, IFNα8, IFNα10, IFNα14, IFNα17, IFNα21, IFNβ или IFNω. В качестве альтернативы антитело может являться специфическим в отношении любых двух, любых трех, любых четырех, любых пяти, любых шести, любых семи, любых восьми, любых девяти, любых десяти, любых одиннадцати, любых двенадцати подтипов IFN I типа или IFNα. Если антитело является специфическим в отношении более одного подтипа IFN I типа, антитело может являться специфическим в отношении IFNα1, IFNα2, IFNα4, IFNα5, IFNα8, IFNα10 и IFNα21; или оно может являться специфическим в отношении IFNα1, IFNα2, IFNα4, IFNα5, IFNα8 и IFNα10; или оно может являться специфическим в отношении IFNα1, IFNα2, IFNα4, IFNα5, IFNα8 и IFNα21; или оно может являться специфическим в отношении IFNα1, IFNα2, IFNα4, IFNα5, IFNα10 и IFNα21. Терапевтическое средство, которое модулирует активность IFNα, может нейтрализовать активность IFNα. Опосредованные IFN I типа заболевание или нарушение можно также лечить с помощью антител, специфических в отношении рецептора IFN I типа, например, IFNAR1. В некоторых аспектах антитела к IFNAR1 могут перекрестно реагировать с IFNAR1 от видов, отличных от человека. В других аспектах антитела к IFNAR1 могут являться специфическими в отношении только IFNAR1 и не проявляют видов или других типов перекрестной реактивности. В некоторых аспектах антитела к IFNAR1 проявляют пониженную аффинность связывания в отношении FC-лигандов и характеризуются пониженной или подавленной эффекторной функцией (ADCC и/или CDC), пониженным или подавленным связыванием с Fc-лигандами, или пониженной или подавленной токсичностью по сравнению с немодифицированным антителом.
[0036] Термин "MEDI-546" относится к Fc-модифицированной версии антитела к IFNAR 9D4, описанной в патенте США №7662381. Термины "MEDI-546" и "анифролумаб" в данном документе используют взаимозаменяемо. Последовательность MEDI-546 описана в U.S. 2011-0059078. MEDI-546 содержит комбинацию трех мутаций: L234F, L235E и P331S, где нумерация соответствует индексу EU, изложенному у Kabat, введенных в нижний шарнирный и СН2-домены IgGl человека, что вызывает снижение их связывания с FcyRI (CD64), FcyRIIA (CD32A), FcyRIII (CD16) и C1q человека. См., например, U.S. 2011/0059078 и Oganesyan et al. Acta Crystallographica D 64:700-704 (2008), которые включены в данный документ посредством ссылки во всей своей полноте. VH- и Vκ- последовательности MEDI-546 показаны в таблице 1.

[0037] Термин "антитело или его антигенсвязывающий фрагмент, которые модулируют активность IFN I типа" относится к антителу (см. выше) в своем наиболее широком смысле, способному модулировать активность IFN I типа у пациента. Используемый в данном документе термин "модулирование" включает ингибирование или подавление активности IFN I типа, а также индукцию или усиление активности IFN I типа. В определенных аспектах активность IFN I типа представляет собой активность IFNα. В некоторых аспектах подавление GS IFN I типа представляет собой подавление активности IFN I типа. В некоторых аспектах антитело или его антигенсвязывающий фрагмент являются моноклональными. В определенных аспектах антитело или его антигенсвязывающий фрагмент, которые модулируют активность IFN I типа, специфически связываются с рецептором IFN I типа, таким как IFNAR1. В некоторых конкретных аспектах антитело или его антигенсвязывающий фрагмент специфически связываются с субъединицей 1 IFNAR1.
[0038] Термин "антитело" используется в данном документе в своем наиболее широком смысле и включает, например, моноклональные антитела, поликлональные антитела, поливалентные антитела, мультиспецифические антитела, химерные антитела и гуманизированные антитела. Термин "антитело" включает целые антитела. Термин "антитело" также относится к белку, содержащему по меньшей мере две тяжелых (Н) цепи иммуноглобулина и две легких (L) цепи иммуноглобулина, соединенные между собой дисульфидными связями, или его антигенсвязывающему сегменту. Каждая тяжелая цепь состоит из вариабельного участка тяжелой цепи (в данном документе сокращенно VH) и константного участка тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CHI, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (в данном документе сокращенно VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL можно дополнительно подразделять на области гипервариабельности, называемые определяющими комплементарность областями (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FRI, CDRI, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
[0039] Термин "антигенсвязывающий фрагмент" относится к одному или нескольким фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, IFNAR). Было показано, что антигенсвязывающая функция антитела может осуществляться с помощью фрагментов антитела полной длины. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающий фрагмент" антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CHI; (ii) Р(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CHI; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и (vi) выделенную определяющую комплементарность область (CDR). Более того, несмотря на то, что два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединить с применением рекомбинантньгх способов с помощью синтетического линкера, который позволяет получить их в виде единой белковой цепи, в которой области VL и VH соединяются попарно с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv), см., например, Bird et al. (1988) Science 242:423-426 и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Подразумевается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающий фрагмент" антитела. Такие фрагменты антител получают с помощью традиционных методик, известных специалистам в данной области, и фрагменты проверяют на пригодность таким же образом, как и интактные антитела.
[0040] Подразумевается, что используемое в данном документе выражение "выделенное антитело" относится к антителу, которое фактически не содержит других антител, имеющих отличающиеся антигенные свойства (например, выделенное антитело, которое специфически связывается с IFNAR, фактически не содержит антител, которые специфически связываются с антигенами, отличными от IFNAR). Выделенное антитело, которое специфически связывается с IFNAR, может, тем не менее, обладать перекрестной реактивностью в отношении других антигенов, таких как молекулы IFNAR от других видов. Более того, выделенное антитело может фактически не содержать другой клеточный материал и/или химические вещества.
[0041] Используемый в данном документе термин "моноклональное антитело" относится к получению молекул антител одной молекулярной композиции. Моноклональное антитело проявляет одну специфичность связывания и аффинность в отношении определенного эпитопа.
[0042] Подразумевается, что используемый в данном документе термин "антитело человека" включает антитела, имеющие вариабельные области, в которых как каркасные области, так и области CDR получают из последовательностей иммуноглобулина человека зародышевого типа. Кроме того, если антитело содержит константную область, константную область также получают из последовательностей иммуноглобулина человека зародышевого типа. Антитела человека по настоящему изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина человека зародышевого типа (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo). Однако используемый в данном документе термин "антитело человека" не подразумевает включение антител, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающих, такого как мышь, привиты к человеческим каркасным последовательностям.
[0043] Термин "моноклональное антитело человека" относится к антителам, проявляющим одну специфичность связывания, которые имеют вариабельные области, в которых как каркасные области, так и области CDR получают из последовательностей иммуноглобулина человека зародышевого типа. В одном варианте осуществления моноклональные антитела человека продуцируются гибридомой, которая включает В-клетку, полученную от трансгенного животного, отличного от человека, например, трансгенной мыши, обладающей геномом, который содержит трансген тяжелой цепи и трансген легкой цепи человека, слитый с иммортализованной клеткой.
[0044] Используемый в данном документе термин "рекомбинантное антитело человека" включает все антитела человека, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, например (а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомными в отношении генов иммуноглобулина человека или гибридомы, полученной из него (описано далее ниже), (b) антитела, выделенные из клетки хозяина, трансформированной для экспрессии антитела человека, например, из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека, и (d) антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, которые включают сплайсинг последовательностей гена иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные области, в которых каркасные области и области CDR получают из последовательностей иммуноглобулина человека зародышевого типа. Тем не менее, в определенных вариантах осуществления такие рекомбинантные антитела человека могут подвергаться мутагенезу in vitro (или, при использовании животного, трансгенного в отношении последовательностей Ig человека, соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, будучи полученными из последовательностей VH и VL человека зародышевого типа и родственными им, не могут естественно находиться в наборе антител человека зародышевого типа in vivo.
[0045] Используемый в данном документе термин "антитело" также включает "химерные" антитела, в которых сегмент тяжелой и/или легкой цепи является идентичным или гомологичным соответствующим последовательностям в антителах, полученных от определенного вида или принадлежащих к определенному классу или подклассу антител, тогда как остальная часть цепи(цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (патент США №4816567 и Morrison et al, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
[0046] Базовые структуры антител в системах позвоночных являются относительно хорошо изученными. См., например, Harlow et al. (1988) Antibodies: A Laboratory Manual (2nd ed.; Cold Spring Harbor Laboratory Press).
[0047] В случае, когда есть два или более определения термина, который применяется и/или принят в данной области техники, подразумевается, что определение термина, используемого в данном документе, включает все такие значения, если явно не указано иное. Специфический пример представляет применение термина "определяющий комплементарность участок" ("CDR") для описания несмежных антиген-связывающих сайтов, встречающихся в пределах вариабельной области полипептидов как тяжелой, так и легкой цепи. Эта конкретная область была описана в Rabat et al. (1983) U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" и в Chothia and Lesk, J. Mol. Bioi. 196:901-917 (1987), которая включена в данный документ посредством ссылки, где определения включают перекрывания или подмножества аминокислотных остатков при сравнении друг с другом. Тем не менее, подразумевается, что применение одного из двух определений для обозначения CDR антитела или его вариантов находится в пределах объема термина, как определяется и применяется в данном документе. Соответствующие аминокислотные остатки, которые охватываются CDR, как определено согласно каждой из упомянутых выше ссылок, приведены ниже в таблице 2 для сравнения. Точное число остатков, которые охватываются конкретным CDR, будет варьировать в зависимости от последовательности и размера CDR. Специалисты в данной области могут обычным образом определить, какие остатки составляют конкретный CDR, с учетом аминокислотной последовательности вариабельной области антитела.
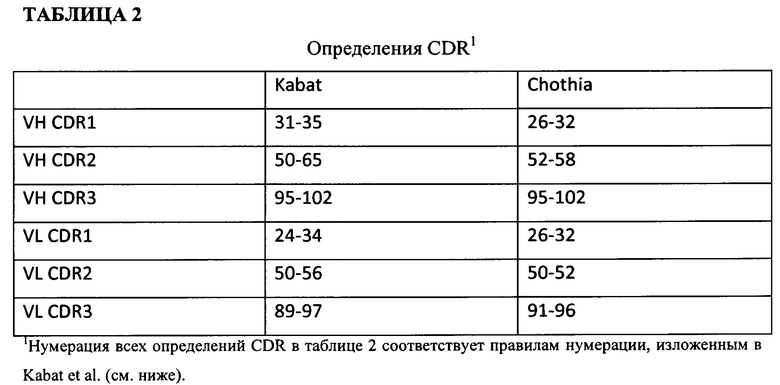
[0048] Kabat et al. также определили систему нумерации последовательностей вариабельного домена, которую можно применять к любому антителу. Специалист в данной области может однозначно соотнести эту систему "нумерации по Kabat" с любой последовательностью вариабельного домена, без использования каких-либо экспериментальных данных, помимо самой последовательности. Как используется в данном документе, "нумерация по Kabat" относится к системе нумерации, изложенной в Kabat et al. (1983) U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest". Если не указано иное, то ссылки на нумерацию специфических положений аминокислотных остатков в антителе к IFNAR или его антигенсвязывающем фрагменте, варианте или производном по настоящему изобретению приведены в соответствии с системой нумерации по Kabat.
[0049] Термины "лечить" или "лечение", используемые в данном документе, относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, где целью является предупреждение или замедление (уменьшение) нежелательного физиологического изменения или нарушения у субъекта, такого как прогрессирование воспалительного заболевания или состояния. Благоприятные или желаемые клинические результаты включают без ограничения облегчение симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (частичную либо полную), поддающуюся либо не поддающуюся обнаружению. Термин "лечение" может означать также увеличение выживаемости по сравнению с ожидаемой выживаемостью в том случае, если лечение не было получено. К нуждающимся в лечении относятся те, у кого уже есть состояние или нарушение, а также те, кто предрасположен к состоянию или нарушению, или те, у кого нужно предупреждать развитие состояния или нарушения.
[0050] Такие выражения как "осуществление лечения", или "лечение", или"лечить" относится как к (1) терапевтическим мерам, с помощью которых излечивают, замедляют, ослабляют симптомы диагностированного патологического состояния или расстройства и/или останавливают его прогрессирование, так и к (2) профилактическим или предупреждающим мерам, с помощью которых предупреждают и/или замедляют развитие патологического состояния или нарушения, на которое осуществляют нацеливание. Таким образом, к нуждающимся в лечении относят тех, у кого уже есть нарушение; тех, кто предрасположен к развитию нарушения, и тех, у кого нужно предупредить развитие нарушения.
[0051] Термины "эффективное количество", или "эффективное количество для", или "терапевтически эффективное количество" включают указание на дозировку терапевтического средства, достаточную для получения желаемого результата.
[0052] Под "субъектом" или "пациентом" подразумевается любой субъект, в частности, субъект-млекопитающее, для которого желательны диагностика, прогнозирование или терапия. Используемые в данном документе термины "субъект" или "пациент" включают любого человека или любое животное, отличное от человека. Термин "животное, отличное от человека" включает всех позвоночных животных, например, млекопитающих и животных, отличных от млекопитающих, таких как приматы, отличные от человека, овцы, собаки, кошки, лошади, коровы, медведи, цыплята, амфибии, рептилии и т.д. Используемые в данном документе фразы, такие как "пациент, имеющий опосредованное IFN I типа заболевание или нарушение" включают субъектов, таких как субъекты-млекопитающие, которые будут получать пользу от введения антитела или его антигенсвязывающего фрагмента, которые модулируют активность IFN I типа, например, для выявления, визуализации или другой диагностической процедуры, и/или от лечения, т.е. временного облегчения или предупреждения заболевания, с помощью такого антитела или его антигенсвязывающего фрагмента.
Составы на основе антитела
[0053] В вариантах осуществления настоящее изобретение предусматривает стабильный состав на основе антител, содержащий антитело к IFNAR1 или его антигенсвязывающий фрагмент. В вариантах осуществления антитело к IFNAR1 представляет собой анифролумаб. В вариантах осуществления составы по настоящему изобретению содержат как анифролумаб, так и его антигенсвязывающий фрагмент.
[0054] В вариантах осуществления составы на основе антител по настоящему изобретению содержат антитело или его антигенсвязывающий фрагмент, которые содержат последовательность домена VH, содержащую от 0 до 5 аминокислотных замен по сравнению с эталонным VH, имеющим аминокислотную последовательность под SEQ ID NO: 1.
[0055] В вариантах осуществления составы на основе антител по настоящему изобретению содержат антитело или антигенсвязывающий фрагмент, содержащие домен Vκ, содержащий 0-5 аминокислотных замен по сравнению с эталонным Vκ, имеющим аминокислотную последовательность под SEQ ID NO: 2.
[0056] В некоторых вариантах осуществления антитело в составе на основе антител очищают перед добавлением в состав на основе антител. Термины "выделять" и "очищать" относятся к отделению антитела от примесей или других загрязняющих веществ в композиции, в которой находится антитело, например, композиции, содержащей белки клетки-хозяина. В некоторых вариантах осуществления антитело очищено от примесей по меньшей мере на 50%, 70%, 80%, 90%, 95%, 98%, 99%, 99,5% или 99,9% (вес/вес). Например, в некоторых вариантах осуществления очистка антитела, например антитела к IFNAR1, будет включать отделение антитела от 99% (вес/вес) белков клетки-хозяина, первоначально присутствующих в композиции.
[0057] В некоторых вариантах осуществления термины "выделять" и "очищать" относятся к отделению антитела, например, антитела к IFNAR1, от примесей или других загрязняющих веществ в композиции в той степени, которая соответствует рекомендациям правительственной организации, например, Всемирной организации здравоохранения или Управления по контролю качества пищевых продуктов и лекарственных средств США.
[0058] Способы очистки антитела известны специалистам в данной области. Подходящие методики для проведения очистки включают различные типы хроматографии, такие как аффинная хроматография, хроматография с гидрофобным взаимодействием, ионообменная (например, катионообменная хроматография или хроматография смешанного типа), и фильтрацию.
[0059] Аффинная хроматография относится к способу разделения, при котором антитело, в силу своих свойств специфического связывания, связывается с аффинным лигандом для антитела. Функциональный аффинный лиганд может быть иммобилизован на твердой или полутвердой подложке, так что, когда композицию, содержащую антитело, пропускают над лигандом и твердой подложкой, антитело, имеющее специфическую аффинность связывания с лигандом, адсорбируется на лиганд, а один или несколько других компонентов композиции не адсорбируются или связываются с более низкой аффинностью и могут быть отделены от антитела. Примеры примесей, которые, как правило, не связываются (или плохо связываются) включают производственные примеси (например, белки клетки-хозяина, ДНК, компоненты среды) и некоторые родственные примеси (например, фрагменты антитела). В некоторых вариантах осуществления твердую подложку, содержащую лиганд, промывают один или несколько раз буфером для удаления дополнительных примесей перед удалением адсорбированного антитела с лиганда и подложки. После удаления одной или нескольких примесей адсорбированное антитело можно удалить (элюировать) с лиганда и подложки, что в результате приводит к выделению антитела с исходной композиции. Способы удаления антитела с лиганда и подложки зависят от лиганда и известны специалистам в данной области техники, и могут включать, например, изменения в окружающей среде, например, рН, добавление либо хаотропных средств, либо денатурирующих средств, или добавление коммерчески доступных элюирующих буферов. В некоторых вариантах осуществления более одного процесса аффинной очистки можно применять в отношении композиции с антителом. Различные аффинные лиганды известны из уровня техники, включая белок А и белок G (и их сочетания). Иммобилизованные лиганды являются коммерчески доступными. Например, аффинные системы с белком А включают MabSelect, MabSelect SuRe, MabSelect Xtra, MabSelect SuRe LX, Sepaharose CL-4B, ProSep vA, ProSep vA Ultra и Ceramic HyperD.
[0060] Ионообменная хроматография включает катионообменную хроматографию и хроматографию в смешанном режиме. Катионообменная хроматография относится к любому способу, посредством которого антитело и часть примеси или примесей можно разделить на основе различий заряда с использованием катионообменной матрицы. Катионообменная матрица обычно содержит ковалентно связанные отрицательно заряженные группы. Можно использовать слабые или сильные катионообменные смолы. Как правило, сильные катионообменные смолы содержат на подложке органические группы, включающие в зависимости от рН сульфоновую кислоту или сульфонатные группы. Слабые катионообменные смолы обычно содержат на подложке органические группы, включающие карбоновую кислоту или карбоксилатные группы, в зависимости от значения рН. В определенных вариантах осуществления можно использовать мультимодальные катионообменные смолы, которые включают дополнительные механизмы связывания, а также ионные взаимодействия, например, одно или несколько водородных связывающих взаимодействий, и гидрофобные взаимодействия. Примеры подходящих катионообменных смол хорошо известны в данной области и могут включать без ограничения Fractogel, карбоксиметил (СМ), сульфоэтил (SE), сульфопропил (SP), фосфат (Р) и сульфонат (S), PROP AC WCX-10™ (Dionex), Capto S, S-Sepharose FF, Fractogel EMD SO3M, Toyopearl Megacap II SP 550C, Poros 50 HS и SP-сефарозную матрицу. В некоторых вариантах осуществления более одного процесса катионообменной хроматографии можно применять в отношении композиции.
[0061] Хроматография в смешанном режиме относится к способу, в котором реализуется более одной формы взаимодействия между неподвижной фазой и аналитами для достижения их отделения от примесей (например, производственных примесей, таких как белки, ДНК клетки-хозяина и/или эндогенные или занесенные вирусы). Примеры анионообменных матриц известны из уровня техники и могут включать без ограничения Capto Adhere, Sartobind Q, Natrix Q, Chromasorb Q и Mustang Q.
[0062] В некоторых вариантах осуществления для удаления примесей можно применять дополнительные стадии фильтрации. Например, в некоторых вариантах осуществления используют нанофильтрацию или ультрафильтрацию. Нанофильтрация включает пропускание композиции через матрицу с размером пор, например, менее 75 нм, менее 50 нм и даже менее 15 нм, для отделения примесей, например, вирусов, от антитела. Коммерчески доступные нанофильтры и ультрафильтры, которые могут быть использованы, производятся различными поставщиками, такими как Millipore Corporation (Биллерика, Массачуссетс, например, Viresolve Pro и Viresolve Pro +), Pall Corporation (Ист Хиллз, Нью-Йорк), GE Healthcare Sciences (Пискатауэй, Нью-Джерси) и Sartorius Corporation (Геттинген, Германия).
[0063] В некоторых вариантах осуществления антитело, используемое в составах по настоящему изобретению, например, антитело к IFNAR, или его антигенсвязывающий фрагмент содержат определенную по Kabat последовательность VH из SEQ ID NO: 1 и определенную по Kabat последовательность Vκ под SEQ ID NO: 2, где антитело находится в составе в концентрация от 10 мг/мл до 300 мг/мл, от 30 мг/мл до 250 мг/мл, от 50 мг/мл до 200 мг/мл, от 100 мг/мл до 200 мг/мл, от 125 мг/мл до 175 мг/мл, от 130 мг/мл до 170 мг/мл, от 135 мг/мл до 165 мг/мл, от 140 мг/мл до 160 мг/мл, от 145 мг/мл до 155 мг/мл, 130 мг/мл, 135 мг/мл, 140 мг/мл, 145 мг/мл, 146 мг/мл, 147 мг/мл, 148 мг/мл, 149 мг/мл, 150 мг/мл, 151 мг/мл, 152 мг/мл, 153 мг/мл, 154 мг/мл, 155 мг/мл, 156 мг/мл, 157 мг/мл, 158 мг/мл, 159 мг/мл или 160 мг/мл. В некоторых вариантах осуществления антитело находится в концентрации приблизительно 50 мг/мл, 55 мг/мл, 60 мг/мл, 65 мг/мл, 70 мг/мл, 75 мг/мл, 80 мг/мл, 85 мг/мл, 90 мг/мл, 95 мг/мл, 100 мг/мл, 125 мг/мл, 130 мг/мл, 140 мг/мл, 150 мг/мл, 160 мг/мл, 170 мг/мл, 180 мг/мл, 190 мг/мл, 200 мг/мл.
[0064] Составы на основе антител по настоящему изобретению содержат лизин. Лизин является незаменимой аминокислотой, характеризующейся следующей структурой:
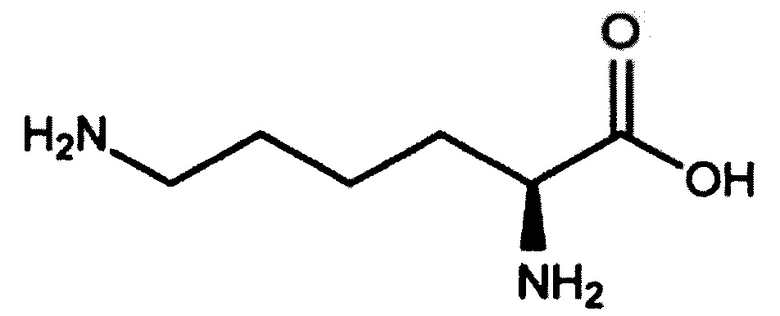
Используемый в данном документе лизин может включать свободную основную форму лизина, а также любые возможные его соли. В вариантах осуществления солевая форма лизина представляет собой ацетат лизина, монохлорид лизина, дихлорид лизина, L-аспартат лизина и L-глутамат лизина. В некоторых вариантах осуществления лизин включает его фармацевтически приемлемую соль. Например, лизин будет включать гидрохлорид лизина. Используемый в данном документе лизин также включает все энантиомеры (например, L-лизин и S-лизин) и любую комбинацию энантиомеров (например, 50% L-лизина и 50% S-лизина; 90%-100% L -лизина и 10%-0% S-лизина т.д.). В некоторых вариантах осуществления термин "лизин" включает более 99% L-лизина и менее 1% S-лизина. В некоторых вариантах осуществления термин "лизин" включает энантиомерно чистый L-лизин. В некоторых вариантах осуществления лизин представляет собой лизин фармацевтической степени чистоты.
[0065] В вариантах осуществления составы на основе антител по настоящему изобретение содержат от приблизительно 10 до приблизительно 100 мМ лизина, от приблизительно 20 до приблизительно 90 мМ лизина, от приблизительно 30 мМ лизина до приблизительно 80 мМ лизина, от приблизительно 40 до приблизительно 70 мМ лизина, от приблизительно 45 до приблизительно 65 мМ лизина, от приблизительно 45 до приблизительно 60 мМ лизина, от приблизительно 50 до приблизительно 55 мМ лизина в составе на основе антител, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела или приблизительно 150 мг/мл антитела. В вариантах осуществления составы по настоящему изобретению содержат приблизительно 50 мМ лизина-HCl в составе на основе антител, содержащем от 100 до 200 мг/мл антитела, или приблизительно 150 мг/мл антитела, незаряженное вспомогательное вещество, поверхностно-активное вещество и буфер для составления.
[0066] Составы на основе антител по настоящему изобретению могут содержать незаряженное вспомогательное вещество. Термин вспомогательное вещество относится к фармакологически неактивному веществу, составленному с антителом, как описано в данном документе. В некоторых вариантах осуществления вспомогательное вещество может способствовать предотвращению денатурации или иным образом способствовать стабилизации антитела. Подходящие вспомогательные вещества, которые можно использовать в фармацевтических композициях, известны из уровня техники. Примеры можно брать, например, из справочника: Gennaro, Alfonso R.: "Remington's Pharmaceutical Sciences", Mack Publishing Company, Easton, Pa., 1990. В некоторых вариантах осуществления вспомогательное вещество представляет собой "незаряженное" вспомогательное вещество, т.е. вспомогательное вещество не несет ни положительный "+", ни отрицательный "-" заряд. В некоторых вариантах осуществления вспомогательное вещество выбрано из группы, состоящей из фруктозы, глюкозы, маннозы, сорбозы, ксилозы, лактозы, мальтозы, сахарозы, декстрана, пуллулана, декстрина, циклодекстринов, растворимого крахмала, трегалозы, сорбита, эритрита, изомальта, лактита, мальтита, ксилита, глицерина, лактита, гидроксиэтилкрахмала, водорастворимых глюканов.
[0067] В некоторых вариантах осуществления незаряженное вспомогательное вещество в составе на основе антител имеет концентрацию от приблизительно 1 мМ до приблизительно 1 М, от приблизительно 2 мМ до приблизительно 500 мМ, от приблизительно 5 мМ до приблизительно 400 мМ, от приблизительно 10 мМ до приблизительно 300 мМ или от приблизительно 20 мМ до приблизительно 250 мМ. В некоторых вариантах осуществления незаряженное вспомогательное вещество в составе на основе антител имеет концентрацию от приблизительно 30 мМ до приблизительно 230 мМ, от приблизительно 40 мМ до приблизительно 220 мМ, от приблизительно 50 мМ до приблизительно 210 мМ, от приблизительно 60 мМ до приблизительно 210 мМ, от приблизительно 70 мМ до приблизительно 200 мМ, от приблизительно 80 мМ до приблизительно 190 мМ, от приблизительно 90 мМ до приблизительно 180 мМ, от приблизительно 100 мМ до приблизительно 170 мМ, от приблизительно 110 мМ до приблизительно 160 мМ, от приблизительно 120 мМ до приблизительно 150 мМ, от приблизительно 125 мМ до приблизительно 145 мМ, от приблизительно 125 мМ до приблизительно 140 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 135 мМ, приблизительно 140 мМ, приблизительно 150 мМ, приблизительно 160 мМ или приблизительно 170 мМ, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела. В одном варианте осуществления незаряженное вспомогательное вещество в составе с антителом составляет приблизительно 130 мМ. В некоторых вариантах осуществления незаряженное вспомогательное вещество в составе на основе антител имеет концентрацию от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 100 мМ до приблизительно 450 мМ, от приблизительно 110 мМ до приблизительно 350 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 140 мМ или приблизительно 145 мМ, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела или приблизительно 150 мг/мл антитела. В одном варианте осуществления незаряженное вспомогательное вещество в составе с антителом составляет приблизительно 130 мМ.
[0068] В некоторых вариантах осуществления незаряженным вспомогательным веществом является трегалоза, представленная формулой:
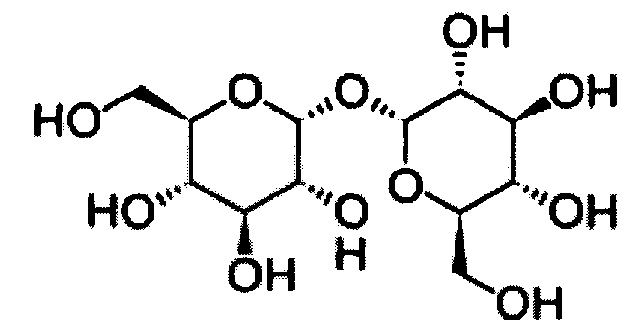
[0069] В некоторых вариантах осуществления трегалоза в составе на основе антител имеет концентрацию от приблизительно 1 мМ до приблизительно 1 М, от приблизительно 2 мМ до приблизительно 500 мМ, от приблизительно 5 мМ до приблизительно 400 мМ, от приблизительно 10 мМ до приблизительно 300 мМ или от приблизительно 20 мМ до приблизительно 250 мМ. В некоторых вариантах осуществления трегалоза в составе на основе антител имеет концентрацию от приблизительно 30 мМ до приблизительно 230 мМ, от приблизительно 40 мМ до приблизительно 220 мМ, от приблизительно 50 мМ до приблизительно 210 мМ, от приблизительно 60 мМ до приблизительно 210 мМ, от приблизительно 70 мМ до приблизительно 200 мМ, от приблизительно 80 мМ до приблизительно 190 мМ, от приблизительно 90 мМ до приблизительно 180 мМ, от приблизительно 100 мМ до приблизительно 170 мМ, от приблизительно 110 мМ до приблизительно 160 мМ, от приблизительно 120 мМ до приблизительно 150 мМ, от приблизительно 125 мМ до приблизительно 145 мМ, от приблизительно 125 мМ до приблизительно 140 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 135 мМ, приблизительно 140 мМ, приблизительно 150 мМ, приблизительно 160 мМ или приблизительно 170 мМ, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела. В одном варианте осуществления трегалоза в составе на основе антител имеет концентрацию приблизительно 130 мМ. В некоторых вариантах осуществления трегалоза в составе на основе антител имеет концентрацию от приблизительно 50 мМ до приблизительно 500 мМ, от приблизительно 100 мМ до приблизительно 450 мМ, от приблизительно 110 мМ до приблизительно 350 мМ, приблизительно 120 мМ, приблизительно 125 мМ, приблизительно 130 мМ, приблизительно 140 мМ или приблизительно 145 мМ, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела или приблизительно 150 мг/мл антитела. В одном варианте осуществления трегалоза в составе на основе антител имеет концентрацию приблизительно 130 мМ.
[0070] Различные другие компоненты можно включить в состав на основе антител. В некоторых вариантах осуществления состав на основе антител может содержать буфер (например, гистидиновый, ацетатный, фосфатный или цитратный буфер) и/или стабилизатор (например человеческий альбумин) и т.д. В некоторых вариантах осуществления состав на основе антител может содержать фармацевтически приемлемые носители, в том числе, например, ионообменные вещества, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, сахароза, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлозу, полиакрилаты, блок-сополимеры полиэтилена и полиоксипропилена и полиэтиленгликоль.
[0071] В некоторых вариантах осуществления состав с антителом дополнительно содержит поверхностно-активное вещество. В некоторых вариантах осуществления поверхностно-активное вещество выбрано из группы, состоящей из Triton Х-100, Tween 80, полисорбата-20, полисорбата-80, ноноксинола-9, полиоксамера, стеарилового спирта, додецилсульфата натрия и сорбитанмоностеарата.
[0072] В некоторых вариантах осуществления поверхностно-активное вещество представляет собой полисорбат-80, т.е. полиоксиэтилен-(20)-сорбитанмонолаурат, представленный формулой:

Полисорбат-80 (PS-80) коммерчески доступен от нескольких коммерческих поставщиков, например, Alkest® TW 80 (Univar®) и Tween® 80 (Sigma-Aldrich®). Заявители обнаружили, что в некоторых случаях посредством контроля концентрации PS-80 в составе на основе антител увеличивалась стабильность и снижалось количество образующихся частиц при хранении в течение длительных периодов времени.
[0073] В некоторых вариантах осуществления PS-80 в составе на основе антител имеет концентрацию от приблизительно 0,01% до приблизительно 0,1%, от приблизительно 0,02% до приблизительно 0,09%, от приблизительно 0,02% до приблизительно 0,08%, от приблизительно 0,03% до приблизительно 0,08%, от приблизительно 0,04% до приблизительно 0,07%, от приблизительно 0,05% до приблизительно 0,06%, приблизительно 0,02%, приблизительно 0,03%, приблизительно 0,04%, приблизительно 0,05%, приблизительно 0,06% приблизительно 0,07%, например, составе на основе антител, содержащем от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или приблизительно 150 мг/мл антитела. В некоторых вариантах осуществления PS-80 в составе на основе антител составляет приблизительно 0,05%.
[0074] В некоторых вариантах осуществления состав на основе антител дополнительно содержит буфер гистидин/гистидин-HCl. В некоторых вариантах осуществления состав на основе антител содержит от приблизительно 1 мМ до приблизительно 100 мМ, от приблизительно 5 мМ до приблизительно 80 мМ буфера гистидин/гистидин-HCl, от приблизительно 10 мМ до приблизительно 60 мМ буфера гистидин/гистидин-HCl, от приблизительно 15 мМ до приблизительно 50 мМ буфера гистидин/гистидин-HCl, от приблизительно 15 мМ до приблизительно 30 мМ буфера гистидин/гистидин-HCl или приблизительно 25 мМ буфера гистидин/гистидин-HCl в составах на основе антител по настоящему изобретение, например, составе на основе антител, содержащем от 100 до 200 мг/мл антитела или приблизительно 150 мг/мл антитела. В одном варианте осуществления буфер гистидин/гистидин-HCl в составе на основе антител имеет концентрацию приблизительно 25 мМ.
[0075] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента; 50 мМ лизина-HCl; 130 мМ незаряженного вспомогательного вещества; 0,05% поверхностно-активного вещества; 25 мМ буфера для составления, где состав характеризуется рН приблизительно 5,9.
[0076] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба; 50 мМ лизина-HCl; 130 мМ незаряженного вспомогательного вещества; 0,05% поверхностно-активного вещества; 25 мМ буфера для составления, где состав характеризуется рН приблизительно 5,9
[0077] В дополнительных вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба; 50 мМ лизина-HCl; 130 мМ дигидрата трегалозы; 0,05% полисорбата-80; 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН 5,9.
[0078] В некоторых вариантах осуществления настоящее изобретение относится к стабильному составу на основе антител, содержащему (а) от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, (b) от приблизительно 0,02% до приблизительно 0,1% полисорбата-80, (с) от приблизительно 100 мМ до приблизительно 160 мМ трегалозы, (d) от приблизительно 40 мМ до приблизительно 60 мМ L-лизина-HCl (е) и 15-35 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет от приблизительно 5,5 до приблизительно 6,5.
[0079] В дополнительных вариантах осуществления настоящее изобретение относится к стабильному составу на основе антител, содержащему (а) от приблизительно 145 мг/мл до приблизительно 155 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, (b) от приблизительно 0,04% до приблизительно 0,08% полисорбата-80, (с) приблизительно 120-140 мМ дигидрата трегалозы, (d) приблизительно 45-55 мМ L-лизина-HCl и (е) приблизительно 20-30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет от приблизительно 5,8 до приблизительно 6,1.
[0080] В дополнительных вариантах осуществления настоящее изобретение относится к стабильному составу на основе антител, содержащему (а) приблизительно 150 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, (b) приблизительно 0,05% полисорбата-80, (с) приблизительно 130 мМ дигидрата трегалозы, (d) приблизительно 50 мМ L-лизина-HCl и (е) приблизительно 25 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 5,9.
[0081] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента; 50 мМ лизина-HCl; 130 мМ дигидрата трегалозы; 0,05% полисорбата-80; 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН приблизительно 5,9.
[0082] В дополнительных вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему 150 мг/мл анифролумаба; 50 мМ лизина-HCl; 130 мМ дигидрата трегалозы; 0,05% полисорбата-80; 25 мМ гистидина/гистидина-HCl, где состав характеризуется рН 5,9.
[0083] В некоторых вариантах осуществления различные компоненты можно не включать в состав на основе антител, или он может "практически не содержать" данный компонент. Используемый в данном документе термин "практически не содержит" относится к составу с антителом, при этом указанный состав содержит менее 0,01%, менее 0,001%, менее 0,0005%, менее 0,0003% или менее 0,0001% указанного компонента.
[0084] Составы на основе антител могут характеризоваться различными осмолярными концентрациями. Способы измерения осмолярности составов с антителом известны специалистам в данной области техники и могут включать, например, осмометр (например, Advanced Instrument Inc 2020, осмометр, измеряющий понижение температуры замерзания). В некоторых вариантах осуществления состав имеет осмолярность 200-600 мосм/кг, 260-500 мосм/кг или 300-450 мосм/кг.
[0085] Состав на основе антител по настоящему изобретению может иметь различные уровни рН. В некоторых вариантах осуществления рН состава с антителом составляет от 4 до 7, от 4,5 до 6,5 или от 5 до 6. В некоторых вариантах осуществления рН состава с антителом составляет 5,0. В некоторых вариантах осуществления рН состава с антителом составляет 6,0. В некоторых вариантах осуществления рН состава на основе антител составляет ≤ 7,0. Различные средства можно использовать для достижения желаемого уровня рН, в том числе без ограничения добавление соответствующего буфера.
[0086] Описанные в данном документе составы на основе антител имеют различные значения вязкости. Способы измерения вязкости составов на основе антител известны специалистам в данной области и могут включать, например, измерение реометром (например, реометром Anton Paar MCR301 с любым из пластинчатых элементов размером 50 мм, 40 мм или 20 мм). В некоторых вариантах осуществления настоящего изобретения значения вязкости регистрировали при высоком пределе сдвига 1000 в секунду скорости сдвига. В некоторых вариантах осуществления состав с антителом имеет вязкость менее 20 сентипуаз (сП), менее 18 сП, менее 15 сП, менее 13 сП или менее 11 сП. В некоторых вариантах осуществления состав с антителом имеет вязкость менее 13 сП. Специалист в данной области техники поймет, что вязкость зависит от температуры, следовательно, если не указано иное, значения вязкости, представленные в данном документе, измерены при 25°С, если не указано иное.
[0087] Усилие нагнетания коррелирует с величиной сопротивления, создаваемого составом с антителом при введение субъекту состава с антителом. Усилие нагнетания будет зависеть от калибра иглы для введения, а также от температуры. В некоторых вариантах осуществления состав на основе антител характеризуется усилием нагнетания менее 15 Н, 12 Н, 10 Н или 8 Н при пропускании через тонкостенную иглу для спинномозговой пункции (STW) 27 калибра. В некоторых вариантах осуществления состав на основе антител характеризуется усилием нагнетания менее 15 Н, 12 Н, 10 Н или 8 Н при пропускании через STW иглу 29 калибра.
[0088] В дополнительных вариантах осуществления составы на основе антител по настоящему изобретению являются водным раствором. В некоторых вариантах осуществления состав с антителом не подвергали действию температур замораживания и/или не замораживали, т.е., он оставался в жидком состоянии. В некоторых вариантах осуществления антитело в составе с антителом не подвергали лиофилизации.
[0089] Используемый в данном документе термин "стабильность" в целом относится к сохранению целостности или к сведению к минимуму разрушения, денатурации, агрегации или развертывания биологически активного средства, такого как белок, пептид или другая биологически активная макромолекула. Используемый в данном документе термин "улучшенная стабильность" в целом означает, что при условиях, которые, как известно, приводят к разрушению, денатурации, агрегации или развертыванию, белок (например, антитело, такое как анифролумаб), пептид или другая биологически активная макромолекула, представляющая интерес, сохраняют большую стабильность по сравнению с контрольным белком, пептидом или другой биологически активной макромолекулой.
[0090] В некоторых вариантах осуществления стабильность относится к составу на основе антител, характеризующемуся уровнями образования частиц от низкого до невыявляемого. Используемая в данном документе фраза "уровни образования частиц от низкого до невыявляемого" относится к образцам, содержащим менее 1000 частиц/мл, менее 700 частиц/мл, менее 650 частиц/мл, менее 500 частиц/мл, менее 400 частиц/мл, менее 200 частиц/мл, менее 100 частиц/мл или менее 1 частицы/мл, что определяют с помощью анализа HIAC либо визуального анализа, где выявленные частицы превышают 10 микрон в размере, после хранения при приблизительно 40°С в течение приблизительно 18 месяцев. В некоторых вариантах осуществления в составе с антителом либо с помощью анализа HIAC, либо визуального анализа не обнаружено никаких частиц.
[0091] В некоторых вариантах осуществления стабильность относится к пониженной фрагментации антитела. В вариантах осуществления скорость фрагментации антитела, например, анифролумаба, в составах по настоящему изобретению составляет от приблизительно 2,0 до 4,0 процента в месяц в течение 12 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость фрагментации антитела, например, анифролумаба, в составах по настоящему изобретению составляет от приблизительно 2,0 до 4,0 процента в месяц в течение 6 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость фрагментации антитела, например, анифролумаба, в составах по настоящему изобретению составляет от приблизительно 2,0 до 4,0 процента в месяц в течение 2 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость фрагментации антитела, например, анифролумаба, в составах по настоящему изобретению составляет от приблизительно 3,0 до 4,0 процента в месяц в течение 2 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000.
[0092] В дополнительных вариантах осуществления стабильность относится к пониженной агрегации антитела. В вариантах осуществления скорость агрегации составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 0,5 до 2,5% в месяц в течение 12 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость агрегации составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 0,5 до 2,5% в месяц в течение 6 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость агрегации составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 0,5 до 2,5% в месяц в течение 2 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В дополнительных вариантах осуществления скорость агрегации составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 1 до 2% в месяц в течение 2 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000.
[0093] В дополнительных вариантах осуществления стабильность относится к пониженным потерям чистоты. В вариантах осуществления скорость потери чистоты составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 3 до 5% в месяц в течение 12 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В вариантах осуществления скорость потери чистоты составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 3 до 5% в месяц в течение 6 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000. В дополнительных вариантах осуществления скорость потери чистоты составов на основе антител по настоящему изобретению, содержащих, например, анифролумаб, составляет от приблизительно 3,5 до 4,5% в месяц в течение 2 месяцев, что определяют с помощью анализа HP-SEC, проведенного на системе Agilent HPLC с колонкой TSK-Gel G3000.
[0094] Специалист в данной области поймет, что стабильность белка зависит от других характеристик, помимо композиции состава. Например, на стабильность могут воздействовать температура, давление, влажность, рН и внешние формы ионизирующего излучения. Следовательно, если не определено иное, считается, что упоминаемую в данном документе стабильность измеряют при температуре 40°С, давлении в одну атмосферу, относительной влажности 50%, рН 6,0 и нормальных фоновых уровнях ионизирующего излучения. Стабильность антитела в составе с антителом можно определить с помощью различных средств. В некоторых вариантах осуществления стабильность антитела определяют с помощью эксклюзионной хроматографии (SEC). С помощью SEC разделяют аналиты (например, макромолекулы, такие как белки и антитела) на основании сочетания их гидродинамического размера, коэффициента диффузии и поверхностных свойств. Таким образом, например, с помощью SEC можно отделять антитела в их естественной трехмерной конформации от антител в различных состояниях денатурации и/или антител, которые подверглись разрушению. В SEC неподвижная фаза обычно состоит из инертных частиц, упакованных в плотную трехмерную матрицу внутри стеклянной или стальной колонки. Подвижная фаза может представлять собой чистую воду, водный буфер, органический растворитель, их смеси или другие растворители. Частицы неподвижной фазы имеют небольшие поры и/или каналы, которые позволяют прохождение только молекул размером меньше определенной величины. Большие частицы, таким образом, исключаются из этих пор и каналов, а меньшие частицы удаляются из текучей подвижной фазы. Время, которое частицы проводят иммобилизированными в порах в неподвижной фазе, зависит отчасти от того, как далеко они могут проникать в поры. Их удаление из потока подвижной фазы является причиной их более длительного элюирования из колонки и приводит к разделению между частицами исходя из различий в их размере.
[0095] В некоторых вариантах осуществления SEC объединяют с методикой идентификации для идентификации или получения характеристик белков или их фрагментов. Идентификацию и характеристику белка можно выполнить с помощью различных методик, в том числе без ограничения хроматографических методик, например, высокоэффективной жидкостной хроматографии (HPLC), иммуноанализов, электрофореза, спектроскопии в ультрафиолетовой/видимой/инфракрасной областях спектра, спектроскопии комбинационного рассеяния, резонансной спектроскопии усиленного поверхностью комбинационного рассеяния, масс-спектроскопии, газовой хроматографии, статического светорассеяния (SLS), инфракрасной спектроскопии с преобразованием Фурье (FTIR), кругового дихроизма (CD), методик развертывания белка под воздействием мочевины, собственной флуоресценции триптофана, дифференциальной сканирующей калориметрии и/или связывания белка с ANS.
[0096] В некоторых вариантах осуществления идентификацию белка осуществляют посредством жидкостной хроматографии высокого давления. Различные инструменты и устройства для проведения HPLC известны специалистам в данной области. В целом, HPLC включает загрузку жидкого растворителя, содержащего представляющий интерес белок, на колонку для разделения, в которой происходит разделение. Колонку для разделения с помощью HPLC заполняют твердыми частицами (например, диоксида кремния, полимеров или сорбентов) и смесь образца разделяют на соединения, поскольку она взаимодействует с частицами в колонке. На разделение с помощью HPLC оказывают влияние состояние жидкого растворителя (например, давление, температура), химические взаимодействия между смесью с образцом и жидким растворителем (например, гидрофобность, протонирование и т.д.) и химические взаимодействия между смесью с образцом и твердыми частицами, упакованными внутри колонки для разделения (например, аффинность лиганда, ионный обмен и т.д.).
[0097] В некоторых вариантах осуществления SEC и идентификация белка происходят в одном и том же устройстве или одновременно. Например, SEC и HPLC можно объединять, что часто называется HP-SEC.
[0098] В некоторых вариантах осуществления состав на основе антител содержит от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, где указанный состав является стабильным при хранении при приблизительно 40°С в течение 1-24 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при приблизительно 25°С в течение 1-18 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при приблизительно 5°С в течение 1-6 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при приблизительно 5°С в течение 1-3 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при приблизительно 5 в течение 1-12 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при приблизительно 5°С в течение по меньшей мере 18 месяцев. В некоторых вариантах осуществления состав является стабильным при хранении при температуре приблизительно 5°С в течение 24 месяцев или 36 месяцев.
[0099] Термин "стабильный" может быть относительным, а не абсолютным. Таким образом, в некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 2°С-8°С в течение 6 месяцев. В некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью SEC HPLC, при хранении антитела при температуре от 2°С до 8°С в течение 12 месяцев. В некоторых вариантах осуществления антитело в составе на основе антител является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 2°С-8°С в течение 18 месяцев. В некоторых вариантах осуществления антитело в составе с антителом является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью SEC HPLC, при хранении антитела при температуре от 2°С до 8°С в течение 24 месяцев.
[00100] В некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 23°С-27°С в течение 3 месяцев. В некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 23°С-27°С в течение 6 месяцев. В некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 23°С-27°С в течение 12 месяцев. В некоторых вариантах осуществления антитело является стабильным, если менее 20%, менее 15%, менее 10%, менее 5% или менее 2% антитела разрушается, денатурирует, агрегирует или разворачивается, что определяют с помощью HP-SEC, при хранении антитела при 23°С-27°С в течение 24 месяцев.
[00101] В некоторых вариантах осуществления антитело является стабильным, если менее 6%, менее 4%, менее 3%, менее 2% или менее 1% антитела разрушается, денатурирует, агрегирует или разворачивается за месяц, что определяют с помощью HP-SEC, при хранении антитела при 40°С. В некоторых вариантах осуществления антитело является стабильным, если менее 6%, менее 4%, менее 3%, менее 2% или менее 1% антитела разрушается, денатурирует, агрегирует или разворачивается за месяц, что определяют с помощью HP-SEC, при хранении антитела при 5°С.
[00102] В вариантах осуществления антитело является стабильным, если 1%, 2%, 3%, 4%, 5% или 6% (или от приблизительно 1% до 6%) антитела разрушается, денатурирует, агрегирует или разворачивается за месяц в течение 1-3 месяцев, 1-6 месяцев, 1-12 месяцев, 1-18 месяцев или 1-24 месяцев, что определяют с помощью HP-SEC, при хранении антитела при 5°С.
[00103] В некоторых вариантах осуществления составы на основе антител по настоящему изобретению можно считать стабильными, если антитело характеризуется потерей связывающей активности антитела (в том числе фрагментов данного антитела) в составе по сравнению с эталонным антителом от очень незначительной до отсутствующей, что измеряют с помощью анализов связывания антитела, известных специалистам в данной области, таких как, например, ELISA и т.д., в течение периода 8 недель, 4 месяцев, 6 месяцев, 9 месяцев, 12 месяцев или 24 месяца. В некоторых вариантах осуществления антитело, которое хранилось при температуре приблизительно 40°С в течение по меньшей мере 1 месяца, сохраняет по меньшей мере 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% способности к связыванию с полипептидом рецептора INFAR1 по сравнению с эталонным антителом, которое не поддавалось хранению. В некоторых вариантах осуществления антитело, которое хранилось при температуре приблизительно 5°С в течение по меньшей мере 6 месяцев сохраняет по меньшей мере 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% способности к связыванию с полипептидом рецептора INFAR1 по сравнению с эталонным антителом, которое не поддавалось хранению. В некоторых вариантах осуществления антитело, хранящееся при приблизительно 40°С в течение по меньшей мере 1 месяца, сохраняет по меньшей мере 95% способности к связыванию с полипептидным рецептором INFAR1 по сравнению с эталонным антителом, которое не подвергалось хранению. В некоторых вариантах осуществления антитело, хранящееся при приблизительно 5°С в течение по меньшей мере 6 месяцев, сохраняет по меньшей мере 95% способности к связыванию с полипептидным рецептором INFAR1 по сравнению с эталонным антителом, которое не подвергалось хранению.
[00104] Заявители обнаружили, что в представленных в данном документе составах на основе антител обусловливается значительное снижение образования частиц, что определяют с помощью визуального осмотра, визуализации микропотока (MFI) или эксклюзионной хроматографии (SEC).
[00105] В некоторых вариантах осуществления состав практически не содержит частиц при хранении при температуре приблизительно 40°С в течение 1 месяца, что определяют с помощью визуального контроля. В некоторых вариантах осуществления состав практически не содержит частиц при хранении при температуре приблизительно 5°С в течение по меньшей мере 6 месяцев, по меньшей мере 9 месяцев, по меньшей мере 12 месяцев, по меньшей мере 15 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяцев или по меньшей мере 36 месяцев, что определяют с помощью визуального контроля.
[00106] В некоторых вариантах осуществления состав на основе антител по настоящему изобретению можно применять в фармацевтических целях. Используемые в фармацевтических целях антитела обычно должны характеризоваться высоким уровнем чистоты, особенно в отношении загрязнителей из клеточной культуры, включающих загрязнители-клеточные белки, загрязнители-клеточные ДНК, вирусы и другие передаваемые загрязняющие вещества. См. "WHO Requirements for the use of animal cells as in vitro substrates for the production of biologicals: Requirements for Biological Substances №50." №878. Annex 1, 1998. С учетом опасений относительно загрязнителей Всемирная организация здравоохранения (WHO) установила ограничения относительно уровней различных загрязнителей. Например, WHO рекомендовала ограничение по ДНК менее 10 нг на дозу белковых продуктов. Подобным образом, Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) установило ограничение по ДНК, составляющее менее или равное 0,5 пг/мг белка. Следовательно, в некоторых вариантах осуществления настоящее изобретение относится к составам с антителом, соответствующим или превышающим уровни загрязнителей, которые определены одной или несколькими правительственными организациями, например, Управлением по контролю качества пищевых продуктов и лекарственных средств США и/или Всемирной организацией здравоохранения.
[00107] В некоторых вариантах осуществления состав на основе антител, описанный в данном документе, является фармацевтически приемлемым. "Фармацевтически приемлемый" относится к составу с антителом, который по результатам тщательной медицинской оценки подходит для контакта с тканями человеческого организма и животных без чрезмерной токсичности или других осложнений в соответствии с разумным соотношением польза/риск.
[00108] Чистота составов на основе антител может варьировать. В некоторых вариантах осуществления терапевтическое антитело, представляющее интерес, например, антитело к IFNAR1, составляет более 90% (вес/вес) всех полипептидов, присутствующих в составе на основе антител. В некоторых вариантах осуществления терапевтическое антитело, представляющее интерес, например, антитело к IFNAR1, составляет более 95% (вес/вес), 98% (вес/вес), 99% (вес/вес), 99,5% (вес/вес) или 99,9% (вес/вес) всех полипептидов, присутствующих в составе на основе антител.
[00109] Настоящее изобретение дополнительно предусматривает способы лечения опосредованного IFN I типа заболевания или нарушения у нуждающегося в этом субъекта посредством введения терапевтически эффективного количества состава на основе антител, описанного в данном документе. В вариантах осуществления заболевание или нарушение выбраны из группы, состоящей из системной красной волчанки (SLE), инсулинзависимого сахарного диабета, воспалительного заболевания кишечника, рассеянного склероза, псориаза, аутоиммунного тиреоидита, ревматоидного артрита, гломерулонефрита, склеродермии, миозита и волчаночного нефрита. В дополнительных вариантах осуществления заболевание или нарушение представляют собой воспалительное заболевание кишечника, такое как болезнь Крона, язвенный колит и целиакия. В дополнительных вариантах осуществления заболевание или нарушение представляют собой легочное заболевание или нарушение, такое как системная красная волчанка.
[00110] Состав на основе антител по настоящему изобретению можно вводить субъекту различными способами. В некоторых вариантах осуществления состав с антителом подходит для парентерального введения, например, посредством ингаляции (например, порошковый или аэрозольный спрей), чресслизистого, внутривенного, подкожного, или внутримышечного введения. В некоторых вариантах осуществления состав представляет собой инъекционный состав. В некоторых вариантах осуществления настоящее изобретение относится к герметичному контейнеру, содержащему любой из описанных в данном документе составов с антителом.
[00111] В некоторых аспектах настоящее изобретение относится к различным фармацевтическим лекарственным формам. Различные лекарственные формы могут быть применимы к составам, предусмотренным в данном документе. См, например, Pharmaceutical Dosage Form: Parenteral Medications, Volume 1, 2nd Edition. В одном варианте осуществления фармацевтическая стандартная доза согласно настоящему изобретению содержит состав с антителом в подходящем контейнере, например, флаконе или шприце. В одном варианте осуществления фармацевтическая стандартная доза согласно настоящему изобретению содержит состав с антителом, доставляемый внутривенно, подкожно или внутримышечно. В другом варианте осуществления фармацевтическая стандартная доза согласно настоящему изобретению содержит состав с антителом, доставляемый аэрозолем. В конкретном варианте осуществления фармацевтическая стандартная доза согласно настоящему изобретению содержит состав с антителом, доставляемый подкожно. В другом варианте осуществления фармацевтическая стандартная доза по настоящему изобретению содержит состав на основе антител, доставляемый в виде аэрозоля. В дополнительном варианте осуществления фармацевтическая стандартная доза согласно настоящему изобретению содержит состав с антителом, вводимый интраназально.
[00112] Составы на основе антител по настоящему изобретению можно получить в виде стандартных лекарственных форм путем получения флаконов, содержащих аликвоту водного состава на основе антител, для однократного применения. Например, стандартная доза на флакон может содержать 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл, или 20 мл разных концентраций антитела, которое специфически связывается с рецептором IFNAR1, в диапазоне от приблизительно 0,1 мг/мл до приблизительно 300 мг/мл. При необходимости эти препараты можно откорректировать до требуемой концентрации добавляя стерильный разбавитель в каждый флакон. В конкретном варианте осуществления водные составы на основе антител по настоящему изобретению составляют в однодозовых флаконах в виде стерильной жидкости, которая содержит от приблизительно 2 мг/мл до приблизительно 20 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб. В другом конкретном варианте осуществления водные составы на основе антител по настоящему изобретению составляют в однодозовых флаконах в виде стерильной жидкости, которая содержит от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, от приблизительно 45 до 55 мМ лизина-HCl, от приблизительно 0,04% до приблизительно 0,08% полисорбата-80, от приблизительно 120 мМ до приблизительно 140 мМ трегалозы и приблизительно 20-30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 6. В одном варианте осуществления антитело согласно настоящему изобретению поставляется в 3 см3 флаконах из янтарного боросиликатного стекла типа I USP (West Pharmaceutical Services - № по каталогу 6800-0675) при концентрации от 140 до 160 мг/мл. В другом варианте осуществления антитело по настоящему изобретению поставляется во флаконах объемом 3 см3 из янтарного боросиликатного стекла USP I типа в концентрации 150 мг/мл.
[00113] Составы на основе антител по настоящему изобретению можно получить в виде стандартных лекарственных форм путем получения предварительно заполненного шприца, содержащего аликвоту водного состава на основе антител, для однократного применения. Например, стандартная доза на один предварительно заполненный шприц может содержать 0,1 мл, 0,2 мл, 0,3 мл, 0,4 мл, 0,5 мл, 0,6 мл, 0,7 мл, 0,8 мл, 0,9 мл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл, 15 мл или 20 мл антитела или его антигенсвязывающего фрагмента, которые специфически связываются с полипептидом IFNAR1, в разных концентрациях, варьирующих в диапазоне от приблизительно 140 мг/мл до приблизительно 160 мг/мл. В конкретном варианте осуществления водные составы на основе антител по настоящему изобретению составляют в однодозовых предварительно заполненных шприцах в виде стерильной жидкости, которая содержит от приблизительно 145 мг/мл до приблизительно 155 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, приблизительно 45-55 мМ лизина-HCl, от приблизительно 0,04% до приблизительно 0,08% полисорбата-80, от приблизительно 120 мМ до приблизительно 140 мМ трегалозы и приблизительно 20-30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 6. В конкретном варианте осуществления водные составы на основе антител по настоящему изобретению составляют в однодозовых предварительно заполненных шприцах в виде стерильной жидкости, которая содержит от приблизительно 145 мг/мл до приблизительно 155 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, приблизительно 45-55 мМ лизина-HCl, от приблизительно 0,04% до приблизительно 0,08% полисорбата-80, от приблизительно 120 мМ до приблизительно 140 мМ трегалозы и приблизительно 20-30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 6.
[00114] В ходе однократного применения можно вводить различные величины дозы. Например, в некоторых вариантах осуществления 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг, 1,0 мг, 1,1 мг, 1,2 мг, 1,3 мг, 1,4 мг, 1,5 мг, 1,6 мг, 1,7 мг, 1,8 мг, 1,9 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 12 мг, 14 мг, 16 мг, 18 мг, 20 мг, 30 мг, 40 мг, 50 мг, 70 мг или 100 мг антитела можно вводить в виде однократной дозы.
[00115] Можно применять различные типы шприцев. Шприц можно заполнять составом с антителом непосредственно перед введением субъекту, например, за менее 1 недели, за 1 день, за 6 часов, за 3 часа, за 2 часа, за 1 час, за 30 минут, за 20 минут или за 10 минут перед введением субъекту. В некоторых вариантах осуществления шприц заполняют составом с антителом в месте розничной продажи или в учреждение, где осуществляется лечение субъекта. В некоторых вариантах осуществления шприц является предварительно заполненным, например, шприц заполняют составом с антителом за более 1 день, за 2 дня, за 4 дня, за 1 неделю, за 2 недели, за 1 месяц, за 2 месяца, за 3 месяца, за 6 месяцев, за 12 месяцев, за 18 месяцев, за 24 месяца, за 3 года или за 4 года перед введением субъекту. В некоторых вариантах осуществления предварительно заполненный шприц содержит иглу, например, иглу со стенками стандартного размера 27 калибра, тонкостенную иглу 27 калибра, иглу со стенками стандартного размера 29 калибра или тонкостенную иглу 29 калибра. В некоторых вариантах осуществления предварительно заполненный шприц содержит тонкостенную иглу для спинномозговой пункции 27G.
[00116] В некоторых вариантах осуществления можно применять любой шприц, подходящий для введения нужному субъекту. В некоторых вариантах осуществления шприц представляет собой пластиковый шприц или стеклянный шприц. В некоторых вариантах осуществления шприц изготовлен из материалов, которые практически не содержат вольфрам. В некоторых вариантах осуществления шприц покрыт силиконом. В некоторых вариантах осуществления предварительно заполненный шприц содержит поршень с диском из фторполимерной смолы. Примеры шприцев могут включать без ограничения BD Hypak™ SCF 1 MLL 27G1/2-5B BD260L WL, с 0,4 мг кремнийорганического масла MDN cSTW иглой 27G; Hypak™ длинной конфигурации на 1 мл для биотехнологических препаратов (Becton Dickinson) с пробкой 4023 Flurotec Daikyo Si1000 для Hypak длинной конфигурации на 1 мл от Becton Dickinson (№ по каталогу 47271919); C3Pin; Hypak™ для биотехнологических препаратов с 0,8 мг кремнийорганического масла (Becton Dickinson) шприцы CZ (West, № по каталогу 19550807).
[00117] Водные составы на основе антител по настоящему изобретению можно стерилизовать различными способами стерилизации, в том числе стерилизующей фильтрацией, излучением и т.д. В конкретном варианте осуществления подвергнутый диафильтрации состав на основе антител подвергают стерилизующей фильтрации с помощью предварительно стерилизованного фильтра на 0,2 микрона. Простерилизованные составы с антителом согласно настоящему изобретению можно вводить субъекту для предупреждения, лечения и/или контроля иммунной реакции, например, воспалительной реакции.
[00118] Настоящее изобретение дополнительно предусматривает предварительно заполненные шприцы, содержащие составы на основе антител по настоящему изобретению. В некоторых вариантах осуществления предварительно заполненный шприц содержит (а) от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела к IFNAR1, от приблизительно 25 мМ до 130 мМ лизина или лизиновой соли, незаряженное вспомогательное вещество, поверхностно-активное вещество и буфер для составления.
[00119] Настоящее изобретение дополнительно предусматривает предварительно заполненные шприцы, содержащие составы на основе антител по настоящему изобретению. В некоторых вариантах осуществления предварительно заполненный шприц содержит (а) от приблизительно 100 мг/мл до приблизительно 200 мг/мл анифролумаба или его антигенсвязывающего фрагмента, от приблизительно 40 до 60 мМ лизина-HCl, от приблизительно 100 мМ до приблизительно 160 мМ дигидрата трегалозы, от 0,02% до приблизительно 0,1% полисорбата-80 и от приблизительно 15 мМ до приблизительно 35 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет от приблизительно 5,5 до приблизительно 6,5.
[00120] Настоящее изобретение дополнительно предусматривает предварительно заполненные шприцы, содержащие составы на основе антител по настоящему изобретению. В некоторых вариантах осуществления предварительно заполненный шприц содержит (а) от приблизительно 145 мг/мл до приблизительно 155 мг/мл анифролумаба или его антигенсвязывающего фрагмента, от приблизительно 45 до 55 мМ лизина-HCl, от 120 мМ до приблизительно 140 мМ дигидрата трегалозы, от 0,04% до приблизительно 0,08% полисорбата-80 и от 20 мМ до приблизительно 30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет от приблизительно 5,8 до 6,1.
[00121] Настоящее изобретение дополнительно предусматривает предварительно заполненные шприцы, содержащие составы на основе антител по настоящему изобретению. В некоторых вариантах осуществления предварительно заполненный шприц содержит (а) приблизительно 150 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, приблизительно 50 мМ лизина-HCl, приблизительно 0,05% полисорбата-80, приблизительно 130 мМ дигидрата трегалозы и приблизительно 25 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 5,9.
[00122] Настоящее изобретение дополнительно предусматривает предварительно заполненные шприцы, содержащие составы на основе антител по настоящему изобретению. В некоторых вариантах осуществления предварительно заполненный шприц содержит (а) приблизительно 150 мг/мл анифролумаба, приблизительно 50 мМ лизина-HCl, приблизительно 0,05% полисорбата-80, приблизительно 130 мМ дигидрата трегалозы и приблизительно 25 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 5,9.
[00123] В конкретном варианте осуществления составы на основе антител по настоящему изобретению составляют в однодозовых предварительно заполненных шприцах в виде стерильной жидкости, которая содержит от приблизительно 145 мг/мл до приблизительно 155 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, от приблизительно 45 до 55 мМ лизина-HCl, от приблизительно 0,04% до приблизительно 0,08% полисорбата-80, от приблизительно 120 мМ до приблизительно 140 мМ трегалозы и приблизительно 20-30 мМ гистидина/гистидина-HCl. В вариантах осуществления рН состава составляет приблизительно 6.
[00124] В вариантах осуществления настоящее изобретение относится к предварительно заполненному шприцу, содержащему состав на основе антител по настоящему изобретению, где предварительно заполненный шприц характеризуется средней силой трения скольжения от 1 до 20 Н при оснащении тонкостенной иглой для спинномозговой пункции (STW) 27 калибра. В вариантах осуществления настоящее изобретение относится к предварительно заполненному шприцу, содержащему состав на основе антител по настоящему изобретению, где предварительно заполненный шприц характеризуется средней силой трения скольжения от 5 до 15 Н при оснащении тонкостенной иглой для спинномозговой пункции (STW) 27 калибра. В вариантах осуществления настоящее изобретение относится к предварительно заполненному шприцу, содержащему состав на основе антител по настоящему изобретению, где предварительно заполненный шприц характеризуется средней силой трения скольжения приблизительно 8 Н при оснащении тонкостенной иглой для спинномозговой пункции (STW) 27 калибра.
[00125] В некоторых вариантах осуществления настоящее изобретение относится к набору, содержащему любой из описанных в данном документе составов на основе антител, описанных в данном документе контейнеров, описанных в данном документе стандартных лекарственных форм или описанного в данном документе предварительно заполненного шприца.
[00126] В некоторых вариантах осуществления настоящее изобретение также может относиться к способу получения стабильного состава на основе антител, содержащего антитело, при этом способ предусматривает: (а) очистку антитела или его антигенсвязывающего фрагмента до концентрации от приблизительно 100 мг/мл до приблизительно 200 мг/мл, где антитело представляет собой анифролумаб; и (b) помещение выделенного антитела в стабилизирующий состав с получением стабильного состава на основе антител, где полученный в результате стабильный состав на основе антител содержит: (i) от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, и (ii) от приблизительно 25 мМ до приблизительно 130 мМ лизина или лизиновой соли; (iii) от приблизительно 100 мМ до приблизительно 150 мМ трегалозы, (iv) от приблизительно 0,02% до приблизительно 0,1% полисорбата-80.
[00127] В некоторых вариантах осуществления настоящее изобретение также может относиться к способу получения стабильного состава на основе антител, содержащего антитело, при этом способ предусматривает: (а) очистку антитела или его антигенсвязывающего фрагмента до концентрации от приблизительно 100 мг/мл до приблизительно 200 мг/мл, где антитело представляет собой анифролумаб; и (b) помещение выделенного антитела в стабилизирующий состав с получением стабильного состава на основе антител, где полученный в результате стабильный состав на основе антител содержит от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела; от приблизительно 45 мМ до приблизительно 55 мМ лизина-HCl лизина или лизиновой соли; от приблизительно 100 мМ до приблизительно 150 мМ незаряженного вспомогательного вещества; от приблизительно 0,02% до приблизительно 0,1% поверхностно-активного вещества и буфер для составления.
[00128] В некоторых вариантах осуществления настоящее изобретение также может относиться к способу получения стабильного состава на основе антител, содержащего антитело, при этом способ предусматривает: (а) очистку антитела или его антигенсвязывающего фрагмента от приблизительно 145 мг/мл до приблизительно 155 мг/мл, где антитело представляет собой анифролумаб; и (b) помещение выделенного антитела в стабилизирующий состав с получением стабильного состава на основе антител, где полученный в результате стабильный состав на основе антител содержит от приблизительно 145 мг/мл до приблизительно 155 мг/мл антитела, от приблизительно 25 мМ до приблизительно 130 мМ лизина или лизиновой соли; от приблизительно 120 мМ до приблизительно 140 мМ дигидрата трегалозы; от приблизительно 0,04% до приблизительно 0,08% полисорбата-80; от приблизительно 20 мМ до приблизительно 30 мМ гистидина/гистидина-HCl, где состав характеризуется рН от приблизительно 5,8 до 6,1.
[00129] В некоторых вариантах осуществления настоящее изобретение относится к способу получения стабильного состава на основе антител, при этом способ предусматривает (а) очистку антитела или его антигенсвязывающего фрагмента до приблизительно 150 мг/мл, где антитело представляет собой анифролумаб; и (b) помещение выделенного антитела в стабилизирующий состав с получением стабильного состава на основе антител, где полученный в результате стабильный состав на основе антител содержит: (i) приблизительно 150 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, и (ii) приблизительно 50 мМ лизина-HCl; (iii) приблизительно 130 мМ трегалозы, (iv) приблизительно 0,05% полисорбата-80.
[00130] Хотя многие аспекты настоящего изобретения относятся к водным составам, в целях определения эквивалентов следует отметить, что антитела или составы на основе антител по настоящему изобретению можно при необходимости лиофилизировать. Следовательно, настоящее изобретение охватывает лиофилизированные формы составов согласно настоящему изобретению или лиофилизированные антитела, которые затем восстанавливают в водную форму. В некоторых вариантах осуществления настоящее изобретение относится к способу получения состава на основе растворенного антитела или его антигенсвязывающего фрагмента, содержащего анифролумаб, при этом способ предусматривает: (а) очистку антитела из культуры клеток; (b) лиофилизацию выделенного антитела; (с) добавление лиофилизированного антитела к водному раствору с получением разбавленного состава на основе антител, где разбавленный состав на основе антител содержит: (i) от приблизительно 100 мг/мл до приблизительно 200 мг/мл антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, и (ii) от приблизительно 45 до приблизительно 55 мМ лизина-HCl.
[00131] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему антитело или его антигенсвязывающий фрагмент, где антитело представляет собой анифролумаб, где состав на основе антител практически не содержит частиц. В некоторых вариантах осуществления термин "практически не содержит частиц" относится к отсутствию видимых частиц при наблюдении на просмотровом столе. В некоторых вариантах осуществления термин "практически не содержит частиц" является синонимом описанной ранее фразы "уровни образования частиц от низкого до невыявляемого". В некоторых вариантах осуществления в основном не содержит частицы относится к образцам, содержащим менее 30 частиц/мл, менее 20 частиц/мл, менее 20 частиц/мл, менее 15 частиц/мл, менее 10 частиц/мл, менее 5 частиц/мл, менее 2 частиц/мл или менее 1 частицы/мл, где частицы являются больше 25 мкм и количество частиц определяют с помощью анализа HIAC или визуального анализа. В некоторых вариантах осуществления в основном не содержит частицы относится к образцам, содержащим 1-50 частиц/мл, 2-40 частиц/мл, 3-30 частиц/мл, 4-25 частиц/мл или 5-20 частиц/мл, где частицы являются больше 25 мкм и количество частиц определяют с помощью анализа HIAC или визуального анализа. В некоторых вариантах осуществления термин "видимые частицы" относится к частицам, превышающим 25 мкм.
[00132] В некоторых вариантах осуществления "практически не содержит частиц" относится к образцам, содержащим 1-200 частиц/мл, 10-150 частиц/мл, от приблизительно 30 частиц/мл до приблизительно 100 частиц/мл или 40-80 частиц/мл, где частицы превышают 5 мкм, и количество частиц определяют с помощью анализа HIAC или визуального анализа. В некоторых вариантах осуществления термин "видимые частицы" относится к частицам, превышающим 5 мкм. В некоторых вариантах осуществления в составе с антителом либо с помощью анализа HIAC, либо визуального анализа не обнаружено никаких частиц.
[00133] В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему антитело или его антигенсвязывающий фрагмент, где антитело представляет собой анифролумаб, где состав на основе антител практически не содержит частиц в течение по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 8 месяцев, по меньшей мере 10 месяцев, по меньшей мере 12 месяцев или по меньшей мере 18 месяцев при хранении при 38-42°С. В некоторых вариантах осуществления настоящее изобретение относится к составу на основе антител, содержащему антитело или его антигенсвязывающий фрагмент, где антитело представляет собой анифролумаб, где состав на основе антител практически не содержит частиц в течение по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, по меньшей мере 5 месяцев, по меньшей мере 6 месяцев, по меньшей мере 8 месяцев, по меньшей мере 10 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев, по меньшей мере 24 месяцев, по меньшей мере 30 месяцев, по меньшей мере 36 месяцев или по меньшей мере 48 месяцев при хранении при 2-6°С.
[00134] В некоторых вариантах осуществления настоящее изобретение относится к способу очищения антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, при этом способ предусматривает (i) получение культуры клеток, содержащей антитело, (ii) проведение аффинной хроматографии антитела, (iv) проведение катионного обмена с антителом, (v) проведение хроматографии антитела в смешанном режиме.
[00135] В некоторых вариантах осуществления настоящее изобретение относится к способу очищения антитела или его антигенсвязывающего фрагмента, где антитело представляет собой анифролумаб, при этом способ предусматривает (i) получение культуры клеток, содержащей антитело, (ii) связывание антитела с белком А в колонке, (iii) элюирование антитела из колонки с белком A, (iv) проведение катионного обмена с антителом, (v) проведение хроматографии антитела в смешанном режиме. В некоторых вариантах осуществления способ очистки антитела дополнительно включает процесс инактивации вирусов. В некоторых вариантах осуществления стадию инактивации вирусов проводили путем понижения рН до уровня менее 4,0. В некоторых вариантах осуществления способ дополнительно включает процесс диафильтрации. В некоторых вариантах осуществления способ дополнительно включает процесс фильтрации. В некоторых вариантах осуществления процесс фильтрации является достаточным для удаления активных вирусных частиц.
[00136] В некоторых вариантах осуществления настоящее изобретение относится к способу лечения пациента. В некоторых вариантах осуществления способ предусматривает введение описанных в данном документе составов на основе антител, описанных в данном документе контейнеров, описанных в данном документе стандартных лекарственных форм или описанного в данном документе предварительно заполненного шприца субъекту, нуждающемуся в этом.
[00137] В некоторых вариантах осуществления настоящее изобретение подходит для лечения легочного заболевания или нарушения посредством введения описанного в данном документе состава на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения пациента с эозинофильным заболеванием или нарушением посредством введения описанного в данном документе состава на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения легочного заболевания или нарушения у субъекта, при этом способ предусматривает введение описанных в данном документе составов на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения эозинофильного заболевания или нарушения у субъекта, при этом способ предусматривает введение описанных в данном документе составов на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к лечению легочных заболеваний или нарушений, например, астмы, COPD, эозинофильной астмы, смешанной эозинофильно-нейтрофильной астмы, аспириновой астмы, аллергического бронхолегочного аспергиллеза, острого и хронического эозинофильного бронхита, острой и хронической эозинофильной пневмонии, синдрома Черджа-Стросса, гиперэозинофильного синдрома, легочной эозинофилии, вызванной лекарственными средствами, раздражающими средствами и облучением, легочной эозинофилии, вызванной инфекцией (грибковой, туберкулезной, паразитарной), легочной эозинофилии, ассоциированной с аутоиммунным заболеванием, эозинофильного эзофагита или болезни Крона или их комбинации, у субъекта, при этом способ предусматривает введение описанных в данном документе составов на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к лечению астмы у субъекта, при этом способ предусматривает введение описанных в данном документе составов на основе антител. В некоторых вариантах осуществления настоящее изобретение относится к лечению COPD у субъекта, при этом способ предусматривает введение описанных в данном документе составов на основе антител.
[00138] В некоторых вариантах осуществления для лечения состояния вводят терапевтически эффективное количество описанных в данном документе составов на основе антител. Используемый в данном документе термин "терапевтически эффективное количество" относится к количеству терапевтического средства (например, антитела, которое иммуноспецифически связывается с полипептидом рецептора IFNAR1), которое является достаточным для снижения тяжести заболевания или нарушения (например, заболевания или нарушения, характеризующихся аномальной экспрессией и/или активностью полипептида IFNAR1, заболевания или нарушения, характеризующихся аномальной экспрессией и/или активностью рецептора IFNAR1 или одной или нескольких его субъединиц, аутоиммунного заболевания, воспалительного заболевания, пролиферативного заболевания или инфекции или одного или нескольких их симптомов), уменьшения продолжительности состояния, ослабления одного или нескольких симптомов такого заболевания или нарушения, предупреждения развития такого заболевания или нарушения, вызывания регрессии такого заболевания или нарушения или усиления или улучшения терапевтического(терапевтических) эффекта(эффектов) другого терапевтического средства. В некоторых вариантах осуществления терапевтически эффективное количество нельзя точно указать заранее, и оно может быть определено лицом, осуществляющим уход и лечение, например, врачом или другим медицинским работником, с применением различных способов, например, подбора дозы. Соответствующие терапевтически эффективные количества можно определить с помощью обычного эксперимента с применением, например, моделей на животных.
[00139] Термины "терапевтические средства" и "терапия" могут относиться к любому из протокола(протоколов), способа(способов) и/или средства(средств), которые можно применять в предупреждении, лечении, контроле или ослаблении заболевания или нарушения (например, заболевания или нарушения, характеризующихся аномальной экспрессией и/или активностью полипептида IFNAR1, заболевания или нарушения, характеризующихся аномальной экспрессией и/или активностью рецептора IFNAR1 или одной или нескольких его субъединиц, аутоиммунного заболевания, воспалительного заболевания, пролиферативного заболевания или инфекции (предпочтительно респираторной инфекции) или одного или нескольких их симптомов). В определенных вариантах осуществления термины "терапевтические средства" и "терапия" относятся к биологической терапии, поддерживающей терапии и/или других видов терапии, пригодных при лечении, контроле, предупреждении или ослаблении такого заболевания или нарушения или одного или нескольких симптомов, известных квалифицированному медицинскому персоналу.
[00140] Используемый в данном документе термин "терапевтический протокол" относится к схеме дозирования и регулированию времени назначения одного или нескольких видов терапии (например, терапевтических средств), которые являются терапевтически эффективными.
[00141] Путь введения состава на основе антител по настоящему изобретению может представлять собой введение посредством, например, перорального, парентерального, ингаляционного или местного способов. Используемый в данном документе термин парентеральное включает, например, внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. В некоторых вариантах осуществления антитело представляет собой антитело к IFNAR1, а путь введения представляет собой внутримышечную инъекцию. Хотя все эти формы введения явно рассматриваются как находящиеся в пределах объема настоящего изобретения, в некоторых вариантах осуществления состав с антителом является подходящим для введения посредством инъекции, в частности, для внутривенной или внутриартериальной инъекции или капельного вливания.
[00142] В некоторых вариантах осуществления композиции и способы по настоящему изобретению дают производителю возможность получать состав на основе антител, подходящий для введения человеку, более эффективным образом путем чего-либо из сокращения затрат, сокращения количества стадий способа, уменьшения возможностей ошибки, уменьшения возможностей введения небезопасных или ненадлежащих добавок, сокращения отходов, увеличения срока хранения и т.д.
ПРИМЕРЫ
[00143] Настоящее изобретение теперь описано со ссылкой на следующие примеры. Данные примеры являются только иллюстративными, и настоящее изобретение никоим образом не следует толковать как ограниченное данными примерами, а скорее следует толковать как охватывающее любые возможные варианты, которые становятся очевидными в результате реализации идей, изложенных в данном документе.
Пример 1 Материалы и способы
Материалы
[00144] Все используемые материалы характеризовались степенью очистки, соответствующей требованиям Фармакопеи США (USP) или требованиям нескольких фармакопей. Все растворы и буферы готовили с использованием воды, соответствующей USP, или воды для HPLC и фильтровали перед дальнейшим использованием. Для исследований стабильности образцы получали в асептических условиях в ламинарном боксе биологической защиты (BSC). Нерасфасованный материал хранили при 2-8°С. Исследования стабильности осуществляли с использованием материалов, перечисленных в таблице 3.

Определение концентрации белка
[00145] Концентрации белка определяли путем измерения поглощения при 280 нм с помощью спектрофотометра Agilent UV-Vis с использованием процедуры, адаптированной из SOP DV-6233. Использовали измеренный коэффициент экстинкции 1,39 (мг/мл) ~ см ~. Для образцов коэффициенты поправки на плотность использовали в соответствии с TD-0025 для составов, содержащих сахар или не содержащих сахар.
Измерение вязкости конусно-пластинчатым вискозиметром
[00146] Значения вязкости измеряли с использованием реометра Anton Paar MCR301 с конусным и пластинчатым элементами. Чтобы свести к минимуму необходимый объем использовали 20-мм конус с единичными повторными измерениями для целей скрининга. Результаты регистрировали при высоком пределе сдвига, соответствующем скорости сдвига 1000 в секунду.
Определение чистоты с помощью гель-хроматографии (HPSEC)
[00147] SEC-анализ проводили на системе Agilent HPLC с TSK-Gel G3000 в соответствии с научными рекомендациями для данного состава.
Внешний вид
[00148] Визуальный осмотр образцов проводили с помощью исследования образцов в их соответствующем контейнере в отношении частиц, цвета и прозрачности с использованием стандартов частиц и руководства, адаптированного из стандартной операционной процедуры: Оценка внешнего вида лекарственного вещества, представляющего собой белок, и лекарственного продукта (Visual appearance evaluation of protein drug substance and drug product).
Исследования для оценки влияния уровней вспомогательного вещества на стабильность и вязкость
[00149] Для того, чтобы исследовать влияния концентрации, уровня трегалозы и уровня лизина-HCl (факторов) на стабильность и вязкость (ответы) использовали подход планирования экспериментов. План Бокса-Бенкена получали с использованием программного обеспечения JMP9.1 (SAS, Inc., Кэри, Северная Каролина). План включал факторы: концентрация (от 100 до 200 мг/мл); уровень трегалозы (от 0 до 211 мМ) и уровень лизина-HCL (от 25 до 130 мМ). рН устанавливали при 6,0, исходя из предыдущих данных стабильности состава для составов 1-го цикла. Уровень полисорбата устанавливали при 0,02%. Низкий уровень лизина определяли при 25 мМ, исходя из предварительных высокопроизводительных скрининговых исследованиях вязкости, где значительное снижение вязкости при диапазоне 0-25 мМ лизина-HCl наблюдали при высоких концентрациях (см. пример 2). Стабильность оценивали посредством проведения исследования увеличенной стабильности при 40°С с оценкой внешнего вида и чистоты с помощью HP-SEC (потеря мономеров, агрегация, фрагментация) в качестве регистрируемых показателей. Также измеряли значения количества невидимых невооруженным глазом частиц при 5°С через 1,8 месяца, но дополнительно не анализировали, поскольку между образцами не наблюдали значимой дифференциации.
Устойчивость и влияние уровня лизина-HCl на профиль вязкости
[00150] Получали исходный раствор MEDI-546 при ~ 200 мг/мл в 25 мМ гистидина/гистидина-HCl, 25 мМ лизина-HCl (примечание: это нижний интервал значений концентрации лизина-HCl), 130 мМ дигидрата трегалозы, рН 6,0 и применяли для получения серии разведений, составленных с 0,02% полисорбата-80. Значения концентрации и вязкости измеряли и наносили на график. Также получали и измеряли состав с номинальным условием (50 мМ лизина-HCl). Получали исходный раствор на основе 0,5 М лизина-HCl для доведения исходного раствора MEDI-546 до номинального уровня лизина, составляющего 50 мМ. Проводили аналогичное разведение и составление и измеряли значения вязкости и концентрации.
Оценка функциональности состава для ввода в предварительно заполненных шприцах с иглой STW27 калибра
[00151] Предварительно заполненные шприцы ("PFS") ((BD Hypak SCF 1MLL 27G1/2-SB); с 0,4 мг кремнийорганического масла MDN с тонкостенной STW иглой 27G) заполняли с помощью MEDI-546 при 150 мг/мл в 25 мМ гистидина/гистидина-HCl, 50 мМ лизина-HCI, 130 мМ дигидрата трегалозы, 0,05% полисорбата-80, рН 5,9. Вязкость этой партии была измерена как 9,4 мПа⋅с, а концентрация - 150,7 мг/мл. С помощью вакуумного закупоривания наносили пробки BD Hypak SCF 1MLL 4023 FLUR Daikyo SI1000. Instron 5542 (Норвуд, Массачусетс 02062) использовали для измерения характеристики скольжения при 260 мм/мин. Кроме того, три исследователя оценивали время инъекции с перчатками для имитации артрита и без них (перчатки для имитации артрита из Научно-исследовательского института Джорджии и инъекционный тренажер из Limbsnthings, Великобритания).
Пример 2
Обобщение результатов высокопроизводительного скрининга вязкости
[00152] Высокопроизводительный скрининг вязкости проводили с наночастицами. Вкратце, наночастицы известного размера измеряли в воде (известная вязкость) и образцы (неизвестная вязкость) и соотношение использовали для определения неизвестной вязкости образцов. Эти данные собирали для целей скрининга и анализа тенденции, а не для определения абсолютной вязкости.
[00153] Результаты скрининга HTS в отношении вязкости в зависимости от рН показаны на фигуре 1. Результаты свидетельствовал о том, что вязкость увеличивалась вместе с рН. Исходя из данного потенциального влияния рН на вязкость и возможных эффектов типа Dorman во время TFF, авторы настоящего изобретения сделали вывод, что следует выбирать значение рН состава, составляющее 5,9. Для разработки PFS потребуется дополнительная устойчивость к воздействию рН. Результаты скрининга HTS в отношении вязкости в зависимости от концентрации лизина-HCl (фигура 2) показали значительное снижение вязкости при значении лизина-HCl от нуля до 25 мМ. Практические лабораторные наблюдения за получением образцов также показали, что образцы без лизина являлись более вязкими и трудными в обращении при более высоких концентрациях. По этой причине эксперименты начинали с 25 мМ лизина-HCl в качестве низкого уровня.
Пример 3
Общая оценка результатов стабильности и вязкости для составов
[00154] В таблице 4 представлено обобщение результатов вязкости и увеличенной стабильности для составов на основе антител. В таблице 5 представлено обобщение результатов в отношении невидимых невооруженным глазом частиц (с помощью HIAC) для составов через 1,8 месяца при 5°С. Общая оценка результатов показала, что все значения скорости потери чистоты при 40°С были приемлемыми, находясь в диапазоне от 3,8 до 4,8 процентов в месяц. Скорость фрагментации находилась в диапазоне от 2,8 до 3,4 процентов в месяц, а скорость агрегации находилась в диапазоне от 0,7 до 2,0 процентов в месяц. Визуальные осмотры всех составов через 1 месяц при 40°С указали на схожие характеристики (все имели стандарт 1 для частиц, < III или II для прозрачности и Y6 для цвета). Данные в отношении невидимой невооруженным глазом частицы (HIAC) показали, что все образцы имели менее 670 частиц на мл размером более 10 микрон. Вязкость всех составов находилась в диапазоне от 2,8 до 39,7 мПа⋅с. Несколько составов при 150 мг/мл характеризовались приемлемыми значениями вязкости.
[00155] Дополнительный анализ данных в приведенных ниже примерах показывает, как использовали и интерпретировали данные для выбора подходящего и устойчивого состава, который максимально увеличивает стабильность при обеспечении приемлемой вязкости.
[00156]

Таблица 4 - Обобщение результатов вязкости и увеличенной стабильности для составов
Таблица 5 - Обобщение результатов в отношении невидимых невооруженным глазом частиц для составов через 1,8 месяца при 5°С
Пример 4
Анализ результатов
[00157] В таблице 6 обобщено интерпретацию и выводы, сделанные на основе данных.


[00158] Исходя из результатов анализа, дополнительно оценивали состав, содержащий MEDI-546 при 150 мг/мл в 25 мМ гистидина/гистидина-HCl, 50 мМ лизина-HCl, 130 мМ дигидрата трегалозы, 0,05% полисорбата-80 и рН 5,9.
Пример 6
Подтверждение вязкости и функциональности шприца для состава на основе антител
[00159] В идеале, сила трения скольжения для предварительно заполненного шприца должна быть как можно ниже, чтобы обеспечить функциональность. В данной работе авторы настоящего изобретения ставят целью вязкость менее 20 мПа⋅с и силу трения скольжения менее 15 Н. Предшествующий опыт показал, что составы с номинальными значениями вязкости менее 15 мПа⋅с имели приемлемые характеристики скольжения при оснащении тонкостенными иглами 27 калибра. Возможно до 20 мПа⋅с в PFS с иглой STW 27 калибра. Состав и PFS должны включать устойчивость для учета изменчивости шприцев и состава.
[00160] В этом разделе авторы настоящего изобретения документируют дополнительные данные, демонстрирующие устойчивость вязкости состава в зависимости от концентрации при сравнении с составом с нижним интервалом значений уровня лизина-HCl (25 мМ). В этом разделе также оценивают результаты возможности практической реализации характеристики скольжения и времени инъекции с помощью номинального состава в PFS с иглой STW 27 калибра.
Устойчивость и влияние уровня лизина-HCl на профиль вязкости
[00161] В двух составах получали серии разведений MEDI-546 от 100 до 200 мг/мл. Они содержали MEDI-546 в 25 мМ гистидина/гистидина-HCI, 130 мМ дигидрата трегалозы с 0,02% полисорбата-80 при рН 6,0 либо с 25 мМ, либо с 50 мМ лизина-HCl. Кривые вязкости показаны на фигуре 3. Результаты показывают, что вязкость составов как с низким (25 мМ), так и номинальным (50 мМ) уровнями лизина является приемлемой при 150 мг/мл (<15 мПа⋅с) и они оба характеризуются вязкостью менее приблизительно 20 мПа⋅с при 165 мг/мл. Таким образом, были подтверждены результаты, что номинальный уровень 50 мМ лизина-HCl соответственным образом охвачен низким уровнем 25 мМ с точки зрения характеристики вязкости. Исходя из влияния рН на вязкость и возможных эффектов типа Dorman во время TFF выбирали значение рН состава на основе антител, составляющее 5,9.
Оценка функциональности состава на основе антител в предварительно заполненных шприцах
[00162] В таблице 7 приведены результаты оценки функциональности состава, содержащего MEDI-546 при 150 мг/мл в 25 мМ гистидина/гистидина-HCl, 50 мМ лизина-HCl, 130 мМ дигидрата трегалозы, 0,05% полисорбата-80 и рН 5,9.
[00163] Силы, необходимые для инъекции лекарственного продукта MEDI-546 находились в приемлемых диапазонах. В таблице 8 приведены результаты оценки инъекции пользователя (лабораторных исследователей). Пользователи заявляли, что "усилие нагнетания было легким"; "перчатками для имитации артрита усложняли применение APFS"; "SSI устройство работало". Некоторая изменчивость скорости инъекции была отмечена на основании того, что пользователи являлись новичками в использовании инъекционного тренажера и перчаток (примечание: сила для инъекций не считалась проблемой). Данные результаты указывают на то, что данный состав подходит для применения в PFS с STW иглой 27 калибра. Эти исследования не выявили каких-либо проблем с вязкостью составов на основе антител.
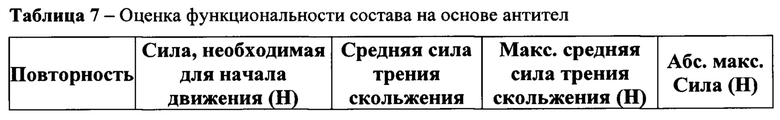
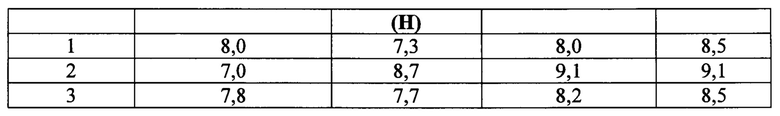

Пример 7 Влияние лизина и белка на вязкость
[00164] Вязкость растворов при различных концентрациях лизина измеряли в зависимости от концентрации белка (анифролумаба), что показано в таблице 9 и на фигуре 4.
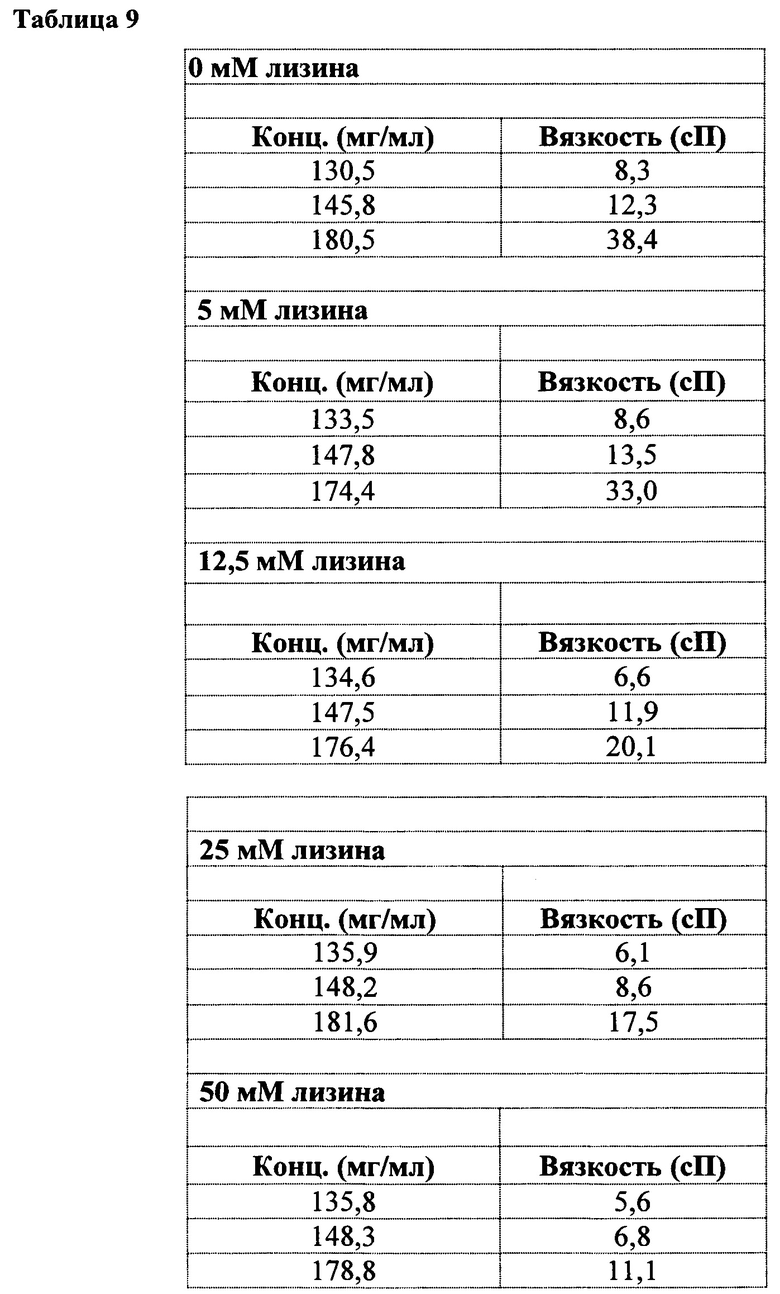
[00165] Измеряли вязкость растворов антитела (анифролумаба) при различных концентрациях в зависимости от концентрации белка, что показано в таблице 10 и на фигуре 5.
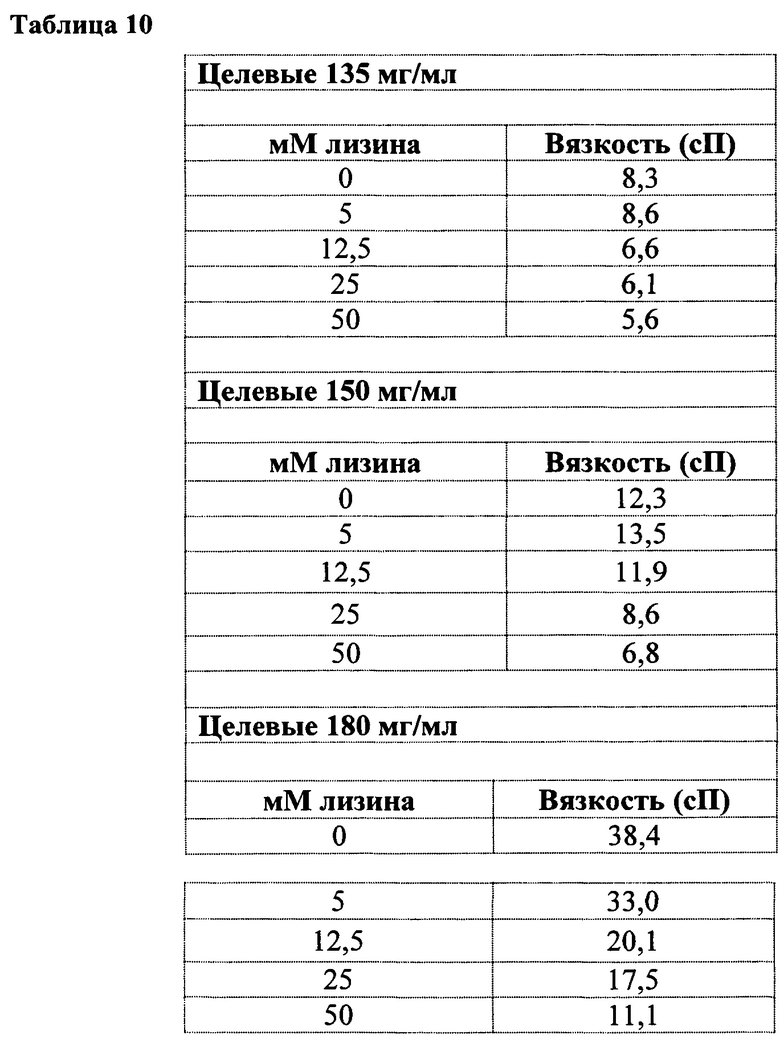
[00166] Примеры, показанные выше, иллюстрируют различные аспекты настоящего изобретения и практическое осуществление способов по настоящему изобретению. Данные примеры не предназначены для обеспечения полного описания многих различных вариантов осуществления настоящего изобретения. Таким образом, хотя настоящее изобретение было довольно подробно описано в качестве иллюстрации и примера в целях ясности понимания, специалисты в данной области техники без труда поймут, что могут быть внесены многие изменения и модификации без отступления от сущности или объема прилагаемой формулы изобретения.
[00167] Все публикации, патенты и заявки на патенты, упоминаемые в данном документе, включены в него посредством ссылки в такой же степени, как если бы каждая отдельная публикация, патент или заявка на патент были конкретно и отдельно указаны как включенные в данный документ посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТАБИЛЬНЫЕ ВОДНЫЕ СОСТАВЫ НА ОСНОВЕ АНТИТЕЛ | 2014 |
|
RU2763787C2 |
| СОСТАВЫ АНТИТЕЛ К RSV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807524C2 |
| СОСТАВ АНТИТЕЛА | 2015 |
|
RU2743681C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К РЕЦЕПТОРУ TSLP ЧЕЛОВЕКА | 2016 |
|
RU2794148C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| СОСТАВЫ НА ОСНОВЕ АНТИТЕЛА | 2017 |
|
RU2769326C2 |
| СТАБИЛИЗИРОВАННЫЕ СОСТАВЫ, СОДЕРЖАЩИЕ АНТИТЕЛА К РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА 6 (IL-6R) | 2011 |
|
RU2554779C2 |
| СТАБИЛЬНЫЕ ПРЕПАРАТЫ СВЯЗЫВАЮЩЕГО СРЕДСТВА НА ОСНОВЕ IgG4 | 2013 |
|
RU2644214C2 |
| СОСТАВЫ АНТИТЕЛ | 2014 |
|
RU2694055C2 |
| ПРЕПАРАТ ДЛЯ БИСПЕЦИФИЧЕСКИХ АКТИВАТОРОВ Т-КЛЕТОК (BITE) | 2013 |
|
RU2679124C2 |
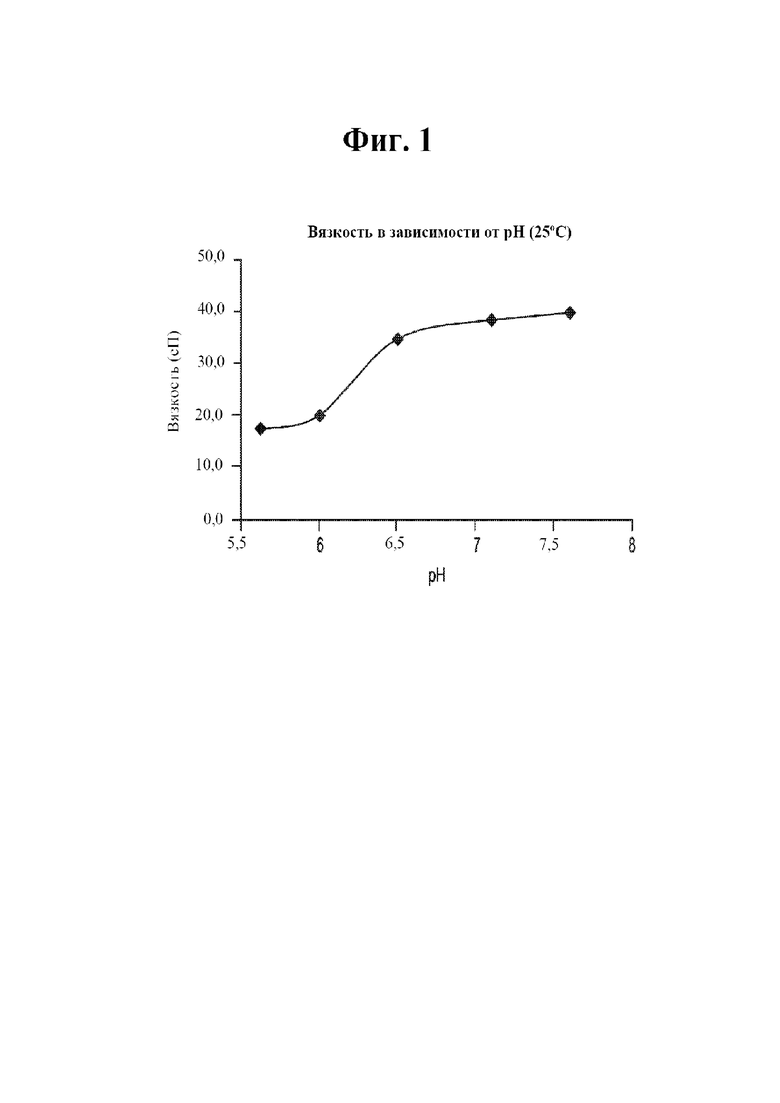

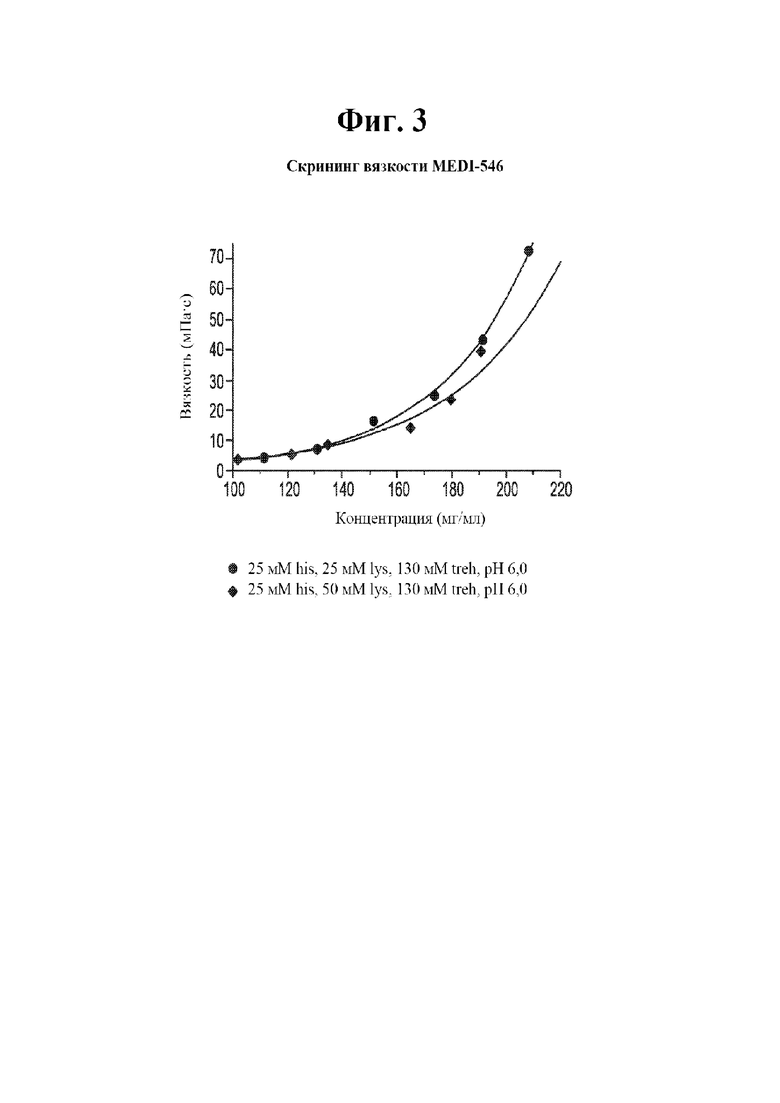
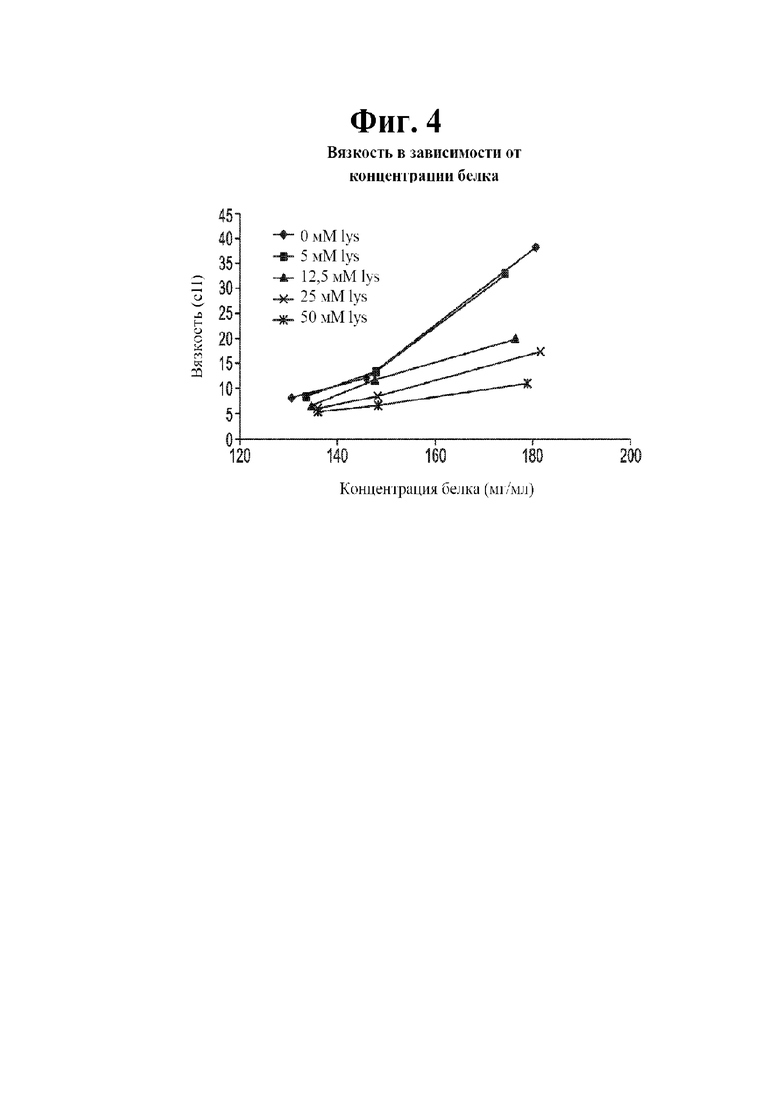
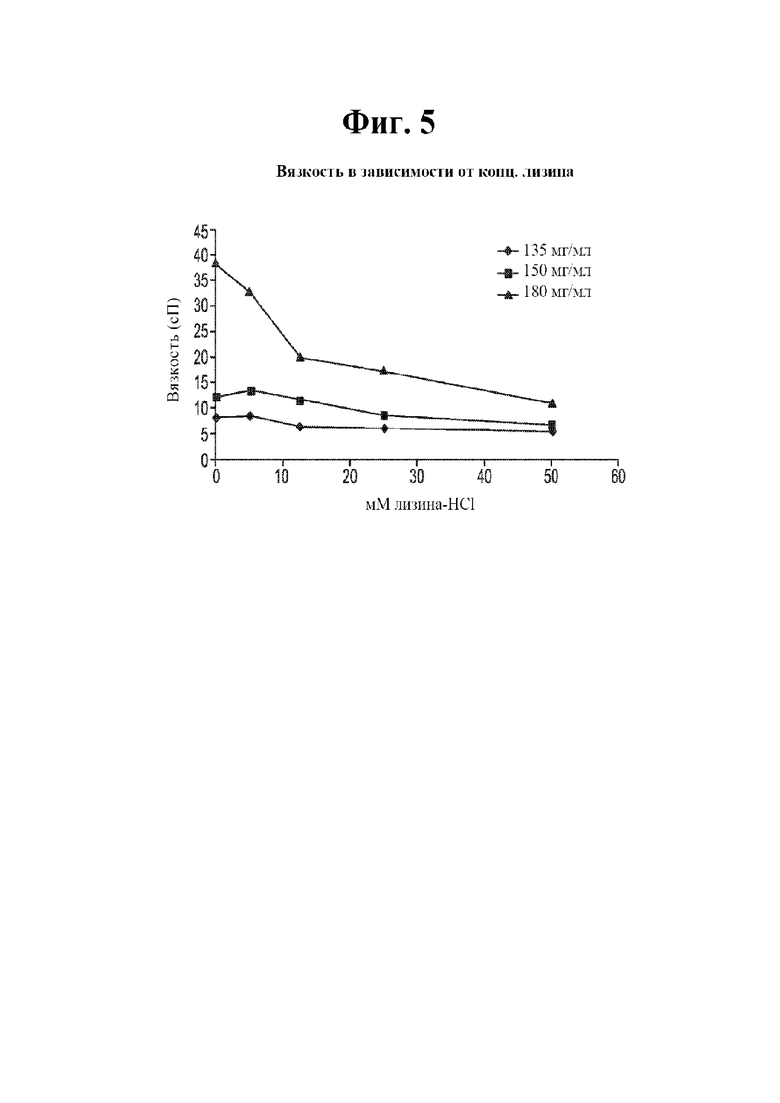
Изобретение относится к области биохимии, в частности к составу на основе антитела, обладающему специфическим связыванием с рецептором интерферона альфа 1 (IFNAR1). Изобретение позволяет эффективно лечить заболевания, ассоциированные с рецептором интерферона альфа 1 (IFNAR1). 3 н. и 10 з.п. ф-лы, 5 ил., 10 табл., 4 пр.
1. Состав на основе антитела, обладающий специфическим связыванием с рецептором интерферона альфа 1 (IFNAR1), содержащий:
a. 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента;
b. 50 мМ лизина-HCl;
c. 130 мМ дигидрата трегалозы;
d. 0,05% полисорбата-80;
e. 25 мМ гистидина/гистидина-HCl,
где состав характеризуется pH 5,9.
2. Состав на основе антитела по п. 1, где состав характеризуется вязкостью, равной 20 мПа·с или меньше при 25°C.
3. Состав на основе антитела по любому из пп. 1-2, где указанный состав является стабильным при хранении при приблизительно 40°C в течение 1-24 месяцев.
4. Состав на основе антитела по любому из пп. 1-3, где указанный состав является стабильным при хранении при приблизительно 40°C в течение 1-18 месяцев.
5. Состав на основе антитела по любому из пп. 1-4, где состав содержит менее 700 частиц на мл с размером более 10 мкм или равным этому значению после хранения при приблизительно 40°C в течение 18 месяцев.
6. Состав на основе антитела по любому из пп. 1-5, где скорость потери чистоты состава при 40°C составляет от 3 до 5% в месяц в течение 12 месяцев, что определяется с помощью HP-SEC.
7. Состав на основе антитела по любому из пп. 1-6, где скорость фрагментации состава составляет от 2,0 до 4,0% в месяц в течение 12 месяцев, что определяется с помощью HP-SEC.
8. Состав на основе антитела по любому из пп. 1-7, где скорость агрегации состава составляет от 0,5 до 2,5% в месяц в течение 12 месяцев, что определяется с помощью HP-SEC.
9. Состав на основе антитела по любому из пп. 1-8, где от приблизительно 1 до 6% антитела разрушается, денатурирует, агрегирует или разворачивается за месяц при хранении при приблизительно 5°C в течение 1-24 месяцев.
10. Состав на основе антитела по любому из пп. 1-9, где антитело, хранящееся при приблизительно 5°C в течение по меньшей мере 6 месяцев, сохраняет по меньшей мере 80% способности к связыванию с полипептидом IFNAR по сравнению с эталонным антителом, которое не подвергалось хранению.
11. Состав на основе антитела по п. 10, где состав подходит для внутривенного, подкожного или внутримышечного введения.
12. Предварительно заполненный шприц, включающий состав на основе антитела, содержащий:
a. 150 мг/мл анифролумаба или его антигенсвязывающего фрагмента;
b. 50 мМ лизина-HCl;
c. 130 мМ дигидрата трегалозы;
d. 0,05% полисорбата-80;
e. 25 мМ гистидина/гистидина-HCl,
где состав характеризуется pH 5,9.
13. Фармацевтическая стандартная лекарственная форма, обладающая специфическим связыванием с рецептором интерферона альфа 1 (IFNAR1), подходящая для парентерального введения человеку, которая содержит состав на основе антитела по любому из пп. 1-11 в подходящем контейнере.
| WO 2010056804 A1, 20.05.2010 | |||
| WO 2009070642 A1, 04.06.2009 | |||
| WO 2014186350 A1, 20.11.2014 | |||
| WO 2015063180 A1, 07.05.2015 | |||
| RU 2007118648 A, 27.11.2008. |
Авторы
Даты
2020-09-08—Публикация
2016-08-18—Подача