ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к стабильной фармацевтической композиции, содержащей антитело к рецептору TSLP человека. Также настоящее изобретение относится к стабильной и высококонцентрированной фармацевтической композиции, содержащей антитело к рецептору TSLP человека.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Известно, что моноклональное антитело, которое специфически связывается с рецептором TSLP человека (тимусным стромальным лимфопоэтином) и ингибирует действие TSLP человека через рецептор TSLP человека, является пригодным для профилактики и/или лечения различных заболеваний, при которых TSLP человека и рецептор TSLP человека вовлечены в патологию заболевания (например, профилактики и/или лечения астмы) (патентная литература 1).
[0003] В патентной литературе 1 в качестве антитела к рецептору TSLP человека описан полностью принадлежащий человеку тип T7-27 и описано, что он ингибирует экспрессию иРНК TARC (хемокина, регулируемого тимусом и активацией), индуцируемого TSLP, и продукцию белка MDC (макрофагального хемокина), и что он подавляет аллергическую реакцию на модели сенсибилизации аскаридным антигеном на обезьянах.
[0004] С другой стороны, в последние годы были разработаны различные лекарственные препараты на основе антител, и в настоящее время они являются доступными для медицинской области. Многие лекарственные препараты на основе антител вводят путем внутривенного введения, подкожного введения или т.п., и, таким образом, их предоставляют в форме парентеральной фармацевтической композиции, такой как жидкий препарат, лиофилизированный препарат или т.п. для медицинской области. Поскольку предполагают, что парентеральные фармацевтические композиции непосредственно вводят в организм, необходимыми являются стабильные фармацевтические препараты.
[0005] Также с фармацевтической точки зрения поскольку предполагают внутривенное введение или подкожное введение в качестве пути введения, в случае получения того же фармацевтического препарата, принимая во внимание дозу для подкожного введения, необходимым является, чтобы фармацевтический препарат представлял собой высококонцентрированный препарат.
[0006] Однако в растворе, содержащем высокую концентрацию антитела, могут происходить нежелательные явления, включая образование нерастворимых агрегатов и/или растворимых агрегатов. Нерастворимые агрегаты и растворимые агрегаты образуются в растворенном состоянии в результате образования связи с молекулами антитела. Кроме того, когда раствор хранят в течение длительного периода времени, дезамидирование остатка аспарагина может снижать физиологическую активность молекулы антитела.
[0007] В качестве способа применительно к высококонцентрированному антителу и белковому препарату известно изобретение, относящееся к стабильному, жидкому препарату с низкой мутностью, содержащему белок или антитело в количестве от 100 до 260 мг/мл, гидрохлорид аргинина в количестве от 50 до 200 ммоль/л, гистидин в количестве от 10 до 100 ммоль/л, полисорбат в количестве от 0,01 до 0,1%, где pH препарата находится в диапазоне от 5,5 до 7,0, кинематическая вязкость составляет приблизительно 50 сСт или менее, и осмолярность в диапазоне от 200 мосмоль/кг до 450 мосмоль/кг (патентная литература 2). Однако антитело к рецептору TSLP человека не раскрывают и не предполагают в патентной литературе 2.
[0008] В патентной литературе 3 раскрыто изобретение, относящееся к стабильной фармацевтической композиции, содержащей антитело к TSLP, но оно не является изобретением, относящимся к антителу к рецептору TSLP.
СПИСОК ЦИТИРУЕМЫХ ДОКУМЕНТОВ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0009] [Патентная литература 1] WO 2015/020193
[Патентная литература 2] WO 2004/091658
[Патентная литература 3] WO 2014/031718
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
[0010] Целью настоящего изобретения является предоставление стабильной фармацевтической композиции, содержащей полностью принадлежащий человеку тип T7-27, который представляет собой антитело к рецептору TSLP человека.
Более конкретно, целью настоящего изобретения является предоставление фармацевтической композиции, содержащей полностью принадлежащий человеку тип T7-27, который представляет собой антитело к рецептору TSLP человека, например, (i) фармацевтической композиции, способной подавлять образование химически модифицированных веществ, таких как дезамидированные формы и окисленные формы, или продуктов разложения или мультимеров, которое повышается в результате нагревания, (ii) фармацевтической композиции, способной подавлять образование окисленных форм, которому способствует добавление аргинина, (iii) фармацевтической композиции, способной подавлять образование микрочастиц, которое повышается после физического стресса, или (iv) фармацевтической композиции, способной подавлять образование окисленных форм, которое повышается, когда концентрация поверхностно-активного вещества является высокой.
РЕШЕНИЕ ЗАДАЧИ
[0011] Авторы настоящего изобретения выявили, что можно получать стабильную фармацевтическую композицию путем формуляции полностью принадлежащего человеку типа T7-27, который представлял собой антитело к рецептору TSLP человека, в растворе аргинина (пример 2 ниже), такую стабильную фармацевтическую композицию можно получать путем доведения pH раствора до подходящего диапазона, или с использованием различных буферных компонентов (примеры 1, 3 и 4 ниже), и кроме того, стабильную фармацевтическую композицию можно получать с использованием поверхностно-активного вещества, путем доведения концентрации антитела или т.п., и выполнили настоящее изобретение.
[0012] Настоящее изобретение относится к:
[1] стабильной фармацевтической композиции, содержащей антитело к рецептору TSLP человека, фармацевтически приемлемый буфер, аргинин или его фармацевтически приемлемую соль и поверхностно-активное вещество, где следующие ниже (1) и/или (2) представляют собой антитело к рецептору TSLP человека:
(1) антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3, и
(2) антитело к рецептору TSLP человека, состоящее из аминокислотных последовательностей антитела, получаемого посттрансляционной модификацией антитела к рецептору TSLP человека (1);
[2] фармацевтической композиции по [1], где фармацевтически приемлемый буфер представляет собой один, или два или более выбранных из группы, состоящей из фосфорной кислоты, лимонной кислоты, уксусной кислоты, янтарной кислоты, гистидина, аскорбиновой кислоты, глутаминовой кислоты, молочной кислоты, малеиновой кислоты, трометамола и глюконовой кислоты;
[3] фармацевтической композиции по [1] или [2], где фармацевтически приемлемый буфер представляет собой фосфорную кислоту;
[4] фармацевтической композиции по любому из пунктов [1]-[3], где концентрация фармацевтически приемлемого буфера составляет от 5 до 100 ммоль/л;
[5] фармацевтической композиции по любому из пунктов [1]-[4], где фармацевтическая композиция представляет собой жидкий препарат или лиофилизированный препарат, или высушенный распылением препарат;
[6] фармацевтической композиции по [5], где фармацевтическая композиция представляет собой жидкий препарат;
[7] фармацевтической композиции по [5], где фармацевтическая композиция представляет собой жидкий препарат, pH жидкого препарата составляет от 5 до 6, или где фармацевтическая композиция представляет собой лиофилизированный препарат или высушенный распылением препарат, pH раствора после восстановления препарата в воде составляет от 5 до 6;
[8] фармацевтической композиции по [7], где фармацевтическая композиция представляет собой жидкий препарат, и pH жидкого препарата составляет от 5 до 6;
[9] фармацевтической композиции по любому из пунктов [1]-[8], где концентрация аргинина или его фармацевтически приемлемой соли составляет 700 ммоль/л или менее;
[10] фармацевтической композиции по любому из пунктов [1]-[9], где поверхностно-активное вещество представляет собой один, или два или более выбранных из группы, состоящей из полисорбатов и полоксамера 188;
[11] фармацевтической композиции по любому из пунктов [1]-[10], где поверхностно-активное вещество представляет собой полисорбат 80;
[12] фармацевтической композиции по любому из пунктов [1]-[11], где содержание поверхностно-активного вещества составляет от 0,001 до 1% (масс./об.);
[13] фармацевтической композиции по любому из пунктов [1]-[12], где содержание поверхностно-активного вещества составляет от 0,01 до 0,2% (масс./об.);
[14] фармацевтической композиции по любому из пунктов [5]-[13], где фармацевтическая композиция представляет собой жидкий препарат, содержание антитела к рецептору TSLP человека составляет от 0,007 до 2 ммоль/л, или где фармацевтическая композиция представляет собой лиофилизированный препарат или высушенный распылением препарат, содержание раствора после восстановления препарата в воде составляет от 0,007 до 2 ммоль/л;
[15] фармацевтической композиции по любому из пунктов [1]-[14], где фармацевтическую композицию хранят, содержание каждого из продукта разложения и мультимера составляет 10% или менее, или содержание химически модифицированного вещества составляет 50% или менее;
[16] фармацевтической композиции по [1], содерджащей антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3;
[17] фармацевтической композиции по [1], содержащей антитело к рецептору TSLP человека, состоящее из аминокислотных последовательностей антитела, получаемого посттрансляционной модификацией антитела к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3;
[18] фармацевтической композиции по [1], содержащей антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности аминокислот 1-447 SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3; и
[19] фармацевтической композиции по [1], содержащей антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3, и антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности аминокислот 1-447 SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
[0013] По настоящему изобретению можно предоставлять стабильную фармацевтическую композицию, содержащую полностью принадлежащий человеку тип T7-27, который представляет собой антитело к рецептору TSLP человека, более конкретно, стабильную фармацевтическую композицию содержащую антитело к рецептору TSLP человека, способную подавлять образование химически модифицированных веществ, таких как дезамидированные формы и окисленные формы, или продуктов разложения или мультимеров или образование микрочастиц.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
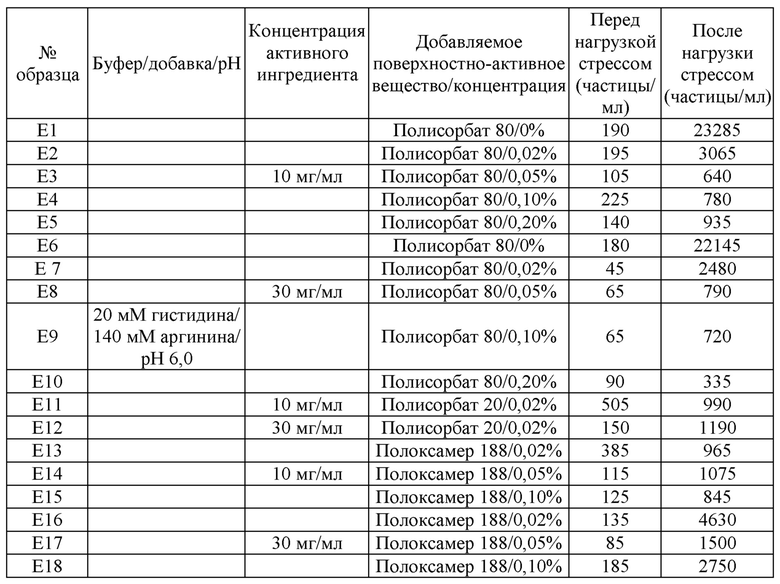
[0014] [Фиг. 1-1] на фиг. 1-1 представлены результаты оценки SEC и IEC, получаемых в примере 1 (мультимеры SEC).
[Фиг. 1-2] на фиг. 1-2 представлены результаты оценки SEC и IEC, получаемые в примере 1 (продукты разложения SEC).
[Фиг. 1-3] на фиг. 1-3 представлены результаты оценки SEC и IEC, получаемые в примере 1 (основной пик IEC).
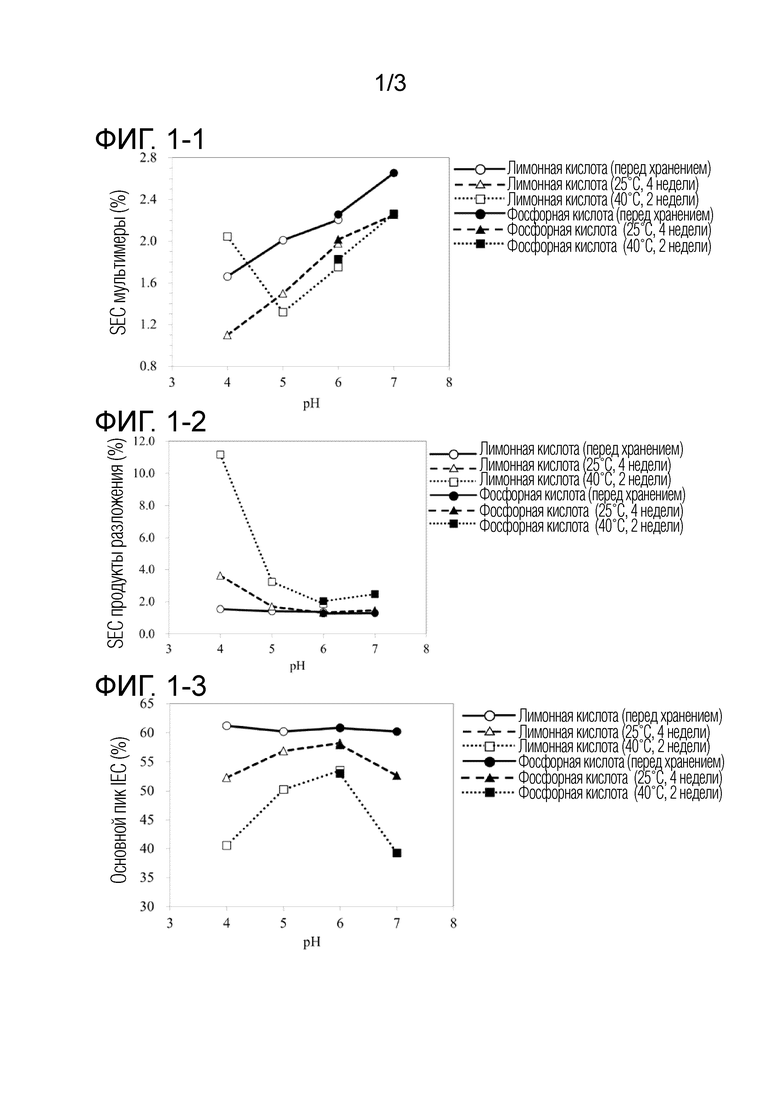
[Фиг. 2] на фиг. 2 представлены результаты оценки SEC, получаемые в примере 2.
[Фиг. 3-1] на фиг. 3-1 представлены результаты аргинина и pH в группе составов, содержащих фосфорную кислоту, получаемые в примере 3.
[Фиг. 3-2] на фиг. 3-2 представлены результаты аргинина и pH в группе составов, содержащих гистидин, получаемые в примере 3.
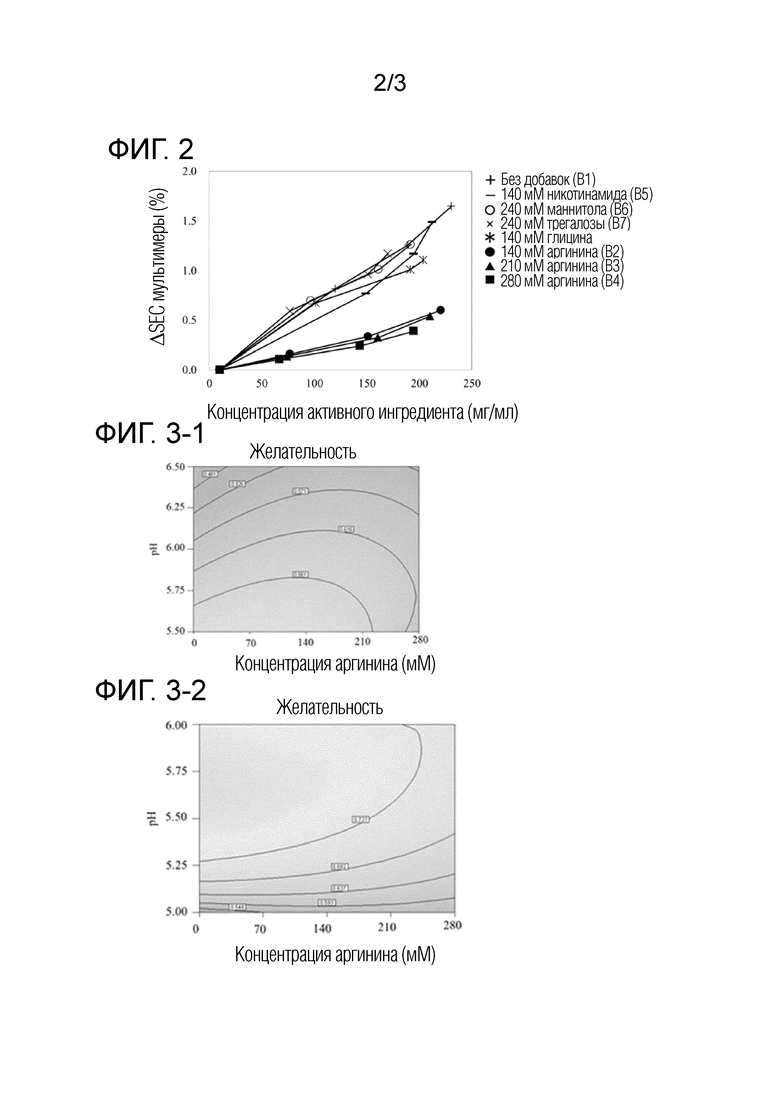
[Фиг. 4-1] на фиг. 4-1 представлены результаты оценки HIC, получаемые в примере 5.
[Фиг. 4-2] на фиг. 4-2 представлены результаты оценки HIC, получаемые в примере 5.
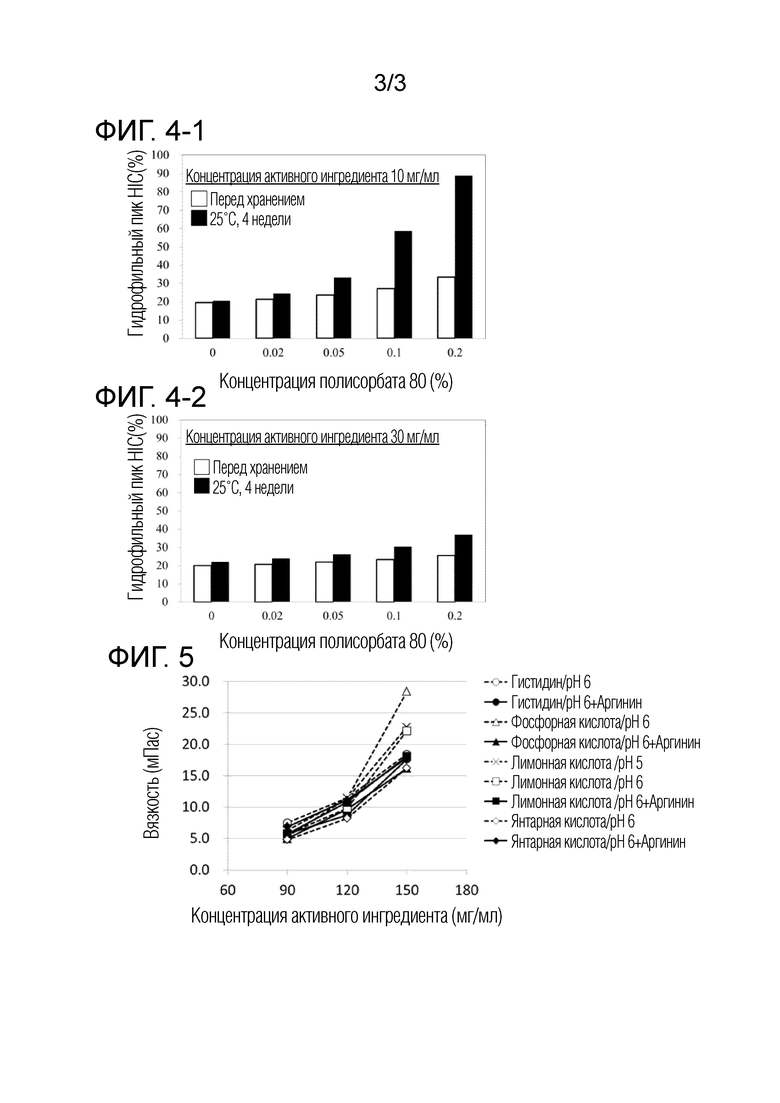
[Фиг. 5] на фиг. 5 представлены результаты оценки вязкости, получаемые в примере 6.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0015] Термин "стабильная", как используют в настоящем описании, означает наличие стабильности в отношении, например, нагревания, света, температуры и/или влажности. Например, после того как фармацевтическая композиция отстаивается в предопределенных условиях, это означает, что примеси, содержащиеся в фармацевтической композиции, например, химически модифицированные вещества, такие как дезамидированные формы и окисленные формы, или продукты разложения или мультимеры, составляют определенное количество или менее. Количества определяют как процентное содержание (%) путем измерения площади пиков мультимеров или пиков продуктов разложения, детектируемых посредством SEC способом автоматического анализа, и делением их на сумму площадей всех пиков, включая основной пик, путем измерения площади основного пика, детектируемого посредством IEC способом автоматического анализа, и делением ее на сумму площадей всех пиков отличных от основного пика, или путем измерения площади гидрофильного пика, детектируемого посредством HIC способом автоматического интегрирования, и делением ее на сумму площадей всех пиков, включая основной пик. Как используют в настоящем описании, основной пик означает пик активного соединения.
[0016] Химически модифицированное вещество представляет собой структуру, образуемую в результате химической модификации части последовательности молекулы антитела. Количество химически модифицированных веществ определяют как от 0% до 70% в качестве одного из вариантов осуществления и от 0% до 50% в качестве другого варианта осуществления.
[0017] Дезамидированная форма представляет собой химически модифицированное вещество, в котором участок аминоостатков молекулы антитела претерпевает реакцию дезамидирования. Способ измерения дезамидированной формы конкретно не ограничен, при условии, что дезамидированную форму можно измерять. Способ измерения включает, например, ионообменную хроматографию и т.п. Количество дезамидированных форм определяют от 0% до 70% в качестве одного из вариантов осуществления, от 0% до 50% в качестве другого варианта осуществления, и от 0% до 30% в качестве еще одного другого варианта осуществления.
[0018] Окисленная форма представляет собой химически модифицированное вещество, в котором часть последовательности молекулы антитела является окисленной. Способ измерения окисленной формы конкретно не ограничен, при условии, что можно измерять окисленную форму. Способ измерения включает, например, хроматографию на основе гидрофобных взаимодействий, ионообменную хроматографию и т.п. Количество окисленных форм определяют как от 0% до 70% в качестве одного из вариантов осуществления и как от 0% до 50% в качестве другого варианта осуществления.
[0019] Продукт разложения представляет собой фрагмент, образуемый в результате удаления части молекулы антитела. Способ измерения продукта разложения конкретно не ограничен, при условии, что можно измерять продукт разложения. Способ измерения включает, например, эксклюзионную хроматографию, электрофорез в геле, капиллярный электрофорез, динамическое светорассеяние, подсчет количества частиц в режиме светотени, микропотоковую визуализацию и т.п. Количество продуктов разложения определяют как от 0% до 10% в качестве одного из вариантов осуществления и от 0% до 5% в качестве другого варианта осуществления.
[0020] Мультимер представляет собой комплекс, образуемый в результате сборки множества молекул антитела. Способ измерения мультимера конкретно не ограничен, при условии, что можно измерять мультимер. Способ измерения включает, например, эксклюзионную хроматографию, электрофорез в геле, капиллярный электрофорез, динамическое светорассеяние, подсчет количества частиц в режиме светотени, микропотоковую визуализацию и т.п. Количество мультимеров определяют как от 0% до 10% в качестве одного из вариантов осуществления и от 0% до 5% в качестве другого варианта осуществления.
[0021] Термин "стабильная", как используют в настоящем описании, означает, что количество примесей подавляется по меньшей мере в течение 6 месяцев, предпочтительно в течение 1 года, более предпочтительно в течение 2 лет при температуре охлаждения (от 2°C до 8°C); по меньшей мере в течение 3 месяцев, предпочтительно в течение 6 месяцев, более предпочтительно в течение 1 года при комнатной температуре (от 22°C до 28°C); или по меньшей мере 1 неделю, предпочтительно в течение 2 недель при 40°C. Например, каждое из количества мультимеров и количества продуктов разложения после хранения при 5°C в течение 2 лет составляет 10% или менее, предпочтительно 5% или менее, более предпочтительно 3% или менее; каждое из количества мультимеров и количества продуктов разложения после хранения при 25°C в течение 3 месяцев составляет 10% или менее, предпочтительно 5% или менее, более предпочтительно 3% или менее; или каждое из количества мультимеров и количества продуктов разложения после хранения при 40°C в течение 1 недели составляет 5% или менее, предпочтительно 3% или менее.
[0022] Термин "приблизительно", как используют в настоящем описании, когда его используют в отношении числовых величин, означает большее значение переменной, в основном, в пределах экспериментальной ошибки (например, в доверительном интервале 95% для среднего), или в пределах ±10% от указанной величины и все величины переменой. В связи с этим, даже в случае числового значения без "приблизительно" можно интерпретировать подобным образом.
[0023] Существует пять классов антител: IgG, IgM, IgA, IgD и IgE. Основная структура молекулы антитела является общей для каждого класса и состоит из тяжелой цепи с молекулярной массой от 50000 до 70000 и легкой цепи от 20000 до 30000. Тяжелая цепь, как правило, состоит из полипептида, содержащего приблизительно 440 аминокислот, и имеет характерную структуру для каждого класса, и тяжелые цепи IgG, IgM, IgA, IgD и IgE называют Igγ, Igμ, Igα, Igδ и Igε, соответственно. IgG дополнительно включает подклассы: IgG1, IgG2, IgG3 и IgG4, и их тяжелые цепи называют Igγ1, Igγ2, Igγ3 и Igγ4, соответственно. Легкая цепь, как правило, состоит из полипептида, содержащего приблизительно 220 аминокислот, и известно два типа легких цепей: тип L и тип K, и их называют Igλ и Igκ, соответственно. Касательно полипептидного строения основной структуры молекулы антитела две гомологичные тяжелые цепи и две гомологичные легкие цепи связаны дисульфидными связями (связь S-S) и нековалентными связями, и молекулярная масса составляет от 150000 до 190000. Два типа легких цепей могут образовывать пару с любой тяжелой цепью. Индивидуальная молекула антитела всегда состоит из двух идентичных легких цепей и двух идентичных тяжелых цепей.
[0024] Существует четыре (пять для μ- или ε-цепи) внутрицепочечных связей S-S и две внутрицепочечные связи S-S, и одна петля образуется каждые 100-110 аминокислотных остатков, и эта пространственная структура является аналогичной для каждой петли и называется структурной единицей или доменом. Аминокислотная последовательность, домена, расположенного на амино-конце (N-конце) тяжелой и легкой цепей, не является константной, даже если антитело относится к виду, который представляет собой тот же класс (подкласс) от того же вида животного, и домен называется вариабельной областью, и каждый домен называется вариабельной областью тяжелой цепи и вариабельной областью легкой цепи. Аминокислотная последовательность со стороны карбокси-конца (C-конца) от вариабельной области всегда является константной для каждого класса или подкласса и называется константной областью.
[0025] Известно, что когда антитело экспрессируют в клетках, антитело претерпевает посттрансляционную модификацию. В качестве примеров посттрансляционной модификации, при которой изменяется аминокислотный остаток, можно привести отщепление лизина на C-конце тяжелой цепи карбоксипептидазой, модификацию до пироглутаминовой кислоты в результате пироглутамилирования глутамина или глутаминовой кислоты на N-конце тяжелой и легкой цепей или т.п., и известно, что лизин на C-конце тяжелой цепи удаляется, и происходит модификация до пироглутаминовой кислоты для большей части глутамина на N-конце тяжелой цепи в различных антителах (Journal of Pharmaceutical Sciences, 2008, Vol. 97, p. 2426). Кроме того, в данной области известно, что такая посттрансляционная модификация в результате пироглутамилирование на N-конце или делеция лизина на C-конце не влияет на активность антитела (Analytical Biochemistry, 2006, Vol. 348, p. 24-39).
[0026] В качестве антитела к рецептору TSLP человека фармацевтическая композиция по настоящему изобретению содержит антитело к рецептору TSLP человека из следующих ниже (1) и/или (2):
(1) антитела к рецептору TSLP человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3, и
(2) антитела к рецептору TSLP человека, состоящего из аминокислотных последовательностей антитела, получаемого посттрансляционной модификацией антитела к рецептору TSLP человека, содержащего тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3 (WO 2015/020193).
[0027] В одном из вариантов осуществления посттрансляционная модификация в антителе к рецептору TSLP человека (2) представляет собой пироглутамилирование на N-конце вариабельной области тяжелой цепи и/или делеция лизина на C-конце тяжелой цепи. Например, в качестве антитела к рецептору TSLP человека (2) можно привести в пример антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности аминокислот 1-447 SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3.
[0028] В одном из вариантов осуществления фармацевтическая композиция по настоящему изобретению содержит антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3, и антитело к рецептору TSLP человека, содержащее тяжелую цепь, состоящую из аминокислотной последовательности аминокислот 1-447 SEQ ID NO:1, и легкую цепь, состоящую из аминокислотной последовательности SEQ ID NO:3.
[0029] Специалисты в данной области могут легко получать антитело к рецептору TSLP человека, используемое в настоящем изобретении, на основании информации о последовательности тяжелой цепи и легкой цепи антитела к рецептору TSLP человека, раскрытого в настоящем описании, известными в данной области способами. В качестве способа получения антитела к рецептору TSLP человека, используемого в настоящем изобретении, можно привести в пример способ, раскрытый в WO 2015/020193.
[0030] Количество антитела в одной единице фармацевтической композиции (препарата) составляет, например, от 0,001 мг до 1000 мг в качестве одного из вариантов осуществления и от 0,01 мг до 100 мг в качестве другого варианта осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
[0031] Когда фармацевтическая композиция находится в твердом состоянии (например, лиофилизированный препарат, высушенный распылением препарат или т.п.), количество антитела составляет, например, от 0,001 мг до 1000 мг в качестве одного из вариантов осуществления и от 0,01 мг до 100 мг в качестве одного из вариантов осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
Жидкий объем при растворении в момент использования составляет, например, от 0,1 мл до 100 мл в качестве варианта осуществления и от 1 мл до 10 мл в качестве другого варианта осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
[0032] Когда фармацевтическая композиция находится в жидком состоянии (жидкий препарат), концентрация антитела составляет, например, от 1 мг/мл до 300 мг/мл (приблизительно от 0,007 ммоль/л до 2 ммоль/л) в качестве варианта осуществления, от 1 мг/мл до 200 мг/мл (приблизительно от 0,007 ммоль/л до 1 ммоль/л) в качестве одного из вариантов осуществления, от 1 мг/мл до 100 мг/мл (приблизительно от 0,007 ммоль/л до 0,7 ммоль/л) в качестве еще одного другого варианта осуществления, и от 10 мг/мл до 50 мг/мл (приблизительно от 0,07 ммоль/л до 0,3 ммоль/л) в качестве еще одного другого варианта осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
Доза составляет от 0,001 мг до 1000 мг в качестве одного из вариантов осуществления и от 0,01 мг до 100 мг в качестве другого варианта осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
[0033] Показания включают профилактику и/или лечение различных заболеваний, при которых TSLP человека и рецептор TSLP человека вовлечены в патологию заболевания, например, профилактику и/или лечение астмы.
[0034] "Фармацевтически приемлемый буфер", используемый в настоящем изобретении, конкретно не ограничен, при условии, что он является фармацевтически приемлемым и находится в состоянии раствора, pH раствора можно доводить до желаемого диапазона значений pH.
[0035] Более конкретно, pH находится в диапазоне, например, от 5 до 6 в качестве одного из вариантов осуществления и от 5,0 до 6,0 в качестве другого варианта осуществления. Когда буфер представляет собой фосфорную кислоту или ее соль, pH находится в диапазоне предпочтительно от 5,5 до 5,7, и когда буфер представляет собой гистидин или его соль, pH находится в диапазоне предпочтительно от 5,3 до 6,0.
Когда фармацевтическая композиция представляет собой жидкий препарат, pH определяют как pH жидкого препарата, и когда фармацевтическая композиция представляет собой лиофилизированный препарат или высушенный распылением препарат, pH определяют как pH раствора, получаемого путем растворения препарата в воде.
[0036] В качестве буферного компонента в качестве одного из вариантов осуществления входит, например, фосфорная кислота (натрий или калий), лимонная кислота, уксусная кислота, янтарная кислота, гистидин, аскорбиновая кислота, глутаминовая кислота, молочная кислота, малеиновая кислота, трометамол, глюконовая кислота, их фармацевтически приемлемая соль или т.п. В качестве другого варианта осуществления входит фосфорная кислота или ее фармацевтически приемлемая соль (натриевая соль или калиевая соль). Дигидрофосфат натрий входит в качестве еще одного другого варианта осуществления.
Один вид или два или более видов таких буферных компонентов можно соответствующим образом использовать в подходящих количествах.
[0037] Концентрация буфера конкретно не ограничена, при условии, что pH можно доводить в пределах желаемого диапазона значений pH. Более конкретно, он составляет, например, он 5 до 100 ммоль/л в качестве одного варианта осуществления, от 5 до 70 ммоль/л в качестве другого варианта осуществления и от 5 до 50 ммоль/л в качестве еще одного другого варианта осуществления.
[0038] Когда фармацевтическая композиция находится в состоянии раствора (жидкий препарат), растворенном в воде для инъекций, количество буфера составляет, например, от 0,1 до 100 мг/мл в качестве одного варианта осуществления, и от 0,1 до 50 мг/мл в качестве другого варианта осуществления. Когда фармацевтическая композиция находится в твердом состоянии (лиофилизированный препарат) в результате лиофилизации или т.п., например, количество после восстановления в 1 мл воды для инъекций составляет от 5 до 100 ммоль/л в качестве одного варианта осуществления, от 5 до 70 ммоль/л в качестве другого варианта осуществления и от 5 до 50 ммоль/л в качестве еще одного другого варианта осуществления.
[0039] "Аргинин или его фармацевтически приемлемая соль", используемая в настоящем изобретении, конкретно не ограничена, при условии, что она представляет собой фармацевтически приемлемый аргинин или его соль. Аргинин или его соль обладают функцией стабилизировать его. Например, вводят L-аргинин или гидрохлорид L-аргинина.
[0040] Количество аргинина или его фармацевтически приемлемой соли составляет 150 мг/мл (приблизительно 700 ммоль/л) или менее (исключая не добавление) в качестве одного варианта осуществления, 100 мг/мл (приблизительно 500 ммоль/л) или менее (исключая не добавление) в качестве другого варианта осуществления, и 45 мг/мл (приблизительно 210 ммоль/л) или менее (исключая не добавление). Когда антитело к рецептору TSLP человека составляет 30 мг/мл (приблизительно 0,2 ммоль/л), 30 мг/мл (приблизительно 140 ммоль/л) является предпочтительным для обеспечения изотончности в виду осмотического давления. В качестве нижней границы можно привести пример (исключая не добавление), например, 10 мг/мл (приблизительно 50 ммоль/л) или более. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
[0041] Когда фармацевтическая композиция находится в состоянии раствора (жидкий препарат), растворенного в воде для инъекций, например, в 1 мл, количество составляет 150 мг или менее (исключая не добавление) в качестве одного варианта осуществления, 100 мг или менее (исключая не добавление) в качестве другого варианта осуществления и 45 мг или менее (исключая не добавление) в качестве еще одного другого варианта осуществления, или когда фармацевтическая композиция находится в твердом состоянии (лиофилизированный препарат) в результате лиофилизации или т.п., например, после восстановления водой для инъекций, концентрация аргинина составляет 150 мг/мл (приблизительно 700 ммоль/л) или менее (исключая не добавление) в качестве одного варианта осуществления, 100 мг/мл (приблизительно 500 ммоль/л) или менее (исключая не добавление) в качестве другого варианта осуществления и 45 мг/мл (приблизительно 210 ммоль/л) или менее (исключая не добавление) в качестве еще одного другого варианта осуществления. Когда антитело к рецептору TSLP человека составляет 30 мг/мл, с точки зрения осмотического давления приблизительно 140 ммоль/л является предпочтительным для обеспечения изотоничности.
[0042] Поверхностно-активное вещество, используемое в настоящем изобретении, конкретно не ограничено, при условии, что оно является фармацевтически приемлемым и обладает поверхностной активностью.
Более конкретно, включают, например, неионные поверхностно-активные вещества (например, сложные эфиры жирных кислот и сорбитана, такие как монокаприлат сорбитана, монолаурат сорбитана, монопальмитат сорбитана и т.п.; сложные эфиры жирных кислот и глицерина, такие как монокаприлат глицерина, мономиристат глицерина, моностеарат глицерина и т.п.; сложные эфиры жирных кислот и полиглицерина, такие как декаглицерилмоностеарат, декаглицерилдистеарат, декаглицерилмонолинолеат и т.п.; сложные эфиры жирных кислот и полиоксиэтиленсорбитана, такие как монолаурат полиоксиэтиленсорбитана, моноолеат полиоксиэтиленсорбитана, моностеарат полиоксиэтиленсорбитана, монопальмитат полиоксиэтиленсорбитана, триолеат полиоксиэтиленсорбитана, тристеарат полиоксиэтиленсорбитана и т.п.; сложный эфир жирной кислоты и полиоксиэтиленсорбита, такой как тетрастеарат полиоксиэтиленсорбита, тетраолеат полиоксиэтиленсорбита и т.п.; сложные эфиры жирных кислот и полиоксиэтиленглицерина, такие как полиоксиэтиленглицерилмоностеарат и т.п.; сложные эфиры жирных кислот и полиэтиленгликоля, такие как полиэтиленгликольдистеарат и т.п.; простые алкиловые эфиры полиоксиэтилена, такие как простой лауриловый эфир полиоксиэтилена и т.п.; простые алкиловые эфиры полиоксиэтиленполиоксипропилена, такие как полиоксиэтиленполиоксипропиленгликолевый эфир, полиоксиэтиленполиоксипропиленпропиловый эфир, полиоксиэтиленполиоксипропиленцетиловый эфир, и т.п.; полиоксиэтиленалкилфениловые эфиры, такие как полиоксиэтиленнонилфениловый эфир и т.п.; гидрогенизированное касторовое масло полиоксиэтилена, такое как касторовое масло полиоксиэтилена, гидрогенизированное касторовое масло полиоксиэтилена и т.п.; полиоксиэтиленовые производные пчелиного воска, такие как полиоксиэтиленсорбит-пчелиный воск и т.п.; полиоксиэтиленоыве производные ланолина, такие как полиоксиэтиленланолин и т.п.; и поверхностно-активные вещества с HLB от 6 до 18, такие как амиды жирных кислот полиоксиэтилена и т.п. (например, полиоксиэтиленоктадеканамид и т.п.)); анионные поверхностно-активные вещества (например, алкилсульфаты, содержащие C10-C18-алкильную группу, такую как цетилсульфат натрия, лаурилсульфат натрия, олеилсульфат натрия и т.п.; сульфат алкилового эфира полиоксиэтилена, в котором среднее число моль добавляемых единиц этиленоксида составляет от 2 до 4 и число атомов углерода алкильной группы составляет от 10 до 18, такой как полиоксиэтиленлаурилсульфат натрия и т.п.; алкилсульфосукцинат, содержащий C8-C18-алкильную группу, такой как лаурилсульфосукцинат натрия и т.п.); природные поверхностно-активные вещества, такие как лецитин, глицерофосфолипид и т.п.; сфингофосфолипиды, такие как сфингомиелин и т.п.; и сложные эфиры сахарозы и C12-C18-жирных кислот.
Можно соответствующим образом выбирать и использовать один вид или два или более видов таких поверхностно-активных веществ.
[0043] Поверхностно-активное вещество представляет собой сложные эфиры жирных кислот и полиоксиэтиленсорбитана или алкиловые эфиры полиоксиэтиленполиоксипропилена в качестве одного варианта осуществления, полисорбаты (например, 20, 21, 40, 60, 65, 80, 81 или 85) или поверхностно-активные вещества типа плюроник в качестве другого варианта осуществления, полисорбаты (например, 20 или 80) или полоксамер 188 (плюроник F68) в качестве еще одного другого варианта осуществления, и представляет собой полисорбат 20 или полисорбат 80 в качестве еще одного другого варианта осуществления.
[0044] Количество поверхностно-активного вещества составляет от 0,001 до 1% (масс./об.) в качестве одного варианта осуществления, от 0,005 до 0,5% (масс./об.) в качестве другого варианта осуществления и от 0,01 до 0,2% (масс./об.) в качестве еще одного другого варианта осуществления. Каждый нижний предел и каждый верхний предел можно произвольно объединять при желании.
[0045] Фармацевтическую композицию по настоящему изобретению можно предоставлять в видепарентеральной фармацевтической композиции, такой как жидкий препарат для заполнения контейнера раствором, или лиофилизированный препарат, высушенный распылением препарат или т.п., получаемый подверганием раствора лиофилизации или сушки распылением. Предпочтительная фармацевтическая композиция представляет собой жидкий препарат.
[0046] К фармацевтической композиции по настоящему изобретению при желании можно соответствующим образом добавлять фармацевтические добавки, такие как суспендирующее средство, солюбилизатор, средство придания тоничности, консервант, ингибитор всасывания, разбавляющее средство, смягчающее средство, содержащий серу восстановитель, антиоксидантное средство или т.п.
[0047] В качестве суспендирующего средства можно привести, например, метилцеллюлозу, гидроксиэтилцеллюлозу, гуммиарабик, порошок трагакант, карбоксиметилцеллюлозу натрия, монолаурат полиоксиэтиленсорбитана и т.п.
[0048] В качестве солюбилизирующего средства можно привести, например, гидрогенизированное касторовое масло полиоксиэтилена, никотинамид, монолаурат полиоксиэтиленсорбитана, макрогол, этиловый эфир жирных кислот и касторового масла и т.п.
[0049] В качестве средства придания тоничности можно привести, например, хлорид натрия, хлорид калия, хлорид кальция и т.п.
[0050] В качестве консерванта модно привести, например, метилпарагидроксибензоат, этилпарагидроксибензоат, сорбиновую кислоту, фенол, крезол, хлоркрезол, бензиловый спирт и т.п.
[0051] В качестве ингибитора всасывания можно привести, например, сывороточный альбумин человека, лецитин, декстран, сополимер этиленоксид/пропиленоксид, гидроксипропилцеллюлозу, метилцеллюлозу, гидрогенизированное касторовое масло полиоксиэтилена, полиэтиленгликоль и т.п.
[0052] В качестве разбавляющего средства можно привести, например, гидрат цитрата натрия, ксилит и т.п.
[0053] В качестве смягчающего средства можно привести, например, инозитол, лидокаин и т.п.
[0054] В качестве содержащего серу восстановитель можно привести, например, N-ацетилцистеин, N-ацетилгомоцистеин, тиоктовую кислоту, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбит, тиогликолевую кислота и ее соль, тиосульфат натрия, глутатион, соединение, содержащее сульфгидрильную группу, такую как тиоалкановая кислота, содержащая от 1 до 7 атомов углерода, и т.п.
[0055] В качестве антиоксидантного средства можно привести, например, эриторбовую кислоту, дибутилгидрокситолуол, бутилгидроксианизол, α-токоферол, токоферолацетат, L-аскорбиновую кислоту и ее соль, L-аскорбилпальмитат, стеарат L-аскорбиновой кислоты, бисульфит натрия, сульфит натрия, триамилгаллат, пропилгаллат или хелатирующие средства, такие как динатрийэтилендиаминтетраацетат (EDTA), пирофосфат натрия, метафосфат натрия и т.п.
[0056] Эти фармацевтические добавки можно использовать в подходящем количестве в предалах количества, способного обеспечивать требуемое действие по настоящему изобретению.
[0057] Способ получения фармацевтической композиции по настоящему изобретению характеризуется тем, что включает антитело к рецептору TSLP человека и аргинин или его фармацевтически приемлемую соль. Кроме того, в отношении композиции, содержащей другие компоненты, также включен способ получения известным способом получения по существу стабильной фармацевтической композиции, содержащей антитело к рецептору TSLP человека, полностью принадлежащий человеку тип T7-27.
[0058] Контейнер, который наполняют фармацевтической композицией по настоящему изобретению, можно выбирать в соответствии с целью использования. Контейнер включает контейнеры, имеющие форму определенной емкости, такие как флакон, ампула и шприц, или контейнеры с большой емкостью, такие как бутылка. Контейнер включает шприц (включая одноразовый шприц) в качестве одного варианта осуществления. Посредством предварительного наполнения шприца раствором и предоставлением его в виде препарата в виде предварительно заполненного шприца раствором действие, такое как действие по растворению или т.п. станет ненужным в медицинской области, ожидают быструю ответную реакцию.
[0059] В отношении материала можно привести, например, контейнера стекло, пластик или т.п. В отношении покрытия поверхности в контейнере можно проводить обработку силиконовым покрытием, обработку серой, обработку различными низкощелочными средствами и т.п. Ожидают, что в результате применения этих видов обработки предоставляют более стабильную фармацевтическую композицию.
ПРИМЕРЫ
[0060] Настоящее изобретение ниже дополнительно проиллюстрировано, но не ограниченно каким-либо образом, следующими ниже сравнительными примерами, примерами и экспериментальными примерами.
Антитело к рецептору TSLP человека, используемое в сравнительных примерах, примерах и экспериментальных примерах, получали способом, описанным в WO 2015/020193 или аналогичным способом, и конкретная процедура получения продемонстрирована в ссылочном примере.
Символ "-" в таблицах означает "без добавки".
[0061] Ссылочный пример: Получение антитела к рецептору TSLP человека полностью принадлежащего человеку типа, полностью принадлежащего человеку типа T7-27
В отношении полностью принадлежащего человеку типа T7-27 (далее в настоящем описании в некоторых местах обозначаемого как антитело A), который представлял собой антитело к рецептору TSLP человека полностью принадлежащего человеку типа, используемое в примерах, нуклеотидная последовательность, кодирующая тяжелую цепь, приведена в SEQ ID NO:2, таким образом, кодируемая аминокислотная последовательность приведена в SEQ ID NO:1, нуклеотидная последовательность, кодирующая легкую цепь, приведена в SEQ ID NO:4, и таким образом, кодируемая аминокислотная последовательность приведена в SEQ ID NO:3.
[0062] В соответствии с WO 2015/020193 конструировали вектор GS (Lonza), в который встраивали гены тяжелой цепи и легкой цепи антитела A. Клетки CHOK1SV (Lonza) трансфицировали вектором с получением стабильно экспрессирующего штамма антитела, и экспрессировали антитело. Культуральный супернатант очищали посредством колонки с белком A (GE Healthcare Japan) и ионообменной хроматографии с получением очищенного антитела полностью принадлежащего человеку типа. В результате анализа аминокислотной модификации очищенного антитела A предполагали, что в большей части очищенных антител происходит делеция лизина на C-конце тяжелой цепи.
[0063] Пример 1: Эффект стабилизации в результате выбора оптимального pH
Оценивали влияние pH на стабилизацию препаратов для жидких препаратов, содержащих антитело A.
[0064] В настоящем исследовании для оценки эффекта pH подготавливали оценочные образцы образца № A1-A5. Состав каждого оценочного образца приведен в таблице 1-1 ниже.
[0065] [Таблица 1-1]
[0066] Для оценки стабильности жидких препаратов для каждого образца проводили ускоренное испытание на тепловое воздействие (хранение при 40°C в течение 2 недель и при 25°C в течение 4 недель). Качество антитела до ускоренного теплового воздействия и после него оценивали эксклюзионной хроматографией (SEC) и ионообменной хроматографией (IEC). Условия анализа являются такими, как указано ниже.
[0067] Эксклюзионная хроматография (SEC)
Колонку G3000 SWXL для SEC (Tosoh) подсоединяли к системе ВЭЖХ и пропускали подвижную фазу, состоящую из 10 ммоль/л фосфорной кислоты и 500 ммоль/л NaCl pH 6,8 при скорости потока 0,5 мл/мин. Каждый образец инъецировали в количестве 50 мкг в пересчете на белок (например, 5,0 мкл в случае 10 мг/мл). Время анализа составляло 30 минут, и детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C, и температуру образца устанавливали на 5°C.
[0068] Ионообменная хроматография (IEC)
Колонку Propac WCX 10 для IEC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 20 ммоль/л MES pH 6,0, подводили к линии подвижной фазы А и подвижную фазу, состоящую из 20 ммоль/л MES и 500 ммоль/л NaCl pH 6,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 1 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 10 мкл. Применяли программу градиента IEC таблицы 1-2. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 40°C и температуру образца устанавливали на 5°C.
[0069] Таблица 1-2
[0070] Площади пиков мультимеров и пиков продуктов разложения, детектируемые SEC, и площадь основного пика, детектируемого IEC, измеряли способом автоматического анализа для определения их количеств (%). Количества определяют как процент (%) путем измерения площадей пиков мультимеров или пиков продуктов разложения, детектируемых SEC, способом автоматического анализа и деления их на сумму всех площадей пиков, включая основной пик, или измерением площади основного пика, детектируемого IEC, способом автоматического анализа и деления их на сумму всех площадей пиков, отличных от основного пика. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0071] Результаты оценки SEC и IEC, получаемые в этом примере, приведены на фигурах 1-1, 1-2 и 1-3. В отношении мультимеров SEC, за исключением хранения при 40°C в течение 2 недель, pH, как правило, увеличивал их, в частности при высоком значении pH (фигура 1-1). С другой стороны, в отношении продуктов разложения SEC pH, как правило, увеличивал их, в частности при низком значении pH (фигура 1-2). В отношении основного пика IEC наименьшее снижение происходили при pH 5-6, и оно являлось стабильным (фигура 1-3). Указанные выше результаты подвергали всесторонней оценке и подтверждали, что оптимальный pH составляет приблизительно pH 5-6.
[0072] Пример 2: Подавляющее действие аргинина на повышенное содержание мультимеров
Оценивали подавляющее действие аргинина на повышенное содержание мультимеров для жидких препаратов, содержащих антитело A.
[0073] В настоящем исследовании получали № B1-B4 образцов с различными количествами добавленного аргинина. Состав каждого оценочного образца приведен в таблице 2-1 ниже.
[0074] [Таблица 2-1]
[0075] Каждый получаемый образец, перечисленный в таблице 2-1, концентрировали с использованием центрифужных колонок с получением образцов B1-2-B1-4, B2-2-B2-4, B3-2-B3-4 и B4-2-B4-4. Состав каждого образца приведен в таблице 2-2 ниже.
[0076] [Таблица 2-2]
[0077] Сравнительный пример 1
Получали номера образцов B5-B8, содержащих никотинамид, маннит, трегалоза или глицин. Состав каждого оценочного образца приведен в таблице 2-3 ниже.
[0078] [Таблица 2-3]
[0079] Каждый получаемый образец, перечисленный в таблице 2-3, концентрировали с использованием центрифужных колонок с получением образцов B5-2-B5-4, B6-2-B6-4, B7-2-B7-4 и B8-2-B8-4. Состав каждого образца приведен в таблице 2-4 ниже.
[0080] [Таблица 2-4]
[0081]Каждый из этих образцов оценивали эксклюзионной хроматографией (SEC). Условия анализа являются такими, как указано ниже.
[0082] Эксклюзионная хроматография (SEC)
Колонку G3000 SWXL для SEC (Tosoh) подсоединяли к системе ВЭЖХ и пропускали подвижную фазу, содержащую 10 ммоль/л фосфорной кислоты и 500 ммоль/л NaCl pH 6,8, при скорости потока 0,5 мл/мин. Для изучения концентрации каждый образец инъецировали в количестве 100 мкг в пересчете на белок. Время анализа составляло 30 минут и детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 20°C.
[0083] Площади пиков мультимеров, детектируемые SEC, измеряли способом автоматического анализа для определения их количества (%). Количество определяют как процент (%) путем измерения площадей пиков мультимеров, детектируемые SEC, и деления их на сумму всех площадей пиков, включая основной пик. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0084] Результаты оценки (увеличение пиков мультимеров %) SEC, получаемые в этом примере и сравнительном примере, приведены на фигуре 2. В препаратах, содержащих аргинин (B2, B2-2 to B2-4, B3, B3-2-B3-4, B4 и B4-2-B4-4), повышение содержания мультимеров, сопровождающееся повышением концентрации активного ингредиента, заметно подавлялось. С другой стороны, в препаратах без аргинина (B1 и B1-2-B1-4) и препаратах с никотинамидом, маннитом, трегалозой или глицином (B5, B5-2-B5-4, B6, B6-2-B6-4, B7, B7-2-B7-4, B8 и B8-2-B8-4), повышение содержания мультимеров, сопровождающееся повышением концентрации активного ингредиента, не подавлялось. Можно было подтвердить подавляющее действие аргинина в отношении повышенного содержания мультимеров, когда повышали концентрацию активного ингредиента.
[0085] Различия в концентрации аргинина не влияли на подавляющее действие в отношении повышенного содержания мультимеров (B2, B2-2-B2-4, B3, B3-2-B3-4, B4 и B4-2-B4-4).
[0086] Пример 3: Стимулирующее действие аргинина, гистидин и pH на увеличенный гидрофильный пик HIC
Оценивали влияние аргинина, гистидина и pH на увеличенный гидрофильный пик HIC для жидких препаратов, содержащих антитело A.
[0087] В настоящем исследовании для оценки влияния аргинина, гистидина и pH получали оценочные образцы нос номерами образца C1-C9. Состав каждого оценочного образца приведен в таблице 3-1 ниже.
[0088] [Таблица 3-1]
HCl
HCl
(0,02% масс./об.)
[0089] Для оценки стабильность жидких препаратов для каждого образца проводили испытание на стабильность при хранении (хранение при 5°C в течение 5 месяцев). Качество антитела после хранения оценивали хроматографией на основе гидрофобных взаимодействий (HIC). Условия анализа являются такими, как указано ниже.
[0090] Хроматография на основе гидрофобных взаимодействий (HIC)
Две колонки ProPac HIC-10 для HIC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 800 ммоль/л сульфата аммония, 20 ммоль/л фосфата натрия pH7,0 подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 20 ммоль/л фосфата натрия pH7,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 0,8 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 50 мкл. Применяли программу градиента HIC таблицы 3-2. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 25°C.
[0091] [Таблица 3-2]
[0092] Площадь гидрофильного пика, детектируемого HIC, как показатель окисленной формы, измеряли способом автоматического анализа для определения ее количества (%). Количество определяют как процент (%) путем измерения площади гидрофильного пика, детектируемого HIC, способом автоматического интегрирования и деления ее на сумму всех площадей пиков включая основной пик. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0093] Результаты оценки HIC, получаемые в этом примере, приведены на фигуре 3-3.
[0094] [Таблица 3-3]
[0095] В препаратах, содержащих аргинин (C2, C4, C6 и C7), наблюдали тенденцию к увеличению гидрофильного пика HIC по сравнению с препаратами без аргинина (C3 и C5) и препаратами, содержащими сорбит (C8 и C9).
[0096] В препарате, содержащем pH 7,0 (C6), наблюдали тенденцию к увеличению гидрофильного пика HIC по сравнению с препаратом, содержащим аргинин pH 6,0 (C4).
[0097] В препарате, содержащем гистидин (C1), наблюдали тенденцию к увеличению гидрофильного пика HIC по сравнению с препаратом, содержащим фосфорную кислоту (C3).
[0098] Пример 4: Исследование препаратов путем планирования способа экспериментов
Для жидких препаратов, содержащих антитело A, изучали pH и концентрацию аргинина.
[0099] В настоящем исследовании для оценки эффектов аргинина и pH получали оценочные образцы с номерами образца D1-D18 в соответствии с планом способа экспериментов. Состав каждого оценочного образца приведен 4-1 и 4-2 ниже.
[0100] [Таблица 4-1]
HCl
(0,04% масс./об.)
HCl
[0101] [Таблица 4-2]
[0102] Для оценки стабильности жидких препаратов для каждого образца проводили ускоренное испытание на тепловое воздействие (хранение при 40°C в течение 1 недели). Чистоту антитела до и после ускоренного теплового воздействия оценивали эксклюзионной хроматографией (SEC), ионообменной хроматографией (IEC) и хроматографией на основе гидрофобных взаимодействий (HIC). Условия анализа являются такими, как указано ниже.
[0103] Эксклюзионная хроматография (SEC)
Колонку G3000 SWXL для SEC (Tosoh) подсоединяли к системе ВЭЖХ и пропускали подвижную фазу, состоящую из 20 ммоль/л фосфорной кислоты и 1 моль/л NaCl pH 6,5, при скорости потока 0,5 мл/мин. Каждый образец инъецировали в количестве 50 мкг в пересчете на белок. Время анализа составляло 40 минут, и детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 5°C.
[0104] Ионообменная хроматография (IEC)
Колонку Propac WCX 10 для IEC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из25 ммоль/л фосфорной кислоты pH 6,0, подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 25 ммоль/л фосфорной кислоты и 500 ммоль/л NaCl pH 6,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 1 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 10 мкл. Время анализа составляло 80 минут, и применяли программу градиента IEC таблицы 4-3. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 35°C и температуру образца устанавливали на 5°C.
[0105] [Таблица 4-3]
[0106] Хроматография на основе гидрофобных взаимодействий (HIC)
Две колонки ProPac HIC-10 для HIC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 800 ммоль/л сульфата аммония и 20 ммоль/л фосфата натрия pH 7,0, подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 20 ммоль/л фосфата натрия pH 7,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 0,8 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A, и инъецировали 50 мкл. Применяли программу градиента HIC таблицы 4-4. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 25°C.
[0107] [Таблица 4-4]
[0108] Площади пиков мультимеров и пиков продуктов разложения, детектируемых SEC, площадь основного пика, детектируемого IEC, и площадь гидрофильного пика, детектируемого HIC, измеряли способом автоматического анализа для определения их количества (%). Количества определяют как процент (%) путем измерения площадей пиков мультимеров или пиков продуктов разложения, детектируемых SEC, способом автоматического анализа и деления их на сумму всех площадей пиков, включая основной пик, путем измерения площади основного пика, детектируемого IEC, способом автоматического анализа и деления их на сумму всех площадей пиков, отличных от основного пика, или путем измерения площади гидрофильного пика, детектируемого HIC, способом автоматического интегрирования и деления их на сумму всех площадей пиков, включая основной пик. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0109] Результаты оценки SEC, IEC и HIC, получаемые в этом примере, приведены на фигуре 4-5.
[0110] [Таблица 4-5]
мультимер %
продукт разложения %
основной пик %
Гидрофильный пик %
[0111] Статистический анализ факторов скрининга проводили на основании результатов, и значения p, указывающие на степень вклада каждого показателя, рассчитывали с использованием разработки программного обеспечения для экспериментов Design-Expert (продукта Stat-Ease, Inc.). Результаты приедены в таблице 4-6.
[0112] [Таблица 4-6]
Состав фосфатного буфера
Мультимер %
Гидрофильный пик% повышенный
Состав гистидинового буфера
Мультимер %
Гидрофильный пик% повышенный
*НА: не анализировали
[0113] На основании результатов в отношении всех положений оценки SEC, IEC и HIC в качестве показателя стабильности анализировали диапазон максимального повышения желательности для концентрации аргинина и pH, которые в большей степени способствовали стабилизирующему действию, с использованием разработки программного обеспечения для экспериментов Design-Expert (продукт Stat-Ease, Inc.). Результаты приведены на фигуре 3-1 (группа составов, содержащих фосфорную кислоту) и фигура 3-2 (группа составов, содержащих гистидин).
[0114] На основании результатов предполагали, что антитело являлось стабильным в диапазоне pH от 5,5 до 5,7 и диапазоне концентраций аргинина от 0 до 210 ммоль/л (исключая не добавление) в составах, содержащих фосфорную кислоту, и, что антитело являлось стабильным в диапазоне pH от 5,3 до 6,0 и диапазоне концентраций аргинина от 0 до 210 ммоль/л (исключая не добавление) в составах, содержащих гистидин.
[0115] Пример 5: Подавление образования нерастворимых микрочастиц поверхностно-активным веществом
Для жидких препаратов, содержащих антитело A, оценивали подавляющее действие поверхностно-активных веществ на образование нерастворимых микрочастиц после стрессовой нагрузки.
[0116] В настоящем исследовании для оценки эффектов полисорбата 80, полисорбата 20 и полоксамера 188 (плюроник F68), которые являлись поверхностно-активными веществами, получали оценочные образцы с номерами образца E1-E18. Состав каждого оценочного образца приведен в таблицах 5-1 и 5-2 ниже.
[0117] [Таблица 5-1]
HCl
HCl
[0118] [Таблица 5-2]
ингредиент
HCl
ингредиент
HCl
[0119] Для оценки стабильности жидких препаратов каждый образец подвергали испытанию нагрузки стрессом. Для каждого образца проводили три цикла замораживание-оттаивание в диапазоне от -80°C до 5°C, и встряхивали образцы при 150 об./мин. в течение 24 часов и хранили при освещении 1000 люкс в течение 24 часов. После нагрузки стрессом оценивали число нерастворенных микрочастиц в каждом образце путем подсчета количества частиц в режиме светотени.
[0120] Подсчет количества частиц в режиме светотени
После того, как 0,7 мл образца помещали в 1,5 мл пластиковые пробирки, его подвергали дегазации в течение 2 часов в условиях 25°C и 75 Торр с использованием вакуумной сушилки. После дегазации проводили измерение с использованием счетчика частиц для жидкостей HIAC для лабораторий с установками объем тары 0,2 мл, объем образца 0,2 мл и рабочий цикл 2 (первое измерение удаляли).
[0121] Для оценки влияния концентрация поверхностно-активного вещества и концентрация активного ингредиента в пересчете на белок в отношении образцов E1-E10, образцы хранили при 25°C в течение 4 недель, и оценивали образцы после хранения посредством хроматографии на основе гидрофобных взаимодействий (HIC).
[0122] Хроматография на основе гидрофобных взаимодействий (HIC)
Две колонки ProPac HIC-10 для HIC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 800 ммоль/л сульфата аммония и 20 ммоль/л фосфата натрия pH7,0, подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 20 ммоль/л фосфата натрия pH7,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 0,8 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 50 мкл. Применяли программу градиента HIC таблицы 5-3. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 25°C.
[0123] [Таблица 5-3]
%
[0124] Площадь гидрофильного пика, детектируемого HIC, измеряли способом автоматического анализа для определения его количества (%). Количество определяют как процент (%) путем измерения площади гидрофильного пика, детектируемого HIC, способом автоматического интегрирования и деления ее на сумму всех площадей пиков, включая основной пик. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0125] Результаты оценки числа нерастворимых микрочастиц, получаемые в этом примере, приедены в таблице 5-4. Независимо от того, добавляю или не добавляют поверхностно-активное вещество, наблюдали увеличение числа нерастворимых микрочастиц после нагрузки стрессом, но увеличение числа нерастворимых микрочастиц подавлялось во всех образцах, в которые добавляли поверхностно-активное вещество.
[0126] [Таблица 5-4]
[0127] Результаты оценки HIC, получаемые в этом примере, приведены на фигурах 4-1 и 4-2. Для образцов, содержащих полисорбат 80, наблюдали повышенную тенденцию гидрофильного пика HIC при увеличении концентрации полисорбата 80. С другой стороны, для образцов, содержащих активный ингредиент в концентрации 30 мг/мл (фигура 4-2), увеличение гидрофильного пика HIC подавлялось по сравнению с образцами, содержащими активный ингредиент в концентрации 10 мг/мл (фигура 4-1).
[0128] Пример 6: Понижение вязкость аргинином
Оценивали эффект понижения вязкости аргинином для жидких препаратов, содержащих антитело A.
[0129] В настоящем исследовании для оценки эффект аргинина на вязкость жидких препаратов получали оценочные образцы с номерами образца F1-F12. Состав каждого оценочного образца приведен в таблице 6-1 ниже.
[0130] [Таблица 6-1]
[0131] Сравнительный пример 2
Для оценки эффектов аргинина и pH получали оценочные образцы без аргинина (номера образцов F13 to F27) и оценочные образцы с низким значением pH (номера образцов F19-F21). Состав каждого оценочного образца приведен в таблице 6-2 ниже.
[0132] [Таблица 6-2]
[0133] Для получаемых образцов из таблиц 6-1 и 6-2 вязкость оценивали динамическим светорассеянием (DLS).
[0134] Динамическое светорассеяние (DLS)
Получали стандартную кривую радиуса кажущейся вязкости на основании кажущихся радиусов частиц, получаемых путем добавления частиц полистирола к растворам глицерина 50%, 60%, 65%, 70% и 75% с использованием DynaPro Platereader (Wyatt). Затем измеряли кажущийся радиус посредством добавления частиц полистирол к образцу в высокой концентрации, и рассчитывали вязкость на основании стандартной кривой растворов глицерина.
[0135] Желательно регулировать диапазон вязкости в пределах 1000 мПас или менее, предпочтительно 100 мПас или менее и более предпочтительно 20 мПас или менее.
[0136] Результаты оценки вязкости, получаемые в этом примере и сравнительном примере, приедены в таблице 6-3 и на фигуре 5. Для образцов, в которые добавляли аргинин, подавляли повышение вязкости, которое сопровождает повышение концентрации активного ингредиента.
[0137] С другой стороны, не наблюдали влияние pH на вязкость.
[0138] [Таблица 6-3]
[0139] Пример 7: Оценка стабильности
Стабильность оценивали для жидкого препарата, содержащего антитело A. Состав оценочного образца приведен в таблице 7-1 ниже. После культивирования и очистки оценочный образец получали путем замены буфера на состав из таблицы 7-1, разбавления получаемый раствор лекарственного средства на основе белка раствором, содержащим компоненты, отличные от антитела A, описанными в таблице 7-1, фильтрования его через фильтр 0,22 мкм, наполнения стеклянного флакона фильтратом и выполнением укупорки и герметизации.
[0140] [Таблица 7-1]
[0141] Для оценки стабильность жидкого препарата проводили испытание на стабильность при хранении (при -20°C в течение 12 месяцев и при 5°C в течение 12 месяцев) образца. Качество антитело до и после хранения оценивали эксклюзионной хроматографией (SEC), ионообменной хроматографией (IEC) и хроматографией на основе гидрофобных взаимодействий (HIC). Условия анализа являются такими, как указано ниже.
[0142] Эксклюзионная хроматография (SEC)
Предколонку TSK SWXL (Tosoh) и две колонки G3000 SWXL для SEC (Tosoh), последовательно соединенные, подсоединяли к системе ВЭЖХ, и пропускали подвижную фазу, состоящую из 20 ммоль/л фосфорной кислоты и 1 моль/л NaCl pH 6,5, при скорости потока 0,5 мл/мин. Каждый образец инъецировали в количестве 50 мкг в пересчете на белок. Время анализа составляло 60 минут, и детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C, и температуру образца устанавливали на 5°C.
[0143] Ионообменная хроматография (IEC)
Колонку MabPac SCX10 для IEC (Thermo) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 25 ммоль/л MES pH 6,0, подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 25 ммоль/л MES и 500 ммоль/л NaCl pH 6,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 1 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 10 мкл. Время анализа составляло 70 минут, и применяли программу градиента IEC из таблицы 7-2. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 35C и температуру образца устанавливали на 5°C.
[0144] Таблица 7-2
%
[0145] Хроматография на основе гидрофобных взаимодействий (HIC)
Две колонки ProPac HIC-10 для HIC (Dionex) подсоединяли к системе ВЭЖХ. Подвижную фазу, состоящую из 800 ммоль/л сульфата аммония и 20 ммоль/л фосфата натрия pH7,0, подводили к линии подвижной фазы А, и подвижную фазу, состоящую из 20 ммоль/л фосфата натрия pH7,0, подводили к линии подвижной фазы B, и пропускали подвижные фазы при скорости потока 0,8 мл/мин. Образцы разбавляли до 1 мг/мл подвижной фазой A и инъецировали 50 мкл. Применяли программу градиента HIC из таблицы 7-3. Детекцию проводили при 280 нм УФ. Температуру колонки устанавливали на 30°C и температуру образца устанавливали на 25°C.
[0146] [Таблица 7-3]
%
[0147] Площади пиков мультимеров и пиков продуктов разложения, детектируемые SEC, площадь основного пика, детектируемого IEC, и площадь гидрофильного пика, детектируемого HIC, измеряли способом автоматического анализа для определения их количества (%). Количества определяют как процент (%) путем измерения площадей пиков мультимеров или пиков продуктов разложения, детектируемых SEC, способом автоматического анализа и деления их на сумму всех площадей пиков, включая основной пик, путем измерения площади основного пика, детектируемого IEC способом автоматического анализа и деления их на сумму всех площадей пиков, отличных от основного пика, или путем измерения площади гидрофильного пика, детектируемого HIC, способом автоматического интегрирования и деления их на сумму всех площадей пиков, включая основной пик. Основной пик, как используют в настоящем описании, означает пик активного соединения.
[0148] Результаты оценки SEC, IEC и HIC, получаемые в этом примере, приедены в таблице 7-4. В этом составе в обоих случаях хранения при -20°C в течение 12 месяцев и при 5°C в течение 12 месяцев качество каждого показателя находилось пределах подходящего диапазон, и это подтверждало, что этот состав является стабильным.
[0149] [Таблица 7-4]
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0150] По настоящему изобретению можно предоставлять стабильную фармацевтическую композицию, содержащую антитело к рецептору TSLP человека, более конкретно, стабильную фармацевтическую композицию, содержащую антитело к рецептору TSLP человека, которая подавляет образование химически модифицированных веществ, таких как дезамидированные формы и окисленные формы, или продуктов разложения или мультимеров.
Хотя настоящее изобретение описано со ссылкой на конкретные варианты осуществления, можно проводить различные изменения и модификации, очевидные специалистам в данной области, не выходя за рамки объема прилагаемой формулы изобретения.
ПРОИЗВОЛЬНЫЙ ТЕКСТ В СПИСКЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0151] Признаки "искусственная последовательность" описаны под числовым идентификатором <223> в Списке последовательностей. Нуклеотидные последовательности SEQ ID NO: 2 и 4 в Списке последовательностей представляют собой нуклеотидные последовательности H-цепь и L-цепь антитела к рецептору TSLP человека, соответственно. Аминокислотные последовательности SEQ ID NO: 1 и 3 представляют собой аминокислотные последовательности H-цепи и L-цепи, кодируемые SEQ ID NO: 2 и 4, соответственно.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Astellas Pharma Inc.
<120> ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К
РЕЦЕПТОРУ TSLP ЧЕЛОВЕКА
<130> A16025-999
<150> JP 2015-246826
<151> 2015-12-18
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 448
<212> белок
<213> искусственная последовательность
<220>
<223> H-цепь антитела к рецептору TSLP человека
<400> 1
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Ser
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Lys Trp Val
35 40 45
Ser Ser Val Ser Gly Ser Gly Ala Gly Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Glu Gly Gly Ser Arg Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 2
<211> 1347
<212> ДНК
<213> искусственная последовательность
<220>
<223> ген H-цепи антитела к рецептору TSLP человека
<400> 2
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc cgggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttcgc agctctgcca tgcattgggt ccgccaggct 120
ccagggaagg gactgaaatg ggtctcaagt gttagtggca gtggtgctgg aacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca atcccaagaa tacactgtat 240
ctgcaaatga acagtctgag agccgaggac acggccgtat attattgtgt gaaagaaggg 300
ggcagccggg gttttgacta ctggggccag ggaaccctgg tcaccgtctc ctcagcctcc 360
accaagggcc catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca 420
gcggccctgg gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac 480
tcaggcgccc tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc 540
tactccctta gtagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc 600
tgcaacgtga atcacaagcc cagcaacacc aaggtggaca agaaagttga gcccaaatct 660
tgtgacaaaa ctcacacatg cccaccgtgc ccagcacctg aactcctggg gggaccgtca 720
gtcttcctct tccccccaaa acccaaggac accctcatga tctcccggac ccctgaggtc 780
acatgcgtgg tggtggacgt gagccacgaa gaccctgagg tcaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcataa tgccaagaca aagccgcggg aggagcagta caacagcacg 900
taccgtgtgg tcagcgtcct caccgtcctg caccaggact ggctgaatgg caaggagtac 960
aagtgcaagg tctccaacaa agccctccca gcccccatcg agaaaaccat ctccaaagcc 1020
aaagggcagc cccgagaacc acaggtgtac accctgcccc catcccggga tgagctgacc 1080
aagaaccagg tcagcctgac ctgcctggtc aaaggcttct atcccagcga catcgccgtg 1140
gagtgggaga gcaatgggca gccggagaac aactacaaga ccacgcctcc cgtgctggac 1200
tccgacggct ccttcttcct ctacagcaag ctcaccgtgg acaagagcag gtggcagcag 1260
gggaacgtct tctcatgctc cgtgatgcat gaggctctgc acaaccacta cacgcagaag 1320
agcctctccc tgtctccggg taaatga 1347
<210> 3
<211> 214
<212> белок
<213> искусственная последовательность
<220>
<223> L-цепь антитела к рецептору TSLP человека
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Lys Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Leu Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 4
<211> 645
<212> ДНК
<213> искусственная последовательность
<220>
<223> ген L-цепи антитела к рецептору TSLP человека
<400> 4
gacatccaga tgacccagtc tccatcctca ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgtc gggcgagtca ggacattagc aattatttag cctggtttca gcagaaacca 120
gggaaagccc ctaagtccct gatctatact gcatccagtt tgcaaagtgg ggtcccatca 180
aagttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgccaacag tataatcttt atcctccgac gttcggccaa 300
gggaccaagg tggaaatcaa acggactgtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 645
(1)
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| ЖИДКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К АЛЬФА-РЕЦЕПТОРУ ИНТЕРЛЕЙКИНА-4 ЧЕЛОВЕКА | 2020 |
|
RU2814172C2 |
| ПРЕПАРАТ, СОДЕРЖАЩИЙ АНТИТЕЛО | 2017 |
|
RU2748046C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ОЧИЩЕННЫЕ РЕКОМБИНАНТНЫЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2793783C1 |
| ВАРИАНТЫ ПЕРТУЗУМАБА И ИХ АНАЛИТИЧЕСКАЯ ХАРАКТЕРИСТИКА | 2014 |
|
RU2737727C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2795973C1 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ РЕЦЕПТОРА ПРОГРАММИРУЕМОЙ СМЕРТИ PD-1 ЧЕЛОВЕКА И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ ЛЕЧЕНИЯ | 2012 |
|
RU2563346C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2788949C1 |
| Фармацевтический состав слитого белка taci-fc | 2020 |
|
RU2779387C1 |
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой стабильную жидкую фармацевтическую композицию с pH от 5 до 6, содержащую антитело к рецептору TSLP человека или его антигенсвязывающий фрагмент в концентрации от 1 до 300 мг/мл; фармацевтически приемлемый буфер в концентрации от 5 до 100 ммоль/л; аргинин или его фармацевтически приемлемую соль в концентрации 700 ммоль/л или менее и поверхностно-активное вещество в количестве от 0,001 до 1% мас./об. 2 объект – применение композиции для лечения астмы. Технический результат заключается в стабильности фармацевтической композиции, содержащей полностью принадлежащий человеку тип Т7-27, который представляет собой антитело к рецептору TSLP человека. 2 н. и 18 з.п. ф-лы, 5 ил., 26 табл., 7 пр.
1. Стабильная жидкая фармацевтическая композиция с pH от 5 до 6, содержащая:
антитело к рецептору TSLP человека или его антигенсвязывающий фрагмент в концентрации от 1 до 300 мг/мл;
фармацевтически приемлемый буфер в концентрации от 5 до 100 ммоль/л;
аргинин или его фармацевтически приемлемую соль в концентрации 700 ммоль/л или менее; и
поверхностно-активное вещество в количестве от 0,001 до 1% мас./об.,
где антитело к рецептору TSLP человека или его антигенсвязывающий фрагмент содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 1, или тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 1 с посттрансляционной модификацией, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 3, и
где посттрансляционная модификация тяжелой цепи представляет собой делецию лизина на С-конце тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO: 1, или пироглутамилирование на N-конце тяжелой цепи, имеющей аминокислотную последовательность SEQ ID NO: 1.
2. Композиция по п. 1, где аргинин или его фармацевтически приемлемая соль представляет собой гидрохлорид аргинина.
3. Композиция по п. 2, где гидрохлорид аргинина имеет концентрацию приблизительно 500 ммоль/л или менее.
4. Композиция по п. 3, где гидрохлорид аргинина имеет концентрацию приблизительно 210 ммоль/л или менее.
5. Композиция по п. 1, где содержание аргинина или его фармацевтически приемлемой соли не превышает 210 ммоль/л.
6. Композиция по п. 1, где фармацевтически приемлемый буфер выбран из группы, состоящей из фосфорной кислоты, лимонной кислоты, уксусной кислоты, янтарной кислоты, гистидина, аскорбиновой кислоты, глутаминовой кислоты, молочной кислоты, малеиновой кислоты, трометамола и глюконовой кислоты.
7. Композиция по п. 6, где фармацевтически приемлемый буфер представляет собой гистидин.
8. Композиция по п. 7, где концентрация гистидина составляет от 5 до 70 ммоль/л.
9. Композиция по п. 7, где концентрация гистидина составляет от 5 до 50 ммоль/л.
10. Композиция по п. 1, где поверхностно-активное вещество представляет собой полисорбат или полоксамер 188.
11. Композиция по п. 10, где полисорбат представляет собой полисорбат 20 или полисорбат 80.
12. Композиция по п. 11, где полисорбат представляет собой полисорбат 20.
13. Композиция по п. 11, где полисорбат представляет собой полисорбат 80.
14. Композиция по п. 1, где концентрация поверхностно-активного вещества составляет от 0,005 до 0,5% мас./об.
15. Композиция по п. 1, где концентрация поверхностно-активного вещества составляет от 0,01 до 0,2% мас./об.
16. Композиция по п. 1, где антитело присутствует в концентрации от 1 до 200 мг/мл.
17. Композиция по п. 1, где жидкая фармацевтическая композиция содержит:
антитело к рецептору TSLP человека в концентрации от 1 до 200 мг/мл;
аргинин или его фармацевтически приемлемую соль в концентрации не более 210 ммоль/л;
поверхностно-активное вещество, которое присутствует в количестве от 0,01 до 0,2% мас./об., где поверхностно-активное вещество представляет собой полисорбат 80; и
фармацевтически приемлемый буфер, который представляет собой гистидин в концентрации от 5 до 50 ммоль/л.
18. Композиция по п. 17, где фармацевтически приемлемая соль аргинина представляет собой гидрохлорид аргинина.
19. Композиция по п. 1, где композиция имеет рН от 5,5 до 5,7.
20. Применение композиции по п. 1 для лечения астмы.
| WO 2015020193 A1, 12.02.2015 | |||
| ЖИДКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО ВЫСОКОЙ КОНЦЕНТРАЦИИ | 2008 |
|
RU2497544C2 |
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ ЖИДКИЕ КОМПОЗИЦИИ АНТИ-EGFR АНТИТЕЛ | 2005 |
|
RU2390353C2 |
| WO 2013186700 A1, 19.12.2013 | |||
| US 2008286280 A1, 20.11.2008 | |||
| WO 2003072060 A2, 04.09.2003. | |||
Авторы
Даты
2023-04-12—Публикация
2016-12-16—Подача