[01] В данном документе раскрыты один или несколько ферментов протеаз клады AprL, включая один или несколько вариантов протеазы клады AprL, нуклеиновые кислоты, кодирующие их, и композиции и способы, относящиеся к их получению и применению, включая вариантный фермент субтилизин клады AprL, который характеризуется улучшенными показателями стабильности и/или удаления грязи по сравнению с исходным ферментом субтилизином клады AprL.
[02] Сериновые протеазы представляют собой ферменты (EC № 3.4.21), содержащие серин в активном центре, который инициирует гидролиз пептидных связей белков. Существует две широкие категории сериновых протеаз, основанные на их структуре: химотрипсин-подобные (трипсин-подобные) и субтилизин-подобные. Типичный субтилизин (EC № 3.4.21.62) изначально получали из B. subtilis. Субтилизины и их гомологи являются членами семейства пептидаз S8 согласно схеме классификации MEROPS. Члены семейства S8 содержат каталитическую триаду в порядке Asp, His и Ser в их аминокислотной последовательности. Несмотря на то, что сериновые протеазы давно известны в области промышленно важных ферментов, все еще существует потребность в сконструированных протеазах, которые подходят для определенных условий и применений.
[03] Некоторые варианты осуществления относятся к вариантному ферменту субтилизину клады AprL или его активному фрагменту, содержащему одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация выбрана из: (i) A001C, A001D, A001E, A001Q, A001S, L010M, L010Q, S100G, S102K, S102R, Y103F, Y103M, S104D, G105M, G105R, S108F, S108H, S108K, S108R, E111Q, T114D, T115D, T115E, T115F, T115K, T115Q, N116E, K012C, K012F, K012H, K012M, K012N, K012Q, K012Y, V120S, M123C, M123I, L125I, G127A, G127D, G127I, G127M, G127S, G127T, G127V, A128E, A128H, A128K, A128P, A128R, A128S, A128T, S129H, S129Q, S129R, S129T, S129V, T132C, T132D, T132E, T132K, T132N, T132P, Q136A, Q136C, Q136K, Q136R, V138C, A143D, A143N, G145S, V147L, V148A, V148C, V148M, V148Q, K015A, K015C, K015E, K015I, K015M, K015S, K015T, K015V, S155D, S155F, S155K, S155N, S155R, S157D, S158D, S158I, S158K, S158R, N160C, N160D, N160I, N160M, N160R, T161C, T161D, T161E, T161K, T161Q, T161R, G165A, G165E, G165Q, G165R, G165S, Q017H, A018D, A018E, S181Q, N182D, S183A, S183G, N184C, N184E, N184Q, A186C, S187D, S187E, S187P, Q019D, Q019E, A193D, A193R, A202D, A202E, A202K, A202Q, A202V, G203A, G203C, G203E, G203N, G203Q, Y205E, T210C, T210E, T210I, T210P, T210V, A214E, T215C, L216C, L216H, L216K, L216M, N217S, L234E, L234F, L234Q, L234S, S235D, S235E, P238T, N239A, N239D, N239H, N239M, N239S, N239T, A024E, A024Q, L240D, S241E, S241N, S241Q, S241V, A242G, A242N, S243E, S243Q, S243V, Q244C, Q244E, V245A, V245C, V245T, N247D, N247W, N025D, N025G, N025Q, S250G, S251E, S258C, S258D, S258E, S258H, S258P, S259E, S259P, S259Q, V026A, V026C, V026E, V026H, V026Q, V026R, F260W, K264A, K264C, K264D, K264H, K264M, K264Q, K264S, K264Y, I267C, N268D, N268E, N268Q, V269C, K027C, K027D, K027E, K027M, K027P, A271E, Q274A, Q274C, Q274D, Q274E, Q274G, A029S, T003E, T003I, T003Q, T003V, V030C, I035A, I035S, I035T, I035V, S038T, N043A, N043C, N043F, N043H, N043Q, V044P, V045A, V045C, V045D, V045E, V045F, V045G, V045M, V045N, V045Q, V045R, V045S, V045T, G046D, A048N, A048W, F050H, V051I, A052F, A052G, A052K, A052N, A052P, A052R, A052V, G053N, G053R, A055C, A055D, A055E, A055G, A055H, A055N, A055S, A055V, N057C, N057E, N057G, N057V, T058C, T058I, T058K, T058W, A068C, A068N, A068S, V071A, L074G, D075E, N076K, T077C, T077D, T077H, T077M, T077N, T077P, T077Q, T077S, T078D, T078I, T078V, S086E, S086H, S086R, V087C, V087G, V087S, V087T, S088E, S088N, S088R, L089N, P009C, P009D, P009E, P009N, P009T, L095A, L095V, N096S, S098K, S098R, и G099Q; (ii) A001Q, T003V, K015I, I035A, A068S, V071A, T077N, S086H, V087S, L095A, T115F, M123I, G127T, A128P, A128S, V147L, G165Q, G165S, N184Q, A202V, T210P, N217S, N239S, A242G, S250G, S258P, и Q274A; или (iii) T003V, A068S, T077N, S086H, T115F, M123I, G127T, A128P, G165Q, N184Q, A202V, T210P, N217S, и S258P; где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления, один или несколько вариантов клады AprL, описанных в данном документе, характеризуются улучшенной стабильность по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления улучшенная стабильность характеризуется (i) PI > 1,2 для стабильности или (ii) PI > 1,2 для стабильности с одним или несколькими из PI > 0,8 для очистки с помощью HDD, PI> 0,8 для очистки с помощью HDL при pH 6 или pH 8, PI > 0,8 для очистки с помощью ADW или PI > 0,8 для экспрессии. В еще одних вариантах осуществления исходный фермент субтилизин клады AprL и/или указанный вариант содержат: (i) мотив YNT (SEQ ID NO:46) между Asp32 и His63; (ii) мотив Y56N57T58 (SEQ ID NO:45); (iii) мотив F50V51X152G53E54X355Y56N57T58 (SEQ ID NO:48), где X1 представляет собой A или S и X3 представляет собой A или S; (iv) мотив LSX4S (SEQ ID NO:55) между Lys236 и Arg246, где X4 представляет собой A или G; (v) мотив L240S241A242S243 (SEQ ID NO:50); (vi) мотив L240S241G242S243(SEQ ID NO:56); (vii) мотив KXXXLSX4SQX5R (SEQ ID NO:57), где X представляет собой любую аминокислоту, X4 представляет собой A или G, и X5 представляет собой I или V; (viii) мотив K236XXXLSASQX5R246 (SEQ ID NO: 52), где X представляет собой любую аминокислоту и X5 представляет собой I или V; (ix) мотив K236XXXLSGSQX5R246 (SEQ ID NO:60), где X представляет собой любую аминокислоту и X5 представляет собой I или V; или (viii) мотив 1, выбранный из (i), (ii), и (iii), в комбинации с мотивом 2, выбранным из (iv), (v), (vi), (vii), (viii) и (ix).
[04] В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении в последовательности варианта фермента клады AprL, выбранном из группы, состоящей из 12, 15, 26, 27, 43, 45, 48, 52, 55, 57, 58, 60, 77, 78, 88, 96, 97, 98, 99, 102, 116, 117, 126, 127, 129, 132, 136, 143, 144, 160, 161, 165, 171, 210, 238, 239, 241, 247, и 274, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении последовательности варианта фермента клады AprL, где по меньшей мере 60% модификаций, тестируемых в отношении продуктивного положения, соответствуют по меньшей мере одному из следующих критериев: a) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,9 или больше и, кроме того, PI для любого из перечисленного должен равняться 1,0 или больше; b) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,8 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,2 или больше; или с) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,5 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,5 или больше; и где продуктивное положение выбрано из группы, состоящей из 12, 15, 26, 27, 43, 45, 48, 52, 55, 57, 58, 60, 77, 78, 88, 96, 97, 98, 99, 102, 116, 117, 126, 127, 129, 132, 136, 143, 144, 160, 161, 165, 171, 210, 238, 239, 241, 247, и 274, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления модификация выбрана из группы, состоящей из 12 (K,A,C,F,G,H,L,M,N,Q,S,Y); 15 (K,A,C,E,F,H,I,M,N,R,S,T,V); 26 (V,A,C,E,H,I,M,N,Q,R,S,T); 27 (K, A, C,D,E,L,M,N,P,Q,R,T); 43 (N,A,C,F,G,H,I,K,L,M,Q,R, S,W, Y); 45 (V,A,C,D,E,F,G,I,K,M, N, P,Q, R, S, T,Y); 48 (A,C,D,E,F,H,I,K,M,N,Q,R,W,Y); 52 (A,C,D,E,F,G, H,K,L,M,N,P,Q,R,S,T,V,Y); 55 (A, C,D,E,F,G,H,I,M,N,P,Q,R,S,T,V); 57 (N,A,C,D,E,G,H,P,R,S,V,Y); 58 (T,C,D,F,H,I,K,L,M,P,R, S,V, W, Y); 60 (G,C,E,F,H,I,K,L,M,Q,R,T,Y); 77 (T,C,D,F,H,K,L,M,N,P,Q, R,S,W); 78 (T,C,D,G, I,L,N,Q, S,V,W,Y); 88 (S,A,E,F,G,L,M,N,Q,R,T,V,W,Y); 96 (N,A,C,D,E,G,H,I,K,L,M,Q,S,V,Y); 97 (S,A,C,D,F, G,H,I,K,M,N,P,Q,R,T,W,Y); 98 (S,A,D,E,F,H,K,L,N,P,R,T,V,Y); 99 (G,A,C,D,E,L,M,Q,S,T,V,W); 102 (S,A,D,E,F,G,K,L,N,P,Q,R,T); 116 (N,A,C,D,E,F,G,H,K,L,M,Q,R,S,T,V,Y); 117 (G,C,D,E,H,K,M,N, Q,R,T,V); 126 (G,A,C,E,H,I,K,M,N,Q,R,S,T,V,W,Y); 127 (G,A,D,E,F,I,L,M,Q,S,T, V,W,Y); 129 (S,C, E,F,H,I,M,N,Q,R,T,V,W,Y); 132 (T,A,C,D,E,F,H,I,K,L,M,N,P,Q,S,V,W,Y); 136 (Q,A,C,D,F,G,H,K,L, N,R,S,T,W); 143 (A,C,D,E,F,G,H,I,K,M,N,S,T,Y); 144 (R,A,C,D,E,F,G,H,L,M,N, Q,V, Y); 160 (N,A,C, D,G,I,K,M,P,R); 161 (T,A,C,D,E,I,K,L,M,Q,R,W); 165 (G,A,E,I,K,L,P,Q,R,S,T,Y); 171 (D,A,C,G,H,I, K, N,P,Q,S,T,V); 210 (T,C,D,E,F,H,I,M,N,P,V,Y); 238 (P,A,C,D,E,F,G,I, L,M,N,Q,R,S,T,W); 239 (N,A, C,D,E,H,I,K,L,M,S,T,V,Y); 241 (S,C,D,E,H,L,N,P,Q,T,V); 247 (N,A,D, E,F,H, I,L,M,Q,S,V,W,Y); и 274 (Q,A,C,D,E,F,G,H,I,L,N,S,T,V,W), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы из AprL, изложенной в SEQ ID NO:2.
[05] В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении в последовательности варианта фермента клады AprL, выбранном из группы, состоящей из 1, 9, 22, 24, 25, 53, 86, 89, 95, 100, 105, 108, 114, 115, 119, 125, 128, 140, 146, 155, 158, 187, 202, 203, 234, 237, 240, 243, 244, и 264, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении последовательности варианта фермента клады AprL, где по меньшей мере 40%, но менее 60% модификаций, тестируемых в отношении продуктивного положения, соответствуют по меньшей мере одному из следующих критериев: a) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,9 или больше и, кроме того, PI для любого из перечисленного должен равняться 1,0 или больше; b) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,8 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,2 или больше; или с) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,5 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,5 или больше; и где продуктивное положение выбрано из группы, состоящей из 1, 9, 22, 24, 25, 53, 86, 89, 95, 100, 105, 108, 114, 115, 119, 125, 128, 140, 146, 155, 158, 187, 202, 203, 234, 237, 240, 243, 244, и 264, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления модификация выбрана из группы, состоящей из 1 (A,D,E,F,G,N,Q,S,T,V); 9 (P,A,C,D,E, G,N, Q, S,T); 22 (K,A,F,M,Q,R,S,T,VY); 24 (A,C,D,E,G,N,Q,S,W); 25 (N,D,E,F,G,H,L,M, P,Q,R,S); 53 (G, C, D,E,H,K,N,Q,R); 86 (S,C,E,H,K,L,N,R); 89 (L,A,C,F,G,I,M,N,S,V); 95 (L,A,F,G,I, M,Q,S,V); 100 (S, C,F,G,M,N,R,T,Y); 105 (G,A,C,D,I,M,N,R,S,T); 108 (S,E,F,G,H,K,L,N,Q,R,Y); 114 (T,A,C, D, F, I, K, L,N,Q,S,V); 115 (T,D,E,F,H,I,K,Q,S,W); 119 (D,A,E,F,G,H,M,Q,S); 125 (L,A,E,F,I,N, S,V,Y); 128 (A, C,D,E,H,K,N,P,Q,R,S,T); 140 (N,C,D,F,G,H,M,R,T,V); 146 (V,A,E,H,I,K,L,N,Q,S,T); 155 (S, A,D, E, F, G,H,K,N,Q,R,W); 158 (S,A,D,E,I,K,N,Q,R); 187 (S,A,C,D,E,H,K,P,Q,W); 202 (A,C,D, E,I, K, L, M, Q,S,T,V); 203 (G,A,C,E,H,K,M,N,Q,R,S); 234 (L,E,F,H,Q,S,W,Y); 237 (H,A,C,D,G,I,M,N, Q,S); 240 (L,A,D,E,F,I,M,N,Q,T); 243 (S,C,E,F,I,N,Q,T,V,W); 244 (Q,A,C,D,E,G,H,I,N,R,S,V); и 264 (K, A, C, D,H,M,Q,R,S,Y), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы из AprL, изложенной в SEQ ID NO:2.
[06] В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении в последовательности варианта фермента клады AprL, выбранном из группы, состоящей из 2, 3, 10, 18, 19, 28, 29, 31, 35, 37, 38, 40, 44, 46, 50, 54, 56, 61, 67, 68, 71, 87, 90, 91, 92, 101, 103, 104, 113, 118, 120, 123, 130, 131, 133, 139, 145, 147, 148, 181, 182, 184, 193, 205, 211, 212, 214, 216, 217, 221, 235, 242, 245, 248, 251, 258, 259, и 268, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении последовательности варианта фермента клады AprL, где по меньшей мере 15%, но менее 40% модификаций, тестируемых в отношении продуктивного положения, соответствуют по меньшей мере одному из следующих критериев: a) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,9 или больше и, кроме того, PI для любого из перечисленного должен равняться 1,0 или больше; b) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,8 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,2 или больше; или с) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,5 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,5 или больше; и где продуктивное положение выбрано из группы, состоящей из 2, 3, 10, 18, 19, 28, 29, 31, 35, 37, 38, 40, 44, 46, 50, 54, 56, 61, 67, 68, 71, 87, 90, 91, 92, 101, 103, 104, 113, 118, 120, 123, 130, 131, 133, 139, 145, 147, 148, 181, 182, 184, 193, 205, 211, 212, 214, 216, 217, 221, 235, 242, 245, 248, 251, 258, 259, и 268, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления модификация выбрана из группы, состоящей из 2 (Q,A,I,N); 3 (T,E,I, Q,V); 10 (L,F,M,Q); 18 (A,C,D,E,S); 19 (Q,A,D,E,G,M); 28 (V,A,C, S); 29 (A,C,S,T,V); 31 (L,C,I,V); 35 (I,A,C,G,M,S,T,V); 37 (A,E,G,S); 38 (S,A,C,E,G,N,T); 40 (P,A,C, D,E,M,V); 44 (V,C,E,P,S,T); 46 (G,A,C,D,W); 50 (F,H,K,M,Q,R,V,Y); 54 (E,Q,R,T); 56 (Y,C,E,F,H,P); 61 (N,A,D,F,H,K,Q); 67 (V,M, N,Q); 68 (A,C,G,N,S,T); 71 (V,A,G,L,S); 87 (V,C,G,S,T); 90 (Y,A,C,F, H,N,V); 91 (A,G,M,P,V); 92 (V,A, C,I,T); 101 (G,A,C,N,S,T); 103 (Y,A,F,I,L,M,V,W); 104 (S,A,D,E); 113 (A,C,G,S); 118 (M,F, H, P, Q); 120 (V,A,C,I,S,T); 123 (M,C,I,L,N,Q,S); 130 (G,D,E,H,S); 131 (S,D, R,T); 133 (A,G,M,P,S,T,V); 139 (D,G,K,N,S,T); 145 (G,D,N,S); 147 (V,A,L,M,N); 148 (V,A,C,F,M,Q, S); 181 (S,A,C,D,H,Q); 182 (N, C, D,E,Q); 184 (N,C,E,H,M,Q); 193 (A,D,P,Q,R); 205 (Y,C,E,F,I,M,V); 211 (N,C,E,S); 212 (T,A, D, S); 214 (A,E,H,L,T); 216 (L,A,C,H,K,M); 217 (N,C,E,S); 221 (M,C,H,K); 235 (S,C,D,E,G); 242 (A, E, G, N,S); 245 (V,A,C,I,T); 248 (R,A,N,Q,S); 251 (S,A,C,E,G,N); 258 (S,C,D, E,H,P); 259 (S,E,P,Q); и 268 (N,D,E,Q), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы из AprL, изложенной в SEQ ID NO:2.
[07] В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении в последовательности варианта фермента клады AprL, выбранном из группы, состоящей из 4, 17, 21, 30, 33, 36, 47, 49, 51, 62, 66, 72, 74, 75, 76, 93, 106, 107, 110, 111, 112, 121, 134, 135, 137, 138, 141, 149, 151, 156, 157, 159, 163, 169, 175, 183, 186, 188, 191, 204, 207, 208, 209, 215, 223, 224, 227, 229, 230, 231, 232, 233, 236, 249, 250, 254, 255, 260, 267, 269, 271, и 273, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение представляет собой вариантный фермент субтилизин клады AprL или его активный фрагмент, содержащий аминокислотную модификацию по сравнению с исходным ферментом клады AprL, где модификация находится в продуктивном положении последовательности варианта фермента клады AprL, где по меньшей мере одна модификация, но менее 15% модификаций, тестируемых в отношении продуктивного положения, соответствуют по меньшей мере одному из следующих критериев: a) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,9 или больше и, кроме того, PI для любого из перечисленного должен равняться 1,0 или больше; b) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,8 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,2 или больше; или с) положение, где минимальные индексы продуктивности (PI) по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза диметилказеина (DMC), анализа с очисткой микрообразца ткани PAS-38 при pH 9 или pH 10; и очистки микрообразца ткани EMPA-116 при pH 6, pH 8 или pH 10; и 3) стабильности в моющем средстве в условиях стресса равняются 0,5 или больше и, кроме того, PI для любого из этих тестов должен равняться 1,5 или больше; и где продуктивное положение выбрано из группы, состоящей из 4, 17, 21, 30, 33, 36, 47, 49, 51, 62, 66, 72, 74, 75, 76, 93, 106, 107, 110, 111, 112, 121, 134, 135, 137, 138, 141, 149, 151, 156, 157, 159, 163, 169, 175, 183, 186, 188, 191, 204, 207, 208, 209, 215, 223, 224, 227, 229, 230, 231, 232, 233, 236, 249, 250, 254, 255, 260, 267, 269, 271, и 273, где аминокислотные положения варианта субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина из AprL Bacillus sp., изложенной в SEQ ID NO:2. В некоторых вариантах осуществления модификация выбрана из группы, состоящей из 4 (V,I); 17 (Q,H,M); 21 (F, Y); 30 (V,C,T); 33 (T,C,M); 36 (Q,E,H); 47 (G,A,M); 49 (S,I,T); 51 (V,C,I); 62 (G,S); 66 (H,R); 72 (A, G,S); 74 (L,G); 75 (D,C,E); 76 (N,K); 93 (K,D); 106 (I,G,M); 107 (V,F,I); 110 (I,F); 111 (E,D,Q); 112 (W,A); 121 (I,L,M); 134 (M,L); 135 (K,E,H); 137 (A,S); 138 (V,C,S); 141 (A,S); 149 (V,C); 151 (A, G, P); 156 (G,E); 157 (S,D,R); 159 (G,A,F); 163 (T,E); 169 (K,R); 175 (A,C); 183 (S,A,G); 186 (A,C); 188 (F,W); 191 (V,C); 204 (V,I); 207 (T,C); 208 (Y,F); 209 (P,S); 215 (T,C,V); 223 (S,A,C); 224 (P,A); 227 (A,S); 229 (A,G,S); 230 (A,\G); 231 (A,C); 232 (L,Q); 233 (I,V); 236 (K,A); 249 (L,I,M); 250 (S,A, G); 254 (T,D); 255 (Y,C,E); 260 (F,C,W); 267 (I,C); 269 (V,A,C); 271 (A,D,E); и 273 (A,S), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы из AprL, изложенной в SEQ ID NO:2.
[08] Некоторые варианты осуществления относятся к композиции, содержащей по меньшей мере один вариант, изложенный выше. Некоторые варианты осуществления относятся к способу очистки с применением чистящей композиции, изложенной выше.
[09] На ФИГ. 1 представлена карта плазмиды pHYT-AprL для экспрессии протеаз из AprL дикого типа и вариантных протеаз.
[010] На ФИГ. 2A-F представлено выравнивание белка AprL с подмножеством нескольких последовательностей субтилизина с применением программного обеспечения CLUSTALW.
[011] На ФИГ. 3 представлено выравнивание последовательностей AprL, Blid02339 и родственных субтилизинов с помощью CLUSTAL W.
[012] На ФИГ. 4 представлена карта плазмиды pHYT-BliD02339 для экспрессии протеаз BliD02339 дикого типа и вариантных протеаз.
[013] На ФИГ. 5 показана протеазная активность протеазы BliD02339 на DMC-субстрате.
[014] На ФИГ. 6 показана продуктивность очистки BliD02339 в HDL-детергентах.
[015] На ФИГ. 7 показана продуктивность очистки BliD02339 в HDD-детергентах.
[016] На ФИГ. 8 показана продуктивность очистки BliD02339 в ADW-детергентах.
[017] На ФИГ. 9 показана кладонграмма субтилизинов, включая AprL, BliD02339 и другие члены клады AprL.
[018] На ФИГ. 10 показано структурное изображение области "петли", охватывающей Y56N57T58 (боковые цепи показаны как палочки) AprL (черный), по сравнению с когнатной областью в BPN' (серый) и B. lentus (светло-серый) субтилизинах.
[019] На ФИГ. 11 показано структурное изображение остатков L240S241A242S243. В AprL (черный) боковая цепь Leu240 и Arg248 показаны как палочки. Для сравнения, боковые цепи остатка AprL (черный) и субтилизина BPN' (серый) показаны как тонкие линии.
[020] На ФИГ. 12 показано структурное изображение Asn96 в AprL, образующей водородную связь с амидом основной цепи Ser98 для стабилизации поворота, ведущего к цепи 101-104, которая является частью сайта связывания субстрата.
[021] В настоящем изобретении предусмотрены новые ферменты, являющиеся сериновыми протеазами, в частности, варианты сериновых протеаз клады AprL, а именно ферменты, применимые для моющих композиций. В некоторых вариантах осуществления в настоящем изобретении предусмотрены варианты ферментов, являющихся сериновыми протеазами, содержащие одну или несколько модификаций, таких как замена, по сравнению с исходным ферментом, являющимся сериновой протеазой. В некоторых вариантах осуществления в настоящем изобретении предусмотрены новые варианты ферментов, являющихся сериновыми протеазами клады AprL. В каждом из вышеуказанных случаев ферменты, являющиеся сериновыми протеазами по настоящему изобретению, могут быть применимы в некоторых отраслях промышленности, включая удаление грязи, получение этанола из зерна, корм для животных, обработку пищевых продуктов и средства, способствующие пищеварению, обработку кожи и личная гигиена. Этого можно достичь осуществлением улучшений фермента путем улучшения чистящего действия, стабильности фермента в присутствии химических средств и/или термостабильности фермента, которые повышают эффективность фермента. В настоящем изобретении предусмотрены вариантные ферменты, являющиеся сериновыми протеазами, включая без ограничения вариантные ферменты, являющиеся сериновыми протеазами клады AprL, которые особенно хорошо подходят и применимы в различных применениях для очистки. Настоящее изобретение включает композиции, содержащие по меньшей мере один из вариантных ферментов, являющихся сериновыми протеазами (например, варианты клады AprL), изложенные в данном документе. Некоторые такие композиции включают в себя моющие композиции. В настоящем изобретении предусмотрены различные виды, включая вариантные ферменты, являющиеся сериновыми протеазами видов Bacillus, и композиции, содержащие один или несколько таких вариантных сериновых протеаз клады AprL. Варианты фермента сериновой протеазы по настоящему изобретению могут сочетаться с другими ферментами, применимыми в моющих композициях. В настоящем изобретении также предусмотрены способы очистки с применением вариантов фермента сериновой протеазы по настоящему изобретению.
[022] В настоящее изобретение включены ферментные варианты ферментов, являющихся сериновыми протеазами, содержащие одну или несколько модификаций по сравнению с исходным ферментом, являющимся сериновой протеазой. Варианты ферментов могут быть применимы для моющей композиции, характеризующейся минимальным индексом продуктивности в отношении моющего действия, стабильности фермента в моющих композициях и термостабильности фермента, при наличии по меньшей мере одной из данных характеристик, улучшенных по сравнению с исходным ферментом, являющимся сериновой протеазой.
[023] Кроме того, в настоящем изобретении предусмотрены модификации, такие как замена, в одном или нескольких аминокислотных положениях в ферменте, являющемся сериновой протеазой, который может быть применим в моющей композиции, при этом благоприятные модификации обеспечивают в результате минимальный индекс продуктивности в отношении моющего действия, стабильности фермента в моющих композициях и термостабильности фермента, при наличии по меньшей мере одной из данных характеристик, улучшенных по сравнению с исходным ферментом, являющимся сериновой протеазой. Данные модификации считаются подходящими модификациями в соответствии с настоящим изобретением. Данные аминокислотные положения могут считаться применимыми положениями для комбинационных модификаций по сравнению с исходным ферментом, являющимся сериновой протеазой. Аминокислотные положения фермента, являющегося сериновой протеазой, которые считаются применимыми положениями, могут дополнительно характеризоваться наличием нескольких модификаций, которые подходят для применения в моющей композиции. Для каждого положения большее число возможных приемлемых модификаций означает более высокую продуктивность конкретного положения.
[024] Кроме того, в настоящем изобретении предусмотрены композиции, содержащие данные варианты сериновой протеазы. В некоторых вариантах осуществления в настоящем изобретении предусмотрены чистящие композиции, содержащие по меньшей мере один из этих вариантов сериновой протеазы.
[025] Следует учитывать, что те определенные признаки настоящего изобретения, которые для ясности описаны выше и ниже в контексте отдельных вариантов осуществления, также могут быть представлены в комбинации в одном варианте осуществления. Наоборот, разные признаки настоящего изобретения, которые для краткости описаны в контексте одного варианта осуществления, также могут быть представлены отдельно или в какой-либо подкомбинации.
[026] Для ясности, перед подробным описанием композиций и способов по настоящему изобретению определены следующие термины. Терминам и сокращения, которые не определены, должны соответствовать их обычным значениям, которые используют в уровне техники. Если не указано иное, практическое осуществление настоящего изобретения предусматривает общепринятые методики, традиционно применяемые в молекулярной биологии, белковой инженерии, микробиологии и технологии рекомбинантной ДНК, которые известны специалисту в данной области. Такие методики известны специалистам в данной области и описаны в многочисленных текстах и справочниках, хорошо известных специалистам в данной области. Все патенты, патентные заявки, статьи и публикации, упомянутые в настоящем изобретении, как выше, так и ниже, явным образом включены в настоящий документ посредством ссылки.
[027] Если не указано иное, в данном документе все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понимается специалистом в данной области техники. Если не указано иное, практическое осуществление настоящего раскрытия включает традиционные методики, широко применяемые в молекулярной биологии, белковой инженерии и микробиологии. Хотя при практическом осуществлении настоящего раскрытия находят применение любые способы и материалы, подобные или эквивалентные описанным в настоящем изобретении, в настоящем изобретении описаны некоторые подходящие способы и материалы. Термины, определенные непосредственно ниже, более полно описаны посредством ссылки на описание в целом.
[028] Используемые в данном документе формы единственного числа включают ссылки на множественное число, если в контексте явно не указано иное. Если не указано иное, последовательности нуклеиновых кислот записаны слева направо в ориентации от 5' к 3'; и аминокислотные последовательности записаны слева направо в ориентации от амино- к карбокси-концу. Следует понимать, что настоящее раскрытие не ограничивается конкретными описанными методиками, протоколами и реагентами, описанными в данном документе, если отсутствует указание об обратном.
[029] Практическое осуществление настоящего изобретения предусматривает, если не указано иное, общепринятые методики очистки белка, молекулярной биологии, микробиологии, методики рекомбинантной ДНК и секвенирования белка, все из которых известны специалистам в данной области.
[030] Кроме того, заглавия, приведенные в настоящем изобретении, не являются ограничениями различных аспектов или вариантов осуществления настоящего изобретения, которые можно выполнить исходя из описания в целом. Соответственно, термины, определяемые непосредственно ниже, более полно определены на основе описания в целом. Тем не менее, для того, чтобы облегчить понимание настоящего изобретения, ниже приведены определения для ряда терминов.
[031] Подразумевается, что каждая максимальная числовая граница, раскрываемая в настоящем описании, включает каждую нижнюю числовую границу, как если бы такие нижние числовые границы были бы явно приведены в данном документе. Каждая минимальная числовая граница, раскрываемая в настоящем описании, будет включать каждую нижнюю числовую границу, как если бы такие нижние числовые границы были бы явно приведены в данном документе. Каждый числовой диапазон, приведенный в настоящем описании, будет включать каждый более узкий числовой диапазон, который находится в пределах такого более широкого числового диапазона, как если бы такие более узкие числовые диапазоны были явно приведены в данном документе.
[032] Используемый в данном документе в отношении числового значения термин "приблизительно" относится к диапазону +/- 0,5 числового значения, если указанный термин иным образом конкретно не определен в контексте. Например, фраза "значение pH, составляющее приблизительно 6" относится к значениям pH от 5,5 до 6,5, если явно не определено другое значение pH.
[033] Используемые в данном документе термины "протеаза" и "протеиназа" относятся к ферменту, который способен расщеплять белки и пептиды. Протеаза обладает способностью осуществлять "протеолиз" посредством гидролиза пептидных связей, которые соединяют вместе аминокислоты в пептидной или полипептидной цепи, образующей белок. Такую активность протеазы как разрушающего белок фермента называют "протеолитической активностью". Существует множество широко известных процедур для измерения протеолитической активности (см., например, Kalisz, "Microbial Proteinases", В: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology, (1988)). Например, протеолитическую активность можно определять с помощью сравнительных анализов, в которых анализируют способность соответствующей протеазы гидролизовать подходящий субстрат. Типичные субстраты, применимые в анализе протеазы или протеолитической активности, включают без ограничения диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Колориметрические анализы с использованием таких субстратов хорошо известны в уровне техники (см., например, WO 99/34011 и патент США № 6376450). pNA-пептидильный анализ (см., например, Del Mar et al., Anal Biochem, 99:316-320, 1979) также находит применение для установления концентрации активного фермента. С помощью данного анализа измеряют скорость, при которой п-нитроанилин высвобождается по мере того, как фермент гидролизует растворимый синтетический субстрат, такой как сукцинил-аланин-аланин-пролин-фенилаланин-п-нитроанилид (suc-AAPF-pNA). Скорость появления желтого цвета в результате реакции гидролиза измеряют при 410 нм на спектрофотометре, и она пропорциональна концентрации активного фермента. Кроме того, для определения концентрации общего белка в образце очищенного белка можно применять измерения поглощения при 280 нанометрах (нм). Активность при концентрации субстрат/белок обеспечивает специфическую активность фермента.
[034] Используемый в данном документе в отношении такого полипептида, как протеаза, термин "вариант", относится к полипептиду, содержащему аминокислотную последовательность, которая отличается от аминокислотной последовательности исходного или эталонного полипептида (включая без ограничения полипептиды дикого типа) на по меньшей мере один аминокислотный остаток. В некоторых вариантах осуществления вариант полипептида, который отличается от аминокислотной последовательности исходного или эталонного полипептида, содержит одну или несколько встречающихся в природе или искусственно введенных замен, вставок или делеций аминокислоты. В других вариантах осуществления вариант полипептида, который отличается от аминокислотной последовательности исходного или эталонного полипептида, содержит одну или несколько встречающихся в природе замен, вставок или делеций аминокислоты. В других вариантах осуществления вариант полипептида, который отличается от аминокислотной последовательности исходного или эталонного полипептида, содержит одну или несколько искусственно введенных замен, вставок или делеций аминокислоты.
[035] Как используется в данном документе, "род Bacillus" включает все виды рода "Bacillus," известные специалистам в данной области техники, включая без ограничения B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. sonorensis, B. halodurans, B. pumilus, B. gibsonii, B. pabuli, B. cereus, B. agaradhaerens, B akibai, B. clarkii, B. pseudofirmus, B. lehensis, B. megaterium, B. coagulans, B. circulans, B. lautus, и B. thuringiensis. Следует отметить, что род Bacillus все еще подлежит таксономической реорганизации. Таким образом, предполагается, что род включает виды, которые были переклассифицированы, в том числе без ограничения такие организмы, как B. stearothermophilus, который в настоящее время называется "Geobacillus stearothermophilus". Выработка кислорода резистентными эндоспорами в стрессовых условиях окружающей среды считается определяющим признаком рода Bacillus, хотя данная характеристика также применима к недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus, и Virgibacillus.
[036] Фраза "композиция(композиции), практически не содержащая(содержащие) бора" или "моющее средство(моющие средства), практически не содержащее(содержащие) бора" относится к композиции(композициям) или моющему средству(моющим средствам) соответственно, которые содержат следовые количества бора, например, приблизительно 1000 ppm (1 мг/кг или литр равняется 1 ppm), приблизительно 100 ppm, приблизительно 50 ppm, приблизительно 10 ppm, или приблизительно 5 ppm, или приблизительно 1 ppm, предположительно из компонентов других композиций или моющих средств.
[037] Термины "полинуклеотид" и "нуклеиновая кислота", которые применяются взаимозаменяемо в данном документе, относятся к полимеру с любой длиной из нуклеотидных мономеров, ковалентно связанных в цепи. ДНК (дезоксирибонуклеиновая кислота), полинуклеотид, содержащий дезоксирибонуклеотиды, и РНК (рибонуклеиновая кислота), полимер из рибонуклеотидов, являются примерами полинуклеотидов или нуклеиновых кислот с различными биологическими функциями. Полинуклеотиды или нуклеиновые кислоты включают в себя без ограничения одно-, двух- или трехнитевую ДНК, геномную ДНК, кДНК, РНК, гибрид ДНК-РНК или полимер, содержащий пуриновые и пиримидиновые основания или другие природные, химически, биохимически модифицированные, не встречающиеся в природе или дериватизированные нуклеотидные основания. Следующие примеры полинуклеотидов являются неограничивающими: гены, фрагменты генов, хромосомные фрагменты, маркер(маркеры) экспрессируемых последовательностей (EST), экзоны, интроны, матричная РНК (мРНК), транспортная РНК (тРНК), рибосомная РНК (рРНК), рибозимы, комплементарная ДНК (кДНК), рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК с любой последовательностью, выделенная РНК с любой последовательностью, зонды-нуклеиновые кислоты и праймеры. В некоторых вариантах осуществления полинуклеотиды содержат модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и связывающие группы, такие как фторрибоза и тиоэфир и нуклеотидные ответвления. В конкретном варианте осуществления последовательность нуклеотидов прерывается компонентами, не относящимися к нуклеотидам.
[038] Используемый в данном документе термин "мутация" относится к изменениям, сделанным в эталонной аминокислотной последовательности или последовательности нуклеиновой кислоты. Подразумевается, что данный термин охватывает замены, вставки и делеции.
[039] Используемый в данном документе термин "вектор" относится к конструкции на основе нуклеиновой кислоты, применяемой для введения или переноса нуклеиновой кислоты(нуклеиновых кислот) в целевую клетку или ткань. Вектор, как правило, применяют для введения чужеродной ДНК в клетку или ткань. Векторы включают плазмиды, клонирующие векторы, бактериофаги, вирусы (например, вирусный вектор), космиды, векторы экспрессии, челночные векторы и т.п. Вектор, как правило, включает точку начала репликации, сайт множественного клонирования и селектируемый маркер. Способ вставки вектора в целевую клетку, как правило, называют трансформацией. Настоящее изобретение включает в некоторых вариантах осуществления вектор, который содержит последовательность ДНК, кодирующую полипептид сериновой протеазы (например, предшественник или зрелый полипептид сериновой протеазы), который функционально связан с подходящей пропоследовательностью (например, секреторной, последовательностью сигнального пептида и т. д.), способной влиять на экспрессию последовательности ДНК в подходящей клетке-хозяине, и фолдинг, и транслокацию рекомбинантной полипептидной цепи.
[040] Используемый в данном документе термин "кассета экспрессии", "плазмида экспрессии" или "вектор экспрессии" относится к конструкции на основе нуклеиновой кислоты или вектору, полученным рекомбинантным или синтетическим путем для экспрессии представляющей интерес нуклеиновой кислоты в целевой клетке. Вектор экспрессии или кассета экспрессии, как правило, содержит промоторную нуклеотидную последовательность, которая управляет экспрессией чужеродной нуклеиновой кислоты. Вектор или кассета экспрессии, как правило, также включает любые другие указанные элементы нуклеиновой кислоты, которые делают возможной транскрипцию конкретной нуклеиновой кислоты в целевой клетке. Рекомбинантную кассету экспрессии можно встроить в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Множество векторов для экспрессии у прокариот и эукариот являются коммерчески доступными.
[041] Используемый в данном документе термин "плазмида" относится к внехромосомной молекуле ДНК, которая способна реплицироваться независимо от хромосомной ДНК. Плазмида является двухнитевой (ds) и может быть кольцевой, и ее, как правило, применяют в качестве клонирующего вектора.
[042] Используемый в данном документе в контексте введения последовательности нуклеиновой кислоты в клетку термин "введенный" относится к любому способу, подходящему для переноса последовательности нуклеиновой кислоты в клетку. Такие способы введения включают без ограничения слияние протопластов, трансфекцию, трансформацию, электропорацию, конъюгацию, и трансдукцию (см., например, Ferrari et al., "Genetics," в Hardwood et al. (eds.), Bacillus, Plenum Publishing Corp., стр. 57-72 [1989]).
[043] Трансформация относится к генетическому изменению клетки, которое происходит в результате поглощения, необязательного встраивания в геном и экспрессии генетического материала (например, ДНК).
[044] Как используется в данном документе, нуклеиновая кислота является "функционально связанной" с другой последовательностью нуклеиновой кислоты, если она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связан с нуклеотидной кодирующей последовательностью, если промотор влияет на транскрипцию кодирующей последовательности. Сайт связывания рибосом может быть функционально связан с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции кодирующей последовательности. Как правило, "функционально связанные" последовательности ДНК являются смежными. Однако энхансеры не обязательно должны быть смежными. Связывание осуществляют путем лигирования по подходящим сайтам рестрикции. Если такие сайты отсутствуют, можно применять синтетические олигонуклеотидные адаптеры или линкеры в соответствии с традиционной практикой.
[045] Используемый в данном документе термин "ген", относится к полинуклеотиду (например, сегменту ДНК), который кодирует полипептид и включает области, предшествующие кодирующим областям и идущие следом за ними. В некоторых случаях ген включает промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
[046] Используемый в данном документе термин "рекомбинантный" в случае применения по отношению к клетке, как правило, указывает на то, что клетка была модифицирована путем введения чужеродной последовательности нуклеиновой кислоты, или что клетка происходит от клетки, модифицированной подобным образом. Например, рекомбинантная клетка может содержать ген, не обнаруживаемый в идентичной форме в нативной (нерекомбинантной) форме клетки, или рекомбинантная клетка может содержать нативный ген (обнаруживаемый в нативной форме клетки), который был модифицирован и повторно введен в клетку. Рекомбинантная клетка может содержать нуклеиновую кислоту, эндогенную по отношению к клетке, которая была модифицирована без удаления нуклеиновой кислоты из клетки; такие модификации включают модификации, получаемые путем замещения гена, сайт-специфической мутации и смежных методик, известных рядовым специалистам в данной области. Технология рекомбинантной ДНК включает методики получения рекомбинантной ДНК in vitro и перенос рекомбинантной ДНК в клетки, где она может экспрессироваться или размножаться с получением тем самым рекомбинантного полипептида. "Рекомбинация" и "рекомбинирование" полинуклеотидов или нуклеиновых кислот в целом относится к сборке или объединению двух или более нуклеиновых кислот или полинуклеотидных нитей или фрагментов с образованием нового полинуклеотида или нуклеиновой кислоты.
[047] Говорят, что нуклеиновая кислота или полинуклеотид "кодирует" полипептид, если в своем нативном состоянии или при воздействии на него способами, известными специалистам в данной области, он может транскрибироваться и/или транслироваться с образованием полипептида или его фрагмента. Также говорят, что антисмысловая нить такой нуклеиновой кислоты кодирует последовательность.
[048] Термины "штамм-хозяин" и "клетка-хозяин" относятся к подходящему хозяину для вектора экспрессии, содержащего представляющую интерес последовательность ДНК.
[049] "Белок" или "полипептид" содержит полимерную последовательность аминокислотных остатков. Термины "белок" и "полипептид" используются в данном документе взаимозаменяемо. В данном раскрытии используется одно- и 3-буквенный код для аминокислот, который определен согласно IUPAC-IUB объединенным комитетом по биохимической номенклатуре (Joint Commission on Biochemical Nomenclature (JCBN)). Одна буква X относится к любой из двадцати аминокислот. Также понятно, что полипептид может быть закодирован несколькими нуклеотидными последовательностями из-за вырожденности генетического кода. Мутации могут быть названы с помощью однобуквенного кода для исходной аминокислоты с последующим числом положений, а затем однобуквенным кодом для вариантной аминокислоты. Например, мутация с заменой глицина (G) в положении 87 на серин (S) представлена как "G087S" или "G87S". Мутации также могут быть названы с использованием трехбуквенного кода для аминокислоты с последующим ее положением в полипептидной цепи, считая с N-конца; например, Ala10 для аланина в положении 10. Множественные мутации указаны с использованием вставки "-," "+," "/," или ";" между мутациями. Мутации в положениях 87 и 90 представлены или как "G087S-A090Y", или "G87S-A90Y", или "G87S+A90Y", или "G087S+A090Y". В случае вставок одна или несколько вставленных аминокислот могут быть указаны после положения. Например, "G087GS" обозначает вставленный серин после глицина в положении 87; в качестве второго примера, "G087GSA" обозначает вставленные серин и аланин после глицина в положении 87. Вставки могут быть выполнены в сочетании с заменами; так, "G087RS" обозначает замену в положении 87 глицина на аргинин, после которого следует вставленный остаток серина. В случае делеций, после номера положения используется либо "Δ", либо "del". Таким образом, например, "G087del" обозначает делецию глицина в положении 87. При описании модификации, положение с последующими аминокислотами, перечисленными в скобках, показывает перечень замен в этом положении любой из перечисленных аминокислот. Например, 6(L,I) означает, что положение 6 может быть замещено лейцином или изолейцином. Также в последовательности используется косая черта (/) для обозначения замен, например, F/V указывает на то, что в определенном положении может находится фенилаланин или валин.
[050] "Пропоследовательность" или "пропептидная последовательность" относится к аминокислотной последовательности между сигнальной пептидной последовательностью и зрелой последовательностью протеазы, которая необходима для правильного фолдинга и секреции протеазы; их иногда называют внутримолекулярными шаперонами. Отщепление пропоследовательности или пропептидной последовательности дает в результате зрелую активную протеазу. Бактериальные сериновые протеазы часто экспрессируются в виде проферментов.
[051] Термины "сигнальная последовательность" и "сигнальный пептид" относятся к последовательности аминокислотных остатков, которая может участвовать в секреции или направлении транспорта зрелой формы или формы-предшественника белка. Сигнальная последовательность, как правило, расположена на N-конце по отношению к последовательности белка-предшественника или последовательности зрелого белка. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность в норме отсутствует у зрелого белка. Сигнальная последовательность, как правило, отщепляется от белка сигнальной пептидазой после транспортировки белка.
[052] Термин "зрелая" форма белка, полипептида или пептида относится к функциональной форме белка, полипептида или пептида без сигнальной пептидной последовательности и пропептидной последовательности.
[053] Термин форма "предшественника" белка или пептида относится к зрелой форме белка с пропоследовательностью, функционально связанной с амино- или карбонильным концом белка. Предшественник может также иметь "сигнальную" последовательность, функционально связанную с амино-концом пропоследовательности. Предшественник также может иметь дополнительные полипептиды, которые вовлечены в посттрансляционную активность (например, полипептиды, отщепляемые от него с тем, чтобы оставить зрелую форму белка или пептида).
[054] Термин "дикий тип" в отношении аминокислотной последовательности или последовательности нуклеиновой кислоты указывает на то, что аминокислотная последовательность или последовательность нуклеиновой кислоты является нативной или встречающейся в природе последовательностью. Используемый в данном документе термин "встречающийся в природе" относится к любым объектам (например, белкам, аминокислотам или последовательностям нуклеиновых кислот), обнаруживаемым в природе.
[055] И наоборот, термин "не встречающийся в природе" относится к объектам, не обнаруживаемым в природе (например, рекомбинантным нуклеиновым кислотам и белковым последовательностям, получаемым в лаборатории или модификации последовательности дикого типа).
[056] Используемые в данном документе в отношении положений аминокислотных остатков "соответствующий чему-либо", или "соответствует чему-либо", или "соответствует" относятся к аминокислотному остатку в пронумерованном положении в белке или пептиде или аминокислотному остатку, который аналогичен, гомологичен или эквивалентен пронумерованному остатку в белке или пептиде. Используемый в данном документе термин "соответствующая область" обычно относится к аналогичному положению среди родственных белков или эталонного белка.
[057] Термины "происходящий из" и "полученный из" относятся не только к белку, продуцированному или продуцируемому штаммом рассматриваемого организма, но также к белку, кодируемому последовательностью ДНК, выделенной из такого штамма и продуцированной у организма-хозяина, содержащего такую последовательность ДНК. Кроме того, данный термин относится к белку, который кодируется последовательностью ДНК синтетического и/или кДНК-происхождения и который имеет отличительные характеристики рассматриваемого белка. Для примера, "протеазы, происходящие от Bacillus" относится к таким ферментам с протеолитической активностью, которые в природе продуцируются Bacillus, а также к сериновым протеазам, наподобие тех, которые продуцируются источниками Bacillus, но которые благодаря применению методик генной инженерии продуцируются другими клетками-хозяевами, трансформированными нуклеиновой кислотой, кодирующей сериновые протеазы.
[058] Термин "идентичный" в контексте двух полинуклеотидных или полипептидных последовательностей относится к нуклеиновым кислотам или аминокислотам в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия, что измеряется с применением общедоступного алгоритма сравнения или анализа последовательностей.
[059] Как используется в данном документе, "гомологичные гены" относится к паре генов от различных, но обычно родственных видов, которые соответствуют друг другу и которые идентичны или очень подобны друг другу. Термин охватывает гены, которые разошлись в ходе видообразования (т. е., образовании новых видов) (например, ортологичные гены), а также гены, которые разошлись в результате генетической дупликации (например, паралогичные гены).
[060] Используемый в данном документе термин "гомология" относится к подобию или идентичности последовательностей, при этом идентичность является предпочтительной. Гомологию можно определять с помощью стандартных методик, известных из уровня техники (см., например, Smith and Waterman, Adv. Appl. Math. 2:482 [1981]; Needleman and Wunsch, J. Mol. Biol. 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; компьютерные программы, такие как GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics (Genetics Computer Group, Мэдисон, Висконсин); и Devereux et al., Nucl. Acid Res. 12:387-395 [1984]). Одним примером применимого алгоритма является PILEUP. С помощью PILEUP осуществляют множественное выравнивание последовательностей из группы родственных последовательностей с помощью прогрессивных попарных выравниваний. С помощью него также можно построить древовидную схему, показывающую взаимосвязи между кластерами, используемые для создания выравнивания. В PILEUP используют упрощение способа прогрессивного выравнивания по Фэнгу и Дулиттлу (См., Feng and Doolittle, J. Mol. Evol. 35:351-360 [1987]). Способ подобен таковому, описанному Higgins and Sharp (см., Higgins and Sharp, CABIOS 5:151-153 [1989]). Применимые параметры PILEUP включают в себя штраф за открытие гэпа по умолчанию 3,00, штраф за продление гэпа по умолчанию 0,10 и взвешенные концевые гэпы.
[061] Процентная идентичность последовательностей между эталонной последовательностью и представляющей интерес тестовой последовательностью может быть легко определена специалистом в данной области. Процентную идентичность, общую для полинуклеотидных или полипептидных последовательностей, определяют путем прямого сравнения информации о последовательностях между молекулами с помощью выравнивания последовательностей и определения идентичности способами, известными в уровне техники. Примером алгоритма, который подходит для определения подобия последовательностей, является алгоритм BLAST, (см. Altschul, et al., J. Mol. Biol., 215:403-410 [1990]). Программное обеспечение для выполнения анализов BLAST является общедоступным на сайте Национального центра биотехнологической информации. Данный алгоритм предусматривает сначала идентификацию пары последовательностей с наибольшим сходством (HSP) путем идентификации коротких "слов" с длиной W в последовательности запроса, которые либо совпадают, либо удовлетворяют некоторому положительному пороговому баллу T при выравнивании со "словом" такой же длины в последовательности из базы данных. Эти изначальные хиты соседних слов играют роль начальных точек для поиска более длинных HSP, которые их содержат. Хиты слов продлевают в обоих направлениях вдоль каждой из двух последовательностей, подвергаемых сравнению, до тех пор, пока можно повышать кумулятивный балл выравнивания. Продление хитов слов прекращают в случае, когда совокупный балл выравнивания падает на величину X от максимального достигнутого значения; совокупный балл падает до нуля или ниже или если достигается конец любой из последовательностей. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. В программе BLAST используется в качестве значения по умолчанию длина слова (W) 11, матрица замен BLOSUM62 (см. Henikoff и Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 [1992]), выравнивания (B) 50, ожидание (E) 10, M'5, N'-4 и сравнение обеих нитей.
[062] Затем с помощью алгоритма BLAST осуществляют статистический анализ подобия между двумя последовательностями (см., например, Karlin и Altschul, выше). Одной мерой подобия, предоставляемой алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая обеспечивает указание на вероятность, с которой могут случайно встречаться совпадения между двумя нуклеотидными или аминокислотными последовательностями. Например, нуклеиновую кислоту считают подобной нуклеиновой кислоте сериновой протеазы по настоящему изобретению, если наименьшая суммарная вероятность при сравнении тестовой нуклеиновой кислоты с нуклеиновой кислотой сериновой протеазы составляет менее чем приблизительно 0,1, более предпочтительно менее чем приблизительно 0,01 и наиболее предпочтительно менее чем приблизительно 0,001. Когда тестовая нуклеиновая кислота кодирует полипептид, являющийся сериновой протеазой, она считается схожей с указанной нуклеиновой кислотой сериновой протеазы, если результаты сравнения в виде наименьшей суммы вероятности составляют менее чем приблизительно 0,5 и более предпочтительно менее чем приблизительно 0,2.
[063] "Идентичная" в процентах или процентная "идентичность" в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относится к двум или более последовательностям, которые являются одинаковыми или имеют указанный процент остатков нуклеиновой кислоты или аминокислотных остатков, соответственно, которые одинаковы при сравнении и выравнивании для максимального подобия, которое определяют при помощи алгоритма сравнения последовательностей или визуального просмотра. "Процентная идентичность последовательностей", или "% идентичность", или "% идентичность последовательностей", или "% идентичность аминокислотных последовательностей" рассматриваемой аминокислотной последовательности к эталонной (т.е. запроса) аминокислотной последовательности означает, что рассматриваемая аминокислотная последовательность является идентичной (т.е. на основании аминокислота-с-аминокислотой) на указанный процент с аминокислотной последовательностью запроса на длину сравнения при оптимальном выравнивании последовательностей. Таким образом, 80% идентичность аминокислотных последовательностей или 80% идентичность в отношении двух аминокислотных последовательностей означает, что 80% аминокислотных остатков в двух оптимально выровненных аминокислотных последовательностях являются идентичными.
[064] "Процентная идентичность последовательностей", или "% идентичность", или "% идентичность последовательностей", или "% идентичность нуклеотидных последовательностей" рассматриваемой последовательности нуклеиновой кислоты с эталонной (т.е. запрашиваемой) последовательностью нуклеиновой кислоты означает, что рассматриваемая последовательность нуклеиновой кислоты идентична (т. е. на основании нуклеотид-с-нуклеотидом для полинуклеотидной последовательности) на указанный процент с последовательностью запроса на длину сравнения при оптимальном выравнивании последовательностей. Таким образом, 80% идентичность нуклеотидных последовательностей или 80% идентичность в отношении двух последовательностей нуклеиновых кислот означает, что 80% нуклеотидных остатков в двух оптимально выровненных последовательностях нуклеиновых кислот являются идентичными.
[065] "Процентная идентичность последовательности", или "% идентичности", или "% идентичности последовательности", или "% идентичности белковой последовательности" исследуемой белковой последовательности относительно эталонной (т.е. запрашиваемой) белковой последовательности означает, что исследуемая белковая последовательность является идентичной (т.е. на основе того, какой остаток следует за каким) в указанном процентном соотношении запрашиваемой белковой последовательности в пределах сравниваемой длины, когда последовательности оптимально выравнены. Таким образом, 80% идентичность белковой последовательности или 80% идентичность в отношении двух полипептидных последовательностей означает, что 80% остатков в двух оптимально выровненных белковых последовательностях являются идентичными.
[066] В некоторых вариантах осуществления "процентная идентичность последовательности", или "% идентичности последовательности" или "% идентичности" рассматриваемой последовательности с запрашиваемой последовательностью может быть рассчитана путем оптимального выравнивания двух последовательностей и сравнения двух оптимально выровненных последовательностей по сравниваемой длине. Устанавливается число положений в оптимальном выравнивании, при котором идентичные остатки встречаются в обеих последовательностях, таким образом позволяя получить число совпавших положений, и число совпавших положений затем делят на общее число положений сравниваемой длины (которая, если не указано иное, представляет собой длину запрашиваемой последовательности). Итоговое число умножают на 100 с получением процентной идентичности последовательности исследуемой последовательности с запрашиваемой последовательностью.
[067] "Оптимальное выравнивание" или "оптимально выравнены" относится к выравниванию двух (или более) последовательностей, позволяющему получить наивысший показатель процента идентичности. Например, оптимального выравнивания двух белковых последовательностей можно достичь с помощью выравнивания вручную последовательностей так, чтобы были выровнены друг с другом максимальное количество идентичных аминокислотных остатков в каждой последовательности, или с помощью компьютерных программ, или процедур, описываемых в настоящем изобретении или известных из уровня техники. Оптимального выравнивания двух последовательностей нуклеиновых кислот можно достичь с помощью выравнивания вручную последовательностей так, чтобы были выровнены друг с другом максимальное количество идентичных нуклеотидных остатков в каждой последовательности, или с помощью компьютерных программ, или процедур, описываемых в настоящем изобретении или известных из уровня техники.
[068] В некоторых вариантах осуществления две полипептидные последовательности считают "оптимально выровненными", если они выровнены с применением заданных параметров, таких как заданная матрица аминокислотных замен, штраф за наличие гэпа (также называемый штраф за открытие гэпа) и штраф за продление гэпа, так, чтобы достигать наиболее высокого балла подобия, который возможен для данной пары последовательностей. Матрицу замен BLOSUM62 (см. Henikoff и Henikoff, выше) часто применяют в качестве матрицы оценки для замен по умолчанию в алгоритмах выравнивания полипептидных последовательностей (например, BLASTP). Штраф за наличие гэпа накладывают за введение гэпа из одной аминокислоты в одной из выравниваемых последовательностей, а штраф за продление гэпа накладывают за каждое положение остатка в гэпе. Типичными используемыми параметрами выравнивания являются: матрица замен BLOSUM62, штраф за наличие гэпа=11 и штраф за продление гэпа=1. Балл выравнивания определяют по аминокислотным положениям каждой последовательности, с которых начинается и заканчивается выравнивание (например, окно выравнивания), и необязательно по вставке гэпа или множественных гэпов в одну или обе последовательности так, чтобы достигался самый высокий возможный балл подобия.
[069] Оптимальное выравнивание между двумя или более последовательностями можно определить вручную с помощью визуального просмотра или с помощью компьютера, как например, без ограничения, с помощью, например, программы BLASTP для аминокислотных последовательностей и программы BLASTN для последовательностей нуклеиновых кислот (см., например, Altschul et al., Nucleic Acids Res. 25(17):3389-3402 (1997); См. также веб-сайт Национального центра биотехнологической информации (NCBI)).
[070] Представляющий интерес полипептид может быть указан как "в значительной степени подобный" эталонному полипептиду, если представляющий интерес полипептид содержит аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или по меньшей мере приблизительно 99,5% идентичностью последовательности с аминокислотной последовательностью эталонного полипептида. Процентную идентичность между двумя такими полипептидами можно определить вручную путем просмотра двух оптимально выровненных полипептидных последовательностей или с помощью программного обеспечения или алгоритмов (например, BLAST, ALIGN, CLUSTAL и MUSCLE) с использованием стандартных параметров. Одним из признаков того, что два полипептида являются в значительной степени идентичными, является то, что первый полипептид является иммунологически перекрестно-реагирующим со вторым полипептидом. Как правило, полипептиды, которые отличаются по консервативным аминокислотным заменам, являются иммунологически перекрестно-реагирующими. Таким образом, полипептид в значительной степени идентичен второму полипептиду, например, если два пептида отличаются только по консервативной аминокислотной замене или одной или нескольким консервативным аминокислотным заменам.
[071] Представляющая интерес нуклеиновая кислота может быть указана как "в значительной степени подобная" эталонной нуклеиновой кислоте, если представляющая интерес нуклеиновая кислота содержит нуклеотидную последовательность, характеризующуюся по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или по меньшей мере приблизительно 99,5% идентичностью последовательности с нуклеотидной последовательностью эталонной нуклеиновой кислоты. Процентную идентичность между двумя такими нуклеиновыми кислотами можно определить вручную путем визуального просмотра двух оптимально выровненных последовательностей нуклеиновых кислот или с помощью программного обеспечения или алгоритмов (например, BLAST, ALIGN, CLUSTAL и MUSCLE) с использованием стандартных параметров. Одним из признаков того, что две последовательности нуклеиновых кислот являются в значительной степени идентичными, является то, что две молекулы нуклеиновых кислот гибридизируются друг с другом в жестких условиях (например, в диапазоне от средней до высокой жесткости).
[072] Нуклеиновая кислота или полинуклеотид являются "выделенными", если их по меньшей мере частично или полностью отделяют от других компонентов, в том числе без ограничения, например, других белков, нуклеиновых кислот, клеток и т.п. Подобным образом, полипептид, белок или пептид является "выделенным", если его по меньшей мере частично или полностью отделили от других компонентов, в том числе без ограничения, например, других белков, нуклеиновых кислот, клеток и т.п. В молях выделенные частицы преобладают над другими частицами в композиции. Например, выделенные частицы могут содержать по меньшей мере приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100% (в молях) всех присутствующих макромолекулярных частиц. Предпочтительно, представляющие интерес частицы очищают до необходимой гомогенности (т.е. посторонние частицы не могут быть выявлены в композиции традиционными способами выявления). Чистоту и гомогенность можно определить с помощью ряда методик, хорошо известных в уровне техники, таких как электрофорез в агарозном или полиакриламидном геле образца нуклеиновой кислоты или белка, соответственно, с последующей визуализацией после окрашивания. При необходимости для очистки материала можно использовать методику с высокой разрешающей способностью, такую как высокоэффективная жидкостная хроматография (HPLC) или подобные способы.
[073] Термин "очищенный" при применении к нуклеиновым кислотам или полипептидам обычно означает нуклеиновую кислоту или полипептид, которые практически не содержат других компонентов, что определяют с помощью аналитических методик, хорошо известных в уровне техники (например, очищенный полипептид или полинуклеотид образует отдельную полосу в электрофоретическом геле, хроматографическом элюате и/или средах, подвергаемых центрифугированию в градиенте плотности). Например, нуклеиновая кислота или полипептид, которые дают фактически одну полосу в электрофоретическом геле являются "очищенными". Очищенные нуклеиновая кислота или полипептид являются чистыми по меньшей мере на приблизительно 50%, обычно по меньшей мере на приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8% или более (например, весовой процент в молях). В похожем смысле в настоящем изобретении предусмотрены способы обогащения композиций одной или несколькими молекулами по настоящему изобретению, такими как один или несколько полипептидов или полинуклеотидов по настоящему изобретению. Композиция обогащена молекулой, если имеет место значительное увеличение концентрации молекулы после применения методики очистки или обогащения. Практически чистые полипептид или полинуклеотид по настоящему изобретению (например, практически чистые вариантная протеаза или полинуклеотид, кодирующий вариантную протеазу по настоящему изобретению соответственно), как правило, будут включать по меньшей мере приблизительно 55%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98, приблизительно 99%, приблизительно 99,5% или более по весу (в молях) всех макромолекулярных частиц в конкретной композиции.
[074] В похожем смысле в настоящем изобретении предусмотрены способы обогащения композиций одной или несколькими молекулами по настоящему изобретению, как, например, одним или несколькими полипептидами по настоящему изобретению (например, одной или несколькими вариантными протеазами по настоящему изобретению) или одной или несколькими нуклеиновыми кислотами по настоящему изобретению (например, одной или несколькими нуклеиновыми кислотами, кодирующими одну или несколько вариантных протеаз по настоящему изобретению). Композиция обогащена молекулой, если имеет место значительное увеличение концентрации молекулы после применения методики очистки или обогащения. Практически чистые полипептид или полинуклеотид, как правило, будут включать по меньшей мере приблизительно 55%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98, приблизительно 99%, приблизительно 99,5% или более по весу (в молях) всех макромолекулярных частиц в конкретной композиции.
[075] Используемый в данном документе термин "комбинаторный мутагенез" или "комбинаторный" относится к способам с помощью которых создают библиотеки вариантов нуклеиновых кислот эталонной последовательности нуклеиновой кислоты. В данных библиотеках варианты содержат одну или несколько мутаций, выбранных из предварительно заданного ряда мутаций. Способы также обеспечивают средства введения случайных мутаций, которые не являлись представителями заранее заданного набора мутаций. Некоторые такие способы включают способы, изложенные в патенте США № 6582914, который включен в данный документ при помощи ссылки. Некоторые такие способы комбинаторного мутагенеза включают и/или охватывают способы, предусмотренные в коммерчески доступных наборах (например, QUIKCHANGE® набор для многостороннего сайт-направленного мутагенеза (Multi Site-Directed Mutagenesis Kit) (Stratagene), ПЦР-слияние/ПЦР с удлинением).
[076] Используемая в данном документе фраза "обладающая улучшенными свойствами" при использовании в отношении к вариантной протеазе относится к вариантной протеазе с улучшенным или усиленным моющим или очищающим действием, и/или улучшенной или усиленной стабильностью, необязательно с сохраненным моющим или очищающим действием, по сравнению с соответствующей эталонной протеазой (например, протеазой дикого типа или встречающейся в природе протеазы). Улучшенные свойства вариантной протеазы могут включать в себя улучшенное моющее или очищающее действие и/или улучшенную стабильность. В некоторых вариантах осуществления настоящее изобретение относится к вариантным протеазам по настоящему изобретению, которые проявляют одно из нескольких из следующих свойств: улучшенное действие в отношении мытья рук, улучшенное действие в отношении ручного мытья посуды или мытья посуды вручную, улучшенное действие в отношении автоматического мытья посуды, улучшенное действие в отношении стирки и/или улучшенная стабильность по сравнению с эталонной протеазой (например, протеазой дикого типа, такой как протеаза из AprL дикого типа).
[077] Используемый в данном документе термин "функциональный анализ" относится к анализу, который обеспечивает показатель активности белка. В некоторых вариантах осуществления данный термин относится к аналитическим системам, в которых белок анализируется на предмет его способности функционировать в контексте его обычной функциональной активности. Например, в случае ферментов, функциональный анализ предусматривает определение эффективности фермента при катализе реакции.
[078] Используемый в данном документе термин "целевое свойство" относится к свойству исходного гена, которое необходимо изменить. Следует отметить, что настоящее изобретение не ограничивается каким-либо конкретным целевым свойством. Тем не менее, в некоторых вариантах осуществления целевое свойство представляет собой стабильность продукта гена (например, устойчивость к денатурации, расщеплению белка или другим разрушающим факторам), тогда как в других вариантах осуществления изменяют уровень продуцирования у продуцирующего хозяина.
[079] Термин "свойство" или его грамматические эквиваленты в отношении нуклеиновой кислоты, используемые в данном документе, относятся к любой характеристике или качеству нуклеиновой кислоты, которые можно выбрать или выявить. Данные свойства включают без ограничения свойство, влияющее на связывание с полипептидом, свойство, придаваемое клетке, содержащую конкретную нуклеиновую кислоту, свойство, влияющее на транскрипцию гена (например, сила промотора, узнавание промотора, промоторная регуляция, энхансерная функция), свойство, влияющее на процессинг РНК (например, сплайсинг РНК, стабильность РНК, конформация РНК и посттранскрипционная модификация), свойство, влияющее на трансляцию (например, уровень, регуляция, связывание мРНК с рибосомальными белками, посттрансляционная модификация). Например, сайт связывания транскрипционного фактора, полимеразы, регуляторного фактора и т.д. нуклеиновой кислоты можно изменять для получения желаемых характеристик или для идентификации нежелательных характеристик.
[080] Термин "свойство" или его грамматические эквиваленты в отношении полипептида (включая белки), используемый в данном документе, относится к любой характеристике или качеству полипептида, которые можно выбрать или выявить. Данные свойства включают в себя без ограничения стабильность к окислению, субстратную специфичность, каталитическую активность, ферментативную активность, термостабильность, стабильность к щелочной среде, профиль активности при определенном pH, стабильность к протеолитическому разрушению, KM, kcat, отношение kcat/kM, фолдинг белка, индукцию иммунного ответа, способность связываться с лигандом, способность связываться с рецептором, способность секретироваться, способность воспроизводиться на поверхности клетки, способность олигомеризироваться, способность к передаче сигнала, способность к стимуляции клеточной пролиферации, способность к ингибированию клеточной пролиферации, способность к индукции апоптоза, способность подвергаться модификации путем фосфорилирования или гликозилирования и/или способность лечить заболевание и т.д.
[081] Используемый в данном документе термин "скрининг" имеет свое обычное значение в данной области техники. В одном иллюстративном способе скрининга получают мутантную нуклеиновую кислоту или кодируемый ею вариантный полипептид и оценивают или определяют свойство мутантной нуклеиновой кислоты или вариантного полипептида, соответственно. Определенное свойство мутантной нуклеиновой кислоты или вариантного полипептида можно сравнить со свойством соответствующей нуклеиновой кислоты-предшественника (исходной) или со свойством соответствующего исходного полипептида соответственно.
[082] Специалисту в данной области будет понятно, что процедура скрининга для получения нуклеиновой кислоты или белка с измененным свойством зависит от свойства исходного материала, модификацией которого намереваются поспособствовать получению мутантной нуклеиновой кислоты. Таким образом, специалисту в данной области будет понятно, что настоящее изобретение не ограничивается каким-либо конкретным свойством, подлежащим скринингу, и что в последующем описании свойств приведены лишь иллюстративные примеры. Способы скрининга в отношении любого конкретного свойства в целом описаны в уровне техники. Например, можно измерять связывание, pH, специфичность и т.д., до и после мутации, при этом преобразование указывает на изменение. Предпочтительно, скрининги проводят способом с высокой пропускной способностью, включая проведение одновременного скрининга множества образцов, в том числе без ограничения анализы с использованием чипов, фагового дисплея и множественных субстратов и/или индикаторов.
[083] Как используется в данном документе, в некоторых вариантах осуществления способ скрининга включает одну или несколько стадий отбора, при которых представляющие интерес варианты пополняют из популяции вариантов. Примеры данных вариантов осуществления включают отбор вариантов, которые обеспечивают преимущество в отношении роста организму-хозяину, а также фаговый дисплей или любой другой способ индикации, где варианты можно собирать из популяции вариантов на основании их связывающих или каталитических свойств. В некоторых вариантах осуществления библиотеку вариантов подвергают воздействию стресса (например, тепло, денатурация и т.д.) и затем варианты, которые все еще остаются интактными, идентифицируют в скрининге или пополняют путем отбора. Подразумевается, что данный термин охватывает любые подходящие средства отбора. Действительно, не подразумевается, что настоящее изобретение ограничивается каким-либо конкретным способом скрининга.
[084] Термины "модифицированная последовательность нуклеиновой кислоты" и "модифицированный ген" применяют в настоящем изобретении взаимозаменяемо в отношении последовательности нуклеиновой кислоты, которая включает делецию, вставку или прерывание встречающейся в природе последовательности нуклеиновой кислоты (т.e. дикого типа). В некоторых вариантах осуществления продукт экспрессии модифицированной последовательности нуклеиновой кислоты является усеченным белком (например, если модификацией является делеция или прерывание последовательности). В некоторых вариантах осуществления усеченный белок сохраняет биологическую активность. В альтернативных вариантах осуществления продукт экспрессии модифицированной последовательности нуклеиновой кислоты является удлиненным белком (например, модификации, включающие вставку в последовательность нуклеиновой кислоты). В некоторых вариантах осуществления нуклеотидная вставка в последовательность нуклеиновой кислоты дает в результате усеченный белок (например, если вставка приводит к образованию стоп-кодона). Таким образом, вставка может привести к образованию либо усеченного белка, либо удлиненного белка в качестве продукта экспрессии.
[085] "Мутантная" последовательность нуклеиновой кислоты, как правило, относится к последовательности нуклеиновой кислоты, которая имеет изменение по меньшей мере в одном кодоне, встречающемся в последовательности дикого типа клетки-хозяина, так, что продукт экспрессии мутантной последовательности нуклеиновой кислоты представляет собой белок с измененной аминокислотной последовательностью по сравнению с белком дикого типа. Продукт экспрессии может обладать измененной функциональной способностью (например, усиленной ферментативной активностью).
[086] Используемая в данном документе фраза "изменение в отношении субстратной специфичности" относится к изменению в отношении субстратной специфичности фермента. В некоторых вариантах осуществления изменение в отношении субстратной специфичности определяют как изменение в kcat и/или Km для конкретного субстрата, обусловленной мутациями фермента или изменением условий реакции. Субстратную специфичность фермента определяют путем сравнения показателей каталитической эффективности, которыми он характеризуется для различных субстратов. Данные определения находят практическое применение при оценке эффективности мутантных ферментов, поскольку в целом желательно получать вариантные ферменты, которые проявляют большие отношения kcat/Km в отношении представляющих интерес субстратов. Однако не подразумевается, что настоящее изобретение ограничивается какой-либо конкретной субстратной композицией или субстратной специфичностью.
[087] Используемый в данном документе термин "свойство поверхности" применяется в отношении электростатического заряда, а также таких свойств, как гидрофобность и гидрофильность, которыми обладает поверхность белка.
[088] Используемый в данном документе термин "суммарный заряд" определяется как сумма имеющихся зарядов в молекуле. "Изменения суммарного заряда" осуществляют в отношении исходной белковой молекулы для получения варианта, который имеет суммарный заряд, отличающийся от исходной молекулы (т.e. вариант имеет суммарный заряд, который не является таким же, как заряд исходной молекулы). Например, замена нейтральной аминокислоты отрицательно заряженной аминокислотой или положительно заряженной аминокислоты нейтральной аминокислотой дает в результате суммарный заряд -1 относительно исходной молекулы. Замена положительно заряженной аминокислоты отрицательно заряженной аминокислотой дает в результате суммарный заряд -2 относительно исходного. Замена нейтральной аминокислоты положительно заряженной аминокислотой или отрицательно заряженной аминокислоты нейтральной аминокислотой дает в результате суммарный заряд +1 относительно исходного. Замена отрицательно заряженной аминокислоты положительно заряженной аминокислотой дает в результате суммарный заряд +2 относительно исходного. Суммарный заряд исходного белка также можно изменять путем делеции и/или вставки заряженных аминокислот.
[089] Термины "термически стабильный", и "термостабильный", и "термостабильность" относятся к протеазам, которые сохраняют указанное значение ферментативной активности после воздействия установленными температурами в течение заданного периода времени в условиях, преобладающих в ходе протеолитического, гидролитического, очищающего или другого процесса по настоящему изобретению, при воздействии измененными температурами. "Измененные температуры" охватывают повышенные или пониженные температуры. В некоторых вариантах осуществления протеазы сохраняют по меньшей мере приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после воздействия измененными температурами в течение заданного периода времени, например, по меньшей мере приблизительно 60 минут, приблизительно 120 минут, приблизительно 180 минут, приблизительно 240 минут, приблизительно 300 минут и т.д.
[090] Термин "повышенная стабильность" в контексте устойчивой к окислению, комплексону, термически стабильной и/или устойчивой к pH протеазы относится к более высокой сохраняемой протеолитической активности с течением времени по сравнению с другими протеазами (например, протеазами из AprL) и/или ферментами дикого типа.
[091] Термин "пониженная стабильность" в контексте стабильности к окислению, комплексону, термически стабильной и/или стабильной к pH протеазы относится к более низкой сохраняемой протеолитической активности с течением времени по сравнению с другими протеазами (например, протеазами из AprL) и/или ферментами дикого типа.
[092] Термин "активность в отношении очистки" относится к очищающему действию, достигаемому с помощью вариантной протеазы или эталонной протеазы в условиях, преобладающих в ходе протеолитического, гидролитического, очищающего, удаления грязи/пятен или другого процесса по настоящему изобретению. В некоторых вариантах осуществления очищающее действие вариантной протеазы или эталонной протеазы можно определить с помощью различных анализов в отношении очистки одного или нескольких различных, чувствительных к ферментам загрязнений на предмете или поверхности (например, загрязнение от еды, травы, крови, чернила, молока, растительного масла и/или яичного белка). Очищающее действие вариантной или эталонной протеазы можно определить путем воздействия на загрязнение на предмете или поверхности стандартным(стандартными) моющим(моющими) условием(условиями) и оценки степени, до которой удаляется загрязнение, с помощью различных хроматографических, спектрофотометрических или других количественных методик. Типичные анализы по исследованию очищающего действия и способы очистки известны в уровне техники и включают в себя без ограничения описанные в WO 99/34011 и US6605458, а также такие анализы и способы очистки, включенные в примеры, представленные ниже.
[093] Термин "эффективное количество для очистки" вариантной протеазы или эталонной протеазы относится к количеству протеазы, с помощью которого достигается требуемый уровень ферментативной активности в конкретной чистящей композиции. Такие эффективные количества легко определяются рядовым специалистом в данной области техники и основаны на многих факторах, таких как конкретная применяемая протеаза, применение для очистки, конкретный состав чистящей композиции и от того, жидкая или сухая (например, в виде гранул, таблетки, бруска) композиция необходима и т.д. Термин "индекс удаления грязи" (SRI) вариантной протеазы или эталонной протеазы относится к степени удаление грязи, достигаемой с помощью определенного количества фермента или за счет ферментативной активности.
[094] Термин "вспомогательное вещество для очистки" относится к любой жидкости, твердому или газообразному веществу, включенному в чистящую композицию, отличному от вариантной протеазы настоящего изобретения. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению включают одно или несколько вспомогательных веществ для очистки. Каждое вспомогательное вещество для очистки, как правило, выбирают в зависимости от конкретного типа и формы чистящей композиции (например, жидкость, гранула, порошок, брусок, паста, аэрозоль, таблетка, гель, пена или другая композиция). Предпочтительно, каждое вспомогательное вещество для очистки является совместимым с ферментом, являющимся протеазой, применяемым в композиции.
[095] Термин "усиленное действие" в контексте активности в отношении очистки относится к повышенной или большей активности в отношении очистки, проявляемой ферментом, на определенных чувствительных к ферменту загрязнениях, таких как яйцо, молоко, трава, чернила, растительное масло и/или кровь, которую определяют путем обычной оценки после стандартного цикла мытья и/или нескольких циклов мытья.
[096] Термин "сниженное действие" в контексте активности в отношении очистки относится к пониженной или меньшей активности в отношении очистки, проявляемой ферментом, на определенных чувствительных к ферменту загрязнениях, таких как яйцо, молоко, трава или кровь, которую определяют путем обычной оценки после стандартного цикла мытья.
[097] Очищающее действие можно определить путем сравнения вариантных протеаз в соответствии с настоящим изобретением с эталонными протеазами в различных анализах по исследованию очищающего действия в отношении чувствительных к ферменту загрязнений, таких как трава, кровь, чернила, растительное масло и/или молоко, которое определяют с помощью обычных спектрофотометрических или аналитических методик после условий стандартного цикла мытья.
[098] Используемый в данном документе термин "продукт потребления" означает продукт по уходу за тканью и по уходу за домом. Используемый в данном документе термин "продукт по уходу за тканью и по уходу за домом" или "продукт по уходу за тканью и по уходу за домашним хозяйством" включает продукты, которые обычно предназначены для применения или потребления в форме, в которой они продаются, и которые предназначены для обработки тканей, твердых поверхностей и любых других поверхностей, и очищающие системы только для ухода и очистки поверхностей, не относящихся к живым объектам, а также продукты-кондиционеры для тканей и другие продукты, специально разработанные для ухода и сбережения тканей, и ароматизаторы, включая: ароматизаторы, включающие освежители воздуха и системы доставки отдушки, средство по уходу за салоном автомобиля, средство по уходу за домашними животными, средство по уходу за домашним скотом, средство личной гигиены, средство по уходу за драгоценностями, средство для мытья посуды, средство для кондиционирования ткани (включая смягчение и/или авиваж), моющее средство для стирки, добавку и/или средство по уходу для стирки и ополаскивания, чистящие композиции для предварительной обработки, средство для очистки и/или обработки твердых поверхностей, включая средства для очистки пола и унитаза, средства для очистки и/или обработки стекла, средства для очистки и/или обработки плитки, средства для очистки и/или обработки керамики и другие очищающие средства для потребительского применения или применения в учреждениях. В некоторых вариантах осуществления продукты по уходу за тканью и по уходу за домом подходят для применения на ранах и/или коже. "Продукт по уходу за тканью и по уходу за домом" включает потребительские продукты и продукты для учреждений.
[099] Используемый в данном документе термин "не относящийся к продуктам бытовой химии" относится к композициям, которые добавляются к другим композициям с получением конечного продукта, который может быть a продукт бытовой химии.
[0100] Используемый в данном документе, термин "чистящая композиция для учреждений" относится к продуктам, приемлемым для применения в учреждениях, включая без ограничения школы, больницы, фабрики, магазины, корпорации, здания, рестораны, офисные комплексы и здания, перерабатывающие и/или производственные предприятия, ветеринарные клиники, аграрно-промышленные фермы, крупные аграрно-промышленные фермы и т.д.
[0101] Используемый в данном документе термин "композиция для очистки и/или обработки" является подклассом продуктов по уходу за тканью и по уходу за домом, который включает, если не указано иное, композиции, подходящие для очистки и/или обработки предметов. Такие продукты включают в себя без ограничения продукты для обработки тканей, твердых поверхностей и любых других поверхностей в области ухода за тканью и ухода за домом, включая ароматизаторы, в том числе освежители воздуха и системы доставки отдушки, средство по уходу за салоном автомобиля, средство для мытья посуды, средство для кондиционирования ткани (включая смягчение и/или авиваж), моющее средство для стирки, добавку и/или средство по уходу для стирки и ополаскивания, средство для очистки и/или обработки твердых поверхностей, включая средства для очистки пола и унитаза, гранулированные или порошковые универсальные или "с высокой моющей способностью" средства для мытья, особенно очищающие моющие средства; жидкие, гелевые или в форме пасты универсальные средства для мытья, особенно так называемые жидкие формы с высокой моющей способностью; жидкие моющие средства для тонкой легкой ткани; средства для ручного мытья посуды или средства для мытья посуды с низкой моющей способностью, особенно таковые сильнопенящегося типа; средства для машинного мытья посуды, включая различные типы таблеток, гранулированные, жидкие и вспомогательные ополаскивающие для домашнего применения и применения в учреждениях: шампуни для автомобилей или ковров, средства для очистки ванн, включая средства для чистки унитазов; а также в качестве очищающих вспомогательных средств, таких как отбеливающие добавки и "карандаш-пятновыводитель" или средства типа средств для предварительной обработки, продукты, загруженные в субстрат, такие как салфетки с добавленной пропиткой мягчителем-антистатиком.
[0102] Более того, используемые в данном документе фразы "чистящая композиция" или "чистящий состав" по настоящему изобретению относится к любой композиции в соответствии с настоящим изобретением, пригодной для удаления или устранения соединения (например, нежелательного соединения) с объекта, предмета или поверхности, подлежащих очистке, включая без ограничения, например, ткань, предмет из ткани, предмет посуды, предмет столовой утвари, предмет стеклянной посуды, контактные линзы, другой твердый субстрат, волосы (шампунь) (включая волосы человека или волосяной покров животных), кожу (мыло или/и крем), зубы (ополаскиватели для рта, зубные пасты), поверхность предмета или объекта (например, твердые поверхности, такие как твердая поверхность стола, столешница, стена, предмет мебели, пол, потолок, предмет, не имеющий отношения к посуде, предмет, не имеющий отношения к столовой утвари, и т.д.), фильтры, мембраны (например, фильтрующие мембраны, включая без ограничения ультрафильтрующие мембраны) и т.д. Термин охватывает любой материал и/или добавляемое соединение, выбранные для конкретного типа желаемой чистящей композиции и формы продукта (например, жидкости, геля, гранулы, аэрозоля или другой композиции), при условии, что композиция является совместимой с протеазой и другим(другими) ферментом(ферментами), используемым(используемыми) в композиции. Конкретный выбор материалов чистящей композиции легко осуществить, принимая во внимание поверхность, объект, предмет или ткань, подлежащие очистке, и желаемую форму композиции для условий очистки в ходе применения.
[0103] Чистящие композиции и чистящие составы включают любую композицию, которая подходит для очистки, отбеливания, дезинфекции и/или стерилизации любого объекта, предмета и/или поверхности. Такие композиции и составы включают без ограничения, например, жидкие и/или твердые композиции, в том числе чистящей композиции или моющие композиции (например, жидкость, таблетку, гель, брусок, гранулу и/или твердые чистящей композиции или моющие композиции для стирки и моющие композиции для тонких тканей; композиции и составы для очистки твердых поверхностей, такие как для стеклянных, деревянных, керамических и металлических столешниц и окон; средства для чистки ковров; средства для чистки печей; освежители тканей; смягчители тканей и чистящие или моющие композиции-усилители для стирки белья и текстильного изделия, вспомогательные чистящие композиции для стирки и чистящие композиции для стирки с предварительным замачиванием; композиции для мытья посуды, включая композиции для ручного мытья посуды или мытья посуды вручную (например, моющие средства для "ручного" мытья посуды или мытья посуды "вручную") и композиции для автоматического мытья посуды (например, "моющие средства для автоматического мытья посудыʺ). Формы в виде единичной дозы также находят применение по настоящему изобретению, включая без ограничения шарики, таблетки, капсулы с гелем или другие единичные дозы, такие как дозированные порошки, суспензии или жидкости.
[0104] Чистящая композиция или чистящие составы, используемые в данном документе, включают, если не указано иное, универсальные или интенсивные моющие средства в форме гранул или порошка, в особенности моющие средства для очистки; универсальные моющие средства в форме жидкости, гранул, геля, таблетки, пасты или единичной дозы, в особенности так называемые моющие средства типа интенсивные жидкие (HDL) или интенсивные сухие (HDD); жидкие моющие средства для тонких тканей; водорастворимые мешки-контейнеры с одним или несколькими отделениями, средства для ручного мытья посуды, включая средства сильнопенящегося типа; средства для ручного мытья посуды, средства для автоматического мытья посуды или моющие средства для посуды и столовой утвари, включая различные средства типа таблетки, порошка, твердого вещества, гранул, жидкости для домашнего применения и применение в учреждениях; жидкие чистящие и дезинфицирующие средства, включая антибактериальные типы для мытья рук, чистящие бруски, ополаскиватели для полости рта, средства для очистки зубных протезов, автомобильные шампуни, шампуни для ковров, средства для очистки санузлов; шампуни для волос и/или ополаскиватели для волос для человека и других животных; гели для душа и пены для ванн и средства для очистки металла; а также вспомогательные средства очистки, такие как отбеливающие добавки и средства типа "карандаш для выведения пятен" или предварительной обработки. В некоторых вариантах осуществления композиции в виде гранул находятся в "компактной" форме; в некоторых вариантах осуществления жидкие композиции находятся в "концентрированной" форме.
[0105] Как используется в данном документе, "чистящие композиции для тканей" включают в себя моющие композиции для ручной и автоматической стирки, в том числе вспомогательные композиции для стирки и композиции, подходящие для применения при замачивании и/или предварительной обработке загрязненных тканей (например, одежды, белья и других текстильных материалов).
[0106] Как используется в данном документе, "не относящиеся к чистящим композициям для тканей" включают в себя чистящие композиции для нетекстильных (т.e. нетканевых) поверхностей, в том числе без ограничения, например, моющие композиции для ручного мытья, или для мытья вручную, или автоматического мытья посуды, чистящие композиции для рта, чистящие композиции для зубных протезов, чистящие композиции для контактных линз, чистящие композиции для ран и композиции для личной гигиены.
[0107] Используемый в данном документе термин "композиция для очистки и/или обработки тканевой и/или твердой поверхности" является подклассом композиций для очистки и обработки, который включает в себя, если не указано иное, гранулированные или порошковые универсальные или "с высокой моющей способностью" средства для мытья, особенно чистящие моющие средства; жидкие, гелевые или в форме пасты универсальные средства для мытья, особенно так называемые жидкие типы с высокой моющей способностью; жидкие моющие средства для тонкой легкой ткани; средства для ручного мытья посуды или средства для мытья посуды с низкой моющей способностью, особенно средства сильнопенящегося типа; средства для мытья посуды в посудомоечной машине, включая различные типы таблеток, гранул, жидкостей, и вспомогательные для ополаскивания для домашнего применения и применения в учреждениях; жидкие очищающие и дезинфицирующие средства, шампуни для автомобилей или ковров, средства для очистки ванн, включая средства для очистки унитазов; продукты для кондиционирования тканей, включая смягчение и/или освежение, которые могут быть в жидкой, твердой форме и/или форме салфетки с пропиткой мягчителем-антистатиком; а также чистящие вспомогательные средства, такие как отбеливающие добавки и "карандаш-пятновыводитель" или средства типа средств для предварительной обработки, продукты, загруженные в субстрат, такие как салфетки с добавленной пропиткой мягчителем-антистатиком. Все эти продукты, которые являются применимыми, могут находиться в стандартной, концентрированной или даже высоко концентрированной форме, настолько, чтобы такие продукты могли быть, в определенном аспекте, безводными.
[0108] Используемый в данном документе термин "моющая композиция" или "моющий состав" применяют в отношении композиции, предназначенной для применения в моющей среде для очистки загрязненных или грязных объектов, включая конкретные тканевые и/или нетканевые объекты или предметы. Такие композиции в соответствии с настоящим изобретением не ограничены какими-либо конкретными моющими композицией или составом. Действительно, в некоторых вариантах осуществления моющие средства в соответствии с настоящим изобретением содержат по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением и, кроме того, одно или несколько поверхностно-активных веществ, трансферазу(трансферазы), гидролитические ферменты, оксидоредуктазы, моющие компоненты (например, моющий компонент-соль), отбеливающие средства, активаторы отбеливания, подсинивающие средства, флуоресцентные красители, средства, препятствующие слеживанию, дезодораторы, активаторы ферментов, антиоксиданты и/или солюбилизаторы. В некоторых случаях моющий компонент-соль является смесью силикатной соли и фосфатной соли, предпочтительно с большим количеством силиката (например, метасиликата натрия), чем фосфата (например, триполифосфата натрия). Некоторые композиции по настоящему изобретению, такие как без ограничения чистящие композиции или моющие композиции, не содержат какой-либо фосфат (например, фосфатную соль или фосфатный моющий компонент).
[0109] Используемый в данном документе термин "отбеливание" относится к обработке материала (например, ткани, белья для стирки, технической целлюлозы и т.д.) или поверхности в течение достаточно длительного времени, и/или при соответствующем pH, и/или температурных условиях до достижения эффекта осветления (т.e. беления) и/или очистки материала. Примеры химических веществ, подходящих для отбеливания, включают без ограничения, например, ClO2, H2O2, перкислоты, NO2 и т. д.
[0110] Используемый в данном документе термин "моющее действие" протеазы (например, вариантной протеазы по настоящему изобретению) относится к участию вариантной протеазы в мытье, что придает моющему средству дополнительное очищающее действие по сравнению с моющим средством без добавления вариантной протеазы в композицию. Моющее действие сравнивают при соответствующих условиях мытья. В некоторых тестовых системах другие соответствующие факторы, такие как моющая композиция, концентрация пены, жесткость воды, механика мытья, время, pH и/или температура, можно контролировать таким образом, чтобы имитировать условие(условия), типичное(типичные) для домашнего применения в определенном рыночном сегменте (например, ручное мытье посуды или мытье посуды вручную, автоматическое мытье посуды, очистка столовой посуды, очистка столовой утвари, очистка ткани и т.д.).
[0111] Термин "соответствующие условия мытья" используется в данном документе для обозначения условий, в частности температуры мытья, времени, механики мытья, концентрации пены, типа моющего средства и жесткости воды, обычно применяемых в быту, в сегменте рынка, ориентированного на ручное мытье посуды, автоматическое мытье посуды или моющие средства для стирки.
[0112] Термин "улучшенное моющее действие" используется для указания того, что достигается лучший конечный результат при удалении загрязнений в соответствующих условиях мытья, или что необходимо меньше вариантной протеазы, по весу, для получения такого же конечного результата по отношению к соответствующей протеазе дикого типа или изначальной исходной протеазе.
[0113] Используемый в данном документе термин "дезинфекция" относится к удалению загрязнений с поверхностей, а также ингибированию или уничтожению микробов на поверхностях предметов. Не подразумевается, что настоящее изобретение ограничивается какой-либо конкретной поверхностью, предметом или загрязнением(загрязнениями) или микробами, подлежащими удалению.
[0114] "Компактная" форма чистящих композиций согласно данному документу лучше всего отражается в плотности и, в пересчете на композицию, в количестве неорганической соли-наполнителя. Неорганические соли-наполнители являются традиционными ингредиентами моющих композиций в порошковой форме. В традиционных моющих композициях соли-наполнители присутствуют в значительных количествах, как правило, от приблизительно 17 до приблизительно 35% по весу от всей композиции. Наоборот, в компактных композициях соль-наполнитель присутствует в количествах, не превышающих приблизительно 15% всей композиции. В некоторых вариантах осуществления соль-наполнитель присутствует в количествах, не превышающих приблизительно 10% или более предпочтительно приблизительно 5% по весу композиции. В некоторых вариантах осуществления неорганические соли-наполнители выбирают из солей щелочных и щелочно-земельных металлов, представляющих собой сульфаты и хлориды. В некоторых вариантах осуществления солью-наполнителем является сульфат натрия.
[0115] Положение аминокислотного остатка в данной аминокислотной последовательности, как правило, нумеруют в данном документе с помощью нумерации положения соответствующего аминокислотного остатка аминокислотной последовательности AprL, показанной в SEQ ID NO:2. Аминокислотная последовательность AprL, показанная в SEQ ID NO:2, таким образом служит в качестве эталонной последовательности. Данная аминокислотная последовательность, такая как аминокислотная последовательность вариантной протеазы, описанной в данном документе, может быть выравнена с последовательностью AprL (SEQ ID NO:2) с применением алгоритма выравнивания, описанного в данном документе, и аминокислотный остаток в данной аминокислотной последовательности, который выравнивается (предпочтительно оптимально выравнивается) с аминокислотным остатком в последовательности AprL, можно условно пронумеровать относительно соответствующего аминокислотного остатка в последовательности липазы AprL.
[0116] В целом, номенклатура, применяемая в данном документе, и многие из лабораторных процедур культивирования клеток, молекулярной генетики, молекулярной биологии, химии нуклеиновых кислот и химии белков, описанных ниже, хорошо известны и их обычно используют рядовые специалисты в данной области. Способы получения и способы манипуляции с рекомбинантными нуклеиновыми кислотами, синтез нуклеиновых кислот, способы культивирования клеток и встраивание трансгена (например, трансфекция, электропорация) известны специалистам в данной области и описаны во многочисленных типовых текстах. Стадии синтеза и очистки олигонуклеотидов, как правило, осуществляют в соответствии с инструкциями. Методики и процедуры обычно осуществляют в соответствии с традиционными способами, хорошо известными в уровне техники и в различных общих ссылках, которые приведены по всему данному документу. Полагают, что процедуры, приведенные в них, хорошо известны рядовым специалистам в данной области, и они приведены для удобства читателя.
Ферменты клады AprL по настоящему изобретению
[0117] Используемый в данном документе фермент, являющийся протеазой клады AprL, включает фермент, полипептид, или белок, или их активный фрагмент, обладающий протеолитической активностью. Это включает члены клады AprL, как описано в примере 4, выравнивания, показанные на ФИГ. 2 и ФИГ. 3, и кладограмму на ФИГ. 9. Члены клады AprL идентифицировали путем отбора молекул субтилизина с близкой гомологией с AprL, осуществления структурного выравнивания таких последовательностей с другими субтилизинами и идентификации областей уникальных последовательностей, консервативных для всех ферментов клады AprL.
[0118] В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив YNT (SEQ ID NO:46). В еще одних вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив Y56N57T58 (SEQ ID NO:45), где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В еще одних вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив YNT (SEQ ID NO:46) между Asp32 и His63, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие область "петли" между остатками 52-60, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0119] В дополнительных вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив FVX1GEX2X3YNT (SEQ ID NO:47), где X1 представляет собой A или S, X2 отсутствует или представляет собой любую аминокислоту, и X3 представляет собой A или S. В еще одном дополнительном варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив F50V51X152G53E54X355Y56N57T58 (SEQ ID NO:48), где X1 представляет собой A или S, и X3 представляет собой A или S; и дополнительно, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0120] В других вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив LSX4S (SEQ ID NO:55), где X4 представляет собой A или G. В еще одних вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив LSAS (SEQ ID NO:49). В другом варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив LSGS (SEQ ID NO:58). В еще одних вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:49 или SEQ ID NO:58 между Lys236 и Arg246, где аминокислотные положения пронумерованы в соответствии с последовательность аминокислот протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив L240S241A242S243 (SEQ ID NO:50), где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В дополнительных вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив L240S241G242S243 (SEQ ID NO:56), где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В еще одних вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив KXXXLSX4SQX5R (SEQ ID NO:57), где X представляет собой любую аминокислоту, X4 представляет собой A или G и X5 представляет собой I или V. В еще дополнительных вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив KXXXLSASQX5R (SEQ ID NO:51), где X представляет собой любую аминокислоту, и X5 представляет собой I или V. В еще одном дополнительном варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив KXXXLSGSQX5R (SEQ ID NO:59), где X представляет собой любую аминокислоту, и X5 представляет собой I или V. В еще одних дополнительных вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив K236XXXLSASQX5R246 (SEQ ID NO:52), где X представляет собой любую аминокислоту и X5 представляет собой I или V; и дополнительно, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В еще одном дополнительном варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие мотив K236XXXLSGSQX5R246 (SEQ ID NO:60), где X представляет собой любую аминокислоту, и X5 представляет собой I или V; и дополнительно, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0121] В еще одних дополнительных вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:45, 46, 47 или 48 и SEQ ID NO:49, 50, 51 или 52. В другом варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:45, 46, 47 или 48 и SEQ ID NO: 49, 50, 51, 52, 55, 56, 57, 58, 59 или 60. В еще одном дополнительном варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:45, 46, 47 или 48 и SEQ ID NO: 49 или 50. В еще другом варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:58 между Lys236 и Arg246 и SEQ ID NO:46 между Asp32 и His63, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В еще другом варианте осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO:49 между Lys236 и Arg246 и SEQ ID NO:46 между Asp32 и His63, где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В еще других вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие SEQ ID NO: 47 или 48 и SEQ ID NO: 50, 52, 55, 56 или 60.
[0122] В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие остаток Arg248. В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие остаток Asn96. В некоторых вариантах осуществления ферменты клады AprL включают протеазы, представляющие собой субтилизины, содержащие водородную связь между остатками 96 и 98. В каждом случае номера остатков пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0123] В некоторых вариантах осуществления любые из последовательностей ферментов, являющихся протеазами клады AprL дикого типа, могут быть применимы в качестве исходной последовательности для получения вариантных ферментов, являющихся субтилизинами клады AprL по настоящему изобретению. В дополнительных вариантах осуществления исходным ферментом в случае одного или нескольких вариантов протеаз клады AprL, описанных в данном документе, является фермент клады AprL дикого типа. В некоторых вариантах осуществления фермент, являющийся протеазой субтилизином клады AprL, может иметь один или несколько опознавательных мотивов, как показано выше. Было подтверждено, что представители ферментов клады AprL сходятся в одних и тех же точках разветвления на кладограмме, созданного с применением способа объединения соседних пар (Saitou, N. and Nei, M. (1987) MolBiol. Evol. 4:406-425). Идентичность последовательности для ферментов клады AprL включает ферменты, которые по меньшей мере на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичны последовательности AprL (SEQ ID NO:2). Представители клады AprL включают: AprL (SEQ ID NO:2), фермент субтилизин B. licheniformis CAA62667 (SEQ ID NO:12), фермент субтилизин B. licheniformis YP_006712489 (SEQ ID NO:14), фермент субтилизин B. licheniformis BliD02339 (SEQ ID NO:9), фермент субтилизин B. licheniformis AEU12640 (SEQ ID NO:13), фермент субтилизин B_licheniformis_DY_P00781 (SEQ ID NO:15) и фермент субтилизин B_sonorensis_WP_006636716 (SEQ ID NO:16). В других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является фермент клады AprL, выбранный из AprL (SEQ ID NO:2), фермента субтилизина B. licheniformis CAA62667 (SEQ ID NO:12), фермента субтилизина B. licheniformis YP_006712489 (SEQ ID NO:14), фермента субтилизина B.licheniformis BliD02339 (SEQ ID NO:9), фермента субтилизина B. licheniformis AEU12640 (SEQ ID NO:13), фермента субтилизина B_licheniformis_DY_P00781 (SEQ ID NO:15) и фермента субтилизина B_sonorensis_WP_006636716 (SEQ ID NO:16). В еще других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является AprL (SEQ ID NO:2) или фермент субтилизин B. Licheniformis BliD02339 (SEQ ID NO:9). В еще других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является фермент клады AprL, характеризующийся по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью AprL под SEQ ID NO:2. В еще других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является фермент, представляющий собой протеазу клады AprL, характеризующийся по меньшей мере 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью AprL под SEQ ID NO:2. В еще других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является фермент, представляющий собой протеазу клады AprL, характеризующийся по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью AprL под SEQ ID NO:2. В еще других вариантах осуществления исходным ферментом в случае вариантной протеазы клады AprL является фермент, представляющий собой протеазу клады AprL, характеризующийся по меньшей мере 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью AprL под SEQ ID NO:2.
[0124] В некоторых вариантах осуществления настоящее изобретение включает новые ферменты и варианты клады AprL. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты AprL, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью AprL под SEQ ID NO:2. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus licheniformis, представляющие собой фермент субтилизин CAA62667, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus licheniformis CAA62667 SEQ ID NO:12. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus licheniformis, представляющие собой фермент субтилизин YP_006712489, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus licheniformis YP_006712489 SEQ ID NO:14. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus licheniformis, представляющие собой фермент субтилизин BliD02339, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus licheniformis BliD02339 SEQ ID NO:9. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus licheniformis, представляющие собой фермент субтилизин AEU12640, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus licheniformis AEU12640 SEQ ID NO:13. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus licheniformis, представляющие собой фермент субтилизин DY_P00781, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus licheniformis DY_P00781 SEQ ID NO:15. В некоторых вариантах осуществления настоящее изобретение включает вариантные ферменты Bacillus sorensis, представляющие собой фермент субтилизин WP_006636716, где вариант характеризуется по меньшей мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью с последовательностью фермента субтилизина Bacillus sorensis WP_006636716 SEQ ID NO:16.
Продуктивные положения в ферментах клады AprL
[0125] В настоящем изобретении предусмотрены аминокислотные положения в ферменте протеазе клады AprL, например сериновой протеазе AprL, которые могут быть применимы в моющих композициях, где предпочтительные модификации обеспечивают в результате минимальный индекс продуктивности в отношении чистящего действия, стабильности фермента в моющих композициях и термостабильности фермента, при наличии по меньшей мере одной из данных характеристик, улучшенных по сравнению с его исходным ферментом, являющимся протеазой клады AprL, таким как AprL SEQ ID NO:2, как описано выше. Данные модификации считаются подходящими модификациями по настоящему изобретению.
[0126] Термины "термическая стабильность" и "термостабильность" относятся к сериновым протеазам клады AprL по настоящему изобретению, которые сохраняют определенную степень ферментативной активности после воздействия определенной температурой, зачастую в течение данного периода времени при условиях, преобладающих в ходе процесса протеолиза, гидролиза, очистки или другого процесса, раскрытого в данном документе, например при воздействии измененными температурами. "Измененные температуры" охватывают повышенные или пониженные температуры. В некоторых вариантах осуществления протеаза клады AprL сохраняет по меньшей мере приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеазной активности после воздействия измененными температурами в течение данного периода времени, например, по меньшей мере приблизительно 60, 120, 180, 240 и 300 мин.
[0127] Как используется в данном документе, улучшенные свойства фермента, являющегося протеазой клады AprL, включают вариантный фермент, являющийся вариантной протеазой клады AprL с улучшенным или усиленным моющим или очищающим действием и/или улучшенной или повышенной стабильностью необязательно с сохраненным моющим или очищающим действием по сравнению с соответствующим исходным ферментом клады AprL (например, встречающимся в природе ферментом клады AprL или ферментом клады AprL дикого типа). Улучшенные свойства вариантного фермента клады AprL могут включать улучшенное моющее или очищающее действие и/или улучшенную стабильность. В некоторых вариантах осуществления в настоящем изобретении предусмотрены вариантные ферменты клады AprL по настоящему изобретению, которые проявляют одно из нескольких из следующих свойств: улучшенное действие в отношении мытья рук, улучшенное действие в отношении ручного мытья посуды или мытья посуды вручную, улучшенное действие в отношении автоматического мытья посуды, улучшенное действие в отношении стирки и/или улучшенная стабильность по сравнению с эталонным исходным ферментом клады AprL (например, ферментом AprL дикого типа, таким как протеаза AprL дикого типа со зрелой последовательностью под SEQ ID NO:2).
[0128] Продуктивные положения описывали как такие положения в молекуле, которые являются наиболее применимыми для получения комбинационных вариантов, обладающих улучшенной характеристикой, при этом положение как таковое предусматривает по меньшей мере одну комбинируемую мутацию. Комбинируемые мутации могут быть описаны как такие замены в молекуле, которые могут быть использованы для создания комбинационных вариантов. Комбинируемые мутации являются такими, которые улучшают по меньшей мере одно желаемое свойство молекулы, хотя и незначительно уменьшают либо экспрессию, активность либо стабильность.
[0129] Комбинируемые мутации являются такими, которые улучшают по меньшей мере одно желаемое свойство молекулы, хотя и незначительно уменьшают либо экспрессию, активность либо стабильность. Например, комбинируемые мутации в протеазе клады AprL можно определять с использованием значений индекса продуктивности (PI), полученных в результате анализов, описанных в примере 1: анализа протеаз (активности) с использованием N-suc-AAPF-pNA или диметилказеина (DMC), анализы с микрообразцами ткани EMPA-116, PAS-38 (активности), анализы стабильности и термостабильности в моющих средствах и определение белка (экспрессии).
[0130] Аминокислотные положения фермента, являющегося протеазой клады AprL, которые оказались пригодными положениями, могут содержать различные модификации, которые подходят для применения в моющей композиции. Модификации могут предусматривать вставку, делецию или замену в конкретном положении. В одном варианте осуществления модификацией является замена. В других вариантах осуществления встречающаяся в природе аминокислота заменена на не встречающуюся в природе аминокислоту, где исходным ферментом в случае вариантной протеазы клады AprL является фермент клады AprL дикого типа. В еще некоторых других вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит аминокислотную модификацию по сравнению с исходным ферментом субтилизином клады AprL, где вариантный фермент субтилизин клады AprL характеризуется улучшенными свойствами в отношении очистки по сравнению с исходным ферментом субтилизином клады AprL.
[0131] Для каждого положения большее число возможных приемлемых модификаций означает более высокий балл продуктивности конкретного положения. Например, аминокислотные положения могут содержать по меньшей мере 60%, 40% или 15% тестируемых модификаций в продуктивном положении в качестве подходящих модификаций, где модификация соответствует по меньшей мере одному из следующих критериев приемлемости:
[0132] a) положение, где минимальные PI по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза DMC, очистки микрообразца ткани PAS-38 при pH 9 или 10 и очистки микрообразца ткани EMPA-116 при pH 6, 8 или 10; и 3) стабильности в моющем средстве в условиях стресса составляют ≥ 0,9 и, кроме того, PI для любого из этих тестов должен составлять ≥ 1,0;
[0133] b) положение, где минимальный PI по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза DMC, очистки микрообразца ткани PAS-38 при pH 9 или 10 и очистки микрообразца ткани EMPA-116 при pH 6, 8 или 10; и 3) стабильности в моющем средстве в условиях стресса составляют ≥ и вплоть до 0,8 и, кроме того, PI для любого из этих тестов должен составлять ≥ 1,2; или
[0134] с) положение, где минимальный PI по сравнению с исходным ферментом субтилизином клады AprL для: 1) экспрессии; 2) по меньшей мере одного анализа протеазной активности, выбранного из анализа гидролиза N-suc-AAPF-pNA, гидролиза DMC, очистки микрообразца ткани PAS-38 при pH 9 или 10 и очистки микрообразца ткани EMPA-116 при pH 6, 8 или 10; и 3) стабильности в моющем средстве в условиях стресса составляют ≥ и вплоть до 0,5 и, кроме того, PI для любого из этих тестов должен составлять ≥ и вплоть до 1,5;
[0135] Положения в ферментах клады AprL по настоящему изобретению, которые предусматривают по меньшей мере 60% модификаций, тестируемых в качестве подходящих модификаций, включают положения 12, 15, 26, 27, 43, 45, 48, 52, 55, 57, 58, 60, 77, 78, 88, 96, 97, 98, 99, 102, 116, 117, 126, 127, 129, 132, 136, 143, 144, 160, 161, 165, 171, 210, 238, 239, 241, 247, и 274, где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. Подходящие модификаций включают 12 (K,A,C,F,G,H,L,M,N,Q,S,Y); 15 (K,A,C,E,F,H,I,M,N,R,S,T,V); 26 (V,A,C,E, H,I,M,N,Q,R,S,T); 27 (K,A,C,D,E,L,M,N,P,Q,R,T); 43 (N,A,C,F,G,H,I,K,L,M,Q,R,S,W,Y); 45 (V,A,C, D,E,F,G,I,K,M,N,P,Q,R,S,T,Y); 48 (A,C,D,E,F,H,I,K,M,N,Q,R,W,Y); 52 (A,C,D,E,F,G,H,K,L,M, N,P, Q,R,S,T,V,Y); 55 (A,C,D,E,F,G,H,I,M,N,P,Q,R,S,T,V); 57 (N,A,C,D,E,G,H,P,R,S,V,Y); 58 (T,C,D,F, H,I,K,L,M,P,R,S,V,W,Y); 60 (G,C,E,F,H,I,K,L,M,Q,R,T,Y); 77 (T,C,D,F,H,K,L,M,N,P,Q,R,S,W); 78 (T,C,D,G,I,L,N,Q,S,V,W,Y); 88 (S,A,E,F,G,L,M,N,Q,R,T,V,W,Y); 96 (N,A,C,D,E,G,H,I,K,L,M,Q,S,V, Y); 97 (S,A,C,D,F,G,H,I,K,M,N,P,Q,R,T,W,Y); 98 (S,A,D,E,F,H,K,L,N,P,R,T,V,Y); 99 (G,A,C,D,E,L, M,Q,S,T,V,W); 102 (S,A,D,E,F,G,K,L,N,P,Q,R,T); 116 (N,A,C,D,E,F,G,H,K,L,M,Q,R,S,T,V,Y); 117 (G,C,D,E,H,K,M,N,Q,R,T,V); 126 (G,A,C,E,H,I,K,M,N,Q,R,S,T,V,W,Y); 127 (G,A,D,E,F,I,L,M,Q,S,T, V,W,Y); 129 (S,C,E,F,H,I,M,N,Q,R,T,V,W,Y); 132 (T,A,C,D,E,F,H,I,K,L,M,N,P,Q,S,V,W,Y); 136 (Q,A,C,D,F,G,H,K,L,N,R,S,T,W); 143 (A,C,D,E,F,G,H,I,K,M,N,S,T,Y); 144 (R,A,C,D,E,F,G,H,L,M, N,Q,V,Y); 160 (N,A,C,D,G,I,K,M,P,R); 161 (T,A,C,D,E,I,K,L,M,Q,R,W); 165 (G,A,E,I,K,L,P,Q,R, S, T,Y); 171 (D,A,C,G,H,I,K,N,P,Q,S,T,V); 210 (T,C,D,E,F,H,I,M,N,P,V,Y); 238 (P,A,C,D,E,F,G,I,L,M, N,Q,R, S,T,W); 239 (N,A,C,D,E,H,I,K,L,M,S,T,V,Y); 241 (S,C,D,E,H,L,N,P,Q,T,V); 247 (N,A,D,E,F, H,I,L,M,Q,S,V,W,Y); и 274 (Q,A,C,D,E,F,G,H,I,L,N,S,T,V,W), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0136] Положения в ферментах клады AprL по настоящему изобретению, которые предусматривают по меньшей мере 40% но < 60% модификаций, тестируемых в качестве подходящих модификаций, включают положения 1, 9, 22, 24, 25, 53, 86, 89, 95, 100, 105, 108, 114, 115, 119, 125, 128, 140, 146, 155, 158, 187, 202, 203, 234, 237, 240, 243, 244, и 264, где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. Подходящие модификации включают 1 (A,D,E,F,G,N,Q,S,T,V); 9 (P,A,C,D,E,G,N,Q,S,T); 22 (K,A,F,M,Q,R,S,T,VY); 24 (A,C,D,E,G,N,Q,S, W); 25 (N,D,E,F,G,H,L,M,P,Q,R,S); 53 (G,C,D,E,H,K,N,Q,R); 86 (S,C,E,H,K, L,N,R); 89 (L,A,C,F,G,I, M,N,S,V); 95 (L,A,F,G,I,M,Q,S,V); 100 (S,C,F,G,M,N,R,T,Y); 105 (G,A,C, D,I,M,N,R,S,T); 108 (S,E, F,G,H,K,L,N,Q,R,Y); 114 (T,A,C,D,F,I,K,L,N,Q,S,V); 115 (T,D,E,F,H,I,K, Q,S,W); 119 (D,A,E,F,G,H, M,Q,S); 125 (L,A,E,F,I,N,S,V,Y); 128 (A,C,D,E,H,K,N,P,Q,R,S,T); 140 (N,C,D,F,G,H,M,R,T,V); 146 (V,A,E,H,I,K,L,N,Q,S,T); 155 (S,A,D,E,F,G,H,K,N,Q,R,W); 158 (S,A,D, E,I,K,N,Q,R); 187 (S,A,C, D, E,H,K,P,Q,W); 202 (A,C,D,E,I,K,L,M,Q,S,T,V); 203 (G,A,C,E,H,K,M,N, Q,R,S); 234 (L,E,F,H,Q,S, W,Y); 237 (H,A,C,D,G,I,M,N,Q,S); 240 (L,A,D,E,F,I,M,N,Q,T); 243 (S,C,E, F,I,N,Q,T,V,W); 244 (Q, A,C,D,E,G,H,I,N,R,S,V); и 264 (K,A,C,D,H,M,Q,R,S,Y), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0137] Положения в ферментах клады AprL по настоящему изобретению, которые предусматривают по меньшей мере 15% но < 40% модификаций, тестируемых в качестве подходящих модификаций, включают положения 2, 3, 10, 18, 19, 28, 29, 31, 35, 37, 38, 40, 44, 46, 50, 54, 56, 61, 67, 68, 71, 87, 90, 91, 92, 101, 103, 104, 113, 118, 120, 123, 130, 131, 133, 139, 145, 147, 148, 181, 182, 184, 193, 205, 211, 212, 214, 216, 217, 221, 235, 242, 245, 248, 251, 258, 259 и 268, где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. Подходящие модификации включают 2 (Q,A,I,N); 3 (T,E,I,Q,V); 10 (L,F,M,Q); 18 (A,C,D,E,S); 19 (Q,A,D,E,G,M); 28 (V,A,C,S); 29 (A,C,S,T,V); 31 (L,C,I,V); 35 (I,A,C,G,M,S,T,V); 37 (A,E,G,S); 38 (S,A,C,E,G,N,T); 40 (P,A,C,D,E,M, V); 44 (V,C,E,P,S,T); 46 (G,A,C,D,W); 50 (F,H,K,M,Q,R,V,Y); 54 (E,Q,R,T); 56 (Y,C,E, F,H,P); 61 (N, A,D,F,H,K,Q); 67 (V,M,N,Q); 68 (A,C,G,N,S,T); 71 (V,A,G,L,S); 87 (V,C,G,S,T); 90 (Y,A,C,F,H,N, V); 91 (A,G,M,P,V); 92 (V,A,C,I,T); 101 (G,A,C,N,S,T); 103 (Y,A,F,I,L,M,V,W); 104 (S,A, D,E); 113 (A,C,G,S); 118 (M,F,H,P,Q); 120 (V,A,C,I,S,T); 123 (M,C,I,L,N,Q,S); 130 (G,D,E,H,S); 131 (S,D,R,T); 133 (A,G,M,P,S,T,V); 139 (D,G,K,N,S,T); 145 (G,D,N,S); 147 (V,A,L,M,N); 148 (V,A,C,F, M,Q,S); 181 (S,A,C,D,H,Q); 182 (N,C,D,E,Q); 184 (N,C,E,H,M,Q); 193 (A,D,P,Q,R); 205 (Y,C,E,F,I, M,V); 211 (N,C,E,S); 212 (T,A,D,S); 214 (A,E,H,L,T); 216 (L,A,C,H,K,M); 217 (N,C,E,S); 221 (M,C, H,K); 235 (S,C,D,E,G); 242 (A,E,G,N,S); 245 (V,A,C,I,T); 248 (R,A,N,Q,S); 251 (S,A,C,E,G,N); 258 (S,C,D,E,H, P); 259 (S,E,P,Q); и 268 (N,D,E,Q), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. Для каждого из представленных выше наборов мутаций замена, указанная первой, представляет собой естественную аминокислоту для AprL (SEQ ID NO:2). В некоторых вариантах осуществления настоящего изобретения вариант представляет собой вариант клады AprL, где мутация представляет собой любую из перечисленных выше наборов, за исключением замены, указанной первой.
[0138] Положения в ферментах клады AprL по настоящему изобретению, которые предусматривают по меньшей мере одну модификацию, но < 15% модификаций, тестируемых в качестве подходящих модификаций, включают положения 4, 17, 21, 30, 33, 36, 47, 49, 51, 62, 66, 72, 74, 75, 76, 93, 106, 107, 110, 111, 112, 121, 134, 135, 137, 138, 141, 149, 151, 156, 157, 159, 163, 169, 175, 183, 186, 188, 191, 204, 207, 208, 209, 215, 223, 224, 227, 229, 230, 231, 232, 233, 236, 249, 250, 254, 255, 260, 267, 269, 271, и 273, где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. Подходящие модификации включают 4 (V,I); 17 (Q,H,M); 21 (F,Y); 30 (V,C,T); 33 (T,C,M); 36 (Q,E,H); 47 (G,A,M); 49 (S,I,T); 51 (V,C,I); 62 (G,S); 66 (H,R); 72 (A,G,S); 74 (L,G); 75 (D,C,E); 76 (N,K); 93 (K,D); 106 (I,G,M); 107 (V,F,I); 110 (I,F); 111 (E,D,Q); 112 (W,A); 121 (I,L,M); 134 (M, L); 135 (K,E,H); 137 (A,S); 138 (V,C,S); 141 (A,S); 149 (V,C); 151 (A,G,P); 156 (G,E); 157 (S,D, R); 159 (G,A,F); 163 (T,E); 169 (K,R); 175 (A,C); 183 (S,A,G); 186 (A,C); 188 (F,W); 191 (V,C); 204 (V,I); 207 (T,C); 208 (Y,F); 209 (P,S); 215 (T,C,V); 223 (S,A,C); 224 (P,A); 227 (A,S); 229 (A,G, S); 230 (A, G); 231 (A,C); 232 (L,Q); 233 (I,V); 236 (K,A); 249 (L,I,M); 250 (S,A,G); 254 (T, D); 255 (Y,C,E); 260 (F,C,W); 267 (I,C); 269 (V,A,C); 271 (A,D,E); и 273 (A,S), где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0139] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из A001C, A001D, A024E, A024G, A048C, A048D, A048K, A048N, A052F, A052M, A052V, A052Y, A055C, A072G, A091G, A113C, A128P, A128Q, A133G, A133S, A133T, A143E, A143F, A143H, A143N, A143S, A143W, A193D, A202C, A202D, A202E, A202Q, A227S, D119F, D119S, D119Y, G053C, G053E, G053N, G053Q, G060L, G060Y, G099A, G099T, G101A, G117D, G117V, G127A, G127S, G127T, G130D, G130H, G203A, G203C, G203E, G203M, H237I, I035A, I035C, I035M, I035T, I121L, K012N, K015M, K027C, K027L, K027M, K027R, K264A, K264S, L010M, L095F, L125V, L234Q, L240N, L249I, M123C, M123I, M123L, N025F, N025G, N025L, N025S, N057C, N061A, N076G, N096D, N096G, N116A, N116C, N116L, N116Y, N140A, N160C, N182C, N182D, N184C, N211S, N247F, N247H, N247I, N247L, N247Q, N247S, N247V, N247W, N247Y, P009E, P009T, P238A, P238C, P238D, P238F, P238I, P238R, Q017H, Q136A, Q136C, Q136F, Q136H, Q136K, Q136L, R144F, R144L, R248K, S086R, S088N, S088Y, S097G, S097H, S097Y, S098H, S098L, S100L, S102D, S102E, S102G, S102K, S129E, S129H, S155A, S155D, S155E, S155H, S157D, S158I, S158Q, S181A, S181Q, S183G, S241R, S241T, S243I, S243N, S243T, S243V, S243Y, S251E, S258C, S258D, S258P, T058C, T058D, T058F, T058I, T077C, T077F, T077L, T077M, T078Q, T132A, T132Q, T132V, T132Y, T161Q, T210I, T215C, V026Q, V026R, V026T, V028A, V028C, V045I, V071A, V071L, V120A, V120C, V120I, V146A, V146H, V146K, V147L, V149C, Y056H, и Y255C, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной очисткой с помощью ADW. В других вариантах осуществления улучшенная очистка с помощью ADW характеризуется (i) PI > 1,1 для очистки с помощью ADW или (ii) PI > 1,1 для очистки с помощью ADW с одним или несколькими из PI > 0,8 для очистки с помощью HDL при pH 6, PI > 0,8 для очистки с помощью HDL при pH 8, PI > 0,8 для очистки с помощью HDD, PI > 0,8 для экспрессии или PI > 0,8 для стабильности.
[0140] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из A029T, A048K, A048R, A052F, A052R, A068G, A113C, D119H, E111Q, G099A, G099S, G127A, G127T, G165A, K012G, K012H, K027C, K027E, K027M, L095F, L125I, L125V, L240Q, N025F, N025G, N025L, N043R, N116R, N140R, N160C, N184C, N239K, P238C, P238I, P238M, Q136F, Q136H, Q136K, Q136R, Q136W, S098F, S098H, S104A, S158Q, S241R, V045R, и Y103M, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной очисткой с помощью HDD по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления улучшенная очистка с помощью HDD характеризуется (i) PI > 1,1 для очистки с помощью HDD или (ii) PI > 1,1 для очистки с помощью HDD с одним или несколькими из PI > 0,8 для очистки с помощью HDL при pH 6, PI > 0,8 для очистки с помощью HDL при pH 8, PI > 0,8 для очистки с помощью ADW, PI > 0,8 для экспрессии или PI > 0,8 для стабильности.
[0141] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из A001C, A048R, A052F, G099S, G099T, G101A, G127F, G127I, G127M, G127Q, G127T, G127V, I121M, L010M, L095A, L095F, L095Q, L095S, L125I, L125V, M123C, M123I, N025F, N025S, N116C, N140R, N184C, P238C, P238D, P238I, P238M, P238N, Q136A, S098F, S098H, S102D, S158Q, S241R, T077C, T077F, T215C, V026I, V026Q, V045R, и V149C, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной очисткой HDL при pH 8 по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления улучшенная очистка с помощью HDL при pH 8 характеризуется (i) PI > 1,1 для очистки с помощью HDL при pH 8 или (ii) PI > 1,1 для очистки с помощью HDL при pH 8 с одним или несколькими из PI > 0,8 для очистки с помощью HDD, PI > 0,8 для очистки с помощью HDL при pH 6, PI > 0,8 для очистки с помощью ADW, PI > 0,8 для экспрессии или PI > 0,8 для стабильности.
[0142] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из A001C, A024E, A128D, G053C, G099T, G101A, G101N, G165E, G203C, L095Q, L095S, L125S, N061E, N116C, N184C, S098D, S102D, S102E, S104D, S129E, S155D, S158E, и V026T, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной способностью к очистке HDL при pH 6 по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления улучшенная очистка с помощью HDL при pH 6 характеризуется (i) PI > 1,1 для очистки с помощью HDL при pH 6 или (ii) PI > 1,1 для очистки с помощью HDL при pH 6 с одним или несколькими из PI > 0,8 для очистки с помощью HDD, PI > 0,8 для очистки с помощью HDL при pH 8, PI > 0,8 для очистки с помощью ADW, PI > 0,8 для экспрессии или PI > 0,8 для стабильности.
[0143] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из A001C, A001D, A001E, A001Q, A001S, L010M, L010Q, S100G, S102K, S102R, Y103F, Y103M, S104D, G105M, G105R, S108F, S108H, S108K, S108R, E111Q, T114D, T115D, T115E, T115F, T115K, T115Q, N116E, K012C, K012F, K012H, K012M, K012N, K012Q, K012Y, V120S, M123C, M123I, L125I, G127A, G127D, G127I, G127M, G127S, G127T, G127V, A128E, A128H, A128K, A128P, A128R, A128S, A128T, S129H, S129Q, S129R, S129T, S129V, T132C, T132D, T132E, T132K, T132N, T132P, Q136A, Q136C, Q136K, Q136R, V138C, A143D, A143N, G145S, V147L, V148A, V148C, V148M, V148Q, K015A, K015C, K015E, K015I, K015M, K015S, K015T, K015V, S155D, S155F, S155K, S155N, S155R, S157D, S158D, S158I, S158K, S158R, N160C, N160D, N160I, N160M, N160R, T161C, T161D, T161E, T161K, T161Q, T161R, G165A, G165E, G165Q, G165R, G165S, Q017H, A018D, A018E, S181Q, N182D, S183A, S183G, N184C, N184E, N184Q, A186C, S187D, S187E, S187P, Q019D, Q019E, A193D, A193R, A202D, A202E, A202K, A202Q, A202V, G203A, G203C, G203E, G203N, G203Q, Y205E, T210C, T210E, T210I, T210P, T210V, A214E, T215C, L216C, L216H, L216K, L216M, N217S, L234E, L234F, L234Q, L234S, S235D, S235E, P238T, N239A, N239D, N239H, N239M, N239S, N239T, A024E, A024Q, L240D, S241E, S241N, S241Q, S241V, A242G, A242N, S243E, S243Q, S243V, Q244C, Q244E, V245A, V245C, V245T, N247D, N247W, N025D, N025G, N025Q, S250G, S251E, S258C, S258D, S258E, S258H, S258P, S259E, S259P, S259Q, V026A, V026C, V026E, V026H, V026Q, V026R, F260W, K264A, K264C, K264D, K264H, K264M, K264Q, K264S, K264Y, I267C, N268D, N268E, N268Q, V269C, K027C, K027D, K027E, K027M, K027P, A271E, Q274A, Q274C, Q274D, Q274E, Q274G, A029S, T003E, T003I, T003Q, T003V, V030C, I035A, I035S, I035T, I035V, S038T, N043A, N043C, N043F, N043H, N043Q, V044P, V045A, V045C, V045D, V045E, V045F, V045G, V045M, V045N, V045Q, V045R, V045S, V045T, G046D, A048N, A048W, F050H, V051I, A052F, A052G, A052K, A052N, A052P, A052R, A052V, G053N, G053R, A055C, A055D, A055E, A055G, A055H, A055N, A055S, A055V, N057C, N057E, N057G, N057V, T058C, T058I, T058K, T058W, A068C, A068N, A068S, V071A, L074G, D075E, N076K, T077C, T077D, T077H, T077M, T077N, T077P, T077Q, T077S, T078D, T078I, T078V, S086E, S086H, S086R, V087C, V087G, V087S, V087T, S088E, S088N, S088R, L089N, P009C, P009D, P009E, P009N, P009T, L095A, L095V, N096S, S098K, S098R, и G099Q, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной стабильностью по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления улучшенная стабильность характеризуется (i) PI > 1,2 для стабильности или (ii) PI > 1,2 для стабильности с одним или несколькими из PI > 0,8 для очистки с помощью HDD, PI> 0,8 для очистки с помощью HDL при pH 6 или pH 8, PI > 0,8 для очистки с помощью ADW или PI > 0,8 для экспрессии.
[0144] В еще одних дополнительных вариантах осуществления PI для стабильности измерен в соответствии с анализом стабильности из примера 1, PI для очистки с помощью HDD измерен в соответствии с анализом очистки с помощью HDD из примера 1, PI для очистки с помощью HDL измерен в соответствии с анализом очистки HDL из примера 1, PI для очистки с помощью ADW измерен в соответствии с анализом очистки с помощью ADW из примера 1 и/или PI для экспрессии измерен в соответствии с анализом по определению белка из примера 1.
[0145] В некоторых вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из P009E, S038G, V045R, A052V, T077Q, A091G, S098R, M123I, T132N, T132S, A133S, Q136A, Q136S, G145S, N160R, G165Q, P238R, N239K, A242N, S243Q, S243T, S258E и Q274F, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной способностью к удалению грязи по сравнению с исходным ферментом субтилизином клады AprL. В других вариантах осуществления вариантный фермент субтилизин клады AprL или его активный фрагмент содержит одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клады AprL, где модификация находится в продуктивном положении вариантного фермента субтилизина клады AprL, выбранном из группы, состоящей из P009E, V045R, A052V, T077Q, S098R, M123I, T132N, Q136A, G145S, N160R, G165Q, A242N, S243Q и S258E, где аминокислотные положения вариантного субтилизина клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2. В некоторых вариантах осуществления элементы списка, представленного выше, характеризуются улучшенной способностью к удалению грязи по сравнению с исходным ферментом субтилизином клады AprL.
Полипептиды по настоящему изобретению
[0146] В настоящем изобретении предусмотрены новые полипептиды, которые вместе могут называться "полипептидами по настоящему изобретению". Полипептиды по настоящему изобретению включают выделенные, рекомбинантные, практически чистые или не встречающиеся в природе вариантные и недавно обнаруженные полипептиды ферментов клады AprL, включая, например, вариантные полипептиды ферментов клады AprL, обладающие ферментативной активностью (например, протеазной активностью). В некоторых вариантах осуществления полипептиды по настоящему изобретению пригодны в применениях для очистки и могут быть включены в чистящие композиции, которые пригодны в способах очистки предмета или поверхности (например, поверхности предмета), нуждающихся в очистке.
[0147] В некоторых вариантах осуществления вариант фермента клады AprL может быть вариантом исходного фермента клады AprL из рода Bacillus. Различные ферменты клады AprL были найдены у представителей рода Bacillus, которые характеризуются высокой идентичностью друг с другом и со зрелым ферментом из AprL, как показано в SEQ ID NO:2. См., например, таблицы 8 и 9 и фигуру 2 в примере 4, фигуру 3 в примере 6, и фигуру 9 в примере 12. В различных вариантах осуществления вариант фермента клады AprL может быть вариантом исходного фермента клады AprL из любого из видов, описанных в таблице 8 или 9 или на фигурах 2, 3 или 9.
[0148] В некоторых вариантах осуществления вариант фермента клады AprL может быть вариантом, характеризующимся 50, 60, 70, 80, 90, 95, 96, 97, 98, 99 или 100% идентичностью с ферментом клады AprL, описанным в таблице 8 или 9 или на фигурах 2, 3 или 9; например, протеазой AprL с SEQ ID NO:2 или SEQ ID NO:9.
[0149] Описываются композиции и способы, относящиеся к ферментам клады AprL. Композиции и способы основаны, частично, на наблюдении того, что клонированный и экспрессированный AprL обладает протеолитической активностью в присутствии моющей композиции. AprL также демонстрирует хорошую стабильность в моющих композициях. Эти особенности AprL делают его весьма приемлемым для использования в ряде применений для очистки, при этом фермент может гидролизовать белки в присутствии поверхностно-активных веществ и других компонентов, находящихся в моющих композициях.
[0150] В одном аспекте композиции и способы по настоящему изобретению предусматривают вариантный полипептид клады AprL. Зрелый полипептид клады AprL имеет аминокислотную последовательность под SEQ ID NO:2. Подобным образом в значительной степени идентичные полипептиды клады AprL могут встречаться в природе, например, в других штаммах и изолятах. Эти и другие полипептиды рекомбинантного AprL охвачены композициями и способами в соответствии с настоящим изобретением.
[0151] В некоторых вариантах осуществления настоящее изобретение включает выделенный, рекомбинантный, практически чистый или не встречающиеся в природе вариантный фермент клады AprL, обладающий протеазной активностью, полипептид которого содержит полипептидную последовательность, характеризующуюся по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, по меньшей мере приблизительно 99,5% или 100% идентичностью последовательности с исходным ферментом клады AprL, предусмотренным в данном документе.
[0152] В некоторых вариантах осуществления вариантным полипептидом является вариант, характеризующийся определенной степенью гомологии аминокислотной последовательности по отношению к полипептиду клады AprL, например, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или даже по меньшей мере 99% гомологией последовательности по отношению к аминокислотной последовательности под SEQ ID NO:2 Гомология может быть определена путем выравнивания аминокислотных последовательностей, например, с использованием программы, такой как BLAST, ALIGN или CLUSTAL, которые описаны в данном документе.
[0153] Также предусмотрена выделенная, рекомбинантная, практически чистая или не встречающаяся в природе последовательность, которая кодирует вариантный фермент клады AprL, обладающий протеазной активностью, при этом указанный вариантный фермент клады AprL (например, вариантный AprL), содержащий аминокислотную последовательность, которая отличается от аминокислотной последовательности под SEQ ID NO:2 не более чем на 50, не более чем на 40, не более чем на 30, не более чем на 35, не более чем на 25, не более чем на 20, не более чем на 19, не более чем на 18, не более чем на 17, не более чем на 16, не более чем на 15, не более чем на 14, не более чем на 13, не более чем на 12, не более чем на 11, не более чем на 10, не более чем на 9, не более чем на 8, не более чем на 7, не более чем на 6, не более чем на 5, не более чем на 4, не более чем на 3, не более чем на 2 или не более чем на 1 аминокислотный остаток(аминокислотные остатки), где аминокислотные положения вариантного фермента клады AprL пронумерованы в соответствии с нумерацией соответствующих аминокислотных положений в аминокислотной последовательности AprL, показанной в SEQ ID NO:2, что определяют путем выравнивания аминокислотной последовательности вариантного фермента клады AprL с аминокислотной последовательностью AprL.
[0154] Как отмечалось выше, полипептиды вариантного фермента клады AprL по настоящему изобретению обладают ферментативными активностями (например, протеолитическими активностями) и, таким образом, пригодны в применениях для очистки, в том числе без ограничения способах очистки предметов столовой посуды, предметов столовой утвари, тканей и предметов, имеющих твердые поверхности (например, твердой поверхности стола, столешницы, стены, предмета мебели, пола, потолка и т.д.). Ниже описаны типичные чистящие композиции, содержащие один или несколько полипептидов вариантного фермента клады AprL по настоящему изобретению. Ферментативную активность (например, активность фермента клады AprL) вариантного полипептида фермента клады AprL по настоящему изобретению, можно легко определить с применением процедур, хорошо известных рядовым специалистам в данной области техники. В представленных ниже примерах описаны способы оценки ферментативной активности, очищающего действия, стабильности в моющем средстве и/или термостойкости. Действие вариантных ферментов клады AprL по настоящему изобретению при удалении пятен (например, белкового пятна), очистке твердых поверхностей или очистке белья для стирки, предмета(предметов) столовой посуды или предмета(предметов) столовой утвари можно легко определить с использованием процедур, хорошо известных в уровне техники и/или с использованием процедур, изложенных в примерах.
[0155] Полипептид по настоящему изобретению может быть подвергнут различным изменениям, таким как одна или несколько аминокислотных вставок, делеций и/или замен либо консервативных, либо неконсервативных, включая случаи, при которых такие изменения по сути не изменяют ферментативную активность полипептида. Аналогично, нуклеиновая кислота по настоящему изобретению может быть подвергнута различным изменениям, таким как одна или несколько замен в одной или нескольких нуклеиновых кислотах в одном или нескольких кодонах, так, чтобы конкретный кодон кодировал такую же или иную аминокислоту, приводя либо к молчащей вариации (например, мутация в нуклеотидной последовательности приводит к молчащей мутации в аминокислотной последовательности, например, когда кодируемая аминокислота не изменяется мутацией нуклеиновой кислоты), либо немолчащей вариации, одной или нескольким делециям в одной или нескольких нуклеиновых кислотах (или кодонах) в последовательности, одной или нескольким присоединениям или вставкам в одной или нескольких нуклеиновых кислотах (или кодонах) в последовательности и/или расщеплению или одному или нескольким усечениям одной или нескольких нуклеиновых кислот (или кодонов) в последовательности. Многие такие изменения в последовательности нуклеиновой кислоты могут по сути не изменять ферментативную активность получаемого в результате кодируемого вариантного фермента клады AprL по сравнению с вариантным ферментом клады AprL, кодируемым первоначальной последовательностью нуклеиновой кислоты. Нуклеиновую кислоту в соответствии с настоящим изобретением также можно модифицировать для включения одного или нескольких кодонов, которые обеспечивают оптимальную экспрессию в системе экспрессии (например, бактериальная система экспрессии), при этом, при необходимости, указанный один или несколько кодонов продолжают кодировать одинаковую аминокислоту(аминокислоты).
[0156] В некоторых вариантах осуществления настоящее изобретение предусматривает класс полипептидов, содержащий полипептиды вариантного фермента клады AprL с желаемой ферментативной активностью (например, активностью фермента клады AprL или активностью в отношении очищающего действия), которые содержат последовательности с аминокислотными заменами, описанными в данном документе, а также которые содержат одну или несколько дополнительных аминокислотных замен, таких как консервативные и неконсервативные замены, при этом полипептид проявляет, сохраняет или практически сохраняет желаемую ферментативную активность (например, активность фермента клады AprL или протеолитическую активность, отражающуюся в очищающих активности или действии вариантного фермента клады AprL). Аминокислотные замены в соответствии с настоящим изобретением могут включать без ограничений одну или несколько неконсервативных замен и/или одну или несколько консервативных аминокислотных замен. Консервативная замена аминокислотных остатков, как правило, включает обмен члена в одном функциональном классе аминокислотных остатков на остаток, который принадлежит к тому же функциональному классу (идентичные аминокислотные остатки считаются функционально гомологичными или консервативными при вычислении процентной функциональной гомологи). Консервативная аминокислотная замена, как правило, включает замену аминокислоты в аминокислотной последовательности функционально сходной аминокислотой. Например, функционально сходны аланин, глицин, серин и треонин и поэтому могут служить в качестве консервативных аминокислотных замен друг для друга. Аспарагиновая кислота и глутаминовая кислота могут служить в качестве консервативных замен друг для друга. Аспарагин и глутамин могут служить в качестве консервативных замен друг для друга. Аргинин, лизин и гистидин могут служить в качестве консервативных замен друг для друга. Изолейцин, лейцин, метионин и валин могут служить в качестве консервативных замен друг для друга. Фенилаланин, тирозин и триптофан могут служить в качестве консервативных замен друг для друга.
[0157] Можно предположить другие группы консервативных аминокислотных замен. Например, аминокислоты могут быть сгруппированы по сходной функции или химическим структуре или составу (например, кислотные, основные, алифатические, ароматические, серосодержащие). Например, алифатическая группа может содержать: глицин (G), аланин (A), валин (V), лейцин (L), изолейцин (I). Другие группы, включающие аминокислоты, которые считаются консервативными заменами для другой аминокислоты, включают в себя ароматические: фенилаланин (F), тирозин (Y), триптофан (W); серосодержащие: метионин (M), цистеин (C); основные: аргинин (R), лизин (K), гистидин (H); кислотные: аспарагиновая кислота (D), глутаминовая кислота (E); неполярные незаряженные остатки, цистеин (C), метионин (M) и пролин (P); гидрофильные незаряженные остатки: серин (S), треонин (T), аспарагин (N) и глутамин (Q). Дополнительные группы аминокислот хорошо известны специалистам в данной области и описаны в различных стандартных руководствах. Перечень полипептидных последовательностей в данном документе вместе с вышеуказанными группами замен предоставляет недвусмысленный перечень всех полипептидных последовательностей с консервативными заменами.
[0158] В пределах описанных выше классов аминокислотных остатков существуют более консервативные замены, которые так или иначе могут быть пригодны. Консервативные группы для замещения, которые представляют собой более консервативные, включают в себя валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин.
[0159] Консервативно замещенные вариации полипептидной последовательности по настоящему изобретению (например, вариантные протеазы по настоящему изобретению) характеризуются небольшим процентным содержанием замен, иногда менее 25%, 20%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7% или 6% аминокислот полипептидной последовательности, или менее 5%, 4%, 3%, 2% или 1%, или менее 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотной замены аминокислот полипептидной последовательности консервативно выбранной аминокислотой из той же группы консервативной замены.
[0160] Как описано в других частях данного документа более детально и представлено в примерах в данном документе, полипептиды по настоящему изобретению могут обладать очищающей способностью, которую можно сравнить с известными протеазами, включая известные сериновые протеазы. В некоторых вариантах осуществления вариант протеазы содержит одну или несколько мутаций и имеет общий суммарный заряд -5, -4, -3, -2, -1, 0, 1, 2, 3, 4 или 5 по сравнению с AprL (SEQ ID NO:2). В некоторых вариантах осуществления в настоящем изобретении предусмотрена выделенная, рекомбинантная, практически чистая или не встречающаяся в природе вариантная протеаза (например, вариантная AprL), обладающая протеолитической активностью, при этом указанная вариантная протеаза содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности, показанной в SEQ ID NO:2, 9, 12, 13, 14, 15 или 16, не более чем на 50, не более чем на 45, не более чем на 40, не более чем на 35, не более чем на 30, не более чем на 25, не более чем на 20, не более чем на 19, не более чем на 18, не более чем на 17, не более чем на 16, не более чем на 15, не более чем на 14, не более чем на 13, не более чем на 12, не более чем на 11, не более чем на 10, не более чем на 9 или не более чем на 8 аминокислотных остатков, где аминокислотные положения пронумерованы в соответствии с нумерацией соответствующих аминокислотных положений в аминокислотной последовательности протеазы AprL, показанной в SEQ ID NO:2, что определяют путем выравнивания вариантной аминокислотной последовательности протеазы с аминокислотной последовательностью AprL.
Нуклеиновые кислоты по настоящему изобретению
[0161] В настоящем изобретении предусмотрены выделенные, не встречающиеся в природе или рекомбинантные нуклеиновые кислоты (также называемые в данном документе "полинуклеотидами"), которые вместе могут называться "нуклеиновыми кислотами в соответствии с настоящим изобретением" или "полинуклеотидами в соответствии с настоящим изобретением", которые кодируют полипептиды в соответствии с настоящим изобретением. Нуклеиновые кислоты в соответствии с настоящим изобретением, в том числе все описанные ниже, применимы для рекомбинантного продуцирования (например, экспрессии) полипептидов в соответствии с настоящим изобретением, как правило, посредством экспрессии плазмидного вектора экспрессии, содержащего последовательность, кодирующую представляющий интерес полипептид или его фрагмент. Как обсуждалось выше, полипептиды включают вариантные полипептиды протеазы, включая вариантные полипептиды клады AprL, обладающие ферментативной активностью (например, протеолитической активностью), которые являются пригодными в применениях для очистки и чистящих композициях, предназначенных для очистки предмета или поверхности (например, поверхности предмета), нуждающихся в очистке.
[0162] В некоторых вариантах осуществления в настоящем изобретении предусмотрена выделенная, рекомбинантная, практически чистая или не встречающаяся в природе нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую любой полипептид (в том числе любой белок слияния и т.д.) в соответствии с настоящим изобретением, описанный выше в разделе под названием "Полипептиды в соответствии с настоящим изобретением" и в других местах данного документа. В настоящем изобретении также предусмотрена выделенная, рекомбинантная, практически чистая или не встречающаяся в природе нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую комбинацию двух или более из любых полипептидов в соответствии с настоящим изобретением, описанных выше и в других местах данного документа.
[0163] В некоторых вариантах осуществления настоящее изобретение включает полинуклеотид, кодирующий выделенный, рекомбинантный, практически чистый или не встречающийся в природе вариантный фермент клады AprL, обладающий протеазной активностью, при этом полинуклеотид содержит полинуклеотидную последовательность, характеризующуюся по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, по меньшей мере приблизительно 99,5% или 100% идентичностью последовательности с нуклеотидной последовательностью исходного фермента клады AprL, предусмотренной в данном документе.
[0164] Другие варианты осуществления относятся к полинуклеотиду, содержащему последовательность нуклеиновой кислоты: (i) кодирующую аминокислотную последовательность, характеризующуюся по меньшей мере 99% идентичностью с SEQ ID NO:9; (ii) кодирующую аминокислотную последовательность под SEQ ID NO:9; (iii) кодирующую аминокислотную последовательность под SEQ ID NO: 45, 46, 47, 48, 49, 50, 51 или 52 и дополнительно кодирующую аминокислотную последовательность, характеризующуюся по меньшей мере 99% идентичностью с SEQ ID NO:9; (iv) кодирующую аминокислотную последовательность под SEQ ID NO: 45, 46, 47, 48, 49, 50, 51 или 52 и дополнительно кодирующую аминокислотную последовательность SEQ ID NO:9; (v), характеризующуюся по меньшей мере 99% идентичностью с SEQ ID NO:1 или SEQ ID NO:7; и (vi), комплементарную SEQ ID NO:1 или SEQ ID NO:7.
[0165] В некоторых вариантах осуществления настоящее изобретение включает полинуклеотид, кодирующий выделенный, рекомбинантный, практически чистый или не встречающийся в природе вариантный фермент клады AprL, обладающий протеазной активностью, полипептид которого содержит полипептидную последовательность, характеризующуюся по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, по меньшей мере приблизительно 99,5% или 100% идентичностью последовательности с полипептидной последовательностью исходного фермента клады AprL, предусмотренной в данном документе.
[0166] В некоторых вариантах осуществления вариантным полипептидом является вариант, характеризующийся определенной степенью гомологии аминокислотной последовательности по отношению к полипептиду клады AprL, например, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или даже по меньшей мере 99% гомологией последовательности по отношению к аминокислотной последовательности под SEQ ID NO: 2, 9, 12, 13, 14, 15 или 16. Гомология может быть определена путем выравнивания аминокислотных последовательностей, например, с использованием программы, такой как BLAST, ALIGN или CLUSTAL, которые описаны в данном документе.
[0167] Также предусмотрена выделенная, рекомбинантная, практически чистая или не встречающаяся в природе нуклеиновая кислота, содержащая полинуклеотидную последовательность, которая кодирует вариантную протеазу, обладающую протеолитической активностью, при этом указанная вариантная протеаза (например, вариантная AprL) содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности под SEQ ID NO:2, 9, 12, 13, 14, 15 или 16 не более чем на 50, не более чем на 40, не более чем на 30, не более чем на 35, не более чем на 25, не более чем на 20, не более чем на 19, не более чем на 18, не более чем на 17, не более чем на 16, не более чем на 15, не более чем на 14, не более чем на 13, не более чем на 12, не более чем на 11, не более чем на 10, не более чем на 9, не более чем на 8, не более чем на 7, не более чем на 6, не более чем на 5, не более чем на 4, не более чем на 3, не более чем на 2 или не более чем на 1 аминокислотный остаток(аминокислотные остатки), где аминокислотные положения вариантного фермента протеаза клады AprL пронумерованы в соответствии с нумерацией соответствующих аминокислотных положений в аминокислотной последовательности AprL, показанной в SEQ ID NO:2, что определяют путем выравнивания вариантной аминокислотной последовательности протеазы с аминокислотной последовательностью AprL.
[0168] В настоящем изобретением предусмотрены нуклеиновые кислоты, кодирующие вариант клады AprL, такой как протеаза AprL, изложенные в аминокислотной последовательности SEQ ID NO:2, где вариант клады AprL представляет собой зрелую форму, обладающую протеолитической активностью, и содержит аминокислотную последовательность, содержащую комбинацию аминокислотных замен, приведенных в описании, где аминокислотные положения варианта клады AprL пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2.
[0169] Нуклеиновые кислоты в соответствии с настоящим изобретением могут быть созданы с использованием любых приемлемых методик синтеза, манипуляции и/или выделения или их комбинаций. Например, полинуклеотид в соответствии с настоящим изобретением может быть получен с использованием стандартных методик синтеза нуклеиновых кислот, таких как методики синтеза в твердой фазе, хорошо известные специалистам в данной области. В таких методиках, как правило, синтезируют фрагменты до 50 или более нуклеотидных оснований, затем соединяют (например, способами ферментативного или химического лигирования или способами опосредованной полимеразой рекомбинации) с образованием практически любой желаемой непрерывной последовательности нуклеиновой кислоты. Синтез нуклеиновых кислот в соответствии с настоящим изобретением также можно упростить (или альтернативно выполнить) любым приемлемым способом, известным в уровне техники, в том числе без ограничения химическим синтезом с использованием классического способа фосфороамидирования (см., например, Beaucage et al. Tetrahedron Letters 22:1859-69 [1981]); или способа, описанного Matthes et al. (см. Matthes et al., EMBO J. 3:801-805 [1984], как обычно практикуется при способах автоматизированного синтеза. Нуклеиновые кислоты в соответствии с настоящим изобретением также могут быть получены с использованием автоматизированного синтезатора ДНК. Индивидуализированные нуклеиновые кислоты могут быть получены из ряда коммерческих источников (например, от The Midland Certified Reagent Company, Great American Gene Company, Operon Technologies Inc. и DNA2.0). Другие методики для синтеза нуклеиновых кислот и связанные с ними принципы известны в данной области техники (см., например, Itakura et al., Ann. Rev. Biochem. 53:323 [1984]; и Itakura et al., Science 198:1056 [1984]).
[0170] Как указано выше, методики рекомбинантной ДНК, применимые для модификации нуклеиновых кислот, хорошо известны в данной области техники. Например, известны и широко используются специалистами в данной области методики, такие как расщепление рестрикционной эндонуклеазой, лигирование, обратная транскрипция и продуцирование кДНК и полимеразная цепная реакция (например, ПЦР). Нуклеотиды в соответствии с настоящим изобретением также можно получать путем скрининга библиотек кДНК (например, библиотек кДНК, полученных с применением методик мутагенеза, обычно используемых в уровне техники, в том числе описанных в данном документе) с использованием одного или нескольких олигонуклеотидных зондов, которые могут гибридизироваться с полинуклеотидами или обеспечивать ПЦР-амплификацию полинуклеотидов, которые кодируют полипептид(полипептиды) вариантной протеазы в соответствии с настоящим изобретением. Процедуры для скрининга и выделения клонов кДНК и процедуры ПЦР-амплификации хорошо известны специалистам в данной области и описаны в стандартных справочниках, известных специалистам в данной области. Некоторые нуклеиновые кислоты в соответствии с настоящим изобретением могут быть получены путем изменения встречающегося в природе полинуклеотидного остова (например, который кодирует фермент или исходную протеазу), например, с помощью известных процедур мутагенеза (например, сайт-направленного мутагенеза, сайт-насыщающего мутагенеза и in vitro рекомбинации).
Способы получения модифицированных вариантных протеаз в соответствии с настоящим изобретением
[0171] В уровне техники известен ряд способов, которые подходят для создания модифицированных полинуклеотидов в соответствии с настоящим изобретением, которые кодируют вариантные протеазы в соответствии с настоящим изобретением, в том числе без ограничения, например, сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, делеционный мутагенез, случайный мутагенез, сайт-направленный мутагенез, конструирование синтетических генов путем олигонуклеотидного синтеза и лигирования и направляемая эволюция, а также различные другие рекомбинационные подходы. Способы получения модифицированных полинуклеотидов и белков (например, вариантных протеаз) включают в себя методы перестановки в ДНК, способы, основанные на негомологичной рекомбинации генов, такие как ITCHY (см. Ostermeier et al., 7:2139-44 [1999]), SCRACHY (см. Lutz et al. 98:11248-53 [2001]), SHIPREC (см. Sieber et al., 19:456-60 [2001]) и NRR (см. Bittker et al., 20:1024-9 [2001]; Bittker et al., 101:7011-6 [2004]), и способы, которые основаны на применении олигонуклеотидов для введения произвольных и целевых мутаций, делеций и/или вставок (см. Ness et al., 20:1251-5 [2002]; Coco et al., 20:1246-50 [2002]; Zha et al., 4:34-9 [2003]; Glaser et al., 149:3903-13 [1992]).
Векторы, клетки и способы получения вариантных протеаз в соответствии с настоящим изобретением
[0172] В настоящем изобретении предусмотрены выделенные или рекомбинантные векторы, содержащие по меньшей мере один полинуклеотид в соответствии с настоящим изобретением, описанный в данном документе (например, полинуклеотид, кодирующий вариантную протеазу в соответствии с настоящим изобретением, описанный в данном документе), выделенные или рекомбинантные векторы экспрессии или кассеты экспрессии, содержащие по меньшей мере одну нуклеиновую кислоту или полинуклеотид в соответствии с настоящим изобретением, выделенные, практически чистые или рекомбинантные ДНК-конструкции, содержащие по меньшей мере одну нуклеиновую кислоту или полинуклеотид в соответствии с настоящим изобретением, выделенные или рекомбинантные клетки, содержащие по меньшей мере один полинуклеотид в соответствии с настоящим изобретением, клеточные культуры, содержащие клетки, содержащие по меньшей мере один полинуклеотид в соответствии с настоящим изобретением, клеточные культуры, содержащие по меньшей мере одну нуклеиновую кислоту или полинуклеотид в соответствии с настоящим изобретением, и композиции, содержащие один или несколько таких векторов, нуклеиновых кислот, векторов экспрессии, кассет экспрессии, ДНК-конструкций, клеток, клеточных культур или их любых комбинации или смесей.
[0173] В некоторых вариантах осуществления в настоящем изобретении предусмотрены рекомбинантные клетки, содержащие по меньшей мере один вектор (например, вектор экспрессии или ДНК-конструкция) в соответствии с настоящим изобретением, который содержит по меньшей мере одну нуклеиновую кислоту или полинуклеотид в соответствии с настоящим изобретением. Некоторые такие рекомбинантные клетки трансформированы или трансфицированы по меньшей мере одним таким вектором. Такие клетки, как правило, называют клетками-хозяевами. Некоторые такие клетки включают бактериальные клетки, включая без ограничения клетки Bacillus sp, такие как клетки B. subtilis. Настоящее изобретение также предусматривает рекомбинантные клетки (например, рекомбинантные клетки-хозяева), содержащие по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением.
[0174] В некоторых вариантах осуществления в настоящем изобретении предусмотрен вектор, содержащий нуклеиновую кислоту или полинуклеотид в соответствии с настоящим изобретением. В некоторых вариантах осуществления вектором является вектор экспрессии или кассета экспрессии, в которых полинуклеотидная последовательность в соответствии с настоящим изобретением, кодирующая вариантную протеазу в соответствии с настоящим изобретением, функционально связана с одним или дополнительными сегментами нуклеиновой кислоты, необходимыми для эффективной экспрессии гена (например, с промотором, функционально связанным с полинуклеотидом в соответствии с настоящим изобретением, кодирующим вариантную протеазу в соответствии с настоящим изобретением). Вектор может включать в себя терминатор транскрипции и/или ген отбора, такой как ген устойчивости к антибиотику, который позволяет непрерывное поддерживание в культуре инфицированных плазмидой клеток-хозяев при выращивании в содержащих противомикробное средство средах.
[0175] Вектор экспрессии может быть получен из плазмидной или вирусной ДНК или в альтернативных вариантах осуществления содержит элементы и той, и другой. Типичные векторы включают в себя без ограничения pXX, pC194, pJH101, pE194, pHP13 (см. Harwood and Cutting [eds.], Chapter 3, Molecular Biological Methods for Bacillus, John Wiley & Sons [1990]; подходящие реплецирующиеся плазмиды для B. subtilis включают те, которые перечислены на стр. 92; см. также Perego, Integrational Vectors for Genetic Manipulations in B. subtilis, в Sonenshein et al., [eds.] "B. subtilis and Other Gram-Positive Bacteria: Biochemistry, Physiology and Molecular Genetics", Американское общество микробиологии, Вашингтон, Округ Колумбия [1993], стр. 615-624).
[0176] Для экспрессии и продуцирования представляющего интерес белка (например, вариантной протеазы) в клетке по меньшей мере один вектор экспрессии, содержащий по меньшей мере одну копию полинуклеотида, кодирующего модифицированную протеазу, а предпочтительно содержащий несколько копий, трансформируют в клетку, при условиях, приемлемых для экспрессии протеазы. В некоторых вариантах осуществления настоящего изобретения полинуклеотидную последовательность, кодирующую вариантную протеазу (а также другие последовательности, включенные в вектор), интегрируют в геном клетки-хозяина, тогда как в других вариантах осуществления плазмидный вектор, содержащий полинуклеотидную последовательность, кодирующую вариантную протеазу, остается автономным внехромосомным элементом в клетке. В настоящем изобретении предусмотрены и внехромосомные элементы нуклеиновой кислоты, а также входящие нуклеотидные последовательности, которые интегрированы в геном клетки-хозяина. Векторы, описанные в данном документе, пригодны для продуцирования вариантных протеаз в соответствии с настоящим изобретением. В некоторых вариантах осуществления полинуклеотидная конструкция, кодирующая вариантную протеазу, присутствует в интегрирующемся векторе, что обеспечивает интеграцию и необязательно амплификацию полинуклеотида, кодирующего вариантную протеазу, в бактериальной хромосоме. Примеры сайтов интеграции хорошо известны специалистам в данной области. В некоторых вариантах осуществления транскрипция полинуклеотида, кодирующего вариантную протеазу в соответствии с настоящим изобретением, осуществляется с помощью промотора, который является промотором дикого типа для отобранной протеазы-предшественника. В некоторых других вариантах осуществления промотор является гетерологичным по отношению к протеазе-предшественнику, но функционирует в клетке-хозяине. Так примеры подходящих промоторов для применения в бактериальных клетках-хозяевах включают в себя без ограничения, например, промоторы AprE, amyE, amyQ, amyL, pstS, sacB, pSPAC, pVeg, pHpaII, промотор гена мальтогенной амилазы B. stearothermophilus, гена амилазы B. amyloliquefaciens (BAN), гена щелочной протеазы B. subtilis, гена щелочной протеазы B. clausii, гена ксилозидазы B. pumilis, cryIIIA B. thuringiensis и гена альфа-амилазы B. licheniformis. Дополнительные промоторы включают в себя без ограничения промотор A4, а также PR- или PL-промоторы фага лямбда и промоторы lac, trp или tac E. coli.
[0177] Вариантные протеазы в соответствии с настоящим изобретением могут быть продуцированы в клетках-хозяевах любого подходящего грамположительного микроорганизма, в том числе бактерий и грибов. Например, в некоторых вариантах осуществления вариантная протеаза продуцируется в клетках-хозяевах грибного и/или бактериального происхождения. В некоторых вариантах осуществления клетки-хозяева представляют собой Bacillus spp., Streptomyces spp., Escherichia spp., Aspergillus spp., Trichoderma spp., Pseudomonas spp., Corynebacterium spp., Saccharomyces spp. или Pichia spp. В некоторых вариантах осуществления вариантные протеазы продуцируются клетками-хозяевами Bacillus sp.. Примеры клеток-хозяев Bacillus sp., которые находят применение в продуцировании вариантных протеаз по настоящему изобретению, включают без ограничения B. licheniformis, B. lentus, B. subtilis, B. amyloliquefaciens, B. lentus, B. sonorensis, B. brevis, B. stearothermophilus, B. alkalophilus, B. coagulans, B. circulans, B. pumilis, B. thuringiensis, B. clausii и B. megaterium, а также другие организмы рода Bacillus. В некоторых вариантах осуществления клетки-хозяева B. subtilis используют для продуцирования вариантных протеаз. В US 5264366 и RE 34606 описаны различные штаммы-хозяева Bacillus, которые можно использовать для продуцирования вариантных протеаз в соответствии с настоящим изобретением, хотя могут быть использованы и другие подходящие штаммы.
[0178] Некоторые промышленные бактериальные штаммы, которые можно использовать для продуцирования вариантных протеаз в соответствии с настоящим изобретением, включают в себя нерекомбинантные штаммы (т.e. дикого типа) Bacillus sp., а также варианты встречающихся в природе штаммов и/или рекомбинантных штаммов. В некоторых вариантах осуществления штаммом-хозяином является рекомбинантный штамм, при этом в хозяина был введен полинуклеотид, кодирующий представляющий интерес полипептид. В некоторых вариантах осуществления штамм-хозяин представляет собой штамм-хозяин B. subtilis, и в частности, рекомбинантный штамм-хозяин B. subtilis. Известны многочисленные штаммы B. subtilis, в том числе без ограничения, например, штамм 1A6 (ATCC 39085), 168 (1A01), SB19, W23, Ts85, B637, PB1753 - PB1758, PB3360, JH642, 1A243 (ATCC 39,087), ATCC 21332, ATCC 6051, MI113, DE100 (ATCC 39,094), GX4931, PBT 110 и PEP 211 (см., например, Hoch et al., Genetics 73:215-228 [1973]; см. также патенты США №№ 4450235 и 4302544, а также EP 0134048, каждый из которых включен посредством ссылки во всей своей полноте). Применение B. subtilis в качестве клеток-хозяев для экспрессии хорошо известно в уровне техники (см., например, Palva et al., Gene 19:81-87 [1982]; Fahnestock and Fischer, J. Bacteriol., 165:796-804 [1986]; и Wang et al., Gene 69:39-47 [1988]).
[0179] В некоторых вариантах осуществления клеткой-хозяином Bacillus является Bacillus sp., которая содержит мутацию или делецию по меньшей мере в одном из следующих генов degU, degS, degR и degQ. Предпочтительно мутация находится в гене degU и более предпочтительно мутация находится в degU(Hy)32 (см., например, Msadek et al., J. Bacteriol. 172:824-834 [1990]; и Olmos et al., Mol. Gen. Genet. 253:562-567 [1997]). Один подходящий штамм-хозяин представляет собой B. subtilis, несущий мутацию degU32(Hy). В некоторых вариантах осуществления хозяин Bacillus содержит мутацию или делецию в scoC4 (см., например, Caldwell et al., J. Bacteriol. 183:7329-7340 [2001]); spoIIE (см., например, Arigoni et al., Mol. Microbiol. 31:1407-1415 [1999]); и/или oppA или в других генах оперона opp (см., например, Perego et al., Mol. Microbiol. 5:173-185 [1991]). Действительно, предполагают, что любая мутация в опероне opp, которая приводит к такому же фенотипу, что и мутация в гене oppA, найдет применение в некоторых вариантах осуществления измененного штамма Bacillus в соответствии с настоящим изобретением. В некоторых вариантах осуществления такие мутации происходят отдельно, тогда как в других вариантах осуществления наблюдаются комбинации мутаций. В некоторых вариантах осуществления измененным штаммом-хозяином Bacillus для получения клеток-хозяев, который можно использовать для продуцирования вариантной протеазы в соответствии с настоящим изобретением, является штамм-хозяин Bacillus, который уже содержит мутацию в одном или нескольких из вышеупомянутых генов. Кроме того, находят применение клетки-хозяева Bacillus sp., которые содержат мутацию(мутации) и/или делеции эндогенных генов протеазы. В некоторых вариантах осуществления клетки-хозяева Bacillus содержат делецию генов aprE и nprE. В других вариантах осуществления клетка-хозяин Bacillus sp. содержит делецию 5 генов протеазы, тогда как в других вариантах осуществления клетка-хозяин Bacillus sp. содержит делецию 9 генов протеазы (см., например, публикацию заявки на патент США № 2005/0202535, включенную в настоящий документе посредством ссылки).
[0180] Клетки-хозяева трансформируют по меньшей мере одной нуклеиновой кислотой, кодирующей по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, с использованием любого приемлемого способа, известного в уровне техники. Нуклеиновую кислоту либо включенную в вектор, либо используемую без присутствия плазмидной ДНК, как правило, вводят в микроорганизм, в некоторых вариантах осуществления предпочтительно в клетку E. coli или компетентную клетку Bacillus. Хорошо известны способы введения нуклеиновой кислоты (например, ДНК) в клетки Bacillus или клетки E. coli с использованием плазмидных ДНК-конструкций или векторов и с трансформацией таких плазмидных ДНК-конструкций или векторов в такие клетки. В некоторых вариантах осуществления плазмиды затем выделяют из клеток E. coli и трансформируют в клетки Bacillus. Однако не является обязательным применение промежуточных микроорганизмов, таких как E. coli, и в некоторых вариантах осуществления ДНК-конструкцию или вектор вводят непосредственно в хозяина Bacillus.
[0181] Специалистам в данной области техники хорошо известны подходящие способы введения нуклеиновой кислоты или полинуклеотидных последовательностей по настоящему изобретению в клетки Bacillus (см., например, Ferrari et al., "Genetics," в Harwood et al. [eds.], Bacillus, Plenum Publishing Corp. [1989], pp. 57-72; Saunders et al., J. Bacteriol. 157:718-726 [1984]; Hoch et al., J. Bacteriol. 93:1925 -1937 [1967]; Mann et al., Current Microbiol. 13:131-135 [1986]; Holubova, Folia Microbiol. 30:97 [1985]; Chang et al., Mol. Gen. Genet. 168:11-115 [1979]; Vorobjeva et al., FEMS Microbiol. Lett. 7:261-263 [1980]; Smith et al., Appl. Env. Microbiol. 51:634 [1986]; Fisher et al., Arch. Microbiol. 139:213-217 [1981]; и McDonald, J. Gen. Microbiol. 130:203 [1984]). Действительно, такие способы как трансформация, в том числе протопластная трансформация и конгрессия, трансдукция и протопластное слияние, хорошо известны и подходят для применения в настоящем изобретении. Способы трансформации используют для введения ДНК-конструкции или вектора, содержащих нуклеиновую кислоту, кодирующую вариантную протеазу в соответствии с настоящим изобретением, в клетку-хозяина. Способы, известные в уровне техники для трансформации клеток Bacillus, включают в себя такие способы как трансформация методом спасения плазмидного маркера, которая предусматривает поглощение донорной плазмиды компетентными клетками, несущими частично гомологичную резидентную плазмиду (см. Contente et al., Plasmid 2:555-571 [1979]; Haima et al., Mol. Gen. Genet. 223:185-191 [1990]; Weinrauch et al., J. Bacteriol. 154:1077-1087 [1983]; и Weinrauch et al., J. Bacteriol. 169:1205-1211 [1987]). В этом способе входящая донорная плазмида рекомбинируется с гомологичной областью резидентной "хелперной" плазмиды в процессе, который имитирует хромосомную трансформацию.
[0182] В добавок к традиционно используемым способам в некоторых вариантах осуществления клетки-хозяева непосредственно трансформируются ДНК-конструкцией или вектором, содержащими нуклеиновую кислоту, кодирующую вариантную протеазу в соответствии с настоящим изобретением (т.e. промежуточную клетку не используют для амплификации, или иного процесса, ДНК-конструкции или вектора перед введением в клетку-хозяина). Введение ДНК-конструкции или вектора в соответствии с настоящим изобретением в клетку-хозяина предусматривает такие физические и химические способы, которые известные в уровне техники для введения последовательности нуклеиновой кислоты (например, последовательности ДНК) в клетку-хозяина без вставки в плазмиду или вектор. Такие способы включают в себя без ограничения осаждение хлоридом кальция, электропорацию, оголенную ДНК, липосомы и т.п. В дополнительных вариантах осуществления ДНК-конструкции или вектор совместно трансформируют с плазмидой, и они не вставлены в плазмиду. В дополнительных вариантах осуществления селектируемый маркер удален из измененного штамма Bacillus с помощью известных в данной области техники способов (см. Stahl et al., J. Bacteriol. 158:411-418 [1984]; и Palmeros et al., Gene 247:255 -264 [2000]).
[0183] В некоторых вариантах осуществления трансформированные клетки по настоящему изобретению культивируют в традиционных питательных средах. Подходящие специальные условия для культуры, такие как температура, pH и т.п., известны специалистам в данной области и хорошо описаны в научной литературе. В некоторых вариантах осуществления в настоящем изобретении предусмотрена культура (например, клеточная культура), содержащая по меньшей мере одну вариантную протеазу или по меньшей мере одну нуклеиновую кислоту в соответствии с настоящим изобретением. Также предусмотрены композиции, содержащие по меньшей мере одну нуклеиновую кислоту, вектор или ДНК-конструкцию в соответствии с настоящим изобретением.
[0184] В некоторых вариантах осуществления клетки-хозяева, трансформированные по меньшей мере одной полинуклеотидной последовательностью, кодирующей по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, культивируют в подходящей питательной среде при условиях, обеспечивающих экспрессию протеазы в соответствии с настоящим изобретением, после чего полученную протеазу извлекают из культуры. Среда, используемая для культивирования клеток, включает в себя любую традиционную среду, подходящую для выращивания клеток-хозяев, такую как минимальные или комплексные среды, содержащие соответствующие добавки. Подходящие среды доступны от коммерческих поставщиков или могут быть получены согласно опубликованным рецептам (см., например, каталоги Американской коллекции типовых культур). В некоторых вариантах осуществления протеазу, продуцируемую клетками, извлекают из культуральной среды с применением традиционных процедур, в том числе без ограничения, например, отделения клеток-хозяев от среды путем центрифугирования или фильтрации, осаждения белковых компонентов супернатанта или фильтрата посредством соли (например, сульфатом аммония), хроматографической очистки (например, ионообменной, гель-фильтрационной, аффинной и т.д.). В настоящем изобретении находит применение любой способ, приемлемый для извлечения или очистки вариантной протеазы.
[0185] В некоторых вариантах осуществления вариантная протеаза, продуцируемая рекомбинантной клеткой-хозяином, секретируется в культуральную среду. Последовательность нуклеиновой кислоты, которая кодирует облегчающий очистку домен, может быть использована для облегчения очистки растворимых белков. Вектор или ДНК-конструкция, содержащие полинуклеотидную последовательность, кодирующую вариантную протеазу, дополнительно могут содержать последовательность нуклеиновой кислоты, кодирующей облегчающий очистку домен для облегчения очистки вариантной протеазы (см., например, Kroll et al., DNA Cell Biol. 12:441-53 [1993]). Такие облегчающие очистку домены включают в себя без ограничения, например, металл-хелатирующие пептиды, такие как модули гистидин-триптофан, которые обеспечивают очистку на иммобилизированных металлах (см. Porath, Protein Expr. Purif. 3:263-281 [1992]), домены белка A, которые обеспечивают очистку на иммобилизированном иммуноглобулине, и домен, используемый в системе FLAGS-удлинения/аффинной очистки (например, домены белка A, доступные от Immunex Corp., Сиэттл, Вашингтон). Включение отщепляемой линкерной последовательности, такой как фактор XA или энтерокиназа (например, последовательности, доступные от Invitrogen, San Diego, CA), между доменом очистки и гетерологичным белком также находит применение в облегчении очистки.
[0186] Хорошо известны анализы для выявления и оценки ферментативной активности фермента, такого как вариантная протеаза в соответствии с настоящим изобретением. Рядовому специалисту в данной области также известны различные анализы для выявления и оценки активности протеаз (например, вариантных протеаз в соответствии с настоящим изобретением). В частности, для измерения протеазной активности доступны анализы, которые основаны на высвобождении растворимых в кислоте пептидов из казеина или гемоглобина, измеряемых как поглощение при 280 нм или колориметрически с использованием метода Фолина, хорошо известные специалистам в данной области. Другие иллюстративные анализы включают солюбилизацию хромогенных субстратов (см., например, Ward, "Proteinases," в Fogarty (ed.)., "Microbial Enzymes and Biotechnology", Applied Science, Лондон, [1983], pp. 251-317). Другие типичные анализы включают в себя без ограничения анализ с сукцинил-Ala-Ala-Pro-Phe-паранитроанилидом (suc-AAPF-pNA) и анализ с натриевой солью 2,4,6-тринитробензолсульфоната (анализ с TNBS). Во многих дополнительных справочных материалах, известных специалистам в данной области техники, предусмотрены подходящие способы (см., например, Wells et al., Nucleic Acids Res. 11:7911-7925 [1983]; Christianson et al., Anal. Biochem. 223:119 -129 [1994]; и Hsia et al., Anal Biochem. 242:221-227 [1999]).
[0187] Для определения уровня продуцирования зрелой протеазы (например, зрелых вариантных протеаз в соответствии с настоящим изобретением) в клетке-хозяине можно использовать ряд способов. Такие способы включают в себя без ограничения, например, способы, в которых используют либо поликлональные, либо моноклональные антитела, специфичные для протезы. Типичные способы включают в себя без ограничения твердофазные иммуноферментные анализы (ELISA), радиоиммунологические анализы (RIA), флуоресцентные иммуноанализы (FIA) и сортировку клеток с активацией флуоресценции (FACS). Эти и другие анализы хорошо известны в данной области техники (см., например, Maddox et al., J. Exp. Med. 158:1211 [1983]).
[0188] В некоторых других вариантах осуществления в соответствии с настоящим изобретением предусмотрены способы получения или продуцирования зрелой вариантной протеазы по настоящему изобретению. Зрелая вариантная протеаза не включает в себя сигнальный пептид или пропептидную последовательность. Некоторые способы предусматривают получение или продуцирование вариантной протеазы в соответствии с настоящим изобретением в рекомбинантной бактериальной клетке-хозяине, такой как, например, клетка Bacillus sp. (например, клетка B. subtilis). В некоторых вариантах осуществления в настоящем изобретении предусмотрен способ продуцирования вариантной протеазы в соответствии с настоящим изобретением, при этом способ включает культивирование рекомбинантной клетки-хозяина, содержащей рекомбинантный вектор экспрессии с нуклеиновой кислотой, кодирующей вариантную протеазу в соответствии с настоящим изобретением, при условиях, благоприятных для продуцирования вариантной протеазы. Некоторые из таких способов дополнительно включают извлечение вариантной протеазы из культуры.
[0189] В некоторых вариантах осуществления в настоящем изобретении предусмотрены способы получения вариантной протеазы по настоящему изобретению, при этом способы включают: (a) введение рекомбинантного вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую вариантную протеазу в соответствии с настоящим изобретением, в популяцию клеток (например, бактериальных клеток, таких как клетки B. subtilis); и (b) культивирование клеток в культуральной среде при условиях, благоприятных для продуцирования вариантной протеазы, кодируемой вектором экспрессии. Некоторые из таких способов дополнительно включают: (c) выделение вариантной протеазы из клеток или из культуральной среды.
Чистящие композиции
[0190] Если не отмечено иное, уровни всех компонентов или композиции, представленных в данном документе, приводятся относительно активного уровня этих компонента или композиции и без учета примесей, например остаточных растворителей или побочных продуктов, которые могут присутствовать в коммерчески доступных источниках. Вес ферментных компонентов приводят на основе общего активного белка. Все процентные содержания и отношения рассчитывают по весу, если не указано иное. Все процентные содержания и отношения рассчитывают на основе всей композиции, если не указано иное. Композиции по настоящему изобретению включают чистящие композиции, такие как моющие композиции. В типичных моющих композициях уровни ферментов выражают как чистый фермент по весу всей композиции и, если не указано иное, моющие ингредиенты выражают по весу всех композиций.
[0191] Еще один дополнительный вариант осуществления относится к композиции, содержащей один или несколько вариантов клады AprL, описанных в данном документе, или рекомбинантный полипептид, или его активный фрагмент. В еще одном дополнительном варианте осуществления композиция, описанных в данном документе, содержит фосфат, не содержит фосфата, содержит борат, не содержит бора или их комбинации. В других вариантах осуществления композиция представляет собой не содержащую бора композицию. В некоторых вариантах осуществления не содержащая бора композиция представляет собой композицию, к которой не добавляли стабилизатор на основе бората. В другом варианте осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 5,5% бора. В еще одном дополнительном варианте осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 4,5% бора. В еще другом варианте осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 3,5% бора. В еще одних дополнительных вариантах осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 2,5% бора. В еще одних дополнительных вариантах осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 1,5% бора. В другом варианте осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 1,0% бора. В еще одних дополнительных вариантах осуществления не содержащая бора композиция представляет собой композицию, которая содержит менее чем 0,5% бора. В еще одном дополнительном варианте осуществления не содержащая бора композиция представляет собой композицию, практически не содержащую бора.
[0192] Хотя это и не существенно для целей настоящего изобретения, вспомогательные средства неограничивающего перечня, показанного далее, приемлемы для применения в чистящих композициях в соответствии с настоящим изобретением. В некоторых вариантах осуществления эти вспомогательные средства включают, например, для обеспечения или усиления очищающего действия, для обработки субстрата, подлежащего очистке, или для модификации эстетики чистящей композиции, как в случае с ароматизаторами, окрашивающими средствами, красителями или подобным. Следует понимать, что такие вспомогательные средства являются дополнением к полипептидам сериновой протеазы по настоящему изобретению. Определенная природа таких дополнительных компонентов и уровни их включения будут зависеть от физической формы композиции и природы операции очистки, для которой ее используют. Подходящие вспомогательные вещества включают без ограничения катализаторы отбеливания, другие ферменты, системы стабилизации фермента, хеланты, оптические отбеливатели, грязеотталкивающие полимеры, средства переноса красителя, диспергаторы, пеногасители, красители, отдушки, красящие вещества, наполнители, соли, фотоактиваторы, флуоресцентные вещества, кондиционеры для ткани, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, средства против усадки, средства против смятия, гермициды, фунгициды, цветные вкрапления, средства для ухода за серебром, препятствующие образованию оксидов и/или антикоррозийные средства, источники щелочности, солюбилизирующие средства, носители, технологические добавки, пигменты и регулирующие pH средства, поверхностно-активные вещества, моющие компоненты, хелатирующие средства, средства, ингибирующие перенос красителя, вспомогательные вещества для осаждения, диспергирующие вещества, дополнительные ферменты и стабилизаторы ферментов, каталитические вещества, активаторы отбеливания, ускорители отбеливания, перекись водорода, источники перекиси водорода, предварительно образованные перкислоты, полимерные диспергирующие средства, глинистые средства для удаления грязи/средства против повторного осаждения, осветлители, пеногасители, красители, отдушки, средства, обеспечивающие эластичность структуры, смягчители для ткани, носители, гидротропы, технологические добавки и/или пигменты. В дополнение к раскрытию ниже, подходящие примеры таких других вспомогательных веществ и уровней применения находятся в USPN 5576282; 6306812; 6326348; 6610642; 6605458; 5705464; 5710115; 5698504; 5695679; 5686014 и 5646101. В вариантах осуществления, в которых чистящие вспомогательные вещества не совместимы с полипептидами сериновой протеазы в соответствии с настоящим изобретением в чистящих композициях, используют подходящие способы содержания чистящих вспомогательных веществ и протеазы(протеаз) отдельно (т.e. без возможности контакта друг с другом) до тех пор, пока не нужна будет комбинация этих двух компонентов. Такие способы разделения включают в себя любой приемлемый способ, известный в уровне техники (например, желатиновые капсулы, инкапсулирование, таблетки, физическое разделение и т.п.). Вышеупомянутые вспомогательные ингредиенты могут составлять остальную часть чистящих композиций в соответствии с настоящим изобретением.
[0193] Чистящие композиции по настоящему изобретению преимущественно используют, например, в применениях для стирки белья, применениях для чистки твердых поверхностей, применениях для мытья посуды, включая автоматическое мытье посуды и ручное мытье посуды, а также косметических применениях, таких как очистка зубных протезов, зубов, волос и кожи. Ферменты по настоящему изобретению также подходят для использования в применениях для очистки контактных линз и очистки раневой поверхности.
[0194] Вариантные протеазы в соответствии с настоящим изобретением также находят применение в чистящих аддитивных продуктах. В некоторых вариантах осуществления находит применение очистка растворами при низкой температуре. В некоторых вариантах осуществления в настоящем изобретении предусмотрены чистящие аддитивные продукты, включающие по меньшей мере один фермент в соответствии с настоящим изобретением, который идеально подходит для включения в процесс мытья, если желательно дополнительное отбеливающее действие. Такие случаи включают в себя без ограничения применения для очистки растворами при низкой температуре. В некоторых вариантах осуществления аддитивный продукт находится в своей простейшей форме, одной или нескольких протеаз. В некоторых вариантах осуществления добавку упаковывают в дозированную форму для добавления в процессе очистки. В некоторых вариантах осуществления добавку упаковывают в дозированную форму для добавления в процессе очистки, при применении источника пероксигена, и когда желательно усиление отбеливающего действия. Любая подходящая отдельная дозированная единица находит применение в настоящем изобретении, в том числе без ограничения шарики, таблетки, желатиновые капсулы или другие отдельные дозированные единицы, такие как предварительно отмеренные порошки или жидкости. В некоторых вариантах осуществления включены наполнитель(наполнители) или материал(материалы)-носитель(носители) для увеличения объема таких композиций. Приемлемые наполнители или материалы-носители включают в себя без ограничения различные соли, представляющие собой сульфат, карбонат и силикат, а также тальк, глину и т.п. Приемлемые наполнители или материалы-носители для жидких композиций включают в себя без ограничения воду или низкомолекулярные первичные и вторичные спирты, в том числе полиолы и диолы. Примеры таких спиртов включают в себя без ограничения метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления композиции содержат от приблизительно 5% до приблизительно 90% таких материалов. Кислотные наполнители находят применение для целей снижения pH. В качестве альтернативы, в некоторых вариантах осуществления чистящая добавка включает в себя вспомогательные ингредиенты, которые более подробно описаны ниже.
[0195] Для чистящих композиций и чистящих добавок в соответствии с настоящим изобретением требуется эффективное количество по меньшей мере одного из вариантов протеазы, представленных в данном документе, отдельно или в комбинации с другими протеазами и/или дополнительными ферментами. Необходимый уровень фермента достигают путем добавления одного или нескольких вариантов протеазы в соответствии с настоящим изобретением. Как правило, чистящие композиции в соответствии с настоящим изобретением содержат по меньшей мере приблизительно 0,0001 весового процента, от приблизительно 0,0001 до приблизительно 10, от приблизительно 0,001 до приблизительно 1 или даже от приблизительно 0,01 до приблизительно 0,1 весового процента по меньшей мере одной из вариантных протеаз в соответствии с настоящим изобретением.
[0196] Чистящие композиции в данном документе, как правило, составляют так, что при применении в процедурах водной очистки вода для мытья будет иметь pH от приблизительно 4,0 до приблизительно 11,5 или даже от приблизительно 5,0 до приблизительно 11,5, или даже от приблизительно 5,0 до приблизительно 8,0, или даже от приблизительно 7,5 до приблизительно 10,5. Составы жидкого продукта, как правило, составляют с pH от приблизительно 3,0 до приблизительно 9,0 или даже от приблизительно 3 до приблизительно 5. Гранулированные продукты для стирки, как правило, составляют с pH от приблизительно 9 до приблизительно 11. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению могут быть составлены с щелочным pH в условиях мытья, таким как pH от приблизительно 8,0 до приблизительно 12,0, или от приблизительно 8,5 до приблизительно 11,0, или от приблизительно 9,0 до приблизительно 11,0. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению могут быть составлены с нейтральным pH в условиях мытья, таким как pH от приблизительно 5,0 до приблизительно 8,0, или от приблизительно 5,5 до приблизительно 8,0, или от приблизительно 6,0 до приблизительно 8,0, или от приблизительно 6,0 до приблизительно 7,5. В некоторых вариантах осуществления условия с нейтральным pH можно измерить при растворении чистящей композиции 1:100 (вес:вес) в деионизированной воде при 20°C, с измерением с применением традиционного pH-метра. Методики регулирования pH при рекомендуемых уровнях применения включают в себя применение буферов, щелочей, кислот и т.д. и хорошо известны специалистам в данной области.
[0197] В некоторых вариантах осуществления, если в гранулированной композиции или жидкости используют вариантную(вариантные) протеазу(протеазы), то желательно, чтобы вариантная протеаза находилась в форме инкапсулированной частицы для защиты вариантной протеазы от других компонентов гранулированной композиции при хранении. Кроме того, инкапсулирование также является средством регулирования доступности вариантной протеазы в процессе очистки. В некоторых вариантах осуществления инкапсулирование усиливает действие вариантной(вариантных) протеазы(протеаз) и/или дополнительных ферментов. В связи с этим вариантные протеазы в соответствии с настоящим изобретением инкапсулируют с любым приемлемым инкапсулирующим материалом, известным в уровне техники. В некоторых вариантах осуществления инкапсулирующий материал, как правило, инкапсулирует по меньшей мере часть катализатора для вариантной(вариантных) протеазы(протеаз) в соответствии с настоящим изобретением. Как правило, инкапсулирующий материал является растворимым в воде и/или диспергируемым в воде. В некоторых вариантах осуществления инкапсулирующий материал имеет температуру стеклования (Tg) 0°C или выше. Температура стеклования описана более подробно в WO 97/11151. Инкапсулирующий материал, как правило, выбирают из углеводов, природных или синтетических смол, хитина, хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафинов и их комбинаций. Если инкапсулирующим материалом является углевод, то его, как правило, выбирают из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. В некоторых типичных вариантах осуществления инкапсулирующий материал представляет собой крахмал (см., например, EP 0922499; US 4977252; US 5354559 и US 5935826). В некоторых вариантах осуществления инкапсулирующим материалом является микросфера, полученная из пластика, такого как термопластики, акрилонитрил, метакрилонитрил, полиакрилонитрил, полиметакрилонитрил и их смеси; коммерчески доступные микросферы, которые находят применение, включают в себя без ограничения поставляемые EXPANCEL® (Stockviksverken, Швеция), и PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES®, LUXSIL®, Q-CEL® и SPHERICEL® (PQ Corp., Вэлли Фордж, Пенсильвания).
[0198] Как описано в данном документе, вариантные протеазы в соответствии с настоящим изобретением находят применение особенно в сфере очистки, в том числе без ограничения моющих средствах для стирки и мытья посуды. При этих применениях ферменты подвергаются различным внешним воздействиям. Вариантные протеазы в соответствии с настоящим изобретением обеспечивают преимущества над многими используемыми в настоящее время ферментами благодаря их стабильности при различных условиях.
[0199] Действительно, существует ряд условий мытья, в том числе изменяющиеся моющие составы, объемы воды для мытья, температуры воды для мытья и продолжительность мытья, которым подвергаются протеазы, участвующие в мытье. Кроме того, моющие составы, используемые в различных географических зонах, имеют различные концентрации релевантных им компонентов, присутствующих в воде для мытья. Например, европейские моющие средства, как правило, содержат приблизительно 4500-5000 ppm моющих компонентов в воде для мытья, тогда как японские моющие средства, как правило, содержат примерно 667 ppm моющих компонентов в воде для мытья. В Северной Америке, особенно в Соединенных Штатах Америки, моющие средства, как правило, содержат приблизительно 975 ppm моющих компонентов, присутствующих в воде для мытья.
[0200] Система с низкой концентрацией моющего средства включает в себя моющие средства, для которых в воде для мытья присутствует менее приблизительно 800 ppm моющих компонентов. Японские моющие средства, как правило, считаются системами с низкой концентрацией моющего средства, поскольку они содержат приблизительно 667 ppm моющих компонентов, присутствующих в воде для мытья.
[0201] Средняя концентрация моющего средства предусматривает присутствие в воде для мытья от приблизительно 800 ppm до приблизительно 2000 ppm моющих компонентов. Североамериканские моющие средства обычно считаются системами со средней концентрацией моющего средства, поскольку они содержат около 975 ppm моющих компонентов в воде для мытья. В Бразилии в воде для мытья, как правило, присутствует около 1500 ppm моющих компонентов.
[0202] Система с высокой концентрацией моющего средства включает в себя моющие средства, при которых в воде для мытья присутствует более приблизительно 2000 ppm моющих компонентов. Европейские моющие средства обычно считаются системами с высокой концентрацией моющего средства, поскольку они содержат около 4500-5000 ppm моющих компонентов в воде для мытья.
[0203] В Латинской Америке моющие средства обычно являются моющими средствами с фосфатным моющим компонентом повышенного пенообразования, и в диапазон моющих средств, используемых в Латинской Америке, могут попадать моющие средства и средних, и высоких концентраций, поскольку диапазон моющих компонентов в воде для мытья составляет от 1500 ppm до 6000 ppm. Как упоминается выше, в Бразилии в воде для мытья, как правило, присутствует около 1500 ppm моющих компонентов. Однако в других географических зонах, не ограниченных другими странами Латинской Америки, моющие средства с фосфатным моющим компонентом повышенного пенообразования могут содержать системы с высокой концентрацией моющего средства до приблизительно 6000 ppm моющих компонентов, присутствующих в воде для мытья.
[0204] В свете вышеупомянутого очевидно, что концентрации моющих композиций в типичных моющих растворах во всем мире варьируют от менее приблизительно 800 ppm моющей композиции ("географические зоны с низкой концентрацией моющих средств"), например, от приблизительно 667 ppm в Японии до приблизительно 800 ppm - приблизительно 2000 ppm ("географические зоны со средней концентрацией моющих средств"), например, от приблизительно 975 ppm в США и приблизительно 1500 ppm в Бразилии до более чем приблизительно 2000 ppm ("географические зоны с высокой концентрацией моющих средств"), например, от приблизительно 4500 ppm до приблизительно 5000 ppm в Европе, и приблизительно 6000 ppm в географических зонах с фосфатными моющими компонентами с высоким пенообразованием.
[0205] Концентрации типичных моющих растворов определяют эмпирически. Например, в США типичная машина для мытья вмещает объем моющего раствора приблизительно 64,4 л. Следовательно, для получения концентрации приблизительно 975 ppm моющего средства в моющем растворе следует добавить приблизительно 62,79 г моющей композиции в 64,4 л моющего раствора. Это количество, как правило, является типичным количеством, отмеряемым в воду для мытья потребителем с использованием мерной чашки, предоставляемой с моющим средством.
[0206] В качестве следующего примера, в различных географических зонах используют различные температуры для мытья. Температура воды для мытья в Японии, как правило, ниже используемой в Европе. Например, температура воды для мытья в Северной Америке и Японии, как правило, составляет от приблизительно 10 до приблизительно 30°C (например, приблизительно 20°C), тогда как температура воды для мытья в Европе, как правило, составляет от приблизительно 30 до приблизительно 60°C (например, приблизительно 40°C). Однако для экономии энергии многие потребители переходят на использование для мытья холодной воды. Кроме того, в некоторых других областях холодную воду, как правило, используют для стирки, а также в применениях при мытье посуды. В некоторых вариантах осуществления при "мытье в холодной воде" в соответствии с настоящим изобретением используют "моющее средство для холодной водыʺ, подходящее для мытья при температурах от приблизительно 10°C до приблизительно 40°C, или от приблизительно 20°C до приблизительно 30°C, или от приблизительно 15°C до приблизительно 25°C, а также все другие комбинации в диапазоне от приблизительно 15°C до приблизительно 35°C, а также все диапазоны от 10°C до 40°C.
[0207] В качестве дополнительного примера, в различных географических зонах, как правило, вода имеет разную жесткость. Жесткость воды обычно описывают в гранах на галлон смешанных Ca2+/Mg2+. Жесткость является мерой количества кальция (Ca2+) и магния (Mg2+) в воде. Большая часть воды в Соединенных Штатах Америки является жесткой, но степень жесткости варьируется. Вода от среднежесткой (60-120 ppm) до жесткой (121-181 ppm) содержит 60-181 частей на миллион (части на миллион в пересчете на граны на галлон США представляют собой ppm #, поделенные на 17,1, что равняется гранам на галлон) минералов жесткости.
[0208] Жесткость воды в Европе, как правило, составляет более приблизительно 10,5 (например, от приблизительно 10,5 до приблизительно 20,0) гран на галлон смешанных Ca2+/Mg2+ (например, от приблизительно 15 гран на галлон смешанных Ca2+/Mg2+). Жесткость воды в Северной Америке, как правило, больше жесткости воды в Японии, но меньше жесткости воды в Европе. Например, жесткость воды в Северной Америке может составлять от приблизительно 3 до приблизительно 10 гран, от приблизительно 3 до приблизительно 8 гран или приблизительно 6 гран. Жесткость воды в Японии, как правило, ниже жесткости воды в Северной Америке и составляет обычно менее приблизительно 4, например приблизительно 3 грана на галлон смешанных Ca2+/Mg2+.
[0209] Следовательно, в некоторых вариантах осуществления настоящее изобретение предусматривает вариантные протеазы, которые демонстрирует неожиданное моющее действие по меньшей мере при одном наборе условий мытья (например, температуре воды, жесткости воды и/или концентрации моющего средства). В некоторых вариантах осуществления вариантные протеазы в соответствии с настоящим изобретением сравнимы по моющему действию с другими протеазами AprL. В некоторых вариантах осуществления настоящего изобретения вариантные протеазы, представленные в данном документе, проявляют улучшенную стабильность к окислению, улучшенную термическую стабильность, улучшенные чистящие способности при различных условиях и/или повышенную стабильность к хелаторам. Кроме того, вариантные протеазы в соответствии с настоящим изобретением находят применение в чистящих композициях, которые не включают в себя моющие средства, опять таки либо отдельно, либо в комбинации с моющими компонентами и стабилизаторами.
[0210] В некоторых вариантах осуществления настоящего изобретения чистящие композиции содержат по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением на уровне от приблизительно 0,00001% до приблизительно 10% по весу композиции и остальную часть (например, от приблизительно 99,999% до приблизительно 90,0%), содержащую чистящие вспомогательные вещества по весу композиции. В некоторых других вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением содержат по меньшей мере одну вариантную протеазу на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% по весу композиции и остальную часть чистящей композиции (например, от приблизительно 99,9999% до приблизительно 90,0%, от приблизительно 99,999% до приблизительно 98%, от приблизительно 99,995% до приблизительно 99,5% по весу), содержащую чистящие вспомогательные вещества.
[0211] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат один или несколько дополнительных моющих ферментов, которые обеспечивают очищающее действие, и/или уход за тканью, и/или эффекты при мытье посуды. Примеры подходящих ферментов включают без ограничения дополнительные сериновые протеазы, ацилтрансферазы, альфа-амилазы, бета-амилазы, альфа-галактозидазы, арабинозидазы, арилэстеразы, бета-галактозидазы, каррагиназы, каталазы, целлобиогидролазы, целлюлазы, хондроитиназы, кутиназы, эндо-бета-1,4-глюканазы, эндо-бета-маннаназы, эстеразы, экзо-маннаназы, галактаназы, глюкоамилазы, гемицеллюлазы, гиалуронидазы, кератиназы, лакказы, лактазы, лигниназы, липазы, липоксигеназы, маннаназы, металлопротеазы, протеазы, отличные от сериновых протеаз, оксидазы, пектатлиазы, пектинацетилэстеразы, пектиназы, пергидролазы, пероксидазы, фенолоксидазы, фосфатазы, фосфолипазы, фитазы, полигалактуроназы, протеазы, пуллуланазы, редуктазы, рамногалактуроназы, бета-глюканазы, танназы, трансглутаминазы, ксиланацетилэстеразы, ксиланазы, ксилоглюканазы и ксилозидазы или любые их комбинации или смеси. В некоторых вариантах осуществления применяется комбинация ферментов (т.е. "смесь"), содержащая традиционно применяемые ферменты, такие как амилаза, липаза, кутиназа и/или целлюлаза, вместе с применяемой протеазой.
[0212] Вдобавок к вариантам протеазы, представленным в данном документе, в композициях в соответствии с настоящим изобретением находит применение любая другая подходящая протеаза. Подходящие протеазы включают протеазы животного, растительного или микробного происхождения. В некоторых вариантах осуществления используют микробные протеазы. В некоторых вариантах осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления протеазой является сериновая протеаза, предпочтительно щелочная микробная протеаза или подобная трипсину протеаза. Примеры щелочных липолитических ферментов включают в себя субтилизины, особенно происходящие от Bacillus (например, субтилизин, lentus, amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). Дополнительные примеры включают такие мутантные протеазы, как описанные в USPN RE 34606: 5955340; 5700676; 6312936 и 6482628. Дополнительные примеры протеаз включают в себя без ограничения трипсин (например, происхождением от свиньи или коровы) и протеазу из Fusarium, описанную в WO 89/06270. В некоторых вариантах осуществления коммерчески доступные ферменты, являющиеся протеазами, которые находят применение в настоящем изобретении, включают без ограничения протеазы MAXATASE®, MAXACAL™, MAXAPEM™, OPTICLEAN®, OPTIMASE®, PROPERASE®, PURAFECT®, PURAFECT® OXP, PURAMAX™, EXCELLASE™, PREFERENZ™ (например, P100, P110, P280), протеазы EFFECTENZ™ (например, P1000, P1050, P2000), протеазы EXCELLENZ™ (например, P1000), ULTIMASE® и PURAFAST™ (DuPont); ALCALASE®, BLAZE®, CORONASE®, SAVINASE®, PRIMASE®, DURAZYM™, POLARZYME®, OVOZYME®, KANNASE®, LIQUANASE®, NEUTRASE®, RELASE® и ESPERASE® (Novozymes); BLAP™ и варианты BLAP™ (Henkel), и KAP (субтилизин B. alkalophilus; Kao). Различные протеазы описаны в WO 92/21760, WO95/23221, WO 2008/010925, WO 09/149200, WO 09/149144, WO 09/149145, WO 10/056640, WO 10/056653, WO 2010/0566356, WO 11/072099, WO 2011/13022, WO 11/140364, WO 12/151534, WO 2015/038792, WO 2015/089447, WO 2015/089441, публикациях США №№ 2008/0090747, US 5801039 US 5340735 US 5500364, US 5855625, RE 34606, US 5955340, US 5700676, US 6312936, US 6482628, US 8530219, предварительных заявках на патенты США №№ 62/180673 и 62/161077, и заявках согласно PCT №№ PCT/US2015/021813, PCT/US2015/055900, PCT/US2015/057497, PCT/US2015/057492, PCT/US2015/057512, PCT/US2015/057526, PCT/US2015/057520, PCT/US2015/057502 и PCT/US2016/022282. В некоторых дополнительных вариантах осуществления металлопротеазы находят применение в настоящем изобретении, включая без ограничения металлопротеазы, описанные в WO 1999014341, WO 1999033960, WO1999014342, WO1999034003, WO2007044993, WO2009058303, WO2009058661, WO 2014071410, WO2014194032, WO2014194034, WO 2014194054 и WO 2014/194117. Иллюстративные металлопротеазы включают nprE, рекомбинантную форму нейтральной металлопротеазы, экпрессируемой у B. subtilis (см., например, WO 07/044993) и PMN, очищенную нейтральную металлопротеазу из B. amyloliquefacients.
[0213] Кроме того, в настоящем изобретении находит применение любая приемлемая липаза. Приемлемые липазы включают в себя без ограничения липазы бактериального или грибного происхождения. Настоящее изобретение охватывает химически или генетически модифицированные мутанты. Примеры применимых липаз включают липазу H. Lanuginosa (см., например, EP 258068 и EP 305216), липазу Rhizomucor miehei (см., например, EP 238023), липазу Candida, как, например, липазу C. аntarctica (например, липазу C. antarctica A или B; см., например, EP 214761), липазы Pseudomonas, такие как липазы P. alcaligenes и P. pseudoalcaligenes (см., например, EP 218272), липазу P. cepacia (см., например, EP 331376), липазу P. stutzeri (см., например, GB 1372034), липазу P. fluorescens, липазу B. (например, липазу B. subtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus [см., например, JP 64/744992]; и липазу B. pumilus [см., например, WO 91/16422]).
[0214] Кроме того, ряд клонированных липаз находит применение в некоторых вариантах осуществления настоящего изобретения, в том числе без ограничения липаза Penicillium camembertii (см., Yamaguchi et al., Gene 103:61-67 [1991]), липаза Geotricum candidum (см., Schimada et al., J. Biochem., 106:383-388 [1989]) и различные липазы Rhizopus, такие как липаза R. delemar (см. Hass et al., Gene 109:117-113 [1991]), липаза R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 [1992]) и липаза R. oryzae.
[0215] Другие типы полипептидных ферментов, являющихся липазами, такие как кутиназы, также находят применение в некоторых вариантах осуществления настоящего изобретения, в том числе без ограничения кутиназа, происходящая от Pseudomonas mendocina (см. WO 88/09367), и кутиназа, происходящая от Fusarium solani pisi (см. WO 90/09446).
[0216] Дополнительные подходящие липазы включают такие липазы, как M1 LIPASE™, LUMA FAST™ и LIPOMAX™ (DuPont); LIPEX®, LIPOLASE® и LIPOLASE® ULTRA (Novozymes); и LIPASE P™ "Amano" (Amano Pharmaceutical Co. Ltd).
[0217] В некоторых вариантах осуществления настоящего изобретения чистящие композиции в соответствии с настоящим изобретением дополнительно содержат липазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной липазы по весу композиции и остальную часть чистящих вспомогательных веществ по весу композиции. В некоторых других вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением также содержат липазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% липазы по весу композиции.
[0218] Согласно некоторым вариантам осуществления настоящего изобретения любая приемлемая амилаза находит применение в настоящем изобретении. В некоторых вариантах осуществления также находит применение любая амилаза (например, альфа и/или бета), подходящая для применения в щелочных растворах. Приемлемые амилазы включают в себя без ограничения амилазы бактериального или грибкового происхождения. Некоторые варианты осуществления включают в себя химически или генетически модифицированных мутантов. Амилазы, которые находят применение в настоящем изобретении, включают в себя без ограничения α-амилазы, полученные из B. licheniformis (см., например, GB 1296839). Дополнительные подходящие амилазы включают таковые, которые можно найти в WO9100353, WO9402597, WO94183314, WO9510603, WO9526397, WO9535382, WO9605295, WO9623873, WO9623874, WO9630481, WO9710342, WO9741213, WO9743424, WO9813481, WO 9826078, WO9902702, WO9909183, WO9919467, WO9923211, WO9929876, WO9942567, WO 9943793, WO9943794, WO9946399, WO0029560, WO0060058, WO0060059, WO0060060, WO 0114532, WO0134784, WO0164852, WO0166712, WO0188107, WO0196537, WO02092797, WO 0210355, WO0231124, WO2004055178, WO2004113551, WO2005001064, WO2005003311, WO 2005018336, WO2005019443, WO2005066338, WO2006002643, WO2006012899, WO2006012902, WO2006031554, WO2006063594, WO2006066594, WO2006066596, WO2006136161, WO 2008000825, WO2008088493, WO2008092919, WO2008101894, WO2008/112459, WO2009061380, WO2009061381, WO2009100102, WO2009140504, WO2009149419, WO 2010/059413, WO 2010088447, WO2010091221, WO2010104675, WO2010115021, WO10115028, WO2010117511, WO 2011076123, WO2011076897, WO2011080352, WO2011080353, WO 2011080354, WO2011082425, WO2011082429, WO2011087836, WO2011098531, WO2013063460, WO2013184577, WO 2014099523, WO2014164777 и WO2015077126. Коммерчески доступные амилазы, которые находят применение в настоящем изобретении, включают без ограничения DURAMYL®, TERMAMYL®, FUNGAMYL®, STAINZYME®, STAINZYME PLUS®, STAINZYME ULTRA® и BAN™ (Novozymes), а также EFFECTENZ™ S 1000, POWERASE™, PREFERENZ™ S 100, PREFERENZ™ S 110, EXCELLENZ™ S 2000, RAPIDASE® и MAXAMYL® P (DuPont).
[0219] В некоторых вариантах осуществления настоящего изобретения чистящие композиции в соответствии с настоящим изобретением дополнительно содержат амилазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной амилазы по весу композиции и остальную часть чистящих вспомогательных веществ по весу композиции. В некоторых других вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением также содержат амилазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% амилазы по весу композиции.
[0220] В некоторых дополнительных вариантах осуществления любая приемлемая целлюлаза находит применение в чистящих композициях в соответствии с настоящим изобретением. Приемлемые целлюлазы включают в себя без ограничения целлюлазы бактериального или грибкового происхождения. Некоторые варианты осуществления включают в себя химически или генетически модифицированных мутантов. Подходящие целлюлазы включают без ограничения целлюлазы H. insolens (см., например, US 4435307). Особенно приемлемыми целлюлазами являются целлюлазы, обладающие эффектами сохранения цвета (см., например, EP 0495257). Коммерчески доступные целлюлазы, которые находят применение в настоящем изобретении, включают без ограничения CELLUZYME®, CAREZYME® и CAREZYME® PREMIUM (Novozymes), REVITALENZ™ 100 и REVITALENZ® 2000 (DuPont), и KAC-500(B)™ (Kao). В некоторых вариантах осуществления целлюлазы включены в виде частей или фрагментов зрелых дикого типа или вариантных целлюлаз, при этом удаляют часть N-конца (см., например, US 5874276). Дополнительные подходящие целлюлазы включают таковые, которые можно найти в WO2005054475, WO2005056787, US 7449318, US 7833773, US 4435307, EP 0495257 и предварительной заявке на патент США № 62/296678. В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением дополнительно содержат целлюлазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной целлюлазы по весу композиции и остальную часть чистящих вспомогательных веществ по весу композиции. В некоторых других вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением также содержат целлюлазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% целлюлазы по весу композиции.
[0221] Любая маннаназа, приемлемая для применения в моющих композициях, также находит применение в настоящем изобретении. Приемлемые маннаназы включают в себя без ограничения маннаназы бактериального или грибного происхождения. Некоторые варианты осуществления включают в себя химически или генетически модифицированных мутантов. Известны различные маннаназы, которые находят применение в настоящем изобретении (см., например, USPN 6566114; 6602842; 6440991 и предварительных заявках на патент США №№ 62/251516, 62/278383 и 62/278387). Коммерчески доступные маннаназы, которые находят применение в настоящем изобретении, включают без ограничения EFFECTENZ™ M 1000, PREFERENZ® M 100, MANNASTAR® и PURABRITE™ (DuPont), а также MANNAWAY® (Novozymes). В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением дополнительно содержат маннаназы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной маннаназы по весу композиции и остальную часть чистящих вспомогательных веществ по весу композиции. В некоторых вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением также содержат маннаназы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% маннаназы по весу композиции.
[0222] В некоторых вариантах осуществления используют пероксидазы в комбинации с пероксидом водорода или его источником (например, перкарбонатом, перборатом или персульфатом) в композициях в соответствии с настоящим изобретением. В некоторых альтернативных вариантах осуществления используют оксидазы в комбинации с кислородом. Оба типа ферментов используют для "раствора для отбеливания" (т.e. для предотвращения перехода текстильного красителя из окрашенной ткани на другую ткань при стирке тканей вместе в моющей жидкости), предпочтительно вместе с усиливающим средством (см., например, WO 9412621 и WO 9501426). Приемлемые пероксидазы/оксидазы включают в себя без ограничения таковые растительного, бактериального или грибкового происхождения. Некоторые варианты осуществления включают в себя химически или генетически модифицированных мутантов. В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением дополнительно содержат пероксидазные и/или оксидазные ферменты на уровне от приблизительно 0,00001% до приблизительно 10% дополнительных пероксидазы и/или оксидазы по весу композиции и остальную часть чистящих вспомогательных веществ по весу композиции. В некоторых других вариантах осуществления в соответствии с настоящим изобретением чистящие композиции в соответствии с настоящим изобретением также содержат пероксидазные и/или оксидазные ферменты на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% пероксидазных и/или оксидазных ферментов по весу композиции.
[0223] В некоторых вариантах осуществления находят применение дополнительные ферменты, включая без ограничения пергидролазы (см., например, WO2005056782, WO2007106293, WO2008063400, WO2008106214 и WO2008106215). Кроме того, согласно некоторым вариантам осуществления в данном документе предусмотрены смеси вышеупомянутых ферментов, в частности, одного или нескольких из дополнительной протеазы, амилазы, липазы, маннаназы и/или по меньшей мере одной целлюлазы. В действительности предполагается, что различные смеси таких ферментов находят применение в настоящем раскрытии. Также предполагается, что изменяющиеся уровни вариантной(вариантных) протеазы(протеаз) и одного или нескольких дополнительных ферментов могут независимо варьировать до приблизительно 10%, при этом остальной частью чистящей композиции являются чистящие вспомогательные вещества. Конкретный выбор чистящих вспомогательных веществ легко осуществить, принимая во внимание поверхность, объект, предмет или ткань, подлежащие очистке, и требуемую форму композиции для условий очистки в ходе применения (например, посредством применения для мытья моющего средства).
[0224] Примеры приемлемых чистящих вспомогательных веществ включают в себя без ограничения поверхностно-активные вещества, моющие компоненты, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, стабилизирующие ферменты системы, хеланты, оптические отбеливатели, высвобождающие грязь полимеры, средства переноса красителя, подавляющие перенос красителя средства, каталитические материалы, пероксид водорода, источники пероксида водорода, предварительно полученные перкислоты, полимерные диспергирующие средства, средства удаления глинистой грязи, средства для эластичности структуры, диспергаторы, гасители пены, красители, ароматизаторы, окрашивающие средства, соли-наполнители, гидротропы, фотоактиваторы, флуоресцирующие средства, кондиционеры для ткани, смягчители ткани, носители, гидротропы, технологические добавки, растворители, пигменты, гидролизируемые поверхностно-активные вещества, консерванты, антиоксиданты, средства против усадки ткани, средства против складок, противомикробные средства, фунгициды, цветные частицы, противобактериальное средство на основе серебра, препятствующие потемнению и/или антикоррозионные средства, источники щелочности, солюбилизирующие средства, носители, технологические добавки, пигменты и средства контроля рН (см., например, USPN 6610642; 6605458; 5705464; 5710115; 5698504; 5695679; 5686014 и 5646101). Ниже подробно представлены варианты осуществления материалов конкретных чистящих композиций. В вариантах осуществления, в которых чистящие вспомогательные вещества не совместимы с вариантными протеазами в соответствии с настоящим изобретением в чистящих композициях, используют подходящие способы содержания чистящих вспомогательных веществ и протеазы(протеаз) отдельно (т.e. без возможности контакта друг с другом) до тех пор, пока не нужна будет комбинация этих двух компонентов. Такие способы разделения включают в себя любой приемлемый способ, известный в уровне техники (например, желатиновые капсулы, инкапсулирование, таблетки, физическое разделение и т.п.).
[0225] В некоторых вариантах осуществления эффективное количество одной или нескольких вариантных протеаз, представленных в данном документе, включают в композиции, применимые для очистки ряда поверхностей при необходимости удаления белковых пятен. Такие чистящие композиции включают в себя чистящие композиции для таких применений как очистка твердых поверхностей, тканей и посуды. Действительно, в некоторых вариантах осуществления настоящее изобретение предусматривает чистящие композиции для тканей, тогда как в других вариантах осуществления настоящее изобретение предусматривает чистящие композиции, отличные от таковых для тканей. Следует отметить, что настоящее изобретение также относится к чистящим композициям, приемлемым для личной гигиены, в том числе гигиены ротовой полости (включая зубные порошки, зубные пасты, ополаскиватели для рта и т.п., а также чистящие композиции для зубных протезов), кожи, а также чистящие композиции для волос. Предполагается, что настоящее изобретение охватывает моющие композиции в любой форме (т.e. жидкости, гранулы, бруски, полутвердого вещества, гелей, эмульсий, таблеток, капсул и т.п.).
[0226] В качестве примера, ниже более подробно описаны некоторые чистящие композиции, в которых находят применение вариантные протеазы в соответствии с настоящим изобретением. В некоторых вариантах осуществления, в которых чистящие композиции в соответствии с настоящим изобретением составляют в виде композиций, подходящих для применения в способе(способах) стирки белья в стиральной машине, композиции в соответствии с настоящим изобретением предпочтительно содержат по меньшей мере одно поверхностно-активное вещество и по меньшей мере одно соединение моющего компонента, а также один или несколько чистящих вспомогательных веществ, предпочтительно выбранных из органических полимерных соединений, отбеливающих средств, дополнительных ферментов, гасителей пены, диспергаторов, диспергаторов известкового мыла, суспендирующих грязь средств, и средств против повторного осаждения, и ингибиторов коррозии. В некоторых вариантах осуществления композиции для стирки также содержат мягчители (т.e. в качестве дополнительных чистящих вспомогательных веществ). В композициях в соответствии с настоящим изобретением также находят применение моющие аддитивные продукты в твердой или жидкой форме. Такие аддитивные продукты предназначены для дополнения и/или усиления действия традиционных моющих композиций и их можно добавлять на любой стадии процесса очистки. В некоторых вариантах осуществления плотность моющих композиций для стирки белья в данном документе варьирует от приблизительно 400 до приблизительно 1200 г/литр, тогда как в других вариантах осуществления она варьирует от приблизительно 500 до приблизительно 950 г/литр композиции при измерении при 20˚C.
[0227] В вариантах осуществления составленные в качестве композиций для применения в способах ручного мытья посуды композиции в соответствии с настоящим изобретением предпочтительно содержат по меньшей мере одно поверхностно-активное вещество и предпочтительно по меньшей мере один дополнительный чистящий вспомогательный материал, выбранный из органических полимерных соединений, усиливающих пену средств, ионов металлов группы II, растворителей, гидротропов и дополнительных ферментов.
[0228] В некоторых вариантах осуществления различные чистящие композиции, такие как предусмотренные в US 6605458, находят применение с вариантными протеазами по настоящему изобретению. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, являются компактной гранулированной чистящей композицией для ткани, тогда как в других вариантах осуществления композиция является гранулированной чистящей композицией для ткани, применимой в стирке цветных тканей, в дополнительных вариантах осуществления композиция является гранулированной чистящей композицией для ткани, которая обеспечивает смягчение посредством моющей способности, в дополнительных вариантах осуществления композиция является высокоинтенсивной жидкой чистящей композицией для ткани. В некоторых вариантах осуществления композиции, содержащие по меньшей мере одну вариантную протеазу по настоящему изобретению, представляют собой чистящие композиции для ткани, такие как описанные в USPN 6610642 и 6376450. Кроме того, вариантные протеазы в соответствии с настоящим изобретением находят применение в гранулированных моющих композициях для стирки белья, которые обладают особой практичностью в условиях мытья в Европе и Японии (см., например, US 6610642).
[0229] В некоторых альтернативных вариантах осуществления в настоящем изобретении предусмотрены чистящие композиции для твердых поверхностей, содержащие по меньшей мере одну вариантную протеазу, предусмотренную в данном документе. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, являются чистящими композициями для твердых поверхностей, такими как описанные в USPN 6610642; 6376450 и 6376450.
[0230] В еще дополнительных вариантах осуществления настоящее изобретение предусматривает композиции для мытья посуды, содержащие по меньшей мере одну вариантную протеазу, предусмотренную в данном документе. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, являются чистящими композициями для твердых поверхностей, такими как описанные в USPN 6610642 и 6376450. В еще некоторых дополнительных вариантах осуществления настоящее изобретение предусматривает композиции для мытья посуды, содержащие по меньшей мере одну вариантную протеазу, предусмотренную в данном документе. В некоторых дополнительных вариантах осуществления композиции, содержащие по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением, включают в себя композиции для ухода за ротовой полостью, такие как описанные в USPN 6376450 и 6376450. Составы и описания соединений и чистящих вспомогательных веществ, содержащихся в упомянутых ранее USPN 6376450, 6605458, 6605458 и 6610642, находят применение с вариантными протеазами, предусмотренными в данном документе.
[0231] Чистящие композиции по настоящему изобретению составляют в любой подходящей форме и получают любым способом, выбранным специалистом в области составления (см., например, USPN 5879584; 5691297; 5574005; 5569645; 5565422; 5516448; 5489392 и 5486303. Если желательна чистящая композиция с низким pH, то pH такой композиции регулируют путем добавления материала, такого как моноэтаноламин или кислотный материал, такой как HCl.
[0232] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат подкисляющую частицу или аминокарбоновый моющий компонент. Примеры аминокарбонового моющего компонента включают аминокарбоновые кислоты, их соли и производные. В некотором варианте осуществления аминокарбоновый моющий компонент представляет собой аминополикарбоновый моющий компонент, такой как глицин-N,N-диуксусная кислота или производное общей формулы MOOC-CHR-N (CH2COOM)2, где R представляет собой C1-12алкил и M представляет собой щелочной металл. В некоторых вариантах осуществления аминокарбоновые моющие компоненты могут являться метилглициндиуксусной кислотой (MGDA), GLDA (глутаминовой N,N-диуксусной кислотой), иминодисукциновой кислотой (IDS), карбоксиметилинулином и их солями и производными, аспарагиновой кислотой-N-моноуксусной кислотой (ASMA), аспарагиновой кислотой-N,N-диуксусной кислотой (ASDA), аспарагиновой кислотой-N-монопропионовой кислотой (ASMP), иминодикарбоновой кислотой (IDA), N-(2-сульфометил)аспарагиновой кислотой (SMAS), N-(2-сульфоэтил)аспарагиновой кислотой (SEAS), N-(2-сульфометил)глутаминовой кислотой (SMGL), N-(2-сульфоэтил)глутаминовой кислотой (SEGL), IDS (иминодиуксусной кислотой) и их солями и производными, такими как N-метилиминодиуксусная кислота (MIDA), альфа-аланин-N,N-диуксусной кислотой (альфа-ALDA), серин-N,N-диуксусной кислотой (SEDA), изосерин-N,N-диуксусной кислотой (ISDA), фенилаланин-N,N-диуксусной кислотой (PHDA), антраниловой кислотой-N,N-диуксусной кислотой (ANDA), сульфаниловой кислотой-N,N-диуксусной кислотой (SLDA), таурин-N,N-диуксусной кислотой (TUDA) и сульфометил-N,N-диуксусной кислотой (SMDA), и их солями щелочных металлов и производными. В некоторых вариантах осуществления подкисляющая частица имеет средневзвешенный геометрический размер частиц от приблизительно 400 мкм до приблизительно 1200 мкм и объемный вес по меньшей мере 550 г/л. В некоторых вариантах осуществления подкисляющая частица составляет по меньшей мере приблизительно 5% моющего компонента.
[0233] В некоторых вариантах осуществления подкисляющая частица может содержать любую кислоту, включая органические кислоты и неорганические кислоты. Органические кислоты могут иметь один или два карбоксила и в некоторых случаях до 15 атомов углерода, в частности, до 10 атомов углерода, такие как муравьиная, уксусная, пропионовая, каприновая, щавелевая, янтарная, адипиновая, малеиновая, фумаровая, себациновая, яблочная, молочная, гликолевая, винная и глиоксиловая кислоты. В некоторых вариантах осуществления кислота представляет собой лимонную кислоту. Неорганические кислоты включают соляную и серную кислоты. В некоторых случаях подкисляющая частица по настоящему изобретению представляет собой высокоактивную частицу, содержащую высокий уровень аминокарбонового моющего компонента. Было определено, что серная кислота дополнительно способствует стабильности конечной частицы.
[0234] Хотя это и не существенно для целей настоящего изобретения, вспомогательные средства неограничивающего перечня, показанного далее, приемлемы для применения в чистящих композициях в соответствии с настоящим изобретением. В некоторых вариантах осуществления эти вспомогательные средства включают, например, для обеспечения или усиления очищающего действия, для обработки субстрата, подлежащего очистке, или для модификации эстетики чистящей композиции, как в случае с ароматизаторами, окрашивающими средствами, красителями или подобным. Следует понимать, что такие вспомогательные средства являются дополнением к вариантным протеазам в соответствии с настоящим изобретением. Определенная природа таких дополнительных компонентов и уровни их включения будут зависеть от физической формы композиции и природы операции очистки, для которой ее используют. Приемлемые вспомогательные вещества включают в себя без ограничения поверхностно-активные вещества, моющие компоненты, хелатирующие средства, подавляющие перенос красителя средства, осаждающие добавки, диспергаторы, дополнительные ферменты и стабилизаторы фермента, каталитические материалы, активаторы отбеливания, усилители отбеливания, пероксид водорода, источники пероксида водорода, предварительно полученные перкислоты, полимерные диспергирующие средства, средства для удаления глинистой грязи/против повторного осаждения, осветлители, гасители пены, красители, ароматизаторы, средства для эластичности структуры, смягчители ткани, носители, гидротропы, технологические добавки и/или пигменты. Дополнительно к раскрытию ниже, подходящие примеры таких других вспомогательных средств и уровней применения присутствуют в USPN 5576282, 6306812 и 6326348. Вышеупомянутые вспомогательные ингредиенты могут составлять остальную часть чистящих композиций в соответствии с настоящим изобретением.
[0235] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат по меньшей мере одно поверхностно-активное вещество и/или систему поверхностно-активных веществ, при этом поверхностно-активное вещество выбрано из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитических поверхностно-активных веществ, цвиттер-ионных поверхностно-активных веществ, полу-полярных неионных поверхностно-активных веществ и их смесей. В некоторых вариантах осуществления чистящих композиций с низким pH (например, композиций с точным pH от приблизительно 3 до приблизительно 5) композиция, как правило, не содержит алкилэтоксилированный сульфат, так как считается, что такое поверхностно-активное вещество может быть гидролизовано кислотным содержимым таких композиций. В некоторых вариантах осуществления поверхностно-активное вещество присутствует на уровне от приблизительно 0,1% до приблизительно 60%, тогда как в альтернативных вариантах осуществления уровень составляет от приблизительно 1% до приблизительно 50%, тогда как в других дополнительных вариантах осуществления уровень составляет от приблизительно 5% до приблизительно 40%, по весу чистящей композиции.
[0236] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат один(одну) или несколько моющих компонентов для мытья или систем моющих компонентов для мытья. В некоторых вариантах осуществления с включением по меньшей мере одного моющего компонента чистящие композиции содержат по меньшей мере приблизительно 1%, от приблизительно 3% до приблизительно 60% или даже от приблизительно 5% до приблизительно 40% моющего компонента по весу чистящей композиции. Моющие компоненты включают в себя без ограничения полифосфатные соли щелочного металла, аммония и алканоламмония, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, алюмосиликаты, поликарбоксилатные соединения, гидроксиполикарбоксилаты простого эфира, сополимеры малеинового ангидрида с этилен- или винилметиловым эфиром, 1,3,5-тригидроксибензол-2,4,6-трисульфокислоту и карбоксиметилоксиянтарную кислоту, различные соли щелочного металла, аммония и замещенного аммония и полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовой кислоты, янтарной кислоты, лимонной кислоты, оксидиянтарной кислоты, полималеиновой кислоты, бензол-1,3,5-трикарбоновой кислоты, карбоксиметилоксиянтарной кислоты и их растворимых солей. Действительно, предполагается, что любой приемлемый моющий компонент будет находить применение в различных вариантах осуществления настоящего изобретения.
[0237] В некоторых вариантах осуществления моющие компоненты образуют растворимые в воде комплексы обеспечивающих жесткость ионов (например, секвестрирующие моющие компоненты), такие как цитраты и полифосфаты (например, натрия триполифосфат и натрия триполифосфата гексагидрат, калия триполифосфат и смешанный натрия и калия триполифосфат и т.п.). Предполагается, что в настоящем изобретении найдет применение любой приемлемый моющий компонент, в том числе известный в уровне техники (см., например, EP 2100949).
[0238] В некоторых вариантах осуществления моющие компоненты для применения в данном документе включают фосфатные моющие компонент и не содержащие фосфата моющие компоненты. В некоторых вариантах осуществления моющий компонент представляет собой фосфатный моющий компонент. В некоторых вариантах осуществления моющий компонент представляет собой не содержащий фосфата моющий компонент. Если присутствуют, моющие компоненты применяются на уровне от 0,1% до 80%, или от 5 до 60%, или от 10 до 50% по весу композиции. В некоторых вариантах осуществления продукт содержит смесь фосфатных и не содержащих фосфата моющих компонентов. Подходящие фосфатные моющие компоненты включают монофосфаты, дифосфаты, трифосфаты или олигомерные полифосфаты, включая соли щелочных металлов таких соединений, включая натриевые соли. В некоторых вариантах осуществления моющий компонент может быть триполифосфатом натрия (STPP). Дополнительно композиция может содержать карбонат и/или цитрат, предпочтительно цитрат, который способствует достижению нейтрального pH композиции по настоящему изобретению. Другие подходящие не содержащие фосфата моющие компоненты включают гомополимеры и сополимеры поликарбоновых кислот и их частично или полностью нейтрализованных солей, мономерных поликарбоновых кислот и гидроксикарбоновых кислот и их солей. В некоторых вариантах осуществления соли упомянутых выше соединений включают аммониевые и/или соли щелочных металлов, т. е. литиевые, натриевые и калиевые соли, включая натриевые соли. Подходящие поликарбоновые кислоты включают ациклические, алициклические, гетероциклические и ароматические карбоновые кислоты, причем в некоторых вариантах осуществления они могут содержать по меньшей мере две карбоксильные группы, которые в каждом случае отделены друг от друга, в некоторых случаях, не более чем двумя атомами углерода.
[0239] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат по меньшей мере одно хелатирующее средство. Приемлемые хелатирующие средства включают в себя без ограничения хелатирующие медь, железо и/или марганец средства и их смеси. В вариантах осуществления, в которых используют по меньшей мере одно хелатирующее средство, чистящие композиции в соответствии с настоящим изобретением содержат от приблизительно 0,1% до приблизительно 15% или даже от приблизительно 3,0% до приблизительно 10% хелатирующего средства по весу данной чистящей композиции.
[0240] В еще некоторых дополнительных вариантах осуществления чистящие композиции, представленные в данном документе, содержат по меньшей мере одну осаждающую добавку. Приемлемые осаждающие добавки включают в себя без ограничения полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, высвобождающие грязь полимеры, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлуазит и их смеси.
[0241] Как указывается в данном документе в некоторых вариантах осуществления средства против повторного осаждения находят применение в некоторых вариантах осуществления настоящего изобретения. В некоторых вариантах осуществления находят применение неионные поверхностно-активные вещества. Например, в вариантах осуществления автоматизированного мытья посуды находят применение неионные поверхностно-активные вещества для целей изменения свойств поверхности, в частности, для защитного покрытия, во избежание образования пленки и пятен и для улучшения блеска. Такие неионные поверхностно-активные вещества также находят применение в предотвращении повторного отложения грязи. В некоторых вариантах осуществления средство против повторного осаждения является неионным поверхностно-активным веществом, известным в уровне техники (см., например, EP 2100949). В некоторых вариантах осуществления неионное поверхностно-активное вещество может представлять собой этоксилированные неионные поверхностно-активные вещества, эпокси-кэппированные поли(оксиалкилированные) спирты и аминоксидные поверхностно-активные вещества.
[0242] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением включают в себя одно или несколько ингибирующих перенос красителя средств. Приемлемые полимерные ингибирующие перенос красителя средства включают в себя без ограничения поливинилпирролидоновые полимеры, полиамин-N-оксидные полимеры, coполимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси. В вариантах осуществления, в которых используют по меньшей мере одно ингибирующее перенос красителя средство, чистящие композиции в соответствии с настоящим изобретением содержат от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,01% до приблизительно 5% или даже от приблизительно 0,1% до приблизительно 3% по весу чистящей композиции.
[0243] В некоторых вариантах осуществления в композиции в соответствии с настоящим изобретением включают силикаты. В некоторых таких вариантах осуществления находят применение силикаты натрия (например, дисиликат натрия, метасиликат натрия и кристаллические филлосиликаты). В некоторых вариантах осуществления силикаты присутствуют на уровне от приблизительно 1% до приблизительно 20%. В некоторых вариантах осуществления силикаты присутствуют на уровне от приблизительно 5% до приблизительно 15% по весу композиции.
[0244] В некоторых других дополнительных вариантах осуществления чистящие композиции в соответствии с настоящим изобретением также содержат диспергаторы. Приемлемые растворимые в воде органические материалы включают в себя без ограничения гомо- или сополимерные кислоты или их соли, при этом поликарбоновая кислота содержит по меньшей мере два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
[0245] В некоторых других вариантах осуществления ферменты, используемые в чистящих композициях, стабилизируют любой приемлемой методикой. В некоторых вариантах осуществления ферменты, используемые в данном документе, стабилизируются присутствием растворимых в воде источников ионов кальция и/или магния в конечных композициях, которые обеспечивают ферменты такими ионами. В некоторых вариантах осуществления стабилизаторы ферментов включают в себя олигосахариды, полисахариды и неорганические соли двухвалентных металлов, в том числе щелочно-земельных металлов, такие как муравьинокислый кальций. Предполагается, что в настоящем изобретении найдут применение различные методики для стабилизации ферментов. Например, в некоторых вариантах осуществления ферменты, используемые в данном документе, стабилизируются присутствием растворимых в воде источников ионов цинка(II), кальция(II) и/или магния(II) в конечных композициях, которые обеспечивают ферменты такими ионами, а также ионами других металлов (например, бария(II), скандия(II), железа(II), марганца(II), алюминия(III), олова(II), кобальта(II), меди(II), никеля(II) и оксованадия(IV)). Хлориды и сульфаты также находят применение в некоторых вариантах осуществления настоящего изобретения. Примеры приемлемых олигосахаридов и полисахаридов (например, декстрины) известны в уровне техники (см., например, WO 07145964). В некоторых вариантах осуществления также находят применение обратимые ингибиторы протеазы, такие как содержащие бор соединения (например, борат, 4-формилфенилбороновая кислота), и/или находит применение трипептидный альдегид для дополнительного улучшения стабильности при необходимости.
[0246] В некоторых вариантах осуществления в композициях в соответствии с настоящим изобретением присутствуют отбеливатели, активаторы отбеливания и/или катализаторы отбеливания. В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат неорганическое(неорганические) и/или органическое(органические) отбеливающее(отбеливающие) соединение(соединения). Неорганические отбеливатели включают в себя без ограничения пергидратные соли (например, перборатные, перкарбонатные, перфосфатные, персульфатные и персиликатные соли). В некоторых вариантах осуществления неорганическими пергидратными солями являются соли щелочных металлов. В некоторых вариантах осуществления включены неорганические пергидратные соли в виде кристаллического твердого вещества, без дополнительной защиты, хотя в некоторых других вариантах осуществления соль покрывают. Любая приемлемая соль, известная в уровне техники, находит применение в настоящем изобретении (см., например, EP 2100949).
[0247] В некоторых вариантах осуществления в композициях в соответствии с настоящим изобретением используют активаторы отбеливания. Активаторами отбеливания, как правило, являются предшественники органических перкислот, которые усиливают отбеливающее действие в ходе очистки при температурах 60°C и ниже. Активаторы отбеливания, приемлемые для применения в данном документе, включают в себя соединения, которые в условиях пергидролиза дают алифатические пероксикарбоновые кислоты, содержащие предпочтительно от приблизительно 1 до приблизительно 10 атомов углерода, в частности, от приблизительно 2 до приблизительно 4 атомов углерода, и/или необязательно замещенную пербензойную кислоту. Дополнительные активаторы отбеливания известны в данной области техники и находят применение в соответствии с настоящим изобретением (см., например, EP 2100949).
[0248] Кроме того, в некоторых вариантах осуществления, и как далее описано в данном документе, чистящие композиции в соответствии с настоящим изобретением дополнительно содержат по меньшей мере один катализатор отбеливания. В некоторых вариантах осуществления находит применение марганца триазациклононан и родственные комплексы, а также комплексы кобальта, меди, марганца и железа. В настоящем изобретении находят применение дополнительные катализаторы отбеливания (см., например, US 4246612, US 5227084, US 4810410, WO9906521 и EP 2100949).
[0249] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат один или несколько комплексов каталитических металлов. В некоторых вариантах осуществления находит применение содержащий металл катализатор отбеливания. В некоторых вариантах осуществления металлический катализатор отбеливания содержит каталитическую систему, содержащую катион переходного металла с определенной каталитической активностью отбеливания (например, катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца), вспомогательный катион металла, обладающий незначительной каталитической активностью, или не обладающий каталитической активностью (например, катионы цинка или алюминия), и секвестрирующее средство с определенными константами стабильности для каталитических и вспомогательных катионов металлов, в частности, используются этилендиаминтетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их растворимые в воде соли (см., например, US № 4430243). В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением катализируются посредством соединения марганца. Такие соединения и уровни применения хорошо известны в данной области техники (см., например, US 5576282). В дополнительных вариантах осуществления кобальтовые катализаторы отбеливания находят применение в чистящих композициях в соответствии с настоящим изобретением. Различные кобальтовые катализаторы отбеливания известны в данной области техники (см., например, USPN 5597936 и 5595967) и их легко получают с помощью известных процедур.
[0250] В некоторых дополнительных вариантах осуществления чистящие композиции в соответствии с настоящим изобретением включают в себя комплекс переходного металла и макрополициклического жесткого лиганда (MRL). С практической точки зрения, а не в качестве ограничения, в некоторых вариантах осуществления композиции и процессы очистки, представленные в настоящем изобретении, корректируют для обеспечения порядка по меньшей мере одной части на сто миллионов активных частиц MRL в водной среде для мытья, а в некоторых вариантах осуществления для обеспечения от приблизительно 0,005 ppm до приблизительно 25 ppm, более предпочтительно от приблизительно 0,05 ppm до приблизительно 10 ppm и более предпочтительно от приблизительно 0,1 ppm до приблизительно 5 ppm MRL в моющей жидкости.
[0251] В некоторых вариантах осуществления переходные металлы в данном катализаторе отбеливания на основе переходных металлов включают в себя без ограничения марганец, железо и хром. MRL также включают в себя без ограничения специальные сверхжесткие лиганды, которые соединяются поперечными мостиками (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан). Подходящие MRL переходных металлов легко получают с помощью известных процедур (см., например, WO 200032601 и US 6225464).
[0252] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат средства для сохранения металла. Средства для сохранения металла находят применение в предотвращении и/или снижении потускнения, коррозии и/или окисления металла, в том числе алюминия, нержавеющей стали и цветных металлов (например, серебра и меди). Приемлемые средства для сохранения металла включают в себя описанные в EP 2100949, WO 9426860 и WO 94/26859). В некоторых вариантах осуществления средством для сохранения металла является соль цинка. В некоторых других вариантах осуществления чистящие композиции в соответствии с настоящим изобретением содержат от приблизительно 0,1% до приблизительно 5% по весу одного или нескольких средств для сохранения металла.
[0253] В некоторых вариантах осуществления чистящая композиция представляет собой жидкую композицию высокой плотности (HDL), содержащую вариантную протеазу клады AprL. Жидкое моющее средство HDL для стирки белья может содержать моющее поверхностно-активное вещество (10%-40% вес/вес), содержащее анионное моющее поверхностно-активное вещество (выбранное из группы линейных, или разветвленных, или со случайной цепью замещенных или незамещенных алкилсульфатов, алкилсульфонатов, алкоксилированного алкилсульфата, алкилфосфатов, алкилфосфонатов, алкилкарбоксилатов и/или их смесей) и необязательно неионное поверхностно-активное вещество (выбранное из группы линейного, или разветвленного, или со случайной цепью замещенного или незамещенного алкоксилированного алкилового спирта, например, этоксилированного C8-C18алкилового спирта и/или C6-C12алкилфенолалкоксилатов), при этом необязательно весовое отношение анионного моющего поверхностно-активного вещество (с индексом гидрофильности (HIc) от 6,0 до 9) к неионному моющему поверхностно-активному веществу составляет более 1:1. Подходящие моющие поверхностно-активные вещества также включают катионные моющие поверхностно-активные вещество (выбранные из группы соединений алкилпиридиния, алкильных соединений четвертичного аммония, алкильных соединений четвертичного фосфония, алкильных соединений третичного сульфония и/или их смесей), цвиттерионные и/или амфотерные моющие поверхностно-активные вещество (выбранные из группы алканоламинсульфобетаинов), амфолитические поверхностно-активные вещество, полуполярные неонионные поверхностно-активные вещество и их смеси.
[0254] Композиция необязательно может содержать усиливающие поверхностно-активные свойства полимеры, состоящие из амфифильных алкоксилированных очищающих грязь полимеров (выбранных из группы алкоксилированных разветвленных полимеров с гидрофильными и гидрофобными свойствами, таких как алкоксилированные полиалкиленамины, в количестве 0,05 вес. %-10 вес. %) и/или статистических привитых полимеров (обычно содержащих гидрофильную основную цепь, включающую мономеры, выбранные из группы, состоящей из ненасыщенных C1-C6карбоновых кислот, простых эфиров, спиртов, альдегидов, кетонов, сложных эфиров, звеньев сахаров, алкокси звеньев, малеинового ангидрида, насыщенных полиспиртов, таких как глицерин, и их смесей; и гидрофобную(гидрофобные) боковую(боковые) цепь(цепи), выбранную(выбранные) из группы, состоящей из: C4-C25алкильной группы, полипропилена, полибутилена, винилового эфира насыщенной C1-C6монокарбоновой кислоты, C1-C6алкилового эфира акриловой или метакриловой кислоты и их смесей.
[0255] Композиция может включать дополнительные полимеры, такие как высвобождающие грязь полимеры (включают полиэфиры с защищенными анионными концами, например, SRP1, полимеры, содержащие по меньшей мере одно мономерное звено, выбранное из сахарида, дикарбоновой кислоты, полиола и их комбинаций, со статистической или блок-конфигурацией, полимеры на основе этилентерефталата и его сополимеры со статистической или блок-конфигурацией, например, Repel-o-tex SF, SF-2 и SRP6, Texcare SRA100, SRA300, SRN100, SRN170, SRN240, SRN300 и SRN325, Marloquest SL), полимеры, препятствующие повторному осаждению (от 0,1 вес. % до 10 вес. %, включая карбоксилатные полимеры, такие как полимеры, содержащие по меньшей мере один мономер, выбранный из акриловой кислоты, малеиновой кислоты (или малеинового ангидрида), фумаровой кислоты, итаконовой кислоты, аконитовой кислоты, мезаконовой кислоты, цитраконовой кислоты, метиленмалоновой кислоты и любой их смеси, винилпирролидоновый гомополимер и/или полиэтиленгликоль с молекулярным весом в интервале от 500 до 100000 Да); полимеры целлюлозы (включая полимеры из алкилцеллюлозы, алкилалкоксиалкилцеллюлозы, карбоксиалкилцеллюлозы, алкилкарбоксиалкилцеллюлозы, примеры которой включают карбоксиметилцеллюлозу, метилцеллюлозу, метилгидроксиэтилцеллюлозу, метилкарбоксиметилцеллюлозу и их смеси) и полимерные карбоксилаты (такие как статический сополимер малеата/акрилата или полиакрилатный гомополимер).
[0256] Композиция может дополнительно содержать насыщенную или ненасыщенную жирную кислоты, предпочтительно насыщенную или ненасыщенную C12-C24жирную кислоту (от 0 вес. % до 10 вес. %); осаждающие добавки (примеры которых включают полисахариды, предпочтительно целлюлозные полимеры, галогениды полидиаллилдиметиламмония (DADMAC) и сополимеры DAD MAC с винилпирролидоном, акриламиды, имидазолы, галогениды имидазолиния и их смеси, со статистической или блок-конфигурацией, катионную гуаровую камедь, катионную целлюлозу, такую как катионную гидроксиэтилцеллюлозу, катионный крахмал, катионные полиакриламиды и их смеси.
[0257] Композиция может дополнительно содержать средства, ингибирующие перенос красителей, примеры которых включают фталоцианин марганца, пероксидазы, поливинилпирролидодновые полимеры, полиамин-N-оксидные полимеры, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и полививнилимидазолы и/или их смеси; хелатирующие средства, примеры которых включают этилендиаминтетрауксусную кислоту (EDTA), диэтилентриаминпентаметиленфосфоновую кислоту (DTPMP), гидроксиэтандифосфоновую кислоту (HEDP), этилендиамин-N,N'-диянтарную кислоту (EDDS), метилглициндиуксусную кислоту (MGDA), диэтилентриаминпентауксусную кислоту (DTPA), пропилендиаминтетрауксусную кислоту (PDT A), 2-гдроксипиридин-N-оксид (HPNO) или метилглициндиуксусную кислоту (MGDA), глутаминовую N,N-диуксусную кислоту (тетранатриевую соль N,N-дикарбоксиметилглутаминовой кислоты, GLDA), нитрилотриуксусную кислоту (NTA), 4,5-дигидрокси-м-бензолдисульфокислоту, лимонную кислоту и любую ее соль, N-гидроксиэтилэтилендиаминтриуксусную кислоту (HEDTA), триэтилентетраамингексауксусную кислоту (TTHA), N-гидроксиэтилиминодиуксусную кислоту (HEIDA), дигидроксиэтилглицин (DHEG), этилендиаминтетрапропионовую кислоту (EDTP) и их производные.
[0258] Композиция может дополнительно содержать ферменты (обычно от приблизительно 0,01 вес% активного фермента до 0,5 вес% активного фермента) выбранные из протеаз; амилаз; липаз; целлюлаз; холиноксидаз; пероксидаз/оксидаз; пектатлиаз; маннаназ; кутиназ; лакказ; фосфолипаз; лизофосфолипаз; ацилтрансферазы; пергидролазы; арилэстеразы и какой-либо их смеси. Композиция может содержать стабилизатор фермента (примеры которых включают полиолы, такие как пропиленгликоль или глицерин, сахар или сахароспирт, молочную кислоту, обратимый ингибитор протеазы, борную кислоту или производное борной кислоты, например, ароматический эфир борной кислоты или производное фенилбороновой кислоты, такое как 4-формилфенилбороновая кислота).
[0259] Композиция может дополнительно содержать пеногасители на основе кремния или жирных кислот; оттеночные красители, катионы кальция и магния, визуальные сигнальные ингредиенты, противовспениватель (от 0,001 вес% до приблизительно 4,0 вес%) и/или структурообразователь/загуститель (от 0,01 вес% до 5 вес%, выбранные из группы, состоящей из диглицеридов и триглицеридов, дистеарата этиленгликоля, микрокристаллической целлюлозы, материалов на основе целлюлозы, микроволоконной целлюлозы, биополимеров, ксантановой камеди, геллановой камеди и их смесей).
[0260] Композиция может быть в любой жидкой форме, например, в форме жидкости или геля или любой их комбинации.
[0261] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением представляют в форме однократной дозы, в том числе таблеток, капсул, саше, пакетов и пакетов с несколькими отделениями. В некоторых вариантах осуществления предусмотрен формат однократной дозы для обеспечения регулируемого высвобождения ингредиентов в многокамерном пакете (или другой формат однократной дозы). Подходящие форматы однократной дозы и контролируемого высвобождения известны в данной области техники (см., например, EP 2100949, WO02102955, US 4765916, US 4972017 и WO04111178 что касается материалов, подходящих для применения в форматах однократной и контролируемого высвобождения). В некоторых вариантах осуществления форма однократной дозы обеспечена таблетками, завернутыми в растворимую в воде пленку или в растворимые в воде пакеты. Примеры различных форматов однократной дозы представлены в EP 2100947 и WO 2013165725.
[0262] В некоторых вариантах осуществления чистящая композиция представляет собой композицию в виде порошка высокой плотности (HDD), содержащую вариантную протеазу клады AprL. Моющее средство HDD для стирки белья в виде порошка может содержать очищающее поверхностно-активное вещество, включая анионные очищающие поверхностно-активные вещества (например, с линейной или разветвленной, или случайной цепью, замещенные или незамещенные алкилсульфаты, алкилсульфонаты, алкоксилированный алкилсульфат, алкилфосфаты, алкилфосфонаты, алкилкарбоксилаты и/или их смеси), неионное очищающее поверхностно-активное вещество (например, с линейной или разветвленной, или случайной цепью, замещенные или незамещенные C8-C18алкилэтоксилаты, и/или C6-C12алкилфенолалкоксилаты), катионные очищающие поверхностно-активные вещества (например, алкилпиримидиновые соединения, алкильные соединения четвертичного аммония, алкильные соединения четвертичного фосфония, алкильные соединения третичного фосфония и их смеси), цвиттерионные и/или амфотерные очищающие поверхностно-активные вещества (например, алканоламинсульфобетаины); амфолитические поверхностно-активные вещества; полуполярные неионные поверхностно-активные вещества и их смеси; моющие компоненты (не содержащие фосфата моющие компоненты (например, цеолитные моющие компоненты, примеры которых включают цеолит A, цеолит X, цеолит P и цеолит MAP в диапазоне от 0 вес% до менее чем 10 вес%); фосфатные моющие компоненты (например, триполифосфат натрия в диапазоне от 0 вес% до менее чем 10 вес%); лимонная кислота, цитратные соли и нитрилотриуксусная кислота или ее соли в диапазоне от менее чем 15 вес%); силикатная соль (например, силикат натрия или калия или метасиликат натрия в диапазоне от 0 вес% до менее чем 10 вес%, или слоистый силикат (SKS-6)); карбонатная соль (например, карбонат натрия и/или бикарбонат натрия в диапазоне от 0 вес% до менее чем 10 вес%); и отбеливающие средства (включая фотоотбеливатели, (например, сульфонированные фталоцианины цинка, сульфонированные фталоцианины алюминия, ксантеневые красители и их смеси); гидрофобные или гидрофильные активаторы отбеливания (например, додеканоил оксибензолсульфонат, деканоил оксибензолсульфонат, деканоил оксибензойная кислота или их соли, 3,5,5-триметилгексаноил оксибензолсульфонат, тетраацетилэтилендиамин-TAED, нонаноилоксибензолсульфонат-NOBS, нитрильные четвертичные соли, и их смеси); источники перекиси водорода (например, неорганические пергидратные соли, примеры которых включают моно- или тетрагидратную натриевую соль пербората, перкарбоната, персульфата, перфосфата или персиликата); готовые гидрофильные и/или гидрофобные перкислоты (например, перкарбоксикислоты и соли, перкарбоновые кислоты и соли, перимидиновые кислоты и соли и пероксимоносульфокислоты и соли) и их смеси и/или катализаторы отбеливания (например, иминовый усилитель отбеливания (например, иминовые катионы и полиионы); иминовые цвиттерионы; модифицированные амины; модифицированные аминоксиды; N-сульфонилимины; N-фосфонилимины; N-ацетилимины; диоксиды тиадиазола; перфторимины; циклические кетоны сахаров и их смеси; и металлсодержащий катализатор отбеливания (например, катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца вместе со вспомогательными катионами металлов, таких как цинк или алюминий и связывающих, таких как этилендиаминтетрауксусная кислота, этилендиаминтетра (метиленфосфоновая кислота) и их водорастворимые соли).
[0263] Композиция может дополнительно содержать ферменты, выбранные из протеаз; амилаз; липаз; целлюлаз; холиноксидаз; пероксидаз/оксидаз; пектатлиаз; маннаназ; кутиназ; лакказ; фосфолипаз; лизофосфолипаз; ацилтрансферазы; пергидролазы; арилэстеразы и какой-либо их смеси.
[0264] Кроме того, композиция может содержать дополнительные моющие ингредиенты, в том числе микрокапсулы отдушки, смеси отдушек в оболочке из крахмала, оттеночные средства, дополнительные полимеры, включающие в себя полимеры для прочности ткани и катионные полимеры, ингредиенты, закрепляющие краситель, мягчители ткани, осветители (например, C.I. флуоресцентные осветители), флоккулянты, хелатирующие средства, алкоксилированные полиамины, добавки для осаждения на ткани и/или циклодекстрин.
[0265] В некоторых вариантах осуществления чистящая композиция представляет собой моющую композицию для автоматического мытья посуды (ADW), содержащую вариантную протеазу клады AprL. Моющее средство для ADW может содержать два или более неионных поверхностно-активных веществ, выбранных из группы этоксилированных неионных поверхностно-активных веществ, спиртовых алкоксилированных поверхностно-активных веществ, эпокси-кэппированных поли(оксиалкилированных) спиртов или аминоксидных поверхностно-активных веществ, присутствующих в количествах от 0 до 10% по весу; моющих компонентов в диапазоне 5-60%, либо содержащих фосфат (монофосфатов, дифосфатов, триполифосфатов или олигомерных полифосфатов, предпочтительно натрия триполифосфата-STPP), либо бесфосфатных моющих компонентов [соединений на основе аминокислот, примеры которых включают в себя MGDA (метил-глицин-диуксусную кислоту), а также ее соли и производные, GLDA (глутамин-N,N-диуксусную кислоту), а также ее соли и производные, IDS (иминодиянитарную кислоту), а также ее соли и производные, карбоксиметилинулин, а также его соли и производные, и их смеси, нитрилотриуксусную кислоту (NTA), диэтилентриаминпентауксусную кислоту (DTPA), B-анилиндиуксусную кислоту (B-ADA) и ее соли], гомополимеров и coполимеров поликарбоновых кислот и их частично или полностью нейтрализованных солей, мономерных поликарбоновых кислот и гидроксикарбоновых кислот, а также их солей в диапазоне от 0,5% до 50% по весу; сульфонатных/карбоксилированных полимеров (обеспечивающих размерную стабильность продукта) в диапазоне от приблизительно 0,1% до приблизительно 50% по весу; добавок для сушки в диапазоне от приблизительно 0,1% до приблизительно 10% по весу (выбранных из сложных полиэфиров, особенно анионных сложных полиэфиров, необязательно вместе с дополнительными мономерами с 3-6 функциональными группами, которые обеспечивают поликонденсацию, особенно функциональными группами кислоты, спирта или сложного эфира, поликарбонатных, полиуретановых и/или полемочевина-полиорганосилоксановых соединений или их соединений-предшественников типа реакционноспособного циклического карбоната и мочевины); силикатов в диапазоне от приблизительно 1% до приблизительно 20% по весу (силикатов натрия или калия, например, дисиликата натрия, метасиликата натрия и кристаллических филлосиликатов); отбеливателя неорганического (например, солей пергидрата, таких как перборатные, перкарбонатные, перфосфатные, персульфатные и персиликатные соли) и органического (например, органических пероксикислот, в том числе диацил- и тетраацилпероксидов, особенно дипероксидодекандионовой кислоты, диперокситетрадекандионовой кислоты и дипероксигексадекандионовой кислоты); активаторов отбеливания - предшественников органических перкислот в диапазоне от приблизительно 0,1% до приблизительно 10% по весу; катализаторов отбеливания (выбранных из марганца триазациклононана и родственных комплексов, Co, Cu, Mn и Fe биспиридиламина и родственных комплексов, а также пентаминацетата кобальта(III) и родственных комплексов); средств по уходу за металлом в диапазоне от приблизительно 0,1% до 5% по весу (выбранных из бензатриазолов, солей, и комплексов, и/или силикатов металлов); ферментов в диапазоне от приблизительно 0,01 до 5,0 мг активного фермента на грамм моющей композиции для автоматического мытья посуды (ацилтрансферазы, альфа-амилазы, бета-амилазы, альфа-галактозидазы, арабинозидазы, арилэстеразы, бета-галактозидазы, каррагиназы, каталазы, целлобиогидролазы, целлюлазы, хондроитиназы, кутиназы, эндо-бета-1,4-глюканазы, эндо-бета-маннаназы, эстеразы, экзо-маннаназы, галактаназы, глюкоамилазы, гемицеллюлазы, гиалуронидазы, кератиназы, лакказы, лактазы, лигниназы, липазы, липоксигеназы, маннаназы, оксидазы, пектатлиазы, пектинацетилэстеразы, пектиназы, пентозаназы, пероксидазы, фенолоксидазы, фосфатазы, фосфолипазы, фитазы, полигалактуроназы, протеазы, пуллуланазы, редуктазы, раммогалактуроназы, бета-глюканазы, танназы, трансглутаминазы, ксиланацетилэстеразы, ксиланазы, ксилоглюканазы и ксилозидазы и любая их смесь); и компоненты стабилизатора фермента (выбранные из олигосахаридов, полисахаридов и неорганических солей двухвалентных металлов).
[0266] Как указывается выше, чистящие композиции в соответствии с настоящим изобретением составляют в любой приемлемой форме и получают с помощью любого выбранного разработчиком составов процесса, неограничивающие примеры которого описаны в USPN 5879584; 5691297; 5574005; 5569645; 5516448; 5489392 и 5486303. В некоторых вариантах осуществления, в которых желательна чистящая композиция с низким pH, pH такой композиции регулируют путем добавления кислотного вещества, такого как HCl.
[0267] Чистящие композиции, раскрытые в данном документе, находят применение в чистке местоположения (например, поверхности, предмета, посуды или ткани). Как правило, по меньшей мере часть местоположения контактирует с вариантом осуществления чистящей композиции в соответствии с настоящим изобретением, в чистой форме или растворенной в моющей жидкости, а затем местоположение необязательно промывают и/или ополаскивают. Для целей настоящего изобретения "мытье" включает в себя без ограничения очистку и механическое перемешивание. В некоторых вариантах осуществления чистящие композиции, как правило, используются при концентрациях от приблизительно 500 ppm до приблизительно 15000 ppm в растворе. Если моющим растворителем является вода, то температура воды, как правило, варьирует от приблизительно 5˚C до приблизительно 90˚C, и если местоположение включает ткань, то отношение воды к массе ткани, как правило, составляет от приблизительно 1:1 до приблизительно 30:1.
Способы получения и применения чистящих композиций
[0268] Чистящие композиции по настоящему изобретению составляют в любой подходящей форме и получают любым подходящим способом, выбранным специалистом в области составления (см., например, USPN 5879584; 5,691,297; 5,574,005; 5,569,645; 5,565,422; 5,516,448; 5,489,392; 5,486,303; 4,515,705; 4,537,706; 4,515,707; 4,550,862; 4,561,998; 4,597,898; 4,968,451; 5,565,145; 5,929,022; 6,294,514 и 6376445).
Способы применения
[0269] В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением находят применение при очистке поверхностей (например, посуды), белья, твердых поверхностей, контактных линз и т.п. В некоторых вариантах осуществления по меньшей мере часть поверхности приводят в контакт по меньшей мере с одним вариантом осуществления чистящих композиций в соответствии с настоящим изобретением, в чистой форме или растворенных в моющей жидкости, а затем поверхность необязательно промывают и/или ополаскивают. Для целей настоящего изобретения "мытье" включает в себя без ограничения очистку и механическое мытье. В некоторых вариантах осуществления чистящие композиции в соответствии с настоящим изобретением используются при концентрациях от приблизительно 500 ppm до приблизительно 15000 ppm в растворе. В некоторых вариантах осуществления, в которых моющим растворителем является вода, температура воды, как правило, варьирует от приблизительно 5°C до приблизительно 90°C.
[0270] В настоящем изобретении предусмотрены способы очистки или мытья предмета или поверхности (например, твердой поверхности), нуждающихся в очистке, в том числе без ограничения способы очистки или мытья предмета столовой посуды, предмета столовой утвари, предмета из ткани, предмета белья, предмета личной гигиены и т.д. или подобного, а также способы очистки или мытья твердой или мягкой поверхности (например, твердой поверхности предмета).
[0271] В некоторых вариантах осуществления настоящее изобретение предусматривает способ очистки предмета, объекта или поверхности, нуждающихся в очистке, при этом способ предусматривает приведение предмета или поверхности (или части предмета или поверхности, подлежащих очистке) в контакт по меньшей мере с одной вариантной протеазой клады AprL в соответствии с настоящим изобретением или с композицией в соответствии с настоящим изобретением в течение достаточного времени и/или при условиях, приемлемых и/или эффективных для очистки предмета, объекта или поверхности до необходимой степени. Некоторые такие способы дополнительно предусматривают ополаскивание предмета, объекта или поверхности водой. Для некоторых таких способов чистящей композицией является моющая композиция для мытья посуды, а предметом или объектом, подлежащим очистке, является предмет столовой посуды или предмет столовой утвари. Как используется в данном документе, "предметом столовой посуды" является предмет, обычно используемый при подаче или приеме пищи. Предметом посуды может быть без ограничения, например, блюдо, тарелка, чашка, пиала и т.д., а также подобное. Как используется в данном документе, "столовая утварь" является более широким термином, который включает в себя без ограничения, например, блюда, столовые приборы, ножи, вилки, ложки, палочки для еды, приборы из стекла, кувшины, соусники, сосуды для алкогольных напитков, предметы подачи и т.п. Предполагается, что "предмет столовой утвари" включает в себя любой из этих или подобных предметов для подачи или приема пищи. Для некоторых таких способов чистящей композицией является моющая композиция для автоматического мытья посуды или моющая композиция для ручного мытья посуды, а предметом или объектом, подлежащим очистке, является предмет столовой посуды или столовой утвари. Для некоторых таких способов чистящей композицией является моющая композиция для стирки белья (например, порошковая моющая композиция для стирки или жидкая моющая композиция для стирки), а предметом, подлежащим очистке является предмет из ткани. В некоторых других вариантах осуществления чистящей композицией является композиция для предварительной обработки перед стиркой.
[0272] В некоторых вариантах осуществления настоящее изобретение предусматривает способы очистки или мытья предмета из ткани, необязательно нуждающегося в очистке или мытье, соответственно. В некоторых вариантах осуществления способы предусматривают обеспечение композиции, содержащей вариантную протеазу, в том числе без ограничения чистящей композиции для ткани или белья, а также предмета из ткани или предмета белья, нуждающихся в очистке, и приведение предмета из ткани или предмета белья (или части предмета, нуждающегося в очистке) в контакт с композицией при условиях, достаточных или эффективных для очистки или мытья предмета из ткани или предмета белья до необходимой степени.
[0273] В некоторых вариантах осуществления настоящее изобретение предусматривает способ очистки или мытья предмета или поверхности (например, твердой поверхности), необязательно нуждающихся в очистке, при этом способ предусматривает обеспечение предмета или поверхности, подлежащих очистке или мытью, и приведение предмета или поверхности (или части предмета или поверхности, нуждающихся в очистке или мытье), в контакт по меньшей мере с одним вариантом клады AprL в соответствии с настоящим изобретением или с композицией в соответствии с настоящим изобретением, содержащей по меньшей мере один такой вариант клады AprL, в течение достаточного времени и/или при условиях, достаточных или эффективных для очистки или мытья предмета или поверхности до необходимой степени. Такие композиции включают в себя без ограничения, например, чистящую композицию или моющую композицию в соответствии с настоящим изобретением (например, моющую композицию для ручного мытья посуды, чистящую композицию для ручного мытья посуды, моющее средство для белья, или моющее средство для ткани, или чистящую композицию для белья или для ткани, жидкое моющее средство для стирки, жидкую чистящую композицию для стирки, порошковую моющую композицию для стирки, порошковую чистящую композицию для стирки, моющую композицию для автоматического мытья посуды, чистящую или моющую композицию с усилителем для стирки, чистящую добавку для стирки, композицию для стирки с предварительным замачиванием и т.п.). В некоторых вариантах осуществления способ повторяют один или несколько раз, особенно, если желательны дополнительные очистка или мытье. Например, в некотором случае способ необязательно дополнительно предусматривает обеспечение пребывания предмета или поверхности в контакте по меньшей мере с одной вариантной протеазой или композицией в течение периода времени, достаточного или эффективного для очистки или мытья предмета или поверхности до необходимой степени. В некоторых вариантах осуществления способы дополнительно предусматривают ополаскивание предмета или поверхности водой и/или другой жидкостью. В некоторых вариантах осуществления способы дополнительно предусматривают приведение предмета или поверхности в контакт по меньшей мере с одной вариантной протеазой в соответствии с настоящим изобретением или с композицией в соответствии с настоящим изобретением снова и обеспечивают сохранение предмета или поверхности в контакте по меньшей мере с одной вариантной протеазой или композицией в течение периода времени, достаточного для очистки или мытья предмета или поверхности до необходимой степени. В некоторых вариантах осуществления чистящей композицией является моющая композиция для мытья посуды, и предметом, подлежащим очистке, является предмет посуды или столовой утвари. В некоторых вариантах осуществления способов в соответствии с настоящим изобретением чистящей композицией является моющая композиция для автоматического мытья посуды или моющая композиция для ручного мытья посуды, и предметом, подлежащим очистке, является предмет посуды или столовой утвари. В некоторых вариантах осуществления способов чистящей композицией является моющая композиция для стирки белья, и предметом, подлежащим очистке, является предмет из ткани.
[0274] В настоящем изобретении также предусмотрены способы очистки предмета столовой утвари или посуды в автоматической посудомоечной машине, при этом способ предусматривает обеспечение автоматической посудомоечной машины, помещение определенного количества композиции для автоматического мытья посуды, содержащей по меньшей мере один вариант клады AprL в соответствии с настоящим изобретением или композиции в соответствии с настоящим изобретением, достаточного для очистки предмета столовой утвари или посуды в машине (например, путем помещения композиции в соответствующее или предусмотренное отделение для моющего средства или распределительное устройство в машине), укладывание предмета посуды или столовой утвари в машину и функционирование машины для очистки предмета столовой утвари или посуды (например, согласно инструкциям изготовителя). В некоторых вариантах осуществления способы предусматривают любую композицию для автоматического мытья посуды, описанную в данном документе, которая содержит без ограничения по меньшей мере один вариант клады AprL, представленный в данном документе. Количество используемой композиции для автоматического мытья посуды можно легко определить согласно инструкциям или указаниям производителя и можно использовать любую форму композиции для автоматического мытья посуды, содержащей по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением (например, жидкую, порошковую, твердую, гелевую, таблеточную и т.п.), в том числе любую описанную в данном документе.
[0275] В настоящем изобретении также предусмотрены способы очистки поверхности, предмета или объекта, необязательно нуждающихся в очистке, при этом способ предусматривает приведение предмета или поверхности (или части предмета или поверхности, нуждающихся в очистке) в контакт по меньшей мере с одним вариантом клады AprL в соответствии с настоящим изобретением или чистящей композицией в соответствии с настоящим изобретением, в чистой форме или растворенной в моющей жидкости, в течение достаточного времени и/или при условиях, достаточных или эффективных для очистки или мытья предмета или поверхности до необходимой степени. Затем поверхность, предмет или объект может быть (необязательно) промыт и/или ополоснут при необходимости. Для целей настоящего изобретения "мытье" включает без ограничения, например, очистку щеткой и механическое перемешивание. В некоторых вариантах осуществления чистящие композиции используют при концентрациях от приблизительно 500 ppm до приблизительно 15000 ppm в растворе (например, водном растворе). Если моющий растворитель представляет собой воду, температура воды, как правило, варьирует от приблизительно 5˚C до приблизительно 90˚C.
[0276] В настоящем изобретении также предусмотрены способы очистки предмета белья или предмета из ткани в стиральной машине, при этом способ предусматривает обеспечение наличия стиральной машины, помещение количества моющей композиции для стирки, содержащей по меньшей мере один вариантный фермент клады AprL в соответствии с настоящим изобретением, достаточного для очистки предмета белья или предмета из ткани в машине (например, путем помещения композиции в соответствующее или предусмотренное отделение для моющего средства или распределительное устройство в машине), помещение предмета белья или предмета из ткани в машину и функционирование машины для очистки предмета белья или предмета из ткани (например, согласно инструкциям изготовителя). Способы в соответствии с настоящим изобретением предусматривают любую моющую композицию для стирки белья, описанную в данном документе и содержащую без ограничения по меньшей мере один вариантный фермент клады AprL, представленный в данном документе. Количество используемой моющей композиции для стирки белья можно легко определить согласно инструкциям или указаниям производителя, и можно использовать любую форму моющей композиции для стирки, содержащей по меньшей мере одну вариантную протеазу в соответствии с настоящим изобретением (например, твердую, порошковую, жидкую, таблетированную, гелевую и т.п.), в том числе любую описанную в данном документе.
[0277] Иллюстративные моющие составы, которые преимущественно включают полипептид сериновой протеазы по настоящему изобретению, включают составы моющих средств, которые можно найти в WO2013063460, страницы 78-152 и, в частности, в таблицах на страницах с 94 по 152, включенные в данный документ посредством ссылки. Сериновые протеазы обычно включены в моющую композицию на уровне от 0,00001% до 10% белка-фермента по весу композиции. В некоторых вариантах осуществления моющая композиция содержит более чем 0,0001%, 0,001%, 0,01% или 0,1% сериновой протеазы по весу композиции. В некоторых вариантах осуществления моющая композиция содержит менее чем 1%, 0,1%, 0,01% или 0,001% сериновой протеазы по весу композиции.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в кормах для животных
[0278] В дополнительном аспекте настоящего изобретения полипептиды протеаз клады AprL по настоящему изобретению можно применять в качестве компонента композиции корма для животных, добавки в корм для животных и/или корма для домашних животных, содержащей протеазы клады AprL и их варианты. Настоящее изобретение дополнительно относится к способу получения такой композиции корма для животных, добавки в корм для животных и/или корма для домашних животных, включающему смешивание полипептида протеазы клады AprL с одним или несколькими ингредиентами корма для животных и/или ингредиентами добавки в корм для животных и/или ингредиентами корма для домашних животных. Более того, настоящее изобретение относится к применению полипептида протеазы клады AprL в получении композиции корма для животных и/или композиция добавки в корм для животных и/или корм для домашних животных.
[0279] Термин "животное" включает всех жвачных и нежвачных животных. В конкретном варианте осуществления животное является нежвачным животным, таким, как лошадь и животное с однокамерным желудком. Примеры животного с однокамерным желудком включают без ограничения свиней и боровов, таких, как поросята, растущих свиней, свиноматок, птицу, такую, как индюшки, утки, куры, бройлерные цыплята, несушки, рыбу, такую, как лосось, форель, тилапия, сомы и карпы, ракообразные, такие, как креветки. В дополнительном варианте осуществления животное представляет собой жвачное животное, включая без ограничения крупный рогатый скот, молодых телят, коз, овец, жирафов, бизонов, лосей, элков, яков, индийских буйволов, оленей, верблюдов, альпак, лам, антилоп, вилорогов и нилгай.
[0280] В настоящем контексте предполагается, что термин "корм для животных" означают корм для домашних животных, таких, как, без ограничения, собаки, кошки, песчанки, хомяки, шиншиллы, необычные крысы, морские свинки; домашние птицы, такие, как канарейки, длиннохвостые попугаи и попугаи; домашние рептилии, такие, как черепахи, ящерицы и змеи; водные домашние животные, такие, как тропические рыбки и лягушки.
[0281] Термины "композиция корма для животных", "корм" и "корм для скота" используются взаимозаменяемо и могут включать один или несколько кормовых материалов, выбранных из группы, состоящей из a) злаков, таких, как мелкое зерно (например, пшеница, ячмень, рожь, овес их комбинации), и/или крупное зерно, такое, как кукуруза или сорго; b) побочных продуктов злаков, таких, как мука кукурузной клейковины, отогнанные сухие растворимые вещества зерна (Distillers Dried Grain Solubles, DDGS) (особенно отогнанные сухие растворимые вещества зерна на основе кукурузы (cDDGS), пшеничные отруби, второсортная пшеница, смесь отрубей и пшеницы грубого помола, рисовые отруби, рисовая шелуха, овсяная шелуха, пальмовых орехов и пульпы цитрусовых; c) белка, полученного из таких источников, как соя, подсолнечник, арахис, люпин, горох, конские бобы, хлопок, канола, рыбная мука, сухой белок плазмы, мясная и костная мука, картофельный белок, сыворотка, копра, кунжут; d) масел и жиров, полученных из овощных и животных источников; e) минералы и витамины.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в расшлихтовке текстиля
[0282] Также рассматриваются композиции и способы обработки ткани (например, для расшлихтовки текстиля) с применением полипептида протеазы клады AprL по настоящему изобретению. Способы обработки ткани хорошо известны в данной области техники (см. например, US 6077316). Например, тактильное ощущение от ткани и ее внешний вид могут быть улучшены с помощью способа, включающего приведение в контакт ткани с протеазой клады AprL в растворе. Ткань можно обрабатывать раствором под давлением.
[0283] Протеаза клады AprL по настоящему изобретению может применяться во время или после плетения ткани, или на стадии расшлихтовки, или на одной или нескольких дополнительных стадиях обработки ткани. При плетении текстиля нити подвергаются значительному механическому напряжению. Перед плетением на механических ткацких станках нити основы часто покрывают крахмальным аппретом или производными крахмала для повышения прочности на растяжение и для предотвращения разрыва. Протеазы клады AprL по настоящему изобретению можно применять во время или после плетения для удаления крахмального аппрета или производных крахмала. После плетения протеазу клады AprL можно применять для удаления аппрета перед дальнейшей обработкой ткани для обеспечения однородного, устойчивого к стирке результата.
[0284] Протеазу клады AprL по настоящему изобретению можно применять одну или с другими химическими реагентами расшлихтовки и/или ферментами для расшлихтовки ткани, включая ткани, содержащие хлопок, в качестве добавок к моющему средству, например, в водных композициях. Амилазу также можно применять в композициях для получения "застиранного" (stonewashed) эффекта на крашеных индиго джинсовых тканях и способов его получения. В производстве одежды ткань может быть раскроена и сшита в швейные изделия, на которых затем получают требуемую отделку. В частности, в производстве джинсов из джинсовой ткани разработаны различные ферментативные способы окончательной отделки. Конечную отделку джинсовых швейных изделий начинают со стадии ферментативной расшлихтовки, при которой швейные изделия подвергают действию протеолитических ферментов для придания ткани мягкости и для того, чтобы сделать хлопок более восприимчивым для последующих стадий ферментативной окончательной отделки. Протеазу клады AprL можно применять в способах окончательной отделки джинсовых швейных изделий (например, в "способе био-застирывания"), ферментативной расшлихтовке и придания мягкости тканям и/или способах окончательной отделки.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в отбеливании бумажной массы
[0285] Полипептиды протеаз клады AprL, описанные в данном документе, находят дополнительное применение в ферментативно-опосредованном отбеливании бумажной массы, такой как химическая масса, полухимическая масса, крафт-масса, механическая масса или масса, полученная сульфитным способом. В общих чертах, бумажную массу инкубируют с полипептидом протеазы клады AprL по настоящему изобретению при условиях подходящих для отбеливания бумажной массы.
[0286] В некоторых вариантах осуществления масса представляет собой бесхлорную массу, отбеленную кислородом, озоном, пероксидом или пероксикислотами. В некоторых вариантах осуществления полипептиды протеаз клады AprL применяются в ферментативно-опосредованном отбеливании массы, полученной путем модифицированных или продолжительных способов получения массы, которые имеют низкое содержание лигнина. В некоторых других вариантах осуществления полипептиды протеаз клады AprL применяются в чистом виде или предпочтительно в сочетании с ферментами ксиланазами и/или эндоглюконазами, и/или альфа-галактозидазами, и/или целлобиогидролазами.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в разрушении белка
[0287] Полипептиды протеаз клады AprL, описанные в данном документе, находят дополнительное применение в ферментативно-опосредованном удалении животных белков и их последующем разрушении или утилизации, таких как перья, кожа, волосы, шкура и т.п. В некоторых случаях погружение туши животного в раствор, содержащий полипептид протеазы клады AprL по настоящему изобретению может действовать в качестве защиты кожи от повреждения по сравнению с традиционным погружением в воду для обваривания или процессом удаления перьев. В одном варианте осуществления перья можно опрыскать выделенным пептидом металлопротеазы по настоящему изобретению при условиях, подходящих для расщепления или инициации процесса разрушения оперения. В некоторых вариантах осуществления протеазу клады AprL по настоящему изобретению можно применять, как указано выше, в сочетании с окисляющим средством.
[0288] В некоторых вариантах осуществления удалению масла и жира, связанного с сырыми перьями, способствует применение полипептида протеазы клады AprL по настоящему изобретению. В некоторых вариантах осуществления полипептиды протеаз клады AprL применяются в композиции для очистки перьев а также для санации и частичной дегидратации волокон. В некоторых других вариантах осуществления полипептиды протеаз клады AprL применяются в моющем растворе в сочетании с 95% этанолом или другим полярным органическим растворителем с использованием или без поверхностно-активного вещества при приблизительно 0,5% (об./об.).
[0289] В еще других вариантах осуществления раскрытые полипептиды протеаз клады AprL находят применение в извлечении белка из оперения. Раскрытые полипептиды протеаз клады AprL могут применяться в чистом виде или в сочетании с другими ферментами или предварительными обработками, такими как тепло и давление, в подходящих способах обработки перьев и протеолитических способах, таких как раскрытые в PCT/EP2013/065362, PCT/EP2013/065363, и PCT/EP2013/065364, которые включены в данный документ посредством ссылки. В некоторых вариантах осуществления извлеченный белок может в последствии применяться для корма для животных и рыб.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в очистке тканей
[0290] Полипептиды протеаз клады AprL, описанные в данном документе, находят дополнительное применение в ферментативно-опосредованной очистке тканей. Это включает удаление мертвой или поврежденной ткани, например, удаление из для содействия заживлению.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в культуре тканей
[0291] Полипептиды протеаз клады AprL, описанные в данном документе находят дополнительное применение в культуре тканей. В частности, протеазы клады AprL по настоящему изобретению можно применять для суспендирования или ресуспендирования клеток налипших на стенку клеточной культуры, как во время процесса сбора клеток. Протеазы клады AprL по настоящему изобретению можно применять для расщепления белковых связей между культивируемыми клетками и посудой, позволяя суспендировать клетки в растворе.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в пищевых целях
[0292] Полипептиды протеаз клады AprL, описанные в данном документе находят дополнительное применение в качестве пищевой добавки, средства, способствующее пищеварению или переработке пищевых продуктов.
Полипептиды протеаз клады AprL по настоящему изобретению для применения в обработке кожи
[0293] Полипептиды протеаз клады AprL, описанные в данном документе, находят дополнительное применение в обработке кожи путем удаления волос со шкур животных, замачивания, обезжиривания или протравливания, которое является процессом, включающим разрушение неструктурных белков при изготовлении кожи.
ПРИМЕР 1
Количественные анализы
[0294] Следующий анализы являются стандартными анализами, используемыми в описанных ниже примерах. Иногда конкретные протоколы требуют отклонений от этих стандартных анализов. В таких случаях в примерах указаны отклонения от протоколов таких стандартных анализов, приведенных ниже.
Показатель продуктивности
[0295] Индекс продуктивности (PI) фермента позволяет сравнить продуктивность варианта (измеренное значение) с исходным ферментом (теоретическое значение или измеренное значение) при одинаковой концентрации белка. Теоретические концентрации для исходного фермента можно вычислить с применением параметров, полученных из сглаживания по Ленгмюру стандартной кривой для исходного фермента. PI больше 1 (PI>1) указывает на улучшенную продуктивность варианта по сравнению с исходным (например, зрелым беком AprL, SEQ ID NO: 2), при этом PI 1 (PI=1) определяет вариант, который действует так же, как и исходный, и PI, составляющий менее 1 (PI<1) определяет вариант, который действует хуже, чем исходный.
Анализ по определению белка
[0296] Определение концентрации белка проводили с применением способа высокоэффективной жидкостной хроматографии (HPLC) для измерения интегральной площади пика для супернатантов, полученных из культур, выращенных в 96-луночных микротитровальных планшетах (MTP). Применяли приборы для HPLC Agilent 1200 или 1260, оснащенные эксклюзионными колонками Acquity UPLC BEH 125 SEC (Waters). Образец элюировали из колонки с применением 25 мМ натрий-фосфатного буфера с pH 6,8, содержащего 250 мМ хлорида натрия. Поглощение измеряли при 220 нм, и интегрировали пики с применением программного обеспечения ChemStation (Agilent Technologies). Концентрацию белка в образцах вычисляли из стандартной кривой очищенного исходного фермента.
Протеазная активность
[0297] Протеазную активность протеазы AprL и ее вариантов тестировали путем измерения степени гидролиза субстратов N-suc-AAPF-pNA или диметилказеина (DMC). Для анализа AAPF применялись растворы реагентов: 100 мМ Tris с pH 8,6, 10 мМ CalCl2, 0,005% Tween®-80 (Tris /Ca-буфер) и 160 мМ suc-AAPF-pNA в DMSO (исходный раствор suc-AAPF-pNA) (Sigma: S-7388). Для приготовления рабочего раствора 1 мл исходного раствора suc-AAPF-pNA добавляли к 100 мл Tris /Ca-буфера и перемешивали. Образец фермента добавляли к MTP (Greiner 781101), содержащим 1 мг/мл рабочего раствора suc-AAPF-pNA и анализировали на приедмет активности при 405 нм в течение 3 мин. с применением планшет-ридера SpectraMax в кинетическом режиме при RT. Протеазную активность выражали в мOD*мин-1.
[0298] Для DMC-анализа применяли растворы реагентов: 2,5% диметилказеин (DMC, Sigma) в 100 мМ карбоната натрия с pH 9,5, 0,075% TNBSA (2,4,6-тринитробензолсульфоновая кислота, Thermo Scientific) в реагенте А. Реагент A: 45,4 г Na2B4O7.10H20 (Merck) в 15 мл 4N NaOH для достижения конечного объема 1000 мл в воде MQ, раствор для разведения: 10 ммоль NaCl, 0,1 ммоль CaCl2, 0,005% Tween-80, 0,02% Na-азид. MTP (Greiner PS-планшет на 384 микролунок) после добавления 2,5 мкл 20 ppm супернатанта с протеазой наполняли 47,5 мкл субстрата DMC. Затем добавляли 50 мкл TNBSA в реагенте А при медленном перемешивании. Активность измеряли при 405 нм в течение 5 мин. с применением планшет-ридера SpectraMax в кинетическом режиме при RT. Как указано выше для анализа AAPF, активность выражали в мOD*мин.
Общая выборка образцов для анализов стабильности
[0299] Варианты испытывали на стабильность при различных стрессовых условиях (буферы и моющие средства, как указано в таблице ниже) путем измерения остаточной активности после инкубации при повышенной температуре. Повышенная температура была отрегулирована для достижения примерно 30% остаточной активности подвергнутого стрессу образца по сравнению с не подвергавшимся стрессу образцом. Растворенный образец фермента перемешивали в стрессоре и измеряли протеазную активность без стресса. Разведенный образец в стрессоре инкубировали при повышенной температуре, после чего измеряли активность подвергнутой стрессу протеазы по гидролизу либо AAPF, либо DMC.
[0300] Условия анализа стабильности описаны в таблице 1 ниже, моющие средства инактивировали перед применением в анализах стабильности:
[0301] В случае нестрессового условия фермент сразу же анализировали в отношении активности с использованием AAPF или DMC (см. выше). В случае стрессового условия ПЦР-планшет запечатывали и инкубировали при повышенной температуре в течение 5 мин. с применением амплификатора 385 MasterCycler Pro от Eppendorf, затем анализировали на предмет активности. Активность в стрессовых и нестрессовых условиях измеряли либо по гидролизу синтетического субстрата, либо с помощью способа с использованием DMC, как описано выше. % остаточной активности вычисляли путем определения соотношения активности в стрессовых и нестрессовых условиях и умножения его на 100. PI для стабильности получали путем деления значения остаточной активности варианта на таковое для дикого типа.
Продуктивность очистки в случае моющих средств для стирки и атоматического мытья посуды
[0302] Варианты тестировали в отношении продуктивности очистки по сравнению с AprL дикого типа на BMI (кровь/молоко/чернила на хлопке) на микрообразцах ткани (EMPA-116) для применения в стирке и на яичном желтке (яичный желток на полиакриловой ткани, состаренной и окрашенной красителем "черный угольный") на микрообразцах ткани (PAS-38) для применения для мытья посуды. Заранее перфарированные (для размещения на MPT), промытые и заполненные, содержащие микрообразцы ткани, планшеты (Corning 3641) готовились Центром материалов для испытаний BV. Влаардинген, Нидерланды. Планшеты с микрообразцами ткани наполняли моющим средством перед добавлением фермента. Коммерческие моющие средства термоинактивировали для устранения ферментативной активности и дозировали, как описано в таблице 2.
[0303] Обработка моющих средств для инактивации фермента представляла собой следующее: Моющие средства HDL для стирки белья инактивировали путем нагревания жидкости в чистом виде до 95°C в течение 16 часов на водяной бане. Протеазную активность анализировали после инактивации с применением AAPF-субстрата для обеспечения полной инактивации. Моющие средства HDD для стирки белья инактивировали путем получения 10X концентрированного раствора, по сравнению с таковым, применяемым в анализе с окончательной очисткой, и нагревания в течение 16 часов при 95oC. Протеазную активность анализировали после инактивации с применением AAPF-субстрата. После 16 часов нагревания протеазная активность обоих моющих средств HDD и HDL отсутствовала. В таблице 3 представлена композиция моющего средства ADW GSM-B pH 10,5 (приобретенного у WFK Testgewebe GmbH, Брюгген, Германия, www.testgewebe.de)
*pH был установлен для тех моющих средств, для которых было получено значение, и не установлен для обозначенных ND. Источники моющего средства: Kirkland Ultra и Kirkland Ultraclean (Sun Products), OMO Color и OMO Klein & Krachtig, Surf Excel (Unilever) и Blue Moon (Guangzhou Blue Moon) приобретены в местных супермаркетах в 2012 году.
[0304] Аликвоты фермента добавляли в заполненные моющим средством планшеты с микрообразцами ткани для достижения конечного объема 200 мкл для анализов, связанных со стиркой, с конечной концентрацией фермента от 5 до 0,5 ppm Анализы очистки при стирке составами HDL или HDD проводили при 25°C в течение 15-20 мин., а анализы автоматического мытья посуды (ADW) проводили при 40°C в течение 30 мин. После инкубации 100 мкл супернатанта переносили в новый MTP (Costar 9017) и считывали поглощение при 600 нм для образцов ткани EMPA-116 или при 405 нм для образцов ткани PAS-38 с применением планшет-ридера SpectraMax. Результаты поглощения получали путем вычитания значения для имитирующего контроля (без фермента) из каждого значения для образца. PI очистки для каждого условия анализа получали путем деления значений поглощения для данного варианта на предварительно определенное значение для дикого типа при той же концентрации. Значение для дикого типа устанавливали путем сглаживания стандартной кривой очищенного исходного до сглаживания Ленгмюра.
ПРИМЕР 2
Создание библиотеки оценки сайта (SEL) протеазы AprL
[0305] Синтетический ген, кодирующий последовательность AprL, синтезировали в GeneArt, Life Technologies и клонировали в вектор экспрессии "pHYT" (полученный из pHY300PLK (Takara)). Вектор экспрессии pHYT содержит промотор aprE и лидерные последовательности. Карта вектора pHYT, содержащего ген AprL (pHYT-AprL), показана на Фигуре 1. Нуклеотидная последовательность гена AprL изложена в SEQ ID NO:1. Аминокислотная последовательность зрелой формы белка AprL изложена в SEQ ID NO:2. Нуклеотидная последовательность промотора aprE изложена в SEQ ID NO:3. Нуклеотидная последовательность сигнального пептида изложена в SEQ ID NO:4. Нуклеотидная последовательность пропептида изложена в SEQ ID NO:5. Нуклеотидная последовательность терминатора изложена ниже в SEQ ID NO:6.
[0306] С применением методик молекулярной биологии, известных в данной области техники, создавали библиотеки положений в каждом из сайтов в зрелом белке AprL. Соответствующий кодон для каждого сайта был заменен на кодоны для по меньшей мере 10 (из возможных 19) различных аминокислот. Подходящий штамм-хозяин B. subtilis трансформировали плазмидами экспрессии, содержащих варианты. Варианты предоставлялись в 96-луночных MTP. Клетки с вариантами выращивали в среде для культивирования (обогащенные среды наполовину определенного химического состава на основе буфера MOPs, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и дополненные 1% соитоном для устойчивого роста клеток), содержащей 25 ppm тетрациклина, на квадратных планшетах enzyscreen в течение 2 дней при 32°C, 300 об/мин, с влажностью 80% во встряхивающем инкубаторе.
ПРИМЕР 3
Продуктивные положения и комбинируемые мутации
[0307] Продуктивные положения представляют собой положения в молекуле, которые наиболее полезны для создания комбинационных вариантов, демонстрирующих улучшенную характеристику, где само по себе положение допускает по меньшей мере одну комбинируемую мутацию. Комбинируемые мутации представляют собой замены, которые можно применять для получения комбинационных вариантов.
[0308] Комбинируемые мутации являются такими, которые улучшают по меньшей мере одно желаемое свойство молекулы, хотя и незначительно уменьшают либо экспрессию, активность либо стабильность. Комбинируемые мутации в AprL определяли с применением значений PI, полученных из следующих анализов, описанных в примере 1:
экспрессии (определение белка); протеазной активности (AAPF-анализ и DMC-анализ); активности очистки в следующих моющих средствах: и DMC-анализ); активности очистки в следующих моющих средствах: Kirkland Ultra HDD, pH 10,6, OMO Color HDD, pH 10,6, Surf Excel HDD, pH 10,6, Kirkland Ultraclean, HDL, pH 8,2, OMO Klein & Krachtig HDL, pH 8,2, Blue Moon HDL, pH 6,5, GSM-B, pH 10, GSM-B, pH 9; анализов стабильности в следующих моющих средствах и буферах: буфере LAS-EDTA при 53,5°C, 10% Kirkland Ultra при 56°C и 10% OMO Klein & Krachtig при 51°C.
[0309] Комбинируемые мутации были сгруппированы согласно следующим критериям: (i) вариант, где минимальный PI по сравнению с исходным AprL для экспрессии, протеазной активности, включая активность в одном или нескольких анализах активности очистки, и одном или нескольких анализах стабильности составляют ≥ 0,9, и дополнительно имеет PI для любого из данных тестов, составляющий ≥ 1,0 (группа A); (ii) вариант, где минимальный PI по сравнению с исходным AprL для экспрессия, протеазной активности, включая активность в одном или нескольких анализах активности очистки, и одном или нескольких анализах стабильности составляют ≥ 0,8, и дополнительно имеет PI для любого из данных тестов, составляющий ≥1,2 (группа B); или (iii) вариант, где минимальный PI по сравнению с исходным AprL для экспрессии, протеазной активности, включая активность в одном или нескольких анализах активности очистки, и одном или нескольких анализах стабильности составляет ≥0,5, и дополнительно имеет PI для любого из данных тестов, составляющий ≥ 1,5 (группа C).
Свойства комбинируемых мутаций обобщены в таблице 4.
(pH 6, 8, 9, 10)
(Моющее средство или буфер)
[0310] Кроме того, группы A, B и C содержат аминокислотные положения, которые имеют различные степени толерантности к нескольким заменам. Чтобы определить продуктивные положения, авторы настоящего изобретения измеряли степень замен, допустимых в каждом положении, и присваивали показатель продуктивности каждому положению. Показатель продуктивности определяли согласно процентному отношению замен в каждом положении, которое попадает в группы A, B или C, с использованием критерия, изложенного ниже.
[0311] Продуктивные положения определяли как положения, которые показали определенную степень толерантности для нескольких замен и в тоже время отвечали ряду критериев для сочетаемости, изложенному ниже. Критерии для определения показателя продуктивности для продуктивных положений установлены следующим образом: (i) положениям, где < 15% замен в данном положении попадают в группы A, B или C, присваивали показатель продуктивности "1"; (ii) положениям, где < 40%, но ≥ и вплоть до 15% замен в данном положении попадают в группы A, B или C, присваивали показатель продуктивности "2"; (iii) положениям, где < 60%, но ≥ 40% замен в данном положении попадают в группы A, B или C, присваивали показатель продуктивности "3" и (iv) положениям, где 60% или более замен в данном положении попадают в группы A, B или C, присваивали показатель продуктивности "4".
[0312] Положения с показателем продуктивности "1" представляют собой: 4, 17, 21, 30, 33, 36, 47, 49, 51, 62, 66, 72, 74, 75, 76, 93, 106, 107, 110, 111, 112, 121, 134, 135, 137, 138, 141, 149, 151, 156, 157, 159, 163, 169, 175, 183, 186, 188, 191, 204, 207, 208, 209, 215, 223, 224, 227, 229, 230, 231, 232, 233, 236, 249, 250, 254, 255, 260, 267, 269, 271, и 273.
[0313] Положения и соответствующие мутации с показателем продуктивности "1" представляют собой: 4 (V,I); 17 (Q,H, M); 21 (F,Y); 30 (V,C,T); 33 (T,C,M); 36 (Q,E,H); 47 (G,A,M); 49 (S,I,T); 51 (V,C,I); 62 (G,S); 66 (H, R); 72 (A,G,S); 74 (L,G); 75 (D,C,E); 76 (N,K); 93 (K,D); 106 (I,G,M); 107 (V,F,I); 110 (I,F); 111 (E,D, Q); 112 (W,A); 121 (I,L,M); 134 (M,L); 135 (K,E,H); 137 (A,S); 138 (V,C,S); 141 (A,S); 149 (V,C); 151 (A,G,P); 156 (G,E); 157 (S,D,R); 159 (G,A,F); 163 (T,E); 169 (K,R); 175 (A,C); 183 (S,A,G); 186 (A, C); 188 (F,W); 191 (V,C); 204 (V,I); 207 (T,C); 208 (Y,F); 209 (P,S); 215 (T,C,V); 223 (S,A,C); 224 (P, A); 227 (A,S); 229 (A,G,S); 230 (A,\G); 231 (A,C); 232 (L,Q); 233 (I,V); 236 (K,A); 249 (L,I,M); 250 (S,A,G); 254 (T,D); 255 (Y,C,E); 260 (F,C,W); 267 (I,C); 269 (V,A,C); 271 (A,D,E); и 273 (A,S).
[0314] Положения с показателем продуктивности "2" представляют собой: 2, 3, 10, 18, 19, 28, 29, 31, 35, 37, 38, 40, 44, 46, 50, 54, 56, 61, 67, 68, 71, 87, 90, 91, 92, 101, 103, 104, 113, 118, 120, 123, 130, 131, 133, 139, 145, 147, 148, 181, 182, 184, 193, 205, 211, 212, 214, 216, 217, 221, 235, 242, 245, 248, 251, 258, 259, и 268.
[0315] Положения и соответствующие мутации с показателем продуктивности "2" представляют собой: 2 (Q,A,I,N); 3 (T,E,I,Q, V); 10 (L,F,M,Q); 18 (A,C,D,E,S); 19 (Q,A,D,E,G,M); 28 (V,A,C,S); 29 (A,C,S,T,V); 31 (L,C, I,V); 35 (I,A,C,G,M,S,T,V); 37 (A,E,G,S); 38 (S,A,C,E,G,N,T); 40 (P,A,C,D,E,M,V); 44 (V,C,E,P,S,T); 46 (G,A,C,D,W); 50 (F,H,K,M,Q,R,V,Y); 54 (E,Q,R,T); 56 (Y,C,E,F,H,P); 61 (N,A,D,F,H,K,Q); 67 (V, M,N,Q); 68 (A,C,G,N,S,T); 71 (V,A,G,L,S); 87 (V,C,G,S,T); 90 (Y,A,C,F,H,N,V); 91 (A,G,M,P,V); 92 (V,A,C,I,T); 101 (G,A,C,N,S,T); 103 (Y,A,F,I,L,M,V,W); 104 (S,A,D,E); 113 (A,C,G,S); 118 (M,F,H,P, Q); 120 (V,A,C,I,S,T); 123 (M,C,I,L,N,Q,S); 130 (G,D,E,H,S); 131 (S,D,R,T); 133 (A,G,M,P, S,T,V); 139 (D,G,K,N,S,T); 145 (G,D,N,S); 147 (V,A,L,M,N); 148 (V,A,C,F,M,Q,S); 181 (S,A,C,D,H, Q); 182 (N,C,D,E,Q); 184 (N,C,E,H,M,Q); 193 (A,D,P,Q,R); 205 (Y,C,E,F,I,M,V); 211 (N,C,E,S); 212 (T,A,D, S); 214 (A,E,H,L,T); 216 (L,A,C,H,K,M); 217 (N,C,E,S); 221 (M,C,H,K); 235 (S,C,D,E,G); 242 (A,E,G, N,S); 245 (V,A,C,I,T); 248 (R,A,N,Q,S); 251 (S,A,C,E,G,N); 258 (S,C,D,E,H,P); 259 (S,E,P,Q); и 268 (N,D,E,Q).
[0316] Положения с показателем продуктивности "3" представляют собой: 1, 9, 22, 24, 25, 53, 86, 89, 95, 100, 105, 108, 114, 115, 119, 125, 128, 140, 146, 155, 158, 187, 202, 203, 234, 237, 240, 243, 244, и 264.
[0317] Положения и соответствующие мутации с показателем продуктивности "3" представляют собой: 1 (A,D,E,F,G,N, Q,S,T,V); 9 (P,A,C,D,E,G,N,Q,S,T); 22 (K,A,F,M,Q,R,S,T,VY); 24 (A,C,D,E,G,N,Q,S,W); 25 (N,D,E, F,G,H,L,M,P,Q,R,S); 53 (G,C,D,E,H,K,N,Q,R); 86 (S,C,E,H,K,L,N,R); 89 (L,A,C,F,G,I,M,N,S,V); 95 (L,A,F,G,I,M,Q,S,V); 100 (S,C,F,G,M,N,R,T,Y); 105 (G,A,C,D,I,M,N,R,S,T); 108 (S,E,F,G,H,K,L,N,Q, R,Y); 114 (T,A,C,D,F,I,K,L,N,Q,S,V); 115 (T,D,E,F,H,I,K,Q,S,W); 119 (D,A,E,F,G,H,M,Q,S); 125 (L, A, E, F, I,N,S,V,Y); 128 (A,C,D,E,H,K,N,P,Q,R,S,T); 140 (N,C,D,F,G,H,M,R,T,V); 146 (V,A,E, H,I,K, L,N,Q,S, T); 155 (S,A,D,E,F,G,H,K,N,Q,R,W); 158 (S,A,D,E,I,K,N,Q,R); 187 (S,A,C,D,E,H,K,P,Q,W); 202 (A, C,D,E,I,K,L,M,Q,S,T,V); 203 (G,A,C,E,H,K,M,N,Q,R,S); 234 (L,E,F,H,Q,S,W,Y); 237 (H,A,C, D, G,I, M,N,Q,S); 240 (L,A,D,E,F,I,M,N,Q,T); 243 (S,C,E,F,I,N,Q,T,V,W); 244 (Q,A,C,D,E,G,H,I, N, R,S,V); и 264 (K,A,C,D,H,M,Q,R,S,Y).
[0318] Положения с показателем продуктивности "4" представляют собой: 12, 15, 26, 27, 43, 45, 48, 52, 55, 57, 58, 60, 77, 78, 88, 96, 97, 98, 99, 102, 116, 117, 126, 127, 129, 132, 136, 143, 144, 160, 161, 165, 171, 210, 238, 239, 241, 247, и 274.
[0319] Положения и соответствующие мутации с показателем продуктивности "4" представляют собой: 12 (K,A,C,F,G, H, L,M, N,Q,S,Y); 15 (K,A,C,E,F,H,I,M,N,R,S,T,V); 26 (V,A,C,E,H,I,M,N,Q,R,S,T); 27 (K,A,C,D,E,L, M,N,P, Q,R,T); 43 (N,A,C,F,G,H,I,K,L,M,Q,R,S,W,Y); 45 (V,A,C,D,E,F,G,I,K,M,N,P,Q, R,S,T,Y); 48 (A,C, D,E,F,H,I,K,M,N,Q,R,W,Y); 52 (A,C,D,E,F,G,H,K,L,M,N,P,Q,R,S,T,V,Y); 55 (A,C,D,E,F,G, H,I, M,N, P,Q,R,S,T,V); 57 (N,A,C,D,E,G,H,P,R,S,V,Y); 58 (T,C,D,F,H,I,K,L,M,P,R,S,V,W,Y); 60 (G,C,E, F, H,I, K,L,M,Q,R,T,Y); 77 (T,C,D,F,H,K,L,M,N,P,Q,R,S,W); 78 (T,C,D,G,I,L,N,Q,S,V,W, Y); 88 (S, A, E, F,G, L,M,N,Q,R,T,V,W,Y); 96 (N,A,C,D,E,G,H,I,K,L,M,Q,S,V,Y); 97 (S,A,C,D,F,G,H, I,K,M,N, P,Q,R,T,W, Y); 98 (S,A,D,E,F,H,K,L,N,P,R,T,V,Y); 99 (G,A,C,D,E,L,M,Q,S,T,V,W); 102 (S,A,D,E,F, G,K, L,N,P, Q,R,T); 116 (N,A,C,D,E,F,G,H,K,L,M,Q,R,S,T,V,Y); 117 (G,C,D,E,H,K,M,N,Q,R,T, V); 126 (G,A,C, E,H,I,K,M,N,Q,R,S,T,V,W,Y); 127 (G,A,D,E,F,I,L,M,Q,S,T,V,W,Y); 129 (S,C,E,F,H,I, M, N, Q,R,T,V, W,Y); 132 (T,A,C,D,E,F,H,I,K,L,M,N,P,Q,S,V,W,Y); 136 (Q,A,C,D,F,G,H,K,L,N,R,S,T, W); 143 (A,C, D,E,F,G,H,I,K,M,N,S,T,Y); 144 (R,A,C,D,E,F,G,H,L,M,N,Q,V,Y); 160 (N,A,C,D,G,I,K, M,P,R); 161 (T,A,C,D,E,I,K,L,M,Q,R,W); 165 (G,A,E,I,K,L,P,Q,R,S,T,Y); 171 (D,A,C,G,H,I,K,N,P,Q, S,T,V); 210 (T,C,D,E,F,H,I,M,N,P,V,Y); 238 (P,A,C,D,E,F,G,I,L,M,N,Q,R,S,T,W); 239 (N,A,C,D,E,H, I,K,L,M,S, T,V,Y); 241 (S,C,D,E,H,L,N,P,Q,T,V); 247 (N,A,D,E,F,H,I,L,M,Q,S,V,W,Y); и 274 (Q,A, C, D,E,F,G, H,I,L,N,S,T,V,W).
[0320] Комбинируемые мутации в AprL определяли с применением значений PI, полученных из анализов, описанных в примере 1: определения белка (экспрессия), анализов протеазной активности (AAPF, DMC), активности очистки в следующих моющих средствах: (Kirkland Ultra HDD, pH 10,6, OMO Color HDD, pH 10,6, Surf Excel HDD, pH 10,6, Kirkland Ultraclean, HDL, pH 8,2, OMO Klein & Krachtig HDL, pH 8,2, Blue Moon HDL, pH 6,5, GSM-B, pH 10 и GSM-B pH 9) и анализов стабильности в следующих моющих средствах и буферах (буфере LAS-EDTA при 53,5°C, 10% Kirkland Ultra при 56°C и 10% OMO Klein & Krachtig при 51°C). Комбинируемые мутации определяли в группы A, B или C согласно критериям, изложенным в примере 4. Этим заменам затем присваивали показатель пригодности на основании группы(групп) (A, B, C), если проявлялась замена, и при этом более высокий показатель пригодности представляет более пригодную замену для применения в получении комбинационных вариантов. Показатели пригодности определены в таблице 5. Показатели пригодности для отдельных замен AprL, которые подходят под описанные выше критерии, представлены в таблице 6.
Оценка полезных мутаций AprL для определенных вариантов применения для очистки
[0321] Варианты SEL были дополнительно сгруппированы в различные категории на основе их продуктивности в различных условиях анализа, как описано ниже. Для этого анализа были исключены варианты SEL, для которых значения PI в HPLC были либо 0, либо 0,1. Кроме того, значения PI считались контрольными для каждого анализа, где соответствующее значение CV было меньше 0 или больше 100.
[0322] Для получения наилучших мутаций для каждой категории продуктивности в дополнение к значениям PI в HPLC и значениям PI HDL, pH 6, были рассчитаны 4 суррогатных значения PI: 1) значение PI HDD, которое больше, чем PI BMI-OMO-HDD или PI BMI-Kirkland-HDD; 2) значение PI HDL, которое больше, чем PI BMI-OMO-HDL или BMI-Kirkland-HDL; 3) значение PI ADW, которое больше, чем PI EGG-GSM9 или PI EGG GSM10; и
4) PI для стабильности, которое представляет собой максимальный PI для стабильности в LAS/EDTA, PI для стабильности в HDL Kirkland или PI для стабильности в HDL OMO.
[0323] Чтобы сгруппировать наиболее полезные мутации для применения в HDL, pH8, суррогатное значение PI HDL pH8 было установлено как большее, чем 1,1 и все другие граничные значения PI были установлены как большие, чем 0,8. Для наиболее полезных мутаций для применения в HDD, суррогатное значение PI HDD было установлено как большее, чем 1,1, и все другие граничные значения PI были установлены как большие, чем 0,8. Для наиболее полезных мутаций для применения в ADW, суррогатное значение PI ADW было установлено как большее, чем 1,1 и все другие граничные значения PI были установлены как большие, чем 0,8. Для наиболее полезных мутаций для применения в HDL, pH6, суррогатное значение PI HDL, pH6 было установлено как большее, чем 1,1, и все другие граничные значения PI были установлены как большие, чем 0,8. Для наиболее полезных мутаций, обеспечивающих стабильность, значения PI для стабильности были установлены как большие, чем 1,2, и все другие граничные значения PI были установлены как большие, чем 0,8. Число мутаций, полученных для каждой категории, показано в таблице 7 ниже, и конкретные мутации в каждой категории перечислены ниже.
[0324] Критерии для группирования в каждую категорию: PI > 1,1 для конкретной категории, т.е. ADW, HDL pH6, HDL pH 8 или HDD и PI > 0,8 для всех протестированных свойств, включая экспрессию; или PI > 1,2 для стабильности и PI > 0,8 для всех протестированных свойств, включая экспрессию.
[0325] Список наиболее полезных мутаций для применения в ADW: A001C, A001D, A024E, A024G, A048C, A048D, A048K, A048N, A052F, A052M, A052V, A052Y, A055C, A072G, A091G, A113C, A128P, A128Q, A133G, A133S, A133T, A143E, A143F, A143H, A143N, A143S, A143W, A193D, A202C, A202D, A202E, A202Q, A227S, D119F, D119S, D119Y, G053C, G053E, G053N, G053Q, G060L, G060Y, G099A, G099T, G101A, G117D, G117V, G127A, G127S, G127T, G130D, G130H, G203A, G203C, G203E, G203M, H237I, I035A, I035C, I035M, I035T, I121L, K012N, K015M, K027C, K027L, K027M, K027R, K264A, K264S, L010M, L095F, L125V, L234Q, L240N, L249I, M123C, M123I, M123L, N025F, N025G, N025L, N025S, N057C, N061A, N076G, N096D, N096G, N116A, N116C, N116L, N116Y, N140A, N160C, N182C, N182D, N184C, N211S, N247F, N247H, N247I, N247L, N247Q, N247S, N247V, N247W, N247Y, P009E, P009T, P238A, P238C, P238D, P238F, P238I, P238R, Q017H, Q136A, Q136C, Q136F, Q136H, Q136K, Q136L, R144F, R144L, R248K, S086R, S088N, S088Y, S097G, S097H, S097Y, S098H, S098L, S100L, S102D, S102E, S102G, S102K, S129E, S129H, S155A, S155D, S155E, S155H, S157D, S158I, S158Q, S181A, S181Q, S183G, S241R, S241T, S243I, S243N, S243T, S243V, S243Y, S251E, S258C, S258D, S258P, T058C, T058D, T058F, T058I, T077C, T077F, T077L, T077M, T078Q, T132A, T132Q, T132V, T132Y, T161Q, T210I, T215C, V026Q, V026R, V026T, V028A, V028C, V045I, V071A, V071L, V120A, V120C, V120I, V146A, V146H, V146K, V147L, V149C, Y056H, и Y255C.
[0326] Список наиболее полезных мутаций для применения в HDD: A029T, A048K, A048R, A052F, A052R, A068G, A113C, D119H, E111Q, G099A, G099S, G127A, G127T, G165A, K012G, K012H, K027C, K027E, K027M, L095F, L125I, L125V, L240Q, N025F, N025G, N025L, N043R, N116R, N140R, N160C, N184C, N239K, P238C, P238I, P238M, Q136F, Q136H, Q136K, Q136R, Q136W, S098F, S098H, S104A, S158Q, S241R, V045R, и Y103M.
[0327] Список наиболее полезных мутаций для применения в HDL (pH 8): A001C, A048R, A052F, G099S, G099T, G101A, G127F, G127I, G127M, G127Q, G127T, G127V, I121M, L010M, L095A, L095F, L095Q, L095S, L125I, L125V, M123C, M123I, N025F, N025S, N116C, N140R, N184C, P238C, P238D, P238I, P238M, P238N, Q136A, S098F, S098H, S102D, S158Q, S241R, T077C, T077F, T215C, V026I, V026Q, V045R, и V149C.
[0328] Список наиболее полезных мутаций для применения в HDL (pH 6): A001C, A024E, A128D, G053C, G099T, G101A, G101N, G165E, G203C, L095Q, L095S, L125S, N061E, N116C, N184C, S098D, S102D, S102E, S104D, S129E, S155D, S158E, и V026T.
[0329] Список наиболее полезных мутаций для стабильности: A001C; A001D; A001E; A001Q; A001S; L010M; L010Q; S100G; S102K; S102R; Y103F; Y103M; S104D; G105M; G105R; S108F; S108H; S108K; S108R; E111Q; T114D; T115D; T115E; T115F; T115K; T115Q; N116E; K012C; K012F; K012H; K012M; K012N; K012Q; K012Y; V120S; M123C; M123I; L125I; G127A; G127D; G127I; G127M; G127S; G127T; G127V; A128E; A128H; A128K; A128P; A128R; A128S; A128T; S129H; S129Q; S129R; S129T; S129V; T132C; T132D; T132E; T132K; T132N; T132P; Q136A; Q136C; Q136K; Q136R; V138C; A143D; A143N; G145S; V147L; V148A; V148C; V148M; V148Q; K015A; K015C; K015E; K015I; K015M; K015S; K015T; K015V; S155D; S155F; S155K; S155N; S155R; S157D; S158D; S158I; S158K; S158R; N160C; N160D; N160I; N160M; N160R; T161C; T161D; T161E; T161K; T161Q; T161R; G165A; G165E; G165Q; G165R; G165S; Q017H; A018D; A018E; S181Q; N182D; S183A; S183G; N184C; N184E; N184Q; A186C; S187D; S187E; S187P; Q019D; Q019E; A193D; A193R; A202D; A202E; A202K; A202Q; A202V; G203A; G203C; G203E; G203N; G203Q; Y205E; T210C; T210E; T210I; T210P; T210V; A214E; T215C; L216C; L216H; L216K; L216M; N217S; L234E; L234F; L234Q; L234S; S235D; S235E; P238T; N239A; N239D; N239H; N239M; N239S; N239T; A024E; A024Q; L240D; S241E; S241N; S241Q; S241V; A242G; A242N; S243E; S243Q; S243V; Q244C; Q244E; V245A; V245C; V245T; N247D; N247W; N025D; N025G; N025Q; S250G; S251E; S258C; S258D; S258E; S258H; S258P; S259E; S259P; S259Q; V026A; V026C; V026E; V026H; V026Q; V026R; F260W; K264A; K264C; K264D; K264H; K264M; K264Q; K264S; K264Y; I267C; N268D; N268E; N268Q; V269C; K027C; K027D; K027E; K027M; K027P; A271E; Q274A; Q274C; Q274D; Q274E; Q274G; A029S; T003E; T003I; T003Q; T003V; V030C; I035A; I035S; I035T; I035V; S038T; N043A; N043C; N043F; N043H; N043Q; V044P; V045A; V045C; V045D; V045E; V045F; V045G; V045M; V045N; V045Q; V045R; V045S; V045T; G046D; A048N; A048W; F050H; V051I; A052F; A052G; A052K; A052N; A052P; A052R; A052V; G053N; G053R; A055C; A055D; A055E; A055G; A055H; A055N; A055S; A055V; N057C; N057E; N057G; N057V; T058C; T058I; T058K; T058W; A068C; A068N; A068S; V071A; L074G; D075E; N076K; T077C; T077D; T077H; T077M; T077N; T077P; T077Q; T077S; T078D; T078I; T078V; S086E; S086H; S086R; V087C; V087G; V087S; V087T; S088E; S088N; S088R; L089N; P009C; P009D; P009E; P009N; P009T; L095A; L095V; N096S; S098K; S098R; и G099Q.
ПРИМЕР 4
Сравнение протеазы AprL с родственными молекулами
Определение гомологичных протеаз
[0330] Родственные белки идентифицировали с помощью поиска BLAST (Altschul et al., Nucleic Acids Res, 25:3389-402, 1997) по неизбыточной базе данных белков NCBI, и выборка показанной в таблице 8. Подобным образом поиск проводили по базе данных Genome Quest Patent с параметрами поиска, установленными на значения по умолчанию, с применением аминокислотных последовательностей зрелых белков для протеазы AprL (SEQ ID NO:2), в качестве запрашиваемой последовательности, и выборка показана в таблице 9. Процентная идентичность (PID) в обоих случаях поиска определяли как число идентичных остатков разделенное на число выровненных остатков при попарном выравнивании. Значение, обозначенное "длина последовательности" в таблицах, соответствует длине (в аминокислотах) для белков, на которые даются ссылки с приведенными номерами доступа, тогда как "выровненная длина" относится к последовательности, используемой для выравнивания и расчета PID.
Выравнивание последовательностей субтилизина с AprL
[0331] Аминокислотная последовательность зрелого AprL (SEQ ID NO: 2) белок был выровнен с множеством последовательностей субтилизина с применением программного обеспечения CLUSTALW (Thompson et al., Nucleic Acids Research, 22:4673-4680, 1994) с параметрами по умолчанию. На Фигуре 2 показано выравнивание белка AprL с выборкой таких последовательностей протеазы.
ПРИМЕР 5
Обнаружение и идентификация субтилизина BliD02339
[0332] Секвенирование генома B. licheniformis штамма Bra7 (коллекция культур Dupont) позволило выявить, что этот штамм продуцирует субтилизин, который отличается от субтилизина Carlsberg (база данных NCBI, № доступа CAJ70731.1) и других субтилизинов видов B. licheniformis. Последовательность гена, BliD02339.n, кодирующего субтилизин (предшественник) B. licheniformis Bra7 показана в SEQ ID NO:7.
[0333] Препрофермент, кодируемый геном BliD02339.n, показан в SEQ ID NO:8. На N-конце белок имеет сигнальный пептид длиной в 29 аминокислот, как было предсказано посредством SignalP-NN (Emanuelsson et al., Nature Protocols (2007) 2: 953-971). Сигнальная пептидная последовательность подчеркнута и выделена жирным в SEQ ID NO: 8. Присутствие сигнального пептида указывает на то, что такая сериновая протеаза является секретируемым ферментом. Как и другие сериновые протеазы, фермент имеет пропоследовательность, прогнозируемая длина которой составляет 76 аминокислот (курсивом в SEQ ID NO: 8). Это предсказание сделано на основании про-зрелого соединения в гомологичных сериновых протеазах, таких как субтилизин Carlsberg (Waldeck et al., Appl. Environ. Microbiol. (2006) 72:7879-7885). Последовательность прогнозируемой, полностью процессированной зрелой цепи (BliD02339, 274 аминокислот) показана в SEQ ID NO: 9. Аминокислотная последовательность препрофермента BliD02339 изложена как SEQ ID NO: 8:
MMRKKSFWLGMLTALMLVFTMAFSDSASAAQPAKNVEKDYIVGFKS
GVKTASVKKDIIKESGGKVDKQFRIINAAKAKLDKEALKEVKNDPDVAYVEEDHVAHALAQTVPYGIPLIKADKVQAQGFKGANVKVAVLDTGIQASHPDLNVVGGASFVAGEAYNTDGNGHGTHVAGTVAALDNTTGVLGVAPNVSLYAVKVLNSSGSGSYSGIVSGIEWATTNGMDVINMSLGGPSGSTAMKQAVDNAYARGVVVVAAAGNSGSSGNTNTIGYPAKYDSVIAVGAVDSNSNRASFSSVGAKLEVMAPGAGVYSTYPTSTYATLNGTSMASPHVAGAAALILSKHPNLSASQVRNRLSSTATYLGSSFYYGKGLINVEAAAQ.
ПРИМЕР 6
Сравнение протеазы BliD02339 с субтилизином Carlsberg
[0334] Выравнивание последовательности протеазы BliD02339 с субтилизином AprL показано на Фигуре 3. BliD02339 отличается от субтилизина Carlsberg по 4 положениям: положениям 86, 128, 194 и 211. Наиболее интересным является остаток лизина в положении 194 в BliD02339 (субтилизин Carlsberg имеет остаток аспарагиновой кислоты в этом положении), поскольку он является причиной значительной разницы в заряде между BliD02339 и субтилизином Carlsberg и другими субтилизинами B. licheniformis, известными в данной области техники. Вычисленный заряд при pH 7 для BliD02339 составляет 1,19, для субтилизина Carlsberg -0,80. Такая разница в заряде может влиять на свойства фермента, такие как продуктивность очистки, стабильность и/или эффективность.
ПРИМЕР 7
Гетерологичная экспрессия BliD02339
[0335] Протеаза BliD02339 была получена в B. subtilis с применением кассеты экспрессии, состоящей из промотора B. subtilis aprE, последовательности сигнального пептида B. subtilis aprE, пропептида нативной протеазы BliD02339, зрелой протеазы BliD02339 и терминатора BPN'. Эту кассету клонировали в реплицируемый челночный вектор pHYT и трансформировали в подходящий штамм B. subtilis. Вектор pHYT получали из pHY300PLK (Takara) путем добавления терминатора после гена устойчивости к тетрациклину с использованием сайтов BstEII и EcoRI (терминаторная последовательность (SEQ ID NO: 10)). Сайт HindIII в pHY300PLK также удаляли с применением линкера, клонированного по сайтам BamHI и HindIII (новая линкерная последовательность, (SEQ ID NO: 11)).
Карта вектора pHYT, содержащего ген BliD02339 (pHYT-BliD02339), показана на Фигуре 4.
[0336] Для получения BliD02339 подходящий штамм B. Subtilis, содержащий pHYT-BliD02339, культивировали в обогащенных средах наполовину определенного химического состава на основе буфера MOPs, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода и дополненными 1% соитона для устойчивого роста клеток. Среда была дополнена 25 ppm тетрациклина. После инкубирования (2 дня при 32°C) протеазу BliD02339 выявляли в среде для выращивания. После центрифугирования и фильтрования супернатанты культуры с протеазой BliD02339 использовали для анализов.
[0337] Белок определяли количественно с помощью способа без окраски Imager Criterion. Способ основан на использовании неокрашенных предварительно подготовленных PAGE-гелей, где интенсивность каждой полосы будет зависеть от количества остатков триптофана, имеющихся в представляющем интерес белке. Предварительно подготовленные гели The Criterion™ TGX (Tris-Glycine extended) Stain-Free™ для PAGE включают уникальные трехгалогензамещенные соединения. Это позволяет осуществлять флуоресцентное определение белков с помощью системы визуализации Gel Doc™ EZ. Трехгалогензамещенные соединения реагируют с остатками триптофана в индуцированной УФ реакции с получением флуоресценции, которую можно легко определить в гелях посредством визуализатора системы Gel Doc EZ. Реагенты, применяемые в анализе: концентрированный (10x) буфер для образцов Laemmli (Kem-En-Tec, № по каталогу 42556); либо 18-, либо 26-луночные предварительно подготовленные гели Criterion TGX Strain-Free (Bio-Rad, №№ по каталогу 567-8124 и 567-8125 соответственно); и маркеры молекулярной массы белков "Precision Plus Protein Standards" (Bio-Rad, № по каталогу 161- 0363). Анализ проводили следующим образом: 25 мкл образца белка и 25 мкл 0,5M HCL добавляли в 96-луночный ПЦР-планшет на льду для инактивации протеазы и предотвращения самогидролиза. К 50 мкл смеси кислого белка добавляли 50 мкл буфера для образцов, содержащего 0,385 мг DTT, в 96 -луночный ПЦР-планшет. После этого камеру заполняли подвижным буфером, устанавливали гелевую кассету. Затем 10 мкл каждого образца вместе с маркерами загружали в каждый карман. После этого запускали электрофорез при 200 В в течение 35 мин. После проведения электрофореза гель переносили в устройство визуализации. Применяли программное обеспечение Image Lab для подсчета интенсивности для каждой полосы. Зная количество белка и содержание триптофана стандартного образца, может быть построена калибровочная кривая. Количество в экспериментальном образце можно определить посредством эктраполяции интенсивности от полосы и числа остатков триптофана на концентрацию белка. Такой способ количественного определения белка применяли для получения образцов протеазы BliD02339, применяемых для анализов, показанных в последующих примерах.
[0338] Образец выделенной протеазы BliD02339 анализировали посредством LC-MS/MS, как описано далее. При подготовке к подтверждению последовательности, включая определение N- и С-концов, образец протеазы BliD02339 подвергали серии химических обработок в центробежном фильтре на 10 кДа. Образец денатурировали и восстанавливали/алкилировали мочевиной и обрабатывали DTT/иодацетамидом. Стадию гуанидинизации проводили для превращения остатков лизина в остакти гомоаргинина для защиты боковых цепей лизина от ацетилирования. Реакция ацетилирования с применением сульфо-NHS-ацетата (сульфосукцинимидилацетата) модифицирует только N-концевой остаток белка. Образец затем смешивали с буфером, содержащим 40 об./об.% 18O-воды: 60 об./об.% 16O-воды и протеолитические ферменты применяли для расщепления белка. Конечные пептиды будут содержать смеси 18O и 16O, за исключением карбоксильного конца, который будет сохранять нативный 16O, как будет понятно из изотопного распределения пептидов. Пептид, происходящий из N-конца белка, будет являться единственным ацетилированным пептидом. Полученные пептиды разделяли и анализировали с применением системы нано-LC, после чего с применением масс-спектрометра высоко разрешения LTQ Orbitrap (Thermo Fisher). Аминокислотную последовательность выводили из спектров фрагментов MS/MS пептидов. Исходя из этого анализа, было подтверждено, что N-конец выделенного белка нначинается с А в положении 1 из прогнозируемой зрелой последовательности. Было определено, что последовательность зрелого белка соответствует последовательности, приведенной в SEQ ID:9, состоящей из 274 аминокислот.
ПРИМЕР 8
Протеазная активность BliD02339
[0339] Протеазную активность протеазы BliD02339 тестировали путем измерения гидролиза субстрата DMC. Растворы реагентов, применяемые для DMC-анализа, представляли собой: 2,5% вес/объем диметилказеин (DMC, Sigma C-9801) в 100 мМ натрий-карбонатного буфера с pH 9,5, 0,075% TNBSA (2,4,6-тринитробензолсульфоновая кислота, Thermo Scientific) в реагенте А. Реагент A: 45,4 г Na2B4O7.10H20 (Merck) в 15 мл 4N NaOH для достижения конечного объема 1000 мл в деионизированной воде. Супернатанты с протеазой разводили в растворе для разведения: 10 мМ NaCl, 0,1 ммоль CaCl2, 0,005% Tween-80 до соответствующей концентрации для достижения линейного ответа при гидролизе в течение 5 мин. 96-луночный планшет MTP заполняли 95 мкл субстрата DMC с последующим добавлением 5 мкл разведенного супернатанта с протеазой. Затем добавляли 100 мкл TNBSA в реагенте А при медленном перемешивании. Активность измеряли при 405 нм в течение 5 мин. с применением планшет-ридера SpectraMax в кинетическом режиме при RT. Абсорбцию имитирующого контроля, не содержащего протеазы, вычитали из значений. Активность выражали в мOD/мин. Кривая протеазной активности для BliD02339 показана на Фигуре 5. Было обнаружено, что специфическая активность протеазы BliD02339 в DMC-анализе составляет 26 мOD/мин/ppm (где ppm представляет собой конечную концентрацию протеазы в анализе). Было обнаружено, что специфическая активность GG36 и протеаз BPN' составляет 54 и 23 мOD/мин/ppm, соответственно, при одинаковых условиях анализа.
ПРИМЕР 9
pH-профиль BliD02339
[0340] Зависимость протеолитической активности протеазы BliD02339 от pH была изучена с использованием субстрата азо-казеина в 50 мМ буфера ацетат/бис-трис/HEPES/CHES, включающем 50 мМ CaCl2. Влияние рН от 4 до 12 измеряли с шагом в 1 рН. Одну таблетку Protaxyme AK (Megazyme, Ирландия) добавляли в стеклянную пробирку для тестирования вместе с 1,9 мл соответствующего буфера и магнитной мешалкой с последующей мягкой гидратацией при 40°С в течение 5 мин. на водяной бане с регулируемой температурой, оснащенной магнитной мешалкой. 100 мкл образца свежеприготовленной протеазы (разбавленной в деионизированной воде до соответствующей концентрации для анализа) добавляли к предварительно обезвоженному субстрату, и реакцию проводили при 40°С в течение 10 мин. Для прекращения реакции добавляли 10 мл 2% вес/объем раствора трис-буфера с рН 12 и раствор перемешивали, и сразу фильтровали через фильтр Whatman № 1. Супернатант собирали и для этого супернатанта измеряли поглощение при 590 нм для количественного определения продукта реакции. Из каждого показания образца вычитали поглощение буфера в качестве контроля, и полученные значения преобразовывали в проценты относительной активности, определяя активность при оптимальном рН как 100%. Было определено, что BliD02339 сохраняет ≥50% активности в пределах диапазона pH 6-12 в условиях этого анализа.
ПРИМЕР 10
Температурный профиль BliD02339
[0341] Температурную зависимость протеолитической активности протеазы BliD02339 от pH измеряли с использованием субстрата азо-казеина в 50 мМ буфера ацетат/бис-трис/HEPES/CHES, включающем 50 мМ CaCl2 при pH 9. Активность измеряли при температуре от 30°C до 80°С с шагом 10°С. Одну таблетку Protaxyme AK (Megazyme, Ирландия) добавляли в стеклянную пробирку для тестирования вместе с 1,9 мл соответствующего буфера и магнитной мешалкой с последующей мягкой гидратацией при заданных температурах в течение 5 мин. на водяной бане с регулируемой температурой, оснащенной магнитной мешалкой. 100 мкл образца свежеприготовленной протеазы (разбавленной в деионизированной воде до соответствующей концентрации для анализа) добавляли к предварительно обезвоженному субстрату, и реакцию проводили при температурах от 30°С до 80°С в течение 10 мин. Для прекращения реакции добавляли 10 мл 2% вес/об. трис-буфера с рН 12 и раствор перемешивали, и сразу фильтровали через фильтр Whatman №1. Супернатант собирали и для этого супернатанта измеряли поглощение при 590 нм для количественного определения продукта реакции. Из каждого показания образца вычитали поглощение буфера в качестве контроля, и полученные значения преобразовывали в проценты относительной активности, определяя активность при оптимальной температуре как 100%. Было установлено, что BliD02339 сохраняет ≥50% активности в пределах диапазона 55-75°C в условиях этого анализа.
ПРИМЕР 11
Продуктивность очистки BliD02339
[0342] Продуктивность очистки BliD02339 тестировали на BMI (кровь/молоко/чернила на хлопке) на микрообразцах (EMPA-116, Центр материалов для испытаний, Нидерланды) для применения, связанного со стиркой, и на яичном желтке (яичный желток на полиакриловой ткани, состаренный и окрашенной красителем "угольный черный") на микрообразцах ткани (PAS-38, Центр материалов для испытаний, Нидерланды) для применения, связанного с мытьем посуды. MTP (Corning 3641), содержащие предварительно перфорированные (для размещения на MTP) образцы ткани, промывали и заполняли моющим средством перед добавлением фермента. Моющие средства OMO color HDD, Kirkland Ultra HDD, OMO Klein & Krachtig HDL, Kirkland Ultraclean HDL, GSM-B 10,5 ADW и GSM-B 9 ADW дозировали, как описано в таблицах 2 или 3 выше.
[0343] Моющие средства HDL для стирки белья инактивировали путем нагревания до 95°C в течение 4 часов на водяной бане. Коммерческие моющие средства HDD для стирки белья инактивировали путем получения 10% вес/объем раствора и нагревания в течение 4 часов при 95oC. Протеазную активность анализировали после инактивации с применением AAPF-субстрата. После 4-часового нагревания протеазная активность обоих моющих средств HDD и HDL отсутствовала.
[0344] Аликвоты фермента добавляли в заполненные моющим средством планшеты с микрообразцами ткани для достижения конечного объема 200 мкл для анализов, связанных со стиркой, до конечной концентрации фермента от 0,04 до 10 ppm. Анализы очистки при стирке составами HDL или HDD проводили при 25°C в течение 15 мин., тогда как ADW-анализы проводили при 40°C в течение 30 мин.
[0345] После инкубирования 100 мкл супернатанта переносили в свежий MTP (Costar 9017) и считывали поглощение при 600 нм для образцов ткани EMPA-116 или при 405 нм для образцов ткани PAS-38 с применением планшет-ридера SpectraMax. Поглощение контроля в виде только буфера вычитали и итоговые значения OD при 600 нм (для моющих средств HDL и HDD ) и 405 нм (для моющего средства ADW) наносили на график в виде функции концентрации протеазы. Данные подставляли в уравнение Ленгмюра. Продуктивность очистки BliD02339 в графическом виде показана на фигурах 6-8.
ПРИМЕР 12
Кладограмма для субтилизинов, включая AprL и BliD02339
[0346] Кладограмму для зрелых последовательностей белка AprL (SEQ ID NO:2) и BliD02339 (SEQ ID NO: 9) строили с применением выборки последовательностей субтилизинов, показанной в таблице 8. Последовательности вводили в программу Vector NTI Advance, и путеводное дерево создавали с использованием способа объединения соседних пар (NJ) (Saitou, N, и Nei, M. (1987) Mol Biol Evol 4, 406-425). Способ NJ осуществляется на матрице расстояний между всеми парами последовательностей, подлежащих анализу. Эти расстояния связаны со степенью расхождения между последовательностями. Путеводное дерево рассчитывали после выравнивания последовательностей. Структуру дерева рассчитывали с применением следующих параметров: коррекция Кимура для расстояния между последовательностями и игнорирование положений с гэпами. AlignX отображает вычисленные значения расстояния в скобках после названия молекулы, отображенные на кладограмме, показанной на Фигуре 9. Основываясь на распределении по кладограмме, некоторые субтилизины были сгруппированы, как показано на фигуре 9, для образования клады AprL.
ПРИМЕР 13
Уникальные признаки субтилизинов клады AprL
[0347] Как показано на фигуре 9, субтилизин AprL (B. licheniformis Carlsberg), его близкий гомолог BliD02339 и все другие субтилизины B. licheniformis плюс субтилизины B. sonorenisis обладают достаточным количеством признаков для получения клады, в последствии получившей название клада AprL. Для определения положения инвариантных остатков, разделяемых ферментами в кладе AprL, была использована структура AprL с высоким разрешением (pdb 3UNX). В качестве сравнения использовались структуры с высоким разрешением других субтилизинов (BPN 'pdb 2ST1 и субтилизин B. lentus pdb 1JEA). Сравнение этих структур служило для идентификации серии последовательностей/структурных мотивов со значительными различиями между ферментами клады AprL и другими субтилизинами. Некоторые из этих инвариантных областей значимости описаны ниже.
[0348] Петля 52-60 сильно различается между субтилизинами клады AprL и другими субтилинами, примером которых являются BPN' и субтилизин B lentus. Одним из признаков последовательности субтилизинов клады AprL является наличие остатков Tyr-Asn-Thr («YNT») в положениях 56-58, который определяет конечную конфигурацию этой петли в сублизинах клады AprL, см. фигуру 10. На фигуре 10 можно увидеть, что единственная последовательность YNT находится на конце петли. Конформация этой петли 52-60 является гетерологичной в различных показанных структурах субтилизина. Авторы настоящего изобретения приписывают эту разницу, отчасти, данной уникальной последовательности. Эта петля иногда является сайтом автолитического расщепления и поэтому конформация с неусеченной петлей AprL имеет решающее значение для ее функции.
[0349] Остатки 240-243 в субтилизинах клады AprL имеют общую последовательность Leu-Ser-Ala-Ser («LSAS»). В этой области Leu240 меньше, чем более крупные гидрофобные остатки, обнаруженные в других субтилизинах, таких как BPN 'и B. lentus, в которых обнаруживается боковая цепь триптофана, см. фигуру 11. Меньший Leu в кладе AprL может разместить боковую цепь Arg 248, что позволяет сохранить поворот и ввести положительный заряд на поверхности в этом положении в субтилизинах клады AprL.
Кроме того, Asn 96 в сублизинах клады AprL может образовывать водородную связь с амином основной цепи остатка Ser 98 для стабилизации поворота, ведущего к цепи 101-104, которая является одной частью сайта связывания субстрата, см. фигуру 12.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> DANISCO US INC.
<120> ВАРИАНТЫ ПРОТЕАЗЫ КЛАДЫ AprL И ИХ ПРИМЕНЕНИЯ
<130> 40518-WO-PCT-2
<150> US 62/161,077
<151> 2015-05-13
<160> 60
<170> PatentIn версия 3.5
<210> 1
<211> 822
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность гена AprL
<400> 1
gcgcaaaccg ttccttacgg cattcctctc attaaagcgg acaaagtgca ggctcaaggc 60
tttaagggag cgaatgtaaa agtagccgtc ctggatacag gaatccaagc atctcatccg 120
gacttgaacg tagtcggcgg agcgagcttt gtggctggcg aagcatataa caccgacggc 180
aacggacacg gcacacatgt tgccggtaca gtagctgcgc ttgacaatac aacgggtgta 240
ttaggcgttg cgccaagcgt atccttgtac gcggttaaag tactgaactc aagcggaagc 300
ggatcataca gcggcattgt aagcggaatc gagtgggcga caacaaacgg catggatgtt 360
atcaatatga gccttggggg agcatcaggc tcgacagcga tgaaacaggc agtcgacaat 420
gcatacgcaa gaggggttgt cgttgtagca gcagctggga acagcggatc ttcaggaaac 480
acgaatacaa ttggctatcc tgcgaaatac gattctgtca tcgctgttgg cgcggtagac 540
tctaacagca acagagcttc attttccagt gtgggagcag agcttgaagt catggctcct 600
ggcgcaggcg tatacagcac ttacccaacg aacacttatg caacattgaa cggaacgtca 660
atggcttctc ctcatgtagc gggagcagca gctttgatct tgtcaaaaca tccgaacctt 720
tcagcttcac aagtccgcaa ccgtctctcc agcacggcga cttatttggg aagctccttc 780
tactatggga aaggtctgat caatgtcgaa gctgccgctc aa 822
<210> 2
<211> 274
<212> БЕЛОК
<213> Неустановленное
<220>
<223> Bacillus sp.
<220>
<221> другой_признак
<223> Субтилизин AprL из Bacillus sp.
<400> 2
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Phe Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Gln Ala Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Ser Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Gly Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Asn Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Ala
115 120 125
Ser Gly Ser Thr Ala Met Lys Gln Ala Val Asp Asn Ala Tyr Ala Arg
130 135 140
Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Asn Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 3
<211> 607
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность промотора aprE
<400> 3
attcctccat tttcttctgc tatcaaaata acagactcgt gattttccaa acgagctttc 60
aaaaaagcct ctgccccttg caaatcggat gcctgtctat aaaattcccg atattggtta 120
aacagcggcg caatggcggc cgcatctgat gtctttgctt ggcgaatgtt catcttattt 180
cttcctccct ctcaataatt ttttcattct atcccttttc tgtaaagttt atttttcaga 240
atacttttat catcatgctt tgaaaaaata tcacgataat atccattgtt ctcacggaag 300
cacacgcagg tcatttgaac gaattttttc gacaggaatt tgccgggact caggagcatt 360
taacctaaaa aagcatgaca tttcagcata atgaacattt actcatgtct attttcgttc 420
ttttctgtat gaaaatagtt atttcgagtc tctacggaaa tagcgagaga tgatatacct 480
aaatagagat aaaatcatct caaaaaaatg ggtctactaa aatattattc catctattac 540
aataaattca cagaatagtc ttttaagtaa gtctactctg aattttttta aaaggagagg 600
gtaacta 607
<210> 4
<211> 87
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность сигнального пептида
<400> 4
gtgagaagca aaaaattgtg gatcagcttg ttgtttgcgt taacgttaat ctttacgatg 60
gcgttcagca acatgtctgc tagcgca 87
<210> 5
<211> 228
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность пропептида
<400> 5
gctcaaccgg cgaaaaatgt tgaaaaggat tatattgtcg gatttaagtc aggagtgaaa 60
accgcatctg tcaaaaagga catcatcaaa gagagcggcg gaaaagtgga caagcagttt 120
agaatcatca acgcggcaaa agcgaagcta gacaaagaag cgcttaagga agtcaaaaat 180
gatccggatg tcgcttatgt ggaagaggat catgtggccc atgccttg 228
<210> 6
<211> 247
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая нуклеотидная последовательность терминатора
<400> 6
acataaaaaa ccggccttgg ccccgccggt tttttattat ttttcttcct ccgcatgttc 60
aatccgctcc ataatcgacg gatggctccc tctgaaaatt ttaacgagaa acggcgggtt 120
gacccggctc agtcccgtaa cggccaagtc ctgaaacgtc tcaatcgccg cttcccggtt 180
tccggtcagc tcaatgccgt aacggtcggc ggcgttttcc tgataccggg agacggcatt 240
cgtaatc 247
<210> 7
<211> 1137
<212> ДНК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(1137)
<223> Нуклеотидная последовательность гена BliD02339.n
<400> 7
atgatgagga aaaagagttt ttggcttggg atgctgacgg ccttaatgct cgtgttcacg 60
atggcattca gcgattccgc ttctgctgct caaccggcga aaaatgttga aaaggattat 120
attgtcggat ttaagtcagg agtgaaaacc gcatctgtca aaaaggacat catcaaagag 180
agcggcggaa aagtggacaa gcagtttaga atcatcaacg cggcaaaagc gaagctagac 240
aaagaagcgc ttaaggaagt caaaaatgat ccggatgtcg cttatgtgga agaggatcat 300
gtggcccatg ccttggcgca aaccgttcct tacggcattc ctctcattaa agcggacaaa 360
gtgcaggctc aaggctttaa gggagcgaat gtaaaagtag ccgtcctgga tacaggaatc 420
caagcttctc atccggactt gaacgtagtc ggcggagcaa gctttgtggc tggcgaagct 480
tataacaccg acggcaacgg acacggcacg catgttgccg gtacagtagc tgcgcttgac 540
aatacaacgg gtgtattagg cgttgcgccg aacgtatcct tgtacgcggt taaagtgctg 600
aattcaagcg gaagcggatc ttacagcggc attgtaagcg gaatcgagtg ggcgacgaca 660
aacggcatgg atgttatcaa catgagcctt ggaggaccat caggctcaac agcgatgaaa 720
caggcggttg acaatgcata tgcaagaggg gttgtcgttg tggcggctgc tgggaacagc 780
ggatcttcag gaaacacgaa tacaatcggc tatcctgcga aatacgactc tgtcatcgca 840
gttggcgcgg tagactctaa cagcaacaga gcttcatttt ccagcgtcgg agcaaagctt 900
gaagtcatgg ctcctggcgc aggcgtgtac agcacttacc caaccagcac ttatgcaaca 960
ttgaacggaa cgtcaatggc ttctcctcat gtagcgggag cagcagcttt gatcttgtca 1020
aaacatccga acctttcagc ttcacaagtc cgcaaccgtc tctccagtac ggcgacttat 1080
ttgggaagct ccttctacta tggaaaaggt ctgatcaatg tcgaagctgc cgctcaa 1137
<210> 8
<211> 379
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(379)
<223> Аминокислотная последовательность препрофермента BliD02339
<400> 8
Met Met Arg Lys Lys Ser Phe Trp Leu Gly Met Leu Thr Ala Leu Met
1 5 10 15
Leu Val Phe Thr Met Ala Phe Ser Asp Ser Ala Ser Ala Ala Gln Pro
20 25 30
Ala Lys Asn Val Glu Lys Asp Tyr Ile Val Gly Phe Lys Ser Gly Val
35 40 45
Lys Thr Ala Ser Val Lys Lys Asp Ile Ile Lys Glu Ser Gly Gly Lys
50 55 60
Val Asp Lys Gln Phe Arg Ile Ile Asn Ala Ala Lys Ala Lys Leu Asp
65 70 75 80
Lys Glu Ala Leu Lys Glu Val Lys Asn Asp Pro Asp Val Ala Tyr Val
85 90 95
Glu Glu Asp His Val Ala His Ala Leu Ala Gln Thr Val Pro Tyr Gly
100 105 110
Ile Pro Leu Ile Lys Ala Asp Lys Val Gln Ala Gln Gly Phe Lys Gly
115 120 125
Ala Asn Val Lys Val Ala Val Leu Asp Thr Gly Ile Gln Ala Ser His
130 135 140
Pro Asp Leu Asn Val Val Gly Gly Ala Ser Phe Val Ala Gly Glu Ala
145 150 155 160
Tyr Asn Thr Asp Gly Asn Gly His Gly Thr His Val Ala Gly Thr Val
165 170 175
Ala Ala Leu Asp Asn Thr Thr Gly Val Leu Gly Val Ala Pro Asn Val
180 185 190
Ser Leu Tyr Ala Val Lys Val Leu Asn Ser Ser Gly Ser Gly Ser Tyr
195 200 205
Ser Gly Ile Val Ser Gly Ile Glu Trp Ala Thr Thr Asn Gly Met Asp
210 215 220
Val Ile Asn Met Ser Leu Gly Gly Pro Ser Gly Ser Thr Ala Met Lys
225 230 235 240
Gln Ala Val Asp Asn Ala Tyr Ala Arg Gly Val Val Val Val Ala Ala
245 250 255
Ala Gly Asn Ser Gly Ser Ser Gly Asn Thr Asn Thr Ile Gly Tyr Pro
260 265 270
Ala Lys Tyr Asp Ser Val Ile Ala Val Gly Ala Val Asp Ser Asn Ser
275 280 285
Asn Arg Ala Ser Phe Ser Ser Val Gly Ala Lys Leu Glu Val Met Ala
290 295 300
Pro Gly Ala Gly Val Tyr Ser Thr Tyr Pro Thr Ser Thr Tyr Ala Thr
305 310 315 320
Leu Asn Gly Thr Ser Met Ala Ser Pro His Val Ala Gly Ala Ala Ala
325 330 335
Leu Ile Leu Ser Lys His Pro Asn Leu Ser Ala Ser Gln Val Arg Asn
340 345 350
Arg Leu Ser Ser Thr Ala Thr Tyr Leu Gly Ser Ser Phe Tyr Tyr Gly
355 360 365
Lys Gly Leu Ile Asn Val Glu Ala Ala Ala Gln
370 375
<210> 9
<211> 274
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(274)
<223> BliD02339
<400> 9
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Phe Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Gln Ala Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Asn Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Gly Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Asn Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Pro
115 120 125
Ser Gly Ser Thr Ala Met Lys Gln Ala Val Asp Asn Ala Tyr Ala Arg
130 135 140
Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Lys Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Ser Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 10
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая терминаторная последовательность
<400> 10
ggttaccttg aatgtatata aacattctca aagggatttc taataaaaaa cgctcggttg 60
ccgccgggcg ttttttatgc atcgatggaa ttc 93
<210> 11
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая новая линкерная последовательность
<400> 11
ggatcctgac tgcctgagct t 21
<210> 12
<211> 274
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(274)
<223> B_licheniformis_CAA62667
<400> 12
Gly Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Phe Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Gln Ala Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Ser Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Ala Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Thr Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Ala
115 120 125
Ser Val Ser Thr Ala Met Lys Gln Ala Val Asp His Ala Tyr Ala Arg
130 135 140
Gly Ala Val Val Val Ser Ser Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Asn Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Thr Arg Leu Ser Arg Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Ser Tyr Gly Arg Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 13
<211> 274
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(274)
<223> B_licheniformis_AEU12640.1
<400> 13
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Leu
1 5 10 15
His Ala Gln Gly Phe Lys Gly Ala Asn Val Lys Gly Ala Val Leu Ala
20 25 30
Thr Gly Ile Pro Thr Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Ser Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Gly Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Asn Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Ala
115 120 125
Ser Gly Ser Thr Ala Met Lys Gln Ala Val Asp Asn Ala Tyr Ala Lys
130 135 140
Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Asn Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 14
<211> 274
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(274)
<223> B_licheniformis_YP_006712489
<400> 14
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Gln Ala Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Asn Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Gly Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Asn Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Pro
115 120 125
Ser Gly Ser Thr Ala Met Lys Gln Ala Val Asp Asn Ala Tyr Ala Arg
130 135 140
Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Ser Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 15
<211> 274
<212> БЕЛОК
<213> Bacillus licheniformis
<220>
<221> другой_признак
<222> (1)..(274)
<223> B_licheniformis_DY_P00781
<400> 15
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Gly Ile Ile Asp
20 25 30
Thr Gly Ile Ala Ala Ser His Thr Asp Leu Lys Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ser Gly Glu Ser Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Asn Val Ser Leu Tyr Ala Ile Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Thr Tyr Ser Ala Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Gln Asn Gly Leu Asp Val Ile Asn Met Ser Leu Gly Gly Pro
115 120 125
Ser Gly Ser Thr Ala Leu Lys Gln Ala Val Asp Lys Ala Tyr Ala Ser
130 135 140
Gly Ile Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Ser
145 150 155 160
Gln Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Lys Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Val Ser Val Tyr Ser Thr Tyr
195 200 205
Pro Ser Asn Thr Tyr Thr Ser Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Tyr Pro Thr Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Asn Leu
245 250 255
Gly Asp Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 16
<211> 274
<212> БЕЛОК
<213> Bacillus sonorensis
<220>
<221> другой_признак
<222> (1)..(274)
<223> B_sonorensis_WP_006636716
<400> 16
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Gly Ile Ile Asp
20 25 30
Thr Gly Ile Ala Ser Ser His Thr Asp Leu Lys Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ser Gly Glu Ser Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Asn Val Ser Leu Tyr Ala Ile Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Thr Tyr Ser Ala Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Gln Asn Gly Leu Asp Val Ile Asn Met Ser Leu Gly Gly Pro
115 120 125
Ser Gly Ser Thr Ala Leu Lys Gln Ala Val Asp Lys Ala Tyr Ala Ser
130 135 140
Gly Ile Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Ser
145 150 155 160
Gln Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Lys Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ser Glu Leu Glu Val Met Ala Pro Gly Val Ser Val Tyr Ser Thr Tyr
195 200 205
Pro Ser Asn Thr Tyr Thr Ser Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Tyr Pro Thr Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Asn Leu
245 250 255
Gly Asp Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 17
<211> 269
<212> БЕЛОК
<213> Bacillus lentus
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_lentus_P29600
<400> 17
Ala Gln Ser Val Pro Trp Gly Ile Ser Arg Val Gln Ala Pro Ala Ala
1 5 10 15
His Asn Arg Gly Leu Thr Gly Ser Gly Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Thr His Pro Asp Leu Asn Ile Arg Gly Gly Ala Ser
35 40 45
Phe Val Pro Gly Glu Pro Ser Thr Gln Asp Gly Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Ser Ala Glu Leu Tyr Ala Val Lys Val Leu Gly Ala
85 90 95
Ser Gly Ser Gly Ser Val Ser Ser Ile Ala Gln Gly Leu Glu Trp Ala
100 105 110
Gly Asn Asn Gly Met His Val Ala Asn Leu Ser Leu Gly Ser Pro Ser
115 120 125
Pro Ser Ala Thr Leu Glu Gln Ala Val Asn Ser Ala Thr Ser Arg Gly
130 135 140
Val Leu Val Val Ala Ala Ser Gly Asn Ser Gly Ala Gly Ser Ile Ser
145 150 155 160
Tyr Pro Ala Arg Tyr Ala Asn Ala Met Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Ser Phe Ser Gln Tyr Gly Ala Gly Leu Asp Ile
180 185 190
Val Ala Pro Gly Val Asn Val Gln Ser Thr Tyr Pro Gly Ser Thr Tyr
195 200 205
Ala Ser Leu Asn Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Ala
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Val Gln Ile
225 230 235 240
Arg Asn His Leu Lys Asn Thr Ala Thr Ser Leu Gly Ser Thr Asn Leu
245 250 255
Tyr Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 18
<211> 269
<212> БЕЛОК
<213> Bacillus clausii
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_clausii_BAD63300
<400> 18
Ala Gln Ser Val Pro Trp Gly Ile Ser Arg Val Gln Ala Pro Ala Ala
1 5 10 15
His Asn Arg Gly Leu Thr Gly Ser Gly Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Thr His Pro Asp Leu Asn Ile Arg Gly Gly Ala Ser
35 40 45
Phe Val Pro Gly Glu Pro Ser Thr Gln Asp Gly Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Ser Ala Glu Leu Tyr Ala Val Lys Val Leu Gly Ala
85 90 95
Ser Gly Ser Gly Ser Val Ser Ser Ile Ala Gln Gly Leu Glu Trp Ala
100 105 110
Gly Asn Asn Gly Met His Val Ala Asn Leu Ser Leu Gly Ser Pro Ser
115 120 125
Pro Ser Ala Thr Leu Glu Gln Ala Val Asn Ser Ala Thr Ser Arg Gly
130 135 140
Val Leu Val Val Ala Ala Ser Gly Asn Ser Gly Ala Gly Ser Ile Ser
145 150 155 160
Tyr Pro Ala Arg Tyr Ala Asn Ala Met Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Ser Phe Ser Gln Tyr Gly Ala Gly Leu Asp Ile
180 185 190
Val Ala Pro Gly Val Asn Val Gln Ser Thr Tyr Pro Gly Ser Thr Tyr
195 200 205
Ala Ser Leu Asn Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Val Gln Ile
225 230 235 240
Arg Asn His Leu Lys Asn Thr Ala Thr Gly Leu Gly Asn Thr Asn Leu
245 250 255
Tyr Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 19
<211> 269
<212> БЕЛОК
<213> Bacillus lehensis
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_lehensis_AFK08970
<400> 19
Met Gln Thr Val Pro Trp Gly Ile Asn Arg Val Gln Ala Pro Ile Ala
1 5 10 15
Gln Ser Arg Gly Phe Thr Gly Thr Gly Val Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Asn His Ala Asp Leu Arg Ile Arg Gly Gly Ala Ser
35 40 45
Phe Val Pro Gly Glu Pro Asn Ile Ser Asp Gly Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Ile
65 70 75 80
Gly Val Ala Pro Asn Val Asp Leu Tyr Gly Val Lys Val Leu Gly Ala
85 90 95
Ser Gly Cys Gly Ser Ile Ser Gly Ile Ala Gln Gly Leu Gln Trp Ala
100 105 110
Ala Asn Asn Gly Met His Ile Ala Asn Met Ser Leu Gly Ser Ser Ala
115 120 125
Gly Ser Ala Thr Met Glu Gln Ala Val Asn Gln Ala Thr Ala Ser Gly
130 135 140
Val Leu Val Val Ala Ala Ser Gly Asn Ser Gly Ala Gly Asn Val Gly
145 150 155 160
Phe Pro Ala Arg Tyr Ala Asn Ala Met Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Ser Phe Ser Gln Tyr Gly Ala Gly Leu Asp Ile
180 185 190
Val Ala Pro Gly Val Gly Val Gln Ser Thr Val Pro Gly Asn Gly Tyr
195 200 205
Ala Ser Phe Asn Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Val Gln Ile
225 230 235 240
Arg Asn His Leu Lys Asn Thr Ala Thr Asn Leu Gly Asn Thr Thr Gln
245 250 255
Phe Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 20
<211> 269
<212> БЕЛОК
<213> Bacillus subtilis
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_subtilis_AAA87324
<400> 20
Met Gln Thr Val Pro Trp Gly Ile Asn Arg Val Gln Ala Pro Ile Ala
1 5 10 15
Gln Ser Arg Gly Phe Thr Gly Thr Gly Val Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Asn His Ala Asp Leu Arg Ile Arg Gly Gly Ala Ser
35 40 45
Phe Val Pro Gly Glu Pro Asn Ile Ser Asp Gly Asn Gly His Gly Thr
50 55 60
Gln Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Asn Val Asp Leu Tyr Gly Val Lys Val Leu Gly Ala
85 90 95
Ser Gly Ser Gly Ser Ile Ser Gly Ile Ala Gln Gly Leu Gln Trp Ala
100 105 110
Ala Asn Asn Gly Met His Ile Ala Asn Met Ser Leu Gly Ser Ser Ala
115 120 125
Gly Ser Ala Thr Met Glu Gln Ala Val Asn Gln Ala Thr Ala Ser Gly
130 135 140
Val Leu Val Val Ala Ala Ser Gly Asn Ser Gly Ala Gly Asn Val Gly
145 150 155 160
Phe Pro Ala Arg Tyr Ala Asn Ala Met Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Thr Phe Ser Gln Tyr Gly Ala Gly Leu Asp Ile
180 185 190
Val Ala Pro Gly Val Gly Val Gln Ser Thr Val Pro Gly Asn Gly Tyr
195 200 205
Ala Ser Phe Asn Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Val Gln Ile
225 230 235 240
Arg Asn His Leu Lys Asn Thr Ala Thr Asn Leu Gly Asn Thr Thr Gln
245 250 255
Phe Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 21
<211> 269
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(269)
<223> Bacillus_sp_BAA25184
<400> 21
Met Gln Thr Val Pro Trp Gly Ile Asn Arg Val Gln Ala Pro Ile Ala
1 5 10 15
Gln Ser Arg Gly Phe Thr Gly Thr Gly Val Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Asn His Ala Asp Leu Arg Ile Arg Gly Gly Ala Ser
35 40 45
Phe Val Pro Gly Glu Pro Asn Ile Ser Asp Gly Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Asn Val Asp Leu Tyr Gly Val Lys Val Leu Gly Ala
85 90 95
Ser Gly Ser Gly Ser Ile Ser Gly Ile Ala Gln Gly Leu Gln Trp Ala
100 105 110
Ala Asn Asn Gly Met His Ile Ala Asn Met Ser Leu Gly Ser Ser Ala
115 120 125
Gly Ser Ala Thr Met Glu Gln Ala Val Asn Gln Ala Thr Ala Ser Gly
130 135 140
Val Leu Val Val Ala Ala Ser Gly Asn Ser Gly Ala Gly Asn Val Gly
145 150 155 160
Phe Pro Ala Arg Tyr Ala Asn Ala Met Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Ser Phe Ser Gln Tyr Gly Ala Gly Leu Asp Ile
180 185 190
Val Ala Pro Gly Val Gly Val Gln Ser Thr Val Pro Gly Asn Gly Tyr
195 200 205
Ser Ser Phe Asn Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Val Gln Ile
225 230 235 240
Arg Asn His Leu Lys Asn Thr Ala Thr Asn Leu Gly Asn Thr Asn Gln
245 250 255
Phe Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 22
<211> 269
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_sp_Sendai_BAA06157
<400> 22
Asn Gln Val Thr Pro Trp Gly Ile Thr Arg Val Gln Ala Pro Thr Ala
1 5 10 15
Trp Thr Arg Gly Tyr Thr Gly Thr Gly Val Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ser Thr His Pro Asp Leu Asn Ile Arg Gly Gly Val Ser
35 40 45
Phe Val Pro Gly Glu Pro Ser Tyr Gln Asp Gly Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Val
65 70 75 80
Gly Val Ala Pro Asn Ala Glu Leu Tyr Ala Val Lys Val Leu Gly Ala
85 90 95
Asn Gly Ser Gly Ser Val Ser Ser Ile Ala Gln Gly Leu Gln Trp Thr
100 105 110
Ala Gln Asn Asn Ile His Val Ala Asn Leu Ser Leu Gly Ser Pro Val
115 120 125
Gly Ser Gln Thr Leu Glu Leu Ala Val Asn Gln Ala Thr Asn Ala Gly
130 135 140
Val Leu Val Val Ala Ala Thr Gly Asn Asn Gly Ser Gly Thr Val Ser
145 150 155 160
Tyr Pro Ala Arg Tyr Ala Asn Ala Leu Ala Val Gly Ala Thr Asp Gln
165 170 175
Asn Asn Asn Arg Ala Ser Phe Ser Gln Tyr Gly Thr Gly Leu Asn Ile
180 185 190
Val Ala Pro Gly Val Gly Ile Gln Ser Thr Tyr Pro Gly Asn Arg Tyr
195 200 205
Ala Ser Leu Ser Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Gln Lys Asn Pro Ser Trp Ser Asn Thr Gln Ile
225 230 235 240
Arg Gln His Leu Thr Ser Thr Ala Thr Ser Leu Gly Asn Ser Asn Gln
245 250 255
Phe Gly Ser Gly Leu Val Asn Ala Glu Ala Ala Thr Arg
260 265
<210> 23
<211> 269
<212> БЕЛОК
<213> Bacillus clausii
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_clausii_ABI26631
<400> 23
Ser Gln Thr Val Pro Trp Gly Ile Ser Phe Ile Asn Thr Gln Gln Ala
1 5 10 15
His Asn Arg Gly Ile Phe Gly Asn Gly Ala Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ala Ser His Pro Asp Leu Arg Ile Ala Gly Gly Ala Ser
35 40 45
Phe Ile Ser Ser Glu Pro Ser Tyr His Asp Asn Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Ser Ala Asp Leu Tyr Ala Val Lys Val Leu Asp Arg
85 90 95
Asn Gly Ser Gly Ser Leu Ala Ser Val Ala Gln Gly Ile Glu Trp Ala
100 105 110
Ile Asn Asn Asn Met His Ile Ile Asn Met Ser Leu Gly Ser Thr Ser
115 120 125
Gly Ser Ser Thr Leu Glu Leu Ala Val Asn Arg Ala Asn Asn Ala Gly
130 135 140
Ile Leu Leu Val Gly Ala Ala Gly Asn Thr Gly Arg Gln Gly Val Asn
145 150 155 160
Tyr Pro Ala Arg Tyr Ser Gly Val Met Ala Ala Ala Ala Val Asp Gln
165 170 175
Asn Gly Gln Arg Ala Ser Phe Ser Thr Tyr Gly Pro Glu Ile Glu Ile
180 185 190
Ser Ala Pro Gly Val Asn Ile Asn Ser Thr Tyr Thr Gly Asn Arg Tyr
195 200 205
Glu Ser Leu Ser Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Ser Arg Tyr Pro Ser Tyr Thr Asn Asn Gln Ile
225 230 235 240
Arg Gln Arg Ile Asn Gln Thr Ala Thr Tyr Leu Gly Ser Pro Ser Leu
245 250 255
Tyr Gly Asn Gly Leu Val His Ala Gly Arg Ala Thr Gln
260 265
<210> 24
<211> 269
<212> БЕЛОК
<213> Bacillus halodurans
<220>
<221> другой_признак
<222> (1)..(269)
<223> B_halodurans_BAB04574
<400> 24
Ser Gln Thr Val Pro Trp Gly Ile Ser Phe Ile Asn Thr Gln Gln Ala
1 5 10 15
His Asn Arg Gly Ile Phe Gly Asn Gly Ala Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ala Ser His Pro Asp Leu Arg Ile Ala Gly Gly Ala Ser
35 40 45
Phe Ile Ser Ser Glu Pro Ser Tyr His Asp Asn Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Ser Ala Asp Leu Tyr Ala Val Lys Val Leu Asp Arg
85 90 95
Asn Gly Ser Gly Ser Leu Ala Ser Val Ala Gln Gly Ile Glu Trp Ala
100 105 110
Ile Asn Asn Asn Met His Ile Ile Asn Met Ser Leu Gly Ser Thr Ser
115 120 125
Gly Ser Ser Thr Leu Glu Leu Ala Val Asn Arg Ala Asn Asn Ala Gly
130 135 140
Ile Leu Leu Val Gly Ala Ala Gly Asn Thr Gly Arg Gln Gly Val Asn
145 150 155 160
Tyr Pro Ala Arg Tyr Ser Gly Val Met Ala Val Ala Ala Val Asp Gln
165 170 175
Asn Gly Gln Arg Ala Ser Phe Ser Thr Tyr Gly Pro Glu Ile Glu Ile
180 185 190
Ser Ala Pro Gly Val Asn Val Asn Ser Thr Tyr Thr Gly Asn Arg Tyr
195 200 205
Val Ser Leu Ser Gly Thr Ser Met Ala Thr Pro His Val Ala Gly Val
210 215 220
Ala Ala Leu Val Lys Ser Arg Tyr Pro Ser Tyr Thr Asn Asn Gln Ile
225 230 235 240
Arg Gln Arg Ile Asn Gln Thr Ala Thr Tyr Leu Gly Ser Pro Ser Leu
245 250 255
Tyr Gly Asn Gly Leu Val His Ala Gly Arg Ala Thr Gln
260 265
<210> 25
<211> 269
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(269)
<223> Bacillus_sp_ADD64465
<400> 25
Ser Gln Thr Val Pro Trp Gly Ile Ser Phe Ile Ser Thr Gln Gln Ala
1 5 10 15
His Asn Arg Gly Ile Phe Gly Asn Gly Ala Arg Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Ala Ser His Pro Asp Leu Arg Ile Ala Gly Gly Ala Ser
35 40 45
Phe Ile Ser Ser Glu Pro Ser Tyr His Asp Asn Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly Val Leu
65 70 75 80
Gly Val Ala Pro Ser Ala Asp Leu Tyr Ala Val Lys Val Leu Asp Arg
85 90 95
Asn Gly Ser Gly Ser Leu Ala Ser Val Ala Gln Gly Ile Glu Trp Ala
100 105 110
Ile Asn Asn Asn Met His Ile Ile Asn Met Ser Leu Gly Ser Thr Ser
115 120 125
Gly Ser Ser Thr Leu Glu Leu Ala Val Asn Arg Gly Asn Asn Ala Gly
130 135 140
Ile Leu Leu Val Gly Ala Ala Gly Asn Thr Gly Arg Gln Gly Val Asn
145 150 155 160
Tyr Pro Ala Arg Tyr Ser Gly Val Met Ala Val Ala Ala Val Asp Gln
165 170 175
Asn Gly Gln Arg Ala Ser Phe Ser Thr Tyr Gly Pro Glu Ile Glu Ile
180 185 190
Ser Ala Pro Gly Val Asn Val Tyr Ser Thr Tyr Thr Gly Asn Arg Tyr
195 200 205
Val Ser Leu Ser Gly Thr Ser Met Ala Ala Pro His Val Ala Gly Thr
210 215 220
Ala Ala Leu Val Lys Ser Arg Tyr Pro Ser Tyr Thr Asn Asn Gln Ile
225 230 235 240
Arg Gln Arg Ile Asn Gln Thr Ala Thr Tyr Leu Gly Ser Ser Asn Leu
245 250 255
Tyr Gly Asn Gly Leu Val His Ala Gly Arg Ala Thr Gln
260 265
<210> 26
<211> 273
<212> БЕЛОК
<213> Bacillus pseudofirmus
<220>
<221> другой_признак
<222> (1)..(273)
<223> B_pseudofirmus_ADC49870
<400> 26
Ala Gln Thr Val Pro Trp Gly Ile Pro Tyr Ile Tyr Ser Asp Val Val
1 5 10 15
His Arg Gln Gly Tyr Phe Gly Asn Gly Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Val Ala Pro His Pro Asp Leu His Ile Arg Gly Gly Val Ser
35 40 45
Phe Ile Ser Thr Glu Asn Thr Tyr Val Asp Tyr Asn Gly His Gly Thr
50 55 60
His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Tyr Gly Val Leu
65 70 75 80
Gly Val Ala Pro Gly Ala Glu Leu Tyr Ala Val Lys Val Leu Asp Arg
85 90 95
Asn Gly Ser Gly Ser His Ala Ser Ile Ala Gln Gly Ile Glu Trp Ala
100 105 110
Met Asn Asn Gly Met Asp Ile Ala Asn Met Ser Leu Gly Ser Pro Ser
115 120 125
Gly Ser Thr Thr Leu Gln Leu Ala Ala Asp Arg Ala Arg Asn Ala Gly
130 135 140
Val Leu Leu Ile Gly Ala Ala Gly Asn Ser Gly Gln Gln Gly Gly Ser
145 150 155 160
Asn Asn Met Gly Tyr Pro Ala Arg Tyr Ala Ser Val Met Ala Val Gly
165 170 175
Ala Val Asp Gln Asn Gly Asn Arg Ala Asn Phe Ser Ser Tyr Gly Ser
180 185 190
Glu Leu Glu Ile Met Ala Pro Gly Val Asn Ile Asn Ser Thr Tyr Leu
195 200 205
Asn Asn Gly Tyr Arg Ser Leu Asn Gly Thr Ser Met Ala Ser Pro His
210 215 220
Val Ala Gly Val Ala Ala Leu Val Lys Gln Lys His Pro His Leu Thr
225 230 235 240
Ala Ala Gln Ile Arg Asn Arg Met Asn Gln Thr Ala Ile Pro Leu Gly
245 250 255
Asn Ser Thr Tyr Tyr Gly Asn Gly Leu Val Asp Ala Glu Tyr Ala Ala
260 265 270
Gln
<210> 27
<211> 276
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(276)
<223> B_sp_sprD_AAC43581
<400> 27
Ala Gln Thr Val Pro Tyr Gly Val Pro His Ile Lys Ala Asp Val Ala
1 5 10 15
His Ala Gln Asn Val Thr Gly Ser Gly Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Asp Ala Ser His Glu Asp Leu Arg Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ser Glu Glu Pro Asp Ala Leu Thr Asp Gly Asn Gly His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Asn Val Gly
65 70 75 80
Val Leu Gly Val Ser Tyr Asp Val Asp Leu Tyr Ala Val Lys Val Leu
85 90 95
Ser Ala Gly Gly Ser Gly Thr Leu Ala Gly Ile Ala Gln Gly Ile Glu
100 105 110
Trp Ala Ile Asp Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Ser Thr Gly Ser Thr Thr Leu Lys Gln Ala Ser Asp Asn Ala Tyr Asn
130 135 140
Ser Gly Ile Val Val Ile Ala Ala Ala Gly Asn Ser Gly Ser Val Leu
145 150 155 160
Gly Leu Val Asn Thr Ile Gly Tyr Pro Ala Arg Tyr Asp Ser Val Ile
165 170 175
Ala Val Gly Ala Val Asp Ser Asn Asn Asn Arg Ala Ser Phe Ser Ser
180 185 190
Val Gly Ser Gln Leu Glu Val Met Ala Pro Gly Val Ala Ile Asn Ser
195 200 205
Thr Leu Pro Gly Asn Gln Tyr Gly Glu Leu Asn Gly Thr Ser Met Ala
210 215 220
Ser Pro His Val Ala Gly Ala Ala Ala Leu Leu Leu Ala Gln Asn Pro
225 230 235 240
Asn Leu Thr Asn Val Gln Val Arg Glu Arg Leu Arg Asp Thr Ala Thr
245 250 255
Asn Leu Gly Ser Ala Phe Asn Tyr Gly His Gly Val Ile Asn Leu Glu
260 265 270
Arg Ala Leu Gln
275
<210> 28
<211> 276
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(276)
<223> Bacillus_sp_BAD21128
<400> 28
Ser Gln Thr Val Pro Tyr Gly Val Pro His Ile Lys Ala Asp Val Ala
1 5 10 15
His Ser Gln Asn Val Thr Gly Asn Gly Val Lys Val Ala Ile Leu Asp
20 25 30
Thr Gly Ile Asp Ala Ala His Glu Asp Leu Arg Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Pro Asn Ala Leu Gln Asp Gly Asn Gly His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Gln Val Gly
65 70 75 80
Val Leu Gly Val Ala Tyr Asp Val Asp Leu Tyr Ala Val Lys Val Leu
85 90 95
Gly Ala Asp Gly Ser Gly Thr Leu Ser Gly Ile Ala Gln Gly Ile Glu
100 105 110
Trp Ser Ile Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Ser Thr Gly Ser Thr Thr Leu Lys Gln Ala Ala Asp Asn Ala Tyr Asn
130 135 140
Ser Gly Leu Val Val Val Ala Ala Ala Gly Asn Ser Gly Asp Phe Phe
145 150 155 160
Gly Leu Ile Asn Thr Ile Gly Tyr Pro Ala Arg Tyr Asp Ser Val Ile
165 170 175
Ala Val Gly Ala Val Asp Ser Asn Asn Arg Arg Ala Ser Phe Ser Ser
180 185 190
Val Gly Ser Gln Leu Glu Val Met Ala Pro Gly Val Asn Ile Leu Ser
195 200 205
Thr Leu Pro Gly Asn Ser Tyr Gly Ser Leu Asn Gly Thr Ser Met Ala
210 215 220
Ser Pro His Val Ala Gly Ala Ala Ala Leu Leu Leu Ala Gln Asp Pro
225 230 235 240
Thr Leu Thr Asn Val Gln Val Arg Glu Ile Leu Arg Asp Thr Ala Thr
245 250 255
Asn Leu Gly Ser Ser Phe Tyr Tyr Gly Asn Gly Val Ile Asp Val Glu
260 265 270
Lys Ala Leu Gln
275
<210> 29
<211> 275
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(275)
<223> Bacillus_sp_sprC_AAC43580
<400> 29
Ala Gln Thr Val Pro Trp Gly Ile Pro His Ile Lys Ala Asp Lys Ala
1 5 10 15
His Ala Ala Gly Val Thr Gly Ser Gly Val Lys Val Ala Ile Leu Asp
20 25 30
Thr Gly Ile Asp Ala Asn His Ala Asp Leu Asn Val Lys Gly Gly Ala
35 40 45
Ser Phe Val Ser Gly Glu Pro Asn Ala Leu Gln Asp Gly Asn Gly His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Thr Thr Gly
65 70 75 80
Val Leu Gly Val Ala Tyr Asn Ala Asp Leu Tyr Ala Val Lys Val Leu
85 90 95
Ser Ala Ser Gly Ser Gly Thr Leu Ser Gly Ile Ala Gln Gly Ile Glu
100 105 110
Trp Ser Ile Ser Asn Gly Met Asn Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Ser Ser Gly Ser Thr Ala Leu Gln Gln Ala Cys Asn Asn Ala Tyr Asn
130 135 140
Arg Gly Ile Val Val Ile Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly
145 150 155 160
Asn Arg Asn Thr Met Gly Tyr Pro Ala Arg Tyr Ser Ser Val Ile Ala
165 170 175
Val Gly Ala Val Ser Ser Asn Asn Thr Arg Ala Ser Phe Ser Ser Val
180 185 190
Gly Ser Glu Leu Glu Val Met Ala Pro Gly Val Asn Ile Leu Ser Thr
195 200 205
Thr Pro Gly Asn Asn Tyr Ala Ser Phe Asn Gly Thr Ser Met Ala Ala
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Lys Ala Lys Tyr Pro Ser
225 230 235 240
Met Thr Asn Val Gln Ile Arg Glu Arg Leu Lys Asn Thr Ala Thr Asn
245 250 255
Leu Gly Asp Pro Phe Phe Tyr Gly Lys Gly Val Ile Asn Val Glu Ser
260 265 270
Ala Leu Gln
275
<210> 30
<211> 275
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(275)
<223> Bacillus_sp_BAD11988
<400> 30
Ala Gln Thr Thr Pro Trp Gly Val Thr His Ile Asn Ala His Arg Ala
1 5 10 15
His Ser Ser Gly Val Thr Gly Ser Gly Val Lys Val Ala Ile Leu Asp
20 25 30
Thr Gly Ile His Ala Ser His Pro Asp Leu Asn Val Arg Gly Gly Ala
35 40 45
Ser Phe Ile Ser Gly Glu Ser Asn Pro Tyr Ile Asp Ser Asn Gly His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Thr Val Gly
65 70 75 80
Val Leu Gly Val Ala Tyr Asn Ala Glu Leu Tyr Ala Val Lys Val Leu
85 90 95
Ser Ala Ser Gly Ser Gly Thr Leu Ser Gly Ile Ala Gln Gly Val Glu
100 105 110
Trp Ser Ile Ala Asn Lys Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Ser Ser Gly Ser Thr Ala Leu Gln Arg Ala Val Asp Asn Ala Tyr Arg
130 135 140
Asn Asn Ile Val Val Val Ala Ala Ala Gly Asn Ser Gly Ala Gln Gly
145 150 155 160
Asn Arg Asn Thr Ile Gly Tyr Pro Ala Arg Tyr Ser Ser Val Ile Ala
165 170 175
Val Gly Ala Val Asp Ser Asn Asn Asn Arg Ala Ser Phe Ser Ser Val
180 185 190
Gly Ser Glu Leu Glu Val Met Ala Pro Gly Val Ser Ile Leu Ser Thr
195 200 205
Val Pro Gly Ser Ser Tyr Ala Ser Tyr Asn Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Leu Lys Ala Lys Tyr Pro Asn
225 230 235 240
Trp Ser Ala Ala Gln Ile Arg Asn Lys Leu Asn Ser Thr Thr Thr Tyr
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Asn Gly Val Ile Asn Val Glu Arg
260 265 270
Ala Leu Gln
275
<210> 31
<211> 275
<212> БЕЛОК
<213> Bacillus circulans
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_circulans_ADN04910
<400> 31
Ala Gln Thr Val Pro Tyr Gly Ile Pro Gln Ile Lys Ala Pro Ala Val
1 5 10 15
His Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile His Ala Ala His Pro Asp Leu Asn Val Ala Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Pro Asn Ala Thr Gln Asp Phe Gln Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asp Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Arg Asn Gly Asp Gly Gln Tyr Ser Trp Ile Ile Ser Gly Ile Glu
100 105 110
Trp Ala Val Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Asn Gly Ser Thr Ala Leu Lys Asn Ala Val Asp Thr Ala Asn Asn
130 135 140
Arg Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Thr Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Asp Ser Thr Ile Ala
165 170 175
Val Ala Asn Val Asn Ser Ser Asn Val Arg Asn Ser Ser Ser Ser Ala
180 185 190
Gly Pro Glu Leu Asp Val Ser Ala Pro Gly Thr Ser Ile Leu Ser Thr
195 200 205
Val Pro Ser Arg Gly Tyr Thr Ser Tyr Thr Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Asn Pro Asn
225 230 235 240
Leu Ser Asn Ser Gln Val Arg Gln Arg Leu Glu Asn Thr Ala Thr Pro
245 250 255
Leu Gly Asn Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ser Asn
275
<210> 32
<211> 276
<212> БЕЛОК
<213> Bacillus lehensis
<220>
<221> другой_признак
<222> (1)..(276)
<223> B_lehensis_AFP23380
<400> 32
Met Ala Gln Thr Val Pro Tyr Gly Ile Pro Gln Ile Lys Ala Pro Ala
1 5 10 15
Val His Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu
20 25 30
Asp Thr Gly Ile His Ala Ala His Pro Asp Leu Asn Val Ala Gly Gly
35 40 45
Ala Ser Phe Val Pro Ser Glu Pro Asn Ala Thr Gln Asp Phe Gln Ser
50 55 60
His Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asp Asn Thr Ile
65 70 75 80
Gly Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val
85 90 95
Leu Asp Arg Tyr Gly Asp Gly Gln Tyr Ser Trp Ile Ile Ser Gly Ile
100 105 110
Glu Trp Ala Val Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly
115 120 125
Gly Pro Asn Gly Ser Thr Ala Leu Lys Asn Ala Val Asp Thr Ala Asn
130 135 140
Asn Arg Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Thr
145 150 155 160
Gly Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Asp Ser Thr Ile
165 170 175
Ala Val Ala Asn Val Asn Ser Asn Asn Val Arg Asn Ser Ser Ser Ser
180 185 190
Ala Gly Pro Glu Leu Asp Val Ser Ala Pro Gly Thr Ser Ile Leu Ser
195 200 205
Thr Val Pro Ser Ser Gly Tyr Thr Ser Tyr Thr Gly Thr Ser Met Ala
210 215 220
Ser Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Tyr Pro
225 230 235 240
Asn Leu Ser Thr Ser Gln Val Arg Gln Arg Leu Glu Asn Thr Ala Thr
245 250 255
Pro Leu Gly Asn Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln
260 265 270
Ala Ala Ser Asn
275
<210> 33
<211> 275
<212> БЕЛОК
<213> Bacillus stratosphericus
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_stratosphericus_WP_007497196
<400> 33
Ala Gln Thr Val Pro Tyr Gly Ile Pro Gln Ile Lys Ala Pro Ala Val
1 5 10 15
His Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile His Ala Ala His Pro Asp Leu Asn Val Ala Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Pro Asn Ala Thr Gln Asp Phe Gln Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asp Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Arg Asn Gly Asp Gly Gln Tyr Ser Trp Ile Ile Ser Gly Ile Glu
100 105 110
Trp Ala Val Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Thr Ala Leu Lys Asn Ala Val Asp Thr Ala Asn Asn
130 135 140
Arg Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Thr Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Asp Ser Thr Ile Ala
165 170 175
Val Ala Asn Val Asn Ser Asn Asn Val Arg Asn Ser Ser Ser Ser Ala
180 185 190
Gly Pro Glu Leu Asp Val Ser Ala Pro Gly Thr Ser Ile Leu Ser Thr
195 200 205
Val Pro Ser Ser Gly Tyr Thr Ser Tyr Thr Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Tyr Pro Asn
225 230 235 240
Leu Ser Thr Ser Gln Val Arg Gln Arg Leu Glu Asn Thr Ala Thr Pro
245 250 255
Leu Gly Asn Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ser Asn
275
<210> 34
<211> 275
<212> БЕЛОК
<213> Bacillus pumilus
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_pumilus_ADK11996
<400> 34
Ala Gln Thr Val Pro Tyr Gly Ile Pro Gln Ile Lys Ala Pro Ala Val
1 5 10 15
His Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile His Ala Ala His Pro Asp Leu Asn Val Ala Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Pro Asn Ala Thr Gln Asp Phe Gln Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asp Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Arg Asn Gly Asp Gly Gln Tyr Ser Trp Ile Ile Ser Gly Ile Glu
100 105 110
Trp Ala Val Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Ala Ser Gly Ser Thr Ala Leu Lys Asn Ala Val Asp Thr Ala Asn Asn
130 135 140
Arg Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly
145 150 155 160
Ser Arg Ser Thr Val Gly Tyr Pro Ala Lys Tyr Glu Ser Thr Ile Ala
165 170 175
Val Ala Asn Val Asn Ser Asn Asn Val Arg Asn Ser Ser Ser Ser Ala
180 185 190
Gly Pro Glu Leu Asp Val Ser Ala Pro Gly Thr Ser Ile Leu Ser Thr
195 200 205
Val Pro Ser Ser Gly Tyr Thr Ser Tyr Thr Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys Asn Pro Asn
225 230 235 240
Leu Thr Asn Ser Gln Val Arg Gln Arg Leu Glu Asn Thr Ala Thr Pro
245 250 255
Leu Gly Asp Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ser Asn
275
<210> 35
<211> 275
<212> БЕЛОК
<213> Bacillus sp.
<220>
<221> другой_признак
<222> (1)..(275)
<223> Bac_sp_HYC10_WP008359041
<400> 35
Ala Gln Thr Val Pro Tyr Gly Ile Pro Gln Ile Lys Ala Pro Ala Val
1 5 10 15
His Ala Gln Gly Tyr Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile His Ala Ala His Pro Asp Leu Asn Val Ala Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Pro Asn Ala Thr Gln Asp Phe Gln Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asp Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Arg Asn Gly Asp Gly Gln Tyr Ser Trp Ile Ile Ser Gly Ile Glu
100 105 110
Trp Ala Val Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Thr Ala Leu Lys Asn Ala Val Asp Thr Ala Asn Asn
130 135 140
Arg Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Asp Ser Thr Ile Ala
165 170 175
Val Ala Asn Val Asn Ser Asn Asn Val Arg Asn Ser Ser Ser Ser Ala
180 185 190
Gly Pro Glu Leu Asp Val Ser Ala Pro Gly Thr Ser Ile Leu Ser Thr
195 200 205
Val Pro Ser Ser Gly Tyr Ala Ser Tyr Thr Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn
225 230 235 240
Leu Thr Asn Thr Gln Val Arg Gln Arg Leu Glu Asn Thr Ala Thr Pro
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Asn
275
<210> 36
<211> 275
<212> БЕЛОК
<213> Bacillus atrophaeus
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_atrophaeus_YP003972439
<400> 36
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Val
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Lys Val Ser Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Pro Asn Pro Phe Gln Asp Gly Asn Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Val Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Ser Ser Ser Gly Ser Gly Asp Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Gln Gly Ser Thr Ala Leu Lys Ala Val Val Asp Lys Ala Val Ser
130 135 140
Gln Gly Ile Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Pro Ser Val Ile Ala
165 170 175
Val Gly Ala Val Asp Ser Asn Asn Gln Arg Ala Ser Phe Ser Ser Ala
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Ser Ser Tyr Gly Ser Tyr Asn Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Val Leu Ser Lys His Pro Asn
225 230 235 240
Trp Thr Asn Ser Gln Val Arg Asn Ser Leu Glu Ser Thr Ala Thr Asn
245 250 255
Leu Gly Asn Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 37
<211> 275
<212> БЕЛОК
<213> Bacillus amyloliquefaciens
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_amyloliquefaciens_CAA24990
<400> 37
Ala Gln Ser Val Pro Tyr Gly Val Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Lys Val Ala Gly Gly Ala
35 40 45
Ser Met Val Pro Ser Glu Thr Asn Pro Phe Gln Asp Asn Asn Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Gly Ala Asp Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Ala Ala Leu Lys Ala Ala Val Asp Lys Ala Val Ala
130 135 140
Ser Gly Val Val Val Val Ala Ala Ala Gly Asn Glu Gly Thr Ser Gly
145 150 155 160
Ser Ser Ser Thr Val Gly Tyr Pro Gly Lys Tyr Pro Ser Val Ile Ala
165 170 175
Val Gly Ala Val Asp Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Val
180 185 190
Gly Pro Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Asn Lys Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn
225 230 235 240
Trp Thr Asn Thr Gln Val Arg Ser Ser Leu Glu Asn Thr Thr Thr Lys
245 250 255
Leu Gly Asp Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 38
<211> 275
<212> БЕЛОК
<213> Bacillus methylotrophicus
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_methylotrophicus_AGC81872
<400> 38
Ala Gln Ser Val Pro Tyr Gly Val Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Phe Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Lys Val Ala Gly Gly Ala
35 40 45
Ser Met Val Pro Ser Glu Thr Asn Pro Phe Gln Asp Arg Asn Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Val Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Gly Ala Asp Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ala Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Ala Ala Leu Lys Ala Ala Val Asp Lys Ala Val Ala
130 135 140
Ser Gly Val Val Val Val Ala Ala Ala Gly Asn Glu Gly Thr Ser Gly
145 150 155 160
Gly Ser Ser Thr Val Gly Tyr Pro Gly Lys Tyr Pro Ser Val Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Val
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Asn Lys Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn
225 230 235 240
Trp Thr Asn Thr Gln Val Arg Ser Ser Leu Glu Asn Thr Thr Thr Lys
245 250 255
Leu Gly Asp Ala Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 39
<211> 275
<212> БЕЛОК
<213> Geobacillus stearothermophilus
<220>
<221> другой_признак
<222> (1)..(275)
<223> G_stearothermophilus_ABY25856
<400> 39
Ala Gln Ser Val Pro Tyr Gly Val Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Phe Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Lys Val Ala Gly Gly Ala
35 40 45
Ser Met Val Pro Ser Glu Thr Asn Pro Phe Gln Asp Asn Asn Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Val Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Gly Ala Asp Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ala Tyr Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Ala Ala Leu Lys Ala Ala Val Asp Lys Ala Val Ala
130 135 140
Ser Gly Ile Val Val Val Ala Ala Ala Gly Asn Glu Gly Thr Ser Gly
145 150 155 160
Ser Ser Ser Thr Val Gly Tyr Pro Gly Lys Tyr Pro Ser Val Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Val
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Asn Lys Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Ser
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn
225 230 235 240
Trp Thr Asn Thr Gln Val Arg Ser Ser Leu Glu Asn Thr Thr Thr Lys
245 250 255
Leu Gly Asp Ala Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 40
<211> 275
<212> БЕЛОК
<213> Bacillus vallismortis
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_vallismortis_WP010329279
<400> 40
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Asn Val Arg Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Thr Asn Pro Tyr Gln Asp Gly Ser Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Ser Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Asn Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Ser Thr Gly Asn Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Lys Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Thr Ala Leu Lys Ser Val Val Asp Arg Ala Val Ala
130 135 140
Ser Gly Ile Val Val Val Ala Ala Ala Gly Asn Glu Gly Thr Ser Gly
145 150 155 160
Ser Ser Ser Thr Ile Gly Tyr Pro Ala Lys Tyr Pro Ser Thr Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Gly Ser Phe Ser Ser Val
180 185 190
Gly Pro Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Gly Thr Tyr Gly Ser Tyr Asn Gly Thr Ser Met Ala Thr
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Thr
225 230 235 240
Trp Thr Asn Thr Gln Val Arg Asn Arg Leu Glu Ser Thr Thr Thr Tyr
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 41
<211> 275
<212> БЕЛОК
<213> Bacillus subtilis
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_subtilis_ACJ07037
<400> 41
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Asn Val Lys Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Thr Asn Pro Tyr Gln Asp Gly Ser Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Asn Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Ser Thr Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Ser Gly Ser Thr Ala Leu Lys Thr Val Val Asp Lys Ala Val Ser
130 135 140
Ser Gly Ile Val Val Ala Ala Ala Ala Gly Asn Glu Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Pro Ser Thr Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Ala
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Gly Thr Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Thr
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Thr
225 230 235 240
Trp Thr Asn Ala Gln Val Arg Asp Arg Leu Glu Ser Thr Ala Thr Tyr
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 42
<211> 275
<212> БЕЛОК
<213> Bacillus subtilis
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_subtilis_str168_CAA74536
<400> 42
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Asn Val Arg Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Thr Asn Pro Tyr Gln Asp Gly Ser Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Ile Ala Ala Leu Asn Asn Ser Ile Gly
65 70 75 80
Val Leu Gly Val Ser Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Ser Thr Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Thr Gly Ser Thr Ala Leu Lys Thr Val Val Asp Lys Ala Val Ser
130 135 140
Ser Gly Ile Val Val Ala Ala Ala Ala Gly Asn Glu Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Pro Ser Thr Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Ala
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Gly Thr Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Thr
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Thr
225 230 235 240
Trp Thr Asn Ala Gln Val Arg Asp Arg Leu Glu Ser Thr Ala Thr Tyr
245 250 255
Leu Gly Asn Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 43
<211> 275
<212> БЕЛОК
<213> Bacillus mojavensis
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_mojavensis_WP010333625
<400> 43
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Asn Val Arg Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Thr Asn Pro Tyr Gln Asp Gly Ser Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Ser Thr Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Thr Gly Ser Thr Ala Leu Lys Thr Val Val Asp Lys Ala Val Ala
130 135 140
Ser Gly Ile Val Val Val Ala Ala Ala Gly Asn Glu Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Pro Ser Thr Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Ala
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Gly Thr Tyr Gly Ala Tyr Asn Gly Thr Ser Met Ala Thr
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Thr
225 230 235 240
Trp Thr Asn Ala Gln Val Arg Asp Arg Leu Glu Ser Thr Ala Thr Tyr
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 44
<211> 275
<212> БЕЛОК
<213> Bacillus subtilis
<220>
<221> другой_признак
<222> (1)..(275)
<223> B_subtilis_BAN09118
<400> 44
Ala Gln Ser Val Pro Tyr Gly Ile Ser Gln Ile Lys Ala Pro Ala Leu
1 5 10 15
His Ser Gln Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Ile Asp
20 25 30
Ser Gly Ile Asp Ser Ser His Pro Asp Leu Asn Val Arg Gly Gly Ala
35 40 45
Ser Phe Val Pro Ser Glu Thr Asn Pro Tyr Gln Asp Gly Ser Ser His
50 55 60
Gly Thr His Val Ala Gly Thr Val Ala Ala Leu Asn Asn Thr Ile Gly
65 70 75 80
Val Leu Gly Val Ala Pro Ser Ala Ser Leu Tyr Ala Val Lys Val Leu
85 90 95
Asp Ser Thr Gly Ser Gly Gln Tyr Ser Trp Ile Ile Asn Gly Ile Glu
100 105 110
Trp Ala Ile Ser Asn Asn Met Asp Val Ile Asn Met Ser Leu Gly Gly
115 120 125
Pro Thr Gly Ser Thr Ala Leu Lys Thr Val Val Asp Lys Ala Val Ala
130 135 140
Ser Gly Ile Val Val Val Ala Ala Ala Gly Asn Glu Gly Ser Ser Gly
145 150 155 160
Ser Thr Ser Thr Val Gly Tyr Pro Ala Lys Tyr Pro Ser Thr Ile Ala
165 170 175
Val Gly Ala Val Asn Ser Ser Asn Gln Arg Ala Ser Phe Ser Ser Ala
180 185 190
Gly Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr
195 200 205
Leu Pro Gly Gly Thr Tyr Gly Ser Tyr Asn Gly Thr Ser Met Ala Thr
210 215 220
Pro His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Thr
225 230 235 240
Trp Ser Asn Ala Gln Val Arg Asp Arg Leu Glu Ser Thr Ala Thr Asn
245 250 255
Leu Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Gln Ala
260 265 270
Ala Ala Gln
275
<210> 45
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<223> Аминокислотный мотив Tyr56-Asn57-Thr58 (аминокислотные положения в соответствии с нумерацией в аминокислотной последовательности протеазы AprL, показанной в SEQ ID NO: 2).
<400> 45
Tyr Asn Thr
1
<210> 46
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 46
Tyr Asn Thr
1
<210> 47
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<222> (3)..(3)
<223> Xaa представляет собой Ala или Ser
<220>
<221> другой_признак
<222> (6)..(6)
<223> Xaa, если присутствует, представляет собой любую аминокислоту
<220>
<221> другой_признак
<222> (7)..(7)
<223> Xaa представляет собой Ala или Ser
<400> 47
Phe Val Xaa Gly Glu Xaa Xaa Tyr Asn Thr
1 5 10
<210> 48
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<223> Мотив F50V51X152G53E54X355Y56 N57T58 (SEQ ID NO:48), где X1 представляет собой A или S, и X3 представляет собой A и S; и дополнительно где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2
<220>
<221> другой_признак
<222> (3)..(3)
<223> Xaa представляет собой Ala или Ser
<220>
<221> другой_признак
<222> (6)..(6)
<223> Xaa представляет собой Ala или Ser
<400> 48
Phe Val Xaa Gly Glu Xaa Tyr Asn Thr
1 5
<210> 49
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 49
Leu Ser Ala Ser
1
<210> 50
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<223> Мотив Leu240-Ser241-Ala242-Ser243 (аминокислотные положения в соответствии с нумерацией в аминокислотной последовательности протеазы AprL, показанной в SEQ ID NO: 2)
<400> 50
Leu Ser Ala Ser
1
<210> 51
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<222> (2)..(4)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> другой_признак
<222> (10)..(10)
<223> Xaa представляет собой Val или Ile
<400> 51
Lys Xaa Xaa Xaa Leu Ser Ala Ser Gln Xaa Arg
1 5 10
<210> 52
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> другой_признак
<223> Мотив K236XXXLSASQX5R246 (SEQ ID NO:52), где X представляет собой любую аминокислоту, и X5 представляет собой I или V; и дополнительно где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2
<220>
<221> другой_признак
<222> (2)..(4)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> другой_признак
<222> (10)..(10)
<223> Xaa представляет собой Val или Ile
<400> 52
Lys Xaa Xaa Xaa Leu Ser Ala Ser Gln Xaa Arg
1 5 10
<210> 53
<211> 254
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность
<400> 53
Ala Gln Thr Val Pro Tyr Gly Ile Ile Lys Ala Pro Val His Ala Gln
1 5 10 15
Gly Tyr Thr Gly Ser Asn Val Lys Val Ala Val Leu Asp Thr Gly Ile
20 25 30
Ala Ser His Pro Asp Leu Asn Val Gly Gly Ala Ser Phe Val Pro Ser
35 40 45
Glu Pro Gln Asp Gly Asn Gly His Gly Thr His Val Ala Gly Thr Val
50 55 60
Ala Ala Leu Asn Asn Thr Ile Gly Val Leu Gly Val Ala Pro Ser Ala
65 70 75 80
Ser Leu Tyr Ala Val Lys Val Leu Ala Ser Gly Ser Gly Ser Tyr Ser
85 90 95
Ile Ile Gln Gly Ile Glu Trp Ala Ile Asn Asn Met Asp Val Ile Asn
100 105 110
Met Ser Leu Gly Gly Pro Ser Gly Ser Thr Ala Leu Lys Gln Ala Val
115 120 125
Asp Ala Ala Ser Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly
130 135 140
Ser Ser Gly Thr Thr Val Gly Tyr Pro Ala Lys Tyr Ser Val Ile Ala
145 150 155 160
Val Gly Ala Val Asp Ser Asn Asn Asn Arg Ala Ser Phe Ser Ser Gly
165 170 175
Ser Glu Leu Asp Val Met Ala Pro Gly Val Ser Ile Gln Ser Thr Leu
180 185 190
Pro Gly Asn Tyr Ala Ser Tyr Asn Gly Thr Ser Met Ala Ser Pro His
195 200 205
Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Ser Trp Ser
210 215 220
Asn Ser Gln Val Arg Asn Arg Leu Asn Thr Ala Thr Leu Gly Ser Phe
225 230 235 240
Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala Ala Gln
245 250
<210> 54
<211> 274
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая консенсусная последовательность
<400> 54
Ala Gln Thr Val Pro Tyr Gly Ile Pro Leu Ile Lys Ala Asp Lys Val
1 5 10 15
Gln Ala Gln Gly Phe Lys Gly Ala Asn Val Lys Val Ala Val Leu Asp
20 25 30
Thr Gly Ile Gln Ala Ser His Pro Asp Leu Asn Val Val Gly Gly Ala
35 40 45
Ser Phe Val Ala Gly Glu Ala Tyr Asn Thr Asp Gly Asn Gly His Gly
50 55 60
Thr His Val Ala Gly Thr Val Ala Ala Leu Asp Asn Thr Thr Gly Val
65 70 75 80
Leu Gly Val Ala Pro Asn Val Ser Leu Tyr Ala Val Lys Val Leu Asn
85 90 95
Ser Ser Gly Ser Gly Ser Tyr Ser Gly Ile Val Ser Gly Ile Glu Trp
100 105 110
Ala Thr Thr Asn Gly Met Asp Val Ile Asn Met Ser Leu Gly Gly Pro
115 120 125
Ser Gly Ser Thr Ala Met Lys Gln Ala Val Asp Asn Ala Tyr Ala Arg
130 135 140
Gly Val Val Val Val Ala Ala Ala Gly Asn Ser Gly Ser Ser Gly Asn
145 150 155 160
Thr Asn Thr Ile Gly Tyr Pro Ala Lys Tyr Asp Ser Val Ile Ala Val
165 170 175
Gly Ala Val Asp Ser Asn Ser Asn Arg Ala Ser Phe Ser Ser Val Gly
180 185 190
Ala Glu Leu Glu Val Met Ala Pro Gly Ala Gly Val Tyr Ser Thr Tyr
195 200 205
Pro Thr Asn Thr Tyr Ala Thr Leu Asn Gly Thr Ser Met Ala Ser Pro
210 215 220
His Val Ala Gly Ala Ala Ala Leu Ile Leu Ser Lys His Pro Asn Leu
225 230 235 240
Ser Ala Ser Gln Val Arg Asn Arg Leu Ser Ser Thr Ala Thr Tyr Leu
245 250 255
Gly Ser Ser Phe Tyr Tyr Gly Lys Gly Leu Ile Asn Val Glu Ala Ala
260 265 270
Ala Gln
<210> 55
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (3)..(3)
<223> Xaa представляет собой Ala или Gly
<400> 55
Leu Ser Xaa Ser
1
<210> 56
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<220>
<221> ДРУГОЙ_ПРИЗНАК
<223> Мотив L240S241G242S243 (SEQ ID NO:56), где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2
<400> 56
Leu Ser Gly Ser
1
<210> 57
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (2)..(4)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (7)..(7)
<223> Xaa представляет собой Ala или Gly
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (10)..(10)
<223> Xaa представляет собой Ile или Val
<400> 57
Lys Xaa Xaa Xaa Leu Ser Xaa Ser Gln Xaa Arg
1 5 10
<210> 58
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<400> 58
Leu Ser Gly Ser
1
<210> 59
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (2)..(4)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (10)..(10)
<223> Xaa представляет собой Ile или Val
<400> 59
Lys Xaa Xaa Xaa Leu Ser Gly Ser Gln Xaa Arg
1 5 10
<210> 60
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив
<220>
<221> ДРУГОЙ_ПРИЗНАК
<223> Мотив K236XXXLSGSQX5R246 (SEQ ID NO:60), где X представляет собой любую аминокислоту, и X5 представляет собой I или V; и дополнительно где аминокислотные положения пронумерованы в соответствии с аминокислотной последовательностью протеазы AprL, изложенной в SEQ ID NO:2
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (2)..(4)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> ДРУГОЙ_ПРИЗНАК
<222> (10)..(10)
<223> Xaa представляет собой Ile или Val
<400> 60
Lys Xaa Xaa Xaa Leu Ser Gly Ser Gln Xaa Arg
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ ПРОТЕАЗ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2790443C2 |
| КОМПОЗИЦИЯ МОЮЩЕГО СРЕДСТВА ДЛЯ СТИРКИ | 2017 |
|
RU2716130C1 |
| КОМПОЗИЦИЯ МОЮЩЕГО СРЕДСТВА ДЛЯ СТИРКИ С НИЗКИМ ПОКАЗАТЕЛЕМ PH | 2017 |
|
RU2716255C1 |
| КОМПОЗИЦИЯ МОЮЩЕГО СРЕДСТВА ДЛЯ СТИРКИ С НИЗКИМ ПОКАЗАТЕЛЕМ PH | 2017 |
|
RU2719356C1 |
| КОМПОЗИЦИЯ МОЮЩЕГО СРЕДСТВА ДЛЯ СТИРКИ С НИЗКИМ ПОКАЗАТЕЛЕМ PH | 2017 |
|
RU2715886C1 |
| КОМПОЗИЦИЯ МОЮЩЕГО СРЕДСТВА ДЛЯ СТИРКИ | 2017 |
|
RU2719358C1 |
| СПОСОБЫ УЛУЧШЕНИЯ ЗДОРОВЬЯ РАСТЕНИЯ С ПРИМЕНЕНИЕМ СВОБОДНЫХ ФЕРМЕНТОВ И МИКРООРГАНИЗМОВ, ЭКСПРЕССИРУЮЩИХ ФЕРМЕНТЫ НА ПОВЫШЕННОМ УРОВНЕ | 2017 |
|
RU2802848C2 |
| МОЮЩИЕ КОМПОЗИЦИИ ДЛЯ СТИРКИ С УДАЛЕНИЕМ ПЯТЕН | 2020 |
|
RU2780648C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ ВИРУСА ПТИЧЬЕГО ГРИППА ПОДТИПА H5 | 2019 |
|
RU2809084C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ РЕКОМБИНАНТНЫЕ КЛЕТКИ BACILLUS И ИНСЕКТИЦИД | 2015 |
|
RU2736562C2 |
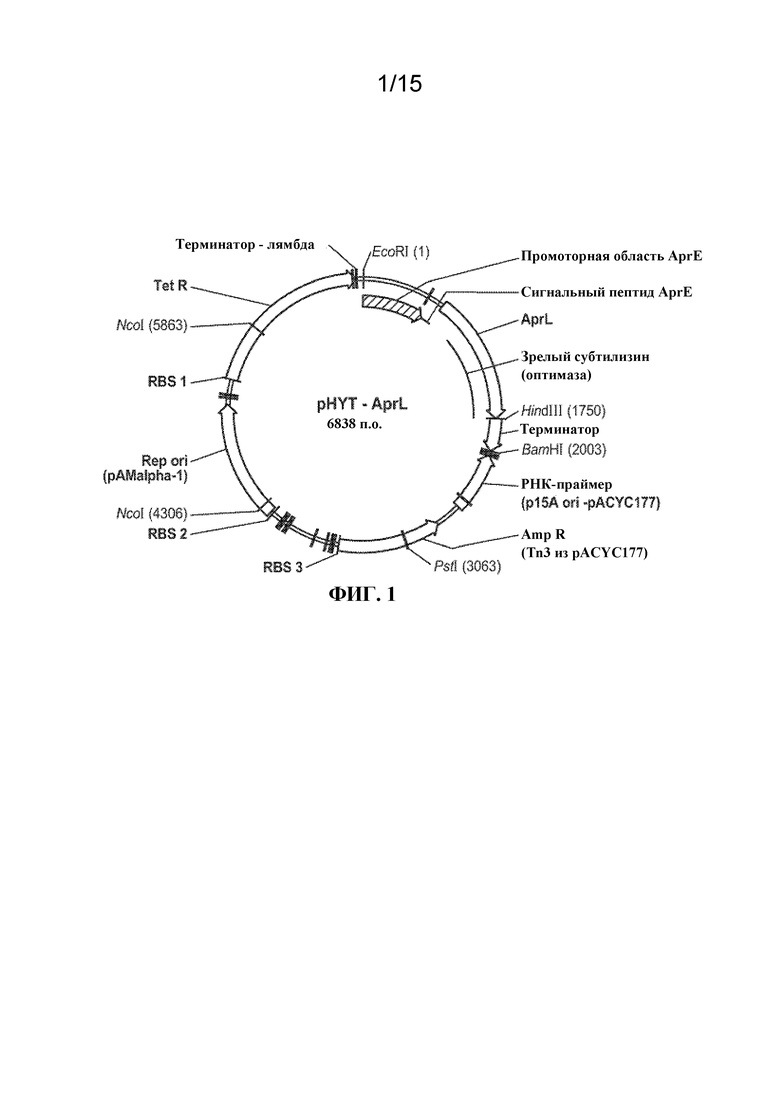






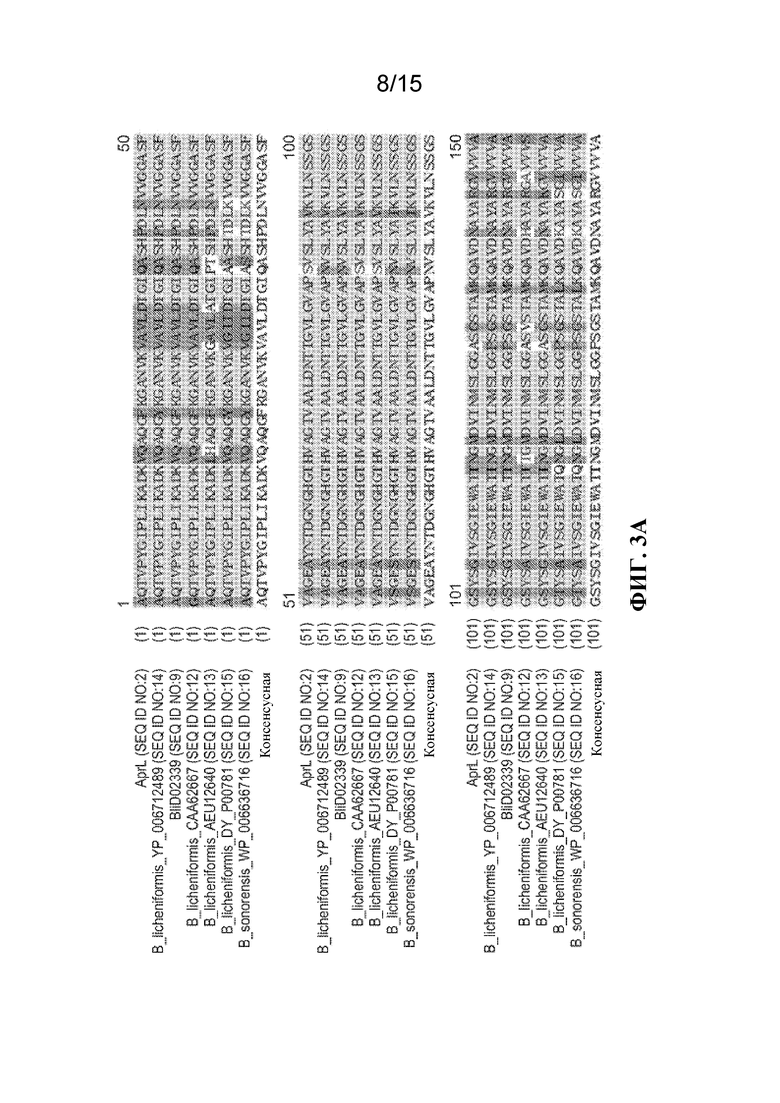

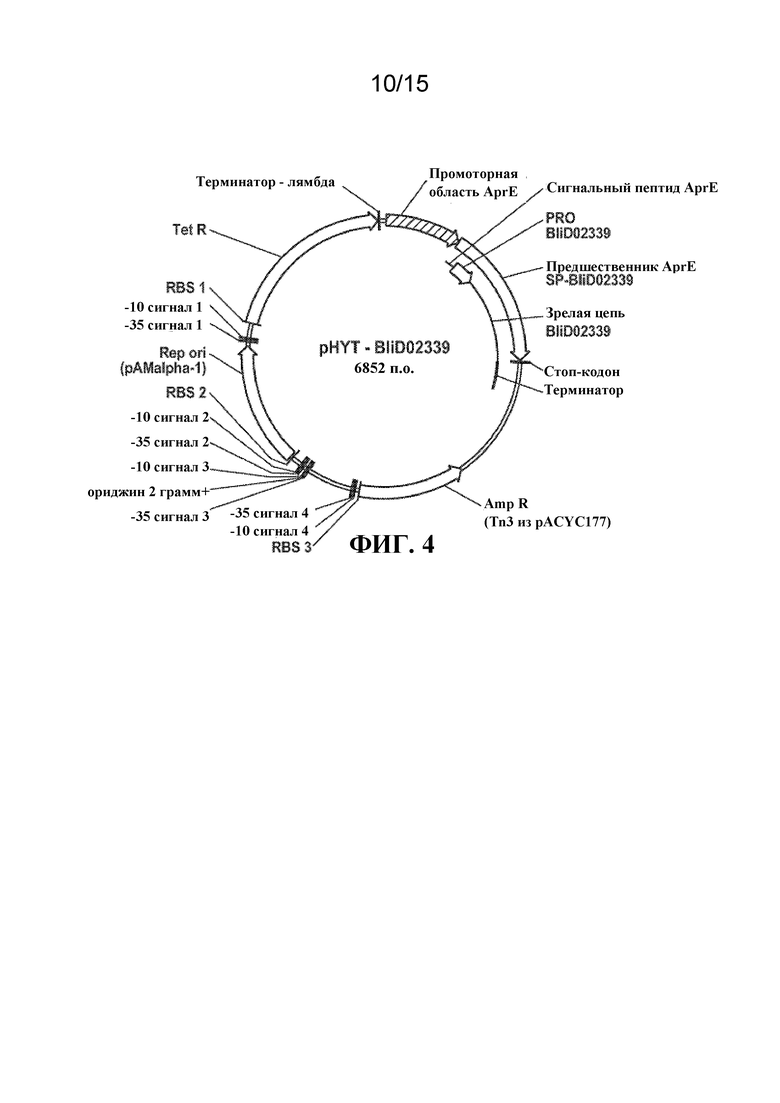
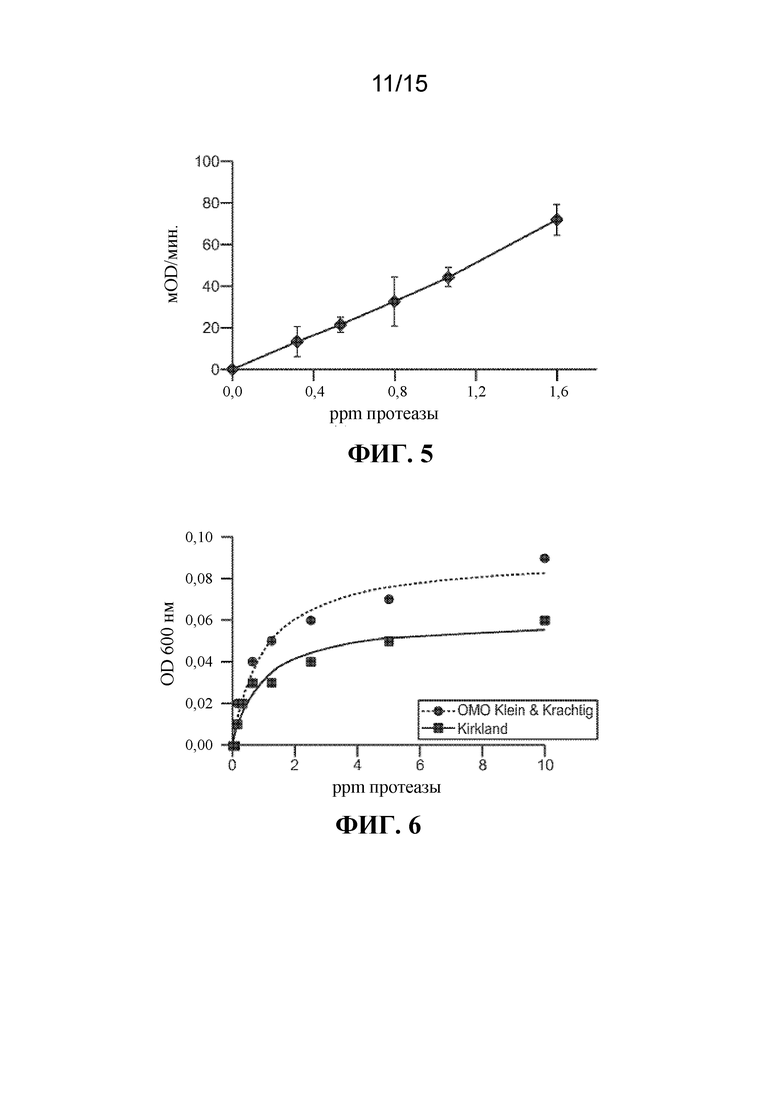
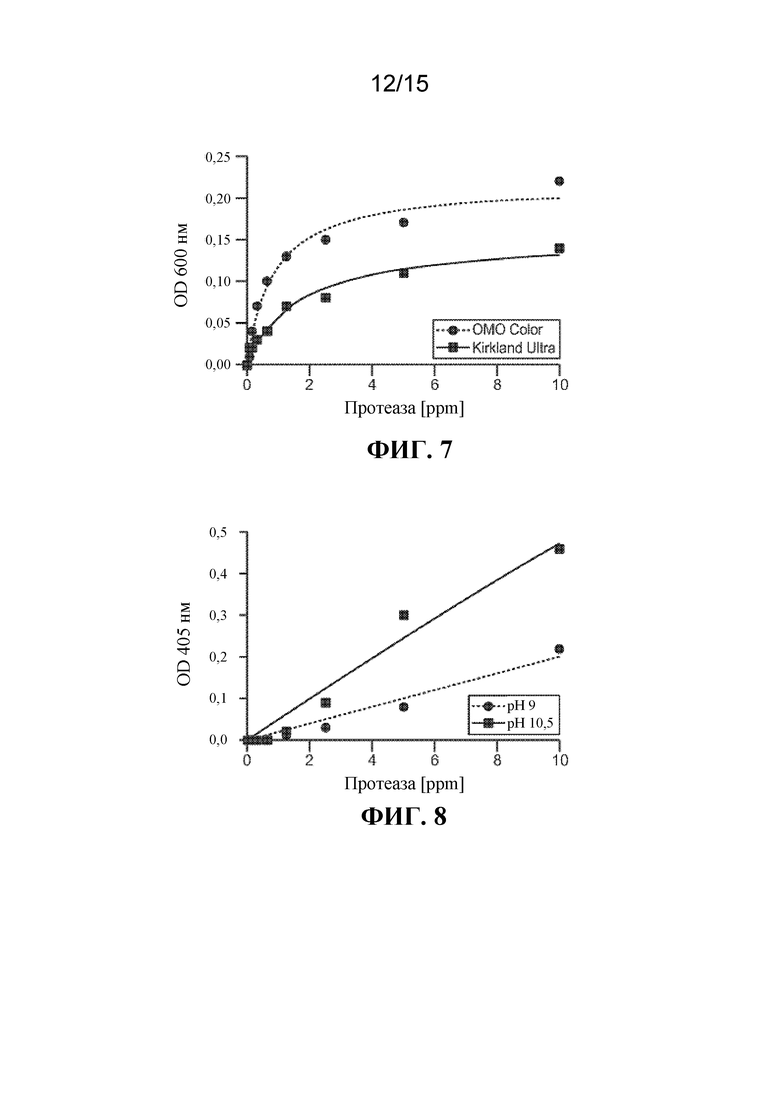
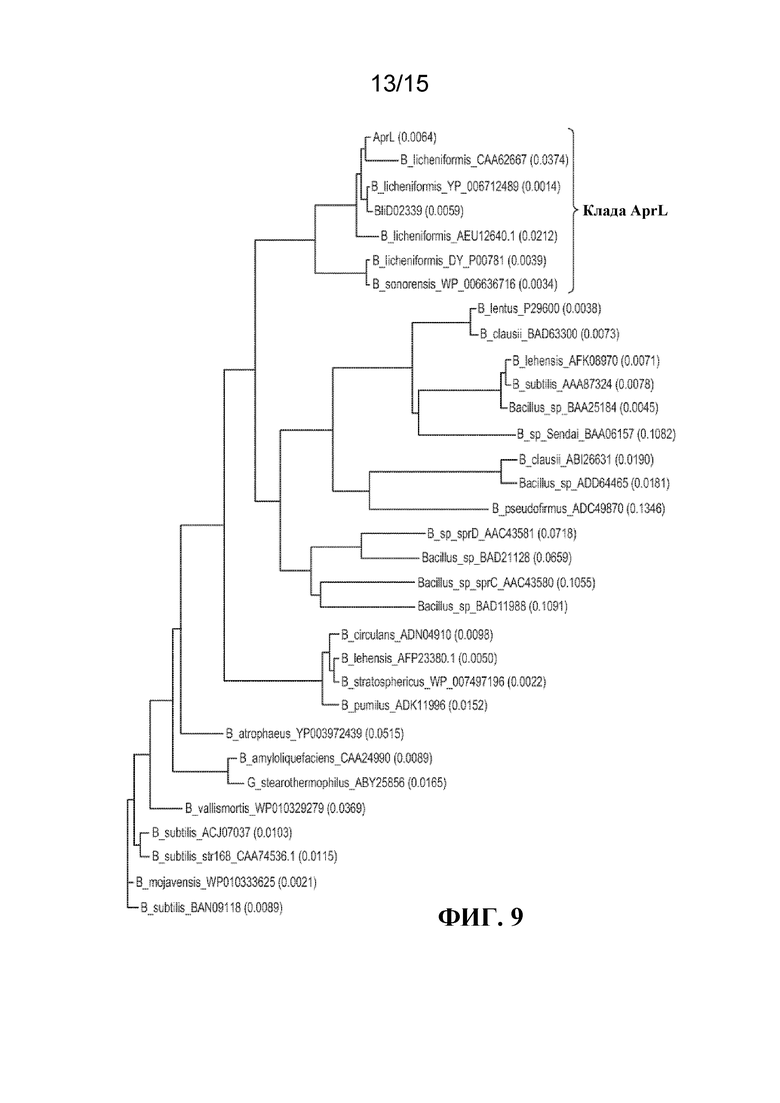
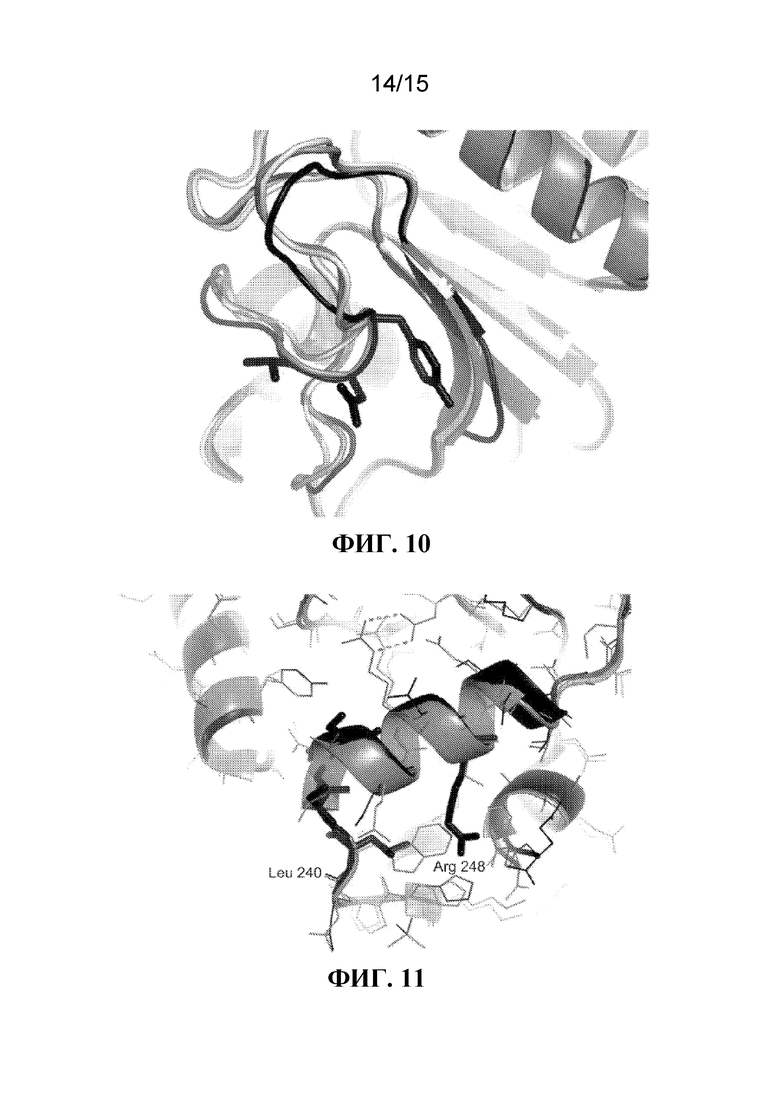
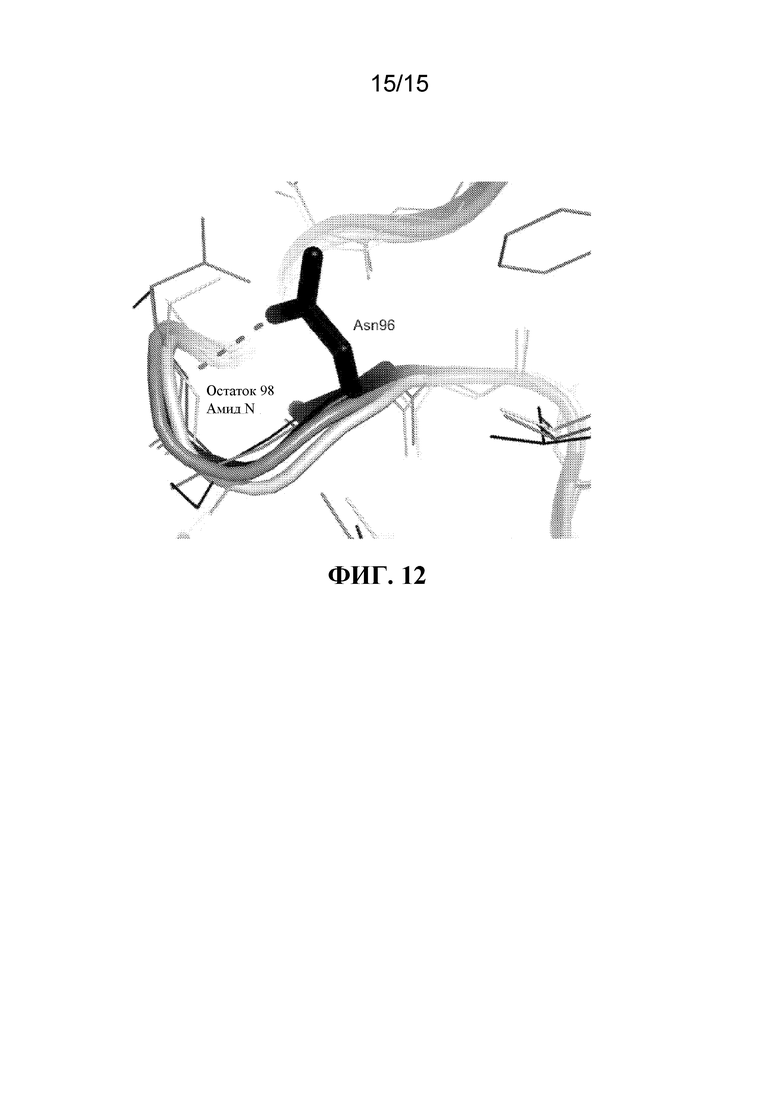
Изобретение относится к биотехнологии и представляет собой ферменты, являющиеся протеазами клады AprL, нуклеиновые кислоты, кодирующие их, композиции и способы, относящиеся к их получению и применению. Изобретение позволяет получать эффективный фермент и использовать его в моющих и чистящих средствах. 6 н. и 11 з.п. ф-лы, 12 ил., 9 табл., 13 пр.
1. Вариантный фермент субтилизин клада AprL или его активный фрагмент, содержащий одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клада AprL, где модификация выбрана из: G127A, G127D, G127I, G127M, G127S, G127T и G127V; где аминокислотная последовательность указанного варианта имеет по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 2; и где аминокислотные положения варианта субтилизина клада AprL пронумерованы в соответствии с аминокислотной последовательностью субтилизина AprL Bacillus sp., изложенной в SEQ ID NO: 2.
2. Вариант по любому из предыдущих пунктов, дополнительно содержащий одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клада AprL, где модификация выбрана из:
(i) A001C, A048R, A052F, G099S, G099T, G101A, G127F, G127I, G127M, G127Q, G127T, G127V, I121M, L010M, L095A, L095F, L095Q, L095S, L125I, L125V, M123C, M123I, N025F, N025S, N116C, N140R, N184C, P238C, P238D, P238I, P238M, P238N, Q136A, S098F, S098H, S102D, S158Q, S241R, T077C, T077F, T215C, V026I, V026Q, V045R, и V149C; или
(ii) A001C, A024E, A128D, G053C, G099T, G101A, G101N, G165E, G203C, L095Q, L095S, L125S, N061E, N116C, N184C, S098D, S102D, S102E, S104D, S129E, S155D, S158E, и V026T, где указанный вариант характеризуется улучшенной очисткой с помощью HDL при pH 6 и/или pH 8 по сравнению с исходным ферментом субтилизином клада AprL.
3. Вариант по любому из предыдущих пунктов, дополнительно содержащий одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клада AprL, где модификация выбрана из: A029T, A048K, A048R, A052F, A052R, A068G, A113C, D119H, E111Q, G099A, G099S, G127A, G127T, G165A, K012G, K012H, K027C, K027E, K027M, L095F, L125I, L125V, L240Q, N025F, N025G, N025L, N043R, N116R, N140R, N160C, N184C, N239K, P238C, P238I, P238M, Q136F, Q136H, Q136K, Q136R, Q136W, S098F, S098H, S104A, S158Q, S241R, V045R, и Y103M, где указанный вариант характеризуется улучшенной очисткой с помощью HDD по сравнению с исходным ферментом субтилизином клада AprL.
4. Вариант по любому из предыдущих пунктов, дополнительно содержащий одну или несколько аминокислотных модификаций по сравнению с исходным ферментом субтилизином клада AprL, где модификация выбрана из: A001C, A001D, A024E, A024G, A048C, A048D, A048K, A048N, A052F, A052M, A052V, A052Y, A055C, A072G, A091G, A113C, A128P, A128Q, A133G, A133S, A133T, A143E, A143F, A143H, A143N, A143S, A143W, A193D, A202C, A202D, A202E, A202Q, A227S, D119F, D119S, D119Y, G053C, G053E, G053N, G053Q, G060L, G060Y, G099A, G099T, G101A, G117D, G117V, G127A, G127S, G127T, G130D, G130H, G203A, G203C, G203E, G203M, H237I, I035A, I035C, I035M, I035T, I121L, K012N, K015M, K027C, K027L, K027M, K027R, K264A, K264S, L010M, L095F, L125V, L234Q, L240N, L249I, M123C, M123I, M123L, N025F, N025G, N025L, N025S, N057C, N061A, N076G, N096D, N096G, N116A, N116C, N116L, N116Y, N140A, N160C, N182C, N182D, N184C, N211S, N247F, N247H, N247I, N247L, N247Q, N247S, N247V, N247W, N247Y, P009E, P009T, P238A, P238C, P238D, P238F, P238I, P238R, Q017H, Q136A, Q136C, Q136F, Q136H, Q136K, Q136L, R144F, R144L, R248K, S086R, S088N, S088Y, S097G, S097H, S097Y, S098H, S098L, S100L, S102D, S102E, S102G, S102K, S129E, S129H, S155A, S155D, S155E, S155H, S157D, S158I, S158Q, S181A, S181Q, S183G, S241R, S241T, S243I, S243N, S243T, S243V, S243Y, S251E, S258C, S258D, S258P, T058C, T058D, T058F, T058I, T077C, T077F, T077L, T077M, T078Q, T132A, T132Q, T132V, T132Y, T161Q, T210I, T215C, V026Q, V026R, V026T, V028A, V028C, V045I, V071A, V071L, V120A, V120C, V120I, V146A, V146H, V146K, V147L, V149C, Y056H, и Y255C, где указанный вариант характеризуется улучшенной очисткой с помощью ADW по сравнению с исходным ферментом субтилизином клада AprL.
5. Вариант по любому из предыдущих пунктов, где указанный исходный фермент субтилизин клада AprL содержит аминокислотную последовательность под SEQ ID NO: 2, 9, 12, 13, 14, 15 или 16 или содержит аминокислотную последовательность, имеющую по меньшей мере 85% идентичность аминокислотной последовательности SEQ ID NO: 2.
6. Вариант по любому из предыдущих пунктов, где указанный исходный фермент субтилизин клада AprL и/или указанный вариант содержат:
(i) мотив YNT (SEQ ID NO: 46) между Asp32 и His63;
(ii) мотив Y56N57T58 (SEQ ID NO: 45);
(iii) мотив F50V51X152G53E54X355Y56N57T58 (SEQ ID NO: 48), где X1 представляет собой A или S, и X3 представляет собой A или S;
(iv) мотив LSX4S (SEQ ID NO: 55) между Lys236 и Arg246, где X4 представляет собой A или G;
(v) мотив L240S241A242S243 (SEQ ID NO: 50);
(vi) мотив L240S241G242S243(SEQ ID NO: 56);
(vii) мотив KXXXLSX4SQX5R (SEQ ID NO: 57), где X представляет собой любую аминокислоту, X4 представляет собой A или G, и X5 представляет собой I или V;
(viii) мотив K236XXXLSASQX5R246 (SEQ ID NO: 52), где X представляет собой любую аминокислоту, и X5 представляет собой I или V;
(ix) мотив K236XXXLSGSQX5R246 (SEQ ID NO: 60), где X представляет собой любую аминокислоту, и X5 представляет собой I или V; или
(viii) мотив 1, выбранный из (i), (ii) и (iii), в комбинации с мотивом 2, выбранным из (iv), (v), (vi), (vii), (viii) и (ix).
7. Вариант по любому из предыдущих пунктов, где указанный исходный фермент субтилизин клада AprL и/или указанный вариант содержат (i) аминокислотную последовательность под SEQ ID NO: 45, 46, 47 или 48; и (ii) аминокислотную последовательность под SEQ ID NO: 49, 50, 51, 52, 55, 56, 57, 58, 59 или 60, например, где указанный исходный фермент субтилизин клада AprL и/или указанный вариант содержат аминокислотную последовательность под SEQ ID NO:49 или 58 между Lys236 и Arg246 и аминокислотную последовательность под SEQ ID NO: 46 между Asp32 и His63.
8. Вариант по любому из предыдущих пунктов, где указанный исходный фермент субтилизин клада AprL и/или указанный вариант содержат остаток Asn96, и/или указанный вариант содержит водородную связь между остатками 96 и 98.
9. Вариант по любому из предыдущих пунктов, где указанный вариант характеризуется по меньшей мере 90% идентичностью аминокислотной последовательности с аминокислотной последовательностью под SEQ ID NO: 2.
10. Композиция, содержащая по меньшей мере один вариант по любому из пп. 1-9, где указанная композиция представляет собой чистящую композицию или моющую композицию, необязательно выбрана из группы, состоящей из моющего средства для стирки белья, моющего средства для смягчения ткани, моющего средства для мытья посуды и моющего средства для твердых поверхностей, и где указанная композиция дополнительно содержит поверхностно-активное вещество; по меньшей мере один стабилизатор; по меньшей мере одно отбеливающее средство; по меньшей мере один вспомогательный ингредиент; один или несколько дополнительных ферментов или производных ферментов, выбранных из группы, состоящей из ацилтрансфераз, альфа-амилаз, бета-амилаз, альфа-галактозидаз, арабинозидаз, арилэстераз, бета-галактозидаз, каррагиназ, каталаз, целлобиогидролаз, целлюлаз, хондроитиназ, кутиназ, эндо-бета-1,4-глюканаз, эндо-бета-маннаназ, эстераз, экзо-маннаназ, галактаназ, глюкоамилаз, гемицеллюлаз, гиалуронидаз, кератиназ, лакказ, лактаз, лигниназ, липаз, липоксигеназ, маннаназ, оксидаз, пектатлиаз, пектинацетилэстераз, пектиназ, пентозаназ, пероксидаз, фенолоксидаз, фосфатаз, фосфолипаз, фитаз, полигалактуроназ, протеаз, пуллуланаз, редуктаз, рамногалактуроназ, бета-глюканаз, танназ, трансглутаминаз, ксиланацетилэстераз, ксиланаз, ксилоглюканаз и ксилозидаз, дополнительных ферментов металлопротеаз и их комбинаций.
11. Композиция по п. 10, где указанная чистящая композиция не содержит фосфата или содержит фосфат.
12. Композиция по любому из пп. 10-11, где указанная чистящая композиция не содержит бора или содержит борат.
13. Композиция по любому из пп. 10-12, где указанная композиция представляет собой композицию в виде гранул, порошка, твердого вещества, бруска, жидкости, таблетки, геля, однократной дозы или пасты.
14. Способ очистки поверхности предмета, нуждающегося в очистке, включающий приведение указанной поверхности предмета, нуждающейся в очистке, в контакт с вариантом по любому из пп. 1-9 или композицией по любому из пп. 10-13 с получением очищенной поверхности предмета.
15. Полинуклеотид, содержащий последовательность нуклеиновой кислоты, кодирующую вариант по любому из пп. 1-9, где указанный полинуклеотид необязательно является выделенным.
16. Вектор экспрессии, содержащий полинуклеотид по п. 15.
17. Клетка-хозяин для экспрессии полинуклеотида по п. 15, где указанная клетка-хозяин трансформирована вектором по п. 16.
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛ(АРИЛ) ГАЛОИДСИЛАНОВ, СОДЕРЖАЩИХ АДАМАНТИЛЬНЫЙ РАДИКАЛ | 0 |
|
SU405901A1 |
| WO 9628557 A2, 20.05.2010 | |||
| МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ДНК, КОДИРУЮЩАЯ МОДИФИЦИРОВАННЫЙ СУБТИЛИЗИН, ВЕКТОР ЭКСПРЕССИИ, КОДИРУЮЩИЙ ДНК, И ШТАММ КУЛЬТУРЫ КЛЕТКИ ХОЗЯИНА | 1994 |
|
RU2136756C1 |
Авторы
Даты
2020-10-09—Публикация
2016-05-13—Подача