Изобретение относится к микробиологии и биотехнологии и касается получения трансформанта дрожжей Komagataella kurtzmanii, способного продуцировать бета-глюканазу (β-глюканазу).
β-глюканы представляют собой семейство полисахаридов, состоящих из мономеров D-глюкозы, соединенных посредством β-гликозидных связей, и являются естественным компонентом клеточных стенок бактерий, грибов, дрожжей и злаков, таких как овес и ячмень. β-глюканы различного происхождения различаются структурой, уровнем разветвления и молекулярной массой, а также физико-химическими свойствами. β-1,3-1,4-глюканы являются основными компонентами клеточной стенки представителей семейства злаковых, таких как ячмень, рожь, рис и пшеница, и составляют до 70% от массы стенок эндосперма.
β-1,3-1,4-глюканазы - ферменты, способные гидролизовать β-1,3-1,4-глюканы, находят широкое применение в качестве добавки к кормам сельскохозяйственных животных с однокамерным желудком
В птицеводческих и свиноводческих отраслях водорастворимый некрахмальный полисахарид β-глюкан действует как антипитательный агент. Корм для домашних животных, смешанный с ферментами β-1,3-1,4-глюканазы и ксиланазы, усиливает увеличение веса, потребление корма и усвояемость азота (+5,6%) и липидов (+6,2%), а также уменьшает образование липкого помета, что существенно уменьшает санитарные проблемы [Trends in Biotechnology, 1993, 11(10), 424-430].
Природными источниками β-глюканаз являются различные микроорганизмы: бактерии, грибы, дрожжи и актиномицеты.
Большинство кормовых ферментных препаратов, в состав которых входят β-глюканазы, имеют грибное происхождение. Однако, с научной и технологической точки зрения большой интерес представляет разработка рекомбинантных продуцентов ферментов на основе дрожжей, поскольку они более удобны для проведения генно-инженерных работ и быстрее накапливают целевой фермент в сравнении с грибными продуцентами. Существенным преимуществом дрожжевых продуцентов является также то, что на их основе значительно легче создавать продуценты моноферментов, тогда как грибные продуценты обычно синтезируют комплексы целлюлитических ферментов. Промышленное получение моноферментов позволяет более эффективно решать задачи составления оптимальной композиции ферментов при использовании различных субстратов.
В настоящее время наиболее перспективным является создание продуцентов на основе рекомбинантных штаммов метилотрофных дрожжей рода Pichia, Komagataella или Hansenula [J Ind Microbiol Biotechnol 2009, 36: 1435-1438],
Использование метилотрофных дрожжей позволяет достичь высокой скорости экспрессии гетерологичных белков с высокой плотностью клеток, а также высокого уровня и качества N-гликозилирования белков.
Особенно часто для высокоуровневой экспрессии геретологичных белков используют метилотрофные дрожжи Pichia pastoris [FEMS Microbiol. Rev., 2000, 24,45-66].
Показано [J. Ind. Microbiol. Biotechnol., 2012 39(6), 869-876], что ген bgl16C1 из Penicillium pinophilum, кодирующий эндо-1,3(4)-β-D-глюканазу, эффективно экспрессируется в клетках дрожжей Pichia pastoris, при этом активность рекомбинантной β-глюканазы в культуральной жидкости при культивировании в 15-литровом ферментере составляет 28721 U/ml.
Известны также рекомбинантные штаммы Pichia pastoris, продуцирующие термостабильную β-1,3-1,4-глюканазу из Bacillus amyloliquefaciens. [CN 101899458]
Komagataella kurtzmanii - новый вид метилотрофных дрожжей, выделен из Pichia pastoris [Antonie van Leeuwenhoek, 2013, 104(3), Published online, DOI 10.1007/s10482-013-9956-7]. Для этого вида дрожжей описана система экспрессии и на модельных штаммах продемонстрирована ее эффективность для продукции гетерологических белков [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.].
Поскольку гены β-глюканаз различного происхождения экспрессируются в метилотрофных дрожжах с различной эффективностью [Биотехнология, 2018, 34(4), 26-36], важной задачей для конструирования продуцентов является выбор генов, кодирующих β-глюканазу и эффективно работающих в дрожжах.
Поиск новых высокоактивных β-глюканаз, обладающих свойствами, необходимыми для их индустриального использования и способных эффективно экспрессироваться в дрожжах, а также создание на их основе промышленно значимых продуцентов является актуальной задачей.
Показано, что ген bgl26 из Paenibacillus jamilae кодирует эндо-β-1,3-1,4-глюканазу, обладающую промышленно ценными свойствами и относящуюся к семейству гликозилгидролаз GH16 [Биотехнология, 2019, 35, 4, 15-23].
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих β--глюканазу.
Задача решена путем получения трансформанта дрожжей Komagataella kurtzmanii, продуцирующего β-глюканазу, содержащего ген, кодирующий эндо-β-1,3-1,4-глюканазу из Paenibacillus jamilae, или ген, кодирующий фермент, аминокислотная последовательность которого гомологична аминокислотной последовательности эндо-β-1,3-1,4-глюканазы из Paenibacillus jamilae не менее, чем на 90%.
К ферментам, аминокислотная последовательность которых гомологична эндо-β-1,3-1,4-глюканазе из Paenibacillus jamilae не менее, чем на 90% относятся, ферменты семейства гликозилгидролаз GH16, обладающие β-глюканазной активностью например, β-глюканаза из Paenibacillus polymyxa, или β-глюканаза из Paenibacillus terrae, или β-глюканаза из Paenibacillus peoriae, или β- -глюканаза из Paenibacillus kribbensis.
Получение заявленных трансформантов включает введение гена bgl26, кодирующего эндо-β-1,3-1,4-глюканазу из Paenibacillus jamilae, или гена, кодирующего фермент, обладающий β-глюканазной активностью, аминокислотная последовательность которого гомологична аминокислотной последовательности эндо-β-1,3-1,4-глюканазы из Paenibacillus jamilae не менее, чем на 90%, в клетки дрожжей Komagataella kurtzmanii с помощью экспрессионной кассеты, включающей в свой состав ген, кодирующий синтез целевого продукта, промотор, подходящий для работы в дрожжах Komagataella kurtzmanii, сигнальный пептид для осуществления секреции фермента в культуральную жидкость, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграцию осуществляют путем как гомологичной, так и негомологичной рекомбинации. Трансформацию экспрессионной кассеты в клетки дрожжей Komagataella kurtzmanii осуществляют любым подходящим методом, например, методом электоропорации [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.]
Конструирование экспрессионных кассет осуществляют стандартными методами генетической инженерии [Рыбчин В.Н. Основы генетической инженерии. - СПб.: СПбГТУ, 1999. Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y. Cold Spring Harbor Laboratory, 1989.] с использованием генетических элементов, подходящих для работы с дрожжами Komagataella kurtzmanii [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.]
Изобретение проиллюстрировано следующими фигурами:
Фиг. 1 Экспрессионная кассета 1.
Фиг. 2 Экспрессионная кассета 2
Фиг. 3 Электрофорез гена bgl26 из Paenibacillus jamilae и гена bgl из Paenibacillus polymyxa
Изобретение подтверждено следующими примерами.
Пример 1. Конструирование трансформантов дрожжей Komagataella kurtzmanii, несущих ген bgl26 из Paenibacillus jamilae
В качестве источника гена bgl26 используют тотальную геномную ДНК штамма Paenibacillus jamilae Bg1 ВКПМ В-13193 [Биотехнология, 2019, 35, 4, 15-23]. Синтезируют ДНК гена bgl26 методом ПЦР с использованием праймеров BglP.jam-f  и BglP.jam-r
и BglP.jam-r 
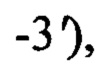 содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI Полученный фрагмент ДНК обрабатывают рестриктазами EcoRI и NotI и клонируют в состав экспрессионного вектора рАОХ-cre [Биотехнология 2019 Т. 35 №5 С. 20-28], в результате чего получают плазмиду pAOX-cre-Bgl26, в состав которой входят следующие генетические элементы:
содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI Полученный фрагмент ДНК обрабатывают рестриктазами EcoRI и NotI и клонируют в состав экспрессионного вектора рАОХ-cre [Биотехнология 2019 Т. 35 №5 С. 20-28], в результате чего получают плазмиду pAOX-cre-Bgl26, в состав которой входят следующие генетические элементы:
1. Ген bgl26 _Paenibacillus jamilae, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора
2. Терминатор транскрипции ТТАОХ
3. Кассета, фланкированная сайтами lox66 и lox71, в состав которой входит ген устойчивости к генетицину (G418) - kanMX - под контролем дрожжевого TEF-промотора, и ген cre, кодирующий рекомбиназу бактериофага Р1 под контролем АОХ1-промотора P. pastoris
4. Селективный маркер для клеток Е. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину
5. Бактериальный pUC origin
Для получения интегративной экспрессионной кассеты 1 (фиг. 1) плазмиду pAOX-cre-Bgl26 обрабатывают эндонуклеазой рестрикции BglII и используют для трансформации клеток дрожжей.
Указанную интегративную экспрессионную кассету трансформируют в клетки Komagataella kurtzmanii ВКПМ Y-727. Процедуру трансформации осуществляют методом электропорации, как описано в [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.].
Селекцию трансформантов ведут на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 500 мкг/мл.
Для отбора наиболее продуктивных трансформантов и выщепления маркерного гена проводят культивирование в жидкой ферментационной питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением метанола (3 мас. %) в 96-луночных планшетах при 30°С в течение 72 ч на качалке (250 об/мин). В качестве контроля используют штамм Komagataella kurtzmanii ВКПМ Y-727.
Определение активности β-глюканазы в культуральной жидкости проводят с использованием динитросалициловой кислоты (ДНС - метод) [Anal. Chem., 1959, 31 (3), 426-428] в 96-луночном планшете следующим образом. В каждой лунке смешивают 25 мкл 1% раствора субстрата β-глюкана ячменя в 0,5 М ацетатном буфере (рН 6) и 25 мкл культуральной жидкости. Инкубацию проводят при 50°С 10 минут, после чего добавляют в лунку 50 мкл раствора ДНС. Планшет прогревают при 99°С 10 минут и измеряют оптическую плотность окрашенного раствора при длине волны 546 нм. В качестве стандарта используют раствор глюкозы.
По результатам ферментации отбирают наиболее продуктивный трансформант.Клетки отобранного трансформанта рассевают до отдельных колоний на агаризованную питательную среду YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, глюкоза - 2, вода - остальное). Для дальнейших исследований отбирают колонии, не способные к росту в присутствии антибиотика G418. Таким образом отобран трансформант Komagataella kurtzmanii В118 с выщепленным маркерным геном, который при культивировании в планшете синтезирует эндо-1,3-1,4-β-глюканазу в количестве 332 ед/мл культуральной жидкости.
Для подтверждения наличия в хромосоме полученного трансформанта вставки гена bgl26 Paenibacillus jamilae методом полимеразной цепной реакции (ПЦР) используют хромосомальную ДНК, выделенную из клеток этого трансформанта и пары специфических праймеров BglP.j-f и BglP.j-r
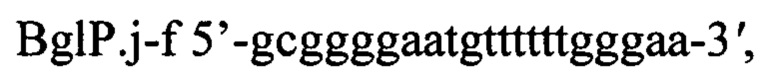
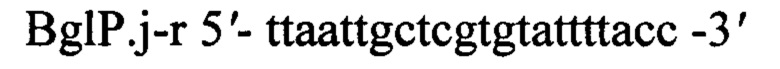
Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
30 циклов:
95°С - 30 сек.
57°С - 30 сек.
72°С - 60 сек.
72°С - 5 мин. - 1 цикл
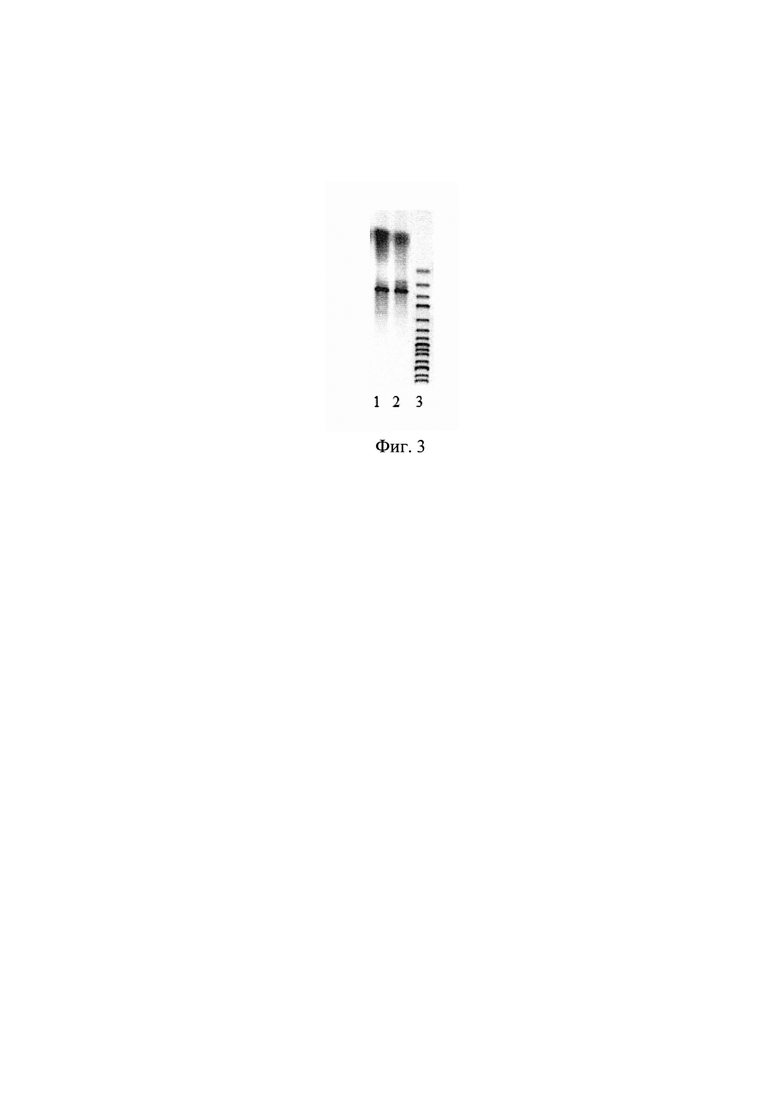
Для контроля величины амплифицированных фрагментов ДНК при электрофорезе использован молекулярный маркер GeneRuler 1 kb DNA Ladder (Fermentas) (линия 2, фиг. 2, размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н.). Наработка фрагмента ДНК размером 642 п.н. (линия 1 фиг. 3) свидетельствует о присутствии в хромосоме штамма вставки гена bgl26 Paenibacillus jamilae
Пример 2. Культивирование трансформанта Komagataella kurtzmanii В118, несущего ген bgl26 Paenibacillus jamilae.
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде YP с добавлением глюкозы (1 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Через 18 часов добавляют метанол (1 мас. %) Ферментацию продолжают в течение 72 часов, добавляя метанол (1 мас. %) через каждые 24 часа. После окончания ферментации определяют количество фермента β-глюканазы в культуральной жидкости с использованием ДНС метода.
Через 72 часа ферментации количество эндо-1,3-1,4-β-глюканазы составляет 1280 ед/мл культуральной жидкости.
Пример 3. Конструирование трансформантов дрожжей Komagataella kurtzmanii, несущих ген bgl из Paenibacillus polymyxa.
В качестве источника гена bgl используют тотальную геномную ДНК штамма Paenibacillus polymyxa Bg23 ВКПМ В-4056. Синтезируют ДНК гена bgl методом ПЦР с использованием праймеров BglP.pol-f 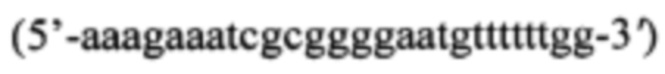 и BglPpol-r
и BglPpol-r  содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI.
содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI.
Полученный фрагмент ДНК обрабатывают рестриктазами EcoRI и NotI и клонируют в состав экспрессионного вектора рАОХ-cre [Биотехнология 2019 Т. 35 №5 С. 20-28], в результате чего получают плазмиду pAOX-cre-Bgl, в состав которой входят следующие генетические элементы:
1. Ген bgl _Paenibacillus polymyxa, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора
2. Терминатор транскрипции ТТАОХ
3. Кассета, фланкированная сайтами lox66 и lox71, в состав которой входит ген устойчивости к генетицину (G418) - kanMX - под контролем дрожжевого TEF-промотора, и ген cre, кодирующий рекомбиназу бактериофага Р1 под контролем АОХ1-промотора P. pastoris
4. Селективный маркер для клеток Е. coli - ген bla, кодирующий β-лактамазу, придающий клеткам устойчивость к ампициллину
5. Бактериальный pUC origin
Для получения интегративной экспрессионной кассеты 2 (фиг. 2) плазмиду pAOX-cre-Bgl обрабатывают эндонуклеазой рестрикции BglII и используют для трансформации клеток дрожжей.
Указанную интегративную экспрессионную кассету трансформируют в клетки Komagataella kurtzmanii ВКПМ Y-727. Процедуру трансформации, селекции, отбора и определение активности фермента осуществляют как описано в примере 1
По результатам ферментации отбирают наиболее продуктивный трансформант.. Клетки отобранного трансформанта рассевают до отдельных колоний на агаризованную питательную среду YPD. Для дальнейших исследований отбирают колонии, не способные к росту в присутствии антибиотика G418. Таким образом отобран трансформант Komagataella kurtzmanii В899 с выщепленным маркерным геном, который при культивировании в планшете синтезирует β-глюканазу в количестве 198 ед/мл культуральной жидкости.
Для подтверждения наличия в хромосоме полученного трансформанта вставки гена bgl Paenibacillus polymyxa методом полимеразной цепной реакции (ПЦР) используют хромосомальную ДНК, выделенную из клеток этого трансформанта и пары специфических праймеров BglP.p-f и BglP.p-r
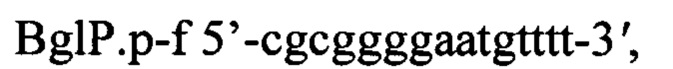

Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
30 циклов:
95°С - 30 сек.
57°С - 30 сек.
72°С - 60 сек.
72°С - 5 мин. - 1 цикл
Для контроля величины амплифицированных фрагментов ДНК при электрофорезе использован молекулярный маркер GeneRuler 1 kb DNA Ladder (Fermentas) (линия 3, фиг. 2, размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н.). Наработка фрагмента ДНК размером 642 п.н. (линия 1 фиг. 3) свидетельствует о присутствии в хромосоме штамма вставки гена bgl Paenibacillus polymyxa.
Пример 4. Культивирование трансформанта Komagataella kurtzmanii В899, содержащего ген, кодирующий β-глюканазу из Paenibacillus polymyxa
Культивирование трансформанта Komagataella kurtzmanii В899 проводят как описано в примере 2.
Через 72 часа ферментации количество |3-глюканазы составляет 983 ед/мл культуральной жидкости.
Таким образом, получены трансформанты Komagataella kurtzmani, продуцирующие β-глюканазу.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу из Bacillus pumilus и бета-глюканазу из Paenibacillus jamilae | 2019 |
|
RU2736441C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы из Paenibacillus jamilae | 2019 |
|
RU2730577C1 |
| Трансформант дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу | 2019 |
|
RU2722563C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы | 2018 |
|
RU2701640C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий ксиланазу | 2019 |
|
RU2714113C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий бета-глюканазу | 2019 |
|
RU2720914C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент бета-глюканазы | 2018 |
|
RU2701494C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis | 2019 |
|
RU2728033C1 |
| Штамм дрожжей Pichia pastoris, продуцирующий ксиланазу из Paenibacillus brasilensis | 2019 |
|
RU2728243C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701308C1 |

Изобретение относится к трансформанту дрожжей Komagataella kurtzmanii, продуцирующему β-глюканазу. Предложенный трансформант дрожжей Komagataella kurtzmanii содержит ген, кодирующий эндо-β-1,3-1,4-глюканазу из Paenibacillus jamilae, или ген, кодирующий фермент, аминокислотная последовательность которого гомологична аминокислотной последовательности эндо-β-1,3-1,4-глюканазы из Paenibacillus jamilae не менее, чем на 90%. Изобретение позволяет расширить арсенал рекомбинантных микроорганизмов, продуцирующих β-глюканазу. 1 з.п. ф-лы, 3 ил., 4 пр.
1. Трансформант дрожжей Komagataella kurtzmanii, продуцирующий β-глюканазу, содержащий ген, кодирующий эндо-β-1,3-1,4-глюканазу из Paenibacillus jamilae, или ген, кодирующий фермент, аминокислотная последовательность которого гомологична аминокислотной последовательности эндо-β-1,3-1,4-глюканазы из Paenibacillus jamilae не менее чем на 90%.
2. Трансформант по п. 1, в котором в качестве фермента, аминокислотная последовательность которого гомологична эндо-β-1,3-1,4-глюканазе из Paenibacillus jamilae не менее чем на 90%, используют β-глюканазу из Paenibacillus polymyxa, или β-глюканазу из Paenibacillus terrae, или β-глюканазу из Paenibacillus peoriae, или β-глюканазу из Paenibacillus kribbensis.
| Борщевская Л.Н., Гордеева Т.Л., Калинина А.Н., Синеокий С.П., Федоров А.С | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Биотехнология | |||
| Спецвыпуск, 2018 | |||
| Устные доклады, с | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ТЮРИН О.В | |||
| Разработка системы экспрессии генов на | |||
Авторы
Даты
2020-11-17—Публикация
2019-12-26—Подача