Изобретение относится к микробиологии и биотехнологии и касается получения трансформантов дрожжей Pichia pastoris, способных продуцировать ксиланазу.
Ксилан является основным структурным полисахаридом растительных клеткок и вторым после целлюлозы наиболее распространенным полисахаридом в природе [Biotech. Genet. Eng. Rev. 1995, 13, 100-131]. Это комплексный полисахарид, основная цепь которого состоит из β-(1-4) связанного ксилозного скелета с небольшим количеством β-(1-3) ответвлений [Macromol Rapid Commun., 2000, 21(9), 542-556. doi: 10.1002/1521-3927(20000601)21:9<542::AID-MARC542>3.0.СО;2-7].
Полная деградация ксилана требует комплекса ксиланолитических ферментов, включающих эндо-ксиланазу, ксилозидазу, глюкуронидазу, ацетилэстеразу и арабинофуранозидазу [Crit Rev Biotechnol., 2002, 22, 33-64, doi: 10.1080/07388550290789450].
Основную роль в разрушении ксилана играет эндо-ксиланаза (эндо-1,4-β-ксиланаза, ЕС 3.2.1.8), которая катализирует случайный гидролиз ксилана до ксилололигосахаридов.
Эндо-1,4-β-ксиланазу широко используют в различных отраслях промышленности. При кормопроизводстве введение ксиланаз уменьшает содержание некрахмальных полисахаридов, тем самым снижая вязкость корма в кишечнике животных и улучшая усвояемость и питательную ценность плохо разлагаемых кормов. [J. Anim. Sci., 2002, 80, 2773-2779; Br. Poult. Sci., 2003, 44, 60-66; Br. Poult. Sci., 2003, 44, 291-298]
Природными источниками ксиланаз являются различные микроорганизмы: бактерии, грибы, дрожжи и актиномицеты [FEMS Microbiology Reviews, 2005, 29 (1), 3-23].
Традиционно ферментные препараты, в состав которых входят ксиланазы, получают на основе нерекомбинантных или рекомбинантных штаммов грибов рода Trichoderma, Aspergillus или Penicillium. Однако грибные штаммы, помимо ксиланазы, продуцируют ряд других ферментов, относящихся к карбогидразам, а именно: целлюлазу, глюканазу, пектиназу и маннаназу, что не позволяет использовать их при производстве моноферментных препаратов.
Наиболее перспективным является создание продуцентов ферментов на основе рекомбинантных штаммов метилотрофных дрожжей Pichia pastoris. При использовании несбраживаемых источников углерода (глицерина, метанола и т.п.) дрожжи Pichia pastoris способны к росту с образованием биомассы высокой плотности, что позволяет получать значительные количества гетерологичного белка [Appl. Microbiol. Biotechnol, 2000, 54(6), 741-750]. При этом процесс культивирования метилотрофных дрожжей достаточно прост, поскольку их рост не блокируется продуктами метаболизма [FEMS Microbiol. Rev., 2000, 24: 45-66, doi: 10.1111/j.1574-6976.2000.tb00532.x].
Известны примеры создания продуцентов ксиланазы на основе дрожжей Pichia pastoris.
Показано [Protein Expression and Purification 57 (2008), 101-107], что ген reBlxA из Bacillus licheniformis, кодирующий ксиланазу А, эффективно экспрессируется в клетках дрожжей Pichia pastoris, при этом активность рекомбинантной ксиланазы в культуральной жидкости составляет 122.9 U/mg.
Известны также рекомбинантные штаммы Pichia pastoris, продуцирующие ксиланазу из Streptomyces sp. FA1 [CN 107142225 А] и ксиланазу из Neocallimastix frontalis [CN 104130951 A].
В работе [Биотехнология, 2018, 34 (6), 22-32], что эндо-1,4-β-ксиланаза из Paenibacillus brasilensis обладает промышленно ценными свойствами. На основе Р pastoris получены штаммы, секретирующие ксиланазу из Paenibacillus brasilensis, продуктивность которых при культивировании в пробирках составляет 1114 и 1728 ед/мл культуральной жидкости [RU 2701308, RU 2701642].
Однако, остается потребность в расширении арсенала штаммов P. pastoris с повышенной продукцией эндо-1,4-β-ксиланазы из Paenibacillus brasilensis.
Одним из подходов, позволяющих повысить продукцию целевых белков в Р. pastoris, является коэкспрессия генов-помощников, входящих в систему ответа клетки на несвернутый белок (UPR - unfolded protein response) [Экологическая генетика, 2017, 15(2), 21-30]. В качестве таких генов используют, в частности, ген, кодирующий протеиндисульфидизомеразу (Pdi), которая выступает в качестве шаперона, ингибируя агрегацию неправильно свернутых белков; ген НАС1, кодирующий активатор транскрипции генов UPR и другие. Так, в работе [Journal of proteomics, 91 (2013) 58-72] в состав хромосомы рекомбинантного штамма Р. pastoris, продуцирующего ксиланазу из Bacillus halodurans, был интегрирован ген НАС1 из P. pastoris, что привело к увеличению продуктивности на 38% по сравнению с исходным штаммом.
Однако, суперэкспрессия гена НАС1 в P. pastoris может не только увеличивать продукцию некоторых гетерологичных ферментов, но и снижать, а также не оказывать никакого эффекта [Microb. Cell Factories, 2010, 9, 49].
Таким образом, суперэкспресия гена НАС1 по-разному влияет на продукцию различных ферментов, и, при существующем состоянии знаний в данной области, вспомогательные (хелперные) функции гена НАС1, а также других генов-помощников, не могут быть предсказаны даже в случае доступности последовательности ДНК всего генома организма-хозяина [ЕА017803].
Сведений о влиянии суперэкспрессии гена НАС1 из P. pastoris на продукцию клетками P. pastoris ксиланазы из Paenibacillus brasilensis нами не выявлено.
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих эндо-1,4-β-ксиланазу.
Задача решена путем получения трансформанта дрожжей P. pastoris, продуцирующего ксиланазу, несущего в составе хромосомы ген xyl, кодирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis, и дополнительные копии гена НАС1 из P. pastoris.
Получение заявляемого трансформанта заключается в совместной экспрессии гена xyl, кодирующего эндо-1,4-β-ксиланазу из Paenibacillus brasilensis [MK014302 GenBank] и дополнительных копий гена НАС1 из P. pastoris, кодирующего активатор транскрипции генов UPR [ХМ_002489994.1 GenBank].
Трансформация гена xyl в клетки дрожжей P. pastoris осуществляется с помощью экспрессионной кассеты, включающей целевой ген, промотор, работающий в дрожжах P. pastoris, сигнальный пептид для осуществления секреции фермента в культуральную жидкость, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграцию осуществляют путем как гомологичной, так и негомологичной рекомбинации.
Трансформацию дополнительных копий гена НАС1 в клетки дрожжей Р. pastoris осуществляют с помощью экспрессионной кассеты, включающей целевой ген, промотор, работающий в дрожжах P. pastoris, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграцию осуществляют путем как гомологичной, так и негомологичной рекомбинации.
Трансформация указанных генов может быть осуществлена в любой последовательности, любым подходящим методом, в частности, методом электоропорации [http://tools.thermofisher.com/content/sfs/manuals/pich_man.pdf] или методом с использованием полиэтиленгликоля или протопластов [http://www.thermofisher.com/order/catalog/product/K173001].
Получение заявляемого трансформанта может быть осуществлено также трансформацией в клетки штамма дрожжей P. pastoris, являющегося продуцентом эндо-1,4-β-ксиланазы из Paenibacillus brasilensis, дополнительных копий гена НАС1 из P. pastoris.
Конструирование экспрессионных кассет осуществляют стандартными методами генетической инженерии [Рыбчин В.Н. Основы генетической инженерии. - СПб.: СПбГТУ, 1999, Sambrook J., Maniatis Т., Fritsch Е. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989] с использованием генетических элементов, подходящих для работы с дрожжами Pichia pastoris. В качестве промоторов могут быть использованы AOX1, DAS, FLD1, ICL1, PHO89, THI11, ADH1, ENO1, GUT1, GAP, TEF1, PGK1, GCW14, G1, G6 или другие [Appl Microbiol Biotechnol (2014) 98: 5301-5317]. В качестве сигнальных пептидов используют α-фактор, PHO1, SUC2, PHA-E, KILM1, pGKL, CLY, CLY-L8, K28 pre-pro-toxin или другие [Appl Microbiol Biotechnol (2014) 98: 5301-5317]. В качестве селективных маркеров используют любые подходящие маркеры, например, гены резистентности к антибиотикам зеоцину, генетицину (G418) или бластицидину С, а также гены комплементирующие ауксотрофные мутации в геноме Pichia pastoris, например, HIS4, МЕТ2, ADE1, ARG4, URA3, URA5, GUT1 [Yeast 2005; 22: 249-270]. В качестве плечей для гомологичной интеграции используют, например, последовательности генов АОХ1, HIS4 [http://www.thermofisher.com/order/catalog/product/V17520] или другие последовательности, гомологичные участкам хромосомы дрожжей Pichia pastoris.
Изобретение проиллюстрировано следующими фигурами:
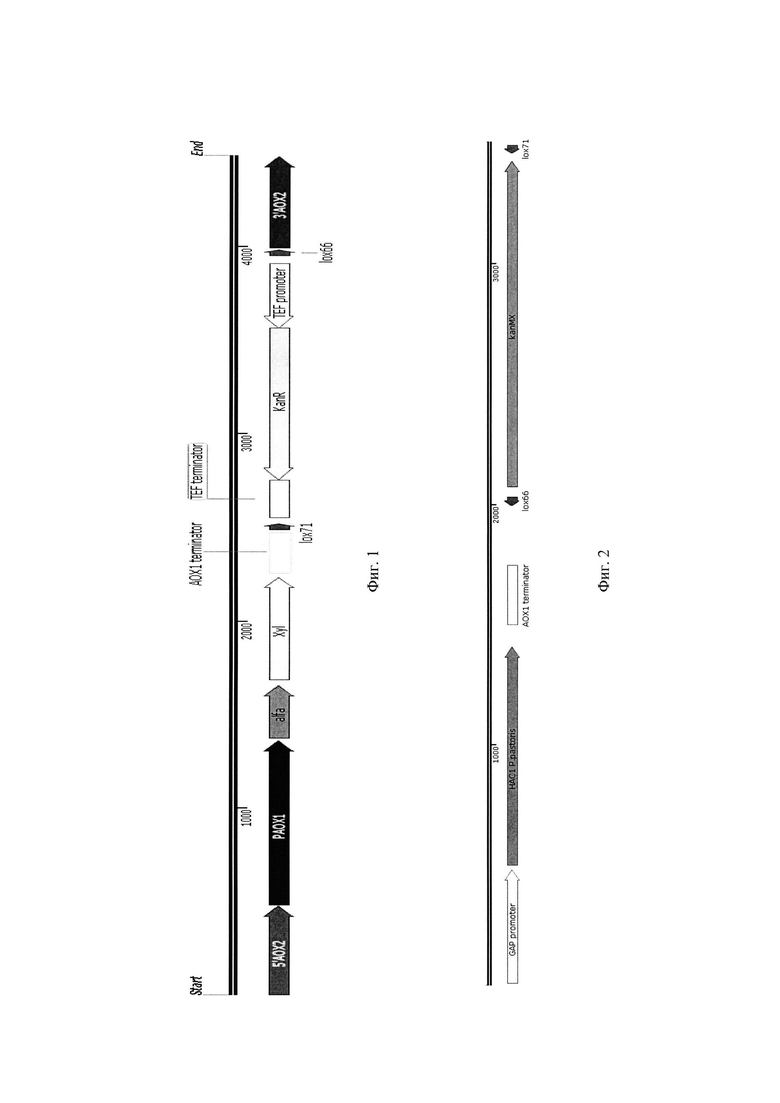
Фиг. 1 Экспрессионная кассета 1
Фиг. 2 Экспрессионная кассета 2
Изобретение подтверждено следующими примерами.
Пример 1. Конструирование трансформанта P. pastoris, продуцирующего эндо-1,4-β-ксиланазу из Paenibacillus brasilensis
При конструировании интегративной кассеты для экспрессии гена xyl используют метод "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68.]. В качестве источника гена xyl используют тотальную геномную ДНК Paenibacillus brasilensis X1 ВКПМ В-13092 [Биотехнология, 2018, 34 (6), 22-32]. Синтезируют ДНК гена xyl методом ПЦР с использованием праймеров XylP-f и XylP-r
XylP-f5'-gcgacagactactggcaaaat-3',
XylP-r5'-ttaccacaccgttacgttaga-3'.
Полученную последовательность ДНК встраивают в состав экспрессионной кассеты 1 (фиг. 1), в состав которой входят следующие генетические элементы:
1. Ген xyl Paenibacillus brasilensis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер kan, фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора и обуславливающий у дрожжей Pichia pastoris устойчивость к антибиотику генетицину (G418);
4. Область интеграции - нуклеотидная последовательность гена АОХ2.
Указанную интегративную экспрессионную кассету трансформируют в штамм Pichia pastoris ВКПМ Y-4392, полученный на основе штамма Pichia pastoris DSMZ 70877 интеграцией в хромосому кассеты Pcup-cre, состоящей из гена cre, кодирующего рекомбиназу бактериофага Р1 под контролем Pcup промотора из Saccharomyces cerevisiae.
Штамм Pichia pastoris ВКПМ Y-4392 предварительно выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1 М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут и промывают в ледяном растворе 1 М сорбитола. Обработанные таким образом клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25 uF. После порации добавляют 1 мл ледяного раствора 1 М сорбитола.
Селекцию трансформантов ведут на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 500 мкг/мл.
Для отбора наиболее продуктивных трансформантов проводят их культивирование в жидкой ферментационной питательной среде YP с добавлением метанола (3 мас. %) в 96-луночных планшетах при 30°С в течение 72 ч на качалке (250 об/мин). В качестве контроля используют штамм Pichia pastoris ВКПМ Y-4392.
Определение активности ксиланазы в культуральной жидкости проводят с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428] в 96-луночном планшете следующим образом: в каждой лунке смешивают 25 мкл 1% раствора субстрата ксилана березы в 0,5 М ацетатном буфере (рН 6) и 25 мкл культуральной жидкости. Инкубацию проводят при 50°С 10 минут, после чего добавляют в лунку 50 мкл раствора ДНС. Планшет прогревают при 99°С 10 минут и измеряют оптическую плотность окрашенного раствора при длине волны 546 нм. В качестве стандарта используют раствор глюкозы.
По результатам ферментации отбирают наиболее продуктивный трансформант Xyl66, который при культивировании в планшете синтезирует ксиланазу в количестве 308 ед/мл культуральной жидкости.
Для выщепления маркерного гена kanMX из экспрессионной кассеты, интегрированной в хромосому трансформанта Xyl66, проводят индукцию гена cre, кодирующего рекомбиназу бактериофага Р1, встроенного в хромосому штамма Pichia pastoris Y-4392 (Mut+, INS Pcup-cre) и находящегося под контролем промотора Pcup. Индукция происходит в присутствии ионов меди. Для этого клетки трансформанта №66 выращивают в жидкой питательной среде YP с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл, после чего добавляют раствор сульфата меди до концентрации 0,3 М, инкубируют в течении 3 часов, после чего клетки высевают на агаризованную питательную среду YP с добавлением глюкозы (2 мас. %). Отбирают колонии, не способные к росту в присутствии антибиотика G418.
Таким образом отобран трансформант Xyl66 с выщепленным маркерным геном kanMX, способный к синтезу фермента эндо-1,4-β-ксиланазы Paenibacillus brasilensis.
Пример 2 Получение трансформанта, несущего в составе хромосомы дополнительные копии гена НАС из Pichia pastoris
При конструировании интегративной кассеты для экспрессии гена НАС1 используют метод "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68.]. В качестве источника гена НАС1 используют тотальную геномную ДНК Pichia pastoris ВКПМ Y-4392. Синтезируют ДНК гена НАС1 методом ПЦР с использованием праймеров HAC1-f и HAC1-r.
НАС1-f5'-atgcccgtagattcttctca-3',
HAC1-r5'-ctattcctggaagaatacaaagt-3'
Полученную последовательность ДНК встраивают в состав экспрессионной кассеты 1 (фиг. 2), в состав которой входят следующие генетические элементы:
1. Ген НАС1_Pichia pastoris под контролем GAP промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер kan , фланкированный сайтами lox 66 и lox 71, под контролем дрожжевого TEF промотора и обуславливающий у дрожжей Pichia pastoris устойчивость к антибиотику генетицину (G418);
Указанную экспрессионную кассету интегрируют в состав хромосомы трансформанта Xyl66. Трансформацию экспрессионной кассеты, отбор наиболее активного трансформанта и выщепление маркерного гена проводят как описано выше.
Отобран трансформант Xyl66-НАС145, в состав хромосомы которого интегрированы ген xyl и дополнительные копии гена НАС1 из Pichia pastoris, способный к синтезу фермента эндо-1,4-β-ксиланазы Paenibacillus brasilensis в количестве 495 ед/мл КЖ при культивировании в планшете.
Пример 3. Получение ксиланазы путем культивирования трансформанта Xyl66-НАС145
Посевную культуру выращивают в пробирках (50 мл) с 10 мл жидкой питательной среды YPD с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке с 250 об/мин. Посев ферментационной среды осуществляют в соотношении 1/10.
Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде состава (мас. %): дрожжевой экстракт - 0,5, пептон - 1, вода - остальное с добавлением глюкозы (1 мас. %) в пробирках (50 мл) с рабочим объемом 5 мл. Через 18 часов добавляют метанол (1 мас. %) Ферментацию продолжают в течение 72 часов, добавляя метанол (1 мас. %) через каждые 24 часа. После окончания ферментации определяют количество фермента ксиланазы в культуральной жидкости с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428].
Через 72 часа ферментации количество фермента составило 1780 ед/мл культуральной жидкости.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Pichia pastoris, продуцирующий ксиланазу из Paenibacillus brasilensis | 2019 |
|
RU2728243C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий ксиланазу | 2019 |
|
RU2714113C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701308C1 |
| Штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701642C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент ксиланазы из Pyromyces finnis | 2019 |
|
RU2725475C1 |
| Штамм Komagataella phaffii T07/pPZL-4x-OA-xyl-AsOr, обладающий способностью продуцировать ксиланазу из грибов вида Aspergillus oryzae | 2022 |
|
RU2796447C1 |
| Дрожжи Komagataella kurtzmanii - рекомбинантный продуцент бета-глюканазы | 2019 |
|
RU2736440C1 |
| Штамм дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу из Bacillus pumilus и бета-глюканазу из Paenibacillus jamilae | 2019 |
|
RU2736441C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы из Paenibacillus jamilae | 2019 |
|
RU2730577C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий фитазу Escherichia coli | 2019 |
|
RU2737621C1 |
Изобретение относится к микробиологии и биотехнологии и касается получения рекомбинантных штаммов дрожжей Pichia pastoris, способных продуцировать эндо-1,4-β-ксиланазу. Получен трансформант дрожжей Pichia pastoris - продуцент ксиланазы, несущий в составе хромосомы ген, кодирующий эндо-1,4-β-ксиланазу, из Paenibacillus brasilensis, и дополнительные копии гена НАС1 из Pichia pastoris. Изобретение позволяет расширить ассортимент высокоэффективных продуцентов ксиланаз. 2 ил, 3 пр.
Трансформант дрожжей Pichia pastoris - продуцент ксиланазы, несущий в составе хромосомы ген, кодирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis, и дополнительные копии гена НАС1 из Pichia pastoris.
| CN 104130951 A, 05.11.2014 | |||
| Штамм дрожжей Pichia pastoris - продуцент ксиланазы | 2018 |
|
RU2701642C1 |
| Головка для термоэлектрического пирометра | 1927 |
|
SU17803A1 |
Авторы
Даты
2020-07-28—Публикация
2019-12-11—Подача