Изобретение относится к медицине, биотехнологии и молекулярной биологии и может быть использовано для селекции олигонуклеотидов (аптамеров), применяемых в детекции, очистке и изоляции веществ, медицинской диагностике и терапии в качестве функциональных аналогов моноклональных антител.
Возможность моноклональных антител специфически распознавать индивидуальные молекулярные мишени широко используется в различных областях науки и медицины. Например, антитела, помеченные радио- либо магнитоактивными материалами используют для локализации патогенных зон в организме пациента. Иммобилизованные на носителе антитела позволяют изолировать соответствующие антигены из смеси молекул. Также лекарственные препараты на основе моноклональных антител используют для направленного терапевтического воздействия на молекулярные маркеры различных заболеваний.
В отличие от антител, олигонуклеотиды менее токсичны и иммуногенны, при этом они обладают гораздо большей термической стабильностью, их технологически проще и дешевле синтезировать.
Известен способ селекции аптамеров с использованием технологии высокопроизводительного секвенирования (High-Throughput Sequencing, HTS). Он позволяет отслеживать динамику накопления аффинных последовательностей в реальном времени, что значительно уменьшает затраты времени, необходимого для изоляции целевых олигонуклеотидов. Недостатком метода является необходимость использования специального дорогостоящего оборудования, такого, как секвенатор ДНК 2-го либо следующего поколения; кроме того, программное обеспечение данного оборудования должно допускать совершение нестандартных операций, что не всегда достижимо.
Широко применяется способ, получивший название традиционный SELEX (Systematic Evolution of Ligands by Exponential enrichment). Он основан на итеративной инкубации комбинаторной библиотеки олигонуклеотидов с молекулярной мишенью с последующим разделением фракций связавшихся и не связавшихся с мишенью аптамеров и амплификацией отобранных олигонуклеотидов методом полимеразной цепной реакции (ПЦР).
Ниже кратко описано выполнение традиционного SELEX.
Комбинаторная библиотека состоит из ДНК-олигонуклеотидов, каждый из которых включает в себя центральный регион со случайной последовательностью нуклеотидов, заключенный между двумя участками с известной последовательностью, используемыми для ПЦР-амплификации олигонуклеотидов между раундами SELEX.
Комбинаторную библиотеку инкубируют с очищенной молекулярной мишенью в разных соотношениях ДНК : мишень, к примеру, 10:1,100:1 либо 1000:1. Как правило, берут избыток олигонуклеотидов для того, чтобы происходила конкуренция между потенциальными аптамерами за связывание с молекулярной мишенью в процессе селекции. Инкубацию проводят при комнатной температуре либо температуре 37С° в течение промежутка времени длиной от 4 минут до двух часов, после чего проводят фильтрацию инкубационной смеси. Фильтры сделаны из отрицательно заряженной нитроцеллюлозной бумаги; большинство белков, наиболее популярного класса молекулярных мишеней селекции, имеют положительный суммарный заряд, в то время как нуклеиновые кислоты включают в себя отрицательно заряженный углеводо-фосфатный остов. Таким образом, нитроцеллулозная бумага позволяет иммобилизовать белковую фракцию и связавшиеся с ней олигонуклеотиды, в то время как остальная ДНК не оседает на фильтре из-за электростатического отталкивания.
Следующим шагом является снятие связавшейся с молекулярной мишенью ДНК с нитроцеллулозных фильтров. Для этого можно использовать коммерческие наборы, к примеру, PowerWater DNA isolation kit (Mobio) или QIAamp DNA extraction kit (Qiagen), но они не предназначены для работы с низкими концентрациями ДНК в образце, свойственными для SELEX.
Альтернативным способом является метод химического лизиса с помощью протеиназы К [PMID:25706303]. Образцы инкубируют с лизоцимом в SET-буфере в течение 30 минут при 37 С, после чего добавляют 10% SDS и протеиназу К и далее инкубируют в течение 2 часов при 5 С. Получившийся лизат добавляют к смеси 1% гексадецилметил бромида аммония и хлорида натрия, после чего инкубируют еще 30 минут при 65 С. Верхнюю водную фракцию переносят в чистую пробирку, добавляют смесь хлороформа с изоамилолом (24:1) и центрифугируют 5 минут, после чего проводят переосаждение изопропанолом с предварительной инкубацией при -20 С в течение 12-14 часов.
Полученную ДНК используют в качестве матрицы для полимеразной цепной реакции (ПЦР) с целью амплификации отобранных олигонуклеотидов. Один такой раунд, состоящий из этапов связывания с мишенью, разделения и амплификации называется раундом SELEX. Как правило, для селекции высокоспецифических аптамеров необходимо провести от 8 до 12 раундов SELEX, после чего некоторые из полученных олигонуклеотидов секвенируют для определения первичной структуры.
Этот способ выбран качестве наиболее близкого аналога. Он позволяет изолировать из комбинаторных библиотек олигонуклеотиды с высоким сродством к мишени, которые к тому же могут оказывать влияние на ее (мишени) функциональную активность [PMID: 2200121]. Недостатком указанного способа является систематическое обогащение фракции целевых аптамеров олигонуклеотидами, неспецифически связывающимися с мишенью либо носителем/средой, используемыми для разделения фракций. Кроме того, средняя эффективность снятия олигонуклеотидов с нитроцеллулозного фильтра составляет порядка 80% [PMID: 2200121]. Совокупность этих факторов приводит к тому, что доля успешных попыток получения аптамеров является невысокой [PMID: 29036890].
Задачей настоящего изобретения является снижение доли олигонуклеотидов, неспецифически оседающих на носителе/среде разделения, во фракции целевых аптамеров.
Решение указанной задачи осуществляется посредством проведения селекции при низких концентрациях комбинаторной библиотеки, что делает возможным образование ПЦР-продукта только при условии существенного накопления ДНК-матрицы на мишени в результате образования специфических взаимодействий.
Предлагаемый способ не требует дорогостоящего специализированного оборудования; почти все необходимые приборы и реагенты входят в стандартное оснащение молекулярно-биологический или биохимической лаборатории либо легко доступны.
Описание чертежей
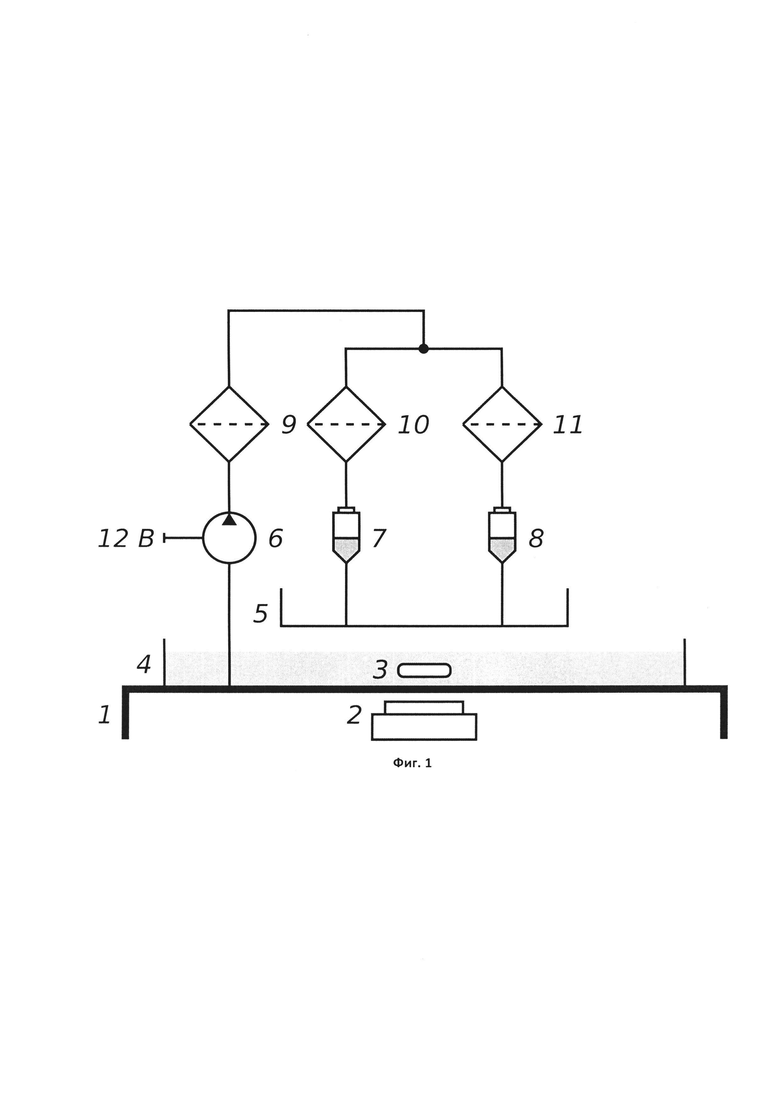
Фиг. 1. Схема установки для селекции олигонуклеотидов. 1 - полая опора высотой 20 см; 2 - магнитная мешалка; 3 - магнитный перемешивающий элемент цилиндрической формы; 4 - бак с раствором библиотеки олигонуклеотидов (объем должен позволять достигнуть фоновой концентрации библиотеки); 5 - сливной бак (объем, равный объему бака 4); 6 - электрический насос; 7 - колонка с иммобилизированной мишенью ("опыт"); 8 - контрольная колонка (белок A/G-агароза без иммобилизированной мишени, "контроль"); 9, 10, 11 - фильтрующие насадки.
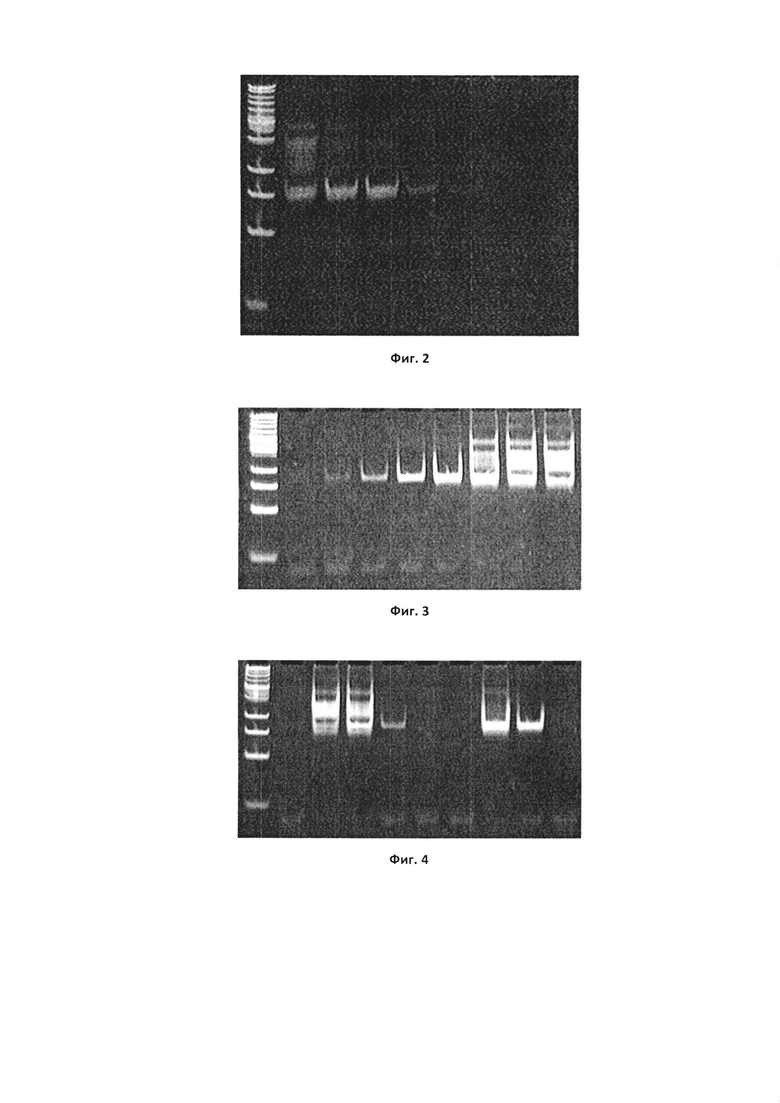
Фиг. 2. Результаты ПЦР-амплификации разных разведений библиотеки олигонуклеотидов. Дорожка 1 - маркер молекулярной массы ДНК; дорожки 2-8 - ПЦР-продукты растворов 1-7, соответственно; дорожка 9 - отрицательный контроль (ddH2O вместо ДНК-матрицы).
Фиг. 3. Определение количества циклов ПЦР для получения однородного ампликона библиотеки олигонуклеотидов. Дорожка 1 - маркер молекулярной массы ДНК Quick-Load Low Molecular Weight DNA Ladder (New England Biolabs); дорожка 2 - 5 циклов ПЦР, нанесено 5 мкл; дорожка 3 - 7 циклов ПЦР, нанесено 5 мкл; дорожка 4 - 9 циклов ПЦР, нанесено 5 мкл; дорожка 5 - 11 циклов ПЦР, нанесено 5 мкл; дорожка 6 - 13 циклов ПЦР, нанесено 5 мкл; дорожка 7 - 15 циклов ПЦР, нанесено 15 мкл; дорожка 8 - 17 циклов ПЦР, нанесено 15 мкл; дорожка 9 - 19 циклов ПЦР, нанесено 15 мкл.
Фиг. 4. Результаты первого раунда селекции. Дорожка 1 - маркер молекулярной массы; дорожка 2 - результат ПЦР-амплификации 1 мкл раствора из бака до внесения библиотеки; дорожка 3 - результат ПЦР-амплификации 1 мкл раствора библиотеки после прекондиционирования; дорожка 4 - результат ПЦР-амплификации 1 мкл раствора библиотеки после всех прокачек из бака в бак; дорожка 5 - результат ПЦР-амплификации 1 мкл раствора после последней промывки; дорожка 6 - результат ПЦР-амплификации 3 мкл переосажденного элюата после обработки протеиназой К, колонка «опыт»; дорожка 7 - результат ПЦР-амплификации 3 мкл переосажденного элюата после обработки протеиназой К, колонка «контроль»; дорожка 8 - результат ПЦР-амплификации 3 мкл суспензии без обработки протеиназой, колонка «опыт»; дорожка 9 - результат ПЦР-амплификации 3 мкл суспензии без обработки протеиназой, колонка «контроль»; дорожка 10 - негативный контроль (все компоненты ПЦР-смеси без добавления ДНК-матрицы).
Подготовка комбинаторной библиотеки олигонуклеотидов
На этом этапе определяют концентрацию комбинаторной библиотеки (фоновую концентрацию), ПЦР-амплификация которой не детектируется с помощью полиакриламидного гель-электрофореза и поэтому не способна повлиять на результат селекции за счет образования нецелевых либо неспецифических взаимодействий с носителем, на котором иммобилизуют мишень селекции. Для этого готовят серию десятикратных последовательных разведений исходного раствора комбинаторной библиотеки добавлением соответствующего количества деионизированной дистиллированной воды (mQ H2O). Полученные разведения используют при подготовке ПЦР-смесей. Компоненты реакции аккуратно смешивают и переносят в ПЦР-амплификатор; полимеразную цепную реакцию проводят согласно условиям, приведенным в Таблицу 1. В колонке стрелкой показано, что нужно сделать 25 циклов участка от денатурации до элонгации.

Результаты ПЦР анализируют с помощью полиакриламидного гель-электрофореза (ПААГЭ). По яркости полос на геле оценивают количество ДНК в ПЦР-продукте. Определяют предел видимости для используемой комбинаторной библиотеки олигонуклеотидов по поиску соседних дорожек с видимой и невидимой полосами, соответствующими электрофоретической подвижности комбинаторной библиотеки. Проводят расчет фоновой концентрации библиотеки по формуле
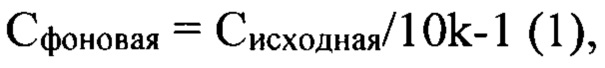
где k - номер раствора при разведении библиотеки, для которого впервые не детектировали видимую полосу, номер 1 соответствует исходному раствору комбинаторной библиотеки.
Также на этом этапе проводят определение максимального количества циклов ПЦР, при котором получается однородный ПЦР-продукт (ампликон) для используемой комбинаторной библиотеки олигонуклеотидов. Высокие концентрации матричной ДНК уменьшают специфичность амплификации, что сопровождается появлением на электрофореграммах дополнительных полос с повышенной молекулярной массой относительно комбинаторной библиотеки олигонуклеотидов. Отбирают аликвоту комбинаторной библиотеки, содержащую порядка 1010 индивидуальных олигонуклеотидов, чего должно быть достаточно для селекции высокоспецифичных аптамеров к молекулярной мишени [PMID: 7574500]. С таким количеством ДНК-матрицы готовят ряд ПЦР-смесей. Полимеразную цепную реакцию проводят согласно условиям, указанным в Табл. 1, но устанавливая для каждой ПЦР-смеси индивидуальное количество циклов, от 5 до 30. Результаты анализируют с помощью ПААГЭ. По характеру полос на геле определяют количество циклов амплификации, позволяющее получить однородный ПЦР-продукт, не содержащий неспецифических ампликонов. Проводят расчет концентрации комбинаторной библиотеки олигонуклеотидов после амплификации по формуле:
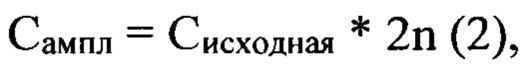
где n - максимальное количество циклов, при котором на электрофореграмме наблюдают однородный ПЦР-продукт. Эту операцию проводят перед каждым последующим раундом селекции, поскольку состав комбинаторной библиотеки изменяется, что не позволяет использовать одинаковые условия амплификации.
Подготовка эксперимента по селекции олигонуклеотидов
Подготовка мишени селекции В качестве мишени используют препарат рекомбинантного белка-мишени, конъюгированного с Fc-доменом IG1 человека. Порядка 8 мкг белка иммобилизируют на белок-A/G агарозе согласно протоколу производителя агарозы с использованием центрифужных колонок с завинчивающейся крышкой. Эффективность иммобилизации оценивают по оптической плотности раствора белка до и после инкубации с белок-A/G агарозой, разница должна составлять не менее 80%, в противном случае следует провести повторную инкубацию элюата.
Сборка установки для селекции олигонуклеотидов
Собирают установку для SELEX согласно схеме на Фиг. 1. Объем баков 4 и 5 оценивают по формуле 
В качестве фильтрующих насадок используют альтернативные фильтрующие диски, входящие в комплект центрифужных колонок с отвинчивающейся крышкой, которые подсоединяют к системе с помощью держателей для фильтров Swinnex. Для питания электрического насоса используют источник питания PowerPack Universal с выходным напряжением, установленным на 12 В. Элементы системы соединяют с помощью стерильных патрубков.
Подготовка смеси модифицированных и немодифицированных дезоксирибонуклеозидтрифосфатов
Для приготовления смеси один из дезоксирибонуклеозидтрифосфатов (dNTP) заменяют на сочетание соответствующего конвенционального dNTP и его модифицированной версии в соотношении 1:3, или 2,5 мМ и 7,5 мМ, соответственно. Таким образом, в каждом олигонуклеотиде на случайной позиции (начиная с позиции 21, поскольку первые 20 нуклеотидов соответствуют прямому праймеру) может содержаться от 0 до 3 (другими словами, до 4%) модифицированных dNTP. Конечную концентрацию всех остальных dNTP делают равной 10 мМ. Подготовка комбинаторной библиотеки к первому раунду селекции Готовят ПЦР-смесь согласно Таблице 2 - Компоненты для приготовления ПЦР-смеси объемом 25 мкл.
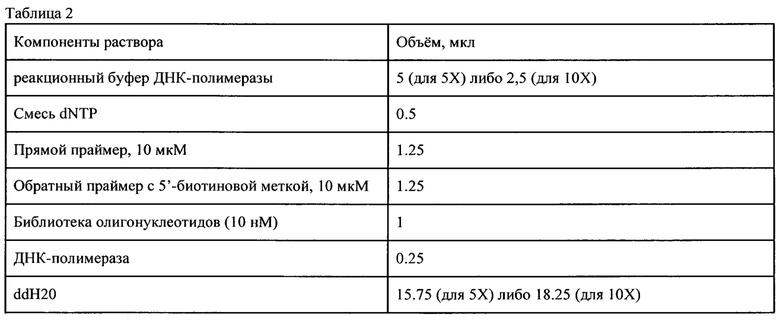
Компоненты реакции смешивают на льду и переносят в ПЦР-амплификатор, предварительно разогретый до 98 С. Полимеразную цепную реакцию проводят согласно условиям, указанным в Таблице 1 с количеством циклов амплификации, подсчитанным по формуле (2).
Выделение одноцепочечных олигонуклеотидов
В центрифужную пробирку с завинчивающейся крышкой наносят 50 мкл стрептавидин-сефарозы. Трижды промывают буфером PBS (рН 7.2), после чего наносят 25 мкл ПЦР-смеси после амплификации. Инкубацию проводят в течение 60 мин при комнатной температуре на ротационном шейкере. Затем отделяют не связавшиеся со стрептавидин-сефарозой олигонуклеотиды центрифугированием, трижды промывают колонку буфером PBS (рН 7.2), после чего наносят 25 мкл 50% раствора формамида в PBS. Колонку инкубируют с раствором формамида в течение 15 мин термостате, разогретом до 47 С, после чего выделяют целевую фракцию одноцепочечных олигонуклеотидов центрифугированием (30 сек, 1000 g).
Проводят прекондиционирование одноцепочечной библиотеки олигонуклеотидов, для чего разбавляют ее в 1 л 0.5Х буфера PBS (рН 7.2), 140 мМ NaCl, 5 mM KCl. Раствор нагревают до кипения, после чего добавляют в него библиотеку одноцепочечных олигонуклеотидов и оставляют при комнатной температуре в течение 10 часов (overnight).
Эксперимент по селекции олигонуклеотидов
Описание основано на Фиг. 1. В баке (4) готовят необходимый объем 0.5Х буфера PBS (рН 7.2), 140 мМ NaCl, 5 mM KCl для прокачки через системы селекции, равный {Vсистемы - 1 л}. Добавляют в него 1 л раствора прекондиционированной библиотеки, весь раствор перекачивают через опытную и контрольную колонки в аналогичный бак (5) четыре раза со скоростью 175 мл/мин, каждый раз перенося весь объем обратно в бак (4). После прокачки обе колонки трехкратно промывают 1 л 0.5Х раствора PBS, 140 мМ NaCl, 5 мМ KCl в режиме непрерывной прокачки в течение 10 минут. Затем колонки отсоединяют от установки, центрифугируют досуха, агарозу со связавшимися олигонуклеотидами смывают с колонок в пробирки 100 мкл 0.5Х раствора PBS, 140 мМ NaCl, 5 мМ KCl.
После указанных операций проводят оценку качества получившихся и промежуточных фракций. Для этого готовят ПЦР-смеси согласно Таблице 2, используя в качестве матрицы следующие образцы:
- раствор из бака (4) до внесения библиотеки;
- раствор библиотеки после прекондиционирования;
- раствор библиотеки после всех прокачек из бака в бак;
- раствор после последней промывки колонки "опыт";
- суспензия агарозы, колонка "опыт";
- суспензия агарозы, колонка "контроль";
- ddH2O, отрицательный контроль.
Проводят ПЦР-амплификацию по программе, указанной в Таблице 1, установив 32 цикла амплификации. В лунки предварительно подготовленного полиакриламидного геля наносят маркер молекулярной массы и по 3 мкл указанных растворов. Следят, чтобы в дорожках с отрицательными контролями не содержалось полос, свидетельствующих о загрязнении растворов, в то время как дорожка, содержащая суспензию агарозы с колонки «опыт» обязана содержать ярко выраженные полосы. При соблюдении всех этих условий можно переходить к следующему раунду селекции. Количество циклов амплификации библиотеки при подготовке к следующему раунду селекции каждый раз необходимо перепроверять с помощью определения точки появления неспецифического отжига праймеров с помощью описанного выше протокола.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Способ селекции аптамеров к EGFR человека
Препарат EGFR, конъюгированного с Fc-доменом IG1 человека, иммобилизировали на белок A/G-агарозе. Селекция состояла из пяти раундов, каждый раунд состоял из следующих этапов:
1. подготовка библиотеки к раунду
1.1 определение количества циклов ПЦР для получения однородного продукта
1.2 проведение ПЦР в присутствии модифицированных нуклеотидов
1.3 выделение смысловой одноцепочечной ДНК и определение концентрации
1.4 прекондиционирование
2. проведение селекции
Для определения "фоновой" концентрации библиотеки с последовательностью
5' - GpGpApApGpApGpApApGpGpApCpApTpApTpGpApT- (N40) - TpTpGpApCpTpApGpTpApCpApTpGpApCpCpApGpA - 3',
где р - остаток фосфорной кислоты, соединяющий соседние нуклеозиды в молекуле ДНК, предположительно каждый остаток фосфорной кислоты в молекуле находится в виде натриевой соли; N40 - участок случайной последовательности, состоящий из 40 последовательных случайных дезоксирибонуклеозидов (N); А, С, G, Т - дезоксирибонуклеозиды аденозин, цитозин, гуанидин и тимидин, соответственно, делали следующие разведения:
- раствор 1: 1 мкл 10 мкМ библиотеки, разведенный в 1000 мкл ddH2O (6.02 ⋅ 10∧9 молекул в мкл);
- раствор 2: 1.2 ⋅ 10∧7 молекул в мкл;
- раствор 3: 6.02 ⋅ 10∧6 молекул в мкл;
- раствор 4: 1.2 ⋅ 10∧4 молекул в мкл;
- раствор 5: 6.02 ⋅ 10∧3 молекул в мкл;
- раствор 6: 12 молекул в мкл;
- раствор 7: 6 молекул в мкл.
Полученные разведения использовали при приготовлении ПЦР-смесей согласно значениям, приведенным в Таблице 2. Проводили ПЦР-амплификацию в соответствии с условиями, приведенными в Таблице 1. Готовили разделяющий полиакриламидный гель и наносили по 5 мкл каждого ПЦР-продукта, а также 2 мкл маркера молекулярной массы в разные лунки геля. Проводили электрофорез, используя условия (продолжительность электрофореза, сила тока и напряжение), рекомендуемые производителем оборудования.
Согласно результатам электрофореза, представленном на Фиг. 2, предел видимости для используемой библиотеки олигонуклеотидов находился между растворами 5 (последняя видимая полоса, соответствующая электрофоретической подвижности ДНК длиной 80 п.о.) и 6 (полоса для ДНК-библиотеки не детектируется). Это соответствует концентрации библиотеки порядка 6,02 ⋅ 10∧3 молекул в мкл.
При синтезе олигонуклеотидов, содержащих модифицированные дезоксинуклеотиды, в настоящем проекте использовали ДНК-полимеразу Q5 (Q5 High-Fidelity DNA Polymerase, New England BioLabs, кат. номер M0491S). В ПЦР-смесь всегда наносили биотинилированный обратный праймер с последовательностью biotin - 5' - TCTGGTCATGTACTAGTCAA - 3' и согласно прилагаемому протоколу использовали реагент Q5 High GC Enhancer, входящий в комплект Q5 High-Fidelity DNA Polymerase. Конечная концентрация праймеров в ПЦР-смеси составляла 0,5 мкМ.
Для приготовления смеси dNTP использовали соотношение dTTP и 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата, равное 1:3. Таким образом, концентрации dATP, dGTP и dCTP в ПЦР-смеси составляли 200 мкМ, dTTP 50 мкМ и 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата 150 мкМ.
Для оценки количества циклов ПЦР, при котором получается гомогенный продукт, проводили расцикловку. В случае подготовки к первому раунду для этого брали 1 мкМ 10 мМ раствора библиотеки, разводили в 1000 раз, в каждую ПЦР-смесь объемом 25 мкл наносили 1 мкл такого раствора библиотеки. Всего делали 8 систем с разным количеством циклов ПЦР (Фиг. 3).
По результатам расцикловки делали 12 циклов ПЦР-амплификации библиотеки в присутствии 5-аминоаллил-2'-дезоксиуридин-5'-трифосфата.
Согласно формуле (2), концентрация библиотеки после амплификации должна составлять Сампл=9.8 ⋅ 10∧11 мол-л/мкл.
Проводили наработку необходимого количества одноцепочечной библиотеки. После получения одноцепочечной смысловой цепи измеряли ее концентрацию, для первого раунда селекции брали 1,6 мкл одноцепочечной библиотеки. Согласно формуле (3), библиотеку необходимо было разбавить в ~10∧8 раз, чтобы довести до фоновой концентрации. Таким образом, общий объем системы составил 16 л.
После прекондиционирования в 1 л 0.5Х буфера PBS (рН 7.2), 140 мМ NaCl, 5 mM KCl полученный раствор библиотеки добавляли к 15 л 0.5Х буфера PBS (рН 7.2), 140 мМ NaCl, 5 mM KCl, находящимся в баке (4). Проводили селекцию согласно описанному способу. Результаты первого раунда селекции представлены на Фиг. 4.
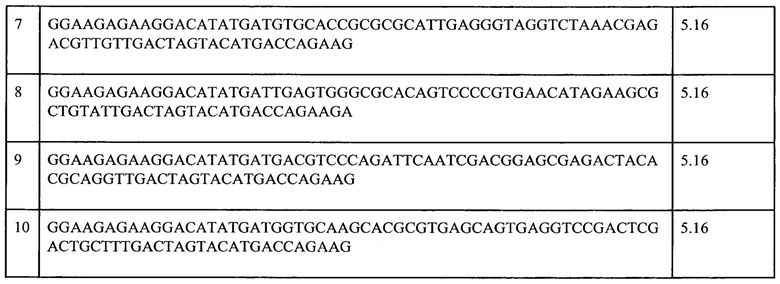
Для последующих раундов селекции проводили соответственно 31, 28, 27 и 28 циклов ПЦР, поскольку именно такое количество позволяло получить однородный продукт при максимальной амплификации библиотеки. ДНК из суспензии колонок "опыт" и "контроль" после третьего и пятого раунов селекции затем амплифицировали с помощью ПЦР и определяли первичную структуру методом высокопроизводительного секвенирования. Проводили вычитающую селекцию, для чего сравнивали полученные первичные структуры с колонок «опыт» и «контроль» и искали такие, для которых наблюдали обогащение в колонке «опыт» между третьим и пятым раундами селекции при отсутствии обогащения в колонке «контроль». Десять наиболее часто встречающихся последовательностей в колонке "опыт", не встречающихся в колонке "контроль", представлены в Таблице 3.

Таким образом, проведение селекции при низких концентрациях комбинаторной библиотеки продемонстрировало, что предлагаемый способ действительно позволяет детектировать накопление олигонуклеотидов с повышенной аффинностью к молекулярной мишени при снижении доли олигонуклеотидов, неспецифически оседающих на носителе. Кроме того, предлагаемый способ не использует сопряженный с потерями этап снятия олигонуклеотидов с носителя, что существенно повышает вероятность успешного получения аптамеров по сравнению с известным способом.
--->
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT AAGTAGCACA GTCGTAGACG GGTCGAGACG GGTGGCTCGG CTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT CACCGAGTAC GGGGTCACTC GGACAAGCAA AAGCAAGGAA GTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT AAGGAGCTGA GCGTTCTGGT AGGTCAACTA GCGTTCACGA TTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT GATCTGCGAC TCGCTGTAGA TGGTAGTCGT ATTGTGGAGG ATTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT GCCGTTTCAG GGACATCGGA GGTTACGCTC TACATATCGC CTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT ACGGATCTCA AGTGCCCGTG GACCCGGTGG CAGAACGGAC GTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT GTGCACCGCG CGCATTGAGG GTAGGTCTAA ACGAGACGTT GTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT TGAGTGGGCG CACAGTCCCC GTGAACATAG AAGCGCTGTA TTGACTAGTA CATGACCAGA AGA
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT GACGTCCCAG ATTCAATCGA CGGAGCGAGA CTACACGCAG GTTGACTAGT ACATGACCAG AAG
<110> Общество с ограниченной ответственностью «АПТО-ФАРМ»
<120> Способ селекции одноцепочечных олигонуклеотидов с повышенной аффинностью к молекулярной мишени
<140> 2019142423
<141> 19.12.2019
<160>
<210>
<211> 83
<212> ДНК
<213>
<400> GGAAGAGAAG GACATATGAT GGTGCAAGCA CGCGTGAGCA GTGAGGTCCG ACTCGACTGC TTTGACTAGTACATGACCAGAAG
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ направленного истощения олигонуклеотидных библиотек для снижения неспецифической адсорбции при твердофазной селекции аптамеров на основе нуклеиновых кислот | 2015 |
|
RU2618872C1 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯСЯ С ПРОТЕОЛИТИЧЕСКОЙ СУБЪЕДИНИЦЕЙ НЕЙРОТОКСИНА ТИПА A CLOSTRIDIUM BOTULINUM | 2014 |
|
RU2571210C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК, ПРИМЕНИМАЯ В КАЧЕСТВЕ ЗОНДА ДЛЯ ОБЕСПЕЧЕНИЯ МАКСИМАЛЬНОГО СООТНОШЕНИЯ "СИГНАЛ/ФОН" В ТЕСТ-СИСТЕМАХ НА ОСНОВЕ ИММУНО-ПЦР | 2014 |
|
RU2566550C1 |
| СПОСОБ СОЗДАНИЯ И СЕЛЕКЦИИ БИБЛИОТЕКИ МОДИФИЦИРОВАННЫХ АПТАМЕРОВ | 2016 |
|
RU2652952C1 |
| СПОСОБ СПЕЦИФИЧЕСКОГО ОТБОРА ВЫСОКОАФФИННЫХ МОЛЕКУЛ ДНК (ДНК-АПТАМЕРОВ) К РЕКОМБИНАНТНОМУ БЕЛКУ-МИШЕНИ | 2012 |
|
RU2513700C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯСЯ С БАКТЕРИЯМИ Escherichia coli O157:H7 | 2014 |
|
RU2566551C1 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК-АПТАМЕРОВ, СВЯЗЫВАЮЩАЯ ШИГА-ТОКСИН ТИПА 2 | 2014 |
|
RU2566552C1 |
| Последовательность ДНК-аптамера, связывающаяся с пептидогликан-ассоциированным липопротеином Legionella pneumophila | 2019 |
|
RU2737829C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pGST/ART/X, КОДИРУЮЩАЯ СЛИТНЫЙ ХИМЕРНЫЙ ПОЛИПЕПТИД GST/ART/X ДЛЯ ВЫСОКОСПЕЦИФИЧНОЙ СЕЛЕКЦИИ АПТАМЕРОВ К БЕЛКУ-МИШЕНИ X В СОСТАВЕ ПОЛИПЕПТИДА | 2014 |
|
RU2558295C1 |
Изобретение относится к области биотехнологии и может быть использовано в селекции из комбинаторных библиотек индивидуальных одноцепочечных олигонуклеотидов или семейств олигонуклеотидов с требуемыми функциями. Для придания повышенного структурного разнообразия и высокой аффинности к мишени олигонуклеотиды содержат до 4% модифицированных гетероциклических оснований. Для получения олигонуклеотидов используют низкую концентрацию комбинаторных библиотек, индивидуальную для каждого раунда селекции, что позволяет контролировать комплексообразование между олигонуклеотидами и молекулярной мишенью и нейтрализовать эффект нецелевых и неспецифических взаимодействий с носителем, применяемым для иммобилизации молекулярной мишени. Описывается также установка для проведения селекции и необходимые подготовительные эксперименты. Полученные в результате олигонуклеотиды характеризуются низкими скоростями диссоциации и могут быть использованы в качестве аналогов моноклональных антител в типичных для них сценариях применения, 2 з.п. ф-лы, 3 табл., 1 пр., 4 ил.
1. Способ селекции олигонуклеотидов с повышенной аффинностью к молекулярной мишени, включающий многораундовую прокачку раствора комбинаторной библиотеки олигонуклеотидов через колонку с иммобилизованной на носителе молекулярной мишенью и через колонку с носителем без иммобилизованной мишени с последующей вычитающей селекцией и отличающийся тем, что селекцию проводят при низкой концентрации комбинаторной библиотеки олигонуклеотидов, индивидуальной для каждого раунда, позволяющей детектировать накопление только высокоаффинных олигонуклеотидов, причем количество библиотеки олигонуклеотидов для каждого раунда определяют по максимальному числу циклов полимеразной цепной реакции (ПЦР), позволяющему детектировать однородный ПЦР-продукт.
2. Способ по п. 1, отличающийся тем, что олигонуклеотиды в комбинаторной библиотеке содержат до 4% модифицированных гетероциклических оснований.
3. Способ по п. 1, отличающийся тем, что детекцию накопления высокоаффинных олигонуклеотидов проводят с помощью 32 циклов полимеразной цепной реакции (ПЦР) с использованием носителя с иммобилизированной мишенью после раунда селекции в качестве матрицы.
| СПОСОБ СОЗДАНИЯ И СЕЛЕКЦИИ БИБЛИОТЕКИ МОДИФИЦИРОВАННЫХ АПТАМЕРОВ | 2016 |
|
RU2652952C1 |
| СПОСОБ СЕЛЕКЦИИ АПТАМЕРОВ К ЗАДАННЫМ БЕЛКОВЫМ МИШЕНЯМ НА ПОВЕРХНОСТИ КЛЕТОК | 2012 |
|
RU2518368C1 |
Авторы
Даты
2020-11-20—Публикация
2019-12-19—Подача