ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к растворам для консервации и/или перфузии изолированной ткани или изолированного органа, причем растворы содержат декстран, глюкозу, ионы кальция, буфер и воду, имеют рН, лежащий в диапазоне от 6,6 до 7,8, и являются стерильными вследствие того, что их подвергли тепловой стерилизации, а также к способам приготовления и применения этих растворов.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Растворы декстрана используют для различных медицинских целей в течение более чем 50 лет. Раствор Perfadex® - это термически стерилизованный раствор декстрана, который был разработан для перфузии органов в начале 1970-х годов. В течение последних пятнадцати-двадцати лет он стал основным продуктом для консервации легких перед трансплантацией. Раствор Macrodex® и раствор Rheomacrodex® использовали еще дольше в качестве плазмозаменителей во время хирургических операций и у пациентов с травмами. Раствор PrimECC® (РСТ/ЕР2011.069524) - еще один раствор декстрана, показанный к применению в качестве раствора для первичного заполнения аппаратов искусственного кровообращения. Все эти растворы коммерчески доступны с субфизиологическим рН, лежащим в диапазоне от примерно 4 до примерно 6. Растворы могут быть слегка забуферены фосфатом и/или бикарбонатом, однако, поскольку рН снижается во время тепловой стерилизации вследствие гидролиза декстрана, то рН в коммерчески доступном продукте обычно ниже 6,6 и часто ниже 6 при температуре его применения. Субфизиологический рН не был основной проблемой в случае продуктов для инфузий, таких как раствор Macrodex® или раствор PrimECC®, поскольку их кислотность невелика, а компоненты плазмы, в основном - сывороточный альбумин, мгновенно выполняют роль буфера, поддерживая физиологический рН плазмы.
Если раствор декстрана используют для промывания или перфузии изолированного органа, то в этом случае остается не так много компонентов плазмы, таких как сывороточный альбумин, и поэтому буферная емкость в изолированном органе или ткани снижается. Поэтому на практике пользователи обычно забуферивают раствор Perfadex® трис(гидроксиметил)аминометаном (далее обозначаемым в данной публикации как TRIS, также известным под названием ТНАМ; от англ.: tris(hydroxymethyl)aminomethane) или сходными буферами для достижения физиологического рН непосредственно перед употреблением. Забуферивание раствора Perfadex® пользователями (также называемое забуфериванием перед употреблением) разрешено, но всегда существует риск совершить ошибки, если продукт не поставлен готовым к употреблению. Пользователь может вообще забыть забуферить раствор, или пользователь может использовать неправильный буфер или неправильную его концентрацию. Любое из этих обстоятельств может негативно повлиять на качество изолированного органа, например - легкого или легких. Поэтому готовый к употреблению предварительно забуференный раствор для перфузии органов может повысить безопасность консервации органов и удобство пользователя.
В публикации WO 2012/142487 описан раствор для перфузии легких, названный OCS раствором, содержащий Декстран 40, магний, кальций, натрий, питательные вещества, такие как глюкоза, гормоны, буфер и т.д. В публикации указано, что рН OCS раствора контролируют во время его приготовления, что OCS раствор термически стерилизован, что в OCS раствор перед употреблением добавляют культуральную среду для клеток, и что рН полученной среды регулируют перед употреблением с использованием, например, бикарбоната (абзацы [0010], [0035], [0045] и [0066]), что свидетельствует о том, что OCS раствор производят с субфизиологическим рН, что требует дополнительного забуферивания перед употреблением.
Неавтоклавированные, стерилизованные посредством фильтрации растворы декстрана, такие как STEEN раствор (PCT/SE01/02419), использовали при физиологическом рН в течение примерно 15 лет, однако по сведениям авторов настоящего изобретения не было доступных термически стерилизованных растворов декстрана с рН, лежащим в диапазоне от 6,6 до 7,8, для применения в медицине. Стерилизующая фильтрация приемлема для продуктов малого объема, обычно - с низким содержанием декстрана. В противном случае декстран может закупорить фильтр.
Другой проблемой, связанной с тепловой стерилизацией растворов, которые, в частности, содержат глюкозу, особенно - растворов для перитонеального диализа, является разложение глюкозы до токсичных продуктов ее разложения. Предпринимались попытки снизить содержание этих токсичных побочных продуктов посредством дальнейшего снижения рН раствора до примерно 3 во время тепловой стерилизации или посредством отделения электролитов и глюкозы во время стерилизации (Ledebo et al., 2000, и Wieslander et al., 1995).
Та же проблема разложения глюкозы известна из производства растворов декстрана для различных медицинских целей, например - для консервации органов. Основное решение этой проблемы состояло в увеличении количества глюкозы в растворе перед стерилизацией, чтобы обеспечить в конечном продукте, предназначенном для использования, содержание глюкозы, достаточное для поддержания метаболизма органа. Это решение не учитывает потенциальный токсический эффект продуктов разложения глюкозы. Напротив, перегрузка глюкозой во время производства усиливает проблему вследствие образования повышенных количеств потенциально токсичных продуктов разложения глюкозы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает раствор для консервации и/или перфузии изолированной ткани или изолированного органа, который решает эти проблемы и обеспечивает дополнительные преимущества. Раствор содержит декстран, глюкозу, ионы кальция, буфер и воду. Раствор имеет рН, лежащий в диапазоне от 6,6 до 7,8, и является стерильным вследствие того, что он был подвергнут тепловой стерилизации. Изолированную ткань или орган можно выбрать, например, из легкого, сердца, печени, почки, поджелудочной железы и/или кишечника. Раствор забуферивают до физиологически приемлемого рН при температуре его использования перед тепловой стерилизацией (это также называют предварительным забуфериванием) и дополняют ионами кальция для имитации состава экстраклеточной жидкости также перед тепловой стерилизацией (это также называют предварительной суплементацией (дополнением) кальцием), после чего подвергают тепловой стерилизации. Поэтому полученный раствор является готовым к употреблению, поскольку он не требует дополнительного забуферивания или дополнительной суплементации кальцием или другими соединениями перед употреблением. Более того, сочетание предварительного забуферивания и предварительной суплементации кальцием перед тепловой стерилизацией обеспечивает защиту глюкозы перед тепловой стерилизацией, поддерживает более высокую концентрацию глюкозы в растворе и за счет этого снижает образование потенциально токсичных продуктов разложения.
Настоящее изобретение также обеспечивает способ приготовления раствора для консервации и/или перфузии изолированной ткани или изолированного органа. Способ включает стадию (1) объединения декстрана, глюкозы, ионов кальция, буфера и воды с получением начального раствора. Способ также включает стадию (2) доведения рН начального раствора до значения, лежащего в диапазоне от 7,0 до 7,8, если это необходимо. Способ также включает стадию (3) проведения тепловой стерилизации начального раствора с получением раствора для консервации и/или перфузии органов.
Настоящее изобретение также обеспечивает способ консервации и/или перфузии изолированной ткани или изолированного органа. Способ включает стадию (1) получения объема раствора для консервации и/или перфузии изолированной ткани или изолированного органа, из стерильного контейнера, в котором хранился раствор. Способ также включает стадию (2) введения полученного объема раствора в изолированную ткань или изолированный орган, за счет чего обеспечивается консервация и/или перфузия изолированной ткани или изолированного органа.
Настоящее изобретение также обеспечивает способ промывания, хранения и/или транспортировки изолированного легкого после его удаления у донора в процессе подготовки к последующей трансплантации реципиенту. Способ включает стадию (1) промывания изолированного легкого донора промывочным объемом раствора для консервации и/или перфузии изолированной ткани или изолированного органа. Способ также включает стадию (2) по меньшей мере частичного заполнения стерильного контейнера для хранения органов заправочным объемом раствора и погружения изолированного легкого в заправочный объем раствора.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Растворы для консервации и/или перфузии органов
Как указано выше, настоящее изобретение обеспечивает раствор для консервации и/или перфузии изолированной ткани или изолированного органа. Раствор содержит декстран, глюкозу, ионы кальция, буфер и воду. Раствор имеет рН, лежащий в диапазоне от 6,6 до 7,8, и является стерильным вследствие того, что он был подвергнут тепловой стерилизации.
Растворы, содержащие декстран, например - Декстран 40, и низкие концентрации калия, например - концентрации, равные внеклеточным, использовали для консервации органов с 1960-х годов, причем эти растворы имели различные названия, например - растворы декстрана, растворы Декстрана 40 и/или LPD растворы.
В конце 1990-х годов LPD раствор под названием Perfadex® стал основным консервирующим раствором для использования с органами, богатыми эндотелием, такими как легкие. Состав раствора Perfadex® (указанный в виде массы в 1 литре) следующий:
Можно использовать другие электролитные композиции, если они являются физиологически приемлемыми и имеют электролитный состав, относительно близкий к составу плазмы.
Декстраны
Как указано выше, раствор для консервации и/или перфузии органов по настоящему изобретению содержит декстран. Декстраны - это полисахариды с молекулярной массой, большей или равной 1000 дальтон (Да), которые имеют линейную основную цепь, состоящую из повторяющихся а-связанных D-глюкопиранозильных элементов, и которые можно разделить на три класса - Класс 1, Класс 2 и Класс 3, исходя из их структуры. Коммерчески доступные декстраны можно классифицировать согласно их источнику и/или среднемассовой молекулярной массе. Коммерчески доступные декстраны включают, например, декстраны, полученные из Leuconostoc spp. или Leuconostoc mesenteroides. Коммерчески доступные декстраны также включают, среди прочего, например, декстраны, имеющие среднемассовые молекулярные массы, равные примерно 20000 дальтон, также обозначаемые как Декстран 20, равные примерно 40000 дальтон, также обозначаемые как Декстран 40, равные примерно 60000 дальтон, также обозначаемые как Декстран 60, и равные примерно 70000 дальтон, также обозначаемые как Декстран 70, а также смеси этих и других декстранов.
Декстран 40 идеален для консервации органов благодаря оптимальному размеру его молекулы, который обеспечивает достаточное онкотическое давление в растворах декстрана без ненужного повышения их вязкости, в частности - в концентрации, лежащей в диапазоне от 40 г/л до 60 г/л, предпочтительно - 50 г/л, в растворах декстрана. Однако Декстран 40 можно заменить Декстраном 60, Декстраном 70 или любым другим декстраном, имеющим обеспечивающее онкотическое давление распределение молекул по размеру, лежащее между Декстраном 20 и Декстраном 70, с получением приемлемых результатов.
Соответственно, в некоторых вариантах осуществления раствора для консервации и/или перфузии органов по настоящему изобретению декстран имеет среднемассовую молекулярную массу, лежащую в диапазоне от 20000 Да до 70000 Да, например - от 30000 Да до 50000 Да или от 33000 Да до 42000 Да. Также в некоторых вариантах осуществления настоящего изобретения декстран включает Декстран 40. Также в некоторых вариантах осуществления настоящего изобретения декстран содержится в растворе в концентрации, лежащей в диапазоне от 40 г/л до 60 г/л, например - от 45 г/л до 55 г/л, от 48 г/л до 52 г/л или в концентрации, равной 50 г/л. Также в некоторых примерах декстран включает декстран, полученный из Leuconostoc spp.или Leuconostoc mesenteroides.
Глюкоза, ионы кальция и буфер
Как указано выше, раствор для консервации и/или перфузии органов по настоящему изобретению также содержит глюкозу и ионы кальция.
В течение примерно 15 последних лет в 90% всех трансплантатов легких перед трансплантацией использовали раствор Perfadex®. Раствор Perfadex®, как и все остальные коммерческие растворы Декстрана 40, коммерчески доступен с низким значением рН, лежащим в диапазоне от примерно 4 до примерно 6, и поэтому непосредственно перед употреблением он требует забуферивания для получения более высокого рН, Это забуферивание преимущественно производят с использованием TRIS. Причиной, по которой раствор Perfadex® поставляют с низким рН, является желание повысить стабильность продукта, в частности - содержащейся в нем глюкозы, в частности - во время тепловой стерилизации. Как подробно обсуждается ниже, авторы настоящего изобретения показали, что, в отличие от предшествующего уровня техники, в растворе для консервации и/или перфузии органов по настоящему изобретению повышенный перед тепловой стерилизацией рН, лежащий в диапазоне от 7,0 до 7,8, предпочтительно - равный 7,4±0,2, стабилизирует глюкозу во время процесса тепловой стерилизации.
Многие пользователи также дополняли раствор Perfadex® стерильным раствором ионов кальция непосредственно перед употреблением, так как было показано, что это полезно для эндотелия (Ingemanson et al., 1996). Одной из причин, по которой ионы кальция не включали в раствор Perfadex® раньше, чем непосредственно перед употреблением, было то, что высказывалось предположение о том, что, если добавить ионы кальция перед тепловой стерилизацией раствора Perfadex®, то во время тепловой стерилизации и последующего хранения может выпасть в осадок фосфат кальция. Авторы настоящего изобретения неожиданно показали, что в растворе для консервации и/или перфузии органов по настоящему изобретению не происходит образования осадка во время тепловой стерилизации или последующего хранения в течение 24 месяцев после тепловой стерилизации. Более того, в отличие от предшествующего уровня техники, авторы настоящего изобретения показали, что суплементация кальциевыми ионами совместно с рН, лежащим в диапазоне от 7,0 до 7,8, предпочтительно - равным 7,4±0,2, синергистически стабилизирует глюкозу во время тепловой стерилизации.
По этим причинам забуферивание TRIS и суплементация кальциевыми ионами раствора Perfadex® были признаны полезными или даже необходимыми для конечного использования, однако ранее ни TRIS, ни ионы кальция не добавляли в раствор Perfadex®, кроме как непосредственно перед употреблением, из-за ожидавшихся проблем во время тепловой стерилизации и хранения. Одним из преимуществ раствора для консервации и/или перфузии органов по настоящему изобретению, основанным на предварительном забуферивании и предварительной суплементации кальцием перед тепловой стерилизацией, является то, что раствор для консервации и/или перфузии органов может быть получен в форме продукта, готового к употреблению. Готовый к употреблению продукт обеспечивает удобство для пользователя и повышает безопасность, поскольку возникает меньше рисков, связанных с неправильным забуфериванием и/или другой суплементацией, если нет необходимости в дополнительном забуферивании или другой суплементации.
Соответственно, в некоторых вариантах осуществления раствора для консервации и/или перфузии органов по настоящему изобретению перед тепловой стерилизацией глюкоза содержится в растворе в концентрации, лежащей в диапазоне от 0,5 г/л до 5 г/л, например - от 0,6 г/л до 3 г/л, от 0,8 г/л до 2 г/л, от 0,9 г/л до 1,5 г/л, или в концентрации, равной 1 г/л. Это означает, что глюкоза содержится в начальном растворе в концентрации, лежащей в диапазоне от 0,5 г/л до 5 г/л, перед тем как начальный раствор подвергают тепловой стерилизации с получением раствора для консервации и/или перфузии органов и, соответственно, до частичного разложения глюкозы, которое происходит во время тепловой стерилизации. Поэтому в некоторых примерах глюкозу можно добавить к начальному раствору в концентрации, лежащей в диапазоне от 0,5 г/л до 5 г/л, после чего начальный раствор можно подвергнуть тепловой стерилизации с получением раствора для консервации и/или перфузии органов, в котором глюкоза содержится в растворе в концентрации, лежащей в диапазоне от 0,5 г/л до 5 г/л.
Также в некоторых вариантах осуществления настоящего изобретения разложение глюкозы во время тепловой стерилизации составляло менее 10%, например - менее 9,5% или менее 9,0%. Это означает, что тепловая стерилизация начального раствора с целью получения раствора для консервации и/или перфузии органов приводит к получению раствора для консервации и/или перфузии органов, имеющего концентрацию глюкозы, которая ниже концентрации глюкозы, имевшейся в начальном растворе, и это снижение опять-таки обусловлено частичным разложением глюкозы, которое происходит во время тепловой стерилизации, и это снижение составляет менее 10% от концентрации глюкозы, имевшейся в начальном растворе.
Также в некоторых вариантах осуществления раствора для консервации и/или перфузии органов по настоящему изобретению ионы кальция содержатся в растворе в концентрации, лежащей в диапазоне от 0,3 мМ до 1,5 мМ, например - от 0,4 мМ до 1 мМ, или в концентрации, равной 0,5 мМ. Также в некоторых вариантах осуществления настоящего изобретения раствор не дает осадка в течение 24 месяцев хранения при температуре, лежащей в диапазоне от 5°С до 25°С. Также в некоторых вариантах осуществления настоящего изобретения раствор дополнительно содержит фосфатные ионы. Также в некоторых вариантах осуществления настоящего изобретения фосфатные ионы содержатся в растворе в концентрации, лежащей в диапазоне от 0,2 мМ до 0,8 мМ, например - от 0,7 мМ до 0,8 мМ.
Температура раствора, выбор буфера и рН
Как указано выше, раствор для консервации и/или перфузии органов по настоящему изобретению также содержит буфер. Кроме того, раствор имеет рН, лежащий в диапазоне от 6,6 до 7,8, и является стерильным вследствие того, что он был подвергнут тепловой стерилизации.
Промывку, перфузию и консервацию органов выполняют при субфизиологических температурах. Обычно в начале промывки органа выполняют промывку при комнатной температуре, затем выполняют холодную промывку и холодную консервацию при температурах, лежащих в диапазоне от 2°С до 15°С. рН соответствующего раствора декстрана зависит от температуры. В частности, это имеет место, когда в растворе декстрана используют буфер, например - TRIS. рН раствора, забуференного TRIS, повышается примерно на 0,01 единицы рН при снижении температуры на один градус Цельсия. Обычно рН измеряют при комнатной температуре, то есть от 18°С до 25°С, или более конкретно - при 25°С. Разность температур при переходе от 25°С к 5°С приводит к повышению рН раствора, забуференного TRIS, примерно на 0,2 единицы рН.
Ткани, в частности - легкие, более чувствительны к рН выше 7,4, и в частности - выше 7,8, чем к рН ниже 7,4. Поэтому предпочтительно, чтобы рН раствора декстрана не превышал 7,8 при любой температуре его использования, и предпочтительно не превышал 7,6. Что касается нижнего диапазона, то такой низкий рН как 6,6, измеренный при 25°С, может быть приемлемым для хранения при температуре, лежащей в диапазоне от 2°С до 15°С, поскольку рН раствора декстрана может быть немного выше при низкой температуре. Легочная ткань в течение короткого периода времени также может выдержать промывку при комнатной температуре раствором с таким низким рН, как 6,6, в частности, потому что во время промывки в сосудах присутствует больше сывороточного альбумина, чем при консервации, и потому что сывороточный альбумин забуферивает слабую кислотность раствора декстрана.
Как указано выше, раствор для консервации и/или перфузии органов по настоящему изобретению может быть предварительно забуферен TRIS. При предварительном забуферивании TRIS используют температурную зависимость TRIS буфера, и поэтому приемлемое значение рН сохраняется после тепловой стерилизации при целевой температуре его использования, и пользователю не нужно производить забуферивание. рН раствора перед тепловой стерилизацией, то есть рН начального раствора, который будет подвергнут тепловой стерилизации с получением раствора для консервации и/или перфузии органов, предпочтительно должен лежать в диапазоне от 7,0 до 7,8 при комнатной температуре (или при 25°С) перед тепловой стерилизацией, более предпочтительно - в диапазоне от 7,2 до 7,6. рН раствора обычно снижается на 0,4 единицы рН или менее, более конкретно - в диапазоне от 0,1 до 0,3 единицы рН, после тепловой стерилизации вследствие разложения глюкозы и декстрана. Соответственно, при приготовлении начального раствора с рН, лежащим в диапазоне от 7,0 до 7,8 при комнатной температуре (или при 25°С), более предпочтительно - в диапазоне от 7,2 до 7,6 перед тепловой стерилизацией, раствор для консервации и/или перфузии органов после тепловой стерилизации будет иметь рН, подходящий для консервации и/или перфузии органов, например - рН, лежащий в диапазоне от 6,6 до 7,8, рН, лежащий в диапазоне от 6,7 до 7,7, или рН, лежащий в диапазоне от 6,9 до 7,6, также при комнатной температуре или при 25°С.
Следует иметь в виду, что раствор для консервации и/или перфузии органов по настоящему изобретению также может быть предварительно забуферен другими буферами, отличающимися от TRIS или использованными в дополнение к TRIS, исходя из принципов, сходных с обсуждавшимися в случае TRIS. Примером такого альтернативного буфера является BIS-TRIS.
Также следует иметь в виду, что раствор для консервации и/или перфузии органов по настоящему изобретению может быть подвергнут тепловой стерилизации, основанной на паровой стерилизации в автоклаве при подходящей температуре в течение подходящего времени, например - при 121°С в течение 20 минут или более, или с использованием альтернативного времени и температуры до достижения F0, лежащего в диапазоне от 12 до 15.
Соответственно, в некоторых вариантах осуществления раствора для консервации и/или перфузии органов по настоящему изобретению буфер содержит органический или биологический буфер, который присутствует в растворе в концентрации, лежащей в диапазоне от 1 мМ до 15 мМ, например - от 1,5 мМ до 10 мМ, от 2 мМ до 5 мМ, или в концентрации, равной 3 мМ. Также в некоторых примерах органический или биологический буфер содержит TRIS в концентрации, лежащей в диапазоне от 1 мМ до 5 мМ, например - от 1,5 мМ до 4 мМ, или в концентрации, равной 3 мМ.
Также в некоторых вариантах осуществления раствор для консервации и/или перфузии органов имеет рН, лежащий в диапазоне от 6,6 до 7,8 при комнатной температуре, например - при температуре, лежащей в диапазоне от 18°С до 25°С, или при 25°С.Также в некоторых вариантах осуществления раствор имеет рН, лежащий в диапазоне от 6,7 до 7,7, или рН, лежащий в диапазоне от 6,9 до 7,6, также при комнатной температуре, например - при температуре, лежащей в диапазоне от 18°С до 25°С, или при 25°С.
Также в некоторых вариантах осуществления раствор для консервации и/или перфузии органов является стерильным вследствие того, что его подвергают тепловой стерилизации, основанной на стерилизации паром в автоклаве, например - при температуре, лежащей в диапазоне от 115°С до 130°С, или при температуре, лежащей в диапазоне от 118°С до 123°С, или при 121°С, в течение по меньшей мере 5 минут, или по меньшей мере 10 минут, или в течение 20 минут или более, до достижения F0, равного по меньшей мере 10, или по меньшей мере 12, или по меньшей мере 15, или лежащего в диапазоне от 12 до 15.
Разложение глюкозы во время тепловой стерилизации
Если рассмотреть разложение глюкозы более подробно, то следует отметить, что разложение глюкозы во время тепловой стерилизации в основном было исследовано в связи с растворами для парентерального питания и растворами для перитонеального диализа. Эти растворы содержат относительно высокие концентрации глюкозы, в характерном случае - около 1,5%, и часто их используют многократно у одного и того же пациента. Проблему разложения глюкозы в растворах для перитонеального диализа, его токсические эффекты и превентивные меры, предпринимаемые для предотвращения токсических эффектов, подробно изучили исследователи в Университетской больнице г. Лунд совместно с исследователями компании Gambro АВ в городе Лунд, Швеция. Их результаты были опубликованы в многочисленных публикациях, на некоторые из которых даны ссылки в данной публикации (Nilsson Thorell et al., 1993, Ledebo et al., 2000, и Wieslander et al., 1995). В публикации Nilsson Thorell et al., 1993 был идентифицирован ряд продуктов разложения глюкозы, такие как ацетальдегид, 5-гидроксиметилфурфураль (5-HMF; от англ.: 5-hydroxymethylfurfural), глиоксаль, метилглиоксаль, формальдегид и 2-фуральдегид. Также был сделан вывод о том, что присутствовали неидентифицированные продукты разложения, которые могут быть ответственными за цитотоксические эффекты, наблюдаемые после тепловой стерилизации растворов для перитонеального диализа.
Решения для исключения разложения глюкозы, предложенные Ledebo et al., 2000, и Wieslander et al., 1995, основаны прежде всего на исключении тепловой стерилизации. Если же раствор необходимо подвергнуть тепловой стерилизации, то ее следует проводить при низком рН, предпочтительно - в диапазоне от примерно 3 до примерно 3,5, или глюкозу не следует стерилизовать совместно с электролитами.
В растворах декстрана для перфузии органов концентрация глюкозы обычно лежит в диапазоне от примерно 0,05% до примерно 0,5%. Хорошо известно, что глюкоза разлагается во время тепловой стерилизации, и этому противодействовали посредством избыточной суплементации глюкозы во время производства в диапазоне от примерно 5% до примерно 10%, чтобы по меньшей мере приблизиться к расчетной целевой концентрации в конечном продукте после тепловой стерилизации. В характерном случае от 10% до 15% глюкозы могут разложиться во время тепловой стерилизации на основе стерилизации паром, как описано выше, например - с получением F0 в диапазоне от 12 до 15. Потенциальные токсические эффекты продуктов разложения не были проанализированы, по-видимому, из-за того, что последующее воздействие является кратковременным и однократным. Хотя при использовании растворов декстрана для перфузии органов не наблюдали прямой токсичности, снижение содержания потенциально токсичных продуктов разложения глюкозы, достигнутое в растворе для консервации и перфузии органов по настоящему изобретению, должно быть выгодным, поскольку оно может дополнительно повысить безопасность продукта. Другим преимуществом стабилизации глюкозы во время производства растворов для консервации и/или перфузии органов является то, что при этом в большей степени гарантируется важное содержание глюкозы в конечном продукте в концентрациях, которые будут поддерживать метаболизм во время хранения изолированной ткани или изолированного органа.
Стабилизация глюкозы
Если рассмотреть стабилизацию глюкозы более подробно, как это сделано в публикациях, соответствующих предшествующему уровню техники (Ledebo et al., 2000, и Wieslander et al., 1995), то низкий рН считается важным для снижения разложения глюкозы и образования продуктов разложения глюкозы. Кроме того, в публикации Wieslander et al., 1995, указано, что Са2+ является каталитическим веществом для разложения глюкозы, и предложено держать Са2+ совместно с ионами Mg2+, Cl- и Na+ отдельно от глюкозы во время тепловой стерилизации.
Как указано выше, авторы настоящего изобретения показали, что, в отличие от предшествующего уровня техники, повышение рН до значения, лежащего в диапазоне от 7,0 до 7,8, предпочтительно - до 7,4±0,2, перед тепловой стерилизацией стабилизирует глюкозу во время процесса тепловой стерилизации, основанной на стерилизации паром, как описано выше, например - с получением F0 в диапазоне от 12 до 15. Также отмечено, что, в отличие от предшествующего уровня техники, авторы настоящего изобретения показали, что суплементация ионов кальция совместно с рН, лежащим в диапазоне от 7,0 до 7,8, предпочтительно - равным 7,4±0,2, синергистически стабилизирует глюкозу во время тепловой стерилизации. Стабилизирующий эффект не обнаруживается, если в раствор добавляют ионы кальция без повышения рН. Как показано в Таблице 2 из Примера 1, два раствора без регулирования рН и без добавления стабильного при тепловой стерилизации органического или биологического буфера, такого как TRIS (то есть LPD и LPD + CaCl2) потеряли почти 13% глюкозы из-за разложения глюкозы во время тепловой стерилизации, тогда как в растворе, забуференном TRIS, в котором рН был доведен до 7,4±0,2 (LPD + TRIS), разложение составило менее 10%, а при дополнительной суплементации ионами кальция (LPD + TRIS + CaCl2) разложение составило менее 9%.
Как описано выше, раствор для консервации и/или перфузии органов по настоящему изобретению предварительно забуферивают до физиологически приемлемого рН и суплементируют низкой концентрацией ионов кальция, что обеспечивает более сходную с плазмой крови электролитную основу раствора. Забуферивание TRIS до физиологически приемлемого рН оказывает глюкозопротекторный эффект во время тепловой стерилизации. Более того, комбинация ионов кальция и физиологически приемлемого рН раствора синергистически дополнительно стабилизирует глюкозу во время тепловой стерилизации.
Выбор буфера
Если более подробно обсудить буферы, то буферы для раствора для консервации и/или перфузии органов по настоящему изобретению, предназначенного для тепловой стерилизации, необходимо тщательно выбирать, поскольку многие буферы, такие ка MOPS (3-[N-морфолино]пропансульфоновая кислота; от англ.: 3-(N-morpholino)propanesulfonic acid) и HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота; от англ.: 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid), могут разлагаться во время тепловой стерилизации. Другим важным фактором при выборе буфера для раствора электролитов, близкого к физиологическому, является риск осаждения при взаимодействии буфера и двухвалентных катионов во время производства и в течение срока хранения продукта. Известно, что бикарбонат и фосфат выпадают в осадок при взаимодействии с ионами кальция и магния, если они присутствуют в концентрациях, превышающих пределы растворимости. TRIS является идеальным буфером для растворов, прошедших тепловую стерилизацию, хотя можно использовать и другие буферы, обладающие теми же двумя свойствами - возможностью тепловой стерилизации и отсутствием образования осадка с двухвалентными катионами. Другим полезным фактором для буфера, используемого в перфузионном и/или консервационном растворе, предназначенном для применения при гипотермии, то есть при температуре, меньшей или равной 25°С или, предпочтительно, меньшей или равной 15°С, является зависимость рН от температуры. Как указано выше, TRIS обеспечивает повышение рН примерно на 0,01 при снижении температуры на один градус Цельсия. Это означает, что раствор можно хранить при немного более низком Н при комнатной температуре, обеспечивая стабильность продукта и не нарушая требуемый приемлемый физиологический рН при более низкой температуре применения.
Концентрация буфера должна быть достаточной для поддержания рН в диапазоне от 6,6 до 7,8 в течение всего срока хранения продукта, но она не должна превышать уровень токсичности для ткани. Для TRIS концентрация в конечном растворе, лежащая в диапазоне от 1 мМ до 15 мМ или, предпочтительно, от 1 мМ до 5 мМ, считается одновременно достаточной и безопасной.
Источник ионов кальция
Источником ионов кальция для раствора для консервации и/или перфузии органов по настоящему изобретению может быть любая растворимая физиологически приемлемая соль, содержащая ион кальция, например - лактат кальция, глюконат кальция или, предпочтительно, хлорид кальция. Концентрация ионов кальция в растворе для консервации и/или перфузии органов должна быть сходной с их концентрацией в плазме крови человека, которая равна примерно 1,5 мМ. Предпочтительной может быть немного более низкая концентрация, так как она снижает риск образования осадка с фосфатными ионами, присутствующими в растворе. Поэтому оптимальная концентрация ионов кальция в растворе лежит в диапазоне от 0,3 мМ до 1,5 мМ.
Вода
Как указано выше, раствор для консервации и/или перфузии органов по настоящему изобретению также содержит воду. Подходящая вода включает воду сверхвысокого качества, например - воду для инъекций.
Способы приготовления растворов для консервации и/или перфузии органов
Как указано выше, настоящее изобретение также обеспечивает способ приготовления раствора для консервации и/или перфузии изолированной ткани или изолированного органа. Способ включает стадию (1) объединения декстрана, глюкозы, ионов кальция, буфера и воды с получением начального раствора. Способ также включает стадию (2) доведения рН начального раствора до значения, лежащего в диапазоне от 7,0 до 7,8 или от 7,2 до 7,6, если это необходимо. Способ также включает стадию (3) обработки начального раствора посредством тепловой стерилизации с получением раствора для консервации и/или перфузии органов.
Способы консервации и/или перфузии изолированной ткани или изолированного органа
Как указано выше, настоящее изобретение также обеспечивает способ консервации и/или перфузии изолированной ткани или изолированного органа.
Способ включает стадию (1) получения объема раствора для консервации и/или перфузии изолированной ткани или изолированного органа из стерильного контейнера, в котором хранился раствор. Способ также включает стадию (2) введения полученного объема раствора в изолированную ткань или изолированный орган, за счет чего обеспечивается консервация и/или перфузия изолированной ткани или изолированного органа. Стерильный контейнер может быть, например, пакетом со стерильной жидкостью, например - пакетом со стерильной жидкостью объемом 1000 мл или пакетом со стерильной жидкостью объемом 3000 мл, или другим контейнером.
В некоторых вариантах осуществления способа получение на стадии (1) включает введение в стерильный контейнер стерильной трубки и обеспечение вытекания объема раствора из стерильного контейнера через стерильную трубку, а введение на стадии (2) включает введение полученного объема раствора из стерильной трубки в изолированную ткань или изолированный орган.
Также в некоторых вариантах осуществления настоящего изобретения введение на стадии (2) осуществляется в условиях гипотермии при температуре, меньшей или равной 25°С. Например, в некоторых вариантах осуществления настоящего изобретения введение на стадии (2) осуществляется в условиях гипотермии при температуре, лежащей в диапазоне от 2°С до 15°С.
Также в некоторых вариантах осуществления настоящего изобретения в полученный объем раствора не добавляют дополнительные ингредиенты во время стадий (1) и (2) или между этими стадиями. Согласно этим вариантам осуществления настоящего изобретения в полученный объем раствора не добавляют дополнительный буфер, кислоту, основание, культуральную среду или другие дополнительные ингредиенты во время стадий (1) и (2) или между этими стадиями. Следует иметь в виду, что согласно этим вариантам осуществления настоящего изобретения раствор получают готовым к употреблению. Также следует иметь в виду, что в других вариантах осуществления настоящего изобретения полученный объем раствора можно подвергнуть дальнейшей суплементации дополнительными ингредиентами в зависимости от условий консервации и/или перфузии.
Также в некоторых вариантах осуществления настоящего изобретения изолированная ткань или изолированный орган включают одно или более из легкого, сердца, печени, почки, поджелудочной железы и/или кишечника. Изолированная ткань или изолированный орган могут быть изолированы от кровотока в полости тела донора или после извлечения из тела донора, или и то, и другое может быть осуществлено последовательно.
Способы промывания, хранения и/или транспортировки изолированного легкого после его удаления у донора в процессе подготовки к последующей трансплантации реципиенту
Как указано выше, настоящее изобретение также обеспечивает способ промывания, хранения и/или транспортировки изолированного легкого после его удаления у донора в процессе подготовки к последующей трансплантации реципиенту.
Способ включает стадию (1) промывания изолированного легкого донора промывочным объемом раствора для консервации и/или перфузии изолированной ткани или изолированного органа. Способ также включает стадию (2) по меньшей мере частичного заполнения стерильного контейнера для хранения органов загрузочным объемом раствора и погружения изолированного легкого в загрузочный объем раствора.
Согласно этому способу раствор для консервации и/или перфузии органов может служить в качестве предварительно забуференного внеклеточного раствора, содержащего Декстран 40 и кальций, который можно использовать для быстрого охлаждения, перфузии и хранения легких для трансплантации. Введение раствора с рекомендованными температурами эффективно охладит орган с целью снижения его метаболических потребностей. Следует использовать асептическую технику.
Также согласно этому способу стадии (1) и (2) можно осуществлять в различном порядке. Например, промывание стадии (1) можно осуществить первым, затем последуют заполнение стадии (2), затем погружение стадии (2). Также, например, можно вначале осуществить заполнение стадии (2), затем промывание стадии (1) и затем погружение стадии (2). Также, например, можно одновременно осуществить промывание стадии (1) и заполнение стадии (2), а затем осуществить погружение стадии (2).
В некоторых вариантах осуществления способа промывание стадии (1) можно вначале осуществить при комнатной температуре, чтобы более тщательно удалить кровь из кровеносных сосудов, а затем осуществить холодное промывание, выполняемое при температуре, лежащей в диапазоне от 2°С до 8°С. Промывание предпочтительно следует провести как антеградно, так и ретроградно. Заполнение согласно стадии (2) предпочтительно выполняют при температуре, лежащей в диапазоне от 2°С до 8°С. Это можно выполнить, например, так, что промывочный объем раствора вначале используют при комнатной температуре, затем при температуре, лежащей в диапазоне от 2°С до 8°С, и загрузочный объем раствора также используют при температуре, лежащей в диапазоне от 2°С до 8°С.
Также в некоторых вариантах осуществления настоящего изобретения промывание стадии (1) приводит к получению эффлюента из изолированного легкого, и его проводят до тех пор, пока эффлюент не станет прозрачным. Например, промывание можно осуществить посредством подачи промывочного объема раствора непрерывным потоком, что приводит к получению эффлюента из изолированного легкого. Также промывание можно производить, например, до тех пор, пока эффлюент не будет иметь такую же степень прозрачности, что и эталонный объем раствора для консервации и/или перфузии органов, который не был использован для промывания.
Также в некоторых вариантах осуществления настоящего изобретения промывочный объем раствора соответствует от 50 до 75 мл раствора на кг массы тела донора и/или от 3 л до 8 л раствора, хотя в других вариантах осуществления настоящего изобретения промывочный объем может больше или меньше указанных объемов.
Также в некоторых вариантах осуществления настоящего изобретения способ дополнительно включает стадии (3) герметичного закрытия стерильного контейнера для хранения органов с находящимся в нем изолированным легким стерильной крышкой и стадию (4) хранения стерильного контейнера для хранения органов при температуре, лежащей в диапазоне от 2°С до 8°С, в течение периода времени до 12 часов, в зависимости от исходного качества легкого, перед трансплантацией изолированного легкого реципиенту, причем стадии (3) и (4) осуществляют после стадий (1) и (2).
Согласно этим вариантам осуществления настоящего изобретения хранение на стадии (4) можно осуществить, например, посредством помещения герметично закрытого стерильного контейнера для хранения органов в хорошо изолированную коробку или транспортировочный ящик при температуре, лежащей в диапазоне от 2°С до 8°С. В этих примерах можно использовать лед для обкладывания со всех сторон стерильного контейнера для хранения органов, но следует обеспечить, чтобы лед не вступал в прямой контакт с изолированным легким.
Также согласно этим вариантам осуществления настоящего изобретения изолированное легкое можно хранить, в зависимости от его исходного качества, в течение периода, лежащего в диапазоне от 1 часа до 12 часов, от 3 часов до 12 часов, от 6 часов до 12 часов, от 9 часов до 12 часов, от 10 часов до 12 часов или от 11 часов до 12 часов, перед трансплантацией изолированного легкого реципиенту. Также согласно этим вариантам осуществления настоящего изобретения во время такого хранения изолированного легкого изолированное легкое можно транспортировать к реципиенту, например - транспортировать в пределах медицинского учреждения, например - больницы или центра трансплантации органов, или из одного медицинского учреждения в другое.
Также в некоторых вариантах осуществления настоящего изобретения промывочный объем раствора получают из одного или более стерильных контейнеров, в которых хранился раствор. Один или более стерильных контейнеров могут быть стерильными контейнерами, описанными выше, например - одним или более стерильными мешками объемом 1000 мл и/или одним или более стерильными мешками объемом 3000 мл, и т.п. Согласно этим вариантам осуществления настоящего изобретения в промывочный объем раствора не добавляют дополнительные ингредиенты перед стадией (1) или во время стадии (1).
Также в некоторых вариантах осуществления настоящего изобретения промывочный объем раствора получают из одного или более стерильных контейнеров, в которых хранился раствор. Один или более стерильных контейнеров могут быть стерильными контейнерами, описанными выше, например - одним или более стерильными мешками объемом 1000 мл и/или одним или более стерильными мешками объемом 3000 мл, и т.п. Согласно этим вариантам осуществления настоящего изобретения в промывочный объем раствора не добавляют дополнительные ингредиенты перед стадией (2) или во время стадии (2).
Также в некоторых вариантах осуществления настоящего изобретения в раствор для консервации и/или перфузии органов не добавляют дополнительные ингредиенты перед любой стадией или во время любой стадии способа. Следует иметь в виду, что согласно этим вариантам осуществления настоящего изобретения раствор получают готовым к употреблению. Также следует иметь в виду, что в других вариантах осуществления настоящего изобретения в некоторые объемы раствора можно добавить дополнительные ингредиенты в зависимости от условий промывания, хранения и/или транспортировки.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1
Приготовили четыре раствора для испытания согласно Таблице 1.
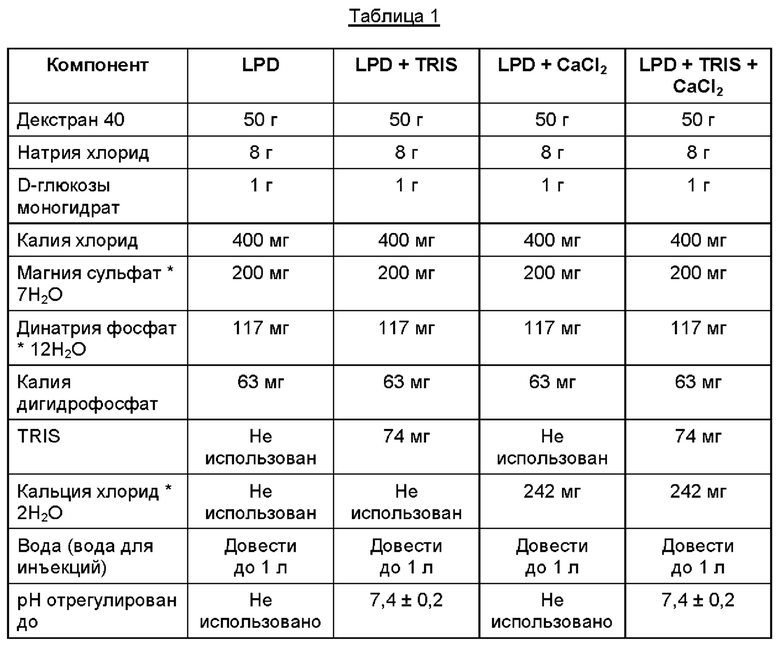
Все четыре раствора одновременно автокпавировали при 121°С в течение 20 минут, что соответствовало F0, равному 15.
Разложение глюкозы в каждом растворе после тепловой стерилизации измерили с использованием анализа ВЭЖХ-ОРИ на глюкозу согласно Фармакопее США для декстрана 40 в растворах глюкозы для инъекций. Результаты представлены в Таблице 2.
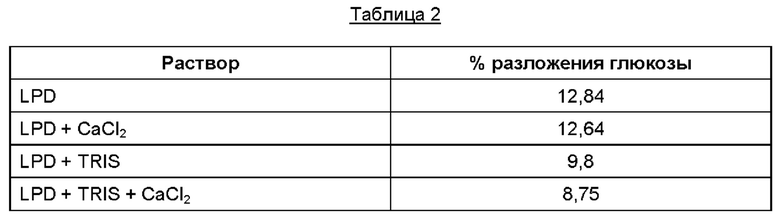
Ионы кальция сами по себе не оказывали на глюкозу стабилизирующего действия, как это происходило при предварительном забуферивании. Однако сочетание ионов кальция и предварительного забуферивания обеспечивало синергистический эффектпо стабилизации глюкозы.
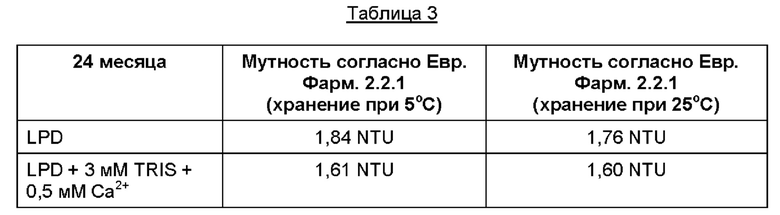
Образование осадка также измерили в двух растворах. В Таблице 3 приведены турбидиметрические данные после хранения 24 месяцев при двух различных температурах для LPD и LPD + кальций + TRIS. Измерение мутности выполнили с использованием способа из Европейской Фармакопеи, 2.2.1 Прозрачность и степень опалесцентности жидкости, причем мутность выражали в единицах нефелометрической мутности (здесь и далее NTU, от англ.: nephelometric turbidity units).
Ссылки
1. Heat sterilization of fluids for peritoneal dialysis gives rise to aldehydes. Nilsson-Thorell CB1, Muscalu N, Andren AH, Kjellstrand PT, Wieslander AP. Perit Dial Int. 1993; 13(3):208-13.
2. Heat sterilization of glucose-containing fluids for peritoneal dialysis: biological consequences of chemical alterations. Wieslander AP, Kjellstrand PT, Rippel B. Perit Dial Int. 1995; 15(7Suppl): S52-9; discussion S59-60.
3. Can we prevent the degradation of glucose in peritoneal dialysis solutions? Ledebo I, Wieslander A, Kjellstrand P. Perit Dial Int. 2000; 20 Suppl 2:S48-51.
4. Importance of calcium in long-term preservation of the vasculature. Ingemansson R, Sjoberg T, Steen S. Ann Thorac Surg. 1996 Apr; 61 (4):1158-62.
| название | год | авторы | номер документа |
|---|---|---|---|
| Раствор для предтрансплантационной подготовки донорских легких | 2023 |
|
RU2815501C1 |
| РАСТВОР ДЛЯ КОНСЕРВАЦИИ ОРГАНОВ | 2024 |
|
RU2840731C1 |
| СПОСОБ КОНСЕРВАЦИИ ЯИЧНИКОВ | 2023 |
|
RU2822518C1 |
| РАСТВОР КРОВЕЗАМЕНИТЕЛЯ НА ВОДНОЙ ОСНОВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2142282C1 |
| СПОСОБ КОНСЕРВАЦИИ ОРГАНОВ | 2006 |
|
RU2440131C2 |
| РАСТВОР И СПОСОБ ДЛЯ ОЖИВЛЕНИЯ И ВОССТАНОВЛЕНИЯ ИШЕМИЧЕСКИ ПОВРЕЖДЕННОЙ ТКАНИ | 1997 |
|
RU2199310C2 |
| СПОСОБ УСКОРЕННОЙ ДЕЦЕЛЛЮЛЯРИЗАЦИИ БИОЛОГИЧЕСКОЙ ТКАНИ ИЛИ ОРГАНА | 2019 |
|
RU2714327C1 |
| КОМПОЗИЦИЯ ДЛЯ КОНСЕРВАЦИИ И ХРАНЕНИЯ ОРГАНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИМПЛАНТАЦИИ ПАЦИЕНТУ | 1988 |
|
RU2019965C1 |
| УДАЛЕНИЕ И ВОССТАНОВЛЕНИЕ СОДЕРЖАНИЯ КЛЕТОК В ОРГАНАХ И ТКАНЯХ | 2012 |
|
RU2635478C9 |
| РАСТВОРЫ ДЛЯ ТРАНСПЛАНТАТОВ ОРГАНОВ И СПОСОБ ТРАНСПЛАНТАЦИИ ОРГАНА | 1995 |
|
RU2161405C2 |
Изобретение относится к области биотехнологии, а именно к раствору для консервации изолированной ткани или изолированного органа, приготовлению указанного раствора, консервации изолированной ткани или изолированного органа, к способу промывания, хранения и/или транспортировки изолированного легкого после его удаления у донора в процессе подготовки к последующей трансплантации реципиенту. Способ включает объединение декстрана, глюкозы, ионов кальция, буфера и воды с получением начального раствора. Затем осуществляют доведение рН начального раствора до значения, лежащего в диапазоне от 7,2 до 7,6, если это необходимо. Далее проводят тепловую стерилизацию начального раствора с получением раствора для консервации изолированной ткани или изолированного органа. Полученный раствор используется для консервации, а также промывания, хранения и/или транспортировки изолированного органа или ткани путем введения указанного раствора в изолированную ткань или изолированный орган. Изобретение позволяет поддерживать более высокую концентрацию глюкозы в растворе и снизить образование потенциально токсичных продуктов разложения за счет предварительного забуферивания и предварительной суплементации кальцием перед тепловой стерилизацией, что обеспечивает защиту глюкозы во время тепловой стерилизации. 4 н. и 11 з.п. ф-лы, 3 табл., 1 пр.
1. Раствор для консервации изолированной ткани или изолированного органа, который содержит декстран, глюкозу, ионы кальция, буфер и воду, причем раствор имеет рН, лежащий в диапазоне от 6,6 до 7,8, и является стерильным вследствие того, что он был подвергнут тепловой стерилизации, причем все компоненты присутствовали в нем до тепловой стерилизации, и причем буфер содержит трис(гидроксиметил)аминометан (TRIS), который присутствует в растворе в концентрации, лежащей в диапазоне от 1 мМ до 15 мМ.
2. Раствор по п. 1, отличающийся тем, что декстран имеет среднемассовую молекулярную массу (Mw), лежащую в диапазоне от 20000 дальтон до 70000 дальтон.
3. Раствор по п. 2, отличающийся тем, что декстран содержит Декстран 40.
4. Раствор по любому из пп. 1-3, отличающийся тем, что декстран присутствует в растворе в концентрации, лежащей в диапазоне от 40 г/л до 60 г/л.
5. Раствор по любому из пп. 1-4, отличающийся тем, что глюкоза присутствует в растворе в концентрации, лежащей в диапазоне от 0,5 г/л до 5 г/л, перед тепловой стерилизацией.
6. Раствор по любому из пп. 1-5, отличающийся тем, что ионы кальция присутствуют в растворе в концентрации, лежащей в диапазоне от 0,3 мМ до 1,5 мМ.
7. Раствор по п. 1, отличающийся тем, что органический или биологический буфер содержит трис(гидроксиметил)аминометан (TRIS) в концентрации, лежащей в диапазоне от 1 мМ до 5 мМ.
8. Раствор по любому из пп. 1-7, отличающийся тем, что раствор дополнительно содержит фосфатные ионы в концентрации, лежащей в диапазоне от 0,2 мМ до 0,8 мМ.
9. Способ приготовления раствора для консервации изолированной ткани или изолированного органа по любому из пп. 1-8, включающий стадии: (1) объединения декстрана, глюкозы, ионов кальция, буфера и воды с получением начального раствора; (2) доведения рН начального раствора до значения, лежащего в диапазоне от 7,2 до 7,6, если это необходимо; и (3) проведения тепловой стерилизации начального раствора с получением раствора для консервации изолированной ткани или изолированного органа.
10. Способ консервации изолированной ткани или органа, включающий стадию (1) получения объема раствора для консервации изолированной ткани или изолированного органа по любому из пп. 1-8 из стерильного контейнера, в котором хранился раствор; и стадию (2) введения полученного объема раствора в изолированную ткань или изолированный орган, за счет чего обеспечивается консервация изолированной ткани или изолированного органа.
11. Способ по п. 10, отличающийся тем, что получение на стадии (1) включает введение в стерильный контейнер стерильной трубки и обеспечение вытекания объема раствора из стерильного контейнера через стерильную трубку, а введение на стадии (2) включает введение полученного объема раствора из стерильной трубки в изолированную ткань или изолированный орган.
12. Способ по п. 10 или 11, отличающийся тем, что введение на стадии (2) осуществляют в условиях гипотермии при температуре, меньшей или равной 25°C, причем предпочтительно введение на стадии (2) осуществляют в условиях гипотермии при температуре, лежащей в диапазоне от 2°C до 15°C.
13. Способ по любому из пп. 10-12, отличающийся тем, что в полученный объем раствора не добавляют дополнительные ингредиенты во время стадий (1) и (2) или между этими стадиями.
14. Способ по любому из пп. 10-13, отличающийся тем, что изолированная ткань или изолированный орган включает одно или более из легкого, сердца, печени, почки, поджелудочной железы и/или кишечника.
15. Способ промывания, хранения и/или транспортировки изолированного легкого после его удаления у донора в процессе подготовки к последующей трансплантации реципиенту, который включает стадии: (1) промывания изолированного легкого донора промывочным объемом раствора для консервации изолированной ткани или изолированного органа по любому из пп. 1-8 и (2) по меньшей мере частичного заполнения стерильного контейнера для хранения органов загрузочным объемом раствора и погружения изолированного легкого в загрузочный объем раствора.
| WO9722244 А1, 26.06.1997 | |||
| US5654266 А, 05.08.1997 | |||
| КОМПОЗИЦИЯ ДЛЯ КОНСЕРВАЦИИ И ХРАНЕНИЯ ОРГАНА, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИМПЛАНТАЦИИ ПАЦИЕНТУ | 1988 |
|
RU2019965C1 |
Авторы
Даты
2020-11-25—Публикация
2017-01-17—Подача