Настоящее изобретение относится к молекулярной биологии и медицине, а конкретно, к ДНК-полимеразе Pol eta человека и способу применения ДНК-аптамеров для ингибирования активности Pol eta. ДНК-аптамеры настоящего изобретения могут иметь биологическое и терапевтическое применение. ДНК-аптамеры могут быть использованы в качестве ингибитора Pol eta человека, средства связывания и детекции Pol eta в научных исследованиях, а также ингибирования активности в клетках человека с целью повышения эффективности препаратов химиотерапии.
Действие большинства химиотерапевтических препаратов основано на блокировании репликации быстро делящихся опухолевых клеток с помощью повреждения ДНК. Механизмы удаления повреждений ДНК в ходе репарации и механизмы, обеспечивающие толерантность клеток к повреждениям ДНК, снижают терапевтический эффект химиотерапии. К механизмам толерантности к повреждениям ДНК относится транслезионный синтез (или «синтез через поврежденные участки»). У человека насчитывается не менее десятка транслезионных ДНКП, каждая из которых специализируется на репликации определенных типов повреждений ДНК.
В последние годы началась разработка ингибиторов транслезионных ДНК-полимераз человека. К настоящему моменту получены ингибиторы на основе низкомолекулярных соединений для Pol eta [Zafar MK. et al. Biochemistry 2018, 57:1262-1273] и Rev1 [Sail V. et al, ACS Chem Biol 2017, 12:1903-1912]. Созданы ингибиторы на основе рибозимов и РНК-аптамеров к Revl [Dumstorf С.А. et al, Mol. Cancer Res. 2009, 7:247-254], ДНК-полимеразе бета [Gening L.. et al, Nucleic Acids Res 2006, 34:2579-2586] и ДНК-полимеразе йота [Lakhin A.V. et al, Nucleic Acid Ther. 2012, 22:49-57].
Одной из наиболее перспективных мишеней для разработки эффективных ингибиторов репликации в опухолевых клетках является Pol eta, которая относится к Y-семейству ДНКП. Pol eta эффективно и безошибочно ведет синтез ДНК напротив Т-Т циклобутановых димеров, защищая организм от вредного воздействия УФ-излучения. Мутации Pol eta у человека приводят к развитию варианта пигментной ксеродермы (XP-V фенотип), которая сопровождается чувствительностью клеток кожи к УФ, высокой частотой мутагенеза и рака кожи [Masutani С. et al, EMBO J. 2000, 19:3100-3109]. Pol eta осуществляет эффективный синтез через цисплатиновые GpG аддукты, вызванные распространенными химиотерапевтическими препаратами цисплатином и оксалиплатином [Vaisman A. et al, Biochemistry 2000, 39:4575-4580; Ouzon-Shubeita H. et al, Biochem J. 2019, 476:747-758]. Дефекты активности Pol eta в опухолевых клетках пациентов с XP-V обуславливают высокую чувствительность клеток к цисплатину. Это определяет высокую эффективность химиотерапии для этой группы пациентов и делает цисплатин препаратом выбора [Albertella M.R. et al., 2005, Cancer Res 65: 9799-9806]. Pol eta вызывает цисплати-новую резистентность клеток опухолей яичников [Srivastava А.K. et al, Proc. Natl. Acad. Sci USA. 2015, 112:4411-4416], легких и мочевого пузыря [Zhang J. et al., Cancer Res. 2019, 79:3714-3724]. Pol eta также повышает устойчивость опухолевых клеток к препаратам цитарабину и гемцитарабину [Chen, Y.W. et al, Mol. Cancer Res. 2006, 4:257-265; Rechkoblit O. et al., Sci. Rep. 2018, 8:12702]. Таким образом, Pol eta является новой мишенью для создания лекарственных средств борьбы с резистентностью к препаратам химиотерапии.
Одним из новых подходов к разработке ингибиторов ДНК-полимераз является создание аптамеров. В предлагаемом изобретении задача ингибирования Pol eta решается путем применения ДНК-аптамеров. Проведенный патентный поиск не выявил источников информации о применении аптамеров в качестве ингибиторов Pol eta человека.
Специфичные взаимодействия между белками и нуклеиновыми кислотами лежат в основе многих клеточных биохимических процессов. Большое комбинаторное разнообразие нуклеиновых кислот и их способность формировать самые разные вторичные и третичные структуры делают возможным направленный поиск последовательностей нуклеиновых кислот, которые обладают способностью взаимодействовать с определенными белками. Такие небольшие олигонуклеотидные молекулы нуклеиновых кислот, образующие прочные комплексы с определенными молекулами-мишенями, были названы аптамерами. Аптамеры к белкам часто связываются в функционально важных участках молекулы и являются ингибиторами активности белков-мишеней. Аптамеры могут содержать одноцепочечные, двухцепочечные или трехцепочечные области.
Аптамеры получают методом систематической эволюции лигандов экспоненциальным обогащением (SELEX - «Systematic Evolution of Ligands by Exponential Enrichment))) с помощью селекции из больших библиотек случайных последовательностей (комбинаторные ДНК и РНК-библиотеки), используя их способность специфически связываться с соответствующими иммобилизованными белками-лагандами. В результате нескольких раундов отбора аптамеров к иммобилизованной на аффинной смоле белка-мишени происходит постепенное обогащение библиотеки случайных последовательностей нуклеиновых кислот последовательностями, которые обладают высоким сродством. После идентификации аптамер можно получить или синтезировать по любому известному методу, включая химические методы синтеза и ферментативные методы синтеза
По своей специфичности и высокой аффинности аптамеры, как правило, не уступают антителам, а по ряду показателей обладают преимуществом перед антителами. Аптамеры обладают низкой иммуногенностью и токсичностью, лучшей способностью проникать через биологические мембраны. Аптамеры, специфически распознающие определенные типы рецепторов, могут проникать через гематоэнцефалический барьер [Monaco I. et al, J. Med. Chem. 2017, 60:4510-4516] и могут служить в качестве средств доставки терапевтических прапаратов. Важным преимуществом является доступность химического или ферментативного синтеза аптамеров в больших количествах и простота химической модификации нуклеиновых кислот.
На основе аптамеров разрабатывается новые препараты для лечения разных заболеваний. Некоторые лекарства на основе РНК- и ДНК-аптамеров находятся на стадии клинических испытаний или поступили на фармацевтический рынок. Аптамеры-ингибиторы были получены к некоторым РНК- и ДНК-полимеразам: РНК-полимеразе вируса гриппа [Yuan S. et. al., Antimicrob. Agents Chemother. 2015, 59:4082-4093], РНК-полимеразе энтеровируса везикулярного стоматита [Forrest S. et. al., J. Gen. Virol. 2014, 95:2649-2657], обратной транскриптазе вируса иммунодефицита человека [Shiang Nanoscale 2013, 5:2756-2764], ДНК-полимеразам бета [Gening L. et al, Nucleic Acids Res 2006, 34:2579-2586] и йота [Lakhin A.V. et al, Nucleic Acid Ther. 2012, 22:49-57] человека. Основным механизмом ингибирования биохимической активности РНК-полимераз и ДНК-полимераз аптамерами является их связывание с активным центром фермента и конкуренция аптамеров за связывание с дезоксирибонуклеотидтрифосфатами. Константы диссоциации комплексов аптамеров с белками, как правило, лежат в области нано- и пикомолярных значений.
При разработке настоящего изобретения в качестве белка-мишени использовали полноразмерную рекомбинантную Pol eta человека с аффинным GST-тагом, иммобилизованную на смоле с глутатион-сефарозой. Индивидуальные аптамеры были отобраны из комбинаторной одноцепочечной ДНК-библиотеки длиной 75 нуклеотидов, содержащей центральный рандомизированный участок, окруженный участками связывания праймеров (GGGAGCTCAGAATAAACGCTCAA и TTCGACATGAGGCCCGGATC), которые необходимы для амплификации библиотеки при проведении отбора. Одноцепочечную библиотеку ДНК инкубировали с Pol eta и не связавшиеся с белком-мишенью олигонуклеотиды смывали с аффинной смолы (перед связыванием с иммобилизованным ферментом смесь аптамеров предварительно инкубировали с пустым сорбентом, чтобы исключить отбор молекул, взаимодействующих с ним). Связанные с белком-мишенью молекулы ДНК элюировали и амплифицировали в ходе ПЦР. Амплифицированная двухцепочечная ДНК была затем использована для получения обогащенной библиотеки однонитевых олигонуклеотидов. Процедура отбора была проведена 12 раз.
Настоящее изобретение обеспечивают аптамеры, обладающие способностью специфически связываться с Pol eta и ингибировать ДНК-полимеразную активность фермента. "Специфичность связывания" аптамера к его мишени означает, что аптамер связывается со своей мишенью с намного более высокой степенью аффинности, чем когда он связывается с другими, нецелевыми, компонентами в смеси или образце.
ДНК-аптамеры настоящего изобретения содержат центральный район с уникальной нуклеотидной последовательностью и 5'- и 3'-концевые последовательности. Центральная уникальная часть содержит мотив G-квадруплекса, представляющий собой последовательность ДНК с четырмя повторами гуанинов и способную образовывать структуру из четырех цепей, удерживаемую G-G-парными взаимодействиями. Такие структуры отличаются высокой стабильностью в растворе.
Длина и состав аптамеров настоящего изобретения не ограничены. Уникальная центральная часть может быть использована как часть большей молекулы ДНК. ДНК-аптамеры могут содержать дополнительные вариативные районы, фланкирующие центральный район, где n представляет собой любое количество нуклеотидов приблизительно от 1 до 10, выбранных из а, с, t, g и не оказывающих неблагоприятного воздействия на свойства аптамера. 5'- и 3'-концевые последовательности могут быть модифицированы. Модификации могут быть направлены на защиту 5'- и 3'-концов от действия экзонуклеаз и включать ненуклеозидные линкеры, инвертированный dT, метиленовую групп между 4' и 2' положениями дезоксирибозы (закрытая ДНК), включать флуоресцентные вещества, радиоактивные изотопы, биотин и пептиды. Изобретение охватывает все модификации и эквиваленты, которые могут быть включены в настоящее изобретение согласно его формуле.
Настоящее изобретение и вариант его реализации иллюстрируется приведенным ниже примером. Доказательством достижимости технического результата в примере служит ингибирование полимеризации ДНК Pol eta in vitro с помощью ДНК-аптамеров.
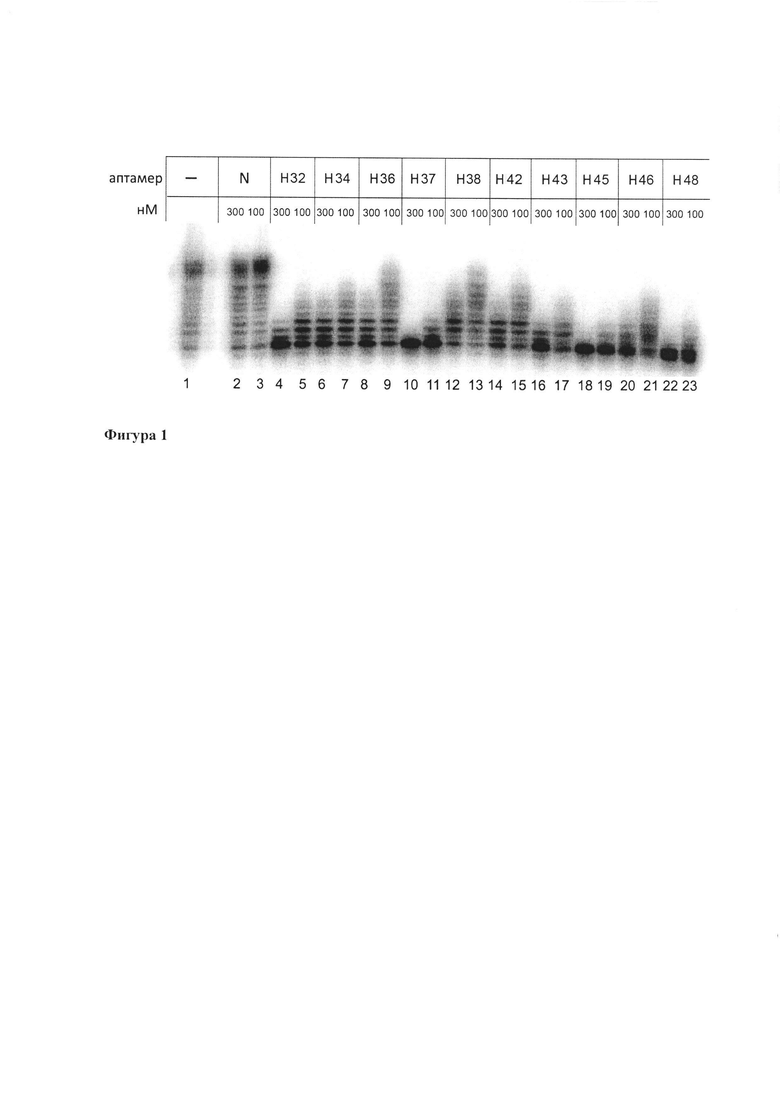
Пример демонстрирует ингибирование ДНК-полимеразной активности Pol eta (фигура 1). Одноцепочечный ДНК-аптамер или исходную библиотеку в концентрации 3 мкМ отжигали в буфере, содержащем 100 мМ NaCl, 50 мМ KCl, 30 мМ Хепес рН 7,4, 1 мМ ДТТ, нагреванием до 90°С и охлаждением до 24°С в течение 10 мин. Аптамер и контрольную библиотеку в концентрации 300 нМ или 100 нМ инкубировали с Pol eta человека в концентрации 100 нМ и олигонуклеотидным ДНК-субстратом с матричной ДНК длиной 30 нуклеотидов и 5'-32Р-меченым праймером длиной 16 нуклеотидов в концентрации 30 нМ в буфере, содержащем 30 мМ Хепес рН 7,4, 8% глицерин, 10 мМ MgCl2, 1 мМ ДТТ, 100 мкг/мл БСА, при 22°С в течение 5 мин. Добавляли смесь дезоксирибонуклеотидтрифосфатов в концентрации 50 мкМ и инкубировали при 37°С 10 мин. Синтез ДНК останавливали на льду добавлением равного объема смеси формамида с 40 мМ ЭДТА и красителем бромфеноловым синим. 32Р-меченые продукты синтеза ДНК разделяли в денатурирующем 23% полиакриламидном геле и детектировали с помощью радиографии. Сокращение длины синтезируемых молекул ДНК при инкубировании Pol eta с ДНК-аптамерами, но не библиотекой свидетельствует об падении ДНК-полимеразной активности Pol eta. Наибольшей ингибирующей способностью обладали аптамеры Н37 (описывается формулой 1), Н45 (описывается формулой 2) и Н48 (описывается формулой 3).
Приведенные примеры не ограничивают других возможных вариантов реализации настоящего изобретения. Аптамеры настоящего изобретения могут обладать ингибиторной активностью и против молекул Pol eta, полученных из других видов млекопитающих. ДНК-аптамеры могут служить средством для связывания и детекции Pol eta человека. ДНК-аптамер может использоваться для создания аффинного хроматографического сорбента и очистки Pol eta с помощью данного сорбента. ДНК-аптамер может служить реактивом для детекции и оценки количества Pol eta в биологических образцах. Способность аптамера связываться с белком-мишенью с высокой специфичностью и высокой аффинностью может облегчить детекцию белка-мишени в исследуемом образце, позволяя определить отсутствие, присутствие и концентрацию молекул Pol eta. Таким образцом может быть любой материал, полученный от организма, в том числе культуры клеток, клеточные экстракты культур клеток и тканей, срезы тканей. Мечение ДНК-атамеров флуоресцентыми красителями или радиоактивными изотопами позволит повысить чувствительность способа детекции и/или сократить время анализа.
Стабилизированные ДНК-аптамеры со сходной нуклеотидной последовательностью и структурными мотивами центрального района могут быть использованы для ингибирования активности Pol eta в клетках человека с целью повышения эффективности препаратов химиотерапии. Доставка ДНК-аптамера в клетки может быть осуществлена с помощью известных методик трансфекции и доставки нуклеиновых кислот или с помощью слияния с аптамером, который служит средством доставки (химера из двух аптамеров).
Фигура 1 показывает ингибирование ДНК-полимеразной активности Pol eta человека ДНК-аптамерами in vitro. К 100 нМ Pol eta добавляли 100 или 300 нМ аптамера (дорожки 4-23) В качестве контролей добавляли исходную библиотеку (N, дорожки 2,3) или не добавляли ни ДНК-аптамеры, ни библиотеку (дорожка 1).
--->
Нуклеотидные последовательности
<110> Institute of Molecular Genetics of Russian Academy of Sciences
<120> DNA aptamers to human DNA polymerase Pol eta
<160> 3
<210> 1
<211> 72
<212> DNA
<213> Artificial Sequence
<220>
<221> misc_feature
<222> 24
<223> Designed DNA aptamer to human Pol eta
<400> 1
gggagctcag aataaacgct caanggggct ggtttggtta ttcggcagtt gnttcgacat 60 gaggcccgga tc 72
<210> 2
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<221> misc_feature
<222> 24
<223> Designed DNA aptamer to human Pol eta
<400> 1
gggagctcag aataaacgct caanagggat aaggggtggg gatagcggan ttcgacatga 60 ggcccggatc 70
<210> 3
<211> 61
<212> DNA
<213> Artificial Sequence
<220>
<221> misc_feature
<222> 24
<223> Designed DNA aptamer to human Pol eta
<400> 1
gggagctcag aataaacgct caantggagg agggtgggga nttcgacatg aggcccggat 60
c 61
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ДНК-аптамеры к праймазе и ДНК-полимеразе PrimPol человека | 2020 |
|
RU2770691C2 |
| ДНК-АПТАМЕР, ОБЛАДАЮЩИЙ ВЫСОКИМ СРОДСТВОМ К БЕЛКУ ИНТЕРЛЕЙКИН-6 | 2023 |
|
RU2814541C2 |
| СПОСОБ СОЗДАНИЯ И СЕЛЕКЦИИ БИБЛИОТЕКИ МОДИФИЦИРОВАННЫХ АПТАМЕРОВ | 2016 |
|
RU2652952C1 |
| ДНК-аптамер, связывающий внеклеточный домен EGFR | 2018 |
|
RU2700097C1 |
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ | 2018 |
|
RU2703799C1 |
| АНТИКОАГУЛЯНТ ПРЯМОГО ДЕЙСТВИЯ НА ОСНОВЕ МОДУЛЬНОГО БИВАЛЕНТНОГО ДНК АПТАМЕРА, СЕЛЕКТИВНОГО К ТРОМБИНУ | 2016 |
|
RU2631829C1 |
| Способ определения субстратной эффективности производных трифосфатов дезоксиуридина для ДНК-полимераз методом реакции достраивания праймера | 2019 |
|
RU2731739C1 |
| АПТАМЕРНЫЕ ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА, ПРИМЕНИМЫЕ ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ РАССТРОЙСТВ | 2006 |
|
RU2406507C2 |
Изобретение относится к области биотехнологии, а именно к ДНК-аптамерам к ДНК-полимеразе эта (Pol eta) человека и способу применения ДНК-аптамеров для ингибирования активности Pol eta. Аптамеры являются нуклеиновыми кислотами, которые проявляют высокую аффинность к веществу-мишени, и ингибиторами активности биологических молекул. Изобретение позволяет ингибировать ДНК-полимеразиой активности Pol eta, что достигается взаимодействием ДНК-аптамеров с молекулой Pol eta. 1 ил.
ДНК-аптамер, предназначенный для специфического связывания с Pol eta человека и ингибирования его ДНК-полимеразной активности, имеющий нуклеотидную последовательность, выбранную из группы, состоящей из:
п. 1. ДНК-аптамер формулы 1
gggagctcag aataaacgct caanggggct ggtttggtta ttcggcagtt gnttcgacat 60
gaggcccgga tc 72
п. 2. ДНК-аптамер формулы 2
gggagctcag aataaacgct caanagggat aaggggtggg gatagcggan ttcgacatga 60
ggcccggatc 70
п. 3. ДНК-аптамер формулы 3
gggagctcag aataaacgct caantggagg agggtgggga nttcgacatg aggcccggat 60
с 61
где n представляет собой любое количество нуклеотидов от 1 до 10, выбранных из а, с, t, g, которые могут быть дополнительно введены в аптамер.
| ЛАХИН А.В., и др | |||
| Влияние MN (II) на ошибочную активность ДНК-полимеразы Йота в экстрактах нормальных и опухолевых клеток человека, Молекулярная генетика, Микробиология и вирусология, N1, 2013, с.14-20 | |||
| Albertella, et al | |||
| A role for polymerase η in the cellulartolerance to cisplatin-induced damage, Cancer Res, 2005, 65,9799-9806 | |||
| ZAFAR, M.K | |||
| et |
Авторы
Даты
2020-11-26—Публикация
2020-01-13—Подача