Область техники, к которой относится изобретение
Настоящее изобретение относится к области молекулярной биологии, органической химии, биотехнологии, микробиологии и медицины и обеспечивает определение субстратной свойств производных 2`-дезоксиуридин-5`-трифосфатов и матричнозависимых ДНК-полимераз, предназначенных для получения высокоэффективных модифицированных ДНК-аптамеров методом SELEX.
Сущность изобретения заключается в сочетании методов реакции достраивания праймера (Primer Extension, РЕХ) на гомонуклеотидной матрице состоящей из 20 аденинов с фланкирующей частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог, а также электрофоретического контроля высокого разрешения с оценкой длин продуктов РЕХ. Сочетание этих методов позволяет определять относительную, количественную субстратную эффективность производных трифосфатов дезоксиуридина для матричнозависимыми ДНК-полимеразами, ранжировать по параметру эффективности производные трифосфатов дезоксиуридина для различных ДНК-полимераз.
Предлагаемое изобретение может быть использовано при получении модифицированных фрагментов ДНК и модифицированных ДНК-аптамеров методом SELEX, функциональных аналогов, миметиков, белковых моноклональных антител.
Уровень техники, к которой относится изобретение
Модификация нуклеиновых кислот с сохранением способности взаимодействовать с комплементарными молекулами ДНК, РНК привела к расширению области применения таких нуклеиновых кислот. Модифицированные нуклеиновые кислоты нашли применение в молекулярной диагностике, терапии, в сенсорных системах и датчиках. Модицикации подвергаются концы НК, сахаро-рибозный фрагмент, фосфоэфирный мостик, связывающий сахаро-рибозные фрагменты нуклеотидов, нуклеиновыне основания. Поиск способов модификации нуклеиновых кислот, поиск модификаций, которые не нарушают способности НК к комплементарным взаимодействиям и позволяют амплифицировать такие НК является одним из направлений биотехнологического развития промышленно-развитых стран.
Введение индикаторной метки в ДНК-зонд позволяет увеличить чувствительность и точность регистрации взаимодействия этого зонда с анализируемым субстратом. Введение индикаторной метки позволило разработать ряд диагностических тест-систем, использующих ДНК-биосенсоры или ДНК-биочипы. ДНК-биочипы, в англоязычной литературе microarray, позволяют проводить массовые анализы биологических образцов ДНК с одновременным анализом сотен и даже тысяч исследуемых параметров (транслокации, точечные нуклеотидные замены (SNPs), выявление возбудителей бактериальных и вирусных заболеваний и т.п.). Такой индикаторной меткой может быть радиоактивный изотоп (Detection of specific sequences in nucleic acids, US patent, 4883750, - 1989, Applied biosystems, США), биотин (Langer P.R. Enzymatic synthesis of biotin-labeled polynucleotides: novel nucleic acid affinity probes / P.R. Langer, A.A. Waldrop, D.C. Ward // Proc Nati Acad Sci USA. - 1981. - V. 78. - № 11. - P. 6633 - 6637), флуоресцентный краситель (Биочип для определения мутаций в гене галактоза-1-фосфат-уридил трансферазы, вызывающих поражение печени у новорожденных детей, RU патент, - 2009139324, - 2009, Учреждение Российской академии наук Институт молекулярной биологии им. В.А. Энгельгардта РАН, Федеральное агентство по науке и инновациям, Россия) и др.
Нуклеиновые кислоты определенного строения могут взаимодействовать с молекулярными мишенями белковой природы (Ellington A.D., Szostak J.W. In vitro selection of RNA molecules that bind specific ligands. // Nature - 1990. - V. 346. - P. 818-822.
Tuerk C, Gold L (1990) Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. // Science - 1990. V. - 249. P. - 505-510).
Одноцепочечные фрагменты нуклеиновых кислот, имеющие аффинное сродство к молекулярной мишени, получили название аптамеры. Аптамеры на основе нуклеиновых кислот, по сути, являются функциональными синтетическиими аналогами белковых антител. Аптамеры получают путем отбора фрагментов нуклеиновых кислот по признаку их аффинного сродства к мишени.
Методология заключается в повторяющихся циклах взаимодействия вырожденной комбинаторной библиотеки олигонуклеотидов (библиотека олигонуклеотидов со случайными нуклеотидными последовательностями) с молекулярной мишенью и стадиях ферментативной амплификации методом ПЦР той части ДНК-библиотеки, которая связалась с мишенью. Циклы селекции многократно повторяют.
Используя метод селекции in vitro SELEX (систематическая эволюция лигандов путем экспоненциального обогащения), можно выделить высокоспецифичные аптамеры для большинства белков. Связывание происходит путем образования водородных связей, электростатических и ван-дер-ваальсовых взаимодействий нуклеиновых оснований и определенных пространственных форм белковой глобулы.
Недостатком аптамеров на основе природных нуклеотидов является ограниченное разнообразие функциональных групп, входящих в состав ДНК. В белках имееется 21 функциональная группа, в ДНК 4 функциональные группы. Аптамеры на основе природных нуклеотидов часто имеют высокие константы диссоциации со своими мишенями, что является недостатком.
Для увеличения липофильного (гидрофобного) взаимодействия аптамеров с мишенью в их структуру вводят липофильные заместители, чаще всего в 5-положение пиримидинового основания нуклеотидов.
Получают такие аптамеры, сомамеры, путем выбора из библиотек олигонуклеотидов, у которых один из природных нуклеотидов полностью заменен на модифицированный (Expanding the chemistry of DNA for in vitro selection. / Vaught J.D., Bock C., Carter J., Fitzwater T, Otis M, et al. // J. Am. Chem. Soc. - 2010. V. - 132. P. - 4141-4151; Aptamer-based multiplexed proteomic technology for biomarker discovery. / Gold L., Ayers D., Bertino J., et al. // PLoS One. - 2010. V.- 5. № - 12. e15004)
Авторами публикации (The joys of in vitro selection: chemically dressing oligonucleotides to satiate protein targets / B.E. Eaton // Curr. Opin. Chem. Biol. - 1997. - V. 1. - P. 10 - 16;
Davies D.R., Gelinas A.D., Zhang C., Rohloff J.C., et al. Unique motifs and hydrophobic interactions shape the binding of modified DNA ligands to protein targets. // Proc. Nath. Acad. Sci. - 2012. V. - 109. No - 49. P. - 19971-1997) для получения модифицированных аптамеров предложены карбоксамидные производные дезоксиуридинтрифосфата. Для получения аптамеров на основе карбоксамидных производных дезоксиуридина разработана специальная модифицированная процедура SELEX. С природной ДНК-библиотеки методом реакции удлинения праймера (primer extension, РЕХ) получали комплементарные копии одноцепочечных модифицированных ДНК, которые затем использовали для взаимодействия с мишенью. Реакция удлинения праймера (primer extension, РЕХ) менее чувствительна к изменениям в структуре нуклеотидов чем ПЦР. С той части одноцепочечных модифицированных ДНК, которые связались с мишенью, получают комплементарные копии природных ДНК. Копии природных ДНК затем амплифицируют в ПЦР и получают частично обогащенную природную ДНК-библиотеку, которую используют на последующем цикле селекции. Циклы селекции многократно повторяют.
При этом модифицированные нуклеотиды по-разному воспринимаются ДНК-полимеразами различного происхождения.
В ведущих научных лабораториях промышленно-развитых стран ведутся интенсивные исследования по поиску структур модифицированных нуклеотидов, которые бы воспринимались ДНК-полимеразами и поиск ДНК-полимераз, которые совместимы с модифицированными нуклеотидами. Поиску способов определения субстратной совместимости модифицированных нуклеотидов и ДНК-полимераз уделяется значительное внимание.
Авторами патентной заявки (Cytidine-5-carboxamide modified nucleotide compositions and methods related thereto, WO патентная заявка, - 077292, - 2015, Somalogic Inc, США) для получения аптамеров предложен ряд модифицированных дезоксицитидинтрифосфатов с не встречающимися в природных биомолекулах функциональными группами, присоединенными через карбоксамидный линкер. Совместимость предложенных производных дезоксицитидина с ДНК-полимеразами в ПЦР авторами не указывается.
В патентной завявке (Compositions and methods for detecting microorganisms, WO патентная заявка, - 126769, - 2015, Somalogic Inc, США) ряд модифицированных нуклеотидов, предназначенных для получения аптамеров, существенно расширен. Наряду с производными дезоксицитидина предложено использовать производные дезоксиуридина. Кроме того, помимо карбоксамидного линкера, предложено использовать линкеры, включающие комбинацию нескольких гетероатомов. Совместимость предложенных производных дезоксиуридина и дезоксицитидина с ДНК-полимеразами в ПЦР авторами не указывается.
Автором публикации (The joys of in vitro selection: chemically dressing oligonucleotides to satiate protein targets / B.E. Eaton // Curr. Opin. Chem. Biol. - 1997. - V. 1. - P. 10 - 16; New uridine derivatives for systematic evolution of RNA ligands by exponential enrichment / T. Dewey, A. Mundt, G. Crouch et al. // J. Am. Chem. Soc. - 1995. - V. 117. - P. 8474 - 8475) предложен ряд модифицированных дезоксиуридинтрифосфатов, содержащих в положении 5 нуклеозида различные функциональные группы. Совместимость предложенных производных дезоксиуридинтрифосфатов с ДНК-полимеразами в ПЦР автором не указывается.
В патенте (Functionalized pyrimidine nucleosides and nucleotides and DNA's incorporating same, US patent, - 1998, - 6175001, The Scripps Research Institute, США) для получения аптамеров предложен ряд модифицированных пиримидиновых нуклеотидов, содержащих в положении 5 функциональные группы, характерные для природных аминокислот.
Авторами публикации (Systematic characterization of 2`-deoxynucleoside-5`-triphosphate analogs as substrates for DNA polymerases by polymerase chain reaction and kinetic studies on enzymatic production of modified DNA / Kuwahara M., J. Nagashima, M. Hasegawa et al // Nucleic Acids Res. - 2006. - V. 34. - P. 5383 - 5394) исследована субстратная совместимость модифицированных по 5-положению трифосфатов 2`-дезоксиуридина и 2`-дезоксицитидина с ДНК-полимеразами Taq, Tth, Vent(exo-), KOD Dash and KOD(exo-) в ПЦР при полной замене природного dTTP на модифицированный аналог. В качестве матрицы использовали коммерческую плазмиду pUC18 и по паре комплементарных праймеров к регионам длиной 110 и 108 пар нуклеотидов. Полноразмерные продукты регистрировали методом электрофореза. Эффективность получения полноразмерных продуктов в ПЦР с модифицированными нуклеотидами сильно различается для ДНК-полимераз. Различия наблюдали и для исследованных регионов, что связано с различиями в последовательности нуклеотидов.
Авторами публикации (Direct PCR amplification of various modified DNAs having amino acids: Convenient preparation of DNA libraries with high-potential activities for in vitro selection. /Kuwahara M., Hanawa K., Ohsawa K. et al // Bioorganic & Medicinal Chemistry. - 2006. - V. 14. - P. 2518 - 2526) расширен ряд модифицированных по С5-положению трифосфатов 2`-дезоксиуридина. В структуру заместителей дополнительно ввели остатки природных аминокислот. Модифицированные нуклеотиды исследовали в качестве субстратов с ДНК-полимеразами Taq, Tth, Vent(exo-), KOD Dash and KOD(exo-) в ПЦР при полной замене природного dTTP на модифицированный аналог.
В публикации (The application of a modified nucleotide in aptamer selection: novel thrombin aptamers containing 5-(1 -pentynyl)-2'-deoxyuridine. / Latham J.A., Johnson R., Toole J.J. // Nucleic Acids Research. - 1994. - V. 22. - P. 2817 - 2822) предложен модифицированный 2`-дезоксиуридин-5`-трифосфат, несущий в 5-положении функциональную пентинильную группу. Соединение оказалось совместимо с доступной Vent (exo-) ДНК-полимеразой в ПЦР. На основе этого модифицированного нуклеотида получен модифицированный ДНК-аптамер к белку тромбину.
Заявляемое изобретение отличается от вышеописанных аналогов тем, что для определения субстратной совместимости модифицированных 2`-дезоксиуридин-5`-трифосфатов с модифицирующими группами по 5-положению пиримидинового основания и ДНК-полимераз использовали сочетание методов: реакции достраивания праймера (Primer Extension) на гомонуклеотидной матрице состоящей из 20 аденинов с фланкирующей (праймерной) частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог, а также метода электрофоретического разделения высокого разрешения с оценкой длин продуктов реакции достраивания праймера. Сочетание этих методов позволяет определять субстратную эффективность производных трифосфатов дезоксиуридина для матрично-зависимых ДНК-полимераз, ранжировать по параметру эффективности производные трифосфатов дезоксиуридина для различных ДНК-полимераз.
Заявляемое изобретение позволяет определить степень совместимости ДНК-полимераз и модифицированных трифосфатов дезоксиуридина в зависимости от химической природы модифицирующего заместителя и длины линкера, соединяющего его с пиримидиновым основанием.
Наиболее перспективными областями применения изобретения является использование совместимых производных трифосфатов дезоксиуридина и ДНК-полимераз при получении модифицированых аптамеров, которые по назначению могут применяться для анализа белковых, пептидных и низкомолекулярных биологически-активных молекулярных мишеней, в том числе в датчиках и сенсорных устройствах, а также в качестве терапевтических средств. Модифицированные аптамеры, в отличие от антител, устойчивы к протеазам, что открывает новые возможности их применения, недостижимые для антител.
Раскрытие изобретения
В заявляемом изобретении для определения субстратной эффективности производных трифосфатов дезоксиуридина с ДНК-полимеразами использовали сочетание методов:
- реакции достраивания праймера (Primer Extension) на синтетической гомонуклеотидной матрице, состоящей из 20 аденинов с фланкирующей (праймерной) частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог и разных временах проведения реакции (кинетический контроль по дискретным точкам);
- электрофоретического контроля высокого разрешения продуктов реакции достраивания праймера с оценкой длин продуктов.
В заявляемом изобретении использовали синтетические олигонуклеотиды, матрицу М и праймер P: (М): 5`-(A)20-TTG-TCA-CTC-AGA-CCA-ACT-CCC-T-NH2-3`; (Р): 5`-Су3-A-GGG-AGT-TGG-TCT-GAG-TGA-CAA-3`. Матрица M содержит аминогруппу на 3'-конце для блокирования трансферазной активности ДНК-полимераз (Smirnov I. P., Kolganova N. A., Vasiliskov V. A., Chudinov A. V., Timofeev E. N. // Sci Rep. 2017. V. 7. P. 16674. DOI: 10.1038/s41598-017-06136-9). Праймер P маркирован по 5'-концу флуоресцентным красителем Cy3.
В заявляемом изобретении использовали модифицированные 2`-дезоксиуридин-5`-трифосфатов (mod-dUTP), несущие по С5-положению функциональные группы, присоединенные через карбониламиноаллильный линкер, аллильная часть линкера связана с 5-положением пиримидинового основания транс-алкеновой связью (Фиг. 1). Функциональные группы представлены линейными алифатическими: этильной (dU121), пропильной (dU119), бутильной (dU126); пентильной (dU127); разветвленными алифатическими: изо-пропильной (dU104), 2-метилпропильной (dU105), 3-метилбутильной (dU106), 4-метилпентильной (dU120); фенилалкильными: фенилметильной (dU99), 2-фенилэтильной (dU111), 3-фенилпропильной (dU118), (4-оксифенил)метильной (dU122); алкилиндольными: (3-индолил)метильной (dU100), (3-индолил)этильной (dU107), (3-индолил)пропильной (dU110). Модифицированные производные 2`-дезоксиуридин-5`-трифосфатов получены реакцией 5-аминоаллил-2`-дезоксиуридин-5`-трифосфатов с N-оксисукцинимидными производными соответствующих кислот (Чудинов А.В., Киселева Я.Ю., Кузнецова В.Е., Шершов В.Е., Спицын М.А., Гусейнов Т.О., Лапа С.А., Тимофеев Э.Н., Арчаков А.И., Лисица А.В., Радько С.П., Заседателев А.С. 2017. Ферментативный синтез ДНК с высокой степенью модификации. Молекуляр. биология. 51, 534 - 544)
В заявляемом изобретении использовали ДНК-полимеразы с отсутствующей корректирующей 3’-5’- экзонуклеазной активностью, относящиеся к разным семействам - Taq (семейство А), Vent(exo-) и DeepVent (exo-) (семейство В).
В заявляемом изобретении реакцию достраивания праймера проводили в реакционной смеси, содержащей праймер Р, матрицу М, dCTP, dATP, dGTP и dTTP или один из модифицированных dUTP (mod dUTP) (Фиг. 1) и одну из ДНК-полимераз - Taq, Vent(exo-), или Deep Vent (exo-).
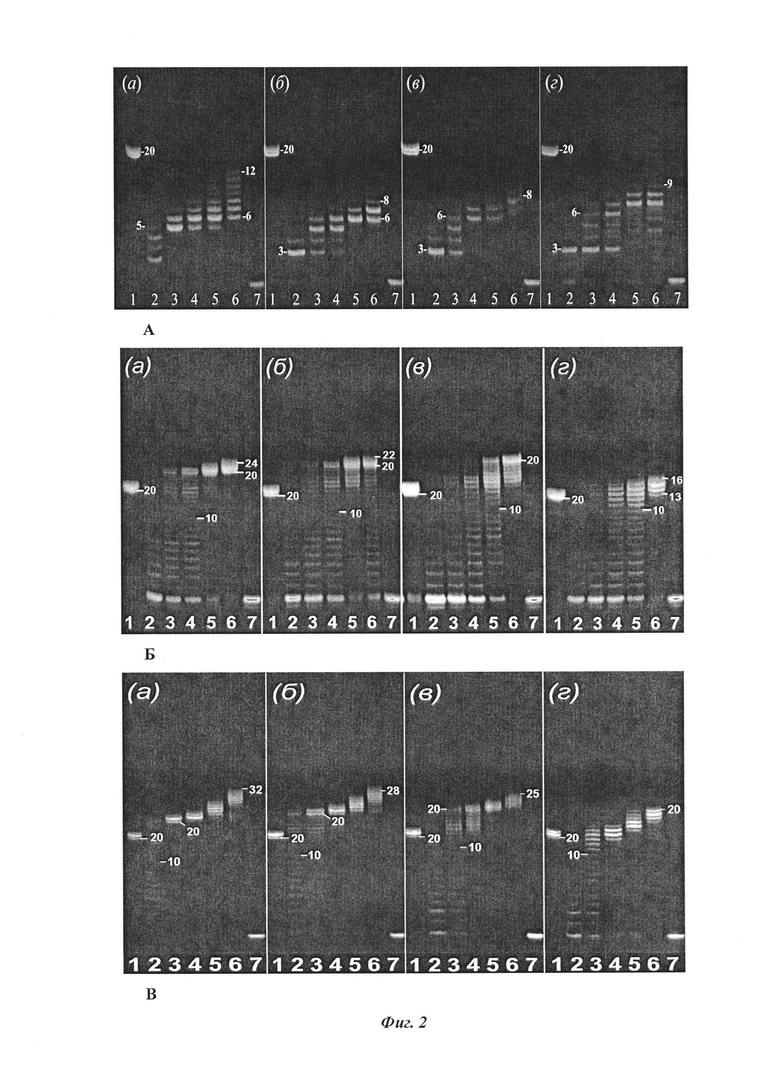
В заявляемом изобретении оценку длин продуктов реакции достраивания праймера проводили методом аналитического электрофореза в 20% полиакриламидном геле в денатурирующих условиях. Визуализацию продуктов реакции осуществляли в свете флуоресценции красителя Cy3, которым был маркирован праймер. Возбуждение флуоресценции при 535 нм и регистрация при 580 нм (Фиг. 2).
Наличие продуктов реакции достраивания праймера определяли по оптической плотности полос в дорожках геля. В качестве критерия субстратной эффективности производных трифосфатов дезоксиуридина с ДНК-полимеразами приняты длины продуктов реакции достраивания праймера, которые образуются за время реакции. Длины продуктов реакции достраивания праймера для модифицированных 2`-дезоксиуридин-5`-трифосфатов определяли по числу шагов полимеразы, при котором интенсивность соответствующей данному шагу полосы на электрофореграмме уменьшается до 50 % от максимальной интенсивности полос в ряду всех шагов, начиная с первого в данной дорожке электрофореза. За нулевой шаг принимали полосу, которую образует праймер. За один шаг принимали разницу между продуктами, отличающимися на один исследуемый нуклеотид, учитывая соседние по вертикали полосы в дорожке. В каждой дорожке производили свою нормировку интенсивности регистрируемых флуоресцентных сигналов, что позволяет уменьшить влияние неравномерности освещенности поля при флуоресцентной регистрации на результат.
Такой критерий позволяет определить предельную длину достроенной комплементарной цепи праймера по уровню сигнала «50%». Длины продуктов реакции достраивания праймера для модифицированных 2`-дезоксиуридин-5`-трифосфатов определенные на основании результатов электрофореза, приведены в Таблице 1.
Из таблицы 1 видно, что эффективность достраивания комплементарного продукта в реакции достраивания праймера на гомополимерной матрице состоящей из 20 аденинов с фланкирующей (праймерной) частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог зависит от типа заместителя и вида ДНК-полимеразы.
В ряду трифосфатов дезоксиуридина, модифицированных по С5-положению азотистого основания фрагментами насыщенных алифатических углеводородов (dU121, dU119, dU126, dU127, dU104, dU105, dU106, dU120) с увеличением длины (и гидрофобности) последних эффективность уменьшается незначительно и для Taq-, и для Vent (exo-)- и для Deep Vent (exo-) полимеразы. В ряду ароматических (dU99, dU111, dU118, dU122) и гетероциклических углеводородов (dU100, dU107, dU110) с увеличением длины линкера соединяющего ароматический и гетероциклический фразмент с пиримидиновым основанием эффективность также уменьшается незначительно.
Существенная разница наблюдается для разных полимераз. По эффективности достраивания комплементарного продукта по гомополимерной матрице полимеразы Vent (exo-)- и Deep Vent (exo-) существенно превосходят Taq-полимеразу.
Полимеразы Vent (exo-)- и Deep Vent (exo-) работают быстрее, чем Taq-полимераза.
Для Vent (exo-)- и Deep Vent (exo-) полимераз при длительном времени реакции достраивания праймера более 30 мин наблюдается образование продуктов с длиной более 20 нуклеотидов, что превышает длину гомополимерной матрицы. Данный эффект может быть объяснен эффектом проскальзывания (slippage) (Shinde D., Lai Y., Sun F., Arnheim N. / Taq DNA polymerase slippage mutation rates measured by PCR and quasi-likelihood analysis (CA/GT)n and (A/T)n microsatellites. // Nucleic Acids research, 2003. Vol 31, No 3, P. 974-980; Sharon F. Edwards, Mario Sirito, Ralf Krahe, Richard R. Sinden. / A Z-DNA sequence reduces slipped-strand structure formation in the myotonic dystrophy type 2 (CCTG) (CAGG) repeat. // Proc. Nat. Acad. Sc., 2009, 106(9), 3270-3275)].
Реакцию достраивания праймера с модифицированными по 5-положению 2`-дезоксиуридин-5`-трифосфатами и с полимеразами Vent (exo-) - и Deep Vent (exo-) не следует проводить более 30 мин.
Краткое описание фигур
Фиг. 1. Химическое строение производных 2`-дезоксиуридин-5`-трифосфатов (mod dUTP), несущих по С5-положению функциональные группы, присоединенные через карбониламиноаллильный линкер.
Фиг. 2. Электрофоретическое разделение продуктов реакции удлинения праймера (primer extension) c нуклеотидами (а) - dU121, (б) - dU119, (в) - dU126, (г) - dU127 при различных интервалах времени реакции, 20% денатурирующий полиакриламидный гель (соотношение акриламид : бисакриламид, 19:1), температура 50 °С, регистрация в диапазоне Cy3. На электрофореграмме сделаны пометки числа достроившихся модифицированных нуклеотидов. Описание дорожек:
А: Taq полимераза. Дорожка 1 - контроль с dTTP, 1 ч; Далее, дорожки 2-7 при полной замене dTTP на соответствующий обозначению в верхнем левом углу каждой фореграммы [(а)- (г)] модифицированный нуклеотид с временем реакции: дорожка 2 - 5 мин; 3 - 30 мин; 4 - 1 ч; 5 - 2 ч; 6 - 4 ч; 7 - контроль, праймер.
Б - В: Б - Vent (exo-)-, В - Deep Vent (exo-) полимераза. Дорожка 1 - контроль с dTTP и Taq полимеразой, 1 ч; Дорожки 2-7 при полной замене dTTP на соответствующий обозначению в верхнем левом углу каждой фореграммы [(а)- (г)] модифицированный нуклеотид с временем реакции: дорожка 2 - 10 сек; 3 - 1 мин; 4 - 5 мин; 5 - 30 мин; 6 - 3 ч; 7 - контроль, праймер.
Таблица 1. Предельная длина достроенной комплементарной цепи праймера, определенная по результатам электрофореза, с матрицей из 20 аденинов, модифицированных 2`-дезоксиуридин-5`-трифосфатов, ДНК-полимераз при различных временах реакции. Концентрация mod dUTP, dCTP, dATP, dGTP 200 pm/mkl.
Осуществление изобретения
Для осуществления изобретения субстратную эффективность производных трифосфатов дезоксиуридина для ДНК-полимераз изучали методом реакции достраивания праймера на гомонуклеотидной матрице состоящей из 20 аденинов с фланкирующей (праймерной) частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог на амплификаторе PTC-220 (Bio-Rad, США).
Использовали Taq-, Vent (exo-)-и DeepVent (exo-) ДНК-полимеразы. В реакционную смесь брали 5 ед. акт. для Taq-, и по 2 ед. акт. для Vent (exo-) и DeepVent (exo-) полимераз.
Реакционная смесь (25 мкл) содержала 200 мкМ каждого из немодифицированных дезоксинуклеозидтрифосфатов dATP, dCTP, dGTP, dTTP или один из mod-dUTPs при полной замене природного dTTP на mod-dUTP. В качестве матрицы использовали синтетический олигонуклеотид составленный из 20 аденинов с фланкирующей (праймерной) частью длиной 22 нуклеотида с аминогруппой на 3'-конце для блокирования трансферазной активности ДНК-полимераз (Smirnov I. P., Kolganova N. A., Vasiliskov V. A., Chudinov A. V., Timofeev E. N. // Sci Rep. 2017. V. 7. P. 16674. DOI: 10.1038/s41598-017-06136-9). Праймер комплиментарный праймерной части матрицы маркирован по 5`-концу флуоресцентным красителем Cy3.
Реакцию достраивания праймера проводили в рекомендованном производителем ДНК-полимераз буфере при температуре 72 °С.
Время элонгации варьировали от 10 сек до 4 ч. Продукты реакции анализировали методом электрофореза высокого разрешения в 20 % полиакриламидном геле (соотношение акриламид : бисакриламид, 19:1) в денатурирующих условиях (7 М мочевина, TBE буфер (89 мМ трис-борат и 2 мМ этилендиаминтетрауксусная кислота, pH 8.3) температура 50 оС). Изображение геля получали в диапазоне флуоресценции красителя Cy3 с возбуждением при 535 нм и регистрацией при 580 нм.
Изображения гелей в диапазоне флуоресцении Cy3 были получены на исследовательском широкопольном анализаторе флуоресцентных изображений, который был оснащен RTE/CCD-1536-K/1 CCD камерой (Roper Scientific, Sarasota, FL, USA), ртутной лампой и парой фильтров 535DF35 и 580DF27 (Omega Optical, Brattleboro, VT, USA), а также компьютером с программой ImaGel Research для количественного обсчета результатов ээлектрофореза.
В качестве количественного критерия оценки субстратной эффективности 2`-дезоксиуридин-5`-трифосфатов для ДНК-полимераз в реакции достраивания праймера при данном времени реакции, было выбрано такое число шагов полимеразы, при котором интенсивность соответствующей данному шагу полосы на электрофореграмме уменьшается до 50 % от максимальной интенсивности полос в ряду всех шагов, начиная с первого в данной дорожке электрофореза. За нулевой шаг принимают полосу, которую образует праймер. За один шаг принимают разницу между продуктами, отличающимися на один исследуемый нуклеотид, учитывая соседние по вертикали полосы в дорожке. В каждой дорожке производится своя нормировка интенсивности регистрируемых флуоресцентных сигналов. Это позволяет уменьшить влияние неравномерности освещенности поля при флуоресцентной регистрации на результат.
Примеры и их применение
Для осуществления изобретения использовали модифицированные трифосфаты дезоксиуридина которые синтезировали по методу, описанному в статье (Чудинов А.В., Киселева Я.Ю., Кузнецова В.Е., Шершов В.Е., Спицын М.А., Гусейнов Т.О., Лапа С.А., Тимофеев Э.Н., Арчаков А.И., Лисица А.В., Радько С.П., Заседателев А.С. 2017. Ферментативный синтез ДНК с высокой степенью модификации. Молекуляр. биология. 51, 534 - 544).
Использовали синтетические олигонуклеотиды, матрицу М и праймер P:
(М): 5`-(A)20-TTG-TCA-CTC-AGA-CCA-ACT-CCC-T-NH2-3`;
(Р): 5`-Су3-A-GGG-AGT-TGG-TCT-GAG-TGA-CAA-3`.
Использовали немодифицированные dNTPs (Thermo Scientific, США), полимеразы Taq (Thermo Scientific), Vent (exo-) (New England Biolabs, США) и DeepVent (exo-) (New England Biolabs, США). Реакцию достраивания праймера проводили в амплификаторе PTC-220 (Bio-Rad, США), Продукты реакции анализировали методом электрофореза высокого разрешения на 20% полиакриламидном геле. Изображение геля получали в диапазоне флуоресценции красителя Cy3.
Использовали полуавтоматические пипетки (Gilson, Франция), амплификатор PTC-220 (Bio-Rad, США), центрифуга-вортекс “Микроспин” FV-2400 (Biosan, Латвия), высокоскоростная центрифуга для микропробирок Frontier5515 (Ohaus, США), система для горизонтального электрофореза (ООО “Хеликон”, Россия), широкопольный анализатор флуоресцентных изображений, оснащенный RTE/CCD-1536-K/1 CCD камерой (Roper Scientific, Sarasota, FL, USA), ртутной лампой и фильтрами 535DF35 и 580DF27 (Omega Optical, Brattleboro, VT, USA), а также компьютером с программой ImaGel Research для количественного обсчета результатов электрофореза. Олигонуклеотиды синтезировали с помощью автоматического синтезатора ABI 394 DNA/RNA (Applied Biosystems, США). Измерение концентрации олигонуклеотидов и ДНК проводили с помощью спектрофотометра для микрообъемов Nano Drop 1000 (Thermo Scientific, США).
Пример 1. Реакцию удлинения праймера (РЕХ) проводили в 25 мкл реакционной смеси содержащей эквимолярную смесь матрицы М, праймера Р 5 мкМ, dU121(или один из dU119, dU126, dU127, dU104, dU105, dU106, dU120, dU99, dU111, dU118, dU122, dU100, dU107, dU110), dATP, dCTP, dGTP каждого по 200 мкМ, Taq ДНК-полимеразу 5 ед.акт., реакционный буфер, поставляемый производителем полимеразы. Реакцию достраивания праймера проводили в амплификаторе ТерЦик (ДНК Технологии, Россия), при 72 °С в течение 5 мин (или одного из интервалов времени 30 мин, 1 час, 2 часа, 4 часа). Изображение геля получали в диапазоне флуоресценции красителя Cy3. Оптическую плотность полос в дорожке геля и количественный обсчет результатов электрофореза проводили с помощью программы ImaGel Research. Предельная длина достроенной комплементарной цепи праймера приведена в Таблице 1. Пример картины изображения гелей для dU121, dU119, dU126 и dU127 представлены на Фиг. 2 А.
Пример 2. Аналогично примеру 1 с заменой Taq ДНК-полимеразы на Vent (exo-)-ДНК полимеразу 2 ед. акт. и реакционный буфер, поставляемый производителем полимераз с проведением реакции в течение 10 сек (или одного из интервалов времени 1 мин, 5 мин, 30 мин, 3 часа). Предельная длина достроенной комплементарной цепи праймера приведена в Таблице 1. Пример картины изображения гелей для dU121, dU119, dU126 и dU127 представлены на Фиг. 2 Б.
Пример 3. Аналогично примеру 1 с заменой Taq ДНК-полимеразы на Deep Vent (exo-)-ДНК полимеразу 2 ед. акт. и реакционный буфер, поставляемый производителем полимераз с проведением реакции в течение 10 сек (или одного из интервалов времени 1 мин, 5 мин, 30 мин, 3 часа). Предельная длина достроенной комплементарной цепи праймера приведена в Таблице 1. Пример картины изображения гелей для dU121, dU119, dU126 и dU127 представлены на Фиг. 2 В.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБСТРАТНОЙ СОВМЕСТИМОСТИ МОДИФИЦИРОВАННЫХ ТРИФОСФАТОВ ДЕЗОКСИУРИДИНА И ДНК-ПОЛИМЕРАЗ СОЧЕТАНИЕМ МЕТОДОВ КОЛИЧЕСТВЕННОЙ ПЦР И ЭЛЕКТРОФОРЕЗА | 2019 |
|
RU2736969C1 |
| Способ ферментативного получения модифицированных ДНК для создания реагентов, специфично связывающихся с гидрофобными участками высокомолекулярных органических соединений | 2017 |
|
RU2699522C2 |
| Способ получения модифицированных комбинаторных ДНК библиотек методом твердофазной реакции удлинения праймера на ПЭТ-микрочастицах | 2018 |
|
RU2734941C2 |
| Способ оценки влияния модифицированных трифосфатов дезоксинуклеозидов на олигонуклеотидный состав комбинаторных ДНК-библиотек для проведения селекции модифицированных аптамеров | 2021 |
|
RU2779058C1 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |
| СПОСОБ АМПЛИФИКАЦИИ НУКЛЕИНОВЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ ФОСФОРИЛГУАНИДИНОВЫХ ОЛИГОНУКЛЕОТИДОВ | 2017 |
|
RU2698134C2 |
| Флуоресцентно-меченые дезоксиуридинтрифосфаты | 2016 |
|
RU2637310C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ХАРАКТЕРИСТИК ПОСЛЕДОВАТЕЛЬНОСТИ МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ ПУТЕМ ОБНАРУЖЕНИЯ И ХАРАКТЕРИСТИКИ ВАРИАЦИЙ ЭТОЙ ПОСЛЕДОВАТЕЛЬНОСТИ | 1998 |
|
RU2264468C2 |
| АНАЛОГИ ПРИРОДНЫХ ДЕЗОКСИРИБОНУКЛЕОЗИДТРИФОСФАТОВ И РИБОНУКЛЕОЗИДТРИФОСФАТОВ, СОДЕРЖАЩИЕ РЕПОРТЁРНЫЕ ФЛУОРЕСЦЕНТНЫЕ ГРУППЫ, ДЛЯ ИСПОЛЬЗОВАНИЯ В АНАЛИТИЧЕСКОЙ БИООРГАНИЧЕСКОЙ ХИМИИ | 2014 |
|
RU2582198C1 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ L-НУКЛЕИНОВЫХ КИСЛОТ | 2013 |
|
RU2704833C2 |

Настоящее изобретение относится к области биотехнологии и обеспечивает определение субстратной совместимости свойств производных 2`-дезоксиуридин-5`-трифосфатов и матричнозависимых ДНК-полимераз. Изобретение может быть использовано при получении модифицированных фрагментов ДНК, а также при получении высокоэффективных модифицированных аптамеров методом SELEX. 8 з.п. ф-лы, 2 ил., 1 табл., 3 пр.
1. Способ определения субстратной совместимости модифицированных 2`-дезоксиуридин-5`-трифосфатов и ДНК-полимераз, отличающийся тем, что используют сочетание методов:
- реакции достраивания праймера (Primer Extension) на гомонуклеотидной матрице, состоящей из 20 аденинов с фланкирующей (праймерной) частью, при полной замене природного 2`-дезокситимидин-5`-трифосфата на модифицированный аналог;
- электрофоретического контроля высокого разрешения с оценкой длин продуктов реакции достраивания праймера.
2. Способ по п. 1, отличающийся тем, что исследуют кинетику реакции достраивания праймера электрофоретическим анализом продуктов при различных временах реакции.
3. Способ по п. 1, отличающийся тем, что модифицированные 2`-дезоксиуридин-5`-трифосфаты содержат в своей структуре функциональные группы, которые присоединены к 5-положению пиримидинового основания карбониламиноаллильным линкером, аллильная часть линкера связана с 5-положением пиримидинового основания транс-алкеновой связью, функциональные группы представлены линейными алифатическими (этильной, пропильной, бутильной, пентильной), разветвленными алифатическими (изо-пропильной, 2-метилпропильной, 3-метилбутильной, 4-метилпентильной), фенилалкильными (метилфенильной, 2-фенилэтильной, 3-фенилпропильной, (4-оксифенил)метильной), алкилиндольными группами (3-индолил)метильной, (3-индолил)этильной, (3-индолил)пропильной).
4. Способ по п. 1, отличающийся тем, что использованы ДНК-полимеразы с отсутствующей корректирующей 3'-5'-экзонуклеазной активностью, относящиеся к разным семействам - Taq (семейство А), Vent(exo-) (семейство Б) и Deep Vent (ехо-) (семейство В).
5. Способ по п. 1, отличающийся тем, что используют синтетические олигонуклеотиды - матрицу М, с аминогруппой на 3'-конце для блокирования трансферазной активности ДНК-полимераз, и праймер Р, маркирований по 5'-концу флуоресцентным красителем Cy3,
(М): 5`-(A)20-TTG-TCA-СТС-AGA-CCA-ACT-CCC-T-NH2-3`;
(Р): 5`-Су3-A-GGG-AGT-TGG-TCT-GAG-TGA-CAA-3`.
6. Способ по п. 1, отличающийся тем, что наличие продуктов реакции достраивания праймера определяли по оптической плотности полос в дорожках геля.
7. Способ по п. 1, отличающийся тем, что в качестве критерия субстратной эффективности производных трифосфатов дезоксиуридина с ДНК-полимеразами приняты длины продуктов реакции достраивания праймера, которые образуются за время реакции.
8. Способ по п. 1, отличающийся тем, что оценку длин продуктов реакции достраивания праймера проводят методом аналитического электрофореза в 20% полиакриламидном геле в денатурирующих условиях.
9. Способ по п. 1, отличающийся тем, что в качестве критерия субстратной эффективности производных трифосфатов дезоксиуридина с ДНК-полимеразами приняты длины продуктов реакции достраивания праймера, которые образуются за время реакции, длины продуктов реакции достраивания праймера для модифицированных 2`-дезоксиуридин-5`-трифосфатов определяли по числу шагов полимеразы, при котором интенсивность соответствующей данному шагу полосы на электрофореграмме уменьшается до 50% от максимальной интенсивности полос в ряду всех шагов, начиная с первого в данной дорожке электрофореза, за нулевой шаг принимали полосу, которую образует праймер, за один шаг принимали разницу между продуктами, отличающимися на один исследуемый нуклеотид, учитывая соседние по вертикали полосы в дорожке, в каждой дорожке производили свою нормировку интенсивности регистрируемых флуоресцентных сигналов, что позволяет уменьшить влияние неравномерности.
| Canard B., Sarfati R | |||
| S | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Раздвижной паровозный золотник с подвижными по его скалке поршнями между упорными шайбами | 1922 |
|
SU148A1 |
| - No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Sakthivel K., Barbas III C | |||
| F | |||
| Expanding the potential of DNA for binding and catalysis: highly functionalized dUTP derivatives that are substrates for thermostable DNA polymerases, Angewandte Chemie International Edition, | |||
Авторы
Даты
2020-09-08—Публикация
2019-12-13—Подача