Изобретение относится к области биотехнологии и медицины, а конкретно к получению нового аптамера, распознающего EGFR, который обладает улучшенным связыванием с мишенью и может использоваться для распознования и визуализации клеток, экспрессирующих EGFR, и таргетной доставки соединений в эти клетки.
Аптамеры (от латинского Aptus - «соответствовать» и греческого Meros - «единица повтора») - короткие синтетические фрагменты нуклеиновых кислот (олигонуклеотиды) со сложной пространственной структурой, которая определяет их уникальные свойства избирательно связываться (как ключ с замком) с любой мишенью: будь то химическое вещество (изотоп, лекарство, токсин и пр.), полимеры (ферменты, рецепторы, факторы роста, регуляторные и структурные белки, иммуноглобулины и пр.), супрамолекулярные комплексы (например, вирусы), целые клетки (болезнетворные бактерии, злокачественные и другие дефектные клетки).
Важные преимущества аптамеров по сравнению с препаратами белковой и пептидной природы - низкая иммуногенность и возможность при развитии осложнений (например, кровотечений) блокировать их активность специфическими антидотами на основе олигонуклеотидов, комплементарных лекарственному аптамеру. Кроме того, возможность химического синтеза аптамеров позволяет добиваться высокой степени чистоты препарата, воспроизводимости партий и масштабируемости производства.
В патенте US 9125930 «EGFR aptamer inhibitor for use in therapy and diagnosis», приоритет от 12.10.2010, описывается способ лечения EGFR опосредованного расстройства путем введения пациенту фармацевтической композиции, содержащей нуклеотидный аптамер, состоящий из последовательности 5' GCCUUAGUAACGUGCUUUGAUGUCGAUUCGACAGGAGGC 3' (SEQ ID NO: 1) и где EGFR опосредованное расстройство явялется гиперпролиферативным заболеванием. Однако, в данном изобретении описывается действие РНК аптамера.
В патентах KR 101680335 В1 «Aptamer against EGFR and anticancer composition containing the same», приоритет от 29.05.2015 и KR101859615 В1 «EGFR-specific DNA aptamer as incubation additives for promotion of mammalian cell growth and uses thereof», приоритет от 17.07.2016 раскрыты аптамеры к EGFR и композиция, содержащие этот аптамер, однако длина последовательностей довольно большая.
В заявке PCT/GB2015/051812 «Aptamers against egfr and therapeutic uses thereof», приоритет от 23.06.2014 также раскрывается аптамер к EGFR, заявитель представляет широкий спектр последовательностей, которые могут служить в качестве терапевтического агента. С другой стороны, в качестве примера приведены последовательности, не имеющие ничего общего с изобретением заявителя.
Все вышеперечисленные документы несмотря на то, что раскрывают аптамеры и композиции к EGFR, имеют существенные отличия и недостатки. Как-то в некоторых речь идет об РНК аптамерах, которые по сути отличаются от ДНК аптамеров как на химическом уровне, так и структурой. Кроме того, большим недостатком РНК аптамеров является их неустойчивость в физиологических жидкостях и существенные затраты при производстве. В других документах раскрываются ДНК аптамеры сложной или более длинной структуры, что в свою очередь влияет на выход при синтезе и в целом делает воспроизводство дорогим.
Таким образом, существует большая потребность в альтернативных, терапевтически эффективных аптамерах, которые способны при значительном снижении затрат и увеличении выхода при синтезе показывать высокое связывание с EGFR, превышающее существующий уровень техники.
Задачей настоящего изобретения является создание высокоэффективного лиганда к EGFR на основе ДНК аптамера. Для последующего практического применения длина аптамера не должна превышать 50 нуклеотидов, что значительно снижает стоимость и повышает выход при синтезе. Результатом при решении поставленной задачи оказался полученный экспериментальным путем аптамер к EGFR, в частности ДНК аптамер GR20, который связывается с внеклеточным доменом белка.
Из наиболее близких прототипов к изобретению можно отнести ДНК аптамеры упоминаемые в статье «Cell-SELEX Aptamer for Highly Specific Radionuclide Molecular Imaging of Glioblastoma In Vivo» [Wu et al, 2014]. Экспериментальные работы над одним из аптамеров показали значительные результаты, превосходящие показатели прототипа.
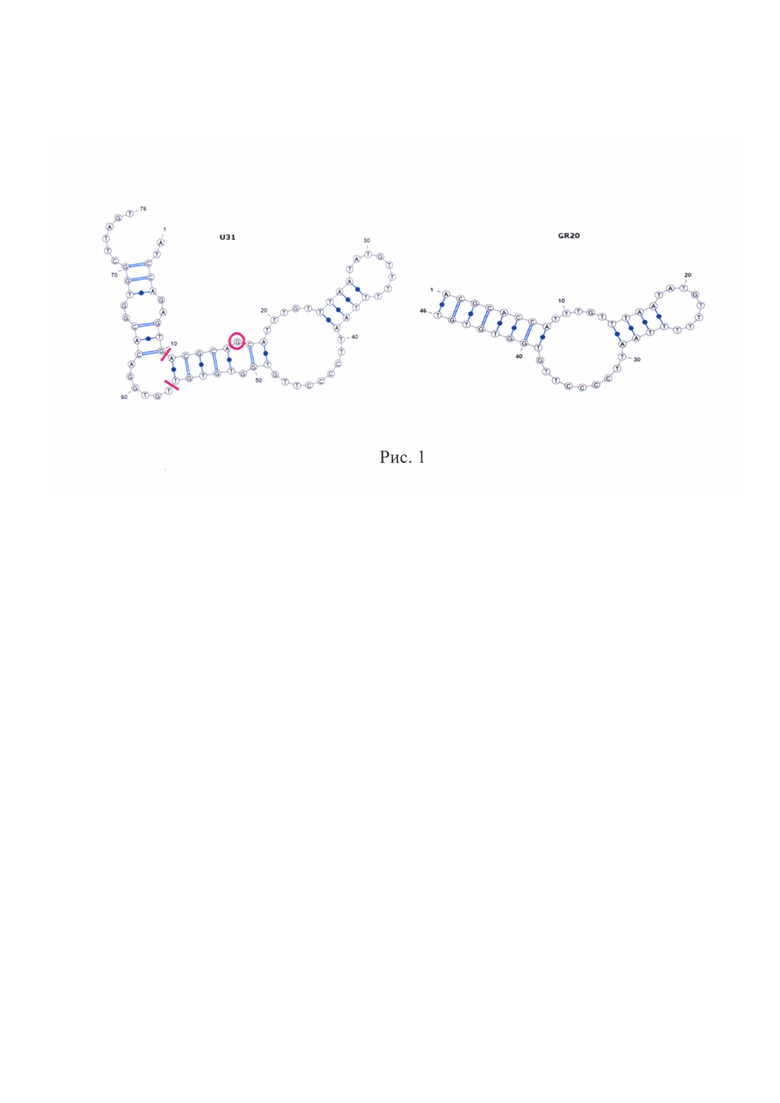
Решение указанной задачи заключается в том, что разработанный ранее аптамерный ДНК олигонуклеотид [Wu et al, 2014], характеризующийся нуклеотидной последовательностью общей формулы ATCCAGAGTGACGCAGCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGTTGTGGACACGGTGGCTTAGT (U31) был укорочен. Вторичные структуры исходного и укороченного аптамеров приведены на Рис. 1. Для получения нового укороченного варианта были обрезаны 5'- и 3'-концевые последовательности 1-10 и 57-76 и был заменен 16G на 16С, что приводит к увеличению дуплекса с 5 до 8 пар нуклеотидов и его стабилизации.
Укороченный аптамер GR20 узнает внеклеточный домен EGFR с аффинностью в три раза больше, чем у исходного аптамера. Удаление незначимых для комплексообразования участков и стабилизация дуплекса привели к улучшенному взаимодействию с белком. Была проведена проверка специфичности аптамера на родственном белке HER2 из этого же семейства ERBB, что и EGFR. Константу диссоциации комплекса с HER2 определить не удалось, однако ее значение более чем 200 нМ.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Исследование связывания с белком.
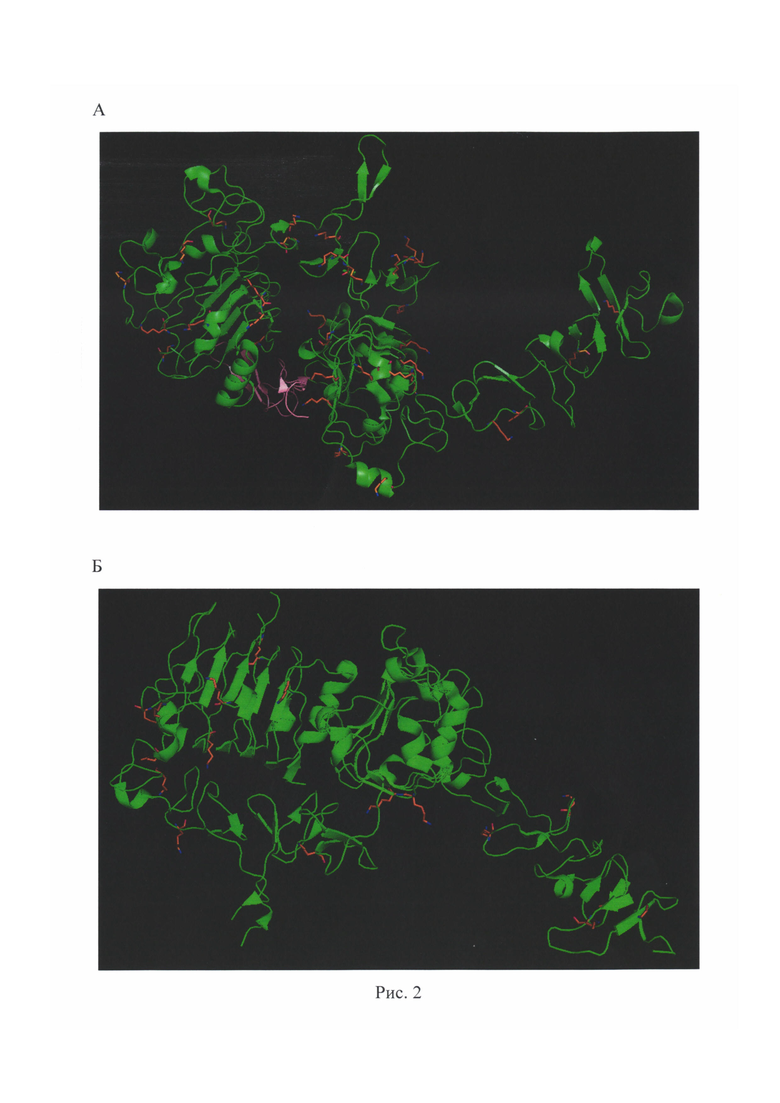
Связывание исходного и укороченного аптамеров к EGFR с рекомбинантным внеклеточным доменом белка изучали методом поверхностного плазмонного резонанса (ППР). Метод ППР основан на изменении оптических свойств поверхности чипа, на которой иммобилизован один из компонентов комплекса (лиганд), при взаимодействии его с другим компонентом комплекса (аналит). В настоящем исследовании в качестве лиганда выступил рекомбинантный белок - рецептор эпидермального фактора роста (EGFR), в качестве аналита - аптамеры к нему. Сигнал от образования комплекса измеряется в условных единицах резонанса (RU), полученные кривые называются сенсограммами. Все исследования методом ППР проводили на приборе ProteOn XPR36 (Bio-Rad Laboratories, Inc.) при температуре 25°С. Рекомбинантный внеклеточный фрагмент белка EGFR (с 25 по 645 аминокислотные остатки) получен от R&D Systems (1095-ER). В качестве отрицательного контроля использовали рекомбинантный внеклеточный домен (с 23 по 652 аминокислотные остатки) аналога EGFR из этого же семейства тирозиновых протеинкиназ ErbB - HER2, полученный от G&P Biosciences (HER2 ECD). На рис. 2 под пунктом «Б» показана структура внеклеточных доменов белков EGFR (Homo sapiens), а именно структура внеклеточной и трансмембранной частей мономерного белка EGFR (зеленый) со связанным EGF (розовый), где оранжевым цветом показаны остатки лизина - ε-аминогруппы из этих остатков могут ковалентно связываться с карбоксильными группами на поверхности чипа. Координаты атомов взяты из PDB ID 3NJP [Lu et al, 2010]. На рис. 2 под пунктом «Б» показана структура внеклеточных доменов НЕР2 (Rattus norvegicus), а именно структура внеклеточной части мономерного белка HER2 (зеленый), где оранжевым цветом показаны остатки лизина - ε-аминогруппы из этих остатков могут ковалентно связываться с карбоксильными группами на поверхности чипа. Координаты атомов взяты из PDB ID 1N8Y [Cho et al, 2003]. Степень сходства внеклеточных доменов белков HER2 человека и крысы составляет 85%, при этом отличие в количестве остатков лизина, необходимых для иммобилизации белков на поверхность чипа, незначительно.
Иммобилизация белка проводилась методом сочетания свободных аминогрупп белка (например, s-аминогрупп остатков лизина) и карбоксильных групп на поверхности чипов GLC или GLM (с низкой или средней плотностью карбоксильных групп на поверхности). Для стадии иммобилизации использовали активирующие и дезактивирующие реагенты из набора ProteOn Amine Coupling Kit (Bio-Rad Laboratories, Inc.).
Свежеприготовленную активирующую смесь 40 мМ гидрохлорида 3-(3-диметиламинопропил)-1-этилкарбодиимида и 10 мМ сульфо-N-гидроксисукцинимида инжектировали со скоростью 30 мкл/мин в течение 300 с. Затем иммобилизовали EGFR и HER2, разведенные в 10 мМ натрий-ацетатном буфере рН 4,6 до концентраций 1 мкг/мл и 11 мкг/мл соответственно, пропуская их растворы со скоростью 25 мкл/мин в течение 60 с.
Оба белка иммобилизовали на разные дорожки чипа до достижения близких значений сигнала в районе 5000 RU. Затем проводили деактивацию несвязавшихся карбоксильных групп чипа при помощи 1 М гидрохлорида этаноламина рН 8,5 (30 мкл/мин 300 с). Сигнал стабилизировали, отмывая нековалентно связавшиеся молекулы белка при помощи последовательного пропускания 10 мМ натрий-ацетатного буфера рН 4,5, натрий-фосфатного буфера (PBS) рН 7,4 и 1 М раствора хлорида натрия (все растворы инжектировали со скоростью 100 мкл/мин в течение 60 с). Все дальнейшие исследования проводили в PBS рН 7,4 (MP Biomedicals, 0928103). Аналит инжектировали со скоростью 100 мкл/мин в течение 120 с, стадия диссоциации длилась 300 с. Для регенерации белка после стадии взаимодействия с аналитом инжектировали последовательно со скоростью 100 мкл/мин 1М раствор хлорида натрия в течение 18 с и PBS в течение 60 с. Для качественной оценки связывания ДНК-аптамеры (Евроген) использовали в качестве аналита в концентрациях 100 нМ, что заведомо превышает KD, но не вызывает неспецифического связывания. Положительный контроль для аптамеров - моноклональные антитела к EGFR: 225 и Н11 (Invitrogen). Отрицательный контроль - аптамер к гемагглютинину вируса гриппа А21 [Jeon S. et al, 2004].
Первичная обработка данных, полученных на приборе, включала в себя удаление артефактов и вычитание сигнала от взаимодействия аптамера с белком HER2. Во всех случаях сигнал от взаимодействия аптамера с отрицательным контролем HER2 был значительно ниже сигнала от взаимодействия с EGFR. Аптамер А21 к гемагглютинину вируса гриппа не связывался ни с EGFR, ни с HER2. B результате качественного анализа известных в литературе аптамеров (оценки Rmax - максимального сигнала от взаимодействия аптамер-белок) была подтверждена действенность выбранной методики исследования. Связывание этих аптамеров с EGFR определено качественно (по Rmax - максимальному сигналу от взаимодействия аптамер-белок). Уменьшение длины аптамера U31 на 30 нуклеотидов по крайней мере не приводит к ухудшению связывания аптамера с EGFR, поскольку Rmax комплекса GR20 с EGFR составляет 12,6±0,5 RU, что не меньше, чем Rmax комплекса U31 с EGFR, равный 6,1±0,3 RU. Рисунок 3 демонстрирует сенсограммы связывания аптамеров U31 и GR20 (100 нМ) с рекомбинантным иммобилизованным белком EGFR. Сигнал от связывания аптамеров с отрицательным контролем (белком HER2) вычтен из сенсограмм.
Пример 2. Определение констант диссоциации.
Для аптамера U31 известна константа диссоциации KD - главная характеристика аффинности комплекса, однако она была получена на культуре клеток, богатых мутантным белком EGFR (U87-EGFRvIII) с использованием метода иммуноферментного анализа [Wu et al, 2014] и равна 8±2 нМ. Для корректного сравнения ранее известного и нового аптамеров мы получили константы диссоциации их комплексов с рекомбинантным внеклеточным фрагментом EGFR методом ППР. Для этого на одном и том же чипе получили сенсограммы для взаимодействия аптамеров в различных концентрациях с белками EGFR и HER2. На рисунке 4 представлены сенсограммы для вычисления KD комплексов аптамеров с белком EGFR. Сигнал от связывания аптамеров с отрицательным контролем (белком HER2) вычтен из сенсограмм. Для количественного определения константы диссоциации использовали следующие концентрации аптамеров: 1000, 100, 30, 3 нМ. Из сигнала от взаимодействия аптамеров с белком EGFR был вычтен сигнал от взаимодействия аптамера с белком HER2.
Каждую сенсограмму обрабатывали вручную при помощи программного обеспечения Origin (OriginLab Corporation) с целью получения данных по кинетике образования комплекса. Комплекс (АБ) аптамера (А) и белка (Б) образуется по следующей реакции:
А+Б↔АБ,
причем константа скорости прямой реакции (ассоциации) - ka, а константа скорости обратной реакции (диссоциации комплекса) kd. Из изменения сигнала на стадии ассоциации (то есть инжекции аналита) можно получить обе эти константы, а из стадии диссоциации (то есть последующего пропускания буфера) - только константу скорости диссоциации. Из соотношения величин этих констант скоростей вычислили равновесную кажущуюся константу диссоциации KD по уравнению:
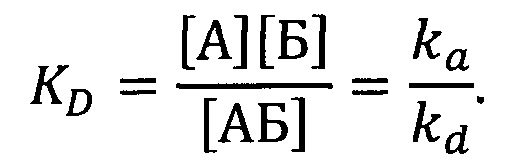
Для аптамера U31 KD составила 23±4 нМ, для GR20 - 6±2 нМ. Таким образом, методом ППР подтверждено, что укороченный аптамер GR20 обладает повышенным сродством к рекомбинантному внеклеточному фрагменту белка EGFR по сравнению с исходным аптамером U31.
Список литературы.
Jeon S. Н., Kayhan В., Ben-Yedidia Т., Arnon R. A DNA aptamer prevents influenza infection by blocking the receptor binding region of the viral hemagglutinin. // J Biol Chem. 2004. V. 279. P. 48410-48419
Wu X, Liang H, Tan Y, Yuan C, Li S, Li X, Li G, Shi Y, Zhang X. Cell-SELEX aptamer for highly specific radionuclide molecular imaging of glioblastoma in vivo. //PLoS One. 2014. V. 9. P. e90752.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДНК-аптамер GR200, узнающий внеклеточный домен EGFR | 2019 |
|
RU2729382C1 |
| Модифицированные ДНК-аптамеры, связывающие внеклеточный домен EGFR | 2019 |
|
RU2723398C1 |
| Модифицированные 50-звенные ДНК-аптамеры, связывающие внеклеточный домен EGFR | 2019 |
|
RU2736790C1 |
| ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ | 2018 |
|
RU2703799C1 |
| СПОСОБ ОТБОРА И ПОЛУЧЕНИЯ СЕЛЕКТИВНЫХ И МУЛЬТИСПЕЦИФИЧЕСКИХ ТЕРАПЕВТИЧЕСКИХ МОЛЕКУЛ С ЗАДАННЫМИ СВОЙСТВАМИ, ВКЛЮЧАЮЩИХ ПО МЕНЬШЕЙ МЕРЕ ДВЕ РАЗЛИЧНЫЕ НАЦЕЛИВАЮЩИЕ ГРУППИРОВКИ, И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2644263C2 |
| СОЕДИНЕНИЯ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ СВЯЗЫВАНИЯ РОСТОВОГО ФАКТОРА ДИФФЕРЕНЦИРОВКИ 11 | 2015 |
|
RU2708170C2 |
| ДНК-АПТАМЕР, ОБЛАДАЮЩИЙ ВЫСОКИМ СРОДСТВОМ К БЕЛКУ ИНТЕРЛЕЙКИН-6 | 2023 |
|
RU2814541C2 |
| ДНК-аптамер, специфично связывающийся с белком Dickkopf-1 человека | 2023 |
|
RU2814580C1 |
| Терапевтическое антитело, специфичное к интерлейкину-11, ингибирующее сигналирование через его рецептор, и способ его использования для лечения пациентов | 2019 |
|
RU2753973C2 |
| Способ термической диссоциации для проведения селекции ДНК-аптамеров | 2019 |
|
RU2723373C1 |

Изобретение относится к области биотехнологии. Описана группа изобретений, включающая аптамерный ДНК олигонуклеотид, специфически связывающийся с EGFR, характеризующийся нуклеотидной последовательностью:
ACGCACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGT, и способ получения вышеуказанного аптамерного ДНК олигонуклеотида. Способ получения ДНК олигонуклеотида заключается в обрезании 5`- и 3`-концевых последовательностей последовательности ATCCAGAGTGACGCAGCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGTTGTGGACACGGTGGCTTAGT и замене 16G на 16С, что приводит к увеличению дуплекса с 5 до 8 пар нуклеотидов и его стабилизации. Предложенное изобретение расширяет арсенал средств для связывания с EGFR. 2 н.п. ф-лы, 4 ил., 2 пр.
1. Аптамерный ДНК олигонуклеотид, специфически связывающийся с EGFR и характеризующийся нуклеотидной последовательностью общей формулы:
ACGCACCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGT.
2. Способ получения аптамерного ДНК олигонуклеотида по п. 1, характеризующийся тем, что от нуклеотидной последовательности общей формулы
ATCCAGAGTGACGCAGCATTTGTTTAATATGTTTTTTAATTCCCCTTGTGGTGTGTTGTGGACACGGTGGCTTAGT обрезаются 5'- и 3'-концевые последовательности 1-10 и 57-76 и заменяется 16G на 16С, что приводит к увеличению дуплекса с 5 до 8 пар нуклеотидов и его стабилизации.
| US 9316647 B2, 19.04.2016 | |||
| WO 2013102096 A1, 04.07.2013 | |||
| Комарова М | |||
| А., Народов А | |||
| А., Замай Т | |||
| Н | |||
| "Перспективы использования аптамеров в диагностике и терапии злокачественых новообразований головного мозга", Сибирское медицинское обозрение, 2015, 6, стр | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Xidong Wu, Huiyu Liang, Yan Tan, Chao Yuan, Shuji Li, Xiaowen Li, Guiping Li, Yusheng Shi, Xingmei Zhang "Cell-SELEX Aptamer for Highly Specific Radionuclide Molecular Imaging of Glioblastoma In Vivo" PLoS One | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2019-09-12—Публикация
2018-12-26—Подача