Перекрестные ссылки на родственные заявки
Настоящее изобретение испрашивает приоритет предварительной заявки США №61/992,717, поданной 13 мая 2014, которая полностью включена в настоящее описание посредством ссылки.
Уровень техники
Отложения нейрофибриллярных клубков (NFTs) являются отличительной чертой различных невропатологии, таких как болезнь Альцгеймера (БА), прогрессирующего супрануклеарного паралича, лобно-височной деменции и паркинсонизма, связанных с хромосомой 17, болезни Пика и деменции боксеров. NFT бляшки состоят из агрегированного гиперфосфорилированного белка tau. Таи представляет собой белок, связанный с цитоскелетом, и участвует в транспорте везикул вдоль микротрубочек в нейронах. При патологических состояниях, белок tau гиперфосфорилирован и образует бета-складчатые агрегаты с фибриллярными бляшками, похожими на Аβ сенильные бляшки. Некоторые нацеленные на белок tau виды терапии имеют целью замедление прогрессирования заболевания путем вмешательства в передачу от клетки к клетке растворимых олигомеров tau, способных заражать соседние клетки с помощью прионного механизма. Альтернативно, tau-ориентированные виды терапии направлены на ингибирование олигомеризации и/или агрегации tau в более крупные фибриллы и клубки (Bulic, В., et al., J. Med. Chem., 2013 56 (11), 4135-55). Такие стратегии предоставляют надежные неинвазивные tau специфические биомаркеры для мониторинга текущей нагрузки tau и прогрессирования заболевания. Таи специфические биомаркеры ПЭТ визуализации обладают потенциалом для мониторинга прогрессирования заболевания, а также обеспечивают прямое считывание tau-целевой эффективности агента и подтверждение его механизма действия в клинических испытаниях (Mathis, С.A.; Klunk, W.Е., Neuron 2013 79 (6), 1035-7; and Jensen, J.R., et al., J. Alzheimer's Disease: JAD 2011 26 Suppl 3, 147-57).
Недавно были обнаружены несколько тау-селективных молекул и радиоактивно-меченых с позитронно активными радионуклидами для ПЭТ-визуализации. Один из них, [18F][A] как сообщалось, связывает tau агрегаты в тканях пациентов с БА с 22 нМ сродством и показал 27-кратную селективность для tau по отношению к Аβ-амилоиду, который образует аналогичным образом структурированные фибриллы. Первичная клиническая оценка [А] продемонстрировала его способность четко различать пациентов с болезнью Альцгеймера и контрольную группу того же возраста. Кроме того, распределение ПЭТ изотопов (трейсеров) у больных с увеличенными баллами MMSE мало отличались от локализации белка tau, описанной с помощью системы по Braak (Braak, Н., et al., Acta Neuropathol 2006 112 (4), 389-404), обнаруженной посмертно в тканях пациентов с соответствующей тяжестью БА. К сожалению, окислительный метаболизм [А] приводит к диссоциации 18F из молекулы и накоплению 18F фторида в минеральных костях. Нежелательное поглощение черепом может потенциально мешать количественной оценке коркового поглощения трейсера. См. Xia, С.F., et al., Alzheimer's Dement. 2013 9 (6), 666-76; Zhang, W., et al., J. Alzheimer's Disease: JAD 2012 31 (3), 601-12; Chien, D.Т., et al., J. Alzheimer's Disease: JAD 2013 34 (2), 457-68; and Chien, D.Т., et al., J. Alzheimer's Disease: JAD 2014 38(1), 171-84.
В настоящее время существует потребность в дополнительных детектируемых соединениях, которые связываются с tau. В частности, необходимы детектируемые соединения с улучшенными свойствами in vivo, такие как улучшенные характеристики метаболизма.
Краткое изложение сущности изобретения
В одном из воплощений настоящее изобретение включает дейтерированное детектируемое соединение, или его соль, которое связывается с белком tau.
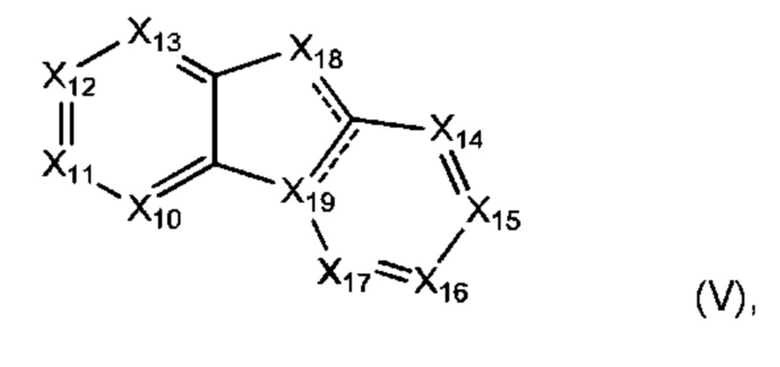
Другой аспект настоящего изобретения включает соединение формулы (I) или формулы (V):

Или его соль, где:
R1 представляет собой фенил, нафтил, 6-членный гетероарил, 9- или 10-членный бициклический гетероциклил, 12-13 членный трициклический карбоциклил, или 12-13 членный трициклический гетероциклил, где R1 возможно замещен одной или более группами Ra, где R1 присоединен к остатку соединения формулы (I) в любом допустимом для синтеза положении;
А отсутствует или представляет собой С1-4алкилен, С3-6циклоалкилен, С2-4алкилен, или С2-4алкилен;
R2 представляет собой 6-, 9- или 10-членный карбоциклил или 5-, 6-, 9- или 10-членный гетероциклил, где указанный карбоциклил и гетероциклил возможно замещен одной или более группами Rb, где R2 присоединен к остатку соединения формулы (I) в любом допустимом для синтеза положении;
каждый Х10-Х17 независимо представляет собой СН или N;
Х18 представляет собой СН, N, О или S; и
Х19 представляет собой СН, С или N;
Каждая  независимо отсутствует или образует двойную связь, при условии, что только одна
независимо отсутствует или образует двойную связь, при условии, что только одна  образует двойную связь;
образует двойную связь;
Каждый Ra независимо выбран из оксо, С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rc, карбоциклила, гетероциклила, галогена, -NO2, -N(Rv)2, -CN, -C(O)-N(Rv)2, -S(O)-N(Rv)2, -S(O)2-N(Rv)2, -O-Rv, -S-Rv, -O-C(O)-Rv, -O-C(O)-O-Rv, -C(O)-Rv, -C(O)-O-Rv, -S(O)-Rv, -S(O)2-Rv, -O-C(O)-N(Rv)2, -N(Rv)-C(O)-ORv, -N(Rv)-C(O)-N(Rv)2, -N(Rv)-C(O)-Rv, -N(Rv)-S(O)-Rv, -N(Rv)-S(O)2-Rv, -N(Rv)-S(O)-N(Rv)2, и -N(Rv)-S(O)2-N(Rv)2, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rc, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -NO2, -N(Rv)2, -CN, -C(O)-N(Rv)2, -S(O)-N(Rv)2, -S(O)2-N(Rv)2, -O-Rv, -S-Rv, -O-C(O)-Rv, -C(O)-Rv, -C(O)-O-Rv, -S(O)-Rv, -S(O)2-Rv, -C(O)-N(Rv)2, -N(Rv)-C(O)-Rv, -N(Rv)-S(O)-Rv, -N(Rv)-S(O)2-Rv, C2-C6 алкенила, Ray, и С1-6алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена;
каждый Rb независимо выбран из оксо, С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, галогена, -NO2, -N(Rw)2, -CN, -C(O)-N(Rw)2, -S(O)-N(Rw)2, -S(O)2-N(Rw)2, -O-Rw, -S-Rw, -O-C(O)-Rw, -O-C(O)-O-Rw, -C(O)-Rw, -C(O)-O-Rw, -S(O)-Rw, -S(O)2-Rw, -O-C(O)-N(Rw)2, -N(Rw)-C(O)-ORw, -N(Rw)-C(O)-N(Rw)2, -N(Rw)-C(O)-Rw, -N(Rw)-S(O)-Rw, -N(Rw)-S(O)2-Rw, -N(Rw)-S(O)-N(Rw)2, и -N(Rw)-S(O)2-N(Rw)2, где каждый из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -NO2, -N(Rw)2, -CN, -C(O)-N(Rw)2, -S(O)-N(Rw)2, -S(O)2-N(Rw)2, -O-Rw, -S-Rw, -O-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -S(O)-Rw, -S(O)2-Rw, -C(O)-N(Rw)2, -N(Rw)-C(O)-Rw, -N(Rw)-S(O)-Rw, -N(Rw)-S(O)2-Rw, C2-C6 алкенила, Ry, и С1-6алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена;
каждый Rc независимо выбран из водорода, галогена, С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из галогена, гидрокси, и C1-6алкокси;
каждый Rd независимо выбран из водорода, галогена, С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из C1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из галогена, гидрокси, и С1-6алкокси;
каждый Rv независимо выбран из водорода, С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, циано, нитро, галогена, -N(Rax)2, -ORax, С2-С6 алкенила, Ray, и С1-С6 алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена; или два Rv, взятые вместе с атомом азота, к которому они присоединены образуют гетероциклил, который возможно замещен одной или более группами, независимо выбранными из оксо, галогена и С1-3алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена;
каждый Rw независимо выбран из водорода, C1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, циано, нитро, галогена, -N(Rx)2, -ORx, С2-С6 алкенила, Ry, и С1-С6 алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена; или два Rw, взятые вместе с атомом азота, к которому они присоединены образуют гетероциклил, который возможно замещен одной или более группами, независимо выбранными из оксо, галогена и С1-3алкила, который возможно замещен одной или более группами, независимо выбранными из оксо и галогена;
каждый Rx независимо выбран из водорода и С1-6алкила;
каждый Rax независимо выбран из водорода и С1-6алкила;
каждый Ry представляет собой арил, который возможно замещен одной или более группами, независимо выбранными из галогена, гидроксила, циано, нитро, амино, -O-S(O)2-Rz, -OSi(Rz)3, и -О-(гетероциклила);
каждый Ray представляет собой арил, который возможно замещен одной или более группами, независимо выбранными из галогена, гидроксил, циано, нитро, амино, -O-S(O)2-Raz, -OSi(Raz)3, и -О-(гетероциклила);
каждый Rz независимо выбран из С1-6алкила и арила;
каждый Raz независимо выбран из С1-6алкила и арила;
каждый m представляет собой 1, 2, 3, 4 или 5; и
каждый n представляет собой 1, 2, 3, 4 или 5;
где соединение формулы (I) и формулы (V) возможно содержит один или более визуализирующих изотопов;
где один или более атомов углерода соединения формулы (I) и формулы (V) является дейтерированным; и
где соединение формулы (V) возможно замещено одной или более группами Ra. В некоторых воплощениях формула (V) является замещенным одной или более группами Ra.
Другой аспект включает фармацевтическую композицию, содержащую дейтерированное соединение, как здесь описано, или его фармацевтически приемлемую соль, и фармацевтически приемлемый растворитель или носитель.
Другой аспект включает способ детекции нейрофибриллярных клубков и/или сенильных бляшек у животных, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения.
Другой аспект включает способ детекции заболевания нервной системы, связанного с амилоидными бляшками и/или агрегацией белка tau у животных, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения, который связан с отложениями амилоида и/или агрегатами белка tau.
Другой аспект включает способ детекции болезни Альцгеймера, связанной с амилоидными бляшками и/или агрегацией белка tau, у животных, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения связанного с отложениями амилоида и/или агрегатами белка tau.
Другой аспект включает способ детекции Болезни Альцгеймера, связанной с агрегированием белка tau, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения связанного с агрегатами белка tau.
Другой аспект включает дейтерированное соединение, как здесь описано, или его фармацевтически приемлемую соль, для применения в медицинской диагностике или лечении.
Другой аспект включает дейтерированное соединение, как здесь описано, или его фармацевтически приемлемую соль, для применения в детекции нейрофибриллярных клубков и/или сенильных бляшек.
Другой аспект включает дейтерированное соединение как здесь описано, или его фармацевтически приемлемую соль, для применения в детекции заболевания нервной системы.
Другой аспект включает дейтерированное соединение как здесь описано, или его фармацевтически приемлемую соль, для применения в детекции болезни Альцгеймера.
Другой аспект включает применение дейтерированного соединения, как здесь описано, или его фармацевтически приемлемой соли, для изготовления лекарственного средства для детекции нейрофибриллярных клубков и/или сенильных бляшек у животных.
Другой аспект включает применение дейтерированного соединения, как здесь описано, или его фармацевтически приемлемой соли, для изготовления лекарственного средства для детекции заболевания нервной системы у животных.
Другой аспект включает применение дейтерированного соединения, как здесь описано, или его фармацевтически приемлемой соли, для изготовления лекарственного средства для детекции болезни Альцгеймера у животных.
Другой аспект включает способ детекции прогрессирующего супрануклеарного паралича, связанного с амилоидными бляшками и/или агрегацией белка tau у животных, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения, связанного с отложениями амилоида и/или агрегатами белка tau.
Другой аспект включает способ детекции прогрессирующего супрануклеарного паралича, связанного с агрегацией белка tau, содержащий введение дейтерированного соединения, содержащего визуализирующий изотоп, как здесь описано, или его фармацевтически приемлемую соль, животному, и измерение радиоактивного сигнала указанного соединения, связанного с агрегатами белка tau.
Краткое описание чертежей
Фиг. 1: Авторадиографическая оценка связывающих свойств [А] и [А]-d2 с использованием тканей мозга человека.
Фиг. 2: In vitro оценка метаболической стабильности соединений [18F][A]-d2 и [18F][A] с использованием микросом печени человека и мыши. Измеряли образование [18F]фторида (2А и 2В) и количество оставшегося родительского соединения (2С и 2D) через 5, 15 и 45 мин.
Фиг. 3: Анализ микросом печени человека и мыши, выполненный с нерадиомеченными соединениями [А] и [A]-d2 показал большую стабильность соединения [A]-d2 и более медленный метаболизм обоих соединений в присутствии микросом печени человека.
Фиг. 4: Преклиническая ПЭТ визуализация у мышей из Примера 6 ниже.
Фиг. 5: РадиоВЭЖХ хроматограмма очищенного соединения [18F][A]-d2.
Фиг. 6: РадиоВЭЖХ хроматограмма очищенного соединения [18F][A].
Фиг. 7A-7F: Оценка in vitro метаболической стабильности соединений [18F][A]-d2 и [18F][A] (n=3) с использованием микросом печени человека, макаки-резус и мыши. Измеряли образование [18F]фторида (7А-7С) и количество оставшегося родительского соединения (7D-7F) через 5, 15 и 45 минут.
Фиг. 8А, 8В: Соединения [18F][A]-d2, [18F][A] или 18F Т807 (370 МБк (10 мКи)) вводили внутривенной болюсной инъекцией анестезированным макакам-резус, и получали данные динамической ПЭТ в течение 240 минут. Измерялись стандартные объемы поглощения ([Радиоактивность]/(введенная доза/масса тела)) в указанных структурах из реконструированных ПЭТ данных. Данные собрали из для же животных, но в разные дни для каждого образца. Соединение [18F][A]-d2 проявило увеличенную стабильность, проявляющуюся посредством снижения поглощения свободного фторида костями черепа.
Фиг. 9: Отношение стандартизированного значения поглощения височной доли [18F][A]-d2 (SUVR) к средней длительности цикла у 3 субъектов: 2 здоровых контролей (НС) и одного пациента с болезнью Альцгеймера (БА).
Фиг.10: Среднее значение [18F][A]-d2 SUVR (серое вещество мозжечка в качестве референсного) для интервала 90-120 мин после введение трейсера. Субъекты 1-2, здоровые контроли (НС). Субъект 3, пациент с БА.
Подробное описание изобретения
Соединения и определения
Определения и термины описаны более детально ниже. Химические элементы идентифицированы в соответствии с периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed.
Если не указано иного, соединения включают энантиомерные, диастереомерные и геометрические (или конформационные) изомерные формы данной структуры. Например, включены R- и S конфигурации для каждого асимметричного центра, Z и Е-изомеры с двойной связью, Z и Е конформационные изомеры, одиночные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси. Если не указано иного, включены все таутомерные формы изображенных здесь структур. Кроме того, если не указано иное, структуры, изображенные здесь, также включают соединения, которые отличаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, включены соединения, где произошла независимая замена или обогащения одного или более атомов водорода дейтерием или тритием, углерода на 13С- или 14С углерод, азот на 15N азот, сера на 33S, 34S или 36S серу, или кислород на 17O или 18O кислород. Также соединения применяются, например, в качестве аналитических инструментов, в качестве зондов в биологических исследованиях, или в качестве терапевтических агентов.
Там, где конкретный энантиомер описан, он может, в некоторых воплощениях, быть в основном свободным от соответствующего энантиомера, и может также упоминаться как "оптически обогащенный". "Оптически обогащенный", как здесь используется, означает, что смесь энантиомеров состоит из значительно большей доли одного энантиомера, и может быть описан энантиомерным избытком (эи %). В некоторых воплощениях, смесь энантиомеров состоит из по меньшей мере приблизительно 90% от массы данного энантиомера (приблизительно 90% эи). В других воплощениях, смесь энантиомеров состоит из, по меньшей мере приблизительно 95%, 98% или 99% от массы данного энантиомера (приблизительно 95%, 98% или 99% эи). Энантиомеры и диастереомеры могут быть выделены из рацемической смеси с помощью любого способа, известного специалистам в данной области техники, в том числе перекристаллизации из растворителей, в которых один стереоизомер более растворим, чем другой, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ), сверхкритической хроматографии (SFC), образования и кристаллизации хиральных солей, которые затем разделяют любым из указанных выше способов, или получение с помощью асимметричного синтеза и, возможно, дополнительно обогащенные. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen, et al., Tetrahedron 33:2725 (1977); Eliel, E.L. Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); Wilen, S.H. Tables of Resolving Agents and Optical Resolutions p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972).
Термин "гетероатом" означает любой атом, независимо выбранный из атома, отличного от атома углерода или водорода, например, один или более кислородов, серы, азота, фосфора или кремния (включая любые окисленные формы азота, серы, фосфора или кремния; и кватернизированные формы любого азота).
Термины "гало" и "галоген", как здесь используется, относятся к атому, выбранному из фтора (фтор, -F), хлора (хлор, -Cl), брома (бромо, -Br) и йода (йод, -I).
Термин "оксо" относится к=O или (=O)2.
Термин "ненасыщенный", как здесь используется, означает, что остаток обладает одним или более участком ненасыщенности.
Термин "карбоцикл", используемый отдельно или как часть более крупного фрагмента, относится к насыщенной, частично ненасыщенной, или ароматической кольцевой системе, имеющей от 3 до 20 атомов углерода. В одном воплощении, карбоциклил включает от 3 до 12 атомов углерода (С3-С12). В другом воплощении, карбоциклил включает С3-С8, С3-С10 или С5-С10. В другом варианте, карбоциклил, в качестве моноцикла, включает С3-С8, С3-С6 или С5-С6. В другом воплощении, карбоциклил, в качестве бицикла, включает С7-С12. В другом воплощении, карбоциклил, как спиро система, включает С5-С12. Примеры моноциклических карбоциклилов включают циклопропил, циклобутил, циклопентил, 1 циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, пердейтериоциклогексил, 1-циклогексен-1-енил, 1-циклогекс- 2-енил, 1-циклогексен-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, фенил, и циклододецилом; бициклические карбоциклилы, имеющие от 7 до 12 атомов в кольце, включают [4,3], [4,4], [4,5], [5,5], [5,6] или [6,6] кольцевые системы, например бицикло [2.2.1] гептанил, бицикло [2.2.2] октанил, нафталенил, и бицикло [3.2.2] нонанил; и спирокарбоциклилы включают спиро [2.2] пентанил, спиро [2,3] гексанил, спиро [2,4] гептанил, спиро [2.5] октанил и спиро [4,5] деканил. Термин карбоциклил включает арильные кольцевые системы, как здесь определено. Термин также включает в себя циклоалкильные кольца (например, насыщенный или частично ненасыщенный моно-, би- или спирокарбоциклы).
Термин "алкил," как здесь используется, относится к линейному или с разветвленной цепочкой моновалентному углеводородному радикалу. В одном воплощении, алкильный радикал состоит из 1-18 атомов углерода (С1-С18). В других воплощениях, алкильный радикал представляет собой С0-С6, С0-С5, С0-С3, С1-С12, С1-С10, C1-C8, С1-С6, C1-C5, С1-С4 или С1-С3. С0 алкил относится к связи. Примеры алкильных групп включают метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (n-Pr, n-пропил, -СН2СН2СН3), 2-пропил (i-Pr, i-пропил, -СН(СН3)2), 1-бутил (n-Bu, n-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (i-Bu, i-бутил, -СН2СН(СН3)2), 2-бутил (s-Bu, s-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (t-Bu, t-бутил, -С(СН3)3), 1-пентил (n-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-СН(СН2СН3)(СН2СН2СН3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-3-пентил (-С(СН3)(СН2СН3)2), 2-метил-3-пентил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-диметил-2-бутил (-СН(СН3)С(СН3)3, гептил, октил, нонил, децил, ундецил и додецил.
Термин "алкенил," как здесь используется, означает линейный или с разветвленной цепью моновалентный углеводородный радикал с по меньшей мере одной двойной связью углерод-углерод. Алкенил включает радикалы, обладающие как "цис", так и "транс" конфигурацией, или альтернативно, "Е" и "Z" конфигурацией. В одном примере, алкенильный радикал состоит из двух -восемнадцати атомов углерода (C2-C18). В других примерах, алкенильный радикал представляет собой C2-C12, С2-С10, С2-С8, С2-С6 или С2-С3. Примеры включают, без ограничения, этенил или винил (-СН=СН2), проп-1-енил (-СН=СНСН3), проп-2-енил (-СН2СН=СН2), 2-метилпроп-1-енил, бут-1-енил, бут-2-енил, бут-3-енил, бута-1,3-диенил, 2-метилбута-1,3-диен, гекс-1-енил, гекс-2-енил, гекс-3-енил, гекс-4-енил и гекса-1,3-диенил.
Термин "алкинил", как здесь используется, означает линейный или с разветвленной цепью моновалентный углеводородный радикал с по меньшей мере одной тройной связью углерод-углерод. В одном примере алкинильный радикал состоит из двух-восемнадцати атомов углерода (С2-С18). В других примерах, алкинильный радикал представляет собой С2-С12, С2-С10, С2-С8, С2-С6 или С2-С3. Примеры включают, без ограничения, этинил (-С≡СН), проп-1-инил (-С≡ССН3), проп-2-инил (пропаргил, -СН2С≡СН), бут-1-инил, бут-2-инил и бут-3-инил.
Термин "алкокси" относится к линейному или разветвленному моновалентному радикалу, представленному формулой -OR, в которой R представляет собой алкил, алкенил, алкинил или карбоциклил. Алкоксигруппы включают метокси, этокси, пропокси, изопропокси и циклопропокси.
Термин "галоалкил" как здесь используется, относится к алкилу, как здесь определено, который замещен одной или более (например, 1, 2, 3 или 4) галогеновыми группами.
Термин "арил", используемый отдельно или как часть более крупного фрагмента, как в "арилалкиле", "арилалкокси", или "арилоксиалкиле", относится к моноциклической, бициклической или трициклическими, углеродной кольцевой системе, которая включает конденсированные кольца, где по меньшей мере одно кольцо в системе является ароматическим. Термин "арил" может быть использован взаимозаменяемо с термином "арильное кольцо". В одном воплощении арил включает в себя группы, содержащие 6-18 атомов углерода. В другом воплощении арил включает в себя группы, содержащие 6-10 атомов углерода. Примеры арильной группы включают фенил, нафтил, антрацил, бифенил, фенантренил, нафтаценил, 1,2,3,4-тетрагидронафталенил, 1Н-инденил, 2,3-дигидро-1Н-инденил, и т.д., который может быть замещенным или независимо замещенным одним или более заместителями, описанными в настоящем документе. Конкретный арил представляет собой фенил. В другом воплощении арил включает арильное кольцо, конденсированное с одним или более карбоциклических колец, такие как инданил, фталимидил, нафтимидил, фенантриидинил, или тетрагидронафтил, и т.д., где радикал или точка присоединения находятся в ароматическом кольце.
Термин "гетероарил", используемый отдельно или как часть более крупного фрагмента, например, "гетероарилалкил", или "гетероарилалкокси", относится к моноциклической, бициклической или трициклической кольцевой системе, содержащей от 5 до 14 атомов в кольце, где по меньшей мере одно кольцо является ароматическим и содержит, по меньшей мере, один гетероатом. В одном воплощении гетероарил включает 4-6-членные моноциклические ароматические группы, где один или более атомов в кольце представляет собой азот, серу или кислород, который необязательно замещен независимо представляет собой. В другом воплощении, гетероарил включает 5-6-членный моноциклический ароматические группы, где один или более атомов в кольце представляет собой азот, серу или кислород, который возможно независимо замещен. В другом воплощении гетероарил включает бициклические или трициклические ароматические группы, где один или несколько кольцевых атомов (например, 1, 2, 3, 4, 5, 6, 7 или 8) представляет собой азот, серу или кислород, который возможно независимо замещен. Примеры гетероарильных групп включают тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, триазинил, тетразинил, тетразоло [1,5-б] пиридазинил, имидазол [1,2-а] пиримидинил, пуринил, бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил, индолил, 1,3-тиазол-2-ил, 1,3,4-триазол-5- ил, 1,3-оксазол-2-ил, 1,3,4-оксадиазол-5-ил, 1,2,4-оксадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 1Н-тетразол-5-ил, 1,2,3-триазол-5-ил, и пирид-2-ила N-оксид. Термины "гетероарил" также включает в себя группы, в которых гетероарил конденсирован с одним или более, арильным, карбоциклильным или гетероциклическим кольцом, где радикал или точка присоединения находится на гетероарильном кольце. Неограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4Н-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил и пиридо [2,3-b] -1,4-оксазин-3 (4Н)-онил. Гетероарильная группа может быть моно-, би- или трициклической.
Как здесь используется, термин "гетероциклил" относится к "карбоциклилу" как здесь определено, где один или более (например, 1, 2, 3 или 4) атомов углерода заменены на гетероатом (например, O, N или S). В некоторых воплощениях, гетероциклил относится к насыщенной кольцевой системы, например, от 3 до 12-членной насыщенной гетероциклической кольцевой системе. В некоторых воплощениях гетероциклил относится к гетероарильной кольцевой системе, такой как от 5 до 14-членной гетероарильной кольцевой системе. Гетероциклил может быть необязательно замещен одним или несколькими заместителями, независимо выбранными из тех, которые определены в данном описании. В одном воплощении гетероциклил включает 5-6-членные моноциклическоие кольцевые группы, где один или более атомов в кольце представляет собой азот, серу или кислород (например, 1, 2, 3 или 4), которые независимо возможно замещены. В другом воплощении, гетероциклил включает бициклические или трициклические группы, где один или несколько кольцевых атомов (например, 1, 2, 3, 4, 5, 6, 7 или 8) представляет собой азот, серу или кислород, которые необязательно независимо замещены.
В одном примере гетероциклил включает 3-12 кольцевых атомов, и включает моноциклические, бициклические, трициклические и спирокольцевые системы, где кольцевые атомы представляют собой углерод, и от одного до пяти атомов в кольце представляют собой гетероатомы, выбранные из азота, серы или кислорода, которые независимо возможно замещены одной или несколькими группами. В одном примере гетероциклил включает от 1 до 4 гетероатомов. В другом примере гетероциклил включает от 3 до 7-членные моноциклы, имеющие один или несколько гетероатомов, выбранных из азота, серы или кислорода. В другом примере гетероциклил включает от 4 до 6-членные моноциклы, имеющие один или несколько гетероатомов, выбранных из азота, серы или кислорода. В другом примере, гетероциклил включает в себя 3-членные моноциклы. В другом примере, гетероциклил включает в себя 4-членные моноциклы. В другом примере, гетероциклил включает 5-6-членные моноциклы. В одном примере гетероциклильная группа включает 0 до 3 двойных связей. Любой гетероатом азота или серы возможно может быть окислен (например, NO, SO, SO2), и любой гетероатома азота может быть возможно кватернизован (например, [NR4]+Cl-, [NR4]+OH-). Примеры гетероциклилов включают оксиранил, азиридинил, тииранил, азетидинил, оксетанил, тиетанил, 1,2-дитиетанил, 1,3-дитиетанил, пирролидинил, дигидро-1Н-пирролил, дигидрофуранил, тетрагидрофуранил, дигидротиенил, тетрагидротиенил, имидазолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, 1,1-диоксо-тиоморфолинил, дигидропиранил, тетрагидропиранил, гексагидротиопиранил, гексагидропиримидинил, оксазинанил, тиазинанил, тиоксанил, гомопиперазинил, гомопиперидинил, азепанил, оксепанил, тиепанил, оксазепинил, оксазепанил, диазепанил, 1,4-диазепанил, диазепинил, тиазепинил, тиазепанил, тетрагидротиопиранил, оксазолидинил, тиазолидинил, изотиазолидинил, 1,1-диоксоищотиазолидинонил, оксазолидинонил, имидазолидинонил, 4,5,6,7-тетрагидро[2Н]индазолил, тетрагидробензоимидазолил, 4,5,6,7-тетрагидро-бензо[d]имидазолил, 1,6-дигидроимидазол[4,5-d]пирроло[2,3-b]пиридинил, тиазинил, оксазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил, тетрагидропиримидил, 1-пирролинил, 2-пирролинил, 3-пирролинил, индолинил, тиапиранил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, пиразолидинил, дитианил, дитиоланил, пиримидинонил, пиримидиндионил, пиримидин-2,4-дионил, пиперазинонил, пиперазиндионил, пиразолидинилимидазолинил, 3-азабицикло [3.1.0] гексанил, 3,6-диазабицикло [3.1.1] гептанил, 6 азабицикло [3.1.1] гептанил, 3-азабицикло [3.1.1] гептанил, 3 азабицикло [4.1.0] гептанил, азабицикло [2.2.2] гексанил, 2 азабицикло [3.2.1] октанил, 8-азабицикло [3.2.1] октанил, 2 азабицикло [2.2.2] октанил, 8-азабицикло [2.2.2] октанил, 7 оксабицикло [2.2.1] гептан, азаспиро [3.5] нонанил, азаспиро [2,5] октанил, азаспиро [4,5] деканил, 1-азаспиро [4,5] декан-2-онил, азаспиро [5,5] ундеканил, тетрагидроиндолил, октагидроиндолил, тетрагидроизоиндолил, тетрагидроиндазолил, и 1,1-диоксогексагидротиопиранил. Примеры 5-членных гетероциклилов, содержащих атом серы или кислорода и от одного до трех атомов азота, включают тиазолил, тиазол-2-ил и тиазол-2-ила N-оксид, тиадиазолил, в том числе 1,3,4-тиадиазол-5-ил и 1,2,4-тиадиазол-5-ил, оксазолил, например оксазол-2-ил, и оксадиазолил, такой как 1,3,4-оксадиазол-5-и, ил-1,2,4-оксадиазол-5-ил. Примеры 5-членного кольцевого гетероциклила, содержащего от 2 до 4 атомов азота, включают имидазолил, такой как имидазол-2-ил; триазолил, такой как 1,3,4-триазол-5-ил; 1,2,3-триазол-5-ил, 1,2,4-триазол-5-ил, и тетразолил, такой как 1Н-тетразол-5-ил. Примерами бензо-конденсированных 5-членных гетероциклилов являются бензоксазол-2-ил, бензотиазол-2-ил и бензимидазол-2-ил. Примеры 6-членных гетероциклилов содержат от одного до трех атомов азота и возможно атом серы или кислорода, например пиридил, такие как пирид-2-ил, пирид-3-ил, и пирид-4-ил; пиримидил, такие как пиримид-2-ил и пиримид-4-ил; триазинил, такой как 1,3,4-триазин-2-ил и 1,3,5-триазин-4-ил; пиридазинил, в частности пиридазин-3-ил, и пиразинил. Пиридиновые N-оксиды и пиридазиновые N-оксиды и пиридил, пиримид-2-ил, пиримид-4-ил, пиридазинил и 1,3,4-триазин-2-тловые группы являются другими примерами гетероциклильных групп.
Как здесь используется, термин "частично ненасыщенный" относится к кольцевому остатку, который включает по меньшей мере одну двойную или тройную связь между кольцевыми атомами, но при этом кольцевой остаток не является ароматическим.
"Фармацевтически приемлемые соли" включает как кислотно-аддитивные, так и основно-аддитивные соли. Необходимо понимать, что когда соединение или Пример настоящего изобретения показаны в качестве конкретной соли, подразумеваются также соответствующее свободное основание, а также другие соли соответствующего свободного основания (включая фармацевтически приемлемые соли соответствующего свободного основания).
обозначает соли,. Фармацевтически приемлемые соли включают кислотно-аддитивные соли а также основно-аддитивные соли.
"Фармацевтически приемлемая кислотно-аддитивная соль" означает те соли, которые сохраняют биологическую эффективность и свойства свободного основания и которые не являются биологически или иным образом нежелательными, которые образованы с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.д., и органическими кислотами, выбранными из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.д.
"Фармацевтически приемлемые основно-аддитивная соль" означает те фармацевтически приемлемые соли, которые образованы с неорганическим основанием, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.д. Конкретными основно-аддитивными солями являются соли аммония, калия, натрия м магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин-, дициклогексиламин-, лизин-, аргинин-, гистидин-, кофеин-, прокаин-, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурин, пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и т.д.. Конкретными примерами нетоксических оснований являются изопропиламин, диэтиламин, этаноламин, трометамин, дициклогексиламин, холин, и кофеин
Термин «таутомер» или «таутомерная форма» относится к структурным изомерам с различной энергией, которые являются взаимопереходящими друг в друга через низкоэнергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) включают интерконверсию через миграцию протона, такую как кето-енольная или имин-енаминная изомеризация. Валентные таутомеры охватывают взаимопревращение путем реорганизации некоторых связывающих электронов.
В случае возникновения каких-либо противоречий между названиями и структурами представленных соединений, главными являются структуры.
В настоящем изобретении термин "около" используется для обозначения того, что значение включает стандартное отклонение или ошибку используемых устройства и/или способа для определения указанного значения.
Как здесь используется, единственное или множественное значение подразумевают друг друга, если не указано иного. Как здесь используется, "другой" означает по меньшей мере второй или более.
Визуализирующие изотопы и визуализация
Диагностические методы в ядерной медицине используют радиоактивные трейсеры, которые испускают гамма-лучи изнутри тела. Эти трейсеры, как правило, представляют собой короткоживущие изотопы, соединенные с химическими соединениями, которые позволяют изучать конкретные физиологические процессы. Они могут вводиться в виде инъекций, ингаляций или перорально. Первый тип используется, когда одиночные фотоны обнаруживаются с помощью гамма-камеры, которая может просматривать органы с множества разных углов. Камера создает изображение из точек, из которых испускается излучение; это изображение усиливается с помощью компьютера и просматривается врачом на мониторе для определения ненормальных состояний.
Позитронно-эмиссионная томография (ПЭТ) представляет собой точный и сложный метод с использованием изотопов, полученных в циклотроне. Позитрон-излучающий радионуклид вводится, как правило, в виде инъекций, и накапливается в ткани-мишени. Поскольку он распадается, он испускает позитрон, который быстро соединяется с близлежащим электроном с результатом в виде одновременного излучения двух идентифицируемых гамма-лучей в противоположных направлениях. Они обнаруживаются с помощью камеры ПЭТ и дают очень точное указание их происхождения. Наиболее важна клиническая роль ПЭТ в онкологии, с фтором-18 в качестве радиоактивного трейсера, так как она оказалась наиболее точным неинвазивным методом обнаружения и оценки большинства видов рака. Она также хорошо используется в сердечной и мозговой визуализации.
Ряд медицинских диагностических методик, в том числе ПЭТ и ОФЭКТ (однофотонная эмиссионная компьютерная томография), используют радиоактивно-меченые соединения и хорошо известны в данной области техники. ПЭТ и ОФЭКТ являются очень чувствительными методами и требуют небольшого количества радиоактивно-меченых соединений, называемых трейсерами. Меченые соединения транспортируются, накапливаются и преобразуются in vivo условиях таким же образом, как и соответствующие немеченые радиоактивно соединения. Трейсеры или зонды, могут быть радиоактивно мечены с помощью радионуклидов, полезных для ПЭТ-визуализации, таких как 11С, 13N, 15O, 18F, 64Cu и 124I, или с помощью радионуклидов, полезных для визуализации ОФЭКТ, таких как 99Тс, 77Br, 61Cu, 153Gd, 123I, 125I, 131I и 32Р. Они являются примерами "визуализирующих изотопов", в том смысле, как этот термин используется в настоящем изобретении.
ПЭТ создает изображения на основе распределения молекулярных визуализирующих трейсеров, несущих позитрон-излучающие изотопы, в ткани пациента. Метод ПЭТ имеет потенциал для обнаружения дефектов функционирования на клеточном уровне в исследуемых тканях или органах. ПЭТ используется в клинической онкологии, например, для визуализации опухолей и метастаз, и использовался для диагностики некоторых заболеваний головного мозга, а также для картирования функционирования головного мозга и сердца. Точно так же, ОФЭКТ может быть использована для уточнения любого гамма визуального исследования, где может быть полезным истинное 3D представление, например, визуализация опухоли, инфекции (лейкоциты), щитовидной железы или костей.
В соответствии с другим вариантом осуществления настоящее изобретение также направлено на способ визуализации амилоидных отложений и NTFs. Когда соединения по настоящему изобретению применяют в качестве визуализирующих агентов, они метятся одним или более подходящими визуализирующими изотопами (например, радиоактивные изотопы, радиометки или радиоактивные метки), например, радиоактивные галогены, такие как 18F и/или одним или несколькими радиоактивными металлами.
Что касается радиоактивных галогенов, изотопы 125I полезны для лабораторных испытаний, но они, как правило, не подходят для диагностических целей из-за относительно длительного периода полураспада (60 дней) и низкого уровня гамма-излучения (30-65 кэВ) для 125I. Изотоп 123I имеет период полураспада тринадцать часов и гамма энергию 159 кэВ, и поэтому распространено, что мечение лигандов, которые будут применяться в диагностических целях, будет происходить с помощью этого изотопа или 18F (период полураспада 2 часов). Другие визуализирующие изотопы, которые могут быть использованы, включают 131I, 77Br и 76Br.
В другом воплощении соединения настоящего изобретения содержат радиоактивный изотоп углерода в качестве радиоактивной метки. Это относится к соединению, которое содержит один или более атомом радиоактивного углерода, предпочтительно 11С, с удельной активностью выше, чем уровень фона для этого атома. Хорошо известно, что природные элементы присутствуют в виде различных изотопов, некоторые из которых радиоактивны. Радиоактивность природных элементов представляет собой результат естественного распределения или обилия этих изотопов, и обычно упоминается как фоновый уровень. Меченные углеродом соединения настоящего изобретения имеют специфическую активность, которая выше, чем природное присутствие, и, следовательно, выше фонового уровня. Меченные углеродом композиции настоящего изобретения могут применяться для отслеживания, визуализации, лучевой терапии, и т.д.
Специалистам в данной области техники знакомы с различные способы обнаружения меченых соединений для целей визуализации. Например, позитронно-эмиссионной томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ) может применяться для обнаружения радиоактивно-меченых соединений. Метка, которая вводится в соединение, может зависеть от необходимого способа обнаружения. Специалисты в данной области техники знакомы с обнаружением с помощью ПЭТ позитронно-активного атома, такого как 18F. Настоящее изобретение также направлено на конкретные соединения, описанные в настоящем описании, где атом 18F заменяется на немеченый атом фтора. Специалисты в данной области техники знакомы с детекцией с помощью ОФЭКТ фотон-излучающего атома, такого как 123I или 99mTc.
Радиоактивные агенты для диагностики или обнаружения должны иметь достаточную радиоактивность и концентрацию радиоактивности, которая может гарантировать надежную диагностику и обнаружение. Требуемый уровень радиоактивности может быть достигнут с помощью способов, приведенных здесь для получения соединений. Визуализации амилоидных отложений и NTFs также может быть проведена количественно, так что количество амилоидных отложений и NTFs может быть определено.
Как правило, для агента визуализации мозга in vivo в мозга необходимым условием является способность преодолевать интактный гематоэнцефалический барьер. На первой стадии метода визуализации меченое соединение вводят в ткань или пациенту в детектируемом количестве. Соединение, как правило, является частью фармацевтической композиции и вводится в ткань или пациенту способами, хорошо известными специалистам в данной области техники. Как правило, введение осуществляют внутривенно.
В других вариантах осуществления настоящего изобретения меченое соединение вводят пациенту в детектируемом количестве и после того, как прошло достаточно времени для соединения, которое должно связаться с отложениями амилоида и/или белка tau, меченое соединение обнаруживают неинвазивно. В другом воплощении настоящего изобретения меченое соединение вводят пациенту, дают достаточное количество времени для связывания соединения с отложениями амилоида, и затем образец ткани пациента удаляют и меченое соединение в ткани обнаруживается вне пациента. В другом воплощении настоящего изобретения образец ткани удаляют из организма пациента, и меченое соединение вводят в образец ткани. После того, как проходит достаточное количество времени для связывания соединения с отложением амилоида и/или белка tau, соединение детектируют.
Детектируемое количество представляет собой количество меченого соединения, необходимое для обнаружения с помощью выбранного способа детекции. Количество меченого соединения, которое вводят пациенту для получения детекции, может быть легко определено специалистами в данной области. Например, увеличивающееся количество меченого соединения может вводиться пациенту, пока соединение не будет обнаружено с помощью выбранного способа детекции. Метку вводят в соединения с целью детекции соединений.
Необходимое количество времени может быть легко определено путем введения детектируемого количества меченого соединения пациенту, и затем обнаружение меченого соединения в различные моменты времени после введения.
Введение меченого соединения пациенту может быть осуществлено системным или местным способом введения. Например, меченое соединение можно вводить пациенту таким образом, чтобы оно было доставлено по всему телу. В качестве альтернативы, меченое соединение можно вводить в определенный орган или ткань, представляющие интерес. Например, желательно найти и количественно оценить отложения амилоида в головном мозге для диагностики или отслеживания прогрессирования болезни Альцгеймера у пациента.
Один или несколько визуализирующих изотопов могут быть включены в соединение формулы (I) путем замены одного или более атомов (например, атомов водорода или углерода) в соединении формулы (I) или формулы (V) на визуализирующий изотоп. Включение визуализирующего изотопа может быть осуществлено с использованием известных методик. Например, методы могут быть основаны на нуклеофильном или электрофильном 18F-фторировании подходящих предшественников, как рассмотрено, например, в Medicinal Chemistry Approaches to Personalized Medicine (Lackey, Roth Eds), Chapter 12 (Wiley-VCH, ISBN 978-3-527-33394-3). Смотрите также заявку на патент США №2011/0182812, включенную сюда посредством ссылки во всей его полноте.
Дейтерированный
Термин "дейтерированный" означает обогащенные дейтерием выше его естественного содержания в одном или более положениях соединения. Когда определенное положение, например, атом углерода, является дейтерированным, следует понимать, что содержание дейтерия в этом положении существенно больше, чем природное содержание дейтерия, которое составляет 0,015%. Дейтерированное положение обычно имеет минимальный изотопный коэффициент обогащения, по меньшей мере, 3000 (45% инкорпорированного дейтерия).
Термин "изотопный фактор обогащения" как здесь используется, означает отношение между изотопным составом и естественным содержанием конкретного изотопа. В некоторых воплощениях, соединение имеет изотопный коэффициент обогащения, по меньшей мере, 3500 (52,5% инкорпорации дейтерия) при заданном дейтерированном атоме, по меньшей мере, 4000 (60% инкорпорации дейтерия), по меньшей мере, 4500 (67,5% инкорпорации дейтерия), по меньшей мере, 5000 (75% инкорпорации дейтерий), по меньшей мере, 5500 (82,5% инкорпорации дейтерия), по меньшей мере, 6000 (90% инкорпорации дейтерия), по меньшей мере, 6333,3 (95% инкорпорации дейтерия), по меньшей мере, 6466,7 (97% инкорпорации дейтерия), по меньшей мере, 6600 (99% инкорпорации дейтерия), или по крайней мере 6633,3 (99,5% инкорпорации дейтерия). В некоторых воплощениях, достигается 100% включение дейтерия.
Следует понимать, что дейтерированное соединение содержит один или несколько атомов дейтерия. Например, дейтерированное соединение может содержать только один дейтерий. В некоторых воплощениях, дейтерированное соединение содержит только два дейтерия. В некоторых воплощениях, дейтерированное соединение содержит только три дейтерия. В некоторых воплощениях, дейтерированное соединение содержит четыре дейтерия. В некоторых воплощениях, дейтерированное соединение содержит 1, 2, 3 или 4 дейтерия, или любой диапазон, получаемый из него.
Дейтерий может быть включен в соединение формулы (I) с использованием различных известных реагентов и методик синтеза. Например, дейтерий может быть включен в соединение (I Формулы) с использованием LiAlD4. Он также может быть включен в соединение Формулы (I), например, посредством восстановления, каталитического гидрогенизирования или изотопного обмена с использованием соответствующих дейтерированных реагентов, таких как дейтериды, D2 и D2O.
Значения Примеров
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (I) или его соль.
В некоторых воплощениях R1 представляет собой 6-членное гетероарильное кольцо.
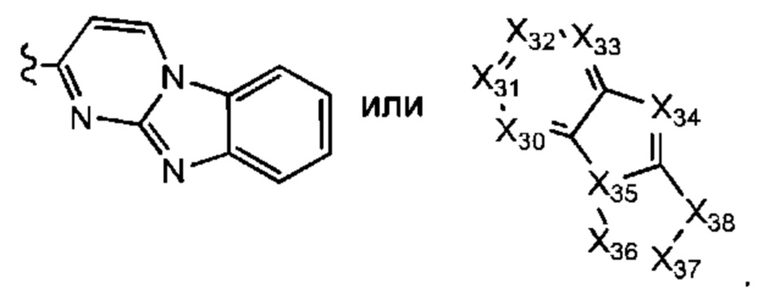
В некоторых воплощениях R1 представляет собой:
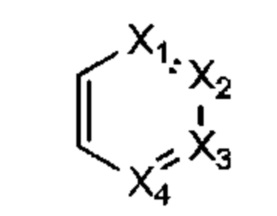
где:
X1, Х2, Х3 и Х4 каждый независимо представляет собой СН или N; и
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой фенил, пиридил или пиримидин.
В некоторых воплощениях R1 представляет собой 9- или 10-членное бициклическое гетероарильное кольцо.
В некоторых воплощениях R1 представляет собой 9- или 10-членное бициклическое гетероарильное кольцо, которое содержит один или более атомов азота.
В некоторых воплощениях R1 представляет собой 9- или 10-членное бициклическое гетероарильное кольцо, которое содержит два или более атомов азота.
В некоторых воплощениях R1 представляет собой 9- или 10-членное бициклическое гетероарильное кольцо, которое содержит один или более атомов азота и один или более атомов кислорода.
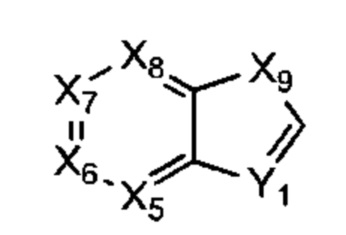
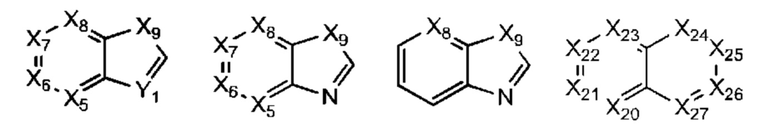
В некоторых воплощениях R1 представляет собой:
где:
Х5, Х6, Х7 и Х8 каждый независимо представляет собой СН или N;
Х9 представляет собой СН2, NH, О или S; и
Y1 представляет собой СН или N;
где R1 возможно замещен одной или более группами Ra.
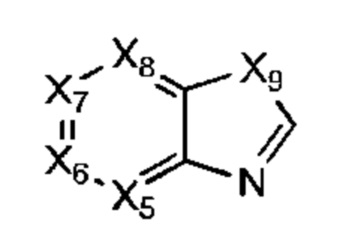
В некоторых воплощениях R1 представляет собой:
где:
Х5, Х6, Х7 и Х8 каждый независимо представляет собой СН или N; и
Х9 представляет собой СН2, NH, О или S;
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой:
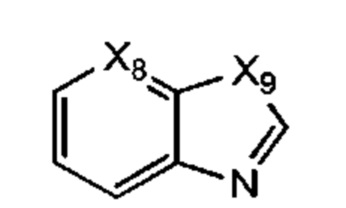
где:
Х8 представляет собой СН или N; и Х9 представляет собой СН2, NH, О или S; где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях Х9 представляет собой СН2.
В некоторых воплощениях Х9 представляет собой О.
В некоторых воплощениях Х9 представляет собой S.
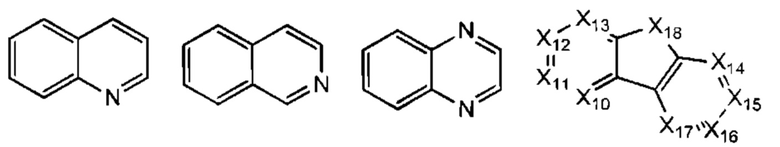
В некоторых воплощениях R1 представляет собой:
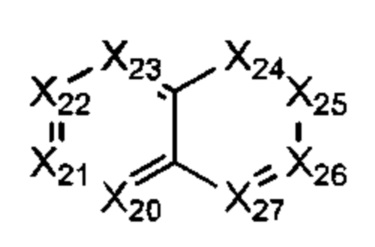
где:
Х20-Х27 каждый независимо представляет собой СН или N;
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой:
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой 12-13 членный три циклический гетероциклил, который содержит один или более атомов азота.
В некоторых воплощениях R1 представляет собой 12-13 членный трициклический гетероциклил, который содержит два или более атомов азота.
В некоторых воплощениях R1 представляет собой 12-13 членный трициклический гетероциклил, который содержит три или более атомов азота.
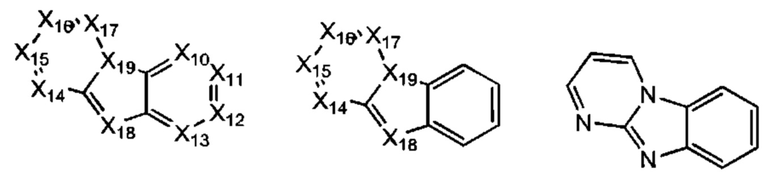
В некоторых воплощениях R1 представляет собой:
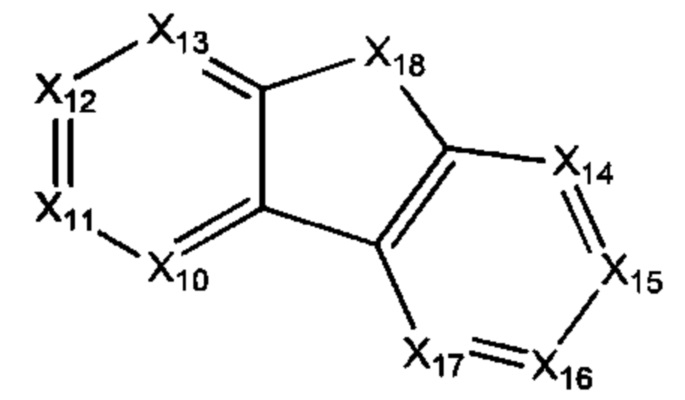
где:
каждый Х10-Х17 независимо представляет собой СН или N; и
Х18 представляет собой СН2, NH, О или S;
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой:
где:
каждый X10-X17 независимо представляет собой СН или N;
Х18 представляет собой СН или N; и
Х19 представляет собой СН или N;
где R1 возможно замещен одной или более группами Ra.
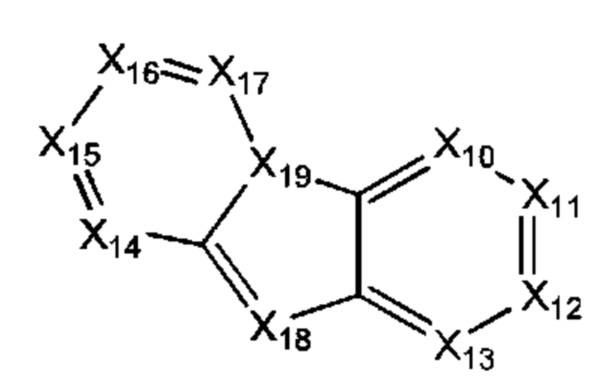
В некоторых воплощениях R1 представляет собой:
где:
каждый Х14-Х17 независимо представляет собой СН или N;
Х18 представляет собой СН или N; и
Х19 представляет собой СН или N;
где R1 возможно замещен одной или более группами Ra.
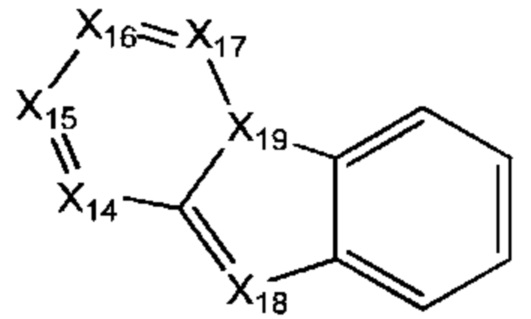
В некоторых воплощениях R1 представляет собой:
и возможно замещен одной или более группами Ra.
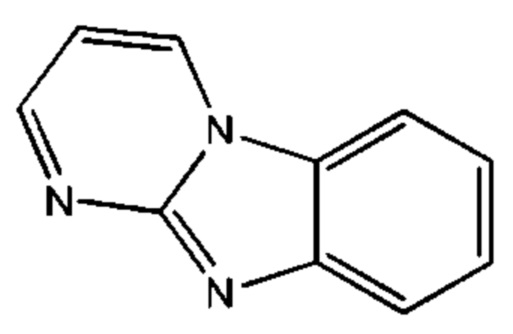
В некоторых воплощениях R1 представляет собой:
и возможно замещен одной или более группами Ra.
В некоторых воплощениях R1 представляет собой:
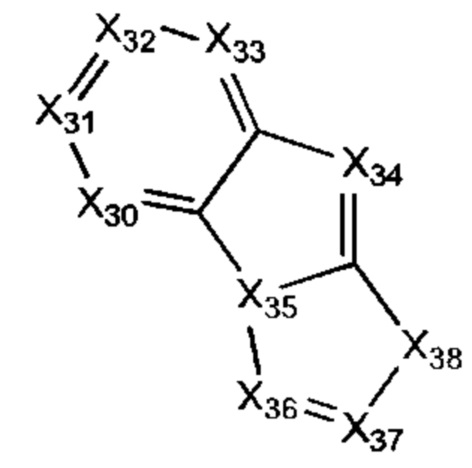
где:
каждый Х30-Х37 независимо представляет собой СН или N; и
Х38 представляет собой СН2, NH, О или S;
где R1 возможно замещен одной или более группами Ra.
В некоторых воплощениях А отсутствует.
В некоторых воплощениях А представляет собой этинил;
В некоторых воплощениях R2 представляет собой 6-членный карбоциклил, который возможно замещен одной или более группами Rb.
В некоторых воплощениях R2 представляет собой циклогексил или фенил, где указанный циклогексил и фенил возможно замещен одной или более группами Rb.
В некоторых воплощениях R2 представляет собой пирролил, тиофенил, имидазолил, тиазолил, оксазолил, пиразолил, изоксазолил, изотиазолил, морфолинил, пиперидинил, пиперазинил, пирролидинил, пиридинил, пиримидинил, пиразинил, 3-азабицикло[3.1.0]гексанил, или пиридазинил, где указанный R2 возможно замещен одной или более группами Rb.
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (V), или его соль.
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (Va):
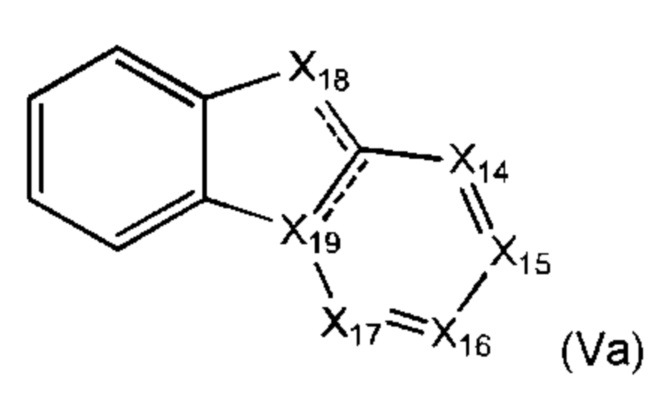
или его соль, где соединение формулы (Va) замещено одной или более группами Ra.
В некоторых воплощениях указанное соединение содержит визуализирующий изотоп.
В некоторых воплощениях визуализирующий изотоп представляет собой 18F.
В некоторых воплощениях указанное соединение представляет собой соединение формулы (la):
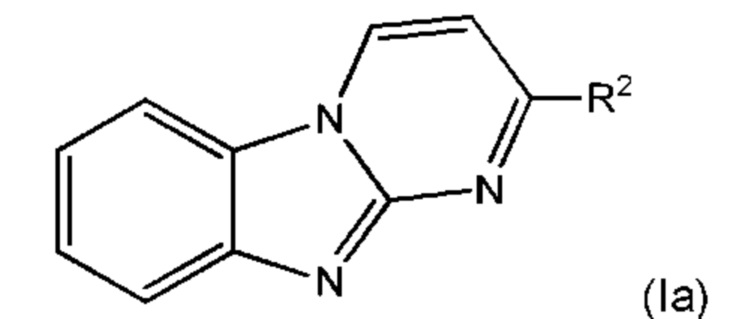
или его соль, где:
R2 представляет собой 6-членный карбоциклил или 5- или 6-членный гетероциклил, где указанный карбоциклил и гетероциклил возможно замещен одной или более группами Rb;
каждый Rb независимо выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, -F, -Cl, -Br, -I, -NO2, -N(Rw)2, -CN, -C(O)-N(Rw)2, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, и -C(O)-O-Rw, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -C(O)-N(Rw)2, и -N(Rw)-C(O)-Rw.
В некоторых воплощениях соединение представляет собой соединение формулы (Ia):
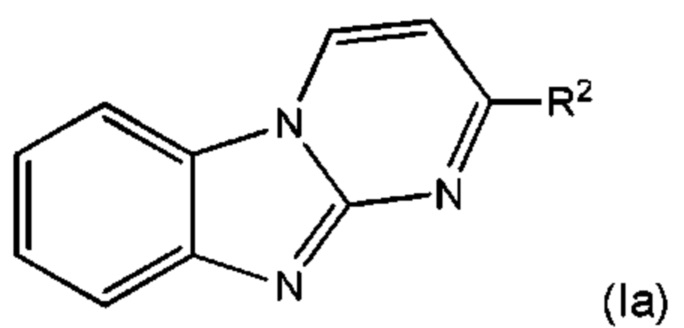
или его соль, где:
R2 представляет собой пиперидинил или 3-азабицикло[3.1.0]гексанил, где указанный пиперидинил и 3-азабицикло[3.1.0]гексанил возможно замещен одной или более группами Rb; и каждый Rb независимо выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, -F, -Cl, -Br, -I, -NO2, -N(Rw)2, -CN, -C(O)-N(Rw)2, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, и -C(O)-O-Rw, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -C(O)-N(Rw)2, и -N(Rw)-C(O)-Rw.
В некоторых воплощениях соединение представляет собой соединение формулы (Ib):
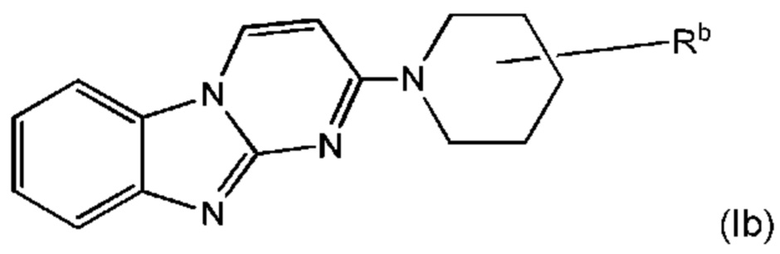
или его соль, где:
Rb является дейтерированным и выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, -N(Rw)2, -C(O)-N(Rw)2, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, и -C(O)-O-Rw, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -O-Rw, -О-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -C(O)-N(Rw)2, и -N(Rw)-C(O)-Rw; и
Rb содержит один или более визуализирующих изотопов.
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (Ic):
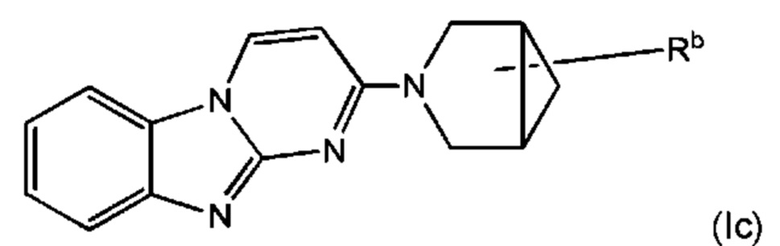
или его соль, где:
Rb является дейтерированным и выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, -N(Rw)2, -C(O)-N(Rw)2, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, и -C(O)-O-Rw, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -O-Rw, -О-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -C(O)-N(Rw)2, и -N(Rw)-C(O)-Rw; и
Rb содержит один или более визуализирующих изотопов.
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (Id):
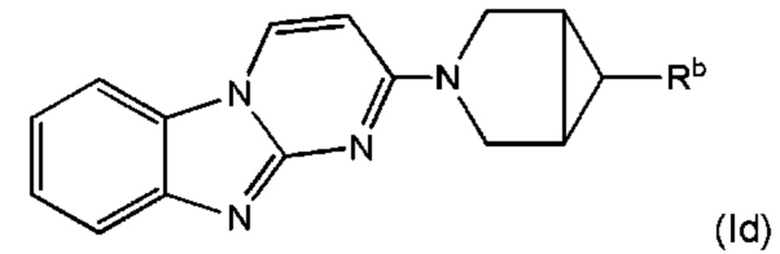
или его соль, где:
Rb является дейтерированным и выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила, гетероциклила, -N(Rw)2, -C(O)-N(Rw)2, -O-Rw, -O-C(O)-Rw, -C(O)-Rw, и -C(O)-O-Rw, где любой из С1-6алкила, С2-6алкенила, С2-6алкинила, -(O-CH2-CH2)m-Rd, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из оксо, галогена, -O-Rw, -О-C(O)-Rw, -C(O)-Rw, -C(O)-O-Rw, -C(O)-N(Rw)2, и -N(Rw)-C(O)-Rw; и
Rb содержит один или более визуализирующих изотопов.
В некоторых воплощениях каждый Ra независимо выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, и -O-Rv; и каждый Rv независимо выбран из водорода, С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами независимо выбранными из -ORax.
В некоторых воплощениях каждый Ra независимо выбран из -O-Rv; и каждый Rv независимо выбран из водорода, С1-6алкила, С2-6алкенила, С2-6алкинила, и карбоциклила.
В некоторых воплощениях каждый Ra независимо выбран из -O-СН3.
В некоторых воплощениях каждый Rb независимо выбран из С1-6алкила, С2-6алкенила, С2-6алкинила, и -O-Rw, где любой из С1-6алкила, С2-6алкенила, и С2-6алкинила, возможно замещен одной или более группами, независимо выбранными из -O-Rw; и каждый Rw независимо выбран из водорода, С1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила, где каждый из C1-6алкила, С2-6алкенила, С2-6алкинила, карбоциклила и гетероциклила возможно замещен одной или более группами, независимо выбранными из -ORx; где по меньшей мере один Rb является дейтерированным и содержит один или более визуализирующих изотопов.
В некоторых воплощениях каждый Rb представляет собой С1-6алкил, который возможно замещен одной или более группами, независимо выбранными из -O-Rw; и каждый Rw независимо выбран из С1-6алкила; где по меньшей мере один Rb является дейтерированным и содержит один или более визуализирующих изотопов.
В некоторых воплощениях Rb представляет собой С1-6алкильную группу, которая содержит один или более визуализирующих изотопов.
В некоторых воплощениях Rb представляет собой С1-6алкильную группу, которая содержит визуализирующий изотоп 18F.
В некоторых воплощениях соединение по изобретению содержит атом углерода, который является как дейтерированным, так и ковалентно присоединенным к визуализирующему изотопу.
В некоторых воплощениях Rb представляет собой -CH2-*CD2-18F, где углерод, помеченный * является дейтерированным.
В некоторых воплощениях Rb представляет собой -CH2-*CD2-18F, где углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 3500.
В некоторых воплощениях Rb представляет собой -CH2-*CD2-18F, где углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6000.
В некоторых воплощениях Rb представляет собой -СН2-CH2-O-*CD2-*CD2-18F, где каждый атом углерода, помеченный * является дейтерированным.
В некоторых воплощениях Rb представляет собой -СН2-CH2-O-*CD2-*CD2-18F, где каждый атом углерода, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 3500.
В некоторых воплощениях Rb представляет собой -СН2-CH2-O-*CD2-*CD2-18F, где каждый атом углерода, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6000.
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы (Ie):
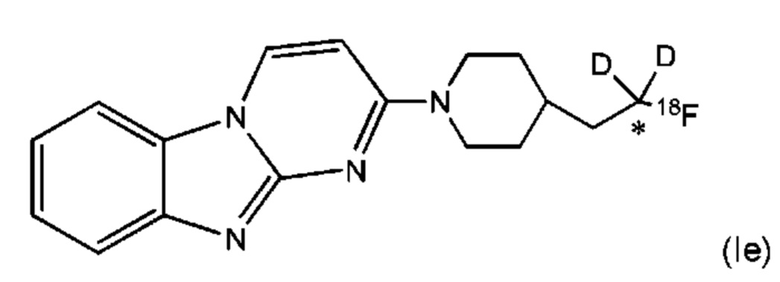
где углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 3500. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 4000. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 4500. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 5000. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 5500. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6000. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6333.3. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6466.7. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6600. В некоторых воплощениях углерод, помеченный *, обладает фактором обогащения изотопом дейтерия по меньшей мере 6633.3. В некоторых воплощениях, 100% включения дейтерия достигается по отношению к углероду, помеченному * в соединении формулы (Ie).
В некоторых воплощениях соединение по изобретению представляет собой соединение формулы:
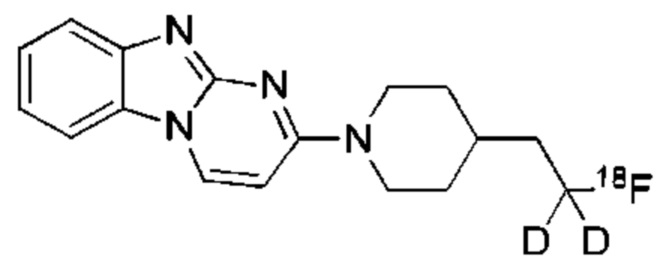
или его соль. В некоторых воплощениях соединение по изобретению представляет собой соединение, выбранное из:
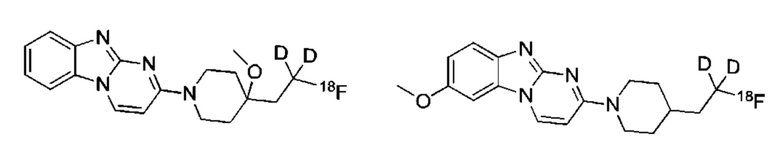
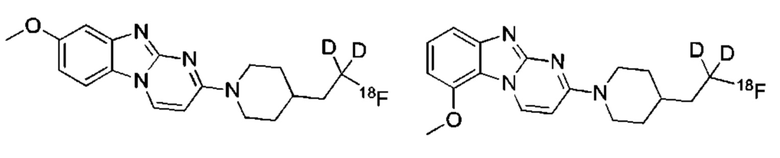
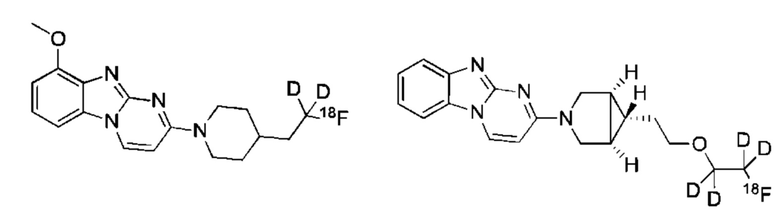
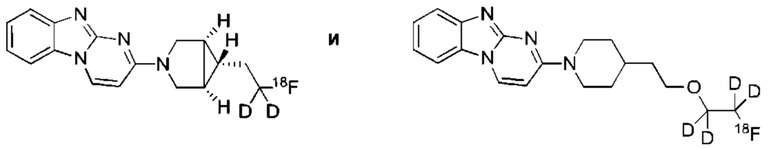
и их соли.
R1 могут быть присоединены к остатку соединения формулы (I) через любое возможное положение для синтеза. Например, когда R1 обладает одним из следующих значений, он может быть присоединен к остатку соединения формулы (I) через любое возможное положение для синтеза:
Например, в одном воплощении, атом водород может быть удален от атома углерода или азота в R1 с получением открытой валентности, которая может образовать ковалентную связь с остатком соединения формулы (I).
Показания
Соединения Настоящего изобретения могут применяться в различных контекстах, таких как визуализация и детекция. В некоторых воплощениях соединение вводят пациентам, которые страдают от или подвержены риску развития заболевания нервной системы. В некоторых воплощениях, неврологическое нарушение связано с образованием амилоидных бляшек и/или агрегатов белка tau и/или NFTs.
"Заболевание нервной системы" как здесь используется, относится к заболеванию или расстройству, которое затрагивает центральную нервную систему, и/или которое имеет этиологию в ЦНС. Типичные заболевания или расстройства ЦНС включают, без ограничения, нейропатию, амилоидоз, рак, глазные заболевания или расстройства, вирусные или микробные инфекции, воспаление, ишемию, нейродегенеративные заболевания, судорожные припадки, поведенческие расстройства и лизосомальную болезнь накопления. В рамках настоящего изобретения следует понимать, что ЦНС включает глаза, которые, как правило, отгорожены от остальной части тела гематоофтальмическим барьером. Конкретные примеры заболеваний нервной системы включают, без ограничения, нейродегенеративные заболевания, в том числе, без ограничения, болезнь телец Леви, синдром постполиомиелита, синдром Шая Дрейджера, оливомостомозжечковая атрофия, болезнь Паркинсона, множественная системная атрофия, мтриатонигральная дегенерации, прионные заболевания (включая, без ограничения, синдром коровьего бешенства, Скрейпи, синдром Крейтцфельда-Якоба, куру, болезнь Герстмана-Штрауслера-Шейнкера, хроническая изнуряющая болезнь, и фатальная семейная бессонница), бульбарный синдром, заболевания двигательных нейронов, гетеродегенеративные заболевания нервной системы (включая, без ограничения, болезнь Канавана, болезнь Хантингтона, нейрональный цероид-липофусциноз, болезнь Александера, синдром Туретта, синдром кудрявый волос Менкеса, синдром Коккейна, синдром Галлервордена-Шпатца, болезнь Лафора, синдром Ретта, гепатолентикулярную дегенерацию, синдром Леша-Найана, и синдром Унферрихта-Лундборга), деменцию (включая, без ограничения, болезнь Пика и спиноцеребеллярную атаксию), и рак (например, центральной нервной системы, в том числе метастазы в головном мозге в результате рака в других частях тела). Таутопатии также охватываются термином "заболевания нервной системы" и относятся к tau-связанным нарушениям или состояниям, которые могут перекрываться с одним или несколькими из состояний, указанных выше. Не ограничивающие примеры таутопатии включают, без ограничения, болезнь Альцгеймера, прогрессирующий супрануклеарный паралич, кортикобазальную дегенерацию, болезнь Пика, инсульт, старение, черепно-мозговые травм и умеренные когнитивные нарушения.
Создание препаратов и введение
Другой аспект включает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль. В одном воплощении композиция дополнительно содержит фармацевтически приемлемый носитель или наполнитель. В некоторых воплощениях композицию готовят для введения нуждающемуся в этом пациенту.
Термин "пациент" или "индивидуум", как здесь используется, относится к животному, такому как млекопитающее, такое как человек. В одном воплощении, пациент или индивидуум относится к грызунам (например, мыши или крысы), собаке или человеку.
Термин "фармацевтически приемлемый носитель или наполнитель" относится к нетоксичным носителям или наполнителям, которые не нарушают фармакологическую активность соединения, с которым оно было приготовлено. Фармацевтически приемлемые носители или наполнители, которые могут быть использованы в композициях по настоящему изобретению, включают, без ограничения, воду, соли, и этанол
Композиции, содержащие соединение, или его соль, как правило, вводят внутривенно. Препараты для инъекций, например стерильные инъецируемые водные или масляные суспензии, могут быть приготовлены в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъекционный препарат может также представлять собой стерильный инъецируемый раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые могут быть использованы, можно указать воду, раствор Рингера, и физиологический раствор (например, U.S.Р. или изотонический раствор хлорида натрия). Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. С этой целью любое нелетучее масло может быть использовано, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяются в инъецируемых препаратах.
Инъекционные композиции могут быть стерилизованы, например, посредством фильтрации через бактериальный удерживающий фильтр или включением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций непосредственно перед использованием.
В некоторых воплощениях фармацевтические композиции могут вводиться с пищей или без. В некоторых воплощениях фармацевтически приемлемые композиции вводят без пищи. В некоторых воплощениях фармацевтически приемлемые композиции по данному изобретению вводят с пищей.
Конкретные дозировки и схемы лечения для каждого конкретного пациента будут зависеть от множества факторов, включая возраст, вес тела, общее состояние здоровья, пол, питание, время введения, скорость выведения, сочетание лекарственных препаратов, решение лечащего врача, и тяжесть конкретного заболевания. Количество представленного соединения или его соли в композиции будет также зависеть от конкретного соединения в композиции.
В одном воплощении композицию, содержащую соединение настоящего изобретения, вводят внутривенно в количестве трейсера и количестве радиоактивности, чтобы обеспечивалось безопасность воздействия, но достаточного для получения изображений. В некоторых воплощениях, диапазон доз составляет от 5-20 мКи на субъект. В некоторых воплощениях, диапазон дозировки составляет приблизительно, по меньшей мере приблизительно, или не более чем приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 мКи или более на каждый субъект, или любой диапазон, получаемый из вышеуказанного.
Пояснения к примерам
Как показано в Примерах ниже, в некоторых конкретных воплощениях, соединения по настоящему изобретению получают в соответствии со следующими общими методиками. Необходимо оценивать, что, несмотря на то, что общие способы изображают синтез некоторых соединений настоящего изобретения, следующие общие способы и другие способы, известные квалифицированным специалистам, могут применяться ко всем соединениям и подклассам и видам каждого из этих соединений, как здесь описано.
Примеры
Общие условия. Обычные растворители и химические соединения покупали в фирме Aldrich (Milwaukee, WI) или VWR International (Randor, PA), (E)-1,1,1-трихлоро-4-этоксибут-3-ен-2-он в компании PharmaSys (Саrу, NC) и трет бутил 4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилат в компании Santa Cruz Biotechnology Inc. (Santa Cruz, CA). 18F-фтор приобретали у компании PETNET Solutions (Palo Alto, CA), 18F колонка захвата и высвобождения (8 мг) приобретались в компании ORTG, Inc. (Oakdale, TN), и картридж HLB plus sep-pak в копании Waters (Milford, MA). Образцы тканей человеческого мозга получили из Banner Sun Health Research Institute (Sun City, AZ), замороженные нефиксированные образцы резали на препараты толщиной 5 мкм и хранились при -80°С. Спектры ЯМР считывались на спектрометре Bruker Avance II 400 при 298 K. Спектр 1Н записывался при 400 MHz и химические сдвиги указывались в ч./млн (ppm) по отношению к TMS; спектр 19F записывали при 376.3 MHz и химические сдвиги устанавливались с использованием ТФУ в качестве внешнего референса, стандартизированного до -76.55 ppm. Модель 521 микроволновой печи (Resonance Instruments, Skokie, IL) использовали для радиохимических реакций. Следующие системы применялись для анализа и очистки продуктов: Система А: Аналитическая ЖХМС: СВЭЖХ Waters Acquity запущенная при 0.7 мл/мин. Колонка: СВЭЖХ Acquity UPLC ВЕН С18 1.7 мкм 2.1×30 мм. Подвижная фаза А: вода с 0.1% муравьиной кислотой, В: ацетонитрил с 0.1% муравьиной кислотой, линейный градиент 5-95% В за 2 мин. Система оснащена детекторами Acquity PDA и Acquity SQ. Система В: Препаративная ВЭЖХ: насос Waters 2545, работающий при 70 мл/мин. Колонка Phenomenex Gemini-NX 10 мкм С18 11 OA АХ 100×30.00 мм. Подвижная фаза А1: вода с 0.1 муравьиной кислотой, А2: вода с 0.1% NH4OH, В: ацетонитрил. Линейный градиент А1 или А2 до В за 10 мин. Система D: Полупрепаративная ВЭЖХ: Agilent 1290, работающий при 4 мл/мин. Колонка: Phenomenex Luna 5 мкм С18 100А, 250×10 мм. Подвижная фаза А: вода с 0.1% муравьиной кислотой, В: ацетонитрил с 0.1% муравьиной кислотой. Система Е: установка аналитической ЖХМС, состоящая из ВЭЖХ: Помпа: Agilent 1290, работающая при 0.5 мл/мин. Колонка: Phenomenex Kinetex 2.6 мкм С18 100А, 50×2.1 мм. Подвижная фаза А: вода с 0.1% муравьиной кислотой, В: ацетонитрил с 0.1% муравьиной кислотой. Линейный градиент: 5-95% В за 3 мин с последующими 95% B в течение 1 мин. ЖХ система оснащена УФ-детектором и детектором радиоактивности (РМТ) и соединена с ЖХ/МС масс-спектрометром HRMS Agilent 6220 Accurate-Mass TOF LC/MS (Santa Clara, CA). Данные авторадиографии собрали на Typhoon FLA 9500 (GE Healthcare Bio-Sciences, Uppsala, Sweden) визуализаторе фосфора с использованием рентгенографических пластинок FujiFilm BAS-SR 2025 (Kanagawa, Japan). Микросомы печени человека и мыши получили от компании BD Gentest (Bedford, MA). C57BL/6 мыши приобретались в компании Harlan Laboratories (Livermore, CA). Применялся протокол соответствующий уходу за животными, одобренный институциональным комитетом Genentech по уходу и использованию животных, который является аккредитованным Международной ассоциацией оценки и аккредитации лабораторных исследований на животных (AAALAC).
Пример 1. Синтез 1,1-дидейтерио-2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)-1-[18F]фторэтана ([18F][A]-d2)
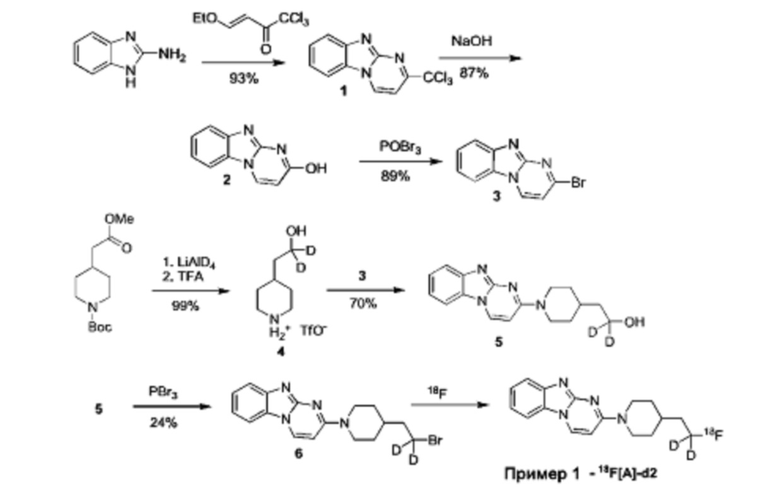
18F-Фторид, захваченный на картридже захвата и высвобождения, элюировали с использованием раствора, содержащего TBHCO3 (150 мкл, 0.075 М) в ацетонитриле (500 мкл) и воде (350 мкл). Растворитель эвапорировали с использованием слабого потока азота и нагрева в микроволновой печи при 120°С с последующим азеотропным удалением оставшейся воды с использованием ацетонитрила (4×0.5 мл). Предшественник 6 (2 мг) растворили в 0.5 мл ацетонитрила и добавили в пробирку, содержащую 18F-фторид, и нагревали с использованием микроволновой печи при 120°С, 50 W в течение 350 с. Реакционную смесь сконцентрировали до приблизительно 100 мкл и разбавили водой (2 мл) для инъекций в полупрепаративной ВЭЖХ (Система D). Продукт элюировали 15% В в течение 10 мин с последующими 20% В в течение 10-15 мин. Содержащую продукт фракцию разбавили водой до двукратного объема и продукт выделили с использованием HLB + sep-pak картридж, предварительно обработанного этанолом (10 мл) и водой (10 мл), и разбавили этанолом (3 мл). Этанол эвапорировали досуха и продукт [18F][A]-d2 сформировался. Радиохимическая чистота оценивалась с помощью ЖХМС (Пример Е).
Идентичность [18F][A]-d2 подтвердили с помощью ко-элюции с полностью охарактеризованным холодным стандартом [A]-d2 (Система Е, время задержки 1.5 мин). Радиохимическая чистота [18F][A]-d2 составляла 99% (Фиг. 5) со специфической активностью 70,000-110,000 Ки/ммоль.
Промежуточное соединение 6 получили следующим образом.
a. 2-(трихлорометил)бензо[4,5]имидазол[1,2-а]пиримидин (1) 2-амино-бензимидазол (5.0 г, 37.6 ммоль) суспендировали в толуоле (150 мл) и добавили триэтиламин (5.3 мл, 37.6 ммоль). (E)-1,1,1-Трихлоро-4-этоксибут-3-ен-2-он добавили при комнатной температуре. Получившуюся смесь нагрели до 120°С в течение 30 минут. Растворитель эвапорировали с получением неочищенного продукта в виде желтого осадка 10 г (93%). ЖХМС Система А) найденный удельный заряд 286.1, рассчитан для C11H7C13N3 (М+Н)+ 285.96. 1Н NMR DMSO-d6 δ 9.77 (d, 1Н), 8.41 (d, 1Н), 7.95 (d, 1Н), 7.75 (d, 1Н), 7.62 (dd, 1Н), 7.53 (dd, 1Н).
b. 2-гидроксибнзо[4,5]имидазол[1,2-а]пиримидин (2) NaOH (49 мл, 1 н) добавили к соединению 1 (10 г, 38 ммоль), суспендированному в ацетонитриле (150 мл). Смесь нагрели до 90°С в течение 2 часов. Смесь охладили и сконцентрировали до приблизительно половины первоначального объема. Смесь охладили до 0°С и рН довели до 7-8 с использованием 1 н HCl. Преципитат собрали и высушили с получением неочищенного соединения 2 (6.1 гд, 87%). ЖХМС Система А) найденный удельный заряд 186.1, рассчитан для C10H8N3O (М+Н)+ 186.1. 1Н NMR DMSO-d6 δ 12.60 (bs, 1Н), 8.77 (d, 1Н), 7.89 (d, 1Н), 7.51 (d, 1Н), 7.31 (dd, 1Н), 7.23 (dd, 1Н), 6.10 (d, 1Н).
c. 2-бромобензо[4,5]имидазол[1,2-а]пиримидин (3) POBr3 (30 г, 106 ммоль) добавили по порциям к суспензии соединения 2 (6.1 г, 33 ммоль) в 1,2-дихлоржтане (100 мл) и ДМФ (1 мл) и смесь затем нагревали до 100°С в течение 1 часа. Реакционную смесь сконцентрировали, влили в воду со льдом (100 мл) и рН довели до 8 с использованием концентрированной NH4OH. Преципитат собрали и промыли ледяной водой и высушили под вакуумом с получением соединения 3 в виде коричнево оранжевого масла (7.3 г, 89%). ЖХМС Система А) найденный удельный заряд 248.1, рассчитан для C10H7BrN3 (М+Н)+ 247.97. 1Н NMR DMS0-d6 δ 9.03 (d, 1Н), 8.05 (d, 1Н), 7.60 (d, 1Н), 7.44 (dd, 1Н), 7.37 (dd, 1Н), 6.42 (d, 1Н).
e. 1,1-дидейтерио-2-(пиперидин-4-ил)этанол (4) Трет-бутил 4-(2-метокси-2-оксоэтил)пиперидин-1-карбоксилат (0.5 г, 2 ммоль) растворили в ТГФ (3 мл) и по каплям добавили в течение 20 мин к суспензии LiAlD4 (0.25 г, 6 ммоль) в ТГФ (3 мл) перемешанной при комнатной температуре. Реакционную смесь перемешивали в течение 1 часа, затем избыток LiAlD4 разложили с помощью воды. Преципитат удалили посредством фильтрации и промыли ТГФ. Органические экстракты сконцентрировали; маслянистый осадок растворили в 98% трифторуксусной кислоте и перемешивали при комнатной температуре в течение 30 минут. Трифторуксусную кислоту удалили при пониженном давлении; маслянистый осадок тритурировали с толуолом и высушили под вакуумом. Неочищенное соединение 4 получили в виде трифторацетатной соли (500 мг, 100%) и использовали без дополнительной очистки. ЖХМС Система А) найденный удельный заряд 132.06, рассчитан для C7H14D2NO (М+Н)+ 132.13. 1Н NMR DMSO-d6 δ 3.40-3.25 (m, 2Н), 2.92-2.82 (m, 2Н), 1.92-1.78 (m, 2Н), 1.63 (m, 2Н), 1.25-1.37 (m, 3Н), 8.64-8.30 (bd, 2Н), 9.12 (bs, 1Н).
f. 1,1-дидейтерио-2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)этанол (5) Смесь соединения 4 (0.5 г, 2 ммоль), диизопропилэтиламина (1.4 мл, 8 ммоль) и 5 (0.5 г, 2 ммоль) в ДМФ (10 мл) нагревали до 95°С в течение 2 часов. Реакционную смесь охладили и влили в воду со льдом (100 мл) и получившийся преципитат собрали и высушили под вакуумом. Маточную жидкость, содержащую существенное количество продукта, эвапорировали досуха при пониженном давлении и продукт очистили на ВЭЖХ Система В, А2 и 5-50% В). Всего 412 мг, (70%) соединения 5 получили. ЖХМС Система А) найденный удельный заряд 299.3, рассчитан для C17H19D2N4O (М+Н)+ 299.18. 1Н NMR DMSO-d6 δ 8.93 (d, 1Н), 7.93 (d, 1Н), 7.50 (dd, 1Н), 7.31 (dd, 1Н), 7.14 (dd, 1Н), 6.87 (d, 1Н), 4.56 (m, 2Н), 4.33 (s, 1Н), 3.00 (m, 2Н), 1.81-1.75 (m, 3Н), 1.39 (d, 2Н), 1.19-1.09 (m, 2 Н).
g. 1,1-дидейтерио-2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)-1-бромэтан (6) Раствор PBr3 (1 М, 0.4 мл) в дихлорметане медленно добавили к охлажденной (0°С) суспензии соединения 5 в дихлорметане. Охлаждающую ванну удалили через 10 минут и реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь охладили до 0°С и добавили дополнительную порцию раствора PBr3 (0.4 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем погасили несколькими каплями воды и сконцентрировали под вакуумом. Неочищенный продукт очистили на ВЭЖХ системе В, А2 и 20-60% В) с получением соединения 6 (20 мг, 17%) в виде белого осадка. ЖХМС Система А) найденный удельный заряд 361.15, рассчитан для C17H18D2BrN4 (М+Н)+ 361.09. 1Н NMR DMSO-d6 δ 8.94 (d, 1Н), 7.94 (d, 1Н), 7.50 (d, 1Н), 7.29 (dd, 1Н), 7.15 (dd, 1Н), 6.88 (d,1H), 4.48 (m, 2Н), 3.04 (m, 2Н), 1.95 (m, 1Н), 1.83 (m, 4Н), 1.19 (m, 2Н).
Пример 2. Синтез 1,1-дидейтерио-2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)-1-фторэтана ([A]-d2)
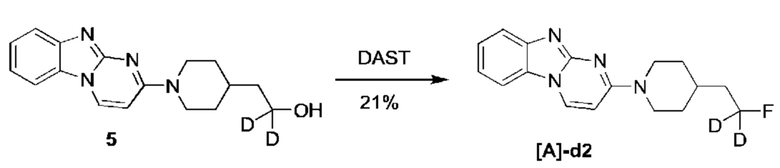
Диэтиламиносеры трифторид (0.17 мл, 1.25 ммоль) добавили в охлажденный (-78°С) раствор соединения 5 (75 мг, 0.25 ммоль) в дихлорметане (2 мл). Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь затем охладили до -78°С и добавили дополнительное количество диэтиламиносеры трифторида (0.17 мл, 1.25 ммоль). Реакционную смесь нагрели до комнатной температуры и погасили насыщенным водным раствором NaHCO3. Смесь сконцентрировали, перерастворили в ДМСО и очистили на ВЭЖХ системе В, А2 и 5-50% В) с получением соединения [A]-d2 в виде белого осадка (16 мг, 21%). ЖХМС Система А) найденный удельный заряд 301.3 рассчитан для C17H18D2FN4 (М+Н)+ 301.17. 1Н NMR DMSO-d6 δ 1Н 8.94 (d, 1Н), 7.94 (d, 1Н), 7.50 (d, 1Н), 7.29 (dd, 1Н), 7.14 (dd, 1Н), 6.88 (d, 1Н), 4.57 (m, 2Н), 3.01 (m, 2Н), 1.84-1.76 (m, 3Н), 1.58-1.66 (dd, 2Н), 1.15-1.24 (m, 2Н); 19F NMR DMSO-d6 δ - 219.1.
Пример 3. Синтез 2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)-1-фторэтана ([А])
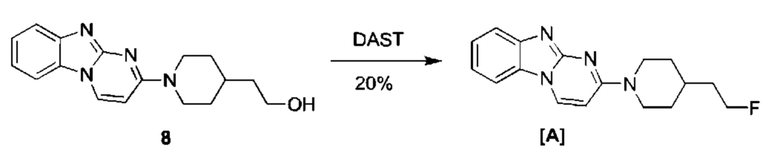
Диэтиламиносеры трифторид (0.225 мл, 1.7 ммоль) добавили в охлажденный (-78°С) раствор соединения 9 (100 мг, 0.34 ммоль) в дихлорметане (2 мл). Реакционной смеси дали нагреться до комнатной температуры и погасили насыщенным водным раствором NaHCO3. Смесь сконцентрировали, перерастворили в ДМСО и очистили на ВЭЖХ системе В, А1 и 5-50% В) с получением соединения [А] в виде белого осадка (20 мг, 20%). ЖХМС Система А) найденный удельный заряд 299.5 рассчитан для C17H20FN4 (М+Н)+ 299.16. 1Н NMR DMSO-d6 δ 8.94 (d, 1Н), 7.94 (d, 1Н), 7.50 (d, 1Н), 7.28 (dd, 1Н), 7.14 (dd, 1Н), 6.88 (d, 1Н), 4.62, 4.46 (dt, 2Н), 4.60 (bm, 2Н), 3.01 (m, 2Н), 1.84 (m, 3Н), 1.5-1.7 (m, 2Н), 1.05-1.3 (m, 2Н); 19F NMR DMSO-d6 δ - 217.9.
Пример 4. Синтез 2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)-1-[18F]фторэтана ([18F][A])
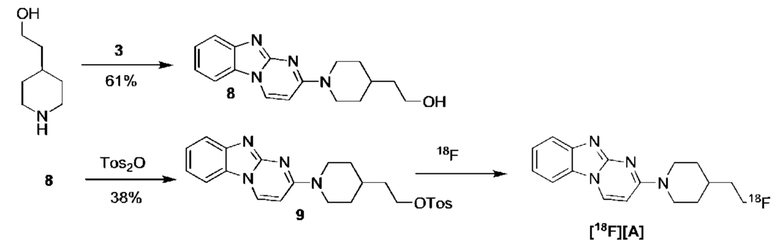
18F-фторид, захваченный на картридже захвата и высвобождения элюировали с помощью раствора, содержащего TBHCO3 (150 мкл, 0.075 М) в ацетонитриле (500 мкл) и воде (350 мкл). Растворитель эвапорировали с использованием слабого потока азота и нагрева в микроволновой печи до 120°С с последующим азеотропным удалением оставшейся воды с использованием ацетонитрила (4×0.5 мл). Соединение 9 (2 мг) растворили в 0.5 мл ацетонитрила и добавили в пробирку, содержащую 18F-фторид и нагревали с использованием микроволновой печи до 120°С, 50 W в течение 350 секунд. Реакционную смесь сконцентрировали до приблизительно 100 мкл и разбавили водой (2 мл) для инъекций для полупрепаративной ВЭЖХ Системы D). Продукт элюировали 15% В в течение 10 минут с последующими 20% В в течение 10-15 минут. Содержащую продукт фракцию разбавили водой до двукратного объема и продукт выделили с использованием картриджа HLB plus sep-pak предварительно обработанного этанолом (10 мл) и водой (10 мл), и и разбавили этанолом (3 мл). Этанол эвапорировали досуха и получили соединение [18F][A]. Радиохимическую чистоту оценивали с помощью ЖХМС, Система Е).
Идентичность [18F][A] подтвердили совместной элюцией с полностью охарактеризованным холодным стандартом [А] с использованием Системы Е, время задержки 1.5 мин). Радиохимическая чистота [А] составила 99% (Фиг. 6) со специфической активностью 70,000-110,000 Ки/ммоль.
Промежуточное соединение 9 получили следующим образом.
a. 2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)этанол (8) 2-(Пиперидин-4-ил)этанол (0.7 г, 5.4 ммоль) и соединение 3 (1.0 г 4 ммоль) смешали в ДМФ (12 мл) и реакционную смесь нагревали до 100°С в течение 30 минут. Суспензию охладили до комнатной температуры и влили в 5% водный раствор Na2CO3 (250 мл). Преципитат собрали, промыли ледяной водой и высушили с получением соединения 8 в виде коричнево-оранжевого осадка (0.74 г, 61%). ЖХМС Система А) найденный удельный заряд 297.3 рассчитан для C17H21N4O (М+Н)+ 297.16. 1Н NMR DMSO-d6 δ 9.05 (d, 1Н), 8.04 (d, 1Н), 7.53 (d, 1Н), 7.40 (t, 1Н), 7.29 (dd, 1Н), 7.09 (d, 1Н), 4.59 (m, 2Н), 4.37 (bs, 1Н), 3.49 (t, 2Н), 3.09 (m, 2Н), 1.85-1.82 (m, 3Н), 1.40 (dt, 2Н), 1.17-1.13 (m, 2Н).
b. 2-(1-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ил)пиперидин-4-ил)этила п-толуолсульфонат (9) Раствор п-толуолсульфонового ангидрида (0.7 г, 2.1 ммоль) в пиридине (5 мл) добавили к охлажденной (0°С) суспензии соединения 8 в пирдине (10 мл). Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 2 часов. Другую порцию п-толуолсульфонового ангидрида (0.7 г, 2.1 ммоль) добавили при комнатной температуре и смесь перемешивали в течение 30 минут до завершения реакции. Реакционную смесь влили в воду (150 мл) и продукт экстрагировали дихлорметаном (2×50 мл) и органические экстракты высушили над MgSO4. Неочищенный продукт очистили на ВЭЖХ системе В, А1 и 20-60% В) с получением соединения 9 в виде п-толуолсульфонатной соли (0.29 г, 38%) в виде желтоватого осадка. ЖХМС Система А) найденный удельный заряд 451.7, рассчитан для C24H27N4O3S (М+Н)+ 451.1798; HRMS Система Е) найденный удельный заряд 451.1799. 1Н NMR DMSO-d6 δ 9.15 (d, 1Н), 8.13 (d, 1Н), 7.82 (d, 2Н), 7.57 (d, 1Н), 7.52-7.40 (m, 6Н), 7.26 (d, 1Н), 7.10 (d, 2Н), 4.50 (m, 2Н), 4.20 t, 2Н), 3.11 (m, 2Н), 2.44 (s, 3Н), 2.28 (s, 3Н), 1.70 (m, 3Н), 1.6 (m, 2Н), 1.06-1.16 (m, 2Н).
Пример 5. Синтез 2-((1R,5S,6s)-6-(2-фторэтил)-3-азабицикло[3.1.0]гексан-3-ил)-(бензо[4,5]имидазо[1,2-а]пиримидин-2-ила) ([18F][B])
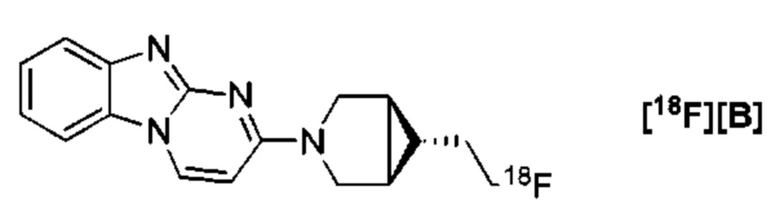
Синтез соединения С-1 был основан на литературной методике. См. Пример 53 в WO 2004/033451, включенном сюда посредством ссылки.
Синтез (1S,5R,6s)-6-(2-(трет-бутилдиметилсилилокси)этил)-3-азабицикло[3.1.0]гексана (С-1) и (1R,5S,6s)-6-(2-(трет-бутилдиметилсилилокси)этил)-3-азабицикло[3.1.0]гексана (С-2)
Стадия 1: бензил 2,5-дигидро-1Н-пиррол-1-карбоксилат (С-4)
Пирролидин (С-3) (46.9 г, 672 ммоль) растворили в ДХМ (700 мл) при 0°С. Cbz-Cl (95.2 г, 560 ммоль) медленно добавили. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 14 часов. Растворитель удалили при пониженном давлении остаток растворили в этилацетате. Этилацетатный раствор промыли 0.5 н HCl два раза, насыщенным раствором бикарбоната натрия, и солевым раствором. Затем его высушили над MgSO4 и отфильтровали. Фильтрат удалили при пониженном давлении и остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 5:1 РЕ/ЕА с получением соединения, указанного в заголовке (46.0 г, 40%), в виде желтого масла. MS-ESI: [М+Н]+ 204.3
Стадия 2: 3-бензил 6-этил (1R,5S,6s)-3-азабицикло3.1.0гексан-3,6-дикарбоксилат (С-5) и 3-бензил 6-этил (1R,5S,6s)-3-азабицикло3.1.0гексан-3,6-дикарбоксилат (С-6)
Раствор этилдиазоацетата (93 мл) в дихлорэтане (720 мл) медленно добавили (в течение 5 ч) к смеси бензил 3-пироллин-карбоксилата (С-4) (36.0 мг) и ацетата родия(II) (1.27 г) в дихлорэтане (360 мл). Смесь нагревали при 80°С в течение 5 часов. Растворитель эвапорировали при пониженном давлении. Остаток растворили в 1:1 гептан/ЕА и отфильтровали через нейтральный оксид алюминия. Фильтрат эвапорировали при пониженном давлении и остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 3:1 гептан/ЕА (от 3/1 до 2/1) с получением соединений, указанных в заголовке: С-5 (18.0 г, 35%) и С-6 (10.0 г, 19%).
MS-ESI: [М+Н]+ 290.1
Стадия 3: (1R,5S,6r)-бензил-6-(гидроксиметил)-3-азабицикло3.1.0гексан-3-карбоксилат (С-7)
При 0°С в раствор 3-бензил 6-этил (1R,5S,6r)-3-азабицикло3.1.0гексан-3,6-дикарбоксилата (С-5) (31.8 г, 110 ммоль) в ТГФ (110 мл) добавили раствор ВН3. ТГФ комплекса (1 М в ТГФ, 275 мл, 275 ммоль). Смесь перемешивали при 65°С в течение 2 часов. Реакционной смеси дали остыть до комнатной температуры и растворитель удалили при пониженном давлении. Солевой раствор и ДХМ добавили и слои разделили. Водный слой подкислили до рН 5 с помощью 1 М раствора HCl и экстрагировали дважды с помощью ДХМ. Объединенный органический слой высушили над MgSO4, отфильтровали, и эвапорировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 1:1 РЕ/ЕА с получением соединения, указанного в заголовке (24.0 г, 80%) в виде бесцветного масла.
MS-ESI: [М+Н]+ 248.1
Стадия 4: (1R,5S,6r)-бензил 6-формил-3-азабицикло3.1.0гексан-3-карбоксилат (С-8)
К раствору (1R,5S,6r)-бензил 6-(гидроксиметил)-3-азабицикло3.1.0гексан-3-карбоксилата (С-7) (22.2 г, 90 ммоль) в дихлорметане (1 L) добавили периодинан Десса-Мартина (76.32 г, 180 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов и погасили с помощью водного раствора Na2S2O3. Затем ее экстрагировали дважды дихлорметаном. Объединенный экстракт промыли солевым раствором и насыщенным раствором NaHCO3. Органический слой высушили над MgSO4, отфильтровали, и эвапорировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 5:1 РЕ/ЕА с получением соединения, указанного в заголовке (19.0 г, 80%), в виде бесцветного масла.
MS-ESI: [М+Н]+ 246.1
Стадия 5: (1S,5R,6s)-бензид 6-винил-3-азабицикло3.1.0гексан-3-карбоксилат (С-9)
К суспензии метилтрифенилфосфония бромида (34.6 г, 97.2 ммоль) в ТГФ (80 мл) при 0°С в атмосфере N2 добавили KHMDS (1.0 М в ТГФ, 97.2 мл, 97.2 ммоль) по каплям. Смесь оставили перемешиваться при комнатной температуре в течение 1 часа и затем охладили до -78°С. Раствор of (1R,5S,6r)-бензил 6-формил-3-азабицикло3.1.0гексан-3-карбоксилата (С-8) (11.9 г, 48.6 ммоль) в безводном ТГФ (160 мл) медленно добавили. Смесь нагревали до -10°С и перемешивали в течение 1 часа. Затем ее погасили насыщенным раствором NH4Cl, экстрагировали дважды с помощью этилацетата, высушили над MgSO4, отфильтровали, и сконцентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией EtOAc/РЕ (10% до 20) с получением соединения, указанного в заголовке (8.0 г, 67%).
MS-ESI: [М+Н]+ 244.1
Стадия 6: (1S,5R,6s)-бензил 6-(2-гидроксиэтил)-3-азабицикло3.1.0гексан-3-карбоксилат (С-10)
К раствору (1S,5R,6s)-бензил 6-винил-3-азабицикло3.1.0гексан-3-карбоксилата (С-9) (11.0 г, 45 ммоль) в ТГФ (120 мл), охлажденному до 0°С, добавили раствор ВН3. ТГФ комплекса (1 M в ТГФ, 67.5 мл, 67.5 ммоль) и смесь перемешивали в течение 30 минут. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 1 часа. Затем ее снова охладили до 0°С и осторожно обработали раствором 3 н NaOH (37.5 мл), с последующим добавлением H2O2 (30% раствор, 45 мл). Получившуюся смесь нагревали до 65°С и перемешивали в течение 2 часов. Затем ей дали остыть до комнатной температуры и растворитель удалили под вакуумом. Солевой раствор и этилацетат добавили и слои разделили. Водный слой подкислили до рН 5 с помощью 1 М раствора HCl и экстрагировали дважды с помощью этилацетата. Объединенный органический слой высушили над MgSO4, отфильтровали, и сконцентрировали при пониженном давлении с получением неочищенного спирта, который использовали на следующей стадии без дополнительной очистки.
MS-ESI: [М+Н]+ 262.1
Стадия 7: 2-((1S,5R,6s)-3-азабицикло3.1.0гексан-6-ил)этанол (С-1)
К раствору (1S,5R,6s)-бензил 6-(2-гидроксиэтил)-3-азабицикло3.1.0гексан-3-карбоксилата (С-10) (7.44 г, 28.5 ммоль) в МеОН (200 мл) добавили палладий на угле (10%, 2.23 г). Колбу заполнили газообразным водородом и перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь затем отфильтровали через слои целита и фильтрат сконцентрировали при пониженном давлении с получением неочищенного соединения, указанного в заголовке, которое очистили посредством основанной на массе обратно-фазовой препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде желтого масла (2.7 г, 75%).
MS-ESI: [М+Н]+ 128.3
1Н NMR (500 MHz, CDCl3) δ 4.30 (br s, 2Н), 3.70-3.67 (m, 2Н), 3.24-3.21 (m, 2Н), 3.11-3.08 (m, 2Н), 1.53-1.49 (m, 2Н), 1.41-1.39 (m, 2Н), 0.92-0.90 (m, 1Н).
Стадия 8: (1R,5S,6s)-6-(2-(трет-бутилдиметилсилилокси)этил)-3-азабицикло[3.1.0]гексан (С-2)
При 0°С в раствор 2-((1S,5R,6s)-3-азабицикло[3.1.0]гексан-6-ил)этанола (С-1) (1.27 г, 10 ммоль) в безводном ДМФ (30 мл) добавили имидазол (1.7 г, 25 ммоль) и трет-бутилдиметилсилилхлорид (1.95 г, 13 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Добавили этилацетат и раствор промыли солевым раствором, 1 М раствором HCl, высушили над MgSO4), отфильтровали, и сконцентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 200:1 этилацетат/Et3N с получением соединения, указанного в заголовке (1.18 г, 49%), в виде бесцветного масла.
MS-ESI: [М+Н]+ 242.1
1Н NMR (500 MHz, DMSO-d6) δ 3.57 (t, J=8.0 Hz, 2H), 2.78-2.76 (m, 2H), 2.62-2.60 (m, 2H), 1.38-1.35 (m, 2H), 1.11-1.09 (m, 2H), 0.86 (s, 9H), 0.61-0.59 (m, 1H), 0.02 (s, 6H).
Синтез 2-((1S,5R,6r)-3-азабицикло[3.1.0]гексан-6-ил)этанола (D-1)
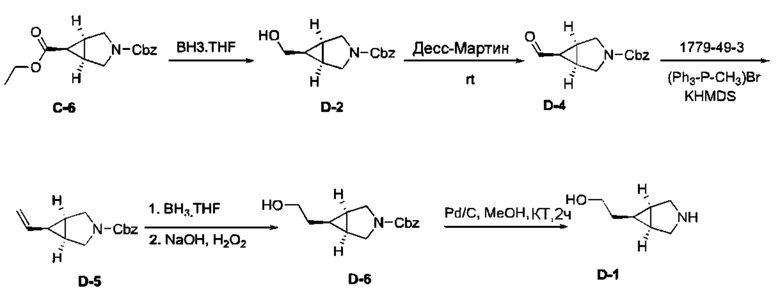
Стадия 1: (1R,5S,6s)-бензил 6-(гидроксиметил)-3-азабицикло3.1.0гексан-3-карбоксилат (D-2)
К раствору (1R,5S,sr)-3-бензил 6-этил 3-аза-бицикло[3.1.0]гексан-3,6-дикарбоксилата (С-6) (10.0 г, 34.6 ммоль) в ТГФ (50 мл) при 0°С добавили раствор ВН3. ТГФ комплекса (1 М в ТГФ, 70 мл, 70 ммоль). Реакционную смесь перемешивали при 65°С в течение 2 часов. Реакционной смеси дали остыть до комнатной температуры и растворитель удалили при пониженном давлении. К остатку добавили солевой раствор и ДХМ. Слои получившейся смеси разделили. Водный слой подкислили до рН 5 с помощью 1 М раствора HCl и экстрагировали дважды с помощью ДХМ. Объединенный органический экстракт высушили над MgSO4, отфильтровали, и эвапорировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 1:1 РЕ/ЕА с получением соединения, указанного в заголовке (6.4 г, 75%), в виде бесцветного масла.
MS-ESI: [М+Н]+ 248.1
Стадия 2: (1R,5S,6s)-бензил 6-формил-3-азабицикло[3.1.0]гексан-3-карбоксилат (D-4)
К раствору (1R,5S,6s)-бензил 6-(гидроксиметил)-3-азабицикло[3.1.0]гексан-3-карбоксилата (D-2) (11.1 г, 45 ммоль) в дихлорметане (0.5 л) добавили периодинан Десса-Мартина (38.2 г, 90 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь погасили водным раствором Na2S2O3, экстрагировали дважды дихлорметаном. Объединенный экстракт промыли солевым раствором и насыщенным раствором NaHCO3, высушили над MgSO4, отфильтровали, и эвапорировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией 5:1 РЕ/ЕА с получением соединения, указанного в заголовке (9.0 г, 76%), в виде бесцветного масла.
MS-ESI: [М+Н]+ 246.1
Стадия 3: (1S,5R,6r)-бензил 6-винил-3-азабицикло[3.1.0]гексан-3-карбоксилат (D-5)
К суспензии метилтрифенилфосфония бромида (23.1 г, 65 ммоль) в ТГФ (60 мл) при 0°С в атмосфере N2 добавили [KHMDS] (1.0 М в ТГФ, 65 мл, 65 ммоль) по каплям. Смесь оставили перемешиваться при комнатной температуре в течение 1 часа и затем охладили до -78°С. Раствор (1R,5S,6s)-бензил 6-формил-3-азабицикло[3.1.0]гексан-3-карбоксилата (D-4) (8.0 г, 32.4 ммоль) в безводном ТГФ (100 мл) медленно добавили и смесь нагрели до -10°С и перемешивали в течение 1 часа. Реакционную смесь погасили насыщенным раствором NH4Cl и эвапорировали при пониженном давлении. Остаток экстрагировали дважды с помощью этилацетата, высушили над MgSO4, отфильтровали, и сконцентрировали при пониженном давлении. Остаток очистили посредством колоночной хроматографии на силикагеле с элюцией EtOAc/гексаны (10% до 20%) с получением соединения, указанного в заголовке (5.3 г, 66%).
MS-ESI: [М+Н]+ 244.1
Стадия 4: (1S,5R,6r)-бензил 6-(2-гидроксиэтил)-3-азабицикло[3.1.0]гексан-3-карбоксилат (D-6)
К раствору (1S,5R,6r)-бензил 6-винил-3-азабицикло[3.1.0]гексан-3-карбоксилата (D-5) (5.3 г, 21.7 ммоль) в ТГФ (60 мл), охлажденном при 0°С добавили раствор ВН3. ТГФ комплекса (1 М в ТГФ, 32.5 мл, 32.5 ммоль). Смесь перемешивали в течение 30 минут. Реакционной смеси дали нагреться до комнатной температуры и перемешивали в течение 1 часа. Затем ее снова охладили до 0°С. Смесь осторожно обработали 3н раствором NaOH (18.1 мл), с последующим добавлением H2O2 (30 процентный раствор, 22 мл). Получившуюся смесь перемешивали при 65°С в течение 2 часов. Реакционной смеси дали остыть до комнатной температуры и растворитель удалили при пониженном давлении. К остатку добавили солевой раствор и этилацетат. Слои получившейся смеси разделили. Водный слой подкислили с помощью 1 М раствора HCl до рН 5, экстрагировали дважды с помощью этилацетата, высушили над MgSO4, отфильтровали, и сконцентрировали при пониженном давлении с получением неочищенного соединения, указанного в заголовке, которое использовали на следующей стадии без дополнительной очистки.
MS-ESI: [М+Н]+ 262.1
Стадия 5: 2-((1S,5R,6r)-3-азабицикло[3.1.0.]гексан-6-ил)этанол (D-1)
К раствору (1S,5R,6r)-бензил 6-(2-гидроксиэтил)-3-азабицикло[3.1.0]гексан-3-карбоксилата (D-6) (3.72 г, 14.25 ммоль) в МеОН (100 мл) добавили палладий на угле (10 процентный, 1.13 г). Колбу заполнили газообразным водородом и перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь затем отфильтровали через слои целита. Фильтрат сконцентрировали при пониженном давлении с получением неочищенного соединения, указанного в заголовке, которое очистили посредством основанной на массе обратно-фазовой препаративной ВЭЖХ с получением целевого соединения в виде осадка.
MS-ESI: [М+Н]+ 128.3
1Н NMR (500 MHz, DMSO-d6) δ 5.8-5.0 (br s, 2Н), 3.47-3.43 (m, 2Н), 3.38-3.36 (m, 1Н), 3.23-3.21 (m, 1Н), 3.00-2.98 (m, 1Н), 2.82-2.79 (m, 1Н), 1.55-1.53 (m, 1Н), 1.48-1.45 (m, 2Н), 1.28-1.24 (m, 1Н), 0.88-0.79 (m, 1Н).
Соединения В-2, В-3, и В-4 синтезировали с использованием методик, аналогичных тем, которые описаны выше, со следующим выходом и аналитическими характеристиками.
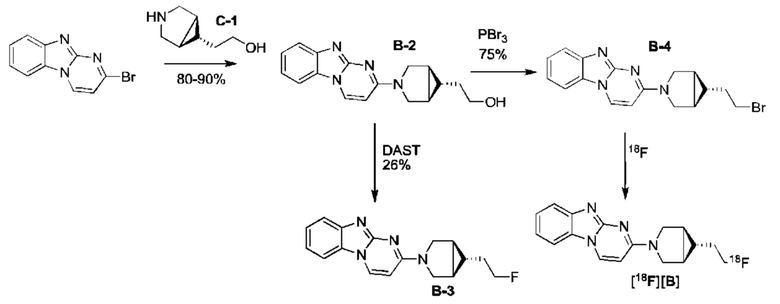
Соединение В-2 Желтый осадок, выход 80-90%. ЖХМС 295.25 @ 0.82 мин >99%. NMR DMSO-d6 400 MHz 9.06 (d, 1Н), 8.06 (d, 1Н), 7.54 (d, 1Н), 7.42 (t, 1Н), 7.31 (t, 1Н), 6.73 (d, 1Н), 4.47 (bs, 1Н), 3.87 (dd, 2Н), 3.66 (m, 2Н), 3.48 (t, 2Н), 1.60 (m, 2Н), 1.43 (dq, 2Н), 0.63 (m, 1Н)
Соединение В-3 (охлажденный стандарт) Белый осадок, выход 26%.ЖХМС 297.59 @ 0.87 мин >99%. NMR 300 MHz DMSO-d6 1Н 8.95 (d, 1Н), 7.95 (d, 1Н), 7.50 (d, 1H), 7.30 (dt, 1H), 7.17 (dt, 1H), 6.54 (d, 1H), 4.59, 4.43 (dt, 2H), 3.7-4.0 (m, 2H), 3.5-3.7 (m, 2H), 1.55-1.8 (m, 4H), 0.64 (m, 1H). 19F - 216.62
Соединение В-4 (предшественник) Белый осадок, выход 75%. ЖХМС: 357.26 359.25 @ 1.03 min >99%. NMR 400 MHz DMSO-d4 8.94 (d, 1Н), 7.93 (d, 1Н), 7.50 (d, 1Н), 7.29 (dd, 1Н), 7.14 (dd, 1Н), 6.51 (d, 1Н), 3.90-3.80 (m, 2Н), 3.59 (t, 2Н), 3.50-3.70 (m, 2Н), 1.83 (dd, 2Н), 1.67 (m, 2Н), 0.71 (m, 1Н)
[18F][B] может быть получен в аналогичных для мечения условиях, как описано выше, с выходом 5-10% с поправкой на разложение.
Возможный синтез [18F][B]-d2
Окисление аминоспирта до аминокислоты С-1
H2IO6 (85 мг) суспендируют в воде (1 мл) и ацетонитриле (1 мл) и энергично перемешивают в течение 15 мин. Аминоспирт (50 мг) добавили с последующим добавлением хлорхромата пиридина (5 мг). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и конечный продукт выделяют.
Способ Вос-защиты аминокислоты 2-1
К раствору соединения С-1 в ДХМ добавляют трет-бутилоксикарбонила ангидрид (1.5 экв.) и DIEA (3 экв.) при 0°С. Смеси дают нагреться до комнатной температуры и перемешивают до завершения реакции.
Синтез метилового эфира 3-1
Свежеприготовленный раствор диазометана в эфире (набор Diazald) добавили в раствор соединения 2-2 в диоксане при комнатной температуре. Взаимодействие контролируют и дополнительное количество диазометанового раствора добавляют для завершения конверсии соединения 2-2 в метиловый эфир.
Синтез дидейтериоаминоспирта 4-1
Метиловый эфир (Соединение 3-1) восстанавливают с помощью LiAlD4 до дейтерированного спирта и проводят депротекцию с помощью ТФУ с получением Соединения 4-1, как описано выше.
Оставшиеся стадии являются такими же, как показано для [18F][A]-d2.
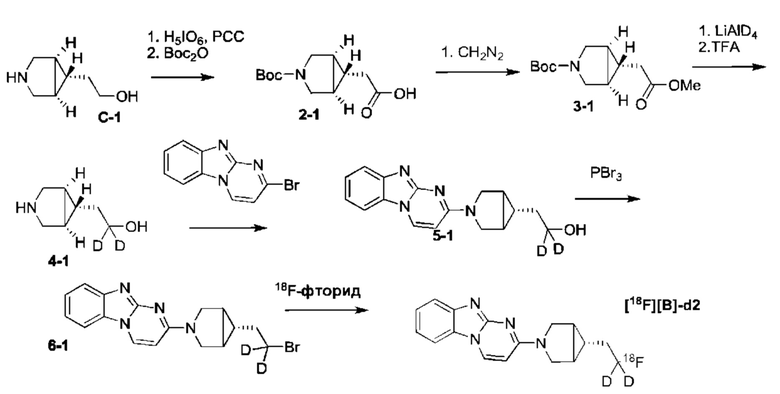
Синтез дополнительных соединений
С использованием методик, аналогичных тем, которые описаны в настоящем изобретении, также могут быть получены следующие соединения формулы (I):
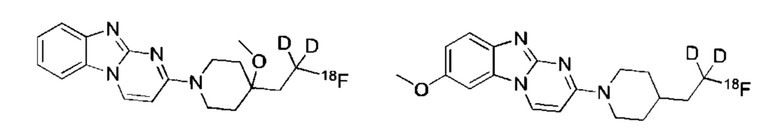
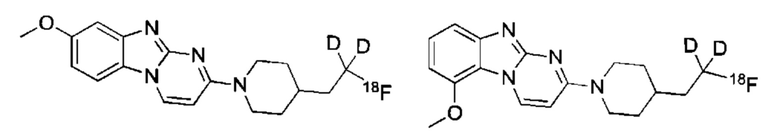
Пример 6. Биологическая оценка
Авторадиография Трейсер [18F][A] или [18F][A]-d2 растворили в ФСБ, содержащем 5% ДМСО и 5% этанол в конечной концентрации 40 мкКи/мл. Затем 0.5 мл стокового раствора перенесли на предметное стекло с свежевысушенным срезом ткани 5 мкм толщины и инкубировали в течение 90 мин при комнатной температуре. Слайды промыли погружением в следующие растворы: ФСБ в течение 1 мин, 70% этанол 2 мин, 30% этанол 2 мин и ФСБ 1 мин. Образцы высушили при комнатной температуре в течение 30 мин и экспонировали на планшетах для фосфоимейджера в течение 20 ч. Экспонированные планшеты сканировали при разрешении 25 мкм.
МикроПЭТ визуализация
Визуализация ПЭТ проводилась на сканере Inveon РЕТ/СТ (Siemens Medical Solutions USA Inc.). Животных, подверженных анестезии севофлураном, помещали головой вперед на животе на койку для сканера и запускали динамичное 45 минутное сканирование. Приблизительно 3.7 МБк 18F-радиомеченного трейсера в изотоническом растворе (100-130 мкл) вводили в виде 60 секундной внутривенной инфузии через хвостовую вену. Температуру тела измеряли ректально и поддерживали теплым потоком воздуха при 37°С. Повторяющиеся реконструкции изображения всего тела получили с использованием эмпирического алгоритма (MAP, гиперпараметр β 0.05) и корректировали для затухания сигнала с использованием плотности ткани, полученной на СТ. Проекции создавались с помощью PMOD 3.305 (PMOD Technologies, Ltd., Zurich, Switzerland) и применялись для получения количественных уровней активности в еаСН интересующем органе и использованием анализа интересующего региона.
Анализ стабильности микросом Трейсер [18F][A]-d2 или [18F][A] растворили в фосфат-калийном буфере (Kpi) (100 мМ) при концентрации 500-600 мкКи/мл. Нерадиоактивные соединения 7 и 10 растворили в буфере Kpi при концентрации 10 мкМ. Реакционную пробирку заполнили суспензией микросом человека или мыши (12.5 мкл, 20 мг/мл) с последующим буфером Kpi (388 мкл, 10 мМ), NADPH (50 мкл, 10 мМ) и инкубировали при 37°С в течение 5-10 мин. Раствор радиоактивного [18F][A]-d2 или [18F][A] (50 мкл, 250-300 мкКи) или нерадиоактивного соединения 7 или 8 (50 мкл, 10 мкМ) добавили в реакционную пробирку и смесь инкубировали при 37°С. Аликвоты (50 мкл) реакционной смеси отобрали через 5, 15 и 45 минут после добавления тестовых соединений, смешали с охлажденным на льду ацетонитрилом (100 мкл) и центрифугировали. Супернатант анализировали с помощью ЖХМС, Система Е).
Статистический анализ
Статистический анализ проводили и точки формировали с помощью программного обеспечения R версии 2.10.1 (R Foundation for Statistical Computing, Vienna, Austria). Статистическая достоверность определялась с использованием т-теста Стьюдента и значения р менее чем 0.05 считалось достоверным. Все данные представлены как среднее ± стандартное отклонение.
Результаты и обсуждение
Оба [18F][A] и [18F][A]-d2 получили за одну стадию с использованием полученного in-situ [18F]TBAF. После ВЭЖХ очистки, [18F][A]-d2 получили с 7% радиохимическим выходом в течение 90 минут (n=4) с коррекцией затухания; [18F][A] получили с 12% выходом в течение 96 мин (n=9). Радиохимическая чистота обоих трейсеров была больше 99% и специфическая активность находилась в диапазоне 70-110 Ки/мкмоль.
Авторадиографическая оценка [18F][A] и [18F][A]-d2 проводилась с использованием мозговых тканей, собранных посмертно от людей-доноров. Оба соединения, [18F][A] и [18F][A]-d2, показали идентичный паттерны связывания с tau (Фиг. 1). Положительная окраска обнаружена в сером веществе тканей, содержащих высокий уровень нейрофибриллярных клубков и высокий Аβ-аамилоида, характеризуемый 5 по шкале Браака. Ткани отрицательного контроля, содержащие высокий или умеренный уровень Аβ-амилоида, но не нейрофибриллярных клубков с оценкой 3 или 2 по шкале Браака, не окрашивались положительно ни [18F][A], ни [18F][A]-d2. Нагрузка нейрофибриллярными клубками или Аβ-амилоидом измерялась стандартными иммуногистохимическими способами.
Метаболическая стабильность и образование [18F]F- оценивалась in vitro с использованием микросом печени человека или мыши (Tipre, D. N, et al., J. Nucl. Med. 2006 47 (2), 345-53). Более медленный метаболизм [А] в анализе микросом печени человека по сравнению с мышами был показан для обоих соединений, метаболизм [А] является зависимым от NADPH, указывая на возможное участие ферментов цитохрома Р450 (Zhang, W., et al., J. Alzheimer's Disease:JAD 2012 31 (3), 601-12). Сравнение нерадиомеченых [А] и [A]-d2 в анализе микросом печени показало более высокую стабильность [A]-d2 по сравнению с [А] как в микросомах печени человека, так и микросомах печени мыши. Метаболизм [А] и [A]-d2 в микросомах печени мыши очень быстрый, фракция неметаболизированного соединения [А] уменьшалась до 2% за 5 мин при этом количество [A]-d2 составляло 11% (Фиг. 3В) В микросомах печени человека количество оставшегося [А] составляло 15% через 40 мин, а количество [A]-d2 все еще составляло 56% (Фиг. 3А). Метаболизм обоих [А] и [A]-d2 был зависимым от NADPH, предполагая участие ферментов цитохрома Р450.
Радиомеченые трейсеры [18F][A] и [18F][A]-d2 (n=3) также инкубировались с суспензиями микросом печени человека или мыши с или без NADPH при 37°С и смесь анализировали на присутствие радиоактивных метаболитов через 5, 15 и 45 мин (Фиг. 2). В присутствии микросом печени мыши оба [18F][A] и [18F][A]-d2 быстро метаболизировали до 18F-фторида (время задержки (rt)=0.38 мин), и двух радиоактивных метаболита М2 и М1 (rt=1.2 и 1.4 мин). Превращение [18F][A] и [18F][A]-d2 в М2 и М1 было очень быстрым и количество родительского соединения (rt=1.5 мин) составляло только 1.6±0.9% и 2.0±0.3 соответственно (Фиг. 2D) через 5 минут. Через 45 минут количество образованного [18F]F- из [18F][A] (50.1±12.9%) было достоверно (р=0.035) выше по сравнению с количеством [18F]F- образованного из [18F][A]-d2 (13.8±2.4%) (Фиг. 2В). В присутствии микросом печени человека конверсия обоих трейсеров в [18F]F-, М1 и М2 была медленнее, чем в микросомах печени мыши. Несмотря на это [18F][A] все еще метаболизировался более быстро, чем дидейтерированный [18F][A]-d2. Через 45 мин инкубации с микросомами печени человека фракция, относящаяся к родительскому соединению ([18F][A]) составляла 35.7±0.9%, а фракция радиоактивности, относящаяся к [18F][A]-d2 составляла 91.7±0.21% (Фиг. 2С). Количество [18F]F- составляло 36.7±2.7% в случае [18F][A] при этом не было детектировано [18F]F- в качестве продукта метаболизма [18F][A]-d2 в микросомах печени человека через 45 минут (Фиг. 2А).
Динамическую ПЭТ визуализацию у мышей (n=6) использовали для оценки свойств in vivo соединений [18F][A] и [18F][A]-d2. Поглощение обоих трейсеров было одинаковым в печени и почках (Фиг. 4Е, 4D). Пик поглощения в мозге (8.3±2.0 и 7.4±2.2% ID/г) достоверно не отличался между трейсерами (р=0.444) (Фиг. 4С) также как и сигнал из крови, полученный целого сердца (Фиг. 4В). Однако мыши, которым инъецировали [18F][A]-d2 показали существенное (р=1.19×10-4) снижение поглощения костями (14.3±1.7% ID/г) через 30-45 мин после инъекции трейсера по сравнению с поглощением в костях мышей, инъецированных соединением [А] (31.2±4.8% ID/г) как следствие более медленного ферментативного дефторирования (Фиг. 4А). Проекции максимальной интенсивности (Фиг. 4F) показали улучшения в качестве снимков. Данные ПЭТ визуализации полностью согласовывались с результатами сравнения [18F][A] и [18F][A]-d2 in vitro с использованием микросом печени мышей. В in vitro эксперименте замещение геминальных атомов водорода в соединении [18F][A] на дейтерий приводило к 73% снижению образования [18F]F- и снижение поглощения костями, наблюдаемое при in vivo ПЭТ также было близко к 54%.
Сравнение in vitro и in vivo соединений [18F][A]-d2 и [18F][A] предполагает, что [18F][A]-d2 является более метаболически стабильным, приводя к существенному снижению образования [18F]F- по сравнению с [18F][A]. Указанные данные таке демонстрируют, что [A]-d2 метаболизм и образование [18F]F- у человека ожидается более низким, чем у мышей, следовательно [18F][A]-d2 может обеспечить tau-специфичные изображения с существенно сниженным фоном по сравнению с [18F][A] в клинических условиях.
Дополнительные исследования
Радиомеченные трейсеры [18F][A] и [18F][A]-d2 (n=3) инкубировали с суспензиями микросом печени человека, макаки-резус и мышей с или без NADPH при 37°С и смесь анализировали на присутствие радиоактивных метаболитов через 5, 15 и 45 мин. В присутствии микросом печени мышей и макаки-резус оба и [18F][A] и [18F][A]-d2 быстро метаболизировались до 18F-фторида (время задержки (rt)=0.38 мин), и двух радиоактивных метаболитов М2 и М1 (rt=1.2 и 1.4 мин). Конверсия [18F][A] и [18F][A]-d2 в М2 и М1 была очень быстрой и количество родительского соединения (rt=1.5 мин) составляло только 1.6±0.9% и 2.0±0.3, соответственно через 5 мин (Фиг. 7Е) в присутствии микросом печени мыши. Оба соединения были немного более стабильными в микросомах печени макаки-резус (Фиг. 7F). Через 45 мин количество образованного [18F]F- из [18F][A] (50.1±12.9%) было существенно (р=0.035) выше чем количество [18F]F- образованного из [18F][A]-d2 (13.8±2.4%) в микросомах печени мыши (Фиг. 7В) и аналогичный эффект наблюдался в микросомах печени макаки-резус ([18F][A]-d2: 15.4±1.3% против [18F][A]: 46.1±1.0%) (Фиг. 7С). В присутствии микросом печени человека конверсия обоих трейсеров в [18F]F-, М1 и М2 была медленнее, чем в микросомах печени мыши или макаки-резус. Тем не менее, [18F][A] метаболизировался все еще более быстро, чем дидейтерированное соединение [18F][A]-d2. Через 45 мин инкубации с микросомами печени человека фракция, относящаяся к родительскому соединению ([18F][A]) составляла 35.7±0.9%, а радиоактивная фракция, относящаяся к [18F][A]-d2 была существенно выше 67.1±6.3% (р=0.012) (Фиг. 7D). Количество [18F]F- составляло 36.7±2.7% в случае [18F][A] но [18F]F- не детектировался (р=0.002) в качестве продукта метаболизма соединения [18F][A]-d2 в микросомах печени человека через 45 мин (Фиг. 7А).
Оценка микросомальной стабильности в качестве предиктора стабильности in-vivo соединений [18F][A] и [18F][A]-d2 предполагает существенно более высокую метаболическую стабильность соединения [18F][A]-d2 по сравнению с соединением [18F][A] и существенно более низкую скорость образования 18F-фторида у макак-резус и мышей. Неожиданно, 18F-фторид совсем не обнаруживался в качестве метаболита соединения [18F][A]-d2 при использовании микросом печени человека, предполагая гораздо более высокую стабильность соединения [18F][A]-d2 в человеке, чем у мышей или макак-резус.
Эти ПЭТ изображения, полученные у мышей и макак-резус с использованием [18F][A] и [18F][A]-d2 дополнительно подтверждают предсказание in-vitro более низкого образования 18F-фторида, выглядящего как поглощение радиоактивности в минеральных костях в случае соединения [18F][A]-d2 по сравнению с [18F][A].
Введение соединения [18F][A]-d2 приматам
[18F][A]-d2, [18F][A] или 18F Т807 (см. Chien et al., J. Alzheimers Dis, 38:171-84 (2014)) (370 МБк (10 мКи)) вводили внутривенно болюсной инъекцией анестезированным макакам-резус, и получали данные динамической ПЭТ в течение 240 минут. Стандартные значения поглощения ([Радиоактивность]/(инъекционная доза/масса тела)) измерялись в указанных структрах из реконструированных ПЭТ данных (как показано на Фиг. 8А, 8В). Данные собрали от одних и тех же животных, но в различные дни для каждого зонда. Соединение [18F][A]-d2 показало увеличенную стабильность, проявляющуюся в снижении поглощения черепом свободного фторида.
Введение соединения [18F][A]-d2 человеку
Всего 5 субъектов, 3 пациента с болезнью Альцгеймера (БА) и 2 здоровых добровольца (HV) принимали участие в этом исследовании. Протокол данного исследования требует наличия следующих компонентов для каждого субъекта: скрининговая оценка, МРТ, [18F]флорбетапир (только для БА пациентов) и [18F][A]-d2. Методика скрининга включает нейрофизиологическую оценку, основные показатели жизнедеятельности, ЭКГ, объективный осмотр пациента, МРТ, и [18F]флорбетапир ПЭТ визуализацию для подтверждения присутствия отложений амиоида у пациентов, клинически диагностированных как с возможной БА. Кроме того каждый субъект проходил клиническую оценку и анализы клинической безопасности для удостоверения, что субъект был медицински стабилен для завершения протокола исследования. Скрининговые процедуры проводились в течение 30 дней перед визуализацией [18F][A]-d2. Подходящие субъекты принимали участие в одиночной сессии визуализации с помощью [18F][A]-d2. Распределение связывания tau оценивалось для каждой группы субъектов (БА и HV) для анализа связывания с tau. Для каждого пациента с БА сравнивалось распределение Аβ и tau. Связывание tau в мозге оценивалось с помощью ПЭТ с использованием соединения [18F][A]-d2. Связывание радиолиганда сравнивали с HV субъектами, кто обладал от минимальной концентрации до отсутствия tau по сравнению с пациентами с БА, которые, как ожидалось, обладали от умеренной до высокой плотности tau.
Все субъекты, получили одиночную дозу соединения [18F][A]-d2. Субъекты получили болюсную внутривенную инъекцию не более, чем 370 МБк (~10 мКи). Данные, полученные от 3 субъектов, представлены ниже.
Методика визуализации
Снимки получили с использованием камеры HR+ ПЭТ в трехмерном режиме и реконструировали с использованием итеративного алгоритма, включающего поправку на рассеяние и измеренное затухание (источник 68Ge). Динамические изображения получали после инъекции (~370 МБк). Протокол сканирования содержал 2 сканируемых сегмента у двух здоровых контрольных субъектов (НС), Субъекты 1 и 2 (0-120 мин и ~150-180 мин) и 3 сегмента у подверженных БА пациента, Субъекты 3 (0-60 мин, 93-123 мин и 147-177 мин).
Анализ изображений [18F][A]-d2 и предварительный результаты
Объемное MP изображение, суммированное изображение первых 15 мин после введения трейсера [18F][A]-d2 совместно регистрировались с использованием Statistical Parametic Mapping SPM8 (программного обеспечения, предоставленного членами и кллабораторами из Wellcome Trust Centre for Neuroimaging). Выравнивание дополнительных ПЭТ сегментов относительно первого ПЭТ сегмента проводилось с использованием собственной разработки аналитического программного обеспечения, написанного на Matlab® (версия 8 релиз 2014а). Затем с использованием МРТ сканирования для анатомического изображения, интересующие нерегулярные области (ROI) вычерчивались для каждого субъекта в фронтальных долях, теменных долях, затылочных долях, и височных долях, сером веществе мозжечка и белом веществе (полуовальный центр) с использованием программного обеспечения MIM®.
Кривые временной активности в ткани (ТАС) соединения [18F][A]-d2 выражали в SUV (Стандартизированный объем поглощения) с использованием веса каждого субъекта и соответствующей дозы инъецированного трейсера: TAC(SUV) = ТАС(Бк/см3) × 1000 см3/кг × Вес субъекта (кг) / Доза инъекции (Бк). Постройка ТАС и все последующие анализы проводились с использованием собственной разработки аналитического программного обеспечения, написанного на Matlab®.
Отношение к серому веществу мозжечка или отношение стандартизированного объема поглощения (SUVR) рассчитывалось. Фиг. 9 показывает отношение SUVR височных долей к средней длительности цикла у 3 субъектов. Ясное разделение кривых наблюдается как минимум на 30 минуту после инъекции. Кривые SUVR двух здоровых контролей остаются относительно постоянными вскоре после инъекции. SUVR у пациентов с БА достигает плато в интервале от 90 до 120 мин.
Средние значения для интервалов 40-60 мин и 90-120 мин после инъекции трейсера показаны в Таблицах 1 и 2, соответственно. Значения SUVR больше у больных БА, что соотносится с увеличенным количеством tau в мозге.
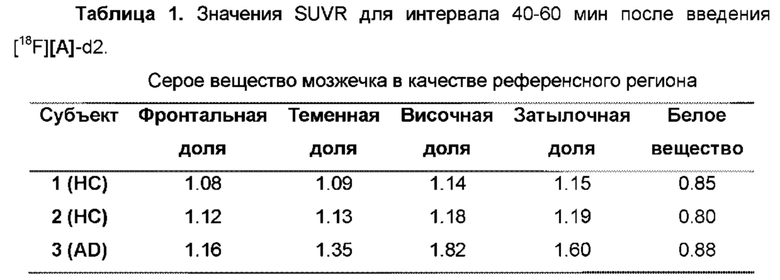
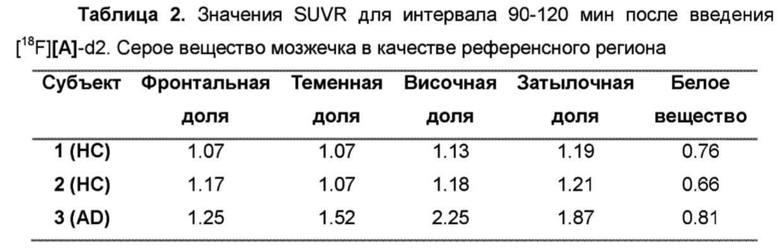
Изображения Фиг. 10, полученные у субъектов 1-3, с использованием соединения [18F][A]-d2 показали отсутствие поглощения радиоактивности костными тканями, как было предсказано анализом стабильности микросом in-vitro. Отсутствие поглощения в черепе предполагает несущественное дефторирование трейсера.
Несмотря на определенное количество описанных воплощений, эти примеры могут быть изменены с получением других воплощений, которые используют описанные здесь соединения и способы. Таким образом, объем настоящего изобретения должен в первую очередь определяться формулой, а не конкретными воплощениями, которые выступают только в качестве примера.
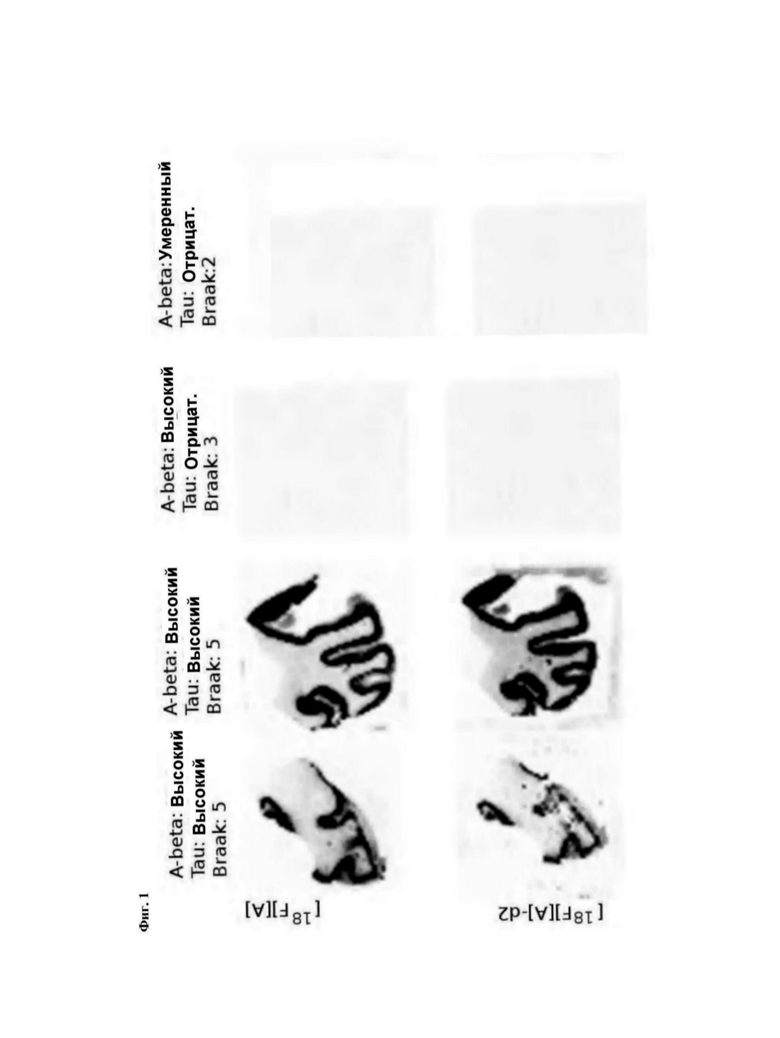
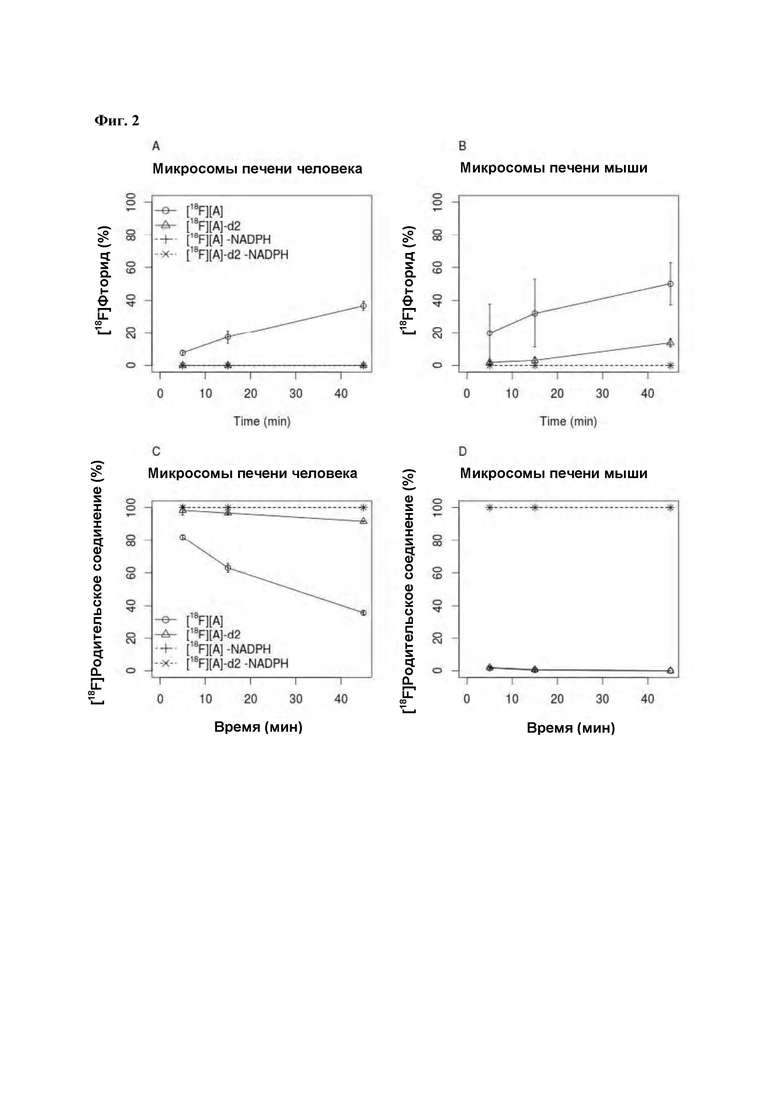
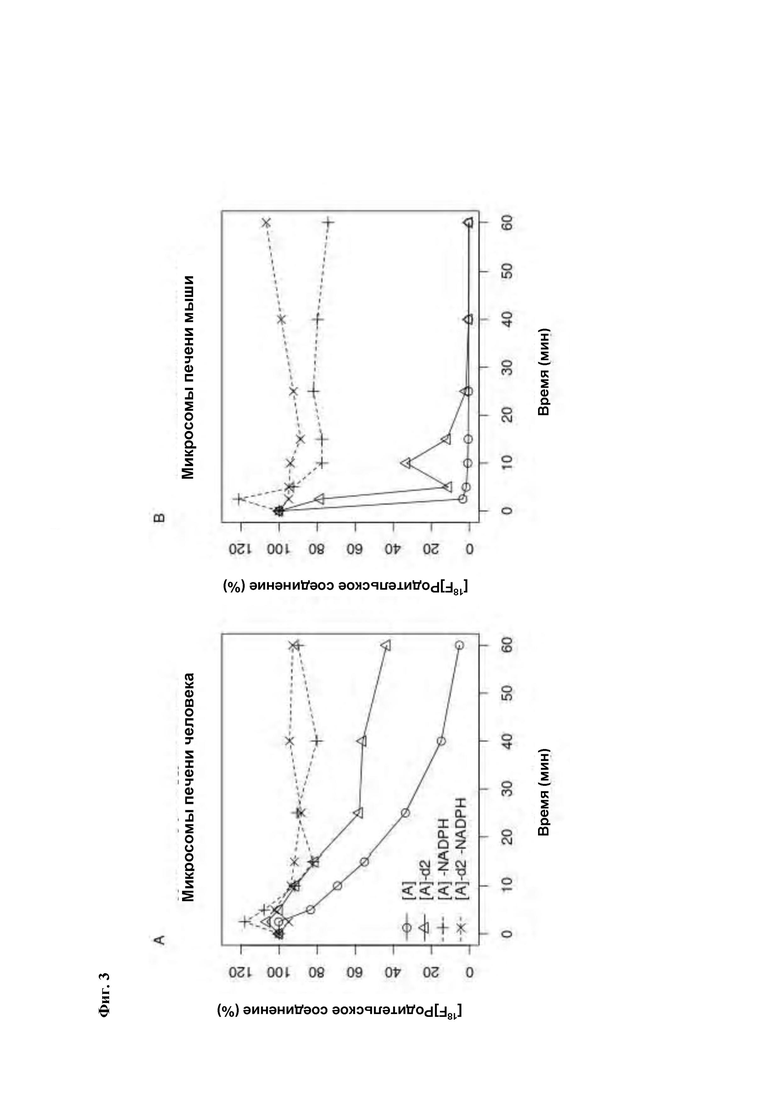
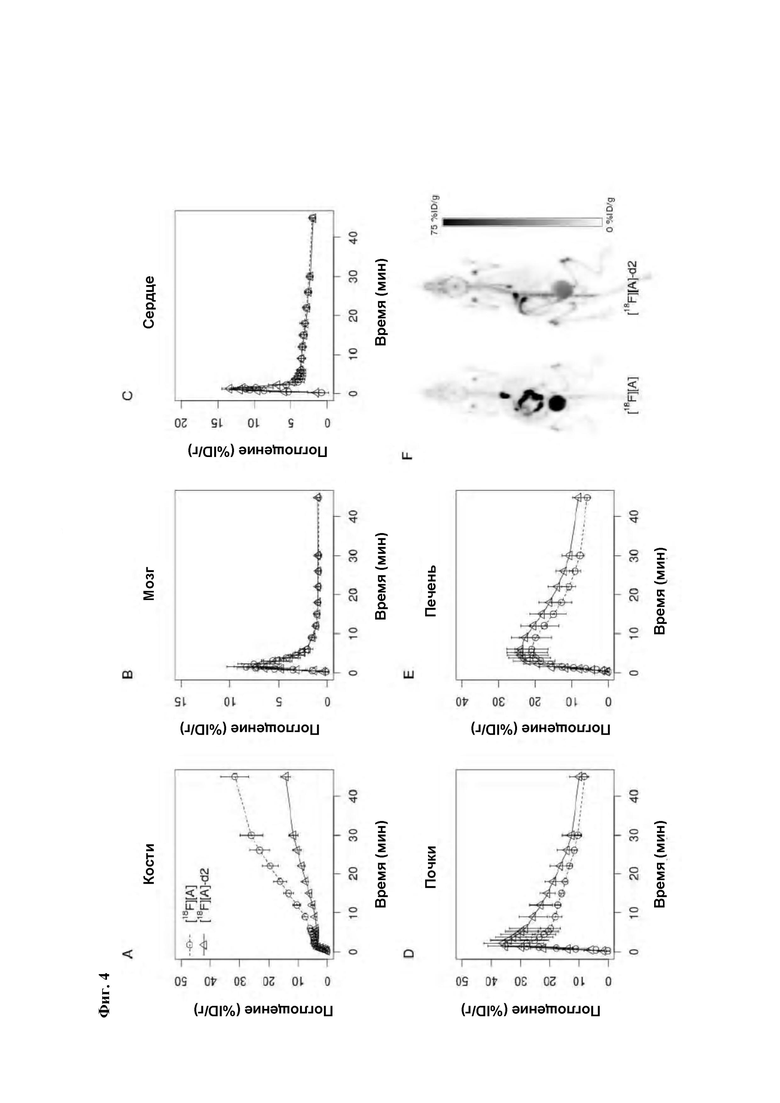
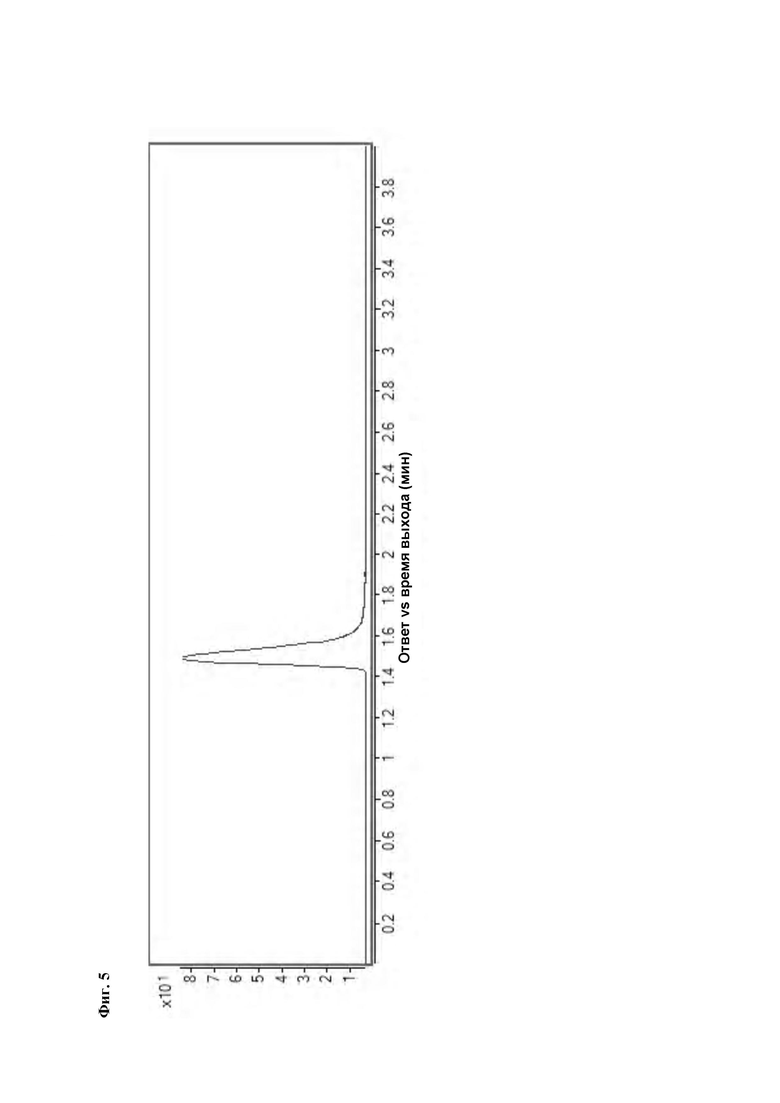
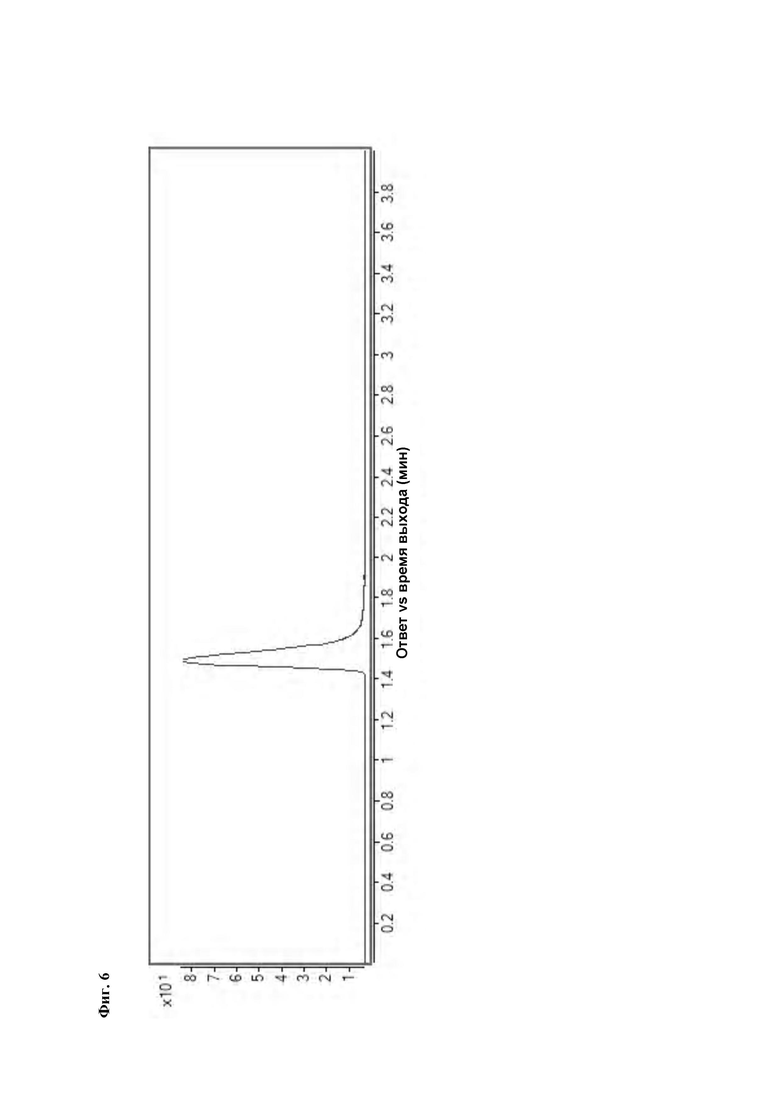
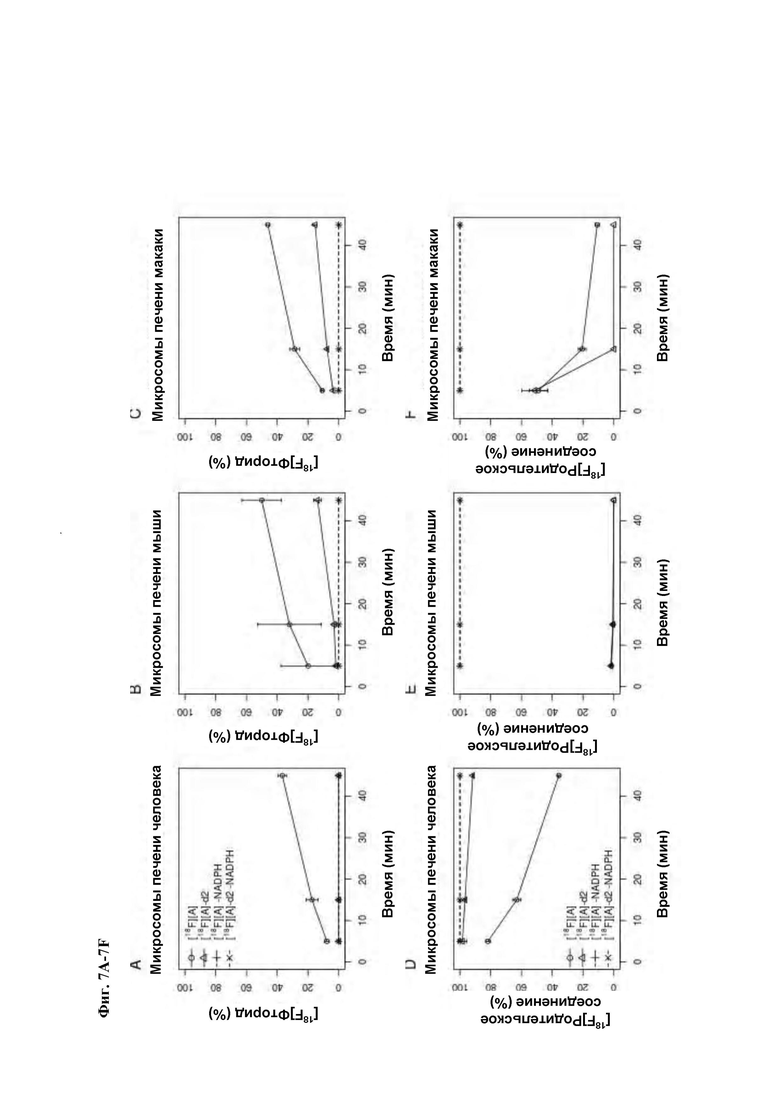
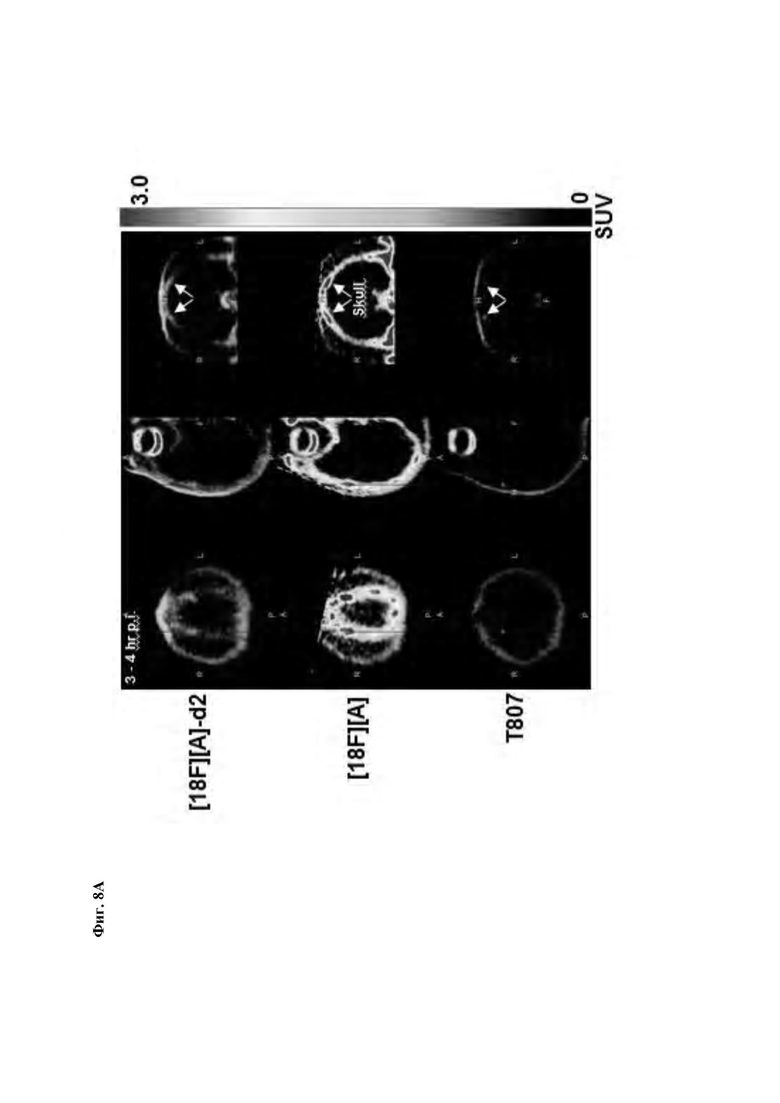
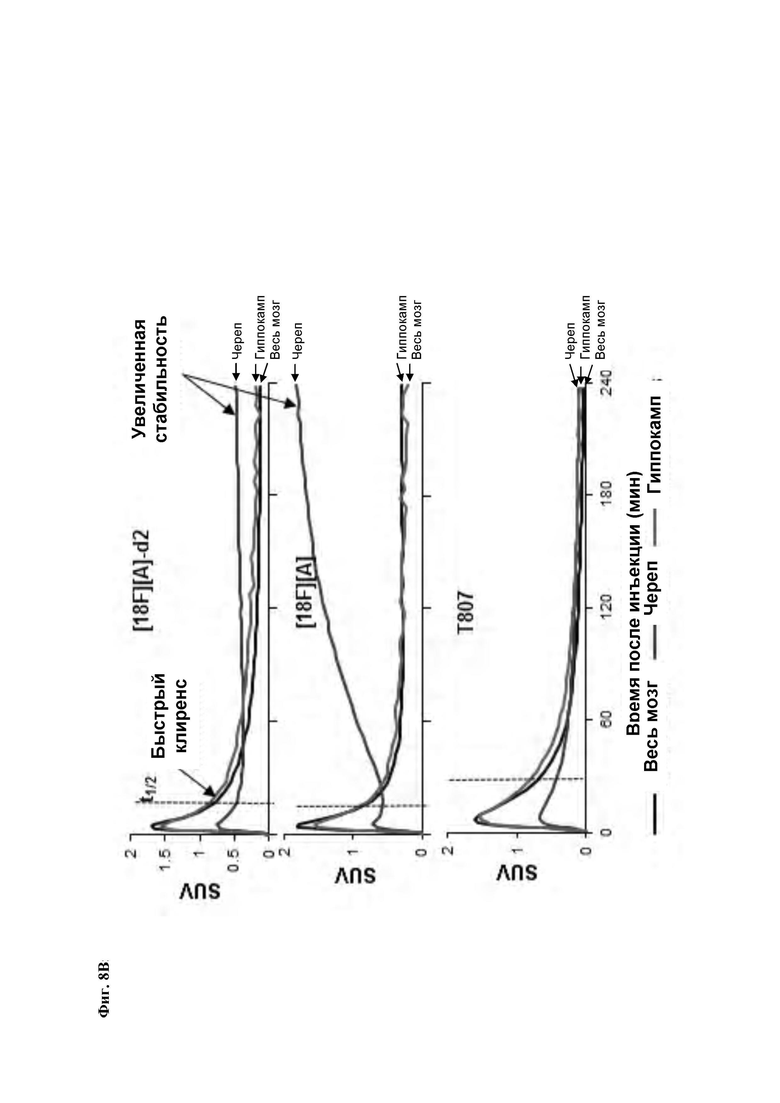
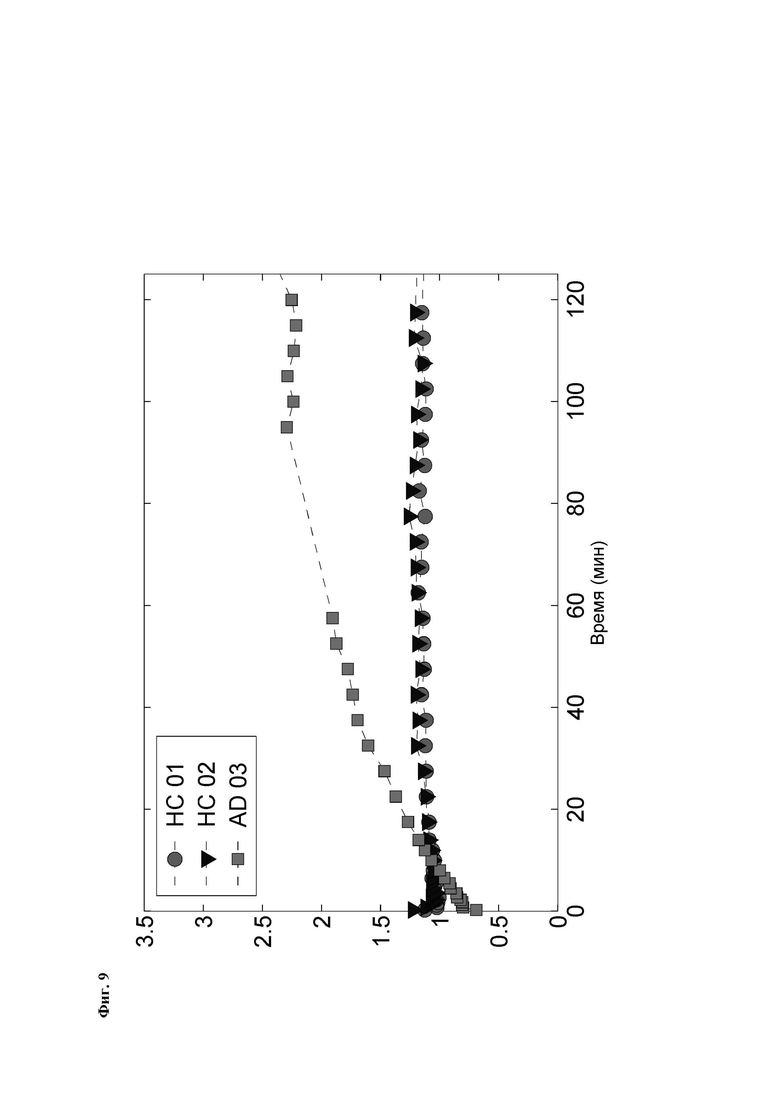
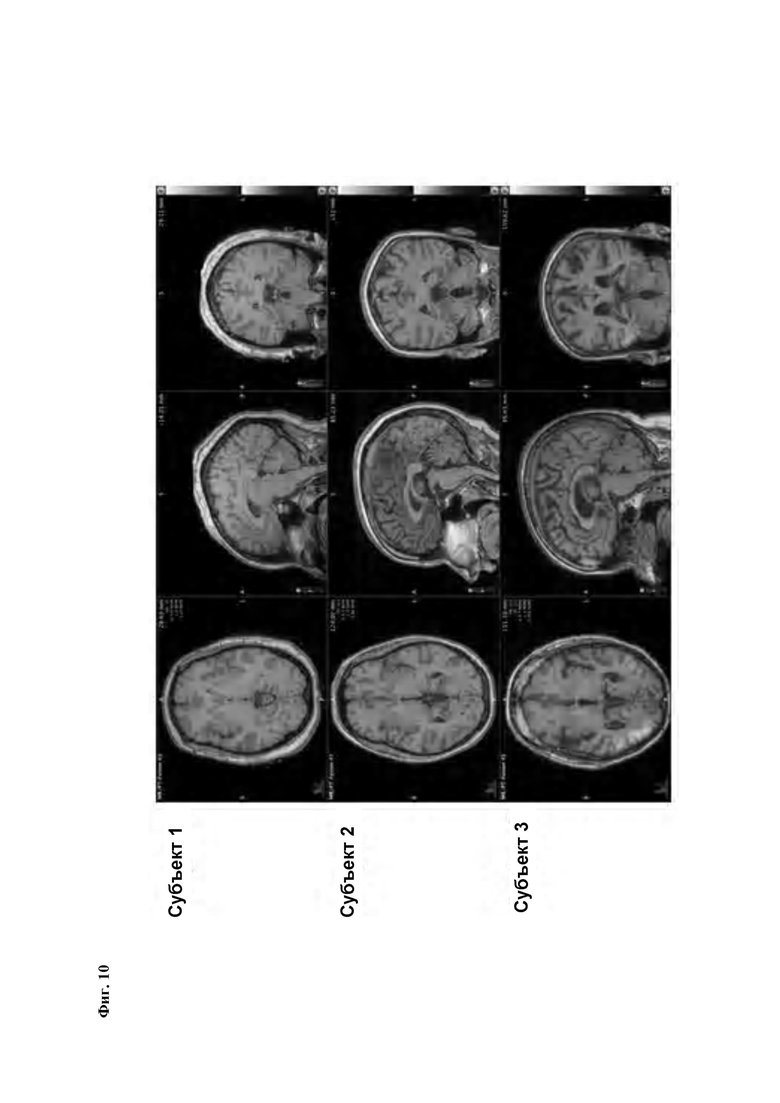
Группа изобретений относится к фармацевтической химии и включает соединение формулы
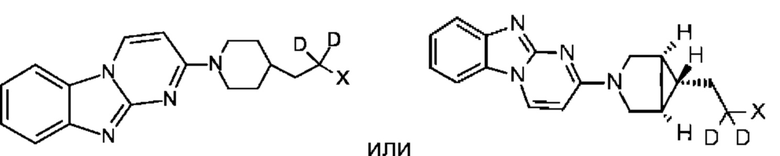 , где X является бромом или гидрокси, а также способ получения соединения формулы (III). Способ осуществляют путем получения бромпроизводного соединения 10, которое далее подвергают 18-F фторированию. В формуле (III) R3 представляет собой группу, выбранную из
, где X является бромом или гидрокси, а также способ получения соединения формулы (III). Способ осуществляют путем получения бромпроизводного соединения 10, которое далее подвергают 18-F фторированию. В формуле (III) R3 представляет собой группу, выбранную из 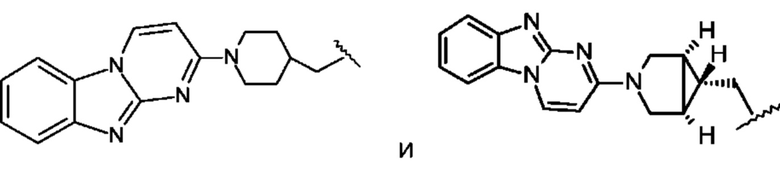 . Технический результат – промежуточные соединения для получения визуализирующего агента для белков tau, обладающего улучшенными характеристиками метаболизма и свойствами стабильности in vivo. 2 н. и 10 з.п. ф-лы, 11 ил., 2 табл., 6 пр.
. Технический результат – промежуточные соединения для получения визуализирующего агента для белков tau, обладающего улучшенными характеристиками метаболизма и свойствами стабильности in vivo. 2 н. и 10 з.п. ф-лы, 11 ил., 2 табл., 6 пр.
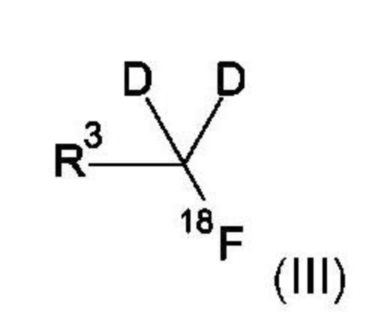
 10
10
1. Соединение, выбранное из:
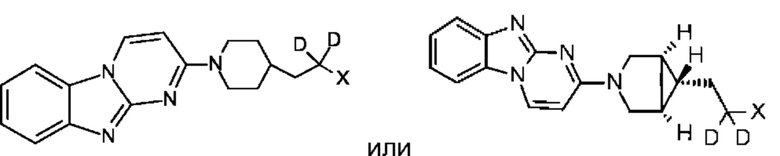
где X обозначает бром или гидрокси.
2. Соединение по п. 1, где X представляет собой гидрокси.
3. Соединение по п. 1, представляющее собой
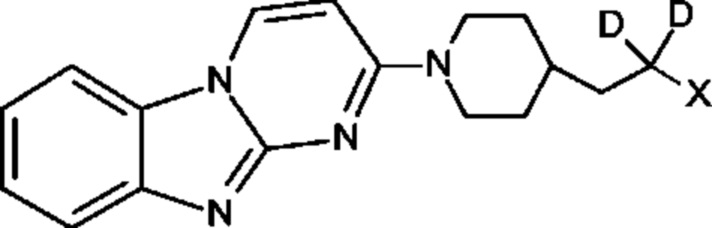
где X представляет собой бром или гидрокси.
4. Соединение по п. 1 или 2, представляющее собой
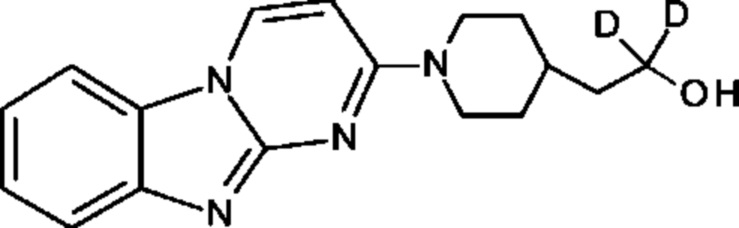 .
.
5. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 3500.
6. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 4000.
7. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 4500.
8. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 5000.
9. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 5500.
10. Соединение по любому из пп. 1-4, в котором каждый дейтерированный атом углерода обладает фактором обогащения изотопом дейтерия по меньшей мере 6000.
11. Способ получения соединения формулы (III)

где R3 представляет собой группу, выбранную из
при котором получают бромпроизводное соединения 10
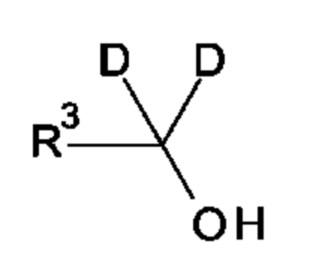 10,
10,
и указанное бромпроизводное далее подвергают 18-F фторированию.
12. Способ по п. 11, где R3 представляет собой
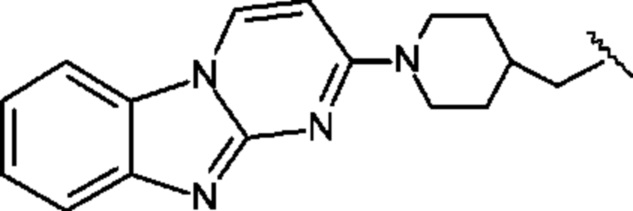 .
.
| ZHANG et al | |||
| A highly selective and specific PET Tracer for imaging of Tau Pathologies | |||
| Journal of Alzheimer's disease, 2012, vol.31, no.3, pp.601-612 | |||
| Gao Mingzhang et al | |||
| Висячий замок с кольцевой поворотной дужкой | 1923 |
|
SU808A1 |
| Bioorganic & Madicinal Chemistry Letters, 2014, 24, pp | |||
Авторы
Даты
2023-03-14—Публикация
2015-05-12—Подача