Настоящее изобретение обеспечивает рекомбинантные антигенсвязывающие области и антитела и функциональные фрагменты, содержащие такие антигенсвязывающие области, которые являются специфическими для человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis (молекула клеточной адгезии, связанная с карциноэмбриональным антигеном, CD66c, перекрестно-реагирующий неспецифический антиген, NCA, NCA-50/90), и поэтому они не реагируют перекрестно в значительной степени с близкородственной человеческой СЕАСАМ1, человеческой СЕАСАМ3 и человеческой СЕАСАМ5. Настоящее изобретение также относится к способам получения такого вида антител.
Антитела, соответственно, могут применяться для лечения рака и других нарушений и состояний, связанных с экспрессией СЕАСАМ6. Настоящее изобретение также обеспечивает последовательности нуклеиновых кислот, кодирующие вышеуказанные антитела, векторы, содержащие их, фармацевтические композиции и наборы с инструкциями по применению.
Уровень техники
Терапия на основе антител является эффективным и клинически обоснованным методом лечения различных видов рака, включая солидные опухоли. Например, HERCEPTIN® успешно используется для лечения рака молочной железы, и RITUXAN® эффективен в отношении типов рака, связанных с В-клетками. В основе разработки новой успешной терапии на основе антител лежит выделение антител против белков клеточной поверхности, которые, как обнаружено, предпочтительно экспрессируются на клетках-мишенях (например, раковых клетках, иммунных клетках и т.д.), которые способны функционально модифицировать активность соответствующего рецептора.
Блокада антителами молекул иммунной контрольной точки для активации иммунных клеток и, таким образом, для иммунотерапии рака является клинически обоснованным подходом. В 2011 году CTLA-4 блокирующее антитело ипилимумаб было одобрено FDA для 2-ой линии терапии метастатической меланомы (Yervoy). Другим примером является блокада оси PD-1/PD-L1, для которой несколько препаратов либо одобрены, либо в настоящее время находятся на стадии клинического разработки, и для которой были отмечены впечатляющие клинические реакции в случае меланомы, RCC и рака легких (Henick et al., Expert Opin Ther Targets. 2014 Dec;18(12):1407-20)).
Семейство белков молекулы клеточной адгезии, связанной с карциноэмбриональным антигеном, (СЕАСАМ) принадлежит к супергенному семейству иммуноглобулинов (Ig) и обычно имеет переменный (V)-подобный домен, идентифицируемый как N-домен. За N-доменом следует либо ни один, либо до шести константных С2-подобных доменов Ig (называемых А или В). Эти внеклеточные домены необходимы для функциональности СЕАСАМ в качестве гомо- и гетерофильных молекул межклеточной адгезии (Obrinck, Curr Opin Cell Biol. 1997 Oct; 9(5):616-26) или в качестве рецепторов патогенов человека и грызунов (Kuespert et al., Curr Opin Cell Biol. 2006 Oct; 18(5):565-71; Voges et al., PLoS One. 2012;7(6):e39908). СЕАСАМ рецепторы ассоциируются как димеры или олигомеры и многочисленные ассоциации с другими партнерами на мембране и, следовательно, модулируют важные функции. Помимо их экспрессии в тканях человека, семейство генов СЕАСАМ является высококонсервативным у 27 других видов млекопитающих и лучше всего описано у мышей, крыс, крупного рогатого скота, собаки, утконоса и опоссума (Kammerer and Zimmermann, BMC Biol. 2010 Feb 4; 8:12). Наиболее охарактеризованной биологической функцией СЕАСАМ является поддержка адгезии клетка-клетка посредством их гомо- и гетерофильных взаимодействий, включая роль в дифференциации и образовании трехмерной структуры ткани, ангиогенеза, апоптоза, подавления опухолей и метастазов. (Kuespert et al., Curr Opin Cell Biol. 2006 Oct; 18(5):565-71). Более подробно члены семейства описаны в других обзорах (Horst and Wagener, Handb Exp Pharmacol. 2004;(165): 283-341; Gray-Owen and Blumberg, Nat Rev Immunol. 2006 Jun;6(6):433-46).
CEACAM6 (молекула клеточной адгезии, связанная с карциноэмбриональным антигеном 6, CD66c, перекрестно-реагирующий неспецифический антиген, NCA, NCA-50/90) представляет собой гликозилфосфатидилинозитол (GPI)-связанный белок клеточной поверхности с одним N-доменом и двумя С2-подобными доменами, которые опосредуют ряд возможных цис- или транс-направленных взаимодействий белков СЕАСАМ через их внеклеточные домены с множеством мембранных рецепторов, некоторые из которых были идентифицированы. (Beauchemin and Arabzadeh, Cancer Metastasis Rev. 2013 Dec;32(3-4):643-71).
CEACAM6 экспрессируется в различных эпителиях нормальной ткани человека, таких как толстой кишки (Blumenthal et al., BMC Cancer, 2007, Jan 3;7:2.), легкого (Kolla et al., Am J Physiol Lung Cell Mol Physiol 296: L1019-L1030) и гранулоцитов (Kuroki et al., Biochem Biophys Res Commun., 1992, Jan 31, 182 (2): 501-6). В гранулоцитарной линии CEACAM6 экспрессировалась на всех стадиях гранулоцитарного созревания, за исключением ранних клеток-предшественников, участвующих в дифференцировке линии (Strickland et al., J Pathol. 2009 Jul;218(3):380-90);  et al., American Journal of Pathology, 156 (2), 595-605). CEACAM6 не экспрессируется у грызунов. (Beauchemin et al., Exp Cell Res. 1999 Nov 1;252(2):243-9).
et al., American Journal of Pathology, 156 (2), 595-605). CEACAM6 не экспрессируется у грызунов. (Beauchemin et al., Exp Cell Res. 1999 Nov 1;252(2):243-9).
Экспрессия CEACAM6 была описана для нескольких видов рака. При раке толстой кишки CEACAM6 повышено регулируется в 55% случаев, и независимый прогностический фактор позволяет разбивать пациентов на группы с низким и высоким риском (Jantscheff et al., J Clin Oncol., 2003, окт. 1, 21 (19): 3638-46). При аденокарциноме поджелудочной железы было обнаружено, что 92% (n=82) анализируемых образцов были положительными, тогда как экспрессия CEACAM6 была более распространена в очагах PanIN высокой степени злокачественности, чем в очагах PanIN низкого степени злокачественности (Duxbury et al., Ann Surg. 2005 Mar, 241 (3): 491-6). Это было подтверждено в другом исследовании, где >90% инвазивных аденокарцином поджелудочной железы (110 из 115 испытуемых) показали устойчивую экспрессию СЕАСАМ6 (Strickland et al., J Pathol., 2009, июль, 218 (3): 380-90). Кроме того, Blumenthal et al. обнаружили экспрессию СЕАСАМ6 в опухолях молочной железы, опухолях поджелудочной железы, аденокарциномах яичников, аденокарциноме легкого, метастазах в лимфатических узлах и метастазах от опухолей молочной железы, толстой кишки и легкого. (Blumenthal et al., BMC Cancer. 2007 Jan 3;7:2).
Экспрессия СЕАСАМ6 при раке молочной железы также сообщалась другими исследователями (Maraqa et al., Clin Cancer Res. 2008 Jan 15;14(2):405-11; Poola et al., Clin Cancer Res. 2006 Aug 1;12(15):4773-83; Balk-Moller et al., Am J Pathol. 2014 Apr;184(4):1198-208); Tsang et al., Breast Cancer Res Treat. 2013 Nov;142(2):311-22). Кроме того, экспрессия СЕАСАМ6 была обнаружена при множественной миеломе (Witzens-Harig et al., Blood 2013 May 30, 121 (22): 4493-503), раке желудка (Deng et al., Genet Mol Res., 2014 Sep 26, 13 (3): 7686-97) и раке головы и шеи (Cameron et al., Mol Cancer. 2012 Sep 28; 11:74).
Экспериментальные данные подтверждают роль СЕАСАМ6 как важного регулятора метастазов. Kim et al. показали, что подавление экспрессии СЕАСАМ6 в клетках LoVo с использованием СЕАСАМ6-специфической миРНК или увеличение ее экспрессии в клетках НСТ116, соответственно, затрудняло или увеличивало инвазию через внеклеточный матрикс (Kim et al., Clin Chim Acta. 2013 Jan 16;415:12-9). Подавление экспрессии СЕАСАМ6 приводит к повышенной активности промотора Е-кадгерина. Blumenthal et al. показали, что СЕАСАМ5 и СЕАСАМ6 способствовали метастатическому распространению CRC, которое может быть блокировано моноклональными антителами in vivo. (Blumenthal et al., BMC Cancer. 2007 Jan 3;7:2). Также было показано, что СЕАСАМ6 экспрессируется в CD133-позитивных клетках в образцах рака толстой кишки, способных образовывать обогащенные стволовыми клетками сферы толстой кишки, для которых пролиферация, клоногенный потенциал, а также in vivo туморогенный потенциал значительно затрудняются при ее подавлении (Gemei et al., Cancer. 2013 Feb 15;119(4):729-38). При раке молочной железы было показано, что резистентные к тамоксифену образцы проявляют сверхэкспрессию СЕАСАМ6, и СЕАСАМ6 является значительным предиктором рецидива заболевания (Maraqa et al., Clin Cancer Res. 2008 Jan 15;14(2):405-11). миРНК-опосредуемое подавление СЕАСАМ6 в MMU1-тамоксифен-резистентном производном клеток MCF7 обращало эндокринную резистентность, анкерную независимость этих клеток и инвазивные свойства (Lewis-Wambi et al., Eur J Cancer. 2008 Aug;44(12):1770-9). При аденокарциноме легкого экспрессия СЕАСАМ6 была в значительной степени связана с неблагоприятным клиническим исходом (Kobayashi et al., Br J Cancer. 2012 Nov 6;107(10):1745-53). При раке поджелудочной железы подавление СЕАСАМ6 с помощью миРНК обращало приобретенную резистентность к аноикозу опухолевых клеток поджелудочной железы Mia(AR). Сверхэкспрессия СЕАСАМ6 в Capan2 раковых клетках поджелудочной железы увеличивала резистентность к гемцитабину, тогда как миРНК-опосредованное подавление экспрессии СЕАСАМ6 в клетках ВхРС3 хемосенсибилизировало их к лекарственному средству путем модуляции активности AKT Src-зависимым образом (Duxbury et al., Cancer Res. 2004 Jun 1;64(11):3987-93). Эти эффекты соответствовали увеличению инвазивности высоко экспрессирующих СЕАСАМ6 клеток, проявляющих активность c-src и экспрессию матриксной металлопротеиназы (ММР9) (Duxbury et al., Br J Cancer. 2004 Oct 4;91(7): 1384-90).
Т-клеточные ответы против связанных с опухолью антигенов были описаны для многих опухолях (Beckhove et al., J Clin Invest. 2004 Jul;114(1):67-76; Choi et al., Blood. 2005 Mar 1;105(5):2132-4; Sommerfeldt et al., Cancer Res. 2006 Aug 15;66(16):8258-65; Schmitz-Winnenthal et al., Cancer Res. 2005 Nov 1;65(21):10079-87.;  et al., Proc Natl Acad Sci U S A. 2000 Apr 25;97(9):4760-5; Romero et al., Adv Immunol. 2006;92:187-224) и часто вызывают накопление опухоль-специфических Т-клеток памяти в лимфоидных органах или в крови (Choi et al., Blood. 2005 Mar 1;105(5):2132-4; Feuerer et al., Nat Med. 2001 Apr;7(4):452-8; Letsch et al., Cancer Res. 2003 Sep 1;63(17):5582-6). Однако способность Т-клеток реагировать против аутологичных опухолевых клеток обычно низка (Horna and Sotomayor, Curr Cancer Drug Targets. 2007 Feb;7(1):41-53); Yang and Carbone, Adv Cancer Res. 2004;92:13-27). Многие опухоли обладают способностью блокировать эффекторные функции Т-клеток, что способствует ограниченной активности опухолевой иммунотерапии. Т-клеточная невосприимчивость к опухолевым клеткам была продемонстрирована для широкого спектра видов рака (Pardoll, Nat Immunol. 2012 Dec;13(12):1129-32).
et al., Proc Natl Acad Sci U S A. 2000 Apr 25;97(9):4760-5; Romero et al., Adv Immunol. 2006;92:187-224) и часто вызывают накопление опухоль-специфических Т-клеток памяти в лимфоидных органах или в крови (Choi et al., Blood. 2005 Mar 1;105(5):2132-4; Feuerer et al., Nat Med. 2001 Apr;7(4):452-8; Letsch et al., Cancer Res. 2003 Sep 1;63(17):5582-6). Однако способность Т-клеток реагировать против аутологичных опухолевых клеток обычно низка (Horna and Sotomayor, Curr Cancer Drug Targets. 2007 Feb;7(1):41-53); Yang and Carbone, Adv Cancer Res. 2004;92:13-27). Многие опухоли обладают способностью блокировать эффекторные функции Т-клеток, что способствует ограниченной активности опухолевой иммунотерапии. Т-клеточная невосприимчивость к опухолевым клеткам была продемонстрирована для широкого спектра видов рака (Pardoll, Nat Immunol. 2012 Dec;13(12):1129-32).
CEACAM6 также способствует регулированию CD8+ Т-клеточного ответа. Недавно Witzens-Harig et al. продемонстрировали для множественной миеломы, экспрессирующей несколько членов семейства СЕАСАМ, что лечение с помощью анти-СЕАСАМ6 mAbs или миРНК, подавляющих CEACAM6, восстановило реакционную способность Т-клеток против злокачественных плазмоцитов, указывая на роль CEACAM6 в регуляции CD8+ Т-клеточного ответа (Witzens-Harig et al., Blood 2013 May 30; 121 (22): 4493-503). До сих пор рецептор для CEACAM6 на Т-клетках не был идентифицирован. Однако совместная культура CEACAM6-положительных клеток миеломы с Т-клетками приводила к модуляции событий передачи сигнала Т-клетками, включая активацию SHP фосфатаз путем лигирования CEACAM6 (Lin and Weiss, J Cell Sci. 2001 Jan;114(Pt 2):243-4; Latour et al., Mol Cell Biol. 1997 Aug;17(8):4434-41; Wen et al., J Immunol. 2010 Dec 1;185(11):6413-9). CEACAM6 не имеет собственной сигнальной способности, и ее ингибирующая способность предположительно опосредуется связыванием с рецепторами на поверхности Т-клеток. Таким рецептором может быть, например, СЕАСАМ1, для которого был описан механизм модуляции врожденных и адаптивных иммунных ответов. СЕАСАМ1 (CD66a) обладает цитоплазматическим концом, содержащим иммунорецепторный тирозиновый ингибирующий мотив (ITIM). СЕАСАМ1 хранится во внутриклеточных везикулах и при активации Т-клеток быстро (от 24 ч до 72 ч) экстернализируется и экспрессируется на поверхности Т-клеток, где он опосредует блокаду эффекторных функций Т-клеток после гомо- или гетерофильного связывания с лигандами, экспрессируемыми на клетках-мишенях (Gray-Owen and Blumberg, Nat Rev Immunol. 2006 Jun;6(6):433-46). Природа этого связывания неизвестна и может быть гомо- или гетерофильным связыванием с другими СЕАСАМ или связыванием с другими компонентами внеклеточного матрикса, рецепторами фактора роста, интегринами или кадгеринами. Сообщалось о гомофильных взаимодействиях между СЕАСАМ1 и СЕАСАМ1 (Ortenberg et al., Mol Cancer Ther., 2012 Jun; 11 (6): 1300-10). Гетерофильные взаимодействия СЕАСАМ были описаны, например, между СЕАСАМ1 и СЕАСАМ5, CEACAM6 и СЕАСАМ8 (Cavallaro and Christofori, Nat Rev Cancer. 2004 Feb;4(2):118-32).
Как описано выше, СЕАСАМ6 является очень привлекательной мишенью для терапевтического вмешательства при иммунотерапии рака. Как уже отмечалось, СЕАСАМ6 является членом семейства высоко гомологичных белков. Таким образом, антитело, подходящее для лечения человека, которое облегчает иммуносупрессию СЕАСАМ6, должно быть способно различать СЕАСАМ6 и другие паралогичные белки, такие как СЕАСАМ1, СЕАСАМ3, СЕАСАМ5, каждый из которых имеет различные функции и распределение в тканях, чтобы ограничить его способ действия и локализацию до СЕАСАМ6 и избежать нежелательных побочных эффектов.
Поскольку СЕАСАМ6 не только экспрессируется на опухолевых клетках, но также и на нормальных тканях (особенно гранулоцитах, но также эпителиальных клетках, например, клетках легкого и желудочно-кишечного тракта - Chan and Stanners, Mol Ther. 2004 Jun; 9 (6): 775-85; Strickland et al., J Pathol, 2009, Jul, 218 (3): 380-90), абсолютно важно иметь возможность предсказать профиль побочных эффектов терапевтического антитела. Это тем более важно, поскольку ожидаемым способом действия будет ингибирование иммуносупрессии, то есть иммуноактивация, которая может привести к серьезным опасностям (случай с CD28 суперагонистом TGN1412; Suntharalingam et al., N Engl J Med. 2006 Sep 7;355(10):1018-28). Поэтому необходимо тщательно оценивать побочные эффекты на иммунную систему, непосредственно влияющие на гранулоциты. Чтобы обеспечить разработку терапевтического антитела для человека и предсказательно протестировать переносимость перед клиническими исследованиями, антитело должно проявлять соответствующую способность к перекрестной реакции по отношению к соответствующим токсикологическим видам, в случае СЕАСАМ6 к нечеловеческим приматам, предпочтительно Масаса fascicularis (яванские макаки).
В качестве предварительного условия, терапевтическое антитело должно связываться с высокой аффинностью с человеческим СЕАСАМ6 на клетках, селективно связываться с СЕАСАМ6 (без связывания с любыми паралогами), быть способным перекрестно реагировать с СЕАСАМ6 макак в пределах одного порядка моновалентной KD (чтобы надежно отражать связывание на нормальных тканях в токсикологической модели на макаках, даже при низких поверхностных плотностях в условиях связывания на основе неавидности), связываться с подобным эпитопом, как на человеческой СЕАСАМ6, иметь возможность облегчить иммуносупрессию, опосредованную СЕАСАМ6, быть неиммуногенным при лечении человека (т.е. человеческим или гуманизированным антителом), и быть достаточно стабильным, чтобы обеспечить клиническую разработку, получение препарата и хранение в течение длительного периода времени в качестве фармацевтического средства. Последнее важно, как было отмечено ранее, так как физическое разрушение (особенно агрегация) может усилить иммунный ответ на терапевтический белок (Hermeling et al., Pharm Res. 2004 Jun;21(6):897-903), и агрегация тесно связана с разворачиванием IgG и его термической стабильностью (Vermeer and Norde, Biophys J. 2000 Jan;78(1):394-404).
Существует несколько анти-СЕАСАМ6 антител. Большинство из них являются антителами, не относящимися к человеку, многие из которых являются поликлональными. Специфичность и избирательность для человеческой СЕАСАМ6, а также способность перекрестие реагировать с СЕАСАМ6 макак в большинстве случаев не раскрыты или не известны.
Терапевтические антитела, направленные против СЕАСАМ6, также известны в данной области техники. Некоторые из них не являются селективными для человеческой СЕАСАМ6 (например, MN-3 от Immunomedics, Neo201/h16C3 от Neogenix, оба связываются, кроме того, с человеческой СЕАСАМ5). Однодоменное антитело 2А3 и его слитые варианты (WO 2012040824 и Niu et al., J Control Release, 2012, Jul 10, 161 (1): 18-24) не характеризуются селективностью и способность к перекрестной реакции в отношении СЕАСАМ6 макак.
Селективные анти-СЕАСАМ6 антитела явным образом перекрестие реагирующие с СЕАСАМ6 макак не раскрыты (Strickland et al., J Pathol. 2009 Jul;218(3):380-90).
Мышечное антитело 9А6 (Genovac/Aldevron) является единственным антителом, которое, как описано, может модулировать иммуноподавляющую активность СЕАСАМ6 (Witzens-Harig et al., Blood 2013 May 30, 121 (22): 4493-503). 9A6 ингибирует иммуноподавляющую активность СЕАСАМ6, приводя к усилению секреции цитокинов Т-клетками in vitro и противоопухолевой эффективности in vivo (Khandelwal et al., Poster Abstract 61, Meeting Abstract from 22nd Annual International Cancer Immunotherapy Symposium October 6-8, 2014, New York City, USA). Хотя его селективность, как оказалось, является соответствующей, оно ранее не было охарактеризовано как перекрестие реагирующее с СЕАСАМ6 макак. Кроме того, его мышиная природа исключает прямое терапевтическое применение у людей.
Как показано в примерах, антитело 9A6 связывается срекомбинантным человеческим СЕАСАМ6, но не было обнаружено связывания с рекомбинантным СЕАСАМ6 Масаса mulatta или Масаса fascicularis. Для сравнения также было протестировано Neo201-hIgG1. Это антитело проявляло высокую аффинность связывания с СЕАСАМ6 как человека, так и макак. Но Neo201 связывается с человеческой СЕАСАМ5 и СЕАСАМ6 и поэтому не является специфичным для СЕАСАМ6.
В заключение, существует высокая потребность в терапевтическом моноклональном антителе, которое имеет следующие признаки:
i. Антитело имеет высокую аффинность связывания с человеческой СЕАСАМ6.
ii. Антитело селективно с СЕАСАМ6, не связываясь с какими-либо паралогами, особенно СЕАСАМ1, СЕАСАМ3, и СЕАСАМ5.
iii. Антитело способно перекрестно реагировать с СЕАСАМ6 макака в пределах одного порядка моновалентной KD
iv. Антитело является неиммуногенным для лечения человека, то есть является человеческим или гуманизированным антителом
v. Антитело способно облегчить СЕАСАМ6-опосредованную иммуносупрессию.
Такое антитело не известны из уровня техники. 9А6, связывающееся с N-терминальным доменом 1 человеческой СЕАСАМ6, является единственным известным анти-СЕАСАМ6-антителом, которое способно облегчить иммуносупрессию, опосредованную СЕАСАМ6, но не способно перекрестно реагировать с СЕАСАМ6 макаки, в отличие от мышиного антитела. Neo201 связывается с другим доменом вне N-терминального домена 1 СЕАСАМ6. Терапевтическая эффективность Neo201-hIgG1 была опубликована, основываясь на ADCC (Proceedings of the 102nd Annual Meeting of the American Association for Cancer Research; 2011 Apr 2-6; Orlando, FL. Philadelphia (PA): AACR: Du et al., Cancer Res April 15, 2011; 71(8 Supplement): 4582).
Авторы настоящего изобретения предположили, что облегчение опосредованной СЕАСАМ6 иммуносупрессии связано со связыванием с N-терминальным доменом 1. Но получение антител, связывающихся с N-терминальным доменом 1 СЕАСАМ6, связано со сложной проблемой селективности.
Выравнивание последовательностей на Фиг. 1 показывает очень высокую степень сходства белковых последовательностей человеческой СЕАСАМ6 и человеческой СЕАСАМ3, человеческой СЕАСАМ5 и человеческой СЕАСАМ1 во всей внеклеточной области. Целевая область (домен 1 человеческой СЕАСАМ6) особенно подобна с другими СЕАСАМ, что также отражено в таблице 7. Паралоги человеческой СЕАСАМ6 (например, СЕАСАМ1, СЕАСАМ3 и СЕАСАМ5) намного больше подобны человеческой СЕАСАМ6, чем ортолог яванских макак. На самом деле, в N-терминальной области в первичной последовательности есть только 2 положения, которые идентичны у человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, но отличаются от аминокислот в других человеческих паралогах (отмечены на Фиг. 1 звездочками).
Неожиданно авторы настоящего изобретения смогли найти способ получения антител, имеющих желаемую селективность и все желательные функциональные признаки.
Сущность изобретения
Настоящее изобретение относится к антителам или их аниген-связывающим фрагментам или их вариантам, которые проявляют высокую аффинность к белку человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis и которые не имеют значительного перекрестного взаимодействия с близкородственным человеческим СЕАСАМ1, человеческим СЕАСАМ3 и человеческим СЕАСАМ5. Это означает, что антитела или их антигенсвязывающие фрагменты антитела или их варианты являются селективными для СЕАСАМ6. Антитела обеспечивали связывание с N-терминальным доменом 1, который является высококонсервативным среди этих белков.
Анти-СЕАСАМ6 антитела согласно настоящему изобретению также способны изменять in vitro цитокиновый профиль опухоль-специфических Т-клеток в сторону более цитотоксического и/или активированного фенотипа, характеризующегося повышенной секрецией IFN-гамма и/или IL-2 и/или TNF-альфа. Поэтому антитела согласно настоящему изобретению способны облегчить СЕАСАМ6-опосредованное иммуноподавление, и индуцировать иммуноактивацию, что в конечном итоге приводит к противоопухолевой эффективности in vivo.
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты нарушают взаимодействие СЕАСАМ6 и СЕАСАМ1, что может быть механизмом модуляции врожденных и адаптивных иммунных ответов.
Таким образом, антитела согласно настоящему изобретению являются подходящими для лечения рака, а также его метастаз, в частности экспрессирующих СЕАСАМ6 опухолей, таких как колоректальный рак, немелкоклеточный рак легкого (NSCLC), мелкоклеточный рак легкого (SCLC), рак поджелудочной железы, рак желудка, рак молочной железы и множественная миелома.
Настоящее изобретение описывает антитела, которые отличаются от существующих анти-СЕАСАМ6 антител, поскольку они способны связываться с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis в пределах одного порядка моновалентной kd (чтобы надежно отражать связывание на нормальных тканях в токсикологической модели на макаках, даже при низких поверхностных плотностях в условиях связывания на основе неавидности) и не реагируют перекрестие в значительной степени с близкородственными паралогами СЕАСАМ1, СЕАСАМ3 и СЕАСАМ5. Таким образом, эти антитела подходят для доклинических токсикологических исследований на яванских макаках для оценки их профилей безопасности. Поскольку СЕАСАМ6 не только экспрессируется на опухолевых клетках, но также и на нормальных тканях (особенно гранулоцитах, но также эпителиальных клетках, например, легкого и желудочно-кишечного тракта - Chan and Stanners, Mol Ther. 2004 Jun;9(6):775-85; Strickland et al., J Pathol. 2009 Jul;218(3):380-90), абсолютно важно иметь возможность предсказать профиль побочных эффектов терапевтического антитела. Это тем более важно, поскольку ожидаемым способом действия будет ингибирование иммуносупрессии, то есть иммуноактивация, которая может привести к серьезным опасностям (например, при исследовании CD28 суперагониста TGN1412), поэтому побочные эффекты на иммунную систему в дополнение к прямым воздействиям на гранулоциты должны быть тщательно оценены.
Весьма предпочтительные анти-СЕАСАМ6 антитела согласно настоящему изобретению приведены в Таблице 1, характеризуясь их структурными признаками.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один, два, три, четыре, пять, восемь, десять, пятнадцать или более аминокислотных остатков, выбранных из группы, состоящей из Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
Анти-СЕАСАМ6 антитело согласно настоящему может вводиться совместно с известными лекарственными средствами, и в некоторых случаях само антитело может быть модифицировано. Например, антитело может быть конъюгировано с цитотоксическим агентом, иммунотоксином, токофором или радиоизотопом для потенциального дальнейшего повышения эффективности.
Настоящее изобретение обеспечивает антитела, которые составляют инструмент для диагноза злокачественные или диспластические состояния, при которых Экспрессия СЕАСАМ6 повышена по сравнению с нормальной тканью. Предпочтительными являются анти-СЕАСАМ6 антитела, конъюгированные с обнаруживаемым маркером. Предпочтительными маркерами являются радиометка, фермент, хромофор или фуорофор.
Настоящее изобретение также относится к полинуклеотидам, кодирующим антитела согласно настоящему изобретению, или их антигенсвязывающим фрагментам, клеткам, экспрессирующим антитела согласно настоящему изобретению, или их антигенсвязывающие фрагменты, способам получения антител согласно настоящему изобретению, или их антигенсвязывающие фрагменты, способам ингибирования роста диспластических клеток с использованием антител согласно настоящему изобретению, или их антигенсвязывающих фрагментов, а также способам лечения и выявления рака с использованием антител согласно настоящему, или их антигенсвязывающих фрагментов.
Настоящее изобретение также относится к выделенным последовательностям нуклеиновых кислот, каждая из которых может кодировать вышеупомянутое антитело или его антигенсвязывающий фрагмент, которое является специфичным для эпитопа СЕАСАМ6. Нуклеиновые кислоты согласно настоящему изобретению подходят для рекомбинантного продуцирования антител или антигенсвязывающих фрагментов антител. Таким образом, настоящее изобретение также относится к векторам и клеткам-хозяевам, содержащим последовательность нуклеиновой кислоты согласно настоящему изобретению.
Композиции согласно настоящему изобретению могут быть использованы для терапевтических или профилактических применений. Следовательно, настоящее изобретение включает фармацевтическую композицию, содержащую антитело согласно настоящему изобретению или его антигенсвязывающий фрагмент и, следовательно, фармацевтически приемлемый носитель или эксципиент. Связанным объектом настоящего изобретения является способ лечения нарушения или состояния, связанного с нежелательным присутствием экспрессирующих СЕАСАМ6 клеток. В предпочтительном варианте выполнения настоящего изобретения вышеупомянутым нарушением является рак. Такой способ включает стадии введения субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции, которая содержит антитело согласно настоящему изобретению, как описано или раскрыто в настоящей заявке.
Кроме того, настоящее изобретение относится к способам получения такого вида антител. Настоящее изобретение обеспечивает инструкции по использованию библиотеки антител для выделения одного или более членов такой библиотеки, которые специфически связываются с СЕАСАМ6. Кроме того, настоящее изобретение обеспечивает инструкцию по иммунизации мышей с образованием клеточных линий гибридомы, которые секретируют антитела, которые специфически связываются с СЕАСАМ6 и которые являются перекрестно-реагирующими с СЕАСАМ6 Масаса fascicularis (яванская макака). В соответствии с настоящим изобретением также обеспечиваются инструкции по гуманизации мышиных антител, которые специфически связываются с СЕАСАМ6.
Краткое описание чертежей
Фиг. 1: Выравнивание белковых последовательностей внеклеточных областей паралогов человеческой СЕАСАМ6, а также ортологов СЕАСАМ6 Масаса fascicularis (яванская макака). Числа указывают положение аминокислот после удаления сигнальной пептидной последовательности. Позиции в N-терминальной области в первичной последовательности, идентичные в человеческой СЕАСАМ6 и СЕАСАМ6 яванской макаки, но отличающиеся от аминокислот в этом положении в других человеческих паралогах, отмечены звездочками. N-терминальный домен 1 помещен в рамку.
Фиг. 2: Аминокислотные последовательности вариабельных доменов VL и VH для ТРР-2971. Последовательности, трансплантированные в рамках человека, выделяются как подчеркнутые жирным шрифтом. CDR согласно определению Кэбота указаны курсивом. Серые заштрихованные буквы представляют собой различия в последовательностях из ТРР-3187 по сравнению с ТРР-2971.
Фиг. 3: Аминокислотные последовательности вариабельных доменов VL и VH для ТРР-3310 и ТРР-3714. Последовательности, полученные из CDR мыши ТРП-2971, выделяются как подчеркнутые жирные буквы. CDR согласно определению Кэбота указаны курсивом. Антитела ТРР-3310 и ТРР-3714 отличаются двумя аминокислотами в рамках VH, выделенными как подчеркнутые нежирные буквы.
Фиг. 4: Аминокислотные последовательности вариабельных доменов VL и VH для ТРР-3820 и ТРР-3821. Последовательности, полученные из CDR мыши ТРР-3187, выделяются как подчеркнутые жирные буквы. CDR согласно определению Кэбота указаны курсивом. Антитела ТРР-3820 и ТРР-3821 отличаются двумя аминокислотами в рамках VH, выделенными как подчеркнутые нежирные буквы.
Фиг. 5: In vitro фармакологический эффект анти-СЕАСАМ6 антитела на секрецию IFN-гамма специфичными для пептида сурвивина Т клетками и степень этой секреции. А+В. IFN-гамма ELISpot анализ специфичных для пептида сурвивина Т клеток и KS опухолевых клеток. 10,000 KS опухолевых клеток совместно культивировали вместе с 2,500 Сурвивин ТС в течение 20 ч. Концентрация антитела в сокультуре составляла 30 мкг/мл. С. IFN-гамма ELISA анализ специфичных для пептида сурвивина ТС и KS опухолевых клеток. 10,000 KS опухолевых клеток совместно культивировали вместе с 20,000 Сурвивин ТС в течение 20 ч. Концентрация антитела в сокультуре составляла 30 мкг/мл. Х-ось показывает различные протестированные состояния: в А: 1 = 10,000 KS клеток; 2 = 2,500 Т клеток; 3 = без обработки антителом; 4 = контроль изотипически сходное антитело; 5 = ТРР-3470 (9A6-hIgG2) 6 = ТРР-3323; в В: 1 = 10,000 KS клеток; 2 = 2,500 Т клеток; 3 = без обработки антителом; 4 = контроль изотипически сходное антитело; 5 = ТРР-3470 (9A6-hIgG2) 6 = ТРР-3310; 7 = ТРР-3707; в С: 1 = 10,000 KS клеток; 2 = 20,000 Т клеток; 3 = без обработки антителом; 4 = контроль изотипически сходное антитело; 5 = ТРР-3470 (9A6-hIgG2) 6 = ТРР-3310; 7 = ТРР-3707; Y-ось соответствует количеству пятен IFN-гамма на лунку (в А и В) или концентрации IFN-гамма в пг/мл (в С). Звездочки показывают статистически значимые результаты в соответствии с t-критерием Студента, непарным, двухсторонним. Полосы ошибок представляют SEM.
Фиг. 6: In vitro фармакологический эффект анти-СЕАСАМ6 антитела на секрецию цитокинов (IFN-гамма, IL-2 и TNF-альфа) специфичными для пептида сурвивина Т клетками. A. Luminex анализ IFN-гамма. В. Luminex анализ IL-2. С. Luminex анализ TNFa. Luminex анализ цитокинов специфичных для пептида сурвивина ТС и KS опухолевых клеток. 10,000 KS опухолевых клеток совместно культивировали вместе с 20,000 Сурвивин ТС в течение 20 ч. Концентрация антитела в сокультуре составляла 30 мкг/мл. Х-ось показывает различные протестированные состояния: 1 = 10,000 KS клеток; 2 = 20,000 Т клеток; 3 = без обработки антителом; 4 = контроль изотипически сходное антитело; 5 = ТРР-3470 (9A6-hIgG2) 6 = ТРР-3310; 7 = ТРР-3707; Y-соответствует концентрации цитокинов в пг/мл.
Фиг. 7: Влияние анти-СЕАСАМ6 антител на рост опухоли in vivo. 2×106 KS клеток рака молочной железы инокулировали подкожно. На день 23 и 27 специфичные к опухолевому антигену Т клетки (специфичные для пептида сурвивина) ввели посредством внутривенной инъекции, 200 мкг анти-СЕАСАМ6 антитела или изотопически сходного контроля ввели интрапарентерально на день 22, 24, 26 и 28. Рост опухоли оценивали каждые 2-3 дня. Планки погрешностей представляют SEM. Y-ось = поверхность опухоли (мм2); Х-ось = дни; ТС = специфичные для пептида сурвивина Т клетки. 1 = PBS-обработанные; 2 = обработка Т клетками и изотипически сходным контролем антитела; 3 = обработка Т клетками и ТРР-3470 (9A6-hIgG2); 4=обработка Т клеткам и ТРР-3310; 5 = обработка Т клетками и ТРР-3707.
Фиг. 8: Последовательности предпочтительных анти-СЕАСАМ6 антител согласно настоящему изобретению с аннотациями. Обеспечиваются белковые и ДНК последовательности тяжелой и легкой цепей IgG, а также VH и VL областей выбранных антител. Ниже приведены аннотации для важных последовательностей антител (VH и VL области в IgG полной длины, и CDR области (H-CDR1, H-CDR2, H-CDR3, L-CDR1, L-CDR2, L-CDR3)).
Фиг. 9: изображение одного N-терминального домена 1 человеческой СЕАСАМ6 (ТРР-1794, белый), связанного с Fab фрагментом АРР-1574 (тяжелая и легкая цепи окрашены в темно и светло серый цвет, соответственно).
Фиг. 10: Подробная информация об области контакта белка, показанная на Фиг. 9. Выбранные остатки изображены в виде палочки и окрашены как на Фиг. 9. Нумерация соответствует ТРР-1794 (SEQ ID №169)
Фиг. 11: xCELLigence цитотоксический анализ с применением специфичных для пептида сурвивина CD8+ Т клеток.
А. 20,000 KS опухолевых клеток рака молочной железы совместно культивировали с 20,000 сурвивин специфичными Т клетками В. 40,000 НСТ-116-hC6 опухолевых клеток совместно культивировали с 20,000 сурвивин специфичными Т клетками. Цитотоксичность контролировали в течение ~100 ч. Антитела применяли при 30 мкг/мл конечной концентрации: #1, время добавления Т клеток; #2, только опухолевые клетки; #3, без антитела; #4, контроль изотипически сходное антитело; #5, анти-PD-L1 Ab в качестве человеческого IgG2; #6, ТРР-3470 9А6 Ab в качестве человеческого IgG2; #7 ТРР-3310 hIgG2. Звездочки показывают статистически значимые результаты в соответствии с t-критерием Студента, непарным, двухсторонним. X, ось x, время (часы); Y, ось Y, индекс нормализованных клеток.
Фиг. 12: xCELLigence цитотоксический анализ с применением полученных у человека Т клеток рака поджелудочной железы (TIL-12).
А и В: 10,000 НСС2935 опухолевых клеток совместно культивировали с 50,000 лимфоцитарными клетками, инфильтрирующими рак поджелудочной железы (TIL-12). Цитотоксичность контролировали в течение ~150 ч. Анти-CD3 х ЕрСАМ биспецифичное mAb (0.25 нг/мл) было добавлено в сокультуру прямо к Т клеткам против опухолевых клеток, независимых от HLA.
А: #1, добавление Т клеток; #2 только опухолевые клетки; #3, без антитела; #4, контроль изотипически сходное антитело; #5, анти-PD-L1 Ab в качестве человеческого IgG2; #6, ТРР-3470; #7 ТРР-3310; Антитела применяли при 30 мкг/мл.
В: Зависимость от концентрации ТРР-3310-опосредованного эффекта: #1, добавление Т клеток; #2, только опухолевые клетки; #3, ТРР-3310 при 0.07 мкг/мл; #4, ТРР-3310 при 0.02 мкг/мл; #5, контроль изотипически сходное антитело при 50 мкг/мл; #6, ТРР-3310 при 0.021 мкг/мл; #7, ТРР-3310 при 0.062 мкг/мл; #8, ТРР-3310 при 1.85 мкг/мл; #9, ТРР-3310 при 5.5 мкг/мл; #10, ТРР-3310 при 16.67 мкг/мл; #11, ТРР-3310 при 50 мкг/мл;
Х - х-ось. Время (часы); Y, Y-ось, индекс нормализованных клеток
Подробное описание настоящего изобретения
Настоящее изобретение основано на обнаружении новых антител, которые имеют специфическую аффинность к СЕАСАМ6 и могут обеспечивать терапевтическое преимущество субъекту. Антитела согласно настоящему изобретению, которые могут быть человеческими, гуманизированными или химерными, могут использоваться во многих контекстах, которые более полно описаны в настоящей заявке.
Определения
Если иного не указано, все технические и научные термины, используемые в настоящей заявке, имеют значение, обычно понимаемое специалистом в области техники, к которой относится настоящее изобретение. Однако следующие ссылки могут предоставить специалисту в области техники, к которой относится настоящее изобретение, общее определение многих терминов, используемых в контексте настоящего изобретения, и на них можно ссылать и использовать, если такие определения согласуются со значениями, обычно понимаемыми в данной области техники. Такие ссылки включают, но без ограничения к этому. Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); Hale & Marham, The Harper Collins Dictionary of Biology (1991); и Lackie et al., The Dictionary of Cell & Molecular Biology (3d ed. 1999); и Cellular and Molecular Immunology, Eds. Abbas, Lichtman and Pober, 2nd Edition, W.B. Saunders Company. Любой дополнительный технический источник, доступный для специалиста в данной области техники, предоставляющий определения терминов, используемых в настоящей заявке, имеющих значение, обычно понимаемое в данной области техники, можно использовать для консультации. В целях настоящего изобретения далее приводятся определения следующих терминов. Дополнительные термины определены в другой части описания настоящего изобретения. Как используется в настоящей заявке и в прилагаемой формуле изобретения, формы единственного числа включают множественное число, если из контекста настоящего изобретения явно не следует иное. Таким образом, например, ссылка на «ген» является ссылкой на один или более генов и включает в себя его эквиваленты, известные специалистам в данной области техники, и так далее.
Термины «полипептид» и «белок» применяются в настоящей заявке взаимозаменяемо для обозначения полимера аминокислотных остатков. Термины применимы к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой искусственный химический миметик соответствующей природной аминокислоты, а также к природным аминокислотным полимерам и неприродным аминокислотным полимерам. Если не указано иное, конкретная полипептидная последовательность также неявно охватывает их консервативно модифицированные варианты.
Аминокислоты могут упоминаться в настоящей заявке в соответствии с их общеизвестным трехбуквенным обозначением или однобуквенным обозначением, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB. Нуклеотиды также могут упоминаться с помощью их общепринятых однобуквенных кодов.
Как применяется в настоящей заявке, термин «СЕАСАМ6» обозначает «молекулу клеточной адгезии, связанную с карциноэмбриональным антигеном 6», также известную как «CD66c» (кластер дифференциации 66с), или перекрестно-реагирующий неспецифический антиген, или NCA, или NCA-50/90. СЕАСАМ6 представляет собой гликозилфосфатидилинозитол (GPI)-связанный белок клеточной поверхности, участвующий в адгезии клетка-клетка. СЕАСАМ6 экспрессируется в высокой степени на поверхности различных опухолевых клеток, таких как опухолевые клетки рака толстой кишки, поджелудочной железы, молочной железы и легких.
Эталонная последовательность для человеческой СЕАСАМ6 доступна из базы данных UniProtKB/Swiss-Prot под номером доступа Р40199.3 (SEQ ID NO: 179 = ТРР-4639), включая сигнальный пептид (положения 1-34) и пропептидную цепь (положения 321-344). Наблюдался один нуклеотидный полиморфизм в положении 239 (G-V обмен). Зрелый внеклеточный домен человеческой СЕАСАМ6 состоит из аминокислот в положении 35-320 согласно SEQ ID №179.
человеческая СЕАСАМ6 (SEQ-ID NO: 179)

Белковая последовательность СЕАСАМ6 Масаса fascicularis (яванские макаки) была получена авторами настоящего изобретения и представлена ТРР-4189 (SEQ-ID No: 177). Зрелый внеклеточный домен СЕАСАМ6 яванских макак состоит из аминокислот в положении 35-320 согласно SEQ-ID No: 177.
СЕАСАМ6 Macaco fascicularis (яванская макака) (SEQ-ID NO: 177)

Доменная организация человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis (яванская макака) является следующей (на основе последовательности из базы данных UniProtKB/Swiss-Prot под номером доступа Р40199.3 и SEQ-ID NO: 179 = ТРР-4639 & SEQ-ID No: 177 = ТРР-4189, соответственно):

Белок человеческой СЕАСАМ1 полной длины доступен из базы данных UniProtKB/Swiss-Prot под номером доступа Р13688.2 (SEQ-ID No: 173 = ТРР-4185). Зрелый внеклеточный домен СЕАСАМ1 человека состоит из аминокислот в положении 35-428 согласно SEQ-ID No: 173.
человеческая СЕАСАМ1 (SEQ-ID NO: 173)

Белок человеческой СЕАСАМ3 полной длины доступен из базы данных UniProtKB/Swiss-Prot под номером доступа Р40198.2 (SEQ-ID No: 175 = ТРР-4187). Зрелый внеклеточный домен СЕАСАМ3 человека состоит из аминокислот в положении 35-155 согласно SEQ-ID No: 175.
человеческая СЕАСАМ3 (SEQ-ID NO: 175)

Белок человеческой СЕАСАМ5 полной длины доступен из базы данных UniProtKB/Swiss-Prot под номером доступа Р06731.3 (SEQ-ID No: 176 = ТРР-4188). Зрелый внеклеточный домен СЕАСАМ5 человека состоит из аминокислот в положении 35-685 согласно SEQ-ID No: 176.
человеческая СЕАСАМ5 (SEQ-ID NO: 176)

Термины «анти-СЕАСАМ6 антитело» и «антитело, которое связывается с СЕАСАМ6» относятся к антителу, которое способно связывать СЕАСАМ6 с достаточной аффинностью, так что антитело полезно в качестве диагностического и/или терапевтического агента при нацеливании на СЕАСАМ6. В одном варианте выполнения настоящего изобретения степень связывания анти-СЕАСАМ6 антитела с неродственным не-СЕАСАМ6 белком составляет менее около 5% или предпочтительно менее около 2% связывания антитела с СЕАСАМ6, как измерено, например, поверхностным плазменным резонансом (SPR). В некоторых вариантах выполнения настоящего изобретения антитело, которое связывается с СЕАСАМ6, имеет константу диссоциации (KD)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах выполнения настоящего изобретения анти-СЕАСАМ6 антитело связывается с эпитопом СЕАСАМ6, который является консервативным среди СЕАСАМ6 у разных видов.
Термин "антитело", как применяется в описании настоящего изобретения, описывает иммуноглобулиновые молекулы, предпочтительно состоящие из четырех полипептидных цепей, двух тяжелых (Н) цепей и двух легких (L) цепей, которые, как правило, связываются дисульфидными мостиками. Каждая тяжелая цепь содержит вариабельный домен тяжелой цепи (сокращаемые в настоящем изобретении как VH) и константный домен тяжелой цепи. Константный домен тяжелой цепи может содержать, например, три домена СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельный домен легкой цепи (сокращаемый в настоящем изобретении как VL) и константный домен легкой цепи. Константный домен легкой цепи содержит один домен (CL). Домены VL и VH могут быть дополнительно подразделены на гипервариабельные участки, называемые участками, определяющими комплементарность (CDR), вкрапленные в области, которые являются более консервативными, называемые каркасными участками (FR). Каждый VH и VL, как правило, состоит из трех CDR и до четырех FR. расположенных от N-конца к С-концу, например, в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Как применяется в описании настоящего изобретения, термин «участки, определяющие комплементарность» (CDR; например, CDR1, CDR2 и CDR3), относится к аминокислотным остаткам вариабельного домена антитела, присутствие которого необходимо для связывания антигена. Каждый вариабельный домен, как правило, имеет три участка CDR, идентифицируемые как CDR1, CDR2 и CDR3. Каждый участок, определяющий комплементарность, может содержать аминокислотные остатки из "участка, определяющего комплементарность", как определено по Кэботу (например, около остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельной области легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или те остатки из "гипервариабельной петли" (например, около остатков 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельной области легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (НЗ) в вариабельном домене тяжелой цепи (Chothia and Lesk; J Mol Biol 196:901-917 (1987)). В некоторых случаях участок, определяющий комплементарность, может включать аминокислоты как из участка CDR, определенного в соответствии с Кэботом, так и из гипервариабельной петли.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей интактные антитела могут быть отнесены к различным "классам". Существует пять главных классов интактных антител: IgA, IgD, IgE, IgG и IgM - и некоторые из них могут дополнительно разделяться на "подклассы" (изотипы), например, IgGI, IgG2, IgG3, IgG4, IgA и IgA2. Предпочтительным классом иммуноглобулинов для использования в данном изобретении является IgG.
Константные домены тяжелой цепи, которые соответствуют различным классам антител, называют [альфа], [дельта], [эпсилон], [гамма] и [мю], соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов известны. Как применяется в описании настоящего изобретения, антитела являются общеизвестными антителами и их функциональными фрагментами.
"Функциональный фрагмент" или "антигенсвязывающий фрагмент антитела" антитела/иммуноглобулина настоящим определен как фрагмент антитела/иммуноглобулина (например, вариабельная область IgG), который сохраняет антигенсвязывающую область. "Антигенсвязывающая область" антитела, как правило, состоит из одной или более гипервариабельных областей антитела, например, CDR1, -2, и/или -3 области; однако вариабельные "каркасные" области могут также играть важную роль в связывании антигена, например, обеспечивая каркас для CDR. Предпочтительно, "антигенсвязывающая область" содержит аминокислотные остатки по меньшей мере от 4-ого до 103-его вариабельной области легкой цепи (VL) и от 5-ого до 109-ого вариабельной области тяжелой цепи (VH), более предпочтительно от 3 до 107 VL и от 4 до 111 VH, и особенно предпочтительным являются полные цепи VL и VH (положение аминокислот 1-109 VL и 1-113 VH; нумерация в соответствии с WO 97/08320).
"Функциональные фрагменты" или "антигенсвязывающие фрагменты антитела" в соответствии с настоящим изобретением включают Fab, Fab', F(ab') 2 и фрагменты Fv; диатела; доменные антитела (DAbs), линейные антитела; одноцепочечные молекулы антител (scFv); и мультиспецифичные, такие как би- и триспецифические, антитела, образованные из фрагментов антител (С. А. K Borrebaeck, editor (1995) Antibody Engineering (Breakthroughs in Molecular Biology), Oxford University Press; R. Kontermann & S. Duebel, editors (2001) Antibody Engineering (Springer Laboratory Manual), Springer Verlag). Подразумевается, что антитело, отличное от "мультиспецифического" или "мультифункционального" антитела, имеет идентичные сайты связывания. F(ab')2 или Fab могут быть спроектированы, чтобы минимизировать или полностью удалить межмолекулярные дисульфидные взаимодействия, которые возникают между доменами СН 1 и CL.
Термин «Fc область» в настоящей заявке используется для определения С-терминальной области тяжелой цепи иммуноглобулина, которая содержит по меньей мере часть константной области. Термин включает в себя природные последовательности Fc-областей и варианты Fc-областей. В одном варианте выполнения настоящего изобретения область Fc тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-терминальной лизин (Lys447) Fc области может быть или может отсутствовать. Если не указано иное, нумерация аминокислотных остатков в Fc области или константной области соответствует системе нумерации ЕС, также называемой индексом ЕС, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Варианты антител или антигенсвязывающих фрагментов антител, рассматриваемых в настоящем изобретении, являются молекулами, в которых сохраняется связывающая активность антитела или антигенсвязывающего фрагмента антитела.
«Связывающие белки», рассматриваемые в контексте настоящего изобретения, представляют собой, например, миметики антител, такие как аффитела, аднектины, антикалины, сконструированные белки с анкириновым повтором, авимеры, наночастицы (обзор Gebauer M. et al., Curr. Opinion in Chem. Biol. 2009; 13:245-255; Nuttall S.D. et al., Curr. Opinion in Pharmacology 2008; 8:608-617).
"Человеческое" антитело или его антигенсвязывающий фрагмент настоящим определено как такое, которое не является химерным (например, не "гуманизированным") и не из (ни полностью, ни частично) видов, отличных от человека. Человеческое антитело или его антигенсвязывающий фрагмент могут быть получены от человека или могут быть синтетическим человеческим антителом. "Синтетическое человеческое антитело" определяется в настоящем изобретении как антитело, получившее последовательность, полностью или частично, in silico из синтетических последовательностей, которые основаны на анализе известных человеческих последовательностей антител. Конструирование in silico последовательности человеческого антитела или его фрагмента может быть достигнуто, например, с помощью анализа базы данных человеческих антител или последовательностей фрагмента антител и созданием полипептидной последовательности, с использованием данных, полученных оттуда. Другим примером человеческого антитела или его антигенсвязывающего фрагмента является антитело, которое кодируется нуклеиновой кислотой, выделенной из библиотеки последовательностей антител человеческого происхождения (например, такой библиотеки, которая основана на антителах, взятых из человеческого природного источника). Примеры человеческих антител включают антитела, описанные в Soderlind et al., Nature Biotech. 2000, 18:853-856.
"Гуманизированное антитело" или его гуманизированный антигенсвязывающий фрагмент определяются в настоящем изобретении как такие, которые (i) получаются из нечеловеческого источника (например, трансгенной мыши, которая несет гетерологичную иммунную систему), антитело которого происходит из последовательности человеческой зародышевой линии; (ii), где аминокислоты каркасной области нечеловеческого антитела частично заменены человеческими аминокислотными последовательностями с помощью генетической инженерией или (iii) трансплантированы на гипервариабельном участке (CDR), где гипервариабельные участки CDR вариабельного домена имеют нечеловеческое происхождение, в то время как одна или более структур вариабельного домена имеют человеческое происхождение, а константный домен (если таковой имеется) имеет человеческое происхождение.
"Химерное антитело" или его антигенсвязывающий фрагмент определяется в настоящем изобретении как антитело, в котором вариабельные домены имеют нечеловеческое происхождение, а некоторые или все константные домены имеют человеческое происхождение.
Термин "моноклинальное антитело", как применяется в описании настоящего изобретения, относится к антителу, полученному из популяции по существу гомогенных антител, то есть, индивидуальные антитела, содержащиеся в популяции, являются идентичными антителами за исключением возможных мутаций, например, естественных мутаций, которые могут присутствовать в незначительном количестве. Таким образом, термин "моноклональный" указывает на характер антител, как не являющихся смесью отдельных антител. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело препарата моноклональных антител направлено против единственного эпитопа на антигене. В дополнение к их специфичности препараты моноклональных антител имеют преимущество в том, что они как правило, неконтаминированы другими иммуноглобулинами. Термин "моноклональный" не следует истолковывать, как требование продуцирования антитела каким-то особым методом. Термин моноклональное антитело специфически включает химерные, гуманизированные и человеческие антитела.
"Выделенное" антитело представляет собой антитело, которое было идентифицировано и выделено из компонента клетки, которая экспрессировала его. Контаминирующими компонентами клетки являются материалы, которые мешать в диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
«Выделенная» нуклеиновая кислота является той, которая была идентифицирована и отделена от компонента ее естественной среды. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в хромосомном положении, отличном от ее естественного хромосомного положения.
Как использующиеся в настоящем изобретении, антитело, которое "связывается специфически с" антигеном, "является специфическим к/для" антигену/антигена или "специфически узнает" антиген, представляющий интерес, например, опухоль-ассоциированную полипептидную антигенную мишень, является антителом, которое связывает антиген с достаточной аффинностью, таким образом, что антитело становится полезным как терапевтический агент в клетке-мишени или ткани-мишени, экспрессирующих антиген, и имеющее незначительную кросс-реактивность с другими белками или имеющее незначительную кросс-реактивность с такими белками как ортологи и варианты (например, мутантные формы, варианты сплайсинга или протеолитически усеченные формы) вышеупомянутой антигенной мишени. Выражение "специфически узнает" или "связывается специфически с" или является "специфическим к/для" по отношению к конкретному полипептиду или эпитопу на конкретной полипептидной цепи, как применяется в описании настоящего изобретения, может демонстрироваться, например, антителом или его антигенсвязывающим фрагментом, имеющим моновалентную КD для антигена меньше, чем около 10-4 М, альтернативно меньше, чем около 10-5 М, альтернативно меньше, чем около 10-6 М, альтернативно меньше, чем около 10-7 М, альтернативно меньше, чем около 10-8 М, альтернативно меньше, чем около 10-9 М, альтернативно меньше, чем около 10-10 М, альтернативно меньше, чем около 10-11 М, альтернативно меньше, чем около 10-12 М, или меньше. Антитело "связывается специфически с" антигеном, "специфическое к/для" антигену/антигена или "специфически узнает" антиген, если такое антитело в состоянии отличить такой антиген от одного или более ссылочного антигена(ов). В своей самой общей форме, "специфическое связывание", "связывается специфически с", является "специфическим к/для" или "специфически узнает" относится к способности антитела различать между антигеном, представляющим интерес, и неродственным антигеном, как определяется, например, в соответствии с одним из нижеследующих способов. Такие способы включают, но не ограничены этим: Вестерн-блоттинг, ELISA, РИА (радиоиммуноанализ), ECL (электрогенерированная хемилюминесценция), IRMA (иммунорадиометрический анализ) и пептидное сканирование. Например, может быть осуществлен стандартный анализ ELISA. Оценка может осуществляться посредством стандартного развития окрашивания (например, вторичное антитело с пероксидазой хрена и тетраметилбензидином с перекисью водорода). Реакция в определенных лунках оценивается по оптической плотности, например, при 450 нм. Типичная фоновая интенсивность (= негативной реакции) может быть 0,1 OD; типичная положительная реакция может давать 1 OD. Это означает, что отношение положительное/отрицательное может быть более чем 5-кратное, 10-кратное, 50-кратное и предпочтительно более чем 100-кратное. Как правило, определение специфичности связывания осуществляется при помощи не единственного референс-антигена, но набора от около трех до пяти неродственных антигенов, таких как молочный порошок, БСА, трансферрин и т.п.
"Связывающая способность" относится к силе сумме общих нековалентных взаимодействий между единственным связывающим участком молекулы и ее партнером по связыванию. Если не обозначено иначе, как использующаяся в настоящем изобретении, "связывающая способность" относится ко внутренней связывающей способности, которая отражает взаимодействие 1:1 между членами пары по связыванию (например, антителом и антигеном). Константа диссоциации "KD" обычно используется, чтобы описать сродство между молекулой (такой как антитело) и его партнером по связыванию (таким как антиген), то есть, как сильно лиганд связывается с конкретным белком. Аффинности лиганд-белок зависят от нековалентных межмолекулярных взаимодействий между этими двумя молекулами. Аффинность может быть измерена общепринятыми методиками, известными в данной области техники, включая описанные в настоящем изобретении. В одном варианте осуществления "kd" или "значение kd" в соответствии с настоящим изобретением измеряются при помощи анализа поверхностного плазменного резонанса с использованием подходящих устройств, включая, но без ограничения к этому, устройства Biacore, такие как Biacore T100, Biacore T200, Biacore 2000, Biacore 4000, Biacore 3000 (GE Healthcare Biacore, Inc.), или устройство ProteOn XPR36 (Bio-Rad Laboratories, Inc.).
Как применяется в описании настоящего изобретения, термин «эпитоп» включает любую детерминанту белка, способную к специфическому связыванию с иммуноглобулином или Т-клеточными рецепторами. Эпитопные детерминанты обычно состоит из химически активных поверхностных группировок молекул, таких как аминокислотные или углеводные боковые цепи или комбинации вышеперечисленного и обычно имеют специфические трехмерные структурные особенности, так же как специфические особенности распределения заряда.
«Антитело, которое связывается с одним и тем же эпитопом» в качестве эталонного антитела или «антитело, которое конкурирует за связывание» с эталонным антителом, относится к антителу, которое блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 10%, 20%, 30%, 40%, 50% и более, и наоборот, контрольное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 10%, 20%, 30%, 40%, 50% и более. Примерный конкурентный анализ представлен в настоящей заявке.
«Антитело, которое связывается с эпитопом целевого белка Z, где указанный эпитоп содержит аминокислотные остатки X1, Х2, Х3, …», представляет собой антитело, которое содержит атомы в пределах 5 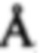 , предпочтительно в пределах 4
, предпочтительно в пределах 4 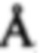 , к атомам указанных аминокислотных остатков X1, Х2, Х3, … целевого белка Z после связывания антитела с его целевым белком. Такие эпитопы могут быть определены с использованием рентгеновской кристаллической структуры, как показано в примере 16.
, к атомам указанных аминокислотных остатков X1, Х2, Х3, … целевого белка Z после связывания антитела с его целевым белком. Такие эпитопы могут быть определены с использованием рентгеновской кристаллической структуры, как показано в примере 16.
"Антителозависимая клеточная цитотоксичность" или "ADCC" относится к форме цитотоксичности, в которой секретируемый Ig, связанный с рецептором гамма Fc (FcyRs), присутствующим на специфических цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторным клеткам связаться специфически с клеткой-мишенью, несущей антиген, и впоследствии убить клетку-мишень, например, цитотоксинами. Чтобы оценить ADCC активность антитела, представляющего интерес, может быть осуществлен in vitro анализ ADCC, такой как описанный в патенте США №5500362 или патенте США 5821337 или патенте США №6737056 (Presta). Полезные эффекторные клетки для такого исследования включают РВМС и NK клетки.
"Комплементзависимая цитотоксичность" или "CDC" относятся к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы компонента (Clq) с антителами (соответствующего подкласса), которые связаны с антигеном, им распознанным. Для оценки активации компонента используют анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Полипептидные варианты с измененными аминокислотными последовательностями Fc-фрагмента (полипептиды с различными вариантами Fc-фрагмента) и увеличенное или уменьшенное связывание Clq описаны, например, в патенте США No. 6194551 и WO 1999/51642.
Как применяется в настоящей заявке, термин «оголенное антитело» относится к антителу, которое не конъюгировано с гетерологичной частью (например, цитотоксической частью) или радиоактивной меткой. Это оголенное антитело моет присутствовать в фармацевтической композиции.
Термин иммуноконъюгат (взаимозаменяемо называемый "конъюгат антитело-лекарственное средство" или "ADC") относится к антителу, конъюгированному с одним или более цитотоксическим агентом, таким как химиотерапевтический агент, лекарственная субстанция, агент, ингибирующий рост, токсин (например, белковый токсин, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или их фрагменты), или радиоактивный изотоп (то есть, радиоконъюгат). Иммуноконъюгаты использовались для местной доставки цитотоксических веществ, таких как лекарственные средства, которые убивают или ингибируют рост или пролиферацию клеток при лечении рака (например, Liu et al, Proc Natl. Acad. Sci. (1996), 93, 8618-8623)). Иммуноконъюгаты позволяют осуществлять направленную доставку лекарственных молекул в опухоль и внутриклеточное накопление там, где системное введение неконъюгированных лекарственных средств может привести к недопустимым уровням токсичности для нормальных клеток и/или тканей. Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин. Токсины могут проявить свои цитотоксические эффекты посредством механизмов, включающие связывание тубулина, связывание ДНК или ингибирование топоизомеразы.
«Процент (%) идентичности последовательности" относительно ссылочной полинуклеотидной или полипептидной последовательности, соответственно, определяли как процент остатков нуклеиновой кислоты или аминокислотных остатков, соответственно, в последовательности-кандидате, которые идентичны по остаткам нуклеиновой кислоты или аминокислотным остаткам, соответственно в ссылочной полинуклеотидной или полипептидной последовательности, соответственно, после выравнивания последовательностей и введение гэпов при необходимости, для достижения максимального процента идентичности последовательности. Консервативные замены не рассматриваются как часть идентичности последовательности. Предпочтительным является выравнивание без гэпов. Выравнивание с целью определения процента идентичности аминокислотной последовательности может быть достигнуто различными способами, которые находятся в пределах компетентности специалистов в данной области техники, например, с использованием общедоступного программного обеспечения, такое как BLAST, BLAST 2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых полноразмерных последовательностей.
«Гомологичность последовательности" указывает процент аминокислот, которые либо идентичны, либо представляют собой консервативные аминокислотные замены.
Термин «созревшие антитела» или «созревшие антиген-связывающие фрагменты», такие как созревшие Fab-варианты, включают производные антитела или фрагмента антитела, обладающие более сильным связыванием, т.е. связыванием с повышенной аффинностью, с данным антигеном, таким как внеклеточный домен целевого белка. Созревание представляет собой процесс идентификации небольшого числа мутаций, например, в шести CDR антитела или фрагмента антитела, приводящий к увеличению его аффинности. Процесс созревания представляет собой комбинацию методов молекулярной биологии для введения мутаций в антитело и скрининга для идентификации улучшенных связующих.
«Антагонистическое» антитело или «блокирующее» антитело представляет собой антитело, которое значительно ингибирует (или частично или полностью) биологическую активность антигена, который оно связывает.
«Агонистическое» антитело или антитело с «агонистической активностью» представляет собой антитело, которое связывается с его мишенью и индуцирует активацию (частично или полностью) соответствующей мишени, что, например, приводит к активации сигнальных путей или биологических эффектов (либо частично, либо полностью), которые опосредованы соответствующей мишенью. «Агонистическое» антитело или антитело с «агонистической активностью», как используется в настоящей заявке, представляет собой антитело, которое может имитировать по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
Термин «фармацевтический состав»/«фармацевтическая композиция» относится к препарату, который находится в такой форме, чтобы обеспечить эффективную биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые неприемлемо токсичны для субъекта, которому подлежит введение композиции.
Используемый в настоящей заявке термин «вектор» относится к молекуле нуклеиновой кислоты, способной распространять другую нуклеиновую кислоту, с которой она связана. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы упоминаются в настоящей заявке как «экспрессионные векторы».
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. К клеткам-хозяевам относятся «трансформанты», «трансформированные клетки», «трансфектанты», «трансфицированные клетки» и «трансдуцированные клетки», которые включают первично трансформированную/трансфицированную/трансдуцированную клетку и потомство, полученное из нее, независимо от количества пассажей. Потомство не может быть полностью идентичным по содержанию нуклеиновой кислоты в родительской клетке, но может содержать мутации. В настоящую заявку включено мутантное потомство, которое имеет ту же функцию или биологическую активность, что и скринированные или отобранные в первоначально трансформированной клетке.
Антитела согласно настоящему изобретению
Настоящее изобретение относится к антителам или их аниген-связывающим фрагментам или их вариантам, которые специфически связываются с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, и которые поэтому не реагируют перекрестно в значительной степени с близкородственной человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5.
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты специфически связываются со зрелым внеклеточным доменом СЕАСАМ6 и зрелым внеклеточным доменом СЕАСАМ6 Масаса fascicularis, и не реагируют перекрестно в значительной степени с близкородственными зрелыми внеклеточными доменами человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5. Зрелые внеклеточные домены могут быть частью белков полной длины, экспрессируемых на клеточной поверхности, а также растворимых белков (природного происхождения или рекомбинантно эксрпессируемых).
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты специфически связываются с белками, содержащими зрелый внеклеточный домен человеческой СЕАСАМ6 и/или зрелый внеклеточный домен СЕАСАМ6 Масаса fascicularis, и не реагирует перекрестно в значительной степени с белками, содержащими только близкородственные зрелые внеклеточные домены человеческой СЕАСАМ1 и/или человеческой СЕАСАМ3, и/или человеческой СЕАСАМ5.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые являются специфическими для человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascilularis, что означает, что антитела являются перекрестно-реагирующими с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascilularis.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые являются селективными для СЕАСАМ6, что означает, что они не реагируют перекрестно в значительной степени с близкородственными СЕАСАМ1, СЕАСАМ3, и СЕАСАМ5.
В другом варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые связываются с человеческой СЕАСАМ6 и являются перекрестно реагирующими с СЕАСАМ6 другого вида, включая, но без ограничения к этому, макак с подобной аффинностью. Предпочтительно, указанным другим видом являются нечеловекообразная обезьяна, такая как, например, Масаса fascicularis, Масаса mulatta, орангутанг, горилла и шимпанзе. Наиболее предпочтительно, антитела, или их антиген-связывающие фрагменты антитела или их варианты связываются с человеческой СЕАСАМ6 и являются перекрестие реагирующими с СЕАСАМ6 яванских макак.
Моноклональное антитело, связывающееся с антигеном 1 (Ag1), является «перекрестно-реагирующим» с антигеном 2 (Ag2), когда значения EC50 и/или kd находятся в подобном диапазоне для обоих антигенов. В настоящем описании моноклональное антитело, связывающееся с Ag1, является перекрестно-реагирующим с Ag2, когда отношение сродства к Ag1 к аффинности к Ag2 равно или менее 10 (≤10) и равно или более 0,1 (≥0,1), что означает что аффинности для Ag1 и Ag2 не отличаются более чем в 10 раз (аффинности находятся в пределах одного порядка моновалентной KD) при условии, что аффинности измеряются одним и тем же методом в тех же экспериментальных условиях для обоих антигенов.
Соответственно, антитело согласно настоящему изобретению имеет отношение аффинности для человеческой СЕАСАМ6 к аффинности для СЕАСАМ6 Масаса fascicularis, которое равно или менее 10 (≤10) и равно или более 0,1 (≥0,1), что означает, что аффинности для человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis не отличаются более чем в 10 раз (аффинности находятся в пределах одного порядка моновалентной KD). Таким образом, антитело согласно настоящему изобретению, или его антигенсвязывающий фрагмент антитела или его вариант согласно настоящему изобретению могут быть использованы в токсикологических исследованиях, проведенных на обезьянах, поскольку профиль токсичности, наблюдаемый у обезьян, будет релевантным для прогнозирования потенциальных неблагоприятных эффектов у людей.
Моноклональное антитело, связывающееся с антигеном 1 (Ag1), является «не перекрестно-реагирующим в значительной степени» с антигеном 3 (Ag3), когда аффинности сильно отличаются для двух антигенов. Аффинность для Ag3 может не поддаваться измерению, если ответ на связывание (измеренный сигнал связывания в анализе) слишком низок. В настоящей заявке моноклональное антитело, связывающееся с Ag1, является «не перекрестно-реагирующим в значительной степени» с Ag3, когда ответ на связывание (измеренный сигнал связывания в анализе) моноклинального антитела с Ag3 составляет менее 5%, предпочтительно менее 2% от ответа связывания того же моноклонального антитела с Ag1 в той же самой экспериментальной установке и при той же концентрации антител. На практике используемой концентрацией антитела может быть EC50 или kd, или концентрация, необходимая для достижения плато насыщения, полученного с помощью Ag1.
В соответствии с настоящим изобретением антитела или их антиген-связывающие фрагменты антитела или их варианты не реагируют в значительной степени с человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5.
Предпочтительный вариант выполнения настоящего изобретения имеет аффинность для человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, которая составляет ≤400 нМ, предпочтительно ≤200 нМ, альтернаивно предпочтительно ≤100 нМ, определенную как моновалентную аффинность к рекомбинантной СЕАСАМ6 (смотрите Пример 2), как показано в Таблице 13, Таблице 18 и Таблице 20.
В соответствии с настоящим изобретением антитела или их антиген-связывающие фрагменты антитела или их варианты связываются с доменом 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и доменом 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177) (аффинности находятся в пределах одного порядка величины моновалентной KD). Домен 1 СЕАСАМ6 также известен как N домен.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые специфически связываются с доменом 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и специфически связывается с доменом 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177) с аффинностями (моновалентная KD), которые находятся в пределах одного порядка величины. Весьма предпочтительными являются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые имеют аффинность к обоим, домену 1 человеческой СЕАСАМ6 и домену 1 СЕАСАМ6 Масаса fascicularis, равную KD≤100 нМ.
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты специфически связываются с белками, содержащими домен 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и/или домен 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177).
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты специфически связываются с белками, содержащими домен 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и/или домен 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177), и не реагируют перекрестно в значительной степени с близкородственной человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5.
Антитела согласно настоящему изобретению или их антиген-связывающие фрагменты антитела или их варианты специфически связываются с белками, содержащими домен 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и/или домен 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177), и не реагируют перекрестно в значительной степени с белками, содержащими только близкородственные зрелые внеклеточные домены человеческой СЕАСАМ1, и/или человеческой СЕАСАМ3, и/или человеческой СЕАСАМ5.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их аниген-связывающие фрагменты или их варианты, которые специфически связываются со зрелым внеклеточным доменом СЕАСАМ6 и зрелым внеклеточным доменом СЕАСАМ6 Масаса fascicularis, и конкурентоспособны для связывания с антителом 9А6 (Genovac/Aldevron) на человеческой СЕАСАМ6 и не реагируют перекрестно в значительной степени с близкородственными зрелыми внеклеточными доменами человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их аниген-связывающие фрагменты или их варианты, которые специфически связываются с доменом 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179) и доменом 1 СЕАСАМ6 Масаса fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177), и конкурентоспособны для связывания с антителом 9А6 (Genovac/Aldevron) на человеческой СЕАСАМ6.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые специфически связываются с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, и которые препятствуют взаимодействию СЕАСАМ6 СЕАСАМ1. Антитело препятствует взаимодействию СЕАСАМ6 и СЕАСАМ1, когда сигнал связывания предварительно образованного комплекса антитело-СЕАСАМ6 уменьшен на более 20%, предпочтительно на более 50% по сравнению со сигналом связывания белка СЕАСАМ6 самого по себе, в типичном анализе связывания с СЕАСАМ1, который приведен в примерах. Вмешательство во взаимодействие СЕАСАМ6 и СЕАСАМ1 может быть механизмом модуляции врожденных и адаптивных иммунных ответов.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые специфически связываются с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, и которые имеют иммуномодулирующую активность. «Иммуномодуляция» представляет собой регулировку иммунного ответа на желаемый уровень, как при иммуноусилении, иммуносупрессии или индукции иммунологической толерантности. Лекарственное средство «иммуномодулирующее антитело» представляет собой агент, модифицирующий иммунный ответ, который стимулирует или подавляет иммунный ответ для лечения заболевания, например, рака, или противовоспалительное средство. Настоящее изобретение обеспечивает анти-СЕАСАМ6 иммуномодулирующее антитело, как показано в Примере 11, которое блокирует СЕАСАМ6, которая является подавляющим иммунные клетки лигандом на раковых клетках и возможно других клетках, включая компоненты иммунных систем, что приводит к изменению профиля экспрессии иммунного маркера и статуса активации Т клеток в направлении повторной активации противоопухолевых Т клеток и эффективного противоопухолевого иммунного ответа. Антитело, связывающееся с доменом 1 СЕАСАМ6, является предпочтительным.
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые специфически связываются с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, и которые способны ослаблять СЕАСАМ6-опосредованное иммуноподавление специфичных к опухолевому антигену Т клеток, как измерено посредством секреции IFN-гамма специфичными к опухолевому антигену Т клетками или числа IFN-гамма, секретируемого Т клетками. Анти-СЕАСАМ6 антитело способно ослаблять СЕАСАМ6-опосредованное иммуноподавление специфичных к опухолевому антигену Т клеток, если антитело в сокультуре опухоль-специфичных Т клеток с опухолевыми клетками дает в >1.2, предпочтительно в >1,5 раз увеличение секреции IFN-гамма по сравнению с контрольными образцами. Предпочтительно специфичные для опухолевого антигена Т клетки представляют собой CD8+ Т клетки. Предпочтительным является антитело, которое не реагирует перекрестие в значительной степени с близкородственными СЕАСАМ1, СЕАСАМ3, и СЕАСАМ5, и которое связывается с доменом 1 СЕАСАМ6. Это в качестве примера показано блокадой СЕАСАМ6 антителами согласно настоящему изобретению в сокультуре специфичных для пептида сурвивина CD8+ Т клеток с KS опухолевыми клетками, что дает увеличение в >1,5 раз секреции IFN-гамма по сравнению с контрольными образцами, которые были обработаны изотипически сходным контролем (Фиг. 5 и Фиг. 6).
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые специфически связываются с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, и которые способны изменять цитокиновый профиль специфичных к опухолевому антигену Т клеток в направлении более цитотоксичного и/или активированного фенотипа, характеризующегося увеличенной секрецией IFN-гамма и/или IL-2 и/или TNF-альфа. Предпочтительно специфичными для опухолевого антигена Т клетками являются CD8+ Т клетки, и фенотип характеризутся увеличенной секрецией IFN-гамма и IL-2 и TNF-альфа. Анти-СЕАСАМ6 антитело способно изменять цитокиновый профиль специфичных к опухолевому антигену Т клеток в направлении более цитотоксического и/или активированного фенотипа, если антитело в сокультуре опухоль-специфичных CD8+ T клеток с опухолевыми клетками дает увеличение в >1.2, предпочтительно в >1,5 раз секреции IFN-гамма и/или IL-2 и/или TNF-альфа по сравнению с контрольными образцами, которые были обработаны изотипически сходным контролем. Блокада СЕАСАМ6 антителами согласно настоящему изобретению в сокультуре специфичных для пептида сурвивина Т клеток с KS опухолевыми клетками дает увеличение в >1,5 раза секреции IFN-гамма, IL-2 и TNF-альфа по сравнению с контрольными образцами, которые были обработаны изотипически сходным контролем (Фиг. 6).
В варианте выполнения настоящего изобретения обеспечиваются антитела или их антиген-связывающие фрагменты антитела или их варианты, которые связываются с широким диапазоном различных клеточных линий, экспрессирующих СЕАСАМ6, включая, но без ограничения к этому, показанные в примерах. Эти примеры включают клеточные линии человека из опухолей различного происхождения (например, NSCLC, SCLC, CRC, PancCA, BreastCA, GastricCA, множественная миелома, рак шейки матки, рак кожи, которые представляют собой рак, ранее описанный в литературе как СЕАСАМ6-положительный (смотрите введение или обзор Beauchimen and Arabzadeh, Cancer Metastasis Rev. 2013 Dec;32(3-4):643-71).
В варианте выполнения настоящего изобретения обеспечиваются антитела, или их антиген-связывающие фрагменты антитела или их варианты, которые безопасны для введения человеку. Предпочтительно антитела являются химерными, гуманизированными или человеческими. Высоко предпочтительными являются гуманизированные или человеческие антитела.
Тем не менее, в некоторых анализах предпочтительной является экспрессия антитела согласно настоящему, как мышиного IgG; иммуногистохимия с образцами человека, например, может быть легче проанализирована с использованием мышиных антител или химерных антител человека-мыши.
В другом варианте выполнения настоящего изобретения обеспечиваются антитела, которые составляют инструмент для диагностики злокачественных или диспластических состояний, при которых экспрессия СЕАСАМ6 повышена по сравнению с нормальной тканью, или где СЕАСАМ6 является слущивающимся из клеточной поверхности и становится обнаруживаемым в сыворотке. Обеспечиваются анти-СЕАСАМ6 антитела, конъюгированные с детектируемым маркером. Предпочтительными маркерами являются радиометка, фермент, хромофор или флуорофор.
Во всем этом документе делается ссылка на следующие предпочтительные анти-СЕАСАМ6 антитела согласно настоящему изобретению, как показано в таблице 1.
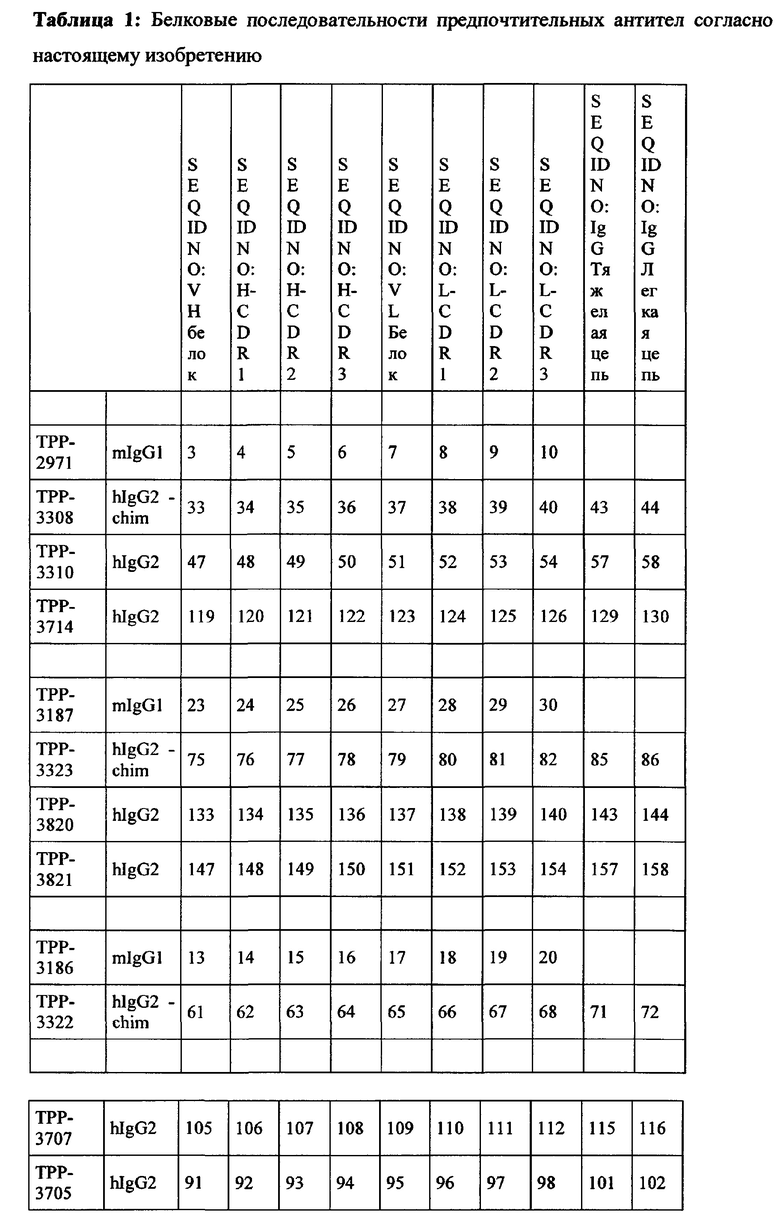
Последовательности предпочтительных антител согласно настоящему изобретению или их антигенсвязывающих фрагментов, приведенные в Таблице 1, дополнительно приводятся и поясняются на Фиг. 8.
ТРР-3308 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 43, и область легкой цепи, соответствующую SEQ ID NO: 44.
ТРР-3310 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 57, и область легкой цепи, соответствующую SEQ ID NO: 58.
ТРР-3714 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 129, и область легкой цепи, соответствующую SEQ ID NO: 130.
ТРР-3323 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 85, и область легкой цепи, соответствующую SEQ ID NO: 86.
ТРР-3820 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 143, и область легкой цепи, соответствующую SEQ ID NO: 144.
ТРР-3821 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 157, и область легкой цепи, соответствующую SEQ ID NO: 158.
ТРР-3322 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 71, и область легкой цепи, соответствующую SEQ ID NO: 72.
ТРР-3707 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 115, и область легкой цепи, соответствующую SEQ ID NO: 116.
ТРР-3705 представляет собой антитело, содержащее область тяжелой цепи, соответствующую SEQ ID NO: 101, и область легкой цепи, соответствующую SEQ ID NO: 102.
В другом предпочтительном варианте выполнения настоящего изобретения антитела или антиген-связывающие фрагменты содержат CDR последовательности тяжелой и легкой цепи, которые на по меньшей мере 50%, 55%, 60% 70%, 80%, 90, или 95% идентичны по меньшей мере одной, предпочтительно соответствующей, CDR последовательности антитела "ТРР-2971", "ТРР-3186", "ТРР-3187", "ТРР-3308", "ТРР-3310", "ТРР-3322", "ТРР-3323", "ТРР-3705", "ТРР-3707", "ТРР-3714", "ТРР-3820", "ТРР-3821" или на по меньшей мере 50%, 60%, 70%, 80%, 90%, 92% или 95% идентичны VH или VL последовательности "ТРР-2971", "ТРР-3186", "ТРР-3187", "ТРР-3308", "ТРР-3310", "ТРР-3322", "ТРР-3323", "ТРР-3705", "ТРР-3707", "ТРР-3714", "ТРР-3820", "ТРР-3821", соответственно.
В другом предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит по меньшей мере одну CDR последовательность или по меньшей мере одну последовательность вариабельной тяжелой цепи или последовательность вариабельной легкой цепи, как показано в Таблице 1.
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 4 (H-CDR1), SEQ ID NO: 5 (H-CDR2) и SEQ ID NO: 6 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 8 (L-CDR1), SEQ ID NO: 9 (L-CDR2) и SEQ ID NO: 10 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 34 (H-CDR1), SEQ ID NO: 35 (H-CDR2) и SEQ ID NO: 36 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 38 (L-CDR1), SEQ ID NO: 39 (L-CDR2) и SEQ ID NO: 40 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 48 (H-CDR1), SEQ ID NO: 49 (H-CDR2) и SEQ ID NO: 50 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 52 (L-CDR1), SEQ ID NO: 53 (L-CDR2) и SEQ ID NO: 54 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 120 (H-CDR1), SEQ ID NO: 121 (H-CDR2) и SEQ ID NO: 122 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 124 (L-CDR1), SEQ ID NO: 125 (L-CDR2) и SEQ ID NO: 126 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 24 (H-CDR1), SEQ ID NO: 25 (H-CDR2) и SEQ ID NO: 26 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 28 (L-CDR1), SEQ ID NO: 29 (L-CDR2) и SEQ ID NO: 30 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 76 (H-CDR1), SEQ ID NO: 77 (H-CDR2) и SEQ ID NO: 78 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 80 (L-CDR1), SEQ ID NO: 81 (L-CDR2) и SEQ ID NO: 82 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 134 (H-CDR1), SEQ ID NO: 135 (H-CDR2) и SEQ ID NO: 136 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 138 (L-CDR1), SEQ ID NO: 139 (L-CDR2) и SEQ ID NO: 140 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 148 (H-CDR1), SEQ ID NO: 149 (H-CDR2) и SEQ ID NO: 150 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 152 (L-CDR1), SEQ ID NO: 153 (L-CDR2) и SEQ ID NO: 154 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 62 (H-CDR1), SEQ ID NO: 63 (H-CDR2) и SEQ ID NO: 64 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 66 (L-CDR1), SEQ ID NO: 67 (L-CDR2) и SEQ ID NO: 68 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 14 (H-CDR1), SEQ ID NO: 15 (H-CDR2) и SEQ ID NO: 16 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 18 (L-CDR1), SEQ ID NO: 19 (L-CDR2) и SEQ ID NO: 20 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 106 (H-CDR1), SEQ ID NO: 107 (H-CDR2) и SEQ ID NO: 108 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 110 (L-CDR1), SEQ ID NO: 111 (L-CDR2) и SEQ ID NO: 112 (L-CDR3).
В предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит антиген-связывающую область тяжелой цепи, которая содержит SEQ ID NO: 92 (H-CDR1), SEQ ID NO: 93 (H-CDR2) и SEQ ID NO: 94 (H-CDR3), и содержит антиген-связывающую область легкой цепи, которая содержит SEQ ID NO: 96 (L-CDR1), SEQ ID NO: 97 (L-CDR2) и SEQ ID NO: 98 (L-CDR3).
Антитела различаются по последовательности не только в пределах их областей, определяющих комплементарность (CDR), но также в пределах каркасного участка (FR). Эти различия последовательностей кодируются в разных V-генах. гаметический набор антител человека был полностью секвенирован. Существует около 50 функциональных генов зародышевой линии VH, которые могут быть сгруппированы в шесть подсемейств в соответствии с гомологией последовательностей VH1, VH2, VH3, VH4, VH5 и VH6 (Tomlinson et al., 1992, J. Mol. Biol., 227, 776-798; Matsuda & Honjo, 1996, Advan. Immunol., 62, 1-29). Около 40 функциональных VL kappa genes, содержащих семь подсемейств, известны (Сох et al., 1994, Eur. J. Immunol. 24, 827-836; Barbie & Lefranc, 1998, Exp. Clin. Immunogenet. 15, 171-183): Vkappa1, Vkappa2, Vkappa3, Vkappa4, Vkappa5, Vkappa6 и Vkappa7. В настоящей заявке раскрываются тяжелые цепи антител согласно настоящему изобретению, которые относятся к подсемейству VH2 человека, и легкие цепи антител согласно настоящему изобретению, которые принадлежат к подсемейству Vkappa1 человека, соответственно. Известно, что каркасные последовательности антител, принадлежащих к одному и тому же подсемейству, тесно связаны между собой, например, антитела, содержащие член подсемейства VH3 человека, все обладают сравнимой стабильностью (Honegger et al., 2009, Protein Eng Des Sel. 22(3): 121-134). В данной области хорошо известно, что CDR из антител могут быть трансплантированы на разных каркасах, сохраняя при этом особые признаки соответствующего исходного антитела. CDR были успешно трансплантированы на каркасах, принадлежащих к другому виду, а также к на каркасах того же вида, принадлежащего к другому подсемейству. В еще одном варианте выполнения настоящего изобретения антитело или его антиген-связывающий фрагмент согласно настоящему изобретению содержит по меньшей мере одну CDR-последовательностъ антитела согласно настоящему изобретению, как показано в таблице 1, и последовательность каркаса вариабельной цепи человека.
В предпочтительном варианте выполнения настоящего изобретения антитело или его антиген-связывающий фрагмент согласно настоящему изобретению содержит вариабельную легкую цепь или антиген-связывающую область вариабельной цепи, содержащую L-CDR1, L-CDR2 и L-CDR3 последовательность вариабельной легкой цепи, и вариабельную тяжелую цепь или антиген-связывающую область тяжелой цепи, содержащую H-CDR1, H-CDR2 и H-CDR3 последовательность вариабельной тяжелой цепи антитела согласно настоящему изобретению, как показано в Таблице 1, и каркасную последовательность вариабельной легкой цепи человека и вариабельной тяжелой цепи человека.
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 3 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 7 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 33 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 37 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 119 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 123 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 23 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 27 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 75 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 79 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 133 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 137 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 147 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 151 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 13 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 17 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 61 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 65 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 105 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 109 (VL).
В весьма предпочтительном варианте выполнения настоящего изобретения антитело согласно настоящему изобретению или его антиген-связывающий фрагмент содержит последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 91 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 95 (VL).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один, два, три, четыре, пять, восемь, десять, пятнадцать или более аминокислотных остатков, выбранных из группы, состоящей из Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu и мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один, два, три, четыре, пять, восемь, десять, пятнадцать или более аминокислотных остатков, выбранных из группы, состоящей из Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu 129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Рhe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один, два, три, четыре, пять, восемь, десять, пятнадцать или более аминокислотных остатков, выбранных из группы, состоящей из Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению или его антиген-связывающий фрагмент антитела, или его вариант связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL), и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL) и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один, два, три, четыре, пять, восемь, десять, пятнадцать или более аминокислотных остатков, выбранных из группы, состоящей из Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL) и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
В некоторых вариантах выполнения настоящего изобретения, анти-СЕАСАМ6 антитело согласно настоящему изобретению взаимодействует с, например, связывается с, эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Рrо59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179, и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант конкурирует за связывание с СЕСЕАМ6 с антителом, содержащим последовательность вариабельной тяжелой цепи, как представлено SEQ ID NO: 47 (VH), и последовательности вариабельной легкой цепи, как представлено SEQ ID NO: 51 (VL) и где указанный антиген или его антиген-связывающий фрагмент антитела или его вариант связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию (нумерация согласно SEQ-ID: 179).
Антителом согласно настоящему изобретению может быть IgG (иммуноглобулин G например, IgG1 IgG2, IgG3, IgG4) или IgA, IgD, IgE, IgM, тогда как фрагментом антитела может быть Fab, Fab', F(ab')2, Fab'-SH или scFv, например. Фрагментом антитела согласно настоящему изобретению, соответственно, может быть, или он может содержать, антиген-связывающая область, которая работает одним или более путями, как описано в настоящей заявке.
В предпочтительном варианте выполнения настоящего изобретения антитела или антиген-связывающие фрагменты антител согласно настоящему изобретению являются моноклональными.
В некоторых вариантах выполнения настоящего изобретения антитела согласно настоящему изобретению или их антигенсвязывающие фрагменты, или нуклеиновые кислоты, кодирующие их, выделяют. Выделенный биологический компонент (такие как молекула нуклеиновой кислоты или белок, такое как антитело) является компонентом, который был по существу отделен или очищен от других биологических компонентов в клетке организма, в котором компонент естественно существует, например, другая хромосомная и внехромосомная ДНК и РНК, белки и органеллы. Термин также охватывает нуклеиновые кислоты и белки, полученные посредством рекомбинантной экспрессии в клетке-хозяине, а также нуклеиновые кислоты, синтезированные химическим путем.
Получение антитела
Антитело согласно настоящему исследованию можно получить из библиотеки рекомбинантных антител, которая основана на аминокислотных последовательностях, которые были выделены из антител большого числа здоровых добровольцев, например, с использованием технологии n-CoDeR®, полные CDR человека рекомбинируются в новые молекулы антител (Carlson &  , Expert Rev Mol Diagn. 2001 May; 1(1): 102-8). Или альтернативно, например, библиотеки антител, как библиотека фаговых отображений полностью человеческого антитела, описанная в Hoet RM et al., Nat Biotechnol 2005; 23(3):344-8), могут быть использованы для выделения СЕАСАМ6-специфичных антител. Антитела или фрагменты антител, выделенные из библиотек антител человека, считаются человеческими антителами или фрагментами человеческого антитела.
, Expert Rev Mol Diagn. 2001 May; 1(1): 102-8). Или альтернативно, например, библиотеки антител, как библиотека фаговых отображений полностью человеческого антитела, описанная в Hoet RM et al., Nat Biotechnol 2005; 23(3):344-8), могут быть использованы для выделения СЕАСАМ6-специфичных антител. Антитела или фрагменты антител, выделенные из библиотек антител человека, считаются человеческими антителами или фрагментами человеческого антитела.
Человеческие антитела могут быть дополнительно получены путем введения иммуногена трансгенному животному, которое было модифицировано для получения интактных человеческих антител или интактных антител с вариабельными областями человека в ответ на провокацию антигеном. Такие животные обычно содержат все или часть локусов иммуноглобулина человека, которые заменяют эндогенные локусы иммуноглобулина или которые присутствуют внехромосомно или интегрированы случайным образом в хромосомы животного. Например, может быть проведена иммунизация мышей, созданных методами генетической инженерии, среди прочего, иммунизация мышей hMAb (например, VelocImmune mouse® или XENOMOUSE®).
Другие антитела могут быть получены с применением гибридомной технологии (например смотрите  and Milstein Nature. 1975 Aug 7; 256(5517):495-7), с получением, например, мышиного, крысиного, или кроличьего антител, которые могут быть превращены в химерные или гуманизированные антитела. Гуманизированные антитела и способы их получения приводятся, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Natl Acad. Sci. USA 86:10029-10033 (1989); патентах США №5,821,337, 7,527,791, 6,982,321, и 7,087,409; Kashmiri et al., Methods 36:25-34 (2005) (описывается трансплантация определяющей специфичность области (SDR); Padlan, Mol. Immunol. 28:489-498 (1991) (описывается "перекладка"); Dall' Acqua et al., Methods 36:43-60 (2005) (описывается "FR шаффлинг"); и Osboum et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описывается подход «направленная селекция" для FR шаффлинга).
and Milstein Nature. 1975 Aug 7; 256(5517):495-7), с получением, например, мышиного, крысиного, или кроличьего антител, которые могут быть превращены в химерные или гуманизированные антитела. Гуманизированные антитела и способы их получения приводятся, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Natl Acad. Sci. USA 86:10029-10033 (1989); патентах США №5,821,337, 7,527,791, 6,982,321, и 7,087,409; Kashmiri et al., Methods 36:25-34 (2005) (описывается трансплантация определяющей специфичность области (SDR); Padlan, Mol. Immunol. 28:489-498 (1991) (описывается "перекладка"); Dall' Acqua et al., Methods 36:43-60 (2005) (описывается "FR шаффлинг"); и Osboum et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описывается подход «направленная селекция" для FR шаффлинга).
Приведены примеры получения антител с использованием библиотеки рекомбинантных антител и иммунизации мышей в сочетании с последующей гуманизацией.
Объектом настоящего изобретения является способ получения антител, специфически связывающихся с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, которое не реагирует перекрестно в значительной степени с человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5. В варианте выполнения настоящего изобретения обеспечивается способ получения анти-СЕАСАМ6 антитела, отличающийся тем, что он включает стадии иммунизации животного, предпочтительно мыши, доменом 1 СЕСАМ6 яванских макак (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177), определяющим аминокислотную последовательность антител, специфически связывающихся с человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, с последующей необязательной гуманизацией или генерацией химерного антитела, и экспрессии указанных антител. Экспрессионной системой может быть рекомбинантная или бесклеточная экспрессионная система. Подходящими клетками-хозяевами для рекомбинантной экспрессии являются прокариотические и эукариотические клетки. Предпочтительными являются млекопитающие экспрессионные системы.
Пептидные варианты
Антитела или антиген-связывающие фрагменты согласно настоящему изобретению не ограничиваются конкретными пептидными последовательностями, представленными в настоящей заявке. Напротив, изобретение также охватывает варианты этих полипептидов. Ссылаясь на текущее раскрытие и общедоступные технологии и ссылки, квалифицированный специалист может получить, протестировать и использовать функциональные варианты антител, раскрытых в настоящей заявке, в то время как эти варианты, имеющие способность связываться с СЕАСАМ6, входят в объем настоящего изобретения.
Вариант может включать, например, антитело, которое имеет по меньшей мере один измененный домен/положение области, определяющей комплементарность (CDR) (гипервариабельной) и/или каркасной последовательности (FR) (вариабельная) по отношению к пептидной последовательности, раскрытой в настоящей заявке.
Изменяя один или более аминокислотных остатков в области CDR или FR, квалифицированный специалист обычно может получить мутированные или разнообразные последовательности антител, которые можно скринировать по отношению к антигену, для новых или улучшенных свойств, например.
Другим предпочтительным вариантом выполнения настоящего изобретения является антитело или его антиген-связывающий фрагмент, в котором VH и VL последовательности выбираются, как показано в Таблице 1. Квалифицированный специалист может использовать данные в таблице 1 для разработки пептидных вариантов, которые входят в объем настоящего изобретения. Предпочтительно, чтобы варианты были сконструированы путем изменения аминокислот в пределах одной или более областей CDR; вариант может также иметь одну или более измененных каркасных областей. Изменения также могут быть сделаны в каркасных областях. Например, домен FR пептида может быть изменен там, где есть отклонение в остатке по сравнению с последовательностью зародышевой линии.
Альтернативно, специалист в данной области техники мог сделать такой же анализ, сравнивая аминокислотные последовательности, раскрытые в настоящем изобретении, с известными последовательностями того же класса таких антител с использованием, например, процедуры, описанной в Knappik A., et al, JMB 2000, 296:57-86.
Кроме того, варианты могут быть получены с использованием одного антитела в качестве отправной точки для оптимизации с помощью диверсификации одного или более аминокислотных остатков в антителе, предпочтительно аминокислотных остатков в одном или более CDR, и с помощью скрининга получающейся коллекции вариантов антител для вариантов с улучшенными свойствами. Особенно предпочтительным является диверсификация одного или более аминокислотных остатков в CDR3 VL и/или VH. Диверсификация может быть осуществлена с помощью синтеза коллекции молекул ДНК, с использованием технологии тринуклеотидного мутагенеза (TRIM) Virnekas В. et al., Nucl. Acids Res. 1994, 22:5600.). Антитела или их антигенсвязывающие фрагменты включают молекулы с модификациями/вариациями, включая, но не ограничиваясь этим, например, модификации, приводящие к измененному периоду полураспада (например, модификацией Fc-участка или присоединением дополнительных молекул, таких как ПЭГ), измененной аффинности связывания или измененной активности ADCC или CDC.
Консервативные аминокислотные варианты
Полипептидные варианты могут быть сделаны так, чтобы сохранить общую молекулярную структуру пептидной последовательности антитела, описанной в настоящем изобретении. Учитывая свойства отдельных аминокислот, некоторые рациональные замены специалистом в данной области техники будут признаны полезными. Аминокислотные замены, а именно "консервативные замены", могут быть сделаны, например, на основе подобия полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природе вовлекаемых остатков.
Например, (а) неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; (b) полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин; (с) положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и (d) отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Замены, как правило, могут делаться внутри групп (а)-(d). Кроме того, глицин и пролин могут быть заменять друг друга на основе их способности разрушить α-спирали. Похожим образом некоторые аминокислоты, такие как аланин, цистеин, лейцин, метионин, глутаминовая кислота, глутамин, гистидин и лизин более часто находятся в α-спирали, в то время как валин, изолейцин, фенилаланин, тирозин, триптофан и треонин чаще находятся в β-складчатых структурах. Глицин, серии, аспарагиновая кислота, аспарагин и пролин обычно находятся в петлях. Некоторые предпочтительные замены могут быть сделаны среди следующих групп: (i) S и Т; (ii) Р и G; и (iii) А, V, L и I. С учетом известного генетического кода и рекомбинантных и синтетических методик ДНК специалист в данной области техники с легкостью может сконструировать ДНК, кодирующую консервативные аминокислотные варианты.
Варианты гликозилирования
Когда антитело содержит Fc-область, углевод, присоединенный к ней, может быть изменен. Нативные антитела, продуцируемые клетками млекопитающих, обычно включают разветвленный 2-антеннарный олигосахарид, который обычно присоединяется посредством N-связывания с Asn297, используя ЕС нумерацию по Кэботу доменов СН2 Fc области; смотрите, например, Wright et al. Trends Biotechnol. 15: 26-32 (1997).
В некоторых вариантах выполнения настоящего изобретения, антитело, представленное в настоящей заявке, изменяется для увеличения или уменьшения степени, до которой антитело гликозилировано. Добавление или делеция сайтов гликозилирования к антителу может быть удобно осуществлено путем изменения экспрессионной системы (например, клетки-хозяина) и/или путем изменения аминокислотной последовательности, так что создается или удаляется один или более сайтов гликозилирования
В одном и варианте выполнения настоящего изобретения агликозильные антитела, имеющие пониженную эффекторную функцию, или производные антитела, получают экспрессией в прокариотическом хозяине. Подходящие прокариотические хозяева включают, но без ограничения к этому, Е. coli, Bacillus subtilis, Salmonella typhimurium и различные виды в пределах рода Pseudomonas, Streptomyces, и Staphylococcus.
В одном варианте выполнения настоящего изобретения обеспечиваются варианты антител с пониженной эффекторной функцией, которые характеризуются модификацией в консервативном N-связанном сайте в доменах СН2 области Fc указанного антитела. В одном варианте выполнения настоящего изобретения модификация включает мутацию в сайте гликозилирования тяжелой цепи для предотвращения гликозилирования в сайте. Таким образом, в одном предпочтительном варианте выполнения настоящего изобретения агликозильные антитела или производные антитела получают мутацией сайта гликозилирования тяжелой цепи, т.е. мутацией N297, с использованием EU нумерации по Кэботу, и экспрессией в соответствующей клетке-хозяине.
В другом варианте выполнения настоящего изобретения агликозильные антитела или производные антител имеют уменьшенную эффекторную функцию, где модификация в консервативном N-связанном сайте в доменах СН2 области Fc указанного антитела или производного антитела включает удаление гликанов СН2 домена, - т.е., дегликозилирование. Эти агликозильные антитела могут быть получены обычными способами и затем дегликозилируются ферментативно. Способы ферментативного дегликозилирования антител хорошо известны из уровня техники (например, Winkelhake & Nicolson (1976), J Biol Chem. 251(4): 1074-80).
В другом варианте выполнения настоящего изобретения дегликозилирование может быть достигнуто посредством применения ингибитора гликозилирования туникамицина (Nose & Wigzell (1983), Proc Natl Acad Sci USA, 80(21):6632-6). To есть модификацией является предотвращение гликозилирования в консервативном N-связанном сайте в СН2-доменах Fc-области указанного антитела.
В одном варианте выполнения настоящего изобретения, обеспечиваются варианты антитела, имеющие углеводную структуру, которая не содержит фукозу, присоединенную (напрямую или косвенно) к Fc области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем вычисления среднего количества фукозы в сахарной цепи при Asn297 по отношению к сумме всех гликоструктур, присоединенных к Asn 297 (например, комплексной, гибридной и высокоманнозной структуры), как измерено масс-спектрометрией MALDI-TOF, как описанные в WO 2008/077546, например. Asn297 относится к аспарагиновому остатку, расположенному около положения 297 в области Fc (Eu-нумерация остатков Fc-области); однако Asn297 также может располагаться около ±3 аминокислот выше или ниже по ходу транскрипции от положения 297, то есть между положениями 294 и 300 из-за незначительных вариаций последовательности антител. Такие варианты фукозилирования могут иметь улучшенную ADCC функцию.
Примерные публикации, относящиеся к "дефукозилированным" или "фукоза-дефицитным" вариантам антител, включают: Okazaki et al. J Mol. Biol. 336: 1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004).
Примеры клеточных линий, способных продуцировать дефукозилированные антитела включают Lec13 СНО клетки, дефицитные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); и WO 2004/056312), и нокаутные клеточные линии, такие как ген альфа-1,6-фукозилтрансферазы, FUT8, нокаутные СНО клетки (смотрите, например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006)).
Варианты антител дополнительно снабжены разветвленными пополам олигосахаридами, например, в которых 2-антенарный олигосахарид, присоединенный к Fc-области антитела, делят пополам GlcNAc. Такие варианты антител могут иметь уменьшенное фукозилирование и/или улучшенную ADCC функцию. Примеры таких вариантов антител описаны, например, в WO 2003/011878; патенте США №6,602,684; и US 2005/0123546.
Также обеспечиваются варианты антител с по меньшей мере одним галактозным остатком в олигосахариде, присоединенном к области Fc. Такие варианты антител могут иметь улучшенную CDC функцию. Такие варианты антител описаны, например, в WO 1997/30087; WO 1998/58964; и WO 1999/22764.
Варианты Fc области
В некоторых вариантах выполнения настоящего изобретения, одна или более аминокислотных модификаций (например, замещение) могут быть введены в Fc область антитела (например, Fc область человеческого IgG1, IgG2, IgG3 или IgG4), обеспеченного согласно настоящему изобретению, с получением, таким образом, варианта Fc области.
В некоторых вариантах выполнения настоящего изобретения изобретение охватывает вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, которые делают его желательным кандидатом для применений, в которых период полураспада антитела in vivo имеет важное значение, но некоторые эффекторные функции (такие как комплемент и ADCC) не нужны или вредны. Анализы цитотоксичности in vitro и/или in vivo могут быть проведены для подтверждения снижения/истощения активности CDC и/или ADCC. Например, анализы связывания Fc-рецептора (FcR) могут быть проведены, чтобы гарантировать, что антитело не обладает FcγR-связыванием (следовательно, вероятно, не обладает активностью ADCC), но сохраняет способность FcRn-связывания. В некоторых вариантах выполнения настоящего изобретения в области Fc производятся изменения, которые приводят к изменению (то есть либо улучшенному, либо уменьшенному) C1q связывания и/или комплементзависимой цитотоксичности (CDC).
В некоторых вариантах выполнения настоящего изобретения, настоящее изобретение охватывает вариант антитела, который обладает увеличенным или уменьшенным периодом полураспада. Антитела с увеличенными периодами полураспада и улучшенным связыванием с неонатальным Fc рецептором (FcRn), которые отвечают за передачу материнских IgG плоду (Guyer et al., J Immunol. 117:587 (1976) и Kim et al., J Immunol. 24:249 (1994)), описаны в US 2005/0014934 (Hinton et al.). Эти антитела содержат Fc область с одним или более замещениями в ней, которые улучшают связывание Fc области с FcRn.
Конъюгаты антитело-лекарственное средство (ADC)
Настоящее изобретение также обеспечивает конъюгаты антитело-лекарственное средство (ADC, иммуноконъюгаты), содержащие анти-СЕАСАМ6 антитело, конъюгированное с одним или более цитотоксичными агентами, такими как химиотерапевтические вещества или лекарственные средства, ингибиторы роста, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибкового, растительного, человеческого или животного происхождения, или их фрагменты), или радиоактивные изотопы.
В одном варианте выполнения настоящего изобретения, иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более лекарственными средствами, включая, но без ограничения к этому, майтанзиноид (смотрите Патенты США №5,208,020, 5,416,064 и европейский патент ЕР 0425235); ауристатин, такой как монометилауристатиновые составляющие лекарственного средства DE и DF (ММАЕ и MMAF) (смотрите Патенты США №5,635,483 и 5,780,588, и 7,498,298); доластатин; калихемицин или его производные; антрациклин, такой как дауномицин или доксорубицин; метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен; и СС1065.
В другом варианте выполнения настоящего изобретения, иммуноконъюгат содержит антитело, как описано в настоящей заявке, конъюгировано с ферментативно активным токсином или его фрагментом, включая, но без ограничения к этому, дифтерийную цепь А, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (Р API, Р АРII, и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены.
В другом варианте выполнения настоящего изобретения, иммуноконъюгат содержит антитело, как описано в настоящей заявке, конъюгированное с радиоактивным атомом с образованием радиоконъюгата. Множество радиоактивных изотопов доступны для получения радиоконъюгатов. Примеры включают 227Th, 225Ас, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы Lu. Когда радиоконъюгат применяется для обнаружения, он может содержать радиоактивный атом для сцинтиграфических исследований, например Тс99m, или спиновую метку для ядерно-магнитного резонанса (ЯМР), включая, такие как иод-123 снова, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента могут быть получены с использованием множества бифункциональных связывающих белок агентов, таких как N-сукцинимидил-3-(2-пиридилдитио) пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол).
Линкер может быть «расщепляемым линкером», облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, кислотнолабильный линкер, чувствительный к пептидазе линкер, фотолабильный линкер, диметил-линкер или дисульфидсодержащий линкер (Chari et al., Cancer Res. 52: 12 7-131 (1992).
Иммуноконъюгаты или ADC в контексте настоящего изобретения явно рассматриваются как, но без ограничения к этому, как конъюгаты, полученные с помощью сшивающих реагентов, включая, но без ограничения к этому, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A).
ДНК молекулы согласно настоящему изобретению
Настоящее изобретение также относится к ДНК молекулам, которые кодируют антитело согласно настоящему изобретению или его антиген-связывающий фрагмент. ДНК последовательности, применяемые для экспрессированных антител, приведены в Таблице 32. Эти последовательности оптимизированы в определенных случаях для экспрессии у млекопитающих. Молекулы ДНК в соответствии с настоящим изобретением не ограничены последовательностями, раскрытыми в настоящем изобретении, но также и включают их варианты. Варианты ДНК в пределах изобретения могут быть описаны в отношении их физических свойств при гибридизации. Специалист в данной области техники понимает, что ДНК может использоваться для идентификации ее комплементарной цепи и, так как ДНК является двухцепочечной, ее эквивалента или гомолога, используя методики гибридизации нуклеиновой кислоты. Также понятно, что гибридизация может произойти при меньше чем 100%-ая комплементарность. Однако, учитывая соответствующий выбор условий, могут использоваться методики гибридизации для дифференциации среди последовательностей ДНК на основе их структурным родством с конкретным зондом. Для руководства относительно таких условий см. Sambrook et al., 1989 supra and Ausubel et al., 1995 (Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Sedman, J.G., Smith, J.A., & Struhl, K. eds. (1995). Current Protocols in Molecular Biology. New York: John Wiley and Sons).
Структурное сходство между двумя полинуклеотидными последовательностями может быть выражено как функция "жесткости" условий, при которых эти две последовательности гибридизуются друг с другом. Как применяется в описании настоящего изобретения, термин "жесткость" относится к степени, с которой условия ограничивают гибридизацию. Жесткие условия сильно ограничивают гибридизацию, и только наиболее структурно родственные молекулы гибридизуются друг с другом в таких условиях. С другой стороны нежесткие условия способствуют гибридизации молекул, демонстрирующих меньшую степень структурной родственности. Жесткость гибридизации, поэтому, прямо коррелирует со структурными взаимосвязями двух последовательностей нуклеиновой кислоты.
Жесткость гибридизации является функцией многих факторов, включая общую концентрацию ДНК, ионную силу, температуру, размер зонда и присутствие агентов, которые разрушают водородную связь. Факторы, стимулирующие гибридизацию, включают высокие концентрации ДНК, высокую ионную силу, низкие температуры, более длинные зонды и отсутствие агентов, которые разрушают водородные связи. Гибридизация, как правило, выполняется в две фазы: фаза "связывание" и фаза "отмывание".
Функционально эквивалентные варианты ДНК
Еще один класс вариантов ДНК в объеме настоящего изобретения может быть описан в отношении продукта, который они кодируют. Эти функционально эквивалентные полинуклеотиды характеризуются тем фактом, что они кодируют те же самые последовательности пептида, из-за вырожденности генетического кода.
Попятно, что варианты молекул ДНК, обеспеченные в настоящем изобретении, могут быть сконструированы несколькими различными способами. Например, они могут быть сконструированы как полностью синтетические ДНК. Методы эффективного синтеза олигонуклеотидов в диапазоне от 20 до около 150 нуклеотидов легко доступны. См. Ausubel et al, section 2.11, Supplement 21 (1993). Перекрывающиеся олигонуклеотиды могут быть синтезированы и собраны способом, о котором впервые сообщил Khorana et al, J. Mol. Biol. 72:209-217 (1971); см. также Ausubel et al., supra, Section 8.2. Синтетические ДНК предпочтительно конструируются с удобными сайтами рестрикции, спроектированными на 5' и 3' концах гена, для облегчения клонирования в соответствующий вектор.
Как было показано, метод генерирования вариантов должен начинаться с одной из ДНК, раскрытых в настоящем изобретении, и затем проводиться сайт-направленный мутагенез. См. Ausubel et al., supra, chapter 8, Supplement 37 (1997). В типичном методе целевая ДНК клонируется в одноцепочечную ДНК бактериофага в качестве носителя. Одноцепочечная ДНК изолируется и гибридизуется с олигонуклеотидом, содержащим желаемую нуклеотидную замену(ы). Комплементарная цепь синтезируется, и двухцепочечный фаг вводится в хозяина. Часть получающегося потомства будет содержать ожидаемый мутант, что может быть подтверждено с использованием секвенирования ДНК. Кроме того, доступны различные способы, которые увеличивают вероятность, что потомства фагов будет ожидаемый мутантом. Эти способы известны специалистам в данной области техники, и наборы коммерчески доступны для получения таких мутантов.
Рекомбинантные конструкции ДНК и экспрессия
Настоящее изобретение дополнительно обеспечивает рекомбинантные конструкции ДНК, содержащие одну или более нуклеотидных последовательностей в соответствии с настоящим изобретением (смотрите Таблицу 32). Рекомбинантные конструкции в соответствии с настоящим изобретением используются в соединении с вектором, таким как плазмида, фагмида, фаг или вирусный вектор, в который вставлена молекула ДНК, кодирующая антитело в соответствии с настоящим изобретением или его антиген-связывающий фрагмент или его вариант.
Антитело, антиген-связывающая часть или его вариант, обеспеченные в настоящем изобретении, могут быть получены рекомбинантной экспрессией последовательностей нуклеиновой кислоты, кодирующих легкие и тяжелые цепи или их части в клетке-хозяине. Для экспрессии антитела, антиген-связывающей части или его варианта рекомбинантно клетка-хозяин может быть трансфецирована одним или более рекомбинантными экспрессионным векторами, несущими фрагменты ДНК, кодирующие легкие и/или тяжелые цепи или их части таким образом, что легкие и тяжелые цепи экспрессируются в клетке-хозяине. Стандартные методологии рекомбинантных ДНК используются для приготовления и/или получения нуклеиновых кислот, кодирующих тяжелые и легкие цепи, для инкорпорации этих нуклеиновых кислот в рекомбинантные экспрессионные вектора и для введения векторов в клетки-хозяев так, как описано в Sambrook, Fritsch and Maniatis (eds.), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel, F.M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патенте США No. 4816397 от Boss et al.
Кроме того, последовательности нуклеиновой кислоты, кодирующие вариабельные домены тяжелых и/или легких цепей, могут быть превращены, например, в полинуклеотидные последовательности, кодирующие полноразмерные цепи антитела, Fab фрагменты или scFv. Фрагмент ДНК, кодирующий VL- или VH может быть функционально связан, (таким образом, что аминокислотные последовательности, закодированные двумя фрагментами ДНК, оказались в одной рамке считывания) к другому фрагменту ДНК, кодирующему, например, константный домен антитела или гибкий линкер. Последовательности человеческих константных доменов тяжелой цепи и легкой цепи известны специалистам в данной области техники (см., например, Kabat, Е.A., el al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, охватывающие эти области, могут быть получены стандартной амплификацией с помощью ПЦР.
Чтобы создать полинуклеотидную последовательность, которая кодирует scFv, нуклеиновые кислоты, кодирующие VH и VL, могут быть функционально связаны с другим фрагментом, кодирующим гибкий линкер, таким образом, чтобы последовательности VH и VL могли бы быть экспрессированы как белок с непрерывной единственной цепью с областями VL и VH, соединенными гибким линкером (см., например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al, Nature (1990) 348:552-554).
Для экспрессии антител, антигенсвязывающих частей или их производных могут использоваться стандартные методы экспрессии рекомбинантных ДНК (см., например, Goeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990)). Например, ДНК, кодирующая требуемый полипептид, может быть вставлена в экспрессионный вектор, который затем трансфецируется в подходящую клетку-хозяина. Подходящими клетками-хозяевами являются прокариотические и эукариотические клетки. Примерами для прокариотических клеток-хозяев, являются, например, бактерии, примерами для эукариотических клеток-хозяев являются дрожжевые, клетки насекомых или млекопитающих. В некоторых вариантах осуществления ДНК, кодирующие тяжелые и легкие цепи, вставляются в отдельные векторы. В других вариантах осуществления ДНК, кодирующие тяжелые и легкой цепи, вставляются в один и тот же вектор. Подразумевается, что конструкция экспрессионного вектора, включая выбор регуляторных последовательностей определяется такими факторами, как выбор клетки-хозяина, уровень экспрессии требуемого белка и будет ли экспрессия конститутивной или индуцибельной.
Поэтому, вариантом выполнения настоящего изобретения также являются клетки-хозяева, содержащие вектор или молекулу нуклеиновой кислоты, причем клеткой-хозяином может быть клетка-хозяин высшего эукариота, такая как клетка млекопитающего, клетка-хозяин низшего эукариота, такая как дрожжевая клетка, и может быть прокариотическая клетка, такая как бактериальная клетка.
Другим вариантом выполнения настоящего изобретения является способ применения клетки-хозяина для получения антитела или антиген-связываюих фрагментов, включающий культивирование клетки-хозяина в подходящих условиях и выделение указанного антитела.
Поэтому другим вариантом выполнения настоящего изобретения является получение антител согласно настоящему изобретению с помощью клеток-хозяев согласно настоящему изобретению и очистка этих антител до по меньшей мере 95% гомогенности по массе.
Бактериальная экспрессия
Полезные экспрессионные векторы для использования в бактериях конструируются путем инсерции структурной последовательности ДНК, кодирующей требуемый белок, вместе с подходящими сигналами инициирования трансляции и терминации в функционирующую рамку считывания с функциональным промотором. Вектор должен содержать один или более фенотипически селектируемые маркеры и сайт инициации репликации, чтобы гарантировать поддержания вектора и, если требуется, обеспечить амплификацию в клетке-хозяине. Подходящие прокариотические хозяева для трансформации включают E.coli, Bacillus subtilis, Salmonella typhimurium и различные виды в родах Pseudomonas, Streptomyces и Staphylococcus.
Бактериальные векторы могут базироваться, например, на бактериофагах плазмидах или фагмидах. Эти векторы могут содержать селектируемый маркер и бактериальный сайт инициации репликации, полученный из коммерчески доступных плазмид, как правило, содержащих элементы известного вектора для клонирования pBR322 (АТСС 37017). После трансформации подходящего штамма хозяина и роста штамма-хозяина до соответствующей плотности клеток селектируемый промотор дерепрессируется/индуцируется подходящим способом (например, изменением температуры или химической индукцией), и клетки культивируются в течение дополнительного периода. Клетки, как правило, отделяются центрифугированием, разрушаются физическими или химическими средствами и получающийся первичный экстракт сохраняется для дополнительной очистки.
В бактериальных системах целый ряд экспрессионных векторов могут быть преимущественно выбраны в зависимости от предполагаемого применения предназначенного для экспрессии белка. Например, если должно быть произведено большое количество такого белка для генерации антител или для скрининга библиотеки пептидов, например, могут быть желательными векторы, которые направляют экспрессию высоких уровней продуктов в виде гибридных белков, которые являются легко очищаемыми. Антитела в соответствии с настоящим изобретением или их антигенсвязывающий фрагмент включают очищенные природные продукты, продукты химических синтетических процессов и продукты, полученные с помощью рекомбинантных методик из прокариотического хозяина, включая, например, E. coli, Bacillusa subtilis, Salmonella typhimurium и различные виды в пределах родов Pseudomonas, Streptomyces и Staphylococcus, предпочтительно из клеток E. coli.
Поэтому вариантом выполнения настоящего изобретения является экспрессионный вектор, содержащий последовательность нуклеиновой кислоты кодирующую новые антитела согласно настоящему изобретению.
Антитела согласно настоящему изобретению или их антигенсвязывающие фрагменты или их варианты включают естественно очищенные продукты, продукты методик химического синтеза, и продукты, полученные рекомбинантными методиками из прокариотического хозяина, включая, например, Е. coli, Bacillus subtilis, Salmonella typhimurium и различные виды в пределах родов Pseudomonas, Streptomyces, и Staphylococcus, предпочтительно, из клеток Е. coli.
Экспрессия у млекопитающих
Предпочтительные регуляторные последовательности для экспрессии в клетках-хозяевах млекопитающих включают вирусные элементы, которые направляют высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вакуолизирующего обезьяньего вируса 40 (SV40) (например, промотор/энхансер SV40), аденовируса (например, основной поздний промотор аденовируса (AdMLP)) и полиомы. Экспрессия антитела может быть конститутивной или регулируемой (например, индуцируемой добавлением или удалением индукторов малой молекулы, таких как тетрациклин в сочетании с системой Тет). Для дальнейшего описания вирусных регуляторных элементов и их последовательностей смотрите, например, патент США 5,168,062 от Stinski, патент США 4510245 от Bell et al. и патент США 4,968,615 от Schaffher et al. Рекомбинантные экспрессионные векторы могут также включать точки начала репликации и селективные маркеры (смотрите например, патенты США 4,399,216, 4,634,665 и 5,179,017). Подходящие селективные маркеры включают гены, которые придают устойчивость к лекарственным средствам, как например G418, пуромицин, гигромицин, бластицидин, цеоцин/блеомицин или метотрексат, или селективный маркер, которые используют ауксотрофии, как например глютаминсинтетаза (Bebbington et al., Biotechnology (N Y). 1992 Feb; 10(2): 169-75), на клетке-хозяине, в которую был введен вектор. Например, ген дигидрофолатредуктазы (DHFR) придает устойчивость к метотрексату, ген neo обеспечивает устойчивость к G418, ген bsd из Aspergillus terreus придает устойчивость к бластидину, пуромицин-N-ацетилтрансферазу придает устойчивость к пуромицину, продукт гена Sh ble придает устойчивость к цеоцину, а устойчивость к гигромицину обеспечивается геном устойчивости к гигромицину E. coli (hyg или hph). Выбираемые маркеры, такие как DHFR или глютаминсинтетаза, также полезны для методов амплификации в сочетании с МТХ и MSX
Трансфекцию экспрессирующего вектора в клетку-хозяина можно проводить с использованием стандартных методов, таких как электропорация, нуклеофекция, кальций-фосфатная преципитация, липофекция, трансфекция на основе поликатиона, такая как трансфекция на основе поликатиона, такая как трансфекция на основе полиэтиленимина (PEI) и трансфекция DEAE-декстраном.
Подходящие клетки-хозяева млекопитающих для экспрессии антител, их антиген-связывающих фрагментов или их вариантов, обеспечиваемые согласно настоящему изобретению, включают яичник китайского хомячка (СНО клетки), такие как СНО-K1, CHO-S, CHO-K1SV [включая dhfr- СНО клетки, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220 и Urlaub et al., Cell. 1983 Jun; 33(2):405-12, с применением DHFR селектируемого маркера, например, как описано в R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621; и другие нокаутные клетки, примеры которых приведены в Fan et al., Biotechnol Bioeng. 2012 Apr; 109(4):1007-15], NS0 миеломные клетки, COS клетки, HEK293 клетки, HKB11 клетки, BHK21 клетки, САР клетки, ЕВ66 клетки, и SP2 клетки.
Экспрессия также может быть временной или полустабильной в системах экспрессии, таких как HEK293, HEK293Т, HEK293-EBNA, HEK293Е, HEK293-6Е, HEK293-Freestyle, HKB11, Expi293F, 293EBNALT75, СНО Freestyle, CHO-S, СНО-K1, CHO-K1SV, CHOEBNALT85, CHOS-XE, CHO-3E7 или САР-Т-клетки (например, Durocher et al., Nucleic Acids Res. 2002 Jan 15; 30(2):E9).
В некоторых вариантах выполнения настоящего изобретения экспрессионный вектор сконструирован таким образом, что экспрессированный белок секретируется в культуральную среду, в которой растут клетки-хозяева. Антитела, их антигенсвязывающие фрагменты или их варианты могут быть выделены из культуральной среды с использованием стандартных способов очистки белка.
Очистка
Антитела в соответствии с настоящим изобретением или их антигенсвязывающий фрагмент могут быть выделены и очищены из рекомбинантных клеточных культур известными методами включающими, но не ограниченные этим: осаждением сульфатом аммония или этанолом, экстракцией кислотой, хроматография с использованием белка А, хроматография с использованием белка G, анионная или катионная ионообменная хроматография, хроматография на фосфоцеллюлозе, гидрофобная хроматография, аффинная хроматография, хроматография на гидроксиапатите и хроматография с использованием белка лектина. Высокоэффективная жидкостная хроматография ("ВЭЖХ") может также использоваться для очистки. См., например, Colligan, Current Protocols in Immunology или Current Protocols in Protein Science, John Wiley & Sons, NY, N.Y., (1997-2001), например, Chapters 1, 4, 6, 8, 9, 10, каждый из которых полностью включен в настоящее изобретение посредством ссылки.
Антитела в соответствии с настоящим изобретением или их антигенсвязывающий фрагмент включают естественно очищенные продукты (очищенные природные продукты), продукты химических синтетических процессов и продукты, произведенные рекомбинантными методиками из эукариотического хозяина, включая, например, клетки дрожжей, высших растений, насекомых и млекопитающих, предпочтительно из клеток млекопитающих. В зависимости от хозяина, использованного в рекомбинантном технологическом процессе, антитело в соответствии с настоящим изобретением или его антигенсвязывающий фрагмент может быть гликозилированным или может быть негликозилированным, причем гликозилированный предпочтительный. Такие способы описаны во многих стандартных лабораторных руководствах, таких как Sambrook, supra, Sections 17.37-17,42; Ausubel, supra, Sections 10, 12, 13, 16, 18 и 20.
В предпочтительных вариантах осуществления антитело очищалось (1) больше чем 95% по массе антитела как определяется, например, по методу Лоури, спектроскопией в УФ и видимой областях спектра или капиллярным SDS гель-электрофорезом (например, на устройстве Caliper LabChip GXII, GX 90 или Biorad Bioanalyzer), и в дополнительно предпочтительных вариантах осуществления больше чем 99% по массе, (2) до степени, достаточной, чтобы получить по меньшей мере 15 остатков N-терминальных или внутренней аминокислотной последовательности, или (3) до гомогенности, определенной с помощью SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием Кумасси-синего или, предпочтительно окрашиванием серебром. Выделенное встречающееся в природе антитело включает антитело в рекомбинантных клетках, так как по меньшей мере один компонент природного окружения антитела не будет присутствовать. Как правило, однако выделенное антитело будет получено по меньшей мере одностадийной очисткой.
Терапевтические способы
Терапевтические способы включают введение субъекту, нуждающемуся в лечении, терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента или его варианта, предусмотренного настоящим изобретением. «Терапевтически эффективное» количество согласно настоящему изобретению определяется как количество антитела или его антигенсвязывающего фрагмента, которое является достаточным количеством, чтобы уменьшить пролиферацию СЕАСАМ6-положительной клетки или уменьшить размер СЕАСАМ6-экспрессирующей опухоли в обработанной области субъекта - либо в виде разовой дозы, либо в соответствии с режимом множественного введения доз, отдельно или в комбинации с другими агентами, что приводит к ослаблению неблагоприятного состояния, но которое является токсикологически приемлемым. Субъектом может быть человек или не принадлежащее к человеку животное (например, кролик, крыса, мышь, собака, обезьяна или другой примат нижнего порядка).
В варианте выполнения настоящего изобретения обеспечиваются антитело или его антиген-связывающий фрагмент для применения в качестве лекарственного средства.
В варианте выполнения настоящего изобретения обеспечиваются антитело или его антиген-связывающий фрагмент для применения в качестве лекарственного средства для лечения рака. В предпочтительном варианте выполнения настоящего изобретения раком является опухоль, и в весьма предпочтительном варианте выполнения настоящего изобретения раком является солидная опухоль.
Вариантом выполнения настоящего изобретения является применение антитела или его антиген-связывающего фрагмента для получения лекарственного средства для лечения заболевания.
Вариантом выполнения настоящего изобретения является применение антитела или его антиген-связывающего фрагмента для получения лекарственного средства для лечения рака. В предпочтительном варианте выполнения настоящего изобретения раком является опухоль, и в весьма предпочтительном варианте выполнения настоящего изобретения раком является солидная опухоль.
Антитела в соответствии с настоящим изобретением или их антигенсвязывающие фрагменты могут использоваться в качестве терапевтического или диагностического инструмента во множестве ситуаций с нежелательной экспрессией СЕАСАМ6, например, при расстройствах клеточной пролиферации, таком как рак или фиброзные заболевания. Расстройства и состояния, особенно подходящие для лечения с антителом в соответствии с настоящим изобретением, являются солидными опухолями, такими как раковые опухоли молочной железы, дыхательных путей, мозга, репродуктивных органов, пищеварительного тракта, мочевых путей, глаза, печени, кожи, головы и шеи, щитовидной железы, паращитовидной железы и их отдаленных метастазов. Эти расстройства также включают лимфомы, саркомы и лейкемии.
Опухоли пищеварительного тракта включают, но без ограничения к этому, рак анального канала, рак толстой кишки, рак толстой и прямой кишки, рак пищевода, рак желчного пузыря, рак желудка, рак поджелудочной железы, рак прямой кишки, рак тонкого кишечника и рак слюнных желез.
Примеры рака пищевода включают, но без ограничения к этому, карциномы и аденокарциномы пищевода, а также плоскоклеточный рак, лейомиосаркому, злокачественную меланому, рабдомиосаркому и лимфому.
Примеры рака желудочно-кишечного тракта включают, но без ограничения к этому аденокарциному желудка интестинального типа и диффузного типа.
Примеры рака поджелудочной железы включают, но без ограничения к этому протоковую аденокарциному, железисто-плоскоклеточный рак и эндокринные опухоли поджелудочной железы.
Примеры рака молочной железы включают, но не ограничены этим: инвазивную протоковую карциному, инвазивную дольковую карциному, протоковую карциному in situ и дольковую карциному in situ.
Примеры раковых образований в дыхательных путях включают, но не ограничены этим: мелкоклеточную и немелкоклеточную карциному легких, также как аденому бронха и плевролегочную бластому.
Примеры мозговых раковых образований включают, но не ограничены этим: глиому ствола мозга и гипоталамуса, церебеллярную и церебральную астроцитому, глиобластому, медуллобластому, эпендимому, также как нейроэктодермальную и шишковидную опухоль.
Опухоли мужских репродуктивных органов включают, но без ограничения к этому, рак предстательной железы и рак яичка. Опухоли женских репродуктивных органов включают, но без ограничения к этому, рак эндометрия, рак шейки матки, рак яичников, рак влагалища и рак наружных половых органов, а также саркому матки.
Примеры рака яичников включают, но без ограничения к этой, серозную опухоль, эндометриоидную опухоль, муцинозную цистаденокарциному, гранулезотекаклеточную опухоль, опухоль из клеток Сертоли и арренобластому.
Примеры рака шейки матки включают, но без ограничения к этому, плоскоклеточный рак, аденокарциному, аденосквамозную карциному, мелкоклеточную карциному, нейроэндокринную опухоль, стекловидно-клеточную карциному и аденокарциному селезенки.
Опухоли мочевых путей включают, но не ограничены этим: рак мочевого пузыря, пениса, почек, почечной лоханки, мочеточника, уретральный и наследственные и спорадические папиллярные почечные раковые образования.
Примеры рака почки включают в себя, но без ограничения к этому, почечно-клеточную карциному, карциному уротелиальных клеток, опухоль юкстагломерулярных клеток (ренинома), ангиомиолипому, почечную онкоцитому, карциному Беллини канальцев, светлоклеточную саркому почек, мезобластную нефрому и опухоль Вильмса.
Примеры рака мочевого пузыря включают, но без ограничения к этому переходно-клеточный рак, плоскоклеточный рак, аденокарциному, саркому и мелкоклеточную карциному.
Раковые опухоли в глазе включают, но не ограничены этим, внутриглазную меланому и ретинобластому.
Примеры раковых опухолей печени включают, но не ограничены этим, гепатоцеллюлярную карциному (карциномы клеток печени с или без фиброламеллярным вариантом), холангиокарциному (карцинома внутрипеченочной желчной протоки), и смешанную гепатоцеллюлярную холангиокарциному.
Рак кожи включает, но не ограничен этим: плоскоклеточную карциному, саркому Капоши, злокачественную меланому, рак кожи клеток Меркеля и немеланомный рак кожи.
Рак головы и шеи включат, но не ограничен этим: рак гортани, подглоточный рак, рак ротоглотки, рак губы и рак полости рта и плоскоклеточный рак.
Лимфомы включают, но не ограничены этим: СПИД-ассоциированную лимфому, неходжкинскую лимфому, Т-клеточную лимфому кожи, лимфому Беркита, болезнь Ходжкина и лимфому центральной нервной системы.
Саркомы включают, но не ограничены этим: саркому мягкой ткани, остеогенную саркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому.
Лейкемии включают, но не ограничены этим: острую миелоидную лейкемию, острой лимфобластную лейкемию, хронический лимфолейкоз, хроническую гранулоцитную лейкемию и лейкоз ворсистых клеток.
В предпочтительном варианте выполнения настоящего изобретения, антитела согласно настоящему изобретению или их антигенсвязывающие фрагменты являются подходящими для терапевтического или диагностического способа для лечения или диагностики раковых заболеваний, содержащихся в группе, состоящей из колоректального рака, немелкоклеточного рака легких (NSCLC), мелкоклеточного рака легких (SCLC), рака поджелудочной железы, рака желудка, рака молочной железы и множественной миеломы.
Кроме того, антитела согласно настоящему изобретению или их антигенсвязывающие фрагменты также могут применяться в качестве терапевтического или диагностического инструмента для множества других нарушений, в которых СЕАСАМ6 участвует, таких как, но без ограничения к этому легочная инфекция, например, грипп, болезнь Крона, воспалительное заболевание кишечника, псориаз, кистозный фиброз легких, профилактика бактериальной стыковки с GI-intract, травма, кровотечение, хирургия, инсульт, инфаркт миокарда, сепсис, пневмония, вакцинация от инфекции и рака, хроническая вирусная инфекция.
Нарушения, упомянутые выше, были хорошо охарактеризованы у людей, но также существуют с аналогичной этиологией у других животных, включая млекопитающих, и могут подлежать лечению путем введения фармацевтических композиций согласно настоящему изобретению.
Антитело в соответствии с настоящим изобретением или его антиген-связывающий фрагмент, или его вариант может быть введено совместно с известными медикаментами, и в некоторых случаях антитело могло быть само модифицировано. Например, антитело может быть конъюгировано с цитотоксическим агентом или радиоизотопом для возможного дополнительного увеличения эффективности.
Антитела в соответствии с настоящим изобретением могут быть введены как единственный фармацевтический агент или в сочетании с одним или более дополнительными терапевтическими агентами, если комбинация не вызывает неприемлемых побочных эффектов. Эта комбинированная терапия включает введение единственной дозы лекарственной формы, которые содержит антитело в соответствии с настоящим изобретением и один или более дополнительные терапевтические агенты, так же как введение антитела в соответствии с настоящим изобретением и каждого дополнительного терапевтического агента в его собственной отдельной лекарственной форме. Например, антитело в соответствии с настоящим изобретением и терапевтический агент могут быть введены пациенту совместно в виде единственном пероральной лекарственной формы, такой как таблетка или капсула, или каждое вещество можно введено в отдельных лекарственных формах.
Если используются отдельные лекарственные формы, антитело в соответствии с настоящим изобретением и один или более дополнительных терапевтических агентов могут быть введены по существу в одно и то же время (например, одновременно) или ступенчато в отдельные моменты времени (например, последовательно).
В частности, антитела, согласно настоящему изобретению или их антигенсвязывающие фрагменты или их варианты, могут быть использованы в фиксированной или отдельной комбинации с другими противоопухолевыми агентами, такими как алкилирующие агенты, антиметаболиты, растительные противоопухолевые агенты, агенты гормональной терапии, топоизомеразные ингибиторы, иммунологические средства, антитела, лекарственные средства на основе антител, модификаторы биологического ответа, антиангиогенные соединения, клеточная терапия и другие противоопухолевые препараты, включая без ограничения к этому, производные камптотецина, киназные ингибиторы, нацеленные лекарственные средства.
В связи с этим ниже приведен неограниченный список примеров вторичных агентов, которые могут использоваться в комбинации с антителами согласно настоящему изобретению:
Алкилирующие агенты включают, но не ограничены этим: N-оксид азотистого иприта, циклофосфамид, ифосфамид, тиотепа, ранимустин, нимустин, темозоломид, алтретамин, апазиквон, бросталлицин, бендамустин, кармустин, эстрамустин, фотемустин, глуфосфамид, мафосфамид, бендамустин и митолактол; скоординированные платиной алкилирующие агенты включают, но не ограничены этим, цисплатин, карбоплатин, эптаплатин, лобаплатин, недаплатин, оксалиплатин и сатртаплатин;
Антиметаболиты включают, но не ограничены этим, метотрексат, 6-меркаптопурин рибозид, меркаптопурин, 5-фторурацил сам по себе или в комбинации с лейковорином, тегафур, доксифлуридин, кармофур, цитарабин, цитарабин окфосфат, еноцитабин, гемцитабин, флударабин, 5-азацитидин, капецитабин, кладрибин, клофарибин, децитабин, эфлорнитин, этинилцитидин, цитозин арабинозид, гидроксимочевина, мелфалан, неларабин, нолатрексед, окфосфит, преметрексед двунатриевый, пентостаин, пелитрексол, ралтитрексид, триапин, триметрексат, видарабин, винкристин и винорелбин;
Агенты гормональной терапии включают, но не ограничены этим: эксеместан, лупрон, анастрозол, доксеркальциферол, фадрозол, форместан, ингибиторы 11β-гидроксистероид-дегидрогеназы 1 типа, ингибиторы 17α-гидроксилазы/17,20-лиазы, такие как абиратерона ацетат, ингибиторы 5-α-редуктазы, такие как финастерид и эпристерид, антиэстрогены, такие как тамоксифена цитрат и фулвестрант, Трелстар, торемифен, ралоксифен, лазофоксифен, летрозол, антиандрогены, такие как бикалутамид, флутамид, мифепристон, нилутамид, касодекс и антипрогестероны, и их комбинации;
Выделенные из растений противоопухолевые вещества включают, например, выбранные из ингибиторов митоза, например эпотилоны, такие как сагопилон, иксабепилон и эпотилон В, винбластин, винфлунин, доцетаксел и паклитаксел;
Цитотоксические агенты, ингибирующие топоизомеразу, включает, но не ограничены этим: акларубицин, доксорубицин, амонафид, белотекан, камптотецин, 10-гидроксикамптотецин, 9-аминокамптотецин, дифломотекан, иринотекан, топотекан, эдотекарин, эпимбицин, этопозид, эксатекан, гиматекан, луртотекан, митоксантрон, пирамбицин, пиксантрон, рубитекан, собузоксан, тафлупозид и их комбинации;
Иммунологические препараты включают интерфероны, такие как интерферон альфа, интерферон альфа-2а, интерферон альфа-2b, интерферон бета, интерферон гамма-1а и интерферон гамма-n1 и другие иммуностимулирующие агенты, такие как L19-IL2 и другие производные IL2, филграстим, лентинан, сизофилан, ТераЦис, убенимекс, алдеслейкин, алемтузумаб, ВАМ-002, дакарбазин, даклизумаб, денилейкин, гемтузумаб, озогамицин, ибритумомаб, имиквмод, ленограстим, лентинан, вакцина против меланомы (Corixa), молграмостим, сарграмостим, тазонермин, теклейкин, тималазин, тозитумомаб, вимлизин, эпратузумаб, митумомаб, ореговомаб, пемтумомаб и провенге; ALNX6000, урелумаб, PF-005082566, галунизертиб, AZ10606120, NF340, BMS-777607;
Иммунологические средства также включают лекарственные средства, направленные на модуляторы и соингибиторные рецепторы контрольной точки иммунного ответа, включая, но без ограничения к этому, CTLA-4, PD1, PD-L1, В7-Н3 рецептор, В7-Н4 рецептор, BTLA, TIM3, LAG3, KIRDL, 2В4, VISTA, CD244, CD160, TIGIT, СЕАСАМ1, СЕАСАМ5, HHLA2. В частности некоторыми из этих лекарственных средств являются ипилимумаб, тремелимумаб, ниволумаб, пембролизумаб, пидилизумаб, АМР-224, АМР-514, PDR001, MDX1105, BMS-936,559, атезолизумаб, Medi4736, авелумаб, MSB0010718C, MGA271, IMP321, BMS-986,016, бавитуксимаб, MNRP1685A, Целекоксиб, PF-04418948, RQ-15986;
Иммунологические средства также включают активаторы костимулирующих рецепторов, включая лекарственные средства, направленные на, но без ограничения к этому, CD28, ICOS, 4-IВВ, ОХ40, CD27, KIRDS, GITR, HVEM, TNFRSF25, CD40L. TMIGD2, TIM-1, СЕАСАМ1, СЕАСАМ5. Среди этих лекарственных средств присутствуют СР-870893, Лукатумумаб, дацетузумаб, анти-ОХ40, MEDI0562, MEDI6469, MEDI6383, CDX-1127, TRX518, варлилумаб;
Иммунологические средства также включают средства, которые модулируют активность Treg, включая средства, направленные на, но без ограничения к этому, FOXP3, CD25, CCR4. К этим агентам относится даклизумаб;
Иммунологические средства также включают средства, которые модулируют активность супрессорных клеток миелоидного происхождения, включая средства, направленные на, но без ограничения к этому, CSF1R. Примером является эмактузумаб, таладафил;
Иммунологические средства также включают средства, которые модулируют врожденный иммунный ответ, включая средства, направленные на толл-подобные рецепторы, включая, но без ограничения к этому, TLR3, TLR4, TLR7, TLR8, TLR9, NGK2A, NKG2D. Этими лекарственными средствами являются, например, имиквимод, CPG7909 (PF-3512676, CPG2006); MGN1703, SD-101, хилтонол (поли ICLC), анти-NGK2A (IPH2201), OM-174, 852A, VTX-2337, IMO-2055;
Иммунологические средства также включают лекарственные средства, которые модулируют врожденный иммунный ответ, включая лекарственные средства, направленные на, но без ограничения к этому, CSF-1, CSF1R, KIR, ILTs, LIRs, MICA, MICB, CD244, CCL2, CD47. В частности некоторыми из этих лекарственных средств являются анти-KIR (IHP2101; IPH2101; 1-7F9); лирилумаб (IPH2012; BMS-986,015); карлумаб (CNTO888), IMC-CS4, FPA008, PLX3397, ARRY-382, СС-90002, анти-CD47 (Hu5F9-G4), BLZ945;
Иммунологические средства также включают средства для перенацелевания иммунных клеток, включая, но без ограничения к этому, биспецифичные антитела, переориентирующиеся антитела с двойной аффинностью, например, против В7-Н3, привлекающий Т-клетки биспецифический активатор, например, CD19xCD3; например, Removab анти-EPCAMxCD3xFC, NK клетка-нацеливающие средства;
Иммунологические средства также включают средства, которые модулируют микроокружение опухоли и улучшают инфилтрацию иммунных клеток и ответ, включая вакцины и адъюванты, и которые не ограничиваются GVAX, FVAX;
В этом отношении вакцины включают вакцины на основе дендритных клеток, вирусные вакцины, вакцины на основе мРНК, вакцины на основе мультипептидов;
Иммунологические средства также включают средства для улучшенной инфильтрации иммунных клеток, включая, но без ограничения к этому, IFN-g, IL15, IL21, IL2, CXCR4, СХСl12. Некоторыми из этих лекарственных средств являются дененикокин (BMS982, 470), ALT-803, hetIL15, улокуплумаб, ВКТ140, СХСR2-специфичное моноклональное антитело, AD3100, маравирокс, PF-4136309;
Иммунологические средства также включают средства или способы воздействия, которые улучшают примирование и активацию АРС и Т клеток, включая лекарственные средства, направленные на, но без ограничения к этому, m-TOR GSK3бета ингибиторы, загруженные носители для лекарственных средств (например, терапевтическая противораковая вакцина «Провендж»), радиотерапию, дистанционную лучевую терапию;
Иммунологические средства также включают модуляторы кинуренинового пути, включая лекарственные средства, направленные на, но без ограничения к этому, IDO1, IDO2, TDO. Среди этих лекарственных средств присутствуют INCB024360, Индоксимод (NLG8189; 1-метил-D-триптофан, D-1MT), GDC-0919, NLG919, LM10;
Иммунологические средства также включают модуляторы аденозинового пути, включая лекарственные средства, направленные на но без ограничения к этому CD39, CD73, А2А рецептор, А2В рецептор. Такие лекарственные средства включают Compound, NCX-4016, АТ38, SCH58261, SCH420814, PSB1115, ARL67176, АМРСР;
Иммунологические средства также включают модулятор пути TGFbeta/ALK5.
Такие лекарственные средства включают OY2157299, EW-7187;
Иммунологические средства также включают Sting активаторы;
Модификаторы биологического ответа являются агентами, которые модифицируют защитные механизмы живых организмов или биологические ответы, такие как выживание, рост или дифференцировка клеток ткани, для придания им противоопухолевой активности; такие агенты включают, например, крестин, лентинан, сизофиран, пицибанил, промун и убенимекс;
Анти-ангиогенные соединения включают, но не ограничены этим, ацитретин, афлиберцепт, ангиостатин, аплидин, асентар, акситиниб, бевацизумаб, бриваниб аланинат, силенгтид, комбретастатин, эндостатин, фенретинид, галофугинон, пазопаниб, ранибизумаб, ребимастат, рецентин, регорафениб, ремоваб, ревлимид, сорафениб, скваламин, сунитиниб, телатиниб, талидомид, украин, ваталаниб и витаксин;
Анти-ангиогенные соединения также включают ингибиторы VEGF, включая, но без ограничения к этому, сорафениб, регорафениб, бевацизумаб, сунитиниб, рецентин, акситиниб, афлиберцепт, телатиниб, бриваниб аланинат, ваталаниб, пазопаниб и ранибизумаб;
Лекарственные средства на основе антител включают, но без ограничения к этому, трастузумаб, цетуксимаб, бевацизумаб, ритуксимаб, тицилимумаб, ипилимумаб, тремелимумаб, пембролизумаб, ниволумаб, пидилизумаб, RG-7446/ MPDL3280A, BMS-936559 (MDX1105), дурвалумаб (Medi-4736), MSB-0010718C, люмиликсимаб, катумаксомаб, атасисепт, ореговомаб, панитумумаб и алемтузумаб;
Лекарственные средства на основе антител также включают торий-нацеленные конъюгаты, но без ограничения к этому, нацеленные на мезотелин, С4.4А, FGFR2, HER2, PSMA;
Лекарственные средства на основе антител также включают торий-нацеленные конъюгаты, но без ограничения к этому, нацеленные на мезотелин, С4.4А, FGFR2, HER2, PSMA, СЕАСАМ6;
Лекарственные средства на основе антител также включают биспецифичные (или мультиспецфичные) форматы антител, включая, но без ограничения к этому, биспецифичные (или мультиспецфичные) IgG и биспецифичные (или мультиспецфичные) форматы антител, а также слитые белки и их конъюгаты (например, CrossMab, DAF(2in1), DAF(4in1), DutaMab, DT-IgG, KiH объединенный IgG, объединенный с заряженной парой IgG, KiH-commonLC, обмен Fab-фрагментами, SEEDbody, Triomab, LUZ-Y, Fcab,  , ортогональный Fab, DVD-IgG, IgG(H)-scFv, scFv-(H)IgG, IgG(L)-scFv, scFv-(L)IgG, IgG(L,H)-Fv, IgG(H)-V, V(H)-IgG, IgG(L)-V, V(L)-IgG, KIH-IgG-scFab, 2scFv-IgG, IgG-2scFv, scFv4-Ig, Zybody, DVI-IgG (4in1), ди-нанотело, BiTE, диатело, DART, DART-Fc, TandAb, scДиатело, scДиатело-СН3, Диатело-СН3, Тройное тело, миниантитело, Минитело, TriBi минитело, scFv-СН3 KIH, Fab-scFv, scFv-CH-CL-scFv, F(ab')2, F(ab')2-scFv2, scFv-LIH, Fab-scFv-Fc, тетравалентный HCAb, scДиатело-Fc, Диатело-Fc, тандем scFv-Fc, интратело, Dock и Lock слитый белок, ImmTAC, HSAbody, scДиатело-HAS, тандем scFv-токсин, IgG-IgG, Cov-X-тело, scFv1-PEG-scFv2 и другие);
, ортогональный Fab, DVD-IgG, IgG(H)-scFv, scFv-(H)IgG, IgG(L)-scFv, scFv-(L)IgG, IgG(L,H)-Fv, IgG(H)-V, V(H)-IgG, IgG(L)-V, V(L)-IgG, KIH-IgG-scFab, 2scFv-IgG, IgG-2scFv, scFv4-Ig, Zybody, DVI-IgG (4in1), ди-нанотело, BiTE, диатело, DART, DART-Fc, TandAb, scДиатело, scДиатело-СН3, Диатело-СН3, Тройное тело, миниантитело, Минитело, TriBi минитело, scFv-СН3 KIH, Fab-scFv, scFv-CH-CL-scFv, F(ab')2, F(ab')2-scFv2, scFv-LIH, Fab-scFv-Fc, тетравалентный HCAb, scДиатело-Fc, Диатело-Fc, тандем scFv-Fc, интратело, Dock и Lock слитый белок, ImmTAC, HSAbody, scДиатело-HAS, тандем scFv-токсин, IgG-IgG, Cov-X-тело, scFv1-PEG-scFv2 и другие);
Лекарственные средства на основе антител также включают рекомбинантные белки, полученные рекомбинантными технологиями с антитело-подобными связующими свойствами, такие как, но без ограничения к этому, молекулы DARPIN;
Клеточная терапия включает, но не ограничивается ими, инфильтрирующий опухоль лимфоцит, выделенный у больных раком, как например Ex vivo стимулированные Т клетки, например, Сипулейцел-Т;
Клеточная терапия включает, но не ограничивается ими, инфильтрирующий опухоль лимфоцит, выделенный у больных раком, как например Сипулейцел-Т и генно-инженерные Т-клетки, несущие химерные антигеновые рецепторы (CAR), такие как, например, CD19-CAR-Т-клетки; CAR-HER2-T-клетки;
Другие противоопухолевые агенты включающие, например, алитретиноин, амплиген, атрасентан бексаротен, бортезомиб, бозентан, кальцитриол, эксизулинд, фотемустин, ибандроновая кислота, милтефозин, митоксантрон, L-аспарагиназа, прокарбазин, дакарбазин, гидроксикарбамид, пегаспаргаза, пентостатин, тазаротен, велкад, нитрат галлия, канфосфамид, даринапарзин и третиноин, PI3065, TG100-115;
ингибиторы EGFR (HER1) такие как, например, цетуксимаб, панитумумаб, вектибикс, гефитиниб, эрлотиниб и Зактима;
ингибиторы HER2 такие как, например, лапатиниб, тратузумаб и пертузумаб;
ингибиторы mTOR такие как, например, темсиролимус, сиролимус/рапамицин и эверолимус;
ингибиторы c-Met;
PI3K ингибиторы, такие как PI3K ингибитор 1 (2-амино-N-[7-метокси-8-(3-морфолин-4-илпропокси)-2,3-дигидроимидазо[1,2-с]квиназолин-5-ил]пиримидин-5-карбоксамид дигидрохлорид (смотрите соединение Примеров 1 и 2 в WO 2012/136553)
и AKT ингибиторы;
ингибиторы CDK (циклин-зависимой киназы), такие как росковитин и флавопиридол;
Ингибиторы контрольной точки сборки митотического веретена и таргетированные антимитотические агенты, такие как ингибиторы PLK, ингибиторы Aurora (например, Гесперидин), ингибиторы контрольной точки киназы и ингибиторы KSP;
BRAFV600E ингибиторы, такие как вемурафениб, дабрафениб;
Ингибиторы HDAC такие как, например, панобиностат, вориностат, MS275, белиностат и LBH589;
ингибиторы HSP90 и HSP70;
Протеасомные ингибиторы, такие как бортезомиб и карфилзомиб;
Ингибиторы сериновой/треониновой киназы, включающие ингибиторы MEK и ингибиторы Raf, такие как сорафениб;
Ингибиторы фарнезилтрансферазы такие как, например, типифарниб;
Ингибиторы тирозинкиназы включающие, например, дасатиниб, нилотибиб, регорафениб, бозуганиб, сорафениб, бевацизумаб, сунитиниб, цедираниб, акситиниб, афлиберцепт, телатиниб, иматиниба мезилат, бриванид аланинат, пазопаниб, ранибизумаб, ваталаниб, цетуксимаб, панитумумаб, вектибикс, гефитиниб, эрлотиниб, лапатиниб, тратузумаб, пертузумаб и ингибиторы c-Kit;
Агонисты рецептора витамина D;
Ингибиторы белка Всl-2, такие как обатоклакс, натрий облимерсен и госсипол;
Антагонисты рецептора кластера дифференцировки 20, как например, ритуксимаб;
Ингибиторы рибонуклеотид редуктазы, как например, гемцитарабин;
Агонисты лиганда рецептора 1 некроза опухоли, вызывающие апоптоз, такой как, например, мапатумумаб;
Связанные с фактором некроза опухоли индуцирующие апоптоз агонисты лиганда рецептора 2, такие как, например, лексатумумаб, конатумумаб, CS-1008, PRO95780;
Антагонисты рецептора 5-гидрокситриптамина такие как, например, rEV598, ксалипрод, палоносетрона гидрохлорид, гранисетрон, зиндол и АВ-1001;
Антагонисты рецептора 5-гидрокситриптамина такие как, например, rEV598, ксалипрод, палоносетрона гидрохлорид, гранисетрон, зиндол и АВ-1001;
Ингибиторы интегринов, включающие ингибиторы α-5-бета-1-интегрина такие как, например, Е7820, JSM 6425, волоциксимаб и эндостатин;
Антагонисты андрогенового рецептора включающие, например, нандролон деканоат, флюоксиместерон, Андроид, Prost-aid, андромустин, бикалутамид, флутамид, апоципротерон, апофлутамид, хлормадинона ацетат, андрокур, таби, ципротерона ацетат и нилутамид;
Ингибиторы ароматазы такие как, например, анастрозол, летрозол, тестолактон, эксеместан, аминоглютетимид и форместан;
Ингибиторы матриксной металлопротеиназы;
Кроме того, антитела согласно настоящему изобретению могут быть объединены со способами воздействия, которые вызывают иммуногенетическую клеточную смерть включая, но без ограничения к этому, ультрафиолетовый свет, окисляющие обработки, термический шок, нацеленную и ненацеленную радиотерапию, шиконин, высоко гидростатическое давление, онколитические вирусы и фотодинамическую терапию;
Кроме того, антитела согласно настоящему изобретению могут быть объединены с агентами, которые вызывают иммуногенетическую клеточную смерть включая, но без ограничения к этому, сунитиниб, JAK2 ингибиторы, антрациклины, доксорубицин, митоксантрон, оксалиплатин, и циклофосфамид, нацеленные и ненацеленные микротрубки-дестабилизирующие лекарственные средства (такие как например, ауристатины и майтанзиноиды);
Соединения согласно настоящему изобретению также могут применяться для лечения рака вместе с радиотерапией и/или хирургическим вмешательством;
Кроме того, антитела согласно настоящему изобретению могут применяться, как таковые или в композициях, в исследовании и диагностики, или в качестве аналитических контрольных стандартов, и тому подобное, которые хорошо известны из уровня техники;
Способы диагностики
Анти-СЕАСАМ6 антитела или их антигенсвязывающие фрагменты могут применяться для обнаружения присутствия СЕАСАМ6-экспрессирующих опухолей. Присутствие СЕАСАМ6-содержащих клеток или слущивающихся СЕАСАМ6 в различных биологических образцах, включая сыворотку и образцы биопсии ткани, может быть обнаружено анти-СЕАСАМ6 антителами. Кроме того, анти-СЕАСАМ6 антитела могут применяться в различных методиках визуализации, таких как иммуносцинтиграфия с 99Тс (или другим изотопом) конъюгированным антителом. Например, протокол визуализации, подобный описанному с 111In конъюгированным анти-PSMA антителом, может применяться для обнаружения карциномы поджелудочной железы или яичника (Sodee et al., Clin. Nuc. Med. 21: 759-766, 1997). Другим методом обнаружения, который может быть использован, является позитронно-излучающая томография с помощью конъюгированного антитела согласно настоящему изобретению с подходящим изотопом (смотрите Herzog et al., J. Nucl. Med. 34:2222-2226, 1993).
Фармацевтические композиции и введение
Для лечения любого из вышеупомянутых расстройств, могут быть составлены фармацевтические композиции для использования в соответствии с настоящим изобретением в обычной манере с использованием одного или более физиологически приемлемого носителя или вспомогательного вещества. Антитело в соответствии с настоящим изобретением или антигенсвязывающий фрагмент могут быть введены с помощью любых подходящих средств, которые могут варьироваться в зависимости от типа расстройства, которое подвергается лечению. Возможные способы введения лекарственного средства включают парентеральный (например, внутримышечный, внутривенный, внутриартериальный, внутрибрюшинный или подкожный), внутрилегочный и интраназальный, и, при необходимости, для местной иммуносупрессивной терапии внутриочаговое введение. Кроме того, антитело в соответствии с настоящим изобретением вводиться посредством импульсной инфузии, например, уменьшая дозы антитела. Предпочтительно, дозирование осуществляется в виде инъекций, наиболее предпочтительно внутривенных или подкожных инъекции, что частично зависит от того, будет ли введение короткое или хроническое. Количество, которое будет введено, будет зависеть от множества факторов, таких как клинические симптомы, масса человека, вводятся ли другие лекарственные средства. Специалист в данной области техники понимает, что способ введения изменяется в зависимости от расстройства или патологического состояния, которое собираются лечить.
Вариантом выполнения настоящего изобретения являются фармацевтические композиции, которые содержат анти-СЕАСАМ6 антитела или их антигенсвязывающие фрагменты или их варианты, сами по себе или в комбинации с по меньшей мере одним другим агентом, таким как стабилизирующее соединение, которое может вводиться в любом стерильном, биосовместимом фармацевтическом носителе, включая, но без ограничения к этому, солевой раствор, буферизированный солевой раствор, декстрозу и воду. Другим вариантом выполнения настоящего изобретения являются фармацевтические композиции СЕАСАМ6-связывающего антитела или его антигенсвязывающего фрагмента и дополнительное фармацевтически активное соединение, которое является подходящим для СЕАСАМ6-связанных заболеваний, таких как рак. Любая из этих молекул может быть введена отдельно пациенту или в сочетании с другими веществами, лекарствами или гормонами в фармацевтических композициях, где они смешаны с вспомогательным веществом(ами) или фармацевтически приемлемыми носителями. В одном варианте осуществления настоящего изобретения фармацевтически приемлемый носитель является фармацевтически инертным.
Настоящее изобретение также касается введения фармацевтических композиций. Такое введение осуществляется перорально или парентерально. Способы парентеральной доставки включают: местное, внутриартериальное (непосредственно к опухоли), внутримышечное, подкожное, внутримедуллярное, интратекальное, внутрижелудочковое, внутривенное, внутрибрюшинное или интраназальное введение. В дополнение к активным ингредиентам эти фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, содержащие вспомогательные вещества и вспомогательные средства, которые облегчают процессинг активных соединений в препараты, которые могут использоваться фармацевтически. Более подробная информация о методиках для составления и введения может быть найдена в последнем издании Remington's Pharmaceutical Sciences (Ed. Maack Publishing Co, Easton, Pa.).
Фармацевтические композиции для перорального введения могут быть составлены с использованием фармацевтически приемлемых носителей, известных специалистам в данной области техники, в дозировках, подходящих для перорального введения. Такие носители позволяют фармацевтическим композициям быть сформулированными в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, паст, суспензий и т.п., для проглатывания пациентом.
Фармацевтические препараты для перорального использования могут быть получены путем комбинирования активных соединений с твердым вспомогательным веществом, при необходимости размалывая (гранулируя) получающуюся смесь, и перерабатывая смесь гранул после добавления подходящих вспомогательных средств при необходимости, чтобы получить таблетки или ядро драже. Подходящими вспомогательными веществами являются углеводные или белковые наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлозы, такие как метил целлюлоза, гидроксипропилметилцеллюлоза, или натрий карбоксиметилцеллюлоза; и камеди, включая гуммиарабик и трагакантовую камедь; и белки, такие как желатин и коллаген. При необходимости могут быть добавлены вещества для улучшения распадаемости таблеток или солюбилизирующие агенты, такие как поперечно сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Ядра драже снабжаются подходящими покрытия, такими как концентрированные растворы сахаров, которые могут также содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, глазировочные растворы, и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к таблеткам или покрытиям драже для идентификации продукта или характеризации количества активного соединения, то есть дозировку.
Фармацевтические препараты, которые могут использоваться перорально, включают твердые капсулы, приготовленные из желатина, так же как мягкие, герметические капсулы, приготовленные из желатина и покрытия такого как глицерин или сорбит. Твердые капсулы могут содержать активные ингредиенты, смешанные с наполнителем или связующими веществами, такими как лактоза или крахмалы, лубрикантами, такими как тальк или стеарат магния, и при необходимости, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или диспергированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкий полиэтиленгликоль с или без стабилизаторов.
Фармацевтические композиции для парентерального введения включают водные растворы активных соединений. Для инъекции фармацевтические композиции в соответствии с настоящим изобретением могут быть составлены в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнка, раствор Рингера или забуференный физиологический раствор. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензий, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Дополнительно, суспензии активных соединений могут быть получены в виде соответствующих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды или липосомы. При необходимости, суспензии могут также содержать подходящие стабилизирующие агенты или агенты, которые повышают растворимость соединений, что позволяет получить препарат высококонцентрированных растворов.
Для местного или назального введения используются в композиции пенетранты, соответствующие конкретному барьеру, через который должен быть пройден. Такие пенетранты известны специалистам в данной области техники.
Фармацевтические композиции в соответствии с настоящим изобретением могут производиться способом, который известен специалистам в данной области техники, например, посредством обычного смешивания, растворения, гранулирования, создания драже, отмачивания, эмульгирования, заключения в капсулу, включения или процессов лиофилизации.
Фармацевтическая композиция может обеспечиваться в виде соли и может быть сформирована с кислотами, включая, но не ограничиваясь этим: хлористоводородную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли имеют тенденцию быть более растворимыми в водных или других протонных растворителях, которые являются соответствующими формами свободного основания. В других случаях предпочтительными препаратами могут быть лиофилизованные порошки в 1 мМ - 50 мМ гистидина или фосфата или Трис, 0,1%-2% сахарозы и/или 2%-7% маннита в интервале рН от 4,5 до 7,5, которые объединяются с буфером пред использованием
После того, как фармацевтические композиции, содержащие соединение в соответствии с настоящим изобретением, введенные в приемлемой носитель, были приготовлены, они могут быть помещаться в соответствующий контейнер и маркироваться для лечения указанного состояния. Для введения антител против СЕАСАМ6 или их антиген-связывающего фрагмента, такая маркировка должна включать количество, частоту и способ введения.
Наборы
Настоящее изобретение также касается фармацевтических упаковок и наборов, содержащих один или более контейнеров, заполненных одним или более ингредиентами вышеупомянутых композиций в соответствии с настоящим изобретением. Ассоциированным с таким контейнером(ами) может быть уведомление в форме, предписанной правительственным агентством, регулирующим изготовление, применение или продажу фармацевтических препаратов или биологических продуктов, выражающее одобрение этого агентства изготовление, применение или продажу продукта для введения человеку.
Терапевтически эффективная доза
Фармацевтические композиции, подходящие для использования в настоящем изобретении, включают композиции, в которых активные ингредиенты содержатся в эффективном количестве, чтобы достигнуть намеченной цели, то есть лечения конкретного болезненного состояния, характеризуемого экспрессией СЕАСАМ6.
Определение эффективной дозы находится в компетенции специалистов в данной области техники.
Определение терапевтически эффективного количества нового антитела согласно настоящему изобретению или его антиген-связывающего фрагмента или его варианта в основном будет зависеть от конкретных особенностей пациента, способа введения и природы расстройства, которое собираются лечить. Общее руководство может быть найдено, например, в публикациях Международной конференции по вопросам гармонизации (International Conference on Harmonization) и в REMINGTON'S PHARMACEUTICAL SCIENCES, chapters 27 and 28, pp. 484-528 (18th ed., Alfonso R. Gennaro, Ed., Easton, Pa.: Mack Pub. Co., 1990). Более тщательное определение терапевтически эффективного количества будет зависеть от таких факторов как токсичность и эффективность лекарства. Токсичность может быть определена с использованием способов, известных специалистам в данной области техники и, которые можно найти в вышеупомянутых ссылках. Эффективность может быть определена с использованием тех же руководств в сочетании со способами, описанными ниже в Примерах.
Для любого соединения терапевтически эффективная доза может быть оценена первоначально либо в тестах на клеточной культуре, например, неопластических клетках, либо в моделях на животных, обычно мышах, кроликах, собаках, свиньях или обезьянах. Животная модель также используется, чтобы оценить желательный диапазона концентрации и способ введения. Такая информация может затем использоваться для определения полезных доз способа введения для людей.
Терапевтически эффективная доза относится к тому количеству антитела или его антигенсвязывающего фрагмента, которые облегчают симптомы или состояние. Терапевтическая эффективность и токсичность таких соединений могут быть определены стандартными фармацевтическими процедурами на клеточных культурах или экспериментальных животных, например, ED50 (доза, терапевтически эффективная у 50% популяции) и LD50 (доза, смертельная для 50% популяции). Отношение доз терапевтического и токсического эффектов представляет собой терапевтический индекс, и он может быть выражен как отношение ED50/LD50. Предпочтительными являются фармацевтические композиции, которые показывают большие терапевтические индексы. Данные, полученные из опытов на клеточной культуре и исследований на животных, используются для определения диапазона дозировок для использования у людей. Дозировка таких композиций находится предпочтительно в пределах диапазона концентраций в кровотоке, которые включает ED50 с минимальной или отсутствующей токсичностью. Дозировка изменяется в пределах этого диапазона в зависимости от используемой лекарственной формы, чувствительности пациента и способа введения.
Точная дозировка выбирается лечащим врачом в зависимости от пациента, которого собираются лечить. Дозировка и введение приспосабливаются, чтобы обеспечить достаточные уровни активного компонента или поддерживать желаемый эффект. Дополнительные факторы, которые могут быть приняты во внимание, включают серьезность стадии заболевания, например, размер опухоли и местоположение; возраст, массу и пол пациента; диету, время и частоту введения, сочетание(я) лекарств, чувствительности реакции и переносимость/ответ на терапию. Долго действующие фармацевтические композиции могут вводиться каждые 3-4 дня, каждую неделю или один раз каждые две недели в зависимости от периода полураспада и уровня клиренса конкретной композиции.
Нормальное количество на дозу могут изменяться от 0,1 до 100000 микрограмм, до суммарной дозы около 1 г в зависимости от пути введения. Руководство относительно конкретных дозировок и способов доставки обеспечивается в литературе. См. патенты США No. 4657760; 5206344 или 5225212. Специалисты в данной области техники будут использовать различные композиции полинуклеотидов с большей вероятностью, чем композиции белков или их ингибиторов. Точно так же доставка полинуклеотидов или полипептидов будет специфической для конкретных клеток, состояний, местоположений и т.д. Предпочтительными специфическими активностями для радиоактивномеченных антител могут колебаться от 0,1 до 10 мКи/мг белка ((Riva et al., Clin. Cancer Res. 5:3275-3280, 1999; Ulaner et al, 2008 Radiology 246(3): 895-902).
Другим предпочтительным вариантом выполнения настоящего изобретения является:
1. Выделенное антитело ли его антиген-связывающий фрагмент, специфически связывающееся с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis.
2. Выделенное антитело ли его антиген-связывающий фрагмент, специфически связывающееся со зрелым внеклеточным доменом человеческой СЕАСАМ6 (представлен аминокислотами в положении 35-320 согласно SEQ-ID No: 179) и со зрелым внеклеточным доменом СЕАСАМ6 Масаса fascicularis (представлен аминокислотами в положении 35-320 согласно SEQ-ID No: 177).
3. Выделенное антитело ли его антиген-связывающий фрагмент, специфически связывающееся с доменом 1 человеческой СЕАСАМ6 (представленаминокислотами 35-142 согласно SEQ-ID NO: 179), и с доменом 1 СЕАСАМ6 Macaca fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177).
4. Выделенное антитело ли его антиген-связывающий фрагмент, специфически связывающееся с белком, содержащим домен 1 человеческой СЕАСАМ6 (представлен аминокислотами 35-142 согласно SEQ-ID NO: 179), и белком, содержащим домен 1 СЕАСАМ6 Macaca fascicularis (представлен аминокислотами 35-142 согласно SEQ-ID NO: 177).
5. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения 1-4, которое не реагирует перекрестно в значительной степени с человеческой СЕАСАМ1, человеческой СЕАСАМ3, и человеческой СЕАСАМ5.
6. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения 1-5 способное связываться с человеческой СЕАСАМ6 и СЕАСАМ6 Macaca fascicularis, или его зрелый внеклеточный домен, или его домен 1, и аффинности находятся в пределах одного порядка моновалентной KD.
7. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое является конкурентоспособным для связывания с 9А6 антителом (Genovac/Aldevron) на человеческой СЕАСАМ6.
8. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое препятствует взаимодействию СЕАСАМ6 и СЕАСАМ1.
9. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое способно изменять цитокиновый профиль специфичных к опухолевому антигену Т клеток в направлении более активированного фенотипа, характеризующегося увеличением секреции IFN-гамма, предпочтительно в ≥1,5 раз (1,5 раз или более) по сравнению с контрольными образцами.
10. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое способно индуцировать иммуномодуляцию.
11. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое способно понижать СЕАСАМ6-опосредованное иммуноподавление специфичных к опухолевому антигену Т клеток, как измерено либо секрецией IFN-гамма специфичных к опухолевому антигену Т клеток, либо числом IFN-гамма-секретирующих активированных Т клеток.
12. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое способно изменять цитокиновый профиль специфичных к опухолевому антигену Т клеток в направлении более цитотоксичного/или активированного фенотипа, характеризующегося увеличением секреции IFN-гамма и/или IL-2 и/или TNF-альфа, предпочтительно в ≥1,5 раз (1,5 раз или более), увеличением секреции IFN-гамма и/или IL-2 и/или TNF-альфа по сравнению с контрольными образцами.
13. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит один или более аминокислотных остатков, выбранных из группы, состоящей из Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
14. Антитело или его антиген-связывающий фрагмент согласно варианту выполнения настоящего изобретения 13, который связывается с эпитопом человеческой СЕАСАМ6, где указанный эпитоп содержит аминокислотные остатки Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 последовательности SEQ ID NO: 179.
15. Антитело или его антиген-связывающий фрагмент согласно варианту выполнения настоящего изобретения 13 или 14, которое связывается с белком человеческой СЕАСАМ6, содержащим Ile63Leu мутацию, и которое не связывается с белком человеческой СЕАСАМ6, содержащим Ile63Phe мутацию, согласно нумерации SEQ ID NO: 179.
16. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, содержащее:
i. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 48, H-CDR2, содержащий SEQ ID NO: 49, и H-CDR3, содержащий SEQ ID NO: 50, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 52, L-CDR2, содержащий SEQ ID NO: 53, и L-CDR3, содержащий SEQ ID NO: 54, или
ii. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 106, H-CDR2, содержащий SEQ ID NO: 107, и H-CDR3, содержащий SEQ ID NO: 108, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 110, L-CDR2, содержащий SEQ ID NO: 111, и L-CDR3, содержащий SEQ ID NO: 112, или
iii. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 4, H-CDR2, содержащий SEQ ID NO: 5, и H-CDR3, содержащий SEQ ID NO: 6, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 8, L-CDR2, содержащий SEQ ID NO: 9, и L-CDR3, содержащий SEQ ID NO: 10, или
iv. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 34, H-CDR2, содержащий SEQ ID NO: 35, и H-CDR3, содержащий SEQ ID NO: 36, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 38, L-CDR2, содержащий SEQ ID NO: 39, и L-CDR3, содержащий SEQ ID NO: 40, или
v. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 120, H-CDR2, содержащий SEQ ID NO: 121, и H-CDR3, содержащий SEQ ID NO: 122, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 124, L-CDR2, содержащий SEQ ID NO: 125, и L-CDR3, содержащий SEQ ID NO: 126, или
vi. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 24, H-CDR2, содержащий SEQ ID NO: 25, и H-CDR3, содержащий SEQ ID NO: 26, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 28, L-CDR2, содержащий SEQ ID NO: 29, и L-CDR3, содержащий SEQ ID NO: 30, или
vii. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 76, H-CDR2, содержащий SEQ ID NO: 77, и H-CDR3, содержащий SEQ ID NO: 78, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 80, L-CDR2, содержащий SEQ ID NO: 81, и L-CDR3, содержащий SEQ ID NO: 82, или
viii. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 134, H-CDR2, содержащий SEQ ID NO: 135, и H-CDR3, содержащий SEQ ID NO: 136, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 138, L-CDR2, содержащий SEQ ID NO: 139, и L-CDR3, содержащий SEQ ID NO: 140, или
ix. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 148, H-CDR2, содержащий SEQ ID NO: 149, и H-CDR3, содержащий SEQ ID NO: 150, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 152, L-CDR2, содержащий SEQ ID NO: 153, и L-CDR3, содержащий SEQ ID NO: 154, или
x. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 14, H-CDR2, содержащий SEQ ID NO: 15, и H-CDR3, содержащий SEQ ID NO: 16, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 18, L-CDR2, содержащий SEQ ID NO: 19, и L-CDR3, содержащий SEQ ID NO: 20, или
xi. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 62, H-CDR2, содержащий SEQ ID NO: 63, и H-CDR3, содержащий SEQ ID NO: 64, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 66, L-CDR2, содержащий SEQ ID NO: 67, и L-CDR3, содержащий SEQ ID NO: 68, или
xii. антиген-связывающую область тяжелой цепи, которая содержит H-CDR1, содержащий SEQ ID NO: 92, H-CDR2, содержащий SEQ ID NO: 93, и H-CDR3, содержащий SEQ ID NO: 94, и антиген-связывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 96, L-CDR2, содержащий SEQ ID NO: 97, и L-CDR3, содержащий SEQ ID NO: 98.
17. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, содержащее:
i. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 47, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 51, или
ii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 105, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 109, или
iii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 3, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 7, или
iv. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 33, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 37, или
v. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 119, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 123, или
vi. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 23, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 27, или
vii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 75, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 79, или
viii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 133, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 137, или
ix. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 147, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 151, или
x. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 13, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 17, или
xi. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 61, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 65, или
xii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 91, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 95.
18. Антитело по любому из предшествующих вариантов выполнения настоящего изобретения, которое представляет собой IgG антитело.
19. Антитело согласно варианту выполнения настоящего изобретения 18, содержащее:
i. область тяжелой цепи, соответствующую SEQ ID NO: 57, и область легкой цепи, соответствующую SEQ ID NO: 58, или
ii. область тяжелой цепи, соответствующую SEQ ID NO: 115, и область легкой цепи, соответствующую SEQ ID NO: 116, или
iii. область тяжелой цепи, соответствующую SEQ ID NO: 43, и область легкой цепи, соответствующую SEQ ID NO: 44, или
iv. область тяжелой цепи, соответствующую SEQ ID NO: 129, и область легкой цепи, соответствующую SEQ ID NO: 130, или
v. область тяжелой цепи, соответствующую SEQ ID NO: 85, и область легкой цепи, соответствующую SEQ ID NO: 86, или
vi. область тяжелой цепи, соответствующую SEQ ID NO: 143, и область легкой цепи, соответствующую SEQ ID NO: 144, или
vii. область тяжелой цепи, соответствующую SEQ ID NO: 157, и область легкой цепи, соответствующую SEQ ID NO: 158, или
viii. область тяжелой цепи, соответствующую SEQ ID NO: 71, и область легкой цепи, соответствующую SEQ ID NO: 72, или
ix. область тяжелой цепи, соответствующую SEQ ID NO: 101, и область легкой цепи, соответствующую SEQ ID NO: 102.
20. Антиген-связывающий фрагмент согласно вариантам выполнения настоящего изобретения 1-17, который представляет собой scFv, Fab, Fab' фрагмент или F(ab')2 фрагмент.
21. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое представляет собой моноклональное антитело или антиген-связывающий фрагмент.
22. Антитело или его антиген-связывающий фрагмент по любому из предшествующих вариантов выполнения настоящего изобретения, которое представляет собой человеческое, гуманизированное или химерное антитело или его антиген-связывающий фрагмент.
23. Конъюгат антитело-лекарственное средство, содержащий антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22.
24. Выделенная последовательность нуклеиновой кислоты, которая кодирует антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22.
25. Вектор, содержащий последовательность нуклеиновой кислоты согласно варианту выполнения настоящего изобретения 24.
26. Выделенная клетка, экспрессирующая антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 и/или содержащая нуклеиновую кислоту согласно варианту выполнения настоящего изобретения 24 или вектор согласно варианту выполнения настоящего изобретения 25.
27. Выделенная клетка согласно варианту выполнения настоящего изобретения 26, где указанной клеткой является прокриотическая или эукариотическая клетка.
28. Способ получения антитела или его антиген-связывающего фрагмента по любому из вариантов выполнения настоящего изобретения 1-22, включающий культивирование клетки согласно варианту выполнения настоящего изобретения 27 и очистку антитела или его антиген-связывающего фрагмента.
29. Антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23 для применения в качестве лекарственного средства.
30. Антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23 для применения в качестве диагностического средства.
31. Антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23 для применения в качестве лекарственного средства для лечения рака.
32. Антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23 для получения лекарственного средства для лечения заболевания.
33. Антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23 для получения лекарственного средства для лечения рака.
34. Фармацевтическая композиция, содержащая антитело или его антиген-связывающий фрагмент по любому из вариантов выполнения настоящего изобретения 1-22 или конъюгат антитело-лекарственное средство согласно варианту выполнения настоящего изобретения 23.
35. Комбинация фармацевтической композиции согласно варианту выполнения настоящего изобретения 34 и одного или более терапевтически активных соединений.
36. Способ лечения заболевания или состояния, связанных с нежелательным присутствием СЕАСАМ6, включающий введение субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции согласно варианту выполнения настоящего изобретения 34 или комбинацию согласно варианту выполнения настоящего изобретения 35.
37. Способ получения анти-СЕАСАМ6 антител, специфически связывающихся с человеческой СЕАСАМ6 и СЕАСАМ6 Масаса fascicularis, где способ включает иммунизацию животного, предпочтительно мыши, белком, содержащим домен 1 СЕСАМ6 яванской макаки, представленный аминокислотами 35-142 согласно SEQ-ID NO: 177, определяющим аминокислотную последовательность антител, специфически связывающихся с человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, с последующей необязательной гуманизацией или генерацией химерного антитела, и рекомбинантной экспрессией указанных антител.
Примеры
Настоящее изобретение далее описывается посредством следующих примеров. Примеры приведены исключительно для иллюстрации изобретения со ссылкой на конкретные варианты осуществления. Эти примеры, иллюстрирующие некоторые конкретные объекты настоящего изобретения, не вносят ограничения или не ограничивают объем раскрытого изобретения.
Все примеры были выполнены с использованием стандартных методов, которые хорошо известны и являются стандартными для специалистов в данной области техники, за исключением случаев, иное описано подробно. Стандартные методы молекулярной биологии следующих примеров могут быть выполнены как описано в стандартных лабораторных руководствах, таких как Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed.; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989.
Пример 1: Последовательности и инструменты получения СЕАСАМ6 макак
Обзор белковых последовательностей антигенов и применяемых ссылочных соединений приводится в Таблице 2:
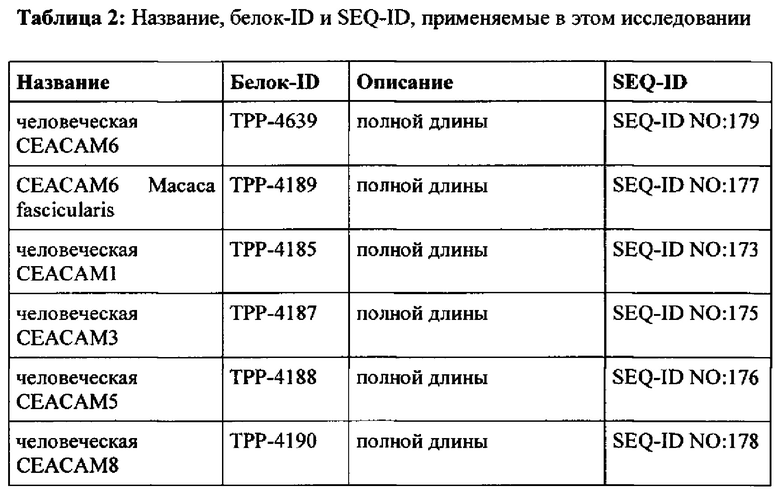
Белковые последовательности для человеческой СЕАСАМ были получены из базы данных UniProtKB/TrEMBL: человеческая СЕАСАМ6 (Р40199), человеческая СЕАСАМ1 (Р13688), человеческая СЕАСАМ3 (Р40198), человеческая СЕАСАМ5 (Р06731), человеческая СЕАСАМ8 (Р31997), человеческая СЕАСАМ 19 (Q7Z692). Также была доступна белковая последовательность (макаки-резус) СЕАСАМ6 Масаса mulatta (F6YVW1). Последовательность белка Масаса fascicularis (яванские макаки) СЕАСАМ6 была выведена из общедоступных нуклеотидных последовательностей путем: а) применения общих правил интрона/экзон слайсинга; b) сравнения с различными белковыми последовательностями обезьян/приматов и с) консервативности геномной структуры между человеком/ приматом/обезьяной. СЕАСАМ6 яванских макак представлен ТРР-4189.
Рекомбинантные внеклеточные домены СЕАСАМ были получены из коммерческих источников или получены на месте. С этой целью внеклеточные домены были С-терминально дополнены сайтом расщепления Factor Ха, человеческим Fc фрагментом IgG1, а также His Tag, и экспрессировались в клетках HEK293 с использованием стандартных методик временной трансфекции. Белки очищали от супернатанта клеточной культуры с помощью белка-А и эксклюзионной хроматографии по размеру. В случаях, когда Fc-часть необходимо удалить, белки отщепляли с помощью Factor Ха в соответствии с рекомендациями производителя (например, Factor Ха протеаза от Hematologic Technologies Inc. HTI No. HCXA-0060) и затем очищали с помощью белка-А и эксклюзионной хроматографии по размеру. В случаях, в которых биотинилированные белки необходимы, применяли коммерческий набор для биотинилирования (например, EZ-Link амин-PEG3-биотин от Pierce #21347), и степень биотинилирования определяли коммерческим наборами (например, Biotin Quantitation Kit от Pierce #28005).
Одиночный N-терминальный домен 1 человеческой СЕАСАМ6 был получен как 6х His слитая белковая конструкция в E. coli BL21 DE3 с использованием рЕТ28 вектора (Novagen). После индукции всю ночь с IPTG при 37°С рекомбинантный белок выделяют и повторно подвергают рефолдингу из телец включения. До рефолдинга тельца включения промыли в буфере Tris рН 8,5, содержащем 150 мМ NaCl, 1 мМ EDTA, 0,1% Tween20, и солюбилизировали в том же буфере, содержащем 8 М мочевины и без детергента. Раствор медленно разбавляли (1:10) в 50 мМ CHES, рН 9,2, содержащем 500 мМ аргинина, и инкубировали при 4°С в течение 16 часов. Очистка была достигнута путем стандартной хроматографии на никеле-NTA и эксклюзионной хроматографии по размерам в 30 мМ Tris-буфере с рН 8,5, 150 мМ NaCl на Superdex 75.
9А6 мышиное антитело IgG1 (GM-0509) было получено у Genovac и химеризовано с человеческим IgG1 и человеческим IgG2. Основой для белковой последовательности Neo201 как либо человеческого IgG1, либо человеческого IgG2 был источник US 20130189268. Все антитела экспрессировали в клетках HEK293 с использованием стандартных методик временной трансфекции и очищали от супернатанта клеточной культуры с помощью белка-А и эксклюзионной хроматографии по размеру.
Подходящие клеточные линии HeLa, экспрессировали различные рецепторы человеческой СЕАСАМ полной длины. Поэтому были трансфицированы последовательности следующих рецепторов: человеческая СЕАСАМ1 (ТРР-4185), человеческая СЕАСАМ3 (ТРР-4187), человеческая СЕАСАМ5 (ТРР-4188), человеческая СЕАСАМ6 (ТРР-4639), человеческая СЕАСАМ8 (ТРР-4190), человеческая СЕАСЕАМ19 (ТРР-4186) или СЕАСАМ6 яванских макак (ТРР-4189). Клеточная линия HeLa не эндогенно экспрессирует любой из этих рецепторов на поверхности, что было подтверждено FACS-анализом, и поверхностная экспрессия может быть обнаружена только после трансфекции соответствующего рецептора СЕАСАМ. Вкратце, экспрессионные конструкции клонировали в векторы на основе UCOE (EMD Millipore Corporation) и трансфицировали в клетках HeLa. После селекции с помощью гигромицина, подходящие стабильные клоны были скринированы с помощью Вестерн-блоттинга полного клеточного лизата, а также FACS окрашивания клеточной поверхности, применяя подходящие антитела (человеческая СЕАСАМ1: #МАВ22441 от R&D Systems; человеческая СЕАСАМ5: #МАВ41281 от R&D Systems; человеческая СЕАСАМ6: #МАВ3934 от R&D Systems; человеческая СЕАСАМ8: ab90294 от abcam; человеческая СЕАСАМ 19: #NBP1-70494 от Novus; человеческая СЕАСАМ3: AF4166 от R&D Systems; СЕАСАМ6 яванских макак: Neo201-hIgG1).
Пример 2: характеризация иммуномодуляции 9A6-mIgG1 антитела
9А6 антитело было описано в литературе как иммуномодулирующее (Witzens-Harig et al., Blood 2013 May 30; 121(22): 4493-503). Антитело было охарактеризовано в отношении его аффинности, его селективности в отношении других человеческих СЕАСАМ, и перекрестной реакционной способности с СЕАСАМ6 обезьян, его специфического связывания с определенным доменом на СЕАСАМ6, и его селективности в отношении других человеческих СЕАСАМ.
Измерения аффинности с применением поверхностного плазмонного резонанса (SPR)
Эксперименты поверхностного плазмонного резонанса (SPR) для количественного анализа связывания выполнялись либо с использованием Biacore Т100, Biacore Т200, либо Biacore 4000 (GE Healthcare Biacore, Inc.), оснащенного Series S Sensor Chips CM5 (GE Healthcare Biacore, Inc.). Анализы связывания проводили при 25°С с помощью буфера для анализа HBS-EP + (10 мМ HEPES, рН 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,05% поверхностно-активного вещества Р20). Антитела были захвачены анти-hIgG иммобилизованного антитела, ковалентно иммобилизованного на поверхности сенсорного чипа с помощью химии связывания аминов. Реагенты для связывания амина (1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC), N-гидроксисукцинимид (NHS), этаноламин-HCl, рН 8,5) использовали из набора Amine Coupling Kit (GE Healthcare, код продукта BR-1000-50). Анти-hIgG, анти-mIgG иммобилизованные антитела и иммобилизационный буфер (10 мМ ацетата натрия, рН 5,0) использовали из наборов Human Antibody Capture Kit (GE Healthcare, BR-1008-39) и Mouse Antibody Capture Kit (GE Healthcare, BR-1008-38), соответственно. Поверхность сенсорного чипа активировалась свежеприготовленным раствором 0,2 М EDC и 0,05 М NHS, пропускаемым через поверхность сенсорного чипа в течение 420 с при скорости потока 10 мкл/мин с последующей инъекцией анти-hIgG или анти-mIgG иммобилизированного антитела (растворенное до 25 мкг/мл в иммобилизационном буфере) в течение 180 с при скорости потока 5 мкл/мин. Избыток активированных групп блокировали одномолярным раствором этаноламина, инжектированным со скоростью потока 10 мкл/мин в течение 420 с.
Антигены СЕАСАМ использовали в качестве аналита для определения значений KD. Антитела захватывали в течение 20 с при скорости потока 10 мкл/мин перед каждой инъекцией аналита. Для определения кинетической аффинности различные концентрации между 1,56 и 200 нМ белка человеческой СЕАСАМ1, человеческой СЕАСАМ3, человеческой СЕАСАМ5, человеческой СЕАСАМ6, СЕАСАМ6 яванских макак, домена 1 СЕАСАМ6 яванских макак в буфере для анализа (смотрите выше) инъецировали к захваченным антителам при скорости потока 60 мкл/мин в течение 3 минут, и диссоциацию контролировали в течение 10 минут.
Полученные сенсограммы были двуссылочными, то есть коррекция исходной ячейки в строке с последующим вычитанием выборки буфера. Значения KD рассчитывались на основе соотношения констант скорости диссоциации (kd) и ассоциации (ka), которые были получены с помощью глобально подобранных сенсограмм с моделью связывания Ленгмюра первого порядка 1:1, реализованной в программном обеспечении Biacore Evaluation (Biacore Т100/Т200/4000 Evaluation Software, GE Healthcare Biacore, Inc.).
"сэндвич" эксперименты конкуренции посредством SPR
"Сэндвич" эксперименты конкуренции посредством SPR осуществляли как указано выше с небольшими изменениями. Во-первых, каждое антитело, подлежащее анализу, было ковалентно иммобилизовано на поверхности сенсора через аминное связывание (подробности смотрите выше). Чтобы проверить, конкурирует ли другое антитело за связывание с определенным антигеном СЕАСАМ, соответствующий антиген захватывают инъецированием над иммобилизованным антителом, а второе антитело, которое должно быть протестировано на конкуренцию, сразу же затем инъецировали. Если второе антитело связывается с антигеном, связанным первым антителом (+), оба антитела не проявляют конкуренции и наоборот, если связывание не наблюдается при инъекции второго антитела (-), оба антитела конкурируют за подобный эпитоп.
Исследования на основе картирования доменов с применением ELISA
Чтобы выяснить конкретную информацию об эпитопе, были сконструированы, экспрессированы и очищены несколько конструкций химерных доменов. Вкратце, последовательность человеческой СЕАСАМ6 дикого типа была С-терминально слита с фрагментом Fc человеческого IgG1, экспрессирована в клетках HEK293, и очищена от супернатанта с помощью белка-А и эксклюзионной хроматографии по размеру (ТРР-1790). Для создания разных доменных химер человеческую последовательность одного одиночного домена была, следовательно, заменена соответствующей последовательностью Macaca mulatta (F6YVW1) в Fc-слитой человеческой СЕАСАМ6. Это создало три различные доменные химеры hDom1-hDom2-mDom3 (ТРР-1793), hDom1-mDom2-hDom3 (ТРР-1792) и mDom1-hDom2-hDom3 (ТРР-1791), вместе с Fc-слитой конструкцией Macaca mulatta в качестве контроля (ТРР-1306). Кроме того, для химер, одиночный домен 1 человеческой СЕАСАМ6 был получен, как описано выше, из Е. coli (ТРР-1794).
Картирование доменной специфичности антитела осуществляли с применением анализа ELISA:
Для анализа ELISA Fc-слитые доменные химеры и одиночный домен 1 наносили на пластины Nunc MaxiSorb и блокировали с помощью раствора SmartBlock. После инкубации с серией концентраций IgG (1 нМ - 1000 нМ) в течение 1 ч, пластины промывали с помощью PBS/T. Анализ связанных конструкций IgG с доменом СЕАСАМ6 был достигнут за счет обнаружения с помощью античеловеческий IgG (Fab специфичного)-пероксидаза антитела (А0293, Sigma). Обнаружение флуоресценции проводили с помощью AmplexRed (А12222, Invitrogen) в соответствии со стандартными протоколами.
Анализ связывания на основе ELISA
Анализы ELISA использовали для характеристики связывания антител с различными паралогами и ортологами CEACAM. Черные 384-луночные планшеты покрывали 25 мкл/лунка различных белковых препаратов СЕАСАМ при 2 мкг/мл в буфере для покрытия (Candor) в течение 1 часа при 37°С. После промывки PBS/0,05% Tween-20 лунки блокировали с помощью 100% Smart Block (Candor) в течение одного часа при 37°С. После трех промывок с PBS/0,05% Tween-20 добавляли серию разведений антитела в PBS/0.05% Tween-20/10% Smart Block в диапазоне от 2 мкг/мл до 2 нг/мл, и планшеты инкубировали в течение 1 часа при комнатной температуре. После трех промывок с PBS/0,05% Tween-20 добавляли соответствующее вторичное антитело. Для обнаружения белков с человеческим Fc, таким как ТРР-1173, использовали анти-человеческий IgG HRP (Sigma АО 170) при разведении 1:10.000. Для обнаружения белков с мышиным Fc, таким как ТРР-1744, использовали анти-мышиный IgG HRP (ThermoScientific 31432) при разведении 1:10.000. PBS/0,05% Tween-20/10% Smart Block использовали в качестве буфера для разбавления. Планшеты инкубировали в течение 1 часа при комнатной температуре. После трех промывок пластины были проявлены с помощью Amplex Red (Life Technologies), и флуоресценция считывалась на длине волны излучения 590 нм. Программное обеспечение GraphPad Prism 6.0 использовалось для расчета значений ЕС50 с использованием четырехпараметрической нелинейной кривой.
Результаты
Чтобы измерить моновалентное сродство 9А6 к человеческой СЕАСАМ6 и оценить его перекрестную реакционную способность по отношению к СЕАСАМ6 макак, эксперименты SPR проводились, как описано выше. Результаты показаны в таблице 3:

Как показано, 9A6-mIgG1 может связываться с высокой аффинностью (22 нМ) с рекомбинантной человеческой СЕАСАМ6. Однако никакого связывания с СЕАСАМ6 Масаса mulatta не обнаружено. Для сравнения также был протестирован Neo201-hIgG1. Это антитело проявляло высокую аффинность, связываясь с СЕАСАМ6 как человека, так и макак. Таким образом, 9А6 демонстрирует высокую аффинность связывания с человеческой СЕАСАМ6, но оно не является перекрестно реакционно способным с СЕАСАМ6 макак.
Для картирования связывающего домена 9А6 на СЕАСАМ6 связывание на разных химерах человека/обезьяны оценивали с помощью ELISA, как описано выше. Чтобы иметь возможность сравнить с Neo201-hIgG1 (ТРР-1173), 9А6 был химеризован с человеческим IgG1 (ТРР-1745). Результаты показаны в таблице 4:
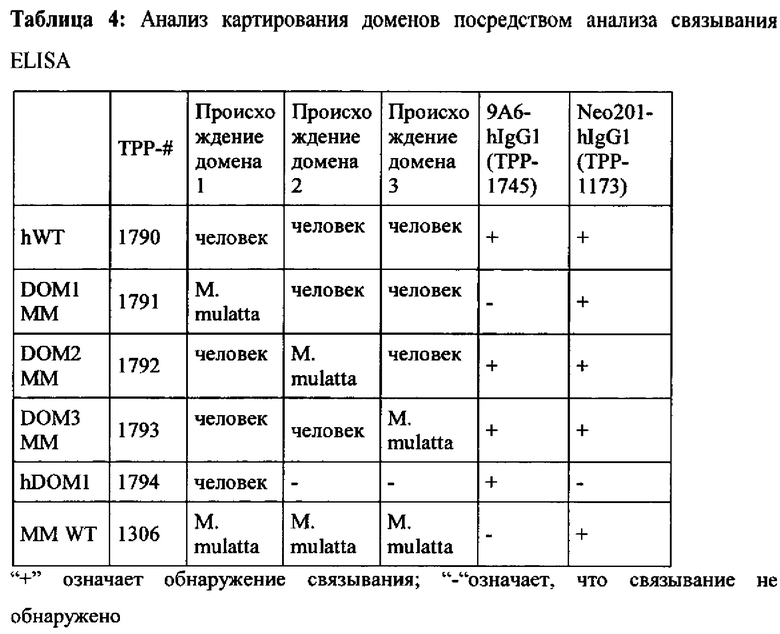
9А6 способен связываться с человеческой СЕАСАМ6 дикого типа и с химерами, использующими домен 2 или 3 СЕАСАМ6 Масаса mulatta. Однако он не связывается с химерой, использующей Домен 1 из СЕАСАМ6 Масаса mulatta или СЕАСАМ6 Масаса mulatta дикого типа. В соответствии с этим он способен связываться с одиночным доменом 1 человеческой СЕАСАМ6. Напротив, Neo201-hIgG1 связывается со всеми протестированными формами, за исключением одиночного домена 1 человеческой СЕАСАМ6. В заключение 9А6 связывается с N-терминальным доменом 1 человеческой СЕАСАМ6.
Для обоснования результатов был проведен эксперимент на конкурирование за связывание, как указано выше. Результаты показаны в таблице 5.
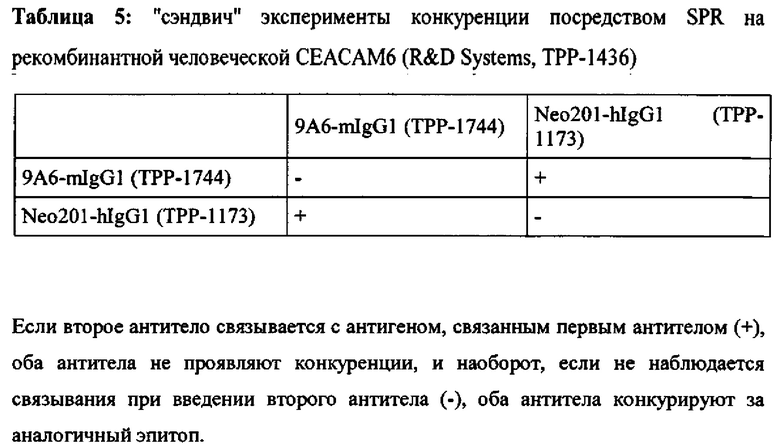
Как видно из таблицы 5, 9A6-mIgG1 и Neo201-hIgG1 не конкурируют друг с другом за связывание с человеческой СЕАСАМ6. Это согласуется с опубликованным эпитопом Neo201, находящимся за пределами домена 1.
Чтобы проанализировать селективность 9А6 в отношении различных ортологов СЕАСАМ6 и обеспечить сравнение с Neo201-hIgG1, 9А6 подвергали химеризации с hIgG1 (ТРР-1745). В эксперименте по связыванию ELISA, проведенном, как описано выше, значения ЕС50, перечисленные в таблице 6, были получены:
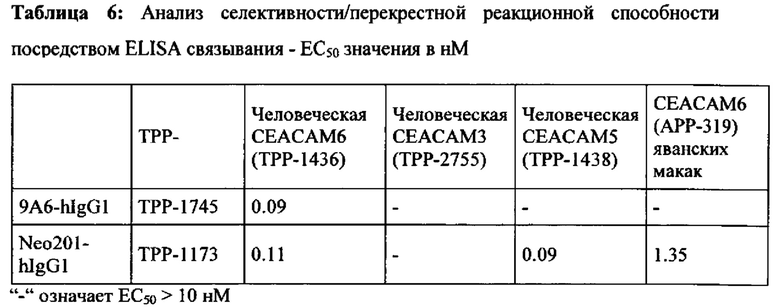
Высокая аффинность связывания 9А6 с человеческой СЕАСАМ6 была подтверждена. В соответствии с экспериментами SPR с использованием СЕАСАМ6 резус-макак, 9А6 также не связывается с СЕАСАМ6 яванских макак. Это, однако, селективно для СЕАСАМ6, поскольку не наблюдалось связывание с человеческой СЕАСАМ3 или СЕАСАМ5.
Напротив, Neo201-hIgG1 демонстрирует сходную высокую аффинность связывания с человеческой СЕАСАМ6 и даже перекрестно реагирует с СЕАСАМ6 яванских макак. Это происходит при уменьшенной селективности, так как он демонстрирует также высокую аффинность связывания с человеческой СЕАСАМ5.
Пример 3: Выравнивание белковых последовательностей СЕАСАМ
Зрелая внеклеточная форма человеческой СЕАСАМ6 (аминокислоты 35-320 UniProtKB/Swiss-Prot: Р40199.3) состоит из разных доменов: N-терминальной домен 1 (по данным www.uniprot.org аминокислоты 35-142 от UniProtKB/Swiss-Prot: Р40199.3), домен 2 (в соответствии с www.uniprot.org аминокислоты 145-232 от UniProtKB/Swiss-Prot: Р40199.3) и домен 3 (согласно www.uniprot.org аминокислоты 237- 314 от UniProtKB/Swiss-Prot: Р40199.3). Поскольку целью было идентифицировать селективное антитело с высоким сродством к N-терминальному домену 1 СЕАСАМ6, которое при этом является перекрестно-реагирующим с СЕАСАМ6 яванских макак, была оценена вероятность объединения желаемых свойств в одной молекуле.
С этой целью белковая последовательность N-терминального домена 1 человеческой СЕАСАМ6 сравнивалась с другими белками с использованием алгоритма Blastp (NCBI), используя стандартные установки для идентификации наиболее релевантных гомологов СЕАСАМ6. (Частично) зрелые внеклеточные домены человеческой СЕАСАМ6 (аминокислоты 35-320 из UniProtKB/Swiss-Prot: Р40199.3), человеческой СЕАСАМ 1 (аминокислоты 35-428 UniProtKB/Swiss-Prot: P13688.2), человеческой СЕАСАМ3 (аминокислоты 35-155 из UniProtKB/Swiss-Prot: Р40198.2), человеческой СЕАСАМ5 (аминокислоты 35-417 из UniProtKB/Swiss-Prot: Р06731.3) и СЕАСАМ6 яванских макак (macaca fascicularis) (аминокислоты 35-320 из ТРР-4189) были выровнены с использованием "Global Alignment - Wilbur and Lipman (fast)" в программном обеспечении Phylosopher (Genedata). Выравнивание показано на Фиг. 1. Идентичность последовательности в процентах N-терминального домена 1 человеческой СЕАСАМ6 с другими N-терминальными доменами (в соответствии с выравниванием) определялась с использованием программного обеспечения Vector NTI (Life Technologies). Эти результаты показаны в таблице 7.
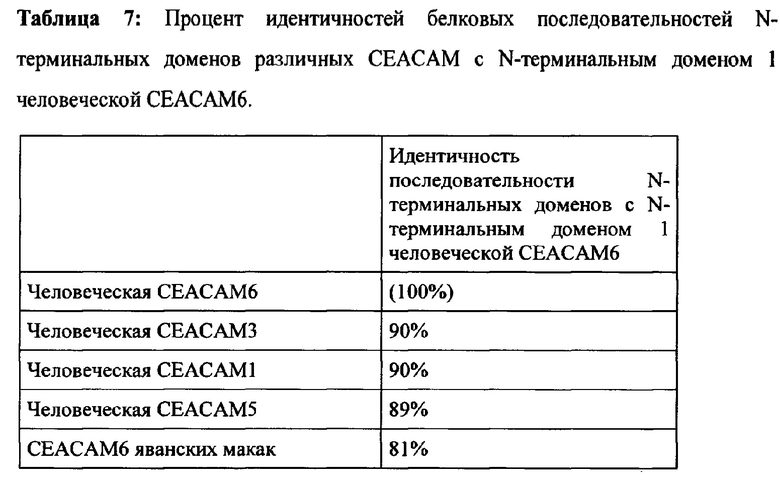
Выравнивание последовательностей на Фиг. 1 показывает очень высокую степень подобия белковых последовательностей человеческой СЕАСМ6 и человеческой СЕАСАМ3, человеческой СЕАСАМ5 и человеческой СЕАСАМ1 по всей внеклеточной области. Целевая область (домен 1 человеческой СЕАСАМ6) особенно подобна другим СЕАСАМ, что также отображено в Таблице 7.
Паралоги человеческой СЕАСАМ6 намного более подобны человеческой СЕАСАМ6, чем ортологу яванских макак. На самом деле, существует только 2 положения в N-терминальной области в первичной последовательности, которые идентичны в человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, но отличны от аминокислот в этом положении в других паралогах человека (отмечены на Фиг. 1 звездочками).
В заключение: очень сложно идентифицировать антитело с высокой аффинностью с N-терминальным доменом 1 человека СЕАСАМ6, которое является селективным, но все же перекрестно-реакционноспособным с СЕАСАМ6 макак.
Пример 4: антитела, полученные фаговым отображением
Для идентификации человеческого анти-СЕАСАМ6 антитела различные отборы из Fab-фаговой библиотеки FAB-300 от DYAX были осуществлены, по существу, как описано ранее (Hoet et al., 2005; Huang et al., 2006). Как показано в Таблице 8, различные стратегии с до 4 серий отбора фагов применялись с использованием биотинилированной Fc-меченной рекомбинантной человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак (ТРР-1436 и ТРР-2443), нанесенной на стрептавидиновые шарики, и опухолевой клеточной линии человека KPL-4 (Kurebayashi et al., Br J Cancer. 1999 Feb; 79 (5-6): 707-17), которая экспрессирует большое количество эндогенного целевого белка на поверхности клетки. Кроме того, истощение связующего против СЕАСАМ5 (ТРР-1438; hC5) и СЕАСАМ1 (ТРР-1437; hC1) (нецелевание) или рекомбинантного человеческого IgG1-Fc (Fc) было включено, как указано, перед каждым отбором на белковые мишени. Например, в стратегии А после истощения на шариках, покрытых человеческой СЕАСАМ1 (hC1), первая серия пэннинга была сделана на человеческой СЕАСАМ6 (hC6). Полученный выход был разделен, и одна часть была использована для второй и третьей серий отбора на человеческой СЕАСАМ6. Другая часть была использована для второй серии пэннинга на клетках KPL-4, третьей серии на человеческой СЕАСАМ6 и финальной четвертой серии пэннинга на клетках KLP-4. В стратегии С проводили стадию оценки специфичности с использованием мышиного mAb 9A6-mIgG1 (ТРР-1744).
Пулы фагов, обогащенные различными сериями отбора, подвергали скринингу для связывания с целевыми и нецелевыми с помощью Fab-фагового анализа ELISA, как описано (Hoet et al., Nat Biotechnol, 2005 Mar, 23 (3): 344-8) или FACS-анализа на клетках, экспрессирующих СЕАСАМ6. Пулы фагов с благоприятным профилем были выбраны для удаления гена III и последующего ELISA-скрининга растворимого Fab в ELISA. ДНК полученных sFab-попаданий была секвенирована, а уникальные представители охарактеризованы на связывание клеток с помощью FACS-анализа на клетках KPL-4 (таблица 9). В некоторых вариантах фаговое связующее согласно изобретению непосредственно повторно клонировали в IgG.
Связывание выбранных фаговых отображений, очищенных фрагментов Fab (смотрите перечень в Таблице 9) с биотинилированными вариантами человеческой СЕАСАМ1 (ТРР-1437), человеческой СЕАСАМ5 (ТРР-1438) и человеческой СЕАСАМ6 (ТРР-1436) было проанализировано с помощью биослойной интерферометрии с использованием устройства Octet RED384 (Pall ForteBio Corp.). Биотинилированные антигены загружали в биосенсоры Стрептавидина (SA) (ForteBio Part номер 18-5019) и после базовой стадии уравновешивания в буфере для анализа (PBS, дополненная 0,1% (мас./об.) BSA, 0,02% (об./об.) Tween20 и 0,05% (об./об.) азида натрия, ForteBio Part номер 18-5032), связывание Fabs, разбавленных в буфере для анализа, до конечной концентрации 200 нМ контролировали в течение 300 секунд с последующей фазой диссоциации, равной 300 секунд.
Соответствующие очищенные Fab фрагменты из Таблицы 9 также проявляли связывание с человеческой СЕАСАМ6, но не с человеческой СЕАСАМ5 или человеческой СЕАСАМ1.
Чтобы проанализировать, конкурируют ли Fab с 9А6 за связывание с человеческой СЕАСАМ6, был проведен конкурентный эксперимент. Здесь биотинилированная человеческая СЕАСАМ6 (ТРР-1436) загружался на биосенсоры SA, и ответы связывания Fab сравнивали с ответами связывания Fab, полученными с загруженной СЕАСАМ6, насыщенной 9A6-mIgG1 (ТРР-1744) (как описано в примере 1). Если ответ связывания в присутствии 9А6 значительно снижается или исключается, это свидетельствует о том, что тестируемый Fab связывается с эпитопом, подобным эпитопу 9А6.
Неожиданно, все протестированные Fab были способны конкурировать с 9А6 за связывание с человеческой СЕАСАМ6.
Fab последовательности были реформатированы в формат человеческой IgG1 для дальнейшей характеризации.
Аффинности (моновалентная KD) реформатированных антител в отношении рекомбинантной человеческой СЕАСАМ6 (ТРР-1436) были определены посредством SPR, аналогично экспериментальным методикам, описанным в Примере 2. Сенсорграммы были либо оценены глобально подобранными сенсограммами с моделью связывания Ленгмюра первого порядка 1:1, либо анализом статической стабильности, осуществленным в программном обеспечении Biacore Evaluation (Biacore Т200/4000 Evaluation Software). Результаты показаны в Таблице 10:

Как очевидно из Таблицы 10, антитела показали довольно низкие моновалентные аффинности, причем самым низким значением (самая высокая аффинность) является 76 нМ для ТРР-1679. Три IgG, проявляющие самые высокие моновалентные аффинности, были проанализированы в отношении их селективности и перекрестной реакционной способности с СЕАСАМ6 яванских макак в эксперименте связывания ELISA (проводили аналогично протоколу, приведенному в Примере 2)
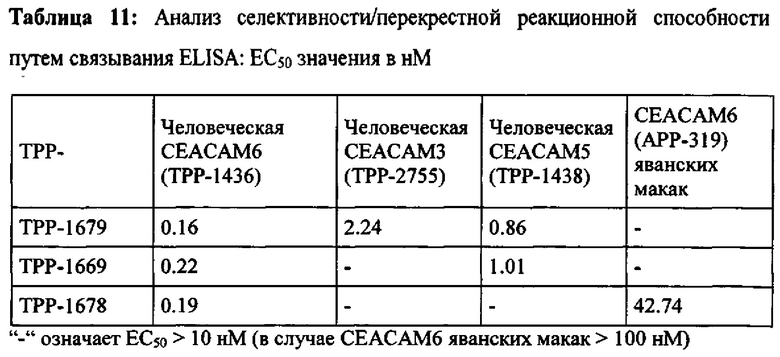
Подводя итог, были получены антитела с довольно плохими моновалентными аффинностями. Это может быть компромиссное ухудшение из-за отсутствия связывания к другим паралогом. Тем не менее, профиль селективности часто является недостаточным (смотрите ТРР-1679 и ТРР-1669 в таблице 11). Из всех протестированных антител ТРР-1678 является единственной с очень несущественной перекрестной реакционной способностью с рекомбинантной СЕАСАМ6 яванских макак (смотрите Таблица 11).
В заключение не было получено никаких терапевтически полезных анти-СЕАСАМ6 антител с использованием фагового отображения без дальнейшего созревания.
Пример 5: Созревание антител, полученных в результате фагового отображения
Чтобы получить антитела с желаемыми профилями аффинности, селективности и перексрестной реакционной способности, некоторые антитела, полученные в результате фагового отображения, были антителами с созревшей аффинностью.
Поэтому, все CDR аминокислотные положения ТРР-1669, ТРР-1678 и ТРР-1679 были рандомизированы по отдельности. Полученные варианты были экспрессированы и оценены на связывания с несколькими членами семейства СЕАСАМ (человеческая СЕАСАМ6, СЕАСАМ6 яванских макак, человеческая СЕАСАМ3 и человеческая СЕАСАМ5) путем связывания ELISA в клеточных супернатантах.
Для ТРР-1669 индивидуальные мутации, усиливающие связывание с СЕАСАМ6 яванских макак без одновременного усиления связывания с другими членами семейства СЕАСАМ человека, не могли быть идентифицированы.
Для ТРР-1679 было идентифицировано несколько отдельных мутаций, которые усиливали связывание с человеческой СЕАСАМ6 без сопутствующего усиления связывания с другими членами семейства СЕАСАМ человека, и была создана библиотека рекомбинаций, содержащая все возможные пермутации. Соответствующие варианты были экспрессированы в виде изотипов человеческого IgG2, очищены и оценены на связывание с многими членами семейства СЕАСАМ с помощью SPR, аналогично экспериментальным методикам, описанным в Примере 2. Таблица 12 суммирует свойства выбранных антител, полученных этим способом.
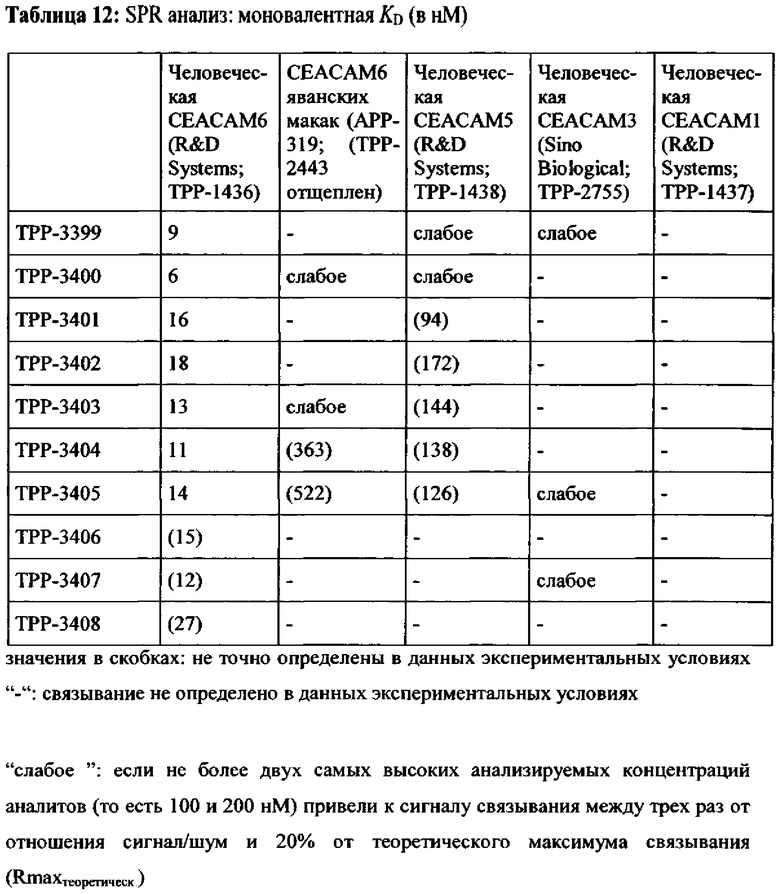
Результаты, полученные в Таблице 12, показывают, что улучшение аффинности и селективности вполне возможно. Однако это также подчеркивает проблему получения перекрестно-реактивных связующих с СЕАСАМ6 яванских макак, которые по меньшей мере находятся в одном порядке величины относительно моновалентной афинности к человеческой СЕАСАМ6.
Для ТРР-1678 было идентифицировано несколько отдельных мутаций, которые улучшали связывание с человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак без большего сопутствующего усиленного связывания с другими членами семейства СЕАСАМ человека, и была создана библиотека рекомбинации, содержащая несколько пермутаций. Соответствующие варианты были экспрессированы в виде изотипов человеческого IgG2, очищены и оценены на связывание с несколькими членами семейства СЕАСАМ с помощью SPR аналогично экспериментальным методикам, описанным в примере 2 (суммированы в таблице 13).
Связывающие характеристики этих антител также определяли с помощью связывания ELISA (моновалентное связывание, биотинилированные белки СЕАСАМ): Разведение 1: 440 анти-человеческого IgG (Sigma, I2136) в буфере для покрытия (Candor) использовали для покрытия черных 384-луночных планшетов Maxisorp (Nunc) в течение 1 часа при 37°С. После одной промывки PBS/0,05% Tween-20 планшеты блокировали 100% SmartBlock (Candor) в течение 1 часа при 37°С. После трех промывок на планшет добавляли 2 мкг/мл соответствующих антител в PBS/0,05% Tween-20/10% SmartBlock. Планшеты инкубировали в течение 1 часа при комнатной температуре. После трех промывок добавляли серию разведений соответствующих биотинилированных белков СЕАСАМ в PBS/0,05% Tween-20/10% SmartBlock, и планшеты инкубировали в течение одного часа при комнатной температуре. После трех промывок добавляли 1 мкг/мл стрептавидин-пероксидазы (Sigma, S5512) в PBS/0,05% Tween-20/10% SmartBlock, и планшеты инкубировали в течение 30 минут при комнатной температуре. После трех промывок планшеты проявляли с помощью Amplex Red (Life Technologies), и флуоресценция считывалась при длине волны излучения 590 нм. Программное обеспечение GraphPad Prism 6.0 использовалось для расчета значений ЕС50 с использованием четырехпараметрической нелинейной кривой.
Варианты с существенно улучшенным профилем связывания, селективности и перекрестной реакционной способности были идентифицированы как суммировано в таблице 13 и таблице 14 для выбранных антител, полученных этим способом.
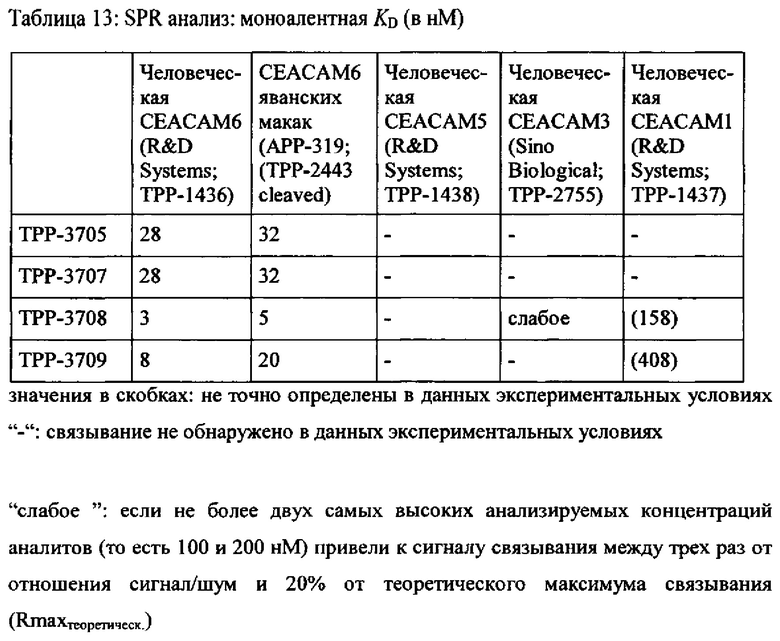
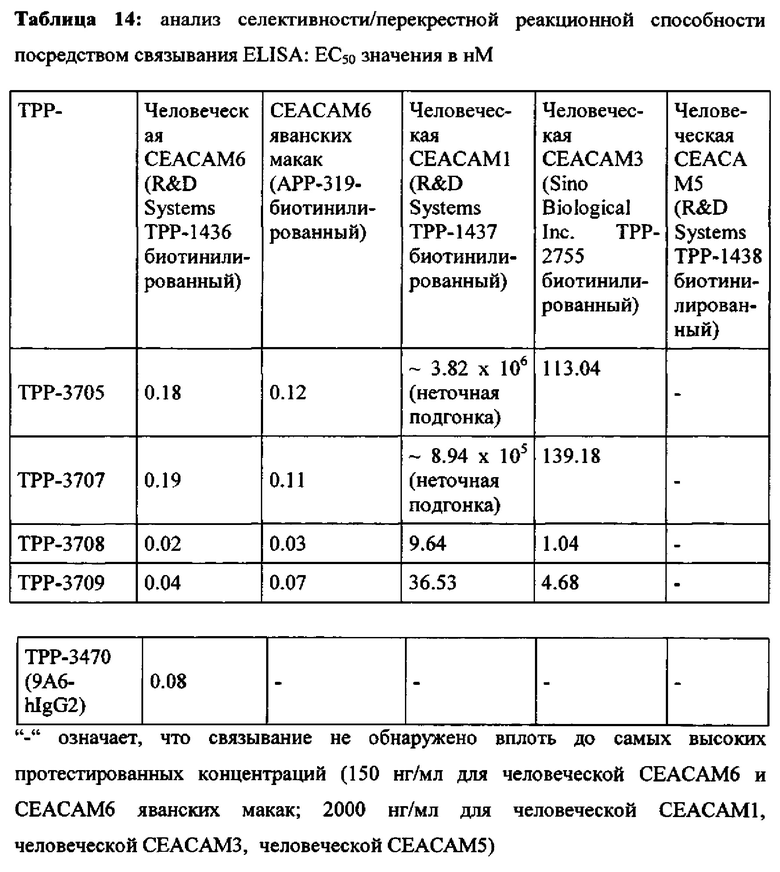
В заключение, используя предшественник ТРР-1678, удалось получить несколько высокоаффинных человеческих антител к человеческому СЕСАСАМ6, которые действительно перекрестно реагируют с СЕАСАМ6 яванских макак и являются селективными по отношению к СЕАСАМ6: связывание ТРР-3707 с человеческой СЕАСАМ6 происходит примерно в 730 раз лучше, чем с человеческой СЕАСАМ3 (620-кратное для ТРР-3705), судя по сравнению их соответствующих значений ЕС50.
Пример 6: Получение антитела посредством мышиной иммунизации
Для получения мышиных моноклональных антител против СЕАСАМ6 были проведены две различные стратегии иммунизации на основе последовательности иммуногенов, применяемых к Balb/c мышам(стратегия А и В в таблице 15). В рамках каждой стратегии мышей иммунизировали либо через лапу, либо путем внутрибрюшинного применения антигенов в ходе 5 серий инъецирования, как показано в таблице 15. Стратегия А была сосредоточена на иммунизации с помощью домена 1 СЕАСАМ6 яванских макак, тогда как стратегия В была основана на сочетании внеклеточной СЕАСАМ6 полной длины человека и яванских макак в качестве иммуногенов.
Иммунизация с помощью лапы основывалась на 5 инъекциях 1 мкг антигена один раз в неделю. Иммунизация по внутрибрюшинному пути была основана на 4 инъекциях IP раз в две недели (10 мкг антигена), а затем одна внутривенная бустер-инъекция.
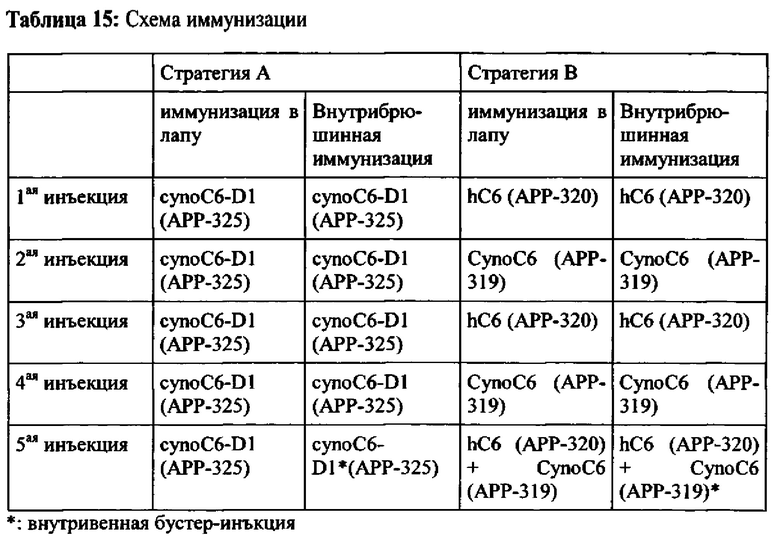
Через четыре дня после последней инъекции клетки лимфатических узлов или селезенка мышей сливали в соответствии со стандартными методами (например,  and Milstein Nature. 1975 Aug 7, 256 (5517): 495-7). Скрининг полученных гибридомных клонов проводили в ELISA с использованием биотинилированных антигенов и белков вне мишени (как указано в таблице 16). Более подробно микротитровальные планшеты были покрыты козьими антимышиными антителами всю ночь при 4°С. Планшеты на следующий день промывали и блокировали 5% BSA в течение 2 ч при комнатной температуре, а затем проводили еще одну стадию промывки. 20 мкл супернатантов гибридомы инкубировали с биотинилированными антигенами в течение 1 часа при комнатной температуре, и смеси переносили в покрытые лунки, с последующей стадией инкубации (1 ч при комнатной температуре). После промывки планшета анти-стрептавидин-HRP конъюгаты добавляли в течение 30 мин при комнатной температуре. Наконец, лунки промывали, и цветовая реакция была запущена путем добавления 50 мкл ТМВ и записана в планшетном ридере.
and Milstein Nature. 1975 Aug 7, 256 (5517): 495-7). Скрининг полученных гибридомных клонов проводили в ELISA с использованием биотинилированных антигенов и белков вне мишени (как указано в таблице 16). Более подробно микротитровальные планшеты были покрыты козьими антимышиными антителами всю ночь при 4°С. Планшеты на следующий день промывали и блокировали 5% BSA в течение 2 ч при комнатной температуре, а затем проводили еще одну стадию промывки. 20 мкл супернатантов гибридомы инкубировали с биотинилированными антигенами в течение 1 часа при комнатной температуре, и смеси переносили в покрытые лунки, с последующей стадией инкубации (1 ч при комнатной температуре). После промывки планшета анти-стрептавидин-HRP конъюгаты добавляли в течение 30 мин при комнатной температуре. Наконец, лунки промывали, и цветовая реакция была запущена путем добавления 50 мкл ТМВ и записана в планшетном ридере.
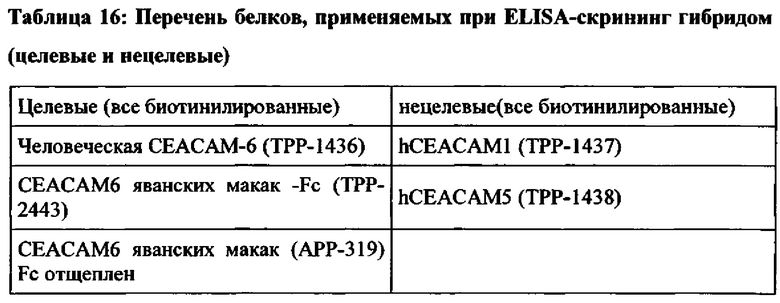
Удивительно, но только стратегия А привела к тому, что клоны показали благоприятный профиль в отношении перекрестной реакционной способности, а также селективности человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак. Кроме того, некоторые виды специфических клонов были получены из обеих стратегий.
Кандидаты, выбранные положительно по ELISA, субклонировали за по меньшей мере 3 цикла клонирования и продуцировались в больших количествах из асцитной жидкости по хроматографии белка А.
Антитела из мышиного иммунизации также характеризовались на связывание с СЕАСАМ6 в клеточном контексте. HeLa-клетки, сверхэкспрессирующие человеческую СЕАСАМ6 или СЕАСАМ6 яванских макак, использовали в экспериментах FACS с супернатантами из гибридомы или очищенных mIgs (смотрите Пример 1). Нетрансфицированные клетки HeLa служили отрицательным контролем. Таблица 17 обобщает профиль идентифицированных кандидатов из ELISA и FACS-анализа:
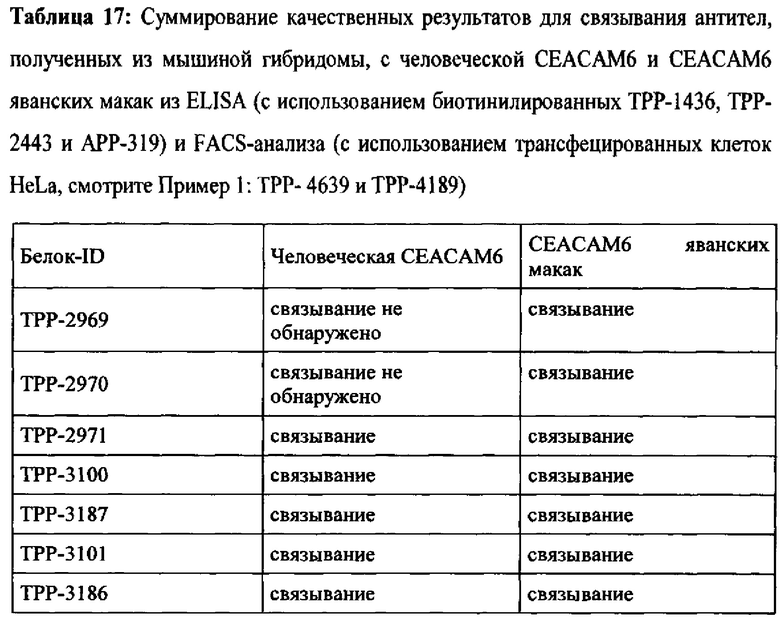
Полученные мышиные антитела были более охарактеризованы в отношении их моновалентных аффинностей (KD), их селективности по отношению к другим паралогам человека и степени их перекрестной реакционной способности к СЕАСАМ6 яванских макак с помощью SPR-анализа в виде очищенных mIgG.
SPR проводили аналогично экспериментальным методикам, описанным в Примере 2.
Результаты суммированы в Таблице 18:
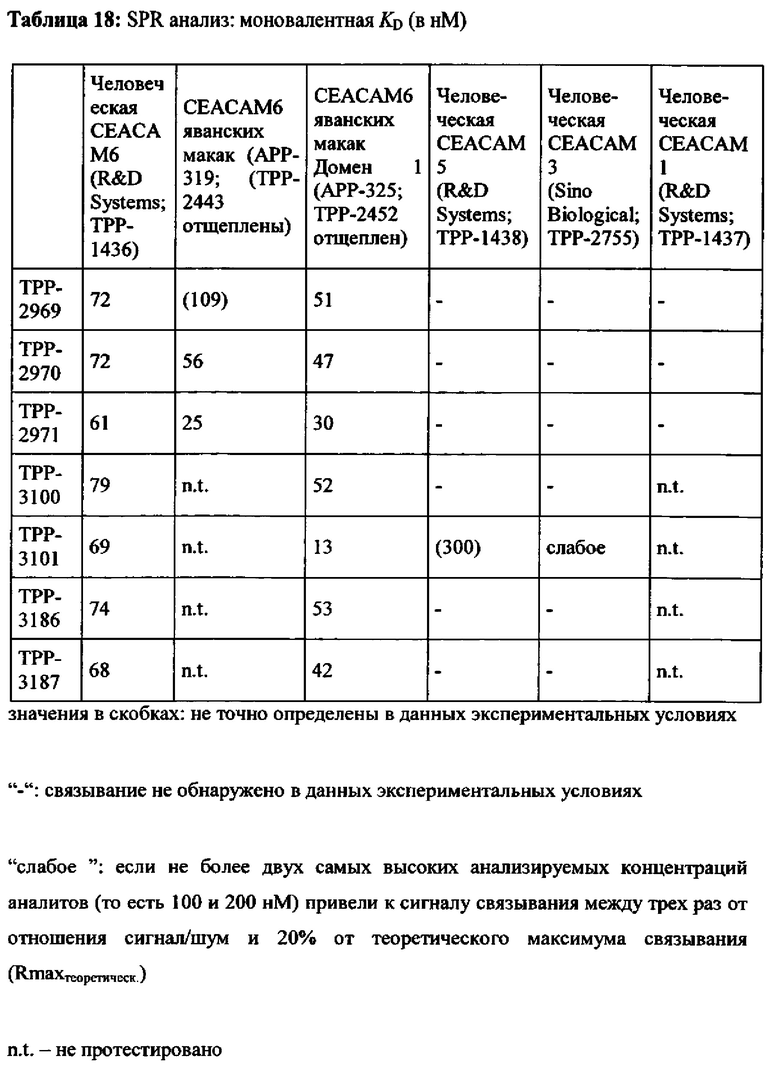
Наблюдались нерешенные расхождения для ТРР-2969 и ТРР-2970: при первоначальном анализе ELISA и FACS они были представлены специфическими для СЕАСАМ6 яванских макак, тогда как в более позднем эксперименте SPR они проявляли также связывание с рекомбинантной человеческой СЕАСАМ6.
Подводя итог: иммунизация мышей с помощью N-концевого домена 1 СЕАСАМ6 яванских макак (АРР-325) неожиданно дала некоторые антитела (например, ТРР-3186, ТРР-2971, ТРР-3187), которые действительно являются перекрестно реакционно способными в отношении человеческой СЕАСАМ6-СЕАСАМ6 яванских макак и в то же время селективными в отношении других человеческих паралогов. Аффинности находятся в подходящем диапазоне для терапевтических целей, но их мышиное происхождение и связанные с ним иммуногенные факторы исключают терапевтические применения у людей.
Пример 7: Гуманизация антител
Чтобы получить антитела, подходящие для терапевтических применений у людей, выбранные мышиные антитела были гуманизированы.
Выбранные последовательности антител, полученных из мышиной гибридомы, определяли путем секвенирования кДНК антител соответствующих линий клеток гибридомы (см. Таблицу 17). Согласно результатам для последовательностей, ТРР-3100 и ТРР-3186 идентичны. ТРР-3101 дал последовательность одной тяжелой цепи, но двух легких цепей. ТРР-2971 и ТРР-3187 были очень похожи. Они отличались четырьмя аминокислотами (см. Фиг. 2).
Дешифрованные мышиные последовательности VH и VL антитела ТРР-2971 и ТРР-3187 были гуманизированы путем трансплантации CDR согласно определению Кэбота в каркасные структуры зародышей линии человека. В качестве исключения HCDR2 был частично трансплантирован. Поскольку эта CDR является очень длинной (16 аминокислот) согласно определению Кэбата, трансплантировали только первые 9 аминокислот. Эти аминокислоты представляют собой часть HCDR2, которая идентична HCDR2 в соответствии с определением Chothia (для определений CDR согласно Kabat and Chothia смотрите: Andre C.R. Martin, "Protein sequence and structure analysis of antibody variable domains" in Antibody Engineering (Springer Lab Manuals), Eds.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg).
Каркасы человеческих зародышевых линий были выбраны на основе поисков подобия частей FW1, FW2, FW3 и FW4 мышиного каркаса с набором человеческих VH и VL, а также последовательностей J-элемента зародышевой линии. Мышиные CDR были трансплантированы в наилучшим образом совпадающие последовательности зародышевой линии (за исключением CDR), которыми были IGKV1-9*01 и IGKJ2*01 для VL (Идентичности 69.6%, FW1; 86.7%, FW2; 71.9%, FW3; 80.0%, FW4) и IGHV2-70*01 и IGHJ6*01 для VH ((Идентичности: 73.3% (ТРР-2971) и 70.0% (ТРР-3187), FW1; 85.7%, FW2; 71.9%, FW3; 90.9%, FW4)). Последовательности зародышевой линии, применяемые в поисках сходства, были получены из набора данных VBASE2 (Retter I, Althaus НН,  R,
R,  W: VBASE2, an integrative V gene database. Nucleic Acids Res. 2005 Jan 1; 33(Database issue): D671-4). Названия, присвоенные наиболее близким последовательностям зародышевой линии, были взяты из системы IMGT (Lefranc, М.-Р., Giudicelli, V., Ginestoux, С., Jabado-Michaloud, J., Folch, G., Bellahcene, F., Wu, Y., Gemrot, E., Brochet, X., Lane, J., Regnier, L., Ehrenmann, F., Lefranc, G. and Duroux, P. IMGT®, the international ImMunoGeneTics information system®. Nucl. Acids Res, 37, D1006-D1012 (2009); doi:10.1093/nar/gkn838)).
W: VBASE2, an integrative V gene database. Nucleic Acids Res. 2005 Jan 1; 33(Database issue): D671-4). Названия, присвоенные наиболее близким последовательностям зародышевой линии, были взяты из системы IMGT (Lefranc, М.-Р., Giudicelli, V., Ginestoux, С., Jabado-Michaloud, J., Folch, G., Bellahcene, F., Wu, Y., Gemrot, E., Brochet, X., Lane, J., Regnier, L., Ehrenmann, F., Lefranc, G. and Duroux, P. IMGT®, the international ImMunoGeneTics information system®. Nucl. Acids Res, 37, D1006-D1012 (2009); doi:10.1093/nar/gkn838)).
Были созданы два варианта гуманизированных последовательностей, полученных из ТРР-2971: ТРР-3310 и ТРР-3714. В VH ТРР-3310 J элемент оставался неизменным по сравнению с мышиным родоначальником, тогда как в VH ТРР-3714 J элемент был сделан полностью подобным человеческой зародышевой линии (см. Фиг. 3). В гуманизированных последовательностях не обнаружено сайтов гликозилирования или неспаренных цистеинов.
Кроме того, были созданы два варианта гуманизированных последовательностей, полученных из ТРР-3187: ТРР-3820 и ТРР-3821 (см. Фиг. 4). По сравнению с ТРР-3714, VH в ТРР-3820 содержала треонин вместо серина в положении 30 в HFW1 и глицин вместо аланина в положении 46 в HFW2, тогда как VL содержала два аспарагиновых остатка вместо двух сериновых остатков в положениях 92 и 93 в LCDR3. Эти четыре аминокислотные замены отражают различия между последовательностями мышиного родоначальника ТРР-3187 и ТРР-2971.
Вариабельный домен VH в ТРР-3821 идентично ТРР-3714, тогда как VL содержала два аспарагиновых остатка вместо двух сериновых остатков в положениях 92 и 93 в LCDR3 по сравнению с ТРР-3714. Эти две аминокислотные замены отражают различия в CDR между последовательностями мышиного родоначальника ТРР-3187 и ТРР-2971. В последовательностях ТРР-3820 и ТРР-3821 не обнаружено сайтов гликозилирования или неспаренных остатков цистеина.
Определение аффинности и «сэндвич» конкурентные эксперименты химеризованных и гуманизированных антител выполнялись посредством SPR аналогично экспериментальным методикам, описанным в Примере 2, и результаты приведены в Таблице 19 и Таблице 20:
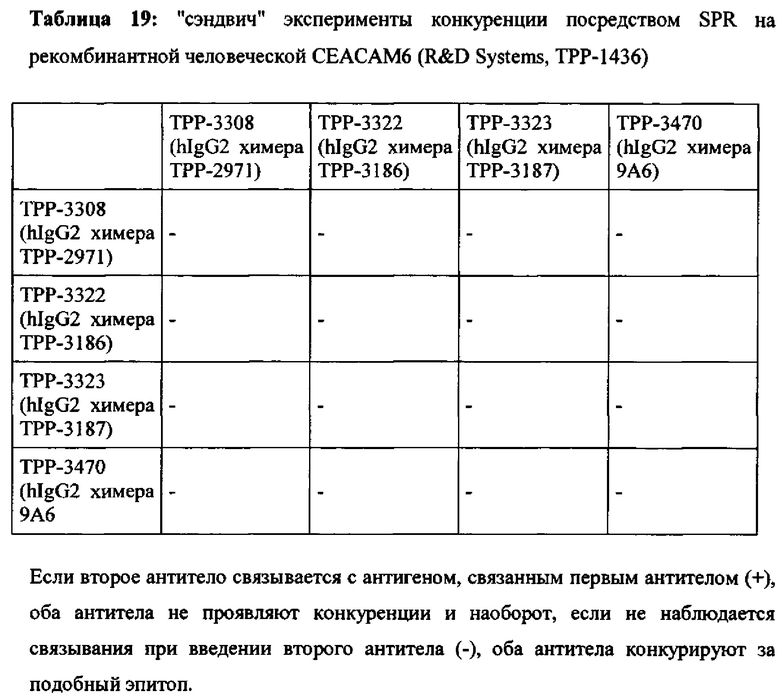
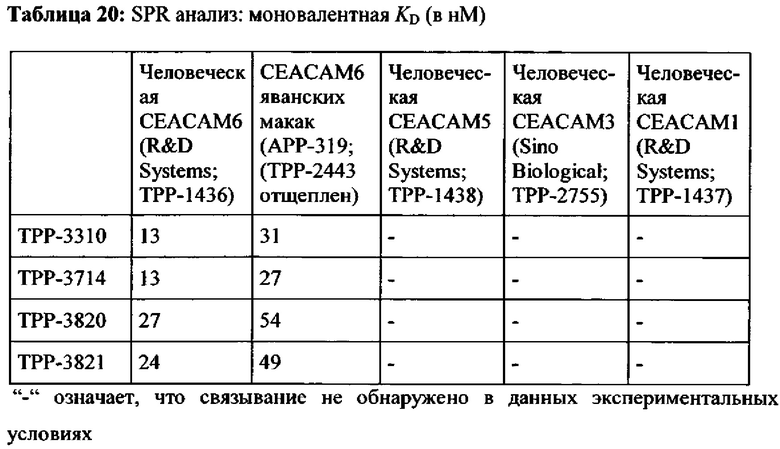
Анализ селективности и перекрестной реакционной способности проводили путем связывания ELISA (моновалентные, биотинилированные белки СЕАСАМ) по аналогии с протоколом, представленным в примере 5. Полученные результаты суммированы в таблице 21.
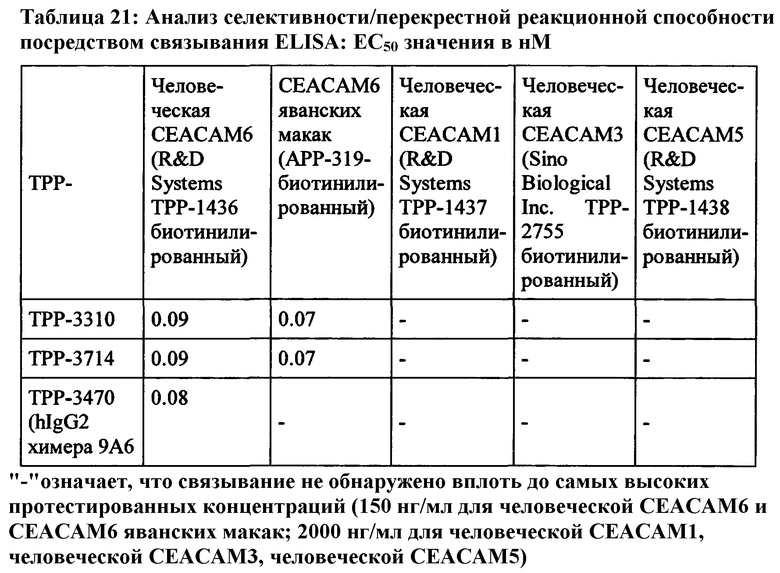
Результаты в Таблице 19 показывают, что ТРР-2971, ТРР-3186 и ТРР-3187 конкурируют за один и тот же или подобный эпитоп человеческой СЕАСАМ6, как 9A6-hIgG2. Результаты в Таблице 20 и Таблице 21 подчеркивают высокую аффинность связывания с человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак с истинной перекрестной реакционной способностью, будучи селективными по отношению к СЕАСАМ6 и не связываются с паралогами СЕАСАМ6.
В заключение, гуманизация была полностью успешной, при этом антитела проявляли еще более высокую аффинность, чем их мышиные предшественники, что позволяет терапевтическое применение у людей.
Пример 8: Селективное связывание СЕАСАМ6 на клетках
Чтобы продемонстрировать связывание и селективность анти-СЕАСАМ6 антитела к аутентичным антигенам, антитела были протестированы на связывание с нативным СЕАСАМ6 на поверхности клеток различных клеточных линий с помощью экспериментов FACS.
СЕАСАМ6 селективность протестировали на панели HeLa-клеток, которые были трансфецированы различными СЕАСАМ-рецепторами (человеческая СЕАСАМ1, человеческая СЕАСАМ3, человеческая СЕАСАМ5, человеческая СЕАСАМ6, человеческая СЕАСАМ8, человеческая СЕАСАМ19 и СЕАСАМ6 яванских макак - смотрите Пример 1) по сравнению со связыванием клеток HeLa дикого типа, которые, как было показано, являются СЕАСАМ6 отрицательными. Значения EC50 определили для связывания с клетками HeLa, трансфецированными человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак. Результаты показаны в Таблице 22.
Для FACS экспериментов клетки HeLa дикого типа культивировали в RPMI-1640, 10% FCS, тогда как трансфецированные СЕАСАМ-рецептором HeLa клетки получили, кроме того, 0.5% гентамицина (сток 10 мг/мл, Fa. РАА) и 200 мкг/мл гигромицина В (сток 50 мг/мл, Invitrogen). Клетки промыли 3 раза с PBS без Ca2+/Mg2+ и отсоединили от культурального планшета неферментативно с помощью EDTA буфера диссоциации (Gibco). Клетки промыли в холодном FACS буфере (PBS без Ca2+/Mg2+ и инактивированный нагреванием 3% FCS), и подсчитали с применением подсчитывающего устройства (Invitrogen). 105 клеток на лунку нанесли на планшет и инкубировали с соответствующим первичным антителом (5 мкг/мл) в течение 1 ч при 4°С на встряхивателе для планшета. Затем клетки промыли (400 g, 5') с FACS буфером 2 раза, ресуспендировали в 100 мкл, содержащих вторичное антитело (РЕ-анти-мышиный или анти-человеческий IgG, 1:150 разбавление, Dianova #115-115-164, #109-115-098) и инкубировали в течение еще одного часа при 4°С на встряхивателе для планшета. После 2 промывок клетки ресуспендировали в 100 мкл FACS буфера и проанализировали на устройстве FACS Canto II (Beckton Dickinson) или FACS Array (Beckton Dickinson).
Для анализа EC50 первичные антитела применяли при увеличении концентраций в диапазоне от 0,1 нМ до 100 нМ. Значения половины максимального связывания (ЕС50) определялась путем нанесения среднего сигнала интенсивности флуоресценции по отношению к концентрации (логарифмическая шкала). Построение кривой по данным осуществляли с использованием программного обеспечения для анализа призмы Graph Pad.
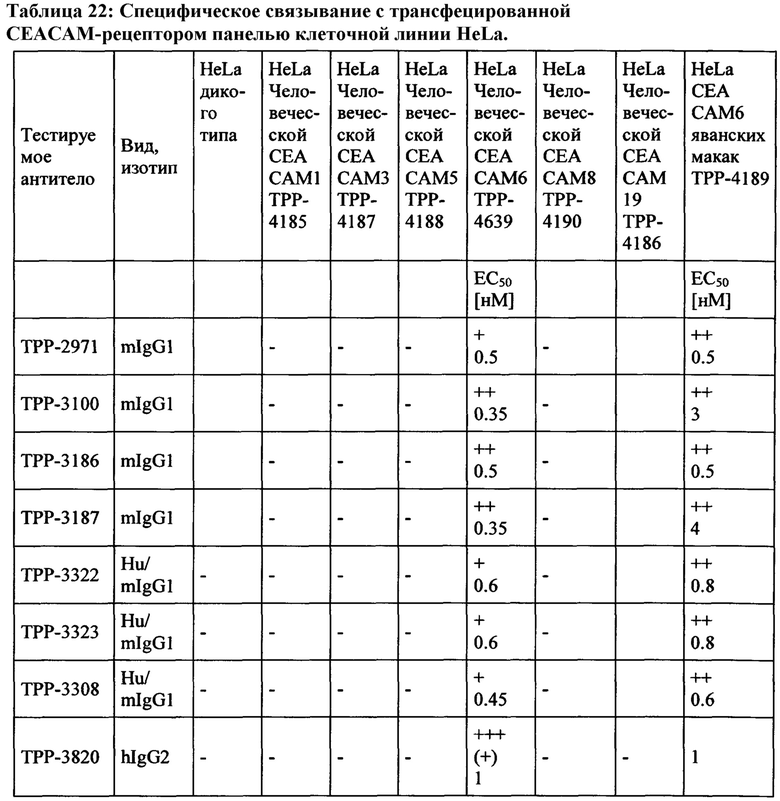
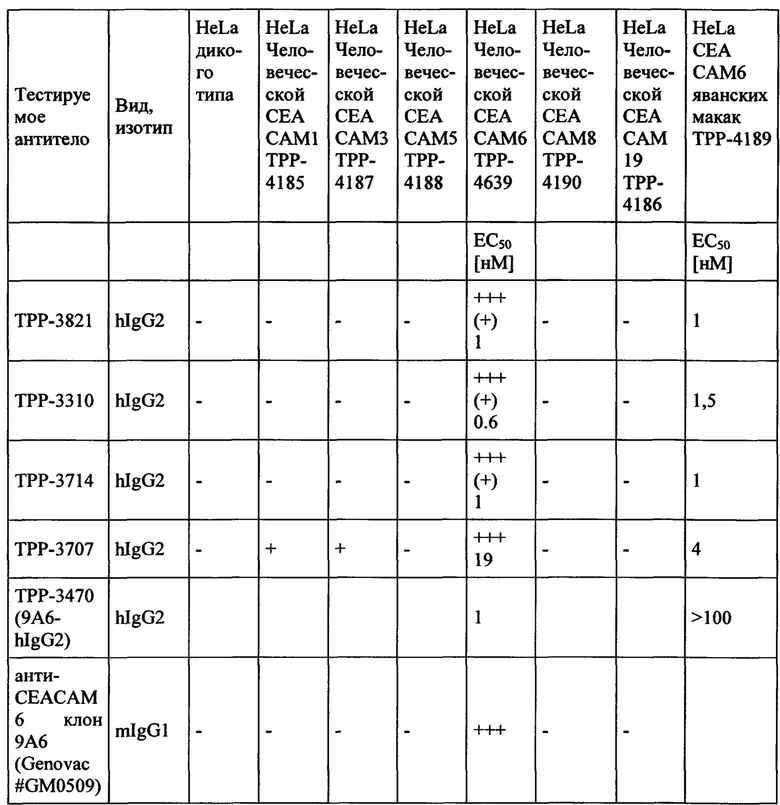
Определения -, +, ++, +++ как определено из сдвига среднего log флуоресценции FACS: - = нет сдвига; + = сдвиг log, по сравнению с контрольным антителом, среднее 10-100; ++ = 2 log сдвиг, среднее 100-1,000; +++ = 3 log сдвиг, среднее 1,000-10,000
Анти-СЕАСАМ6 антитела также были протестированы на их связывание с различными линиями раковых клеток, которые эндогенно экспрессируют СЕАСАМ6 по FACS анализу. Клеточные линии культивировали согласно протоколам, предоставленным американской коллекцией тканевых культур (АТСС). Наблюдаемый сигнал связывания был специфическим, так как несвязывающийся изотипический контроль не приводил к сдвигу сигнала флуоресценции. Значения половины максимального связывания (ЕС50) находятся в низком наномолярном диапазоне (Таблица 23).
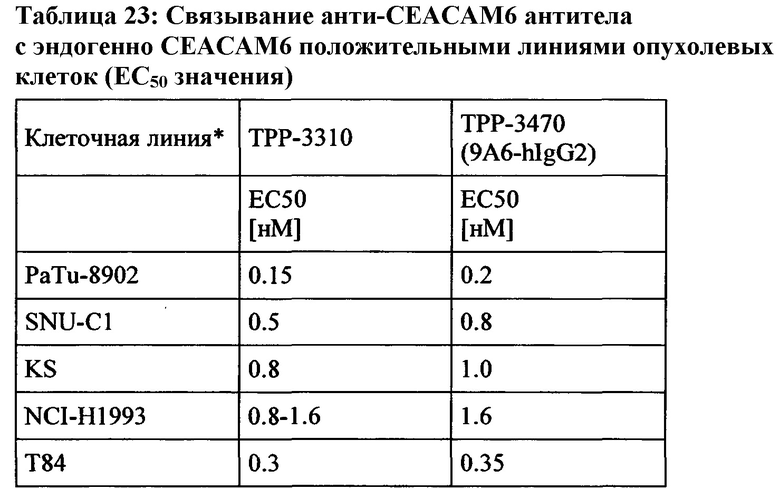
*Все клеточные линии из общественного банка тканей, такого как американская коллекция тканевых культур и т.д., за исключением клеточной линии рака молочной железы K.S, любезно предоставленной доктором Brigitte  (University of
(University of  ).
).
В заключение, для мышиных ТРР-2971, ТРР-3100, ТРР-3186 и ТРР-3187 антител, а также человеческих ТРР-3820, ТРР-3821, ТРР-3310, ТРР-3714 и ТРР-3707 антител, селективное связывание с человеческой аутентичной СЕАСАМ6 клеточной поверхностью было продемонстрировано (нет связывания с другими паралогами). Связывание этих антител с человеческой СЕАСАМ6 сопоставимо с 9А6 на клеточных линиях, экспрессирующих человеческую СЕАСАМ6. Для ТРР-3310 подобное связывание как 9A6-hIgG2 с эндогенно экспрессируемой СЕАСАМ6 на линиях опухолевых клеток человека было продемонстрировано.
Антитела согласно настоящему изобретению также связываются с СЕАСАМ6 яванских макак с сопоставимой силой как с человеческим рецептором в диапазоне ЕС50 связывания от однозначного числа до субнаномолярной аффинности, тогда как отсутствие связывание 9А6 с СЕАСАМ6 яванских макак на клеточной поверхности было обнаружено до 100 нМ. Это результат показывает действительную перекрестную реакционную способность с человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак для антитела согласно настоящему изобретению, тогда как 9А6 действительно преимущественной связывается с человеческой СЕАСАМ6.
Пример 9: Анализ термостабильности
Термостабильность IgG исследовали с использованием дифференциальной сканирующей калориметрии (DSC) с использованием системы VP-Capillary DSC (MicoCal Inc.) с объемом ячейки 0,137 мл. Все образцы разбавляли в DPBS рН 7,4 до конечной концентрации 0,5 мг/мл, и буферный контроль без белка использовали в качестве эталона. Образцы отсканировали от 20 до 120°С со скоростью сканирования 120°С/ч. Полученные термограммы были скорректированы путем вычитания контрольных сканирований буфера и нормализованы для концентрации белка с использованием программы анализа данных Origin 7.0 (OriginLab Corp.). Температуры плавления были получены путем подгонки данных DSC к нелинейной регрессии («Non-2-state: Cursor init»), представлена Origin.
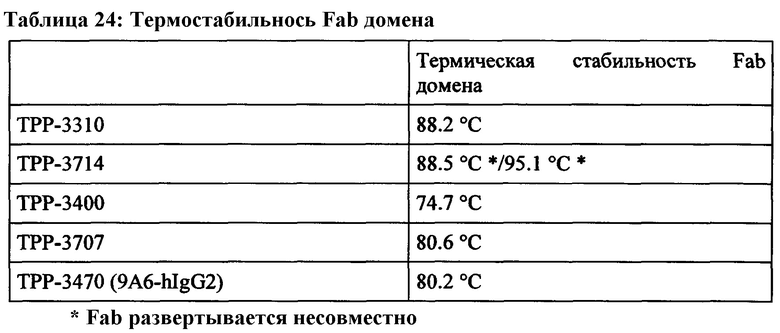
Все измеренные IgG демонстрируют высокую термостабильность в Fab-домене. Термостабильность ТРР-3310 и ТРР-3714 значительно выше и значительно превышают термостабильность ТРР-3470 (9A6-hIgG2). Это удивительно, поскольку высокая стабильность была связана с антителами, обладающими каркасом VH3 (Honegger et al., 2009, Protein Eng Des Sel. 22(3): 121-134).
Высокая термостабильность свидетельствует о лучшей фармацевтической пригодности ТРР-3310 и ТРР-3174 по сравнению с ТРР-3470 (9A6-hIgG2) (лучшая стабильность, меньшая склонность к агрегации, меньший риск иммуногенности).
Пример 10: Вмешательство в взаимодействие между СЕАСАМ6 и СЕАСАМ1
Было высказано предположение, что СЕАСАМ1 может быть связующим партнером для СЕАСАМ6 в транс на активированных Т-клетках (Witzens-Harig et al., Blood 2013 May 30; 121(22):4493-503)): транс и цис-гомофильные и гетерофильные взаимодействия между СЕАСАМ были описаны, например, между СЕАСАМ1 и СЕАСАМ5 или СЕАСАМ6 и СЕАСАМ8. СЕАСАМ1 отображается на активированных Т-клетках, лигирование и фосфорилирование СЕАСАМ1 рекрутируют SН2-домен-содержащий белок тирозинфосфатазу 1 (SHP1). SHP1 дефосфорилирует ZAP70, что приводит к ингибированию передачи сигналов TCR. Таким образом, дотирование СЕАСАМ1 приводит к раннему ингибированию активации Т-клеток в течение 10 минут после активации.
Более того, сообщалось о роли СЕАСАМ5 в ингибировании реакций природных клеток -киллеров (NK) на клетки колоректального рака (Zheng et al., PLoS One. 2011; 6(6):e21146), которые могут быть основаны на его гетерофильном связывании с ингибирующее СЕАСАМ1, экспрессируемой на NK-клетках.
Поэтому прямое взаимодействие СЕАСАМ6-СЕАСАМ1 тестировали с использованием рекомбинантных белков в связывании ELISA. После предварительных экспериментов было обнаружено умеренное, но специфическое взаимодействие между СЕАСАМ1 и СЕАСАМ6, был использован следующий протокол: черные 384-луночные планшеты Maxisorb (Nunc) были покрыты 1 мкг/мл СЕАСАМ1 (R&D Systems, TPP-1437) в буфере для покрытия (Candor) в течение 1 часа при 37°С или оставались непокрытыми в качестве контроля. После одной промывки PBS/0,05% Tween-20 лунки блокировали 100% Smart Block (Candor) в течение 1 часа при 37°С. В отдельных планшетах серии разведении антител, представляющих интерес, в PBS/0,05% Tween-20, 10% SmartBlock инкубировали с 2 мкг/мл СЕАСАМ6-Fc (ТРР-1790) в течение 1 часа при комнатной температуре. Блокированные планшеты промывали три раза и добавляли предварительно сформированные антитела-СЕАСАМ6-комплексы. Планшеты инкубировали в течение 1 часа при комнатной температуре. После трех промывок добавляли анти-человеческий IgG HRP (Sigma A1070) при 1: 10000, и планшеты инкубировали в течение 1 часа при комнатной температуре. После трех промывок планшеты проявляли с помощью Amplex Red (Life Technologies), и флуоресценция считывалась при длине волны излучения 590 нм.
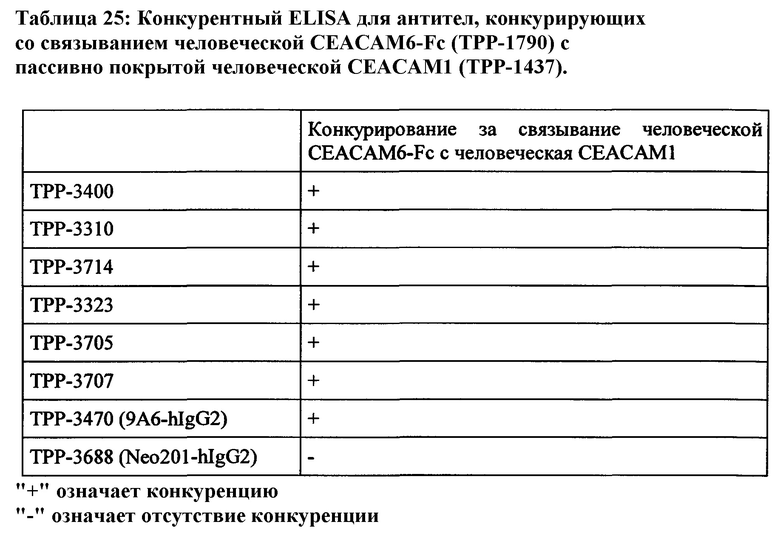
Как показано в Таблице 25, возможно конкурировать со взаимодействием СЕАСАМ6 с СЕАСАМ1 со всеми протестированными антителами, за исключением ТРР-3688 (Neo201-hIgG2).
В заключение это наблюдение согласуется с гипотезой: а) СЕАСАМ1 на активированных Т-клетках является возможным партнером по взаимодействию для СЕАСАМ6, приводя к ингибированию Т-клеток; b) N-терминальный домен D1 СЕАСАМ6 участвует в взаимодействии между СЕАСАМ1 и СЕАСАМ6, и с) антитела, согласно настоящему изобретению, способны вмешиваться в взаимодействие СЕАСАМ6-СЕАСАМ1.
Пример 11: Ингибирование иммуноподавляющей активности СЕАСАМ6 in vitro
Иммуноподавляющая функция СЕАСАМ6 на опухолевых клетках изучалась недавно in vitro (Witzens-Harig et al.. Blood 2013 May 30; 121(22):4493-503) и in vivo (Khandelwal et al., Poster Abstract 61, Meeting Abstract from 22nd Annual International Cancer Immunotherapy Symposium October 6-8, 2014, New York City, USA). Было показано, что коммерчески доступное антитело 9А6 (Genovac/Aldevron) способно ингибировать иммуноподавляющую активность СЕАСАМ6, что приводит к усиленной секреции цитокинов Т-клетками in vitro и противоопухолевой эффективности in vivo.
Для изучения влияния антитела согласно настоящему изобретению на иммуноподавляющую активность СЕАСАМ6 были проведены эксперименты на основе сокультуры модельной линии опухолевых клеток с модельным клоном опухолевый антиген-специфическиие Т-клетки:
Т-клетки, специфичные для опухолевых антигенов, были получены с помощью методики, описанной в Brackertz et al (Brackertz et al., Blood Cancer J. 2011 Mar; 1(3):e11). Вкратце, сурвивин-специфические CD8+ Т-клетки выделяли из периферических мононуклеарных клеток с помощью специфичной для CD8 магнитно-активированной клеточной сортировки. Отобранные HLA-A2-CD8+ Т-клетки повторно стимулировали аллогенными HLA-A2+ дендритными клетками, нагруженными 10 мкг HLA-ограниченного пептидного эпитопа Сурвивин95-104 (ELTLGEFLKL). После стимуляции пролиферирующие Т-клетки окрашивали мультимерами НLА-А2/Сурвивин95-104 (А * 02: 01 391 LMLGEFLKL Сурвивин 96-104 с маркировкой АРС, Prolmmune Limited, # F391-4A-E), отсортировали по FACS и клонировали при ограничении разбавления на 96-луночных планшетах.
Размножение клонов Т-клеток осуществляли путем культивирования клонов 2×105 Т-клеток и питающих клеток, состоящих из 5×107 облученных РВМС (30 Гр) и 1×107 облученных LCL (эти линии лимфобластоида В, которые были получены путем трансдукции EBV В-клеток периферической крови от здоровых доноров с EBV-инфицированной клеточной линией обезьян (В95/8, АТТС), как описано в Brackertz et al., Blood Cancer J. 2011 Mar; 1(3):e11 и Dissertation Andreas Moosmann, Ludwig-Maximilians-University Munich, Germany, 2002) от разных доноров (100-150 Гр) в 40 мл среды RPMI-1640 с глутамином (Sigma-Aldrich), 10% сывороткой человека (сыворотка человека АВ, Valley Biomedical, Inc, # HP1022), 1% пенициллина/стрептомицина (Life Technologies) при 37°С и 5% СО2. Размножение произошло в присутствии 50 Ед/мл IL-2 (Proleukin, Novartis, №1003780), 2,5 нг/мл IL-15 (rhIL-15-CF R&D # 247_IL-025/CF) и 30 нг/мл античеловеческого CD3 антитела (ОKТ3 eBiosciences 16-0037-85) в течение 14 дней. Клеточную линию рака молочной железы человека KS (полученная от доктора Бригитте Гюкель (Университет Тюбингена, Германия)) культивировали в DMEM (Sigma-Aldrich) с 10% FCS (FBS Superior, Biochrom) и 1% пенициллина/стрептомицина при 37°С и 5% СО2.
Для анализа модулирующей активности анти-СЕАСАМ6 антитела на иммуноподавляющую функцию СЕАСАМ6 in vitro клон специфических для пептида сурвивина CD8+ Т-клеток был совместно культивирован вместе с СЕАСАМ6+, HLA-A2+ и сурвивин+ клеточной линией рака молочной железы KS, и секрецию IFN-гамма как показатель активности Т-клеток измеряли либо посредством IFN-гамма ELISpot, либо IFN-гамма ELISA.
Для совместной культуры опухолевые клетки KS отделяли неферментативно с использованием PBS-EDTA в течение 5 мин, центрифугировали, промывали и подсчитывали. Концентрацию клеток доводили до 1×105 клеток/мл в X-Vivo-20 (Lonza), и клетки предварительно обрабатывали анти-СЕАСАМ6 антителом или изотипически сходным контролем антител в течение 10 мин на льду. После стадии инкубации 100000 клеток-мишеней KS высевали непосредственно трижды на пластины IFN-гамма-ELISpot или U-96-Well ELISA соответственно. В то же время, специфичные для пептида сурвивина Т клетки собирали, промывали с X-Vivo-20 и высевали по номерам клеток, указанным на клетках-мишенях KS. Со-культуру опухолевых клеток, анти-CERAMA6 антитела и Т-клеток инкубировали в течение 20-40 ч при 37°С. IFN-гамма ELISpot (MABTECH: ELISpot Assay для человеческого интерферона гамма # 3420-3РТ, антитела mAB 1-D1K анти-IFNg, mAB 7-В6-1-биотин, Steptavivin-ALP, BCIP/NBT плюс субстрат для ELISpot # 3650-10) и IFN-гамма-ELISA (BD человеческий ИФН-гамма ELISA №555142) были разработаны в соответствии с инструкциями производителя. Планшеты ELISpot подсчитывали с помощью C.T.L. Планшетный ридер ELISpot и оптическую плотность для планшета ELISA измеряли с помощью планшетного ридера Тесал Infinite M200. Эксперимент считался действительным, если положительный контроль ТРР-3470 (9A6-hIgG2) был статистически значимым по сравнению с контролем изотипически сходного антитела.
Совместная культура опухолевых клеток KS со специфическими для пептида сурвивина CD8+ Т-клетками в присутствии анти-СЕАСАМ6-антитела приводила к статистически значимому увеличению продуцирования IFN-гамма Т-клетками (фиг. 5) по сравнению с образцами, не обработанными анти-СЕАСАМ6 антителом или обработанными изотипически сходным контролем антитела.
В заключение было показано, что перекрестно-реакционноспособные антитела яванских макак ТРР-3310, ТРР-3707 и ТРР-3323 способны облегчить СЕАСАМ6-опосредованное иммуноподавление специфичных к опухолевому антигену Т клеток в той же степени, что и ТРР-3470 (9A6-hIgG2), как измерено либо секрецией IFN-гамма специфичными для пептида сурвивина CD8+ Т-клетками, либо количеством IFN-гамма, секретируемого активированными Т-клетками.
Пример 12: Анализ профиля цитокинов/хемокинов, секретируемых Т-клетками, обработанными анти-СЕАСАМ6-антителом
Чтобы изучить влияние анти-СЕАСАМ6 антитела на профиль цитокинов/хемокинов Т-клеток человека в отношении улучшенной цитотоксичности и эффективного противоопухолевого иммунного ответа, анализ мультиплексных цитокинов на основе люминекса на основе экспериментов по совместному культивированию модельной линии опухолевых клеток и модели клона специфичных к опухолевому антигену Т-клеток осуществили.
Клон специфичных для пептида сурвивина CD8+ Т клеток получили и размножили in vitro, как описано в Примере 11. Культуру опухолевых клеток и ELISA сокультивировали, как описано в Примере 11.
Через 20 ч планшеты с сокультурами центрифугировали в течение 10 мин при 1400 об/мин и собирали супернатант. Мультиплексный анализ проводили с использованием MILLIPLEX Human Cytokine/Chemokine Magnetic Bead Panel - Premixed 38 Plex analytes (Merck Millipore #HCYTMAG-60K-PX38) в системе BioPlex100 (Bio-Rad) в соответствии с инструкциями производителя. Стандартные кривые и концентрации были рассчитаны с помощью Bio-Plex Manager 6.0. Эксперимент считался действительным, если положительный контроль ТРР-3470 (9A6-hIgG2) был >1,5 раза увеличен по сравнению с контролем изотипически сходного антитела.
Блокада СЕАСАМ6 антителами, согласно настоящему изобретению, в со-культуре специфичных для пептида сурвивина Т клеток с опухолевыми клетками KS дает >1,5-кратное увеличение секреции IFN-гамма, IL-2 и TNF-альфа по сравнению с контрольными образцами, которые были обработаны изотипически сходным контролем (Фиг. 6).
В заключение, перекрестие реакционноспособные антитела ТРР-3310 и ТРР-3707 яванских макак способны изменять цитокиновый профиль специфичных для пептида сурвивина CD8+ Т-клеток на более цитотоксический и активированный фенотип, характеризующийся повышенной секрецией IFN-гамма, IL-2 и TNF-альфа, как измерено мультиплексным анализом на основе Luminex, в той же степени, что и ТРР-3470 (9A6-hIgG2).
Пример 13: Противоопухолевая эффективность в адоптивной KS модели переноса Т клеток
Противоопухолевая эффективность анти-СЕАСАМ6 антитела (9А6, Genovac/Aldevron) изучалась in vivo в адоптивных системах переноса Т-клеток человека, в которых опухолевый антиген-специфические человеческие Т-клетки размножаются in vitro и совместно вводятся с анти-СЕАСАМ6 антителом голым мышам, несущим ксенотрансплантированные опухоли человека (Khandelwal et al., Poster Abstract 61, Meeting Abstract from 22nd Annual International Cancer Immunotherapy Symposium October 6-8, 2014, New York City, USA).
Чтобы изучить влияние антител согласно настоящему изобретению на противоопухолевую эффективность, провели следующий эксперимент на основе адоптивной модели переноса Т клеток:
Клон специфичных для пептида сурвивина CD8+ Т клеток получили и размножили in vitro, как описано в Примере 11.
Шести-восьминедельным самкам мышей NOD-Scid (NOD.CB17-Prkdcscid/J; Charles River, France) вводили подкожно 2×106 KS опухолевых клеток (см. Пример 11). Рандомизацию мышей проводили на 16-й день, и мыши с поверхностью опухоли ниже 40 мм2 исключались (= опухоль не принималась). Мышей (n=8-10 мышей на группу) обрабатывали на 23 и 27 день с помощью внутривенного адоптивного переноса 5×106 клонов специфичных для пептида сурвивина Т-клеток. 200 мкг анти-СЕАСАМ6 антитела ТРР-3740, ТРР-3707, ТРР-3310 или соответствующего изотипически сходного контрольного антитела вводили интраперитонеально в дни 22, 24, 26 и 28. Контрольной группе вводили PBS вместо Т-клеток и антител. Подкожно выращенные опухоли измеряли с помощью суппорта и затем вычисляли поверхность, используя формулу «длина × ширина». Только те эксперименты считались действительными, когда контрольная группа мышей, обработанная средой, демонстрировала устойчивое и значительное увеличение площади опухоли и объема опухоли на протяжении всей продолжительности исследования. Исход эксперимента может зависеть от параметров, которые трудно контролировать: не только in vivo рост клеточных линий KS оказался переменным, но и выживаемость Т-клеток у мышей, а также инфильтрация Т-клеток в опухоли проявляли значительные вариации.
Адоптивный перенос специфичных для пептида сурвивина Т клеток в комбинации с тестируемым анти-СЕАСАМ6 антителом приводил к уменьшенной опухолевой нагрузке по сравнению с Т-клетками, инъецированными с подходящим по изотипу контролем, или контрольной группой PBS (Фиг. 7). Аналогичную эффективность наблюдали с использованием ТРР-3740 (9А6-hIgG2).
В заключение, перекрестно реакционно-способные антитела яванских макак ТРР-3310 и ТРР-3707 проявили противоопухолевую эффективность в той же степени, что и ТРР-3470 (9A6-hIgG2) в адоптивной модели переноса Т-клеток с использованием специфических для пептида сурвивина CD8+ Т клеток и KS опухолей.
Пример 14: Линии опухолевых клеток и опухолевые ткани, которые являются СЕАСАМ6 положительными
СЕАСАМ6 экспрессируется в различных раковых опухолях, которые являются потенциальными целевыми показаниями для лечения иммуномодулирующими антителами СЕАСАМ6. Поэтому раковые клеточные линии различного происхождения и которые представляют разные виды рака, были протестированы на экспрессию СЕАСАМ6 путем анализа FACS. Результаты показаны в таблице 26.
Линии клеток рака, которые были приобретены в общественных банках тканей, таких как американская коллекция культур тканей (АТСС) и т.д., были культивированы в соответствии с инструкциями поставщика.
Клетки промыли 3 раза с PBS без Ca2+/Mg2+ и отделяли от культурального планшета неферментативно с буфером для диссоциации EDTA (Gibco). Клетки промыли в холодном буфере FACS (PBS без Ca2+/Mg2+ и инактивированный нагреванием 3% FCS) и подсчитывали с использованием счетчика клеток (Invitrogen). 105 клеток на лунку высевали и инкубировали с мышиным моноклональным антителом 9А6 (ТРР-1744, 5 мкг/мл) или очищенным NA/LE мышиным IgG1 в качестве антитела изотипического контроля (BD Pharmingen # 553447) в течение 1 часа при 4°С на встряхивателе для планшетов. Затем клетки промыли (400 g, 5') с FACS буфером 2 раза, ресуспендировали в 100 мкл, содержащих РЕ-меченное анти-мышиное вторичное антитело (1:150 разбавление, Dianova #115-115-164), и инкубировали в течение еще 1 часа при 4°С на встряхивателе для планшетов. После 2 промывок клетки ресуспендировали в 100 мкл FACS буфера и проанализировали на устройстве FACS Canto II (Beckton Dickinson) или FACS Array (Beckton Dickinson). Наблюдаемый сигнал связывания был специфичен, поскольку несвязывающийся изотипический контроль не приводил к сдвигу сигнала флуоресценции (Таблица 26).
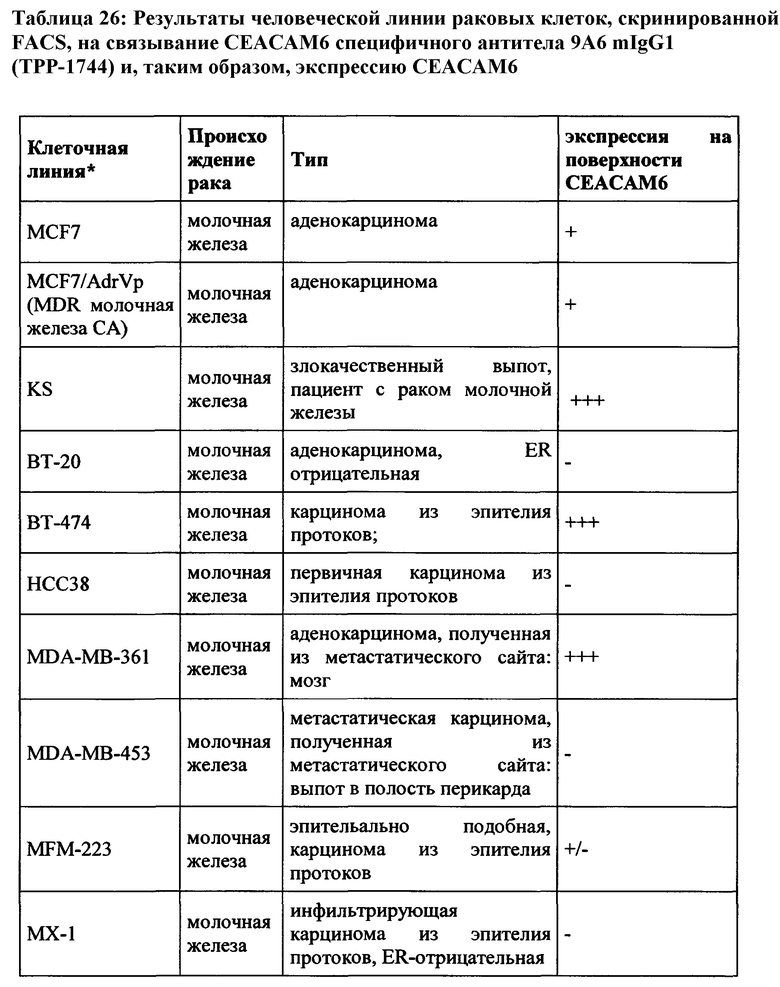
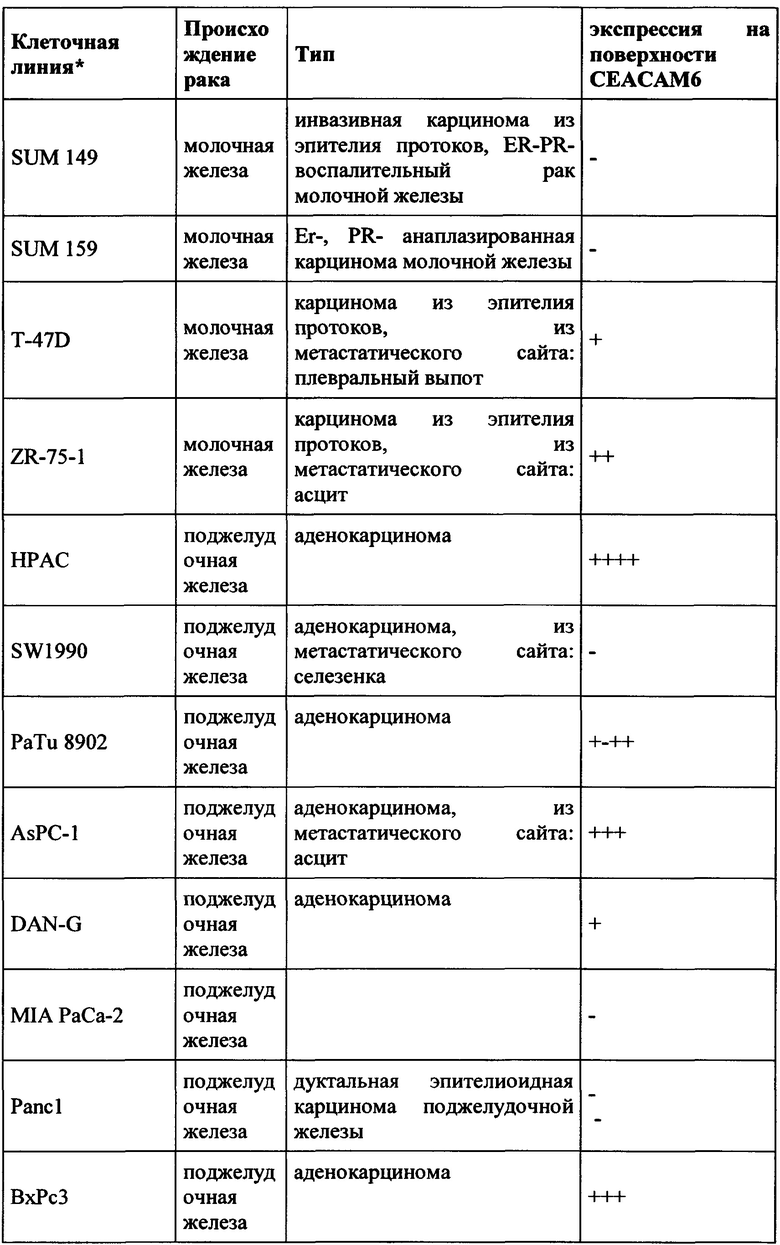
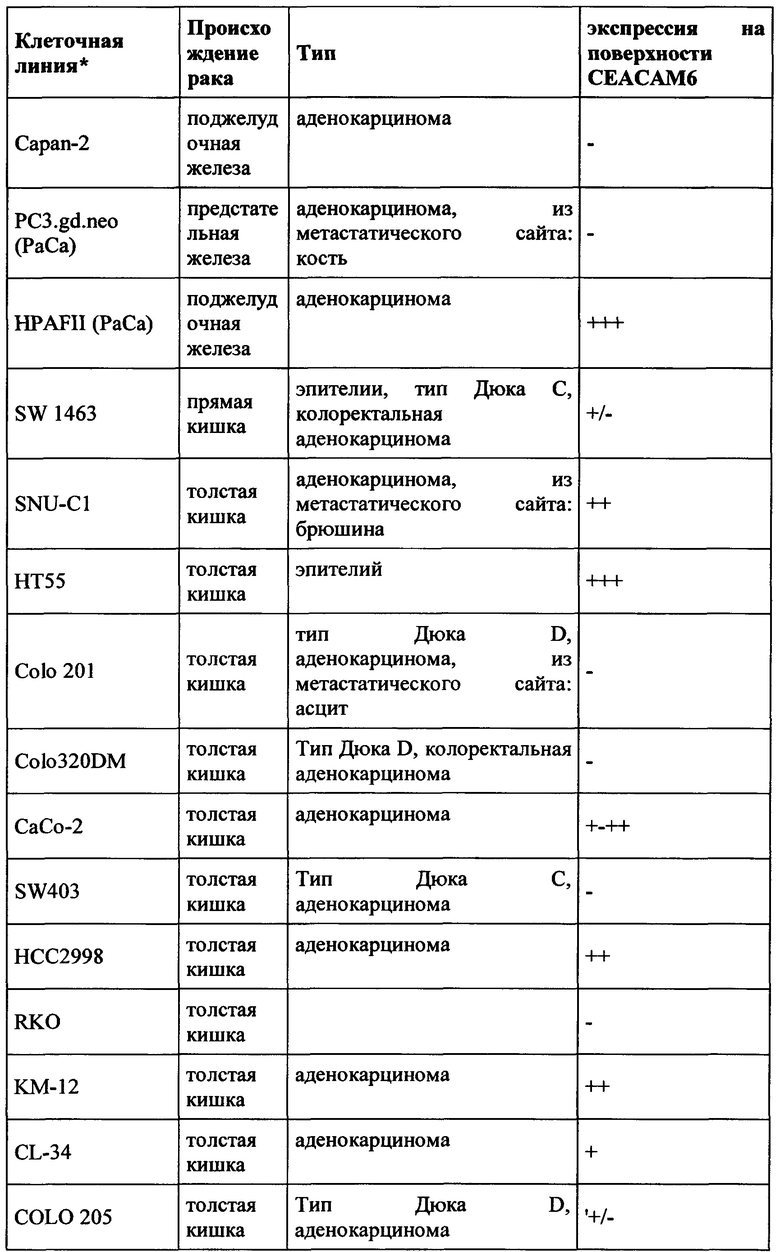
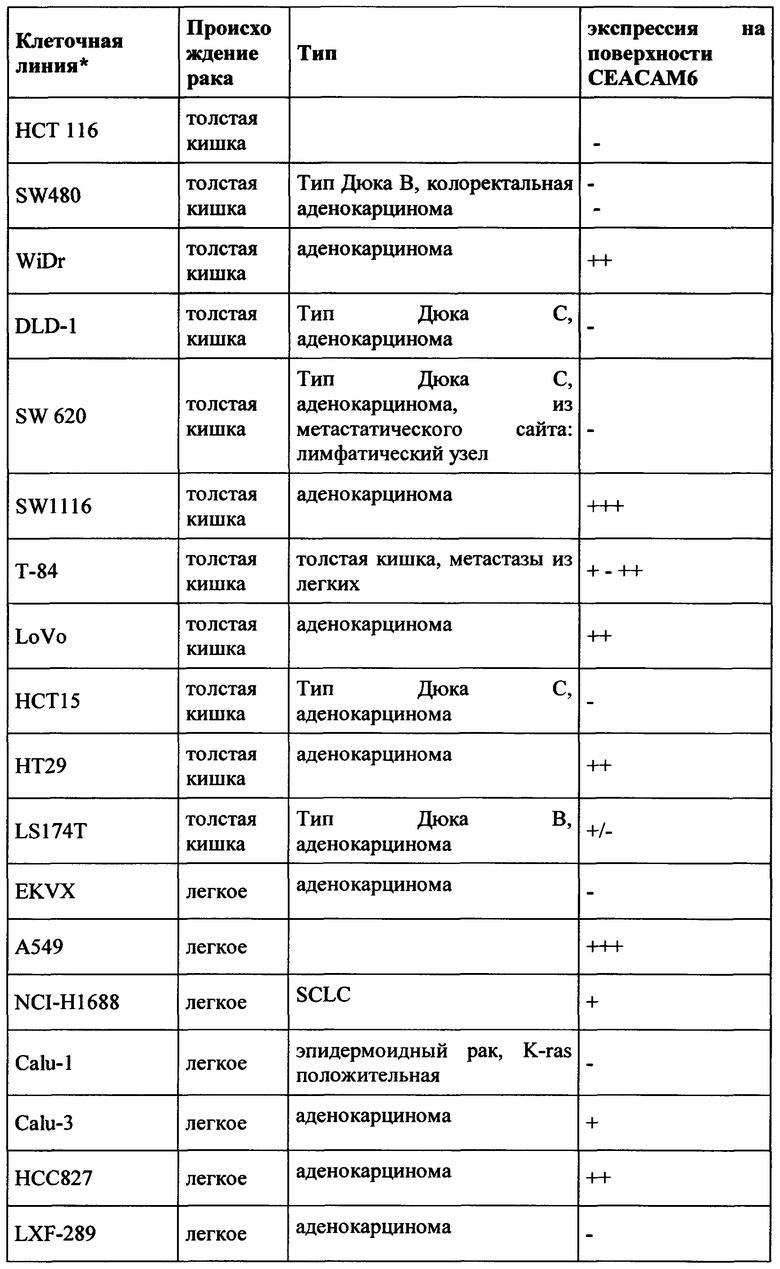
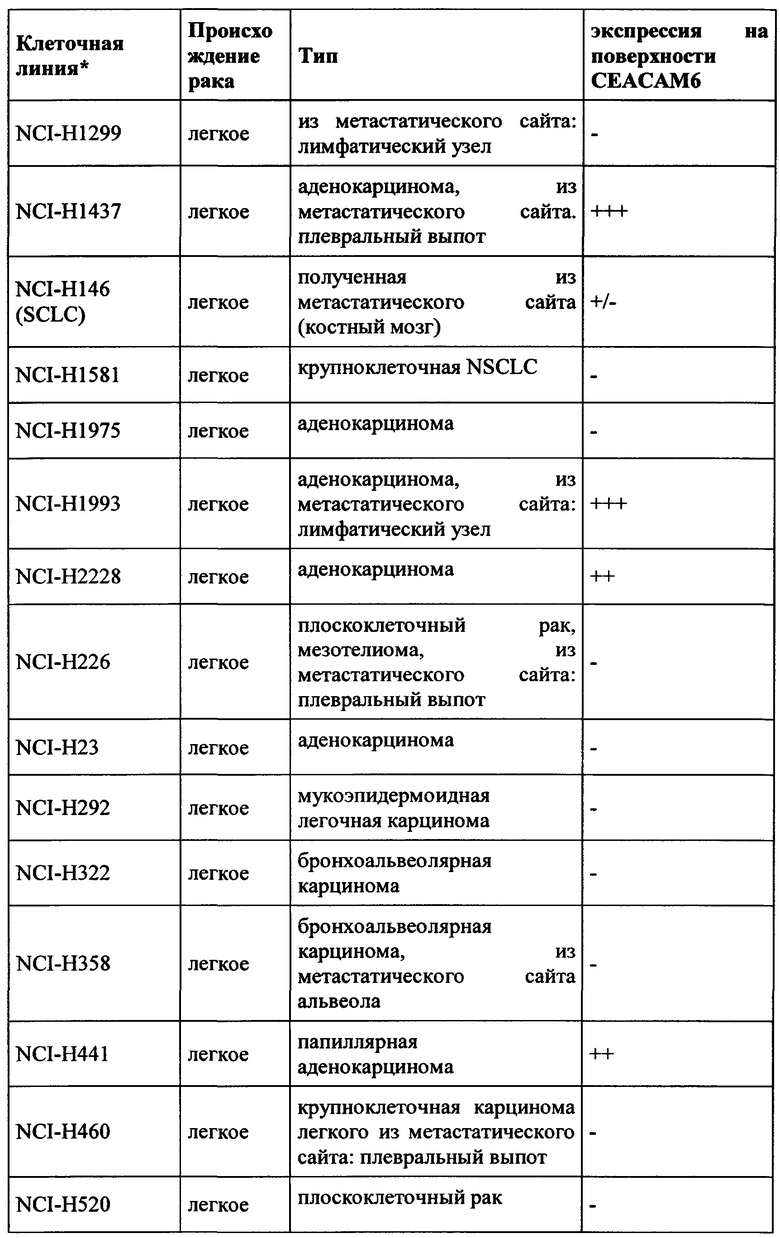
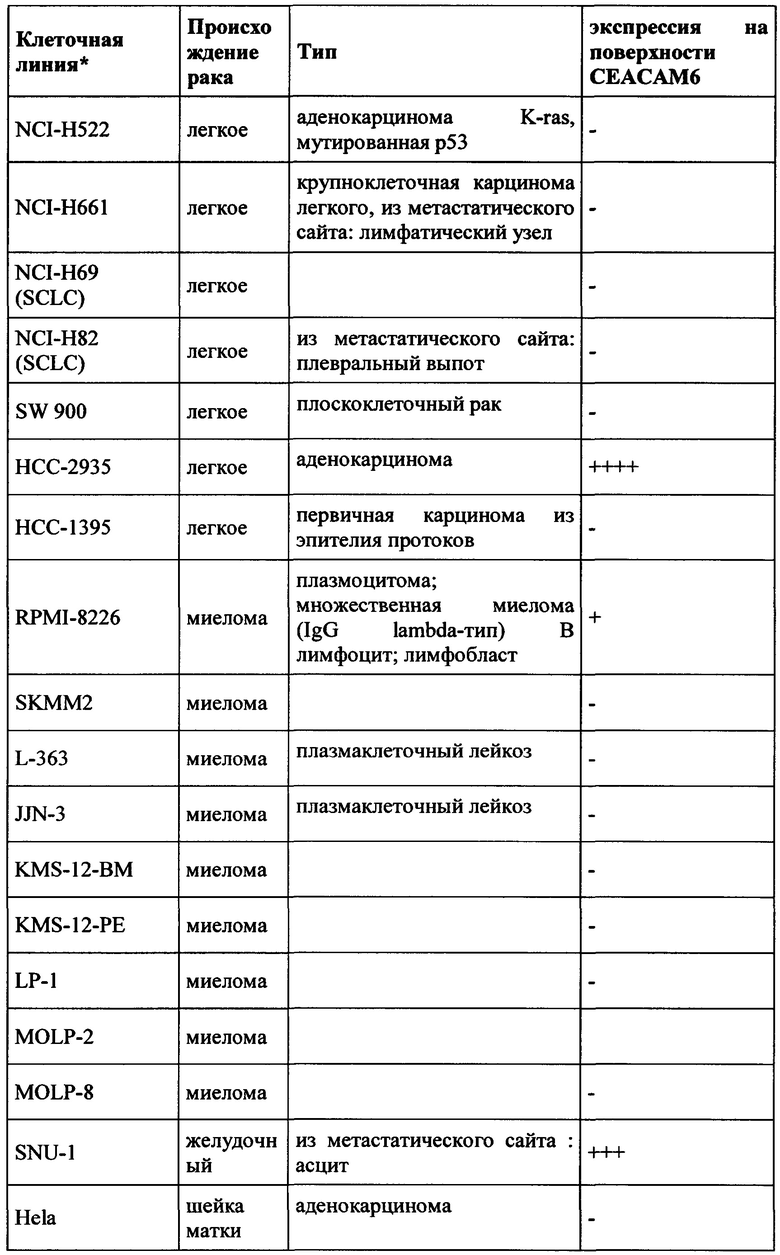
Определения -, +, ++, +++ как определено из сдвига среднего log флуоресценции FACS: - = нет сдвига; + = сдвиг log, по сравнению с контрольным антителом, среднее 10-100; ++ = 2 log сдвиг, среднее 100-1,000; +++ = 3 log сдвиг, среднее 1,000-10,000; ++++ = 4 log сдвиг; среднее >10000
* Все клеточные линии из общественного банка тканей, такого как американская коллекция тканевых культур и т.д., за исключением линии клеточной линии рака молочной железы KS, любезно предоставленной Dr.  (
( ); B. Gueckel, Cancer Cell International 2004, 4 (Suppl 1):S38).
); B. Gueckel, Cancer Cell International 2004, 4 (Suppl 1):S38).
В заключение, СЕАСАМ6 экспрессируется в клеточных линиях, которые представляют различные виды рака (например, колоректальный рак, немелкоклеточный рак легкого (NSCLC), мелкоклеточный рак легкого (SCLC), рак поджелудочной железы, рак желудка, рак молочной железы и множественная миелома), которые представляют собой потенциальные целевые показатели для лечения иммуномодулирующими антителами СЕАСАМ6 и другими модификаторами ответа (например, пептиды, малые молекулы, искусственные "скаффолд" связующие и т.д.).
Пример 15: Связывание с одиночным доменом 1 человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак
Чтобы проверить, могут ли антитела согласно настоящему изобретению связываться с выделенным одиночным доменом 1 человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, проводились SPR эксперименты, как в примере 1.
Одиночный N-терминальный домен 1 СЕАСАМ6 яванских макак (ТРР-2453) получили, как описано в Примере 1, аналогично ТРР-1794:

SEQ-ID N0:180 (ТРР-2453)

Аффинности (моновалентная KD) антител согласно настоящему изобретению к рекомбинантному одиночному домену 1 человеческой СЕАСАМ6 и СЕАСАМ6 яванских макак, определяли посредством SPR аналогично экспериментальным методикам, описанным в примере 1, и показаны в Таблице 27.

"-": связывание не обнаружено
В заключении, антитела согласно настоящему изобретению связываются с N-терминальным доменом СЕАСАМ6 как человека, так и яванских макак со сравнимыми аффинностями.
Пример 16: рентгеновская кристаллическая структура одиночного N-терминального домена 1 человеческой СЕАСАМ6 в комплексе с Fab фрагментом АРР-1574
Кристаллическая структура одиночного N-терминального домена 1 человеческой СЕАСАМ6 (ТРР-1794; SEQ ID NO 169), связанного с Fab фрагментом, относящимся к ТРР-3310 (называемый АРР-1574), была определена.
Чтобы облегчить получение Fab фрагмента ТРР-3310 получили в качестве варианта человеческого IgG1 (назвали ТРР-5468, смотрите Таблицу 28). Папаиновое расщепление ТРР-5468 и последующая очистка приводят к АРР-1574. Этот Fab фрагмент содержит вариабельные домены (VH и VL) ТРР-3310 (смотрите Таблицу 28).

Как подробно описано в Примере 1, домен 1 СЕАСАМ6 был экспрессирован и подвергся рефолдингу из Е. coli. Fab-фрагмент антитела был получен путем расщепления антитела папаином, с последующим образованием комплекса. Кристаллография белка затем применялась для получения атомного разрешения для одиночного N-терминального домена 1 человеческой СЕАСАМ6, связанного с АРР-1574 Fab, для определения эпитопа.
Получение белка
Одиночный N-терминальный домен 1 человеческой СЕАСАМ6 (ТРР-1794; SEQ-ID 169) был получен в виде конструкции 6х His слитого белка, как описано в Примере 1. Белок концентрировали до 6.7 мг/мл до образования комплекса.
Соответствующий Fab-фрагмент ТРР-5468 (человеческий IgG1) был получен посредством расщепления протеазой папаин. 1 мг антитела смешали с 50 мкл иммобилизованного папаина (ThermoFisher #20341) буферном растворе для гидролиза (20 мМ Na-фосфат рН 7.0, 10 мМ EDTA, 20 мМ цистеин-HCl) и инкубировали в течение 4 ч при 37°С при непрерывном перемешивании. Иммобилизованный папаин удалили центрифугированием, и полученный Fc-фрагменты и нерасщепленные IgG удалили пропусканием над MabSelectSURE (GE Healthcare, #11-0034-89 AC). Fab-фрагмент в проходящем потоке далее очистили посредством эксклюзионной хроматографии по размеру в 30 мМ Tris буфера рН 8.5, 150 мМ NaCl на Superdex 75 и концентрировали до 7.2 мг/мл.
Для образования комплекса, очищенный Fab-фрагмент и N-терминальный домен 1 человеческой СЕАСАМ6 смешали при соотношении 1 Fab к 1.4 N-терминального домена 1 человеческой СЕАСАМ6 для 1 N-терминального домена 1 человеческой СЕАСАМ6 в течение 1 ч при 4°С. Полученный белковый комплекс выделили посредством эксклюзионной хроматографии по размеру в 30 мМ Tris буфера рН 8.5, 150 мМ NaCl на Superdex 75 и затем концентрировали до 21.2 мг/мл до кристаллизации.
Кристаллизация и определение структуры
Комплекс одиночного N-терминального домена 1 человеческой СЕАСАМ6 и Fab фрагмента АРР-1574 концентрировали до 21.2 мг/мл, центрифугировали при 20,000 g в течение 10 минут и скринировали для кристаллизации. Кристаллы для сбора данных выращивали посредством диффузии паров висячей капли при 20°С. Подробно, 0.2 мкл комплекса смешали с 0.2 мкл резервуарного раствора, содержащего 100 мМ три натрия цитрата рН 4.9, 19% (мас./об.) PEG 4000 и 10% (об./об.) изопропанола. Каплю затем уравновесили относительно 80 мкл того же резервуарного раствора. Перед сбором данных кристаллы охладили жидким азотом.
Данные дифракции были собраны на пучке 14-1 в источнике BESSY II Synchrotron Source (Helmholtz Zentrum Berlin) и обработаны с использованием XDS (Kabsch, W. XDS. Acta Cryst. D66, 125-132 (2010). Данные комплекса N-терминальный домен 1 человеческой СЕАСАМ6 -Fab-фрагмент АРР-1574 обрабатывали до 2,7 Å в пространственной группе Р1 с размерами ячеек а=64.7 Å, b=65.2 Å, с=78.6 Å, альфа =66.1°, бета =87.2° и гамма =88.5°. Структура комплекса была разрешена путем молекулярного замещения с использованием PHASER (McCoy AJ et al, J Appl Cryst (2007). 40, 658-674) с собственными структурами N-терминального домена 1 человеческой СЕАСАМ6 и Fab в качестве моделей для поиска. Окончательная модель была построена в COOT (Emsley, P. et al, Acta Cryst D66, 486-501 (2010)) и улучшена с применением ССР4 (Winn, М. D. et al. Acta. Cryst. D67, 235-242 (2011)).
Эпитоп определяли в виде остатков одиночного N-терминального домена 1 человеческой СЕАСАМ6, которые содержат атомы в пределах 5 Å до любого атома в Fab-фрагменте АРР-1574, как идентифицировано NCONT в программном обеспечении ССР4 ((Winn, М. D. et al. Acta. Cryst. D67, 235-242 (2011)) и перечислено в Таблице 29). В асимметричной единице (наименьшей уникальной единице в кристалле) имеется два экземпляра комплекса N-терминальный домен 1 человеческой СЕАСАМ6 - Fab-фрагмент АРР-1574. Только остатки, контактирующие с антителом, которые являются общими для обоих копий перечислены в качестве остатков эпитопа.
Эпитоп
Кристаллическая структура комплекса одиночный N-терминальной домен 1 человеческой СЕАСАМ6 - Fab фрагмент АРР-1574 была использована для идентификации эпитопа Fab-фрагмента АРР-1574 на СЕАСАМ6. Поверхность взаимодействия на одиночно N-терминальном домене 1 человеческой СЕАСАМ6 Fab-фрагментом АРР-1574 образована несколькими непрерывными и прерывистыми (то есть несмежными) последовательностями; а именно остатки Pro59, Gln60, Asn61, Arg62, Ile63, Gly64, Val83, Ile84, Gly85, Thr86, Gln88, Thr90, Pro91, Ile125, Ser127, Asp128 и Leu129 (нумерация согласно SEQ-ID:179; TPP-4639), как подробно раскрыто в Таблице 29.
В очень близком прямом контакте находятся остатки, имеющие по меньшей мере один атом, который удален от антитела на 3,6 Å или менее. Этими остатками являются: Gln60, Asn61, Arg62, Ile63, Val83, Ile84, Gly85, Thr90, Ser127, Asp128 и Leu129 (нумерация согласно SEQ-ID:179; ТРР-4639).
Эти остатки образуют примерный трехмерный конформационный эпитоп, который распознается Fab-фрагментом АРР-1574 (Фиг. 9 и 10).
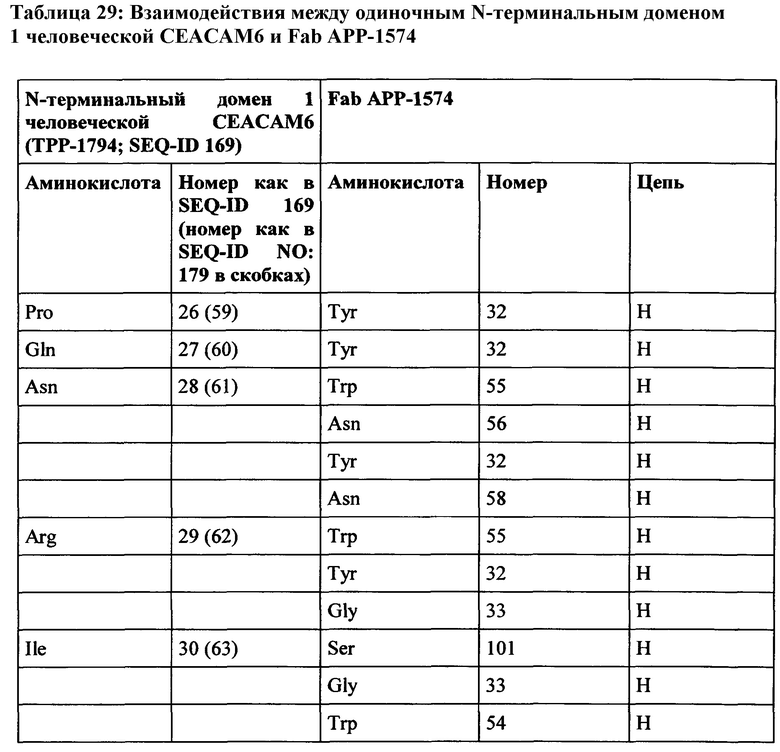
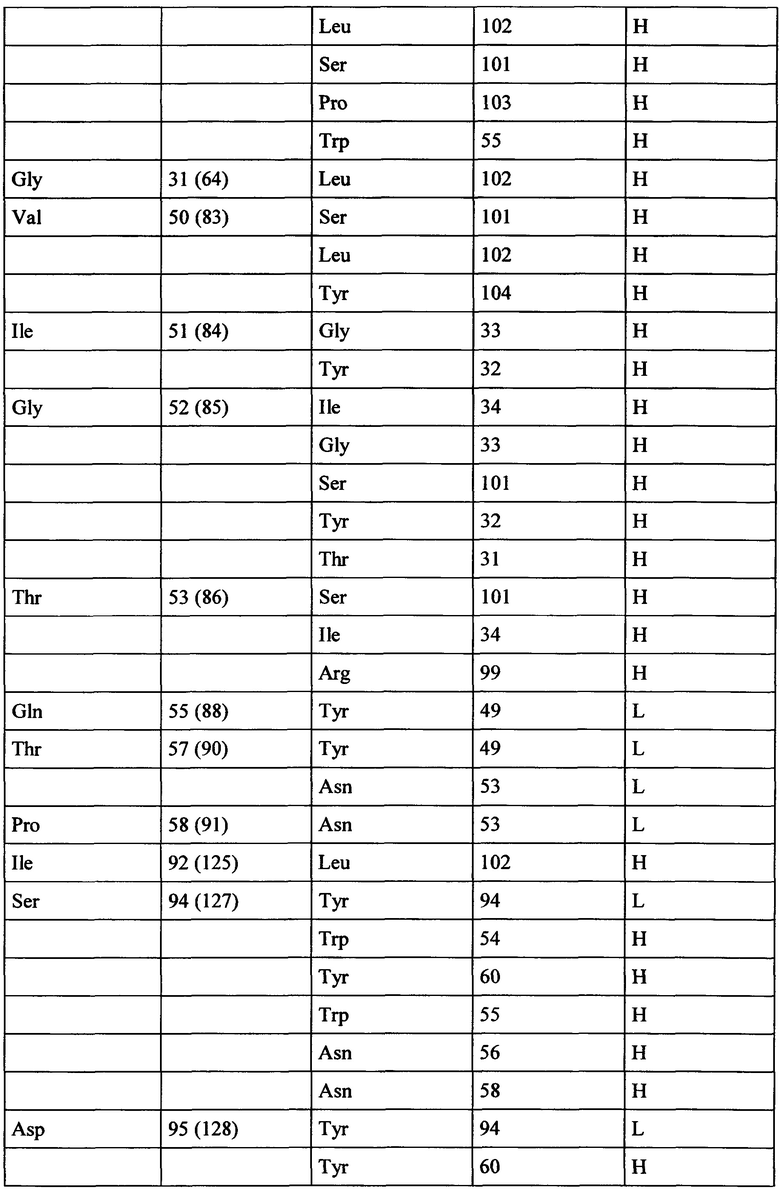
Остатки N-терминального домена 1 СЕАСАМ6 пронумерованы как в SEQ ID NO 169. Остатки антитела пронумерованы на основе их линейной аминокислотной последовательности (SEQ ID NO: 183 и SEQ ID NO: 184), и соответствующие цепи помечены ("Н" для тяжелой цепи, "L" для легкой цепи). Остатки одиночного N-терминального домена 1 СЕАСАМ6, как показано в настоящей заявке, имеют по меньшей мере один атом с 5 Å до любого атома в Fab фрагменте APP-1574, для учета потенциальных взаимодействий, опосредованных водой
При тщательном анализе эпитопа становится очевидным, что изолейцин-63 (согласно SEQ ID NO: 179) человеческой СЕАСАМ6 является центральной частью эпитопа. Боковая цепь изолейцин имеет хорошую форму, комплементарную с APP-1574. Моделирование показывает, что лейцин в этом положении в СЕАСАМ6 яванских макак может быть стерически размещен и не будет нарушать взаимодействие. Это объясняет сохраняющуюся активность связывания с СЕАСАМ6 яванских макак и является основой перекрестной реакционной способности для человека-яванских макак. Напротив, фенилаланин в этом положении (как в человеческой СЕАСАМ1, человеческой СЕАСАМ3 и человеческая СЕАСАМ5) не может быть стерически размещен и приводит к потере активности связывания. Это является основанием для селективности СЕАСАМ6.
Таким образом, распознавание изолейцина-63 (согласно SEQ ID NO: 179) представляет собой самый значительный «настройщик селективности» между целевыми СЕАСАМ. Режим распознавания АРР-1574 человеческой СЕАСАМ6 оптимально использует разницу ключевых остатков между целевыми и нецелевыми. Предыдущий анализ структуры Fab-фрагмента ТРР-1679 (профиль селективности которого недостаточен, смотрите Пример 4) в комплексе с N-терминальным доменом 1 также идентифицировал изолейцин-63 (согласно SEQ ID NO: 179) в качестве потенциального настройщика селективности (данные не показаны). Однако, поскольку механизм молекулярного распознавания по ТРР-1679 отличается, в связи с чем изолейцин-63 (по SEQ ID NO: 179) расположен на периферии участка связывания, его трудно было использовать.
Таким образом, связывания, кроме того, с другими остатками, образующими эпитоп (таблица 29), также оптимально используя связывание с определяющим селективность и перекрестную реакционно-способность остатком изолейцин-63 (в соответствии с SEQ ID О: 179) СЕАСАМ6 и все еще позволяя размещение лейцина в этом положении, но не фенилаланина, будут СЕАСАМ6 селективными, но в то же время перекрестие реакционно-способными с человеческой СЕАСАМ6 - СЕАСАМ6 яванских макак.
Мутагенез
Чтобы обосновать выводы и предсказания структурного анализа в исследованиях связывания, были получены следующие мутанты N-терминального домена 1 человеческой СЕАСАМ6:
Белки экспрессировались в Е. coli, подвергали рефолдингу и очищали, как описано в Примере 1. Сравнительную активность связывания с белком домена 1 дикого типа и двумя одиночными мутациями определяли методом ELISA. 1,5 мкг/мл растворов белка в PBS наносили на ночь на 384 планшеты Nunc MaxiSorp (Sigma, P6491). Планшеты промывали с PBS/T и блокированными Smart block (CANDOR Bioscience GmbH, 113125). Затем на лунки наносили серию разбавлений ТРР-3310, ТРР-1679 и антитела изотопического контроля. После промывания PBS/T связные антитела были обнаружены с помощью античеловеческого IgG Fc POD (Sigma, А0170) и 10 мкМ раствора Amplex Red (Thermo, A12222). Сигналы положительного связывания были обнаружены с помощью флуоресценции (Ex. 535 нм/Em. 590 нм). Таблица 32 показывает активность связывания для ТРР-3310 с белком домена 1 дикого типа и мутацию изолейцин 63 (как в SEQ ID NO: 179) на лейцин (как в яванских макаках). Мутация аминокислоты в положении 63 (как в SEQ ID NO: 179) на фенилаланин (как в человеческой СЕАСАМ1, человеческой СЕАСАМ3 и человеческой СЕАСАМ5) приводит к полной потере связывающей способности. В качестве контроля для демонстрации эффективного рефолдинга белков N-терминального домена 1 СЕАСАМ6 использовали ТРР-1679 (см. Пример 4), для которого наблюдалось связывание в той же степени со всеми антигенами, протестированными в Таблице 31.
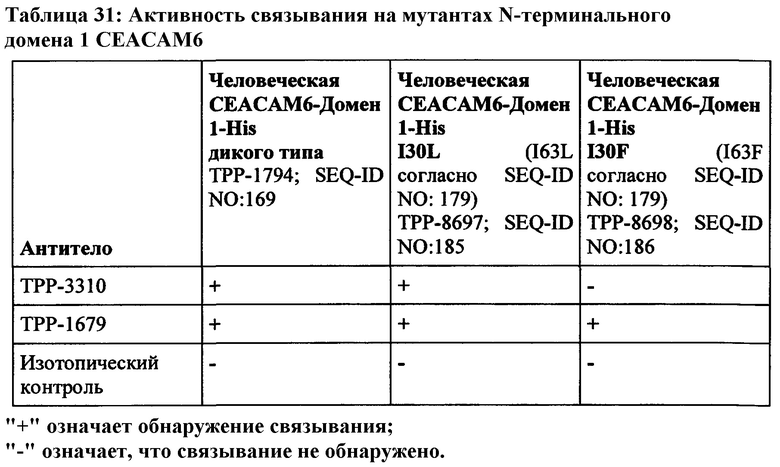
В заключение, действительно перекрестно реагирующее антитело ТРР-3310 с человеческой СЕАСАМ6 - СЕАСАМ6 яванских макак, которое в то же время является селективным по отношению к другим паралогам человека, было толерантно к I63L замещению (согласно SEQ ID: 179) (что соответствует СЕАСАМ6 яванских макак), но не I63F замещению (согласно SEQ ID: 179) (соответствующий остаток в человеческих паралогах СЕАСАМ1, СЕАСАМ3 и СЕАСАМ5) в контексте N-терминального домена 1 человеческой СЕАСАМ6, согласуется с результатами, полученными из рентгеновской кристаллографии, обосновывая наш прогноз.
Пример 17: Анализ опосредованной Т клетками цитотоксичности в присутствии СЕАСАМ6 антител
Влияние анти-СЕАСАМ6 антитела на опосредованную Т-клетку цитотоксичность изучали в экспериментах по цитотоксичности с сокультурами СЕАСАМ6 - положительных опухолевых клеток и Т-клеток, полученных из разных источников. Этими Т-клетками были либо CD8+ сурвивин Т-клетки, либо Т-клетки, полученные из рака поджелудочной железы. Для этих экспериментов по уничтожению опухолевых клеток использовалась система анализа цитотоксичности на основе полного сопротивления (xCELLigence).
Специфичный для пептида сурвивина CD8+ Т-клеточный клон был получен и размножен in vitro, как описанные в примере 11. Инфильтрирующие рак поджелудочной железы линии лимфоцитов (TIL) были выделены из свежей первичной культуры опухолевой ткани в результате хирургического вмешательства. Вкратце, свежий первичный тканевый материал разрезали на мелкие кусочки и культивировали в небольших чашках в среде X-Vivo-15 (Lonza), содержащей 2% человеческого сывороточного альбумина, 2,5 мкг/мл Fungizone, 20 мкг/мл гентамицина, 1% пенициллина/Стрептомицин с 6000 IU/IL-2 в течение 10-18 дней. Затем клетки из супернатанта собирали и либо замораживали, либо использовали непосредственно для «протокола быстрого роста» (REP). Для быстрого роста TIL замороженные TIL осторожно оттаивали и культивировали с 0,6*106 клеток/мл в течение 1 дня в полной лимфоцитарной среде CLM RPMI-1640 (Life Technologies # 21875034), 10% человеческой АВ-сыворотки (MILAN Analytica # 000083), 1% пенициллина/стрептомицина (Life Technologies # 15140122), 1% мл HEPES (Life Technolgies # 15630056), 0,01% β-меркаптоэтанола (сток 50 мМ) (Life Technologies # 31350010)) с 6000 IU/мл IL-2. TIL собирали и обогащали при соотношении 1:100 с 60 мкг облученного питающего РВМС от 3 разных доноров в среде 400 мл REP (50% CLM смешивали с 50% свободной от сыворотки AIM-V среды (Gibco # 12055091), содержащей 3000 IU/мл IL-2 и 30 нг/мл антитела ОKТ-3 (eBioscience # 16-0037-85)) в колбах G-REX-100 (Wilson Wolf # 80500S).
Клетки культивировали и расщепляли, как описано в Jin et al., J Immunother. 2012 Apr; 35(3):283-92. Через 14 дней клетки собирали и замораживали в аликвотах. Перед анализом цитотоксичности с соультурой отдельные аликвоты TIL осторожно оттаивали и культивировали с 0,6*106 клеток/мл в течение 2 дней в CLM, содержащем 6000 IU/мл IL-2, и 1 день в CLM без IL-2.
Опухолевые клетки культивировали согласно стандартным протоколам и инструкциям поставщика
Опосредованную Т-клетками цитотоксичность анализировали на основе анализа цитотоксичности на основе полного сопротивления (xCELLigence). В этой системе для анализа, свободной от метки, цитотоксичность измеряют непосредственно и непрерывно в течение длительного периода времени около 100-150 ч (в реальном времени). Адгезивные опухолевые клетки прикрепляются к микроэлектродам на дне 96-луночного Е-планшета (E-Plate VIEW 96 PET, ACEA Biosciences #ID: H000568), что изменяет электрическое сопротивление этих электродов. Это контролируется как увеличение безразмерного «индекса ячейки». После прилипания опухолевых клеток (~24 ч) к лункам добавляют антитела и Т-клетки, что, если Т-клетки проявляют цитотоксическую активность, приводит к лизису опухолевых клеток и отрыву от электродов. Этот отрыв изменяет сопротивление лунок и измеряется как уменьшение «индекса ячейки» или «индекса нормализованных клеток», который является «индексом ячейки», нормализованным к моменту времени добавления Т клеток. Т-клетки сами по себе не влияют на электрическое сопротивление электродов, и поэтому измеряется только цитолиз опухолевых клеток. (Ререr et al, J Immunol Methods. 2014 Mar; 405:192-8)
В первых экспериментах установили, что уничтожение опухолевых клеток, наблюдаемое в этой системе анализа, зависит от дозы Т-клеток и работает для разных отношений опухолевые клетки: Т-клетки и разных источников Т-клеток (специфичные для пептида сурвивина CD8+ Т-клетки, TIL пациентов с раком поджелудочной железы).
Затем изучили влияние анти-СЕАСАМ6 антител на цитолитическую эффективность сурвивин-специфичных Т-клеток. Таким образом, СЕАСАМ6 положительные KS рака молочной железы или СЕАСАМ6 трансфицированные НСТ-116 (HCT116-hC6) рака толстой кишки добавляли на 96-луночный планшет в течение 24 ч до того, как специфичные для пептида сурвивина Т клетки были добавлены при разных соотношениях клеток вместе с анти-СЕАСАМ6 mAbs.
Сокультивирование проводилась в течение периода времени ~100 ч. В этих экспериментах наблюдали улучшенную зависимую от Т-клеток цитотоксичность в присутствии анти-СЕАСАМ6 антитела ТРР-3310 и ТРР-3470 ~21% на обеих клеточных линиях. Результаты отображаются в Фиг. 11 А и В), например, для одного клеточного отношения. Примечательно, что специфичные для пептида сурвивина CD8+ Т-клетки уже сами по себе демонстрируют высокий цитотоксический эффект 45-62%, что, скорее всего, связано с преактивацией культивируемых Т-клеток и, таким образом, рассматривается как фоновый цитолиз. Таким образом, увеличение секреции IFN-гамма, наблюдаемое в предыдущих анализах ELISA, приводит к цитотоксическому эффекту в течение примерно 24 часов сокультивирования. Был сделан вывод, что обработка СЕАСАМ6-положительных опухолевых клеток анти-СЕАСАМ6-антителом приводит к улучшенному опосредованному специфичными для пептида сурвивина CD8+ Т-клеткми уничтожению обеих линий опухолевых клеток.
В последующих экспериментах протестировали влияние антител СЕАСАМ6 на цитолитическую активность полученных у пациентов TIL клеток рака поджелудочной железы. Поэтому на 96-луночный планшет добавляли клеточную линию СЕАСАМ6-положительных клеток рака легких НСС2935 и культивировали в течение 24 часов. Затем добавляли TIL при различных соотношениях в присутствии антитела СЕАСАМ6 (30 мкг/мл) и биспецифического антитела анти-СD3 × анти-ЕРСАМ IgG (0,25 нг/мл) ( et al., Int J Cancer. 2002 Sep 10; 101(2):183-9; Salnikov et al., J Cell Mol Med. 2009 Sep; 13(9B):4023-33), чтобы обеспечить убийство клеток HLA-независимое, опосредованное Т-клетками уничтожение опухолевых клеток. В присутствии анти-СЕАСАМ6 антител ТРР-3310 и ТРР-3470 наблюдали полное падение сопротивления, которое не наблюдалась при введении изотопически подобного контрольного антитела. Падение сопротивления интерпретируется как полное цитолитическое уничтожение целевой клеточной линии НСС2935. В дополнительном эксперименте можно продемонстрировали, что влияние СЕАСАМ6 антитела ТРР-3310 является зависимым от дозы, и значение IC50 0,62-0,21 мкг/мл было определено. На Фиг. 12 показаны примерные результаты для TIL-12.
et al., Int J Cancer. 2002 Sep 10; 101(2):183-9; Salnikov et al., J Cell Mol Med. 2009 Sep; 13(9B):4023-33), чтобы обеспечить убийство клеток HLA-независимое, опосредованное Т-клетками уничтожение опухолевых клеток. В присутствии анти-СЕАСАМ6 антител ТРР-3310 и ТРР-3470 наблюдали полное падение сопротивления, которое не наблюдалась при введении изотопически подобного контрольного антитела. Падение сопротивления интерпретируется как полное цитолитическое уничтожение целевой клеточной линии НСС2935. В дополнительном эксперименте можно продемонстрировали, что влияние СЕАСАМ6 антитела ТРР-3310 является зависимым от дозы, и значение IC50 0,62-0,21 мкг/мл было определено. На Фиг. 12 показаны примерные результаты для TIL-12.
Таким образом, эти эксперименты показывают, что антитела СЕАСАМ6 согласно настоящему изобретению могут эффективно блокировать иммуноподавляющий рецептор СЕАСАМ6 и улучшать цитотоксическую эффективность не только модельных Т-клеток, но и лимфоцитов, инфильтрующих опухоли, полученные пациентов, против СЕАСАМ6-положительных опухолевых клеток.
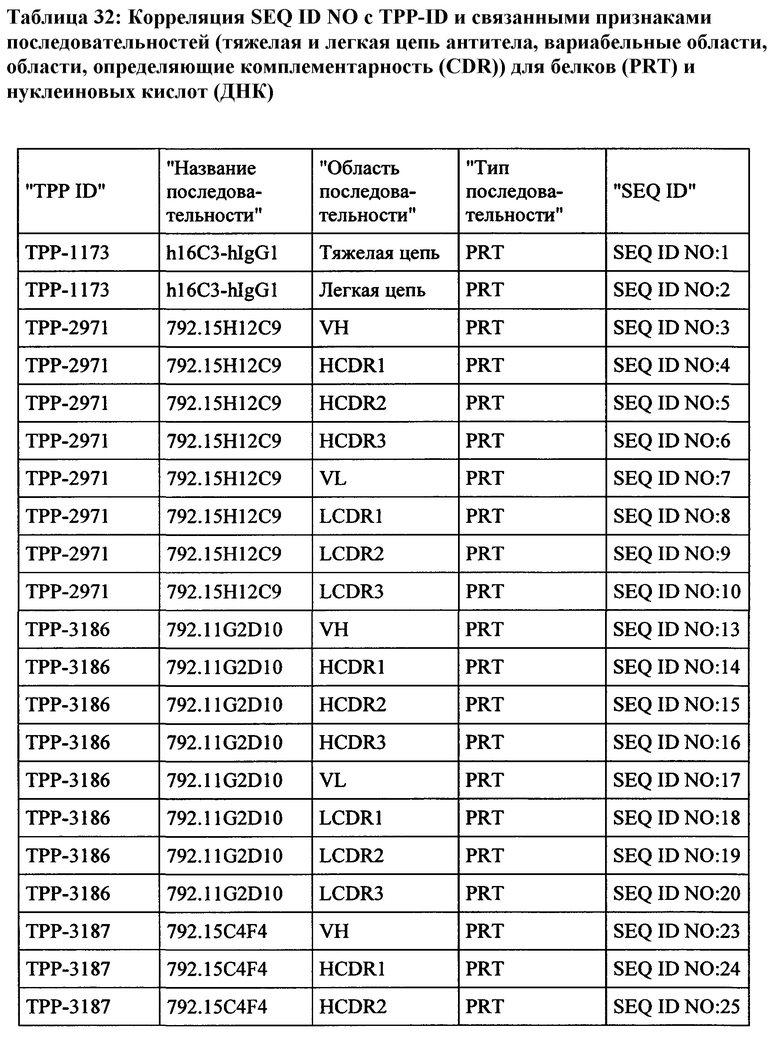
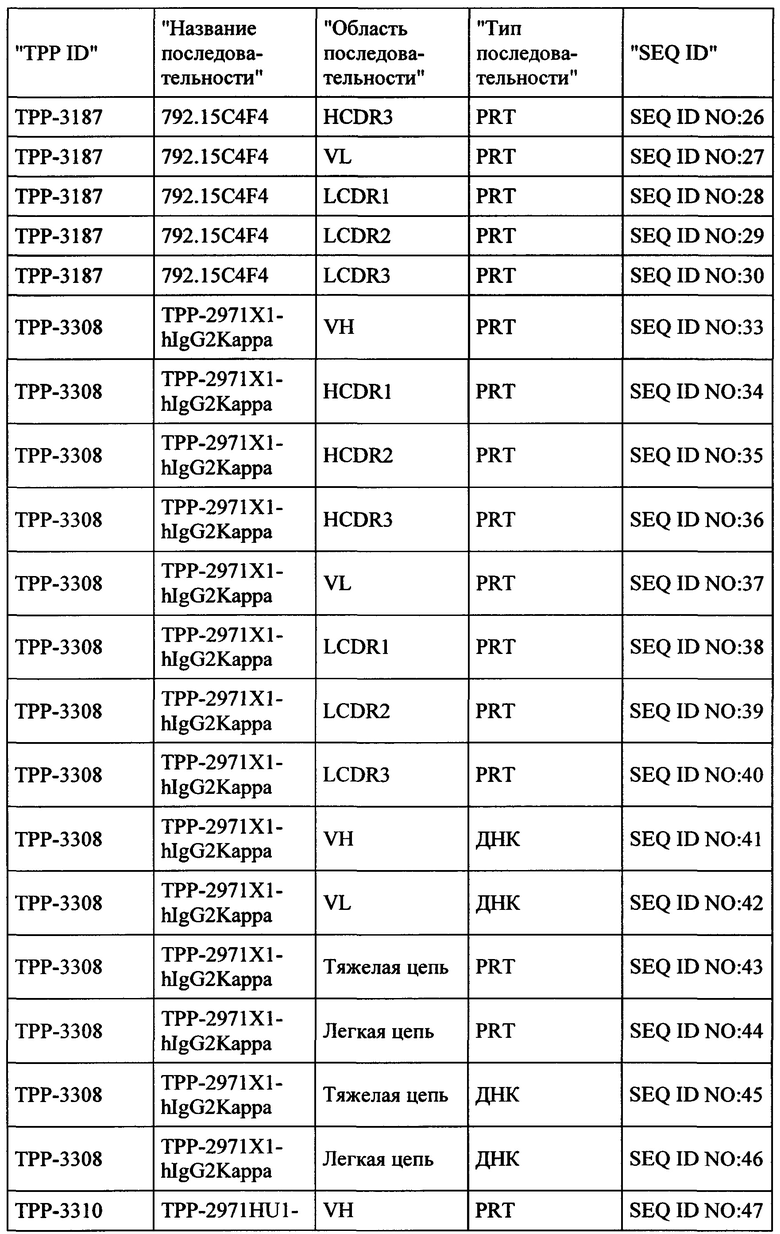
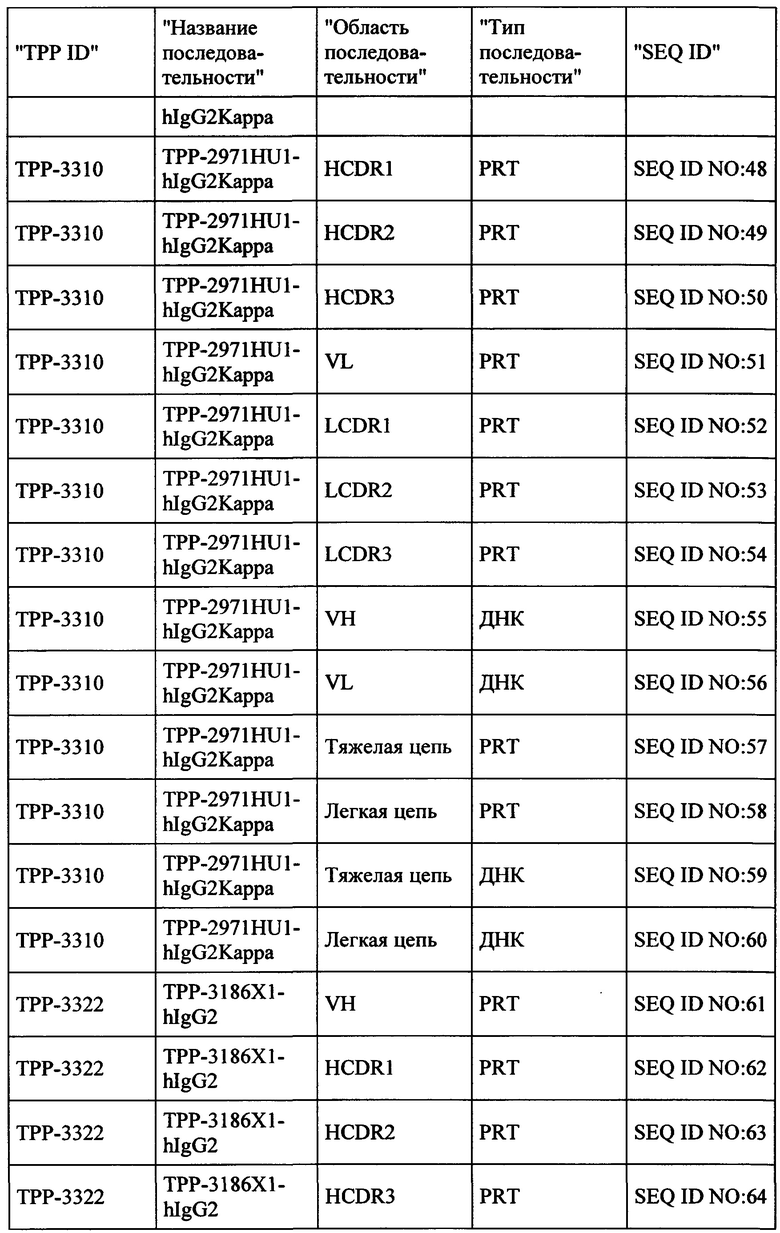
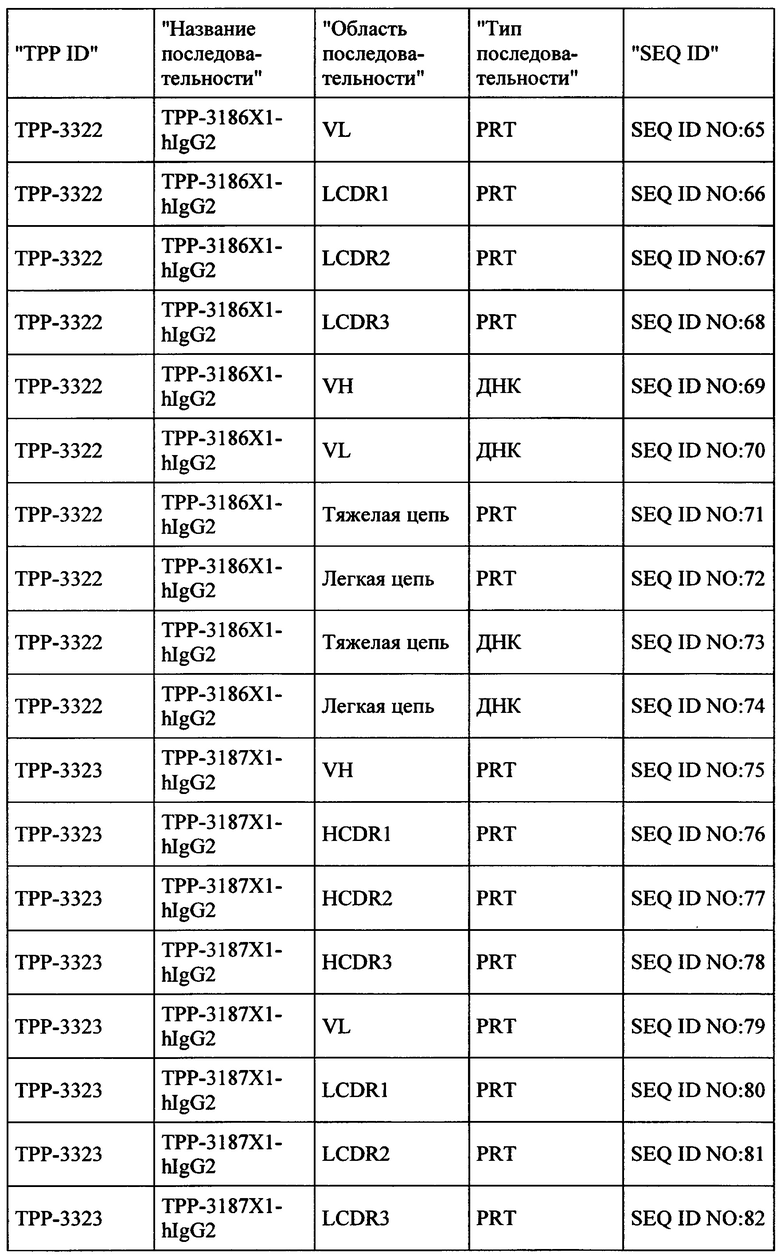
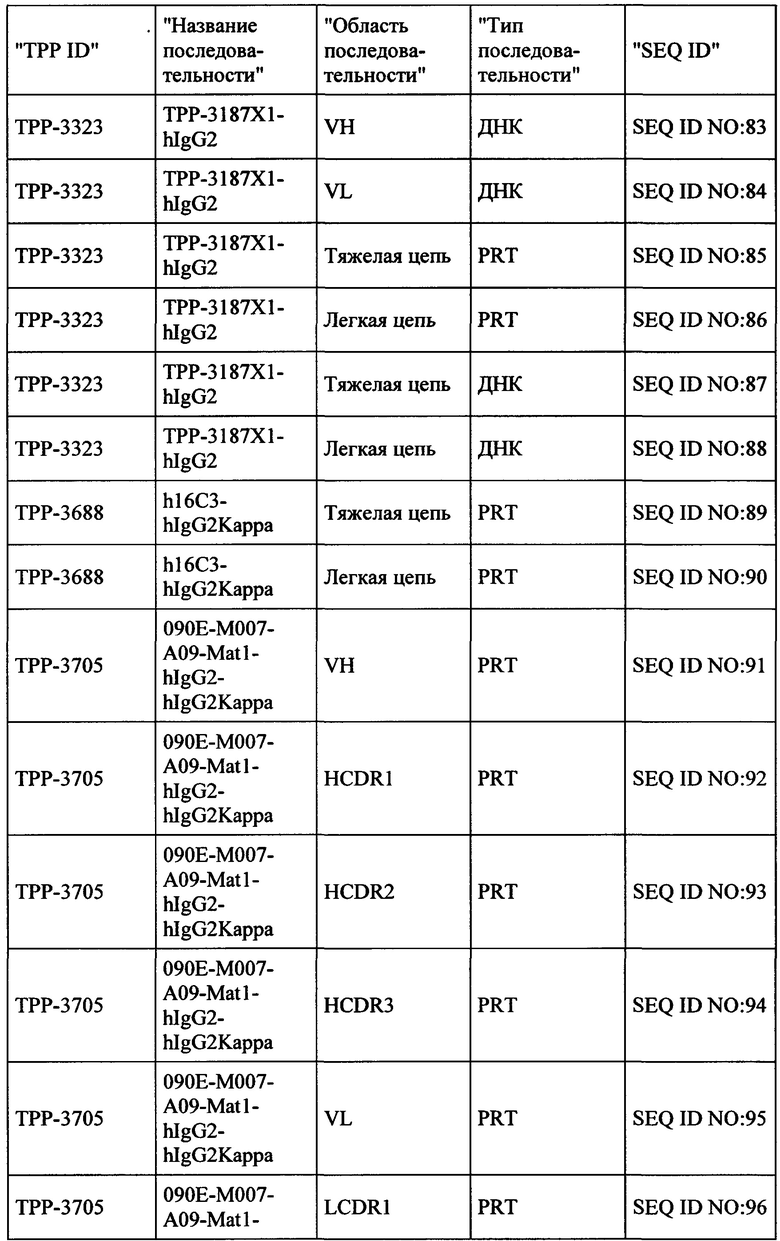
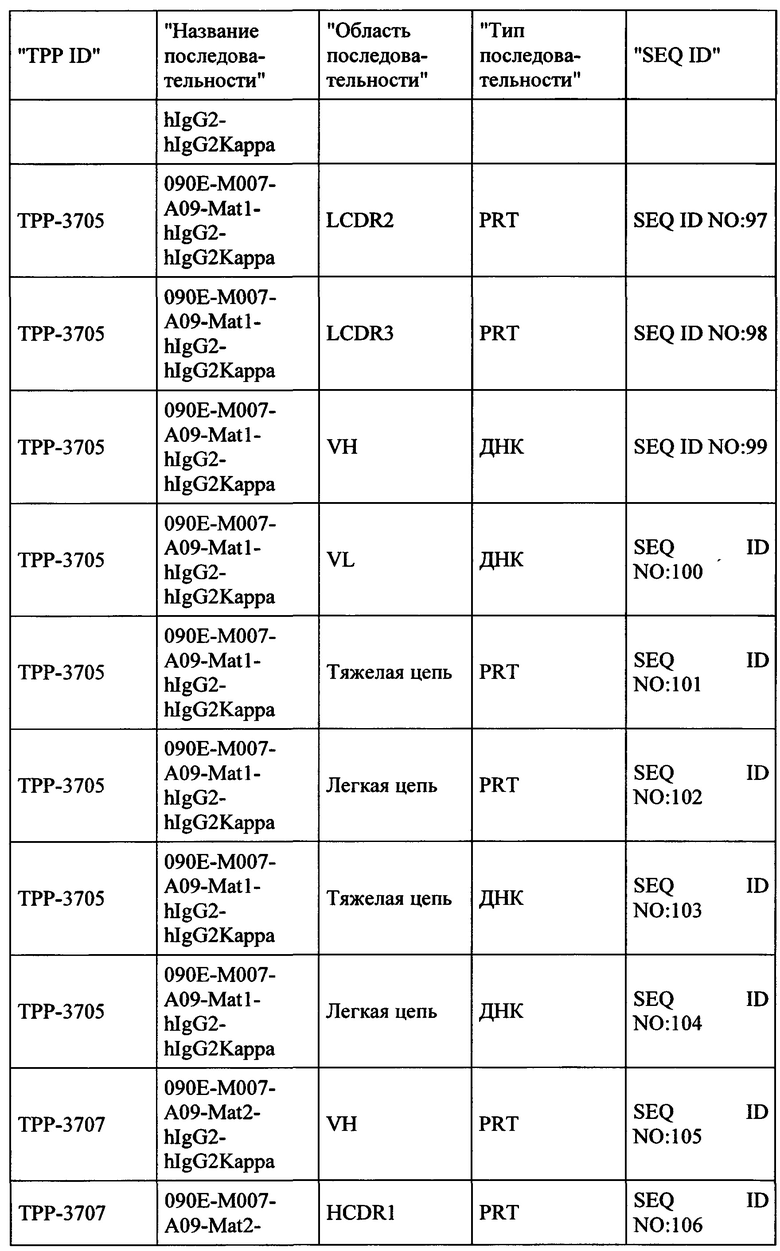
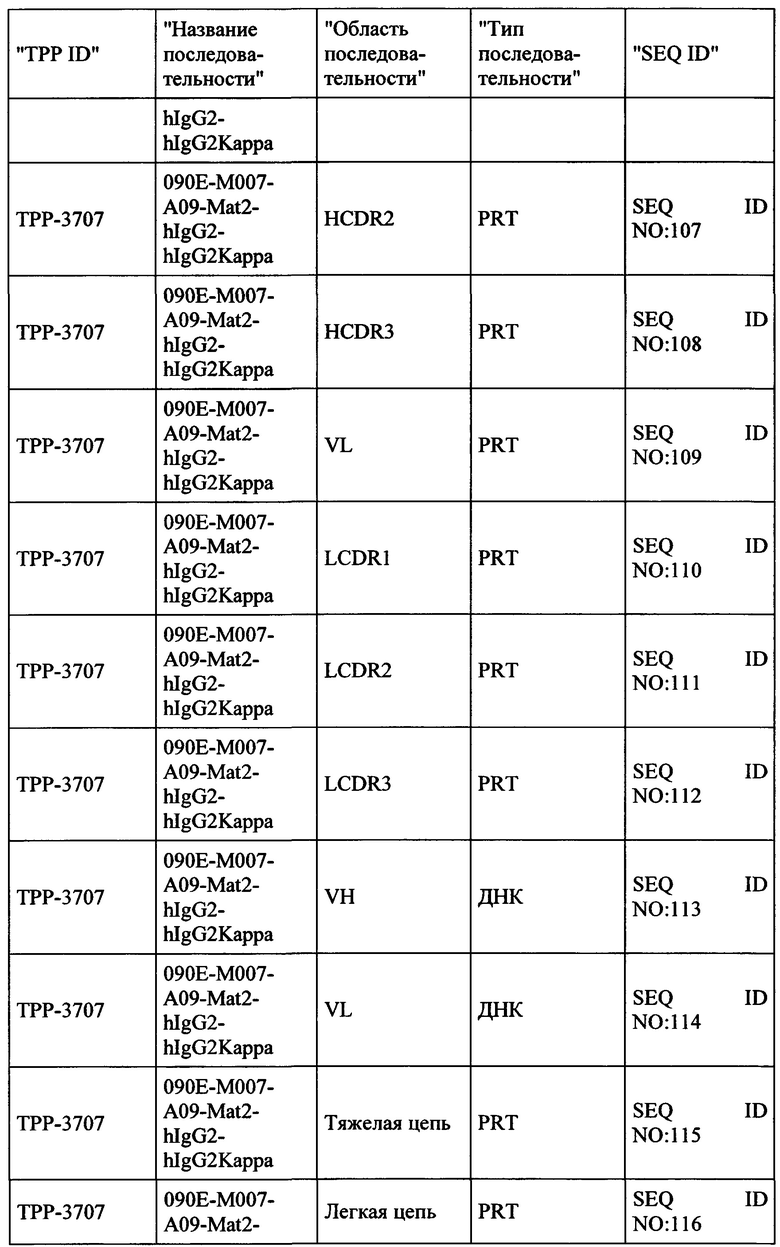
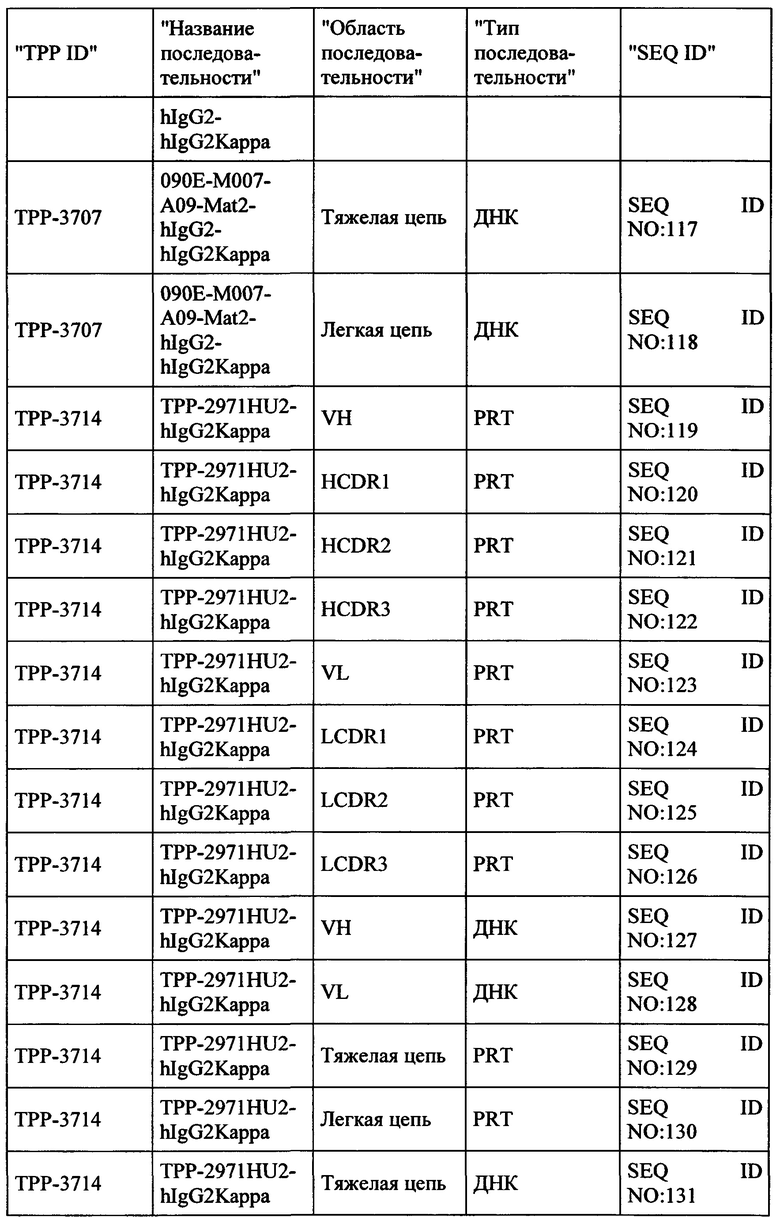
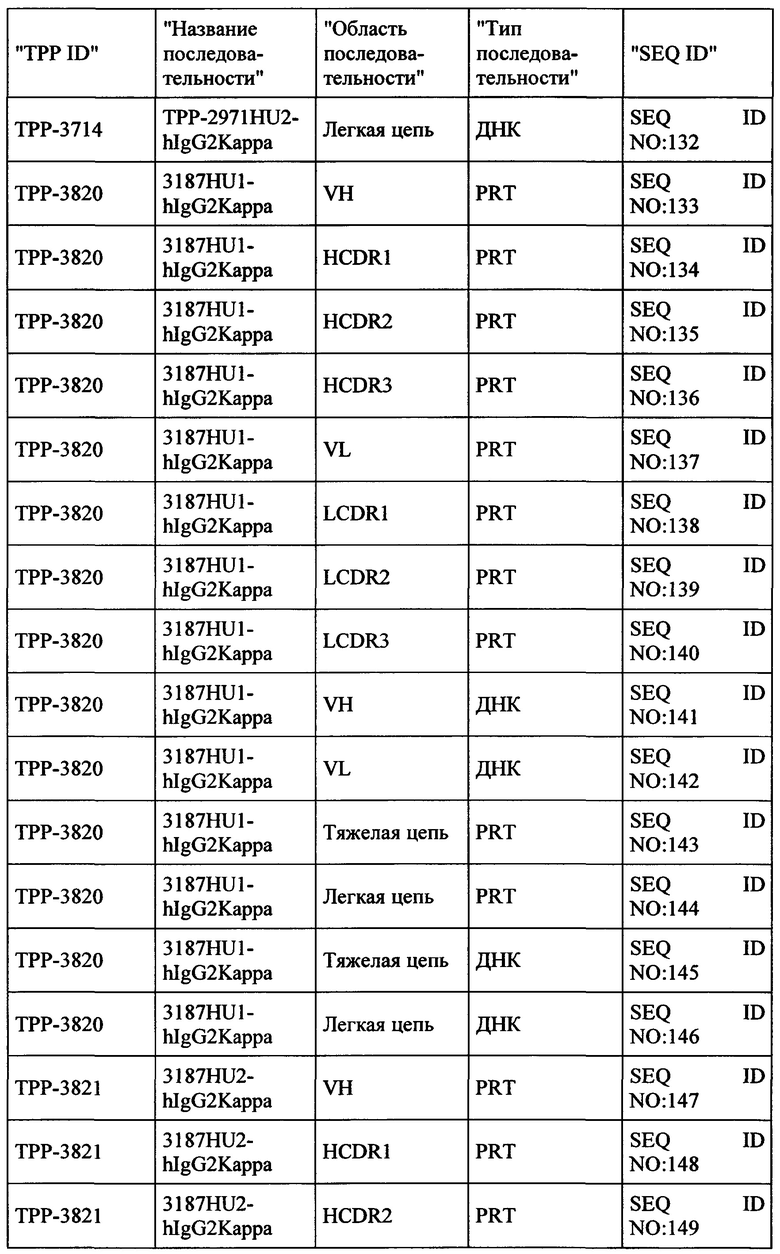
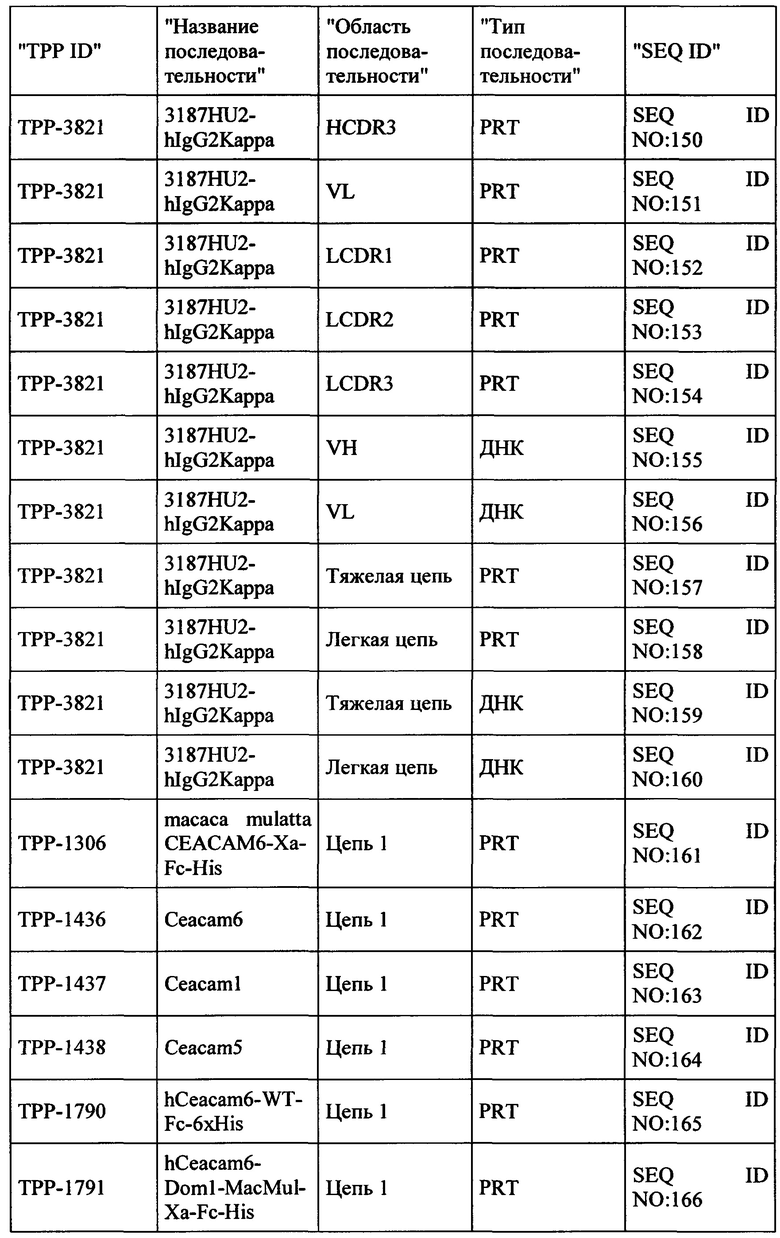
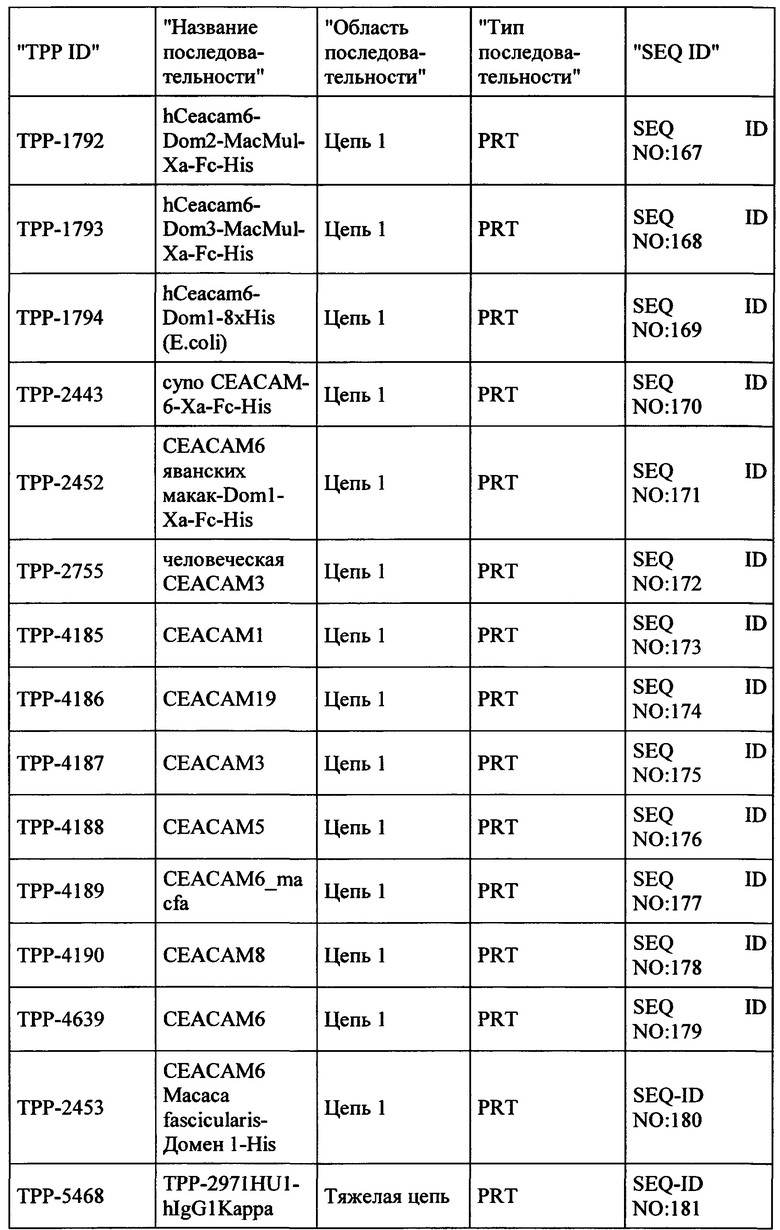
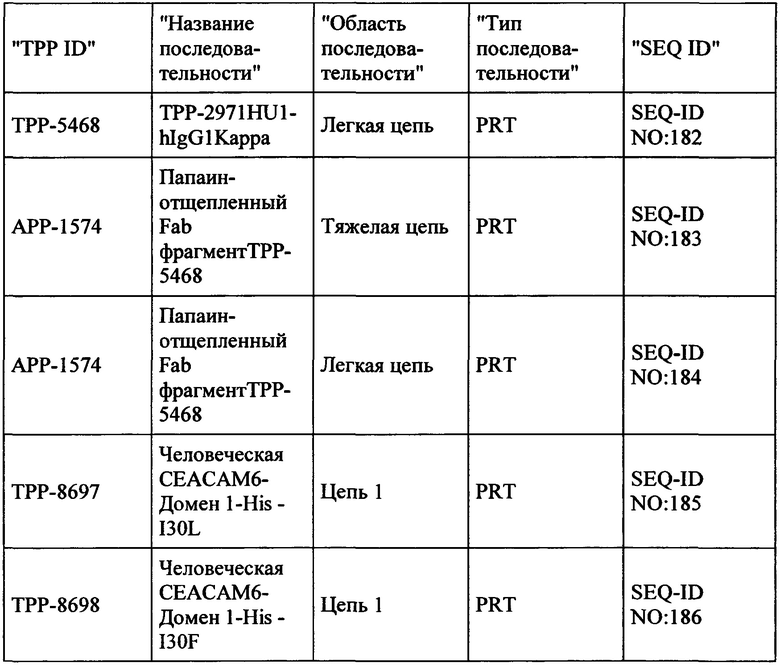
--->
Перечень последовательностей
<110> Bayer Pharma AG
<120> АНТИ-CEACAM6 АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ
<130> BHC 14 1 064
<160> 186
<170> PatentIn version 3.5
<210> 1
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1173, h16C3-hIgG1, тяжелая цепь
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Leu Ile Ser Thr Tyr Ser Gly Asp Thr Lys Tyr Asn Gln Asn Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Ser Gly Ser Arg Tyr Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly
450
<210> 2
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1173, h16C3-hIgG1, легкая цепь
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Arg Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Leu Ala Thr Gly Met Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Val Leu Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, VH
<400> 3
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Asp Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 4
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, HCDR1
<400> 4
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 5
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, HCDR2
<400> 5
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 6
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, HCDR3
<400> 6
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 7
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, VL
<400> 7
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 8
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, LCDR1
<400> 8
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, LCDR2
<400> 9
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 10
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, LCDR3
<400> 10
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 11
<211> 129
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, тяжелая цепь
<400> 11
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Asp Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro
115 120 125
Leu
<210> 12
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2971, 792.15H12C9, легкая цепь
<400> 12
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120
<210> 13
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, VH
<400> 13
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Cys Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 14
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, HCDR1
<400> 14
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 15
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, HCDR2
<400> 15
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 16
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, HCDR3
<400> 16
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 17
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, VL
<400> 17
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 18
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, LCDR1
<400> 18
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 19
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, LCDR2
<400> 19
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 20
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, LCDR3
<400> 20
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 21
<211> 129
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, тяжелая цепь
<400> 21
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Cys Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro
115 120 125
Leu
<210> 22
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3186, 792.11G2D10, легкая цепь
<400> 22
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120
<210> 23
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, VH
<400> 23
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 24
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, HCDR1
<400> 24
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 25
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, HCDR2
<400> 25
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 26
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, HCDR3
<400> 26
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 27
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, VL
<400> 27
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 28
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, LCDR1
<400> 28
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 29
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, LCDR2
<400> 29
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 30
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, LCDR3
<400> 30
Gln Gln Tyr Asn Asn Tyr Pro Leu Thr
1 5
<210> 31
<211> 129
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, тяжелая цепь
<400> 31
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro
115 120 125
Leu
<210> 32
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3187, 792.15C4F4, легкая цепь
<400> 32
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
115 120
<210> 33
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, VH
<400> 33
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Asp Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 34
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, HCDR1
<400> 34
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 35
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, HCDR2
<400> 35
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 36
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, HCDR3
<400> 36
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 37
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, VL
<400> 37
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 38
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, LCDR1
<400> 38
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 39
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, LCDR2
<400> 39
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 40
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, LCDR3
<400> 40
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 41
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, VH
<400> 41
caggtcacac tgaaagagag cggccctggc atcctgcagc ccagccagac cctgagcctg 60
acctgcagct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctggatcaga 120
cagcccagcg gcaaggacct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atcagcaagg acaccagcaa caaccaggtg 240
ttcctgaaga tcgccagcgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccaccc tgaccgtgtc ctca 354
<210> 42
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, VL
<400> 42
gacatcgtga tgacccagag ccagaaattc atgagcacca gcgtgggcga ccgggtgtcc 60
atcacatgca aggccagcca gaacgtgggc accgccgtgg cctggtatca gcagaagccc 120
ggccagagcc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccgac 180
agattcacag gcagcggcag cggcaccgac ttcaccctga ccatcagcaa catgcagagc 240
gaggacctgg ccgactactt ctgccagcag tacagcagct accccctgac cttcggagcc 300
ggcaccaagc tggaactgaa a 321
<210> 43
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, тяжелая цепь
<400> 43
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Asp Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 44
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, легкая цепь
<400> 44
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 45
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, тяжелая цепь
<400> 45
caggtcacac tgaaagagag cggccctggc atcctgcagc ccagccagac cctgagcctg 60
acctgcagct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctggatcaga 120
cagcccagcg gcaaggacct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atcagcaagg acaccagcaa caaccaggtg 240
ttcctgaaga tcgccagcgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccaccc tgaccgtgtc ctcagccagc 360
accaagggcc ccagcgtgtt ccctctggcc ccttgtagca gaagcaccag cgagtctaca 420
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ccgtgaccgt gtcctggaac 480
tctggcgctc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 540
tactctctga gcagcgtcgt gacagtgccc agcagcaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc cagcaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gccccccttg tcctgcccct ccagtggctg gcccttccgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg 780
gtggatgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca acagcacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtg 960
tccaacaagg gcctgcctgc ccccatcgag aaaaccatca gcaagaccaa aggccagccc 1020
cgcgagcccc aggtgtacac actgcctcca agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccca tgctggacag cgacggctca 1200
ttcttcctgt acagcaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
agctgcagcg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgagcctg 1320
agccctggc 1329
<210> 46
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3308, TPP-2971X1-hIgG2Kappa, легкая цепь
<400> 46
gacatcgtga tgacccagag ccagaaattc atgagcacca gcgtgggcga ccgggtgtcc 60
atcacatgca aggccagcca gaacgtgggc accgccgtgg cctggtatca gcagaagccc 120
ggccagagcc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccgac 180
agattcacag gcagcggcag cggcaccgac ttcaccctga ccatcagcaa catgcagagc 240
gaggacctgg ccgactactt ctgccagcag tacagcagct accccctgac cttcggagcc 300
ggcaccaagc tggaactgaa acgaaccgtg gccgctccca gcgtgttcat cttcccacct 360
agcgacgagc agctgaagtc cggcacagcc tctgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaatgccc tgcagagcgg caacagccag 480
gaaagcgtga ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gt 642
<210> 47
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, VH
<400> 47
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 48
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, HCDR1
<400> 48
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 49
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, HCDR2
<400> 49
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 50
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, HCDR3
<400> 50
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 51
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, VL
<400> 51
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, LCDR1
<400> 52
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 53
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, LCDR2
<400> 53
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 54
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, LCDR3
<400> 54
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 55
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, VH
<400> 55
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tctccggctt ctccctgtcc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaaggccct ggaatggctg gctcacatct ggtggaacga caacaagtac 180
tactccacct ccctgaaaac ccggctgacc atctccaagg acacctccaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
tccctgccct acttcgacta ctggggccag ggcaccacac tgaccgtcag ctca 354
<210> 56
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, VL
<400> 56
gatatccagc tgacccagtc ccccagcttc ctgtctgcct ctgtgggcga cagagtgacc 60
atcacatgca aggcctccca gaacgtgggc accgccgtgg cttggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgccctct 180
agattctccg gctctggctc tggcaccgag tttaccctga ccatctccag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tactcctcct accccctgac ctttggcgga 300
ggcaccaagg tggaaatcaa g 321
<210> 57
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, тяжелая цепь
<400> 57
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 58
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, легкая цепь
<400> 58
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 59
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, тяжелая цепь
<400> 59
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tctccggctt ctccctgtcc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaaggccct ggaatggctg gctcacatct ggtggaacga caacaagtac 180
tactccacct ccctgaaaac ccggctgacc atctccaagg acacctccaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
tccctgccct acttcgacta ctggggccag ggcaccacac tgaccgtcag ctcagcttcc 360
accaagggcc cctccgtgtt ccctctggcc ccttgctccc ggtccacctc tgagtctacc 420
gccgctctgg gctgcctggt gaaagactac ttccccgagc ccgtgaccgt gtcctggaac 480
tctggcgccc tgacctccgg cgtgcacacc tttccagccg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtggt gacagtgccc tcctccaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc ctccaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gcccaccctg tcctgctcca cctgtggctg gccccagcgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc tcccggaccc ccgaagtgac ctgcgtggtg 780
gtggacgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca actccacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtc 960
tccaacaagg gcctgcctgc ccccatcgaa aagaccatca gcaagaccaa gggccagccc 1020
cgcgagcccc aggtgtacac actgcccccc agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctggtgaa aggcttctac ccctccgaca ttgccgtgga atgggagtcc 1140
aacggacagc ctgagaacaa ctacaagacc acccccccca tgctggactc cgacggctca 1200
ttcttcctgt actccaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
tcctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgtccctg 1320
agccccggc 1329
<210> 60
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3310, TPP-2971HU1-hIgG2Kappa, легкая цепь
<400> 60
gatatccagc tgacccagtc ccccagcttc ctgtctgcct ctgtgggcga cagagtgacc 60
atcacatgca aggcctccca gaacgtgggc accgccgtgg cttggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgccctct 180
agattctccg gctctggctc tggcaccgag tttaccctga ccatctccag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tactcctcct accccctgac ctttggcgga 300
ggcaccaagg tggaaatcaa gcggaccgtg gccgctccct ccgtgtttat cttcccaccc 360
tccgacgagc agctgaagtc cggcacagct tccgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg caactcccag 480
gaatccgtga ccgagcagga ctccaaggac agcacctact ccctgtcctc caccctgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 61
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, VH
<400> 61
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Cys Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 62
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, HCDR1
<400> 62
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 63
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, HCDR2
<400> 63
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 64
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, HCDR3
<400> 64
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 65
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, VL
<400> 65
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 66
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, LCDR1
<400> 66
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 67
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, LCDR2
<400> 67
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 68
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, LCDR3
<400> 68
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 69
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, VH
<400> 69
caggtcacac tgaaagagag cggccctggc atcctgcagc ccagccagac cctgagcctg 60
acctgcagct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctgcatcaga 120
cagcccagcg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atcagcaagg acaccagcaa caaccaggtg 240
ttcctgaaga tcgccagcgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccaccc tgaccgtgtc ctca 354
<210> 70
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, VL
<400> 70
gacatcgtga tgacccagag ccagaaattc atgagcacca gcgtgggcga ccgggtgtcc 60
atcacatgca aggccagcca gaacgtgggc accgccgtgg cctggtatca gcagaagccc 120
ggccagagcc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccgac 180
agattcacag gcagcggcag cggcaccgac ttcaccttca ccatcagcaa catgcagagc 240
gaggacctgg ccgactactt ctgccagcag tacagcagct accccctgac cttcggagcc 300
ggcaccaagc tggaactgaa a 321
<210> 71
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, тяжелая цепь
<400> 71
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Cys Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 72
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, легкая цепь
<400> 72
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 73
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, тяжелая цепь
<400> 73
caggtcacac tgaaagagag cggccctggc atcctgcagc ccagccagac cctgagcctg 60
acctgcagct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctgcatcaga 120
cagcccagcg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atcagcaagg acaccagcaa caaccaggtg 240
ttcctgaaga tcgccagcgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccaccc tgaccgtgtc ctcagccagc 360
accaagggcc ccagcgtgtt ccctctggcc ccttgtagca gaagcaccag cgagtctaca 420
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ccgtgaccgt gtcctggaac 480
tctggcgctc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 540
tactctctga gcagcgtcgt gacagtgccc agcagcaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc cagcaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gccccccttg tcctgcccct ccagtggctg gcccttccgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg 780
gtggatgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca acagcacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtg 960
tccaacaagg gcctgcctgc ccccatcgag aaaaccatca gcaagaccaa aggccagccc 1020
cgcgagcccc aggtgtacac actgcctcca agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccca tgctggacag cgacggctca 1200
ttcttcctgt acagcaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
agctgcagcg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgagcctg 1320
agccctggc 1329
<210> 74
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3322, TPP-3186X1-hIgG2, легкая цепь
<400> 74
gacatcgtga tgacccagag ccagaaattc atgagcacca gcgtgggcga ccgggtgtcc 60
atcacatgca aggccagcca gaacgtgggc accgccgtgg cctggtatca gcagaagccc 120
ggccagagcc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccgac 180
agattcacag gcagcggcag cggcaccgac ttcaccttca ccatcagcaa catgcagagc 240
gaggacctgg ccgactactt ctgccagcag tacagcagct accccctgac cttcggagcc 300
ggcaccaagc tggaactgaa acgaaccgtg gccgctccca gcgtgttcat cttcccacct 360
agcgacgagc agctgaagtc cggcacagcc tctgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaatgccc tgcagagcgg caacagccag 480
gaaagcgtga ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gt 642
<210> 75
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, VH
<400> 75
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 76
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, HCDR1
<400> 76
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 77
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, HCDR2
<400> 77
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala Leu Lys Ser
1 5 10 15
<210> 78
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, HCDR3
<400> 78
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 79
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, VL
<400> 79
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 80
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, LCDR1
<400> 80
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 81
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, LCDR2
<400> 81
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 82
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, LCDR3
<400> 82
Gln Gln Tyr Asn Asn Tyr Pro Leu Thr
1 5
<210> 83
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, VH
<400> 83
caagtgaccc tgaaagagtc cggccctggc atcctgcagc cttcccagac cctgtccctg 60
acctgctcct tctccggctt ctccctgacc acctacggca tcggcgtggg ctggatcaga 120
cagccttctg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atctccaagg acacctccaa caaccaggtg 240
ttcctgaaga tcgcctccgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
tccctgccct acttcgacta ttggggccag ggcaccaccc tgaccgtcag ctca 354
<210> 84
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, VL
<400> 84
gacatcgtga tgacccagtc ccagaaattc atgtccacct ccgtgggcga ccgggtgtcc 60
atcacatgca aggcctctca gaacgtgggc accgccgtgg cctggtatca gcagaagcct 120
ggccagtccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgcccgat 180
agattcaccg gctctggctc tggcaccgac ttcaccctga ccatctccaa catgcagtcc 240
gaggacctgg ccgactactt ctgccagcag tacaacaact accccctgac cttcggcgct 300
ggcaccaagc tggaactgaa g 321
<210> 85
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, тяжелая цепь
<400> 85
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Asn Thr Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 86
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, легкая цепь
<400> 86
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 87
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, тяжелая цепь
<400> 87
caagtgaccc tgaaagagtc cggccctggc atcctgcagc cttcccagac cctgtccctg 60
acctgctcct tctccggctt ctccctgacc acctacggca tcggcgtggg ctggatcaga 120
cagccttctg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacaacaccg ccctgaagtc ccggctgacc atctccaagg acacctccaa caaccaggtg 240
ttcctgaaga tcgcctccgt ggacaccgcc gataccgcca cctactactg cgcccggatc 300
tccctgccct acttcgacta ttggggccag ggcaccaccc tgaccgtcag ctcagcttcc 360
accaagggcc cctccgtgtt ccctctggcc ccttgctccc ggtccacctc tgagtctacc 420
gccgctctgg gctgcctggt gaaagactac ttccccgagc ccgtgaccgt gtcctggaac 480
tctggcgccc tgacctccgg cgtgcacacc tttccagccg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtggt gacagtgccc tcctccaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc ctccaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gcccaccctg tcctgctcca cctgtggctg gccccagcgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc tcccggaccc ccgaagtgac ctgcgtggtg 780
gtggacgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca actccacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtc 960
tccaacaagg gcctgcctgc ccccatcgaa aagaccatca gcaagaccaa gggccagccc 1020
cgcgagcccc aggtgtacac actgcccccc agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctggtgaa aggcttctac ccctccgaca ttgccgtgga atgggagtcc 1140
aacggacagc ctgagaacaa ctacaagacc acccccccca tgctggactc cgacggctca 1200
ttcttcctgt actccaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
tcctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgtccctg 1320
agccccggc 1329
<210> 88
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3323, TPP-3187X1-hIgG2, легкая цепь
<400> 88
gacatcgtga tgacccagtc ccagaaattc atgtccacct ccgtgggcga ccgggtgtcc 60
atcacatgca aggcctctca gaacgtgggc accgccgtgg cctggtatca gcagaagcct 120
ggccagtccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgcccgat 180
agattcaccg gctctggctc tggcaccgac ttcaccctga ccatctccaa catgcagtcc 240
gaggacctgg ccgactactt ctgccagcag tacaacaact accccctgac cttcggcgct 300
ggcaccaagc tggaactgaa gagaaccgtg gccgctccct ccgtgtttat cttcccaccc 360
tccgacgagc agctgaagtc cggcacagct tccgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg caactcccag 480
gaatccgtga ccgagcagga ctccaaggac agcacctact ccctgtcctc taccctgacc 540
ctgtccaagg ccgattacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 89
<211> 446
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3688, h16C3-hIgG2Kappa, тяжелая цепь
<400> 89
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Leu Ile Ser Thr Tyr Ser Gly Asp Thr Lys Tyr Asn Gln Asn Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Ser Gly Ser Arg Tyr Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys
210 215 220
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 90
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3688, h16C3-hIgG2Kappa, легкая цепь
<400> 90
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Arg Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Leu Ala Thr Gly Met Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Val Leu Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 91
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, VH
<400> 91
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Leu Tyr
20 25 30
Gln Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 92
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, HCDR1
<400> 92
Leu Tyr Gln Met His
1 5
<210> 93
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, HCDR2
<400> 93
Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 94
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, HCDR3
<400> 94
Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro
1 5 10
<210> 95
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, VL
<400> 95
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser His Glu Ile Asp Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Tyr Trp Leu Lys Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gly Tyr Asp Asp Leu Ser Val
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105
<210> 96
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, LCDR1
<400> 96
Gln Ala Ser His Glu Ile Asp Asn Tyr Leu Asn
1 5 10
<210> 97
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, LCDR2
<400> 97
Asp Ala Tyr Trp Leu Lys Thr
1 5
<210> 98
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, LCDR3
<400> 98
Gln Gly Tyr Asp Asp Leu Ser Val Thr
1 5
<210> 99
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, VH
<400> 99
gaagtgcagc tggtggaatc cggcggaggc ctggtgcagc ctggcggatc tctgagactg 60
tcttgtgccg cctccggctt caccttcagc ctgtaccaga tgcactgggt gcgacaggcc 120
cctggcaagg gactggaatg ggtgtcctgg atctccttct ccggcggcaa taccggctac 180
gccgactccg tgaagggccg gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtgc tagagccacc 300
ggctactcct ccccctggta tctggatcct tggggccagg gcacactcgt gaccgtcagc 360
tca 363
<210> 100
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, VL
<400> 100
gacatccaga tgacccagag cccttccagc ctgtccgcct ctgtgggcga cagagtgacc 60
atcacctgtc aggcctccca cgagatcgac aactacctga actggtatca gcagaagccc 120
ggcaaggccc ccaagctgct gatctacgat gcctactggc tgaaaaccgg cgtgccctcc 180
agattctccg gctctggctc tggcaccgac tttaccctga ccatctccag cctgcagccc 240
gaggatatcg ccacctacta ttgtcagggc tacgacgacc tgtccgtgac ctttggcgga 300
ggcaccaagg tggacatcaa g 321
<210> 101
<211> 446
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, тяжелая цепь
<400> 101
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Leu Tyr
20 25 30
Gln Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys
210 215 220
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 102
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, легкая цепь
<400> 102
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser His Glu Ile Asp Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Tyr Trp Leu Lys Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gly Tyr Asp Asp Leu Ser Val
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 103
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, тяжелая цепь
<400> 103
gaagtgcagc tggtggaatc cggcggaggc ctggtgcagc ctggcggatc tctgagactg 60
tcttgtgccg cctccggctt caccttcagc ctgtaccaga tgcactgggt gcgacaggcc 120
cctggcaagg gactggaatg ggtgtcctgg atctccttct ccggcggcaa taccggctac 180
gccgactccg tgaagggccg gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtgc tagagccacc 300
ggctactcct ccccctggta tctggatcct tggggccagg gcacactcgt gaccgtcagc 360
tcagcttcca ccaagggccc ctccgtgttc cctctggccc cttgctcccg gtccacctct 420
gagtctaccg ccgctctggg ctgcctggtg aaagactact tccccgagcc cgtgaccgtg 480
tcctggaact ctggcgccct gacctccggc gtgcacacct ttccagccgt gctgcagtcc 540
tccggcctgt actccctgtc ctccgtggtg acagtgccct cctccaactt cggcacccag 600
acctacacct gtaacgtgga ccacaagccc tccaacacca aggtggacaa gaccgtggaa 660
cggaagtgct gcgtggaatg cccaccctgt cctgctccac ctgtggctgg ccccagcgtg 720
ttcctgttcc ccccaaagcc caaggacacc ctgatgatct cccggacccc cgaagtgacc 780
tgcgtggtgg tggacgtgtc ccacgaggac cccgaggtgc agttcaattg gtacgtggac 840
ggcgtggaag tgcacaacgc caagaccaag cccagagagg aacagttcaa ctccaccttc 900
cgggtggtgt ccgtgctgac cgtggtgcat caggactggc tgaacggcaa agagtacaag 960
tgcaaggtct ccaacaaggg cctgcctgcc cccatcgaaa agaccatcag caagaccaag 1020
ggccagcccc gcgagcccca ggtgtacaca ctgcccccca gccgggaaga gatgaccaag 1080
aaccaggtgt ccctgacctg tctggtgaaa ggcttctacc cctccgacat tgccgtggaa 1140
tgggagtcca acggacagcc tgagaacaac tacaagacca ccccccccat gctggactcc 1200
gacggctcat tcttcctgta ctccaagctg acagtggaca agtcccggtg gcagcagggc 1260
aacgtgttct cctgctccgt gatgcacgag gccctgcaca accactacac ccagaagtcc 1320
ctgtccctga gccccggc 1338
<210> 104
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3705, 090E-M007-A09-Mat1-hIgG2-hIgG2Kappa, легкая цепь
<400> 104
gacatccaga tgacccagag cccttccagc ctgtccgcct ctgtgggcga cagagtgacc 60
atcacctgtc aggcctccca cgagatcgac aactacctga actggtatca gcagaagccc 120
ggcaaggccc ccaagctgct gatctacgat gcctactggc tgaaaaccgg cgtgccctcc 180
agattctccg gctctggctc tggcaccgac tttaccctga ccatctccag cctgcagccc 240
gaggatatcg ccacctacta ttgtcagggc tacgacgacc tgtccgtgac ctttggcgga 300
ggcaccaagg tggacatcaa gcggacagtg gccgctccct ccgtgtttat cttcccaccc 360
tccgacgagc agctgaagtc cggcacagct tccgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaagtg gataacgccc tgcagtccgg caactcccag 480
gaatccgtga ccgagcagga ctccaaggac agcacctact ccctgtcctc caccctgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 105
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, VH
<400> 105
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Leu Tyr
20 25 30
Gln Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 106
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, HCDR1
<400> 106
Leu Tyr Gln Met His
1 5
<210> 107
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, HCDR2
<400> 107
Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 108
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, HCDR3
<400> 108
Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro
1 5 10
<210> 109
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, VL
<400> 109
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser His Glu Ile Asp Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Tyr Trp Ser Lys Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gly Tyr Asp Asp Leu Ser Val
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys
100 105
<210> 110
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, LCDR1
<400> 110
Gln Ala Ser His Glu Ile Asp Asn Tyr Leu Asn
1 5 10
<210> 111
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, LCDR2
<400> 111
Asp Ala Tyr Trp Ser Lys Thr
1 5
<210> 112
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, LCDR3
<400> 112
Gln Gly Tyr Asp Asp Leu Ser Val Thr
1 5
<210> 113
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, VH
<400> 113
gaagtgcagc tggtggaatc cggcggaggc ctggtgcagc ctggcggatc tctgagactg 60
tcttgtgccg cctccggctt caccttcagc ctgtaccaga tgcactgggt gcgacaggcc 120
cctggcaagg gactggaatg ggtgtcctgg atctccttct ccggcggcaa taccggctac 180
gccgactccg tgaagggccg gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtgc tagagccacc 300
ggctactcct ccccctggta tctggatcct tggggccagg gcacactcgt gaccgtcagc 360
tca 363
<210> 114
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, VL
<400> 114
gacatccaga tgacccagag cccttccagc ctgtccgcct ctgtgggcga cagagtgacc 60
atcacctgtc aggcctccca cgagatcgac aactacctga actggtatca gcagaagccc 120
ggcaaggccc ccaagctgct gatctacgac gcctactggt ccaagaccgg cgtgccctcc 180
agattctccg gctctggctc tggcaccgac tttaccctga ccatctccag cctgcagccc 240
gaggatatcg ccacctacta ttgtcagggc tacgacgacc tgtccgtgac ctttggcgga 300
ggcaccaagg tggacatcaa g 321
<210> 115
<211> 446
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, тяжелая цепь
<400> 115
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Leu Tyr
20 25 30
Gln Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Trp Ile Ser Phe Ser Gly Gly Asn Thr Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Thr Gly Tyr Ser Ser Pro Trp Tyr Leu Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys
210 215 220
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 116
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, легкая цепь
<400> 116
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser His Glu Ile Asp Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Tyr Trp Ser Lys Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gly Tyr Asp Asp Leu Ser Val
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 117
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, тяжелая цепь
<400> 117
gaagtgcagc tggtggaatc cggcggaggc ctggtgcagc ctggcggatc tctgagactg 60
tcttgtgccg cctccggctt caccttcagc ctgtaccaga tgcactgggt gcgacaggcc 120
cctggcaagg gactggaatg ggtgtcctgg atctccttct ccggcggcaa taccggctac 180
gccgactccg tgaagggccg gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtgc tagagccacc 300
ggctactcct ccccctggta tctggatcct tggggccagg gcacactcgt gaccgtcagc 360
tcagcttcca ccaagggccc ctccgtgttc cctctggccc cttgctcccg gtccacctct 420
gagtctaccg ccgctctggg ctgcctggtg aaagactact tccccgagcc cgtgaccgtg 480
tcctggaact ctggcgccct gacctccggc gtgcacacct ttccagccgt gctgcagtcc 540
tccggcctgt actccctgtc ctccgtggtg acagtgccct cctccaactt cggcacccag 600
acctacacct gtaacgtgga ccacaagccc tccaacacca aggtggacaa gaccgtggaa 660
cggaagtgct gcgtggaatg cccaccctgt cctgctccac ctgtggctgg ccccagcgtg 720
ttcctgttcc ccccaaagcc caaggacacc ctgatgatct cccggacccc cgaagtgacc 780
tgcgtggtgg tggacgtgtc ccacgaggac cccgaggtgc agttcaattg gtacgtggac 840
ggcgtggaag tgcacaacgc caagaccaag cccagagagg aacagttcaa ctccaccttc 900
cgggtggtgt ccgtgctgac cgtggtgcat caggactggc tgaacggcaa agagtacaag 960
tgcaaggtct ccaacaaggg cctgcctgcc cccatcgaaa agaccatcag caagaccaag 1020
ggccagcccc gcgagcccca ggtgtacaca ctgcccccca gccgggaaga gatgaccaag 1080
aaccaggtgt ccctgacctg tctggtgaaa ggcttctacc cctccgacat tgccgtggaa 1140
tgggagtcca acggacagcc tgagaacaac tacaagacca ccccccccat gctggactcc 1200
gacggctcat tcttcctgta ctccaagctg acagtggaca agtcccggtg gcagcagggc 1260
aacgtgttct cctgctccgt gatgcacgag gccctgcaca accactacac ccagaagtcc 1320
ctgtccctga gccccggc 1338
<210> 118
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3707, 090E-M007-A09-Mat2-hIgG2-hIgG2Kappa, легкая цепь
<400> 118
gacatccaga tgacccagag cccttccagc ctgtccgcct ctgtgggcga cagagtgacc 60
atcacctgtc aggcctccca cgagatcgac aactacctga actggtatca gcagaagccc 120
ggcaaggccc ccaagctgct gatctacgac gcctactggt ccaagaccgg cgtgccctcc 180
agattctccg gctctggctc tggcaccgac tttaccctga ccatctccag cctgcagccc 240
gaggatatcg ccacctacta ttgtcagggc tacgacgacc tgtccgtgac ctttggcgga 300
ggcaccaagg tggacatcaa gcggacagtg gccgctccct ccgtgtttat cttcccaccc 360
tccgacgagc agctgaagtc cggcacagct tccgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaagtg gataacgccc tgcagtccgg caactcccag 480
gaatccgtga ccgagcagga ctccaaggac agcacctact ccctgtcctc caccctgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 119
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, VH
<400> 119
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 120
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, HCDR1
<400> 120
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 121
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, HCDR2
<400> 121
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 122
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, HCDR3
<400> 122
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 123
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, VL
<400> 123
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 124
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, LCDR1
<400> 124
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 125
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, LCDR2
<400> 125
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 126
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, LCDR3
<400> 126
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 127
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, VH
<400> 127
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tctccggctt ctccctgtcc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaaggccct ggaatggctg gctcacatct ggtggaacga caacaagtac 180
tactccacct ccctgaaaac ccggctgacc atctccaagg acacctccaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
tccctgccct acttcgacta ctggggccag ggcacactcg tgaccgtcag ctca 354
<210> 128
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, VL
<400> 128
gatatccagc tgacccagtc ccccagcttc ctgtctgcct ctgtgggcga cagagtgacc 60
atcacatgca aggcctccca gaacgtgggc accgccgtgg cttggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgccctct 180
agattctccg gctctggctc tggcaccgag tttaccctga ccatctccag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tactcctcct accccctgac ctttggcgga 300
ggcaccaagg tggaaatcaa g 321
<210> 129
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, тяжелая цепь
<400> 129
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 130
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, легкая цепь
<400> 130
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 131
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, тяжелая цепь
<400> 131
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tctccggctt ctccctgtcc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaaggccct ggaatggctg gctcacatct ggtggaacga caacaagtac 180
tactccacct ccctgaaaac ccggctgacc atctccaagg acacctccaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
tccctgccct acttcgacta ctggggccag ggcacactcg tgaccgtcag ctcagcttcc 360
accaagggcc cctccgtgtt ccctctggcc ccttgctccc ggtccacctc tgagtctacc 420
gccgctctgg gctgcctggt gaaagactac ttccccgagc ccgtgaccgt gtcctggaac 480
tctggcgccc tgacctccgg cgtgcacacc tttccagccg tgctgcagtc ctccggcctg 540
tactccctgt cctccgtggt gacagtgccc tcctccaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc ctccaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gcccaccctg tcctgctcca cctgtggctg gccccagcgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc tcccggaccc ccgaagtgac ctgcgtggtg 780
gtggacgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca actccacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtc 960
tccaacaagg gcctgcctgc ccccatcgaa aagaccatca gcaagaccaa gggccagccc 1020
cgcgagcccc aggtgtacac actgcccccc agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctggtgaa aggcttctac ccctccgaca ttgccgtgga atgggagtcc 1140
aacggacagc ctgagaacaa ctacaagacc acccccccca tgctggactc cgacggctca 1200
ttcttcctgt actccaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
tcctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgtccctg 1320
agccccggc 1329
<210> 132
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3714, TPP-2971HU2-hIgG2Kappa, легкая цепь
<400> 132
gatatccagc tgacccagtc ccccagcttc ctgtctgcct ctgtgggcga cagagtgacc 60
atcacatgca aggcctccca gaacgtgggc accgccgtgg cttggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctactcc gcctccaacc ggtacaccgg cgtgccctct 180
agattctccg gctctggctc tggcaccgag tttaccctga ccatctccag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tactcctcct accccctgac ctttggcgga 300
ggcaccaagg tggaaatcaa gcggaccgtg gccgctccct ccgtgtttat cttcccaccc 360
tccgacgagc agctgaagtc cggcacagct tccgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaacgccc tgcagtccgg caactcccag 480
gaatccgtga ccgagcagga ctccaaggac agcacctact ccctgtcctc caccctgacc 540
ctgtccaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gtctttcaac cggggcgagt gt 642
<210> 133
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, VH
<400> 133
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 134
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, HCDR1
<400> 134
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 135
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, HCDR2
<400> 135
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 136
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, HCDR3
<400> 136
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 137
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, VL
<400> 137
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 138
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, LCDR1
<400> 138
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 139
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, LCDR2
<400> 139
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 140
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, LCDR3
<400> 140
Gln Gln Tyr Asn Asn Tyr Pro Leu Thr
1 5
<210> 141
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, VH
<400> 141
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tcagcggctt cagcctgacc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacagcacca gcctgaaaac ccggctgacc atcagcaagg acaccagcaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
agcctgccct acttcgacta ctggggccag ggcaccctcg tgacagtgtc atca 354
<210> 142
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, VL
<400> 142
gatatccagc tgacccagag ccccagcttt ctgagcgcca gcgtgggcga cagagtgacc 60
atcacatgca aggccagcca gaacgtgggc acagccgtgg cctggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccagc 180
agattttctg gcagcggctc cggcaccgag ttcaccctga caatcagcag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tacaacaact accccctgac cttcggcgga 300
ggcaccaagg tggaaattaa a 321
<210> 143
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, тяжелая цепь
<400> 143
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 144
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, легкая цепь
<400> 144
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 145
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, тяжелая цепь
<400> 145
caagtgaccc tgagagagtc cggccctgcc ctcgtgaagc ctacccagac cctgacactg 60
acctgcacct tcagcggctt cagcctgacc acctacggca tcggcgtggg ctggatcaga 120
cagcctcctg gcaagggcct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacagcacca gcctgaaaac ccggctgacc atcagcaagg acaccagcaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgccagaatc 300
agcctgccct acttcgacta ctggggccag ggcaccctcg tgacagtgtc atcagccagc 360
accaagggcc ccagcgtgtt ccctctggcc ccttgtagca gaagcaccag cgagtctaca 420
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ccgtgaccgt gtcctggaac 480
tctggcgctc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 540
tactctctga gcagcgtcgt gacagtgccc agcagcaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc cagcaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gccccccttg tcctgcccct ccagtggctg gcccttccgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg 780
gtggatgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca acagcacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtg 960
tccaacaagg gcctgcctgc ccccatcgag aaaaccatca gcaagaccaa aggccagccc 1020
cgcgagcccc aggtgtacac actgcctcca agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccca tgctggacag cgacggctca 1200
ttcttcctgt acagcaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
agctgcagcg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgagcctg 1320
agccctggc 1329
<210> 146
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3820, 3187HU1-hIgG2Kappa, легкая цепь
<400> 146
gatatccagc tgacccagag ccccagcttt ctgagcgcca gcgtgggcga cagagtgacc 60
atcacatgca aggccagcca gaacgtgggc acagccgtgg cctggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccagc 180
agattttctg gcagcggctc cggcaccgag ttcaccctga caatcagcag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tacaacaact accccctgac cttcggcgga 300
ggcaccaagg tggaaattaa acgaaccgtg gccgctccca gcgtgttcat cttcccacct 360
agcgacgagc agctgaagtc cggcacagcc tctgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaatgccc tgcagagcgg caacagccag 480
gaaagcgtga ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gt 642
<210> 147
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, VH
<400> 147
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 148
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, HCDR1
<400> 148
Thr Tyr Gly Ile Gly Val Gly
1 5
<210> 149
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, HCDR2
<400> 149
His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser Leu Lys Thr
1 5 10 15
<210> 150
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, HCDR3
<400> 150
Ile Ser Leu Pro Tyr Phe Asp Tyr
1 5
<210> 151
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, VL
<400> 151
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 152
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, LCDR1
<400> 152
Lys Ala Ser Gln Asn Val Gly Thr Ala Val Ala
1 5 10
<210> 153
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, LCDR2
<400> 153
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 154
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, LCDR3
<400> 154
Gln Gln Tyr Asn Asn Tyr Pro Leu Thr
1 5
<210> 155
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, VH
<400> 155
caggtcacac tgagagagtc cggccctgcc ctggtgaaac ccacccagac cctgaccctg 60
acatgcacct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctggatcaga 120
cagccccctg gcaaggccct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacagcacca gcctgaaaac ccggctgacc atcagcaagg acaccagcaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccctgg tgaccgtgtc ctca 354
<210> 156
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, VL
<400> 156
gatatccagc tgacccagag ccccagcttt ctgagcgcca gcgtgggcga cagagtgacc 60
atcacatgca aggccagcca gaacgtgggc acagccgtgg cctggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccagc 180
agattttctg gcagcggctc cggcaccgag ttcaccctga caatcagcag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tacaacaact accccctgac cttcggcgga 300
ggcaccaagg tggaaattaa a 321
<210> 157
<211> 443
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, тяжелая цепь
<400> 157
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys
210 215 220
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
290 295 300
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 158
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, легкая цепь
<400> 158
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 159
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, тяжелая цепь
<400> 159
caggtcacac tgagagagtc cggccctgcc ctggtgaaac ccacccagac cctgaccctg 60
acatgcacct tcagcggctt cagcctgagc acctacggca tcggcgtggg ctggatcaga 120
cagccccctg gcaaggccct ggaatggctg gcccacatct ggtggaacga caacaagtac 180
tacagcacca gcctgaaaac ccggctgacc atcagcaagg acaccagcaa gaaccaggtg 240
gtgctgacca tgaccaacat ggaccccgtg gacaccgcca cctactactg cgcccggatc 300
agcctgccct acttcgacta ctggggccag ggcaccctgg tgaccgtgtc ctcagccagc 360
accaagggcc ccagcgtgtt ccctctggcc ccttgtagca gaagcaccag cgagtctaca 420
gccgccctgg gctgcctcgt gaaggactac tttcccgagc ccgtgaccgt gtcctggaac 480
tctggcgctc tgacaagcgg cgtgcacacc tttccagccg tgctgcagag cagcggcctg 540
tactctctga gcagcgtcgt gacagtgccc agcagcaact tcggcaccca gacctacacc 600
tgtaacgtgg accacaagcc cagcaacacc aaggtggaca agaccgtgga acggaagtgc 660
tgcgtggaat gccccccttg tcctgcccct ccagtggctg gcccttccgt gttcctgttc 720
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg 780
gtggatgtgt cccacgagga ccccgaggtg cagttcaatt ggtacgtgga cggcgtggaa 840
gtgcacaacg ccaagaccaa gcccagagag gaacagttca acagcacctt ccgggtggtg 900
tccgtgctga ccgtggtgca tcaggactgg ctgaacggca aagagtacaa gtgcaaggtg 960
tccaacaagg gcctgcctgc ccccatcgag aaaaccatca gcaagaccaa aggccagccc 1020
cgcgagcccc aggtgtacac actgcctcca agccgggaag agatgaccaa gaaccaggtg 1080
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccca tgctggacag cgacggctca 1200
ttcttcctgt acagcaagct gacagtggac aagtcccggt ggcagcaggg caacgtgttc 1260
agctgcagcg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgagcctg 1320
agccctggc 1329
<210> 160
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TPP-3821, 3187HU2-hIgG2Kappa, легкая цепь
<400> 160
gatatccagc tgacccagag ccccagcttt ctgagcgcca gcgtgggcga cagagtgacc 60
atcacatgca aggccagcca gaacgtgggc acagccgtgg cctggtatca gcagaagcct 120
ggcaaggccc ccaagctgct gatctacagc gccagcaacc ggtacaccgg cgtgcccagc 180
agattttctg gcagcggctc cggcaccgag ttcaccctga caatcagcag cctgcagccc 240
gaggacttcg ccacctacta ctgccagcag tacaacaact accccctgac cttcggcgga 300
ggcaccaagg tggaaattaa acgaaccgtg gccgctccca gcgtgttcat cttcccacct 360
agcgacgagc agctgaagtc cggcacagcc tctgtcgtgt gcctgctgaa caacttctac 420
ccccgcgagg ccaaggtgca gtggaaggtg gacaatgccc tgcagagcgg caacagccag 480
gaaagcgtga ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaagtgac ccaccagggc 600
ctgtctagcc ccgtgaccaa gagcttcaac cggggcgagt gt 642
<210> 161
<211> 532
<212> PRT
<213> Macaca mulatta (Rhesus monkey)
<400> 161
Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Leu Ile Gly Phe Asn
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val Ala Tyr
35 40 45
Val Ile Glu Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser Gly Arg
50 55 60
Glu Thr Val Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Ser Tyr Thr Leu Gln Val Ile Lys Gly Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Tyr Ile Thr Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Asp Phe Thr Cys Glu Pro Asp Ile His Ser Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Asp Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ala Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn Leu Ser
180 185 190
Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Val Pro Thr Ile
195 200 205
Ser Pro Ser Asn Ser Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Thr Ala Gln Tyr Ser Trp Phe Val Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala Tyr Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Met Met Ile Thr Val Ser Gly Ile Glu
275 280 285
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
290 295 300
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
305 310 315 320
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
325 330 335
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
340 345 350
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
355 360 365
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
370 375 380
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
385 390 395 400
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
405 410 415
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
420 425 430
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
435 440 445
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
450 455 460
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
465 470 475 480
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
485 490 495
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
500 505 510
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
515 520 525
His His His His
530
<210> 162
<211> 292
<212> PRT
<213> Homo sapiens
<400> 162
Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Val Gln Asn Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Met Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ser Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn Arg Ser
180 185 190
Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Gly Pro Thr Ile
195 200 205
Ser Pro Ser Lys Ala Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe Ile Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala His Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Thr Met Ile Thr Val Ser Gly His His
275 280 285
His His His His
290
<210> 163
<211> 404
<212> PRT
<213> Homo sapiens
<400> 163
Gln Leu Thr Thr Glu Ser Met Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Val His Asn Leu Pro Gln Gln Leu Phe Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Arg Gln Ile Val Gly Tyr
35 40 45
Ala Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Asn Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asp Thr Thr Tyr Leu Trp
130 135 140
Trp Ile Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Thr Arg Asn Asp Thr
165 170 175
Gly Pro Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn Arg Ser
180 185 190
Asp Pro Val Thr Leu Asn Val Thr Tyr Gly Pro Asp Thr Pro Thr Ile
195 200 205
Ser Pro Ser Asp Thr Tyr Tyr Arg Pro Gly Ala Asn Leu Ser Leu Ser
210 215 220
Cys Tyr Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Leu Ile Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Thr Cys His Ala Asn Asn Ser Val Thr
260 265 270
Gly Cys Asn Arg Thr Thr Val Lys Thr Ile Ile Val Thr Glu Leu Ser
275 280 285
Pro Val Val Ala Lys Pro Gln Ile Lys Ala Ser Lys Thr Thr Val Thr
290 295 300
Gly Asp Lys Asp Ser Val Asn Leu Thr Cys Ser Thr Asn Asp Thr Gly
305 310 315 320
Ile Ser Ile Arg Trp Phe Phe Lys Asn Gln Ser Leu Pro Ser Ser Glu
325 330 335
Arg Met Lys Leu Ser Gln Gly Asn Thr Thr Leu Ser Ile Asn Pro Val
340 345 350
Lys Arg Glu Asp Ala Gly Thr Tyr Trp Cys Glu Val Phe Asn Pro Ile
355 360 365
Ser Lys Asn Gln Ser Asp Pro Ile Met Leu Asn Val Asn Tyr Asn Ala
370 375 380
Leu Pro Gln Glu Asn Gly Leu Ser Pro Gly His His His His His His
385 390 395 400
His His His His
<210> 164
<211> 657
<212> PRT
<213> Homo sapiens
<400> 164
Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Val His Asn Leu Pro Gln His Leu Phe Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Arg Gln Ile Ile Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly Arg
50 55 60
Glu Ile Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Ile Ile Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu His Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe Arg Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Lys Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asp Ala Thr Tyr Leu Trp
130 135 140
Trp Val Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Arg Thr Leu Thr Leu Phe Asn Val Thr Arg Asn Asp Ser
165 170 175
Ala Ser Tyr Lys Cys Glu Thr Gln Asn Pro Val Ser Ala Arg Arg Ser
180 185 190
Asp Ser Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Ala Pro Thr Ile
195 200 205
Ser Pro Leu Asn Thr Ser Tyr Arg Ser Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe Val Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Thr Cys Gln Ala His Asn Ser Asp Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Thr Thr Ile Thr Val Tyr Ala Glu Pro
275 280 285
Pro Lys Pro Phe Ile Thr Ser Asn Asn Ser Asn Pro Val Glu Asp Glu
290 295 300
Asp Ala Val Ala Leu Thr Cys Glu Pro Glu Ile Gln Asn Thr Thr Tyr
305 310 315 320
Leu Trp Trp Val Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
325 330 335
Leu Ser Asn Asp Asn Arg Thr Leu Thr Leu Leu Ser Val Thr Arg Asn
340 345 350
Asp Val Gly Pro Tyr Glu Cys Gly Ile Gln Asn Glu Leu Ser Val Asp
355 360 365
His Ser Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Asp Pro
370 375 380
Thr Ile Ser Pro Ser Tyr Thr Tyr Tyr Arg Pro Gly Val Asn Leu Ser
385 390 395 400
Leu Ser Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Leu
405 410 415
Ile Asp Gly Asn Ile Gln Gln His Thr Gln Glu Leu Phe Ile Ser Asn
420 425 430
Ile Thr Glu Lys Asn Ser Gly Leu Tyr Thr Cys Gln Ala Asn Asn Ser
435 440 445
Ala Ser Gly His Ser Arg Thr Thr Val Lys Thr Ile Thr Val Ser Ala
450 455 460
Glu Leu Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Lys Pro Val Glu
465 470 475 480
Asp Lys Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Ala Gln Asn Thr
485 490 495
Thr Tyr Leu Trp Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg
500 505 510
Leu Gln Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Phe Asn Val Thr
515 520 525
Arg Asn Asp Ala Arg Ala Tyr Val Cys Gly Ile Gln Asn Ser Val Ser
530 535 540
Ala Asn Arg Ser Asp Pro Val Thr Leu Asp Val Leu Tyr Gly Pro Asp
545 550 555 560
Thr Pro Ile Ile Ser Pro Pro Asp Ser Ser Tyr Leu Ser Gly Ala Asn
565 570 575
Leu Asn Leu Ser Cys His Ser Ala Ser Asn Pro Ser Pro Gln Tyr Ser
580 585 590
Trp Arg Ile Asn Gly Ile Pro Gln Gln His Thr Gln Val Leu Phe Ile
595 600 605
Ala Lys Ile Thr Pro Asn Asn Asn Gly Thr Tyr Ala Cys Phe Val Ser
610 615 620
Asn Leu Ala Thr Gly Arg Asn Asn Ser Ile Val Lys Ser Ile Thr Val
625 630 635 640
Ser Ala Ser Gly Thr Ser Pro Gly Leu Ser Ala His His His His His
645 650 655
His
<210> 165
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1790, hCeacam6-WT-Fc-6xHis
<400> 165
Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Val Gln Asn Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Met Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ser Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn Arg Ser
180 185 190
Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Gly Pro Thr Ile
195 200 205
Ser Pro Ser Lys Ala Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe Ile Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala His Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Thr Met Ile Thr Val Ser Gly Ile Glu
275 280 285
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
290 295 300
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
305 310 315 320
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
325 330 335
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
340 345 350
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
355 360 365
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
370 375 380
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
385 390 395 400
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
405 410 415
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
420 425 430
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
435 440 445
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
450 455 460
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
465 470 475 480
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
485 490 495
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
500 505 510
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
515 520 525
His His His His
530
<210> 166
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1791, hCeacam6-Dom1-MacMul-Xa-Fc-His
<400> 166
Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Leu Ile Gly Phe Asn
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val Ala Tyr
35 40 45
Val Ile Glu Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser Gly Arg
50 55 60
Glu Thr Val Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Ser Tyr Thr Leu Gln Val Ile Lys Gly Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Val Gln Asn Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Met Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ser Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn Arg Ser
180 185 190
Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Gly Pro Thr Ile
195 200 205
Ser Pro Ser Lys Ala Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe Ile Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala His Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Thr Met Ile Thr Val Ser Gly Ile Glu
275 280 285
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
290 295 300
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
305 310 315 320
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
325 330 335
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
340 345 350
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
355 360 365
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
370 375 380
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
385 390 395 400
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
405 410 415
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
420 425 430
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
435 440 445
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
450 455 460
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
465 470 475 480
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
485 490 495
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
500 505 510
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
515 520 525
His His His His
530
<210> 167
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1792, hCeacam6-Dom2-MacMul-Xa-Fc-His
<400> 167
Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Tyr Ile Thr Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Asp Phe Thr Cys Glu Pro Asp Ile His Ser Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Asp Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ala Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn Leu Ser
180 185 190
Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Gly Pro Thr Ile
195 200 205
Ser Pro Ser Lys Ala Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe Ile Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala His Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Thr Met Ile Thr Val Ser Gly Ile Glu
275 280 285
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
290 295 300
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
305 310 315 320
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
325 330 335
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
340 345 350
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
355 360 365
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
370 375 380
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
385 390 395 400
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
405 410 415
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
420 425 430
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
435 440 445
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
450 455 460
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
465 470 475 480
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
485 490 495
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
500 505 510
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
515 520 525
His His His His
530
<210> 168
<211> 532
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1793, hCeacam6-Dom3-MacMul-Xa-Fc-His
<400> 168
Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Ala Phe Thr Cys Glu Pro Glu Val Gln Asn Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Met Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ser Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn Arg Ser
180 185 190
Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Val Pro Thr Ile
195 200 205
Ser Pro Ser Asn Ser Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Thr Ala Gln Tyr Ser Trp Phe Val Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala Tyr Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Met Met Ile Thr Val Ser Gly Ile Glu
275 280 285
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
290 295 300
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
305 310 315 320
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
325 330 335
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
340 345 350
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
355 360 365
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
370 375 380
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
385 390 395 400
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
405 410 415
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
420 425 430
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
435 440 445
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
450 455 460
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
465 470 475 480
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
485 490 495
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
500 505 510
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
515 520 525
His His His His
530
<210> 169
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-1794, hCeacam6-Dom1-8xHis (E.coli)
<400> 169
Met Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys
1 5 10 15
Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly Tyr
20 25 30
Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly
35 40 45
Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly
50 55 60
Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr
65 70 75 80
Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu
85 90 95
Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Gly Ser Gly
100 105 110
Ser His His His His His His His His
115 120
<210> 170
<211> 533
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2443, cyno CEACAM-6-Xa-Fc-His
<400> 170
Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Thr Leu Gly Phe Asn
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val Ala Tyr
35 40 45
Val Ile Gly Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser Gly Arg
50 55 60
Glu Met Ile Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Ser Tyr Thr Leu Gln Ala Ile Lys Glu Asp Leu Val
85 90 95
Thr Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu Pro Lys
100 105 110
Pro Tyr Ile Thr Ser Asn Asn Ser Asn Pro Val Glu Asp Lys Asp Ala
115 120 125
Val Asp Phe Thr Cys Glu Pro Asp Ile His Ser Thr Thr Tyr Leu Trp
130 135 140
Trp Val Asn Asp Gln Ser Leu Pro Val Ser Pro Arg Leu Gln Leu Ser
145 150 155 160
Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Lys Arg Asn Asp Ala
165 170 175
Gly Ala Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn Leu Ser
180 185 190
Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Val Pro Thr Ile
195 200 205
Ser Pro Ser Asn Ser Asn Tyr Arg Pro Gly Glu Asn Leu Asn Leu Ser
210 215 220
Cys His Ala Ala Ser Asn Pro Thr Ala Gln Tyr Ser Trp Phe Val Asn
225 230 235 240
Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn Ile Thr
245 250 255
Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala Tyr Asn Ser Ala Thr
260 265 270
Gly Leu Asn Arg Thr Thr Val Met Met Ile Thr Val Ser Gly Ser Ile
275 280 285
Glu Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His
290 295 300
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
305 310 315 320
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
325 330 335
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
340 345 350
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
355 360 365
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
370 375 380
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
385 390 395 400
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
405 410 415
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
420 425 430
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
435 440 445
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
450 455 460
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
465 470 475 480
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
485 490 495
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
500 505 510
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His
515 520 525
His His His His His
530
<210> 171
<211> 356
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-2452, cynomolgus Ceacam6-Dom1-Xa-Fc-His
<400> 171
Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Thr Leu Gly Phe Asn
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val Ala Tyr
35 40 45
Val Ile Gly Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser Gly Arg
50 55 60
Glu Met Ile Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Thr Gly Ser Tyr Thr Leu Gln Ala Ile Lys Glu Asp Leu Val
85 90 95
Thr Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu Ile Glu
100 105 110
Gly Arg Asp Met Asp Thr Gly Pro Lys Ser Cys Asp Lys Thr His Thr
115 120 125
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
130 135 140
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
145 150 155 160
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
165 170 175
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
180 185 190
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
195 200 205
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
210 215 220
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
225 230 235 240
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
245 250 255
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
260 265 270
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
275 280 285
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
290 295 300
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
305 310 315 320
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
325 330 335
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys His His
340 345 350
His His His His
355
<210> 172
<211> 127
<212> PRT
<213> Homo sapiens
<400> 172
Lys Leu Thr Ile Glu Ser Met Pro Leu Ser Val Ala Glu Gly Lys Glu
1 5 10 15
Val Leu Leu Leu Val His Asn Leu Pro Gln His Leu Phe Gly Tyr Ser
20 25 30
Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly Tyr
35 40 45
Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Ala Ala Tyr Ser Gly Arg
50 55 60
Glu Thr Ile Tyr Thr Asn Ala Ser Leu Leu Ile Gln Asn Val Thr Gln
65 70 75 80
Asn Asp Ile Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu Val
85 90 95
Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Gln Glu Asn Ala Pro
100 105 110
Gly Leu Pro Val Gly Ala Val Ala Gly His His His His His His
115 120 125
<210> 173
<211> 526
<212> PRT
<213> Homo sapiens
<400> 173
Met Gly His Leu Ser Ala Pro Leu His Arg Val Arg Val Pro Trp Gln
1 5 10 15
Gly Leu Leu Leu Thr Ala Ser Leu Leu Thr Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Gln Leu Thr Thr Glu Ser Met Pro Phe Asn Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Val His Asn Leu Pro Gln Gln Leu Phe Gly
50 55 60
Tyr Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Arg Gln Ile Val
65 70 75 80
Gly Tyr Ala Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Asn Ser
85 90 95
Gly Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val
100 105 110
Thr Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp
115 120 125
Leu Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu
130 135 140
Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asp Thr Thr Tyr
165 170 175
Leu Trp Trp Ile Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Thr Arg Asn
195 200 205
Asp Thr Gly Pro Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn
210 215 220
Arg Ser Asp Pro Val Thr Leu Asn Val Thr Tyr Gly Pro Asp Thr Pro
225 230 235 240
Thr Ile Ser Pro Ser Asp Thr Tyr Tyr Arg Pro Gly Ala Asn Leu Ser
245 250 255
Leu Ser Cys Tyr Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Leu
260 265 270
Ile Asn Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn
275 280 285
Ile Thr Val Asn Asn Ser Gly Ser Tyr Thr Cys His Ala Asn Asn Ser
290 295 300
Val Thr Gly Cys Asn Arg Thr Thr Val Lys Thr Ile Ile Val Thr Glu
305 310 315 320
Leu Ser Pro Val Val Ala Lys Pro Gln Ile Lys Ala Ser Lys Thr Thr
325 330 335
Val Thr Gly Asp Lys Asp Ser Val Asn Leu Thr Cys Ser Thr Asn Asp
340 345 350
Thr Gly Ile Ser Ile Arg Trp Phe Phe Lys Asn Gln Ser Leu Pro Ser
355 360 365
Ser Glu Arg Met Lys Leu Ser Gln Gly Asn Thr Thr Leu Ser Ile Asn
370 375 380
Pro Val Lys Arg Glu Asp Ala Gly Thr Tyr Trp Cys Glu Val Phe Asn
385 390 395 400
Pro Ile Ser Lys Asn Gln Ser Asp Pro Ile Met Leu Asn Val Asn Tyr
405 410 415
Asn Ala Leu Pro Gln Glu Asn Gly Leu Ser Pro Gly Ala Ile Ala Gly
420 425 430
Ile Val Ile Gly Val Val Ala Leu Val Ala Leu Ile Ala Val Ala Leu
435 440 445
Ala Cys Phe Leu His Phe Gly Lys Thr Gly Arg Ala Ser Asp Gln Arg
450 455 460
Asp Leu Thr Glu His Lys Pro Ser Val Ser Asn His Thr Gln Asp His
465 470 475 480
Ser Asn Asp Pro Pro Asn Lys Met Asn Glu Val Thr Tyr Ser Thr Leu
485 490 495
Asn Phe Glu Ala Gln Gln Pro Thr Gln Pro Thr Ser Ala Ser Pro Ser
500 505 510
Leu Thr Ala Thr Glu Ile Ile Tyr Ser Glu Val Lys Lys Gln
515 520 525
<210> 174
<211> 300
<212> PRT
<213> Homo sapiens
<400> 174
Met Glu Ile Pro Met Gly Thr Gln Gly Cys Phe Ser Lys Ser Leu Leu
1 5 10 15
Leu Ser Ala Ser Ile Leu Val Leu Trp Met Leu Gln Gly Ser Gln Ala
20 25 30
Ala Leu Tyr Ile Gln Lys Ile Pro Glu Gln Pro Gln Lys Asn Gln Asp
35 40 45
Leu Leu Leu Ser Val Gln Gly Val Pro Asp Thr Phe Gln Asp Phe Asn
50 55 60
Trp Tyr Leu Gly Glu Glu Thr Tyr Gly Gly Thr Arg Leu Phe Thr Tyr
65 70 75 80
Ile Pro Gly Ile Gln Arg Pro Gln Arg Asp Gly Ser Ala Met Gly Gln
85 90 95
Arg Asp Ile Val Gly Phe Pro Asn Gly Ser Met Leu Leu Arg Arg Ala
100 105 110
Gln Pro Thr Asp Ser Gly Thr Tyr Gln Val Ala Ile Thr Ile Asn Ser
115 120 125
Glu Trp Thr Met Lys Ala Lys Thr Glu Val Gln Val Ala Glu Lys Asn
130 135 140
Lys Glu Leu Pro Ser Thr His Leu Pro Thr Asn Ala Gly Ile Leu Ala
145 150 155 160
Ala Thr Ile Ile Gly Ser Leu Ala Ala Gly Ala Leu Leu Ile Ser Cys
165 170 175
Ile Ala Tyr Leu Leu Val Thr Arg Asn Trp Arg Gly Gln Ser His Arg
180 185 190
Leu Pro Ala Pro Arg Gly Gln Gly Ser Leu Ser Ile Leu Cys Ser Ala
195 200 205
Val Ser Pro Val Pro Ser Val Thr Pro Ser Thr Trp Met Ala Thr Thr
210 215 220
Glu Lys Pro Glu Leu Gly Pro Ala His Asp Ala Gly Asp Asn Asn Ile
225 230 235 240
Tyr Glu Val Met Pro Ser Pro Val Leu Leu Val Ser Pro Ile Ser Asp
245 250 255
Thr Arg Ser Ile Asn Pro Ala Arg Pro Leu Pro Thr Pro Pro His Leu
260 265 270
Gln Ala Glu Pro Glu Asn His Gln Tyr Gln Gln Asp Leu Leu Asn Pro
275 280 285
Asp Pro Ala Pro Tyr Cys Gln Leu Val Pro Thr Ser
290 295 300
<210> 175
<211> 252
<212> PRT
<213> Homo sapiens
<400> 175
Met Gly Pro Pro Ser Ala Ser Pro His Arg Glu Cys Ile Pro Trp Gln
1 5 10 15
Gly Leu Leu Leu Thr Ala Ser Leu Leu Asn Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Lys Leu Thr Ile Glu Ser Met Pro Leu Ser Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Val His Asn Leu Pro Gln His Leu Phe Gly
50 55 60
Tyr Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val
65 70 75 80
Gly Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Ala Ala Tyr Ser
85 90 95
Gly Arg Glu Thr Ile Tyr Thr Asn Ala Ser Leu Leu Ile Gln Asn Val
100 105 110
Thr Gln Asn Asp Ile Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp
115 120 125
Leu Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Gln Glu Asn
130 135 140
Ala Pro Gly Leu Pro Val Gly Ala Val Ala Gly Ile Val Thr Gly Val
145 150 155 160
Leu Val Gly Val Ala Leu Val Ala Ala Leu Val Cys Phe Leu Leu Leu
165 170 175
Ala Lys Thr Gly Arg Thr Ser Ile Gln Arg Asp Leu Lys Glu Gln Gln
180 185 190
Pro Gln Ala Leu Ala Pro Gly Arg Gly Pro Ser His Ser Ser Ala Phe
195 200 205
Ser Met Ser Pro Leu Ser Thr Ala Gln Ala Pro Leu Pro Asn Pro Arg
210 215 220
Thr Ala Ala Ser Ile Tyr Glu Glu Leu Leu Lys His Asp Thr Asn Ile
225 230 235 240
Tyr Cys Arg Met Asp His Lys Ala Glu Val Ala Ser
245 250
<210> 176
<211> 702
<212> PRT
<213> Homo sapiens
<400> 176
Met Glu Ser Pro Ser Ala Pro Pro His Arg Trp Cys Ile Pro Trp Gln
1 5 10 15
Arg Leu Leu Leu Thr Ala Ser Leu Leu Thr Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Val His Asn Leu Pro Gln His Leu Phe Gly
50 55 60
Tyr Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Arg Gln Ile Ile
65 70 75 80
Gly Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser
85 90 95
Gly Arg Glu Ile Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Ile
100 105 110
Ile Gln Asn Asp Thr Gly Phe Tyr Thr Leu His Val Ile Lys Ser Asp
115 120 125
Leu Val Asn Glu Glu Ala Thr Gly Gln Phe Arg Val Tyr Pro Glu Leu
130 135 140
Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Lys Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asp Ala Thr Tyr
165 170 175
Leu Trp Trp Val Asn Asn Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Phe Asn Val Thr Arg Asn
195 200 205
Asp Thr Ala Ser Tyr Lys Cys Glu Thr Gln Asn Pro Val Ser Ala Arg
210 215 220
Arg Ser Asp Ser Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Ala Pro
225 230 235 240
Thr Ile Ser Pro Leu Asn Thr Ser Tyr Arg Ser Gly Glu Asn Leu Asn
245 250 255
Leu Ser Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe
260 265 270
Val Asn Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn
275 280 285
Ile Thr Val Asn Asn Ser Gly Ser Tyr Thr Cys Gln Ala His Asn Ser
290 295 300
Asp Thr Gly Leu Asn Arg Thr Thr Val Thr Thr Ile Thr Val Tyr Ala
305 310 315 320
Glu Pro Pro Lys Pro Phe Ile Thr Ser Asn Asn Ser Asn Pro Val Glu
325 330 335
Asp Glu Asp Ala Val Ala Leu Thr Cys Glu Pro Glu Ile Gln Asn Thr
340 345 350
Thr Tyr Leu Trp Trp Val Asn Asn Gln Ser Leu Pro Val Ser Pro Arg
355 360 365
Leu Gln Leu Ser Asn Asp Asn Arg Thr Leu Thr Leu Leu Ser Val Thr
370 375 380
Arg Asn Asp Val Gly Pro Tyr Glu Cys Gly Ile Gln Asn Lys Leu Ser
385 390 395 400
Val Asp His Ser Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp
405 410 415
Asp Pro Thr Ile Ser Pro Ser Tyr Thr Tyr Tyr Arg Pro Gly Val Asn
420 425 430
Leu Ser Leu Ser Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser
435 440 445
Trp Leu Ile Asp Gly Asn Ile Gln Gln His Thr Gln Glu Leu Phe Ile
450 455 460
Ser Asn Ile Thr Glu Lys Asn Ser Gly Leu Tyr Thr Cys Gln Ala Asn
465 470 475 480
Asn Ser Ala Ser Gly His Ser Arg Thr Thr Val Lys Thr Ile Thr Val
485 490 495
Ser Ala Glu Leu Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Lys Pro
500 505 510
Val Glu Asp Lys Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Ala Gln
515 520 525
Asn Thr Thr Tyr Leu Trp Trp Val Asn Gly Gln Ser Leu Pro Val Ser
530 535 540
Pro Arg Leu Gln Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Phe Asn
545 550 555 560
Val Thr Arg Asn Asp Ala Arg Ala Tyr Val Cys Gly Ile Gln Asn Ser
565 570 575
Val Ser Ala Asn Arg Ser Asp Pro Val Thr Leu Asp Val Leu Tyr Gly
580 585 590
Pro Asp Thr Pro Ile Ile Ser Pro Pro Asp Ser Ser Tyr Leu Ser Gly
595 600 605
Ala Asn Leu Asn Leu Ser Cys His Ser Ala Ser Asn Pro Ser Pro Gln
610 615 620
Tyr Ser Trp Arg Ile Asn Gly Ile Pro Gln Gln His Thr Gln Val Leu
625 630 635 640
Phe Ile Ala Lys Ile Thr Pro Asn Asn Asn Gly Thr Tyr Ala Cys Phe
645 650 655
Val Ser Asn Leu Ala Thr Gly Arg Asn Asn Ser Ile Val Lys Ser Ile
660 665 670
Thr Val Ser Ala Ser Gly Thr Ser Pro Gly Leu Ser Ala Gly Ala Thr
675 680 685
Val Gly Ile Met Ile Gly Val Leu Val Gly Val Ala Leu Ile
690 695 700
<210> 177
<211> 344
<212> PRT
<213> Macaca fascicularis (Cynomolgus monkey)
<400> 177
Met Gly Pro Pro Ser Ala Pro Pro Cys Arg Ile Cys Val Pro Trp Lys
1 5 10 15
Glu Val Leu Leu Thr Ala Ser Leu Leu Thr Phe Trp Ser Pro Pro Thr
20 25 30
Thr Ala Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Thr Leu Gly
50 55 60
Phe Asn Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val
65 70 75 80
Ala Tyr Val Ile Gly Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser
85 90 95
Gly Arg Glu Met Ile Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val
100 105 110
Thr Gln Asn Asp Thr Gly Ser Tyr Thr Leu Gln Ala Ile Lys Glu Asp
115 120 125
Leu Val Thr Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu
130 135 140
Pro Lys Pro Tyr Ile Thr Ser Asn Asn Ser Asn Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Asp Phe Thr Cys Glu Pro Asp Ile His Ser Thr Thr Tyr
165 170 175
Leu Trp Trp Val Asn Asp Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Lys Arg Asn
195 200 205
Asp Ala Gly Ala Tyr Glu Cys Glu Ile Gln Asn Pro Val Ser Ala Asn
210 215 220
Leu Ser Asp Pro Val Ile Leu Asn Val Leu Tyr Gly Pro Asp Val Pro
225 230 235 240
Thr Ile Ser Pro Ser Asn Ser Asn Tyr Arg Pro Gly Glu Asn Leu Asn
245 250 255
Leu Ser Cys His Ala Ala Ser Asn Pro Thr Ala Gln Tyr Ser Trp Phe
260 265 270
Val Asn Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn
275 280 285
Ile Thr Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala Tyr Asn Ser
290 295 300
Ala Thr Gly Leu Asn Arg Thr Thr Val Met Met Ile Thr Val Ser Gly
305 310 315 320
Ser Ala Pro Gly Leu Ser Ala Val Ala Thr Val Gly Ile Met Ile Gly
325 330 335
Val Leu Ala Arg Val Ala Leu Ile
340
<210> 178
<211> 349
<212> PRT
<213> Homo sapiens
<400> 178
Met Gly Pro Ile Ser Ala Pro Ser Cys Arg Trp Arg Ile Pro Trp Gln
1 5 10 15
Gly Leu Leu Leu Thr Ala Ser Leu Phe Thr Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Gln Leu Thr Ile Glu Ala Val Pro Ser Asn Ala Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Val His Asn Leu Pro Gln Asp Pro Arg Gly
50 55 60
Tyr Asn Trp Tyr Lys Gly Glu Thr Val Asp Ala Asn Arg Arg Ile Ile
65 70 75 80
Gly Tyr Val Ile Ser Asn Gln Gln Ile Thr Pro Gly Pro Ala Tyr Ser
85 90 95
Asn Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Met Arg Asn Val
100 105 110
Thr Arg Asn Asp Thr Gly Ser Tyr Thr Leu Gln Val Ile Lys Leu Asn
115 120 125
Leu Met Ser Glu Glu Val Thr Gly Gln Phe Ser Val His Pro Glu Thr
130 135 140
Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Thr Gln Asn Thr Thr Tyr
165 170 175
Leu Trp Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Arg Thr Leu Thr Leu Leu Ser Val Thr Arg Asn
195 200 205
Asp Val Gly Pro Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn
210 215 220
Phe Ser Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Ala Pro
225 230 235 240
Thr Ile Ser Pro Ser Asp Thr Tyr Tyr His Ala Gly Val Asn Leu Asn
245 250 255
Leu Ser Cys His Ala Ala Ser Asn Pro Pro Ser Gln Tyr Ser Trp Ser
260 265 270
Val Asn Gly Thr Phe Gln Gln Tyr Thr Gln Lys Leu Phe Ile Pro Asn
275 280 285
Ile Thr Thr Lys Asn Ser Gly Ser Tyr Ala Cys His Thr Thr Asn Ser
290 295 300
Ala Thr Gly Arg Asn Arg Thr Thr Val Arg Met Ile Thr Val Ser Asp
305 310 315 320
Ala Leu Val Gln Gly Ser Ser Pro Gly Leu Ser Ala Arg Ala Thr Val
325 330 335
Ser Ile Met Ile Gly Val Leu Ala Arg Val Ala Leu Ile
340 345
<210> 179
<211> 344
<212> PRT
<213> Homo sapiens
<400> 179
Met Gly Pro Pro Ser Ala Pro Pro Cys Arg Leu His Val Pro Trp Lys
1 5 10 15
Glu Val Leu Leu Thr Ala Ser Leu Leu Thr Phe Trp Asn Pro Pro Thr
20 25 30
Thr Ala Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly
35 40 45
Lys Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Ile Gly
50 55 60
Tyr Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val
65 70 75 80
Gly Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser
85 90 95
Gly Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val
100 105 110
Thr Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp
115 120 125
Leu Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Glu Leu
130 135 140
Pro Lys Pro Ser Ile Ser Ser Asn Asn Ser Asn Pro Val Glu Asp Lys
145 150 155 160
Asp Ala Val Ala Phe Thr Cys Glu Pro Glu Val Gln Asn Thr Thr Tyr
165 170 175
Leu Trp Trp Val Asn Gly Gln Ser Leu Pro Val Ser Pro Arg Leu Gln
180 185 190
Leu Ser Asn Gly Asn Met Thr Leu Thr Leu Leu Ser Val Lys Arg Asn
195 200 205
Asp Ala Gly Ser Tyr Glu Cys Glu Ile Gln Asn Pro Ala Ser Ala Asn
210 215 220
Arg Ser Asp Pro Val Thr Leu Asn Val Leu Tyr Gly Pro Asp Gly Pro
225 230 235 240
Thr Ile Ser Pro Ser Lys Ala Asn Tyr Arg Pro Gly Glu Asn Leu Asn
245 250 255
Leu Ser Cys His Ala Ala Ser Asn Pro Pro Ala Gln Tyr Ser Trp Phe
260 265 270
Ile Asn Gly Thr Phe Gln Gln Ser Thr Gln Glu Leu Phe Ile Pro Asn
275 280 285
Ile Thr Val Asn Asn Ser Gly Ser Tyr Met Cys Gln Ala His Asn Ser
290 295 300
Ala Thr Gly Leu Asn Arg Thr Thr Val Thr Met Ile Thr Val Ser Gly
305 310 315 320
Ser Ala Pro Val Leu Ser Ala Val Ala Thr Val Gly Ile Thr Ile Gly
325 330 335
Val Leu Ala Arg Val Ala Leu Ile
340
<210> 180
<211> 123
<212> PRT
<213> Искусственная последовательность
<220>
<223> Macaca fascicularis CEACAM6-домен 1-His
<400> 180
Met Gln Leu Thr Ile Glu Ser Arg Pro Phe Asn Val Ala Glu Gly Lys
1 5 10 15
Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Thr Leu Gly Phe
20 25 30
Asn Trp Tyr Lys Gly Glu Arg Val Asp Ala Lys Arg Leu Ile Val Ala
35 40 45
Tyr Val Ile Gly Thr Gln Gln Thr Thr Pro Gly Pro Ala His Ser Gly
50 55 60
Arg Glu Met Ile Tyr Ser Asn Ala Ser Leu Leu Ile Gln Asn Val Thr
65 70 75 80
Gln Asn Asp Thr Gly Ser Tyr Thr Leu Gln Ala Ile Lys Glu Asp Leu
85 90 95
Val Thr Glu Glu Ala Thr Gly Arg Phe Trp Val Tyr Pro Glu Leu Gly
100 105 110
Ser Gly Ser His His His His His His His His
115 120
<210> 181
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-5468 - тяжелая цепь
<400> 181
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 182
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-5468 - легкая цепь
<400> 182
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 183
<211> 225
<212> PRT
<213> Искусственная последовательность
<220>
<223> APP-1574 - тяжелая цепь (Fab)
<400> 183
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Tyr
20 25 30
Gly Ile Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asn Lys Tyr Tyr Ser Thr Ser
50 55 60
Leu Lys Thr Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ser Leu Pro Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His
225
<210> 184
<211> 214
<212> PRT
<213> Искусственная последовательность
<220>
<223> APP-1574 - легкая цепь (Fab)
<400> 184
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 185
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-8697, hCEACAM6-домен 1-His - I30L
<400> 185
Met Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys
1 5 10 15
Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Leu Gly Tyr
20 25 30
Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly
35 40 45
Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly
50 55 60
Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr
65 70 75 80
Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu
85 90 95
Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Gly Ser Gly
100 105 110
Ser His His His His His His His His
115 120
<210> 186
<211> 121
<212> PRT
<213> Искусственная последовательность
<220>
<223> TPP-8698, hCEACAM6-домен 1-His - I30F
<400> 186
Met Lys Leu Thr Ile Glu Ser Thr Pro Phe Asn Val Ala Glu Gly Lys
1 5 10 15
Glu Val Leu Leu Leu Ala His Asn Leu Pro Gln Asn Arg Phe Gly Tyr
20 25 30
Ser Trp Tyr Lys Gly Glu Arg Val Asp Gly Asn Ser Leu Ile Val Gly
35 40 45
Tyr Val Ile Gly Thr Gln Gln Ala Thr Pro Gly Pro Ala Tyr Ser Gly
50 55 60
Arg Glu Thr Ile Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr
65 70 75 80
Gln Asn Asp Thr Gly Phe Tyr Thr Leu Gln Val Ile Lys Ser Asp Leu
85 90 95
Val Asn Glu Glu Ala Thr Gly Gln Phe His Val Tyr Pro Gly Ser Gly
100 105 110
Ser His His His His His His His His
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ СВЯЗУЮЩЕГО И АКТИВНОГО ВЕЩЕСТВА (ADC), ИМЕЮЩИЕ ФЕРМЕНТАТИВНО РАСЩЕПЛЯЕМЫЕ ГРУППЫ | 2017 |
|
RU2761390C2 |
| МОНОВАЛЕНТНЫЕ АНТИТЕЛА К ПРОПЕРДИНУ И ФРАГМЕНТЫ АНТИТЕЛ | 2018 |
|
RU2790103C2 |
| АНТИТЕЛА С ПРИВИТЫМ МОЗГОВЫМ НАТРИЙУРЕТИЧЕСКИМ ПЕПТИДОМ | 2019 |
|
RU2839970C2 |
| АНТИТЕЛА С ПРИВИТЫМ ПРЕДСЕРДНЫМ НАТРИЙУРЕТИЧЕСКИМ ПЕПТИДОМ | 2019 |
|
RU2822433C2 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ ФАКТОРА XI И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758160C2 |
| ПОЛИПЕПТИДЫ, КОТОРЫЕ СВЯЗЫВАЮТСЯ С КОМПОНЕНТОМ КОМПЛЕМЕНТА C5 ИЛИ СЫВОРОТОЧНЫМ АЛЬБУМИНОМ, И ИХ БЕЛКИ СЛИЯНИЯ | 2018 |
|
RU2794359C2 |
| ВАРИАНТНЫЕ СВЯЗЫВАЮЩИЕ CD3 ДОМЕНЫ И ИХ ПРИМЕНЕНИЕ В КОМБИНИРОВАННОЙ ТЕРАПИИ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2810222C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА СЛИТЫЙ БЕЛОК, В КОТОРОМ СЛИТЫ ПРОНИКАЮЩИЙ В ОПУХОЛЬ ПЕПТИД И АНТИАНГИОГЕННОЕ СРЕДСТВО, ДЛЯ ПРЕДУПРЕЖДЕНИЯ И ЛЕЧЕНИЯ РАКА ИЛИ СВЯЗАННЫХ С АНГИОГЕНЕЗОМ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2727238C2 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |




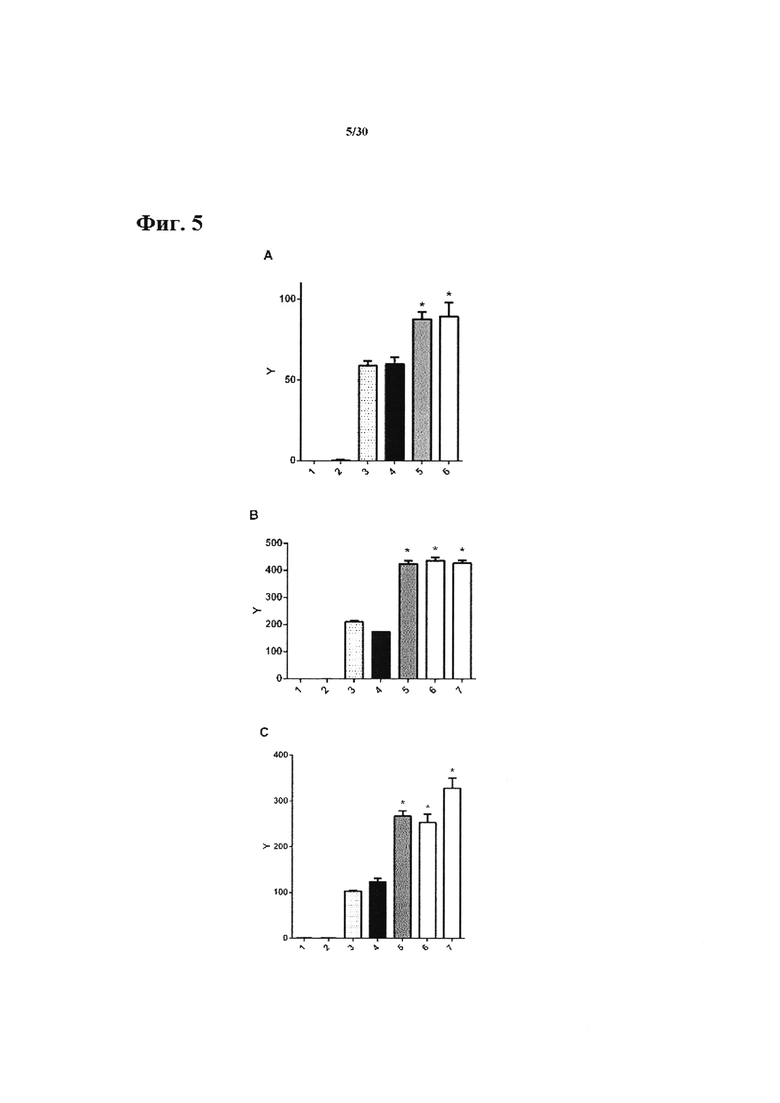
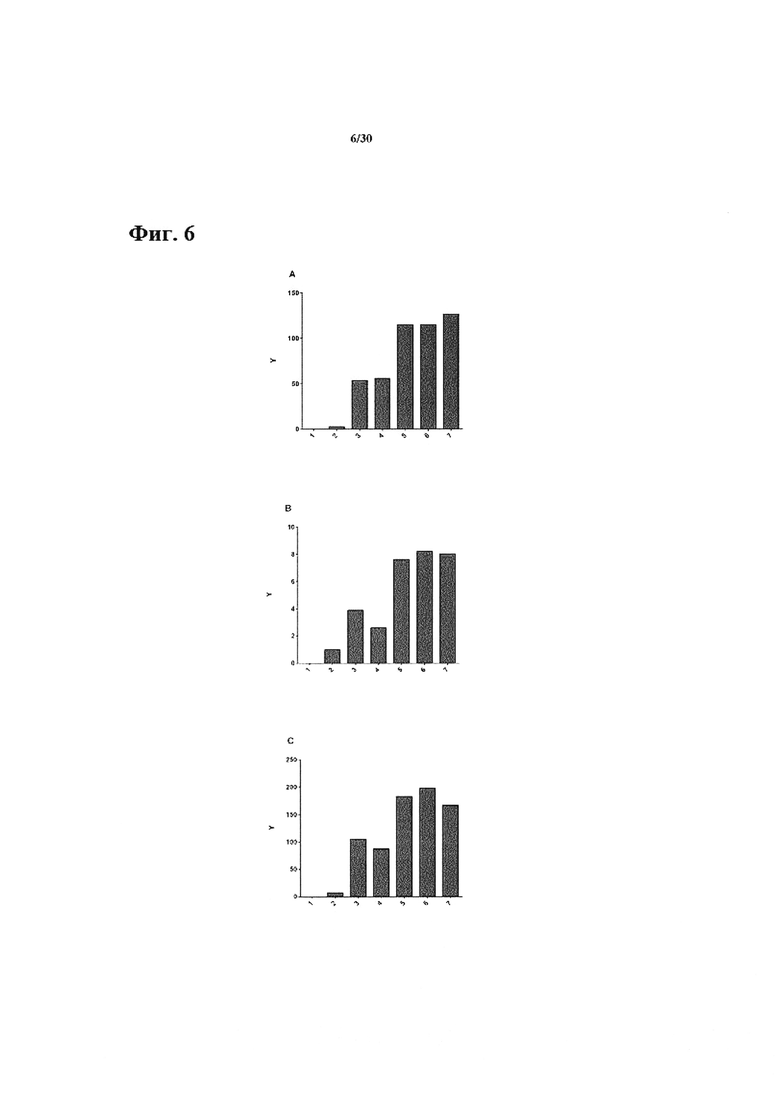
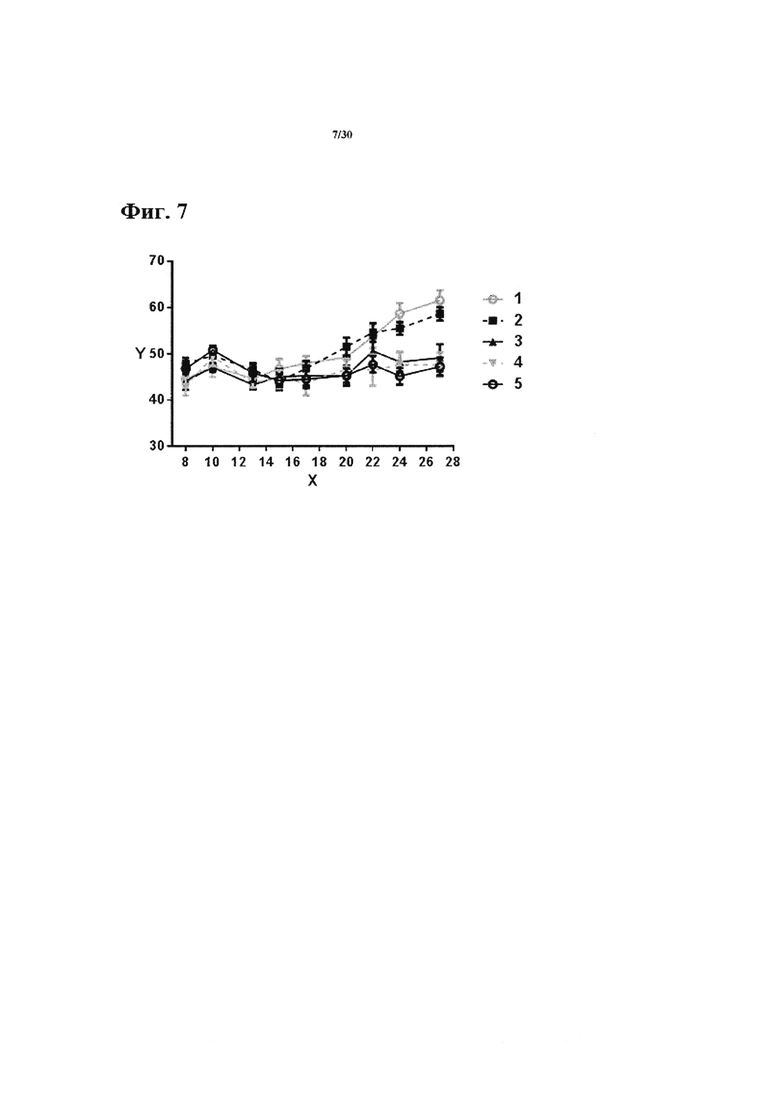




















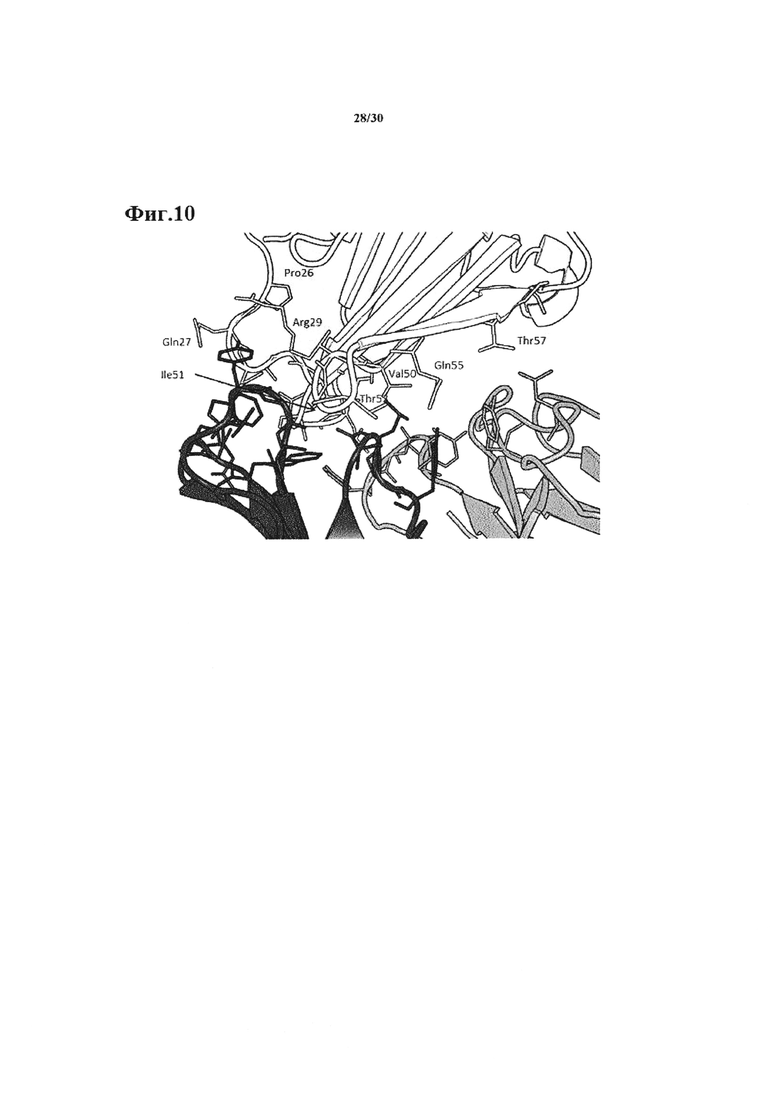
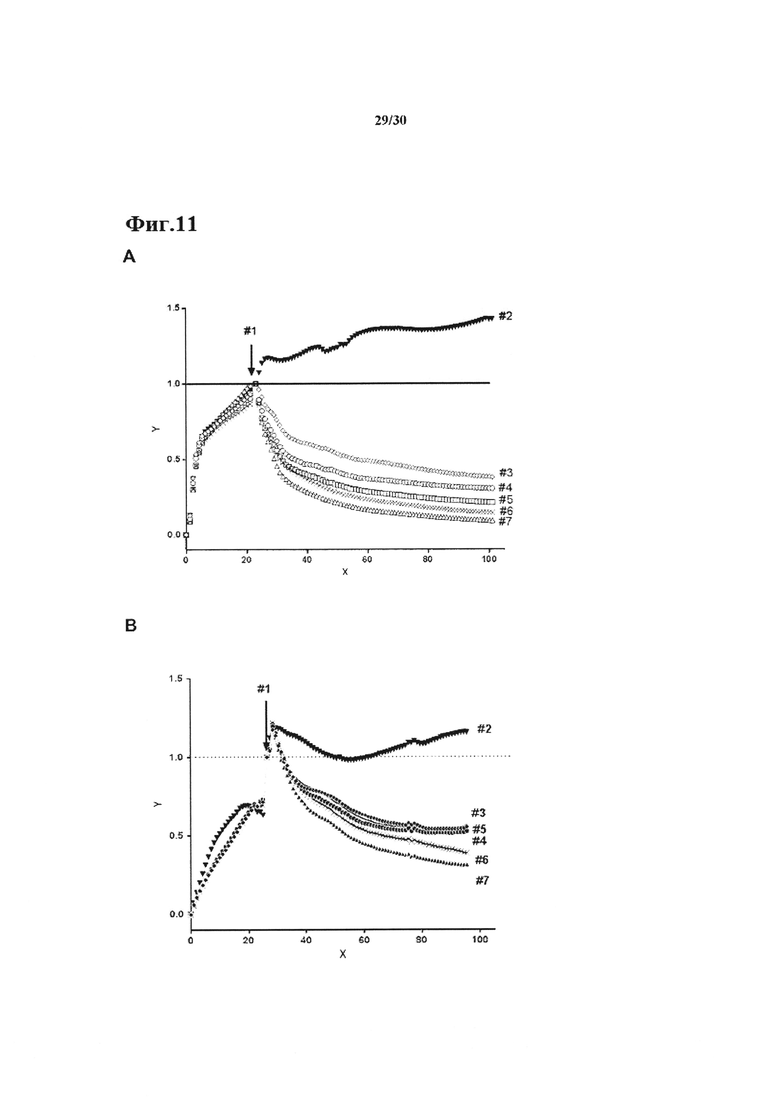
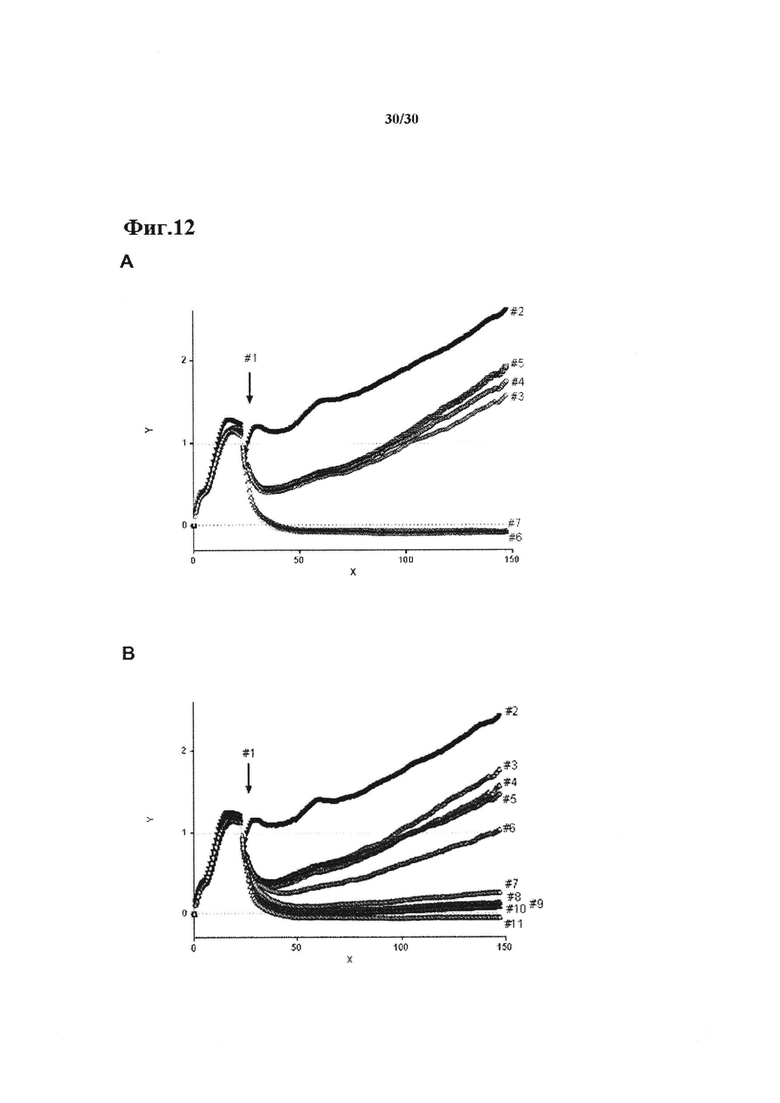
Изобретение относится к области биотехнологии. Предложено антитело или его антигенсвязывающий фрагмент, специфически связывающие СЕАСАМ6 человека и Масаса fascicularis. Антитела по изобретению не реагируют перекрестно в значительной степени с близкородственным человеческим СЕАСАМ1, человеческим СЕАСАМ3 и человеческим СЕАСАМ5. Также изобретение относится к нуклеиновым кислотам, кодирующим указанные антитело или его фрагмент, содержащим их векторам и клеткам, к способам получения антител, фармацевтическим композициям. Антитела могут применяться для лечения рака и других нарушений и состояний, связанных с экспрессией СЕАСАМ6. 13 н. и 7 з.п. ф-лы, 12 ил., 32 табл., 17 пр.
1. Выделенное анти-СЕАСАМ6 антитело или его антигенсвязывающий фрагмент, содержащие:
i. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 48, H-CDR2, содержащий SEQ ID NO: 49, и H-CDR3, содержащий SEQ ID NO: 50, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 52, L-CDR2, содержащий SEQ ID NO: 53, и L-CDR3, содержащий SEQ ID NO: 54, или
ii. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 106, H-CDR2, содержащий SEQ ID NO: 107, и H-CDR3, содержащий SEQ ID NO: 108, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 110, L-CDR2, содержащий SEQ ID NO: 111, и L-CDR3, содержащий SEQ ID NO: 112, или
iii. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 4, H-CDR2, содержащий SEQ ID NO: 5, и H-CDR3, содержащий SEQ ID NO: 6, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 8, L-CDR2, содержащий SEQ ID NO: 9, и L-CDR3, содержащий SEQ ID NO: 10, или
iv. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 34, H-CDR2, содержащий SEQ ID NO: 35, и H-CDR3, содержащий SEQ ID NO: 36, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 38, L-CDR2, содержащий SEQ ID NO: 39, и L-CDR3, содержащий SEQ ID NO: 40, или
v. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 120, H-CDR2, содержащий SEQ ID NO: 121, и H-CDR3, содержащий SEQ ID NO: 122, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 124, L-CDR2, содержащий SEQ ID NO: 125, и L-CDR3, содержащий SEQ ID NO: 126, или
vi. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 24, H-CDR2, содержащий SEQ ID NO: 25, и H-CDR3, содержащий SEQ ID NO: 26, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 28, L-CDR2, содержащий SEQ ID NO: 29, и L-CDR3, содержащий SEQ ID NO: 30, или
vii. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 76, H-CDR2, содержащий SEQ ID NO: 77, и H-CDR3, содержащий SEQ ID NO: 78, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 80, L-CDR2, содержащий SEQ ID NO: 81, и L-CDR3, содержащий SEQ ID NO: 82, или
viii. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 134, H-CDR2, содержащий SEQ ID NO: 135, и H-CDR3, содержащий SEQ ID NO: 136, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 138, L-CDR2, содержащий SEQ ID NO: 139, и L-CDR3, содержащий SEQ ID NO: 140, или
ix. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 148, H-CDR2, содержащий SEQ ID NO: 149, и H-CDR3, содержащий SEQ ID NO: 150, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 152, L-CDR2, содержащий SEQ ID NO: 153, и L-CDR3, содержащий SEQ ID NO: 154, или
x. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 14, H-CDR2, содержащий SEQ ID NO: 15, и H-CDR3, содержащий SEQ ID NO: 16, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 18, L-CDR2, содержащий SEQ ID NO: 19, и L-CDR3, содержащий SEQ ID NO: 20, или
xi. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 62, H-CDR2, содержащий SEQ ID NO: 63, и H-CDR3, содержащий SEQ ID NO: 64, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 66, L-CDR2, содержащий SEQ ID NO: 67, и L-CDR3, содержащий SEQ ID NO: 68, или
xii. антигенсвязывающую область тяжелой цепи, которая содержит Н-CDR1, содержащий SEQ ID NO: 92, H-CDR2, содержащий SEQ ID NO: 93, и H-CDR3, содержащий SEQ ID NO: 94, и антигенсвязывающую область легкой цепи, которая содержит L-CDR1, содержащий SEQ ID NO: 96, L-CDR2, содержащий SEQ ID NO: 97, и L-CDR3, содержащий SEQ ID NO: 98.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, содержащие
i. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 47, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 51, или
ii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 105, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 109, или
iii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 3, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 7, или
iv. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 33, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 37, или
v. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 119, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 123, или
vi. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 23, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 27, или
vii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 75, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 79, или
viii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 133, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 137, или
ix. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 147, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 151, или
x. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 13, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 17, или
xi. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 61, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 65, или
xii. вариабельную последовательность тяжелой цепи, как представлено SEQ ID NO: 91, и вариабельную последовательность легкой цепи, как представлено SEQ ID NO: 95.
3. Антитело по п. 1, которое представляет собой IgG антитело.
4. Антитело по п. 1, содержащее:
i. область тяжелой цепи, соответствующую SEQ ID NO: 57, и область легкой цепи, соответствующую SEQ ID NO: 58, или
ii. область тяжелой цепи, соответствующую SEQ ID NO: 115, и область легкой цепи, соответствующую SEQ ID NO: 116, или
iii. область тяжелой цепи, соответствующую SEQ ID NO: 43, и область легкой цепи, соответствующую SEQ ID NO: 44, или
iv. область тяжелой цепи, соответствующую SEQ ID NO: 129, и область легкой цепи, соответствующую SEQ ID NO: 130, или
v. область тяжелой цепи, соответствующую SEQ ID NO: 85, и область легкой цепи, соответствующую SEQ ID NO: 86, или
vi. область тяжелой цепи, соответствующую SEQ ID NO: 143, и область легкой цепи, соответствующую SEQ ID NO: 144, или
vii. область тяжелой цепи, соответствующую SEQ ID NO: 157, и область легкой цепи, соответствующую SEQ ID NO: 158, или
viii. область тяжелой цепи, соответствующую SEQ ID NO: 71, и область легкой цепи, соответствующую SEQ ID NO: 72, или
ix. область тяжелой цепи, соответствующую SEQ ID NO: 101, и область легкой цепи, соответствующую SEQ ID NO: 102.
5. Антигенсвязывающий фрагмент по п. 1, который представляет собой scFv-, Fab-, Fab'-фрагмент или F(ab')2-фрагмент.
6. Антитело или антигенсвязывающий фрагмент по п. 1, которые представляют собой моноклональное антитело или антигенсвязывающий фрагмент.
7. Антитело или антигенсвязывающий фрагмент по любому из пп. 1-6, которые представляют собой человеческое, гуманизированное или химерное антитело или его антигенсвязывающий фрагмент.
8. Конъюгат антитело-лекарственное средство в качестве диагностического агента при нацеливании на СЕАСАМ6, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7.
9. Конъюгат антитело-лекарственное средство в качестве терапевтического агента при нацеливании на СЕАСАМ6, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7.
10. Выделенная нуклеиновая кислота, которая кодирует антитело или антигенсвязывающий фрагмент по любому из пп. 1-7.
11. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 10.
12. Выделенная клетка-хозяин, экспрессирующая антитело или антигенсвязывающий фрагмент по любому из пп. 1-7 и содержащая нуклеиновую кислоту по п. 10 или вектор по п. 11.
13. Выделенная клетка по п. 12, где указанной клеткой является прокариотическая или эукариотическая клетка.
14. Способ получения антитела или антигенсвязывающего фрагмента по любому из пп. 1-7, включающий культивирование клетки по п. 13 и очистку антитела или антигенсвязывающего фрагмента.
15. Применение антитела или антигенсвязывающего фрагмента по любому из пп. 1-7 или конъюгата антитело-лекарственное средство по п. 9 в качестве лекарственного средства для лечения заболевания или состояния, связанного с нежелательным присутствием экспрессирующих СЕАСАМ6 клеток.
16. Применение антитела или антигенсвязывающего фрагмента по любому из пп. 1-7 или конъюгата антитело-лекарственное средство по п. 8 в качестве диагностического средства для диагноза злокачественных или диспластических состояний, при которых экспрессия СЕАСАМ6 повышена по сравнению с нормальной тканью.
17. Применение антитела или антигенсвязывающего фрагмента по любому из пп. 1-7 или конъюгата антитело-лекарственное средство по п. 9 в качестве лекарственного средства для лечения рака.
18. Фармацевтическая композиция для лечения заболевания или состояния, связанного с нежелательным присутствием экспрессирующих СЕАСАМ6 клеток, содержащая терапевтически эффективное количество антитела или антигенсвязывающего фрагмента по любому из пп. 1-7 или конъюгата антитело-лекарственное средство по п. 9.
19. Комбинация фармацевтической композиции по п. 18 и одного или более терапевтически активных соединений в терапевтически эффективном количестве для лечения заболевания или состояния, связанного с нежелательным присутствием экспрессирующих СЕАСАМ6 клеток.
20. Способ лечения заболевания или состояния, связанных с нежелательным присутствием СЕАСАМ6, включающий введение субъекту, нуждающемуся в этом, эффективного количества фармацевтической композиции по п. 18 или комбинации по п. 19.
| STRICKLAND L.A | |||
| et al., Preclinical evaluation of carcinoembryonic cell adhesion molecule (CEACAM) 6 as potential therapy target for pancreatic adenocarcinoma, J Pathol, 2009, vol.218, Issue 3, pp.380-390 | |||
| RILEY C.J | |||
| et al., Design and Activity of a Murine and Humanized Anti-CEACAM6 Single-Chain Variable Fragment in the Treatment of Pancreatic |
Авторы
Даты
2020-12-21—Публикация
2016-03-21—Подача