ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании заявок на патент США с номерами 62/631,043 (подана 15 февраля 2018 года; находится на стадии рассмотрения) и 62/738,632 (подана 28 сентября 2018 года; находится на стадии рассмотрения), содержание каждой из которых полностью включено в настоящую заявку посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка содержит один или более перечней последовательностей соответствующих положениям 37 C.F.R. 1.821 и далее, представленных на машиночитаемых носителях (название файла: 1301 0150РСТ ST25.txt, файл создан 30 января 2019 года и имеет размер 295037 байта), содержание указанного файла полностью включено в настоящую заявку.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к полиспецифичным связывающим молекулам (например, биспецифичному антителу, диателу, биспецифичному одноцепочечному вариабельному фрагменту (scFv), трехвалентной молекуле, тандемному димерному антителу (TandAb®), BiTE® и так далее), содержащим связывающий CD3 домен, способный связывать эпитоп CD3, а также домен, связывающий относящийся к заболеванию антиген, способный связывать эпитоп относящегося к заболеванию антигена («DA») (например, «связывающей DA × CD3 молекуле»). Настоящее изобретение, в частности, относится к таким связывающим DA × CD3 молекулам, содержащим вариантный связывающий CD3 домен (вариант связывающего CD3 домена, «в. связывающий CD3 домен»), который содержит домен CDRH1, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3, аминокислотная последовательность по меньшей мере одного из которых отличается от аминокислотной последовательности соответствующей CDR эталонного связывающего CD3 домена («эт. связывающего CD3 домена»), и при этом указанная связывающая DA × CD3 молекула, содержащая такой в. связывающий CD3 домен, проявляет измененную аффинность в отношении CD3 по сравнению со связывающей DA × CD3 молекулой, содержащей такой эт.связывающий CD3 домен. Настоящее изобретение, в частности, относится к таким связывающим DA × CD3 молекулам, содержащим в. связывающий CD3 домен, которые проявляют пониженную аффинность в отношении CD3 и способны опосредовать перенаправленное уничтожение экспрессирующих DA клеток-мишеней, а также демонстрируют более низкие уровни высвобождения цитокинов по сравнению со связывающей DA × CD3 молекулой, содержащей эт.связывающий CD3 домен. Настоящее изобретение, в частности, относится к применению связывающих DA × CD3 молекул, содержащих в. связывающий CD3 домен, при лечении рака и ассоциированных с патогеном заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат такую молекулу (молекулы).
УРОВЕНЬ ТЕХНИКИ
I. Иммунная система млекопитающих
[0004] Иммунная система млекопитающих осуществляет функцию защиты от множества состояний, включая, например, травму, инфекцию и неоплазию. Эффективность развития иммунологического ответа на патогены, чужеродные вещества и раковые антигены у человека и других млекопитающих обусловлена двумя характеристиками: исключительной специфичностью иммунного ответа в отношении распознавания антигена и иммунологической памятью, которая обеспечивает более быстрые и более интенсивные ответы при повторной активации тем же антигеном (Portoles, P. et al. (2009) "The TCR/CD3 Complex: Opening the Gate to Successful Vaccination," Current Pharmaceutical Design 15:3290-3300; Guy, C.S. et al. (2009) "Organization of Proximal Signal Initiation at the TCR:CD3 Complex" Immunol Rev. 232(1):7-21; Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy" Cancer Cell 27:450-461).
[0005] У здоровых индивидуумов иммунная система находится в состоянии покоя и ингибируется совокупностью разнообразных ингибирующих рецепторов и лигандов рецепторов. Распознавание ракового антигена, микробного патогена или аллергена обусловливает стимуляцию широкого спектра активирующих рецепторов и лигандов рецепторов, что вызывает активацию иммунной системы. Такая активация приводит к активации макрофагов, клеток - естественных киллеров (NK-клетки) и антигенспецифичных цитотоксических Т-клеток, а также способствует высвобождению различных цитокинов, действие которых направлено против предполагаемой угрозы здоровью субъекта (Dong, С.etal. (2003) ''Immune Regulation by Novel Costimulatory Molecules," Immunolog. Res. 28(1):39-48; Viglietta, V. et al. (2007) "Modulating Co-Stimulation" Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy" Adv. Immunol. 90:297-339). Иммунная система способна возвращаться в нормальное для нее состояние покоя, когда противоположно направленные ингибирующие иммунные сигналы преобладают над активирующими иммунными сигналами.
[0006] Таким образом, можно полагать, что патологическое состояние при раке (и, несомненно, патологические состояния при инфекционных заболеваниях) отражает недостаточность адекватной активации иммунной системы субъекта. Такая недостаточность может отражать неадекватность презентации активирующих иммунных сигналов, или она может отражать недостаточную способность ослаблять ингибирующие иммунные сигналы в организме субъекта. Исследователями было определено, что в некоторых случаях раковые клетки могут взаимодействовать с иммунной системой, что обеспечивает ускользание от обнаружения иммунной системой (Topalian, S.L. et al. (2015) "Immune Checkpoint Blockade: A Common Denominator Approach to Cancer Therapy" Cancer Cell 27:450-461).
[0007] Функционирование иммунной системы млекопитающих опосредовано двумя отдельными, но взаимосвязанными системами: гуморальной иммунной системой и клеточной иммунной системой. В целом, гуморальная система опосредована растворимыми молекулами (антителами или иммуноглобулинами), продуцируемыми В-клетками. Такие молекулы обладают способностью соединяться с антигенами, которые были признаны чужеродными для организма, и нейтрализовать их. Клеточная иммунная система включает мобилизацию определенных клеток, называемых «Т-клетками», которые выполняют множество терапевтических функций. Т-клетки представляют собой лимфоциты, созревающие в тимусе и циркулирующие между тканями, лимфатической системой и кровеносной системой. В ответ на присутствие и распознавание чужеродных структур (антигенов) Т-клетки становятся «активированными», чтобы инициировать иммунный ответ. Во многих случаях эти чужеродные антигены экспрессируются на клетках-хозяевах в результате неоплазии или инфекции. Несмотря на то, что сами Т-клетки не секретируют антитела, они обычно необходимы для секреции антител вторым классом лимфоцитов, «В-клетками» (которые происходят из костного мозга). Крайне важно, что Т-клетки проявляют исключительную иммунологическую специфичность, которая обеспечивает способность отличать один антиген от другого).
[0008] Для активации Т-клеток необходимы два взаимодействия (Viglietta, V. et al. (2007) "Modulating Co-Stimulation" Neurotherapeutics 4:666-675; Korman, A.J. et al. (2007) "Checkpoint Blockade in Cancer Immunotherapy," Adv. Immunol. 90:297-339). При первом взаимодействии клетка должна экспонировать соответствующий антиген-мишень, связанный с главным комплексом гистосовместимости («МНС») класса I или класса II клетки, чтобы он мог связаться с Т-клеточным рецептором («TCR») наивного Т-лимфоцита. Несмотря на то, что почти все типы клеток могут осуществлять функции антиген-презентирующих клеток, некоторые клетки, такие как макрофаги, В-клетки и дендритные клетки, специализируются на презентации чужеродных антигенов и являются «профессиональными» «антиген-презентирующими клетками». Иммунологическое обнаружение антигена, связанного с молекулами МНС I антиген-презентирующей клетки, приводит к продукции цитотоксических Т-клеток. Иммунологическое обнаружение антигена, связанного с молекулами МНС II антигенпрезентирующей клетки, 1 приводит к продукции цитотоксических Т-клеток. При втором взаимодействии лиганд антигенпрезентирующей клетки должен связаться с корецептором Т-клетки (Dong, С.et al. (2003) "Immune Regulation by Novel Costimulatory Molecules" Immunolog. Res. 28(l):39-48; Lindley, P.S. et al. (2009) "The Clinical Utility Of Inhibiting CD28-Mediated Costimulation," Immunol. Rev. 229:307-321). Т-клетки, подвергнувшиеся воздействию обоих стимулирующих сигналов, приобретают способность отвечать на цитокины (такие как интерлейкин-2 и интерлейкин-12).
[0009] В отсутствие обоих костимулирующих сигналов во время взаимодействия с TCR Т-клетки переходят в функционально невосприимчивое состояние, называемое клональной анергией (Khawli, L.A. et al. (2008) "Cytokine, Chemokine, and Co-Stimulatory Fusion Proteins for the Immunotherapy of Solid Tumors" Exp. Pharmacol. 181:291-328). При патологических состояниях Т-клетки играют ключевую роль в различных органоспецифических аутоиммунных заболеваниях, таких как диабет I типа, ревматоидный артрит и рассеянный склероз (Dong, С.et al. (2003) ''Immune Regulation by Novel Costimulatory Molecules," Immunolog. Res. 28(1):39-48).
[0010] Этот путь, включающий иммунные «контрольные точки», важен для поддержания аутотолерантности (то есть для предотвращения у субъекта развития атаки иммунной системы, направленной на его/ее собственные клетки («аутоиммунной» реакции)), а также для ограничения сопутствующего повреждения тканей во время противомикробных или противоаллергических иммунных ответов. Если контакт с Т-клеткой приводит к возникновению только одного из двух необходимых сигналов, Т-клетка не активируется и не возникает адаптивного иммунного ответа. Таким образом, «двухсигнальный» механизм активации Т-клеток позволяет иммунной системе способ избежать нежелательных ответов, таких как ответы на собственные антигены, которые в противном случае приводили бы к атаке иммунной системы, направленной на собственные клетки субъекта («аутоиммунной» реакции).
II. Молекулы клеточной поверхности клеточной иммунной системы
A. CD3, CD4 и CD8
[0011] Клетки иммунной системы характеризуются экспрессией специализированных молекул гликопротеинов клеточной поверхности. Взаимодействие между такими молекулами и молекулами других клеток инициирует, поддерживает или ослабляет иммунный ответ.В частности, все Т-клетки характеризуются экспрессией CD3. CD3 представляет собой корецептор Т-клеток, состоящий из четырех отдельных цепей (Wucherpfennig, K.W. et al. (2010) "Structural Biology Of The T-Cell Receptor: Insights into Receptor Assembly, Ligand Recognition, And Initiation of Signaling," Cold Spring Harb. Perspect. Biol. 2(4):a005140; pages 1-14; Chetty, R. etal. (1994) "CD3: Structure, Function, And Role OfImmunostaining In Clinical Practice" J. Pathol. 173(4):303-307; Guy, C.S. et al. (2009) "Organization Of Proximal Signal Initiation At The TCR:CD3 Complex" Immunol. Rev. 232(1):7-21).
[0012] У млекопитающих указанный комплекс содержит цепь CD3γ, цепь CD3δ и две цепи CD3ε. Эти цепи связываются с TCR для генерации сигнала активации в Т-лимфоцитах (Smith-Garvin, J.E. et al. (2009) "T Cell Activation" Annu. Rev. Immunol. 27:591-619). В отсутствие CD3 TCR не собираются должным образом и подвергаются деградации (Thomas, S. et al. (2010) "Molecular Immunology Lessons From Therapeutic T-Cell Receptor Gene Transfer," Immunology 129(2): 170-177). CD3 обнаруживается в связанном с мембраной виде на всех зрелых Т-клетках и не обнаруживается практически ни в каком другом типе клеток (см. Janeway, С.A. et al. (2005) In: Immunobiology: The Immune System In Health And Disease," 6th ed. Garland Science Publishing, NY, pp.214- 216; Sun, Z. J. et al. (2001) "Mechanisms Contributing To TCell Receptor Signaling And Assembly Revealed By The Solution Structure Of An Ectodomain Fragment Of The CD3ε:γ Heterodimer," Cell 105(7):913-923; Kuhns, M.S. et al. (2006) "Deconstructing The Form And Function Of The TCR/CD3 Complex" Immunity. 2006 Feb;24(2):133-139).
[0013] Инвариантный сигнальный компонент CD3ε комплекса TCR на Т-клетках был использован в качестве мишени для обеспечения формирования иммунологического синапса между Т-клетками и раковыми клетками. Совместное вовлечение CD3 и опухолевого антигена активирует Т-клетки, вызывая лизис раковых клеток, экспрессирующих опухолевый антиген (Baeuerle et al. (2011) "Bispecific T-cell Engager For Cancer Therapy" In: Bispecific Antibodies, Kontermann, R.E. (Ed.) Springer-Verlag; 2011:273-287). Этот подход обеспечивает возможность повсеместного взаимодействия биспецифичных антител с компартментом Т-клеток с высокой специфичностью в отношении раковых клеток и имеет широкое применение для множества опухолевых антигенов клеточной поверхности, а также был применен для нацеливания на инфицированные патогеном клетки (см., например, Sloan et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targeting Molecules (DARTs) that Bind HIV Envelope and Recruit Cytotoxic T Cells" PLoS Pathog 11(11): el005233. doi: 10.1371/journal.ppat. 1005233; WO 2014/159940 и WO 2016/054101).
[0014] Первая субпопуляция Т-клеток, называемая «хелперными Т-клетками», характеризуется экспрессией CD4 (то есть они являются «CD4+» а также CD3+). Т-клетки CD4+ являются важнейшими организаторами большинства иммунных и аутоиммунных ответов млекопитающих (Dong, С.et al. (2003) "Immune Regulation by Novel CostimulatoryMolecules" Immunolog. Res. 28(1):39-48). Было обнаружено, что активация Т-клеток CD4+ опосредована ко стимулирующими взаимодействиями между комплексом антиген:главная молекула гистосовместимости класса II (МНС II), который представлен на поверхности антиген-презентирующей клетки (такой как В-клетка, макрофаг или дендритная клетка), и комплексом двух молекул, TCR и лиганда рецептора CD3 клеточной поверхности, оба из которых представлены на поверхности наивной Т-клетки CD4+. Активированные Т-хелперные клетки способны пролиферировать с получением клеток Th1, которые способны опосредовать воспалительный ответ на клетку-мишень.
[0015] Вторая субпопуляция Т-клеток, называемая «цитотоксическими Т-клетками», характеризуется экспрессией CD8 (то есть они являются «CD8+», а также CD3+). CD8 представляет собой корецептор Т-клеток, состоящий из двух отдельных цепей (Leahy, D.J. (1995) "A Structural View of CD4 and CD8" FASEB J. 9:17-25), который экспрессируется на цитотоксических Т-клетках. Было обнаружено, что активация Т-клеток CD8+ опосредована ко стимулирующими взаимодействиями между комплексом антиген : главная молекула гистосовместимости класса I (МНС I), который представлен на поверхности клетки-мишени, и комплексом CD8 и Т-клеточного рецептора, которые представлены на поверхности Т-клетки CD8+ (Gao, G. et al. (2000) "Molecular Interactions Of Coreceptor CDSAndMHC Class I: The Molecular Basis For Functional Coordination With The T-Cell Receptor, " Immunol. Today 21:630-636). В отличие от главных молекул гистосовместимости класса II (МНС II), которые экспрессируются только определенными клетками иммунной системы, экспрессия молекул МНС I широко распространена. Таким образом, цитотоксические Т-клетки способны связываться с разнообразными типами клеток. Активированные цитотоксические Т-клетки опосредуют уничтожение клеток за счет высвобождения цитотоксинов - перфорина, гранзимов и гранулизина. Благодаря действию перфорина гранзимы проникают в цитоплазму клетки-мишени и, действуя в качестве сериновых протеаз, инициируют каспазный каскад, который представляет собой группу цистеиновых протеаз, что в итоге приводит к апоптозу (программируемой гибели клеток) клеток-мишеней.
В. Т-клеточный рецептор («TCR»)
[0016] Т-клеточный рецептор («TCR») исходно экспрессируется Т-клетками CD4+ или CD8+ и позволяет таким клеткам распознавать антигенные пептиды, которые связаны и презентированы белками МНС класса I или класса II антиген-презентирующих клеток. Распознавание комплекса рМНС (пептид-МНС) TCR инициирует развитие клеточного иммунного ответа, что приводит к продукции цитокинов и лизису антиген-презентирующей клетки (см., например, Armstrong, K.М. et al. (2008) "Conformational Changes And Flexibility In T-Cell Receptor Recognition Of Peptide-МНС Complexes;' Biochem. J. 415(Pt 2): 183-196; Willemsen, R. (2008) "Selection Of Human Antibody Fragments Directed Against Tumor T-Cell Epitopes For Adoptive T-Cell Therapy," Cytometry A. 73(11): 1093-1099; Beier, K.C. et al. (2007) "Master Switches Of T-Cell Activation And Differentiation" Eur. Respir. J. 29:804-812; Mallone, R. et al. (2005) "Targeting T Lymphocytes For Immune Monitoring And Intervention In Autoimmune Diabetes " Am. J. Ther. 12(6):534-550). CD3 представляет собой рецептор, который связывается с TCR (Thomas, S. et al. (2010) "Molecular Immunology Lessons From Therapeutic T-Cell Receptor Gene Transfer" Immunology 129(2):170-177; Guy, C.S. etal. (2009) "Organization Of Proximal Signal Initiation At The TCR:CD3 Complex," Immunol. Rev. 232(1):7-21; St. Clair, E.W. (Epub 2009 Oct 12) "Novel Targeted Therapies For Autoimmunity" Curr. Opin. Immunol. 21(6):648-657; Baeuerle, P.A. et al. (Epub 2009 Jun 9) "Bispecific T-Cell Engaging Antibodies For Cancer Therapy," Cancer Res. 69(12):4941-4944; Smith-Garvin, J.E. et al. (2009) "T Cell Activation" Annu. Rev. Immunol. 27:591-619; Renders, L. et al. (2003) "Engineered CD3 Antibodies For Immunosuppression" Clin. Exp.Immunol. 133(3):307-309).
[0017] Комплекс TCR и CD3, совместно с ζ, цепью (дзета-цепью) CD3 (также известной как дзета-цепь Т-клеточного рецептора Т3, или CD247), составляют «комплекс TCR» (van der Merwe, P.A. etc. (epub Dec. 3, 2010) "Mechanisms For T Cell Receptor Triggering" Nat. Rev. Immunol. 11:47-55; Wucherpfennig, K.W. et al. (2010) "Structural Biology of the T Cell Receptor: Insights into Receptor Assembly, Ligand Recognition, and Initiation of Signaling," Cold Spring Harb. Perspect. Biol. 2:a005140). Указанный комплекс особенно важен, поскольку он содержит большое число (десять) иммунорецепторных тирозиновых активирующих мотивов (ITAM).
[0018] Полиспецифичные молекулы, содержащие связывающий CD3 домен и связывающий домен, специфичный для относящегося к заболеванию антигена («DA»), экспрессируемого на клетке-мишени, способны опосредовать перенаправленное опосредуемое Т-клетками уничтожение таких клеток-мишеней. Однако, вследствие аффинности таких молекул к CD3, такие молекулы могут быть слишком активными, что приводит к нежелательному высвобождению цитокинов из стимулированных Т-клеток. Таким образом, несмотря на предшествующие успехи в идентификации молекул, вовлеченных в иммунные ответы млекопитающих, сохраняется потребность в улучшенных способах терапии для лечения раковых заболеваний и инфекционных заболеваний. В настоящем изобретении предложена панель вариантных связывающих CD3 доменов, имеющих различные кинетические характеристики связывания, которые могут быть применены для модуляции активности таких полиспецифичных молекул, обеспечивающей уничтожение клеток и/или высвобождение цитокинов, с целью увеличения терапевтического окна. Настоящее изобретение направлено на достижение этой и других целей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0019] Настоящее изобретение относится к полиспецифичным связывающим молекулам (например, биспецифичному антителу, диателу, биспецифичному scFv, трехвалентной молекуле, TandAb®, BiTE® и так далее), содержащим связывающий CD3 домен, способный связывать эпитоп CD3, а также связывающий относящийся к заболеванию антиген домен, способный связывать эпитоп относящегося к заболеванию антигена («DA») (например, «связывающей DA × CD3 молекуле»). Настоящее изобретение, в частности, относится к таким связывающим DA × CD3 молекулам, содержащим вариантный связывающий CD3 домен («в. связьшающий CD3 домен»), который содержит домен CDRH1, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3, аминокислотная последовательность по меньшей мере одного из которых отличается от аминокислотной последовательности соответствующей CDR эталонного связывающего CD3 домена («эт.связывающего CD3 домена»), и при этом указанная связывающая DA × CD3 молекула, содержащая такой в. связывающий CD3 домен, проявляет измененную аффинность в отношении CD3 по сравнению со связывающей DA × CD3 молекулой, содержащей такой эт.связывающий CD3 домен. Настоящее изобретение, в частности, относится к таким связывающим DA × CD3 молекулам, содержащим в. связывающий CD3 домен, которые проявляют пониженную аффинность в отношении CD3 и способны опосредовать перенаправленное уничтожение экспрессирующих DA клеток-мишеней, а также демонстрируют более низкие уровни высвобождения цитокинов по сравнению со связывающей DA × CD3 молекулой, содержащей эт.связывающий CD3 домен. Настоящее изобретение, в частности, относится к применению связывающих DA × CD3 молекул, содержащих в. связывающий CD3 домен, при лечении рака и ассоциированных с патогеном заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат такую молекулу (молекулы).
[0020] Более конкретно, в настоящем изобретении предложена связывающая DA × CD3 молекула, содержащая связывающий CD3 домен, способный связывать эпитоп CD3, и связывающий относящийся к заболеванию антиген домен, способный связывать эпитоп относящегося к заболеванию антигена, причем указанный связывающий CD3 домен содержит:
(I) (А) домен CDRH1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 99, SEQ ID NO: 91, SEQ ID NO: 93, SEQ ID NO: 95 и SEQ ID NO: 97;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62; или
(II) (А) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83, SEQ ID NO: 85, SEQ ID NO: 87, SEQ ID NO: 89, SEQ ID NO: 101, SEQ ID NO: 103, SEQ ID NO: 105 и SEQ ID NO: 107;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62; или
(III) (А) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 109 или SEQ ID NO: 111; или
(IV) (А) домен CDRHI, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 113 и SEQ ID NO: 115; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62.
[0021] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанный связывающий CD3 домен содержит:
(I) (А) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 56;
(В) домен VH, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 98, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 100, SEQ ID NO: 102, SEQ ID NO: 104 и SEQ ID NO: 106; или
(II) (А) домен VL, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 108, SEQ ID NO: 110, SEQ ID NO: 112 и SEQ ID NO: 114;
(В) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 55
[0022] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула представляет собой биспецифичное антитело, биспецифичное диатело, биспецифичный scFv, биспецифичное TandAb или трехвалентную связывающую молекулу.
[0023] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула способна связывать более одного относящегося к заболеванию антигена и/или другую молекулу клеточной поверхности эффекторной клетки. В частности, где указанная другая молекула клеточной поверхности эффекторной клетки представляет собой CD2, CD8, CD 16, TCR, NKp46 или NKG2D.
[0024] Настоящее изобретение дополнительно относится к варианту реализации такой связьшающей DA × CD3 молекулы, где указанный относящийся к заболеванию антиген представляет собой раковый антиген или ассоциированный с патогеном антиген.
[0025] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где раковый антиген выбран из группы, состоящей из раковых антигенов: 19.9, 4.2, ADAM-9, АН6, ALCAM, B1, В7-Н3, BAGE, бета-катенина, антигена группы крови ALeb/Ley, антигена лимфомы Беркитта-38.13, С14, СА125, карбоксипептидазы М, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD103, CD123, CD317, CDK4, СБА, СЕАСАМ5/СЕАСАМ6, СО17-1А, СО-43, СО-514, СТА-1, CTLA-4, цитокератина 8, D1.1, D156-22, DR5, группы E1, EGFR, рецептора эфрина, EphA2, Erb, GAGE, ганглиозида GD2/GD3/GM2, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, E6 папилломавируса человека/Е7 папилломавируса человека, HMW-MAA, антигена I, IL13Rα2, интегрина β6, JAM-3, KID3, KID31, пан-антигена карциномы KS 1/4, L6, L20, LEA, LUCA-2, M1:22:25:8, M18, M39, MAGE, MART, мезотелина, MUC-1, MUM-1, MYL, N-ацетилглюкозаминилтрансферазы, неогликопротеина, NS-10, OFA-1, OFA-2, онкостатина M, p15, p97, РЕМ, РЕМА, PIPA, PSA, PSMA, простатической кислой фосфатазы, R24, ROR1, сфинголипида, SSEA-1, SSEA-3, SSEA-4, sTn, пептида, происходящего из Т-клеточного рецептора, Т5А7, TAG-72, TL5, рецептора TNF, рецептора TNF-γ, TRA-1-85, рецептора трансферрина, 5Т4, TSTA, VEGF, рецептора VEGF, VEP8, VEP9, VIM-D5 и гаптена Y, Ley.
[0026] Настоящее изобретение, в частности, относится к варианту реализации такой связывающей DA × CD3 молекулы, где раковый антиген представляет собой В7-Н3, СЕАСАМ5/СЕАСАМ6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2, CD123, СВ19 или ROR1.
[0027] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
[0028] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула содержит: первую полипептидную цепь и вторую полипептидную цепь, ковалентно связанные друг с другом, где:
(A) первая полипептидная цепь содержит, в направлении от N-конца к С-концу:
(i) домен 1, содержащий:
(1) субдомен (1А), который содержит домен VL моноклонального антитела, способного связываться с эпитопом относящегося к заболеванию антигена (VLDA);
и
(2) субдомен (1В), который содержит домен VH моноклонального антитела, способного связываться с эпитопом CD3 (VHCD3);
причем указанные субдомены 1А и 1В отделены друг от друга пептидным линкером; и
(ii) домен 2, который представляет собой способствующий гетеродимеризации домен;
(B) вторая полипептидная цепь содержит, в направлении от N-конца к С-концу:
(i) домен 1, содержащий
(1) субдомен (1А), который содержит домен VL моноклонального антитела, способного связываться с эпитопом CD3 (VLCD3); и
(2) субдомен (1В), который содержит домен VH моноклонального антитела, способного связываться с эпитопом относящегося к заболеванию антигена (VHDA);
причем указанные субдомены 1А и 1В отделены друг от друга пептидным линкером;
(ii) домен 2, который представляет собой способствующий гетеродимеризации домен, причем указанные способствующие
гетеродимеризации домены первой и второй полипептидных цепей различны;
и где:
(a) домен VL первой полипептидной цепи и домен VH второй полипептидной цепи объединяются с получением связывающего относящийся к заболеванию антиген домена, и домен VH первой полипептидной цепи и домен VL второй полипептидной цепи объединяются с получением связывающего CD3 домена; или
(b) домен VL первой полипептидной цепи и домен VH второй полипептидной цепи объединяются с получением связывающего CD3 домена, и домен VH первой полипептидной цепи и домен VL второй полипептидной цепи объединяются с получением связывающего относящийся к заболеванию антиген домена.
[0029] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где:
(a) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой Е-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой K-спиральный домен; или
(b) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой K-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой Е-спиральный домен.
[0030] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где первая или вторая полипептидная цепь дополнительно содержит домен 3, содержащий домен СН2 и СН3 Fc-домена иммуноглобулина.
[0031] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула дополнительно содержит третью полипептидную цепь, содержащую домен СН2 и СН3 Fc-домена иммуноглобулина.
[0032] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула дополнительно содержит связывающий CD8 домен.
[0033] Настоящее изобретение дополнительно относится к варианту реализации такой связывающей DA × CD3 молекулы, где указанная связывающая DA × CD3 молекула содержит:
(I) (А) первый полипептид, содержащий SEQ ID NO: 179;
(B) второй полипептид, содержащий SEQ ID NO: 175; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(II) (А) первый полипептид, содержащий SEQ ID NO: 184;
(B) второй полипептид, содержащий SEQ ID NO: 181; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(III) (А) первый полипептид, содержащий SEQ ID NO: 196;
(B) второй полипептид, содержащий SEQ ID NO: 186; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(IV) (А) первый полипептид, содержащий SEQ ID NO: 197;
(B) второй полипептид, содержащий SEQ ID NO: 192; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(V) (А) первый полипептид, содержащий SEQ ID NO: 193;
(B) второй полипептид, содержащий SEQ ID NO: 194; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(VI) (А) первый полипептид, содержащий SEQ ID NO: 179;
(B) второй полипептид, содержащий SEQ ID NO: 175;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188; или
(VII) (А) первый полипептид, содержащий SEQ ID NO: 184;
(B) второй полипептид, содержащий SEQ ID NO: 181;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188; или
(VIII) (А) первый полипептид, содержащий SEQ ID NO: 196;
(B) второй полипептид, содержащий SEQ ID NO: 186;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188; или
(IX) (А) первый полипептид, содержащий SEQ ID NO: 193;
(B) второй полипептид, содержащий SEQ ID NO: 194;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188.
[0034] Настоящее изобретение дополнительно относится к фармацевтической композиции, которая содержит любую из описанных выше связывающих DA × CD3 молекул и фармацевтически приемлемый носитель.
[0035] Настоящее изобретение дополнительно относится к способу лечения заболевания, включающему введение нуждающемуся в этом субъекту терапевтически эффективного количества любой из описанных выше связывающих DA × CD3 молекул или описанной выше фармацевтической композиции.
[0036] Настоящее изобретение дополнительно относится к варианту реализации такого способа, где заболевание представляет собой рак. Включая варианты реализации, где указанный рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови (гематологического рака), множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
[0037] Настоящее изобретение дополнительно относится к варианту реализации такого способа, где заболевание представляет собой ассоциированное с патогеном заболевание; включая варианты реализации, где ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
[0038] Настоящее изобретение дополнительно относится к применению любой из описанных выше связывающих DA × CD3 молекул или описанной выше фармацевтической композиции при лечении заболевания.
[0039] Настоящее изобретение дополнительно относится к варианту реализации такого применения, где заболевание представляет собой рак. Включая варианты реализации, где рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови, множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
[0040] Настоящее изобретение дополнительно относится к варианту реализации такого применения, где заболевание представляет собой ассоциированное с патогеном заболевание. Включая варианты реализации, где ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ:
[0041] На Фигурах 1А - 1В представлены схематические изображения типичных ковалентно связанных диател, имеющих два эпитоп-связывающих домена, состоящих из двух полипептидных цепей, каждая из которых содержит способствующий гетеродимеризации домен в виде Е-спирали или K-спирали (альтернативные способствующие гетеродимеризации домены представлены ниже). Остаток цистеина может присутствовать в линкере (Фигура 1А) и/или в способствующем гетеродимеризации домене (Фигура 1В). Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки.
[0042] На Фигуре 2 представлено схематическое изображение типичной молекулы ковалентно связанного диатела, имеющей два эпитоп-связывающих домена, состоящей из двух полипептидных цепей, каждая из которых содержит домен СН2 и СН3, расположенный таким образом, что объединенные цепи образуют Fc-домен или его часть. Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки.
[0043] На Фигурах 3А-3С представлены схематические изображения типичных ковалентно связанных четырехвалентных диател, имеющих четыре эпитоп-связывающих домена, состоящих из двух пар полипептидных цепей (то есть в сумме из четырех полипептидных цепей). Один полипептид из каждой пары содержит домен СН2 и СН3, расположенный таким образом, что объединенные цепи образуют Fc-домен или его часть. Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки. Указанные две пары полипептидных цепей могут быть одинаковыми. В таких вариантах реализации, где две пары полипептидных цепей являются одинаковыми и домены VL и VH распознают различные эпитопы (как показано на Фигурах 3А-3В), полученная молекула имеет четыре эпитоп-связывающих домена и является биспецифичной и двухвалентной в отношении каждого связываемого эпитопа. В таких вариантах реализации, где домены VL и VH распознают один и тот же эпитоп (например, в обеих цепях используются одинаковые CDR домена VL и одинаковые CDR домена VH), полученная молекула имеет четыре эпитоп-связывающих домена и является моноспецифичной и четырехвалентной в отношении единственного эпитопа. В качестве альтернативы, указанные две пары полипептидов могут быть различными. В таких вариантах реализации, где две пары полипептидных цепей различны и домены VL и VH каждой пары полипептидов распознают различные эпитопы (как показано с использованием различных затенений и штриховок на Фигуре 3С), полученная молекула имеет четыре эпитоп-связывающих домена и является тетраспецифичной и моновалентной в отношении каждого связываемого эпитопа. На Фигуре 3А показано содержащее Fc-домен диатело, которое содержит способствующий гетеродимеризации домен пептида, содержащий остаток цистеина. На Фигуре 3В показано содержащее Fc-домен диатело, которое содержит способствующие гетеродимеризации домены в виде Е-спирали и K-спирали, содержащие остаток цистеина, и линкер (с необязательным остатком цистеина). На Фигуре 3С показано содержащее Fc-домен диатело, которое содержит домены СН1 и CL антитела для облегчения гетеродимеризации.
[0044] На Фигурах 4А - 4В представлены схематические изображения типичной молекулы ковалентно связанного диатела, имеющей два эпитоп-связывающих домена, состоящих из трех полипептидных цепей. Две из полипептидных цепей содержат домен СН2 и СН3, расположенный таким образом, что объединенные цепи образуют Fc-домен или его часть. Полипептидные цепи, содержащие домены VL и VH, дополнительно содержат способствующий гетеродимеризации домен. Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки.
[0045] На Фигуре 5 представлены схематические изображения типичной молекулы ковалентно связанного диатела, имеющей четыре эпитоп-связывающих домена, состоящих из пяти полипептидных цепей. Две из полипептидных цепей содержат домен СН2 и СН3, расположенный таким образом, что объединенные цепи образуют Fc-домен, который включает Fc-домен полностью или частично. Полипептидные цепи, содержащие связанные домены VL и VH, дополнительно содержат способствующий гетеродимеризации домен. Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки.
[0046] На Фигурах 6A-6F представлены схематические изображения типичных содержащих Fc-домен трехвалентных связывающих молекул, имеющих три эпитоп-связывающих домена. Фигуры 6А и 6В, соответственно, схематически иллюстрируют домены трехвалентных связывающих молекул, содержащих два относящихся по типу к диателам связывающих домена и связывающий домен Fab-типа, имеющих различную ориентацию доменов, в которых относящиеся по типу к диателам связывающие домены являются N-концевыми или С-концевыми по отношению к Fc-домену. Молекулы на Фигурах 6А и 6В содержат четыре цепи. Фигуры 6С и 6D, соответственно, схематически иллюстрируют домены трехвалентных связывающих молекул, содержащих два относящихся по типу к диателам связывающих домена, N-концевых по отношению к Fc-домену, и связывающий домен Fab-типа, в котором легкая цепь и тяжелая цепь соединены полипептидным спейсером, или связывающий домен scFv-типа. Трехвалентные связывающие молекулы на Фигурах 6Е и 6F, соответственно, схематически иллюстрируют домены трехвалентных связывающих молекул, содержащих два относящихся по типу к диателам связывающих домена, С-концевых по отношению к Fc-домену, и связывающий домен Fab-типа, в котором легкая цепь и тяжелая цепь соединены полипептидным спейсером, или связывающий домен scFv-типа. Трехвалентные связывающие молекулы на Фигурах 6C-6F содержат три цепи. Домены VL и VH, распознающие один и тот же эпитоп, показаны с использованием одного и того же затенения или штриховки.
[0047] На Фигурах 7A-7D представлены результаты анализа ЦТЛ и анализа связывания. На Фигуре 7А показаны результаты репрезентативных исследований перенаправленного уничтожения клеток (цитотоксичность в % в анализе ЦТЛ), опосредованного конструкциями диател типа DART-А, содержащими домены VL и VH CD3 mAb 1; CD3 mAb 1 M1; CD3 mAb 1 M2; CD3 mAb 1 M15; CD3 mAb 1 M17; CD3 mAb 1 M18; CD3 mAb 1 M19 и CD3 mAb 1 M20 На Фигурах 7B-7C графически представлена корреляция между константами аффинности (Фигура 7В: KD; Фигура 7С: ka; и Фигура 7D: kd) и активностью ЦТЛ (ЕС50 цитолиза через 18 часов), описанными в таблицах 11-12.
[0048] На Фигурах 8А-8Е представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциями диател типа DART А, содержащими домены VL и VH CD3 mAb 1; CD3 mAb 1 М2; CD3 mAb 1 М7; CD3 mAb 1 М13 и CD3 mAb 1 М15; с применением эффекторных Pan-T-клеток и лейкозных клеток-мишеней MV-4-11. Цитотоксичность в процентах графически представлена на Фигуре 8А. Цитокиновые ответы графически представлены на Фигурах 8В-8Е (Фигура 8В: ИФН-гамма; Фигура 8С: ФНО-альфа; Фигура 8D: ИЛ-6; Фигура 8D: ИЛ-2); отр. контр: отрицательный контроль.
[0049] На Фигурах 9А-9В показана способность диател типа DART-B связываться с относящимися к заболеванию антигенами. На Фигуре 9А показана способность диател типа DART-В CD123-WT, CD123-M1, CD123-M2 и CD123-M18 связываться с экспрессирующими CD123 клетками MOLM-13. На Фигуре 9В показана способность диател типа DART-В 5T4-WT, 5Т4-М1, 5Т4-М2 и 5Т4-М18 связываться с экспрессирующими 5Т4 клетками А498. Связывание определяли с применением биотинилированного антитела, специфичного в отношении Е/K спиралей диател, и стрептавидин-фикоэритрина (РЕ).
[0050] На Фигурах 10А - 10В показана способность диател типа DART-B CD123-WT, CD123-M1, CD123-M2 и CD123-M18 связываться с Т-клетками CD8+ (Фигура 10А) и Т-клетками CD4+ (Фигура 10В).
[0051] На Фигурах 11A-11Q представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциям диател типа DART В CD 123 × CD3 (имеющими Fc-домены): CD123-WT (Фигуры 11В, 11F, 11J и UN), CD123-M2 (Фигуры 11С, 11G, 11K и 11О), CD123-M18 (Фигуры 11D, 11Н, 11L и 11P), ВИЧ-WT (Фигуры 11Е, 11I, 11М и 11Q), с применением эффекторных Pan-T-клеток и клеток-мишеней острого моноцитарного лейкоза (ОМЛ) MOLM-13. Цитотоксичность в процентах графически представлена на Фигуре 11А. Цитокиновые ответы и цитотоксичность в процентах графически представлены на Фигурах 11B-11Q (Фигуры 11В-11Е: ИФН-гамма; Фигуры 11F-11I: ФНО-альфа; Фигуры 11J-11M: ИЛ-6; Фигуры 11N-11Q: ИЛ-2).
[0052] На Фигурах 12А-12Е представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциям диател типа DART В CD 123 × CD3 (имеющими Fc-домены), с применением эффекторных клеток МКПК и клеток-мишеней ОМЛ MOLM-13. Цитотоксичность в процентах графически представлена на Фигуре 12А (Е:Т=15:1, 24 ч). Цитокиновые ответы графически представлены на Фигурах 12В-12Е (Фигура 12В: ИФН-гамма; Фигура 12С: ФНО-альфа; Фигура 12D: ИЛ-6; Фигура 12Е: ИЛ-2).
[0053] На Фигурах 13A-13Q представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциям диател типа DART В 5Т4 × CD3 (имеющими Fc-домены) 5T4-WT (Фигуры 13В, 13F, 13J и 13N), 5Т4-М2 (Фигуры 13С, 13G, 13K и 130), 5Т4-М18 (Фигуры 13D, 13Н, 13L и 13Р), ВИЧ-WT (Фигуры 13Е, 13I, 13М и 13Q), с применением эффекторных Pan-T-клеток и клеток-мишеней почечно-клеточной карциномы А498 (Е:Т=5:1, 24 ч). Цитотоксичность графически представлена на Фигуре 13А. Цитокиновые ответы и цитотоксичность в процентах графически представлены на Фигурах 13B-13Q (Фигуры 13В-13Е: ИФН-гамма; Фигуры 13F-13I: ФНО-альфа; Фигуры 13J-13M: ИЛ-6; Фигуры 13N-13Q: ИЛ-2).
[0054] На Фигурах 14A-14J представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциям диател типа DART В CD 19 × CD3 (имеющими Fc-домены), с применением эффекторных клеток МКПК (Фигуры 14А-14Е) или эффекторных Pan-T-клеток (Фигуры 14F-14J) (Е:Т=30:1 для МКПК и 10:1 для Pan-Т-клеток, 24-48 ч). Цитотоксичность в процентах (48 ч) графически представлена на Фигурах 14А (МКПК) и Фигура 14F (Pan-T-клетки). Цитокиновые ответы через 48 часов с применением МКПК графически представлены на Фигурах 14В-14Е (МКПК) и Фигурах 14G-14J (Pan Т-клетки) (Фигуры 14В и 14G: ИФН-гамма; Фигуры 14С и 14Н: ФНО-альфа; Фигуры 14D и 141: ИЛ-6; Фигуры 14Е и 14J: ИЛ-2).
[0055] На Фигурах 15А-15Е представлена способность типичных диател типа DART-B CD 123 × CD3 опосредовать активацию Т-клеток. Активацию Т-клеток определяли путем оценки способности диател оказывать влияние на экспрессию CD25 и CD69. Цитотоксичность в процентах графически представлена на Фигуре 15А. Активация Т-клеток CD4+, определенная путем оценки CD25, графически представлена на Фигуре 15 В. Активация Т-клеток CD4+, определенная путем оценки CD69, графически представлена на Фигуре 15С. Активация Т-клеток CD8+, определенная путем оценки CD25, графически представлена на Фигуре 15D. Активация Т-клеток CD8+, определенная путем оценки CD69, графически представлена на Фигуре 15Е.
[0056] На Фигурах 16А-16Е представлена способность типичных диател типа DART-B 5Т4 × CD3 опосредовать активацию Т-клеток. Активацию Т-клеток определяли путем оценки способности диател оказывать влияние на экспрессию CD25 и CD69. Цитотоксичность в процентах графически представлена на Фигуре 16А. Активация Т-клеток CD4+, определенная путем оценки CD25, графически представлена на Фигуре 16 В. Активация Т-клеток CD4+, определенная путем оценки CD69, графически представлена на Фигуре 16С. Активация Т-клеток CD8+, определенная путем оценки CD25, графически представлена на Фигуре 16D. Активация Т-клеток CD8+, определенная путем оценки CD69, графически представлена на Фигуре 16Е.
[0057] На Фигурах 17А-17В представлены результаты исследований in vivo способности иллюстративных конструкций диател типа DART В CD 123 × CD3 опосредовать уменьшение размера опухолей in vivo. CD123-WT (50 мкг/кг) или CD123-M18 (в дозе 5 мкг/кг или 50 мкг/кг) вводили мышам, которым предварительно вводили клетки KG1A, и оценивали объем опухоли в течение 35 дней. Фигура 17А: CD4; Фигура 17 В: CD8.
[0058] На Фигурах 18A-18D представлены результаты исследований in vivo способности конструкций диател типа DART В CD123 × CD3 опосредовать уменьшение размера опухолей in vivo. CD123-WT, CD123-M2 или CD123-M18 (в дозе 0,5, 5, 50 или 500 мкг/кг) вводили мышам, которым предварительно вводили клетки KG1A, и оценивали объем опухоли в течение 35 дней. Фигура 18А: CD123-WT; Фигура 18 В: CD123-M2; Фигура 18С: CD123-M18; Фигура 18D: CD123-WT и CD 123-М 18 в группах, получавших дозы 50 мкг/кг и 500 мкг/кг.
[0059] На Фигурах 19A-19D представлены результаты исследований in vivo способности конструкций диател типа DART В CD123 × CD3 опосредовать уменьшение размера опухолей in vivo. CD123-WT, CD123-M2 или CD123-M18 (в дозе 0,5, 5, 50 или 500 мкг/кг) вводили мышам, которым предварительно вводили клетки MV4-11, и оценивали объем опухоли в течение 35 дней. Фигура 19А: CD123-WT; Фигура 19 В: CD123-M18; Фигура 19С: CD123-M2; Фигура 19D: CD123-WT, CD123-M2 и CD123-M18 в группах, получавших дозы 500 мкг/кг.
[0060] На Фигурах 20А-20 В представлены результаты исследований in vivo способности конструкций диател типа DART В 5Т4 × CD3 опосредовать уменьшение размера опухолей in vivo. 5T4-WT (в дозе 10, 50, 100 или 500 мкг/кг), 5Т4-М18 (в дозе 10, 50, 100 или 500 мкг/кг) или 5Т4-М2 (в дозе 500 мкг/кг) вводили мышам, которым предварительно вводили клетки SKOV3, и оценивали объем опухоли в течение 45 дней. Фигура 20А: 5T4-WT; Фигура 20В: 5Т4-М18 и 5Т4-М2.
[0061] На Фигурах 21A-21D представлены результаты исследований in vivo профиля высвобождения цитокинов, индуцированного диателами типа DART-B CD123 × CD3. Содержание цитокинов в сыворотке (пг/мл) оценивали через шесть часов после введения CD123-WT, CD123-M2 или CD123-M18 (в дозе 50 или 500 мкг/кг) мышам, которым предварительно вводили клетки KG1 А. Фигура 21А: ИФН-у; Фигура 21 В: ФНО-а; Фигура 21С: ИЛ-6; и Фигура 21D: ИЛ-2.
[0062] На Фигурах 22А-22С показана способность молекул типа TRIVALENT CD123 × CD3 × CD8, T-CD123-WT, T-CD123-M1, T-CD123-M2 и T-CD123-M18, связываться с антигенами клеточной поверхности. Фигура 22А: связывание с экспрессирующими CD123 клетками MOLM-13; Фигура 22 В: связывание с Т-клетками CD4+; Фигура 22С: связывание с Т-клетками CD8+.
[0063] На Фигурах 23A-23G представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного молекулами типа TRIVALENT CD123 × CD3 × CD8 T-CD123-WT, T-CD123-M1, T-CD123-M2 и T-CD123-M18, с применением различных популяций Т-клеток. Цитотоксичность в процентах при применении Pan-Т-клеток CD3+ (Фигура 23А); Т-клеток CD4+ (Фигура 23В) и Т-клеток CD8+ (Фигура 23С). Цитокиновые ответы при применении Pan-T-клеток CD3+ графически представлены на Фигурах 23D-23G. Фигура 23D: ИФН-γ; Фигура 23Е: ФНО-α; Фигура 23F: ИЛ-6; и Фигура 23G: ИЛ-2.
[0064] На Фигурах 24A-24J показаны содержание цитокинов в сыворотке, экспрессия Ki67 и уровни клинических маркеров патологии, наблюдаемые у яванских макаков, получавших CD123-M18 (10 мг/кг и 20 мг/кг) или CD123-WT (0,003 мг/кг). Фигура 24А: ИФН-γ; Фигура 24В: ФНО-α; Фигура 24С: ИЛ-6; Фигура 24D: ИЛ-2; Фигура 24Е: ИЛ-15; Фигура 24F: положительные по Ki67 Т-клетки CD4+; Фигура 24G: положительные по Ki67 Т-клетки CD8+; Фигура 24Н: тромбоциты; Фигура 24I: С-реактивный белок; Фигура 24J: азот мочевины крови.
[0065] На Фигурах 25A-25G представлены результаты репрезентативного исследования истощения бластных клеток ОМЛ, опосредованного DART-A-WT, CD123-WT, CD123-M1 и CD123-M18, в образцах периферической крови пациента с ОМЛ. Фигура 25А: количество бластных клеток ОМЛ 34+ в процентах от контроля; Фигура 25В: экспансия клеток CD4+; Фигура 25С: экспансия клеток CD8+; Фигуры 25D-G: высвобождение цитокинов (Фигура 25D: ИФН-γ; Фигура 25Е: ФНО-α; Фигура 25F: ИЛ-6; и Фигура 25G: ИЛ-2).
[0066] На Фигурах 26А-26Е представлены результаты репрезентативных исследований перенаправленного уничтожения клеток (анализ ЦТЛ), опосредованного конструкциям диател CD 123 × CD3 CD123-WT, CD123-M1, CD123-M13, CD123-M17, CD123-M18 и CD123-M19, с применением эффекторных Pan-Т- клеток и клеток-мишеней ОМЛ MOLM-13 (Е:Т=15:1, 48-96 ч). Цитотоксичность в зависимости от процента высвобожденной ЛДГ графически представлена на Фигуре 26А. Цитокиновые ответы графически представлены на Фигурах 26В-26Е (Фигура 26В: ИФН-гамма; Фигура 26С: ФНО-альфа; Фигура 26D: ИЛ-6; Фигура 26Е: ИЛ-2).
[0067] На Фигурах 27A-27D представлены совокупные результаты 4-7 анализов перенаправленного уничтожения клеток (анализ ЦТЛ) и исследований высвобождения цитокинов, опосредованных конструкциями диател CD123 × CD3 CD123-WT, CD123-M1, CD123-M13, CD123-M17, CD123-M18, CD123-M19 и DART-A-WT с применением эффекторных Pan-T-клеток и клеток-мишеней MOLM-13 ОМЛ (Е:Т=15:1, 48-96 ч). Значения ЕС50 активности ЦТЛ в пМ графически представлены на Фигуре 27А. Активность ЦТЛ в кратном отношении к значению ЕС50 CD123-WT графически представлена на Фигуре 27В. Emax активности ЦТЛ в процентах от CD123-WT графически представлена на Фигуре 27С.Рассчитанный терапевтический индекс (TI=Етах (ЦТЛ): Етах (цитокина)), нормированный на CD123-WT, графически представлен на Фигуре 27D.
[0068] На Фигурах 28А-28 В представлены результаты исследований in vivo способности конструкций диател CD123 × CD3 опосредовать уменьшение размера опухолей in vivo. CD123-WT (0,5 мг/кг), CD123-M18 или CD123-M13 (в дозе 0,005, 0,05, 0,5 и 1 мг/кг) вводили мышам, которым предварительно вводили клетки KG1A, и оценивали объем опухоли в течение 42 дней. Фигура 28А: CD123-WT и CD123-М18. Фигура 28 В: CD123-WT и CD123-M13.
[0069] На Фигурах 29А-29 В представлены результаты исследований in vivo способности конструкций диател CD 123 × CD3 опосредовать уменьшение размера опухолей in vivo. CD123-WT (0,05 мг/кг), CD123-M18 или CD123-M17 (в дозе 0,005, 0,05, 0,5 и 1 мг/кг) вводили мышам, которым предварительно вводили клетки KG1A, и оценивали объем опухоли в течение 42 дней. Фигура 29А: CD123-WT и CD123-М18. Фигура 29 В: CD123-WT и CD123-M17.
[0070] На Фигурах 30А-30В представлены результаты исследований in vivo профиля высвобождения интерлейкина-2, индуцированного диателами типа DART-В CD123 × CD3. Содержание цитокина в сыворотке (пг/мл) оценивали через шесть часов после введения CD123-WT (0,5 мг/кг), CD123-M13, CD123-M17 или CD123-М18 (в дозе 0,05, 0,5 и 1 мг/кг) мышам, которым предварительно вводили клетки KG1A Фигура 30А: CD123-WT, CD123-M13 и CD123-M18; и Фигура 30В: CD123-WT, CD123-M17 и CD123-M18.
[0071] На Фигурах 31A-31F представлены результаты репрезентативного исследования истощения аутологичных В-клеток под действием CD19-WT, CD19.1-М18 и ВИЧ-М18 в МКПК человека и яванского макака. Истощение В-клеток CD20+ графически представлено на Фигуре 31А (МКПК человека) и Фигуре 31 В (МКПК яванского макака). Высвобождение цитокинов из обработанных МКПК человека графически представлено на Фигурах 31C-F (Фигура 31С: ИФН-γ; Фигура 31D: ФНО-α; Фигура 31Е: ИЛ-6; и Фигура 31F: ИЛ-2).
[0072] На Фигурах 32A-32D показано снижение количества В-клеток, наблюдаемое в периферической крови яванских макаков, получавших CD19.1-M18 (1 мг/кг и 10 мг/кг) или CD123-WT (0,1 мг/кг). Количество В-клеток до введения показано на Фигуре 32А (популяция В-клеток обозначена овалом). Количества в день 1, день 8 и день 15 показаны на Фигурах 32В-32С, соответственно.
[0073] На Фигурах 33А-33С показано иммуногистохимическое окрашивание В-клеток в лимфатических узлах яванских макаков до введения и на 7 день после введения положительного контроля CD19-WT (Фигура 33А: 0,1 мг/кг) или вариантного антитела к CD3 CD19.1-M18 (Фигура 33В: 10 мг/кг; и Фигура 33С: 30 мг/кг).
[0074] На Фигуре 34 показано снижение количества В-клеток, наблюдаемое в периферической крови яванских макаков, получавших CD19.1-M13 (1 мг/кг), CD19.1-M17 (1 мг/кг) или CD19-WT (0,1 мг/кг).
[0075] На Фигурах 35А-35Е показано содержание цитокинов в сыворотке, наблюдаемое у яванских макаков, получавших CD19.1-M13 (1 мг/кг), CD19.1-M17 (1 мг/кг) или CD19-WT (0,1 мг/кг). Фигура 35А: ФНО-α, Фигура 35 В: ИФН-γ, Фигура 35С: ИЛ-2, Фигура 35D: ИЛ-6; и Фигура 35Е: ИЛ-15.
[0076] На Фигурах 36А-36В показана пролиферация Т-клеток, наблюдаемая у яванских макаков, получавших CD19.1-M13 (1 мг/кг), CD19.1-M17 (1 мг/кг) или CD19-WT (0,1 мг/кг). Фигура 36А: положительные по Ki67 Т-клетки CD4+; Фигура 36В: положительные по Ki67 Т-клетки CD8+.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0077] Настоящее изобретение относится к полиспецифичным связывающим молекулам (например, биспецифичному антителу, диателу, биспецифичному scFv, трехвалентной молекуле, TandAb®, BiTE® и так далее), содержащим связывающий CD3 домен, способный связывать эпитоп CD3, а также связывающий относящийся к заболеванию антиген домен, способный связывать эпитоп относящегося к заболеванию антигена («DA») (например, «связывающей DA х CD3 молекуле»). Настоящее изобретение, в частности, относится к таким связывающим DA х CD3 молекулам, содержащим вариантный связывающий CD3 домен («в. связывающий CD3 домен»), который содержит домен CDRH1, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3, аминокислотная последовательность по меньшей мере одного из которых отличается от аминокислотной последовательности соответствующей CDR эталонного связывающего CD3 домена («эт. связывающего CD3 домена»), и при этом указанная связывающая DA х CD3 молекула, содержащая такой в. связывающий CD3 домен, проявляет измененную аффинность в отношении CD3 по сравнению со связывающей DA х CD3 молекулой, содержащей такой эт. связывающий CD3 домен. Настоящее изобретение, в частности, относится к таким связывающим DA х CD3 молекулам, содержащим в. связывающий CD3 домен, которые проявляют пониженную аффинность в отношении CD3 и способны опосредовать перенаправленное уничтожение экспрессирующих DA клеток-мишеней, а также демонстрируют более низкие уровни высвобождения цитокинов по сравнению со связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. Настоящее изобретение, в частности, относится к применению связывающих DA х CD3 молекул, содержащих в. связывающий CD3 домен, при лечении рака и ассоциированных с патогеном заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат такую молекулу (молекулы).
[0078] Как указано выше, терапевтические молекулы согласно настоящему изобретению, в частности, включают биспецифичные связывающие молекулы, которые содержат эпитоп-связывающий домен, способный иммуноспецифично связывать эпитоп молекулы клеточной поверхности эффекторной клетки, и эпитоп-связывающий домен, который способен иммуноспецифично связывать эпитоп клетки-мишени, экспрессирующей относящийся к заболеванию антиген. В контексте настоящей заявки термин «относящийся к заболеванию антиген» (сокращенно «DA») обозначает антиген, который экспрессируется на поверхности аномально измененной или инфицированной клетки и является характерным для такого аномального изменения или инфекции, или который экспрессируется на поверхности чужеродной клетки и является характерным для такого чужеродного происхождения. В контексте настоящей заявки клетка, которая экспрессирует относящийся к заболеванию антиген на своей клеточной поверхности и которая может, таким образом, быть связана терапевтическими молекулами согласно настоящему изобретению и тем самым становиться мишенью для уничтожения, опосредованного такими терапевтическими молекулами, является «клеткой-мишенью». Особое значение для настоящего изобретения имеют относящиеся к заболеванию антигены, которые представляют собой «раковые антигены» или «ассоциированные с патогеном антигены».
I. Антитела и их связывающие домены
[0079] Связывающие DA х CD3 молекулы согласно настоящему изобретению могут представлять собой антитела или могут быть получены из антител (например, путем фрагментации, расщепления и так далее полипептидов антител, или путем применения аминокислотных последовательностей молекул антител или полинуклеотидов (или их последовательностей), которые кодируют такие полинуклеотиды, и так далее).
[0080] Антитела представляют собой молекулы иммуноглобулинов, способные специфично связываться с конкретным доменом, или фрагментом, или конформацией («эпитопом») молекулы, такой как углевод, полинуклеотид, липид, полипептид и так далее. Содержащая эпитоп молекула может обладать иммуногенными свойствами, благодаря которым она вызывает ответ, заключающийся в выработке антител у животного; такие молекулы называют «антигенами». В контексте настоящей заявки термины «антитело» и «антитела» относятся к моноклональным антителам, полиспецифичным антителам, антителам человека, гуманизированным антителам, синтетическим антителам, химерным антителам, поликлональным антителам, камелизированным (camelized) антителам, одноцепочечным Fvs (scFv), одноцепочечным антителам, Fab-фрагментам, F(ab')-фрагментам, стабилизированным дисульфидной связью биспецифичным Fvs (sdFv), внутриклеточным антителам (intrabodies) и эпитоп-связывающим доменам любого из указанных выше. В частности, термин «антитело» включает молекулы иммуноглобулинов и иммунологически активные фрагменты молекул иммуноглобулинов, то есть молекулы, которые содержат эпитоп-связывающий домен. Молекулы иммуноглобулинов могут принадлежать к любому типу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу. Антитела способны «иммуноспецифично связываться» с полипептидом, или белком, или небелковой молекулой вследствие присутствия в такой молекуле определенного домена, или фрагмента, или конформации («эпитопа»).
[0081] Термин «моноклональное антитело» относится к гомогенной популяции антител, где моноклональное антитело состоит из аминокислот (встречающихся в природе или не встречающихся в природе), вовлеченных в избирательное связывание антигена. Моноклональные антитела высокоспецифичны, они нацелены на единственный эпитоп (антигенную детерминанту). Термин «моноклональное антитело» охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но и их фрагменты (такие как Fab, Fab', F(ab')2, Fv, одноцепочечный (scFv), их мутанты), белки слияния, содержащие часть антитела, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена, обладающий требуемой специфичностью и способностью связываться с антигеном. Не предполагается, что он имеет ограничения, связанные с источником антитела или способом его получения (например, посредством гибридомной технологии, отбора с использованием фагового дисплея, экспрессии рекомбинантных генов, с использованием трансгенных животных и так далее). Термин включает цельные иммуноглобулины, а также фрагменты и так далее, описанные выше под определением термина «антитело». Способы получения моноклональных антител известны в данной области техники. Одним из способов, которые могут быть применены, является способ, описанный в источнике Kohler, G. et al. (1975) "Continuous Cultures Of Fused Cells Secreting Antibody Of Predefined Specificity," Nature 256:495-497, или его модификация. Как правило, моноклональные антитела получают в организме мышей, крыс или кроликов. Антитела получают путем иммунизации животного иммуногенным количеством клеток, клеточных экстрактов или препаратов белков, которые содержат желаемый эпитоп. Иммуноген может представлять собой, но не ограничивается перечисленным, первичные клетки, культивируемые линии клеток, раковые клетки, белки, пептиды, нуклеиновые кислоты или ткань. Клетки, применяемые для иммунизации, могут культивироваться в течение определенного периода времени (например, по меньшей мере 24 часа), после чего их применяют в качестве иммуногена. Клетки могут быть применены в качестве иммуногенов отдельно или в комбинации с неденатурирующим адъювантом, таким как Ribi (см., например, Jennings, V.M. (1995) "Review of Selected Adjuvants Used in Antibody Production" ILAR J. 37(3): 119-125). В целом, при использовании в качестве иммуногенов клетки должны оставаться интактными и предпочтительно жизнеспособными. Интактные клетки могут обеспечить лучшее обнаружение антигенов организмом иммунизированного животного, чем разрушенные клетки. Использование денатурирующих или агрессивных адъювантов, например, адъюванта Фрейнда, может привести к разрушению клеток, и, следовательно, не рекомендуется. Иммуноген может быть введен несколько раз через определенные периоды времени, как то два раза в неделю или один раз в неделю, или может быть введен таким образом, чтобы поддерживать жизнеспособность в организме животного (например, в тканевом рекомбинанте). В качестве альтернативы, существующие моноклональные антитела и любые другие эквивалентные антитела, которые являются иммуноспецифичными в отношении желаемого патогенного эпитопа, могут быть секвенированы и получены с помощью рекомбинантных методик любыми способами, известными в данной области техники. В одном из вариантов реализации такое антитело секвенируют, и затем полученную полинуклеотидную последовательность клонируют в вектор для экспрессии или получения больших количеств. Последовательность, кодирующая целевое антитело, может быть сохранена в векторе в клетке-хозяине, и затем может быть проведено наращивание массы клеток-хозяев и их замораживание для последующего использования. Полинуклеотидная последовательность таких антител может быть применена для генетических манипуляций с целью получения моноспецифичных или полиспецифичных (например, биспецифичных, триспецифичных и тетраспецифичных) молекул согласно настоящему изобретению, а также оптимизированного по аффинности химерного антитела, гуманизированного антитела и/или канинизированного (caninized) антитела для улучшения аффинности или других характеристик антитела, как подробно описано ниже.
[0082] Связывающие молекулы согласно настоящему изобретению связывают эпитопы с помощью их связывающих доменов «иммуноспецифичным» образом. В контексте настоящей заявки говорится, что антитело, диатело или другая эпитоп-связывающая молекула «иммуноспецифично» связывает область другой молекулы (то есть эпитоп), если она взаимодействует или образует комплекс с указанным эпитопом более часто, более быстро, на более продолжительное время и/или с большей аффинностью, чем с альтернативными эпитопами. Например, антителом, которое иммуноспецифично связывается с вирусным эпитопом, является антитело, которое связывает этот вирусный эпитоп с большей аффинностью, авидностью, более легко и/или на более продолжительное время, чем при его иммуноспецифичном связывании с другими вирусными эпитопами или невирусными эпитопами. Из этого определения также понятно, что, например, антитело (или фрагмент, или эпитоп), которое иммуноспецифично связывается с первой мишенью, может специфично или преимущественно связываться или не связываться со второй мишенью. По существу, «иммуноспецифичное связывание» не обязательно предполагает (хотя может включать) единственно возможное связывание. Обычно, но не обязательно, в контексте настоящей заявки указание на связывание означает «иммуноспецифичное» связывание.
[0083] В последние несколько десятилетий наблюдается возобновление интереса к терапевтическому потенциалу антител, и антитела стали одним из ведущих классов лекарственных средств, получаемых с помощью биотехнологии (Chan, СЕ. et al. (2009) "The Use Of Antibodies In The Treatment OfInfectious Diseases," Singapore Med. J. 50(7):663-666). Более 200 лекарственных средств на основе антител были одобрены для применения или находятся в стадии разработки.
[0084] Природные антитела (такие как антитела IgG) состоят из двух «легких цепей» объединенных в комплекс с двумя «тяжелыми цепями». Каждая легкая цепь содержит вариабельный домен («VL») и константный домен («CL»). Каждая тяжелая цепь содержит вариабельный домен («VH»), три константных домена («СН1», «СН2» и «СН3») и«шарнирную» область («Н»), расположенную между доменами СН1 и СН2. Напротив, scFv представляют собой одноцепочечные молекулы, полученные путем связывания вариабельных доменов легкой и тяжелой цепи друг с другом посредством короткого связывающего пептида.
[0085] Основная структурная единица встречающихся в природе иммуноглобулинов (например, IgG), таким образом, представляет собой тетрамер, содержащий две легкие цепи и две тяжелые цепи, который обычно экспрессируется в виде гликопротеина с молекулярной массой примерно 150000 Да. Аминоконцевая («N-концевая») часть каждой цепи включает вариабельный домен, содержащий примерно от 100 до 110 или более аминокислот, в первую очередь ответственный за распознавание антигена. Карбоксиконцевая («С-концевая») часть каждой цепи определяет константную область, при этом легкие цепи имеют один константный домен, а тяжелые цепи обычно имеют три константных домена и шарнирный домен. Таким образом, структура легких цепей молекулы IgG представляет собой N-VL-CL-с, и структура тяжелых цепей IgG представляет собой N-VH-CH1-H-CH2-CH3-C (где n и с означают, соответственно, N-конец и С-конец полипептида). Способность интактного немодифицированного антитела (например, антитела IgG) связывать эпитоп антигена зависит от присутствия и последовательностей вариабельных доменов. Если специально не указано иное, порядок доменов молекул белков, описанных в настоящей заявке, соответствует направлению «от N-концевого к С-концевому».
А. Характеристики вариабельных доменов антител
[0086] Вариабельные домены молекулы IgG состоят из трех определяющих комплементарность областей («CDR»), содержащих аминокислотные остатки антитела, которые будут контактировать с эпитопом, а также четырех промежуточных не относящихся к CDR сегментов, называемых каркасными областями («FR»), которые разделяют сегменты CDR и которые в целом поддерживают структуру и определяют положение остатков CDR для обеспечения возможности контактирования с эпитопом (хотя некоторые каркасные остатки также могут играть некоторую роль в таком контакте). Таким образом, домены VL и VH имеют структуру n-FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4-c, где n и с означают, соответственно, N-конец и С-конец указанных доменов. Аминокислотные последовательности CDR определяют, будет ли антитело способно связываться с конкретным эпитопом.
[0087] Аминокислоты вариабельных доменов зрелых тяжелой и легкой цепей иммуноглобулинов обозначаются положением аминокислоты в цепи. В источнике Kabat et at. (Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, NH1, MD (1991) («нумерация Кабата»), явным образом включенном в настоящую заявку посредством ссылки), описаны многочисленные аминокислотные последовательности для антител, идентифицированы консенсусные последовательности аминокислот для каждой подгруппы и присвоен номер остатка каждой аминокислоте. CDR идентифицируют, как определено Кабатом (следует понимать, что CDRH1, определенная Chothia, С. & Lesk, А.М. ((1987) "Canonical structures for the hypervariable regions of immunoglobulins," J. Mol. Biol. 196:901-917), начинается на пять остатков раньше). Схема нумерации Кабата может быть применена к антителам, не включенным в составленный им перечень, путем выравнивания последовательности рассматриваемого антитела с одной из консенсусных последовательностей, пронумерованных по системе Кабата, по консервативным аминокислотам. Этот метод присвоения номеров остатков стал стандартом в данной области техники и позволяет легко идентифицировать аминокислоты в эквивалентных положениях в различных антителах, включая химерные или гуманизированные варианты. Например, аминокислота в положении 50 легкой цепи антитела человека занимает эквивалентное положение по отношению к аминокислоте в положении 50 легкой цепи антитела мыши.
[0088] Полипептиды, которые представляют собой первую, вторую и третью CDR легкой цепи антитела (или могут осуществлять их функции), в настоящей заявке соответственно обозначены как: домен CDRL1, домен CDRL2 и домен CDRL3. Схожим образом, полипептиды, которые представляют собой первую, вторую и третью CDR тяжелой цепи антитела (или могут осуществлять их функции), в настоящей заявке соответственно обозначены как: домен CDRH1, домен CDRH2 и домен CDRH3. Таким образом, термины домен CDRL1, домен CDRL2, домен CDRL3, домен CDRH1, домен CDRH2 и домен CDRH3 относятся к полипептидам, которые, будучи включенными в белок, обусловливают способность этого белка связывать конкретный эпитоп независимо от того, является ли такой белок антителом, имеющим легкую и тяжелую цепи, или представляет собой диатело, или одноцепочечную связывающую молекулу (например, scFv, BiTe и так далее), или представляет собой другой тип белка. Соответственно, в контексте настоящей заявки термин «эпитоп-связывающий домен» обозначает домен, содержащий фрагмент или часть связывающей молекулы (или полипептид, имеющий аминокислотную последовательность такого фрагмента или части), которая обусловливает способность связывающей молекулы иммуноспецифично связывать эпитоп. Эпитоп-связывающий домен может содержать любые 1, 2, 3, 4 или 5 доменов CDR антитела, или может содержать все 6 доменов CDR антитела и, несмотря на способность к иммуноспецифичному связыванию такого эпитопа, может проявлять иммуноспецифичность, аффинность или избирательность по отношению к такому эпитопу, отличные от таковых у данного антитела. Эпитоп-связывающий домен может содержать только часть CDR, а именно подмножество остатков CDR, необходимых для связывания (называемых «определяющими специфичность остатками», или «SDR»; Kim, J.H. et al. (2012) "Humanization By CDR Grafting And Specificity-Determining Residue Grafting" Methods Mol. Biol. 907:237-245; Kim, K.S. et al. (2010) "Construction Of A Humanized Antibody To Hepatitis В Surface Antigen By Specificity-Determining Residues (SDR)-Grafting And De-Immunization," Biochem. Biophys. Res. Commun. 396(2):231-237; Kashmiri, S.V. et al. (2005) "SDR Grafting-A New Approach To Antibody Humanization" Methods 36(1):25-34; Gonzales, N.R. et al. (2004) "SDR Grafting Of A Murine Antibody Using Multiple Human Germline Templates To Minimize Its Immunogenicity" Mol. Immunol. 41:863-872). Однако предпочтительно, чтобы эпитоп-связывающий домен содержал все 6 доменов CDR такого антитела. Эпитоп-связывающий домен антитела может представлять собой одну полипептидную цепь (например, scFv) или может содержать две или более полипептидных цепей, каждая из которых имеет аминный конец и карбоксильный конец (например, диатело, Fab-фрагмент, Fab2 фрагмент и так далее).
[0089] Настоящее изобретение также, в частности, охватывает связывающие молекулы, которые содержат домен VL и/или домен VH гуманизированного антитела. Термин «гуманизированное антитело» антитело относится к химерной молекуле, обычно полученной с помощью рекомбинантных методик, имеющей эпитоп-связывающий домен иммуноглобулина, полученного от видов, не являющихся человеком, и остальную структуру иммуноглобулина - от молекулы, полученной на основе структуры и/или последовательности иммуноглобулина человека. Полинуклеотидная последовательность вариабельных доменов таких антител может быть применена для генетических манипуляций с целью получения таких производных и для улучшения аффинности или других характеристик таких антител. Основной принцип гуманизации антитела предполагает сохранение основной последовательности эпитоп-связывающего домена антитела с заменой остальной части антитела, отличной от антитела человека, последовательностями антитела человека. Существует четыре основных стадии гуманизации моноклонального антитела. К ним относятся: (1) определение нуклеотидной и ожидаемой аминокислотной последовательности вариабельных доменов легкой и тяжелой цепи исходного антитела; (2) конструирование гуманизированного антитела или канинизированного антитела, то есть принятие решения, какую каркасную область антитела следует использовать в процессе гуманизации или канинизации; (3) конкретные подходы/методики гуманизации или канинизации и (4) трансфекция и экспрессия гуманизированного антитела. См., например, патенты США №4,816,567; 5,807,715; 5,866,692 и 6,331,415
[0090] Эпитоп-связывающий домен может включать либо полный вариабельный домен, гибридизованный с константными доменами, либо только определяющие комплементарность области (CDR) такого вариабельного домена, привитые на подходящие каркасные области. Эпитоп-связывающие домены могут быть дикого типа или быть модифицированы посредством одной или более аминокислотных замен. Это позволяет удалить константную область, иммуногенную для людей, однако сохраняется возможность иммунного ответа на чужеродный вариабельный домен (LoBuglio, A.F. et al. (1989) "Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response" Proc. Natl. Acad. Sci. (U.S.A.) 86:4220-4224). Другой подход направлен не только на обеспечение константных областей человеческого происхождения, но и на модификацию вариабельных доменов, а также их реконструирование с получением формы, максимально приближенной к таковой у человека. Известно, что вариабельные домены как тяжелой, так и легкой цепей содержат три определяющих комплементарность области (CDR), которые изменяются при ответе на соответствующие антигены и определяют способность к связыванию, окруженные четырьмя каркасными областями (FR), которые относительно консервативны у данного вида и предположительно обеспечивают поддержание структуры CDR. Когда антитела, не являющиеся человеческими, получают для конкретного антигена, вариабельные домены могут быть «реконструированы» или «гуманизированы» путем прививки CDR, полученных из антитела, не являющегося человеческим, на FR, присутствующие в антителе человека, подлежащем модификации. О применении этого подхода к различным антителам сообщалось в источниках Sato, K. et al. (1993) Cancer Res 53:851-856. Riechmann, L. et al. (1988) "Reshaping Human Antibodies for Therapy" Nature 332:323-327; Verhoeyen, M. et al. (1988) "Reshaping Human Antibodies: Grafting An Antilysozyme Activity" Science 239:1534-1536; Kettleborough, C.A. et al. (1991) "Humanization Of A Mouse Monoclonal Antibody By CDR-Grafting: The Importance Of Framework Residues On Loop Conformation" Protein Engineering 4:773-3783; Maeda, H. et al. (1991) "Construction Of Reshaped Human Antibodies With HIV-Neutralizing Activity" Human Antibodies Hybridoma 2:124-134; Gorman, S.D. et al. (1991) "Reshaping A Therapeutic CD4 Antibody," Proc. Natl. Acad. Sci. (U.S.A.) 88:4181-4185; Tempest, P.R. et al. (1991) "Reshaping A Human Monoclonal Antibody To Inhibit Human Respiratory Syncytial Virus Infection in vivo" Bio/Technology 9:266-271; Co, M.S. et al. (1991) "Humanized Antibodies For Antiviral Therapy" Proc. Natl. Acad. Sci. (U.S.A.) 88:2869-2873; Carter, P. et al. (1992) "Humanization Of An Anti-p185her2 Antibody For Human Cancer Therapy," Proc. Natl. Acad. Sci. (U.S.A.) 89:4285-4289; and Co, M.S. et al. (1992) "Chimeric And Humanized Antibodies With Specificity For The CD33 Antigen" J. Immunol. 148:1149-1154. В некоторых вариантах реализации гуманизированные антитела сохраняют все последовательности CDR (например, гуманизированное антитело мыши, которое содержит все шесть CDR антитела мыши). В других вариантах реализации гуманизированные антитела имеют одну или более CDR (одну, две, три, четыре, пять и/или шесть), которые отличаются по последовательности от исходного антитела.
[0091] Был описан ряд молекул гуманизированных антител, содержащих эпитоп-связывающий домен, полученный из иммуноглобулина, не являющегося иммуноглобулином человека, включая химерные антитела, имеющие вариабельный домен антитела грызунов или модифицированный вариабельный домен антитела грызунов и связанные с ними определяющие комплементарность области (CDR), гибридизованные с константными доменами антитела человека (см., например, Winter et al. (1991) "Man-made Antibodies," Nature 349:293-299; Lobuglio et al. (1989) "Mouse/Human Chimeric Monoclonal Antibody In Man: Kinetics And Immune Response" Proc. Natl. Acad. Sci. (U.S.A.) 86:4220-4224 (1989), Shaw et al. (1987) "Characterization Of A Mouse/Human Chimeric Monoclonal Antibody (11-1 A) To A Colon Cancer Tumor-Associated Antigen" J. Immunol. 138:4534-4538, and Brown et al. (1987) "Tumor-Specific Genetically Engineered Murine/Human Chimeric Monoclonal Antibody" Cancer Res. 47:3577-3583). В других источниках описаны CDR антитела грызунов, привитые на стабилизирующую каркасную область (FR) антитела человека, с последующей гибридизацией с подходящим константным доменом антитела человека (см., например, Riechmann, L. et al. (1988) "Reshaping Human Antibodies for Therapy; "Nature 332:323-327; Verhoeyen, M. et al. (1988) "Reshaping Human Antibodies: Grafting An Antilysozyme Activity," Science 239:1534-1536; и Jones et al. (1986) "Replacing The Complementarity-Determining Regions In A Human Antibody With Those From A Mouse" Nature 321:522-525). В другом источнике описаны CDR антитела грызунов, стабилизированные рекомбинантно венированными каркасными областями антитела грызунов. См., например, публикацию заявки на европейский патент №519,596. Эти «гуманизированные» молекулы выполнены с возможностью минимизации нежелательного иммунного ответа на молекулы антител грызунов к антителам человека, который ограничивает продолжительность и эффективность терапевтического применения этих фрагментов у реципиентов-людей. Другие способы гуманизации антител, которые также могут быть применены, раскрыты в источнике Daugherty et al. (1991) "Polymerase Chain Reaction Facilitates The Cloning, CDR-Grafting, And Rapid Expression Of A Murine Monoclonal Antibody Directed Against The CD18 Component Of Leukocyte Integrins" Nucl. Acids Res. 19:2471-2476 и в патентах США №6,180,377; 6,054,297; 5,997,867 и 5,866,692.
В. Характеристики константных областей антител
[0092] Во всем объеме настоящей заявки нумерация остатков в константной области IgG соответствует нумерации согласно индексу EU, описанной в источнике Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, NH1, MD (1991) («нумерации Кабата»), явным образом включенном в настоящую заявку посредством ссылки. Термин «индекс EU по системе Кабата» относится к нумерации константных доменов антитела EU IgG1 человека.
[0093] В ряде различных положений внутри константных областей антитела (например, Fc-положениях, включая, но не ограничиваясь перечисленными, положения 270, 272, 312, 315, 356 и 358 в соответствии с нумерацией согласно индексу EU по системе Кабата) наблюдались полиморфизмы, и, следовательно, могут существовать небольшие различия между представленной последовательностью и последовательностями, известными из уровня техники. Полиморфные формы иммуноглобулинов человека хорошо охарактеризованы. В настоящее время известно 18 аллотипов тяжелых цепей («Gm-аллотипов»): G1m (1, 2, 3, 17), или G1m (а, x, f, z), G2m (23), или G2m (n), G3m (5, 6, 10, 11, 13, 14, 15, 16, 21, 24, 26, 27, 28), или G3m (b1, с3, b3, b0, b3, b4, s, t, g1, c5, u, v, g5) (Lefranc, et al., "The Human IgG Subclasses: Molecular Analysis Of Structure, Function And Regulation.” Pergamon, Oxford, pp. 43-78 (1990); Lefranc, G. et al., 1979, Hum. Genet: 50, 199-211). Следует, в частности, учитывать, что антитела согласно настоящему изобретению могут включать любой аллотип, изоаллотип или гаплотип любого гена иммуноглобулина и не ограничиваются аллотипом, изоаллотипом или гаплотипом последовательностей, представленных в настоящей заявке. Помимо этого, в некоторых системах экспрессии С-концевой аминокислотный остаток (выделенный жирным шрифтом выше) домена СН3 может быть удален постгрансляционно. Соответственно, С-концевой остаток домена СН3 является необязательным аминокислотным остатком в связывающих молекулах согласно настоящему изобретению. В частности, настоящее изобретение охватывает связывающие молекулы, лишенные С-концевого остатка домена СН3. Настоящее изобретение также, в частности, охватывает такие конструкции, содержащие С-концевой остаток лизина в домене СН3.
1. Константные домены тяжелой цепи
[0094] Домены СН1 двух тяжелых цепей антитела образуют комплекс с константной областью легкой цепи «CL» антитела и присоединяются к доменам СН2 тяжелых цепей через промежуточный шарнирный домен.
[0095] Иллюстративный домен СН1 представляет собой домен CH1 IgG1 человека. Аминокислотная последовательность иллюстративного домена CH1 IgG1 человека (SEQ ID NO: 1):
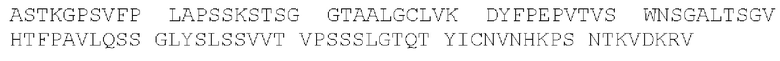
[0096] Иллюстративный домен CH1 представляет собой домен CH1 IgG2 человека. Аминокислотная последовательность иллюстративного домена CH1 IgG2 человека (SEQ ID NO: 2):
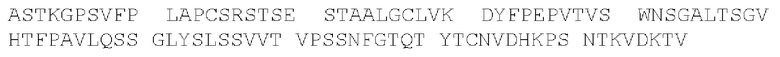
[0097] Иллюстративный домен CH1 представляет собой домен CH1 IgG3 человека. Аминокислотная последовательность иллюстративного домена CH1 IgG3 человека (SEQ ID NO: 3):
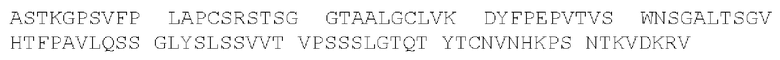
[0098] Иллюстративный домен CH1 представляет собой домен CH1 IgG4 человека. Аминокислотная последовательность иллюстративного домена CH1 IgG4 человека (SEQ ID NO: 4):
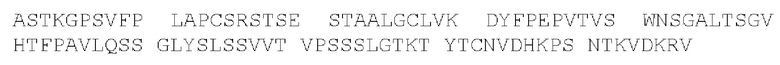
[0099] Один из иллюстративных шарнирных доменов представляет собой шарнирный домен IgG1 человека. Аминокислотная последовательность иллюстративного шарнирного домена IgG1 человека (SEQ ID NO: 5):  .
.
[00100] Другой иллюстративный шарнирный домен представляет собой шарнирный домен IgG2 человека. Аминокислотная последовательность иллюстративного шарнирного домена IgG2 человека (SEQ ID NO: 6):  .
.
[00101] Другой иллюстративный шарнирный домен представляет собой шарнирный домен IgG3 человека. Аминокислотная последовательность иллюстративного шарнирного домена IgG2 человека (SEQ ID NO: 7):

[00102] Другой иллюстративный шарнирный домен представляет собой шарнирный домен IgG4 человека. Аминокислотная последовательность иллюстративного шарнирного домена IgG4 человека (SEQ ID NO: 8):  . Как описано в настоящей заявке, шарнирный домен IgG4 может содержать стабилизирующую мутацию, такую как замена S228P. Аминокислотная последовательность иллюстративного S228P-стабилизированного шарнирного домена IgG4 человека (SEQ ID NO: 9):
. Как описано в настоящей заявке, шарнирный домен IgG4 может содержать стабилизирующую мутацию, такую как замена S228P. Аминокислотная последовательность иллюстративного S228P-стабилизированного шарнирного домена IgG4 человека (SEQ ID NO: 9):  .
.
[00103] Домены СН2 и СН3 двух тяжелых цепей антитела IgG взаимодействуют с образованием «Fc-домена» антител IgG, который распознается клеточными Fc-рецепторами, включая Fc-гамма рецепторы (FcγR), но не ограничиваясь ими. В контексте настоящей заявки термин «Fc-домен» используют для определения С-концевой области тяжелой цепи IgG. Говорится, что Fc-домен относится к определенному изотипу, классу или подклассу IgG, если его аминокислотная последовательность наиболее гомологична этому изотипу по сравнению с другими изотипами IgG. Помимо известного применения антител в диагностике, было показано, что они пригодны для применения в качестве терапевтических агентов.
[00104] Аминокислотная последовательность домена СН2-СН3 иллюстративного IgG1 человека (SEQ ID NO: 10):

в соответствии с нумерацией согласно индексу EU по системе Кабата, где  представляет собой лизин (K) или отсутствует.
представляет собой лизин (K) или отсутствует.
[00105] Аминокислотная последовательность домена СН2-СН3 иллюстративного IgG2 человека (SEQ ID NO: 11):

в соответствии с нумерацией согласно индексу EU по системе Кабата, где  представляет собой лизин (K) или отсутствует.
представляет собой лизин (K) или отсутствует.
[00106] Аминокислотная последовательность домена СН2-СН3 иллюстративного IgG3 человека (SEQ ID NO: 12):

в соответствии с нумерацией согласно индексу EU по системе Кабата, где  представляет собой лизин (K) или отсутствует.
представляет собой лизин (K) или отсутствует.
[00107] Аминокислотная последовательность домена СН2-СН3 иллюстративного IgG4 человека (SEQ ID NO: 13):

в соответствии с нумерацией согласно индексу EU по системе Кабата, где  представляет собой лизин (K) или отсутствует.
представляет собой лизин (K) или отсутствует.
2. Константные домены легкой цепи
[00108] Как указано выше, каждая легкая цепь антитела содержит вариабельный домен («VL») и константный домен («CL»).
[00109] Предпочтительным доменом CL является домен CL каппа IgG человека. Аминокислотная последовательность иллюстративного домена CL каппа человека (SEQ ID NO: 14):
[00110] В качестве альтернативы, иллюстративный домен CL представляет собой домен CL лямбда IgG человека. Аминокислотная последовательность иллюстративного домена CL лямбда человека (SEQ ID NO: 15):
II. Полиспецифичные связывающие молекулы
[00111] Способность антитела связывать эпитоп антигена зависит от наличия и аминокислотной последовательности доменов VL и VH антитела. Взаимодействие легкой цепи и тяжелой цепи антитела и, в частности, взаимодействие его доменов VL и VH приводит к образованию одного из двух эпитоп-связывающих доменов природного антитела, такого как IgG. Природные антитела способны связывать только один вид эпитопа (то есть они являются моноспецифичными), хотя они могут связывать несколько копий этого вида (то есть проявлять двухвалентность или поливалентность).
[00112] Функциональные возможности антител могут быть усовершенствованы путем получения полиспецифичных молекул на основе антител, которые могут одновременно связывать два отдельных различающихся антигена (или различные эпитопы одного антигена), и/или путем получения молекулы на основе антитела, имеющей большую валентность (то есть более двух связывающих доменов) для одного и того же эпитопа и/или антигена.
[00113] Для получения молекул, обладающих большими возможностями, чем природные антитела, были разработаны разнообразные форматы рекомбинантных биспецифичных антител (см., например, публикации заявок РСТ № WO 2008/003116, WO 2009/132876, WO 2008/003103, WO 2007/146968, WO 2009/018386, WO 2012/009544, WO 2013/070565), в большинстве из которых используют линкерные пептиды либо для слияния дополнительного эпитоп-связывающего домена (например, scFv, VL, VH и так далее) с ядром антитела или введения его внутрь ядра (IgA, IgD, IgE, IgG или IgM), либо для слияния нескольких эпитоп-связывающих доменов (например, двух Fab-фрагментов или scFv). В альтернативных форматах используют линкерные пептиды для слияния эпитоп-связывающих доменов (например, scFv, VL, VH и так далее) с доменом димеризации, таким как домен СН2-СН3, или альтернативными полипептидами (WO 2005/070966, WO 2006/107786 WO 2006/107617, WO 2007/046893). В публикациях заявок РСТ № WO 2013/174873, WO 2011/133886 и WO 2010/136172 раскрыто триспецифичное антитело, в котором домены CL и СН1 подвергают переключению относительно их соответствующих природных положений, и домены VL и VH были диверсифицированы (WO 2008/027236; WO 2010/108127) для обеспечения их возможности связывать более одного антигена. В публикациях заявок РСТ № WO 2013/163427 и WO 2013/119903 раскрыта модификация домена СН2 для обеспечения содержания аддукта гибридного белка, содержащего связывающий домен. В публикациях заявок РСТ № WO 2010/028797, WO2010028796 и WO 2010/028795 раскрыты рекомбинантные антитела, Fc-домены которых были заменены дополнительными доменами VL и VH с получением трехвалентных связывающих молекул. В публикациях заявок РСТ № WO 2003/025018 и WO2003012069 раскрыты рекомбинантные диатела, отдельные цепи которых содержат домены scFv. В публикации заявки РСТ № WO 2013/006544 раскрыты поливалентные Fab-молекулы, которые синтезируют в виде единой полипептидной цепи и затем подвергают протеолизу с получением гетеродимерных структур. В публикациях заявок РСТ № WO 2014/022540, WO 2013/003652, WO 2012/162583, WO 2012/156430, WO 2011/086091, WO 2008/024188, WO 2007/024715, WO 2007/075270, WO 1998/002463, WO 1992/022583 и WO 1991/003493 раскрыто добавление дополнительных связывающих доменов или функциональных групп к антителу или части антитела (например, добавление диатела к легкой цепи антитела, или добавление дополнительных доменов VL и VH к легкой и тяжелой цепям антитела, или добавление гетерологичного гибридного белка, или связывание нескольких доменов Fab друг с другом).
[00114] В данной области техники дополнительно отмечена возможность получения диател, которые отличаются от таких природных антител тем, что они способны связывать два или более различных видов эпитопов (то есть проявлять биспецифичность или полиспецифичность помимо или вместо двухвалентности или поливалентности) (см., например, Holliger et al. (1993) "Diabodies”: Small Bivalent And Bispecific Antibody Fragments," Proc. Natl. Acad. Sci. (U.S.A.) 90:6444-6448; US 2004/0058400 (Ftollinger et al); US 2004/0220388 / WO 02/02781 (Mertens et al.); Alt et al. (1999) FEBS Lett. 454(l-2):90-94; Lu, D. et al. (2005) CA Fully Human Recombinant IgG-Like Bispecific Antibody To Both The Epidermal Growth Factor Receptor And The Insulin-Like Growth Factor Receptor For Enhanced Antitumor Activity" J. Biol. Chem. 280(20): 19665-19672; WO 02/02781 (Mertens et al); Olafsen, T. et al (2004) "Covalent Disulfide-Linked Anti-CEA Diabody Allows Site-Specific Conjugation And Radiolabeling For Tumor Targeting Applications," Protein Eng. Des. Sel. 17(l):21-27; Wu, A. et al. (2001) "Multimerization OfA Chimeric Anti-CD20 Single Chain Fv-Fv Fusion Protein Is Mediated Through Variable Domain Exchange" Protein Engineering 14(2): 1025-1033; Asano et al. (2004) "A Diabody For Cancer Immunotherapy And Its Functional Enhancement By Fusion Of Human Fc Domain," Abstract 3P-683, J. Biochem. 76(8):992; Takemura, S. et al. (2000) "Construction Of A Diabody (Small Recombinant Bispecific Antibody) Using A Refolding System" Protein Eng. 13(8):583-588; Baeuerle, P.A. et al. (2009) "Bispecific T-Cell Engaging Antibodies For Cancer Therapy" Cancer Res. 69(12):4941-4944).
[00115] В частности, были разработаны стабильные ковалентно связанные гетеродимерные немоноспецифичные диатела, называемые диателами DART®; см., например, Sloan, D.D. et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targeting Molecules (DARTs) that Bind HIV Envelope and Recruit Cytotoxic T Cells" PLoS Pathog. 11(11):e1005233. doi: 10.1371/journal.ppat. 1005233; Al Hussaini, M. et al. (2015) "Targeting CD123 InAML Using A T-Cell Directed Dual-Affinity Re-Targeting (DART®) Platform" Blood pii: blood-2014-05-575704; Chichili, G.R. et al. (2015) "A CD3xCD123 Bispecific DART For Redirecting Host T Cells To Myelogenous Leukemia: Preclinical Activity And Safety In Nonhuman Primates" Sci. Transl. Med. 7(289):289ra82; Moore, P.A. et al. (2011) "Application Of Dual Affinity Retargeting Molecules To Achieve Optimal Redirected T-Cell Killing Of B-Cell Lymphoma" Blood 117(17):4542-4551; Veri, M.C. et al. (2010) "Therapeutic Control Of B-Cell Activation Via Recruitment Of Fcgamma Receptor lib (CD32B) Inhibitory Function With A Novel Bispecific Antibody Scaffold," Arthritis Rheum. 62(7): 1933-1943; Johnson, S. et al. (2010) "Effector Cell Recruitment With Novel Fv-Based Dual-Affinity Re-Targeting Protein Leads To Potent Tumor Cytolysis And in vivo B-Cell Depletion" J. Mol. Biol. 399(3):436-449); патенты США №8,044,180; 8,133,982; 8,187,593; 8,193,318; 8,530,627; 8,669,349; 8,778,339; 8,784,808; 8,795,667; 8,802,091; 8,802,093; 8,946,387; 8,968,730 и 8,993,730; публикации заявок на патент США №2009/0060910; 2010/0174053; 2011/0081347; 2011/0097323; 2011/0117089; 2012/0009186; 2012/0034221; 2012/0141476; 2012/0294796; 2013/0149236; 2013/0295121; 2014/0017237 и 2014/0099318; европейские патентные документы № ЕР 1868650; ЕР 2158221; ЕР 2247304; ЕР 2252631; ЕР 2282770; ЕР 2328934; ЕР 2376109; ЕР 2542256; ЕР 2601216; ЕР 2714079; ЕР 2714733; ЕР 2786762; ЕР 2839842; ЕР 2840091 и публикации заявок РСТ № WO 2006/113665; WO 2008/157379; WO 2010/027797; WO 2010/033279; WO 2010/080538; WO 2011/109400; WO 2012/018687; WO 2012/162067; WO 2012/162068; WO 2014/159940; WO 2015/021089; WO 2015/026892 и WO 2015/026894). Такие диатела содержат два или более полипептидов, входящих в состав ковалентных комплексов, и содержат один или более остатков цистеина, встроенных в каждый из используемых видов полипептидов, что обеспечивает возможность образования дисульфидных связей и, следовательно, ковалентного связывания одной или более пар таких полипептидных цепей друг с другом. Например, было показано, что добавление остатка цистеина к С-концу таких конструкций обеспечивает возможность образования дисульфидных связей между задействованными полипептидными цепями, стабилизирующих полученное диатело без влияния на характеристики связывания диатела.
[00116] Простейшее диатело DART® содержит две полипептидные цепи, каждая из которых содержит три домена (Фигуры 1А-1В). Первая полипептидная цепь содержит: (i) домен, содержащий эпитоп-связывающий домен вариабельного домена легкой цепи первого иммуноглобулина (VL1), (ii) второй домен, содержащий эпитоп-связывающий домен вариабельного домена тяжелой цепи второго иммуноглобулина (VH2), и (iii) третий домен, который служит для обеспечения гетеродимеризации («способствующий гетеродимеризации домен») со второй полипептидной цепью и для ковалентного связывания первого полипептида со второй полипептидной цепью диатела. Вторая полипептидная цепь содержит комплементарный первый домен (домен VL2), комплементарный второй домен (домен VH1) и третий домен, который образует комплекс с третьим доменом первой полипептидной цепи для обеспечения гетеродимеризации («способствующий гетеродимеризации домен») и ковалентного связывания с первой полипептидной цепью. Такие молекулы стабильны, эффективны и обладают способностью одновременно связывать два или более антигенов. В одном из вариантов реализации каждый из третьих доменов первой и второй полипептидных цепей содержит остаток цистеина (на чертежах обозначен «©»), который служит для связывания полипептидов посредством ковалентной дисульфидной связи. Третий домен одной или обеих полипептидных цепей может дополнительно содержать последовательность домена СН2-СН3 для того, чтобы объединение одного полипептида диатела в комплекс с другим полипептидом диатела приводило к получению Fc-домена. Такие Fc-домены могут служить для изменения биологического времени полужизни диатела, снижения его иммуногенности или могут обладать способностью связываться с Fc-рецептором клеток (таких как В-лимфоциты, дендритные клетки, клетки-естественные киллеры, макрофаги, нейтрофилы, эозинофилы, базофилы и тучные клетки) для усиления или подавления эффекторной функции. Множество вариаций таких молекул было описано (см., например, публикации заявок на патент США №2015/0175697; 2014/0255407; 2014/0099318; 2013/0295121; 2010/0174053; 2009/0060910; 2007/0004909; публикации заявок на европейский патент № ЕР 2714079; ЕР 2601216; ЕР 2376109; ЕР 2158221; ЕР 1868650 и публикации заявок РСТ № WO 2012/162068; WO 2012/018687; WO 2010/080538; WO 2006/113665), а также предложено в настоящей заявке.
[00117] Недавно были описаны трехвалентные структуры, содержащие два относящихся по типу к диателам связывающих домена и один не относящийся по типу к диателам домен, а также Fc-домен (см., например, публикации заявок РСТ № WO 2015/184207 и WO 2015/184203). Такие трехвалентные связывающие молекулы могут быть применены для получения моноспецифичных, биспецифичных или триспецифичных молекул, более подробно описанных ниже. Способность связывать три различных эпитопа обеспечивает расширенные функциональные возможности.
[00118] В данной области техники известны альтернативные конструкции для применения в случаях, если желательно получить биспецифичную или четырехвалентную молекулу, но не требуется Fc, включая, но не ограничиваясь перечисленными, биспецифичные молекулы-рекрутеры Т-клеток, также называемые «BiTE» (см., например, публикации заявок РСТ №: WO 1993/11161 и WO 2004/106381), и четырехвалентные тандемные антитела, также называемые «TandAbs» (см., например, публикацию заявки на патент США №:2011-0206672; публикацию заявки на европейский патент № ЕР 2371866 и публикации заявок РСТ № WO 1999/057150, WO 2003/025018 и WO 2013/013700). BiTE получают из одной полипептидной цепи, содержащей тандемно связанные scFv, тогда как TandAb получают путем гомодимеризации двух идентичных полипептидных цепей, каждая из которых имеет домен VH1, VL2, VH2 и VL2.
[00119] Возможность получения полиспецифичных связывающих молекул (например, биспецифичных антител, биспецифичных диател, трехвалентных молекул и так далее) привела к их применению (в «транс»-форме) для совместного лигирования двух клеток, например, путем совместного лигирования рецепторов, которые присутствуют на поверхности различных клеток (например, для перекрестного связывания цитотоксических Т-клеток с клетками-мишенями, такими как раковые клетки или инфицированные патогеном клетки, экспрессирующие относящийся к заболеванию антиген) (Staerz et al. (1985) "Hybrid Antibodies Can Target Sites For Attack By T Cells," Nature 314:628-631, and Holliger et al. (1996) "Specific Killing Of Lymphoma Cells By Cytotoxic T-Cells Mediated By A Bispecific Diabody, " Protein Eng. 9:299-305; Marvin et al. (2005) "Recombinant Approaches ToIgG-Like Bispecific Antibodies," Acta Pharmacol. Sin. 26:649-658; Sloan et al. (2015) "Targeting HIV Reservoir in Infected CD4 T Cells by Dual-Affinity Re-targetingMolecules (DARTs) that Bind HIV Envelope and Recruit Cytotoxic T Cells" PLoS Pathog 11(11): e1005233. doi: 10.1371/journal.ppat. 1005233)). В качестве альтернативы (или дополнительно), полиспецифичные молекулы могут быть применены (в «цис»-форме) для совместного лигирования молекул, таких как рецепторы и так далее, которые присутствуют на поверхности одной клетки. Совместное лигирование различных клеток и/или рецепторов пригодно для применения с целью модулирования эффекторных функций и/или передачи сигналов иммунных клеток. Полиспецифичные молекулы (например, биспецифичные диатела), содержащие эпитоп-связывающие домены, могут быть нацелены на поверхностную детерминанту любой иммунной клетки, такую как CD2, CD3, CD8, CD16, TCR, рецептор Natural Killer Group 2, Member D (NKG2D) и так далее, которые экспрессируются на Т-лимфоцитах, клетках - естественных киллерах (NK), антиген-презентирующих клетках или других мононуклеарных клетках. В частности, эпитоп-связывающие домены, нацеленные на рецептор клеточной поверхности, который присутствует на иммунных эффекторных клетках, пригодны для применения в получении полиспецифичных связывающих молекул, способных опосредовать перенаправленное уничтожение клеток.
[00120] В настоящем изобретении предложены связывающие молекулы, которые способны опосредовать перенаправленное уничтожение клетки-мишени (например, раковой клетки или инфицированной патогеном клетки и так далее), экспрессирующей относящийся к заболеванию антиген («DA»). Такие связывающие молекулы способны связывать «первый эпитоп» и «второй эпитоп», где один из таких эпитопов представляет собой эпитоп CD3, а другой такой эпитоп представляет собой эпитоп относящегося к заболеванию антигена. Не имеет значения, обозначен ли конкретный эпитоп как первый или второй эпитоп; такие обозначения имеют отношение только к присутствию и ориентации доменов полипептидных цепей связывающих молекул согласно настоящему изобретению. Таким образом, биспецифичные молекулы согласно настоящему изобретению содержат домены «VLCD3» / «VHCD3», которые способны связывать эпитоп CD3, и домены «VLDA» / «VHDA», которые способны связывать эпитоп относящегося к заболеванию антигена. Настоящее изобретение, в частности, охватывает биспецифичные диатела, биспецифичные scFv, BiTE, антитела, TandAb и трехвалентные связывающие молекулы, полученные с применением любого из способов, предложенных в настоящей заявке.
А. Биспецифичные диатела, лишенные Fc-доменов
[00121] В одном из вариантов реализации связывающая DA х CD3 молекула согласно настоящему изобретению представляет собой биспецифичное диатело и содержит домены, способные связывать как первый, так и второй эпитоп, однако не будет содержать Fc-домена, и, таким образом, будет неспособна связывать молекулы FcγR посредством взаимодействия Fc-FcγR. Первая полипептидная цепь согласно такому варианту реализации биспецифичных диател содержит, в направлении от N-конца к С-концу: N-конец, домен VL моноклонального антитела, способный связывать либо первый, либо второй эпитоп (то есть либо VLCD3, либо VLDA), первый промежуточный спейсерный пептид (линкер 1), домен VH моноклонального антитела, способный связывать эпитоп относящегося к заболеванию антигена (если такая первая полипептидная цепь содержит VLCD3), или домен VH моноклонального антитела, способный связывать CD3 (если такая первая полипептидная цепь содержит VLDA), второй промежуточный спейсерный пептид (линкер 2), необязательно содержащий остаток цистеина, способствующий гетеродимеризации домен и С-конец (Фигуры 1А-1В).
[00122] Вторая полипептидная цепь согласно этому варианту реализации биспецифичных диател содержит, в направлении от N-конца к С-концу: N-конец, домен VL моноклонального антитела, способный связывать первый или второй эпитоп (то есть VLCD3 или VLDA, не являющийся доменом VL, выбранным для включения в первую полипептидную цепь диатела), промежуточный спейсерный пептид (линкер 1), домен VH моноклонального антитела, способный связывать либо первый, либо второй эпитоп (то есть VHCD3 или VHDA, не являющийся доменом VH, выбранным для включения в первую полипептидную цепь диатела), второй промежуточный спейсерный пептид (линкер 2), необязательно содержащий остаток цистеина, способствующий гетеродимеризации домен и С-конец (Фигуры 1А-1В). Используемые домены VL и VH, специфичные в отношении конкретного эпитопа, предпочтительно получены из одного моноклонального антитела или являются производными одного моноклонального антитела. Однако такие домены могут являться производными различных моноклональных антител при условии, что они объединяются с получением функционального сайта связывания, способного иммуноспецифично связывать такой эпитоп. Такие различные антитела в настоящей заявке упомянуты как являющиеся «соответствующими» антителами.
[00123] Домен VL первой полипептидной цепи взаимодействует с доменом VH второй полипептидной цепи с получением первого функционального эпитоп-связывающего домена, который является специфичным в отношении одного из эпитопов (например, первого эпитопа). Схожим образом, домен VL второй полипептидной цепи взаимодействует с доменом VH первой полипептидной цепи с получением второго функционального эпитоп-связывающего домена, который является специфичным в отношении другого эпитопа (то есть второго эпитопа). Таким образом, выбор доменов VL и VH первой и второй полипептидных цепей «скоординирован» таким образом, что две полипептидные цепи диатела в сумме содержат домены VL и VH, способные связывать как первый эпитоп, так и второй эпитоп (то есть в сумме они содержат VLCD3/VHCD3 и VLDA/VHDA).
[00124] Наиболее предпочтительно длина промежуточного спейсерного пептида (то есть «линкера 1», который разделяет такие домены VL и VH) выбрана таким образом, чтобы по существу или полностью предотвратить связывание доменов VL и VH полипептидной цепи друг с другом (например, спейсерный пептид, состоящий из 0, 1, 2, 3, 4, 5, 6, 7, 8 или 9 промежуточных линкерных аминокислотных остатков). Таким образом, домены VL и VH первой полипептидной цепи по существу или полностью неспособны связываться друг с другом. Схожим образом, домены VL и VH второй полипептидной цепи по существу или полностью неспособны связываться друг с другом. Предпочтительный промежуточный спейсерный пептид (линкер 1) имеет последовательность (SEQ ID NO: 16):  .
.
[00125] Длина и состав второго промежуточного спейсерного пептида («линкера 2») выбрана на основании выбора одного или более доменов полипептида, которые способствуют такой димеризации (то есть «способствующего гетеродимеризации домена»). Как правило, второй промежуточный спейсерный пептид (линкер 2) будет содержать 3-20 аминокислотных остатков. В частности, если используемый способсвующий гетеродимеризации домен (домены) не содержит (не содержат) остатка цистеина, используют цистеинсодержащий второй промежуточный спейсерный пептид (линкер 2). Цистеинсодержащий второй промежуточный спейсерный пептид (линкер 2) будет содержать 1, 2, 3 или более остатков цистеина. Предпочтительный цистеинсодержащий спейсерный пептид (линкер 2) имеет последовательность GGCGGG (SEQ ID NO: 17). В качестве альтернативы, линкер 2 не содержит цистеина (например, GGG, GGGS (SEQ ID NO: 18), LGGGSG (SEQ ID NO: 19),  (SEQ ID NO: 20), ASTKG (SEQ ID NO: 21), LEPKSS (SEQ ID NO: 22), APSSS (SEQ ID NO: 23) и так далее), и используют цистеинсодержащий способствующий гетеродимеризации домен, описанный ниже. Необязательно используют и цистеинсодержащий линкер 2, и цистеинсодержащий способствующий гетеродимеризации домен.
(SEQ ID NO: 20), ASTKG (SEQ ID NO: 21), LEPKSS (SEQ ID NO: 22), APSSS (SEQ ID NO: 23) и так далее), и используют цистеинсодержащий способствующий гетеродимеризации домен, описанный ниже. Необязательно используют и цистеинсодержащий линкер 2, и цистеинсодержащий способствующий гетеродимеризации домен.
[00126] Способствующие гетеродимеризации домены могут содержать или состоять из GVEPKSC (SEQ ID NO: 24), или VEPKSC (SEQ ID NO: 25), или AEPKSC (SEQ ID NO: 26) для одной полипептидной цепи и GFNRGEC (SEQ ID NO: 27) или FNRGEC (SEQ ID NO: 28) для другой полипептидной цепи (US2007/0004909).
[00127] В предпочтительном варианте реализации способствующие гетеродимеризации домены будут содержать тандемно повторяющиеся противоположно заряженные спиральные домены, например, «Е-спиральный» способствующий гетеродимеризации домен (SEQ ID NO: 29: 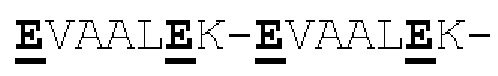
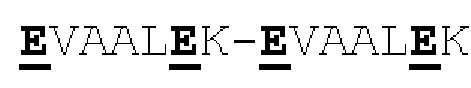 ), остатки глутамата которого будут обеспечивать отрицательный заряд при рН 7, или «K-спиральный» способствующий гетеродимеризации домен (SEQ ID NO: 30:
), остатки глутамата которого будут обеспечивать отрицательный заряд при рН 7, или «K-спиральный» способствующий гетеродимеризации домен (SEQ ID NO: 30: 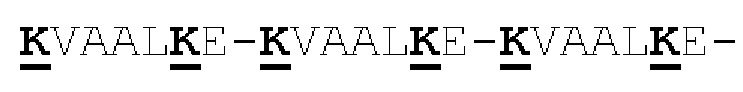
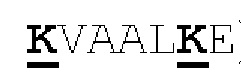 ), остатки лизина которого будут обеспечивать положительный заряд при рН 7. Присутствие таких заряженных доменов способствует ассоциации первого и второго полипептидов и тем самым способствует образованию гетеродимера. Могут быть использованы способствующие гетеродимеризации домены, которые содержат модификации описанных выше последовательностей Е-спирали и K-спирали с целью включения одного или более остатков цистеина. Присутствие таких остатков цистеина позволяет спирали, присутствующей на одной полипептидной цепи, ковалентно связываться с комплементарной спиралью, присутствующей на другой полипептидной цепи, тем самым ковалентно связывая полипептидные цепи друг с другом и повышая стабильность диатела. Примеры таких особенно предпочтительных способствующих гетеродимеризации доменов включают модифицированную Е-спираль, имеющую аминокислотную последовательность
), остатки лизина которого будут обеспечивать положительный заряд при рН 7. Присутствие таких заряженных доменов способствует ассоциации первого и второго полипептидов и тем самым способствует образованию гетеродимера. Могут быть использованы способствующие гетеродимеризации домены, которые содержат модификации описанных выше последовательностей Е-спирали и K-спирали с целью включения одного или более остатков цистеина. Присутствие таких остатков цистеина позволяет спирали, присутствующей на одной полипептидной цепи, ковалентно связываться с комплементарной спиралью, присутствующей на другой полипептидной цепи, тем самым ковалентно связывая полипептидные цепи друг с другом и повышая стабильность диатела. Примеры таких особенно предпочтительных способствующих гетеродимеризации доменов включают модифицированную Е-спираль, имеющую аминокислотную последовательность 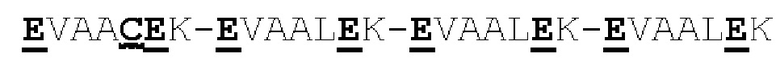 (SEQ ID NO: 31), и модифицированную К-спираль, имеющую аминокислотную последовательность
(SEQ ID NO: 31), и модифицированную К-спираль, имеющую аминокислотную последовательность 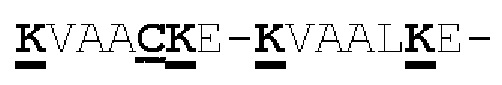
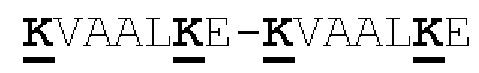 (SEQ ID NO: 32).
(SEQ ID NO: 32).
[00128] Согласно источнику WO 2012/018687, для улучшения фармакокинетических свойств диател in vivo диатело может быть модифицировано таким образом, чтобы оно содержало часть полипептида сывороточного связывающего белка («serum-binding protein») на одном или более концах диатела. Наиболее предпочтительно такая часть полипептида сывороточного связывающего белка будет введена на С-конце полипептидной цепи диатела. Альбумин является наиболее широко представленным в плазме белком и у людей имеет время полужизни 19 дней. Альбумин имеет несколько сайтов связывания для малых молекул, что позволяет ему нековалентно связываться с другими белками и тем самым увеличивать их время полужизни в сыворотке. Альбумин-связывающий домен 3 (ABD3) белка G бактерий рода Streptococcus штамма G148 состоит из 46 аминокислотных остатков, образующих стабильный трехспиральный пучок, и обладает широкой специфичностью связывания с альбумином (Johansson, M.U. et al. (2002) "Structure, Specificity, And Mode Of Interaction For Bacterial Albumin-Binding Modules" J. Biol. Chem. 277(10):8114-8120). Таким образом, особенно предпочтительной частью полипептида сывороточного связывающего белка для улучшения фармакокинетических свойств диатела in vivo является альбумин-связывающий домен (ABD) стрептококкового белка G, и, более предпочтительно, альбумин-связывающий домен 3 (ABD3) белка G бактерий рода Streptococcus штамма G148 (SEQ ID NO: 33): 
[00129] Согласно источнику WO 2012/162068 (включен в настоящую заявку посредством ссылки), «деиммунизированные» варианты SEQ ID NO: 33 обладают способностью ослаблять или устранять связывание МНС класса II. На основании результатов применения комбинаций мутаций, предпочтительными заменами для получения такого деиммунизированного ABD считаются следующие комбинации замен: 66D/70S+71А; 66S/70S+71А; 66S/70S+79А; 64А/65А/71А; 64A/65A/71A+66S; 64A/65A/71A+66D; 64А/65А/71А+66Е; 64A/65A/79A+66S; 64A/65A/79A+66D; 64А/65А/79А+66Е. Варианты ABD имеют модификации L64A L64A, I65A и D79A или модификации N66S, T70S и D79A. Варианты деиммунизированного ABD, имеющие аминокислотную последовательность:
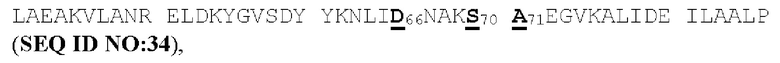
или аминокислотную последовательность:
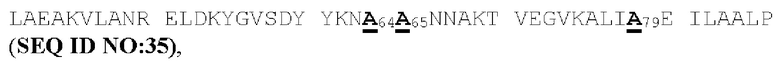
или аминокислотную последовательность:
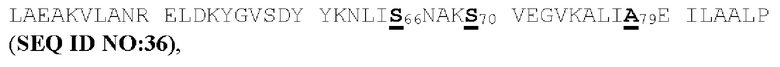
особенно предпочтительны, поскольку такие деиммунизированные ABD проявляют по существу связывание дикого типа, обеспечивая при этом ослабленное связывание МНС класса II. Таким образом, первая полипептидная цепь такого диатела, содержащего ABD, содержит третий линкер (линкер 3), предпочтительно имеющий С-концевое положение по отношению к Е-спиральному (или K-спиральному) домену такой полипептидной цепи, таким образом, что он расположен между Е-спиральным (или K-спиральным) доменом и ABD (который предпочтительно представляет собой деиммунизированный ABD). Предпочтительной последовательностью для такого линкера 3 является SEQ ID NO: 18: GGGS.
В. Диатела, содержащие Fc-домены
[00130] Один из вариантов реализации настоящего изобретения относится к полиспецифичным диателам (например, биспецифичным, триспецифичным, тетраспецифичным и так далее), которые содержат Fc-домен и способны одновременно связывать эпитоп CD3 и эпитоп относящегося к заболеванию антигена. Fc-домен таких молекул может быть иметь любой изотип (например, IgG1, IgG2, IgG3 или IgG4). Указанные молекулы могут дополнительно содержать домен СН1 и/или шарнирный домен. В случае его наличия, домен СН1 и/или шарнирный домен может иметь любой изотип (например, IgG1, IgG2, IgG3 или IgG4) и предпочтительно имеет тот же изотип, что и желаемый Fc-домен.
[00131] Добавление домена СН2-СН3 IgG к одной или обеим полипептидным цепям диатела таким образом, чтобы объединение цепей диатела в комплекс приводило к получению Fc-домена, увеличивает биологическое время полужизни и/или изменяет валентность диатела. Такие диатела содержат две или более полипептидных цепей, последовательности которых позволяют указанным полипептидным цепям ковалентно связываться друг с другом с получением ковалентно связанного диатела, которое способно одновременно связывать первый эпитоп и второй эпитоп.Включение доменов СН2-СН3 IgG в оба полипептида диатела позволит получить двухцепочечное биспецифичное содержащее Fc-домен диатело (Фигура 2).
[00132] В качестве альтернативы, включение доменов СН2-СН3 IgG только в один из полипептидов диатела позволит получить более сложное четырехцепочечное биспецифичное содержащее Fc-домен диатело (Фигуры 3А-3С). На Фигуре 3С показано типичное четырехцепочечное диатело, имеющее константный домен легкой цепи (CL) и константный домен тяжелой цепи СН1, однако в качестве альтернативы могут быть использованы фрагменты таких доменов, а также другие полипептиды (см., например, Фигуры 3А и 3В, публикации заявок на патент США №2013-0295121; 2010-0174053 и 2009-0060910; публикации заявок на европейский патент № ЕР 2714079; ЕР 2601216; ЕР 2376109; ЕР 2158221 и публикации заявок РСТ № WO 2012/162068; WO 2012/018687; WO 2010/080538). Таким образом, например, вместо домена СН1 может быть использован пептид, имеющий аминокислотную последовательность 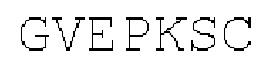 (SEQ ID NO:24),
(SEQ ID NO:24),  (SEQ ID NO:25) или
(SEQ ID NO:25) или  (SEQ ID NO:26), полученный из шарнирного домена IgG человека, и вместо домена CL могут быть использованы 6 С-концевых аминокислот легкой цепи каппа человека,
(SEQ ID NO:26), полученный из шарнирного домена IgG человека, и вместо домена CL могут быть использованы 6 С-концевых аминокислот легкой цепи каппа человека,  (SEQ ID NO:27) или
(SEQ ID NO:27) или  (SEQ ID NO:28). Типичное содержащее пептид четырехцепочечное диатело показано на Фигуре 3А. В качестве альтернативы или дополнительно может быть использован пептид, содержащий тандемные противоположно заряженные спиральные домены, такие как спиральные домены типа «Е-спираль»
(SEQ ID NO:28). Типичное содержащее пептид четырехцепочечное диатело показано на Фигуре 3А. В качестве альтернативы или дополнительно может быть использован пептид, содержащий тандемные противоположно заряженные спиральные домены, такие как спиральные домены типа «Е-спираль» 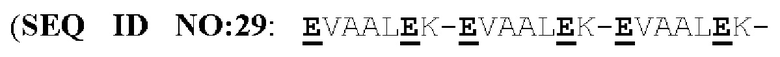

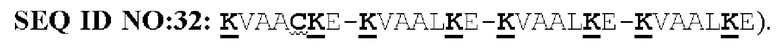 Типичное содержащее спиральный домен четырехцепочечное диатело показано на Фигуре 3В.
Типичное содержащее спиральный домен четырехцепочечное диатело показано на Фигуре 3В.
[00133] Содержащие Fc-домен молекулы диател согласно настоящему изобретению могут содержать дополнительные промежуточные спейсерные пептиды (линкеры), как правило, такие линкеры будут встроены между способствующим гетеродимеризации доменом (например, Е-спиралью или K-спиралью) и доменом СН2-СН3 и/или между доменом СН2-СН3 и вариабельным доменом (то есть VH или VL). Как правило, дополнительные линкеры будут содержать 3-20 аминокислотных остатков и могут необязательно содержать весь шарнирный домен IgG или его часть (предпочтительно цистеинсодержащую часть шарнирного домена IgG, содержащую 1, 2, 3 или более остатков цистеина). Линкеры, которые могут быть использованы в биспецифичных содержащих Fc-домен молекулах диател согласно настоящему изобретению, включают: GGGS (SEQ ID NO: 18), LGGGSG (SEQ ID NO: 19), GGGSGGGSGGG (SEQ ID NO:20), ASTKG (SEQ ID NO:21), LEPKSS (SEQ ID NO:22), APSSS (SEQ ID NO:23), APSSSPME (SEQ ID NO:37), VEPKSADKTHTCPPCP (SEQ ID NO:38), LEPKSADKTHTCPPCP (SEQ ID NO:39), DKTHTCPPCP (SEQ ID NO:40), линкер scFv:  (SEQ ID NO:41); «длинный» линкер:
(SEQ ID NO:41); «длинный» линкер:  (SEQ ID NO:42),
(SEQ ID NO:42),  (SEQ ID NO:22) может быть использован вместо
(SEQ ID NO:22) может быть использован вместо  для облегчения клонирования. Помимо этого, непосредственно за аминокислотами
для облегчения клонирования. Помимо этого, непосредственно за аминокислотами  (SEQ ID NO:22) может следовать
(SEQ ID NO:22) может следовать  (SEQ ID NO:40) с получением альтернативных линкеров:
(SEQ ID NO:40) с получением альтернативных линкеров:  (SEQ ID NO:43) и
(SEQ ID NO:43) и  (SEQ ID NO:44). Биспецифичные содержащие Fc-домен молекулы согласно настоящему изобретению могут содержать шарнирный домен IgG помимо или вместо линкера. Иллюстративные шарнирные домены включают:
(SEQ ID NO:44). Биспецифичные содержащие Fc-домен молекулы согласно настоящему изобретению могут содержать шарнирный домен IgG помимо или вместо линкера. Иллюстративные шарнирные домены включают:  (SEQ ID NO:5) от IgG1,
(SEQ ID NO:5) от IgG1,  (SEQ ID NO:6) от IgG2,
(SEQ ID NO:6) от IgG2, 
 (SEQ ID NO:7) от IgG3,
(SEQ ID NO:7) от IgG3,  (SEQ ID NO:8) от IgG4, и
(SEQ ID NO:8) от IgG4, и  (SEQ ID NO:9) - вариант шарнирного домена IgG4, содержащий стабилизирующую замену S228P (в соответствии с нумерацией согласно индексу EU по системе Кабата) для уменьшения обмена цепей.
(SEQ ID NO:9) - вариант шарнирного домена IgG4, содержащий стабилизирующую замену S228P (в соответствии с нумерацией согласно индексу EU по системе Кабата) для уменьшения обмена цепей.
[00134] Как показано на Фигурах 3А-3С, содержащие Fc-домен диатела согласно настоящему изобретению могут содержать четыре цепи. Первая и третья полипептидные цепи такого диатела содержат три домена: (i) VL1-содержащий домен, (ii) VH2-содержащий домен, (iii) способствующий гетеродимеризации домен и (iv) домен, содержащий последовательность СН2-СН3. Вторая и четвертая полипептидные цепи содержат: (i) VL2-содержащий домен, (ii) VH1-содержащий домен и (iii) способствующий гетеродимеризации домен, где способствующие гетеродимеризации домены способствуют димеризации первой/третьей полипептидных цепей со второй/четвертой полипептидными цепями. Домены VL и/или VH третьей и четвертой полипептидных цепей и домены VL и/или VH первой и второй полипептидных цепей могут быть одинаковыми или различными для обеспечения возможности четырехвалентного связывания, которое является моноспецифичным, биспецифичным или тетраспецифичным. Обозначения «VL3» и «VH3» обозначают соответственно вариабельный домен легкой цепи и вариабельный домен тяжелой цепи такого диатела, которые связывают «третий» эпитоп. Схожим образом, обозначения «VL4» и «VH4» обозначают соответственно вариабельный домен легкой цепи и вариабельный домен тяжелой цепи такого диатела, которые связывают «четвертый» эпитоп. Общая структура полипептидных цепей типичного четырехцепочечного биспецифичного содержащего Fc-домен диатела согласно настоящему изобретению представлена в таблице 1:

[00135] В конкретном варианте реализации диатела согласно настоящему изобретению представляют собой биспецифичные четырехвалентные (то есть имеющие четыре эпитоп-связывающих домена) Fc-содержащие диатела, состоящие в сумме из четырех полипептидных цепей (Фигуры 3А-3С). Биспецифичные четырехвалентные Fc-содержащие диатела согласно настоящему изобретению содержат два домена, связывающих первый эпитоп, и два домена, связывающих второй эпитоп.
[00136] В другом варианте реализации содержащие Fc-домен диатела согласно настоящему изобретению могут содержать три полипептидные цепи. Первый полипептид такого диатела содержит три домена: (i) VL1-содержащий домен, (ii) VH2-содержащий домен и (ш) домен, содержащий последовательность СН2-СН3. Второй полипептид такого диатела содержит: (i) VL2-содержащий домен, (ii) VH1-содержащий домен и (iii) домен, который способствует гетеродимеризации и ковалентному связыванию с первой полипептидной цепью диатела. Третий полипептид такого диатела содержит последовательность СН2-СН3. Таким образом, первая и вторая полипептидные цепи такого диатела связываются с получением эпитоп-связывающего домена VL1/VH1, способного связывать либо первый, либо второй эпитоп, а также эпитоп-связывающего домена VL2/VH2, способного связывать другой такой эпитоп. Первый и второй полипептиды связаны друг с другом дисульфидной связью с участием остатков цистеина в их соответствующих третьих доменах. Следует отметить, что первая и третья полипептидные цепи образуют комплекс друг с другом с получением Fc-домена, стабилизированного посредством дисульфидной связи. Такие биспецифичные диатела обладают повышенной эффективностью. Фигуры 4А и 4 В иллюстрируют структуры таких диател. Такие содержащие Fc-домен диатела могут иметь любую из двух ориентации (таблица 2):
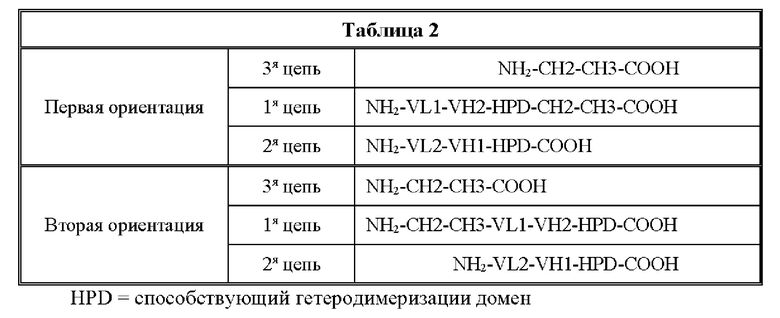
[00137] В конкретном варианте реализации диатела согласно настоящему изобретению представляют собой биспецифичные двухвалентные (то есть обладающие двумя эпитоп-связывающими доменами) Fc-содержащие диатела, состоящие в сумме из трех полипептидных цепей (Фигуры 4А-4В). Биспецифичные двухвалентные Fc-содержащие диатела согласно настоящему изобретению содержат один эпитоп-связывающий домен, иммуноспецифичный в отношении либо первого, либо второго эпитопа, а также эпитоп-связывающий домен VL2/VH2, способный связывать другой такой эпитоп.
[00138] В другом варианте реализации содержащие Fc-домен диатела могут содержать в сумме пять полипептидных цепей. В конкретном варианте реализации две из пяти полипептидных цепей имеют одинаковую аминокислотную последовательность. Первая полипептидная цепь такого диатела содержит: (i) VH1-содержащий домен, (ii) СН1-содержащий домен и (iii) домен, содержащий последовательность СН2-СН3. Первая полипептидная цепь может представлять собой тяжелую цепь антитела, которая содержит VH1 и константную область тяжелой цепи. Вторая и пятая полипептидные цепи такого диатела содержат: (i) VL1-содержащий домен и (ii) CL-содержащий домен. Вторая и/или пятая полипептидные цепи такого диатела могут представлять собой легкие цепи антитела, которые содержат VL1, комплементарный VH1 первой/третьей полипептидной цепи. Первая, вторая и/или пятая полипептидные цепи могут быть выделены из встречающегося в природе антитела. В качестве альтернативы, они могут быть сконструированы рекомбинантными методами. Третья полипептидная цепь такого диатела содержит: (i) VH1-содержащий домен, (ii) CH1-содержащий домен, (iii) домен, содержащий последовательность СН2-СН3, (iv) VL2-содержащий домен, (v) VH3-содержащий домен и (vi) способствующий гетеродимеризации домен, где способствующие гетеродимеризации домены способствуют димеризации третьей цепи с четвертой цепью. Четвертый полипептид таких диател содержит: (i) VL3-содержащий домен, (ii) VH2-содержащий домен и (iii) домен, который способствует гетеродимеризации и ковалентному связыванию с третьей полипептидной цепью диатела.
[00139] Таким образом, первая и вторая, а также третья и пятая полипептидные цепи таких диател связываются с получением двух эпитоп-связывающих доменов VL1/VH1, способных связывать первый эпитоп.Третья и четвертая полипептидные цепи таких диател связываются с получением эпитоп-связывающего домена VL2/VH2, способного связывать второй эпитоп, а также сайта связывания VL3/VH3, способного связывать третий эпитоп. Первый и третий полипептиды связаны друг с другом дисульфидной связью с участием остатков цистеина в их соответствующих константных областях. Следует отметить, что первая и третья полипептидные цепи образуют комплекс друг с другом с получением Fc-домена. Такие полиспецифичные диатела обладают повышенной эффективностью. Фигура 5 иллюстрирует структуру таких диател. Следует понимать, что домены VL1/VH1, VL2/VH2 и VL3/VH3 могут быть одинаковыми или различными для обеспечения возможности связывания, которое является моноспецифичным, биспецифичным или триспецифичным.
[00140] Домены VL и VH полипептидных цепей выбраны таким образом, чтобы получить сайты связывания VL/VH, специфичные в отношении желаемого эпитопа. Сайты связывания VL/VH, полученные при объединении полипептидных цепей, могут быть одинаковыми или различными для обеспечения возможности четырехвалентного связывания, которое является моноспецифичным, биспецифичным, триспецифичным или тетраспецифичным. В частности, домены VL и VH могут быть выбраны таким образом, чтобы поливалентное диатело могло содержать два сайта связывания для первого эпитопа и два сайта связывания для второго эпитопа, или три сайта связывания для первого эпитопа и один сайт связывания для второго эпитопа, или два сайта связывания для первого эпитопа, один сайт связывания для второго эпитопа и один сайт связывания для третьего эпитопа (как изображено на Фигуре 5). Общая структура полипептидных цепей типичных пятицепочечных содержащих Fc-домен диател согласно настоящему изобретению представлена в таблице 3:
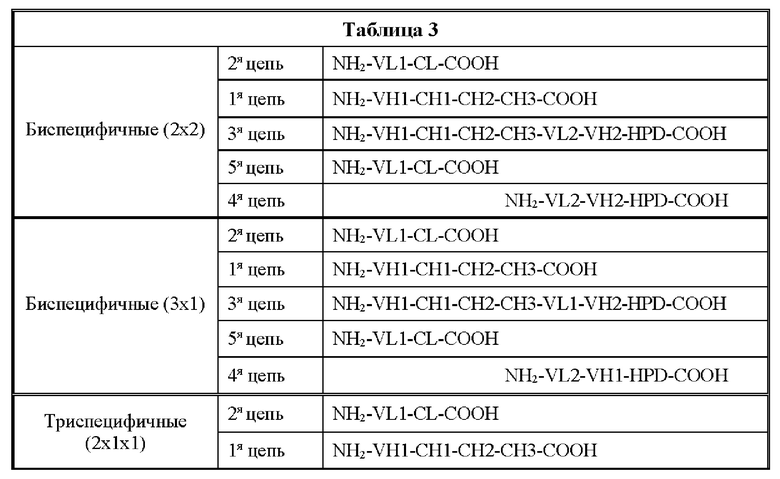

[00141] В конкретном варианте реализации диатела согласно настоящему изобретению представляют собой биспецифичные четырехвалентные (то есть имеющие четыре эпитоп-связывающих домена) Fc-содержащие диатела, состоящие в сумме из пяти полипептидных цепей, содержащие два эпитоп-связывающих домена, иммуноспецифичных в отношении первого эпитопа, и два эпитоп-связывающих домена, специфичных в отношении второго эпитопа. В другом варианте реализации биспецифичные четырехвалентные Fc-содержащие диатела согласно настоящему изобретению содержат три эпитоп-связывающих домена, иммуноспецифичных в отношении первого эпитопа, и один эпитоп-связывающий домен, специфичный в отношении второго эпитопа. Как указано выше, домены VL и VH могут быть выбраны для обеспечения возможности триспецифичного связывания. Соответственно, настоящее изобретение также охватывает триспецифичные четырехвалентные Fc-содержащие диатела. Триспецифичные четырехвалентные Fc-содержащие диатела согласно настоящему изобретению содержат два эпитоп-связывающих домена, иммуноспецифичных в отношении первого эпитопа, один эпитоп-связывающий домен, иммуноспецифичный в отношении второй молекулы, и один эпитоп-связывающий домен, иммуноспецифичный в отношении третьего эпитопа.
[00142] При традиционном осуществлении иммунной функции взаимодействие комплексов антитело-антиген с клетками иммунной системы приводит к целому ряду ответов, начиная от эффекторных функций, таких как антителозависимая цитотоксичность, дегрануляция тучных клеток и фагоцитоз, до иммуномодулирующих сигналов, таких как сигналы, регулирующие пролиферацию лимфоцитов и секрецию антител. Все эти взаимодействия инициирует связывание Fc-домена антител или иммунных комплексов со специализированными рецепторами клеточной поверхности на кроветворных клетках. Разнообразие клеточных ответов, запускаемых антителами и иммунными комплексами, является результатом структурной гетерогенности трех Fc-рецепторов: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). FcγRI (CD64), FcγRIIA (CD32A) и FcγRIII (CD16) являются активирующими (то есть стимулирующими иммунную систему) рецепторами; FcγRIIB (CD32B) является ингибирующим (то есть подавляющим иммунную систему) рецептором. Помимо этого, взаимодействие с неонатальным Fc-рецептором (FcRn) опосредует рециркуляцию молекулы IgG из эндосомы на поверхность клетки и высвобождение в кровь. Аминокислотные последовательности иллюстративных IgG1 (SEQ ID NO:10), IgG2 (SEQ ID NO:11), IgG3 (SEQ ID NO:12) и IgG4 (SEQ ID NO: 13) дикого типа представлены выше.
[00143] Модификация Fc-домена может приводить к измененному фенотипу, например, измененному времени полужизни в сыворотке, измененной стабильности, измененной восприимчивости к клеточным ферментам или измененной эффекторной функции. Поэтому может быть желательно модифицировать содержащую Fc-домен связывающую молекулу согласно настоящему изобретению в отношении эффекторной функции, например, для повышения эффективности такой молекулы при лечении рака. Снижение или устранение опосредованной Fc-доменом эффекторной функции является желательным в некоторых случаях, например, в случае антител, механизм действия которых включает блокирование или антагонизм в отношении несущих антиген-мишень клеток, но не их уничтожение. Повышенная эффекторная функция, как правило, является желательной, когда она направлена на нежелательные клетки, такие как опухолевые и чужеродные клетки, где FcγR экспрессируются в небольших количествах, например, опухолеспецифичные В-клетки с низким содержанием FcγRIIB (например, в случае неходжкинской лимфомы, ХЛЛ и лимфомы Беркитта). Молекулы согласно настоящему изобретению, имеющие такую привнесенную или измененную активность эффекторной функции, пригодны для применения для лечения и/или предотвращения заболевания, расстройства или инфекции, при которых желательна повышенная эффективность активности эффекторной функции.
[00144] Соответственно, в некоторых вариантах реализации Fc-домен содержащих Fc-домен молекул согласно настоящему изобретению может представлять собой сконструированный вариантный Fc-домен. Несмотря на то, что Fc-домен биспецифичных содержащих Fc-домен молекул согласно настоящему изобретению может обладать способностью связываться с одним или более Fc-рецепторами (например, FcγR), более предпочтительно такой вариантный Fc-домен будет иметь измененные характеристики связывания с FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) или FcγRIIIB (CD16b) (относительно связывания, демонстрируемого Fc-доменом дикого типа), например, будет проявлять усиленное связывание с активирующим рецептором и/или будет характеризоваться существенно сниженной способностью связываться с ингибирующим рецептором (рецепторами) или отсутствием таковой. Таким образом, Fc-домен содержащих Fc-домен молекул согласно настоящему изобретению может содержать полностью или частично домен СН2 и/или полностью или частично домен СН3 полного Fc-домена, или может содержать последовательность вариантного СН2 и/или вариантного СН3 (которая может содержать, например, одну или более вставок и/или одну или более делеций относительно доменов СН2 или СН3 полного Fc-домена). Такие Fc-домены могут содержать части полипептида, отличные от Fc, или могут содержать части неприродных полных Fc-доменов, или могут включать не встречающиеся в природе ориентации доменов СН2 и/или СН3 (такие как, например, два домена СН2 или два домена СН3, или, в направлении от N-конца к С-концу, домен СН3, связанный с доменом СН2, и так далее).
[00145] Модификации Fc-домена, определенные как изменяющие эффекторную функцию, известны в данной области техники, включая модификации, которые усиливают связывание с активирующими рецепторами (например, FcγRIIA (CD16A) и ослабляют связывание с ингибирующими рецепторами (например, FcγRIIB (CD32B) (см., например, Stavenhagen, J.B. etal. (2007) "Fc Optimization Of Therapeutic Antibodies Enhances Their Ability To Kill Tumor Cells In Vitro And Controls Tumor Expansion In Vivo Via Low-Affinity Activating Fcgamma Receptors" Cancer Res. 57(18):8882-8890). В таблице 4 перечислены иллюстративные одинарные, двойные, тройные, четырехкратные и пятикратные замены (нумерация (в соответствии с индексом EU) и замены относятся к аминокислотной последовательности SEQ ID NO:10, представленной выше) в соответствии с иллюстративными модификациями, которые усиливают связывание с активирующими рецепторами и/или ослабляют связывание с ингибирующими рецепторами.
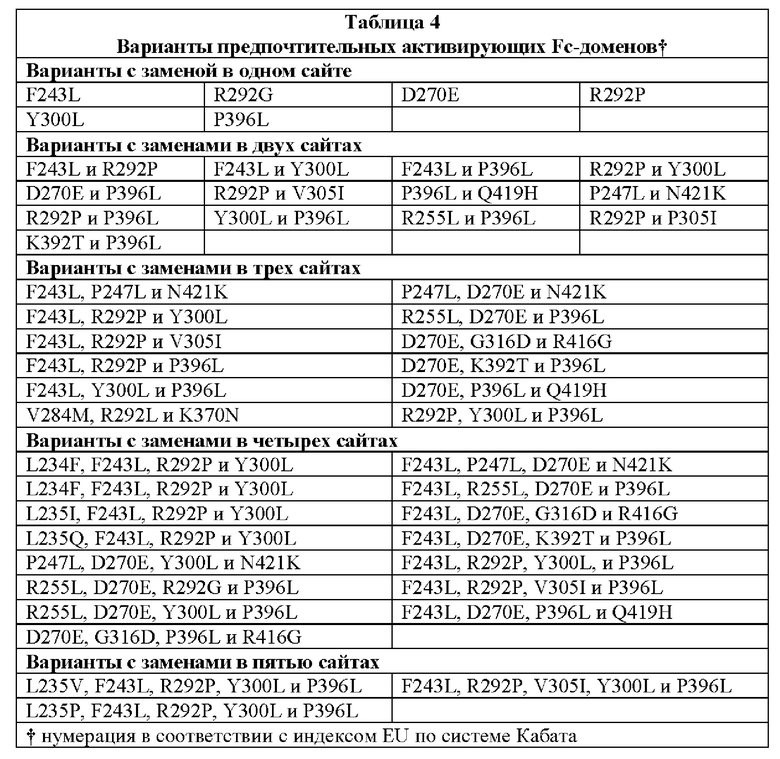
[00146] Иллюстративные варианты Fc-доменов IgG1 человека с ослабленным связыванием CD32B и/или усиленным связыванием CD16A содержат замены F243L, R292P, Y300L, V305I или P396L, где указанная нумерация соответствует нумерации согласно индексу EU по системе Кабата. Эти аминокислотные замены могут присутствовать в Fc-домене IgG1 человека в любой комбинации. В одном из вариантов реализации вариантный Fc-домен IgG1 человека содержит замены F243L, R292P и Y300L. В другом варианте реализации вариантный Fc-домен IgG1 человека содержит замены F243L, R292P, Y300L, V305I и P396L.
[00147] В некоторых вариантах реализации предпочтительно, чтобы Fc-домены содержащих Fc-домен связывающих молекул согласно настоящему изобретению проявляли пониженное связывание (или по существу его отсутствие) с FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) или FcγRIIIB (CD16b) (относительно связывания, проявляемого Fc-доменом IgG1 дикого типа (SEQ ID NO:10)). В конкретном варианте реализации содержащие Fc-домен связывающие молекулы согласно настоящему изобретению содержат Fc-домен IgG, который проявляет пониженную эффекторную функцию антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ). В предпочтительном варианте реализации домены СН2-СН3 таких связывающих молекул содержат любые 1, 2, 3, или 4 из замен: L234A, L235A, D265A, N297Q и N297G, где нумерация соответствует нумерации согласно индексу EU по системе Кабата. В другом варианте реализации домены СН2-СН3 содержат замену N297Q, замену N297G, замены L234A и L235A или замену D265A, поскольку эти мутации устраняют связывание с FcR. В качестве альтернативы используют домен СН2-СН3 встречающегося в природе Fc-домена, который по своей природе проявляет пониженное связывание (или по существу его отсутствие) с FcγRIIIA (CD 16а) и/или пониженную эффекторную функцию (относительно связывания и эффекторной функции, проявляемых Fc-доменом IgG1 дикого типа (SEQ ID NO:10)). В конкретном варианте реализации содержащие Fc-домен связывающие молекулы согласно настоящему изобретению содержат Fc-домен IgG2 (SEQ ID NO:11), Fc-домен IgG3 (SEQ ID NO:12) или Fc-домен IgG4 (SEQ ID NO:13). В случае использования Fc-домена IgG4 настоящее изобретение также охватывает введение стабилизирующей мутации, такой как замена S228P в шарнирной области, описанная выше (см., например, SEQ ID NO:9). Поскольку замены N297G, N297Q, L234A, L235A и D265A устраняют эффекторную функцию, в обстоятельствах, при которых эффекторная функция является желательной, предпочтительно не используют эти замены.
[00148] Предпочтительная последовательность IgG1 для доменов СН2 и СН3 содержащих Fc-домен молекул согласно настоящему изобретению со сниженной или устраненной эффекторной функцией будет содержать замены L234A/L235A (SEQ ID NO:45):

где X представляет собой лизин (K) или отсутствует.
[00149] Время полужизни в сыворотке белков, содержащих Fc-домены, может быть увеличено за счет увеличения аффинности связывания Fc-домена с FcRn. Термин «время полужизни» в контексте настоящей заявки означает фармакокинетическое свойство молекулы, которое является мерой среднего времени жизни молекул после их введения. Время полужизни может быть выражено как время, необходимое для удаления пятидесяти процентов (50%) известного количества молекулы из организма субъекта (например, пациента-человека или другого млекопитающего) или его определенного отдела, например, определяемое в сыворотке, то есть время полужизни в кровотоке или в других тканях. В целом, увеличение времени полужизни приводит к увеличению среднего времени удержания (СВУ) в кровотоке для введенной молекулы.
[00150] В некоторых вариантах реализации содержащие Fc-домен связывающие молекулы согласно настоящему изобретению содержат вариантный Fc-домен, который содержит по меньшей мере одну модификацию аминокислоты относительно Fc-домена дикого типа, такую, что молекула имеет увеличенное время полужизни (относительно такой молекулы, если бы она содержала Fc-домен дикого типа). В некоторых вариантах реализации содержащие Fc-домен связывающие молекулы согласно настоящему изобретению содержат вариантный Fc-домен IgG, который содержит продлевающую время полужизни замену аминокислоты в одном или более положениях, выбранных из группы, состоящей из 238, 250, 252, 254, 256, 257, 256, 265, 272, 286, 288, 303, 305, 307, 308, 309, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424, 428, 433, 434, 435 и 436, где нумерация соответствует нумерации согласно индексу EU по системе Кабата. Многочисленные мутации, способные увеличивать время полужизни содержащей Fc-домен молекулы, известны в данной области техники и включают, например, M252Y, S254T, Т256Е и их комбинации. Например, см. мутации, описанные в патентах США №6,277,375, 7,083,784; 7,217,797, 8,088,376; публикациях заявок на патент США №2002/0147311; 2007/0148164 и публикациях заявок РСТ № WO 98/23289; WO 2009/058492 и WO 2010/033279, которые полностью включены в настоящую заявку посредством ссылки.
[00151] В некоторых вариантах реализации содержащие Fc-домен связывающие молекулы согласно настоящему изобретению, демонстрирующие увеличенное время полужизни, содержат вариантный Fc-домен, содержащий замены в двух или более из остатков Fc-домена: 250, 252, 254, 256, 257, 288, 307, 308, 309, 311, 378, 428, 433, 434, 435 и 436. В частности, две или более замены, выбранные из: T250Q, M252Y, S254T, Т256Е, K288D, T307Q, V308P, A378V, M428L, N434A, Н435К и Y436I. В конкретном варианте реализации такие молекулы могут иметь вариантный Fc-домен IgG, содержащий замены:
(A) M252Y, S254T и Т256Е;
(B) M252Y и S254T;
(C) M252Y и Т256Е;
(D) T250Q и M428L;
(E) T307Q и N434A;
(F) A378V и N434A;
(G) N434A и Y436I;
(H) V308P и N434A; или
(I) K288D и Н435К.
[00152] В предпочтительном варианте реализации содержащая Fc-домен связывающая молекула согласно настоящему изобретению содержит вариантный Fc-домен IgG, содержащий любую 1, 2 или 3 из замен: M252Y, S254T и Т256Е. Настоящее изобретение дополнительно охватывает такие связывающие молекулы, которые содержат вариантный Fc-домен, содержащий:
(A) одну или более мутаций, которые изменяют эффекторную функцию и/или связывание с FcγR; и
(B) одну или более мутаций, которые увеличивают время полужизни в сыворотке.
[00153] Последовательность IgG1 для доменов СН2 и СН3 содержащих Fc-домен молекул согласно настоящему изобретению, которая обеспечивает увеличенное время полужизни (и которая имеет 10-кратное увеличение связывания с FcRn как яванского макака, так и человека) (Dall'Acqua, W.F. et al. (2006) "Properties of Human IgG1s Engineered for Enhanced Binding to the Neonatal Fc Receptor (FcRn)" J. Biol. Chem. 281(33):23514-23524), будет содержать замены M252Y/S254T/T256E (SEQ ID NO:46):


где X представляет собой лизин (K) или отсутствует.
[00154] Альтернативная последовательность IgG1 для доменов СН2 и СН3 содержащих Fc-домен молекул согласно настоящему изобретению, объединяющая сниженную или устраненную эффекторную функцию, обеспечиваемую заменами L234A/L235A, и увеличенное время полужизни в сыворотке, обеспечиваемое заменами M252Y/S254T/T256E, представлена SEQ ID NO: 47:

где X представляет собой лизин (K) или отсутствует.
[00155] Для некоторых антител, диател и трехвалентных связывающих молекул, для которых желательно иметь содержащие Fc-домен полипептидные цепи с различающейся аминокислотной последовательностью (например, для которых желательно иметь неидентичные содержащие Fc-домен полипептидные цепи), желательно уменьшить или предотвратить гомодимеризацию между доменами СН2-СН3 идентичных цепей (например, двух первых полипептидных цепей или между доменами СН2-СН3 двух третьих полипептидных цепей). Домены СН2 и/или СН3 таких полипептидных цепей не обязательно должны быть идентичны по последовательности, и их успешно модифицируют с целью способствовать образованию комплекса между двумя полипептидными цепями. Например, замена аминокислоты (предпочтительно замена на аминокислоту, содержащую объемную боковую группу, образующую «выступ», например, триптофан) может быть введена в домен СН2 или СН3 таким образом, чтобы стерические препятствия предотвращали взаимодействие с доменом со схожей мутацией и создавали условия для спаривания содержащего мутацию домена с доменом, в котором была сконструирована комплементарная или подходящая мутация, то есть «впадина» (например, замена на глицин). Такие наборы мутаций могут быть сконструированы в любой паре содержащих образующие Fc-домен домены СН2-СН3 полипептидов, чтобы способствовать гетеродимеризации. Способы белковой инженерии для обеспечения преобладания гетеродимеризации над гомодимеризацией хорошо известны в данной области техники, в частности, в отношении конструирования иммуноглобулиноподобных молекул, и охватываются настоящей заявкой (см., например, источники Ridgway et al. (1996) " 'Knobs-Into-Holes' Engineering Of Antibody CH3 Domains For Heavy Chain Heterodimerization, " Protein Engr. 9:617-621, Atwell et al. (1997) "Stable Heterodimers From Remodeling The Domain Interface Of A Homodimer Using A Phage Display Library, " J. Mol. Biol. 270: 26-35, и Xie et al. (2005) "A New Format Of Bispecific Antibody: Highly Efficient Heterodimerization, Expression And Tumor Cell Lysis," J. Immunol. Methods 296:95-101; каждый из которых настоящим полностью включен в настоящую заявку посредством ссылки).
[00156] Предпочтительный «выступ» создают путем модификации Fc-домена IgG таким образом, чтобы он содержал модификацию T366W. Предпочтительную «впадину» создают путем модификации Fc-домена IgG таким образом, чтобы он содержал модификации T366S, L368A и Y407V. Для облегчения очистки гомодимера имеющей «впадину» полипептидной цепи от конечной биспецифичной гетеродимерной содержащей Fc-домен молекулы сайт связывания белка А имеющих «впадину» доменов СН2 и СН3 в полипептидной цепи предпочтительно подвергают мутации путем замены аминокислоты в положении 435 (H435R). Таким образом, гомодимер имеющей «впадину» полипептидной цепи не будет связывать белок А, тогда как биспецифичный гетеродимер сохранит свою способность связывать белок А через сайт связывания белка А на имеющей «выступ» полипептидной цепи. В альтернативном варианте реализации имеющая «впадину» полипептидная цепь может содержать аминокислотные замены в положениях 434 и 435 (N434A/N435K).
[00157] Предпочтительная аминокислотная последовательность IgG1 для доменов СН2 и СН3 одной содержащей Fc-домен полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению будет иметь имеющую «выступ» последовательность (SEQ ID NO:48):

где X представляет собой лизин (K) или отсутствует.
[00158] Альтернативной аминокислотной последовательностью IgG1 для доменов СН2 и СН3 одной содержащей Fc-домен полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению, имеющей замену M252Y/S254T/T256E и имеющую «выступ» последовательность, является SEQ ID NO:49:

где X представляет собой лизин (K) или отсутствует.
[00159] Предпочтительная аминокислотная последовательность IgG1 для доменов СН2 и СН3 другой содержащей Fc-домен полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению будет иметь имеющую «впадину» последовательность (SEQ ID NO:50):

где X представляет собой лизин (K) или отсутствует.
[00160] Альтернативной аминокислотной последовательностью IgG1 для доменов СН2 и СН3 другой содержащей Fc-домен полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению, имеющей замену M252Y/S254T/T256E и имеющую «впадину» последовательность, является SEQ ID NO:51:

где Х представляет собой лизин (K) или отсутствует.
[00161] Следует отметить, что, домены СН2-СН3 последовательностей SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50 и SEQ ID NO:51 содержат замену на аланин в положении 234 и замену на аланин в положении 235, и, таким образом, образуют Fc-домен, проявляющий пониженное связывание (или по существу его отсутствие) с FcγRIA (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD 16a) или FcγRIIIB (CD 16b) (относительно связывания, проявляемого Fc-доменом дикого типа (SEQ ID NO:10)). Настоящее изобретение также охватывает такие домены СН2-СН3, которые содержат остатки аланина дикого типа, альтернативные и/или дополнительные замены, которые изменяют эффекторную функцию Fc-домена и/или активность его связывания с FyR. Настоящее изобретение также охватывает такие домены СН2-СН3, которые дополнительно содержат одну или более увеличивающих время полужизни аминокислотных замен. В частности, настоящее изобретение охватывает такие имеющие «впадину» и такие имеющие «выступ» домены СН2-СН3, которые дополнительно содержат M252Y/S254T/T256E.
[00162] Аминокислотная последовательность IgG4 для доменов СН2 и СН3 первой полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению имеет увеличенное время полужизни в сыворотке (относительно доменов СН2 и СН3 IgG1) вследствие наличия в ней Y252/T254/E256 (SEQ ID NO:52):

где Х представляет собой лизин (K) или отсутствует.
[00163] Имеющий «выступ» вариант такой аминокислотной последовательности СН2-СН3 IgG4 имеет аминокислотную последовательность SEQ ID NO:53:

где Х представляет собой лизин (K) или отсутствует.
[00164] Имеющий «впадину» вариант такой аминокислотной последовательности СН2-СН3 IgG4 имеет аминокислотную последовательность SEQ ID NO:54:

где Х представляет собой лизин (K) или отсутствует.
[00165] Предпочтительно, чтобы первая полипептидная цепь имела имеющую «выступ» последовательность СН2-СН3, такую как в SEQ ID NO:48 или SEQ ID NO:49. Однако будет понятно, что имеющий «впадину» домен СН2-СН3 (например, SEQ ID NO:50 или SEQ ID NO:51) может быть использован в первой полипептидной цепи, и в этом случае имеющий «выступ» домен СН2-СН3 (например, SEQ ID NO:48 или SEQ ID NO:49) может быть использован во второй полипептидной цепи содержащей Fc-домен молекулы согласно настоящему изобретению, имеющей две полипептидные цепи (или в третьей полипептидной цепи содержащей Fc-домен молекулы, имеющей три, четыре или пять полипептидных цепей).
[00166] В других вариантах реализации настоящее изобретение охватывает содержащие Fc-домен связывающие молекулы, содержащие домены СН2 и/или СН3, которые были сконструированы таким образом, чтобы обеспечивать преобладание гетеродимеризации над гомодимеризацией, с помощью мутаций, известных в данной области техники, таких как мутации, раскрытые в публикациях заявок РСТ №WO 2007/110205; WO 2011/143545; WO 2012/058768; WO 2013/06867, все из которых полностью включены в настоящую заявку посредством ссылки.
III. Трехвалентные связывающие молекулы, содержащие Fc-домены
[00167] Другой вариант реализации настоящего изобретения относится к трехвалентным связывающим молекулам, содержащим Fc-домен, способным одновременно связывать первый эпитоп, второй эпитоп и третий эпитоп, где по меньшей мере один из таких эпитопов не идентичен другому. Такие трехвалентные связывающие молекулы содержат три эпитоп-связывающих домена, два из которых являются относящимися по типу к диателам связывающими доменами, которые обеспечивают сайт связывания А и сайт связывания В, и один из которых является связывающим доменом Fab-типа или связывающим доменом scFv-типа и обеспечивает сайт связывания С (см., например, Фигуры 6A-6F, публикации заявок РСТ № WO 2015/184207 и WO 2015/184203). Таким образом, такие трехвалентные связывающие молекулы содержат домены «VL1» / «VH1», которые способны связывать первый эпитоп, и домены «VL2» / «VH2», которые способны связывать второй эпитоп, а также домены «VL3» и «VH3», которые способны связывать «третий» эпитоп такой трехвалентной связывающей молекулы. «Относящийся по типу к диателам связывающий домен» представляет собой тип эпитоп-связывающего домена, присутствующего в диателе, описанном выше. Каждый из «связывающего домена Fab-типа» и «связывающего домена scFv-типа» представляет собой эпитоп-связывающий домен, полученный путем взаимодействия домена VL легкой цепи иммуноглобулина и комплементарного домена VH тяжелой цепи иммуноглобулина. Связывающие домены Fab-типа отличаются от относящихся по типу к диателам связывающих доменов тем, что две полипептидные цепи, которые образуют связывающий домен Fab-типа, содержат только один эпитоп-связывающий домен, тогда как две полипептидные цепи, которые образуют относящийся по типу к диателам связывающий домен, содержат по меньшей мере два эпитоп-связывающих домена. Схожим образом, связывающие домены scFv-типа также отличаются от относящихся по типу к диателам связывающих доменов тем, что они содержат только один эпитоп-связывающий домен. Таким образом, в контексте настоящей заявки связывающие домены Fab-типа и связывающие домены scFv-типа отличаются от относящихся по типу к диателам связывающих доменов.
[00168] Как правило, трехвалентные связывающие молекулы согласно настоящему изобретению будут содержать четыре различных полипептидных цепи (см. Фигуры 6А-6В), однако указанные молекулы могут содержать меньшее или большее количество полипептидных цепей, например, вследствие объединения таких полипептидных цепей друг с другом (например, с помощью пептидной связи) или вследствие разделения таких полипептидных цепей с получением дополнительных полипептидных цепей, или вследствие присоединения меньшего количества полипептидных цепей или дополнительных полипептидных цепей через дисульфидные связи. Фигуры 6C-6F иллюстрируют этот аспект настоящего изобретения с помощью схематического изображения таких молекул, имеющих три полипептидные цепи. Как показано на Фигурах 6A-6F, трехвалентные связывающие молекулы согласно настоящему изобретению могут иметь альтернативные ориентации, при которых относящиеся по типу к диателам связывающие домены являются N-концевыми (Фигуры 6А, 6С и 6D) или С-концевыми (Фигуры 6В, 6Е и 6F) по отношению к Fc-домену. Домены СН2 и СН3, пригодные для применения для получения трехвалентных связывающих молекул, представлены выше и включают имеющие «выступ» и имеющие «впадину» домены.
[00169] В некоторых вариантах реализации первая полипептидная цепь таких трехвалентных связывающих молекул согласно настоящему изобретению содержит: (i) VL1-содержащий домен, (ii) VH2-содержащий домен, (iii) способствующий гетеродимеризации домен и (iv) домен, содержащий последовательность СН2-СН3. Домены VL1 и VL2 имеют N-концевое или С-концевое положение по отношению к содержащему СН2-СН3 домену, как представлено в таблице 4 (см. также Фигуры 6А и 6В). Вторая полипептидная цепь согласно таким вариантам реализации содержит: (i) VL2-содержащий домен, (ii) VH1-содержащий домен и (iii) способствующий гетер од имеризации домен. Третья полипептидная цепь согласно таким вариантам реализации содержит: (i) VH3-содержащий домен, (ii) CH1-содержащий домен и (iii) домен, содержащий последовательность СН2-СН3. Третья полипептидная цепь может представлять собой тяжелую цепь антитела, которая содержит VH3 и константную область тяжелой цепи, или полипептид, который содержит такие домены. Четвертый полипептид согласно таким вариантам реализации содержит: (i) VL3-содержащий домен и (ii) CL-содержащий домен. Четвертая полипептидная цепь может представлять собой легкую цепь антитела, которая содержит VL3, комплементарный VH3 третьей полипептидной цепи, или полипептид, который содержит такие домены. Третья или четвертая полипептидные цепи могут быть выделены из встречающихся в природе антител. В качестве альтернативы, они могут быть сконструированы рекомбинантными методами, синтетически или другими способами.
[00170] Вариабельный домен легкой цепи первой и второй полипептидных цепей отделен от вариабельных доменов тяжелой цепи таких полипептидных цепей промежуточным спейсерным пептидом, имеющим достаточно небольшую длину, чтобы обеспечить связывание их доменов VL1/VH2 (или VL2/VH1) с получением эпитоп-связывающего домена, способного связывать либо первый, либо второй эпитоп.Предпочтительный для этой цели промежуточный спейсерный пептид (линкер 1) имеет последовательность (SEQ ID NO:16): 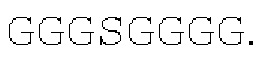 Другие домены трехвалентных связывающих молекул могут быть разделены одним или более промежуточными спейсерными пептидами (линкерами), необязательно содержащими остаток цистеина. В частности, как указано выше, такие линкеры, как правило, будут встроены между вариабельными доменами (то есть VH или VL) и способствующими гетеродимеризации доменами пептида (например, Е-спиралью или К-спиралью), а также между способствующими гетеродимеризации доменами (например, Е-спиралью или К-спиралью) и доменами СН2-СН3 такого пептида. Иллюстративные линкеры, пригодные для применения для получения трехвалентных связывающих молекул, представлены выше, а также предложены в заявках РСТ №: PCT/US 15/33081 и PCT/US 15/33076. Таким образом, первая и вторая полипептидные цепи таких трехвалентных связывающих молекул связываются с получением сайта связывания VL1/VH1, способного связывать первый эпитоп, а также сайта связывания VL2/VH2, способного связывать второй эпитоп.Третья и четвертая полипептидные цепи таких трехвалентных связывающих молекул связываются с получением сайта связывания VL3/VH3, способного связывать третий эпитоп.
Другие домены трехвалентных связывающих молекул могут быть разделены одним или более промежуточными спейсерными пептидами (линкерами), необязательно содержащими остаток цистеина. В частности, как указано выше, такие линкеры, как правило, будут встроены между вариабельными доменами (то есть VH или VL) и способствующими гетеродимеризации доменами пептида (например, Е-спиралью или К-спиралью), а также между способствующими гетеродимеризации доменами (например, Е-спиралью или К-спиралью) и доменами СН2-СН3 такого пептида. Иллюстративные линкеры, пригодные для применения для получения трехвалентных связывающих молекул, представлены выше, а также предложены в заявках РСТ №: PCT/US 15/33081 и PCT/US 15/33076. Таким образом, первая и вторая полипептидные цепи таких трехвалентных связывающих молекул связываются с получением сайта связывания VL1/VH1, способного связывать первый эпитоп, а также сайта связывания VL2/VH2, способного связывать второй эпитоп.Третья и четвертая полипептидные цепи таких трехвалентных связывающих молекул связываются с получением сайта связывания VL3/VH3, способного связывать третий эпитоп.
[00171] Как описано выше, трехвалентные связывающие молекулы согласно настоящему изобретению могут содержать три полипептида. Трехвалентные связывающие молекулы, содержащие три полипептидные цепи, могут быть получены путем связывания доменов N-конца четвертого полипептида с VH3-содержащим доменом третьего полипептида (например, с помощью промежуточного спейсерного пептида (линкера 4)). В качестве альтернативы используют третью полипептидную цепь трехвалентной связывающей молекулы согласно настоящему изобретению, содержащую следующие домены: (i) VL3-содержащий домен, (ii) VH3-содержащий домен и (iii) домен, содержащий последовательность СН2-СН3, где VL3 и VH3 отделены друг от друга промежуточным спейсерным пептидом, который является достаточно длинным (по меньшей мере 9 или более аминокислотных остатков), чтобы при объединении этих доменов образовался эпитоп-связывающий домен. Один из предпочтительных для этой цели промежуточных спейсерных пептидов имеет последовательность: 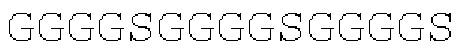 (SEQ ID NO:41).
(SEQ ID NO:41).
[00172] Следует понимать, что домены VL1/VH1, VL2/VH2 и VL3/VH3 таких трехвалентных связывающих молекул могут быть различными для обеспечения возможности связывания, которое является моноспецифичным, биспецифичным или триспецифичным. В частности, домены VL и VH могут быть выбраны таким образом, чтобы трехвалентная связывающая молекула содержала два сайта связывания для первого эпитопа и один сайт связывания для второго эпитопа, или один сайт связывания для первого эпитопа и два сайта связывания для второго эпитопа, или один сайт связывания для первого эпитопа, один сайт связывания для второго эпитопа и один сайт связывания для третьего эпитопа.
[00173] Общая структура полипептидных цепей типичных трехвалентных связывающих молекул согласно настоящему изобретению представлена на Фигурах 6A-6F и в таблице 5:
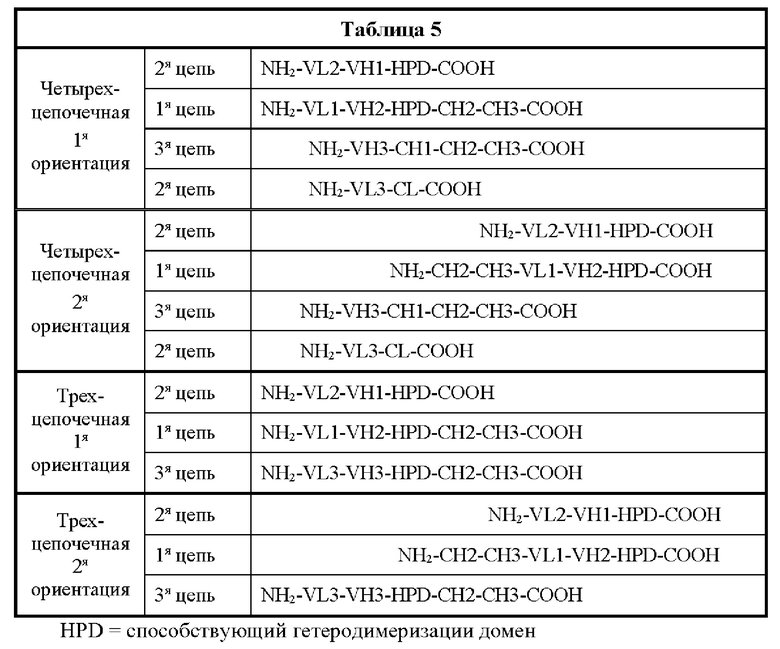
[00174] Как указано выше, такие трехвалентные связывающие молекулы могут содержать три, четыре, пять или более полипептидных цепей.
IV. Варианты реализации настоящего изобретения
[00175] Как указано выше, настоящее изобретение относится к связывающим DA х CD3 молекулам, содержащим в. связывающий CD3 домен, который содержит домен CDRhI, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3, аминокислотная последовательность по меньшей мере одного из которых отличается от аминокислотной последовательности соответствующей CDR эт.связывающего CD3 домена. Эт. связывающий CD3 домен, который следует использовать для такого сравнения с конкретным в. связывающим CD3 доменом, представляет собой связывающий CD3 домен выделенного связывающего CD3 антитела, который имеет наибольшую идентичность последовательности CDR с таким конкретным в. связывающим CD3 доменом. Эт. связывающий CD3 домен также предпочтительно имеет по меньшей мере 95%-100% идентичности в каркасных областях. Предпочтительный эт. связывающий CD3 домен содержит домен CDRH1, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3 CD3 mAb-1. Связывающие DA x CD3 молекулы согласно настоящему изобретению, которые содержат такой в. связывающий CD3 домен, проявляют измененную аффинность в отношении CD3 по сравнению со связывающей DA х CD3 молекулой, содержащей такой эт. связывающий CD3 домен. Настоящее изобретение, в частности, относится к таким связывающим DA х CD3 молекулам, содержащим в. связывающий CD3 домен, которые проявляют пониженную аффинность в отношении CD3 и способны опосредовать перенаправленное уничтожение клеток-мишеней, экспрессирующих относящийся к заболеванию антиген, а также демонстрируют сниженные уровни высвобождения цитокинов по сравнению со связывающей DA х CD3 молекулой, содержащей эт.связывающий CD3 домен. Настоящее изобретение, в частности, относится к применению связывающих DA х CD3 молекул, содержащих в. связывающий CD3 домен, при лечении рака и ассоциированных с патогеном заболеваний. Настоящее изобретение также относится к фармацевтическим композициям, которые содержат такую молекулу (молекулы).
[00176] Таким образом, настоящее изобретение охватывает связывающие DA х CD3 молекулы, содержащие один или более доменов VH и/или VL в. связывающего CD3 домена, или, более предпочтительно, части CDRH1, CDRH2 и CDRH3, а также части CDRL1, CDRL2 и CDRL3 таких доменов. В предпочтительном варианте реализации настоящего изобретения такие связывающие DA х CD3 молекулы будут дополнительно содержать связывающие домены, достаточные для обеспечения возможности связывания таких молекул с эпитопами одного, двух или более относящихся к заболеванию антигенов. В другом предпочтительном варианте реализации настоящего изобретения такие связывающие DA х CD3 молекулы будут дополнительно содержать связывающие домены, достаточные для обеспечения возможности связывания таких молекул с эпитопами другой молекулы, экспрессируемой на поверхности эффекторной клетки, такой как CD2, CD8, CD 16, Т-клеточный рецептор (TCR), NKp46, NKG2D и так далее, которые экспрессируются на Т-лимфоцитах, клетках-естестве иных киллерах (NK), антиген-презентирующих клетках или других мононуклеарных клетках.
[00177] Настоящее изобретение также относится к фармацевтическим композициям, которые содержат такую связывающую DA х CD3 молекулу (молекулы).
[00178] Обладая связывающими доменами, достаточными для иммуноспецифичного связывания CD3 и относящегося к заболеванию антигена, молекулы согласно настоящему изобретению обладают способностью опосредовать перенаправленное уничтожение клетки-мишени (например, раковой клетки или инфицированной патогеном клетки), которая экспонирует относящийся к заболеванию антиген на своей поверхности. Совместное присутствие обеих таких аффинностей связывания служит для локализации экспрессирующей CD3 эффекторной клетки в месте присутствия клетки-мишени (то есть для «перенаправления» эффекторной клетки) таким образом, что она может опосредовать уничтожение клетки-мишени. Как обсуждалось выше, такие молекулы могут быть биспецифичными или могут быть способны связывать более двух эпитопов (например, триспецифичные молекулы).
[00179] Попыткам применения связывающих CD3 молекул препятствовала высокая степень активации иммунной системы, вызванной такой терапией, а также сопутствующая и нежелательная продукция высоких количеств цитокинов у некоторых пациентов. Таким образом, несмотря на то, что нацеленная на CD3 терапия приводила к значительной степени активации иммунной системы у получавших ее пациентов, коррелировавшей с существенным повышением эффективности, применение таких молекул было связано со значительной токсичностью (Frey, N.V. et al. (2016) "Cytokine Release Syndrome With Novel Therapeutics For Acute Lymphoblastic Leukemia," Hematol. Am. Soc. Hematol. Educ Program. (1):567-572;Teachey, D.T. et al. (2013) "Cytokine Release Syndrome After Blinatumomab Treatment Related To Abnormal Macrophage Activation And Ameliorated With Cytokine-Directed Therapy" Blood 121(26):5154-5157;Le Jeune, C. et al. (2016) "Potential For Bispecific T-Cell Engagers: Role Of Blinatumomab In Acute Lymphoblastic Leukemia" Drug Des. Devel. Ther. 10:757-765;Newman, M.J. et al. (2016) "A Review Of Blinatumomab, A Novel Immunotherapy" J. Oncol. Pharm. Pract. 22(4):639-645;Fitzgerald, J.C. et al. (2017) "Cytokine Release Syndrome After Chimeric Antigen Receptor T-Cell Therapy for Acute Lymphoblastic Leukemia" Crit. Care Med. 45(2):e124-e131; Teachey, D.T. et al. (2016) "Identification of Predictive Biomarkers for Cytokine Release Syndrome after Chimeric Antigen Receptor T-cell Therapy for Acute Lymphoblastic Leukemia," Cancer Discov. 6(6):664-679;Goebeler, M.E. et al. (2016) "Blinatumomab: A CD19/CD3 Bispecific T Cell Engager (Bite) With Unique Anti-Tumor Efficacy" Leuk. Lymphoma57(5): 1021-1032; Barrett, D.M. et al. (2014) "Toxicity Management For Patients Receiving Novel T-Cell Engaging Therapies," Curr. Opin. Pediatr. 26(1):43-49).
[00180] Настоящее изобретение устраняет такое препятствие, демонстрируя, что исходные связывающие CD3 домены (то есть эт.связывающие CD3 домены), которые проявляют как высокую цитотоксичность, так и высокое высвобождение цитокинов при включении в связывающие DA х CD3 молекулы, могут быть сконструированы для получения вариантов (то есть в. связывающих CD3 доменов), обладающих измененной аффинностью к CD3, которые способны опосредовать перенаправленное уничтожение, а также демонстрируют сниженные уровни высвобождения цитокинов по сравнению со связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. В частности, связывающие DA х CD3 молекулы, содержащие в. связывающие CD3 домены согласно настоящему изобретению, демонстрируют сниженные уровни высвобождения любого одного или более из: ИФН-γ, ФНО-α, ИЛ-2 и/или ИЛ-6.
[00181] Настоящее изобретение частично основано на признании того факта, что цитотоксичность и высвобождение цитокинов являются отдельными свойствами связывающих DA х CD3 молекул. Настоящее изобретение охватывает вариантные связывающие CD3 домены (то есть в. связывающие CD3 домены), которые сохраняют высокий уровень цитотоксичности, демонстрируя при этом сниженные уровни высвобождения цитокинов, и применение связывающих DA х CD3 молекул, содержащих такие в. связывающие CD3 домены, при лечении заболевания. В контексте настоящей заявки термин «вариантные» в отношении таких связывающих CD3 доменов предназначен для обозначения связывающих CD3 доменов, содержащих по меньшей мере одну CDRH и/или по меньшей мере одну CDRL, которая отличается от «соответствующей» CDRH и/или CDRL «эталонного» связывающего CD3 домена (то есть эт.связывающего CD3 домена). В контексте настоящей заявки термин «соответствующая» CDRH и/или CDRL указывает на сравнение двух последовательностей CDR, в которых обе такие CDR являются доменами CDH1, обе такие CDR являются доменами CDH2, обе такие CDR являются доменами CDH3, обе такие CDR являются доменами CDL1, обе такие CDR являются доменами CDL2 или обе такие CDR являются доменами CDL3. Предпочтительным эт. связывающим CD3 доменом для иллюстративных в. связывающих CD3 доменов, описанных в настоящей заявке, является связывающий CD3 домен, содержащий по меньшей мере 5, по меньшей мере 4, по меньшей мере 3, по меньшей мере 2 или по меньшей мере 1 из CDR: CDH1, CDRH2, CDRH3 и CDL1, CDRL2 и CDRL3 CD3 mAb 1. Предпочтительно такие иллюстративные в. связывающие CD3 домены будут содержать по меньшей мере 5 из CDR: CDH1, CDRH2, CDRH3, и CDL1, CDRL2 и CDRL3 CD3 mAb 1 В. связывающие CD3 домены могут быть получены путем химической модификации одной или более CDR эт. связывающего CD3 домена, однако более предпочтительно будут получены путем конструирования одного или более полинуклеотидов, которые кодируют одну или более из таких CDR эт. связывающего CD3 домена, с тем отличием, что они были изменены для кодирования желаемого в. связывающего CD3 домена, с последующей экспрессией такого полинуклеотида в подходящей системе экспрессии белка (например, клетке или системе трансляции in vitro). Цитотоксичность может быть определена любым подходящим способом (например, с помощью анализа ЦТЛ для определения ЕС50, максимума и так далее). Высвобождение цитокинов может быть определено путем анализа любого одного или более из: ИФН-гамма, ФНО-альфа, ИЛ-6 или ИЛ-2 любым подходящим способом (например, с помощью анализа ЦТЛ для определения ЕС50, максимума и так далее).
[00182] Следует отметить, что абсолютные уровни максимальной цитотоксичности и высвобождение цитокинов не являются единственными используемыми критериями оценки того, является ли рассматриваемый связывающий CD3 домен подходящим в. связывающим CD3 доменом, охватываемым настоящим изобретением. Помимо этого, или в качестве альтернативы, могут быть использованы значения ЕС50. В соответствии с настоящей заявкой, подходящим в. связывающим CD3 доменом является домен, который при встраивании в связывающую DA х CD3 молекулу способен опосредовать высокие уровни цитотоксичности (то есть низкую концентрацию ЕС50), демонстрируя при этом сниженные уровни высвобождения цитокинов.
[00183] В некоторых вариантах реализации настоящего изобретения предложен в. связывающий CD3 домен, который при встраивании в связывающую DA х CD3 молекулу опосредует перенаправленное уничтожение клеток клетками до максимальных значений цитотоксичности (например, при оценке с помощью анализа ЦТЛ за 18-48 часов), что составляет по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 100% от такового, опосредованного связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. Дополнительно, или в качестве альтернативы, связывающая DA х CD3 молекула, содержащая в. связывающие CD3 домены согласно настоящему изобретению, демонстрирует ЕС50 цитотоксичности (например, при оценке с помощью анализа ЦТЛ за 18-48 часов), которая на менее чем примерно 10%, менее чем примерно 20%, менее чем примерно 30%, менее чем примерно 40%, менее чем примерно 50%, менее чем примерно 60%, менее чем примерно 70%, менее чем примерно 80%, менее чем примерно 90%, менее чем примерно 100%, менее чем примерно 200%, менее чем примерно 300%, менее чем примерно 400% или менее чем примерно 500% превышает ЕС50 цитотоксичности, демонстрируемую связывающей DA х CD3 молекулой, содержащей эт.связывающий CD3 домен. Дополнительно, или в качестве альтернативы, отношение ЕС50 цитотоксичности (например, при оценке с помощью анализа ЦТЛ за 18-24 часа) связывающей DA х CD3 молекулы, содержащей в. связывающий CD3 домен согласно настоящему изобретению, к ЕС50 цитотоксичности связывающей DA х CD3 молекулы, содержащей эт.связывающий CD3 домен (ЕС50 вариантного/ ЕС50 эталонного), составляет менее примерно 2, менее примерно 5, менее примерно 10, менее примерно 20, менее примерно 40, менее примерно 60, менее примерно 80, менее примерно 100 или менее примерно 200.
[00184] В некоторых вариантах реализации связывающая DA х CD3 молекула, содержащая в. связывающие CD3 домены согласно настоящему изобретению, демонстрирует максимальное высвобождение одного или более цитокинов (например, при оценке с помощью анализа ЦТЛ за 18-24 часа), которое на по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90% или более ниже такового, демонстрируемого связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. Дополнительно, или в качестве альтернативы, связывающие DA х CD3 молекулы, содержащие в. связывающие CD3 домены согласно настоящему изобретению, демонстрируют ЕС50 высвобождения одного или более цитокинов (например, при оценке с помощью анализа ЦТЛ за 18-48 часов), которая на по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 40%, по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80, по меньшей мере примерно 90% или более превышает таковую, демонстрируемую связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. В конкретных вариантах реализации высвобождаемый цитокин выбран из группы, состоящей из: ИФН-γ, ФНО-α, ИЛ-2 и ИЛ-6. Дополнительно, или в качестве альтернативы, отношение ЕС50 высвобождения одного или более цитокинов (например, при оценке с помощью анализа ЦТЛ за 18-24 часа) связывающей DA х CD3 молекулы, содержащей в. связывающий CD3 домен согласно настоящему изобретению, к таковому для связывающей DA х CD3 молекулы, содержащей эт. связывающий CD3 домен (ЕС50 вариантного/ ЕС50 эталонного), составляет более 1, более 2, более 5, более 10, более 20, более 40, более 60, более 80, более 100 или более 200.
[00185] Помимо этого, связывающие DA х CD3 молекулы, содержащие в. связывающий CD3 домен согласно настоящему изобретению, сохраняют по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 100% активности in vivo (например, противоопухолевой, противопатогенной активности), проявляемой связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен. С учетом настоящего раскрытия следует понимать, что связывающие DA х CD3 молекулы, содержащие в. связывающий CD3 домен, могут быть введены в более высокой дозе для достижения активности in vivo, которая составляет по меньшей мере примерно 50% или более от активности, проявляемой связывающей DA х CD3 молекулой, содержащей эт.связывающий CD3 домен, однако такая более высокая доза будет вызывать сниженные уровни высвобождения цитокинов по сравнению со связывающей DA х CD3 молекулой, содержащей эт. связывающий CD3 домен.
[00186] В одном из вариантов реализации такие связывающие DA х CD3 молекулы согласно настоящему изобретению будут моноспецифичными, то есть будут обладать способностью связываться только с одним эпитопом CD3 и только с одним эпитопом относящегося к заболеванию антигена.
[00187] В качестве альтернативы, такие связывающие DA х CD3 молекулы могут быть полиспецифичными, то есть способными связывать 1, 2, 3, 4 или более 4 эпитопов, которые могут быть распределены любым образом с обеспечением связывания 1, 2 или более эпитопов CD3 и 1, 2, 3, 4 или более 4 эпитопов одного или более относящихся к заболеванию антигенов.
[00188] В некоторых вариантах реализации, где такие связывающие DA х CD3 молекулы способны иммуноспецифично связываться только с одним относящимся к заболеванию антигеном, они могут быть способны иммуноспецифично связываться только с одним эпитопом CD3 а также с одним, двумя эпитопами такого относящегося к заболеванию антигена (где два эпитопа относящегося к заболеванию антигена могут быть одинаковыми или различными), или они могут быть способны иммуноспецифично связываться только с одним эпитопом CD3 и с тремя эпитопами такого относящегося к заболеванию антигена (где три эпитопа относящегося к заболеванию антигена могут быть одинаковыми, или могут быть различными, или могут представлять собой два одинаковых эпитопа и один отличающийся эпитоп).
[00189] В других вариантах реализации, где такие связывающие DA х CD3 молекулы способны иммуноспецифично связываться с двумя различными относящимися к заболеванию антигенами (например, первым относящимся к заболеванию антигеном и вторым относящимся к заболеванию антигеном), они могут быть способны иммуноспецифично связываться только с одним эпитопом CD3 и с одним или двумя эпитопами первого относящегося к заболеванию антигена (где два эпитопа первого относящегося к заболеванию антигена могут быть одинаковыми или различными) и двумя или одним эпитопом (эпитопами) второго относящегося к заболеванию антигена (где два эпитопа второго относящегося к заболеванию антигена могут быть одинаковыми или различными).
[00190] В других вариантах реализации такие связывающие DA х CD3 молекулы могут быть способны иммуноспецифично связываться с тремя различными относящимися к заболеванию антигенами (например, первым относящимся к заболеванию антигеном, вторым относящимся к заболеванию антигеном и третьим относящимся к заболеванию антигеном) и только одним эпитопом CD3.
[00191] В других вариантах реализации такие связывающие DA х CD3 молекулы могут быть способны иммуноспецифично связываться с одним или двумя различными относящимися к заболеванию антигенами (например, первым относящимся к заболеванию антигеном и вторым относящимся к заболеванию антигеном), только одним эпитопом CD3 и одной или двумя другими молекулами клеточной поверхности (где молекулы клеточной поверхности могут быть одинаковыми или различными) эффекторной клетки (которая может являться эффекторной клеткой того же типа или может являться эффекторной клеткой другого типа).
[00192] Таким образом, например, такие связывающие DA х CD3 молекулы могут связывать:
(1) один эпитоп CD3 и один эпитоп относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(2) один эпитоп CD3 и два эпитопа одного относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(3) один эпитоп CD3, эпитоп первого относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и эпитоп второго относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(4) один эпитоп CD3 и три эпитопа одного относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(5) один эпитоп CD3, два эпитопа первого относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и один эпитоп второго относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(6) один эпитоп CD3, эпитоп первого относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и эпитоп второго относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени;
(7) один эпитоп CD3, один эпитоп относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и один эпитоп молекулы клеточной поверхности, отличный от CD3, который представлен на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа);
(8) один эпитоп CD3, два эпитопа относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и один эпитоп молекулы клеточной поверхности, отличный от CD3, который представлен на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа);
(9) один эпитоп CD3, эпитоп первого относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, эпитоп второго относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и один эпитоп молекулы клеточной поверхности, отличный от CD3, который представлен на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа);
(10) один эпитоп CD3, эпитоп относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, и два эпитопа молекулы клеточной поверхности, отличные от CD3, которые представлены на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа); или
(11) один эпитоп CD3, эпитоп относящегося к заболеванию антигена, который представлен на поверхности клетки-мишени, эпитоп первой молекулы клеточной поверхности, отличный от CD3, который представлен на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа), и эпитоп второй молекулы клеточной поверхности, отличный от CD3, который представлен на поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа, что и экспонирующая CD3 клетка, или может являться эффекторной клеткой другого типа).
[00193] Таким образом, в настоящем изобретении рассматриваются связывающие DA х CD3 молекулы, которые содержат первый эпитоп-связывающий домен, способный иммуноспецифично связывать эпитоп CD3, и второй эпитоп-связывающий домен, способный иммуноспецифично связывать эпитоп относящегося к заболеванию антигена, который представлен на поверхности такой клетки-мишени, а также третий эпитоп-связывающий домен, способный иммуноспецифично связывать эпитоп другой молекулы клеточной поверхности эффекторной клетки (которая может являться эффекторной клеткой того же типа или может являться эффекторной клеткой другого типа). В конкретном варианте реализации указанная другая молекула клеточной поверхности эффекторной клетки представляет собой CD8. Таблица 6 иллюстрирует возможные комбинации специфичности связывания иллюстративных молекул согласно настоящему изобретению.
[00194] Путем построения более сложных молекул могут быть получены связывающие DA х CD3 молекулы, способные связывать CD3, а также один или более относящихся к заболеванию антигенов и, необязательно, другую молекулу клеточной поверхности эффекторной клетки, имеющие более четырех эпитоп-связывающих доменов. Не налагается никаких ограничений относительно природы или количества эпитопов или дополнительных эпитопов, которые могут быть связаны молекулами согласно настоящему изобретению, за исключением случаев, когда такая дополнительная связывающая способность лишает молекулу или ее связывающий домен, который способен связываться с эпитопом CD3, возможности такого связывания, и лишает молекулу или ее связывающий домен, который способен связываться с эпитопом относящегося к заболеванию антигена возможности такого связывания, таким образом, молекула (молекулы) может опосредовать перенаправленное уничтожение клетки-мишени.
V. Иллюстративные связывающие молекулы
[00195] Настоящее изобретение относится к связывающим DA х CD3 молекулам (например, диателу, биспецифичному антителу, биспецифичному, трехвалентной молекуле, BiTe, TandAb и так далее), способным связываться с CD3 и относящимся к заболеванию антигеном, таким как раковый антиген или ассоциированный с патогеном антиген. Такие связывающие молекулы могут быть легко получены из CDR антител и из доменов VL и VH антител. Ниже перечислены иллюстративные антитела, которые могут быть применены для получения связывающих молекул и комбинированной терапии согласно настоящему изобретению.
А. Антитело к CD3 CD3 mAb 1
[00196] В настоящем изобретении применяют вариантные связывающие CD3 домены (то есть в. связывающие CD3 домены), которые содержат вариабельный домен легкой цепи (VL) и вариабельный домен тяжелой цепи (VH) антител к CD3 человека или их связывающие CD3 части, и которые опосредуют связывание варианта с CD3. В контексте настоящей заявки термин «связывание варианта/вариантное связывание» предназначен для обозначения связывания, определенного посредством сравнения со связыванием, проявляемым связывающими CD3 доменами эталонного антитела, CDR которого имеют наибольшую идентичность последовательностей с CDR вариантного связывающего CD3 домена. Эталонным связывающим CD3 антителом для иллюстративных в. связывающих CD3 доменов согласно настоящему изобретению является CD3 mAb 1, эт. связывающий CD3 домен которого способен связывать CD3 человека и CD3 нечеловекообразных приматов (например, яванского макака).
[00197] Аминокислотная последовательность домена VH CD3 mAb 1 (SEQ ID NO: 55) представлена ниже (остатки CDRH обозначены подчеркиванием):

где Х представляет собой аспартат (D) или глицин (G)
[00198] Аминокислотная последовательность домена VL CD3 mAb 1 (SEQ ID NO: 56) представлена ниже (остатки CDRL обозначены подчеркиванием):


[00199] Эт. связывающий CD3 домен «CD3 mAb 1» содержит домен VH CD3 mAb 1, имеющий либо аспартат (D), либо глицин (G) в положении 65 по Кабату, соответствующем остатку 68 SEQ ID NO: 55 (то есть X в SEQ ID NO: 55 представляет собой аспартат (D) или глицин (G)), и домен VL CD3 mAb 1 (SEQ ID NO: 56). Таким образом, например, когда такой домен VH CD3 mAb 1 имеет глицин (G) в качестве остатка 68, его последовательность представляет собой SEQ ID NO: 63, представленную ниже (остатки CDRH обозначены подчеркиванием, положение 65 по Кабату обозначено двойным подчеркиванием):
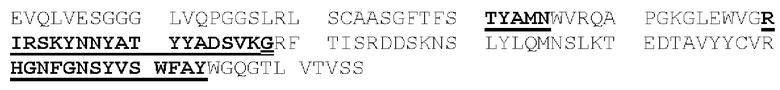
[00200] Связывающие CD3 молекулы, которые содержат в. связывающий CD3 домен согласно настоящему изобретению, могут быть распознаны с помощью анализа ЦТЛ, в котором:
(1) биспецифичное связывающее раковый антиген x CD3 диатело (например, диатело CD123 x CD3 или диатело 5Т4 x CD3), потенциально содержащее в. связывающий CD3 домен, и
(2) биспецифичное связывающее раковый антиген x CD3 диатело, содержащее соответствующий эт. связывающий CD3 домен, (например, эт. связывающий CD3 домен CD3 mAb 1),
отдельно инкубируют с эффекторными Pan-T-клетками (или МКПК) и опухолевыми клетками-мишенями (например, клетками MOLM-13 или А498), например, при отношении количеств эффекторных клеток и клеток-мишеней 5:1 (или 15:1 для МКПК) в течение 18, 24 или 42 часов, и определяют цитотоксичность в процентах (то есть уничтожение клеток) и/или ЕС50 (например, путем оценки высвобождения лактатдегидрогеназы (ЛДГ) в среду поврежденными клетками с помощью набора для нерадиоактивного анализа цитотоксичности CytoTox 96® (Promega)). В одном из вариантов реализации высвобождение цитокинов ИФН-γ, ФНО-α, ИЛ-6 и ИЛ-2 может быть определено в конце анализа ЦТЛ. Популяции Т-лимфоцитов CD4+ и CD8+ также могут быть оценены в отношении положительной регуляции маркеров активации CD69 и CD25 в конце анализа ЦТЛ. Сравнение цитотоксичности в процентах и/или ЕС50 для биспецифичного связывающего раковый антиген x CD3 диатела, потенциально содержащего в. связывающий CD3 домен, с таковыми для связывающего раковый антиген × CD3 диатела, содержащего эт. связывающие CD3 домены, позволяет идентифицировать в. связывающие CD3 домены, которые проявляют желаемое вариантное связывание CD3 и/или сниженный уровень высвобождения цитокинов.
[00201] Связывающие CD3 молекулы, которые содержат в. связывающий CD3 домен согласно настоящему изобретению, в качестве альтернативы могут быть распознаны с помощью анализа связывания, в котором:
(1) биспецифичное связывающее раковый антиген x CD3 диатело, потенциально содержащее в. связывающий CD3 домен, и
(2) биспецифичное связывающее раковый антиген x CD3 диатело, содержащее эт. связывающий CD3 домен (например, эт. связывающий CD3 домен CD3 mAb 1),
отдельно оценивают в отношении их способности связываться с поверхностью клеток, относящихся к экспрессирующим опухолевый антиген линиям клеток (клеток MOLM-13 или A498), с помощью анализа FACS. Кратко, клетки инкубируют с молекулами диател (в буфере для FACS, содержащем 10% сыворотки человека АВ) в планшетах для микротитрования. Затем клетки промывают и инкубируют с меченым вторичным антителом к Fc человека или с конъюгированным с биотином антителом мыши к EK-спирали, которое распознает Е-спиральный/K-спиральный (EK) способствующий гетеродимеризации домен диател, смешанным со стрептавидин-фикоэритрином. Затем клетки промывают и ресуспендируют в буфере для FACS, и анализируют с помощью проточной цитометрии, и проводят сравнение.
[00202] Связывающие CD3 молекулы, которые содержат в. связывающий CD3 домен согласно настоящему изобретению, в качестве альтернативы могут быть распознаны, например, с помощью модели ксенотрансплантата со смешиванием, как то у мышей NOD/SCID. В таком анализе мышам вводят путем инъекции опухолевые клетки (например, клетки KG1A (ОМЛ)), смешанные с активированными Т-клетками CD4+ или CD8+ человека (Е:Т = 1:5). Биспецифичное связывающее раковый антиген x CD3 диатело, потенциально содержащее в. связывающий CD3 домен, или связывающее раковый антиген x CD3 диатело, содержащее эт. связывающий CD3 домен, вводят животным путем инъекции, и отслеживают и сравнивают степень роста опухоли.
[00203] В качестве альтернативы, любой один, два или более чем два из иллюстративных вариантов CD3 mAb 1, обозначенных в настоящей заявке как «CD3 mAb 1 М3» - «CD3 mAb 1 М26», могут быть применены для получения в. связывающего CD3 домена связывающих DA х CD3 молекул согласно настоящему изобретению. В настоящем изобретении полностью рассматриваются антитела к CD3, содержащие домены VL и VH CD3 mAb 1 М3 - CD3 mAb 1 М26, причем домен VH содержит аспартат (D) в положении 65 по Кабату или глицин (G) в положении 65 по Кабату. Иллюстративные варианты CD3 mAb 1, CD3 mAb 1 М3 - CD3 mAb 1 М26, содержат в. связывающие CD3 домены, которые содержат домен CDRH1, домен CDRH2, домен CDRH3, домен CDRL1, домен CDRL2 и домен CDRL3, аминокислотная последовательность по меньшей мере одного из которых отличается от аминокислотной последовательности соответствующей CDR эт. связывающего CD3 домена (CD3 mAb 1); и от связывающего DA x CD3 домена, содержащего указанный эт. связывающий CD3 домен. Связывающая DA х CD3 молекула, содержащая указанный в. связывающий CD3 домен, связывает CD3 с измененной аффинностью и способна опосредовать перенаправленное уничтожение и демонстрировать более низкие уровни высвобождения цитокинов.
[00204] Аминокислотные последовательности предпочтительных вариантов доменов VH к CD3 согласно настоящему изобретению представляют собой варианты SEQ ID NO: 55 и представлены SEQ ID NO: 207 (остатки CDRH обозначены подчеркиванием):
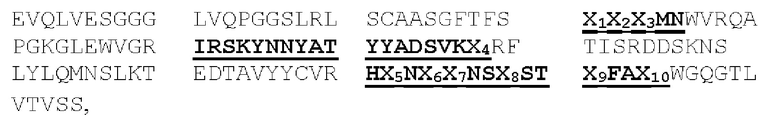
где: X1 представляет собой Т, D или Е; Х2 представляет собой Y, D или Т; Х3 представляет собой А или G; Х4 представляет собой D или G; Х5 представляет собой G, D, Е или K; Х6 представляет собой F или I; Х7 представляет собой G или I; Х8 представляет собой Y, A, G или Q; Х9 представляет собой W, F или Y; и Х10 представляет собой Y или Е.
[00205] Аминокислотные последовательности предпочтительных вариантов доменов VL к CD3 согласно настоящему изобретению представляют собой варианты SEQ ID NO:56 и представлены SEQ ID NO: 208 (остатки CDRL обозначены подчеркиванием):

где: X1 представляет собой G или D; Х2 представляет собой K или G; и Х3 представляет собой L, Е или Q.
В. Вариантные антитела к CD3
1. CD3 mAb 1 Ml
[00206] CD3 mAb 1 M1 представляет собой низкоаффинный вариант CD3 mAb 1, и поэтому также обозначен как «CD3 mAb 1 Low». Аминокислотная последовательность домена VH CD3 mAb 1 M1 представлена ниже как SEQ ID NO: 64 (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 64 содержит замену S100dT (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 64, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где X представляет собой аспартат (D) или глицин (G)
[00207] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 M1 представляет собой SEQ ID NO: 56.

2. CD3 mAb 1 М2
[00208] CD3 mAb 1 М2 имеет более высокую скорость диссоциации, чем CD3 mAb 1, и поэтому также обозначен как «CD3 mAb 1 Fast». Аминокислотная последовательность домена VH CD3 mAb 1 М2 представлена ниже как SEQ ID NO: 66 (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 66 содержит замены G96K и S100dT, нумерация по Кабату (остаток 110 в последовательности, обозначенный двойным подчеркиванием); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 66, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
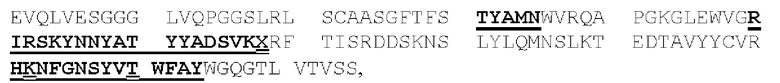
где X представляет собой аспартат (D) или глицин (G)
[00209] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М2 представляет собой SEQ ID NO: 56.

3. CD3 mAb 1 М3
[00210] Аминокислотная последовательность домена VH CD3 mAb 1 М3 (SEQ ID NO: 68) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 68 содержит замену G99I (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 68, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где Х представляет собой аспартат (D) или глицин (G)
[00211] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М3 представляет собой SEQ ID NO: 56.

4. CD3 mAb 1 M4
[00212] Аминокислотная последовательность домена VH CD3 mAb 1 М4 (SEQ ID NO: 70) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 70 содержит замену Y100bA (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 70, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где X представляет собой аспартат (D) или глицин (G)
[00213] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М4 представляет собой SEQ ID NO: 56.

5. CD3 mAb 1 М5
[00214] Аминокислотная последовательность домена VH CD3 mAb 1 М5 (SEQ ID NO: 72) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 72 содержит замену Y100bG (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 72, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
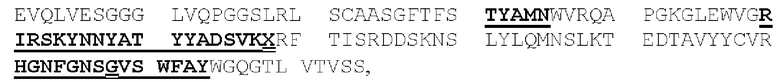
где X представляет собой аспартат (D) или глицин (G)
[00215] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М5 представляет собой SEQ ID NO: 56.

6. CD3 mAb 1 М6
[00216] Аминокислотная последовательность домена VH CD3 mAb 1 М6 (SEQ ID NO: 74) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 74 содержит замену Y100bQ (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 74, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где X представляет собой аспартат (D) или глицин (G)
[00217] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М6 представляет собой SEQ ID NO: 56.

7. CD3 mAb 1 M7
[00218] Аминокислотная последовательность домена VH CD3 mAb 1 М7 (SEQ ID NO: 76) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 76 содержит замену G96D (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 76, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
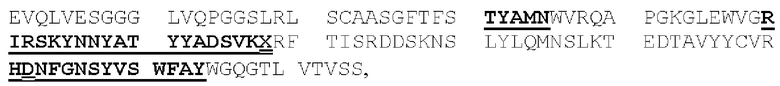
где X представляет собой аспартат (D) или глицин (G)
[00219] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М7 представляет собой SEQ ID NO: 56.

8. CD3 mAb 1 М8
[00220] Аминокислотная последовательность домена VH CD3 mAb 1 М8 (SEQ ID NO: 78) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 78 содержит замену G99E (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 78, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где X представляет собой аспартат (D) или глицин (G)
[00221] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М8 представляет собой SEQ ID NO: 56.

9. CD3 mAb 1 М9
[00222] Аминокислотная последовательность домена VH CD3 mAb 1 М9 (SEQ ID NO: 80) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 80 содержит замену G99K (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 80, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G)):
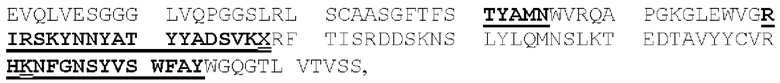
где Х представляет собой аспартат (D) или глицин (G)
[00223] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М9 представляет собой SEQ ID NO: 56.


10. CD3 mAb 1 M10
[00224] Аминокислотная последовательность домена VH CD3 mAb 1 M10 (SEQ ID NO: 82) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 82 содержит замену F98I (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 82, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
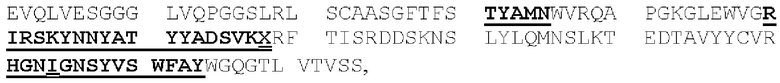
где Х представляет собой аспартат (D) или глицин (G)
[00225] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М10 представляет собой SEQ ID NO: 56.

11. CD3 mAb 1 M11
[00226] Аминокислотная последовательность домена VH CD3 mAb 1 Mil (SEQ ID NO: 84) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 84 содержит замену W100eF (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 84, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
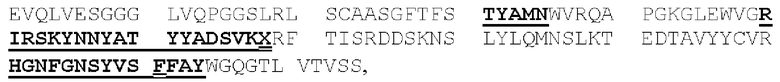
где Х представляет собой аспартат (D) или глицин (G)
[00227] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М11 представляет собой SEQ ID NO: 56.

12. CD3 mAb 1 М12
[00228] Аминокислотная последовательность домена VH CD3 mAb 1 М12 (SEQ ID NO: 86) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 86 содержит замену W100eY (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 86, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
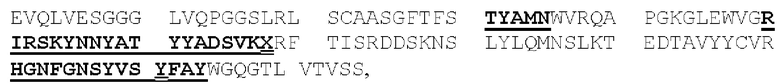
где Х представляет собой аспартат (D) или глицин (G)
[00229] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М12 представляет собой SEQ ID NO: 56.


13. CD3 mAb 1 M13
[00230] Аминокислотная последовательность домена VH CD3 mAb 1 М13 (SEQ ID NO: 88) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 88 содержит замену Y102E (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 88, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где Х представляет собой аспартат (D) или глицин (G)
[00231] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М13 представляет собой SEQ ID NO: 56.

14. CD3 mAb 1 М14
[00232] Аминокислотная последовательность домена VH CD3 mAb 1 М14 (SEQ ID NO: 90) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 90 содержит замену T31D (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 90, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
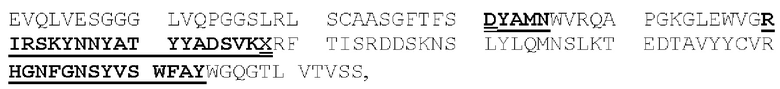
где Х представляет собой аспартат (D) или глицин (G)
[00233] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М14 представляет собой SEQ ID NO: 56.

15. CD3 mAb 1 М15
[00234] Аминокислотная последовательность домена VH CD3 mAb 1 М15 (SEQ ID NO: 92) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 92 содержит замену T31E (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 92, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
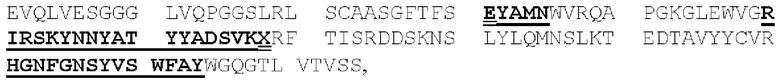
где Х представляет собой аспартат (D) или глицин (G)
[00235] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М15 представляет собой SEQ ID NO: 56.


16. CD3 mAb 1 M16
[00236] Аминокислотная последовательность домена VH CD3 mAb 1 М16 (SEQ ID NO: 94) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 94 содержит замену Y32D (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 94, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):

где Х представляет собой аспартат (D) или глицин (G)
[00237] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М16 представляет собой SEQ ID NO: 56.

17. CD3 mAb 1 М17
[00238] Аминокислотная последовательность домена VH CD3 mAb 1 М17 (SEQ ID NO: 96) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 96 содержит замену Y32T (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 96, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
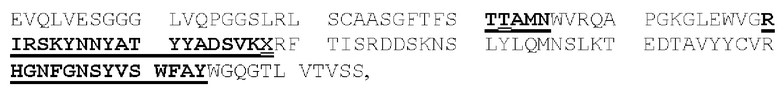
где Х представляет собой аспартат (D) или глицин (G)
[00239] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М17 представляет собой SEQ ID NO: 56.

18. CD3 mAb 1 М18
[00240] Аминокислотная последовательность домена VH CD3 mAb 1 М18 (SEQ ID NO: 98) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 98 содержит замену A33G (обозначена двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 98, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
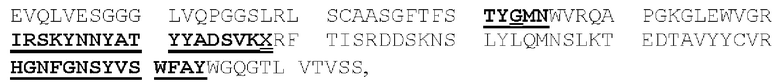
где Х представляет собой аспартат (D) или глицин (G)
[00241] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М18 представляет собой SEQ ID NO: 56.


19. CD3 mAb 1 M19
[00242] Аминокислотная последовательность домена VH CD3 mAb 1 М19 (SEQ ID NO: 100) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 100 содержит замены G96K и F98I (обозначены двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 100, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
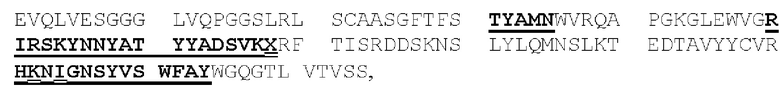
где Х представляет собой аспартат (D) или глицин (G)
[00243] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М19 представляет собой SEQ ID NO: 56.

20. CD3 mAb 1 М20
[00244] Аминокислотная последовательность домена VH CD3 mAb 1 М20 (SEQ ID NO: 102) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 102 содержит замены G96K и Y100bG (обозначены двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 102, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
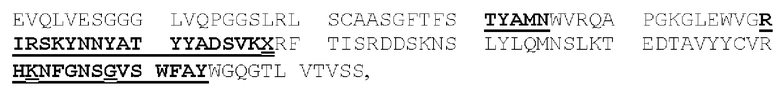
где Х представляет собой аспартат (D) или глицин (G)
[00245] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М20 представляет собой SEQ ID NO: 56.

21. CD3 mAb 1 М21
[00246] Аминокислотная последовательность домена VH CD3 mAb 1 М21 (SEQ ID NO: 104) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 104 содержит замены G96K и W100eF (обозначены двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 104, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
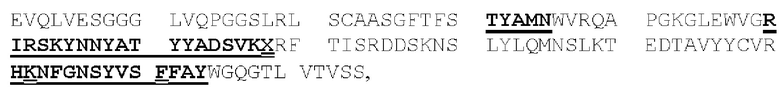
где Х представляет собой аспартат (D) или глицин (G)
[00247] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М21 представляет собой SEQ ID NO: 56.

22. CD3 mAb 1 M22
[00248] Аминокислотная последовательность домена VH CD3 mAb 1 М22 (SEQ ID NO: 106) представлена ниже (остатки CDRH обозначены подчеркиванием). Относительно SEQ ID NO: 55 SEQ ID NO: 106 содержит замены G96K и W100eY (обозначены двойным подчеркиванием, нумерация по Кабату); помимо этого, остаток в положении 65 по Кабату в SEQ ID NO: 106, также обозначенный двойным подчеркиванием, может представлять собой аспартат (D) или глицин (G):
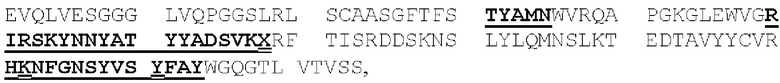
где Х представляет собой аспартат (D) или глицин (G)
[00249] Предпочтительная аминокислотная последовательность домена VL CD3 mAb 1 М22 представляет собой SEQ ID NO: 56.

23. CD3 mAb 1 M23
[00250] Предпочтительная аминокислотная последовательность домена VH CD3 mAb 1 М23 представляет собой SEQ ID NO: 55 или SEQ ID NO: 63.
[00251] Аминокислотная последовательность домена VL CD3 mAb 1 М23 (SEQ ID NO: 108) представлена ниже (остатки CDRL обозначены подчеркиванием). Относительно SEQ ID NO: 56 SEQ ID NO: 108 содержит замену L95E (обозначена двойным подчеркиванием, нумерация по Кабату):


24. CD3 mAb 1 М24
[00252] Предпочтительная аминокислотная последовательность домена VH CD3 mAb 1 М24 представляет собой SEQ ID NO: 55 или SEQ ID NO: 63.
[00253] Аминокислотная последовательность домена VL CD3 mAb 1 М24 (SEQ ID NO: 110) представлена ниже (остатки CDRL обозначены подчеркиванием). Относительно SEQ ID NO:b56 SEQ ID NO: 110 содержит замену L95Q (обозначена двойным подчеркиванием, нумерация по Кабату):
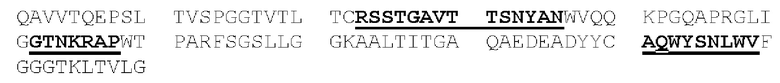

25. CD3 mAb 1 M25
[00254] Предпочтительная аминокислотная последовательность домена VH CD3 mAb 1 М25 представляет собой SEQ ID NO: 55 или SEQ ID NO: 63.
[00255] Аминокислотная последовательность домена VL CD3 mAb 1 М25 (SEQ ID NO: 112) представлена ниже (остатки CDRL обозначены подчеркиванием). Относительно SEQ ID NO: 56 SEQ ID NO: 112 содержит замену G50D (обозначена двойным подчеркиванием, нумерация по Кабату):


26. CD3 mAb 1 М26
[00256] Предпочтительная аминокислотная последовательность домена VH CD3 mAb 1 М26 представляет собой SEQ ID NO: 55 или SEQ ID NO: 63.
[00257] Аминокислотная последовательность домена VL CD3 mAb 1 М26 (SEQ ID NO:114) представлена ниже (остатки CDRL обозначены подчеркиванием). Относительно SEQ ID NO:56 SEQ ID NO:114 содержит замену K53G (обозначена двойным подчеркиванием):
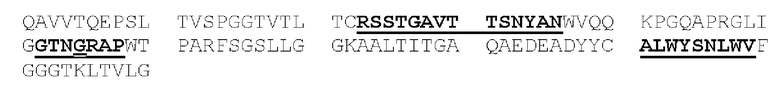
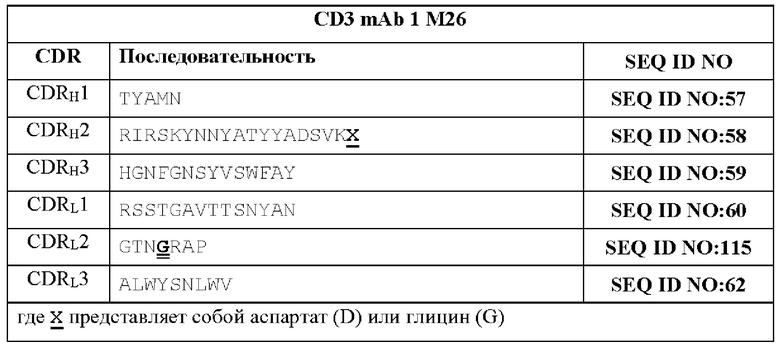
С. Иллюстративные антитела, которые связываются с молекулами клеточной поверхности эффекторной клетки
[00258] В контексте настоящей заявки термин «эффекторная клетка» обозначает клетку, которая прямо или косвенно опосредует уничтожение клеток-мишеней (например, чужеродных клеток, инфицированных клеток или раковых клеток). Примеры эффекторных клеток включают хелперные Т-клетки, цитотоксические Т-клетки, клетки-естественные киллеры (NK), плазматические клетки (В-клетки, секретирующие антитела), макрофаги и гранулоциты. Предпочтительные молекулы клеточной поверхности таких клеток включают CD2, CD3, CD8, CD16, TCR и рецептор NKG2D. Соответственно, молекулы, способные иммуноспецифично связываться с эпитопом таких молекул или с другими молекулами поверхности эффекторной клетки, могут быть применены в соответствии с принципами настоящего изобретения. Иллюстративные антитела, домены VH и VL которых могут быть применены для конструирования молекул, способных опосредовать перенаправленное уничтожение клетки-мишени, представлены ниже.
27. Иллюстративные антитела к CD2
[00259] В одном из вариантов реализации молекулы согласно настоящему изобретению, которые способны опосредовать перенаправленное уничтожение клетки-мишени, будут связываться с эффекторной клеткой путем иммуноспецифичного связывания эпитопа CD2, присутствующего на поверхности такой эффекторной клетки. Молекулы, которые специфично связывают CD2, включают антитело к CD2 «CD2 mAb Lo-CD2a».
[00260] Аминокислотная последовательность домена VH CD2 mAb Lo-CD2a (регистрационный номер АТСС: 11423; SEQ ID NO: 116) представлена ниже (остатки CDRH обозначены подчеркиванием):
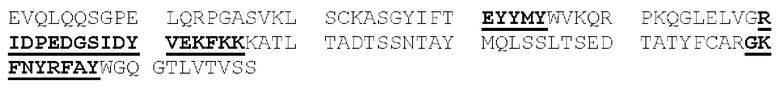
[00261] Аминокислотная последовательность домена VL CD2 mAb Lo-CD2a (регистрационный номер АТСС: 11423; SEQ ID NO:117) представлена ниже (остатки CDRL обозначены подчеркиванием):

28. Иллюстративные антитела к CD8
[00262] В одном из вариантов реализации молекулы согласно настоящему изобретению, которые способны опосредовать перенаправленное уничтожение клетки-мишени, будут связываться с эффекторной клеткой путем иммуноспецифичного связывания эпитопа CD8, присутствующего на поверхности такой эффекторной клетки. Антитела, которые специфично связывают CD8, включают антитела к CD8 «OKT8» и «TRX2».
[00263] Аминокислотная последовательность домена VH OKT8 (SEQ ID NO: 118) представлена ниже (остатки CDRH обозначены подчеркиванием):

[00264] Аминокислотная последовательность домена VL ОКТ8 (SEQ ID NO: 119) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00265] Аминокислотная последовательность домена VH TRX2 (SEQ ID N0:120) представлена ниже (остатки CDRH обозначены подчеркиванием):
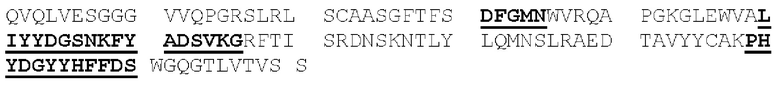
[00266] Аминокислотная последовательность домена VL TRX2 (SEQ ID NO: 121) представлена ниже (остатки CDRL обозначены подчеркиванием):

VI. Иллюстративные раковые и ассоциированные с патогеном антигены
А. Иллюстративные раковые антигены, представленные на поверхности раковых клеток
[00267] В контексте настоящей заявки термин «раковый антиген» обозначает антиген, экспрессия которого на поверхности характерна для раковой клетки, и который, таким образом, может подвергаться воздействию молекулы на основе антитела или иммуномодулируют,ей молекулы. Примеры раковых антигенов включают, но не ограничиваются перечисленными: 19.9, обнаруженный при раке толстой кишки, муцины рака желудка; 4.2; ADAM-9 (публикация заявки на патент США №2006/0172350; публикация заявки РСТ №WO 06/084075); АН6, обнаруженный при раке желудка; ALCAM (публикация заявки РСТ №WO 03/093443); АРО-1 (антиген злокачественно трансформированных лимфоцитов человека) (Trauth, B.C. et al. (1989) "Monoclonal Antibody-Mediated Tumor Regression By Induction Of Apoptosis," Science 245:301-304); B1 (Egloff, A.M. et al. (2006) "Cyclin В1 And Other Cyclins As Tumor Antigens In Immunosurveillance And Immunotherapy Of Cancer," Cancer Res. 66(l):6-9); B7-H3 (Collins, M. et al. (2005) "The В7 Family Of Immune-Regulatory Ligands," Genome Biol. 6:223.1-223.7). Chapoval, A. et al. (2001) "B7-H3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production," Nature Immunol. 2:269-274; Sun, M. et al. (2002) "Characterization of Mouse and Human B7-H3 Genes," J. Immunol. 168:6294-6297); BAGE (Bodey, B. (2002) "Cancer-Testis Antigens: Promising Targets For Antigen Directed Antineoplastic Immunotherapy," Expert Opin. Biol. Ther. 2(6):577-584; бета-катенин (Prange W. et al. (2003) "Beta-Catenin Accumulation In The Progression Of Human Hepatocarcinogenesis Correlates With Loss OfE-Cadherin And Accumulation Of P53, But Not With Expression Of Conventional WNT-1 Target Genes," J. Pathol. 201(2):250-259); антиген группы крови ALeb/Ley, обнаруженный при аденокарциноме толстой кишки; антиген лимфомы Беркитта-38.13; С14, обнаруженный при аденокарциноме толстой кишки; СА125 (антиген карциномы яичника) (Bast, R.C. Jr. et al. (2005) "New Tumor Markers: CA125 And Beyond," Int. J. Gynecol. Cancer 15(Suppl 3):274-281; Yu et al. (1991) "Coexpression Of Different Antigenic Markers On Moieties That Bear CA 125 Determinants," Cancer Res. 51(2):468-475); карбоксипептидазу M (публикация заявки на патент США №2006/0166291); CD5 (Calin, G.A. et al. (2006) "Genomics Of Chronic Lymphocytic Leukemia MicroRNAs As New Players With Clinical Significance," Semin. Oncol. 33(2): 167-173; CD19 (Ghetie et al. (1994) "Anti-CD 19 Inhibits The Growth Of Human B-Cell Tumor Lines In Vitro And Of Daudi Cells In SCID Mice By Inducing Cell Cycle Arrest," Blood 83:1329-1336; Troussard, X. et al. 1998 Hematol Cell Ther. 40(4): 139-48); CD20 (Reff et al. (1994) "Depletion Of В Cells In Vivo By A Chimeric Mouse Human Monoclonal Antibody To CD20," Blood 83:435-445; Thomas, D.A. et al. 2006 Hematol Oncol Clin North Am. 20(5): 1125-36); CD22 (Kreitman, R.J. (2006) "Immunotoxins For Targeted Cancer Therapy," AAPS J. 8(3):E532-51); CD23 (Rosati, S. et al. (2005) "Chronic Lymphocytic Leukaemia: A Review Of The Immuno-Architecture," Curr. Top.Microbiol. Immunol. 294:91-107); CD25 (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4): 139-148); CD27 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas," And Of New Targets For Myeloma Therapy," Haematologica 91(9):1234-1240); CD28 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas," And Of New Targets For Myeloma Therapy," Haematologica 91(9): 1234-1240); CD33 (Sgouros et al. (1993) "Modeling And Dosimetry Of Monoclonal Antibody M195 (Anti-CD33) In Acute Myelogenous Leukemia," J. Nucl. Med. 34:422-430); CD36 (Ge, Y. (2005) "CD36: A MultiligandMolecule," Lab Hematol. 11(1):31-7); CD40/CD154 (Messmer, D. et al. (2005) "CD154 Gene Therapy For Human B-Cell Malignancies," Ann. N. Y. Acad. Sci. 1062:51-60); CD45 (Jurcic, J.G. (2005) "Immunotherapy For Acute Myeloid Leukemia," Curr. Oncol. Rep.7(5):339-346); CD56 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy," Haematologica 91(9): 1234-1240); CD46 (патент США №7148038; публикация заявки РСТ №WO 03/032814); CD52 (Eketorp, S.S. et al. (2014) "Alemtuzumab (Anti-CD52 Monoclonal Antibody) As Single-Agent Therapy In Patients With Relapsed/Refractory Chronic Lymphocytic Leukaemia (CLL)-A Single Region Experience On Consecutive Patients," Ann Hematol. 93(10): 1725-1733; Suresh, T. et al. (2014) "New Antibody Approaches To Lymphoma Therapy," J. Hematol. Oncol. 7:58; Hoelzer, D. (2013) "Targeted Therapy With Monoclonal Antibodies In Acute Lymphoblastic Leukemia" Curr. Opin. Oncol. 25(6):701-706); CD56 (Bataille, R. (2006) "The Phenotype Of Normal, Reactive And Malignant Plasma Cells. Identification Of "Many And Multiple Myelomas" And Of New Targets For Myeloma Therapy," Haematologica 91(9): 1234-1240); CD79a/CD79b (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4): 139-148; Chu, P.G. et al. (2001) "CD79: A Review" Appl. Immunohistochem. Mol. Morphol. 9(2):97-106); CD103 (Troussard, X. et al. (1998) "Hairy Cell Leukemia. What Is New Forty Years After The First Description?" Hematol. Cell. Ther. 40(4): 139-148); CD317(Kawai, S. et al. (2008) "Interferon-A Enhances CD317 Expression And The Antitumor Activity Of Anti-CD317 Monoclonal Antibody In Renal Cell Carcinoma Xenograft Models," Cancer Science 99(12):2461-2466; Wang, W. et al. (2009) HM1.24 (CD317) Is A Novel Target Against Lung Cancer For Immunotherapy Using Anti-HM1.24 Antibody," Cancer Immunology, Immunotherapy 58(6):967-976; Wang, W. et al. (2009) "Chimeric And Humanized Anti-HM1.24 Antibodies Mediate Antibody-Dependent Cellular Cytotoxicity Against Lung Cancer Cells. Lung Cancer," 63(1):23-31; Sayeed, A. et al. (2013) "Aberrant Regulation Of The BST2 (Tetherin) Promoter Enhances Cell Proliferation And Apoptosis Evasion In High Grade Breast Cancer Cells," PLoS ONE 8(6)e67191, pp.1-10); CDK4 (Lee, Y.M. et al. (2006) "Targeting Cyclins And Cyclin-Dependent Kinases In Cancer: Lessons From Mice, Hopes For Therapeutic Applications InHuman," Cell Cycle 5(18):2110-2114); РЭА (раковый эмбриональный антиген; Foon et al. (1995) "Immune Response To The Carcinoembryonic Antigen In Patients Treated With An Anti-Idiotype Antibody Vaccine," J. Clin. Invest. 96(l):334-42); Mathelin, C. (2006) "Circulating Proteinic Biomarkers And Breast Cancer," Gynecol. Obstet. Fertil. 34(7-8):638-646; Tellez-Avila, F.I. et al. (2005) "The Carcinoembryonic Antigen: Apropos Of An Old Friend," Rsv. Invest. Clin. 57(6): 814-819); CEACAM5/CEACAM6 (Zheng, C. et al. (2011) "A Novel Anti-CEACAM5 Monoclonal Antibody, CC4, Suppresses Colorectal Tumor Growth and Enhances NK Cells-Mediated Tumor Immunity," PLoS One 6(6):e21146, pp.1-11); CO17-1A (Ragnhammar et al. (1993) "Effect Of Monoclonal Antibody 17-1A And GM-CSF In Patients With Advanced Colorectal Carcinoma - Long-Lasting, Complete Remissions Can Be Induced," Int. J. Cancer 53:751-758); CO-43 (группа крови Leb); CO-514 (группа крови Lea), обнаруженный при аденокарциноме; СТА-1; CTLA-4 (Peggs, K.S. et al. (2006) "Principles And Use Of Anti-CTLA4 Antibody In Human Cancer Immunotherapy," Curr. Opin. Immunol. 18(2):206-13); цитокератин 8 (публикация заявки PCT №WO 03/024191); D1.1; D156-22; DR5 (Abdulghani, J. et al. (2010) "TRAIL Receptor Signaling And Therapeutics," Expert Opin. Ther. Targets 14(10): 1091-1108; Andera, L. (2009) "Signaling Activated By The Death Receptors Of The TNFR Family," Biomed. Pap.Med. Fac. Univ. Palacky Olomouc Czech. Repub. 153(3):173-180; Carlo-Stella, C. et al. (2007) "Targeting TRAIL Agonistic Receptors for Cancer Therapy," Clin, Cancer 13(8):2313-2317; Chaudhari, B.R. et al. (2006) "Following the TRAIL to Apoptosis," Immunologic Res. 35(3):249-262); группу E1 (группа крови В), обнаруженную при раке поджелудочной железы; EGFR (рецептор эпидермального фактора роста; Adenis, A. et al. (2003) "Inhibitors Of Epidermal Growth Factor Receptor And Colorectal Cancer," Bull. Cancer. 90 Spec No:S228-S232); рецепторы эфрина (и, в частности, EphA2 (патент США №7569672; публикация заявки РСТ №WO 06/084226); Erb (ErbB1; ErbB3; ErbB4; Zhou, Н. et al. (2002) "Lung Tumorigenesis Associated With Erb-B-2 And Erb-B-3 Overexpression In Human Erb-B-3 Transgenic Mice Is Enhanced By Methylnitrosourea," Oncogene 21(57):8732-8740; Rimon, E. et al. (2004) "Gonadotropin-Induced Gene Regulation In Human Granulosa Cells Obtained From IVF Patients: Modulation Of Genes CodingFor Growth Factors And Their Receptors And Genes Involved In Cancer And Other Diseases," Int. J. Oncol. 24(5): 1325-1338); GAGE (GAGE-1; GAGE-2; Akcakanat, A. et al. (2006) "Heterogeneous Expression Of GAGE, NY-ESO-1, MAGE-A and SSX Proteins In Esophageal Cancer: Implications For Immunotherapy," Int. J. Cancer. 118(1): 123-128); GD2/GD3/GM2 (Livingston, P.O. et al. (2005) "Selection Of GM2, Fucosyl GM1, Globo H And Polysialic Acid As Targets On Small Cell Lung Cancers For Antibody-Mediated Immunotherapy," Cancer Immunol. Immunother. 54(10):1018-1025); ганглиозид GD2 (GD2; Saleh et al. (1993) "Generation Of A Human Anti-Idiotypic Antibody That Mimics The GD2 Antigen," J. Immunol., 151, 3390-3398); ганглиозид GD3 (GD3; Shitara et al. (1993) "A Mouse/Human Chimeric Anti-(Ganglioside GD3) Antibody With Enhanced Antitumor Activities," Cancer Immunol. Immunother. 36:373-380); ганглиозид GM2 (GM2; Livingston et al. (1994) "Improved Survival In Stage III Melanoma Patients With GM2 Antibodies: A Randomized Trial Of Adjuvant Vaccination With GM2 Ganglioside," J. Clin. Oncol. 12:1036-1044); ганглиозид GM3 (GM3; Hoon et al. (1993) "Molecular Cloning Of A Human Monoclonal Antibody Reactive To Ganglioside GM3 Antigen On Human Cancers," Cancer Res. 53:5244-5250); GICA 19-9 (Herlyn et al. (1982) "Monoclonal Antibody Detection Of A Circulating Tumor-Associated Antigen. I. Presence Of Antigen In Sera Of Patients With Colorectal, Gastric, And Pancreatic Carcinoma," J. Clin. Immunol. 2:135-140); gp100 (Lotem, M. et al. (2006) "Presentation Of Tumor Antigens By Dendritic Cells Genetically Modified With Viral And Nonviral Vectors," J. Immunother. 29(6):616-27); Gp37 (T-клеточный антиген лейкоза человека; Bhattacharya-Chatterjee et al. (1988) "Idiotype Vaccines Against Human T Cell Leukemia. II. Generation And Characterization Of A Monoclonal Idiotype Cascade (Ab1, Ab2, and Ab3)," J. Immunol. 141:1398-1403); gp75 (антиген меланомы; Vijayasardahl et al. (1990) "The Melanoma Antigen Gp75 Is The Human Homologue Of The Mouse В (Brown) Locus Gene Product," J. Exp.Med. 171(4): 1375-1380); gpA33 (Heath, J.K. et al. (1997) "The Human A33 Antigen Is A Transmembrane Glycoprotein And A Novel Member Of The Immunoglobulin Superfamily," Proc. Natl. Acad. Sci. (U.S.A.) 94(2):469-474; Ritter, G. et al. (1997) "Characterization Of Posttranslational Modifications Of Human A33 Antigen, A Novel Palmitoylated Surface Glycoprotein Of Human Gastrointestinal Epithelium," Biochem. Biophys. Res. Commun. 236(3):682-686; Wong, N.A. et al. (2006) "EpCAM and gpA33 Are Markers Of Barrett's Metaplasia," J. Clin. Pathol. 59(3):260-263; Almqvist, Y. (2006) "In vitro and in vivo Characterization of 177Lu-huA33: A Radioimmunoconjugate Against Colorectal Cancer," Nucl. Med. Biol. 33(8):991-998); антиген HER2 (HER2/neu, p185HER2. Pal SK et al (2006) "Targeting HER2 Epitopes," Semin. Oncol. 33(4):386-391); HMFG (антиген мембраны жировой глобулы молока человека; WO 1995015171); Е6 папилломавируса человека/Е7 папилломавируса человека (DiMaio, D. et al. (2006) "Human Papillomaviruses And Cervical Cancer," Adv. Virus Res. 66:125-59); HMW-MAA (высокомолекулярный антиген меланомы; Natali et al. (1987) "Immunohistochemical Detection Of Antigen In Human Primary And Metastatic Melanomas By The Monoclonal Antibody 140.240 And Its Possible Prognostic Significance," Cancer 59:55-63; Mittelman et al. (1990) "Active Specific Immunotherapy In Patients With Melanoma. A Clinical Trial With Mouse Antiidiotypic Monoclonal Antibodies Elicited With Syngeneic Anti-High-Molecular-Weight-Melanoma-Associated Antigen Monoclonal Antibodies," J. Clin. Invest. 86:2136-2144); антиген I (дифференцировочный антиген; Feizi (1985) "Demonstration By Monoclonal Antibodies That Carbohydrate Structures Of Glycoproteins And Glycolipids Are Onco-Developmental Antigens," Nature 314:53-57); IL13Rα2 (публикация заявки PCT №WO 2008/146911; Brown, C.E. et al. (2013) "Glioma IL13Rα2 Is Associated With Mesenchymal Signature Gene Expression And Poor Patient Prognosis," PLoS One. 18;8(10):e77769; Barderas, R. et al. (2012) "High Expression Of IL-13 Receptor A2 In Colorectal Cancer Is Associated With Invasion, Liver Metastasis, And Poor Prognosis," Cancer Res. 72(11):2780-2790; Kasaian, M.T. et al. (2011) "IL-13 Antibodies Influence IL-13 Clearance In Humans By Modulating Scavenger Activity Of IL-13Rα2," J. Immunol. 187(l):561-569; Bozinov, O. et al. (2010) "Decreasing Expression Of The Interleukin-13 Receptor IL-13Ralpha2 In Treated Recurrent Malignant Gliomas," Neurol. Med. Chir. (Tokyo) 50(8):617-621; Fujisawa, T. et al. (2009) "A novel role of interleukin-13 receptor alpha2 in pancreatic cancer invasion and metastasis," Cancer Res. 69(22):8678-8685); интегрин β6 (публикация заявки PCT №WO 03/087340); JAM-3 (публикация заявки PCT №WO 06/084078); KID3 (публикация заявки PCT №WO 05/028498); KID31 (публикация заявки PCT №WO 06/076584); пан-антиген карциномы KS 1/4 (Perez et al. (1989) "Isolation And Characterization Of A cDNA Encoding The Ks1/4 Epithelial Carcinoma Marker," J. Immunol. 142:3662-3667; Moller et al. (1991) "Bi-specific-Monoclonal-Antibody-Directed Lysis Of Ovarian Carcinoma Cells By Activated Human T Lymphocytes," Cancer Immunol, Immunother. 33(4):210-216; Ragupathi, G. 2005 Cancer Treat Res. 123:157-80); L6 и L20 (антигены карциномы легких человека; Hellström et al. (1986) "Monoclonal Mouse Antibodies Raised Against Human Lung Carcinoma," Cancer Res. 46:3917-3923); LEA; LUCA-2 (публикация заявки на патент США №2006/0172349; публикация заявки РСТ №WO 06/083852); M1:22:25:8; М18; М39; MAGE (MAGE-1; MAGE-3; (Bodey, В. (2002) "Cancer-Testis Antigens:Promising Targets For Antigen Directed Antineoplastic Immunotherapy," Expert Opin. Biol. Ther. 2(6): 577-584); MART (Kounalakis, N. et al. (2005) "Tumor Cell And Circulating Markers In Melanoma: Diagnosis, Prognosis, And Management," Curr. Oncol. Rep.7(5):377-382); мезотелин (Chang, K. et al. (1996) "Molecular Cloning Of Mesothelin, A Differentiation Antigen Present On Mesothelium, Mesotheliomas, And Ovarian Cancers," Proc. Natl. Acad. Sci. (U.S.A.) 93:136-140); MUC-1 (Mathelin, C. (2006) "Circulating Proteinic Biomarkers And Breast Cancer," Gynecol. Obstet. Fertil. 34(7-8):638-646); MUM-1 (Castelli, C. et al. (2000) "T-Cell Recognition Of Melanoma-Associated Antigens," J. Cell. Physiol. 182(3):323-331); Myl; N-ацетилглюкозаминилтрансферазу (Dennis, J.W. (1999) "Glycoprotein Glycosylation And Cancer Progression" Biochim. Biophys. Acta. 6;1473(1):21-34); неогликопротеин; NS-10, обнаруженный при аденокарциномах; OFA-1; OFA-2; онкостатин М (рецептор онкостатина бета; патент США №7572896; публикация заявки РСТ №WO 06/084092); р15 (Gil, J. et al. (2006) "Regulation Of The INK4b-ARF-INK4a Tumour Suppressor Locus: All For One Or One For All," Nat. Rev. Mol. Cell Biol. 7(9):667-677); p97 (ассоциированный с меланомой антиген; Estin et al. (1989) "Transfected Mouse Melanoma Lines That Express Various Levels Of Human Melanoma-Associated Antigen p97," J. Natl. Cancer Instit. 81(6):445-454); РЕМ (полиморфный эпителиальный муцин; Hilkens et al. (1992) "Cell Membrane-Associated Mucins And Their Adhesion-Modulating Property," Trends in Biochem. Sci. 17:359-363); РЕМА (антиген полиморфного эпителиального муцина); PIPA (патент США №7405061; публикация заявки РСТ №WO 04/043239); PSA (простатический специфичный антиген; Henttu et al. (1989) "cDNA Coding For The Entire Human Prostate Specific Antigen Shows High Homologies To The Human Tissue Kallikrein Genes," Biochem. Biophys. Res. Comm. 10(2):903-910; Israeli et al. (1993) "Molecular Cloning Of A Complementary DNA Encoding A Prostate-Specific Membrane Antigen," Cancer Res. 53:227-230; Cracco, C.M. et al. (2005) "Immune Response In Prostate Cancer," Minerva Urol. Nefrol. 57(4):301-311); PSMA (простатический специфичный мембранный антиген; Ragupathi, G. (2005) "Antibody Inducing Polyvalent Cancer Vaccines," Cancer Treat. Res. 123:157-180); простатическую кислую фосфатазу (Tailor et al. (1990) "Nucleotide Sequence Of Human Prostatic Acid Phosphatase Determined From A Full-Length cDNA Clone," Nucl. Acids Res. 18(16):4928); R24, обнаруженный при меланоме; ROR1 (патент США №5843749); сфинголипиды; SSEA-1; SSEA-3; SSEA-4; sTn (Holmberg, L.А. (2001) "Theratope Vaccine (STn-KLH)," Expert Opin. Biol. Ther. 1(5):881-91); пептид, происходящий из Т-клеточного рецептора, при кожной Т-клеточной лимфоме (см. Edelson (1998) "Cutaneous T-Cell Lymphoma: A Model For Selective Immunotherapy," Cancer J. Sci. Am. 4:62-71); T5A7, обнаруженный в миелоидных клетках; TAG-72 (Yokota et al. (1992) "Rapid Tumor Penetration Of A Single-Chain Fv And Comparison With Other Immunoglobulin Forms," Cancer Res. 52:3402-3408); TL5 (группа крови А); рецептор TNF (рецептор TNF-α, рецептор TNF-β; рецептор TNF-γ (van Horssen, R. et al. (2006) "TNF-Alpha In Cancer Treatment: Molecular Insights, Antitumor Effects, And Clinical Utility," Oncologist 11(4):397-408; Gardnerova, M. et al. (2000) "The Use Of TNF Family Ligands And Receptors And Agents Which Modify Their Interaction As Therapeutic Agents," Curr. Drug Targets l(4):327-364); TRA-1-85 (группа крови H); рецептор трансферрина (патент США №7572895; публикация заявки РСТ №WO 05/121179); 5Т4 (TPBG, гликопротеин трофобласта; Boghaert, E.R. et al. (2008) "The Oncofetal Protein, 5T4, Is A Suitable Target For Antibody-Guided Anti-Cancer Chemotherapy With Calicheamicin," Int. J. Oncol. 32(l):221-234; Eisen, T. et al. (2014) "Naptumomab Estafenatox: Targeted Immunotherapy with a Novel Immunotoxin," Curr. Oncol. Rep.16:370, pp. 1-6); TSTA (опухолеспецифичный трансплантационный антиген), такой как антигены вирусиндуцированных опухолей, включая Т-антиген ДНК-содержащих онкогенных вирусов и оболочечные антигены РНК-содержащих онкогенных вирусов, раково-эмбриональный антиген - альфа-фетопротеин, такой как РЭА толстой кишки, раково-эмбриональный антиген опухоли мочевого пузыря (Hellström et al. (1985) "Monoclonal Antibodies To Cell Surface Antigens Shared By Chemically Induced Mouse Bladder Carcinomas," Cancer. Res. 45:2210-2188); VEGF (Pietrantonio, F. et al. (2015) "Bevacizumab-Based Neoadjuvant Chemotherapy For Colorectal Cancer Liver Metastases: Pitfalls And Helpful Tricks In A Review For Clinicians," Crit. Rev. Oncol. Hematol. 95(3):272-281; Grabowski, J.P. (2015) "Current Management Of Ovarian Cancer," Minerva Med. 106(3): 151-156; Field, K.M. (2015) "Bevacizumab And Glioblastoma: Scientific Review, Newly Reported Updates, And Ongoing Controversies," Cancer 121(7):997-1007; Suh, D.H. et al. (2015) "Major Clinical Research Advances In Gynecologic Cancer In 2014," J. Gynecol. Oncol. 26(2): 156-167; Liu, K.J. et al. (2015) "Bevacizumab In Combination With Anticancer Drugs For Previously Treated Advanced Non-Small Cell Lung Cancer," Tumour Biol. 36(3): 1323-1327; Di Bartolomeo, M. et al. (2015) "Bevacizumab Treatment In The Elderly Patient With Metastatic Colorectal Cancer," Clin. Interv. Aging 10:127-133); рецептор VEGF (O'Dwyer. P.J. (2006) "The Present And Future Of Angiogenesis-Directed Treatments Of Colorectal Cancer," Oncologist 11(9):992-998); VEP8; VEP9; VIM-D5 и гаптен Y, Ley, обнаруженный в клетках эмбриональной карциномы. Дополнительные раковые антигены и связывающие их молекулы (например, антитела) раскрыты в таблице 7. Особенно предпочтительными «раковыми антигенами» согласно настоящему изобретению являются 5Т4, В7-Н3, СЕАСАМ5/СЕАСАМ6, CD123, DR5, EGFR, рецептор эфрина, gpA33, HER2/neu, IL13Rα2, ROR1 и VEGF.
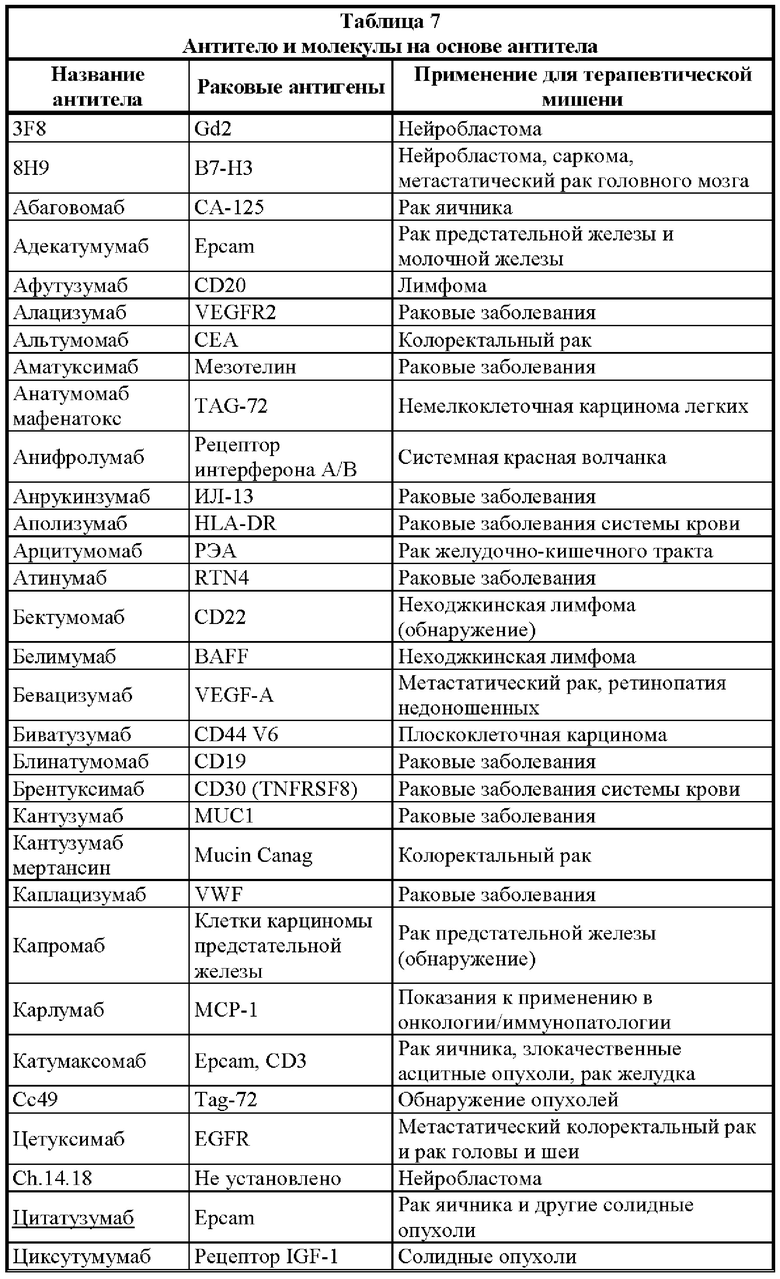
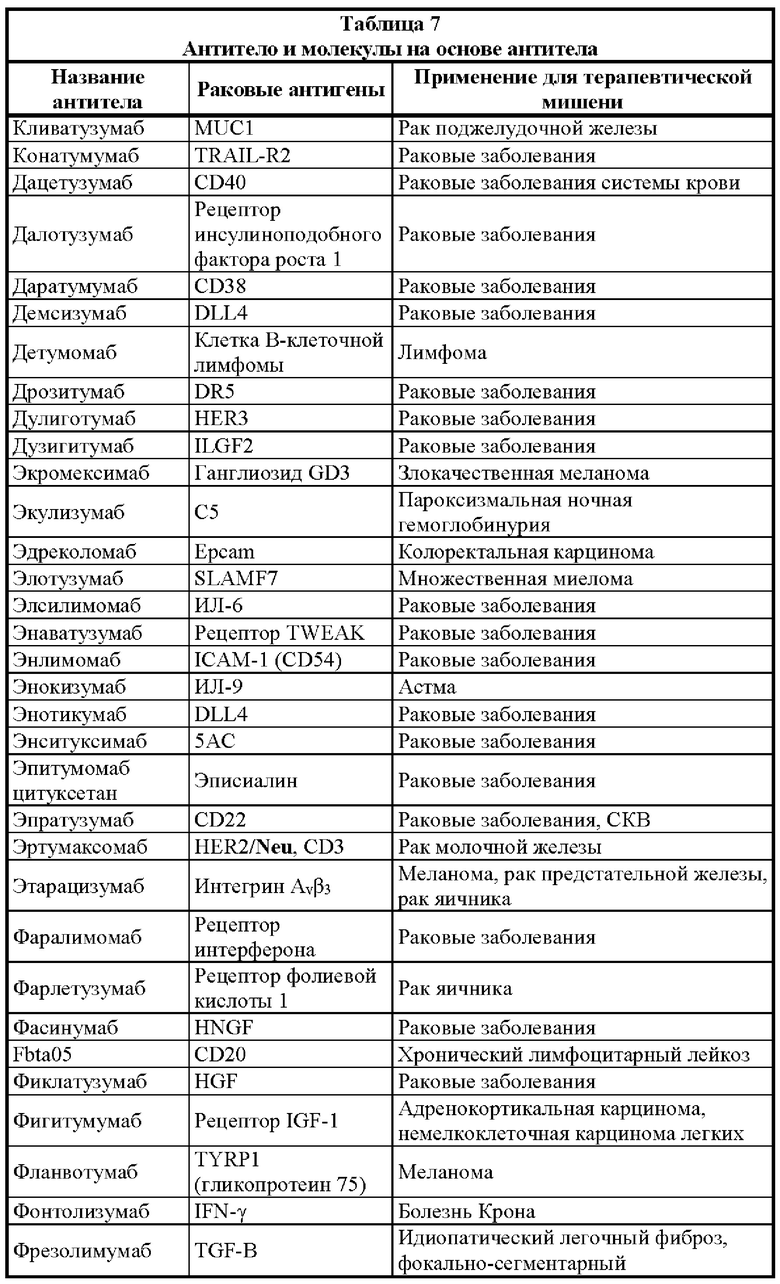
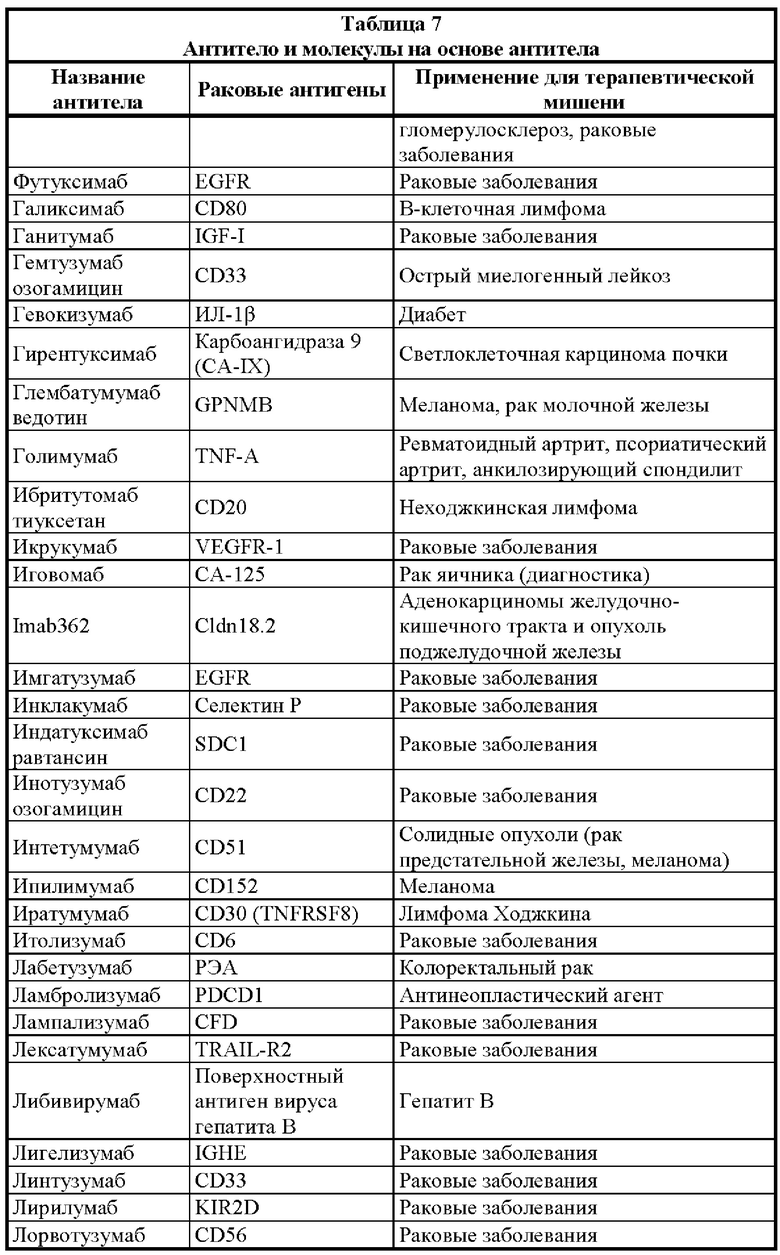
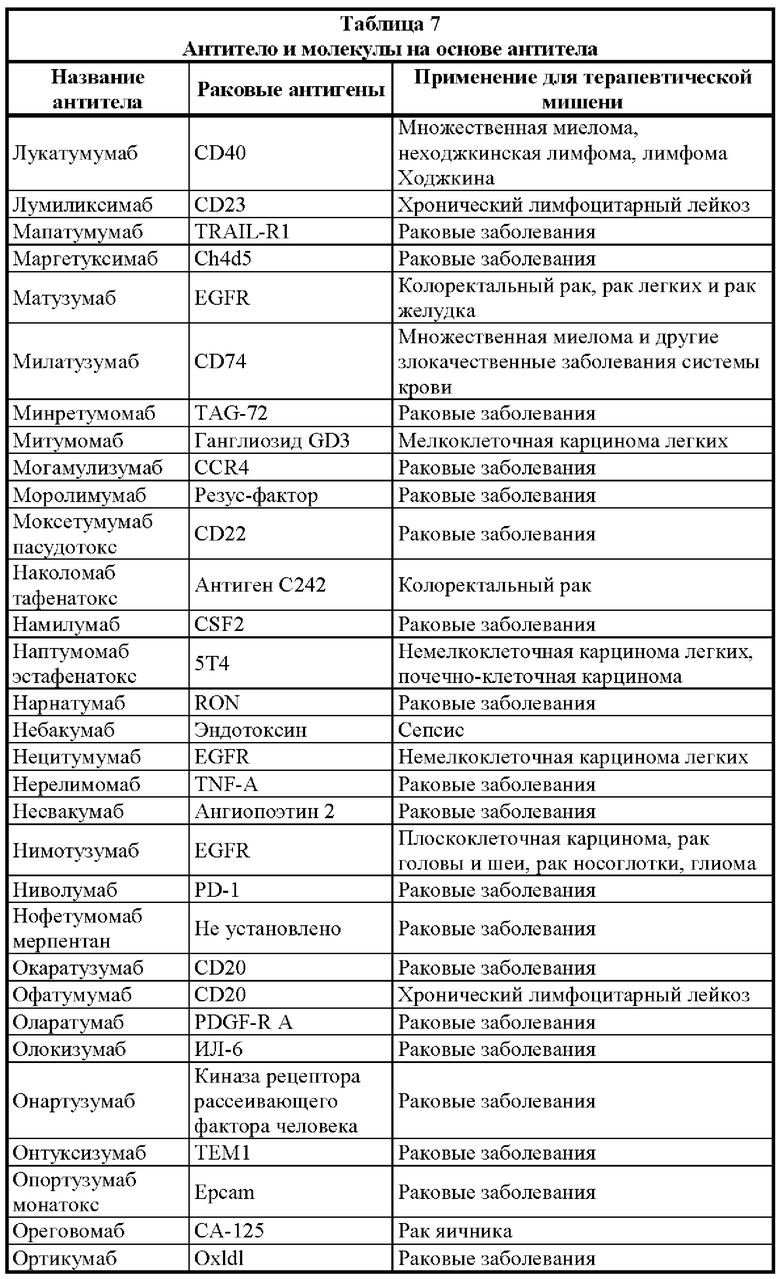
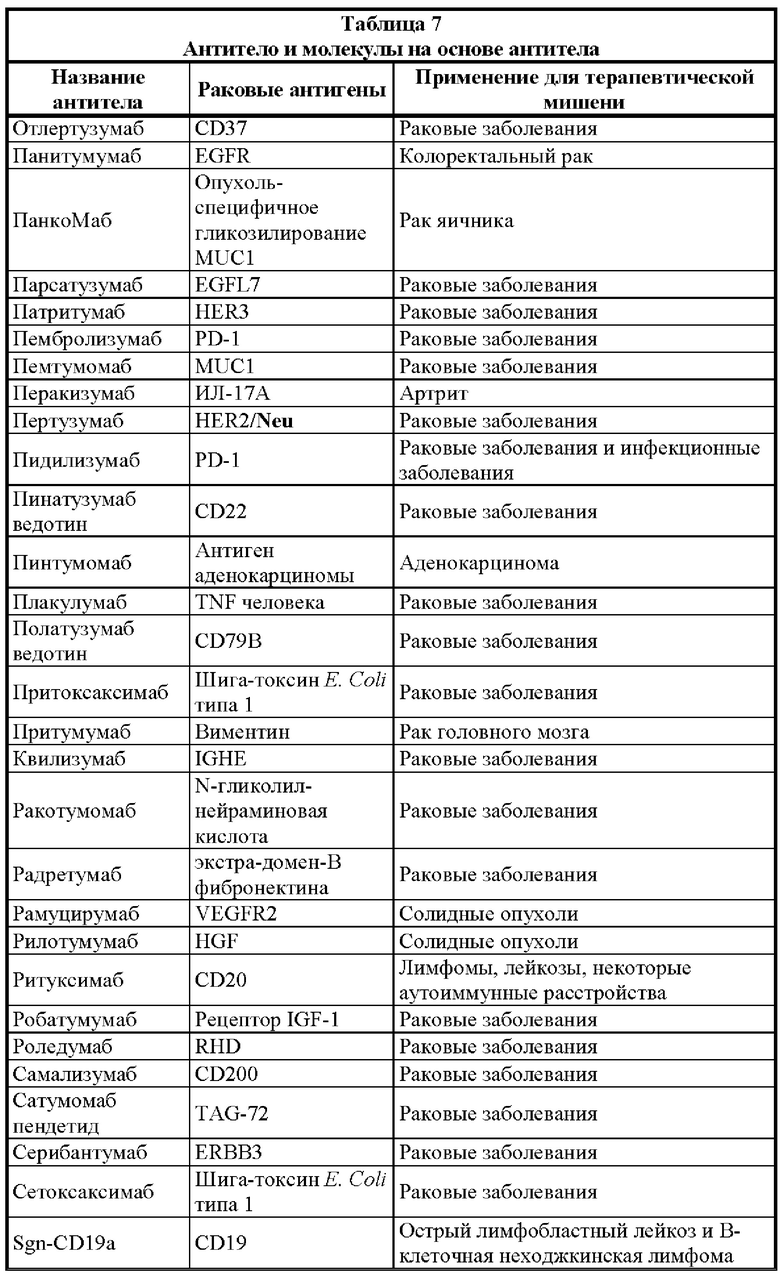
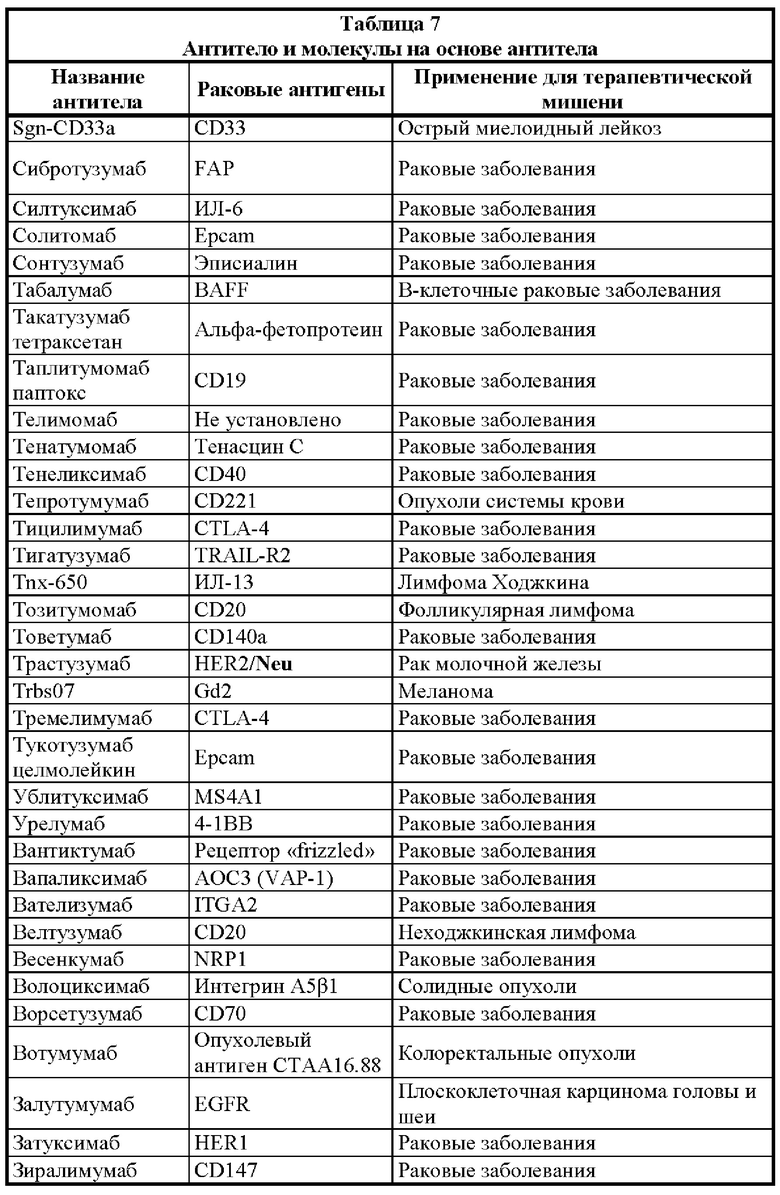
[00268] Иллюстративные антитела, домены VH и VL которых могут быть применены для конструирования связывающих молекул согласно настоящему изобретению, способных связывать раковый антиген, представленный на поверхности раковой клетки, и опосредовать перенаправленное уничтожение таких раковых клеток, перечислены в таблице 7 выше, дополнительные антитела, которые могут быть применены для конструирования молекул, способных связывать раковый антиген, представленный на поверхности раковой клетки, и опосредовать перенаправленное уничтожение таких раковых клеток, представлены ниже.
1. Иллюстративные антитела к В7-Н3
[00269] В7-Н3 представляет собой раковый антиген, сверхэкспрессия которого характерна для различных типов солидных опухолей, и является членом семейства молекул В7, участвующих в иммунной регуляции (см. патенты США №8,802,091; 2014/0328750; 2013/0149236; Loo, D. et al. (2012) "Development Of An Fc-Enhanced Anti-B7-H3 Monoclonal Antibody With Potent Antitumor Activity," Clin. Cancer Res. 18(14):3834-3845). В частности, в нескольких независимых исследованиях было показано, что клетки злокачественных опухолей человека (например, раковые клетки нейробластом, а также рака желудка, яичника, поджелудочной железы и немелкоклеточного рака легкого) демонстрируют заметное увеличение экспрессии белка В7-Н,3З, и что эта повышенная экспрессия связана с повышенной тяжестью заболевания (Zang, X. et al. (2007) "The B7 Family And Cancer Therapy: Costimulation And Coinhibition," Clin. Cancer Res. 13:5271-5279), что позволяет предположить, что В7-Н3 используется опухолями в механизме ускользания от распознавания иммунной системой (Zang, X. et al. (2007) "The В7 Family And Cancer Therapy: Costimulation And Coinhibition," Clin. Cancer Res. 13:5271-5279).
[00270] Также было обнаружено, что В7-Н3 дополнительно стимулирует пролиферацию Т-клеток CD4+ и CD8+. В7-Н3 также стимулирует выработку IFN-γ и литическую активность CD8+ (Chapoval, A. et al. (2001) "В7-Н3: A Costimulatory Molecule For T Cell Activation and IFN-γ Production," Nature Immunol. 2:269-274; Sharpe, A.H. et al. (2002) "The B7-CD28 Superfamily," Nature Rev. Immunol. 2:116-126). Однако указанный белок также, возможно, действует через факторы NFAT (ядерный фактор активированных Т-клеток), NF-κВ (ядерный фактор каппа В) и АР-1 (активирующий белок-1), что приводит к ингибированию активации Т-клеток (Yi. K.Н. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4," Immunol. Rev. 229:145-151). Также полагают, что B7-H3 ингибирует Th1, Th2 или Th17 in vivo (Prasad, D.V. et al. (2004) "Murine B7-H3 Is A Negative Regulator Of T Cells," J. Immunol. 173:2500-2506; Fukushima, A. et al. (2007) "B7-H3 Regulates The Development Of Experimental Allergic Conjunctivitis In Mice," Immunol. Lett. 113:52-57; Yi. K.H. et al. (2009) "Fine Tuning The Immune Response Through B7-H3 And B7-H4," Immunol. Rev. 229:145-151).
[00271] Предпочтительные связывающие B7-H3 молекулы содержат домены VL и/или VH гуманизированного моноклонального антитела к В7-Н3 человека «В7-Н3 mAb-B», «В7-Н3 mAb-C», «В7-Н3 mAb-D» или любого из антител к В7-Н3, предложенных в настоящей заявке, и более предпочтительно содержат 1, 2 или все 3 CDRL домена VL, и/или 1, 2 или все 3 CDRH домена VH таких моноклональных антител к В7-Н3.
[00272] После гуманизации антитела В7-Н3 mAb-B получали два вариантных домена VH, В7-Н3 mAb-B VH1 и В7-Н3 mAb-B VH2; и два вариантных домена VL, В7-Н3 mAb-B VH1 VL1 и В7-Н3 mAb-B VL2, которые могут быть применены в любой комбинации доменов VH/VL для получения функционального связывающего В7-Н3 домена.
[00273] Аминокислотная последовательность домена VH В7-Н3 mAb-B VH1 представляет собой SEQ ID NO: 122 (остатки CDRH обозначены подчеркиванием):
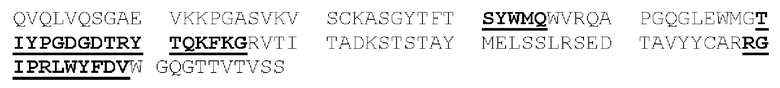
[00274] Аминокислотная последовательность домена VH В7-Н3 mAb-B VH2 представляет собой SEQ ID NO: 123 (остатки CDRH обозначены подчеркиванием):
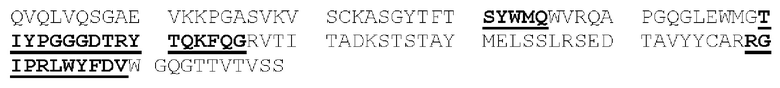
[00275] Аминокислотная последовательность домена VL В7-Н3 mAb-B VL1 представляет собой SEQ ID NO: 124 (остатки CDRL обозначены подчеркиванием).

[00276] Аминокислотная последовательность домена VL В7-Н3 mAb-B VL2 представляет собой SEQ ID NO: 125 (остатки CDRL обозначены подчеркиванием).

[00277] Аминокислотная последовательность домена VH гуманизированного В7-Н3 mAb-C представляет собой SEQ ID NO: 126 (остатки CDRH обозначены подчеркиванием):

[00278] Аминокислотная последовательность домена VL гуманизированного В7-Н3 mAb-C представляет собой SEQ ID NO: 127 (остатки CDRL обозначены подчеркиванием).

[00279] Аминокислотная последовательность домена VH В7-Н3 mAb-D (SEQ ID NO: 128) представлена ниже (остатки CDRH обозначены подчеркиванием).

[00280] Аминокислотная последовательность домена VL В7-Н3 mAb-D (SEQ ID NO: 129) представлена ниже (остатки CDRL обозначены подчеркиванием).

[00281] Особенно предпочтительными являются связывающие В7-Н3 молекулы, которые содержат гуманизированный домен VH и/или VL, включая «Эноблитузумаб» (также известный как MGA271; регистрационный номер CAS 1353485-38-7), но не ограничиваясь им. Эноблитузумаб представляет собой Fc-оптимизированное моноклональное антитело, которое связывается с HER2/neu и опосредует повышенную активность АЗКЦ. Аминокислотные последовательности полных тяжелых и легких цепей эноблитузумаба известны в данной области техники (см., например, WHO Drug Information, 2017, Recommended INN: List 77, 31(1):49). Аминокислотная последовательность домена VH эноблитузумаба представляет собой (SEQ ID NO: 130) (CDRH обозначены подчеркиванием):

Аминокислотная последовательность домена VL эноблитузумаба представляет собой (SEQ ID NO: 131) (CDRL обозначены подчеркиванием):

[00282] В дополнение к обозначенным выше предпочтительным связывающим В7-Н3 молекулам в настоящем изобретении предполагается применение любой из следующих связывающих В7-Н3 молекул: LUCA1; BLA8; РА20 или SKN2 (см. патенты США №7,527,969; 8,779,098 и публикацию заявки на патент согласно РСТ WO 2004/001381); М30; сМ30; M30-H1-L1; M30-H1-L2; M30-H1-L3; M30-H1-L4; M30-H1-L5; M30-H1-L6; M30-H1-L7; M30-H4-L1; M30-H4-L2; M30-H4-L3 и М30-H4-L4 (см. публикацию заявки на патент США 2013/0078234 и публикацию заявки на патент согласно PCT WO 2012/147713); и 8Н9 (см. патенты США №7,666,424; 7,737,258; 7,740,845; 8,148,154; 8,414,892; 8,501,471; 9,062,110; публикацию заявки на патент США 2010/0143245 и публикацию заявки на патент согласно PCT WO 2008/116219).
2. Иллюстративные антитела к СЕАСАМ5 и к СЕАСАМ6
[00283] Было обнаружено, что родственные раково-эмбриональному антигену молекулы клеточной адгезии 5 (СЕАСАМ5) и 6 (СЕАСАМ6) связаны с различными типами раковых заболеваний, включая медуллярный рак щитовидной железы, колоректальный рак, рак поджелудочной железы, гепатоцеллюлярную карциному, рак желудка, рак легкого, раковые заболевания головы и шеи, рак мочевого пузыря, рак предстательной железы, рак матки, рак эндометрия, рак молочной железы, рак системы кроветворения, лейкоз и рак яичника (публикация заявки PCT № WO 2011/034660), и, в частности, колоректальный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, немелкоклеточный рак легкого (НМРЛ), карциномы молочной железы, щитовидной железы, желудка, яичника и матки (Zheng, С.et al. (2011) "ANovelAnti-CEACAM5 Monoclonal Antibody, CC4, Suppresses Colorectal Tumor Growth and Enhances NK Cells-Mediated Tumor Immunity," PLoS One 6(6):e21146, pp.1-11).
[00284] Была обнаружена сверхэкспрессия СЕАСАМ5 в 90% случаев рака желудочно-кишечного тракта, колоректального рака и рака поджелудочной железы, в 70% клеток немелкоклеточного рака легкого и при 50% раковых заболеваний молочной железы (Thompson, J.A. et al. (1991) "Carcinoembryonic Antigen Gene Family: Molecular Biology And Clinical Perspectives," J. Clin. Lab. Anal. 5:344-366). Сверхэкспрессия родственной раково-эмбриональному антигену молекулы клеточной адгезии 6 (СЕАСАМ6) играет важную роль в инвазии и метастазировании различных раковых заболеваний человека, включая медуллярный рак щитовидной железы, колоректальный рак, рак поджелудочной железы, гепатоцеллюлярную карциному, рак желудка, рак легкого, раковые заболевания головы и шеи, рак мочевого пузыря, рак предстательной железы, рак матки, рак эндометрия, рак молочной железы, рак системы кроветворения, лейкоз и рак яичника (публикация заявки РСТ №WO 2011/034660; Deng, X. et al. (2014) "Expression Profiling Of CEACAM6 Associated With The Tumorigenesis And Progression In Gastric Adenocarcinoma," Genet. Mol. Res. 13(3):7686-7697; Cameron, S. et al. (2012) "Focal Overexpression Of CEACAM6 Contributes To Enhanced Tumourigenesis In Head And Neck Cancer Via Suppression Of Apoptosis," Mol. Cancer 11:74, pp. 1-11; Chapin, C. et al. (2012) "Distribution And Surfactant Association Of Carcinoembryonic Cell Adhesion Molecule 6 In Human Lung," Amer. J. Physiol. Lung Cell. Mol. Physiol. 302(2):L216-L25; Riley, C.J. et al. (2009) "Design And Activity Of A Murine And Humanized Anti-СЕАСАМ6 Single-Chain Variable Fragment In The Treatment Of Pancreatic Cancer," Cancer Res. 69(5): 1933-1940; Lewis-Wambi, J.S. et al. (2008) "Overexpression Of CEACAM6 Promotes Migration And Invasion Of Oestrogen-Deprived Breast Cancer Cells," Eur. J. Cancer 44(12): 1770-1779; Blumenthal, R.D. et al. (2007) "Expression Patterns Of CEACAM5 And CEACAM6 In Primary And Metastatic Cancers," BMC Cancer. 7:2, pp. 1-15). Антитела, которые иммуноспецифично связывают СЕАСАМ5 и СЕАСАМ6, коммерчески доступны (Santa Cruz Biotechnology, Inc., Novus Biologicals LLC; Abnova Corporation).
[00285] Аминокислотная последовательность домена VH гуманизированного антитела к СЕАСАМ5 / к СЕАСАМ6 16С3 (ЕР 2585476) (SEQ ID NO: 132) представлена ниже (остатки CDRH обозначены подчеркиванием):
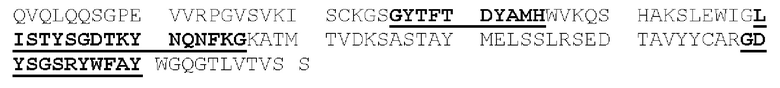
[00286] Аминокислотная последовательность домена VL гуманизированного антитела к СЕАСАМ5 / к СЕАСАМ6 16С3 (ЕР 2585476) (SEQ ID NO: 133) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00287] Аминокислотная последовательность домена VH гуманизированного антитела к СЕАСАМ5/СЕАСАМ6 hMN15 (WO 2011/034660) (SEQ ID NO: 134) представлена ниже (остатки CDRH обозначены подчеркиванием):

[00288] Аминокислотная последовательность домена VL гуманизированного антитела к СЕАСАМ5/СЕАСАМ6 hMN15 (WO 2011/034660) (SEQ ID NO: 135) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00289] Настоящее изобретение, в частности, включает и охватывает связывающие СЕАСАМ5/СЕАСАМ6 молекулы (например, биспецифичные связывающие СЕАСАМ5/СЕАСАМ6 × CD3 молекулы), которые способны связываться с СЕАСАМ5 и/или СЕАСАМ6, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к СЕАСАМ5/СЕАСАМ6 16С3 или hMN15
3. Иллюстративные антитела к EGRF
[00290] Рецептор эпидермального фактора роста (EGFR) представляет собой раковый антиген некоторых видов метастатического колоректального рака, метастатического немелкоклеточного рака легкого и рака головы и шеи. Иллюстративными антителами, которые связывают EGRF человека, являются «Цетуксимаб» и «Панитумумаб». Цетуксимаб представляет собой рекомбинантное химерное моноклональное антитело человека/мыши IgG1 к рецептору эпидермального фактора роста (EGFR) (Govindan R. (2004) "Cetuximab In Advanced Non-Small Cell Lung Cancer," Clin. Cancer Res. 10(12 Pt 2):4241s-4244s; Bou-Assaly, W. et al. (2010) "Cetuximab (Erbitux)," Am. J. Neuroradiol. 31(4):626-627). Панитумумаб (Vectibix®, Amgen) представляет собой полностью гуманизированное моноклональное антитело IgG2 к рецептору эпидермального фактора роста (EGFR) (Foon, K.A. et al. (2004) "Preclinical And Clinical Evaluations Of ABX-EGF, A Fully Human Anti-Epidermal Growth Factor Receptor Antibody," Int. J. Radiat. Oncol. Biol. Phys. 58(3):984-990; Yazdi, M.H. et al. (2015) "A Comprehensive Review of Clinical Trials on EGFR Inhibitors Such as Cetuximab and Panitumumab as Monotherapy and in Combination for Treatment of Metastatic Colorectal Cancer," Avicenna J. Med. Biotechnol. 7(4): 134-144).
[00291] Аминокислотная последовательность домена VH химерного антитела к EGFR цетуксимаба (SEQ ID NO: 136) представлена ниже (остатки CDRH обозначены подчеркиванием):
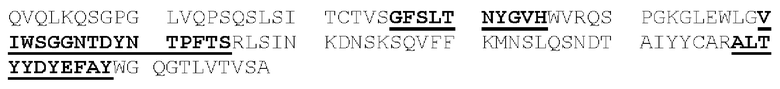
[00292] Аминокислотная последовательность домена VL химерного антитела к EGFR цетуксимаба (SEQ ID NO: 137) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00293] Аминокислотная последовательность домена VH панитумумаба (SEQ ID NO: 138) представлена ниже (остатки CDRH обозначены подчеркиванием):
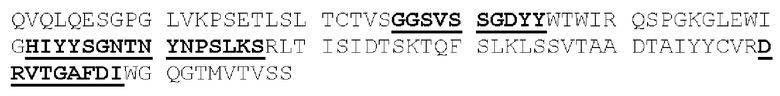
[00294] Аминокислотная последовательность домена VL панитумумаба (SEQ ID NO: 139) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00295] Настоящая заявка, в частности, включает и охватывает связывающие EGFR молекулы (например, биспецифичные связывающие EGFR x CD3 молекулы), которые способны связываться с EGFR, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к EGFR цетуксимаба или панитумумаба.
4. Иллюстративные антитела к EphA2
[00296] Рецепторная тирозинкиназа, рецептор 2 эфрина типа A (EphA2), в норме экспрессируется в участках межклеточных контактов в эпителиальных тканях взрослых, однако в недавних исследованиях также была показана ее сверхэкспрессия в различных типах эпителиальных карцином, причем наибольший уровень экспрессии EphA2 наблюдали в метастатических поражениях. Высокие уровни экспрессии EphA2 были обнаружены при множестве раковых заболеваний и во многих линиях раковых клеток, включая рак предстательной железы, рак молочной железы, немелкоклеточный рака легкого и меланому (Xu, J. et al. (2014) "High EphA2 Protein Expression In Renal Cell Carcinoma Is Associated With A Poor Disease Outcome," Oncol. Lett. Aug 2014; 8(2): 687-692; Miao, B. et al. (2014) "EphA2 is a Mediator of Vemurafenib Resistance and a Novel Therapeutic Target in Melanoma," Cancer Discov. pii: CD-14-0295). EphA2, по-видимому, не только является маркером рака, но, скорее, постоянно сверхэкспрессируется и претерпевает функциональные изменения при многих раковых заболеваниях человека (Chen, P. et al. (2014) "EphA2 Enhances The Proliferation And Invasion Ability Of LnCap Prostate Cancer Cells," Oncol. Lett. 8(1):41-46). Иллюстративными антителами, которые связывают EphA2 человека, являются «EphA2 mAb 1», «EphA2 mAb 2» и «EphA2 mAb 3».
[00297] Аминокислотная последовательность домена VH EphA2 mAb 1 (SEQ ID NO: 140) представлена ниже (остатки CDRH обозначены подчеркиванием):

[00298] Аминокислотная последовательность домена VL EphA2 mAb 1 (SEQ ID NO: 141) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00299] Аминокислотная последовательность домена VH EphA2 mAb 2 (SEQ ID NO: 142) представлена ниже (остатки CDRH обозначены подчеркиванием):
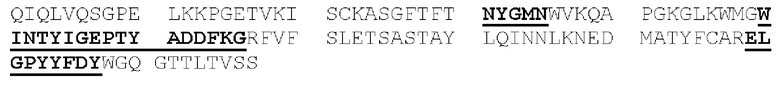
[00300] Аминокислотная последовательность домена VL EphA2 mAb 2 (SEQ ID NO: 143) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00301] Аминокислотная последовательность домена VH EphA2 mAb 3 (SEQ ID NO: 144) представлена ниже (остатки CDRH обозначены подчеркиванием):
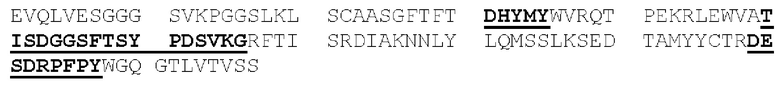
[00302] Аминокислотная последовательность домена VL EphA2 mAb 3 (SEQ ID NO: 145) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00303] Настоящая заявка, в частности, включает и охватывает связывающие EphA2 молекулы (например, биспецифичные связывающие EphA2 x CD3 молекулы), которые способны связываться с EphA2, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к EphA2 EphA2 mAb 1, EphA2 mAb 2 и EphA2 mAb 3.
5. Иллюстративные антитела к gpA33
[00304] Трансмембранный гликопротеин с молекулярной массой 43 кДа А33 (gpA33) экспрессируется в >95% случаев всех колоректальных карцином (Heath, J.K. et al. (1997) "The Human А33 Antigen Is A Transmembrane Glycoprotein And A Novel Member Of The Immunoglobulin Superfamily," Proc. Natl. Acad. Sci. (U.S.A.) 94(2):469-474; Ritter, G. et al. (1997) "Characterization Of Posttranslational Modifications Of Human A33 Antigen, A Novel Palmitoylated Surface Glycoprotein Of Human Gastrointestinal Epithelium," Biochem. Biophys. Res. Commun. 236(3):682-686; Wong, N.A. et al. (2006) "EpCAM and gpA33 Are Markers Of Barrett's Metaplasia," J. Clin. Pathol. 59(3):260-263). Иллюстративным антителом, которое связывается с gpA33 человека, является «gpA33 mAb 1».
[00305] Аминокислотная последовательность домена VH gpA33 mAb 1 (SEQ ID NO: 146) представлена ниже (остатки CDRH обозначены подчеркиванием):
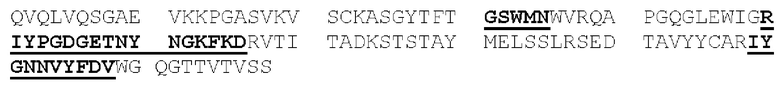
[00306] Аминокислотная последовательность домена VL gpA33 mAb 1 (SEQ ID NO: 147) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00307] Настоящая заявка, в частности, включает и охватывает связывающие gpA33 молекулы (например, биспецифичные связывающие gpA33 x CD3 молекулы), которые способны связываться с gpA33, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к gpA33 gpA33 mAb 1 или любого из моноклональных антител к gpA33, предложенных в WO 2015/026894. Настоящее изобретение дополнительно включает и охватывает иллюстративные биспецифичные связывающие gpA33 x CD3 молекулы, предложенные в WO 2015/026894.
6. Иллюстративные антитела к HER2/neu
[00308] HER2/neu представляет собой рецепторный белок с молекулярной массой 185 кДа, который первоначально был идентифицирован в качестве продукта трансформирующего гена из нейробластом подвергнутых воздействию химических веществ крыс.HER2/neu широко исследовали вследствие его роли при некоторых карциномах человека (включая рак молочной железы и рак желудка) и в развитии млекопитающих (Hynes et al. (1994) Biochim. Biophys. Acta 1198:165-184; Dougall et al. (1994) Oncogene 9:2109-2123; Lee et al. (1995) Nature 378:394-398). Иллюстративные антитела, которые связывают HER2/neu человека, включают «Маргетуксимаб», «Трастузумаб» и «Пертузумаб». Маргетуксимаб (также известный как MGAH22; регистрационный номер CAS 1350624-75-7) представляет собой Fc-оптимизированное моноклональное антитело, которое связывается с HER2/neu и опосредует повышенную активность АЗКЦ. Трастузумаб (также известный как rhuMAB4D5 и реализуемый под названием Герцептин (Herceptin®); регистрационный номер CAS 180288-69-1; см. патент США №5821337) представляет собой гуманизированную версию антитела 4D5, имеющую константные области IgG1/каппа. Пертузумаб (также известный как rhuMAB2C4 и реализуемый под названием Перьета (Perjeta™); регистрационный номер CAS 380610-27-5; см., например, WO 2001/000245) представляет собой гуманизированную версию антитела 2С4, имеющую константные области IgG1/каппа.
[00309] Настоящая заявка, в частности, включает и охватывает связывающие Her2/Neu молекулы (например, биспецифичные связывающие Her2/Neu x CD3 молекулы), которые способны связываться с Her2/Neu, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к Her2/Neu маргетуксимаба, трастузумаба или пертузумаба.
[00310] Аминокислотная последовательность домена VH маргетуксимаба представляет собой (SEQ ID NO: 148) (остатки CDR**h обозначены подчеркиванием):

[00311] Аминокислотная последовательность домена VL маргетуксимаба представляет собой (SEQ ID NO: 149) (остатки CDRL обозначены подчеркиванием):

[00312] Аминокислотные последовательности полных тяжелых и легких цепей маргетуксимаба известны в данной области техники (см., например, WHO Drug Information, 2014, Recommended INN: List 71, 28(l):93-94).
[00313] Аминокислотная последовательность домена VH трастузумаба представляет собой (SEQ ID No: 150) (остатки CDRH обозначены подчеркиванием):

[00314] Аминокислотная последовательность домена VL трастузумаба представляет собой (SEQ ID NO: 151) (остатки CDRL обозначены подчеркиванием):

[00315] Аминокислотная последовательность домена VH пертузумаба представляет собой (SEQ ID NO: 152) (остатки CDRH обозначены подчеркиванием):
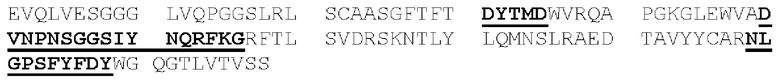
[00316] Аминокислотная последовательность домена VL пертузумаба представляет собой (SEQ ID NO: 153) (остатки CDRL обозначены подчеркиванием):
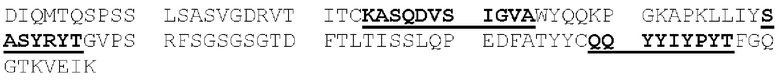
[00317] В дополнение к обозначенным выше предпочтительным связывающим HER2/neu молекулам, в настоящем изобретении рассматриваются связывающие Her2/Neu молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH любой из следующих связывающих Her-2 молекул: 1.44.1; 1.140; 1.43; 1.14.1; 1.100.1; 1.96; 1.18.1; 1.20; 1.39; 1.24 и 1.71.3 (патенты США №8,350,011; 8,858,942 и публикация заявки на патент согласно РСТ 2008/019290); F5 и С1 (патенты США№7,892,554; 8,173,424; 8,974,792 и публикация заявки на патент согласно РСТ WO 99/55367); а также связывающие Her-2 молекулы, предложенные в публикации заявки на патент США US 2013017114 и публикациях заявок на патент согласно РСТ № WO 2011/147986 и WO 2012/143524). Настоящее изобретение дополнительно включает и охватывает иллюстративные биспецифичные связывающие Her2/Neu x CD3 молекулы, предложенные в WO 2012/143524.
7. Иллюстративные антитела к VEGF
[00318] VEGF-A выполняет функцию химического сигнала, который стимулирует ангиогенез при различных заболеваниях, в частности, при некоторых метастатических раковых заболеваниях, таких как метастатический рак толстой кишки, и при некоторых видах рака легкого, рака почки, рака яичника и мультиформной глиобластомы головного мозга. Иллюстративным антителом, которое связывается с VEGF-A человека, является «Бевацизумаб» (Авастин (Avastin®)). Бевацизумаб представляет собой рекомбинантное гуманизированное моноклональное антитело IgG1 (Midgley, R. et al. (2005) "Bevacizumab - Current Status And Future Directions," 7 Ann. Oncol. 16(7): 999-1004; Hall, R.D. et al. (2015) "Angiogenesis Inhibition As A Therapeutic Strategy In Non-Small Cell Lung Cancer (NSCLC)," Transl. Lung Cancer Res. 4(5): 515-523; Narita, Y. (2015) "Bevacizumab For Glioblastoma," Ther. Clin. Risk Manag. 11: 1759-1765).
[00319] Аминокислотная последовательность домена VH бевацизумаба (SEQ ID NO: 154) представлена ниже (остатки CDRH обозначены подчеркиванием):
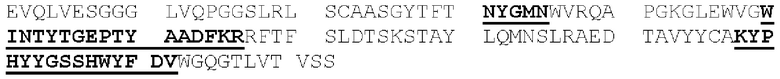
[00320] Аминокислотная последовательность домена VL бевацизумаба (SEQ ID NO: 155) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00321] Настоящая заявка, в частности, включает и охватывает связывающие VEGF молекулы (например, биспецифичные связывающие VEGF x CD3 молекулы), которые способны связываться с VEGF, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклонального антитела к VEGF бевацизумаба.
8. Иллюстративные антитела к 5Т4
[00322] Раково-эмбриональный белок, 5Т4, представляет собой связанный с опухолью белок, представленный на мембране клеток многих карцином, включая карциному почки, толстой кишки, предстательной железы, легкого, и при остром лимфобластном лейкозе (см. Boghaert, E.R. et al. (2008) "The Oncofetal Protein, 5T4, Is A Suitable Target For Antibody-Guided Anti-Cancer Chemotherapy With Calicheamicin," Int. J. Oncol. 32(1): 221-234; Eisen, T. et al. (2014) "Naptumomab Estafenatox: Targeted Immunotherapy with a Novel Immunotoxin," Curr. Oncol. Rep. 16: 370, pp. 1-6). Иллюстративные антитела, которые связываются с 5Т4 человека, включают «5Т4 mAb 1» и «5Т4 mAb 2».
[00323] Аминокислотная последовательность домена VH 5Т4 mAb 1 (SEQ ID NO: 156) представлена ниже (остатки CDR обозначены подчеркиванием):
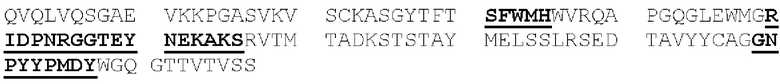
[00324] Аминокислотная последовательность домена VL иллюстративного 5Т4 mAb 1 (SEQ ID NO: 157) представлена ниже (остатки CDR обозначены подчеркиванием):

[00325] Аминокислотная последовательность домена VH 5Т4 mAb 2 (SEQ ID NO: 158) представлена ниже (остатки CDR обозначены подчеркиванием):

[00326] Аминокислотная последовательность домена VL 5Т4 mAb 2 (SEQ ID NO: 159) представлена ниже (остатки CDR обозначены подчеркиванием):

[00327] Настоящая заявка, в частности, включает и охватывает связывающие 5Т4 молекулы (например, биспецифичные связывающие 5Т4 x CD3 молекулы), способные связываться с 5Т4, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к 5Т4 5Т4 mAb 1 или 5Т4 mAb 2, или любого из антител к 5Т4, предложенных в WO 2013/041687 или WO 2015/184203. Настоящее изобретение дополнительно включает и охватывает иллюстративные биспецифичные связывающие 5Т4 x CD3 молекулы, предложенные в WO 2015/184203.
[00328] Настоящая заявка дополнительно, в частности, включает и охватывает триспецифичные связывающие молекулы 5Т4 x CD3 x CD8, которые способны связываться с 5Т4, CD3 и CD8, и, в частности, такие триспецифичные связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к 5Т4 5Т4 mAb 1 или 5Т4 mAb 2, или любого из моноклональных антител к 5Т4, предложенных в WO 2015/184203, и/или домен VL, и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH любого из моноклональных антител к CD8, предложенных в настоящей заявке.
9. Иллюстративные антитела к IL13Rα2
[00329] Рецептор интерлейкина-13 α2 (IL-13Rα2) сверхэкспрессируется при различных раковых заболеваниях, включая глиобластому, колоректальный рак, рак шейки матки, рак поджелудочной железы, множественную меланому, остеосаркому, лейкоз, лимф ому, рак предстательной железы и рак легкого (публикация заявки РСТ № WO 2008/146911; Brown, СЕ. et al. (2013) "Glioma IL13Rα2 Is Associated With Mesenchymal Signature Gene Expression And Poor Patient Prognosis," PLoS One. 18; 8(10): e77769; Barderas, R. et al. (2012) "High Expression Of IL-13 Receptor A2 In Colorectal Cancer Is Associated With Invasion, Liver Metastasis, And Poor Prognosis," Cancer Res. 72(11): 2780-2790; Kasaian, M.T. et al. (2011) "IL-13 Antibodies Influence IL-13 Clearance In Humans By Modulating Scavenger Activity Of IL-13Rα2" J. Immunol. 187(1): 561-569; Bozinov, O. et al. (2010) "Decreasing Expression Of The Interleukin-13 Receptor IL-13Ralpha2 In Treated Recurrent Malignant Gliomas," Neurol. Med. Chir. (Tokyo) 50(8): 617-621; Fujisawa, T. et al. (2009) "A Novel Role Of Interleukin-13 Receptor Alpha2 In Pancreatic Cancer Invasion And Metastasis," Cancer Res. 69(22): 8678-8685). Антитела, которые иммуноспецифично связываются с IL13Rα2, коммерчески доступны и были описаны в данной области техники (Abnova Corporation, Biorbyt, LifeSpan Biosciences, United States Biologicals; см. также публикацию заявки РСТ № WO 2008/146911). Иллюстративные антитела, которые связываются с IL-13Rα2 человека, включают «hu08» (см., например, публикацию заявки РСТ № WO 2014/072888).
[00330] Аминокислотная последовательность домена VH hu08 (SEQ ID NO: 160) представлена ниже (остатки CDR обозначены подчеркиванием):
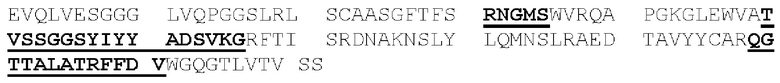
[00331] Аминокислотная последовательность домена VL hu08 (SEQ ID NO: 161) представлена ниже (остатки CDR обозначены подчеркиванием):
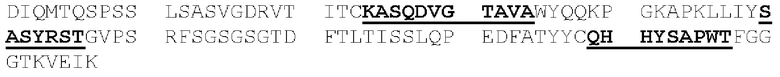
[00332] Настоящая заявка, в частности, включает и охватывает связывающие IL13Rα2 молекулы (например, биспецифичные связывающие IL13Rα2 x CD3 молекулы), которые способны связываться с IL13Rα2, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклонального антитела к IL13Rα2 hu08.
10. Иллюстративные антитела к CD123
[00333] CD 123 (рецептор интерлейкина 3 альфа, IL-3Ra) представляет собой молекулу с молекулярной массой 40 кДа и является частью рецепторного комплекса интерлейкина 3 (Stomski, F.C. et al. (1996) "Human Interleukin-3 (IL-3) Induces Disulfide-Linked IL-3 Receptor Alpha- And Beta-Chain Heterodimerization, Which Is Required For Receptor Activation But Not High-Affinity Binding," Mol. Cell. Biol. 16(6): 3035-3046). Интерлейкин 3 (ИЛ-3) вызывает раннюю дифференцировку мультипотентных стволовых клеток в клетки эритроидных, миелоидных и лимфоидных предшественников. Сообщалось, что CD123 сверхэкспрессируется на злокачественных клетках при различных злокачественных новообразованиях системы крови, включая острый миелоидный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), острый В-лимфобластный лейкоз (B-ALL), волосатоклеточный лейкоз (ВКЛ), властную плазмацитоидную дендритно-клеточную неоплазию (БПДКН), хронический миелогенный лейкоз (ХМЛ), острый В-лимфобластный лейкоз (В-ALL), волосатоклеточный лейкоз (ВКЛ), бластную плазмацитоидную дендритно-клеточную неоплазию (БПДКН) и миелодиспластический синдром (МДС) ( L. et al. (2001) "Interleukin-3 Receptor Alpha Chain (CD123) Is Widely Expressed In Hematologic Malignancies," Haematologica 86(12): 1261-1269). Сверхэкспрессия CD123 связана с худшим прогнозом при ОМЛ (Tettamanti, M.S. et al. (2013) "Targeting Of Acute Myeloid Leukaemia By Cytokine-Induced Killer Cells Redirected With A Novel CD123-Specific Chimeric Antigen Receptor," Br. J. Haematol. 161: 389-401).
L. et al. (2001) "Interleukin-3 Receptor Alpha Chain (CD123) Is Widely Expressed In Hematologic Malignancies," Haematologica 86(12): 1261-1269). Сверхэкспрессия CD123 связана с худшим прогнозом при ОМЛ (Tettamanti, M.S. et al. (2013) "Targeting Of Acute Myeloid Leukaemia By Cytokine-Induced Killer Cells Redirected With A Novel CD123-Specific Chimeric Antigen Receptor," Br. J. Haematol. 161: 389-401).
[00334] Иллюстративным антителом, которое связывается с CD 123 человека и может быть применено в настоящем изобретении, является «CD123 mAb 1» (см., например, публикацию заявки на патент согласно РСТ WO 2015/026892).
[00335] Аминокислотная последовательность домена VH CD123 mAb 1 (SEQ ID NO: 162) представлена ниже (остатки CDRH обозначены подчеркиванием):
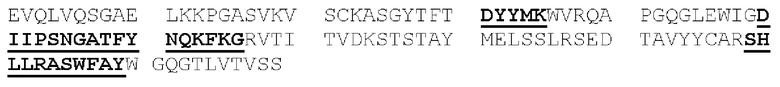
[00336] Аминокислотная последовательность домена VL CD123 mAb 1 (SEQ ID NO: 163) представлена ниже (остатки CDRL обозначены подчеркиванием):
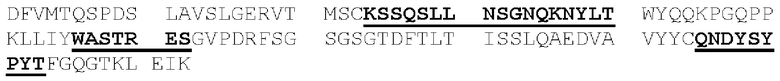
[00337] Настоящая заявка, в частности, включает и охватывает связывающие CD 123 молекулы (например, биспецифичные связывающие CD 123 x CD3 молекулы), которые способны связываться с CD 123, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклонального антитела к CD123 CD123 mAb 1, а также любого из антител к CD123, раскрытых в US 2017/081424 и WO 2016/036937. Настоящее изобретение дополнительно включает и охватывает иллюстративные биспецифичные связывающие CD123 x CD3 молекулы, включая: флотетузумаб (также известный как MGD007; регистрационный номер CAS 1664355-28-5), JNJ-63709178 (Johnson & Johnson, см. также WO 2016/036937) и XmAb 14045 (Xencor, см. также US 2017/081424).
11. Иллюстративные антитела к CD19
[00338] CD19 (поверхностный антиген В-лимфоцитов В4, регистрационный номер Genbank М28170) представляет собой компонент В-клеточного рецепторного комплекса (BCR) и является положительным регулятором передачи сигналов В-клеток, который модулирует порог активации В-клеток и гуморальный иммунитет.CD19 является одним из наиболее широко экспрессируемых антигенов в линии В-клеток и экспрессируется на >95% злокачественных новообразований из В-клеток, включая острый лимфобластный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз (ХЛЛ) и неходжкинскую лимфому (НХЛ). Примечательно, что экспрессия CD19 сохраняется на В-клеточных лимфомах, которые становятся устойчивыми к терапии, нацеленной HaCD20 (Davis et al. (1999) "Therapy of В-С ell Lymphoma With Anti-CD20 Antibodies CanResultln TheLoss Of CD20 Antigen Expression. " Clin Cancer Res, 5: 611-615, 1999). CD19 также был предложен в качестве мишени для лечения аутоиммунных заболеваний (Tedder (2009) "CD19: A Promising В Cell Target For Rheumatoid Arthritis," Nat. Rev. Rheumatol. 5: 572-577).
[00339] Иллюстративным гуманизированным антителом, которое связывается с CD19 человека и которое может быть применено в настоящем изобретении, является антитело к CD19, раскрытое в WO 2016/048938 (в настоящей заявке упоминаемое как «CD19 mAb 1»).
[00340] Аминокислотная последовательность домена VH CD19 mAb 1 (SEQ ID NO: 164) представлена ниже (остатки CDRH обозначены подчеркиванием):
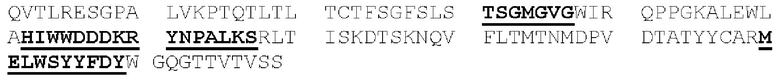
[00341] Аминокислотная последовательность домена VL CD19 mAb 1 (SEQ ID NO: 165) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00342] Аминокислотная последовательность альтернативного домена VL CD19 mAb 1 (SEQ ID NO: 195) представлена ниже (остатки CDRL обозначены подчеркиванием):

[00343] Настоящая заявка, в частности, включает и охватывает связывающие CD19 молекулы (например, биспецифичные связывающие CD19 x CD3 молекулы), которые способны связываться с CD19, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклонального антитела к CD19 CD19 mAb 1 или любого из антител к CD19, раскрытых в патенте США 7,112,324. Настоящее изобретение, в частности, включает и охватывает иллюстративные биспецифичные связывающие CD19 x CD3 молекулы, которые могут быть применены в настоящем изобретении, включая: блинатумомаб (BLINCYTO®; аминокислотную последовательность можно найти в WHO Drug Information, 2009, Recommended INN: List 62, 23(3): 240-241) и дувортуксизумаб (также известный как MGD011; аминокислотную последовательность можно найти в WHO Drug Information, 2016, Proposed INN: List 116, 30(4): 627-629).
В. Иллюстративные ассоциированные с патогеном антигены
[00344] В контексте настоящей заявки термин «ассоциированный с патогеном антиген» обозначает антиген, для которого характерна экспрессия на поверхности инфицированной патогеном клетки, и который, таким образом, может подвергаться воздействию молекулы на основе антител или иммуномодулирующей молекулы. Примеры ассоциированных с патогеном антигенов включают, но не ограничиваются перечисленными, антигены, экспрессируемые на поверхности клетки, инфицированной: вирусом простого герпеса (например, белок инфицированной клетки (ICP)47, gD и так далее), вирусом ветряной оспы, герпесвирусом, связанным с саркомой Капоши, вирусом Эпштейна-Барр (например, LMP-1, LMP-2A, LMP-2B и так далее), цитомегаловирусом (например, UL11 и так далее), вирусом иммунодефицита человека (например, белки env gp160, gp120, gp41 и так далее), папилломавирусом человека (например, Е6, Е7 и так далее), вирусом Т-клеточного лейкоза человека (например, белки env gp64, gp46, gp21 и так далее), вирусом гепатита А, вирусом гепатита В, вирусом гепатита С, вирусом везикулярного стоматита (ВВС), микроорганизмами родов Bacilli, Citrobacter, Cholera, Diphtheria, Enterobacter, Gonococci, Helicobacter pylori, Klebsiella, Legionella, Meningococci, микобактериями, Pseudomonas, Pneumonococci, риккетсиями, Salmonella, Serratia, Staphylococci, Streptococci, Tetanus, Aspergillus (видов fumigatus, niger и так далее), Blastomyces dermatitidis, Candida (видов albicans, krusei, glabrata, tropicalis и так далее), Cryptococcus neoformans, рода Mucorales (видов mucor, absidia, rhizopus), Sporothrix schenkii, Paracoccidioides brasiliensis, Coccidioides immitis, Histoplasma capsulatum, Leptospirosis, Borrelia burgdorferi, паразитами-гельминтами (анкилостома, ленточные черви, трематоды, плоские черви (например, Schistosomia), Giardia lambia, Trichinella, Dientamoeba Fragilis, Trypanosoma brucei, Trypanosoma cruzi и Leishmania donovani). Такие антитела коммерчески доступны из многочисленных источников или могут быть получены путем иммунизации мышей или других животных (в том числе с целью получения моноклональных антител) такими антигенами.
[00345] Иллюстративные антитела, домены VH и VL которых могут быть применены для конструирования молекул, способных связывать ассоциированный с патогеном антиген, представленный на поверхности инфицированной патогеном клетки, представлены ниже, дополнительные антитела известны в данной области техники.
1. Иллюстративное антитело к env ВИЧ
[00346] Белок env ВИЧ представляет собой иллюстративный ассоциированный с патогеном антиген, и антитела, которые связывают белок env ВИЧ, являются иллюстративными антителами, способными связывать ассоциированный с патогеном антиген.
[00347] Начальная стадия инфицирования ВИЧ-1 происходит при связывании CD4 клеточной поверхности с тримерными гликопротеинами оболочки ВИЧ-1 (env), гетеродимером трансмембранного гликопротеина (gp41) и поверхностным гликопротеином (gp120). Гликопротеины gp120 и gp41 первоначально синтезируются в виде единого полипептида gp160, который впоследствии расщепляется с образованием нековалентно связанного комплекса gp120/gp41. Внеклеточный домен env представляет собой гетеродимер с молекулярной массой примерно 140 кДа, состоящий из полного компонента gpl20 и примерно 20 кДа gp41 (Harris, A. et al. (2011) "Trimeric HIV-1 Glycoprotein Gp140 Immunogem And Native HIV-1 Envelope Glycoproteins Display The Same Closed And Open Quaternary Molecular Architectures" Proc. Natl. Acad. Sci. (U.S.A.) 108(28): 11440-11445). Антитела, которые иммуноспецифично связываются с белками env, коммерчески доступны и были описаны в данной области техники (см., например, регистрационный номер GenBank AFQ31503; Buchacher, A. et al. (1994) "Generation Of Human Monoclonal Antibodies Against HIV-1 Proteins; Electrofusion And Epstein-Barr Virus Transformation For Peripheral Blood Lymphocyte Immortalization," AIDS Res. Hum. Retroviruses 10(4): 359-369; Shen, R. (2010) "GP41-Specific Antibody Blocks Cell-Free HIV Type 1 Transcytosis Through Human Rectal Mucosa And Model Colonic Epithelium," J. Immunol. 184(7): 3648-3655; WO 2012/162068 и WO 2016/054101). Иллюстративные антитела, которые связываются с env ВИЧ, включают «7В2» (регистрационный номер GenBank AFQ31503) и «А32» (публикация заявки РСТ № WO 2014/159940). В данной области техники описано несколько доменов VH антитела А32, которые имеют незначительные описанные отличия в каркасных областях 1 и/или 4 (см., например, регистрационный номер Protein Data Base PDB: 4YBL_H, US 2015/0239961 и WO 2006/044410). Любой из этих вариантов доменов VH антитела А32 может быть применен в соответствии с настоящим изобретением.
[00348] Аминокислотная последовательность домена VH 7 В2 (SEQ ID NO: 166) представлена ниже (остатки CDR обозначены подчеркиванием):
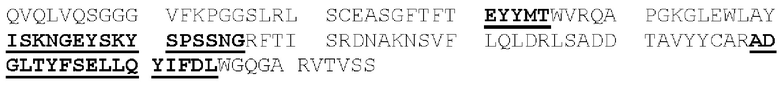
[00349] Аминокислотная последовательность домена VL 7 В2 (SEQ ID NO: 167) представлена ниже (остатки CDR обозначены подчеркиванием):

[00350] Аминокислотная последовательность иллюстративного домена VH А32 (SEQ ID NO: 168) представлена ниже (остатки CDR обозначены подчеркиванием):

где: X представляет собой L или М
[00351] Аминокислотная последовательность такого иллюстративного домена VH А32 (SEQ ID NO: 209), где X представляет собой L, представлена ниже (остатки CDR обозначены подчеркиванием):

[00352] Аминокислотная последовательность домена VL А32 (SEQ ID NO: 169) представлена ниже (остатки CDR обозначены подчеркиванием):

[00353] Настоящая заявка, в частности, включает и охватывает связывающие ВИЧ молекулы (например, биспецифичные связывающие ВИЧ x CD3 молекулы), которые способны связываться с ВИЧ, и, в частности, такие связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к ВИЧ 7 В2, А32, а также любого из антител к ВИЧ, раскрытых в WO 2016/054101, WO 2017/011413, WO 2017/011414. Настоящее изобретение, в частности, включает и охватывает иллюстративные биспецифичные связывающие ВИЧ x CD3 молекулы, предложенные в WO 2014/159940, WO 2015/184203, WO 2017/011413 и WO 2017/011414.
[00354] Настоящая заявка, в частности, дополнительно включает и охватывает связывающие ВИЧ x CD3 x CD8 триспецифичные связывающие молекулы, которые способны связываться с ВИЧ, CD3 и CD8, и, в частности, такие триспецифичные связывающие молекулы, которые содержат домен VL и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH моноклональных антител к ВИЧ 7 В2 или А32, или любого из моноклональных антител к ВИЧ, предложенных в WO 2015/184203, WO 2016/054101, WO 2017/011413, WO 2017/011414, и/или домен VL, и/или домен VH, и/или 1, 2 или все 3 из CDRL домена VL, и/или 1, 2 или все 3 из CDRH домена VH любого из моноклональных антител к CD8, предложенных в WO 2015/184203.
2. Иллюстративное антитело к гликопротеину F RSV
[00355] Еще одним иллюстративным ассоциированным с патогеном антигеном является гликопротеин F RSV. Иллюстративный антителом к гликопротеину F RSV является паливизумаб (см., например, Protein Data Bank (PDB) ID №2HWZ). Альтернативные антитела к гликопротеину F RSV включают мотавизумаб (см., например, PDB ID №3IXT) и вариант паливизумаба, который был сконструирован с целью удаления остатка цистеина из CDRL1 паливизумаба. Аминокислотная последовательность домена VH варианта паливизумаба (SEQ ID NO: 170) представлена ниже (остатки CDR обозначены подчеркиванием):
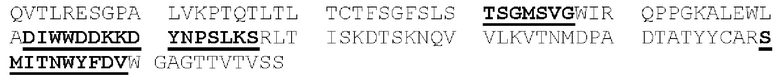
[00356] Аминокислотная последовательность домена VL варианта паливизумаба (SEQ ID NO: 171) представлена ниже (остатки CDR обозначены подчеркиванием):

VII. Иллюстративные связывающие молекулы согласно настоящему изобретению
[00357] Как будет показано ниже, настоящее изобретение проиллюстрировано несколькими связывающими DA х CD3 молекулами, имеющими различные структуры, включая молекулы, способные опосредовать перенаправленное уничтожение опухолевой клетки (например, диатело типа «DART-А», или диатело типа «DART-В», или молекула типа TRIVALENT, описанные ниже).
А. Диатела типа DART-А
[00358] Диатела типа DART-А представляют собой биспецифичные диатела, которые способны связывать CD3 и относящийся к заболеванию антиген (например, раковый антиген) и не содержат Fc-домена. В настоящей заявке представлены иллюстративные диатела типа DART-А, состоящие из двух полипептидных цепей, имеющие один сайт связывания для CD3 и один сайт связывания для ракового антигена CD123 (см., например, Фигуру 1).
[00359] Иллюстративное диатело типа DART-А (обозначенное «DART-A-WT») содержит первую полипептидную цепь, имеющую аминокислотную последовательность SEQ ID NO: 172:

[00360] Остатки 1-113 первой полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 162). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют домену VH CD3 mAb 1 (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют способствующей гетеродимеризации «K-спирали» (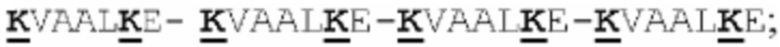 SEQ ID NO: 30)
SEQ ID NO: 30)
[00361] Вторая полипептидная цепь такого иллюстративного диатела типа DART-А DART-A-WT имеет аминокислотную последовательность SEQ ID NO: 173:

[00362] Остатки 1-110 второй полипептидной цепи такого иллюстративного диатела типа DART-A DART-A-WT соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-238 второй полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют домену VH CD123 mAb 1 (SEQ ID NO: 163). Остатки 239-244 (подчеркнуты) второй полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 245-272 второй полипептидной цепи такого иллюстративного диатела типа DART-А соответствуют способствующей гетеродимеризации «Е-спирали» (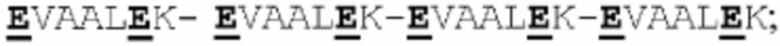 SEQ ID NO: 29).
SEQ ID NO: 29).
[00363] Как будет понятно с учетом настоящего раскрытия, дополнительные диатела типа DART-А, имеющие сайт связывания для альтернативного относящегося к заболеванию антигена и/или имеющие связывающие CD3 домены вариантного антитела к CD3 (то есть в. связывающий CD3 домен) могут быть сконструированы схожим образом (с применением доменов VL и VH таких антител вместо доменов VL и VH иллюстративного диатела типа DART-А). Аналогично, в соответствии с настоящей заявкой, схожим образом могут быть сконструированы альтернативные молекулы типа DART-А, содержащие альтернативные линкеры и/или альтернативные способствующие гетеродимеризации домены. Например, была получена иллюстративная панель диател типа DART-A CD123 x CD3, имеющих такую же структуру, что и диатело DART-A-WT, представленное выше, однако содержащих домены VL и VH одного из вариантов CD3 mAb 1 (М1-М26), представленных выше.
[00364] Каждое иллюстративное диатело типа DART-A CD 123 x CD3 в рассматриваемой панели содержит первую полипептидную цепь, имеющую аминокислотную последовательность SEQ ID NO: SEQ ID NO: 189:

где: X1 представляет собой T, D или Е; Х2 представляет собой Y, D или Т; Х3 представляет собой А или G; Х4 представляет собой D или G; Х5 представляет собой G, D, Е или K; Х6 представляет собой F или I; Х7 представляет собой G или I; X8 представляет собой Y, A, G или Q; X9 представляет собой S или Т; Х10 представляет собой W, F, или Y; и Х11 представляет собой Y или Е.
[00365] Остатки 1-113 первой полипептидной цепи панели иллюстративных диател типа DART-А соответствуют домену CD123 mAb 1 (SEQ ID NO: 162). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи панели иллюстративных диател типа DART-А соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16; дважды подчеркнуты). Остатки 122-246 первой полипептидной цепи панели иллюстративных диател типа DART-А соответствуют домену VH CD3 mAb 1 M1 - CD3 mAb 1 М22 (SEQ ID NOs: 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 102, 104 или 106). Остатки 247-252 (подчеркнуты одной линией) панели иллюстративных диател типа DART-А соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи панели иллюстративных диател типа DART-А соответствуют способствующей гетеродимеризации «K-спирали» (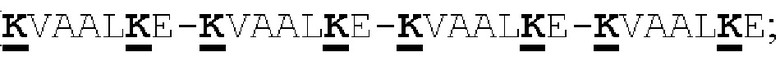 SEQ ID NO: 30).
SEQ ID NO: 30).
[00366] Вторая полипептидная цепь такого иллюстративного диатела типа DART-А имеет аминокислотную последовательность SEQ ID NO: 190:

где: X1 представляет собой G или D; Х2 представляет собой K или G; и Х3 представляет собой L, Е или Q.
[00367] Остатки 1-110 второй полипептидной цепи панели иллюстративных диател типа DART-А соответствуют домену VL CD3 mAb 1 М23 - CD3 mAb 1 М26 (SEQ ID NOs:108, 110, 112 и 114). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи панели иллюстративных диател типа DART-А соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16; дважды подчеркнуты). Остатки 119-238 второй полипептидной цепи панели иллюстративных диател типа DART-А соответствуют домену VH CD123 mAb 1 (SEQ ID NO: 163). Остатки 239-244 (подчеркнуты) второй полипептидной цепи панели иллюстративных диател типа DART-А соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17; подчеркнуты одной линией). Остатки 245-272 второй полипептидной цепи панели иллюстративных диател типа DART-А соответствуют способствующей гетеродимеризации «Е-спирали» (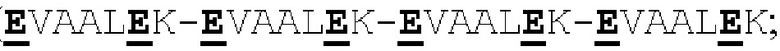 SEQ ID NO: 29).
SEQ ID NO: 29).
[00368] Аминокислотные последовательности и обозначения панели иллюстративных диател типа DART-А, содержащих VL и VH вариантов CD3 mAb 1, представлены в таблице 8 ниже.
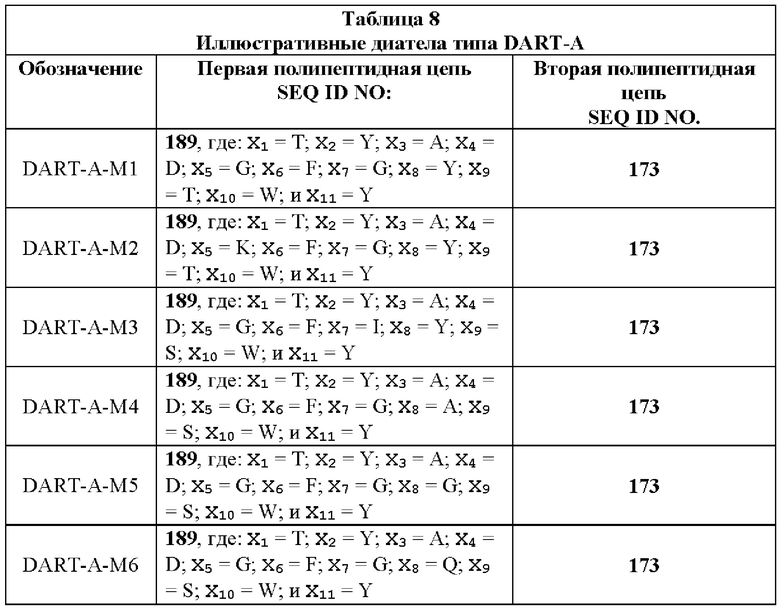
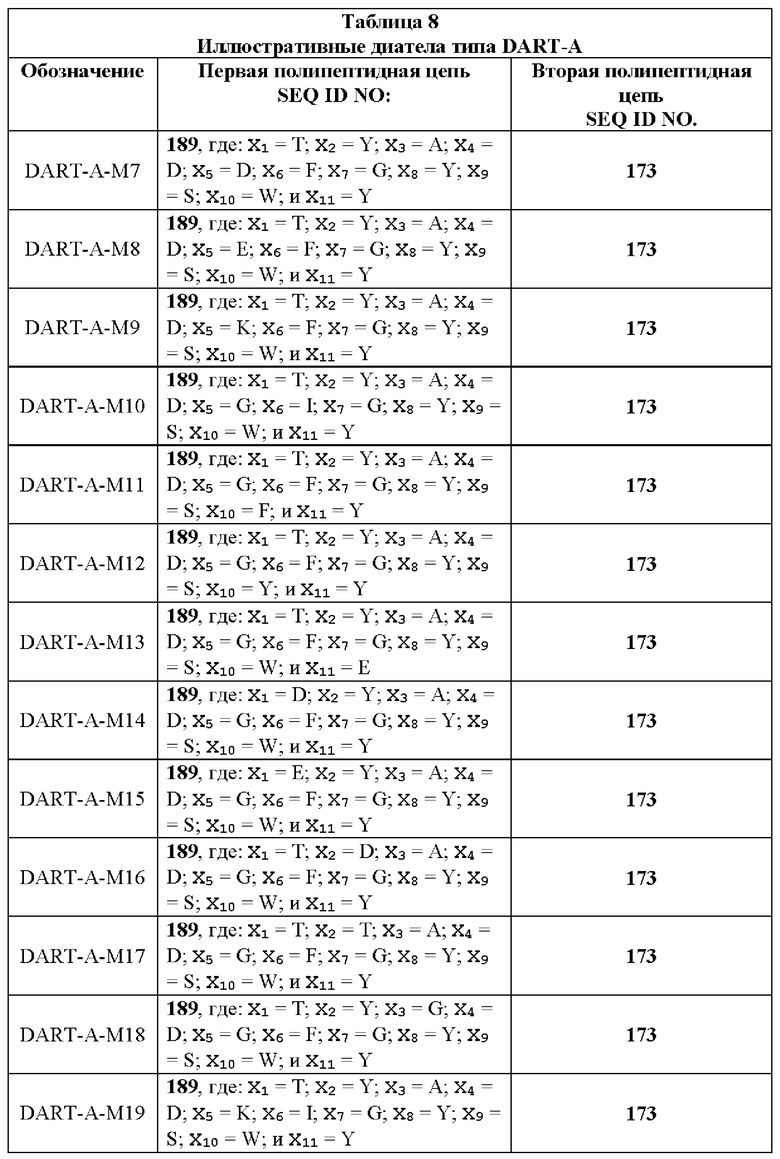

В. Диатела типа DART-B
[00369] Диатела типа DART-В представляют собой биспецифичные диатела, которые способны связывать CD3 и относящийся к заболеванию антиген (например, раковый или относящийся к инфекционному заболеванию антиген) и содержат Fc-домен. В настоящей заявке предложены иллюстративные диатела типа DART-В (таблица 9), состоящие из трех полипептидных цепей и имеющие один сайт связывания для CD3 и один сайт связывания для ракового антигена CD123, 5Т4 или CD19 (см., например, Фигуру 4А).
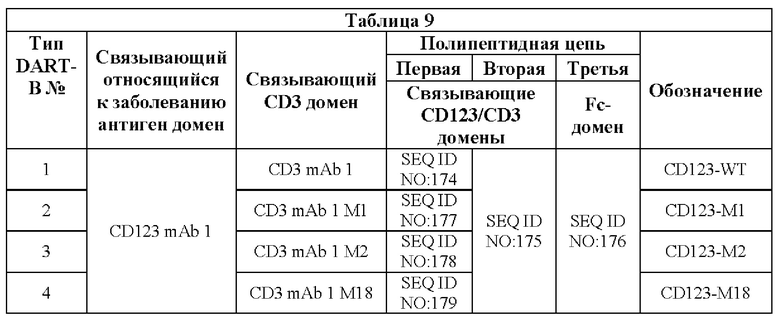
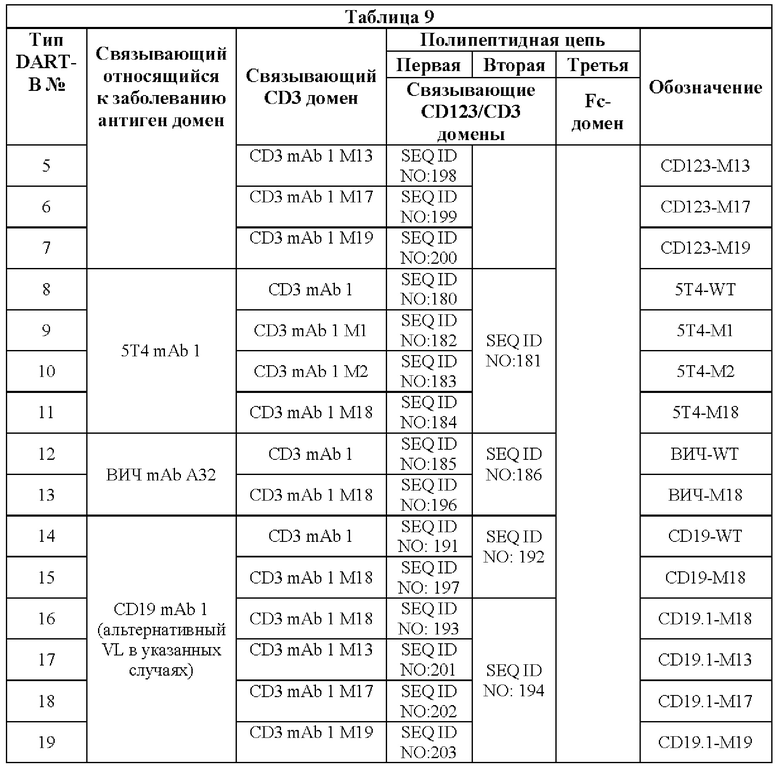
1. Первое иллюстративное диатело типа DART-В CD123-WT (CD123 х CD3 mAb 1)
[00370] Первое иллюстративное диатело типа DART-B (обозначенное «CD123-WT») содержит первую полипептидную цепь, имеющую аминокислотную последовательность SEQ ID NO: 174:

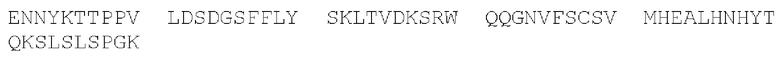
[00371] Остатки 1-113 первой полипептидной цепи CD123-WT соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-WT соответствуют домену VH CD3 mAb 1 (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-WT соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-WT соответствуют способствующей гетеродимеризации «Е-спирали» (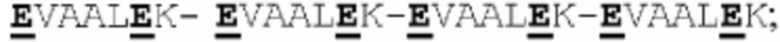 SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-WT соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-WT соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-WT соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-WT соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00372] Вторая полипептидная цепь CD123-WT имеет аминокислотную последовательность SEQ ID NO: 175:

[00373] Остатки 1-110 второй полипептидной цепи CD123-WT соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи CD123-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-238 второй полипептидной цепи CD123-WT соответствуют домену VH CD123 mAb 1 (SEQ ID NO: 162). Остатки 239-244 (подчеркнуты) второй полипептидной цепи соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 245-272 второй полипептидной цепи CD123-WT соответствуют способствующей гетеродимеризации «K-спирали» (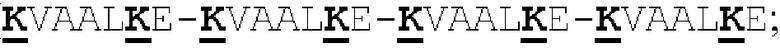 SEQ ID NO: 30)
SEQ ID NO: 30)
[00374] Третья полипептидная цепь CD123-WT имеет аминокислотную последовательность SEQ ID NO: 176:

[00375] Остатки 1-10 третьей полипептидной цепи CD123-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 10-227 третьей полипептидной цепи CD123-WT соответствуют имеющему «впадину» домену СН2-СН3 IgG1 (SEQ ID NO: 50).
[00376] Как будет понятно, третья полипептидная цепь CD123-WT не содержит каких-либо эпитоп-связывающих доменов и, таким образом, может применяться в различных связьшающих DA х CD3 молекулах, имеющих такую структуру типа DART-В.
2. Второе иллюстративное диатело типа DART-B CD123-M1 (CD123 х CD3 mAb 1 M1)
[00377] Второе иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD123-WT, однако содержит домен VH CD3 mAb 1 M1 и обозначено «CD123-M1». Как указано выше, CD3 mAb 1 M1 представляет собой вариант CD3 mAb 1, характеризующийся низкой аффинностью (также называемый «CD3 mAb 1 Low»). Также, как указано выше, домен VL CD3 mAb 1 M1 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00378] Таким образом, второе иллюстративное диатело типа DART-B (CD123-M1) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 177):

[00379] Остатки 1-113 первой полипептидной цепи CD123-M1 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M1 соответствуют домену VH CD3 mAb 1 Ml (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M1 соответствуют способствующей гетеродимеризации «Е-спирали» (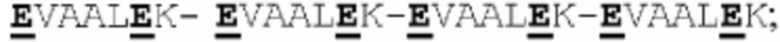 SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M1 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М1 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M1 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М1 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00380] Поскольку домен VL CD3 mAb 1 M1 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M1 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M1 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
3. Третье иллюстративное диатело типа DART-B CD123-M2 (CD123 х CD3 mAb 1 М2)
[00381] Третье иллюстративное диатело типа DART-В является аналогичным описанному выше диателу CD123-M1, однако содержит домен VH CD3 mAb 1 М2 и обозначено «CD123-M2». Как указано выше, CD3 mAb 1 М2 характеризуется большей скоростью диссоциации, чем CD3 mAb 1, и, соответственно, также называется «CD3 mAb 1 Fast». Также, как указано выше, домен VL CD3 mAb 1 М2 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00382] Таким образом, третье иллюстративное диатело типа DART-B (CD123-M2) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 178):

[00383] Остатки 1-113 первой полипептидной цепи CD123-M2 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M2 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M2 соответствуют домену VH CD3 mAb 1 М2 (SEQ ID NO: 59), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M2 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M2 соответствуют способствующей гетеродимеризации «Е-спирали» (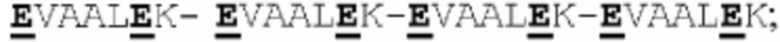 SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M2 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M2 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М2 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M2 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M2 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М2 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00384] Поскольку домен VL CD3 mAb 1 M2 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M2 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M2 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
4. Четвертое иллюстративное диатело типа DART-B CD123-M18 (CD123 х CD3 mAb 1 М18)
[00385] Четвертое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD123-M2, однако содержит домен VH CD3 mAb 1 М18 и обозначено «CD123-M18». Как указано выше, домен VL CD3 mAb 1 М18 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00386] Таким образом, четвертое иллюстративное диатело типа DART-B (CD123-М18) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 179):

[00387] Остатки 1-113 первой полипептидной цепи CD123-M18 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M18 соответствуют домену VH CD3 mAb 1 М18 (SEQ ID NO: 98), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M18 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M18 соответствуют способствующей гетеродимеризации «Е-спирали» ( SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M18 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M18 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00388] Поскольку домен VL CD3 mAb 1 M18 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M18 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M18 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
5. Пятое иллюстративное диатело типа DART-В CD123-M13 (CD123 х CD3 mAb 1 М13)
[00389] Пятое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD123-WT, однако содержит домен VH CD3 mAb 1 М13 и обозначено «CD123-M13». Как указано выше, домен VL CD3 mAb 1 М13 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00390] Таким образом, пятое иллюстративное диатело типа DART-В (CD123-M13) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 198):

[00391] Остатки 1-113 первой полипептидной цепи CD123-M13 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M13 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M13 соответствуют домену VH CD3 mAb 1 М13 (SEQ ID NO: 88), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M13 соответствуют способствующей гетеродимеризации «Е-спирали» ( SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M13 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M13 соответствуют линкеру DKTHTCPPCP (SEQ ID N0:40). Остатки 294-510 первой полипептидной цепи CD123-М13 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M13 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M13 соответствуют линкеру DKTHTCPPCP (SEQ ID N0:40). Остатки 294-510 первой полипептидной цепи CD123-М13 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00392] Поскольку домен VL CD3 mAb 1 M13 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M13 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M1 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
6. Шестое иллюстративное диатело типа DART-B CD123-M17 (CD123 х CD3 mAb 1 M17)
[00393] Шестое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу CD123-WT, однако содержит домен VH CD3 mAb 1 М17 и обозначено «CD123-M17». Как указано выше, домен VL CD3 mAb 1 М17 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00394] Таким образом, шестое иллюстративное диатело типа DART-В (CD123-М17) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 199):

[00395] Остатки 1-113 первой полипептидной цепи CD123-M17 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M17 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M17 соответствуют домену VH CD3 mAb 1 М17 (SEQ ID NO: 96), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M17 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M17 соответствуют способствующей гетеродимеризации «Е-спирали» ( SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M17 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M17 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М17 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M17 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M17 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М17 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00396] Поскольку домен VL CD3 mAb 1 M17 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M17 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M17 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
7. Седьмое иллюстративное диатело типа DART-B CD123-M19 (CD123 х CD3 mAb 1 М19)
[00397] Седьмое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD123-WT, однако содержит домен VH CD3 mAb 1 М19 и обозначено «CD123-M19». Как указано выше, домен VL CD3 mAb 1 М19 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00398] Таким образом, седьмое иллюстративное диатело типа DART-В (CD123-М19) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 200):

[00399] Остатки 1-113 первой полипептидной цепи CD123-M19 соответствуют домену VL CD123 mAb 1 (SEQ ID NO: 163). Остатки 114-121 (дважды подчеркнуты) первой полипептидной цепи CD123-M19 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 122-246 первой полипептидной цепи CD123-M19 соответствуют домену VH CD3 mAb 1 М19 (SEQ ID NO: 100), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 247-252 (подчеркнуты) первой полипептидной цепи CD123-M19 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 253-280 первой полипептидной цепи CD123-M19 соответствуют способствующей гетеродимеризации «Е-спирали» ( SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M19 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М19 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
SEQ ID NO: 29). Остатки 281-283 первой полипептидной цепи CD123-M19 соответствуют линкеру GGG. Остатки 284-293 (подчеркнуты) первой полипептидной цепи CD123-M1 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 294-510 первой полипептидной цепи CD123-М19 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00400] Поскольку домен VL CD3 mAb 1 M19 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD123-M19 такая же, как и последовательность второй полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 175). Аналогично, аминокислотная последовательность третьей полипептидной цепи CD123-M1 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
8. Восьмое иллюстративное диатело типа DART-B 5T4-WT (5Т4 х CD3 mAb 1)
[00401] Восьмое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу CD123-M18, однако содержит связывающий 5Т4 домен вместо связывающего CD123 домена диатела CD123-M18. В дополнение к этому, восьмое иллюстративное диатело типа DART-B содержит домен VH CD3 mAb 1. Указанное восьмое иллюстративное диатело типа DART-В обозначено «5T4-WT».
[00402] Таким образом, восьмое иллюстративное диатело типа DART-В (5T4-WT) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 180):

[00403] Остатки 1-107 первой полипептидной цепи 5T4-WT соответствуют домену VL 5Т4 mAb 1 (SEQ ID NO: 157). Остатки 108-115 (дважды подчеркнуты) первой полипептидной цепи 5T4-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 116-240 первой полипептидной цепи 5T4-WT соответствуют домену VH CD3 mAb 1 (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой глицин (G). Остатки 241-246 (подчеркнуты) первой полипептидной цепи 5T4-WT соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 247-274 первой полипептидной цепи 5T4-WT соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 275-277 первой полипептидной цепи 5T4-WT соответствуют линкеру GGG. Остатки 278-287 (подчеркнуты) первой полипептидной цепи 5T4-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 288-504 первой полипептидной цепи 5T4-WT соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00404] Вторая полипептидная цепь 5T4-WT имеет аминокислотную последовательность (SEQ ID NO: 181):

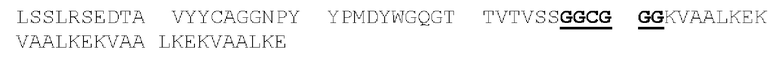
[00405] Остатки 1-110 второй полипептидной цепи 5T4-WT соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи 5T4-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-236 второй полипептидной цепи 5T4-WT соответствуют домену VH 5Т4 mAb 1 (SEQ ID NO: 156). Остатки 237-242 (подчеркнуты) второй полипептидной цепи 5T4-WT соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 243-280 второй полипептидной цепи 5T4-WT соответствуют способствующей гетеродимеризации «К-спирали» (KVAALKE-KVAALKE-KVAALKE-KVAALKE; SEQ ID NO: 30).
[00406] Третья полипептидная цепь 5T4-WT имеет такую же аминокислотную последовательность, что и третья полипептидная цепь диатела CD123-WT (то есть SEQ ID NO: 176).
9. Девятое иллюстративное диатело типа DART-В 5Т4-М1 (5Т4 х CD3 mAb 1 M1)
[00407] Девятое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу 5T4-WT, однако содержит домен VH CD3 mAb 1 M1 и обозначено «5Т4-М1».
[00408] Таким образом, девятое иллюстративное диатело типа DART-B (5Т4-М1) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 182):

[00409] Остатки 1-107 первой полипептидной цепи 5Т4-М1 соответствуют домену VL 5Т4 mAb 1 (SEQ ID NO: 157). Остатки 108-115 (дважды подчеркнуты) первой полипептидной цепи 5Т4-М1 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 116-240 первой полипептидной цепи 5Т4-М1 соответствуют домену VH CD3 mAb 1 M1 (SEQ ID NO: 64), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 241-246 (подчеркнуты) первой полипептидной цепи 5Т4-М1 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 247-274 первой полипептидной цепи 5Т4-М1 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 275-277 первой полипептидной цепи 5Т4-М1 соответствуют линкеру GGG. Остатки 278-287 (подчеркнуты) первой полипептидной цепи 5Т4-М1 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 288-504 первой полипептидной цепи 5Т4-М1 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00410] Поскольку домен VL CD3 mAb 1 M1 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи 5Т4-М1 такая же, как и последовательность второй полипептидной цепи диатела 5T4-WT (то есть SEQ ID NO: 181). Аналогично, аминокислотная последовательность третьей полипептидной цепи 5Т4-М1 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
10. Десятое иллюстративное диатело типа DART-B 5Т4-М2 (5Т4 х CD3 mAb 1 М2)
[00411] Десятое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу 5Т4-М1, однако содержит домен VH CD3 mAb 1 М2 и обозначено «5Т4-М2».
[00412] Таким образом, десятое иллюстративное диатело типа DART-В (5Т4-М2) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 183):

[00413] Остатки 1-107 первой полипептидной цепи 5Т4-М2 соответствуют домену VL 5Т4 mAb 1 (SEQ ID NO: 157). Остатки 108-115 (дважды подчеркнуты) первой полипептидной цепи 5Т4-М2 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 116-240 первой полипептидной цепи 5Т4-М2 соответствуют домену VH CD3 mAb 1 М2 (SEQ ID NO: 66), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 241-246 (подчеркнуты) первой полипептидной цепи 5Т4-М2 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 247-274 первой полипептидной цепи 5Т4-М2 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 275-277 первой полипептидной цепи 5Т4-М2 соответствуют линкеру GGG. Остатки 278-287 (подчеркнуты) первой полипептидной цепи 5Т4-М2 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 288-504 первой полипептидной цепи 5Т4-М2 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00414] Поскольку домен VL CD3 mAb 1 M2 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи 5Т4-М2 такая же, как и последовательность второй полипептидной цепи диатела 5T4-WT (то есть SEQ ID NO: 181). Аналогично, аминокислотная последовательность третьей полипептидной цепи 5Т4-М2 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
11. Одиннадцатое иллюстративное диатело типа DART-В 5Т4-М18 (5Т4 х CD3 mAb 1 M18)
[00415] Одиннадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу 5T4-WT, однако содержит домен VH CD3 mAb 1 М18 и обозначено «5Т4-М18».
[00416] Таким образом, одиннадцатое иллюстративное диатело типа DART-B (5Т4-М18) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 184):


[00417] Остатки 1-107 первой полипептидной цепи 5Т4-М18 соответствуют домену VL 5Т4 mAb 1 (SEQ ID NO: 157). Остатки 108-115 (дважды подчеркнуты) первой полипептидной цепи 5Т4-М18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 116-240 первой полипептидной цепи 5Т4-М18 соответствуют домену VH CD3 mAb 1 М18 (SEQ ID NO: 98), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 241-246 (подчеркнуты) первой полипептидной цепи 5Т4-М18 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 247-274 первой полипептидной цепи 5Т4-М18 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 275-277 первой полипептидной цепи 5Т4-М18 соответствуют линкеру GGG. Остатки 278-287 (подчеркнуты) первой полипептидной цепи 5Т4-М18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 288-504 первой полипептидной цепи 5Т4-М18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00418] Поскольку домен VL CD3 mAb 1 M18 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи 5Т4-М18 такая же, как и последовательность второй полипептидной цепи диатела 5T4-WT (то есть SEQ ID NO: 181). Аналогично, аминокислотная последовательность третьей полипептидной цепи 5Т4-М18 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
12. Двенадцатое иллюстративное диатело типа DART-В ВИЧ-WT (ВИЧ х CD3 mAb 1)
[00419] Двенадцатое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу CD123-WT, однако содержит связывающий ВИЧ домен антитела А32 к ВИЧ вместо связывающего CD123 домена диатела CD123-WT. Указанное двенадцатое иллюстративное диатело типа DART-B обозначено «ВИЧ-WT».
[00420] Таким образом, двенадцатое иллюстративное диатело типа DART-B (ВИЧ-WT) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 185):

[00421] Остатки 1-110 первой полипептидной цепи ВИЧ-WT соответствуют домену VL А32 (SEQ ID NO: 169). Остатки 111-118 (дважды подчеркнуты) первой полипептидной цепи ВИЧ-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-243 первой полипептидной цепи ВИЧ-WT соответствуют домену VH CD3 mAb 1 (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой глицин (G). Остатки 244-248 (подчеркнуты) первой полипептидной цепи ВИЧ-WT соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21; подчеркнуты одной линией). Остатки 249-276 первой полипептидной цепи ВИЧ-WT соответствуют способствующей гетеродимеризации «Е-спирали» (EVAACEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 31). Остатки 277-279 первой полипептидной цепи ВИЧ-WT соответствуют линкеру GGG. Остатки 280-289 (подчеркнуты) первой полипептидной цепи ВИЧ-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40; подчеркнуты одной линией). Остатки 290-506 первой полипептидной цепи ВИЧ-WT соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00422] Вторая полипептидная цепь ВИЧ-WT имеет аминокислотную последовательность (SEQ ID NO: 186):

[00423] Остатки 1-110 второй полипептидной цепи ВИЧ-WT соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи ВИЧ-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-241 второй полипептидной цепи ВИЧ-WT соответствуют домену VH А32 (SEQ ID NO: 209 (то есть SEQ ID NO: 168, где X представляет собой L)). Остатки 242-246 (подчеркнуты) второй полипептидной цепи ВИЧ-WT соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21). Остатки 247-274 второй полипептидной цепи ВИЧ-WT соответствуют способствующей гетеродимеризации «К-спирали» (KVAACKE-KVAALKE-KVAALKE-KVAALKE; SEQ ID NO: 32).
[00424] Третья полипептидная цепь ВИЧ-WT имеет такую же аминокислотную последовательность, что и третья полипептидная цепь диатела CD123-WT (то есть SEQ ID NO: 176).
13. Тринадцатое иллюстративное диатело типа DART-B ВИЧ-М18 (ВИЧ х CD3 mAb 18)
[00425] Тринадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу ВИЧ-WT, однако содержит домен VH CD3 mAb 1 М18. Указанное иллюстративное диатело типа DART-В обозначено «ВИЧ-М18».
[00426] Таким образом, тринадцатое иллюстративное диатело типа DART-B (ВИЧ-MIS) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 196):

[00427] Остатки 1-110 первой полипептидной цепи ВИЧ-М18 соответствуют домену VL А32 (SEQ ID NO: 169). Остатки 111-118 (дважды подчеркнуты) первой полипептидной цепи ВИЧ-М18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-243 первой полипептидной цепи ВИЧ-М18 соответствуют домену VH CD3 mAb 1 M18 (SEQ ID NO:55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой глицин (G). Остатки 244-248 (подчеркнуты) первой полипептидной цепи ВИЧ-М18 соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21; подчеркнуты одной линией). Остатки 249-276 первой полипептидной цепи ВИЧ-М18 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAACEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 31). Остатки 277-279 первой полипептидной цепи ВИЧ-М18 соответствуют линкеру GGG. Остатки 280-289 (подчеркнуты) первой полипептидной цепи ВИЧ-М18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40; подчеркнуты одной линией). Остатки 290-506 первой полипептидной цепи ВИЧ-М18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00428] Поскольку домен VL CD3 mAb 1 M18 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи ВИЧ-М18 такая же, как и последовательность второй полипептидной цепи диатела ВИЧ-WT (то есть SEQ ID NO: 186). Аналогично, аминокислотная последовательность третьей полипептидной цепи ВИЧ-М18 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
14. Четырнадцатое иллюстративное диатело типа DART-В CD19-WT (CD19 х CD3 mAb 1)
[00429] Четырнадцатое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу ВИЧ-WT, однако содержит CD19 mAb 1 вместо связывающего домена А32. Указанное четырнадцатое иллюстративное диатело типа DART-В обозначено «CD19-WT».
[00430] Таким образом, четырнадцатое иллюстративное диатело типа DART-B (CD19-WT) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 191):

[00431] Остатки 1-106 первой полипептидной цепи CD19-WT соответствуют домену VL CD19 mAb 1 (SEQ ID NO: 165). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19-WT соответствуют домену VH CD3 mAb 1 (SEQ ID NO: 55), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой глицин (G). Остатки 240-244 (подчеркнуты) первой полипептидной цепи CD19-WT соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21; подчеркнуты одной линией). Остатки 245-272 первой полипептидной цепи CD19-WT соответствуют способствующей гетеродимеризации «Е-спирали» (EVAACEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 31). Остатки 273-275 первой полипептидной цепи CD19-WT соответствуют линкеру GGG (дважды подчеркнуты). Остатки 276-285 (подчеркнуты одной линией) первой полипептидной цепи CD19-WT соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 286-502 первой полипептидной цепи CD19-WT соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00432] Вторая полипептидная цепь CD19-WT имеет аминокислотную последовательность (SEQ ID NO: 192):

[00433] Остатки 1-110 второй полипептидной цепи CD19-WT соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи CD19-WT соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-238 второй полипептидной цепи CD19-WT соответствуют домену VH CD19 mAb 1 (SEQ ID NO: 164). Остатки 239-243 (подчеркнуты) второй полипептидной цепи CD19-WT соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21). Остатки 244-271 второй полипептидной цепи CD19-WT соответствуют способствующей гетеродимеризации «К-спирали» (KVAACKE-KVAALKE-KVAALKE-KVAALKE; SEQ ID NO: 32).
[00434] Третья полипептидная цепь CD19-WT имеет такую же аминокислотную последовательность, что и третья полипептидная цепь диатела CD123-WT (то есть SEQ ID NO: 176).
15. Пятнадцатое иллюстративное диатело типа DART-B CD19-M18 (CD19 х CD3 mAb 1 M18)
[00435] Пятнадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD19-WT, однако содержит домен VH CD3 mAb 1 М18. Указанное пятнадцатое иллюстративное диатело типа DART-B обозначено «CD19-М18».
[00436] Таким образом, пятнадцатое иллюстративное диатело типа DART-B (CD19-М18) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 197):

[00437] Остатки 1-106 первой полипептидной цепи CD19-M18 соответствуют домену VL CD19 mAb 1 (SEQ ID NO: 165). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19-M18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19-M18 соответствуют домену VH CD3 mAb 1 М18 (SEQ ID NO: 98), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой глицин (G). Остатки 240-244 (подчеркнуты) первой полипептидной цепи CD19-M18 соответствуют линкеру 2 (ASTKG; SEQ ID NO: 21; подчеркнуты одной линией). Остатки 245-272 первой полипептидной цепи CD19-M18 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAACEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 1). Остатки 273-275 первой полипептидной цепи CD19-M18 соответствуют линкеру GGG. Остатки 276-285 (подчеркнуты одной линией) первой полипептидной цепи CD19-М18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 286-502 первой полипептидной цепи CD19-M18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00438] Поскольку домен VL CD3 mAb 1 M18 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD19-M18 такая же, как и последовательность второй полипептидной цепи диатела CD19-WT (то есть SEQ ID NO: 192). Аналогично, третья полипептидная цепь CD19-M18 имеет такую же аминокислотную последовательность, что и третья полипептидная цепь диатела CD123-WT (то есть SEQ ID NO: 176).
16. Шестнадцатое иллюстративное диатело типа DART-В CD19.1-M18 (CD19.1 х CD3 mAb 1 М18)
[00439] Шестнадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD123-M18, однако содержит связывающий CD19 домен, содержащий альтернативный домен VL CD19 mAb 1, вместо связывающего CD123 домена CD123-M18. Указанное иллюстративное диатело типа DART-В обозначено «CD19.1-M18». Как указано выше, домен VL CD3 mAb 1 М18 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00440] Таким образом, шестнадцатое иллюстративное диатело типа DART-B (CD19.1-M18) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 193):

[00441] Остатки 1-106 первой полипептидной цепи CD19.1-M18 соответствуют альтернативному домену VL CD19 mAb 1 (SEQ ID NO: 195). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19.1-M18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19.1-M18 соответствуют домену VH CD3 mAb 1 М18 (SEQ ID NO: 98), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 240-245 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M18 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 246-273 первой полипептидной цепи CD19.1-M18 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 274-276 первой полипептидной цепи CD19-M18 соответствуют линкеру GGG. Остатки 277-286 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M18 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 287-503 первой полипептидной цепи CD19.1-M18 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00442] Вторая полипептидная цепь CD19.1-M18 имеет аминокислотную последовательность (SEQ ID NO: 194):

[00443] Остатки 1-110 второй полипептидной цепи CD19.1-M18 соответствуют домену VL CD3 mAb 1 (SEQ ID NO: 56). Остатки 111-118 (дважды подчеркнуты) второй полипептидной цепи CD19.1-M18 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 119-238 второй полипептидной цепи CD19.1-M18 соответствуют домену VH CD19 mAb 1 (SEQ ID NO: 164). Остатки 239-244 (подчеркнуты одной линией) второй полипептидной цепи CD19.1-M18 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 245-272 второй полипептидной цепи CD19.1-M18 соответствуют способствующей гетеродимеризации «К-спирали» (KVAALKE-KVAALKE-KVAALKE-KVAALKE; SEQ ID NO: 30).
[00444] Аминокислотная последовательность третьей полипептидной цепи CD19.1-М18 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
17. Семнадцатое иллюстративное диатело типа DART-В CD19.1-M13 (CD19.1 х CD3 mAb 1 М13)
[00445] Семнадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD19.1-M18, однако содержит домен VH CD3 mAb 1 М13 и обозначено «CD19.1-M13». Как указано выше, домен VL CD3 mAb 1 М13 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00446] Таким образом, семнадцатое иллюстративное диатело типа DART-B (CD19.1-M13) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 201):

[00447] Остатки 1-106 первой полипептидной цепи CD19.1-M13 соответствуют альтернативному домену VL CD19 mAb 1 (SEQ ID NO: 195). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19.1-M13 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19.1-M18 соответствуют домену VH CD3 mAb 1 М13 (SEQ ID NO: 88), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 240-245 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M13 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 246-273 первой полипептидной цепи CD19.1-M13 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 274-276 первой полипептидной цепи CD19-M13 соответствуют линкеру GGG. Остатки 277-286 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M13 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 287-503 первой полипептидной цепи CD19.1-M13 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00448] Поскольку домен VL CD3 mAb 1 M13 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD19.1-M13 такая же, как и последовательность второй полипептидной цепи диатела CD19.1-M18 (то есть SEQ ID NO: 194). Аминокислотная последовательность третьей полипептидной цепи CD19.1-M13 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
18. Восемнадцатое иллюстративное диатело типа DART-В CD19.1-M17 (CD19.1 х CD3 mAb 1 М17)
[00449] Восемнадцатое иллюстративное диатело типа DART-В является аналогичным описанному выше диателу CD19.1-M18, однако содержит домен VH CD3 mAb 1 М17 и обозначено «CD19.1-M17». Как указано выше, домен VL CD3 mAb 1 М17 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00450] Таким образом, восемнадцатое иллюстративное диатело типа DART-B (CD19.1-M17) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 202):

[00451] Остатки 1-106 первой полипептидной цепи CD19.1-M17 соответствуют альтернативному домену VL CD19 mAb 1 (SEQ ID NO: 195). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19.1-M17 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19.1-M17 соответствуют домену VH CD3 mAb 1 М17 (SEQ ID NO: 96), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 240-245 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M17 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 246-273 первой полипептидной цепи CD19.1-M17 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 274-276 первой полипептидной цепи CD19-M17 соответствуют линкеру GGG. Остатки 277-286 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M17 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 287-503 первой полипептидной цепи CD19.1-M17 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00452] Поскольку домен VL CD3 mAb 1 M17 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD19.1-M17 такая же, как и последовательность второй полипептидной цепи диатела CD19.1-M18 (то есть SEQ ID NO: 194). Аминокислотная последовательность третьей полипептидной цепи CD19.1-M17 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
19. Девятнадцатое иллюстративное диатело типа DART-В CD19.1-M19 (CD19.1 х CD3 mAb 1 М19)
[00453] Девятнадцатое иллюстративное диатело типа DART-B является аналогичным описанному выше диателу CD19.1-M18, однако содержит домен VH CD3 mAb 1 М19 и обозначено «CD19.1-M19». Как указано выше, домен VL CD3 mAb 1 М19 имеет такую же аминокислотную последовательность, что и домен VL CD3 mAb 1.
[00454] Таким образом, девятнадцатое иллюстративное диатело типа DART-B (CD19.1-M19) содержит первую полипептидную цепь, имеющую аминокислотную последовательность (SEQ ID NO: 203):

[00455] Остатки 1-106 первой полипептидной цепи CD19.1-M19 соответствуют альтернативному домену VL CD19 mAb 1 (SEQ ID NO: 195). Остатки 107-114 (дважды подчеркнуты) первой полипептидной цепи CD19.1-M19 соответствуют линкеру 1 (GGGSGGGG; SEQ ID NO: 16). Остатки 115-239 первой полипептидной цепи CD19.1-M19 соответствуют домену VH CD3 mAb 1 М9 (SEQ ID NO: 100), где аминокислота в положении 65 по Кабату (дважды подчеркнута) представляет собой аспартат (D). Остатки 240-245 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M19 соответствуют линкеру 2 (GGCGGG; SEQ ID NO: 17). Остатки 246-273 первой полипептидной цепи CD19.1-M19 соответствуют способствующей гетеродимеризации «Е-спирали» (EVAALEK-EVAALEK-EVAALEK-EVAALEK; SEQ ID NO: 29). Остатки 274-276 первой полипептидной цепи CD19-M19 соответствуют линкеру GGG. Остатки 277-286 (подчеркнуты одной линией) первой полипептидной цепи CD19.1-M19 соответствуют линкеру DKTHTCPPCP (SEQ ID NO: 40). Остатки 287-503 первой полипептидной цепи CD19.1-M19 соответствуют имеющему «выступ» домену СН2-СН3 IgG1 (SEQ ID NO: 48).
[00456] Поскольку домен VL CD3 mAb 1 M19 такой же, как и домен VL CD3 mAb 1, аминокислотная последовательность второй полипептидной цепи CD19.1-M19 такая же, как и последовательность второй полипептидной цепи диатела CD19.1-M18 (то есть SEQ ID NO: 194). Аминокислотная последовательность третьей полипептидной цепи CD19.1-M13 такая же, как и последовательность третьей полипептидной цепи диатела CD123-WT (то есть SEQ ID NO: 176).
[00457] Дополнительные конкретно рассматриваемые диатела типа DART-B CD19 х CD3 являются аналогичными описанному выше CD19-WT (см. четырнадцатое иллюстративное диатело типа DART-В), однако будут содержать домен VH CD3 mAb 1 М13, М17 или М19. Такие диатела будут содержать первую полипептидную цепь, имеющую одну из следующих аминокислотных последовательностей:
[00458] SEQ ID NO: 204 для такого диатела, содержащего домен VH CD3 mAb 1 М13:

[00459] SEQ ID NO: 205 для такого диатела, содержащего домен VH CD3 mAb 1 М17:

[00460] SEQ ID NO: 206 для такого диатела, содержащего домен VH CD3 mAb 1 М19:

[00461] Вторые полипептидные цепи таких диател будут иметь такую же аминокислотную последовательность, что и CD19-WT (то есть SEQ ID NO: 192), и третьи полипептидные цепи таких диател будут иметь такую же аминокислотную последовательность, что и третья полипептидная цепь CD123-WT (то есть SEQ ID NO: 176).
[00462] Как будет понятно с учетом настоящего раскрытия, дополнительные диатела типа DART-B, имеющие сайт связывания для альтернативных относящихся к заболеванию антигенов и/или имеющие связывающие CD3 домены альтернативных вариантных антител к CD3 (то есть в. связывающие CD3 домены), могут быть сконструированы схожим образом (с применением доменов VL и VH таких антител). Аналогично, в соответствии с настоящей заявкой, схожим образом могут быть сконструированы альтернативные молекулы типа DART-B, содержащие альтернативные линкеры и/или альтернативные способствующие гетеродимеризации домены.
[00463] В дополнение к этому, иллюстративные молекулы, способные опосредовать перенаправленное уничтожение клетки, экспрессирующей относящийся к заболеванию антиген (например, опухолевой клетки), которые могут применяться в соответствии со способами согласно настоящему изобретению, включают биспецифичные молекулы, которые способны связывать: CD19 и CD3 (см., например, патент США №7,235,641 и WO 2016/048938); CD123 и CD3 (см., например, Kuo, S.R. et al., (2012) "Engineering a CD123xCD3 Bispecific scFv Immunofusion For The Treatment Of Leukemia And Elimination Of Leukemia Stem Cells" Protein Eng Des Sel. 25:561-9; WO 2015/026892; WO 2016/086189); gpA33 и CD3 (например, WO 2015/026894); CEA и CD3 (например, WO 2013/012414; WO 2017/118675); B7-H3 и CD3 (например, WO 2017/030926); HER2 и CD3 (например, WO 2012/143524); 5T4 и CD3 (например, WO 2015/184203 и WO 2013/041687), и другие молекулы, имеющие связывающий CD3 домен (см., например, WO 2013/026835, WO 2013/158856, WO 2014/110601, WO 2016/182751, WO 2017/053469 и т.д.). Как будет понятно с учетом настоящего раскрытия, в такие молекулы могут быть включены в. связывающие CD3 домены согласно настоящему изобретению.
С. Молекулы типа TRIVALENT
[00464] Молекулы типа TRIVALENT представляют собой трехвалентные молекулы, которые способны связывать до трех различных эпитопов. В частности, молекулы типа TRIVALENT согласно настоящему изобретению способны связывать CD3 и относящийся к заболеванию антиген (например, раковый или относящийся к инфекционному заболеванию антиген) и также могут связывать дополнительный антиген, такой как дополнительный относящийся к заболеванию антиген (например, раковый или относящийся к инфекционному заболеванию антиген) или дополнительный антиген, экспрессируемый на поверхности эффекторной клетки (например, CD8), или могут связываться со вторым эпитопом CD3 или вторым эпитопом относящегося к заболеванию антигена. Молекулы типа TRIVALENT содержат Fc-домен. В настоящей заявке представлены иллюстративные диатела типа TRIVALENT, состоящие из четырех полипептидных цепей и имеющие один сайт связывания для CD3, один сайт связывания для ракового антигена CD123 или для ракового антигена 5Т4 и один сайт связывания для CD8 (см., например, Фигуру 6А). Иллюстративные молекулы типа TRIVALENT согласно настоящему изобретению получены с применением первой и второй полипептидных цепей диател типа DART-В, представленных выше, в сочетании с иллюстративными третьей и четвертой полипептидными цепями, представленными ниже, которые образуют связывающий CD8 домен. Первая и вторая полипептидные цепи образуют связывающие CD3 и DA домены, тогда как третья и четвертая полипептидные цепи образуют связывающий CD8 домен. Первая и третья полипептидные цепи образуют Fc-домен.
[00465] Каждая из иллюстративных молекул типа TRIVALENT, представленных ниже, содержит третью полипептидную цепь, имеющую аминокислотную последовательность SEQ ID NO: 187:

[00466] Остатки 1-121 третьей полипептидной цепи таких иллюстративных молекул типа TRIVALENT соответствуют домену VH антитела к CD8 TRX2 (SEQ ID NO: 120). Остатки 121-219 третьей полипептидной цепи такой иллюстративной молекулы типа TRIVALENT соответствуют домену CH1 IgG1 (SEQ ID NO: 1). Остатки 220-234 третьей полипептидной цепи такой иллюстративной молекулы типа TRIVALENT соответствуют шарнирному домену IgG1 (SEQ ID NO: 5). Остатки 235-451 соответствуют имеющему «впадину» домену СН2-СН3 IgG1 (SEQ ID NO: 50).
[00467] Каждая из иллюстративных молекул типа TRIVALENT, описанных ниже, содержит четвертую полипептидную цепь, имеющую аминокислотную последовательность SEQ ID NO: 188:

[00468] Остатки 1-106 четвертой полипептидной цепи таких иллюстративных молекул типа TRIVALENT соответствуют домену VL антитела к CD8 TRX2 (SEQ ID NO: 121). Остатки 107-213 соответствуют домену CL каппа (SEQ ID NO: 14).
[00469] Последовательности (SEQ ID NO) полипептидных цепей иллюстративных молекул типа TRIVALENT приведены в таблице 10.
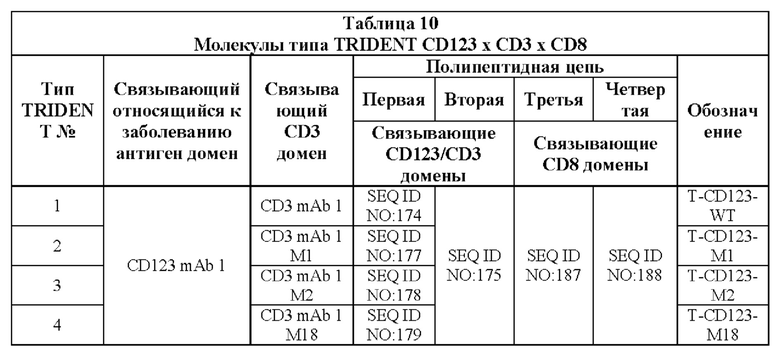
1. Первая иллюстративная молекула типа TRIVALENT Т-CD123-WT (CD123 mAb 1 х CD3 mAb 1 х TRX2)
[00470] Первая иллюстративная молекула типа TRIVALENT (обозначенная «Т-CD123-WT») содержит домены VH и VL CD123 mAb 1, домены VH и VL CD3 mAb 1 и домены VH и VL антитела к CD8 TRX2. Как указано выше, аминокислотная последовательность первой полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-WT (SEQ ID NO: 174). Аналогично, аминокислотная последовательность второй полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-WT (SEQ ID NO: 175). Также, как указано выше, аминокислотные последовательности третьей и четвертой полипептидных цепей всех иллюстративных молекул типа TRIVALENT представляют собой SEQ ID NO:187 и SEQ ID NO: 188, соответственно.
2. Вторая иллюстративная молекула типа TRIVALENT T-CD123-M1 (CD123 mAb 1 х CD3 mAb 1 M1 х TRX2)
[00471] Вторая иллюстративная молекула типа TRIVALENT (обозначенная «Т-CD123-M1») содержит домены VH и VL CD123 mAb 1, домены VH и VL CD3 mAb 1 M1 и домены VH и VL TRX2. Как указано выше, аминокислотная последовательность первой полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-M1 (SEQ ID NO: 177). Аналогично, аминокислотная последовательность второй полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-WT (SEQ ID NO: 175). Также, как указано выше, аминокислотные последовательности третьей и четвертой полипептидных цепей всех иллюстративных молекул типа TRIVALENT представляют собой SEQ ID NO: 187 и SEQ ID NO: 188, соответственно.
3. Третья иллюстративная молекула типа TRIVALENT T-CD123-M2 (CD123 mAb 1 х CD3 mAb 1 М2 х TRX2)
[00472] Третья иллюстративная молекула типа TRIVALENT, обозначенная Т-CD123-M2, связывает содержит домены VH и VL CD123 mAb 1, домены VH и VL CD3 mAb 1 М2 и домены VH и VL TRX2. Как указано выше, аминокислотная последовательность первой полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-M2 (SEQ ID NO: 178). Аналогично, аминокислотная последовательность второй полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-WT (SEQ ID NO:175). Также, как указано выше, аминокислотные последовательности третьей и четвертой полипептидных цепей всех иллюстративных молекул типа TRIVALENT представляют собой SEQ ID NO: 187 и SEQ ID NO: 188, соответственно.
4. Четвертая иллюстративная молекула типа TRIVALENT T-CD123-M18 (CD123 mAb 1 х CD3 mAb 1 М18 х TRX2)
[00473] Четвертая иллюстративная молекула типа TRIVALENT, обозначенная Т-CD123-M18, связывает содержит домены VH и VL CD123 mAb 1, домены VH и VL CD3 mAb 1 М18 и домены VH и VL TRX2. Как указано выше, аминокислотная последовательность первой полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-M18 (SEQ ID NO: 179). Аналогично, аминокислотная последовательность второй полипептидной цепи такая же, как и соответствующая последовательность описанного выше диатела CD123-WT (SEQ ID NO: 175). Также, как указано выше, аминокислотные последовательности третьей и четвертой полипептидных цепей всех иллюстративных молекул типа TRIVALENT представляют собой SEQ ID NO: 187 и SEQ ID NO: 188, соответственно.
[00474] Как будет понятно с учетом настоящего раскрытия, дополнительные диатела типа TRIVALENT, имеющие сайт связывания для альтернативных относящихся к заболеванию антигенов и/или имеющие связывающие CD3 домены альтернативных вариантных антител к CD3 (то есть в. связывающие CD3 домены), могут быть сконструированы схожим образом (с применением доменов VL и VH таких антител). Аналогично, в соответствии с настоящей заявкой, схожим образом могут быть сконструированы альтернативные молекулы типа TRIVALENT, содержащие альтернативные линкеры и/или альтернативные способствующие гетеродимеризации домены.
[00475] В дополнение к этому, иллюстративные молекулы, способные опосредовать перенаправленное уничтожение клетки, экспрессирующей относящийся к заболеванию антиген (например, опухолевой клетки), которые могут быть применены в соответствии со способами согласно настоящему изобретению, включают трехвалентные молекулы, которые способны связывать: В7-Н3, CD3 и CD8 (см., например, WO 2015/184203); 5Т4, CD3 и CD8 (см., например, WO 2015/184203); ROR1, CD3 и CD8 (см., например, WO 2015/184203 и WO 2017/106061); ВИЧ, CD3 и CD8 (см., например, WO 2015/184203; WO2017/011413 и WO2017/011414); gpA33, CD3 и DR5 (см., например, WO 2015/184207); EphA2, CD3 и DR5 (см., например, WO 2015/184207); gpA33, CD3 и EphA2 (см., например, WO 2015/184207) и другие трехвалентные молекулы (см., например, WO 2016/105450; WO 2016/115274; WO 2017/180913). Как будет понятно с учетом настоящего раскрытия, в такие молекулы могут быть включены в. связывающие CD3 домены согласно настоящему изобретению.
VIII. Способы получения
[00476] Молекулы согласно настоящему изобретению наиболее предпочтительно получают с помощью методов рекомбинантной экспрессии молекул нуклеиновых кислот, которые кодируют такие полипептиды, хорошо известных в данной области техники.
[00477] Полипептиды согласно настоящему изобретению могут быть легко получены с применением твердофазного пептидного синтеза (Merrifield, В. (1986) «Solid Phase Synthesis», Science 232(4748): 341-347; Houghten, R.A. (1985) «General Method For The Rapid Solid-Phase Synthesis Large Numbers Of Peptides: Specificity Of Antigen-Antibody Interaction At The Level Of Individual Amino Acids», Proc. Natl. Acad. Sci. (U.S.A.) 82(15):5131-5135; Ganesan, A. (2006) «Solid-Phase Synthesis In The Twenty-First Century», Mini Rev. Med. Chem. 6(1):3-10).
[00478] Антитела могут быть получены рекомбинантно и экспрессированы с применением любого способа, известного в данной области техники. Антитела могут быть получены рекомбинантно путем первичного выделения антител, полученных от животных-хозяев, получения последовательности гена и использования полученной последовательности гена для рекомбинантной экспрессии антитела в клетках-хозяевах (например, клетках СНО). Другой способ, который может быть применен, представляет собой экспрессию последовательности антитела в растениях (например, табаке) или молоке трансгенных животных. Описаны подходящие способы рекомбинантной экспрессии антител в растениях или молоке (см., например, Peeters et al. (2001) «Production Of Antibodies and Antibody Fragments In Plants», Vaccine 19:2756; Lonberg, N. et al. (1995) «Human Antibodies From Transgenic Mice», Int. Rev. Immunol 13:65-93; и Pollock et al. (1999) «Transgenic Milk As A Method For The Production Of Recombinant Antibodies», J. Immunol. Methods 231:147-157). Подходящие способы для получения производных антител, например, гуманизированных, одноцепочечных и других, известны в данной области техники и были описаны выше. В другом варианте антитела могут быть получены рекомбинантно с применением технологии фагового дисплея (см., например, патенты США №5,565,332; 5,580,717; 5,733,743; 6,265,150 и Winter, G. et al. (1994) «Making Antibodies By Phage Display Technology», Annu. Rev. Immunol. 12.433-455).
[00479] Векторы, содержащие рассматриваемые полинуклеотиды (например, полинуклеотиды, кодирующие полипептидные цепи связывающих молекул согласно настоящему изобретению), могут быть введены в клетку-хозяина с применением любого из множества подходящих способов, включая электропорацию, трансфекцию с применением хлорида кальция, хлорида рубидия, фосфата кальция, ДЭАЭ-декстрана или иных веществ, бомбардировку микрочастицами, липофекцию и инфекцию (например, в случае, если вектор представляет собой инфекционный агент, такой как вирус осповакцины). Выбор вводимых векторов или полинуклеотидов часто зависит от свойств клетки-хозяина.
[00480] Любая клетка-хозяин, способная к сверхэкспрессии гетерологичных ДНК, может быть использована с целью экспрессии необходимого полипептида или белка. Неограничивающие примеры подходящих клеток-хозяев млекопитающих включают, но не ограничиваются ими, клетки COS, HeLa и СНО.
[00481] Настоящее изобретение включает полипептиды, содержащие аминокислотную последовательность связывающей молекулы согласно настоящему изобретению. Полипептиды согласно настоящему изобретению могут быть получены с помощью методик, известных в данной области техники. Полипептиды могут быть получены путем протеолитического или иного расщепления антител, рекомбинантными методами (то есть отдельные или слитые полипептиды), как описано выше, или путем химического синтеза. Полипептиды антител, в особенности более короткие полипептиды, содержащие примерно до 50 аминокислот, легко получают путем химического синтеза. Способы химического синтеза известны в данной области техники и являются коммерчески доступными.
[00482] Настоящее изобретение включает варианты описанных связывающих молекул, включая функционально эквивалентные полипептиды, которые не оказывают существенного влияния на свойства таких молекул, а также варианты, которые обладают повышенной или сниженной активностью. Модификация полипептидов является устоявшейся практикой в данной области техники и не требует подробного раскрытия в настоящей заявке. Примеры модифицированных полипептидов включают полипептиды с консервативными заменами аминокислотных остатков, одним или более исключениями или добавлениями аминокислот, которые не приводят к существенному нежелательному изменению функциональной активности, или применение химических аналогов. Аминокислотные остатки, которые могут быть консервативно заменены один на другой, включают, но не ограничиваются ими: глицин/аланин, серин/треонин, валин/изолейцин/лейцин, аспарагин/глутамин, аспарагиновая кислота/глутаминовая кислота, лизин/аргинин и фенилаланин/тирозин. Эти полипептиды также включают гликозилированные и негликозилированные полипептиды, а также полипептиды с иными посттрансляционными модификациями, такими как, например, гликозилирование различными сахарами, ацетилирование и фосфорилирование. Предпочтительно, чтобы аминокислотные замены были консервативными, то есть чтобы заменяющая аминокислота обладала химическими свойствами, схожими со свойствами исходной аминокислоты. Такие консервативные замены известны в данной области техники, и примеры были приведены выше. Модификации аминокислот могут варьироваться от изменения или модификации одной или более аминокислот до полной реконструкции области, такой как вариабельный домен. Изменения в вариабельном домене могут изменять аффинность и/или специфичность связывания. Другие способы модификации включают применение методик пришивки, известных в данной области техники, включая, но не ограничиваясь ими, способы с применением ферментов, окислительное замещение и хелатирование. Модификации могут быть применены, например, для присоединения меток для иммуноанализа, как то присоединение радиоактивных фрагментов для радиоиммуноанализа. Модифицированные полипептиды получают с применением методик, принятых в данной области техники, и для их скрининга могут быть использованы стандартные методы анализа, известные в данной области техники.
[00483] В одном из вариантов реализации представлен слитый полипептид, который содержит легкую цепь, тяжелую цепь или как легкую, так и тяжелую цепь. В другом варианте реализации слитый полипептид содержит гетерологичную константную область иммуноглобулина. В другом варианте реализации слитый полипептид содержит домены VH и VL антитела, получаемого с помощью открыто размещенной (publicly-deposited) гибридомы. Для целей настоящего изобретения слитый белок антитела содержит один или более полипептидных доменов, которые специфично связываются либо с CD3, либо и с CD3, и с относящимся к заболеванию антигеном, а также содержит другую аминокислотную последовательность, к которой он не присоединен в нативной молекуле, например, гетерологичную последовательность или гомологичную последовательность из другой области.
[00484] Настоящее изобретение, в частности, охватывает такие связывающие молекулы (например, антитела, диатела, трехвалентные связывающие молекулы и так далее), которые конъюгированы с диагностическим или терапевтическим фрагментом. Для диагностических целей связывающие молекулы согласно настоящему изобретению могут быть соединены с обнаруживаемым веществом. Такие связывающие молекулы пригодны для мониторинга и/или прогнозирования развития или прогрессирования заболевания в составе методики клинического анализа, такой как определение эффективности конкретной терапии. Примеры обнаруживаемых веществ включают различные ферменты (например, пероксидазу хрена, бета-галактозидазу и так далее), простетические группы (например, авидин/биотин), флуоресцентные вещества (например, умбеллиферон, флуоресцеин или фикоэритрин), люминесцентные вещества (например, люминол), биолюминесцентные вещества (например, люцеферазу или экворин), радиоактивные вещества (например, углерод-14, марганец-54, стронций-85 или цинк-65), позитронно-активные металлы и нерадиоактивные парамагнитные ионы металлов. Обнаруживаемые вещества могут быть соединены или конъюгированы либо непосредственно со связывающей молекулой, либо опосредованно, через промежуточное соединение (например, линкер) с применением методик, известных в данной области техники.
[00485] Для терапевтических целей связывающие молекулы согласно настоящему изобретению могут быть конъюгированы с терапевтическим фрагментом, таким как цитотоксин (например, цитостатический или цитоцидный агент), терапевтический агент или радиоактивный ион металла, например, вещества, излучающие альфа-частицы. Цитотоксин, или цитотоксический агент, включает любой агент, который губителен для клеток, такой как, например, экзотоксин синегнойной палочки (Pseudomonas), дифтерийный токсин, ботулотоксин от А до F, рицин, абрин, сапорин и цитотоксические фрагменты таких агентов. Терапевтический агент включает любой агент, имеющий терапевтический эффект для профилактического или терапевтического воздействия при расстройстве. Такие терапевтические агенты могут представлять собой химические терапевтические агенты, белковые или полипептидные терапевтические агенты, и включают терапевтические агенты, которые обладают желаемой биологической активностью и/или модифицируют рассматриваемый биологический ответ. Примеры терапевтических агентов включают алкилирующие агенты, ингибиторы ангиогенеза, противомитотические агенты, агенты гормональной терапии и антитела, пригодные для лечения клеточно-пролиферативных расстройств. Терапевтический фрагмент может быть соединен или конъюгирован либо непосредственно со связывающей молекулой, либо опосредованно, через промежуточное соединение (например, линкер) с применением методик, известных в данной области техники.
IX. Применение связывающих молекул согласно настоящему изобретению
[00486] Как описано выше, молекулы, которые могут связывать CD3 и относящийся к заболеванию антиген, способны опосредовать перенаправленное уничтожение клетки-мишени (то есть раковой клетки или клетки, инфицированной патогеном), которая экспрессирует соответствующий относящийся к заболеванию антиген на своей клеточной поверхности. Такие молекулы могут быть применены для терапевтических целей, например, у субъектов с раком или инфекцией. Таким образом, связывающие молекулы согласно настоящему изобретению пригодны для лечения любого заболевания или состояния, связанных с экспрессией относящегося к заболеванию антигена, в частности, ракового антигена или ассоциированного с патогеном антигена, на поверхности такой клетки-мишени, или характеризующихся такой экспрессией. Таким образом, без ограничения, связывающие молекулы согласно настоящему изобретению могут быть применены при лечении рака, в частности, рака, характеризующегося экспрессией ракового антигена. Связывающие молекулы согласно настоящему изобретению могут быть применены при лечении инфекции, в частности, инфекции, характеризующейся экспрессией ассоциированного с патогеном антигена.
[00487] В частности, настоящее изобретение охватывает такие способы, в которых указанная молекула, способная связывать CD3, содержит эпитоп-связывающий домен антитела, которое способно связывать CD3, а также содержит эпитоп-связывающий домен, способный связывать относящийся к заболеванию антиген (в частности, раковый антиген или ассоциированный с патогеном антиген) на поверхности клетки-мишени таким образом, чтобы опосредовать перенаправленное уничтожение клетки-мишени (например, путем опосредования перенаправленного уничтожения клеток (например, перенаправленной Т-клеточной цитотоксичности)).
[00488] В конкретном варианте реализации молекула, способная связывать CD3 и относящийся к заболеванию антиген, представляет собой биспецифичное антитело или молекулу, содержащую его эпитоп-связывающие домены (включая биспецифичный scFv, BiTe, TandAb).
[00489] В конкретном варианте реализации молекула, способная связывать CD3 и относящийся к заболеванию антиген, представляет собой биспецифичное диатело.
[00490] В конкретном варианте реализации молекула, способная связывать CD3 и относящийся к заболеванию антиген, представляет собой трехвалентную связывающую молекулу.
[00491] «Проведение терапии», или «лечение», относится к любому введению композиции, которое связано с любым признаком благоприятного или желаемого результата, включая, без ограничения, любой клинический результат, такой как уменьшение симптомов, являющихся следствием заболевания, ослабление симптома инфекции (например, вирусной нагрузки, лихорадки, боли, сепсиса и так далее), уменьшение размера опухоли (в контексте ракового заболевания, например, опухоли молочной железы, рака желудочно-кишечного тракта или рака предстательной железы), замедление роста раковых клеток, задержка начала, развития или прогрессирования метастазирования, уменьшение симптома, являющегося следствием заболевания, повышение качества жизни субъекта-реципиента, снижение дозы иных лекарственных средств, предназначенных для лечения заболевания у субъекта, усиление эффекта другого лекарственного средства, в частности путем нацеливания и/или интернализации, задержка прогрессирования заболевания и/или продление выживаемости субъекта-реципиента.
[00492] Субъекты для получения терапии включают животных, наиболее предпочтительно виды млекопитающих, такие как не являющиеся приматами (например, крупный рогатый скот, лошадиные, кошачьи, псовые, грызуны и так далее) или являющиеся приматами (например, мартышка, такая как яванский макак, человек и так далее). В предпочтительном варианте реализации субъектом является человек.
[00493] Иллюстративные расстройства, которые могут быть подвергнуты лечению с применением различных вариантов реализации настоящего изобретения, включают, но не ограничиваются ими, пролиферативные расстройства, клеточно-пролиферативные расстройства и рак (в частности, рак с экспрессией ракового антигена, связываемого молекулой, способной опосредовать перенаправленное уничтожение клетки), ассоциированные с патогеном заболевания (в частности, хронические вирусные инфекции, связанные с экспрессией ассоциированного с патогеном антигена, связываемого молекулой, способной опосредовать перенаправленное уничтожение клетки). В различных вариантах реализации настоящее изобретение охватывает способы и композиции для лечения, предотвращения или контроля заболевания или расстройства у субъекта, включая введение субъекту терапевтически эффективного количества связывающих молекул согласно настоящему изобретению. Такие молекулы, в частности, пригодны для предотвращения, подавления, снижения роста или регрессии первичных опухолей и метастазов опухолей, а также для снижения патогенной нагрузки или уничтожения клеток, инфицированных патогеном. Без ограничения конкретным механизмом действия, такие молекулы могут опосредовать эффекторную функцию, направленную против клеток-мишеней, стимулировать активацию иммунной системы против клеток-мишеней, обеспечивать перекрестное связывание антигенов клеточной поверхности и/или рецепторов на клетках-мишенях и усиливать апоптоз или передачу сигналов отрицательной регуляции роста, или обеспечивать комбинацию указанного, приводя к устранению и/или снижению количества клеток-мишеней.
[00494] Раковые заболевания, которые могут быть подвергнуты лечению молекулами согласно настоящему изобретению и способами согласно настоящему изобретению, включают, но не ограничиваются ими: рак надпочечников, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, глиобластому, рак почки, немелкоклеточный рак легкого, раковое заболевание системы крови, множественную миелому, меланому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак кожи, почечно-клеточную карциному, рак яичка и рак матки.
[00495] В частности, связывающие CD 19 × CD3 молекулы, связывающие CD 19 × CD3 × CD8 молекулы, связывающие CD 123 × CD3 молекулы и связывающие CD 123 × CD3 × CD8 молекулы согласно настоящему изобретению могут быть применены при лечении ракового заболевания системы крови, включая, но не ограничиваясь ими: острый миелоидный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), миелодиспластический синдром (МДС), острый В-лимфобластный лейкоз (B-ALL), хронический лимфоцитарный лейкоз (ХЛЛ), включая синдром Рихтера или трансформацию ХЛЛ Рихтера, волосатоклеточный лейкоз (ВКЛ), бластную плазмацитоидную дендритно-клеточную неоплазию (БПДКН), неходжкинскую лимфому (НХЛ), включая мантийноклеточную лимфому (МКЛ) и мелкоклеточную лимфоцитарную лимфому (МЛЛ), лимфому Ходжкина, системный мастоцитоз и лимфому Беркитта.
[00496] Ассоциированные с патогеном заболевания, которые могут быть подвергнуты лечению связывающими LAG-3 молекулами согласно настоящему изобретению, включают хронические вирусные, бактериальные, грибковые и паразитарные инфекции. Хронические инфекции, которые могут быть подвергнуты лечению связывающими LAG-3 молекулами согласно настоящему изобретению, включают вирус Эпштейна-Барр, вирус гепатита A (HAV); вирус гепатита В (HBV); вирус гепатита С (HCV); вирусы герпеса (например, HSV-1, HSV-2, HHV-6, CMV), вирус иммунодефицита человека (ВИЧ), вирус везикулярного стоматита (ВВС), Bacilli, Citrobacter, Cholera, Diphtheria, Enterobacter, Gonococci, Helicobacter pylori, Klebsiella, Legionella, Meningococci, микобактерии, Pseudomonas, Pneumonococci, риккетсии, Salmonella, Serratia, Staphylococci, Streptococci, Tetanus, Aspergillus (fumigatus, niger и так далее), Blastomyces dermatitidis, Candida (albicans, krusei, glabrata, tropicalis и так далее), Cryptococcus neoformans, род Mucorales (mucor, absidia, rhizopus), Sporothrix schenkii, Paracoccidioides brasiliensis, Coccidioides immitis, Histoplasma capsulatum, Leptospirosis, Borrelia burgdorferi, паразитов-гельминтов (нематоду, ленточных червей, сосальщиков, плоских червей (например, Schistosomia), Giardia Iambi a, trichinella, Dientamoeba Fragilis, Trypanosoma brucei, Trypanosoma cruzi и Leishmania donovani).
X. Фармацевтические композиции
[00497] Настоящее изобретение охватывает композиции, содержащие молекулу, способную связывать CD3, а также способную связываться с относящимся к заболеванию антигеном (например, связывающую DA × CD3 молекулу, включая, например, связьшающую DA × CD3 × CD8 молекулу, связывающую DA × CD3 × DA молекулу и так далее). Композиции согласно настоящему изобретению включают нерасфасованные лекарственные композиции, пригодные для получения фармацевтических композиций (например, неочищенные или нестерильные композиции), и фармацевтические композиции (то есть композиции, которые подходят для введения субъекту или пациенту), которые могут быть применены для приготовления единичных лекарственных форм. Такие композиции содержат профилактически или терапевтически эффективное количество молекулы, способной связывать CD3, а также способной связывать относящийся к заболеванию антиген таким образом, чтобы обеспечить возможность опосредования перенаправленного уничтожения клеток-мишеней (например, раковой клетки, инфицированной патогеном клетки и так далее), или комбинации таких агентов и фармацевтически приемлемого носителя. Предпочтительно композиции согласно настоящему изобретению содержат профилактически или терапевтически эффективное количество связывающих молекул согласно настоящему изобретению и фармацевтически приемлемый носитель. В предпочтительном аспекте такие композиции являются по существу очищенными (то есть по существу свободными от веществ, которые ограничивают их эффект или вызывают нежелательные побочные эффекты).
[00498] Различные составы таких композиций могут быть применены для введения. Помимо фармакологически активного агента (агентов), композиции согласно настоящему изобретению могут содержать подходящие фармацевтически приемлемые носители, содержащие вспомогательные вещества и дополнительные вещества, которые широко известны в данной области техники и являются относительно инертными веществами, которые облегчают введение фармакологически эффективного вещества или способствуют приготовлению из активных соединений в ходе технологического процесса лекарственных препаратов, которые могут быть фармацевтически применены для доставки в место действия. Например, вспомогательное вещество может придавать форму или консистенцию, или выполнять функцию разбавителя. Подходящие вспомогательные вещества включают, но не ограничиваются ими, стабилизирующие агенты, смачивающие и эмульгирующие агенты, соли для изменения осмолярности, инкапсулирующие агенты, буферы и усилители проникновения через кожу.
[00499] В конкретном варианте реализации термин «фармацевтически приемлемый» означает одобренный регулирующим органом федеральной или региональной власти или приведенный в Фармакопее США или иной общепризнанной фармакопее для применения у животных, и в более конкретном случае у людей. Термин «носитель» относится к разбавителю, адъюванту (например, адъюванту Фрейнда (полному и неполному), вспомогательному веществу или среде, с которой вводят терапевтический агент. В общем случае компоненты композиции согласно настоящему изобретению поставляются либо отдельно, либо в виде смеси в единичной лекарственной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметично закрытой емкости, такой как ампула или саше, с указанием количества активного агента. В случае, если композиция предназначена для введения путем инфузии, она может быть отпущена совместно с инфузионным флаконом, содержащим стерильную воду или физиологический раствор фармацевтической степени чистоты. В случае, если композицию вводят путем инъекции, в комплект поставки может входить ампула со стерильной водой для инъекций или физиологическим раствором, чтобы компоненты могли быть смешаны перед введением.
[00500] В настоящем изобретении также предложена фармацевтическая упаковка или набор, содержащие одну или более емкостей, наполненных связывающей молекулой согласно настоящему изобретению, отдельно или совместно с соответствующим фармацевтически приемлемым носителем. Дополнительно в фармацевтическую упаковку или набор также могут быть включены один или более других профилактических или терапевтических агентов, пригодных для лечения заболевания. В настоящем изобретении также предложена фармацевтическая упаковка или набор, содержащие одну или более емкостей, наполненных одним или более компонентами фармацевтической композиции согласно настоящему изобретению. Совместно с такой емкостью (емкостями) необязательно может находиться пояснение в форме, предписанной государственным органом, регулирующим производство, применение или продажу лекарственных средств или биологических продуктов, отражающее одобрение указанным органом производства, применения или продажи для введения человеку.
[00501] В настоящем изобретении предложены наборы, которые можно применять указанными выше способами. Набор может содержать любую из связывающих молекул согласно настоящему изобретению. Набор может дополнительно содержать один или более других профилактических и/или терапевтических агентов, пригодных для лечения рака, в одной или более емкостях.
XI. Способы введения
[00502] Композиции согласно настоящему изобретению могут быть предложены для лечения, профилактики и облегчения одного или более симптомов, связанных с заболеванием, расстройством или инфекцией, путем введения субъекту эффективного количества фармацевтических композиций согласно настоящему изобретению. В предпочтительном аспекте такие композиции являются по существу очищенными (то есть по существу свободными от веществ, которые ограничивают их эффект или вызывают нежелательные побочные эффекты). В конкретном варианте реализации субъект представляет собой животное, предпочтительно млекопитающее, такое как не являющееся приматом (например, крупный рогатый скот, лошадиные, кошачьи, псовые, грызуны и так далее) или являющееся приматом (например, мартышка, такая как яванский макак, человек и так далее). В предпочтительном варианте реализации субъектом представляет собой человека.
[00503] Способы введения связывающей молекулы или композиции согласно настоящему изобретению включают, но не ограничиваются ими, парентеральное введение (например, внутрикожное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение и введение через слизистые оболочки (например, интраназальный и пероральный пути). В конкретном варианте реализации связывающие молекулы согласно настоящему изобретению вводят внутримышечно, внутривенно или подкожно. Композиции могут быть введены любым удобным путем, например, путем инфузии или болюсной инъекции, путем абсорбции через эпителиальный покров или через кожный покров и слизистые оболочки (например, слизистую оболочку полости рта, слизистую оболочку прямой кишки или тонкого кишечника и так далее), и могут быть введены совместно с другими биологически активными агентами. Введение может быть системным или местным.
[00504] В настоящем изобретении также предусмотрено, что препараты связывающих молекул согласно настоящему изобретению упаковывают в герметично закрытую емкость, такую как ампула или саше, с указанием количества молекулы. В одном из вариантов реализации такие молекулы поставляют в виде сухого стерильного лиофилизированного порошка или безводного концентрата в герметично закрытой емкости, и они могут быть повторно растворены, например, водой или физиологическим раствором до надлежащей концентрации для введения субъекту. Предпочтительно связывающие молекулы согласно настоящему изобретению поставляют в виде сухого стерильного лиофилизированного порошка в герметично закрытой емкости.
[00505] Лиофилизированные препараты связывающих молекул согласно настоящему изобретению следует хранить при температуре от 2°С до 8°С в упаковке производителя, и данные молекулы следует вводить в течение 12 часов, предпочтительно в течение 6 часов, в течение 5 часов, в течение 3 часов или в течение 1 часа после их повторного растворения. В альтернативном варианте реализации такие молекулы поставляют в жидкой форме в герметично закрытой емкости с указанием количества и концентрации данной молекулы, слитого белка или конъюгированной молекулы. Предпочтительно, если такие связывающие молекулы находятся в жидкой форме, их поставляют в герметично закрытой емкости.
[00506] Количество таких препаратов согласно настоящему изобретению, которое будет эффективно для лечения, предотвращения или облегчения одного или более симптомов, связанных с расстройством, может быть установлено с помощью стандартных клинических методик. Точная доза, которая должна быть обеспечена составом, также зависит от пути введения и тяжести состояния, и должна быть рассчитана в соответствии с заключением практикующего врача и обстоятельствами для каждого отдельного пациента. Эффективные дозы могут быть экстраполированы на основании кривых зависимости доза-эффект, полученных в тестовых системах, выполняемых in vitro или с помощью моделей на животных.
[00507] В контексте настоящей заявки «эффективное количество» фармацевтической композиции представляет собой количество, достаточное для возникновения благоприятных или желаемых результатов, включая, без ограничения, клинические результаты, такие как уменьшение симптомов, вызванных заболеванием, ослабление симптома инфекции (например, вирусной нагрузки, лихорадки, боли, сепсиса и так далее) или симптома рака (например, пролиферации раковых клеток, наличия опухоли, метастазов опухоли и так далее), обеспечивающее тем самым повышение качества жизни страдающих данным заболеванием, снижение дозы других лекарственных средств, необходимых для лечения заболевания, усиление эффекта другого лекарственного средства, в частности, путем нацеливания и/или интернализации, задержку прогрессирования заболевания и/или продление выживаемости субъектов. При применении к отдельному активному ингредиенту, вводимому отдельно, указанный термин относится только к данному ингредиенту. При применении к комбинации указанный термин относится к общему количеству активных ингредиентов, которые обеспечивают терапевтический эффект при введении либо совместно, либо последовательно, либо одновременно.
[00508] Эффективное количество может быть введено в один или более приемов. Для целей настоящего изобретения эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное: для уничтожения и/или снижения пролиферации раковых клеток, и/или устранения, снижения и/или задержки развития метастазов из первичной локализации рака; или снижения пролиферации (или действия) инфекционного патогена и снижения и/или задержки развития опосредованного патогеном заболевания как непосредственно, так и опосредованно. В некоторых вариантах реализации эффективное количество лекарственного средства, соединения или фармацевтической композиции может быть или может не быть достигнуто совместно с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, «эффективное количество» можно рассматривать в контексте введения одного или более химиотерапевтических агентов, и отдельно применяемый агент можно рассматривать как введенный в эффективном количестве, если совместно с одним или более другими агентами может быть достигнут или достигается желаемый результат. Хотя индивидуальные потребности различаются, определение оптимальных диапазонов эффективных количеств каждого компонента находится в пределах компетенции специалистов в данной области техники.
[00509] Для связывающих молекул, охватываемых настоящем изобретением, дозу, вводимую пациенту, предпочтительно определяют на основании массы тела (кг) субъекта-реципиента. Для связывающих молекул, охватываемых настоящем изобретением, доза, вводимая пациенту, как правило, составляет от примерно 0,01 мкг/кг до примерно 30 мг/кг массы тела субъекта или более.
[00510] Доза и частота введения связывающей молекулы согласно настоящему изобретению могут быть снижены или изменены за счет улучшенного усвоения и тканевого проникновения молекулы путем модификаций, таких как, например, липидизация.
[00511] Доза связывающей молекулы согласно настоящему изобретению, вводимая пациенту, может быть рассчитана для применения в качестве монотерапии. В качестве альтернативы, молекула может быть применена в комбинации с другой терапевтической композицией, и дозы, вводимые пациенту, будут ниже, чем в случае, если указанные молекулы применяют в качестве монотерапии.
[00512] Фармацевтические композиции согласно настоящему изобретению могут быть введены местно в область, требующую лечения; это может быть достигнуто, например, без ограничения, путем местной инфузии, путем инъекции или путем введения имплантата, причем указанный имплантат является пористым, непористым или гелеобразным материалом, включая мембраны, такие как мембраны Sialastic или волокна. Предпочтительно, чтобы при введении молекулы согласно настоящему изобретению было уделено особое внимание использованию материалов, которыми данная молекула не абсорбируется.
[00513] Композиции согласно настоящему изобретению могут быть доставлены в везикуле, в частности, липосоме (См. Langer (1990) «New Methods Of Drug Delivery» Science 249:1527-1533); Treat ef al, в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353- 365 (1989); Lopez-Berestein, ibid., pp. 317-327).
[00514] Лечение субъекта терапевтически или профилактически эффективным количеством связывающей молекулы согласно настоящему изобретению может включать однократное введение или, предпочтительно, может включать курс лечения. В предпочтительном примере субъект получает лечение фармацевтической композицией согласно настоящему изобретению в течение периода времени от примерно 1 до 10 недель, предпочтительно от 2 до 8 недель, более предпочтительно от примерно 3 до 7 недель, и еще более предпочтительно в течение примерно 4, 5 или 6 недель. Фармацевтические композиции согласно настоящему изобретению могут быть введены один раз в день, причем такое введение осуществляют один раз в неделю, дважды в неделю, один раз каждые две недели, один раз в месяц, один раз каждые шесть недель, один раз каждые два месяца, дважды в год или один раз в год и так далее. В качестве альтернативы, фармацевтические композиции согласно настоящему изобретению могут быть введены дважды в день, причем такое введение осуществляют один раз в неделю, дважды в неделю, один раз каждые две недели, один раз в месяц, один раз каждые шесть недель, один раз каждые два месяца, дважды в год или один раз в год и так далее. В качестве альтернативы, фармацевтические композиции согласно настоящему изобретению могут быть введены три раза в день, причем такое введение осуществляют один раз в неделю, дважды в неделю, один раз каждые две недели, один раз в месяц, один раз каждые шесть недель, один раз каждые два месяца, дважды в год или один раз в год и так далее. Также необходимо осознавать, что эффективная доза молекул, применяемых для лечения, может быть увеличена или снижена в ходе конкретного курса лечения.
XII. Конкретные варианты реализации настоящего изобретения
[00515] Конкретные варианты реализации настоящего изобретения включают варианты реализации Е1-Е27:
Е1. Связывающая DA × CD3 молекула, содержащая связывающий CD3 домен, способный связывать эпитоп CD3, и связывающий относящийся к заболеванию антиген домен, способный связывать эпитоп относящегося к заболеванию антигена, где указанный связывающий CD3 домен содержит:
(I) (А) домен CDRH1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:99, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95 и SEQ ID NO:97;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO:58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO:59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO:60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO:61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO:62; или
(II) (А) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO:57;
(В) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO:58;
(C) домен CDRH3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105 и SEQ ID NO:107;
(D) домен CDRLI, содержащий аминокислотную последовательность SEQ ID NO:60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO:61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO:62; или
(III) (А) домен CDRHI, содержащий аминокислотную последовательность SEQ ID NO:57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO:58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO:59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO:60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO:61; и
(F) домен CDRL3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:109 или SEQ ID NO:111; или
(IV) (А) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO:57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO:58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO:59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO:60;
(E) домен CDRL2, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:113 и SEQ ID NO:115; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO:62.
E2. Связывающая DA x CD3 молекула по п. E1, где указанный связывающий CD3 домен содержит:
(I) (А) домен VL, содержащий аминокислотную последовательность SEQ ID NO:56;
(В) домен VH, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:98, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO: 92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104 и SEQ ID NO:106; или
(II) (А) домен VL, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:108, SEQ ID NO:110, SEQ ID NO:112 и SEQ ID NO:114; (В) домен VH, содержащий аминокислотную последовательность SEQ ID NO:55.
Е3. Связывающая DA × CD3 молекула по пп. E1 или E2, где указанная связывающая DA × CD3 молекула представляет собой биспецифичное антитело, биспецифичное диатело, биспецифичный scFv, биспецифичное TandAb или трехвалентную связывающую молекулу.
Е4. Связывающая DA × CD3 молекула по любому из пп. Е1-Е3, где указанная связывающая DA × CD3 молекула способна связывать более одного относящегося к заболеванию антигена и/или другую молекулу клеточной поверхности эффекторной клетки.
Е5. Связывающая DA × CD3 молекула по любому из пп. Е1-Е4, где указанный относящийся к заболеванию антиген представляет собой раковый антиген.
Е6. Связывающая DA × CD3 молекула по любому из пп. Е1-Е4, где указанный относящийся к заболеванию антиген представляет собой ассоциированный с патогеном антиген.
Е7. Связывающая DA × CD3 молекула по любому из пп. Е4-Е6, где указанная другая молекула клеточной поверхности эффекторной клетки представляет собой CD2, CD8, CD 16, TCR, NKp46 или NKG2D.
Е8. Связывающая DA × CD3 молекула по п. Е5 или Е7, где указанный раковый антиген выбран из группы, состоящей из раковых антигенов: 19.9, 4.2, ADAM-9, АН6, ALCAM, B1, В7-Н3, BAGE, бета-катенина, антигена группы крови ALeb/Ley, антигена лимфомы Беркитта-38.13, С14, СА125, карбоксипептидазы М, CD5, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD36, CD40/CD154, CD45, CD56, CD46, CD52, CD56, CD79a/CD79b, CD 103, CD 123, CD317, CDK4, СЕА, СЕАСАМ 5/СЕАСАМ6, СО17-1А, СО-43, СО-514, СТА-1, CTLA-4, цитокератина 8, D111, D156-22, DR5, группы E1, EGFR, рецептора эфрина, EphA2, Erb, GAGE, ганглиозида GD2/GD3/GM2, GICA 19-9, gp100, Gp37, gp75, gpA33, HER2/neu, HMFG, E6 папилломавируса человека/Е7 папилломавируса человека, HMW-MAA, антигена I, IL13Rα2, интегрина р6, JAM-3, KID3, KID31, пан-антигена карциномы KS 1/4, L6, L20, LEA, LUCA-2, Ml:22:25:8, M18, M39, MAGE, MART, мезотелина, MUC-1, MUM-1, MYL, N-ацетилглюкозаминилтрансферазы, неогликопротеина, NS-10, OFA-1, OFA-2, онкостатина M, pi 5, p97, РЕМ, РЕМА, PIP A, PSA, PSMA, простатической кислой фосфатазы, R24, ROR1, сфинголипида, SSEA-1, SSEA-3, SSEA-4, sTn, пептида, происходящего из Т-клеточного рецептора, Т5А7, TAG-72, TL5, рецептора ФНО, рецептора ФНО-у, TRA-1-85, рецептора трансферрина, 5Т4, TSTA, VEGF, рецептора VEGF, VEP8, VEP9, VIM-D5 и гаптена Y, Ley.
Е9. Связывающая DA × CD3 молекула по п. Е8, где указанный относящийся к заболеванию антиген представляет собой В7-НЗ, СЕАСАМ5/СЕАСАМ6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2, CD123, CD19 или ROR1.
ЕЮ. Связывающая DA × CD3 молекула по п. Е6 или Е7, где указанный ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
Е11. Связывающая DA × CD3 молекула по любому из пп. Е1-Е10, где указанная связывающая DA × CD3 молекула содержит: первую полипептидную цепь и вторую полипептидную цепь, ковалентно связанные друг с другом, где:
(A) первая полипептидная цепь содержит, в направлении от N-конца к С-концу:
(i) домен 1, содержащий:
(1) субдомен (1А), который содержит домен VL моноклонального антитела, способного связываться с указанным эпитопом относящегося к заболеванию антигена (VLDA); и
(2) субдомен (1В), который содержит домен VH моноклонального антитела, способного связываться с указанным эпитопом CD3 (VHCD3);
где указанные субдомены 1А и 1 В отделены друг от друга пептидным линкером; и
(ii) домен 2, который представляет собой способствующий гетеродимеризации домен;
(B) вторая полипептидная цепь содержит, в направлении от N-конца к С-концу:
(i) домен 1, содержащий:
(1) субдомен (1А), который содержит домен VL указанного моноклонального антитела, способного связываться с указанным эпитопом CD3 (VHCD3); и
(2) субдомен (1 В), который содержит домен VH указанного моноклонального антитела, способного связываться с указанным эпитопом относящегося к заболеванию антигена (VHda);
где указанные субдомены 1А и 1В отделены друг от друга пептидным линкером;
(ii) домен 2, который представляет собой способствующий гетеродимеризации домен, причем указанные способствующие гетеродимеризации домены указанной первой и указанной
второй полипептидных цепей различны;
и где:
(a) домен VL первой полипептидной цепи и домен VH второй полипептидной цепи объединяются с получением связывающего относящийся к заболеванию антиген домена, и домен VH первой полипептидной цепи и домен VL второй полипептидной цепи объединяются с получением связывающего CD3 домена; или
(b) домен VL первой полипептидной цепи и домен VH второй полипептидной цепи объединяются с получением связывающего CD3 домена, и домен VH первой полипептидной цепи и домен VL второй полипептидной цепи объединяются с получением связывающего относящийся к заболеванию антиген домена.
Е12. Связывающая DA × CD3 молекула по п. Е11, где:
(a) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой Е-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой K-спиральный домен; или
(b) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой K-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой Е-спиральный домен.
Е13. Связывающая DA × CD3 молекула по п. Е11 или Е12, где первая или вторая полипептидная цепь дополнительно содержит домен 3, содержащий домен СН2 и СН3 Fc-домена иммуноглобулина.
Е14. Связывающая DA × CD3 молекула по п. Е13, где указанная связывающая DA × CD3 молекула дополнительно содержит третью полипептидную цепь, содержащую домен СН2 и СН3 Fc-домена иммуноглобулина.
Е15. Связывающая DA × CD3 молекула по любому из пп. Е11-Е14, где указанная связьшающая DA × CD3 молекула дополнительно содержит связывающий CD8 домен.
Е16. Связьшающая DA × CD3 молекула по любому из пп. Е11-Е15, где указанная связьшающая DA × CD3 молекула содержит:
(I) (А) первый полипептид, содержащий SEQ ID NO:179;
(B) второй полипептид, содержащий SEQ ID NO:175; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(II) (А) первый полипептид, содержащий SEQ ID NO:184;
(B) второй полипептид, содержащий SEQ ID NO:181; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(III) (А) первый полипептид, содержащий SEQ ID NO:196;
(B) второй полипептид, содержащий SEQ ID NO:186; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(IV) (А) первый полипептид, содержащий SEQ ID NO:197;
(B) второй полипептид, содержащий SEQ ID NO:192; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(V) (А) первый полипептид, содержащий SEQ ID NO:193;
(B) второй полипептид, содержащий SEQ ID NO:194; и
(C) третий полипептид, содержащий SEQ ID NO: 176; или
(VI) (А) первый полипептид, содержащий SEQ ID NO:179;
(B) второй полипептид, содержащий SEQ ID NO:175;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO:188; или
(VII) (А) первый полипептид, содержащий SEQ ID NO:184;
(B) второй полипептид, содержащий SEQ ID NO:181;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO:188; или
(VIII) (А) первый полипептид, содержащий SEQ ID NO:196;
(B) второй полипептид, содержащий SEQ ID NO:186;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO:188; или
(IX) (А) первый полипептид, содержащий SEQ ID NO:193;
(B) второй полипептид, содержащий SEQ ID NO:194;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO:188.
Е17. Фармацевтическая композиция, которая содержит связывающую DA × CD3 молекулу по любому из пп. Е1-Е16 и фармацевтически приемлемый носитель.
Е18. Способ лечения заболевания, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества связывающей DA × CD3 молекулы по любому из пп. Е1-Е16 или фармацевтической композиции по п. Е17.
Е19. Способ по п. Е18, причем указанное заболевание представляет собой рак.
Е20. Способ по п. Е19, где указанный рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови, множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
Е21. Способ по п. Е18, причем указанное заболевание представляет собой ассоциированное с патогеном заболевание.
Е22. Способ по п. Е21, где указанный ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
Е23. Связывающая DA × CD3 молекула по любому из пп. Е1-Е16 или
фармацевтическая композиция по п. Е16 для применения при лечении заболевания.
Е24. Связывающая DA × CD3 молекула или фармацевтическая композиция по п. Е23, причем указанное заболевание представляет собой рак.
Е25. Связывающая DA × CD3 молекула или фармацевтическая композиция по п. Е24, где указанный рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови, множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
Е26. Связывающая DA × CD3 молекула или фармацевтическая композиция по п. Е23, причем указанное заболевание представляет собой ассоциированное с патогеном заболевание.
Е27. Связывающая DA × CD3 молекула или фармацевтическая композиция по п. Е26, где указанный ассоциированный с патогеном антиген выбран из группы, состоящей из следующих ассоциированных с патогеном антигенов: белок инфицированной вирусом простого герпеса клетки (ICP) 47, gD вируса простого герпеса, LMP-1 вируса Эпштейна-Барр, LMP-2A вируса Эпштейна-Барр, LMP-2B вируса Эпштейна-Барр, gp160 вируса иммунодефицита человека, gp120 вируса иммунодефицита человека, gp41 вируса иммунодефицита человека, Е6 папилломавируса человека, Е7 папилломавируса человека, gp64 вируса Т-клеточного лейкоза человека, gp46 вируса Т-клеточного лейкоза человека и gp21 вируса Т-клеточного лейкоза человека.
ПРИМЕРЫ
[00516] После приведения общего описания настоящего изобретения то же самое будет проще понять путем отсылки к следующим примерам, которые представлены в качестве иллюстрации и не направлены на ограничение настоящего изобретения, если не указано иное.
Пример 1
Оценка CD3 mAb 1 М3-CD3 mAb 1 М26
[00517] Конструировали библиотеку мутантов scFv CD3 mAb 1 путем насыщающего мутагенеза в 29 положениях CDR и осуществляли экспрессию в Е. coli (XL-1 Blue). Для получения растворимого scFv использовали многолуночный формат. Содержащие scFv супернатанты обрабатывали методом захвата на связывающей гистидиновую метку (His) поверхности и осуществляли скрининг на связывание с рекомбинантным CD3 (гетеродимер s/y цепей Fos/Jun) с применением биосенсора Attana для идентификации в. связывающих CD3 доменов.
[00518] Были получены варианты диатела типа DART-A CD123 × CD3 (обозначенного DART-A-WT; аминокислотные последовательности представлены выше), содержащие домены VH и VL идентифицированных scFv. Таким образом, была получена панель диател типа DART-А, обозначенная DART-A-M1 DART-A-М26, содержащая в. связывающие CD3 домены (такие в. связывающие CD3 домены соответственно обозначены «CD3 mAb 1 M1 - CD3 mAb 1 M26»). Кинетические характеристики связывания CD3 DART-A-M1 - DART-A-M26 определяли с помощью BIACORE® и сравнивали с DART-A-WT. В таблице 11 представлены кинетические характеристики связывания CD3 DART-A-WT и диателами типа DART-А, содержащими в. связывающие CD3 домены CD3 mAb 1 Ml - CD3 mAb 1 М26, расположенные в порядке возрастания ka (R обозначает отношение ка, ка или ки вариантного диатела типа DART-А (содержащего в. связывающий CD3 домен) к DART-A-WT (содержащему эт.связывающий CD3 домен CD3 mAb 1)).
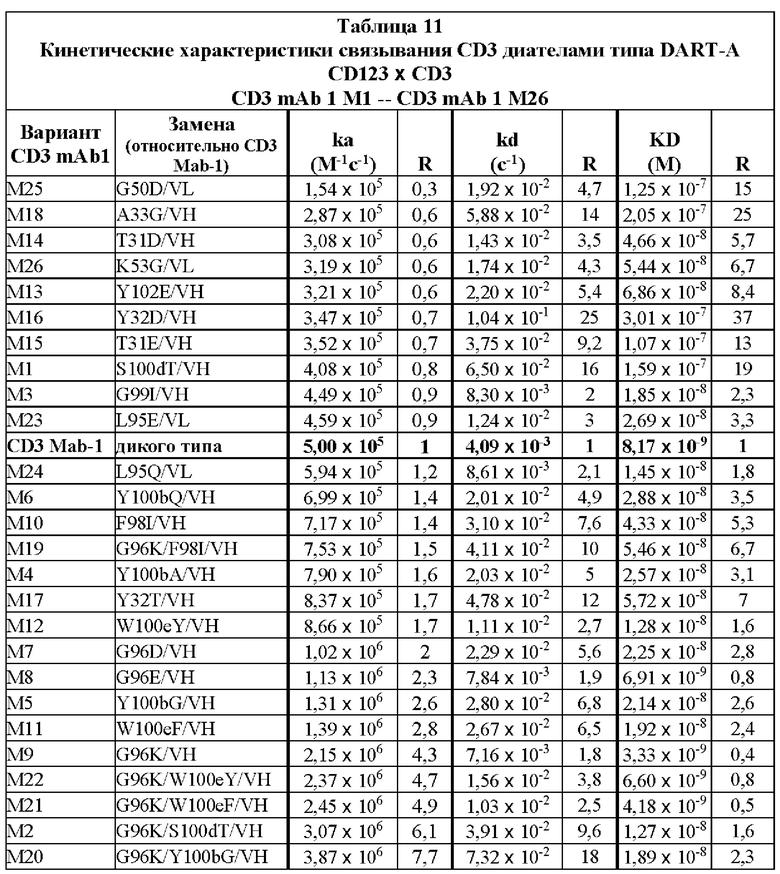
[00519] Способность DART-A-M1 DART-A-M26 (содержащих в. связывающие CD3 домены) опосредовать перенаправленное уничтожение клеток Т-клетками определяли с помощью анализа ЦТЛ и сравнивали с DART-A-WT (содержащим эт.связывающий CD3 домен). Кратко, диатела типа DART-А инкубировали с эффекторными Pan-Т-клетками и опухолевыми клетками-мишенями MOLM-13 при отношении количеств эффекторных клеток и клеток-мишеней 5:1 в течение 18 и 42 часов, и определяли ЕС50 путем оценки высвобождения лактатдегидрогеназы (ЛДГ) в среду поврежденными клетками (например, с помощью набора для нерадиоактивного анализа цитотоксичности CytoTox 96® (Promega), который позволяет количественно определить высвобождение ЛДГ, или аналогичного). В качестве отрицательного контроля использовали связывающее флуоресцеин диатело типа DART-А 4420 × CD3, содержащее связывающий CD3 домен CD3 mAb 1. Помимо этого, оценивали стабильность диател типа DART-А путем определения Tm с применением DSF. Типичные кривые цитотоксичности для DART-A-WT; DART-A-Ml; DART-A-M2; DART-A-M15; DART-A-M17; DART-A-M18; DART-A-M19 и DART-A-M20 представлены на Фигуре 7А. В таблице 12 представлена цитотоксичность (то есть активность перенаправленного уничтожения клеток Т-клетками) DART-A-M1 - DART-A-M26, расположенных в порядке возрастания 18-часовой ЕС50 (R обозначает отношение вариантного диатела типа DART-А (содержащего в. связывающий CD3 домен) к DART-A-WT (содержащему эт.связывающий CD3 домен CD3 mAb 1); ΔTm обозначает изменение Tm по сравнению с WT (Tm=63°С). Связь между кинетическими параметрами и цитолитической активностью графически представлена на Фигурах 7B-7D (Фигура 7В: связь между аффинностью и цитолизом (18-часовой ЕС50), Фигура 7С: связь между скоростью ассоциации и цитолизом (ЕС50). Фигура 7С: связь между скоростью диссоциации и цитолизом (ЕС50)). Указаны варианты CD3 mAbl  М18
М18  М2
М2  и M1
и M1 
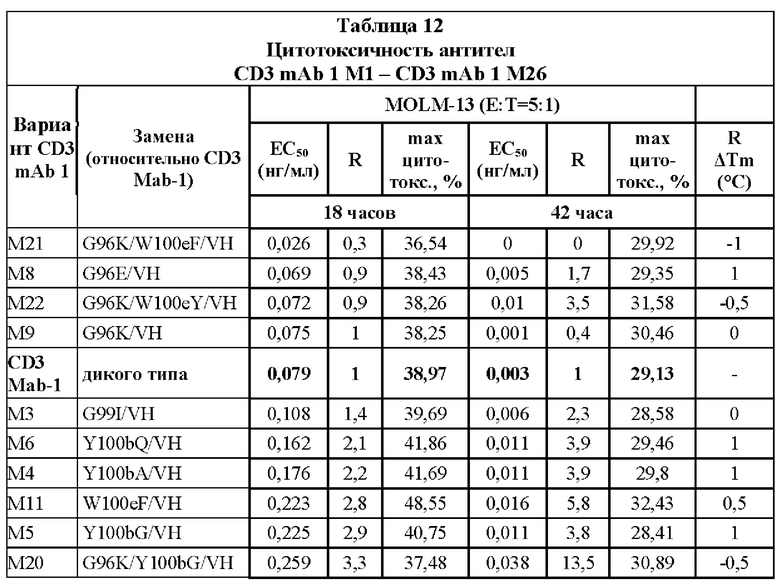
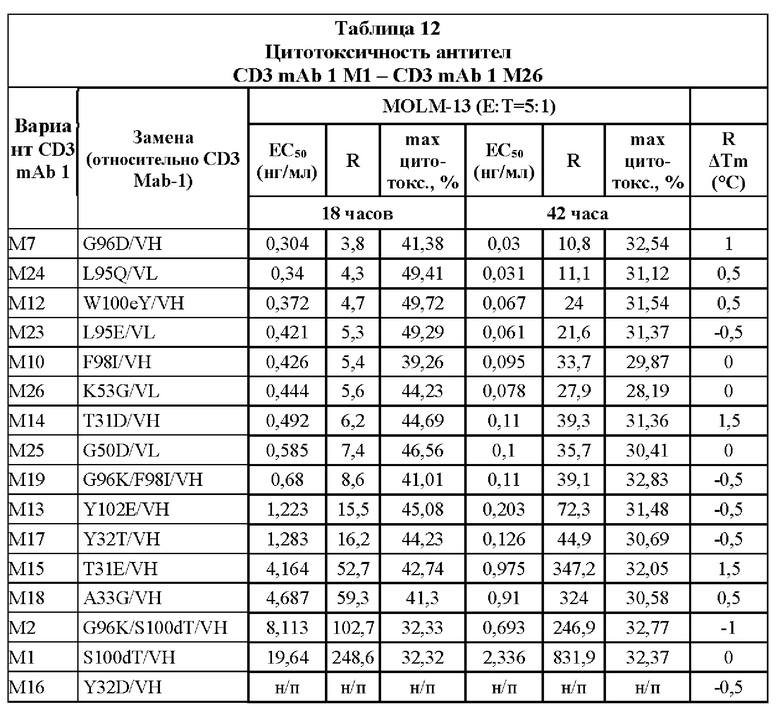
[00520] Как указано в таблицах 11-12, варианты DART-A-M1 DART-A-M26
демонстрировали различные кинетические параметры связывания и активность ЦТЛ, сохраняя при этом свою термостабильность. Такие связывающие DA × CD3 молекулы и их в. связывающие CD3 домены пригодны для применения для модуляции связывания CD3, активности перенаправленного уничтожения клеток Т-клетками и/или активности стимуляции Т-клеток.
Пример 2
Активность ЦТЛ и высвобождение цитокинов для типичных вариантов
[00521] Цитотоксическую активность (ЦТЛ) и профиль высвобождения цитокинов для типичного набора диател типа DART-А, содержащих вариантные домены VL или VH CD3 mAb 1 оценивали путем инкубирования DART-A-WT; DART-A-M2; DART-A-M7; DART-A-M13 и DART-A-M15 в присутствии эффекторных Pan-Т-клеток и лейкозных опухолевых клеток-мишеней MV-4-11 при отношении количеств эффекторных клеток и клеток-мишеней 5:1 в течение 24 часов. Цитотоксичность (то есть уничтожение клеток) в процентах и/или ЕС50 определяли путем оценки высвобождения лактатдегидрогеназы (ЛДГ) в среду поврежденными клетками (например, с помощью набора CytoTox 96® для нерадиоактивного анализа цитотоксичности (Promega), который позволяет количественно определить высвобождение ЛДГ, или аналогичного), она графически представлена на Фигуре 8А. Проводили анализ цитокинов, высвобождаемых в супернатант в ходе ЦТЛ (например, с применением метода Enzyme-Linked ImmunoSpot (ELISPOT) или с помощью набора для определения цитокинов Milliplex). Высвобождение цитокинов графически представлено на Фигурах 8 В-8Е (Фигура 8В: ИНФ-γ, Фигура 8С: ФНО-α, Фигура 8D: ИЛ-6, и Фигура 8Е: ИЛ-2). Значения ЕС50 для цитотоксичности и высвобождения цитокинов представлены в таблице 13. В качестве отрицательного контроля (отр. контр.) использовали связывающее флуоресцеин диатело типа DART-А 4420 × CD3, содержащее связывающий CD3 домен CD3 mAb 1.
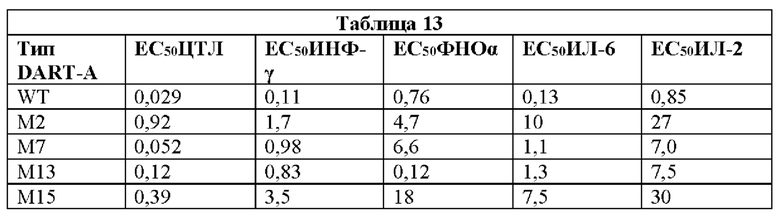
[00522] Результаты этих исследований показывают, что связывающие DA × CD3 молекулы, содержащие в. связывающие CD3 домены, имеющие измененную аффинность, сохраняют цитолитическую активность и демонстрируют один или более сниженных цитокиновых ответов (максимальный ответ и/или ЕС50) по сравнению со связывающей DA × CD3 молекулой, содержащей эт.связывающий CD3 домен.
Пример 3 Получение диател типа DART-В
[00523] Диатела, содержащие домен VH CD3 mAb 1 М18, были выбраны для дальнейшего определения свойств и сравнения с диателами, содержащими домен VH CD3 mAb 1, CD3 mAb 1 Ml и CD3 mAb 1 М2. Таким образом, были получены диатела типа DART-B, представленные в таблице 9, содержащие связывающий относящийся к заболеванию антиген (DA) домен, связывающий раковый антиген CD123, 5Т4 или CD19. Аминокислотные последовательности каждой цепи подробно представлены в настоящей заявке (см. первое - девятнадцатое иллюстративные диатела типа DART-В выше). Кратко, осуществляли экспрессию указанных диател в клетках СНО (временно или стабильно трансфицированных) и очистку на аффинной смоле с белком А (например, MabSelect) с последующей эксклюзионной хроматографией методом ВЭЖХ.
Пример 4
Способность диател типа DART-В связываться с относящимися к заболеванию антигенами
[00524] Способность таких диател связываться с соответствующим относящимся к заболеванию антигеном (то есть CD123 или 5Т4) на поверхности лейкозных раковых клеток-мишеней MOLM-13 (CD 123) или раковых клеток-мишеней карциномы почки А-498 (5Т4) оценивали с помощью FACS. Кратко, клетки инкубировали с молекулами диател (в буфере для FACS, содержащем 10% сыворотки человека АВ) в планшетах для микротитрования. Клетки промывали и инкубировали с конъюгированным с биотином антителом мыши к ЕК-спирали, которое распознает Е-спиральный/K-спиральный (ЕК) способствующий гетеродимеризации домен диател, смешанным со стрептавидин-фикоэритрином. Репрезентативные данные таких исследований показаны на Фигурах 9А-9В. Данные показывают, что типичные диатела были способны связываться с соответствующими относящимися к заболеванию антигенами.
Пример 5
Способность диател типа DART-В связываться с Т-клетками CD4+ и CD8+
[00525] Способность связывающих CD 123 диател: CD123-WT, CD123-M1, CD123-М2 и CD123-M18 связываться с Т-клетками CD4+и CD8+также оценивали с помощью FACS. Связывающее флуоресцеин диатело типа DART-А 4420 × CD3, содержащее связывающий CD3 домен CD3 mAb 1, использовали в качестве контроля на связывание с CD3 («4420-CD3»). Кратко, Т-клетки CD4+ и CD8+ инкубировали с молекулами диател (в буфере для FACS, содержащем 10% сыворотки человека АВ) в планшетах для микротитрования. Клетки промывали и инкубировали с меченым вторичным антителом к Fc человека. Затем клетки промывали и ресуспендировали в буфере для FACS, и анализировали с помощью проточной цитометрии. Репрезентативные данные таких исследований показаны на Фигуре 10А (связывание с Т-клетками CD8+) и Фигура 10В (связывание с Т-клетками CD4+). T-CD123-M1 и T-CD123-M18 демонстрируют пониженное связывание с экспрессирующими CD3 Т-клетками CD4+и CD8+.
[00526] Способность связывающих CD 123 диател: CD123-WT, CD123-M1, CD123-М2 и CD123-M18 связываться с CD3 и CD 123 человека также оценивали с помощью BIAcore®. Кратко, диатела в концентрациях 62,5-1000 нМ пропускали над растворимым CD3 человека, который был иммобилизован на поверхности (нормализованный; 1:1 модель связывания). Высокие концентрации аналита (62,5-1000 нМ) использовали для оценки параметров слабых взаимодействий CD3, однако, высокие концентрации аналита могут быть сопряжены с вкладом неспецифического связывания. В отдельных исследованиях диатела в концентрациях 62,5-100 нМ пропускали над растворимым CD 123, который содержал гистидиновую метку (His-tag) и был связан с поверхностью, содержащей антитело PentaHis (нормализованный; модель связывания - 1:1). В таблице 14 представлены рассчитанные на основании этих исследований ka, kd и KD.
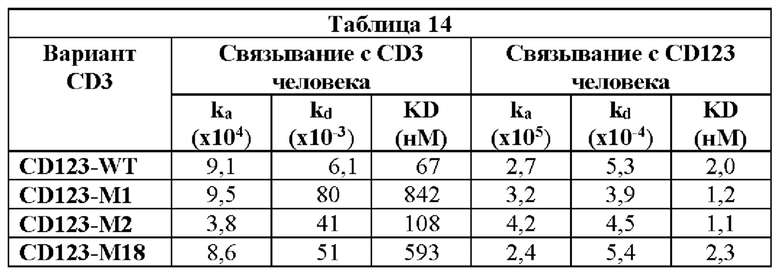
[00527] Способность связывающих 5Т4 диател: 5T4-WT, 5Т4-М1, 5Т4-М2 и 5Т4-М18 связываться с CD3 также оценивали с помощью BIAcore®, как описано выше. В таблице 15А представлены рассчитанные ka, kd и KD.
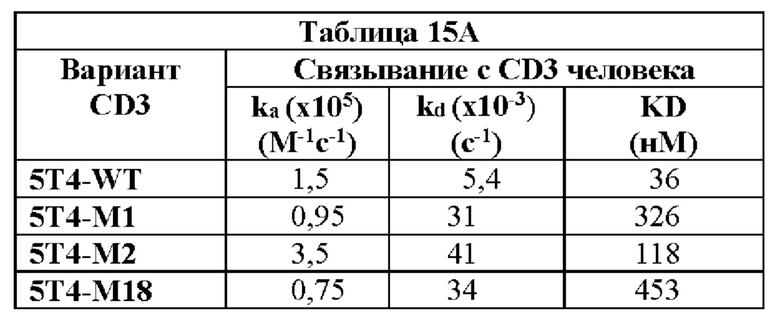
[00528] В дополнительных исследованиях способность связывающих CD123 диател: CD123-WT, CD123-M13, CD123-M17 и CD123-M19 связываться с CD3 человека и CD3 яванского макака также оценивали с помощью BIAcore®. Кратко, диатела в концентрациях 6,25-400 нМ пропускали над иммобилизованным CD3 человека или CD3 яванского макака (модель связывания Ленгмюра 1:1). В таблице 15 В представлены рассчитанные ka, kd и KD.
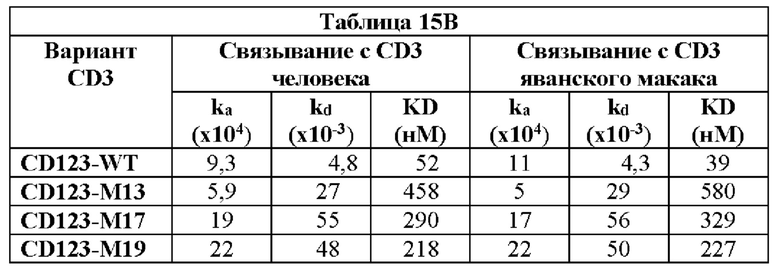
Пример 6
Способность иллюстративных диател типа DART-B опосредовать перенаправленное уничтожение клеток
[00529] Иллюстративные диатела типа DART-B оценивали в отношении их способности опосредовать перенаправленное уничтожение клеток. Там, где это указано, ВИЧ-WT или ВИЧ-М18 (описанные выше) в данном случае используют в качестве отрицательного контроля, поскольку они не связывают раковый антиген. Следует понимать, что диатела ВИЧ-WT и ВИЧ-М18 будут связываться с клетками, экспрессирующими эпитоп, связываемый антителом А32 (ВИЧ env), на их клеточной поверхности (например, с инфицированными ВИЧ клетками), см., например,: WO 2014/1599401 и WO 2016/054101, и способны опосредовать перенаправленное уничтожение клеток таких клеток.
[00530] Результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного иллюстративными конструкциями диател типа DART В CD 123 × CD3, представлены на Фигурах 11A-11Q, Фигурах 12А-12Е, и Фигурах 26А-26Е. Результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного иллюстративными конструкциями диател типа DART В 5Т4 × CD3, представлены на Фигурах 13A-13Q. Результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного иллюстративными конструкциями диател типа DART В CD 19 × CD3, представлены на Фигурах 14A-14J. Эти исследования проводили по существу так, как описано выше, с применением указанных эффекторных клеток и клеток-мишеней, отношения количеств эффекторных клеток и клеток-мишеней и периоды инкубирования описаны ниже (см. также Фигуры НА, 12А, 13А и 14А). Там, где это указано, высвобождение цитокинов ИФН-γ, ФНО-α, ИЛ-6 и ИЛ-2 определяли в конце анализа ЦТЛ с применением стандартных коммерческих реагентов.
[00531] На Фигурах 11A-11Q представлены результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного конструкциями диател типа DART В CD 123 × CD3 (имеющими Fc-домены) CD123-WT, CD123-M2 и CD123-M18, с применением эффекторных Pan-Т-клеток и клеток-мишеней острого моноцитарного лейкоза (ОМЛ) MOLM-13 (Е:Т=5:1, 24 ч). Цитотоксичность в процентах графически представлена на Фигуре 11А. Цитокиновые ответы и цитотоксичность графически представлены на Фигурах 11В-11Q (Фигуры 11В-11Е: ИФН-гамма; Фигуры 11F-11I: ФНО-альфа; Фигуры 11J-11М: ИЛ-6; Фигуры 11N-11Q: ИЛ-2). Фигуры 11 В, 11F, 11J и UN: CD123-WT; Фигуры 11С, 11G, ПК и НО: CD123-M2; Фигуры 11D, 11Н, 11L и 11P: CD123-М18; Фигуры 11Е, 11I, 11М и 11Q: ВИЧ-WT (отрицательный контроль). Схожую цитотоксичность наблюдали в отношении другой линии клеток ОМЛ, MV-4-11.
[00532] На Фигуре НА показано, что связывающие CD123 × CD3 молекулы, содержащие различные варианты CD3 mAb 1, существенно различались по способности опосредовать цитотоксичность, в частности, при оценке путем сравнения ЕС50, однако достигали схожих уровней максимальной цитотоксичности. Помимо этого, эти молекулы различались по способности опосредовать цитокиновые ответы. Например, как видно на Фигурах 11B-11Q, несмотря на то, что CD123-M18 демонстрировал уровни максимальной цитотоксичности, которые были схожи с теми, которые демонстрировал CD123-WT, уровни цитокинов ИФН-а, ФНО-а и ИЛ-6, высвобождаемых при применении CD123-M18, составляли примерно 50% от уровней, высвобождаемых при применении CD123-WT, и уровень ИЛ-2, наблюдаемый при применении CD123-M18, был существенно ниже, чем уровень ИЛ-2, наблюдаемый при применении CD123-WT. Таким образом, было обнаружено, что CD123-M18 может обеспечивать терапевтическую эффективность, сравнимую с таковой для CD123-WT, но с меньшими сопутствующими побочными эффектами, чем в случае CD123-WT.
[00533] На Фигурах 12А-12Е представлены результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного конструкциями диател типа DART В CD123 × CD3 (имеющими Fc-домены), с применением эффекторных клеток МКПК и клеток-мишеней ОМЛ MOLM-13. Цитотоксичность в процентах графически представлена на Фигуре 12А (Е:Т = 15:1, 24 ч). Цитокиновые ответы (при анализе с помощью набора для определения цитокинов Milliplex) графически представлены на Фигурах 12В-12Е (Фигура 12В: ИФН-гамма; Фигура 12С: ФНО-альфа; Фигура 12D: ИЛ-6; Фигура 12Е: ИЛ-2).
[00534] Результаты также показывают, что CD123-WT и CD123-M18 демонстрируют схожие уровни максимальной цитотоксичности, однако CD123-M18 демонстрировал существенно сниженные цитокиновые ответы. Поимо этого, значения ЕС50 CD123-M18 для высвобождения ИФН-γ, ФНО-α или ИЛ-6 были существенно больше таковых для CD123-WT, что указывает на то, что применение CD123-M18 приводило к существенно меньшему высвобождению цитокинов по сравнению с применением CD123-WT.
[00535] На Фигурах 26A-26D и Фигуры 27A-27D представлены результаты исследований перенаправленного уничтожения клеток, опосредованного конструкциями диател типа DART В CD123 × CD3 (имеющими Fc-домены) CD123-WT, CD123-M1, CD123-M13, CD123-M17, CD123-M18 и CD123-M19, с применением эффекторных Pan-Т-клеток и клеток-мишеней острого моноцитарного лейкоза (ОМЛ) MOLM-13 (Е:Т = 5:1, от 48 до 96 часов). Как отмечено ниже, DART-A-WT включали в некоторые исследования в качестве молекулы сравнения. На Фигурах 26A-26D представлены результаты репрезентативного исследования, проводимого в течение 48 часов. На Фигуре 26А графически представлена цитотоксичность в зависимости от процента высвобожденной ЛДГ. Цитокиновые ответы и цитотоксичность графически представлены на Фигурах 26В-26Е (Фигура 26В: ИФН-гамма; Фигура 26С: ФНО-альфа; Фигура 26D: ИЛ-6; Фигура 26Е: ИЛ-2). На Фигурах 27A-27D представлены результаты 4-7 таких исследований, проводимых в течение 48 и 96 часов, которые включали DART-A-WT. На Фигурах 27А-27С представлены сравнительные графики активности цитотоксичности (ЦТЛ) через 48 и 96 часов по результатам четырех таких исследований (Фигура 27А: значения ЕС50 активности ЦТЛ в пМ; Фигура 27В: активность ЦТЛ в кратном отношении к значению ЕС50 для CD123-WT, Фигура 27С: Emax активности ЦТЛ в процентах от CD123-WT). На Фигуре 27D графически представлен терапевтический индекс для активности ЦТЛ в зависимости от цитокина ИЛ-2.
[00536] На Фигуре 26А показано, что хотя связывающие CD123 х CD3 молекулы, содержащие различные варианты CD3 mAb 1, демонстрировали существенно различающиеся кривые цитотоксичности для CD123-M13, CD123-M17, CD123-M18 и CD123-M19, они способны достигать схожей максимальной цитотоксичности. Как было показано выше, каждый из вариантов опосредовал более низкие цитокиновые ответы. Например, как видно на Фигурах 26B-26D, несмотря на то, что CD123-M13, CD123-M17, CD123-M18 и CD123-M19 демонстрировали уровни максимальной цитотоксичности, которые были схожи с теми, которые демонстрировал CD123-WT, уровни высвобожденных цитокинов ИФН-α, ФНО-α, ИЛ-6 и ИЛ-2 были значительно ниже, чем уровень, наблюдаемый при применении CD123-WT. Таким образом, было обнаружено, что каждая из молекул диател, содержащих варианты CD3 mAb 1 M13, М17, М18 и М19, может обеспечивать терапевтическую эффективность, сравнимую с таковой для конструкций диател, содержащих CD3 mAb 1 дикого типа, но с меньшими сопутствующими побочными эффектами.
[00537] Результаты, представленные на Фигурах 27А-27С, также показывают, что CD123-M13, CD123-M17, CD123-M18 и CD123-M19 характеризуются заметно различающимися значениями ЕС50 цитотоксичности, однако достигают максимальной активности ЦТЛ, сравнимой с таковой для CD123-WT и DART-A-WT. Терапевтический индекс (TI) определяли следующим образом, используя ИЛ-2 в качестве типичного цитокина:
TI = Emax (ЦТЛ) : Emax (цитокина)
[00538] Рассчитанные значения TI, нормированные на значения для CD123-WT, графически представлены на Фигуре 27D и также показывают, что связывающие DA х CD3 молекулы, содержащие варианты CD3 mAb 1 M13, М17, М18 и М19, имеют более высокий TI по сравнению с теми, которые содержат CD3 mAb 1 дикого типа.
[00539] На Фигурах 13A-13Q представлены результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного конструкциями диател типа DART В 5Т4 × CD3 (имеющими Fc-домены) 5T4-WT, 5Т4-М1, 5Т4-М2, и 5Т4-М18, с применением эффекторных Pan-Т-клеток и клеток-мишеней почечно-клеточной карциномы А498 (Е:Т = 5:1, 24 ч). Цитотоксичность в процентах графически представлена на Фигуре 13А. Цитокиновые ответы и цитотоксичность графически представлены на Фигурах 13B-13Q (Фигуры 13В-13Е: ИФН-гамма; Фигуры 13F-13I: ФНО-альфа; Фигуры 13J-13M: ИЛ-6; Фигуры 13N-13Q: ИЛ-2). Фигуры 13В, 13F, 13J и 13N: 5T4-WT; Фигуры 13С, 13G, 13K и 13O: 5Т4-М2; Фигуры 13D, 13Н, 13L и 13Р: 5Т4-М18; Фигуры 13Е, 13I, 13М и 13Q: ВИЧ-WT (отрицательный контроль)). Также наблюдали цитотоксичность в отношении клеток карциномы молочной железы ЛМТ-1. Эти результаты показывают, что 5T4-WT и 5Т4-М18 демонстрируют схожие уровни максимальной цитотоксичности, однако существенно различающиеся цитокиновые ответы, причем 5Т4-М18 демонстрирует существенно более низкие уровни высвобождения цитокинов по сравнению с 5T4-WT.
[00540] На Фигурах 14A-14J представлены результаты репрезентативных исследований перенаправленного уничтожения клеток, опосредованного конструкциями диател типа DART В CD19 × CD3 (имеющими Fc-домены) CD19-WT и CD19.1-M18, с применением эффекторных Pan-Т-клеток или эффекторных клеток МКПК и лимфобластоидных клеток-мишеней линии Раджи (Raji) (Е:Т = 30:1 для МКПК и 10:1 для Pan-Т-клеток, 24-48 ч). Цитотоксичность в процентах (48 ч) графически представлена на Фигуре 14А (МКПК) и Фигуре 14F (Pan-Т-клетки). Цитокиновые ответы через 48 часов при применении МКПК графически представлены на Фигурах 14В-14Е (МКПК) и Фигурах 14G-14J (Pan-Т-клетки) (Фигуры 14В и 14G: ИФН-гамма; Фигуры 14С и 14Н: ФНО-альфа; Фигуры 14D и 14I: ИЛ-6; Фигуры 14Е и 14J: ИЛ-2; ВИЧ-М18 (отрицательный контроль)). CD19.1-M18 демонстрировал схожую цитотоксичность и сниженное высвобождение цитокинов в отношении клеток-мишеней линии Дауди (Daudi). Эти результаты показывают, что CD19-WT и CD19.1-M18 демонстрируют схожие уровни максимальной цитотоксичности, однако существенно различающиеся цитокиновые ответы, причем CD19.1-M18 демонстрирует существенно более низкие уровни высвобождения цитокинов по сравнению с CD19-WT.
[00541] Результаты указанных выше исследований подтверждают, что конструкции, содержащие вариант CD3 mAb 1 М18, проявляли более высокую цитотоксическую (ЦТЛ) активность в анализе ЦТЛ, чем конструкции, содержащие варианты M1 и М2. Исследования ЦТЛ также показывают, что конструкции, содержащие вариант М18, демонстрировали более низкие цитокиновые ответы по сравнению с WT, которые были схожи с цитокиновыми ответами, вызываемыми менее активным вариантом М2, или лишь немного превышали их. Таким образом, вариант М18, по-видимому, имеет большее окно для отношения активности ЦТЛ и высвобождения цитокинов.
Пример 7
Способность иллюстративных диател типа DART-В опосредовать активацию Т-клеток
[00542] Способность опосредовать активацию Т-клеток определяли путем оценки способности диател оказывать влияние на экспрессию CD25 и CD69, которые являются маркерами активации Т-клеток, на популяциях Т-клеток CD4+ и CD8+. Популяции Т-клеток получали при исследованиях ЦТЛ, которые проводили по существу как описано выше. Там, где это указано, популяции Т-лимфоцитов CD4+ и CD8+ оценивали в отношении положительной регуляции маркеров активации CD69 и CD25 с помощью проточной цитометрии в конце анализа ЦТЛ.
[00543] Репрезентативные данные для конструкций диател типа DART-В CD123 × CD3 представлены на Фигурах 15А-15Е. Цитотоксичность графически представлена на Фигуре 15А. Активация Т-клеток CD4+, определенная путем оценки CD25, графически представлена на Фигуре 15В. Активация Т-клеток CD4+, определенная путем оценки CD69, графически представлена на Фигуре 15С. Активация Т-клеток CD8+ определенная путем оценки CD25, графически представлена на Фигуре 15D. Активация Т-клеток CD8+ определенная путем оценки CD69, графически представлена на Фигуре 15Е.
[00544] Репрезентативные данные для конструкций диател типа DART-В 5Т4 × CD3 представлены на Фигурах 16А-16Е. Цитотоксичность графически представлена на Фигуре 16А. Активация Т-клеток CD4+, определенная путем оценки CD25, графически представлена на Фигуре 16В. Активация Т-клеток CD4+, определенная путем оценки CD69, графически представлена на Фигуре 16С. Активация Т-клеток CD8+, определенная путем оценки CD25, графически представлена на Фигуре 16D.
Активация Т-клеток CD8+ определенная путем оценки CD69, графически представлена на Фигуре 16Е.
[00545] Результаты этих исследований показывают, что конструкции, содержащие вариант CD3-M18, проявляли повышенную способность к активации Т-клеток по сравнению с конструкциями, содержащими варианты M1 и М2.
Пример 8 Активность иллюстративных диател типа DART-В in vivo в моделях у мышей
[00546] Активность диател типа DART-В CD123 × CD3 CD123-WT и CD123-M18 in vivo оценивали в модели ОМЛ со смешиванием клеток KG1A (Е:Т = 1:5). Кратко, в 0 день мышам NOD/SCID (6 на группу) путем инъекции вводили клетки KG1A (ОМЛ), смешанные с активированными с Т-клетками CD4+ или CD8+ человека (Е:Т = 1:5). Затем вводили контроль-носитель, CD123-WT (50 мкг/кг) или CD123-M18 (5 мкг/кг или 50 мкг/кг). В ходе исследования отслеживали объем опухоли.
[00547] Результаты этого исследования представлены на Фигуре 17А (Т-клетки CD4+) и Фигуре 17В (Т-клетки CD8+). Результаты показывают, что конструкции, содержащие вариант M18, проявляли противоопухолевую активность, сравнимую с таковой для конструкций, содержащих связывающие CD3 домены дикого типа.
[00548] Другое исследование для оценки in vivo активности диател типа DART-B CD123 × CD3 проводили с применением модели восстановленной опухоли, в которой в 0 день мышам MHCI-/- (5 самок на группу) путем подкожной (п/к) инъекции вводили 5 х 106 клеток KG1A (ОМЛ). На 9 день путем внутрибрюшинной инъекции (в/б) вводили 1 х 107 клеток МКПК. Контроль-носитель, CD123-WT, CD123-M2 или CD123-M18 (каждый в дозе 0,5, 5, 50 или 500 мкг/кг) вводили внутривенно (в/в) дважды в неделю (2QW), начиная с 15 дня. В ходе исследования отслеживали объем опухоли.
[00549] Результаты этого исследования представлены на Фигурах 18A-18D. Результаты показывают, что CD123-M2 не проявлял активности в этой модели (Фигура 18В). Напротив, CD123-M18 (Фигура 18С) проявлял противоопухолевую активность, сравнимую с таковой для CD123-WT (Фигура 18А), в частности, в дозах 50 мкг/кг и 500 мкг/кг (Фигура 18D).
[00550] Другое исследование для оценки активности диател типа DART-B CD123 × CD3 in vivo проводили с применением модели приживления МКПК, в которой в 0 день мышам MHCI-/- (6 самцов на группу) путем п/к инъекции вводили 5 х 106 клеток MV4-11 (лейкоз) и путем ретроорбитальной (р/о) инъекции вводили 1 х 107 клеток МКПК. Контроль-носитель, CD123-WT (в дозе 0,5, 5, 50 или 500 мкг/кг), CD123-M18 или CD123-M2 (каждый в дозе 5, 50, 500 или 1000 мкг/кг) вводили внутривенно (в/в) дважды в неделю (2QW), начиная с 14 дня. В ходе исследования отслеживали объем опухоли.
[00551] Результаты этого исследования представлены на Фигурах 19A-19D. Результаты показывают, что CD123-WT проявлял противоопухолевую активность в дозе 0,5 мкг/кг и выше (Фигура 19А). CD123-M18 проявлял противоопухолевую активность в дозе 50 мкг/кг и выше (Фигура 19В). Напротив, CD123-M2 проявлял противоопухолевую активность только в дозе 1000 мкг/кг (Фигура 19С). Как показано на Фигуре 19D, противоопухолевая активность CD123-M18 сравнима с активностью CD123-WT в дозе 500 мкг/кг, тогда как CD123-M2 в этой концентрации проявлял небольшую противоопухолевую активность или ее отсутствие.
[00552] Активность диател типа DART-B 5T4 × CD3 5T4-WT, 5Т4-М1 и 5Т4-М18 in vivo оценивали в модели приживления МКПК, в которой в 0 день мышам MHCI-/- (8 самок на группу) путем п/к инъекции вводили 5 х 106 клеток SKOV3 (карцинома яичников) и путем р/о инъекции вводили 1 х 107 клеток МКПК. Контроль-носитель, 5T4-WT (10, 50, 100 или 500 мкг/кг), 5Т4-М18 (10, 50, 100 или 500 мкг/кг) или 5Т4-М2 (500 мкг/кг) вводили внутривенно (в/в) дважды в неделю (2QW), начиная с 7 дня. В ходе исследования отслеживали объем опухоли.
[00553] Результаты этого исследования представлены на Фигурах 20А-20В. Результаты показывают, что 5T4-WT проявлял высокую противоопухолевую активность во всех исследуемых дозах (Фигура 20А). 5Т4-М18 проявлял дозозависимую противоопухолевую активность, которая была сравнима с активностью 5T4-WT в дозе 500 мкг/кг, тогда как 5Т4-М2 проявлял существенно более низкую активность в дозе 500 мкг/кг (Фигура 20В).
[00554] Профиль высвобождения цитокинов, индуцированного диателами типа DART-B CD123 × CD3, in vivo оценивали в модели со смешиванием МКПК. Кратко, 5 х 106 клеток KG1A (ОМЛ) и 1 х 107 МКПК смешивали и инкубировали в течение ночи, на следующий день мышам NSG (6 самцов на группу) путем п/к инъекции вводили смешанные клетки и внутривенно (в/в) вводили однократную дозу контроля-носителя, CD123-WT, CD123-M18 или CD123-M2 (каждый в дозе 50 или 500 мкг/кг). Через шесть часов после введения оценивали содержание цитокинов в сыворотке. Профили высвобождения цитокинов графически представлены на Фигурах 20A-20D (Фигура 21А: ИФН-γ; Фигура 21В: ФНО-α; Фигура 21С: ИЛ-6; и Фигура 21D: ИЛ-2). Результаты этих исследований показывают, что применение связывающих DA х CD3 молекул, содержащих вариантные домены VL и VH CD3 mAb 1 M2 и CD3 mAb 1 М18 приводит к более низким уровням высвобождения цитокинов.
[00555] Два других исследования для оценки активности диател типа DART-В CD123 × CD3 in vivo проводили с использованием модели восстановленной опухоли, в которой восстановленным по МКПК (введение путем ретроорбитальной (р/о) инъекции 8 х 106 МКПК в 0 день) мышам NSG/MHCI-/- (7-8 мышей на группу) на 7 день путем подкожной (п/к) инъекции вводили 5 х 106 клеток KG1A (ОМЛ). В одном исследовании CD123-WT (0,5 мг/кг), CD123-M18 и CD123-M13 (в дозе 0,005, 0,05, 0,5 и 1 мг/кг) или носитель вводили внутривенно (в/в) дважды в неделю (2QW), начиная с 28 дня. В другом исследовании CD123-WT (0,05 мг/кг), CD123-M18 и CD123-M17 (в дозе 0,005, 0,05, 0,5 и 1 мг/кг) или носитель вводили внутривенно (в/в) дважды в неделю (2QW), начиная с дня 28. В ходе исследования отслеживали объем опухоли.
[00556] Результаты этих исследований представлены на Фигурах 28А-28В (введение CD123-WT, CD123-M18 и CD123-M13) и Фигурах 29А-29В (введение CD123-WT, CD123-M18 и CD123-M17). Результаты показывают, что противоопухолевая активность CD123-M18 была схожа с таковой для CD123-WT в дозах 0,5 мг/кг и выше (Фигуры 28А и 29А), и что CD123-M13 и CD123-M17 проявляли противоопухолевую активность, схожую с таковой для CD123-WT, начиная с дозы всего 0,05 мг/кг, что в 10 раз ниже, чем доза для CD123-M18 (Фигуры 28В и 29В).
[00557] Профили высвобождения цитокинов in vivo, индуцированного диателами типа DART-B CD123 × CD3 CD123-WT, CD123-M13, CD123-M17 и CD123-M18, оценивали в модели со смешиванием МКПК. Кратко, 5 х 106 клеток KG1A (ОМЛ) и 1 х 107 МКПК смешивали и инкубировали в течение ночи, на следующий день мышам NSG (7-8 на группу) путем п/к инъекции вводили смешанные клетки и внутривенно (в/в) вводили однократную дозу CD123-WT (0,5 мг/кг), CD123-M13, CD123-M17 и CD123-M18 (в дозе 0,05, 0,5 и 1 мг/кг) или носителя. Через шесть часов после введения оценивали уровни цитокинов в сыворотке. В одном исследовании животным вводили CD123-WT, CD123-M18 и CD123-M13, и в отдельном исследовании животным вводили CD123-WT, CD123-M18 и CD123-M17. Профили высвобождения цитокина ИЛ-2 графически представлены на Фигурах 30А-30В (Фигура 30А: CD123-WT, CD123-M18 и CD123-M13; Фигура 30В: CD123-WT, CD123-M18 и CD123-M17) и показывают, что применение связывающих DA x CD3 молекул, содержащих вариантные домены VL и VH CD3 mAb 1, приводит к более низким уровням высвобождения цитокинов по сравнению с применением связывающей DA х CD3 молекулы, содержащей домены VL и VH дикого типа.
[00558] Результаты этих исследований на животных показывают, что введение связывающих DA х CD3 молекул, содержащих вариантные домены VL и VH CD3 mAb 1, в частности, домены VL и VH CD3 mAb 1 М2, CD3 mAb 1 M13, CD3 mAb М17 и CD3 mAb 1 M18 (то есть в. связывающие CD3 домены), приводит к более низким уровням высвобождения цитокинов по сравнению с введением связывающих DA х CD3 молекул, содержащих домены VL и VH CD3 mAb 1 (то есть эт. связывающий CD3 домен). В частности, результаты этих исследований показывают, что связывающие DA х CD3 молекулы, содержащие вариантные домены VL и VH CD3 mAb 1 M13, CD3 mAb М17 и CD3 mAb 1 M18, демонстрируют более низкие уровни высвобождения цитокинов, сохраняя при этом противоопухолевую активность in vivo.
Пример 9 Получение молекул типа TRIVALENT
[00559] Домены VH и VL CD3 mAb 1, CD3 mAb 1 M1, CD3 mAb 1 М2 или CD3 mAb 1 M18 применяли для получения молекул типа TRIVALENT, содержащих связывающий относящийся к заболеванию антиген (DA) домен, который связывает раковый антиген CD123, и связывающий домен, который связывает антиген эффекторной клетки CD8 («молекула типа TRIVALENT DA × CD3 × CD8»). В таблице 10 представлены вязывающие CD3 домены и SEQ ID NO для каждой полипептидной цепи. Аминокислотные последовательности каждой цепи подробно представлены в настоящей заявке (см. первую - четвертую иллюстративные молекулы типа TRIVALENT выше).
Пример 10 Определение характеристик молекул типа TRIVALENT DA × CD3 × CDS
[00560] Способность T-CD123-WT, T-CD123-M1, T-CD123-M2 и T-CD123-M18 связывать CD123, экспрессируемый на клетках MOLM-13, оценивали по существу как описано выше. Помимо этого, способность этих молекул связывать Т-клетки CD4+ и Т-клетки CD8+ оценивали по существу как описано выше. Диатело типа DART-B CD123-WT включено в эти исследования для сравнения. Репрезентативные данные этих исследований представлены на Фигуре 22А (связывание с клетками MOLM-13), Фигуре 22В (связывание с Т-клетками CD4+) и Фигуре 22С (связывание с Т-клетками CD8+. Все исследуемые молекулы демонстрируют сопоставимое связывание с экспрессирующими CD123 клетками MOLM-13 и экспрессирующими CD8 Т-клетками CD8+ T-CD123-M1 и T-CD123-M18 демонстрируют значительно сниженное связывание с экспрессирующими CD3 Т-клетками CD4+ по данным MFI (геометрическое среднее). Связывание с Т-клетками CD8+ опосредовано как связывающим CD3, так и связывающим CD8 доменами, присутствующими в молекулах типа TRIVALENT.
[00561] Оценивали способность T-CD123-WT, T-CD123-M1, T-CD123-M2 и Т-CD123-M18 опосредовать перенаправленное уничтожение клеток. Кратко, молекулы типа TRIVALENT инкубировали в присутствии Pan-Т-клеток или очищенных эффекторных клеток - Т-клеток CD4+ или CD8+ - и опухолевых клеток-мишеней MOLM-13 при отношении количеств эффекторных клеток и клеток-мишеней 1:1 в течение 48 часов. Цитотоксичность определяли путем оценки высвобождения лактатдегидрогеназы (ЛДГ) в среду поврежденными клетками (например, с помощью набора для нерадиоактивного анализа цитотоксичности CytoTox 96® (Promega), который позволяет количественно определить высвобождение ЛДГ, или аналогичного). Цитокиновый ответ оценивали в образцах Pan-Т-клеток. Диатело типа DART-B CD123-WT включено в эти исследования для сравнения. Цитотоксичность в процентах графически представлена на Фигурах 23А-23С (Фигура 23А: Pan-Т-клетки; Фигура 23В: Т-клетки CD4+; и Фигура 23С: Т-клетки CD8+). Цитокиновые ответы графически представлены на Фигурах 23D-23G (Фигура 23D: ИФН-гамма; Фигура 23Е: ФНО-альфа; Фигура 23F: ИЛ-6; Фигура 23G: ИЛ-2).
Пример 11 Токсикологические исследования
[00562] Профили безопасности и профили высвобождения цитокинов типичных связывающих CD123 × CD3 молекул оценивали в исследовании по подбору доз у яванских макаков. В этом исследовании оценивали потенциальную токсичность и профили высвобождения цитокинов для CD123-M18 (содержащего в. связывающий CD3 домен CD3 mAb 1 M18) и CD123-WT (содержащего эт. связывающий CD3 домен CD3 mAb 1) при введении посредством многократных внутривенных инфузий. Активность уничтожения клеток сложно оценить в этой модели. План исследования представлен в таблице 16.
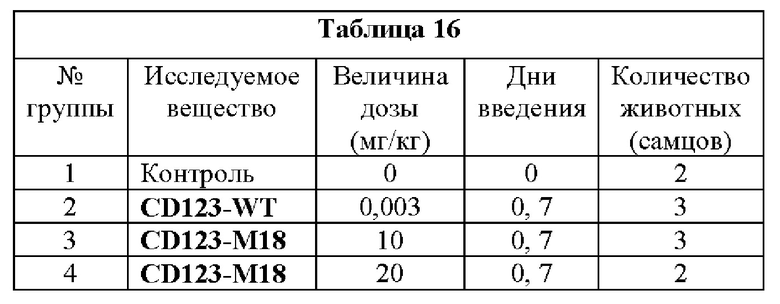
[00563] В группах, получавших CD123-M18 (10 и 20 мг/кг) не наблюдали летальности, потери массы тела или других неблагоприятных явлений. Помимо этого, в этих группах не наблюдали значимых изменений показателей гематологии или клинической химии. Напротив, молекула CD123-WT (0,003 мг/кг) не являлась хорошо переносимой. В этой группе наблюдали синдром высвобождения цитокинов и летальность (1/3). Содержание цитокинов в сыворотке (дни 0-9) графически представлено на Фигурах 24А-24Е (Фигура 24А: ИФН-γ, Фигура 24В: ФНО-α, Фигура 24С: ИЛ-6, Фигура 24D: ИЛ-2, и Фигура 24Е: ИЛ-15). Помимо этого, пролиферацию Т-клеток оценивали с помощью FACS с применением экспрессии Ki67 в качестве маркера пролиферирующих клеток. На Фигуре 24F графически представлена экспансия Т-клеток CD4+, и на Фигуре 24G графически представлена экспансия Т-клеток CD8+ в процентах от клеток CD4+ или CD8+, положительных по Ki67 (дни 0-14). На Фигурах 24H-24I графически представлены несколько важных маркеров гематологии и клинической химии у животных в группах введения (Фигура 24Н: количество тромбоцитов; Фигура 24I: С-реактивный белок; Фигура 24J: азот мочевины). Результаты этого исследования показывают, что связывающие DA x CD3 молекулы, содержащие в. связывающий CD3 домен CD3 mAb 1 M18, хорошо переносятся яванскими макаками, а также демонстрируют минимальное временное увеличение высвобождения ФНО-α, ИФН-γ, ИЛ-2 и ИЛ-6 даже при дозах, превышающих прогнозируемые терапевтические величины, и демонстрируют меньшие изменения множества маркеров клинической химии. Помимо этого, было обнаружено, что связывающие DA x CD3 молекулы, содержащие в. связывающий CD3 домен CD3 mAb 1 M18, предпочтительно стимулируют пролиферацию Т-клеток CD8+.
[00564] Другое токсикологическое исследование проводили с CD123-M13 (содержащим в. связывающий CD3 домен CD3 mAb 1 M13), вводимом в дозах 1 мг/кг и 10 мг/кг, CD123-M17 (содержащим в. связывающий CD3 домен CD3 mAb 1 M17), вводимом в дозах 1 мг/кг и 10 мг/кг, и CD123-M19 (содержащим в. связывающий CD3 домен CD3 mAb 1 M19), вводимом в дозе 10 мг/кг. В этих исследованиях наблюдали, что CD123-M13 демонстрировал более высокое высвобождение цитокинов, чем CD123-M17 или CD123-M19, в частности, в группе, получавшей дозу 10 мг/кг. В этом исследовании наблюдали определенную летальность, в частности, в группе, получавшей высокую дозу CD123-M13, а также временные изменения маркеров гематологии и клинической химии. В таблице 17 представлены сводные данные о летальности, наблюдаемой в этом исследовании и предыдущих токсикологических исследованиях с CD123-WT и CD123-M19.
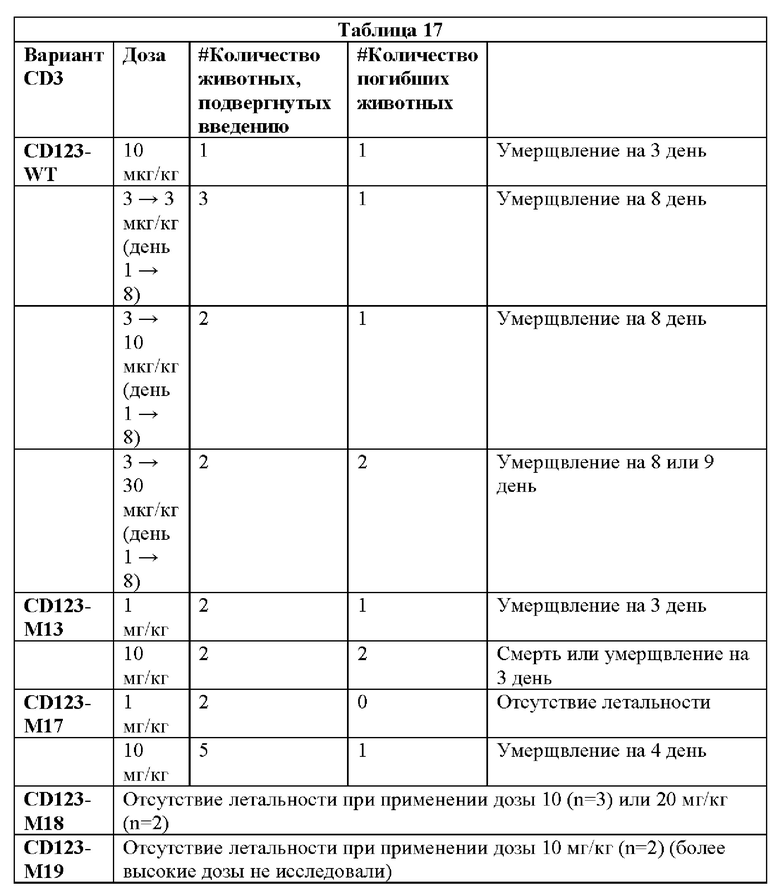
[00565] Как показано в таблице 17, летальность наблюдается у животных, получавших всего 3 мкг/кг (0,003 мг/кг) CD123-M13 (содержащего эт. связывающий CD3 домен CD3 mAb 1), тогда как связывающие CD123 х CD3 молекулы, содержащие в. связывающий CD3 домен CD3 mAb 1 М13, М17, М18 и М19, являются переносимыми в гораздо более высоких дозах, а также демонстрируют сниженные профили высвобождения цитокинов по сравнению с CD123-M13, содержащим эт. связывающий CD3 домен CD3 mAb 1. Распределение переносимых доз по данным этих исследований: CD123-M18 ≥ CD123-M19 > CD123-M17 > CD123-M13 > CD123-WT. Эти данные коррелируют с оценкой терапевтического индекса, представленной выше.
Пример 12
Способность иллюстративных молекул CD123 х CD3 опосредовать истощение бластных клеток ОМЛ
[00566] Иллюстративные CD123 х CD3 диатела оценивали в отношении их способности опосредовать истощение бластных клеток ОМЛ в образцах периферической крови пациента с ОМЛ. Кратко, клетки периферической крови пациента с ОМЛ инкубировали в среде с добавками в присутствии возрастающих концентраций DART-A-WT, CD123-WT, CD123-M1 и CD123-M18. Насыщенность клетками (бластными клетками CD34+, Т-клетками CD3+ и CD8+ анализировали с помощью проточной цитометрии в 0 момент времени и на 6 день и строили график в процентах от интактного контроля или в виде кратного увеличения исходного уровня. Содержание цитокинов анализировали путем анализа на микросферах (BD) в супернатантах, собранных на 4 день инкубирования. Результаты этого исследования представлены на Фигурах 25A-25G. Как показано на Фигуре 25А, CD123-M18 был способен опосредовать истощение бластных клеток ОМЛ в той же степени, что и DART-A-WT и CD123-WT. Однако CD123-M18 демонстрировал существенно сниженное увеличение популяции Т-клеток (Фигура 25В: Т-клетки CD4+; Фигура 25С: Т-клетки CD8+). Помимо этого, CD123-M18 демонстрировал существенно более низкие уровни высвобождения цитокинов (Фигура 25D: ИФН-γ; Фигура 25Е: ФНО-α; Фигура 25F: ИЛ-6; и Фигура 25G: ИЛ-2).
[00567] Эти результаты также показывают, что связывающие DA x CD3 молекулы, содержащие в. связывающие CD3 домены CD3 mAb 1 M18, сохраняли максимальный потенциал уничтожения при немного сниженной эффективности, однако при сопоставимо большем снижении индуцированного мишенью высвобождения цитокинов in vitro и in vivo. Встраивание таких в. связывающих CD3 доменов в связывающие DA х CD3 молекулы может увеличить терапевтический индекс при применении для перенаправленного опосредованного Т-клетками уничтожения.
Пример 13
Способность иллюстративных молекул CD19 х CD3 опосредовать истощение аутологичных В-клеток
[00568] В одной серии исследований иллюстративные диатела CD19 х CD3 CD19-WT (положительный контроль, содержащий эт. связывающий CD3 домен CD3 mAb 1) и CD19.1-M18 (содержащий в. связывающий CD3 домен CD3 mAb 1 M18) оценивали в отношении их способности опосредовать истощение аутологичных В-клеток in vitro и in vivo. Для исследований in vitro использовали МКПК от человека и яванского макака. Кратко, МКПК, полученные от человека или яванского макака, инкубировали в среде с добавками в присутствии возрастающих концентраций CD19-WT (положительный контроль), или CD19.1-M18, или отрицательного контроля ВИЧ-М18. Количество В-клеток анализировали с помощью проточной цитометрии (с применением CD20 в качестве маркера В-клеток) через 48 часов после инкубирования. Уровни цитокинов в супернатантах образцов от человека анализировали путем анализа на микросферах (BD). Результаты этого исследования представлены на Фигурах 31A-31F. Как показано на Фигурах 31А-31В, CD19.1-M18 был способен опосредовать истощение аутологичных В-клеток в МКПК как человека, так и яванского макака, в той же степени, что и CD19-WT. Помимо этого, CD19.1-M18 демонстрировал существенно более низкие уровни высвобождения цитокинов (Фигура 31С: ИФН-γ; Фигура 31D: ФНО-α; Фигура 31Е: ИЛ-6; и Фигура 31F: ИЛ-2).
[00569] Способность положительного контроля CD19-WT и CD19.1-M18 (содержащих в. связывающий CD3 домен CD3 mAb 1 M18) опосредовать истощение аутологичных В-клеток in vivo оценивали в исследовании по подбору доз у яванских макаков. План исследования представлен в таблице 18.
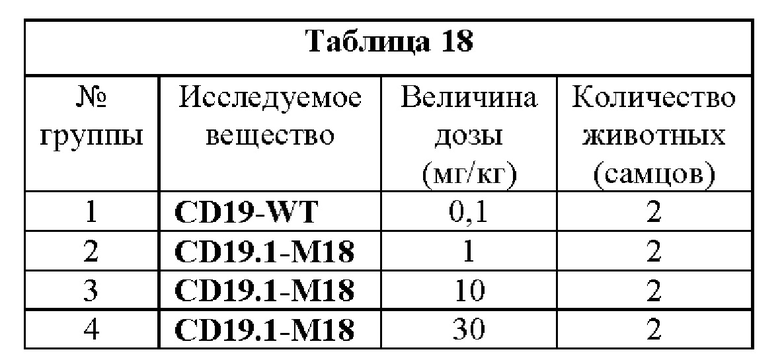
[00570] Диатела CD19 х CD3 вводили путем однократной 2-часовой внутривенной инфузии в 0 день. Образцы периферической крови отбирали до введения и периодически после введения. Количество В-клеток в образцах периферической крови анализировали с помощью проточной цитометрии (с применением CD20 в качестве маркера В-клеток). Репрезентативные данные от 1 из 2 макаков, входивших в группы 1-3, показаны на Фигурах 32A-32D (Фигура 32А: до введения в 0 день;
Фигура 32В: день 1; Фигура 32С: день 8; Фигура 32D: день 15; популяции В-клеток обозначены овалом). Помимо этого, паховые лимфатические узлы, собранные до введения, на 7 день и на 15 день окрашивали с целью выявления В-клеток (с применением CD20 в качестве маркера В-клеток). Репрезентативные иммуногистохимические изображения образцов, собранных до введения и на 7 день от 1 из 2 макаков, входивших в группы 1, 3 и 4, показаны на Фигурах 33А-33С (Фигура 33А: группа 1; Фигура 33В: группа 3; Фигура 33С: группа 4; до введения - слева и на 7 день - справа; окрашенные В-клетки выглядят темными). Результаты этого исследования in vivo показывают, что истощение В-клеток в периферической крови эффективно достигалось в течение одного дня и что истощение сохранялось до 15 дней после введения (см. Фигуры 32A-32D) однократной дозы иллюстративного диатела CD19 х CD3 CD19.1-M18. Схожим образом, истощение В-клеток в лимфатических узлах эффективно достигалось в течение 7 дней (самая ранняя временная точка, исследованная после введения), демонстрируя, что CD19.1-M18 в дозах всего 1 мг/кг способен опосредовать истощение аутологичных В-клеток путем перенаправленного опосредованного Т-клетками уничтожения in vivo в той же степени, что и положительный контроль CD19-WT.
[00571] Способность дополнительных связывающих CD19 × CD3 молекул опосредовать истощение аутологичных В-клеток оценивали у яванских макаков. В этом исследовании активность CD19-WT (положительного контроля, содержащего эт. связывающий CD3 домен CD3 mAb 1); CD19.1-M13 (содержащего в. связывающий CD3 домен CD3 mAb 1 M13) и CD19.1-M17 (содержащего в. связывающий CD3 домен CD3 mAb 1 M17) оценивали в отношении их способности опосредовать истощение аутологичных В-клеток при введении путем многократных внутривенных инфузий. План исследования представлен в таблице 19.
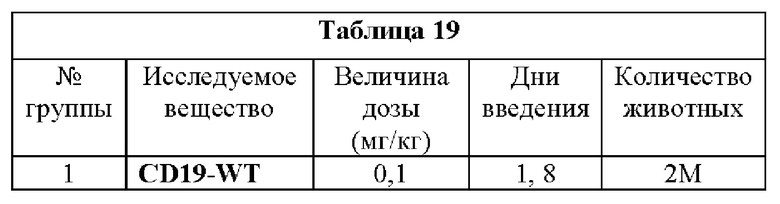
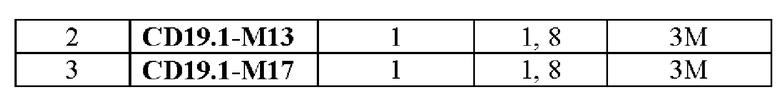
[00572] Не наблюдали летальности, потери массы тела или других существенных неблагоприятных явлений, наблюдали холодные конечности после введения у одного животного в группе 3 в 1 день и у одного животного в группе 2 на 8 день, и то, и другое исчезло на следующий день. Количество В-клеток в образцах периферической крови (отобранные до введения и периодически после введения) анализировали с помощью проточной цитометрии (с применением CD20 в качестве маркера В-клеток). Помимо этого, образцы тканей (селезенки, костного мозга и лимфатических узлов (ЛУ)) оценивали с помощью иммуногистохимии с окрашиванием на CD20. Данные проточной цитометрии для групп 1-3 показаны на Фигуре 34, и данные окрашивания тканей каждого животного (а также интактного животного в группе отрицательного контроля) представлены в таблице 20. Содержание цитокинов в сыворотке оценивали в ходе исследования (до введения и периодически после введения). Содержание ФНО-α, ИФН-γ, ИЛ-2, ИЛ-6 и ИЛ-15 в сыворотке для каждой исследуемой группы графически представлены на Фигурах 35А-35Е, соответственно. Помимо этого, популяции Т-клеток в периферической крови оценивали с помощью FACS с применением экспрессии Ki67 в качестве маркера пролиферирующих клеток. На Фигуре 36А графически представлена экспансия Т-клеток CD4+, и на Фигуре 36В графически представлена экспансия Т-клеток CD8+ в процентах от клеток CD4+ или CD8+, положительных по Ki67 (отобранных до введения и периодически после введения).
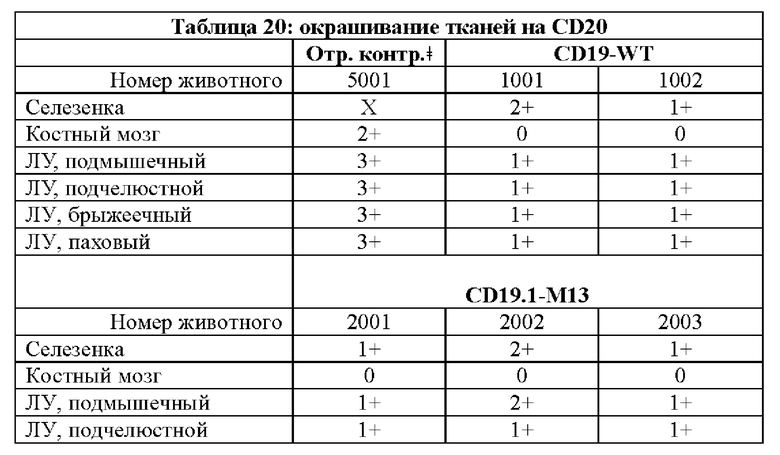
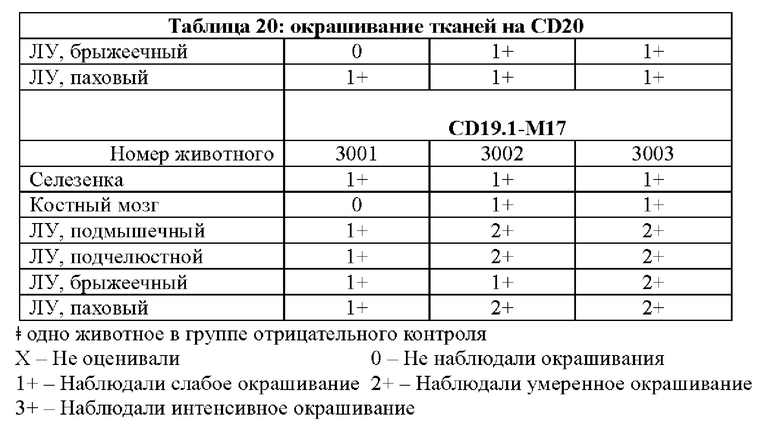
[00573] Результаты этого исследования показывают, что связывающие CD 19 х CD3 молекулы, содержащие в. связывающий CD3 домен CD3 mAb 1 M13 или CD3 mAb 1 М17, были активны у животных, получавших 1 мг/кг CD19.1-M13, демонстрировавших истощение аутологичных В-клеток в той же степени, что и получавшие положительный контроль CD19-WT. Животные, получавшие 1 мг/кг CD19.1-M17, также демонстрировали истощение аутологичных В-клеток, но в несколько меньшей степени, чем положительный контроль. Ожидается, что CD19.1-M17 приведет к достижению сопоставимого истощения при более высоких дозах. Указанные варианты опосредовали гораздо меньшее увеличение высвобождения ИНФ-γ, ФНО-α, ИЛ-2 и ИЛ-6 и небольшое снижение высвобождения ИЛ-15. Помимо этого, наблюдали, что связывающие молекулы, содержащие CD3 mAb 1 M13 и CD3 mAb 1 M17, стимулируют пролиферацию Т-клеток, причем молекулы, содержащие CD3 mAb 1 M13, демонстрируют более высокие уровни пролиферации. Помимо этого, обе молекулы демонстрировали преимущественно стимуляцию пролиферации Т-клеток CD8+.
[00574] Совместно исследования, представленные в приведенных выше примерах, показывают, что связывающие DA x CD3 молекулы, содержащие в. связывающий CD3 домен CD3 mAb 1 (например, M13, M17, М18, М19), проявляли различную аффинность связывания, различные значения ЕС50 цитотоксичности, но все они достигают максимальной активности ЦТЛ, которая является сравнимой с активностью молекул, содержащих эт. связывающий CD3 домен CD3 mAb 1, и таким образом демонстрируют повышенный терапевтический индекс. Эти исследования также показывают, что такие молекулы являются переносимыми и активными в опосредовании перенаправленного уничтожения клеток Т-клетками и в стимулировании активации и пролиферации Т-клеток in vivo.
[00575] Все публикации и патенты, упомянутые в настоящей заявке, включены в настоящий документ посредством ссылки в той же степени, как если бы для каждой отдельной публикации и заявки на патент было конкретно и отдельно указано, что их полное содержание включено в настоящую заявку посредством ссылки. Хотя настоящее изобретение описано применительно к его частным вариантам реализации, следует понимать, что оно допускает дополнительные модификации, и данная заявка подразумевает схватывание любых изменений, применений или адаптации настоящего изобретения, соответствующих, в целом, принципам настоящего изобретения и включающих такие отступления от настоящей заявки, как отступления, относящиеся к общеизвестной или общепринятой практике в области техники, к которой принадлежит настоящее изобретение, и которые могут быть применены к существенным признакам, изложенным выше в настоящей заявке.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MacroGenics, Inc.
Bonvini, Ezio
Huang, Ling
Lam, Chia-Ying
Chichili, Gurunadh Reddy
Alderson, Ralph Froman
Moore, Paul A.
Johnson, Leslie S.
<120> Вариантные связывающие CD3 домены и их применение
в комбинированной терапии при лечении заболеваний
<130> 1301.0150PCT
<150> US 62/738,632
<151> 2018-09-18
<150> US 62/631,043
<151> 2018-02-15
<160> 209
<170> PatentIn, версия 3.5
<210> 1
<211> 98
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(98)
<223> Иллюстративный домен CH1 IgG1 человека
<400> 1
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 2
<211> 98
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(98)
<223> Иллюстративный домен CH1 IgG2 человека
<400> 2
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val
<210> 3
<211> 98
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(98)
<223> Иллюстративный домен CH1 IgG3 человека
<400> 3
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 4
<211> 98
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(98)
<223> Иллюстративный домен CH1 IgG4 человека
<400> 4
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 5
<211> 15
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(15)
<223> Иллюстративный шарнирный домен IgG1 человека
<400> 5
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 6
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(12)
<223> Иллюстративный шарнирный домен IgG2 человека
<400> 6
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
1 5 10
<210> 7
<211> 62
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(62)
<223> Иллюстративный шарнирный домен IgG2 человека
<400> 7
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro Arg Cys
1 5 10 15
Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
20 25 30
Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu
35 40 45
Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
50 55 60
<210> 8
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(12)
<223> Иллюстративный шарнирный домен IgG4 человека
<400> 8
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro
1 5 10
<210> 9
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Шарнирный домен IgG4 человека, содержащий
стабилизирующую замену S228P
<400> 9
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 10
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(217)
<223> Домен CH2-CH3 иллюстративного IgG1 человека
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 10
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 11
<211> 216
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(216)
<223> Домен CH2-CH3 иллюстративного IgG2 человека
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (216)..(216)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 11
Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 12
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(217)
<223> Домен CH2-CH3 иллюстративного IgG3 человека
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 12
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 13
<211> 217
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(217)
<223> Домен CH2-CH3 иллюстративного IgG4 человека
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 13
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 14
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(107)
<223> Иллюстративный домен CL каппа человека
<400> 14
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 15
<211> 104
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(104)
<223> Иллюстративный домен CL лямбда человека
<400> 15
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
50 55 60
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
65 70 75 80
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
85 90 95
Thr Val Ala Pro Thr Glu Cys Ser
100
<210> 16
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Предпочтительный промежуточный спейсерный пептид (линкер 1)
<400> 16
Gly Gly Gly Ser Gly Gly Gly Gly
1 5
<210> 17
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Предпочтительный цистеинсодержащий спейсерный пептид (линкер 2)
<400> 17
Gly Gly Cys Gly Gly Gly
1 5
<210> 18
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 18
Gly Gly Gly Ser
1
<210> 19
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 19
Leu Gly Gly Gly Ser Gly
1 5
<210> 20
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 20
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
1 5 10
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 21
Ala Ser Thr Lys Gly
1 5
<210> 22
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 22
Leu Glu Pro Lys Ser Ser
1 5
<210> 23
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный спейсерный пептид (линкер 2), лишенный остатков цистеина
<400> 23
Ala Pro Ser Ser Ser
1 5
<210> 24
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> способствующий гетеродимеризации домен
<400> 24
Gly Val Glu Pro Lys Ser Cys
1 5
<210> 25
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> способствующий гетеродимеризации домен
<400> 25
Val Glu Pro Lys Ser Cys
1 5
<210> 26
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> способствующий гетеродимеризации домен
<400> 26
Ala Glu Pro Lys Ser Cys
1 5
<210> 27
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> способствующий гетеродимеризации домен
<400> 27
Gly Phe Asn Arg Gly Glu Cys
1 5
<210> 28
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> способствующий гетеродимеризации домен
<400> 28
Phe Asn Arg Gly Glu Cys
1 5
<210> 29
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> «E-спиральный» способствующий гетеродимеризации домен
<400> 29
Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
1 5 10 15
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
20 25
<210> 30
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> «K-спиральный» способствующий гетеродимеризации домен
<400> 30
Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val
1 5 10 15
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
20 25
<210> 31
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеинсодержащий «E-спиральный» способствующий гетеродимеризации домен
<400> 31
Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val
1 5 10 15
Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
20 25
<210> 32
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Цистеинсодержащий «K-спиральный» способствующий гетеродимеризации домен
<400> 32
Lys Val Ala Ala Cys Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val
1 5 10 15
Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
20 25
<210> 33
<211> 46
<212> БЕЛОК
<213> Streptococcus dysgalactiae
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(46)
<223> Связывающий альбумин домен 3 (ABD3) белка G Streptococcus
штамма G148
<400> 33
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Asn Asn Ala Lys Thr Val Glu
20 25 30
Gly Val Lys Ala Leu Ile Asp Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 34
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариантный деиммунизированный связывающий альбумин домен 3 (ABD3)
белка G Streptococcus штамма G148, содержащий замены N66D, T70S и V71A
<400> 34
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Asp Asn Ala Lys Ser Ala Glu
20 25 30
Gly Val Lys Ala Leu Ile Ala Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 35
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариантный деиммунизированный связывающий альбумин домен 3 (ABD3)
белка G Streptococcus штамма G148, содержащий замены L64A, I65A и D79A
<400> 35
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Ala Ala Asn Asn Ala Lys Thr Val Glu
20 25 30
Gly Val Lys Ala Leu Ile Ala Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 36
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариантный деиммунизированный связывающий альбумин домен 3 (ABD3)
белка G Streptococcus штамма G148, содержащий замены N66S, T70S и D79A
<400> 36
Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly
1 5 10 15
Val Ser Asp Tyr Tyr Lys Asn Leu Ile Ser Asn Ala Lys Ser Val Glu
20 25 30
Gly Val Lys Ala Leu Ile Ala Glu Ile Leu Ala Ala Leu Pro
35 40 45
<210> 37
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 37
Ala Pro Ser Ser Ser Pro Met Glu
1 5
<210> 38
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 38
Val Glu Pro Lys Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 39
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 39
Leu Glu Pro Lys Ser Ala Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 40
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 40
Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 41
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер ScFv)
<400> 41
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 42
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид («длинный» линкер)
<400> 42
Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly
1 5 10
<210> 43
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 43
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
<210> 44
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Промежуточный спейсерный пептид (линкер)
<400> 44
Leu Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 45
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий замены L234A/L235A
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 45
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 46
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий замены M252Y/S254T/T256E
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 46
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 47
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий замены L234A/L235A и
M252Y/S254T/T256E
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 47
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 48
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий образующие «выступ» замены
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 48
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 49
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий образующие «выступ» замены
и замены M252Y/S254T/T256E
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 49
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 50
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий образующие «впадину» замены
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 50
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 51
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG1 человека, содержащий образующие «впадину»
замены и замены M252Y/S254T/T256E
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 51
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Xaa
210 215
<210> 52
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG4 человека, содержащий замены Y252/T254T/E256
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 52
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 53
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG4 человека, содержащий образующие «выступ» замены
и замены Y252/T254/E256
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 53
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 54
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен CH2-CH3 IgG4 человека, содержащий образующие «впадину»
замены и замены Y252/T254/E256
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (217)..(217)
<223> Xaa представляет собой лизин (K) или отсутствует
<400> 54
Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Val Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly Xaa
210 215
<210> 55
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 56
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к CD3 человека CD3 mAb 1
<400> 56
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 57
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1
<400> 57
Thr Tyr Ala Met Asn
1 5
<210> 58
<211> 19
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(19)
<223> CDRH2 домена VH антитела к CD3 человека CD3 mAb 1
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (19)..(19)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 58
Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser
1 5 10 15
Val Lys Xaa
<210> 59
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1
<400> 59
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 60
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRL1 домена VL антитела к CD3 человека CD3 mAb 1
<400> 60
Arg Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn
1 5 10
<210> 61
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(7)
<223> CDRL2 домена VL антитела к CD3 человека CD3 mAb 1
<400> 61
Gly Thr Asn Lys Arg Ala Pro
1 5
<210> 62
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(9)
<223> CDRL3 домена VL антитела к CD3 человека CD3 mAb 1
<400> 62
Ala Leu Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 63
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1, содержащий D66
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 64
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M1 («CD3 mAb 1
Low»)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 65
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M1 («CD3
mAb 1 Low»)
<400> 65
His Gly Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe Ala Tyr
1 5 10
<210> 66
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M2 («CD3 mAb 1
Fast»)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 67
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M2 («CD3
mAb 1 Fast»)
<400> 67
His Lys Asn Phe Gly Asn Ser Tyr Val Thr Trp Phe Ala Tyr
1 5 10
<210> 68
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M3
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 68
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Ile Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 69
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M3
<400> 69
His Gly Asn Phe Ile Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 70
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M4
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 70
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Ala Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 71
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M4
<400> 71
His Gly Asn Phe Gly Asn Ser Ala Val Ser Trp Phe Ala Tyr
1 5 10
<210> 72
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M5
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 72
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Gly Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 73
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M5
<400> 73
His Gly Asn Phe Gly Asn Ser Gly Val Ser Trp Phe Ala Tyr
1 5 10
<210> 74
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M6
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Gln Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 75
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M6
<400> 75
His Gly Asn Phe Gly Asn Ser Gln Val Ser Trp Phe Ala Tyr
1 5 10
<210> 76
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M7
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 76
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Asp Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 77
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M7
<400> 77
His Asp Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 78
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M8
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 78
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Glu Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 79
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M8
<400> 79
His Glu Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 80
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M9
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 81
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M9
<400> 81
His Lys Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 82
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M10
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 82
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Ile Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 83
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M10
<400> 83
His Gly Asn Ile Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 84
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M11
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 84
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Phe Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 85
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M11
<400> 85
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Phe Phe Ala Tyr
1 5 10
<210> 86
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M12
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 86
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Tyr Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 87
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M12
<400> 87
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Tyr Phe Ala Tyr
1 5 10
<210> 88
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M13
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 88
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Glu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 89
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M13
<400> 89
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Glu
1 5 10
<210> 90
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M14
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 91
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1 M14
<400> 91
Asp Tyr Ala Met Asn
1 5
<210> 92
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M15
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 92
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Glu Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 93
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1 M15
<400> 93
Glu Tyr Ala Met Asn
1 5
<210> 94
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M16
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 94
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Asp
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 95
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1 M16
<400> 95
Thr Asp Ala Met Asn
1 5
<210> 96
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M17
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 96
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Thr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 97
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1 M17
<400> 97
Thr Thr Ala Met Asn
1 5
<210> 98
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M18
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 99
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(5)
<223> CDRH1 домена VH антитела к CD3 человека CD3 mAb 1 M18
<400> 99
Thr Tyr Gly Met Asn
1 5
<210> 100
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M19
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 100
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Ile Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 101
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M19
<400> 101
His Lys Asn Ile Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 102
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M20
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 102
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Gly Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 103
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M20
<400> 103
His Lys Asn Phe Gly Asn Ser Gly Val Ser Trp Phe Ala Tyr
1 5 10
<210> 104
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M21
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 104
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val Ser Phe Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 105
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M21
<400> 105
His Lys Asn Phe Gly Asn Ser Tyr Val Ser Phe Phe Ala Tyr
1 5 10
<210> 106
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH антитела к CD3 человека CD3 mAb 1 M22
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<400> 106
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val Ser Tyr Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 107
<211> 14
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(14)
<223> CDRH3 домена VH антитела к CD3 человека CD3 mAb 1 M22
<400> 107
His Lys Asn Phe Gly Asn Ser Tyr Val Ser Tyr Phe Ala Tyr
1 5 10
<210> 108
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к CD3 человека CD3 mAb 1 M23
<400> 108
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Glu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 109
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(9)
<223> CDRL3 домена VL антитела к CD3 человека CD3 mAb 1 M23
<400> 109
Ala Glu Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 110
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к CD3 человека CD3 mAb 1 M24
<400> 110
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Gln Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 111
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(9)
<223> CDRL3 домена VL антитела к CD3 человека CD3 mAb 1 M24
<400> 111
Ala Gln Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 112
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к CD3 человека CD3 mAb 1 M25
<400> 112
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Asp Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 113
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(7)
<223> CDRL2 домена VL антитела к CD3 человека CD3 mAb 1 M25
<400> 113
Asp Thr Asn Lys Arg Ala Pro
1 5
<210> 114
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к CD3 человека CD3 mAb 1 M26
<400> 114
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Gly Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 115
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(7)
<223> CDRL2 домена VL антитела к CD3 человека CD3 mAb 1 M26
<400> 115
Gly Thr Asn Gly Arg Ala Pro
1 5
<210> 116
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(118)
<223> Домен VH антитела к CD2 человека CD2 mAb Lo-CD2a
<400> 116
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Gln Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Glu Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Lys Gln Gly Leu Glu Leu Val
35 40 45
Gly Arg Ile Asp Pro Glu Asp Gly Ser Ile Asp Tyr Val Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Lys Phe Asn Tyr Arg Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 117
<211> 112
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(112)
<223> Домен VL антитела к CD2 человека CD2 mAb Lo-CD2a
<400> 117
Asp Val Val Leu Thr Gln Thr Pro Pro Thr Leu Leu Ala Thr Ile Gly
1 5 10 15
Gln Ser Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Asn Trp Leu Leu Gln Arg Thr Gly Gln Ser
35 40 45
Pro Gln Pro Leu Ile Tyr Leu Val Ser Lys Leu Glu Ser Gly Val Pro
50 55 60
Asn Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Met Gln Phe
85 90 95
Thr His Tyr Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 118
<211> 120
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(120)
<223> Домен VH антитела к CD8 человека OKT8
<400> 118
Gln Val Gln Leu Leu Glu Ser Gly Pro Glu Leu Leu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Thr Gly Gly Thr Gly Tyr Asn Gln Lys Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Val Asp Ser Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Phe Arg Tyr Thr Tyr Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 119
<211> 112
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(112)
<223> Домен VL антитела к CD8 человека OKT8
<400> 119
Asp Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Asp Asn Ser Leu Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Val Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Glu Ala Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 120
<211> 121
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(121)
<223> Домен VH антитела к CD8 человека TRX2
<400> 120
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Tyr Tyr Asp Gly Ser Asn Lys Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro His Tyr Asp Gly Tyr Tyr His Phe Phe Asp Ser Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 121
<211> 106
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(106)
<223> Домен VL антитела к CD8 человека TRX2
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Gly Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Thr Asp Ile Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Tyr Gln Tyr Asn Asn Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 122
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к B7-H3 человека B7-H3 mAb-B VH1
<400> 122
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Pro Arg Leu Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 123
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к B7-H3 человека B7-H3 mAb-B VH2
<400> 123
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Tyr Pro Gly Gly Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Pro Arg Leu Trp Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 124
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к B7-H3 человека B7-H3 mAb-B VL1
<400> 124
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 125
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к B7-H3 человека B7-H3 mAb-B VL2
<400> 125
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 126
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к B7-H3 человека B7-H3 mAb-C
<400> 126
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Asn Ser Gly Gly Ser Asn Thr Tyr Tyr Pro Asp Ser Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Asp Gly Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 127
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к B7-H3 человека B7-H3 mAb-C
<400> 127
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Val
35 40 45
Tyr Asn Thr Lys Thr Leu Pro Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 128
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к B7-H3 человека B7-H3 mAb-D
<400> 128
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Gly Thr Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Gly Tyr Arg Tyr Glu Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 129
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к B7-H3 человека B7-H3 mAb-D
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 130
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к B7-H3 человека эноблитузумаба
<400> 130
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Asp Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Gly Arg Gly Arg Glu Asn Ile Tyr Tyr Gly Ser Arg Leu Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 131
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к B7-H3 человека эноблитузумаба
<400> 131
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asn Val Asp Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 132
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к CEACAM5 / CEACAM6 человека
16C3
<400> 132
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile
35 40 45
Gly Leu Ile Ser Thr Tyr Ser Gly Asp Thr Lys Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Ser Gly Ser Arg Tyr Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 133
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к CEACAM5 / CEACAM6 человека
16C3
<400> 133
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Arg Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Trp Gly Ala Ser Asn Leu Ala Asp Gly Met Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Gln Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Asn Val Leu Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 134
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к CEACAM5 / CEACAM6 человека
hMN15
<400> 134
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ser Ser Gly Phe Ala Leu Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Phe Ile Ala Asn Lys Ala Asn Gly His Thr Thr Asp Tyr Ser Pro
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr
85 90 95
Phe Cys Ala Arg Asp Met Gly Ile Arg Trp Asn Phe Asp Val Trp Gly
100 105 110
Gln Gly Thr Pro Val Thr Val Ser Ser
115 120
<210> 135
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к CEACAM5 / CEACAM6 человека
hMN15
<400> 135
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Met Thr Cys Ser Ala Ser Ser Arg Val Ser Tyr Ile
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
35 40 45
Gly Thr Ser Thr Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Tyr Asn Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 136
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH химерного антитела к EGFR человека цетуксимаба
<400> 136
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Asn Thr Asp Tyr Asn Thr Pro Phe Thr
50 55 60
Ser Arg Leu Ser Ile Asn Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ser Asn Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Ala Leu Thr Tyr Tyr Asp Tyr Glu Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 137
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL химерного антитела к EGFR человека цетуксимаба
<400> 137
Asp Ile Leu Leu Thr Gln Ser Pro Val Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Asn Asn Asn Trp Pro Thr
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 138
<211> 119
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(119)
<223> Домен VH антитела к EGFR человека панитумумаба
<400> 138
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 139
<211> 108
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(108)
<223> Домен VL антитела к EGFR человека панитумумаба
<400> 139
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 140
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(118)
<223> Домен VH антитела к EphA2 человека mAb 1
<400> 140
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Arg Tyr
20 25 30
Ser Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Gly Gly Ser Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Lys His Gly Asn Tyr Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 141
<211> 106
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(106)
<223> Домен VL антитела к EphA2 человека mAb 1
<400> 141
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Tyr Thr Leu Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 142
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(118)
<223> Домен VH антитела к EphA2 человека mAb 2
<400> 142
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Ile Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Met Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Pro Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 143
<211> 111
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(111)
<223> Домен VL антитела к EphA2 человека mAb 2
<400> 143
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 144
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(118)
<223> Домен VH антитела к EphA2 человека mAb 3
<400> 144
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Ser Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp His
20 25 30
Tyr Met Tyr Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Asp Gly Gly Ser Phe Thr Ser Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ile Ala Lys Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Glu Ser Asp Arg Pro Phe Pro Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 145
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(107)
<223> Домен VL антитела к EphA2 человека mAb 3
<400> 145
Asp Ile Val Leu Thr Gln Ser His Arg Ser Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ala Ser Thr Arg His Ala Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Gly Asp Leu Ala Leu Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 146
<211> 119
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(119)
<223> Домен VH антитела к gpA33 человека mAb 1
<400> 146
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Glu Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Tyr Gly Asn Asn Val Tyr Phe Asp Val Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 147
<211> 106
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(106)
<223> Домен VL антитела к gpA33 человека mAb 1
<400> 147
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Arg Ser Ser Ile Ser Phe Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 148
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к Her2/Neu человека
маргетуксимаба
<400> 148
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Val Ser Arg Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 149
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к Her2/Neu человека
маргетуксимаба
<400> 149
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly His Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 150
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к Her2/Neu человека
трастузумаба
<400> 150
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 151
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к Her2/Neu человека
трастузумаба
<400> 151
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 152
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к Her2/Neu человека
пертузумаба
<400> 152
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 153
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к Her2/Neu человека
пертузумаба
<400> 153
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 154
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к VEGF человека бевацизумаба
<400> 154
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 155
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к VEGF человека бевацизумаба
<400> 155
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 156
<211> 118
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(118)
<223> Домен VH антитела к 5T4 человека mAb 1
<400> 156
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Phe
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Asn Arg Gly Gly Thr Glu Tyr Asn Glu Lys Ala
50 55 60
Lys Ser Arg Val Thr Met Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Asn Pro Tyr Tyr Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 157
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(107)
<223> Домен VL антитела к 5T4 человека mAb 1
<400> 157
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 158
<211> 127
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(127)
<223> Домен VH антитела к 5T4 человека mAb 2
<400> 158
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Thr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Ser Gly Arg Ala Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Asn Cys
85 90 95
Ala Arg Tyr Gly Pro Leu Phe Thr Thr Val Val Asp Pro Asn Ser Tyr
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 159
<211> 112
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(112)
<223> Домен VL антитела к 5T4 человека mAb 2
<400> 159
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val Tyr Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 160
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH антитела к IL-13R(alpha2) человека hu08
<400> 160
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Asn
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Val Ser Ser Gly Gly Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gln Gly Thr Thr Ala Leu Ala Thr Arg Phe Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 161
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL антитела к IL-13R(alpha2) человека hu08
<400> 161
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Ser Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Ser Ala Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 162
<211> 120
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(120)
<223> Домен VH антитела к CD123 человека mAb 1
<400> 162
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 163
<211> 113
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(113)
<223> Домен VL антитела к CD123 человека mAb 1
<400> 163
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 164
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к CD19 человека mAb 1
<400> 164
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Phe Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Met Glu Leu Trp Ser Tyr Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 165
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к CD19 человека mAb 1
<400> 165
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 166
<211> 126
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(126)
<223> Домен VH антитела к ВИЧ(env) человека 7B2
<400> 166
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Phe Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Thr Glu Tyr
20 25 30
Tyr Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala Tyr Ile Ser Lys Asn Gly Glu Tyr Ser Lys Tyr Ser Pro Ser Ser
50 55 60
Asn Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Val Phe
65 70 75 80
Leu Gln Leu Asp Arg Leu Ser Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asp Gly Leu Thr Tyr Phe Ser Glu Leu Leu Gln Tyr Ile
100 105 110
Phe Asp Leu Trp Gly Gln Gly Ala Arg Val Thr Val Ser Ser
115 120 125
<210> 167
<211> 113
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(113)
<223> Домен VL антитела к ВИЧ(env) человека 7B2
<400> 167
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile His Cys Lys Ser Ser Gln Thr Leu Leu Tyr Ser
20 25 30
Ser Asn Asn Arg His Ser Ile Ala Trp Tyr Gln Gln Arg Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Leu Tyr Trp Ala Ser Met Arg Leu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Leu Gln Ala Glu Asp Val Ala Ile Tyr Tyr Cys His Gln
85 90 95
Tyr Ser Ser His Pro Pro Thr Phe Gly His Gly Thr Arg Val Glu Ile
100 105 110
Lys
<210> 168
<211> 123
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(123)
<223> Домен VH антитела к ВИЧ(env) человека A32
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (118)..(118)
<223> Xaa представляет собой лейцин (L) или метионин (M)
<400> 168
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Ser Cys Thr Val Ser Gly Gly Ser Ser Ser Ser Gly
20 25 30
Ala His Tyr Trp Ser Trp Ile Arg Gln Tyr Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile His Tyr Ser Gly Asn Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Thr Ile Ser Gln His Thr Ser Glu Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Asn Ser Val Thr Val Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Thr Arg Leu Arg Thr Leu Arg Asn Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Xaa Val Thr Val Ser Ser
115 120
<210> 169
<211> 110
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL антитела к ВИЧ(env) человека A32
<400> 169
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln His His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Ser Glu Val Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Glu Tyr Tyr Cys Ser Ser Tyr Thr Asp Ile
85 90 95
His Asn Phe Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 170
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VH гуманизированного антитела к RSV(гликопротеину F)
паливизумаба
<400> 170
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Ser Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Asp Ile Trp Trp Asp Asp Lys Lys Asp Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Lys Val Thr Asn Met Asp Pro Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ser Met Ile Thr Asn Trp Tyr Phe Asp Val Trp Gly Ala
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 171
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Домен VL гуманизированного антитела к RSV(гликопротеину F)
паливизумаба
<400> 171
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Gly Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Asp
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gly Tyr Pro Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 172
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-A CD123 x CD3
DART-A-WT
<400> 172
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala
245 250 255
Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys
260 265 270
Glu Lys Val Ala Ala Leu Lys Glu
275 280
<210> 173
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-A CD123 x CD3
DART-A-WT
<400> 173
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Gln Ser Gly Ala Glu
115 120 125
Leu Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
130 135 140
Tyr Thr Phe Thr Asp Tyr Tyr Met Lys Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Gln Gly Leu Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr
165 170 175
Phe Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Ile Thr Val Asp Lys
180 185 190
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Arg Ser His Leu Leu Arg Ala Ser Trp
210 215 220
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
<210> 174
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-WT
<400> 174
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 175
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-WT
<400> 175
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Gln Ser Gly Ala Glu
115 120 125
Leu Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
130 135 140
Tyr Thr Phe Thr Asp Tyr Tyr Met Lys Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Gln Gly Leu Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr
165 170 175
Phe Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Ile Thr Val Asp Lys
180 185 190
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Arg Ser His Leu Leu Arg Ala Ser Trp
210 215 220
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu
245 250 255
Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
<210> 176
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Третья полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-WT
<400> 176
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 177
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M1
<400> 177
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Thr Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 178
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M2
<400> 178
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Lys Asn
210 215 220
Phe Gly Asn Ser Tyr Val Thr Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 179
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M18
<400> 179
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Gly Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 180
<211> 504
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B 5T4 x CD3
5T4-WT
<400> 180
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
115 120 125
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
130 135 140
Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
165 170 175
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
180 185 190
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
195 200 205
Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val
210 215 220
Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala
245 250 255
Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
260 265 270
Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
275 280 285
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
290 295 300
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
305 310 315 320
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
325 330 335
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
340 345 350
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
355 360 365
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
370 375 380
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
385 390 395 400
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
405 410 415
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
420 425 430
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
435 440 445
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
450 455 460
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
465 470 475 480
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
485 490 495
Ser Leu Ser Leu Ser Pro Gly Lys
500
<210> 181
<211> 270
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-B 5T4 x CD3
5T4-WT
<400> 181
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Val Gln Ser Gly Ala Glu
115 120 125
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
130 135 140
Tyr Thr Phe Thr Ser Phe Trp Met His Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Gln Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Asn Arg Gly Gly Thr
165 170 175
Glu Tyr Asn Glu Lys Ala Lys Ser Arg Val Thr Met Thr Ala Asp Lys
180 185 190
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Gly Gly Asn Pro Tyr Tyr Pro Met Asp
210 215 220
Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly Cys Gly
225 230 235 240
Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
245 250 255
Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
<210> 182
<211> 504
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B 5T4 x CD3
5T4-M1
<400> 182
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
115 120 125
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
130 135 140
Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
165 170 175
Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
180 185 190
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
195 200 205
Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val
210 215 220
Thr Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala
245 250 255
Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
260 265 270
Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
275 280 285
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
290 295 300
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
305 310 315 320
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
325 330 335
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
340 345 350
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
355 360 365
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
370 375 380
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
385 390 395 400
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
405 410 415
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
420 425 430
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
435 440 445
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
450 455 460
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
465 470 475 480
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
485 490 495
Ser Leu Ser Leu Ser Pro Gly Lys
500
<210> 183
<211> 504
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B 5T4 x CD3
5T4-M2
<400> 183
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
115 120 125
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
130 135 140
Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
165 170 175
Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
180 185 190
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
195 200 205
Ala Val Tyr Tyr Cys Val Arg His Lys Asn Phe Gly Asn Ser Tyr Val
210 215 220
Thr Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala
245 250 255
Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
260 265 270
Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
275 280 285
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
290 295 300
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
305 310 315 320
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
325 330 335
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
340 345 350
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
355 360 365
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
370 375 380
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
385 390 395 400
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
405 410 415
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
420 425 430
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
435 440 445
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
450 455 460
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
465 470 475 480
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
485 490 495
Ser Leu Ser Leu Ser Pro Gly Lys
500
<210> 184
<211> 504
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B 5T4 x CD3
5T4-M18
<400> 184
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asp Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly
100 105 110
Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
115 120 125
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
130 135 140
Ser Thr Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
145 150 155 160
Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
165 170 175
Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
180 185 190
Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr
195 200 205
Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val
210 215 220
Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala
245 250 255
Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
260 265 270
Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
275 280 285
Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
290 295 300
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
305 310 315 320
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
325 330 335
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
340 345 350
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
355 360 365
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
370 375 380
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
385 390 395 400
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
405 410 415
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
420 425 430
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
435 440 445
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
450 455 460
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
465 470 475 480
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
485 490 495
Ser Leu Ser Leu Ser Pro Gly Lys
500
<210> 185
<211> 506
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B ВИЧ x CD3
HIV-WT
<400> 185
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln His His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Ser Glu Val Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Glu Tyr Tyr Cys Ser Ser Tyr Thr Asp Ile
85 90 95
His Asn Phe Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly
115 120 125
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
130 135 140
Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
165 170 175
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
180 185 190
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
195 200 205
Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn
210 215 220
Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Ala Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu
245 250 255
Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala
260 265 270
Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
275 280 285
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
290 295 300
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
305 310 315 320
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
325 330 335
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
340 345 350
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
355 360 365
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
370 375 380
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
385 390 395 400
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
405 410 415
Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
420 425 430
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
435 440 445
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
450 455 460
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
465 470 475 480
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
485 490 495
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505
<210> 186
<211> 274
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-B ВИЧ x CD3
HIV-WT
<400> 186
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Gln Leu Gln Glu Ser Gly Pro Gly
115 120 125
Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Ser Cys Thr Val Ser Gly
130 135 140
Gly Ser Ser Ser Ser Gly Ala His Tyr Trp Ser Trp Ile Arg Gln Tyr
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile His Tyr Ser Gly Asn
165 170 175
Thr Tyr Tyr Asn Pro Ser Leu Lys Ser Arg Ile Thr Ile Ser Gln His
180 185 190
Thr Ser Glu Asn Gln Phe Ser Leu Lys Leu Asn Ser Val Thr Val Ala
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Thr Arg Leu Arg Thr Leu
210 215 220
Arg Asn Ala Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser Ala Ser Thr Lys Gly Lys Val Ala Ala Cys Lys Glu Lys Val Ala
245 250 255
Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu
260 265 270
Lys Glu
<210> 187
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Третья полипептидная цепь иллюстративных молекул типа TRIVALENT
<400> 187
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Phe
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Tyr Tyr Asp Gly Ser Asn Lys Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro His Tyr Asp Gly Tyr Tyr His Phe Phe Asp Ser Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn Arg Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 188
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Четвертая полипептидная цепь иллюстративных молекул типа TRIVALENT
<400> 188
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Gly Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Thr Asp Ile Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Tyr Gln Tyr Asn Asn Gly Tyr Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 189
<211> 280
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь иллюстративного диатела типа DART-A
CD123 x CD3, имеющего структуру диатела DART-A-WT, однако
содержащего домены VL и VH одного из вариантов CD3 mAb 1 M1-M26
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (152)..(152)
<223> Xaa представляет собой треонин (T), аспартат (D) или глутамат (E)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (153)..(153)
<223> Xaa представляет собой тирозин (Y), аспартат (D) или треонин (T)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (154)..(154)
<223> Xaa представляет собой аланин (A) или глицин (G)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (189)..(189)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (223)..(223)
<223> Xaa представляет собой глицин (G), аспартат (D), глутамат (E) или лизин (K)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (225)..(225)
<223> Xaa представляет собой фенилаланин (F) или изолейцин (I)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (226)..(226)
<223> Xaa представляет собой глицин (G) или изолейцин (I)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (229)..(229)
<223> Xaa представляет собой тирозин (Y), аланин (A), глицин (G) или глутамин (Q)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (231)..(231)
<223> Xaa представляет собой серин (S) или треонин (T)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (232)..(232)
<223> Xaa представляет собой триптофан (W), фенилаланин (F) или тирозин (Y)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (235)..(235)
<223> Xaa представляет собой тирозин (Y) или глутамат (E)
<400> 189
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Xaa Xaa Xaa Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Xaa Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Xaa Asn
210 215 220
Xaa Xaa Asn Ser Xaa Val Xaa Xaa Phe Ala Xaa Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Lys Val Ala Ala
245 250 255
Leu Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys
260 265 270
Glu Lys Val Ala Ala Leu Lys Glu
275 280
<210> 190
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь иллюстративного диатела типа DART-A
CD123 x CD3, имеющего структуру диатела DART-A-WT, однако
содержащего домены VL и VH одного из вариантов CD3 mAb 1 M1-M26
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (52)..(52)
<223> Xaa представляет собой глицин (G) или аспартат (D)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (55)..(55)
<223> Xaa представляет собой лизин (K) или глицин (G)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (92)..(92)
<223> Xaa представляет собой лейцин (L), глутамат (E) или глутамин (Q)
<400> 190
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Xaa Thr Asn Xaa Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Xaa Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Gln Ser Gly Ala Glu
115 120 125
Leu Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
130 135 140
Tyr Thr Phe Thr Asp Tyr Tyr Met Lys Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Gln Gly Leu Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr
165 170 175
Phe Tyr Asn Gln Lys Phe Lys Gly Arg Val Thr Ile Thr Val Asp Lys
180 185 190
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Arg Ser His Leu Leu Arg Ala Ser Trp
210 215 220
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
<210> 191
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19-WT
<400> 191
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
275 280 285
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
290 295 300
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
305 310 315 320
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
325 330 335
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
340 345 350
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
355 360 365
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
370 375 380
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
385 390 395 400
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
405 410 415
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
420 425 430
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
435 440 445
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
450 455 460
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
465 470 475 480
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
485 490 495
Ser Leu Ser Pro Gly Lys
500
<210> 192
<211> 271
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19-WT
<400> 192
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Thr Leu Arg Glu Ser Gly Pro Ala
115 120 125
Leu Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly
130 135 140
Phe Ser Leu Ser Thr Ser Gly Met Gly Val Gly Trp Ile Arg Gln Pro
145 150 155 160
Pro Gly Lys Ala Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp
165 170 175
Lys Arg Tyr Asn Pro Ala Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Thr Ser Lys Asn Gln Val Phe Leu Thr Met Thr Asn Met Asp Pro Val
195 200 205
Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Met Glu Leu Trp Ser Tyr Tyr
210 215 220
Phe Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
225 230 235 240
Thr Lys Gly Lys Val Ala Ala Cys Lys Glu Lys Val Ala Ala Leu Lys
245 250 255
Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
<210> 193
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19.1-M18
<400> 193
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Phe Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
275 280 285
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
290 295 300
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
305 310 315 320
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
325 330 335
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
340 345 350
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
355 360 365
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
370 375 380
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
385 390 395 400
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
405 410 415
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
420 425 430
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
435 440 445
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
450 455 460
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
465 470 475 480
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
485 490 495
Leu Ser Leu Ser Pro Gly Lys
500
<210> 194
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19.1-M18
<400> 194
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Gln Val Thr Leu Arg Glu Ser Gly Pro Ala
115 120 125
Leu Val Lys Pro Thr Gln Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly
130 135 140
Phe Ser Leu Ser Thr Ser Gly Met Gly Val Gly Trp Ile Arg Gln Pro
145 150 155 160
Pro Gly Lys Ala Leu Glu Trp Leu Ala His Ile Trp Trp Asp Asp Asp
165 170 175
Lys Arg Tyr Asn Pro Ala Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Thr Ser Lys Asn Gln Val Phe Leu Thr Met Thr Asn Met Asp Pro Val
195 200 205
Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Met Glu Leu Trp Ser Tyr Tyr
210 215 220
Phe Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Gly
225 230 235 240
Cys Gly Gly Gly Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu
245 250 255
Lys Glu Lys Val Ala Ala Leu Lys Glu Lys Val Ala Ala Leu Lys Glu
260 265 270
<210> 195
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Альтернативный домен VL гуманизированного антитела к CD19 человека
mAb 1
<400> 195
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Phe Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 196
<211> 506
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B ВИЧ x CD3
HIV-M18
<400> 196
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln His His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Ile Ile Ser Glu Val Asn Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Glu Tyr Tyr Cys Ser Ser Tyr Thr Asp Ile
85 90 95
His Asn Phe Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly
115 120 125
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
130 135 140
Phe Thr Phe Ser Thr Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr
165 170 175
Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
180 185 190
Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr
195 200 205
Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn
210 215 220
Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Ala Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu
245 250 255
Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala
260 265 270
Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
275 280 285
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
290 295 300
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
305 310 315 320
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
325 330 335
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
340 345 350
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
355 360 365
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
370 375 380
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
385 390 395 400
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
405 410 415
Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr
420 425 430
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
435 440 445
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
450 455 460
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
465 470 475 480
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
485 490 495
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505
<210> 197
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19-M18
<400> 197
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
275 280 285
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
290 295 300
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
305 310 315 320
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
325 330 335
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
340 345 350
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
355 360 365
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
370 375 380
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
385 390 395 400
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
405 410 415
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
420 425 430
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
435 440 445
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
450 455 460
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
465 470 475 480
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
485 490 495
Ser Leu Ser Pro Gly Lys
500
<210> 198
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M13
<400> 198
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Glu Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 199
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M17
<400> 199
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Thr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Gly Asn
210 215 220
Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 200
<211> 510
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD123 x CD3
CD123-M19
<400> 200
Asp Phe Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Ser Gly Gly Gly Gly Glu Val Gln Leu Val Glu Ser
115 120 125
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
130 135 140
Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ala Met Asn Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Arg Ile Arg Ser Lys Tyr
165 170 175
Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser Val Lys Asp Arg Phe Thr
180 185 190
Ile Ser Arg Asp Asp Ser Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser
195 200 205
Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Lys Asn
210 215 220
Ile Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Cys Gly Gly Gly Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Glu Val Ala Ala Leu Glu Lys Gly Gly Gly Asp Lys Thr His Thr
275 280 285
Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe
290 295 300
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
305 310 315 320
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
325 330 335
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
340 345 350
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
355 360 365
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
370 375 380
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
385 390 395 400
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
405 410 415
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
420 425 430
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
435 440 445
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
450 455 460
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
465 470 475 480
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
485 490 495
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
500 505 510
<210> 201
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19.1-M13
<400> 201
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Phe Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Glu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
275 280 285
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
290 295 300
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
305 310 315 320
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
325 330 335
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
340 345 350
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
355 360 365
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
370 375 380
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
385 390 395 400
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
405 410 415
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
420 425 430
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
435 440 445
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
450 455 460
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
465 470 475 480
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
485 490 495
Leu Ser Leu Ser Pro Gly Lys
500
<210> 202
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19.1-M17
<400> 202
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Phe Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Thr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
275 280 285
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
290 295 300
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
305 310 315 320
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
325 330 335
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
340 345 350
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
355 360 365
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
370 375 380
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
385 390 395 400
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
405 410 415
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
420 425 430
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
435 440 445
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
450 455 460
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
465 470 475 480
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
485 490 495
Leu Ser Leu Ser Pro Gly Lys
500
<210> 203
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3
CD19.1-M19
<400> 203
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Phe Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Lys Asn Ile Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Cys Gly Gly Gly Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala
245 250 255
Leu Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu
260 265 270
Lys Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
275 280 285
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
290 295 300
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
305 310 315 320
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
325 330 335
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
340 345 350
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
355 360 365
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
370 375 380
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
385 390 395 400
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
405 410 415
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
420 425 430
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
435 440 445
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
450 455 460
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
465 470 475 480
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
485 490 495
Leu Ser Leu Ser Pro Gly Lys
500
<210> 204
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3,
содержащего домен VL CD19 mAb 1 и домен VH CD3 mAb 1 M13
<400> 204
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Glu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
275 280 285
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
290 295 300
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
305 310 315 320
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
325 330 335
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
340 345 350
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
355 360 365
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
370 375 380
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
385 390 395 400
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
405 410 415
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
420 425 430
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
435 440 445
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
450 455 460
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
465 470 475 480
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
485 490 495
Ser Leu Ser Pro Gly Lys
500
<210> 205
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3,
содержащего домен VL CD19 mAb 1 и домен VH CD3 mAb 1 M17
<400> 205
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Thr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
275 280 285
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
290 295 300
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
305 310 315 320
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
325 330 335
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
340 345 350
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
355 360 365
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
370 375 380
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
385 390 395 400
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
405 410 415
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
420 425 430
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
435 440 445
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
450 455 460
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
465 470 475 480
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
485 490 495
Ser Leu Ser Pro Gly Lys
500
<210> 206
<211> 502
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Первая полипептидная цепь диатела типа DART-B CD19 x CD3,
содержащего домен VL CD19 mAb 1 и домен VH CD3 mAb 1 M19
<400> 206
Glu Asn Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Ala Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Ala Ser Asn Arg Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp His Thr Leu Thr Ile Ser Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Val Tyr Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
115 120 125
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
130 135 140
Thr Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
145 150 155 160
Trp Val Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
165 170 175
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
180 185 190
Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala
195 200 205
Val Tyr Tyr Cys Val Arg His Lys Asn Ile Gly Asn Ser Tyr Val Ser
210 215 220
Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Glu Val Ala Ala Cys Glu Lys Glu Val Ala Ala Leu
245 250 255
Glu Lys Glu Val Ala Ala Leu Glu Lys Glu Val Ala Ala Leu Glu Lys
260 265 270
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
275 280 285
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
290 295 300
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
305 310 315 320
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
325 330 335
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
340 345 350
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
355 360 365
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
370 375 380
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
385 390 395 400
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
405 410 415
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
420 425 430
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
435 440 445
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
450 455 460
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
465 470 475 480
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
485 490 495
Ser Leu Ser Pro Gly Lys
500
<210> 207
<211> 125
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(125)
<223> Домен VH вариантов антитела к CD3 человека CD3 mAb 1
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (31)..(31)
<223> Xaa представляет собой треонин (T), аспартат (D) или глутамат (E)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (32)..(32)
<223> Xaa представляет собой тирозин (Y), аспартат (D) или треонин (T)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (68)..(68)
<223> Xaa представляет собой аспартат (D) или глицин (G)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (102)..(102)
<223> Xaa представляет собой глицин (G), аспартат (D), глутамат (E) или лизин (K)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (104)..(104)
<223> Xaa представляет собой фенилаланин (F) или изолейцин (I)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (105)..(105)
<223> Xaa представляет собой глицин (G) или изолейцин (I)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (108)..(108)
<223> Xaa представляет собой тирозин (Y), аланин (A), глицин (G) или глутамин (Q)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (111)..(111)
<223> Xaa представляет собой триптофан (W), фенилаланин (F) или тирозин (Y)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (114)..(114)
<223> Xaa представляет собой тирозин (Y) или глутамат (E)
<400> 207
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Xaa Xaa
20 25 30
Xaa Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Xaa Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Ser
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Xaa Asn Xaa Xaa Asn Ser Xaa Ser Thr Xaa Phe
100 105 110
Ala Xaa Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 208
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(110)
<223> Домен VL вариантов антитела к CD3 человека CD3 mAb 1
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (52)..(52)
<223> Xaa представляет собой глицин (G) или аспартат (D)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (55)..(55)
<223> Xaa представляет собой лизин (K) или глицин (G)
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (92)..(92)
<223> Xaa представляет собой лейцин (L), глутамат (E) или глутамин (Q)
<400> 208
Gln Ala Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Xaa Thr Asn Xaa Arg Ala Pro Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Xaa Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 209
<211> 123
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕРЕМЕННЫЙ ПРИЗНАК
<222> (1)..(123)
<223> Домен VH антитела к ВИЧ(env) человека A32, в котором остаток 118
представляет собой лейцин (L)
<400> 209
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Ser Cys Thr Val Ser Gly Gly Ser Ser Ser Ser Gly
20 25 30
Ala His Tyr Trp Ser Trp Ile Arg Gln Tyr Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile His Tyr Ser Gly Asn Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Thr Ile Ser Gln His Thr Ser Glu Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Asn Ser Val Thr Val Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Thr Arg Leu Arg Thr Leu Arg Asn Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ИММУННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ОБРАТНЫЙ УНИВЕРСАЛЬНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР, ДЛЯ НАЦЕЛИВАНИЯ НА РАЗЛИЧНЫЕ МНОГОЧИСЛЕННЫЕ АНТИГЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ИНФЕКЦИЙ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2824391C2 |
| РЕКРУТИРУЮЩИЕ Т-КЛЕТКИ ПОЛИПЕПТИДЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD123 И TCR АЛЬФА/БЕТА | 2017 |
|
RU2775063C2 |
| CD123-СПЕЦИФИЧЕСКИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2015 |
|
RU2727290C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К Vβ17/CD123 | 2020 |
|
RU2831786C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИТЕЛА К МЕЗОТЕЛИНУ | 2019 |
|
RU2837574C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2837770C2 |
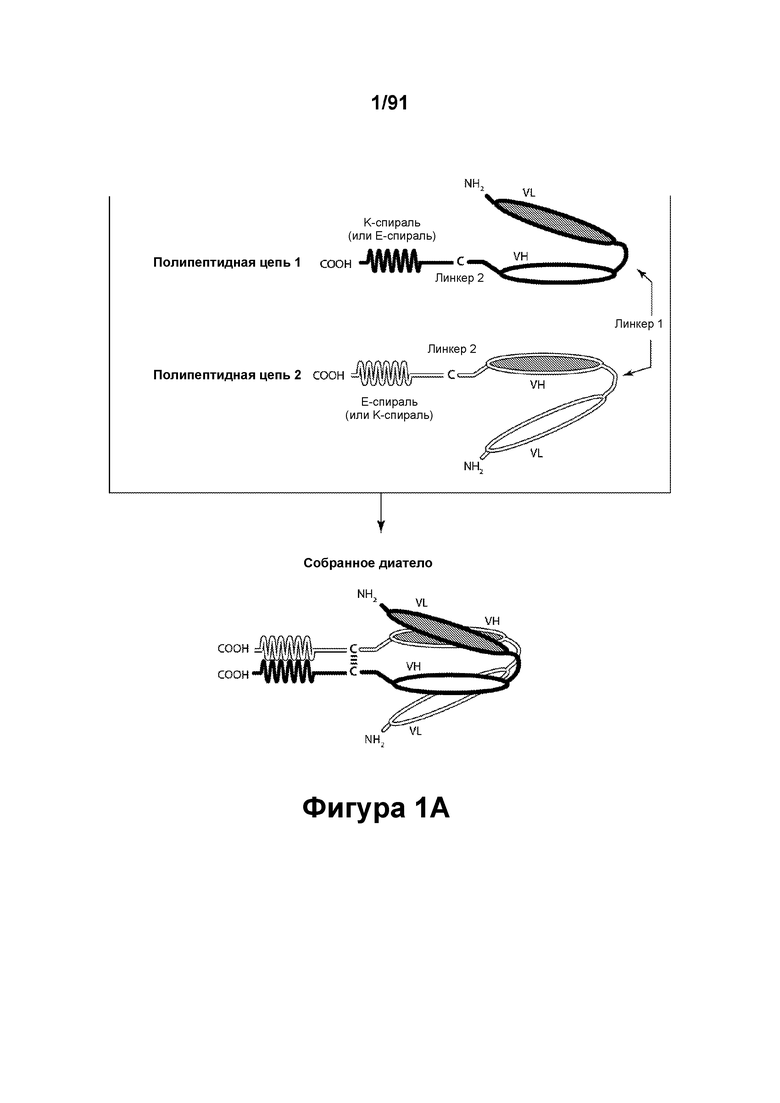
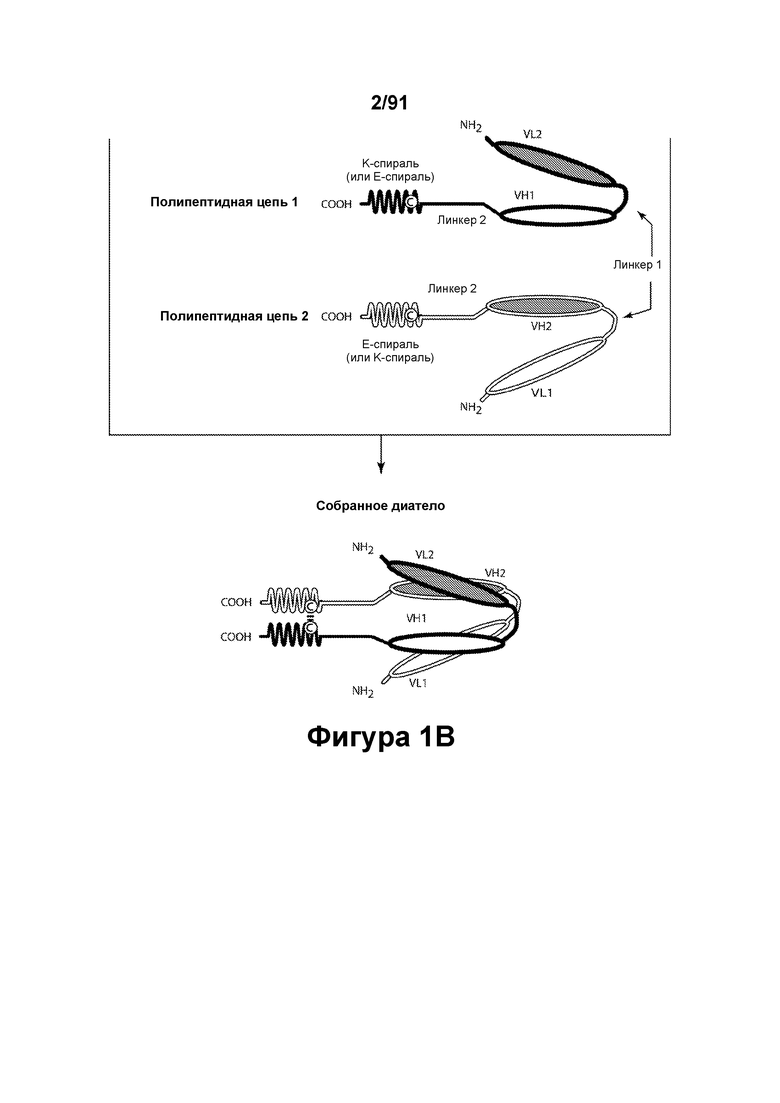
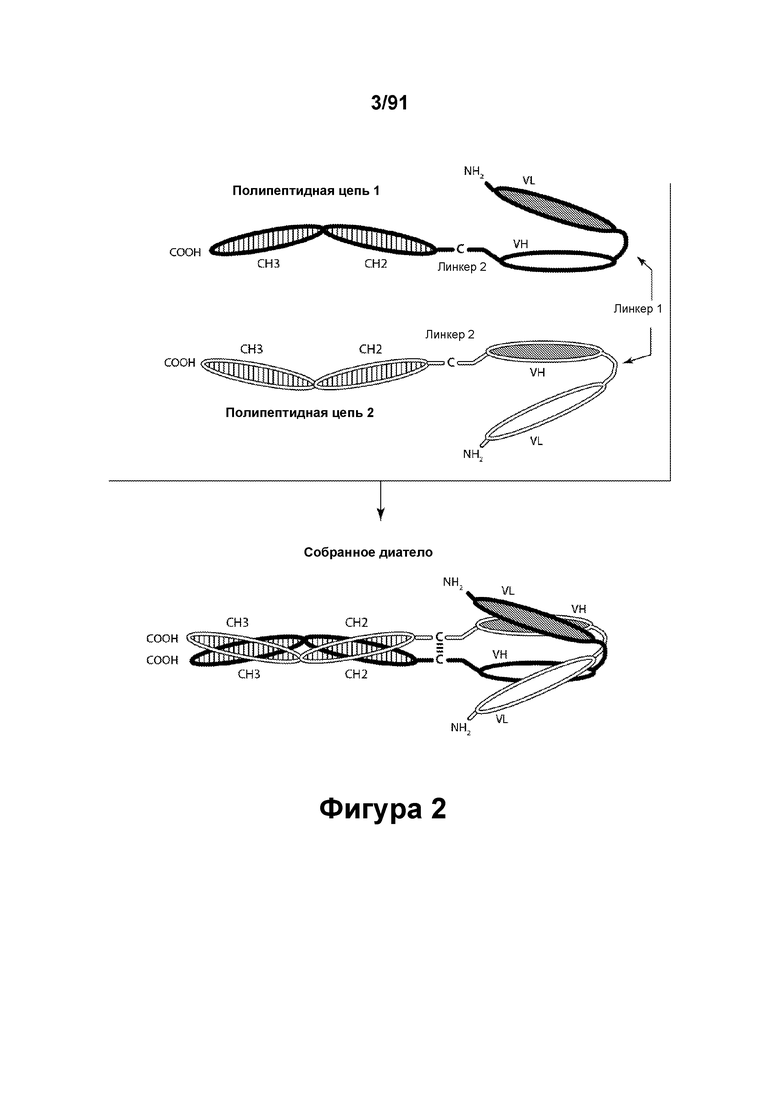
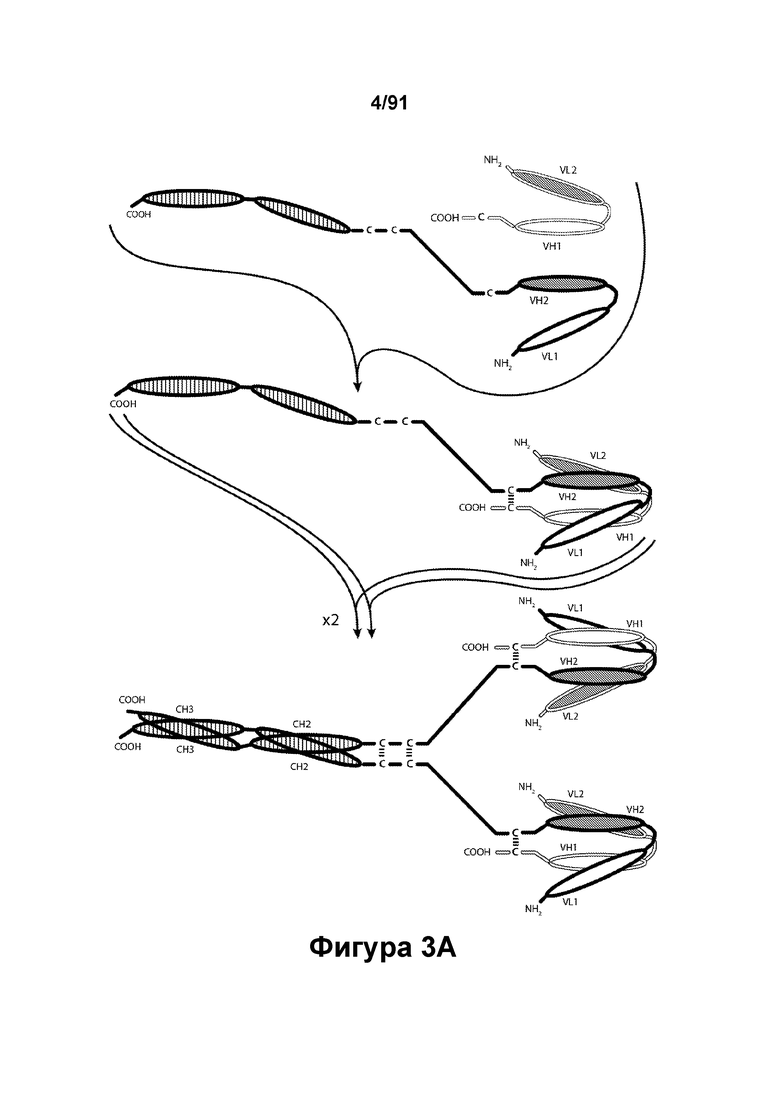
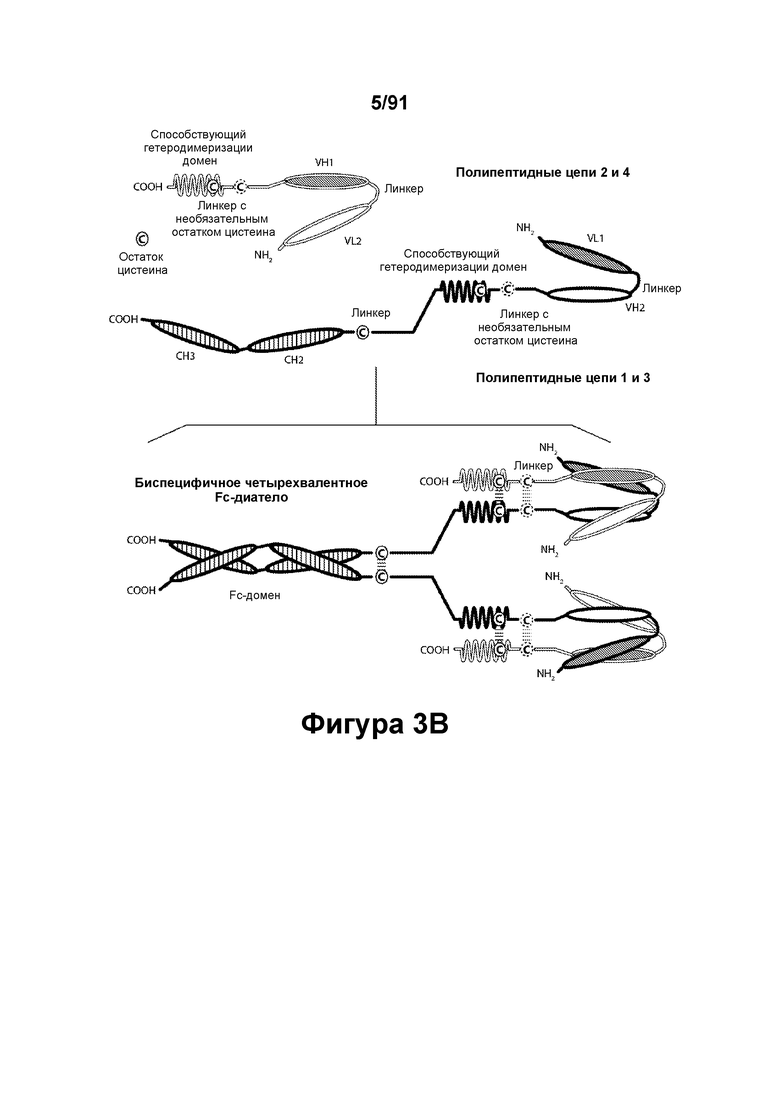
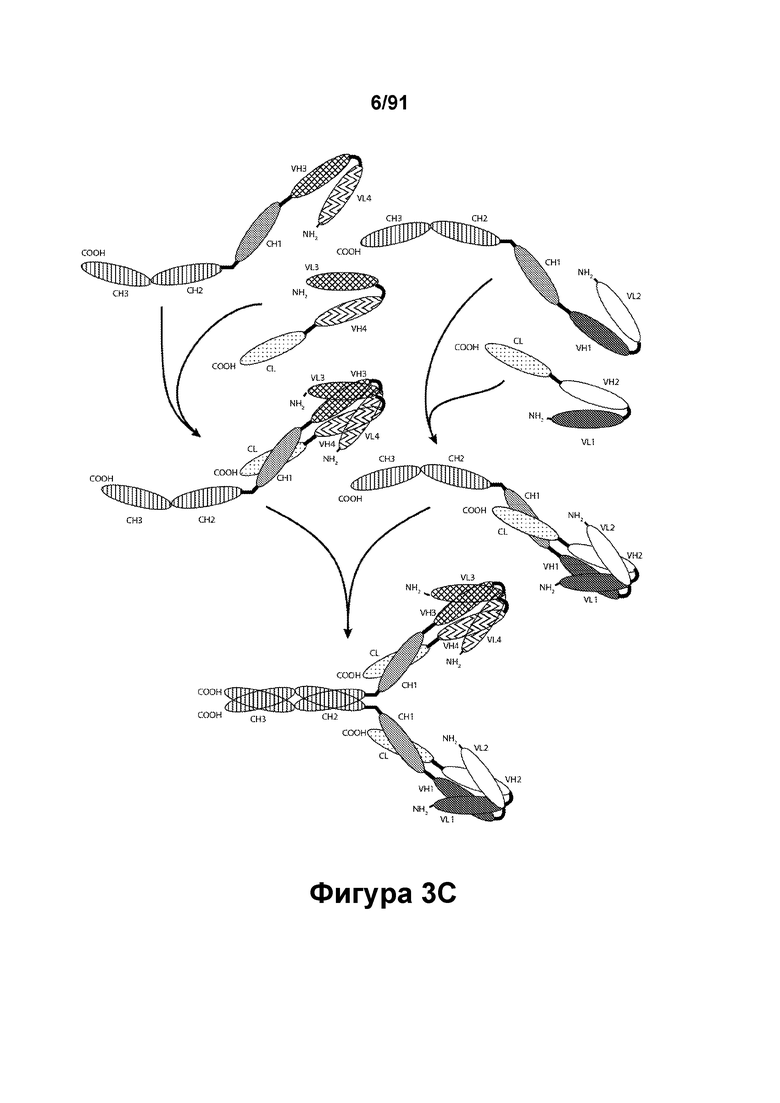
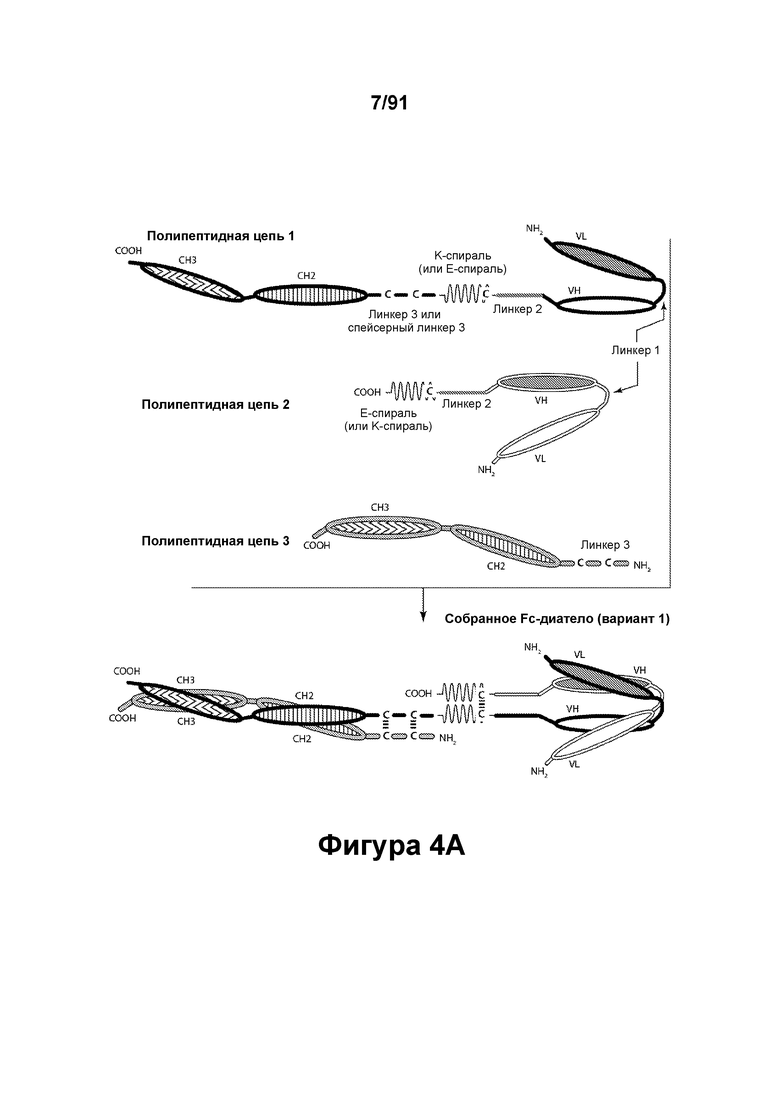
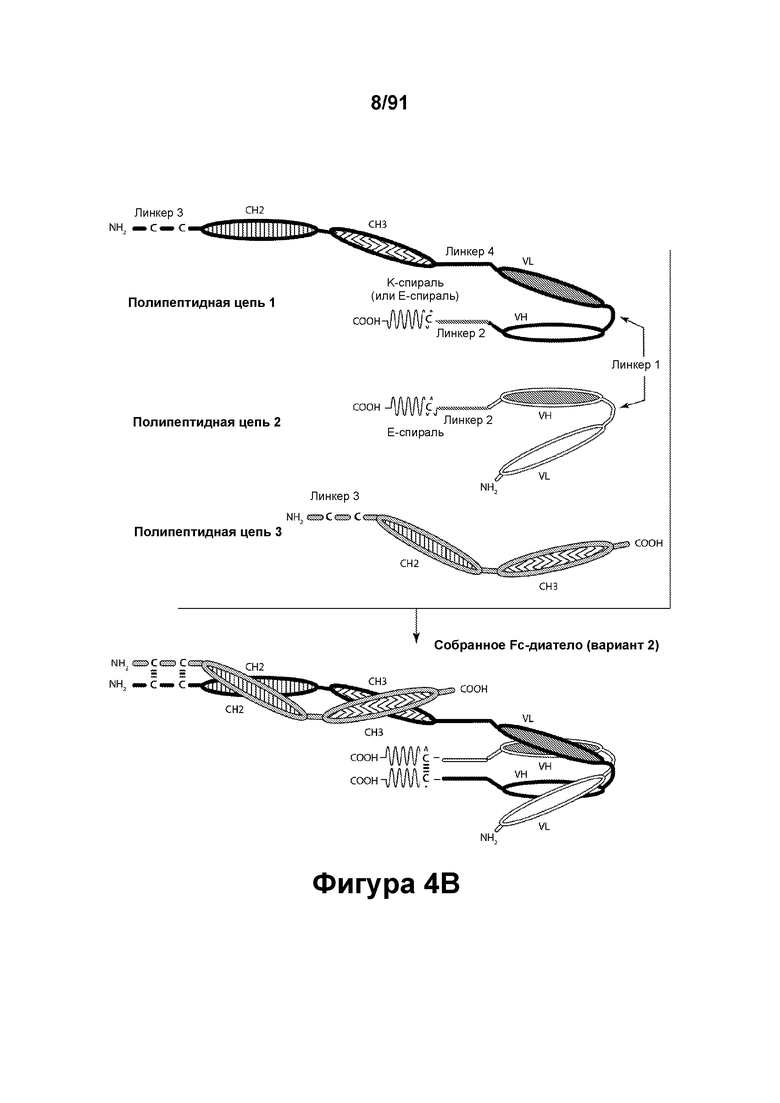
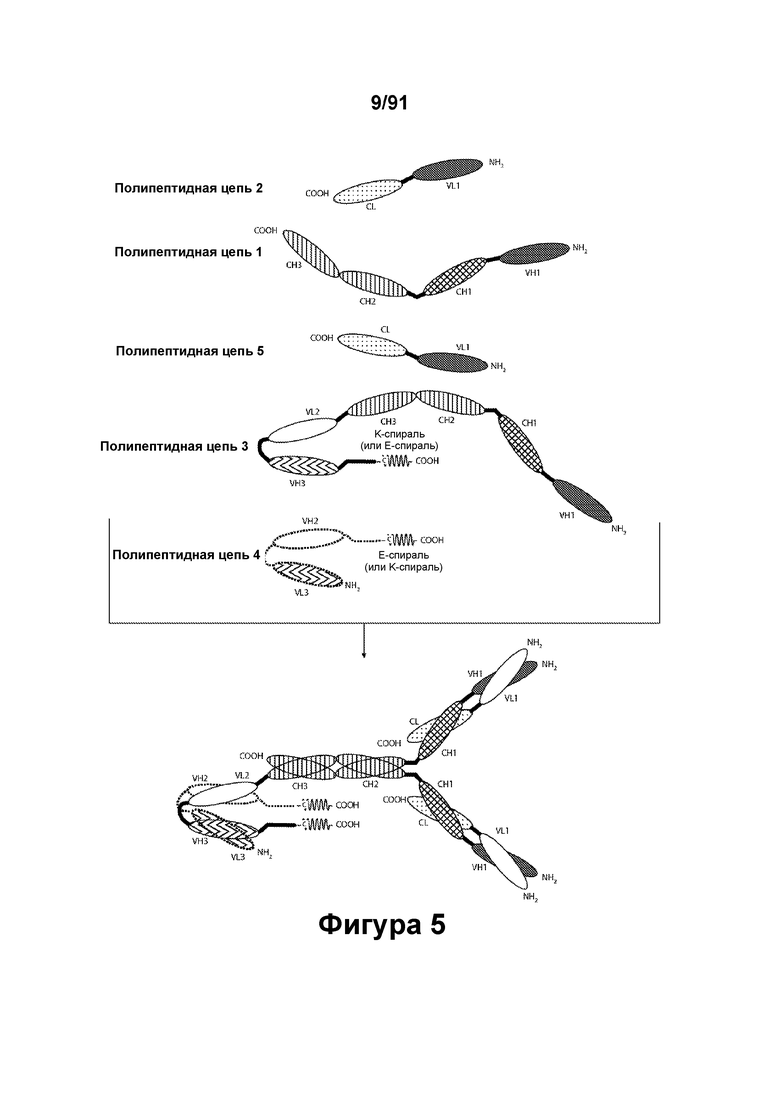
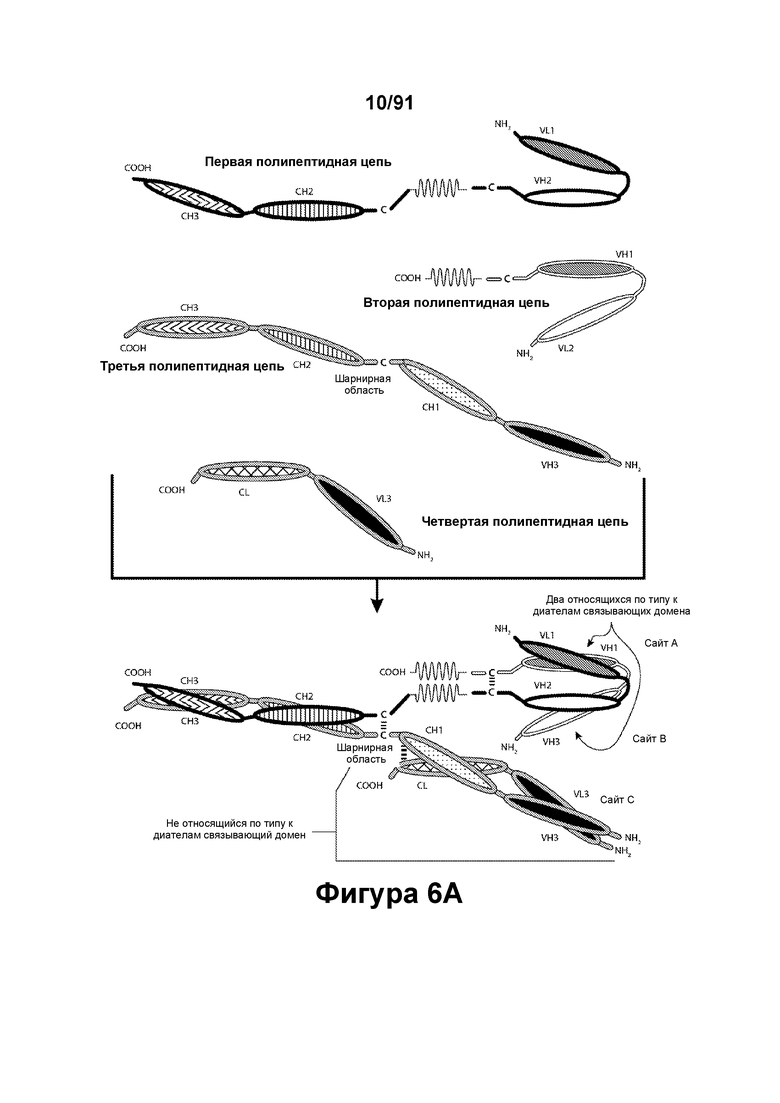
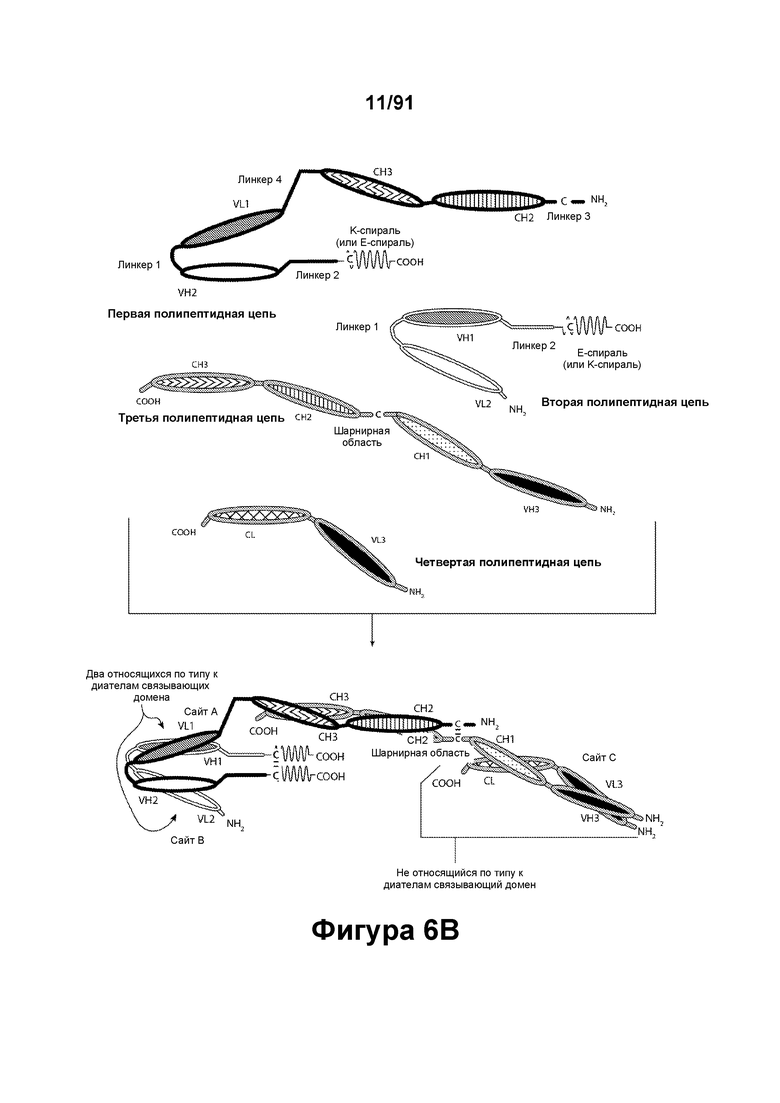
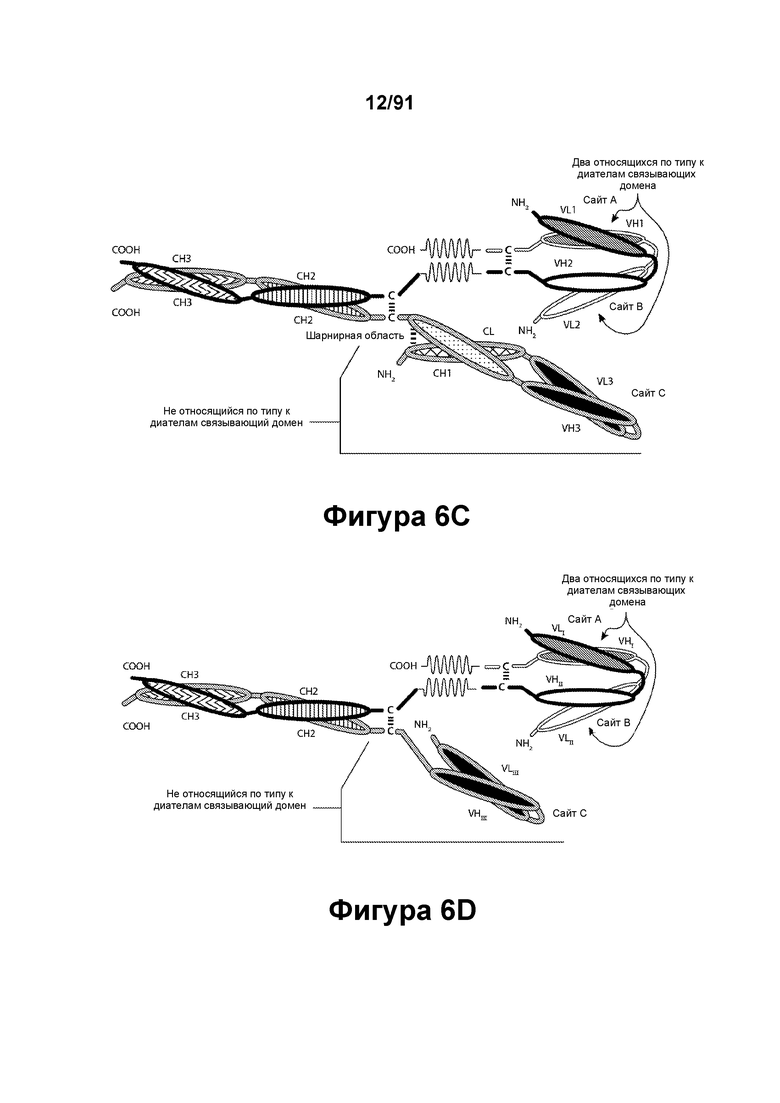
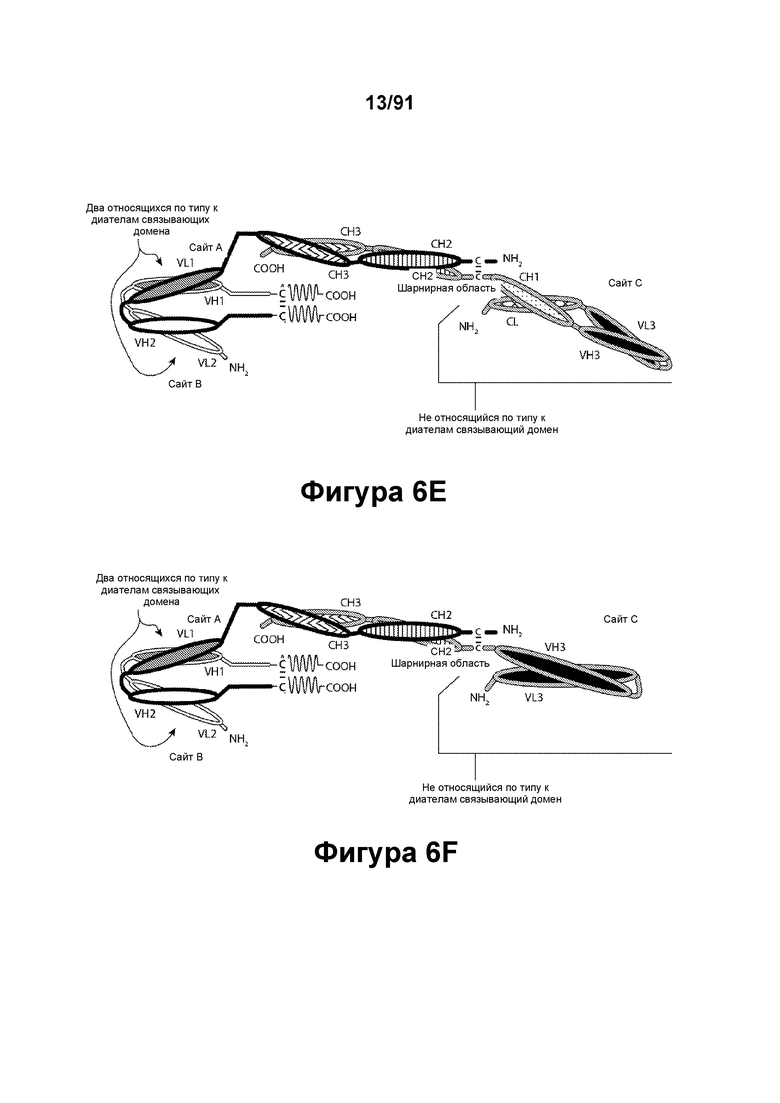
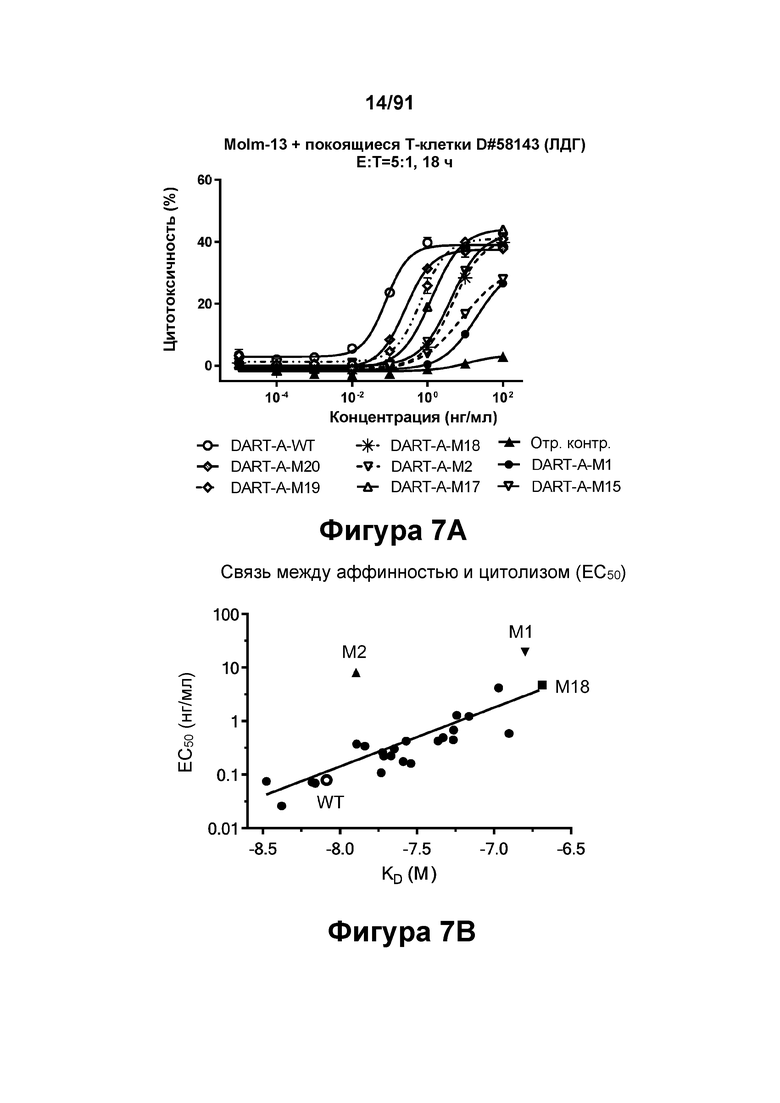
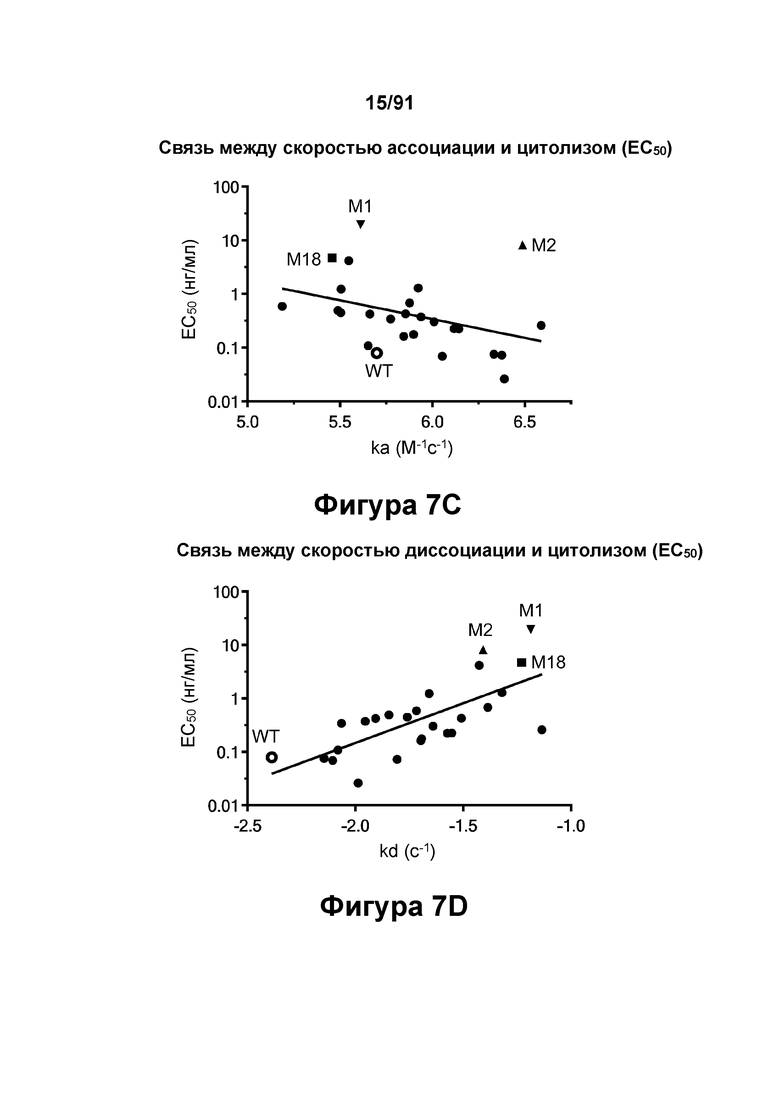
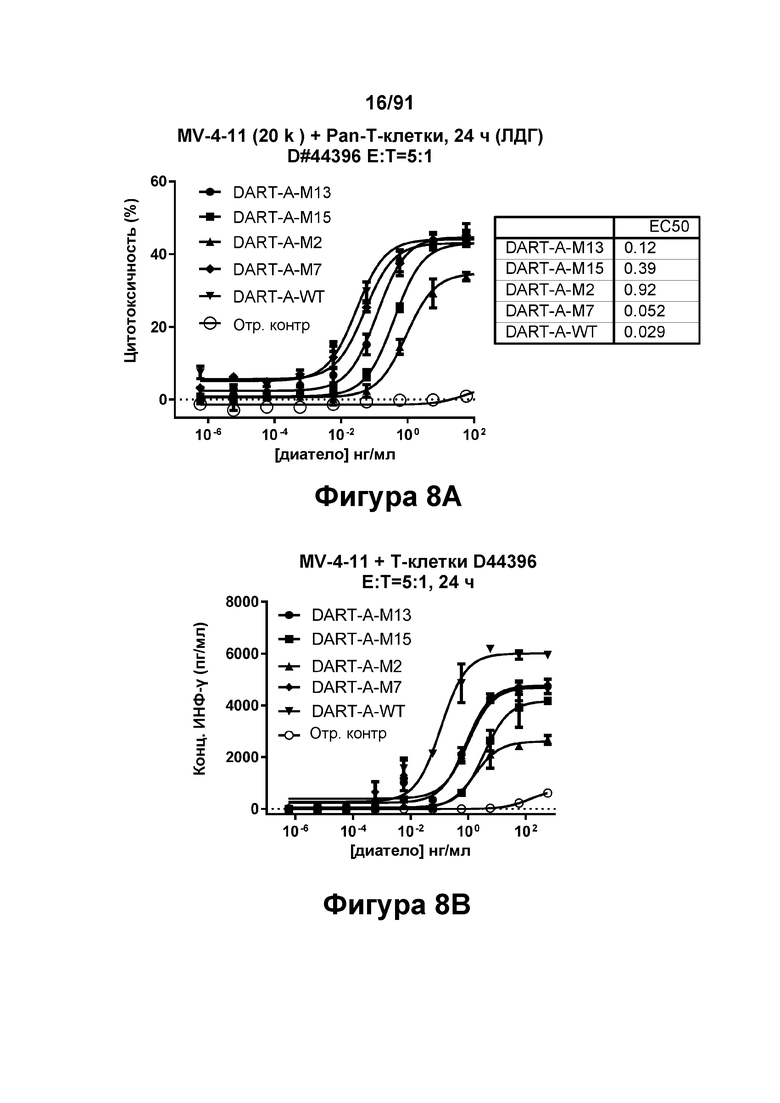
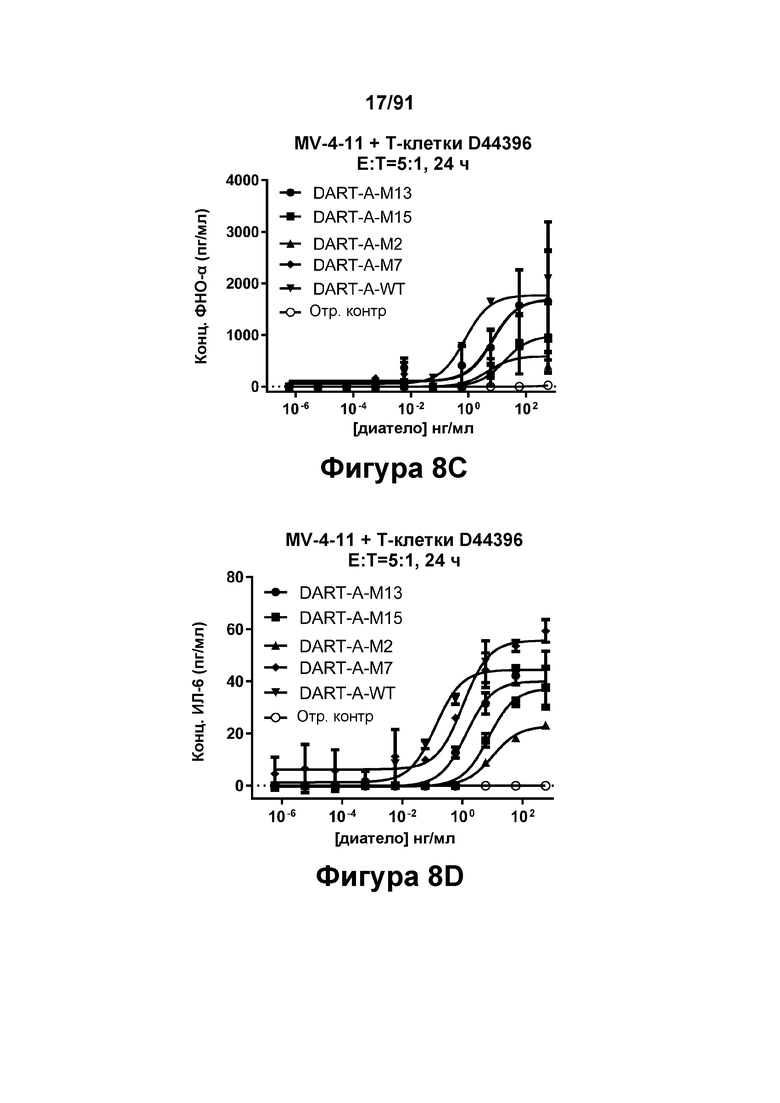
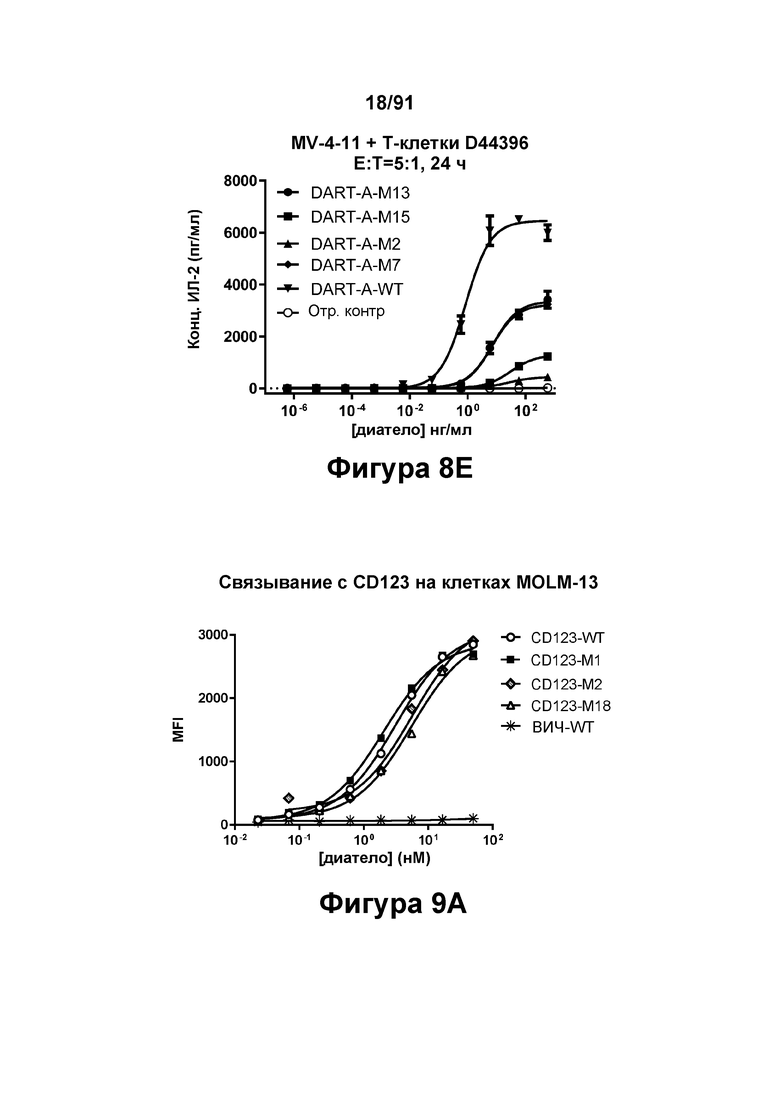
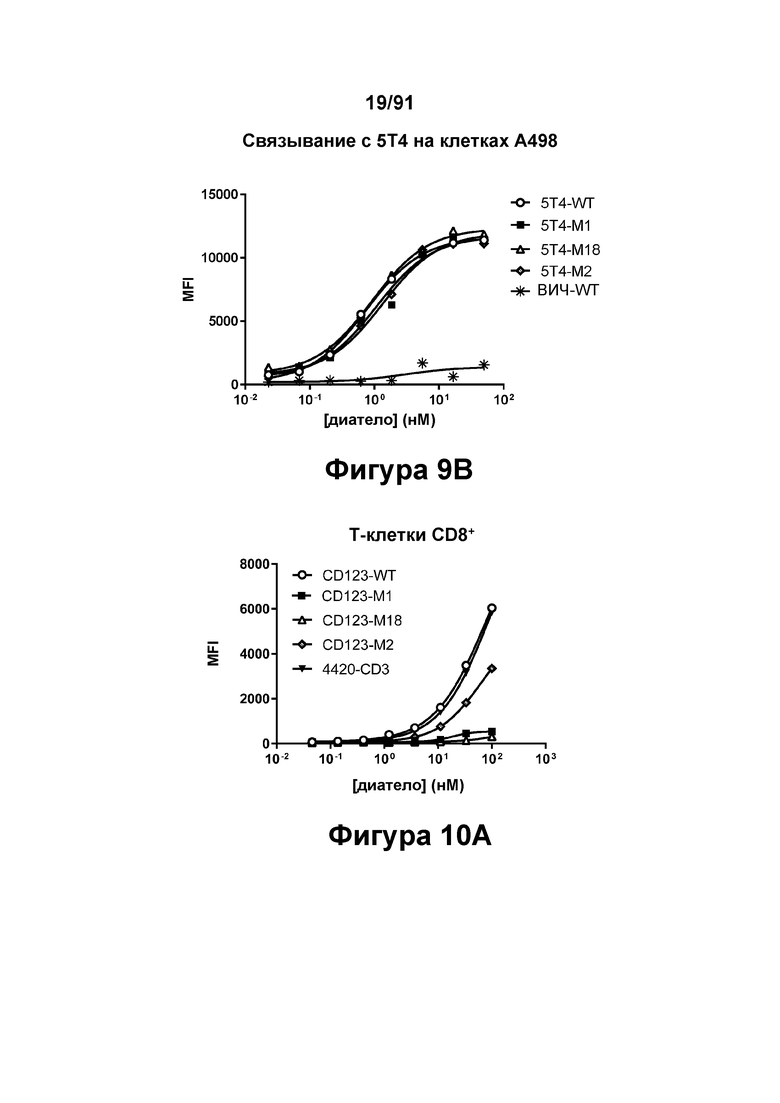
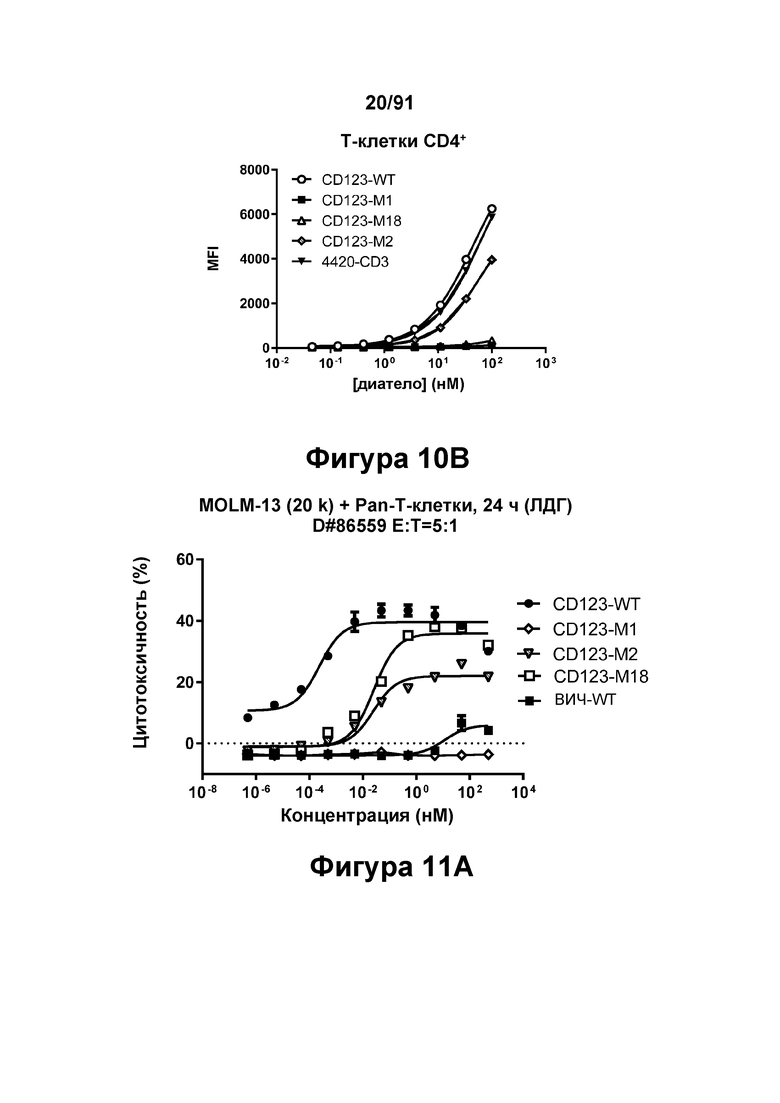
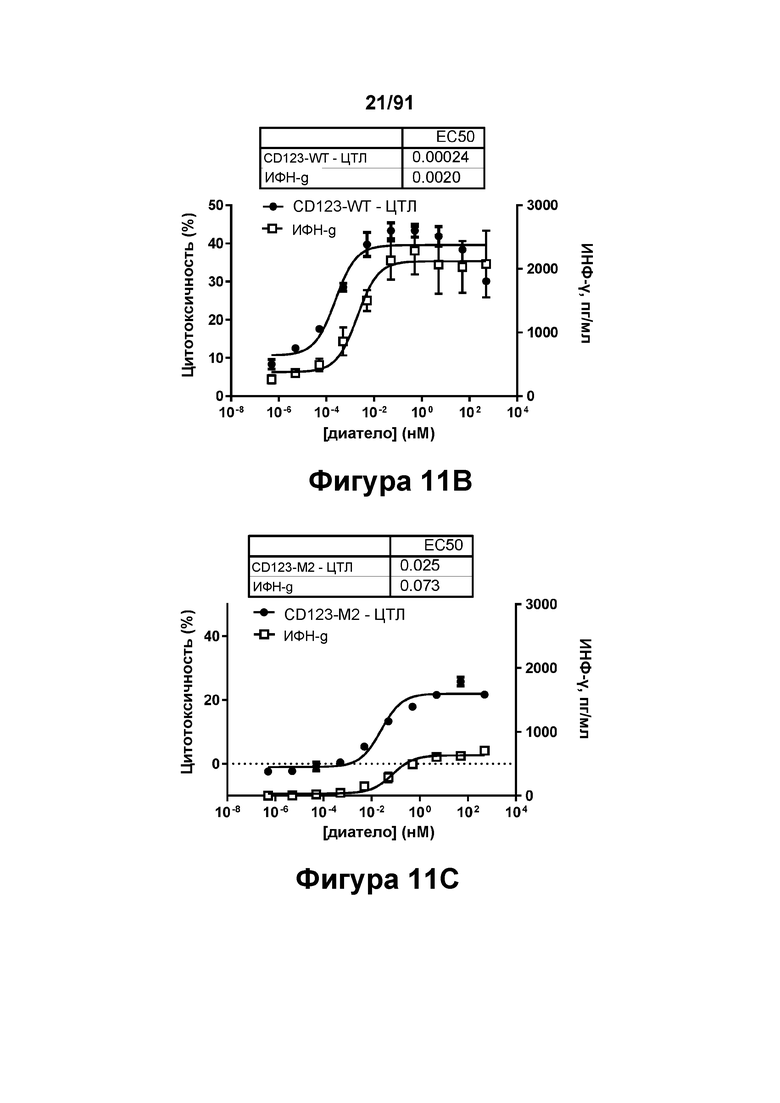
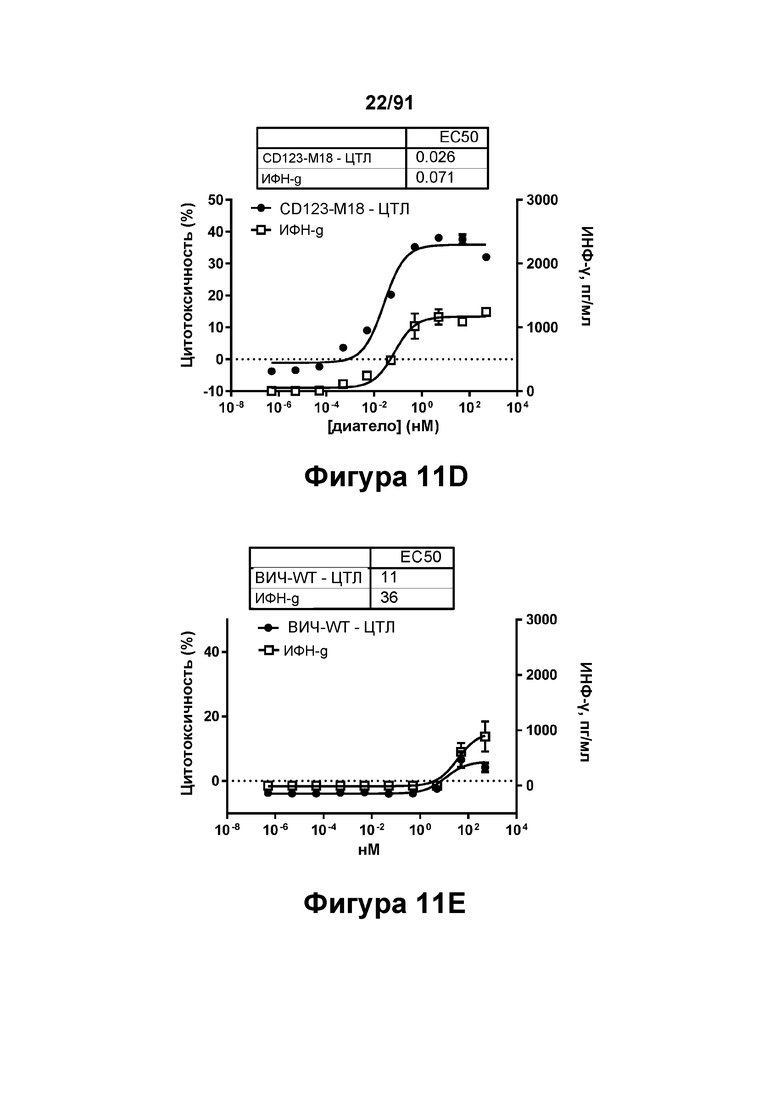
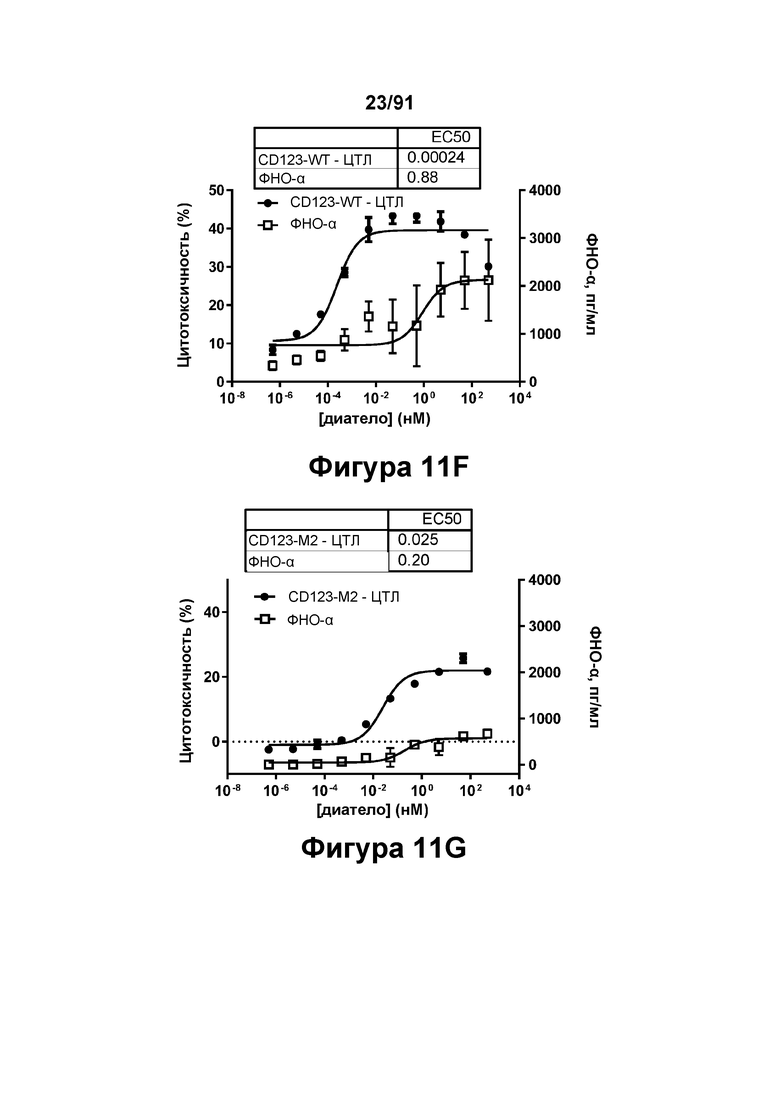
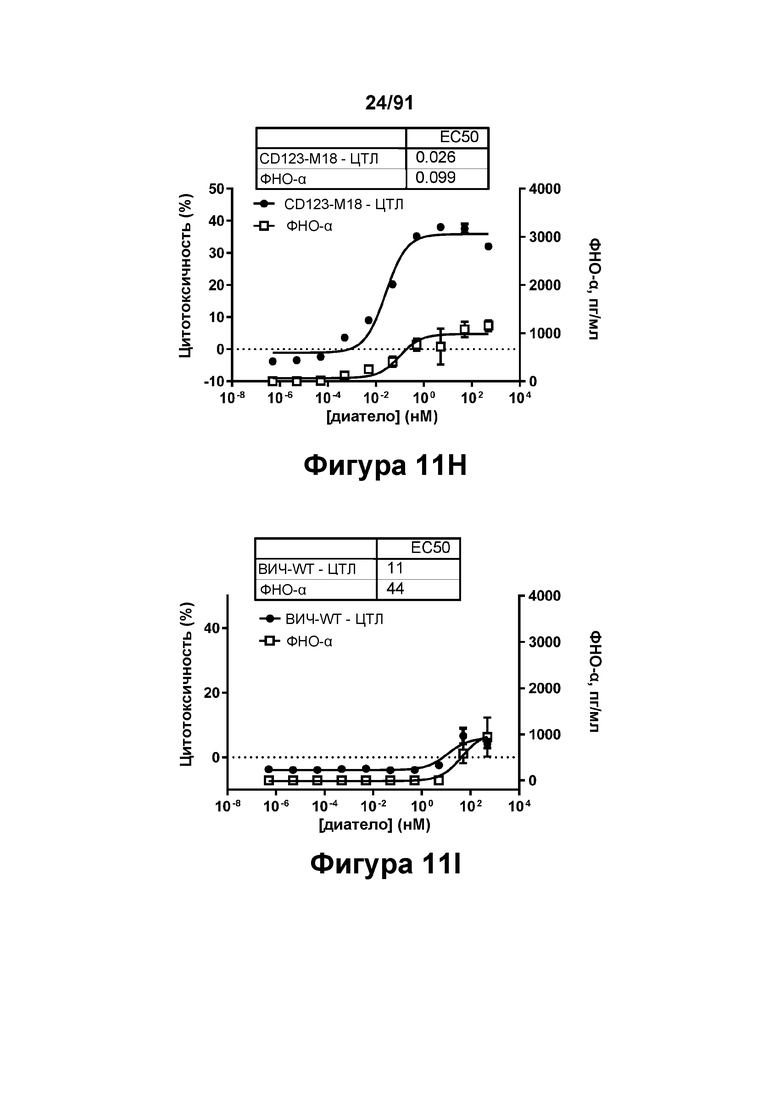
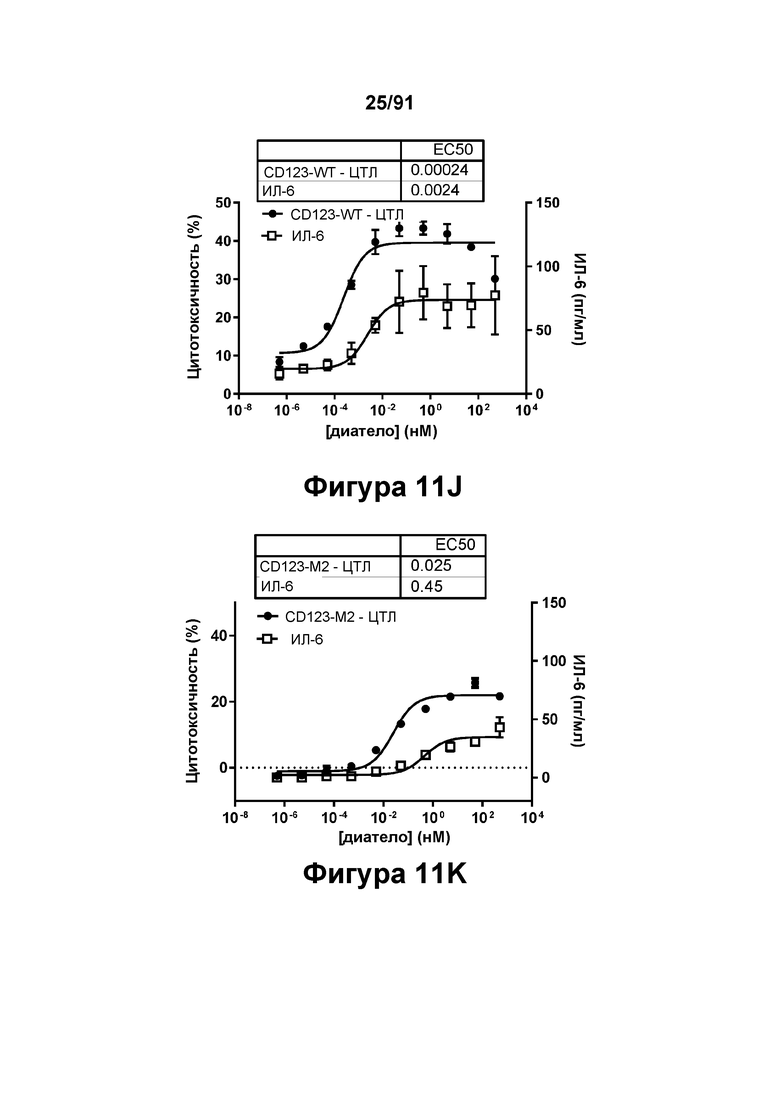
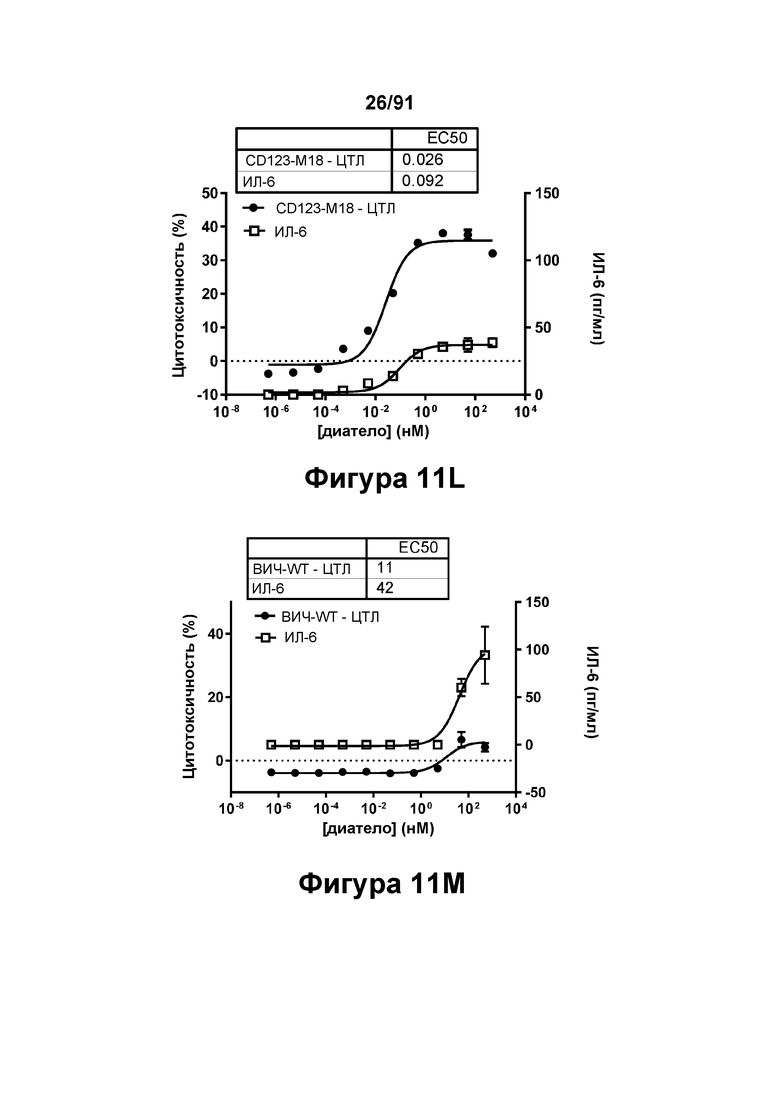
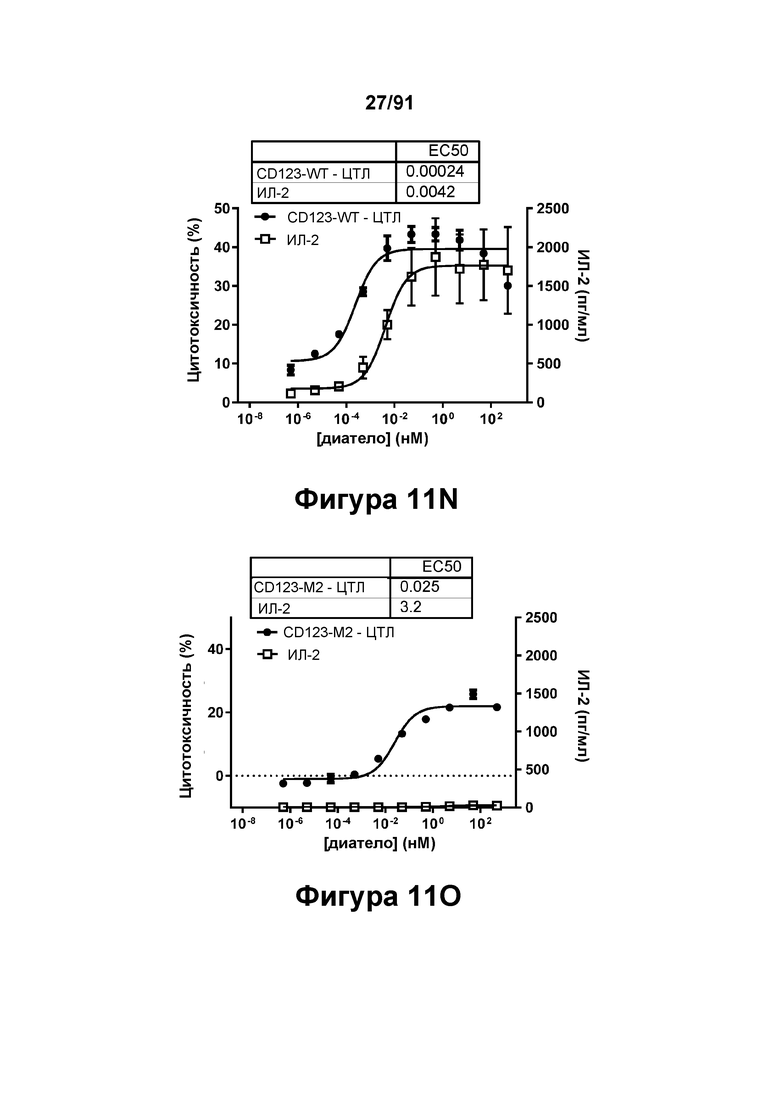
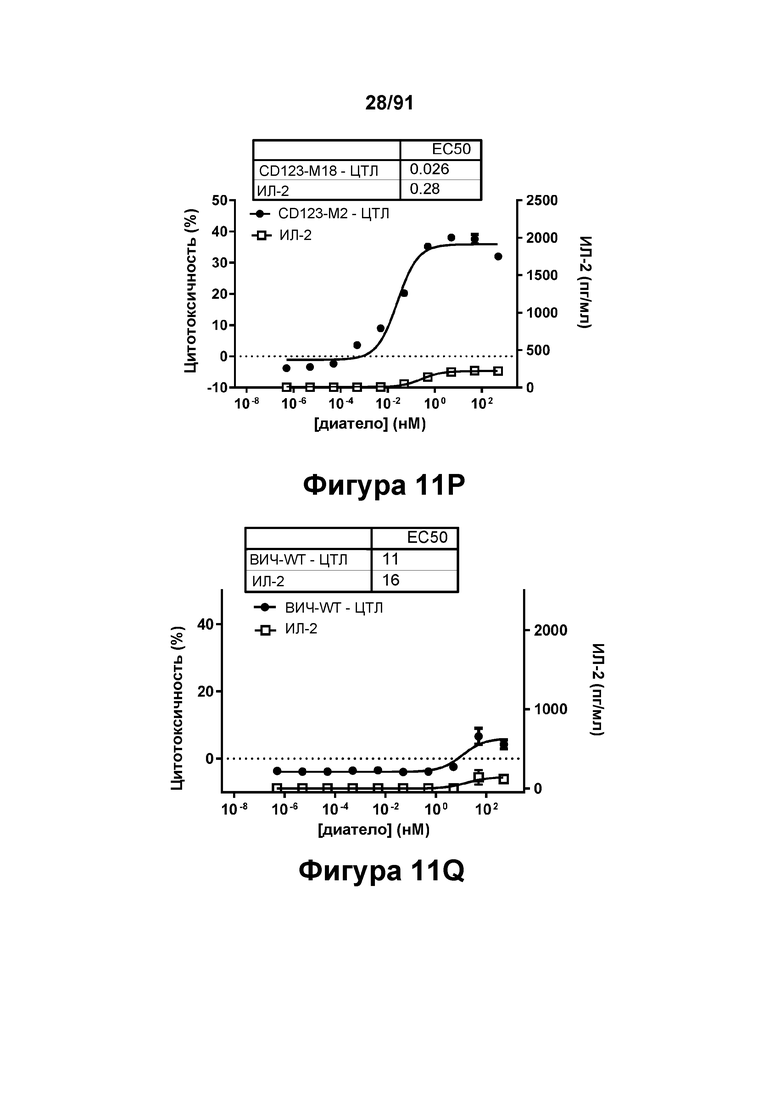
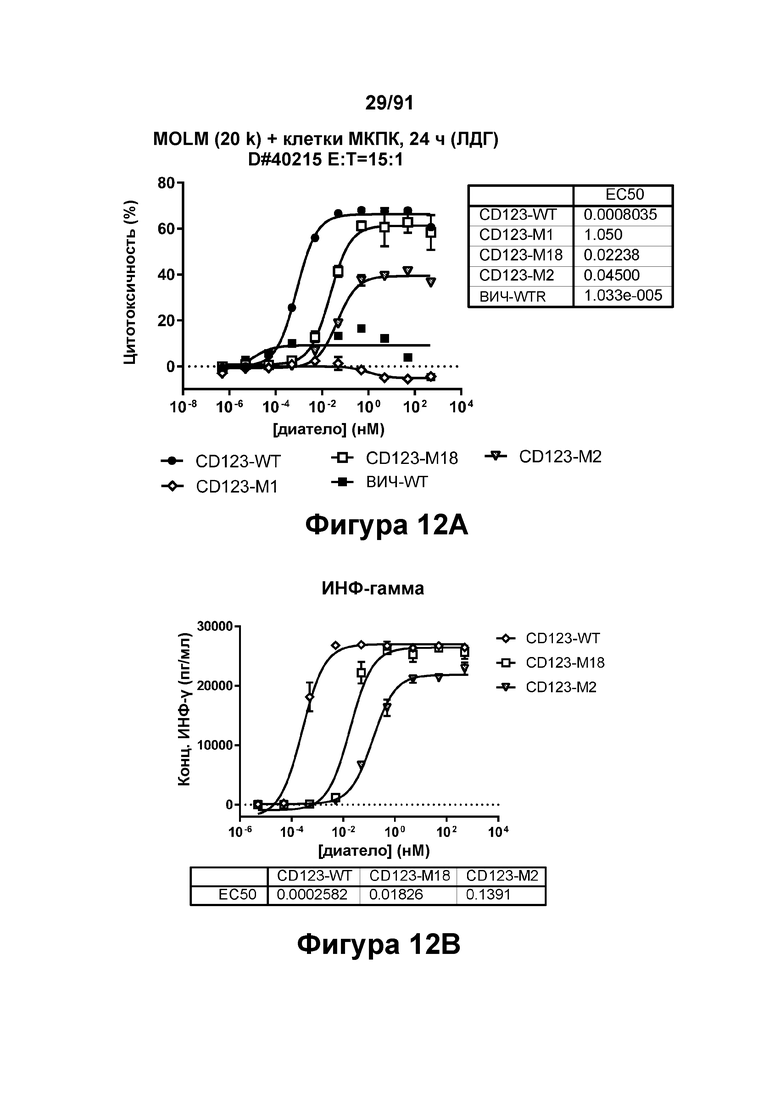
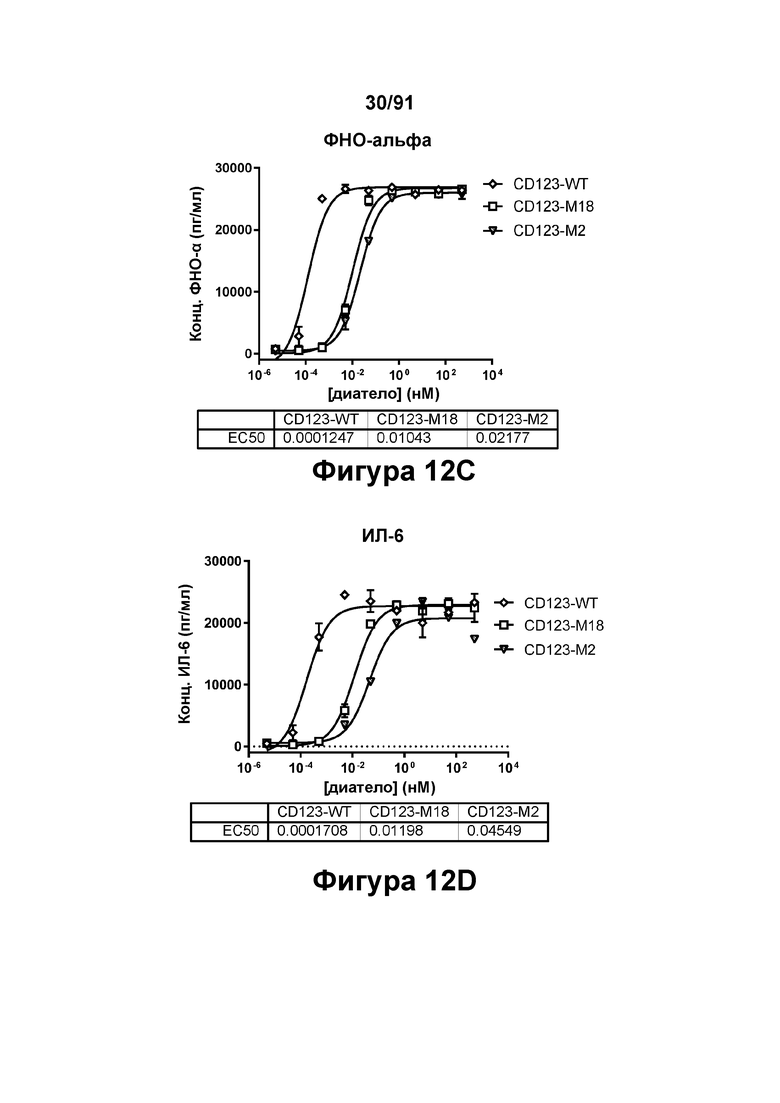
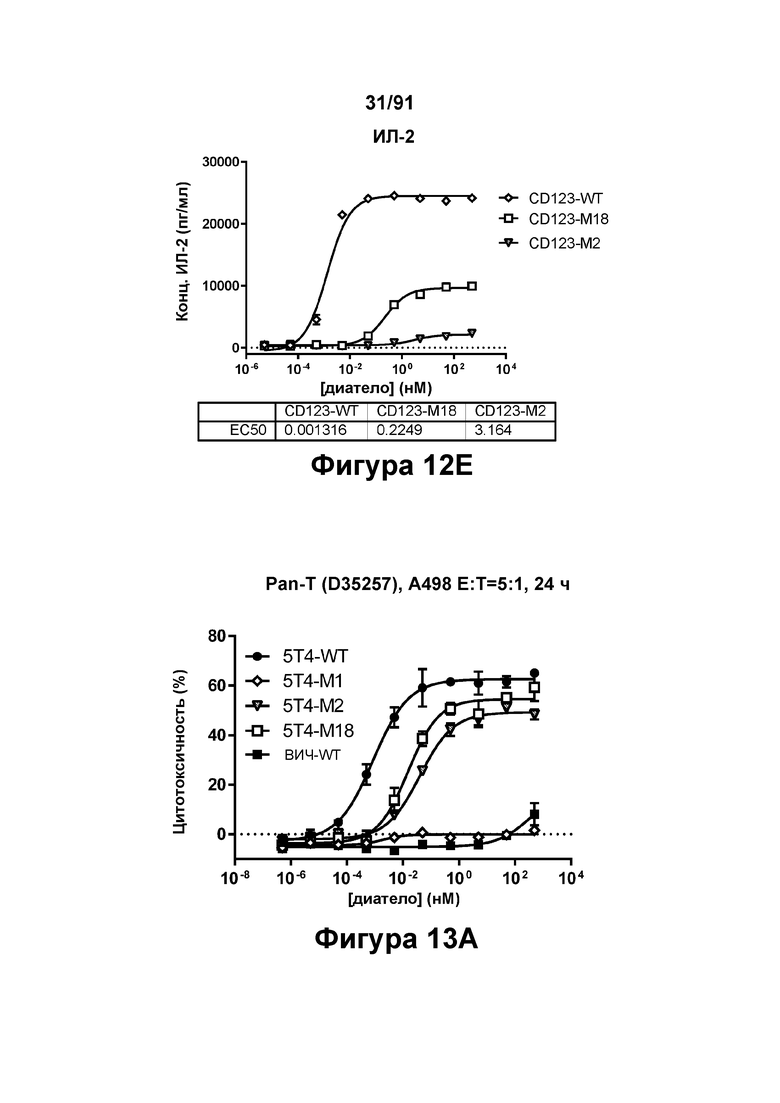
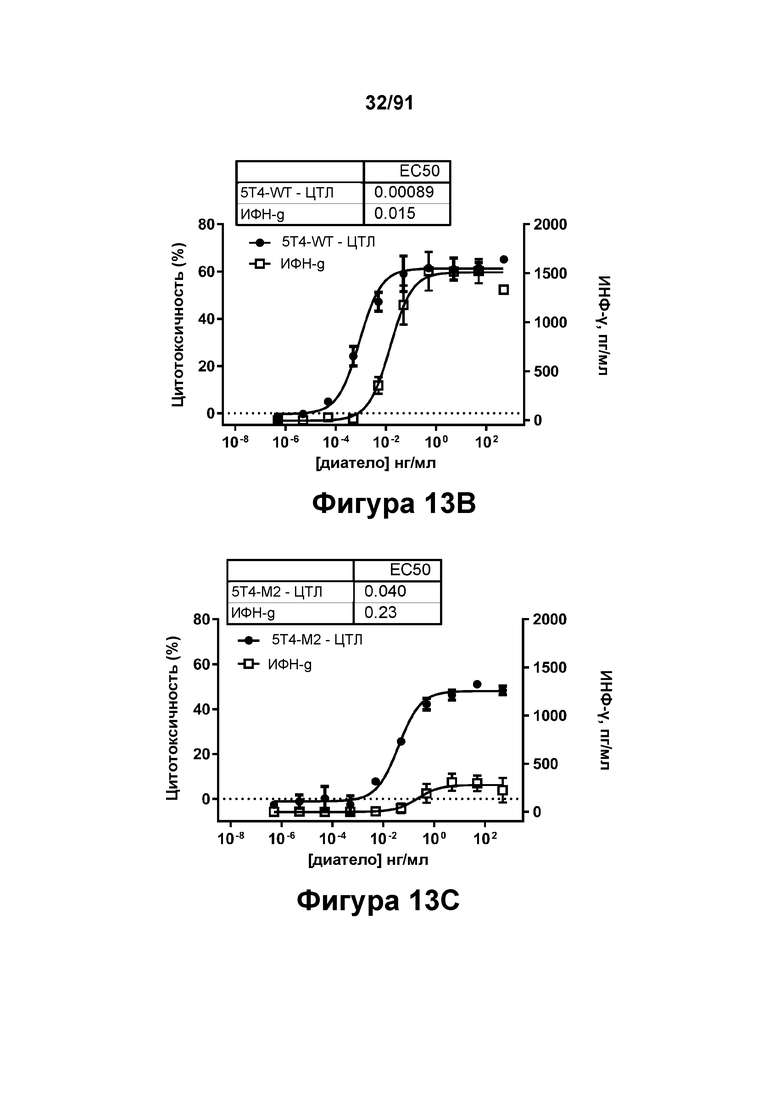
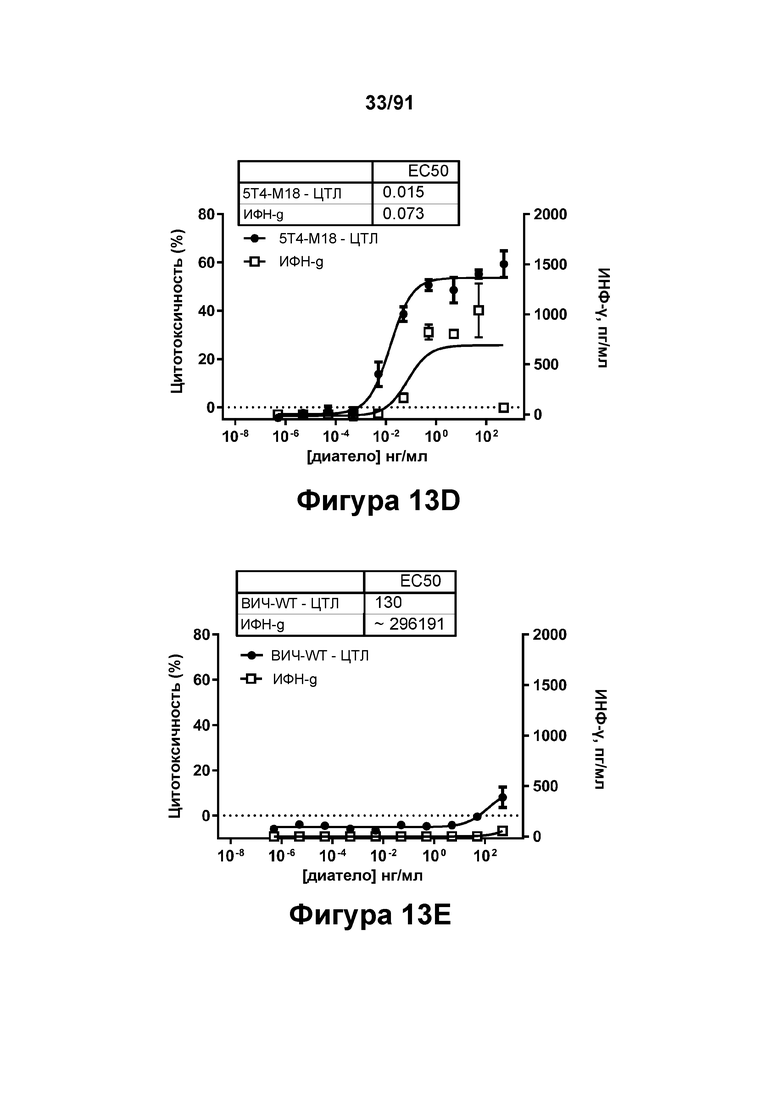
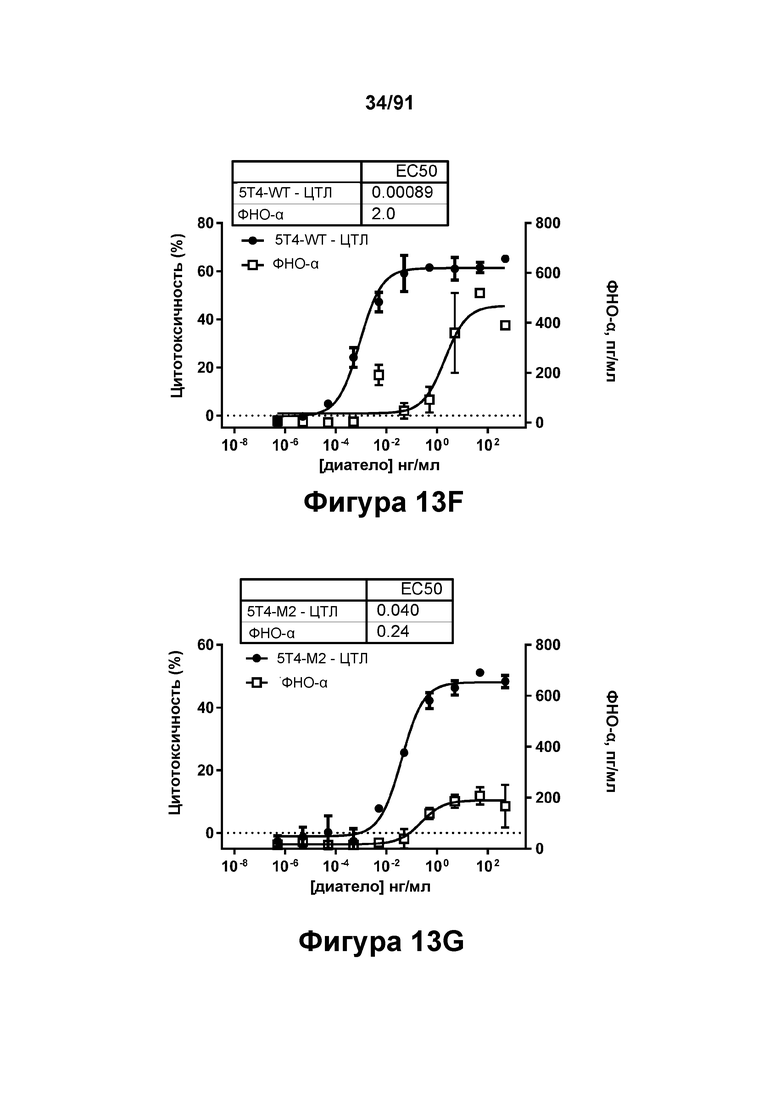
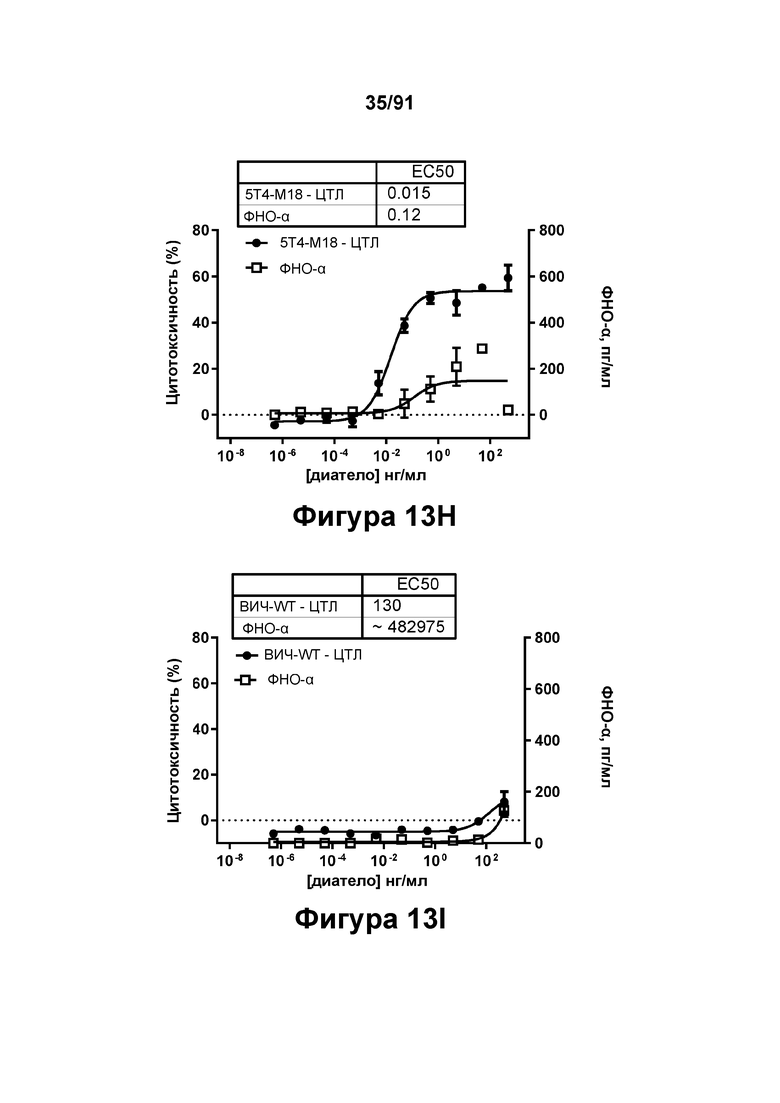
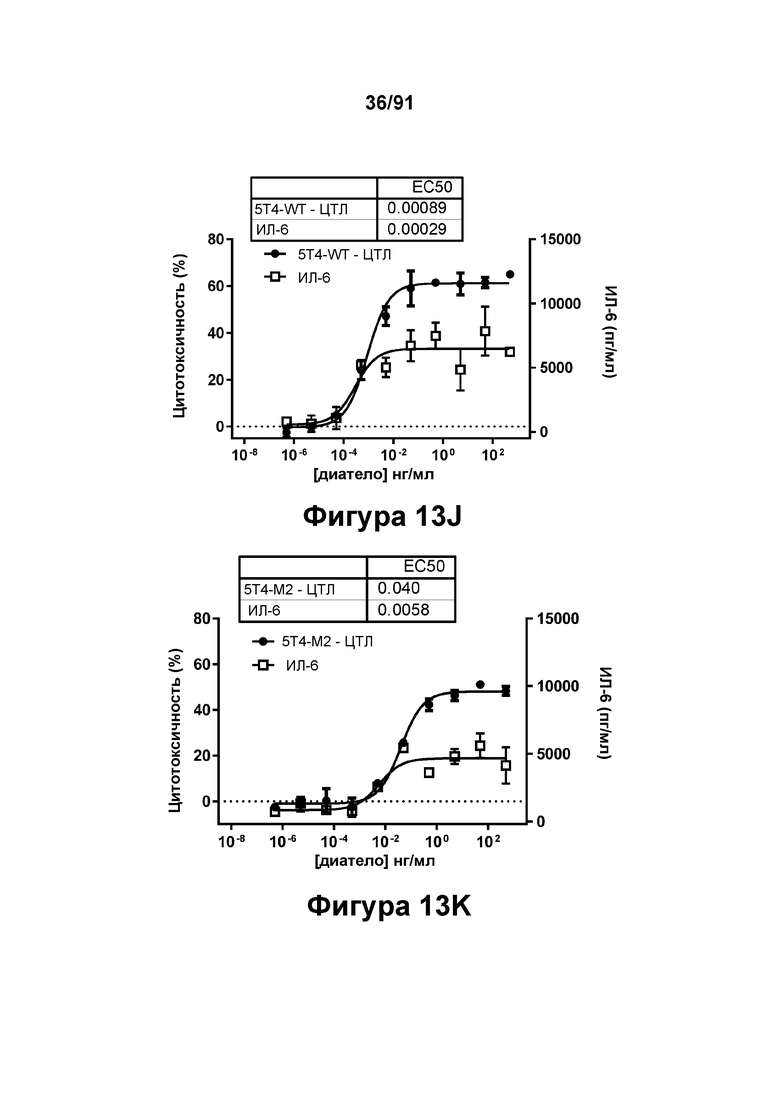
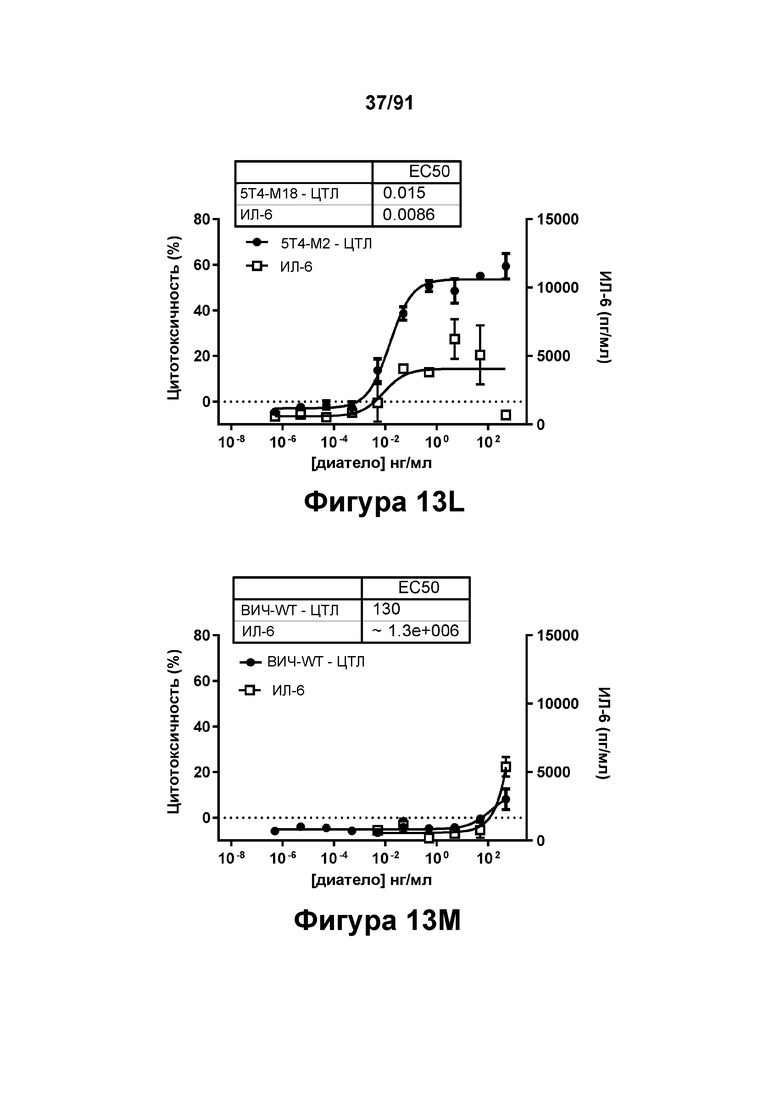
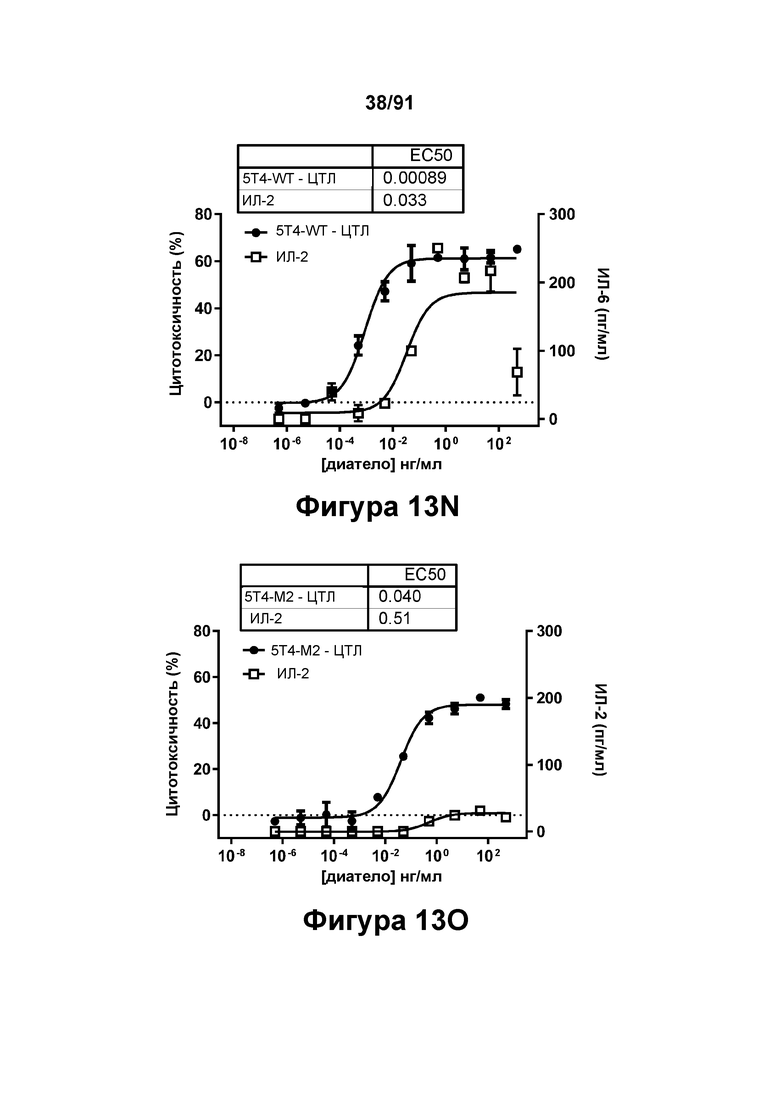
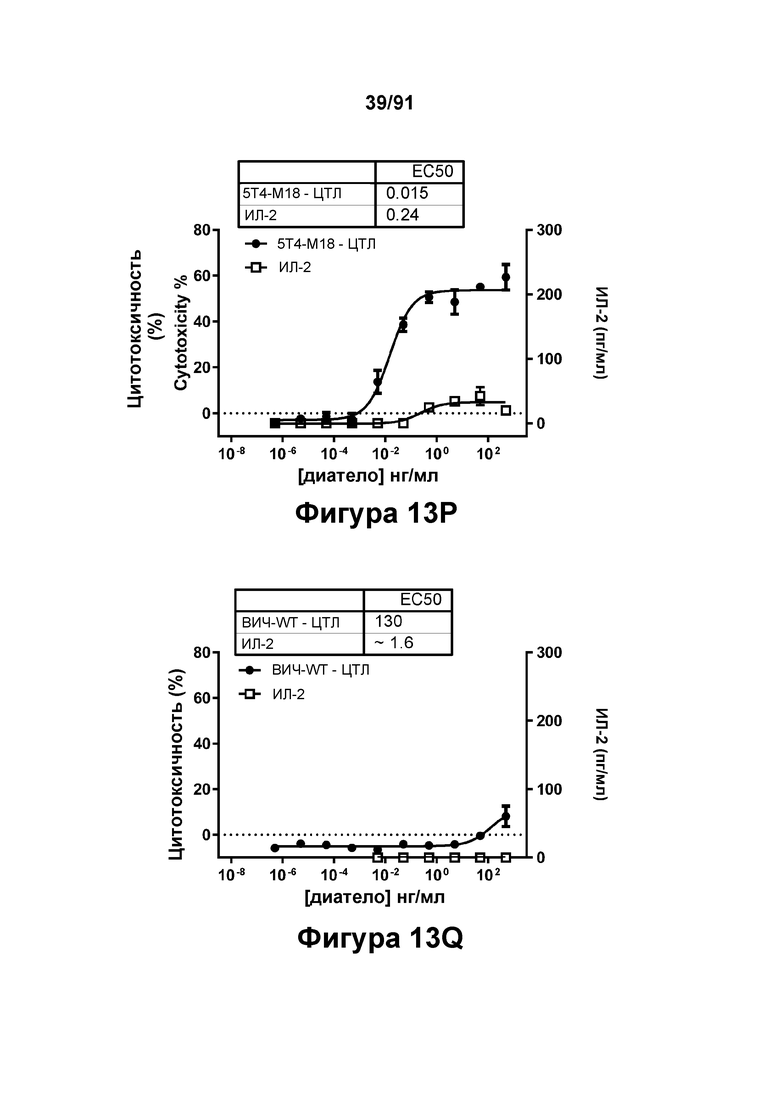
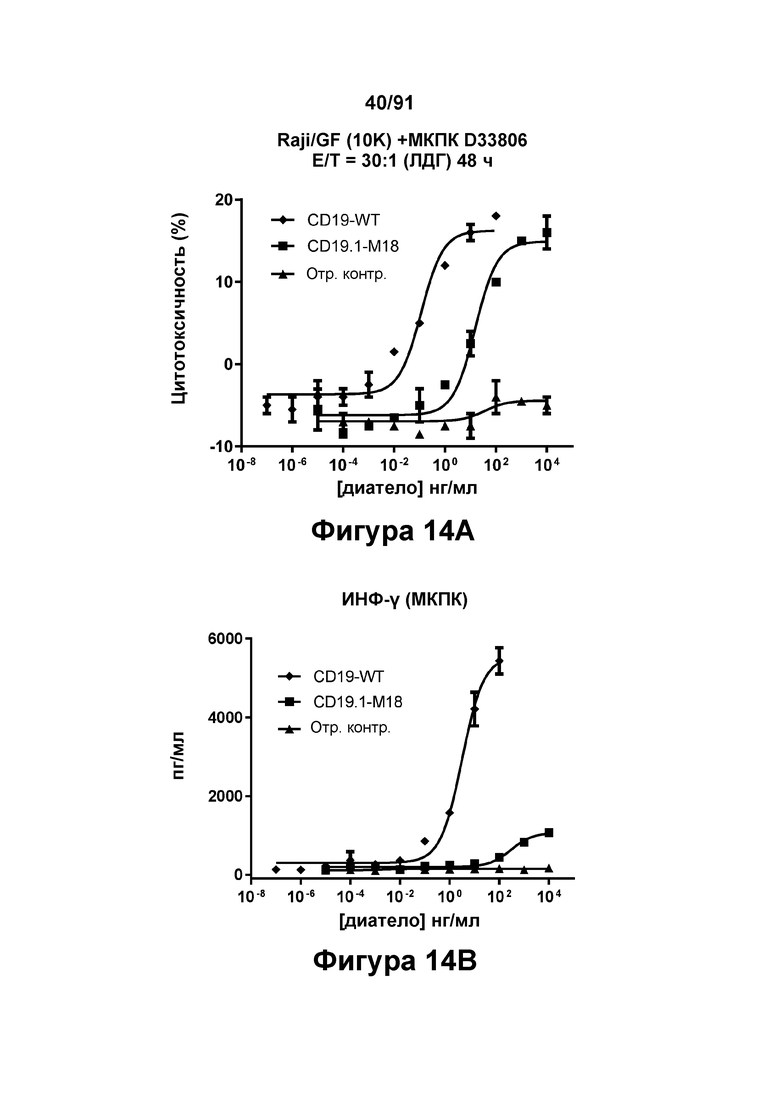
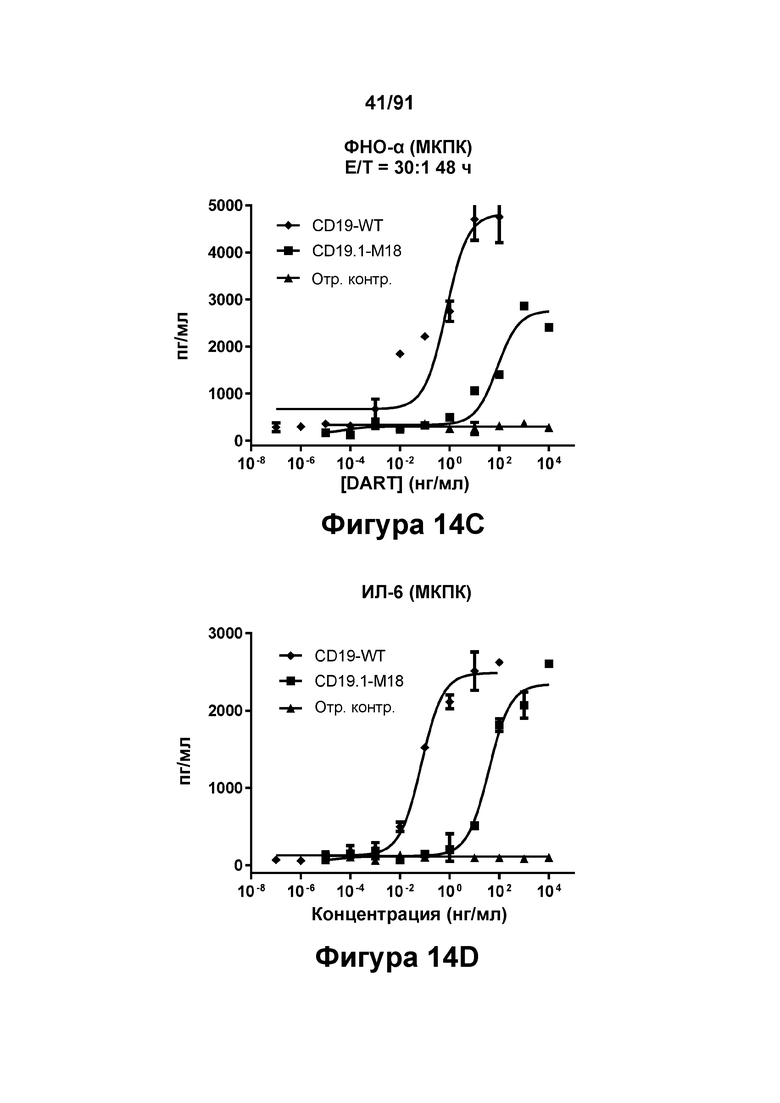
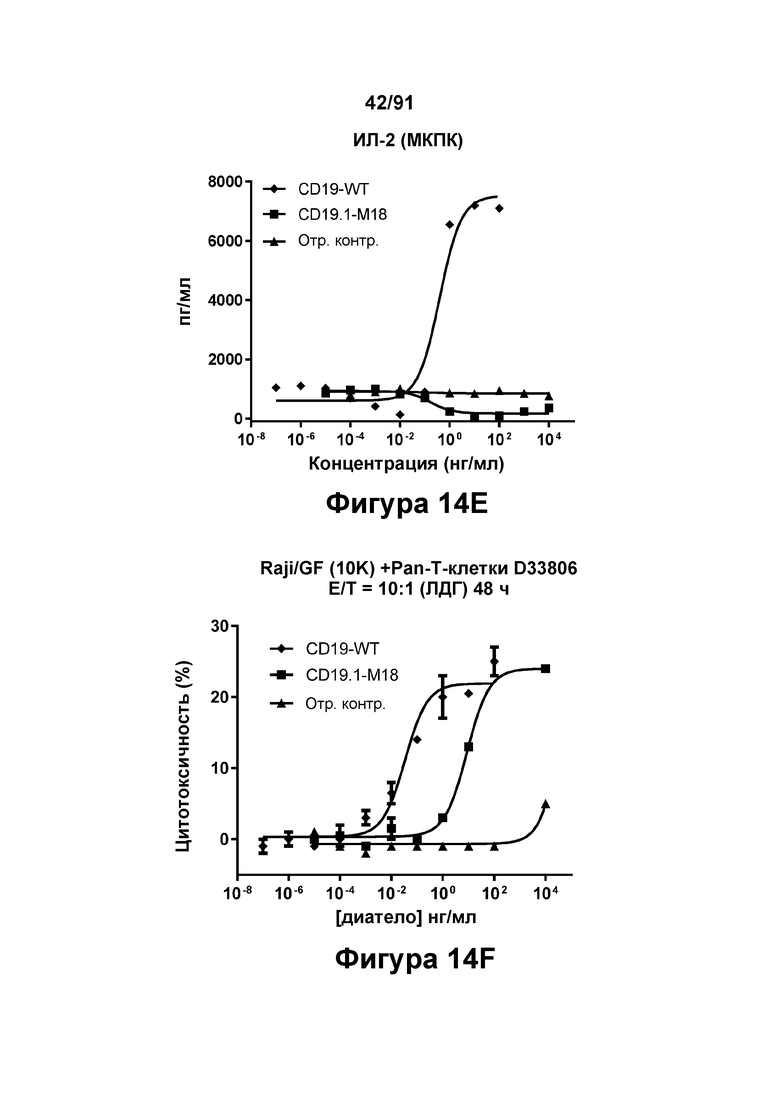
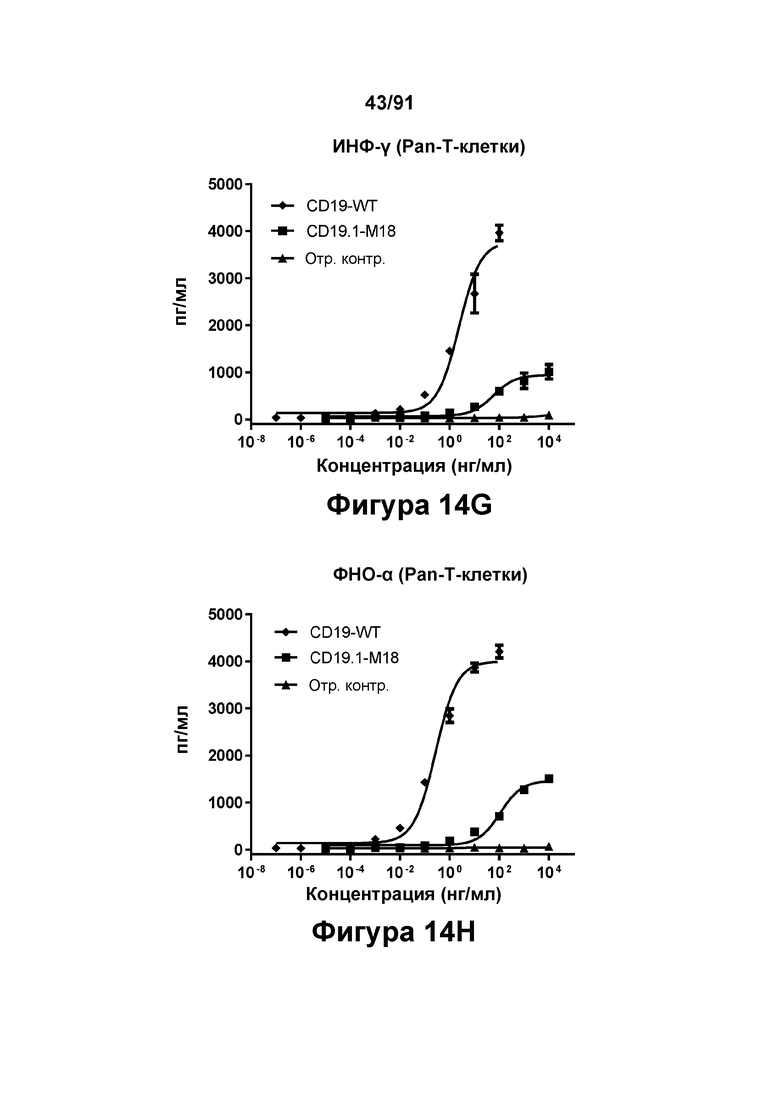
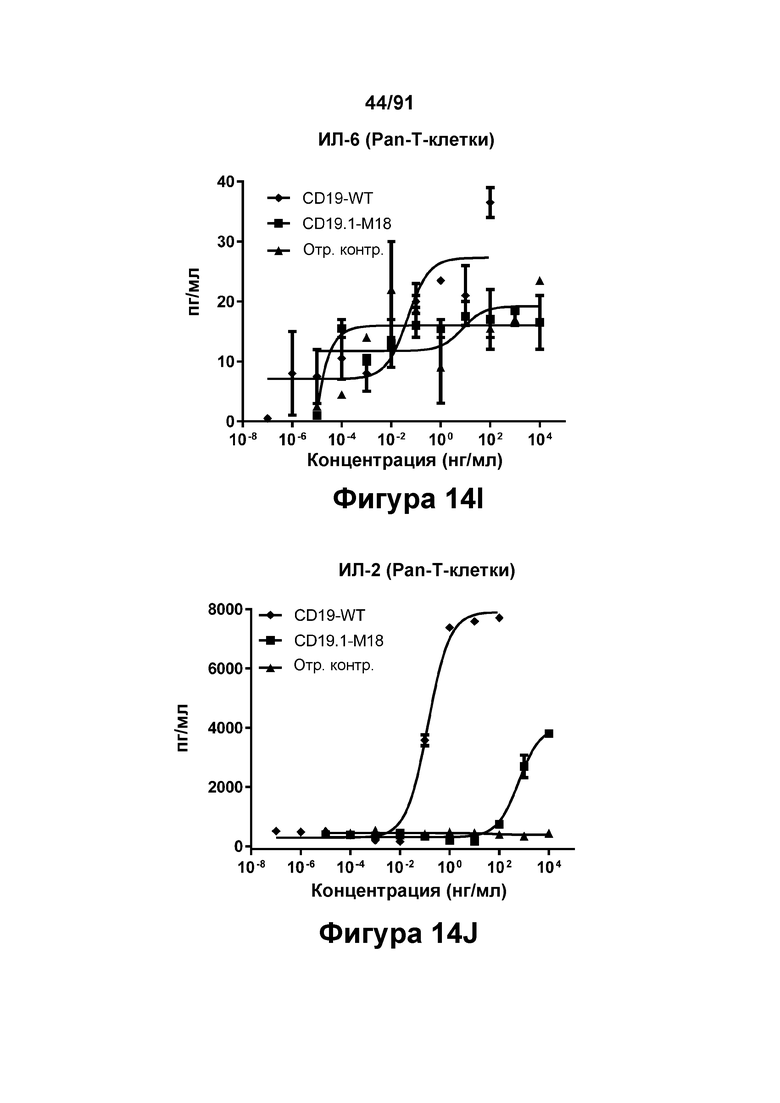
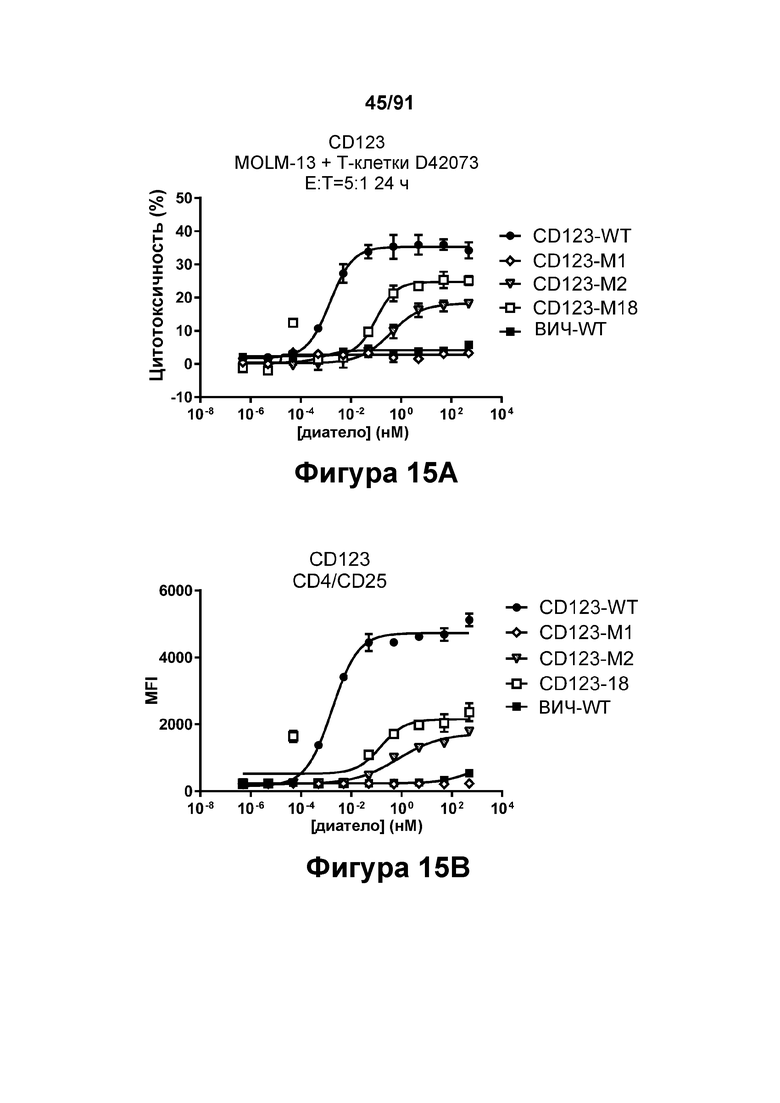
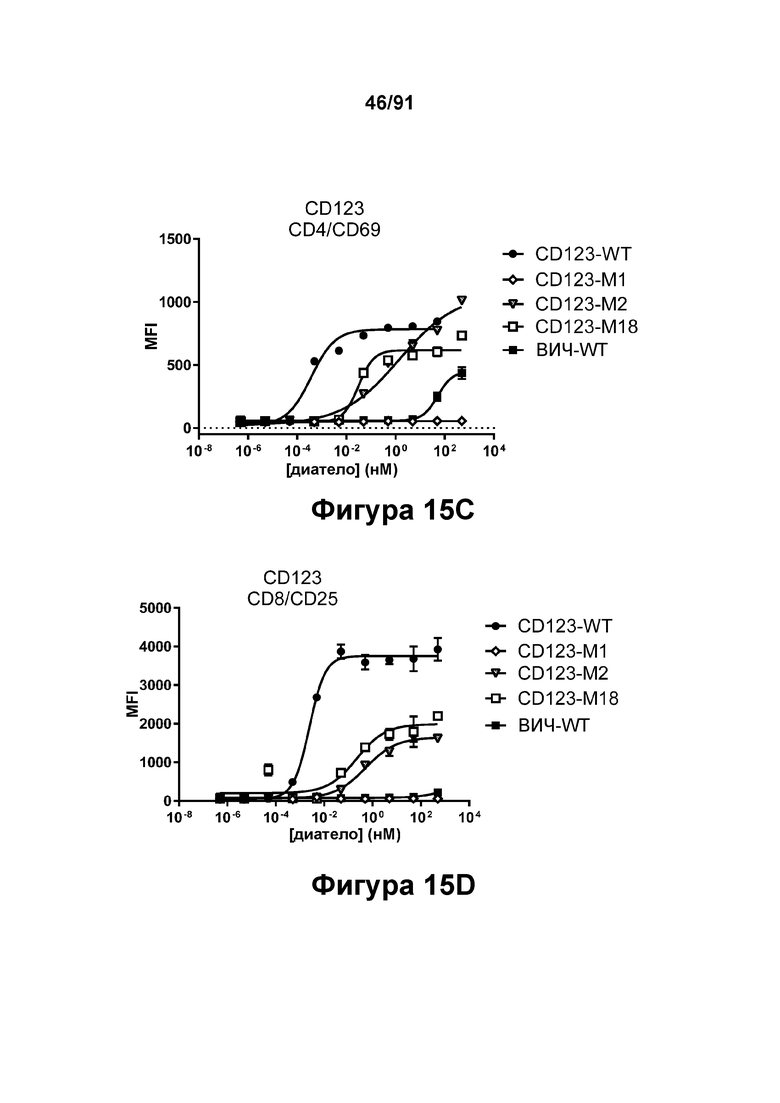
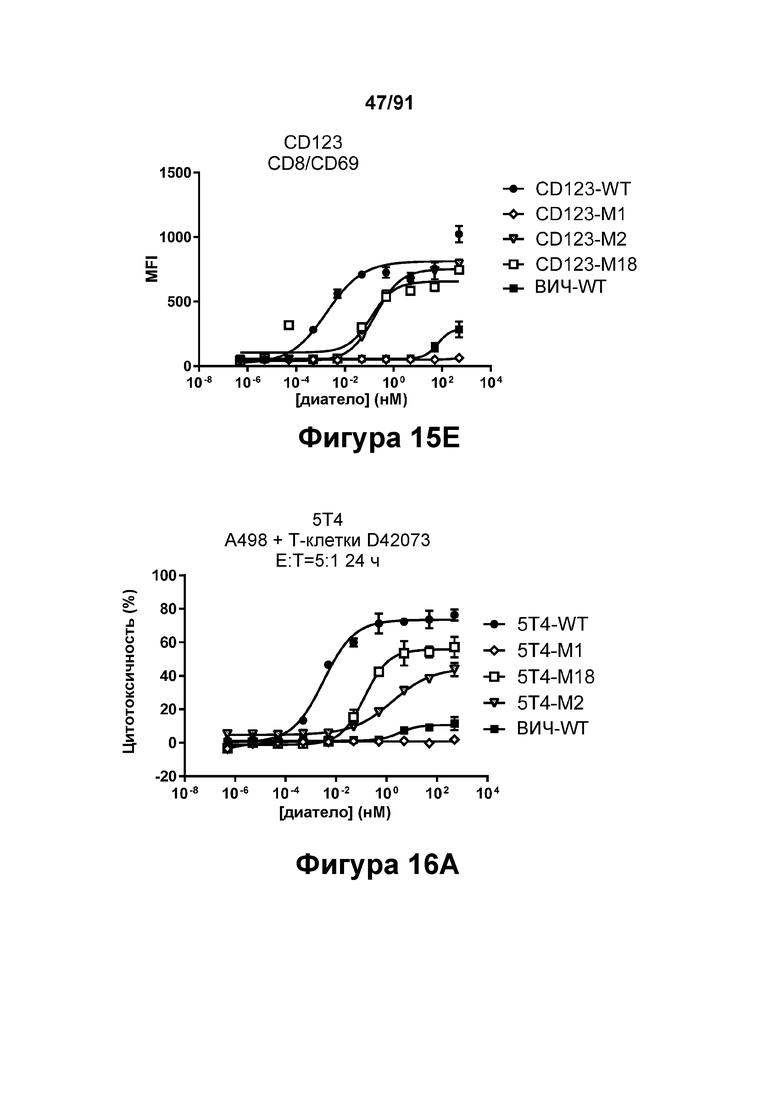
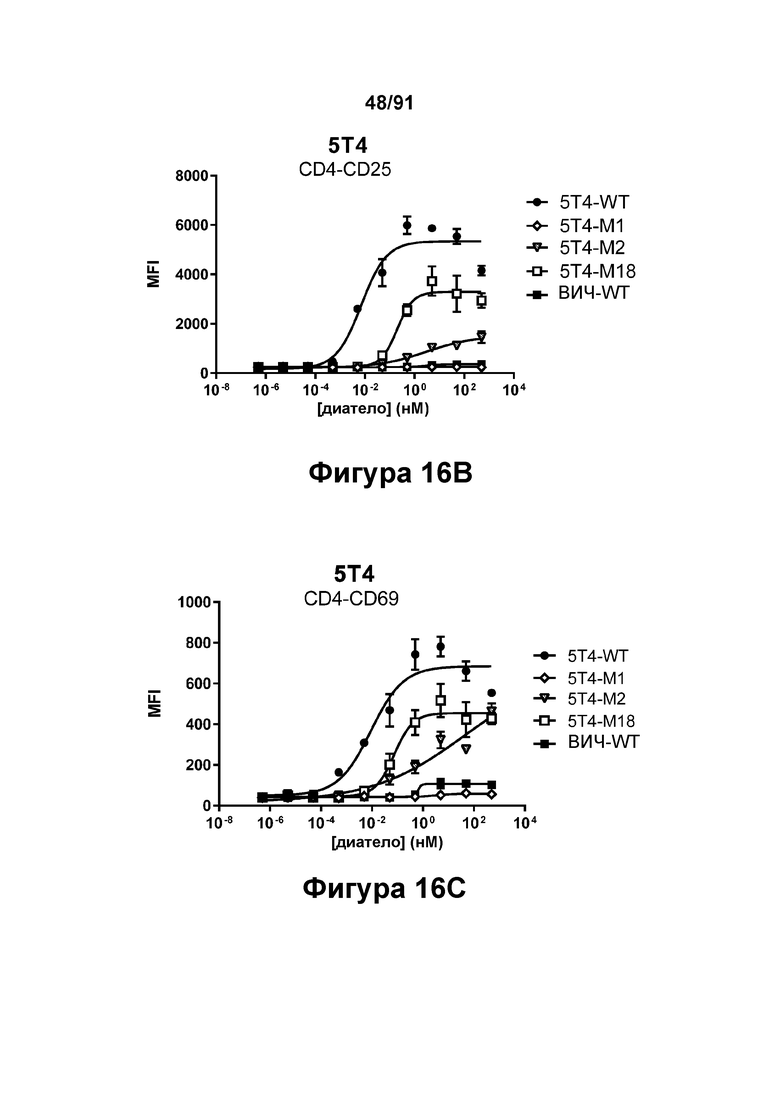
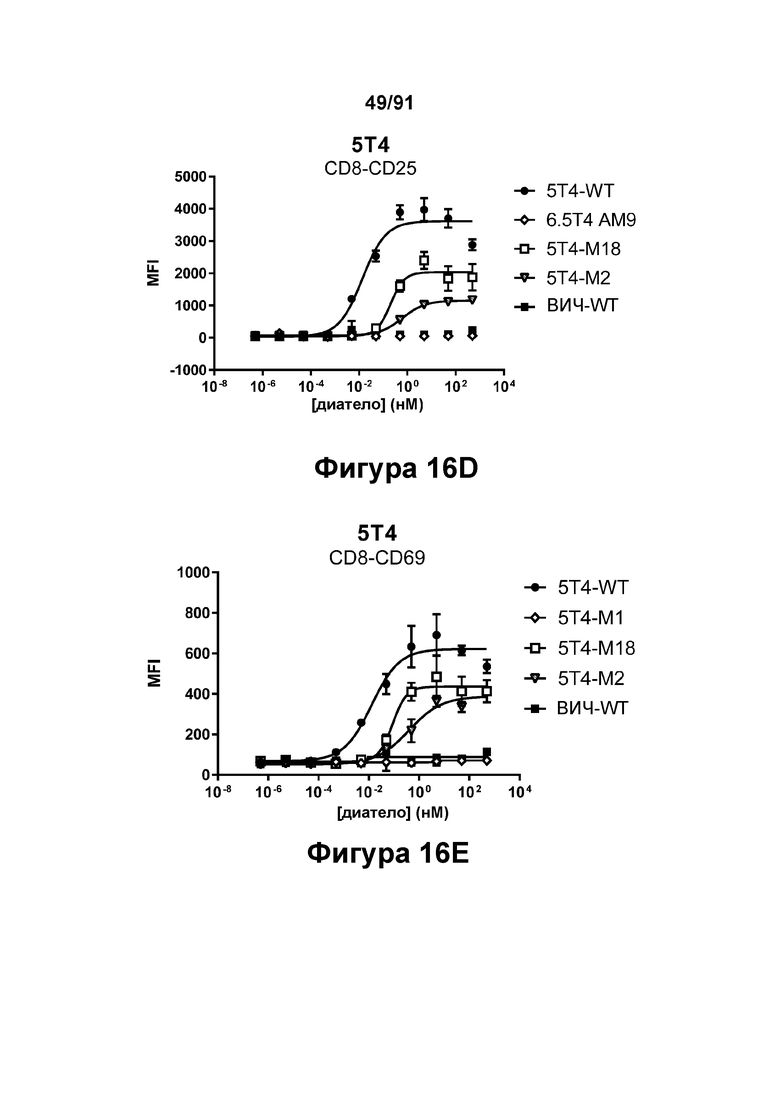
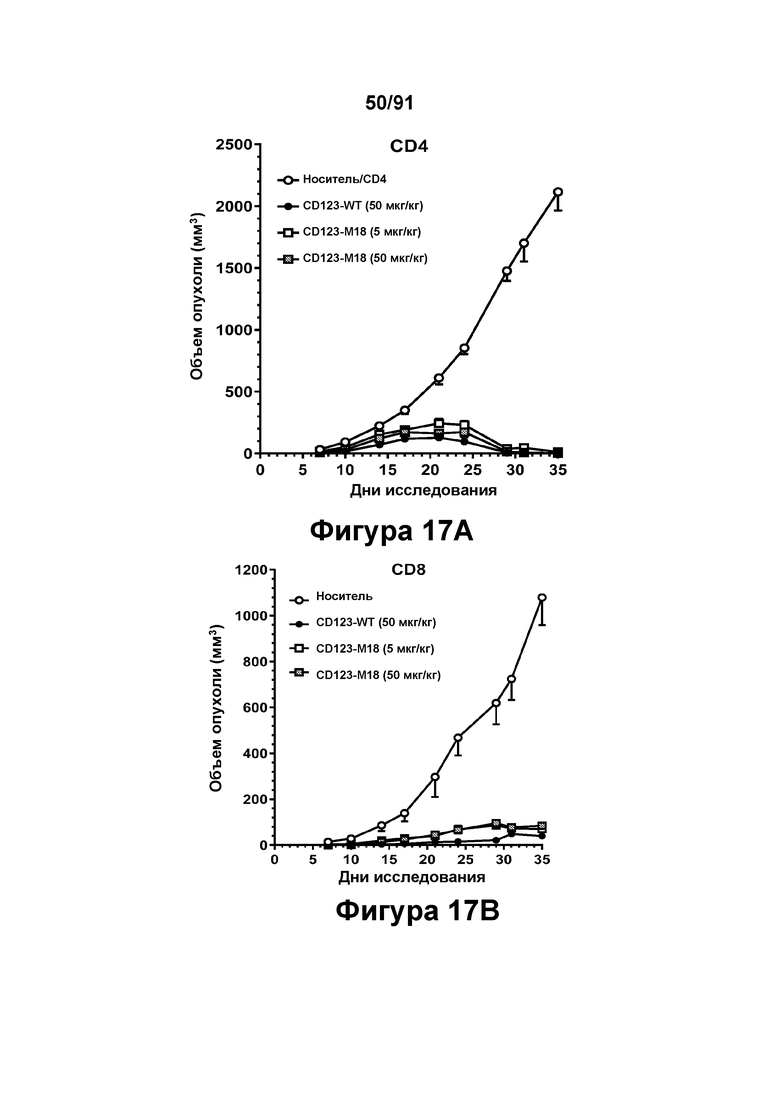
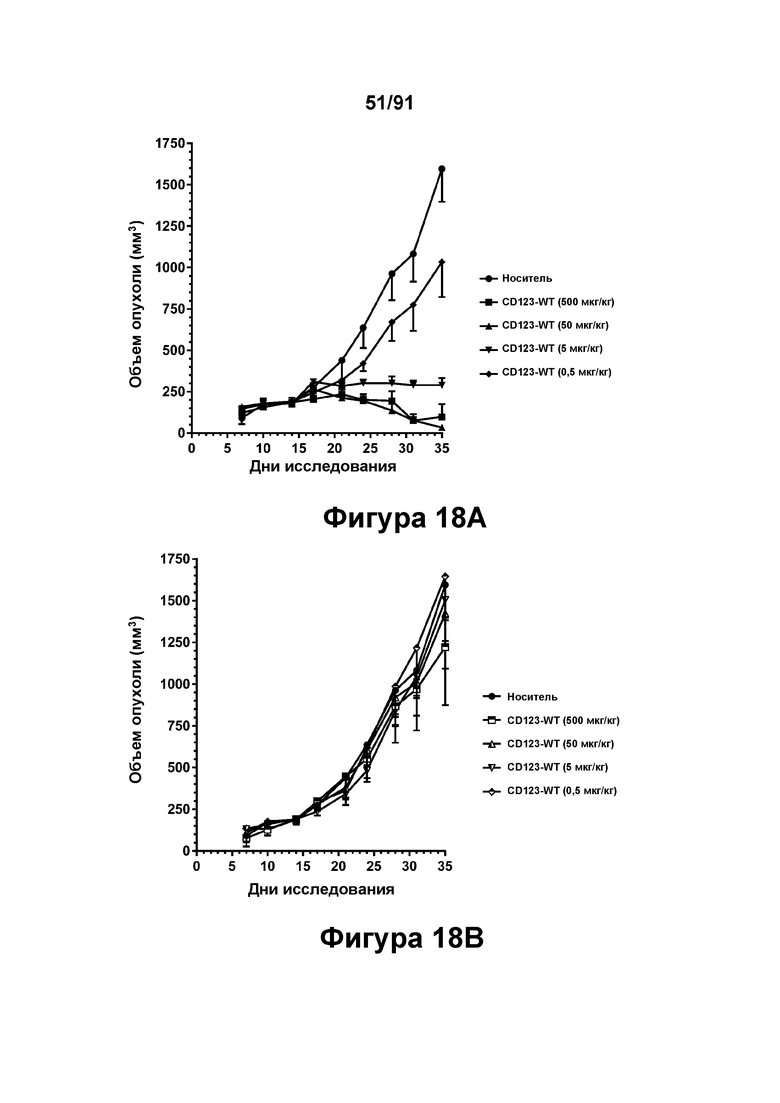
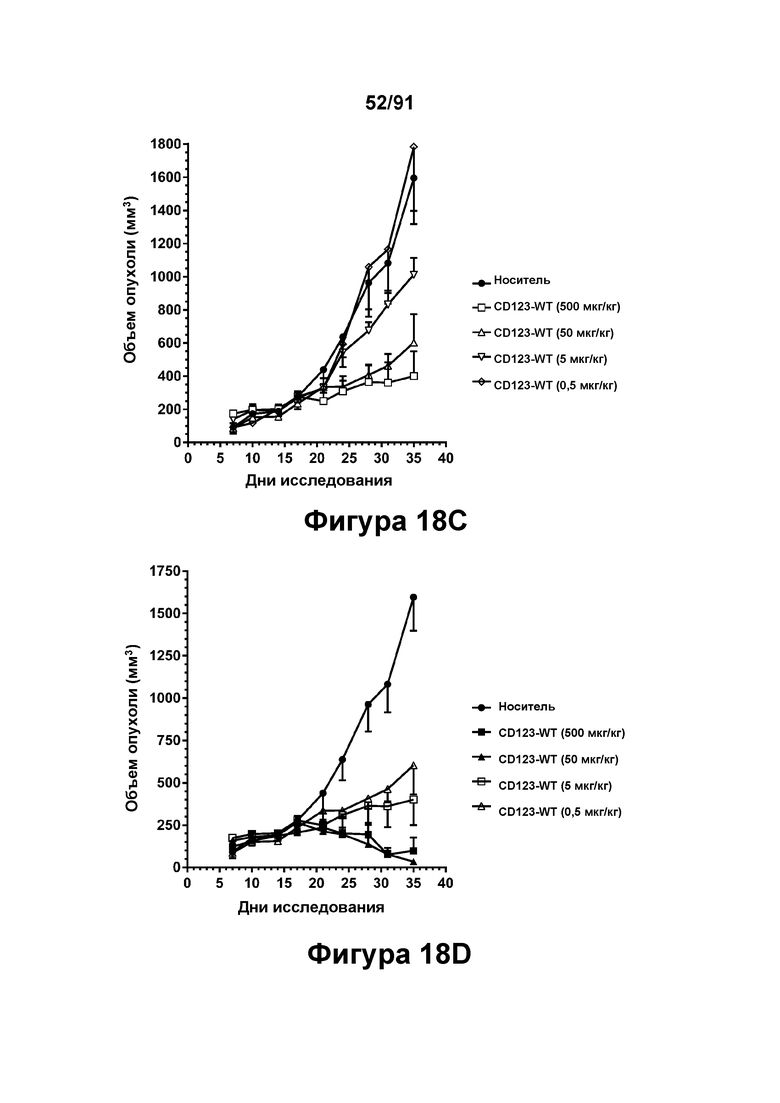
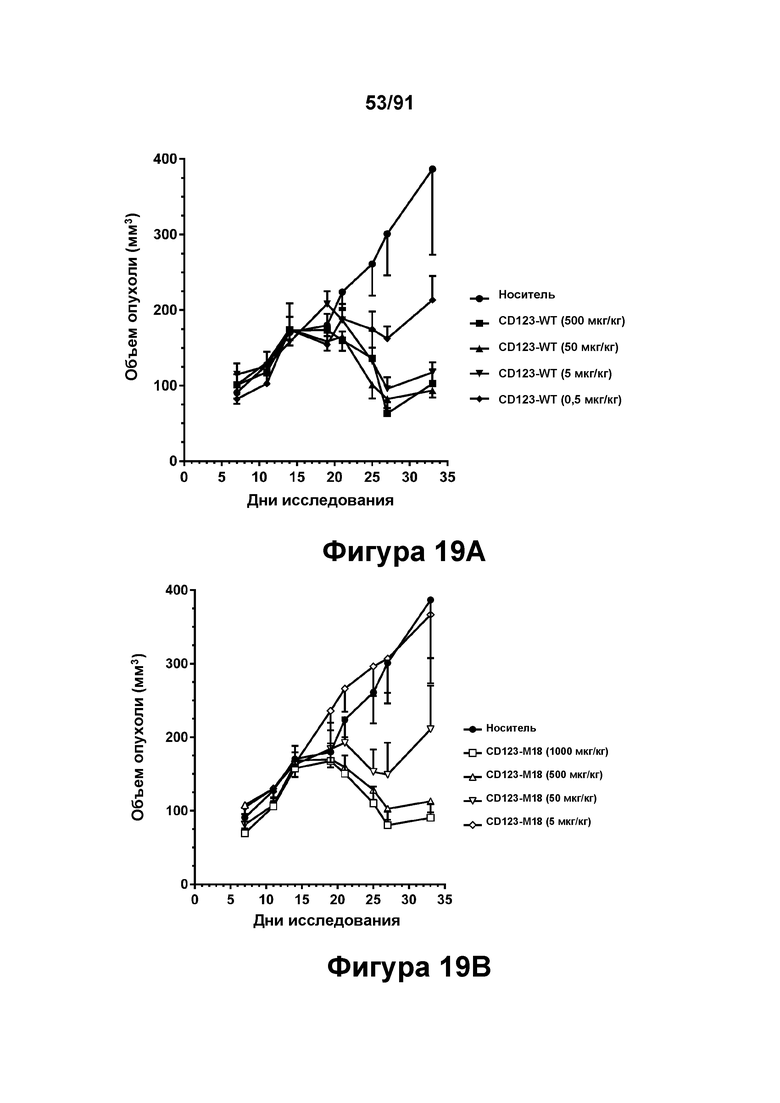
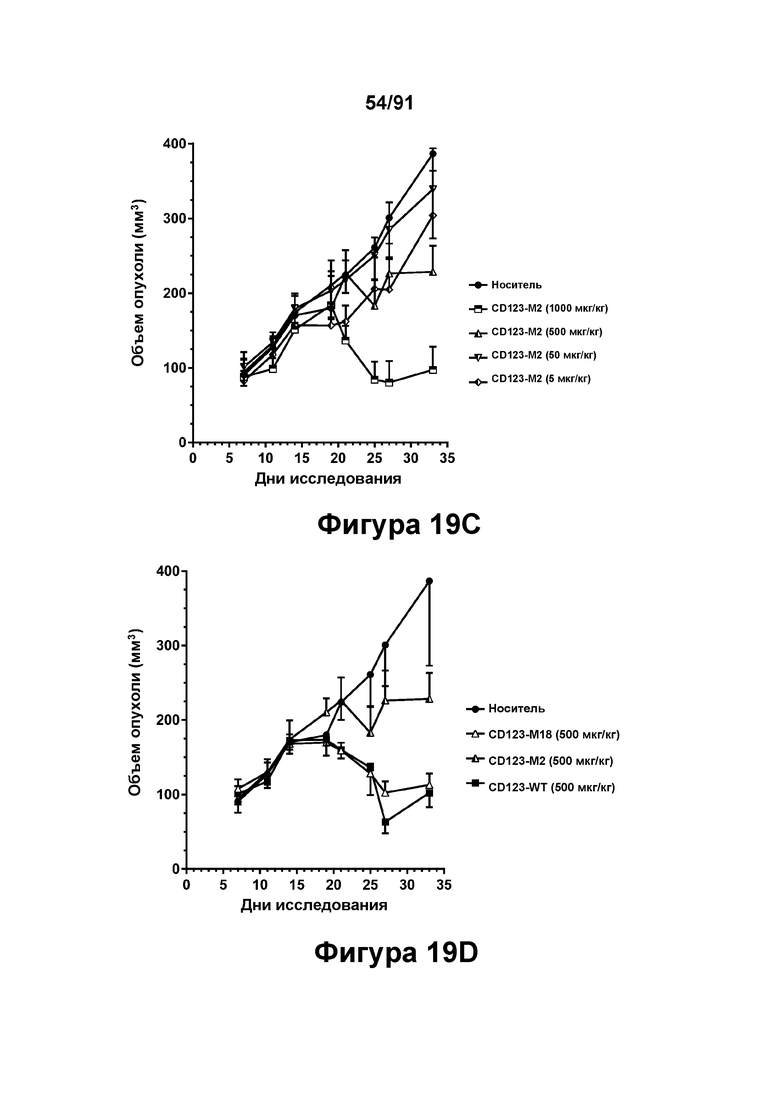
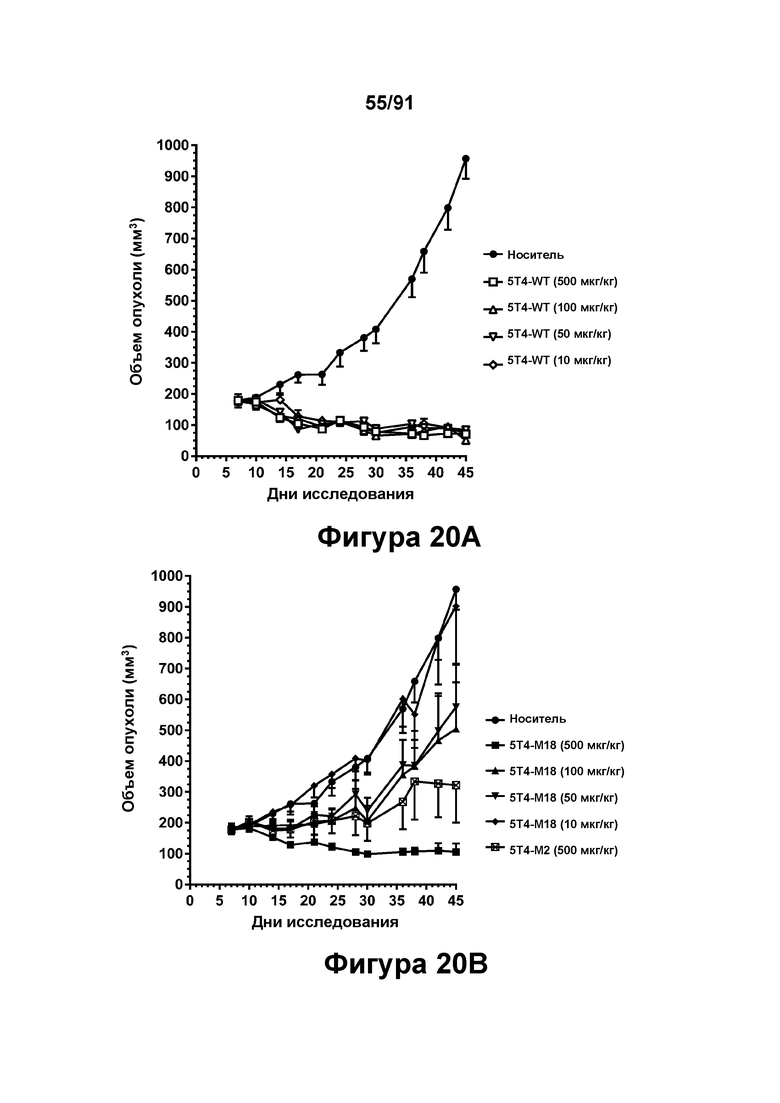
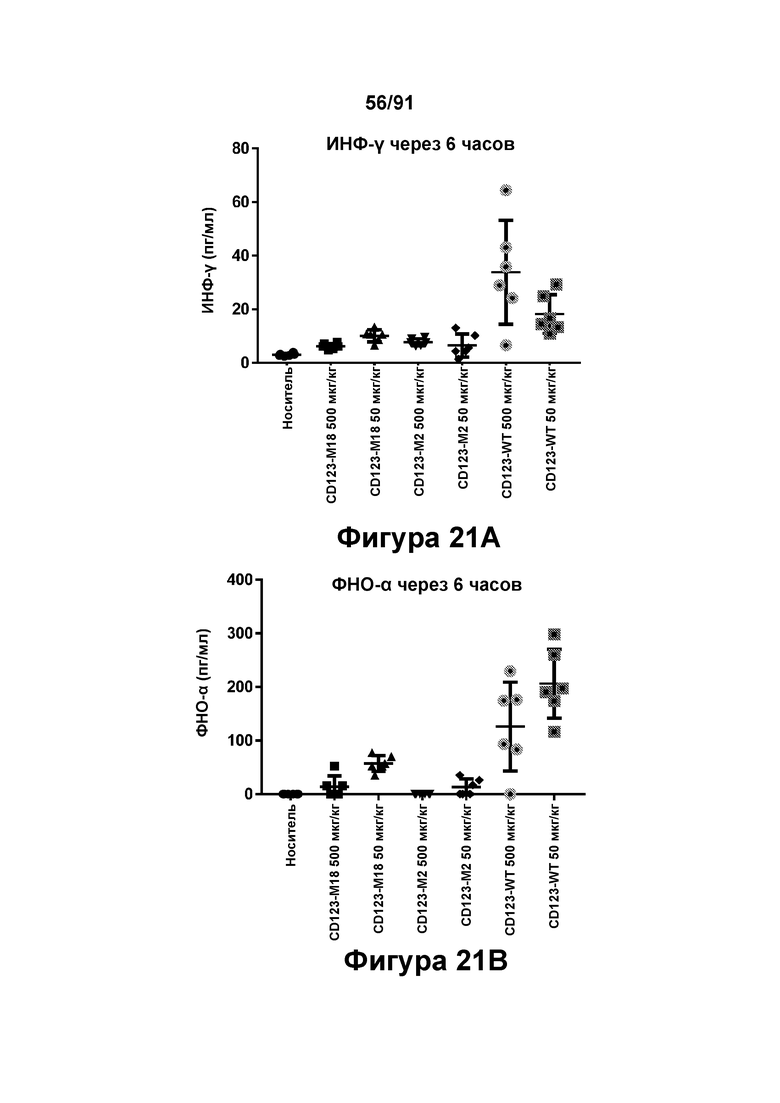
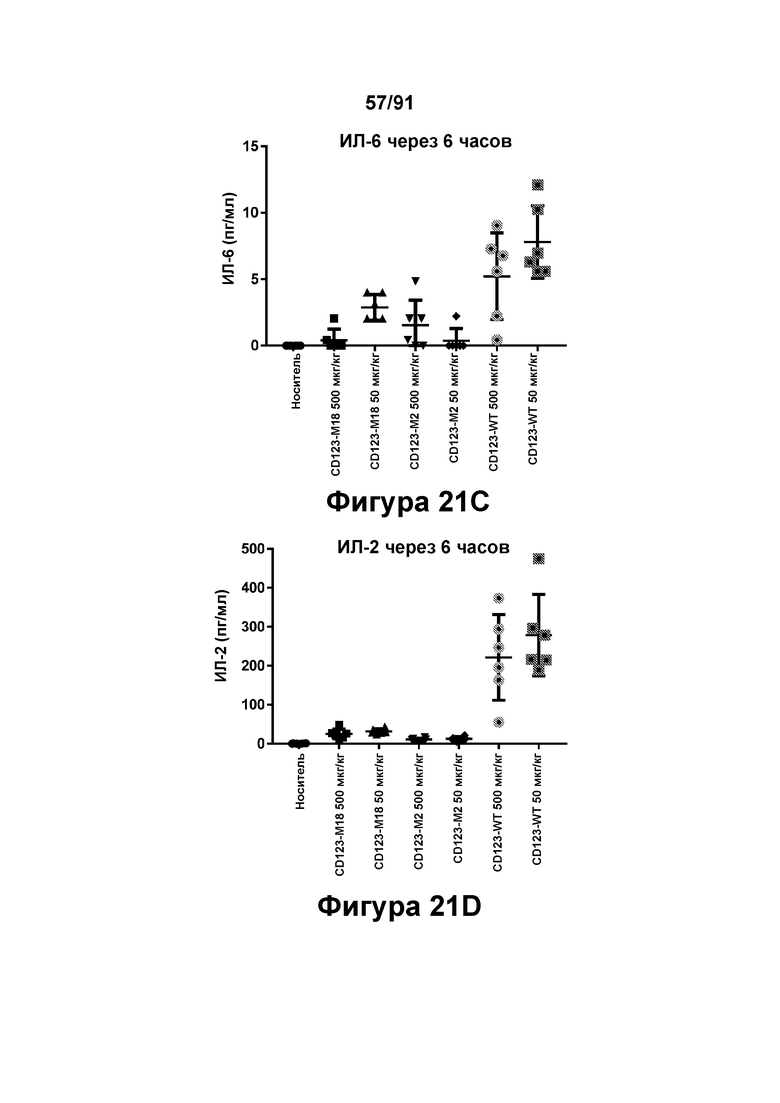
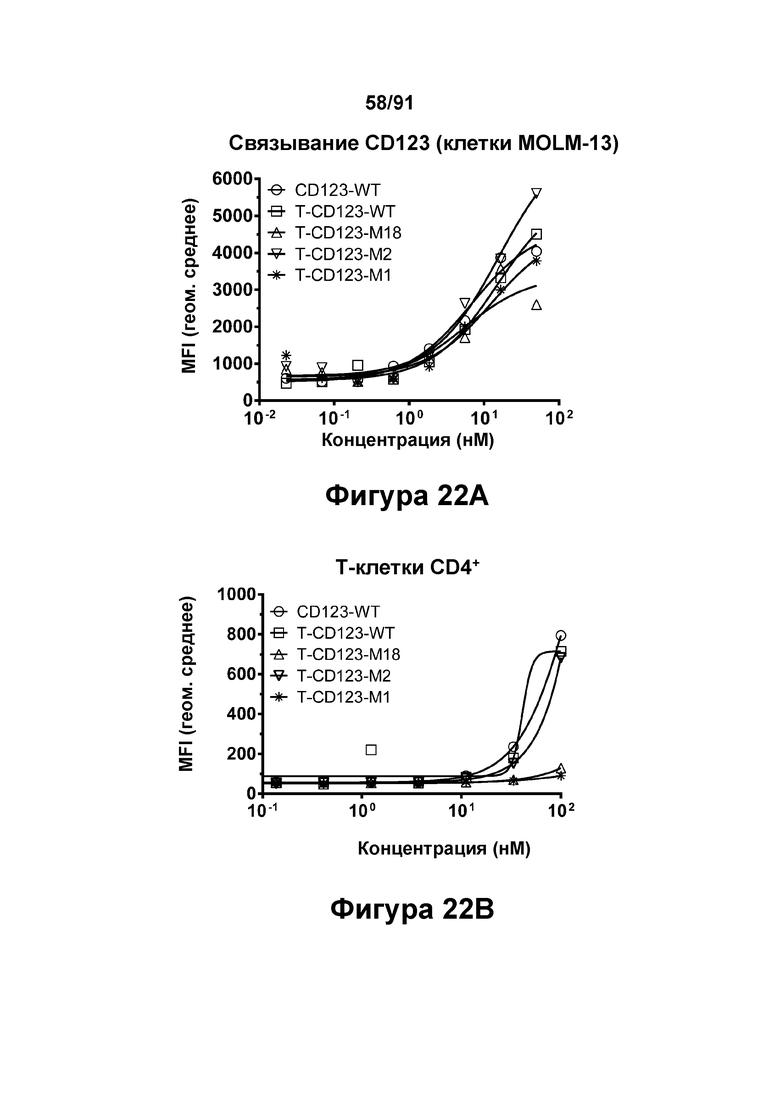
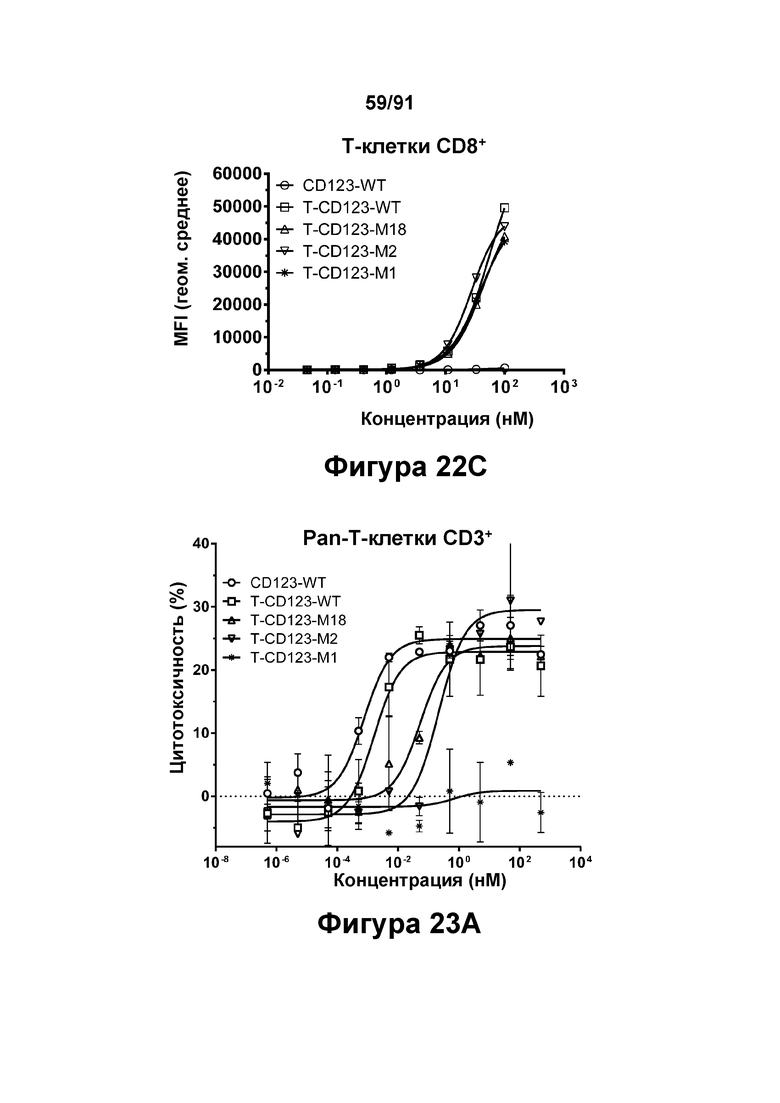
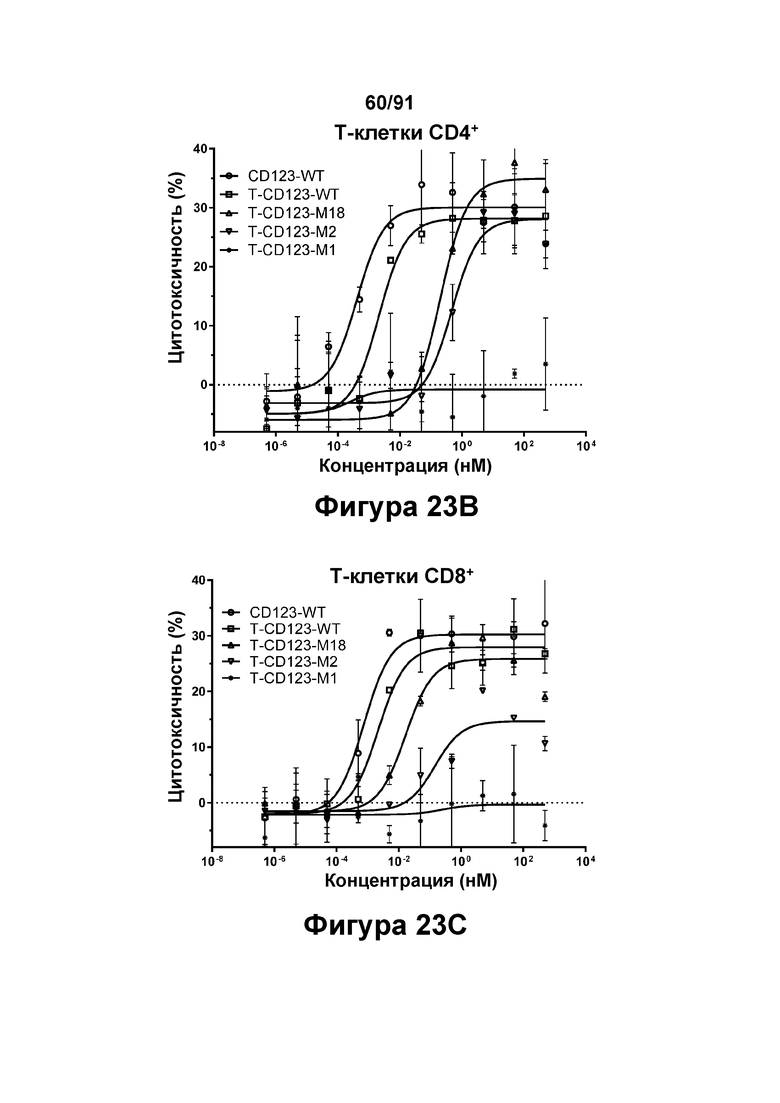
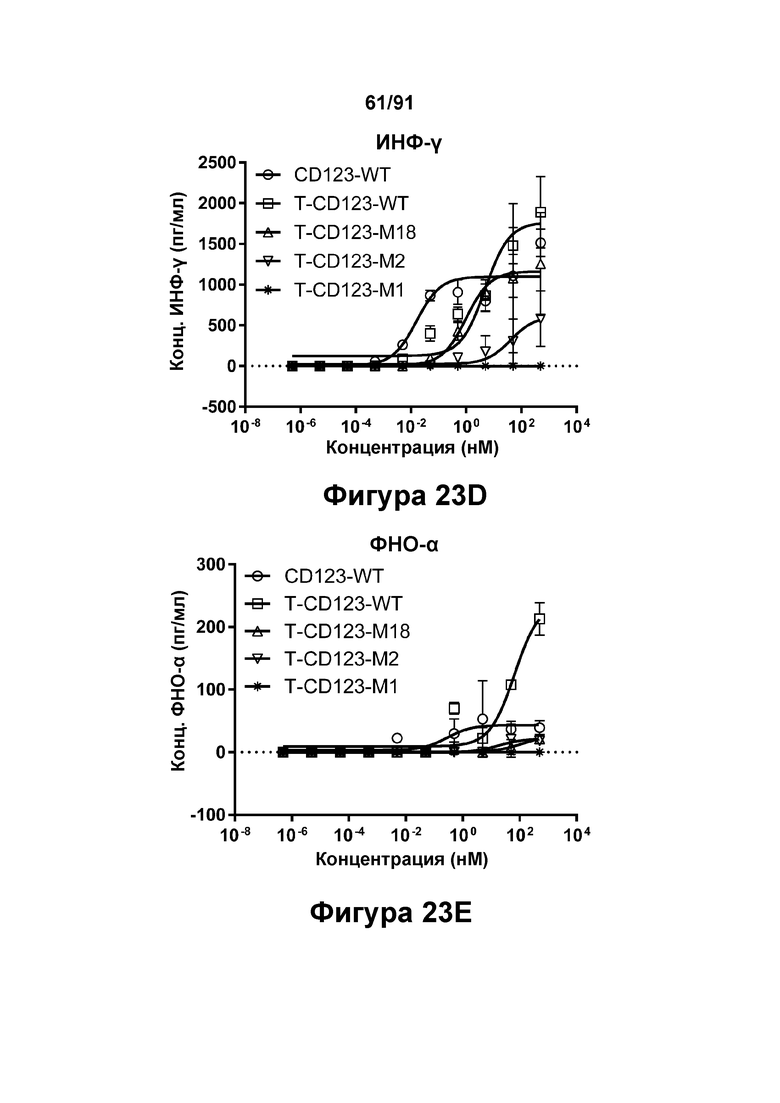
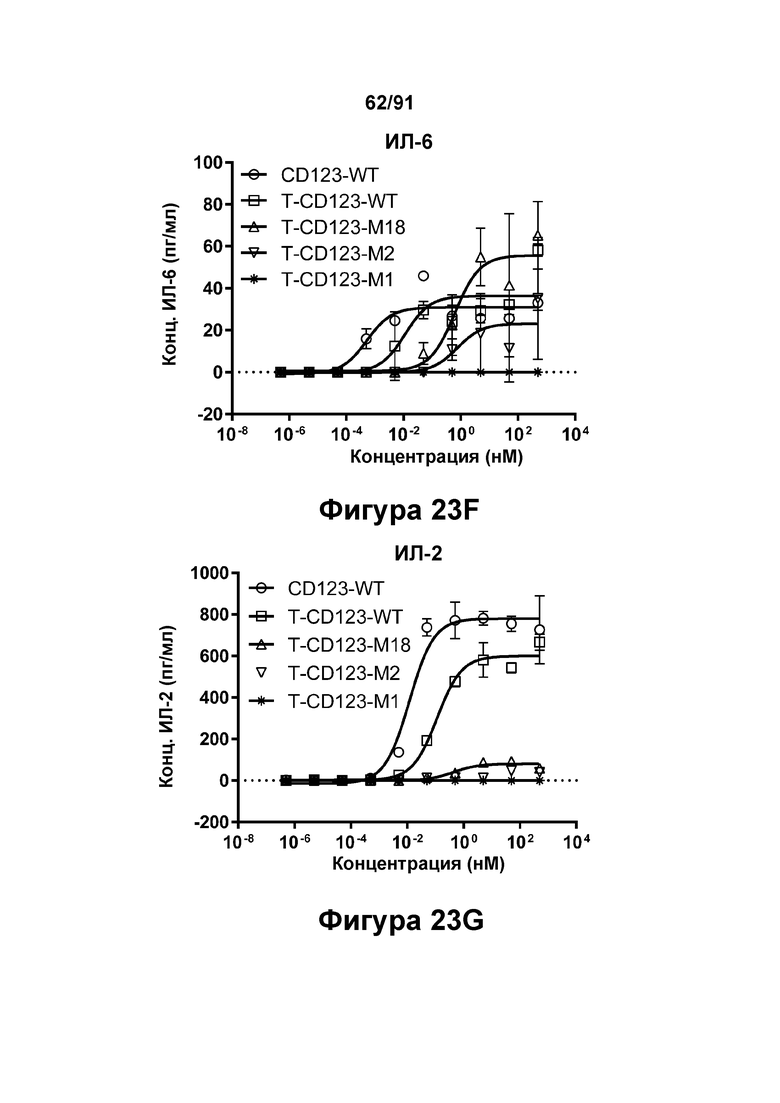
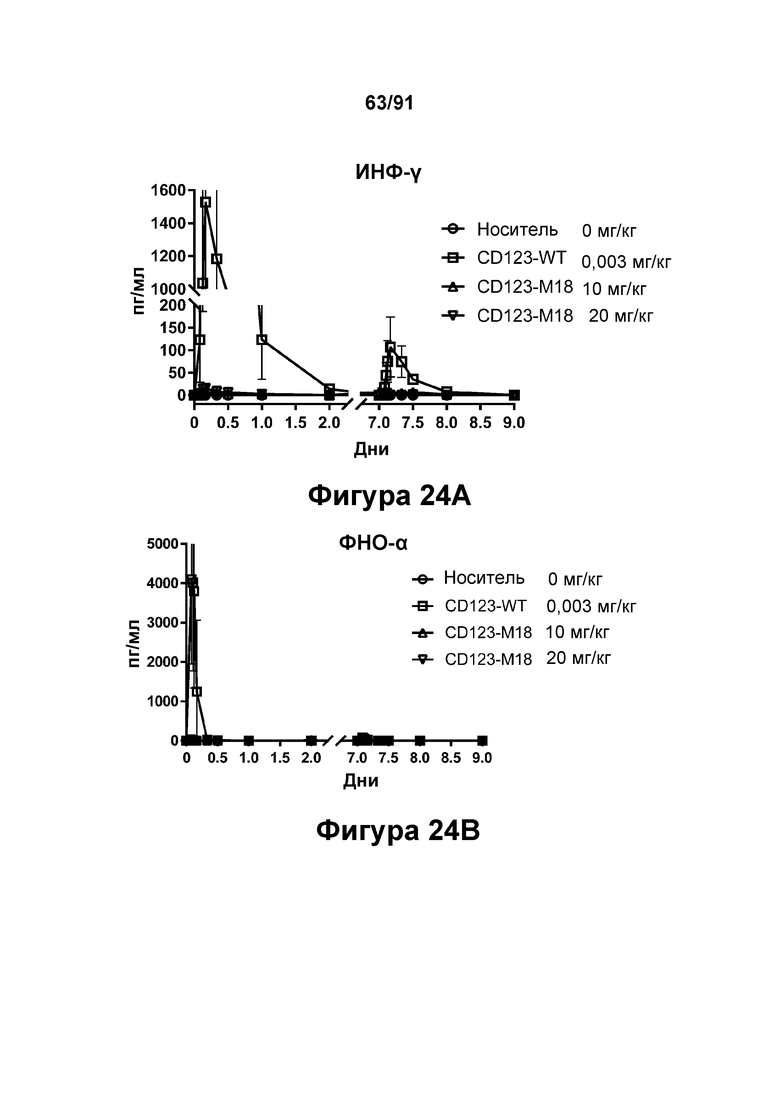
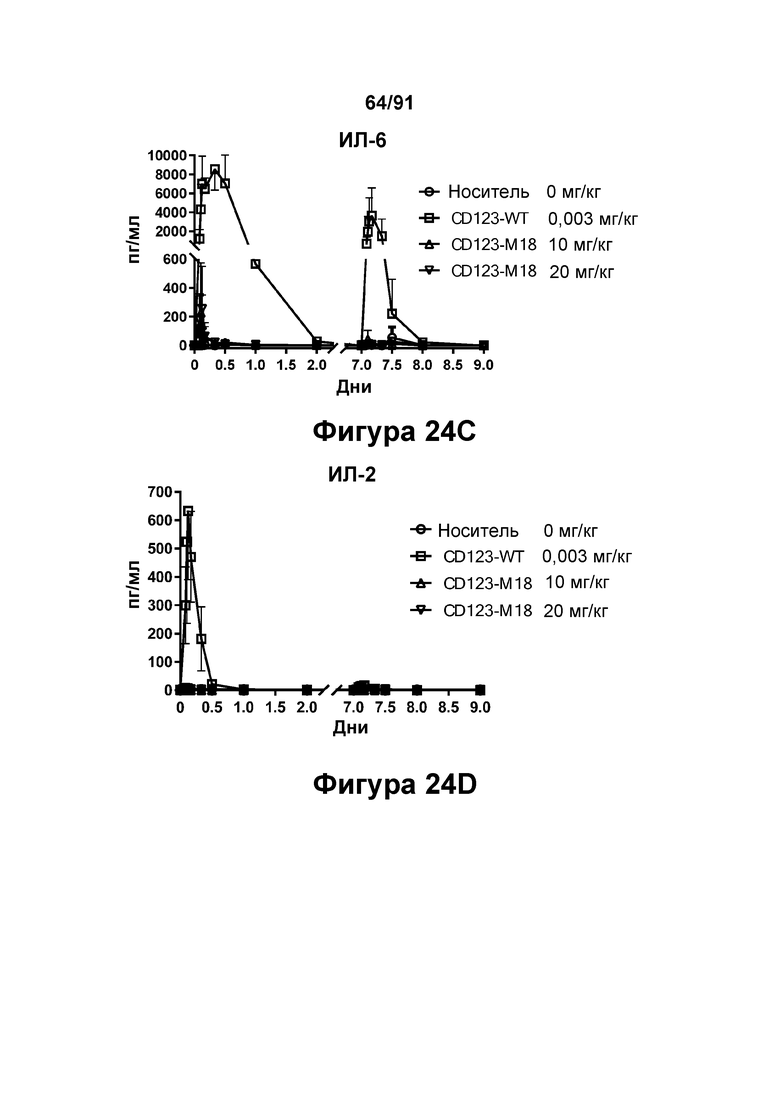
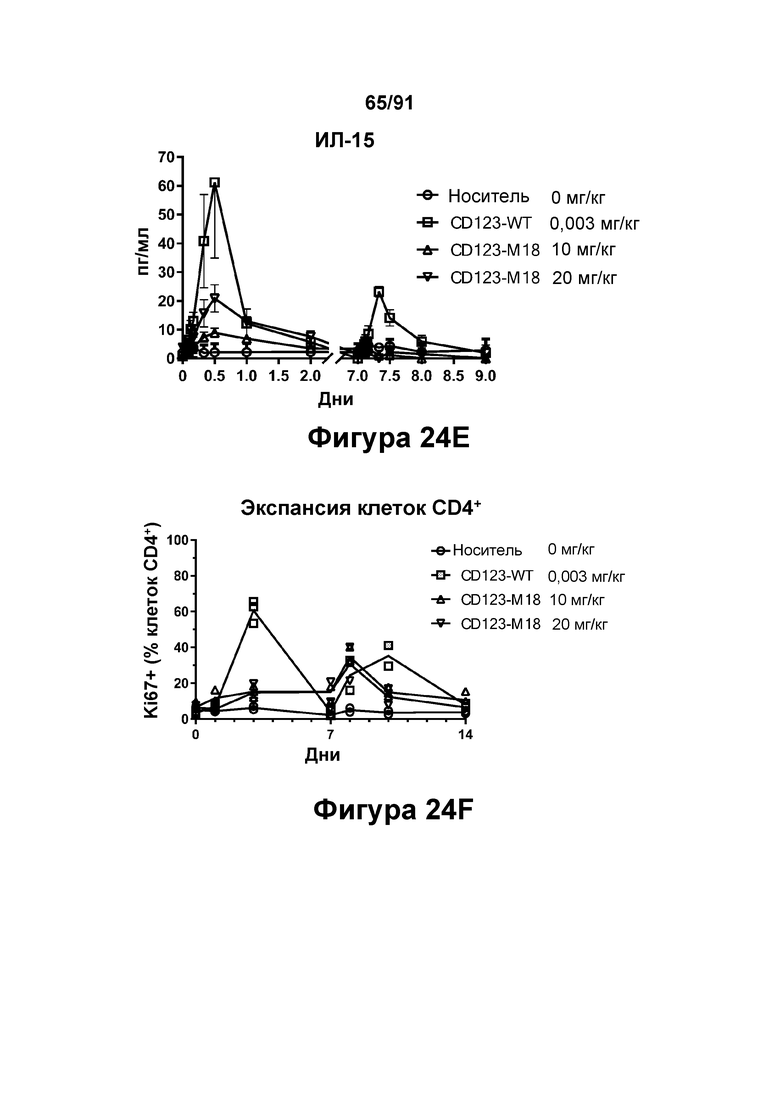
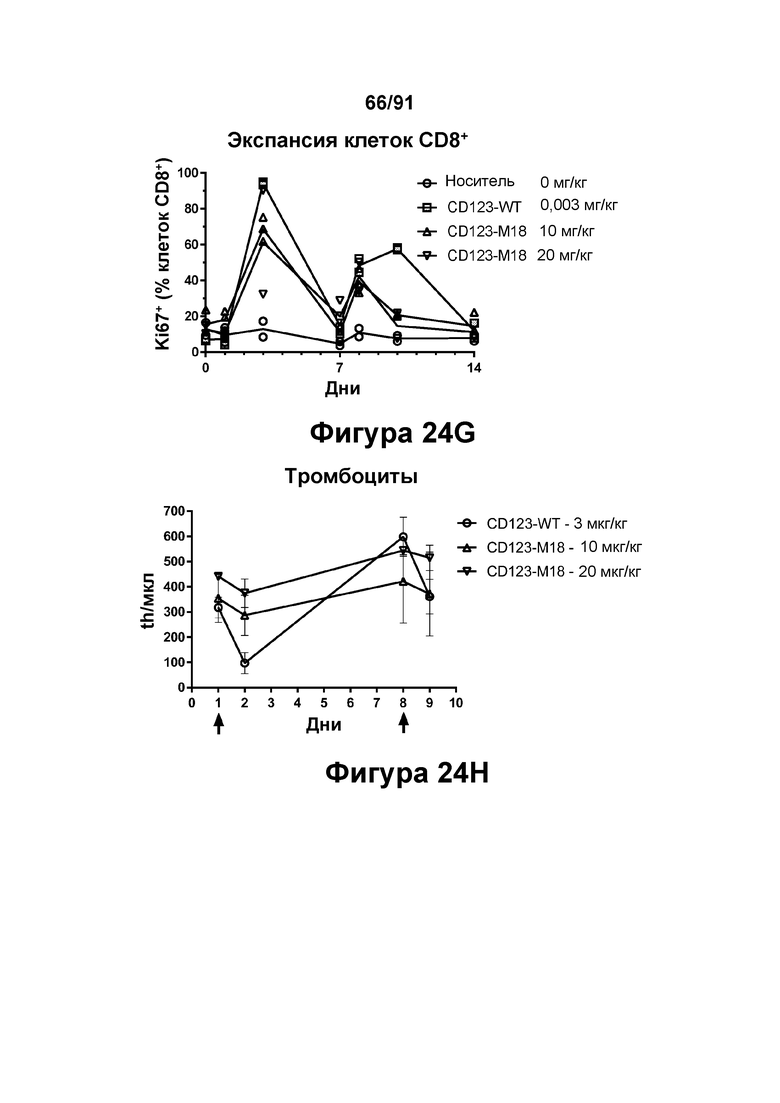
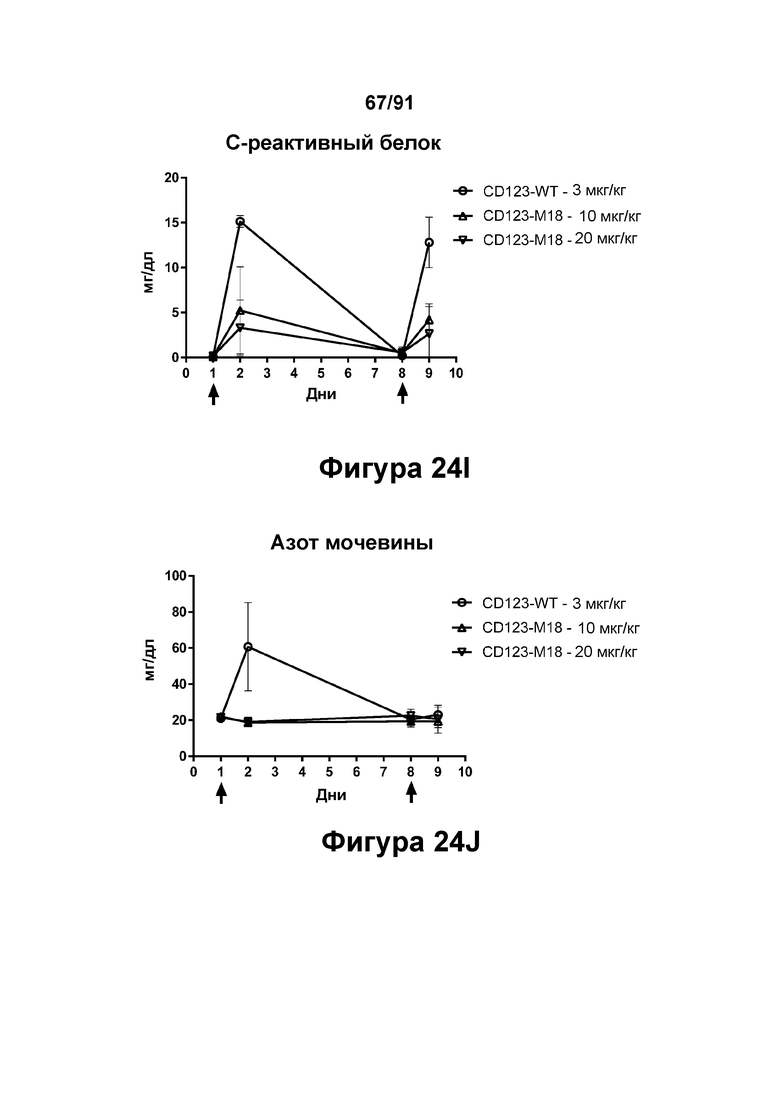
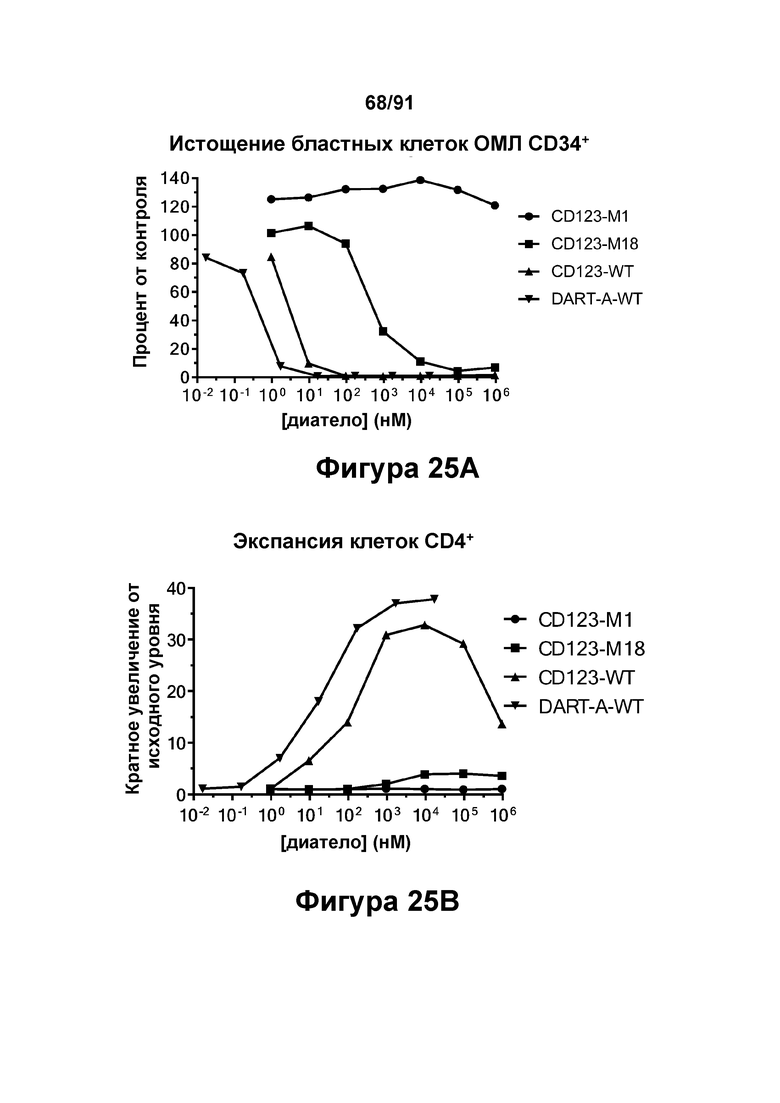
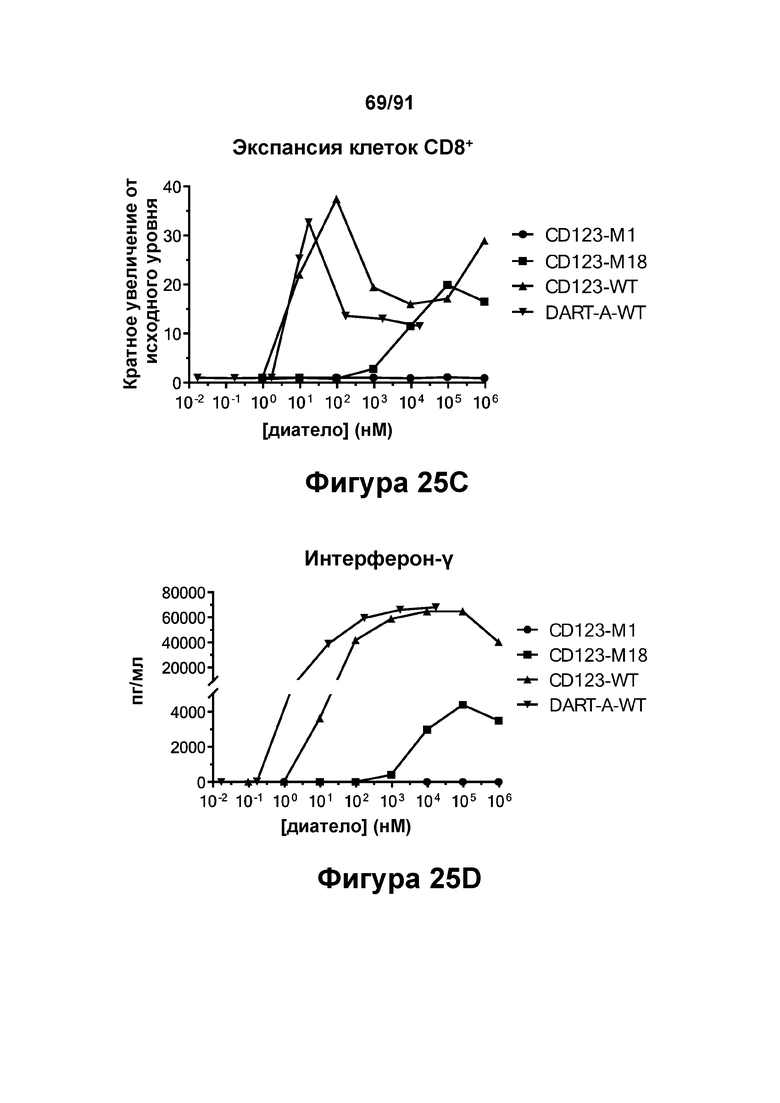
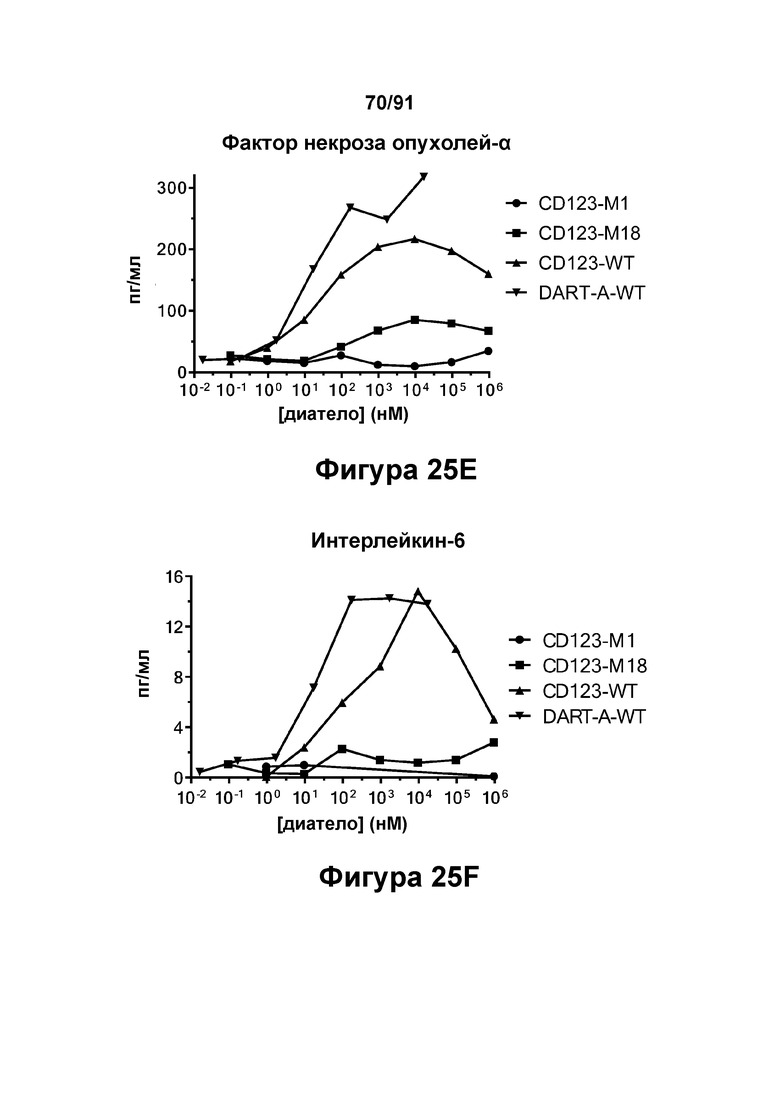
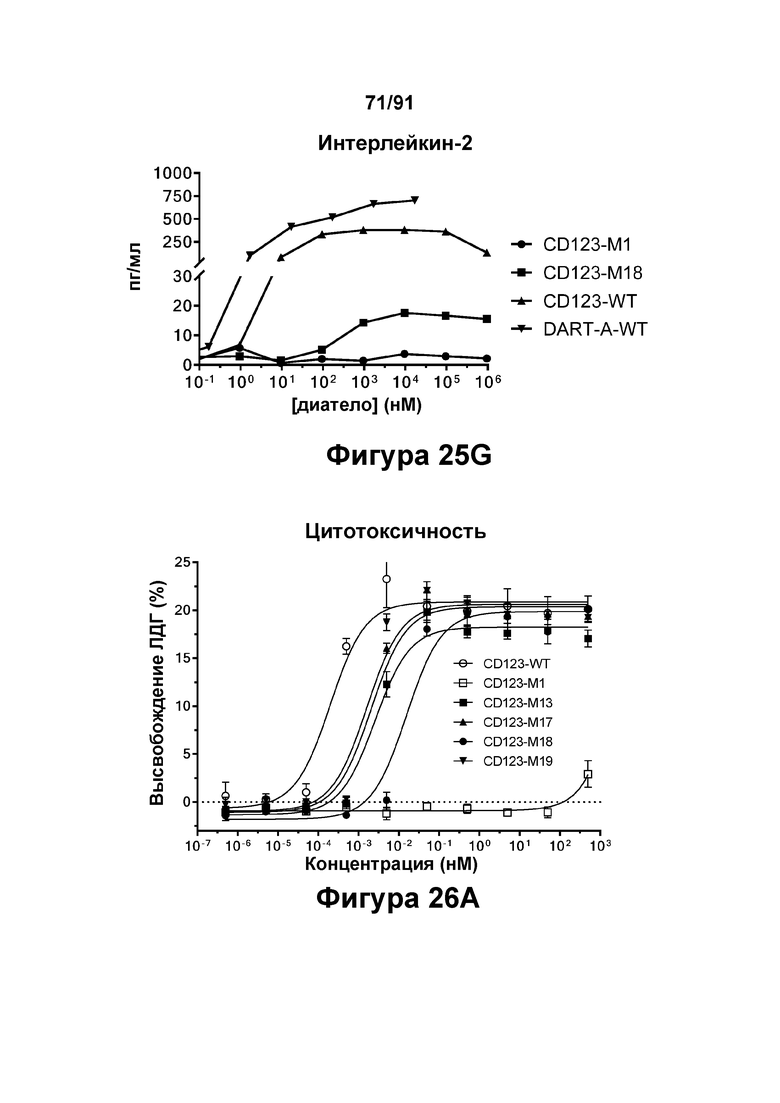
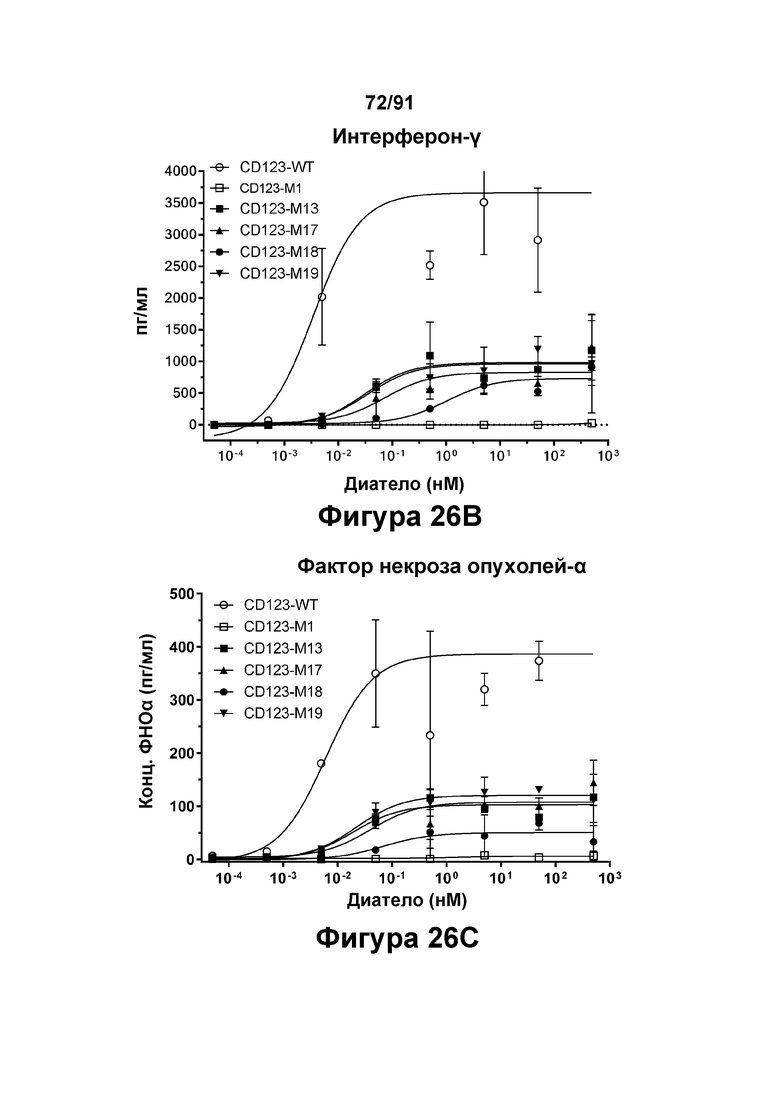
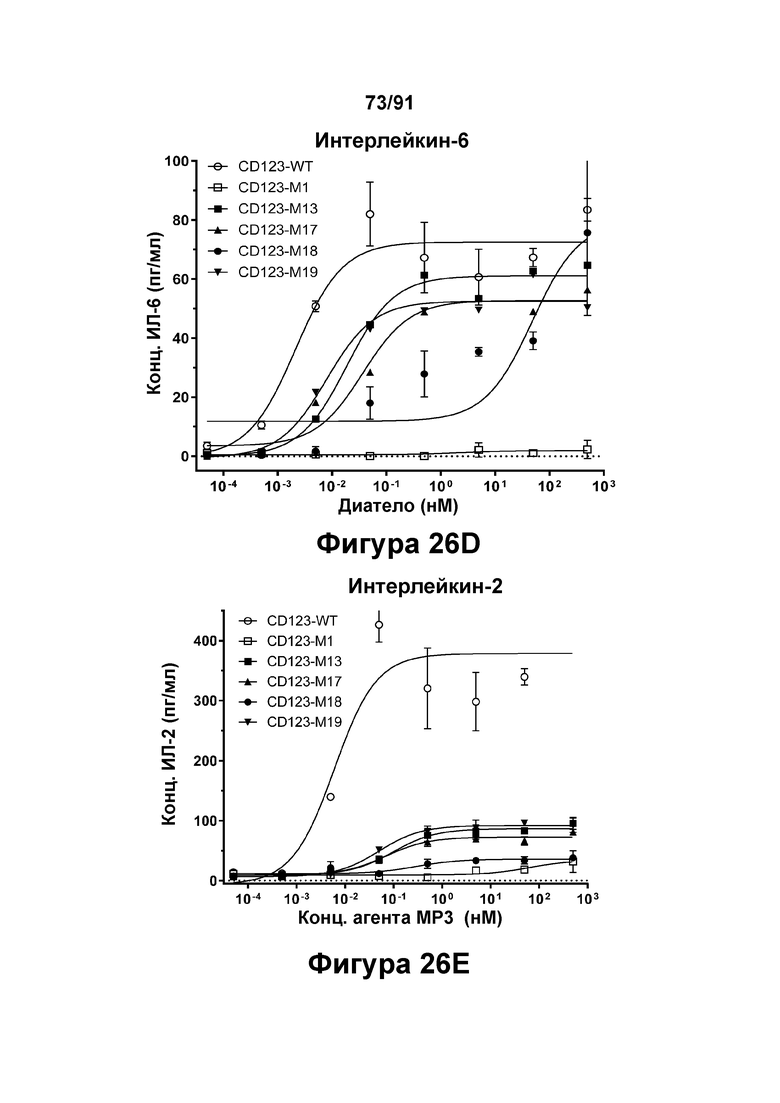
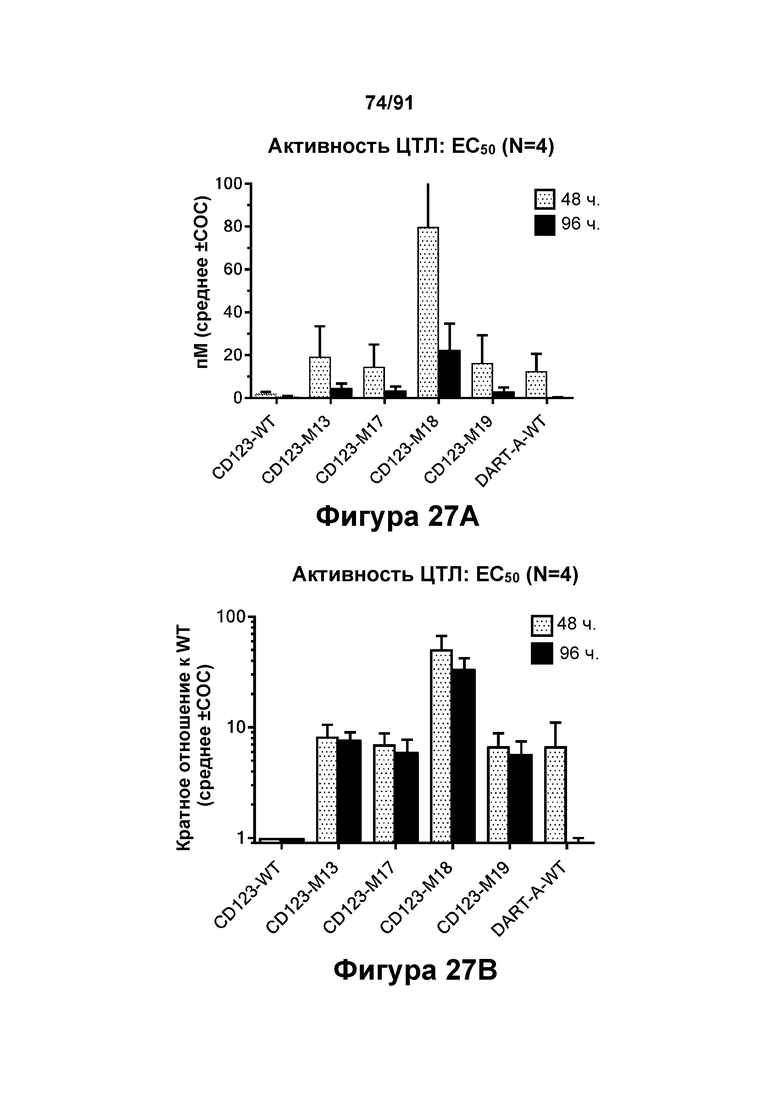
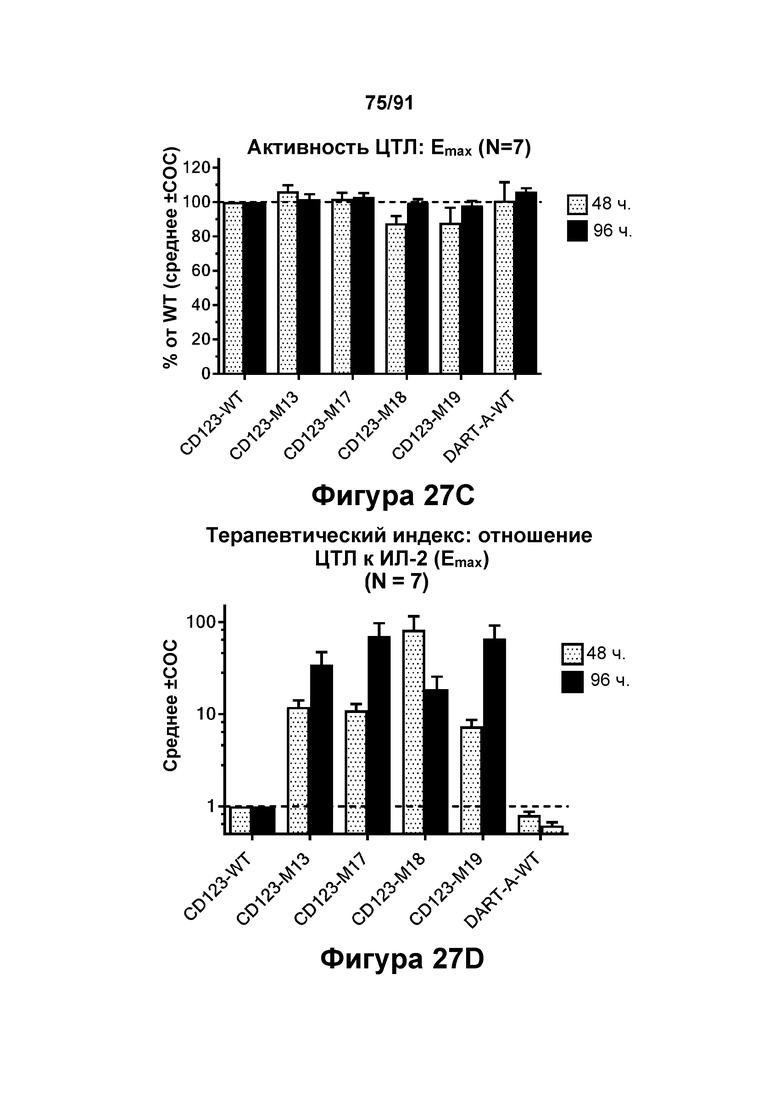
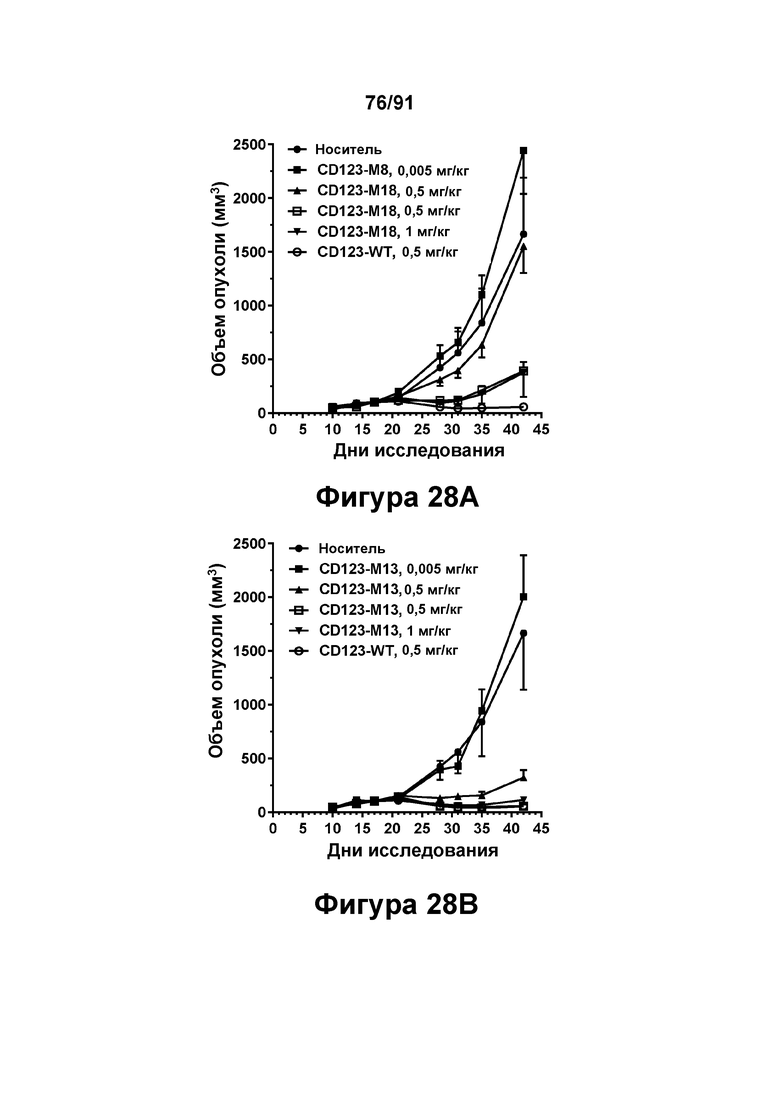
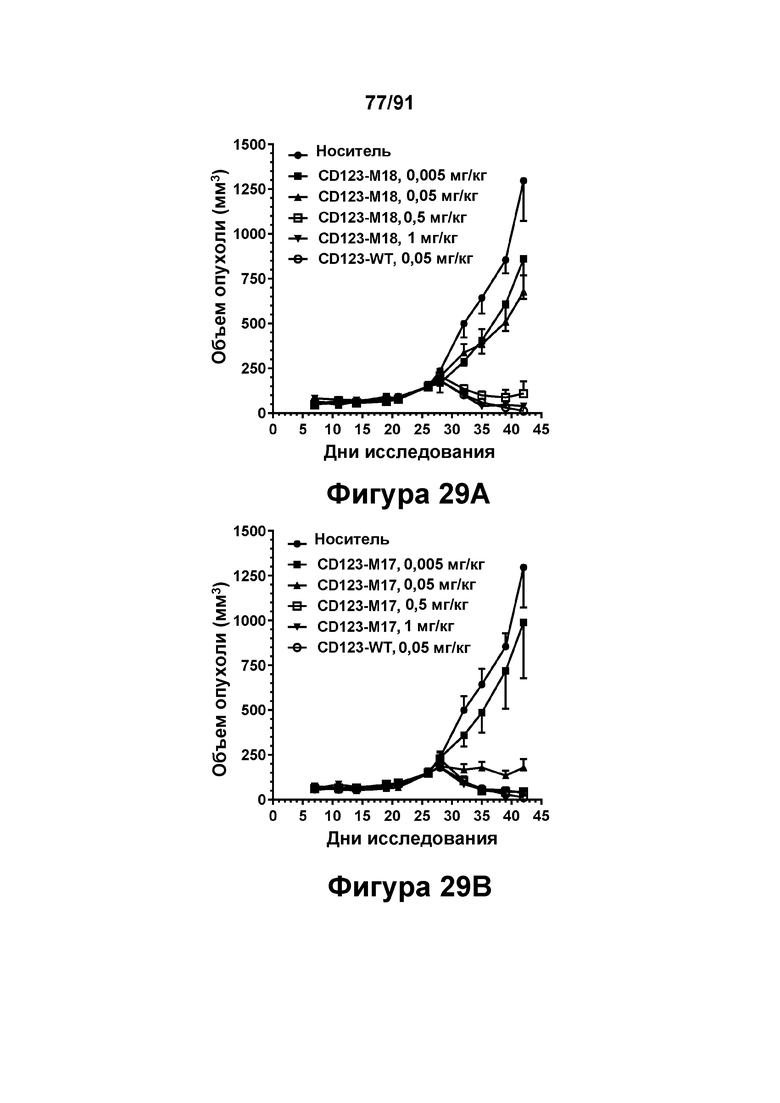
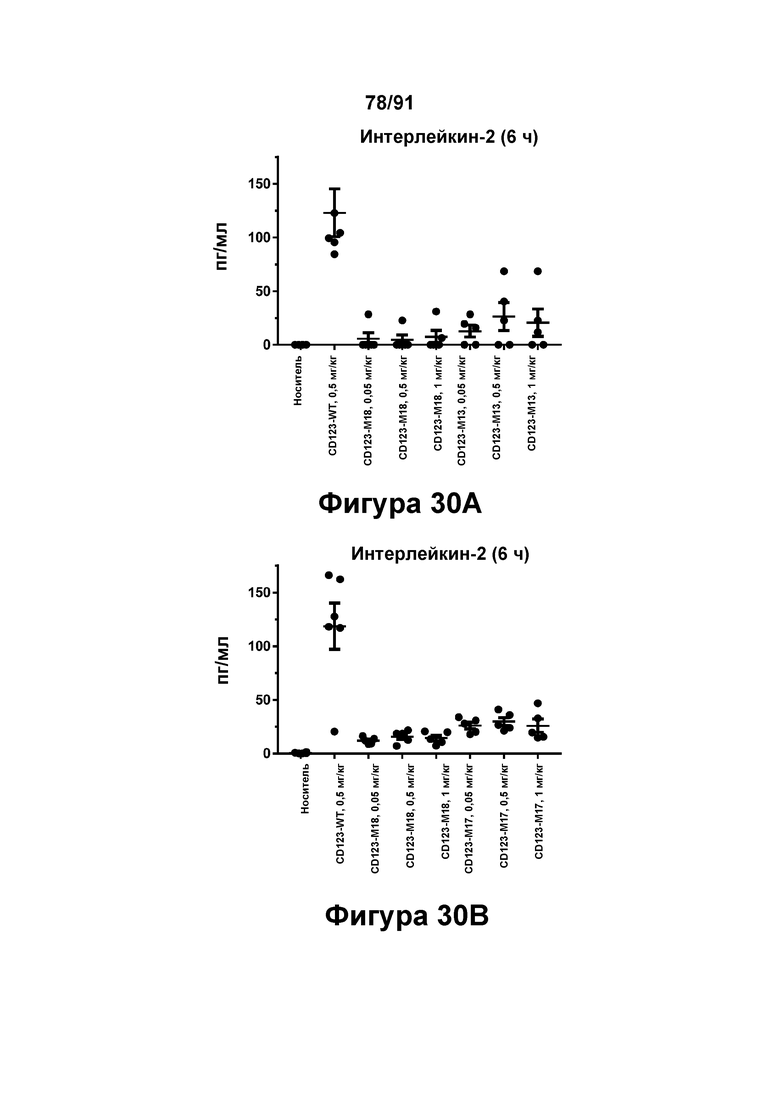
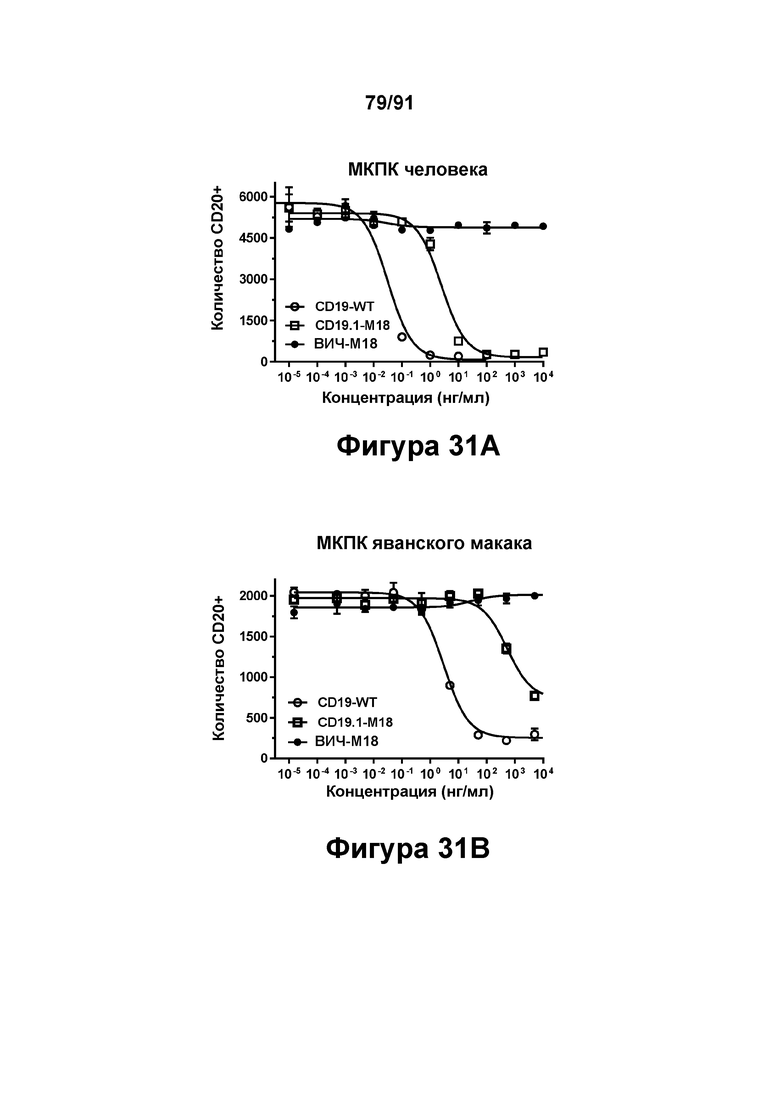
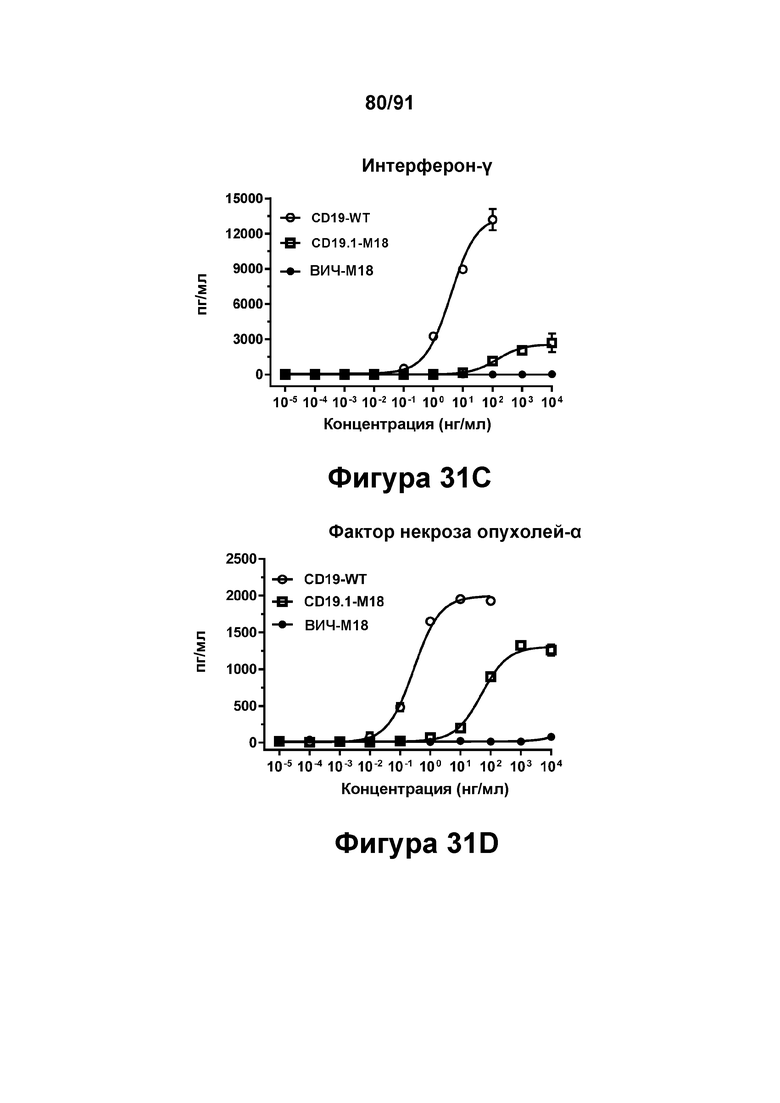
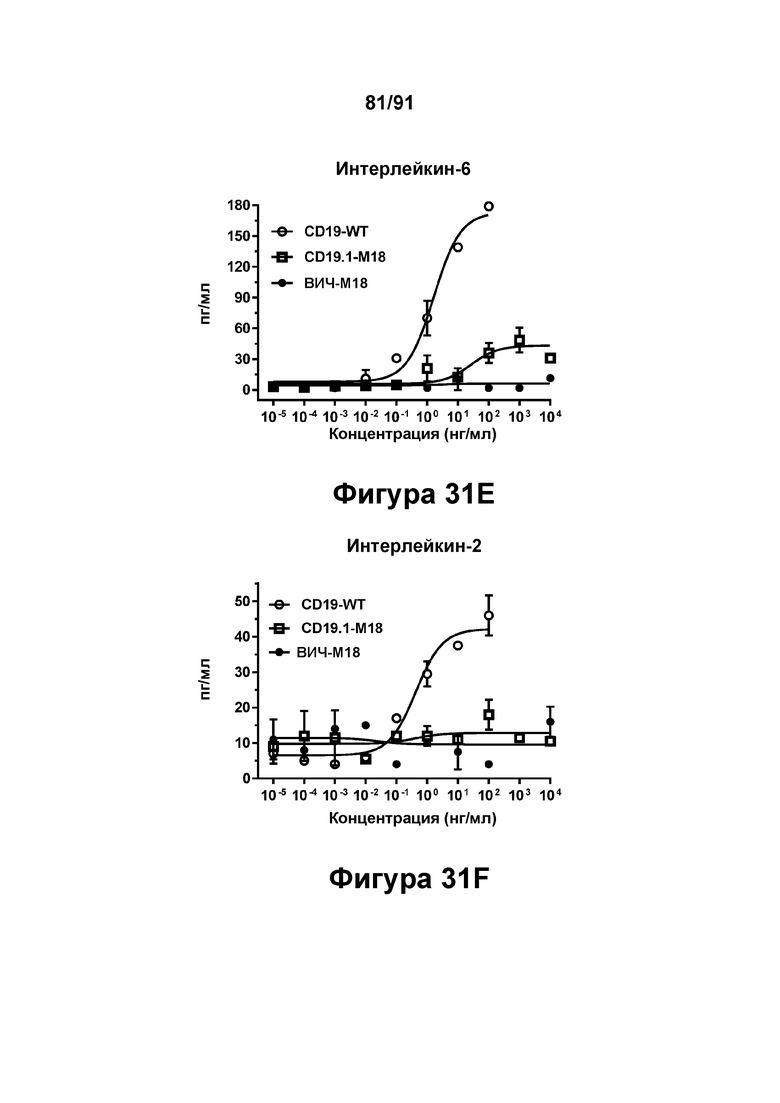
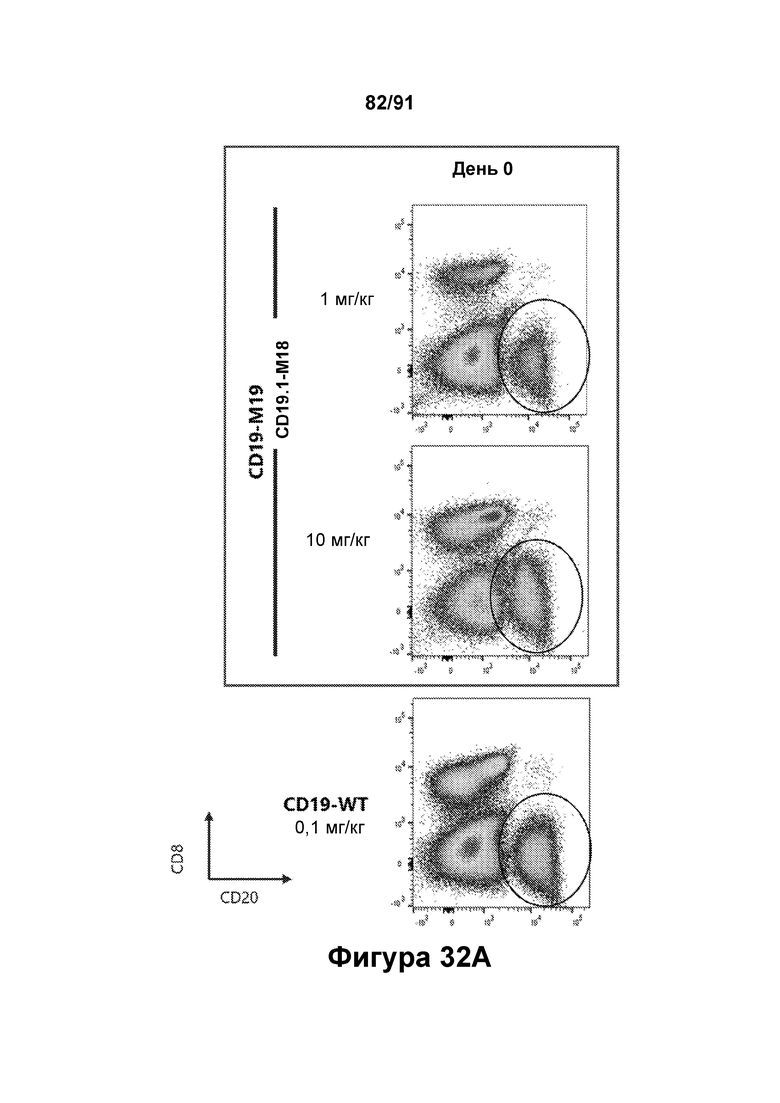
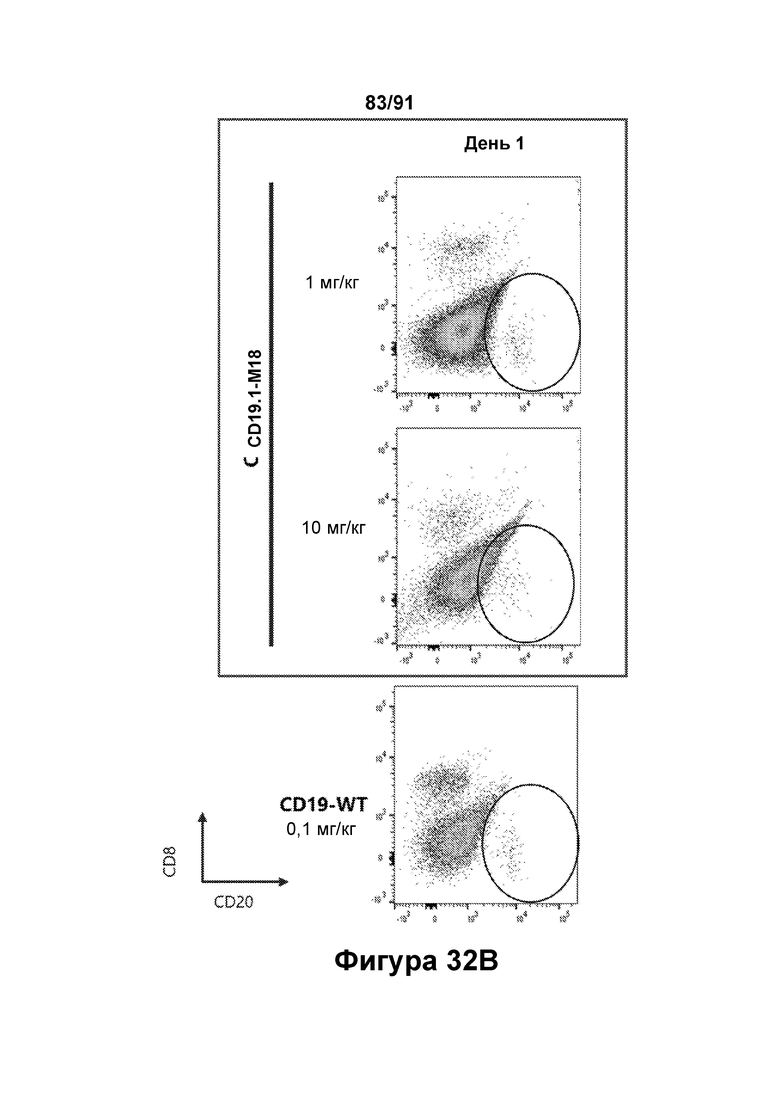
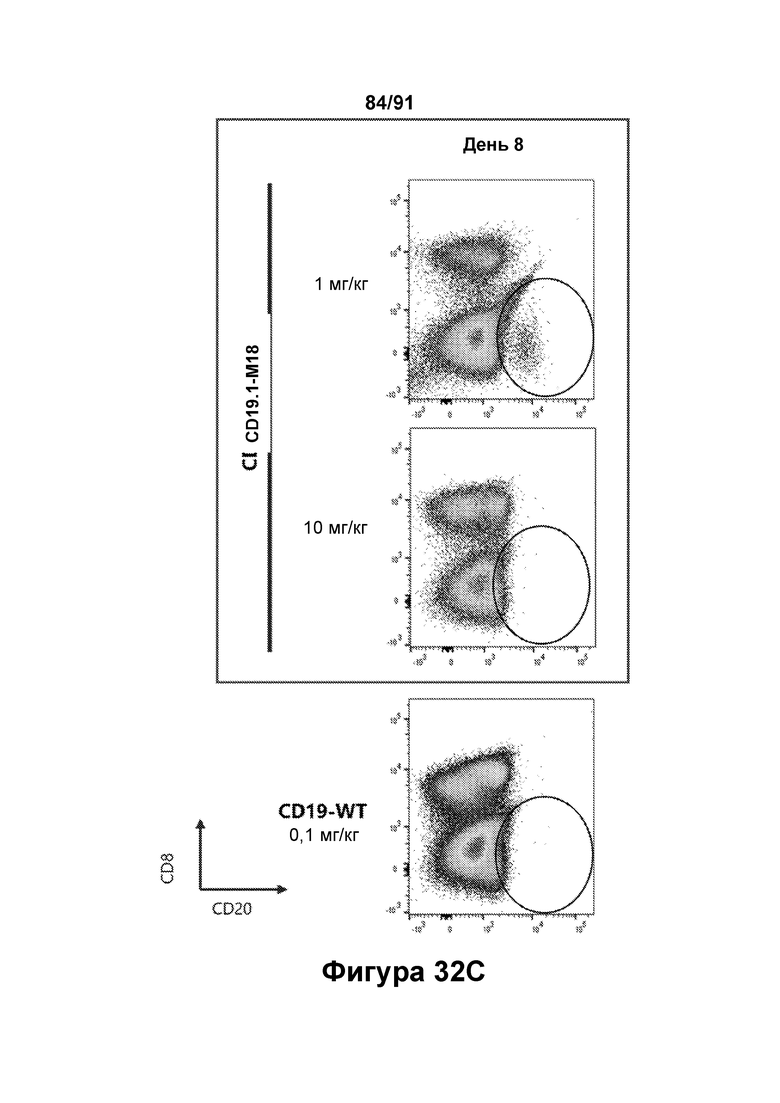
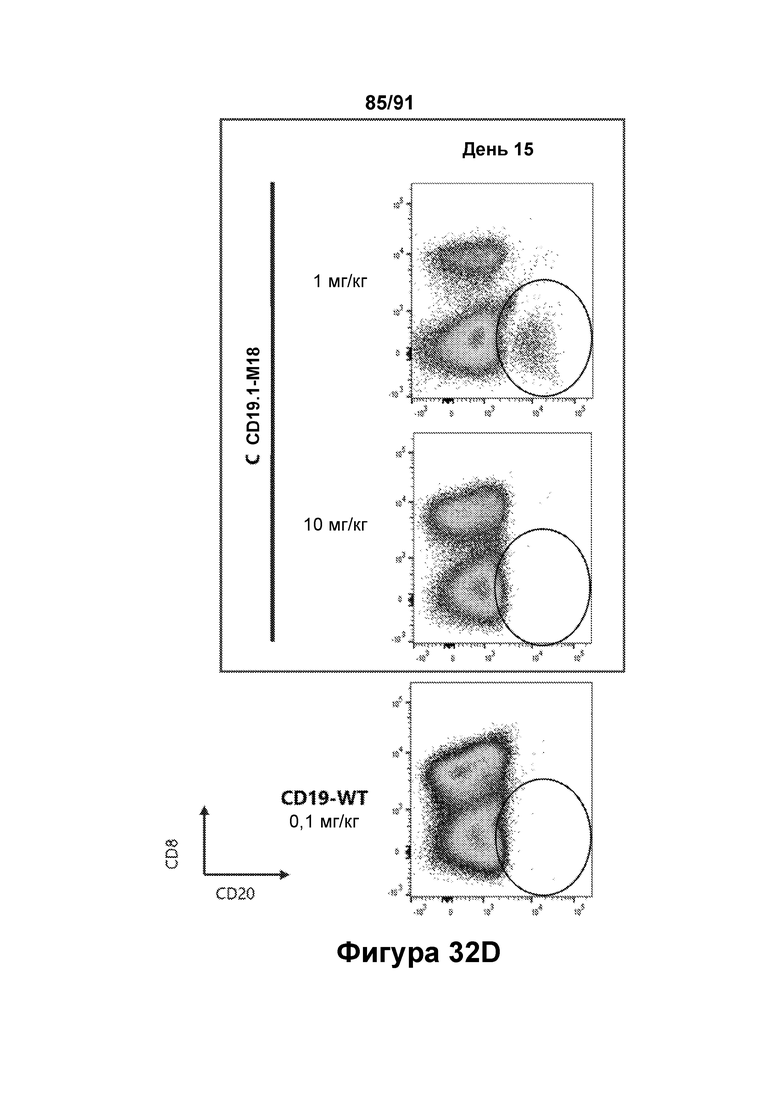
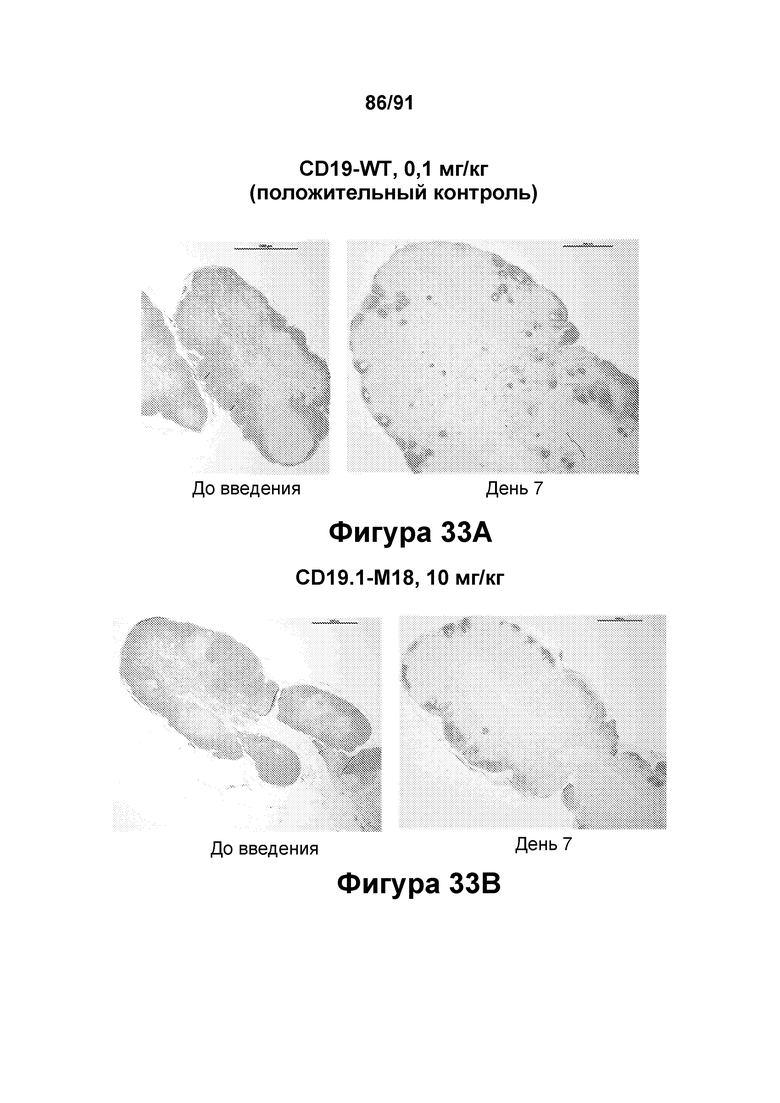
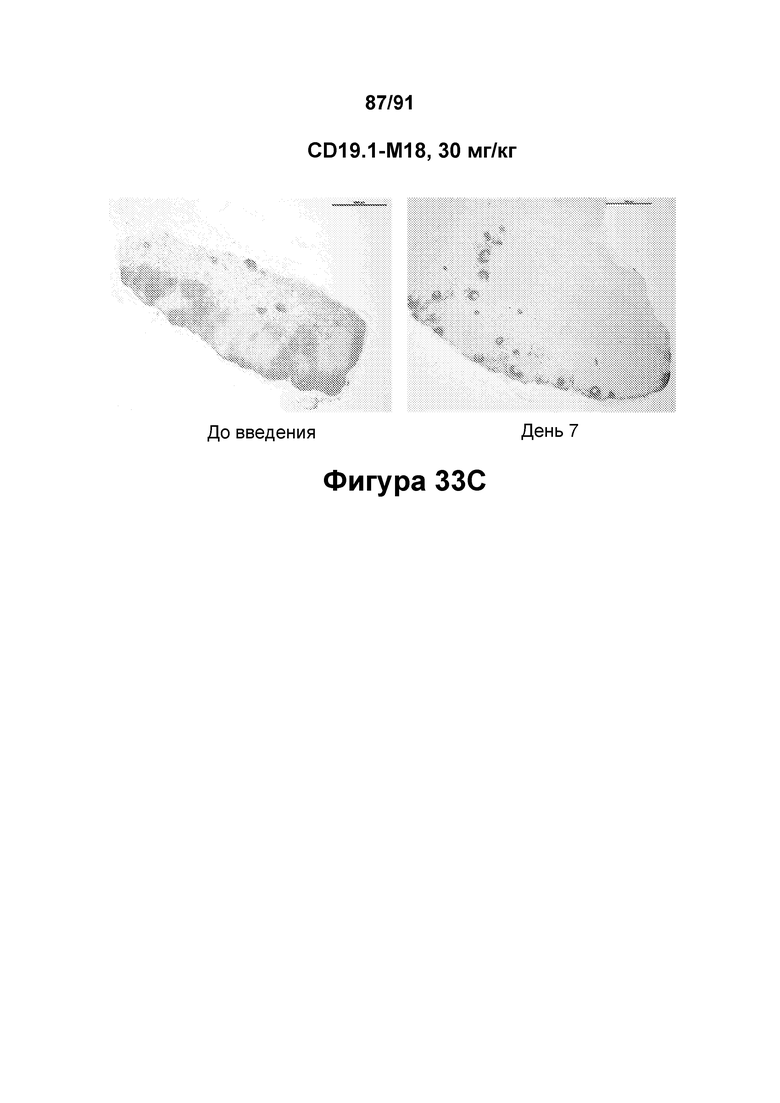
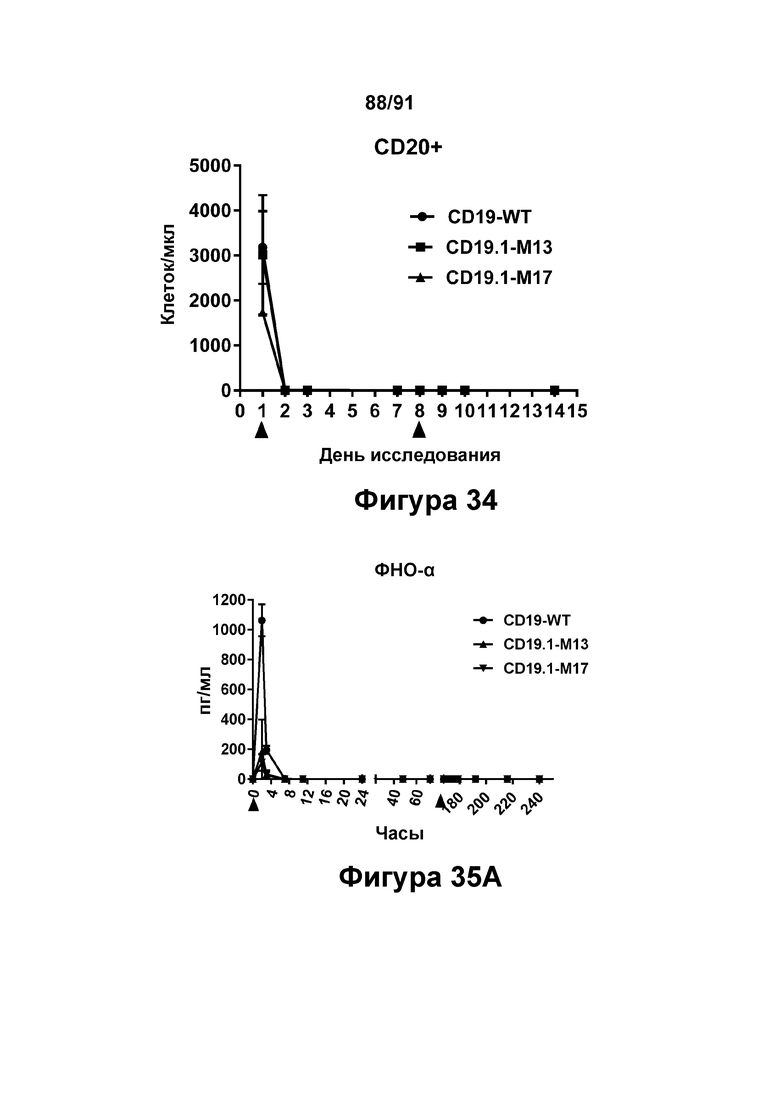
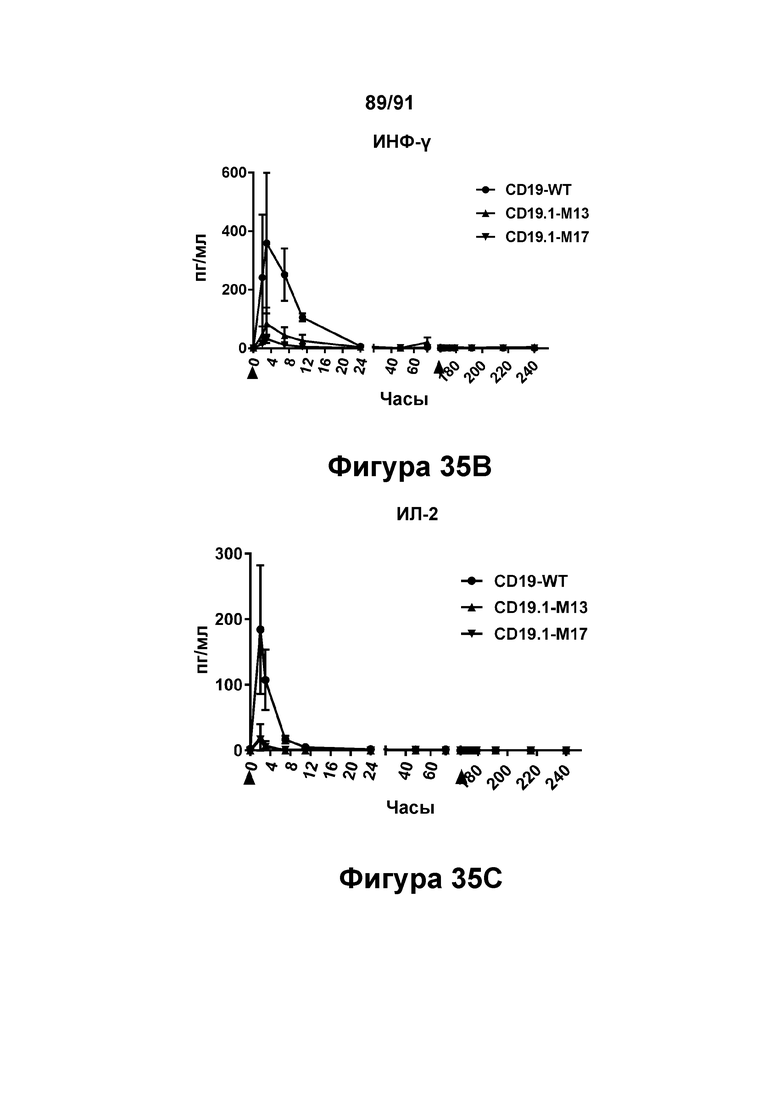
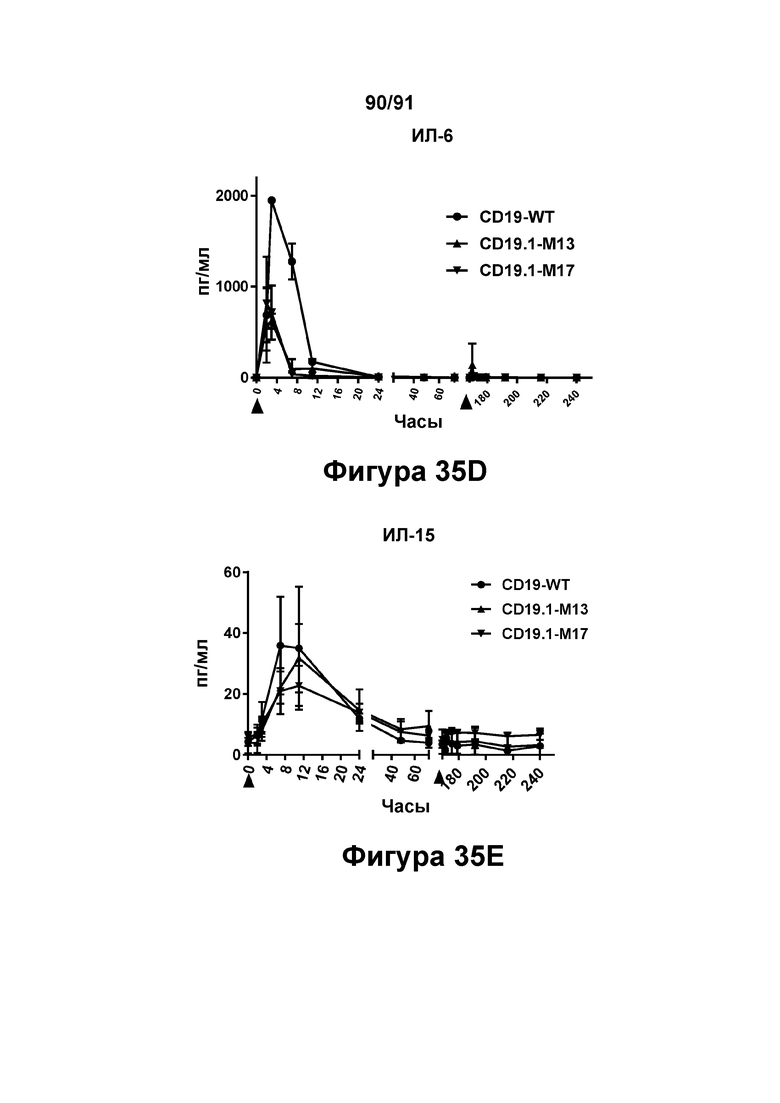
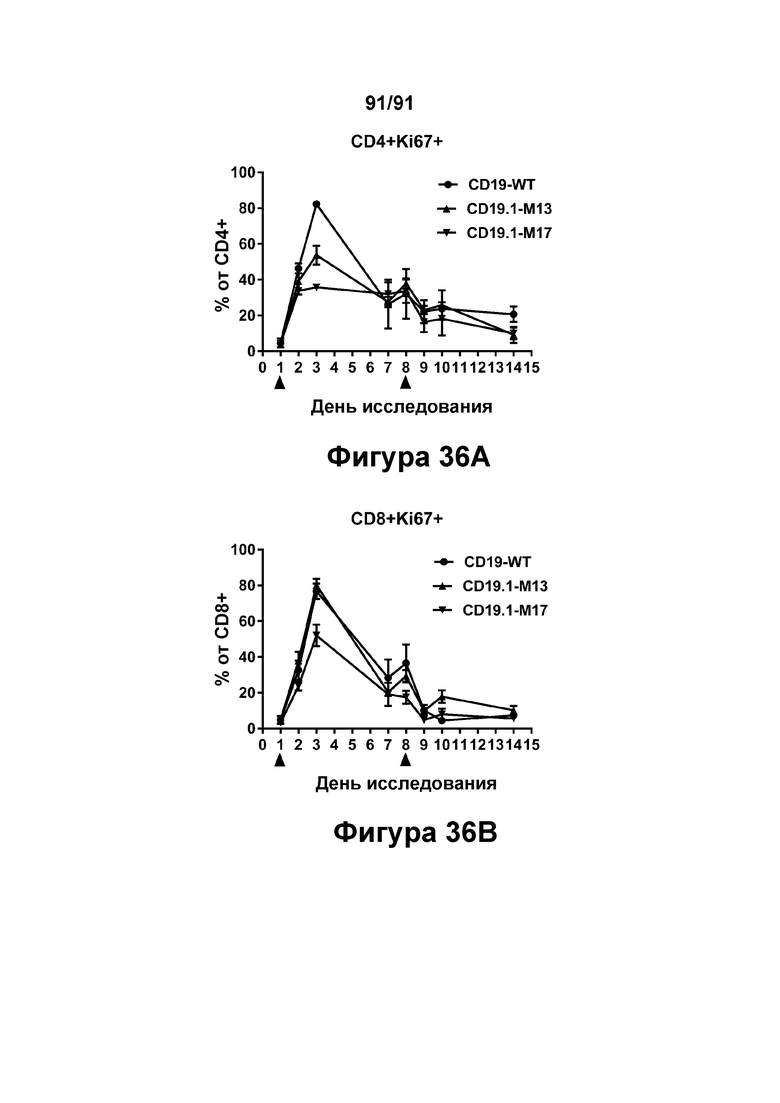
Изобретение относится к области биотехнологии, в частности к связывающей молекуле, специфичной к относящемуся к заболеванию антигену и CD3, а также к композиции, ее содержащей. Изобретение эффективно для лечения заболевания, ассоциированного с B7-H3, CEACAM5/CEACAM6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2 или CD19. 3 н. и 18 з.п. ф-лы, 36 ил., 20 табл., 13 пр.
1. Связывающая молекула, специфичная к относящемуся к заболеванию антигену и CD3 (связывающая DA x CD3 молекула), которая содержит по меньшей мере два связывающих домена, содержащая связывающий CD3 домен, способный связывать эпитоп CD3, и домен, связывающий относящийся к заболеванию антиген, способный связывать эпитоп относящегося к заболеванию антигена, причем указанный относящийся к заболеванию антиген представляет собой B7-H3, CEACAM5/CEACAM6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2 или CD19; и где указанный связывающий CD3 домен содержит:
(I) (A) домен CDRH1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 99, SEQ ID NO: 91, SEQ ID NO: 93, SEQ ID NO: 95 и SEQ ID NO: 97;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62; или
(II) (A) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83, SEQ ID NO: 85, SEQ ID NO: 87, SEQ ID NO: 89, SEQ ID NO: 101, SEQ ID NO: 103, SEQ ID NO: 105 и SEQ ID NO: 107;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62; или
(III) (A) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 61; и
(F) домен CDRL3, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 109 или SEQ ID NO: 111; или
(IV) (A) домен CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 57;
(B) домен CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 58;
(C) домен CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 59;
(D) домен CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 60;
(E) домен CDRL2, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 113 и SEQ ID NO: 115; и
(F) домен CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 62.
2. Связывающая DA x CD3 молекула по п. 1, где указанный связывающий CD3 домен содержит:
(I) (A) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 56;
(B) домен VH, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 98, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 100, SEQ ID NO: 102, SEQ ID NO: 104 и SEQ ID NO: 106; или
(II) (A) домен VL, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 108, SEQ ID NO: 110, SEQ ID NO: 112 и SEQ ID NO: 114;
(B) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 55.
3. Связывающая DA x CD3 молекула по п. 1 или 2, где указанная связывающая DA x CD3 молекула представляет собой биспецифичное антитело, биспецифичное диатело, биспецифичный одноцепочечный вариабельный фрагмент scFv, биспецифичное тандемное димерное антитело (TandAb) или трехвалентную связывающую молекулу.
4. Связывающая DA x CD3 молекула по любому из пп. 1-3, где указанная связывающая DA x CD3 молекула способна связывать более одного относящегося к заболеванию антигена и/или другую молекулу клеточной поверхности эффекторной клетки.
5. Связывающая DA x CD3 молекула по любому из пп. 1-4, где указанный относящийся к заболеванию антиген представляет собой 5T4 или CD19.
6. Связывающая DA x CD3 молекула по любому из пп. 1-5, где указанная связывающая DA x CD3 молекула содержит: первую полипептидную цепь и вторую полипептидную цепь, ковалентно связанные друг с другом, где:
(A) первая полипептидная цепь содержит, в направлении от N-конца к C-концу:
(i) Домен 1, содержащий:
(1) субдомен (1A), который содержит домен VL моноклонального антитела, способного связываться с указанным эпитопом относящегося к заболеванию антигена (VLDA); и
(2) субдомен (1B), который содержит домен VH моноклонального антитела, способного связываться с указанным эпитопом CD3 (VHCD3);
где указанные субдомены 1A и 1B отделены друг от друга пептидным линкером; и
(ii) Домен 2, при этом указанный Домен 2 представляет собой способствующий гетеродимеризации домен;
(B) вторая полипептидная цепь содержит, в направлении от N-конца к C-концу:
(i) Домен 1, содержащий:
(1) субдомен (1A), который содержит домен VL указанного моноклонального антитела, способного связываться с указанным эпитопом CD3 (VLCD3); и
(2) субдомен (1B), который содержит домен VH указанного моноклонального антитела, способного связываться с указанным эпитопом относящегося к заболеванию антигена (VHDA);
где указанные субдомены 1A и 1B отделены друг от друга пептидным линкером;
(ii) Домен 2, который представляет собой способствующий гетеродимеризации домен, причем указанные способствующие гетеродимеризации домены указанной первой и указанной второй полипептидных цепей различны;
и при этом домен VL первой полипептидной цепи и домен VH второй полипептидной цепи ассоциируют с получением домена, связывающего относящийся к заболеванию антиген, и домен VH первой полипептидной цепи и домен VL второй полипептидной цепи ассоциируют с получением связывающего CD3 домена.
7. Связывающая DA x CD3 молекула по п. 6, где:
(a) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой E-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой K-спиральный домен; или
(b) указанный способствующий гетеродимеризации домен указанной первой полипептидной цепи представляет собой K-спиральный домен, и указанный способствующий гетеродимеризации домен указанной второй полипептидной цепи представляет собой E-спиральный домен.
8. Связывающая DA x CD3 молекула по п. 6 или 7, где указанная первая или вторая полипептидная цепь содержит Домен 3, содержащий домен CH2 и CH3 Fc-домена иммуноглобулина.
9. Связывающая DA x CD3 молекула по п. 8, где указанная связывающая DA x CD3 молекула содержит третью полипептидную цепь, содержащую домен CH2 и CH3 Fc-домена иммуноглобулина.
10. Связывающая DA x CD3 молекула по любому из пп. 6-9, где указанная связывающая DA x CD3 молекула дополнительно содержит связывающий CD8 домен.
11. Связывающая DA x CD3 молекула по любому из пп. 6-10, где указанная связывающая DA x CD3 молекула содержит:
(I) (A) первый полипептид, содержащий SEQ ID NO: 184;
(B) второй полипептид, содержащий SEQ ID NO: 181;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188; или
(II) (A) первый полипептид, содержащий SEQ ID NO: 193;
(B) второй полипептид, содержащий SEQ ID NO: 194;
(C) третий полипептид, содержащий SEQ ID NO: 187; и
(D) четвертый полипептид, содержащий SEQ ID NO: 188.
12. Связывающая DA x CD3 молекула по любому из пп. 1-11, где указанный домен, связывающий относящийся к заболеванию антиген, содержит:
(I) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 122, (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 123, (iii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 126, (iv) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 128, или (v) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 130; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 124, (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 125, (iii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 127, (iv) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 129, или (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 131;
(II) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 132, или (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 134; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 133, или (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 135;
(III) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 136, или (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 138; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 137, или (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 139;
(IV) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 140, (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 142, или (iii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 144; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 141, (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 143, или (iii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 145;
(V) (A) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 146; и
(B) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 147;
(VI) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 148, (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 150, или (iii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 152; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 149, (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 151, или (iii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 153;
(VII) (A) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 154; и
(B) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 155;
(VIII) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 156, или (ii) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 158; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 157, или (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 159;
(IX) (A) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 160; и
(B) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 161; или
(X) (A) (i) домен CDRH1, домен CDRH2 и домен CDRH3 согласно SEQ ID NO: 164; и
(B) (i) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 165, или (ii) домен CDRL1, домен CDRL2 и домен CDRL3 согласно SEQ ID NO: 166.
13. Связывающая DA x CD3 молекула по любому из пп. 1-11, где указанный домен, связывающий относящийся к заболеванию антиген, содержит:
(I) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 122, (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 123, (iii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 126, (iv) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 128, или (v) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 130; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 124, (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 125, (iii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 127, (iv) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 129, или (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 131;
(II) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 132, или (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 134; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 133, или (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 135;
(III) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 136, или (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 138; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 137, или (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 139;
(IV) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 140, (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 142, или (iii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 144; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 141, (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 143, или (iii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 145;
(V) (A) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 146; и
(B) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 147;
(VI) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 148, (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 150, или (iii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 152; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 149, (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 151, или (iii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 153;
(VII) (A) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 154; и
(B) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 155;
(VIII) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 156, или (ii) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 158; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 157, или (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 159;
(IX) (A) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 160; и
(B) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 161; или
(X) (A) (i) домен VH, содержащий аминокислотную последовательность SEQ ID NO: 164; и
(B) (i) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 165, или (ii) домен VL, содержащий аминокислотную последовательность SEQ ID NO: 166.
14. Фармацевтическая композиция для лечения заболевания, ассоциированного с B7-H3, CEACAM5/CEACAM6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2 или CD19, которая содержит в эффективном количестве связывающую DA x CD3 молекулу по любому из пп. 1-13 и фармацевтически приемлемый носитель.
15. Фармацевтическая композиция по п. 14, причем указанное заболевание представляет собой рак.
16. Способ лечения заболевания, ассоциированного с B7-H3, CEACAM5/CEACAM6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2 или CD19, включающий введение нуждающемуся в этом субъекту терапевтически эффективного количества связывающей DA x CD3 молекулы по любому из пп. 1-13 или фармацевтической композиции по п. 14.
17. Способ по п. 16, причем указанное заболевание представляет собой рак.
18. Способ по п. 17, где указанный рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови, множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
19. Связывающая DA x CD3 молекула по любому из пп. 1-13 или фармацевтическая композиция по п. 14 для применения при лечении заболевания, ассоциированного с B7-H3, CEACAM5/CEACAM6, EGRF, EphA2, gpA33, HER2/neu, VEGF, 5T4, IL13Rα2 или CD19.
20. Связывающая DA x CD3 молекула или фармацевтическая композиция по п. 19, причем указанное заболевание представляет собой рак.
21. Связывающая DA x CD3 молекула или фармацевтическая композиция по п. 20, причем указанный рак выбран из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака молочной железы, колоректального рака, рака желудка, глиобластомы, рака почки, немелкоклеточного рака легкого, ракового заболевания системы крови, множественной миеломы, меланомы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака кожи, почечно-клеточной карциномы, рака яичка и рака матки.
| WO 2016196230 A1, 08.12.2016 | |||
| US 9212225 B1, 15.12.2015 | |||
| MATTHIAS FRIEDRICH et al | |||
| Приспособление для записи звуковых колебаний | 1921 |
|
SU212A1 |
| WO 2008119565 A2, 09.10.2008 | |||
| ИММУНОГЛОБУЛИН С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ДОМЕНАМИ И ЕГО ПРИМЕНЕНИЯ | 2006 |
|
RU2515108C2 |
Авторы
Даты
2023-12-25—Публикация
2019-02-13—Подача