Изобретение относится к иммунологии и аналитической биохимии и представляет способ повышения чувствительности иммунохроматографического анализа для определения специфических иммуноглобулинов в пробах.
В настоящее время для проведения иммунохроматографической серодиагностики чаще всего используется схема анализа, которая состоит в следующем:
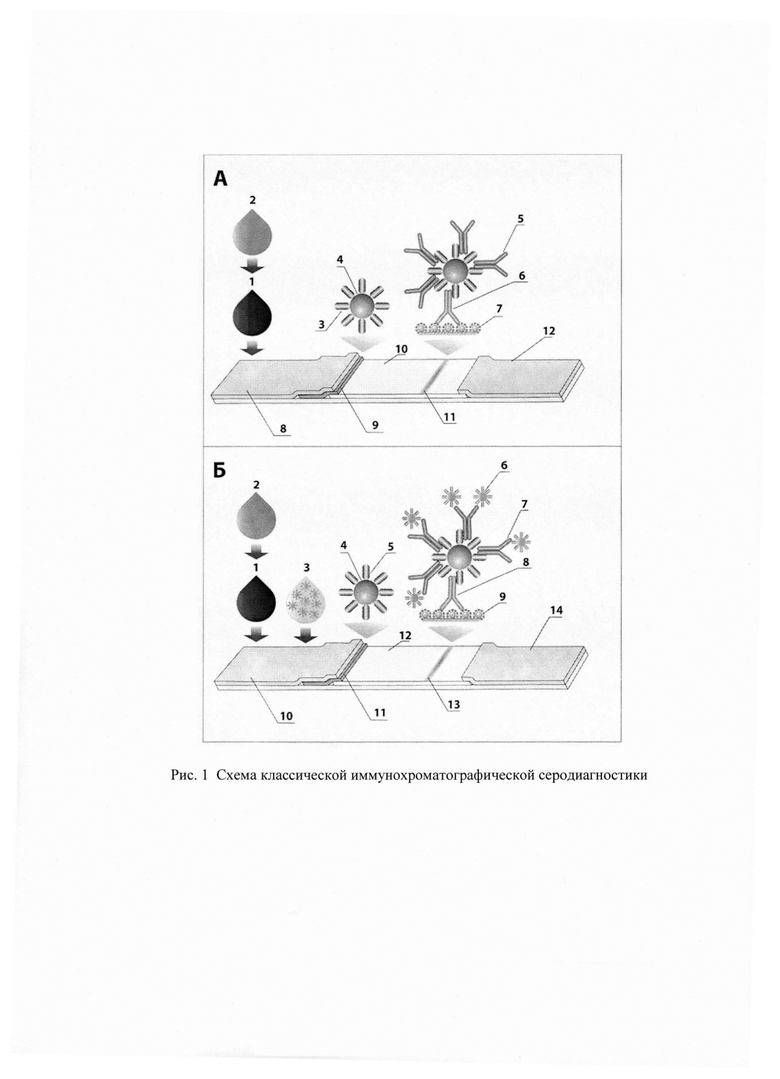
Иммунохроматографическая тест-полоска представляет комплекс последовательно соединенных друг с другом мембран, закрепленных на пластиковой подложке. Начальный и конечный участки тест-полоски содержат мембрану для образца и впитывающую адсорбирующую мембрану. Стекловолоконная или полиэфирная мембрана используется для нанесения конъюгата маркера (чаще всего - наночастиц золота (НЧЗ)) с иммуноглобулин связывающим белком (ИСБ) (как правило, антивидовыми антителами, стрептококковым белком G или стафилококковым белком А). Мембрана для маркерного конъюгата располагается следом за начальной мембраной и соединяется внахлест с рабочей мембраной, обычно, нитроцеллюлозной. На рабочей мембране иммобилизуется антиген или антигены на функциональном участке тест-полоски, называемом аналитической зоной. При контакте жидкой пробы (крови, или сыворотки) с тест-полоской проба впитывается мембранами тест-полоски и последовательно протекает через начальную мембрану, мембрану с маркерным конъюгатом, рабочую мембрану и впитывается конечной адсорбирующей мембраной. При контакте пробы с маркерным конъюгатом происходит связывание содержащихся в ней иммуноглобулинов (Ig) с конъюгатом маркер-ИСБ. Если в исследуемой пробе присутствуют специфические иммуноглобулины против иммобилизованных антигенов, то образовавшийся комплекс маркер-ИСБ-Ig связывается в аналитической зоне с иммобилизованным антигеном. Таким образом, наличие окрашенной полосы в аналитической зоне свидетельствует о положительном результате анализа (Рис. 1А). Часто для подтверждения функциональной активности маркерного конъюгата на рабочую мембрану также наносят контрольную зону с антивидовыми антителами, предназначенными для связывания маркерного конъюгата. В случае отсутствия связывания в контрольной зоне результат теста признается недействительным.
На данном принципе основано подавляющее большинство иммунохроматографических тестов для серодиагностики. Например, данный способ был использован Abdoel и соавт. для иммунохроматографической серодиагностики бруцеллеза сельскохозяйственных животных [Abdoel, Т., Dias, I.T., Cardoso, R. and Smits, H.L., 2008. Simple and rapid field tests for brucellosis in livestock. Veterinary Microbiology, 130(3), pp. 312-319.], Описанный способ рассматривается в настоящей заявке в качестве прототипа.
Основной проблемой применения прототипного способа ИХА в серодиагностике является тот факт, что конъюгат маркер-ИСБ связывает все иммуноглобулины в пробе, а в аналитической зоне связываются только иммуноглобулины, специфичные к иммобилизованному антигену, которые составляют менее 10% всей иммуноглобулиновой фракции даже в гипериммунных сыворотках [HPLC of Biological Macro - Molecules, 2-d ed. Revised And Expanded. Karen M. Gooding, Fred E. Regnier. NY, Marcel Dekker, 2002-777 pages, P. 611.]. Таким образом, основная часть иммуноглобулинов мешает связыванию маркера в аналитической зоне, снижая чувствительность анализа.
Предметом настоящего изобретения является способ ИХА, в котором на тест-полоске, изготовленной по выше описанной схеме, происходит взаимодействие иммуноглобулинов с нанесенным конъюгатом НЧ3-ИСБ с образованием комплекса НЧ3-ИСБ-Ig; компоненты жидкой пробы под действием капиллярных сил продвигаются вдоль тест-полоски, где далее происходит взаимодействие иммобилизованного в тестовой зоне антигена (Ag) с комплексом НЧ3-ИСБ-Ig. В результате в аналитической зоне формируется окрашенный комплекс НЧ3-ИСБ-Ig-Ag (Рис. 1Б). Отличительной особенностью способа является последующее нанесение на начальный участок тест-полоски конъюгата квантовых точек (КвТ) с ИСБ. Конъюгат КвТ-ИСБ взаимодействует со специфическими иммуноглобулинами (антителами), связанными с антигеном в аналитической зоне с образованием комплекса КвТ-ИСБ-Ig-Ag, а также взаимодействию с иммуноглобулинами, связанными с конъюгатом НЧ3-ИСБ в аналитической зоне с образованием комплекса НЧ3-ИСБ-Ig-ИСБ-КвТ. При использовании такого комбинированного подхода неспецифические иммуноглобулины, связавшиеся с НЧ3-ИСБ выполняют роль дополнительных центров связывания КвТ-ИСБ в аналитической зоне, что позволяет повысить чувствительность детекции антител.
Пример.
Иммунохроматографическое определение антител против ЛПС Brucella abortus.
Тест-системы для определения антител против липоплисахарида (ЛПС) Brucella abortus были реализованы в трех вариантах: с использованием конъюгата НЧ3-ИСБ, КвТ-ИСБ и предложенного комбинированного подхода с использованием двух конъюгатов НЧ3-ИСБ и КвТ-ИСБ.
При изготовлении иммунохроматографических тест-систем использовали высокосорбционную рабочую нитроцеллюлозную мембрану с размером пор 15 мкм марки CNPH90 фирмы mdi Easypack («Advanced Microdevices», Индия) и стекловолоконную мембрану под конъюгат PT-R5 («Advanced Microdevices», Индия), мембрану для нанесения образца и конечную адсорбирующую мембрану марки CFSP 223000 (Millipore, США).
Квантовые точки с максимумом эмиссии в области 625 nm, состоящие из CdSe (ядро) и ZnS (оболочка) производства Invitrogen Corporation (США)
На рабочей нитроцеллюлозной мембране были сформированы аналитическая зона с иммобилизованным ЛПС Brucella abortus в концентрации 320 мкг/мл в Na-карбонатном буфере (рН 9,2), а также контрольная зона с иммобилизованными кроличьими антителами против иммуноглобулинов быка в концентрации 500 мкг/мл.
В качестве ИСБ использовали стрептококковый белок G (ИМТЕК, Россия). Конъюгаты НЧЗ со стрептококковым белком G наносили на мембрану из раствора с D520=10 в количестве 13 мкл на см полосы.
После нанесения реагентов мембраны сушили на воздухе при 20-22°С не менее 20 ч. Собранный мультимембранный композит разрезали на полоски шириной 3,5 мм. Нарезку и упаковку проводили при 20-22°С в специальном помещении с относительной влажностью воздуха не более 30%.
Иммунохроматографические тест-системы апробировали на панели сывороток коров, охарактеризованных методом иммуноферментного анализа.
ИХА проводили при комнатной температуре. 1 мкл сыворотки крови вносили в эппендорф и добавляли 3 капли 50 мМ фосфатно-солевого буфера рН 7.4 (~100 мкл), содержащего 1% твин-20, и вертикально помещали тест-полоску в эппендорф. Через 10 мин оценивали результат ИХА. При использовании тест-системы с двумя метками на подложке для конъюгата нанесен конъюгат НЧЗ с белком G, а конъюгат КвТ с белком G наносили на мембрану для пробы в количестве 35 мкл при концентрации 3,4 мкМ (0,12 нмоль на одну тест-полоску) после регистрации окрашивания в аналитической зоне. Через 10 мин после добавления конъюгата КвТ регистрировали сигнал ИХА в флуоресцентной камере при облучении светом с длиной волны 365 нм.
Результаты ИХА антител против ЛПС Brucella abortus представлены на рис. 2. С помощью программного обеспечения TotalLab TL120 (Nonlinear Dynamics Ltd., UK) производили оцифровку изображений тест-систем, в результате чего были получены данные по интенсивности окрашивания аналитических зон на рабочей мембране мультимембранного композита, суммированные в таблице 1. Интенсивность окраски аналитической зоны менее 1 усл. ед. считали сомнительно положительным результатом.
При использовании двух стадий генерации сигнала: с конъюгатом НЧЗ и с конъюгатом КвТ, интенсивность окрашивания в аналитически зоне увеличивается в 2-3 раза по сравнению с тест-системой на основе одного конъюгата КвТ и более чем в 9 раз по сравнению с системой на основе конъюгата НЧЗ. При использовании прототипной методики ИХА с НЧЗ 2 пробы с подтвержденным диагнозом «бруцеллез» дали ложноотрицательный результат, а 2 другие пробы дали сомнительно-положительный результат. Для системы ИХА, изготовленной по прототипной методике с КвТ в качестве маркера, две пробы были признаны положительными и 2 сомнительно положительными. В предлагаемом заявителями способе ИХА все 4 сыворотки, полученные от зараженных животных, были признаны положительными. Таким образом, полученные данные подтверждают повышение чувствительности анализа за счет включения дополнительной стадии связывания с КвТ.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА ДЛЯ СЕРОДИАГНОСТИКИ С КОМБИНИРОВАННОЙ СХЕМОЙ СВЯЗЫВАНИЯ АНТИТЕЛ | 2020 |
|
RU2753237C1 |
| МЕТОД ПОЛУЧЕНИЯ МЕЖМОЛЕКУЛЯРНЫХ КОНЪЮГАТОВ ДЛЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЕЛНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2012 |
|
RU2530560C2 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОЙ СЕРОДИАГНОСТИКИ С ПОСЛЕДОВАТЕЛЬНЫМ ДОБАВЛЕНИЕМ РЕАГЕНТОВ | 2020 |
|
RU2741199C1 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА С ДВОЙНОЙ КОНКУРЕНЦИЕЙ | 2020 |
|
RU2748901C1 |
| СПОСОБ ВЫСОКОЧУВСТВИТЕЛЬНОГО КОНКУРЕНТНОГО ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2022 |
|
RU2789545C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВОЗБУДИТЕЛЮ ТУБЕРКУЛЕЗА | 2008 |
|
RU2395092C2 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2013 |
|
RU2545909C2 |
| СПОСОБ ПРОВЕДЕНИЯ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА ДЛЯ СЕРОДИАГНОСТИКИ | 2012 |
|
RU2532352C2 |
| УНИВЕРСАЛЬНАЯ ТЕСТ-ПОЛОСКА ДЛЯ ВЫБОРОЧНОГО ОПРЕДЕЛЕНИЯ МИКОТОКСИНОВ МЕТОДОМ ИММУНОХРОМАТОГРАФИИ | 2021 |
|
RU2806175C2 |
| Способ повышения чувствительности иммунохроматографических тест-систем лактатом серебра и гидрохиноном | 2020 |
|
RU2733260C1 |

Изобретение относится к иммунологии и аналитической биохимии, а именно к способу повышения чувствительности иммунохроматографического серодиагностического анализа. В предложенном способе на иммунохроматографические мембраны, соединенные в тест-полоску, иммобилизуются в аналитической зоне рабочей нитроцеллюлозной мембраны антиген патогенного организма и на стекловолоконной или полиэфирной подложке конъюгат золотых наночастиц с иммуноглобулин-связывающим белком. После проведения иммунохроматографического анализа пробы крови, плазмы или сыворотки проводится дополнительная стадия взаимодействия связанных в аналитической зоне иммунных комплексов с конъюгатом квантовых точек с иммуноглобулин-связывающим белком и последующая детекция связавшихся квантовых точек по их флуоресценции. Изобретение позволяет обеспечить повышение чувствительности анализа за счет включения дополнительной стадии связывания с конъюгатом квантовых точек. 2 ил., 1 пр.
Способ повышения чувствительности иммунохроматографического серодиагностического анализа, в котором на иммунохроматографические мембраны, соединенные в тест-полоску, иммобилизуются в аналитической зоне рабочей нитроцеллюлозной мембраны антиген патогенного организма и на стекловолоконной или полиэфирной подложке конъюгат золотых наночастиц с иммуноглобулин-связывающим белком, отличающийся тем, что после проведения иммунохроматографического анализа пробы крови, плазмы или сыворотки проводится дополнительная стадия взаимодействия связанных в аналитической зоне иммунных комплексов с конъюгатом квантовых точек с иммуноглобулин-связывающим белком и последующая детекция связавшихся квантовых точек по их флуоресценции.
| ABDOEL T | |||
| et al, Simple and Rapid Field for brucellosis in livestock, Veterinary Microbiology, 2008, v | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ обработки шкур | 1921 |
|
SU312A1 |
| Таранова Н.А | |||
| и др., Получение конъюгатов антител в квантовыми точками для аллергодиагностики, Естественные и технические науки, 2012, номер 1 (57), с | |||
| Термосно-паровая кухня | 1921 |
|
SU72A1 |
| RU 2013143366 A, 25.09.2013 | |||
| RU 2016148726 A, 14.06.2018 | |||
Авторы
Даты
2020-12-28—Публикация
2019-12-27—Подача