Изобретение относится к медицине, а именно к методу управления функциональным состоянием мозга, в том числе гемато-энцефалическим барьером (ГЭБ), в частности, к оптическому управлению функционального состояния мозга, включая ГЭБ и может быть использовано для малоинвазивного воздействия на клетки и сосуды головного мозга для обеспечения усиленной их проницаемости для патологических продуктов метаболизма и лекарственных препаратов при лечении опухолей мозга, инсультов, мигрени, депрессии, болезни Альцгеймера и других заболеваний головного мозга.
Одним из наиболее перспективных методов воздействия на мозг человека и животных является оптический метод воздействия благодаря своей абсолютной безопасности при кратковременных воздействиях, сравнимых по уровню с радиацией, получаемой от солнца в яркий солнечный день. Высокая чувствительность и уникальная специфичность на молекулярном уровне структур мозга к оптическому воздействию по сравнению с воздействиями других физических полей (электрических, акустических, и тепловых) являются фундаментальными свойствами таких воздействий, которые могут дать новые уникальные технологии лечения широкого спектра заболеваний мозга, в том числе основанные на оптогенетике и обратимом нарушении биологических барьеров как новых самостоятельных направлениях в управлении структурами и процессами в головном мозге. Оптическое воздействие в биомедицине определяется взаимодействием света с микроскопическими и макроскопическими составляющими среды в результате поглощения и рассеяния света. Характеристики поглощения и рассеяния света тканями головы человека определяют дозу воздействия излучения на специфические участки мозга в результате его облучения.
Известен способ открытия гематоэнцефалического барьера в головном мозге субъекта неинвазивным методом (см. WO 2007 035721, МПК А61N 1/00, опубл. 29.03.2007), заключающийся в воздействии на мозг ультразвукового излучения, при этом применяют сфокусированный ультразвуковой луч с частотой 1,525 МГц, скоростью распространения около 10 Гц и длительностью импульса 20 мс.
Однако, применение ультразвукового воздействия для открытия ГЭБ мало эффективно, поскольку для доставки лекарственных препаратов в ткани мозга наряду с таким воздействием необходимо дополнительное применение микрокапсул, что усложняет способ и приводит к значительным затратам для его реализации. Кроме этого, воздействие мощной ультразвуковой волны приводит к нагреву до 40оС циркулирующих в крови микрокапсул, что приводит наряду с повышением проницаемости ГЭБ и к таким негативным последствиям, как мозговые геморрагии и отек тканей головного мозга.
Известен также неинвазивный способ повышения проницаемости гематоэнцефалического барьера (см. статью «Новый неинвазивный метод повышения проницаемости гематоэнцефалического барьера с помощью звука» авторов Гекалюк А.С., Уланова М.В., Бодрова А.А., Сагатова М.М., Федорова В.А.
Семячкина-Глушковская О.В. https://medconfer.com ID: 2017-03-4353-T-14953), заключающийся в воздействии на мозг звука (110 дБ, 370 Гц). Способ позволяет повысить проницаемость ГЭБ в течение 4-х часов, что подтверждается проникновением в ткани мозга некоторых высокомолекулярных и низкомолекулярных веществ, а также воды.
Однако, звук оказывает воздействие на все отделы мозга и не обеспечивает избирательного эффекта. Метод может быть применен для доставки лекарственных препаратов при общем лечении тканей мозга, когда не требуется воздействие на определенные центры, например, при болезни Альцгеймера и депрессиях. Использование данного метода для лечения многих других заболеваний мозга, таких как инсульт, онкология, аневризмы, травмы невозможно.
Наиболее близким к заявляемому является неинвазивный способ повышения проницаемости гематоэнцефалического барьера у мышей» (см. патент РФ № 2688013 по кл. МПК A61N5/067, опуб.17.05.2019) путём воздействия лазерного излучения на сосуды мозга в коре больших полушарий, без вскрытия черепа, при этом воздействие осуществляют излучением с длиной волны 1268 нм с мощностью 10-300 мВ в течение 3-17 минут.
Основными недостатками этого способа является использование только одной длины волны излучения, неопределенность в определении плотности мощности излучения, необходимой для запуска биологического эффекта и доставки излучения к объекту воздействия, а также применимость метода только к малым размерам головы, соизмеримых с размерами головы мыши.
Технической проблемой заявляемого изобретения является эффективное управление функциональным состоянием мозга, в том числе ГЭБ, животных и человека в зависимости от размеров головы и толщины отдельных ее тканей с учетом характеристик поглощения и рассеяния света этими тканями.
Техническим результатом является повышение эффективности управления функциональным состоянием мозга, в том числе ГЭБ, для обеспечения усиленной временной и обратимой проницаемости клеток мозга и сосудов для лекарственных препаратов и патологических продуктов метаболизма при лечении опухолей мозга и других социально значимых заболеваний, как инсульты, мигрени, депрессии, болезнь Альцгеймера и другие заболевания головного мозга
Решение технической проблемы достигается тем, что в способе лазерной биомодуляции и повышения проницаемости гематоэнцефалического барьера, включающем воздействие лазерного излучения на головной мозг, согласно изобретению, плотность мощности лазерного излучения определяют методом Монте Карло по размеру черепа, толщине кожи головы, подлежащих мягких тканей, кости черепа, твердой мозговой оболочки, церебрально-спинальной жидкости (ЦСЖ), серого и белого вещества мозга из условия обеспечения плотности мощности в области патологии мозга в интервале 5-20 мВт/см2, при этом длину волны излучения выбирают в пределах, лежащих в видимом и инфракрасном диапазонах длин волн на линиях поглощения молекулярного кислорода.
Воздействие лазерного излучения осуществляют в течение 10-20 минут, выбирают длину волны излучения 477±10 нм, или 578±10 нм, или 630±5 нм, или 762±5 нм, или 1063±5 нм, или 1268±5 нм.
Дополнительно во время лазерного воздействия осуществляют охлаждение поверхности головы струёй холодного воздуха.
Воздействие излучения осуществляют либо на кожу головы без вскрытия черепа, либо на кость черепа путём надрезания кожи головы и подлежащих тканей до кости черепа так, чтобы один край ткани оставался соединенным с кожей головы для последующего заживления, либо через кость черепа на поверхность твердой мозговой оболочки путём просверливания отверстия в кости черепа.
В случае воздействия излучения на кожу головы дополнительно осуществляют механическое надавливание на кожу головы с силой, достаточной для уменьшения толщины слоя кожи и подстилающих мягких тканей в 3-10 раз и увеличения оптического пропускания ткани 5-20 раз, но ограниченной легким болевым ощущением пациента.
Дополнительно на выбранную область головы воздействуют иммерсионным агентом, при этом в случае воздействия на кожу головы иммерсионный агент подогревают до физиологической температуры поверхности головы и выше, вплоть до комфортного ощущения тепла, в случае воздействия на кость черепа иммерсионный агент подогревают до физиологической температуры поверхности кости черепа, а в случае воздействия на твёрдую мозговую оболочку (ТМО) иммерсионный агент подогревают до физиологической температуры внутри черепа.
В качестве иммерсионного агента используют либо дегидратированный глицерин с концентрацией не ниже 90%, либо водный раствор глицерина с концентрацией 60- 90%, либо водный раствор глюкозы с концентрацией 40-60%, либо водный раствор фруктозы с концентрацией 40-80%, либо водный раствор сахарозы с концентрацией 40-70%, либо водные растворы мальтозы и маннитола с концентрациями 40-50%, либо пропиленгликоль с концентрациями 80-100%, либо полиэтиленгликоль (ПЭГ) с молекулярной массой 300-600, либо раствор, составленный из 50% глюкозы, 20% воды и 30% этанола, либо водно-спиртовые растворы глюкозы, сахарозы, фруктозы, мальтозы с концентрациями 50% при содержании спирта до 30%, либо раствор, состоящий из 60% глицерина, 30 % диметилсульфоксида и 10% воды, либо смесь глицерина и пропиленгликоля в соотношении от 9:1 до 1:9.
Для усиления проницаемости кожи используют химические усилители проницаемости кожи, такие как этиловый спирт, диметилсульфоксид, олеиновая кислота, мочевина, гиалуроновая кислота, тиазон, и/или физические усилители проницаемости кожи, такие как сонофорез, электрофорез, лазерофорез.
Локально или системно в мозг вводят целевым образом апконверсионные наночастицы, облучают голову излучением на длине волны 980 нм для генерации излучения на коротковолновых линиях возбуждения синглетного кислорода 477±10 нм, или 578±10 нм, или 630±5 нм непосредственно в области патологии, где локализуются апконверсионные наночастицы.
Для открытых ран при просветлении кости черепа и ТМО используют местное обезболивание.
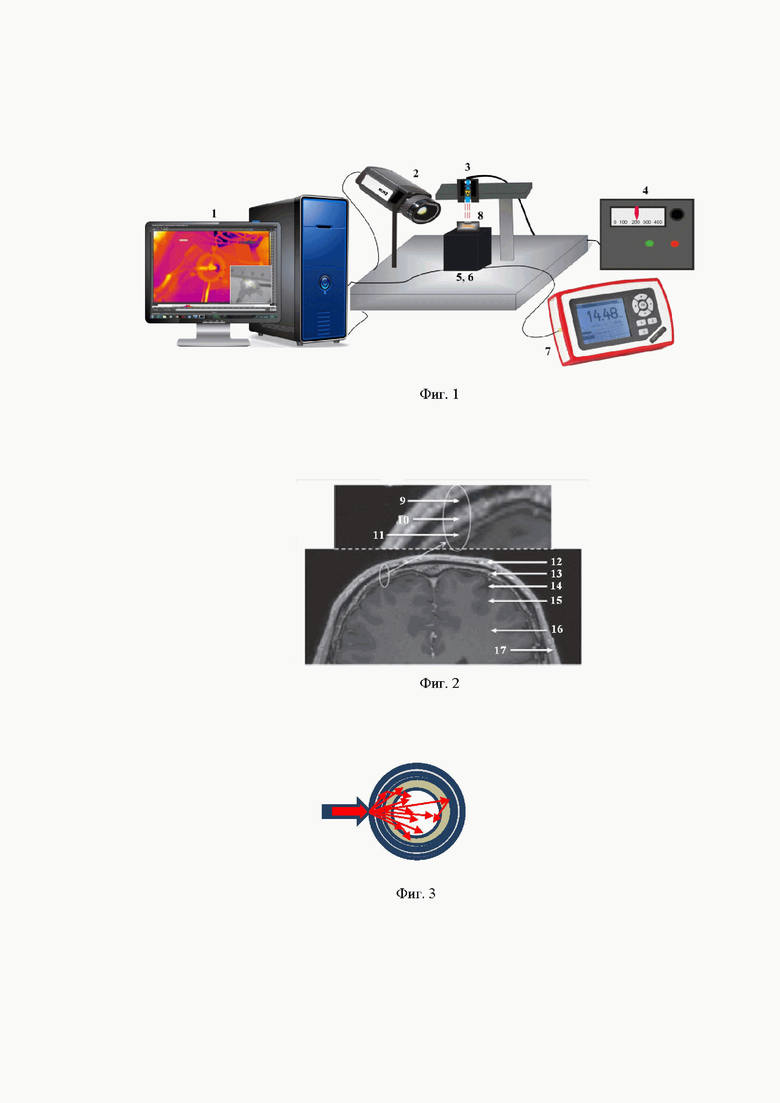
Устройство для реализации способа лазерной биомодуляции и повышения проницаемости гематоэнцефалического барьера содержит, по крайней мере, один источник лазерного излучения, обеспечивающий облучение на одной или нескольких длинах волн; световод (световоды, встроенные в надеваемый на голову шлем с внутренним охлаждением поверхности шлема, соприкасающейся с кожей головы); измеритель падающей мощности, программируемый блок управления источником лазерного изучения и компьютер.
Поскольку оптическое воздействие на клетки и ткани определяется взаимодействием света с микроскопическими и макроскопическими составляющими биологической среды в результате поглощения и рассеяния света, то характеристики поглощения и рассеяния света тканями головы животных и человека определяют дозу воздействия излучения на специфические участки мозга в результате его облучения. Эти свойства являются фундаментальными для реализации таких воздействий и лежат в основе новых уникальных технологий лечения широкого спектра заболеваний мозга, в том числе основанных на обратимом нарушении биологических барьеров, методах оптогенетики и управления степенью оксигенации крови, как новых самостоятельных направлений в управлении структурами и процессами в головном мозге.
Для применения оптических методов управления функциями сосудов и другими функциями головного мозга необходимо знать толщины всех слоев тканей головы и их оптические свойства персонально для каждого пациента или животного, поскольку расчет доз облучения сильно зависит от значений этих параметров.
В общих чертах алгоритм моделирования методом Монте Карло представлен в работе [Wang L., Jacques S.L., Zheng L. MCML - Monte Carlo modeling of light transport in multi-layered tissues // Computer Methods and Programs in Biomedicine, Vol. 47, P. 131-146, 1995]. В нашем случае число фотонных пакетов (по 10000 фотонов в каждом) определялось из постоянной плотности мощности (1 μВт/см2) на поверхности среды. Для получения других плотностей мощности на входе и на различных слоях тканей головы проводился простой пересчет с умножением значений плотности мощности на целое число. Для получения плотности мощности на поверхности головы, равной 1 мВт/см2, необходимо умножать все полученные данные на 103. Моделирование проводилось для плоского пучка.
Изобретение поясняется иллюстрациями, где представлены:
на фиг. 1 - схема устройства для реализации способа;
на фиг. 2 - структура ткани головы человека: кожа/подлежащие мягкие ткани (толщина 0,3 см, μ's = 14,4 см-1), череп (толщина 1 см, μ's = 15,0 см-1), церебральная жидкость (ЦСЖ) (толщина 0,2 см, μ's = 10-3 см-1), серое вещество (толщина 0,4 см, μ's = 24,0 см-1), а белое вещество (толщина 2 см, μ's = 78,0 см-1) (T. Myllyla, et al., Near-infrared spectroscopy in multimodal brain research, in: second ed. Chapter 10 in Handbook of Optical Biomedical Diagnostics. Light-tissue Interaction, vol. 1, SPIE Press PM262, Bellingham, WA, USA, 2016, pp. 687-735);
на фиг. 3 - схематическое представление геометрии моделирования распространения и поглощения света в тканях головы методом Монте Карло: слева падающий пучок лазерного излучения, далее пучок рассеивается и поглощается на слоях тканей разной толщины и с различными оптическими свойствами;
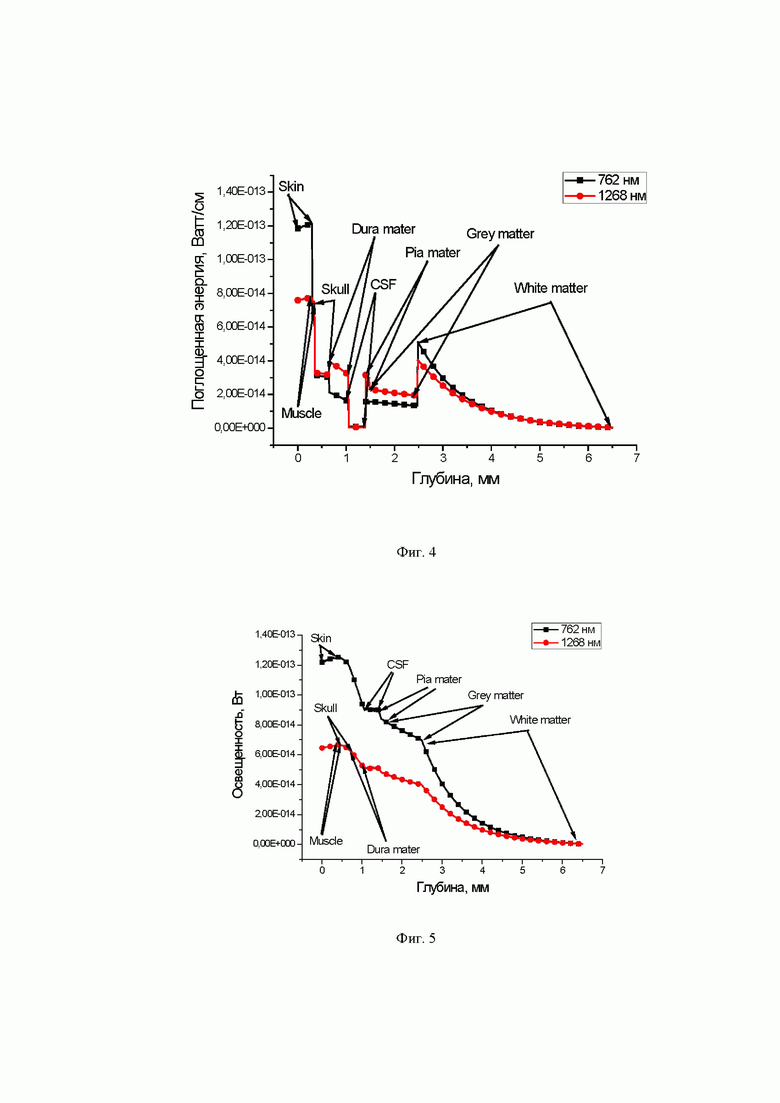
на фиг. 4 - распределение поглощенной энергии по глубине (Ватт/см) для двух длин волн 762 (кривая, помеченная квадратики) и 1268 нм (кривая, помеченная кружками); Skin - кожа, Muscle - мышечная ткань, Skull - кость черепа, Dura mater - твердая мозговая оболочка, CSF - церебрально-спинная жидкость, Pia mater - мягкая оболочка мозга, Grey matter - серое вещество мозга, White matter - белое вещество мозга;
на фиг. 5 - распределение освещенности по глубине (Ватт) для двух длин волн 762 (кривая, помеченная квадратиками) и 1268 нм (кривая, помеченная кружками); Skin - кожа, Muscle - мышечная ткань, Skull - кость черепа, Dura mater - твердая мозговая оболочка, CSF - церебрально-спинная жидкость, Pia mater - мягкая оболочка мозга, Grey matter - серое вещество мозга, White matter - белое вещество мозга;
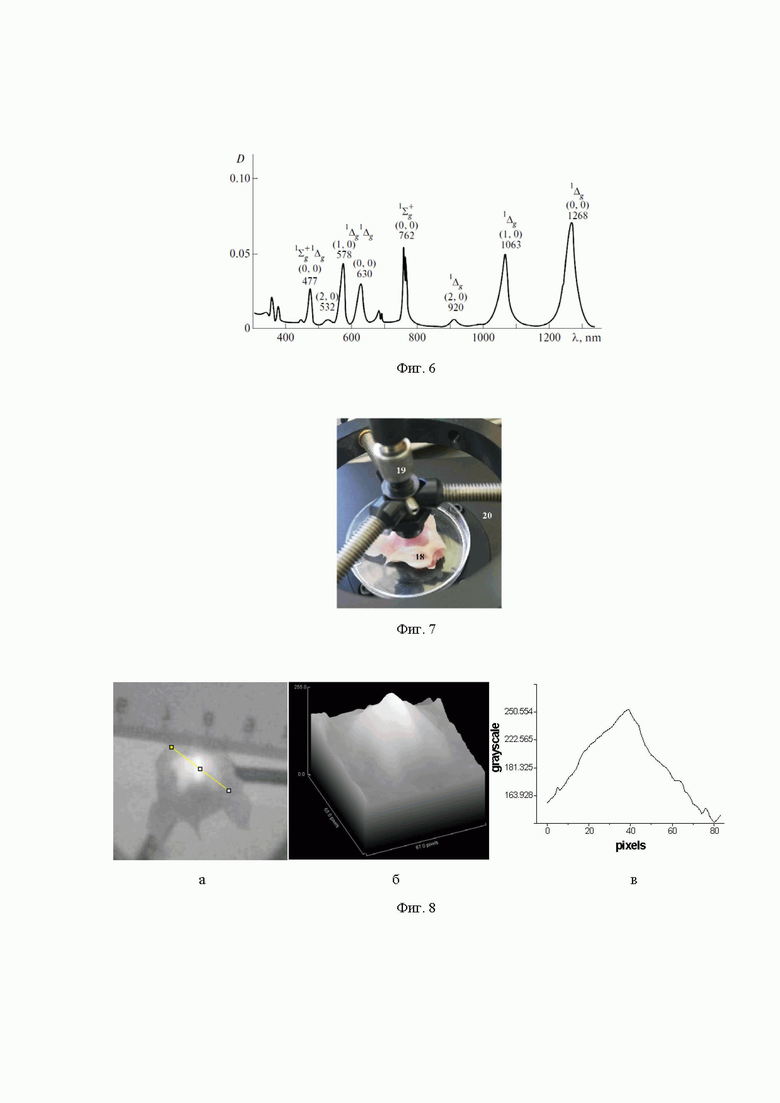
на фиг. 6 - спектр поглощения молекулярного кислорода высокого давления (И.В. Багров и др., Наблюдение люминесценции синглетного кислорода на λ = 1270 нм при светодиодном облучении CCl4, Оптика и спектроскопия, 113 (1), 57-62 (2012));
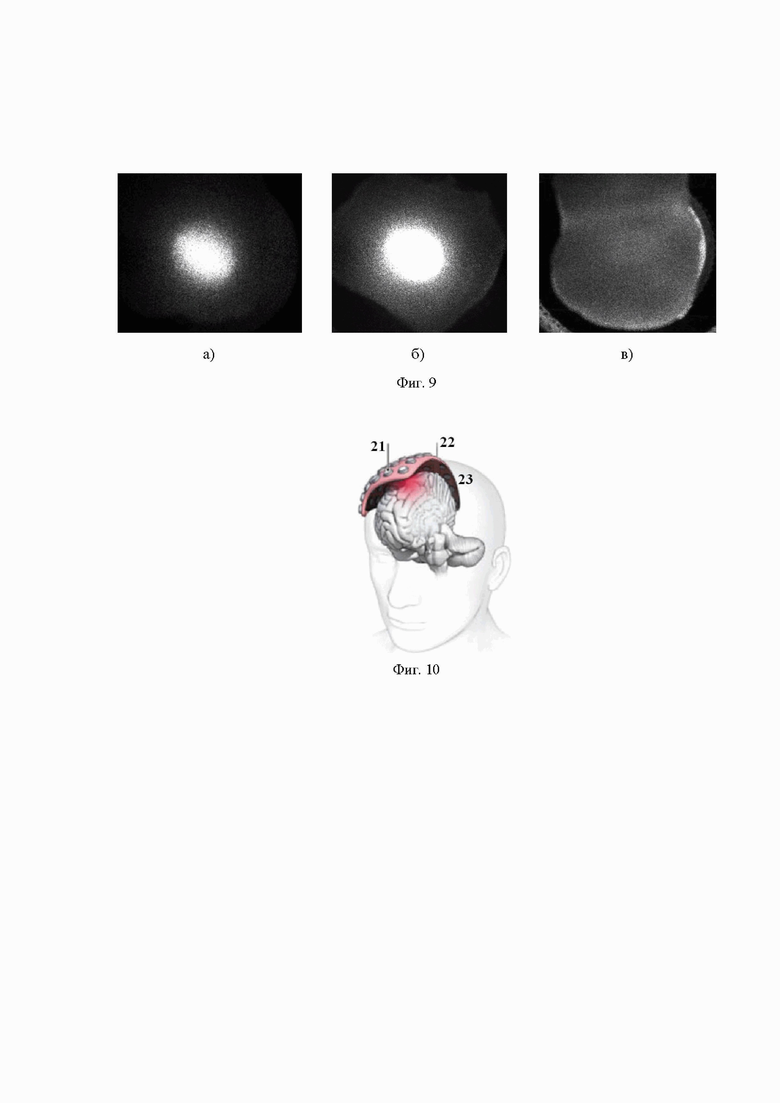
на фиг.7 - образец верхней части головы мыши с удаленным волосяным покровом в чашке Петри во время измерений (1); лазерное излучение подается сверху через световод (2), а измеритель мощности излучения (3) находится снизу со стороны открытого, но цельного мозга;
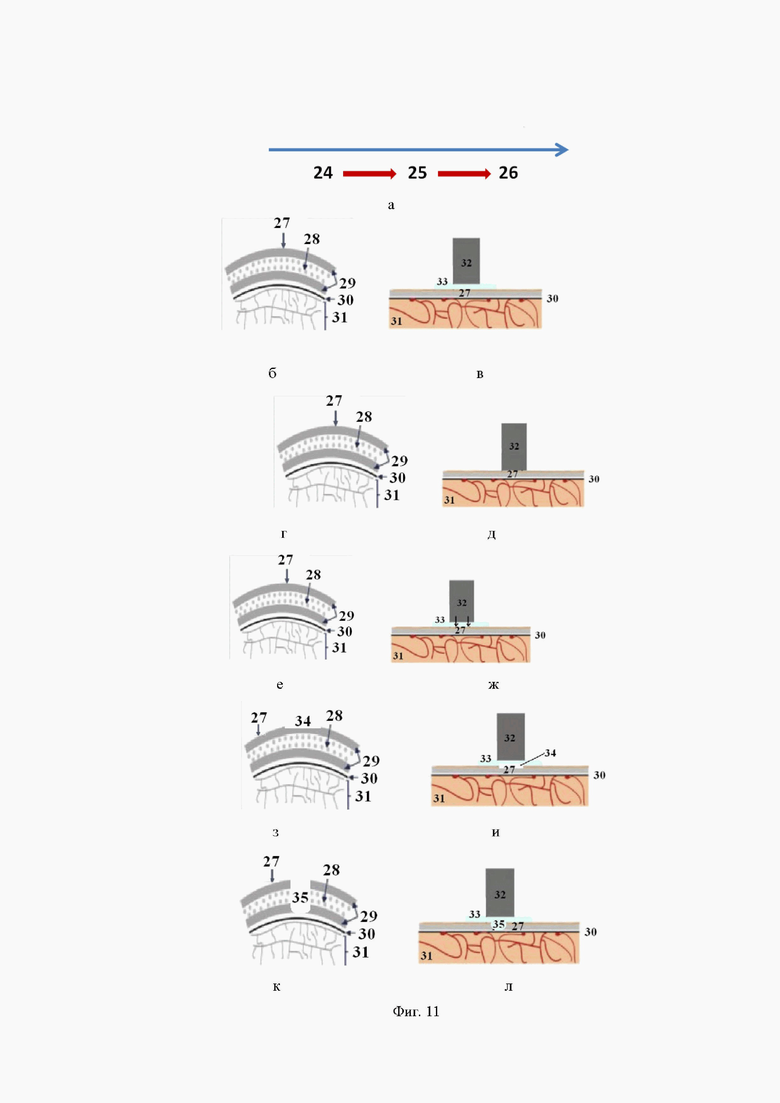
на фиг. 8 - изображение лазерного пучка при его прохождении через всю голову лабораторной мыши на открытой с обратной стороны поверхности мозга, полученное с помощью ИК визуализатора, сопряженного с КМОП-камерой (а); соответствующее 3D-распределение света на обратной поверхности мозга (б); и соответствующее 2D-распределение света по выбранной оператором линии, обозначенной на изображении (а), (в);
на фиг. 9 - микроскопические изображения лазерного пучка с длиной волны 780 нм, прошедшего разные ткани головы крысы: скальп, толщиной 0.9 мм, (а), костную ткань черепа, толщиной 0.96 мм (б), и ткани цельного мозга толщиной 6.2 мм (в).
на фиг. 10 - схематическое представление лазерного облучения мозга с помощью нескольких световодов и охлаждением поверхности головы.
на фиг. 11 - технология иммерсионного оптического просветления тканей головы человека для эффективной доставки лазерного излучения в отделы головного мозга: (а) три этапа технологии: оптическое просветление ткани, доставка излучения в отделы головного мозга и обратное восстановление оптических свойств ткани; (б), (г), (е), (з), (к) анатомическое строение черепа человека; (в) схема оптического просветления кожи: дистальный конец волоконного световода помещают над поверхностью кожи черепа и заполняют пространство между торцом световода и кожей иммерсионным агентом; (д) схема компрессионного оптического просветления кожи: дистальный конец волоконного световода помещают над поверхностью кожи и перемещают его до плотного контакта с кожей и далее до сжатия мягких тканей вплоть до легкого болевого ощущения пациента; (ж) схема компрессионного и иммерсионного оптического просветления кожи: дистальный конец волоконного световода помещают над поверхностью кожи, заполняют пространство между торцом световода и кожей иммерсионным агентом и через 10-30 мин перемещают торец световода до плотного контакта с кожей и далее до сжатия мягких тканей вплоть до легкого болевого ощущения пациента; схема оптического просветления кости черепа: дистальный конец волоконного световода помещают над поверхностью кости черепа и заполняют пространство между торцом световода и костью иммерсионным агентом; (л) схема оптического просветления ТМО: дистальный конец волоконного световода помещают над поверхностью ТМО и заполняют пространство между торцом световода и ТМО иммерсионным агентом.
На иллюстрациях позициями обозначено:
1 - компьютер,
2 - тепловизор,
3 - лазер,
4 - источник питания и регулировка мощности лазера,
5 - камера с ИК визуализатором,
6 - приемник измерителя мощности,
7 - измеритель мощности 1,
8 - образец;
9 - череп (костная кора),
10 - череп (костный мозг),
11 - твердая мозговая оболочка,
12- кожа,
13 - череп,
14 - церебральная жидкость,
15 - серое вещество,
16 - белое вещество,
17 - мышечная ткань,
18 - образец верхней части головы мыши,
19 - лазерное излучение,
20 - измеритель мощности 2,
21- световод 1,
22 - световод 2,
23 - охлаждающий шлем с встроенными световодами,
24 - этап 1- оптическое просветление ткани,
25 - этап 2 - доставка излучения в отделы головного мозга,
26 - этап 3 - обратное восстановление оптических свойств ткани,
27 - скальп (кожа и подстилающие мягкие ткани);
28 - компактная кость;
29 - губчатая кость,
30 - твердая мозговая оболочка (ТМО),
31 - кора головного мозга,
32 - дистальный конец волоконного световода,
33 - иммерсионным агент,
34 - отверстие (разрез) в скальпе,
35 - просверленное отверстие в кости черепа.
Способ осуществляется следующим образом.
Проводят МРТ головы животного или человека для определения локализации патологии, в этой области по МРТ томограмме определяют общий размер черепа, а также толщину кожи головы, подлежащих мягких тканей, кости черепа, твердой мозговой оболочки, церебрально-спинальной жидкости (ЦСЖ), Pia mater, серого и белого вещества мозга в сантиметрах. Типичная МРТ томограмма головы человека, где указаны толщины тканей и соответствующие оптические свойства (приведенный коэффициент рассеяния μꞌs), представлена на Фиг. 2.
Далее на основании МРТ данных методом Монте Карло (см. Фиг. 3) рассчитывают падающую на поверхность кожи головы плотность мощности излучения из условия обеспечения плотности мощности в области патологии мозга в интервале 5 - 20 мВт/см2 (Фиг. 4 и Фиг. 5), при этом длину волны излучения выбирают в пределах, лежащих в видимом и инфракрасном диапазонах длин волн на линиях поглощения молекулярного кислорода 477±10 нм, 578±10 нм, 630±10 нм, 762±10 нм, 1063±10 нм, или 1268±10 нм (Фиг. 6).
Далее рассчитывают необходимую дозу облучения (плотность мощности излучения на определенной глубине внутри мозга и время облучения) для проведения процедуры биомодуляции, включая открытие ГЭБ, для обеспечения доставки лекарственных препаратов в головной мозг путем системного введения препаратов с помощью внутрисосудистой инъекции, а патологических метаболитов из тканей мозга.
Для более эффективной доставки излучения к отделам головного мозга и снижения плотности мощности используют следующие действия.
1) Во время лазерного облучения охлаждают поверхность головы с помощью струи холодного воздуха, охлаждающих спреев или накладок на голову (шапочка или шлем), совмещающих световод для доставки лазерного излучения и систему охлаждения поверхности головы с помощью циркулирующей охлаждающей жидкости.
2) Вводят излучение с помощью нескольких световодов, от 2 и более, для снижения локальной плотности мощности на коже в области входа излучения и сложения этих диффузных световых потоков уже внутри соответствующих отделов головного мозга.
3) Проводят оптическое просветление кожи головы с помощью иммерсионных просветляющих агентов и/или компрессии кожи специальными массажными приспособлениями, прозрачными для света и одновременно выполняющими роль световодов.
4) В ряде сложных случаев используют надрезы кожи головы и подстилающих кожу мягких тканей для прямого контакта торца световода с костью черепа и иммерсионное оптическое просветление кости черепа.
5) В тяжелых случаях для экстренной помощи дополнительно к надрезам кожи сверлят всю толщу кости черепа вплоть до твердой мозговой оболочки (ТМО) и подводят торец световода непосредственно к поверхности ТМО и используют иммерсионное оптическое просветление ТМО.
6) В некоторых случаях используют локальное или системное введение апконверсионных наночастиц, которые при возбуждении на длинах волн ближнего ИК диапазона излучают в области 578 нм.
После того, как получены индивидуальные данные по размерам слоев тканей из МРТ исследования, определены длины волн для облучения и конфигурация режима облучения (охлаждение поверхности головы, использование нескольких световодов, оптическое просветление кожи, надрезы кожи головы и подстилающих кожу мягких тканей, оптическое просветление кости черепа, просверливание кости черепа, оптическое просветление ТМО, использование апконверсионных наночастиц) в зависимости от избранной стратегии лечения проводят индивидуальное моделирование прохождения света через актуальные ткани головы (с учетом изменения параметров биотканей при нагревании, охлаждении и иммерсионном оптическом просветлении) для расчета необходимой дозы облучения (плотности мощности излучения на определенной глубине внутри мозга и времени облучения).
Пример для моделирования методом Монте Карло
Согласно исследованиям Красновского и др. [A. A. Krasnovsky, Jr., A.S. Kozlov, “Photonics of dissolved oxygen molecules. Comparison of the rates of direct and photosensitized excitation of oxygen and reevaluation of the oxygen absorption coefficients,” J. Photochemistry and Photobiology, A: Chemistry 329, 167-174 (2016); A. A. Krasnovsky, Jr., A.S. Kozlov, Laser photochemistry of oxygen. Application to studies of the absorption spectra of dissolved oxygen molecules, J. Biomed. Photonics & Eng. 3(1), 010302-1-10 (2017)] двумя наиболее перспективными длинами волн для прямой генерации синглетного кислорода являются длины волн 1268 нм и 762 нм. В связи с этим в качестве примера были произведены расчеты именно для этих длин волн. В Таблицу 1 сведены данные по толщинам и оптическим свойствам тканей головы мыши, полученные на основании представленных ниже данных наших измерений и данных из литературы.
Таблица 1. Оптические параметры для моделирования методом Монте Карло (МК) распределения света внутри тканей мозга экспериментального животного - мыши. ТМО - твердая мозговая оболочка (dura mater), ЦСЖ - церебрально-спинальная жидкость, включающая паутинную мозговую оболочку, ММО - мягкая мозговая оболочка (pia mater).
Схематически модель головы представлена на Фиг.3. Слева падающий пучок лазерного излучения (красная стрелка), далее пучок рассеивается и поглощается на слоях тканей разной толщины и с различными оптическими свойствами, данные для которых представлены в Таблице 1 для головы мыши.
Таблица 2. Результаты МК-моделирования для отражения и пропускания для цельной головы мыши с параметрами из Табл.1, рассчитанные для трех диаметров лазерного пучка.
Таблица 3. Результаты МК-моделирования доли поглощенных фотонов для цельной головы мыши с параметрами из Табл.1.
Результаты расчетов методом Монте Карло представлены на Фиг. 4 и Фиг. 5, они в целом хорошо соответствуют данным экспериментальных исследований по проникновению лазерного излучения с длиной волны 1268 нм через ткани головы экспериментальных животных, а именно мышей. Серия экспериментов проводилась на тканях головы белых мышей in vitro. В качестве образцов служили верхние части голов мышей, включающих в себя кожу, череп, мозг, которые не были отделены друг от друга (Фиг. 7). Образец головы мыши помещался между лазером и измерителем мощности излучения. Проводились измерения мощности падающего и прошедшего через образцы лазерного излучения с контролем температуры поверхности кожи образцов с помощью тепловизора (Фиг 1). Лазер включали каждый раз приблизительно на 10-15 с. Расстояние от источника излучения до приемника составляло 2.5 см. На основе предварительных экспериментальных данных была выбрана мощность падающего светового пучка, равная 590 мВт, которая не приводила к перегреву кожи при кратковременном освещении. Погрешность измерений составляла 0.1 мВт.
Таблица 4. Значения размера образца вдоль пучка света, температуры кожи и мощности прошедшего через ткани головы излучения, измеренной в пределах апертуры измерителя мощности на длине волны 1268 нм, при входящей мощности 590 мВт или 4.7 Вт/см2 для диаметра падающего пучка 4 мм.
Для исследуемых мышей при диаметре пучка на выходе из мозга, равном 10 мм, оказалось возможным создать плотность мощности соответственно 15.3 мВт/см2 и 14.0 мВт/см2 для образцов 1 и 2, соответственно.
С целью оптимизации процесса облучения головного мозга и обеспечения малого нагрева тканей головы в течение 3 мин, которое является типичным временем облучения, снижали интенсивность падающего излучения до 70 мВт. Образец головы мыши помещался между лазером и измерителем мощности излучения, как и ранее (Фиг.1). Проводились измерения мощности прошедшего лазерного излучения через образцы с контролем температуры поверхности кожи образцов в течение 3 минут работы лазера. Расстояние от источника излучения до приемника составляло 2.5 см. Диаметр падающего светового пучка был равен 4 мм, а прошедшего светового пучка через весь образец, включая цельный мозг, составил 10±1 мм.
На Фиг. 8 представлено изображение лазерного пучка с обратной стороны образца при его прохождении через весь образец, полученное с помощью ИК визуализатора, сопряженного с КМОП-камерой, а в Табл. 5 сведены экспериментальные данные, полученные для двух образцов.
Таблица 5. Значения размера образца вдоль пучка света, температуры кожи и мощности прошедшего через ткани головы излучения, измеренной в пределах апертуры измерителя мощности на длине волны 1268 нм, при входящей мощности 70 мВт, диаметре пучка 4 мм и плотности мощности 557 мВт/см2.
При облучении лазерным излучением на длине волны 1268 нм головы более крупных лабораторных животных, а именно белых крыс, требования к поддержанию температурного режима возрастают, так как из-за больших размеров всех слоев тканей головы требуется на кожу подавать излучение большей интенсивности для обеспечения необходимой облученности отделов мозга животного. Для крыс среднего возраста типичные параметры тканей головы такие: толщина кожи и мышечной ткани под ней вместе составляют 0.6 мм, черепа - 0.85 мм, а мозга - 7.8±0.4 мм.
Таблица 6. Значения падающей мощности лазерного излучения на длине волны 1268 нм Рпад (мВт) и после прохождения излучения через образцы тканей (скальп - кожа вместе с подлежащей мышечной тканью, череп и мозг) и температуры Т (°С) на поверхности биологических тканей (кожа, череп, мозг) при кратковременном (10 с) облучении тканей головы белой лабораторной крысы.
Исходя из полученных экспериментальных данных можно заключить, что при кратковременном облучении кожи головы крысы лазерным излучением мощность от 70 до 190 мВт можно обеспечить довольно высокую плотность мощности на фронтальной поверхности мозга практически не нагревая его. Однако для обеспечения аналогичных уровней мощности на задней по отношению к падающему пучку областей мозга, мощность излучения необходимо существенно повышать до 300-500 мВт, что для сравнительно узких пучков (диаметр 4 мм) влечет за собой высокую плотность мощности и сильный нагрев ткани. Отметим, что эти измерения были проведены для раздельных тканей и высокая плотность мощности непосредственно создавалась на поверхности исследуемой ткани. Отметим также, что кожа ослабляет излучение в 2.5 - 4 раза, ослабление меньше для более высоких мощностей, т.е. более высокого нагрева ткани. Череп примерно также ослабляет излучение 3-5 раз и имеет место аналогичная зависимость от мощности падающего излучения.
Сравнение двух видов лабораторных животных наглядно показывает, что для расчета необходимой дозы облучения на длине волны 1268 нм и учета возможных температурных эффектов необходимо иметь надежные предварительные индивидуальные данные по размерам головы и толщины отдельных слоев из МРТ-исследования (Фиг. 2).
Для излучения на длине волны 762 нм ожидается, что тепловые эффекты не будут такими сильными, а оптическое пропускание будет немного лучше. Эти факты были подтверждены не только при численном моделировании методом МК (см. Фиг. 4 и Фиг. 5), но также экспериментально для исследованиях на белых лабораторных крысах (см. Табл. 7). Экспериментальные исследования были проведены для лазера с близкой длиной волны (780 нм), что не снижает достоверность исследований в силу монотонных зависимостей оптических свойств биотканей от длины волны в пределах 10-20 нм.
Таблица 7. Значения падающей мощности лазерного излучения на длине волны 780 нм и после прохождения излучения через образцы тканей (скальп - кожа вместе с подлежащей мышечной тканью, череп и мозг) при облучении тканей головы двух белых лабораторных крыс.
Микроскопические изображения распределения лазерного излучения с длиной волны 780 нм после прохождения через ткани головы крысы, полученные с помощью КМОП камеры Thorlabs (1280х1024) с объективом 3х увеличением (Фиг. 9), дают представление о рассеивающих свойствах отдельных тканей головы.
Примеры оптимизации доставки излучения к отделам головного мозга и снижения плотности мощности.
1. Охлаждение поверхности головы
Теоретические и экспериментальные методы охлаждения кожи при разнообразных лазерных воздействиях через кожу, например, при удалении волос или жировых отложений, хорошо разработаны и широко применяются в лазерной косметологии [G.B. Altshuler and V.V. Tuchin, Physics behind the light-based technology: Skin and hair follicle interactions with light in Cosmetic Applications of Laser & Light-Based Systems, ed. Gurpreet Ahluwalia, William Andrew, Inc., Norwich, NY, USA, 2009. P.49-109; A. Das, et al., Cooling Devices in Laser therapy, J Cutan Aesthet Surg 2016 Oct-Dec; 9(4): 215-219; doi: 10.4103/0974-2077.197028], однако до настоящего времени не было предложений по использованию охлаждения при лазерном облучении мозга животных и человека.
Поверхность головы можно охлаждать с помощью струи холодного воздуха или охлаждающих спреев, как это принято в лазерной терапии кожных патологий. Однако для надежного управления охлаждением, что важно при облучении мозга, предлагается использовать накладку на голову в виде шлема, в теле которого закреплен световод (несколько световодов) для доставки лазерного излучения к поверхности кожи, и который содержит систему охлаждения поверхности головы, изготовленной в виде полости или системы микротрубочек, встроенных в шлем, по которым циркулирует охлаждающая жидкость (Фиг. 10).
2. Облучение головы с помощью нескольких световодов
В соответствии с приведенным выше математическим моделированием методом Монте Карло и экспериментальными исследованиями распределения света в тканях мозга и сопутствующего нагрева тканей головы представляется рациональным вводить излучение с помощью нескольких световодов, от 2 и более, для обеспечения снижения локальной плотности мощности на коже в области введения излучения и сложения этих диффузных световых потоков уже внутри соответствующих отделов головного мозга. На Фиг. 10 представлено схематическое представление облучения тканей мозга несколькими световодами.
3. Иммерсионное оптическое просветление кожи головы с помощью иммерсионных просветляющих агентов (ОПА)
Для снижения потерь света на коже и соответственно ее нагрева (см., Фиг. 4 и Фиг. 5) предлагается использовать иммерсионное просветление кожи (V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006; A.Yu. Sdobnov, et al., Recent progress in tissue optical clearing for spectroscopic application, Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 197, 216-229 (2018); A.N. Bashkatov, et al., Measurement of tissue optical properties in the context of tissue optical clearing, J. Biomed. Opt. 23(9), 091416 (2018)), которое заключается в нанесении оптимального иммерсионного агента на кожу головы на некоторое время, типично 10-30 мин (Фиг.11 а, б, в), и использование при необходимости химических или физических усилителей проницаемости. В качестве иммерсионного агента могут быть использованы: дегидратированный глицерин с концентрацией не ниже 90%, либо водный раствор глицерина с концентрацией 60-90%, либо водный раствор глюкозы с концентрацией 40-60%, либо водный раствор фруктозы с концентрацией 40-80%, либо водный раствор сахарозы с концентрацией 40-70%, либо водные растворы мальтозы и маннитола с концентрациями 40-50%, либо пропиленгликоль с концентрациями 80-100%, либо полиэтиленгликоль (ПЭГ) с молекулярной массой 300-600, либо.
Для усиления проницаемости кожи могут быть использованы химические усилители проницаемости кожи, такие как этиловый спирт, диметилсульфоксид, олеиновая кислота, мочевина, гиалуроновая кислота, тиазон.
В качестве иммерсионного агента могут быть использованы смеси растворов, в частности - раствор, содержащий глицерин и пропиленгликоль в соотношении от 9:1 до 1:9, либо 50% глюкозы, 20% воды и 30% этанола, либо водно-спиртовые растворы глюкозы, сахарозы, фруктозы, мальтозы с концентрациями 50% при содержании спирта до 30%.
Для усиления проницаемости кожи в качестве иммерсионного агента может быть использован раствор, состоящий из 60% глицерина, 30 % диметилсульфоксида и 10% воды.
Для усиления проницаемости кожи могут быть использованы физические усилители проницаемости кожи, такие как сонофорез, электрофорез, лазерофорез.
Компрессионное оптическое просветление кожи головы и подстилающей мышечной ткани также позволяет пропустить больше света в ткани мозга. Оно основано на нескольких явлениях, которые способствуют существенно более высокому пропусканию света этими тканями, а именно вытеснение крови, уменьшение толщины ткани и вытеснение воды из области надавливания (V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006; Genina E.A., et al., Optical clearing of biological tissues: prospects of application in medical diagnostics and phototherapy, Journal of Biomedical Photonics & Engineering 1(1), 22-58 (2015)). В случае тканей головы компрессию кожи можно осуществить с помощью специальных массажных приспособлений или щеток, которые могут быть совмещены с облучающими световодами, или быть прозрачными для света и одновременно выполнять роль массажера и световода. При использовании таких световедущих щеток, обеспечивается плотный оптический контакт с кожей, поэтому можно также свести к минимуму влияние волос и волосяных фолликулов на эффективность прохождения света внутрь головы [B. Khan et al., “Improving optical contact for functional near-infrared brain spectroscopy and imaging with brush optodes,” Biomed. Opt. Exp. 3 (5), 878-898 (2012); X. Fang et al., Effect of Scalp Hair Follicles on NIRS Quantification by Monte Carlo Simulation and Visible Chinese Human Dataset, IEEE Photonics Journal 10 (5), 3901110 (2018)]. Наиболее простым способом обеспечения компрессии для проведения света является механическое надавливание торца световода на поверхность кожи головы до легкого болевого ощущения пациента (Фиг. 11 г, д).
Комбинация иммерсионного и компрессионного оптического просветления позволяет получить дополнительные выгоды при проведении света внутрь головы, связанные с более высокой эффективностью просветления, обусловленной синергетическим эффектом, так как при более тонкой (растянутой при давлении) коже диффузия иммерсионного агента в ткань происходит существенно быстрее, так как время диффузии τ пропорционально квадрату толщины ткани l и обратно пропорционально коэффициенту диффузии агента Da (V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006),

Например, при сокращении толщины скальпа в 5 раз, время просветления сокращается в 25 раз, а коэффициент пропускания оптического излучения, равный
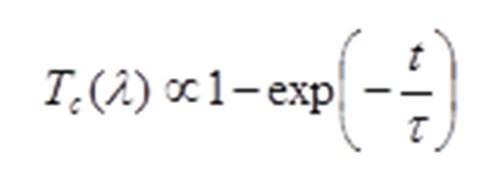
за время t = τ становится максимально большим.
Кроме того, в качестве иммерсионного агента можно использовать такие компоненты, как например, глицерин или лосьоны на его основе, которые создают комфортные ощущения для пациента, снимая дискомфорт, связанный с надавливанием. Все эти действия можно вписать в протокол типичных массажных процедур, выполняемых для кожи головы (B. S. Li, et al. Should we instruct patients to rub topical agents into skin?: the evidence, Journal of Dermatological Treatment, September 2018, DOI: 10.1080/09546634.2018.1527997).
4. Надрезы в коже и иммерсионное просветление кости черепа
В ряде сложных случаев можно использовать надрезы в коже для прямого контакта торца световода с костью черепа. Для снижения потерь света на кости черепа, а также сопутствующего ее нагрева, предлагается использовать иммерсионное просветление [A. N. Bashkatov, et al., “Optical Clearing of Human Cranial Bones by Administration of Immersion Agents,” Biophotonics: From Fundamental Principles to Health, Environment, Security and Defense Applications, Ottawa, Ontario, Canada, Sept. 29-Oct. 9, 2004; V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006; E. A. Genina, A.N. Bashkatov, and V.V. Tuchin, “Optical Clearing of Cranial Bone,” Adv. Optical Technologies, Article ID 267867, 8 pgs, 2008; D. Zhu, et al., Recent progress in tissue optical clearing, Laser Photonics Rev. 7, No. 5, 732-757 (2013); Y.-J. Zhao et al., Skull optical clearing window for in vivo imaging of the mouse cortex at synaptic resolution, Light: Science & Applications 7, e17153 (2018)]. На Фиг.11 (а, з, и) представлена принципиальная схема технологии иммерсионного оптического просветления кости черепа для эффективного проведения лазерного излучения к коре головного мозга и далее в более глубокие отделы мозга. Иммерсионный агент наносится на обнаженную поверхность кости черепа на некоторое время, типично 10-30 мин, в зависимости от толщины черепной кости. Согласно работе (Y.-J. Zhao et al., Skull optical clearing window for in vivo imaging of the mouse cortex at synaptic resolution, Light: Science & Applications (2018) 7, e17153; doi: 10.1038/lsa.2017.153), для временного размягчения верхнего кортикального (твердого пластинчатого) слоя кости черепа, для большей проницаемости для иммерсионного агента, его поверхность обрабатывают 10% коллагеназой или 10% динатриевой солью этилендиаминтетрауксусной кислоты (Disodium Ethylene Diamine Tetra-Acetate (EDTA) (это пищевая добавка E386, которая используется в качестве стабилизатора пищевых продуктов, а также в медицинской и фотохимической промышленности, в качестве сохраняющего вещества, препятствующего окислению, промышленное название Трилон Б) в течение 5-10 мин. После размягчения кость черепа местно обрабатывают 80%-водным раствором глицерина. Оба этапа занимают примерно 15-30 мин.
Биосовместимый иммерсионный агент для оптического просветления интактного черепа может иметь в своем составе лаурилсульфат натрия (Sodium Lauryl Sulfate) (самое распространенное поверхностно-активное вещество (ПАВ), которое есть практически по всех моющих средствах, шампунях, зубной пасте, гелях для душа и пр.), EDTA, диметилсульфоксид (ДМСО) (широко используется в медицине как противовоспалительное, анальгетическое, антисептическое и фибринолитическое средство, хорошо проникает через биологические мембраны, в том числе через кожу, является хорошим транспортным средством, способствуя проникновению через кожу и слизистые оболочки лекарственных препаратов), а также сорбитол (пищевая добавка Е420 - подсластитель, влагоудерживающее вещество) и глюкозу [Zhang Y, Zhang C, Zhong X, Zhu D. Quantitative evaluation of SOCS-induced optical clearing efficiency of skull. Quant Imaging Med Surg 2015;5(1):136-142].
В отличие от работ [Y.-J. Zhao et al., Skull optical clearing window for in vivo imaging of the mouse cortex at synaptic resolution, Light: Science & Applications (2018) 7, e17153; Zhang Y, Zhang C, Zhong X, Zhu D. Quantitative evaluation of SOCS-induced optical clearing efficiency of skull. Quant Imaging Med Surg 2015; 5(1):136-142] при подходе к черепной кости как трехслойной оболочке, в которой выделяют наружную и внутреннюю компактные пластинки (толщиной менее 1 мм), между которыми располагается губчатое вещество - диплоэ (составляющее основную толщину кости) (Зайченко А.А. Конструкционная морфология мозгового черепа человека, Бюллетень медицинских Интернет-конференций 5 (7), 1021-1025 (2015). ISSN 2224-6150; https://studfiles.net/preview/2769287), можно предложить более эффективные композиции иммерсионных агентов и усилителей проницаемости в комбинации с физическими усилителями проницаемости (сонофорез или лазерофорез).
В качестве иммерсионных агентов и химических и физических усилителей проницаемости для кости черепа могут быть использованы аналогичные препараты и воздействия, как и для кожи, однако необходимо использовать местное обезболивание.
5. Отверстие в черепе и иммерсионное оптическое просветление ТМО
В особо тяжелых случаях для экстренной помощи можно дополнительно к надрезам кожи сверлить всю толщу кости черепа вплоть до твердой мозговой оболочки (ТМО) и подводить торец световода непосредственно к поверхности ТМО. Поскольку в медицинской практике в ряде случаев при лечении таких заболеваний, как опухоли головного мозга, используют небольшие отверстия, просверленные в кости черепа человека, то такое отверстие, проделанное без нарушения цельности ТМО, можно использовать для введения волоконного световода для целей лазерного облучения глубинных отделов мозга для лазерной биомодуляции физиологических процессов и открытия ГЭБ для проведения соответствующей лекарственной терапии. Цельность ТМО очень важна с точки зрения поддержания нормального внутричерепного давления и недопущения инфицирования тканей мозга. Просверливание отверстия в черепе является достаточно рутинной процедурой (https://www.healthline.com/health/burr-hole). Такие отверстия можно использовать многократно.
В дополнение к просверливанию канала в черепной кости для введения световода, существенно увеличить введение лазерной мощности в ткани мозга можно с помощью иммерсионного просветления ТМО. ТМО является типичной фиброзной соединительной тканью, будучи относительно толстой и плотной, она состоит из внешнего эндостального и внутреннего менингеального слоев. Средняя толщина твердой мозговой оболочки порядка 0.4 - 0.6 мм. Ее состав и толщина зависят от возраста с преобладанием коллагеновых волокон в составе ткани (более 90% твердой мозговой оболочки), особенно в эндостальном слое. Волокна коллагена расположены в параллельных пучках с различными ориентациями, варьирующимися от однонаправленных до случайных. Соответственно ТМО сильно рассеивает свет, уменьшая эффективную глубина проникновения света через нее далее в кору головного мозга. Нами ранее было предложено использовать иммерсионные агенты, такие как глюкоза и маннитол, для уменьшения рассеяния и более эффективного транспорта излучения через ТМО (Bashkatov AN, et al., In vitro study of control of human dura mater optical properties by acting of osmotical liquids. Proc SPIE 4162:182-188 (2000); Bashkatov AN, et al., Glucose and mannitol diffusion in human dura mater, Biophys J. 85, 3310-3318 (2003)). Эта идея недавно нашла продолжение в виде использования также глицерина, как просветляющего агента (E. C. Cheshire et al. Optical clearing of the dura mater using glycerol: a reversible process to aid the post-mortem investigation of infant head injury, Forensic Sci Med Pathol 11, 395-404 (2015)). Недавние исследования, направленные на разработку нетоксичного иммерсионного агента с высокой эффективностью оптического просветления, выраженной как
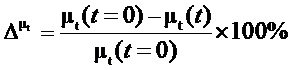
где µt (t = 0) - начальный коэффициент ослабления для интактного образца биоткани, µt (t) - значение коэффициента ослабления в различные моменты времени, показали высокую эффективность глюкозы, как иммерсионного агента, и скорость просветления (суммарный коэффициент диффузии молекул воды и глюкозы) (см. Таблицу 8) (Genina E.A., Bashkatov A.N., Tuchin V.V. Optical clearing of human dura mater under action of glucose solutions, Journal of Biomedical Photonics & Engineering, 3(1), 010309-1-9 (2017); Башкатов А.Н., Генина Э.А., Тучин В.В. Определение коэффициента диффузии глюкозы в твердой мозговой оболочке человека, Изв. Сарат. ун-та, Новая сер., Сер. Физика 18 (1), 32-45 (2018)).
Таблица 8. Эффективность оптического просветления с помощью высококонцентрированной глюкозы, %
Таким образом, одним из возможных агентов может быть глюкоза с концентрацией 3 М, которая позволяет увеличить эффективность доставки света через ТМО более 60 раз (Таблица 8). Такие агенты как маннитол и глицерин также показывают хорошую эффективность просветления ткани за время до получаса. После завершения процедуры, агент хорошо вымывается с помощью физиологического раствора. Процедура допускает многократное использование [V.V. Tuchin, Optical Clearing of Tissues and Blood, PM 154, SPIE Press, Bellingham, WA, 2006].
Таким образом, предлагается следующая последовательность операций: сначала на основании МРТ скана головы в области интереса определяют геометрические размеры слоев мягких и твердых тканей головы животного или человека и делают небольшой округлый надрез кожи головы и подлежащих тканей до кости черепа, так, чтобы один край ткани оставался соединенным с кожей головы, отворачивают надрезанный участок и с использованием данных по измерениям толщины черепа просверливают отверстие в кости черепа так, чтобы была возможность провести оптическое излучение непосредственно через кость черепа на поверхность твердой мозговой оболочки с помощью световода или миниатюрного источника света - облучателя, диаметр отверстия определяется внешним диаметром световода или облучателя, и может быть в диапазоне от 1 до 5 мм. Далее на основании МРТ данных без учета кожи, подстилающих кожу мягких тканей и кости черепа определяют входные параметры для моделирования распределения света в тканях мозга. Определяют необходимые энергетические параметры излучения и экспериментально обеспечивают необходимый уровень плотности мощности для управления физиологическими процессами в головном мозге (биомодуляция) и открытия ГЭБ для обеспечения доставки лекарственных препаратов путем системной инъекции. Для повышения эффективности процедуры и снижения необходимой плотности мощности лазерного излучения ТМО пропитывают иммерсионным агентом, подогретым до физиологической температуры внутри черепа.
В качестве иммерсионных агентов и химических и физических усилителей проницаемости для ТМО могут быть использованы аналогичные препараты и воздействия, как и для кожи, однако необходимо использовать местное обезболивание.
6. Люминесцентные апконверсионные наночастицы
В ряде случаев можно использовать локальное или системное введение апконверсионных наночастиц, которые при возбуждении хорошо проникающим в биоткани излучением на длинах волн ближнего ИК диапазона, например, 980 нм, могут эффективно излучать в области 578 нм, где лежит одна из эффективных линий возбуждения синглетного кислорода и которая не может быть доставлена глубоко в мозг извне. Длину волны апконверсионных наночастиц на основе GdMgB5O10: Yb3+, Mn2+ можно настроить в диапазоне от 550 до 610 нм, изменяя, например, количество ионов Yb3+ и Mn2+, что было недавно продемонстрировано (S. Ye, et al., Transition Metal-Involved Photon Upconversion, Adv. Sci. 3, 1600302-1-25 (2016)). Коэффициент конверсии ИК излучения в видимое обычно на уровне ~ 2,5%, что означает при доставленной плотности мощности к коре головного мозга на уровне 100 мВт/см2, плотность мощности люминесценции на длине волны 578 нм вокруг наночастиц может достичь 2.5 мВт/см2, что на уровне порога для открытия ГЭБ. В возможности реализации такой схемы открытия ГЭБ, убеждают недавно проведенные успешные опыты по запуску оптогенетических каналов, для которых энергетические условия для возбуждающего света существенно более жесткие (S. Chen, et al., Near-infrared deep brain stimulation via upconversion nanoparticle-mediated optogenetics, Science 359, 679-684 (2018)). Было оценено, что лазер мощностью 2,0 Вт с длиной волны 980 нм при прохождении через череп мыши с помощью волоконного световода диаметром сердцевины 200 мкм обеспечит плотность мощности 1380 мВт/см2 на этой длине волны на глубине 4,5 мм в мозге. При такой падающей интенсивности ИК излучения за счет конверсии на наночастицах NaYF4:Yb/Tm@SiO2 ожидается люминесценция на длинах волн 450/475 нм с интенсивностью порядка 34 мВт/см2, достаточной для активации ChR2 в мозге. Экспериментальные данные этих авторов для непрерывного лазера на длине волны 980 нм с импульсно-модулируемой интенсивностью (пиковая мощность 2 Вт, длительность импульса 25 мс, частота 20 Гц, время экспозиции 1 с) показали близкое значение для плотности излучения синей люминесценции апконверсионных наночастиц инжектированных в мозг мыши на глубину 4,5 мм, а именно ~ 6,3 мВт/см2. Несколько меньшее значение, полученное на эксперименте, можно отнести за счет сильного рассеяния и поглощения света белым веществом мозга.
ЛИТЕРАТУРА
1. Sabino C.P., Deana A.M., Yoshimura T.M., da Silva D.F.T., Franca C.M., Hamblin M.R., Ribeiro M.S. The optical properties of mouse skin in the visible and near infrared spectral regions // J. Photochem. Photobiol. B, Vol. 160, P. 72-78, 2016.
2. Bashkatov A.N., Genina E.A., Tuchin V.V. Optical properties of tissues in the visible-NIR spectral range // in Book of Abstracts of 7-th Finnish-Russian Photonics and Laser Symposium PALS'15, Saratov, Russia, September 22-25, 2015, P. 74-75.
3. A.M.K. Nilsson, R. Berg, S. Andersson-Engels, “Measurements of the optical properties of tissue in conjunction with photodynamic therapy”, Appl. Opt. 34, 4609-4619 (1995).
4. Firbank M., Hiraoka M., Essenpreis M., Delpy D.T. Measurement of the optical properties of the skull in the wavelength range 650-950 nm // Phys. Med. Biol., 1993, Vol. 38, P. 503-510.
5. Ghaffari M., Zoghi M., Rostami M., Abolfathi N. Fluid structure interaction of traumatic brain injury: effect of material properties on SAS trabeculae // International Journal of Modern Engineering, Vol. 14(2), P. 54-61, 2014.
6. Сорвойя Х.С.С., Мюллюля Т.С., Кириллин М.Ю., Сергеева Е.А., Мюллюля Р.А., Элесуд А.А., Никкинен Ю., Тервонен О., Кивиниеми В. Неинвазивный МРТ-совместимый волоконно-оптический прибор для функциональной рефлектометрии мозга человека в оптическом и ближнем ИК диапазонах // Квантовая электроника, Т. 40, № 12, С. 1067-1073, 2010.
7. Escamilla-Mackert T., Langhals N.B., Kozai T.D.Y., Kipke D.R. Insertion of a Three Dimensional Silicon Microelectrode Assembly through a Thick Meningeal Membrane // Conf Proc IEEE Eng Med Biol Soc. 2009; 2009: 1616-161.
8. Yaroslavsky A.N., Schulze P.C., Yaroslavsky I.V., Schober R., Ulrich F., Schwarzmaier H.-J. Optical properties of selected native and coagulated human brain tissues in vitro in the visible and near infrared spectral range // Phys. Med. Biol., Vol. 47, P. 2059-2073, 2002.
9. Bashkatov A.N., Genina E.A., Kochubey V.I., Tuchin V.V. Optical properties of human cranial bone in the spectral range from 800 to 2000 nm // Proc. SPIE, Vol. 6163, 616310, 2006.
10. Bashkatov A.N., Genina E.A., Tuchin V.V. Tissue Optical Properties / Chapter 5 in: Handbook of Biomedical Optics, David A. Boas, Constantinos Pitris, and Nimmi Ramanujam (editors), Taylor & Francis Group, LLC, CRC Press Inc., 2011, pp. 67-100.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВИЗУАЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ И/ИЛИ ОРГАНОВ | 2019 |
|
RU2735463C1 |
| Биосенсор для неинвазивного оптического мониторинга патологии биологических тканей | 2016 |
|
RU2633494C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКОГО ИЗОБРАЖЕНИЯ МЕЖФАЛАНГОВЫХ СУСТАВОВ И ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2018 |
|
RU2697594C1 |
| НЕИНВАЗИВНЫЙ СПОСОБ ПОВЫШЕНИЯ ПРОНИЦАЕМОСТИ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2017 |
|
RU2688013C1 |
| СПОСОБ ЛАЗЕРНОЙ ГИПЕРТЕРМИИ ОПУХОЛЕЙ ПРИ ВВЕДЕНИИ ПЛАЗМОННО-РЕЗОНАНСНЫХ НАНОЧАСТИЦ С ПРИМЕНЕНИЕМ ТЕХНИКИ ИММЕРСИОННОГО ОПТИЧЕСКОГО ПРОСВЕТЛЕНИЯ | 2022 |
|
RU2800156C1 |
| СПОСОБ ОПТИЧЕСКОГО ПРОСВЕТЛЕНИЯ СЛИЗИСТОЙ ПОЛОСТИ РТА | 2021 |
|
RU2768584C1 |
| СПОСОБ СТИМУЛЯЦИИ ОЧИСТИТЕЛЬНОЙ ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА | 2020 |
|
RU2766527C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЛИАЛЬНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА СУПРАТЕНТОРИАЛЬНОЙ ЛОКАЛИЗАЦИИ | 2013 |
|
RU2533032C1 |
| СИСТЕМА ДЛЯ АДРЕСНОГО КОНТРОЛЯ НЕЙРОНОВ МОЗГА ЖИВЫХ СВОБОДНОПОДВИЖНЫХ ЖИВОТНЫХ НА ОСНОВЕ РАЗМЫКАЕМОГО ВОЛОКОННО-ОПТИЧЕСКОГО ЗОНДА С МНОГОКАНАЛЬНЫМИ ВОЛОКНАМИ | 2016 |
|
RU2639790C1 |
| УСТРОЙСТВО ДИАГНОСТИКИ И ЛЕЧЕНИЯ СПИННОГО МОЗГА | 2021 |
|
RU2751820C1 |
Изобретение относится к медицине, а именно к методу управления функциональным состоянием мозга, и может быть использовано для лазерной биомодуляции и повышения проницаемости гематоэнцефалического барьера. Воздействуют лазерным излучением на выбранную область головы. При этом плотность мощности лазерного излучения определяют методом Монте Карло по размеру черепа, толщине кожи головы, подлежащих мягких тканей, кости черепа, твердой мозговой оболочки, церебрально-спинальной жидкости (ЦСЖ), серого и белого вещества мозга из условия обеспечения плотности мощности в области патологии мозга в интервале 5-20 мВт/см2. При этом длину волны излучения выбирают в пределах, лежащих в видимом и инфракрасном диапазонах длин волн на линиях поглощения молекулярного кислорода. Способ обеспечивает повышения проницаемости гематоэнцефалического барьера за счет определения оптимальных доз облучения. 24 з.п. ф-лы, 8 табл., 6 пр., 11 ил.
1. Способ лазерной биомодуляции и повышения проницаемости гематоэнцефалического барьера, включающий воздействие лазерного излучения на выбранную область головы, отличающийся тем, что плотность мощности лазерного излучения определяют методом Монте Карло по размеру черепа, толщине кожи головы, подлежащих мягких тканей, кости черепа, твердой мозговой оболочки, церебрально-спинальной жидкости (ЦСЖ), серого и белого вещества мозга из условия обеспечения плотности мощности в области патологии мозга в интервале 5-20 мВт/см2, при этом длину волны излучения выбирают в пределах, лежащих в видимом и инфракрасном диапазонах длин волн на линиях поглощения молекулярного кислорода.
2. Способ по п.1, отличающийся тем, что воздействие лазерного излучения осуществляют в течение 10-20 минут.
3. Способ по п.1, отличающийся тем, что выбирают длину волны излучения 477±10 нм, или 578±10 нм, или 630±5 нм, или 762±5 нм, или 1063±5 нм, или 1268±5 нм.
4. Способ по п.1, отличающийся тем, что дополнительно во время лазерного воздействия осуществляют охлаждение поверхности головы струёй холодного воздуха.
5. Способ по п.1, отличающийся тем, что воздействие осуществляют через кожу головы путём механического надавливания на кожу головы с силой, достаточной для уменьшения толщины слоя кожи и подстилающих мягких тканей в 3-10 раз и увеличения оптического пропускания ткани в 5-20 раз, при этом силу надавливания выбирают ограниченной легким болевым ощущением пациента.
6. Способ по п.1, отличающийся тем, что воздействие падающего излучения осуществляют на кость черепа путём надрезания кожи головы и подлежащих тканей до кости черепа так, чтобы один край ткани оставался соединенным с кожей головы для последующего заживления.
7. Способ по п.1, отличающийся тем, что воздействие осуществляют через кость черепа на поверхность твердой мозговой оболочки путём просверливания отверстия в кости черепа.
8. Способ по п.1, отличающийся тем, что кожу головы пропитывают иммерсионным агентом, подогретым до физиологической температуры поверхности головы и выше, вплоть до комфортного ощущения тепла.
9. Способ по п.1, отличающийся тем, что кость черепа пропитывают иммерсионным агентом, подогретым до физиологической температуры поверхности кости черепа.
10. Способ по п.1, отличающийся тем, что твердую мозговую оболочку пропитывают иммерсионным агентом, подогретым до физиологической температуры внутри черепа.
11. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют дегидратированный глицерин с концентрацией не ниже 90%.
12. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водный раствор глицерина с концентрацией 60-90%.
13. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водный раствор глюкозы с концентрацией 40-60%.
14. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водный раствор фруктозы с концентрацией 40-80%.
15. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водный раствор сахарозы с концентрацией 40-70%.
16. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водные растворы мальтозы и маннитола с концентрациями 40-50%.
17. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют пропиленгликоль с концентрациями 80-100%.
18. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют полиэтиленгликоль (ПЭГ) с молекулярной массой 300-600.
19. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют раствор, содержащий глицерин и пропиленгликоль в соотношении от 9:1 до 1:9.
20. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют раствор, составленный из 50% глюкозы, 20% воды и 30% этанола.
21. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют водно-спиртовые растворы глюкозы, сахарозы, фруктозы, мальтозы с концентрациями 50% при содержании спирта до 30%.
22. Способ по п.8, или 9, или 10, отличающийся тем, что в качестве иммерсионного агента используют раствор, состоящий из 60% глицерина, 30% диметилсульфоксида и 10% воды.
23. Способ по п.8, или 9, или 10, отличающийся тем, что для усиления проницаемости кожи используют химические усилители проницаемости кожи, такие как этиловый спирт, диметилсульфоксид, олеиновая кислота, мочевина, гиалуроновая кислота, тиазон.
24. Способ по п.8, или 9, или 10, отличающийся тем, что для усиления проницаемости кожи используют физические усилители проницаемости кожи, такие как сонофорез, электрофорез, лазерофорез.
25. Способ по п.3, отличающийся тем, что локально или системно в мозг вводят целевым образом апконверсионные наночастицы, облучают голову излучением на длине волны 980 нм для генерации излучения на коротковолновых линиях возбуждения синглетного кислорода 477±10 нм, или 578±10 нм, или 630±5 нм непосредственно в области патологии, где локализуются апконверсионные наночастицы.
| НЕИНВАЗИВНЫЙ СПОСОБ ПОВЫШЕНИЯ ПРОНИЦАЕМОСТИ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2017 |
|
RU2688013C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИЗМЕНЕНИЯ ТРАНСПЛАЦЕНТАРНОЙ ПРОНИЦАЕМОСТИ У КРЫС | 1992 |
|
RU2077074C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИЗМЕНЕНИЯ ТРАНСПЛАЦЕНТАРНОЙ ПРОНИЦАЕМОСТИ У КРЫС | 1992 |
|
RU2077074C1 |
| US 20090005711 A1, 01.01.2009 | |||
| ТЕРСКОВ А | |||
| В | |||
| и др | |||
| Фотодинамический способ открытия гематоэнцефалического барьера | |||
| Материалы IX научной конференции молодых ученых "Представляем научные достижения миру | |||
| Естественные науки" | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Вагонетка для движения по одной колее в обоих направлениях | 1920 |
|
SU179A1 |
Авторы
Даты
2021-01-11—Публикация
2019-12-27—Подача