Область техники, к которой относится изобретение
Изобретение относится к медицине и нанобиотехнологиям, в частности к средствам для доставки лекарственных препаратов пролонгированного действия. Система доставки представляет собой полимер на основе нековалентных комплексов производных β-циклодекстрина с биологически активной молекулой, содержащей хотя бы один ароматических фрагмент. Система доставки может быть использована в фармацевтике для производства формуляции лекарственного средства пролонгированного действия.
Уровень техники
Циклодекстрины представляют собой природные и синтетические олигосахариды, состоящие из шести (α-циклодекстрин), семи (β-циклодекстрин) или восьми (γ-циклодекстрин) D-глюкопиранозных остатков, соединенных между собой 1,4-α-гликозидными связями, и различаются по размеру цикла и растворимости молекулы. Вследствие затруднений во вращении D-глюкопиранозных остатков относительно друг друга молекула циклодекстрина имеют форму «усеченного конуса» или «тора», что обуславливает формирование внешней гидрофильной поверхности и внутренней липофильной полости. Наличие гидрофобной полости позволяет циклодекстринам образовывать нековалентные комплексы включения типа «гость-хозяин» со многими гидрофобными молекулами, в том числе и лекарственными препаратами [Stella V.J., Не Q. Cyclodextrins // Toxicol. Pathol. 2008, Vol. 36, №1, p. 30-42.].
Известно более двадцати производных циклодекстринов с полярными, неполярными и заряженными заместителями разной степени модификации, полученные путем аминирования, этерификации, дегидратации и др. первичных и вторичных гидроксильных групп исходных олигосахаридов. Поскольку в структуре циклодекстринов содержится большое количество реакционноспособных гидроксильных групп, модификации олигосахаридов приводят к значительным изменениям их физико-химических свойств, в том числе и их комплексообразующей способности [de Miranda J.С. et al. Cyclodextrins and ternary complexes: Technology to improve solubility of poorly soluble drugs // Brazilian J. Pharm. Sci. 2011, Vol. 47, №4, p. 665-681]. Так, введенный заместитель оказывает влияние на растворимость циклодекстрина, объем его гидрофобной полости, константу диссоциации его комплекса с лекарственной молекулой. Кроме того, новая функциональная группа может принимать участие в молекулярном узнавании, что можно использовать для создания направленных систем доставки лекарственных препаратов [Valle E.M.M. Cyclodextrins and their uses: A review // Process Biochem. 2004, Vol. 39, №9, p. 1033-1046].
Образование нековалентных комплексов включения циклодекстринов и их производных с лекарственной молекулой определяет их широкое использование в фармацевтической промышленности. Поскольку циклодекстрины и их производные биосовместимы и нетоксичны, циклические олигосахариды активно применяются для получения лекарственных формуляций с улучшенной стабильностью, растворимостью, биодоступностью и проницаемостью препарата сквозь биологические барьеры, пониженной общей и локальной токсичностью, низкой вероятностью возникновения побочных эффектов [Loftsson Т. et. al. Cyclodextrins in drug delivery system // Adv. Drug Deliv. Rev. 2005, Vol. 2, №2, p. 335-351; US 4727064A; RU 2570382C1; WO 2012115538 A1; WO 1997019703 A2; WO 2008107569 A2; WO 2005056607 A1; AU 2005230380 B2].
В связи с доступностью, оптимальными размером полости и повышенной растворимостью производные β-циклодекстрина, полученные вследствие модификации гидроксильных групп на поверхности тора β-циклодекстрина, используются в качестве комплексообразующих агентов небольших лекарственных молекул в фармацевтической промышленности [Loftsson Т. et. al. Cyclodextrins: structure, physicochemical properties and pharmaceutical applications // Int. J. Pharm. 2018, Vol. 535, p. 272-284]. Однако значения констант диссоциации комплексов «гость-хозяин» лекарственных молекул с производными β-циклодекстрина, как правило, находятся в интервале 10-2-10-4 М, такие комплексы обладают недостаточной термодинамической стабильностью для создания систем доставки лекарств пролонгированного действия [Valle E.M.M. Cyclodextrins and their uses: A review // Process Biochem. 2004, Vol. 39, №9, p. 1033-1046]. Для увеличения селективности и сорбционных свойств лиганда по отношению к лекарственным молекулам с различной структурой получают олигомеры и полимеры на основе производных β-циклодекстрина.
Олигомерные и полимерные молекулы, полученные вследствие ковалентного соединения самих молекул циклодекстринов через линкер, характеризуются улучшенной эффективностью комплексообразования и могут придавать системе пролонгированность действия [Swaminathan S. et. al. Cyclodextrin-based nanosponges encapsulating camptothecin: Physicochemical characterization, stability and cytotoxicity // European Journal of Pharmaceutics and Biopharmaceutics. 2010, Vol. 74, p. 193-201; Gidwani В., Vyas A. Synthesis, characterization and application of Epichlorohydrin-β-cyclodextrin polymer // Colloids Surfaces В Biointerfaces. Elsevier B.V. 2014, Vol. 114, p. 130-137; EP 2081965 A1; ЕР 1873167 А2].
Из уровня техники известны способы получения полимеров на основе циклодекстрина (WO 2013045729 A1 «Cyclodextrin nanogels», WO 2009003656 A1 «Cyclodextrin-based nanosponges as a vehicle for antitumoral drugs», CN 102302786 A «Preparation method for beta-cyclodextrin polymer-paclitaxel inclusion compound»), которые могут быть использованы в качестве носителей различных лекарственных препаратов, таких как дексаметазон и паклитаксел. Способы получения полимеров включают в себя следующие стадии: добавление сшивающего агента (глицидиловый эфир, дифенилкарбонат или эпихлоргидрин) к раствору циклодекстрина, выдерживание смеси при температуре 30-100°С в течение 4-24 часов, промывка и сушка. Сорбция лекарственных молекул на полимерном носителе способствует значительному увеличению растворимости препарата (для паклитаксела до 1 мг/мл при растворимости в отсутствие носителя менее 1 мкг/мл), а также более эффективному действию in vitro (антипролиферативное действие комплекса палитаксела с полимером β-циклодекстрина почти в три раза больше, чем свободного палитаксела при низких дозировках). Однако часть молекул β-циклодекстрина может быть недоступна для адсорбции лекарственного препарата вследствие сложной структуры и стерических затруднений, что снижает сорбционную емкость полимера. Кроме того, используемые сшивающие агенты, такие как эпихлоргидрин и дифенилкарбонат могут образовывать канцерогенные и ядовитые вещества в процессе синтеза [Wester P.W. et al. Carcinogenicity study with epichlorohydrin (CEP) by gavage in rats // Toxicology. 1985, Vol. 36, №4, p. 325-339].
Из уровня техники известны способы получения систем доставок лекарственных препаратов, в котором лекарственная молекула ковалентно присоединена к линейному или разветвленному полимеру, содержащему в своей структуре молекулы циклодекстрина. Биологически активную молекулу «пришивают» к полимеру непосредственно или через линкер, образуемые при этом связи могут разрушаться, например, под действием определенного типа излучения (US 20170368194 А1 «Cyclodextrin-based polymers for therapeutic delivery» и WO 2006089007 A2 «Cyclodextrin-based polymers containing photocleavable linkers for drug delivery»). Данная ковалентная связь является биодеградируемой и обеспечивает замедленное высвобождение лекарственного препарата. Однако авторами предложены методически сложные многоступенчатые способы получения таких полимеров, что обусловлено большой вариативностью структур и свойств лекарственных препаратов и вспомогательных полимеров. Более того, поскольку циклодекстрины не являются основными «строительными блоками» полимера, а выступают только в качестве дополнительных звеньев цепи и в полной мере не образуют комплексы включения с лекарственным препаратом, циклодекстрины не способны оказывать сильное влияние на степень включения лекарственного препарата в полимер (на 1 мг носителя приходится не более 0,13 мг лекарственной молекулы) и, следовательно, не обеспечивают значительного замедления высвобождения лекарственного препарата при гидролизе биодеградируемых связей.
Из уровня техники известен способ получения звездчатых полимеров β-циклодекстрина для доставки биологически активных молекул, например, куркумина, которые способствуют увеличению растворимости лекарственного препарата и его замедленному высвобождению (CN 107028913А Method for preparing polycaprolactone-cyclodextrin drug delivery nano-particles). Звездчатые полимеры, полученные на основе β-циклодекстрина вследствие полимеризации ε-капролактона с раскрытием цикла, представляют собой наночастицы со средним размером в 200 нм. Однако способ получения полимеров является многоступенчатым, длительным и методически сложным, а также требует использования большого количества разных органических растворителей и металл содержащих органических соединений. Кроме того, авторами не рассмотрено влияние структуры звездчатого полимера на степень замедления высвобождения лекарственного препарата.
Из уровня техники известен способ получения гидрогелей на основе β-циклодекстрина и его производных для доставки лекарственных препаратов, полученных вследствие ковалентного соединения молекул олигосахаридов различными производными глицидиловых эфиров (WO 2006089993A2 Method of obtaining hydrogels of cyclodextrins with glycidyl ethers, compositions thus obtained and applications thereof). Синтез гидрогелей осуществляется путем смешения растворов циклодекстрина и производного глицидилового эфира и последующим выдерживанием смеси в течение 12 часов при 50°С. Далее полученный гидрогель промывают в соляной кислоте в течение 12 часов и затем в дистиллированной воде в течение 12 часов. После высушивания гидрогели насыщают биологически активным агентом, который образует комплексы включения с молекулами β-циклодекстрина в полимере. Полученное вещество характеризуется замедленным высвобождением биологически активной молекулы (70-100% лекарственного препарата высвобождается из гидрогелей через 8 часов в водной среде.
Однако для достижения высоких значений насыщения гидрогелей лекарственной молекулой требуется длительное время пребывания гидрогеля в растворе (2-7 суток) и/или высокие температуры. Поскольку в системах in vitro и in vivo другие значения рН, например, при пероральном применении рН желудка 1-2 и при внутривенном введении рН 7,4, а также присутствуют ферменты, данная степень замедления высвобождения лекарственного препарата (70-100% за 8 часов в водной среде) может быть недостаточной для создания системы пролонгированного действия.
Наиболее близким к заявляемому изобретению является способ получения водорастворимых систем доставки на основе комплексов циклодекстринов и их производных; ди-, три-, тетрамеров; полимеров для групп лекарственных средств и других активных агентов, связанных биосовместимыми ковалентными связями таких как дисульфидные, амидные, полипептидные и др. (US 20010034333 A1 «Cyclodextrin polymer compositions for use as drug carriers»). Для получения системы доставки производят «сшивание» комплексов производных циклодекстрина и лекарственной молекулы с помощью линкера в водной или водно-органической среде. Однако в условиях синтеза не уделено должного внимания условиям получения комплекса производного β-циклодекстрина с активным агентом (рН, температура, время инкубации и т.д.), поскольку данный процесс может оказывать сильное влияние на структуру полимера и степень включения активного агента. Кроме того, в некоторых случаях синтез является многоступенчатым, требует нагревания смеси до 60°С, что может приводить к модификации и инактивации лекарственной молекулы. Авторы также не раскрывают влияние метода синтеза системы доставки и структуры системы на степень высвобождения лекарственного препарата.
Таким образом до сих пор актуальным является разработка систем создание системы доставки антибактериальных и противоопухолевых лекарственных молекул, обладающих пролонгированным действием.
Раскрытие изобретения
Техническим результатом, на достижение которого направлено заявленное изобретение, является обеспечение пролонгированного действия лекарственного соединения (молекулы) при включении в наночастицы со средним гидрадинамическим диаметром 100-600 нм. Получение 3Д-матриксных структур, полимеров на основе данных комплексов, включает в себя три стадии, минимальное время протекания самих реакций составляет 2,5 часа.
Технический результат достигается 3Д-матриксной структурой пролонгированного высвобождения (контролируемого высвобождения) лекарственного вещества (соединения, молекулы), которая представляет собой водорастворимую или образующую коллоидный раствор частицу с размером 100-600 нм, образованную из комплексов производного β-циклодекстрина, содержащего не менее трех свободных гидроксильных групп, с лекарственным соединением, содержащим по меньшей мере один ароматический фрагмент, соединенных между собой уретановыми связями. При этом, в качестве производного β-циклодектрина используют 2-гидроксипропил β-циклодекстрин, метил β-циклодекстрин или сульфобутиловый эфир β-циклодекстрина, а в качестве лекарственного соединения, содержащего по меньшей мере один ароматический фрагмент, используют антибактериальный препарат, противоопухолевый препарат или препарат, содержащий тетрапирроидные макроциклы. Предпочтительно антибактериальные препараты выбирать из группы, включающей хинолоны, фторхинолоны, куркумин, изониазид, пиразинамид, бензолсульфаниламиды, хлорамфеникол, тетрациклины и т.п.; противоопухолевые препараты из группы, включающей доксорубицин, паклитаксел, митомицин, метотрексат, даунорубицин и т.п.; препарат, содержащий тетрапирроидные макроциклы из группы, включающей гемин хлорид, аргинат гема, хлорины и т.п.
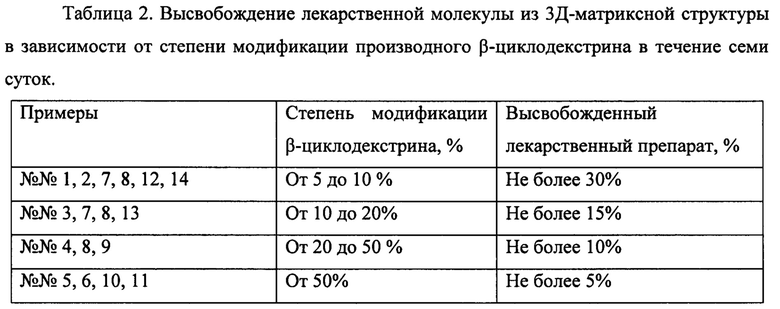
Также технический результат достигается способом получения 3Д-матриксной структуры заключающийся в том, что смешивают водный раствор производного β-циклодектрина и водный раствор лекарственного вещества, полученную смесь нагревают до температуры 37,0-42,0°С, при активном перемешивании добавляют полярный органический растворитель, смешивающийся с водой, в количестве необходимом для достижения объемного соотношения вода: полярный органических растворитель в конечном растворе не менее 50% по объему, затем при активном перемешивании вносят раствор гексаметилендиизоцианата в том же органическом растворителе, взятого из расчета, что мольное соотношение гексаметилендиизоцианат: производное β-циклодекстрина находится в диапазоне от 0,1 до 5, полученную реакционную смесь выдерживают до прекращения изменения мутности смеси и проводят очистку полученного продукта от органического растворителя и непрореагировавших реагентов. При этом, β-циклодектрин и лекарственное вещество берут в мольном соотношении из расчета, что на один ароматических фрагмент лекарственной молекулы берут не менее одной молекулы производного β-циклодектрина. Предпочтительно полярный органический растворитель, смешивающийся с водой выбирать из ряда, включающего диметилсульфоксид (ДМСО), диметилформамид (ДМФА), диметилфумарат (ДМФ), ацетонитрил. Дополнительно полученную наноразмерную частицу очищают от органического растворителя и примесей реагентов методом диализа, с использованием фильтров с размерами пор не более 100 нм или центрифужного концентратора
Ключевым отличием заявляемого изобретения от данного аналога является использование в качестве сшивающего агента 1,6-гексаметидендиизоцианата, образующего в реакции с циклодекстринами биодеградируемые полиуретановые связи [Chemg J.Y. et. Al. Polyurethane-based drug delivery systems // Int. J. Pharm. 2013, Vol. 450, p. 145-162]. Поскольку 1,6-гексаметилендиизоцианат является достаточно длинным, подвижным, гидрофобным сшивающим агентом, то возможно включение в 3Д-матриксную структуру как малых, так и относительно объемных лекарственных молекул, принадлежащих к различным классам, например, антибактериальных препаратов, противоопухолевых, содержащих тетрапирроидные макроциклы.
В 3Д-матриксной структуре лекарственная молекула ковалентно не связана с полимером, а распределена по всему объему полимерной сетки. Удерживание лекарственной молекулы в 3Д-матриксной структуре происходит за счет включения в состав комплекса типа «гость-хозяин» с производным β-циклодекстрина, а также стерически за счет удерживания лекарства в самой полимерной сетке с разным размером пор.
Способ синтеза 3Д-матриксных структур методически прост, включает в себя три стадии: получение комплекса производного циклодекстрина с лекарственной молекулой, «сшивание» комплексов с помощью 1,6-гексаметидендиизоцианата и очистка продукта. Все три стадии протекают в мягких условиях (температурный диапазон 18-42°С, рН в диапазоне 4,0-7,8, содержание полярного органического растворителя не более 50%) и характеризуется высоким выходом (не менее 85%). Возможно получение систем с заданным размером (100-600 или 100-200 нм). Антибактериальное действие 3Д-матриксных структур в жидких средах на двух штаммов Escherichia Coli 669 и 1467 указывает на наличие тенденции к пролонгированному действию по сравнению с действием свободного лекарственного препарата.
Важным аспектом представленной технологии с точки зрения ее дальнейшего применения для различных систем введения лекарства является оценка скорости высвобождения лекарственного препарата из системы для 3Д-матриксных структур в зависимости от степени модификации циклодекстрина, что позволит использовать разработанную систему доставки для достижения требуемого времени циркуляции в кровотоке в широком временном промежутке.
Существенным преимуществом данного изобретения, которым не обладают известные ранее системы, является зависимость скорости высвобождения активного начала от степени модификации полимерного носителя. Таким образом, становится возможным использовать разработанную систему доставки для достижения требуемого времени циркуляции в кровотоке в широком временном промежутке.
3Д-матриксная структура образуется за счет формирования комплексов включения производных β-циклодектрина с лекарственной молекулой с последующим ковалентным связыванием таких комплексов с использованием бифункционального линкера, что приводит к образованию трехмерных частиц.
Краткое описание чертежей
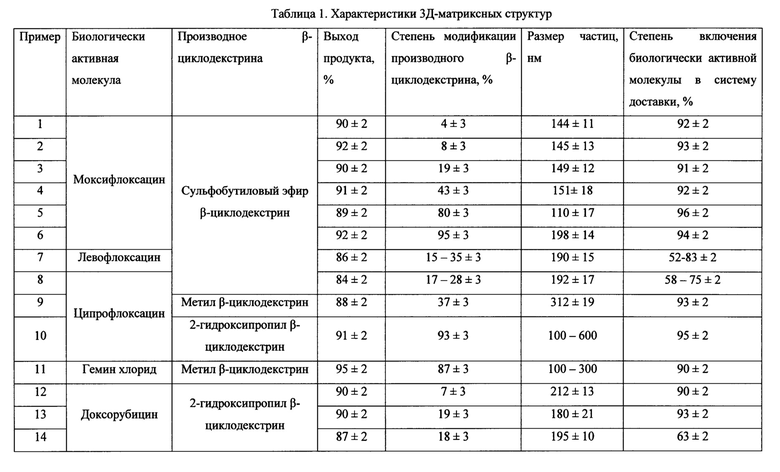
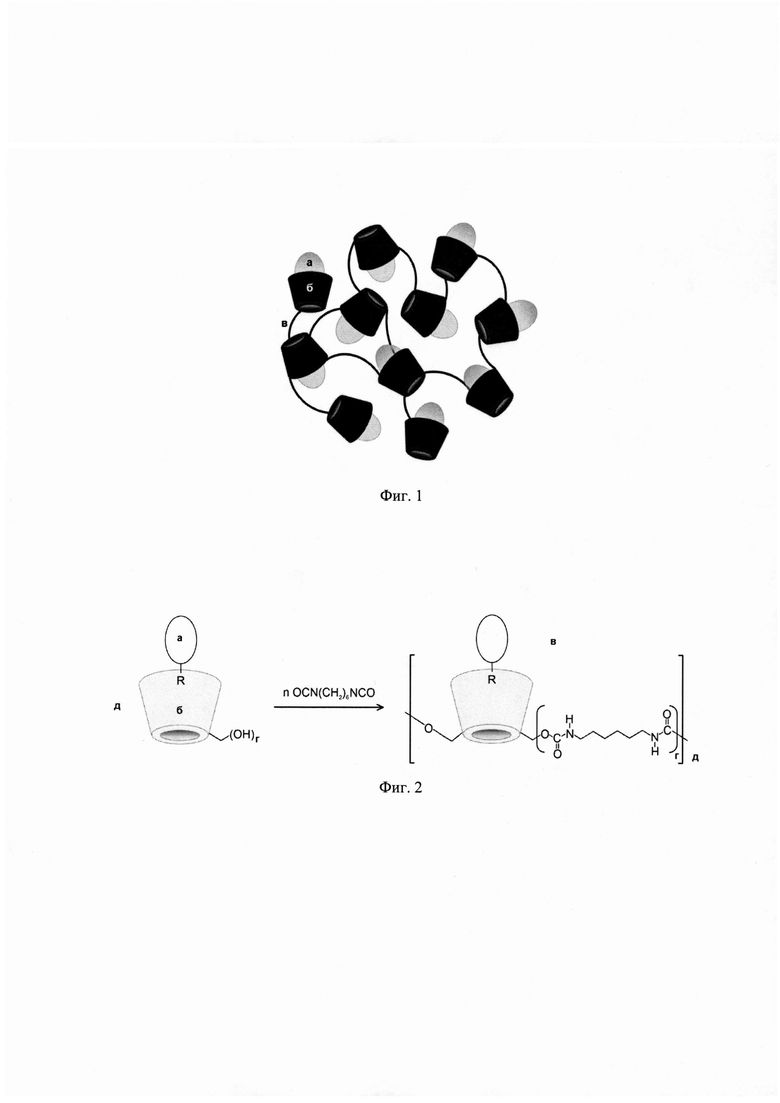
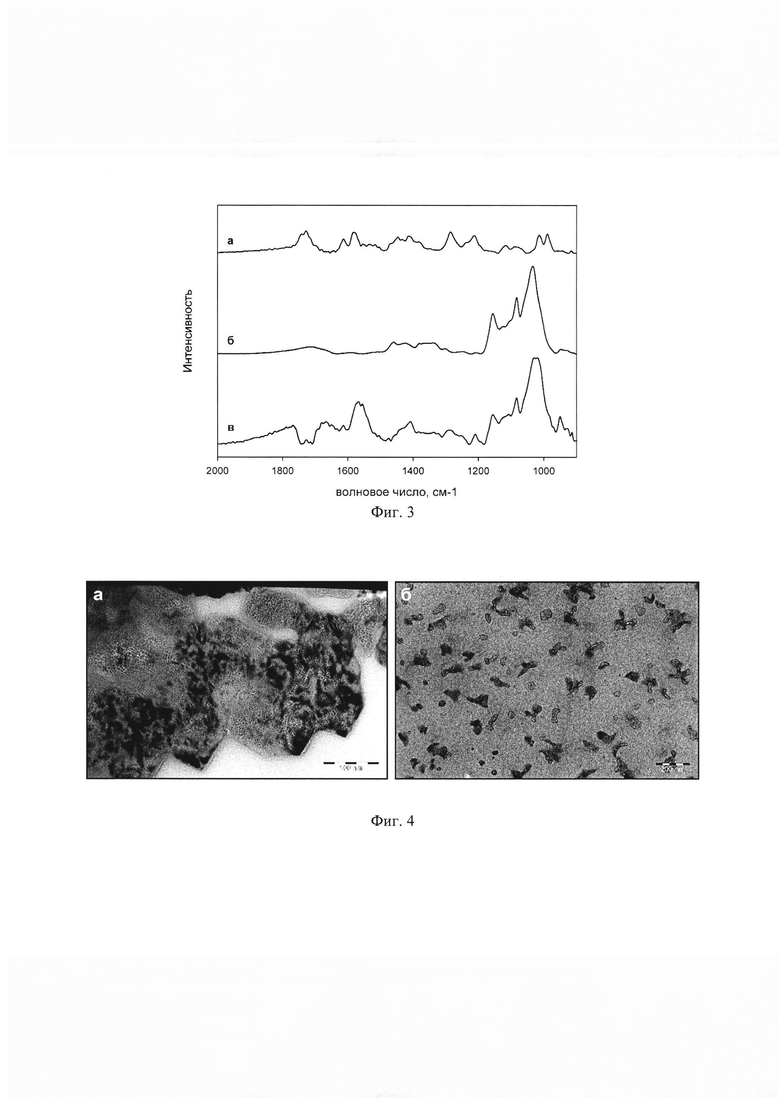
Изобретение поясняется чертежами, где на фиг. 1 представлено схематичное строение 3Д-матриксных структур, на фиг. 2 представлена схема синтеза 3Д-матриксных структур, на фиг. 3 представлены ИК-Фурье спектры свободных лекарственной молекулы и производного β-циклодекстрина, а также 3Д-матриксной структуры, полученной из их комплекса, на фиг 4. представлены микрофотографии 3Д-матриксных структур, на фиг. 5 представлены кривые высвобождения лекарственной молекулы из 3Д-матриксной структуры при 37°С и рН 4,0, на фиг 6. представлено действие 3Д-матриксных структур in vitro.
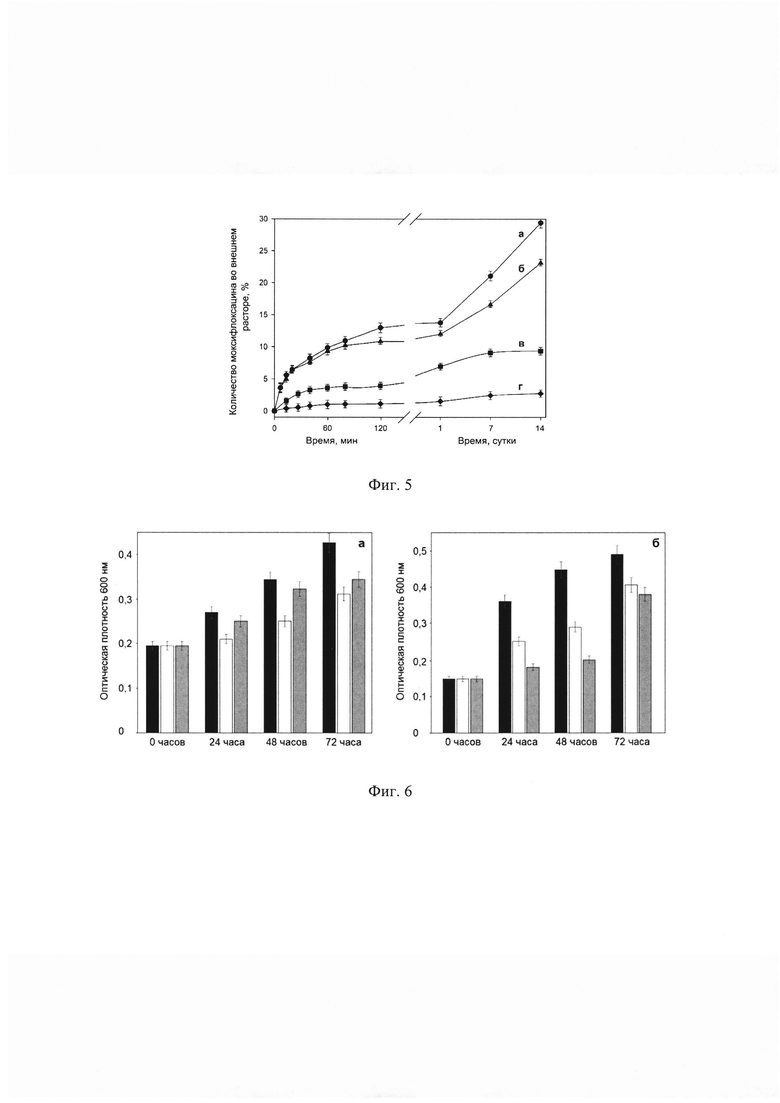
Позициями на фиг. 1 обозначены комплексы лекарственных молекул (а) с производными β-циклодекстрина (б), соединенные между собой линкером (в). Позициями на фиг. 2 обозначены: а - лекарственная молекула, содержащая ароматических фрагмент R, б - производное β-циклодекстрина с количеством свободных гидроксильных групп (г) не менее трех, в - 3Д-матриксная структура, содержащая комплексы лекарственной молекулы и производного β-циклодекстрина в количестве д. Позициями на фиг. 3 обозначены ИК-Фурье спектр доксорубицина в концентрации 0,46 мг/мл (а), 2-гидроксипропил β-циклодекстрина в концентрации 4,5 мг/мл (б), 3Д-матриксной структуре полученной на основе их комплекса, 4,2 мг/мл (в). Позициями на фиг. 4 обозначены: а - неэкструдированные частицы 3Д-матриксных структур на основе сульфобутилового эфира β-циклодекстрина и моксифлоксацина, б - экструдированные частицы 3Д-матриксных структур на основе сульфобутилового эфира β-циклодекстрина и моксифлоксацина. Позициями на фиг. 5 обозначены кривые высвобождения моксифлоксацина из 3Д-матриксной структуры со степенью модификации сульфобутилового эфира β-циклодектстрина 8% (а), 19% (б), 43% (в), 93% (г). Позициями на фиг. 6 обозначена оптическая плотность E.Coli 669 (а) и E.Coli 1467 (б) на 600 нм контроля (черный столбец), моксифлоксацина в концентрации 0,2 мг/л (белый столбец) и 3Д-матриксной структуры моксифлоксацина с сульфобутиловым эфиром β-циклодектстрина со степенью модификации 20% (серый столбец).
Осуществление изобретения
Для разработки системы доставки антибактериальных и противоопухолевых лекарственных препаратов, а также молекул, содержащих тетрапирроидные макроциклы, которые содержат в своей структуре хотя бы один ароматический фрагмент, предложено использовать наночастицы 100-200 или 500-600 нм на основе производных β-циклодекстрина, содержащих в своей структуре не менее трех свободных гидроксильных групп. Для разработки системы доставки. 3Д-матриксной структуры (фиг. 1), предложено использовать комплексы лекарственной молекулы с 2-гидроксипропил β-циклодекстрином, метил β-циклодекстрином или сульфобутиловым эфиром β-циклодекстрином. Синтез систем доставки проводят с помощью высокореакционноспособного бифункционального сшивающего агента 1,6-гексаметилендиизоцианата (фиг. 2).
Преимущества предложенной методики синтеза по сравнению с уже известными -мягкие условия проведения реакции (температурный диапазон 18-42°С, рН в диапазоне 4,0-7,8, содержание полярного органического растворителя не более 50%), методическая простота (две стадии включают в себя смешение и последующее перемешивание растворов, не требуется специальное дорогостоящее оборудование), использование не более 50% органического растворителя в реакционной смеси, возможность получать водорастворимые или образующие коллоидных раствор полимеры с широким диапазоном степени модификации циклодекстринов. Следует отметить высокий выход реакции (больше 85% по содержанию циклодекстрина в полимере) и высокий процент включения лекарственного препарата в пространственную сетку системы доставки (для ряда образцов - более 90%).
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С.
Смешение водных растворов 0,015 - 0,03М производного β-циклодектрина с раствором лекарственной молекулы в концентрации, обеспечивающей мольное соотношение равное не менее одной молекулы производного β-циклодектрина на один ароматических фрагмент лекарственной молекулы. Получение комплекса включения типа «гость-хозяин» осуществляется при перемешивании не менее 30 минут при температуре в интервале 37-42°С. К полученному комплексу добавляется полярный органический растворитель, смешивающийся с водой, например, ДМСО, ДМФА и др., и раствор 0,01-0,1М гексаметилендиизоцианата в том же органическом растворителе при комнатной температуре. При этом объем добавленного гексаметилендиизоцианата рассчитывается исходя из мольного соотношения сшивающий агент: производное β-циклодектрина в диапазоне от 0,1 до 5, а объем добавленного органического растворителя рассчитывается таким образом, чтобы суммарная доля органического растворителя в конечном растворе не превышала 50% по объему. Система инкубируется при комнатной температуре и скорости перемешивании не менее 200 об/мин до окончания реакции, которое можно проконтролировать по прекращению изменения мутности раствора, ИК-спектра суспензии, ТСХ и т.д. Для получения монодисперсного образца полученный комплекс следует экструдировать через фильтр с заданным размером пор (от 100 до 600 нм). Полученная водно-органическая суспензия очищается от органического растворителя и непрореагировавших реагентов, например, методом диализа или с использованием фильтров с размерами пор не более 100 нм. Для получения комплекса в виде высушенного порошка возможно использовать метод лиофилизации.
Структура получаемого комплекса подтверждается определяется с помощью метода ИК-спектроскопии Фурье (фиг. 3). По полосе поглощения в области 1720-1750 см-1 делается вывод о концентрации уретановых связей и степени модификации производного β-циклодекстрина в полученном полимере. Появление полос, соответствующих колебаниям новых функциональных групп, карбоксильных или амино групп свидетельствует о частичном разрушении концевых молекул сшивающего агента. Спектроскопическими методами ИК- и УФ- определяется концентрация лекарственной молекулы включенной внутрь частицы. Размер полученных частиц определяется методами Nanoparticle Tracking Analysis, динамического светорассеяния, микроскопией.
Ниже представлено более подробное описание заявляемого изобретения. Настоящее изобретение может подвергаться различным изменениям и модификациям, понятным специалисту на основе прочтения данного описания. Такие изменения не ограничивают объем притязаний. Например, могут изменяться способы получения комплексов включения производного циклодекстрина и лекарственной молекулы (сухое или термомеханическое смешение и последующее растворение комплекса в буфере, использование сверхкритических технологий и т.д.), тип сшивающего агента (бифункциональные агенты схожей природы, образующие биодеградируемые связи с производными циклодекстринов), способы очистки продукта от органического растворителя и непрореагировавших веществ, а также методы концентрации и сушки полученного вещества.
Пример 1.
Синтез 3Д-матриксных структур для доставки моксифлоксацина. К 1,25 мл водного раствора 0,03 М сульфобутилового эфира β-циклодекстрина (рН=4,0) добавили 1,25 мл 0,03 М водного раствора фторхинолона в том же рН для получения комплекса (мольное соотношение компонентов 1:1). Полученный раствор инкубировали при температуре 37°С в течение часа при перемешивании 200 об/мин. К раствору комплекса, добавили 2406 мкл ДМСО (для достижения в конечном растворе объемного соотношения вода: ДМСО=1:1) и 94 мкл 0,1 М раствор гексаметилендиизоцианата в ДМСО (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 0,25:1). Реакционную смесь выдерживали при 200 об/мин при комнатной температуре до прекращения изменения мутности раствора (ориентировочно 4 часа). Очистку образцов от органического растворителя проводили методом диализа с использованием диализной мембраны 3,5 кДа (Serva).
Пример 2.
Синтез 3Д-матриксных структур проводили аналогично примеру 1. При этом использовали 2310 мкл ДМСО и 188 мкл сшивающего агента (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 0,5: 1).
Пример 3.
Синтез 3Д-матриксных структур проводили аналогично примеру 1. При этом использовали 2220 мкл ДМСО и 281 мкл сшивающего агента (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 0,75:1).
Пример 4.
Синтез 3Д-матриксных структур проводили аналогично примеру 1. При этом использовали 2130 мкл ДМСО и 375 мкл сшивающего агента (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 1:1).
Пример 5.
Синтез 3Д-матриксных структур проводили аналогично примеру 1. При этом использовали 1376 мкл ДМСО и 1125 мкл сшивающего агента (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 3:1).
Пример 6.
Синтез 3Д-матриксных структур проводили аналогично примеру 1. При этом использовали 625 мкл ДМСО и 1875 мкл сшивающего агента (мольное соотношение сшивающий агент: сульфобутиловый эфир β-циклодекстрин = 5:1).
Пример 7
Серию экспериментов по синтезу 3Д-матриксных структур проводили аналогично примерам 1-6, только в качестве лекарственного агента использовался левофлоксацин. В качестве дополнительной стадии образцы экструдировали с помощью ручного экструдера Avanti Polar Lipids USA mini-extruder через мембрану с размером пор 200 нм (Whatman) для получения монодисперсных частиц.
Пример 8
Серию экспериментов по синтезу 3Д-матриксных структур проводили аналогично примерам 1-6 с использованием в качестве лекарственного соединения ципрофлоксацина.
Пример 9
Синтез 3Д-матриксных структур проводили аналогично примеру 4. В качестве производного циклодекстрина использовали метил-β-циклодекстрин в качестве лекарственного агента использовался ципрофлоксацин.
Пример 10
Синтез 3Д-матриксных структур проводили аналогично примеру 6. В качестве производного циклодекстрина использовали 2-гидроксипропил-β-циклодекстрин в качестве лекарственного агента использовался ципрофлоксацин.
Пример 11
Синтез 3Д-матриксных структур для доставки лекарственных препаратов, содержащих тетрапирроидные макроциклы. К 0,5 мл водного раствора 0,03М метил β-циклодекстрина (рН 7,8 фосфатный буфер) добавили 0,5 мл 10 мг/мл водной суспензии геминхлорида в том же буфере (мольное соотношение компонентов 4:1). Полученную смесь инкубировали при температуре 37°С в течение часа при 200 об/мин. Затем к раствору добавили 615 мкл ДМСО при активном перемешивании и 385 мкл 0,2 М раствор гексаметилендиизоцианата в ДМСО при активном перемешивании смеси реагентов (объемное соотношение вода: ДМСО в конечном растворе равна 1 к 1). Объем добавленного раствора сшивающего агента был взят для достижения мольного соотношения сшивающий агент: мономер равное 5 к 1. Реакционную смесь выдерживали до прекращения изменения мутности раствора (приблизительно 2,5 часа) при перемешивании 200 об/мин при комнатной температуре. Очистку образца от органического растворителя провести методом диализа с использованием диализной мембраны 3,5 кДа (Serva).
Пример 12
Синтез 3Д-матриксных структур для доставки доксорубицина. К 400 мкл 0,0225М водного раствора 2-гидроксипропил β-циклодекстрина добавили 100 мкл 5 мг/мл водного раствора доксорубицина для получения нековалентного комплекса (мольное соотношение компонентов 1:1). Полученную смесь инкубировали при температуре 39°С в течение получаса. Затем к раствору добавили 410 мкл ДМСО при перемешивании 200 об/мин и 90 мкл 0,01 М раствора гексаметилендиизоцианата в ДМСО при активном перемешивании смеси реагентов (объемное соотношение вода: ДМСО в конечном растворе равно 1 к 1).Объем добавленного раствора сшивающего агента был взят для достижения мольного соотношения сшивающий агент: мономер равное 0,1 к 1. Реакционную смесь выдерживали до прекращения изменения мутности раствора (~ 2 часа) при перемешивании 300 об/мин при комнатной температуре. Очистку образца от органического растворителя проводили методом диализа с использованием диализной мембраны 3,5 кДа (Serva).
Пример 13
Синтез 3Д-матриксных структур проводили аналогично примеру 12. При этом использовали 140 мкл ДМСО и 360 мкл сшивающего агента (мольное соотношение сшивающий агент: 2-гидроксипропил β-циклодекстрин = 0,4:1).
Пример 14
Синтез 3Д-матриксных структур проводили аналогично примеру 13. При этом В качестве дополнительной стадии образцы экструдировали с помощью ручного экструдера Avanti Polar Lipids USA mini-extruder через мембрану с размером пор 200 нм (Whatman) для получения монодисперсных частиц.
Характеристики всех полученных структур представлены в таблице 1.
При изменении времени инкубации производного β-циклодекстрина с лекарственной молекулой от получаса до трех часов; рН реакции в диапазоне от 4,0 до 7,8; органического растворителя на ДМФА или времени инкубации с сшивающим агентом от двух до четырех часов были получены аналогичные результаты с погрешностью от 5 до 10%.
Анализ структуры и свойств 3Д-матриксных структур
Размер полученных частиц проводился методами Nanoparticle Tracking Analysis, динамического светорассеяния, просвечивающей электронной. Неэкструдированный образец представляет собой полидисперсную коллоидную систему со среднем гидрадинамическим радиусом частиц в диапазоне от 100 до 600 нм и характеризуются коэффициентом полидисперсности в диапозоне от 1,7 до 5,1. Экструдированные образцы представляют собой частицы с заданным размером (200 нм) и имеют низкий коэффициент полидисперсности не более 1,3. На микрофотографиях образцов (фиг. 4) видно, что лекарственное вещество распределено по всему объему полимера, который имеет сетчатое (ячеистое) строение.
Из анализа ИК-спектров образцов следует, что образование 3Д-матриксной структуры сопровождается появлением новых полос поглощения по сравнению со спектрами свободных лекарственной молекулы и производного β-циклодекстрина (фиг. 3): в области 1720-1780 см-1, соответствующих колебаниям уретановых связей; 1670-1640 см-1 и 1540-1580 см-1, соответствующих колебаниям Амид I и Амид II; 950 см-1, соответствующего колебаниям C-N связей. Также обнаружены новые полосы колебаний первичных -NH2 групп 1410 см-1. Исходя из интенсивности полосы поглощения уретановой связи в области 1700-1750 см-1 можно рассчитать степень модификации производного β-циклодекстрина.
Анализ содержания лекарственной молекулы в 3Д-матриксных структурах проводился методами УФ- и ИК- спектроскопии. На основании анализа можно заключить, что эффективность включения лекарственной молекулы в 3Д-матриксную структуру составляет более 90% (для неэкструдированньгх образцов). В среднем на 1 мг носителя приходится 0,45-0,55 мг лекарственного препарата. Экструзия образца через мембрану 200 нм может приводить к потере примерно 50% вещества, и в среднем на 1 мг носителя приходится 0,1-0,3 мг лекарственного вещества.
Высвобождение лекарственного препарата из 3Д-матриксных структур Анализ высвобождения лекарственного препарата из 3Д-матриксных структур проводился в кислой среде (рН 4,0) методом равновесного диализа с использованием диализных мембран 3,5 кДа с регистрированием концентрации лекарственной молекулы во внешнем растворе с помощью метода УФ спектроскопии (таблица 2).
В контрольном эксперименте 100% свободного лекарственного вещества высвобождается через 20-30 минут. Заключение лекарственных молекул в 3Д-матриксные структуры приводит к значительному замедлению высвобождения вещества (фиг. 5). На основании анализа полученных данных можно сделать вывод о том, что с увеличением степени сшивки производного β-циклодекстрина наблюдается более сильное замедление высвобождения лекарственного препарата. Для низких степеней модификации (от 5 до 10%) за 7 дней высвобождается не более 30% лекарственных молекул, заключенных в 3Д-матриксную структуру, для высоких степеней модификации (более 50%) - не более 5%. Таким образом, варьируя степень модификации производного β-циклодекстрина, можно получить 3Д-матриксную структуру с заданным профилем высвобождения лекарственной молекулы.
Важно отметить, что монодисперсные экструдированные образцы характеризуются более быстрым высвобождением биологически активной молекулы на 7-10% (в зависимости от степени сшивки и типа лекарственной молекулы) по сравнению с неэкструдированным образцом, по-видимому, из-за большей площади поверхности частиц.
Изменение рН раствора 3Д-матриксной структуры и внешнего раствора на нейтральные (7,0) приводит к увеличению скорости высвобождения лекарственного препарата на 5-10% в зависимости от степени сшивки и типа лекарственного препарата.
Антибактериальная активность 3Д-матриксных структур
Антибактериальная активность 3Д-матриксных структур комплексов сульфобутилового эфира β-циклодекстрина с моксифлоксацином была проверена на двух штаммах E. Coli с ослабленной клеточной стенкой (штамм 669) и прочной клеточной стенкой (штамм 1467) на твердых и жидких средах.
В работе на твердых средах на чашках Петри были вырезаны кусочки агара диаметром 9 мм, после чего внутрь выемки помещалось 50 мкл образца 3Д-матриксной структуры сульфобутилового эфира β-циклодекстрина с концентрацией фторхинолона моксифлоксацина или левофлоксацина0,2 мг/л для штамма 669 и 1 мг/л для штамма 1467. Спустя 20 минут чашка Петри помещалась в термостат 37°С. Спустя сутки были оценены диаметры воздействия образца на клеточный рост E.Coli. Установлено, что действие экструдированных 3Д-матриксных структур (200 нм) было сравнимо по эффективности со свободным фторхинолоном в той же концентрации. Снижение эффективности препарата составляло не более чем на 15% по сравнению со свободным фторхинолоном. Для неэкструдированного образца 3Д-матриксных структур эффективность составляет не более чем 20% от действия свободного фторхинолона в той же концентрации. Данный эффект наблюдается для обоих штаммов и, по-видимому, обусловлен замедленной диффузией наночастиц в агаризованной среде.
Для исключения эффекта замедленной диффузии наночастиц определение антибактериальной активности исследуемых 3Д-матриксных структур сульфобутилового эфира β-циклодекстрина с левофлоксацином проводили с использованием жидких сред Luria broth. При работе с клетками в жидких средах к клеточной культуре известной плотности были добавлены одинаковые объемы лекарственного препарата или 3Д-матриксной структуры, содержащей такое же количество левофлоксацина - 0,2 мг/л для штамма 669 и 1 мг/л для штамма 1467.
Установлено, что 3Д-матриксные структуры демонстрирует высокую эффективность, близкую к свободному фторхинолону. Эффективность 3Д-матриксных структур отличается от действия свободного фторхинолона не более чем на 10% для образцов со степенью модификации не более 30% и менее чем на 20% для образцов со степенью модификации более 90% для штамма 669 (фиг. 6.а). Для штамма 1467 (фиг. 6.б) эффективность действия 3Д-матриксных структур превосходит действие свободного фторхинолона не более чем на 25% для образцов со степенью модификации не более 30% и менее чем на 10% для образцов со степенью модификации более 90%.
Для исследования пролонгированности действия 3Д-матриксных структур был проанализирован прирост клеточной культуры (увеличение оптической плотности относительно предыдущего дня). Следует отметить, что для штамма E.Coli 669 с ослабленной клеточной стенкой прирост клеточной культуры через 3 дня для 3Д-матриксных структур значительно меньше по сравнению с приростом клеточной культуры в образцах со свободным фторхинолоном. Для штамма E.Coli 1467 с плотной клеточной стенкой наблюдается уменьшение процента прироста клеточной культуры на вторые сутки по сравнению со свободным фторхинолоном. Полученные результаты, по-видимому, свидетельствует о пролонгированности действия 3Д-матриксных структур, которые на 2 и 3 сутки показывают лучшую эффективность по сравнению со свободным препаратом фторхинолона. Таким образом, совокупность экспериментальных данных указывает на значительные преимущества разрабатываемой системы по сравнению о свободными фторхинолонами, а именно эффективность и пролонгированность действия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОЧИЩЕННЫЕ ПРОИЗВОДНЫЕ СУЛЬФОАЛКИЛЬНЫХ ЭФИРОВ ЦИКЛОДЕКСТРИНА ИЛИ ИХ СМЕСЬ, КЛАТРАТНЫЙ КОМПЛЕКС ПРОИЗВОДНЫХ ЦИКЛОДЕКСТРИНА С ЛЕКАРСТВЕННЫМ ВЕЩЕСТВОМ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2113442C1 |
| ЛИПИДНО-ПОЛИМЕРНАЯ СИСТЕМА ОДНОВРЕМЕННОЙ ДОСТАВКИ ДВУХ АНТИБАКТЕРИАЛЬНЫХ СОЕДИНЕНИЙ | 2023 |
|
RU2838145C1 |
| Способ безынъекционного введения лечебных и профилактических препаратов для рыбоводства | 2023 |
|
RU2810583C1 |
| ЛИПОСОМА, ИМЕЮЩАЯ ВНУТРЕННЮЮ ВОДНУЮ ФАЗУ, СОДЕРЖАЩУЮ СОЛЬ СУЛЬФОБУТИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА | 2010 |
|
RU2575793C2 |
| ОЧИЩЕННОЕ ПРОИЗВОДНОЕ ЦИКЛОДЕКСТРИНА, КЛАТРАТНЫЙ КОМПЛЕКС ОЧИЩЕННОГО ПРОИЗВОДНОГО ЦИКЛОДЕКСТРИНА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2099354C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2667010C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЭПИЛЕПСИИ ИЛИ ЭПИЛЕПТИЧЕСКОГО СТАТУСА | 2013 |
|
RU2824132C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КОМПЛЕКСЫ ВКЛЮЧЕНИЯ | 2001 |
|
RU2288921C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУСПЕНЗИИ, СОДЕРЖАЩЕЙ НАНОРАЗМЕРНЫЕ ЧАСТИЦЫ ЛЕКАРСТВА | 2020 |
|
RU2756757C1 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НЕЙРОАКТИВНЫХ СТЕРОИДОВ И СПОСОБЫ ЛЕЧЕНИЯ НАРУШЕНИЙ ЦНС | 2013 |
|
RU2681835C2 |
Группа изобретений относится к области фармацевтической промышленности и биотехнологии, а именно к средству для доставки лекарственного вещества пролонгированного высвобождения, характеризующемуся тем, что представляет собой водорастворимую или образующую коллоидный раствор частицу с размером 100-600 нм, которая имеет 3Д-матриксную структуру, образованную из комплексов производного β-циклодекстрина, содержащего не менее трех свободных гидроксильных групп, и лекарственного соединения, содержащего по меньшей мере один ароматический фрагмент, где производные β-циклодекстрина соединены между собой уретановыми связями; а также к способу получения указанного средства. Осуществление группы обеспечивает пролонгированное действие лекарственного препарата, включенного в частицы. 2 н. и 9 з.п. ф-лы, 6 ил., 2 табл., 14 пр.
1. Средство для доставки лекарственного вещества пролонгированного высвобождения, характеризующееся тем, что представляет собой водорастворимую или образующую коллоидный раствор частицу с размером 100-600 нм, которая имеет 3Д-матриксную структуру, образованную из комплексов производного β-циклодекстрина, содержащего не менее трех свободных гидроксильных групп, и лекарственного соединения, содержащего по меньшей мере один ароматический фрагмент, где производные β-циклодекстрина соединены между собой уретановыми связями.
2. Средство по п. 1, характеризующееся тем, что в качестве производного β-циклодектрина используют 2-гидроксипропил β-циклодекстрин, метил β-циклодекстрин или сульфобутиловый эфир β-циклодекстрина.
3. Средство по п. 1, характеризующееся тем, что в качестве лекарственного соединения, содержащего по меньшей мере один ароматический фрагмент, используют антибактериальный препарат, противоопухолевый препарат или препарат, содержащий тетрапирроидные макроциклы.
4. Средство по п. 3, характеризующееся тем, что антибактериальные препараты выбирают из группы, включающей хинолоны, фторхинолоны, куркумин, изониазид, пиразинамид, бензолсульфаниламиды, хлорамфеникол, тетрациклины.
5. Средство по п. 3, характеризующееся тем, что противоопухолевые препараты выбирают из группы, включающей доксорубицин, паклитаксел, митомицин, метотрексат, даунорубицин.
6. Средство по п. 3, характеризующееся тем, что препарат, содержащий тетрапирроидные макроциклы, выбирают из группы, включающей гемин хлорид, аргинат гема, хлорины.
7. Способ получения средства для доставки лекарственного вещества пролонгированного высвобождения по п. 1, характеризующийся тем, что смешивают водный раствор производного β-циклодектрина и водный раствор лекарственного вещества, полученную смесь нагревают до температуры 37,0–42,0°С, при активном перемешивании добавляют полярный органический растворитель, смешивающийся с водой в количестве, необходимом для достижения объемного соотношения вода : полярный органический растворитель в конечном растворе не менее 50% по объему, затем при активном перемешивании вносят раствор гексаметилендиизоцианата в том же органическом растворителе, взятом из расчета, что мольное соотношение гексаметилендиизоцианат : производное β-циклодекстрина находится в диапазоне от 0,1 до 5, полученную реакционную смесь выдерживают до прекращения изменения мутности смеси и проводят очистку полученного продукта от органического растворителя и непрореагировавших реагентов.
8. Способ по п. 7, характеризующийся тем, что β-циклодектрин и лекарственное вещество берут в мольном соотношении из расчета, что на один ароматический фрагмент лекарственной молекулы берут не менее одной молекулы производного β-циклодектрина.
9. Способ по п. 7, характеризующийся тем, что реакционную смесь выдерживают при перемешивании при комнатной температуре не менее 1 часа.
10. Способ по п. 7, характеризующийся тем, что полярный органический растворитель, смешивающегося с водой, выбирают из ряда, включающего диметилсульфоксид (ДМСО), диметилформамид (ДМФА), диметилфумарат (ДМФ), ацетонитрил.
11. Способ по п. 7, характеризующийся тем, что дополнительно полученную наноразмерную частицу очищают от органического растворителя и примесей реагентов методом диализа с использованием фильтров с размерами пор не более 100 нм или центрифужного концентратора.
| WO 2013045729 A1, 04.04.2013 | |||
| ANNE J.M | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| - Vol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - P | |||
| НАПОЛЬНЫЙ МАНИПУЛЯТОР ДЛЯ ПЕРЕДАЧИ БАНДАЖНЫХ ЗАГОТОВОК С ПРЕССА НА ПРОКАТНЫЙ СТАН | 0 |
|
SU180942A1 |
| Вертикальный выпарной аппарат со ступенчатым давлением | 1931 |
|
SU40962A1 |
| WO 2006048639 A1, 11.05.2006 | |||
| WO 9412217 A1, 09.06.1994. | |||
Авторы
Даты
2021-01-12—Публикация
2019-08-30—Подача