Область техники, к которой относится изобретение
Настоящее изобретение относится к области биоразлагаемых, биосовместимых и биологически активных изделий для медицины и экспериментальной биологии, обладающих дополнительным терапевтическим эффектом за счет биологической активности живых пробиотических бактерий, культивируемых in situ в биоинженерной конструкции, помещенной в область повреждения стенки желудочно-кишечного тракта, для лечения некоторых хронических заболеваний желудочно-кишечного тракта, таких как язвенная болезнь двенадцатиперстной кишки, неспецифический язвенный колит, ишемический колит, болезнь Крона, а также операционные вмешательства на кишечнике с локальным удалением тканей и их осложнения, а также для создания экспериментальных моделей этих заболеваний с целью разработки новых лекарственных и диагностических средств для их лечения. Заявляемый способ позволяет создать медицинское изделие для регенеративной медицины нового типа, где активным действующим началом служат пробиотические бактерии, и может использоваться в биотехнологии, тканевой инженерии, регенеративной медицине, и может использоваться в биотехнологии, тканевой инженерии, регенеративной медицине
Уровень техники
Хронические воспалительные заболевания толстого и тонкого кишечника, такие как язвенная болезнь двенадцатиперстной кишки, неспецифический язвенный колит, ишемический колит, болезнь Крона, а также операционные вмешательства на кишечнике с локальным удалением тканей и их осложнения могут стать причиной образования прободных язв и свищей. Такие повреждения стенки кишечника являются очень серьезной патологией и могут привести к развитию перитонита и смерти, поэтому они практически всегда требуют проведения хирургического лечения. В настоящее время при проведении хирургических операций на тонком и толстом кишечнике все чаще используют заплаты кишечника и эндопротезы (плати, стенты) из биоразлагаемых полимеров, предназначенных для закрытия дефекта тканей стенки кишечника и их регенерации. Однако, недостатками таких медицинских изделий часто являются недостаточная совместимость с окружающими тканями, неспособность к биоразложению с заданными сроками и отсутствие длительного терапевтического воздействия на область дефекта ткани с целью ее регенерации, что связано с использованием полимерных материалов синтетического происхождения, которые обладают плохой биосовместимостью как с тканями стенки кишечника, так и с пробиотическими бактериями, обладающими терапевтическим эффектом при восстановлении тканей. Кроме того, такие изделия часто имеют упрощенное строение, не учитывающее морфологические и физиологические особенности слизистой стенки кишечника, что ухудшает их терапевтическую эффективность, или, напротив, избыточно сложную конструкцию, что значительно усложняет их производство [Бонарцев А.П., Воинова В.В., Бонарцева Г.А. Поли-3-оксибутират и микробиота человека. Прикладная биохимия и микробиология, 2018, 54(6), 561-584].
В настоящее время в медицине, фармацевтике и тканевой инженерии активно используются целый ряд природных биополимеров: альгинат, хитозан, декстран, гиалуроновая кислота, агароза, ксантан, хондроитин сульфат, фибрин, коллаген (желатин), фиброин щелка, поли-L-лизин, полиглутаминовая кислота, поли-3-оксиалканоаты [Бонарцев А.П., Воинова В.В., Бонарцева Г.А. Поли-3-оксибутират и микробиота человека. Прикладная биохимия и микробиология, 2018, 54(6), 561-584]. Так, альгинаты, образующие биосовместимые гидрогели, активно используются в медицине, фармацевтике, косметологии и пищевой промышленности, в биотехнологии, например, для инкапсулирования клеток различных культур млекопитающих (фибробластов, миобластов, остеобластов, МСК, хондроцитов и др.), а также в тканевой инженерии для изготовления матриксов для роста клеток различных типов [Lee K.Y., Mooney D.J. Alginate: properties and biomedical applications. Prog. Polym. Sci., 2012, 37(1), 106-126]. Однако зачастую медицинское использование биополимеров никак не учитывает их роль и функции в природе. Так, если в водорослях альгинаты выполняют преимущественно структурно-механическую функцию, то у бактерий, способных к синтезу этого полисахарида родов Azotobacter и Pseudomonas, их функции более разнообразны, но главная из них - защитная. Клетки этих бактерий синтезируют и секретируют этот экзополихасахарид для формирования внешней слизистой оболочки отдельных клеток и их скоплений - цист или биопленок, которые защищают бактериальные клетки от неблагоприятных внешних факторов. Образование биопленки служит главной причиной патогенеза инфекционных заболеваний, вызываемых Pseudomonas aeruginosa, вызывающими опасное инфекционное поражение эпителия легких. Кроме того, бактериальный альгинат обладает устойчивостью к воздействию альгиназ микробиоты кишечника, в отличие от, например, альгината водорослей. Это связано с тем, что бактериальный альгинат отличается от альгинатов, выделенных из водорослей, более высокой молекулярной массой, большим молярным содержанием в полимере остатков гиалуроновых кислот и уровнем ацетилизования гидроксильных групп маннуроновых остатков в положении 2 и 3. Показано, что эти физико-химические свойства бактериальных альгинатов критически важны для формирования биопленки бактериями Pseudomonas sp.В совокупности эти свойства биополимера позволяют создавать такую слизистую оболочку вокруг бактериальной клетки, которая препятствует: расщеплению биопленки альгиназами, проникновению через нее других бактерий, фагоцитозу инкапсулированных бактерий макрофагами и нейтрофилами, воздействию на них цитотоксических лимфоцитов и антител, снижает воздействие на бактериальные клетки токсинов и антибактериальных лекарственных веществ. Кроме того, альгинатный гидрогель биопленки обеспечивает защиту от высыхания, удержание и аккумуляцию питательных веществ, удержание и связывание катионов, аккумуляцию внеклеточных факторов вирулентности бактерий, утилизации продуктов метаболизма других бактерий, стабильность плазмид и эффективность генетического обмена между бактериями, улучшенную межклеточную связь, создание и поддержание микросреды [Ghafoor А., Hay I.D., Rehm В.Н. Role of exopolysaccharides in Pseudomonas aeruginosa biofilm formation and architecture. Appl. Environ. Microbiol., 2011, 77(15), 5238-5246]. Более того, последние исследования свидетельствуют о том, что и другие бактерии используют альгинаты, синтезируемые P. aeruginosa для формирования своего собственного биофильма [Scoffield J.A., Duan D., Zhu F., Wu H. A commensal streptococcus hijacks a Pseudomonas aeruginosa exopolysaccharide to promote biofilm formation. PLoS Pathog., 2017, 13(4), е1006300]. Показано также, что формирование биопленки патогенными бактериями играет важную роль в процессах заживления и хронического воспаления повреждений эпителия. Отдельные представители микрофлоры эпителия, такие как Staphylococcus epidermidis, Proteus mirabilis, Pseudomonas aeruginosa, Enterococcus faecalis (durans), Escherichia coli, Fusobacterium sp.образуют биопленки, которые представляют собой толстый слизистый барьер, защищающий микроорганизмы от внешних угроз, что ухудшает регенерацию поврежденного эпителия [Percival S.L., McCarty S.M., Lipsky В. Biofilms and Wounds: An Overview of the Evidence. Adv. Wound Care (New Rochelle), 2015, 4(7):373-381].
В последние годы все больше данных свидетельствует о том, что микробиота человека играет важную роль в процессах регенерации эпителия, в т.ч. слизистой стенки кишечника при ее повреждении, и эта роль далеко не всегда негативная. Показано, что микробиота активирует и поддерживает врожденный иммунитет, важна для нормального функционирования иммунной системы, регулирует воспалительные процессы. Показано, что изменения в составе микробиоты кишечника связаны с возникновением различных патологических состояний, в том числе воспалительных заболеваний кишечника, астмы, сахарного диабета I типа, ожирения, сердечно-сосудистых заболеваний и психиатрических отклонений [Aron-Wisnewsky J., Clement K. The gut microbiome, diet, and links to cardiometabolic and chronic disorders. Nat. Rev. Nephrol., 2016, 12(3): 169-181]. Более того, бактерии могут не только противодействовать заживлению эпителиальных тканей, в частности слизистой оболочки кишечника, но и способствовать ему [Uchida М., Shimizu K., Kurakazu K. Yogurt containing Lactobacillus gasseri OLL 2716 (LG21 yogurt) accelerated the healing of acetic acid-induced gastric ulcer in rats. Biosci. Biotechnol. Biochem., 2010, 74(9), 1891-1894; Lam E.K., Yu L., Wong H.P., Wu W.K., Shin V.Y., Tai E.K., So W.H., Woo P.C., Cho C.H. Probiotic Lactobacillus rhamnosus GG enhances gastric ulcer healing in rats. Eur. J. Pharmacol., 2007, 565(1-3), 171-179]. Альгинаты, выделенные из водорослей, использовались для инкапсулирования пробиотических бактерий микробиоты кишечника, в этих исследованиях было показано сохранение жизнеспособности бактерий и положительный эффект инкапсулирования бактерий для терапии заболеваний кишечника при их применении в качестве пробиотиков [D'Orazio G., Di Gennaro P., Boccarusso M., Presti I., Bizzaro G., Giardina S., Michelotti A., Labra M., La Ferla B. Microencapsulation of new probiotic formulations for gastrointestinal delivery: in vitro study to assess viability and biological properties. Appl Microbiol Biotechnol. 2015, 99(22), 9779-9789].
Таким образом, учитывая актуальность исследований по разработке материалов медицинского назначения для восстановления дефектов различных тканей и исследований терапевтического потенциала пробиотических бактерий для регенерации тканей особенно актуальными техническими решениями являются те, которые связаны с разработкой конструкции на основе бактериальных полимеров, служащей для обеспечения жизнеспособности, роста и терапевтической активности пробиотических бактерий для регенерации тканей стенки кишечника. Такой способ позволяет создать медицинское изделие для регенеративной медицины нового типа, где активным действующим началом служат пробиотические бактерии, и может использоваться в биотехнологии, тканевой инженерии, регенеративной медицине.
Из уровня техники известна композиция на основе бактериальных экзополисахаридов, а именно геллановой камеди. Данная композиция, преимущественно для перорального введения, может также содержать агент, улучшающий состояние желудочно-кишечного тракта [RU2563137, 20.09.2015]. Заявлено, что данное изобретение представляет способы и композиции для профилактики или лечения диареи у млекопитающего. К недостаткам данной композиции и способа можно отнести то, что для композиции не показана ее способность улучшать жизнеспособность пробиотических бактерий, а способ не позволяет проводить локальное направленное терапевтическое воздействие на поврежденные ткани стенки пищеварительного тракта.
Из уровня техники известен способ получения препарата с контролируемым высвобождением, способного высвобождать в верхней части тонкого кишечника 99% или более слаборастворимого лекарственного средства [US6274174B1, 14.08.2001]. Заявлено, что изобретателям удалось установить способ получения слаборастворимого лекарственного средства на агрегатах сферических микрочастиц альгината мультивалентного металла, в котором каждая из вторичных частиц имеет удельную площадь от 1 до 280 м2/г. Недостатком данной композиции является ее неспособность улучшать жизнеспособность пробиотических бактерий, а также способ не позволяет проводить локальное направленное терапевтическое воздействие на поврежденные ткани стенки пищеварительного тракта и не предназначен для инкапсулирования в качестве биоактивного агента пробиотических микроорганизмов.
Из уровня техники известна композиция, состоящая из гидрогеля на основе коллагенового матрикса в сочетании с полоксамером или альгинатом и заключенных в нем вирусных векторов [US6333194B1, 25.12.2001]. Как заявлено, данное изобретение направленно на таргетное заживление различных типов тканей или клеток по принципу непосредственной доставки данной композиции к месту повреждения, поэтому такая композиция может относится к области фармакологии. Недостатком такой композиции является то, что некоторые виды вирусов, которые могут доставляться в комбинации, а именно, лентивирусы аденовирусы или вирус герпеса могут вызывать инсерционный мутагенез, по причине случайного встраивания в геном клеток хозяина, также они обладают цитотоксичностью и иммуногенностью, что также нежелательно при терапии живых объектов.
Из уровня техники известно о биополимерном материале в виде микросфер с высокой пористостью на основе поли-3-оксибутирата, полученных методом бактериального биосинтеза, обладающих свойствами биосовместимости и биодеградации, обладающих способностью к контролируемой сорбции и последующему пролонгированному высвобождению положительно заряженного терапевтического белка при введении микросфер в различные ткани, что может быть использовано в регенеративной медицине для длительной терапии повреждений различных тканей. Однако, недостатком данной композиции является ее неспособность улучшать жизнеспособность пробиотических бактерий [RU2692768, 29.12.2017].
Из уровня техники известно о полимерной композиции в виде микрокапсул из различных биоматериалов, в том числе полисахаридов, включая альгинат, содержащих пробиотические бактерии, и помещенных в гель. Недостатками этого материала являются жесткие способы инкапсулирования пробиотических бактерий, что снижает их жизнеспособность; использование большого количества различных материалов, что может снижать биосовместимость материала; и быстрый срок разрушения при температуре 37±1°С [RU2652277, 13.04.2017].
Эта композиция может быть выбрана в качестве наиболее близкого аналога по числу общих сходных признаков.
Раскрытие изобретения
Технической задачей (изобретения), является получение биоинженерной конструкции, состоящей из пористого матрикса на основе бактериального поли-3-оксиалканоата, заполненной гидрогелем из бактериального альгината, в который помещены живые пробиотические бактерии, обладающие антагонистической активностью, что обеспечивает их рост in situ в условиях агрессивной среды желудочно-кишечного тракта при различных его заболеваниях и замещение ими патогенной микрофлоры в области повреждения тканей. Это может быть использовано для лечения различных заболеваний желудочно-кишечного тракта благодаря терапевтической функциональности пробиотиков.
Техническим результатом является получение гибридной биоинженерной конструкции на основе пробиотических бактерий и бактериальных полимеров (поли-3-оксиалканоата и альгината), обеспечивающего не менее 95% выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в материале [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»], а также увеличение их защиты (повышение выживаемости бактерий не менее чем на 50%) в неблагоприятной среде при сохранении биосовместимости (отсутствии цитотоксичности) конструкции in vitro.
Технический результат достигается биоинженерной конструкцией для пробиотических бактерий, представляющей собой расположенный на пористой подложке слой из пористых микросфер в гидрогеле, при этом пористая подложка или пористая подложка с микросферами выполнена из поли-3-оксибутирата и/или его сополимера с 3-оксивалератом с молекулярной массой от 1×104 до 2×106 г/моль и характеризуется наличием сквозных пор (или связанных пор), общей пористостью от 75 до 99%, средним диаметром пор от 0,5 до 20 мкм, где поры заполнены гидрогелем, содержащим пробиотические бактерии, при этом гидрогель выполнен из бактериального альгината с молекулярной массой от 105 до 106 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере от 31 моль % до 48 моль % и уровнем ацетилирования - от 10 моль % до 46 моль %. При этом подложка выполнена толщиной от 10 мкм до 5 см, а диаметр микросфер составляет от 2 до 2000 мкм, микросферы размещены в несколько рядов - от одного до пяти. Также возможен вариант выполнения конструкции в виде трубки, полученной сворачиванием подложки. Бактериальный альгинат является продуктом биосинтеза бактерий рода Azotobacter. В качестве пробиотических бактерий использованы бактерии Lactobacillus и/или Bifidobacterium, или их генетические модификации, в соотношении по числу КОЕ от 1:999 до 999:1. Дополнительно биоинженерная конструкция может содержать, по меньшей мере, одно фармакологически активное вещество, обладающие противовоспалительным действием и стимулирующее регенерацию тканей стенки кишечника, например, симвастатин, куркумин, росвератрол, при этом фармакологически активное вещество находится непосредственно в смеси с поли-3-оксиалканоатом в концентрации от 0,01% до 50% (вес.) лекарственного вещества в полученном полимерном изделии.
Также технический результат достигается способом получения заявляемой биоинженерной конструкции, заключающийся в том, что включает следующие этапы:
- микробиологический биосинтез бактериального альгината с использованием штамма-продуцента рода Azotobacter,
- получение пористой подложки из поли-3-оксибутирата и/или его сополимера с 3-оксивалератом,
- выращивание пробиотических бактерий родов Lactobacillus и Bifidobacterium в бактериальном альгинате,
- заполнение пористой подложки альгинатом с бактериями,
- гелирование бактериального альгината in situ путем добавления водного раствора хлорида кальция.
При этом получение пористого изделия из поли-3-оксиалканоата получают одним из следующих методов: лиофилизация, высушивание, выщелачивание, эмульгирование, электроформование, быстрое прототипирование, лазерная резка. Перед заполнением пористого матрикса гидрогелем в бактериальном альгинате, составляющем его основу, выращены живые пробиотические бактерии до содержания не мнее 1×107 КОЕ/мл. Дополнительно на этапе получения пористого матрикса из поли-3-оксиалканоата в него может быть введено по меньшей мере одно фармакологически активное вещество.
В качестве полимерного материала для изготовления каркасной пористой подложки биоинженерной конструкции выбраны биоразлагаемые и биосовместимые полимеры: поли-3-оксибутират (ПОБ) и сополимер поли-3-оксибутирата с 3-оксивалератом (ПОБВ) различной молекулярной массы (от 1×103 до 2×106), а в случае сополимера - с различным содержанием мономеров 3-оксивалерата (от 0 до 30%). Разработан эффективный метод контролируемого микробиологического получения биосовместимых и биоразлагаемых полимеров, относящихся к классу поли-3-оксиалканоатов. Разработанный способ биосинтеза ПОБ и его сополимеров позволяет получать полимер с заданным узким распределением молекулярной массы и с заданным мономерным составом. Для этого в ходе биосинтеза штаммы-продуценты биополимера видов Azotobacter chroococcum и Azotobacter vinelandii (например, A. chroococcum 7Б) выращивают на питательной среде, содержащей сахарозу в качестве источника углерода, минеральные соли и дополнительный источник углерода (предшественник мономеров в составе сополимера ПОБ или регулятор молекулярной массы): ацетат натрия, соли карбоновых кислот (пропионовой, валериановой) в определенной концентрации, а также при различной рН среды и при различном уровне аэрации [RU2194759, 20.12.2002; RU2201453, 27.03.2003; RU2307159, 27.09.2007; Bonartsev А.Р., Zharkova I.I., Yakovlev S.G., Myshkina V.L., Mahina Т.К., Voinova V.V., Zemov A.L., Zhuikov V.A., Akoulina E.A., Ivanova E.V., Kuznetsova E.S., Shaitan K.V., Bonartseva G.A. Biosynthesis of poly(3-hydroxybutyrate) copolymers by Azotobacter chroococcum 7B: a precursor feeding strategy. Preparative Biochemistry and Biotechnology, 2017, 47(2), 173-184]. Использование этих биополимеров для разработки новых лекарственных изделий представляется многообещающим, ввиду их уникальных свойств: высокой биосовместимости как с тканями и органами, так и бактериями микробиоты человека, способности к полному биоразложению с контролируемой скоростью при одновременно относительной устойчивости к агрессивной среде желудочно-кишечного тракта, способности стимулировать регенерацию различных тканей и препятствовать развитию патогенной микрофлоры [Бонарцев А.П., Воинова В.В., Бонарцева Г.А. Поли-3-оксибутират и микробиота человека. Прикладная биохимия и микробиология, 2018, 54(6), 561-584].
Полимерный материал гидрогеля, служащего субстратом для обеспечения жизнеспособности и роста пробиотических бактерий и предназначенного для заполнения пористой подложки и/или микросфер - бактериальный альгинат получают способом контролируемого микробиологического биосинтеза также с использованием штамм-продуцента этого биополимера Azotobacter chroococcum 7Б [RU2194759, 20.12.2002; Бонарцева Г.А., Акулина Е.А., Мышкина В.Л., Воинова В.В., Махина Т.К., Бонарцев А.П. Биосинтез альгинатов бактериями рода Azotobacter. Прикладная биохимия и микробиология, 2017, 53(1), 61-68]. Для поддержания культуры бактерий используют твердую питательную среду Эшби, следующего состава (г/л): K2HPO4 - 1,05; KH2PO4 - 0,2; MgSO4 - 0,2; NaCl - 0,2; Na2MoO4 - 0,006; СаСО3 - 5,0; сахароза - 20, агар - 20. Для биосинтеза альгината штамм-продуцент A. chroococcum 7Б культивируют в жидкой среде Берка следующего состава (г/л): KH2PO4 - от 0,05 до 1,00; K2HPO4 - от 0,05 до 1,00; MgSO4 - 0,4; NaCl - 0,1; FeSO4 - 0,01; Na2MoO4 - 0,06; CaCl2 - 0,1; цитрат натрия - 0,5; сахароза - от 20 до 40. Сначала готовят посевной материал, для чего штамм-продуцент А. chroococcum 7Б выращивают в жидкой среде Берка указанного состава в качалочных колбах объемом 750 мл (со 100 мл среды) при 250 об./мин (исходный рН среды - 7,2; температура культивирования - 28°С) в течение 24 часов. Затем проводят биосинтез альгината штаммом-продуцентом A. chroococcum 7Б, для чего его культивируют в той же среде после внесения 4% (об.) посевного материала возрастом 24 часа в качалочных колбах на 750 мл (объем культуральной среды - 100 мл) на микробиологической качалке Innova 43 («New Brunswick Scientific», США) при скорости перемешивания от 200 до 400 об./мин в течение 72 часов. Все процедуры проводят в стерильных условиях.
Для выделения альгината проводят обработку биомассы штамма-продуцента 0,9% NaCl и 50 мМ ЭДТА, после чего проводят центрифугирование при 15000 g 30 мин. Осадок отделяют и промывают водой. Затем к нему добавляют 3-кратный объем 96% этилового спирта. Осадок снова отделяют и промывают водой. После этого проводят очистку полученного альгината. Для этого альгинат снова осаждают 3-кратным объемом 96% этилового спирта и проводят диализ против 0.5% NaCl в течение 24 h. Осадок снова отделяют и высушивают при помощи лиофильной сушки. Полученный порошок хранят при 4°С не более 3-х месяцев.
Разработанный способ биосинтеза альгината позволяет получать полимер со следующим сочетанием параметров: молекулярной массой (определяемой методом визкозиметрии) от 105 до 106 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере от 31 моль % до 48 моль % и уровнем ацетилирования - от 10 моль % до 46 моль % (определяемых методом ИК-спектроскопии). Такие параметры бактериального альгината близки свойствам бактериального альгината, образующего бактериальную биопленку [Boyd A., Chakrabarty A.M. Pseudomonas aeruginosa biofilms: role of the alginate exopolysaccharide. J. Ind. Microbiol., 1995, 15(3), 162-168; Nivens D.E., Ohman D.E., Williams J., Franklin M.J. Role of alginate and its О acetylation in formation of Pseudomonas aeruginosa microcolonies and biofilms. J. Bacteriol., 2001, 183(3), 1047-1057; Tielen P., Strathmann M., Jaeger K.E., Flemming H.C., Wingender J. Alginate acetylation influences initial surface colonization by mucoid Pseudomonas aeruginosa. Microbiological Research, 2005, 160(2), 165-176; Ghafoor A., Hay I.D., Rehm B.H. Role of exopolysaccharides in Pseudomonas aeruginosa biofilm formation and architecture. Appl. Environ. Microbiol., 2011, 77(15), 5238-5246].
После получения бактериального альгината изготавливают различные варианты биоинженерной конструкции в несколько этапов.
На 1-ом этапе изготавливают пористые полимерные микросферы. Для этого готовят раствор ПОБ или ПОБВ в хлороформе или метиленхлориде в концентрации полимера от 50 до 200 мг/мл (масс). Готовят 5±1% (масс.) суспензию карбоната аммония в воде и гомогенизируют ее на роторном гомогенизаторе 5±1 минут при 15000±2000 об/мин до достижения стабильной суспензии, после чего переносят ее полностью в стеклянный стакан с раствором ПОБ или ПОБВ в хлороформе или метиленхлориде. После чего гомогенизируют еще 20±5 минут при 15000±2000 об/мин до получения стабильной эмульсии. Затем готовят в стеклянном стакане 1±0,5% (масс.) раствор поливинилового спирта (ПВС) в дистиллированной воде, с помощью верхнеприводной мешалки с перемешивающим элементом пропеллерного типа перемешивают раствор при скорости от 250 до 1000 об/мин (от чего зависит диаметр и пористость образуемых микросфер) и при этом постоянном перемешивании в него добавляют по каплям полученную сложную коллоидную смесь. Перемешивание проводят до полного испарения хлороформа, ориентировочно более 3±0,5 часов. Затем перемещают стакан на магнитную мешалку с подогревом и перемешивают еще 35±5 мин при температуре 35±5°С для полного разложения порообразователя и выхода газов, что выражается в виде образования пузырьков газа, а также для дополнительной отгонки хлороформа; прекращение выделения газа можно протестировать при помощи влажной стандартной индикаторной бумаги (Химмед, РФ) по отсутствию щелочной реакции, которую дает образующийся аммиак. Затем жидкость, содержащую сформированные полимерные микросферы, центрифугируют на настольной центрифуге при 500±100 об/мин для отделения микросфер от раствора эмульгатора ПВС, супернатант максимально отбирают. Полученные микросферы промывают от эмульгатора и других примесей 3-4 раза дистиллированной водой, качество отмывки проверяют при помощи влажной стандартной индикаторной бумаги (Химмед, РФ) по отсутствию щелочной реакции. Промытые микросферы замораживают в жидком азоте и лиофилизируют с помощью лиофильной сушилки. Полученные микросферы просеивают через лабораторные сита У1-ЕСЛ с тканью из сетки по ГОСТ 6613-86 с размером ячеек 40, 94 мкм, 315 или 900 мкм для дополнительного более точного разделения микросфер по их диаметру.
Пористые подложки изготавливают с помощью модифицированного метода выщелачивания [Bonartsev А.Р. et al. Adhesion and growth of bone marrow mesenchymal stem cells on 3D scaffolds from poly(3-hydroxybutyrate)-poly(ethylene glycol) copolymer. Journal of Biomaterials and Tissue Engineering, 2016, 6(1), 42-52]. Эта модификация основана на температурном разложении твердой соли, в то время как стандартный метод подразумевает вымывание соли растворителем. Раствор ПОБВ с молярным содержанием 3-оксивалерата от 6 до 30 моль % и молекулярной массой от 1.5×105 до 1.5×106 г/моль в хлороформе или метиленхлориде в концентрации от 15 до 30 мг/мл смешивали с порошком бикарбоната аммония с линейными размерами частиц соли в диапазоне 90-300 мкм в соотношении от 20:1 до 5:1 по массе и тщательно перемешивали на вортексе 3±1 мин. Смесь помещают в стеклянный сосуд с плоским дном (например, в чашку Петри) диаметром от 40 до 90 мм и оставляют при комнатной температуре до полного испарения органического растворителя от 2 до 3 часов. После этого форму помещают в подогретую дистиллированную воду (70±5°С) до полного прекращения газообразования, промывают дистиллированной водой 4-6 раз для избавления от примесей, качество отмывки проверяют при помощи влажной стандартной индикаторной бумаги (Химмед, РФ) по отсутствию щелочной реакции. Затем высушивают при 37±1°С в течение 24-30 часов до достижения полученной пористой полимерной пленки постоянной массы.
В одном из исполнений изобретения в пористую подложку вводят лекарственное вещество (ЛВ), обладающие противовоспалительным действием и стимулирующее регенерацию тканей стенки кишечника, например, таких как симвастатин, куркумин, росвератрол [Bereswill S.,  Fischer A., Plickert R., Haag L.M., Otto В.,
Fischer A., Plickert R., Haag L.M., Otto В.,  Loddenkemper С.,
Loddenkemper С.,  Heimesaat M.M. Anti-inflammatory effects of resveratrol, curcumin and simvastatin in acute small intestinal inflammation. PLoS One, 2010, 5(12): e15099]. Для этого готовят раствор ЛВ в хлороформе или метиленхлориде в концентрации от 0,01 до 100 мг/мл и на стадии приготовления раствора ПОБВ в хлороформе добавляют в раствор полимера раствор ЛВ в объеме от 1 мкл до 100 мл для достижения массовой доле ЛВ в полученном полимерном изделии от 0,01% до 50% (вес.). Терапевтические свойства симвастатина для желудочно-кишечного тракта описаны в [Cote-Daigneault J., Mehandru S., Ungaro R., Atreja A., Colombel J.F. Potential Immunomodulatory Effects of Statins in Inflammatory Bowel Disease Inflammatory Bowel Diseases, 2016, 22(3), 724-732].
Heimesaat M.M. Anti-inflammatory effects of resveratrol, curcumin and simvastatin in acute small intestinal inflammation. PLoS One, 2010, 5(12): e15099]. Для этого готовят раствор ЛВ в хлороформе или метиленхлориде в концентрации от 0,01 до 100 мг/мл и на стадии приготовления раствора ПОБВ в хлороформе добавляют в раствор полимера раствор ЛВ в объеме от 1 мкл до 100 мл для достижения массовой доле ЛВ в полученном полимерном изделии от 0,01% до 50% (вес.). Терапевтические свойства симвастатина для желудочно-кишечного тракта описаны в [Cote-Daigneault J., Mehandru S., Ungaro R., Atreja A., Colombel J.F. Potential Immunomodulatory Effects of Statins in Inflammatory Bowel Disease Inflammatory Bowel Diseases, 2016, 22(3), 724-732].
Из полученной пористой пленки вырезают полоски длиной от 1 до 400 мм и шириной от 1 до 400 мм. Полученные полоски обмакивают в хлороформе или метиленлориде путем полного погружения в растворитель 3-4 раза, затем на поверхность пленки, не дожидаясь высыхания, сплошным слоем насыпают полученные ранее микросферы различного диаметра от 10 и до 1000 мкм, равномерно распределяя их шпателем и оставляют сушиться в течение 24-30 часов. В одном из исполнений изобретения полученную полоску с нанесенными на нее микросферами сворачивают с небольшим захлестом (от 5 до 10% от длины) в трубку диаметром от 0,2 мм до 120 мм и длиной от 1 до 400 мм. Края пленки склеивают с помощью раствора 2-3% ПОБ в хлороформе, который с помощью пипетки наносят на край пленки с внешней стороны, после чего сворачивают пленку таким образом, чтобы к нему можно было приложить другой ее край с внутренней стороны, склеив эти края и изготовив таким образом трубку. Готовые изделия промывают дистиллированной водой 4-6 раз для избавления от примесей, качество отмывки проверяют при помощи влажной стандартной индикаторной бумаги (Химмед, РФ) по отсутствию щелочной реакции. Затем высушивают при 37±1°С в течение 24-30 часов до достижения полученной пористой полимерной пленки постоянной массы. Готовые изделия можно нарезать на фрагменты необходимого размера.
Таким образом, биоинженерную конструкцию изготовляют из двух видов бактериальных полимеров - поли-3-оксиалканоата и альгината, получаемых биотехнологическим путем, так, чтобы изделие из одного полимера выполняла каркасную «жесткостную» роль, а второй полимер был бы наполнителем и носителем, в который можно было бы загрузить пробиотические бактерии или какие-то другие клетки или вещества при необходимости.
Поверхность и внутренняя структура микросфер представляет собой сложную систему разветвленных сквозных пор с линейными размерами более 4 мкм, что больше среднего размера бактерий. Создание слоя из таких пористых микросфер может решить задачу не только получения некого каркаса, который можно заполнить альгинатным гидрогелем, содержащим пробиотические бактерии, но позволяет значительно увеличить площадь поверхности и шероховатости конструкции, что является очень важной характеристикой изделий для регенерации различных тканей и способствует проникновению в такую конструкцию питательных веществ и биоактивных молекул, адгезии клеток к изделию, ее срастанию с окружающими живыми тканями, постепенной биодеградации изделия с замещением ее регенерирующей тканью.
На следующем этапе в альгинате, полученном микробиологическим путем выращивают пробиотические бактерии. Сначала культуры бактерий родов Lactobacillus и Bifidobacterium выращивают на полужидкой среде, обеспечивающей рост указанных бактерий. В колбы наливают питательную среду, укупоривают ватно-марлевыми пробками и автоклавируют. При культивировании бактерий рода Lactobacillus готовую среду не хранят. При культивировании бактерий рода Bifidobacterium готовую среду хранят не более 2-х недель в бытовом холодильнике при температуре 5-8°С. Посев осуществляют, как только температура среды после автоклавирования достигает 40°С. Для этого с помощью пипетки, вносят в полужидкую питательную среду 1,0±0,1 мл суспензии бактериальных клеток и перемешивают [Schillinger U., Holzapfel W.H. Chapter 8. Culture media for lactic acid bacteria, p. 127-140. In: Handbook of Culture Media for Food Microbiology. Edited by Janet E.L. Corry, G.D.W. Curtis, Rosamund M. Baird. V. 37, 2003].
Параллельно готовят 1±0,1% (вес.) водный раствор альгината натрия с молекулярной массой от 1.0×105 до 2×106 г/моль, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 25±5°С и скорости перемешивания 40-80 об/мин.
Для посева культуры бактерий рода Lactobacillus готовят жидкую посевную культуру. Для этого в пробирку с культурой, растущей на скошенном MRS-агаре, вносят 3±0,2 мл MRS-бульона. Снимают клетки с поверхности твердой среды путем повторного пипетирования и переносят полученную суспензию в колбу, содержащую 150±10 мл питательной среды на основе бактериального альгината в MRS-бульоне. Колбу с жидкой посевной культурой инкубируют 96±6 часа в аэробных условиях на микробиологической качалке при 37±1°С и скорости перемешивания 120±20 об/мин (диаметр орбиты 1,9 см).
Для посева культуры бактерий рода Bifidobacterium сначала проводят пересев со среды с агар-агаром на среду с альгинатом. Для этого из колбы с 96±6 часовой культурой, растущей в полужидкой среде на агар-агаре, стеклянной серологической пипеткой отбирают 8,0±0,2 мл и вносят в колбу со свежеприготовленной полужидкой средой на основе бактериального альгината в MRS-бульоне. Содержимое колбы перемешивают. Для получения культуры бактерий рода Bifidobacterium в полужидкой среде на дно колбы вносят 4,0±0,2 мл рабочей культуры. Содержимое колбы не перемешивают. После инокуляции колбы укупоривают ватно-марлевыми пробками и для термостатирования помещают в микробиологическую качалку. Инкубируют 96±6 часа при 37±1°С без перемешивания.
В одном из исполнений заявляемого способа используют также генетически модифицированные штаммы бактерий родов Lactobacillus и Bifidobacterium. Данные штаммы можно получать из природных штаммов пробиотических бактерий посредством общепринятых способов генетической трансформации с использованием электрокорпорации, описанные, например, для бактерий из рода Lactobacillus [Serror P., Sasaki Т., Ehrlich S.D., Maguin E. Electrotransformation of Lactobacillus delbrueckii subsp.bulgaricus and L. delbrueckii subsp. lactis with Various Plasmids. Appl Environ Microbiol., 2002, 68(1), 46-52] и для бактерий из рода Bifidobacterium [Argnani A., Leer R.J., van Luijk N., Pouwels P.H. A convenient and reproducible method to genetically transform bacteria of the genus Bifidobacterium. Microbiology, 1996, 142, 109-114].
Наконец, на последнем этапе осуществляют «пропитку» полученных конструкций раствором полученного ранее бактериального капсулярного альгината натрия с биомассой пробиотических бактерий или изготовление из альгината с бактериями сфер в наиболее простом варианте. Для этой процедуры используют 1±0,1% (вес.) водный раствор альгината натрия, содержащий не менее 107 КОЕ/г выращенных в нем бактерии родов Lactobacillus и Bifidobacterium. Конструкцию помещают в этот раствор, а емкость с ним в эксикатор, где создают отрицательное давление (0,7-0,8 атм.) в течение 10 мин для вымещения воздуха из пор микросфер и подложки и замещения его раствором альгината и бактериями, содержащимися в нем, при температуре 25±3°С. Внешне процесс заполнения пор микросфер при этих условиях выглядит как образование множества микропузырьков воздуха вокруг микросфер, при этом раствор альгината заполняет поры микросфер и подложки. Затем проводят гелирование альгината, для чего конструкцию, пропитанную раствором альгината натрия помещают в стеклянный стакан со 100 мл 50±1 мМ водного раствора хлорида кальция на 10±1 мин.
В наиболее простом исполнении заявляемого способа из полученного ранее бактериального капсулярного альгината натрия с выращенной в нем биомассой пробиотических бактерий изготавливают гранулы. Для этого автоматической пипеткой в стеклянный стакан с 50±1 мМ водного раствора хлорида кальция по каплям (10-30 мкл) вносят раствор альгината, содержащего бактерии, полученного ранее описанным способом. В результате образуются гранулы альгината диаметром от 0,2 до 1 мм.
В одном из исполнений заявляемого способа помимо бактерий в альгинат вводят биологически активные вещества, обладающие противовоспалительным действием и стимулирующее регенерацию тканей стенки кишечника, например, такого как интерлейкин 10. Для этого готовят раствор биоактивного вещества в воде в концентрации от 0,01 мкг/л до 100 мг/мл и на стадии завершения выращивания бактерий в бактериальном альгинате добавляют в раствор полимера, содержащего бактерии, раствор ЛВ в объеме от 1 мкл до 100 мл для достижения массовой доле ЛВ в полученном полимерном изделии от 0,00001% до 50% (вес). Терапевтические свойства различных биологически активных веществ, в т.ч. интерлейкина 10 для желудочно-кишечного тракта описаны в [Takedatsu Н., Mitsuyama K., Torimura Т. Nanomedicine and drug delivery strategies for treatment of inflammatory bowel disease. World J. Gastroenterol., 2015, 21(40), 11343-11352, doi: 10.3748/wjg.v21.i40.11343].
Эффективность полученных биоинженерных конструкций оценивали с помощью модельных тестов: теста устойчивости при температуре 37°С, теста устойчивости в симулированной среде кишечника, тестов ферментативной устойчивости, теста устойчивости в среде чужеродных бактерий, теста миграции бактерий из гидрогеля, теста исследования на цитотоксичность in vitro. В качестве препарата-сравнения использовали инкапсулированную форму бактерий в водорослевом альгинате, изготовленную путем диспергирования соответствующих пробиотических бактерий родов Lactobacillus и Bifidobacterium в 2% (об.) растворе водорослевого альгината с последующим получением гранул альгинатного гидрогеля с инкапсулированными в них бактериями с помощью раствора хлорида кальция так, что содержание бактерий в полученных гранулах было таким же как и в тестируемых конструкциях.
Тест устойчивости конструкции при температуре 37±1°С: полученные конструкции, содержащие бактерии, помещают на стеклянную поверхность чашки Петри и помещают в термостат с поддерживаемой в нем температурой 37±1°С. Выдерживают в течение 10±1 мин, после чего извлекают и наблюдают за изменением формы и агрегатного состояния гидрогеля, фиксируя время полной деформации с момента помещения на стеклянную поверхность.
Тест устойчивости в симулированной среде кишечника: полученные биоинженерные конструкции в различных формах (гранулы, микросферы, подложка со слоем микросфер в виде пластины или трубки) помещают в стеклянную колбу со 100 мл симулированной среды кишечника следующего состава: 50 мМ KH2PO4, 10 мг/мл желчных кислот, рН=7,5; проводят инкубацию в течение 150 мин. при 37°С. Полученные биоинженерные конструкции должны обеспечивать не менее чем 50% повышение выживаемости бактерий или не менее 95% абсолютной их выживаемости, оцениваемого по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»].
Тест ферментативной устойчивости с использованием альгинат лиазы в симулированной среде кишечника: полученные биоинженерные конструкции в различных формах (гранулы, микросферы, подложка со слоем микросфер в виде пластины или трубки) помещают в стеклянную колбу со 100 мл симулированной среды кишечника, содержащей альгинат лиазу, следующего состава: 50 мМ KH2PO4, 10 мг/мл желчных кислот, 1 мг/мл альгинат лиаза (Сигма-Алдрич, ≥10000 ед./г), рН=7,5; проводят инкубацию в течение 150 мин. при 37°С. Полученные биоинженерные конструкции ого уполномоченно не менее чем 50% повышение выживаемости бактерий, оцениваемого по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов »].
Тест ферментативной устойчивости с использованием лизоцима в симулированной среде кишечника: полученные биоинженерные конструкции в различных формах (гранулы, микросферы, подложка со слоем микросфер в виде пластины или трубки) помещают в стеклянную колбу со 100 мл симулированной среды кишечника, содержащей лизоцим, следующего состава: 50 мМ KH2PO4, 10 мг/мл желчных кислот, 1 мг/мл лизоцима (Сигма-Алдрич, ≥40000 ед./мг), рН=7,5; проводят инкубацию в течение 150 мин. при 37°С. Полученные биоинженерные конструкции обеспечивают не менее чем 50% повышение выживаемости бактерий, оцениваемого по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»].
Тест устойчивости в среде чужеродных бактерий: полученные биоинженерные конструкции в различных формах (гранулы, микросферы, подложка со слоем микросфер в виде пластины или трубки) в стерильных условиях помещают в коническую колбу на 250 мл на полужидкой среде, состоящей из 200 мл MRS-бульона и 0,3% агар-агара в толщу среды, в которую предварительно внесена культура Е. coli BL21 (GE Healthcare, США), содержимое колбы не перемешивают, после инокуляции колбы укупоривают ватно-марлевыми пробками и для термостатирования помещают в микробиологическую качалку, после чего инкубируют 24±4 часа при 37±1°С без перемешивания. Полученные биоинженерные конструкции обеспечивают не менее чем 50% повышение устойчивости культур бактерий родов Lactobacillus или Bifidobacterium к проникновению в конструкцию чужеродных бактерий Е. coli BL21 или наличие в конструкции не более 5% чужеродных бактерий Е. coli BL21 от общего количества бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов »].
Тест миграции бактерий из биоинженерной конструкции: полученные биоинженерные конструкции, содержащие пробиотические бактерии, в стерильных условиях помещают в коническую колбу на 250 мл на полужидкой среде, состоящей из 200 мл MRS-бульона и 0,3% агар-агара в толщу среды, содержимое колбы не перемешивают, после инокуляции колбы укупоривают ватно-марлевыми пробками и для термостатирования помещают в микробиологическую качалку, после чего инкубируют 24±4 часа при 37±1°С без перемешивания. Полученная биоинженерная конструкция должна обеспечивать распространение бактерий родов Lactobacillus или Bifidobacterium в полужидкой среде, в которую помещена конструкция, на расстояние не менее чем 10 мм от образца гидрогеля, оцениваемое по стандартной методике определения числа КОЕ в среде [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»].
Тест исследования на цитотоксичность in vitro проводили согласно ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro». В качестве культуры клеток используют фибробласты мыши линии Balb/3Т3 и испытание методом прямого контакта. Проводят качественную оценку по баллам. Полученная биоинженерная конструкция не должна быть цитотоксичной (должна иметь балл по шкале цитотоксичности не более «0»).
Изготовление сложносоставной полимерной конструкции, состоящей из пористого каркаса, заполненного гидрогелем, который содержит пробиотические бактерии, обеспечивает биологическую активность, жизнеспособность и рост пробиотических бактерий, выполняющих роль активного терапевтического агента. Такое строение биоинженерной конструкции значительно увеличивает площадь поверхности и внутреннего объема изделия как для обеспечения контакта пробиотических бактерий с поврежденными тканями стенки кишечника, та и для их защиты от патогенной микрофлоры при лечении некоторых хронических заболеваний желудочно-кишечного тракта, таких как язвенная болезнь двенадцатиперстной кишки, неспецифический язвенный колит, ишемический колит, болезнь Крона, а также операционные вмешательства на кишечнике с локальным удалением тканей и их осложнения.
Краткое описание чертежей
Предложенное изобретение характеризуется следующими графическими материалами.
На фиг. 1 представлена схема разработанной биоинженерной конструкции. Конструкция состоит из пористой полимерной подложки (3), на поверхности которой иммобилизированы пористые микросферы (1), которые заполнены альгинатным гидрогелем (2), содержащим пробиотические бактерии (4).
На фиг. 2 представлена морфология поверхности биоинженерной конструкции, широкопольная световая микроскопия, ×400.
Осуществление изобретения
Используемые для получения полимерной пористой подложки и микросфер биоразлагаемые и биосовместимые полимеры: ПОБ и ПОБВ получены методом контролируемого биосинтеза с использованием высокоэффективного штамма-продуцента Azotobacter chroococcum 7Б [RU2194759, 20.12.2002; RU2201453, 27.03.2003; RU2307159, 27.09.2007; Bonartsev А.Р., Zharkova I.I., Yakovlev S.G., Myshkina V.L., Mahina Т.K., Voinova V.V., Zernov A.L., Zhuikov V.A., Akoulina E.A., Ivanova E.V., Kuznetsova E.S., Shaitan K.V., Bonartseva G.A. Biosynthesis of poly(3-hydroxybutyrate) copolymers by Azotobacter chroococcum 7B: a precursor feeding strategy. Preparative Biochemistry and Biotechnology, 2017, 47(2), 173-184]. Для биосинтеза бактериального альгината также использовали штамм-продуцент Azotobacter chroococcum 7Б [Бонарцева Г.А., Акулина Е.А., Мышкина В.Л., Воинова В.В., Махина Т.К., Бонарцев А.П. Биосинтез альгинатов бактериями рода Azotobacter. Прикладная биохимия и микробиология, 2017, 53(1), 61-68]. Оптическую плотность культуральной среды контролировали нефелометрически при 520 нм. Морфологию бактерий рода Azotobacter контролировали при помощи световой микроскопии с использованием микроскопа Биомед-1 («Биомед», Россия) с цифровой камерой. Для визуализации клеток и альгината использовали окраску фуксином. Эффективность очистки бактериального альгината контролируют при помощи измерения проводимости 1% (вес/об.) раствора альгината, используя кондуктометр S30 SevenEasyTM (Mettler Toledo, США). Молекулярную массу бактериального альгината определяют методом вискозиметрии; химическое строение и уровень ацетилирования определяют методом ИК-спектроскопии согласно [Бонарцева Г.А., Акулина Е.А., Мышкина В.Л., Воинова В.В., Махина Т.К., Бонарцев А.П. Биосинтез альгинатов бактериями рода Azotobacter. Прикладная биохимия и микробиология, 2017, 53(1), 61-68].
Все остальные используемые реагенты и штаммы пробиотических бактерий родов родов Lactobacillus и Bifidobacterium являются коммерчески доступными (ООО «Спутник-К»), все процедуры, если не оговорено особо, осуществляют при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С, а культивирование пробиотических бактерий - при температуре 37±1°С. Микроструктуру биоинженерной конструкции (общая пористость, размер пор, диаметр полученных микросфер) контролировали с помощью сканирующей электронной микроскопии с использованием электронного микроскопа JSM-6380LA (Jeol, Япония) с предварительным напылением золота на исследуемые образцы в течение 15 мин с помощью установки IB-3 (Giko, Japan) при силе тока 15 мА и программы обработки изображений Image J. Общую пористость рассчитывали как отношение общего объема связных пор конструкции к ее общему объему. Рост культур контролируют методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, USA), морфологическую однородность проверяют при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой). Определение количества бактерий в полученной биоинженерной конструкции проводят по стандартной методике высева бактерий на плотную агаризованную питательную среду с последующим подсчетом выросших колоний; результаты выражают в колониеобразующих единицах (КОЕ) на 1 мл (КОЕ/мл) согласно [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»]. Термины: «биологически активный», «биоинженерный», «пробиотические бактерии», «пробиотики», «культивирование», «биосовместимый», «биоразлагаемый», «терапевтический» употребляются в соответствии с их общепринятыми определениями [Биосовместимые материалы: Учебное пособие / Под. ред. В.И. Севостьянова, М.П. Кирпичникова. Москва. Медицинское информационное агентство, 2011, 540 стр.; Пробиотики и пребиотики / Всемирная гастроэнтерологическая организация (WGO). Практические рекомендации. 2008. http://www.gastroscan.ru/literature/authors/5634].
Настоящее изобретение поясняется конкретными примерами выполнения, которые не являются единственно возможным, но наглядно демонстрирует возможность достижения требуемого технического результата.
Пример 1.
Изготовление биоинженерной конструкции проводят в несколько последовательных этапов.
На первом этапе способом контролируемого микробиологического биосинтеза также получали бактериальный альгинат. Для поддержания культуры бактерий использовали твердую питательную среду Эшби, следующего состава (г/л): K2HPO4 - 1,05; KH2PO4 - 0,2; MgSO4 - 0,2; NaCl - 0,2; Na2MoO4 - 0,006; СаСО3 - 5,0; сахароза - 20, агар - 20. Для биосинтеза альгината штамм-продуцент A. chroococcum 7Б [Патент РФ №2194759, 20.12.2002; Патент РФ №2201453, 27.03.2003; Патент РФ №2307159, 27.09.2007; Bonartsev А.Р., Zharkova I.I., Yakovlev S.G., Myshkina V.L., Mahina Т.K., Voinova V.V., Zernov A.L., Zhuikov V.A., Akoulina E.A., Ivanova E.V., Kuznetsova E.S., Shaitan K.V., Bonartseva G.A. Biosynthesis of poly(3-hydroxybutyrate) copolymers by Azotobacter chroococcum 7B: a precursor feeding strategy. Preparative Biochemistry and Biotechnology, 2017, 47(2), 173-184] культивировали в жидкой среде Берка следующего состава (г/л): KH2PO4 - 0,05; K2HPO4 - 0,05; MgSO4 - 0,4; NaCl - 0,1; FeSO4 - 0,01; Na2MoO4 - 0,06; CaCl2 - 0,1; цитрат натрия - 0,5; сахароза - 40. Сначала готовили посевной материал, для чего штамм-продуцент A. chroococcum 7Б выращивали в жидкой среде Берка указанного состава в качалочных колбах объемом 750 мл (со 100 мл среды) при 250 об./мин (исходный рН среды - 7,2; температура культивирования - 28°С) в течение 24 часов. Затем проводили биосинтез альгината штаммом-продуцентом A. chroococcum 7Б, для чего его культивировали в той же среде после внесения 4% (об.) посевного материала возрастом 24 часа в качалочных колбах на 750 мл (объем культуральной среды - 100 мл) на микробиологической качалке Innova 43 («New Brunswick Scientific», США) при скорости перемешивания 400 об./мин в течение 72 часов. Все процедуры проводили в стерильных условиях. Для выделения альгината проводили обработку биомассы штамма-продуцента 0,9% NaCl и 50 мМ ЭДТА, после чего проводили центрифугирование при 15000 g 30 мин. Осадок отделяли и промывали водой. Затем к нему добавляли 3-кратный объем 96% этилового спирта. Осадок снова отделяли и промывали водой. После этого проводили очистку полученного альгината. Для этого альгинат снова осаждали 3-кратным объемом 96% этилового спирта и проводили диализ против 0.5% NaCl в течение 24 h. Осадок снова отделяли и высушивали при помощи лиофильной сушки. Полученный порошок хранят при 4°С не более 3-х месяцев. Полученный альгинат обладал следующим сочетанием параметров: молекулярной массой (определяемой методом визкозиметрии) 1×105 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере - 36% и уровнем ацетилирования - 23% (определяемых методом ИК-спектроскопии).
На 2-ом этапе выращивали пробиотические бактерии Lactobacillus plantarum 8Р-А3 (ООО «Спутник-К»). На полужидкой среде культуру L. plantarum 8Р-А3 выращивали в конических колбах на 250 мл, содержащих 200 мл MRS-бульона и 0,3% агар-агара. В колбы наливали питательную среду, укупоривали ватно-марлевыми пробками и автоклавировали. Готовую среду не хранят. Посев осуществляли, как только температура среды после автоклавирования достигала 40°С.
Для посева готовят жидкую посевную культуру. Для этого в пробирку с культурой, растущей на скошенном MRS-arape, вносили 3 мл MRS-бульона. Снимали клетки с поверхности твердой среды путем повторного пипетирования и переносили полученную суспензию в колбу, содержащую 150 мл питательной среды. Колбу с жидкой посевной культурой инкубировали 96 часа в аэробных условиях на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). Рост культуры контролировали методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, торговая марка Microsoft Corporation, USA.), морфологическую однородность проверяли при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой).
В конической колбе на 250 мл готовили 1% (вес.) раствор альгината, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 60°С и скорости перемешивания 60 об/мин. Для получения биомассы L. plantarum на жидкой среде в аэробных условиях 6 мл жидкой посевной культуры (5×108 КОЕ/г) вносили в коническую колбу, содержащую полученный 1% раствор альгината в 150 мл MRS-бульона, и инкубировали 96 час на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). После окончания инкубации биомассу осаждали центрифугированием 15 мин при 10000g на центрифуге «Beckman J2-21». Супернатант сливали. Все процедуры проводили в стерильных условиях.
Из полученного таким образом ранее бактериального капсулярного альгината натрия с выращенной в нем биомассой пробиотических бактерий изготавливали гранулы. Для этого автоматической пипеткой на 100 мкл в стеклянный стакан со 100 мл 50 мМ раствора хлорида кальция по каплям (10-30 мкл) вносили раствор альгината, содержащего бактерии.
Полученные гранулы имели диаметр от 0,2 до 1 мм и содержали пробиотические бактерии в концентрации 2,1×108 КОЕ/г бактерий L. plantarum 8Р-А3. Таким образом, произошло увеличение содержания живых бактерий в гранулах против первоначального (1,9×107 КОЕ/г) в 11,1 раза по сравнению с падением содержания бактерий в композиции, описанной в патенте-прототипе, в 11 раз с 1×108 КОЕ/г до 8,8×106 КОЕ/г.
Тест устойчивости конструкции при температуре 37°С показал отсутствие ее деформации. В тесте устойчивости в симулированной среде кишечника полученная конструкция обеспечивала сохранение 2,1×108 КОЕ/г бактерий L. plantarum 8Р-А3, т.е 98% выживаемость бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием альгинат лиазы в симулированной среде кишечника полученная конструкция обеспечивала 51% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием лизоцима в симулированной среде кишечника полученные конструкции обеспечивали 59% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте ферментативной устойчивости с использованием липазы в симулированной среде кишечника полученные конструкции обеспечивали 61% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте устойчивости в среде чужеродных бактерий полученные биоинженерные конструкции обеспечивали присутствие не более 3% чужеродных бактерий Е. coli BL21. В тесте миграции бактерий из гидрогеля гидрогель обеспечивал распространение бактерий на расстояние 8 мм от образца. Оценка всех тестов проводилась по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»]. Тест исследования на цитотоксичность in vitro полученной конструкции показал, что он не является цитотоксичным, а именно, обладает баллом «0» по шкале цитотоксичности [ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro»].
Пример 2.
Изготовление биоинженерной конструкции проводят в несколько последовательных этапов.
На первом этапе способом контролируемого микробиологического биосинтеза также получают бактериальный альгинат. Для поддержания культуры бактерий используют твердую питательную среду Эшби, следующего состава (г/л): K2HPO4 - 1,05; KH2PO4 - 0,2; MgSO4 - 0,2; NaCl - 0,2; Na2MoO4 - 0,006; СаСО3 - 5,0; сахароза - 20, агар - 20. Для биосинтеза альгината штамм-продуцент A. chroococcum 7Б культивируют в жидкой среде Берка следующего состава (г/л): KH2PO4 - 0,05; K2HPO4 - 0,05; MgSO4 - 0,4; NaCl - 0,1; FeSO4 - 0,01; Na2Mo04 - 0,06; CaCl2 - 0,1; цитрат натрия - 0,5; сахароза - 20. Сначала готовят посевной материал, для чего штамм-продуцент A. chroococcum 7Б выращивают в жидкой среде Берка указанного состава в качалочных колбах объемом 750 мл (со 100 мл среды) при 250 об./мин (исходный рН среды - 7,2; температура культивирования - 28°С) в течение 24 часов. Затем проводят биосинтез альгината штаммом-продуцентом A. chroococcum 7Б, для чего его культивируют в той же среде после внесения 4% (об.) посевного материала возрастом 24 часа в качалочных колбах на 750 мл (объем культуральной среды - 100 мл) на микробиологической качалке Innova 43 («New Brunswick Scientific», США) при скорости перемешивания 200 об./мин в течение 72 часов. Все процедуры проводят в стерильных условиях. Для выделения альгината проводят обработку биомассы штамма-продуцента 0,9% NaCl и 50 мМ ЭДТА, после чего проводят центрифугирование при 15000 g 30 мин. Осадок отделяют и промывают водой. Затем к нему добавляют 3-кратный объем 96% этилового спирта. Осадок снова отделяют и промывают водой. После этого проводят очистку полученного альгината. Для этого альгинат снова осаждают 3-кратным объемом 96% этилового спирта и проводят диализ против 0.5% NaCl в течение 24 h. Осадок снова отделяют и высушивают при помощи лиофильной сушки. Полученный порошок хранят при 4°С не более 3-х месяцев.
Полученный альгинат обладает следующим сочетанием параметров: молекулярной массой (определяемой методом визкозиметрии) 2,6×105 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере - 46% и уровнем ацетилирования - 24% (определяемых методом ИК-спектроскопии).
На 2-м этапе готовят рабочие растворы бактериальных полимеров. Готовят раствор поли-3-оксибутирата (ПОБ) с молекулярной массой 3.2×105 г/моль, полученного бактериальным биосинтезом, в общей концентрации 112,5 мг/мл (вес./об.) в объеме 8 мл в стеклянном стакане на 50 мл, для чего готовят навеску в 90 мг. Готовят раствор поли-3-оксибутират-со-3-оксивалета (ПОБВ) с молярным содержанием 3-оксивалерата 17,6% и с молекулярной массой 1.15×106 г/моль, полученного бактериальным биосинтезом, в концентрации 24 мг/мл в хлороформе в общей концентрации 112,5 мг/мл (вес./об.) в объеме 8 мл в стеклянном стакане на 50 мл, для чего готовят навеску в 90 мг.
На 3-м этапе изготавливают пористые подложки биоинженерной конструкции модифицированным методом выщелачивания. Раствор ПОБВ 17,6% 1150 кДа в хлороформе в концентрации 24 мг/мл смешивают с порошком бикарбоната аммония (с размером частиц соли в диапазоне 90-300 мкм в соотношении 10:1 по массе и тщательно перемешивают шпателем. Смесь помещают в стеклянную чашку Петри диаметром 5 см и оставляют при комнатной температуре до полного испарения органического растворителя в течение 3-х часов. После этого форму помещают в горячую дистиллированную воду (60°С) до полного прекращения газообразования, промывают дистиллированной водой 5 раз и высушивают при 37°С в течение суток.
На 4-м этапе получают пористые микросферы со средним диаметром 160 мкм при помощи метода «водная фаза/масляная фаза/водная фаза» (W/O/W), с последующим вымыванием порообразователя. В качестве пороборазователя также используют водный раствор карбоната аммония. 21 мл хлороформенного раствора ПОБ 350 кДа в концентрации 40 мг/мл гомогенизировуют с 6,6 мл 5%-го (вес/об.) водного раствора карбоната аммония. Полученный коллоид по каплям добавляют в 210 мл 1%-го (вес./об.) раствора поливинилового спирта при постоянном перемешивании на верхнеприводной мешалке при скорости 750 об/мин. После полного испарения хлороформа частицы отделяют от эмульгатора (ПВС) путем осаждения и промывки дистиллированной водой. Для полного выхода порообразователя, микросферы инкубируют в горячей дистиллированной воде (70°С). Получают микросферы со средним диаметром 160±30 мкм, обладающие сквозной пористостью с пренебрежительно малой долей закрытых пор, общую пористость 94% и средним размером пор 1,8±0,5 мкм Из полученной пористой пленки вырезают кусочки длиной 2,5 см и шириной 2 см. Полученный кусок сворачивают в трубку. Края пленки склеивают с помощью раствора ПОБ в хлороформе и наносят на поверхность трубки слой микросфер, для чего на поверхность пленки, не дожидаясь ее высыхания, плотным слоем насыпают микросферы и оставляют сушиться в течение 24 час. Готовые двуслойные подложки со слоем пористых микросфер нарезают на кусочки необходимых размеров и трижды промывают стерильным буферным раствором 4-5 раз не менее 2 часов.
На следующем этапе выращивают пробиотические бактерии Lactobacillus plantarum 8Р-А3 (ООО «Спутник-К»). На полужидкой среде культуру L. plantarum 8Р-А3 выращивают в конических колбах на 250 мл, содержащих 200 мл MRS-бульона и 0,3% агар-агара. В колбы наливают питательную среду, укупоривают ватно-марлевыми пробками и автоклавируют. Готовую среду не хранят. Посев осуществляют, как только температура среды после автоклавирования достигает 40°С.
Для посева готовят жидкую посевную культуру. Для этого в пробирку с культурой, растущей на скошенном MRS-агаре, вносят 3 мл MRS-бульона. Снимают клетки с поверхности твердой среды путем повторного пипетирования и переносят полученную суспензию в колбу, содержащую 150 мл питательной среды. Колбу с жидкой посевной культурой (5×108 КОЕ/г) инкубируют 96 часа в аэробных условиях на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). Рост культуры контролируют методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, торговая марка Microsoft Corporation, USA.), морфологическую однородность проверяют при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой).
В конической колбе на 250 мл готовят 1% (вес.) раствор альгината, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 60°С и скорости перемешивания 60 об/мин. Для получения биомассы L. plantarum на жидкой среде в аэробных условиях 6 мл жидкой посевной культуры вносят в коническую колбу, содержащую полученный 1% раствор альгината в 150 мл MRS-бульона, и инкубируют 96 час на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). После окончания инкубации биомассу осаждают центрифугированием 15 мин при 10000g на центрифуге «Beckman J2-21». Супернатант сливают. Все процедуры проводят в стерильных условиях.
На следующем этапе в биомассу L. plantarum в бактериальном альгинате вводят интерлейкин 10 (ИЛ-10). Для этого готовят раствор ИЛ-10 в воде в концентрации 1 мг/мл и на стадии завершения выращивания бактерий в бактериальном альгинате добавляют в 99 мл раствора полимера, содержащего бактерии, раствор ИЛ-10 в объеме 1 мл для достижения массовой доли ИЛ-10 в полученном полимерном изделии 0,0001% (вес.).
На последнем этапе полученную пористую конструкцию на основе ПОБ/ПОБВ заполняют раствором полученного ранее бактериального капсулярного альгината натрия, содержащего пробиотические бактерии. Для этой процедуры конструкцию на основе ПОБ/ПОБВ помещают в 100 мл жидкой биомассы бактерий L. plantarum 8Р-А3 и ИЛ-10 в культуральной среде MRS, содержащей 1% альгината натрия, а емкость с ней в эксикатор, где создают отрицательное давление для вымещения воздуха из пор микросфер и подложки и замещения их раствором среды. Внешне процесс заполнения пор микросфер при этих условиях выглядит как образование множества микропузырьков воздуха вокруг микросфер. Затем проводят гелирование альгината, для чего конструкцию, пропитанную раствором альгината натрия помещают в стеклянный стакан со 100 мл 50 мМ раствора хлорида кальция на 10 мин.
Таким образом, получают биоинженерную композитную полимерную конструкцию в форме трубки длиной 25 мм и диаметром 6 мм, содержащую 1,2×108 КОЕ/г бактерий L. plantarum 8Р-А3. Таким образом, произошло увеличение содержания живых бактерий в конструкции против первоначального (1,9×107 КОЕ/г) в 6,3 раз по сравнению с падением содержания бактерий в композиции, описанной в патенте-прототипе, в 11 раз с 1×108 КОЕ/г до 8,8×106 КОЕ/г.
Тест устойчивости конструкции при температуре 37°С показал отсутствие ее деформации. В тесте устойчивости в симулированной среде кишечника полученная конструкция обеспечивала сохранение 1,2×108 КОЕ/г бактерий L. plantarum 8Р-А3, т.е 99% выживаемость бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием альгинат лиазы в симулированной среде кишечника полученная конструкция обеспечивала 54% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием лизоцима в симулированной среде кишечника полученные конструкции обеспечивали 67% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте ферментативной устойчивости с использованием липазы в симулированной среде кишечника полученные конструкции обеспечивали 79% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте устойчивости в среде чужеродных бактерий полученные биоинженерные конструкции обеспечивали не более 1% чужеродных бактерий Е. coli BL21 в гидрогеле. В тесте миграции бактерий из гидрогеля гидрогель обеспечивал распространение бактерий на расстояние 3 мм от образца. Оценка всех тестов проводилась по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»]. Тест исследования на цитотоксичность in vitro полученной конструкции показал, что он не является цитотоксичным, а именно, обладает баллом «0» по шкале цитотоксичности [ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro»].
Пример 3.
Изготовление биоинженерной конструкции проводят в несколько последовательных этапов.
На первом этапе способом контролируемого микробиологического биосинтеза также получают бактериальный альгинат. Для поддержания культуры бактерий используют твердую питательную среду Эшби, следующего состава (г/л): K2HPO4 - 1,05; KH2PO4 - 0,2; MgSO4 - 0,2; NaCl - 0,2; Na2MoO4 - 0,006; СаСО3 - 5,0; сахароза - 20, агар - 20. Для биосинтеза альгината штамм-продуцент A. chroococcum 7Б культивируют в жидкой среде Берка следующего состава (г/л): KH2PO4 - 0,05; K2HPO4 - 0,05; MgSO4 - 0,4; NaCl - 0,1; FeSO4 - 0,01; Na2MoO4 - 0,06; СаС12 - 0,1; цитрат натрия - 0,5; сахароза - 40. Сначала готовят посевной материал, для чего штамм-продуцент A. chroococcum 7Б выращивают в жидкой среде Берка указанного состава в качалочных колбах объемом 750 мл (со 100 мл среды) при 250 об./мин (исходный рН среды - 7,2; температура культивирования - 28°С) в течение 24 часов. Затем проводят биосинтез альгината штаммом-продуцентом A. chroococcum 7Б, для чего его культивируют в той же среде после внесения 4% (об.) посевного материала возрастом 24 часа в качалочных колбах на 750 мл (объем культуральной среды - 100 мл) на микробиологической качалке Innova 43 («New Brunswick Scientific)), США) при скорости перемешивания 200 об./мин в течение 72 часов. Все процедуры проводят в стерильных условиях. Для выделения альгината проводят обработку биомассы штамма-продуцента 0,9% NaCl и 50 мМ ЭДТА, после чего проводят центрифугирование при 15000 g 30 мин. Осадок отделяют и промывают водой. Затем к нему добавляют 3-кратный объем 96% этилового спирта. Осадок снова отделяют и промывают водой. После этого проводят очистку полученного альгината. Для этого альгинат снова осаждают 3-кратным объемом 96% этилового спирта и проводят диализ против 0.5% NaCl в течение 24 h. Осадок снова отделяют и высушивают при помощи лиофильной сушки. Полученный порошок хранят при 4°С не более 3-х месяцев. Полученный альгинат обладает следующим сочетанием параметров: молекулярной массой (определяемой методом визкозиметрии) 7,6×105 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере - 31% и уровнем ацетилирования - 48% (определяемых методом ИК-спектроскопии).
На 2-ом этапе готовят рабочие растворы бактериальных полимеров. Готовят раствор поли-3-оксибутирата (ПОБ) с молекулярной массой 5.3×105 г/моль, полученного бактериальным биосинтезом, в общей концентрации 112,5 мг/мл (вес./об.) в объеме 8 мл в стеклянном стакане на 50 мл, для чего готовят навеску в 90 мг. Готовят раствор ПОБВ с молярным содержанием 3-оксивалерата 9,0% и с молекулярной массой 8.5×105 г/моль, полученного бактериальным биосинтезом, в концентрации 24 мг/мл в хлороформе в общей концентрации 112,5 мг/мл (вес./об.) в объеме 8 мл в стеклянном стакане на 50 мл, для чего готовят навеску в 90 мг. Готовят раствор симвастатина в 1 мл хлороформа в концентрации 9 мг/мл, для чего готовят навеску в 9 мг.
На 3-ем этапе изготавливают пористые подложки биоинженерной конструкции модифицированным методом выщелачивания и загружают их лекарственным веществом, симвастатином. Смешивают растворы ПОБВ и симвастатина в хлороформе, для чего к 8 мл раствора ПОБВ в хлороформе в концентрации 24 мг/мл добавляют 0,1 мл раствора симвастатина в хлороформе в концентрации 9 мг/мл. Полученный совместный раствор ПОБВ и симвастатина в хлороформе смешивают с порошком бикарбоната аммония (с размером частиц соли в диапазоне 90-300 мкм в соотношении 10:1 по массе) и тщательно перемешивают шпателем. Смесь помещают в стеклянную чашку Петри диаметром 5 см и оставляют при комнатной температуре до полного испарения органического растворителя в течение 3-х часов. После этого форму помещают в горячую дистиллированную воду (60°С) до полного прекращения газообразования, промывают дистиллированной водой 5 раз и высушивают при 37°С в течение суток.
На 4-ом этапе получают пористые микросферы со средним диаметром 120 мкм при помощи метода «водная фаза/масляная фаза/водная фаза» (W/O/W), с последующим вымыванием порообразователя. В качестве пороборазователя также используют водный раствор карбоната аммония. 21 мл хлороформенного раствора ПОБ в концентрации 40 мг/мл гомогенизируют с 6,6 мл 5%-го (вес./об.) водного раствора карбоната аммония. Полученный коллоид по каплям добавляют в 210 мл 1%-го (вес/об.) раствора поливинилового спирта при постоянном перемешивании на верхнеприводной мешалке при скорости 750 об/мин. После полного испарения хлороформа частицы отделяют от эмульгатора (ПВС) путем осаждения и промывки дистиллированной водой. Для полного выхода порообразователя, микросферы инкубируют в горячей дистиллированной воде (70°С). Получают микросферы со средним диаметром 120±25 мкм, обладающие сквозной пористостью с пренебрежительно малой долей закрытых пор, общую пористость 92% и средним размером пор 1,5±0,4 мкм.
Из полученной пористой пленки вырезают полоски длиной 15 мм и шириной 5 мм и наносят на ее поверхность слой микросфер. Для этого на поверхность пленки, не дожидаясь ее высыхания, плотным слоем насыпают микросферы и оставляют сушиться в течение 24 час.
На полужидкой среде культуру Bifidobacterium longum МС-42 (ООО «Спутник-К») выращивают в конических колбах на 250 мл, содержащих 200 мл MRS-бульона и 0,3% агар-агара. В колбы наливают питательную среду, укупоривают ватно-марлевыми пробками и автоклавируют. Готовую среду хранят не более 2-х недель в бытовом холодильнике при температуре 5-8°С. Посев осуществляют, как только температура среды после автоклавирования достигает 40°С.
В конической колбе на 250 мл готовят 1% (вес.) раствор альгината с молекулярной массой 4.8×105 г/моль, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 60°С и скорости перемешивания 60 об/мин. Проводят пересев со среды с агар-агаром на среду с альгинатом. Для этого из колбы с 96 часовой культурой, растущей в полужидкой среде на агар-агаре, стеклянной серологической пипеткой отбирают 8 мл и вносят в колбу со свежеприготовленной полужидкой средой на основе бактериального альгината. Содержимое колбы перемешивают. Для получения культуры В. longum МС-42 в полужидкой среде на дно колбы вносят 4 мл рабочей культуры (1×108 КОЕ/г). Содержимое колбы не перемешивают. После инокуляции колбы укупоривают ватно-марлевыми пробками и для термостатирования помещают в микробиологическую качалку. Инкубируют 96 часа при 37°С без перемешивания. Рост культуры контролируют методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, торговая марка Microsoft Corporation, USA.), морфологическую однородность проверяют при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой).
На последнем этапе полученную пористую конструкцию на основе ПОБ/ПОБВ заполняют раствором полученного ранее бактериального капсулярного альгината натрия, содержащего пробиотические бактерии. Для этой процедуры конструкцию на основе ПОБ/ПОБВ помещают в жидкую биомассу бактерий В. longum МС-42 в культуральной среде MRS, содержащей 1% альгината натрия, а емкость с ней в эксикатор, где создают отрицательное давление для вымещения воздуха из пор микросфер и подложки и замещения их раствором среды. Затем проводят гелирование альгината, для чего конструкцию, пропитанную раствором альгината натрия помещают в стеклянный стакан со 100 мл 50 мМ раствора хлорида кальция на 10 мин.
Таким образом, получают биоинженерную композитную полимерную конструкцию в форме пластины длиной 15 мм и шириной 6 мм, содержащую 1,3×107 КОЕ/г бактерий В. longum МС-42. Таким образом, произошло увеличение содержания живых бактерий в конструкции против первоначального (2,7×106 КОЕ/г) в 4,8 раз по сравнению с падением содержания бактерий в композиции, описанной в патенте-прототипе, в 11 раз с 1×108 КОЕ/г до 8,8×106 КОЕ/г.
Тест устойчивости конструкции при температуре 37°С показал отсутствие ее деформации. В тесте устойчивости в симулированной среде кишечника полученная конструкция обеспечивала сохранение 1,3×107 КОЕ/г бактерий В. longum МС-42, т.е 96% выживаемость бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием альгинат лиазы в симулированной среде кишечника полученная конструкция обеспечивала 87% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием лизоцима в симулированной среде кишечника полученные конструкции обеспечивали 93% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте ферментативной устойчивости с использованием липазы в симулированной среде кишечника полученные конструкции обеспечивали 117% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте устойчивости в среде чужеродных бактерий полученные биоинженерные конструкции обеспечивали отсутствие чужеродных бактерий Е. coli BL21. В тесте миграции бактерий из гидрогеля гидрогель обеспечивал распространение бактерий на расстояние 2 мм от образца. Оценка всех тестов проводилась по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»]. Тест исследования на цитотоксичность in vitro полученной конструкции показал, что он не является цитотоксичным, а именно, обладает баллом «0» по шкале цитотоксичности [ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro»].
Пример 4.
Изготовление биоинженерной конструкции проводят в несколько последовательных этапов.
На первом этапе способом контролируемого микробиологического биосинтеза также получают бактериальный альгинат.Для поддержания культуры бактерий используют твердую питательную среду Эшби, следующего состава (г/л): K2HPO4 - 1,05; KH2PO4 - 0,2; MgSO4 - 0,2; NaCl - 0,2; Na2MoO4 - 0,006; СаСО3 - 5,0; сахароза - 20, агар - 20. Для биосинтеза альгината штамм-продуцент A. chroococcum 7Б культивируют в жидкой среде Берка следующего состава (г/л): KH2PO4 - 1,00; K2HPO4 - 1,00; MgSO4 - 0,4; NaCl - 0,1; FeSO4 - 0,01; Na2MoO4 - 0,06; CaCl2 - 0,1; цитрат натрия - 0,5; сахароза - 30. Сначала готовят посевной материал, для чего штамм-продуцент A. chroococcum 7Б выращивают в жидкой среде Берка указанного состава в качалочных колбах объемом 750 мл (со 100 мл среды) при 250 об./мин (исходный рН среды - 7,2; температура культивирования - 28°С) в течение 24 часов. Затем проводят биосинтез альгината штаммом-продуцентом A. chroococcum 7Б, для чего его культивируют в той же среде после внесения 4% (об.) посевного материала возрастом 24 часа в качалочных колбах на 750 мл (объем культуральной среды - 100 мл) на микробиологической качалке Innova 43 («New Brunswick Scientific)), США) при скорости перемешивания 200 об./мин в течение 72 часов. Все процедуры проводят в стерильных условиях. Для выделения альгината проводят обработку биомассы штамма-продуцента 0,9% NaCl и 50 мМ ЭДТА, после чего проводят центрифугирование при 15000 g 30 мин. Осадок отделяют и промывают водой. Затем к нему добавляют 3-кратный объем 96% этилового спирта. Осадок снова отделяют и промывают водой. После этого проводят очистку полученного альгината. Для этого альгинат снова осаждают 3-кратным объемом 96% этилового спирта и проводят диализ против 0.5% NaCl в течение 24 h. Осадок снова отделяют и высушивают при помощи лиофильной сушки. Полученный порошок хранят при 4°С не более 3-х месяцев. Полученный альгинат обладает следующим сочетанием параметров: молекулярной массой (определяемой методом визкозиметрии) 1,0×106 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере - 35% и уровнем ацетилирования - 10% (определяемых методом ИК-спектроскопии).
На 2-ом этапе готовят раствор ПОБ с молекулярной массой 7.6×105 г/моль, полученного бактериальным биосинтезом, в общей концентрации 112,5 мг/мл в объеме 8 мл в стеклянном стакане на 50 мл, для чего готовят навеску в 90 мг.
На 3-ем этапе получают пористые микросферы со средним диаметром 560 мкм при помощи метода «водная фаза/масляная фаза/водная фаза» (W/0/W), с последующим вымыванием порообразователя. В качестве пороборазователя используют водный раствор карбоната аммония. 21 мл хлороформенного раствора ПОБ 350 кДа в концентрации 40 мг/мл гомогенизируют с 6,6 мл 5%-го (вес./об.) водного раствора карбоната аммония. Полученный коллоид по каплям добавляют в 210 мл 1%-го (масс.) раствора поливинилового спирта при постоянном перемешивании на верхнеприводной мешалке при скорости 750 об/мин. После полного испарения хлороформа частицы отделяют от эмульгатора (ПВС) путем осаждения и промывки дистиллированной водой. Для полного выхода порообразователя, микросферы инкубируют в горячей дистиллированной воде (70°С). Получают микросферы со средним диаметром 560±60 мкм, обладающие сквозной пористостью с пренебрежительно малой долей закрытых пор, общую пористость 96% и средним размером пор 3,4±0,9 мкм
На 4-ом этапе выращивают генетически модифицированные пробиотические бактерии Lactobacillus delbrueckii subsp.bulgaricus NCTC 12712 (ООО «Спутник-К»), содержащие плазмиду pMC1 с геном устойчивости к хлорамфениколу рС194, полученные по стандартной методике [Serror P., Sasaki Т., Ehrlich S.D., Maguin Е. Electrotransformation of Lactobacillus delbrueckii subsp.bulgaricus and L. delbrueckii subsp. lactis with Various Plasmids. Appl Environ Microbiol., 2002, 68(1), 46-52]. На полужидкой среде культуру L. delbrueckii subsp. bulgaricus VI104 выращивают в конических колбах на 250 мл, содержащих 200 мл MRS-бульона и 0,3% агар-агара. В колбы наливают питательную среду, укупоривают ватно-марлевыми пробками и автоклавируют. Готовую среду не хранят. Посев осуществляют, как только температура среды после автоклавирования достигает 40°С.
Для посева готовят жидкую посевную культуру. Для этого в пробирку с культурой, растущей на скошенном MRS-агаре, вносят 3 мл MRS-бульона. Снимают клетки с поверхности твердой среды путем повторного пипетирования и переносят полученную суспензию в колбу, содержащую 150 мл питательной среды. Колбу с жидкой посевной культурой инкубируют 96 часа в аэробных условиях на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). Рост культуры контролируют методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, торговая марка Microsoft Corporation, USA.), морфологическую однородность проверяют при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой).
В конической колбе на 250 мл готовят 1% (вес.) раствор альгината, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 60°С и скорости перемешивания 60 об/мин. Для получения биомассы L. delbrueckii subsp. bulgaricus NCTC 12712 на жидкой среде в аэробных условиях 6 мл жидкой посевной культуры (1×108 КОЕ/г) вносят в коническую колбу, содержащую полученный 1% раствор альгината в 150 мл MRS-бульона, и инкубируют 96 час на микробиологической качалке при 37°С и скорости перемешивания 120 об/мин (диаметр орбиты 1,9 см). После окончания инкубации биомассу осаждают центрифугированием 15 мин при 10000g на центрифуге «Весктап J2-21». Супернатант сливают. Все процедуры проводят в стерильных условиях.
На 5-ом этапе выращивают культуру Bifidobacterium longum МС-42 на полужидкой среде в конических колбах на 250 мл, содержащих 200 мл MRS-бульона и 0,3% агар-агара. В колбы наливают питательную среду, укупоривают ватно-марлевыми пробками и автоклавируют. Готовую среду хранят не более 2-х недель в бытовом холодильнике при температуре 5-8°С. Посев осуществляют, как только температура среды после автоклавирования достигает 40°С.
В конической колбе на 250 мл готовят 1% (вес.) раствор альгината с молекулярной массой 4.8×105 г/моль, полученного микробиологическим путем, в 150 мл MRS-бульона на магнитной мешалке с подогревом при 60°С и скорости перемешивания 60 об/мин. Проводят пересев со среды с агар-агаром на среду с альгинатом. Для этого из колбы с 96 часовой культурой, растущей в полужидкой среде на агар-агаре, стеклянной серологической пипеткой отбирают 8 мл и вносят в колбу со свежеприготовленной полужидкой средой на основе бактериального альгината. Содержимое колбы перемешивают. Для получения культуры В. longum МС-42 в полужидкой среде на дно колбы вносят 4 мл рабочей культуры (1×108 КОЕ/г). Содержимое колбы не перемешивают. После инокуляции колбы укупоривают ватно-марлевыми пробками и для термостатирования помещают в микробиологическую качалку. Инкубируют 96 часа при 37°С без перемешивания. Рост культуры контролируют методом нефелометрии, определяя оптическую плотность при длине волны 600 нм на спектрофотометре (Ultrospec 1100 pro, Amersham Biosciences Limited, торговая марка Microsoft Corporation, USA.), морфологическую однородность проверяют при помощи световой микроскопии (микроскоп Биомед-1, «Биомед», РФ, с цифровой камерой).
На последнем этапе полученные пористые конструкции в форме микросфер на основе ПОБ/ПОБВ заполняют раствором полученного ранее бактериального капсулярного альгината натрия, содержащего пробиотические бактерии. Сначала готовят смесь бактерий в бактериальном альгинате. Для этого 50 мл биомассы выращенных ранее бактерий В. longum МС-42 в культуральной среде MRS, содержащей 1% альгината натрия, смешивают с 50 мл биомассы выращенных ранее генетически модифицированных бактерий Lactobacillus delbrueckii subsp. bulgaricus NCTC 12712 в культуральной среде MRS, содержащей 1% альгината натрия, в стеклянной колбе на 150 мл и тщательно перемешивают. Пористые микросферы на основе ПОБ/ПОБВ помещают в смесь биомассы бактерий в культуральной среде MRS, содержащей 1% альгината натрия, а емкость с ней в эксикатор, где создают отрицательное давление для вымещения воздуха из пор микросфер и замещения их раствором среды. Затем проводят гелирование альгината, для чего конструкцию, пропитанную раствором альгината натрия помещают в стеклянный стакан со 100 мл 50 мМ раствора хлорида кальция на 10 мин.
Таким образом, получают биоинженерную композитную полимерную конструкцию в форме трубки длиной 25 мм и диаметром 6 мм, содержащую 1,2×107 КОЕ/г бактерий L. delbrueckii subsp.bulgaricus NCTC 12712 и 1,0×107 КОЕ/г бактерий В. longum МС-42. Таким образом, произошло увеличение содержания живых бактерий в конструкции против первоначального (2,7×106 КОЕ/г) не менее чем в 3,7 раза по сравнению с падением содержания бактерий в композиции, описанной в патенте-прототипе, в 11 раз с 1×108 КОЕ/г до 8,8×106 КОЕ/г.
Тест устойчивости конструкции при температуре 37°С показал отсутствие ее деформации. В тесте устойчивости в симулированной среде кишечника полученная конструкция обеспечивала обеспечивал сохранение 1,2×107 КОЕ/г бактерий L. delbrueckii subsp.bulgaricus NCTC 12712 и 1,0×107 КОЕ/г бактерий В. longum МС-42., 98% выживаемость бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием альгинат лиазы в симулированной среде кишечника полученная конструкция обеспечивала 61% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в сравнении с контрольным препаратом бактерий, инкапсулированных в альгинатный гидрогель на основе водорослевого альгината. В тесте ферментативной устойчивости с использованием лизоцима в симулированной среде кишечника полученные конструкции обеспечивали 65% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте ферментативной устойчивости с использованием липазы в симулированной среде кишечника полученные конструкции обеспечивали 77% повышение выживаемости бактерий, оцениваемых по стандартной методике определения числа КОЕ в конструкции. В тесте устойчивости в среде чужеродных бактерий полученные биоинженерные конструкции обеспечивали отсутствие чужеродных бактерий Е. coli BL21. В тесте миграции бактерий из гидрогеля гидрогель обеспечивал распространение бактерий на расстояние 3 мм от образца. Оценка всех тестов проводилась по стандартной методике определения числа КОЕ в конструкции [ГОСТ Р 56139-2014 «Продукты пищевые функциональные. Методы определения и подсчета пробиотических микроорганизмов»]. Тест исследования на цитотоксичность in vitro полученной конструкции показал, что он не является цитотоксичным, а именно, обладает баллом «0» по шкале цитотоксичности [ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro»].
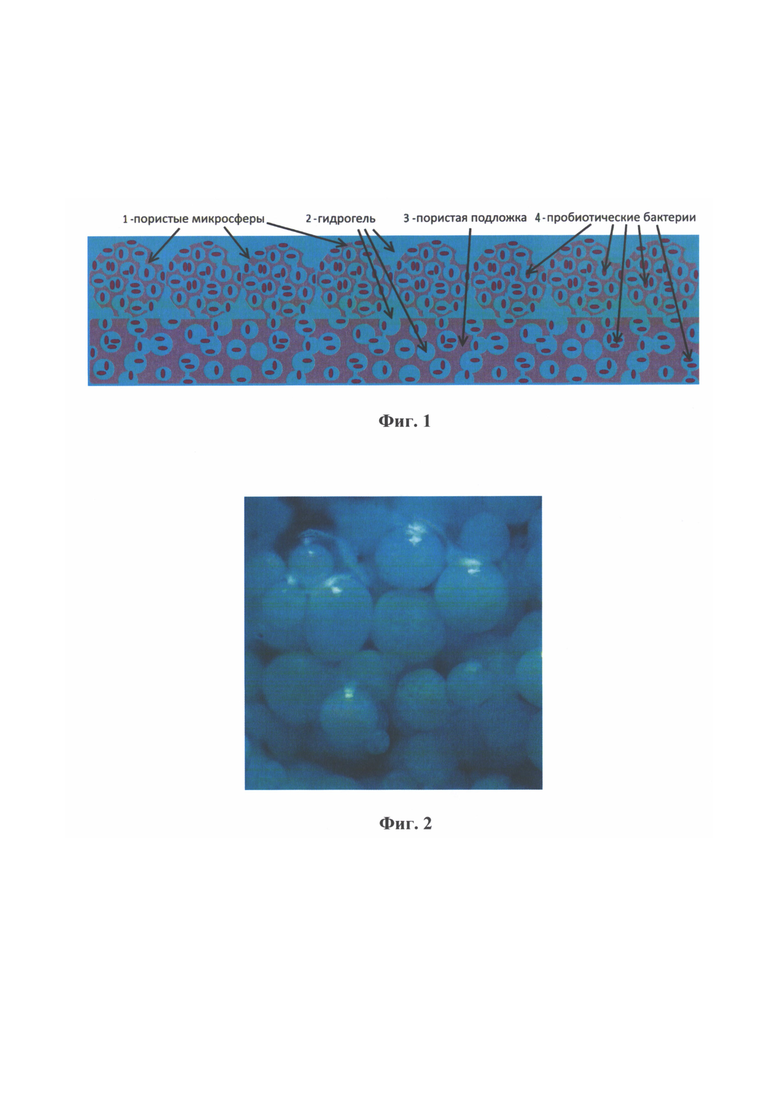
Изобретение относится к области медицины и фармацевтики, в частности к изделию для лечения и создания экспериментальных моделей заболеваний желудочно-кишечного тракта, за счет терапевтического действия живых пробиотических бактерий, культивируемых in situ в биоинженерной конструкции. Предложена биоинженерная конструкция для пробиотических бактерий родов Lactobacillus и Bifidobacterium, представляющая собой расположенный на пористой подложке слой из пористых микросфер в гидрогеле. Пористая подложка выполнена из поли-3-оксибутирата и/или его сополимера с 3-оксивалератом с молекулярной массой от 1×105 до 2×106 г/моль и характеризуется наличием сквозных пор (или связанных пор), общей пористостью от 75 до 99%, средним диаметром пор от 0,5 до 20 мкм. Пористые микросферы выполнены из поли-3-оксибутирата с молекулярной массой от 1×104 до 1×106 г/моль и характеризуются наличием сквозных пор (или связанных пор), общей пористостью от 75 до 99%, средним диаметром пор от 0,5 до 20 мкм. Поры подложки и микросфер заполнены гидрогелем, содержащим пробиотические бактерии. Гидрогель выполнен из бактериального альгината с молекулярной массой от 105 до 106 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере от 31 моль % до 48 моль % и уровнем ацетилирования - от 10 моль % до 46 моль %. Кроме того, предложен способ получения вышеуказанной биоинженерной конструкции. Техническим результатом является получение гибридной биоинженерной конструкции на основе пробиотических бактерий и бактериальных полимеров (поли-3-оксиалканоата и альгината), обеспечивающего не менее 95% выживаемости бактерий, а также увеличение их защиты (повышение выживаемости бактерий не менее чем на 50%) в неблагоприятной среде при сохранении биосовместимости (отсутствии цитотоксичности) конструкции in vitro. 2 н. и 16 з.п. ф-лы, 2 ил., 4 пр.
1. Биоинженерная конструкция для пробиотических бактерий родов Lactobacillus и Bifidobacterium для лечения заболеваний желудочно-кишечного тракта, представляющая собой расположенный на пористой подложке слой из пористых микросфер в гидрогеле, при этом пористая подложка выполнена из поли-3-оксибутирата и/или его сополимера с 3-оксивалератом с молекулярной массой от 1×105 до 2×106 г/моль и характеризуется наличием сквозных пор (или связанных пор), общей пористостью от 75 до 99%, средним диаметром пор от 0,5 до 20 мкм, а пористые микросферы выполнены из поли-3-оксибутирата с молекулярной массой от 1×104 до 1×106 г/моль и характеризуются наличием сквозных пор (или связанных пор), общей пористостью от 75 до 99%, средним диаметром пор от 0,5 до 20 мкм; где поры подложки и микросфер заполнены гидрогелем, содержащим пробиотические бактерии, при этом гидрогель выполнен из бактериального альгината с молекулярной массой от 105 до 106 г/моль, молярным содержанием остатков гулуроновой кислоты в полимере от 31 моль % до 48 моль % и уровнем ацетилирования - от 10 моль % до 46 моль %.
2. Биоинженерная конструкция по п. 1, характеризующаяся тем, что подложка выполнена толщиной от 10 мкм до 5 см, а диаметр микросфер составляет от 2 до 2000 мкм.
3. Биоинженерная конструкция по п. 1, характеризующаяся тем, что микросферы размещены в несколько рядов - от одного до пяти.
4. Биоинженерная конструкция по п. 1, характеризующаяся тем, что выполнена в виде трубки, полученной сворачиванием подложки.
5. Биоинженерная конструкция по п. 1, характеризующаяся тем, что бактериальный альгинат является продуктом биосинтеза бактерий рода Azotobacter.
6. Биоинженерная конструкция по п. 1, характеризующаяся тем, что в качестве пробиотических бактерий использованы бактерии Lactobacillus и/или Bifidobacterium, или их генетические модификации, в соотношении по числу КОЕ от 1:999 до 999:1.
7. Биоинженерная конструкция по п. 1, характеризующаяся тем, что дополнительно содержит по меньшей мере одно фармакологически активное вещество.
8. Биоинженерная конструкция по п. 7, характеризующаяся тем, что в качестве фармакологически активного вещества используют лекарственное вещество, обладающее противовоспалительным действием и стимулирующее регенерацию тканей стенки кишечника.
9. Биоинженерная конструкция по п. 8, характеризующаяся тем, что в качестве лекарственного вещества, обладающего противовоспалительным действием и стимулирующим регенерацию тканей стенки кишечника, используют симвастатин, куркумин, росвератрол.
10. Биоинженерная конструкция по п. 7, характеризующаяся тем, что фармакологически активное вещество находится непосредственно в смеси с сополимером поли-3-оксибутирата с 3-оксивалератом в концентрации от 0,01% до 50% (вес.) лекарственного вещества в полученном полимерном изделии.
11. Биоинженерная конструкция по п. 7, характеризующаяся тем, что фармакологически активное вещество находится непосредственно в смеси с бактериальным альгинатом в концентрации от 0,01% до 50% (вес.) лекарственного вещества в полученном полимерном изделии.
12. Способ получения биоинженерной конструкции по п. 1, характеризующийся тем, что состоит из следующих этапов:
- микробиологический биосинтез бактериального альгината с использованием штамма-продуцента рода Azotobacter,
- получение пористой подложки из поли-3-оксибутирата и/или его сополимера с 3-оксивалератом,
- получение пористых микросфер из поли-3-оксибутрата,
- прикрепление микросфер на поверхности пористой подложки,
- выращивание пробиотических бактерий родов Lactobacillus и Bifidobacterium в бактериальном альгинате,
- заполнение пористой подложки альгинатом с бактериями,
- гелирование бактериального альгината in situ путем добавления водного раствора хлорида кальция.
13. Способ по п. 12, характеризующийся тем, что пористую подложку получают одним из следующих методов: лиофилизация, высушивание, выщелачивание, эмульгирование, электроформование, быстрое прототипирование, лазерная резка.
14. Способ по п. 12, характеризующийся тем, что пористые микросферы получают одним из следующих методов: лиофилизация, распылительное высушивание, выщелачивание, эмульгирование, быстрое прототипирование.
15. Способ по п. 12, характеризующийся тем, что прикрепление пористых микросфер на поверхность пористой подложки осуществляют осаждением их на смоченную растворителем поверхность или осаждением на поверхность в парах растворителя.
16. Способ по п. 12, характеризующийся тем, что перед заполнением пористой подложки и расположенных на ней микросфер гидрогелем в бактериальном альгинате, составляющем его основу, выращены живые пробиотические бактерии до содержания не мнее 1×107 КОЕ/мл.
17. Способ по п. 12, характеризующийся тем, что на этапе получения пористой подложки в нее введено по меньшей мере одно фармакологически активное вещество.
18. Способ по п. 12, характеризующийся тем, что перед заполнением пористой подложки и расположенных на ней микросфер гидрогелем на основе бактериального альгината, содержащим пробиотические бактерии, в него введено по меньшей мере одно фармакологически активное вещество.
| Муравьев А.А | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Современные технологии в медицине | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Иванов С.Ю | |||
| и др | |||
| Разработка и доклинические исследования изолирующей мембраны на основе сополимера | |||
Авторы
Даты
2021-01-13—Публикация
2019-12-24—Подача