ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области техники белков и полипептидов и, в частности, относится к слитому белку FGF21 Fc, слитому белку GLP-1 Fc и комбинированному терапевтическому агенту, в том числе как для профилактики, так и для лечения сердечнососудистых заболеваний и/или метаболических заболеваний, которые включают, но не ограничиваются ими, ожирение, гиперлипидемию, атеросклероз, неалкогольную жировую болезнь печени, диабет, диабетическую кардиомиопатию, коронарную атеросклеротическую болезнь сердца и другие заболевания, связанные с резистентностью к инсулину.
УРОВЕНЬ ТЕХНИКИ
Фактор роста фибробластов 21 (FGF21), член семейства FGF, главным образом синтезируется печенью, и затем высвобождается в кровоток в эндокринной форме. С-конец FGF21 связывается с трансмембранным белком β-клото (β-klotho) эффекторного органа, и затем специфически связывается с рецептором фактора роста фибробластов 1c (FGFR1c) через N-конец с образованием стабильного комплекса FGF21/β-клото/FGFR, и затем активирует нисходящие каскады передачи молекулярных сигналов. Большое количество фундаментальных исследований показало, что FGF21 обладает многими физиологическими функциями, такими как стимулирование утилизации глюкозы, повышение чувствительности к инсулину, активизация расщепления жирных кислот, снижение липидного неогенеза, регулирование баланса холестерина и т.д., и показывает значительный потенциал для применения при сердечно-сосудистых заболеваниях и метаболических заболеваниях. Однако естественный FGF21 подвергается фильтрации и метаболизму клубочками, а также подвержен гидролитическому расщеплению под действием протеазы, что приводит к короткому периоду полувыведения in vivo и серьезно ограничивает потенциал естественного FGF21 в качестве лекарственного средства. С углубленным развитием биотехнологии структурная модификация естественного FGF21 для увеличения периода полувыведения in vivo и улучшения биодоступности стала центром исследований и разработок крупных фармацевтических компаний во всем мире. В настоящее время различные белки FGF21 длительного действия прошли клинические исследования, и большинство из них подвергаются модификации с полиэтиленгликолем, Fc-слиянию белков или ковалентному связыванию CovX-Body для продления периода полувыведения FGF21. Клинические исследования показали, что белок FGF21 длительного действия оказывает положительный терапевтический эффект на улучшение состояния при стеатозе печени у больных с неалкогольной жировой болезнью печени, снижение массы тела и регуляцию липидов в крови, но не проявляет существенных фармакодинамических преимуществ перед существующими на рынке гипогликемическими лекарственными средствами для контроля уровня глюкозы в крови пациентов с диабетом. По сравнению с GLP-1 (глюкагоноподобный пептид-1) млекопитающих или эксендином-4 (Exendin-4), агонисты рецепторов GLP-1 длительного действия представляют собой разновидность белковых продуктов, полученных путем структурной модификации аналогов GLP-1 или эксендина-4, которые имеют в значительной степени увеличенные период полувыведения и биодоступность in vivo и сниженную частоту введений. В настоящее время на рынке доступны различные агонисты рецепторов GLP-1 длительного действия, такие как дулаглутид (Dulaglutide), производимый Eli Lilly and Company, и семаглутид (Semaglutide), производимый Novo Nordisk, которые обладают значительными преимуществами по сравнению с традиционными пероральными противодиабетическими агентами, короткодействующими агонистами рецепторов GLP-1 или препаратами инсулина в контроле уровня глюкозы в крови или соблюдении пациентом режима и схемы лечения в клиническом применении. Однако, из-за ограниченности механизма агонисты рецепторов GLP-1 длительного действия осуществляют соответствующие эффекты, главным образом, стимулируя секрецию и высвобождение инсулина бета-клетками поджелудочной железы при стимуляции глюкозой, физиологическая функция агонистов рецепторов GLP-1 длительного действия в гликометаболизме, в основном, зависит от активности инсулина, и в настоящее время нет убедительных клинических доказательств того, что эти лекарственные средства могут прямо и определенно устранять резистентность к инсулину, ожирение, неалкогольную жировую болезнь печени, гиперлипидемию или другие заболевания, которыми повсеместно страдают пациенты с диабетом, через механизм действия, не зависящий от снижения веса. Этот вид лекарственных средств может играть определенную роль в снижении веса, препятствуя потреблению пищи пациентами, но их действие в снижении веса в основном зависит от неблагоприятных побочных реакций со стороны желудочно-кишечного тракта, вызванных самими лекарственными средствами. Несмотря на достижение некоторых положительных результатов лечения, клинический дискомфорт пациентов в процессе лечения возрастает.
Клинически большинство пациентов с сердечно-сосудистыми заболеваниями и метаболическими заболеваниями также страдают гиперлипидемией, ожирением, гипергликемией, ожирением печени, атеросклерозом и другими заболеваниями. Например, эпидемиологические данные показывают, что около 60% пациентов с сахарным диабетом 2 типа также страдают ожирением, около 50% страдают неалкогольными заболеваниями печени и более 70% имеют аномальные уровни липидов в крови; риск развития сердечнососудистых заболеваний у пациентов с сахарным диабетом в 2-4 раза выше, чем у пациентов без сахарного диабета, и сердечно-сосудистые осложнения стали первым фактором смерти от всех причин среди пациентов с сахарным диабетом; и сердечно-сосудистые осложнения являются второй причиной смерти среди пациентов с неалкогольной жировой болезнью печени. В настоящее время в клинической практике рекомендуется полимедикаментозная комбинированная терапия для одновременного контроля течения нескольких заболеваний. Однако, учитывая ограничения терапевтических эффектов одобренных лекарственных средств, включая слитые белки GLP-1 Fc, об идеальной монотерапии или комбинированной терапии не сообщалось. Следовательно, крайне необходимо разработать более эффективное и всестороннее комбинированное решение для профилактики и лечения таких пациентов. Авторы творчески предположили, что комбинация слитого белка FGF21 Fc и слитого белка GLP-1 Fc может иметь значительный терапевтический потенциал в комплексной терапии и лечении пациентов с сердечно-сосудистыми заболеваниями и метаболическими заболеваниями и полностью удовлетворять требованиям эффективности в клинической практике.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление слитого белка FGF21 Fc, слитого белка GLP-1 Fc и комбинированного терапевтического агента с применением двух белков в качестве двойного агониста FGF21R/GLP-1R длительного действия для профилактики и лечения сердечно-сосудистых заболеваний и/или метаболических заболеваний, особенно для обеспечения комплексной терапии, профилактики и лечения пациентов, осложненных различными сердечно-сосудистыми заболеваниями или метаболическими заболеваниями. Комбинированное введение слитого белка FGF21 Fc и слитого белка GLP-1 Fc, предложенное в настоящем изобретении, неожиданно демонстрирует заметный синергетический эффект на животных моделях ожирения, диабета, гиперлипидемии, неалкогольной жировой болезни печени, атеросклероза, диабетической кардиомиопатии и тому подобное.
В одном аспекте настоящее изобретение относится к слитому белку FGF21 Fc, имеющему аминокислотную последовательность: (1) как показано в SEQ ID NO: 4; или
(2) которая, по существу, идентична (например, последовательность, имеющая, по меньшей мере, 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичности или имеющая одну или более аминокислотных замен (например, консервативную замену), делеций и/или добавлений) любой из вышеуказанных последовательностей.
В другом аспекте настоящее изобретение относится к слитому белку GLP-1 Fc, имеющему аминокислотную последовательность:
(1) как показано в SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 7; или
(2) которая, по существу, идентична (например, последовательность, имеющая, по меньшей мере, 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичности или имеющая одну или более аминокислотных замен (например, консервативную замену), делеций и/или добавлений) любой из вышеуказанных последовательностей.
В другом аспекте настоящее изобретение относится к комбинированному терапевтическому агенту. Комбинированный терапевтический агент состоит из первой фармацевтической композиции, включающей слитый белок FGF21 Fc длительного действия, и второй фармацевтической композиции, включающей слитый белок GLP-1 Fc длительного действия, и где слитый белок FGF21 Fc длительного действия имеет аминокислотную последовательность, выбранную из последовательности, показанной в SEQ ID NO: 4, или последовательность, по существу, идентичную (например, последовательность, имеющую, по меньшей мере, 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичности или имеющую одну или более аминокислотных замен (например, консервативную замену), делеций и/или добавлений) любой из вышеуказанных последовательностей, и слитый белок GLP-1 Fc длительного действия имеет аминокислотную последовательность, выбранную из последовательности, показанной в SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 7, или последовательность, по существу, идентичную (например, последовательность, имеющую, по меньшей мере, 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичности или имеющую одну или более аминокислотных замен (например, консервативную замену) делеций и/или добавлений) любой из вышеуказанных последовательностей. Кроме того, первая фармацевтическая композиция и вторая фармацевтическая композиция дополнительно включают фармацевтически приемлемый носитель, и/или вспомогательное вещество, и/или стабилизирующий агент.
Кроме того, слитый белок FGF21 Fc и слитый белок GLP-1 Fc могут быть включены в фармацевтические композиции в профилактически эффективном количестве или терапевтически эффективном количестве, при этом профилактически эффективное количество или терапевтически эффективное количество определяется в соответствии с терапевтической целью или с профилактической целью, например, в соответствии с состоянием пациента, нуждающегося в лечении, требуемым путем введения и т.д. Кроме того, первую фармацевтическую композицию и вторую фармацевтическую композицию изготавливают в дозированной лекарственной форме, подходящей для перорального введения или введения путем инъекции.
Кроме того, первую фармацевтическую композицию и вторую фармацевтическую композицию изготавливают по отдельности в дозированных лекарственных формах, подходящих для перорального введения или введения путем инъекции.
В другом аспекте настоящее изобретение дополнительно предусматривает применение комбинированного терапевтического агента для получения лекарственного средства для профилактики или лечения сердечно-сосудистых заболеваний и/или метаболических заболеваний.
Кроме того, сердечно-сосудистые заболевания и/или метаболические заболевания включают, но не ограничиваются ими, ожирение, гиперлипидемию, атеросклероз, неалкогольную жировую болезнь печени, диабет, диабетическую кардиомиопатию, коронарную атеросклеротическую болезнь сердца и другие заболевания, связанные с резистентностью к инсулину.
В другом аспекте настоящее изобретение предусматривает способ применения комбинированного терапевтического агента для профилактики и лечения вышеупомянутых заболеваний.
Кроме того, способ включает введение профилактически или терапевтически эффективного количества первой фармацевтической композиции и второй фармацевтической композиции в комбинации субъекту или пациенту, при этом профилактически или терапевтически эффективное количество определяется в соответствии с терапевтической целью или профилактической целью, например, в соответствии с состоянием пациента, нуждающегося в лечении, требуемым путем введения и т.д.
Кроме того, когда первую фармацевтическую композицию и вторую фармацевтическую композицию вводят в комбинации, две фармацевтические композиции вводят одновременно и вместе, вводят одновременно, но по отдельности, или вводят не одновременно, при этом, когда фармацевтические композиции вводят не одновременно, это означает, что фармацевтические композиции вводят последовательно или вводят последовательно через промежутки времени.
Кроме того, первая фармацевтическая композиция и вторая фармацевтическая композиция могут быть введены любым способом, известным в данной области, например, путем инъекции, такой как внутривенная (в/в) или подкожная (и/к) инъекция. Настоящее изобретение имеет следующие преимущества. В одном аспекте, с точки зрения фактического клинического лечебного эффекта и механизма действия лекарственных средств, комбинация двойных агонистов FGF21R/GLP-1R применяется для преодоления сложности механизма возникновения заболевания и выполнения разнообразных требований к лечению, и преимущества и осуществимость комбинации слитого белка FGF21 Fc длительного действия и слитого белка GLP-1 Fc длительного действия полностью выяснены в ходе научных экспериментальных исследований. Терапевтический способ, предусмотренный настоящим изобретением, оптимизирует существующие средства клинического лечения сердечно-сосудистых заболеваний и метаболических заболеваний и, в частности, обеспечивает более эффективную и всестороннюю комбинированную терапию для пациентов с различными сердечно-сосудистыми или метаболическими заболеваниями. В другом аспекте все активные ингредиенты комбинированного терапевтического агента, выбранные в соответствии с настоящим изобретением, представляют собой белковые лекарственные средства длительного действия, которые все могут реализовываться при частоте введения один раз в неделю в клинике, и переносимость комбинированного терапевтического агента пациентом намного выше, чем других лекарственных средств-аналогов инсулина или GLP-1.
Подробное описание
Термин «FGF21» относится к естественному человеческому FGF21, а также к его аналогам и производным, которые сохраняют активность FGF21.
Последовательность естественного белка FGF21 человека может быть получена из базы данных UNIPROT с номером доступа Q9NSA1. Белок-предшественник состоит из 209 аминокислот, включая сигнальный пептид (аминокислоты 1-28) и зрелый белок (аминокислоты 29-209).
Изоформа или аллельная форма естественного FGF21 человека, содержащая Pro вместо Leu в зрелом белке (в положении 174 SEQ ID NO: 1, представленной в настоящем описании), может быть известна, в частности, из US 2001012628 А1. Существует еще одна естественная изоформа FGF21 человека, в которой Gly заменен на Ser (в положении 141 SEQ ID NO: 1, представленной в настоящем описании).
Другая изоформа, содержащая короткий сигнальный пептид (отсутствует Leu в положении 23 SEQ ID NO: 1, представленной в настоящем описании), может быть известна из WO 2003/011213 (см. SEQ ID NO: 2, раскрытую в WO 2003/011213, которая содержит сигнальный пептид из 27 аминокислотных остатков).
В настоящем изобретении естественный FGF21 человека включает последовательность части зрелого белка (аминокислоты 29-209), полученную после удаления лидерного пептида из SEQ ID NO: 1 и замены изоформы L174P или G141S, и, кроме того, естественный FGF21 человека дополнительно включает полноразмерную последовательность белка-предшественника, полученную путем добавления перед предшествующими последовательностями вышеупомянутого сигнального пептида из 27 или 28 аминокислот. Термин «GLP-1» относится к человеческому GLP-1 (7-37) (аминокислоты 1-31 SEQ ID NO: 2), эксендину-4 (7-45) (аминокислоты 1-39 SEQ ID NO: 3) и их аналогам и производным, сохраняющим активность GLP-1.
Термины «аналог FGF21» и «аналог GLP-1» относятся к полипептидам, которые являются или могут быть, соответственно, выведены или получены из соответствующих последовательностей FGF21, GLP-1 и эксендина-4 SEQ ID NO: 1, 2 и 3 путем модификации их аминокислотных последовательностей. Такая модификация может включать замены, делеций и/или добавления одной или более аминокислоты. Например, аминокислоты могут быть добавлены и/или удалены на С-конце, N-конце или внутри аминокислотной последовательности. Предпочтительно, аминокислоты добавляют и/или удаляют на С-конце и/или на N-конце, более предпочтительно, на N-конце. Аминокислотные последовательности с делецией С-концевых или N-концевых аминокислот также могут относиться к укороченной последовательности, как известно в данной области техники. Фармацевтические композиции, включающие слитый белок FGF21 Fc и слитый белок GLP-1 Fc по настоящему изобретению, могут дополнительно включать фармацевтически приемлемый носитель. Для инъекций носитель может представлять собой, например, воду или физиологический раствор. Также могут применяться другие фармацевтически приемлемые вещества, такие как разбавители и соответствующие буферы. Другие фармацевтически приемлемые вещества, такие как эмульгаторы, суспендирующие агенты, растворители, наполнители, агенты, способствующие набуханию, адъюванты, консерванты, антиоксиданты, красители и/или вкусовые агенты, также могут применяться, если это необходимо. Слитый белок FGF21 Fc и слитый белок GLP-1 Fc могут применяться в форме очищенного полипептида или в составе с подходящим фармацевтически приемлемым вспомогательным веществом, как известно в данной области. Фармацевтические композиции могут быть введены любым способом, известным в данной области, например, путем инъекции, такой как внутривенная (в/в) или подкожная (и/к) инъекция. Слитый белок FGF21 Fc и слитый белок GLP-1 Fc могут быть включены в фармацевтические композиции в профилактически эффективном количестве или терапевтически эффективном количестве. Профилактически эффективное количество или терапевтически эффективное количество определяют в соответствии с профилактической целью или терапевтической целью, например, в соответствии с состоянием пациента, нуждающегося в лечении, требуемым путем введения и т.д.
Термин «инсулинорезистентность» относится к состоянию, при котором нормальные дозы инсулина оказывают более низкое биологическое действие, чем обычное биологическое действие, что замедляет поглощение глюкозы жиром и скелетными мышцами, но увеличивает высвобождение глюкозы из печени и свободных жирных кислот из жировой ткани. Первой ответной реакцией инсулинорезистентности является компенсаторная выработка и секреция инсулина для компенсации сниженной чувствительности организма, вызывающая гиперинсулинемию. Следовательно, резистентность к инсулину характеризуется высокими уровнями инсулина и сниженной чувствительностью тканей к удалению глюкозы из кровотока. Инсулинорезистентность является основной причиной ряда метаболических изменений, включая компенсаторную гиперинсулинемию, дислипидемию, компенсаторную гипофункцию бета-клеток поджелудочной железы и гипер гликемию.
Заболевания, связанные с резистентностью к инсулину, конкретно выбраны из синдрома инсулинорезистентности (IRS), диабета 2 типа, нарушения толерантности к глюкозе, метаболического синдрома, гипергликемии, гиперинсулинемии, атеросклероза, гиперхолестеринемии, гипертриглицеридемии, гиперлипидемии, дислипидемии, ожирения, центрального типа ожирения, синдрома поликистозных яичников, повышенной свертываемости крови, артериальной гипертензии и микроальбуминурии. Термин «диабет» представляет собой эндокринное и метаболическое заболевание, вызванное абсолютным или относительным дефицитом секреции инсулина. Патогенез диабета 2 типа включает прогрессирующее развитие инсулинорезистентности в печени и периферических тканях, сопровождающееся нарушением секреции инсулина бета-клетками поджелудочной железы, что приводит к выраженной гипергликемии (аномально высокому уровню глюкозы в крови).
Термин «осложнения диабета» относится к дисфункции в других частях тела, вызванной хронической гипергликемией, такой как диабетическая нефропатия, диабетическая нейропатия, диабетическая стопа (язва стопы и нарушение кровообращения) и заболевания глаз (ретинопатия). Диабет также увеличивает риск сердечных заболеваний и заболеваний костей и суставов. Другие долгосрочные осложнения диабета включают кожные заболевания, расстройства пищеварения, сексуальную дисфункцию и заболевания зубов и десен.
Термин «диабетическая кардиомиопатия» относится к расстройству сердечной мышцы у людей с диабетом, которое нельзя объяснить гипертонической болезнью сердца, коронарной атеросклеротической болезнью сердца или другими заболеваниями сердца. Это заболевание вызывает обширный очаговый некроз миокарда на фоне метаболических нарушений и микроангиопатии, приводит к субклинической сердечной дисфункции и, в конечном итоге, прогрессирует до сердечной недостаточности, аритмии, кардиогенного шока и даже внезапной смерти критических пациентов.
Термин «коронарная атеросклеротическая болезнь сердца» представляет собой заболевание сердца, вызванное атеросклеротическими повреждениями сосудов коронарных артерий, которое приводит к стенозу или закупорке просвета сосудов, что приводит к ишемии миокарда, гипоксии или некрозу.
Термин «дислипидемия» представляет собой нарушение метаболизма липопротеинов, включая перепроизводство или дефект липопротеинов. Дислипидемия может характеризоваться увеличением общего холестерина, холестерина липопротеинов низкой плотности (LDL) и триглицеридов, а также снижением холестерина липопротеинов высокой плотности (HDL) в крови.
Термин «неалкогольная жировая болезнь печени» или «NAFLD» относится ко всем заболеваниям печени, вызванным стеатозом, в отличие от чрезмерного употребления алкоголя. Формы NAFLD включают, но не ограничиваются ими, простую неалкогольную жировую дистрофию печени (NAFL), неалкогольный стеатогепатит (NASH), NAFL с фиброзом печени, NAFL с циррозом печени, NASH с фиброзом печени, NASH с циррозом печени и жировые болезни печени, вызванные гепатитом, ожирением, диабетом, резистентностью к инсулину, гипертриглицеридемией, липопротеинемией, болезнями накопления гликогена, болезнью Вебера-Крисчена, болезнью Вольмана, беременностью или липодистрофией.
Термин «неалкогольный стеатогепатит» (NASH) представляет собой заболевание печени, не связанное с употреблением алкоголя и характеризующееся стеатозом печени, сопровождающимся интралобулярным воспалением и фиброзом.
Термин «атеросклероз» (AS) представляет собой системное заболевание, связанное с нарушением липидного обмена, которое характеризуется тем, что липиды крови проникают в стенку артерии и откладываются в интиме с образованием атероматозных бляшек, что приводит к утолщению и склерозированию артерий. AS преимущественно поражает средние и крупные артерии, и его основными поражениями являются липидоз, очаговый фиброз и образование атероматозных бляшек в интиме артерий, что приводит к уплотнению стенок и сужению просветов и индуцирует ряд вторичных заболеваний, особенно в сердце, головном мозге, почках и других органах, что приводит к ишемическим изменениям. Термин «фармацевтически приемлемый носитель, и/или вспомогательное вещество, и/или стабилизирующий агент» относится к носителю, и/или вспомогательному веществу, и/или стабилизирующему агенту которые фармакологически и/или физиологически совместимы с субъектом и активным ингредиентом и являются нетоксичными для клеток или млекопитающих, подвергшихся их воздействию в применяемых дозах и концентрациях. Фармацевтически приемлемый носитель, и/или вспомогательное вещество, и/или стабилизирующий агент включают, но не ограничиваются ими, агент, регулирующий рН, поверхностно-активное вещество, адъювант, усилитель ионной силы, разбавитель, реагент для поддержания осмотического давления, реагент для замедления абсорбции и консервант. Например, агент для регулирования рН включает, но не ограничивается им, фосфатный буфер. Поверхностно-активное вещество включает, но не ограничивается ими, катионные, анионные или неионогенные поверхностно-активные вещества, такие как Tween-80. Усилитель ионной силы включает, но не ограничивается им, хлорид натрия. Консервант включает, но не ограничивается ими, различные антибактериальные реагенты и противогрибковые реагенты, такие как парабены, хлорбутанол, фенол и сорбиновая кислота. Реагент для поддержания осмотического давления включает, но не ограничивается ими, сахар, NaCl и их аналоги. Реагент для замедления абсорбции включает, но не ограничивается ими, моностеарат и желатин. Разбавитель включает, но не ограничивается ими, воду, водные буферы (такие как забуференный физиологический раствор), спирты и полиолы (такие как глицерин). Консервант включает, но не ограничивается ими, различные антибактериальные реагенты и противогрибковые реагенты, такие как тимеросал, 2-феноксиэтанол, парабены, хлорбутанол, фенол и сорбиновая кислота. Стабилизирующий агент имеет значение, обычно понятное специалистам в данной области, может стабилизировать целевую активность активных ингредиентов в лекарственном средстве и включает, но не ограничивается ими, глутамат натрия, желатин, SPGA, сахара (такие как сорбит, маннит, крахмал, сахароза, лактоза, декстран и глюкоза), аминокислоты (такие как глутамат и глицин), белки (такие как сухая сыворотка, альбумин или казеин) или продукты их разложения (такие как гидролизат лактальбумина).
Термины «пациент», «субъект», «индивидуум» и «объект» относятся к любому человеку или животному, не относящемуся к человеку, в частности, человеку, который подвергается профилактическому или терапевтическому лечению. Например, комбинированный терапевтический агент и способ, описанные в настоящем документе, могут применяться для лечения субъектов с диабетом, NASH, NAFLD или атеросклеротическими заболеваниями. Термин «животное, отличное от человека» включает всех позвоночных, например, млекопитающих и не млекопитающих, таких как приматы, не относящиеся к человеку, овцы, собаки, крупный рогатый скот, куры, земноводные и рептилии.
Термин «эффективное количество» относится к количеству, достаточному или, по меньшей мере, частичному для достижения ожидаемого эффекта. Например, эффективное количество для профилактики заболеваний (таких как опухоль или инфекция) относится к количеству, достаточному для предотвращения, прекращения или отсрочки начала заболевания (такого как опухоль или инфекция) при применении отдельно или в сочетании с одним или более терапевтическими агентами; эффективное количество для лечения заболеваний относится к количеству, достаточному для излечения или, по меньшей мере, частичному прекращению заболевания и его осложнений у пациента, который уже страдал от заболевания, при применении отдельно или в сочетании с одним или более терапевтическими агентами. Определение такого эффективного количества находится в пределах возможностей специалистов в данной области. Например, количество, эффективное для терапевтического применения, зависит от тяжести заболевания, подлежащего лечению, общего состояния иммунной системы пациента, общего состояния пациента, такого как возраст, вес и пол, способа введения лекарственного средства и другого сопутствующего лечения. Термины «результативность» и «эффективность» в отношении лечения включают как фармакологическую эффективность, так и физиологическую безопасность. Фармакологическая результативность относится к способности лекарственного средства способствовать регрессу заболевания или симптома у пациента. Под физиологической безопасностью понимается уровень токсичности или других неблагоприятных физиологических эффектов (побочных эффектов) на клеточном, органном и/или организменном уровне вследствие введения лекарственного средства. «Лечение» или «терапия» для субъекта относится к любому типу вмешательства или лечения субъекта или к введению комбинированного терапевтического агента по настоящему изобретению субъекту с целью способствовать регрессии, частичного снятия симптомов, улучшения, приостановления, отсрочки или предотвращения возникновения, прогрессирования, развития, тяжести или рецидива симптомов, осложнений, состояний или биохимических показателей, связанных с заболеванием.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на массу тела мышей с ожирением (средние значения ± SEM (стандартная погрешность средней величины)), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель,  по сравнению с группой, получавшей только слитый белок GLP-1 Fc,
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, 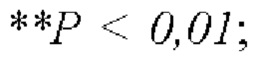 и по сравнению с группой, получавшей только FP4I,
и по сравнению с группой, получавшей только FP4I, 
На Фиг. 2 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на сывороточные маркеры функции печени мышей с ожирением (средние значения ± SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель, 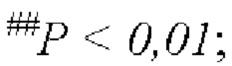 по сравнению с группой, получавшей только слитый белок GLP-1 Fc,
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, 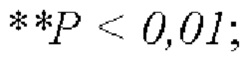 и по сравнению с группой, получавшей только FP4I,
и по сравнению с группой, получавшей только FP4I, 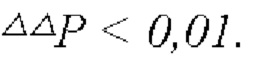
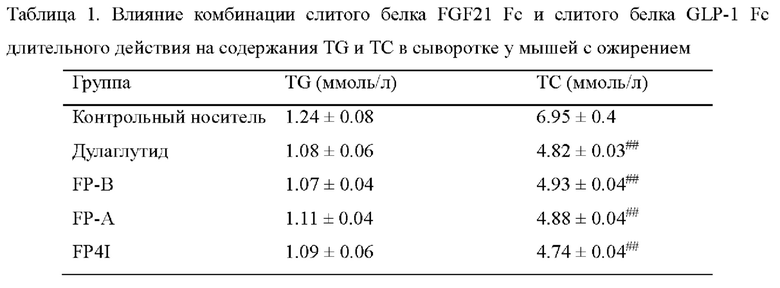
На Фиг. 3 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на содержание триглицеридов в печени мышей с ожирением (средние значения ± SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель, 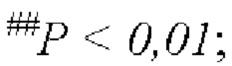 по сравнению с группой, получавшей только слитый белок GLP-1 Fc, **Р<0,01 м, и по сравнению с группой, получавшей только FP4I,
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, **Р<0,01 м, и по сравнению с группой, получавшей только FP4I, 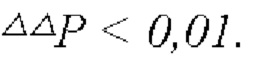
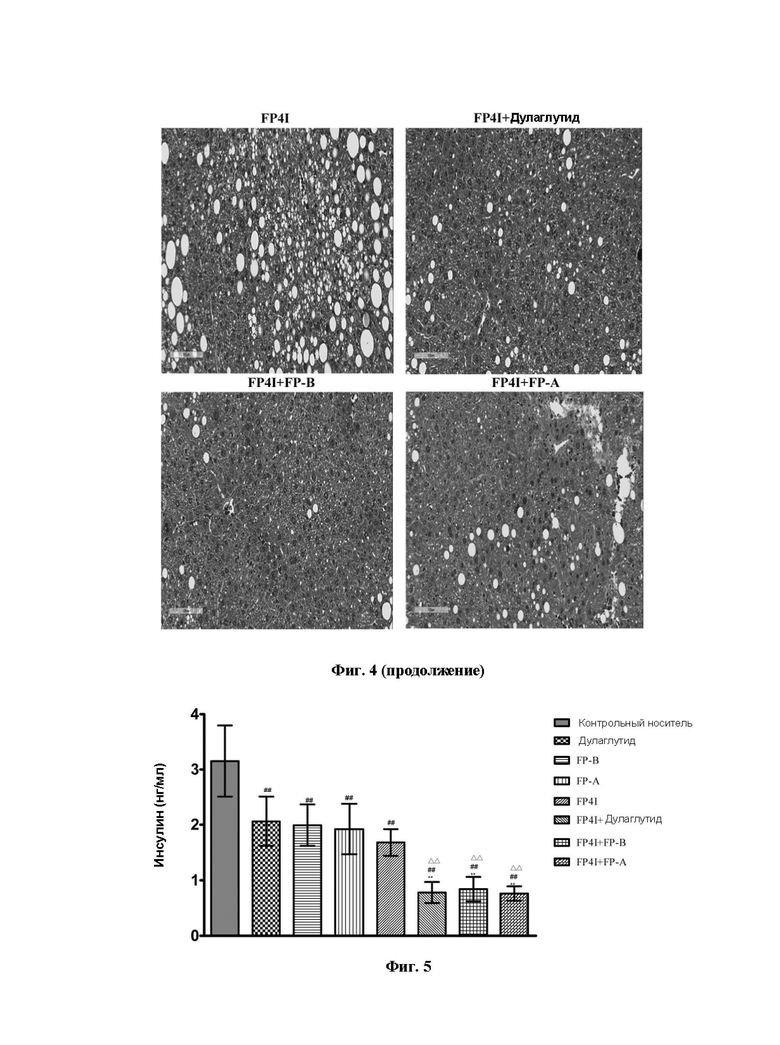
На Фиг. 4 представлены изображения патологии ткани печени мышей с ожирением, у которых применяли FP4I, соответственно, в комбинации со слитым белком GLP-1 Fc дулаглутидом, FP-В и FP-A.
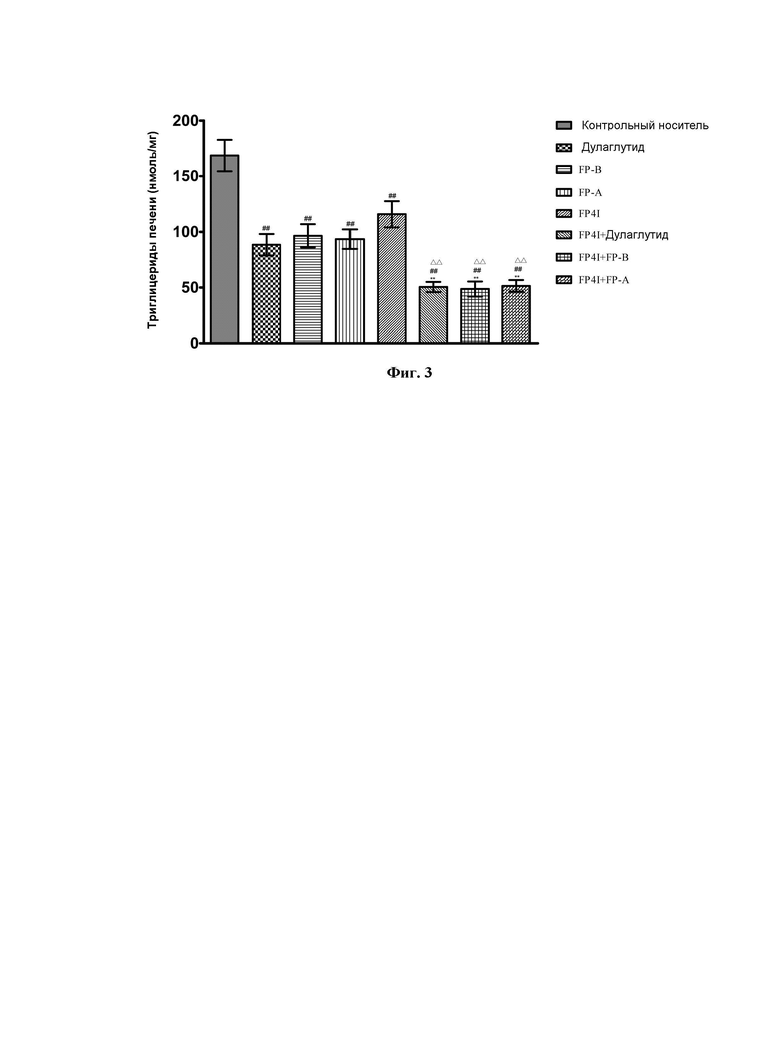
На Фиг. 5 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на уровень инсулина в сыворотке мышей с ожирением (средние значения ± SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель, 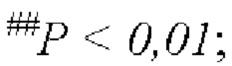 по сравнению с группой, получавшей только слитый белок GLP-1 Fc,
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, 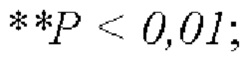 и по сравнению с группой, получавшей только FP4I,
и по сравнению с группой, получавшей только FP4I, 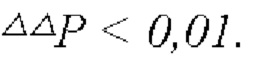
На Фиг. 6 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на сывороточные маркеры функции печени мышей с NASH (средние значения + SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель, 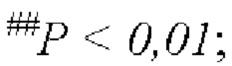 по сравнению с группой, получавшей только слитый белок GLP-1 Fc,
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, 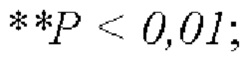 и по сравнению с группой, получавшей только FP4I,
и по сравнению с группой, получавшей только FP4I, 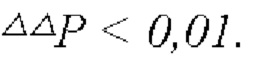
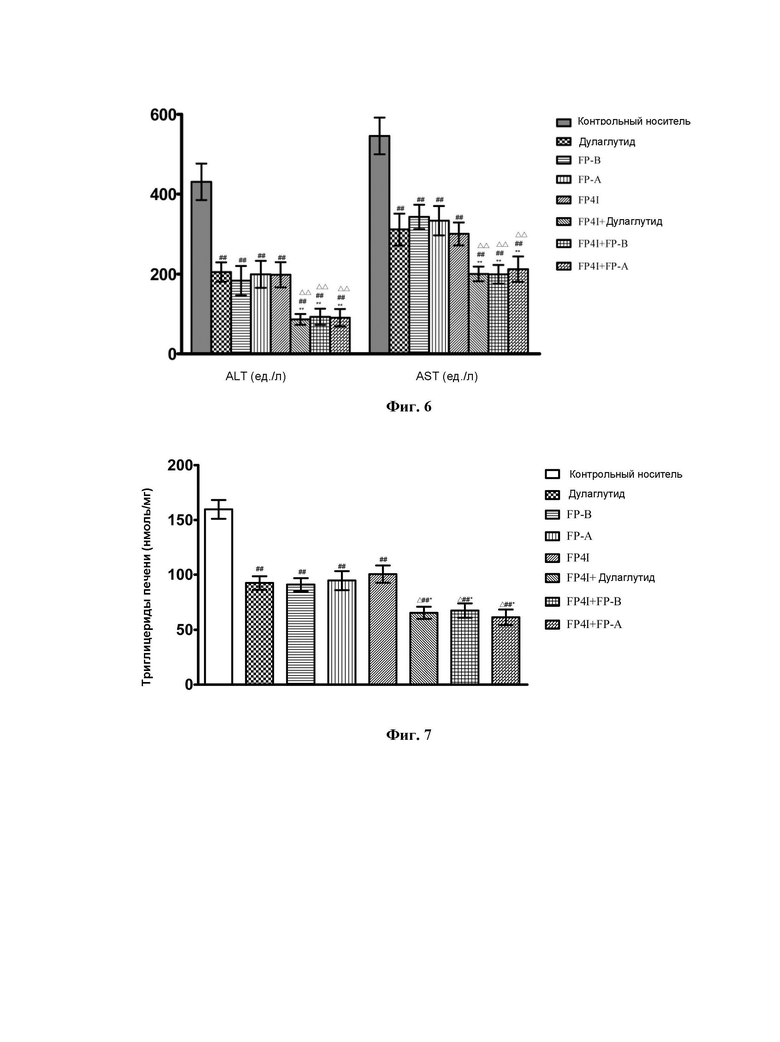
На Фиг. 7 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на содержание триглицеридов в печени мышей с NASH (средние значения ± SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с контрольной группой, получавшей носитель, 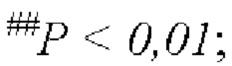 по сравнению с группой, получавшей только слитый белок GLP-1 Fc, *Р<0,05; и по сравнению с группой, получавшей только FP4I, ΔР<0,05.
по сравнению с группой, получавшей только слитый белок GLP-1 Fc, *Р<0,05; и по сравнению с группой, получавшей только FP4I, ΔР<0,05.
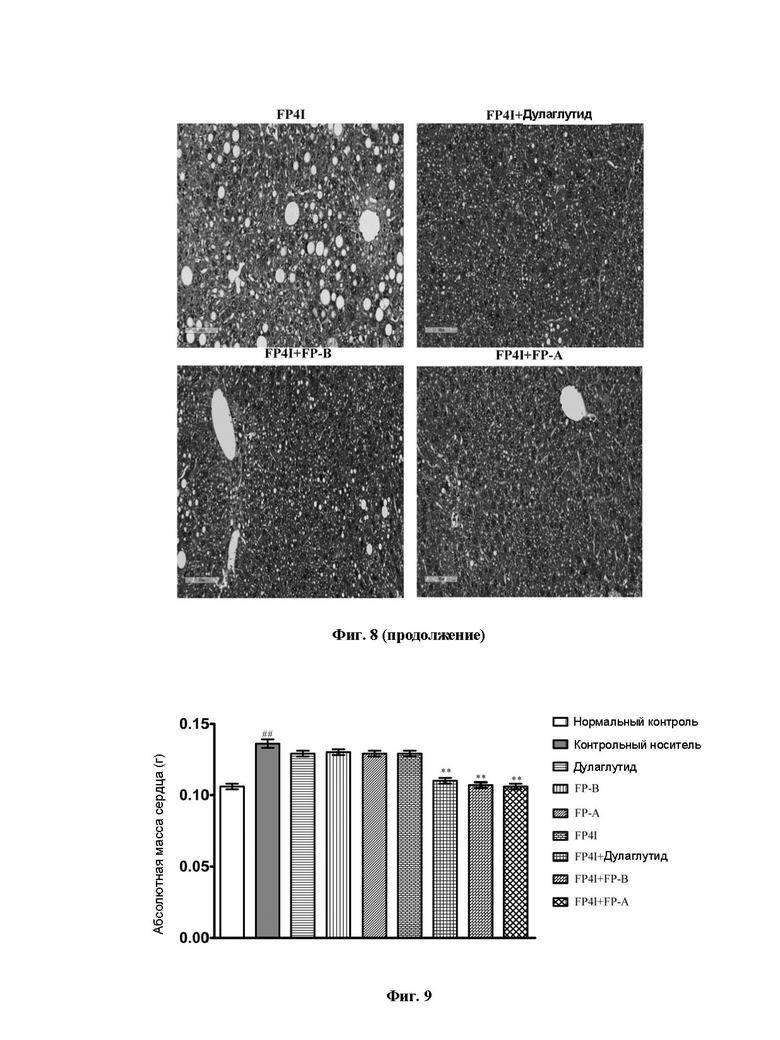
На Фиг. 8 представлены изображения патологии ткани печени мышей с NASH, у которых применяли FP4I, соответственно, в комбинации со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A.
На Фиг. 9 показано влияние комбинации FP4I, соответственно, со слитым белком GLP-1 Fc дулаглутидом, FP-B и FP-A на абсолютную массу сердца мышей линии db/db (средние значения ± SEM), где аннотации маркеров статистически значимого расхождения представляют собой следующие: по сравнению с нормальной контрольной группой, 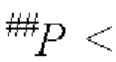
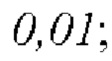 и по сравнению с контрольной группой, получавшей носитель,
и по сравнению с контрольной группой, получавшей носитель, 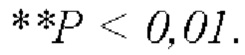
ПРИМЕР
Благодаря применению комбинации слитого белка FGF21 Fc длительного действия (названного FP4I, см. китайский патент CN 107995914 А), соответственно, со слитым белком GLP-1 Fc длительного действия дулаглутидом (торговое наименование: Трулисити (Trulicity)), Ex(1-39)-L3-CTP1-vFcγ2-3 (названным FP-A, см. китайский патент CN 106117370 В) или Ex-(1-45)-L-vFc (названным FP-B, см. китайский патент CN 106279430 В), с применением животных моделей ожирения, гиперлипидемии, неалкогольной жировой болезни печени или диабета в качестве объектов исследования, настоящее описание полностью разъясняет терапевтические преимущества комбинации двух продуктов и обеспечивает более эффективное и всестороннее решение для комплексной тактики ведения, профилактики и лечения сердечно-сосудистых заболеваний и метаболических заболеваний.
Настоящее раскрытие дополнительно описано ниже в сочетании с конкретными примерами. Следует понимать, что примеры, описанные ниже, предназначены только для пояснения, а не для ограничения объема настоящего изобретения.
Пример 1. Терапевтический эффект комбинации при ожирении, нарушении липидного обмена и жировой дегенерации печени, вызванных диетой с высоким содержанием жиров у мышей
1.1 Источники лекарственных средств
Слитый белок FGF21 Fc длительного действия (обозначенный как FP4I, способ получения которого можно найти в CN 107995914 A, и аминокислотная последовательность которого в настоящем раскрытии показана в SEQ ID NO: 4), дулаглутид (производится Lilly Company, США, аминокислотная последовательность которого в настоящем раскрытии показана в SEQ ID NO: 5), Ex(1-39)-L3-CTP1-vFcγ2-3 (обозначенный как FP-A, способ получения которого можно найти в китайском патенте CN 106117370 В, и аминокислотная последовательность которого в настоящем раскрытии показана в SEQ ID NO: 6), Ех-(1-45)-L-vFc (обозначенный как FP-B, способ получения которого можно найти в китайском патенте CN 106279430 В, и аминокислотная последовательность которого в настоящем раскрытии показана в SEQ ID NO: 7).
1.1 Группировка, введение лекарственного средства и взятие проб
Восьминедельные самцы мышей линии C57BL/6J были приобретены у Shanghai SLAC Laboratory Animal Co., Ltd. Мышей кормили при температуре окружающей среды от 22°С до 24°С, относительной влажности от 45% до 65% и времени освещенности 12 ч/день. Мышей после кормления согласно диете D12492 (содержание жира 60%, производство Research Diets, США) в течение 20 недель произвольным образом делили на контрольную группу, получавшую носитель, группу, получавшую FP4I-5 мг/кг (группа FP4I), группу, получавшую дулаглутид 1,5 мг/кг (группа дулаглутида), группу, получавшую FP-B 1,5 мг/кг (группа FP-B), группу, получавшую FP-A 1,5 мг/кг (группа FP-A), группу, получавшую FP4I 5 мг + дулаглутид 1,5 мг/кг (группа FP4I + дулаглутид), группу, получавшую FP4I 5 мг/кг + FP-B 1,5 мг/кг (группа FP4I + FP-B) и группу, получавшую FP4I 5 мг + FP-A 1,5 мг/кг (группа FP4I + FP-A), по восемь мышей в группе. Мышам в контрольной группе, получавшей носитель, и в группах монотерапии подкожно вводили соответствующие белковые растворы или буферы в затылочную область. Мышам в группах комбинированной терапии подкожно вводили FP4I в затылочную область и подкожно вводили дулаглутид, FP-A или FP-B в брюшную область. Мышам делали инъекцию однократно каждые шесть дней, всего четыре раза. После последнего введения мышей в каждой группе не кормили в течение 16 часов, и цельную кровь забирали из глазницы и центрифугировали при 2000 g в течение 15 минут для разделения с получением образцов сыворотки. Ткань печени отделяли и взвешивали, левую латеральную долю печени замораживали в жидком азоте и затем переносили в холодильник при температуре -80°С для консервации, и правую долю печени консервировали в 10% растворе формалина.
1.2 Экспериментальный способ
Содержание ALT, AST, TG, ТС, LDL-c и HDL-c в сыворотке крови мышей определяли с помощью автоматического биохимического анализатора (автоматический биохимический анализатор ERBA XL-200, производство Erba Tech, Германия) и вспомогательного набора (производство Ningbo Medicalsystem Biotechnology Co., Ltd.). Содержание инсулина в сыворотке мышей натощак определяли методом ELISA (с применением набора Mouse Ultrasensitive hisulin ELISA, производство ALPCO, США). Из левой латеральной доли печени мышей забирали около 55 мг ткани печени и определяли содержание триглицеридов на единицу массы печени методом Флоха. Забирали правую долю печени мышей, окрашивали с помощью НЕ (ГЭ) и подвергали гистопатологическому исследованию.
Данные были выражены в виде среднего значения ± стандартная ошибка (средние значения ± SEM) и проанализированы с помощью программного обеспечения для статистического анализа SPSS 18.0. В случае нормального распределения сравнение среднего значения в группах проводили с помощью однофакторного дисперсионного анализа, тест LSD проводили при наличии однородности дисперсий, и тест Dunnet Т3 - при неоднородности дисперсий, и в случае ненормального распределения был проведен непараметрический тест, и Р<0,05 указывало на наличие статистически значимого различия.
1.3 Экспериментальный результат
Результаты показаны на Фиг. 1. По сравнению с контрольной группой, получавшей носитель, масса тела мышей в группе дулаглутида, группе FP-А, группе FP-B и группе FP4I была значительно снижена. По сравнению с группами, в которых мышам вводили только слитый белок FGF21 Fc или только слитый белок GLP-1 Fc, масса тела мышей в группах комбинированной терапии была дополнительно значительно снижена. Результаты показаны на Фиг. 2 и Фиг. 3. Степень улучшения сывороточной функции печени у мышей в группах комбинированной терапии была значительно лучше, чем в группах монотерапии, и содержание триглицеридов в печени было значительно ниже, чем в группах монотерапии. Гистопатологические результаты показывают, что в печени мышей в контрольной группе, получавшей носитель, наблюдалась смесь макровезикулярного стеатоза и микровезикулярного стеатоза, и липидные капли сливались в хлопья. Введение дулаглутида, FP-B, FP-A или FP4I по отдельности уменьшало стеатоз печени у мышей. По сравнению с введением только слитого белка FGF21 Fc или слитого белка GLP-1 Fc степень стеатоза печени у мышей в группах комбинированной терапии уменьшалась в большей степени, как показано на Фиг. 4.
Результаты представлены в Таблице 1 и Таблице 2. Комбинация слитого белка FGF21 Fc и слитого белка GLP-1 Fc оказывала лучший терапевтический эффект на гиперлипидемию у мышей с ожирением, чем в группе, получавшей монотерапию.


Как показано на Фиг. 5, когда FP4I, дулаглутид, FP-B и FP-A применяли по отдельности, симптомы гиперинсулинемии у мышей с ожирением эффективно уменьшались. Когда FP4I применяли в комбинации со слитым белком GLP-1 Fc, влияние FP4I на улучшение резистентности к инсулину значительно усиливалось.
Содержание исследования этого примера показывает, что при применении в качестве объекта исследования мышей с ожирением и типичным метаболическим синдромом, комбинация слитого белка FGF21 Fc длительного действия и слитого белка GLP-1 Fc длительного действия оказывала дополнительное количество превосходных терапевтических эффектов на потерю веса, реверсию стеатоза печени и повреждений печени, вызванных жировой дегенерацией печени, улучшение состояния и лечение сосудистых дегенеративных заболеваний, вызванных дислипидемией, резистентностью к инсулину и повышением уровня липопротеинов низкой плотности, чем при монотерапии.
Пример 2. Терапевтический эффект комбинации при неалкогольном стеатогепатите, вызванном диетой с высоким содержанием фруктозы, жиров и холестерина у мышей
2.1 Группировка, введение лекарственного средства и взятие проб
Восьминедельные самцы мышей линии C57BL/6J были приобретены у Beijing HFK Bioscience Co., Ltd. Мышей кормили при температуре окружающей среды от 22°С до 24°С, относительной влажности от 45% до 65% и времени освещенности 12 ч/день. Мышей после кормления согласно диете D09100301 (содержание жира 40%, содержание фруктозы 40%, масса холестерина 2%, производство Research Diets, США) в течение 30 недель оставляли без пищи в течение 12 часов, забирали около 120 мкл цельной крови из венозного сплетения внутренней спайки век и отделяли сыворотку для определения уровня ALT. В зависимости от массы тела и уровня ALT в сыворотке мышей произвольным образом разделяли на контрольную группу, получавшую носитель, группу, получавшую FP4I 5 мг/кг (группа FP4I), группу, получавшую дулаглутид 1,5 мг/кг (группа дулаглутида), группу, получавшую FP-B 1,5 мг/кг (группа FP-B), группу, получавшую FP-A 1,5 мг/кг (группа FP-A), группу, получавшую FP4I 5 мг + дулаглутид 1,5 мг/кг (группа FP4I + дулаглутид), группу, получавшую FP4I 5 мг/кг + FP-B 1,5 мг/кг (группа FP4I + FP-B) и группу, получавшую FP4I 5 мг + FP-A 1,5 мг/кг (группа FP4I + FP-A), по восемь мышей в группе. Мышам в контрольной группе, получавшей носитель, и в группах монотерапии подкожно вводили соответствующие белковые растворы или буферы в затылочную область. Мышам в группах комбинированной терапии подкожно вводили FP4I в затылочную область и подкожно вводили дулаглутид, FP-A или FP-B в брюшную область. Мышам делали инъекцию однократно каждые шесть дней, всего восемь раз. После последнего введения мышей в каждой группе не кормили в течение 16 часов, и цельную кровь забирали из венозного сплетения внутренней спайки век и центрифугировали при 2000 g в течение 15 минут для разделения с получением образцов сыворотки. Ткань печени отделяли и взвешивали, левую латеральную долю печени замораживали в жидком азоте и затем переносили в холодильник при температуре -80°С для консервации, в то время как правую долю печени консервировали в 10% растворе формалина.
2.2 Экспериментальный способ
Терапевтический эффект оценивали по шкале оценки неалкогольного стеатогепатита (шкала NAS) в соответствии с рекомендациями рабочей группы по патологии Национального института здравоохранения (National Institutes of Health), которая представляла собой, в частности, следующее: стеатоз в гепатоцитах: 0 (<5%), 1 (от 5% до 33%), 2 (от 34% до 66%) и 3 (>66%); интралобулярное воспаление при 20-кратном увеличении: 0 (отсутствует), 1 (<2), 2 (от 2 до 4), 3 (<4); и баллонная дистрофия гепатоцитов: 0 (отсутствует), 1 (редко) и 2 (часто). Биохимический анализ сыворотки, тест на содержание триглицеридов в печени, гистопатологическое исследование и статистический анализ выполняли теми же способами, что и в Примере 1.
2.3 Экспериментальный результат
Как показано на Фиг. 6 и Фиг. 7, на основе лечения монотерапией комбинация может дополнительно улучшать функцию печени мышей с неалкогольным стеатогепатитом и снижать содержание триглицеридов в печени.
Гистопатологические результаты показывают, что в печени мышей в контрольной группе, получавшей носитель, наблюдался сильно выраженный стеатоз, воспалительная клеточная инфильтрация и единичная баллонная дистрофия гепатоцитов. При режиме дозирования и периоде введения, разработанных в этом примере, введение слитого белка FGF21 Fc FP4I или слитого белка GLP-1 Fc дулаглутида, FP-A или FP-B по отдельности может облегчить поражение печени у мышей с неалкогольным стеатогепатитом до определенной степени. По сравнению с группами монотерапии патологическая морфология печени у мышей в группах комбинированной терапии значительно улучшилась, и показатель по шкале NAS значительно снизился. Результаты представлены на Фиг. 8 и в Таблице 3. Содержание исследования этого примера показывает, что комбинация слитого белка FGF21 Fc и слитого белка GLP-1 Fc оказывала более положительный терапевтический эффект на неалкогольный стеатогепатит, который было значительно лучше, чем у групп монотерапии.

Пример 3. Экспериментальное исследование гипогликемического и кардиопротекторного действий комбинации на мышах линии db/db
3.1 Группировка, введение лекарственного средства и взятие проб
Шестинедельные самцы мышей линии db/db были приобретены у Jiangsu GemPharmatech Co., Ltd. Мышей кормили при температуре окружающей среды от 22°С до 24°С, относительной влажности от 45% до 65% и времени освещенности 12 ч/день. Мышей кормили согласно диете D12450B до 14-недельного возраста, и забирали около 20 мкл цельной крови из венозного сплетения внутренней спайки век для определения содержания гликированного гемоглобина. В зависимости от массы тела и уровня гликированного гемоглобина мышей линии db/db произвольным образом разделяли на контрольную группу, получавшую носитель, группу, получавшую FP4I 5 мг/кг (группа FP4I), группу, получавшую дулаглутид 1,5 мг/кг (группа дулаглутида), группу, получавшую FP-B 1,5 мг/кг (группа FP-B), группу, получавшую FP-A 1,5 мг/кг (группа FP-A), группу, получавшую FP4I 5 мг + дулаглутид 1,5 мг/кг (группа FP4I + дулаглутид), группу, получавшую FP4I 5 мг/кг + FP-B 1,5 мг/кг (группа FP4I + FP-B) и группу, получавшую FP4I 5 мг + FP-A 1,5 мг/кг (группа FP4I + FP-A), и мышей линии db/m того же возраста в неделях использовали в качестве нормальной контрольной группы, по восемь мышей в группе. Мышам в контрольных группах и в группах монотерапии подкожно вводили соответствующие белковые растворы или буферы в затылочную область. Мышам в группах комбинированной терапии подкожно вводили FP4I в затылочную область и подкожно вводили дулаглутид, FP-A или FP-B в брюшную область. Мышам делали инъекцию однократно каждые три дня, всего 12 раз. После последнего введения мышей в каждой группе не кормили в течение ночи, и цельную кровь забирали из венозного сплетения внутренней спайки век для определения содержания гликированного гемоглобина. После забора крови мышей умерщвляли путем цервикальной дислокации, отделяли сердечную ткань мышей и определяли путем взвешивания абсолютную массу сердца.
3.2 Экспериментальный способ
Содержание гликированного гемоглобина у мышей определяли методом хроматографии на микрочастицах на специальном общепринятом стандартном детекторе белков NycoCard Reader II (производство Alere Technologies AS, Норвегия). Статистический анализ проводили теми же способами, как в Примере 1.
3.3 Экспериментальные результаты
Результаты показаны в Таблице 4. Введение только одного слитого белка FGF21 Fc или слитого белка GLP-1 Fc показало хороший контроль уровня глюкозы в крови у мышей db/db, но уровень глюкозы в крови был все еще выше, чем уровень глюкозы в крови здоровых мышей. Содержание гликированного гемоглобина у мышей db/db, получавших комбинированную терапию, было значительно ниже, чем в группах монотерапии, и уровень гликированного гемоглобина в основном восстанавливался до уровня глюкозы в крови здоровых мышей.
Мыши линии db/db были мышами со спонтанным диабетом, у которых симптомы были очень похожи на клинические симптомы, поэтому эти мыши могут точно отражать терапевтический эффект гипогликемических лекарственных средств. Изучение этого примера показывает, что комбинация может привести к нормализации уровня глюкозы в крови у мышей db/db, что было лучше в группах монотерапии.
Диабетическая кардиомиопатия представляет собой одно из основных осложнений сахарного диабета, и ее основным патологическим признаком является гипертрофия сердца. Результаты представлены на Фиг. 9. Абсолютная масса сердца 20-недельных мышей линии db/db была значительно выше, чем у здоровых контрольных мышей, демонстрируя характеристики диабетической кардиомиопатии. Введение только слитого белка FGF21 Fc или слитого белка GLP-1 Fc не оказывало существенного влияния на абсолютную массу сердца мышей db/db. После комбинированной терапии абсолютная масса сердца мышей db/db значительно уменьшилась. Изучение этого примера показывает, что комбинированная терапия может предотвращать возникновение и развитие диабетической кардиомиопатии и лечить диабетическую кардиомиопатию.

Все публикации, упомянутые в настоящем раскрытии, включены в настоящий документ посредством ссылки, как если бы каждая публикация была включена в настоящий документ посредством ссылки отдельно. Кроме того, следует иметь в виду, что специалисты в данной области техники, ознакомившиеся с настоящим раскрытием, могут вносить различные изменения или модификации в настоящее раскрытие, и эти эквивалентные формы входят в объем прилагаемой формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> АМПСОРС БИОФАРМА ШАНХАЙ ИНК.
<120> СЛИТЫЙ БЕЛОК FGF21 FC, СЛИТЫЙ БЕЛОК GLP-1 FC И КОМБИНИРОВАННЫЙ
ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, ВКЛЮЧАЮЩИЙ ИХ, И ИХ ПРИМЕНЕНИЕ
<130> 20190717
<140> PCT/CN2020/100774
<141> 2020-07-08
<150> CN201910675288.5
<151> 2019-07-25
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Asp Ser Asp Glu Thr Gly Phe Glu His Ser Gly Leu Trp Val Ser
1 5 10 15
Val Leu Ala Gly Leu Leu Leu Gly Ala Cys Gln Ala His Pro Ile Pro
20 25 30
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr
35 40 45
Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg
50 55 60
Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu
65 70 75 80
Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val
85 90 95
Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly
100 105 110
Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu Leu Leu
115 120 125
Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu
130 135 140
His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly
145 150 155 160
Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu
165 170 175
Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp
180 185 190
Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser Pro Ser Tyr Ala
195 200 205
Ser
<210> 2
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<400> 2
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 3
<211> 39
<212> БЕЛОК
<213> Heloderma suspectum
<400> 3
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 4
<211> 459
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность FP4I
<400> 4
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Pro Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
180 185 190
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
195 200 205
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
210 215 220
Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln Val Glu Cys Pro
225 230 235 240
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
245 250 255
Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr
260 265 270
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
275 280 285
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
290 295 300
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
305 310 315 320
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
325 330 335
Asn Lys Gly Leu Pro Ala Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys
340 345 350
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
355 360 365
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
370 375 380
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
385 390 395 400
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
405 410 415
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
420 425 430
Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr
435 440 445
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 5
<211> 275
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность дулаглутида
<400> 5
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu
35 40 45
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
50 55 60
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly
275
<210> 6
<211> 317
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность FP-A
<400> 6
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Gly Ser Gly Gly Gly Gly Ser Gly Gly
35 40 45
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
50 55 60
Gly Ser Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro
65 70 75 80
Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln Val Glu
85 90 95
Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu
100 105 110
Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu
115 120 125
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln
130 135 140
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
145 150 155 160
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu
165 170 175
Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
180 185 190
Val Ser Asn Lys Gly Leu Pro Ala Ser Ile Glu Lys Thr Ile Ser Lys
195 200 205
Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
210 215 220
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
225 230 235 240
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
245 250 255
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly
260 265 270
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
275 280 285
Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn
290 295 300
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
305 310 315
<210> 7
<211> 278
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность FP-B
<400> 7
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Gly Ser Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser Gly Gly Gly Gly Ser Val Glu Cys Pro Pro Cys Pro Ala Pro
50 55 60
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
65 70 75 80
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
85 90 95
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
100 105 110
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
115 120 125
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
130 135 140
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
145 150 155 160
Ala Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
165 170 175
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
180 185 190
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
195 200 205
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
210 215 220
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
225 230 235 240
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
245 250 255
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
260 265 270
Ser Leu Ser Pro Gly Lys
275
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ С ДВОЙНОЙ ФУНКЦИЕЙ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741345C2 |
| НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА ИММУНОГЛОБУЛИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800919C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ГЕПАТИТА, ФИБРОЗА ПЕЧЕНИ И ЦИРРОЗА ПЕЧЕНИ, ВКЛЮЧАЮЩАЯ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2795548C2 |
| СЛИТЫЕ С FGF21 БЕЛКИ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741087C2 |
| СЛИТЫЕ БЕЛКИ IL-10/FC, ПРИГОДНЫЕ В КАЧЕСТВЕ ЭНХАНСЕРОВ ИММУНОТЕРАПИИ | 2020 |
|
RU2825306C1 |
| НОВЫЙ БЕЛКОВЫЙ КОНЪЮГАТ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА, ОЖИРЕНИЯ И ДИАБЕТА | 2021 |
|
RU2822001C1 |
| ВЫСОКОГЛИКОЗИЛИРОВАННЫЙ СЛИТЫЙ БЕЛОК НА ОСНОВЕ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА VIII, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2722374C1 |
| СЛИТЫЙ БЕЛОК TACI-FC И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2814988C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИФУНКЦИОНАЛЬНЫХ БЕЛКОВ И ИХ ПРОИЗВОДНЫХ | 2018 |
|
RU2795970C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОТИВОРАКОВОГО ЛЕЧЕНИЯ, СОДЕРЖАЩАЯ NK-КЛЕТКИ И СЛИТЫЙ БЕЛОК, КОТОРЫЙ СОДЕРЖИТ БЕЛОК IL-2 И БЕЛОК CD80 | 2020 |
|
RU2832136C1 |



Изобретение относится к области биотехнологии, конкретно к слитым с Fc-фрагментом терапевтическим белкам, и может быть использовано в медицине для применения в лечении ожирения, гиперлипидемии, неалкогольной жировой болезни печени, диабета или диабетической кардиомиопатии. Предложены комбинированный терапевтический агент, состоящий из первой фармацевтической композиции, содержащей слитый белок FGF21 Fc, и второй фармацевтической композиции, содержащей слитый белок GLP-1 Fc, и его применение для профилактики или лечения ожирения, гиперлипидемии, неалкогольной жировой болезни печени, диабета или диабетической кардиомиопатии. Изобретение обеспечивает достижение синергетического эффекта при комбинированном введении слитого белка FGF21 Fc и слитого белка GLP-1 Fc на животных моделях ожирения, диабета, гиперлипидемии, неалкогольной жировой болезни печени, диабетической кардиомиопатии. 2 н. и 5 з.п. ф-лы, 9 ил., 4 табл., 3 пр.
1. Комбинированный терапевтический агент для применения в лечении ожирения, гиперлипидемии, неалкогольной жировой болезни печени, диабета или диабетической кардиомиопатии, состоящий из первой фармацевтической композиции, содержащей слитый белок FGF21 Fc, и второй фармацевтической композиции, содержащей слитый белок GLP-1 Fc, причем слитый белок FGF21 Fc имеет аминокислотную последовательность: как показано в SEQ ID NO: 4; и слитый белок GLP-1 Fc имеет аминокислотную последовательность: как показано в SEQ ID NO: 5, SEQ ID NO: 6 или SEQ ID NO: 7.
2. Комбинированный терапевтический агент по п. 1, где слитый белок FGF21 Fc и слитый белок GLP-1 Fc включены в первую фармацевтическую композицию и вторую фармацевтическую композицию в профилактически эффективном количестве или терапевтически эффективном количестве.
3. Комбинированный терапевтический агент по п. 1, где первая фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель, и/или вспомогательное вещество, и/или стабилизирующий агент.
4. Комбинированный терапевтический агент по п. 1, где вторая фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель, и/или вспомогательное вещество, и/или стабилизирующий агент.
5. Комбинированный терапевтический агент по любому из пп. 1-4, где первая фармацевтическая композиция и вторая фармацевтическая композиция составлены в дозированной лекарственной форме, подходящей для перорального введения или введения путем инъекции.
6. Комбинированный терапевтический агент по любому из пп. 1-4, где первая фармацевтическая композиция и вторая фармацевтическая композиция составлены по отдельности в дозированных лекарственных формах, подходящих для перорального введения или введения путем инъекции.
7. Применение комбинированного терапевтического агента по любому из пп. 1-6 для профилактики или лечения ожирения, гиперлипидемии, неалкогольной жировой болезни печени, диабета или диабетической кардиомиопатии.
| CN 107995914 A, 04.05.2018, CN 108570109 A, 25.09.2018, CN 106117370 A, 16.11.2016, WO 2017074123 A1, 04.05.2017, WO 2010142665 A1, 16.12.2010, CN 110028587 A, 19.07.2019, US 20170166621 A1, 15.06.2017, RU 2604811 C2, 10.12.2016. PAKULA A.A | |||
| et al., Genetic analysis of protein stability and function | |||
| Anna | |||
| Rev | |||
| Genet | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
Авторы
Даты
2023-09-28—Публикация
2020-07-08—Подача