Группа изобретений относится к медицине и ветеринарии, а именно к медицинской и ветеринарной гинекологии, и может быть использовано для лечения женского бесплодия и бесплодия самок животных (далее для лечения женского бесплодия).
Примерно в 40% случаев неспособность супружеских пар зачать ребенка обусловлена бесплодием женщины. Основная причина женского бесплодия связана с нарушением фолликулогенеза.
Рост фолликулов в женском организме осуществляется в несколько этапов. В составе яичников по морфологическим признакам выделяют четыре типа фолликулов: примодиальные, первичные (преантральные), вторичные (антральные) третичные (предовуляторные). К периоду достижения половой зрелости основным типом фолликулов являются примордиальные, представляющие собой ооцит, окруженный одним неполным слоем плоских клеток, предшественников гранулезы. Примордиальные фолликулы образуются еще до рождения ребенка. Они формируются в процессе пролиферации первичных зародышевых клеток в зародышевом яичнике на ранней стадии беременности. В течение жизни женщины 400-500 примордиальных фолликулов могут дойти до стадии овуляции, остальные из 200-450 тысяч фолликулов подвергаются атрезии. Редуцирование фолликулов посредством апоптоза может начаться на любой стадии их развития (Боярский К.Ю., Гайдуков С.Н. Молекулярные основы фолликулогенеза: от стадии больших антральных фолликулов до овуляции // Проблемы репродукции – 2010 – 5 – стр. 13-22). В процессе фолликулогенеза из примордиального образуется первичный фолликул, который представляет собой ооцит, окруженный одним полным слоем гранулезы. Факторы, обеспечивающие выход фолликулов из примордиального состояния неизвестны, но их рост на этой стадии при отсутствии развитой сети кровеносных сосудов в зоне роста не зависит от циркулирующих в крови гормонов и потому является гормонально-нечувствительным. В этот период рост фолликулов регулируется местными факторами. При этом ооцит играет ведущую роль в регуляции перехода от стадии примордиального фолликула к стадии первичного. Для такого перехода необходима экспрессия ооцитом факторов РФД-9 (ростового фактора дифференцировки 9-го типа (CDF-9) и костного морфогенетического фактора роста 15-го типа КМФ-15 (BMP-15)).
При переходе примордиальных фолликулов в первичные увеличиваются размеры ооцита, фолликулярные клетки, окружающие ооцит, пролиферируют, увеличивается их число и размеры, однослойный эпителий становится многослойным. Скорость выхода фолликула из примордиального пула в течение жизни изменяется, увеличиваясь в постнатальном онтогенезе.
По мере увеличения растущего фолликула, окружающая его соединительная ткань уплотняется, давая начало образования внешней оболочке, так называемой теке. Эта стадия роста проходит в аваскулярной зоне яичника в условиях отсутствия гипофизарных гонадотропинов.
Переход фолликула в следующую фазу вторичного фолликула характеризуется значительным увеличением размеров ооцита и числа клеток гранулезы. Эта стадия роста фолликулов может проходить только в присутствии базальных уровней гипофизарных гонадотропинов, в первую очередь фолликулостимулирующий гормон (ФСГ). На этой стадии развития фолликула на клетках гранулезы выявляются рецепторы для ФСГ, а на клетках формирующейся теки обнаруживаются рецепторы для лютеинизирующего гормона (ЛГ) (Боярский К.Ю., Гайдуков С.Н., Чинчаладзе А.С. Факторы, определяющие овариальный резерв женщины // Журнал акушерства и женских болезней. – 2009 – т.58 - №2 – стр. 65-71). В стадии вторичного фолликула тека разделяется на внутреннюю и наружную части. В фолликуле образуется полость с фолликулярной жидкостью, которая содержит стероидные гормоны (эстрогены), гипофизарные гонадотропные факторы роста, ферменты, протеогликаны и другие биологически активные вещества, синтезируемые как местно в клетках гранулезы, теке и ооците, так и поступающих из кровотока. Во внутренней теке происходят процессы, обеспечивающие нейротрофику. В многослойном фолликулярном эпителии обособлена область, несущая половую клетку яйценосный бугорок.
Третий период роста фолликулогенеза является гормонально-зависимым. Третичные фолликулы (граафовы пузырьки) достигают своего максимального развития и характеризуются подготовкой фолликула к овуляции. Фолликул приобретает крупные формы, большую полость, заполненную жидкостью. Стенки фолликула истончаются. Клетки фолликулярного эпителия и теки интенсивно синтезируют половые гормоны, главным образом эстрадиол.
Эстрадиол необходим для осуществления процессов овуляции, а также для того, чтобы обеспечить пролиферацию клеток эндометрия. Повышенное содержание эстрадиола стимулирует выброс ЛГ, который и инициирует овуляцию. В стенке фолликула образуется выпячивание, которое разрывается и яйцеклетка выходит из фолликула. После овуляции на месте фолликула из гранулезы образуется желтое тело, вырабатывающее прогестерон.
Нарушение нормального фолликулогенеза может привести к снижению репродуктивного потенциала женщины. Применение гормональных средств влияет только на гормонозависимые стадии фолликулогенеза в то время как на начальные гормононезависимые этапы гормональные препараты не действуют.
Известно, что для стимуляции роста и созревания ооцитов на ранних стадиях предлагается использовать ростовой фактор дифференцировки 9-го типа (РФД-9, CDP-9, патент US6660717 / A61P15/08, опубл. 09.12.2003). Применение указанного фактора, как полагают авторы, обеспечивает эффективное развитие и созревание фолликулов и ооцитов и получение гамет «высокого качества», необходимых для рождения здорового потомства. Помимо фактора РФД-9 предлагаемое средство рекомендуется дополнять гонадотропинами, в частности ФСГ. Недостатком указанного средства является его полипептидная природа. Для получения РДФ-9 требуется использование трудозатратной рекомбинантной технологии. Кроме того применение гормональных средств может нарушить синтез эндогенных гормонов.
Технической проблемой, на решение которой направлено заявляемое изобретение, является расширение арсенала средств, предназначенных для лечения женского бесплодия, для увеличения фертильности за счет негормонального стимулирования фолликулогенеза. Технический результат заключается в реализации предлагаемых средств, обеспечивающих лечение женского бесплодия за счет негормонального стимулирования фолликулогенеза, в улучшении качества гамет и появлении жизнестойкого потомства.
Для решения поставленной технической проблемы и достижения максимально возможного результата в настоящем изобретении предлагается применение 9-фенил-симм-октагидроселено-ксантена в качестве средства для лечения женского бесплодия, стимулирующего фолликулогенез и способствующего имплантации эмбрионов в эндометрий матки.
Предлагается лекарственный препарат для лечения женского бесплодия, который содержит в качестве активного компонента 9-фенил-симм-октагидроселено-ксантен в эффективном количестве или может содержать дополнительно β-циклодекстрин в соотношениях от 1:1 – до 1:10.
Активный компонент лекарственного препарата для лечения женского бесплодия 9-фенил-симм-октагидроселено-ксантен может быть представлен в виде клатратного комплекса с β-циклодекстрином.
Фармацевтическая композиция для лечения женского бесплодия в качестве активного компонента содержит 9-фенил-симм-октагидроселено-ксантен или может дополнительно содержать β-циклодекстрин, либо 9-фенил-симм-октагидроселено-ксантен может быть представлен в виде клатратного комплекса с β-циклодекстрином.
Указанная фармацевтическая композиция может применяться в форме таблеток, с содержанием 9-фенил-симм-октагидроселено-ксантена от 5 до 30%, а остальное - один или более наполнитель(и). При этом таблетки сформированы посредством прессовки или формовки.
Либо фармацевтическая композиция применяется в форме желатиновых капсул, при следующем соотношении компонентов:
- 9-фенил-симм-октагидроселено-ксантен от 1 до 20%;
- наполнитель(и) или носитель(и) остальное.
Фармацевтическая композиция может быть выполнена в виде растворов, эмульсий, суспензий и др., с содержанием 9-фенил-симм-октагидроселено-ксантенаа от 0,25 до 2%; остальное - наполнитель(и) или носитель(и).
Предлагаемое изобретение предлагается использовать в качестве средств для лечения женского бесплодия, увеличивающих фертильность, стимулирующих фолликулогенез, а также способствующих имплантации эмбрионов в эндометрий матки. Предлагаемое средство обеспечивает улучшение качества гамет и появление жизнестойкого потомства.
Сущность изобретения поясняется примерами конкретного выполнения, в которых:
Препарат 1 – это фармацевтическая субстанция (ФС) с содержанием соединения 9-фенил-симм-октагидроселено-ксантен выше мас.99%
Препарат 2 – смесь соединения 9-фенил-симм-октагидроселено-ксантен с β-циклодекстрином в соотношениях: от 2 мг до 10 мг 9-фенил-симм-октагидроселено-ксантена и от 188 мг до 180 мг β-циклодекстрина, соответственно.
Препарат 3 – клатратный комплекс β-циклодекстрина с 9-фенил-симм-октагидроселено-ксантеном в соотношении 10:1, полученный стандартным способом /патент RU2451680, C07D 345/00, опубл. 27.05.2012г./.
Стимулирование фолликулогенеза у самок мышей линии BALB/c LacY и улучшение их репродуктивных функций под влиянием заявляемых средств для лечения женского бесплодия и увеличения фертильности продемонстрировано в двух независимых экспериментах. В настоящем изобретении, если не указано иное, концентрации представлены в мас.%.
Пример 1. Целью изучения влияния исследуемых препаратов на репродуктивные функции самок млекопитающих (на примере мышей линии BALB/c LacY)» является оценка их способности влиять на содержание ранних (примордиальных и первичных) и апоптотических фолликулов в яичниках инбредных мышей линии BALB/c LacY после 4 недель их внутрижелудочного введения.
В работе использовали самок инбредных мышей линии ВАLB/c LacY, которые отличаются низкой плодовитостью. Дефект репродуктивной функции самок связан с высокой эмбриональной смертностью. Потери эмбрионов до имплантации составляют до 39,5 %; общие эмбриональные потери от числа желтых тел – до 49,4 %. В связи с этим мыши этой линии являются удобным объектом для оценки способности исследуемых препаратов влиять на репродуктивную функцию самок.
В эксперименте были использованы 20 половозрелых самок мышей с исходной массой 20-22 г. В начале эксперимента животные были разделены на 4 группы – контроль и 3 опытных по 5 особей в каждой. Поскольку при клиническом применении предполагается пероральный путь введения исследуемых препаратов, животным опытных групп средства вводили ежедневно интрагастрально в виде суспензии с водой, приготовленной ex tempore. Предлагаемые препараты вводили в течение 4 недель в дозе 0,4 мг на кг массы тела мышей по действующему веществу (9-фенил-симм-октагидроселено-ксантену). Животным контрольной группы в те же сроки ежедневно интрагастрально в виде суспензии с водой вводили соответствующие количества β-циклодекстрина.
В течение опыта ежедневно контролировали состояние животных и в начале и конце экспериментального периода проводили измерение их массы тела. В конце эксперимента мышей подвергали эвтаназии в СО2- камере, проводили аутопсию и выделяли яичники.
Использование замороженных гистологических срезов яичников млекопитающих, в отличие от других методов научного исследования, предоставляет уникальную возможность для изучения функционального состояния и развития женских половых клеток (ооцитов), а также других клеток, участвующих в этом процессе (таких как клетки гранулезы). В отличие от широко используемого пункционного метода выделения ооцитов из яичника, предлагаемый в настоящей работе подход позволяет исследовать женские половые клетки на ранних стадиях развития. Использование же парафиновых гистологических срезов яичников, предварительно обработанных различными видами фиксаторов, не позволяет в полной мере оценить состояние исследуемых клеток из-за эффекта маскирования некоторых антигенов, а также невозможности применения высокоинформативного метода иммунофлуоресценции.
Для извлечения яичников самку умерщвляют, кладут на живот и делают короткий разрез в дорзо-вентральном направлении слева или справа на 5 мм каудальнее нижних ребер (разрезают кожу и стенку брюшной полости). Пинцетом захватывают подушку сальника и вытаскивают наружу вместе с яичником, яйцеводом и верхним отделом матки. Под контролем стереомикроскопа (бинокуляра), используя микропинцет и маленькие ножницы, отделяют яичник от яйцевода, матки и жировой ткани. Яичник мыши имеет размер порядка 1-2 мм с заметными предовуляторными фолликулами величиной порядка 300-500 мкм. Затем извлеченный яичник помещали в специальную форму и заливали в блоки при помощи замораживающего средства Neg-50 Frozen Section Medium (Richard-Allan Scientific, USA), имеющего в своем составе поливиниловый спирт и полиэтиленгликоль, и замораживали при -20оС. Данное средство препятствует образованию "кубического" льда и помогает замороженной ткани сохранять нативную структуру. Замораживающее средство является водорастворимым и никак не сказывается на фоновом окрашивании препарата. Затем готовые блоки монтировали на предметные столики криотома с использованием того же средства и изготавливали криосрезы.
Для изготовления замороженных срезов использовали специальный прибор микротом-криостат MICROM HM 525 (Thermo Scientific, Germany), позволяющий получать срезы толщиной в диапазоне от 2 до 500 мкм. Прибор имеет модульную конструкцию с открывающейся наверх рабочей поверхностью и охлаждающую камеру из нержавеющей стали. Температура камеры регулируется от +5оС до -30оС. Оптимальная температура для производства срезов зависит от соответствующих свойств ткани, особенно от содержания жира. Учитывая предварительную очистку яичников от жира и тот факт, что яичники являются органами с небольшим его содержанием, нами была выбрана оптимальная температура для производства срезов -20оС.
Замороженный блок закрепляли на держателе образца, с помощью соответствующих кнопок на панели управления выбирали необходимую толщину срезов (5 мкм) и изготавливали срезы путем поворота маховика по часовой стрелке. При этом полученный срез сдвигается в щель между верхней стороной ножа и антироллерной пластиной, откуда, откинув антироллер, срез можно перенести на подготовленное чистое предметное стекло (Superfrost Plus Gold Adhesion Slides, Fisher Scientific, Germany), используя кисточку или производя отпечаток. Электростатическое покрытие этих стекол обеспечивает высокую адгезию замороженных срезов ткани, позволяя сохранить срезы на стеклах в процессе окрашивания препаратов, а также избежать образования артефактов из-за способности данных предметных стекол иммобилизовывать ядерные и цитоплазматические компоненты тканей.
Предметные стекла с прикрепленными срезами хранили при -80оС до момента использования.
Для изучения препаратов криосрезов яичников использовали флуоресцентный микроскоп Axiovert 200 (Carl Zeiss, Germany), используя объектив Plan-NEOFLUAR 40×/0,75 и соответствующие наборы фильтров. Изображения записывали с помощью 13-битной монохромной камеры CoolSnapcf (RoperScientific, USA).
Подсчет фолликулов производили на криосрезах яичников животных контрольной и опытных групп после иммуногистохимического окрашивания. Количество проанализированных криосрезов зависело от индивидуального размера органа и состояния ткани после замораживания. Учитывались только тщательно расправленные срезы, с ровными краями и равномерно прокрашенные по всей площади среза.
Для статистической обработки посчитано среднее количество фолликулов (M) на срез для каждой мыши и затем для каждой группы. Для полученных значений контрольной и опытных групп (из 5 мышей каждая) найдена стандартная ошибка (m). Достоверность различий между группами оценивалась с помощью t-критерия Стьюдента.
Идентификацию ранних фолликулов в яичниках проводили после окрашивания криосрезов хроматиновым красителем DAPI и кроличьими моноклональными антителами к белку фибрилларину. Фибрилларин (34–36 кДа) является основным белковым компонентном U3, U8 и U13 малых ядрышковых рибонуклеопротеиновых гранул (мякРНП) и локализуется в фибриллярном центре и плотном фибриллярном компоненте ядрышка. Фибрилларин обладает высокой степенью эволюционной консервативности и его основные функции связаны с процессингом пре-рибосомальной РНК (пре-рРНК) и ее химическими модификациями. Белок содержит три основных структурных домена, включая GAR домен, обогащенный остатками глицина и аргинина, РНК-связывающий домен и область с доминирующей α-спиральной вторичной структурой, обладающей метилтрансферазной активностью. Таким образом, фибрилларин является РНК-связывающим белком ядрышка, участвующим в ранних стадиях процессинга рибосомальной РНК (рРНК).
Показано, что количественное содержание фибрилларина коррелирует с транскрипционной активностью РНК-полимеразы, скоростью клеточного деления и размером ядрышек, что говорит о том, что иммуноцитохимическое выявление этого белка может быть использовано для оценки общего уровня клеточного метаболизма.
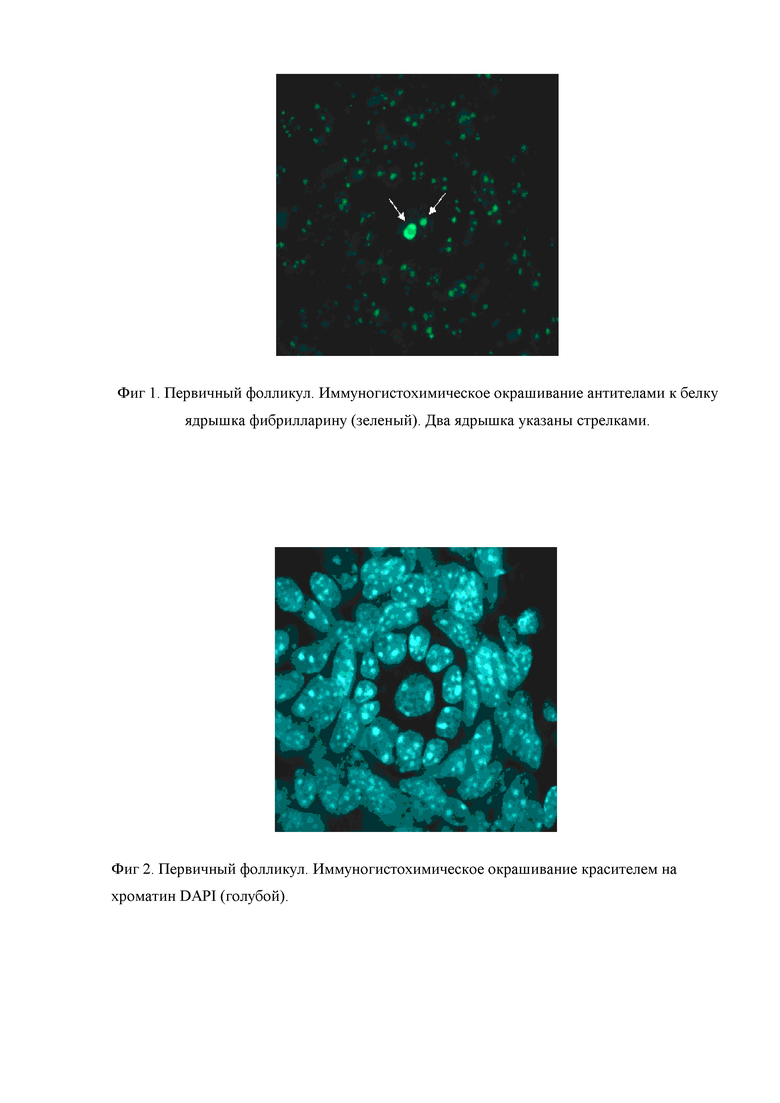
Иммуногистохимическое окрашивание ткани яичников является маркерной реакцией, позволяющей выявлять на криосрезах ооциты различной степени зрелости. Размер ядрышек ооцитов, выявляемых антителами к фибрилларину, сильно превышает таковой у гранулезных, стромальных и других окружающих клеток. В ооцитах в составе примордиальных и первичных фолликулов выявляется, как правило, два ядрышка. Их размер приближается к 5 мкм, что в сочетании со специфической морфологией данных типов фолликулов позволяет безошибочно их идентифицировать (фиг. 1 и 2).
Нами было проанализировано от 23 до 58 криосрезов яичников от каждого животного контрольной и опытных групп. Результаты подсчета количества примордиальных и первичных фолликулов представлены в табл. 2 и на фиг. 1, 2. Динамика изменения массы тела подопытных мышей приведена в табл. 1.
Таблица 1 - Динамика изменения массы тела мышей при месячном внутрижелудочном введении предлагаемых препаратов
Таблица 2 - Количество примордиальных и первичных фолликулов
*Отличия от группы контроля достоверны по t-критерию, p<0,05
Статистическая обработка полученных результатов показала, что количество примордиальных и первичных фолликулов достоверно меньше у мышей, получавших исследуемые препараты по сравнению с контролем. Полученный результат может свидетельствовать о том, что предлагаемые препараты стимулируют фолликулогенез, и к моменту приготовления срезов яичников большая часть созревающих фолликулов уже прошла стадию первичных фолликулов и достигла более поздних стадий развития, не учитываемых в данном эксперименте.
Выявление апоптотических фолликулов на криосрезах яичников
Идентификацию фолликулов с большим количеством апоптотических клеток в яичниках проводили после окрашивания криосрезов хроматиновым красителем DAPI и кроличьими моноклональными антителами к активной форме каспазы-3.
Каспаза-3 — фермент, индуцируемый прогестероном, является компонентом проведения сигнала рецепторной системы Fas/FasL, которой отводится роль в реализации апоптоза, в частности в клетках ткани яичника. Согласно литературным данным в яичниках позвоночных апоптоз опосредуется именно каспазами, благодаря чему обеспечивается удаление избыточных или нежизнеспособных зародышевых и гранулезных клеток, при этом чрезмерность апоптоза и атрезия фолликулов могут отрицательно влиять на фертильность. Нарушения апоптоза вовлечены также в патогенез хронической ановуляции и овариальной дисфункции. Перспективной задачей научных исследований на сегодняшний день является изучение возможности медикаментозного влияния на апоптоз с целью коррекции патологических изменений в женской половой железе, а также возможности повышения положительных исходов программ ЭКО.
Таким образом, иммуногистохимическое окрашивание криосрезов яичников антителами к каспазе-3 является подходящей маркерной реакцией для выяснения возможного влияния исследуемых препаратов на выживаемость прогениторных клеток яичников.
В ходе эксперимента было проанализировано от 23 до 58 криосрезов яичников от каждого животного контрольного и опытных групп. Результаты подсчета количества апоптотических фолликулов представлены в табл. 3.
Результаты проведенных исследований показали, что количество апоптотических фолликулов достоверно больше у мышей, получавших исследуемые препараты в течение 1 месяца по сравнению с контролем. Увеличение количества апоптотических фолликулов может отражать атрезию «излишка» фолликулов, приступивших к созреванию в ответ на применение предлагаемых препаратов, поскольку в организме млекопитающих, в том числе, человека и мыши, функционируют естественные механизмы, ограничивающие количество формирующихся зрелых яйцеклеток до физиологической нормы.
Таблица 3 - Количество апоптотических фолликулов
* Отличия от группы контроля достоверны по t-критерию, p<0,001
# Отличия достоверны по критерию Колмогорова-Смирнова, p<0,05
При применении предлагаемых препаратов в дозе 0,4 мг/кг ежедневно в течение 4 недель, у самок мышей линии ВАLB/c LacY, характеризующихся низкой плодовитостью, связанной с высокой эмбриональной гибелью потомства, предположительно, из-за плохого качества родительских гамет, в яичниках отмечается снижение количества ранних фолликулов (примордиальных и первичных) и увеличение числа фолликулов, претерпевающих атрезию (апоптических фолликулов).
Известно, что с каждым менструальным циклом общее количество фолликулов в яичнике уменьшается, и при их исчезновении наступает менопауза [Richardson S. et al. Follicular depletion during the menopausal transition: evidence for accelerated loss and ultimate exhaustion// Jour.Clin.Endocr.Metab. - 1987.- Vol. 65. - р. 1231 - 1237; Боярский К.Ю., Гайдуков С.Н., Чинчаладзе А.С. Факторы, определяющие овариальный резерв женщины // Журнал акушерства и женских болезней. – 2009 – т.58 - №2 – стр. 65-71]. При этом, чем интенсивнее происходит фолликулогенез, тем быстрее истощается овариальный резерв (ОР), отражающий остаточное количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) (Боярский и др., 2009). Поскольку скорость снижения количества примордиальных и первичных (ранних) фолликулов коррелирует с интенсивностью фолликулогенеза, наблюдаемое в данном эксперименте уменьшение их числа относительно контроля может свидетельствовать об усилении процессов образования фолликулов у животных, получавших предлагаемые препараты. В пользу данного утверждения свидетельствует и выявленное увеличение количества апоптических фолликулов, которое связано с известными, функционирующими в организме естественными механизмами, контролирующими число образующихся яйцеклеток [Боярский К.Ю., Гайдуков С.Н. Молекулярные основы фолликулогенеза: от стадии больших антральных фолликулов до овуляции // Проблемы репродукции – 2010 – 5 – стр. 13-22; Зенкина В.Г. Значение апоптоза в яичниках при развитии некоторых заболеваний репродуктивной системы// Фундаментальные исследования №6, 2011. с.227-230]. Из большого числа активизирующихся примордиальных фолликулов, приступивших к дифференцировке, до овуляции доходит только небольшое количество доминантных фолликулов, количество которых, как и, соответственно, число рождающихся впоследствии детёнышей, отличается у разных видов. Например, у человека обычно созревает по 1 яйцеклетке в каждом цикле, у других млекопитающих количество созревающих яйцеклеток больше (в среднем, около 4-8 яйцеклеток у мыши, около 6 – у кошек и т. д.). Остальные созревающие фолликулы, отстающие в развитии от доминантных, претерпевают атрезию — останавливаются в развитии на разных стадиях и гибнут путем апоптоза [Боярский К.Ю., Гайдуков С.Н. Молекулярные основы фолликулогенеза: от стадии больших антральных фолликулов до овуляции // Проблемы репродукции – 2010 – 5 – стр. 13-22; Зенкина В.Г. Значение апоптоза в яичниках при развитии некоторых заболеваний репродуктивной системы// Фундаментальные исследования №6, 2011. с.227-230; Березовкая Е.П. Гормонотерапия в акушерстве и гинекологии: иллюзии и реальность// 2014]. Следовательно, чем больше фолликулов вступают на путь дифференцировки, тем больше их погибнет путем атрезии, при относительно неизменном количестве образующихся зрелых яйцеклеток. Таким образом, увеличение числа апоптических фолликулов в совокупности с общим снижением количества оставшихся ранних фолликулов, наблюдаемое на фоне применения предлагаемых препаратов, может отражать повышение интенсивности фолликулогенеза, связанное с увеличением количества фолликулов, вышедших из состояния покоя и приступивших к созреванию. В этой ситуации, реализация естественных процессов в организме, контролирующих количество образующихся зрелых яйцеклеток, функционирует как фактор их естественного отбора, и образования, впоследствии, наиболее здорового потомства.
Пример 2. Целью данного исследования была оценка влияния исследуемых препаратов на репродуктивную функцию мышей при их введении одному полу (самкам).
Исследования проводили на 60 самцах и 120 самках мышей линии ВАLB/c LacY с исходной массой тела 20-25 г. Предлагаемые препараты в виде суспензии с водой, приготовленной ex tempore, вводили самкам мышей опытных групп ежедневно интрагастрально в течение 2-х недель в дозе 0,4 мг на кг массы тела. Самок разделили на 4 подгруппы: контрольную (n=30) и 3 опытные группы по 30 особей (n=90). Самкам опытных групп ежедневно в течение 2-х недель (3-4 эстральных циклов) внутрижелудочно вводили предлагаемые препараты, а самкам контрольной группы – β-циклодекстрин 0,4 мг на кг массы тела. Группа самцов, состоящая из 60 животных в течение 6 недель (2-3 цикла созревания сперматозоидов) получали соответствующее количество β-циклодекстрина. Исследуемые препараты вводили в 10 часов 1 раз в сутки. После введения изучаемых препаратов формировали следующие группы животных:
• Группа А: К 15 контрольным самцам были подсажены 30 контрольных самок (Контроль);
• Группа Б: К 15 контрольным самцам были подсажены 30 опытных самок (Препарат 1);
• Группа В: К 15 контрольным самцам были подсажены 30 опытных самок (Препарат 2);
• Группа Г: К 15 контрольным самцам были подсажены 30 опытных самок (Препарат 3).
Во всех исследуемых группах самок в течение двух эстральных циклов просматривали вагинальные мазки, отмечали стадии проэкструс, экструс и диэкструс. Обнаружение в вагинальных мазках сперматозоидов считали первым днем наступления беременности. По истечению 10 суток из самок в каждой из четырех групп формировали по две подгруппы (А1 и А2, Б1 и Б2, В1 и В2, Г1 и Г2). В каждой группе первые подгруппы самок (А1, Б1, B1 и Г1) вскрывали на 20 день беременности, подсчитывали число плодов, резорбций, мест имплантаций в полости матки, желтых тел в яичниках. На основании полученных данных по нижеуказанным формулам рассчитывали показатели предимплантационной и постимплантационной гибели и индексов плодовитости и беременности.
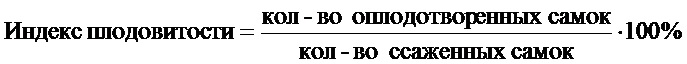
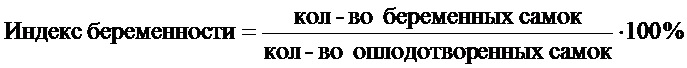
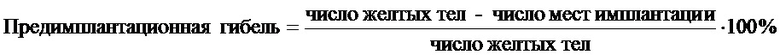

При осмотре плодов регистрировали патологические изменения (подкожные кровоизлияния и отек подкожной клетчатки, нарушения развития скелета, глазных яблок).
Вторые подгруппы беременных самок оставляли на роды, фиксировали дату родов, количество мышат в помете, массу тела новорожденных мышат. На 21 день со дня родов вычисляли процент выживаемости, отмечали общий и средний вес мышат, оценивали показатель постнатальной смертности.

Для статистической обработки данных использовали стандартные методы, приведённые в руководстве B.Ю. Урбаха «Биометрические методы» и пакетах программ Excel 2003 и SigmaStat 3.0.
Результаты исследований влияния предлагаемых препаратов на плодовитость мышей линии ВАLB/c LacY свидетельствуют о том, что эти животные в контроле имеют низкую плодовитость и только у 50 % оплодотворённых самок наступает беременность (табл.4, гр. А). Повышение индекса беременности до 67,9 % наблюдалось в группах, в которых самки принимали исследуемые препараты (группы Б, В и Г).
Таблица 4 - Влияние изучаемых препаратов на показатели плодовитости мышей-самок линии ВАLB/c LacY
В таблице 5 приведены данные, полученные при анализе вскрытых на 20-й день беременности самок, по следующим показателям репродуктивной функции: количество желтых тел, мест имплантации и живых плодов. Эти данные позволяют рассчитать по приведенным выше формулам предимплантационную и постимплантационную типы гибели зародышей мышей контрольной и опытных групп.
Полученные результаты (табл. 5) показали, что введение предлагаемых препаратов самкам (группы Б1, В1 и Г1) снижает предимплантационную и постимплантационную гибель зародышей.
Таблица 5 - Влияние предлагаемых препаратов на репродуктивную функцию мышей-самок линии ВАLB/c LacY, вскрытых на 20-й день беременности
Приведенные в таблице 6 данные свидетельствуют о том, что введение мышам-самкам предлагаемых препаратов увеличивает по сравнению с контролем число и процент рожающих самок (табл. 6, группы Б2, В2 и Г2). Увеличение числа рожающих самок соответствует увеличению числа пометов, что повышает общую численность мышат в анализируемых группах. Исследование постнатального развития родившегося потомства мышей линии ВАLB/c LacY показало, что введение самкам (табл. 7, группы Б2, В2 и Г2) предлагаемых препаратов увеличивает по сравнению с контролем общее число новорожденных мышат, из которых от 85,2 % до 90,0 % доживают до 3-х недельного возраста.
Таблица 6 - Влияние предлагаемых препаратов на показатели родовой активности мышей-самок линии ВАLB/c LacY
(50,0 %)
(61,5 %)
(61,5 %)
(71,4 %)
Таблица 7 - Влияние предлагаемых препаратов на показатели постнатального развития мышат линии ВАLB/c LacY
(72,2%)
(85,2%)
(87,3%)
(90,0%)
*Отличия от группы контроля достоверны по t-критерию, p<0,05
Также была проведена оценка изменения массы тела новорожденных мышат, родившихся от самок, которым вводили предлагаемые препараты. Полученные результаты показали, что по росту и развитию новорожденные мышата, рожденные от самок опытных групп (табл. 7, группы Б2, В2 и Г2) достоверно опережали своих сверстников из контроля (табл. 7, группа А2).
Проведённые нами исследования показали, что у мышей линии ВАLB/c LacY имеются некоторые нарушения репродуктивной функции, связанные с деторождением беременных самок и рождением жизнеспособного потомства.
Для повышения репродуктивной способности женских особей предлагаются препараты, представляющие собой 9-фенил-симм-октагидроселено-ксантен, его смесь и клатратный комплекс с β-циклодекстрином, которые обеспечивают стимулирование детородной функции, плодовитости самок и жизнеспособности рождённого потомства.
Следует отметить, что в Примерах 1 и 2 Препарат 2, представляющий смесь соединения 9-фенил-симм-октагидроселено-ксантен с β-циклодекстрином исследовался в соотношении 2 мг к 188 мг β-циклодекстрина, соответственно. При этом соотношении 9-фенил-симм-октагидроселено-ксантена с β-циклодекстрином отмечено стимулирование детородной функции, плодовитости самок и жизнеспособности рождённого потомства. Аналогичные результаты были получены при введении мышам-самкам Препарата 2 в других предложенных соотношениях.
Применение предлагаемых препаратов в дозе 0,4 мг/кг ежедневно в течение 4 недель, у самок мышей линии ВАLB/c LacY, приводит к увеличению количества апоптических фолликулов (атрезию) в совокупности с уменьшением остаточного количества ранних фолликулов. Полученные результаты Примера 1 согласуются с результатами, приведенными в Примере 2, об общем положительном влиянии предлагаемых препаратов на репродуктивные показатели самок и качество полученного потомства, и свидетельствуют о более высокой интенсивности фолликулогенеза у животных, получающих изучаемые вещества. При этом предлагаемые препараты не нарушают естественные процессы в организме, контролирующие количество образующихся зрелых яйцеклеток. В данной ситуации, при большем числе фолликулов, вступивших на путь дифференцировки, большее их количество претерпевают атрезию при относительно неизменном числе образующихся зрелых яйцеклеток. Этот комплекс естественных физиологических процессов предполагает, что в оогенезе образуется пул жизнеспособных яйцеклеток, при оплодотворении которых формируется здоровое потомство.
Таким образом, проведенные исследования позволяют сделать вывод о том, что предлагаемые препараты оказывают положительное влияние на репродуктивную функцию женских особей, в значительной мере связанное со стимулированием у них фолликулогенеза.
Предлагаемые препараты расширяют арсенал средств, предназначенных в гинекологии для лечения женского бесплодия за счет негормонального стимулирования фолликулогенеза.
Примеры твердых лекарственных форм включают, например, таблетки, пилюли, желатиновые капсулы и др.
Примеры жидких лекарственных форм для инъекций и парентерального введения включают растворы, эмульсии, суспензии и др.
Композиции, как правило, получают с помощью стандартных процедур, предусматривающих смешение активного соединения с жидким или тонко измельченным твердым носителем.
Композиции согласно изобретению в форме таблеток содержат от 5 до 30 % активного соединения и наполнитель(и) или носитель(и). В качестве таковых для таблеток применяются: а) разбавители: свекловичный сахар, лактоза, глюкоза, натрия хлорид, сорбит, маннит, гликоль, фосфат кальция двузамещенный; б) связующие вещества: магниевый силикат алюминия, крахмальная паста, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза и поливинил пиррол и дон; в) разрыхлители: декстроза, агар, альгиновая кислота или ее соли, крахмал, твин.
ПРИМЕР.
100 мг таблетки, содержащие по 2 мг 9-фенил-симм-октагидроселено-ксантена
Таблетка может быть сформирована посредством прессовки или формовки активного ингредиента с одним или более дополнительными ингредиентами. Получение прессованных таблеток осуществляется на специальной установке. Активный ингредиент в свободной форме, такой, как порошок или гранулы, в количестве 20 г (количество вещества, необходимое для получения 10000 таблеток) перемешивается со связующим веществом - трагакантом (200 г), смешивается с разбавителем - лактозой (530 г), в смесь добавляется разрыхляющее вещество - альгиновая кислота (200 г) и отдушка - лимонная кислота (50 г).
Для желатиновых капсул обычно используются дополнительно красители и стабилизаторы. В качестве красителей применяются: тетразин, индиго; в качестве стабилизаторов могут быть представлены: натрия метабисульфит, натрия бензоат. Предлагаемые желатиновые капсулы содержат от 1 до 20 % активного ингредиента.
ПРИМЕР.
1 капсула 5 мг содержит:
Активное вещество:
9-фенил-симм-октагидроселено-ксантен - 5 мг в пересчете на безводное вещество
Вспомогательные вещества:
Бетадекс (β-циклодекстрин) до массы содержимого 190 мг
Капсулы твердые желатиновые:
Желатин
Титана диоксид (Е171)
Активный ингредиент в свободной форме, такой, как порошок или гранулы, в количестве 50 г (количество вещества, необходимое для получения 10000 таблеток) перемешивается с веществом бетадекс (1850 г).
Инъекционные формы композиции предпочтительно представляют собой изотонические и масляные растворы, суспензии. Вышеуказанные формы могут стерилизоваться и содержать добавки, такие как консерванты: натрия метабисульфит, бензойная кислота, натрия бензоат, смесь метилпарабена и пропилпарабена; стабилизаторы: абрикосовая и аравийская камедь, декстрин, крахмальный клейстер, метилцеллюлоза, твин; соли, регулирующие осмотическое давление (хлорид натрия), или буферы. Кроме того, они могут содержать другие терапевтически полезные вещества.
ПРИМЕР
2 мл ампулы, содержащие по 1 мг 9-фенил-симм-октагидроселено-ксантена

Для приготовления инъекционных форм активное соединения (1 г; количество, необходимое для изготовления 1000 ампул) тонко измельчают и смешивают в смесителе с соевым маслом гидрированным (2000 мл). Полученный раствор фасуют в ампулы по 2 мл и стерилизуют паром в течение 30 мин.
Назначаемая для приема доза активного компонента (9-фенил-симм-октагидроселено-ксантена формулы 1 или его смеси с β-циклодекстрином или клатратного комплекса с β-циклодекстрином) варьирует в зависимости от многих факторов, таких как возраст, пол, масса тела пациента, симптомы и тяжесть заболевания, конкретно назначаемое соединение, способ приема, форма препарата, в виде которой назначается активное соединение. Обычно, общая назначаемая доза составляет от 0,5 до 20 мг в день. Общая доза может быть разделена на несколько доз, например, для приема от 1 до 4 раз в день. При оральном назначении интервал общих доз активного вещества составляет от 0,5 до 20 мг в день, предпочтительно, от 1 до 10 мг. При парентеральном приеме интервал назначаемых доз составляет от 0,1 до 5 мг в день, предпочтительно, от 0,5 до 2 мг. Эффективная терапевтическая доза препарата может быть выбрана лечащим врачом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ГЕНЕРАТИВНОЙ ПОТЕНЦИИ ЯИЧНИКОВ | 2008 |
|
RU2367949C1 |
| Белково-пептидный комплекс, повышающий жизнеспособность фолликулов в яичниках млекопитающих | 2017 |
|
RU2660587C1 |
| Препарат для стимуляции фолликулогенеза и способ его применения | 2016 |
|
RU2629871C1 |
| ПРИМЕНЕНИЕ СОЛЕЙ ВОЛЬФРАМА (VI) ДЛЯ ЛЕЧЕНИЯ ЖЕНСКОГО БЕСПЛОДИЯ У МЛЕКОПИТАЮЩИХ, НЕ СТРАДАЮЩИХ ДИАБЕТОМ | 2014 |
|
RU2635507C2 |
| Рекомбинантный белок GBD-SSTad-SSTad, способ его получения и применения | 2019 |
|
RU2722849C1 |
| СРЕДСТВО ДЛЯ УЛУЧШЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ | 2012 |
|
RU2487705C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ УГНЕТЕНИЯ ГАРМОНАЛЬНОЙ АКТИВНОСТИ ЯИЧНИКОВ | 1999 |
|
RU2191584C2 |
| Фармацевтическая композиция с пролонгированным действием гонадотропинов для проведения индукции суперовуляции у самок млекопитающих | 2016 |
|
RU2633079C2 |
| СПОСОБ ДИАГНОСТИКИ ЖЕНСКОЙ ФЕРТИЛЬНОСТИ | 2023 |
|
RU2807923C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПРОКАНЦЕРОГЕННОГО ДЕЙСТВИЯ СИНЕСТРОЛА НА ЯИЧНИКИ ПОТОМСТВА ЖЕНСКОГО ПОЛА У ЛАБОРАТОРНЫХ МЫШЕЙ | 2018 |
|
RU2676437C1 |
Изобретение относится к области медицины и ветеринарии, а именно к медицинской и ветеринарной гинекологии, и предназначено для лечения бесплодия. Применяют 9-фенил-симм-октагидроселено-ксантен в качестве средства для лечения женского бесплодия, стимулирующего фолликулогенез и способствующего имплантации эмбрионов в эндометрий матки. Использование изобретения обеспечивает увеличение фертильности за счет негормонального стимулирования фолликулогенеза. 7 табл., 3 пр., 2 ил.
Применение 9-фенил-симм-октагидроселено-ксантена в качестве средства для лечения женского бесплодия, стимулирующего фолликулогенез и способствующего имплантации эмбрионов в эндометрий матки.
| КЛАТРАТНЫЙ КОМПЛЕКС ЦИКЛОДЕКСТРИНА ИЛИ АРАБИНОГАЛАКТАНА С 9-ФЕНИЛ-СИММ-ОКТАГИДРОСЕЛЕНОКСАНТЕНОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2011 |
|
RU2451680C1 |
| СРЕДСТВО ДЛЯ УЛУЧШЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ | 2012 |
|
RU2487705C1 |
| СПОСОБ НОРМАЛИЗАЦИИ ВОСПРОИЗВОДИТЕЛЬНОЙ ФУНКЦИИ КОРОВ | 2001 |
|
RU2212888C2 |
| СРЕДСТВО ДЛЯ УЛУЧШЕНИЯ И/ИЛИ ВОССТАНОВЛЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ | 2009 |
|
RU2414215C1 |
Авторы
Даты
2021-01-21—Публикация
2017-06-28—Подача