Изобретение относится к экспериментальной медицине и онкологии и онкогинекологии, может быть использовано для контролируемого моделирования пренатального проканцерогенного воздействия на яичники потомства лабораторных животных.
Известно, что эстрогены в пренатальном периоде оказывают влияние на развитие яичников у потомства лабораторных мышей, проявляющееся в разной степени морфологических изменениях в зрелом возрасте [Sulaymanova R.T, Khaziev A.R., Magadeev T.R., Yusupova L.R., Khayrullin R.M. The sinestrol treatments of pregnant mice affect body growth of their offspring in early postnatal development. Revista Argentina De Anatomia Clinica.2014.].
Однако механизмы этого провоцирующего воздействия не представляется возможным изучить вследствие отсутствия однотипных по используемым дозам препаратов, воспроизводимых лабораторных моделей.
Первыми работами в этом направлении с использованием больших дозировок эстрогенов были исследования Лакасанджа в 1932 году [Lacassagne A. Apparition de cancer de la mamelle chez la souris male, soumise a des injections de folliculine. C.R. Acad. Sci., 1932. 195, 630.]. Объектом его изучения являлись преканцерогенные (предраковые) структурные изменения в молочной железе мышей, спровоцированные канцерогенным действием очень больших доз препарата эстрадиол-бензоата. Преканцерогенный эффект женских стероидных гормонов объяснялся молекулярным сходством синтетических и естественных эстрогенов со структурой канцерогенных углеводородов фенантрена, способных при длительном введении вызывать неопластические изменения в тканях организма.
Цитотоксические эффекты больших доз синестрола подтвердились в исследованиях Е.Л. Пригожина в 1961 году на экспериментально вызываемых ими опухолевых процессах в молочной железе крыс и мышей [Подильчак М.Д. Роль эстрогенов в процессе бластомогенеза. В кН.: Материалы 3-го съезда онкологов СССР УССР. Киев, 1963, с. 134]. Синестрол в высокой дозировке вызывал гиперпластические процессы с последующей канцерогенной пролиферацией эндометрия [Подiльчак М.Д. Реакцiя матки та яечникив на довготриале застосувания синестролу. Педiатрiя, акуш., гинекол., 1961, 3, 42].
В исследованиях Е.Л. Пригожина использовались восковые пилюли с 30% раствором синестрола, вживляемые животным под кожу. По данным Б.В. Ключарева с целью получения опухолей предстательной железы у крыс использовалось внутримышечное введение 1% раствора синестрола в объеме 0,5 мл один раз в неделю в течение 3-х месяцев (5 мг в неделю). По мнению вышеуказанного автора, данная дозировка для лабораторных животных является токсической, опытные крысы испытывали токсическое влияние препарата в виде снижения двигательной активности и потери волосяного покрова [Ключаров Б.В., Экспериментальные новообразования предстательной железы и их гормонотерапия. Л., 1954].
В поддержку токсического эффекта препаратов с эстрогенной активностью были проведенные исследования Гачечиладзе Л.Ф. [Структурные и гистохимические изменения молочных желез и яичников при введении синэстрола / Л.Ф. Гачечиладзе // Экспериментальное исследование. - Тбилиси, 1967. - С. 7-41]. Три раза в неделю вводилось 0,05 мг (50 мкг\мышь) синестрола. Кратковременное воздействие эстрогенов приводило к дистрофическим изменениям яичника, структурным и гистохимическим изменениям в молочной железе, являющимися пусковым механизмом в развитии неопластических изменений.
Известно, что введение низких доз эстрадиола (0,25 и 0,35 мг на один грамм массы) и средних терапевтических (0,5 и 0,7 мг на один грамм массы) у морских свинок вызывает неопластические изменения в яичниках лабораторных животных - от двухсторонних серозных кист яичников до папиллярных цистаденом [Induction of epithelial neoplasms in the ovaries of guinea pigs by estrogenic stimulation Silva E.G. 1998].
Известен способ моделирования гинекомастии в эксперименте, характеризующийся тем, что крысам вводят внутримышечно 0,5 мл 0,6% масляного раствора димэстрола 1 раз в неделю в течение 45 дней [патент RU 2330327, 2008].
Также известен способ моделирования фиброзно-кистозной болезни молочной железы в эксперименте, включающий внутримышечное введение девственным самкам крыс синэстрола в дозе 0,5 мл 2% масляного раствора в комбинации с 0,5 мл 2,5% масляного раствора прогестерона. Введение осуществляют в 1, 7, 14, 21, 28 и 35 дни эксперимента [патент RU 2605655, 2016].
Известен способ моделирования субтоксического действия эстрогенов путем введения диэтилстилбистрола (ДЕС) в дозе 100-200 мкг/кг/день (2,5-5 мкг/мышь/день) лабораторным мышам на 11-17 день беременности, которое оказывает тормозящее воздействие на развитие репродуктивного тракта, как у самцов, так и у самок потомства [Prostate enlargement in mice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses Frederick S. vom Saal, Barry G. Timms, 1997 Mar 4].
В доступной научно-медицинской и патентной литературе сведений об известности способа моделирования проканцерогенного действия синестрола на ткани яичника у потомства не обнаружено.
Задачей предлагаемого изобретения является разработка способа моделирования проканцерогенного (провоцирующего развитие злокачественных новообразований) действия повышенного уровня гормонов на яичники потомства женского пола у лабораторных животных путем введения в материнский организм эффективной субтоксической дозы синэстрола в критический день закладки этих органов.
Технический результат при использовании изобретения - получение предельно допустимой дозы синестрола, оказывающей морфологически и иммуногистохимически контролируемый проканцерогенный эффект на ткани яичника у потомства женского пола лабораторных мышей.
Предлагаемый способ моделирования проканцерогенного действия пренатального уровня синестрола на ткани яичника потомства у лабораторных мышей в постнатальном периоде выполняется следующим образом. Беременным самкам лабораторных мышей внутримышечно вводят синестрол в дозе 40 мкг/кг массы животного в виде 2% масляного раствора на 11 сутки пренатального периода. В качестве растворителя используют оливковое масло.
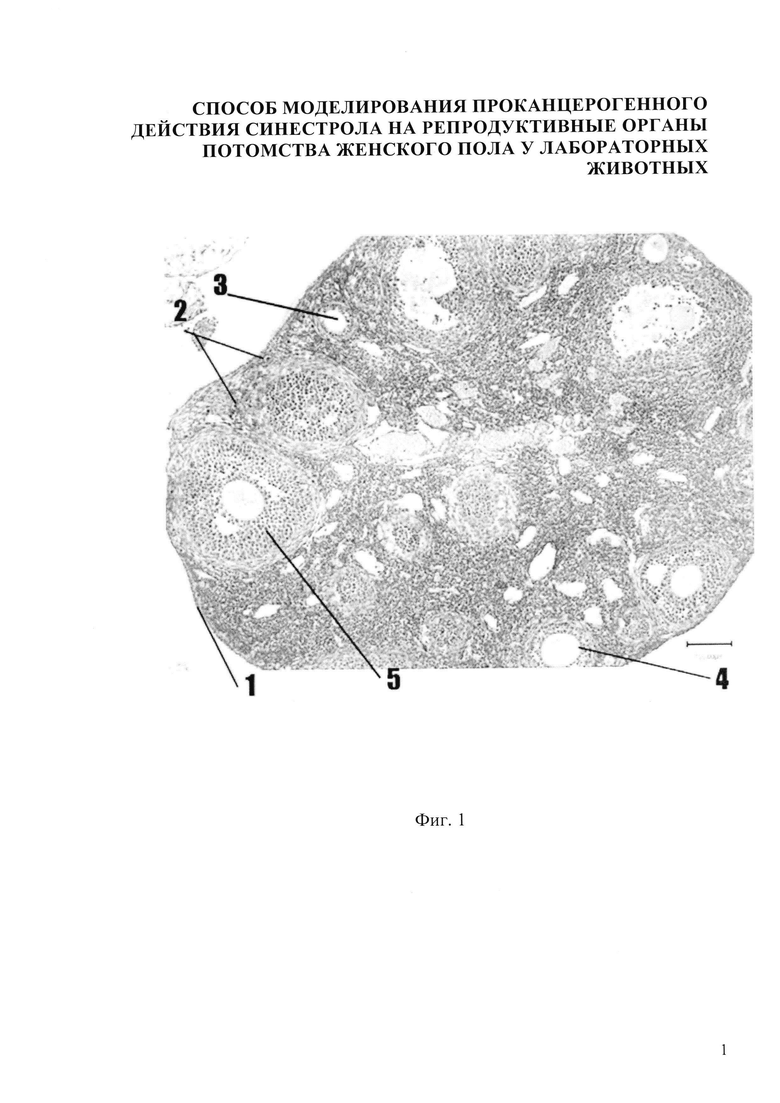
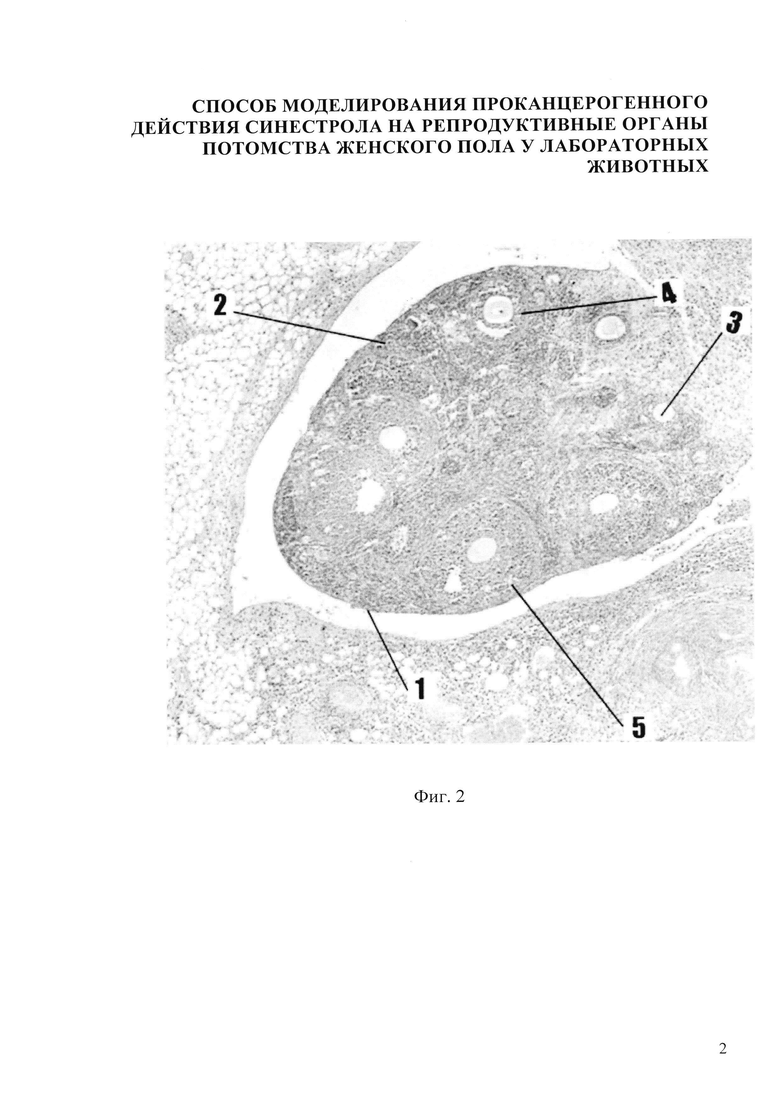
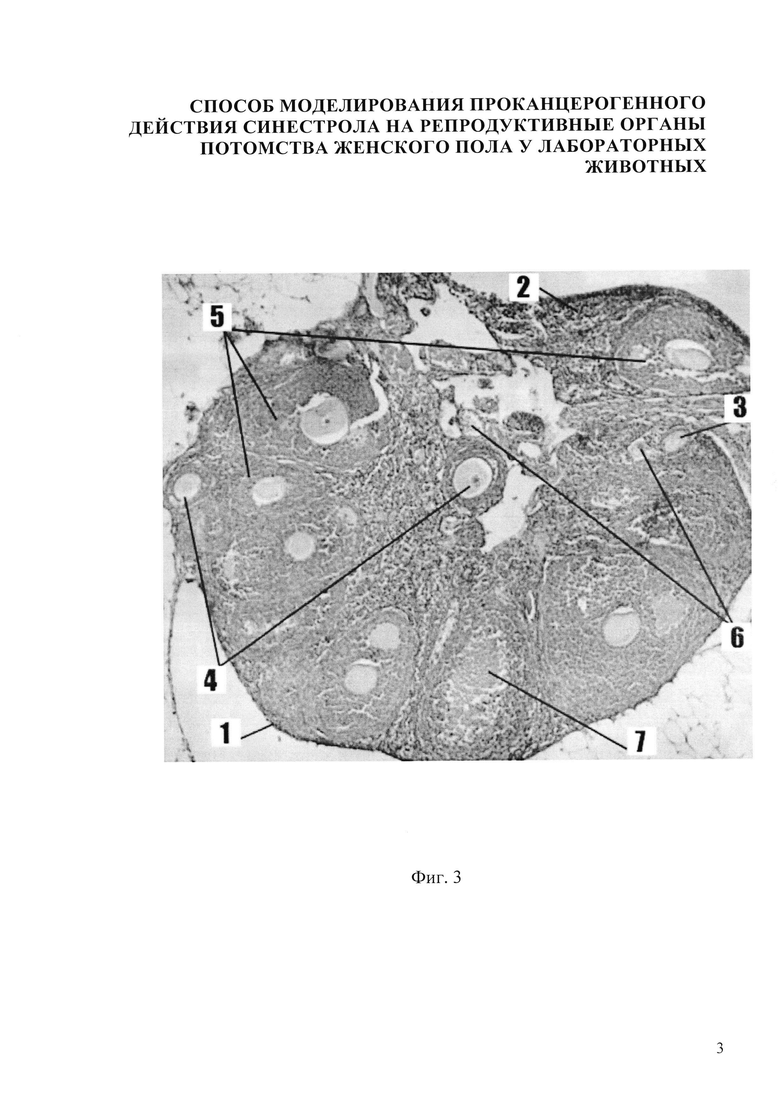
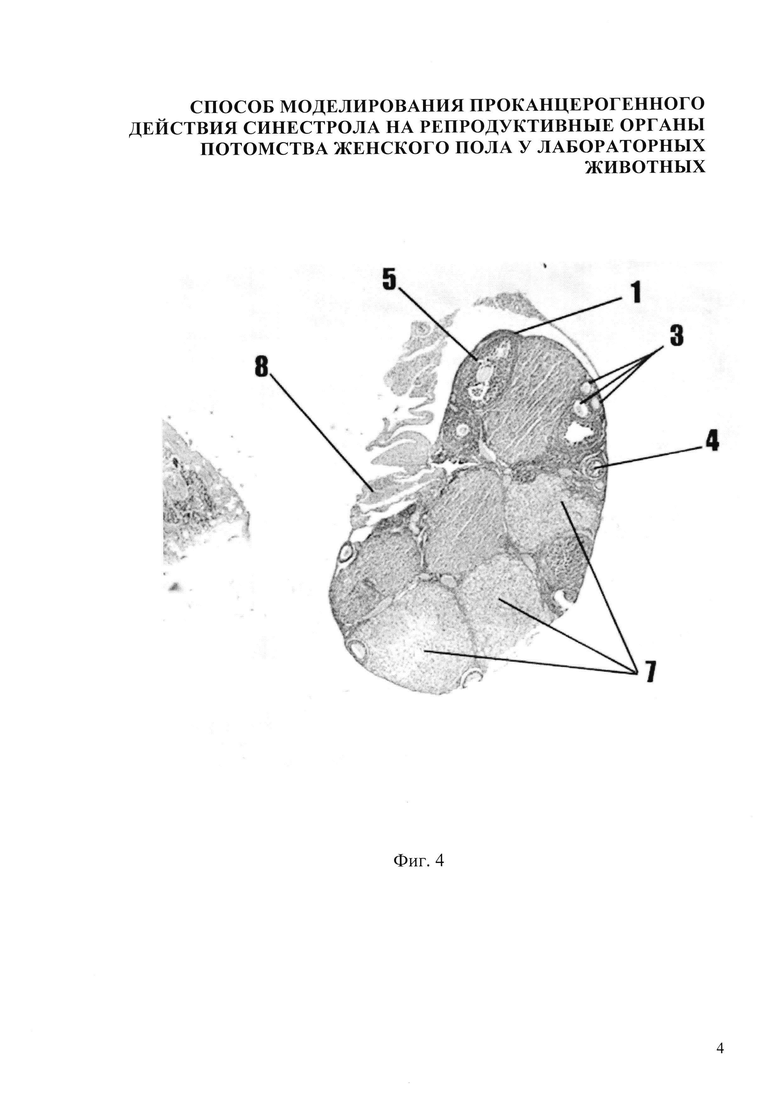
Изобретение иллюстрируется следующими фигурами: на фиг.1,5 представлено микрофото гистологического препарата яичника потомства беременных мышей контрольной группы, не получавших препарат синэстрола; на фиг. 2, 6 - микрофото гистологического препарата яичника потомства после введения синестрола в дозе 25 мкг/кг массы беременной мыши на 11 сутки пренатального периода; на фиг. 3, 7 - микрофото гистологического препарата яичника потомства после введения синестрола в дозе 40 мкг/кг массы беременной мыши на 11 сутки пренатального периода; на фиг. 4, 8 - микрофото гистологического препарата яичника потомства после введения синестрола в дозе 50 мкг/кг массы беременной мыши на 11 сутки пренатального периода
Модель может быть рекомендована:
1) в фармакологии: для разработки и испытания новых и существующих лекарственных препаратов, предупреждающих развитие злокачественных новообразований яичников у потомства с неблагоприятным воздействием стероидных гормонов в период их внутриутробного развития;
2) в акушерстве: для разработки профилактических мер при вынужденном использовании эстрогенов для поддержки беременности при привычном невынашивании с целью нивелирования их проканцерогенного воздействия на яичники потомства;
3) в гинекологии и онкогинекологии: для исследования молекулярно-клеточных механизмов пренатального программирования развития рака и других заболеваний репродуктивных органов и его гормональных факторов;
4) в персонализированной медицине: в исследованиях клеточной и молекулярно-генетической предрасположенности к раку и предраковым заболеваниям репродуктивных органов, измененных уровней гормонов отягчающих это состояние.
Расчеты эффективности доз препарата производили в соответствии с коэффициентами для перерасчета доз веществ в мкг/кг для мышей [Арзамасцев Е.В. Методологические указания по изучению общетоксического действия фармакологических веществ. // Москва. - 1997.; Хабриев Р.У. Руководство по экспериментальному изучению новых фармакологических веществ. // - 2005. - с. 49-51.; Гуськова Т.А. Доклиническое токсикологическое изучение лекарственных средств как гарантия безопасности проведения их клинических исследований. // -2010]. В качестве экспериментальных животных использовали белых лабораторных мышей, которые были получены и содержались в питомнике ГУЛ ДП ПСХ «Питомник лабораторных животных», расположенном по адресу Республика Башкортостан, Чишминский район, с. Горный. Условия вивария и содержания животных соответствует РД-АПК 3.10.07.02-09 «Методические рекомендации по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений», другим необходимым санитарным нормам и требованиям ветеринарного контроля и надзора работ с лабораторными и экспериментальными животными, лицензия №99-04-000097 от 25.01.2005 г. Федеральная служба по надзору в сфере здравоохранения и социального развития (Справка представлена от филиала ФГУП «НПО «Микроген» Минздрава России в г. Уфа «Иммунопрепарат» от 11.03.2014 г.). Исследуемые мыши были разделены на 4 группы, в каждой по 5 животных:
Контрольная группа №1 - экспозиция оливкового масла в дозировке 0.2 мкг на беременную мышь внутримышечно.
Опытная группе №2 - экспозиция синтетического эстрогена синестрола в виде 2% масляного раствора в дозировке 25 мкг/кг массы беременной мыши внутримышечно.
Опытная группа №3 - экспозиция синтетического эстрогена синестрола в виде 2% масляного раствора в дозировке 40 мкг/кг массы беременной мыши внутримышечно.
Опытная группа №4 - экспозиция синтетического эстрогена синестрола в виде 2% масляного раствора в дозировке 50 мкг/кг массы беременной мыши внутримышечно.
Животных выводили из опыта по окончании сроков на 90-е сутки и усыпляли в соответствии с Директивой 2010/63 / ЕС Европейского парламента и Совета 22 / о9 / 2010 о защите животных в научных целях и рекомендациями других международных российских и институциональных правил в области биоэтики. Для исследования извлекали яичник потомства лабораторной мыши. Органы фиксировали в 10%-ном нейтральном забуференном формалине в течение 24 часов, подвергали стандартной гистологической обработке. Готовили срезы 5-6 мкм, после соответствующей гистологической проводки следующим этапом проводилось окрашивание срезов гематоксилин-эозином и иммуногистохимическим (ИГХ) методом. Парафиновые срезы толщиной 4 мкм окрашивали с помощью иммуногистостейнера Leica Microsystems Bond™ (Германия). В работе были использованы в качестве первых антител поликлональные антитела для мыши (Santa Cruz Biotechnology, США): к рецепторам bcl 2 (клон N-19), PCNA (клон PC 10), р 53 (клон fl-393-G). Все антитела были в разведении 1:300. Для демаскировки использовали непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия). Докраску проводили раствором гематоксилина. Оценку специфичности реакции проводили при окрашивании срезов без первых антител. Исследование и визуализацию препаратов проводили с использованием светового микроскопа Leica DMD 108 (Германия) со специализированным программным обеспечением управления настройками и захвата изображения.
Всего приготовлено 96 микропрепаратов.
На гистологической картине яичника потомства мыши контрольной группы видны следующие структуры: яичник покрыт терминальным эпителием 1, хорошо различимы корковый и мозговой слои яичника. В корковом веществе яичника фолликулы находятся на разных стадиях развития: примордиальный фолликул 2, первичный (униламинарный) фолликул 3, вторичный (мультиламинарный) фолликул 4, третичный фолликул 5. Мозговое вещество яичника невелико по сравнению с корковым. Оно хорошо васкуляризировано, сосуды в нем расширены и умеренно кровенаполнены. В строме - умеренный отек и полнокровные сосуды (фиг. 1). Во вторичных фолликулах наблюдается примерно 1% ядерной экспресии, в третичных фолликулах - 5-6% умеренной ядерной экспрессии. В строме наблюдается 1% ядерной экспрессии (Фиг. 5).
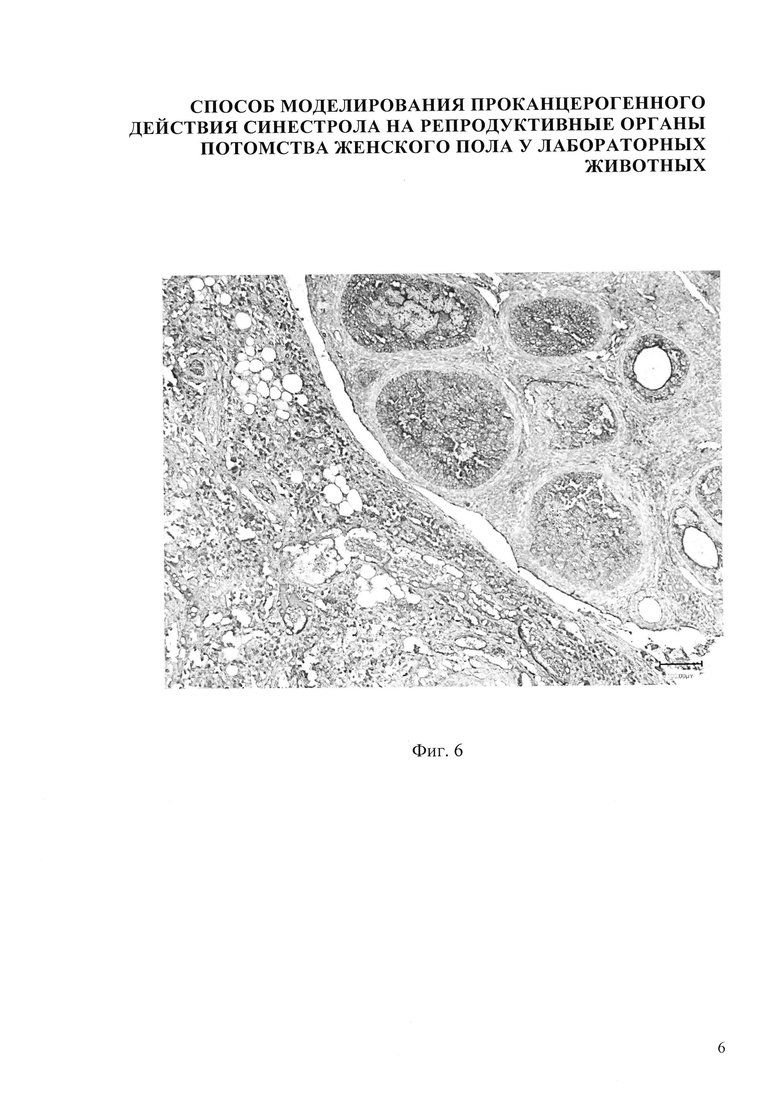
В результате внутримышечного введения синестрола в дозе 25 мкг/кг массы беременной мыши установлено, что гистологическая картина яичника потомства представлена следующими структурами: яичник покрыт терминальным эпителием 1, хорошо различимы корковый и мозговой слои яичника. В корковом веществе яичника фолликулы находятся на разных стадиях развития: примордиальный 2, первичный (униламинарный) фолликул 3, вторичный (мультиламинарный) фолликул 4, третичный фолликул 5. Мозговое вещество яичника невелико по сравнению с корковым, оно хорошо васкуляризовано, сосуды в нем расширены и умеренно кровенаполнены (фиг. 2). В фолликулах определяются единичные очаги яркой экспрессии белка-онкосупрессора Р53 до 9-10%. В строме - яркая экспрессия Р53 до 5% (Фиг. 6).
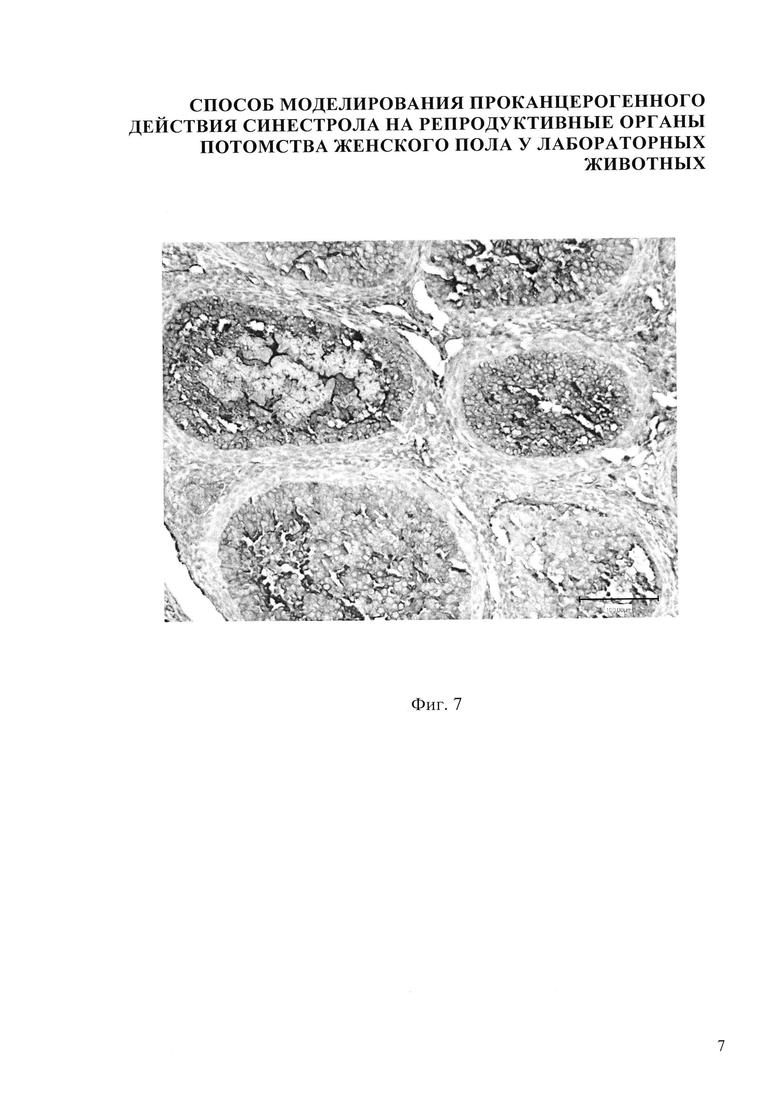
В результате внутримышечного введения синестрола в дозе 40 мкг/кг массы беременной мыши установлено, что гистологическая картина яичника потомства представлена следующими структурами: яичник покрыт терминальным эпителием 1, хорошо различимы корковый и мозговой слои яичника. В корковом веществе яичника фолликулы находятся на разных стадиях развития: примордиальный фолликул 2, первичный (униламинарный) фолликул 3, вторичный (мультиламинарный) фолликул 4, третичный фолликул 5, наблюдается уменьшение размеров третичных фолликулов. Также в корковом веществе имеются атретические тела 6 и желтое тело 7. Мозговое вещество яичника невелико по сравнению с корковым. Оно хорошо васкуляризировано, сосуды в нем расширены и умеренно кровенаполнены (фиг. 3). В созревающих фолликулах определяется яркая экспрессия Р53 до 14-15%, в строме - умеренная очаговая экспрессия до 7%, в желтом теле - яркий позитив в единичных клетках (фиг. 7).
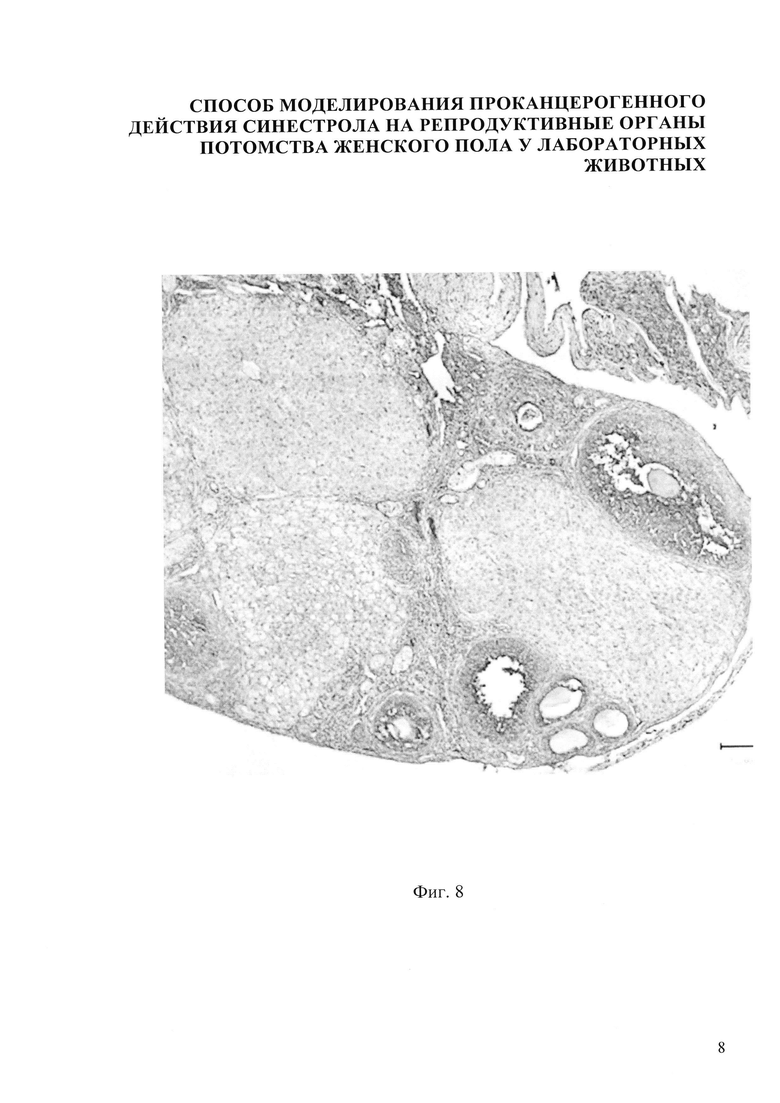
В результате внутримышечного введения синестрола в дозе 50 мкг/кг массы беременной мыши установлено, что гистологическая картина яичника потомства представлена следующими изменениями: наличием очагов кровоизлияния 8, площадь яичника представлена большим количеством желтых тел 7, фолликулы с яйцеклетками переместились на периферию, корковое вещество осталось в небольших количествах, вместе с ним сократилось количество первичных (униламинарный) фолликул 3, вторичных (мультиламинарных) фолликулов 4, третичных фолликулов 5, яичник покрыт терминальным эпителием 1 (фиг. 4). В желтых телах - позитив в единичных клетках, в строме - яркая экспрессия Р53 до 8%, в отдельных фолликулах - яркая экспрессия Р53 составляет до 15-20%, причем отмечается увеличение количества окрашенных элементов соответственно созреванию фолликулов (фиг. 8).
Полученные данные выявляют наличие положительной корреляции между повышенным уровнем половых гормонов в период пренатального развития и структурно-функциональной цепочкой изменений в яичниках потомства женского пола в позднем постнатальном онтогенезе.
Таким образом, введение синестрола в дозе 40 мкг/кг массы мыши на 11 сутки пренатального периода оказывает проканцерогенный с точки зрения морфологических и иммуногистохимических изменений эффект на репродуктивную систему потомства лабораторных мышей, с одной стороны не вызывая необратимые изменения в тканях яичников, такие как большое количество желтых тел, расположенных по всему периметру яичника, уменьшение или отсутствие первичных, вторичных и третичных фолликул, отсутствие которых приводит к бесплодию на основе патоморфологических критериев, определяемых на светооптическом уровне, как при дозировке 50 мкг/кг, но в то же время резко повышая иммуногистохимические показатели, свидетельствующие о преканцерогенных изменениях на молекулярно-генетическом уровне, наиболее отчетливо проявляющихся в выраженном повышении активности белка-онкосупрессора Р53.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ПРОКАНЦЕРОГЕННОГО ДЕЙСТВИЯ ФУЛВЕСТРАНТА НА ЯИЧНИКИ ПОТОМСТВА ЖЕНСКОГО ПОЛА У ЛАБОРАТОРНЫХ МЫШЕЙ | 2019 |
|
RU2722988C1 |
| Способ регулирования половой деятельности млекопитающих | 1986 |
|
SU1837888A3 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТУБЕРКУЛЕЗА ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ | 2015 |
|
RU2600926C2 |
| СРЕДСТВО ДЛЯ ПРЕРЫВАНИЯ ПОЛОВОЙ ОХОТЫ У САМОК КОШЕК "АНТИМЯУ" | 1992 |
|
RU2015698C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ В ЭКСПЕРИМЕНТЕ | 2012 |
|
RU2533739C2 |
| Белково-пептидный комплекс, повышающий жизнеспособность фолликулов в яичниках млекопитающих | 2017 |
|
RU2660587C1 |
| Средство для лечения женского бесплодия и бесплодия самок животных | 2017 |
|
RU2740922C2 |
| СПОСОБ ДИАГНОСТИКИ ГЕНЕРАТИВНОЙ ПОТЕНЦИИ ЯИЧНИКОВ | 2008 |
|
RU2367949C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПОЛОВОЙ ЦИКЛИЧНОСТИ И ПЛОДОВИТОСТИ КОРОВ ПРИ ГИПОФУНКЦИИ ЯИЧНИКОВ | 2013 |
|
RU2531939C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ВОСПРОИЗВОДИТЕЛЬНОЙ ФУНКЦИИ У БЕСПЛОДНЫХ КОРОВ | 1991 |
|
RU2050159C1 |

Изобретение относится к экспериментальной медицине, онкологии, а именно к онкогинекологии, и может быть использовано для моделирования проканцерогенного действия синестрола на ткани яичника у потомства женского пола. Самкам лабораторных мышей на 11 сутки пренатального периода внутримышечно вводят синестрол в дозе 40 мкг/кг массы мыши в виде 2% масляного раствора. Способ обеспечивает получение морфологически и иммуногистохимически контролируемого проканцерогенного эффекта на ткани яичника у потомства женского пола лабораторных мышей за счет применения эффективной субтоксической дозы синестрола. 1 з.п. ф-лы, 8 ил.
1. Способ моделирования проканцерогенного действия синестрола на ткани яичника у потомства женского пола, заключающийся в том, что лабораторным мышам на 11 сутки пренатального периода внутримышечно вводят синестрол в дозе 40 мкг/кг массы мыши в виде 2% масляного раствора.
2. Способ по п. 1, отличающийся тем, что в качестве растворителя используют оливковое масло.
| ВОЗДЕЙСТВИЕ MORINDA CITRIFOLIA, ПРЕДОТВРАЩАЮЩЕЕ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ | 2004 |
|
RU2346700C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГИНЕКОМАСТИИ В ЭКСПЕРИМЕНТЕ | 2006 |
|
RU2330327C1 |
| СЕЛЕКТИВНОЕ ИНГИБИРОВАНИЕ ПРОДУКЦИИ ЭСТРОГЕНА И ОБЕСПЕЧЕНИЕ ЭСТРОГЕННОГО ДЕЙСТВИЯ В ОРГАНИЗМЕ ЧЕЛОВЕКА | 2004 |
|
RU2324372C2 |
| US 5709844 A, 20.01.1998 | |||
| ГАЧЕЧИЛАДЗЕ Л.Ф | |||
| Структурные и гистохимические изменения молочных желез и яичников при введении синэстрола | |||
| Экспериментальное исследование, Тбилиси, 1967, с | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| КИСЕЛЕВ В.И | |||
| Роль метаболитов эстрогенов в канцерогенезе репродуктивных органов | |||
| Акушерство и гинекология, 2006, N 3, С | |||
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| XIA REN et al | |||
| Local estrogen metabolism in epithelial ovarian cancer suggests novel targets for therapy | |||
| The Journal of Steroid Biochemistry and Molecular Biology, June 2015, V | |||
| Деревянный коленчатый рычаг | 1919 |
|
SU150A1 |
| HECHT J et al | |||
| Relationship between epidemiologic risk factors and hormone receptor expression in ovarian cancer: results from the Nurses' Health Study | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2018-12-28—Публикация
2018-01-09—Подача