Изобретение относится к медицине, а именно к лечению, и может быть использовано в онкологии для лечения онкологических заболеваний посредством иммунотерапии в качестве адъювантной терапии, терапии в период реабилитации, а также в ходе проведения мониторинга иммунного гомеостаза онкологического больного в сезонах при многолетнем наблюдении и последующей его коррекции.
В соответствии с применяемыми стандартами лечение рака может включать хирургическое вмешательство, химиотерапию, гормональную терапию, лучевую терапию, биологическую терапию, иммунотерапию (Минздрав РФ, Клинические рекомендации «Меланома кожи и слизистых оболочек», МКБ 10: С43, С51, С60.9, С63.2, год утверждения (частота пересмотра): 2020 (пересмотр каждый год), версия 1.2020; Минздрав РФ Клинические рекомендации «Рак молочной железы», МКБ 10: С50, год утверждения (частота пересмотра): 2020 (каждые 3 года); Минздрав РФ Клинические рекомендации «Рак ободочной кишки и ректосигмоидного отдела», МКБ 10: С18/С19, год утверждения (частота пересмотра): 2020 (пересмотр каждые 3 года) и др.) Каждый из выше перечисленных способов лечения имеет отрицательное воздействие на организм, что требует последующей его нейтрализации. Кроме того, каждый из вышеперечисленных способов лечения воспринимается индивидуально и у некоторых пациентов в процессе проведения курса может вызывать серьезные побочные эффекты, оказывающие отрицательное влияние на сохранение удовлетворительного общего состояния пациента, которое может привести к ограничению или невозможности продолжения лечения, выполняемого стандарта курсом: химиотерапия, гормональная терапия, биологическая терапия или иммунотерапия. Во всех случаях, независимо от стадии заболевания, существует необходимость в проведении многокомпонентного лечения онкологического больного, как в период реабилитации - поддерживающая терапия, так и для продолжения лечения, прерванного из-за симптомов, связанных с токсическим воздействием лечебных мероприятий, а так же в связи с изменяющимися биологическими характеристиками пациента в динамике наблюдения. Кроме того, во всех случаях, как для облегчения симптомов, связанных с токсическим воздействием лечебных мероприятий, так и для продолжения лечения симптомов заболевания требуется оценка общего состояния организма онкологического больного. При этом важным является выбор показателей иммунного гомеостаза, интерпретация параметров которых позволяет оценить дефект иммунитета, сохранившегося или изменившегося после лечения, и выполнить его адекватную коррекцию индивидуально, с учетом состояния организма пациента в данный момент времени.
Известен способ индивидуализации лечения больных раком тела матки молодого возраста (РФ, патент №2508550, G01N 33/52, 27.02.2014), в соответствии с которым в опухолевой ткани эндометрия, полученной после операции у женщин репродуктивного возраста, анализируют плоидность клеток опухоли по фазам клеточного цикла. Выявляют соотношение анеуплоидных клеток в S-фазе клеточного цикла к диплоидным клеткам в S-фазе клеточного цикла, выраженное в процентах. В соответствии с полученным результатом выбирают вид адъювантной терапии. При значении соотношения ≤0,8 больным в послеоперационном периоде назначают лучевую терапию. При значении соотношения >0,8 назначают курс полихимиотерапии с последующей сочетанной лучевой терапией.
В выявленном способе решающим критерием для выбора адъювантной терапии являются результаты набора статистических данных. Это привязывает выбранные критерии к конкретному заболеванию. Кроме того, выбранный критерий не учитывает состояние всего иммунитета пациента, сохранившегося после лечения, а следовательно, в процессе адъювантной терапии не позволяет выполнить адекватную индивидуальную коррекцию иммунитета с учетом индивидуальных особенностей состояния иммунитета пациента на данный момент времени.
Известен способ определения тактики лечения местно-распространенного и диссеминированного почечно-клеточного рака (РФ, патент №2403056, A61K 38/20, A61K 38/21, A61K 31/675, A61K 31/7068, А61Ρ 35/00, 10.11.2010), в соответствии с которым определяют абсолютную концентрацию клеток с фенотипами CD57+ в мм3 и CD4+CD25+Treg в мм3, а также уровни спонтанной продукции интерлейкина-6 в пг/мл, интерлейкина-8 в пг/мл и интерферона-γ в пг/мл. По полученным значениям рассчитывают дискриминантные функции и по наибольшему значению функции прогнозируют продолжительность жизни больного. После чего назначают лечение в зависимости от прогнозируемой продолжительности жизни. Использование изобретения позволяет проводить адекватное лечение больных с разной продолжительностью жизни, оптимизировать режимы введения препаратов, улучшить отдаленные результаты лечения больных диссеминированным и местно-распространенным почечно-клеточным раком.
Известен способ лечения диссеминированного почечно-клеточного рака (РФ, патент №2409382, А61К 38/20, А61К 31/675, А61К 35/60, А61Р 35/00, 20.01.2011), в соответствии с которым предварительно в периферической крови больного определяют абсолютную концентрацию клеток с фенотипом CD4+CD25+Foxp3Treg в мм3. При его значении выше 100 клеток/мм3, больному в течение трех недель одновременно с циклофосфамидом вводят Ронколейкин, причем циклофосфамид вводят в количестве 200 мг внутримышечно три раза в неделю через день, а Ронколейкин - три раза в неделю, одновременно с циклофосфамидом в количестве 1 мг внутривенно капельно в течение двух часов, растворяя его в 400 мл физиологического раствора или в той же дозе ингаляционно, растворяя его в 8-10 мл физиологического раствора. Также в течение трех недель вводят Неовастат по 30 мл два раза в день перорально ежедневно. После окончания курса лечения повторяют каждые 5 недель определение в крови абсолютной концентрации клеток с фенотипом CD4+CD25+Foxp3TregB мм3, если ее значение выше 100 клеток/мм3, лечение продолжают по той же схеме, а ниже 100 клеток/мм3 - за больным устанавливают динамическое наблюдение. Способ позволяет улучшить результаты лечения больных ДПКР, снизить количество побочных эффектов.
Известен способ лечения почечно-клеточного рака (РФ, патент №2712454, A61K 31/664, A61K 38/19, А61Р 35/00, G01N 33/574,29.01.2020), в соответствии с которым больному вводят комбинацию препаратов: 3 раза в неделю в количестве 12000000 ME в сутки и Эндоксан. Эндоксан вводят перорально в количестве 50 мг в сутки и дополнительно Рефнот подкожно в количестве 200000 ЕД в сутки два раза в неделю. Каждые 8 недель проводят компьютерно-томографическое исследование опухоли. При наличии рентгенологических признаков прогрессирования заболевания определяют уровни спонтанной продукции IL-10 (X1), индуцированной продукции IL-8 (Х2), спонтанной продукции IL-4 (Х3), индуцированной продукции TNF-α (Х4) и абсолютную концентрацию натуральных киллеров с рецепторами Т-лимфоцитов CD3+CD16+56+(Х5). По полученным значениям рассчитывают дискриминантные функции F1 и F2. При F1>F2 продолжают лечение в прежнем режиме. При F2>F1 больного переводят на терапию сунитинибом. Между 8-недельными циклами сунитиниба делают перерыв по 2 недели. Изобретение позволяет улучшить показатели выживаемости больных почечно-клеточным раком.
Известен, наиболее близкий к предлагаемому, способ определения тактики лечения диссеминированного почечно-клеточного рака (РФ, патент №2216325 РФ, A61K 31/505, 38/20, 38/21, А61Р 13/12, 35/00, 20.11.2003), в соответствии с которым больному проводят иммунологическое исследование крови на содержание интерлейкина-6, интерферона-γ, кислотолабильной фракции интерферона-α/β, а также клеток с фенотипами CD8+, CD25+ и CD95+, и если содержание интерлейкина-6 и/или кислотолабильной фракции интерферона -α/β в 1.5 раза и более выше нормы и/или содержание интерферона-γ в 3 раза и более выше нормы, больному проводят иммунохимиотерапию в составе: 5-фторурацил в дозе 0.7-0.8 г/м2 внутривенно капельно в течение 72 часов с 1 по 4 неделю лечения и Ронколейкина по 1 мг 3 раза в неделю на 1 и 4 неделе лечения и 0.5 мг 3 ρ аза в неделю на 2 и 3 неделе, чередуя с интерфероном-α в дозе 6.0 млн МЕ/м2, если содержание интерлейкина-6 и кислотолабильной фракции интерферона -α/β не более чем в 1.5 выше нормы, содержание интерферона-γ не более чем в 3 раза выше нормы, содержание CD25+ в норме или выше, содержание CD8+ ниже и/или CD95+ выше нормы, больному в течение двух недель ежедневно внутривенно вводят Ронколейкин®, чередуя его количество по 0.5 мг и 1 мг на введение, если при этом содержание CD25+ ниже нормы, больному предварительно в течение 5 дней дополнительно вводят по 0.5 мг Ронколейкина® подкожно, если при этом CD8+ выше, CD95+ ниже нормы, при отсутствии признаков клинического прогрессирования заболевания, за больным устанавливается динамическое наблюдение. Принятую тактику лечения осуществляют неоднократно в соответствии с иммунограммой, повторяя ее каждые три месяца.
В выявленных способах лечения онкологического заболевания в качестве критериев для принятия решения о необходимости проведения иммунотерапии используют показатели иммунной системы, которые позволяют оценить реакцию организма только при лечении онкологическом заболевании почек, что не позволяет использовать эти критерии в отношении других онкологических заболеваний.
Кроме того, в выявленных способах решающим критерием для коррекции иммунитета являются результаты набора статистических данных. Это также привязывает выбранные критерии к конкретному онкологическому заболеванию, а именно: к онкологическому заболеванию почек. Кроме того, использование статистических данных не позволяет оценить индивидуально у конкретного пациента уровень иммунитета, сохранившегося после курса лечения, а, следовательно, не позволяет выполнить адекватную индивидуальную коррекцию иммунитета с учетом индивидуальных особенностей состояния иммунитета пациента в данный момент времени.
Таким образом, существует проблема создания универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения.
Предлагаемый способ лечения онкологических заболеваний при осуществлении решает проблему создания универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения.
Кроме того, предлагаемый способ лечения онкологических заболеваний при осуществлении обеспечивает достижение технического результата: возможность выполнения направленной иммунотерапии для широкого спектра онкологических заболеваний; возможность индивидуального подхода к выбору иммунотерапии и индивидуальной тактики ведения больного; за счет возможности учета изменчивости иммунитета под влиянием токсичных цитостатиков (иммунодепрессантов) или применения лучевой и химиотерапии: повышение эффективности лечения, снижение побочных эффектов, улучшение безрецидивных отдаленных результатов лечения, повышение показателя выживаемости, повышение эффективности назначений для дальнейшего лечения.
Сущность заявленного изобретения состоит в том, что в способе лечения онкологических заболеваний, в соответствии с которым после окончания первичного комплексного лечения злокачественного новообразования проводят иммунологические исследования крови пациента и по результатам исследования выбирают тактику выполнения иммунотерапии, новым является то, что в исследуемой периферической крови пациента определяют количество субпопуляций Τ-лимфоцитов CD3+, 10*9/л, синтезирующих спонтанно и стимулированно первый тип цитокинов, способных влиять системно на иммунный гомеостаз и течение опухолевого процесса, а именно: фактор некроза опухоли (TNF-α), интерлейкин - 2 (IL-2), интерферон γ (INF-γ), а также определяют субпопуляции Т-лимфоцитов CD3+, а именно: абсолютное количество субпопуляций лимфоцитов CD4+ и CD8+ Т-лимфоцитов; определяют абсолютное значение В-лимфоцитов, определяют абсолютные значения нейтрофилов и общих лимфоцитов; кроме того, для верхних и нижних границ общепринятых интервалов референтных абсолютных значений нейтрофилов, общих лимфоцитов, В-лимфоцитов, суббопопуляций лимфоцитов CD4+ и CD8+ путем вычисления частного определяют значения отношений абсолютных значений: нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам, при этом полученные значения частного отношений для верхних и нижних границ общепринятых интервалов референтных значений и интервал значений частного, заключенных между ними, принимают за норму, после чего оценивают системное влияние на течение опухолевого процесса каждого из цитокинов, а именно: TNF-α, INF-γ, IL-2, - путем вычисления коэффициента реакции для каждого из них по формуле: Кр=nCD3+стим/nCD3+спонт, где
Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2;
nCD3+стим - количество клеток Τ-лимфоцитов (CD3+) в периферической крови, синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции;
CD3+спонт - количество клеток Т-лимфоцитов CD3+ в периферической крови синтезирующих соответствующий цитокин спонтанно,
при этом за норму реакции цитокинов принимают значения коэффициентов реакции в диапазоне: для TNF-α от 80 до 120, для IL-2 от 80 до 120, для INF-γ от 150 до 250, затем полученные результаты вычисления коэффициентов реакции сравнивают с нормой соответственно, и, если выявляют пару цитокинов, в которой значение коэффициента реакции у каждого из цитокинов в паре превышает значение верхнего предела нормы соответственно, то такую цитокиновую пару определяют как гиперреактивную, если значение коэффициента реакции у каждого из цитокинов в паре ниже значения нижнего предела нормы соответственно, то такую цитокиновую пару определяют как гипореактивную, затем, для результатов исследования периферической крови больного определяют значения частного отношений абсолютных значений нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также абсолютных значений общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам, фиксируют полученные для больного результаты вычислений частного исследуемых отношений, полученные результаты вычислений частного исследуемых отношений сравнивают соответственно с интервалами значений частного исследуемых отношений, принятых за норму, включая верхние и нижние границы и, если в результате сравнений все полученные значения частного исследуемых отношений соответствуют значениям нормы или выявлены исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы, но при этом отклонения от нормы не достигают 50%, и не выявлена гипер- или гипореактивная цитокиновая пара, то лечение не назначают, если гипо- или гиперреактивная пара цитокинов выявлена, но при этом выявляют исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы при этом отклонения от нормы достигают 50% и более, то назначают терапию исходя из показателей крови пациента и их значений в выявленных исследуемых отношениях.
Решение заявленной проблемы и достижение заявленного технического результата осуществляют следующим образом.
Существенные признаки формулы изобретения: «Способ лечения онкологических заболеваний, в соответствии с которым после окончания первичного комплексного лечения злокачественного новообразования проводят иммунологические исследования крови пациента и по результатам исследования выбирают тактику выполнения иммунотерапии, …» - являются неотъемлемой частью заявленного способа и обеспечивают его осуществимость, а следовательно, обеспечивают достижение заявленного технического результата.
Известно, что реакция иммунной системы, влияя на развитие заболевания, в частности, онкологического, может быть использована в качестве критерия для прогнозирования течения онкологических заболеваний (РФ, патент №2622756, G01N 33/53,19.06.2017).
В заявляемом изобретении реакцию иммунной системы на течение онкологического заболевания используют в качестве критерия в процессе принятия решения для проведения направленной иммунотерапии. При этом заявленные в формуле изобретения в качестве критериев показатели иммунного гомеостаза в совокупности отражают на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе организма на внешнее воздействие в виде проведенного курса лечения, что позволяют использовать заявленный способ лечения для широкого круга онкологических заболеваний.
Это объясняется следующим.
В заявленном способе лечения онкологических заболеваний в качестве в качестве критерия для принятия решения для проведения направленной иммунотерапии выбраны показатели иммунного статуса больного: абсолютные количество нейтрофилов, абсолютное количество общих лимфоцитов, абсолютное количество субпопуляций Т-лимфоцитов CD3+, 10*9/л, синтезирующих спонтанно и стимулированно первый тип цитокинов, способных влиять системно на иммунный гомеостаз и течение опухолевого процесса, а именно: фактор некроза опухоли (TNF-α), интерлейкин-2 (IL-2), интерферону (INF-γ), субпопуляции Т-лимфоцитов CD3+, а именно: абсолютное количество субпопуляций лимфоцитов CD4+ и CD8+; абсолютное количество В-лимфоцитов (CD3+ CD19+).
Нейтрофилы и лимфоциты - это клетки, несущие ответственность за иммунитет человека.
На сегодня установлено, что нейтрофилы являются ключевыми эффекторными и регуляторными клетками как врожденного, так и адаптивного иммунитета, активно участвующими в реализации противоопухолевого ответа (Нестерова И.В., Колесникова Н.В., Чудилова Г.А. и др. (2015) Нейтрофильные гранулоциты: новый взгляд на «старых игроков» на иммунологическом поле. Иммунология, 36(4): 257-264); Pylaeva Ε., Lang S., Jablonska J. (2016) The essential role of type I interferons in differentiation and activation of tumor-associated neutrophils. Front. Immunol., 7: 629.; Siono R.V., Fridlender Z.G., Granot Z. (2015) The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron., 8(3): 125-158; Donskov F. (2013) Immunomonitoringand prognostic relevance of neutrophils in clinical trials. Semin. Cancer Biol, 23(3): 200-207 // «Клетки врожденного иммунитета и их связь с прогнозом заболевания у больных раком грудной железы (обзор литературы)», Кукшкина С.Н., Фильчиков В.Ф., Национальный институт рака, Киев «Экспериментальные исследования, онкоморфология, онкоиммунология», №4(28) 2917, https://www.clmicaloncology.com.ua/article/20133/kletki-vrozhdennogo-immuniteta-i-ix-svyaz-s-prognozom-zabolevaniya-u-bolnyx-rakoiTi-grudnoj-zhelezy-obzor-literatury).
Нейтрофилы берут на себя легкие воспалительные процессы.
Нейтрофилы - это самая многочисленная группа лейкоцитов. Они первыми реагируют на проникновение в организм патогенных бактерий. Защита от бактериальных инфекций - их главная задача, хотя они могут принимать участие и в других важных процессах: в формировании системной воспалительной реакции с обеспечением клеточного неспецифического и специфического иммунитета.
Количество нейтрофилов в периферической крови больного является одной из основных характеристик системы врожденного иммунитета (https://studfile.net/preview/6831657/page:142/).
Нейтрофилы представляют собой наиболее многочисленный вид лейкоцитов крови (белые клетки крови, которые участвуют в формировании иммунитета организма). Данные клетки крови образуются в красном костном мозге из гранулоцитарного ростка кроветворения.
Нейтрофилы принадлежат к гранулоцитарным клеткам крови, которые содержат в своей цитоплазме зернистость (гранулы). В этих гранулах нейтрофилов находятся миелопероксидаза, лизоцим, катионные белки, кислые и нейтральные гидролазы, коллагеназа, лактоферрин, аминопептидаза. Благодаря такому содержимому своих гранул нейтрофилы выполняют важные функции в организме. Они проникают из крови в органы и ткани организма и уничтожают болезнетворные, чужеродные микроорганизмы. Уничтожение происходит путем фагоцитоза, то есть нейтрофилы поглощают и переваривают чужеродные частицы, после чего сами погибают.
Нейтрофилы погибают, поглощая чужеродные вредоносные объекты. Организм начинает вырабатывать новые. Поэтому, если общее число нейтрофилов (в том числе и палочкоядерных) увеличивается, можно сделать вывод о наличии активного процесса по типу инфекционного острого воспаления, но опухолевого типа.
Уменьшение общей численности нейтрофилов с повышением незрелых клеток говорит о неактивном, хронически протекающем или недостаточном воспалительном ответе и компенсируемым условно-патогенными микроорганизмами.
Определяются нейтрофилы в общем анализе крови при подсчете лейкоцитарной формулы (процентного содержания разных видов лейкоцитов относительно общего количества лейкоцитов). (https://ymadam.net/zdorove/sdaem-analizy/analiz-krovi-na-nejtrofily.php).
Обычно снижение уровня нейтрофилов наблюдается при снижении иммунитета. Нейтрофилы, как и другие лейкоциты, являются защитниками организма. В основном они отвечают за уничтожение бактерий. У нейтрофилов хорошо развит аппарат движения, благодаря которому они способны быстро мигрировать к месту воспаления или инфицирования. Функции нейтрофилов обусловлены их способностью двигаться.
Кроме того, наряду с основной функцией - фагоцитозом, нейтрофилы имеют цитотоксическое действие. Цитотоксические препараты (цитотоксины) - теоретически запускают процесс некроза внутри злокачественной клетки, антигормональные препараты, используемые в онкологии, запускают процесс апоптоза клетки. При недостаточных дозах цитостатиков, развитии невосприимчивости к цитостатику, быстром выведении лекарства из организма возникает частичный эффект ослабления жизнедеятельности опухолевой клетки, отличающийся от исходно предполагаемого эффекта.
Цитотоксическая активность нейтрофилов заключается в повреждении клетки-мишени на расстоянии. Такое действие осуществляется при участии фактора, который вырабатывают Τ-лимфоциты (https://icvtormet.nj/krov/chto-otvechayut-neyrofily-krovi; Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html).
Описаны механизмы цитотоксичности нейтрофилов в системе иммунитета против опухоли (https://medbe.ru/materials/onkoimmunologiya-i-immunoterapiya-raka/mekhanizmy-tsitotoksichnosti-neytrofllov-v-sisteme-immuniteta-protiv-opukholi/© MedBe.ru; Бережная Η.Μ., Чехун В.Φ. Опубликовал Константин Моканов), которые показывают, что цитотоксический потенциал нейтрофилов очень высок.
Лимфоциты берут на себя воспалительные процессы средней тяжести.
Уровень лимфоцитов в теле здорового человека от всего числа лейкоцитов, то есть иммунных клеток, занимает тридцать процентов. Лимфоциты обеспечивают и длительно поддерживают иммунитет человека.
Поскольку назначение лимфоцитов заключается в быстром распознавании проникающих вредоносных элементов, то увеличение их числа при начале любого заболевания является нормальной и абсолютно естественной реакцией иммунной системы.
Лимфоциты делятся на несколько видов, которые отличаются функционально.
Самую большую группу составляют виды Т-клеток (CD3+): 75% от числа белых кровяных телец. В заявленном способе для определения реакции организма на лечение используют субпопуляцию Т-лимфоцитов CD4+ (Т-хелпер), CD8+ (Т-киллер) и В-лимфоциты (CD3+CD19+). Содержание их в крови пациента характеризует клеточный иммунитет.
Соотношение Τ - и В-лимфоцитов имеет важную роль для оценки состояния этого звена иммунитета. Исследование клеточного иммунитета необходимо для выявления первичного или вторичного иммунодефицита, а также для контроля за проведением иммуностимулирующей терапии (Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html).
Клеточное звено иммунитета является превалирующим не только при вирусных и грибковых патогенах, атипичных возбудителях (микоплазмы, хламидии), бактериальных инфекциях с внутриклеточным пребыванием возбудителя (микобактерии), но и при иммунном ответе на опухоли (см. там же).
Молекулы CD4+ экспрессируют на своей поверхности Т-лимфоциты, которые получили название хелперов. Это главные регуляторные клетки иммунного ответа. От деятельности Τ-хелперов зависит как направление (разворачивания) иммунного ответа, так и его эффективность. Субпопуляция CD4+ выполняет роль (катализатора) корецептора, стабилизируя рецепторы антиген-презентирующей клетки и Т-хелпера во время антигенной презентации на антиген-презентирующие клетки.
Молекулы CD8+ содержат на своей поверхности цитотоксические Т-лимфоциты. Это эффекторные клетки иммунного ответа. Именно цитотоксические Т-лимфоциты наносят конечный повреждающий удар по мишеням иммунной агрессии (опухолевым и инфицированным клеткам). CD8+ молекула выступает в роли корецептора, стабилизируя взаимодействие рецепторов Т-киллера и клетки-мишени во время иммунного распознавания последней (Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html).
В организме человека соотношение количества В-лимфоцитов (CD3+CD19+) к общему количеству лимфоцитов составляет 15%. В-лимфоциты производят антитела и обеспечивают организм соответствующей защитой. В - лимфоциты имеют уникальное свойство запоминания чужеродного организма и сохранения подходящих антител в течение длительного промежутка времени.
Уровень В-лимфоцитов характеризует гуморальное звено иммунитета. Поскольку синтез антител В-лимфоцитами является Т-зависимым процессом, то для достоверной оценки гуморального звена иммунитета следует учитывать уровень Τ-хелперов (CD3+CD4+), что выполняется в заявляемом способе.
Гуморальное звено является преобладающим при бактериальных инфекциях с внеклеточным пребыванием патогена (стрептококки, стафилококки, эшерихии, синегнойная палочка, протей и др.), а также при полостных протозойных и гельминтных инвазиях (Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html).
Кроме того, в заявляемом способе для определения иммунного статуса онкологического больного в периферической крови больного определяют абсолютное количество Т-лимфоцитов CD3+, 10*9/л, синтезирующих спонтанно и стимулированно провоспалительные цитокины, способные влиять системно на иммунный гомеостаз и течение опухолевого процесса, а именно: фактор некроза опухоли (TNF-α), интерлейкин-2 (IL-2), интерферону (INF-γ).
Комплекс показателей содержания разных цитокинов больного составляет его цитокиновый профиль.
Цитокины - это подобные гормонам клеточные специфические белки, которые синтезируются различными клетками в организме: клетками иммунной системы, клетками крови, селезенки, вилочковой железы, соединительной ткани и другими типами клеток (http://www.tiensmed.ru/news/citokiny-abl.html). При этом основная масса цитокинов образуется лимфоцитами, что обуславливает их системное влияние на организм. В соответствии с заявленной формулой изобретения для осуществления способа лечения определяют абсолютное значение общих лимфоцитов
Цитокины представляют собой низкомолекулярные информационные растворимые белки, обеспечивающие передачу сигналов между клетками. Деятельность цитокинов можно охарактеризовать как обеспечивающую взаимодействие между клетками (регулирующую их взаимоотношение: клетки иммунной системы - лимфоциты), так и как функционально контролирующую функцию между системами: регуляция продолжительности и интенсивности иммунных реакций (противоопухолевая и противовирусная защита организма); регуляция воспалительных реакций; участие в развитии аутоиммунных реакций; определение выживаемости клеток; участие в механизме возникновения аллергических реакций; стимуляция или подавление роста клеток; участие в процессе кроветворения; обеспечение функциональной активности или токсического воздействия на клетку; согласованность реакций эндокринной, иммунной и нервной систем; поддержание гомеостаза (динамической стабильности) организма (http.7/www.tiensmed.ru/news/citokiny-abl.html).
Цитокины осуществляют согласованное взаимодействие всех клеток в иммунной системе, являясь регуляторами иммунных реакций. Они обеспечивают обмен информацией между клетками иммунной системы и координацию их действий, обеспечивают взаимосвязь в пределах иммунной системы между специфическим иммунитетом и неспецифической защитной реакцией организма, между гуморальным и клеточным иммунитетом.
Посредством цитокинов Т-хелперы (лимфоциты, "распознающие" чужеродные белки микроорганизмов) передают команду Т-киллерам (клеткам, уничтожающим чужеродный белок). Точно также с помощью цитокинов Т-супрессоры (разновидность лимфоцитов) контролируют функцию Т-киллеров и передают им информацию о прекращении уничтожения клеток.
Цитокины, обладая подобием гормонального эффекта, действуют по аналогии с ним. Однако на клетках иммунной системы низкими дозами цитокины стимулируют иммунологический эффект, средними дозами - регулируют иммунологический эффект, а высокими дозами - тормозят. В онкологии чаще используют высокие дозы цитокинов, в частности, IL-2, INF-γ.
Именно цитокины, осуществляя синхронизованную связь между эндокринной, нервной, кроветворной и иммунной системами, вовлекают все эти системы в формирование комплексной защитной реакции организма на внедрение повреждающего болезнетворного агента. При помощи специфических рецепторов провоспалительные цитокины связываются и вовлекают в процесс другие типы клеток: кожи, соединительной ткани, внутренней стенки сосудов, эпителиальные клетки. Все эти клетки также начинают продуцировать провоспалительные цитокины системного характера. При этом происходит смещение защитной реакции в сторону нейтрофилов, лимфоцитов или совместно. Однако в результате присутствия злокачественного образования и в ходе лечения происходит истощение этих видов клеток, что требует оценочного контроля содержания в периферической крови больного нейтрофилов, лимфоцитов. Последнее реализуется в заявляемом способе лечения.
В заявленном способе оценивают системное влияние на течение опухолевого процесса каждого из цитокинов, а именно: TNF-α, INF-γ, IL-2, - путем вычисления коэффициента реакции для каждого из них. За норму реакции цитокинов принимают значения коэффициентов реакции, в диапазоне: для TNF-α от 80 до 120, для IL-2 от 80 до 120, для INF-γ от 150 до 250. Полученные результаты вычисления коэффициентов реакции сравнивают с нормой соответственно, и, если выявляют пару цитокинов, в которой значение коэффициента реакции у каждого из цитокинов в паре превышает значение верхнего предела нормы соответственно, то такую цитокиновую пару определяют как гиперреактивную, если значение коэффициента реакции у каждого из цитокинов в паре ниже значения нижнего предела нормы соответственно, то такую цитокиновую пару определяют как гипореактивную.
Количественные значения TNF-α, IL-2, INF-γ, принятые за норму получены опытным путем и являются оптимальными.
Вычисление коэффициента реакции цитокинов выполняют известным способом, описанным в патенте РФ, патент №2622756, G01N 33/53, 19.06.2017, в котором оценивают влияние на течение опухолевого процесса каждого вида цитокина путем вычисления коэффициента реакции для каждого из них по формуле:
Кр=nCD3+стим/nCD3+спонт, где
Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2;
nCD3+стим - количество клеток Τ-лимфоцитов (CD3+) в периферической крови, синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции;
CD3+спонт - количество клеток Т-лимфоцитов CD3+ в периферической крови синтезирующих соответствующий цитокин спонтанно.
В известном способе прогнозирования течения онкологических заболеваний (РФ, патент №2622756, G01N 33/53,19.06.2017) вычисление коэффициента реакции провоспалительных цитокинов TNF-α, IL-2, INF-γ используют для оценки реактивности влияния каждого из них на течение опухолевого процесса. В известном изобретении это обеспечивает возможность прогнозирования течения онкологических заболеваний путем оценки взаимосвязи между совокупной реактивностью влияния на течение опухолевого процесса провоспалительных цитокинов TNF-α, IL-2, INF-γ и количественным значением отношения субпопуляций лимфоцитов CD4+ к CD8+.
В отличие от известного, в заявленном способе лечения онкологических заболеваний коэффициент реакции провоспалительных цитокинов TNF-α, IL-2, INF-γ входит в состав универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения.
Ранее коэффициент реакции провоспалительных цитокинов TNF-α, IL-2, INF-γ и его расчет по вышеприведенной математической формуле не использовался для решения проблемы создания универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения и использован впервые автором изобретения.
Кроме того, вычисление коэффициента реакции цитокина по вышеприведенной формуле позволяет оценить способность системного влияния цитокинов на течение опухолевого процесса в настоящий момент времени в зависимости от общего состояния иммунной системы пациента, используя не количественный параметр цитокина в крови, а через непосредственную оценку степени его активизации через отношение между спонтанным и стимулированным лимфоцитом, что обеспечивает достоверность результата и обеспечивает достижение заявленного технического результата.
В заявленном способе в составе универсального набора критериев для принятия решения о выполнении направленной иммунотерапии используют цитокины, регулирующие воспалительные реакции: провоспалительные цитокины, а именно интерлейкин-2 (IL-2), интерферону (INF-γ), фактор некроза опухоли TNF-α.
Количественное содержание в периферической крови больного IL-2, INF-γ, TNF-α характеризует функциональную активность Т-хелперов 1 типа (Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html; From Medscape Education Oncology Tumor Immunity: Exploring the Role of a Checkpoint CME Mary L. Disis, MD Faculty and Disclosures CME Released:05/13/2014; Valid for credit through 05/13/2015/).
Цитокин интерферон гамма INF-γ относится к цитокинам, регулирующим клеточный и гуморальный иммунитет, а также является противовирусным иммунорегулятором.
При этом по характеру действия: цитокин интерлейкин-2 (IL-2) относят к цитокинам - регуляторам иммунной системы, обеспечивающим взаимодействие в самой системе и ее связи с другими системами.
Фактор некроза опухоли TNF-α обладает регуляторным и токсическим действием на клетки (http://www.tiensmed.ru/news/citokiny-abl.html). TNF-α (фактор некроза опухолей-альфа) вызывает образование на внутренней оболочке стенки сосудов очагов адгезии (прилипания): сначала лейкоциты прилипают к эндотелию, а затем проникают через сосудистую стенку. Этот провоспалительный цитокин стимулирует синтез и выделение лейкоцитами и эндотелиальными клетками других провоспалительных цитокинов (IL-8 и других) и тем самым аутоактивирует клетки на продукцию медиаторов воспаления (лейкотриенов, гистамина, простагландинов, оксида азота и других). При проникновении в организм инфекции выработка и выделение TNF-α начинается на месте внедрения микроорганизма (в клетках слизистой оболочки, кожи, региональных лимфоузлов) - то есть цитокин TNF-α активирует местные защитные реакции. При этом TNF-α, кроме местного действия, оказывает еще и системное: активирует иммунную систему, эндокринную, нервную и систему гемопоэза, при этом воздействует и влияет системно на весь организм.
В настоящее время на практике в лечении широко используются именно эти цитокины, а именно: интерферону, интерлейкин-2, и индукторы фактора некроза опухолей (ФИО), что обеспечивает возможность осуществимости заявленного способа.
Известно, что у человека показатели периферической крови могут изменяться даже при наличии незначительного компенсируемого воспалительного процесса. Для онкологического больного, учитывая широкий диапазон нормы, динамика показателей периферической крови не может быть критерием скрытого течения рецидива заболевания или появления метастаза. Кроме того проведение лучевого или цитостатического лечения у всех онкологических больных вызывает различной степени дозозависимое угнетение всех показателей периферической крови. При этом отдельно взятый даже и измененный показатель на любом этапе лечения не носит специфических для онкологического заболевания отличий (РФ, патент №2247377, G01N 33/49, G01N 33/48,27.02.2005).
Учитывая вышеизложенное, в заявляемом способе авторами изобретения впервые для принятия решения для выполнения направленной иммунотерапии в качестве интерпретируемых критериев предложены значения частного отношений абсолютных значений: нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам. При этом за норму принимают частные исследуемых отношений, которые предварительно вычисляют для верхних и нижних границ общепринятых интервалов референтных значений показателей иммунного гомеостаза, представленных в числителе и в знаменателе исследуемых отношений. Принимают за норму полученные значения частного отношений для верхних и нижних границ общепринятых интервалов референтных значений и интервал значений частного, заключенных между ними.
Использование значений частного отношений абсолютных значений показателей иммунитета: нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам - в составе универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения, а также выбор заявленных показателей иммунитета для решения вышеуказанной проблемы, предложены авторами изобретения впервые и ранее не известны.
Диагностическое и прогностическое значение имеют индивидуальные показатели нормы у данного пациента с учетом возраста и наличия сопутствующих хронических заболеваний, действия вредных факторов, медикаментозной нагрузки. В заявленном способе значения частного исследуемых отношений показателей иммунитета пациента и заявленные в формуле изобретения исследуемые показатели иммунитета пациента являются диагностически достоверными, поскольку учитывают на данный момент времени возраст, наличие хронических заболеваний, помимо основного диагноза, действие первичного лечения. Благодаря тому, что исследуемые отношения содержат в себе качественные (исследуемый показатель крови) и количественные характеристики изучаемых факторов иммунной защиты, учитывается степень тяжести клеточного Т-иммунодефицита, угнетение фагоцитарной активности нейтрофилов, макрофагов.
Известно, что реальную информацию об изменениях иммунограммы дают значительные нарушения показателей в иммунограмме, а именно: 40-50% от нормы и более. В связи с лабильностью показателей иммунограммы их незначительные колебания возможны у совершенно здоровых лиц (Пособие по клинической иммунологии для практических врачей http://www.dovidnyk.org/dir/21/118/1296.html).
В заявленном изобретении считаются без отклонений от нормы полученные значения частного исследуемых отношений, соответствующие значениям нормы, или выявленные исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нор мы, но при этом отклонения от нормы не достигают 50%.
С отклонениями от нормы относят исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы и отклонения от нормы достигают 50% и более. Это обеспечивает достоверность интерпретации критериев для принятия решения о выполнении направленной иммунотерапии.
Известно, что нормальное содержание той или иной субпопуляции лимфоцитов еще не свидетельствует о достаточном абсолютном количестве соответствующих иммунокомпетентных клеток. Часто в состав иммунограммы включают так называемый иммунорегуляторный индекс, который является соотношением уровней CD3+CD4+ к CD8+ Т-лимфоцитам. Уровень иммунорегуляторного индекса оценивают в сопоставлении с фазой иммунного ответа. В период разгара и стихания клинических проявлений иммунорегуляторный индекс достигает высоких значений за счет большого процентного содержания Т-хелперов (CD4+ Т-клеток). В период реконвалесценции значение показателя уменьшается, в связи с нарастанием уровня CD8+ Т-клеток (киллеров). Нарушение такой закономерности свидетельствует о неадекватности иммунной реакции и о возможности хронизации инфекции, в связи с неполной эрадикацией возбудителя или истощения иммунной реакции и неполной элиминацией опухолевых антигенов.
В заявляемом способе в качестве критерия для принятия решения о выполнении направленной иммунотерапии исследуют отношения нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+. При достаточном количестве этих субпопуляций значение частного исследуемых соответствующих отношений находится в интервале значений, принятых за норму. Отклонение от нормы говорит об обратном. При этом в любом случае полученное значение частного исследуемых отношений с упомянутыми выше субпопуляциями соответствует фазе заболевания пациента в данный момент времени. Таким образом, в заявленном способе контролируют не только достаточность соответствующих иммунокомпетентных клеток, но и опосредованно контролируют отношение субпопуляций лимфоцитов CD4+ к субпопуляциям лимфоцитов CD8+.
Известно, что отклонения от нормы в лейкоцитарной формуле имеют в диагностике очень важное значение, поскольку в большинстве случаев именно в ней и происходят изменения при появлении недугов.
Отношение нейтрофилов к лимфоцитам - это показатель, отражающий дисбаланс между различными звеньями иммунитета
Как правило, при вирусных поражениях общий уровень лейкоцитов (абсолютный) сохраняется в нормальных значениях, хотя иногда может быть слегка увеличен, но при этом лимфоциты будут повышены, а уровень нейтрофилов, наоборот, будет понижен. Наблюдается такое обычно при инфекциях бактериального или вирусного типа, но подобная реакция организма может возникнуть и при применении некоторых лекарственных средств, при воздействии радиации, а также при появлении опухолей. (https://vseanalizy.com/obshhiy-krovi/limfocity/nejtrofily-i-limfotsity.html).
В заявленном способе обеспечивается контроль отношения абсолютного значения нейтрофилов к лимфоцитам в реальном масштабе времени, что обеспечивает правильность принятия решения по терапии больного.
В заявленном способе терапию назначают при наличии гипо- или гиперреактивной пары цитокинов и исходя из значений частного исследуемых соотношений показателей иммунитета пациента. Полученные для больного результаты вычислений частного исследуемых отношений сравнивают соответственно с интервалами значений частного исследуемых отношений, принятых за норму, включая верхние и нижние границы и, если в результате сравнений все полученные значения частного исследуемых отношений соответствуют значениям нормы или выявлены исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы, но при этом отклонения от нормы не достигают 50%, и не выявлена гипер- или гипореактивная цитокиновная пара, то лечение не назначают,
если гипо- или гиперреактивная пара цитокинов выявлена, но при этом выявляют исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы при этом отклонения от нормы достигают 50% и более, то назначают терапию исходя из показателей крови пациента и их значений в выявленных исследуемых отношениях.
Это объясняется тем, что, как показывает результат качественного анализа исследуемых отношений, в числителе и в знаменателе отношение содержит показатель крови, характеризующий соответствующее ему звено иммунитета: врожденный и приобретенный (клеточный и гуморальный). Кроме того, результат разделения цитокинов на гипо- или гиперреактивные пары путем вычисления их коэффициентов реактивности, а также выявление исследуемых отношений показателей иммунитета с отклонениями от нормы дает возможность определить участие, помимо полученного пациентом лечения, процесса по типу инфекционного острого воспаления, оценить риск его агрессивности. В результате, зная онкологическое заболевание пациента, выявленную неблагоприятную цитокиновую пару и изменившие свои значения показатели иммунитета в выявленных исследуемых соотношениях с отклонениями от нормы, клиницист получает возможность назначать лечение с моделированием выгодного цитокинового эффекта с возможностью нейтрализации эффекта неблагоприятной пары и нормализации в выявленных исследуемых отношениях изменившихся значений показателей иммунитета.
Как отмечалось выше, в заявленном способе терапию назначают при наличии гипо- или гиперреактивной пары цитокинов (TNF-α, IL-2, INF-γ) и исходя из значений частного исследуемых отношений показателей иммунитета пациента для результатов исследования периферической крови больного: отношений абсолютных значений нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также абсолютных значений общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам. При этом количественные значения коэффициентов реакции цитокинов и показателей иммунитета пациента в исследуемых соотношениях соответствуют значениям на данный момент времени. Кроме того, для оценки степени влияния цитокина на течение опухолевого процесса используют не количественное содержание цитокина в крови, а вычисляют коэффициент реакции цитокина, оценивая, тем самым, степень влияния цитокинов на течение опухолевого процесса также в режиме реального времени. В результате заявленный способ реализует возможность индивидуального подхода к выбору иммунотерапии и индивидуальной тактики ведения больного. Обеспечивает возможность учета изменчивости иммунитета под влиянием токсичных цитостатиков (иммунодепрессантов) или применения лучевой и химиотерапии, что, в свою очередь, обеспечивает повышение эффективности лечения, снижение побочных эффектов, улучшение отдаленности лечения, повышение показателя выживаемости, повышение эффективности назначений для дальнейшего лечения.
Использование в заявленном способе в составе критерия для принятия решения о проведении направленной иммунотерапии цитокинов TNF-α, IL-2, INF-γ, а также показателей периферической крови больного: абсолютных значений нейтрофилов, общих лимфоцитов, В-лимфоцитов, субпопуляций лимфоцитов CD4+ и CD8+, которые в совокупности оказывают системное влияние на течение опухолевого процесса, позволяет распространить предлагаемый способ лечения на широкий круг онкологических заболеваний.
Из вышеизложенного следует, что заявленный способ лечения онкологических заболеваний имеет в качестве критериев информативные показатели иммунного гомеостаза, набор которых позволяет достоверно оценить состояние иммунной системы больного, выявить не только причинно-следственную связь, обусловившую настоящее состояние организма, но и правильно выбрать направление для адьювантного лечения больного. Кроме того, в заявленном способе в качестве критерия для принятия решения о проведении иммунотерапии используют не статистические расчетные коэффициенты, а конкретные референтные значения, используемые данной лабораторией при выполнении анализа крови именно этого пациента. В результате используемый в заявленном способе набор критериев для выполнения направленной иммунотерапии, учитывает на системном уровне общее состояние организма, возникающее в результате взаимодействия организма со злокачественной опухолью. Возможности учета изменчивости иммунитета под влиянием токсичных цитостатиков (иммунодепрессантов) или применения лучевой и химиотерапии, повышает эффективность назначений для дальнейшего лечения, обеспечивает точный дифференцированный прогноз и возможность индивидуальной тактики ведения больного, что увеличивает продолжительность жизни больного. В результате заявленный способ лечения онкологических заболеваний, охарактеризованный существенными признаками заявленной формулы изобретения, при осуществлении позволяет дифференцировать и обосновать терапию в зависимости от вида иммунологического нарушения с учетом нозологии и биологического подтипа злокачественного новообразования, в том числе, имеющего агрессивный характер, с проведением как патогенетического иммунологического лечения направленного на поврежденное звено иммунитета, так и с нормализацией изменившихся значений показателей иммунитета, при этом являющихся критериями неблагоприятного течения заболевания, а именно: выровнять их до уровня референтного значения и тем самым, повлиять на безрецидивное течение злокачественного образования.
Таким образом, предлагаемый способ лечения онкологических заболеваний при осуществлении решает проблему создания универсального набора критериев для выбора и осуществления направленной адъювантной и поддерживающей иммунотерапии онкологического больного, отражающих на системном уровне взаимосвязь иммунной системы организма с локальным и системным влиянием на опухоль при ответе на внешнее воздействие в виде проведенного курса лечения.
Кроме того, предлагаемый способ лечения онкологических заболеваний при осуществлении обеспечивает достижение технического результата: возможность выполнения направленной иммунотерапии для широкого спектра онкологических заболеваний; возможность индивидуального подхода к выбору иммунотерапии и индивидуальной тактики ведения больного; за счет возможности учета изменчивости иммунитета под влиянием токсичных цитостатиков (иммунодепрессантов) или применения лучевой и химиотерапии: повышение эффективности лечения, снижение побочных эффектов, улучшение безрецидивных отдаленных результатов лечения, повышение показателя выживаемости, повышение эффективности назначений для дальнейшего лечения.
Заявленный способ лечения онкологических заболеваний осуществляют следующим образом. После окончания первичного комплексного лечения злокачественного новообразования проводят иммунологические исследования крови пациента и по результатам исследования выбирают тактику выполнения иммунотерапии. При этом в исследуемой периферической крови пациента определяют количество субпопуляций Т-лимфоцитов CD3+, 10*9/л, синтезирующих спонтанно и стимулированно первый тип цитокинов, способных влиять системно на иммунный гомеостаз и течение опухолевого процесса, а именно: фактор некроза опухоли (TNF-α), интерлейкин - 2 (IL-2), интерферон γ (INF-γ). Определяют субпопуляции Т-лимфоцитов CD3+, а именно: абсолютное количество субпопуляций лимфоцитов CD4+ и CD8+ Т-лимфоцитов; определяют абсолютное значение В-лимфоцитов, определяют абсолютные значения нейтрофилов и общих лимфоцитов. Кроме того, для верхних и нижних границ общепринятых интервалов референтных абсолютных значений нейтрофилов, общих лимфоцитов, В-лимфоцитов, субпопуляций лимфоцитов CD4+ и CD8+ путем вычисления частного определяют значения отношений абсолютных значений: нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам. Полученные значения частного отношений для верхних и нижних границ общепринятых интервалов референтных значений и интервал значений частного, заключенных между ними, принимают за норму. После чего оценивают системное влияние на течение опухолевого процесса каждого из цитокинов, а именно: TNF-α, INF-γ, IL-2, - путем вычисления коэффициента реакции для каждого из них по формуле: Кр=nCD3+стим/nCD3+спонт, где
Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2;
nCD3+стим - количество клеток Τ-лимфоцитов (CD3+) в периферической крови, синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции;
CD3+спонт - количество клеток Т-лимфоцитов CD3+ в периферической крови синтезирующих соответствующий цитокин спонтанно.
За норму реакции цитокинов принимают значения коэффициентов реакции в диапазоне: для TNF-α от 80 до 120, для IL-2 от 80 до 120, для INF-γ от 150 до 250. Полученные результаты вычисления коэффициентов реакции сравнивают с нормой соответственно, и, если выявляют пару цитокинов, в которой значение коэффициента реакции у каждого из цитокинов в паре превышает значение верхнего предела нормы соответственно, то такую цитокиновую пару определяют как гиперреактивную, если значение коэффициента реакции у каждого из цитокинов в паре ниже значения нижнего предела нормы соответственно, то такую цитокиновую пару определяют как гипореактивную. Затем, для результатов исследования периферической крови больного определяют значения частного отношений абсолютных значений нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также абсолютных значений общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам. Фиксируют полученные для больного результаты вычислений частного исследуемых отношений. Полученные результаты вычислений частного исследуемых отношений сравнивают соответственно с интервалами значений частного исследуемых отношений, принятых за норму, включая верхние и нижние границы, и, если в результате сравнений все полученные значения частного исследуемых отношений соответствуют значениям нормы или выявлены исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы, но при этом отклонения от нормы не достигают 50%, и не выявлена гипер- или гипореактивная цитокиновная пара, то лечение не назначают,
если гипо- или гиперреактивная пара цитокинов выявлена, но при этом выявляют исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы при этом отклонения от нормы достигают 50% и более, то назначают терапию исходя из показателей крови пациента и их значений в выявленных исследуемых отношениях.
Осуществимость заявленного способа лечения онкологических заболеваний подтверждают приведенные примеры.
Все пациенты выполняли исследование крови в МАУ «Клинико-диагностический центр», Управление здравоохранения администрации г. Екатеринбурга. На этом основании расчет частного исследуемых отношений показателей иммунограммы для крайних значений референтных интервалов для всех примеров одинаков.
Расчет частного исследуемых отношений показателей иммунограммы для крайних значений референтных интервалов представлен в Таблице 1.
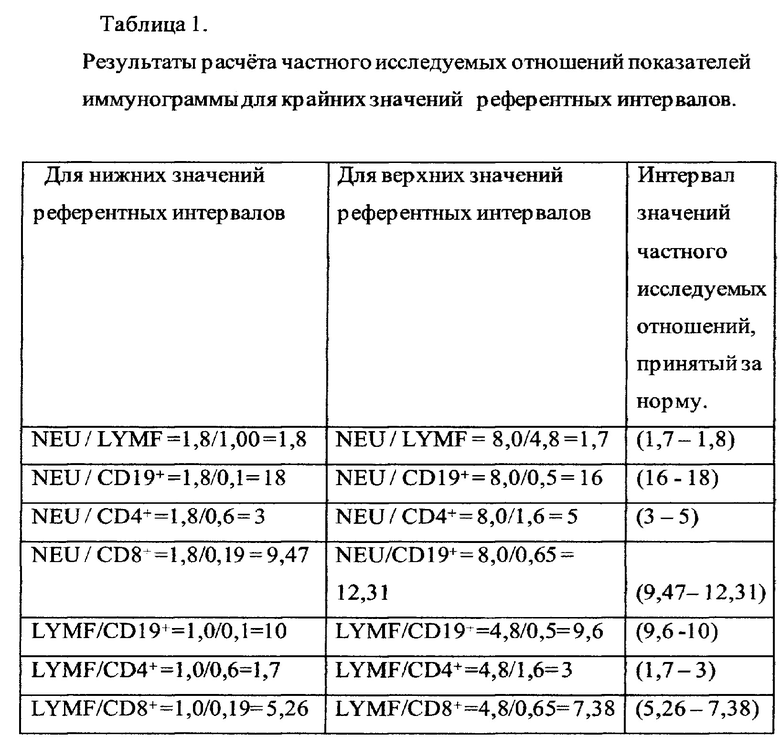
Полученные значения вышеперечисленных отношений для верхних и нижних границ общепринятых интервалов референтных значений и интервал значений, заключенных между ними, принимают за норму.
Пример 1. Больная Α., 65 лет. Анамнез - рак молочной железы с лейкопенией. Было выполнено комплексное лечение рака молочной железы Т220, МЭ,6 XT с лейкопенией без КСФ, лучевая терапия на рубец в соответствии со стандартом терапии (2018 г.).
Через 6 месяцев (2018) г. сделана контрольная иммунограмма.
Состояния организма больной оценивали в соответствии с заявленной формулой изобретения.
Вычислили коэффициенты реакции для TNF-α, INF-γ, IL-2 по формуле:
Кр=nCD3+стим/nCD3+спонт, где
Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2;
nCD3+стим - количество клеток Т-лимфоцитов (CD3+) в периферической крови, синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции;
CD3+спонт - количество клеток Т-лимфоцитов CD3+ в периферической крови синтезирующих соответствующий цитокин спонтанно (известным способом, описанным в патенте РФ, патент №2622756, G01N 33/53, 19.06.2017.)
За норму реакции цитокинов принимают значения коэффициентов реакции, в диапазоне: для TNF-α от 80 до 120, для IL-2 от 80 до 120, для INF-γ от 150 до 250 (ед.изм. 10*9/л)
Цитокиновый статус в соответствии контрольной иммунограммой:
CD3+ TNF-α стим=0,408, CD3+ TNF-α спонт=0,003;
CD3+ INF-γ стим=0,179, CD3+ INF-γ спонт=0,004;
CD3+ IL-2 стим=0,301, CD3+ IL-2 спонт=0,004.
Коэффициенты реакции для TNF-α, INF-γ, IL-2:

Выявлена гипореактивная пара цитокинов: INF-γ, IL-2.
Для результатов исследования периферической крови больного определи значения частного отношений абсолютных значений нейтрофилов к общим лимфоцитам, нейтрофилов к субпопуляциям лимфоцитов CD4+, нейтрофилов к субпопуляциям лимфоцитов CD8+, нейтрофилов к В-лимфоцитам, а также абсолютных значений общих лимфоцитов к субпопуляциям лимфоцитов CD4+, общих лимфоцитов к субпопуляциям лимфоцитов CD8+, общих лимфоцитов к В-лимфоцитам, фиксируют полученные для больного результаты вычислений частного исследуемых отношений, полученные результаты вычислений частного исследуемых отношений сравнивают соответственно с интервалами значений частного исследуемых отношений, принятых за норму, включая верхние и нижние границы.
Показатели исследования периферической крови пациента:


Таким образом, выявлена гипореактивная пара и выявлены исследуемые отношения, у которых значения частного выходят за границы нижнего или верхнего значений интервалов нормы при этом отклонения от нормы достигают 50% и более. В соответствии со способом назначают терапию, исходя из показателей крови пациента и их значений в выявленных исследуемых отношениях.
Уровень В-лимфоцитов характеризует гуморальное звено иммунитета. Поскольку синтез антител В-лимфоцитами является Т-зависимым процессом, то для достоверной оценки гуморального звена иммунитета следует учитывать уровень Т-хелперов (CD3+CD4+), что выполняется в заявляемом способе.
Качественный анализ показателей крови пациента в выявленных исследуемых отношениях и их значений показал, что превышение верхних допустимых границ частного NEU/CD19+ и LYMF/CD19+ обусловлено низким содержанием В-лимфоцитов, что говорит об ослаблении гуморального звена иммунитета,
повышенным содержанием нейтрофилов, что позволяет предположить наличие процесса по типу инфекционного острого воспаления,
повышенным содержанием лимфоцитов, увеличение которых является в данном случае естественной реакцией иммунной системы. Назначен курс терапии: ронколейкин 500 тыс 1 раз в 10 дней - для восстановления цитокинового ответа ИЛ-2 и Τ-активин 8 доз по 4 мл внутримышечно через день - для нормализации количества Τ клеток.
Следующая контрольная иммунограмма получена в апреле 2019 г.
Цитокиновый статус:
CD3+ TNF-α стим=0,564, CD3+ TNF-α спонт=0,004;
CD3+ INF-γ стим=0,398, CD3+ INF-γ спонт=0,007;
CD3+ IL-2 стим=0,288, CD3+ IL-2 спонт=0,004.
Коэффициенты реакции для TNF-α, INF-γ, IL-2:
KpTNF-α=0,564/0,004=141 больше верхнего значения 120
KpIL-2=0,288/0,004=122 больше верхнего значения 120
КрINF-γ=0,398/0,007=56,9 меньше нижнего значения 150
Выявлена гиперреактивная пара цитокинов TNF-α, IL-2.
Показатели исследования периферической крови пациента:


Результаты исследования
Выявлена гиперреактивная пара цитокинов TNF-α, IL-2:

Снижение на 67% ниже нижнего значения нормы значения частного исследуемого отношения NEU/CD8+ говорит о превышении уровнем CD8+ (клеток киллеров) уровня общего количества нейтрофилов. Снижение общего количества нейтрофилов в исследуемом отношении говорит о наличии неактивного, хронически протекающего или недостаточно компенсированного воспалительного процесса опухолевого типа. Увеличение общего количества клеток киллеров CD8+ говорит о неадекватности иммунной реакции и о возможности хронизации инфекции, в связи с неполной эрадикацией инфекционного возбудителя.
При этом значения коэффициентов реакции в гиперреактивной паре близки к верхним пределам нормы.
Назначен только гриппферол 10000 Ед - индуктор интерферонов в нос по 1 пшику ежедневно на 6 месяцев. Цитокин интерферон гамма INF-γ относится к цитокинам, регулирующим клеточный и гуморальный иммунитет, а также является противовирусным иммунорегулятором. Цель назначения - профилактировать инфекционные процессы в сезон ОРЗ и гриппа.
По основному заболеванию признаков местного рецидивирования и отдаленного метастазирования не выявлено.
Следующая контрольная иммунограмма получена 25.11.2019 г.
Цитокиновый статус:
CD3+ TNF-α стим=0,477, CD3+ TNF-α спонт=0,004;
CD3+ INF-γ стим=0,238, CD3+ INF-γ спонт=0,004;
CD3+ IL-2 стим=0,273, CD3+ IL-2 спонт=0,004.
Коэффициенты реакции для TNF-α, INF-γ, IL-2:

Все цитокины гипореактивные.
Показатели исследования периферической крови пациента:
Лимфоциты (LYMF): 1,49; нейтрофилы (NEU): 1,67;
В-лимфоциты (СО19+): 0,15; CD4+: 0,51; CD8+: 0,48.

Результаты исследования
Все цитокины гипореактивные:
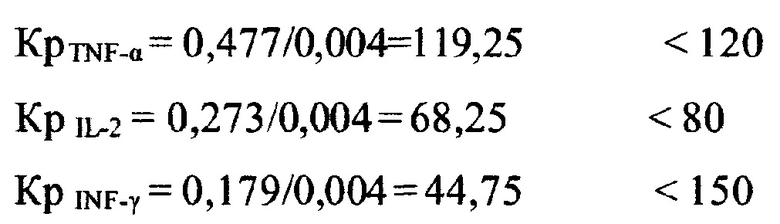
NEU/CD8+=1,67/0,48=3,48 - на 63% ниже нижнего значения нормы.
Назначен курс Ронколейкина 500 тЕд 1 раз в 10 дней на 6 месяцев, поскольку цитокин IL-2 относят к цитокинам - регуляторам иммунной системы, обеспечивающим взаимодействие в самой иммунной системе и ее связи с другими системами.
Наблюдается без признаков Ρ и МТС.
Все следующие примеры выполнены по аналогии с Примером 1.
Пример 2. Больная Н. Г.р. 1957. Оперативное вмешательство: ДЗ С50 метахронный РМЖ, справа pT1cN0M0, комплексное лечение 2016 г, операция Блохина справа с лимфаденэктомией / лучевая терапия Грэй на МЖ и пути лимфооттока в соответствие со стандартами лечения 2016 г. Далее - наблюдение. Слева Быстрый рост pT4cN1бMo, 4АС+4паклитаксел в полной дозе. Операция - реабляция справа и мастэктомия по Мадден слева. Гистологически 4 степень леч. паморфоза, ИГХ-ЛБ тип (2017 г.).
Анализ иммунограммы проведен накануне дня операции.
2017 г., сентябрь.
Вычисляем коэффициенты реакции для TNF-α, INF-γ, IL-2:
Цитокиновый статус:

Выявлена гипореактивная пара IL-2, INF-γ.
Показатели исследования периферической крови пациента:


Результаты исследований
Выявлена гипореактивная пара цитокинов IL-2, INF-γ.
выявлены исследуемые отношения, у которых значения частного выходят за границы нижних и верхних значений интервалов нормы на 50% и выше:

Послеоперационный период протекал с длительной гиперемией и инфильтрацией всего операционного поля с 2 сторон, с зудом и купированием зуда периодически на прием антигистаминных препаратов. В соответствии со стандартами назначен препарат «Анастразол». Клинически поле инфильтрации кожи области послеоперационного рубца без изменений.
Терапия на этапе реабилитации назначена после повторного исследования иммунограммы, который приведен ниже.
2018 г., апрель.
Цитокиновый статус:

Выявлено, что все три возможные пары цитокинов гипореактивные.
Показатели исследования периферической крови пациента:

Результаты исследования
Выявлено, что все три возможные пары цитокинов гипореактивные.

Назначен ронколейкин 500 тЕд п/к в соответствии с инструкцией применения препарата, но 1 раз в неделю длительно на 6 месяцев, до следующего контрольного анализа иммунограммы.
2019. июнь. Цитокиновый статус

Выявлена гипореактивная пара цитокинов: INF-γ и IL-2.
Показатели исследования периферической крови пациента

Результаты исследований
Выявлена гипореактивная пара цитокинов: INF-γ и IL-2.

Назначена терапия в постоянном режиме базовым препаратом «Анастразол» и иммонореабилитационная терапия ρонколейкином 500 тЕд п/к в соответствии с инструкцией применения препарата, но в режиме 1 раз в неделю.
Контрольная иммунограмма 2019 г., декабрь.
Цитокиновый статус:

Выявлена гипореактивная пара цитокинов: INF-γ и IL-2.
Показатели исследования периферической крови пациента, 2019 год, декабрь:


Результаты исследований
Выявлена гипореактивная пара цитокинов: INF-γ и IL-2.

При контрольном осмотре 2019 г - признаков местного рецидива не выявлено. За шесть месяцев приема препарата медленно нормализовалась кожа области послеоперационного поля, исчезла ее плотность, гиперемия и инфильтрация. По параметрам иммунограммы, по сравнению с ситуацией 2017 года) ситуация расценена как стабильная, с увеличением количественных величин CD4+ и CD8+, и нормализацией количества CD 19+ и терапия продолжена в постоянном режиме базовым препаратом «Анастразол» и иммонореабилитационная терапия ронколейкином в той же дозе, в режиме 1 раз в неделю. Кроме того, добавлен интерферон в нос (Гриппферол 10000 Ед в нос ежедневно)
Местно, по основному заболеванию при плановом обследовании в соответствии с КР 379/1 МЗ России от 2020 г., признаков местного рецидивирования нет, отдаленного метастазирования нет.
Пример 3. Больной Б., 48 лет. Анамнез 2011 год: С18.7; ЗНО сигмовидной кишки pT3N1M0, G3, левосторонняя гемиколэктомия 6 курсов XT, в режиме «Мейо-5» фторурацил с лейковорином. Терапия проведена в соответствие со стандартами Ассоциации онкологов России 2011 г.
Через полтора года (2013 г.) был выполнен иммунологический мониторинг.
Год 2013 г.
Получена первая контрольная иммунограмма.
Вычисляем коэффициенты реакции для TNF-α, INF-γ, IL-2
Цитокиновый статус:

Выявлена гипореактивная пара цитокинов: INF-γ, IL-2.
Показатели исследования периферической крови пациента:

Результаты исследования
Выявлена гипореактивная пара цитокинов: INF-γ, IL-2.
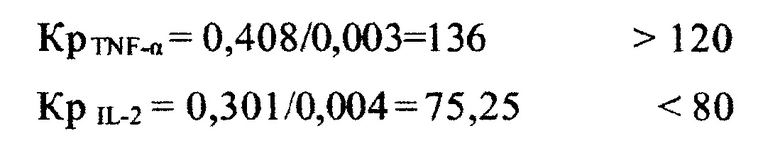

Для рака толстой кишки имеет значение гиперреактивность фактора некроза опухоли. Из результатов исследования видно, что пара цитокинов интерлейкин 2 и интерферон гамма гипореактивна, а цитокин фактор некроза опухоли гиперреактивен. При этом превышение верхних допустимых границ частного NEU/CD19+ и LYMF/CD19+ говорит об ослаблении гуморального звена иммунитета и наличии процесса по типу инфекционного острого воспаления.
С целью подавления активности KpTNF-α фактора некроза опухоли повторной отсрочено от даты оперативного лечения было назначено 2 курса 5 фторурацил в дозе 500 мг в/в до 4,5 гр с перерывом 28 дней.
Выполнялся контроль за нормализацией активности цитокинов. Признаков рецидива и МТС нет.
28.05.2020 г.
Цитокиновый статус:

Не выявлено гипо-гиперреактивной пары цитокинов.
Показатели исследования периферической крови пациента:


Результаты исследований: поскольку в результате сравнений с нормой все полученные значения частного исследуемых отношений соответствуют значениям нормы и не выявлена гипер- или гипореактивная цитокиновная пара, то лечение не назначено.
Пациент находится под наблюдением без признаков местного и отдаленного рецидивирования и метастазирования 7 лет.
Пример 4. Больная 3., 53 года. Операция мелонома T1a1 мм Брюслау. Иссечение июль 2019.
Получена контрольная иммунограмма 04.10.2019.
Цитокиновый статус:

Выявлена гипореактивная пара цитокинов: IL-2. INF-γ.
Показатели исследования периферической крови пациента:


Результаты исследования
Выявлена гипореактивная пара цитокинов: IL-2. INF-γ.
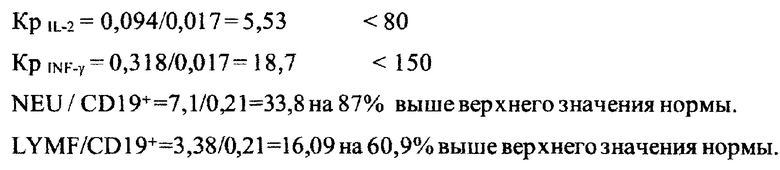
Назначен интерферон в нос на 6 мес.
Повторная контрольная иммунограмма 21.04.2020.
Цитокиновый статус:

Все цитокины гипореактивны.
Показатели исследования периферической крови пациента:
Лимфоциты (LYMF): 3,16; нейтрофилы (NEU): 4,57;

Результаты исследований
Все три возможные пары цитокинов гипореактивны, но, по сравнению с 2019 годом, близки к норме.
LYMF/CD8+=1,41/0,69=2,04 на 61% ниже нижнего значения нормы.
Назначен интерферон гамма. Согласно стандартов проводится наблюдение за региональными лимфоузлами паховыми.
Вышеприведенные примеры выполнения заявленного способа подтверждают, что для конкретного пациента, имея совокупную информацию: онкологическое заболевание пациента, выявленную неблагоприятную цитокиновую пару и показатели иммунитета в исследуемых соотношениях с отклонениями от нормы, изменившие свои значения при наличии выявленной неблагоприятной цитокиновой пары, - клиницист, используя заявленный способ лечения, получает возможность назначать адъювантную или поддерживающую терапию с моделированием цитокинового эффекта, обеспечивающего нейтрализацию эффекта неблагоприятной пары.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования течения онкологических заболеваний | 2016 |
|
RU2622756C1 |
| Способ оценки риска прогрессирования метастатического колоректального рака после анти-VEGF терапии | 2024 |
|
RU2823505C1 |
| СПОСОБ РАСЧЕТА ПРОГНОЗА РАННЕГО ПРОГРЕССИРОВАНИЯ МЕЛАНОМЫ КОЖИ | 2017 |
|
RU2643761C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДОВ ОСТРОГО ВИРУСНОГО ГЕПАТИТА В | 2007 |
|
RU2325656C1 |
| Способ прогнозирования продолжительности жизни больных с метастатическими формами опухолей | 2023 |
|
RU2821659C1 |
| Способ оценки чувствительности опухоли к иммуноонкологическим препаратам | 2021 |
|
RU2771760C1 |
| Способ определения тактики лечения больных с метастатическими формами и рецидивами трижды негативного рака молочной железы | 2023 |
|
RU2818730C1 |
| Способ прогнозирования развития метастазов у больных нерезектабельным трижды негативным раком молочной железы | 2023 |
|
RU2802141C1 |
| Способ прогнозирования длительности безрецидивного периода у больных резектабельным трижды негативным раком молочной железы | 2021 |
|
RU2780922C1 |
| Способ дифференциальной диагностики инфекционного мононуклеоза Эпштейна-Барр-вирусной этиологии, острого бактериального тонзиллита и острого вирусного гепатита "В" у взрослых | 2017 |
|
RU2687563C2 |
Изобретение относится к области медицины и касается способа подбора выбора поддерживающей иммунотерапии после окончания первичного комплексного лечения злокачественного новообразования молочной железы (РМЖ), сигмовидной кишки, меланомы. Сущность способа заключается в том, что в периферической крови пациента определяют количество TNF-α, INF-γ, IL-2; CD4+, CD8+, CD19+, общее количество лимфоцитов и нейтрофилов. Далее вычисляют по формуле Кр=nCD3+стим / nCD3+спонт, где Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2; nCD3+cтим - количество клеток Т-лимфоцитов (CD3+), синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции; CD3+спонт - количество клеток Т-лимфоцитов CD3+,синтезирующих соответствующий цитокин спонтанно. Далее проводят вычисления отношения абсолютных значений нейтрофилов к общим лимфоцитам (NEU/LYMF), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD4+(NEU/CD4+), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD8+(NEU/CD8+), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD19+(NEU/CD19+). В зависимости от полученных данных назначают поддерживающую иммунотерапию. Использование способа позволяет повысить эффективность первичного комплексного лечения злокачественного новообразования. 1 табл., 4 пр.
Способ выбора поддерживающей иммунотерапии после окончания первичного комплексного лечения злокачественного новообразования молочной железы (РМЖ), сигмовидной кишки, меланомы, включающий:
- определение в периферической крови пациента количества TNF-α, INF-γ, IL-2; CD4+, CD8+, CD19+, общего количества лимфоцитов и нейтрофилов и вычисление коэффициента по формуле:
Кр=nCD3+стим / nCD3+спонт,
где Кр - коэффициент реакции влияния на течение опухолевого процесса для соответствующего провоспалительного цитокина, а именно: TNF-α, INF-γ, IL-2;
nCD3+cтим - количество клеток Т-лимфоцитов (CD3+) в периферической крови, синтезирующих соответствующий цитокин в стандартной тест системе после стимуляции;
CD3+спонт - количество клеток Т-лимфоцитов CD3+ в периферической крови синтезирующих соответствующий цитокин спонтанно, при этом за норму реакции цитокинов принимают значения коэффициентов реакции в диапазоне: для TNF-α от 80 до 120, для IL-2 от 80 до 120, для INF-γ от 150 до 250, при этом, если в результате сравнения с нормой выявляют группу из двух разных цитокинов, в которой значение коэффициента реакции у каждого из цитокинов выше верхнего значения нормы соответственно, то такую цитокиновую группу определяют как гиперреактивную, если в результате сравнения с нормой выявляют группу из двух разных цитокинов, в которой значение коэффициента реакции у каждого из цитокинов ниже нижнего значения нормы соответственно, то такую цитокиновую группу определяют как гипореактивную;
- вычисления отношения абсолютных значений нейтрофилов к общим лимфоцитам (NEU/LYMF), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD4+(NEU/CD4+), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD8+(NEU/CD8+), отношения абсолютных значений нейтрофилов к субпопуляциям лимфоцитов CD19+(NEU/CD19+),
при этом за норму принимают для NEU/LYMF интервал значений (1,7-1,9), для NEU/CD4+ интервал значений (3-5), для NEU/CD8+ интервал значений (9,47-12,31), для (NEU/CD19+) интервал значений (16-18);
- вычисления отношения общего количества лимфоцитов к субпопуляциям лимфоцитов CD4+(LYMF/CD4+), общего количества лимфоцитов к субпопуляциям лимфоцитов CD8+(LYMF/CD8+), общего количества лимфоцитов к субпопуляциям лимфоцитов CD19+(LYMF/CD19+),
при этом за норму принимают для LYMF/CD4+ интервал значений (1,7-3), для LYMF/CD8+ интервал значений (5,26-7,38), для LYMF/CD19+ интервал значений (9,6-10);
и, при выявлении у пациента с диагнозом РМЖ гипореактивной группы из двух цитокинов INF-γ, IL-2, и NEU/CD19+ на 50% и более выше верхнего значения нормы, LYMF/CD19+ на 50% и более выше верхнего значения нормы назначают ронколейкин 500 курсом 1 раз в 10 дней и Т-активин 8 доз по 4 мл внутримышечно через день;
при выявлении у пациента с диагнозом РМЖ гиперреактивной группы из двух цитокинов TNF-α, IL-2, при этом коэффициент реакции для INF-γ ниже нижнего значения нормы, NEU/CD8+ на 50% и более ниже нижнего значения нормы назначают гриппферон 100000 Ед в нос по 1 дозе ежедневно на 6 месяцев;
при выявлении у пациента с диагнозом РМЖ цитокинов TNF-α, INF-γ, IL-2 с коэффициентами реакции ниже нижнего значения нормы и NEU/CD8+ на 50% и более ниже нижнего значения нормы назначают ронколейкин 500 курсом 1 раз в 10 дней на 6 месяцев;
при выявлении у пациента с диагнозом РМЖ цитокинов TNF-α, INF-γ, IL-2 с коэффициентами реакции ниже нижнего значения нормы и NEU/CD8+ на 50% и более ниже нижнего значения нормы, LYMF/CD8+ на 50% и более ниже нижнего значения нормы назначают ронколейкин 500 курсом 1 раз в 10 дней на 6 месяцев;
при выявлении у пациента с диагнозом рак толстой кишки гипореактивной группы из двух цитокинов INF-γ, IL-2, и NEU/ CD19+ на 50% и более выше верхнего значения нормы, LYMF/CD19+ на 50% и более выше верхнего значения нормы назначают два курса 5 фторурацил в дозе 500 мг в/в до 4,5 г с перерывом 28 дней;
при выявлении у пациента с меланомой гипореактивной группы из двух цитокинов INF-γ, IL-2, и NEU/CD19+ на 50% и более выше верхнего значения нормы, LYMF/CD19+ на 50% и более выше верхнего значения нормы назначают интерферон в нос на 6 месяцев.
| СПОСОБ ОПРЕДЕЛЕНИЯ ТАКТИКИ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ПОЧЕЧНО-КЛЕТОЧНОГО РАКА | 2002 |
|
RU2216325C1 |
| Онкология | |||
| Национальное руководство | |||
| Под ред | |||
| Чиссов В.И | |||
| ГЕОТАР-Медиа, 2008 | |||
| В.М | |||
| МОИСЕЕНКО и Н.М | |||
| ВОЛКОВ, История иммунотерапии рака // Практическая Онкология, 2016, Т | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Веникодробильный станок | 1921 |
|
SU53A1 |
| С.И | |||
| ОЖЕГОВ Толковый словарь русского языка | |||
| Под ред | |||
| Л.И | |||
| Скворова, 28-е изд-е, Москва, Мир и Образование, 2019, С.743 | |||
| СПОСОБ ИНДИВИДУАЛЬНОГО ПОДБОРА И КОРРЕКЦИИ ЛЕЧЕБНОЙ ДОЗЫ ИНТЕРФЕРОНА У БОЛЬНЫХ РАКОМ ПОЧКИ | 2005 |
|
RU2314123C2 |
Авторы
Даты
2021-01-28—Публикация
2020-07-23—Подача