Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики коронавирусной инфекции у приматов, как в практике ветеринарной службы, так и для научных исследований.
Известны исследования коронавирусной инфекции обезьян (диссертации и автореферат «Коронавирусная инфекция обезьян» по ВАК РФ 03.00.06, кандидат биологических наук Гончарук, Елена Ивановна 1991 https://www.dissercat.com/content/koronavirusnaya-infektsiya-obezyan.
Обезьяны как животные - ближайшие родственники людей и с помощью их представляются уникальные возможности при изучении патологии человека. Многими исследователями убедительно доказано, что по чувствительности к вирусам обезьяны почти не отличаются от человека. Более того, они являются единственными животными, у которых инфекции протекают с теми же проявлениями, что у человека. Диагностику коронавирусной инфекции у приматов, проводили с помощью электронной микроскопии и ИФА, с помощью последнего метода доказано антигенное родство изолятов с коронавирусом человека.
При проведении исследований была установлена высокая инфицированность обезьян разного вида, возраста и пола. Чаще всего вирусы обнаруживали в кишечнике, поджелудочной железе, легких и реже - в других органах. Кроме того спонтанная коронавирусная инфекция обезьян является персистентной, протекающей с поражением респираторного и/или ЖКТ, сопровождается периодическими обострениями, во время которых наблюдаются клинические проявления энтероколита и/или пневмонии. Гибель животных наступает в основном от присоединившихся заболеваний, чаще бактериальной природы.
Для проведения исследований были использованы вирусологические методы, основным методом детекции изучаемых вирусов является электронно-микроскопический (ЭМ), а именно негативное контрастирование. Также были использованы иммунологические методы.
Недостатком известного технического решения является не достаточно достоверная диагностика коронавирусной инфекции у приматов.
Известны способы диагностики возбудителей инфекции человека или обезьян и набор для его осуществления (патенты РФ, №№2385945, 2385946, кл. C12Q 1/68, 2010 г.) в которых использованы наборы для ПЦР-диагностики возбудителей инфекции человека или обезьян, характеризующийся тем, что он содержит праймеры, термостабильный фермент Tag- полимеразу, буфер для постановки реакции, смесь четырех дезоксинуклеотидтрифосфатов, положительный контроль, отрицательный контроль, воск и масло для проведения ПЦР.
Общим недостатком известных технических решений является отсутствие возможности диагностики коронавирусной инфекции у приматов.
Наиболее близким по технической сущности является тест-система (патент РФ №2694499, C12Q 1/68, 2019 г. - прототип) для обнаружения генома возбудителя коронавирусной инфекции у животных при помощи мультиплексной полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в реальном времени, которая включает буфер для проведения ПЦР, смесь для ее проведения, состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов, специфичных для коронавируса и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE и обратной транскриптазы MMLV REVERSE TRANSCRIPTASE. Смесь рекомбинантных плазмидных ДНК, содержит фрагменты генома коронавируса и фрагмент генома бактериофага MS2.
Недостатком известного технического решения является отсутствие возможности получения достоверной диагностики коронавирусной инфекции у приматов.
Техническим результатом является расширение функциональных возможностей и получение достоверной диагностики с помощью ОТ - ПЦР в реальном времени.
Технический результат достигается тем, что в тест-системе для выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, включающей буфер для проведения полимеразной цепной реакции, смесь для ее проведения, состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов, специфичных для коронавируса и для внутреннего контрольного образца в виде суспензии бактериофага MS2 с концентрацией 5×10 копий нуклеотидных последовательностей на 1 мкл; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE и обратной транскриптазы MMLV REVERSE TRANSCRIPTASE; буфер для разведения РНК в виде деионизованной воды, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец в виде смеси рекомбинантных плазмидных ДНК, содержащих фрагмент генома коронавирусной инфекции и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, согласно изобретению смесь рекомбинантных плазмидных ДНК содержит фрагмент генома коронавирусной инфекции нового типа (nCov19) и фрагмент генома бактериофага MS2 со следующими нуклеотидными последовательностями:
 - прямой праймер,
- прямой праймер,
 - обратный праймер,
- обратный праймер,
 - зонд,
- зонд,
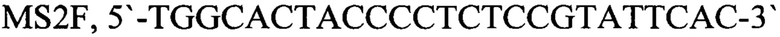 - прямой праймер,
- прямой праймер,
 - обратный праймер,
- обратный праймер,
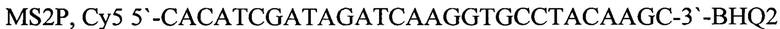 - зонд.
- зонд.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики коронавирусной инфекции нового типа nCoV19 у приматов используют тест-систему с использованием специфичных для участка генома коронавируса nCoV19 олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага MS2 с новой нуклео-тидной последовательностью, это связано с тем что эти нуклеотидные последовательности лучше сочетаются с праймерами на nCoV19 и обеспечивают достоверную диагностику.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемую тест-систему рекомендовано использовать в ветеринарной вирусологии, а именно в качестве средств диагностики коронавирусной инфекции нового типа nCoV19 у приматов, как в практике ветеринарной службы, так и для научных исследований, что соответствует критерию «промышленная применимость».
Использование заявляемых олигонуклеотидных праймеров nCoV19F и nCoV19R флуоресцентно-меченного зонда nCoV19P обеспечивает специфическое выявление РНК коронавируса у приматов.
Использование разных видов контроля, для которых используют различные формы материала бактериофага MS2: суспензия и фрагмент генома со специфическими к нему праймерами и зондом, бактериофага MS2 обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения РНК из образцов.
Праймеры, специфичные для генома возбудителя коронавирусной инфекции нового типа (nCov19), были отобраны на основе участка нуклеотидной последовательности гена N, кодирующего синтез белка, нуклеокапсидного фосфопротеина (nucleocapsid phosphoprotein gene вируса) и являющегося важнейшим компонентом вириона SARS-подобных коронавирусов, входящих в род бета-коронавирусов семейства Coronaviridae отряда Nidovirales. Как и другие представители этого рода, геном коронавируса нового типа (nCov19) представлен однонитевой РНК(+), размером порядка 30000 нуклеотидов.
Для выбора последовательности и расчета первичной структуры олигонуклеотидных праймеров и зондов, был проведен сравнительный анализ доступных в электронных базах данных GenBank и GISAID нуклеотидных последовательности гена N, кодирующего синтез структурного белка вируса, нуклеокапсидного фосфопротеина.
С помощью программы "BioEdit 7.0" выравнены нуклеотидные последовательности гена N генома вирусов - представителей родов бета-коронавирусов (А-Н видов) и альфа-коронавирусов последовательностью гена N генома коронавируса нового типа (nCoV19) изолята Wuhan-Hu-1, ((Wuhan seafood market pneumonia virus isolate Wuhan-Hu-1, complete genome, NCBI Reference Sequence, 29,903 bp linear RNA, 28274-29533 / gene="N" / product="nucleocapsid phosphoprotein") (код доступа NC 045512.2). В результате анализа построенного элайнмента внутри гена, кодирующего нуклеокапсидный фосфопротеин вируса выбран участок между 28750 и 29050 нуклеотидами, содержащий уникальные нуклеотидные последовательности.
С помощью программы "Oligo 6.0" рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд nCoV19-P, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров nCov19-F и nCoV19-R. В качестве флуорофора на 5'-конце использован яркий родаминовый краситель-ROX(carboxy-X-rhodamine), уравновешенный гасителем (Quencher-BHQ-2) на 3'-конце нуклеотидного зонда. Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
С помощью программы "Oligo 6.0" проанализирована нуклеотидная последовательность бактериофага MS2 (Enterobacteria phage MS2 isolate ST4, complete genome, код доступа EF204940). Бактериофаг MS2 содержит однонитевую позитивно ориентрованную РНК размером 3569 оснований. В результате анализа внутри гена белка "созревания" (maturation protein) выбран участок между 200 и 350 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд MS2P11, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров MS2F11 и MS2R11. Используя программу "Oligo 6.0", описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР. Пример применения тест-системе для выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов
Для исследования используют следующий биологический материал, взятый от инфицированных приматов:
- фекалии весом 5 г отбирают в стерильный пластиковый контейнер.
- из тканей кишечника вырезают кусочки размером 1 см3 и помещают в стерильный контейнер. Далее обрабатывают исследуемый материал.
Пробы тканей кишечника с содержимым (до 1 г) гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10% суспензию на стерильном физиологическом растворе. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 9000 об/мин в течение 1 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции РНК.
Из фекалий (1-5 г) готовят 10% суспензию на стерильном физиологическом растворе. Взвесь фекалий декантируют в течение 5-10 минут. Отбирают 1 мл надосадочной жидкости и переносят в чистую пробирку 1,5 мл, центрифугируют при 5000 об./мин на центрифуге «MiniSpin», Eppendorf, в течение 5 мин. Экстракцию РНК из осветленного экстракта фекалий проводят по возможности, сразу.
Для исследования респираторной коронавирусной инфекции используют по выбору: мазки из носа, горла, носоглотки, носоглоточные аспираты, назальные смывы, мокроту, бронхоальвеолярный лаваж, секционный материал, образцы культуральной жидкости.
• Выделения из носоглотки и трахеи, мазки со слизистой носовой полости, снимают с помощью стерильного зонда, зонд помещают в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора/фосфатного буфера/транспортной среды.
• Фарингеальные смывы помещают в стерильный контейнер. Смывы, мазки берут на исследование без предварительной подготовки.
Вязкую по консистенции мокроту обрабатывают реагентами типа муколизин, с целью снижения вязкости.
Анализ проводят с помощью набора реагентов «ПЦР-КОРОНАВИРУС (nCoV19) - ФАКТОР» (Инструкция по применению «ПЦР-КОРОНАВИРУС-приматы-ФАКТОР», набора реагентов для выявления РНК коронавируса (nCoV19) приматов в биологическом материале методом обратной транскрипции и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ОТ-ПЦР-РВ), ТУ 21 10.60-133-51062356-2017, http://www.vetfaktor.ru/) который состоит из трех этапов (см. таблицу 1 и 2):
• экстракция НК;
• проведение ОТ-ПЦР РВ с флуоресцентной детекцией в режиме реального времени;
• учет результатов анализа.

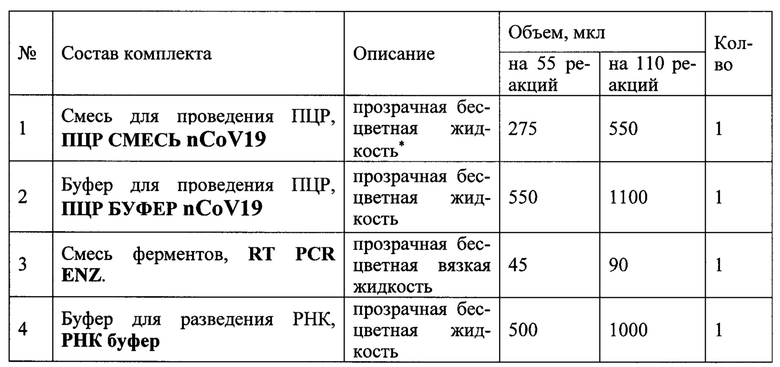

Реакцию ОТ-ПЦР РВ проводят в одной пробирке. Подготовка образцов к проведению ПЦР
Общий объем реакционной смеси - 25 мкл, объем РНК-пробы - 10 мкл. Успешное прохождение реакции контролируют использованием ПКО nCoV19, ВКО nCoV19 и РНК буфера.
Буфер для проведения ОТ-ПЦР, ПЦР буфер nCoV19; состав: 2,5х ПЦР-буфер (хлорид калия, 100 мМ, Трис-HCl, рН 8,8 100 мМ, глицерол 1%, Tween-20 0.02%); хлорид магния, 5 мМ; деионизированная вода.
Смесь для проведения ПЦР, ПЦР-смесь nCoV19 состав: эквимолярная смесь дезоксинуклеозидтрифосфатов (дНТФ) в концентрации 0,25 мМ; деионизированная вода, смесь праймеров и флуоресцентного зонда на корона-вирус (прямой и обратный праймеры nCoV19F и nCoV19R в концентрации 0,2 мкМ, зонд nCoV19P- ROX в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5), смесь праймеров и флуоресцентного зонда на ПКО (прямой и обратный праймеры MS2F и MS2R в концентрации 0,2 мкМ, зонд MS2P-Cy5 в концентрации 0,1 мкМ, взятых в соотношении 1:1:0,5).
Смесь ферментов, RT PCR ENZ, состав: ДНК полимераза с антителами, ингибирующими активность фермента, TAQ POLYMERASE (5 ед/мкл), обратная транскриптаза MMLV REVERSE TRANSCRIPTASE (100 ед/мкл).
Буфер для разведения РНК, РНК буфер, состав: деионизованная вода.
Внутренний контрольный образец, ВКО nCoV19; состав: суспензия бактериофага MS2 (5×103/мл)
- Отрицательный контрольный образец, ОКО (ТЕ буфер); состав: ТЕ буфер (10 мМ Tris-HCl, 0,5 мМ EDTA, рН 8,0)
- Положительный контрольный образец, ПКО nCoV19; состав: смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса nCoV19 и фрагмент генома бактериофага MS2, взяты в соотношении 1:1.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
10 мкл ПЦР БУФЕР nCoV19
5 мкл ПЦР СМЕСЬ nCoV19
0,75 мкл RT PCR ENZ.
Отбирают необходимое количество пробирок для амплификации НК исследуемых и контрольных проб. В них вносят по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки внести:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл РНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую внести по 10 мкл НК соответствующей пробы, включая пробу ВК-);
в) в пробирку с положительным контролем ПЦР (К+) 10 мкл ПКО nCoV19.
Проведение реакции ПЦР РВ с флуоресцентной детекцией
Параметры температурно-временного режима амплификации на приборах «Rotor-Gene Q», «ДТ-96» и «CFX96» указаны в таблице 3.

Поместить подготовленные для проведения ПЦР пробирки в ячейки амплификатора.
Интерпретация результатов анализа
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в режиме «реального времени» в соответствии с инструкцией производителя к прибору.
Учет результатов ОТ-ПЦР проводился по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct> для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции НК в соответствии с таблицей 4.

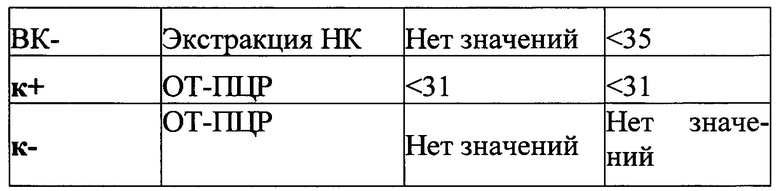
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- на канале ROX/Orange и для отрицательного контроля этапа ПЦР К- на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых по каналу Cy5/Red значение Ct отсутствует или превышает 35 цикл (при этом по каналу ROX/Orange значение Ct также отсутствует) требуют повторного проведения исследования с этапа ГГЦР. Задержка в значениях пороговых циклов для исследуемых образцов на канале Cy5/Red указывает на присутствие ингибиторов в пробах или на ошибки при постановке реакции ОТ-ПЦР. Требуется провести исследование, начиная с этапа экстракции НК.
Образец считается положительным, РНК коронавируса приматов присутствует, если наблюдается рост специфического сигнала на канале ROX/Orange, при этом значения Ct контрольных образцов находятся в пределах нормы (см. Табл. 4). Если для исследуемого образца по каналу ROX/Orange значение Ct определяется позднее 35 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (наблюдается рост специфического сигнала на канале ROX/Orange) - образец считается положительным.
Образец считается отрицательным (РНК коронавируса приматов отсутствует) если не определяется значение Ct (не наблюдается рост специфического сигнала) на канале ROX/Orange, при этом значения Ct по каналу Cy5/Red и Ct контрольных образцов находятся в пределах нормы (Табл. 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов | 2020 |
|
RU2740097C1 |
| Тест-система для обнаружения генома возбудителя коронавирусной инфекции у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694499C1 |
| Способ выявления генома возбудителя коронавирусной инфекции у крупного рогатого скота | 2018 |
|
RU2694558C1 |
| Тест-система для обнаружения генома вируса парагриппа 3 типа у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2681473C1 |
| Тест-система для выявления РНК возбудителя вируса артериита у лошадей | 2018 |
|
RU2698662C1 |
| Тест-система для обнаружения генома возбудителя ротовируса типа А у сельскохозяйственных животных с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694501C1 |
| Способ выявления генома возбудителя ротовирусной инфекции у сельскохозяйственных животных | 2018 |
|
RU2689718C1 |
| Способ выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота | 2018 |
|
RU2696069C2 |
| Тест-система для выявления РНК вируса болезни Шмалленберга у сельскохозяйственных животных | 2018 |
|
RU2694719C1 |
| Способ выявления РНК возбудителя вируса артериита у лошадей | 2018 |
|
RU2700481C1 |
Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики коронавирусной инфекции у приматов. Описана тест-система для выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, включающая буфер для проведения полимеразной цепной реакции. Тест-система представляет собой смесь, состоящую из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов, специфичных для коронавируса и для внутреннего контрольного образца в виде суспензии бактериофага MS2 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE и обратной транскриптазы MMLV REVERSE TRANSCRIPTASE; буфер для разведения РНК в виде деионизованной воды, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец в виде смеси рекомбинантных плазмидных ДНК, содержащих фрагмент генома коронавирусной инфекции и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, согласно изобретению смесь рекомбинантных плазмидных ДНК содержит фрагмент генома коронавирусной инфекции нового типа (nCov19) и фрагмент генома бактериофага MS2 со следующими нуклеотидными последовательностями:
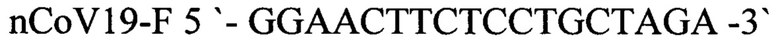 - прямой праймер,
- прямой праймер,
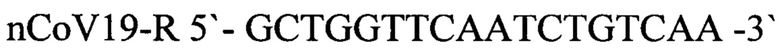 - обратный праймер,
- обратный праймер,
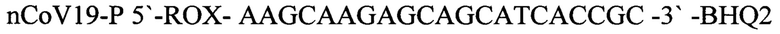 -зонд,
-зонд,
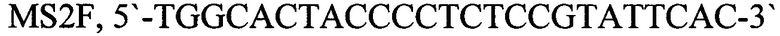 - прямой праймер,
- прямой праймер,
 - обратный праймер,
- обратный праймер,
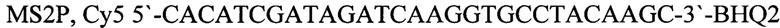 - зонд. Изобретение расширяет функциональные возможности и достоверность диагностики с помощью ОТ - ПЦР в реальном времени. 4 табл.
- зонд. Изобретение расширяет функциональные возможности и достоверность диагностики с помощью ОТ - ПЦР в реальном времени. 4 табл.
Тест-система для выявления генома возбудителя коронавирусной инфекции нового типа (nCov19) у приматов с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, включающая буфер для проведения полимеразной цепной реакции, смесь для ее проведения, состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов, специфичных для коронавируса и для внутреннего контрольного образца в виде суспензии бактериофага MS2 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE и обратной транскриптазы MMLV REVERSE TRANSCRIPTASE; буфер для разведения РНК в виде деионизованной воды, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец в виде смеси рекомбинантных плазмидных ДНК, содержащих фрагмент генома коронавирусной инфекции и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, отличающаяся тем, что смесь рекомбинантных плазмидных ДНК содержит фрагмент генома коронавирусной инфекции нового типа (nCov19) и фрагмент генома бактериофага MS2 со следующими нуклеотидными последовательностями:
nCoV19-F 5'-GGAACTTCTCCTGCTAGA-3' - прямой праймер,
nCoV19-R 5'-GCTGGTTCAATCTGTCAA -3' - обратный праймер,
nCoV19-P 5'-ROX- AAGCAAGAGCAGCATCACCGC -3'-BHQ2 - зонд,
MS2F, 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер,
MS2R, 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер,
MS2P, Су5 5'-CACATCGATAGATCAAGGTGCCTACAAGC-3'-BHQ2 - зонд.
| Способ выявления генома возбудителя коронавирусной инфекции у крупного рогатого скота | 2018 |
|
RU2694558C1 |
| НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО МЕЧЕНЫХ ЗОНДОВ ДЛЯ ИДЕНТИФИКАЦИИ РНК КОРОНАВИРУСОВ ВИДОВ 229Е, NL63, ОС43, HKU1 МЕТОДОМ ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНОЙ ОБРАТНО-ТРАНСКРИПТАЗНОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2011 |
|
RU2473702C1 |
| Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703394C1 |
| Тест-система для обнаружения генома вируса парагриппа 3 типа у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2681473C1 |
| Тест-система для выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней | 2018 |
|
RU2703401C1 |
| WO 2016034610 A1, 10.03.2016 | |||
| US 7527926 B2, 05.05.2009. | |||
Авторы
Даты
2021-01-29—Публикация
2020-08-11—Подача