ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет предварительной заявки на патент США №62/285,039, поданной 12 февраля 2016 года, содержание которой полностью включено в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным тетрагидроизохинолина или их солям, которые могут применяться в качестве активного ингредиента для фармацевтической композиции, в частности, фармацевтической композиции для лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы.
ОБСУЖДЕНИЕ УРОВНЯ ТЕХНИКИ
Цитоскелет скелетных и сердечных мышечных клеток является уникальным по сравнению с цитоскелетом всех других клеток. Он состоит из почти кристаллической периодической структуры плотно упакованных цитоскелетных белков, называемой саркомером. Саркомер упорядоченно организован в виде взаимно соединенной периодической структуры тонких и толстых филаментов. Толстые филаменты состоят из миозина, двигательного белка, ответственного за преобразование химической энергии гидролиза АТФ в силу и направленный момент. Тонкие филаменты состоят из мономеров актина, организованных в спиральную периодическую структуру. Существует четыре регуляторных белка, присоединенных к актиновым филаментам, что позволяет модулировать сокращение ионами кальция. Приток внутриклеточного кальция инициирует мышечное сокращение; толстые и тонкие филаменты скользят мимо друг друга, возбуждаемые повторяющимися взаимодействиями моторных доменов миозина с тонкими филаментами актина.
Из тринадцати отдельных классов миозина в клетках человека ответственным за сокращение скелетной, сердечной и гладкой мышцы являются белки класса миозин-II. Миозины данного класса существенно отличаются по аминокислотному составу и по общей структуре от миозинов двенадцати других различных классов. Миозин-II образует гомодимеры, дающие в результате два глобулярных головных домена, связанные между собой длинным хвостом из альфа-спиралей, скрученных в суперспираль (coiled coil), образующим сердцевину толстого филамента саркомера. Данные глобулярные головки содержат каталитический домен, где происходит присоединение актина и осуществляются АТФазные функции миозина. При присоединении к филаменту актина высвобождение фосфата (в реакции перехода от ADP-Pi к ADP) сигнализирует об изменении в структурной конформации каталитического домена, что, в свою очередь, изменяет ориентацию связывающегося с актином домена легкой цепи, образующего плечо рычага, который выступает из глобулярной головки; данное движение именуется рабочим ходом. Такое изменение ориентации миозиновой головки по отношению к актину заставляет толстый филамент, который является частью миозина, перемещаться относительно тонкого филамента актина, к которому он присоединен. Отсоединение глобулярной головки от филамента актина (регулируемое Са2+), связанное с возвратом каталитического домена и легкой цепи к их первоначальным конформациям/ориентациям, завершает каталитический цикл, ответственный за внутриклеточное движение и сокращение мышцы.
Тропомиозин и тропонин опосредуют воздействие кальция на взаимодействие актина с миозином. Тропониновый комплекс состоит из трех полипептидных цепей: тропонин С, который связывает ионы кальция; тропонин I, который связывается с актином; и тропонин Т, который связывается с тропомиозином. Скелетный комплекс тропонин-тропомиозин регулирует сайты связывания миозина, захватывая сразу несколько актиновых единиц.
Тропонин, комплекс трех полипептидов, описанных выше, является вспомогательным белком, который тесно связан с филаментами актина в мышце позвоночных. Тропониновый комплекс действует согласованно с мышечной формой тропомиозина для опосредования зависимости АТФазной активности миозина от Са2+ и, тем самым, регулирует сокращение мышцы. Полипептиды тропонина именуются Т, I и С по их активностям, соответственно, связывания с тропомиозином, ингибирования и связывания кальция. Тропонин Т связывается с тропомиозином и, как предполагается, несет ответственность за расположение тропонинового комплекса на тонком филаменте мышцы. Тропонин I связывается с актином, и комплекс, образованный тропонинами I и Т и тропомиозином, ингибирует взаимодействие актина и миозина. Скелетный тропонин С способен связывать до четырех молекул кальция. Исследования подтверждают, что, при возрастании уровня кальция в мышце, тропонин С предоставляет сайт связывания для тропонина I, забирая его с актина. Это заставляет молекулу тропомиозина также смещать свое положение, тем самым экспонируя сайты связывания миозина на актине и стимулируя АТФазную активность миозина.
Скелетная мышца человека состоит из различных типов сокращающихся волокон, классифицированных по типу их миозина и называемых или медленными, или быстрыми волокнами. В таблице 1 сведены различные белки, которые составляют данные типы мышц.
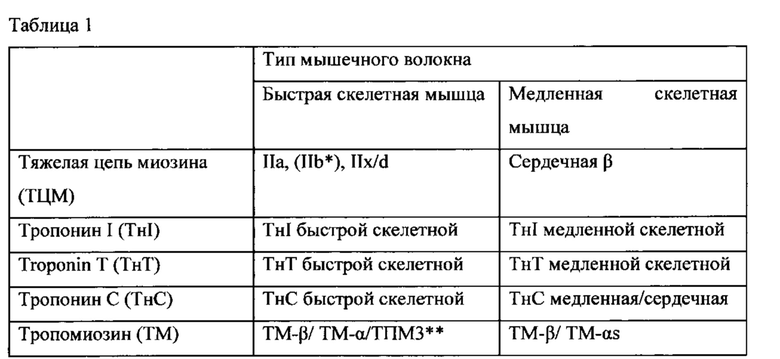
* ТЦМ IIb не экспрессируется в мышцах человека, но присутствует у грызунов и других млекопитающих.
**ТРМ3 представляет собой тропомиозин 3
У здоровых людей большинство скелетных мышц состоят как из быстрых, так и медленных волокон, хотя их соотношение изменяется с типом мышц. Медленные скелетные волокна, часто называемые волокнами типа I, имеют большее структурное подобие с сердечной мышцей и, как правило, более способствуют точному и постуральному контролю. Они обыкновенно имеют более высокую окислительную способность и являются более устойчивыми к усталости при продолжительном использовании. Волокна быстрой скелетной мышцы, часто называемые волокнами типа II, классифицируются на быстро окисляющиеся волокна (IIa) и быстрые гликолитические волокна (тип IIx/d). Хотя данные мышечные волокна имеют различные типы миозина, они содержат много общих компонентов, включая тропониновые и тропомиозиновые регуляторные белки. Быстрые волокна скелетной мышцы обеспечивают действие с большей силой, но устают быстрее чем медленные волокна скелетной мышцы, и функционально являются полезными для резких, с большим диапазоном движений, таких как вставание с кресла или корректировка при падении.
Сокращение мышц и генерация силы управляются нервными стимулами, передающимися иннервирующими двигательными нейронами. Каждый двигательный нейрон может иннервировать большое число (приблизительно от 100 до 380) мышечных волокон, сокращаемых как единое целое, которые называются двигательной единицей. Когда требуется сократить мышцу, то двигательные нейроны посылают стимулы в виде нервных импульсов (потенциалы действия) от стволовой части мозга или спинного мозга к каждому волокну в двигательной единице. Область контакта между нервом и мышечными волокнами представляет собой специализированный синапс, называемый нервно-мышечным соединением (НМС, neuromuscular junction (NMJ)). Здесь мембранные деполяризационные потенциалы действия в нерве преобразуются в импульс в мышечном волокне посредством высвобождения нейротрансмиттера ацетилхолина (АцХ, acetylcholine (ACh)). АцХ иницирует второй потенциал действия в мышце, который быстро распространяется вдоль волокна и внутри инвагинаций в мембране, называемых t-канальцами. Т-канальцы физически подсоединены к запасам Са2+ внутри саркоплазматического ретикулума (CP) мышцы посредством рецептора дигидропиридина (РДГП). Стимуляция РДГП активирует второй Са2+-канал в CP, рианодиновый рецептор, для инициации высвобождения Са2+ из запасов в CP в мышечную цитоплазму, где он может взаимодействовать с тропониновым комплексом для инициации мышечного сокращения. Если стимулирование мышцы прекращается, то кальций быстро откачивается обратно в CP с помощью АТР-зависимого кальциевого насоса, Са2+-АТРазы сарко/эндоплазматического ретикулума (sarco/endoplasmic reticulum Ca2+-ATPase (SERCA)).
Мышечная функция может быть ослаблена при болезни многими механизмами. Примерами являются слабость, связанная с престарелым возрастом (называемая саркопенией) и синдромы кахексии, связанные с такими заболеваниями, как рак, сердечная недостаточность, хроническая обструктивная болезнь легких (ХОБЛ, chronic obstructive pulmonary disease (COPD)) и хроническая болезнь почек/диализ. Тяжелая мышечная дисфункция может возникать из-за нервно-мышечных заболеваний (таких как боковой амиотрофический склероз (amyotrophic lateral sclerosis (ALS)), спинальная мышечная атрофия (spinal muscular atrophy (SMA)) и миастения гравис) или мышечных миопатий (таких как мышечные дистрофии). Кроме того, мышечная функция может быть ослаблена из-за нарушений, связанных с реабилитацией, таких как недостаточное восстановление после хирургических операций (например, постхирургическая мышечная слабость), длительный постельный режим или реабилитация после инсульта. Дополнительными примерами заболеваний или состояний, при которых ослабевает мышечная функция, являются заболевания периферической сосудистой системы (например, синдром Шарко), синдром хронической усталости, метаболический синдром, ожирение, мышечная дисфункция тазового дна и уретры/анального сфинктера (например, недержание мочи, такое как стрессовое недержание мочи (stress urinary incontinence (SUI)) и смешанное недержание мочи (mixed urinary incontinence (MUI)) и недержание кала), мышечная дисфункция после повреждения спинного мозга (post-spinal cord injury (SCI)) и обусловленная использованием дыхательного аппарата мышечная слабость.
В настоящее время возможности лечения большинства нервно-мышечных заболеваний либо ограничены, либо отсутствуют. В WO 2008/016669 описано соединение, представленное следующей общей формулой (А) для лечения пациента, имеющего заболевание, отвечающее на модуляцию скелетного тропонина С и т.д.
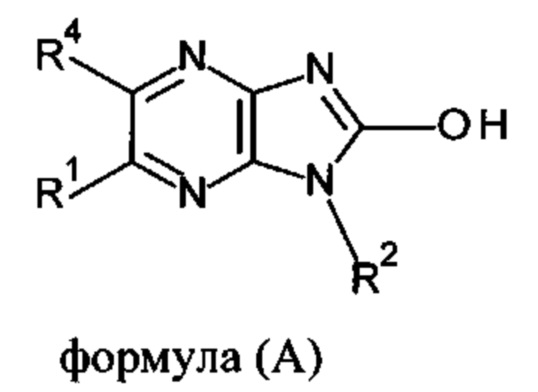
Обозначение символов дано в данной публикации.
WO 02011/0133888 раскрывает соединение, представленное следующей общей формулой (В) для лечения пациента, имеющего заболевание, отвечающее на модуляцию скелетного тропонина С и т.д.
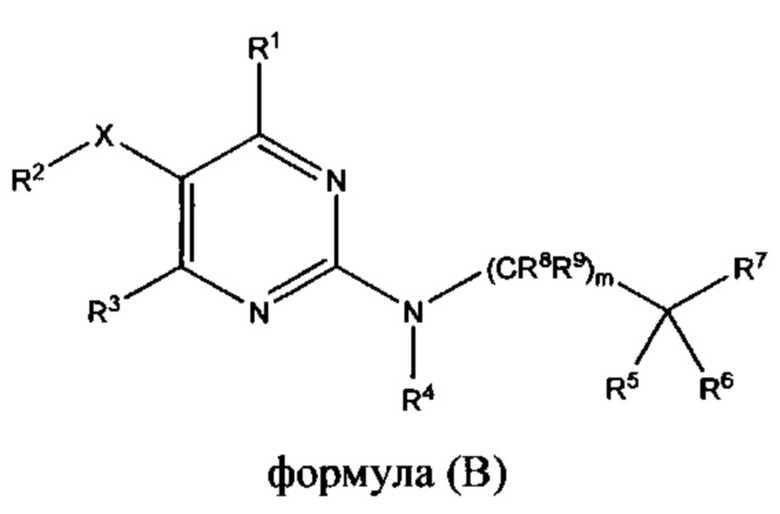
Обозначение символов дано в данной публикации.
WO 2011/0133882, WO 2011/133920 и US 2013-0060025 раскрывают другое соединение для лечения пациента, имеющего заболевание, отвечающее на модуляцию скелетного тропонина С и т.д.
В WO 2013/151938, WO 2013/155262 и WO 2015/168064 описаны способы лечения, такие как улучшение функции диафрагмы, повышение устойчивости к усталости скелетной мышцы, уменьшение снижения жизненной емкости легких, с использованием активатора тропонина скелетных мышц.
US 3947451 и US 3301857, а также Journal of Heterocyclic Chemistry, 7 (3) р615-22, (1970) и Synthetic Communications, 32 (12) p1787-90, (2002) раскрывают соединения, содержащие структуру 1,4-дигидроизохинолина-3(2Н), но не раскрывают никакой фармакологической активности соединений, описанных в данных публикациях.
Tetrahedron Letters, 50 (47) р6476-6479, (2009) раскрывает 1,1-диаллил-3-оксо-2,4-дигидроизохинолин-4-карбоксилат, но не раскрывает никакой фармакологической активности соединений, описанных в данной публикации.
Соответственно, существует необходимость в разработке новых соединений, которые модулируют сокращение скелетной мышцы. По-прежнему сохраняется необходимость в веществах, которые используют новые механизмы действия и которые могут приводить к лучшим результатам, в том, что касается ослабления симптомов заболевания, безопасности и смертности пациентов как за короткий, так и за длительный периоды, а также улучшения терапевтических показателей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, одной из задач настоящего изобретения является создание новых соединений тетрагидроизохинолина и их солей, которые могут применяться в качестве активного ингредиента для фармацевтических композиций, в частности, фармацевтических композиций для лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы.
Другой задачей настоящего изобретения является создание новых фармацевтических композиций, которые содержат такое соединение.
Другой задачей настоящего изобретения является разработка новых способов получения такого соединения.
Другой задачей настоящего изобретения является создание новых способов предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы.
Данные и другие задачи настоящего изобретения, которые станут очевидными в последующем подробном описании, были достигнуты соединениями формулы (I) и (I') по изобретению, описанными ниже.
Настоящее изобретение обеспечивает новые соединения, которые, как ожидается, будут использоваться в качестве активного ингредиента в фармацевтической композиции и, в частности, в фармацевтической композиции для предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы. Модуляция саркомера скелетной мышцы может осуществляться, например, путем модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ.
В настоящем изобретении обеспечены соединения формулы (I), (I') и их варианты осуществления, а также фармацевтические композиции, содержащие такие соединения, способы получения таких соединений и способы применения таких соединений в терапии. Предполагается, что любое из фармацевтических композиций, способов получения и способов применения, обеспеченных в настоящем изобретении, охватывает любое из соединений формулы (I), (I') и любых их вариантов осуществления, обеспеченных в настоящем изобретении, включая, без ограничений, варианты осуществления от 1-1 до 8-4 и варианты осуществления (1)-(57).
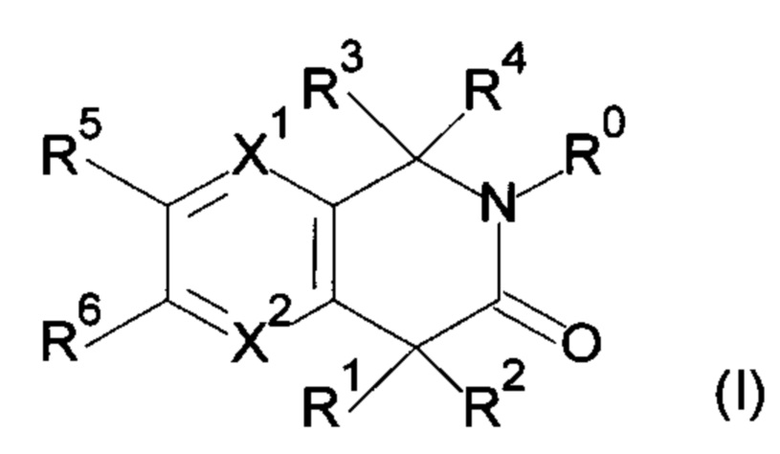
Настоящее изобретение относится к соединению формулы (I) или его соли и фармацевтической композиции, содержащей соединение формулы (I) или его соль и наполнитель.
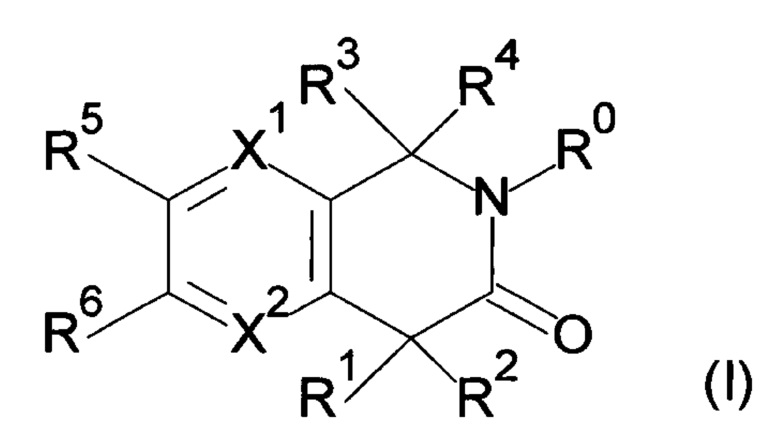
где
X1: C-R11 или N;
X2: C-R12 или N;
R11: i) Н, ii) галоген, iii) -CN или iv) -O-C1-6 алкил;
R12: Н или галоген;
R1: i) Н, ii) C1-6 алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и пиразолила(ов), iii) С 2-6алкенил или iv) -O-R0;
R2: i) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранными из группы, состоящей из -OR0 (одной или более), галогена(ов), -COOR0 (одной или более), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы G1, и гетероарила(ов), который выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, причем данный гетероарил может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -OR0, v) -NR23R24, vi) -COOR0 или vii) фенил;
R21: H или С1-6алкил;
R22: i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами) или ii) фенил;
R23: i) Н, или ii) C1-6алкил, который может быть замещен одной или более -ОН (одной или более);
R24: i) С1-6алкил, который может быть замещен одним или несколькими фенилом(ами), который может быть замещен одним или несколькими галогеном(ами), ii) С3-8циклоалкил, который может быть замещен одним или несколькими С1-6алкилом(ами), iii) фенил, который может быть замещен одним или несколькими галогеном(ами) или (iv) тетрагидропиранил; или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-пиперидинового кольца или 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом, и 4-пиперидиновое кольцо может быть замещено одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -SO2-(С1-6алкила) и -COOR0;
R3, R4: одинаковые или отличающиеся друг от друга, i) C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или и) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который выбран из группы, состоящей из пиразолила и тиенила, причем данный гетероарил может быть замещенным одним или несколькими С1-6алкилом(ами) или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом;
R5: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими -O-(C1-6алкилом(ами), iii) -O-(С1-6алкил), iv) галоген, v) -СОО-(С1-6алкил) или vi) С3-8циклоалкил;
R6: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -O-(С1-6алкила(ов), который может быть замещен одним или несколькими галогеном(ами)), и галогена(ов), (iii) -ОН, iv) -O-(С1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-(С1-6алкил), viii) С3-8циклоалкил, ix) -NR0R0 или х) С2-6алкенил;
Группа G1: i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена, или vi) -O-(С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов));
Группа G2: i) галоген, ii) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов), или iii) -CONR0R0;
R0: одинаковые или отличающиеся друг от друга, Н или C1-6алкил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли и фармацевтической композиции, содержащей соединение формулы (I) или его соль и наполнитель.
где
X1: C-R11 или N;
X2: C-R12 или N;
R11: i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12: Н или галоген;
R1: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и пиразолила(ов), iii) С2-6алкенил, iv) -OR0;
R2: i) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -OR0 (одной или более), галогена(ов), -COOR0 (одной или более), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранным (и) из группы G1, и гетероарила(ов), который выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, причем данный гетероарил может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -OR0, v) -NR23R24, vi) -COOR0 или vii) фенил;
R21: H или C1-6алкил;
R22: i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами) или ii) фенил;
R23: i) H, или ii) C1-6алкил, который может быть замещен одной или более -ОН-группой (одной или более);
R24: i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами), которые могут быть замещены одним или несколькими галогеном(ами), ii) С3-8циклоалкил, который может быть замещен одним или несколькими С1-6алкилом(ами), iii) фенил, который может быть замещен одним или несколькими галогеном(ами) или (iv) тетрагидропиранил; или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-пиперидинового кольца или 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом, и 4-пиперидиновое кольцо может быть замещено одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из SO2-(C1-6алкила) и -COOR0;
R3, R4: одинаковые или отличающиеся друг от друга, i) C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или ii) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который выбран из группы, состоящей из пиразолила и тиенила, причем данный гетероарил может быть замещенным одним или несколькими С1-6алкилом(ами) или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом;
R5: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими -O-(C1-6алкилом(ами), iii) -О-(C1-6алкил), iv) галоген, v) -СОО-(С1-6алкил) или vi) С3-8циклоалкил;
R6: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -O(С1-6алкила(ов), который может быть замещен одним или несколькими галогеном(ами)) и галогена(ов), (iii) -ОН, iv) -O-(C1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi)-CN, vii) -S-(С1-6алкил), viii) С3-8циклоалкил, ix) -NR0R0 или х) С2-6алкенил;
Группа G1: i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящий из -ОН (одной или более) и галогена, или vi) -O-(С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов));
Группа G2: i) галоген, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов), или iii) -CONR0R0;
R0: одинаковые или отличающиеся друг от друга, Н или C1-6алкил, при условии, что упомянутое соединение не является метил-1,1-диаллил-3-оксо-2,4-дигидроизохинолин-4-карбоксилатом или его солью.
Если специально не указано иначе, когда символы в одной формуле в данной спецификации также используются в других формулах, одни и те же символы обозначают одинаковые значения. Когда один и тот же символ используется более одного раза в данной формуле, следует понимать, что каждый экземпляр данного символа в формуле представляет собой независимо выбранный химический фрагмент и что все экземпляры данного символа в формуле необязательно должны представлять собой идентичные химические фрагменты.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его соль и фармацевтически приемлемый наполнитель. Кроме того, изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ, содержащей соединение формулы (I) или его соль. Кроме того, настоящее изобретение относится к средству для предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ, содержащему соединение формулы (I) или его соль.
Кроме того, настоящее изобретение относится к применению соединения формулы (I) или его соли для производства фармацевтической композиции для предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ; применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ; соединению формулы (I) или его соли для применения в предотвращении или лечении заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ; и способу предотвращения или лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы, например, модуляции тропонинового комплекса саркомера быстрой скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов, включающему введение субъекту эффективного количества соединения формулы (I) или его соли. Далее, «субъект» представляет собой человека или не являющееся человеком животное, нуждающееся в профилактике или лечении, и, в одном варианте осуществления, представляет собой человека, нуждающегося в профилактике или лечении.
В одном аспекте соединение формулы (I) или его соль модулирует сокращение саркомера скелетной мышцы. В частности, соединения модулируют тропониновый комплекс саркомера скелетной мышцы посредством одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ. Как используется в данном контексте, «модуляция» означает либо увеличение, либо уменьшение активности. В некоторых случаях соединения, описанные и/или раскрытые в настоящем изобретении, потенцируют (то есть увеличивают активность) одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ. В других случаях соединения, описанные и/или раскрытые в настоящем изобретении, ингибируют (т.е. уменьшают активность) одного или более быстрого скелетного миозина, актина, тропомиозина, тропонина С, тропонина I и тропонина Т, а также их фрагментов и изоформ. Как используется в данном контексте, «активация волокна быстрой скелетной мышцы, такого как миофибрилла», означает усиление ответа волокна быстрой скелетной мышцы (такого как миофибрилла) на стимуляцию/Са2+.
В следующем аспекте соединения и фармацевтические композиции, описанные и/или раскрытые в настоящем изобретении, способны модулировать сокращение быстрого саркомера скелетной мышцы in vivo и могут иметь применение при заболеваниях как человека, так и животных. Модуляция была бы желательной при ряде состояний или заболеваний, включая, но не ограничиваясь ими: 1) нервно-мышечные нарушения, такие как боковой амиотрофический склероз (Amyotrophic Lateral Sclerosis (ALS)), спинальная мышечная атрофия (Spinal Muscular Atrophy (SMA)), периферические невропатии и миастения; 2) нарушения произвольной мышцы, включая мышечные дистрофии, миопатии и состояния мышечного истощения, такие как синдромы саркопении и кахексии (например, синдромы кахексии, вызванные такими заболеваниями, как рак, сердечная недостаточность, хроническая обструктивная болезнь легких (ХОБЛ) и хроническая почка болезнь/диализ), связанные с реабилитацией дефициты, такие как ассоциированные с выздоровлением после хирургической операции (например, послеоперационная мышечная слабость), длительный постельный режим или реабилитация после инсульта, а также вентилятор-индуцированная мышечная слабость; 3) расстройства центральной нервной системы (ЦНС), при которых мышечная слабость, атрофия и усталость являются выраженными симптомами, такие как рассеянный склероз, болезнь Паркинсона, инсульт и повреждение спинного мозга; 4) мышечные симптомы, вызванные системными расстройствами, включая болезнь периферическиой сосудистой системы (Peripheral Vascular Disease (PVD)) или периферическую артериальную болезнь (Peripheral Arterial Disease (PAD)) (например, синдром Шарко), метаболический синдром, синдром хронической усталости, ожирение и дряхлость из-за старения; и 5) мышечной дисфункции тазового дна и уретры/анального сфинктера, такие как стрессовое недержание мочи, смешанное недержание мочи и недержание кала. Кроме того, модуляция была бы также желательна при ряде состояний или заболеваний, в том числе, но не ограничиваясь ими, ХОБЛ, легочные заболевания, кроме ХОБЛ, такие как пневмония, саркопения, сердечная недостаточность, PAD (периферическая артериальная болезнь), диабет, ожирение, ХЗП (хроническая болезнь почек, CKD (Chronic Kidney Disease)), рак, слабость, приобретенная в отделении интенсивной терапии (ОИТ), состояния после операций, включая операции на суставах и при переломе бедра.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (stress urinary incontinence (SUI)), смешанного недержания мочи (mixed urinary incontinence (MUI)) и недержания кала, содержащей соединение формулы (I) или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, содержащей соединение формулы (I) или его соль. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), содержащей соединение формулы (I) или его соль. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом, содержащей соединение формулы (I) или его соль. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (Amyotrophic Lateral Sclerosis (ALS)), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, содержащей соединение формулы (I) или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (spinal cord injury (SCI)) и дисфункции после инсульта, содержащей соединение формулы (I) или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, мышечной слабости, обусловленной использованием дыхательного аппарата, и синдрома хронической усталости, содержащей соединение формулы (I) или его соль.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для изготовления фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для изготовления фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечных миопатий. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, мышечной слабости, обусловленной использованием дыхательного аппарата, и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В еще одном аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В другом аспекте настоящее изобретение относится к способу предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В другом своем аспекте настоящее изобретение относится к способу для предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В другом аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В другом аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, включающему введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом своем аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В любом варианте осуществления, описанном в настоящем изобретении, субъект представляет собой человека или не являющееся человеком животное, нуждающееся в профилактике или лечении, и в одном варианте осуществления субъект представляет собой человека, нуждающегося в профилактике или лечении.
В еще одном аспекте настоящее изобретение относится к соединению формулы (I) или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В другом своем аспекте настоящее изобретение относится к соединению формулы (I) или его соли для применения в предупреждении или лечении хронической обструктивной болезни легких (ХОБЛ). В другом своем аспекте настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для применения в предупреждении или лечении кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В другом своем аспекте настоящее изобретение относится к соединению формулы (I) или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В другом своем аспекте настоящее изобретение относится к соединению формулы (I) или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В другом своем аспекте настоящее изобретение относится к соединению формулы (I) или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Более полное понимание настоящего изобретения и многих из его сопутствующих преимуществ будут легко получены, поскольку они станут более понятными со ссылкой на нижеследующее подробное описание при рассмотрении в связи с прилагаемыми чертежами, где:
ФИГ. 1 представляет собой графики, показывающие результаты, полученные с помощью анализа физической выносливости крыс при беге на беговой дорожке. Значимость определяется как *р<0,05 по сравнению с обработкой носителем. На ФИГ. 1 «пример 20» означает соединение из примера 20 и «пример 22b» означает соединение из примера 22b.
ФИГ. 2 представляет собой график, показывающий результаты, полученные с помощью анализа индуцированного стимулированием электрическим полем (Electrical Field Stimulation (EFS)) сжатия изолированного наружного анального сфинктера (External Anal Sphincter (EAS)). На ФИГ. 2 «пример 20» означает соединение из примера 20.
ФИГ. 3 представляет собой график, показывающий результаты, полученные с помощью анализа EFS-индуцированного сжатия изолированного EAS. На ФИГ. 3 «пример 22b» означает соединение из примера 22b.
ФИГ. 4 представляет собой график, показывающий результаты, полученные с помощью анализа анального давления, вызванного электрическим стимулированием пуденального нерва. На ФИГ. 4 «пример 20» означает соединение из примера 20 и «пример 22b» означает соединение из примера 22b.
ФИГ. 5 представляет собой график, показывающий результаты, полученные с помощью анализа давления точки утечки мочи (Leak Point Pressure (LPP)) под давлением, создаваемым в брюшной полости. На ФИГ. 5 «пример 20» означает соединение из примера 20.
ФИГ. 6 представляет собой график, показывающий результаты, полученные с помощью анализа LPP мочи под давлением, создаваемым в брюшной полости. На ФИГ. 6 «пример 22b» означает соединение из примера 22b.
ФИГ. 7 представляет собой диаграмму, показывающую временные рамки исследования анализа по шкале Basso, Beattie, and Bresnahan (BBB) после повреждения спинного мозга (SCI). На ФИГ. 7 «пример 52» означает соединение из примера 52.
На ФИГ. 8 представлены графики, показывающие результаты, полученные с помощью анализа по шкале ВВВ после SCI. На ФИГ. 8 «пример 52» означает соединение из примера 52.
На ФИГ. 9 представлены графики, показывающие результаты, полученные с помощью анализа зависимости мышечной силы от кальция в биопсиях мышц диафрагмы при хронической обструктивной легочной болезни (ХОБЛ). На ФИГ. 9 «пример 20» означает соединение из примера 20. F означает силу отдельных волокон из биопсий мышц. рСа означает -log[Ca2+].
ФИГ. 10 представляет собой графики, показывающие результаты, полученные с помощью анализа зависимости мышечной силы от кальция в биопсиях широчайшей мышцы спины при хронической обструктивной легочной болезни (ХОБЛ). На ФИГ. 10 «пример 20» означает соединение из примера 20. F означает силу одиночных волокон из биопсий мышц. рСа означает -log[Ca2+].
ПОДРОБНОЕ ОПИСАНИЕ
Далее настоящее изобретение будет описано подробно.
Термин «алкил» относится к алкилу с прямой или разветвленной цепью. Соответственно, «C1-6алкил» представляет собой алкил с прямой или разветвленной цепью, имеющий от 1 до 6 атомов углерода, и его конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил или н-гексил; в одном варианте осуществления метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил; в одном варианте осуществления группа, выбранная из группы, состоящей из метила, этила и изопропила; и в одном варианте осуществления группа, выбранная из группы, состоящей из метила и этила. Понятно, что линейный или разветвленный алкил относится к линейному или разветвленному насыщенному углеводороду.
Термин «алкенил» относится к ненасыщенной алкильной группе с прямой или разветвленной цепью, имеющей упомянутое число атомов углерода (например, от 2 до 8 или от 2 до 6 атомов углерода) и по меньшей мере одну двойную связь углерод-углерод, полученную удалением одной молекулы водорода от смежных атомов углерода соответствующего алкила. Данная группа может быть или в цис-, или транс-конфигурации (конфигурация Z или Е) относительно двойной (двойных) связи (связей). Алкенильные группы включают, но не ограничиваются ими, этенил, пропенил (например, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил)) и бутенил (например, но-1-ен-1-ил, но-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, но-2-ен-1-ил, 2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил). Алкенильные группы могут быть получены любым способом, известным в данной области техники.
Термин «алкинил» относится к ненасыщенной алкильной группе с прямой или разветвленной цепью, имеющей упомянутое число атомов углерода (например, от 2 до 8 или от 2 до 6 атомов углерода) и по меньшей мере одну тройную связь углерод-углерод, полученную удалением двух молекул водорода от смежных атомов углерода соответствующего алкила. Алкинильные группы включают, но не ограничиваются ими, этинил, пропинил (например, проп-1-ин-1-ил или проп-2-ин-1-ил) и бутинил (например, но-1-ин-1-ил, бут-1-ин-3-ил или, но -3-ин-1-ил). Алкинильные группы могут быть получены любым способом, известным в данной области техники.
Термин «циклоалкил» относится к неароматическому, полностью насыщенному карбоциклическому кольцу, имеющему упомянутое число атомов углерода, например, от 3 до 10, или от 3 до 8, или от 3 до 6 атомов углерода в кольце. Циклоалкильные группы могут быть моноциклическими или полициклическими (например, бициклическими или трициклическими). Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил и циклогексил, а также мостиковые и каркасные группы колец (например, норборнан или бицикло[2.2.2] октан).
Термин «гетероарил» относится к моноциклическому ароматическому гетерокольцу или бициклическому ароматическому гетерокольцу. «Моноциклическое ароматическое гетероциклическое кольцо» включает моноциклическую ароматическую гетероциклическую группу, содержащую от 5 до 7 членов кольца, которая содержит от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы, в виде кольцеобразующего атома, и его конкретные примеры включают пирролил, пиразолил, имидазолил, триазолил, фурил, тиенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил или пиразинил; в одном варианте осуществления, пиразолил, имидазолил, триазолил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил или пиридил.
Термин «бициклическое ароматическое гетероциклическое кольцо» относится к бициклической ароматической гетероциклической группе, в которой моноциклическое ароматическое гетероциклическое кольцо слито с бензольным кольцом или моноциклическим ароматическим гетероциклическим кольцом и включает в себя частично гидрированную кольцевую группу, и его конкретные примеры включают индолил, изоиндолил, индазолили, бензотриазолил, бензофуранил, бензотиенил, бензооксазолил, бензотиазолил, хинолил, изохинолил, циннолинил, хиназолинил, хиноксалинил, нафтиридинил, пропиридил, тиенопиридил, индолинил, дигидробензофуранил, дигидробензотиенил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил, дигидропропиридил или дигидротиенопиридил; и в одном варианте осуществления бензотиенил.
Термин «насыщенное гетероциклическое кольцо» включает от 3 до 8-членную насыщенную кольцевую группу, которая содержит от 1 до 4 гетероатомов, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы в качестве кольцеобразующего атома, и может быть соединен с C1-6алкиленом, в котором атом серы, в качестве кольцеобразующего атома, может быть окислен. Конкретные примеры включают азепанил, диазепанил, оксазепанил, тиазепанил, азиридинил, азетидинил, пирролидинил, имидазолидинил, пиперидинил, пиразолидинил, пиперазинил, азоцианил, тиоморфолинил, тиазолиндинил, изотиазолиндинил, оксазолиндинил, морфолинил, тиоморфолинил, тетрагидротиопиранил, оксатиоранил, оксиранил, оксетанил, диоксиранил, тетрагидрофуранил, тетрагидропиранил или 1,4-диоксанил.
Термин «галоген» обозначает фтор, хлор, бром или йод; в одном конкретном варианте осуществления фтор, хлор или бром; в другом конкретном варианте осуществления фтор; в еще одном конкретном варианте осуществления хлор и в другом конкретном варианте осуществления бром.
Термин «R3, R4 и атом углерода, связанный с R3 и R4, взаимодействуют с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом» означает, как видно из описания, что R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо, как описано ниже;
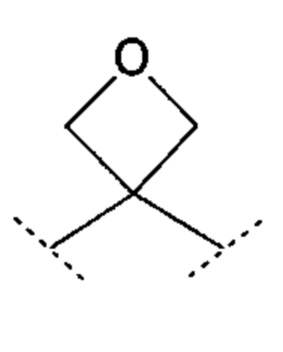 .
.
Термин «R1, R2 и атом углерода, связанный с R1 и R2, взаимодействуют с образованием 4-пиперидинового кольца или 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом» означает, как ясно из описания, что R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, как описано ниже;
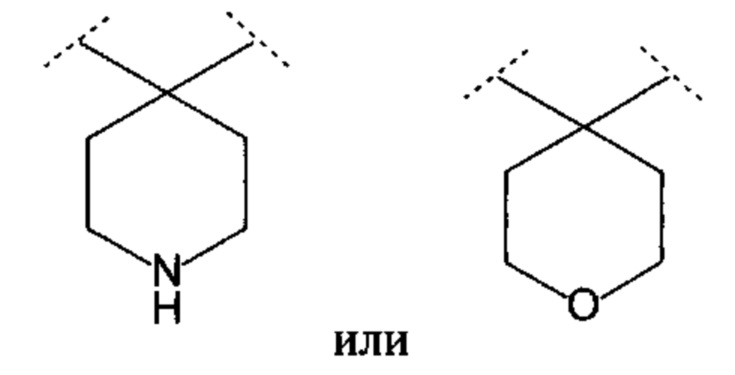 .
.
В описании выражение «который может быть замещено» означает «который не замещен» или «который замещен от около 1 до около 5 заместителями». Кроме того, если он имеет множество заместителей, то заместители могут быть такими же или отличаться друг от друга.
В порошковой рентгенограмме, описанной в настоящей спецификации, шаг кристаллической решетки и общий паттерн имеют важное значение для идентификации кристаллов по характеру данных рентгеновской порошковой дифрактометрии, и угол дифракции и интенсивность дифракции не должны быть строго интерпретированы, поскольку они могут включать некоторые ошибки в соответствии с направлением роста кристаллов, размером частиц и условиями измерения. Дифракционные углы (2θ(°)) порошковой рентгенограммы в настоящем описании могут включать погрешность измерения ± 0,2° в качестве варианта осуществления с учетом допустимой погрешности, принятой в способе измерения. Кроме того, например, пик, который находится рядом с пиком, полученным из фармацевтических наполнителей и на наклоненной базовой линии пика, может визуально сдвигаться на ± 0,3° в случае, когда измерение способом рентгеновской порошковой дифрактометрии осуществляется в случае смеси с фармацевтическими наполнителями.
Как в доклинических, так и в клинических условиях было показано, что активаторы быстрого скелетного тропонинового комплекса усиливают отклик быстрой скелетной мышцы на стимуляцию нерва, что приводит к увеличению развития мышечной силы при субмаксимальном возбуждении мышцы (см., например, Russell et al., «The Fast Skeletal Troponin Activator, CK-2017357, Increases Skeletal Muscle Force in vitro and in situ», 2009 г. Experimental Biology Conference, New Orleans, LA, April 2009). Показано, что активаторы быстрого скелетного тропонинового комплекса увеличивают чувствительность к кальцию покрытых кожей волокон скелетных мышц, а в мышце в живом организме увеличивают чувствительность к частоте стимуляции, что в каждом случае приводит к увеличению развития мышечной силы при субмаксимальном возбуждении мышц. Было также показано, что такие активаторы снижают мышечную усталость и/или повышают полное время до достижения усталости в состояниях нормального и низкого окисления (см., например, Russell et al., «The Fast Skeletal Troponin Activator, CK-2017357, Increases Skeletal Muscle Force and Reduces Muscle Fatigue in vitro and in situ» («Быстрый скелетный тропониновый возбудитель,CK-2017357, увеличивает силу скелетной мышцы и снижает усталость мышцы in vitro и in situ»), 5th Cachexia Conference, Barcelona, Spain, December 2009; Hinken et al., «The Fast Skeletal Troponin Activator, CK-2017357, Reduces Muscle Fatigue in an in situ Model of Vascular Insufficiency)) («Быстрый скелетный тропониновый возбудитель, CK-2017357, снижает усталость мышцы в модели сосудистой недостаточности in situ»), Society for Vascular Medicine's 2010 Annual Meeting: 21st Annual Scientific Sessions, Cleveland, OH, April 2010). Увеличение мышечной силы в ответ на входной сигнал на нерве было также продемонстрировано на здоровых добровольцах-людях (см., например, Hansen et al., «CK-2017357, a Novel Activator of Fast Skeletal Muscle, Increases Isometric Force Evoked by Electrical Stimulation of the Anterior Tibialis Muscle in Healthy Male Subjects)) («Новый возбудитель, CK-2017357, увеличивает изометрическую силу, вызванную электрической стимуляцией мышцы Anterior Tibialis в здоровых мужских субъектах»), Society for Neuroscience 40th Annual Meeting: Neuroscience 2010, November 2010). Работа с дополнительными доклиническими моделями мышечной функции наводит на мысль, что активаторы быстрого скелетного тропонинового комплекса также приводят к увеличению мощности и/или физической выносливости мышцы. Данные фармакологические свойства приводят к выводу, что такой механизм возбуждения мог бы найти применение, например, в состояниях, когда ухудшена нервно-мышечная функция.
Настоящее изобретение обеспечивает способы повышения эффективности быстрой скелетной мышцы пациента, нуждающегося в этом, состоящие в назначении упомянутому пациенту эффективного количества соединения или композиции, описанных и/или раскрытых в настоящем изобретении, которое(ая) избирательно связывает тропониновый комплекс волокна или саркомера быстрой скелетной мышцы. В некоторых вариантах осуществления соединение, раскрытое и/или описанное в настоящем изобретении, возбуждает волокна или саркомеры быстрой скелетной мышцы. В некоторых вариантах осуществления введение соединения, раскрытого и/или описанного в настоящем изобретении, приводит к повышению выходной мощности быстрой скелетной мышцы. В некоторых вариантах осуществления введение соединения, раскрытого и/или описанного в настоящем изобретении, приводит к более высокой чувствительности волокон или саркомеров быстрой скелетной мышцы к ионам кальция по сравнению с волокнами или саркомерами быстрой скелетной мышцы, не обработанными данным соединением. В некоторых вариантах осуществления введение соединения, раскрытого и/или описанного в настоящем изобретении, приводит к снижению концентрации ионов кальция, приводящему к связыванию миозина быстрой скелетной мышцы и актина. В некоторых вариантах осуществления введение соединения, раскрытого и/или описанного в настоящем изобретении, приводит к тому, что волокно быстрой скелетной мышцы генерирует силу в более высокой степени на субмаксимальных уровнях возбуждения мышцы.
Настоящее изобретение также обеспечивает способ сенсибилизации волокна быстрой скелетной мышцы для продуцирования силы в ответ на снижение концентрации иона кальция, включающий контактирование волокна быстрой скелетной мышцы с соединением или композицией, описанными и/или раскрытыми в настоящем изобретении, которое(ая) избирательно связывается с тропониновыми комплексами в саркомере быстрой скелетной мышцы. В некоторых вариантах осуществления контактирование волокна быстрой скелетной мышцы с соединением приводит к активации волокна быстрой скелетной мышцы при более низкой концентрации ионов кальция, чем в нелеченном волокне быстрой скелетной мышцы. В некоторых вариантах осуществления контактирование волокна быстрой скелетной мышцы с соединением приводит к продуцированию увеличенной силы при более низкой концентрации ионов кальция по сравнению с нелеченным волокном быстрой скелетной мышцы.
Настоящее изобретение также обеспечивает способ увеличения времени до усталости быстрой скелетной мышцы у пациента, нуждающегося в этом, включающий контактирование волокон быстрой скелетной мышцы с соединением или композицией, описанными и/или раскрытыми в настоящем изобретении, которое(ая) избирательно связывается с тропониновыми комплексами волокон быстрой скелетной мышцы. В некоторых вариантах осуществления соединение связывается с образованием комплексов лиганд-тропонин-ион кальция, которые возбуждают волокна быстрой скелетной мышцы. В некоторых вариантах осуществления образование комплексов и/или активация волокон быстрой скелетной мышцы приводит к повышенной силе и/или увеличению времени до достижения усталости по сравнению с нелеченными волокнами быстрой скелетной мышцы, контактирующими с аналогичной концентрацией ионов кальция.
Некоторые варианты осуществления настоящего изобретения описаны ниже.
Вариант осуществления 1-1
Соединение формулы (I) или его соль, где
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н или галоген.
Вариант осуществления 1-2
Соединение формулы (I) или его соль, где X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н.
Вариант осуществления 1-3
Соединение формулы (I) или его соль, где
X1 представляет собой C-R11;
X2 представляет собой C-R12;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н.
Вариант осуществления 1-4
Соединение формулы (I) или его соль, где
X1 представляет собой C-R11;
X2 представляет собой N; и
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил.
Вариант осуществления 1-5
Соединение формулы (I) или его соль, где
X1 представляет собой N; и
X2 представляет собой Н.
Вариант осуществления 2-1
Соединение формулы (I) или его соль, где
R1 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и пиразолила(ов), iii) С2-6алкенил или iv) -OR0;
R2 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, который может быть замещен одним или несколькими заместителями, выбранными из группы G1, и гетероарил выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, причем данный гетероарил может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы G2, ii) С2-6алкенил, iii) С1-6алкинил, iv) -OR0, v) -NR23R24, vi) -COOR0 или vii) фенил;
R21 представляет собой H или C1-6алкил;
R22 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами) или ii) фенил;
R23 представляет собой i) Н или ii) C1-6алкил, который может быть замещен одной или несколькими группой (группами) -ОН; и
R24 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами), который может быть замещен одним или несколькими галогеном(ами), ii) С3-8циклоалкил, который может быть замещен одним или несколькими C1-6алкилом(ами), iii) фенил, который может быть замещен одним или несколькими галогеном(ами), или iv) тетрагидропиранил; или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-пиперидинового кольца или 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом, и 4-пиперидиновое кольцо может быть замещено одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -SO2-C1-6алкила и -COOR0;
Группа G1 выбрана из группы, состоящей из i) галогена, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкила, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов) и vi) -OC1-6алкила, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов);
Группа G2 выбрана из группы, состоящей из i) галогена, ii) C1-6лкила, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов) и iii) -CONR0R0; и
R0 являются одинаковыми или отличаются друг от друга и представляют собой Н или C1-6алкил.
Вариант осуществления 2-2
Соединение формулы (I) или его соль, где
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -OR0 (одной или более), галогена(ов), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -COOR0 (одной или более), и гетероарила(ов), который выбран из группы, состоящей из пиразолила и триазолила, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24 или v) -COOR0;
R21 представляет собой C1-6алкил;
R22 представляет собой C1-6алкил;
R23 представляет собой С1-6алкил; и
R24 представляет собой i) С3-8циклоалкил или ii) фенил; или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом; и
R0 являются одинаковыми или отличаются друг от друга, представляют собой Н или C1-6алкил.
Вариант осуществления 2-3
Соединение формулы (I) или его соль, где
R1 представляет собой C1-6алкил;
R2 представляет собой C1-6алкил, который может быть замещен -OR0; и
R0 являются одинаковыми или отличаются друг от друга, представляют собой Н или C1-6алкил.
Вариант осуществления 2-4
Соединение формулы (I) или его соль, где
R1 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и пиразолила, iii) С2-6алкенил или iv) -OR0;
R2 представляет собой i) С1-6алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, который может быть замещен одним или несколькими заместителями, выбранными из группы G1, и гетероарила, который выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, причем данный гетероарил может быть замещен одним или несколькими заместителями, выбранными из группы G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -OR0, v) -NR23R24 или vi) фенил;
R21 представляет собой Н или C1-6алкил;
R22 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими фенильными заместителями или ii) фенил;
R23 представляет собой -i) Н или ii) C1-6алкил, который может быть замещен одним или несколькими заместителями -ОН;
R24 представляет собой -i) C1-6алкил, который может быть замещен одним или несколькими фенильными заместителями, которые могут быть замещены одним или несколькими галогенными заместителями, ii) С3-8циклоалкил, который может быть замещен одним или несколькими С1-6алкильными заместителями, iii) фенил, который может быть замещен одним или несколькими галогенными заместителями или iv) тетрагидропиранил;
Группа G1 представляет собой i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена, или vi) -O-(С1-6алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена);
Группа G2 представляет собой i) галоген, ii) C1-6алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена или iii) -CONR0R0; и
каждый R0 представляет собой независимо Н или С1-6алкил.
Вариант осуществления 3-1
Соединение формулы (I) или его соль, где
R3 и R4 являются одинаковыми или отличаются друг от друга, i) С1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или ii) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который выбран из группы, состоящей из пиразолила и тиенила, причем данный гетероарил(ы) может быть замещен(ы) одним или несколькими С1-6алкилом(ами), или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом.
Вариант осуществления 3-2
Соединение формулы (I) или его соль, где
R3 и R4 являются одинаковыми или отличаются друг от друга, i) С1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или и) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и пиразолила(ов), который может быть замещен одним или несколькими С1-6алкилом(ами), или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом.
Вариант осуществления 3-3
Соединение формулы (I) или его соль, где
R3 и R4 являются одинаковыми или отличаются друг от друга, представляют собой C1-3алкил.
Вариант осуществления 3-4
Соединение формулы (I) или его соль, где
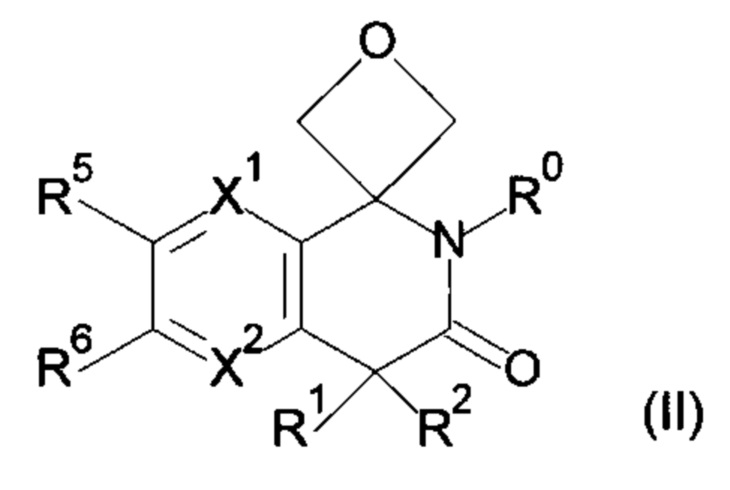
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом, представленный ниже формулой (II);
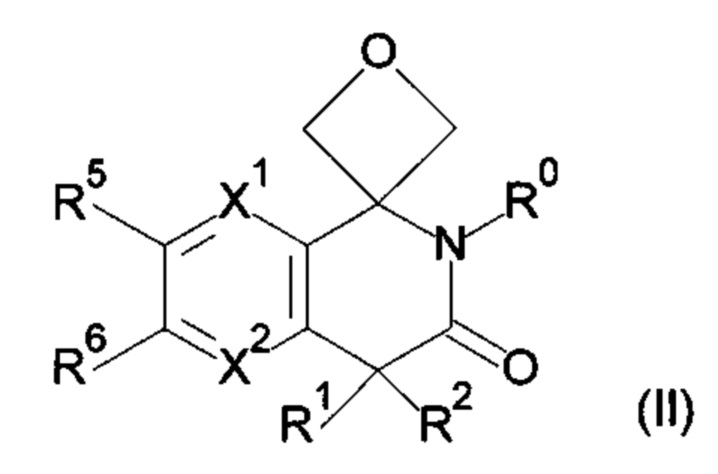
Вариант осуществления 3-5
Соединение формулы (I) или его соль, где
R3 и R4 независимо представляют собой i) С1-3алкил, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена и -ОН, или
R3 и R4, вместе с атомом углерода, к которому они присоединены, образуют 3-оксетановое кольцо.
Вариант осуществления 4-1
Соединение формулы (I) или его соль, где
R5 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими -ОС1-6алкилом(ами), iii) -O-C1-6алкил, iv) галоген, v) -COO-C1-6алкил или vi) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -O-(C1-6алкила(ов), который может быть замещен одним или несколькими галогеном(ами)), и галогена(ов), (iii) -ОН, iv) -O-(С1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-C1-6алкил, viii) С3-8циклоалкил, ix) -NR0R0 или x) С2-6алкенил; и
R0 является одинаковым или различным, представляет собой Н или C1-6алкил.
Вариант осуществления 4-2
Соединение формулы (I) или его соль, где
R5 представляет собой i) Н, ii) C1-6алкил, iii) -OC1-6алкил, iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -O-(C1-6алкила)(ов) и галогена(ов), iii) -ОН, iv) -O-(С1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-C1-6алкил, viii) -NR0R0 или ix) С2-6алкенил; и
R0 является одинаковым или различным, представляет собой Н или C1-6алкил.
Вариант осуществления 4-3
Соединение формулы (I) или его соль, где
R5 представляет собой Н; и
R6 представляет собой i) C1-6алкил, ii) -O-(С1-6алкил, который замещен от одного до трех галогенами), iii) галоген или iv) -CN.
Настоящее изобретение включает соединения, которые представляют собой сочетание двух или более вариантов осуществления, описанных выше в от 1-1 до 4-3, которые не противоречат друг другу. Конкретные примеры включают в себя следующие варианты осуществления.
Вариант осуществления 5-1
Соединение формулы (I) или его соль, где
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12 представляет собой Н;
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -OR0 (одной или более), галогена(ов), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -COOR0 (одной или более), и гетероарила(ов), который выбран из группы, состоящей из пиразолила и триазолила, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24 или v) -COOR0;
R21 представляет собой С1-6алкил;
R22 представляет собой C1-6алкил;
R23 представляет собой С1-6алкил;
R24 представляет собой i) С3-8циклоалкил или ii) фенил; или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом;
R3 и R4 являются одинаковыми или отличаются друг от друга, i) C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или ii) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и пиразолила(ов), который может быть замещен одним или несколькими С1-6алкилом(ами), или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом;
R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-C1-6алкил, iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОС1-6алкила и галогена, iii) -ОН, iv) -OC1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-C1-6алкил, viii) -NR0R0 или ix) C2-6алкенил;
R0 является одинаковым или различным, представляет собой Н или С1-6алкил.
Вариант осуществления 5-2
Соединение или его соль, как описано в варианте осуществления 5-1 выше, в котором
R1 представляет собой С1-6алкил;
R2 представляет собой C1-6алкил, который может быть замещен -OR0;
R3, R4 и атом углерода, связанный с R3 и R4, взаимодействуют с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом, представленный ниже формулой (II);
R5 представляет собой Н; и
R6 представляет собой i) C1-6алкил, ii) -OC1-6алкил, который замещен от одного до трех галогенами, iii) галогеном или iv) -CN.
Вариант осуществления 5-3
Соединение или его соль, как описано в варианте осуществления 5-2 выше, в котором X1 и X2 являются такими, как описано в варианте осуществления 1-3.
Вариант осуществления 6-1
Соединение формулы (I) или его соль, в котором R1 и R2 являются такими, как описано в варианте осуществления 2-1, и
X1: C-R11 или N;
X2: C-R12 или N;
R11: i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12: Н или галоген;
R3, R4: одинаковые или отличающиеся друг от друга, i) C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более) или ii) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который выбран из группы, состоящей из пиразолила и тиенила, причем данный гетероарил может быть замещенным одним или несколькими С1-6алкилом(ами), или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом;
R5: i) Н, ii) C1-6алкил, который может быть замещен одним или несколькими -O-(C1-6алкилом(ами), iii) -O-(С1-6алкил), iv) галоген, v) -СОО-(С1-6алкил) или vi) С3-8циклоалкил;
R6: i) Н, и) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -O-(С1-6алкила(ов), который может быть замещен одним или несколькими галогеном(ами)), и галогена(ов), (iii) -ОН, iv) -O-(С1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-(С1-6алкил), viii) С3-8циклоалкил, ix) -NR0R0 или х) С2-6алкенил;
Группа G1: i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящий из -ОН (одной или более) и галогена, или vi) -O-(С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов));
Группа G2: i) галоген, ii) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и галогена(ов), или iii) -CONR0R0.
Вариант осуществления 6-2
Соединение или его соль, как описано в варианте осуществления 6-1 выше, в котором R3 и R4 являются такими, как описано в варианте осуществления 3-1.
Вариант осуществления 6-3
Соединение или его соль, как описано в варианте осуществления 6-2 выше, в котором R3 и R4 являются такими, как описано в варианте осуществления 4-1.
Вариант осуществления 7-1
Соединение, или его соль, которое выбрано из группы, состоящей из
(-)-2-(дифторметил)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила,
8,8-диэтил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила,
(-)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
(+)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбонитрила,
8',8'-диэтил-7'-оксо-7',8'-дигидро-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-2'-карбонитрила,
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
2-(дифторметокси)-8,8-диметил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-2-(дифторметокси)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она.
Вариант осуществления 7-2
Соединение или его соль, которое выбрано из группы, состоящей из
(-)-2-(дифторметил)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксэтан]-7(8Н)-она,
4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила,
8,8-диэтил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила,
(-)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
(+)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбонитрила,
8',8'-диэтил-7'-оксо-7',8'-дигидро-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-2'-карбонитрила,
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохино лин-1,3'-оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
2-(дифторметокси)-8,8-диметил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-2-(дифторметокси)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она.
Вариант осуществления 7-3
Соединение или его соль, которое выбрано из группы, состоящей из
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она.
Вариант осуществления 7-4
Соединение или его соль, которое представляет собой
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрил.
Вариант осуществления 7-5
Соединение или его соль, которое представляет собой
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Вариант осуществления 7-6
Соединение или его соль, которое представляет собой
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрил.
Вариант осуществления 7-7
Соединение или его соль, которое представляет собой
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Вариант осуществления 7-8
Соединение или его соль, которое представляет собой
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Один вариант осуществления настоящего изобретения включает в себя, но не ограничивается ими, следующие варианты осуществления от 8-1 до 8-4:
Вариант осуществления 8-1
Кристаллическая форма 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила, имеющая спектр рентгеновской порошковой дифракции, содержащий максимумы интенсивности в следующих углах 2θ(°): 12,1, 15,6, 16,6, 21,4 и 23,4, измеренный при излучении Cu-Kα (1,54184  ).
).
Вариант осуществления 8-2
Кристаллическая форма 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетано]-6-карбонитрила, имеющая спектр рентгеновской порошковой дифракции, содержащий максимумы интенсивности в следующих углах 2θ(°): 8,3, 12,1, 15,6, 16,6, 17,3, 20,5, 21,4, 23,4, 24,0 и 25,7, измеренный при излучении Cu-Kα (1,54184  ).
).
Вариант осуществления 8-3
Кристаллическая форма (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она, имеющая спектр рентгеновской порошковой дифракции, содержащий максимумы интенсивности в следующих углах 2θ(°): 12,2, 15,5, 18,3, 21,7 и 22,7, измеренный при излучении Cu-Kα (1,54184  ).
).
Вариант осуществления 8-4
Кристаллическая форма (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она, имеющая спектр рентгеновской порошковой дифракции, содержащий максимумы интенсивности в следующих углах 2θ(°): 6,7, 11,1, 12,2, 13,7, 15,5, 16,2, 17,0, 18,3, 21,7 и 22,7, измеренный при излучении Cu-Kα (1,54184  ).
).
В еще одном варианте осуществления настоящее изобретение включает в себя фармацевтическую композицию, содержащую соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль и фармацевтически приемлемый наполнитель. В еще одном варианте осуществления настоящее изобретение включает в себя фармацевтическую композицию, включающую кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 и фармацевтически приемлемый наполнитель.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, содержащее соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости, включающей соединение в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соль.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, содержащей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, содержащей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), содержащей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В следующем аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, включающей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, содержащей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В другом аспекте настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости, содержащей кристаллическую форму в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4.
В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для изготовления фармацевтической композиции для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В еще одном аспекте настоящее изобретение относится к применению соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ). В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В еще одном аспекте настоящее изобретение относится к применению кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом, включающему введение субъекту эффективное количество соединения формулы (I) или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости, включающему введение субъекту эффективного количества соединения в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли.
В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения хронической обструктивной болезни легких (ХОБЛ), включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком, или хроническим заболеванием почек/диализа, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4. В другом аспекте настоящее изобретение относится к способу для предотвращения или лечения заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости, включающему введение субъекту эффективного количества кристаллической формы в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4.
В еще одном аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении хронической обструктивной болезни легких (ХОБЛ). В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В другом своем аспекте настоящее изобретение относится к соединению в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 1-1 до варианта осуществления 7-8 или его соли для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
В еще одном аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала. В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении. В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении хронической обструктивной болезни легких (ХОБЛ). В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом. В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий. В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта. В другом аспекте настоящее изобретение относится к кристаллической форме в соответствии с любым из вышеупомянутых вариантов осуществления от варианта осуществления 8-1 до варианта осуществления 8-4 для применения в предупреждении или лечении заболевания или состояния выбранный из группы, состоящей из заболевания периферической сосудистой системы, заболевания периферических артерий, нарушений, связанных с реабилитацией, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата мышечной слабости и синдрома хронической усталости.
Кроме того, один вариант осуществления настоящего изобретения описан ниже.
Вариант осуществления (1) Соединение формулы (I') или его соль
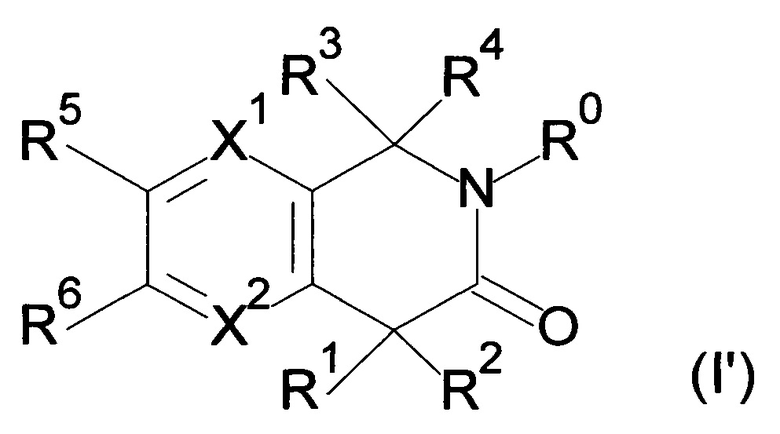
где,
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12 представляет собой Н или галоген;
R1 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и пиразолила, iii) С2-6алкенил или iv) -OR0;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо друг от друга выбранными из G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -OR0, v) -NR23R24, vi) -COOR0 или vii) фенил;
каждый R21 независимо представляет собой Н или C1-6алкил;
каждый R22 независимо представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями, или ii) фенил;
R23 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями -ОН;
R24 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями, причем фенильные заместители независимо необязательно замещены одним или несколькими галогенными заместителями, ii) С3-8циклоалкил, необязательно замещенный одним или несколькими C1-6алкильными заместителями, iii) фенил, необязательно замещенный одним или несколькими галогенными заместителями, или iv) тетрагидропиранил; или
R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, причем данное 4-пиперидиновое кольцо необязательно замещено одним или несколькими заместителями, выбранными из группы, состоящей из -SO2-(С1-6алкила) и -COOR0;
R3 и R4 независимо представляют собой i) C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН, или ii) С2-6алкенил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -ОН и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и тиенила, и причем каждый гетероарил независимо необязательно замещен одним или несколькими C1-6алкильными заместителями; или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой i) Н, ii) С1-6алкил, необязательно замещенный одним или несколькими -O-(С1-6алкил) заместителями, iii) -О-(C1-6алкил), iv) галоген, v) -COO-(C1-6алкил) или vi) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -O-(C1-6алкила, необязательно замещенного одним или несколькими галогенными заместителями) и галогена, iii) -ОН, iv) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), v) галоген, vi) -CN, vii) -S-(С1-6алкил), viii) С3-8циклоалкил, ix) -NR0R0 или x) С2-6алкенил;
каждый G1 независимо представляет собой i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена, или vi) -O-(С1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена);
каждый G2 независимо представляет собой i) галоген, ii) С1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена или iii) -CONR0R0; и
каждый R0 независимо представляет собой Н или С1-6алкил,
при условии, что упомянутое соединение не является метил-1,1-диаллил-3-оксо-2,4-дигидроизохинолин-4-карбоксилатом или его солью.
Вариант осуществления (2) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой C-R11.
Вариант осуществления (3) Соединение варианта осуществления (1) или (2) или его соль, в котором R11 представляет собой Н.
Вариант осуществления (4) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой N.
Вариант осуществления (5) Соединение любого из вариантов осуществления (1)-(4) или его соль, в котором X2 представляет собой C-R12.
Вариант осуществления (6) Соединение варианта осуществления (5) или его соль, в котором R12 представляет собой Н.
Вариант осуществления (7) Соединение любого из вариантов осуществления (1)-(4) или его соль, в котором X2 представляет собой N.
Вариант осуществления (8) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором R1 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями.
Вариант осуществления (9) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором R1 представляет собой C1-6алкил.
Вариант осуществления (10) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо друг от друга выбранными из G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -OR0, v) -NR23R24 или VI) фенил;
каждый R21 независимо представляет собой Н или C1-6алкил;
каждый R22 независимо представляет собой i) С1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями, или ii) фенил;
R23 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями -ОН;
R24 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями, причем фенильные заместители независимо необязательно замещены одним или несколькими галогенными заместителями, ii) С3-8циклоалкил, необязательно замещенный одним или несколькими C1-6алкильными заместителями, iii) фенил, необязательно замещенный одним или несколькими галогенными заместителями, или iv) тетрагидропиранил;
каждый G1 независимо представляет собой i) галоген, ii) -COOR0, iii) -CONR0R0, iv) -OH, v) C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена, или vi) -O-(С1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена);
каждый G2 независимо представляет собой i) галоген, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена или iii) -CONR0R0;
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (11) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо выбранными из группы G2;
каждый R21 независимо представляет собой C1-6алкил;
каждый R22 независимо представляет собой C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями;
каждый G1 независимо представляет собой i) галоген или ii) -COOR0;
каждый G2 независимо представляет собой C1-6алкил; и
каждый R0 независимо представляет собой Н или С1-6алкил.
Вариант осуществления (12) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо выбранными из G2;
каждый G2 независимо представляет собой C1-6алкил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (13) Соединение любого из вариантов осуществления (10)-(12) или его соль, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и триазолила.
Вариант осуществления (14) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой С1-6алкил, необязательно замещенный одним или несколькими заместителями -OR0; и каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (15) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой C1-6алкил.
Вариант осуществления (16) Соединение любого из вариантов осуществления (1)-(9) или его соль, в котором R2 представляет собой i) С2-6алкенил, ii) С2-6алкинил, iii) -NR23R24, iv) -COOR0 или v) фенил;
R23 представляет собой C1-6алкил;
R24 представляет собой C1-6алкил, С3-8циклоалкил или фенил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (17) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором R1 и R2, каждый, представляет собой метил.
Вариант осуществления (18) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором R1 представляет собой метил, R2 представляет собой C1-6алкил, необязательно замещенный одним или несколькими заместителями -OR0, и каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (19) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, причем данное 4-пиперидиновое кольцо необязательно замещено одним или несколькими заместителями, выбранными из группы, состоящей из -SO2-(С1-6алкила) и -COOR0.
Вариант осуществления (20) Соединение любого из вариантов осуществления (1)-(19) или его соль, в котором R3 и R4 независимо представляют собой i) C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН; или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо.
Вариант осуществления (21) Соединение любого из вариантов осуществления (1)-(19) или его соль, в котором R3 и R4 независимо представляют собой i) C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН, или ii) С2-6алкенил, необязательно замещенный одним или несколькими гетероарильными заместителями, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и тиенила и причем каждый гетероарил независимо необязательно замещен одним или несколькими C1-6алкильными заместителями.
Вариант осуществления (22) Соединение любого из вариантов осуществления (1)-(19) или его соль, в котором R3 и R4 независимо представляют собой C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН.
Вариант осуществления (23) Соединение любого из вариантов осуществления (1)-(19) или его соль, в котором R3 и R4 вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо.
Вариант осуществления (24) Соединение любого из вариантов осуществления (1)-(23) или его соль, в котором R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6)алкил), iv) галоген или v) С3-8циклоалкил.
Вариант осуществления (25) Соединение любого из вариантов осуществления (1)-(23) или его соль, в котором R5 представляет собой Н.
Вариант осуществления (26) Соединение любого из вариантов осуществления (1)-(25) или его соль, в котором R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -O-(С1-6алкила, необязательно замещенного одним или несколькими галогенными заместителями) и галогена, iii) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN, vi) -S-(С1-6алкил) или vii) С3-8циклоалкил.
Вариант осуществления (27) Соединение любого из вариантов осуществления (1)-(25) или его соль, в котором R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями, iii) -ОН, iv) -O-(C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), v) галоген, vi) -CN или vii) С2-6алкенил.
Вариант осуществления (28) Соединение любого из вариантов осуществления (1)-(25) или его соль, в котором R6 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6)алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN, vi) -NR0R0 или vii) С2-6алкенил.
Вариант осуществления (29) Соединение любого из вариантов осуществления (1)-(25) или его соль, в котором R6 представляет собой i) галоген или ii) -CN.
Вариант осуществления (30) Соединение любого из вариантов осуществления (1)-(29) или его соль, в котором каждый R0 представляет собой Н.
Вариант осуществления (31) Соединение любого из вариантов осуществления (1)-(29) или его соль, в котором каждый R0 независимо представляет собой С1-6алкил.
Вариант осуществления (32) Соединение любого из вариантов осуществления (1)-(7) или его соль, в котором
R1 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо друг от друга выбранными из G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24, v) -COOR0 или vi) фенил;
каждый R21, R22 и R23 независимо представляет собой C1-6алкил;
R24 представляет собой i) C1-6алкил, ii) С3-8циклоалкил или iii) фенил; или
R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, причем данное 4-пиперидиновое кольцо необязательно замещено одним или несколькими заместителями, выбранными из группы, состоящей из -SO2-(С1-6алкила) и -COOR0;
R3, R4 независимо представляют собой i) C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН, или ii) С2-6алкенил, необязательно замещенный одним или несколькими гетероарильными заместителями, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и тиенила, и причем каждый гетероарил независимо необязательно замещен одним или несколькими C1-6алкильными заместителями, или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо.
R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6алкил), iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -O-(С1-6алкила, необязательно замещенного одним или несколькими галогенными заместителями) и галогена, iii) -ОН, iv) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), v) галоген, vi) -CN, vii) -S-(C1-6алкил), viii) С3-8циклоалкил, ix) -NR0R0 или x) С2-6алкенил;
каждый G1 независимо представляет собой i) галоген или ii) -COOR0;
каждый G2 независимо представляет собой ii) C1-6алкил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (33) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой C-R11;
X2 представляет собой C-R12;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12 представляет собой Н или галоген;
R1 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, ii) -NR23R24 или iii) фенил;
каждый R21 независимо представляет собой C1-6алкил;
каждый R22 независимо представляет собой C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями;
R23 представляет собой C1-6алкил;
R24 представляет собой i) C1-6алкил, ii) С3-8циклоалкил или iii) фенил; или
R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, причем данное 4-пиперидиновое кольцо необязательно замещено одним или несколькими заместителями, выбранными из группы, состоящей из -SO2-(С1-6алкила) и -COOR0;
R3 и R4 независимо представляют собой C1-3алкил, необязательно замещенный одним или несколькими галогенными заместителями, или
R3 и R4, вместе с атомом углерода, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6алкил), iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями, iii) -ОН, iv) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN или v) С2-6алкенил;
каждый G1 независимо представляет собой i) галоген или ii) -COOR0; и
каждый R0 независимо представляет собой Н или С1-6алкил.
Вариант осуществления (34) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12 представляет собой Н;
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -COOR0, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и триазолила, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24 или v) -COOR0;
R21 представляет собой C1-6алкил;
R22 представляет собой C1-6алкил;
R23 представляет собой C1-6алкил;
R24 представляет собой i) С3-8циклоалкил или ii) фенил; или
R1, R2, вместе с углеродом, к которому они присоединены, образуют 4-тетрагидропирановое кольцо;
R3 и R4 независимо представляют собой i) C1-3алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и -ОН, или ii) С2-6алкенил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -ОН и пиразолила, причем каждый пиразолил независимо необязательно замещен одним или несколькими C1-6алкильными заместителями; или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6алкил), iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -O-(С1-6алкила) и галогена, iii) -ОН, iv) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), v) галоген, vi) -CN, vii) -S-(С1-6алкил), viii) -NR0R0 или ix) С2-6алкенил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (35) Соединение варианта осуществления (34) или его соль, в котором
R1 представляет собой C1-6алкил;
R2 представляет собой C1-6алкил, необязательно замещенный -OR0;
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н; и
R6 представляет собой i) C1-6алкил, ii) -O-(С1-6алкил, необязательно замещенный от одного до трех галогенными заместителями), iii) галоген или iv) -CN.
Вариант осуществления (36) Соединение варианта осуществления (34) или (35) или его соль, в котором
X1 представляет собой C-R11;
X2 представляет собой C-R12;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н.
Вариант осуществления (37) Соединение (1) или его соль, в котором
X1 представляет собой C-R11;
X2 представляет собой C-R12;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил;
R12 представляет собой Н или галоген;
R1 представляет собой i) Н или ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена, -COOR0, -CONR21R22, фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из G1, и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, ii) -NR23R24 или iii) фенил;
каждый R21 независимо представляет собой C1-6алкил;
каждый R22 независимо представляет собой C1-6алкил, необязательно замещенный одним или несколькими фенильными заместителями;
R23 представляет собой C1-6алкил;
R24 представляет собой i) C1-6алкил, ii) С3-8циклоалкил или iii) фенил; или
R1 и R2, вместе с углеродом, к которому они присоединены, образуют 4-пиперидиновое кольцо или 4-тетрагидропирановое кольцо, причем данное 4-пиперидиновое кольцо необязательно замещено одним или несколькими заместителями, выбранными из группы, состоящей из -SO2-(C1-6алкила) и -COOR0;
R3 и R4 независимо представляют собой C1-3алкил, необязательно замещенный одним или несколькими галогенными заместителями, или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой i) Н, ii) C1-6алкил, iii) -О-(С1-6алкил), iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями, iii) -ОН, iv) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN или v) С2-6алкенил;
каждый G1 независимо представляет собой i) галоген или ii) -COOR0; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (38) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой C-R11;
X2 представляет собой N;
R11 представляет собой Н;
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо выбранными из G2, ii) С2-6алкенил, iii) С2-6алкинил или vi) -COOR0;
R3 и R4 независимо представляют собой i) C1-3алкил или ii) С2-6алкенил, необязательно замещенный одним или несколькими гетероарильными заместителями, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и тиенила, и причем каждый гетероарил независимо необязательно замещен одним или несколькими С1-6алкильными заместителями или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -O-(C1-6алкила, необязательно замещенного одним или несколькими галогенными заместителями) и галогена, iii) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN или vi) -S-(С1-6алкил);
каждый G2 независимо представляет собой С1-6алкил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (39) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой C-R11;
X2 представляет собой N;
R11 представляет собой Н;
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -OR0, галогена и гетероарила, причем каждый гетероарил независимо выбран из группы, состоящей из пиридила, пиразолила, имидазолила, тиазолила, тиадиазолила, тиенила, оксазолила, изоксазолила и триазолила, и причем каждый гетероарил необязательно замещен одним или несколькими заместителями, независимо выбранными из G2, ii) C2-6алкенил, iii) C2-6алкинил или vi) -COOR0;
R3 и R4 независимо представляют собой i) C1-3алкил или ii) С2-6алкенил, необязательно замещенный одним или несколькими гетероарильными заместителями, причем каждый гетероарил независимо выбран из группы, состоящей из пиразолила и тиенила, и причем каждый гетероарил независимо необязательно замещен одним или несколькими С1-6алкилами заместители, или
R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н;
R6 представляет собой i) Н, ii) C1-6алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из -O-(C1-6алкила, необязательно замещенного одним или несколькими галогенными заместителями) и галогена, iii) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN или vi) -S-(С1-6алкил);
каждый G2 независимо представляет собой C1-6алкил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (40) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой N;
X2 представляет собой C-R12;
R12 представляет собой Н;
R1 представляет собой i) Н, ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, необязательно замещенный одним или несколькими заместителями -OR0 или ii) -COOR0;
R3 и R4 независимо представляют собой С1-3алкил или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н;
R6 представляет собой i) галоген или ii) -CN; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (41) Соединение варианта осуществления (1) или его соль, в котором
X1 и X2, каждый, представляют собой N;
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил или ii) -COOR0;
R3 и R4 независимо представляют собой C1-3алкил, необязательно замещенный одним или несколькими -ОН, или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н;
R6 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6алкил, необязательно замещенный одним или несколькими галогенными заместителями), iv) галоген, v) -CN, iv) -NR0R0 или vii) С2-6алкенил; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (42) Соединение варианта осуществления (1) или его соль, в котором
X1 представляет собой СН;
X2 представляет собой СН или N;
R1 представляет собой Н или C1-6алкил;
R2 представляет собой C1-6алкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -OR0 и галогена;
R3 и R4 независимо представляют собой C1-3алкил или
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н;
R6 представляет собой Н, C1-6алкил, галоген или -CN; и
каждый R0 независимо представляет собой Н или C1-6алкил.
Вариант осуществления (43) Соединение варианта осуществления (1) или его соль, в котором
X1 и X2, каждый, представляют собой N;
R1 представляет собой Н, метил или этил;
R2 представляет собой метил или этил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из -ОН и галогена;
R3 и R4, вместе с углеродом, к которому они присоединены, образуют 3-оксетановое кольцо;
R5 представляет собой Н; и
R6 представляет собой Н, метил, галоген или -CN.
Вариант осуществления (44) Соединение любого из вариантов осуществления (1)-(16) и (18)-(43) или его соль, в котором атом углерода, несущий R1 и R2, находится в конфигурации S в случае, если R1 не то же самое, что и R2.
Вариант осуществления (45) Соединение любого из вариантов осуществления (1)-(16) и (18)-(43) или его соль, в котором атом углерода, несущий R1 и R2, находится в конфигурации R в случае, если R1 не то же самое, что и R2.
Вариант осуществления (46) Соединение любого из вариантов осуществления (1)-(22) и (24)-(45) или его соль, в котором атом углерода, несущий R3 и R4, находится в конфигурации S в случае, если R3 не то же самое, что и R4.
Вариант осуществления (47) Соединение любого из вариантов осуществления (1)-(22) и (24)-(45) или соль, в котором атом углерода, несущий R3 и R4, находится в конфигурации R в случае, если R3 не то же самое, что и R4.
Вариант осуществления (48) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой C-R11 и X2 представляет собой C-R12, и где соединение выбрано из группы, состоящей из:
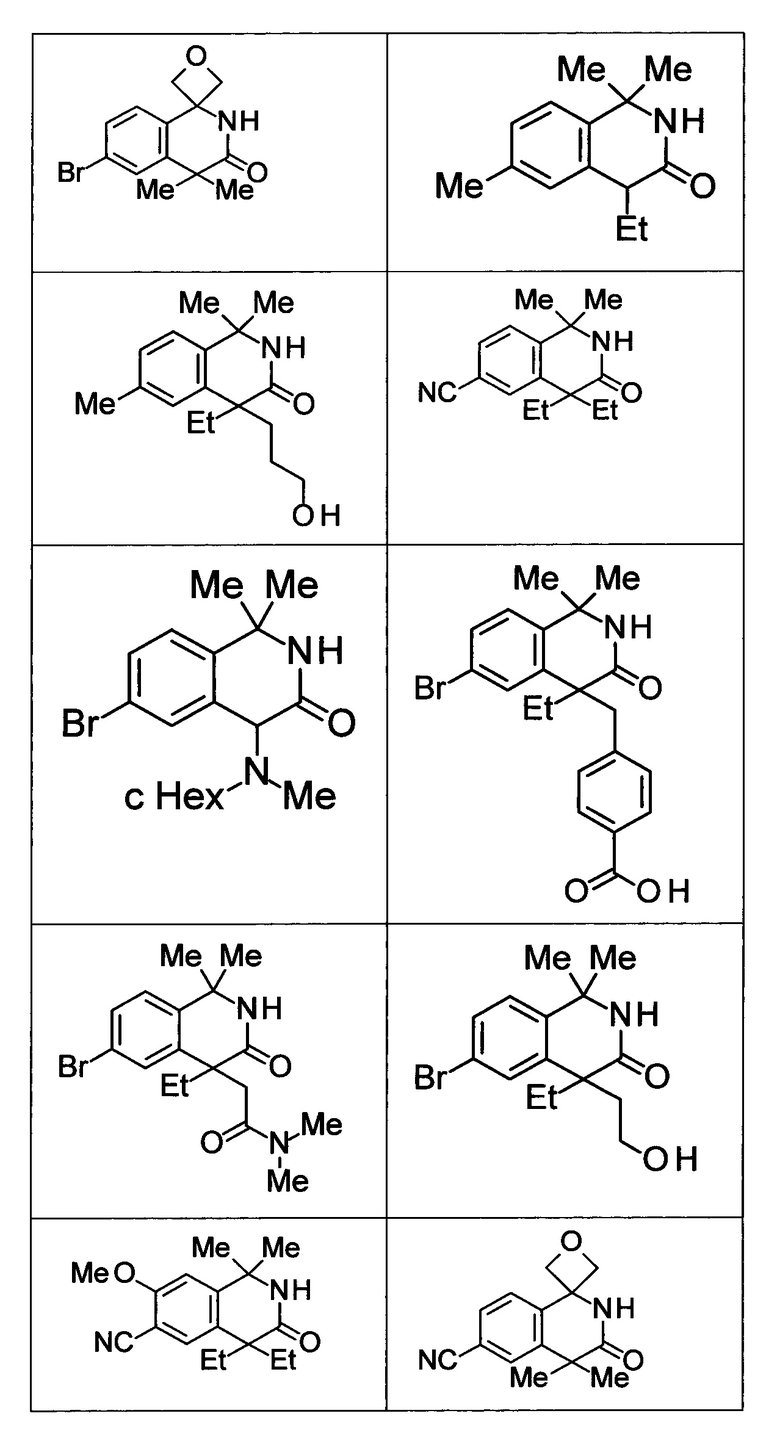
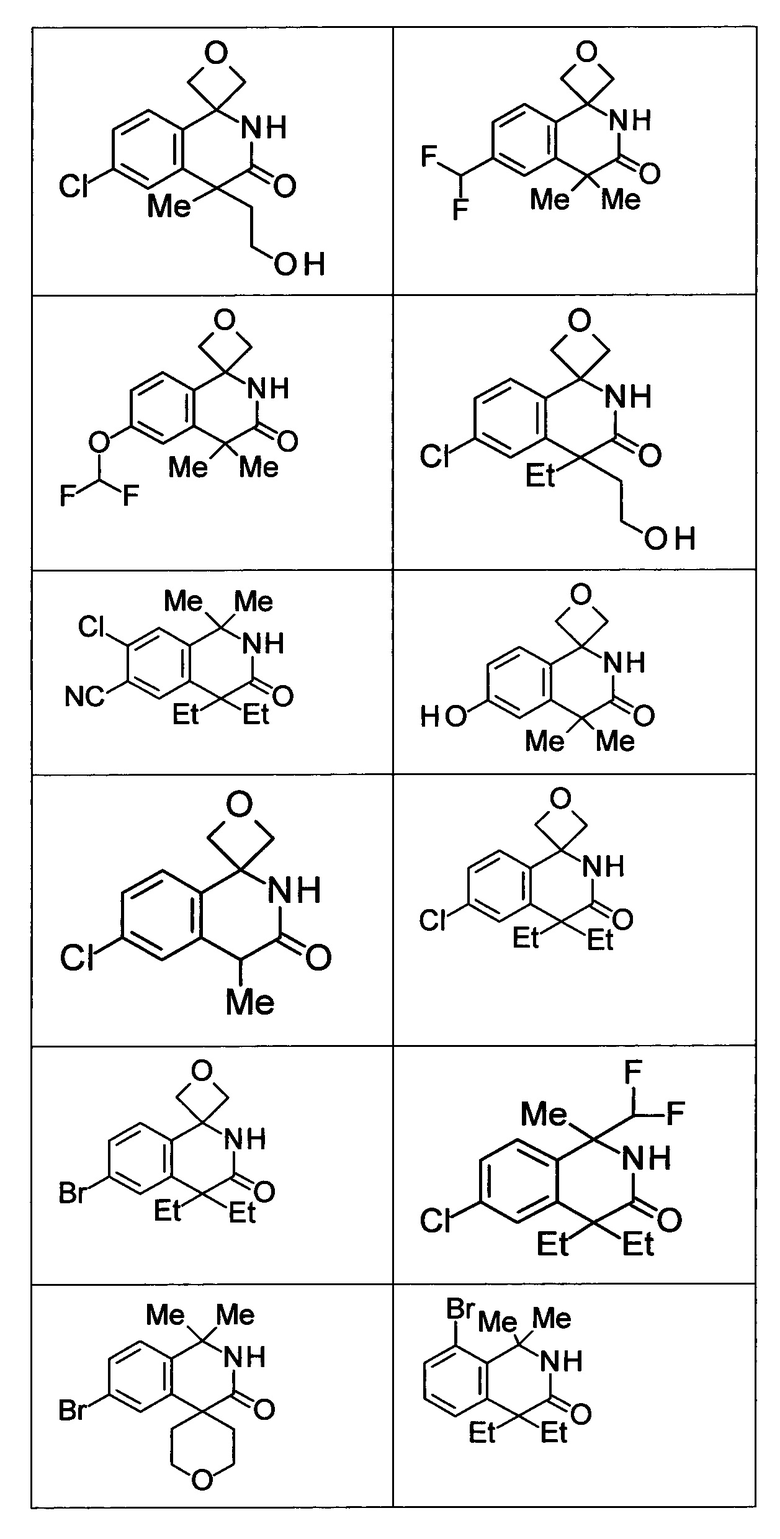
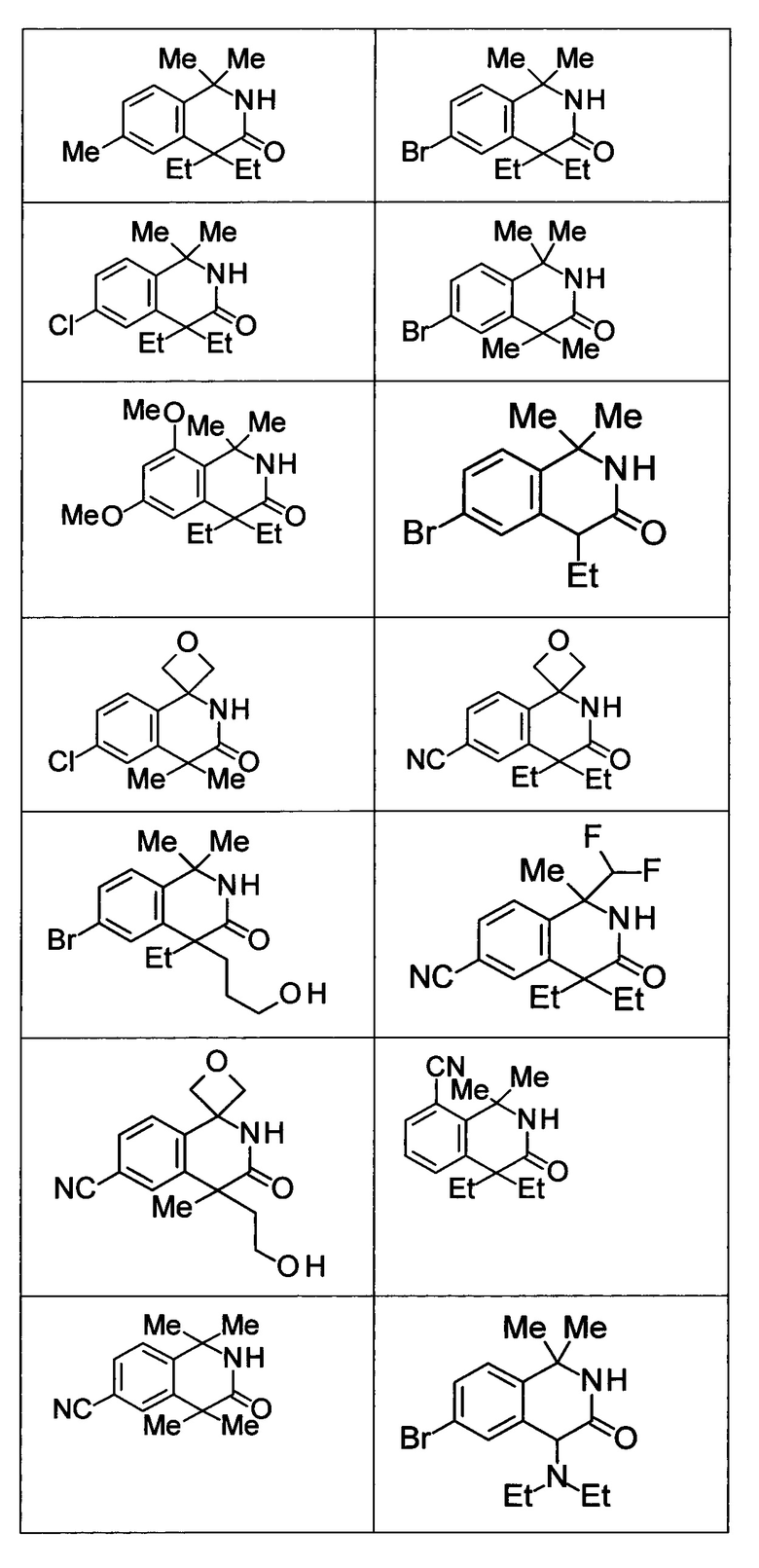
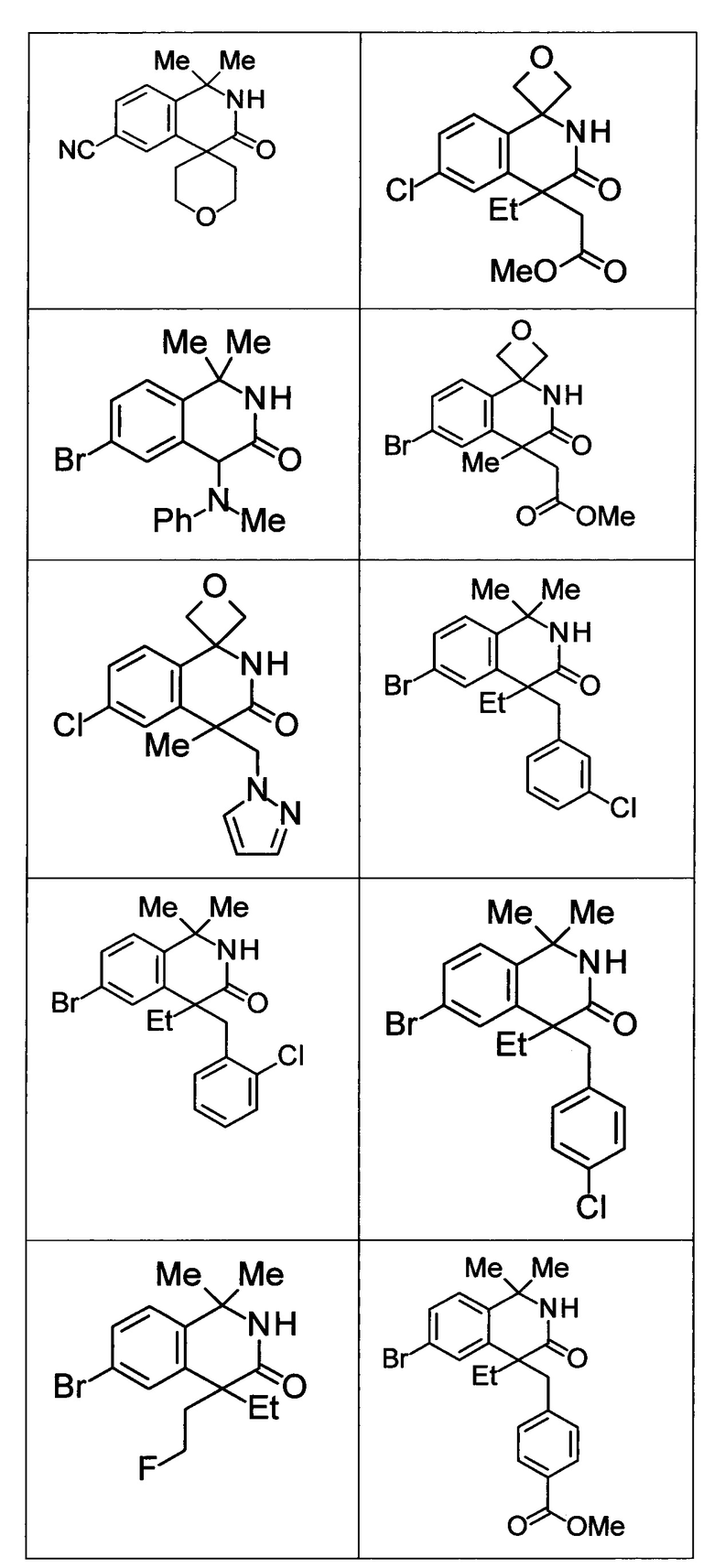
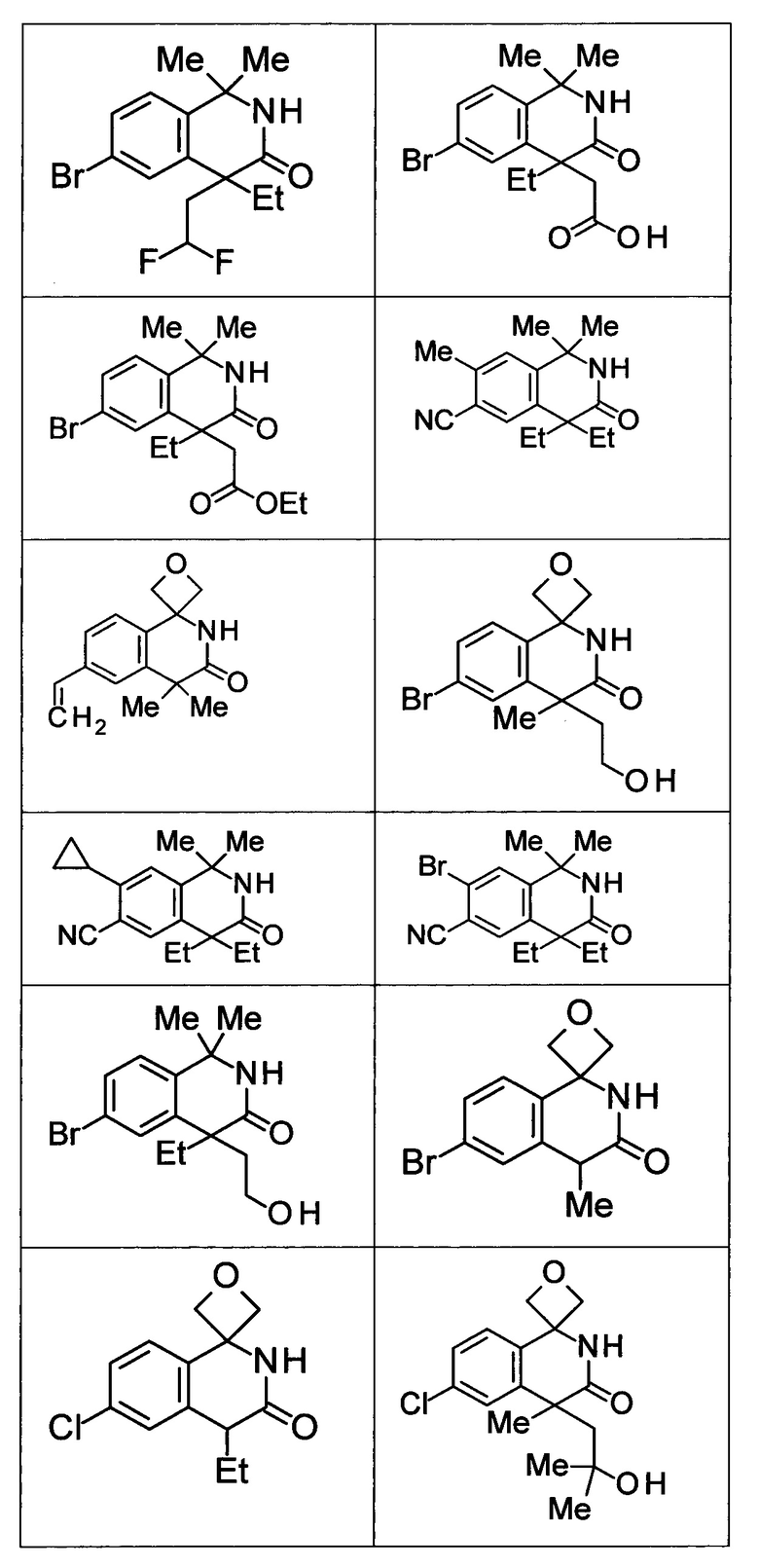
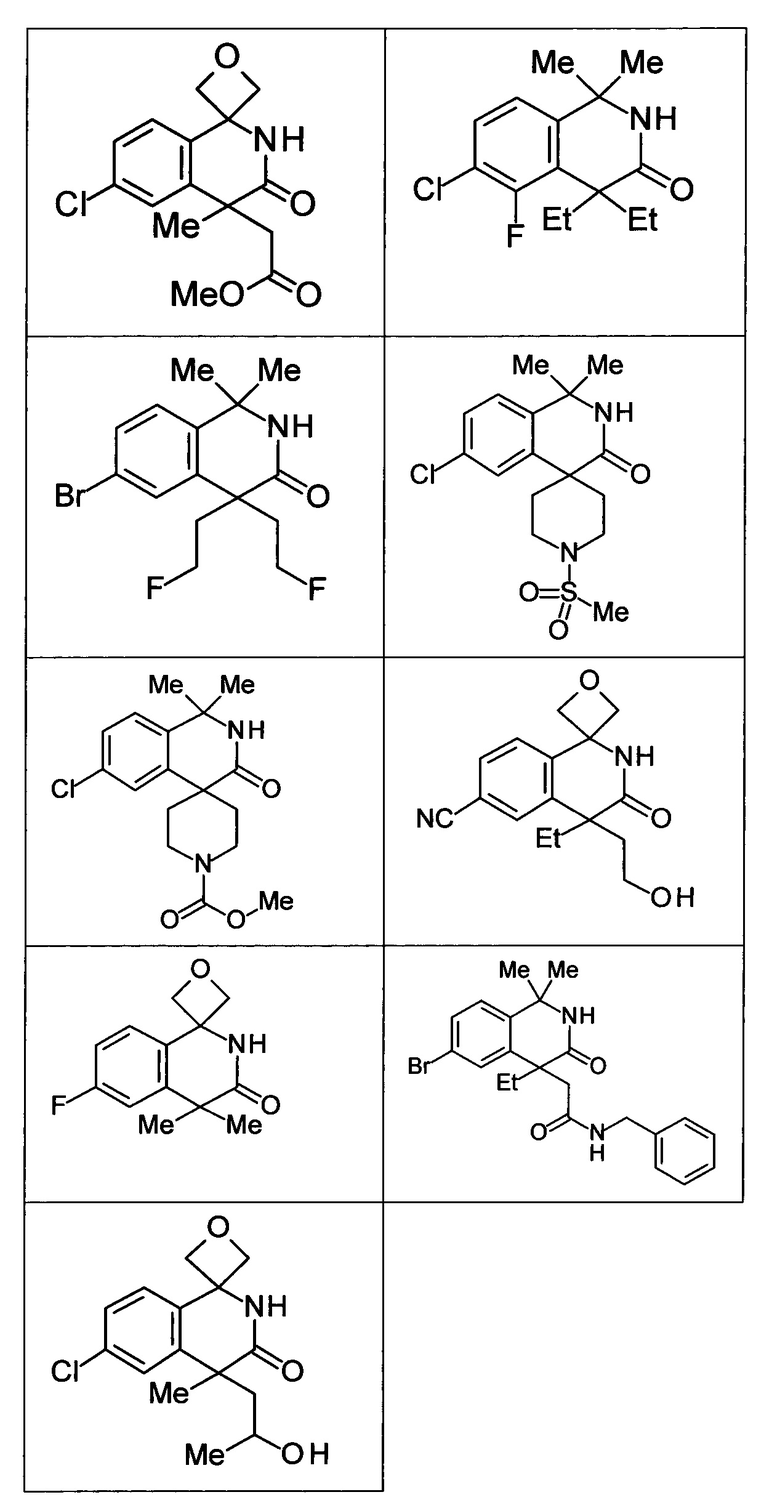
Вариант осуществления (49) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой C-R11 и X2 представляет собой N, и где соединение выбрано из группы, состоящей из:
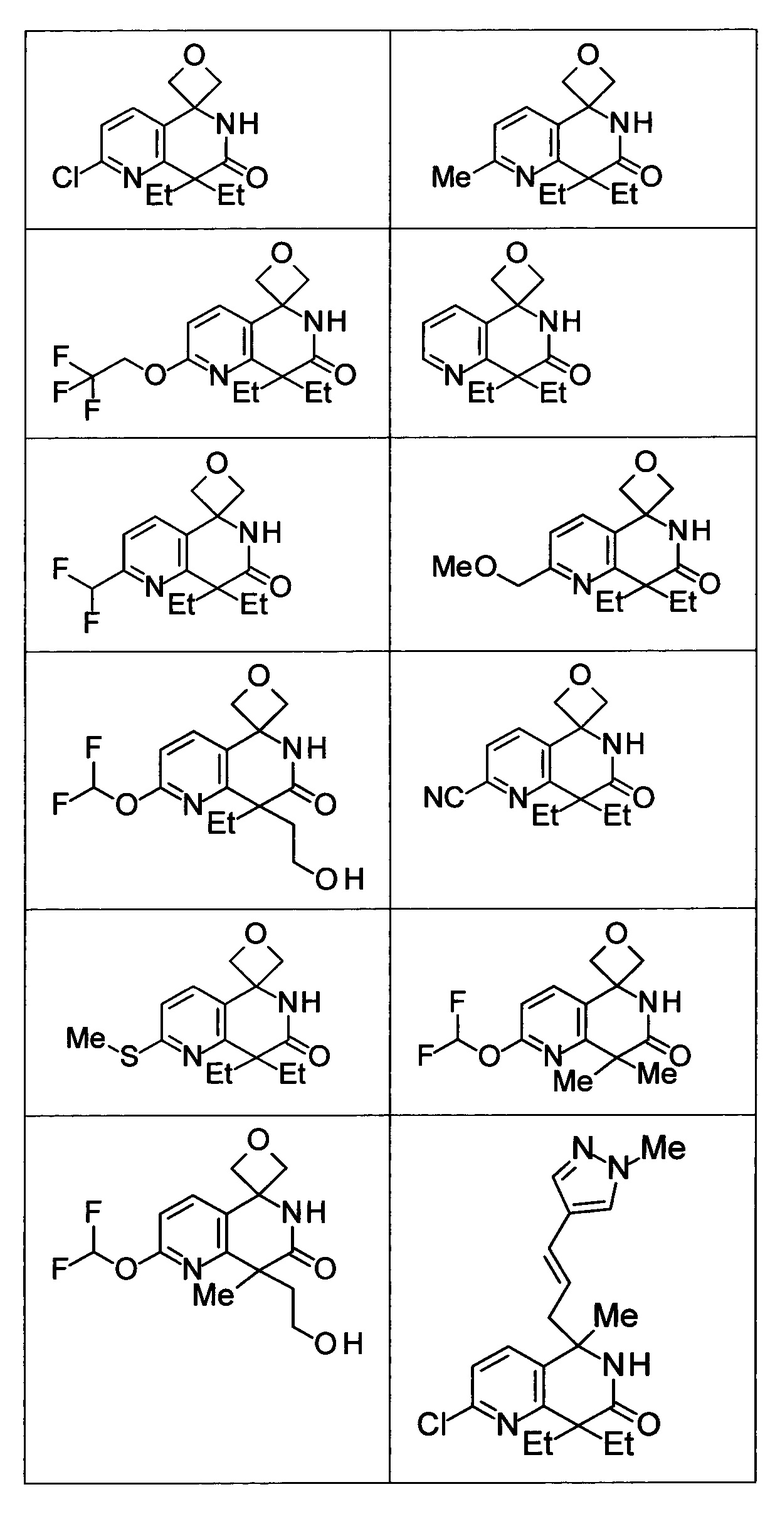
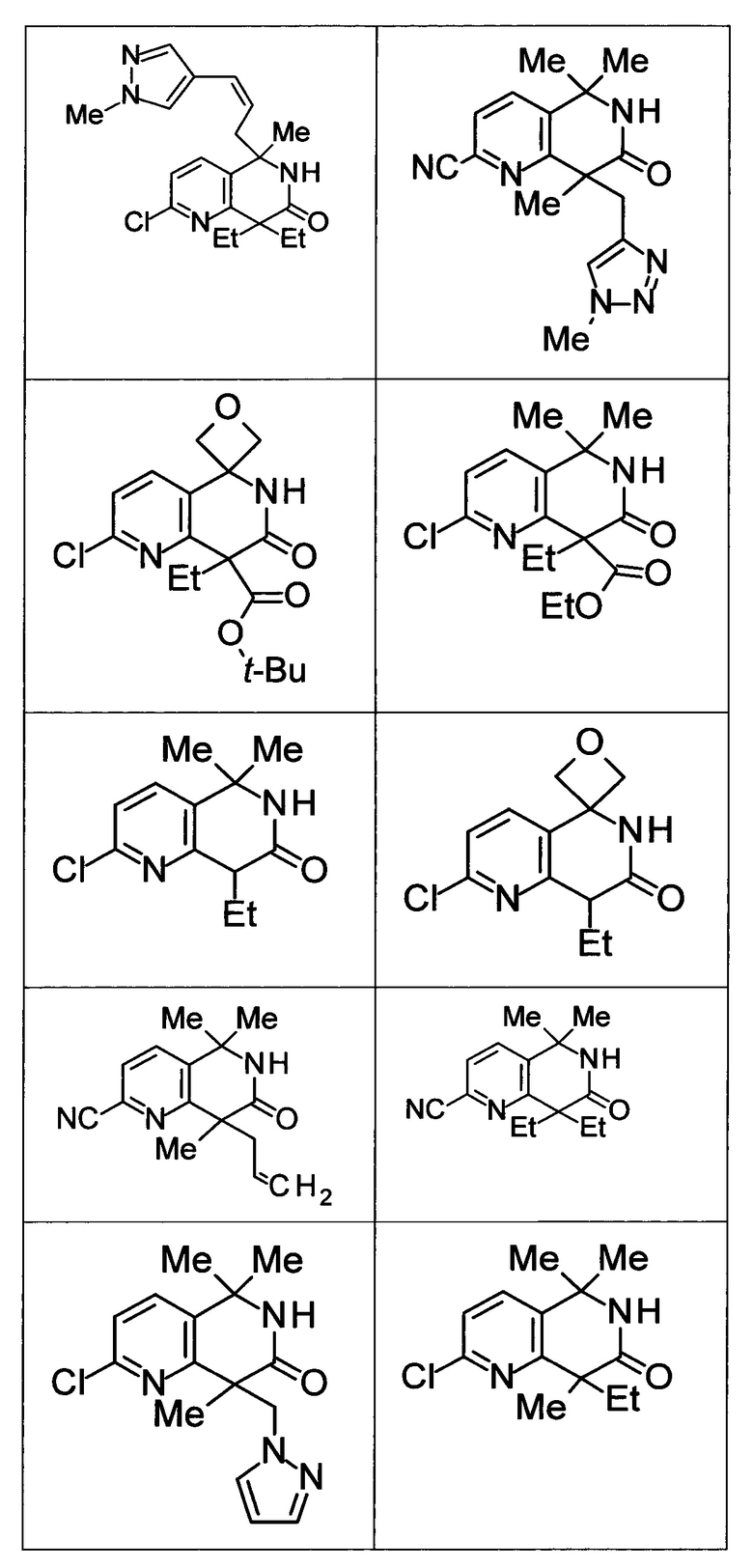
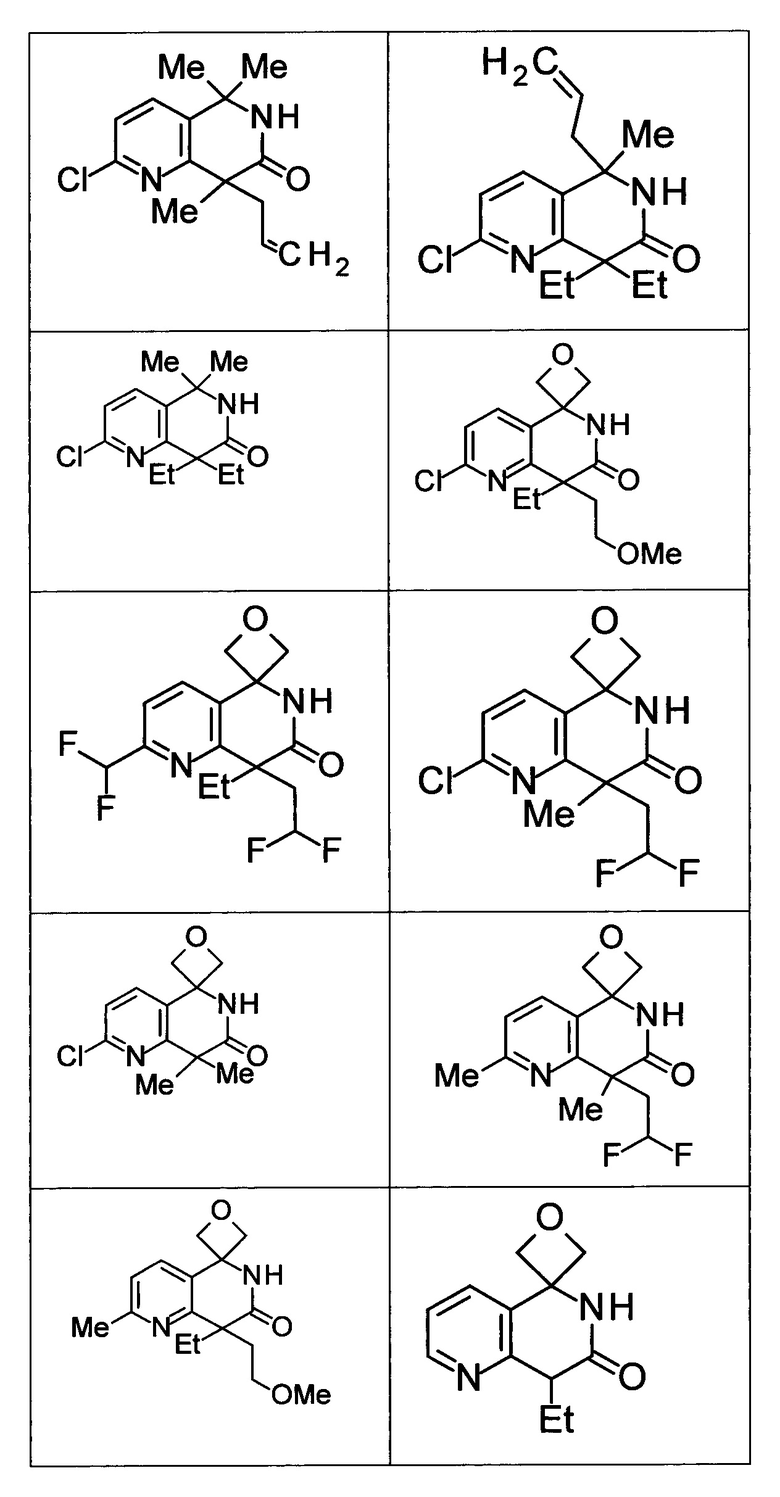
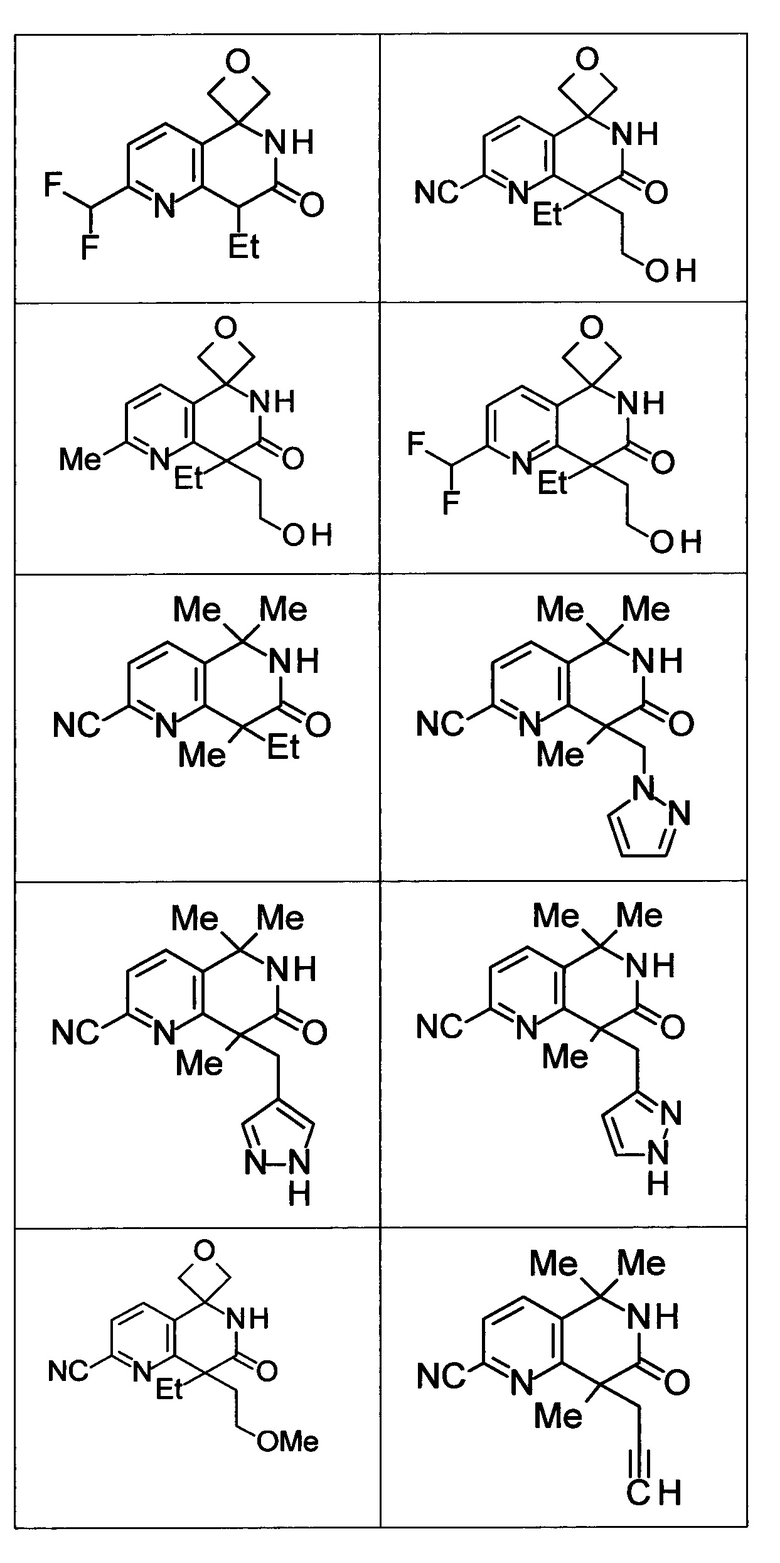
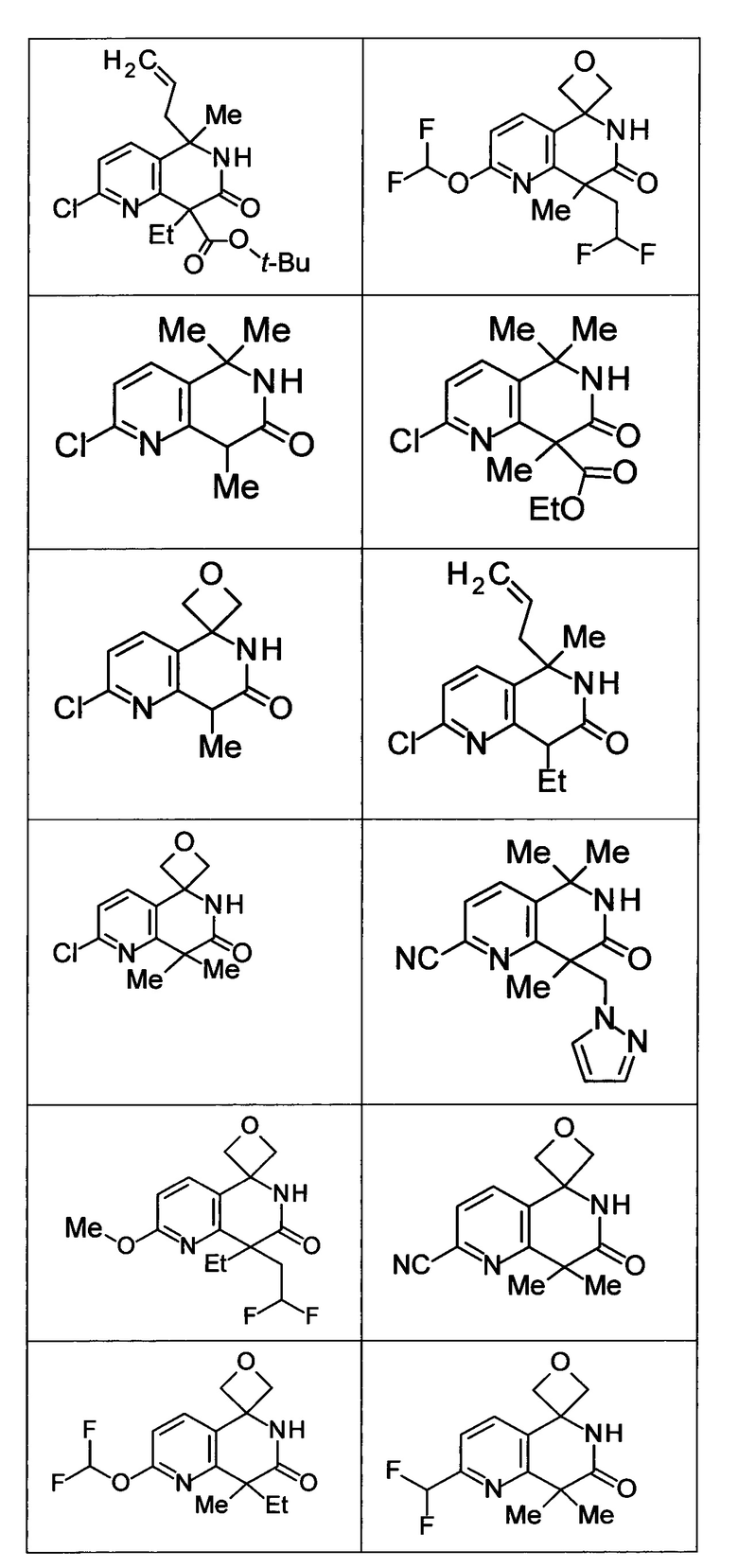
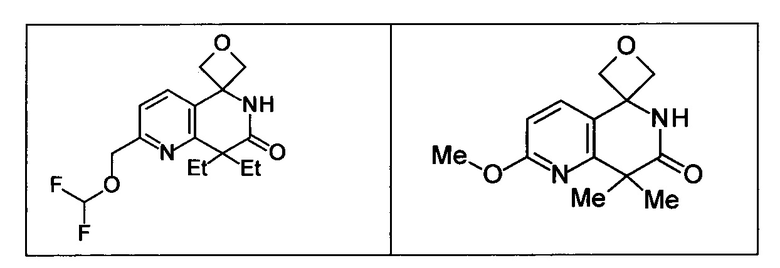
Вариант осуществления (50) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой N и X2 представляет собой C-R12, и где соединение выбрано из группы, состоящей из:
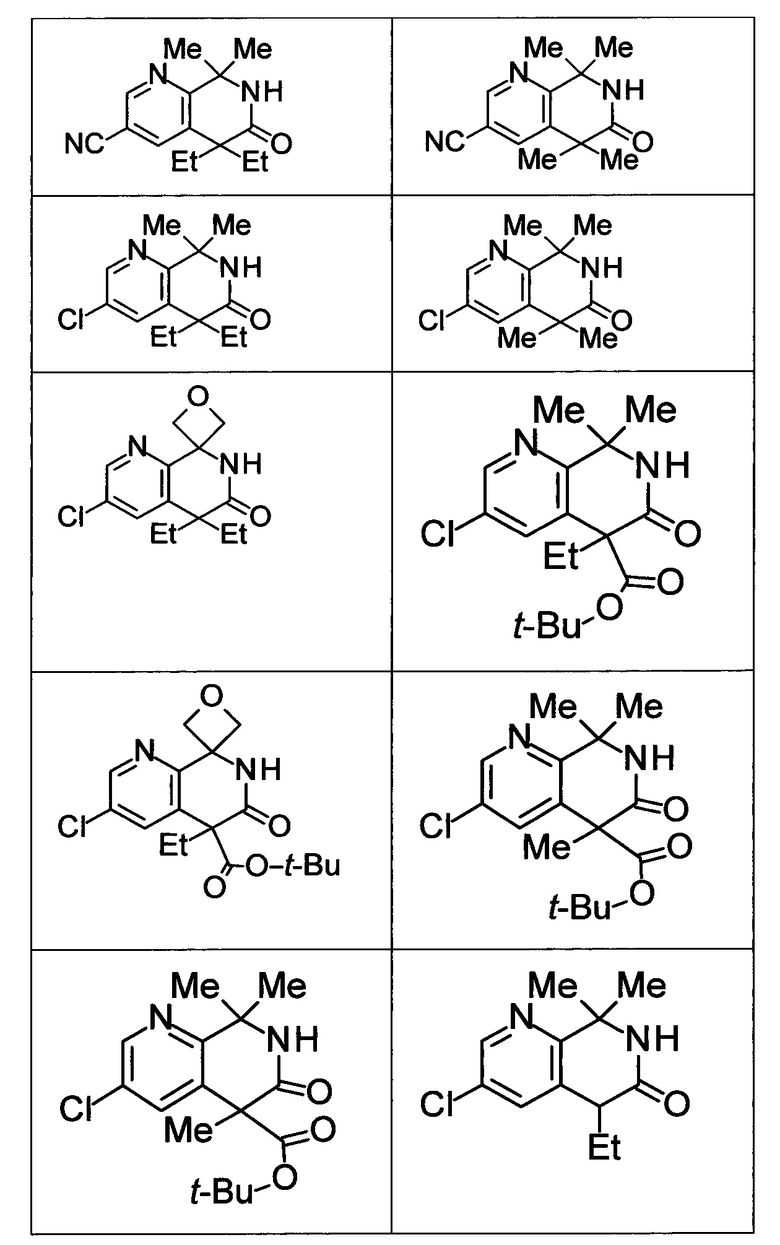
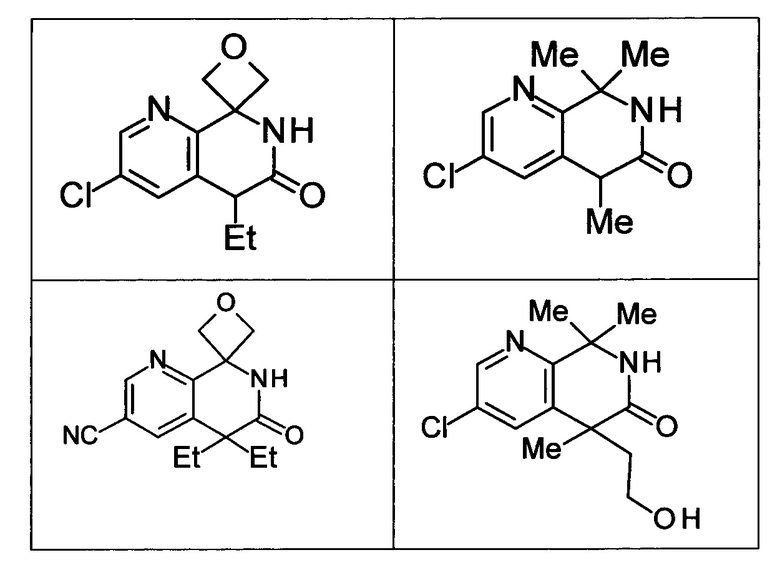
Вариант осуществления (51) Соединение варианта осуществления (1) или его соль, в котором X1 представляет собой N и X2 представляет собой N, и где соединение выбрано из группы, состоящей из:
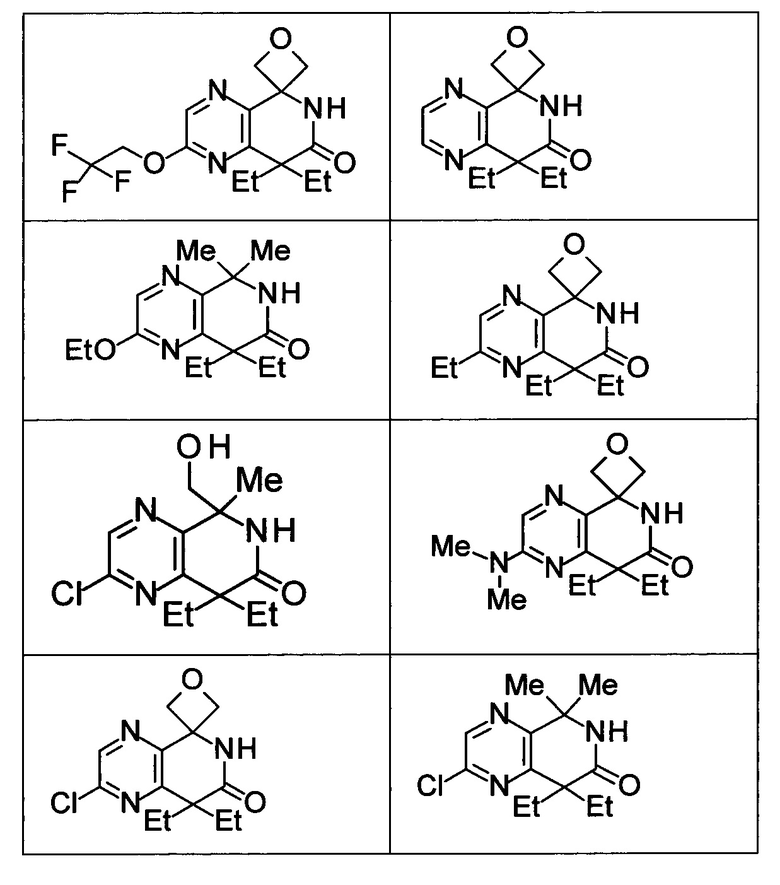
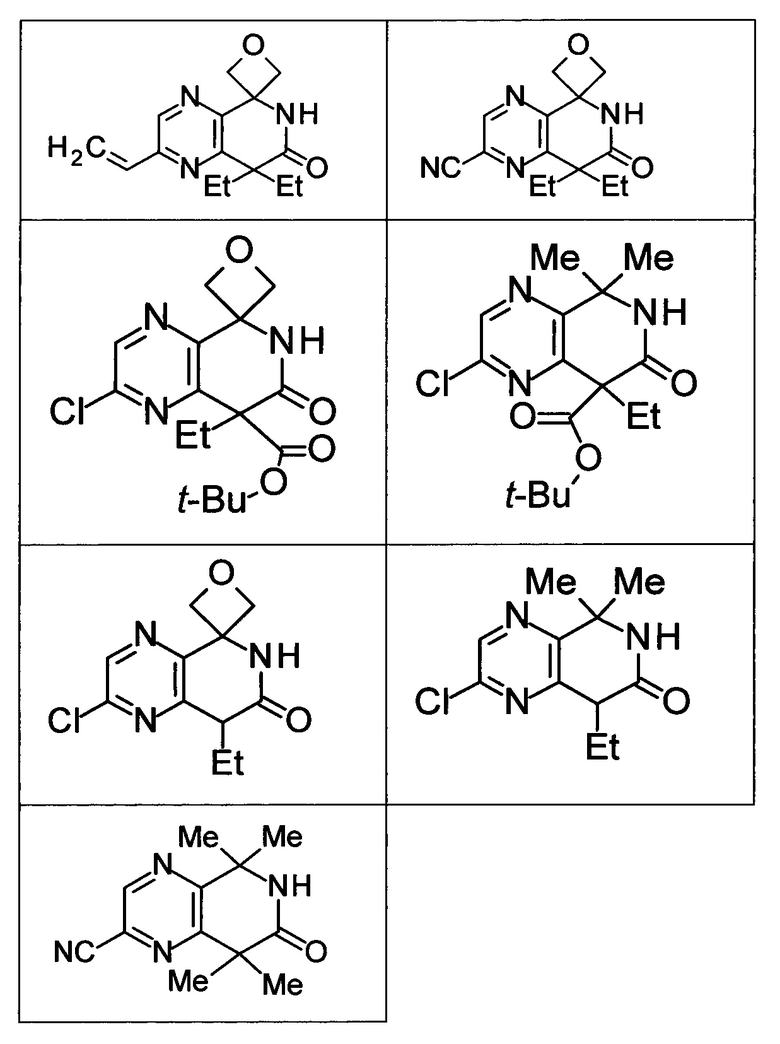
Вариант осуществления (52) Соединение или его соль, выбранное из группы, состоящей из
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она.
Вариант осуществления (53) Соединение варианта осуществления (52), или его соль, которое представляет собой 4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрил.
Вариант осуществления (54) Соединение варианта осуществления (52), или его соль, которое представляет собой 6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Вариант осуществления (55) Соединение варианта осуществления (52) или его соль, которое представляет собой 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6 карбонитрил.
Вариант осуществления (56) Соединение варианта осуществления (52) или его соль, которое представляет собой (+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Вариант осуществления (57) Соединение варианта осуществления (52) или его соль, которое представляет собой (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он.
Вариант осуществления (58) Фармацевтическая композиция, содержащая соединение любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель.
Вариант осуществления (59) Фармацевтическая композиция для лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости, включающая соединение любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемую соль.
Вариант осуществления (60) Применение соединения любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для лечения заболевания или состояния, выбранного из группы, состоящей стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости.
Вариант осуществления (61) Применение соединения любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемой соли для лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости.
Вариант осуществления (62) Способ лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости, включающий введение субъекту эффективного количества соединения любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемой соли.
Вариант осуществления (63) Соединение любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемая соль для применения в предотвращении или лечении заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости.
Вариант осуществления (64) Набор, содержащий соединение любого из вариантов осуществления (1)-(57) или его фармацевтически приемлемую соль и инструкции для применения при лечении заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI), недержания кала, дряхлости, саркопении, хронической обструктивной болезни легких (ХОБЛ), синдрома кахексии и/или мышечного истощения, вызванного сердечной недостаточностью, раком или хроническим заболеванием/диализом почек, бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении, мышечной миопатии, мышечной дисфункции после повреждения спинного мозга (SCI), мышечной дисфункции после инсульта, заболевания периферической сосудистой системы, заболевания периферических артерий, дефицита, относящегося к реабилитации, метаболического синдрома, ожирения, обусловленной использованием дыхательного аппарата слабости мышц и синдрома хронической усталости.
Вариант осуществления (65) Изделие, содержащее соединение по любому из вариантов осуществления (1)-(57) или его фармацевтически приемлемую соль.
Любая вариация, описанная в настоящем изобретении со ссылкой на формулу (I), также может быть применена к формуле (I'), как если бы каждая такая вариация была конкретно описана для формулы (I'). Аналогично, любая вариация, описанная в настоящем изобретении со ссылкой на формулу (I'), также может быть применена к формуле (I), как если бы каждая такая вариация была конкретно описана для формулы (I). Кроме того, каждая вариация X1, X2, R1, R2, R3, R4, R5, R6 и R0, описанная в настоящем изобретении, может быть объединена друг с другом, как если бы каждое такое сочетание было специально и отдельно описано.
Что касается соединения формулы (I) или формулы (I'), то, в зависимости от вида заместителей, могут существовать их таутомеры или геометрические изомеры. В настоящем описании соединение формулы (I) или формулы (I') может быть описано только в одной форме изомеров в некоторых случаях, но изобретение включает другие изомеры, изолированные формы изомеров или их смесь.
Кроме того, некоторые соединения формулы (I) или формулы (I') могут иметь асимметричные атомы углерода или асимметрии в некоторых случаях, и, соответственно, могут существовать оптические изомеры. Изобретение включает изолированную форму оптического изомера соединения формулы (I) или формулы (I'), или смесь оптических изомеров в любом соотношении.
Кроме того, в настоящее изобретение также включено фармацевтически приемлемое пролекарство соединения, представленного формулой (I) или формулой (I'). Фармацевтически приемлемое пролекарство относится к соединению, имеющему группу, которая может быть превращена в аминогруппу, гидроксильную группу, карбоксильную группу или тому подобное, путем сольволиза или в физиологическом состоянии. Примеры групп, образующих пролекарство, включают те, которые описаны в Prog. Med., 5, 2157-2161 (1985) или «Pharmaceutical Research and Development» (Hirokawa Publishing Company, 1990), vol. 7, Drug Design, 163-198.
Кроме того, соль соединения формулы (I) или формулы (I') представляет собой фармацевтически приемлемую соль соединения формулы (I) или формулы (I'), и соединения формулы (I) или формулы (I') могут образовывать кислотно-аддитивную соль или соль с основанием, в зависимости от вида заместителей в некоторых случаях. Конкретно, их примеры включают кислотно-аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, а также с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропановая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолилвинная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, аспарагиновая кислота кислота и глутаминовая кислота, а также соли с металлическими анионами, такими как натрий, калий, магний, кальций и алюминий, а также с органическими основаниями, такими как метиламин, этиламин и этаноламин, соли с различными аминокислотами, такими как ацетиллейцин, лизин и орнитин, или производные аминокислот, аммониевые соли и другие.
Кроме того, настоящее изобретение также включает различные гидраты или сольваты и кристаллические полиморфные вещества соединения формулы (I) или формулы (I') и его соли. Кроме того, изобретение также включает соединения, меченные различными радиоактивными или нерадиоактивными изотопами.
Соединение формулы (I) или формулы (I') или его соль может быть получено путем применения различных известных способов синтеза с использованием характеристик, основанных на их основных структурах или видах заместителей. В зависимости от типов функциональных групп, в некоторых случаях предпочтительно защищать функциональную группу с помощью соответствующей защитной группы (группы, которая может легко превращаться в функциональную группу), во время выполнения стадий от исходных материалов до промежуточных продуктов. Примеры защитной группы включают защитные группы, как описано в «Greene's Protective Groups in Organic Synthesis (5th edition, John Wiley & Sons, Inc., 2014)», под редакцией P.G.M. Wuts и т.п., которые могут быть выбраны соответствующим образом и использоваться в зависимости от условий реакции. В данных способах желаемое соединение может быть получено путем введения защитной группы для проведения реакции, а затем, при желании, удаления защитной группы.
Кроме того, про лекарство соединения формулы (I) или формулы (I') может быть получено путем введения специфической группы во время выполнения стадий из исходных материалов в промежуточные продукты таким же образом, как и для вышеупомянутых защитных групп, или при дальнейшем проведении реакции с использованием полученного соединения формулы (I) или формулы (I'). Реакцию можно проводить, применяя способ, известный специалисту в данной области техники, такой как общая этерификация, амидирование и дегидратация
Ниже ниже будут описаны типичные способы получения соединения формулы (I) или формулы (I') и соединения формулы (а), которое является исходным соединением. Каждый из производственных процессов также может быть выполнен со ссылкой на документы, прилагаемые к описанию в настоящем документе. Кроме того, способы получения по изобретению не ограничиваются примерами, как показано ниже.
Производственный процесс 1
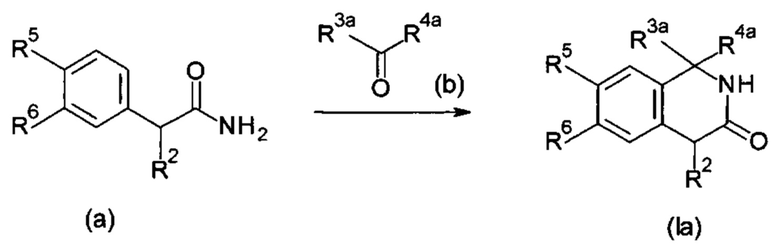
(в котором R3a, R4a представляет одинаковые или отличные друг от друга заместители, C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более), или C2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который выбран из группы, состоящей из пиразолила и тиенила, причем данный гетероарил(ы) может быть замещен(ы) одним или несколькими C1-6алкилом(ами), который должен применяться в дальнейшем).
Данная реакция представляет собой способ получения соединения формулы (1а), которое представляет собой соединение по изобретению, посредством реакции циклизации, известной как реакция Пикте-Шпенглера (Pictet-Spengler.)
Данную реакцию проводят с использованием соединения формулы (а) и (b) в эквивалентных количествах или любого из них в избыточном количестве при перемешивании смеси в температурных условиях в диапазоне от температуры охлаждения до температуры кипения с обратным холодильником в кислых условиях, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции, или без растворителя. Примеры кислоты, используемой в настоящем изобретении, конкретно не ограничены, но включают хлористоводородную кислоту, бромистоводородную кислоту, иодистоводородную кислоту, уксусную кислоту, трифторуксусную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту, полифосфорную кислоту, метансульфоновую кислоту и реагент Итона (Eaton). См. также, например, Synthetic Communications, 32 (12), 1787-1790 (2002).
Производственный процесс 2
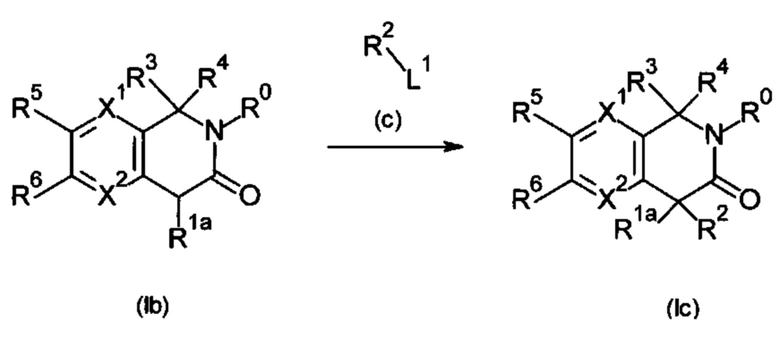
(в котором R1a представляет собой C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и пиразолила(ов), и) C2-6алкенил или iii) -OR0, который будет применяться далее).
Данный производственный процесс представляет собой способ получения соединения формулы (Ic), которое включено в соединение формулы (I) или формулы (I') из соединения формулы (Ib), которое также включено в состав формулы (I) или формулы (I') и соединения формулы (с). Примеры L1 могут включать хлор и тому подобное.
Реакцию проводят с использованием соединения формулы (Ib) и соединения формулы (с) в эквивалентных количествах или любого из них в избыточном количестве, путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до температуры нагревания, предпочтительно при температуре от -20°C до 60°C, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции, в присутствии основания. Примеры основания, используемого в настоящем изобретении, конкретно не ограничены, но включают гидрид натрия, трет-бутоксид калия, карбонат калия и карбонат цезия. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п., простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное, N,N-диметилформамид, 1,3-диметилимидазолидин-2-он, 1-метилпирролидин-2-он, диметилсульфоксид, этилацетат, ацетонитрил, воду и их смеси. См. также, например, WO 2011/159760 А1 и WO 2005/26120.
Производственный процесс 3
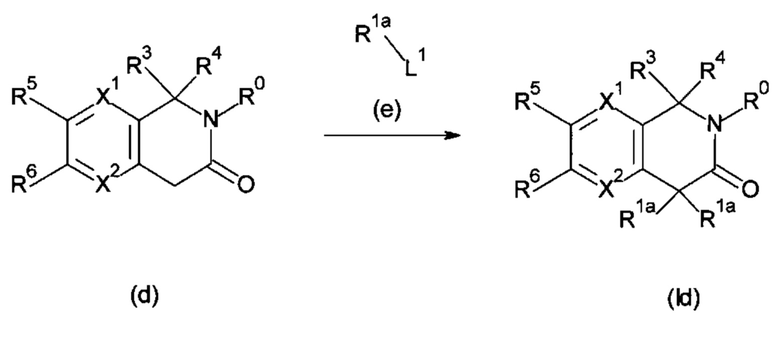
Данный производственный процесс представляет собой способ получения соединения формулы (Id) из соединения формулы (d) и соединения (е).
Реакцию проводят с использованием соединения формулы (d) и соединения формулы (е) в 2 моль, эквиваленте или большем количестве соединения формулы (е) путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до температуры нагревания, предпочтительно при температуре от -40°C до 60°C, более предпочтительно при температуре от -20°C до 60°C, как правило, в течение от 0,1 часа до 5 дней в растворителе, который является инертным по отношению к реакции, в присутствии 2 мол. эквивалента или большего количества основания. Примеры основания, используемого в настоящем изобретении, конкретно не ограничены, но включают гидрид натрия, трет-бутоксид калия, карбонат калия, гидроксид лития и карбонат цезия. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п., простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное, N,N-диметилформамид, 1,3-диметилимидазолидин-2-он, 1-метилпирролидин-2-он, диметилсульфоксид, этилацетат, ацетонитрил, воду и их смеси. См. также, например, WO 2011/159760.
Производственный процесс 4
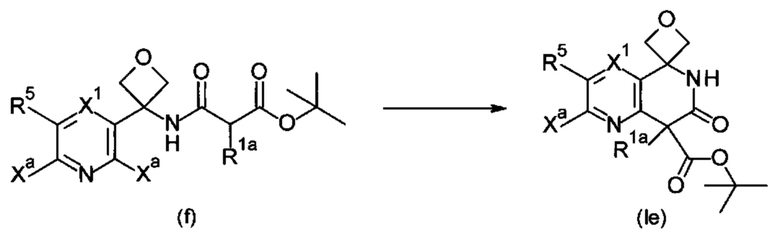
(в котором Ха представляет галоген).
Данная реакция представляет собой способ получения соединения формулы (Ie), который представляет собой соединение по изобретению, посредством реакции циклизации.
Данную реакцию проводят с использованием соединения формулы (f) в присутствии эквивалентного или большего количества основания путем перемешивани смеси в температурных условиях в диапазоне от температуры охлаждения до комнатной температуры, обычно в течение от 0,1 часов до 5 дней, в растворителе, который является инертным по отношению к реакции, или без растворителя. Примеры основания, используемого в настоящем изобретении, конкретно не ограничены, но включают бис(триметилсилил)амид натрия, гидрид натрия и трет-бутоксид калия. Примеры растворителей, используемых в настоящем описании, конкретно не ограничены, но включают в себя простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметил эфир и тому подобное, N,N-диметилформамид, 1,3-диметилимидазолидин-2-он, 1-метилпирролидин-2-он и тому подобное. Кроме того, существуют некоторые случаи, когда смешанный растворитель из растворителя и воды очень подходит для реакции. См. также, например, WO 2008/82009.
Производственный процесс 5
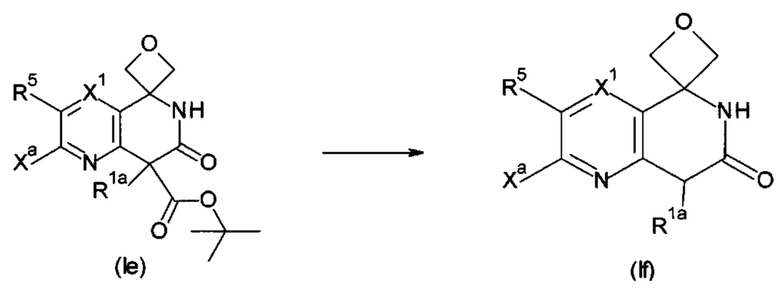
Данная реакция представляет собой способ получения соединения формулы (If), которое представляет собой соединение по изобретению, посредством реакции декарбоксилирования.
Данную реакцию проводят с использованием соединения формулы (Ie) в присутствии эквивалентного или большего количества кислоты путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до температуры кипения с обратным холодильником в кислых условиях, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции или без растворителя. Примеры кислоты, используемой в настоящем изобретении, конкретно не ограничены, но включают соляную кислоту, бромистоводородную кислоту, иодистоводородную кислоту, муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту и серную кислоту. Примеры растворителя, используемого в данном описании, конкретно не ограничены, но включают галогенированные углеводороды, такие как дихлорметан, 1,2-дихлороэтан, хлороформ и тому подобное, N,N-диметилформамид, тетрагидрофуран и тому подобное. Кроме того, существуют некоторые случаи, когда смешанный растворитель из растворителя и воды очень подходит для реакции. См. также, например, J. Org. Chem., 1983, 48 (6), pp. 791-796, Org. Lett., 2011, Vol. 13, p 5560-5563.
Производственный процесс 6
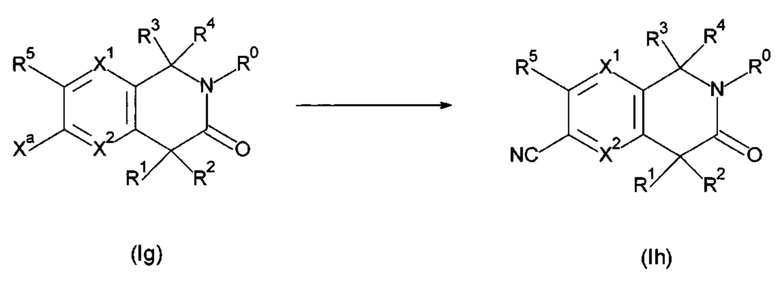
Данная реакция представляет собой способ получения соединения формулы (Ih), которое представляет собой соединение по изобретению, путем цианирования с использованием Pd-катализатора из соединения формулы (Ig).
Данную реакцию проводят с использованием соединения формулы (Ig) и цианирующего реагента путем перемешивани смеси в температурных условиях в диапазоне от температуры охлаждения до температуры нагревания до кипения с обратным холодильником или с использованием микроволнового облучения, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции или без растворителя. Примеры цианирующего реагента, используемые в настоящем изобретении, конкретно не ограничены, но могут включать CuCN, Zn(CN)2, KCN. Кроме того, существует некоторые случаи, когда наличие палладиевого катализатора, такого как палладий(II)диацетат, Pd2(dba)3, Pd(TFA)2 или [1,1'-бис(дифенилфосфино)ферроцен]дихлоропалладий(II), очень подходит для реакции. Кроме того, существуют некоторые случаи, когда присутствие ди-трет-бутил(2',4',6'-триизопропилбифенил-2-ил)фосфина (tBuXphos), 2',4',6'-диизопропил-1,1'-бифенил-2-илдициклогексилфосфина (Xphos), или 1,1'-бис(дифенилфосфино)ферроцена (dppf) подходит для реакции. Кроме того, есть некоторые случаи, когда присутствие Zn подходит для реакции. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и тому подобное, N,N-диметилформамид, N,N-диметилацетамид, тетрагидрофуран и тому подобное. Кроме того, существуют некоторые случаи, когда смешанный растворитель из растворителя и воды очень подходит для реакции. См., например, Org. Lett., 2007, 9 (9), pp. 1711-1714, Med. Chem. Lett., 2013, 4 (2), pp. 211-215, Journal of Medicinal Chemistry, 2005, vol. 48, p. 3953-3979.
Некоторые соединения формулы (I) или формулы (I') могут быть получены по известной реакции, такой как связывание Suzuki, замещение ipso и т.д., из соединения (If). См. также, например, WO 02010/131145; WO 2008/147547; и US 6809097.
Некоторые соединения формулы (I) или формулы (I') могут быть получены известными способами, такими как галогенирование, восстановление, гидроксилирование, конденсация амидов и т.д., из соединений формулы (I) или формулы (I'). См. также, например, Bioorganic and Medicinal Chemistry, 2011, vol. 19, p. 1666-1673; Journal of Organic Chemistry, 1980, vol. 45, p. 4391-4398; и WO 2010/51373.
Соединение формулы (d) может быть получено тем же способом производственного процесса 1. Некоторые синтетические промежуточные соединения для получения соединения формулы (I) или формулы (I') могут быть получены известными синтетическими способами или синтетическими способами, описанными в данном изобретении, из известных соединений. См. также, например, WO 2008/3690; Org. Lett., 2007, 9 (9), pp. 1711-1714; Med. Chem. Lett., 2013, 4 (2), pp. 211-215; J. Org. Chem. 2013, 78, 2661-2669; Bioorganic and Medicinal Chemistry Letters, 2010, vol. 20, p. 1890-1894; и J. Org. Chem. 2013, 78, 2786-2791.
Производственный процесс синтетических промежуточных продуктов 1
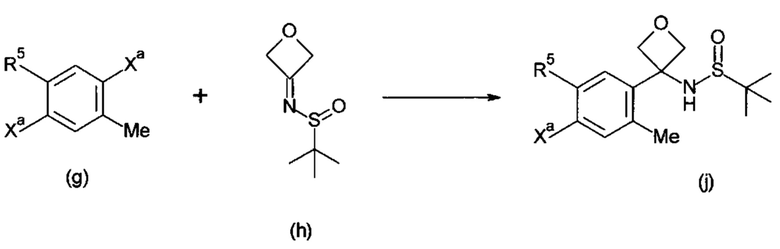
Данную реакцию проводят с использованием соединения формулы (g) и соединения формулы (h) в щелочных условиях, путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до комнатной температуры, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции, или без растворителя. Примеры основного реагента, используемые в настоящем изобретении, конкретно не ограничены, но включают н-бутиллитий, втор-бутиллитий, трет-бутиллитий. Примеры растворителей, используемых в настоящем описании, конкретно не ограничены, но включают в себя простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное, углеводороды, такие как н-гексан, н-пентан и тому подобное, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное.
Производственный процесс синтетических промежуточных соединений 2
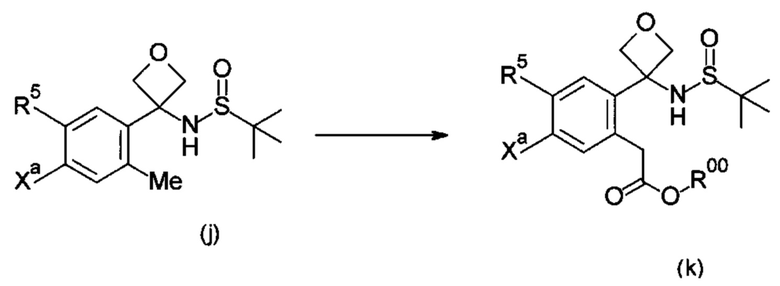
(где R00 представляет C1-6алкил, который будет применяться далее).
Данную реакцию проводят с использованием соединения формулы (j) и R00-OCO-Lv (Lv представляет О-(C1-6алкил) или галоген) путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до комнатной температуры, как правило, в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции, или без растворителя в щелочных условиях. Примеры основного реагента, используемого в данном описании, конкретно не ограничены, но включают н-бутиллитий, втор-бутиллитий, трет-бутиллитий, диизопропиламид лития и 2,2,6,6-тетраметилпиперидид лития. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное, углеводороды, такие как н-гексан, н-пентан и тому подобное.
Производственный процесс синтетических промежуточных продуктов 3
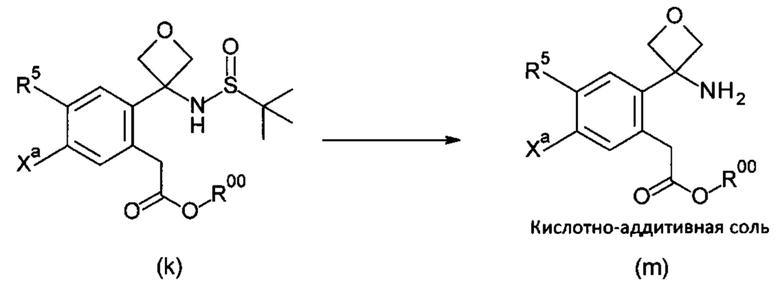
Данную реакцию проводят с использованием соединения формулы (k) в кислых условиях в растворителе, который является инертным по отношению к реакции или без растворителя, путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до комнатной температуры, обычно в течение 0,1 часа до 5 дней. Примеры кислоты, используемой в настоящем изобретении, конкретно не ограничены, но включают соляную кислоту, бромистоводородную кислоту, иодистоводородную кислоту, уксусную кислоту, трифторуксусную кислоту, серную кислоту, азотную кислоту и тионилхлорид. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают этилацетат, ацетонитрил, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное, углеводороды, такие как н-гексан, н-пентан, и тому подобное, спирты, такие как метанол, этанол и тому подобное.
Производственный процесс синтетических промежуточных соединений 4
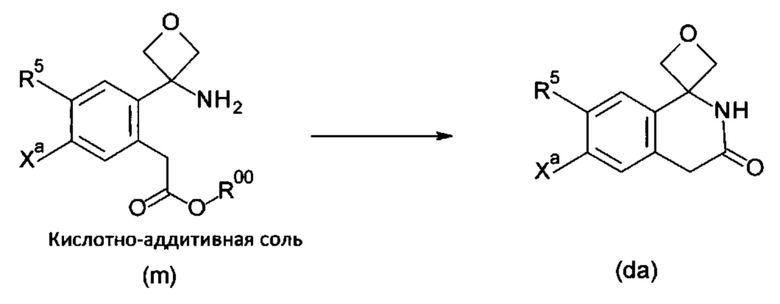
Данную реакцию проводят с использованием соединения формулы (m) в растворителе, который является инертным по отношению к реакции, или без растворителя в щелочных условиях, путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до комнатной температуры, обычно в течение 0,1 часа до 5 дней. Примеры основного реагента, используемый в данном описании, конкретно не ограничены, но включают карбонат натрия водорода, гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, гидрокарбонат калия, триэтиламин и N,N-диизопропилэтиламин. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают воду, спирты, такие как метанол, этанол и т.п., простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан, циклопентилметиловый эфир и тому подобное.
Производственный процесс синтетических промежуточных продуктов 5
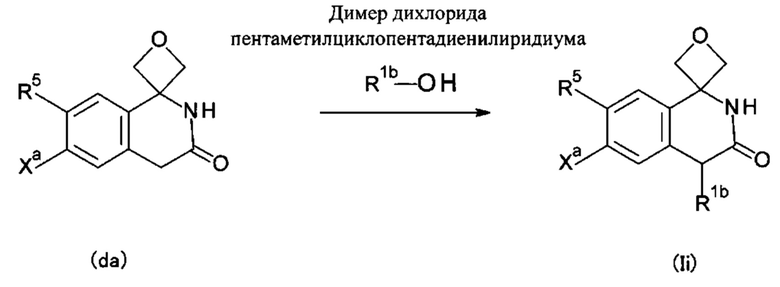
(в котором R1b представляет C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов)).
Данную реакцию проводят с использованием соединения формулы (da), димера дихлорида пентаметилциклопентадиенилиридиума (III) и R1b-OH, путем перемешивания смеси в температурных условиях в диапазоне от температуры охлаждения до температуры нагревания до кипения с обратным холодильником или с использованием микроволнового излучения, обычно в течение от 0,1 часа до 5 дней, в растворителе, который является инертным по отношению к реакции, или без растворителя в щелочных условиях. Примеры основания, используемого в настоящем изобретении, конкретно не ограничены, но могут включать гидроксид калия, гидроксид натрия, трет-бутоксид калия, карбонат калия и карбонат цезия. Примеры растворителя, используемого в настоящем изобретении, конкретно не ограничены, но включают спирт, такой как R1b-OH, ароматические углеводороды, такие как бензол, толуол, ксилол и тому подобное. В случае использования спирта в качестве растворителя, спирт должен быть таким же, как R1b-OH. См. также, например, Tetrahedron, 65 (2009), 4375-4383.
Соединение формулы (I) или формулы (I') выделяют и очищают в виде его свободного соединения, или в виде его соли, гидрата, сольвата или кристаллического полиморфного вещества. Соль соединения формулы (I) или формулы (I') также может быть получена обычным способом.
Выделение и очистку осуществляют с использованием общих химических операций, таких как экстракция, фракционная кристаллизация и различные типы фракционной хроматографии.
Различные изомеры могут быть получены, выбирая подходящее исходное соединение, или разделены при разделении с использованием различий в физико-химических свойствах изомеров. Например, оптические изомеры могут быть получены с помощью общих способов оптического разделения рацемических соединений (например, фракционная кристаллизация, введение соединения в диастереомерную соль с оптически активным основанием или кислотой, хроматография с использованием хиральной колонки или тому подобное; и другие), или также могут быть получены из соответствующего оптически активного исходного соединения.
Фармакологическую активность определенных соединений формулы (I) или формулы (I') подтверждали следующим анализом.
Пример анализа 1: Подготовка и анализ быстрых скелетных миофибрилл
Подготовка быстрых скелетных миофибрилл: кроличьи скелетные миофибриллы были препарированы, базируясь на способе Herrmann et al. (Biochem., 32 (28): 7255-7263(1993)). Миофибриллы были препарированы из поясничной мышцы кролика, приобретенной у Pel-Freez Biologicals (Arkansas) и хранимой на льду в течение 2 дней заказа. Измельченную мышцу гомогенизировали в 10 объемах холодного как лед «стандартного» буфера (50 мМ Tris, pH 7,4, 0,1 М KOAc, 5 мМ KCl, 2 мМ дитиотреитола (ДТТ), 0,2 мМ фенилметилсульфонилфторида (ФМСФ), 10 мкМ лейпептина, 5 мкМ пепстатина и 0,5 мМ азида натрия), содержащего 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА) и 0,5% Triton Х-100, с использованием гомогенизатора Omni-MaC-Ro. Миофибриллы выделяли низкоскоростным центрифугированием (3000 об/мин в течение 10 минут) и промывали 2 раза в буфере, содержащем Тритон Х-100, чтобы обеспечить удаление клеточной мембраны.
После промывки Тритоном миофибриллы промывали 3 раза в «стандартном» буфере, содержащем 2 мМ ацетата магния. Проводили конечную промывку в аналитическом буфере (12 мМ пиперазин-1,4-бис (2-этансульфокислота) (PIPES), pH 6,8, 60 мМ KCl, 1 мМ ДТТ) и доводили до 10% сахарозы для мгновенной заморозки в жидком азоте и хранения при -80°C.
Активация быстрых скелетных миофибрилл: активаторы быстрых волокон были идентифицированы измерением ферментативной активности препаратов мышечных миофибрилл с использованием патентованной аналитической системы PUMA (товарный знак) (см., например, патенты США №№6410254, 6743599, 7202051 и 7378254). Препараты миофибрилл состояли из скелетной мышцы кролика (приблизительно 90% быстрых волокон), которая была механически гомогенизирована и промыта детергентом (Тритон X-100) для удаления клеточных мембран. Данный препарат сохранял все саркомерные компоненты в нативной конформации, и ферментативная активность еще регулировалась кальцием. Соединения были протестированы с использованием миофибрилльной суспензии и уровня кальция, достаточного для повышения ферментативной активности миофибрилл до 25% от их максимальной степени (именуется как рСа25). Ферментативную активность отслеживали посредством ферментной системы, связанной с пируваткиназой и лактатдегидрогеназой. Данный анализ восстанавливает продуцируемый миозином ADP в АТФ окислением НАДН, что создает изменение спектральной поглощающей способности на 340 нм. Буферной системой являлась 12 мМ PIPES, 2 мМ MgCl2, 1 мМ ДТТ при pH 6,8 (буфер РМ12). Данные были представлены как АС 1.4, что является концентрацией, при которой соединение повысило ферментативную активность на 40%. Результаты суммированы в таблице 2 ниже. В таблице 2 «Соед. из прим.» обозначает соединение из соответствующего примера со ссылкой на структуры, представленные в таблице 4 ниже.
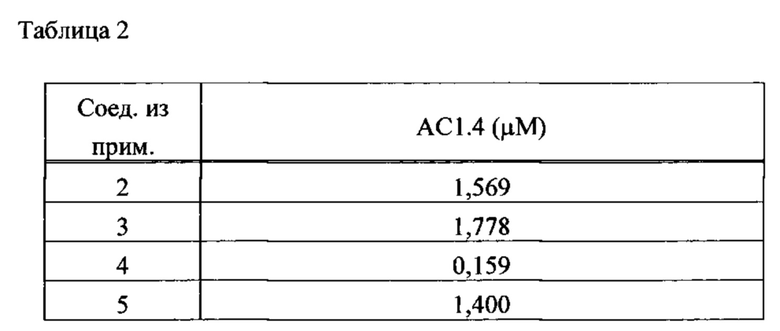
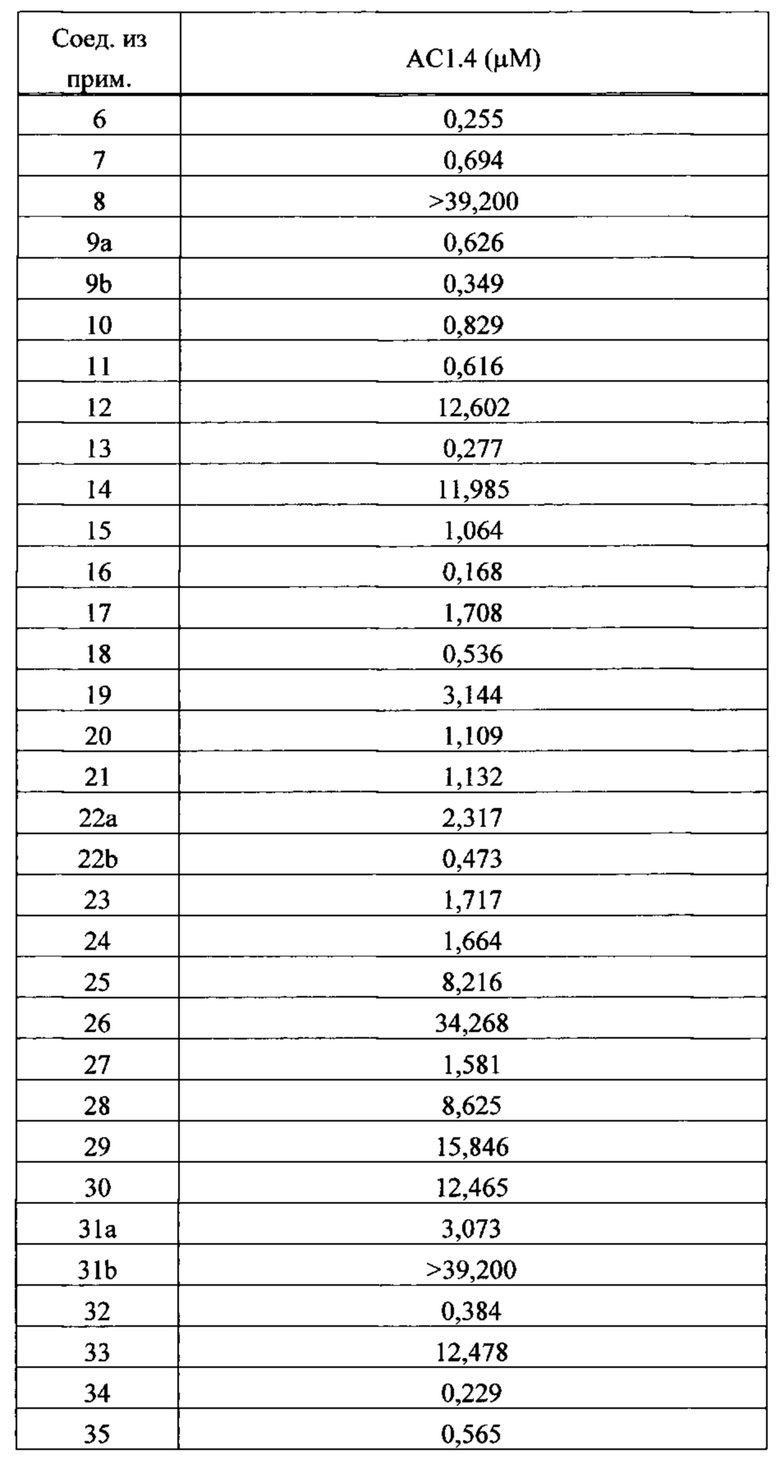
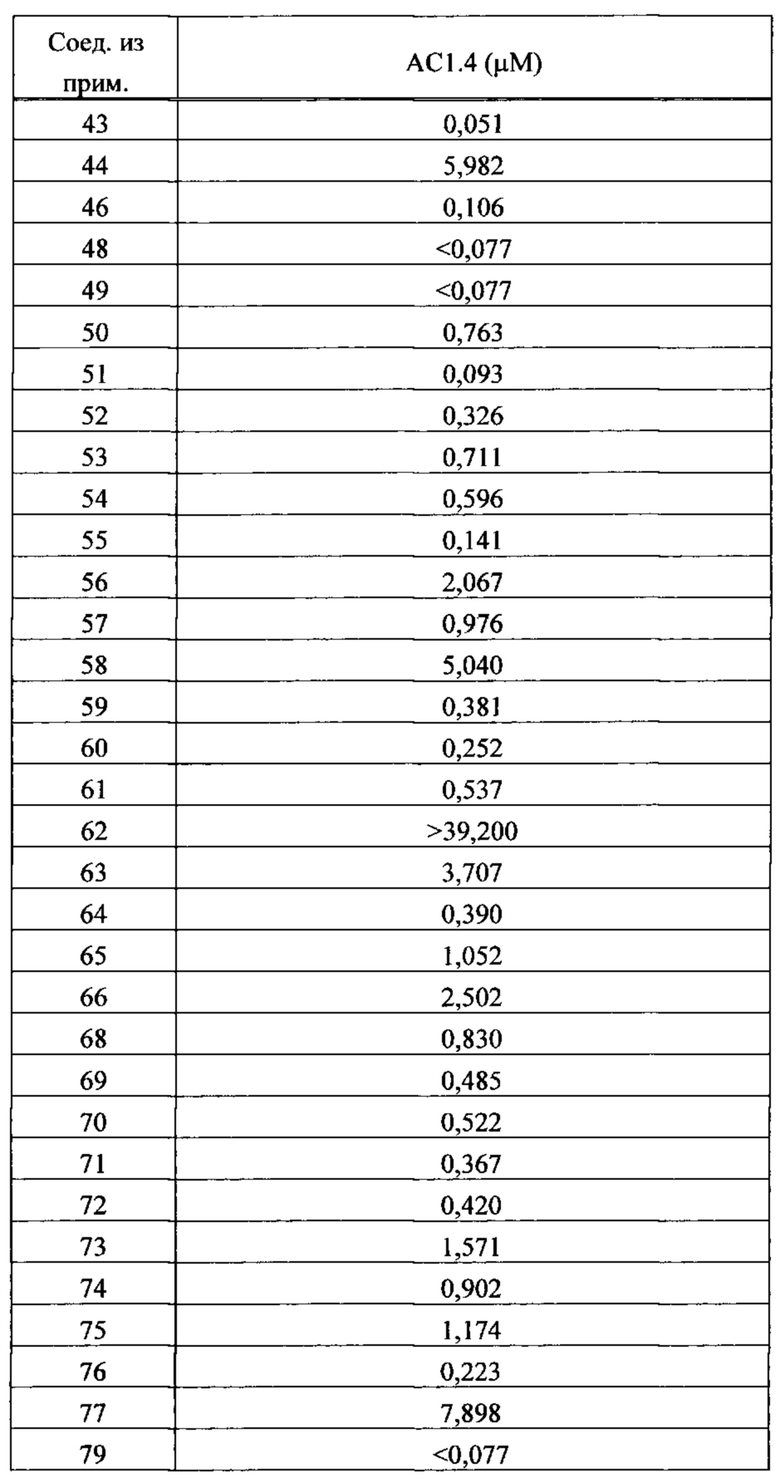
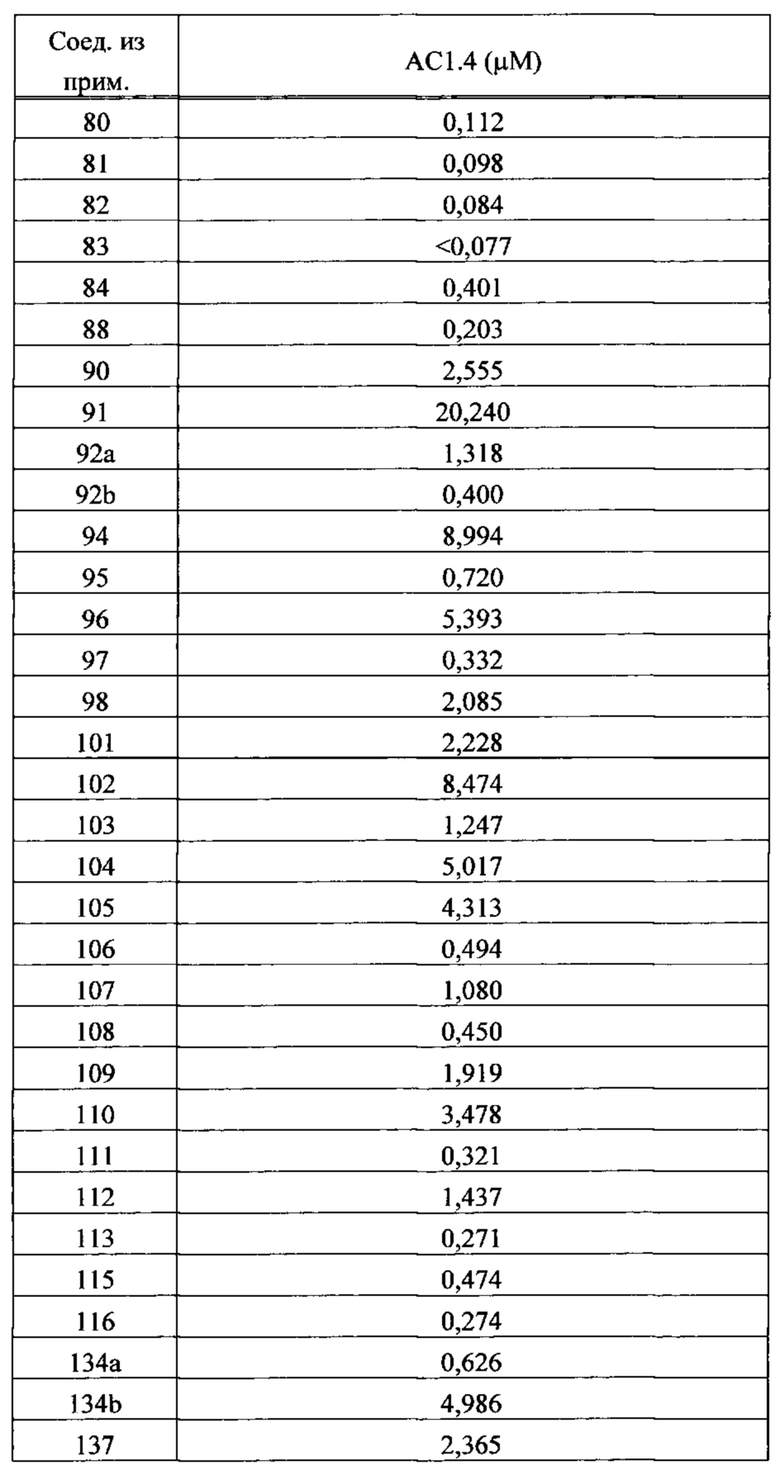
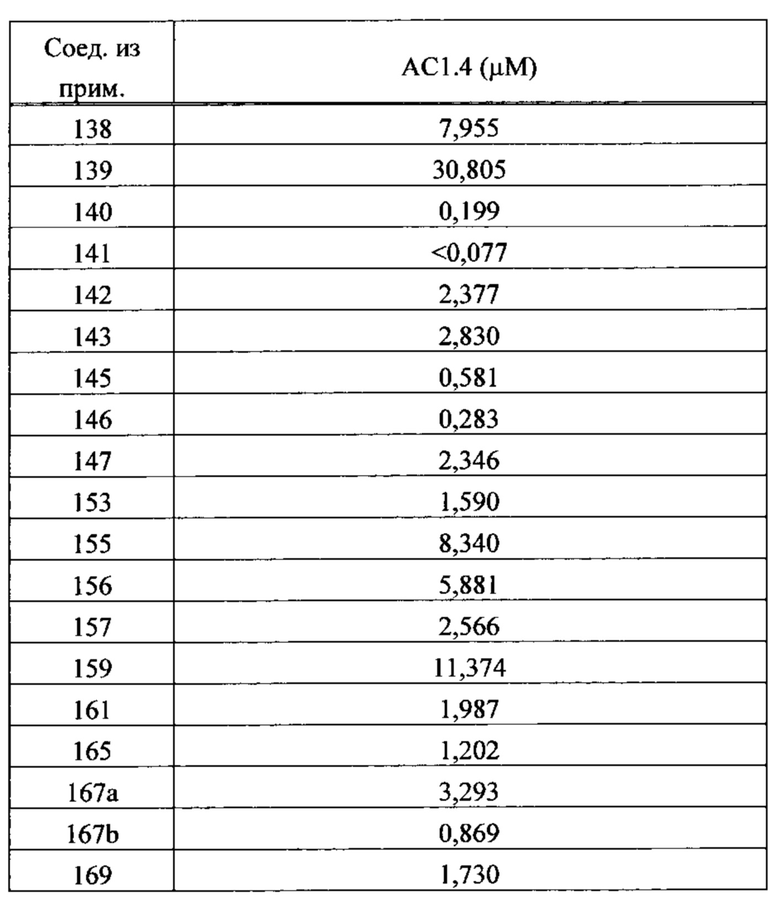
Пример анализа 2: Подготовка и анализ изометрической мышечной силы подошвенного сгибателя стопы крысы
Самцов крыс Sprague Dawley погружали в стабильный наркоз с помощью ингалируемого изофлурана (1-5%). Один разрез был сделан в средней области бедра правой ноги, чтобы обнажить седалищный нерв. Чтобы предотвратить одновременное сокращение мышц разгибателей стопы, был сделан дополнительный надрез латерально по отношению к коленной чашечке, чтобы изолировать и рассечь малоберцовый нерв. Затем крыс помещали на платформу установки (Aurora Scientific, Model 806С) для исследования мышечной силы in situ, в которой поддерживали температуру тела. Колено иммобилизовали, зажав его между двумя заостренными винтами, а ступню прочно фиксировали на педали преобразователя силы (Aurora Scientific, Онтарио, Канада). В обнаженный седалищный нерв вкалывали игольчатые электроды из нержавеющей стали (0,10 мм). Изометрическую силу мышечного сокращения подошвенного сгибателя стопы оценивали по сгибанию голеностопного сустава под углом 90 градусов. Нерв раздражали электрическим током 30 Гц (в условиях субмаксимальной стимуляции), и генерируемую мышечную силу регистрировали с использованием серводвигателя. В качестве исходной силы была установлена сила, развиваемая в ответ на предшествующую дозу 30 Гц. В качестве максимальной изометрической силы была установлена сила, развиваемая в ответ на предшествующую дозу 150 Гц. Соединения были составлены следующим образом: 50% полиэтиленгликоль (ПЭГ): 16% кавитрон (Cavitron): 10% диметилацетамид (ДМА), и их вводили непрерывной внутривенной инфузией в течение шестидесяти минут. Силу, генерируемую мышцей в ответ на соединение, измеряли каждые две минуты в течение периода дозирования. Данные представляли как оцененное значение EC50, которое представляет собой концентрацию, при которой мышечная сила составляет 50% от максимального напряжения, развиваемого в ответ на предшествующую дозу. Результаты по ЕС50 приведены в таблице 3 ниже. В таблице 3 «Соед. из прим.» означает соединение из примера со ссылкой на структуры, представленные в таблице 4 ниже.
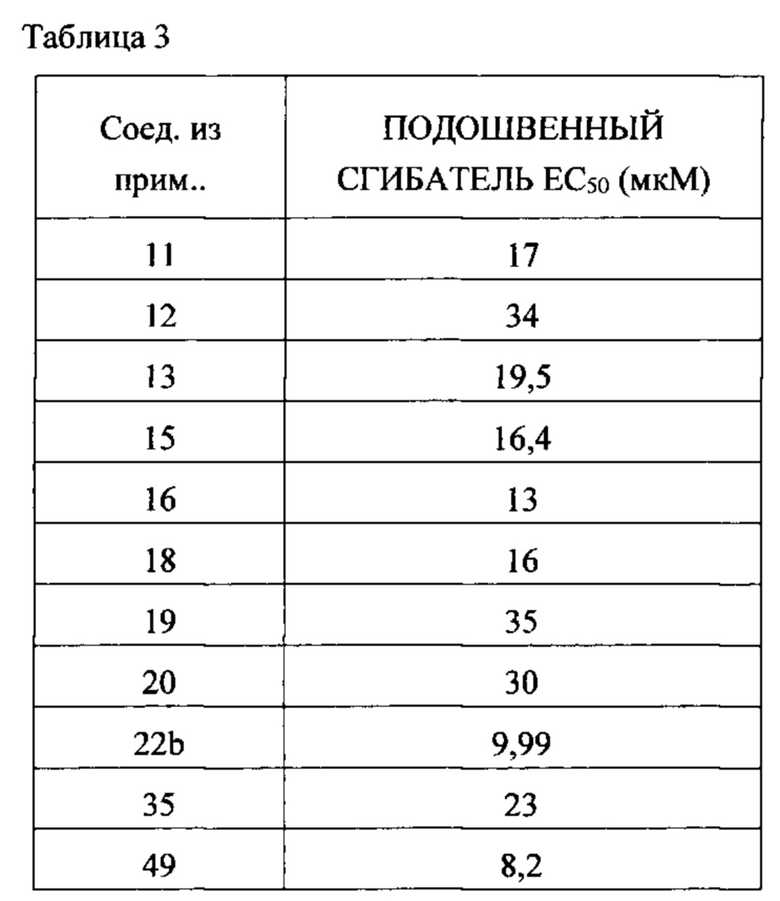
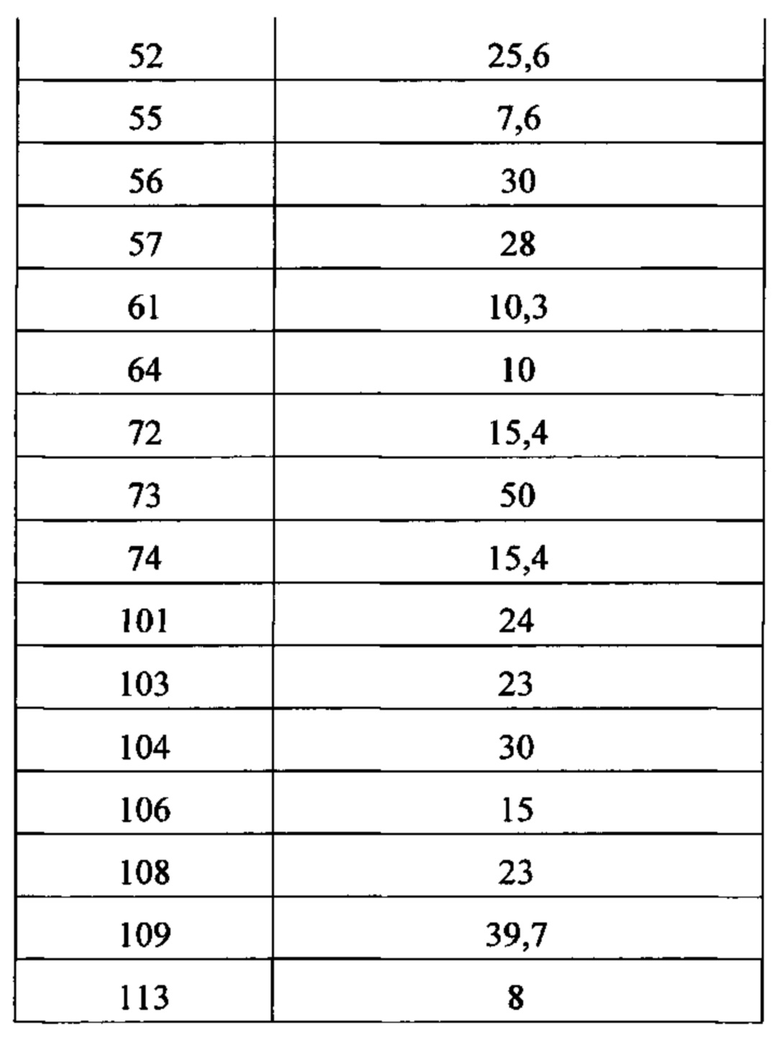
Пример анализа 3: Подготовка и анализ физической выносливости крысы при беге на беговой дорожке
Самок крыс Sprague Dawley приучали к бегу на беговой дорожке (treadmill, тредмил) (Columbus Instruments). Крыс тренировали на беговой дорожке в течение 5 дней со скоростью 25 метров в минуту (м/мин) в течение десяти минут при наклоне 5°. Для оценки влияния соединений на физическую выносливость при беге на беговой дорожке было проведено слепое перекрестное исследование с использованием теста на беговой дорожке. Крысам вводили носитель (0,5% гидроксипропилметилцеллюлоза (НРМС)/0,2 мкм Tween-80) или соединение в определенный момент времени перед процедурой на основе фармакокинетических свойств каждого из соответствующих соединений перед тестированием на беговой дорожке. Затем крысы бежали до тех пор, пока не наступало утомление, с постоянной скоростью 35 м/мин или постепенно изменяющейся скоростью в диапазоне от 25 до 45 м/мин в течение интервала времени до 150 минут. Время пребывания на беговой дорожке было записано. Через два дня после первого теста на беговой дорожке крысам вводили, соответственно, соединение противоположного действия и повторяли протокол испытаний на беговой дорожке. Конечную кровь собирали для анализа соединения в плазме. Данные о пробеге на беговой дорожке суммированы на ФИГ. 1.
Увеличение пробега на беговой дорожке: Как показано на ФИГ. 1, соединение из примера 20 и соединение из примера 22b увеличивают пробег на беговой дорожке.
Пример анализа 4: Подготовка и анализ индуцированного стимулированием электрическим полем (Electrical Field Stimulation (EFS)) сокращения изолированного наружного анального сфинктера (External Anal Sphincter (EAS))
Подготовка анализа EFS-индуцированного сокращения изолированного EAS от крыс. EAS был изолирован от самок SD-крыс (в возрасте от 10 до 11 недель), которых подвергали эвтаназии с обескровливанием под анестезией. Изолированный круглый EAS разрезали и разделяли на две полоски. Один конец каждой полоски подвешивали на датчике натяжения (ТВ-611Т, Nihon Kohden), прикрепленном к усилителю (АР-621G, Nihon Kohden) и интерфейсу (Power Lab, Ad Instrument), и подвешенную полоску помещали в тканевую ванну, заполненную буфером Кребса. Буфер Кребса продували 95% O2 и 5% CO2, и выдерживали в тепле при 37°C. Другой конец полоски был подвешен на электроде системы EFS (SEN-7203 и SEN-8203, Nihon Kohden), прикрепленном к усилителю привода (SEG-3104, Nihon Kohden). Подвешенную полоску промывали буфером Кребса и оставляли под натяжением 0,5 г в течение 30 минут, чтобы стабилизировать натяжение покоя. Данную стадию (промывка и 30 минут покоя для полоски) повторяли три раза для полной стабилизации натяжения покоя. Стабилизированную полоску стимулировали одним импульсом (20 В и длительность импульса 30 мкс), и полоска, которая показала сокращение более 60 мг, была выбрана и использована для дальнейшего EFS-сокращения. После того, как выбранная полоска была промыта буфером Кребса, полоску подвергали EFS, условия которого составляли стимулирующее напряжение 20 В, длительность импульса 30 мкс, частота 20 Гц и продолжительность 1 сек. EFS повторяли три раза с интервалом 30 секунд. Силу сокращения определяли как разность натяжения полоски между сокращением до и после EFS. Предварительное сокращение определяли как среднюю силу сокращения трехкратного EFS без какого-либо соединения. После измерения предварительного сокращения соединение из примера 20, соединение из примера 22b или ДМСО добавляли в буфер Кребса с полоской. Спустя пятнадцать минут после добавления полоску подвергали EFS три раза с интервалом 30 секунд. Последующее сокращение определяли как среднюю силу сокращения после трехкратного EFS с каждым соединением и рассчитывали как % от предварительного сокращения. Эффект служащего примером соединения 20 или служащего примером соединения 22b анализировали с использованием множественного сравнительного теста Dunnett (значение вероятности менее 0,05 считали значимой разницей). Данные выражали как среднее ± стандартная ошибка среднего (SEM).
Увеличение EFS-индуцированного сокращения изолированного EAS: Как показано на ФИГ. 2 и 3, соединение из примера 20 и соединение из примера 22b увеличивали EFS-индуцированное сокращение изолированного EAS от крыс.
Пример анализа 5: Подготовка и анализ анального давления, вызванного электрической стимуляцией пудендального нерва.
Подготовка к тесту анального давления крысы, вызванного электрической стимуляцией пудендального нерва. Самки SD-крыс (в возрасте от 11 до 12 недель) голодали в течение от 12 до 16 ч, и их обезболивали уретаном (1,2 г/кг, s.c). Канюлю (РЕ 50) для введения исследуемого вещества вставляли в яремную вену. Делали разрез в нижней части спины и электроды для электростимуляции помещали под односторонние пудендальные нервы. Катетер UniTip (Unisensor AG) для измерения анального давления, прикрепленный к усилителю (AP-621G, Nihon Kohden) и интерфейсу (Lab питания, ADInstrument), вставляли в задний проход через анальное отверстие. Стимуляцию пудендального нерва (PudNS, частота: 10 Гц, длительность импульса: 50 мкс, продолжительность: 400 мс, напряжение: 1 В) проводили электрическим стимулятором (SEN-3401, Nihon Kohden), и положение катетера фиксировали в точке, в которой PudNS-индуцированное повышение анального давления может быть вызвано стабильно. Напряжение было отрегулировано таким образом, чтобы вызвать повышение максимального анального давления от 30% до 90% на уровне от 1 до 10 В. Для оценки испытуемого вещества PudNS (частота: 10 Гц, длительность импульса: 50 мкс, продолжительность: 400 мс, напряжение: скорректировано выше) повторяли с интервалами в 1 минуту. Перед введением испытуемого вещества выявляли по меньшей мере 3 раза повышение анального давления, которое было в каждом случае приблизительно эквивалентным. Носитель, соединение из примера 20 (3 мг/мл/кг) или соединение из примера 22b (3 мг/мл/кг) вводили внутривенно. Среднее давление, вычисленное по последним трем повышениям анального давления перед введением, и среднее давление, рассчитанное по трем повышениям анального давления в промежутке от 1 до 4 мин после введения, определяли как предварительное и последующее давление, соответственно. Данные выражали в процентах от предварительного давления, и воздействие носителя, служащего примером соединения 20 или служащего примером соединения 22b анализировали с использованием множественного сравнительного теста Dunnett (значение вероятности менее 0,05 считали значимой разницей). Данные выражали как среднее ± SEM у 4 животных.
PudNS-индуцированное повышение анального давления. Как показано на ФИГ. 4, соединение из примера 20 и соединение из примера 22b значительно усиливали PudNS-индуцированное повышение анального давления.
Пример анализа 6: Подготовка и анализ давления в точке утечки мочи (Leak Point Pressure (LPP)) при увеличении абдоминального давления
Подготовка крысиной модели утечки мочи при абдоминальном давлении. Крысиная модель была подготовлена на основе способа Conway et. и др. (Int Urogynecol J 16:359-363, 2005). Самок SD-крыс (в возрасте от 10 до 14 недель) анестезировали пентобарбиталом. После лапаротомии делали разрез в куполе мочевого пузыря, и канюлю (РЕ 100, Becton, Dickinson и Company) вставляли в мочевой пузырь и сшивали ниткой. Кроме того, другую канюлю (РЕ 100, Becton, Dickinson и Company) вставляли в двенадцатиперстную кишку и сшивали ниткой. После закрытия брюшной полости мочу в мочевом пузыре сливали и вводили физиологический солевой раствор через канюлю в мочевом пузыре. Объем физиологического солевого раствора в мочевом пузыре поддерживался на уровне 75% от максимальной емкости мочевого пузыря (максимальная емкость была установлена как объем, при котором начинается утечка физиологического раствора из отверстия мочеиспускательного канала). Затем физиологический раствор вводили при скорости 0,6 мл/ч через установленную в мочевом пузыре канюлю с инфузионными насосами (TE-331S и STC-525, Terumo), и давление в мочевом пузыре регистрировали с использованием следующих приборов: датчика давления (DX-100, Nihon Kohden), усилителей давления (АР-601G, AP-621G и AP630G, Nihon Kohden) и интерфейса (Power Lab; ADInstruments). Параллельно с инфузией физиологического солевого раствора, живот крыс вручную прижимали крышкой пластиковой центрифужной пробирки объемом 50 мл, и давление в мочевом пузыре в тот момент времени, когда начиналась утечка из отверстия мочеиспускательного канала, определяли как LPP. Абдоминальное сжатие повторяли более пяти раз с интервалом в 1 минуту. Предварительное LPP устанавливали как среднее значение трех показателей LPP непосредственно перед дозированием соединения. 5 мл/кг служащего примером соединения 20, служащего примером соединения 22b или носителя (13,3% ДМСО, 13,3% PEG400, 13,3% Tween20 и 60% дистиллированной воды) дозировали через канюлю в двенадцатиперстной кишке, и LPP измеряли три раза в следующий каждый момент времени: 5, 15, 30, 45 и 60 минут после дозирования. Delta LPP рассчитывали на основе разницы с Pre-LPP.
Увеличение LPP. Как показано на ФИГ. 5 и 6, соединение из примера 20 и соединение из примера 22b увеличивали LPP в крысиной модели утечки мочи при увеличении абдоминального давления.
Аналитический пример 7: Подготовка и анализ по шкале Basso, Beattie и Bresnahan (ВВВ) после повреждения спинного мозга (post-spinal cord injury (SCI))
Подготовка крысиной модели после SCI: крысиная модель была подготовлена на основе способа Scheff et. и др. (J Neurotrauma, 2003, февраль, 20(2): 179-93.), который использует ударный элемент Infinite Horizon impactor (IH-0400, Precision Systems and Instrumentation). Самок SD-крыс (в возрасте 10 недель) анестезировали смесью 0,3 мг/кг медетомидина, 4 мг/кг мидазорама и 5 мг/кг буторфанола (s.c.). Разрезали дорсальную область крыс и вскрывали грудной отдел позвоночника от позвонка Т8 до позвонка Т12. Затем выполняли ламинэктомию на позвонках Т9 и Т10. На предметном столике IH-0400 открытый позвоночник крыс стабилизировали зажимом двумя пинцетами, прикрепленными к шарнирам IH-0400. Каждый из шарниров и пинцетов был плотно зажат.Травму Т9 и Т10 вызывали ударом стержня силой 210 кдин. После закрытия дорсальной области крыс размещали по одной в клетку для послеоперационного лечения, которое включает внутримышечные инъекции 5 мл физиологического солевого раствора и 50 мг/кг цефамецина внутримышечно дважды в день в течение недели после SCI, и включает ручное опорожнение мочевого пузыря крыс два раза в день с использованием приема Креде (Crede) до тех пор, пока не восстановится функция мочевого пузыря. В три временных интервала (день 6-7, день 13-14 и день 20-21 после SCI) выполняли дозирование и оценку по шкале ВВВ испытываемого вещества (соединение из примера 52 или носитель), как показано на ФИГ. 7. Показатель по шкале ВВВ определяли в соответствии с способом Basso et. al. (J Neurotrauma. 1995 Feb; 12(1):1-21.). Эффект служащего примером соединения 52 или носителя анализировали с использованием непарного t-критерия (значение вероятности менее 0,05 считали значимой разницей). Данные выражали как среднее ± SEM.
Увеличение оценки по шкале ВВВ. Как показано на ФИГ. 8, соединение из примера 52 увеличило оценку по шкале ВВВ в крысиной модели после SCI.
Пример анализа 8: Подготовка и анализ соотношения сила-кальций при хронической обструктивной болезни легких (ХОБЛ).
Образцы биопсий диафрагмы и широчайшей мышцы спины были получены от контрольных пациентов и пациентов с ХОБЛ, которые подвергались торакотомии для удаления первичной опухоли легкого. Все пациенты с ХОБЛ были классифицированы как имеющие умеренное или тяжелое заболевание в соответствии с классификацией GOLD. Часть свежей биопсии помещали в течение 24 часов при -20°C в 4 мл глицеринового «релаксационного» раствора (5,89 мМ Na2АТФ, 6,48 мМ MgCl2, 40,76 мМ Kprop, 100 мМ BES, 6,97 мМ ЭГТА, 14,50 мМ CrP), содержащего высокие концентрации протеазных ингибиторов (1,0 мМ ДТТ, 0,24 мМ ФМСФ, 0,4 мМ лейпептина, 0,1 мМ Е64). Сегменты одиночных волокон длиной приблизительно от 1 до 1,5 мм затем выделяли в релаксационном растворе при 5°C. На обоих концах были прикреплены два алюминиевых зажима. Мышечные волокна инкубировали в течение 10 минут в холодном (5°C) скиннинг-растворе (релаксационные растворы с 1% Тритон Х-100, 1,0 мМ ДТТ, 0,24 мМ ФМСФ, 0,04 мМ лейпептина, 0,01 мМ Е64) для пермеабилизации плазматической мембраны, обеспечивающей активацию мышечных филаментов с помощью экзогенного кальция. Затем мышечные волокна размещали горизонтально на двух крючках из нержавеющей стали в камере, заполненной релаксационным раствором (200 мкл), со стеклянным дном на предметном столике инвертированного микроскопа (Zeiss, The Netherlands). Один крючок был присоединен к силовому преобразователю (модель 403А Aurora Scientific Inc, Ontaria, Canada) с резонансной частотой 10 кГц, тогда как другой конец был присоединен к сервомотору (модель 315С, Aurora Scientific Inc, Aurora, Ontario, Canada) с шагом в 250 мкс. Размеры волокна измерялись с помощью устройства камеры, соединенного с объективом. Длину волокна определяли с 100-кратным увеличением, глубину и ширину измеряли в самой широкой части ячейки с увеличением в 400 раз (предполагали эллиптическое поперечное сечение миофибриллы). Волокна растягивали до оптимальной длины, устанавливая длину саркомера на 2,5 мкм с выделенным программным обеспечением Aurora. Чтобы обеспечить стабильное закрепление волокна в зажимах по всему механическому протоколу, мышечное волокно максимально активировали до эксперимента и, при необходимости, укорачивали, получая саркомер длиной 2,5 мкм. Отдельные мышечные волокна переносили из релаксационного в до-, суб- и максимально активирующие растворы (5,97 мМ Na2ATP, 7,0 мМ СаЭГТА, 6,28 мМ MgCl, 40,64 мМ Kprop, 100 мМ BES и 14,50 мМ CrP с рСа в диапазоне от 4,5 до 9) с помощью автоматизированного управляющего устройства ванны. Во время эксперимента данные автоматически собирались с помощью платы сбора данных (частота дискретизации 10000 Гц). Все измерения проводились при 20°C. Мышечные волокна активировали растворами, содержащими инкрементальные концентрации кальция с носителем (1% ДМСО) или 5 мкМ служащего примером соединения 20, и регистрировали полученную силу. Были проанализированы по меньшей мере пять быстросокращающихся мышечных волокон, полученных от одного субъекта. Полученные данные по зависимости силы от рСа были аппроксимированы к уравнению Хилла, давая рСа50. 5 мкМ служащего примером соединения 20 повышало чувствительность силы к кальцию в образцах диафрагм как от контрольных пациентов, так и от пациентов с ХОБЛ (контроль: 5,74±0,02 против 6,11±0,03, ХОБЛ: 5,76±0,02 против 6,11±0,02, среднее ± SEM, n=6/группа, р<0,0001). 5 мкМ служащего примером соединения 20 повышало чувствительность силы к кальцию в образцах широчайшей мышцы спины как от контрольных пациентов, так и от пациентов с ХОБЛ (контроль: 5,76±0,02 против 6,11±0,03, ХОБЛ: 5,78±0,02 против 6,13±0,02, среднее ± SEM, n=6/группа, р<0,0001). Данные по зависимости силы от рСа суммированы на ФИГ. 9 и 10. Значение определяется как *р<0,05 по сравнению с обработкой носителем.
Соединения формулы (I) или формулы (I') или их соль модулируют сокращение саркомера скелетной мышцы и, как ожидается, будут использоваться в качестве средства для предупреждения или лечения 1) нервно-мышечных нарушений, 2) нарушений добровольной мышцы, 3) нарушений ЦНС, при которых мышечная слабость, атрофия и усталость являются выраженными симптомами, 4) мышечных симптомов, вызванных системными расстройствами, и 5) дисфункции мышцы тазового дна и уретры/анального сфинктера.
В варианте осуществления настоящего изобретения соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения нервно-мышечных заболеваний, то есть заболеваний, которые влияют на любую часть нервно-мышечной единицы. Нервно-мышечные заболевания включают, например: 1) заболевания двигательной единицы, включая, но не ограничиваясь ими, боковой амиотрофический склероз (ALS), включающий варианты бульбарный и первичный боковой склероз (primary lateral sclerosis (PLS)); спинную мышечную атрофию (SMA) типа 1-4; синдром Кеннеди; синдром постполиомиелита; двигательные невропатии, включая, например, полинейропатию критического состояния; мультифокальную двигательную нейропатию с блоком проводимости; болезнь Шарко-Мари-Тута (Charcot-Marie-Tooth) и другие наследственные двигательные и сенсорные невропатии; и синдром Гийена-Барре (Guillain-Barre), 2) расстройства нервно-мышечного соединения, включая миастению, миастенический синдром Ламберта-Итона (Lambert-Eaton) и длительную нервно-мышечную блокаду из-за наркотиков или токсинов; и 3) периферические невропатии, такие как острая воспалительная демиелинизирующая полирадикулоневропатия, диабетическая невропатия, хроническая воспалительная демиелинизирующая полирадикулоневропатия, травматические поражения периферических нервов, невропатия проказы, васкулитная невропатия, дерматомиозит/полимиозит и невропатия атаксии Фридрейха (Friedreich).
В другом варианте осуществления настоящего изобретения соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения нарушений добровольной мышцы. Нарушения добровольной мышцы включают 1) мышечные дистрофии (в том числе, например, Дюшенна (Duchenne), Беккера (Becker), Лимба-Ридла (Limb-Girdle), плече-лопаточно-лицевая (Ландузи-Дежерина), Эмери-Дрейфуса (Emery-Dreyfus), окулофарингеальные и врожденные мышечные дистрофии); и 2) миопатии, такие как нематическая миопатия, заболевание центрального стержня, врожденные миопатии, митохондриальные миопатии, острая миопатия; воспалительные миопатии (такие как дерматомиозит/полимиозит и миозит включения), эндокринные миопатии (например, связанные с гипер- или гипотиреозом), синдром Кушинга или Аддисона или заболевания и расстройства гипофизарной железы, метаболические миопатии (такие как болезни хранения гликогена, например, болезнь Мак Ардля (McArdle), болезнь Помпе (Pompe) и т.д.), миопатия, вызванная лекарственными средствами (статинами, антиретровирусными препаратами, и стероидная миопатия), рестриктивное заболевание легких, саркоидоз, синдром Шварца-Джампеля (Schwartz-Jampel), фокальные мышечные атрофии и дистальные миопатии.
В конкретном варианте осуществления соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения бокового амиотрофического склероза (ALS). ALS представляет собой болезнь, которая обычно возникает в пожилом возрасте (возраст 50+) и характеризуется быстрым прогрессированием от начальной слабости конечности до паралича и смерти. Средняя продолжительность жизни после постановки диагноза составляет от 3 до 5 лет. Причина заболевания для большинства пациентов с ALS неизвестна (называется спонтанной формой), в то время как у небольшой части пациентов есть наследственная форма (семейная) болезни. Состояние вызывает прогрессирующую смерть двигательных нейронов по причинам, которые не ясны. Выжившие двигательные единицы пытаются компенсировать умирающие путем иннервирования большего количества волокон (называемого прорастанием), но это может лишь частично исправить мышечную функцию, так как мышцы впоследствии более подвержены проблемам координации и усталости. В конце концов, выжившие двигательные нейроны умирают, что приводит к полному параличу пораженной мышцы. Болезнь обычно смертельна в результате возможной потери иннервации диафрагмы, что приводит к респираторной недостаточности. Существующие варианты лечения для ALS ограничены.
В другом конкретном варианте осуществления соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения спинальной мышечной атрофии (SMA). SMA представляет собой генетическое заболевание, которое возникает из-за мутации белка, двигательного нейрона 1 выживаемости (survival motor neuron 1 (SMN1)), который, по-видимому, необходим для выживания и здоровья двигательных нейронов. Болезнь наиболее распространена у детей, так как большинство пациентов выживают только до 11-12 лет. В настоящее время доступное лечение SMA отсутствует.
В другом конкретном варианте осуществления соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения миастении. Myasthenia gravis (тяжелая миастения) представляет собой хроническое аутоиммунное нейромышечное заболевание, при котором организм вырабатывает антитела, которые блокируют, изменяют или разрушают белки, участвующие в передаче сигналов на нервно-мышечном соединении, тем самым предотвращая возникновение мышечного сокращения. Данные белки включают никотиновый ацетилхолиновый рецептор (AChR) или, реже, мышечно-специфическую тирозинкиназу (MuSK), участвующую в кластеризации ACHR (см., например, Drachman, N. Eng. J. of Med., 330: 1797-1810, 1994). Заболевание характеризуется разной степенью слабости скелетных (добровольных) мышц тела. Отличительной чертой миастении является мышечная слабость, которая увеличивается в периоды активности и облегчается после периодов отдыха. Хотя миастения может повлиять на любую добровольную мышцу, определенные мышцы, такие как те, которые контролируют движение глаз и век, выражение лица, жевание, разговоры и глотание, часто, но не всегда, вовлечены в расстройство. Также могут быть затронуты мышцы, которые контролируют дыхание, движения шеи и конечностей. В большинстве случаев первым заметным симптомом является слабость глазных мышц. В других случаях первыми признаками могут быть трудности с глотанием и невнятной речью. Степень мышечной слабости, проявляющейся при миастении, значительно варьирует у пациентов, начиная от локализованной формы, ограниченной глазными мышцами (глазная миастения), до тяжелой или обобщенной формы, в которой затрагиваются многие мышцы, иногда включающие те, которые контролируют дыхание. Симптомы, которые различаются по типу и тяжести, могут включать опускание одного или обоих век (птоз), размытое или двойное зрение (диплопия) из-за слабости мышц, которые контролируют движения глаз, нестабильную или ковыляющую походку, слабость в руках, руках, пальцах, ногах и шее, изменение выражения лица, затруднение глотания и одышку, а также нарушение речи (дизартрия). Общая слабость развивается приблизительно у 85% пациентов.
В других вариантах осуществления соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения саркопении, например, саркопении, связанной со старением или заболеванием (например, ВИЧ-инфекция). Саркопения характеризуется потерей массы, качества и силы скелетных мышц. Клинически, снижение массы ткани скелетных мышц (мышечная атрофия) способствует дряхлости у пожилых людей. У мужчин в возрасте от 50 до 80 лет мышечная масса снижается на одну треть. У пожилых людей продолжительная госпитализация может привести к дальнейшей атрофии из-за бездействия, что приведет к потенциальной потере способности к самостоятельной жизни и к прогрессирующему физическому упадку. Более того, процесс физического старения серьезно влияет на состав тела, включая значительное снижение мышечной массы тела и увеличение суммарного ожирения. Изменения в суммарном ожирении и распределении жира, по-видимому, являются важными факторами во многих распространенных возрастных заболеваниях, таких как гипертония, непереносимость глюкозы и диабет, дислипидемия и атеросклеротическое сердечнососудистое заболевание. Кроме того, возможно, что связанное со старостью уменьшение мышечной массы, а затем силы и физической выносливости может быть критическим фактором, определяющим функциональную потерю, зависимость и инвалидность. Слабость мышц также является одним из основных факторов, предрасполагающих пожилых людей к падению и возникающей заболеваемости и смертности.
Соединения и композиции, описанные и/или раскрытые в данном изобретении, как ожидается, будут применяться для лечения кахексии. Кахексия представляет собой состояние, часто связанное с раком или другими серьезными заболеваниями или состояниями (например, хроническая обструктивная болезнь легких (ХОБЛ), сердечная недостаточность, хроническое заболевание почек и почечный диализ), которое характеризуется прогрессирующей потерей веса, атрофией мышц и усталостью, обусловленной потерей жировой ткани и скелетных мышц.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения мышечных дистрофий. Мышечная дистрофия может характеризоваться прогрессирующей мышечной слабостью, разрушением и регенерацией мышечных волокон и возможной заменой мышечных волокон волокнистой и жировой соединительной тканью.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения постхирургической мышечной слабости, которая представляет собой уменьшение силы одной или нескольких мышц после хирургической процедуры. Слабость может быть общей (т.е. полная слабость тела) или локализованной в определенной области, стороне тела, конечности или мышцах.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения посттравматической мышечной слабости, что выражается в уменьшении силы одной или нескольких мышц после травматического эпизода (например, телесного повреждения). Слабость может быть общей (т.е. полная слабость тела) или локализованной в определенной области, стороне тела, конечности или мышцах.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения мышечной слабости и усталости, вызванной заболеванием периферическиой сосудистой системы (peripheral vascular disease (PVD)) или заболеванием периферических артерий (peripheral artery disease (PAD)). Заболевание периферическиой сосудистой системы является заболеванием или расстройством системы кровообращения вне мозга и сердца. Заболевание периферических артерий (PAD), также известное как окклюзионная болезнь периферических артерий (PAOD), представляет собой форму PVD, при которой происходит частичная или полная блокировка артерии, которая обычно ведет к ноге или руке. PVD и/или PAD могут быть результатом, например, атеросклероза, воспалительных процессов, ведущих к стенозу, образования эмболов/тромбов или повреждения кровеносных сосудов из-за заболевания (например, диабета), инфекции или травмы. PVD и/или PAD могут вызывать острую или хроническую ишемию, как правило, ног. Симптомы PVD и/или PAD включают боль, слабость, онемение или судороги в мышцах из-за снижения кровотока (хромота или синдром Шарко), мышечную боль, боли, судороги, онемение или усталость, которые возникают во время физических нагрузок, и облегчаются благодаря короткому периоду отдыха (перемежающаяся хромота), боль при отдыхе (боль в состоянии покоя) и потерю биологической ткани (гангрена). Симптомы PVD и/или PAD часто встречаются в мышцах голени, но симптомы могут наблюдаться и в других мышцах, таких как мышцы тазобедренного сустава или бедра. Факторы риска для PVD и/или PAD включают возраст, ожирение, сидячий образ жизни, курение, диабет, высокое кровяное давление и высокий уровень холестерина (то есть высокий уровень ЛПНП и/или высокий уровень триглицеридов и/или низкий уровень ЛПВП). Люди, у которых есть ишемическая болезнь сердца или история сердечного приступа или инсульта, также имеют повышенную частоту наличия PVD и/или PAD. Показано, что активаторы быстрого скелетного тропонинового комплекса уменьшают мышечную усталость и/или увеличивают общее время до усталости в моделях сосудистой недостаточности in vitro и in situ (см., например, Russell et al., "The Fast Skeletal Troponin Activator, CK-2017357, Increases Skeletal Muscle Force and Reduces Muscle Fatigue in vitro and in situ", 5th Cachexia Conference, Barcelona, Spain, December 2009; Hinken et al., "The Fast Skeletal Troponin Activator, CK-2017357, Reduces Muscle Fatigue in an in situ Model of Vascular Insufficiency", Society for Vascular Medicine's 2010 Annual Meeting: 21st Annual Scientific Sessions, Cleveland, OH, April 2010).
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения симптомов слабости, например, слабости, связанной со старением, которая, как было показано, влияет на истощение двигательной единицы и мышечную мощь (McComas, Journal of Electromyography and Kinesiology, Vol. 8, 391-402, 1998). Старческая слабость характеризуется одним или более из непреднамеренной потери массы, мышечной слабости, медленной скорости при ходьбе, истощения и низкой физической активности.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, используются для лечения мышечной слабости и/или усталости, вызванными синдромом истощения, что является состоянием, характеризующимся непроизвольной потерей массы, связанной с хронической лихорадкой и диареей. В некоторых случаях пациенты с синдромом истощения теряют 10% от базовой массы тела в течение одного месяца.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения мышечных заболеваний и состояний, вызванных структурными и/или функциональными аномалиями ткани скелетных мышц, включая мышечные дистрофии, врожденные мышечные дистрофии, врожденные миопатии, дистальные миопатии, другие миопатии (например, миофибриллярные, с тельцами включения), миотонические синдромы, болезни мышечных ионных каналов, злокачественные гипертермии, метаболические миопатии, врожденные миастенические синдромы, саркопению, атрофию мышц и кахексияю.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения заболеваний и состояний, вызванных мышечной дисфункцией, возникающей из-за нейронной дисфункции или передачи, включая боковой амиотрофический склероз, спинальные мышечные атрофии, наследственные атаксии, наследственные двигательные и сенсорные невропатии, наследственные параплегии, инсульт, рассеянный склероз, черепно-мозговые травмы с двигательным дефицитом, травмы спинного мозга, болезнь Альцгеймера, болезнь Паркинсона с двигательным дефицитом, тяжелую миастению и синдром Ламберта-Итона.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения заболеваний и состояний, вызванных дисфункцией ЦНС, спинного мозга или мышц, происходящей вследствии эндокринной и/или метаболической дисрегуляции, включая хромоту, вторичную по отношению к заболеваниям периферических артерий, гипотиреоз, гипер- или гипопаратиреоз, диабет, дисфункцию надпочечников, дисфункцию гипофиза и кислотно/основные дисбалансы.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться для лечения заболеваний и состояний, вызванных дисфункциями мышц тазового дна и уретры/анального сфинктера, включая недержание мочи, такое как стрессовое недержание мочи (SUI) и смешанное недержание мочи (MUI), и недержание кала (Bharucha et al., Am. J. Gacrpoenterol., Vol. 110, 127-36 (2015)).
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться в сочетании с одним или несколькими устройствами электрической стимуляции мышцы (electrical muscle stimulation (EMS)) для лечения стрессового недержания мочи, смешанного недержания мочи и недержания кала. Примеры устройств EMS включают InterStim II® (Стимулятор сакрального нерва, Medtronic; сакральный нерв контролирует уретральный сфинктер, анальный сфинктер и мышцу тазового дна) и Uromaster® (Интерференциальная низко-частотная стимуляция уретрального сфинктера, анального сфинктера и мышцы тазового дна; Nihon Medix Co.). Совокупное воздействие соединений по настоящему изобретению и EMS на уретральный сфинктер, анальный сфинктер и мышцу тазового дна видно из результатов примера 2 из WO 2016/039367 или примера анализа 5 данного описания (Подготовка и анализ анального давления, вызванного электрической стимуляцией пудендального нерва).
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться в сочетании с одним или несколькими устройствами стимуляции электрической мышцы (EMS) для лечения мышечной дисфункции после инсульта, мышечной дисфункции после повреждения спинного мозга (SCI) и нарушений, связанных с реабилитацией. Примеры устройств EMS включают NESS L300® (Limb muscle stimulator; Bioness Inc.), NESS L300®Plus (Limb muscle stimulator; Bioness Inc.), NESS H200® (Limb muscle stimulator; Bioness Inc.), IVES® (Limb muscle stimulator; OG Wellness Technologies Co., Ltd), WalkAide® (Limb muscle stimulator; Innovative Neurotronics, Inc.) и NM-F1, (Limb muscle stimulator; ITO PHYSIOTHERAPY&REHABILITATION). Совокупное воздействие соединений по настоящему изобретению и EMS на конечную мышцу видно из результатов примера анализа 2 данного описания (подготовка и анализ изометрической мышечной силы подошвенного сгибателя стопы крысы) или из результатов исследования, описанного в Muscle Nerve. 2014 Dec; 50(6):925-31.
Также ожидается, что соединения и композиции, описанные и/или раскрытые в настоящем изобретении, будут применяться в сочетании с одним или несколькими устройствами стимуляции электрической мышцы (EMS) для лечения дисфункций мышц диафрагмы при боковом амиотрофическом склерозе (ALS) и после повреждения спинного мозга (SCI). Примеры устройств EMS включают NeuRx Diaphragm Pacing System (DPS)® (Diaphragm muscle stimulator; SYNAPSE Biomedical Inc.). Совокупное воздействие соединений по настоящему изобретению и EMS на диафрагму видно из результатов исследования, описанного в PLoS One. 2014; 9 (5): е96921.
Соединения и композиции, описанные и/или раскрытые в настоящем изобретении, могут вводиться отдельно или в сочетании с другими видами терапии/или терапевтическими средствами, применимыми для лечения вышеупомянутых расстройств.
Фармацевтическая композиция, включающая один или два или более видов соединения формулы (I) или формулы (I) в качестве активного ингредиента, может быть приготовлена с использованием эксципиента, который обычно используется в данной области, то есть эксципиента для фармацевтического препарата, носителя для фармацевтического препарата и тому подобное, в соответствии с обычно используемым способом.
Фармацевтическая композиция по настоящему изобретению может включать одно или более соединений формулы (I) или формулы (I') или любого его варианта осуществления, включая, без ограничения, любой из вариантов осуществления от 1-1 до 8-4 и любой из вариантов осуществления (1)-(57). Фармацевтическая композиция может содержать один энантиомер любого из соединений формулы (I) или формулы (I'), содержащего его, или один диастереомер любого из соединений формулы (I) или формулы (I'), содержащего его, или смесь энантиомеров или диастереомеров любого из соединений формулы (I) или формулы (I'), содержащего ее в любом соотношении.
Введение может осуществляться либо пероральным введением посредством таблеток, пилюль, капсул, гранул, порошков, растворов и тому подобного, либо парентеральным введением посредством инъекций, таких как внутрисуставные, внутривенные и внутримышечные инъекции, суппозиториев, трансдермальных жидких препаратов, мазей, трансдермальных пластырей, трансмукозальных жидких препаратов, трансмукозальных пластырей, ингаляторов и тому подобного.
В качестве твердой композиции для перорального введения используются таблетки, порошки, гранулы и тому подобное. В такой твердой композиции один или два или более видов активных ингредиентов смешивают по меньшей мере с одним неактивным эксципиентом. В обычном способе композиция может содержать неактивные добавки, такие как смазывающее средство, разрыхлитель, стабилизатор или вспомогательное средство для солюбилизации. При необходимости таблетки или пилюли могут быть покрыты сахаром или пленкой вещества для желудочного или энтеросолюбильного покрытия.
Жидкая композиция для перорального введения включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры или тому подобное, а также включает в себя обычно используемые инертные разбавители, например очищенную воду или этанол. В дополнение к инертному разбавителю, жидкая композиция может также включать вспомогательные вещества, такие как вспомогательное вещество для солюбилизации, увлажняющее вещество и суспендирующее вещество, подсластители, ароматизаторы, ароматические соединения и антисептики.
Инъекции для парентерального введения включают стерильные водные или неводные растворы, суспензии или эмульсии. Водный растворитель включает, например, дистиллированную воду для инъекций и физиологический солевой раствор. Примеры неводного растворителя включают спирты, такие как этанол. Такая композиция может дополнительно включать в себя вещество для поддержания тоничности, антисептик, увлажняющее вещество, эмульгатор, диспергирующее вещество, стабилизирующее вещество или вспомогательное вещество для солюбилизации. Они стерилизуются, например, фильтрацией через удерживающий бактерии фильтр, примешивание бактерицида или облучение. Кроме того, они также могут быть использованы путем приготовления стерильной твердой композиции и растворения или суспендирования в стерильной воде или стерильном растворителе для инъекций до ее применения.
Примеры средства для внешнего применения включают мази, твердые пластыри, кремы, желе, припарки, спреи и лосьоны. Средство дополнительно содержит обычно используемые мазевые основы, лосьонные основы, водные или неводные жидкие препараты, суспензии, эмульсии и т.п.
В качестве трансмукозальных средств используют ингалятор и трансназальное средство в виде твердого, жидкого или полутвердого состояния, и они могут быть получены в соответствии со способом, известным в соответствующем уровне техники. Например, к ним может быть соответствующим образом добавлен известный эксципиент, а также вещество, регулирующее pH, антисептик, поверхностно-активное вещество, смазывающее вещество, стабилизирующее вещество, загуститель или тому подобное. Для введения может быть использовано соответствующее устройство для ингаляции или продувки. Например, соединение можно вводить отдельно или в виде порошка приготовленной смеси, или в виде раствора или суспензии в сочетании с фармацевтически приемлемым носителем с использованием известного устройства или распылителя, такого как дозированное ингаляционное устройство для введения. Сухой порошковый ингалятор или тому подобное может использоваться для однократного или многократного применения, и может использоваться сухой порошок или капсула, содержащая порошок. Альтернативно, препарат может быть в таком виде, как аэрозольный спрей под давлением, который использует подходящий пропеллент, например подходящий газ, такой как хлорфторалканы и диоксид углерода, или в других видах.
Обычно, в случае перорального введения суточная доза составляет от около 0,001 мг/кг до 100 мг/кг, предпочтительно от 0,1 мг/кг до 30 мг/кг и более предпочтительно от 0,1 мг/кг до 10 мг/кг, на массу тела, вводимая одной порцией или от 2 до 4 разделенными порциями. В случае внутривенного введения ежедневную дозу целесообразно вводить от около 0,0001 мг/кг до 10 мг/кг на массу тела один раз в день или два или более раз в день. Кроме того, трансмукозальное средство вводят в дозе от около 0,001 мг/кг до 100 мг/кг на массу тела один раз или несколько раз в день. Решение о величине дозы принимается надлежащим образом в ответ на индивидуальный случай, принимая во внимание симптомы, возраст, пол и тому подобное.
Хотя существуют различия в зависимости от пути введения, лекарственной формы, места введения и типа экципиента или добавки, фармацевтическая композиция по изобретению содержит от 0,01 мас. % до 100 мас. %, как вариант осуществления, от 0,01 мас. % до 50 мас. %, одного или более соединений формулы (I) или формулы (I') или его соли, которое является активным ингредиентом.
Соединение формулы (I) или формулы (I') можно применять в сочетании с различными средствами для лечения или профилактики заболеваний, на которые, как считают, соединение формулы (I) или формулы (I') оказывает воздействие. Такие комбинированные препараты можно вводить одновременно или отдельно и непрерывно, или в желаемом временном интервале. Препараты, подлежащие совместному введению, могут быть смесью или могут быть приготовлены индивидуально.
Другие признаки изобретения станут очевидными в ходе следующих описаний вариантов осуществления, служащих примерами, которые приведены для иллюстрации изобретения и не предназначены для его ограничения.
ПРИМЕРЫ
Способ получения соединения формулы (I) или формулы (I') будет описан в настоящем изобретении ниже более подробно со ссылкой на примеры. Кроме того, изобретение не ограничено соединениями, описанными в примерах ниже. Кроме того, способы получения исходных соединений будут описаны в примерах получения. Кроме того, производственные процессы для соединения формулы (I) или формулы (I') не ограничиваются производственными процессами конкретных примеров, показанных ниже, но соединение формулы (I) или формулы (I') может быть получено объединением данных технологических процессов или способом, очевидным для специалиста в данной области техники.
Кроме того, номенклатурное программное обеспечение, такое как ACD/Name (зарегистрированная торговая марка, Advanced Chemistry Development, Inc.), может быть использовано в данное спецификации для номенклатуры соединений в некоторых случаях.
Более того, следующие сокращения могут быть использованы в примерах, примерах подготовки и таблицах ниже в некоторых случаях. Например, "Стр" обозначает структурную химическую формулу («Ме» представляет метил, «Et» представляет этил, «Ас» представляет ацетил, «п-Bu» представляет н-бутил, «tBu» или «t-Bu» представляет трет-бутил, «сНех» представляет циклогексил, «Ph» представляет фенил, «Bz» представляет бензил, «SEM» представляет [2-(триметилсилил)этокси]метил, «TBDMS» представляет трет-бутилдиметилсилил, «TMS» представляет собой триметилсилил, «Вос» представляет трет-бутоксикарбонил), «EtOAc» представляет этилацетат, «DMAc» представляет N,N-диметилацетамид, «tBuOH» представляет трет-бутиловый спирт, «IPE» представляет диизопропиловый эфир, «DMI» представляет 1,3-диметилимидазолидин-2-он, «DMFA» представляет N,N-диметилформамид, «THF» представляет тетрагидрофуран, «MeCN» представляет ацетонитрил, «NMP» представляет 1-метилпирролидин-2-он, «DCE» представляет 1,2-дихлорэтан, «TFA» представляет трифторуксусную кислоту, «WSC/HCl» представляет гидрохлорид N-[3-(диметиламино)пропил]-N'-этилкарбодиимида, «HOBt» представляет 1Н-бензотриазол-1-ол, «TBAF» представляет тетрабутиламмоний фторид, «Pd2(dba)3» представляет трис(дибензилиденацетон)дипалладий, «NaHMDS» представляет бис(триметилсилил)амид натрия, «n-BuLi» представляет н-бутиллитий, «KOtBu» представляет трет-бутоксид калия, «EtOH», представляет этанол, «Et2O» представляет диэтиловый эфир, «DMSO» представляет диметилсульфоксид, «KOAc» представляет ацетат калия, «MeI» представляет метилиодид и «DIPEA» представляет N,N-диизопропилэтиламин, «мин» представляет минуты, «водн.» представляет водный раствор, «Ar» представляет аргон, «ВЭЖХ» означает высокоэффективную жидкостную хроматографию, «DAT» означает физико-химические данные, «NMR» означает ядерный магнитный резонанс, «ESI+» означает значения m/z в масс-спектроскопии (способ электрораспылительной ионизации ESI, представляя [М+Н]+, если не указано иное), «APCI/ESI+» означает APCI/ESI-MS (способ химической ионизации атмосферного давления APCI, представляя [М+Н]+, если не указано иное; где APCI/ESI означает одновременное измерение APCI и ESI), «APCI» означает значения m/z в масс-спектроскопии (способ химической ионизации атмосферного давления APCI, представляя [М+Н]+, если не указано иное), 1H-NMR (CDCl3): δ (м.д.) пиков в 1H-NMR в CDCl3, 1H-NMR (DMSO-d6): δ (м.д.) пиков в 1H-NMR в DMSO-d6, 1H-NMR (CD3OD): δ (м.д.) пиков в 1Н-NMR в CD3OD, s: синглет (спектр), d: дублет (спектр), t: триплет (спектр), q: квартет (спектр), br: широкая линия (спектр) (например, brs), m: мультиплет (спектр). SFC представляет сверхкритическую флюидную хроматографию. Амино-кремнезем представляет аминофункциональный силикагель, такой как Chromatorex NH (торговая марка и Hi-flash амино (торговая марка).
Символ «*» в химической структурной формуле указывает, что соответствующее соединение представляет собой единственный оптический изомер. Символ «#» указывает, что соответствующее соединение представляет собой смесь изомеров, которые имеют конфигурации (R) и (S), соответственно, в асимметричном атоме, причем стерическая конфигурация не показана (рацемат). Символ «$» указывает, что соответствующее соединение представляет собой смесь из 4 стереоизомеров. Кроме того, HCl в структурной формуле указывает, что данное соединение является моногидрохлоридом; 2HCl указывает, что данное соединение представляет собой дигидрохлорид.
Кроме того, для удобства, концентрация в моль/л представлена обозначением М. Например, 1 М водный раствор гидроксида натрия означает 1 моль/л водного раствора гидроксида натрия.
При выполнении хиральной сверхкритической флюидной хроматографии (supercritical fluid chromatography (SFC)) в примерах 92а и 92b использовали CHIRALCEL® OZ-H в качестве колонки, СО2:МеОН=80:20 в качестве подвижной фазы. При выполнении хиральной сверхкритической флюидной хроматографии (SFC) в примерах 134а и 134b использовали ChromegaChiral СС4 в качестве колонки, СО2:EtOH с 0,5% изопропиламином = 85:15 в качестве подвижной фазы.
Результат порошковой дифракции рентгеновских лучей в настоящем изобретении измеряли с использованием RINT-TTRII при следующих условиях трубки: Cu, ток в трубке: 300 мА, напряжение на трубке: 50 кВ, ширина выборки: 0,020°, скорость сканирования: 4°/мин, длина волны: 1,54184 Å и диапазон измерения углов дифракции (2θ): от 2,5° до 40°.
Пример получения 1 (1а и 1b)
К твердому раствору Р2О5 (50,0 г) добавляли Н3РО4 (50,6 г) и смесь перемешивали при 140°С в течение 1,5 часов. К смеси добавляли 2-(3-бромфенил)ацетамид (5,00 г) и ацетон (3,5 мл) при 80°С и затем перемешивали при 140°С в течение 2 часов. К смеси добавляли ацетон (2,0 мл) при 140°С и перемешивали при той же температуре в течение 1 часа. Затем к смеси снова добавили ацетон (2,0 мл) при 140°С и перемешивали при той же температуре в течение дополнительного 1 часа. Смесь выливали в ледяную воду и разбавляли EtOAc, и фазы разделяли. Органический слой промывали насыщен. водн. NaHCO3 и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CHCl3/МеОН). Полученное твердое вещество промывали 50% EtOAc/гексаны с получением 6-бром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (2,01 г) в виде твердого вещества. Маточную жидкость концентрировали при пониженном давлении с получением смеси 1:1 6-бром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она и 8-бром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (996 мг) в виде твердого вещества.
Пример получения 2
Смесь 6-бром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (100 мг), N-бромсукцинимида (72 мг), 3-хлорпербензойной кислоты (7 мг) и CCl4 (3 мл) кипятили с обратным холодильником в течение 3 часов. Затем смесь охлаждали до комнатной температуры, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 4,6-дибром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (75 мг) в виде твердого вещества.
Пример получения 3
К смеси 2-(3-бромфенил)бутановой кислоты (582 мг) и MeCN (10 мл) добавляли WSC/HCl (551 мг) и HOBt (389 мг) в атмосфере Ar и смесь перемешивали при комнатной температуре в течение 1 часа. К смеси добавляли 28% водн. аммиака (0,8 мл) при охлаждении на ледяной бане по каплям в течение 5 мин. Затем смесь перемешивали при комнатной температуре в течение 13 часов. Смесь концентрировали при пониженном давлении, разбавляли H2O и перемешивали при охлаждении на ледяной бане в течение 1 часа. Осадок собирали, получая неочищенный продукт в виде твердого вещества. Полученное твердое вещество очищали колоночной хроматографией на силикагеле (EtOAc/CHCl3) с получением 2-(3-бромфенил)бутанамида (427 мг) в виде твердого вещества.
Пример получения 4
Смесь 1-(2,6-дихлорпиридин-3-ил)этан-1-она (78,8 г), CH2Cl2 (300 мл), 2-метилпропан-2-сульфинамида (60,6 г) и тетраэтоксида титана (284,4 г) перемешивали при 50°С в течение ночи. Добавляли дополнительный тетраэтоксид титана (50,0 г) и смесь перемешивали при 50°С в течение 4 часов. Смесь охлаждали до комнатной температуры и затем медленно добавляли водн. NaHCO3. Затем смесь фильтровали через слой целита и слой целита промывали CH2Cl2. Фильтрат концентрировали, суспендировали в EtOAc и затем промывали насыщен. водн. NaHCO3. Органический слой сушили над Na2SO4, концентрировали и затем очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением N-[1-(2,6-дихлорпиридин-3-ил)этилиден]-2-метилпропан-2-сульфинамида (63,9 г) в виде масла.
Пример получения 5
К смеси N-[1-(2,6-дихлорпиридин-3-ил)этилиден]-2-метилпропан-2-сульфинамида (130,5 г) и THF (300 мл) медленно добавляли аллил-бромид магния (1 M в Н2О, 447 мл) при -78°С. Смесь перемешивали при -78°С в течение 2 часов с последующим медленным добавлением насыщен. водн. NaHCO3 (600 мл). Смесь нагревали до комнатной температуры и фильтровали через слой целита. Целит промывали EtOAc. Фильтрат промывали три раза насыщен. водн. NaHCO3 (100 мл). Органический слой сушили над Na2SO4 и затем концентрировали с получением N-[2-(2,6-дихлорпиридин-3-ил)пент-4-ен-2-ил]-2-метилпропан-2-сульфинамида (134,8 г) в виде масла.
Пример получения 6
К смеси 5-хлор-2,3-дифторпиридина (9,0 г), изобутиронитрила (4,2 г) и толуола (120 мл) добавляли NaHMDS (2 M в THF, 30,6 мл) при -78°С. Смесь затем перемешивали в течение 1 часа. Смесь разбавляли насыщен. водн. NH4Cl (50 мл) и нагревали до комнатной температуры. Затем смесь разбавляли EtOAc (300 мл), промывали водой (100 мл), насыщенным солевым раствором (100 мл), сушили над Na2SO4, концентрировали и затем очищали колоночной хроматографией на силикагеле (EtOAc/гексаны), получая 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропаннитрил (10,6 г) в виде твердого вещества.
Пример получения 7
Смесь 2-(2,6-дихлорпиридин-3-ил)-2-метилпропаннитрила (10,00 г) и серной кислоты (100 мл) перемешивали при комнатной температуре в течение 12 часов. Смесь выливали в ледяную воду и смесь подщелачивали 28% водным раствором аммиака. К смеси добавляли EtOAc и H2O, и фазы разделяли. Водный слой экстрагировали EtOAc, и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 2-(2,6-дихлорпиридин-3-ил)-2-метилпропанамида (10,76 г) в виде твердого вещества.
Пример получения 8
К смеси 2-(2,6-дихлорпиридин-3-ил)-2-метилпропанамида (10,76 г), MeCN (220 мл) и Н2О (110 мкл) добавляли [бис(трифторацетокси)йод]бензол (22,00 г) при комнатной температуре. Затем смесь перемешивали при комнатной температуре в течение 24 часов. Смесь разбавляли насыщен. водн. NaHCO3. К смеси добавляли EtOAc и H2O, и фазы разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои экстрагировали 1 М водным раствором. HCl. Водный слой подщелачивали водным NaHCO3 и экстрагировали EtOAc, и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 2-(2,6-дихлорпиридин-3-ил)пропан-2-амина (9,40 г) в виде масла.
Пример получения 9
К смеси 2-(2,6-дихлорпиридин-3-ил)пропан-2-амина (4,40 г) и 2,4-диметоксибензальдегида (3,92 г) и CH2Cl2 (100 мл) добавляли триацетоксиборгидрид натрия (6,80 г) при комнатной температуре. Затем смесь перемешивали при той же температуре в течение 12 часов. К смеси добавляли CHCl3 и насыщен. водн. NaHCO3 и фазы разделяли. Водный слой экстрагировали CHCl3 и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основе аминосиликагеля (EtOAc/гексаны) с получением 2-(2,6-дихлорпиридин-3-ил)-N-(2,4-диметоксибензил)пропан-2-амина (7,62 г) в виде масла.
Пример получения 10
К смеси 2-(2,6-дихлорпиридин-3-ил)-N-(2,4-диметоксибензил)пропан-2-амина (7,62 г), 2,6-диметилпиридина (7,5 мл) и толуола (100 мл) добавляли смесь этил 2-(хлоркарбонил) бутаноата (5,55 г) и толуола (20 мл) с охлаждением на ледяной бане в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 30 мин и перемешивали при комнатной температуре в течение 6 часов. К смеси добавляли EtOAc и насыщен. водн. NaHCO3 и фазы разделяли. Водный слой, экстрагированный EtOAc, и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на основе аминосиликагеля (EtOAc/гексаны) с получением этил-2-{[2-(2,6-дихлорпиридин-3-ил)пропан-2-ил](2,4-диметоксибензил)карбамоил}бутаноата (9,65 г) в виде твердого вещества.
Пример получения 11
К смеси трет-бутил-2-{[1-{[трет-бутил(диметил)силил]окси}-2-(3,5-дихлорпиразин-2-ил)пропан-2-ил]карбамоил}бутаноата (1,17 г, 1:1 всех стереоизомеров) и безводного толуола (10 мл) добавляли по каплям NaHMDS (1 M в толуоле, 6,95 мл) при охлаждении на ледяной бане. Смесь перемешивали при той же температуре в течение 2 часов. Смесь разбавляли насыщен. водн. NH4Cl (30 мл) и экстрагировали EtOAc (2×75 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением трет-бутил-5-({[трет-бутил(диметил)силил]окси}метил)-2-хлор-8-этил-5-метил-7-оксо-5,6,7,8-тетрагидропиридо[3,4-b]пиразин-8-карбоксилата (457 мг, смесь 3:2 всех стереоизомеров) в виде масла.
Пример получения 12
К смеси 5,5,8-триметил-7-оксо-8-(проп-2-ин-1-ил)-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила (40 мг) и DMSO2O (5:1, 1 мл) добавляли триметилсилиметилазид (100 мг), сульфат меди (1) (1 мг) и аскорбат натрия (3 мг). Смесь перемешивали при комнатной температуре в течение 18 часов с последующей фильтрацией через фильтр в шприце. Фильтрат затем очищали с помощью ВЭЖХ (от 1 до 50% MeCN, 0,1% муравьиной кислоты) с получением 5,5,8-триметил-7-оксо-8-({1-[(триметилсилил)метил]-1Н-1,2,3-триазол-4-ил}метил)-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила (29 мг) в виде твердого вещества.
Пример получения 13
Смесь 2-(трет-бутоксикарбонил)бутановой кислоты (14,8 г), тионилхлорида (11,5 мл), CH2Cl2 (80 мл) и DMF (4 капли) перемешивали при комнатной температуре в течение 2 часов, а затем концентрировали с получением трет-бутил-2-(хлоркарбонил)бутаноата (16,1 г) в виде масла.
Пример получения 14
К смеси 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропаннитрила (7,5 г), DMSO (75 мл) и K2CO3 (7,85 г) медленно добавляли Н2О2 (30% водный раствор, 44 мл) при охлаждении на ледяной бане. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Затем реакционную смесь разбавляли EtOAc (300 мл), промывали Н2О (100 мл), насыщенным солевым раствором (100 мл), сушили над Na2SO4 и концентрировали с получением 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропанамида (8,2 г) в виде твердого вещества.
Пример получения 15
К смеси 2,2,6,6-тетраметилпиперидина (45 мл) и THF (350 мл) добавляли н-BuLi (1,55 М в гексане, 155 мл) с охлаждением на бане сухой лед-ацетон в атмосфере Ar. Затем смесь перемешивали при охлаждении на ледяной бане в течение 10 мин. К смеси добавляли смесь 2,6-дихлорпиридина (36,96 г) и THF (100 мл) при охлаждении на бане сухой лед-ацетон в течение 20 мин. Затем смесь перемешивали при той же температуре в течение 1 часа. К смеси добавляли смесь 2-метил-N-(оксетан-3-ORден)пропана-2-сульфинамида (35,00 г) и THF (50 мл) при той же температуре в течение 30 мин. Затем смесь перемешивали при той же температуре в течение 1 часа. Смесь разбавляли насыщен. водн. NH4Cl (200 мл) при той же температуре. К смеси добавляли EtOAc (200 мл) и затем отделяли органический слой. Водный слой экстрагировали EtOAc (200 мл) и объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток дважды очищали колоночной хроматографией на силикагеле (CHCl3/EtOAc и EtOAc/гексаны), получая N-[3-(2,6-дихлорпиридин-3-ил)оксетан-3-ил]-2-метилпропан-2-сульфинамид (31,58 г) в виде пены.
Пример получения 16
К смеси N-[3-(2,6-дихлорпиридин-3-ил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (79,29 г) и EtOAc (1,2 л) добавляли HCl (4 M в EtOAc, 184 мл) при комнатной температуре. Затем смесь перемешивали при той же температуре в течение 1 часа. Осадок собирали и промывали EtOAc с получением моногидрохлорида 3-(2,6-дихлорпиридин-3-ил)оксетан-3-амина (59,61 г) в виде твердого вещества.
Пример получения 17
Смесь N-[3-(3,5-дихлорпиразин-2-ил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (1,21 г), 2-(трет-бутоксикарбонил)бутановой кислоты (847 мг), иодида 2-хлор-1-метилпиридиния (1,44 г), триэтиламина (758 мг) и MeCN (20 мл) кипятили с обратным холодильником в течение 4 часов и частично концентрировали (около 5 мл). Остаток растворяли в EtOAc, промывали H2O, насыщенным солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением трет-бутил-2-{[3-(3,5-дихлорпиразин-2-ил)оксетан-3-ил]карбамоил}бутаноата (951 мг) в виде твердого вещества.
Пример получения 18
К смеси 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,70 г) и DMF (45 мл) добавляли NaH (55%-ная дисперсия в минеральном масле, 363 мг) при охлаждении на ледяной бане. Затем смесь перемешивали при той же температуре в течение 10 мин. К смеси добавляли [2-(хлорметокси)этил](триметил)силан (1,20 мл) при охлаждении на ледяной бане. Затем смесь перемешивали при комнатной температуре в течение 4 часов. При охлаждении на ледяной бане добавляли дополнительный NaH (55%-ная дисперсия в минеральном масле, 368 мг) и [2-(хлорметокси)этил](триметил)силан (1,20 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли насыщен. водн. NH4Cl. К смеси добавляли Н2О и EtOAc, и фазы разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-хлор-8,8-диэтил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,73 г) в виде масла.
Пример получения 19
К смеси 2-хлор-8,8-диэтил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,73 г), 1,4-диоксана (35 мл) и H2O (3,5 мл) добавляли 2,4,6-тривинилциклотрибороксановый пиридиновый комплекс (2,08 г), [1,1'-бис(дифенилфосфино) ферроцен]дихлорпалладий (II) (330 мг) и K2CO3 (1,76 г). Затем смесь перемешивали при 110°С в течение 4 часов. Смесь фильтровали через слой целита. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 8,8-диэтил-6-{[2-(триметилсилил)этокси]метил}-2-винил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,37 г) в виде смолы.
Пример получения 20
К смеси 8,8-диэтил-6-{[2-(триметилсилил)этокси]метил}-2-винил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,37 г), THF (72 мл) и H2O (18 мл) добавляли OsO4 (2,5 мас. % в tBuOH, 3,50 мл) при комнатной температуре. Затем смесь перемешивали при комнатной температуре в течение 10 мин. К смеси добавляли смесь периодата натрия (2,31 г) и Н2О (54 мл). Затем смесь перемешивали при комнатной температуре в течение 3 часов. Смесь разбавляли насыщен. водн. Na2S2O3 (100 мл) и концентрировали при пониженном давлении. К смеси добавляли EtOAc и фазы разделяли. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 8,8-диэтил-7-оксо-6-{[2-(триметилсилил)этокси]метил}-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбальдегида (524 мг) в виде твердого вещества.
Пример получения 21
К смеси 8,8-диэтил-7-оксо-6-{[2-(триметилсилил)этокси]метил}-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбальдегида (524 мг) и THF (15 мл) добавляли NaBH4 (66 мг) при охлаждении на ледяной бане в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 2 часов. Смесь разбавляли насыщен. водн. NH4Cl. К смеси добавляли EtOAc и фазы разделяли. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 8,8-диэтил-2-(гидроксиметил)-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (567 мг) в виде твердого вещества.
Пример получения 22
К смеси 8,8-диэтил-2-(гидроксиметил)-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (283 мг) и DMFA (6 мл) добавляли NaH (55%-ная дисперсия в минеральном масле, 45 мг) при охлаждении на ледяной бане. Затем смесь перемешивали в течение 10 мин. К смеси добавляли MeI (65 мкл). Затем смесь перемешивали при комнатной температуре в течение 1 часа. Смесь разбавляли насыщен. водн. NH4Cl. К смеси добавляли EtOAc и фазы разделяли. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 8,8-диэтил-2-(метоксиметил)-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (299 мг) в виде масла.
Пример получения 23
Смесь 8-(2-{[трет-бутил(диметил)силил]окси}этил)-2-хлор-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (456 мг), Zn(CN)2 (398 мг), Zn (38 мг), бис(трифторацетат) палладия (II) (41 мг), ди-трет-бутил(2,4',6'-триизопропилбифенил-2-ил)фосфина (tBuXphos, 106 мг) и DMAc (10 мл) (через который пропускали газ Ar в течение 15 мин перед использованием) нагревали в микроволновом реакторе при 130°С в течение 1 часа. Смесь разбавляли EtOAc и Н2О и фильтровали через слой целита. Фильтрат экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 8-(2-{[трет-бутил(диметил)силил]окси}этил)-8-этил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбонитрила (342 мг) в виде твердого вещества.
Пример получения 24
К смеси 6-хлор-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (30,00 г) и DMI (150 мл) добавляли NaH (55%-ная дисперсия в минеральном масле, 5,78 г) при охлаждении на ледяной бане. После удаления ледяной бани смесь перемешивали в течение 20 мин. К смеси добавляли по каплям смесь трет-бутил(2-йодэтокси)диметилсилана (39,74 г) и DMI (30 мл) в течение 5 мин при охлаждении на ледяной бане. После удаления ледяной бани смесь перемешивали в течение 2 часов. Смесь выливали в ледяную воду (500 мл) и затем перемешивали при комнатной температуре в течение ночи. Осадок собирали с получением 4-(2-{[трет-бутил(диметил)силил]окси}этил)-6-хлор-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (49,98 г) в виде твердого вещества.
Пример получения 25
К смеси трет-бутил-5-({[трет-бутил(диметил)силил]окси}метил)-2-хлор-8-этил-5-метил-7-оксо-5,6,7,8-тетрагидропиридо[3,4-b]пиразин-8-карбоксилата (457 мг, смесь 3:2 всех стереоизомеров) и CH2Cl2 (3 мл) добавляли TFA (3 мл). Смесь перемешивали при комнатной температуре в течение 1,5 часов. Растворители выпаривали при пониженном давлении и остаток распределяли между EtOAc (50 мл) и насыщен. водн. NaHCO3 (20 мл). Слои разделяли, и органическую фазу сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 5-({[трет-бутил(диметил)силил]окси}метил)-2-хлор-8-этил-5-метил-5,8-дигидропиридо[3,4-b]пиразин-7(6Н)-она (140 мг, смесь 3:2 всех стереоизомеров) в виде твердого вещества.
Пример получения 26
К смеси 6-бром-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (1,00 г), КОАс (497 мг), бис(пинаколато)диборона (1,03 г) и [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (247 мг) добавляли 1,4-диоксан (15 мл) и смесь перемешивали при 85°С в течение 18 часов. Смесь охлаждали до комнатной температуры и разбавляли EtOAc (100 мл) и H2O (100 мл). Двухфазную смесь фильтровали через слой целита и слои разделяли. Водную фазу экстрагировали EtOAc (100 мл). Объединенные органические экстракты промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали до получения неочищенного твердого вещества. Твердое вещество суспендировали в CH2Cl2 (5 мл), растирали и выдерживали при комнатной температуре в течение 15 мин. Осадок собирали с получением 4,4-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2Н-спиро[изохинолин-1,3'-оксетана]-3(4Н)-она (721 мг) в виде твердого вещества.
Пример получения 27
К смеси моногидрохлорида 3-(2,6-дихлорпиридин-3-ил)оксетан-3-амина (31,0 г) и DMFA (300 мл) добавляли 2-(трет-бутоксикарбонил) бутановую кислоту (27,4 г), WSC/HCl (34,9 г), HOBt (24,6 г) и триэтиламин (42 мл) при комнатной температуре. Затем смесь перемешивали при той же температуре в течение 3 часов. К смеси добавляли Н2О и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением трет-бутил-2-{[3-(2,6-дихлорпиридин-3-ил)оксетан-3-ил]карбамоил}бутаноата (42,9 г) в виде твердого вещества.
Пример получения 28
К смеси 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,18 г), Pd2(dba)3 (200 мг), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (XantPhos, 245 мг) и 1,4-диоксана (24 мл) добавляли 2-этилгексил-3-сульфанилпропаноат (1,35 мл) и DIPEA (2,20 мл). Смесь перемешивали при 90°С в течение 15 часов в атмосфере аргона. После охлаждения смеси до комнатной температуры твердое вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 2-этилгексил-3-[(8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-ил)сульфанил]пропаноата (1,78 г) в виде масла.
Пример получения 29
К смеси 8-(2-трет-бутил(диметил)силил]окси}этил)-2-хлор-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]7(8Н)-она (20,94 г) и толуола (200 мл) добавляли Cs2CO3 (33,2 г), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (XantPhos, 1,18 г), палладий(II) диацетат (230 мг), бензиловый спирт (10,55 мл) в упомянутом порядке, и затем смесь перемешивали при 110°С в течение 30 мин в атмосфере Ar. Смесь охлаждали до комнатной температуры. Смесь фильтровали через слой целита и осадок на фильтре промывали EtOAc. Фильтрат промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-(бензилокси)-8-(2-{[трет-бутил(диметил)силил]окси}этил)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (23,89 г) в виде твердого вещества.
Пример получения 30
Смесь 2-(бензилокси)-8-(2-{[трет-бутил(диметил)силил]окси}этил)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (23,87 г), 10% палладия на углероде (50% влажного, 2 г) и EtOH (240 мл) перемешивали при комнатной температуре в течение 2 часов в атмосфере водорода (1 атм). После того как смесь фильтровали через слой целита, осадок на фильтре промывали CHCl3. Фильтрат концентрировали при пониженном давлении. Остаток в 50% IPE/гексане (200 мл) перемешивали при температуре дефлегмации и затем охлаждали до комнатной температуры. Осадок собирали с получением 8-(2-трет-бутил(диметил)силил]окси}этил)-8-этил-2-гидрокси-6Н-спиро[1,6-нафтиридин-5,3'-оксетана]-7(8Н)-она (14,15 г) в виде твердого вещества.
Пример получения 31
К смеси 2-гидрокси-8,8-диметил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,44 г), NMP (15 мл) и Н2О (1,5 мл) добавляли Cs2CO3 (2,59 г) и хлор(дифтор)ацетат натрия (1,52 г) в атмосфере Ar, затем смесь перемешивали при 100°С в течение 2 часов. Смесь охлаждали до комнатной температуры и к смеси добавляли Cs2CO3 (2,59 г) и хлор(дифтор)ацетат натрия (1,52 г). Смесь перемешивали при 100°С в течение 1,5 часов. Смесь охлаждали до комнатной температуры и к смеси добавляли Cs2CO3 (2,59 г) и хлор(дифтор)ацетат натрия (1,52 г). Смесь перемешивали при 100°С в течение 1 часа. Смесь охлаждали до комнатной температуры, затем разбавляли Н2О и экстрагировали EtOAc. Органический слой промывали Н2О и насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 2-(дифторметокси)-8,8-диметил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридина-5,3'-оксетан]-7(8Н)-она (1,48 г) в виде твердого вещества.
Пример получения 32
Смесь 2-(5-хлор-3-фторпиридин-2-ил)-2-метилпропанамида (2,16 г), [бис(трифторацетокси)иод]бензола (5,16 г), MeCN (48 мл) и Н2О (24 мл) перемешивали в течение ночи. Затем реакционную смесь разбавляли EtOAc (200 мл), промывали Н2О (100 мл), насыщенным солевым раствором (100 мл), сушили над Na2SO4 и концентрировали с получением 5-хлор-3-фтор-2-(2-изоцианатопропан-2-ил)пиридинаа (1,9 г) в виде твердого вещества.
Пример получения 33
К смеси 8-(2-трет-бутил(диметил)силил]окси}этил)-8-этил-2-гидрокси-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (14,69 г) и MeCN (75 мл) добавляли смесь KOH (21,0 г) и Н2О (75 мл). К смеси добавляли диэтил[бром (дифтор) метил]фосфонат (13,0 г) при охлаждении на ледяной бане, а затем смесь перемешивали при той же температуре в течение 30 мин. Смесь трижды экстрагировали EtOAc и объединенные органические слои промывали насыщен. водн. NaHCO3 и насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток в EtOAc (30 мл) и гексане (100 мл) перемешивали при кипячении с обратным холодильником и затем охлаждали до комнатной температуры. Осадок собирали с получением 8-(2-трет-бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксан-7(8Н)-она (11,46 г) в виде твердого вещества.
Пример получения 34
К смеси 8-(2-трет-бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-метил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,80 г) и THF (36 мл) добавляли TBAF (1,0 М в THF, 3,5 мл) при охлаждении на ледяной бане, и затем смесь перемешивали в течение 1 часа при той же температуре и затем перемешивали при комнатной температуре в течение ночи. Смесь выливали в насыщен. водн. NaHCO3 и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 2-(дифторметокси)-8-(2-гидроксиэтил)-8-метил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,43 г) в виде масла.
Пример получения 35
Смесь 5-хлор-3-фтор-2-(2-изоцианатопропан-2-ил)пиридина (1,7 г), МеОН (8 мл) и триметиламина (2 мл) перемешивали в течение 1 часа и затем частично концентрировали. Полученное твердое вещество фильтровали и фильтрат концентрировали с получением метил[2-(5-хлор-3-фторпиридин-2-ил)пропан-2-ил]карбамата, который использовали непосредственно на следующей стадии.
Пример получения 36
К смеси 4-бром-1-иод-2-метилбензола (87,5 г) и THF (400 мл) добавляли по каплям н-BuLi (1,55 М в гексане, 200 мл) в течение 50 мин с охлаждением на бане с сухим льдом и ацетоном в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 10 мин. К смеси добавляли по каплям смесь 2-метил-N-(оксетан-3-ОRден)пропана-2-сульфинамида (56,8 г) и THF (40 мл) в течение 30 мин при той же температуре. Затем смесь перемешивали при той же температуре в течение 1 часа. Смесь разбавляли насыщен. водн. NH4Cl (200 мл) при той же температуре и добавляли насыщенный солевой раствор (100 мл), и перемешивали при комнатной температуре в течение 30 мин. Затем органический слой отделяли, концентрировали и разбавляли EtOAc (300 мл). Водный слой экстрагировали EtOAc (300 мл), и объединенные органические слои дважды промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. К остатку добавляли IPE (150 мл) и смесь перемешивали при комнатной температуре в течение 15 мин и при охлаждении на ледяной бане в течение 30 мин. Осадок собирали и промывали IPE с получением N-[3-(4-бром-2-метилфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (48,07 г) в виде твердого вещества.
Пример получения 37
К смеси 2,2,6,6-тетраметилпиперидина (81 мл) и THF (95 мл) добавляли по каплям в течение 8 минут n-BuLi (1,55 М в гексане, 300 мл) с охлаждением на бане с сухим льдом и ацетоном в атмосфере Ar. Затем смесь перемешивали при охлаждении на ледяной бане в течение 30 мин. К смеси добавляли смесь N-[3-(4-бром-2-метилфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (48,06 г), диэтилкарбоната (33,7 мл) и THF (220 мл) по каплям в течение 30 мин при охлаждении на бане с сухим льдом и ацетоном. Затем смесь нагревали до -40°С в течение 30 мин и перемешивали при той же температуре в течение 10 мин. Смесь разбавляли насыщен. водн. NH4Cl (700 мл) при той же температуре и добавляли солевой раствор (100 мл). Затем органический слой отделяли, концентрировали и разбавляли EtOAc (500 мл). Водный слой экстрагировали EtOAc (500 мл) и объединенные органические слои промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением этил (5-бром-2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}фенил)ацетата (63,78 г) в виде твердого вещества.
Пример получения 38
К смеси HCl (4 M в EtOAc, 115 мл), EtOAc (250 мл) и кусочка затравочного твердого вещества желаемого соединения (этил[2-(3-аминооксан-3-ил)-5-бромфенил]ацетат моногидрохлорид) добавляли по каплям смесь этил 5-бром-2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}фенил)ацетата (63,77 г) и EtOAc (250 мл) при комнатной температуре в течение 20 мин. Затем смесь перемешивали при той же температуре в течение 20 мин. Осадок собирали и промывали EtOAc (100 мл) и 50% EtOAc/гексан (200 мл) с получением моногидрохлорида этил[2-(3-аминооксан-3-ил)-5-бромфенил]ацетата (48,68 г) в виде твердого вещества.
Затравочное твердое вещество, описанное выше, получали по той же методике, без затравочного твердого вещества в маломасштабном эксперименте.
Пример получения 39
К смеси NaHCO3 (15,2 г) и H2O (700 мл) порциями при комнатной температуре добавляли моногидрохлорид этил[2-(3-аминооктан-3-ил)-5-бромфенил]ацетата (48,67 г). Затем смесь перемешивали при той же температуре в течение 40 мин. Осадок собирали и промывали Н2О (100 мл) два раза и МеОН (100 мл) два раза с получением 6-бром-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (32,35 г) в виде твердого вещества.
Пример получения 40
К смеси (2,6-дихлорпиридин-3-ил)ацетонитрила (3,86 г) и THF (120 мл) добавляли NaH (55%-ная дисперсия в минеральном масле, 2,00 г) при охлаждении на ледяной бане в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 10 мин. К смеси добавляли MeI (3,25 мл) при охлаждении на ледяной бане в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 2 часов. Смесь разбавляли насыщен. водн. NH4Cl при той же температуре. Затем добавляли Н2О и EtOAc, и фазы разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-(2,6-дихлорпиридин-3-ил)-2-метилпропаннитрила (4,39 г) в виде твердого вещества.
Пример получения 41
Смесь метил (2-(5-хлор-3-фторпиридин-2-ил)пропан-2-ил)карбамата (900 мг), EtOH (12 мл) и NaOH (3 М в H2O, 4 мл) нагревали в микроволновом реакторе при 150°С в течение 30 мин. Затем реакционную смесь концентрировали и экстрагировали EtOAc (150 мл). Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали с получением 2-(5-хлор-3-фторпиридин-2-ил)пропан-2-амина (520 мг).
Пример получения 42 (42а и 42b)
8-(2-{[трет-Бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-он (14,42 г) разделяли хиральной колоночной хроматографией (CHIRALFLASH (торговая марка) IA, элюент: гексан/EtOAc 80/20 - 0/100, скорость потока; 12-20 мл/мин), получая 8-(2-{[трет-бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-он (6,93 г, один энантиомер с более коротким временем удерживания) в виде твердого вещества и 8-(2-{[трет-бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-он (6,78 г: один энантиомер с более длительным временем удерживания) в виде твердого вещества.
Пример получения 83
К смеси 1-бром-4-хлор-2-метилбензола (73,28 г) и THF (250 мл) добавляли по каплям н-BuLi (1,55 М в гексане, 220 мл) в течение 90 мин с охлаждением на бане с сухим льдом и ацетоном в атмосфере N2. Затем смесь перемешивали при той же температуре в течение 10 мин. К смеси добавляли по каплям смесь 2-метил-N-(оксетан-3-ORден)пропан-2-сульфинамида (50,00 г) и THF (100 мл) в течение 60 мин при той же температуре. Затем смесь перемешивали при той же температуре в течение 20 мин. Смесь разбавляли насыщен. водн. NH4Cl при той же температуре и нагревали до комнатной температуры. Смесь частично концентрировали при пониженном давлении и затем смесь разбавляли Н2О и дважды экстрагировали EtOAc. Объединенные органические слои промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Объединенные водные слои фильтровали через слой целита и осадок трижды промывали EtOAc. Фильтрат экстрагировали EtOAc и органический слой промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Объединенные остатки разбавляли IPE и затем концентрировали при пониженном давлении. К остатку добавляли IPE и выдерживали при комнатной температуре в течение ночи. Твердое вещество собирали и промывали 50% IPE/гексаны, чтобы получить N-[3-(4-хлор-2-метилфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамид (57,00 г) в виде твердого вещества.
Пример получения 84
К смеси 2,2,6,6-тетраметилпиперидина (109 мл) и THF (114 мл) добавляли по каплям n-BuLi (1,55 М в гексане, 400 мл) в течение 40 мин с охлаждением на бане с сухим льдом и MeCN в атмосфере N2. К смеси добавляли смесь N-[3-(4-хлор-2-метилфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (57,0 г), диэтилкарбоната (45,0 мл) и THF (256 мл) по каплям в течение 90 мин при охлаждении на бане с сухим льдом и MeCN. Затем смесь перемешивали при той же температуре в течение 30 мин. Смесь разбавляли насыщен. водн. NH4Cl при той же температуре. Смесь частично концентрировали при пониженном давлении и смесь экстрагировали EtOAc дважды. Объединенные органические слои дважды промывали 50% насыщенным солевым раствором/H2O, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением этил(2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}-5-хлорфенил)ацетата (70,6 г) в виде масла.
Пример получения 85
К смеси HCl (4 M в EtOAc, 285 мл) и EtOAc (850 мл) добавляли смесь этил(2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}-5-хлорфенил)ацетата (142,46 г) и EtOAc (800 мл) по каплям при комнатной температуре в течение 25 мин. Затем смесь перемешивали при той же температуре в течение 25 мин. Осадок собирали и три раза промывали 50% EtOAc/гексаны, чтобы получить моногидрохлорид этил[2-(3-аминооктан-3-ил)-5-хлорфенил]ацетата (116,70 г) в виде твердого вещества.
Пример получения 86
К смеси NaHCO3 (42,0 г) и Н2О (1170 мл) добавляли порциями по частям при комнатной температуре этил[2-(3-аминооктан-3-ил)-5-хлорфенил]ацетат моногидрохлорид (116,7 г). Затем смесь перемешивали при той же температуре в течение 1 часа. Осадок собирали и промывали дважды Н2О и дважды EtOAc, получая 6-хлор-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (62,9 г) в виде твердого вещества.
Пример получения 95
К смеси 2-(3,5-дихлорпиразин-2-ил)-2-метилпропанамида (2,5 г), Н2О (11 мл), MeCN (11 мл) и серной кислоты (11 мл) добавляли натрий нитрита (3,7 г) при охлаждении на льду. Смесь перемешивали при той же температуре в течение 10 мин и затем нагревали до комнатной температуры и перемешивали в течение 2 часов. Полученное твердое вещество собирали и промывали H2O с получением 2-(3,5-дихлорпиразин-2-ил)-2-метилпропановой кислоты (2,5 г) в виде твердого вещества.
Пример получения 96
Смесь 2-(3,5-дихлорпиразин-2-ил)-2-метилпропановой кислоты (2,2 г), толуола (45 мл), триэтиламина (1,7 мл) и дифенилфосфорилазида (3,1 г) перемешивали при кипячении с обратным холодильником в течение 2,5 часов. Затем смесь охлаждали до комнатной температуры и добавляли 4-метоксибензиловый спирт (5,2 г) и триэтиламин (7,8 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и затем концентрировали. Неочищенный продукт растворяли в CH2Cl2 (10 мл) с последующим добавлением TFA (10 мл). Смесь перемешивали при комнатной температуре в течение 3 часов и затем концентрировали. К неочищенному твердому веществу добавляли HCl (4 M в 1,4-диоксане, 10 мл) при комнатной температуре и затем концентрировали с получением моногидрохлорида 2-(3,5-дихлорпиразин-2-ил)пропан-2-амина (1,4 г) в виде твердого вещества.
Пример получения 100
К смеси 2-бром-4-фтор-1-йодбензола (3,12 г) и THF (25 мл) добавляли по каплям n-BuLi (1,6 М в гексане, 6,5 мл) при -100°С в атмосфере азота. Полученную смесь перемешивали при той же температуре в течение 30 мин и затем медленно добавляли по каплям 2-метил-N-(оксетан-3-илиден)пропан-2-сульфинамид (2,0 г) в THF (5 мл) при поддержании внутренней температуры от -90 до -100°С. Полученный раствор перемешивали при той же температуре в течение 30 мин. Смесь разбавляли насыщен. водн. NH4Cl (50 мл) и Н2О (50 мл) и экстрагировали EtOAc (2×100 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали, концентрировали и затем очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением N-[3-(2-бром-4-фторфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамида (1,29 г) в виде твердого вещества.
Пример получения 101
В круглодонную колбу емкостью 200 мл загружали N-[3-(2-бром-4-фторфенил)оксетан-3-ил]-2-метилпропан-2-сульфинамид (1,05 г), Pd2(dba)3 (137 мг) и 2-дициклогексилфосфино-2',4',6'-триопропилбифенил (Xphos, 143 мг). Из колбы откачивали воздух и заполняли азотом 3 раза, и через шприц добавляли безводный дегазированный THF (15 мл) с последующим добавлением хлорида трет-бутокси-2-оксоэтилцинка (0,5 М в Et2O, 15 мл). Полученную смесь перемешивали при 55°С в течение 1 часа и затем охлаждали до комнатной температуры и разбавляли EtOAc (100 мл) и Н2О (50 мл). Смесь фильтровали через слой целита. Фазы разделяли и водную фазу экстрагировали EtOAc (50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, и концентрировали с получением коричневого твердого вещества. К смеси неочищенного твердого вещества и CH2Cl2 (50 мл) добавляли TFA (10 мл). Полученную смесь перемешивали при комнатной температуре в течение 1,5 часов. Растворители выпаривали и оставшийся остаток распределяли между насыщен. водн. NaHCO3 (50 мл) и EtOAc (50 мл). Слои разделяли и водную фазу промывали EtOAc (50 мл). Затем водную фазу подкисляли до рН 5 муравьиной кислотой и экстрагировали EtOAc (2×50 мл). Объединенные органические экстракты сушили над Na2SO4 и концентрировали с получением (2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}-5-фторфенил)уксусной кислоты (0,52 г) в виде твердого вещества.
Пример получения 102
К смеси (2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}-5-фторфенил)уксусной кислоты (491 мг) и 1,4-диоксана (4 мл) добавляли HCl (4 M в 1,4-диоксане, 0,45 мл) при охлаждении на ледяной бане. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Осадок фильтровали с получением неочищенного твердого вещества (150 мг) и использовали непосредственно на следующей стадии. Смесь неочищенного твердого вещества (150 мг), DMF (2 мл), O-(бензотриазол-1-ил)-N,N,N',N',N'-гексафторфосфата (HBTU, 326 мг), HOBt (116 мг) и триметиламина (0,24 мл) перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь выливали в Н2О (25 мл) и EtOAc (25 мл). Органический слой отделяли, промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Полученное твердое вещество промывали 25% CH2Cl2/гексаны, получая 6-фтор-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (85 мг) в виде твердого вещества.
Пример получения 104
К смеси (2-{3-[(трет-бутилсульфинил)амино]оксетан-3-ил}-5-хлорпиридин-3-ил)уксусной кислоты (4,84 г) и MeCN (112 мл) добавляли тионилхлорид (2,1 мл) при охлаждении на ледяной бане. Реакционную смесь перемешивали при той же температуре в течение 90 мин. К смеси добавляли насыщен. водн. NaHCO3 (40 мл) и затем смесь концентрировали до объема около 80 мл, и образовавшееся твердое вещество отфильтровывали и промывали H2O (15 мл), Et2O (30 мл) и EtOAc (10 мл). Полученное твердое вещество затем растирали с 10% МеОН/гексаном, получая 3-хлор-5Н-спиро[1,7-нафтиридин-8,3'-оксетан-6 (7Н)-он (1,12 г) в виде твердого вещества.
Пример 1
В трехгорлую колбу емкостью 1000 мл загружали 6-бром-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (17,35 г) и DMF (160 мл). Из колбы откачивали воздух и дважды заполняли Ar, и NaH (55%-ная дисперсия в минеральном масле, 6,50 г) добавляли порциями при охлаждении на ледяной бане, а затем смесь перемешивали при комнатной температуре в течение 30 мин. К смеси добавляли по каплям смесь MeI (8,1 мл) и DMF (35 мл) при охлаждении на ледяной бане в течение 1 часа. Добавляли дополнительный MeI (0,5 мл) при охлаждении на ледяной бане и смесь перемешивали при той же температуре в течение 10 мин. Смесь разбавляли H2O (250 мл) и насыщен. водн. NH4Cl (150 мл) и перемешивали при комнатной температуре в течение 1 часа. Осадок собирали и смесь твердого вещества и 40% толуола/гексана (200 мл) перемешивали при кипячении с обратным холодильником в течение 1 часа и затем охлаждали до комнатной температуры. Смесь перемешивали при комнатной температуре в течение 30 мин и осадок собирали с получением 6-бром-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (14,47 г) в виде твердого вещества.
Пример 2
К твердому продукту Р2О5 (20,00 г) добавляли Н3РО4 (12 мл), и смесь перемешивали при 140°С в течение 1 часа. К смеси добавляли 2-(3-метилфенил)бутанамид (3,00 г) и ацетон (2,70 мл) при 100°С, и перемешивали при той же температуре в течение 2 часов. К смеси добавляли ацетон (2,70 мл) при 120°С и перемешивали при той же температуре в течение 2 часов. Смесь выливали в ледяную воду и разбавляли EtOAc и отделяли. Органический слой промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток промывали EtOAc/гексаном с получением 4-этил-1,1,6-триметил-1,4-дигидроизохинолин-3(2Н)-она (2,83 г) в виде твердого вещества.
Пример 3
Смесь 4-этил-1,1,6-триметил-1,4-дигидроизохинолин-3(2Н)-она (600 мг), NaH (60%-ная дисперсия в минеральном масле, 167 мг) и DMF (6,0 мл) перемешивали при охлаждении на ледяной бане в течение 30 мин. К смеси добавляли 2-(3-бромпропокси)тетрагидро-2Н-пиран (924 мг) при той же температуре и перемешивали при комнатной температуре в течение ночи. К смеси добавляли EtOAc и насыщенный солевой раствор, и фазы разделяли. Органический слой промывали H2O и насыщенным солевым раствором и сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны). К остатку добавляли HCl (1 М водный раствор, 5,0 мл) и THF (5,0 мл) и перемешивали при 70°С в течение 2 часов. К смеси добавляли EtOAc и насыщенный солевой раствор, и фазы разделяли. Органический слой промывали Н2О и насыщенным солевым раствором и сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны до CHCl3/МеОН). Остаток промывали гексаном с получением 4-этил-4-(3-гидроксипропил)-1,1,6-триметил-1,4-дигидроизохинолин-3(2Н)-она (84 мг) в виде твердого вещества.
Пример 4
В колбу емкостью 500 мл загружали 6-бром-4,4-диэтил-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-он (15,0 г), палладий(II) бис(трифторацетат) (1,62 г), Zn (1,27 г), ди-трет-бутил(2,4',6'-триизопропилбифенил-2-ил)фосфин (tBuXPhos, 4,11 г) и дегазированный DMAc (полученный барботажем Ar в течение 5 мин, 150 мл). Из колбы откачивали воздух и внова заполняли Ar три раза, и добавляли при комнатной температуре Zn(CN)2 (7,39 г). Смесь перемешивали при 80°С в течение 6 часов. После охлаждения до комнатной температуры к смеси добавляли EtOAc (300 мл). Затем нерастворимое вещество фильтровали через слой целита и промывали EtOAc (300 мл). Фильтрат дважды промывали Н2О (150 мл) и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. К остатку добавляли 50% гексан/EtOAc (240 мл) и перемешивали при 80°С в течение 30 мин и при комнатной температуре в течение 30 мин. Осадок собирали и промывали 50% гексаном/EtOAc (80 мл) с получением 4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила (6,18 г) в виде твердого вещества.
Пример 5
К смеси 4,6-дибром-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (150 мг) и THF (3,0 мл) добавляли N-метилциклогексиламин (153 мг). Затем смесь перемешивали при комнатной температуре в течение 15 часов. Смесь выливали в насыщен. водн. NaHCO3 и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 6-бром-4-[циклогексил(метил)амино]-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (118 мг) в виде твердого вещества.
Пример 6
К смеси 2-хлор-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетана]-7(8Н)-она (6,0 г) и DMF (150 мл) добавляли NaH (55%-ная дисперсия в минеральном масле, 1,13 г) при охлаждении на ледяной бане в атмосфере Ar. Через 10 мин добавляли EtI (2,0 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщен. водн. NH4Cl и EtOAc, и органический слой отделяли, дважды промывали Н2О и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (6,19 г) в виде твердого вещества.
Пример 7
К смеси метил 4-[(6-бром-4-этил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-4-ил)метил]бензоата (300 мг), THF (6,0 мл) и МеОН (6,0 мл) добавляли NaOH (1 М водный раствор, 1,4 мл) при комнатной температуре и перемешивали при той же температуре в течение 72 часов. Смесь нейтрализовали до рН 7-8 с помощью 1 М водн. HCl и Н2О при охлаждении на ледяной бане. К смеси добавляли EtOAc и фазы разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CHCl3/МеОН) с получением твердого вещества. Полученное твердое вещество промывали EtOAc с получением 4-[(6-бром-4-этил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-4-ил)метил]бензойной кислоты (212 мг) в виде твердого вещества.
Пример 8
К смеси (6-бром-4-этил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-4-ил)уксусной кислоты (170 мг) и DMFA (2 мл) добавляли HOBt (101 мг), WSC/HCl (144 мг), моногидрохлорид диметиламина (122 мг) и DIPEA (260 мкл), и смесь перемешивали при комнатной температуре в течение 15 часов. Смесь разбавляли H2O и экстрагировали EtOAc. Органический слой промывали H2O и насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 2-(6-бром-4-этил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-4-ил)-N,N-диметилацетамида (128 мг) в виде твердого вещества.
Пример 9
6-Бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-он (210 мг) разделяли с помощью хиральной сверхкритической флюидной хроматографии (SFC) (CHIRALPAK® IС, элюирование СО2:МеОН=65:35, скорость потока; 15 мл/мин, обратное давление, 100 бар, температура колонки; 40°С). Один энантиомер с более коротким временем удерживания промывали гексаном с получением (+)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (82 мг) в виде твердого вещества. Другой энантиомер с более длительным временем удерживания промывали гексаном с получением (-)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она (82 мг) в виде твердого вещества.
Пример 10
К смеси 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,65 г), 1,4-диоксана (40 мл) и H2O (4 мл) (которые барботировали газообразным Ar перед использованием) добавляли триметилбороксин (1,64 мл), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (430 мг) и K2CO3 (3,0 г). Затем смесь перемешивали при 110°С в течение 4 часов. Смесь разбавляли EtOAc и Н2О и фильтровали через слой целита. Органический слой отделяли, промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток последовательно очищали колоночной хроматографией на силикагеле (EtOAc/гексаны), хроматографией на колонке с аминосиликагелем (EtOAc/гексаны), а затем колоночной хроматографией на силикагеле (CHCl3/МеОН). Остаток затвердевал в 9% IPE/гексане (10 мл), с получением 8,8-диэтил-2-метил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-он (1,3 г) в виде твердого вещества.
Пример 11
Смесь 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (0,75 г), 2,2,2-трифторэтанола (1,90 мл), Cs2CO3 (1,75 г), диацетата палладия (II) (60 мг), ди-трет-бутил(2,4',6'-триизопропилбифенил-2-ил)фосфина (tBuXphos, 225 мг) и дегазированного толуола (15 мл) нагревали в микроволновом реакторе при 150°С в течение 90 мин. Дополнительная партия (всего две партии) подвергалась той же процедуре, что и выше. Смесь в двух флаконах разбавляли Н2О и EtOAc и фильтровали через слой целита. Органический слой отделяли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны). Остаток затвердевал в 6% IPE/гексане (10 мл), и его собирали с получением 8,8-диэтил-2-(2,2,2-трифторэтокси)-6Н-спиро[1,6-нафтиридин-5,3-оксан-7(8Н)-она (1,56 г) в виде твердого вещества.
Пример 12
К смеси 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (500 мг) и EtOH (17 мл) добавляли триэтиламин (500 мкл) и 10% палладий на углероде (50% влажный, 100 мг) при положительном потоке Ar. Смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. К остатку добавляли Н2О и смесь экстрагировали CHCl3. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (385 мг) в виде твердого вещества.
Пример 13
К смеси 8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (100 мг), цинка бис(дифторметансульфината) (253 мг), TFA (31 мкл), CH2Cl2 (2,1 мл) и Н2О (0,6 мл) добавляли трет-бутилгидропероксид (70% водный раствор, 177 мкл) при охлаждении на ледяной бане. Затем смесь перемешивали при комнатной температуре в течение 22 часов. Смесь разбавляли 50% насыщен. водн. Na2S2O3/насыщен. водн. NaHCO3. Смесь экстрагировали CHCl3. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-(дифторметил)-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (62 мг).
Пример 14
К смеси 8,8-диэтил-2-(метоксиметил)-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (299 мг) и DMFA (9 мл) добавляли TBAF (550 мг). Затем смесь перемешивали при 100°С в течение 8 часов. К смеси добавляли Н2О и EtOAc, и фазы разделяли. Органический слой дважды промывали Н2О и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны). Остаток промывали 5% IPE/гексаном (2 мл) с получением 8,8-диэтил-2-(метоксиметил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (100 мг) в виде твердого вещества.
Пример 15
К смеси 8-(2-трет-бутил(диметил)силил]окси}этил)-2-(дифторметокси)-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетана]-7(8Н)-она (8260 мг, один энантиомер с более коротким временем удерживания) и THF (80 мл) добавляли HCl (1 М водный раствор, 25 мл) с водяной баней, и затем смесь перемешивали в течение 10 мин при комнатной температуре. Смесь разбавляли насыщен. водн. NaHCO3 и концентрировали при пониженном давлении, и смесь три раза экстрагировали CHCl3. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CHCl3/МеОН). Остаток нагревали в IPE (20 мл). После охлаждения смеси до комнатной температуры осадок собирали с получением (-)-2-(дифторметокси)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3-оксан-7(8Н)-она (5,73 г) в виде твердого вещества.
Пример 16
Смесь 2-хлор-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (118 мг), Zn(CN)2 (150 мг), Zn (12 мг), палладия(II) бис(трифторацетата) (15 мг), ди-трет-бутил(2,4',6'-триизопропилбифенил-2-ил)фосфина (tBuXphos, 38 мг) и DMAc (4 мл) нагревали в микроволновом реакторе при температуре 130°С в течение 1 часа. После охлаждения смесь разбавляли EtOAc и Н2О и затем фильтровали через слой целита. Органический слой отделяли, промывали Н2О и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]2-карбонитрила (78 мг) в виде твердого вещества.
Пример 17
К смеси 2-этилгексил-3-[(8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-ил)сульфанил]пропаноата (625 мг), THF (6,3 мл) и МеОН (6,3 мл) добавляли KOtBu (168 мг) при охлаждении на ледяной бане и смесь перемешивали при комнатной температуре в течение 1 часа и при 60°С в течение 20 часов в атмосфере Ar. После охлаждения до комнатной температуры к смеси добавляли MeI (110 мкл) и смесь перемешивали при комнатной температуре в течение 1 часа. Растворители выпаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) и хроматографией на аминосиликагеле (EtOAc/гексаны). К остатку добавляли IPE (2 мл) и смесь обрабатывали ультразвуком. После добавления гексана (10 мл) смесь перемешивали при комнатной температуре в течение 10 мин. Осадок собирали, получая в виде твердого вещества 8,8-диэтил-2-(метилсульфанил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (225 мг).
Пример 18
К смеси 2-(дифторметокси)-8,8-диметил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (1,40 г) и NMP (25 мл) добавляли TBAF гидрат (2,90 г) и смесь перемешивали при 100°С в течение 3 часов. Смесь охлаждали до комнатной температуры, затем разбавляли Н2О и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением твердого вещества. Полученное твердое вещество разбавляли IPE (3 мл) и гексаном (15 мл), и смесь перемешивали при комнатной температуре в течение 10 мин. Твердое вещество собирали, чтобы получить неочищенное твердое вещество. Полученное твердое вещество (неочищенное, 483 мг) растворяли в MeCN (6 мл) и МеОН (4 мл). Затем раствор очищали с помощью ВЭЖХ (колонка: YMC-Pack ODS-A, S-15 мкм, 12 нм, 250×50, скорость потока: 80 мл/мин, детектирование: ELSD (детектор испарительного светорассеяния) (и UV=210 нм), элюент: MeCN/0,1% НСО2Н водн.] с получением 2-(дифторметокси)-8,8-диметил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (406 мг) в виде твердого вещества.
Пример 19
К смеси 2-(дифторметокси)-8-(2-гидроксиэтил)-8-метил-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (343 мг) и CH2Cl2 (7 мл) добавляли TFA (0,3 мл) при охлаждении на ледяной бане, и затем смесь перемешивали в течение 3 часов при той же температуре. К смеси добавляли TFA (0,3 мл) при охлаждении на ледяной бане и затем смесь перемешивали еще 1 час. Смесь концентрировали и остаток разбавляли CHCl3 (4 мл) и MeCN (4 мл). К смеси добавляли этилендиамин (1 мл), и затем смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали и остаток очищали хроматографией на силикагеле (CHCl3/МеОН) с получением твердого вещества (132 мг). Остаток затвердевал в МеОН и IPE с получением 2-(дифторметокси)-8-(2-гидроксиэтил)-8-метил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (93 мг) в виде твердого вещества.
Пример 20
К смеси 6-бром-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (24,9 г) и дегазированного DMF (полученного барботажем Ar в течение 10 мин) добавляли Zn(CN)2 (9,9 г), Zn (2,75 г), Pd2(dba)3 (770 мг) и 1,1'-бис(дифенилфосфино)ферроцен (932 мг). Затем смесь перемешивали при 80°С в течение 14 часов. К смеси добавляли EtOAc (500 мл) и перемешивали в течение 10 мин. Затем нерастворимое вещество фильтровали через слой целита и промывали EtOAc (500 мл). Фильтрат промывали H2O (50 мл), 28% водным раствором аммиака (100 мл) и насыщенным солевым раствором (50 мл) дважды, и объединенные водные слои дважды экстрагировали EtOAc (250 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в THF (750 мл) при нагревании и после охлаждения до комнатной температуры добавляли аммоний пирролидин-1-карбодитиоат (1,22 г). Затем смесь перемешивали при комнатной температуре в течение 1 часа. Смесь фильтровали через слой целита и фильтрат концентрировали при пониженном давлении. Остаток затвердевал в EtOAc (200 мл), и его собирали. Твердое вещество очищали колоночной хроматографией на колонке с аминосиликагелем (CHCl3/гексан) с получением 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6 карбонитрила (18,87 г) в виде твердого вещества.
Пример 21
К смеси 7-хлор-4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила (80 мг) и 1,4-диоксана (800 мкл) добавляли МеОН (56 мкл) и KOtBu (38 мг) при комнатной температуре. Смесь нагревали в микроволновом реакторе при 120°С в течение 30 мин. К смеси добавляли насыщен. водн. NH4Cl и экстрагировали CHCl3. Органический слой концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основе аминосиликагеля (EtOAc/гексаны). К полученному твердому веществу добавляли 50% гексан/EtOAc (2 мл), и затем смесь перемешивали при комнатной температуре в течение 10 мин. Осадок собирали, промывали 50% гексаном/EtOAc (1 мл), получая 4,4-диэтил-7-метокси-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила (14 мг) в виде твердого вещества.
Пример 22
6-Хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (130,00 г) разделяли с помощью хиральной колоночной хроматографии (CHIRALPAK (торговая марка) IС, элюент: 100% МеОН) с получением (+)-6-хлор-4-(2-гидроксиэтил)-4- метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (58,4 г: >99% ее, более короткое время удерживания) в виде твердого вещества и (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (58,3 г: 99% ее, более продолжительное время удерживания) в виде твердого вещества.
Пример 23
К смеси 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбальдегида (150 мг) и CH2Cl2 (4 мл) добавляли трифторид бис(2-метоксиэтил)аминосеры (2,70 г). Смесь перемешивали при комнатной температуре в течение 48 часов. К смеси добавляли CH2Cl2 (25 мл) и насыщен. водн. NaHCO3 (25 мл). Слои разделяли и водную фазу экстрагировали дополнительным CH2Cl2 (20 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью ВЭЖХ с обращенной фазой с градиентом от 10% до 100% MeCN/H2O с 0,1% муравьиной кислотой в течение 40 минут (Phenomenex Gemini, 5 микрон С18) с получением 6-(дифторметил)-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (38 мг) в виде твердого вещества.
Пример 24
К смеси 6-гидрокси-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (475 мг) и DMFA (4 мл) добавляли Cs2CO3 (1,20 г) и хлордифторацетат натрия (700 мг), и смесь перемешивали при 90°С в течение 18 часов. Смесь охлаждали до комнатной температуры и добавляли EtOAc (100 мл) и Н2О (100 мл). Слои разделяли и водную фазу экстрагировали EtOAc (50 мл). Объединенные органические фазы сушили над Na2SO4 и концентрировали. Остаток очищали с помощью ВЭЖХ с обращенной фазой с градиентом от 10% до 100% MeCN/Н2Ос 0,1% муравьиной кислотой в течение более 40 мин (PhenomeneXGemini, 5 микрон С18) с получением 6-(дифторметокси)-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (107 мг) в виде твердого вещества.
Пример 25
К смеси DMF (0,5 мл), 2,2,2-трифторэтанола (0,5 мл) и NaH (60%-ная дисперсия в минеральном масле, 28 мг) добавляли 2'-хлор-8',8'-диэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-он (20 мг). Смесь перемешивали при 100'С в течение 1 часа. Смесь охлаждали до комнатной температуры и разбавляли насыщенным раствором. водн. NH4Cl (10 мл). Затем добавляли EtOAc (30 мл) и Н2О (20 мл), и полученный органический слой отделяли, промывали насыщенным солевым раствором, сушили над Na2SO4 и очищали с помощью ВЭЖХ с обращенной фазой (20-100% MeCN/Н2О, 0,1% буфер муравьиной кислоты) в течение 40 минут с получением 8',8'-диэтил-2'-(2,2,2-трифторэтокси)-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (15 мг) в виде твердого вещества.
Пример 26
Смесь дихлорида бис(циклопентадиенил)циркония(IV) (20 мг) и бис(2-метоксиэтокси)алюмогидрида натрия (Red-Al, 3,4 М в толуоле, 1,8 г) перемешивали в течение 10 мин и затем охлаждали на ледяной бане, Затем к смеси добавляли 2'-хлор-8',8'-диэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-он (200 мг) и смесь перемешивали в течение 30 мин. Смесь нагревали до комнатной температуры и разбавляли насыщен. водн. NaHCO3 (10 мл). Затем добавляли EtOAc и Н2О, и органический слой отделяли, промывали насыщенным солевым раствором, сушили над Na2SO4 и очищали с помощью ВЭЖХ с обращенной фазой (20-100% MeCN/Н2О, 0,1% буфер муравьиной кислоты) в течение 40 минут с получением 8',8'-диэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (150 мг) в виде твердого вещества.
Пример 27
Смесь 2-хлор-8,8-диэтил-5,5-диметил-5,8-дигидропиридо[3,4-b]пиразин-7(6Н)-она (100 мг) и этоксида натрия (25%-ный раствор в EtOH, 5 мл) нагревали в микроволновом реакторе при 190°С в течение 30 мин. К смеси добавляли EtOAc (100 мл) и Н2О (50 мл) и органический слой затем отделяли. Органический слой затем промывали Н2О (50 мл), сушили над Na2SO4, концентрировали при пониженном давлении и очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 2-этокси-8,8-диэтил-5,5-диметил-5,8-дигидропиридо[3,4-b]пиразин-7(6Н)-она (45 мг) в виде твердого вещества.
Пример 28
Смесь 8',8'-диэтил-2'-винил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (6 мг), 10% палладия на углероде (12 мг) и МеОН (2 мл) перемешивали в атмосфере водорода (20 фунтов на квадратный дюйм) в течение 2 часов. Смесь затем фильтровали через слой целита и фильтрат концентрировали. Остаток очищали с помощью ВЭЖХ с обращенной фазой (20-100% MeCN/Н2О, 0,1% буфер муравьиной кислоты) в течение 40 минут с получением 2',8',8'-триэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (4 мг) в виде твердого вещества.
Пример 29
К смеси 5-(трет-бутил(диметил)силил]окси}метил)-2-хлор-8,8-диэтил-5-метил-5,8-дигидропиридо[3,4-b]пиразин-7(6Н)-она (20 мг) и безводного THF (1 мл) добавляли TBAF (1 M в THF, 0,070 мл) при охлаждении на ледяной бане, и смесь перемешивали в течение 5 мин при охлаждении на ледяной бане, а затем 15 мин при комнатной температуре. Смесь разбавляли насыщен. водн. NaHCO3 (5 мл) и экстрагировали EtOAc (2×20 мл). Объединенные органические экстракты промывали насыщенным солевым раствором и сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 2-хлор-8,8-диэтил-5-(гидроксиметил)-5-метил-5,8-дигидропиридо[3,4-b]пиразин-7(6Н)-она (11 мг) в виде твердого вещества.
Пример 30
Смесь 2'-хлор-8',8'-диэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (28 мг) и Me2NH(2 М в THF, 1 мл) нагревали в микроволновом реакторе при 130°С в течение 1 часа. Реакционную смесь охлаждали и очищали непосредственно с помощью ВЭЖХ с обращенной фазой (20-100% MeCN/Н2О, 0,1% буфер муравьиной кислоты) в течение 40 минут с получением 2'-(диметиламино)-8',8'-диэтил-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-7'(8'Н)-она (10 мг) в виде твердого вещества.
Пример 31 (31а и 31b)
Смесь 5-аллил-2-хлор-8,8-диэтил-5-метил-5,8-дигидро-1,6-нафтиридин-7(6Н)-она (100 мг), 1-метил-4-винил-1Н-пиразола (74 мг), катализатора Граббса (Grubbs) второго поколения (6 мг) и CH2Cl2 (1 мл) перемешивали при 40°С в течение 4 дней и добавляли в начале 2-го и 3-го дней еще одну порцию катализатора (6 мг). Затем реакционную смесь непосредственно очищали с помощью ВЭЖХ с обращенной фазой (от 5 до 100% MeCN/Н2О, 0,1% буфер муравьиной кислоты) в течение 40 мин с получением цис- и трансизомеров 2-хлор-8,8-диметил-5-метил-5-[3-(1-метил-1Н-пиразол-4-ил)проп-2-ен-1-ил]-5,8-дигидро-1,6-нафтиридин-7(6Н)-она в виде твердых веществ (изомер с более коротким временем удерживания, 2 мг, изомер с более длительным временем удерживания, 7 мг).
Пример 32
К смеси метил(6-хлор-4-этил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-4-ил)ацетата (389 мг) и безводного THF (5 мл) добавляли по каплям литийалюминийгидрид (1,0 М в THF, 1,32 мл) при охлаждении на ледяной бане. Смесь перемешивали при охлаждении на ледяной бане в течение 20 мин и затем добавляли H2O (0,050 мл), NaOH (3 М водный раствор, 0,050 мл) и H2O (0,150 мл). Смесь фильтровали через слой целита и отфильтрованные твердые вещества промывали избытком THF (200 мл). Фильтрат сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) с получением пены. Пену растирали и обрабатывали ультразвуком в Et2O и фильтровали, получая в виде твердого вещества 6-хлор-4-этил-4-(2-гидроксиэтил)-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (235 мг).
Пример 33
К смеси 5,5,8-триметил-7-оксо-8-({1-[(триметилсилил)метил]-1Н-1,2,3-триазол-4-ил}метил)-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила (27 мг) и THF (2 мл) добавляли H2O (20 мкл) и TBAF (1 M в THF, 100 мкл). Смесь перемешивали при комнатной температуре в течение 24 часов. Смесь концентрировали и распределяли между EtOAc (10 мл) и H2O. Органический слой отделяли и водную фазу экстрагировали EtOAc (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью ВЭЖХ с обращенной фазой (от 5 до 100% MeCN, 0,1% муравьиной кислоты) с получением 5,5,8-триметил-8-[(1-метил-1Н-1,2,3-триазол-4-ил)метил]-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила (11 мг) в виде твердого вещества.
Пример 34
К смеси 4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила (1,00 г) и DCE (15 мл) добавляли N-хлорсукцинимид (690 мг), диацетат палладия (II) (45 мг) и моногидрат п-толуолсульфоновой кислоты (378 мг) при комнатной температуре. Затем смесь перемешивали при 70°С в течение 16 часов. К смеси добавляли N-хлорсукцинимид (676 мг) при комнатной температуре. Затем смесь перемешивали при 70°С в течение 7 часов. К смеси добавляли N-хлорсукцинимид (676 мг), диацетат палладия (II) (47 мг) и моногидрат п-толуолсульфоновой кислоты (375 мг) при комнатной температуре. Затем смесь перемешивали при 70°С в течение 1 дня. После охлаждения до комнатной температуры смесь непосредственно очищали колоночной хроматографией на силикагеле (EtOAc/гексаны). К полученному остатку добавляли 50% гексан/EtOAc, и затем смесь перемешивали при 80°С в течение 10 мин и при комнатной температуре в течение 1 часа. Осадок собирали с получением 7-хлор-4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила (140 мг) в виде твердого вещества.
Пример 35
К смеси 4-(2-{[трет-бутил(диметил)силил]окси}этил)-6-хлор-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (49,98 г) и THF (350 мл) добавляли HCl (1 М водный раствор, 164 мл) при охлаждении на ледяной бане. Смесь перемешивали при комнатной температуре в течение 30 мин. При охлаждении на ледяной бане добавляли смесь NaHCO3 (16,0 г) и Н2О (200 мл), и затем THF выпаривали при пониженном давлении. К смеси добавляли EtOAc (200 мл) и перемешивали при комнатной температуре в течение 15 мин. Затем добавляли гексан (400 мл) и перемешивали при комнатной температуре в течение 2 часов. Осадок собирали, промывали Н2О (100 мл), 33% EtOAc/гексаны (50 мл), получая 6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (31,56 г) в виде твердого вещества.
Пример 36
К смеси трет-бутил-2-{[3-(2,6-дихлорпиридин-3-ил)оксетан-3-ил]карбамоил}бутаноата (42,9 г) и THF (500 мл) добавляли NaHMDS (1,1 М в THF, 250 мл) по каплям при охлаждении на ледяной бане в атмосфере Ar. Затем смесь перемешивали при той же температуре в течение 2 часов. К смеси добавляли Н2О и экстрагировали EtOAc. Органический слой промывали Н2О и насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (CHCl3/МеОН). Остаток промывали гексаном с получением трет-бутил-2-хлор-8-этил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-8-карбоксилата (27,7 г) в виде твердого вещества.
Пример 37
Смесь этил-2-хлор-6-(2,4-диметоксибензил)-8-этил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-8-карбоксилата (8,36 г), анизола (6 мл) и TFA (25 мл) перемешивали при 80°С в течение 4 часов. После охлаждения растворитель выпаривали при пониженном давлении. Остаток подщелачивали до рН от 7 до 8 с помощью насыщен. водн. NaHCO3 при охлаждении на ледяной бане и экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением этил-2-хлор-8-этил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридина-8-карбоксилата (5,56 г) в виде твердого вещества.
Пример 38
Смесь этил-2-хлор-8-этил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-8-карбоксилата (5,60 г) и H2SO4 (12 М водного раствора, 60 мл) перемешивали при 50°С в течение 8 часов. После охлаждения смесь выливали в ледяную воду и подщелачивали 28% водным раствором аммиака. EtOAc и Н2О добавляли к смеси, и фазы разделяли. Водный слой экстрагировали EtOAc и объединенные органические слои промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 2-хлор-8-этил-5,5-диметил-5,8-дигидро-1,6-нафтиридин-7(6Н)-она (4,25 г) в виде твердого вещества.
Пример 39
К смеси трет-бутил-2-хлор-8-этил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-8-карбоксилата (27,7 г) и DCE (300 мл) добавляли TFA (30 мл). Затем смесь перемешивали при 50°С в течение 4 часов. Смесь концентрировали. К остатку добавляли Н2О и 1 М вод. NaOH при охлаждении на ледяной бане и экстрагировали смесью EtOAc и THF. Органический слой промывали насыщенным солевым раствором и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. К остатку добавляли IPE и обрабатывали ультразвуком. Осадок собирали, получая в виде твердого вещества 2-хлор-8-этил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-он (17,1 г).
Пример 40
Смесь дихлорида 6-хлор-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (4,0 г), дихлорида пентаметилциклопентадиениридиума(III) (73 мг), KOH (123 мг) и МеОН (16 мл) обрабатывали ультразвуком для дегазации в атмосфере Ar. Смесь нагревали в микроволновом реакторе при 130°С в течение 90 мин. Затем смесь перемешивали при охлаждении на ледяной бане в течение 15 мин. Дополнительные девять партий (всего десять партий) подвергали той же процедуре, что и описанная выше. Осадок во всех сосудах собирали на одной и той же воронке, промывали EtOH и получали 6-хлор-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (34,31 г) в виде твердого вещества.
Пример 41
К смеси 4,4-диметил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2Н-спиро[изохинолин-1,3'-оксетан]3(4Н)-она (700 мг) и THF (20 мл) добавляли KOH (1 М водный раствор, 6,12 мл) и Н2О2(35% водный раствор, 0,56 мл). Смесь перемешивали при комнатной температуре в течение 15 мин. Смесь нейтрализовали до рН 7, используя 1 М вод. HCl. Добавляли EtOAc (100 мл) и слои разделяли. Водную фазу экстрагировали EtOAc (75 мл). Объединенные органические экстракты объединяли, промывали насыщенным солевым раствором и сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 6-гидрокси-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетана]-3(4Н)-она (475 мг) в виде твердого вещества.
Пример 42
К смеси 6-бром-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (3,00 г) и DMF (75 мл, дегазированный азотом) добавляли NaH (60%-ная дисперсия в минеральном масле, 895 мг). Из реакционной колбы откачивали воздух и повторно заполняли азотом три раза, и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 30 мин. К смеси добавляли по каплям смесь EtI (3,49 г) и DMF (2 мл) при охлаждении на ледяной бане и смесь перемешивали при комнатной температуре в течение 30 мин. К смеси осторожно добавляли Н2О при охлаждении на ледяной бане и смесь разбавляли EtOAc и фазы разделяли. Водную фазу экстрагировали EtOAc и объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (EtOAc/гексаны) с получением 6-бром-4,4-диэтил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (2,59 г) в виде твердого вещества.
Пример 52
В трехгорлую колбу емкостью 1000 мл загружали 6-хлор-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (30,00 г), NMP (75 мл) и DMI (75 мл). Из колбы откачивали воздух и дважды заполняли Ar, и NaH (55%-ная дисперсия в минеральном масле, 13,48 г) добавляли порциями в течение 10 минут при охлаждении на ледяной бане, а затем смесь перемешивали при той же температуре в течение 10 мин. К смеси добавляли по каплям смесь MeI (17,5 мл) и NMP (30 мл) при охлаждении на ледяной бане в течение 100 мин. Смесь перемешивали при той же температуре в течение 20 мин. Дополнительный MeI (0,25 мл) добавляли при охлаждении на ледяной бане и смесь перемешивали при той же температуре в течение 1 часа. Смесь разбавляли H2O при охлаждении на ледяной бане, а затем перемешивали при той же температуре в течение 30 мин. Осадок собирали и промывали H2O и EtOAc/гексаны (1/3), получая неочищенное твердое вещество. К твердому веществу добавляли EtOAc и смесь нагревали до 90°С и затем перемешивали при комнатной температуре в течение ночи. Осадок собирали, получая неочищенное твердое вещество. Твердое вещество очищали хроматографией на силикагеле (EtOAc/гексаны) с получением 6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (10,88 г) в виде твердого вещества.
Пример 55
В круглодонную колбу емкостью 250 мл загружали 6-бром-4,4-диэтил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (2,70 г), 1,1'-бис(дифенилфосфино)ферроцен (462 мг), Pd2(dba)3 (381 мг), Zn(CN)2 (1,27 г) и Zn (218 мг). К твердому веществу добавляли DMAc (30 мл, дегазировали азотом в течение 45 мин перед использованием). Из колбы откачивали воздух и заполняли азотом три раза, а затем перемешивали при 90°С в течение 16 часов. Смесь охлаждали до комнатной температуры и разбавляли H2O и EtOAc. Двухфазную смесь фильтровали через слой целита и слои разделяли. Водную фазу трижды экстрагировали дополнительным EtOAc и объединенные органические слои промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (МеОН/CH2Cl2) с получением твердого вещества. Твердое вещество промывали EtOH с получением 4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила (1,55 г) в виде твердого вещества.
Пример 137
К смеси метил(6-хлор-4-метил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-4-ил)ацетата (60 мг) и безводного THF (2 мл) добавляли метилмагнийбромид (3 М в Et2O, 0,323 мл). Смесь перемешивали при комнатной температуре в течение 15 мин. Смесь разбавляли насыщен. водн. NH4Cl (1 мл) и Н2О (5 мл). Смесь экстрагировали EtOAc (2×35 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью ВЭЖХ с обращенной фазой с использованием градиента от 10 до 100% MeCN/Н2О в течение 50 мин с 0,1% муравьиной кислотой (PhenomeneXGemini, 5 микрон С18). Остаток затвердевал в Et2O, с получением 6-хлор-4-(2-гидрокси-2-метилпропил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (38 мг) в виде твердого вещества.
Пример 143
К смеси 8,8-диэтил-2-(гидроксиметил)-6-{[2-(триметилсилил)этокси]метил}-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (283 мг), CuI (47 мг) и MeCN (12 мл) добавляли дифтор(фторсульфонил)уксусную кислоту (0,14 мл) при 80°С. Через 1 час к смеси добавляли дифтор(фторсульфонил)уксусную кислоту (0,14 мл) при той же температуре. Через 2 часа к смеси добавляли CuI (106 мг) и дифтор(фторсульфонил)уксусную кислоту (0,14 мл) при той же температуре. Затем смесь перемешивали при той же температуре в течение 1 часа. После охлаждения до комнатной температуры добавляли насыщен. водн. NaHCO3 и экстрагировали EtOAc. Органический слой сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (EtOAc/гексаны) дважды с получением 2-[(дифторметокси)метил]-8,8-диэтил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она (14 мг) в виде твердого вещества.
Пример 148
К смеси 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила (59,22 г) и EtOH (1260 мл) добавляли Н2О (540 мл). Смесь перемешивали при 75°С в течение 20 мин и 78°С в течение 15 мин. К смеси добавляли Н2О (1,8 л) и перемешивали при 65°С в течение 80 мин и охлаждали до 20°С в течение 1 часа, и затем перемешивали при 20°С в течение 2 часов. Осадок собирали, промывали 35% водн. EtOH с получением 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила (54,43 г) в виде кристалла.
В результате подвергания кристаллов измерению способом порошковой дифракции рентгеновских лучей с использованием Cu в качестве трубки, была получена диаграмма, включающая пики при 2θ (°)=8,3, 12,1, 15,6, 16,6, 17,3, 20,5, 21,4, 23,4, 24,0 и 25,7.
Пример 149
6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (21,59 г) разделяли хиральной колоночной хроматографией (CHIRALFLASH (товарный знак) IC, элюент; от 40 до 100% этанол/гексаны, затем 100% МеОН) с получением (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксан]-3(4Н)-она (более длительное время удерживания). Затем соединение очищали колоночной хроматографией на силикагеле (CHCl3/МеОН). Остаток выпаривали совместно с EtOAc, затем добавляли EtOAc (30 мл) и обрабатывали ультразвуком. К смеси добавляли EtOAc (10 мл) и гексан (80 мл), а затем снова обрабатывали ультразвуком. Смесь перемешивали при комнатной температуре в течение 15 мин. Осадок собирали и сушили при 50°С при пониженном давлении с получением (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (8,99 г) в виде кристалла.
В результате подвергания кристаллов измерению с способом порошковой дифракции рентгеновских лучей с использованием Cu в качестве трубки, была получена диаграмма, включающая пики при 2θ (°) = 6,7, 11,1, 12,2, 13,7, 15,5, 16,2, 17,0, 18,3, 21,7 и 22,7.
Пример 154
К жидкости полифосфорной кислоты (20 г) добавляли трет-бутил-4-(3-хлорфенил)-4-цианопиперидин-1-карбоксилат (4,5 г) при 140°С и перемешивали в течение 5 мин. К смеси добавляли ацетон (2,3 г) по каплям в течение 2 часов. Затем смесь перемешивали при 100°С в течение 1 часа. Смесь охлаждали до комнатной температуры и медленно выливали в смесь льда (около 100 г) и EtOAc (300 мл). Органический слой отделяли. Водный слой обрабатывали K2CO3 до тех пор, пока рН смеси не достиг 10, после чего дважды экстрагировали EtOAc (400 мл). Объединенные органические слои промывали насыщен. водн. NaHCO3, сушили над MgSO4, фильтровали и концентрировали с получением 6-хлор-1,1-диметил-1,2-дигидро-3Н-спиро[изохинолин-4,4'-пиперидин]-3-она (1,5 г) в виде твердого вещества.
Пример 155
Смесь 6-хлор-1,1-диметил-1,2-дигидро-3Н-спиро[изохинолин-4,4'-пиперидина]-3-она (56 мг), CH2Cl2 (2 мл), DIPEA (0,070 мл) и метансульфонилхлорида (0,017 мл) перемешивали при комнатной температуре в течение 30 мин, а затем очищали непосредственно с использованием ВЭЖХ с обращенной фазой (от 5 до 100% MeCN/H2O, 0,1% буфера муравьиной кислоты) в течение 40 минут с получением 6-хлор-1,1-диметил-1'-(метилсульфонил)-1,2-дигидро-3Н-спиро[изохинолин-4,4'-пиперидин]-3-она (34 мг) в виде твердого вещества.
Справочный пример 166
К смеси 6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она (259 мг) и CH2Cl2 (7 мл) добавляли 1,1,1-триацетокси-1,1-дигидро-1,2-бензодиооксол-3(1Н)-он (периодинан Десса-Мартина (Dess-Martin)) (585 мг), и смесь перемешивали при комнатной температуре в течение 30 мин. К смеси добавляли CH2Cl2 и дважды промывали насыщен. водн. NaHCO3. Органический слой затем сушили над Na2SO4, фильтровали и концентрировали с получением (6-хлор-4-метил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-4-ил)ацетальдегида (514 мг) в виде твердого вещества.
Пример 167 (167а и 167b)
К смеси (6-хлор-4-метил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-4-ил)ацетальдегида (514 мг, неочищенный продукт от предыдущей реакции) и THF (8 мл) добавляли метилмагнийбромид (3 М в Et2O, 0,9 мл) при охлаждении на ледяной бане, и полученную смесь перемешивали при охлаждении на ледяной бане в течение 30 мин. Смесь разбавляли насыщен. водн. NH4Cl (5 мл) и Н2О (30 мл) с последующей экстракцией дважды EtOAc (75 мл). Объединенные органические слои промывали насыщенным солевым раствором и концентрировали до получения неочищенного твердого вещества. Неочищенное твердое вещество очищали с помощью ВЭЖХ с обращенной фазой (PhenomeneXGemini, 5 микрон С18, от 10 до 100% MeCN/H2O с 0,1% муравьиной кислотой в течение 50 минут), чтобы получить оба диастереомера в виде твердых веществ. Как показал анализ измерения монокристаллической структуры с помощью рентгеновских лучей, первым диастереомером, который элюировался с колонки, был rac-(4R)-6-хлор-4-[(2R)-2-гидроксипропил]-4-метил -2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (65 мг), и вторым диастереомером, торый элюировался с колонки, был rac-(4R)-6-хлор-4-[(2S)-2-гидроксипропил]-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он (69 мг).
Соединения примеров получения, референтных примеров и примеров, показанных в таблицах ниже, получали тем же способом или аналогично способам в примерах получения, референтных примерах или примерах, как описано выше. В таблице 4 «прим. соед.» обозначает соединение из примера. В таблице 4 «соед. референтного прим. 166» обозначает соединение из референтного примера 166. В таблице 5 «прим. соед.» обозначает соединение из примера со ссылкой на структуры, представленные в таблице 4. В таблице 5 «соед. референтного прим. 166» обозначает соединение из референтного примера 166 со ссылкой на структуру соединения референтного примера 166, представленную в таблице 4. Кроме того, каждое соединение из примера и соединение из референтного примера, перечисленное в таблице 5, получали в соответствии с процедурой, описанной в соответствующем примере или референтном примере, или аналогичной процедуре, описанной в соответствующем примере или референтном примере, обозначенном «Syn». Например, первая запись в таблице 5 относится к соединению примера 1, имеющему структуру, показанную в первой записи в таблице 4. Данное соединение из примера получают в соответствии с процедурой, описанной в примере 1 в настоящем изобретении, и данные для такого соединения примера таковы, как указано в первой записи в таблице 5. В таблице 6 «соед. прим. получ.» обозначает соединение из примера получения. В таблице 7 «соед. прим. получ.» обозначает соединение из примера получения со ссылкой на структуры, представленные в таблице 6. Кроме того, каждое соединение из примера получения, приведенное в таблице 7, получали в соответствии с процедурой, описанной в соответствующем упомянутом примере получения или аналогичной процедуре, описанной в соответствующем упомянутом примере получения, обозначенном «PSyn». Например, первая запись в таблице 7 относится к соединению из примера получения 1а, имеющему структуру, показанную в первой записи таблицы 6. Данное соединение из примера получения получали в соответствии с процедурой, описанной в примере получения 1 в настоящем изобретении, и данные для данного соединения из примера получения приводятся в первой записи таблицы 7.
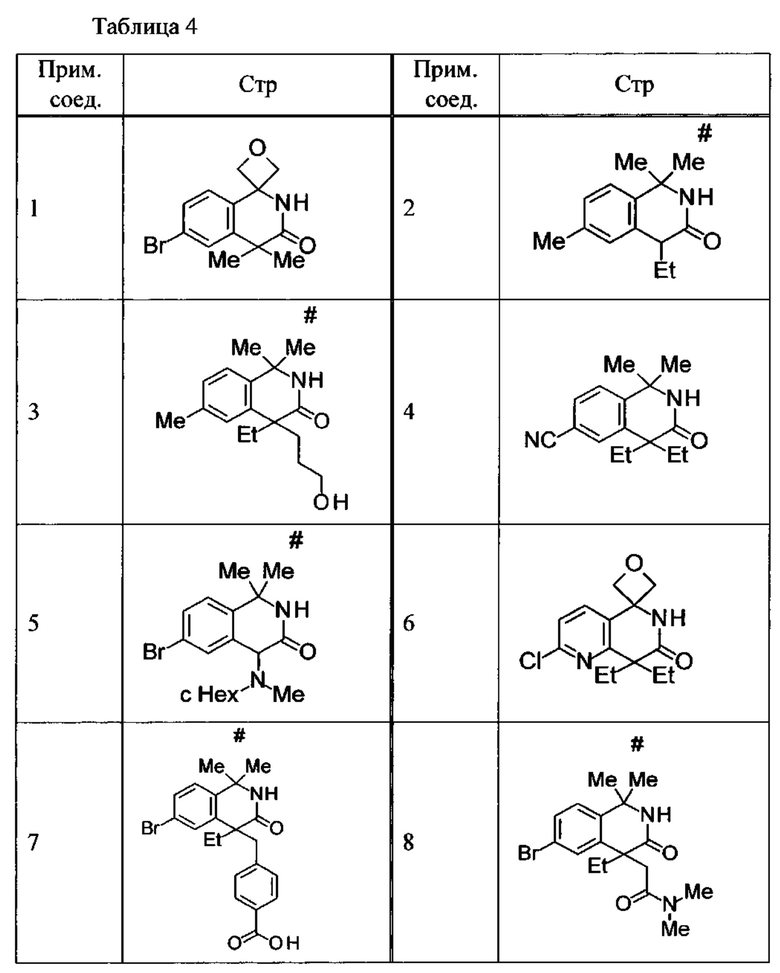
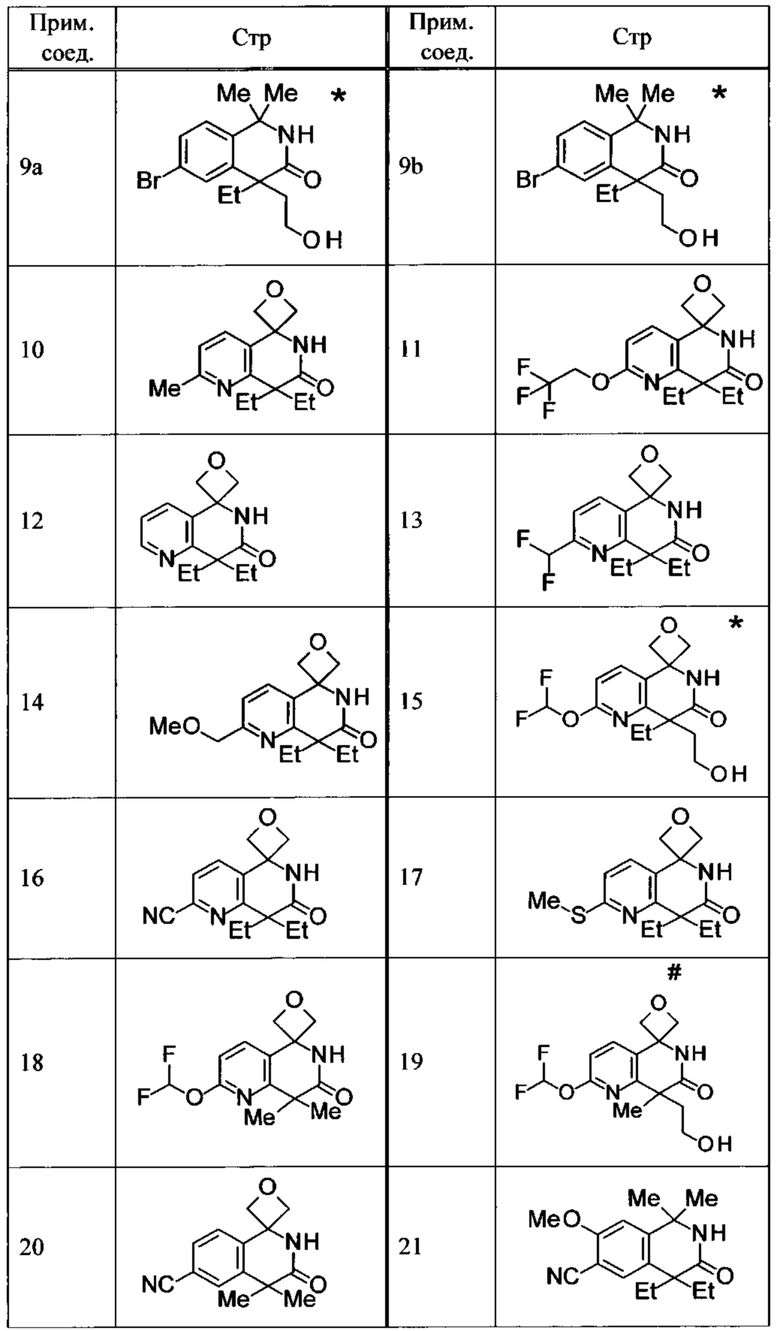
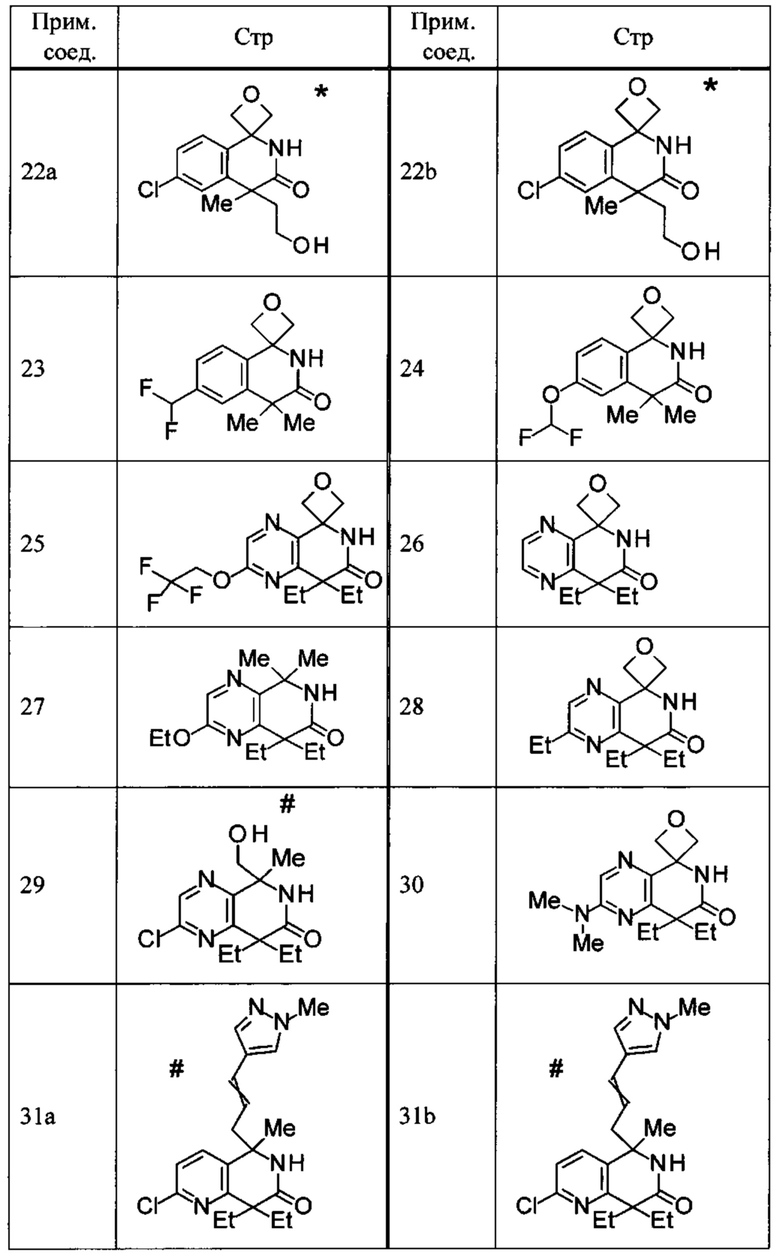
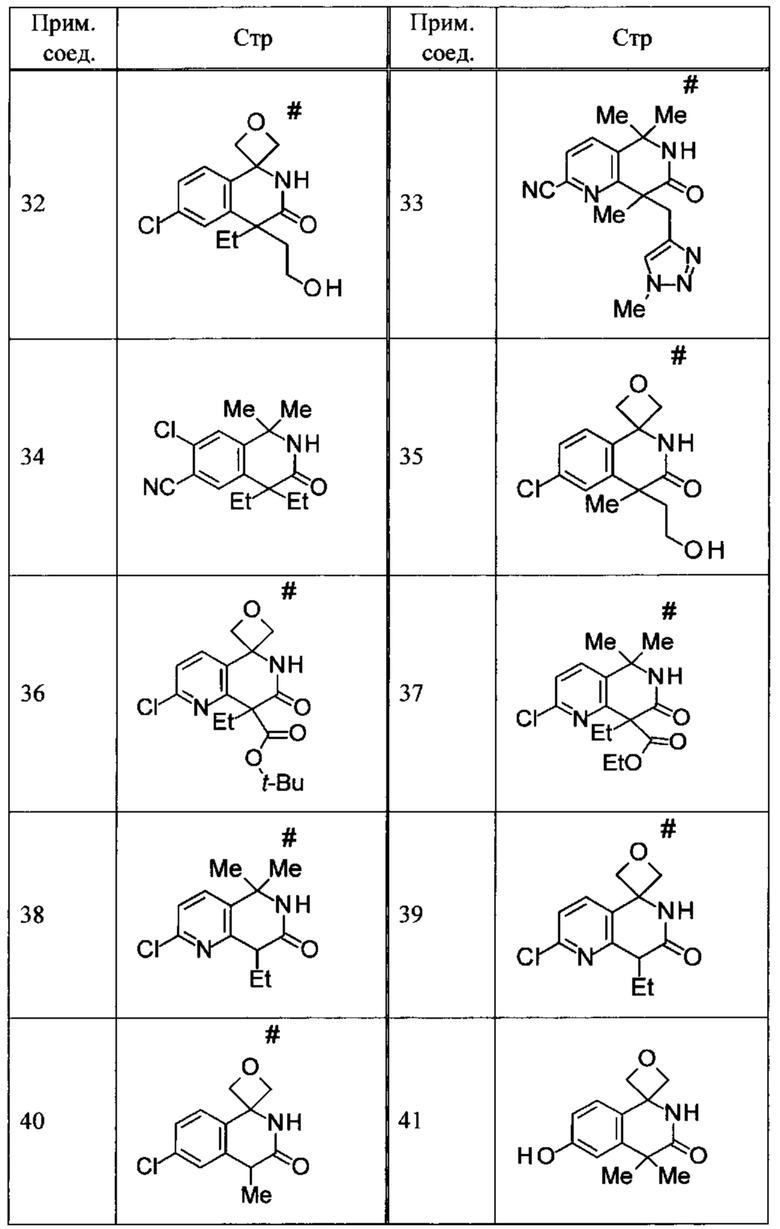
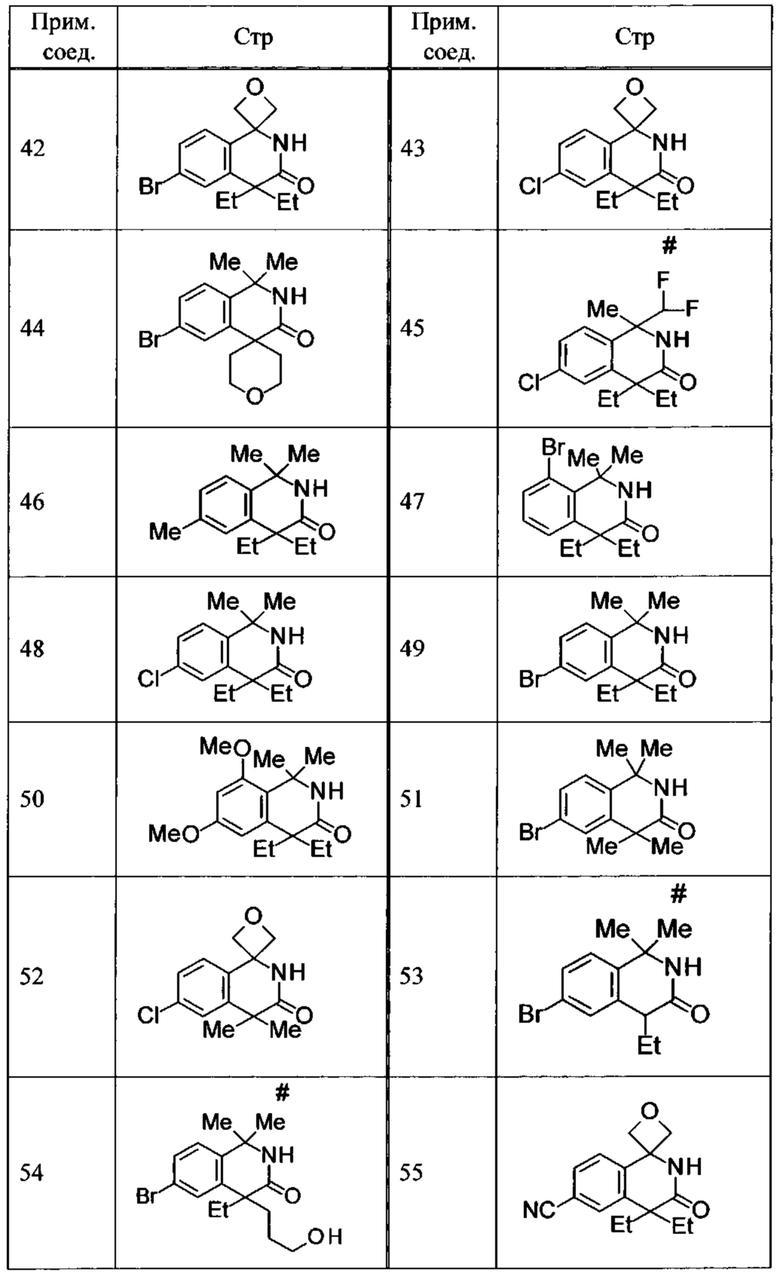
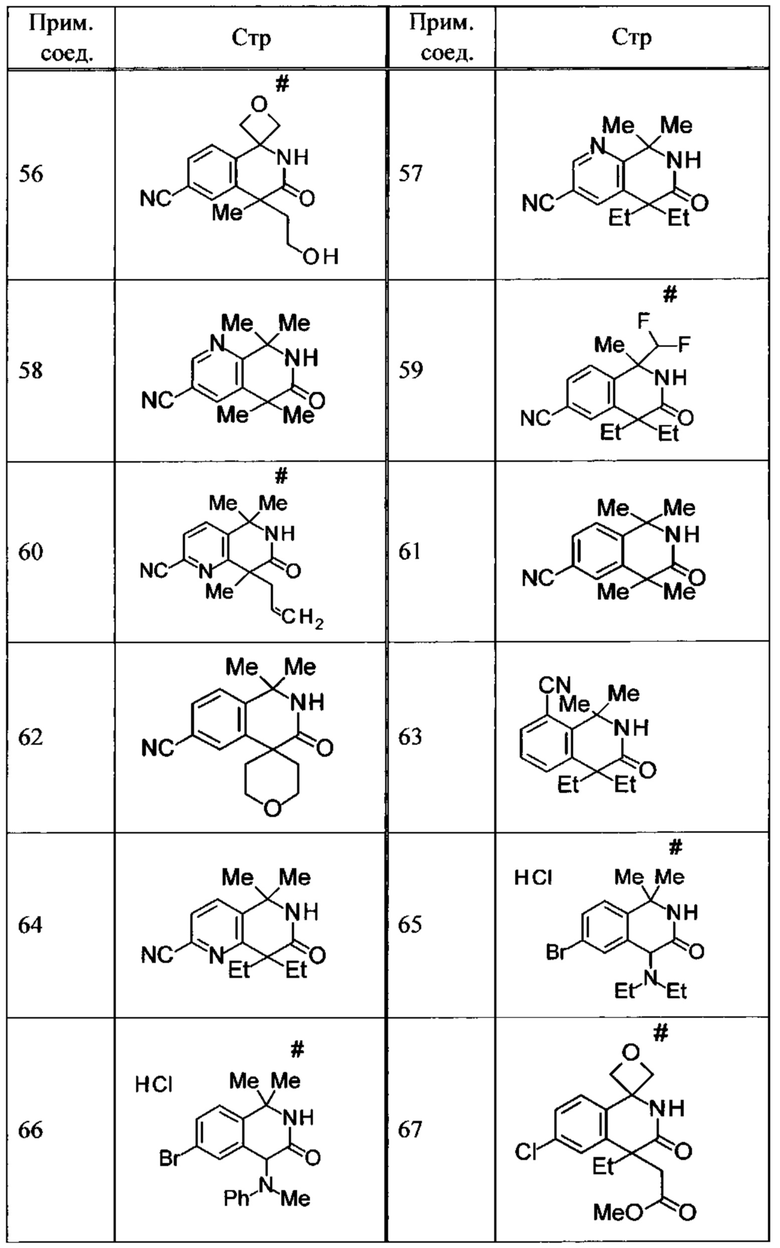
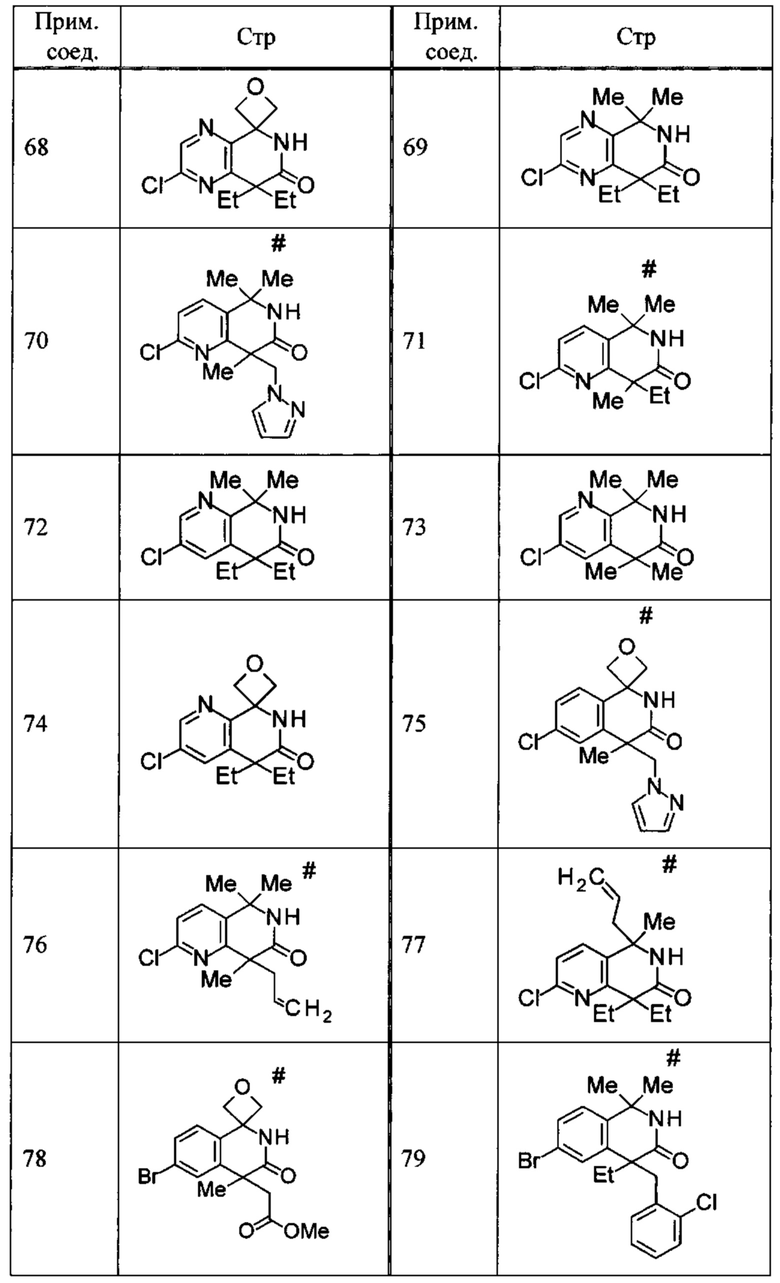
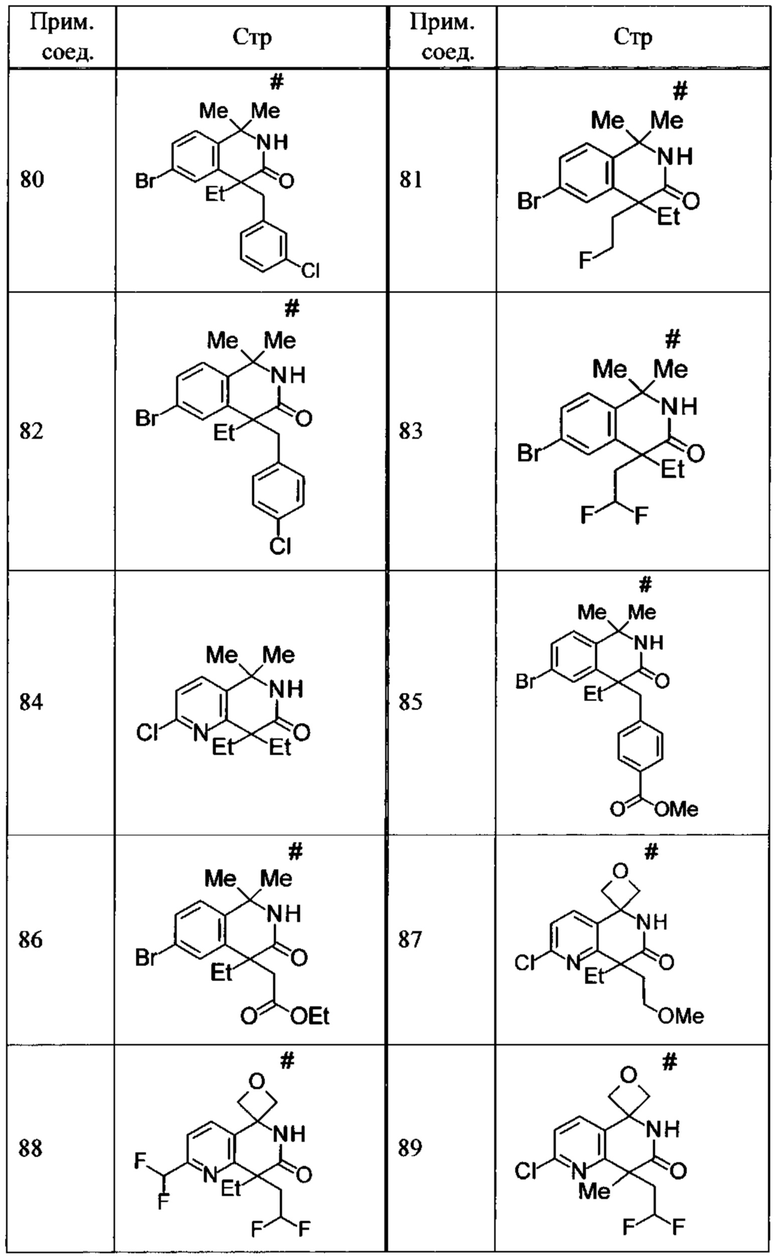
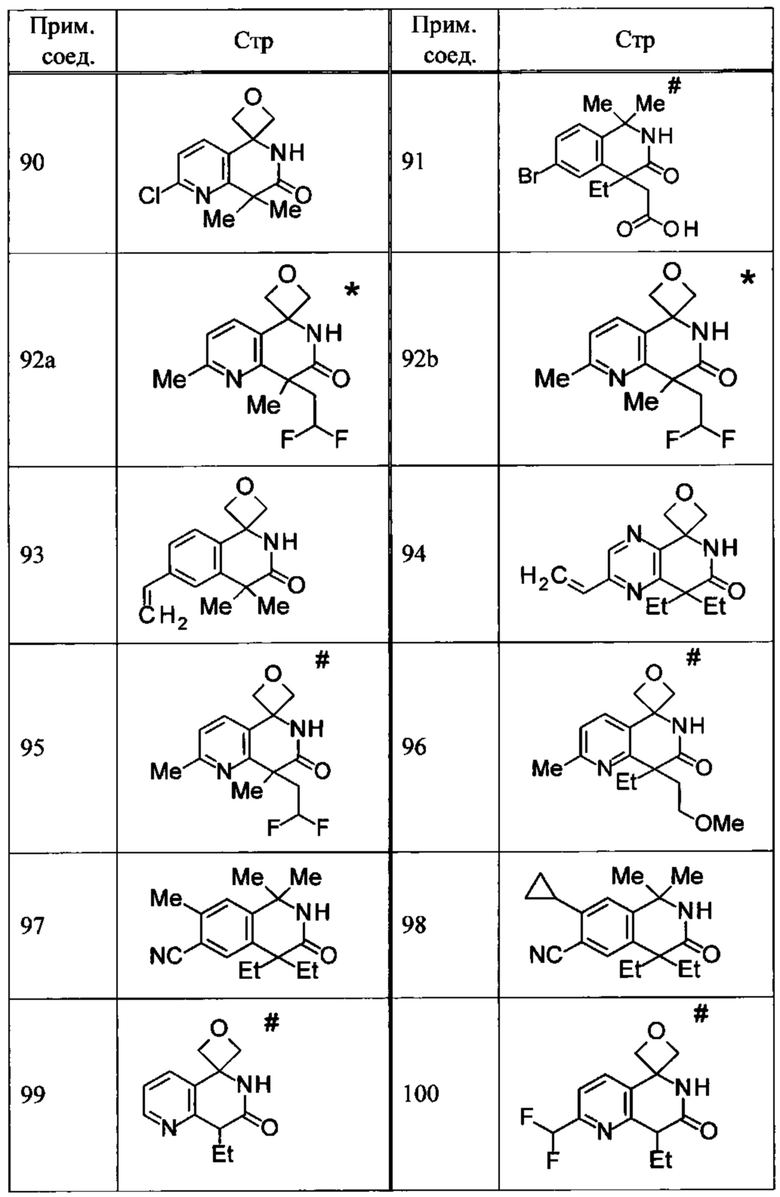
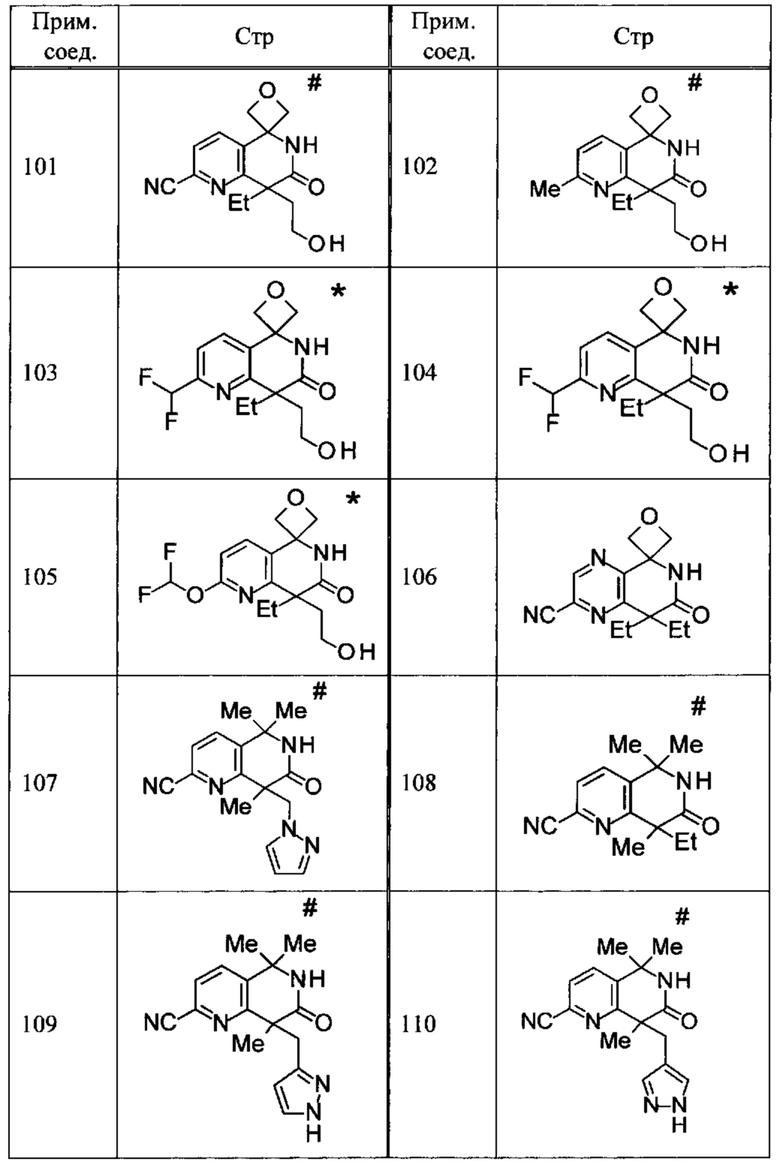
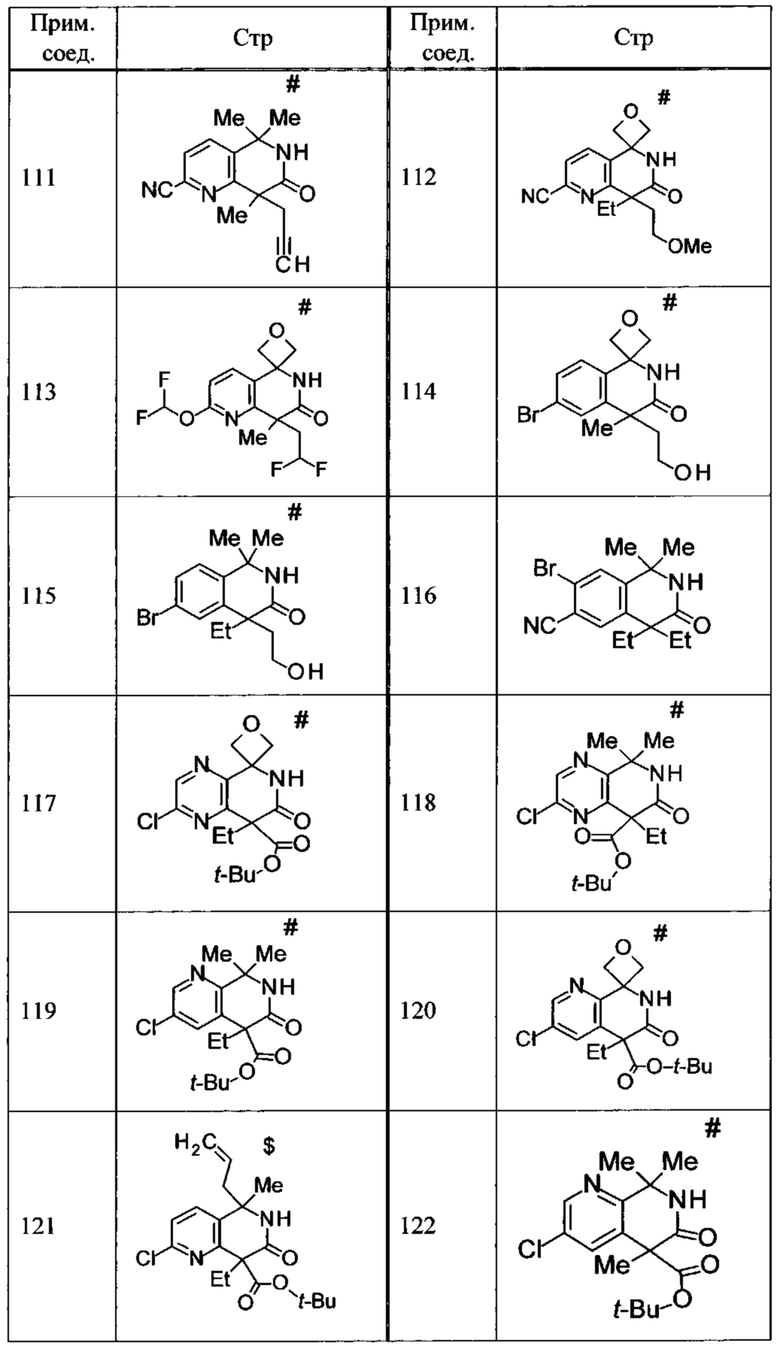
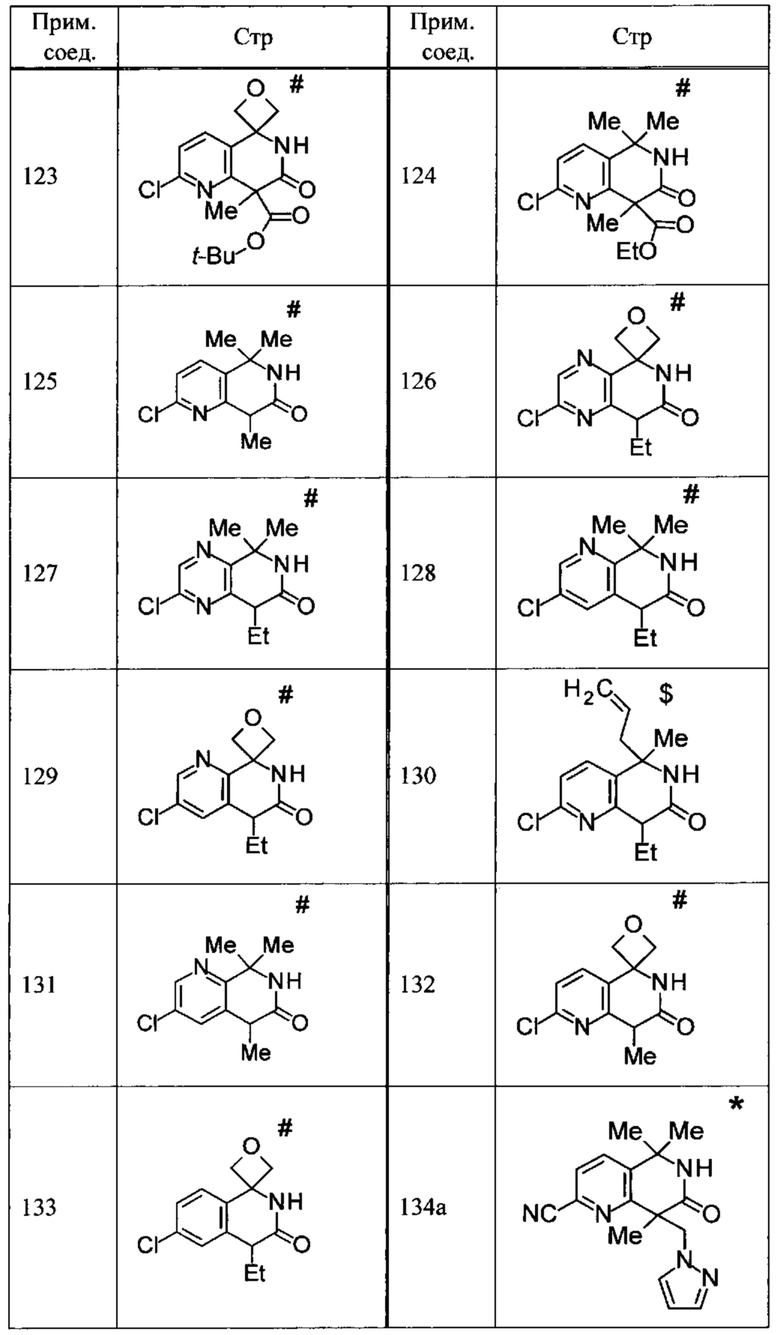
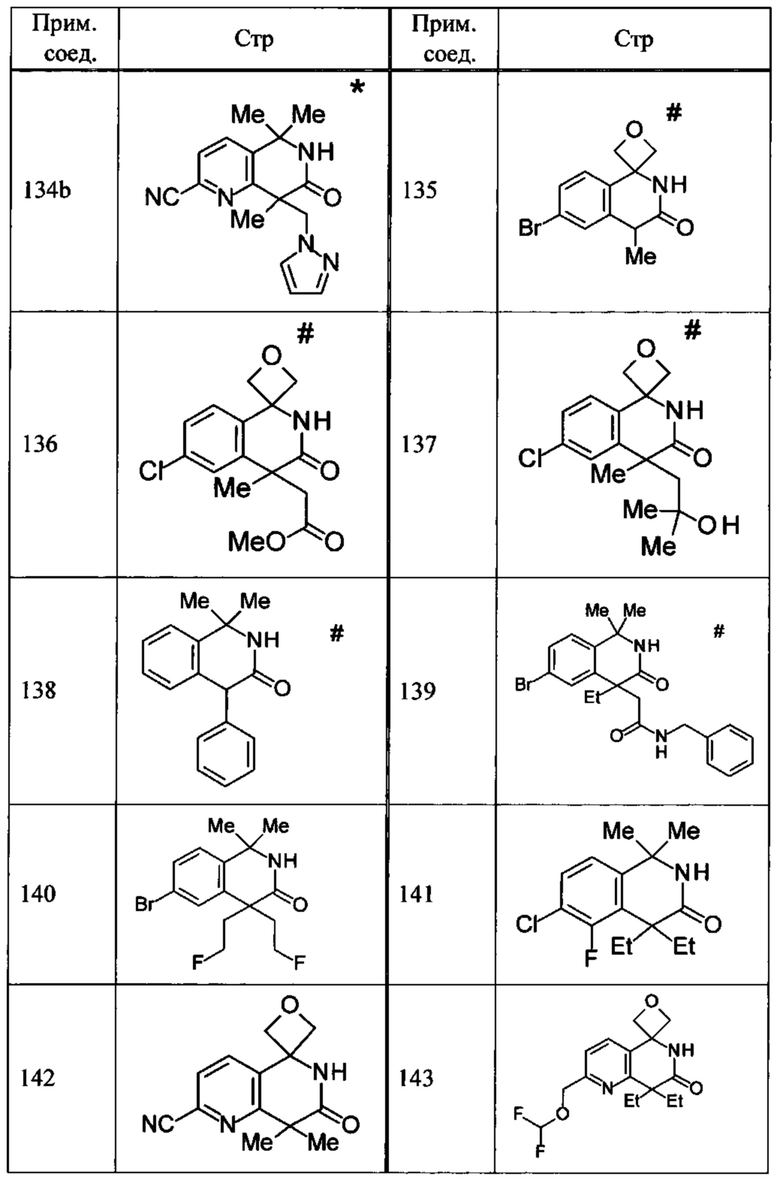
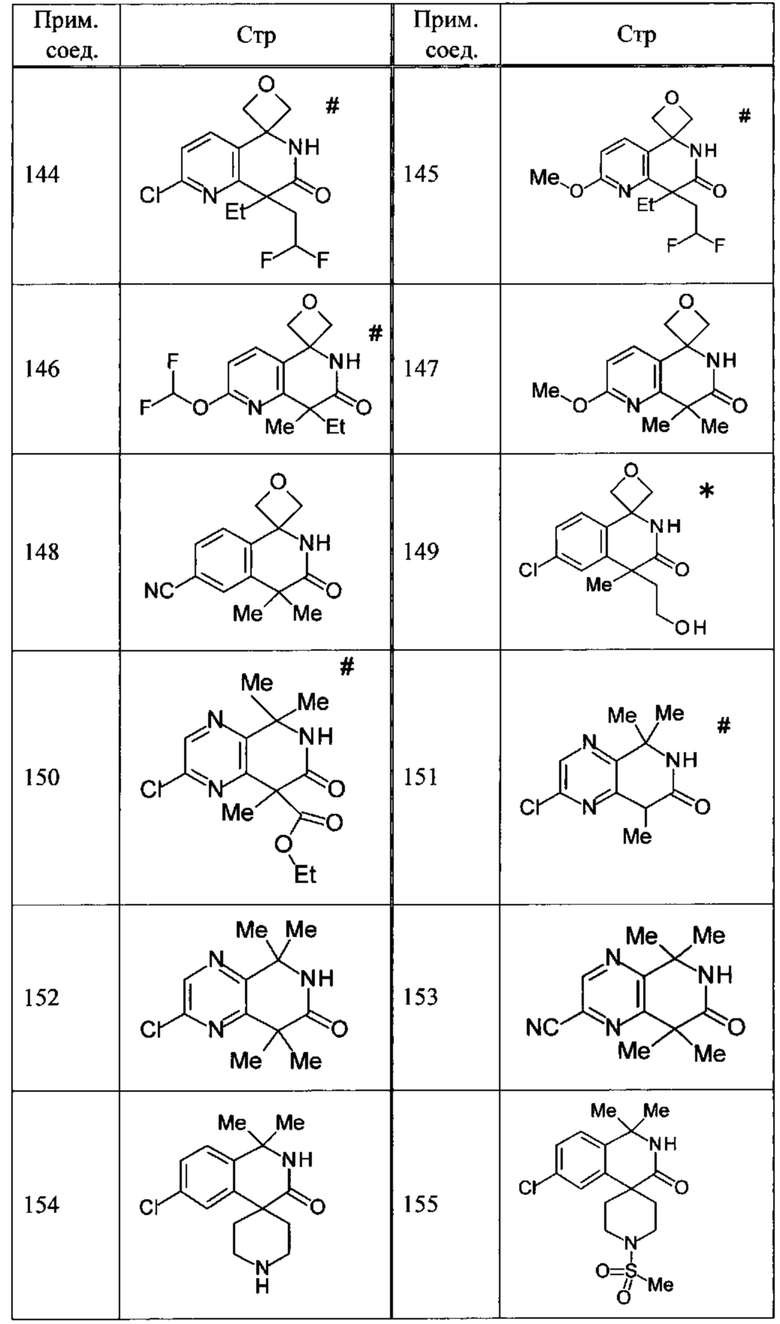
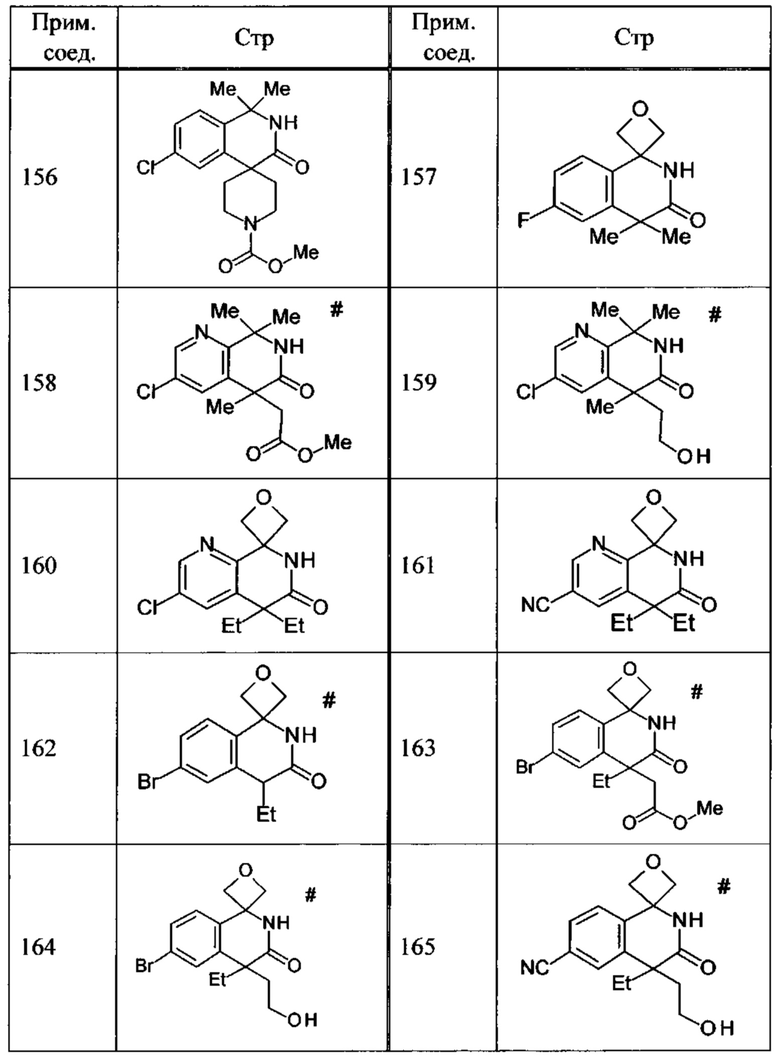
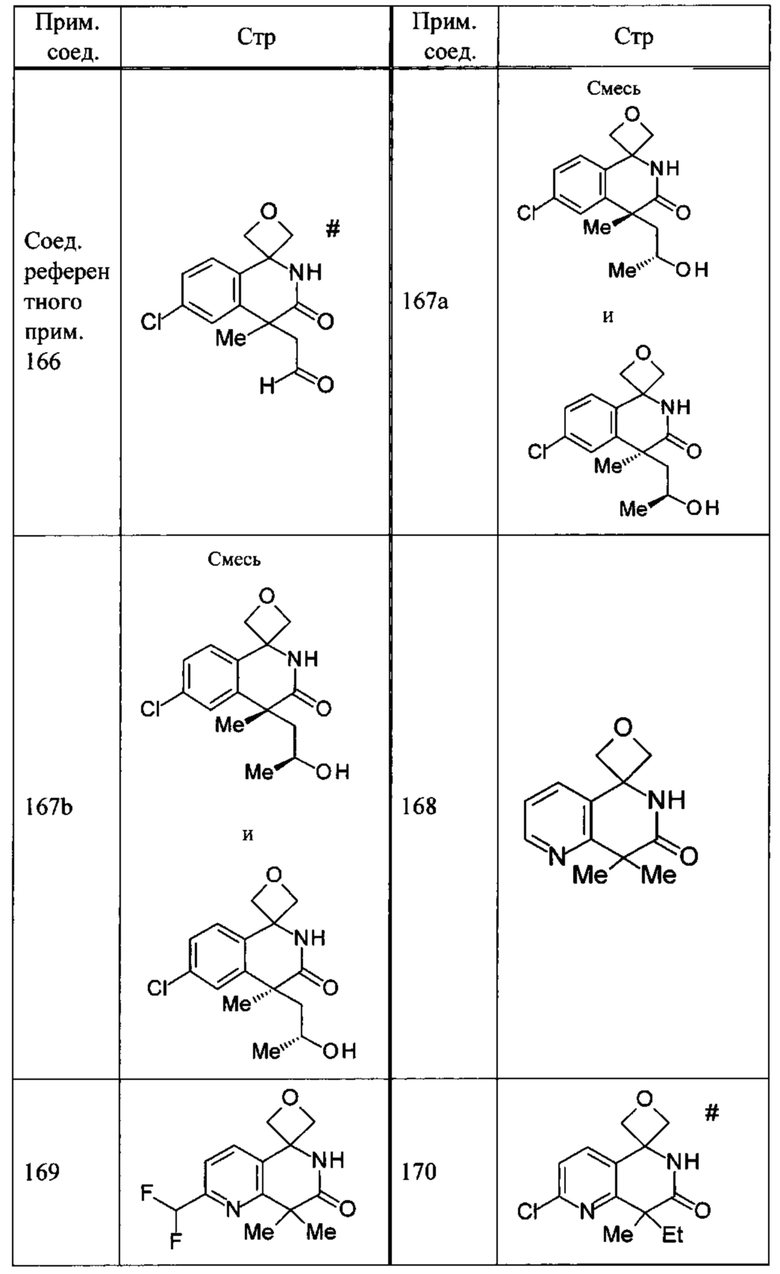
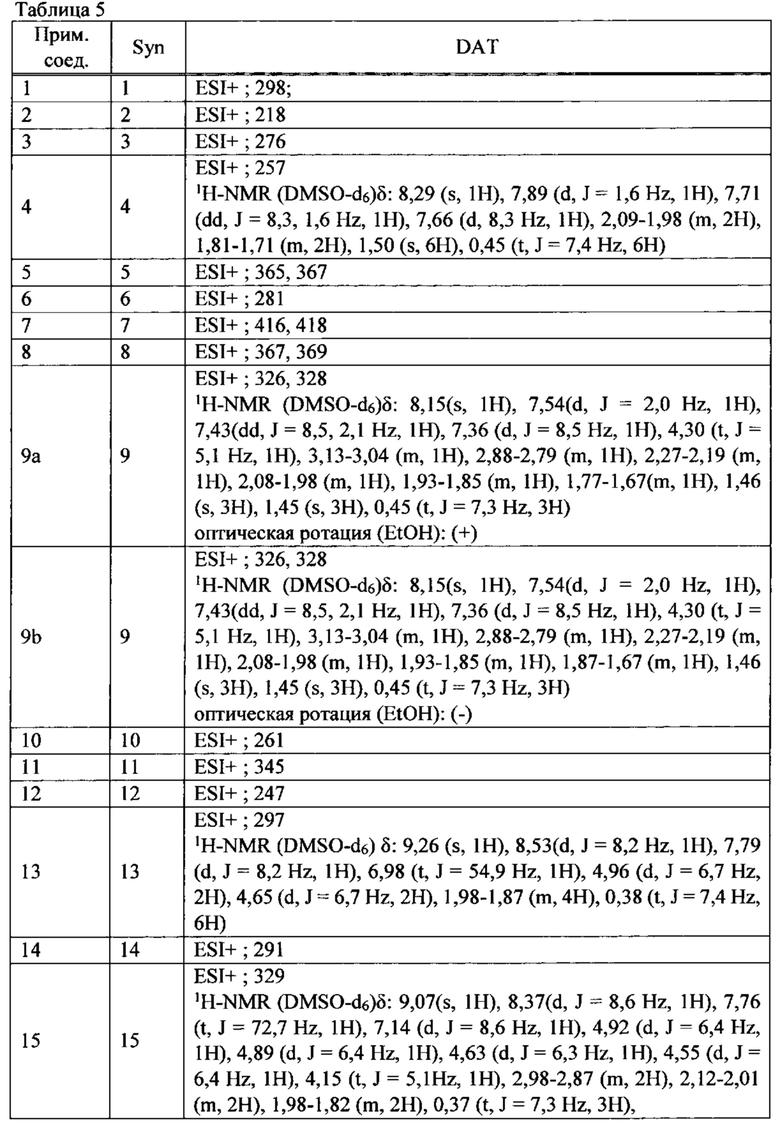
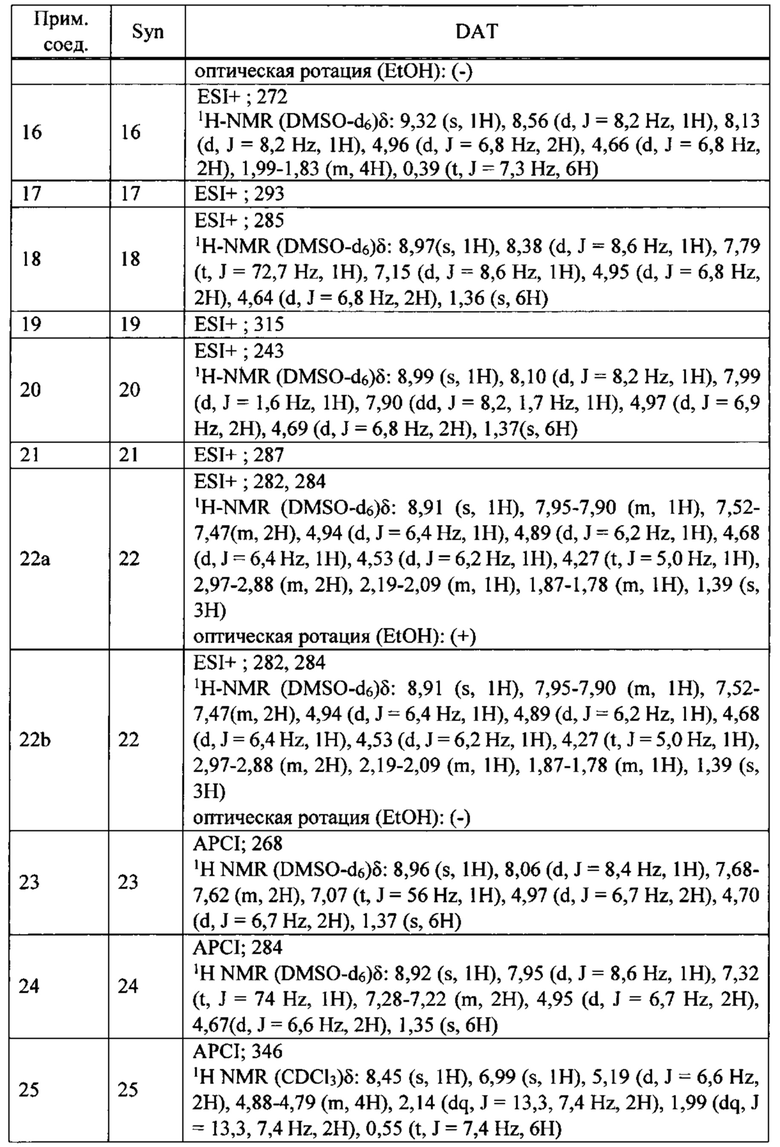
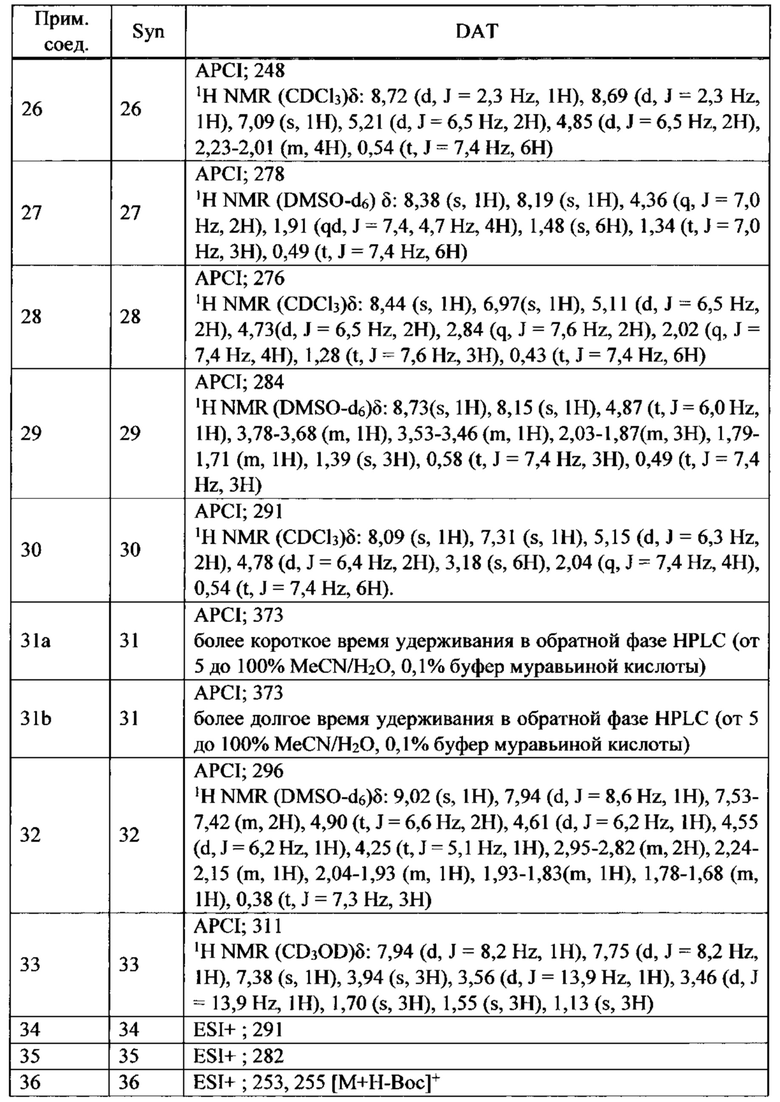
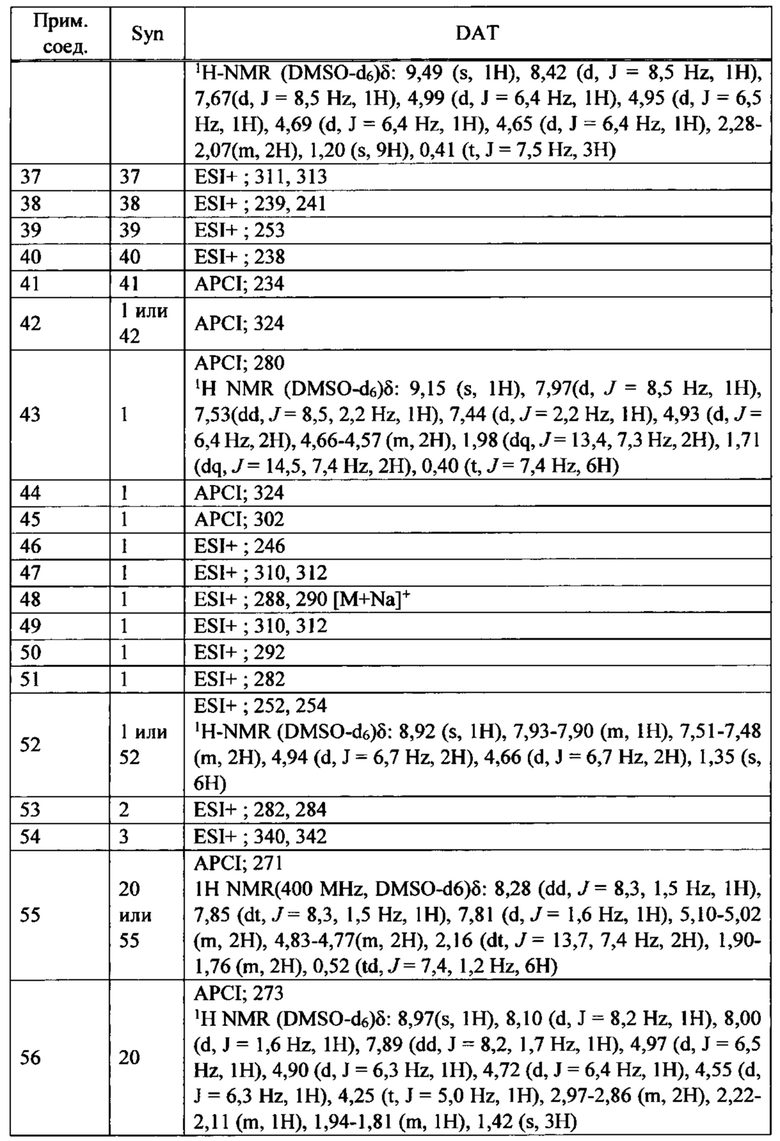
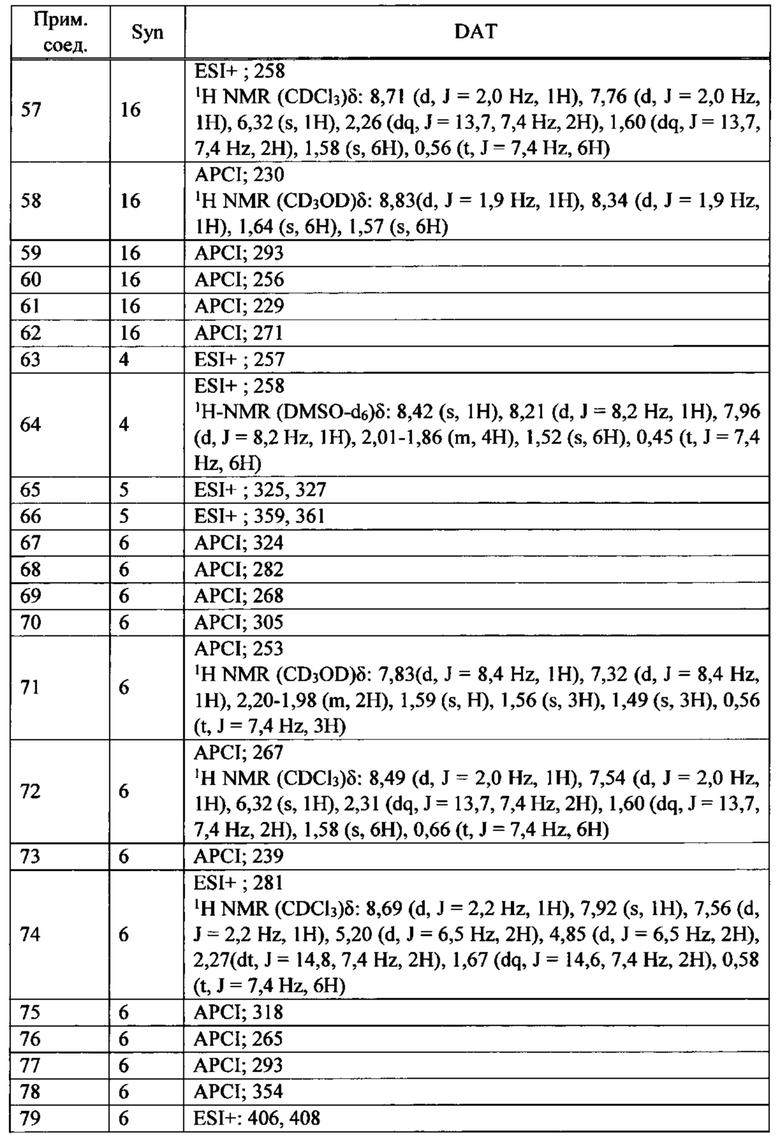
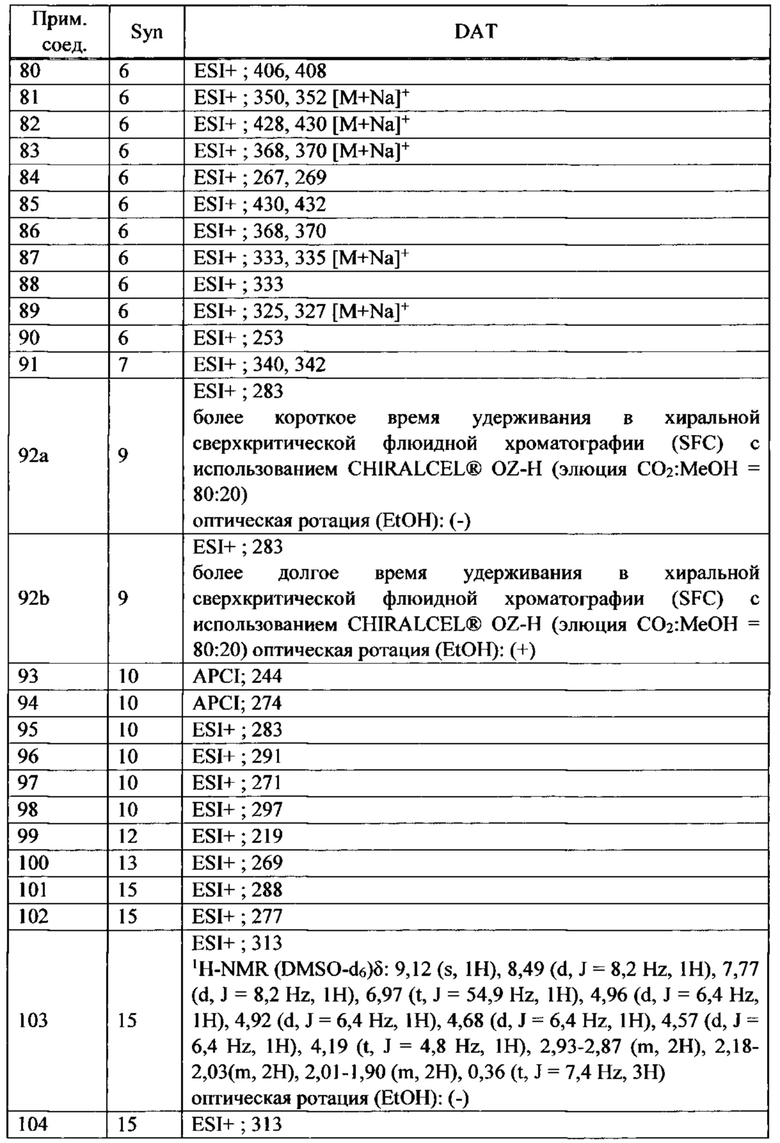
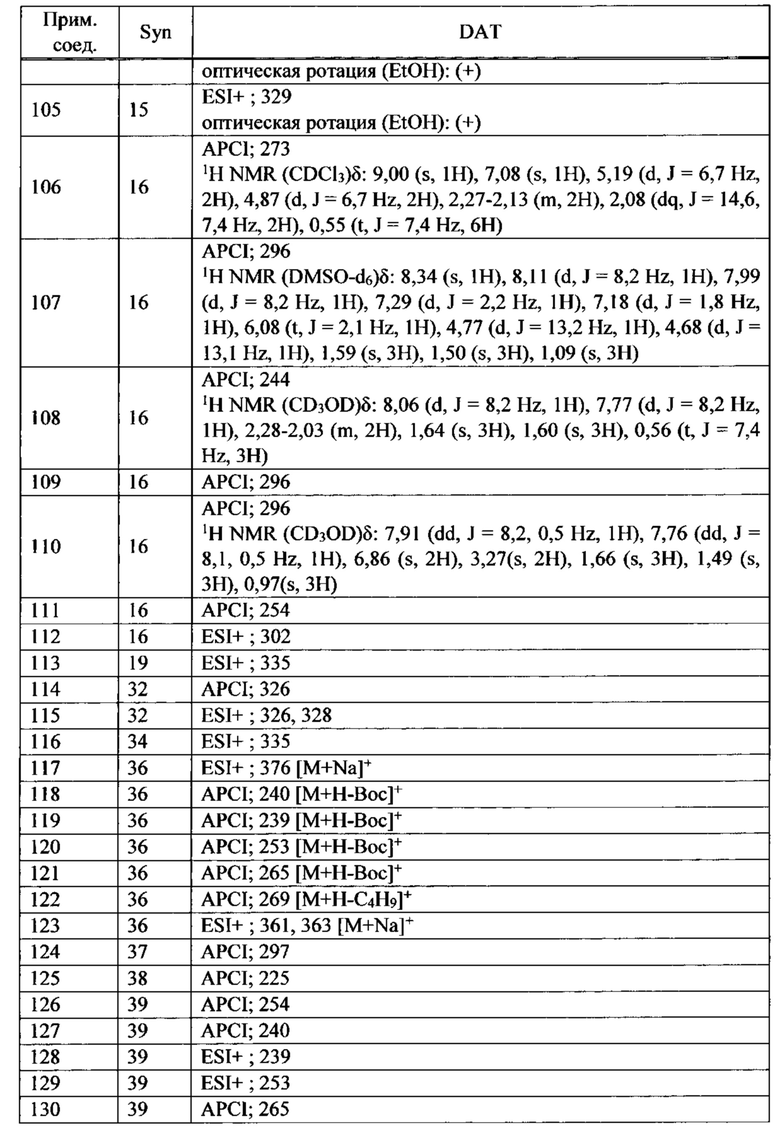
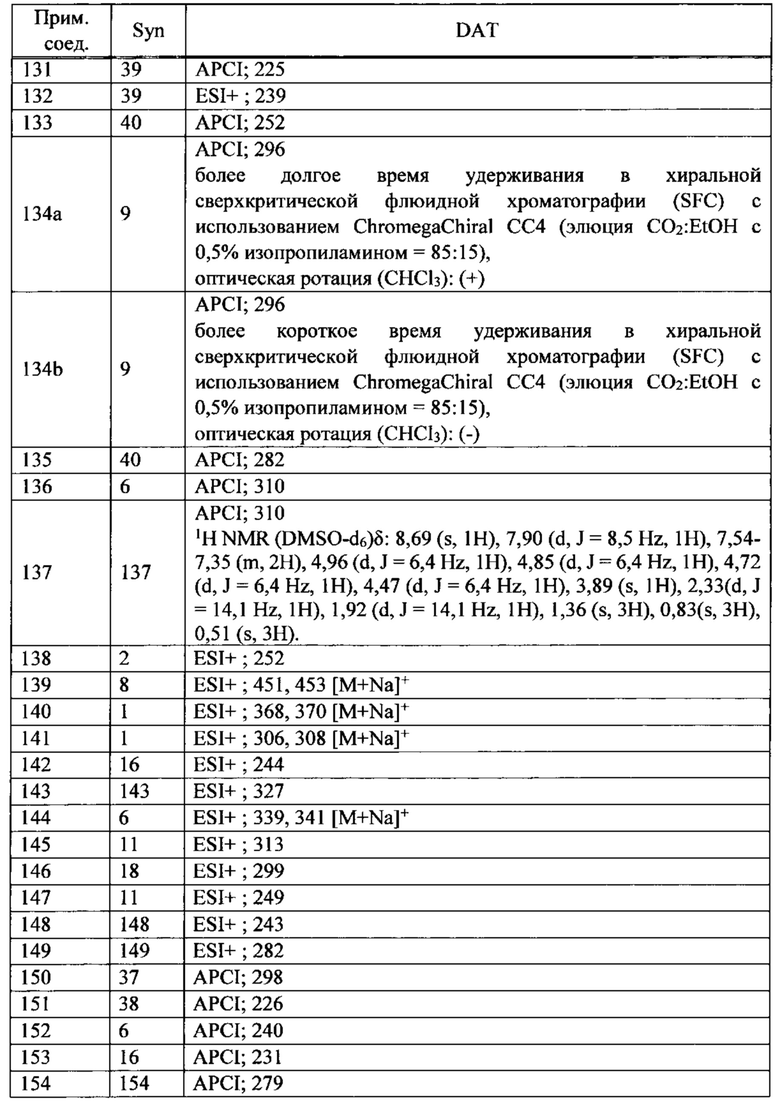
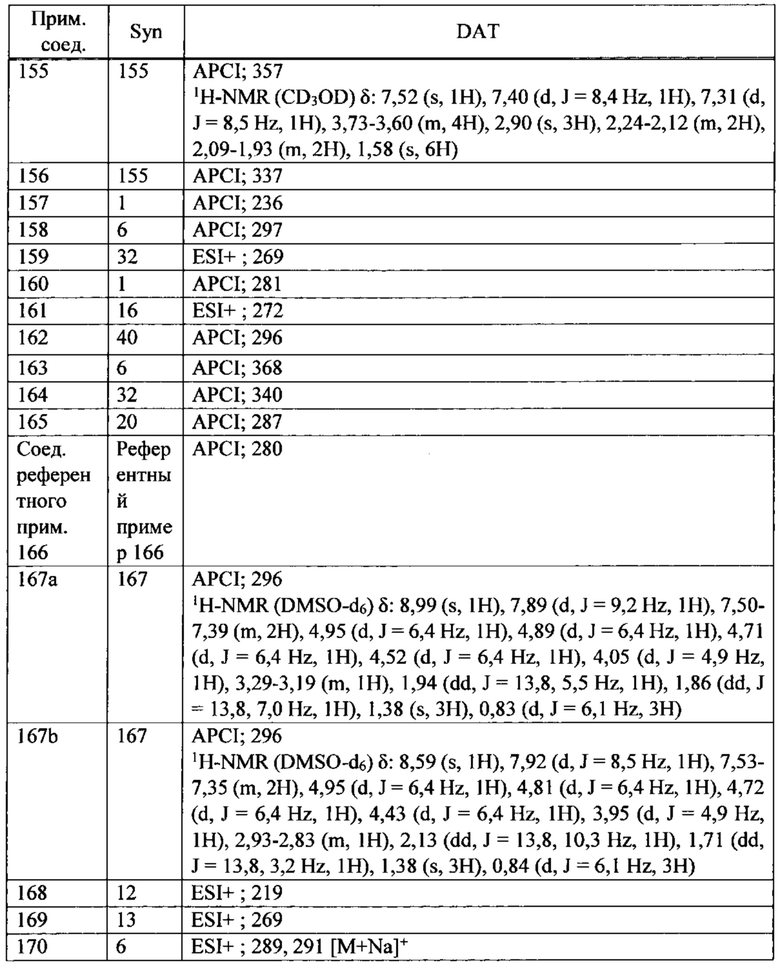
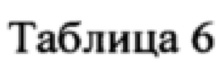
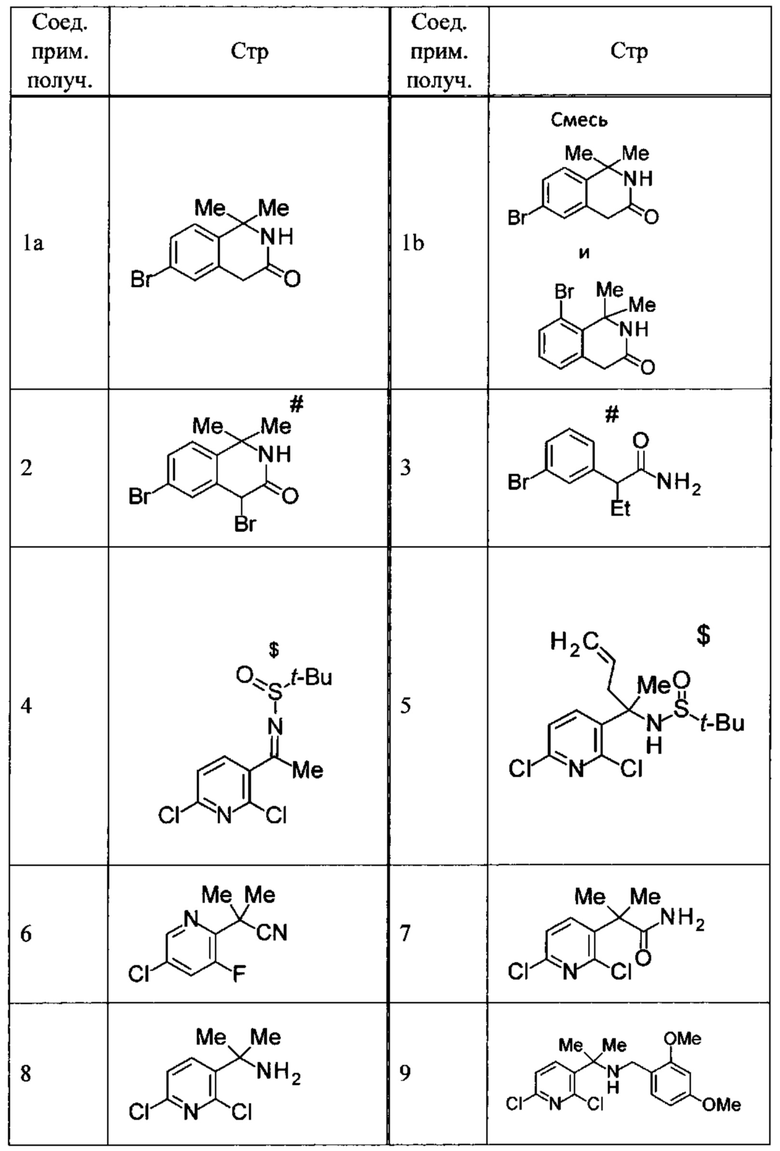
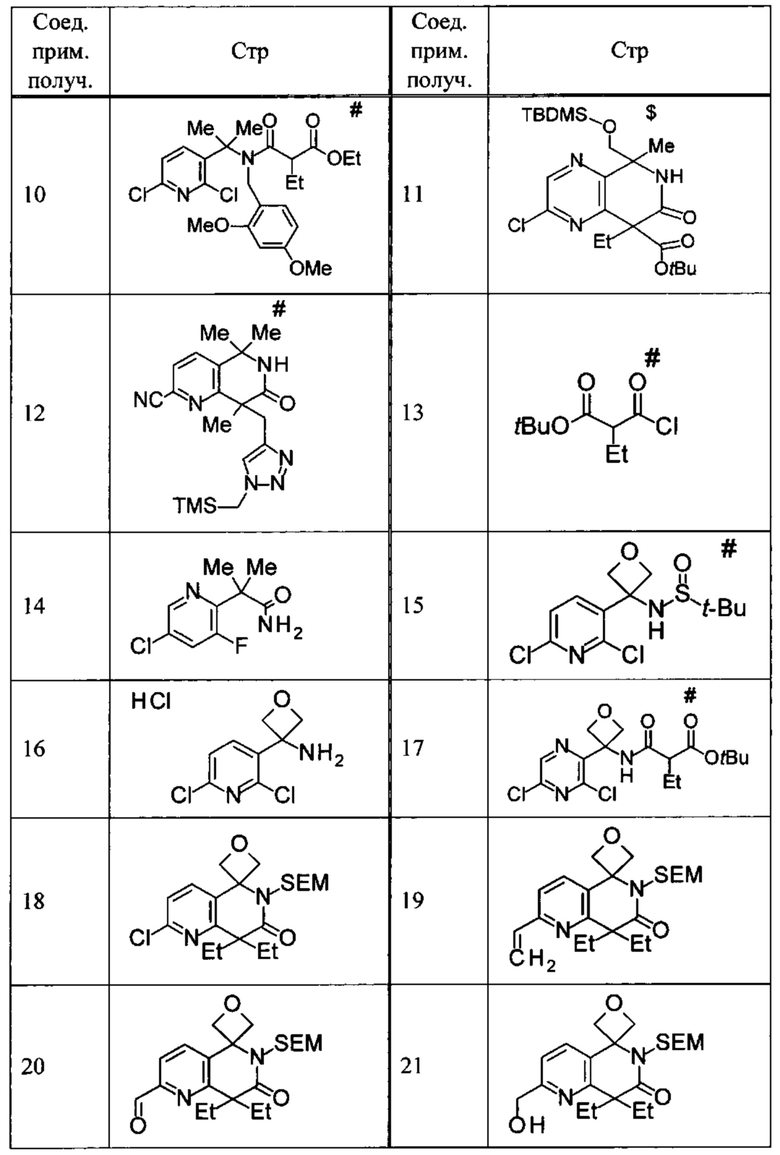
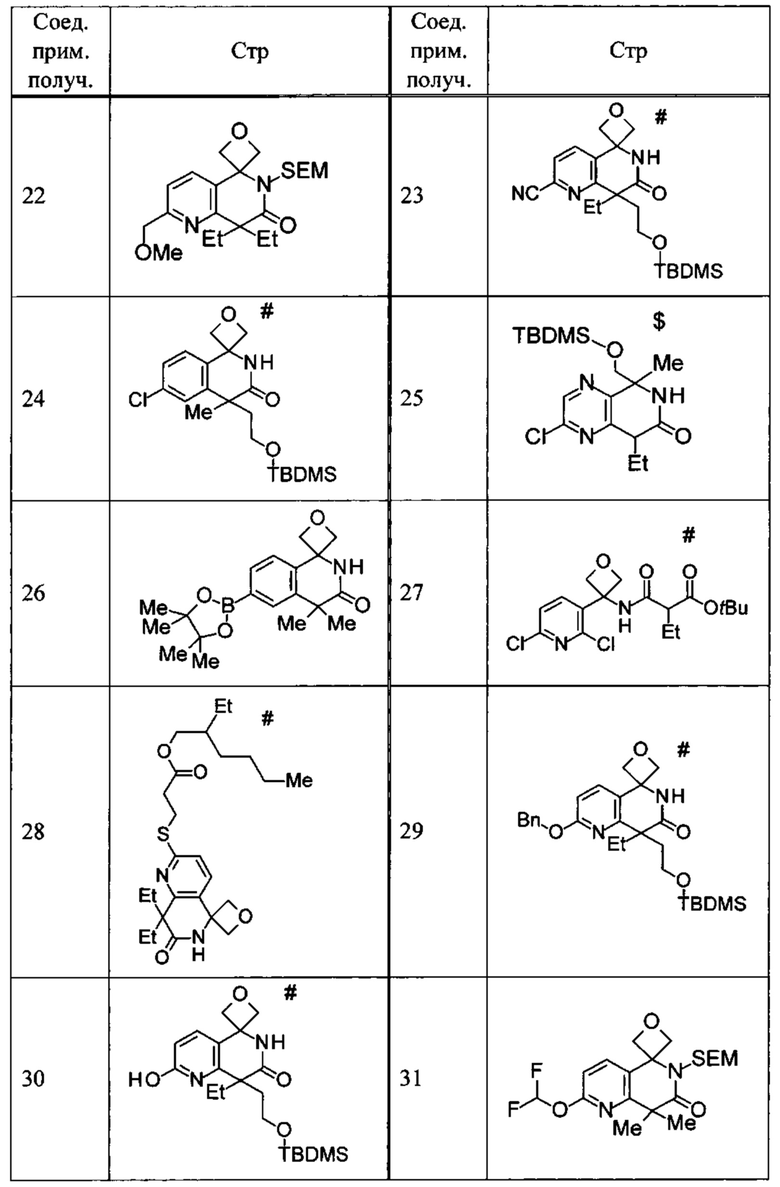
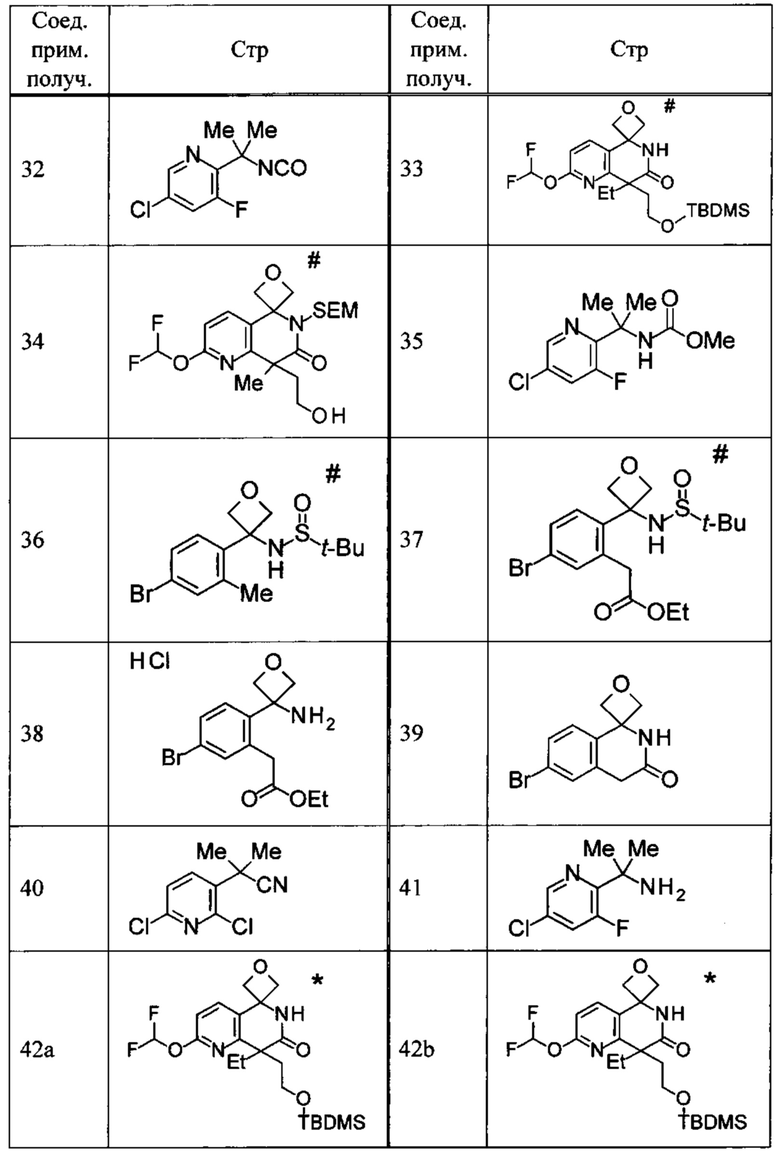
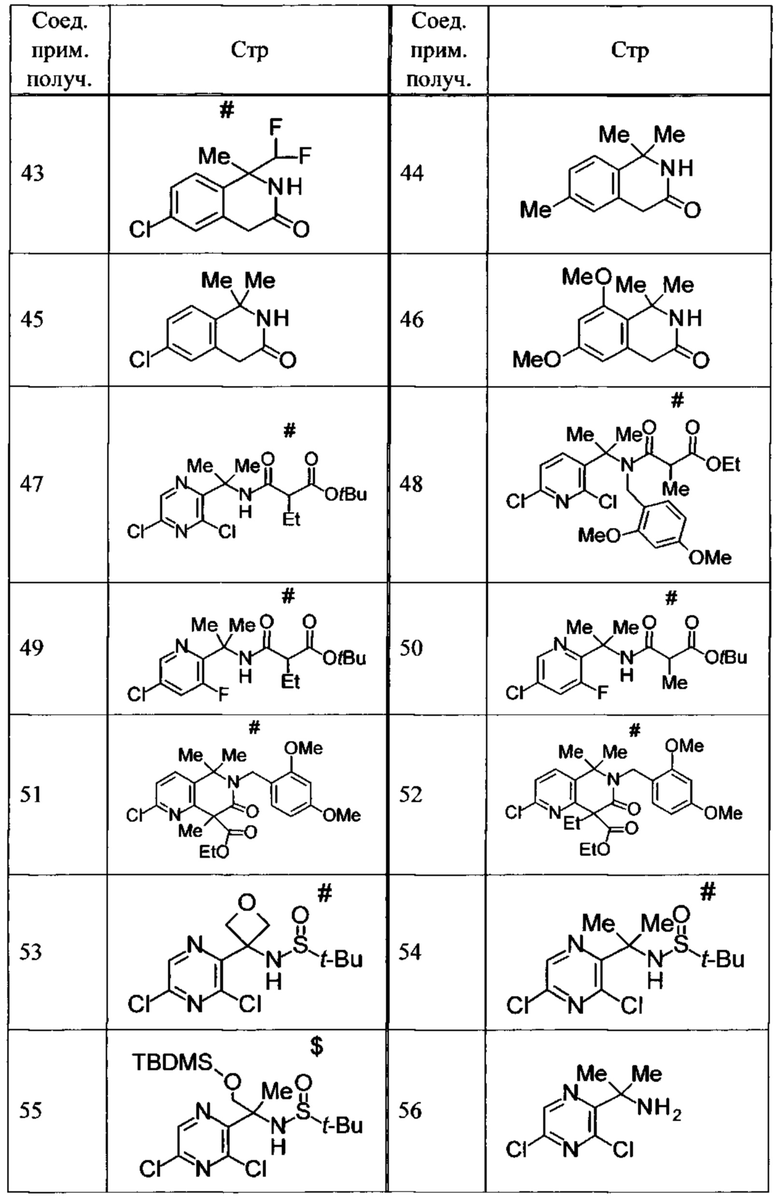
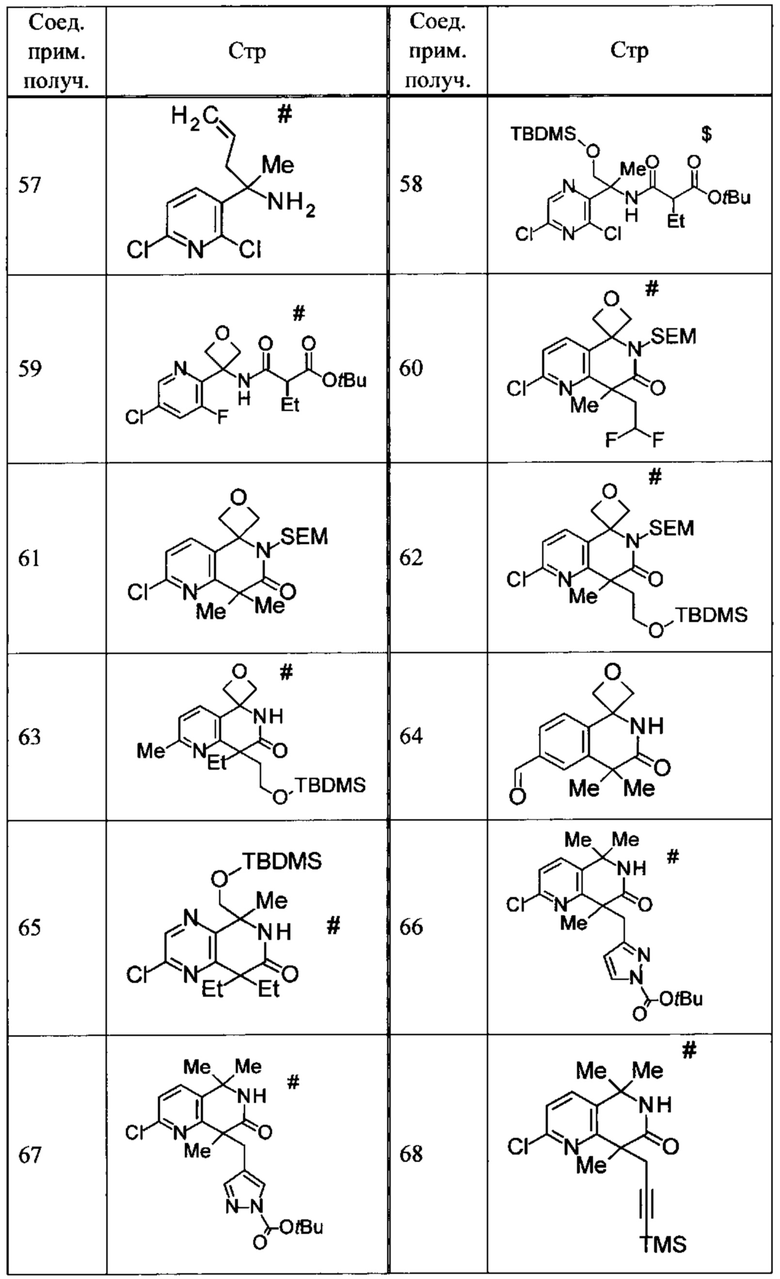
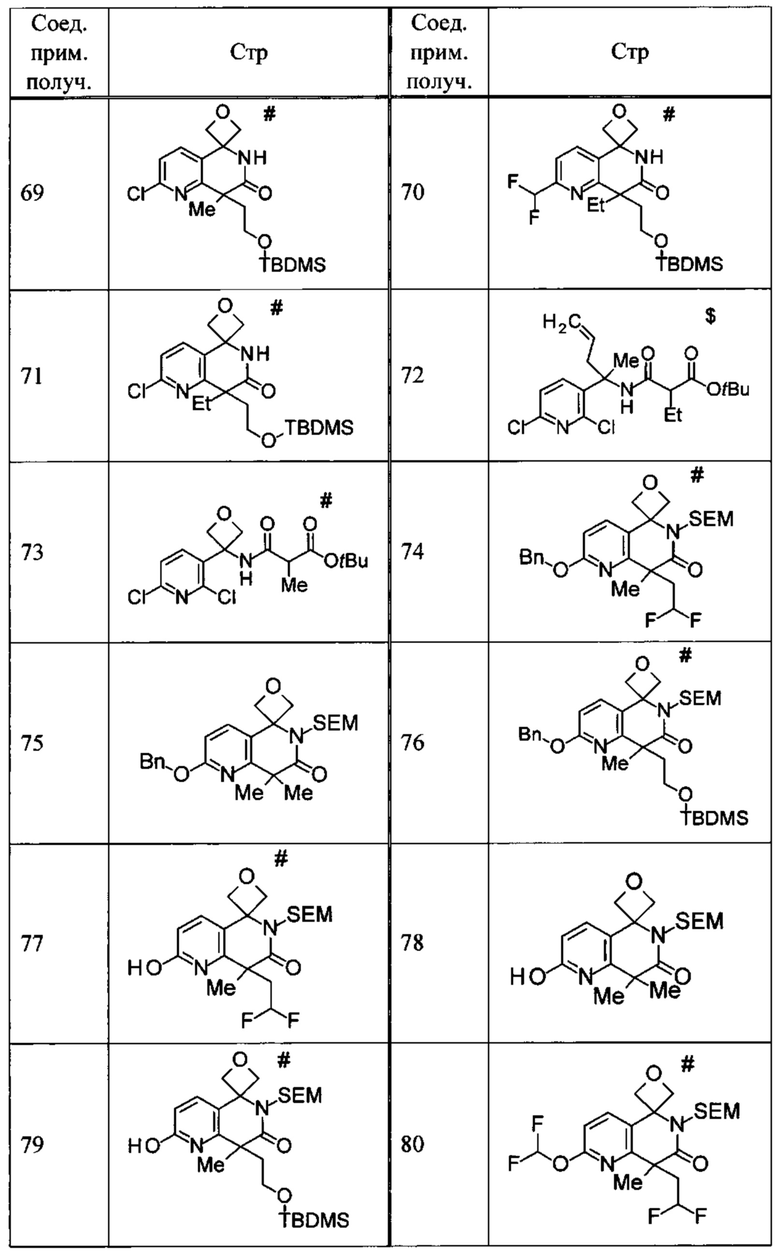
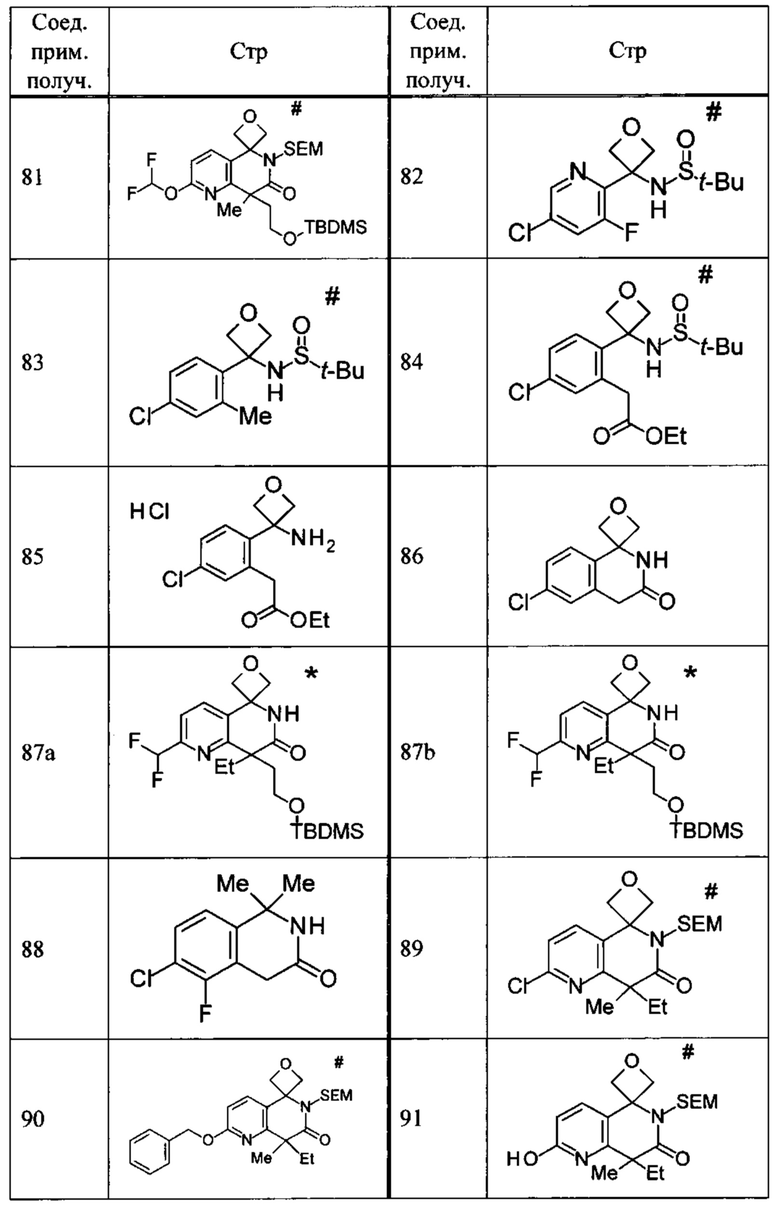
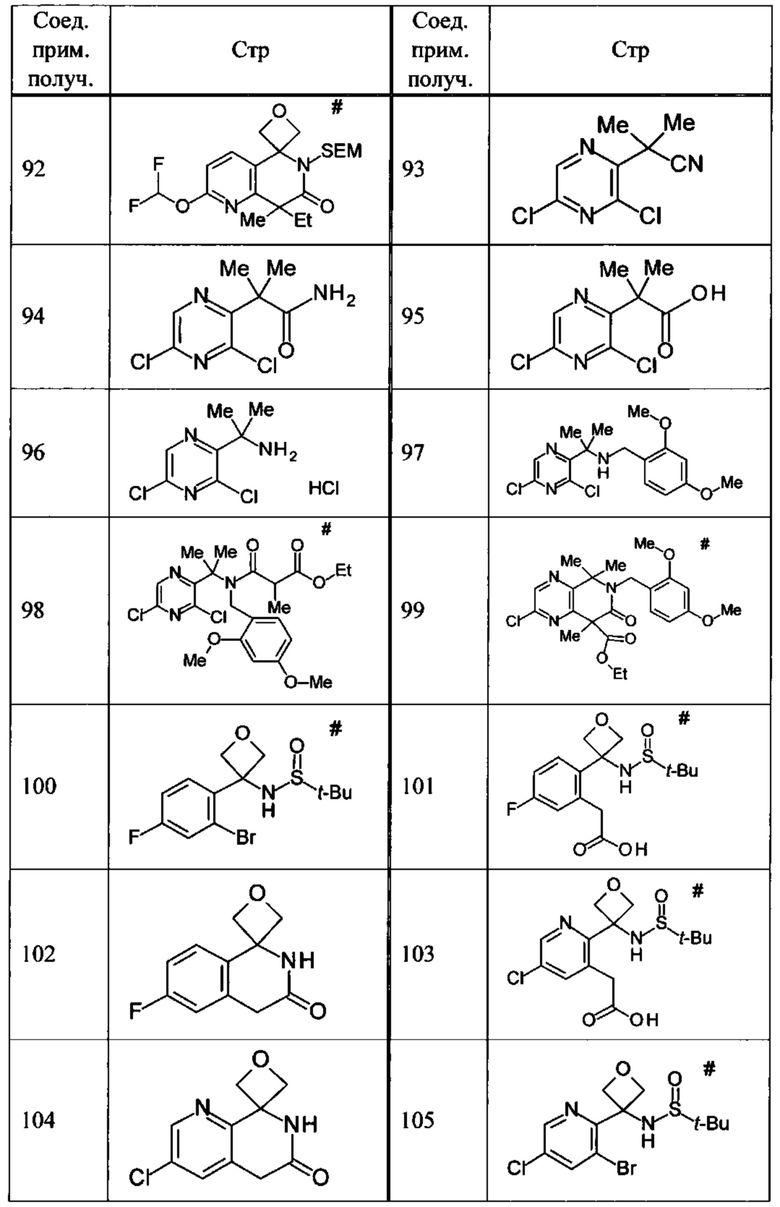
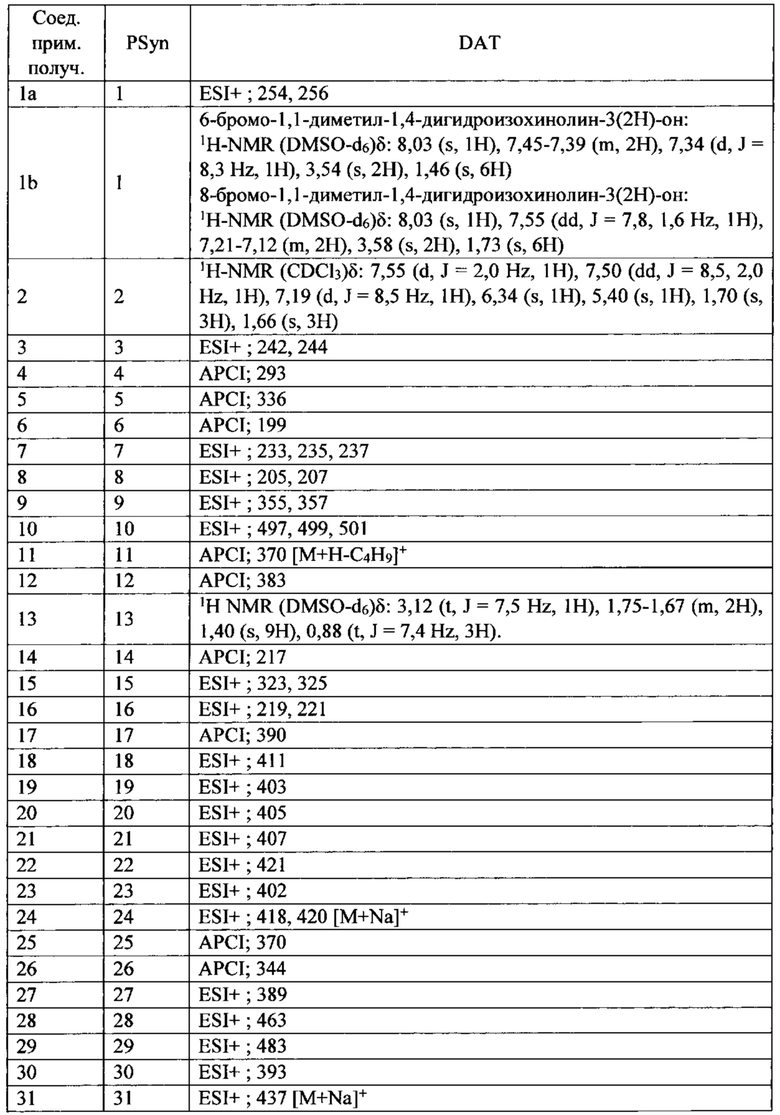
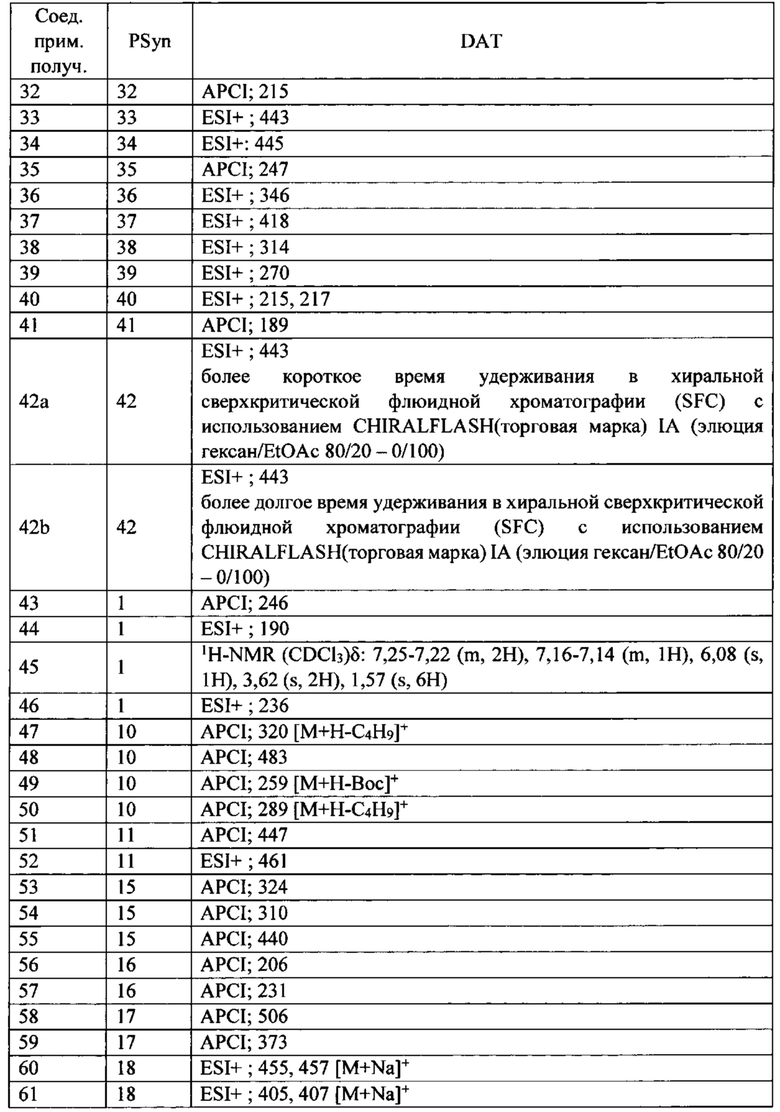
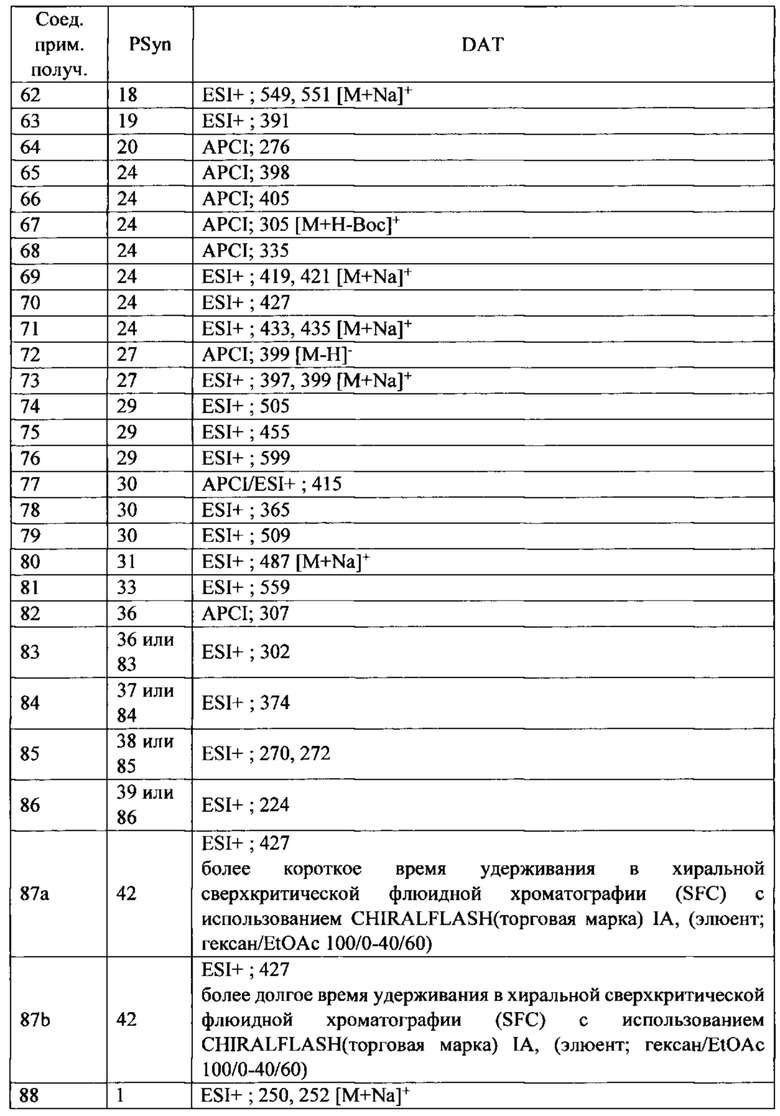
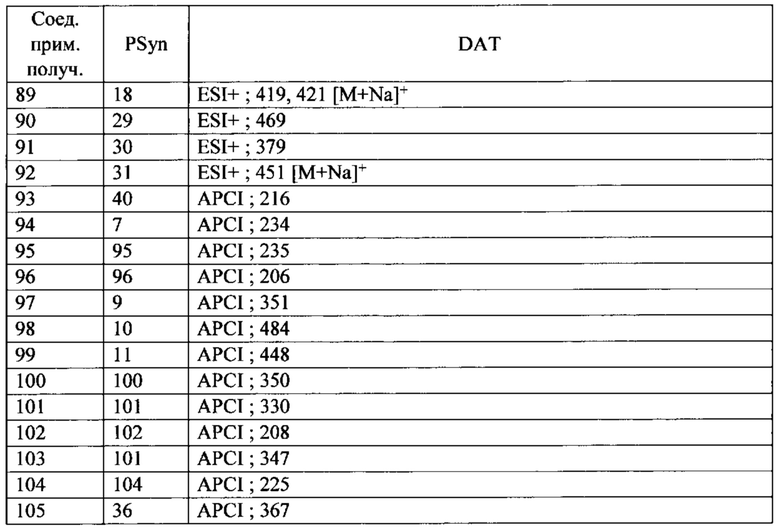
Хотя способы и композиции были детально описаны со ссылкой на определенные связанные с их применением аспекты, следует понимать, что модификации и вариации находятся в пределах сущности и объема того, что описано и заявлено.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Соединения формулы (I) или формулы (I') или их соль модулируют сокращение саркомера скелетной мышцы и поэтому, как ожидается, будут использоваться в качестве средства для предотвращения или лечения 1) нервно-мышечных нарушений, 2) нарушений добровольной мышцы, 3) нарушений ЦНС, при которых мышечная слабость, атрофия и усталость являются выраженными симптомами, 4) мышечных симптомов, вызванных системными расстройствами, и 5) дисфункций мышцы тазового дна и уретры/анального сфинктера.
Если в настоящем изобретении указывается числовой предел или диапазон, то включены конечные точки. Кроме того, специально включены все значения и поддиапазоны в числовом пределе или диапазоне, как если бы они были явно выписаны.
Используемые в настоящем изобретении слова «a» и «an» и т.п. имеют значение «один или более».
Видно, что многочисленные модификации и варианты настоящего изобретения возможны в свете вышеприведенных положений. Поэтому следует понимать, что в рамках прилагаемой формулы изобретения изобретение может быть осуществлено иначе, чем конкретно описано в настоящем изобретении.
Все патенты и другие ссылки, упомянутые выше, полностью включены в настоящее изобретение посредством данной ссылки, так же, как если бы они были подробно изложены.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ПСИХИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2572624C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АЗАИНДОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NIK | 2018 |
|
RU2780577C2 |
| ПЕПТИДНЫЕ ЭПОКСИКЕТОНЫ ДЛЯ ИНГИБИРОВАНИЯ ПРОТЕАСОМЫ | 2007 |
|
RU2450016C2 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2815636C1 |
| Необязательно конденсированные гетероциклил-замещенные производные пиримидина, пригодные для лечения воспалительных, метаболических, онкологических и аутоиммунных заболеваний | 2015 |
|
RU2719422C2 |
| ПРОИЗВОДНЫЕ 2-ФЕНИЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ БОГАТОЙ ЛЕЙЦИНОМ ПОВТОРНОЙ КИНАЗЫ 2 (LRRK2) ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2661197C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ БИАРИЛОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНДОЛАМИН-2,3-ДИОКСИГЕНАЗЫ (IDO) | 2018 |
|
RU2786586C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛАМИНОПИРИМИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ОБОГАЩЕННОЙ ЛЕЙЦИНОВЫМИ ПОВТОРАМИ КИНАЗЫ 2 (LRRK2) ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ БОЛЕЗНИ ПАРКИНСОНА | 2013 |
|
RU2637948C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| ПРОТИВОРАКОВЫЕ БЕНЗОПИРАЗИНЫ, ДЕЙСТВУЮЩИЕ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ FGFR-КИНАЗ | 2012 |
|
RU2639863C2 |
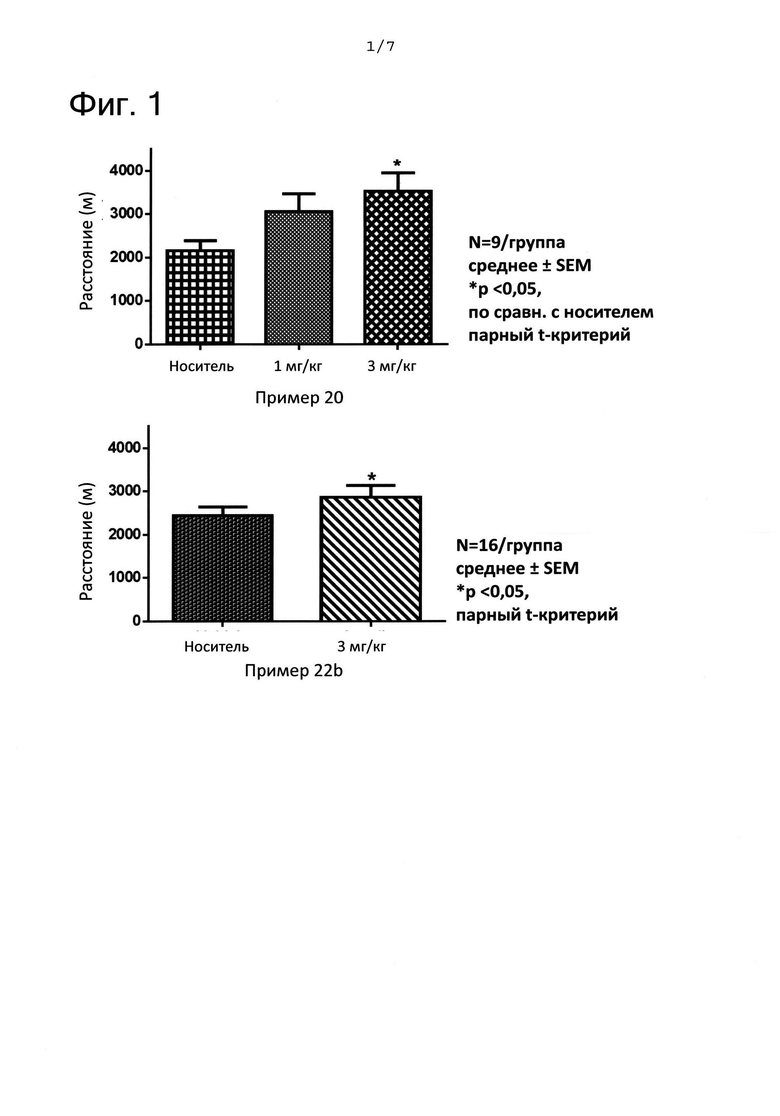
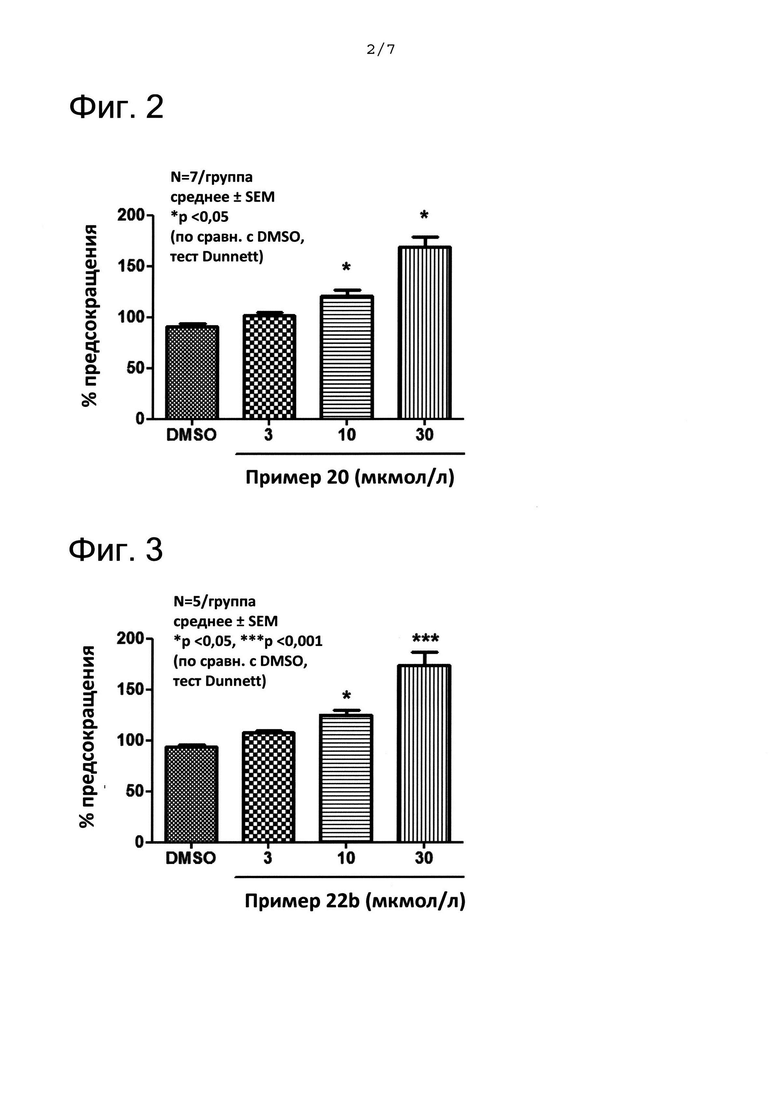
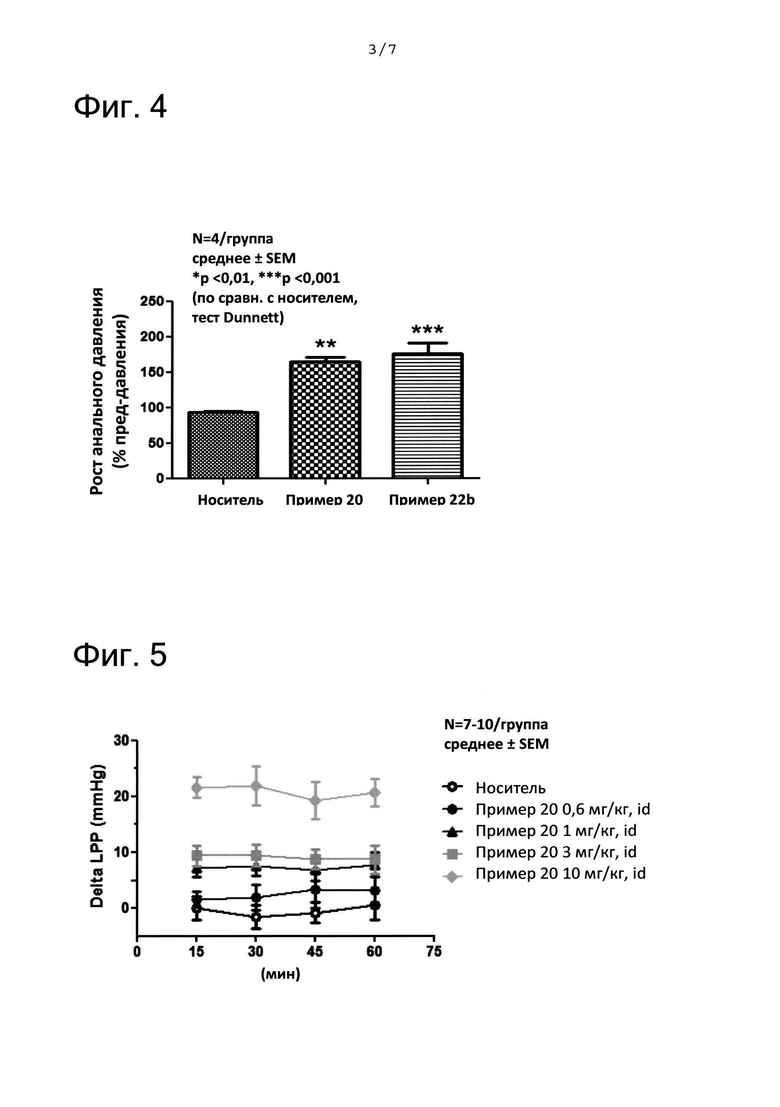
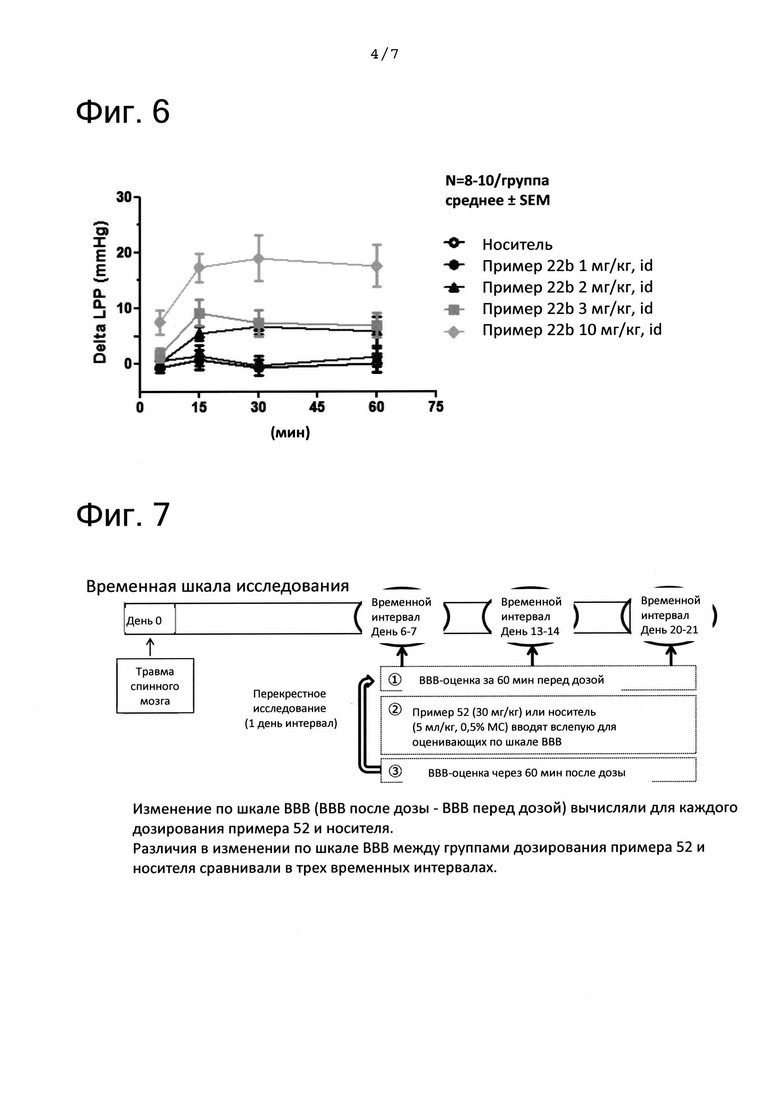
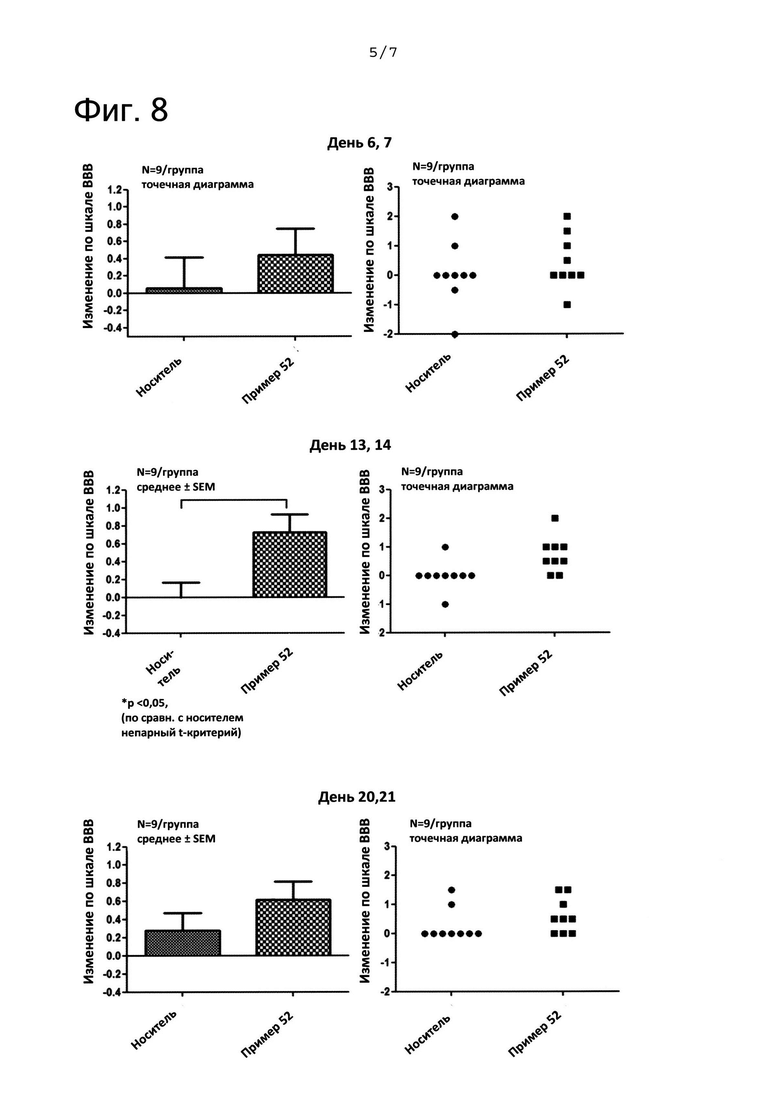
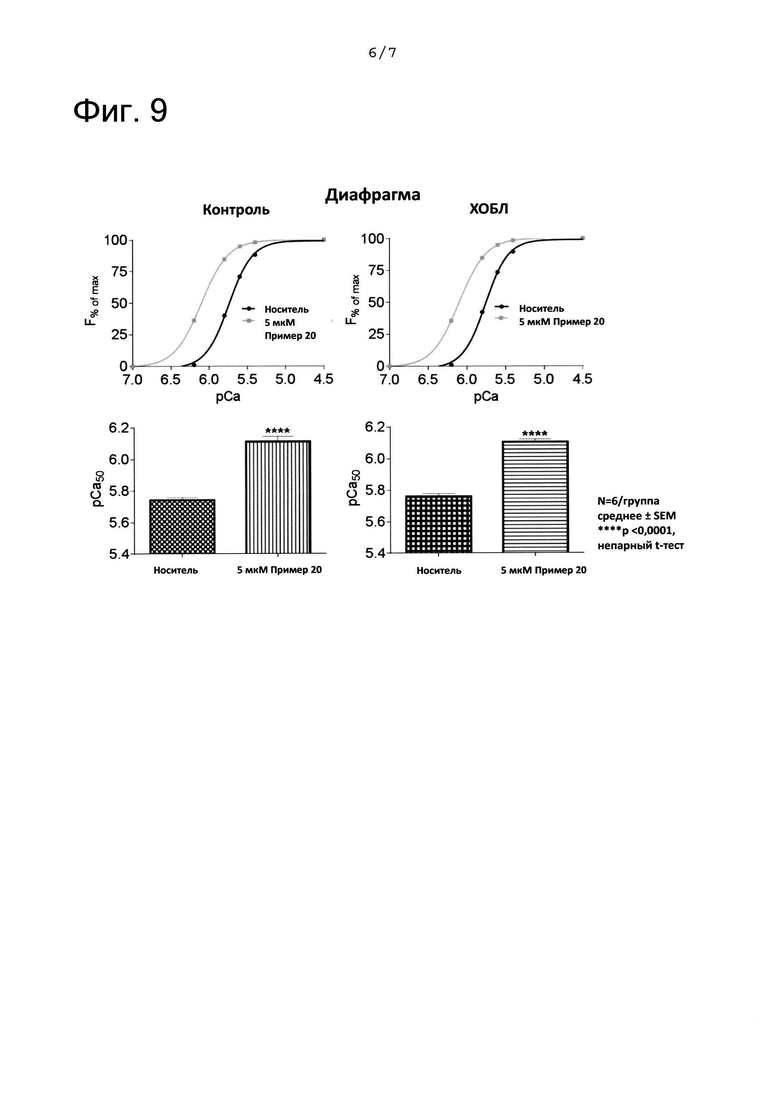
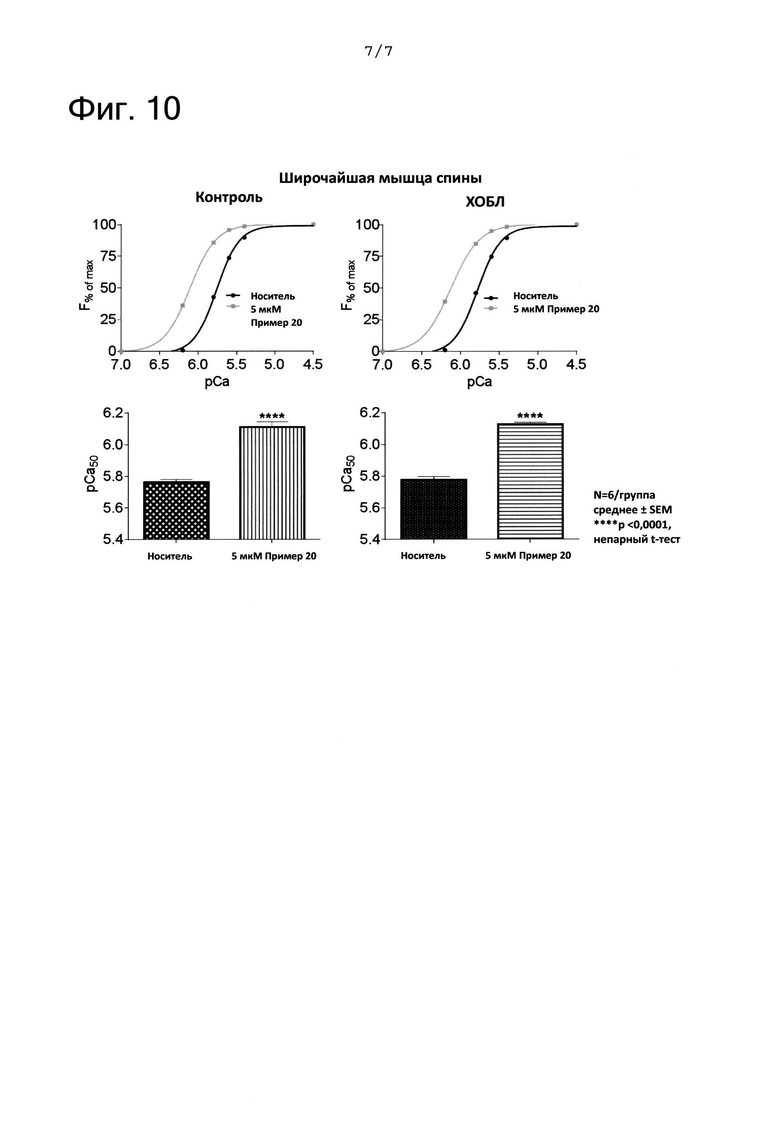
Изобретение относится к новым соединениям производных тетрагидроизохинолина формулы (I), а также применению и способам лечения заболевания или состояния, чувствительного к модуляции сокращения саркомера скелетной мышцы. Технический результат: получены новые соединения, которые модулируют сокращения саркомера скелетной мышцы и могут быть применимы для лечения опосредованных заболеваний. 22 н. и 10 з.п. ф-лы, 7 табл., 167 пр., 10 ил.
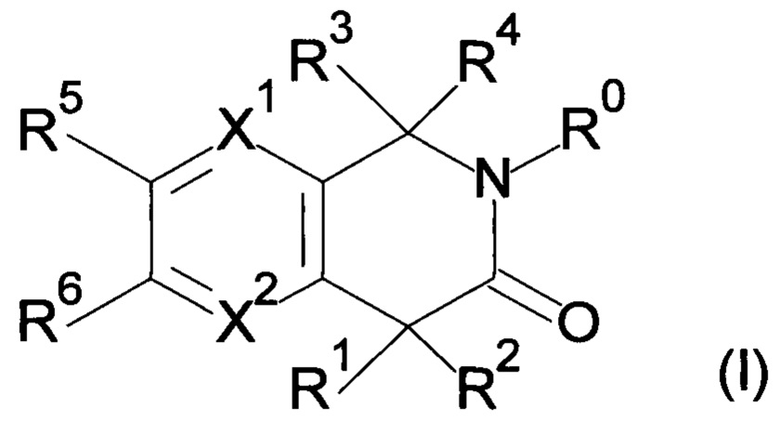
1. Соединение формулы (I) или его фармацевтически приемлемая соль:
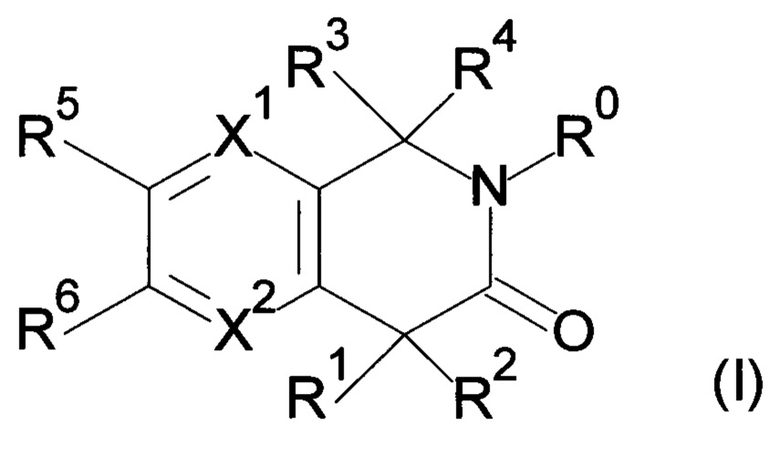
где
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -O-C1-6алкил;
R12 представляет собой Н или галоген;
R1 представляет собой i) Н или ii) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов);
R2 представляет собой i) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранными из группы, состоящей из -OR0 (одной или более), галогена(ов), -COOR0 (одной или более), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранными из группы G1, и гетероарила(ов), который выбран из группы, состоящей из пиразолила и триазолила, причем данный гетероарил может быть замещен одним или несколькими заместителем (заместителями), выбранными из группы G2, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24, v) -COOR0 или vi) фенил;
R21 представляет собой Н или С1-6алкил;
R22 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими фенилом(ами);
R23 представляет собой С1-6алкил, который может быть замещен одной или более -ОН группой (группами);
R24 представляет собой i) C1-6алкил или ii) фенил, который может быть замещен одним или несколькими галогеном(ами); или
R1, R2 и атом углерода, связанный с R1 и R2, могут взаимодействовать с образованием 4-тетрагидропиранового кольца, и атом углерода, связанный с R1 и R2, представляет собой спироатом;
R3, R4 одинаковые или отличающиеся друг от друга, i) C1-3алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -ОН (одной или более), или ii) С2-6алкенил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более) и гетероарила(ов), который представляет собой пиразолил, причем данный гетероарил может быть замещенным одним или несколькими С1-6алкилом(ами), или
R3, R4 и атом углерода, связанный с R3 и R4, могут взаимодействовать с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом;
R5 представляет собой i) Н, ii) C1-6алкил, iii) -O-(С1-6алкил), iv) галоген или v) С3-8циклоалкил;
R6 представляет собой i) Н, ii) С1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -О-(C1-6алкила(ов), который может быть замещен одним или несколькими галогеном(ами)) и галогена(ов), (iii) -ОН, iv) -O-(С1-6алкил, который может быть замещен одним или несколькими галогеном(ами)), v) галоген, vi) -CN, vii) -S-(С1-6алкил), viii) -NR0R0 или х) С2-6алкенил;
Группа G1 представляет собой i) галоген, ii) -COOR0 или iii) -CONR0R0;
Группа G2 представляет собой C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -ОН (одной или более);
R0 независимо при каждом появлении одинаковые или отличающиеся друг от друга, Н или C1-6алкил,
при условии, что упомянутое соединение не является метил-1,1-диаллил-3-оксо-2,4-дигидроизохинолин-4-карбоксилатом или его фармацевтически приемлемой солью.
2. Соединение или его фармацевтически приемлемая соль по п. 1, в котором
R1 представляет собой i) Н или ii) C1-6алкил;
R2 представляет собой i) C1-6алкил, который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из -OR0 (одной или более), галогена(ов), -CONR21R22 (одной или более), фенила(ов), который может быть замещен одним или несколькими заместителем (заместителями), выбранным(и) из группы, состоящей из галогена(ов) и -COOR0 (одной или более), и гетероарила(ов), который выбран из группы, состоящей из пиразолила и триазолила, ii) С2-6алкенил, iii) С2-6алкинил, iv) -NR23R24 или v) -COOR0;
R21 представляет собой C1-6алкил;
R22 представляет собой C1-6алкил;
R23 представляет собой C1-6алкил; и
R24 представляет собой фенил.
3. Соединение или его фармацевтически приемлемая соль по любому из предыдущих пунктов, в котором
X1 представляет собой C-R11 или N;
X2 представляет собой C-R12 или N;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н.
4. Соединение или его фармацевтически приемлемая соль по любому из предыдущих пунктов, в котором
R1 представляет собой C1-6алкил;
R2 представляет собой C1-6алкил, который может быть замещен -OR0;
R3, R4 и атом углерода, связанный с R3 и R4, взаимодействуют с образованием 3-оксетанового кольца, и атом углерода, связанный с R3 и R4, представляет собой спироатом, представленный формулой (II) ниже:
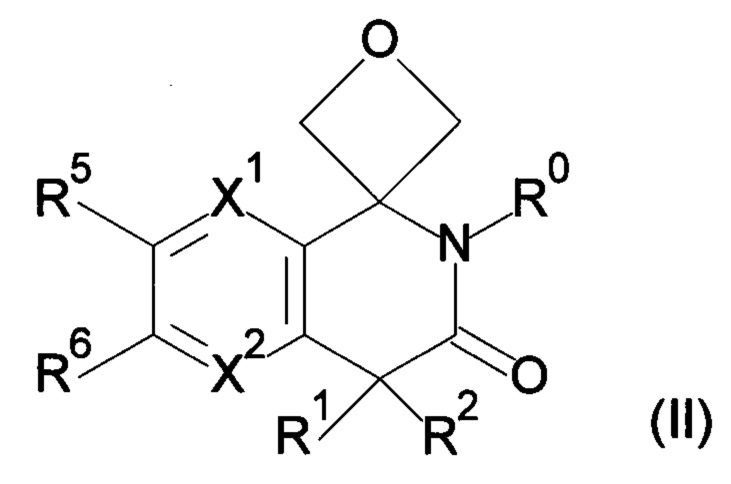
R5 представляет собой Н; и
R6 представляет собой i) C1-6алкил, ii) -OC1-6алкил, который замещен от одного до трех галогенами, iii) галогеном или iv) -CN.
5. Соединение или его фармацевтически приемлемая соль по любому из предыдущих пунктов, в котором
X1 представляет собой C-R11;
X2 представляет собой C-R12;
R11 представляет собой i) Н, ii) галоген, iii) -CN или iv) -OC1-6алкил; и
R12 представляет собой Н.
6. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой соединение, выбранное из группы, состоящей из
(-)-2-(дифторметил)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
4,4-диэтил-1,1-диметил-3-оксо-1,2,3,4-тетрагидроизохинолин-6-карбонитрила,
8,8-диэтил-5,5-диметил-7-оксо-5,6,7,8-тетрагидро-1,6-нафтиридин-2-карбонитрила,
(-)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
(+)-6-бром-4-этил-4-(2-гидроксиэтил)-1,1-диметил-1,4-дигидроизохинолин-3(2Н)-она,
8,8-диэтил-7-оксо-7,8-дигидро-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-2-карбонитрила,
8',8'-диэтил-7'-оксо-7',8'-дигидро-6'Н-спиро[оксетан-3,5'-пиридо[3,4-b]пиразин]-2'-карбонитрила,
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрила,
2-(дифторметокси)-8,8-диметил-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-2-(дифторметокси)-8-этил-8-(2-гидроксиэтил)-6Н-спиро[1,6-нафтиридин-5,3'-оксетан]-7(8Н)-она,
или фармацевтически приемлемую соль указанного соединения.
7. Соединение или его фармацевтически приемлемая соль, которое представляет собой соединение, выбранное из группы, состоящей из
4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро [изохинолин-1,3'-оксетан]-6-карбонитрила,
6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3-оксетан]-6-карбонитрила,
(+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она и
(-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-она,
или фармацевтически приемлемую соль указанного соединения.
8. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой 4,4-диэтил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3-оксетан]-6-карбонитрил,
или его фармацевтически приемлемую соль.
9. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой 6-хлор-4,4-диметил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он,
или его фармацевтически приемлемую соль.
10. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой 4,4-диметил-3-оксо-3,4-дигидро-2Н-спиро[изохинолин-1,3'-оксетан]-6-карбонитрил,
или его фармацевтически приемлемую соль.
11. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой (+)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро [изохинолин-1,3'-оксетан]-3(4Н)-он,
или его фармацевтически приемлемую соль.
12. Соединение или фармацевтически приемлемая соль по п. 1, которое представляет собой (-)-6-хлор-4-(2-гидроксиэтил)-4-метил-2Н-спиро[изохинолин-1,3'-оксетан]-3(4Н)-он,
или его фармацевтически приемлемую соль.
13. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала.
14. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении.
15. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения мышечной слабости, вызванной кахексией, связанной с хронической обструктивной болезнью легких (ХОБЛ).
16. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом.
17. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий.
18. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта.
19. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения мышечной слабости и усталости, связанной с болезнью периферической сосудистой системы или периферической артериальной болезнью.
20. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения постхирургической мышечной слабости.
21. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения мышечной слабости, связанной с метаболическим синдромом или ожирением.
22. Применение соединения или его фармацевтически приемлемой соли по п. 7 для лечения вентилятор-индуцированной мышечной слабости и синдрома хронической усталости.
23. Способ лечения заболевания или состояния, выбранного из группы, состоящей из стрессового недержания мочи (SUI), смешанного недержания мочи (MUI) и недержания кала, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
24. Способ лечения заболевания или состояния, выбранного из группы, состоящей из дряхлости и саркопении, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
25. Способ лечения мышечной слабости, вызванной кахексией, связанной с хронической обструктивной болезнью легких (ХОБЛ), включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
26. Способ лечения синдрома кахексии и/или атрофии мышц, вызванного сердечной недостаточностью, раком или хроническим заболеванием почек/диализом, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
27. Способ лечения заболевания или состояния, выбранного из группы, состоящей из бокового амиотрофического склероза (ALS), спинальной мышечной атрофии (SMA), тяжелой миастении и мышечных миопатий, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
28. Способ лечения заболевания или состояния, выбранного из группы, состоящей из мышечной дисфункции после повреждения спинного мозга (SCI) и мышечной дисфункции после инсульта, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
29. Способ лечения мышечной слабости и усталости, связанной с болезнью периферической сосудистой системы или периферической артериальной болезнью, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
30. Способ лечения постхирургической мышечной слабости, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
31. Способ лечения мышечной слабости, связанной с метаболическим синдромом или ожирением, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
32. Способ лечения вентилятор-индуцированной мышечной слабости и синдрома хронической усталости, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п. 7.
| WO 2009108332 A1, 03.09.2009 | |||
| Приспособление в двигателях внутреннего горения для испарения и смешивания с воздухом тяжелых сортов топлива | 1926 |
|
SU17925A1 |
| ЗАМЕЩЕННЫЕ ЦИКЛОАЛКИЛАМИНОМ ПРОИЗВОДНЫЕ ИЗОХИНОЛОНА | 2007 |
|
RU2457203C2 |
| KIM SUNG HWAN ET AL, "An expedient synthesis of poly-substituted 1-arylisoquinolines from [delta]-ketonitriles via indium-mediated Barbier reaction prot", TETRAHEDRON LETTERS, 50, 47, стр | |||
| ВАЛИК ДЛЯ ПИШУЩЕЙ МАШИНЫ | 1926 |
|
SU6476A1 |
Авторы
Даты
2021-02-18—Публикация
2017-02-10—Подача