Ссылка на родственные заявки
Согласно настоящей заявке испрашивается преимущество приоритета в соответствии с предварительной заявкой на выдачу патента США №62/094915, поданной 19 декабря 2014 года, содержание которой таким образом включено в настоящий документ с помощью ссылки.
Включение путем ссылки
Для тех юрисдикции, которые разрешают включение только путем ссылки, текст каждого документа, цитируемого в настоящем документе, таким образом включен с помощью ссылки в полном его объеме.
Область техники, к которой относится настоящее изобретение
Биосовместимые имплантаты применяют в различных областях применения, включая, например, восстановление или замену поврежденных или нарушенных тканей в организме человека. Некоторые такие имплантаты содержат биосовместимые каркасные материалы, которые при хирургической имплантации в организм субъекта-реципиента заселяются клетками субъекта и интегрируются в ткани субъекта. Для обеспечения достаточного запаса кислорода и питательных веществ, такие имплантаты, как правило, должны инвазироваться эндотелиальными клетками после хирургической имплантации, а эндотелиальные клетки должны затем формировать функциональные кровеносные сосуды, которые соединяются с существующей сосудистой системой субъекта. Степень и скорость, с которой эндотелиальные клетки проникают в такие имплантированные каркасы и формируют функциональные кровеносные сосуды, являются, таким образом, важной детерминантой конечной полезности таких имплантатов Способность создавать трехмерные биосовместимые каркасы, содержащие предварительно сформированные кровеносные сосуды in vitro, т.е. до хирургической имплантации, может значительно увеличить скорость и эффективность, с которыми такие имплантаты интегрируются в ткани субъекта-реципиента in vivo. Тем не менее, предыдущие попытки создания таких имплантатов имели неоднозначный успех. Например, несколько предыдущих попыток индуцировать формирование кровеносных сосудов in vitro с помощью коллагеновых гелей или матригеля не привели к прорастанию кровеносных сосудов или формированию кровеносных сосудов с проходимыми просветами, окруженными ориентированными эндотелиальными клетками. (Обзор некоторых таких предыдущих попыток см. в Nakatsu et al. (2003) "Angiogenic sprouting and capillary lumen formation modeled by human umbilical vein endothelial cells (HUVEC) in fibrin gels: the role of fibroblasts and angiopoietin-1." Microvascular Research, Vol. 66, pp. 102-112.) Другие попытки включали культивирование монослоев эндотелиальных клеток на сферах, покрытых компонентами внеклеточного матрикса, а затем встраивание сфер в фибриновые гели. Было обнаружено, что такие способы приводят в результате к формированию кровеносных сосудов с проходимыми просветами лишь в том случае, если на верхней части гелей выращивали фибробласты кожи. Было обнаружено, что без такого совместного культивирования фибробластов эндотелиальные клетки первоначально формируют короткие, узкие нитеподобные структуры, которые впоследствии разрушаются без формирования кровеносных сосудов. См. работу Nakatsu et al. (2003). Сообщалось, что фибробласты необходимы для формирования просвета эндотелиальными клетками, что согласуется с этими результатами. См. работу Newman et al. (2011) "The requirement for fibroblasts in angiogenesis: fibroblast-derived matrix proteins are essential for endothelial cell lumen formation;" Molecular Biology of the Cell, Vol. 22, pp. 3791-3800.
Краткое раскрытие настоящего изобретения
Настоящее изобретение, отчасти, основано, на неожиданном открытии, что сконструированные эндотелиальные клетки, экспрессирующие аденовирусный белок E4ORF1, могут формировать кровеносные сосуды с проходимыми просветами внутри трехмерных биосовместимых каркасов in vitro. Несмотря на то, что ранее было показано, что E4ORF1+ эндотелиальные клетки могут формировать неососуды в пробках матригеля in vivo после совместной инъекции таких клеток с жидким матригелем в бока мышей и что E4ORF1+ эндотелиальные клетки могут формировать неоангиогенные трубки на покрытых матригелем культуральных планшетах (см. патент США №8465732), насколько известно заявителю, способность таких клеток формировать естественные кровеносные сосуды с открытыми просветами в трехмерном каркасе in vitro ранее продемонстрирована не была. Как описано в настоящем документе, неожиданно было обнаружено, что естественные E4ORF1+ кровеносные сосуды могут формировать сосуды с открытыми просветами внутри трехмерных биосовместимьгх каркасных материалов in vitro за период, который составляет лишь несколько дней, даже в отсутствие клеток других типов, таких как фибробласты, и что сосудосодержащие имплантаты можно культивировать и поддерживать in vitro в течение продолжительных периодов времени - до 6 недель. Интересно отметить, что также было обнаружено, что кровеносные сосуды в этих имплантатах могут выходить за границы биосовместимых каркасов, создавая выступающие кровеносные сосуды, которые видны как свободно плавающие в культуральной среде, окружающей каркасный материал. Основываясь на этих открытиях, настоящее изобретение относится к определенным новым и улучшенным имплантатам, подходящим для хирургической имплантации субъектам, а также к способам изготовления и применения таких имплантатов.
Таким образом, в соответствии с одним вариантам осуществления настоящее изобретение относится к имплантату, подходящему для хирургической имплантации субъекту, содержащему: (а) биосовместимый каркасный материал и (b) кровеносные сосуды, расположенные в биосовместимом каркасном материале, причем кровеносные сосуды содержат E4ORF1+ сконструированные эндотелиальные клетки.
В соответствии с другим вариантом осуществления настоящее изобретение относится к способу получения имплантата, подходящего для хирургической имплантации субъекту, причем способ предусматривает культивирование популяции сконструированных E4ORF1+ эндотелиальных клеток в контакте с биосовместимым каркасным материалом in vitro до формирования кровеносных сосудов в биосовместимом каркасном материале, таким образом получая имплантат, содержащий E4ORF1+ кровеносные сосуды
Биосовместимые каркасные материалы, применяемые в имплантатах и способах по настоящему изобретению, обычно представляют собой такие трехмерные структуры, чтобы в трехмерной структуре могли быть расположены сосуды. В соответствии с некоторыми такими вариантами осуществления имплантаты по настоящему изобретению содержат сеть связанных кровеносных сосудов, которые могут содержать капилляры. В соответствии с некоторыми такими вариантами осуществления кровеносные сосуды имеют открытые/проходимые просветы. В соответствии с некоторыми такими вариантами осуществления один или несколько кровеносных сосудов могут выступать за границы биосовместимого каркасного материала.
В соответствии с некоторыми вариантами осуществления E4ORF1+ сконструированные эндотелиальные клетки, применяемые в имплантатах и способах по настоящему изобретению, также экспрессируют полипептид ETV2 (т.е. они представляют собой E4ORF1+ ETV2+ эндотелиальные клетки). В соответствии с другими такими вариантами осуществления E4ORF1+ сконструированные эндотелиальные клетки также экспрессируют рекомбинантный транскрипционный фактор семейства ETS (т.е. они представляют собой E4ORF1+ ETS+).
В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки могут представлять собой эмбриональные клетки, или постнатальные клетки, или клетки взрослых. В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки, применяемые в имплантатах и способах по настоящему изобретению, представляют собой эндотелиальные клетки млекопитающих. В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки представляют собой эндотелиальные клетки человека. В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки получены от эндотелиальных клеток пупочной вены человека (HUVEC).
В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки, применяемые в имплантатах и способах по настоящему изобретению, представляют собой орган-специфичные эндотелиальные клетки. Например, в соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут представлять собой специфичные для гематопоэтической системы эндотелиальные клетки, или специфичные для нервной системы эндотелиальные клетки, или специфичные для сердца эндотелиальные клетки, или специфичные для легких эндотелиальные клетки, или специфичные для печени эндотелиальные клетки, или специфичные для почек эндотелиальные клетки, или специфичные для мышц эндотелиальные клетки, или специфичные для хряща эндотелиальные клетки, или специфичные для сухожилия эндотелиальные клетки, или специфичные для жировой ткани эндотелиальные клетки. В соответствии с некоторыми такими вариантами осуществления применяемые орган-специфичные эндотелиальные клетки получают из органа или ткани, в который или в которую необходимо поместить имплантат.
В соответствии с некоторыми вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки, применяемые в имплантатах и способах по настоящему изобретению, получены от эндотелиальных клеток субъекта, которому будет проведена хирургическая имплантация имплантата, т.е. они являются аутологичными эндотелиальными клетками. В соответствии с другими вариантами осуществления сконструированные E4ORF1+ эндотелиальные клетки получены от эндотелиальных клеток донора того же вида, что и субъект, которому будет проведена хирургическая имплантация имплантата, т.е. они являются аллогенными эндотелиальными клетками. В соответствии с некоторыми такими вариантами осуществления аллогенный донор имеет тканевое соответствие (или частичное соответствие) с субъектом, которому будет проведена хирургическая имплантация имплантата. Например, в соответствии с некоторыми вариантами осуществления донор имеет такой же МНС-тип (или HLA-тип), что и субъект, которому будет проведена хирургическая имплантация имплантата. В соответствии с некоторыми другими вариантами осуществления донор имеет МНС-тип (или HLA-тип), который частично соответствует типу субъекта, которому будет проведена хирургическая имплантация имплантата. В соответствии с еще одними вариантами осуществления донор имеет МНС-тип (или HLA-тип), который отличается от типа субъекта, которому будет проведена хирургическая имплантация имплантата.
В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материалы, применяемые в имплантатах и способах по настоящему изобретению, содержат клетки одного или нескольких дополнительных типов, в дополнение к сконструированным эндотелиальным клеткам. В соответствии с некоторыми такими вариантами осуществления клетки дополнительных типов могут быть генетически модифицированными. В соответствии с другими такими вариантами осуществления клетки дополнительных типов могут быть интактными (т.е. генетически не модифицированными). В соответствии с некоторыми такими вариантами осуществления клетки дополнительных типов могут быть эмбриональными клетками, или постнатальными клетками, или клетками взрослых. В соответствии с некоторыми вариантами осуществления клетки таких дополнительных типов могут быть стволовыми клетками или клетками-предшественниками. В соответствии с другими вариантами осуществления клетки таких дополнительных типов могут быть дифференцированными клетками. В соответствии с некоторыми вариантами осуществления такие стволовые клетки или клетки-предшественники могут представлять собой гематопоэтические стволовые клетки, костные стволовые клетки, мышечные стволовые клетки, нервные стволовые клетки, эпителиальные стволовые клетки, кожные стволовые клетки, мезенхимальные стволовые клетки, стволовые клетки кишечника или сперматогониальные стволовые клетки. В соответствии с некоторыми вариантами осуществления дифференцированные клетки могут быть дифференцированными гематопоэтическими клетками, костными клетками, мышечными клетками, нервными клетками, перицитами, клетками волосяных фолликул, жировыми клетками, кератиноцитами, эпителиальными клетками, кожными клетками, фибробластами, клетками кишечника или тестикулярными клетками.
В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал, применяемый в имплантатах и способах по настоящему изобретению, в имплантатах является твердым при 4°С. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал является твердым при 21°С. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал содержит одну или несколько молекул внеклеточного матрикса, такого как коллаген или фибрин. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал в имплантатах содержит децеллюляризированную ткань животного, такую как децеллюляризированная свиная ткань. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал в имплантатах не является матригелем. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал в имплантатах не содержит гиалуроновую кислоту.
В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат сыворотку. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат экзогенные факторы роста. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат экзогенные ангиогенные факторы. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат экзогенный VEGF. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат экзогенный FGF.
В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат фибробласты. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат ангиогенные факторы фибробластов. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат компоненты внеклеточного матрикса фибробластов.
В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат сферические микрочастицы носителя. В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению не содержат сферические микрочастицы носителя, покрытые молекулой внеклеточного матрикса.
В соответствии с некоторыми вариантами осуществления настоящее изобретение относится к способу лечения нуждающегося в том субъекта, причем способ предусматривает имплантацию субъекту описываемого в настоящем документе имплантата. В соответствии с некоторыми такими способами субъект имеет дефект ткани, и имплантат имплантируют субъекту хирургическим путем в участок дефекта ткани. В соответствии с некоторыми такими способами сконструированные E4ORF1+ эндотелиальные клетки представляют собой орган-специфичные эндотелиальные клетки, и имплантат имплантируют хирургическим путем в орган, из которого получены орган-специфичные эндотелиальные клетки. В соответствии с некоторыми такими способами субъектом является субъект-млекопитающее. В соответствии с некоторыми такими способами субъектом является субъект-человек. В соответствии с некоторыми такими способами сконструированные E4ORF1+ эндотелиальные клетки получены от собственных эндотелиальных клеток субъекта, т.е. они являются аутологичными эндотелиальными клетками. В соответствии с другими такими способами сконструированные E4ORF1+ эндотелиальные клетки в имплантате получены от эндотелиальных клеток аллогенного донора, такого как аллогенный донор с тем же МНС- или HLA-типом, что и у субъекта, или аллогенный донор с частичным соответствием по МНС- или HLA-типу с субъектом.
Эти и другие варианты осуществления настоящего изобретения описаны далее в прилагаемых разделах Примеры, Формула изобретения и Описании чертежей настоящего документа. Кроме того, специалистам в настоящей области техники будет очевидно, что определенные модификации и комбинации вариантов осуществления, описанных в настоящем документе, подпадают под объем настоящего изобретения и могут быть осуществлены без постановки излишних опытов.
Краткое описание чертежей
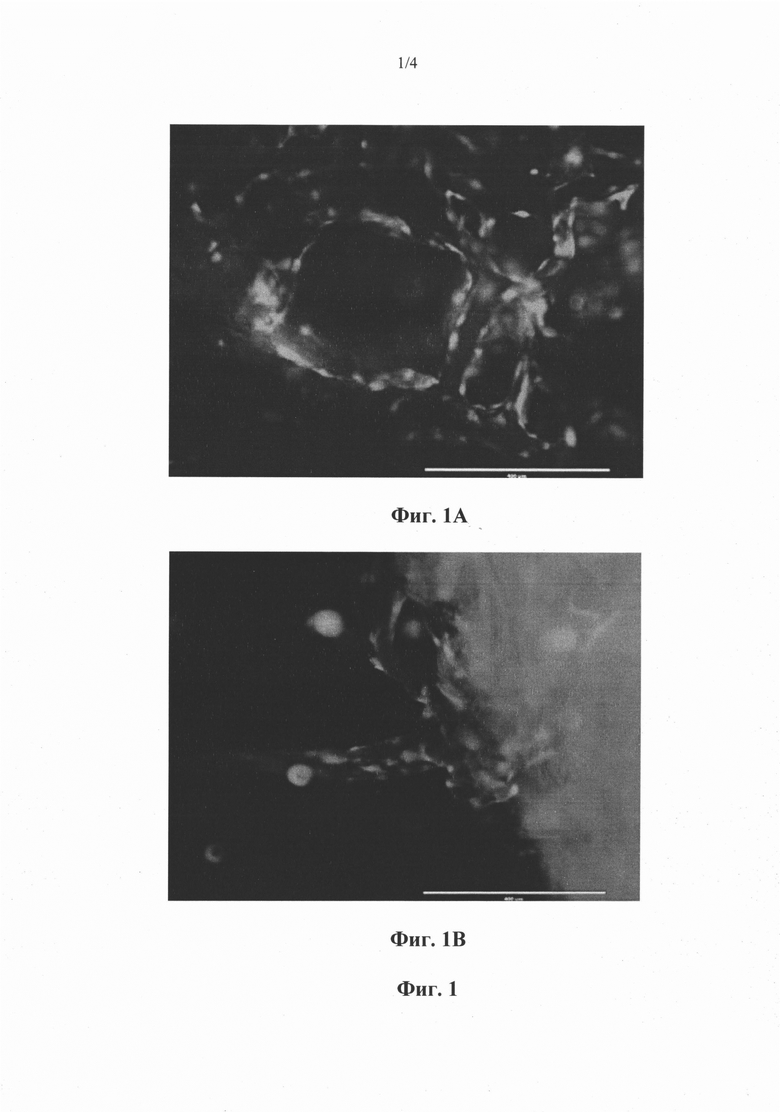
Фиг. 1А и 1В. Изображения флуоресцентной микроскопии имплантатов, которые были засеяны сконструированными эндотелиальными клетками, экспрессирующими E4ORF1 и зеленый флуоресцентный белок (GFP), и поддерживались in vitro, как описано в примере 1. Белая полоса внизу каждого изображения соответствует 400 микронам. Зеленая флуоресценция в результате экспрессии GFP в эндотелиальных клетках на черно-белых изображениях выглядит как белая. Структуры кровеносных сосудов с открытыми просветами можно видеть как на фиг. 1А, так и на фиг. 1В. На фиг. 1В можно увидеть кровеносные сосуды, выходящие за границы каркасного материала.
Фиг. 2А и 2В. Фотографии двух имплантатов после удаления из брюшной полости мыши через 48 часов после хирургической имплантации. «Испытываемый» имплантат на фиг. 2А был засеян E4ORF1+ сконструированными эндотелиальными клетками, и его поддерживали в культуре до хирургической имплантации, как описано в примерах 1 и 2. Васкуляризацию и кровь внутри имплантата можно видеть в обведенной кружком области на фиг. 2А. «Контрольный» имплантат на фиг. 2 В не был засеян эндотелиальными клетками до хирургической имплантации, и у него не наблюдали определяемой васкуляризации или кровотока
Фиг. 3. Фотографии двух имплантатов после удаления из брюшной полости мыши через 4 недели после хирургической имплантации. Показанный справа «испытываемый» имплантат был засеян E4ORF1+ сконструированными эндотелиальными клетками, и его поддерживали в культуре до имплантации, как описано в примерах. Можно видеть значительную васкуляризацию и содержание крови в «испытываемом» имплантате справа - на данном черно-белом изображении видны в виде темных/черных областей по краю имплантата. «Контрольный» имплантат слева не был засеян эндотелиальными клетками до имплантации.
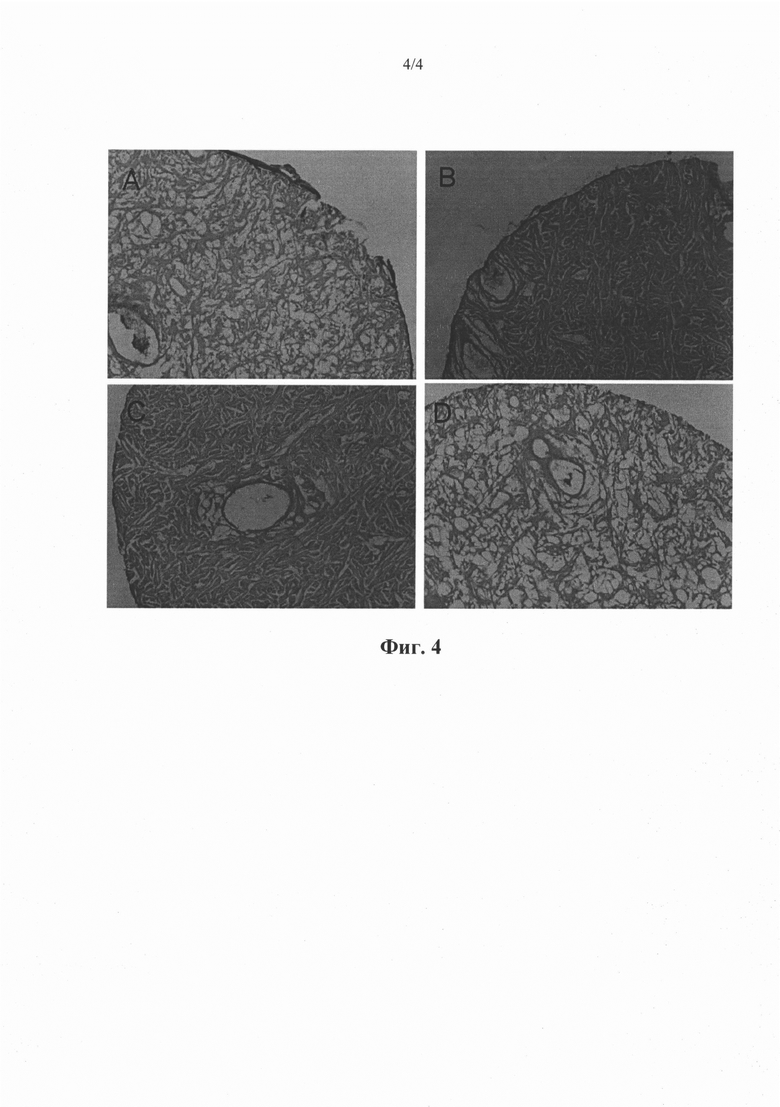
Фиг. 4A-D. Микрофотографии гистологических срезов имплантатов, которые были имплантированы хирургическим путем в брюшную полость мыши и удалены через 2 недели после имплантации. «Испытываемые» имплантаты на фиг. 4А и фиг. 4В были засеяны E4ORF1+ сконструированными эндотелиальными клетками, как описано в примерах. «Контрольные» имплантаты на фиг. 4С и фиг. 4D не были засеяны эндотелиальными клетками до имплантации. «Испытываемые» имплантаты на фиг. 4А на фиг. и 4 В характеризовались повышенной насыщенностью клетками по сравнению с имплантатами на фиг. 4С и 4D.
Подробное раскрытие настоящего изобретения
В разделах «Краткое раскрытие настоящего изобретения», «Фигуры», «Краткое описание чертежей», «Примеры» и «Формула изобретения» раскрытия настоящего патента описаны некоторые из основных вариантов осуществления настоящего изобретения. В этом разделе «Подробное раскрытие настоящего изобретения» приведено некоторое дополнительное описание касательно композиций и способов по настоящему изобретению, и подразумевают, что раздел необходимо рассматривать в сочетании со всеми другими разделами раскрытия настоящего патента. Кроме того, как будет очевидно специалистам в настоящей области техники, различные варианты осуществления, описанные по всему раскрытию настоящего патента, можно, и так и подразумевается, объединять в комбинации со множеством различных способов. Такие комбинации конкретных вариантов осуществления, описанных в настоящем документе, подразумевают как подпадающие под объем настоящего изобретения
Ниже приведены некоторые определения. Другие термины либо определены в другом месте раскрытия настоящего патента, либо имеют значение, которое очевидно из контекста, в котором их используют, либо их используют в соответствии с их обычным значением в настоящей области техники.
Определения
Применяемые в настоящем документе термины «приблизительно» и «примерно», в случае их применения в отношении числовых значений, означают в пределах + или - 20% от указанного значения.
Применяемый в настоящем документе термин «культивирование» относится к размножению клеток на или в средах различных видов. «Совместное культивирование» относится к размножению клеток двух или более различных типов на или в средах различных видов, например, в соответствии с некоторыми вариантами осуществления можно совместно культивировать эндотелиальные клетки и стволовые клетки или клетки-предшественники.
Применяемый в настоящем документе термин «эффективное количество» относится к количеству указанного средства или клеточной популяции (например, полипептида E4ORF1, молекулы нуклеиновой кислоты, кодирующей полипептид E4ORF1, или популяции E4ORF1+ сконструированных эндотелиальных клеток), описанных в настоящем документе, которое является достаточным для достижения определяемого эффекта по одному или нескольким результатам, описанным в настоящем документе. Например, в случае экспрессии E4ORF1 в эндотелиальных клетках, эффективное количество молекулы нуклеиновой кислоты (например, в векторе), которое должно быть введено/доставлено в эндотелиальные клетки, может быть таким, которое приводит в результате к определяемому увеличению выживаемости или пролиферации эндотелиальных клеток по сравнению с этими показателями у любого подходящего контроля (например, E4ORFT эндотелиальных клеток). В случае внесения молекул нуклеиновой кислоты, кодирующих E4ORF1, в эндотелиальные клетки, эффективное количество молекулы нуклеиновой кислоты (например, в векторе) может быть таким, которое приводит в результате к определяемому увеличению выживаемости или пролиферации эндотелиальных клеток по сравнению с этими показателями у любого подходящего контроля (например, E4ORF1" клеток). В случае способов, которые предусматривают введение E4ORF1+ эндотелиальных клеток субъекту, эффективное количество может быть таким, которое приводит в результате к определяемому улучшению одного или нескольких необходимых биологических или терапевтических показателей (таких как, например, улучшенная регенерация эндотелия/сосудов, улучшенный ангиогенез, улучшенная выживаемость или приживление имплантата и т.д.) по сравнению с показателями любого подходящего контроля (например, E4ORF1- эндотелиальных клеток). Соответствующее «эффективное количество» в любом отдельном случае можно определить эмпирически, например, с помощью известных в настоящей области стандартных методик, таких как исследование с повышением дозы, и можно определить с учетом таких факторов, как планируемое применение, планируемый способ доставки/введения, необходимая частота доставки/введения и т.д. Кроме того, «эффективное количество» можно определить с помощью анализов, таких как те, которые описаны в разделе «Примеры» раскрытия настоящего патента, для оценки формирования кровеносных сосудов в имплантатах и/или для оценки интеграции имплантата в ткань in vivo.
Термин «сконструированный», при его применении по отношению к клеткам, в настоящем документе относится к клеткам, которые были сконструированы человеком для получения в результате описываемого фенотипа (например, E4ORF1+ или ETV2+ или экспрессии рекомбинантного транскрипционного фактора ETS) или для экспрессии описываемой молекулы нуклеиновой кислоты или полипептида. Термин «сконструированные клетки» не предназначен для охвата встречающихся в природе клеток, а наоборот, предназначен для охвата, например, клеток, которые содержат рекомбинантную молекулу нуклеиновой кислоты, или клеток, которые были иным образом искусственно изменены (например, путем генетической модификации, как определено ниже), например, так, чтобы они экспрессировали полипептид, который они иначе не экспрессировали бы, или чтобы они экспрессировали полипептид на существенно более высоких уровнях, чем это наблюдается у отличных от сконструированных эндотелиальных клеток.
«Генетическая модификация», или «геномодифицированный», или «генетически модифицированный» относится к любому добавлению к нормальным нуклеотидным последовательностей клетки или делеции или нарушению у них. Например, в соответствии с некоторыми вариантами осуществления описываемые эндотелиальные клетки были генетически модифицированы таким образом, чтобы они содержали молекулу нуклеиновой кислоты, которая кодирует аденовирусный полипептид E4ORF1, и/или молекулу нуклеиновой кислоты, которая кодирует любой из других конкретных полипептидов, описанных в настоящем документе (например, полипептиды транскрипционного фактора ETS, такие как полипептиды ETV2). Аналогичным образом, в соответствии с некоторыми вариантами осуществления описываемые в настоящем документе эндотелиальные клетки или клетки любого из других описываемых в настоящем документе типов (такие как стволовые клетки, или клетки-предшественники, или нервные клетки, мышечные клетки, перициты, эпителиальные клетки, жировые клетки, фибробласты, кератиноциты, моноциты, нейтрофилы, лимфоциты, Т-клетки, В-клетки или стволовые клетки волосяного фолликула) при необходимости также могут содержать одну или несколько других генетических модификаций. Термин «генетическая модификация» охватывает применение средства доставки гена и включает без ограничения трансдукцию (опосредованный вирусом перенос нуклеиновой кислоты реципиенту, либо in vivo, либо in vitro), трансфекцию (поглощение клетками выделенной нуклеиновой кислоты), опосредованный липосомой перенос и другие средства, хорошо известные в настоящей области.
Термин «интактный» или «дикого типа» при применении по отношению к описываемым в настоящем документе клеткам относится к клеткам, которые не были генетически модифицированы (в том смысле, как этот термин определен выше) или которые не являются «сконструированными» клетками (в том смысле, как этот термин определен выше). Например, эндотелиальные клетки или клетки других типов, которые были получены от субъекта и которые не были генетически модифицированы человеком, считают «интактными» клетками или клетками «дикого типа».
Применяемая в настоящем документе фраза «выделенный имплантат» относится к имплантату, который не находится внутри организма субъекта, а вместо этого находится ex vivo/in vitro. Например, имплантат in vitro в культуральной среде считают «выделенным имплантатом». Обычно «выделенный» имплантат является имплантатом, который был создан in vitro, а не in vivo, и который еще не был имплантирован или инкубирован in vivo. Таким образом, как правило, выделенный имплантат относится к созданному in vitro имплантату, который, будучи подходящим для хирургической имплантации, еще не был имплантирован хирургическим путем субъекту. Все варианты осуществления настоящего изобретения, которые относятся к «имплантатам», обычно предусматривают «выделенные имплантаты».
Применяемый в настоящем документе термин «рекомбинантный» относится к молекулам нуклеиновой кислоты, которые созданы человеком (в том числе машиной) при помощи способов молекулярной биологии и генной инженерии (таких как молекулярное клонирование) и которые содержат нуклеотидные последовательности, которые иначе не существовали бы в природе. Таким образом, молекулы рекомбинантной нуклеиновой кислоты должны отличаться от молекул нуклеиновой кислоты, которые существуют в природе, например, в геноме организма. Молекулу нуклеиновой кислоты, которая содержит комплементарную ДНК-копию или «кДНК»-копию последовательности мРНК без каких-либо промежуточных интронных последовательностей, таких как встречающиеся в соответствующей последовательности геномной ДНК, таким образом будут считать рекомбинантной молекулой нуклеиновой кислоты. В качестве примера, рекомбинантная молекула нуклеиновой кислоты E4ORF1 может содержать кодирующую E4ORF1 последовательность, функционально связанную с промотором и/или другими генетическими элементами, с которыми эта кодирующая последовательность обычно не ассоциирована в природном геноме аденовируса. Аналогичным образом, рекомбинантная молекула нуклеиновой кислоты ETV2 может содержать кДНК-последовательность ETV2 (т.е. последовательность, которая не существует в природе в геноме организма) и/или может содержать кодирующие ETV2 последовательности, функционально связанные с промотором и/или другими генетическими элементами, с которыми такая кодирующая последовательность обычно не ассоциирована в геноме организма.
Термины «субъект» и «пациент» применяют в настоящем документе взаимозаменяемо, и они относятся, за исключением тех случаев, когда это указано, к млекопитающим, таким как люди и отличные от человека приматы, а также кролики, крысы, мыши, козы, свиньи и другие виды млекопитающих.
Применяемая в настоящем документе фраза «практически чистый» в отношении популяции клеток относится к популяции клеток указанного типа (например, определяемого по экспрессии одного или нескольких указанных клеточных маркеров, морфологическим характеристикам или функциональным характеристикам) или указанных типов (множественное число) в вариантах осуществления, где совместно применяют клетки двух или более различных типов, то есть по меньшей мере к приблизительно 50%, предпочтительно по меньшей мере к приблизительно 75-80%, более предпочтительно по меньшей мере к приблизительно 85-90% и наиболее предпочтительно по меньшей мере к приблизительно 95% клеток, составляющих общую популяцию клеток. Таким образом, «практически чистая популяция клеток» относится к популяции клеток, которая содержит менее чем приблизительно 50%, предпочтительно менее чем приблизительно 20-25%, более предпочтительно менее чем приблизительно 10-15% и наиболее предпочтительно менее чем приблизительно 5% клеток, которые не относятся к указанному типу или типам.
Молекулы нуклеиновых кислот и полипептиды
Аденовирусный участок ранней транскрипции 4 (Е4) содержит по меньшей мере 6 открытых рамок считывания (E4ORF). Ранее было показано, что весь участок Е4 регулирует ангиогенез и способствует выживаемости эндотелиальных клеток (см. Zhang et al. (2004), J. Biol. Chem. 279(12):11760-66). Ранее также было показано, что во всем участке Е4 именно последовательность E4ORF1 отвечает за эти биологические эффекты у эндотелиальных клеток. См. патент США №8465732. Также см. Seandel et al. (2008), "Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene," PNAS, 105(49): 19288-93. Несколько из описанных в настоящем документе вариантов осуществления настоящего изобретения включают сконструированные эндотелиальные клетки, которые являются E4ORF1+ -, т.е. которые экспрессируют полипептид E4ORF1. Аналогичным образом, несколько из описанных в настоящем документе вариантов осуществления настоящего изобретения включают сконструированные эндотелиальные клетки, которые являются ETV2+ или ETS+. Такие клетки характеризуются соответственно экспрессией полипептида ETV2 или полипептида транскрипционного фактора семейства ETS. Все эти полипептиды (E4ORF1, ETV2, ETS) в настоящем документе совместно называются «полипептидами по настоящему изобретению».
«Полипептиды по настоящему изобретению» кодируются молекулами нуклеиновой кислоты. Таким образом, в соответствии с некоторыми вариантами осуществления настоящее изобретение относится к молекулам нуклеиновой кислоты, которые кодируют аденовирусный полипептид E4ORF1, молекулам нуклеиновой кислоты, которые кодируют полипептид транскрипционного фактора ETS, и/или молекулам нуклеиновой кислоты, которые кодируют полипептид транскрипционного фактора ETV2. Такие молекулы нуклеиновой кислоты в настоящем документе совместно называются «молекулами нуклеиновой кислоты по настоящему изобретению».
Полипептиды по настоящему изобретению и молекулы нуклеиновой кислоты по настоящему изобретению могут иметь аминокислотные последовательности или нуклеотидные последовательности, которые указаны в настоящем документе или известны из уровня техники, или могут иметь аминокислотные или нуклеотидные последовательности, которые являются вариантами, производными, мутантами или фрагментами таких аминокислотных или нуклеотидных последовательностей, при условии, что такие варианты, производные, мутанты или фрагменты имеют, или кодируют полипептид, который имеет, одно или несколько из описанных в настоящем документе функциональных свойств или одно или несколько из свойств, необходимых для описанных в настоящем документе применений, или не предотвращают или не блокируют одно или несколько из описанных в настоящем документе свойств или применений (которые включают без ограничения способность стимулировать выживание эндотелиальных клеток in vitro и способность эндотелиальных клеток формировать кровеносные сосуды в имплантате in vitro).
В тех вариантах осуществления, которые включают полипептиды транскрипционного фактора ETS, такие как полипептиды ETV2, полипептид может представлять собой любой полипептид транскрипционного фактора ETS млекопитающих, такой как полипептид человека, отличного от человека примата, кролика, крысы, мыши, козы или свиньи. В соответствии с некоторыми предпочтительными вариантами осуществления полипептид может представлять собой полипептид человека. Аминокислотные последовательности таких полипептидов и последовательности нуклеиновых кислот, которые кодируют такие полипептиды, хорошо известны из уровня техники и доступны в хорошо известных общедоступных базах данных, таких как база данных Genbank.
В тех вариантах осуществления, которые включают аденовирусные полипептиды E4ORF1, применяемая полипептидная последовательность может происходить от аденовируса любого подходящего типа или штамма, такого как аденовирус человека 2, 3, 5, 7, 9, 11, 12, 14, 34, 35, 46, 50 или 52 типа. В соответствии с некоторыми предпочтительными вариантами осуществления применяемая полипептидная последовательность происходит от аденовируса человека 5 типа. Аминокислотные последовательности таких аденовирусных полипептидов и последовательности нуклеиновых кислот, которые кодируют такие полипептиды, хорошо известны из уровня техники и доступны в хорошо известных общедоступных базах данных, таких как база данных Genbank. Например, в число подходящих последовательностей входят следующие: аденовируса человека 9 (номер доступа в Genbank CAI05991), аденовируса человека 7 (номер доступа в Genbank AAR89977), аденовируса человека 46 (номер доступа в Genbank ААХ70946), аденовируса человека 52 (номер доступа в Genbank АВК35065), аденовируса человека 34 (номер доступа в Genbank AAW33508), аденовируса человека 14 (номер доступа в Genbank AAW33146), аденовируса человека 50 (номер доступа в Genbank AAW33554), аденовируса человека 2 (номер доступа в Genbank AP.sub.--000141), аденовируса человека 12 (номер доступа в Genbank АР.sub.--000141), аденовируса человека 35 (номер доступа в Genbank AP.sub.--000607), аденовируса человека 7 (номер доступа в Genbank AP.sub.--000570), аденовируса человека 1 (номер доступа в Genbank AP.sub.--000533), аденовируса человека 11 (номер доступа в Genbank AP.sub.--000474), аденовируса человека 3 (номер доступа в Genbank ABB 17792) и аденовируса человека 5 типа (номер доступа Genbank D12587).
В соответствии с некоторыми вариантами осуществления полипептиды и молекулы нуклеиновых кислот по настоящему изобретению имеют такие же аминокислотные или нуклеотидные последовательности, как и последовательности, которые конкретно перечислены в настоящем документе или известны из уровня техники (например, в общедоступных базах данных последовательностей, таких как база данных Genbank). В соответствии с некоторыми вариантами осуществления полипептиды и молекулы нуклеиновой кислоты по настоящему изобретению могут иметь аминокислотные или нуклеотидные последовательности, которые являются вариантами, производными, мутантами или фрагментами таких последовательностей, например, вариантами, производными, мутантами или фрагментами с более чем 85% идентичности последовательности с такими последовательностями. В соответствии с некоторыми вариантами осуществления варианты, производные, мутанты или фрагменты имеют приблизительно 85% идентичности с известной последовательностью или приблизительно 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности последовательности с известной последовательностью. В соответствии с некоторыми вариантами осуществления применяют вариант, производное, мутант или фрагмент известной нуклеотидной последовательности, которые варьируют по длине на приблизительно 50 нуклеотидов, или приблизительно 45 нуклеотидов, или приблизительно 40 нуклеотидов, или приблизительно 35 нуклеотидов, или приблизительно 30 нуклеотидов, или приблизительно 28 нуклеотидов, 26 нуклеотидов, 24 нуклеотида, 22 нуклеотида, 20 нуклеотидов, 18 нуклеотидов, 16 нуклеотидов, 14 нуклеотидов, 12 нуклеотидов, 10 нуклеотидов, 9 нуклеотидов, 8 нуклеотидов, 7 нуклеотидов, 6 нуклеотидов, 5 нуклеотидов, 4 нуклеотида, 3 нуклеотида, 2 нуклеотида или 1 нуклеотид относительно известной нуклеотидной последовательности. В соответствии с некоторыми вариантами осуществления применяют вариант, производное, мутант или фрагмент известной аминокислотной последовательности, которые варьируют в длину на приблизительно 50 аминокислот, или приблизительно 45 аминокислот, или приблизительно 40 аминокислот, или приблизительно 35 аминокислот, или приблизительно 30 аминокислот, или приблизительно 28 аминокислот, 26 аминокислот, 24 аминокислоты, 22 аминокислоты, 20 аминокислот, 18 аминокислот, 16 аминокислот, 14 аминокислот, 12 аминокислот, 10 аминокислот, 9 аминокислот, 8 аминокислот, 7 аминокислот, 6 аминокислот, 5 аминокислот, 4 аминокислоты, 3 аминокислоты, 2 аминокислоты или 1 аминокислоту по отношению к известной аминокислотной последовательности.
В соответствии с теми вариантами осуществления, где применяют последовательность нуклеиновой кислоты или аминокислотную последовательность E4ORF1, в соответствии с некоторыми вариантами осуществления такие последовательности применяют без других последовательностей из аденовирусного участка Е4, например, не в контексте нуклеотидной последовательности всего участка Е4 или не вместе с другими полипептидами, кодируемыми участком Е4. Однако, в соответствии с некоторыми другими вариантами осуществления такие последовательности можно применять в сочетании с одной или несколькими другими последовательностями нуклеиновой кислоты или аминокислотными последовательностями из участка Е4, такими как последовательности E4ORF2, E4ORF3, E4ORF4 или E4ORF5 или их варианты, мутанты или фрагменты Например, несмотря на то, что последовательности E4ORF1 можно применять в конструкциях (таких как вирусные векторы), которые содержат другие последовательности, гены или кодирующие участки (такие как промоторы, маркерные гены, гены устойчивости к антибиотикам и тому подобное), в соответствии с некоторыми вариантами осуществления последовательности E4ORF1 применяют в конструкциях, которые не содержат весь участок Е4 или которые не содержат другие ORF из всего участка Е4, такие как E4ORF2, E4ORF3, E4ORF4 и/или E4ORF5.
Молекулы нуклеиновой кислоты по настоящему изобретению можно применять в конструкциях, которые содержат различные другие последовательности нуклеиновой кислоты, гены или кодирующие участки, в зависимости от необходимого применения, например, гены устойчивости к антибиотикам, репортерные гены или метки экспрессии (такие как, например, нуклеотидные последовательности, кодирующие GFP) или любые другие нуклеотидные последовательности или гены, которые могут быть необходимы. Полипептиды по настоящему изобретению можно экспрессировать отдельно или как часть химерных белков.
В соответствии с некоторыми вариантами осуществления молекулы нуклеиновой кислоты по настоящему изобретению могут находиться под контролем одного или нескольких промоторов, позволяющих прохождение экспрессии. Можно применять любой промотор, способный управлять экспрессией последовательностей нуклеиновой кислоты в клетке необходимого типа. Примеры подходящих промоторов включают без ограничения промоторы CMV, SV40, RSV, HIV-Ltr и MML. Промотор также может представлять собой промотор из аденовирусного генома или его вариант. Например, при использовании E4ORF1, промотор может представлять собой промотор, применяемый для управления экспрессией соответствующих генов в аденовирусе.
В соответствии с некоторыми вариантами осуществления молекулы нуклеиновой кислоты по настоящему изобретению могут быть помещены под контроль индуцируемого промотора, так чтобы экспрессию последовательностей нуклеиновой кислоты можно было при необходимости включать или выключать. Можно применять любую подходящую индуцируемую систему экспрессии, такую как, например, индуцируемая тетрациклином система экспрессии или индуцируемая гормоном система экспрессии. Например, молекулы нуклеиновой кислоты по настоящему изобретению можно экспрессировать пока они необходимы, а затем отключить, когда необходимый результат был достигнут, например, когда был достигнут достаточный рост или пролиферация эндотелиальных клеток. Возможность включения или выключения экспрессии может быть особенно полезна для применений in vivo.
Молекулы нуклеиновой кислоты по настоящему изобретению могут содержать встречающиеся в природе нуклеотиды, синтетические нуклеотиды или их комбинацию. Например, в соответствии с некоторыми вариантами осуществления молекулы нуклеиновой кислоты по настоящему изобретению могут содержать РНК, такуюкак синтетическая модифицированная РНК, которая стабильна в клетках и может быть использована для непосредственной экспрессии/продуцирования белка непосредственно в клетках. В соответствии с другими вариантами осуществления молекулы нуклеиновой кислоты по настоящему изобретению могут содержать ДНК. В соответствии с вариантами осуществления, в которых применяют ДНК, последовательности ДНК могут быть функционально связаны с одним или несколькими подходящими промоторами и/или регуляторными элементами, позволяющими (и/или способствующими, усиливающими или регулирующими) экспрессию в клетках, и могут присутствовать в одном или нескольких подходящих векторах или конструкциях. Молекулы нуклеиновой кислоты по настоящему изобретению можно вводить в эндотелиальные клетки в одной и той же конструкции нуклеиновой кислоты, или их можно вводить в раздельных конструкциях нуклеиновой кислоты.
Молекулы нуклеиновой кислоты по настоящему изобретению можно вводить в эндотелиальные клетки с помощью любой известной в настоящей области подходящей системы, включая без ограничения методики трансфекции и методики опосредованной вирусом трансдукции. Способы трансфекции, которые можно применять в соответствии с настоящим изобретением, включают без ограничения опосредованную липосомами трансфекцию, опосредованную полибреном трансфекцию, опосредованную DEVE декстраном трансфекцию, электропорацию, осаждение фосфатом кальция, микроинъекцию и бомбардировку микрочастицами. Способы опосредованной вирусом трансдукции, которые можно применять, включают без ограничения опосредованную лентивирусом трансфекцию, опосредованную аденовирусом трансдукцию, опосредованную ретровирусом трансдукцию, опосредованную аденоассоциированным вирусом трансдукцию и опосредованную вирусом герпеса трансдукцию.
Настоящее изобретение также относится к векторам, включая векторы экспрессии, которые содержат молекулы нуклеиновой кислоты по настоящему изобретению. Например, в соответствии с одним вариантом осуществления настоящее изобретение относится к вектору экспрессии, содержащему нуклеотидную последовательность, кодирующую полипептид транскрипционного фактора ETS, и нуклеотидную последовательность, кодирующую полипептид E4ORF1. В соответствии с некоторыми такими вариантами осуществления транскрипционным фактором ETS является ETV2. В соответствии с некоторыми такими вариантами осуществления вектор экспрессии представляет собой лентивирусный вектор. В соответствии с некоторыми вариантами осуществления нуклеотидная последовательность, кодирующая полипептид транскрипционного фактора ETS, и нуклеотидная последовательность, кодирующая полипептид E4ORF1, находятся под контролем отдельных промоторов. В соответствии с некоторыми вариантами осуществления нуклеотидная последовательность, кодирующая полипептид транскрипционного фактора ETS, и нуклеотидная последовательность, кодирующая полипептид E4ORF1, находятся под контролем одного промотора, например, с последовательностью участка внутренней посадки рибосомы (IRES) между последовательностями ETS и E4ORF1.
В соответствии с некоторыми вариантами осуществления можно применять пептидомиметик. Пептидомиметик представляет собой небольшую, похожую на белковую цепь, предназначенную для имитации полипептида. Такая молекула может быть сконструирована для имитирования любого из полипептидов по настоящему изобретению (например, полипептида ETV2 или E4ORF1). Из уровня техники известны различные способы модификации пептида для создания пептидомиметика или иного конструирования пептидомиметика, и они могут быть использованы для создания пептидомиметика одного из полипептидов по настоящему изобретению.
Обработка, манипуляция и экспрессия полипептидов и молекул нуклеиновых кислот по настоящему изобретению могут быть выполнены с использованием обычных методов молекулярной биологии и клеточной биологии. Такие методы Хорошо известны из уровня техники. Например, можно обратиться к идеям Sambrook, Fritsch and Maniatis eds., "Molecular Cloning A Laboratory Manual, 2nd Ed., Cold Springs Harbor Laboratory Press, 1989); к серии Methods of Enzymology (Academic Press, Inc.) или любым другим стандартным работам в отношении руководств по подходящим методам для их применения при обработке, манипулировании и экспрессии нуклеотидной и/или аминокислотной последовательностей. Дополнительные аспекты, относящиеся к обработке или экспрессии последовательностей E4ORF1, описаны в патенте США №8465732, содержание которого включено таким образом в настоящее описание посредством ссылки.
Сконструированные эндотелиальные клетки
В соответствии с некоторыми вариантами осуществления настоящее изобретение относится к «сконструированным эндотелиальным клеткам».
В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки представляют собой E4ORF1+ сконструированные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки представляют собой E4ORF1+ ETV2+ сконструированные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки представляют собой E4ORF1+ ETS+сконструированные эндотелиальные клетки.
В соответствии с другими вариантами осуществления сконструированные эндотелиальные клетки экспрессируют один или несколько маркеров. Действительно, следует отметить, что во всех описанных в настоящем документе вариантах осуществления, которые включают в себя E4ORF1+ сконструированные эндотелиальные клетки, в качестве альтернативы E4ORF1+ клеткам можно применять эндотелиальные клетки, которые были сконструированы (например, путем трансфекции или трансдукции молекулой нуклеиновой кислоты или путем обработки любым другим средством, таким как белок или химическое средство) так, чтобы они экспрессировали один или несколько из приведенных далее маркеров или экспрессировали повышенные уровни одного или нескольких из приведенных далее маркеров, например, с уровнями, которые 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз, в 10 раз, в 20 раз, в 30 раз, в 40 раз или в 50 раз выше уровней одного или нескольких из приведенных далее маркеров по сравнению с неконструированными эндотелиальными клетками (например, по сравнению с интактными эндотелиальными клетками или по сравнению с эндотелиальными клетками, которые не были сконструированы таким Же образом, но были иначе подвергнуты сравнительной обработке). Такими маркерами являются: интегрин альфа 11, матрилин 2, ингибитор металлопептидазы TIMP 3, дельта-подобный 4, эластин, Smoothelin-подобный 2, синдекан 1, кальпонин 3 кислый, белок С (инактиватор факторов коагуляции Va и VIIIa), фактор дифференцировки и роста 3, белок межклеточных щелевых контактов альфа 4 37 кДа, металлопептидаза ADAM с мотивом 18 тромбоспондинового типа 1, интерлейкин 33, лептиновый рецептор, сульфатаза 1, эфрин-А1, дипептидилпептидаза 4, коллаген VIII типа, альфа 1, хемокиновый (С-С мотив) лиганд 2, кислый хрящевой белок 1, цистеинил-лейкотриеновый рецептор 2, фактор роста 2 (основной) фибробластов, ламинин бета 3, молекула CD82, инсулиновый рецептор, эфрин-В1, подобный хемокиновому (С-С-мотив) рецептору белок 1, белок межклеточных щелевых контактов, альфа 4, 37 кДа, и фибулин 2. Вышеперечисленные маркеры и их соответствующие символы генов также проиллюстрированы в приведенной ниже таблице 1.
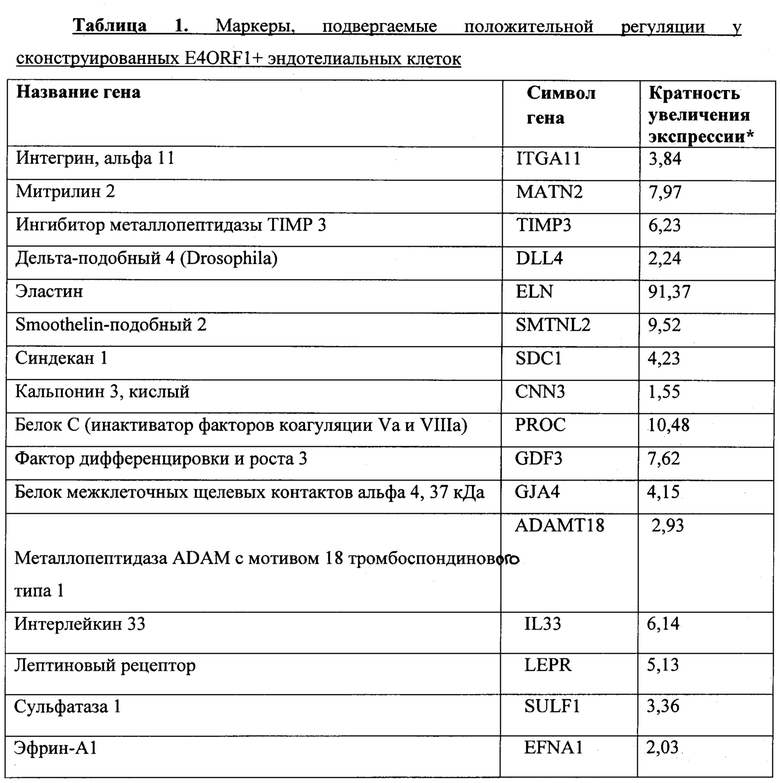

* кратность увеличения экспрессии в 12-м пассаже (Р12) Е4ORF1-экспрессирующих HUVEC по сравнению с (Р12) отличных от Е4ORF1-экспрессирующих HUVEC, по результатам секвенирования РНК.
В соответствии с некоторыми такими вариантами осуществления сконструированные эндотелиальные клетки экспрессируют, или экспрессируют с повышенными уровнями, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или все 29 из вышеуказанных маркеров. В соответствии с некоторыми такими вариантами осуществления сконструированные эндотелиальные клетки экспрессируют, или экспрессируют с повышенными уровнями, эластин. В соответствии с некоторыми такими вариантами осуществления сконструированные эндотелиальные клетки экспрессируют, или экспрессируют с повышенными уровнями, эластин, белок С, кислый хрящевой белок 1 и фибулин 2. В соответствии с некоторыми такими вариантами осуществления сконструированные эндотелиальные клетки экспрессируют, или экспрессируют с повышенными уровнями, эластин, белок С, кислый хрящевой белок 1, фибулин 2, матрилин 2, smoothelin-подобный белок 2, фактор дифференцировки и роста 3, интерлейкин 33, лептиновый рецептор и цистеинил-лейкотриеновый рецептор 2.
Сконструированные эндотелиальные клетки могут быть получены из любого подходящего источника эндотелиальных клеток, который известен из уровня техники. В соответствии с некоторыми вариантами осуществления эндотелиальные клетки представляют собой первичные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки представляют собой клетки млекопитающих, такие как клетки человека или отличного от человека примата или клетки кролика, крысы, мыши, козы, свиньи или других млекопитающих. В соответствии с некоторыми вариантами осуществления эндотелиальные клетки представляют собой первичные эндотелиальные клетки человека. В соответствии с некоторыми вариантами осуществления эндотелиальные клетки представляют собой эндотелиальные клетки пупочной вены (UVEC), такие как эндотелиальные клетки пупочной вены человека (HUVEC). В соответствии с некоторыми вариантами осуществления эндотелиальные клетки представляют собой интактные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления эндотелиальные клетки представляют собой генетически модифицированные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут быть получены из стволовых клеток или клеток-предшественников. Например, в соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут быть получены из плюрипотентных стволовых клеток, таких как индуцированные плюрипотентные стволовые клетки (iPS-клетки) или эмбриональные стволовые клетки (ES-клетки). В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут быть получены из эндотелиальных клеток-предшественников. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут быть получены из неэндотелиальных клеток дифференцированного типа с помощью способа перепрограммирования, такого как способ прямого перепрограммирования или способ, при котором дифференцированную клетку перепрограммируют в клетку менее дифференцированного типа (такую как клетка плюрипотентного или мультипотентного типа) перед последующей дифференцировкой менее дифференцированной клетки в эндотелиальную клетку. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки представляют собой орган-специфичные эндотелиальные клетки. Например, в соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут представлять собой специфичные для гематопоэтической системы эндотелиальные клетки, или специфичные для нервной системы эндотелиальные клетки, или специфичные для сердца эндотелиальные клетки, или специфичные для легких эндотелиальные клетки, или специфичные для печени эндотелиальные клетки, или специфичные для почек эндотелиальные клетки, или специфичные для мышц эндотелиальные клетки, или специфичные для хряща эндотелиальные клетки, или специфичные для жировой ткани эндотелиальные клетки. В соответствии с некоторыми такими вариантами осуществления применяемые орган-специфичные эндотелиальные клетки получают из органа или ткани, в который или в которую необходимо поместить имплантат. Например, в соответствии с некоторыми вариантами осуществления, если имплантат необходимо имплантировать в ткань легкого или применять для лечения дефекта легкого, используемыми эндотелиальными клетками могут быть специфичные для легких эндотелиальные клетки. Аналогично, если имплантат необходимо имплантировать в ткань печени или применять для лечения дефекта печени, используемыми эндотелиальными клетками могут быть специфичные для печени эндотелиальные клетки. Другие подходящие эндотелиальные клетки, которые можно применять, включают описанные ранее как подходящие для экспрессии E4ORF1 в патенте США №8465732, содержание которого таким образом включено посредством ссылки.
В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки являются генетически модифицированными таким образом, чтобы они содержали одну или несколько генетических модификаций в дополнение к и наряду с экспрессией любой из описанных в настоящем документе конкретных молекул или маркеров (например, E4ORF1). Например, такие клетки могут содержать скорректированную версию гена, о котором известно, что он вовлечен или может быть вовлечен в развитие заболевания или нарушения, которое затрагивает эндотелиальные клетки, или любого другого гена, такого как терапевтически полезный ген, который может быть необходимо внести в эндотелиальные клетки или ввести или доставить с использованием сконструированных эндотелиальных клеток.
Сконструированные эндотелиальные клетки по настоящему изобретению могут существовать или быть представлены в различных формах. Например, в соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут содержать популяцию клеток, такую как выделенную популяцию клеток. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут содержать популяцию клеток in vitro, которую, например, необходимо добавить к имплантату или включить в состав имплантата. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут содержать практически чистую популяцию клеток. Аналогично, в соответствии с некоторыми вариантами осуществления выделенные имплантаты по настоящему изобретению могут содержать практически чистую популяцию эндотелиальных клеток. Например, в соответствии с некоторыми вариантами осуществления по меньшей мере приблизительно 50%, предпочтительно по меньшей мере приблизительно 75-80%, более предпочтительно по меньшей мере приблизительно 85-90% и наиболее предпочтительно по меньшей мере приблизительно 95% клеток, составляющих общую популяцию клеток, будут сконструированными эндотелиальными клетками по настоящему изобретению. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки могут быть представлены в форме композиции, содержащей сконструированные клетки и один или несколько дополнительных компонентов. Например, в соответствии с некоторыми вариантами осуществления настоящее изобретение может относиться к композиции, содержащей популяцию описанных в настоящем документе сконструированных эндотелиальных клеток вместе с раствором-носителем, таким как физиологический солевой раствор, клеточная суспензионная среда, клеточная культуральная среда или тому подобное. В соответствии с некоторыми вариантами осуществления такие композиции могут быть терапевтическими композициями, содержащими популяцию сконструированных эндотелиальных клеток и раствор-носитель, который подходит для введения субъекту, например, субъекту-человеку. При необходимости могут быть включены другие терапевтически приемлемые средства. Специалист в настоящей области техники может легко подобрать подходящие средства для включения в терапевтические композиции в зависимости от предназначенного применения.
В соответствии с некоторыми вариантами осуществления у сконструированных эндотелиальных клеток по настоящему изобретению до применения (например, терапевтического применения) инактивированы митотические процессы с тем, чтобы они не могли реплицироваться. Этого можно достичь, например, с помощью химического средства, такого как митомицин С, или путем облучения сконструированных эндотелиальных клеток.
Биосовместимые каркасы
В соответствии с определенными вариантами осуществления биосовместимый каркас, применяемый в соответствии с настоящим изобретением, может представлять собой, или может содержать, фактически состоять из или состоять из любого материала, который является биосовместимым, может быть инфильтрован клетками (например, содержащий пористую структуру) и подходит для хирургической имплантации живому субъекту. Примеры таких каркасов включают без ограничения каркасы, которые содержат, состоят или фактически состоят из децелюляризированной ткани животного (такой как децелюляризированная свиная ткань, например, XenMatrix, доступная от Bard, Inc.) или одного или нескольких компонентов внеклеточного матрикса (ЕСМ), таких как коллаген, ламинин и/или фибрин. В соответствии с некоторыми вариантами осуществления биосовместимый каркас содержит по меньшей мере приблизительно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% коллагена. В соответствии с некоторыми вариантами осуществления биосовместимый каркас содержит по меньшей мере приблизительно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% ламинина. В соответствии с некоторыми вариантами осуществления биосовместимый каркас содержит по меньшей мере приблизительно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 95% фибрина. В соответствии с некоторыми вариантами осуществления биосовместимый каркас является каркасом, который имеет твердую форму при температуре 4°С и/или при комнатной температуре (около 21°С), или как при первой, так и при второй температуре. В соответствии с некоторыми вариантами осуществления биосовместимый каркас не содержит гиалуроновую кислоту. В соответствии с некоторыми вариантами осуществления биосовместимый каркас не содержит более чем приблизительно 5%, 4%, 3%, 2%, 1% или 0,5% гиалуроновой кислоты. В соответствии с некоторыми вариантами осуществления биосовместимый каркас не содержит матригель. В соответствии с некоторыми вариантами осуществления биосовместимый каркасный материал может быть выбран в зависимости от местоположения ткани, в которую его необходимо имплантировать, например, на основании ее биомеханических свойств или любых других биологических свойств.
Имплантаты
Описываемые в настоящем документе имплантаты содержат биосовместимый каркасный материал и сконструированные эндотелиальные клетки. В соответствии с некоторыми вариантами осуществления биосовместимый каркас имеет трехмерную структуру, а сконструированные эндотелиальные клетки формируют в имплантате кровеносные сосуды.
В соответствии с некоторыми вариантами осуществления имплантаты также могут содержать клетки других типов, в дополнение к эндотелиальным клеткам. В соответствии с некоторыми вариантами осуществления клетки таких дополнительных типов могут быть стволовыми или клетками-предшественниками, такими как эмбриональные стволовые (ES) клетки, индуцированные плюрипотентные стволовые клетки (iPSC), гематопоэтические стволовые клетки, костные стволовые клетки, мышечные стволовые клетки, нервные стволовые клетки, эпителиальные стволовые клетки, кожные стволовые клетки, мезенхимальные стволовые клетки, стволовые клетки кишечника, сперматогониальные стволовые клетки и тому подобные. В соответствии с некоторыми вариантами осуществления клетки таких дополнительных типов могут быть дифференцированными клетками, такими как гематопоэтические клетки, костные клетки, мышечные клетки, нервные клетки, эпителиальные клетки, кожные клетки, фибробласты, клетки кишечника, тестикулярные клетки и тому подобные. В соответствии с некоторыми вариантами осуществления клетки таких дополнительных типов могут быть генетически модифицированными клетками. В соответствии с некоторыми вариантами осуществления клетки таких дополнительных типов могут быть интактными (не модифицированными генетически) клетками. Другие примеры клеток, которые можно вносить или применять со сконструированными эндотелиальными клетками по настоящему изобретению, приведены в патенте США №8465732, содержание которого таким образом включено посредством ссылки.
В соответствии с некоторыми вариантами осуществления имплантат может иметь любой подходящий размер и/или форму в зависимости от предназначенного применения имплантата. Например, если имплантат предназначен для замены или восстановления конкретного дефекта ткани, имплантат может быть выполнен так, чтобы он имел размер и форму, подходящую для введения в такой дефект ткани.
Способы культивирования и способы изготовления имплантатов
Способы культивирования клеток хорошо известны из уровня техники, и можно применять любые подходящие способы культивирования клеток. Например, сконструированные эндотелиальные клетки по настоящему изобретению или имплантаты, содержащие такие клетки, можно культивировать с применением способов, которые известны как пригодные для культивирования других эндотелиальных клеток, или способов, которые известны как пригодные для культивирования E4ORF1+ эндотелиальных клеток, например, как описано в патенте США №8465732, содержание которого таким образом включено посредством ссылки. В соответствии с некоторыми вариантами осуществления сконструированные эндотелиальные клетки по настоящему изобретению или имплантаты, содержащие такие клетки, можно культивировать в отсутствие сыворотки, или в отсутствие экзогенных факторов роста, или в отсутствие как сыворотки, так и экзогенных факторов роста, или в отсутствие экзогенных ангиогенных факторов.
Сконструированные эндотелиальные клетки по настоящему изобретению также можно подвергнуть криоконсервации. Специалистам в настоящей области известны различные способы культивирования клеток и криоконсервации клеток, такие как способы, описанные в работе Culture of Animal Cells: A Manual of Basic Technique, 4th Edition (2000) by R. Ian Freshney ("Freshney"), содержание которой включено таким образом в настоящее описание посредством ссылки.
Имплантаты по настоящему изобретению могут быть изготовлены любым подходящим способом, известным из уровня техники. Например, в соответствии с одним вариантом осуществления настоящее изобретение относится к способу получения описываемого в настоящем документе имплантата, предусматривающему приведение в контакт биосовместимого каркаса с популяцией сконструированных эндотелиальных клеток in vitro. В соответствии с некоторыми вариантами осуществления начальная стадия приведения в контакт может включать размещение биосовместимого каркасного материала в культуре сконструированных эндотелиальных клеток или поверх нее. В соответствии с некоторыми вариантами осуществления начальная стадия приведения в контакт может включать размещение сконструированных эндотелиальных клеток на или в биосовместимом каркасном материале. Во время начальной стадии приведения в контакт, и после нее, сконструированные эндотелиальные клетки, биосовместимый каркас и полученный в результате имплантат можно поддерживать в условиях культивирования, о которых известно, что они пригодны для культивирования эндотелиальных клеток, таких как описанные в настоящем документе. Биосовместимый каркас, при необходимости, можно инкубировать с популяцией сконструированных эндотелиальных клеток в течение достаточного времени для инфильтрации эндотелиальными клетками биосовместимого каркаса или в течение достаточного времени для формирования эндотелиальными клетками кровеносных сосудов в биосовместимом каркасе. Например, в соответствии с некоторыми вариантами осуществления биосовместимый каркас можно инкубировать с популяцией сконструированных эндотелиальных клеток в течение приблизительно 1 дня (24 часов), 2 дней (48 часов), 3 дней, 4 дней, 5 дней, 6 дней или 7 дней (1 недели) или в течение приблизительно 2 недель, 3 недель, 4 недель, 5 недель или 6 недель или более перед применением имплантата, например, для имплантации субъекту.
Субъекты и способы лечения
В соответствии с некоторыми вариантами осуществления субъекты, которым можно имплантировать имплантаты по настоящему изобретению, являются субъектами, относящимися к любому виду животных, у которых может быть необходимо применение имплантата для облегчения лечения дефекта ткани. В соответствии с некоторыми вариантами осуществления субъект представляет собой млекопитающее, например, млекопитающее, выбранное из группы, состоящей из приматов (таких как люди и обезьяны), грызунов (таких как мыши, крысы и кролики), видов овечьих (таких как овцы и козы), видов крупного рогатого скота (например, коров), видов свиней, видов лошадей, видов кошачьих и видов собак. В соответствии с некоторыми вариантами осуществления субъектом является человек.
Имплантаты по настоящему изобретению можно применять для лечения дефекта ткани у нуждающегося в том субъекта. Такие субъекты могут иметь «дефект ткани». Используемый в настоящем документе термин «дефект ткани» предназначен для охвата различных типов состояний и типов поражения ткани, повреждения ткани или дисфункции ткани, включая без ограничения вызванные травматическим повреждением, старением, дегенеративным заболеванием, генетическими нарушениями, инфекционным заболеванием, аутоиммунным заболеванием или злокачественной опухолью. Предлагаемые в настоящем документе способы лечения могут обеспечить или могут быть направлены на достижение, замену, реконструкцию, регенерацию, восстановление или дополнения дефекта ткани у субъекта. Например, в соответствии с одним вариантом осуществления описываемый в настоящем документе имплантат можно применять для лечения сахарного диабета у субъекта (например, путем замены или дополнения дефектной инсулин-секретирующей ткани) или для лечения нейропатии. В соответствии с другим вариантом осуществления описываемый в настоящем документе имплантат можно применять для лечения нейропатии, например, путем размещения имплантата вблизи пораженного нерва, например, нерва, имеющего пораженную, дефектную или отсутствующую миелиновую оболочку, причем такой имплантат может облегчить восстановление нерва, в том числе его миелиновой оболочки.
Имплантаты по настоящему изобретению можно имплантировать хирургическим путем нуждающемуся в том субъекту с использованием стандартных хирургических способов и методов, известных в настоящей области. Например, имплантат в соответствии с настоящим изобретением можно имплантировать хирургическим путем в участок дефекта ткани или, при необходимости, вблизи участка дефекта ткани.
В соответствии с некоторыми вариантами осуществления имплантаты по настоящему изобретению содержат сконструированные эндотелиальные клетки, которые получены от того же субъекта, которому будет проведена имплантация имплантата - т.е. аутологичные клетки. В соответствии с другими вариантами осуществления имплантаты по настоящему изобретению содержат сконструированные эндотелиальные клетки, которые получены от аллогенного субъекта-донора. В соответствии с некоторыми такими вариантами осуществления аллогенный донор характеризуется тканевым соответствием с субъектом, у которого будет размещен имплантат (например, соответствием по HLA или соответствием по МНС). В соответствии с некоторыми такими вариантами осуществления аллогенный донор не соответствует или частично соответствует с субъектом, у которого будет размещен имплантат (например, частичное несоответствие по HLA или частичное несоответствие по МНС). В соответствии с вариантами осуществления, в которых сконструированные эндотелиальные клетки получены от аллогенного донора, может быть необходимо лечение субъекта одним или несколькими иммунодепрессантами для уменьшение риска отторжения «чужих» эндотелиальных клеток.
Наборы
Настоящее изобретение также относится к наборам для изготовления описываемых в настоящем документе имплантатов и для осуществления различных описываемых в настоящем документе способов. Такие наборы могут содержать любой из описываемых в настоящем документе компонентов, включая без ограничения нуклеотидные последовательности (например, кодирующие E4ORF1), сконструированные эндотелиальные клетки (например, E4ORF1+ эндотелиальные клетки), интактные эндотелиальные клетки, средства или композиции для обнаружения сконструированных эндотелиальных клеток или экспрессируемых в них белков или молекул нуклеиновой кислоты (например, зонды на основе нуклеиновых кислот, антитела и т.д.), среды или композиции, пригодные для культивирования сконструированных эндотелиальных клеток или для поддержания или культивирования имплантатов, содержащих сконструированные эндотелиальные клетки, биосовместимые каркасные материалы или любую их комбинацию. Все такие наборы необязательно могут содержать инструкции по применению, емкости, сосуды для культивирования и тому подобное. С набором в комплекте может идти вкладыш и может включать в себя любой письменный или записанный материал, который может иметь электронную или машиночитаемую форму (например, диск, оптический диск, микросхема памяти или лента), в котором представлены инструкции или другая информация по применению содержимого набора.
Определенные аспекты настоящего изобретения могут быть дополнительно описаны в приведенных далее неограничивающих примерах.
Примеры
Пример 1
In vitro культивирование имплантатов, содержащих сконструированные эндотелиальные клетки
Сконструированные E4ORF1+ эндотелиальные клетки пупочной вены человека (HUVEC), экспрессирующие аденовирусный белок E4ORFT и зеленый флуоресцентный белок (GFP), культивировали как описано в примере 3. Сконструированные E4ORF1+ HUVEC высевали в стандартных условиях в 24-луночный планшет и позволяли им достичь конфлюентности. Использовали децелюляризированный свиной коллагеновый матрикс (XenMatrix™ Surgical Graft, Bard Davol, Inc. Уорик, Род-Айленд). Коллагеновый матрикс получали либо путем расслоения матриксного материала на мелкие кусочки ножницами, либо с помощью 6-мм пуансона для кожи. Для засевания коллагенового матрикса сконструированными HUVEC использовали два альтернативных способа. В соответствии с первым способом, коллагеновый матрикс размещали непосредственно поверх монослоев сконструированных HUVEC, которые культивировались на поверхности 24-луночных планшетов. В соответствии со вторым способом, коллагеновый матрикс размещали в лунках 24-луночного планшета, а поверх коллагенового матрикса размещали сконструированные HUVEC, которые были собраны из сосудов для их культивирования. Для сконструированных HUVEC в обоих состояниях наблюдали врастание в коллагеновый матрикс в пределах 24 часов, и они оставались видимыми в коллагеновом матриксе во всех моментах времени испытания (вплоть до 6 недель). Кровеносные сосуды можно было визуализировать в пределах 48 часов после посева сконструированных эндотелиальных клеток, и они присутствовали во всех моментах времени испытания (вплоть до 6 недель). Сконструированные E4ORF1+ HUVEC формировали структуры кровеносных сосудов с открытыми просветами, которые наблюдали у всех коллагеновых матриксов (см. фиг. 1 А), а также выходили за границы матриксов и в окружающую среду (см. фиг. 1В).
Пример 2
In vivo имплантация коллагеновых матриксов, содержащих сконструированные эндотелиальные клетки
Коллагеновые матриксы засеивали сконструированными HUVEC как описано в примере 1. Клетки культивировали in vitro в течение от 8 дней до 6 недель после засевания сконструированными HUVEC, а затем соответственно имплантировали мышам (использовали иммунокомпрометированных мышей для минимизации любой реакции отторжения к эндотелиальным клеткам человека). Мышей анестезировали и готовили к операции. В коже живота производили 8 мм разрез. Вставляли зажимы между брюшной мышцей и кожей для создания пространства, которое должны были занять имплантаты. Каждое животное получало один «контрольный» имплантат (содержащий материал на основе коллагенового матрикса, который был пропитан средой, но не был засеян эндотелиальными клетками) и один «испытываемый» имплантат (содержащий сконструированные HUVEC). Имплантаты собирали спустя период времени от 48 часов до 4 недель после имплантации. При удалении имплантатов было обнаружено, что испытуемые имплантаты срослись с окружающими тканями мыши намного сильнее, чем контрольные имплантаты. На момент времени 48 часов испытуемые имплантаты были уже частично соединены при помощи анастомоза, о чем свидетельствовало наличие крови, проникавшей в трансплантат (фиг. 2А), в то время как контрольные имплантаты не были (фиг. 2В). Во время удаления трансплантата испытуемый матрикс также заметно сросся с окружающей тканью, тогда как у матрикса без эндотелиальных клеток не наблюдали сращения. На фиг. 3 проиллюстрирована гораздо большая степень васкуляризации, наблюдаемая у испытуемых имплантатов, по сравнению с контролями через 4 недели после имплантации. Имплантаты отделяли и подвергали гистологическому исследованию.
Оказалось, что испытуемые имплантаты характеризовались большей степенью насыщенности клетками, чем контрольные имплантаты. См. фиг. 4.
Пример 3
Культивирование E4QRF1+ сконструированных эндотелиальных клеток и имплантатов. содержащих E4QRF1+ сконструированные эндотелиальные клетки
Для культивирования эндотелиальных клеток на коллагеновых матриксах брали эндотелиальные клетки пупочной вены человека (HUVEC) у давших согласие доноров без известных заболеваний и трансдуцировали их аденовирусным E4ORF1 с получением E4ORF1+ HUVEC. Сконструированные HUVEC выращивали в виде прилипающих клеток с использованием стандартных в настоящей области техники способов. Такой стандартный способ предусматривает разделение клеток при достижении 100% конфлюентности, культивирование при температуре 37°С, размножение на обработанных тканевой культурой слоях среды, колбах или лунках и применение среды, обозначаемой следующим образом: среда 199, дополненная добавкой из эндотелиальных клеток (50 мкг/мл), эмбриональной бычьей сывороткой (FBS, конечная концентрация: 20%), раствором противогрибкового средства и антибиотика, буфером HEPES (10 мМ), гепарином (50 мкг/мл) и Glutamax. По мере пролиферации клеток среду заменяли либо в ходе субкультивирования в более крупных колбах, либо если возраст среды превышал 2 дня культивирования.
Эндотелиальные клетки размещали в контакте с матриксами лишь тогда, когда матриксы были гидратированы. При культивировании E4ORF1+ эндотелиальных клеток с коллагеновыми матриксами использовали несколько вариантов способа культивирования. В соответствии с одним способом, твердый коллагеновый матрикс разрезали на 25 мм2 кусочки с помощью инструментов, оснащенных острым лезвием (такими как лезвия безопасной бритвы, скальпели или ножницы). В соответствии с другим способом, твердый коллагеновый матрикс разрезали на круглые кусочки с помощью стоматологических пуансонов. В соответствии с другим способом, E4ORF1+ эндотелиальные клетки (ЕС) были в конфлюентном монослое с матриксом, размещенном поверх достаточного количества среды, так чтобы она покрывала матрикс. ЕС мигрировали в матрикс. В соответствии с одним способом культивирования, матрикс размещали в лунке с достаточным количеством среды, чтобы она покрывала матрикс. E4ORF1+ ЕС вносили в суспензии среды в лунку, содержащую матрикс. ЕС прилипали и росли на матриксе до опосредованного контактом подавления роста. Для долгосрочных инкубирований среду меняли каждые 2-3 дня, при этом соблюдали осторожность, чтобы не контактировать непосредственно с матриксом для предупреждения разрушения сосудистых структур. Инвазию коллагенового матрикса клетками E4ORF1+ ЕС отмечали в пределах 24 часов в каждом способе, при этом увеличение инвазии продолжалось в течение нескольких дней в зависимости от количества высеянных клеток и размера трансплантата. Чрезмерный рост (определяемый как E4ORFT+ ЕС, растущие множеством слоев, комков или скоплений) не отмечали - что согласовывалось с тем, что рост клеток блокировался при конфлюентности. Содержащие просвет структуры с внешним видом кровеносного сосуда наблюдали спустя 48 часов, и они сохранялись в течение нескольких недель (фиг. 1В).
In vivo эксперименты проводили путем хирургической имплантации таких матриксов иммунокомпрометированным мышам NOD scid gamma (NSG), которые не были способны давать иммунный ответ на E4ORF1+ ЕС человека. Анестезированных мышей очищали, брили и стабилизировали. Производили небольшой 8 мм разрез в коже. Вводили тупоконечные зажимы в закрытом состоянии, затем открывали после их введения между кожей и мышцей для создания полости. Действие повторяли в противоположном направлении. Затем в этих полостях размещали контрольные и испытываемые матриксы.


Изобретение относится к области биотехнологии, а именно к изолированному имплантату, подходящему для хирургической имплантации субъекту-млекопитающему, и лечению субъекта, имеющего дефект ткани. Способ включает культивирование популяции сконструированных E40RF1+ эндотелиальных клеток в контакте с биосовместимым каркасным материалом, который имеет пористую структуру и содержит коллаген, фибрин, ламинин или децеллюляризированную ткань животного, in vitro до формирования кровеносных сосудов в биосовместимом каркасном материале, таким образом получая имплантат, содержащий E40RF1+ кровеносные сосуды. Полученный трансплантат содержит биосовместимый каркасный материал, который имеет пористую структуру и содержит коллаген, фибрин, ламинин или децеллюляризированную ткань животного, и кровеносные сосуды, расположенные в биосовместимом каркасном материале, причем кровеносные сосуды содержат E40RF1+сконструированные эндотелиальные клетки. Далее указанный трансплантат имплантируется нуждающемуся субъекту. Изобретение позволяет расширить арсенал технических средств. 3 н. и 87 з.п. ф-лы, 1 табл., 3 пр., 4 ил.
1. Изолированный имплантат, подходящий для хирургической имплантации субъекту-млекопитающему, содержащий: (а) биосовместимый каркасный материал, который имеет пористую структуру и содержит коллаген, фибрин, ламинин или децеллюляризированную ткань животного, и (b) кровеносные сосуды, расположенные в биосовместимом каркасном материале, причем кровеносные сосуды содержат E40RF1+ сконструированные эндотелиальные клетки.
2. Изолированный имплантат по п. 1, содержащий сеть соединенных кровеносных сосудов.
3. Изолированный имплантат по п. 1, причем кровеносные сосуды содержат капилляры.
4. Изолированный имплантат по п. 1, причем кровеносные сосуды имеют открытые просветы.
5. Изолированный имплантат по п. 1, причем один или несколько кровеносных сосудов выступают за границы биосовместимого каркасного материала.
6. Изолированный имплантат по п. 1, причем E40RF1+ сконструированные эндотелиальные клетки представляют собой E40RF1+ETV2+.
7. Изолированный имплантат по п. 1, причем сконструированные эндотелиальные клетки экспрессируют рекомбинантный транскрипционный фактор семейства ETS.
8. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки представляют собой эндотелиальные клетки млекопитающего.
9. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки представляют собой эндотелиальные клетки человека.
10. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток пупочной вены человека (HUVEC).
11. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки представляют собой орган-специфичные эндотелиальные клетки.
12. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток субъекта, которому будет проведена хирургическая имплантация имплантата.
13. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с тем же МНС- или HLA-типом, что и у субъекта, которому будет проведена хирургическая имплантация имплантата.
14. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с частичным соответствием по МНС- или HLA-типу с субъектом, которому будет проведена хирургическая имплантация имплантата.
15. Изолированный имплантат по п. 1, причем сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с отличиями по МНС- или HLA-типу относительно субъекта, которому будет проведена хирургическая имплантация имплантата.
16. Изолированный имплантат по п. 1, дополнительно содержащий стволовые клетки или клетки-предшественники, расположенные в биосовместимом каркасном материале.
17. Изолированный имплантат по п. 16, причем стволовые клетки или клетки-предшественники выбраны из группы, состоящей из гематопоэтических стволовых клеток, костных стволовых клеток, мышечных стволовых клеток, нервных стволовых клеток, эпителиальных стволовых клеток, стволовых клеток волосяного фолликула, кожных стволовых клеток, мезенхимальных стволовых клеток, стволовых клеток кишечника и сперматогониальных стволовых клеток.
18. Изолированный имплантат по п. 1, дополнительно содержащий клетки одного или нескольких дополнительных типов, расположенные в биосовместимом каркасном материале.
19. Изолированный имплантат по п. 18, причем клетки дополнительных типов выбраны из группы, состоящей из гематопоэтических клеток, костных клеток, мышечных клеток, нервных клеток, перицитов, клеток волосяных фолликул, жировых клеток, кератиноцитов, эпителиальных клеток, кожных клеток, фибробластов, клеток кишечника и тестикулярных клеток.
20. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал является твердым при 4°С.
21. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал является твердым при 21°С.
22. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит одну или несколько молекул внеклеточного матрикса.
23. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит коллаген.
24. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит фибрин.
25. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит ламинин.
26. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит децеллюляризированную ткань животного.
27. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал содержит децеллюляризированную свиную ткань.
28. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал не является матригелем.
29. Изолированный имплантат по п. 1, причем биосовместимый каркасный материал не содержит гиалуроновую кислоту.
30. Изолированный имплантат по п. 1, причем имплантат не содержит сыворотку.
31. Изолированный имплантат по п. 1, причем имплантат не содержит экзогенные факторы роста.
32. Изолированный имплантат по п. 1, причем имплантат не содержит экзогенные ангиогенные факторы.
33. Изолированный имплантат по п. 1, причем имплантат не содержит экзогенный VEGF.
34. Изолированный имплантат по п. 1, причем имплантат не содержит экзогенный FGF.
35. Изолированный имплантат по п. 1, причем имплантат не содержит фибробласты.
36. Изолированный имплантат по п. 1, причем имплантат не содержит ангиогенные факторы фибробластов.
37. Изолированный имплантат по п. 1, причем имплантат не содержит компоненты внеклеточного матрикса фибробластов.
38. Изолированный имплантат по п. 1, причем имплантат не содержит сферические микрочастицы носителя.
39. Изолированный имплантат по п. 1, причем имплантат не содержит сферические микрочастицы носителя, покрытые молекулой внеклеточного матрикса.
40. Способ получения имплантата, подходящего для хирургической имплантации субъекту - млекопитающему, причем способ предусматривает культивирование популяции сконструированных E40RF1+ эндотелиальных клеток в контакте с биосовместимым каркасным материалом, который имеет пористую структуру и содержит коллаген, фибрин, ламинин или децеллюляризированную ткань животного, in vitro до формирования кровеносных сосудов в биосовместимом каркасном материале, таким образом получая имплантат, содержащий E40RF1+ кровеносные сосуды.
41. Способ по п. 40, предусматривающий, что культивирование проводят до формирования сети соединенных кровеносных сосудов.
42. Способ по п. 40, предусматривающий, что культивирование проводят до тех пор, пока один или несколько кровеносных сосудов не будет выступать за границы биосовместимого каркасного материала.
43. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 24 часов.
44. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 48 часов.
45. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 3 дней.
46. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 4 дней.
47. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 5 дней.
48. Способ по п. 40, предусматривающий, что культивирование проводят в течение по меньшей мере 1 недели.
49. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки представляют собой E40RF1+ETV2+.
50. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки экспрессируют рекомбинантный транскрипционный фактор семейства ETS.
51. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки представляют собой орган-специфичные эндотелиальные клетки.
52. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки представляют собой эндотелиальные клетки млекопитающего.
53. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки представляют собой эндотелиальные клетки человека.
54. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток субъекта, которому будет проведена хирургическая имплантация имплантата.
55. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с тем же МНС- или HLA-типом, что и у субъекта, которому будет проведена хирургическая имплантация имплантата.
56. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с тем же МНС- или HLA-типом, что и у субъекта, которому будет проведена хирургическая имплантация имплантата.
57. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с частичным соответствием по МНС- или HLA-типу с субъектом, которому будет проведена хирургическая имплантация имплантата.
58. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток аллогенного донора с отличиями по МНС- или HLA-типу относительно субъекта, которому будет проведена хирургическая имплантация имплантата.
59. Способ по п. 40, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки получены от эндотелиальных клеток пупочной вены человека (HUVEC).
60. Способ по п. 40, предусматривающий, что кровеносные сосуды содержат капилляры.
61. Способ по п. 40, предусматривающий, что кровеносные сосуды имеют просветы.
62. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит расположенные в нем стволовые клетки или клетки-предшественники.
63. Способ по п. 62, предусматривающий, что стволовые клетки или клетки-предшественники выбраны из группы, состоящей из гематопоэтических стволовых клеток, костных стволовых клеток, мышечных стволовых клеток, нервных стволовых клеток, эпителиальных стволовых клеток, кожных стволовых клеток, стволовых клеток волосяного фолликула, мезенхимальных стволовых клеток, стволовых клеток кишечника и сперматогониальных стволовых клеток.
64. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит расположенные в нем клетки одного или нескольких дополнительных типов.
65. Способ по п. 64, предусматривающий, что клетки дополнительных типов выбраны из группы, состоящей из гематопоэтических клеток, костных клеток, мышечных клеток, нервных клеток, перицитов, клеток волосяных фолликул, жировых клеток, кератиноцитов, эпителиальных клеток, кожных клеток, фибробластов, клеток кишечника и тестикулярных клеток.
66. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал является твердым при 4°С.
67. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал является твердым при 21°С.
68. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал не является матригелем.
69. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал не содержит гиалуроновую кислоту.
70. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит одну или несколько молекул внеклеточного матрикса.
71. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит коллаген.
72. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит децеллюляризированную ткань животного.
73. Способ по п. 40, предусматривающий, что биосовместимый каркасный материал содержит децеллюляризированную свиную ткань.
74. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие сыворотки.
75. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие экзогенных факторов роста.
76. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие экзогенных ангиогенных факторов.
77. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие экзогенного VEGF.
78. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие экзогенного FGF.
79. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие фибробластов.
80. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие ангиогенных факторов фибробластов.
81. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие компонентов внеклеточного матрикса фибробластов.
82. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие сферических микрочастиц носителя.
83. Способ по п. 40, предусматривающий, что культивирование проводят в отсутствие сферических микрочастиц носителя, покрытых молекулой внеклеточного матрикса.
84. Способ лечения, нуждающегося в том субъекта-млекопитающего, причем способ предусматривает имплантацию субъекту- млекопитающему имплантата по любому из пп. 1-39, причем субъект имеет дефект ткани и причем имплантат имплантируют субъекту хирургическим путем в участок дефекта ткани.
85. Способ по п. 84, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки представляют собой орган-специфичные эндотелиальные клетки и что имплантат имплантируют хирургическим путем в орган, из которого получены орган-специфичные эндотелиальные клетки.
86. Способ по п. 84, предусматривающий, что субъектом является субъект-человек.
87. Способ по п. 84, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки в имплантате получены от собственных эндотелиальных клеток субъекта.
88. Способ по п. 84, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки в имплантате получены от эндотелиальных клеток аллогенного донора с тем же МНС- или HLA-типом, что и у субъекта.
89. Способ по п. 84, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки в имплантате получены от эндотелиальных клеток аллогенного донора с частичным соответствием по МНС- или HLA-типу с субъектом, которому будет проведена хирургическая имплантация имплантата.
90. Способ по п. 84, предусматривающий, что сконструированные E40RF1+ эндотелиальные клетки в имплантате получены от эндотелиальных клеток аллогенного донора с отличиями по МНС- или HLA-типу относительно субъекта, которому будет проведена хирургическая имплантация имплантата.
| SANDLER V.M., et al | |||
| "Reprogramming Human Endothelial to Hematopoietic Cells Requires Vascular Induction", Nature | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| US 20130224161 A1, 29.08.2013 | |||
| US 20100168872 A2, 01.07.2010 | |||
| САДОВОЙ М.А | |||
| и др | |||
| "Клеточные матрицы (скаффолды) для целей регенерации кости: современное состояние проблемы", | |||
Авторы
Даты
2021-02-25—Публикация
2015-12-18—Подача