Изобретение относится к медицине и может быть использовано в регенеративной медицине, онкологии, радиологии и дерматологии для повышения эффективности комплексной терапии у пациентов с местными лучевыми поражениями кожи и ее придатков, обеспечивающее благоприятные условия для заживления пораженной поверхности, повышения ранозаживляющей активности репаративных и иммунных процессов, восстановления трофики, ремоделирования фиброзной и соединительной ткани и достойного качества жизни пациентов и может быть использовано в лечебных учреждениях.
Актуальность предлагаемого способа определяется сложностью и длительностью лечения, большими финансовыми затратами на лечение, длительной потерей трудоспособности, необходимостью реабилитации и высокой инвалидизацией больных с местными лучевыми поражениями. На сегодняшний день самое большое использование искусственных источников ионизирующего излучения осуществляется в современной медицине. Они широко применяются в лучевой диагностики и терапии. Также трудно переоценить их вклад и при лечении онкологических заболеваний. В настоящее время около 50% всех больных со злокачественными заболеваниями получают ту или иную форму лучевой терапии, которая бесспорно является одним из важнейших, а зачастую и единственным, методом лечения. Но, несмотря на неоспоримые преимущества от использования источников ионизирующего излучения в медицине, наряду с повышением эффективности диагностических и лечебных процедур неизбежно возрастает вероятность повреждения здоровых тканей и органов.
Применение современных мер радиационной защиты не всегда позволяет избежать развития патологических процессов в здоровых тканях и органах. Чем в большей степени суммарная поглощенная доза излучения превышает толерантность облучаемых тканей, тем чаще наблюдается развитие местных лучевых поражений. Наиболее часто, от 20 до 40% от всех осложнений после использования источников ионизирующего излучения, развиваются местные лучевые (радиационные) поражения кожных покровов. При этом повреждаются не только кожа, но и подкожно-жировая клетчатка, мышцы, кости, сосудисто-нервные пучки и внутренние органы. Они могут возникать как в раннем постлучевом периоде - в течение первых 3-х месяцев после проведенного лечения, так и в более поздние сроки. Характер и степень поражения нормальных тканей зависят от индивидуальной радиочувствительности, возраста и сопутствующей патологии пациента, энергии излучения источника ионизирующего излучения (рентгеновское, -β, -γ, -тормозное излучение и быстрые электроны) и методики проведения процедуры. Ранние лучевые повреждения характеризуются развитием первичной эритемы (в первые несколько суток после облучения), сменяющейся после латентного периода сухим, влажным (буллезным) или язвенно-некротическим дерматитом в зависимости от поглощенной дозы облучения. Описанные патоморфологические изменения, прежде всего, обусловлены повреждением стволовых и прогенироторных клеток базального слоя эпидермиса и эпителия вокруг придатков кожи, функциональными нарушения кровообращения, и как следствие - снижением процессов репарации в окружающих тканях. Продолжительность восстановительного периода зависит от числа сохранившихся стволовых клеток, которые необходимы для заживления раневого процесса. Как правило, при проведении стандартных терапевтических мер для стимуляции регенеративных процессов, приводит к благоприятного исходу. Однако если в облученных тканях не осталось стволовых клеток, а замещения за счет окружающих тканей не происходит, то лучевые повреждения могут сохраняться в течение длительного времени. При достижении суммарной поглощенной дозы предельно толерантной для здоровых тканей, происходит увеличение частоты развития поздних лучевых осложнений. Они проявляются через 4-6 месяцев после облучения и в большинстве случаев их развитие никак не связано с наличием и тяжестью ранних осложнений. В основе патологического процесса преимущественно, наряду с гибелью стволовых клеток, лежит повреждение клеток эндотелия капилляров, что приводит к микроциркуляторным расстройства и гипоксии тканей. Это ведет к усугублению патологического фиброзированию тканей и нарушает их регенерацию, что в свою очередь ведет к дальнейшему разрушению сосудов микроциркуляторного русла.
Таким образом, происходит образование патологического круга, и течение раневого процесса при поздних местных лучевых поражениях характеризуется волнообразным течением с постепенным прогрессированием. Симптомы могут варьировать от легкой степени атрофии кожных покровов, до глубоких постоянно рецидивирующих язвенных изменений. В большинстве случаев наблюдаются трофические изменения кожи, усиление или уменьшение пигментации, регионарный лимфостаз, кератоз, атрофии кожных покровов или усиление процессов фиброзирования с образованием контрактур. Как правило, поздние лучевые осложнения не разрешаются самостоятельно, а лечение пациентов с повреждениями кожи представляет особую проблему для клиницистов. Это длительный и трудоемкий процесс, сочетающий в себе несколько методов лечения -хирургический и консервативный. На сегодняшний день не существует единого мнения и подхода по тактике ведения пациентов с местными лучевыми поражениями кожных покровов. В связи с особенностями патологического процесса (нарушение репарационных процессов и выраженное хроническое воспаление) большинство из имеющихся современных медикаментозных средств, направленных на усиление регенеративных процессов, не могут обеспечить быстрого и полного восстановления кожных покровов. Совершенствование системы оказания медицинской помощи, поиск новых, более эффективных средств для профилактики и лечения местных лучевых поражений является одной из актуальных медико-социальных проблем современной медицины.
Наиболее близким по технической сущности к предлагаемому способу является способ лечения местных лучевых поражений кожи с помощью аутотрансплантации жировой ткани, полученной в результате липосакции (Васильев, B.C. Роль аутотрансплантации жировой ткани в лечении лучевых повреждений мягких тканей. /B.C. Васильев, С.А. Васильев, И.А. Карпов, Н.В. Мигранова // Вестник ЮУрГУ. Серия «Образование, здравоохранение, физическая культура». - 2013. - том 13. - №2,. - с. 126-124). Однако использование свежевыделенного липоаспирата без проведения этапов специфических лабораторных этапов по его очистке от клеточных элементов крови и выделению стромально-васкулярной фракции, не обеспечивает должного восстановления регенеративного потенциала клеток дермы и необходимую васкуляризацию кожи.
Техническим результатом предлагаемого способа повышения эффективности комплексной терапии при местных лучевых поражениях является обеспечение благоприятных условий для заживления пораженной поверхности, повышения ранозаживляющей активности репаративных и иммунных процессов, восстановления трофики, ремоделирования фиброзной и соединительной ткани и достойного качества жизни пациентов.
Указанный технический результат достигается, тем, что у пациента проводят забор жировой ткани в нижней трети передней брюшной стенки шприцевой липосакцией, из полученного липоапирата путем ферментативной обработки, промывания и фильтрации выделяют стромально-васкулярную фракцию жировой ткани, состоящую из стромальных клеток (15-30%, из них: 3% составляют стволовые клетки и клетки-предшественники), эндотелиальных клеток (10-20%), гранулоцитов (10-15%), моноцитов (5-15%), лимфоцитов (10-15%), перицитов (3-5%), гемопоэтических стволовых клеток (<0,1%), осуществляют введение суспензии жизнеспособных клеток стромально-васкулярной фракции жировой ткани по всей поверхности пораженной области в полученном количестве в объеме 4,5 мл, в предлагаемом способе лечения пациентов с местными лучевыми поражениями.
Описание предлагаемого способа
У пациентов с местными лучевыми поражениями кожи в асептических условиях под местной анестезией производился забор жировой ткани путем аспирационной шприцевой липосакции в нижней трети передней брюшной стенки. Объем жировой ткани составлял 250 мл. В стерильных условиях проводилась ферментативная обработка, промывание и фильтрация полученного липоаспирата с последующим центрифугированием и получением стромально-васкулярной фракции жировой ткани. Осуществлялась оценка качества аутологичных регенеративных клеток (стромально-васкулярной фракции) жировой ткани: подсчет количества клеток с помощью автоматического счетчика клеток Counterss Invitrogen (Invitrogen), определение иммунологической принадлежности и жизнеспособности методом проточной цитофлюориметрии (BD FACS Canto II, USA). Для исследования фенотипа клеток стромально-васкулярной фракции жировой ткани использовались моноклональные антитела к следующим антигенным маркерам: CD146, CD31, CD45, CD34, CD105, CD90, CD73 (BD Bioscience, USA). Окрашивание проводили в соответствии с рекомендациями производителя. Стромально-васкулярная фракция жировой ткани состояла из стромальных клеток (15-30%, из них: 3% составляют стволовые клетки и клетки-предшественники - положительная экспрессия CD105, CD90, CD73), эндотелиальных клеток (10-20% - положительная экспрессия более CD31), клетки крови (5-15% - положительная экспрессия CD45), перицитов (3-5% - положительная экспрессия CD146), гемопоэтических стволовых клеток (<0,1% - положительная экспрессия CD34). После получения результатов лабораторной оценки проводили внутрикожное введение полученных жизнеспособных клеток стромально-васкулярной фракции жировой ткани по всей поверхности пораженной области. Объем вводимой клеточной суспензии, содержащей аутологичные регенеративные клетки жировой ткани, составлял 4,5 мл, среднее количество ЯСК - 64±4,7 млн. в мл. Забор жировой ткани, получение и введение стромально-васкулярной фракции жировой ткани проводили однократно.
Режим предлагаемого способа основан на анализе результатов клинических наблюдений за 7 больными с местными лучевыми поражениями кожных покровов.
Пример осуществления способа
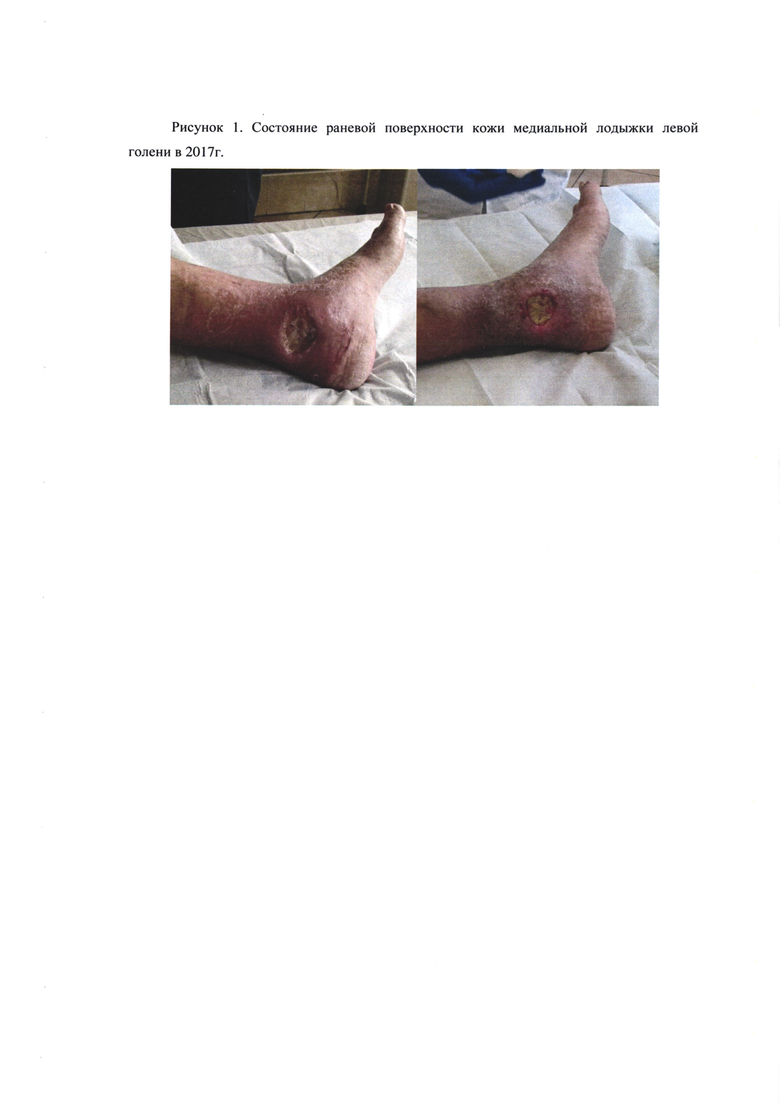
Пациент Л. 78 лет, болен с 2012 года когда был установлен диагноз базальноклеточного рака кожи медиальной лодыжки левой голени, по поводу которого проведено дистанционное лучевое лечение в суммарной дозе 60 Гр. В 2013 г. в области облучения была диагностирована поздняя лучевая язва медиальной лодыжки левой голени. Проводилась стандартная консервативная терапия - без эффекта. С 2014 г. был проведен ряд пластических операций направленных на закрытие раневого дефекта: иссечение поздней лучевой язвы и пластика раневого дефекта мышечно-фасциальным лоскутом на сосудистой ножке. В последующем с 2015 г. было проведено еще три последовательных различных пластик раневого дефекта в связи с не приживлением пересаженного лоскута и формированием лучевой язвы. В 2017 г. вновь был зарегистрирован рецидив поздней лучевой язвы в области пересаженного лоскута (Рисунок 1).
Учитывая патогенез развития поздних лучевых осложнений, было принято решение применить заявленный способ в комплексной терапии перед пластикой раневой поверхности.
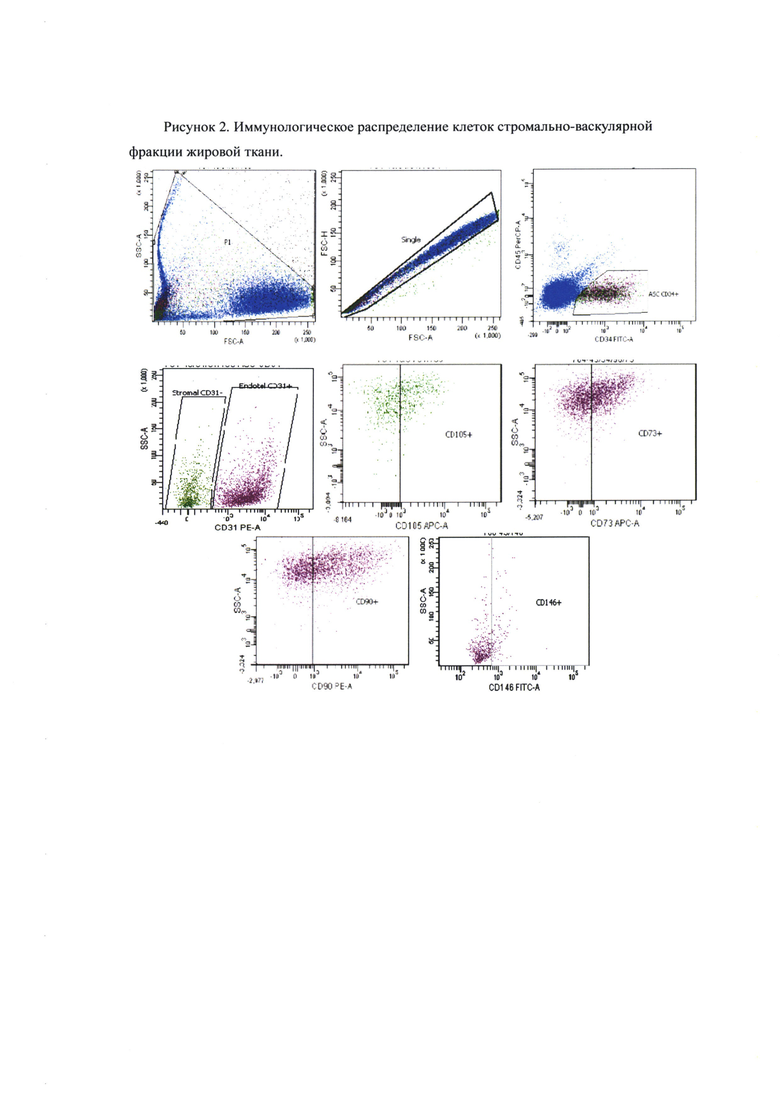
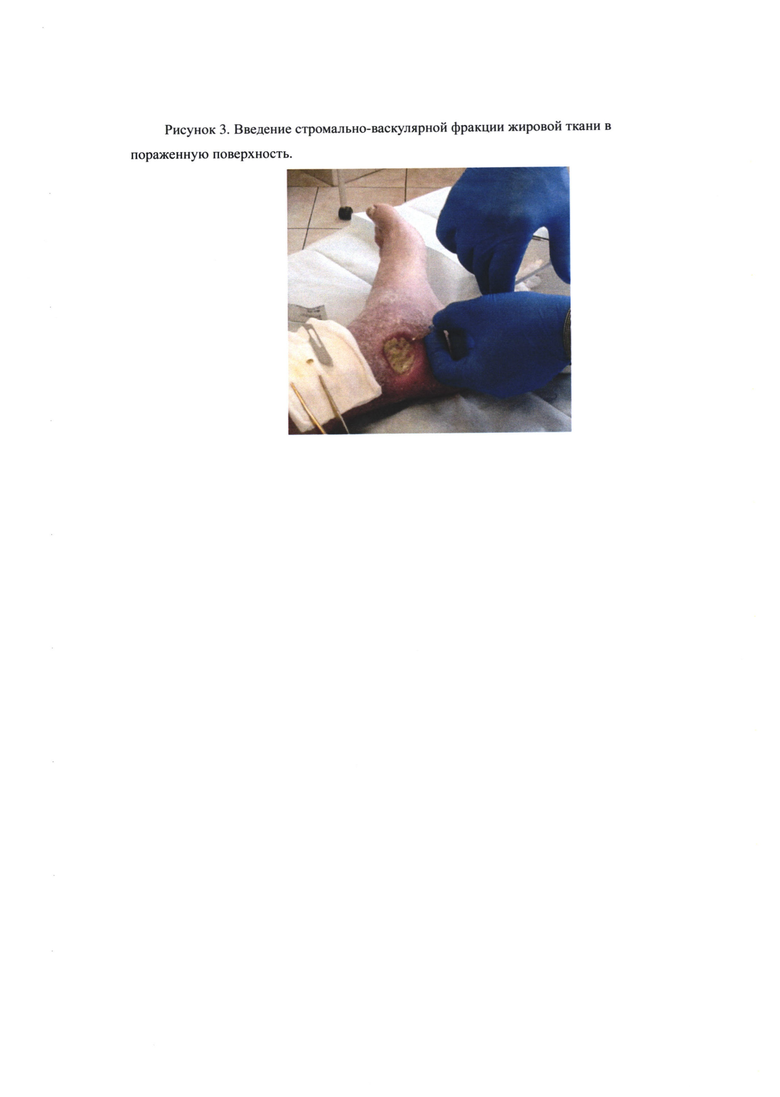
У пациента под местной анестезией в асептических условиях проведен забор жировой ткани из передней брюшной стенки живота. Липоаспират в объеме 250 мл был доставлен в лабораторию. В асептических условиях после отмывания липоаспирата от разрушенных адипоцитов, компонентов раствора и эритроцитов было получено 50 мл жировой ткани. Путем ферментативной обработки, промывания, фильтрации и последующим центрифугированием полученной жировой ткани получили 28,5 млн. клеток с жизнеспособностью 96,2%. Была подтверждена принадлежность полученных клеток к стромально-васкулярной фракции жировой ткани с помощью проточного иммуноцитофлюориметра. Стромально-васкулярная фракция жировой ткани состояла из стромальных клеток (15-30%, из них: 3% составляют стволовые клетки и клетки-предшественники - положительная экспрессия CD105, CD90, CD73), эндотелиальных клеток (10-20% - положительная экспрессия более CD31), клетки крови (5-15% - положительная экспрессия CD45), перицитов (3-5% - положительная экспрессия CD146), гемопоэтических стволовых клеток (<0,1% - положительная экспрессия CD34) (Рисунок 2). Клетки ресуспензировали в изотоническом растворе натрия хлорида в объеме 4,5 мл. Проводили внутрикожное введение жизнеспособных регенеративных клеток стромально-васкулярной фракции жировой ткани в пораженную область по всей поверхности. (Рисунок 3).
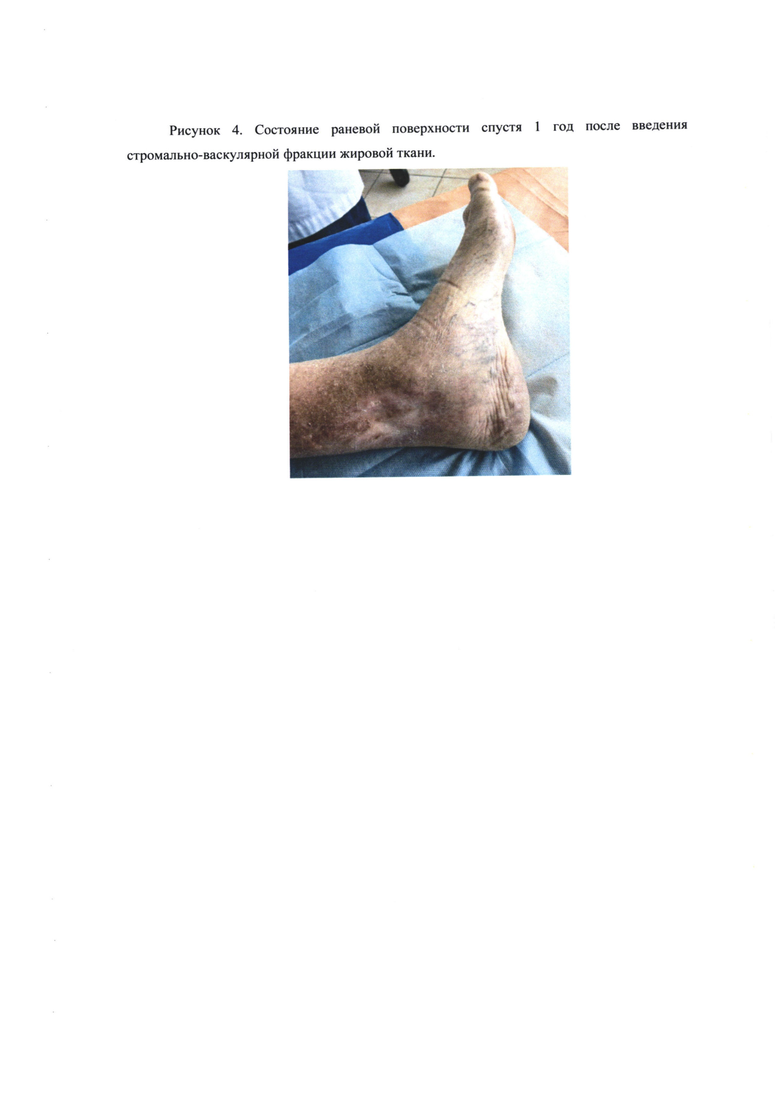
Через 6 месяцев и 12 месяцев наблюдения у пациента пересаженный лоскут был жизнеспособным, язвенных изменений не отмечалось (Рисунок 4).
Таким образом, данные клинические примеры продемонстрировали, что в предлагаемом способе лечения пациентов с глубокими термическими ожогами в комплексной терапии в результате лечения пациенту обеспечиваются благоприятные условия для заживления пораженной поверхности, повышения ранозаживляющей активности репаративных и иммунных процессов, восстановления трофики, ремоделирования фиброзной и соединительной ткани и достойного качества жизни пациентов.
Предложенный способ лечения был проведен на 7 пациентах с местными лучевыми поражениями. В результате лечения пациентам были созданы благоприятные условия для заживления пораженной поверхности, повышения ранозаживляющей активности репаративных и иммунных процессов, восстановления трофики, ремоделирования фиброзной и соединительной ткани и достойного качества жизни пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ СО СКЛЕРОАТРОФИЧЕСКИМ ЛИХЕНОМ ВУЛЬВЫ В КОНСЕРВАТИВНОЙ ТЕРАПИИ | 2018 |
|
RU2698089C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ГЛУБОКИМИ ТЕРМИЧЕСКИМИ ОЖОГАМИ В КОМПЛЕКСНОЙ ТЕРАПИИ | 2017 |
|
RU2668801C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУР МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА, ВЫДЕЛЕННЫХ ИЗ ЛИПОАСПИРАТА | 2007 |
|
RU2351649C1 |
| УСТРОЙСТВО ДЛЯ ВЫДЕЛЕНИЯ КЛЕТОЧНЫХ ФРАКЦИЙ ИЗ ТКАНЕЙ ЧЕЛОВЕКА И ЖИВОТНЫХ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2620304C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2011 |
|
RU2608641C2 |
| Способ лечения обморожений с использованием мезенхимальных стволовых клеток, выделенных из красного костного мозга | 2020 |
|
RU2748539C1 |
| МЕЗЕНХИМАЛЬНЫЕ СТРОМАЛЬНЫЕ КЛЕТКИ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА СЕПСИСА | 2015 |
|
RU2715866C2 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2006 |
|
RU2435846C2 |
| Способ лечения эректильной дисфункции | 2016 |
|
RU2622757C1 |
| ПРИМЕНЕНИЕ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ДЛЯ ЛЕЧЕНИЯ СВИЩЕЙ | 2016 |
|
RU2744977C2 |
Изобретение относится к области биотехнологии, а именно к лечению пациентов с местными лучевыми поражениями. Способ включает забор у пациента жировой ткани в нижней трети передней брюшной стенки шприцевой липосакцией. Из полученного липоапирата путем ферментативной обработки, промывания и фильтрации выделяют стромально-васкулярную фракцию жировой ткани, состоящую из стромальных клеток (15-30%, из них: 3% составляют стволовые клетки и клетки-предшественники, - положительная экспрессия CD105, CD90, CD73), эндотелиальных клеток (10-20% - положительная экспрессия более CD31), клеток крови (5-15% - положительная экспрессия CD45), перицитов (3-5% - положительная экспрессия CD146), гемопоэтических стволовых клеток (<0,1% - положительная экспрессия CD34). Затем осуществляют введение суспензии жизнеспособных клеток стромально-васкулярной фракции жировой ткани по всей поверхности пораженной области в полученном количестве в объеме 4,5 мл. Изобретение позволяет обеспечить благоприятные условия для заживления пораженной поверхности, повышения ранозаживляющей активности репаративных и иммунных процессов, восстановления трофики, ремоделирования фиброзной и соединительной ткани и достойного качества жизни пациентов. 1 пр., 4 ил.
Способ лечения пациентов с местными лучевыми поражениями, включающий использование клеток стромально-васкулярной фракции жировой ткани, отличающийся тем, что у пациента проводят забор жировой ткани в нижней трети передней брюшной стенки шприцевой липосакцией, из полученного липоапирата путем ферментативной обработки, промывания и фильтрации выделяют стромально-васкулярную фракцию жировой ткани, состоящую из стромальных клеток (15-30%, из них: 3% составляют стволовые клетки и клетки-предшественники, - положительная экспрессия CD105, CD90, CD73), эндотелиальных клеток (10-20% - положительная экспрессия более CD31), клеток крови (5-15% - положительная экспрессия CD45), перицитов (3-5% - положительная экспрессия CD146), гемопоэтических стволовых клеток (<0,1% - положительная экспрессия CD34), осуществляют введение суспензии жизнеспособных клеток стромально-васкулярной фракции жировой ткани по всей поверхности пораженной области в полученном количестве в объеме 4,5 мл.
| ВАСИЛЬЕВ В.С., и др | |||
| "Роль аутотрансплантации жировой ткани в лечении лучевых повреждений мягких тканей", Вестник ЮУрГУ | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| US 8545833 B1, 01.10.2013 | |||
| BOURIN P., et al | |||
| "Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: a joint statement of the | |||
Авторы
Даты
2021-03-11—Публикация
2019-11-08—Подача