ОБЛАСТЬ ТЕХНИКИ
[0001] Данное изобретение относится к области лечения заболеваний, связанных с С-реактивным белком.
УРОВЕНЬ ТЕХНИКИ
[0002] 1-метилникотинамид (1-МНА) представляет собой четвертичное соединение пиридиния. Он является метаболитом никотинамида. 1-МНА может существовать в формах различных фармацевтически приемлемых солей, например, 1-МНА хлорид.
[0003] С-реактивный белок (СРБ) - это белок плазмы, синтезируемый печенью, котрый является чувствительным и динамическим системным маркером воспаления. СРБ представляет собой кольцевидный пентамерный белок острой фазы, уровни которого повышаются в ответ на воспаление после секреции интерлейкина-6 макрофагами и Т- клетками. СРБ связывается с лизофосфатидилхолином, экспрессируемым на поверхности мертвых или умирающих клеток, и некоторыми типами бактерий, чтобы активировать систему комплемента с помощью комплекса C1Q. Thompson, D. et al. "The physiological structure of human C-reactive protein and its complex with phosphocholine" Structure 7 (2): 169-77 (1999). СРБ является представителем семейства белков пентраксинов. СРБ представляет собой рецептор распознавания паттерна (PRR - pattern recognition receptor) врожденной иммунной системы для выявления присутствия антигенов. Количество СРБ в крови или сыворотке крови можно определить с помощью анализов крови.
[0004] Уровни СРБ повышены при всех заболеваниях, которые характеризуются некоторой степенью воспаления. Уровень СРБ повышается в течение двух часов после начала воспаления и достигает пика через 48 часов. Его период полураспада составляет около 18 часов. Уровень СРБ зависит от скорости его продуцирования, которая коррелирует с интенсивностью вызывающего фактора. Повышенный уровень СРБ считается «маркером» воспалительных заболеваний. Снижение или падение уровня СРБ рассматривается как показатель уменьшения воспаления.
[0005] Концентрация СРБ в кровотоке может возрасти в 10000 раз при острых реакциях на серьезные инфекции или значительные повреждения тканей. Как правило, уровни СРБ в крови или сыворотке, превышающие 10 мг/л, указывают на наличие по меньшей мере одного текущего воспалительного заболевания. Различные исследования показывают, что хроническое внутреннее воспаление может привести ко многим серьезным, возрастным заболеваниям, включая болезни сердца, некоторые формы рака и нейродегенеративные состояния, такие как болезнь Альцгеймера и болезнь Паркинсона.
[0006] Выявление людей, которые подвержены риску развития сердечно-сосудистых заболеваний, но которые в настоящее время не имеют симптомов, имеет важное значение в первичной профилактике. Алгоритмы прогнозирования сердечно-сосудистого риска основаны на основных факторах риска, таких как артериальное давление, статус курения, гиперлипидемия или дислипидемия, а также наличие или отсутствие диабета. Дислипидемия - это заболевание с ненормальным количеством липидов в крови. Дислипидемия характеризуется повышенным уровнем триглицеридов в крови (ТГ), повышенным уровнем липопротеинов низкой плотности в крови (ЛПНП), повышенным уровнем общего холестерина в крови, низким уровнем липопротеинов высокой плотности в крови (ЛПВП), повышенным уровнем аполипопротеина B в крови (апо B), повышенным уровнем аполипопротеина А1 в крови (апо А1) или комбинацией вышеуказанного.
[0007] Эти основные традиционные факторы риска сердечно-сосудистых заболеваний и инсультов в значительной степени вытекают из Фрамингемского исследования сердца в начале 1960-х годов. Эти факторы риска и их взаимосвязь с возрастом и полом были положены в основу в 1980-х годах шкалы риска Фрамингема (Framingham Risk Score), которая использовалась для оценки риска сердечно-сосудистых заболеваний.
[0008] Оценка риска по Фрамингему имеет ограничения, поскольку она не всегда адекватно предсказывает риск сердечно-сосудистых заболеваний (например, ишемической болезни сердца (ИБС)). См. Risk factors for atherosclerosis, Highlights, XV International Symposium on Atherosclerosis, p. 2, (June 14-18, 2009). Например, люди страдают сердечно-сосудистыми заболеваниями, несмотря на то, что они классифицируются как имеющие низкий риск заболеваний согласно традиционным факторам (например, уровень липидов в крови, таких как ТГ и/или холестерин ЛПНП в пределах нормы). Сообщалось, что большинство сосудистых явлений происходит среди людей без признаков очень высокого уровня холестерина ЛПНП. Ridker P. M. et al., "Should C-Reactive Protein Be Added to Metabolic Syndrome and to Assessment of Global Cardiovascular Risk?" Circulation 109:2818-2825 (2004). И около 20% сердечно-сосудистых явлений происходят у людей, у которых традиционные факторы риска не были выявлены.
[0009] Сообщалось, что уровень СРБ в крови или сыворотке связан с риском сердечно-сосудистых заболеваний (например, ишемической болезни сердца, ишемического инсульта и смертности по причине сосудистого заболевания). Он использовался в качестве маркера независимо или вместе с традиционными факторами риска сердечно- сосудистых заболеваний, а также был целью для снижения риска сердечно-сосудистых заболеваний. См. The Emerging Risk Factors Collaboration "C-reactive Protein Concentration and Risk of Coronary Heart Disease, Stroke, and Mortality: An Individual Participant Meta- analysis," The Lancet 375:132-140 (2010); Musunuru K. et al., "The Use of High-sensitivity Assays for C-reactive Protein in Clinical Practice," Nature Clinical Practice 5(10):621-635 (2008). СРБ может быть более полезным и точным, чем традиционные факторы в прогнозировании рисков сердечно-сосудистых заболеваний, особенно в субпопуляции индивидов, где традиционные факторы могут быть неадекватными.
[0010] Например, исследование JUPITER (Обоснование Использования Статинов в Первичной Профилактике: Интервенционное Исследование по Оценке Розувастатина (Justification for the Use of Statins in Primary Prevention: an Intervention Trial Evaluating Rosuvastatin)) показало, что пациенты с уровнем СРБ > 2 мг/л, но без гиперлипидемии (например, уровень холестерина ЛПНП ниже 130 мг/дл) имеют преимущество при терапии статинами (например, уменьшение сердечно-сосудистых явлений). Ridker P.M. et al., "The JUPITER Trial Results, Controversies, and Implications for Prevention," Circ. Cardiovasc. Qual. Outcomes. 2:279-285 (2009). Исследование JUPITER также показало, что частота сердечно-сосудистых явлений была снижена с помощью терапии, снижающей СРБ у пациентов с уровнем СРБ <1,0 мг/мл. Эти результаты показывают, что СРБ может быть уменьшен независимо от холестерина ЛПНП и что СРБ является независимой терапевтической мишенью при профилактике и/или лечении сердечно-сосудистых заболеваний.
[0011] Повышенные уровни СРБ также наблюдаются при многих воспалительных заболеваниях, таких как ревматоидный артрит, рак толстой кишки, рак молочной железы, рак легких, рак печени, рак поджелудочной железы, инфекция, воспалительное заболевание кишечника, системная красная волчанка, пневмококковая пневмония, ревматизм, туберкулез, почечная недостаточность. и боковой амиотрофический склероз.
[0012] В US 2006104941 раскрыто применение агента, снижающего уровень липидов, включая никотиновую кислоту и статин для лечения человека без гиперхолестеринемии с уровнем СРБ в крови или сыворотке выше нормы для снижения риска сердечно- сосудистых расстройств. Однако использование никотиновой кислоты было ограничено из-за дозозависимых побочных эффектов, включая диспепсию, боль в животе, диарею и, в особенности, покраснение. Кроме того, никотиновая кислота противопоказана пациентам с заболеваниями печени и не должна использоваться для пациентов с нестабильной стенокардией или в острой фазе инфаркта миокарда.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0013] В одном аспекте в данном документе раскрыт способ лечения субъекта для предотвращения сердечно-сосудистого заболевания или для снижения или уменьшения риска сердечно-сосудистого заболевания, включающий введение субъекту терапевтически эффективного количества 1-МНА или его фармацевтически приемлемой соли, при этом субъект имеет уровень СРБ в крови или сыворотке менее 10 мг/л. Также раскрыто 1-МНА или его фармацевтически приемлемую соль для применения в способе профилактики сердечно-сосудистых заболеваний или снижения или уменьшения риска сердечно- сосудистых заболеваний у субъекта, при этом у субъекта уровень СРБ в крови или сыворотке составляет менее 10 мг/л. Также раскрыто применение 1-МНА или его фармацевтически приемлемой соли для приготовления лекарственного средства для профилактики сердечно-сосудистых заболеваний или снижения риска сердечно- сосудистых заболеваний у субъекта, при этом у субъекта уровень СРБ в крови или сыворотке составляет менее 10 мг/л. В некоторых аспектах субъект имеет уровень СРБ в крови или сыворотке менее 3 мг/л или менее 1 мг/л. В некоторых аспектах сердечно- сосудистое заболевание выбрано из группы, состоящей из ишемической болезни сердца (ИБС), заболевания периферических артерий, заболевания сонной артерии, застойной сердечной недостаточности, инсульта, инфаркта миокарда, стенокардии и их комбинации. В одном аспекте введение 1-МНА или его фармацевтически приемлемой соли снижает или уменьшает уровень СРБ у субъекта. В некоторых аспектах способ дополнительно включает введение одного или нескольких дополнительных активных агентов вместе с 1- МНА или его фармацевтически приемлемой солью.
[0014] В другом аспекте в данном документе раскрыт способ лечения заболевания, связанного с повышенными или нежелательными уровнями СРБ в крови или сыворотке у субъекта, для снижения уровней СРБ у субъекта или для предотвращения заболевания, связанного с повышением уровней СРБ у субъекта, способ включает введение субъекту терапевтически эффективного количества 1-МНА или его фармацевтически приемлемой соли. Также раскрыт 1-МНА или его фармацевтически приемлемая соль для применения в способе лечения заболевания, связанного с повышенными или нежелательными уровнями СРБ в крови или сыворотке у субъекта для снижения уровней СРБ у субъекта или для предотвращения заболевания, связанного с повышением уровня СРБ у субъекта. Также раскрыто применение 1-МНА или его фармацевтически приемлемой соли для приготовления лекарственного средства для лечения заболевания, связанного с повышенными или нежелательными уровнями уровней СРБ в крови или сыворотке у субъекта для снижения уровней СРБ у субъекта или для предотвращения заболевания, связанного с повышением уровня СРБ у субъекта. В некоторых аспектах заболевание включает ревматоидный артрит, рак толстой кишки, рак молочной железы, рак легких, рак печени, рак поджелудочной железы, инфекцию, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, туберкулез, почечную недостаточность, амиотрофический боковой склероз или их комбинацию. В некоторых вариантах реализации изобретения субъект, особенно перед введением, имеет уровень СРБ в крови или сыворотке 10 мг/л или выше. В некоторых вариантах реализации изобретения лечение снижает или понижает уровень СРБ субъекта.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0015] Для облегчения понимания изобретения, раскрытого в данном документе, ряд терминов и фраз определены ниже.
Определения
[0016] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистами в области техники, к которой относится данное раскрытие. Например, Краткий словарь по биомедицине и молекулярной биологии (Concise Dictionary of Biomedicine and Molecular Biology), Juo, Pei-Show, 2-е изд., 2002, CRC Press; Словарь клеточной и молекулярной биологии (Dictionary of Cell and Molecular Biology), 3-е изд., 1999, Academic Press; и Оксфордский словарь биохимии и молекулярной биологии (Oxford Dictionary Of Biochemistry And Molecular Biology), пересмотренный, 2000, Oxford University Press, предоставляют специалисту общий словарь многих терминов, использованных в данном раскрытии.
[0017] В данном описании и прилагаемой формуле изобретения формы единственного числа существительного включают формы множественного числа, если из контекста не следует иначе. Термины, подразумевающие использование исчисляемого существительного единственного числа, а также термины «один или более» и «по меньшей мере один» могут использоваться в данном документе взаимозаменяемо.
[0018] Кроме того, «и/или» при использовании в контексте данного документа следует понимать как конкретное раскрытие каждого из двух указанных признаков или компонентов с другим или без него. Таким образом, термин «и/или», используемый в фразе, такой как «A и/или B», предназначен для включения в него «A и B», «A или B», «A» (отдельно) и «B» (отдельно). Аналогичным образом, термин «и/или», используемый в фразе, такой как «A, B и/или C», предназначен для охвата каждого из следующих аспектов: А, В и С; А, В или С; А или С; А или В; B или C; А и С; А и B; B и C; A (отдельно); B (отдельно); и С (отдельно).
[0019] Числовые диапазоны включают числа, определяющие диапазон. Когда диапазон значений указан, следует понимать, что каждое промежуточное целочисленное значение и каждая его доля между перечисленными верхним и нижним пределами этого диапазона также конкретно раскрыты вместе с каждым поддиапазоном между такими значениями. Верхний и нижний пределы любого диапазона могут быть независимо включены в диапазон или исключены из него, и каждый диапазон, в который включены любое, либо оба, либо ни одно из предельных значений, также входит в объем изобретения. Когда значение явно указано, следует понимать, что значения, которые приблизительно равны количеству или величине, что и указанное значение, также входят в объем изобретения. При раскрытии комбинации каждая субкомбинация элементов этой комбинации также специально раскрыта и входит в объем изобретения. И наоборот, когда разные элементы или группы элементов раскрыты индивидуально, их комбинации также раскрыты. Когда любой элемент изобретения раскрывается как имеющий множество альтернатив, также раскрываются примеры данного изобретения, в которых каждая альтернатива исключается отдельно или в любой комбинации с другими альтернативами; более чем один элемент изобретения может иметь такие исключения, и все комбинации элементов, имеющие такие исключения, раскрываются.
[0020] Используемый в контексте данного документа термин «около» относится к тому, что понимаемое число не ограничивается точным числом, указанным в данном документе, и предназначен для обозначения диапазонов, по существу, в указанном диапазоне, не выходя за рамки объема изобретения. Используемый в контексте данного документа термин «около» будет понятен специалистам в данной области техники для учета предела погрешности или ошибок измерения, например, в диапазоне до плюс или минус 10% от конкретного термина.
[0021] Используемый в контексте данного документа термин «C-реактивный белок» или «СРБ» относится к кольцевому (кольцеобразному) пентамерному белку, обнаруженному в крови или сыворотке, уровни которого повышаются в ответ на воспаление. СРБ представляет собой белок острой фазы, синтезируемый печенью, уровни которого увеличиваются после секреции интерлейкина-6 макрофагами и/или Т-клетками. Pepys M.B. and Hirschfield G.M. "C-reactive protein: a critical update" The Journal of Clinical Investigation 111(12): 1805-12 (2003).
[0022] У людей ген, кодирующий СРБ, находится на первой хромосоме (1q21-q23). СРБ человека имеет 224 аминокислоты и молекулярную массу мономера 25,106 Да. СРБ человека имеет регистрационный номер GenBank CAA39671. Уровень СРБ в крови или сыворотке менее 10 мг/л указывает на отсутствие воспаления, в то время как уровень СРБ в крови или сыворотке 10 мг/л или выше указывает на наличие воспаления. См. Thomas, L. Labor und Diagnose p. 1010, TH-Books, Frankfurt (2008).
[0023] Используемые в контексте данного документа термины «лечить», «лечение», «проводить лечение», «лечение» чего либо или «лечить» кого либо относятся к (i) снижению вероятности заболевания или расстройства (например, сердечно-сосудистого заболевания, такого как ИБС, или другие заболевания, раскрытые в данном документе), (ii) уменьшению частоты возникновения заболевания или расстройства, (iii) уменьшению тяжести заболевания или расстройства, предпочтительно, до такой степени, что субъект меньше страдает или больше не испытывает дискомфорта и/или измененной из-за этого функции (iv) уменьшению признака или маркера заболевания или расстройства, такому как снижение уровня СРБ в крови или сыворотке, или (v) их комбинации.
[0024] Например, лечение может относиться к способности терапии при введении субъекту предотвращать возникновение заболевания или расстройства и/или излечивать или ослаблять симптомы, признаки или причины заболевания или расстройства. Лечение также относится к снижению интенсивности или уменьшению по меньшей мере одного клинического симптома и/или ингибированию или задержке прогрессирования состояния и/или предотвращению или отсрочке начала заболевания или расстройства. Таким образом, термины «лечить», «лечение» или «лечение» чего либо (или грамматически эквивалентные термины) относятся как к профилактическим, так и к терапевтическим режимам лечения.
[0025] Фраза «снижение или уменьшение риска сердечно-сосудистых заболеваний» относится к (i) профилактике сердечно-сосудистых заболеваний или расстройств (например, ИБС), уменьшению потенциала или возможности сердечно-сосудистых заболеваний или расстройств, (ii) уменьшению возникновения сердечно-сосудистых заболеваний или расстройств или (iii) снижению показателя или маркера сердечно- сосудистого риска, такому как снижение уровня СРБ в крови или сыворотке.
[0026] Используемая в контексте данного документа фраза «заболевания, связанные с С- реактивным белком» относится к заболеваниям, при которых может быть установлена зависимость или связь, или корреляция с уровнями СРБ в крови или сыворотке. Фраза включает заболевания, связанные с уровнем СРБ в крови или сыворотке менее 10 мг/л, а также заболевания, связанные с уровнем в крови или сыворотке 10 мг/л или выше. Например, фраза включает риск сердечно-сосудистых заболеваний (например, ИБС), таких заболеваний, как ревматоидный артрит, рак толстой кишки, рак молочной железы, рак легких, рак печени, рак поджелудочной железы, инфекция, воспалительное заболевание кишечника, системная красная волчанка, пневмококковая пневмония, ревматическая лихорадка, туберкулез, почечная недостаточность, амиотрофический боковой склероз или их комбинацию.
[0027] Термины «субъект», «индивидуум» или «пациент» в контексте данного документа относятся к любому субъекту, в частности субъекту-млекопитающему, для которого желательной является диагностика, прогноз, профилактика или терапия заболевания или расстройства (например, сердечно-сосудистого заболевания, такого как ИБС или другие заболевания, описанные в данном документе). Используемые в контексте данного документа термины «субъект», «индивидуум» или «пациент» включают человека или любое животное, не являющееся человеком. Термин «животное, не являющееся человеком» включает всех позвоночных животных, например млекопитающих и не млекопитающих, таких как мыши, приматы, не являющиеся человеком, овцы, собаки, кошки, лошади, коровы, медведи, цыплята, земноводные, рептилии и т.д. В предпочтительных вариантах реализации изобретения субъект представляет собой человека.
[0028] Используемый в контексте данного документа термин «уровень СРБ в крови» относится к уровню СРБ в крови, плазме или сыворотке, если иное не следует из контекста. Термины «уровень СРБ в крови», «уровень СРБ в плазме» и «уровень СРБ в сыворотке» используются в данном документе взаимозаменяемо, если иное не следует из контекста.
[0029] Используемый в контексте данного документа термин «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективному для «лечения» заболевания или расстройства у субъекта или уменьшения риска, потенциала, возможности или возникновения заболевания или расстройства (например, сердечно-сосудистого заболевания такого как ИБС или другое заболевание, раскрытое в данном документе). «Терапевтически эффективное количество» включает количество лекарственного средства или терапевтического агента, которое приводит к некоторому улучшению или обеспечивает пользу субъекту, имеющему или подверженному риску заболевания или расстройства (например, сердечно-сосудистого заболевания, такого как ИБС или другое заболевание, раскрытое в данном документе). Таким образом, «терапевтически эффективное» количество представляет собой количество, которое уменьшает риск, потенциал, возможность или возникновение заболевания или расстройства или обеспечивает некоторое снижение, смягчение и/или уменьшение по меньшей мере одного показателя (например, уровня СРБ в крови или сыворотке) и/или смягчение по меньшей мере одного клинического симптома заболевания или расстройства (например, сердечно-сосудистого заболевания, такого как ИБС, или другого заболевания, раскрытого в данном документе).
[0030] Используемый в контексте данного документа термин «введение» или «применение» лекарственного средства или терапевтического средства включает доставку, применение или предоставление терапии или лекарственного средства субъекту, включая самостоятельное введение субъектом.
[0031] Используемый в контексте данного документа термин «1-метилникотинамид», также известный как 1-МНА, представляет собой четвертичное соединение пиридиния, катион которого имеет структурную формулу
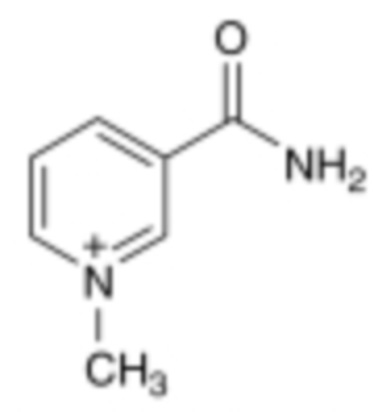 .
.
[0032] Термин «фармацевтически приемлемая соль» относится к кислотной или основной соли основного соединения, которая, как правило, безопасна, нетоксична, не является биологически или иным образом нежелательной, и полезна для ветеринарного применения и/или для фармацевтического применения для человека. Раскрытие в данном документе раскрывает 1-МНА, который способен образовывать широкий спектр солей с анионами различных неорганических и органических кислот. Под «фармацевтически приемлемой солью 1-МНА» понимается соединение формулы 1-МНАX-, где X- представляет собой фармацевтически приемлемый анион.
Способы снижения или уменьшения риска сердечно-сосудистых заболеваний у пациентов с уровнем СРБ крови или сыворотки 10 мг/л или менее
[0033] Раскрытие в данном документе основано на открытии, что 1-МНА или его фармацевтически приемлемая соль снижает уровни СРБ в крови или сыворотке у субъекта (например, человека). Преимущественно, введение 1-МНА или его фармацевтически приемлемой соли не имеет многих побочных эффектов, которые имеют никотиновые кислоты (например, покраснение, гепатотоксичность, подагра). В одном варианте реализации изобретения раскрытие в данном документе предлагает способ предотвращения сердечно-сосудистых заболеваний или снижения или уменьшения риска сердечно-сосудистых заболеваний у субъекта, у которого уровень СРБ в крови или сыворотке менее 10 мг/л, причем способ включает введение субъекту терапевтически эффективного количества 1-МНА или его фармацевтически приемлемой соли. В одном варианте реализации изобретения сердечно-сосудистое заболевание включает ИБС, заболевание периферических артерий, заболевание сонной артерии, застойную сердечную недостаточность, инсульт, инфаркт миокарда, стенокардию или их комбинацию. В некоторых вариантах реализации изобретения способ снижает риск развития ИБС. В других вариантах реализации изобретения способ снижает риск инсульта, инфаркта миокарда или их комбинации у субъекта. В некоторых вариантах реализации изобретения субъект представляет собой человека. Снижение или уменьшение уровня СРБ в крови или сыворотке снижает риск сердечно-сосудистых заболеваний.
[0034] Не намереваясь быть связанными какой-либо теорией, предполагается, что СРБ может играть роль в патогенезе сердечно-сосудистых заболеваний посредством прямого провоспалительного эффекта и может инициировать атеросклероз с помощью различных механизмов. Повышенные уровни СРБ в крови или сыворотке крови указывают на воспаление, которое может играть роль в патогенезе сердечно-сосудистых заболеваний, таких как острые атеротромботические явления и атеросклероз. СРБ может присутствовать в клетках сосудов без каких-либо клинических признаков атеросклеротического сужения сосуда, таких как коронарные сосуды, при определении, например, с помощью ангиографии или ультразвукового исследования. У индивидов с низким уровнем СРБ (например, СРБ < 1,0 мг/л) атеросклероз может развиться с меньшей скоростью, чем у людей с более высоким уровнем СРБ (например, СРБ > 3,0 мг/л).
[0035] При оценке сердечно-сосудистых рисков важен уровень СРБ в крови или сыворотке от нуля до 3,0 мг/л и до около 10,0 мг/л. Уровень СРБ менее 1,0 мг/л рассматривается как низкий риск сердечно-сосудистых заболеваний; уровень СРБ от 1,0 м/л до менее 3,0 мг/л рассматривается как средний риск сердечно-сосудистых заболеваний; и уровень СРБ от 3,0 мг/л до менее 10,0 мг/л рассматривается как высокий риск сердечно-сосудистых заболеваний.
[0036] В некоторых вариантах реализации изобретения субъект имеет уровень СРБ менее 1,0 мг/л. В некоторых вариантах реализации изобретения субъект имеет уровень СРБ менее 0,5 мг/л. В некоторых вариантах реализации изобретения субъект имеет уровень СРБ от 0,5 мг/л до менее 1,0 мг/л.
[0037] В некоторых вариантах реализации изобретения субъект имеет уровень СРБ от 1,0 мг/л до менее чем 10,0 мг/л. В некоторых вариантах реализации изобретения субъект имеет уровень СРБ от 1,0 мг/л до менее 3,0 мг/л, от 1,0 мг/л до 2,0 мг/л, от 1,0 мг/л до 2,7 мг/л или от 2,0 до менее 3,0 мг/л. В некоторых вариантах реализации изобретения субъект имеет уровень СРБ от 3,0 мг/л до 5,0 мг/л, от 3,0 мг/л до 7,0 мг/л или от 3,0 мг/л до менее чем 10,0 мг/л.
[0038] В некоторых вариантах реализации изобретения субъект представляет собой субъект (например, человека), не имеющий дислипидемии. Существуют общие рекомендации по показателям дислипидемии, то есть уровням холестерина ЛПВП в крови, холестерина ЛПНП, ТГ, апо А1, апо В и общего холестерина у людей. Например, исследуемый уровень холестерина ЛПНП составляет менее 130 мг/дл (3,35 ммоль/л) или менее 160 мг/дл (4,15 ммоль/л). Исследуемый уровень холестерина ЛПВП составляет 60 мг/дл или выше, исследуемый уровень ТГ составляет 150 мг/дл или менее, а исследуемый уровень общего холестерина составляет 200 мг/дл (5,15 ммоль/л) или менее. Исследуемый уровень апо В составляет < 80 мг/дл. См., например, Руководство Американской ассоциации клинических эндокринологов по лечению дислипидемии и профилактике атеросклероза (Руководство AACE) (American Association of Clinical Endocrinologists' Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis (AACE Guidelines)), доступное по адресу https://www.aace.com/files/lipid-guidelines.pdf. Уровни ТГ в крови, холестерина ЛПНП, холестерина ЛПВП, апо B и апо A1 можно определять способами, хорошо известными в данной области техники. Уровень общего холестерина в крови можно рассчитать способами, известными в данной области техники, например, используя следующее уравнение: холестерин ЛПВП + холестерин ЛПНП + 20 процентов от уровня ТГ.
[0039] В некоторых вариантах реализации изобретения субъект (например, человек), подвергаемый лечению, представляет собой субъект, не страдающим дислипидемией, например, имеет нормальный уровень общего холестерина в крови (например, ≤200 мг/дл), нормальный уровень холестерина ЛПНП (например, ≤ 130 мг/дл), нормальный уровень ТГ (например, ≤ 150 мг/дл) или нормальный уровень холестерина ЛПВП (например, ≥ 60 мг/дл) или их комбинацию.
[0040] В некоторых вариантах реализации изобретения способ снижает или понижает уровень СРБ в крови или сыворотке у субъекта по сравнению с уровнем до лечения. В некоторых вариантах реализации изобретения лечение не вызывает покраснения у субъекта. В некоторых вариантах реализации изобретения субъект представляет собой человека.
[0041] В некоторых вариантах реализации изобретения субъекту вводят фармацевтически приемлемую соль 1-МНА. Неограничивающие фармацевтически приемлемые соли 1- МНА включают сульфат, хлорид, бромид, йодид, нитрат, бисульфат, фосфат, кислый фосфат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, соли аминокислот, соли моно-, ди- и трикарбоновых кислот, например, ацетат, бензоат, салицилат, гидроксиацетат, лактат, малеат, малонат, малат, тартрат, битартрат, изоникотинат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формат, бензоат, глутамат, памоат (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)), оксалат и цитрат. В некоторых вариантах реализации изобретения фармацевтически приемлемая соль включает хлоридную, бензоатную, салицилатную, ацетатную, цитратную и лактатную соли 1-МНА. В некоторых вариантах реализации изобретения соль 1-МНА представляет собой хлорид 1- МНА, также известный как коммерчески доступный хлорид 1-МНА TRIA-662. (например, Sigma, Cayman Chemical).
[0042] Фармацевтически приемлемые соли 1-МНА могут быть получены из никотинамида способами, известными специалистам в данной области техники. Соли с анионом галогена могут быть получены из никотинамида прямым метилированием метилгалогенидом, как известно в данной области техники, например, как описано в AT131118, GB348345, US3614408, и US4115390. Соли с не галогеновым анионом могут быть получены заменой галогенового аниона на другой анион, например, с помощью обработки солью другого аниона, такой как, например, натриевая или серебряная соль другого аниона. В качестве иллюстрации, лактат и ацетат могут быть получены обработкой галогенида, предпочтительно хлорида, лактатом или ацетатом серебра соответственно. Салицилат может быть получен с помощью обработки галогенида, предпочтительно хлорида, салицилатом натрия.
Методы лечения заболеваний у субъекта с уровнем СРБ в крови или сыворотке выше 10 мг/л
[0043] В одном аспекте в данном раскрытии предложен способ лечения заболевания, связанного с повышенными или нежелательными уровнями СРБ в крови или сыворотке (например, уровень СРБ выше 10 мг/л) у субъекта, для снижения уровней СРБ у субъекта или для предотвращения заболевания, связанного с повышением уровня СРБ у субъекта. Способ включает введение субъекту терапевтически эффективного количества 1-МНА или его фармацевтически приемлемой соли. Например, уровни СРБ, превышающие 100,0 мг/л, связаны с серьезной травмой и тяжелой инфекцией (сепсис). Уровни СРБ между 10,0 и 40,0 мг/л связаны с легким воспалением и вирусными инфекциями. Уровни СРБ между 40,0 и 200,0 мг/л связаны с активным воспалением и бактериальной инфекцией.
[0044] В некоторых вариантах реализации изобретения заболевание включает ревматоидный артрит, рак толстой кишки, рак молочной железы, рак легких, рак печени, рак поджелудочной железы, инфекцию, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, туберкулез, почечную недостаточность, амиотрофический боковой склероз или их комбинацию. В некоторых вариантах реализации изобретения заболевание представляет собой ревматоидный артрит, инфекцию, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, туберкулез, почечную недостаточность, боковой амиотрофический склероз или их комбинацию. В некоторых вариантах реализации изобретения заболевание представляет собой ревматоидный артрит, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, почечную недостаточность или их комбинацию. В некоторых вариантах реализации изобретения заболевание представляет собой ревматоидный артрит, воспалительное заболевание кишечника, системную красную волчанку или их комбинацию. В некоторых вариантах реализации изобретения заболевание представляет собой ревматоидный артрит, воспалительное заболевание кишечника, боковой амиотрофический склероз или их комбинацию. В некоторых вариантах реализации изобретения заболевание представляет собой ревматоидный артрит. В некоторых вариантах реализации изобретения заболевание представляет собой боковой амиотрофический склероз.
[0045] В некоторых вариантах реализации изобретения субъект имеет уровень СРБ в крови или сыворотке от 10 мг/л до около 100 мг/л, от 10 до 90 мг/л, от 10 мг/л до 80 мг/л, от 10 мг/л до 70 мг/л, от 10 мг/л до 60 мг/л, от 10 мг/л до 50 мг/л, от 10 мг/л до 40 мг/л, от 10 мг/л до 30 мг/л, от 10 мг/л до 20 мг/л, от 20 мг/л до 100 мг/л, от 20 мг/л до 80 мг/л, от 20 мг/л до 60 мг/л, от 20 мг/л до 40 мг/л, от 30 мг/л до 100 мг/л, от 20 мг/л до 80 мг/л, от 30 мг/л до 60 мг/л, от 30 мг/л до 40 мг/л, от 40 мг/л до 100 мг/л, от 40 мг/л до 80 мг/л, от 40 мг/л до 60 мг/л, от 50 мг/л до 100 мг/л, от 50 мг/л до 80 мг/л, от 50 мг/л до 60 мг/л, от 60 мг/л до 100 мг/л, от 60 мг/л до 80 мг/л, от 70 мг/л до 100 мг/л, от 70 мг/л до 80 мг/л, от 80 мг/л до 100 мг/л, от 80 мг/л до 60 мг/л или от 90 мг/л до 100 мг/л.
[0046] В некоторых вариантах реализации изобретения лечение снижает или уменьшает уровень СРБ в крови или сыворотке у субъекта по сравнению с уровнем до лечения. В некоторых вариантах реализации изобретения лечение не вызывает покраснения у субъекта. В некоторых вариантах реализации изобретения субъект представляет собой человека.
Доза 1-МНА или его фармацевтически приемлемой соли и способ введения
[0047] В раскрытых в данном документе способах терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли включает количество, эффективное для снижения уровня СРБ в крови или сыворотке субъекта по сравнению с таковым до лечения. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли для предотвращения сердечно-сосудистых заболеваний или снижения или уменьшения риска сердечно-сосудистых заболеваний включает количество, эффективное для снижения или уменьшения уровня СРБ в крови или сыворотке субъекта по сравнению с таковым до лечения. Терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли для проведения лечения может зависеть от факторов, включая уровень СРБ в крови или сыворотке у субъекта до лечения, уровень липидов в крови (например, холестерина ЛПНП, ТГ, холестерина ЛПВП или общий уровень холестерина) у субъекта, наличие или отсутствие других состояний (например, наличие или отсутствие диабета), возраст и пол субъекта и может быть скорректировано специалистом в данной области техники (например, врачом).
[0048] В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли для лечения заболеваний, связанных с повышенным или увеличенным уровнем СРБ в крови или сыворотке (например, уровень СРБ более 10 мг/л), включает количество, эффективное для снижения уровня СРБ в крови или сыворотке по сравнению с уровнем до лечения. Такие заболевания включают ревматоидный артрит, некоторые онкологические заболевания, инфекцию, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, туберкулез, почечную недостаточность, боковой амиотрофический склероз или их комбинацию. Терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли для проведения лечения может зависеть от факторов, включая тип заболевания, степень состояния (например, тяжесть заболевания), возраст субъекта и наличие у субъекта двух или более заболеваний или состояний (например, ревматоидный артрит и инфекция) и может быть скорректировано специалистом в данной области техники (например, врачом).
[0049] В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли составляет от 1000 мг до около 8000 мг, от около 1000 мг до около 7000 мг, от около 1000 мг до около 6000 мг, от около 1000 мг до около 5000 мг, от около 1000 мг до около 4000 мг, от около 1000 мг до около 3000 мг, от около 1000 мг до около 2000 мг, от около 2000 мг до около 8000 мг, от около 2000 мг до около 7000 мг, от около 2000 мг до около 6000 мг, от около 2000 мг до около 5000 мг, от около 2000 мг до около 4000 мг, от около 2000 мг до около 3000 мг, от около 3000 мг до около 8000 мг, от около 3000 мг до около 7000 мг, от около 3000 мг до около 6000 мг, от около 3000 мг до около 5000 мг, от около 3000 мг до около 4000 мг, от около 4000 мг до около 8000 мг, от около 4000 мг до около 7000 мг, от около 4000 мг до около 6000 мг, от около 4000 мг до около 5000 мг, от около 5000 мг до около 8000 мг, от около 5000 мг до около 7000 мг, от около 5000 мг до около 6000 мг, от около 6000 мг до около 8000 мг, от около 6000 мг до около 7000 мг, от около или 7000 мг до около 8000 мг в день.
[0050] В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли составляет около 1000 мг, около 2000 мг, около 3000 мг, около 4000, около 5000 мг, около 6000 мг, около 7000 мг или около 8000 мг в день. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли составляет около 1000 мг, около 3000 мг или около 6000 мг в день.
[0051] В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят один раз в день, два раза в день или три раза в день. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят более трех раз в день. Терапевтически эффективное количество может быть введено в одной дозе или разделено на несколько доз, при условии, что доза является достаточно высокой, чтобы субъект получал пользу от дозы или лечения.
[0052] Терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли может вводиться субъектом или кем-либо, кроме субъекта, системно (например, перорально, через слизистую оболочку или посредством инъекции) или локально (например, местно или с помощью суппозитория) с помощью различных путей введения, известных в данной области техники. Неограничивающие примеры путей введения включают пероральный, местный (например, трансдермальный), трансмукозальный (например, буккальный и подъязычный), инъекционный (например, внутривенный, внутримышечный и подкожный) и ингаляционный (например, аэрозоль). В некоторых вариантах реализации изобретения терапевтически эффективное количество 1- МНА или его фармацевтически приемлемой соли вводят перорально. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят трансмукозально. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят путем инъекции. В некоторых вариантах реализации изобретения лечение не вызывает покраснения у субъекта. В некоторых вариантах реализации изобретения терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят один раз в день, два раза в день или три раза в день, предпочтительно в пероральной лекарственной форме.
[0053] 1-МНА или его фармацевтически приемлемую соль вводят до тех пор, пока субъект получает пользу от введения (например, СРБ в крови или сыворотке снижается или поддерживается на пониженном уровне по сравнению с уровнем до лечения). В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемую соль вводят в течение, по меньшей мере, одного месяца, по меньшей мере, трех месяцев, по меньшей мере, шести месяцев, по меньшей мере, одного года, по меньшей мере, трех лет или, по меньшей мере, пяти лет.
Комбинированная Терапия
[0054] При использовании в способе снижения или уменьшения риска сердечно- сосудистых заболеваний 1-МНА или его фармацевтически приемлемую соль можно вводить вместе с одним или более дополнительными активными агентами одновременно или по отдельности. Один или более дополнительных активных агентов включают аспирин и/или лекарственные средства из различных классов гиполипидемических препаратов, включая (1) ингибиторы HMG-CoA-редуктазы (например, статины, такие как ловастатин, правастатин, флувастатин, симвастатин, аторвастатин, розувастатин и питавастатин), (2) производные фиброевой кислоты (например, гемфиброзил, фенофибрат и фенофибриновая кислота), (3) секвестранты желчных кислот (например, холестирамин, колестипол, колесевелам и гидрохлорид), (4) ингибиторы всасывания холестерина (например, эзетимиб) или их комбинацию (например, эзетимиб/симвастатин). В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль используется вместе с аспирином, статином или их комбинацией. В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль используется в комбинации с аспирином. В других вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль используется в комбинации со статином, таким как ловастатин, правастатин, флувастатин, симвастатин, аторвастатин, розувастатин или питавастатин. Количество одного или более дополнительных активных агентов известно в данной области техники, например, см. Руководство AACE. В некоторых вариантах реализации изобретения способ снижает или понижает уровень СРБ в крови или сыворотке у субъекта по сравнению с уровнем до лечения. В некоторых вариантах реализации изобретения лечение не вызывает покраснения у субъекта. В некоторых вариантах реализации изобретения субъект представляет собой человека.
[0055] При лечении заболеваний, связанных с повышенным, увеличенным или нежелательным уровнем СРБ в крови или сыворотке (например, уровень СРБ выше 10 мг/л) у субъекта, способ может дополнительно включать введение субъекту одного или более дополнительных активных агентов. Такие заболевания включают ревматоидный артрит, рак толстой кишки, рак молочной железы, рак легких, рак печени, рак поджелудочной железы, инфекцию, воспалительное заболевание кишечника, системную красную волчанку, пневмококковую пневмонию, ревматическую лихорадку, туберкулез, почечную недостаточность, амиотрофический боковой склероз или их комбинацию. В одном варианте реализации изобретения заболевание представляет собой ревматоидный артрит, а способ также включает введение одного или более активных агентов, которые лечат это заболевание. В одном варианте реализации изобретения заболевание представляет собой инфекцию (например, пневмококковую пневмонию, ревматизм, туберкулез), а способ дополнительно включает введение одного или более активных агентов, которые лечат инфекцию. В одном варианте реализации изобретения заболевание представляет собой воспалительное заболевание кишечника, а способ дополнительно включает введение одного или более активных агентов, которые лечат это заболевание. В одном варианте реализации изобретения заболевание представляет собой системную красную волчанку, а способ дополнительно включает введение одного или более активных агентов, которые лечат системную красную волчанку. В одном варианте реализации изобретения заболевание представляет собой рак толстой кишки, а способ дополнительно включает введение одного или более активных агентов, которые лечат рак толстой кишки. В одном варианте реализации изобретения заболевание представляет собой рак молочной железы, а способ дополнительно включает введение одного или более активных агентов, которые лечат рак молочной железы. В одном варианте реализации изобретения заболевание представляет собой рак легких, а способ дополнительно включает введение одного или более активных агентов, которые лечат рак легких. В одном варианте реализации изобретения заболевание представляет собой рак печени, а способ дополнительно включает введение одного или более активных агентов, которые лечат рак печени. В одном варианте реализации изобретения заболевание представляет собой рак поджелудочной железы, а способ дополнительно включает введение одного или более активных агентов, которые лечат рак поджелудочной железы. В одном варианте реализации изобретения заболевание представляет собой почечную недостаточность, а способ дополнительно включает введение одного или более активных агентов, которые лечат заболевание или использование процедуры для лечения почечной недостаточности (например, гемодиализа). В одном варианте реализации изобретения заболевание представляет собой боковой амиотрофический склероз, а способ дополнительно включает введение одного или более активных агентов, которые лечат заболевание.
[0056] Типовые активные агенты для лечения ревматоидного артрита включают стероидный, нестероидный противовоспалительный препарат (NSAID), метотрексат, гидроксихлорохин, сульфасалазин, лефлуномид, циклофосфамид, азатиоприн, тофацитиниб, абатацепт (Orencia®),адалимумаб (Humira®), анакинра (Kineret®), цертолизумаб (Cimzia®), этанерцепт (Enbrel®), голимумаб (Simponi®), инфликсимаб (Remicade®), ритуксимаб (Rituxan®), тоцилизумаб (Actemra®), тофацитиниб (Xeljanz®) или их комбинацию.
[0057] Типовые активные агенты для лечения инфекции (например, пневмококковая пневмония, ревматическая лихорадка или туберкулез) включают антибактериальные агенты, такие как пенициллины, цефалоспорины, ванкомицин (Vancocin®), полимиксин, грамицидин, тетрациклины, макролиды, хлорамфеникол, клиндамицин, спектиномицин, сульфонамиды, ципрофлоксацин (Cipro®), офлоксацин (Floxin®), изониазид (INH®), рифампицин, пиразинамид, этамбутол (Myambutol®), стрептомицин или их комбинацию.
[0058] Типовые активные агенты для лечения воспалительного заболевания кишечника включают мезаламин (Lialda®), бальсалазид (Colazal®), олсалазин (Dipentum®), преднизон, гидрокортизон, азатиоприн (Azasan®) меркаптопурин (Purinethol®), циклоспорин, инфликсимаб (Remicade®), адалимумаб (Humira®), голимумаб (Simponi®), метотрексат (Rheumatrex), натализумаб (Tysabri®), ведолизумаб (Entyvio®), устекинумаб (Stelara®) или их комбинацию.
[0059] Типовые активные агенты для лечения системной красной волчанки включают преднизон, кортизон, гидрокортизон, NSAID (индометацин (Indocin®), набуметон (Relafen®), целекоксиб (Celebrex®), хлорохин (Aralen®) и гидроксихлорохин (Plaquenil®), азатиоприн (Imuran®), метотрексат (Rheumatrex®), циклофосфамид (Cytoxan®) или их комбинацию.
[0060] Типовые активные агенты для лечения рака толстой кишки включают 5-фторурацил (5-FU), капецитабин (Xeloda®), иринотекан (Camptosar®), оксалиплатин (Eloxatin®), трифлуридин, типирацил (Lonsurf®) или их комбинацию.
[0061] Типовые активные агенты для лечения рака молочной железы включают анастрозол, бевацизумаб, капецитабин, карбоплатин, деносумаб, доцетаксел, доксорубицин, эрибулин, эксеместан, фторурацил, фулвестрант, гемцитабин, иксабепилон, лапатиниб, летрозол, метотрексат, паклитаксел, трастузумаб, тамоксифен или их комбинацию.
[0062] Типовые активные агенты для лечения рака легких включают бевацизумаб, карбоплатин, цисплатин, кризотиниб, доцетаксел, доксорубицин, эрлотиниб, этопозид, гемцитабин, паклитаксел, пеметрексед, винорелбин или их комбинацию.
[0063] Типовые активные агенты для лечения рака печени включают тозилат сорафениба (Nexavar®).
[0064] Типовые активные агенты для лечения рака поджелудочной железы включают паклитаксел (Abraxane), эверолимус (Afinitor®), гидрохлорид эрлотиниба (Tarceva®), 5-FU (инъекция фторурацила), гидрохлорид гемцитабина (Gemzar®), гидрохлорид иринотекана (Onivyde®), митомицин C (Mitozytrex®), сунитиниб малат (Sutent®) или их комбинацию.
[0065] Типовые способы лечения почечной недостаточности включают гемодиализ.
[0066] В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемую соль можно вводить в сочетании с одним или более дополнительными препаратами, снижающими уровень СРБ для лечения заболеваний, связанных с СРБ, таких как ревматоидный артрит, или для предотвращения/уменьшения или снижения риска сердечно-сосудистых заболеваний. Типовые дополнительные препараты, снижающие уровень СРБ, включают (1) ингибиторы циклооксигеназы-2 (COX-2) (например, рофекоксиб и целекоксиб), (2) антитромбоцитарные препараты (например, клопидогрел), (3) противодиабетические препараты (например, производные тиазолидиндиона, такие как росиглитазон, росиглитазон и пиоглитазон), (4) антиэстрогены (например, тамоксифен), (5) антагонисты βадренорецепторов (например, карведилол и пропранолол), (6) антиоксиданты (например, витамины E и C, RRR-α-токоферол ацетат), (7) ингибиторы ангиотензинпревращающего фермента (ACE) (например, рамиприл, квинаприл, фозиноприл, лизиноприл и каптоприл), (8) блокаторы рецепторов ангиотензина (например, валсартан, лозартан, кандесартан, ирбесартан и телмисартан), (9) антагонисты кальциевых каналов (например, верапамил, дигидропиридины, амлодипин и валсартан) и (10) диуретики (например, гидрохлоротиазид).
[0067] Один или более дополнительных активных агентов могут вводиться вместе (например, одновременно) с 1-МНА или его фармацевтически приемлемой солью или отдельно (например, до или после), субъектом или другим лицом. В некоторых вариантах реализации изобретения один или более дополнительных активных агентов можно вводить системно или локально различными способами, известными в данной области техники. Неограничивающие типовые пути введения включают пероральный, местный, трансмукозальный, инъекционный и ингаляционный. В некоторых вариантах реализации изобретения один или более дополнительных активных агентов находятся в той же лекарственной форме, что и 1-МНА, или его фармацевтически приемлемая соль, например, в пероральной лекарственной формы. В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль приготовлена в одной и той же лекарственной форме с одним или более дополнительными активными агентами, такими как аспирин и/или статин, в некоторых вариантах реализации изобретения лекарственная форма представляет собой твердую пероральную лекарственную форму (например, таблетки или капсулы). Доза и режимы дозирования одного или более дополнительных активных агентов известны в данной области техники, например, доступны на этикетке лекарственного средства и/или определяются медицинским работником (например, врачом).
Приготовления, содержащие 1-МНА или его фармацевтически приемлемую соль [0068] 1-МНА или его фармацевтически приемлемая соль могут быть приготовлены в различных фармацевтических композициях для введения. Неограничивающие примерные фармацевтических композиций включают растворы, суспензии, эмульсии, таблетки, пилюли, гранулы, порошки, мультичастицы, капсулы, капсулы, содержащие жидкости, капсулы, содержащие порошки, капсулы, содержащие мультичастицы, пастилки, композиции с замедленным высвобождением, суппозитории, трансдермальные пластыри, трансмукозальные пленки, сублингвальные таблетки или пленки, аэрозоли, спреи или любые другие формы, подходящие для использования. Различные фармацевтические композиции и способы получения композиций известны в данной области техники, например, как описано в Remington's Pharmaceutical Sciences 1447-1676 (Alfonso R. Gennaro ed., 19th ed. 1995), включенной в данное описание посредством ссылки в полном объеме.
[0069] Когда фармацевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят перорально, например, содержащееся в фармацевтически приемлемой пероральной лекарственной форме, такие пероральные лекарственные формы также могут содержать подходящее количество одного или более фармацевтически приемлемых эксципиентов, включая разбавитель, суспендирующий агент, солюбилизатор, связующее вещество, дезинтегрант, консервант, краситель, смазывающее вещество и тому подобное. Фармацевтические эксципиенты могут быть жидкими, такими как вода или масло, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Фармацевтический эксципиент может представлять собой солевой раствор, гуммиарабик, желатин, крахмальную пасту, тальк, кератин, коллоидный диоксид кремния, мочевину и тому подобное. Кроме того, могут использоваться вспомогательные, стабилизирующие, загущающие, смазывающие и окрашивающие агенты. В одном варианте реализации изобретения фармацевтически приемлемый эксципиент является стерильным при введении человеку. Подходящие фармацевтические эксципиенты также включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол, и тому подобное. Фармацевтические композиции, если желательно, могут также содержать незначительные количества смачивающих или эмульгирующих агентов или буферизующий агент для поддержания рН. Примеры фармацевтически приемлемых носителей и эксципиентов, которые можно использовать для приготовления пероральных лекарственных форм, известны в данной области техники, например, описаны в Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (1986).
[0070] В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль приготовлена для перорального введения, например, в форме таблеток, капсул, гелевых капсул, каплет, леденцов, водных или масляных растворов, суспензий, гранул, порошков, эмульсий, сиропов или эликсиров. Таблетки могут быть спрессованы, покрыты энтеросолюбильной оболочкой, покрыты сахаром, покрыты пленочной оболочкой, многократно спрессованы или многослойны.
[0071] Пероральные лекарственные формы, содержащие 1-МНА или его фармацевтически приемлемую соль согласно данному изобретению, могут содержать один или более дополнительных компонентов, таких как, например, подсластители, такие как фруктоза, аспартам или сахарин; ароматизаторы, такие как мята перечная, масло грушанки или вишня; красители; консерванты и стабилизаторы для обеспечения стабильных фармацевтически приемлемых лекарственных форм. Способы и композиции для изготовления твердых пероральных лекарственных форм известны в данной области техники, например, описаны в Pharmaceutical Dosage Forms: Tablets (Lieberman, Lachman and Schwartz, eds., 2nd ed.), опубликованной Marcel Dekker, Inc. Способы и композиции для изготовления таблеток (прессованных и формованных), капсул (твердые и мягкие желатиновые капсулы) и пилюль также описаны в Remington's Pharmaceutical Sciences 1553-1593 (Arthur Osol, ed., 16th ed., Mack Publishing, Easton, PA 1980). Жидкие пероральные лекарственные формы включают водные и неводные растворы, эмульсии, суспензии и растворы и/или суспензии, восстановленные из не шипучих гранул, необязательно содержащие один или более подходящих растворителей, консервантов, эмульгирующих агентов, суспендирующих агентов, разбавителей, подсластителей, красителей, ароматизаторов и тому подобного. Способы и композиции для изготовления жидких пероральных лекарственных форм известны в данной области техники, например, описаны в Pharmaceutical Dosage Forms: Disperse Systems, (Lieberman, Rieger and Banker, eds.), опубликованной Marcel Dekker, Inc.
[0072] В некоторых вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль доставляются в форме немедленного высвобождения. В других вариантах реализации изобретения 1-МНА или его фармацевтически приемлемая соль согласно данному изобретению доставляются в системе с контролируемым высвобождением или в системе с замедленным высвобождением. Фармацевтические композиции с контролируемым или пролонгированным высвобождением могут улучшить лекарственную терапию по сравнению с результатами, достигнутыми их неконтролируемыми или не пролонгированными аналогами. Преимущества композиций с контролируемым или пролонгированным высвобождением включают пролонгированную активность лекарственного средства, сниженную частоту дозирования и повышенную совместимость. Кроме того, композиции с контролируемым или пролонгированным высвобождением могут благоприятно влиять на время начала действия или другие характеристики, такие как уровни лекарственного средства в крови, и, таким образом, могут уменьшать возникновение неблагоприятных побочных эффектов.
[0073] Композиции с контролируемым или пролонгированным высвобождением могут первоначально немедленно высвобождать количество 1-МНА или его фармацевтически приемлемой соли согласно данному изобретению, которое быстро обеспечивает желаемый терапевтический или профилактический эффект, и постепенно и непрерывно высвобождать оставшиеся количества для поддержания уровня терапевтического или профилактического эффекта в течение длительного периода времени. Контролируемое или пролонгированное высвобождение активного ингредиента может стимулироваться различными условиями, включая, но не ограничиваясь этим, изменения pH, изменения температуры, концентрации или доступности ферментов, концентрации или доступности воды или других физиологических условий или соединений. Способы изготовления пероральных лекарственных форм с контролируемым или пролонгированным высвобождением известны в данной области техники, например, как описано в Remington's Pharmaceutical Sciences 1553-1593 (Arthur Osol, ed., 16th ed., Mack Publishing, Easton, PA 1980). В некоторых вариантах реализации изобретения контролируемое или пролонгированное высвобождение может быть обеспечено способами, описанными, например, в патенте США № 5007790, раскрытие которого включено в данный документ посредством ссылки в полном объеме. Такие лекарственные формы для перорального введения с контролируемым или пролонгированным высвобождением содержат множество частиц дисперсии лекарственного средства в гидрофильном набухающем в воде сшитом полимере, который сохраняет свою физическую целостность в течение срока дозирования, но после этого быстро растворяется. При попадании внутрь частицы набухают, способствуя задержке в желудке и позволяя желудочной жидкости проникать в частицы, тем самым растворяя и высвобождая лекарственное средство.
[0074] Средства обеспечения контролируемого высвобождения и пролонгированного высвобождения для использования в соответствии с данным раскрытием могут быть выбраны из известных в данной области техники. Примеры включают, но не ограничиваются этим, описанные в патентах США №: 3,845,770; 3,916,899; 3,536,809; 3,598,123; 4,008,719; 5,674,533; 5,059,595; 5,591,767; 5,120,548; 5,073,543; 5,639,476; 5,354,556; и 5,733,566, каждый из которых включен в данный документ посредством ссылки. Такие лекарственные формы могут быть использованы для обеспечения контролируемого или пролонгированного высвобождения одного или более активных ингредиентов с использованием, например, гидроксипропилметилцеллюлозы, других полимерных матриксов, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, мультичастиц, липосом, микросфер или их комбинации для обеспечения желаемого профиля высвобождения в различных пропорциях. Подходящие приготовления с контролируемым или пролонгированным высвобождением, известные в данной области техники, в том числе описанные в данном документе, могут быть легко выбраны для использования с активными ингредиентами изобретения с учетом данного раскрытия. Другие системы с контролируемым или пролонгированным высвобождением, которые обсуждаются в обзоре Langer, Science 249:1527-1533 (1990), могут быть выбраны для использования в соответствии с данным раскрытием.
[0075] Когда 1-МНА или его фармацевтически приемлемая соль согласно данному изобретению находятся в форме таблетки или пилюли, на таблетку или пилюлю можно нанести покрытие, чтобы задержать распад и всасывание в желудочно-кишечном тракте, тем самым обеспечивая устойчивое действие в течение продолжительного периода времени. Селективно проницаемые мембраны, окружающие осмотически активное «движущее» соединение, также подходят для перорально вводимых композиций. В этих последних случаях жидкость из окружающей среды, окружающей капсулу, впитывается движущим соединением, которое набухает, вытесняя агент или композицию агента через отверстие. Эти средства доставки могут обеспечить практически ровный профиль доставки средства, в отличие от профилей приготовлений немедленного высвобождения, которые имеют пики. Также можно использовать материал с задержкой высвобождения, такой как моностеарат глицерина или стеарат глицерина. Пероральные композиции могут включать стандартные эксципиенты, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза и карбонат магния. В одном варианте реализации изобретения эксципиенты имеют фармацевтическую степень чистоты.
[0076] Пероральные фармацевтические композиции с контролируемым или пролонгированным высвобождением, содержащие 1-МНА или его фармацевтически приемлемую соль, включают единичные лекарственные формы, такие как, но не ограничиваясь этим, таблетки, капсулы, желатиновые капсулы и каплеты. В некоторых вариантах реализации изобретения пероральные лекарственные формы представляют собой таблетки или капсулы.
[0077] Фармацевтические композиции (например, пероральные лекарственные формы), содержащие 1-МНА или его фармацевтически приемлемую соль, можно вводить один раз в день, два раза в день, три раза в день или более трех раз в день. В некоторых вариантах реализации изобретения фармацевтические композиции вводят один раз в день или два раза в день. Как правило, лекарственные формы с немедленным высвобождением вводят чаще, чем лекарственные формы с контролируемым или пролонгированным высвобождением.
[0078] Фармацевтические композиции могут содержать различное количество 1-МНА или его фармацевтически приемлемой соли. В некоторых вариантах реализации изобретения количество 1-МНА или его фармацевтически приемлемой соли в фармацевтической композиции составляет от около 500 мг до около 2500 мг, от около 500 мг до около 2000 мг, от около 500 мг до около 1500 мг, от около 500 мг до около 1000 мг, от около 600 мг до около 2500 мг, от около 600 мг до около 2000 мг, от около 600 мг до около 1500 мг, от около 600 мг до около 1000 мг, от около 700 мг до около 2500 мг, от около 700 мг до около 2000 мг, от около 700 мг до около 1500 мг, от около 700 мг до около 1000 мг, от около 800 мг до около 2500 мг, от около 800 мг до около 2000 мг, от около 800 мг до около 1500 мг, от около 900 мг до около 2500 мг, от около 900 мг до около 2000 мг, от около 900 мг до около 1500 мг, от около 1000 мг до около 2500 мг, от около 1000 мг до около 2000 мг или от около 1000 мг до около 1500 мг. В некоторых вариантах реализации изобретения количество 1-МНА или его фармацевтически приемлемой соли в фармацевтической композиции составляет около 500, около 600, около 700, около 800, около 900, около 1000, около 1200, около 1300, около 1400, около 1500 около 1600, около 1700, около 1800, около 1900, около 2000, около 2100, около 2200, около 2300, около 2400 или около 2500 мг.
[0079] В некоторых вариантах реализации изобретения фармацевтическая композиция, содержащая 1-МНА или его фармацевтически приемлемую соль, раскрытая в данном документе, дополнительно содержит один или более дополнительных агентов, таких как те, которые описаны выше. В некоторых вариантах реализации изобретения фармацевтическая композиция содержит 1-МНА или его фармацевтически приемлемую соль и аспирин и/или лекарственные средства из различных классов гиполипидемических лекарственных средств, включая (1) ингибиторы HMG-CoA-редуктазы (например, статины, такие как ловастатин, правастатин, флувастатин, симвастатин, аторвастатин, розувастатин и питавастатин), (2) производные фиброевой кислоты (например, гемфиброзил, фенофибрат и фенофибриновая кислота), (3) секвестранты желчных кислот (например, холестирамин, колестипол, колесевелам и гидрохлорид), (4) ингибиторы всасывания холестерина (например, эзетимиб) или их комбинацию (например, эзетимиб/симвастатин).
[0080] В некоторых вариантах реализации изобретения твердая оральная композиция содержит 1-МНА или его фармацевтически приемлемую соль и аспирин. В некоторых вариантах реализации изобретения твердая пероральная композиция содержит 1-МНА или его фармацевтически приемлемую соль и статин, такой как ловастатин, правастатин, флувастатин, симвастатин, аторвастатин, розувастатин и питавастатин. В некоторых вариантах реализации изобретения твердая пероральная композиция содержит 1-МНА или его фармацевтически приемлемую соль и производное фибриновой кислоты (например, гемфиброзил, фенофибрат и фенофибриновую кислоту). В некоторых вариантах реализации изобретения твердая оральная композиция содержит 1-МНА или его фармацевтически приемлемую соль и секвестрант желчных кислот (например, холестирамин, колестипол и колесевелам). В некоторых вариантах реализации изобретения твердая пероральная композиция содержит 1-МНА или его фармацевтически приемлемую соль и ингибиторы абсорбции холестерина (например, эзетимиб). В некоторых вариантах реализации изобретения твердая оральная композиция содержит 1- МНА или его фармацевтически приемлемую соль, аспирин и статин.
[0081] В некоторых вариантах реализации изобретения фармацевтическая композиция, содержащая 1-МНА или его фармацевтически приемлемую соль и один или более дополнительных агентов, представляет собой пероральную фармацевтическую композицию. В некоторых вариантах реализации изобретения пероральная фармацевтическая композиция представляет собой твердую пероральную композицию. В некоторых вариантах реализации изобретения твердая пероральная фармацевтическая композиция представляет собой таблетку, капсулу, желатиновую капсулу, каплету или пастилку.
[0082] В композициях (например, твердых пероральных композициях), содержащих 1-МНА или его фармацевтически приемлемую соль и один или более дополнительных активных агентов, можно определить количество 1-МНА или его фармацевтически приемлемой соли и одного или более дополнительных агентов принимая во внимание суточную дозу каждого лекарственного средства, содержащегося в композиции, частоту дозирования и аспекты производства, которые могут определить специалисты в данной области техники. В некоторых вариантах реализации изобретения количество 1-МНА или его фармацевтически приемлемой соли является таким, как описано выше. Способы и эксципиенты для приготовления пероральных фармацевтических композиций раскрыты выше.
Тесты для определения уровня СРБ в крови или сыворотке
[0083] Как правило, существует два типа тестов для измерения уровня СРБ в крови или сыворотке. Первый тип теста менее чувствителен (например, ELISA) и полезен для мониторинга общих воспалительных изменений у пациентов с воспалительными заболеваниями (например, инфекцией и ревматоидным артритом), где уровни СРБ выше 10 мг/л. Тесты СРБ доступны в коммерческих диагностических лабораториях, например, стандартные или традиционные тесты СРБ, доступные в Quest Diagnostics.
[0084] Второй тип теста представляет собой высокочувствительные тесты СРБ или вч-СРБ, которые измеряют низкие уровни СРБ с чувствительностью обнаружения, например, 0,2 мг/л или 0,04 мг/л. Уровни СРБ в крови или сыворотке менее 10 мг/л обычно тестируются с использованием вч-СРБ-тестов, которые используются для определения и мониторинга сердечно-сосудистого риска.
[0085] вч-СРБ тесты доступны в коммерческих диагностических лабораториях. Типовые тесты вч-СРБ включают тесты Cardio IQ® вч-СРБ или вч-СРБ, предоставляемые Quest Diagnostics. Поскольку уровни СРБ увеличиваются при острой инфекции и травме, следует избегать тестирования, например, в течение 2-3 недель у пациентов с инфекцией или другим острым заболеванием. Люди с клинически очевидными воспалительными состояниями, такими как ревматоидный артрит или волчанка, имеют повышенные уровни СРБ. Следует избегать оценки вч-СРБ с целью оценки риска сердечно-сосудистых заболеваний у таких пациентов, по крайней мере, до 2 недель после разрешения воспалительных реакций.
[0086] Тесты СРБ в крови и сыворотке можно проводить натощак и без такового или в разное время суток, так как уровни СРБ не сильно колеблются в разное время или в разных условиях.
Пример
Обработка 1-МНА хлоридом снижает уровень СРБ в крови или сыворотке
[0087] План исследования
[0088] Исследование было рандомизированным, двойным слепым, плацебо-контролируемым, с принудительным повышением дозы, многоцентровым исследованием.
[0089] Критерии включения - Пациенты были в возрасте по крайней мере 18 лет и ≤ 80 лет на момент информированного согласия;
- У женщин с детородным потенциалом должен быть отрицательный тест мочи на беременность при осмотре и посещении 4. Женщины считались не способными к деторождению, если они:
a. подвергались гистерэктомии или перевязке маточных труб до посещения 1;
b. были определены, как находящиеся в состоянии постменопаузы в результате отсутствия менструаций в течение 12 месяцев или уровень ФСГ находился в диапазоне менопаузы;
Женщины с детородным потенциалом должны согласиться использовать эффективный метод контроля рождаемости на протяжении всего исследования. Приемлемые средства контроля рождаемости включают в себя: имплантируемые контрацептивы, инъекционные контрацептивы, оральные контрацептивы, трансдермальные контрацептивы, внутриматочные контрацептивы, мужские или женские презервативы со спермицидом, воздержание или стерильный половой партнер;
- Пациенты, у которых во время визитов 2 и 3 (недели -4 и -2) был обнаружен средний уровень холестерина ЛПНП на уровнях, при которых липидомодифицирующая лекарственная терапия не показана в соответствии с суждением исследователя в соответствии с рекомендациями ATP III (доступны по адресу: http://www.nhlbi.nih.gov/guidelines/cholesterol/atp3full.pdf);
- Пациенты, которые продемонстрировали средние уровни триглицеридов в сыворотке крови ≥ 200 мг/дл (2,26 ммоль/л), но ≤ 500 мг/дл (5,65 ммоль/л), измеренные при 2 последовательных посещениях в течение контролируемого диетического базового периода (посещения 2 и 3 или посещения 3 и 3a) и имеющие более низкий уровень в пределах 25% от верхнего уровня (более высокое значение минус более низкое значение)/более высокое значение < 0,25);
- Пациенты, которые были готовы поддерживать стабильную диету и уровень физической активности на протяжении всего исследования;
- Пациенты, которые желали и могли подписать форму с информацией и согласием и следовать протоколу, включая доступность для всех посещений/последующего наблюдения в телефонном режиме в течение приблизительно 26 недель.
[0090] Критерий исключения
- Пациенты, которые были беременны, планируют забеременеть во время исследования или кормящие грудью
- Пациенты с клинически значимыми нарушениями электрокардиографии при первом или четвертом посещении;
- Пациенты с индексом массы тела > 45 кг/м2 на посещении 1;
- Пациенты, у которых было изменение веса > 5% от начальной массы тела между визитами 1 и 4 (рандомизация);
- Пациенты с плохо контролируемым диабетом, при определении уровня гемоглобина A1c > 9,5% до посещения 4 (рандомизация);
- Пациенты, у которых были признаки заболевания печени (ALT или AST более 2,0 ULN, билирубин более 1,5 ULN или цирроз) при посещении 1;
- Пациенты с почечной дисфункцией, при определении скорости клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2 при посещении 1;
- Пациенты, у которых был гипотиреоз, который не лечился или не был стабильным в течение по меньшей мере 6 месяцев до начала исследования;
- Пациенты с плохо контролируемой артериальной гипертензией, определяемой как среднее систолическое артериальное давление выше 160 мм рт.ст. и/или диастолическое артериальное давление выше 100 мм рт.ст. при посещении 1. У пациентов с ишемическим поражением органов, среднее систолическое артериальное давление выше 140 мм рт.ст. и среднее диастолическое артериальное давление выше 90 мм рт. ст. при посещении 1;
- Пациенты с тяжелой гипотонией, определяемой как систолическое артериальное давление ≤ 90 мм рт.ст. или диастолическое артериальное давление ≤ 60 мм рт.ст. и симптоматикой;
- Пациенты, у которых была активная язвенная болезнь желудка;
- Пациенты с известной непереносимостью (кроме покраснения) или аллергией на плацебо или исследуемый продукт;
- Пациенты, у которых были какие-либо известные случаи ишемической болезни сердца, цереброваскулярных заболеваний или заболеваний периферических артерий;
- Пациенты, которые использовали любой из следующих препаратов/добавок, модифицирующих липиды, со времени после скрининга до завершения исследования:
Ниацин (никотиновая кислота) или ниацинамид (никотинамид) Фибраты или производные фиброевой кислоты, включая фенофибрат, гемфиброзил, клофибрат
Секвестранты желчных кислот, включая холестирамин, колесевелам, колестипол гидрохлорид
Ингибиторы HMG-CoA редуктазы (статины), включая аторвастатин, церивастатин, флувастатин, ловастатин, правастатин, симвастатин, розувастатин
Эзетимиб
Омега-3 жирные кислоты
Добавки, содержащие льняное семя, триптофан, рыбий жир или водорослевое масло.
Стерол/станольные продукты
Добавки из красного ферментированного риса или соевые изофлавоновые добавки
Пищевые добавки с клетчаткой, в том числе > 2 чайных ложек Metamucil® или добавок, содержащих псиллиум, в день.
Другие натуральные продукты для здоровья или рецептурные препараты, которые по оценкам исследователя, могут изменять уровень липидов в сыворотке у индивидуума.
- Пациенты, у которых в анамнезе была стенокардия или инфаркт миокарда;
- Пациенты, которые по оценке исследователя имели клинически значимую гиперурикемию или в анамнезе имелся подагрический артрит;
- Пациенты с известным нефритическим синдромом или информацией в анамнезе > 3 г белка/сутки в моче;
- Пациенты, у которых была известна семейная недостаточность липопротеинлипазы, дефицит апо CII или семейная дисбеталипопротеинемия;
- Пациенты, которым необходим перитонеальный диализ или гемодиализ из-за почечной недостаточности;
- Пациенты, у которых в анамнезе были злокачественные новообразования, за исключением пациентов, которые не имели заболеваний в течение > 5 лет или резецировали базальный или плоскоклеточный рак кожи или рак шейки матки in situ;
- Пациенты, которые проходили бариатрическую операцию;
- Пациенты, у которых в анамнезе был панкреатит, кроме вторичного в результате желчнокаменной болезни;
- Пациенты, которые ожидали серьезную операцию во время исследования;
- Пациенты, которые проходили программы или лечение препаратами для снижения веса во время исследования;
- Пациенты, которые проходили лечение ингибиторами ВИЧ-протеазы, циклофосфамидом или изотретиноином;
- Пациенты, которые проходили лечение тамоксифеном, эстрогенами или прогестинами, которые не были стабильными в течение > 4 недель до скрининга при посещении 1;
- Пациенты с запланированным или предполагаемым использованием всех системных кортикостероидов при посещении 1, были разрешены локальные, местные, ингаляционные или назальные кортикостероиды;
- Пациенты, у которых было донорство крови > 1 пинты (0,5 л) в течение 30 дней до скрининга, или донорство плазмы в течение 7 дней до скрининга при посещении 1;
- Пациенты, которые употребляли > 14 алкогольных напитков в неделю (1 напиток = 12 унций пива, 5 унций вина или 1,5 унции крепких напитков) при посещении 1;
- Пациенты, которые ранее злоупотребляли наркотиками;
- Пациенты, которые участвовали в другом клиническом испытании в течение 30 дней после подписания формы информации и согласия;
- Пациенты, которые не соблюдали прием одного слепого исследуемого продукта (<80% исследуемого продукта) или диеты согласно промежуточной оценке между визитами 1 и 4;
- Пациенты, у которых было какое-либо состояние или которые проходили терапию, которые, по мнению исследователя, могут представлять опасность для пациента или сделать участие в исследовании не в интересах пациента;
- Пациенты, у которых была ослабленная психо-эмоциональная функция или любая другая причина, в результате которой можно ожидать, что пациент будет испытывать трудности в соблюдении требований исследования.
[0091] После подписания информированного согласия 164 пациента получали плацебо по 1000 мг три раза в день во время еды в рамках простого слепого исследования в течение базового периода от 6 до 8 недель с контролируемым рационом. Из выборки подходящих субъектов, которые завершили 6-8-недельный базовый период с контролируемой диетой, 71 субъект (22 получали плацебо и 49 получали 1-МНА хлорид), отвечающие всем критериям включения и не соответствующие ни одному критерию исключения, были рандомизированы двойным слепым способом (соотношение 3:1) в группу лечения. Периоды лечения были следующими: недели 1 и 2 - две таблетки по 500 мг, принимаемые три раза в день во время еды (общая суточная доза 3000 мг); недели с 3 до 14 две таблетки по 1000 мг принимаемые три раза в день во время еды (общая суточная доза 6000 мг). Допускалось снижение дозы до 3000 мг в день в случае, если субъект не мог переносить ежедневный прием по 6000 мг в течение установленного периода. Согласно этому сценарию субъект с пониженной дозой оставался на переносимой дозе в течение всего периода испытания. Уровни вч-СРБ в крови оценивали в течение базового периода, после рандомизации и в течение активного периода лечения. Все образцы крови были собраны после 12-часового голодания. На протяжении всего исследования субъекты должны были придерживаться полезной для сердца диеты и воздерживаться от/минимизировать потребление этилового спирта. Безопасность и переносимость оценивались на протяжении всего исследования посредством физических обследований, электрокардиограмм, рутинной гематологии и химического анализа крови, показателей жизненно важных функций и побочных явлений.
[0092] Результаты исследования вч-СРБ приведены в Таблице 1.
Таблица 1. Краткое содержание и статистический анализ изменения С-реактивного белка
[0093] Результаты показывают, что введение 1-МНА хлорида снижает уровень СРБ в крови или сыворотке у субъекта примерно на 16% от исходного уровня.
[0094] Статистический анализ изменений СРБ от исходного уровня до конца исследования показан в Таблице 2 ниже.
[0095] Таблица 2. Статистический анализ изменения СРБ от исходного уровня до конца исследования
[0096] В анализе скорректированное среднее геометрическое процентное изменение было получено путем возведения в степень скорректированного среднего значения из модели ANCOVA, затем вычитали 1 и умножали на 100. Границы доверительных интервалов 95% были получены аналогично. Основываясь на модели ANCOVA изменения log- трансформированного СРБ, включая группу лечения и log-трансформированное исходное значение, изменение уровня СРБ в крови в этом исследовании было приблизительно -17% относительно плацебо.
[0097] Следует понимать, что раздел «Подробное описание сущности изобретения», а не разделы «Краткое описание сущности изобретения» и «Реферат», предназначен для использования в интерпретации формулы изобретения. Разделы «Краткое описание сущности изобретения» и «Реферат» могут излагать один или более, но не все типовые варианты реализации данного изобретения, как предполагается изобретателем (ями), и, таким образом, не предназначены для ограничения каким-либо образом данного изобретения и прилагаемой формулы изобретения.
[0098] Данное изобретение было описано выше с помощью функциональных структурных элементов, иллюстрирующих реализацию определенных функций и их взаимосвязи. Границы этих функциональных структурных элементов были определены в данном документе произвольно для удобства описания. Альтернативные границы могут быть определены при условии, что указанные функции и их связи выполняются надлежащим образом.
[0099] Вышеприведенное описание конкретных вариантов реализации изобретения будет настолько полно раскрывать общую природу изобретения, что другие люди могут, применяя знания в данной области техники, легко модифицировать и/или адаптировать для различных применений такие конкретные варианты реализации изобретения, без излишних экспериментов, не отступая от общей концепции данного изобретения. Следовательно, такие адаптации и модификации должны рассматриваться как находящиеся в рамках и объеме эквивалентов раскрытых вариантов реализации изобретения, основанных на представленных в данном документе инструкциях и руководствах. Следует понимать, что фразеология или терминология в данном документе предназначена для целей описания, а не ограничения, так что терминология или фразеология данного описания должны интерпретироваться специалистом в свете инструкций и руководств.
[0100] Масштаб и объем данного изобретения не должны быть ограничены каким-либо из вышеописанных типовых вариантов реализации изобретения, но должны быть определены только в соответствии с нижеследующей формулой изобретения и эквивалентами ее пунктов.
Настоящее изобретение относится к области медицины, а именно к способу лечения субъекта для предотвращения сердечно-сосудистого заболевания или снижения риска сердечно-сосудистого заболевания, включающему введение субъекту терапевтически эффективного количества 1-метилникотинамида (1-МНА) или его фармацевтически приемлемой соли, причем до введения субъект имеет уровень С-реактивного белка в крови (СРБ) менее 10 мг/л, и при этом сердечно-сосудистое заболевание выбрано из группы, состоящей из ишемической болезни сердца (ИБС), заболевания периферических артерий, заболевания сонной артерии, застойной сердечной недостаточности, инсульта, инфаркта миокарда, стенокардии и их комбинации, при этом предпочтительно способ снижает уровень СРБ в крови или сыворотке у субъекта по сравнению с уровнем до введения; при этом предпочтительно фармацевтически приемлемая соль представляет собой 1-метилникотинамидхлорид, причем предпочтительно субъект представляет собой человека. Настоящее изобретение обеспечивает снижение уровня С-реактивного белка в крови или сыворотке крови. 6 з.п. ф-лы, 2 табл., 1 пр.
1. Способ лечения субъекта для предотвращения сердечно-сосудистого заболевания или снижения риска сердечно-сосудистого заболевания, включающий введение субъекту терапевтически эффективного количества 1-метилникотинамида (1-МНА) или его фармацевтически приемлемой соли,
причем до введения субъект имеет уровень С-реактивного белка в крови (СРБ) менее 10 мг/л,
и при этом сердечно-сосудистое заболевание выбрано из группы, состоящей из ишемической болезни сердца (ИБС), заболевания периферических артерий, заболевания сонной артерии, застойной сердечной недостаточности, инсульта, инфаркта миокарда, стенокардии и их комбинации,
при этом предпочтительно способ снижает уровень СРБ в крови или сыворотке у субъекта по сравнению с уровнем до введения;
при этом предпочтительно фармацевтически приемлемая соль представляет собой 1-метилникотинамидхлорид,
причем предпочтительно субъект представляет собой человека.
2. Способ по п. 1, в котором субъект имеет уровень С-реактивного белка (СРБ) в крови в диапазоне, выбранном из группы, состоящей из: менее чем 1,0 мг/л, менее чем 0,5 мг/л, от 0,5 мг/л до менее чем 1,0 мг/л, от 1,0 мг/л до менее чем 10,0 мг/л, от 1,0 мг/л до менее чем 10 мг/л, более предпочтительно менее 0,5 мг/л, более предпочтительно от 0,5 мг/л до менее чем 1,0 мг/л, предпочтительно менее 1,0 мг/л, от 1,0 мг/л до менее чем 3,0 мг/л, от 1,0 мг/л до 2,0 мг/л, от 1,0 мг/л до 2,7 мг/л или от 2,0 мг/л до менее чем 3,0 мг/л, от 3,0 мг/л до 5,0 мг/л, от 3,0 мг/л до 7,0 мг/л или от 3,0 мг/л до менее чем 10,0 мг/л.
3. Способ по любому из пп. 1 или 2, в котором способ снижает риск ИБС, заболевания периферических артерий, заболевания сонной артерии, застойной сердечной недостаточности, инсульта, инфаркта миокарда, стенокардии или их комбинации у субъекта, предпочтительно ИБС, инсульта, инфаркта миокарда, стенокардии или их комбинации у субъекта, предпочтительно инсульта, инфаркта миокарда или их комбинации у субъекта, предпочтительно ИБС.
4. Способ по любому из пп. 1-3, в котором субъект представляет собой недислипидемический субъект,
при этом предпочтительно субъект имеет нормальный уровень общего холестерина в крови, нормальный уровень липопротеинов низкой плотности в крови (ЛПНП-холестерин), нормальный уровень триглицеридов (ТГ), нормальный уровень липопротеинов высокой плотности (ЛПВП-холестерин) или их комбинации.
5. Способ по любому из пп. 1-4, в котором лечение не вызывает покраснения у субъекта.
6. Способ по любому из пп. 1-5, в котором терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят перорально.
7. Способ по любому из пп. 1-6, в котором терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли составляет от 1000 мг до 8000 мг, от 1000 мг до 7000 мг, от 1000 мг до 6000 мг, от 1000 мг до 5000 мг, от 1000 мг до 4000 мг, от 1000 мг до 3000 мг, от 1000 мг до 2000 мг, от 2000 мг до 8000 мг, от 2000 мг до 7000 мг, от 2000 мг до 6000 мг, от 2000 мг до 5000 мг, от 2000 мг до 4000 мг, от 2000 мг до 3000 мг, от 3000 мг до 8000 мг, от 3000 мг до 7000 мг, от 3000 мг до 6000 мг, от 3000 мг до 5000 мг, от 3000 мг до 4000 мг, от 4000 мг до 8000 мг, от 4000 мг до 7000 мг, от 4000 мг до 6000 мг, от 4000 мг до 5000 мг, от 5000 мг до 8000 мг, от 5000 мг до 7000 мг, от 5000 мг до 6000 мг, от 6000 мг до 8000 мг, от 6000 мг до 7000 мг, от 7000 мг до 8000 мг в день,
предпочтительно 1000 мг, 2000 мг, 3000 мг, 4000, 5000 мг, 6000 мг, 7000 мг или 8000 мг в день, еще более предпочтительно 1000 мг, 3000 мг или 6000 мг в день, и/или
при этом терапевтически эффективное количество 1-МНА или его фармацевтически приемлемой соли вводят один раз в день, два раза в день или три раза в день.
| WO 2007074406 A2, 05.07.2007 | |||
| US 2009118225 A1, 07.05.2009 | |||
| US 2008249140 A1, 09.10.2008 | |||
| Е.В | |||
| Хоролец и др | |||
| Диагностическая значимость С-реактивного белка в генезе патологии сердечно-сосудистой системы / Журнал фундаментальной медицины и биологии, 2013, N 1. |
Авторы
Даты
2021-03-11—Публикация
2017-07-16—Подача