Согласно настоящей заявке испрашивается преимущество в соответствии с заявкой на выдачу европейского патента EP16382190.3, поданной 29 апреля 2016 г.
Настоящее изобретение относится к области медицинских подходов для заболеваний глаз, которые могут приводить к частичной или полной слепоте. Настоящее изобретение относится к применимому семейству пептидов - ингибиторов дипептидилпептидазы-4 (DPP-4), подлежащих местному нанесению на глаза.
Уровень техники
Нейродегенеративные заболевания сетчатки относятся к состояниям сетчатки, характеризующимся прогрессирующей потерей нейронов. Диабетическая ретинопатия, возрастная макулярная дегенерация, глаукома и пигментный ретинит считаются заболеваниями сетчатки, при которых нейродегенерация играет существенную роль.
Глубокий анализ указанных заболеваний, их критически важных участков, а также возможных способов защиты и путей, ведущих к восстановлению, можно найти в Schmidt et al., “Neurodegenerative Diseases of the Retina and Potential for the Protection and Recovery”, Current Neuropharmacology - 2008, Vol. No. 6, pp.: 164-178.
Диабетическая ретинопатия (DR) представляет собой наиболее распространенное осложнение сахарного диабета и остается ведущей причиной слепоты среди людей трудоспособного возраста в развитых странах. Современные способы лечения DR, такие как лазерная фотокоагуляция, интравитреальные инъекции кортикостероидов или средств против VEGF, назначают на слишком поздних стадиях заболевания, и они связаны со значительными неблагоприятными эффектами.
DR классически считается микроциркуляторным заболеванием сетчатки. Тем не менее, существуют некоторые данные, которые свидетельствуют о том, что нейродегенерация сетчатки представляет собой раннее событие в патогенезе DR, которое участвует в нарушениях микроциркуляции, которые происходят при DR, что можно заключить из Simó с соавт. по заказу Европейского консорциума по раннему лечению диабетической ретинопатии (EUROCONDOR). “Neurodegeneration is an early event in diabetic retinopathy: therapeutic implications”, Br. J. Ophthalmol. - 2012, vol. 96, pp.1285-1290. Другие ссылки, в которых упоминаются подходы для лечения DR, раскрыты в Simó R, Hernández C, “Novel approaches for treating diabetic retinopathy based on recent pathogenic evidence”, Prog Retin Eye Res -2015, vol. no. 48, pp.:160-80; и Simó R, Hernández C; European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR). “Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives”, Trends Endocrinol Metab -2014; vol. no. 25(1), pp.: 23-33.
В случае DR нейродегенерация (потеря эффективных нейронов) происходит на ранних стадиях заболевания и вызывает функциональные патологические изменения, такие как потеря как цветоразличения, так и контрастной чувствительности. Эти изменения можно обнаружить с помощью электрофизиологических исследований у пациентов с сахарным диабетом даже с менее чем двумя годами продолжительности сахарного диабета, т.е. до того, как микрососудистые поражения можно обнаружить при офтальмологическом обследовании. Кроме того, латентность в замедленной мультифокальной ERG (электроретинографии) (mfERG-IT) предсказывает развитие ранних микрососудистых патологических изменений. Более того, нейроретинальная дегенерация инициирует и/или активирует несколько метаболических и сигнальных путей, которые будут участвовать в микроангиопатическом процессе, а также в нарушении гематоретинального барьера (важнейшего элемента в патогенезе DR).
Нарушение гематоретинального барьера (BRB) (или разрушение) можно оценить с помощью оптической когерентной томографии (OCT).
Ранние стадии нейродегенеративных заболеваний сетчатки или нейродегенерации, ассоциированной с этими патологиями, в настоящее время не лечатся, хотя они предотвращали бы прогрессирующие поражения, такие как проблемы микроциркуляции, приводящие к отеку сетчатки и неоваскуляризации сетчатки. Таким образом, на ранних стадиях, в частности DR, лечение не применяют и проводят стандартное последующее наблюдение за пациентами.
С другой стороны, когда ранние стадии указанного нейродегенеративного заболевания сетчатки, в частности DR, представляют собой терапевтическую мишень, было бы неразумно рекомендовать агрессивное лечение, такое как лазерная фотокоагуляция или интравитреальные инъекции. На сегодняшний день использование глазных капель не считается подходящим путем для введения лекарственных средств, направленных на профилактику или прекращение DR. Это связано с тем, что обычно считается, что они не достигают заднего сегмента глаза (т.е. стекловидного тела и сетчатки), как заявлено в Urtti A et al., “Challenges and obstacles of ocular pharmacokinetics and drug delivery”. Adv. Drug. Deliv. Rev. 2006, vol. 58, pp. 1131-1135. Несмотря на то, что существует небольшое доказательство того, что соединения, вводимые в роговицу, могут достигать сетчатки, они представляют собой изолированные случаи и относятся к соединениям с низкой молекулярной массой, таким как те, которые упомянуты в Aiello et al., “Targeting Intraocular Neovascularization and Edema - One Drop at a Time”, N. Eng. J Med - 2008, vol. 359, pp. 967-969. Aiello с соавт. показали, что в двух различных анализах происходящее из пирролидина соединение (называемое TG100572, 4-хлор-3-(5-метил-3-{[4-(2-пирролидин-I-илэтокси)фенил]амино}-1,2,4-бензотриазин-7-ил)фенол)) со способностью действовать в качестве ингибитора киназ, участвующих в создании новых сосудов и отеке сетчатки, смогло достичь мишени в сетчатке после введения в форме глазных капель.
Тем не менее, достижение сетчатки путем прохождения через роговицу или склеру является трудным и непредсказуемым, главным образом, из-за анатомической природы этой ткани. Местное нанесение лекарственного средства является применимым при лечении многих нарушений переднего сегмента, но считается неэффективным при доставке терапевтических концентраций лекарственного средства в задний сегмент глаза вследствие уникальных анатомических, физиологических и биохимических барьеров глаза.
Существует два основных пути для перемещения жидкостей и растворенных веществ через клеточные слои: трансклеточный путь (активный ионный транспорт с затратой энергии) и параклеточный путь (в основном основанный на пассивной диффузии по градиентным концентрациям и проницаемости). Роговица разделена на 3 основных сложных слоя: эпителий, строма и эндотелий. Эпителий роговицы является липофильным и состоит из многослойных плоских клеток толщиной от 5 до 7 клеточных слоев. Сразу же за эпителием роговицы находится коллагеновая боуменова мембрана. За боуменовой мембраной находится гидрофильная ламеллярная строма. Поскольку она является гидрофильной, строма является сильным барьером для липофильных молекул, хотя в ней отсутствуют комплексы плотных контактов. Рядом со стромой лежит одноклеточный слой десцеметовой мембраны и внеклеточный матрикс, секретируемый самым глубоким слоем роговицы, эндотелием. Эндотелий роговицы характеризуется толщиной одного слоя кубовидных клеток и является липофильной областью, ответственной за предотвращение просачивания питательных веществ из водянистой влаги в роговицу и за транспорт воды из бессосудистой роговицы в переднюю камеру глаза. Таким образом, липофильно-гидрофильно-липофильный характер роговицы, как проиллюстрировано, является основным фактором, влияющим на проницаемость любого лекарственного средства.
Кроме того, липофильный и гидрофильный характер лекарственных средств, иногда присутствующих в одном лекарственном средстве, ставит дополнительные задачи. Таким образом, лекарственное средство может легко проникать через один из слоев, но ему препятствуют другие.
В этом отношении ограничивающими факторами являются не только молекулярная масса соединения, но и другие признаки, такие как гидрофобность, липофильность, растворимость в каждой из структур (см. Malhotra et al., “Permeation through cornea”, Indian Journal of Experimental Biology-2001, vol. no. 39, pp.: 11-24). Все указанные параметры действительно затрудняют для соединения, даже характеризующегося низкими молекулярными массами (<180 Да), возможность достигать внутренних частей глаза (жидкости стекловидного тела или сетчатки) через роговицу. В это связи, даже если одно лекарственное средство может пройти, это не означает, что другое лекарственное средство с одинаковой молекулярной массой может достигать внутренних частей глаза.
Точно так же проницаемость склеры и конъюнктивы для лекарственных средств для достижения сетчатки сильно осложняется и в высокой степени зависит от многих характерных признаков лекарственного средства. В частности, в отношении этих трудностей можно упомянуть обширную работу Prausnitz et al., “Permeability of Cornea, Sclera, and Conjunctiva: A Literature Analysis for Drug Delivery to the Eye”, Journal of Pharmaceutical Sciences - 1998, vol. no. 87(12), pp.: 1479-1488.
По всем указанным причинам в настоящее время отсутствует какая-либо зарегистрированная для продажи композиции для офтальмологического (местно в глаз) лечения любых заболеваний сетчатки.
Ингибиторы DPP-4 представляют собой относительно новый класс пероральных лекарственных средств от сахарного диабета, также известный как глиптины, которые назначают людям с сахарным диабетом 2 типа. Они действуют путем блокирования действия DPP-4, фермента, который разрушает группу желудочно-кишечных гормонов, называемых инкретины (главным образом, глюкагоноподобный пептид-1, GLP-1). Инкретины помогают стимулировать выработку инсулина, когда это необходимо (например, после еды), и снижают выработку глюкагона печенью, когда в этом нет необходимости (например, во время переваривания).
Дипептидилпептидаза-4 (DPP-4, или DPP-IV), также известная как белок 2 комплексообразования аденозиндезаминазы или CD26 (кластер дифференцировки 26), представляет собой белок, который у людей кодируется геном DPP4. Она представляет собой высококонсервативную пептидазу с высокой селективностью по отношению к пептидам с пролином или аланином во втором NH2-концевом положении. Ген кодирует трансмембранный белок II типа из 766 аминокислот, который прикреплен к липидному бислою одним гидрофобным сегментом, расположенным на N-конце, и характеризуется коротким цитоплазматическим хвостом из шести аминокислот (см. Meester I et al., “CD26, let it cut or cut it down”, Immunol Today- 1999, vol. no. 20, pp.:367-375). Внеклеточная часть CD26 содержит домен гликозилирования, богатый цистеином домен, и каталитический домен. DPP-4 предпочтительно отщепляет N-концевые дипептиды от белков и олигопептидов, содержащих пролин или аланин в предпоследнем положении (Xaa-Pro- или Xaa-Ala-) (см. Abbott, et al., “Cloning, expression and chromosomal localization of a novel human dipeptidyl peptidase (DPP) IV homolog, DPP8”, Eur J Biochem -2000; vol. no. 267, pp.: 6140-5). Субстраты DPP-4 включают в себя многочисленные нейропептиды (например, вещество P), гормоны (т.е. GLP-1, GLP-2, инсулиновый фактор роста-1, нейропептид-Y, пептид YY, соматотропин-рилизинг-гормон, эритропоэтин) и хемокины (т.е. IP-10, RANTES, стромальный клеточный фактор-1) (см. Kim et al., “The Nonglycemic Actions of Dipeptidyl Peptidase-4 Inhibitors”- BioMed Research International Volume 2014, Article ID 368703).
Несмотря на общий механизм действия, существует значительная гетерогенность в фармакокинетике различных ингибиторов DPP-4 (DI). Таким образом, они демонстрируют различия в периоде полужизни, биодоступности, метаболизме и пути экскреции. Некоторые ингибиторы DPP-4 действуют посредством конкурентного ферментативного ингибирования (ситаглиптин и алоглиптин), в то время как другие являются блокаторами комплекса субстрат-фермент (саксаглиптин и вилдаглиптин) (см. Baetta et al., “Pharmacology of dipeptidylpeptidase-4 inhibitors: similarities and differences”, Drugs-2011, vol. no.71, pp.:1441-1467).
Сахарный диабет представляет собой группу хронических заболеваний, характеризующихся гипергликемией. Чтобы предотвратить диабетические осложнения, необходимо снизить гипергликемию с использованием средств для снижения уровня глюкозы в крови. Введение любого антидиабетического лекарственного средства, такого как ингибиторы DPP-4, может снизить интенсивность или смягчить симптомы DR, поскольку ведущая причина или первопричина заболевания, в частности, высокие уровни глюкозы в крови, в конечном итоге приближены к норме.
В этом отношении документ, в котором показана активная роль гемиглиптина (ингибитора DPP-4) при диабетической ретинопатии, представляет собой один из Jung et al., “Gemigliptin, a dipeptidyl peptidase-4 inhibitor, inhibits retinal pericyte injury in db/db mice and retinal neovascularization in mice”, Biochimica et Biophysica Acta, Molecular Basis of Disease- 2015, vol. no. 1852(12), pp.:2618-2629. Jung с соавт. сообщают, что гемиглиптин, вводимый перорально мышам с сахарным диабетом (db/db), может улучшить апоптоз перицитов сетчатки и просачивание из сосудов у этих мышей.
Тем не менее, в настоящее время отсутствуют данные о прямом благоприятном эффекте на сетчатку указанных ингибиторов. В этой связи также следует отметить, что ингибиторы DPP-4 не проходят через гематоэнцефалический барьер. Учитывая, что гематоэнцефалический барьер и BRB весьма схожи, также является общепринятым и более чем вероятно, что они не проходят через BRB. В маловероятном случае, когда некоторое количество ингибиторов DPP-4 может проходить BRB, для достижения сетчатки в терапевтических концентрациях потребуются высокие дозы, что увеличивает вероятность системных неблагоприятных эффектов.
В международной патентной публикации согласно РСТ WO2014131815 неожиданно обнаружили, что, несмотря на их высокую молекулярную массу, ретинальное местное введение в глаз некоторых агонистов GLP-1, а также самого GLP-1 может предотвратить нейродегенеративный процесс, возникающий на ранних стадиях диабетической ретинопатии. В этом документе авторы также предоставили доказательства того, что другие заболевания сетчатки, в которых нейродегенерация играет существенную роль, можно лечить и/или предотвращать с помощью местного офтальмологического введения (глазные капли) указанных соединений.
В настоящее время необходимы альтернативные виды лечения нейродегенеративных заболеваний сетчатки. В конкретном случае DR и связанного с ним микрососудистого нарушения или повреждения сетчатки необходимы альтернативные виды лечения фоновой ретинопатии или непролиферативной DR, а также для защиты нейросетчатки от повреждения (приводящего к потере нейронов). Следовательно, необходимы новые фармакологические виды лечения для ранних стадий заболевания, когда начинается нейродегенерация. Раннее лечение DR и любой другой нейродегенерации сетчатки будет эффективным в снижении прогрессирования до поздних стадий, требующих агрессивных видов лечения, таких как лазерная фотокоагуляция, интравитреальные инъекции кортикостероидов или средств против VEGF или хирургическое вмешательство.
Сущность изобретения
Авторы настоящего изобретения обнаружили, что DDP-4 присутствует в сетчатке человека и в высокой степени экспрессируется в сетчатке, а именно в пигментном эпителии сетчатки (RPE) пациентов, страдающих сахарным диабетом. Исследовали ингибиторы фермента DPP-4 (действующие посредством конкурентного ферментативного ингибирования, такие как ситаглиптин, или являющиеся блокаторами комплекса субстрат-фермент, такие как саксаглиптин), и неожиданно они достигали сетчатки при нанесении местно в глаз (т.е. в роговицу или свод конъюнктивы или склеру, иными словами, путем офтальмологического нанесения на поверхность глаза), несмотря на их молекулярные массы и сложность структур. Указанные ингибиторы даже являлись способными защищать и предотвращать дегенерацию сетчатки и просачивание из сосудов. Указанные соединения действовали как нейропротекторы сетчатки (в частности нейросетчатки, которая является частью сетчатки, включая в себя нейроны, но без пигментного эпителия сетчатки).
Следует подчеркнуть, что местное введение ингибиторов согласно настоящему изобретению не только достигает сетчатки, но также достигает эффективных концентраций для подавления развития ранних стадий DR путем предотвращения нарушения BRB и профилактики или лечения микрососудистого нарушения, связанного с DR. Это нарушение в основном обнаруживают по просачиванию белков из сосудов сетчатки.
Таким образом, согласно первому аспекту настоящее изобретение относится к ингибиторам DPP-4 или их фармацевтически приемлемой соли или сольвату для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративного заболевания сетчатки.
Местное офтальмологическое лечение и/или профилактика представляет собой лечение и/или профилактику, таким образом наносимые на поверхность глаза (т.е. на роговицу, склеру или свод конъюнктивы), вследствие того, что на удивление и неожиданно указанные ингибиторы могут достигать сетчатки при применении местно на глаза (т.е. при офтальмологическом введении лекарственного средства). Это применимо к любому из вариантов осуществления и комбинации вариантов осуществления, раскрытых в настоящем изобретении.
С учетом существующего уровня техники неожиданным было то, что молекулы с высокой молекулярной массой и химически сложные с точки зрения их гидрофобной (липофильной) и гидрофильной частей смогли достичь сетчатки, будучи введенными местно на поверхность роговицы, склеру или конъюнктиву. Как показано выше, соединению, подлежащему нанесению на роговицу, склеру или свод конъюнктивы, и которое затем должно достичь сетчатки, необходимо преодолеть несколько барьеров с различной липофильной и гидрофильной природой. Таким образом, настоящее изобретение обеспечивает реальный вклад в настоящую область техники, путем демонстрации того, что ингибиторы DPP-IV, обычно используемые антидиабетические лекарственные средства, также можно наносить местно на глаз, с тем чтобы способствовать профилактике некоторых из наиболее неблагоприятных сопутствующих заболеваний при сахарном диабете; нейродегенеративных заболеваний сетчатки, включая в себя, в частности, диабетическую ретинопатию.
Таким образом, назревшая потребность в области офтальмологии также была решена путем получения ингибиторов DPP-4, которые посредством местного введения в глаза или в качестве ингредиентов местных композиций (таким образом, местных глазных композиций), могут достигать сетчатки и проявлять по отношению к ней нейропротективный эффект. Кроме того, местное введение этих ингибиторов ограничивает их действие на глаз и минимизирует связанные с этим системные неблагоприятные эффекты.
Этот аспект настоящего изобретения также можно сформулировать как применение ингибиторов дипептидилпептидазы-4 или их фармацевтически приемлемой соли или сольвата для получения лекарственного средства для местного офтальмологического лечения и/или профилактики нейродегенеративных заболеваний сетчатки, в частности, для местного офтальмологического лечения и/или профилактики повреждения сетчатки на ранних стадиях нейродегенеративных заболеваний сетчатки и связанного с ними микрососудистого нарушения или повреждения сетчатки, в частности, на ранних стадиях DR, вследствие нейропротективного эффекта ингибиторов. Настоящее изобретение также относится к способу местного офтальмологического лечения и/или профилактики нейродегенеративных заболеваний сетчатки, в частности, нейропротекции на ранних стадиях нейродегенеративных заболеваний сетчатки, в частности на ранних стадиях DR и связанного с ней микрососудистого нарушения или повреждения сетчатки, предусматривающему введение (что означает местное введение в глаз) ингибитора дипептидилпептидазы-4 или его фармацевтически приемлемой соли или сольвата вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями нуждающемуся в этом субъекту, включая в себя человека.
Кроме того, авторы настоящего изобретения демонстрируют, что путем ингибирования DPP-4 сетчатки, таким образом, непосредственно воздействуя через этот фермент, расположенный в сетчатке, нейродегенеративные заболевания сетчатки, в частности, с ранними стадиями нейродегенеративных заболеваний сетчатки и связанным с ними микрососудистым нарушением или повреждением сетчатки, можно лечить не как вторичный эффект снижения уровня глюкозы в крови, но благодаря прямому действию на фермент сетчатки. Следовательно, настоящее изобретение также относится к ингибиторам DPP-4 или их фармацевтически или ветеринарно приемлемой соли для применения в лечении и/или профилактике нейродегенеративного заболевания сетчатки; в частности, для местного офтальмологического лечения и/или профилактики повреждения сетчатки на ранних стадиях нейродегенеративных заболеваний сетчатки и связанного с ними микрососудистого нарушения или повреждения сетчатки.
Другой аспект настоящего изобретения представляет собой фармацевтическую или ветеринарную местную глазную композицию для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративного заболевания сетчатки, которая содержит эффективное количество ингибитора дипептидилпептидазы-4 или его фармацевтически или ветеринарно приемлемой соли или сольвата и их смесей вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями.
Последний аспект представляет собой фармацевтические или ветеринарные местные композиции, содержащие терапевтически эффективное количество ингибитора DPP-4 или его фармацевтически или ветеринарно приемлемой соли вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями, причем композиция характеризуется динамической вязкостью, составляющей 5,0 × 10-4 Па·с - 300 Па·с, при 20°C, pH от 4,5 до 9,0, и при этом ингибитор дипептидилпептидазы-4 находится в концентрации, составляющей 5 мг/мл - 200 мг/мл по отношению к конечному объему композиции.
Краткое описание чертежей
Фиг. 1 представляет собой график со столбиками, показывающими концентрацию DPP-4 (нг/мл) в кишечнике, печени и сетчатке человека (RPE и нейросетчатке). Белые столбики: недиабетические доноры. Черные столбики: диабетические доноры. * p <0,05
Фиг. 2 представляет собой графическое изображение с процентным отношением TUNEL-положительных клеток в слоях сетчатки. Процентное отношение TUNEL (терминальное дезоксиуридиновое мечение концов разорванной нити ДНК)-положительных клеток для демонстрации апоптоза было значительно выше (p <0,001) у мышей db/db, получивших лечение с помощью несущей среды (D-плацебо) по сравнению с другими группами (D-saxa и контроль) во всех слоях сетчатки (внешний ядерный слой, ONL; внутренний ядерный слой, INL; и слой ганглиозных клеток, GCL). N = 10 мышей на группу (минимум 10 срезов на сетчатку). Saxa: саксаглиптин.
Фиг. 3 представляет собой график со столбиками с концентрацией глутамата в сетчатке (мкмоль/г белка) в исследуемых группах. * p <0,05 по сравнению с другими группами. Saxa: саксаглиптин.
Фиг. 4 представляет собой график со столбиками с количественным определением иммунофлуоресценции GLAST в условных единицах (A.U.). n=10 мышей на группу. Результаты представляют собой среднее ± SD. *p <0,05 между мышами db/db, получившими лечение с помощью несущей среды (D-плацебо), и другими группами (D-саксаглиптин и контроль (db/+)).
На фиг. 5 показаны кривые электроретинографии (ERG) в ответ на интенсивность стимулов, составляющую 3200 кандел (кд)с/м2 (панель A) и 12800 кандел (кд)с/м2 (панель B) у репрезентативной недиабетической мыши (C(db/+)), мыши db/db, получившей лечение с помощью несущей среды (D-плацебо), и мыши db/db, получившей лечение с помощью саксаглиптина (D-саксаглиптин). Средние значения амплитуды измеряют в микровольтах (мкВ); T означает время в миллисекундах (мс).
На фиг. 6 (A) показано просачивание из сосудов связанного с сывороточным альбумином голубого Эванса, визуализированное с помощью конфокального лазерного сканирующего микроскопа. Количество и степень просачивания комплекса голубого Эванса с альбумином визуализируют и показывают стрелками в группе D-плацебо. На нижней панели фиг. 6 (B) количественное определение иммунофлуоресценции альбумина на цифровых изображениях, полученных с помощью лазерного сканирующего микроскопа Fluoview FV 1000, показано в условных единицах (A.U.). Результаты представляют собой среднее ± SD. *p <0,05 между мышами db/db, получившими лечение с помощью несущей среды (D-плацебо), и другими группами: D-саксаглиптин и C(db/+).
На фиг. 7, относящейся к примеру 3, показано процентное отношение TUNEL-положительных клеток в слоях сетчатки у мышей db/db, получивших лечение с помощью несущей среды (D-плацебо), по сравнению с другими группами (D-ситаглиптин и контроль (db/+)) во всех слоях сетчатки (* p <0,01). ONL: внешний ядерный слой; INL: внутренний ядерный слой; GCL: слой ганглиозных клеток. N=10 мышей на группу (минимум 10 срезов на сетчатку).
Фиг. 8 представляет собой график со столбиками с концентрацией глутамата в сетчатке (мкмоль/г белка) в исследуемых группах. * p <0,05 по сравнению с другими группами. Sita: ситаглиптин.
На фиг. 9 (A) показано просачивание из сосудов связанного с сывороточным альбумином голубого Эванса, визуализированное с помощью конфокального лазерного сканирующего микроскопа. Количество и степень просачивания комплекса голубого Эванса с альбумином визуализируют и показывают стрелками в D-плацебо. На нижней панели фиг. 9 (B) количественное определение иммунофлуоресценции альбумина на цифровых изображениях, полученных с помощью лазерного сканирующего микроскопа Fluoview FV 1000, показано в условных единицах (A.U.). Результаты представляют собой среднее ± SD. *p <0,05 между db/db мышами, получившими лечение с помощью несущей среды (D-плацебо), и другими группами: D-ситаглиптин и C (db/+).
Подробное описание изобретения
Для содействия пониманию предусмотрены следующие определения.
В контексте настоящего изобретения термин “нейропротекция” означает любой вид лечения или профилактический способ, который можно использовать для того, чтобы нейроны, составляющие нейросетчатку, сохранялись и оставались в физиологическом состоянии, соответствующем одному из здоровых животных-субъектов (включая в себя людей). “Нейросетчатка” представляет собой часть сетчатки, включая в себя нейроны и не включая в себя пигментный эпителий сетчатки. Нейросетчатка отвечает за цикл превращений родопсина.
Выражение “нейропротекция на ранних стадиях диабетической ретинопатии” относится к любому способу лечения или профилактическому способу, проводимому до установления поздних стадий DR.
“Ранние стадии диабетической ретинопатии” следует понимать как время, в течение которого, вследствие наличия сахарного диабета, функциональные патологические изменения можно обнаружить в глазу (т.е. цветоразличение, контрастная чувствительность и электроретинографические патологические изменения), но характер микрососудистых изменений DR еще полностью не развился, иными словами, нельзя заметить типичные поражения непролиферативной DR.
“Микрососудистое нарушение или повреждение сетчатки, связанное с диабетической ретинопатией” следует понимать как включающее в себя такие патологические изменение микрососудов сетчатки, как генерализованное и фокальное сужение артериол, а также артериовенозное сужение, которое отражает кумулятивное повреждение сосудов вследствие диабетической ретинопатии (на ранней или поздней стадии заболевания). Это микрососудистое нарушение или повреждение сетчатки в основном обнаруживают по наличию просачивания из сосудов сетчатки, позволяющего обнаруживать белки (например, экстравазацию альбумина) из крови внутри кровеносных сосудов сетчатки в разные слои сетчатки.
Используемое в настоящем документе выражение "терапевтически эффективное количество" относится к количеству соединения, которое при введении является достаточным для предотвращения развития или облегчения до некоторой степени одного или нескольких симптомов рассматриваемого заболевания. Конкретная доза соединения, вводимого согласно настоящему изобретению, будет, безусловно, определяться конкретными обстоятельствами, связанными с конкретным случаем, включая в себя вводимое соединение, путь введения, конкретное состояние, подлежащее лечению, и аналогичные соображения.
Используемый в настоящем документе термин "фармацевтически или ветеринарно приемлемый" относится к соединениям, материалам, композициям и/или лекарственным формам, которые в рамках здравого медицинского и ветеринарного суждения являются подходящими для применения в контакте с тканями субъекта (например, человека или любого другого животного) без существенной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримо с разумным соотношением риск/польза. Каждый носитель, вспомогательное вещество и т.д. также должен являться "приемлемым" в смысле совместимости с другими ингредиентами фармацевтической композиции. Он также должен являться подходящим для применения в контакте с тканью или органом людей и животных без чрезмерной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений, соизмеримо с разумным соотношением риск/польза. Подходящие носители, вспомогательные вещества и т.д. можно найти в стандартных фармацевтических текстах, и они включают в себя в качестве примера консерванты, агглютинирующие средства, увлажняющие средства, смягчающие средства и антиоксиданты.
Как показано выше, авторы настоящего изобретения предлагают новый терапевтический подход в отношении нейродегенеративных заболеваний сетчатки (заболеваний сетчатки, при которых нейродегенерация играет существенную роль), который, помимо того, что является неагрессивным, применим при лечении ранних стадий указанных заболеваний и, в частности, при лечении ранних стадий DR и связанных с DR микрососудистых нарушений сетчатки глаза, выявленных по просачиванию из сосудов сетчатки.
Согласно конкретному варианту осуществления первого аспекта настоящего изобретения ингибитор DPP-4 предусмотрен для применения путем ингибирования дипептидилпептидазы-4 сетчатки. Иными словами, местное лечение в глазу происходит вследствие прямого ингибирования фермента DPP-4 в сетчатке.
Согласно другому конкретному варианту осуществления ингибиторы DPP-4 выбраны из группы, состоящей из ситаглиптина, саксаглиптина, вилдаглиптина, линаглиптина, анаглиптина, тенелиглиптина, алоглиптина, трелаглиптина, гемиглиптина, омариглиптина, их фармацевтически приемлемых солей или сольватов и их смесей.
Согласно конкретному варианту осуществления первого аспекта настоящего изобретения ингибитор DPP-4 для применения, как показано выше, представляет собой конкурентный ферментативный ингибитор DPP-4, и он выбран из группы, состоящей из ситаглиптина, линаглиптина, алоглиптина, их фармацевтически приемлемых солей или сольватов и их смесей.
Согласно еще одному конкретному варианту осуществления первого аспекта настоящего изобретения ингибиторы DPP-4 для местного офтальмологического лечения и/или профилактики нейродегенеративных заболеваний сетчатки представляют собой блокатор комплекса субстрат-фермент DPP-4, и они выбраны из группы, состоящей из соединения согласно формуле саксаглиптина, вилдаглиптина, анаглиптина, их фармацевтически приемлемых солей или сольватов и их смесей.
Согласно еще более конкретному варианту осуществления ингибитор DPP-4 представляет собой саксаглиптин. Согласно другому также более конкретному варианту осуществления ингибитор DPP-4 представляет собой ситаглиптин.
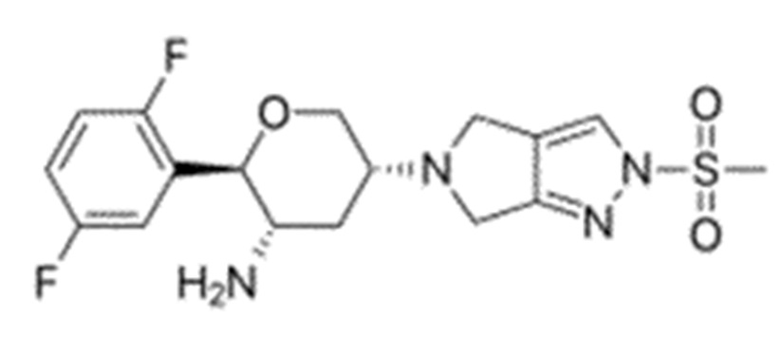
Химические формулы всех указанных конкретных соединений перечислены в ниже. В соответствии с их структурной формулой ингибиторы DPP-4 можно сгруппировать по сходным функциональным группам или сходным частями молекул:

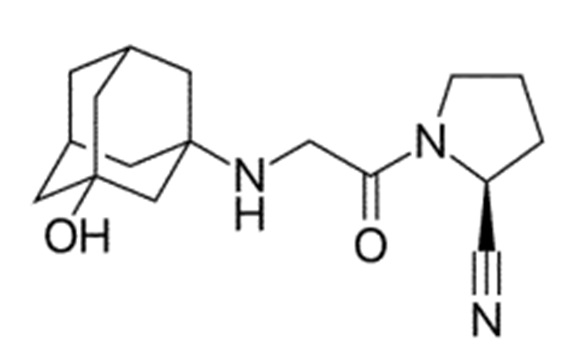
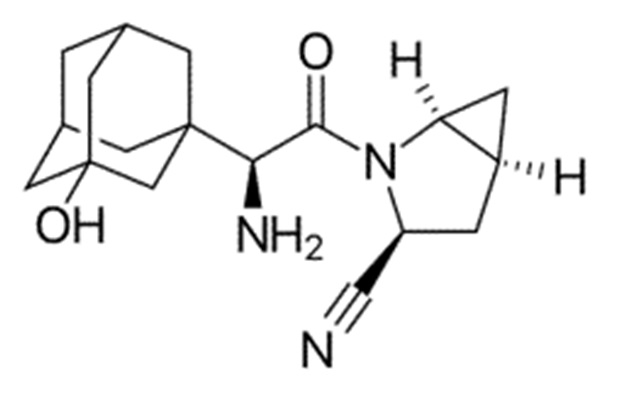
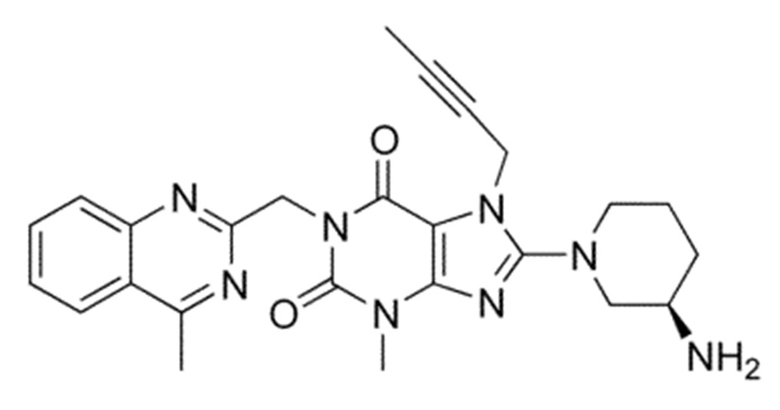
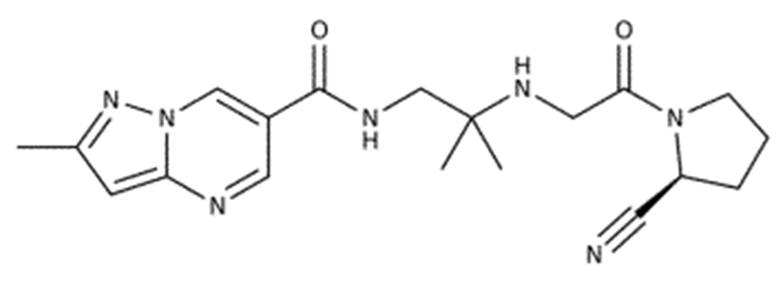
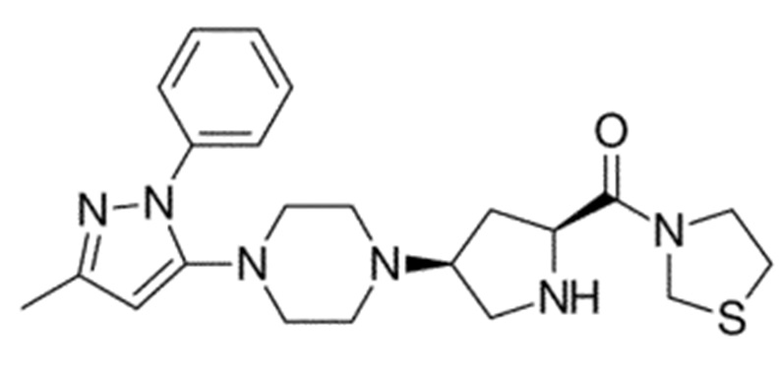
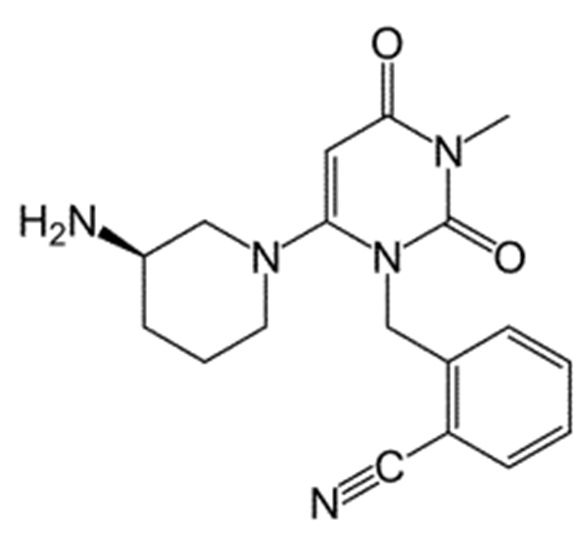
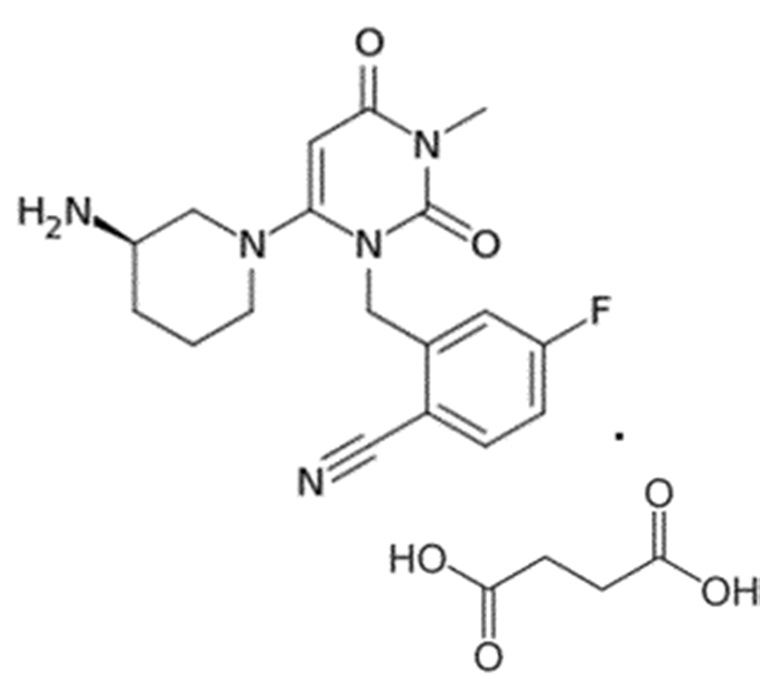
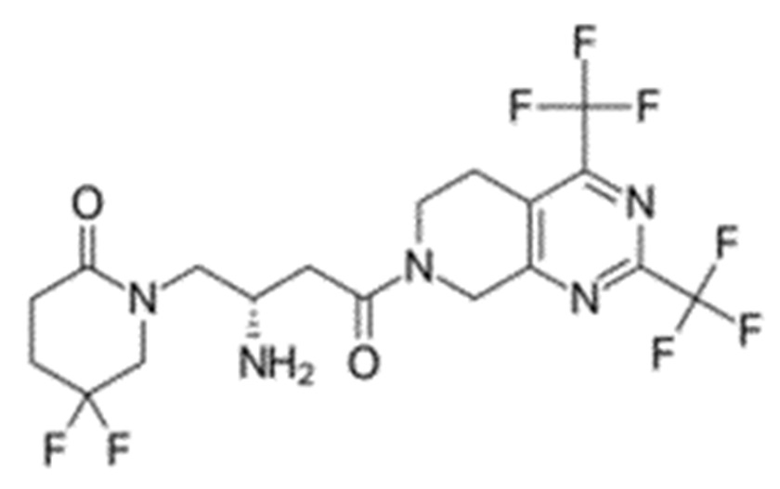
Другие применимые ингибиторы DPP-4 представляют собой дутоглиптин (и его тартратная соль) и лупеол.
Согласно конкретному варианту осуществления ингибитор DPP-4 для применения в местном офтальмологическом лечении и/или профилактике согласно настоящему изобретению предусмотрен для применения в лечении и/или профилактике нейродегенеративного заболевания сетчатки, выбранного из группы, состоящей из DR, возрастной макулярной дегенерации, глаукомы и пигментного ретинита.
Согласно предпочтительному варианту осуществления ингибитор DPP-4 предусмотрен для применения в лечении и/или профилактике диабетической ретинопатии и связанного с DR микрососудистого нарушения сетчатки. Это означает, что микрососудистое нарушение или повреждение сетчатки, происходящее при DR и, как правило, обнаруживаемое по просачиванию белков из сосудов сетчатки в слои сетчатки, можно лечить с помощью местного офтальмологического введения ингибиторов DPP-4.
Кроме того, согласно другому предпочтительному варианту осуществления ингибитор DPP-4 предусмотрен для применения в местном офтальмологическом лечении и/или профилактике ранних стадий DR.
В частности, на указанных ранних стадиях, когда DR еще не установлена, ингибиторы согласно настоящему изобретению, нанесенные местно, действуют как нейропротективные средства для нейросетчатки, таким образом проявляя нейропротективный эффект, как будет проиллюстрировано в примерах ниже. Нейроны предохраняются от повреждения и потери функции и сохраняются в здоровом физиологическом состоянии. Те же рассуждения применимы и к другим нейродегенеративным заболеваниям сетчатки. Действительно, пептиды можно использовать благодаря их нейропротективным свойствам.
Ниже представлен краткий обзор развития диабетической ретинопатии. Метаболические пути, запускаемые гипергликемией, и сама по себе гипергликемия, приводят к DR, но необходим период времени, составляющий не менее пяти лет, прежде чем DR можно диагностировать при офтальмоскопическом обследовании. Первая стадия, которую можно увидеть, представляет собой фоновую ретинопатию или непролиферативную диабетическую ретинопатию (NPDR) (которую устанавливают по микроаневризмам, микрогеморрагиям и твердым экссудатам). На этой стадии отсутствует специфическое лечение, кроме стандартного последующего наблюдения за субъектом с сахарным диабетом. На этой стадии естественная история болезни может следовать по двум направлениям, которые не исключают друг друга. Одним из них является развитие клинически значимого диабетического макулярного отека (DMO), при котором наиболее важным патогенным элементом является разрушение гематоретинального барьера (BRB). Этот путь чаще встречается у пациентов с сахарным диабетом 2 типа. Другое направление относится к пролиферативной диабетической ретинопатии (PDR), которая чаще встречается при сахарном диабете 1 типа. В этом последнем случае существенную роль капиллярная окклюзия играет, создавая дисбаланс между ангиогенными и антиангиогенными факторами, что в конечном итоге стимулирует неоваскуляризацию (отличительный признак PDR). Однако даже до того, как NPDR можно обнаружить при офтальмологическом обследовании, существует нейродегенерация сетчатки и просачивание из сосудов. Агрессивные виды лечения проводятся при установлении DMO и PDR. Указанные виды лечения включают в себя фотокоагуляцию (PGC), интравитреальные инъекции кортикостероидов и/или средства против фактора роста эндотелия сосудов (IVTR) и витрэктомию (VTR).
С помощью ингибиторов DDP-4 для применения в местном офтальмологическом лечении и/или профилактике DR согласно настоящему изобретению можно избежать некоторых из этих агрессивных видов лечения, если на ранних стадиях заболевания, когда можно обнаружить функциональные патологические изменения (т.е. цветоразличение, контрастная чувствительность и электроретинографические патологические изменения) и просачивание из сосудов, субъект получает соединения, содействующие нейропротекции сетчатки. Таким образом, если сетчатка защищена от последствий хронических уровней глюкозы в крови, основные осложнения можно минимизировать, или даже они никогда не возникнут при действительном улучшении качества жизни пациентов с сахарным диабетом. Местное введение в глаз ингибиторов DPP-4, раскрытых выше, представляет собой несомненное преимущество, избегая дальнейших агрессивных видов лечения.
Защита от нейродегенерации сетчатки, выявленной с помощью нескольких офтальмологических исследований, представляет собой хороший подход для лечения DR до развития патологических изменений сосудов. На ранних стадиях DR существует нейродегенерация (что можно обнаружить по потере как цветоразличения, так и контрастной чувствительности, глиальной активации и апоптоза нервных клеток). Ингибиторы DPP-4 для местного введения (местного введения в глаз) согласно настоящему изобретению являются применимыми на этих ранних стадиях, когда не назначают никакого лечения и рекомендуется только последующее наблюдение до тех пор, пока не будут установлены поздние стадии развития DR (клинически значимый диабетический макулярный отек и/или пролиферативная диабетическая ретинопатия).
Лечение на ранних стадиях DR характеризуется несомненным преимуществом в том, что позволяет избежать дополнительных осложнений, а именно следующего: микроаневризмы, микрогеморрагии, твердые экссудаты, капиллярная окклюзия и неоваскуляризация.
Согласно другому варианту осуществления ингибиторы DPP-4 для применения согласно настоящему изобретению представляют собой ингредиенты (компоненты) фармацевтических или ветеринарных местных глазных композиций, причем указанные композиции содержат по меньшей мере один ингибитор DPP-4, как определено выше, и любые фармацевтически или ветеринарно приемлемые местные носители и/или вспомогательные вещества.
Как показано выше, другой предмет настоящего изобретения представляет собой фармацевтическую или ветеринарную местную композицию для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративного заболевания сетчатки, которая содержит эффективное количество ингибитора дипептидилпептидазы-4 или его фармацевтически или ветеринарно приемлемой соли или сольвата и их смесей вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями.
Согласно конкретному варианту осуществления этого второго аспекта настоящего изобретения фармацевтические или ветеринарные местные глазные композиции для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративных заболеваний сетчатки содержат по меньшей мере один ингибитор DPP-4, выбранный из группы, состоящей из ситаглиптина, саксаглиптина, вилдаглиптина, линаглиптина, анаглиптина, тенелиглиптина, алоглиптина, трелаглиптина, гемиглиптина, омариглиптина. Конкретные носители и/или вспомогательные вещества относятся к воде, солевым буферам и смесям воды в масле или масла в воде. Конкретные вспомогательные вещества выбраны из консервантов, агглютинирующих средств, увлажняющих средств, смягчающих средств и антиоксидантов.
Согласно конкретному варианту осуществления этого второго аспекта настоящего изобретения фармацевтические или ветеринарные местные глазные композиции для применения, как указано выше, дополнительно содержат соединение, выбранное из группы, состоящей из GLP-1 млекопитающего, конкретно GLP-1 человека (UniProt: P01275), лираглутида, эксенатида, ликсисенатида, их солей и их смесей.
GLP-1 (глюкагоноподобный пептид-1) представляет собой эндогенный инсулинoтропный пептид, который секретируется L-клетками желудочно-кишечного тракта в ответ на прием пищи (“инкретиновый ответ”). GLP-1, действуя через свой рецептор (GLP-1R), характеризуется сильными эффектами на зависимую от глюкозы секрецию инсулина, экспрессию гена инсулина, регенерацию островковых бета-клеток, моторику желудочно-кишечного тракта, энергетический гомеостаз и потребление пищи. Рецептор GLP-1 (GLP-1R) является представителем семейства связывающих пептидные гормоны рецепторов класса B1 (секретиноподобные рецепторы) 7-спиральных трансмембранных, гетеротримерных, связанных с G-белком рецепторов (GPCR). GLP-1R характеризуются широким распределением, и они встречаются в поджелудочной железе, жировой ткани, мышцах, сердце, желудочно-кишечном тракте и печени. Кроме того, GLP-1R встречается повсеместно в центральной нервной системе (т.е. в гипоталамусе, полосатом теле, стволе головного мозга, черном веществе и субвентрикулярной зоне), и существуют некоторые доказательства того, что стимуляция GLP-1R с помощью GLP-1 проявляет нейропротективные эффекты как на центральную, так и на периферическую нервные системы.
GLP-1 человека представляет собой пептид из 37 аминокислотных остатков, происходящий из препроглюкагона, который синтезируется, среди прочего, в L-клетках в дистальной подвздошной кишке, в поджелудочной железе и в головном мозге. Препроглюкагон человека идентифицирован с идентификационным номером P01275 в базе данных UniProt 6 февраля 2007 г; версия 3. Процессинг препроглюкагона с получением GLP-1 (7-36)амида, GLP-1(7-37) и GLP-2 происходит, главным образом, в L-клетках. Для описания фрагментов и аналогов этого пептида используют простую систему. Таким образом, например, Gly8-GLP-1(7-37) обозначает фрагмент (аналог) GLP-1, формально происходящий из GLP-1 путем делеции аминокислотных остатков 1 - 6 и замещения встречающегося в природе аминокислотного остатка в положении 8 (Ala) на Gly. Аналогично, Lys34(Nε-тетрадеканоил)-GLP-1 (7-37) обозначает GLP-1(7-37), где ε-аминогруппа остатка Lys в положении 34 была подвергнута тетрадеканоилированию.
Конкретные аналоги GLP-1 включают в себя лираглутид (который также называется Arg34Lys26(Nε-(γ-глутамил(Nα-гексадеканоил)))-GLP-1 (7-37)) и с номером согласно CAS 204656-20-2 (SEQ ID NO: 1).
Ликсисенатид представляет собой другой аналог GLP-1 (т.е. агонист GLP-1) с аминокислотной последовательностью HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPSKKKKKXaa1, где Xaa1 представляет собой остаток лизина, в котором конец -COOH модифицирован (амидирован) с помощью группы -NH2 (в настоящем описание также раскрыт как SEQ ID NO: 2). Номер согласно CAS представляет собой 827033-10-3.
Эксенатид представляет собой соединение, характеризующееся номером согласно CAS 141732-76-5. Он представляет собой пептид с аминокислотной последовательностью HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPXaa1, где Xaa1 представляет собой остаток серина, в котором концевой -COOH модифицирован (амидирован) с помощью группы -NH2 (в настоящем описании также раскрыт как SEQ ID NO: 3)
Предпочтительные фармацевтические или ветеринарные местные глазные композиции выбраны из группы, состоящей из растворов (например, глазных капель), кремов, лосьонов, мазей, эмульсий, аэрозолей и неаэрозольных спреев, гелей, притираний и суспензий. Как показано выше, фармацевтические или ветеринарные местные глазные композиции следует понимать как местные глазные композиции, наносимые на роговицу, склеру или на свод конъюнктивы.
Указанные фармацевтические или ветеринарные местные глазные композиции также относятся к твердым или полутвердым матрицам или подложкам, в частности поддающимся биоэрозии и/или биоразлагаемым полимерным матрицам для доставки ингибиторов DPP-4, которые содержатся в матрицах.
Кроме того, композиции согласно настоящему изобретению могут содержать другие ингредиенты, такие как ароматические добавки, красители и другие компоненты, известные в настоящей области техники для применения в местных глазных составах.
Местные глазные композиции согласно настоящему изобретению можно получить в соответствии со способами, хорошо известными в настоящей области техники. Подходящие вспомогательные вещества и/или носители, а также любой pH-буфер и их количества смогут легко определить специалисты в настоящей области техники в соответствии с типом получаемого состава.
Примеры конкретных увлажняющих средств (которые также называются растворители - увлажняющие средства) выбраны из группы, состоящей из полиэтиленгликоля (ПЭГ общей формулы H(OCH2CH2)nOH; где n представляет собой среднее число оксиэтиленовых групп в полимере), пропиленгликоль, глицерин и их смеси. В контексте настоящего изобретения увлажняющее средство представляет собой соединение, характеризующееся свойствами растворителя и увлажняющего средства.
ПЭГ различных молекулярных масс широко используют в фармацевтических композициях (представляющих собой местные, парентеральные, офтальмологические, пероральные и ректальные композиции). Подходящие ПЭГ, подлежащие применению в местных глазных композициях для применения согласно настоящему изобретению, характеризуются молекулярной массой, составляющей 300-35000 г/моль, более конкретно 600-20000 г/моль, даже более конкретно 1000-8000 г/моль, более конкретно 3000-6000 г/моль и предпочтительно приблизительно 4000 г/моль.
Согласно конкретному варианту осуществления композиций для применения согласно настоящему изобретению увлажняющее средство содержится в количестве, составляющем 1% - 49% масс./объем. по отношению к общему объему композиции. Более конкретно 5% - 40%, даже 10% - 30% и даже более конкретно 15% - 25%.
Вспомогательные вещества, используемые в качестве pH-буферов, представляют собой вещества, обеспечивающие pH от 4,5 до 9,0, более конкретно от 4,5 до 8,5, даже более конкретно от 6,0 до 8,2 и предпочтительно от 7,0 до 8,1, даже более предпочтительно от 7,5 до 8,0. Примеры pH-буферов включают в себя цитратные соли (лимонная кислота/цитратный буфер), фосфатные соли (ортофосфорная/фосфатный буфер), боратные соли (борная кислота/боратный буфер) и их смеси, причем все соли являются фармацевтически приемлемыми. pH-буферы, кроме того, могут содержать аминокислоты, в частности аргинин, лизин и происходящее из аминов соединение, выбранное из метилглюкамина и трометамола, и их смеси.
Вспомогательные вещества и/или носители, более подходящие для липофильных композиций (что значает, что композиции не смешиваются с водой при 15-35°C), включают в себя синтетические или полусинтетические липофильные вспомогательные вещества, содержащие масло какао, растительные гидрогенизированные масла и твердые полусинтетические глицериды.
Другие компоненты в местной глазной (офтальмологической) композиции согласно настоящему изобретению включают в себя, согласно конкретным вариантам осуществления, поверхностно-активные вещества, растворители (органические и неорганические растворители; т.е. воду), способстввующие регулированию вязкости средства, консерванты, агглютинирующие средства, смягчающие средства и антиоксиданты, обеспечивающие изотоничность и/или изоосмотичность средства, мукоадгезивные полимеры, средство, усиливающие абсорбцию активного начала (т.е. ингибитора DPP-4). Среди поверхностно-активных веществ особенно применимыми являются глицериды, полисорбаты, натрийлаурилсульфат, фосфолипиды (такие как фосфатидилхолин или фосфатидилглицерин), жирные кислоты полиоксиэтилена, моно-, ди- и триглицериды, необязательно замещенные полиоксиэтиленом и их смеси.
Среди органических растворителей особенно применимыми в композициях являются рициновое масло, ПЭГ, полоксамеры, полисорбаты, глицерин, триглицериды с жирными кислотами с C6-C10 атомами углерода и их смеси.
Способствующие регулированию вязкости средства представляют собой, в частности, поливиниловый спирт, соединения, происходящие из целлюлозы, такие как метилцеллюлоза и гидроксипропилметилцеллюлоза, карбомеры, ПЭГ и их смеси. Консерванты представляют собой, в частности, борную кислоту, бензалконий хлорид, бензойную кислоту, п-гидроксибензойные сложные эфиры C1-C4-алькильный цепей, хлорбутанол, бензиловый спирт и их смеси.
Обеспечивающие изотоничность и/или изоосмотичность средства представляют собой, в частности, хлорид натрия, декстрозу, трегалозу, маннит, аминокислоты и их смеси. Средства, усиливающие абсорбцию активного начала, включают в себя сапонин, жирные кислоты, пирролидон, поливинилпирролидон, пировиногградную кислоту и их смеси. Мукоадгезивные полимеры (обычно используемые в качестве гелеобразующих средств) представляют собой, в частности, следующее: гиалуроновая кислота, полигалактуроновая кислота, полиакриловая кислота, хондроитин сульфат, метилeцеллюлоза, гидроксипропилметилцеллюлоза, желатин, метилцеллюлоза, ксантановая камедь, натрийкарбоксиметилцеллюлоза, хитозан, карбопол, геллановая камедь, пектин, альгинаты, каррагенаты и их смеси.
Эмульсионные и микроэмульсионные основы представляют собой, в частности, жирнокислотные ложные эфиры глицерина, полиоксиэтиленовые спирты, рициновое масло, триглицериды с жирными кислотами с C6-C10 атомами углерода и их смеси.
Кремовые и мазевые основы представляют собой, в частности, вазелин, парафин, ПЭГ, силиконы и смеси
Согласно предпочтительному варианту осуществления необязательно в комбинации с любыми вариантами осуществления выше или ниже местная глазная композиция согласно настоящему изобретению представляет собой раствор в форме глазных капель, который также называется раствор - глазные капли. Введение пептидов в форме глазных капель обеспечивает большое преимущество в простоте использования нуждающимся в этом субъектом и в том, что он не вызывает неприятные ощущения.
Композиции для применения согласно настоящему изобретению согласно конкретному варианту осуществления необязательно в комбинации с любым вариантом осуществления выше или ниже представляют собой композиции длительного высвобождения. Иными словами, композиции составлены в виде систем доставки с длительным высвобождением, обеспечивающих доставку активного начала (т.е. ингибиторов DPP-4) с заданной скоростью для поддержания постоянной концентрации лекарственного средства в течение установленного периода времени с минимальными побочными эффектами.
Конкретные составы для доставки длительного высвобождения содержат наночастицы и микрочастицы, инкапсулирующие ингибитор DPP-4, липосомы и неисомы, все из которых содержат соединение, выбранное из следующего: полимолочная кислота, сополимер молочной и гликолевой кислот, полистиролы, хитозан, альбумин, лектины, желатины, акрилаты и метакрилаты, поликапролактоны, полиакриламиды, декстраны, агароза, сорбитан, холестерин и их смеси. Другие конкретные составы для доставки длительного высвобождения содержат полимер, конъюгированный с ингибиторами DPP-4, составляя гидрогели.
Все указанные фармацевтические или ветеринарные местные глазные композиции согласно другому конкретному варианту осуществления второго аспекта необязательно в комбинации с любыми вариантами осуществления выше или ниже, являются применимыми в местном офтальмологическом лечении и/или профилактике нейродегенеративных заболеваний сетчатки, выбранных из группы, состоящей из диабетической ретинопатии (DR), возрастной макулярной дегенерации, глаукомы и пигментного ретинита. В частности, они являются применимыми в профилактике и/или лечении диабетической ретинопатии и связанного с ней микрососудистого нарушения или повреждения. Более конкретно, они являются применимыми в местном офтальмологическом лечении ранних стадий диабетической ретинопатии.
Как указано, настоящее изобретение в качестве другого аспекта предусматривает фармацевтическую или ветеринарную местную композицию, содержащую терапевтически эффективное количество ингибитора DPP-4 или его фармацевтически или ветеринарно приемлемой соли вместе с местные фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями, причем композиция характеризуется динамической вязкостью, составляющей 5,0 × 10-4 Па·с - 300 Па·с, pH от 4,5 до 9,0, и при этом ингибитор дипептидилпептидазы-4 находится в концентрации, составляющей 5 мг/мл - 200 мг/мл по отношению к конечному объему композиции.
Более конкретно фармацевтическая или ветеринарная местная композиция содержит терапевтически эффективное количество ингибитора DPP-4 или его фармацевтически или ветеринарно приемлемой соли вместе с местные фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями, причем композиция характеризуется динамической вязкостью, составляющей 5,0 × 10-4 Па·с - 300 Па·с при 20°C, pH от 4,5 до 9,0, и при этом ингибитор дипептидилпептидазы-4 находится в концентрации, составляющей 20 мг/мл - 200 мг/мл по отношению к конечному объему композиции.
В связи с этим фармацевтические или ветеринарные местные глазные композиции согласно настоящему изобретению являются жидкими композициями или полутвердыми композициями, характеризующимися консистенцией, характерной для крема или мази.
Когда в настоящем описании указано, что композиция характеризуется конкретной вязкостью в пределах диапазона, это относится к динамической вязкости. Таким образом, фармацевтические или ветеринарные местные композиции согласно настоящему изобретению характеризуются динамической вязкостью, составляющей 5,0 × 10-4 Па·с - 300 Па·с при комнатной температуре (т.е. 20 ±0,1°C) и нормальном атмосферном давлении. Согласно конкретному варианту осуществления этого третьего аспекта динамическая вязкость фармацевтической или ветеринарной местной композиции составляет 8,9 × 10-4 Па·с - 100 Па·с
Согласно Европейской фармакопее (8-е издание, 2.2.8 “Вязкость”) динамическая вязкость или коэффициент вязкости η представляет собой тангенциальную силу на единицу поверхности, известную как напряжение сдвига T и выражаемую в паскалях, необходимую для движения, параллельно плоскости скольжения, слоя жидкости в 1 кв. метр со скоростью (v) 1 метр в секунду относительно параллельного слоя на расстоянии (x) 1 метр. Соотношение dv/dx является градиентом скорости, дающим скорость сдвига D, выраженную в обратных секундах (с-1), так что η=T/D. Единицей динамической вязкости является паскаль-секунда (Па·с).
Все вспомогательные вещества и/или носители и буферы, упомянутые ранее, применимы к указанному другому аспекту.
В частности, указанные местные композиции с установленной вязкостью находятся в форме растворов (например, глазных капель), кремов, лосьонов (например, глазных лосьонов), мазей, эмульсий, аэрозолей и неаэрозольных спреев, гелей, притираний и суспензий. Все из них можно наносить на поверхность глаза (роговицу, конъюнктиву, склеру), и они позволяют ингибиторам DPP-4 высвобождаться для достижения сетчатки. Конкретные композиции представляют собой глазные капли, глазные лосьоны, полутвердые глазные препараты (т.е. мази, кремы или гели). Некоторые из глазных растворов и лосьонов можно получить во время введения из порошков глазных капель и порошков глазных лосьонов, поставляемых в сухой, стерильной форме для растворения или суспендирования в подходящей жидкой несущей среде.
Более конкретно, ингибиторы DPP-4, как указано ранее, выбраны из группы, состоящей из ситаглиптина, саксаглиптина, вилдаглиптина, линаглиптина, анаглиптина, тенелиглиптина, алоглиптина, трелаглиптина, гемиглиптина, омариглиптина и их смесей вместе с местные фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями.
Согласно другому конкретному варианту осуществления фармацевтических или ветеринарных местных глазных композиций согласно настоящему изобретению pH составляет от 5,5 до 7,5, более конкретно 7,0.
Согласно еще одному конкретному варианту осуществления фармацевтических или ветеринарных местных глазных композиций согласно настоящему изобретению ингибитор DPP-4 находится в концентрации, составляющей 50 мг/мл - 150 мг/мл по отношению к конечному объему композиции. Более конкретно концентрация составляет 50 мг/мл - 150 мг/мл.
Еще более конкретно, если ингибитор представляет собой саксаглиптин, он находится в концентрации, составляющей 80 мг/мл - 120 мг/мл по отношению к конечному объему композиции. Более конкретно концентрация составляет от 80 мг/мл до 100 мг/мл по отношению к конечному объему композиции. Конкретно она составляет 100 мг/мл по отношению к конечному объему композиции.
Еще более конкретно, если ингибитор представляет собой ситаглиптин, он находится в концентрации, составляющей 50 мг/мл - 120 мг/мл по отношению к конечному объему композиции. Более конкретно концентрация составляет 50 мг/мл - 80 мг/мл по отношению к конечному объему композиции. Конкретно она составляет 50 мг/мл по отношению к конечному объему композиции.
Во всем описании и формуле изобретения не подразумевается, что слово "содержат" и его вариации исключают другие технические признаки, добавки, компоненты или стадии. Более того, слово “содержат” охватывает случай “состоящий из”. Дополнительные объекты, преимущества и признаки согласно настоящему изобретению станут очевидны специалистам в настоящей области техники при изучении описания или могут быть изучены путем осуществления на практике настоящего изобретения. Следующие примеры и графические материалы приведены в качестве иллюстрации, и они не предназначены для ограничения настоящего изобретения. Кроме того, настоящее изобретение охватывает все возможные комбинации конкретных и предпочтительных вариантов осуществления, описанных в настоящем документе.
ПРИМЕРЫ
ПРИМЕР 1. Концентрация DPP-4 повышается в диабетических сетчатках людей
Экспрессию DPP-4 определяли в сетчатках людей от диабетических и недиабетических доноров. Сетчатки получали из Банка тканей (Tissue Bank) Центра авторов настоящего изобретения (Banc de Sang i Teixits Hospital Universitari Vall d’Hebron). Всего 8 диабетических доноров и 8 недиабетических доноров, совпадающих по возрасту и полу, включали в исследование. Одну глазную чашу извлекали для отделения нейросетчатки от пигментного эпителия сетчатки (RPE) и обе ткани немедленно замораживали с помощью жидкого азота и хранили при -80°C. Ткани, полученные из глазной чаши, использовали для исследований экспрессии генов и измерений белков. Другую глазную чашу также извлекали и как RPE, так и нейросетчатку пропитывали парафином и использовали для проведения иммуногистохимических исследований. Период времени от смерти до энуклеации глаза составлял 3,7±1,5 ч.
Процедура донорства глазной чаши и манипуляций с этим биологическим материалом строго регламентирована протоколом донорства Банка тканей (Tissue Bank) Центра авторов настоящего изобретения и одобрена этическим комитетом.
- Экстракция РНК и количественная ОТ-ПЦР:
Общую РНК экстрагировали с использованием реагента TRIzol® (Invitrogen, Madrid, Spain). Затем образцы РНК обрабатывали с помощью ДНКазы (Qiagen, Madrid, Spain) для удаления геномных примесей и очищали на колонке RNeasy MinElute (Qiagen, Madrid, Spain). Количество РНК измеряли на спектрофотометре Nanodrop и целостность определяли на биоанализаторе Agilent 2100. Обратную транскрипцию проводили с помощью набора High Capacity kit (Applied Biosystems, Madrid, Spain) со случайными гексамерными праймерами. ПЦР в режиме реального времени проводили с использованием праймеров для DPP-4.
- Измерение белка DPP-4:
Концентрацию DPP-4 оценивали в экстрактах сетчатки (RPE и нейросетчатки) с помощью количественного ферментного «сэндвич»-иммуноанализа (R&D Systems, Minneapolis, MN) с нижней границей обнаружения, составляющей 0,016 нг/мл.
- Иммуногистохимия
Срезы сетчатки глаз доноров-людей (8 недиабетических и 8 диабетических доноров) депарафинизировали в ксилоле и регидратировали в этаноле установленной степени чистоты. Для устранения аутофлуоресценции микроскопические препараты отмывали в перманганате калия. Затем срезы инкубировали в течение 1 ч в 2% BSA 0,05 % Tween в PBS для блокирования неспецифичностей. Первичное антитело инкубировали в течение ночи при 4°C в том же блокирующем буфере (1:500; Abcam, Cambridge, UK). Затем срезы отмывали и инкубировали с Alexa Fluor® 488 (Molecular Probes, Eugene, OR) при комнатной температуре в течение 1 ч. Микроскопические препараты накрывали покровными стеклами с каплей среды для заливки, содержащей DAPI для визуализации клеточных ядер (Vector Laboratories, Burlingame, CA). Изображения получали с помощью конфокального лазерного сканирующего микроскопа (FV1000, Olympus. Hamburg, Germany) с увеличением в 40 раз с использованием 488 нм и 405 нм спектральных линий излучения лазера и каждое изображение сохраняли с разрешением, составляющим 1024×1024 пикселей.
- Результаты:
DPP-4 экспрессировался в сетчатке человека. Повышенную экспрессию иРНК DPP-4 обнаруживали в RPE от диабетических доноров по сравнению с недиабетическими донорами (5,69 ±1,77 по сравнению с контролем 1,4±1,38, p <0,05). В нейросетчатке не наблюдали значимых различий между двумя группами.
Концентрация DPP-4 являлась значимо более высокой в RPE от диабетических доноров по сравнению с недиабетическими донорами (p <0,05). Все указанные данные отображены на фиг. 1, причем содержания DDP-4 (нг/мл) показаны в кишечнике (эталонные значения), печени (эталонные значения), RPE и нейросетчатке. Белые столбики: недиабетические доноры. Черные столбики: диабетические доноры. В нейросетчатке отсутствуют значимые различия между двумя группами. Иммуногистохимический анализ показал, что DPP-4 диффузно распределен по всей сетчатке.
ПРИМЕР 2. Саксаглиптин, введенный в глазных каплях, предотвращает нейродегенерацию сетчатки, вызванную сахарным диабетом
Нейропротективный эффект глазных капель, содержащих саксаглиптин, исследовали на модели с использованием db/db мышей. Сообщалось, что db/db мыши воспроизводят признаки нейродегенеративного процесса, который происходит в диабетическом глазу человека. В связи с этим, они представляют собой подходящую модель для исследования нейропротективных лекарственных средств (согласно Bogdanov et al., “The db/db mouse: a useful model for the study of diabetic retinal neurodegeneration”, PLoS One-2014, vol. no. 9(5):e97302). Всего 20 самцов мышей db/db (BKS.Cg- + Lepr db/+ Lepr db/OlaHsd) возрастом 10 недель приобретали у Harlan Laboratories, Inc. Кроме того, 10 недиабетических (db/+) мышей, совпадающих по возрасту, использовали в качестве контрольной группы.
Содержащие саксаглиптин или несущую среду глазные капли вводили непосредственно на верхнюю поверхность роговицы каждого глаза с использованием шприца. Одну каплю (5 мкл) саксаглиптина (1 мкM) в каждый глаз или несущей среды (5 мкл 0,9% хлорида натрия) в каждый глаз вводили дважды в день в течение 14 дней. На 15 день глаза животных закапывали каплей саксаглиптина или несущей среды приблизительно за один час до вскрытия. Это исследование было одобрено Комитетом по уходу за животными и их использованию института VHIR (Vall d’Hebron Research Institute). Все эксперименты проводили в соответствии с положениями Европейского сообщества (86/609/CEE) и ARVO (Ассоциация по исследованиям зрения и офтальмологии).
Записи данных полноформатной электроретинографии (ERG) измеряли с использованием платформы Ganzfeld ERG (Phoenix Research Laboratories, Pleasanton, CA) в соответствии с рекомендациями ISCEV (Международное сообщество клинической электрофизиологии зрения) (согласно Marmor et al., “Standard for clinical electroretinography.”, International Society for Clinical Electrophysiology of Vision (2004), Doc Ophthalmol-2004; vol.108, pp.:107-114).
- Измерения нейродегенерации:
(A) Измерения глиальной активации
Глиальную активацию оценивали с помощью лазерной сканирующей конфокальной микроскопии с использованием специфических антител к GFAP (глиальный фибриллярный кислый белок). Срезы фиксировали в кислом метаноле (-20°C) в течение 2 мин с последующими тремя отмывками с помощью PBS, по 5 мин каждая. Срезы пермеабилизировали с помощью TBS-Triton X-100 0,025% и инкубировали в блокирующем средстве (1% BSA и 10% козья сыворотка в PBS) в течение 2 ч при комнатной температуре. Срезы затем инкубировали с кроличьи антителом к GFAP (Abcam Ltd, Cambridge, U.K.) (1:500 разведение, полученное в блокирующем растворе) в течение ночи при 4°C во влажной атмосфере. После трех отмывок в PBS, по 5 мин каждая, срезы инкубировали со вторичным козьим антителом к антителу кролика Alexa 488 (Invitrogen) (1:200 разведение, полученное в блокирующем растворе). Срезы отмывали трижды в PBS, докрашивали с помощью Hoestch и заливали с помощью среды для заливки Mounting Medium Fluorescence (Prolong, Invitrogen) и накрывали покровным стеклом. Сравнительные цифровые изображения образцов регистрировали с помощью конфокального лазерного сканирующего микроскопа Olympus Fluoview FV 1000 с использованием идентичных настроек яркости и контрастности.
Для оценки степени глиальной активации использовали описанную ранее шкалу оценки на основании степени окрашивания GFAP (Anderson et al., “Glial and endothelial blood-retinal barrier responses to amyloid-beta in the neural retina of the rat”, Clin Ophthalmol-2008, vol. no. 2, pp.:801-816). Указанная шкала оценки является следующей: только область основания клеток Мюллера/GCL (показатель в баллах 1); область основания клеток Мюллера/GCL вместе с несколькими проксимальными процессами (показатель в баллах 2); основание клеток Мюллера вместе с многочисленными процессами, но не распространяющимся до ONL (показатель в баллах 3); основание клеток Мюллера вместе с повсеместными процессами, при этом некоторые из них в ONL (показатель в баллах 4); основание клеток Мюллера вместе с многочисленными процессами потемнения от GCL до наружного края ONL (показатель в баллах 5).
(B) Иммуногистохимический анализ для оценки апоптоза
Окрашивание TUNEL (терминальное дезоксиуридиновое мечение концов разорванной нити ДНК) проводили с использованием набора DeadEnd Fluorometric TUNEL System (PROMEGA, Madison, WI, USA). Криосрезы сетчатки пермеабилизировали путем инкубации в течение 2 мин на льду с 0,1% Triton X-100 в свежеприготовленном 0,1% цитрате натрия. Вторичное антитело представляло собой козье антитело к антителу кролика Alexa 488 (Invitrogen, San Diego CA, USA). Для оценки с помощью лазерной сканирующей конфокальной микроскопии длина волны возбуждающего света составляла 488 нм, и использовали обнаружение в диапазоне 515-565 нм (зеленый).
(C) Количественное определение глутамата
Количественное определение глутамата проводили с помощью обращенно-фазовой сверхвысокоэффективной жидкостной хроматографии (UPLC) (Acquity-UPLC, Waters) в виде аминохинолиновых производных (AccQ-Tag chemistry, MassTrak AAA method and instruments, Waters, Milford, MA).
(D) Иммуногистохимия в отношении GLAST
GLAST (глутамат-аспартатный транспортер), главный транспортер глутамата, оценивали с помощью флуоресцентной микроскопии с использованием специфических антител [кроличье антитело к GLAST (EAAT1) (1:100, Abcam ab416, Cambridge, UK).
Накопление глутамата во внеклеточном пространстве и избыточная активация глутаматных рецепторов (“эксайтотоксичность”) играют важную роль в нейродегенерации сетчатки. Транспортеры глутамата являются необходимыми для поддержания внеклеточной концентрации глутамата ниже нейротоксических уровней. Глутамат-аспартатный транспортер (GLAST) является наиболее преобладающим транспортером глутамата, отвечающим по меньшей мере за 50% поглощения глутамата в сетчатке млекопитающего.
- Результаты
Концентрация глюкозы в крови и масса тела в конце лечения являлись сходными у db/db мышей, получивших лечение с помощью содержащих саксаглиптин глазных капель, по сравнению с db/db мышами, получившими лечение с помощью несущей среды.
(A) Нейродегенерацию сетчатки предотвращали у диабетических мышей, получивших лечение с помощью саксаглиптина:
Глиальная активация
У недиабетических мышей экспрессия GFAP ограничивалась слоем ганглиозных клеток сетчатки (GCL), и, следовательно, показатель в баллах GFAP составлял ≤ 2. Диабетические мыши, получившие лечение с помощью несущей среды (D-плацебо), представляли значимо более высокую экспрессию GFAP, чем недиабетические мыши, совпадающие по возрасту (C (db/+)). Таким образом, 100% диабетических мышей представляли показатель в баллах GFAP, составляющий ≥3. Введение саксаглиптина (глазные капли) в течение двух недель (D-саксаглиптин) приводило к значимому уменьшению реактивного глиоза, и показатель в баллах GFAP мышей, получивших лечение с помощью саксаглиптина, составлял <3 во всех случаях. Все указанные данные извлекали из цифровых изображений (не показано) с помощью лазерного сканирующего микроскопа Fluoview FV 1000, показывающего иммунофлуоресценцию глиального фибриллярного кислого белка (GFAP) (зеленый) между репрезентативными образцами от db/db мыши, получившей лечение с помощью несущей среды (D-плацебо), db/db мыши, получившей лечение с помощью саксаглиптина (D-саксаглиптин), и недиабетической мыши (c(db/+)). Ядра метили с помощью Hoechst (синий), и четко просматривались внешний ядерный слой (ONL), внутренний ядерный слой (INL) и слой ганглиозных клеток (GCL).
Для понимания в следующей таблице 1 показано процентное отношение (%) положительного мечения GFAP:
Таблица 1
В этой таблице 1 показано количественное определение глиальной активации на основании степени окрашивания GFAP. Шкала оценки являлась следующей: только область основания клеток Мюллера/GCL (показатель в баллах 1); область основания клеток Мюллера/GCL вместе с несколькими проксимальными процессами (показатель в баллах 2); основание клеток Мюллера вместе с многочисленными процессами, но не распространяющимся до ONL (показатель в баллах 3); основание клеток Мюллера вместе с повсеместными процессами, при этом некоторые из них в ONL (показатель в баллах 4); основание клеток Мюллера вместе с многочисленными процессами потемнения от GCL до наружного края ONL (показатель в баллах 5). n = 10 мышей на группу (5 срезов сетчатки на мышей).
Апоптоз сетчатки
Скорость апоптоза являлась значимо более высокой у диабетических мышей, получивших лечение с помощью несущей среды, по сравнению с недиабетическими мышами во всех слоях сетчатки. Введение саксаглиптина (глазные капли) в течение двух недель приводило к значительному предотвращению апоптоза во всех слоях сетчатки, как выведено из фиг. 2, гистограмме, на которой показано процентное отношение (%) TUNEL-положительных клеток для мышей в группе D-плацебо (диабетические и не получившие лечение, которым несущую среду вводили в каждый глаз) D-Saxa (диабетические и получившие капли саксаглиптина) и контроля (недиабетические мыши).
(B) Введение саксаглиптина предотвращает увеличение глутамата, индуцированное сахарным диабетом
Содержания глутамата (мкмоль/г белка) в диабетических сетчатках были выше, чем в недиабетических сетчатках. У диабетических мышей, получивших лечение с помощью саксаглиптина, концентрация глутамата являлась значимо более низкой по сравнению с диабетическими мышами, получившими лечение с помощью несущей среды (p <0,05), и сходной с контрольными мышами (p=n.s). Данные показаны на фиг. 3 для контролей, мышей в группе D-плацебо и мышей S-Saxa, с теми же значениями, как представлены выше.
Объясняя эти данные, обнаружили, что глутамат-аспартатный транспортер (GLAST), главный транспортер глутамата, экспрессируемый клетками Мюллера, значительно снижался в сетчатках диабетических мышей, получивших лечение с помощью несущей среды (D-плацебо) по сравнению с недиабетическими мышами (контроль db/+), как показано на цифровых изображениях (не показано) с помощью лазерного сканирующего микроскопа Fluoview FV 1000, на которых показана иммунофлуоресценция глутамат-аспартатного транспортера (GLAST) (красный) между репрезентативными образцами от db/db мыши, получившей лечение с помощью несущей среды (D-плацебо), db/db мыши, получившей лечение с помощью саксаглиптина (D-саксаглиптин), и недиабетической мыши (контроль (db/+)). Ядра метили с помощью Hoechst (синий).
У диабетических мышей, получивших лечение с помощью саксаглиптина (D-саксаглиптин), эта отрицательная регуляция GLAST, индуцированная сахарным диабетом, предотвращалась, таким образом, также показывая красное окрашивание и напоминая изображение контроля.
Все указанные данные приведены на фиг. 4, где показано количественное определение GLAST иммунофлуоресценции в условных единицах (A.U.). n=10 мышей на группу. Результаты представляют собой среднее ± SD. *p <0,05 между db/db, получившими лечение с помощью несущей среды (D-плацебо), и другими группами (D-саксаглиптин и контроль (db/+).
(C) Местное введение саксаглиптина предотвращает нарушение гематоретинального барьера (BRB)
Для оценки эффекта саксаглиптина на раннее микрососудистое нарушение исследовали просачивание альбумина. Повышенную экстравазацию альбумина наблюдали у db/db мышей, получивших лечение с помощью несущей среды (D-плацебо), по сравнению с контрольными животными (C db/+). Лечение с помощью саксаглиптина (D-саксаглиптин, глазные капли) предотвращало просачивание альбумина у db/db/ мышей.
На фиг. 6 (A) показано просачивание через сосуды связанного с сывороточным альбумином голубого Эванса, визуализированного с помощью конфокального лазерного сканирующего микроскопа. Количество и степень просачивания комплексов голубого Эванса с альбумином (стрелки) явно увеличивалось в группе D-плацебо, чем в других группах. На нижней панели на фиг. 6 (B) показано количественное определение иммунофлуоресценции альбумина цифровых изображений с помощью лазерного сканирующего микроскопа Fluoview FV 1000. Иммуногистохимические изображения, полученные с помощью лазерного сканирующего микроскопа Fluoview FV 1000, из которых проводили количественное определение альбумина (красный), не показаны. Три типа исследуемых образцов являлись следующими: D-плацебо, D-саксаглиптин и C (db/+). Результаты представляют собой среднее ± SD. *p <0,05 между db/db, получившими лечение с помощью несущей среды (D-плацебо), и другими группами.
(D) Лечение с помощью саксаглиптина предотвращает патологические изменения в ERG, вызванные сахарным диабетом
Лечение с помощью саксаглиптина, введенного местно на глаз, предотвращало снижение амплитуды a-волны и b-волны, индуцированное сахарным диабетом, а также увеличение латентности a-волны и b-волны. Данные показаны на фиг. 5, где электроретинограммы (ERG) при 3200 кд*с/м2 (панель A) и при 12800 кд*с/м2 (панель B) представлены для мышей в группе D-плацебо (диабетические, получившие лечение с помощью несущей среды в виде глазных капель), контролей (C; d/+) и мышей группы D-саксаглиптина (диабетические, получившие лечение с помощью саксаглиптина в виде глазных капель). Среднюю амплитуду измеряли в микровольтах (мкВ); T означает время в миллисекундах (мс).
ПРИМЕР 3. Ситаглиптин, введенный местно (глазные капли), предотвращает нейродегенерацию сетчатки, вызванную сахарным диабетом.
Дизайн исследования и методология являлись такими же, как и используемые в примере 2. Результаты, полученные с использованием глазных капель ситаглиптина, являлись очень сходными с результатами, полученными с лечением с помощью глазных капель саксаглиптина.
Концентрация глюкозы в крови и масса тела в конце лечения являлись сходными у db/db мышей, получивших лечение с помощью глазных капель ситаглиптина (S-ситаглиптин), по сравнению с db/db мышами, получившими лечение с помощью несущей среды (D-плацебо).
Глиальная активация
Введение ситаглиптина (глазных капель) в течение двух недель приводило к значимому снижению реактивного глиоза, и показатель в баллах GFAP мышей, получивших лечение с помощью ситаглиптина, составлял ≤ 3 во всех случаях, как видно из данных в таблице 2.
Таблица 2.
Апоптоз сетчатки
Скорость апоптоза являлась значимо более высокой у диабетических мышей, получивших лечение с помощью несущей среды, чем у недиабетических мышей во всех слоях сетчатки. Введение ситаглиптина (глазных капель) в течение двух недель приводило к значительному предотвращению апоптоза во всех слоях сетчатки, как видно из фиг. 7, гистограмме, на которой показано процентное отношение (%) TUNEL-положительных клеток для мышей в группе D-плацебо (диабетические и получившие несущую среду - глазные капли; черные столбики слева в каждом наборе), группы D-ситаглиптина (получившие капли ситаглиптина; серые столбики посередине в каждом наборе) и контроля (db/+). Изображены данные для различных слоев сетчатки (слой ганглиозных клеток; GCL, внутренний ядерный слой; INN, и внешний ядерный слой; ONL). Процентное отношение TUNEL-положительных клеток являлось значимо более высоким у db/db мышей, получивших лечение с помощью несущей среды, по сравнению с другими группами во всех слоях сетчатки (* p <0,01). ONL: внешний ядерный слой; INL: внутренний ядерный слой; GCL: слой ганглиозных клеток. N=10 мышей на группу (минимум 10 срезов на сетчатку).
Лечение ситаглиптином (глазными каплями) также предотвращало накопление глутамата путем устранения отрицательной регуляции GLAST, индуцированной сахарным диабетом, тем же путем, что и саксаглиптин (фиг. 8). Кроме того, ситаглиптин также предотвращал функциональные патологические изменения, измеренные с помощью ERG.
В конец концов, ситаглиптин также сохранял барьерную функцию BRB. На фиг. 9 (A) показано просачивание из сосудов связанного с сывороточным альбумином голубого Эванса, визуализированного с помощью конфокального лазерного сканирующего микроскопа. Количество и степень просачивания комплексов голубого Эванса с альбумином (стрелки) явно увеличивалось в группе D-плацебо, чем в других группах. На нижней панели на фиг. 9 (B) показано количественное определение иммунофлуоресценции альбумина цифровых изображений с помощью лазерного сканирующего микроскопа Fluoview FV 1000. Иммуногистохимические изображения, полученные с помощью лазерного сканирующего микроскопа Fluoview FV 1000, из которых проводили количественное определение альбумина (красный), не показаны. Три типа исследуемых образцов являлись следующими: D-плацебо, D-ситаглиптин и C (db/+). Результаты представляют собой среднее ± SD. *p <0,05 между db/db, получившими лечение с помощью несущей среды (D-плацебо), и другими группами.
Экстравазацию альбумина наблюдали у db/db мышей, получивших лечение с помощью несущей среды (D-плацебо), по сравнению с контрольными животными (C db/+). Лечение с помощью ситаглиптина (D-ситаглиптин, глазные капли) предотвращало просачивание альбумина у db/db/ мышей.
Следует отметить, что все указанные эффекты глазных капель саксаглиптина и ситаглиптина наблюдали без какого-либо изменения содержаний глюкозы в крови и, следовательно, они не могут быть отнесены к изменениям в диабетической среде. Однако нельзя исключать активацию других путей, не связанных с рецептором GLP-1.
Хотя данные не показаны, ингибиторы DPP-4 (саксаглиптин и ситаглиптин), введенные с помощью глазных капель, приводили к значимому увеличению внутриретинального содержания GLP-1 и его главного нижележащего переносчика cAMP, таким образом, предотвращая нейродегенерацию и просачивание из сосудов у db/db мышей. Это не означает, что благоприятные эффекты ингибиторов DPP-4 должны быть обусловлены исключительно усилением GLP-1. Без ограничения какой-либо теорией авторы настоящего изобретения считают, что на самом деле ингибиторы DPP-4 сами по себе активируют несвязанные нисходящие сигнальные пути GLP-1R, которые могут быть вовлечены в нейропротекцию.
В связи с этим, Dietrich с соавт. [Dietrich N, Kolibabka M, Busch S, et al (2016) The DPP4 Inhibitor Linagliptin Protects from Experimental Diabetic Retinopathy. PLoS One 11:e0167853] недавно сообщили о том, что линаглиптин (ингибитор DPP-4) характеризуется нейропротективным эффектом у C. Elegans, модели нейродегенерации, вызванной высокими содержаниями глюкозы, которые не экспрессируют GLP-1R. Кроме того, следует отметить, что связанный с G-белком рецептор (GPcR), подобный рецептору 1 фактора коагуляции II (F2rl 1, ранее известный как Par2), который распространен в ганглиозных клетках сетчатки, можно активировать с помощью DPP-IV [Wronkowitz N, Görgens SW, Romacho T et al (2014) Soluble DPP4 induces inflammation and proliferation of human smooth muscle cells via protease-activated receptor 2. Biochim Biophys Acta 1842(9):1613-21]. После стимуляции F2rl1 стимулирует ангиогенез и воспаление и, следовательно, мог бы являться важной мишенью при лечении DR. Кроме того, было показано, что IL-1RA, конкурентный антагонист рецепторов IL-1β, представляет собой субстрат DPP-4 [Zhang H, Maqsudi S, Rainczuk A et al (2015) Identification of novel dipeptidyl peptidase 9 substrates by two-dimensional differential in-gel electrophoresis. FEBS J 282(19):3737-57]. Следовательно, ингибирование DPP-4 могло бы смягчить отрицательную роль IL-1β в патогенезе DR путем предотвращения расщепления IL-1RA.
Учитывая то, что неожиданно ингибиторы DPP-4 могли эффективно достигать сетчатки при введении местно на поверхность глаза (через роговицу, склеру или конъюнктиву), они также являются действительной альтернативой использованию GLP-1 или любого агониста GLP-1 местно на поверхность глаза для достижения сетчатки, поскольку вследствие своей непептидной природы они являются более стабильными и легкими в обращении при получении содержащих их композиций.
Провели статистический анализ полученных данных. Нормальное распределение переменных оценивали с использованием критерия Колмогорова-Смирнова. Данные представляли как среднее ± SD. Сравнение непрерывных переменных проводили с использованием непарного t-критерия Стьюдента. При проведении многочисленных сравнений использовали однофакторный дисперсионный анализ с последующим критерием Бонферрони. Сравнение между категориальными переменными выполняли с помощью точного критерия Фишера. Уровни статистической значимости устанавливали при p <0,05.
Все эти данные, взятые вместе, обеспечивают первое доказательство того, что местное офтальмологическое введение (глазные капли) ингибиторов DPP-4 характеризуется сильным эффектом на предотвращение нейродегенеративного процесса сетчатки, который возникает на ранних стадиях диабетической ретинопатии. Данные также свидетельствуют о том, что другие заболевания сетчатки, в которых нейродегенерация играет существенную роль (связанную или не связанную с сигнальным путем рецептора GLP-1), можно лечить и/или предотвращать с помощью местного офтальмологического введения (глазных капель) указанных соединений.
Ссылки, цитируемые с настоящей заявке
- Schmidt et al., “Neurodegenerative Diseases of the Retina and Potential for the Protection and Recovery”, Current Neuropharmacology - 2008, Vol. No. 6, pp.: 164-178.
- Simo et al., “Neurodegeneration is an early event in diabetic retinopathy: therapeutic implications”, Br. J. Ophthalmol. - 2012, vol. 96, pp.1285-1290.
- Urtti A et al., “Challenges and obstacles of ocular pharmacokinetics and drug delivery”. Adv. Drug. Deliv. Rev. 2006, vol. 58, pp. 1131-1135.
- Aiello et al., “Targeting Intraocular Neovascularization and Edema - One Drop at a Time”, N. Eng. J Med - 2008, vol. 359, pp. 967-969.
- Malhotra et al., “Permeation through cornea”, Indian Journal of Experimental Biology-2001, vol. no. 39, pp.: 11-24.
- De Meester I et al., “CD26, let it cut or cut it down”, Immunol Today- 1999, vol. no. 20, pp.:367-375.
- Abbott, et al., “Cloning, expression and chromosomal localization of a novel human dipeptidyl peptidase (DPP) IV homolog, DPP8”, Eur J Biochem -2000; vol. no. 267, pp.: 6140-50.
- Kim et al., “The Nonglycemic Actions of Dipeptidyl Peptidase-4 Inhibitors”- BioMed Research International Volume 2014, Article ID 368703.
- Baetta et al., “Pharmacology of dipeptidylpeptidase-4 inhibitors: similarities and differences”, Drugs-2011, vol. no.71, pp.:1441-1467.
- Prausnittz et al., “Permeability of Cornea, Sclera, and Conjunctiva: A Literature Analysis for Drug Delivery to the Eye”, Journal of Pharmaceutical Sciences - 1998, vol. no. 87(12), pp.: 1479-1488.
- Jung et al., “Gemigliptin, a dipeptidyl peptidase-4 inhibitor, inhibits retinal pericyte injury in db/db mice and retinal neovascularization in mice”, Biochimica et Biophysica Acta, Molecular Basis of Disease- 2015, vol. no. 1852(12), pp.:2618-2629.
- Anderson et al. “Glial and endothelial blood-retinal barrier responses to amyloid-beta in the neural retina of the rat”. Clin Ophthalmol - 2008, Vol. No.: 2, pp.:801-816.
- Simó R, Hernández C, “Novel approaches for treating diabetic retinopathy based on recent pathogenic evidence”, .Prog Retin Eye Res -2015, vol. no. 48, pp.:160-80.
- Simó R, Hernández C; European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR). “Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives”, Trends Endocrinol Metab -,2014; vol. no.25(1), pp.: 23-33.
- Bogdanov et al., “The db/db mouse: a useful model for the study of diabetic retinal neurodegeneration”, PLoS One-2014, vol.no.9(5):e97302.
- Marmor et al., “Standard for clinical electroretinography”, International Society for Clinical Electrophysiology of Vision (2004), Doc Ophthalmol-2004; vol.108, pp.:107-114.
- Dietrich N, Kolibabka M, Busch S, et al (2016) The DPP4 Inhibitor Linagliptin Protects from Experimental Diabetic Retinopathy. PLoS One 11:e0167853
- Wronkowitz N, Görgens SW, Romacho T et al (2014) Soluble DPP4 induces inflammation and proliferation of human smooth muscle cells via protease-activated receptor 2. Biochim Biophys Acta 1842(9):1613-21]
- Zhang H, Maqsudi S, Rainczuk A et al (2015) Identification of novel dipeptidyl peptidase 9 substrates by two-dimensional differential in-gel electrophoresis. FEBS J 282(19):3737-57.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ФУНДАСИО ОСПИТАЛЬ УНИВЕРСИТАРИ ВАЛЬ Д'ЭБРОН - ИНСТИТУТ ДЕ РЕСЕРКА
<120> ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ-4 ДЛЯ МЕСТНОГО ОФТАЛЬМОЛОГИЧЕСКОГО ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ СЕТЧАТКИ
<130> P3572PC00
<150> EP16382190.3
<151> 2016-04-29
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 31
<212> PRT
<213> Artificial
<220>
<223> Liraglutide; analogue of glucagon like peptide-1 (7-37)
(GLP-1(7-37))
<220>
<221> LIPID
<222> (20)..(20)
<223> Lysine residue (K, Lys) comprises the lipophilic substituent N
epsilon-(gamma-glutamyl(N-alfa-hexadecanoyl)) attached by an
amide link to the amino group of the lysine side chain
<400> 1
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Arg Gly Arg Gly
20 25 30
<210> 2
<211> 44
<212> PRT
<213> Artificial
<220>
<223> Lixisenatide; glucagon-like peptide-1 agonist; derived from
exenatide
<220>
<221> MOD_RES
<222> (44)..(44)
<223> X is a lysine residue in which the -COOH terminal has been
modified by a -NH2 group
<400> 2
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Ser Lys Lys Lys Lys Lys Xaa
35 40
<210> 3
<211> 39
<212> PRT
<213> Artificial
<220>
<223> Exenatide; glucagon-like peptide-1 agonist; synthetic version of
hormone exendine-4 found in the saliva of the Gila monster
<220>
<221> MOD_RES
<222> (39)..(39)
<223> X is a serine residue in which the -COOH terminal has been
modified by a -NH2 group
<400> 3
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Xaa
35
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПОЧЕК, СОДЕРЖАЩАЯ ИНГИБИТОР DPP-IV | 2014 |
|
RU2652343C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2010 |
|
RU2532330C2 |
| Способ лечения гипергликемии | 2017 |
|
RU2739255C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ АГОНИСТАМИ GPR119 И ИНГИБИТОРАМИ DPP-4 | 2020 |
|
RU2818562C2 |
| ОФТАЛЬМОЛОГИЧЕСКОЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ НЕОАНГИОГЕННЫХ ПАТОЛОГИЙ ГЛАЗА | 2009 |
|
RU2519739C2 |
| КОМБИНАЦИЯ ФОЛИЕВОЙ КИСЛОТЫ И РАМИПРИЛА: ЦИТОПРОТЕКТОРНЫЕ, НЕЙРОПРОТЕКТОРНЫЕ И РЕТИНОПРОТЕКТОРНЫЕ ОФТАЛЬМОЛОГИЧЕСКИЕ КОМПОЗИЦИИ | 2011 |
|
RU2602738C2 |
| ИНГИБИТОРЫ НЕЙТРАЛЬНОЙ ЭНДОПЕПТИДАЗЫ (НЭП) И РАСТВОРИМОЙ ЭНДОПЕПТИДАЗЫ ЧЕЛОВЕКА (РЭПч) ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГЛАЗНЫХ БОЛЕЗНЕЙ | 2019 |
|
RU2758771C1 |
| КОМПОЗИЦИИ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ КАЛЬЦИНОЗА КЛАПАНА, СОДЕРЖАЩИЕ DPP-4 ИНГИБИТОР | 2015 |
|
RU2680527C1 |
| КОМБИНАЦИЯ ДЛЯ РЕГЕНЕРАТИВНОЙ ТЕРАПИИ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 1 ТИПА | 2018 |
|
RU2694527C1 |
| МЕСТНЫЙ ГЛАЗНОЙ ПЕПТИДНЫЙ СОСТАВ | 2010 |
|
RU2561585C2 |
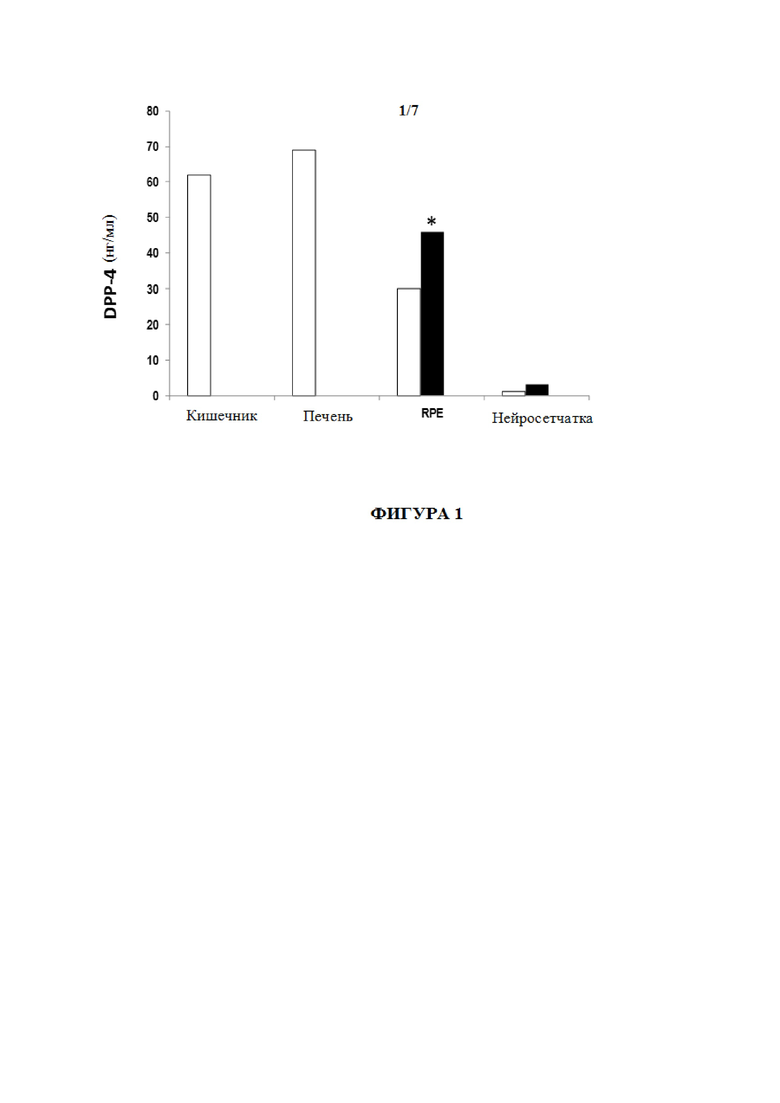

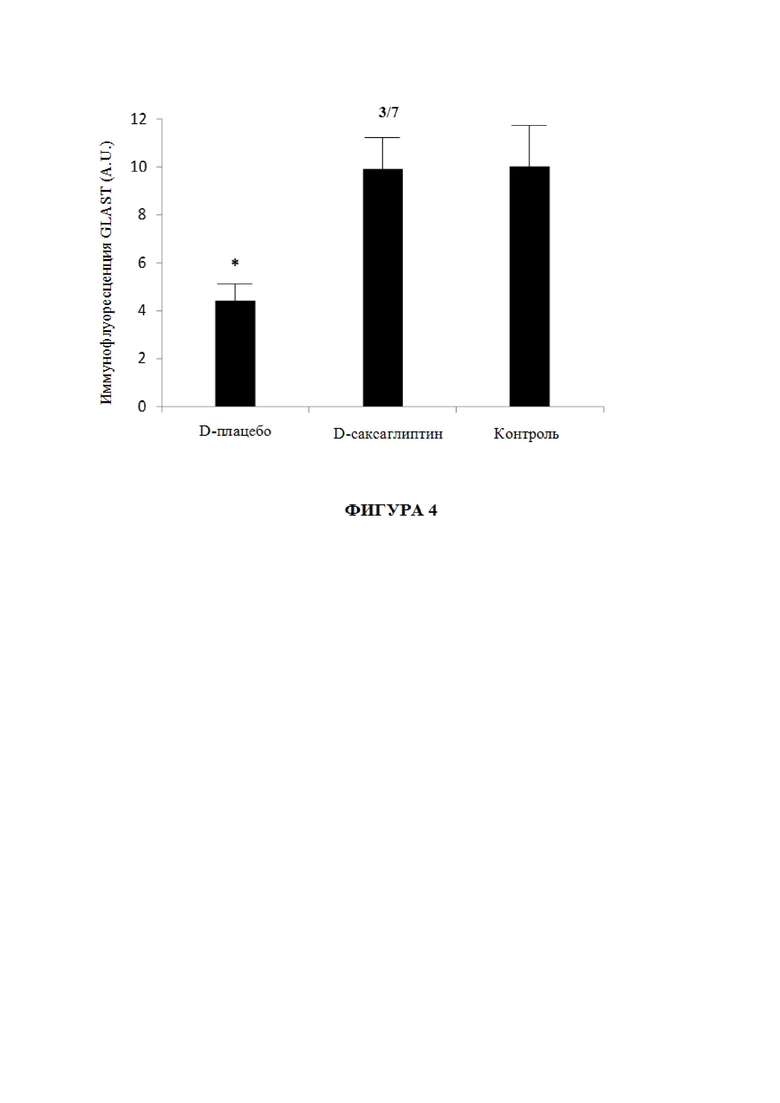
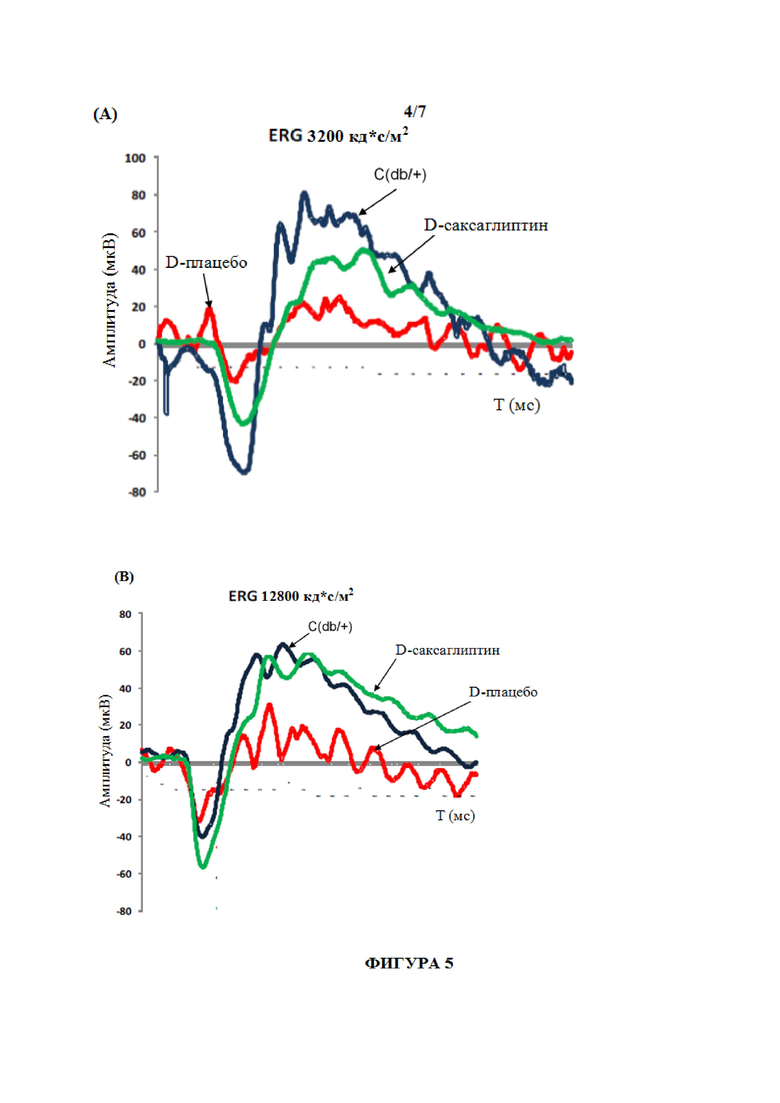
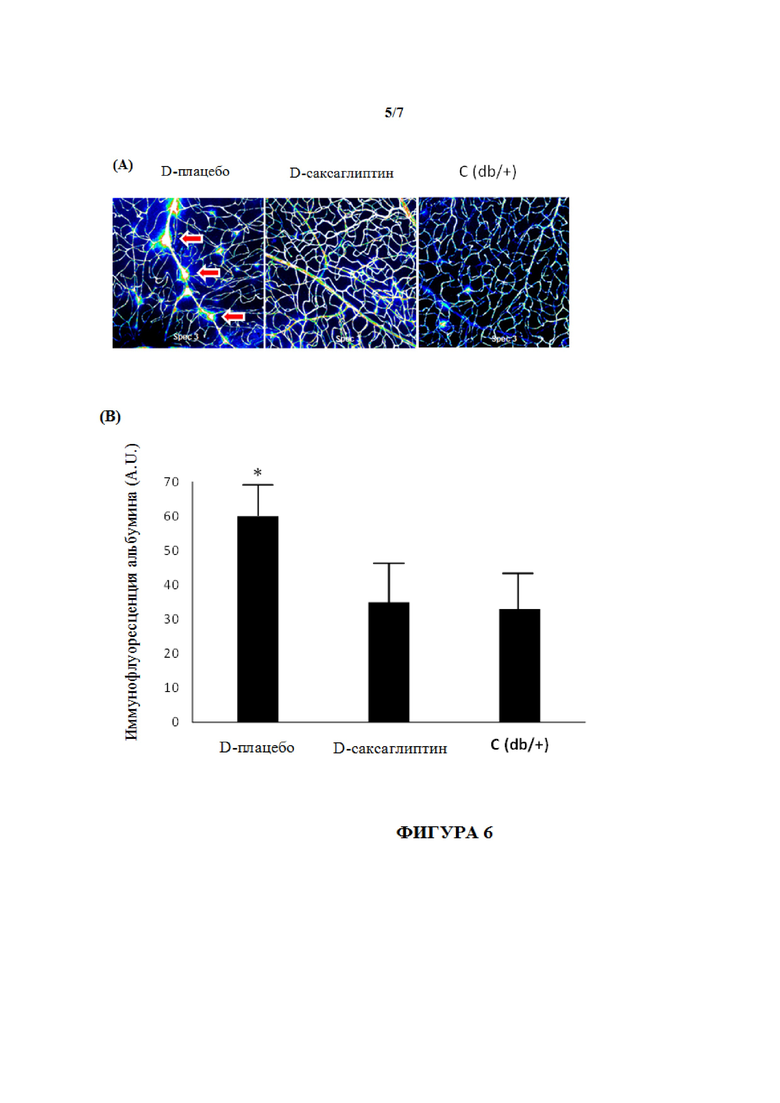
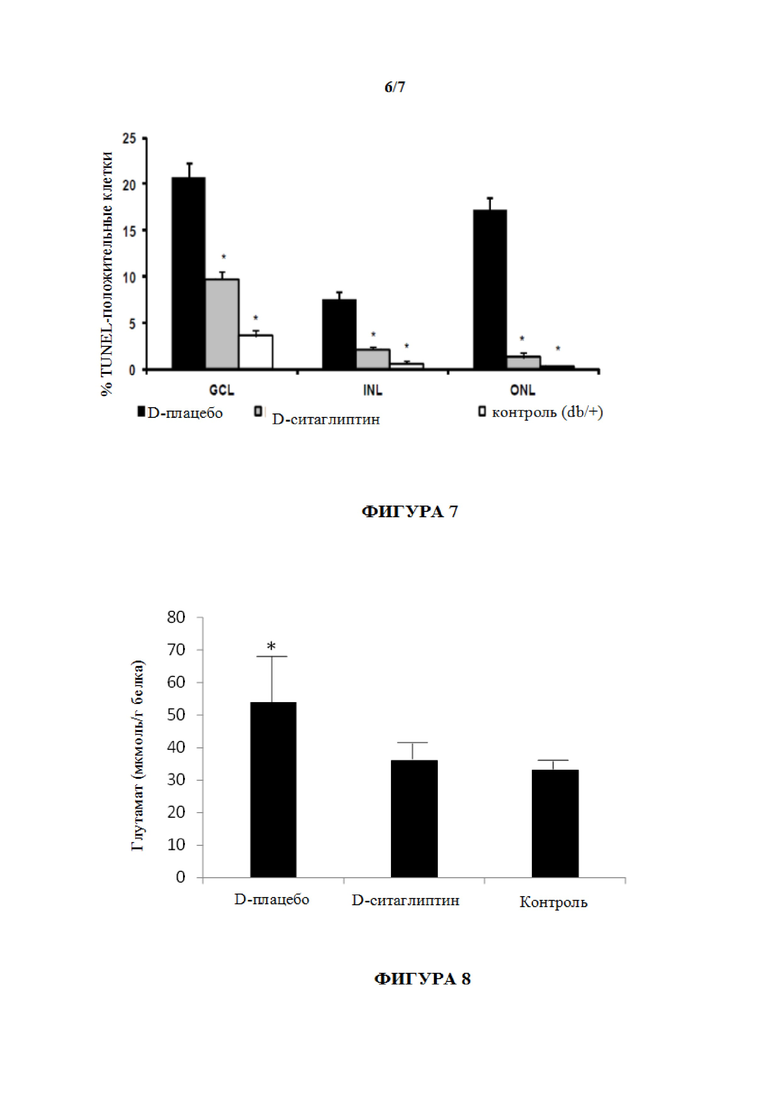

Изобретение относится к ингибиторам дипептидилпептидазы-4, выбранным из группы, включающей в себя саксаглиптин и ситаглиптин, для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративных заболеваний сетчатки, в частности диабетической ретинопатии и связанного с ней микрососудистого нарушения. Кроме того, изобретение относится к фармацевтической или ветеринарной композиции, которая содержит ингибитор дипептидилпептидазы-4, выбранный из группы включающей в себя саксаглиптин и ситаглиптин для применения в местном лечении и/или профилактике указанных выше заболеваний. Технический результат: применение ингибиторов дипептидилпептидазы-4 или их фармацевтически приемлемой соли или сольвата для получения лекарственного средства для местного офтальмологического лечения и/или профилактики нейродегенеративных заболеваний сетчатки, в частности для местного офтальмологического лечения и/или профилактики повреждения сетчатки на ранних стадиях нейродегенеративных заболеваний сетчатки и связанного с ними микрососудистого нарушения или повреждения сетчатки. 3 н. и 9 з.п. ф-лы, 2 табл., 3 пр., 9 ил.
1. Ингибитор дипептидилпептидазы-4 или его фармацевтически приемлемая соль для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративного заболевания сетчатки, где ингибитор дипептидилпептидазы-4 выбран из группы, состоящей из ситаглиптина, саксаглиптина и их фармацевтически приемлемых солей.
2. Ингибитор дипептидилпептидазы-4 для применения по п. 1 путем ингибирования дипептидилпептидазы-4 сетчатки.
3. Ингибитор дипептидилпептидазы-4 для применения по п. 1, причем нейродегенеративное заболевание сетчатки выбрано из группы, состоящей из диабетической ретинопатии (DR), возрастной макулярной дегенерации, глаукомы и пигментного ретинита.
4. Ингибитор дипептидилпептидазы-4 для применения по п. 1, причем нейродегенеративное заболевание сетчатки представляет собой диабетическую ретинопатию и связанное с ней микрососудистое нарушение.
5. Ингибитор дипептидилпептидазы-4 для применения по п. 4, который используют в местном офтальмологическом лечении ранних стадий диабетической ретинопатии.
6. Фармацевтическая или ветеринарная местная глазная композиция для применения в местном офтальмологическом лечении и/или профилактике нейродегенеративного заболевания сетчатки, которая содержит эффективное количество ингибитора дипептидилпептидазы-4, выбранного из группы, состоящей из ситаглиптина и саксаглиптина, или его фармацевтически или ветеринарно приемлемой соли вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями.
7. Фармацевтическая или ветеринарная местная композиция для применения по п. 6, которая выбрана из группы, состоящей из растворов, кремов, лосьонов, мазей, эмульсий и суспензий.
8. Фармацевтическая или ветеринарная местная композиция для применения по п. 7, которая представляет собой раствор - глазные капли.
9. Фармацевтическая или ветеринарная местная композиция для применения по п. 6, причем нейродегенеративное заболевание сетчатки выбрано из группы, состоящей из диабетической ретинопатии, возрастной макулярной дегенерации, глаукомы и пигментного ретинита.
10. Фармацевтическая или ветеринарная местная глазная композиция для применения по п. 6, которая представляет собой композицию длительного высвобождения.
11. Фармацевтическая или ветеринарная местная глазная композиция для применения по п. 6, которую используют в местном офтальмологическом лечении и/или профилактике ранних стадий диабетической ретинопатии.
12. Фармацевтическая или ветеринарная местная глазная композиция, содержащая ингибитор дипептидилпептидазы-4, выбранный из группы, состоящей из ситаглиптина и саксаглиптина, или его фармацевтически или ветеринарно приемлемую соль вместе с местными фармацевтически или ветеринарно приемлемыми вспомогательными веществами и/или носителями, причем композиция характеризуется динамической вязкостью, составляющей от 5,0 × 10-4 Па·с до 300 Па·с при 20°C, pH от 4,5 до 9,0, и где ингибитор дипептидилпептидазы-4 находится в концентрации, составляющей 5 мг/мл - 200 мг/мл по отношению к конечному объему композиции.
| Rahul S Pandit et al: "Retinal and lens protective effect of sitagliptin in streptozotocin induced type-I diabetic wistar rats", Biomedicine & Aging Pathology, 01.04.2013, v.3, n.2, р | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2021-03-16—Публикация
2017-04-28—Подача