[0001] Настоящая заявка испрашивает приоритет на основании родственной заявки на патент с серийным номером 62/505027, поданной 11 мая 2017 года.
Область техники
[0002] Область техники включает фармацевтические композиции, содержащие сульфат атропина, особенно различные стабильные при хранении, готовые к применению, не содержащие консервантов композиции и способ получения таких композиций.
Уровень техники
[0003] Описание уровня техники включает информацию, которая может быть полезна для понимания настоящего изобретения. Не следует полагать, что какая-либо информация, представленная здесь, относится к уровню техники или имеет отношение к заявленному изобретению, или что любая публикация, на которую приведены конкретные или неявные ссылки, представляет собой уровень техники.
[0004] Все публикации и патентные заявки в настоящем документе включены посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка были конкретно и отдельно указаны для включения посредством ссылки. Если определение или применение термина во включенной ссылке является противоречивым или противоречит определению этого термина, приведенному в настоящем документе, следует применять определение этого термина, приведенное в настоящем документе, а определение этого термина в ссылке применять не следует.
[0005] Атропин представляет собой сложный эфир тропина и троповой кислоты и обычно доступен в форме сульфатной соли. Неферментативный спонтанный гидролиз атропина в водном растворе приводит к образованию тропина и троповой кислоты, которые не являются токсичными, но не обладают биологической активностью при применении в офтальмологии. Например, для определенных инъекционных составов была протестирована стабильность, и со временем в составах наблюдалось разрушение до и после истечения срока годности (Acad Emerg Med April 2004, Vol. 11, No. 4:329-334). Примечательно, что в большинстве случаев потеря атропина была значительной, но составляла менее 25% от начальной концентрации. Однако эти составы включали атропин в высоких концентрациях от 0,4 мг/мл до 2 мг/мл и имели очень низкий рН (обычно равный или менее рН 4), который в большинстве случаев не подходит для офтальмологического применения.
[0006] Для офтальмологического применения атропин поступает на рынок как Atropine Care (Akorn) в форме 1% раствора лекарственного средства для лечения амблиопии, и дополнительно содержит 0,01% масс./масс. консерванта бензалкония хлорида. При других показаниях к применению атропин также применяли в нескольких педиатрических исследованиях, чтобы замедлить прогрессирование миопии. В частности, у детей, которым местно вводили капли атропина, заболевание прогрессировало более медленно, чем у контрольной группы в том же исследовании. Преимущественно, у детей, получающих глазные капли, содержащие низкие концентрации атропина, (например, в диапазоне 0,01-0,05% масс./об. (0,01% масс./масс.)) светобоязнь и другие побочные эффекты наблюдались в значительно меньшей степени (см., например, Ophthalmology, 2015:1-9). Действительно, применение атропина в низкой дозе (т.е., 0,01%) стало предпочтительным способом выбора для замедления прогрессирования миопии. К сожалению, токсические эффекты хлорида бензалкония были продемонстрированы в лабораторных и в клинических условиях, и включают нестабильность слезной пленки, потерю бокаловидных клеток, плоскоклеточную конъюнктивальную метаплазию и апоптоз, разрушение барьера эпителия роговицы и повреждение более глубоких тканей глаза (см., например, Prog Retin Eye Res. 2010 Jul 29(4):312-34).
[0007] В других известных композициях и способах составы атропина описаны в WO 2017/204262, которые включают различные буферные ингредиенты и водорастворимые полимеры, в которых рН большинства составов составляет примерно 4,3, 4,5 или 5,0 при концентрации атропина 0,01% масс./масс. Хотя было показано, что такие составы снижают прогрессирование миопии без усиления мидриатического действия атропина, стабильность атропина, измеренная по увеличению количества троповой кислоты, является менее необходимой в течение всего лишь четырех недель.
[0008] Поскольку нормальные слезы имеют рН примерно 7,4, офтальмологический раствор должен иметь тот же рН, что и слезная жидкость. Однако это является проблемой для офтальмологических растворов, содержащих сульфат атропина, так как сульфат атропина подвергается большей степени гидролиза в растворах, рН которых ближе к нейтральным и основным условиям. Таким образом, атропин является более стабильным в офтальмологических растворах с более кислым pH. Например, Atropine Care с концентрацией атропина 1% масс./масс. хранят при pH 5,5, но срок годности все еще ограничен 15 месяцами. Кроме того, разрушение атропина до троповой кислоты в водном растворе заметно ускоряется при снижении концентрации атропина (например, US 9421199), что еще больше усугубляет проблемы стабильности, особенно в составах с низкой дозой атропина.
[0009] Чтобы уменьшить гидролитическое разрушение, воду в составах с низкой дозой атропина можно по меньшей мере частично заменить дейтерированной (тяжелой) водой, как описано в патенте США US 9421199. Хотя применение кинетических изотопных эффектов в стабильности является по существу привлекательным, тем не менее, остаются различные недостатки. Среди прочего, по меньшей мере некоторые из составов патента '199 все еще содержали консервант. Кроме того, все еще известно, что дейтерированная вода подвергается H/D-обмену и, как таковая, обеспечивает доставку дейтерия субъекту, получающему такие составы.
[0010] В качестве альтернативы атропин также можно доставлять в пониженных концентрациях из поперечно сшитой неразрушаемой полимерной матрицы, как описано в US 2016/0338947. К сожалению, чтобы удерживать полимер вдали от роговицы, на склеру необходимо наносить имплантат определенной формы, который обычно плохо переносится или может вызывать дискомфорт.
[0011] Следовательно, существует потребность в улучшенных стабильных при хранении готовых к применению композициях, которые содержат атропин в низких концентрациях, имеют физиологически необходимый рН и предпочтительно не содержат консерванта.
Краткое описание изобретения
[0012] Предмет настоящего изобретения относится к готовым к применению композициям атропина, обладающим улучшенной стабильностью и физиологически приемлемым pH. Наиболее предпочтительно, такие композиции также по существу не содержат консервантов.
[0013] В одном аспекте предмета настоящего изобретения авторы настоящего изобретения рассматривают жидкую стабильную при хранении офтальмологическую композицию с низкой дозой атропина, которая содержит водный раствор, содержащий буфер, регулятор тоничности, модификатор вязкости и атропин или его фармацевтически приемлемую соль, где атропин или его фармацевтически приемлемая соль присутствуют в офтальмологической композиции атропина в количестве, равном или менее 0,05 масс.%, где буфер имеет концентрацию, равную или менее 75 мМ, и где офтальмологическая композиция атропина имеет рН от 5,0 до 6,0, причем офтальмологическая композиция атропина приготовлена таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0014] Предпочтительно, атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина и присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,02% масс., или в количестве, равном или менее 0,01% масс., или в количестве от 0,01 до 0,05% масс. или в количестве от 0,001 до 0,01% масс. В большинстве случаев буфер имеет концентрацию, равную или менее 60 мМ, или равную или менее 50 мМ. Кроме того, предполагается, что буфер содержит дигидрофосфат натрия и гидрофосфат натрия. В других вариантах реализации композиция дополнительно содержит хелатор, обычно бикарбоновую кислоту, трикарбоновую кислоту или аминополикарбоновую кислоту, и хелатор присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс.
[0015] Кроме того, предполагается, что офтальмологическая композиция атропина имеет рН 5,0 (+/- 0,2) или рН 5,5 (+/- 0,2) или имеет рН 6,0 (+/- 0,2). Регулятор тоничности предпочтительно представляет собой фармацевтически приемлемую соль, которая присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс. В других вариантах реализации модификатор вязкости представляет собой модифицированную целлюлозу, и предпочтительно гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу. Кроме того, в целом предпочтительно офтальмологическая композиция атропина по существу не содержит консерванта.
[0016] Таким образом, авторы настоящего изобретения также рассматривают жидкую стабильную при хранении офтальмологическую композицию с низкой дозой атропина, которая по существу состоит из водного раствора, содержащего буфер, регулятор тоничности, хелатор, модификатор вязкости и атропин или его фармацевтически приемлемую соль. В таких композициях предпочтительно атропин или его фармацевтически приемлемая соль присутствуют в офтальмологической композиции атропина в количестве, равном или менее 0,05% масс., буфер имеет концентрацию, равную или менее 75 мМ, и офтальмологическая композиция атропина имеет рН от 5,0 до 6,0. Кроме того, такие офтальмологические композиции атропина приготовлены таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0017] Чаще всего атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина, и атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,02% масс., или в количестве, равном или менее 0,01% масс. или в количестве от 0,001% масс. до 0,01% масс. В некоторых вариантах реализации буфер имеет концентрацию, равную или менее 60 мМ, или имеет концентрацию, равную или менее 50 мМ. Также предполагается, что буфер содержит дигидрофосфат натрия и гидрофосфат натрия. Хелатор обычно представляет собой бикарбоновую кислоту, трикарбоновую кислоту или аминополикарбоновую кислоту. Например, подходящие хелаторы включают этилендиаминтетрауксусную кислоту (ЭДТА), обычно присутствующую в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс.
[0018] В других вариантах реализации офтальмологическая композиция атропина имеет рН от 5,0 (+/- 0,2) до 5,5 (+/- 0,2) или рН от 5,5 (+/- 0,2) до 6,0 (+/- 0,2), и/или регулятор тоничности представляет собой фармацевтически приемлемую соль, которая присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс. Подходящие модификаторы вязкости включают гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Чаще всего офтальмологическая композиция атропина по существу не содержит консерванта.
[0019] Например, рассматриваемые композиции включают композиции, в которых атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,001% масс. до 0,01% масс., где буфер содержит дигидрофосфат натрия и гидрофосфат натрия и имеет концентрацию, равную или менее 50 мМ, где модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу, и где офтальмологическая композиция атропина по существу не содержит консерванта. В других примерах рассматриваемые композиции включают композиции, в которых атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,01% масс. до 0,05% масс., где буфер содержит дигидрофосфат натрия и гидрофосфат натрия и имеет концентрацию, равную или менее 50мМ, где модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу, и где офтальмологическая композиция атропина по существу не содержит консерванта.
[0020] С другой стороны, авторы настоящего изобретения также рассматривают стабильную при хранении не содержащую консервантов офтальмологическую композицию атропина, которая содержит водный раствор, содержащий низкую дозу атропина или его фармацевтически приемлемой соли, буфер с низкой силой, фармацевтически приемлемую соль и целлюлозный модификатор вязкости, где буфер с низкой силой имеет концентрацию, равную или менее 50 мМ, и где атропин в низкой дозе присутствует в концентрации, равной или менее 0,05% масс., и где офтальмологическая композиция атропина по существу не содержит консерванта.
[0021] Например, атропин в низкой дозе в таких композициях присутствует в концентрации, равной или менее 0,01% масс., или присутствует в офтальмологической композиции атропина в количестве от 0,01% до 0,02% масс., или присутствует в офтальмологической композиции атропина в количестве от 0,001% масс. до 0,01% масс. Чаще всего, атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина, и/или буфер с низкой силой содержит первый или второй буферный компонент (например, дигидрофосфат натрия и гидрофосфат натрия). Чаще всего, офтальмологическая композиция атропина имеет рН от 5,0 до 6,0, или pH от 5,5 (+/- 0,2) до 6,0 (+/- 0,2). Рассматриваемые композиции обычно также включают хелатор (например, бикарбоновую кислоту, трикарбоновую кислоту, аминополикарбоновую кислоту), который предпочтительно присутствует в количестве 0,01% масс. (+/- 20% абс.). Кроме того, предполагается, что фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс. или в количестве 0,5% масс. (+/- 0,2% масс.).
[0022] Предпочтительные целлюлозные модификаторы вязкости включают гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу, которые обычно присутствуют в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологической композиции атропина. В предпочтительных вариантах реализации офтальмологическая композиция атропина приготовлена таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0023] Например, в рассматриваемых композициях атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,001% масс. до 0,01% масс., где буфер с низкой силой содержит дигидрофосфат натрия и гидрофосфат натрия, и где офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0 (+/- 0,2). В другом примере атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в рассматриваемых композициях в количестве от 0,001% масс. до 0,01% масс., где офтальмологическая композиция атропина дополнительно содержит хелатор в количестве 0,01% масс. (+/- 20% абс.) от офтальмологической композиции атропина, и где офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0 (+/- 0,2). В качестве альтернативы, буфер с низкой силой в рассматриваемых композициях содержит дигидрофосфат натрия и гидрофосфат натрия, где композиция дополнительно содержит хелатор в количестве 0,01% масс. (+/- 20% абс.) от офтальмологической композиции атропина, где офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0 (+/- 0,2), где соль присутствует в офтальмологической композиции атропина в количестве 0,5% масс. ( +/- 0,2% масс.), и где целлюлозный модификатор вязкости присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологической композиции атропина.
[0024] В еще одном аспекте предмета настоящего изобретения авторы настоящего изобретения также рассматривают способ повышения стабильности атропина при хранении в жидкой офтальмологической композиции с низкой дозой. Обычные низкие дозы составляют от 0,01% масс. до 0,02% масс., или от 0,001% масс. до 0,01% масс., или равны или менее 0,01% масс. от офтальмологического состава. Предпочтительные способы включают стадию приготовления водного раствора с буферной системой с низкой силой, которая включает первый и второй буферный компонент, где буферная система с низкой силой имеет концентрацию буфера, равную или менее 75 мМ, и дополнительную стадию включения в водный раствор фармацевтически приемлемой соли, модификатора вязкости и хелатора. На еще одной стадии атропин или его фармацевтически приемлемую соль включают в состав в низкой дозе (например, равной или менее 0,05% масс. от офтальмологического состава), и рН офтальмологического состава доводят до рН от 5 до 6. Предпочтительно офтальмологический состав приготовлен таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60% в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0025] Например, первый и второй буферные компоненты представляют собой дигидрофосфат натрия и гидрофосфат натрия, соответственно, и буферная система с низкой силой имеет концентрацию буфера, равную или менее 50 мМ. Кроме того, предполагается, что фармацевтически приемлемая соль представляет собой хлорид натрия, который обычно присутствует в офтальмологической композиции атропина в количестве 0,5% масс. (+/- 0,2% масс.) от офтальмологического состава. Кроме того, предпочтительно хелатор представляет собой бикарбоновую кислоту, трикарбоновую кислоту или аминополикарбоновую кислоту (например, ЭДТА), предпочтительно в количестве 0,01% масс. (+/- 20% абс.) от офтальмологического состава.
[0026] В других вариантах реализации модификатор вязкости представляет собой целлюлозный модификатор вязкости, такой как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Чаще всего целлюлозный модификатор вязкости присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологического состава. В других вариантах реализации целлюлозный модификатор вязкости получают в форме отдельного раствора и объединяют с водным раствором, содержащим буферную систему, фармацевтически приемлемую соль, модификатор вязкости, хелатор и атропин или его фармацевтически приемлемую соль. При необходимости водный раствор готовят с применением дезоксигенированной воды. Чаще всего, рН состава составляет от 5,5 (+/- 0,2) до 6,0 (+/- 0,2), и атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина. Предпочтительно рассматриваемые способы также включают стадию стерилизации офтальмологического состава, и, в частности, стерильную фильтрацию. При необходимости офтальмологический состав затем помещают в одноразовую или многодозовую емкость.
[0027] Кроме того, авторы настоящего изобретения также рассматривают способ получения стабильного при хранении жидкого офтальмологического состава с низкой дозой атропина, который включает стадии приготовления буферного раствора с низкой силой с низкой дозой атропина в первой емкости, обеспечение стерильной фильтрации буферного раствора с низкой силой с низкой дозой атропина с получением стерильного буферного раствора с низкой силой с низкой дозой атропина, где буфер с низкой силой содержит первый и второй и второй буферный компонент, которые образуют буферную систему с низкой силой, имеющую концентрацию, равную или менее 75 мМ в офтальмологическом составе, где атропин присутствует в количестве, равном или менее 0,05% масс. от офтальмологического состава, и где буферный раствор с низкой силой с низкой дозой атропина дополнительно содержит регулятор тоничности и хелатор. На другой стадии раствор полимера готовят во второй емкости, и раствор полимера стерилизуют способом, отличным от стерильной фильтрации (например, автоклавирование), чтобы получить стерильный раствор полимера. Чаще всего, раствор полимера содержит полимер для модификации вязкости буферного раствора с низкой силой с низкой дозой атропина в комбинации. На другой стадии стерильный буферный раствор с низкой силой с низкой дозой атропина и стерильный раствор полимера объединяют для получения стерильного жидкого офтальмологического состава с низкой дозой.
[0028] Как правило, первый и второй буферные компоненты представляют собой дигидрофосфат натрия и гидрофосфат натрия, соответственно, и/или буферная система с низкой силой имеет концентрацию буфера, равную или менее 50 мМ в офтальмологическом составе. Атропин обычно присутствует в количестве от 0,01% масс. до 0,02% масс., или от 0,001% масс. до 0,01% масс., или в количестве, равном или менее 0,01% масс. от офтальмологического состава. Наиболее предпочтительно регулятор тоничности представляет собой фармацевтически приемлемую соль, обычно хлорид натрия, в количестве 0,5% масс. (+/- 0,2% масс.) от офтальмологического состава. Кроме того, хелатор обычно представляет собой бикарбоновую кислоту, трикарбоновую кислоту или аминополикарбоновую кислоту (например, ЭДТА), предпочтительно в количестве 0,01% масс. (+/- 20% абс.) от офтальмологического состава.
[0029] Также предполагается, что полимер представляет собой целлюлозный полимер, и особенно гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу. Предпочтительно целлюлозный полимер присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологического состава, и/или рН буферного раствора с низкой силой с низкой дозой атропина доводят до рН от 5 до 6 или от 5,5 (+/- 0,2) до 6,0 (+/- 0,2).
[0030] В других вариантах реализации стадия объединения включает смешивание стерильного буферного раствора с низкой силой с низкой дозой атропина и стерильного раствора полимера в течение по меньшей мере 30 минут и, необязательно, дополнительно включает стадию заполнения многодозовой емкости офтальмологической композицией. Предпочтительно офтальмологический состав приготовлен таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0031] Следовательно, авторы настоящего изобретения также рассматривают набор для лечения миопии, который включает в себя первую емкость, которая содержит стабильный при хранении жидкий офтальмологический состав с низкой дозой атропина, где первая емкость выполнена в форме одноразовой емкости однократного применения или многодозовой емкости, и вторая емкость содержит первую емкость, где стабильный при хранении жидкий офтальмологический состав с низкой дозой атропина содержит водный раствор, содержащий буфер, регулятор тоничности, модификатор вязкости и атропин или его фармацевтически приемлемую соль, где атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,05% масс., где буфер имеет концентрацию, равную или менее 75 мМ, и где офтальмологическая композиция атропина имеет рН от 5,0 до 6,0, и где офтальмологическая композиция атропина приготовлена таким образом, что после хранения в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
[0032] Например, в некоторых вариантах реализации первая емкость представляет собой емкость, изготовленную способом выдува-наполнения-запайки (BSF), и/или вторая емкость представляет собой ламинированный металлизированный пакет. В других вариантах реализации атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс., или в количестве от 0,01% масс. до 0,05% масс., или в количестве от 0,001% масс. до 0,01% масс. Наиболее предпочтительно буфер имеет концентрацию, равную или менее 75 мМ, или равную или менее 50 мМ. Например, предпочтительные буферы содержат дигидрофосфат натрия и гидрофосфат натрия, и могут дополнительно содержать хелатор (например, бикарбоновую кислоту, трикарбоновую кислоту или аминополикарбоновую кислоту, такую как ЭДТА), который присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс.
[0033] Чаще всего, офтальмологическая композиция атропина имеет рН 5,0 (+/- 0,2), или pH 5,5 (+/- 0,2), или pH 6,0 (+/- 0,2), и также считается, что регулятор тоничности представляет собой фармацевтически приемлемую соль, которая присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс. Предпочтительные модификаторы вязкости представляют собой модифицированные целлюлозы, такие как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Также предпочтительно офтальмологическая композиция атропина по существу не содержит консерванта.
[0034] Различные задачи, признаки, аспекты и преимущества предмета настоящего изобретения станут более очевидными из следующего подробного описания предпочтительных вариантов реализации.
Краткое описание чертежей
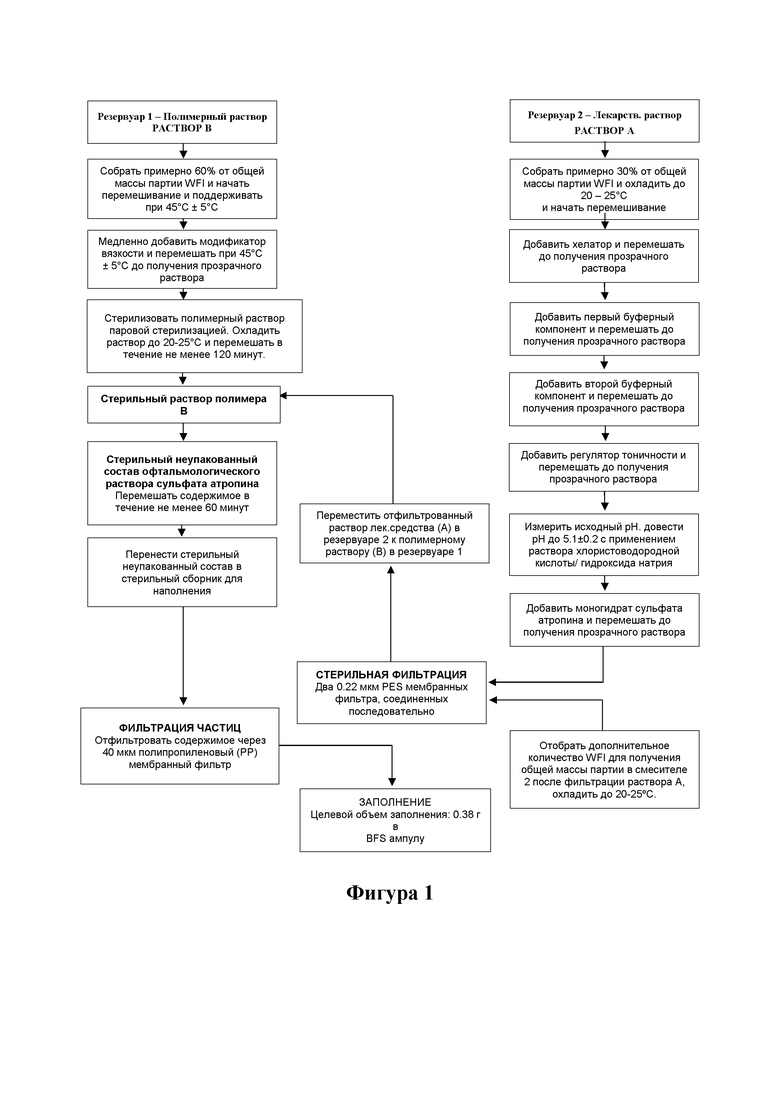
[0035] На фигуре 1 изображен примерный способ получения стабильного при хранении и офтальмологического состава с низкой дозой атропина.
Подробное описание изобретения
[0036] Предмет настоящего изобретения относится к стабильным водным офтальмологическим композициям атропина (и его фармацевтически приемлемых солей) в готовой к применению форме, которые являются стерильными и предпочтительно по существу не содержат консервантов. Стабильность рассматриваемых композиций характеризуется низкой степенью разрушения атропина до троповой кислоты при низких концентрациях атропина, а также физиологически необходимым pH. Например, жидкие и стабильные при хранении офтальмологические композиции с низкой дозой атропина обычно стабильны при хранении в течение по меньшей мере двух месяцев при 25°C и относительной влажности 60%, таким образом, при разрушении атропина в составе образуется троповая кислота в количестве, равном или менее 0,35%. Более предпочтительно, композиции также не содержат консерванты, и, в частности, хлорид бензалкония, который обычно применяют в качестве консерванта. Такая стабильность является особенно неожиданной, когда концентрация атропина в офтальмологической композиции является относительно низкой (например, 0,02% масс.) и когда композиция имеет относительно высокий pH (например, от 5,0 до 6,0), так как в целом известно, что стабильность атропина уменьшается при уменьшении концентрации и повышении pH.
[0037] Не желая быть связанными какой-либо теорией или гипотезой, авторы настоящего изобретения предполагают, что низкая буферная сила при применении двухкомпонентной буферной системы при pH, близком к нейтральному pH (например, pH 5,0-6,0), снижает гидролиз атропина до троповой кислоты, когда концентрации атропина являются относительно низкими (например, равными или менее 0,05% масс. или равными или менее 0,02% масс. или равными или менее 0,01% масс.). Если не указано иное, все проценты являются массовыми процентами (% масс.) или выражены в форме массы по объему (масс./об.). Кроме того, следует отметить, что массовые проценты сульфата атропина, представленные в настоящем документе, приведены в расчете на моногидрат сульфата атропина.
[0038] Более конкретно, и, как более подробно описано ниже, авторы настоящего изобретения обнаружили, что офтальмологические композиции с низкой дозой атропина могут быть приготовлены с атропином в концентрации, готовой к применению (например, для лечения миопии), которые имеют близкое к физиологическому значение рН, и в составе которых предпочтительно отсутствует какой-либо консервант. Неожиданно, что стабильность при хранении в течение двух месяцев при 25°C и относительной влажности 60% представленных в настоящем документе офтальмологических композиций является удивительно высокой, причем образование троповой кислоты в результате гидролиза атропина в большинстве случаев составляет 0,35% или ниже, 0,30% или ниже или 0,28% или ниже. Аналогичным образом, рассматриваемые составы в условиях ускоренного хранения в течение двух месяцев при 40°C и относительной влажности 75% также демонстрируют в равной степени благоприятный профиль с образованием троповой кислоты в большинстве случаев в количестве 1,7% или ниже, 1,5% или ниже, 1,3% или ниже или 1,2% или ниже.
[0039] Следовательно, рассматриваемая композиция атропина согласно предмету настоящего изобретения может быть преимущественно получена в готовом для применения формате, который позволяет избежать неудобств, связанных с разбавлением концентрированных композиций атропина в разбавителях перед введением. Таким образом, готовые составы также исключают риски микробного загрязнения и/или ошибки в расчетах, связанные с разведением. Чаще всего, рассматриваемые составы доступны в диапазоне концентраций, которые обычно необходимы практикующим врачам для лечения миопии, и в особенности миопии у детей. Следовательно, атропин обычно присутствует в составах в количестве, равном или менее 0,05% масс. или в количестве, равном или менее 0,02% масс. или в количестве, равном или менее 0,01% масс. Например, атропин или его фармацевтически приемлемая соль может присутствовать в офтальмологической композиции в количестве от 0,01% до 0,05% масс., от 0,001% масс. до 0,02% масс. или от 0,001% масс. до 0,01% масс. Следует понимать, что атропин для приготовления рассматриваемых составов может представлять собой атропин или любую его фармацевтически приемлемую соль, включая минеральные соли (например, соль HCl) и органические соли (например, сульфат). Аналогичным образом, при необходимости атропин также можно применять в форме любого подходящего пролекарства.
[0040] Например, в одном примерном варианте реализации концентрация атропина в рассматриваемых составах атропина составляет от примерно 0,001% до примерно 0,05% (масс./масс.); или от примерно 0,005% до примерно 0,045% (масс./масс.), или от примерно 0,006% до примерно 0,035% (масс./масс.), или от примерно 0,007% до примерно 0,030% (масс./масс.), или от примерно 0,008% до примерно 0,025% (масс./масс.), или от примерно 0,009% до примерно 0,022% (масс./масс.), или от примерно 0,01% до примерно 0,021% (масс./масс.) или от примерно 0,01% до примерно 0,02% (масс./масс.).
[0041] В другом примерном варианте реализации концентрация атропина в рассматриваемых составах атропина составляет от примерно 0,001% до примерно 0,05% (масс./масс.); или от примерно 0,005% до примерно 0,045% (масс./масс.), или от примерно 0,006% до примерно 0,035% (масс./масс.), или от примерно 0,007% до примерно 0,030% (масс./масс.), или от примерно 0,008% до примерно 0,025% (масс./масс.), или от примерно 0,009% до примерно 0,022% (масс./масс.), или от примерно 0,01% до примерно 0,021% (масс./масс.) или от примерно 0,01% до примерно 0,02% (масс./масс.).
[0042] В другом примерном варианте реализации концентрация атропина в рассматриваемых составах атропина составляет примерно 0,001%, или примерно 0,002%, или примерно 0,003%, или примерно 0,004%, или примерно 0,005%, или примерно 0,006%, или примерно 0,007%, или примерно 0,008%, или примерно 0,009%, или примерно 0,01%, или примерно 0,011%, или примерно 0,012%, или примерно 0,013%, или примерно 0,014%, или примерно 0,015%, или примерно 0,016%, или примерно 0,017%, или примерно 0,018%, или примерно 0,019%, или примерно 0,02%, или примерно 0,021%, или примерно 0,022%, или примерно 0,023%, или примерно 0,024%, или примерно 0,025%, или примерно 0,026%, или примерно 0,027%, или примерно 0,028%, или примерно 0,029%, или примерно 0,030%, или примерно 0,031%, или примерно 0,032%, или примерно 0,033%, или примерно 0,034%, или примерно 0,035%, или примерно 0,036%, или примерно 0,037%, или примерно 0,038%, или примерно 0,039%, или примерно 0,040%, или примерно 0,041%, или примерно 0,042%, или примерно 0,043%, или примерно 0,044%, или примерно 0,045%, или примерно 0,046%, или примерно 0,047%, или примерно 0,048%, или примерно 0,049% или примерно 0,0499% (масс./масс.).
[0043] В еще одном примерном варианте реализации концентрация атропина в рассматриваемых составах атропина составляет примерно 0,001% или 0,002% или 0,003% или 0,004% или 0,005% или 0,006% или 0,007% или 0,008% или 0,009% или 0,01% или 0,011% или 0,012% или 0,013% или 0,014% или 0,015% или 0,016% или 0,017% или 0,018% или 0,019% или 0,02% или 0,021% или 0,022% или 0,023% или 0,024% или 0,025% или 0,026% или 0,027% или 0,028% или 0,029% или 0,030% или 0,031% или 0,032% или 0,033% или 0,034% или 0,035% или 0,036% или 0,037% или 0,038% или 0,039% или 0,040% или 0,041% или 0,042% или 0,043% или 0,044% или 0,045% или 0,046% или 0,047% или 0,048% или 0,049% или 0,0499% (масс./масс.).
[0044] В других примерных вариантах реализации концентрация атропина в рассматриваемых составах атропина составляет от примерно 0,005% до примерно 0,015% (масс./масс.), или от примерно 0,015% до примерно 0,025% (масс./масс.), или примерно 0,01% (масс./масс.), или примерно 0,02% (масс./масс.) или от 0,005% до 0,015% (масс./масс.), или от 0,015% до 0,025% (масс./масс.), или 0,01% (масс./масс.), или 0,02% (масс./масс.), или от примерно 0,001% (масс./масс.) до примерно 0,01% (масс./масс.), или от примерно 0,005% (масс./масс.) до примерно 0,02% (масс./масс.), или от примерно 0,008% (масс./масс.) до примерно 0,012% (масс./масс.).
[0045] Подходящие буферы в целом представляют собой буферы, которые стабилизируют рН рассматриваемых жидких составов в диапазоне, близком к нейтральному pH, например, от pH 4,0 до 7,5 или от pH 4,5 до 6,5, и более предпочтительно от pH 5,0 до 6,0. Таким образом и чаще всего рН рассматриваемых составов является равным или менее 6,5 и, чаще всего, равным или менее 6,0, и, чаще всего, менее 5,8, но более 4,5, чаще всего, более 5,0, и, чаще всего, более 5,2. Например, подходящие композиции атропина могут иметь pH 5,0 (+/- 0,2), или pH 5,5 (+/- 0,2), или pH 6,0 (+/- 0,2).
[0046] В других аспектах предмета настоящего изобретения авторы настоящего изобретения обнаружили, что буферная система и/или буфер могут оказывать неожиданное влияние на стабильность атропина, как более подробно обсуждается ниже. В частности, после доведения концентрации буфера до 75 мМ или менее при рН от 5,0 до 6,0, стабильность атропина резко возрастала при хранении в нормальных условиях хранения и в условиях ускоренного старения, что было определено с помощью количественного определения троповой кислоты посредством ВЭЖХ, которая представляет собой побочный продукт гидролиза атропина. Не ограничиваясь предметом настоящего изобретения, буферная сила, как правило, является относительно низкой, например, равной или менее 100 мМ, равной или менее 75 мМ, равной или менее 60 мМ, равной или менее 50 мМ или от 5 мМ до 50 мМ (например, 10 мМ, 20мМ, 30мМ, 40 мМ).
[0047] Таким образом, в примерных вариантах реализации буферная система представляет собой фармацевтическую композицию в концентрации от примерно 10 мМ до примерно 75 мМ, или от примерно 10 мМ до примерно 60 мМ, или от примерно 0,1 мМ до примерно 60 мМ, или от примерно 0,1 мМ до примерно 55 мМ, или от примерно 0,1 мМ до примерно 50 мМ, или от примерно 5 мМ до примерно 60 мМ, или от примерно 0,1 мМ до примерно 10 мМ, или от примерно 1 мМ до примерно 10 мМ, или от примерно 9 мМ до примерно 20 мМ, или от примерно 15 мМ до примерно 25 мМ, или от примерно 19 мМ до примерно 29 мМ, или от примерно 24 мМ до примерно 34 мМ, или от примерно 29 мМ до примерно 39 мМ, или от примерно 34 мМ до примерно 44 мМ, или от примерно 39 мМ до примерно 49 мМ, или от примерно 44 мМ до примерно 54 мМ, или от примерно 19 мМ до примерно 54 мМ, или от примерно 25 мМ до примерно 54 мМ.
[0048] Безусловно, следует принимать во внимание, что в данной области техники известно много типов буферных систем и буферов, и все они считаются подходящими для применения в настоящем изобретении, включая буферные системы, содержащие кислоту и соль кислоты, первую и вторую соли (например, одноосновную и двухосновную соли) и амфотерные буферные молекулы. Например, подходящие буферные системы, содержащие кислоту и соль кислоты, включают буферы лимонной кислоты/цитрата натрия, буферы этановой кислоты/этаноата натрия, борной кислоты/бората натрия, в то время как подходящие буферы, содержащие первую и вторую соли, включают дигидрофосфат натрия/гидрофосфат натрия или дигидрофосфат натрия/цитрат натрия и т. д. Аналогичным образом, подходящие амфотерные буферные молекулы включают HEPES, MOPS, PIPES, MES и т. д.
[0049] Кроме того, в дополнительных рассматриваемых аспектах состав также включает один или более хелатирующих агентов, в частности хелаторы ионов металлов. Например, подходящие хелаторы включают различные бикарбоновые кислоты, трикарбоновые кислоты и аминополикарбоновые кислоты, такие как этилендиаминтетрауксусная кислота (ЭДТА), этиленгликоль-бис(β-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота (EGTA), и пента(карбоксиметил) диэтилентриамин (DTPA) и их соли и гидраты. Не ограничиваясь предметом настоящего изобретения, предполагается, что хелаторы ионов металлов будут замедлять как исходный, так и стимулированный ионами металлов гидролиз атропина. Примечательно, что авторы настоящего изобретения неожиданно обнаружили, что необходимый эффект хелаторов наблюдался при относительно низких концентрациях хелаторов. Например, снижение исходного и стимулированного ионами металлов гидролиза атропина наблюдалось при концентрациях хелатора от 10 мкг/мл до 50 мкг/мл, от 50 мкг/мл до 250 мкг/мл и от 100 мкг/мл до 500 мкг/мл. С другой стороны, концентрации хелатора, равные или менее 0,03% масс. или равные или менее 0,02% масс. или равные или менее 0,01% масс., являются особенно предпочтительными. Интересно, что хелаторы, и особенно аминополикарбоновые кислоты, сохраняли стабилизирующий эффект при низких концентрациях, несмотря на относительно низкий рН, благоприятный для протонированных форм хелаторов.
[0050] Следовательно, подходящие хелатирующие агенты включают мономерные поликислоты, такие как ЭДТА, циклогександиаминтетрауксусная кислота (CDTA), гидроксиэтилэтилендиаминтетрауксусная кислота (HEDTA), диэтилентриаминпентауксусная кислота (DTPA), димеркаптопропансульфоновая кислота (DMPS), димеркаптосукциновая кислота (DMSA), аминотриметиленфосфоновая кислота (ATPA), лимонная кислота, их офтальмологически приемлемые соли и комбинации любых из вышеперечисленных. Другие подходящие хелатирующие агенты включают пирофосфаты, триполифосфаты и гексаметафосфаты, хелатирующие антибиотики, такие как хлорохин и тетрациклин, азотсодержащий хелатирующий агент, содержащий два или более хелатирующих атомов азота в иминогруппе или в ароматическом кольце (например, диимины, 2,2'-бипиридины и т. д.) и различные полиамины, такие как циклам (1,4,7,11-тетраазациклотетрадекан), N-(C1-C30-алкил)-замещенные цикламы (например, гексадециклам, тетраметилгексадецилциклам), диэтилентриамин (DETA), спермин, диэтилнорспермин (DENSPM), диэтилгомо-спермин (DEHOP) и дефероксамин (N'-[5-[[4-[[5-(ацетилгидроксиамино)пентил]амино]-1,4-диоксобутил]гидроксиамино]пентил]-N'-(5-аминопентил)-N-гидроксибутандиамид; также известный как десферриоксамин B и DFO).
[0052] В отношении подходящих солей предполагается, что соль представляет собой фармацевтически приемлемую соль, которую можно применять для повышения тоничности. Следовательно, рассмотрены фармацевтические приемлемые соли, а особенно NaCl, в концентрации по меньшей мере 0,2% масс. или по меньшей мере 0,4% масс. или по меньшей мере 0,5% масс. или по меньшей мере 0,7% масс. Например, подходящие концентрации соли составляют от 0,2% масс. до 1,1% масс., от 0,4% масс. до 0,9% масс. или от 0,3% масс. до 0,7% масс. В зависимости от конкретной концентрации соли могут быть добавлены дополнительные регуляторы тоничности, и подходящие регуляторы тоничности включают глицерин, тиоглицерин, маннит, лактозу и декстрозу. Количество применяемого агента, регулирующего тоничность, можно регулировать для получения осмоляльности составов в диапазоне от 260 до 340 мОсм/кг. Для проверки и регулирования количества добавляемого агента, регулирующего тоничность, для получения необходимой осмоляльности можно применять осмометр.
[0052] Так как рассматриваемые составы применяют в качестве офтальмологических составов, обычно предпочтительно, чтобы состав также включал модификатор вязкости для регулирования вязкости состава до динамической вязкости от 5 до 50 сПз (сантипуаз), и более предпочтительно от 10 до 40 сПз, и наиболее предпочтительно от 10 до 30 сПз. Хотя в данной области техники известно множество модификаторов вязкости, таких как различные полимеры, глицерин и полисахаридные полимеры (все из которых рассматриваются в настоящем документе), особенно предпочтительные модификаторы вязкости включают целлюлозные модификаторы вязкости. Например, предпочтительные целлюлозные модификаторы вязкости включают модифицированную и немодифицированную гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу.
[0053] Следует понимать, что точное количество модификатора вязкости может варьироваться в зависимости от типа используемого модификатора и необходимой конечной вязкости. Например, если модификатор вязкости представляет собой целлюлозный модификатор, и конечная вязкость должна составлять от 1 до 30 сПз, подходящие количества модификатора обычно будут находиться в диапазоне 0,5% масс. (+/- 0,1% масс.) от офтальмологической композиции атропина. Специалист в данной области техники легко сможет отрегулировать вязкость до необходимой величины с применением вискозиметров (например, ротационного, вибрационного и т.д.), хорошо известных в данной области техники.
[0054] В примерных вариантах реализации, подходящие концентрации модификатора вязкости в рассматриваемых офтальмологических составах могут составлять любую величину менее 5% (масс./масс.). Например, подходящие концентрации модификатора вязкости включают от 0,01% до 4,99% (масс./масс.); или от 0,05% до 4,50% (масс./масс.), от 0,10% до 3,50% (масс./масс.), от 0,15% до 3,00% (масс./масс.), от ,20% до 2,50% (масс./масс.), от 0,21% до 2,20% (масс./масс.), от 0,22% до 2,10% (масс./масс.), от 0,23% до 2,00% (масс./масс.), от 0,24% до 1,90% (масс./масс.); от 0,25% до 1,80% (масс./масс.), от 0,26% до 1,70% (масс./масс.), от 0,27% до 1,60% (масс./масс.), от 0,28% до 1,50% (масс./масс.), от 0,29% до 1,40% (масс./масс.), от 0,30% до 1,30% (масс./масс.), от 0,31% до 1,2% (масс./масс.), от 0,32% до 1,10% (масс./масс.), от 0,33% до 1,00% (масс./масс.), от 0,34% до 0,90% (масс./масс.); от 0,35% до 0,80% (масс./масс.), от 0,36% до 0,75% (масс./масс.), от 0,37% до 0,70% (масс./масс.), от 0,38% до 0,69% (масс./масс.), от 0,39% до 0,68% (масс./масс.), от 0,40% до 0,67% (масс./масс.), от 0,41% до 0,66% (масс./масс.), от 0,42% до 0,65% (масс./масс.), от 0,43% до 0,64% (масс./масс.), от 0,44% до 0,63% (масс./масс.), от 0,45% до 0,62% (масс./масс.), от 0,45% до 0,61% (масс./масс.), от 0,45% до 0,60% (масс./масс.), от 0,45% до 0,59% (масс./масс.), от 0,45% до 0,58% (масс./масс.), от 0,45% до 0,57% (масс./масс.), от 0,45% до 0,56% (масс./масс.), от 0,45% до 0,55% (масс./масс.), от 0,46% до 0,54% (масс./масс.), от 0,47% до 0,53% (масс./масс.), от 0,48% до 0,52% (масс./масс.) или от 0,49% до 0,51% (масс./масс.).
[0055] Таким образом, подходящие концентрации модификатора вязкости в рассматриваемых офтальмологических составах включают 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,10%, 0,11%, 0,12%, 0,13%, 0,14%, 0,15%, 0,16%, 0,17%, 0,18%, 0,19%, 0,20%, 0,21%, 0,22%, 0,23%, 0,24%, 0,25%, 0,26%, 0,27%, 0,28%, 0,29%, 0,30%,0,31%, 0,32%, 0,33%, 0,34%, 0,35%, 0,36%, 0,37%, 0,38%, 0,39%, 0,40%, 0,41%, 0,42%, 0,43%, 0,44%, 0,45%, 0,46%, 0,47%, 0,48%, 0,49%, 0,50%, 0,51%, 0,52%, 0,53%, 0,54%, 0,55%, 0,56%, 0,57%, 0,58%, 0,59%, 0,60%, 0,61%, 0,62%, 0,63%, 0,64%, 0,65%, 0,66%, 0,67%, 0,68%, 0,69%, 0,70%, 0,71%, 0,72%, 0,73%, 0,74%, 0,75%, 0,76%, 0,77%, 0,78%, 0,79%, 0,80%, 0,81%, 0,82%, 0,83%, 0,84%, 0,85%, 0,86%, 0,87%, 0,88%, 0,89%, 0,90%, 0,91%, 0,92%, 0,93%, 0,94%, 0,95%, 0,96%, 0,97%, 0,98%, 0,99%, 1,00%, 1,10%, 1,20%, 1,30%, 1,40%, 1,50%, 1,60%, 1,70%, 1,80%, 1,90%, 2,00%, 2,10%, 2,20%, 2,30%, 2,40%, 2,50%, 2,60%, 2,70%, 2,80%, 2,90%, 3,00%, 3,10%, 3,20%, 3,30%, 3,40%, 3,50%, 3,60%, 3,70%, 3,80%, 3,90%, 4,00%, 4,10%, 4,20%, 4,30%, 4,40%, 4,50%, 4,60%, 4,70%, 4,80%, 4,90% и 4,99% (масс./масс.).
[0056] Кроме того, следует понимать, что рассматриваемые композиции по существу не содержат консерванты (т.е., консерванты не более 0,01% масс., и чаще всего не более 0,005% масс.). Например, консерванты, которые обычно не включают, представляют собой хлорид бензалкония, хлорид или бромид цетримида или цетримония, бромид бензододециния, мирамин, хлорид цетилпиридиния, хлорид полидрония или поликватерниум-1, поликватерниум-42 (также известный как поликсетоний), хлорид сепазония; производные ртути, такие как соли фенилртути (ацетат, борат или нитрат), мертиолят натрия (иначе называемый тиомерсал или тимеросал) и меркуробутол; амидины, такие как биглюконат хлоргексидина или полигексаметилен бигуанид (PHMB); спирты, такие как хлорбутанол или фенилэтанол или бензиловый спирт или фенол или м-крезол или феноксиэтанол; парабены или сложные эфиры, такие как парагидроксибензойная кислота, метилпарабен и пропилпарабен).
[0057] Действительно, авторы настоящего изобретения неожиданно обнаружили, что составы без консервантов имели такую же стабильность, как и с консервантами.
[0058] Что касается стерилизации рассматриваемых составов, следует иметь в виду, что рассматриваемые составы могут быть стерилизованы с применением всех известных способов стерилизации, включая фильтрацию через фильтры 0,22 микрона, термическую стерилизацию, автоклавирование, облучение (например, гамма, электронный пучок, микроволны). Преимущественно, и как более подробно показано ниже, авторы настоящего изобретения также обнаружили, что рассматриваемые составы могут быть составлены из двух партий, в которых регулятор вязкости стерилизуют с применением насыщенного пара высокого давления при 121°C (в течение по меньшей мере 5 или по меньшей мере 10 или по крайней мере 15 минут) отдельно от раствора атропина, буфера и соли, который независимо стерилизуют фильтрованием.
[0059] Например, в одном предпочтительном аспекте предмета настоящего изобретения, как изображено на фигуре, получение офтальмологического раствора осуществляют с применением двух отдельных производственных линий, в которых раствор модификатора вязкости готовят и стерилизуют отдельно от раствора лекарственного средства. В частности, такой способ позволяет быстро и полностью растворить атропин, регулятор тоничности, буферные компоненты и хелатор, а также обеспечивает способ стерилизации, который уменьшает или даже полностью исключает термический гидролиз атропина. После приготовления стерильного раствора атропина этот раствор затем можно объединить с раствором модификатора вязкости, который также был стерилизован. Хотя по существу можно применять стерилизацию с применением фильтра, как в случае раствора атропина, было обнаружено, что термическая стерилизация с применением автоклава помогает полностью растворить модификатор вязкости и обеспечить легкое смешивание вязкого раствора с раствором лекарственного средства. С другой стороны, следует понимать, что раздельный процесс приготовления и стерилизации позволяет избежать различных трудностей, которые в противном случае были бы связаны с приготовлением одной партией, включая увеличение времени перемешивания компонента для растворения буфера, регулятора тоничности и хелатора при повышенном перемешивании, повышенном времени стерильной фильтрации вследствие более высокой вязкости и т. д.
[0060] Исходя из достигнутой стабильности, объединенные растворы, рассматриваемые в настоящем документе, можно дополнительно отфильтровать через фильтр для частиц (например, полипропиленовый фильтр 40 микрон) и заполнить ими емкости из полиэтилена, полипропилена или полиэтилена низкой плотности с применением предварительно сформированных емкостей в одноразовом формате или многодозовом формате или с применением процесса выдува-наполнения-запайки (BFS). BFS представляет собой форму современного асептического производства, при котором емкость формируют, заполняют и герметизируют в одной непрерывной автоматизированной системе, не требующей вмешательства человека. Способ начинают с экструзии пластиковых гранул в форме горячей полой трубки из расплавленного пластика, называемой заготовкой. Следующая стадия представляет собой формование посредством выдува емкости с открытым верхом, через который емкость заполняют, пока пластик остается горячим и в расплавленном состоянии. После заполнения емкость герметично запаивают и охлаждают. Процесс выдува-наполнения-запайки может занимать несколько секунд, и рассматриваемые готовые композиции для инъекций преимущественно готовят таким образом, чтобы выдерживать требования к температуре и давлению без существенного разрушения атропина (например, разрушения менее 5% масс., менее 3% масс., менее 2% масс., менее 1% масс.)
[0061] После наполнения полимерных полупроницаемых инфузионных емкостей большого объема составами атропина (например, емкость BFS, обычно 1,0 мл BFS ампулы), необязательно на емкости можно наносить слой или покрывать системой вторичной упаковки, включающей алюминиевый пакет.
[0062] Следующие примеры приведены только для иллюстративных целей и не должны интерпретироваться как ограничение настоящего изобретения.
Примеры
[0063] Следующие примеры иллюстрируют некоторые эксперименты, приводящие к получению составов в соответствии с предметом настоящего изобретения, однако не должны рассматриваться как ограничивающие объем формулы изобретения каким-либо образом.
[0064] Количественный анализ:
[0065] Комбинированный способ испытаний, основанный на ультраэффективной жидкостной хроматографии (UPLC), был разработан для идентификации, количественного определения и определения родственных соединений в одном эксперименте. Это было достигнуто с помощью обращенно-фазового градиента UPLC с УФ-детектированием, включая получение спектров УФ-поглощения в режиме реального времени. Октадецилсилил-замещенный диоксид кремния с размером частиц менее 2 мкм применяли в качестве неподвижной фазы для хроматографического анализа. Подвижную фазу готовили путем смешивания водного буферного раствора с кислым pH и смесью ацетонитрил-вода. Количественное определение активного ингредиента и родственных соединений проводили путем сравнения соответствующих пиковых откликов раствора образца с пиковым откликом атропина стандартного раствора. Относительные коэффициенты отклика применяли для корректировки влияния химической структуры на отклики. В этот метод испытаний включены два метода идентификации. Атропин идентифицировали на основании времени удерживания основного пика на хроматограмме раствора образца и спектра УФ-поглощения, полученного в пределах этого пика.
[0066] Примерные составы и исследования стабильности:
[0067] Офтальмологические готовые к применению композиции с низкими дозами атропина готовили с применением двухстадийного процесса, по существу, как показано на фигуре 1.
[0068] Стадия 1 - Приготовление фазы раствора полимера. К примерно 60% WFI медленно добавляли необходимое количество ГПМЦ и перемешивали до получения прозрачного раствора. Затем раствор подвергали автоклавированию при 121°C в течение примерно 30 минут.
[0069] Стадия 2 - Приготовление фазы раствора лекарственного средства: К примерно 30% WFI последовательно добавляли необходимые количества динатрия эдетата, дигидрофосфата натрия, гидрофосфата фосфата натрия и хлорида натрия после полного растворения каждого ингредиента. Измеряли рН раствора и доводили до примерно 5,5 ± 0,1 с помощью соляной кислоты/гидроксида натрия. К вышеуказанному раствору добавляли сульфат атропина и перемешивали до полного растворения.
[0070] Затем раствор лекарственного средства со стадии 2 смешивали с раствором полимера со стадии 1. Объем партии доводили с применением WFI для получения фармацевтической композиции. В таблицах 1-3 приведены примерные составы с добавлением регулятора тоничности и без него, с добавлением ЭДТА и низким количеством ЭДТА, и с различной буферной силой.
(Низкое количество ЭДТА)
Таблица 1
Таблица 2
Таблица 3
[0071] Если не указано иное, фармацевтические композиции из таблицы 3 (50 мМ буферная композиция с NaCl) подвергали исследованиям долгосрочной стабильности. Готовили лабораторные партии офтальмологического раствора сульфата атропина (приблизительно 0,4 мл), разливали в 1 мл ампулы способом выдува-наполнения-запайки (BFS), и затем упаковывали их в алюминиевые пакеты. Некоторое количество упакованных в пакеты ампул подвергали длительным исследованиям стабильности при 25°C ± 2°C/относительной влажности 60% ± 5% в соответствии с условиями стабильности Международного комитета по гармонизации (см. URL: ich.org). Пакетированные ампулы, подвергнутые этим исследованиям долгосрочной стабильности, собирали через 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца и 3 месяца хранения для оценки стабильности, открывали и тестировали на уровни атропина сульфата, троповой кислоты, pH (где применимо) и вязкость (где применимо). Уровни атропина и троповой кислоты измеряли с применением метода UPLC, и результаты показаны в таблицах 4-8.
неделя
недели
недели
месяц
месяца
месяца
Таблица 4
недели
недели
месяц
месяца
месяца
Таблица 5
неделя
недели
недели
месяц
месяца
месяца
Таблица 6
неделя
недели
недели
месяц
месяца
месяца
Таблица 7
неделя
недели
недели
месяц
месяца
месяца
Таблица 8
[0072] Как легко увидеть из приведенных выше результатов, растворы атропина с пониженной концентрацией буферной системы (75 мМ, и особенно 50 мМ и менее) имели значительно более низкие уровни троповой кислоты (продукта разрушения атропина) уже через 1 месяц. Для экстраполяции уровней разрушения по окончании 24 месяцев применяли регрессионный анализ. Основываясь на методах экстраполяции, обычно используемых в данной области техники, концентрации 50 мМ и без буфера имеют срок годности 18-24 месяца, что является на 3-9 месяцев дольше экстраполированного срока годности для композиции 100 мМ, который составляет 15 месяцев.
[0073] Указанные выше композиции также подвергали исследованиям стабильности в условиях ускоренного старения. Готовили лабораторные партии офтальмологического раствора сульфата атропина (приблизительно 0,4 мл), разливали в 1 мл ампулы способом выдува-наполнения-запайки (BFS), и затем упаковывали их в алюминиевые пакеты. Некоторое количество упакованных в пакеты ампул подвергали исследованиям стабильности в условиях ускоренного старения при 40°C ± 2°C/относительной влажности 75% ± 5% в соответствии с условиями стабильности Международного комитета по гармонизации. Пакетированные ампулы, подвергнутые этим исследованиям стабильности в условиях ускоренного старения, собирали через 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца и 3 месяца хранения для оценки стабильности, открывали и тестировали на уровни атропина сульфата, троповой кислоты и вязкости (где применимо). Уровни атропина и троповой кислоты измеряли с применением метода UPLC, и результаты показаны в таблицах 9-13.
неделя
недели
недели
месяц
месяца
месяца
Таблица 9
недели
недели
месяц
месяца
месяца
Таблица 10
неделя
недели
недели
месяц
месяца
месяца
Таблица 11
неделя
недели
недели
месяц
месяца
месяца
Таблица 12
неделя
недели
недели
месяц
месяца
месяца
Таблица 13
[0074] Еще раз, из данных легко можно получить, что растворы атропина с пониженной концентрацией буферной системы (75 мМ, и особенно 50 мМ и менее) имели значительно более низкие уровни троповой кислоты (продукта разрушения атропина) уже через 1 месяц. Для экстраполяции уровней разрушения по окончании 24 месяцев применяли регрессионный анализ. Основываясь на методах экстраполяции, обычно используемых в данной области техники, концентрации 50 мМ и без буфера имеют срок годности 18-24 месяца, что является на 3-9 месяцев дольше экстраполированного срока годности для композиции 100 мМ, который составляет 15 месяцев.
[0075] Дополнительные исследования стабильности с применением дополнительных изменений состава снова установили, что более низкая буферная сила, особенно при применении двухкомпонентной буферной системы, обеспечивает повышенную стабильность офтальмологических составов с низкой дозой атропина, имеющих композиции, как показано в таблицах 14-15, как в нормальных условиях, так и в условиях ускоренного старения (результаты приведены в таблицах 16-19.
(Benecel E4M Pharm)
Таблица 14
(Benecel E4M Pharm)
Таблица 15
Таблица 16
Таблица 17
Таблица 18
Таблица 19
[0076] Было протестировано влияние pH и стабильность композиций из таблицы 20, и примерные результаты испытаний для pH 3,5 и pH 6,0 представлены в таблицах 21-22 (pH 3,5) и таблицах 23-24 (рН 6,0) ниже.
Таблица 20
недели
месяц
(RRT=1,21)
Таблица 21
недели
месяц
(RRT=1,21)
Таблица 22
недели
месяц
(RRT=1,21)
Таблица 23
недели
месяц
месяца
(RRT=1,21)
Таблица 24
[0077] Офтальмологический раствор сульфата атропина предназначен для получения однодозового или многодозового продукта для местного введения в глаза, который преимущественно может быть получен в форме ампулы способом выдува-наполнения-запайки (BFS) в качестве первичной системы укупорки емкостей. Например, подходящие материалы для ампул включают смолу Lyondellbasell Purell PE 3020 D, которая была испытана следующим образом:
[0078] Композиции, показанные в таблице 3 (50 мМ буферная композиция с NaCl, низкое количество ЭДТА), заполненные в ампулы BFS, тестировали при концентрациях 0,01% (масс./об.) и 0,02% (масс./об.) при в условиях ускоренного старения (40°C/75% относительной влажности) и условиях долгосрочного (25°C/60% относительной влажности) хранения. Заполненные ампулы BFS затем упаковывали во вторичную упаковку (здесь: ламинированный пакет) для хранения, как указано. Результаты этого исследования представлены в таблицах 25-28.
Таблица 25
Таблица 26
Таблица 27
Таблица 28
[0079] В настоящем документе в описании и в последующей формуле изобретения, артикли определенной и неопределенной формы единственного числа включают ссылку на множественное число, если контекст явно не предписывает иное. Также, в описании в настоящем документе, значение «в» включает «в» и «на», если контекст явно не предписывает иное.
[0080] В некоторых вариантах реализации числа, выражающие количества ингредиентов, свойства, такие как концентрация, условия реакции и т. д., используемые для описания и заявления некоторых вариантов реализации настоящего изобретения, следует понимать как изменяемые в некоторых случаях термином «примерно». Соответственно, в некоторых вариантах реализации числовые параметры, изложенные в письменном описании и прилагаемой формуле изобретения, являются приблизительными значениями, которые могут варьироваться в зависимости от необходимых свойств, которые должны быть получены в конкретным варианте реализации. В некоторых вариантах реализации числовые параметры следует толковать с учетом количества сообщаемых значащих цифр и с применением обычных методов округления. Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем некоторых вариантов реализации настоящего изобретения, являются приблизительными, числовые значения, изложенные в конкретных примерах, сообщаются настолько точно, насколько это практически осуществимо. Числовые значения, представленные в некоторых вариантах реализации настоящего изобретения, могут содержать определенные ошибки, обязательно являющиеся результатом стандартного отклонения, обнаруженного в их соответствующих тестовых измерениях.
[0081] Однако специалистам в данной области техники должно быть очевидно, что возможны многие другие модификации, помимо уже описанных, без отступления от идей настоящего изобретения. Следовательно, предмет изобретения не должен быть ограничен, кроме как в сущности раскрытия. Специалист в данной области техники распознает множество способов и материалов, подобных или эквивалентных тем, которые описаны в настоящем документе, которые могут быть использованы при реализации настоящего изобретения. Действительно, настоящее изобретение никоим образом не ограничивается описанными способами и материалами.
[0082] Кроме того, при интерпретации раскрытия все термины следует интерпретировать самым широким возможным способом в соответствии с контекстом. В частности, термины «содержит» и «содержащий» следует интерпретировать как относящийся к элементам, компонентам или стадиям неисключительным образом, указывая на то, что ссылочные элементы, компоненты или стадии могут присутствовать или быть использованы или комбинированы с другими элементами, компонентами или стадиями, на которые не приведено явной ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ХОЛИНОВОГО ЭФИРА ЛИПОЕВОЙ КИСЛОТЫ | 2015 |
|
RU2735790C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПРЕСБИОПИИ, МИДРИАЗА И ДРУГИХ ГЛАЗНЫХ РАССТРОЙСТВ | 2019 |
|
RU2824137C2 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2020 |
|
RU2832581C1 |
| КОМПОЗИЦИИ ОКСИМЕТАЗОЛИНА И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2020 |
|
RU2820596C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПЛАЗМИНОГЕН, И ЕЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2711989C2 |
| СТАБИЛЬНЫЙ ВОДНЫЙ РАСТВОР | 2014 |
|
RU2665639C2 |
| СОСТАВЫ ДЛЯ ПАРЕНТЕРАЛЬНОЙ ДОСТАВКИ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2539387C2 |
| КОМПОЗИЦИИ СТАБИЛЬНЫХ ТИАКУМИЦИНОВ | 2008 |
|
RU2484829C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРЕПАРАТИВНАЯ ФОРМА | 2004 |
|
RU2362560C2 |
| КАПСУЛЫ ЗАДЕРЖАННОГО ВЫСВОБОЖДЕНИЯ ИЗ МЯГКОГО ЖЕЛАТИНА | 2020 |
|
RU2822392C2 |
Настоящее изобретение относится к фармацевтической промышленности, а именно к жидкой стабильной при хранении офтальмологической композиции с низкой дозой атропина (варианты), к способу получения стабильного при хранении жидкого офтальмологического состава с низкой дозой атропина и способу увеличения его стабильности, к набору для лечения миопии. Жидкая стабильная при хранении офтальмологическая композиция с низкой дозой атропина содержит водный раствор, содержащий буфер в концентрации, равной или менее 75 мМ, регулятор тоничности, модификатор вязкости, хелатор и атропин или его фармацевтически приемлемую соль в низкой дозе, и при этом офтальмологическая композиция атропина имеет рН от 5,0 до 6,0; и при этом офтальмологическая композиция атропина по существу не содержит консерванта (варианты). Вышеуказанное позволяет получать жидкие стабильные при хранении офтальмологические композиции с низкой дозой атропина, обладающие улучшенной стабильностью и физиологически приемлемым pH, где композиции содержат низкий уровень троповой кислоты от разложения атропина (менее 0,35%), а также по существу не содержат консервантов. 6 н. и 103 з.п. ф-лы, 1 ил., 28 табл.
1. Жидкая стабильная при хранении офтальмологическая композиция с низкой дозой атропина, содержащая:
водный раствор, содержащий буфер, регулятор тоничности, модификатор вязкости, хелатор и атропин или его фармацевтически приемлемую соль;
при этом атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,01 до 0,05% масс.;
при этом буфер имеет концентрацию, равную или менее 75 мМ, и при этом офтальмологическая композиция атропина имеет рН от 5,0 до 6,0; и
при этом офтальмологическая композиция атропина по существу не содержит консерванта.
2. Композиция по п. 1, в которой атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина.
3. Композиция по п. 1, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,02% масс.
4. Композиция по п. 1, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном 0,01% масс.
5. Композиция по п. 1, в которой буфер имеет концентрацию, равную или менее 60 мМ.
6. Композиция по п. 1, в которой буфер имеет концентрацию, равную или менее 50 мМ.
7. Композиция по п. 5, в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
8. Композиция по п. 1, в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
9. Композиция по п. 1, в которой хелатор представляет собой хелатор иона металла.
10. Композиция по п. 9, в которой хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
11. Композиция по п. 9, в которой хелатор присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс.
12. Композиция по п. 1, в которой офтальмологическая композиция атропина имеет рН от 5,0 до 5,2.
13. Композиция по п. 1, в которой офтальмологическая композиция атропина имеет рН 5,5 (+/- 0,2).
14. Композиция по п. 1, в которой офтальмологическая композиция атропина имеет рН от 5,8 до 6,0.
15. Композиция по п. 1, в которой регулятор тоничности представляет собой фармацевтически приемлемую соль, и в которой соль присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс.
16. Композиция по п. 1, в которой модификатор вязкости представляет собой модифицированную целлюлозу.
17. Композиция по п. 16, в которой модифицированная целлюлоза представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
18. Жидкая стабильная при хранении офтальмологическая композиция с низкой дозой атропина, по существу состоящая из:
водного раствора, содержащего буфер, регулятора тоничности, хелатора, модификатора вязкости и атропина или его фармацевтически приемлемой соли;
при этом атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,01 до 0,05% масс.; и
при этом буфер имеет концентрацию, равную или менее 75 мМ, и при этом офтальмологическая композиция атропина имеет рН от 5,0 до 6,0.
19. Композиция по п. 18, в которой атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина.
20. Композиция по п. 18, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,02% масс.
21. Композиция по п. 18, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве 0,01% масс.
22. Композиция по п. 19, в которой буфер имеет концентрацию, равную или менее 60 мМ.
23. Композиция по п. 20, в которой буфер имеет концентрацию, равную или менее 50 мМ.
24. Композиция по п. 22, в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
25. Композиция по п. 23, в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
26. Композиция по п. 18, в которой хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
27. Композиция по п. 24, в которой хелатор представляет собой этилендиаминтетрауксусную кислоту (ЭДТА).
28. Композиция по п. 25, в которой хелатор представляет собой этилендиаминтетрауксусную кислоту (ЭДТА).
29. Композиция по п. 26, в которой хелатор присутствует в офтальмологической композиции атропина в количестве, равном или менее 0,01% масс.
30. Композиция по п. 18, в которой офтальмологическая композиция атропина имеет рН от 5,0 до 5,5 (+/- 0,2).
31. Композиция по п. 18, в которой офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0.
32. Композиция по п. 18, в которой регулятор тоничности представляет собой фармацевтически приемлемую соль, и в которой соль присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс.
33. Композиция по п. 18, в которой модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
34. Композиция по п. 18, в которой офтальмологическая композиция атропина по существу не содержит консерванта.
35. Композиция по п. 18, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве 0,01% масс., в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия и имеет концентрацию, равную или менее 50 мМ, в которой модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу, и причем офтальмологическая композиция атропина по существу не содержит консерванта.
36. Композиция по п. 18, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,01% масс. до 0,05% масс., в которой буфер содержит дигидрофосфат натрия и гидрофосфат натрия и имеет концентрацию, равную или менее 50 мМ, в которой модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу, и причем офтальмологическая композиция атропина по существу не содержит консерванта.
37. Стабильная при хранении не содержащая консерванта офтальмологическая композиция атропина, содержащая:
водный раствор, содержащий низкую дозу атропина или его фармацевтически приемлемую соль, буфер с низкой силой, регулятор тоничности, хелатор и целлюлозный модификатор вязкости;
при этом буфер с низкой силой имеет концентрацию, равную или менее 50 мМ, и при этом атропин в низкой дозе присутствует в концентрации от 0,01 до 0,05% масс.; и
при этом офтальмологическая композиция атропина по существу не содержит консерванта.
38. Композиция по п. 37, в которой атропин в низкой дозе присутствует в концентрации, равной 0,01% масс.
39. Композиция по п. 37, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,01 до 0,02% масс.
40. Композиция по п. 37, в которой атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина.
41. Композиция по п. 37, в которой буфер с низкой силой содержит первый и второй буферные компоненты.
42. Композиция по п. 41, в которой буфер с низкой силой содержит дигидрофосфат натрия и гидрофосфат натрия.
43. Композиция по п. 37, в которой офтальмологическая композиция атропина имеет рН от 5,0 до 6,0.
44. Композиция по п. 37, в которой офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0 (+/- 0,2).
45. Композиция по п. 37, в которой хелатор представляет собой хелатор иона металла.
46. Композиция по п. 45, в которой хелатор присутствует в количестве 0,01% масс. (+/- 20% абс.).
47. Композиция по п. 45, в которой хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
48. Композиция по п. 37, в которой фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс.
49. Композиция по п. 37, в которой фармацевтически приемлемая соль представляет собой хлорид натрия, и в которой соль присутствует в офтальмологической композиции атропина в количестве 0,5% масс. (+/- 0,2% масс.).
50. Композиция по п. 37, в которой целлюлозный модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
51. Композиция по п. 37, в которой целлюлозный модификатор вязкости присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологической композиции атропина.
52. Композиция по п. 37, в которой офтальмологическая композиция атропина приготовлена таким образом, что после хранения в течение по меньшей мере двух месяцев при 25 °С и относительной влажности 60% в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
53. Композиция по п. 37, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве 0,01% масс., в которой буфер с низкой силой содержит дигидрофосфат натрия и гидрофосфат натрия, и причем офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0.
54. Композиция по п. 37, в которой атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве 0,01% масс., причем хелатор присутствует в количестве 0,01% масс. (+/- 20% абс.) от офтальмологической композиции атропина, и причем офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0.
55. Композиция по п. 37, в которой буфер с низкой силой содержит дигидрофосфат натрия и гидрофосфат натрия, причем хелатор присутствует в количестве 0,01% масс. (+/- 20% абс.) от офтальмологической композиции атропина, причем офтальмологическая композиция атропина имеет рН от 5,5 (+/- 0,2) до 6,0, причем соль присутствует в офтальмологической композиции атропина в количестве 0,5% масс. (+/- 0,2% масс.), и причем целлюлозный модификатор вязкости присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологической композиции атропина.
56. Способ увеличения стабильности атропина при хранении в жидком офтальмологическом составе с низкой дозой, включающий:
получение водного раствора с буферной системой с низкой силой, которая содержит первый и второй буферные компоненты, при этом буферная система с низкой силой имеет концентрацию, равную или менее 75 мМ буфера;
включение в водный раствор регулятора тоничности, модификатора вязкости и хелатора;
включение в водный раствор низкой дозы атропина или его фармацевтически приемлемой соли, при этом низкая доза составляет от 0,01 до 0,05% масс. от офтальмологического состава; и
доведение pH офтальмологического состава до pH от 5 до 6.
57. Способ по п. 56, в котором буферная система с низкой силой имеет концентрацию, равную или менее 50 мМ буфера.
58. Способ по п. 56, в котором фармацевтически приемлемая соль представляет собой хлорид натрия, и в котором соль присутствует в офтальмологической композиции атропина в количестве 0,5% масс. (+/- 0,2% масс.) от офтальмологического состава.
59. Способ по п. 56, в котором хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
60. Способ по п. 59, в котором хелатор представляет собой этилендиаминтетрауксусную кислоту (ЭДТА).
61. Способ по п. 56, в котором хелатор присутствует в количестве 0,01% масс. (+/- 20% абс.) от офтальмологического состава.
62. Способ по п. 56, в котором модификатор вязкости представляет собой целлюлозный модификатор вязкости.
63. Способ по п. 62, в котором целлюлозный модификатор вязкости представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
64. Способ по п. 62, в котором целлюлозный модификатор вязкости присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологического состава.
65. Способ по п. 62, в котором целлюлозный модификатор вязкости получают в форме отдельного раствора и объединяют с водным раствором, содержащим буферную систему, фармацевтически приемлемую соль, модификатор вязкости, хелатор и атропин или его фармацевтически приемлемую соль.
66. Способ по п. 56, в котором низкая доза составляет от 0,01% масс. до 0,02% масс. от офтальмологического состава.
67. Способ по п. 56, в котором низкая доза составляет 0,01% масс. от офтальмологического состава.
68. Способ по п. 56, в котором водный раствор приготовлен с применением дезоксигенированной воды.
69. Способ по п. 56, в котором рН составляет от 5,5 (+/- 0,2) до 6,0.
70. Способ по п. 56, в котором атропин или его фармацевтически приемлемая соль представляет собой сульфат атропина.
71. Способ по п. 56, дополнительно включающий стадию стерилизации офтальмологического состава.
72. Способ по п. 71, в котором стадия стерилизации включает стерильную фильтрацию.
73. Способ по п. 56, дополнительно включающий стадию наполнения многодозовой емкости офтальмологическим составом.
74. Способ получения стабильного при хранении жидкого офтальмологического состава с низкой дозой атропина, включающий:
получение буферного раствора с низкой силой с низкой дозой атропина в первой емкости, и проведение стерильной фильтрации буферного раствора с низкой силой с низкой дозой атропина с получением стерильного буферного раствора с низкой силой с низкой дозой атропина;
при этом буфер с низкой силой содержит первый и второй буферные компоненты, которые образуют буферную систему с низкой силой, имеющую концентрацию, равную или менее 75 мМ, в офтальмологическом составе, при этом атропин присутствует в количестве, составляющем от 0,01 до 0,05% масс. от офтальмологического состава;
при этом буферный раствор с низкой силой с низкой дозой атропина дополнительно содержит регулятор тоничности и хелатор;
получение полимерного раствора во второй емкости, и стерилизацию полимерного раствора способом, отличным от стерильной фильтрации, с получением стерильного полимерного раствора;
при этом полимерный раствор содержит полимер для модификации вязкости буферного раствора с низкой силой с низкой дозой атропина в комбинации; и
объединение стерильного буферного раствора с низкой силой с низкой дозой атропина и стерильного полимерного раствора с получением стерильного жидкого офтальмологического состава с низкой дозой.
75. Способ по п. 74, в котором первый и второй буферные компоненты представляют собой дигидрофосфат натрия и гидрофосфат натрия, соответственно.
76. Способ по п. 74, в котором буферная система с низкой силой имеет концентрацию, равную или менее 50 мМ буфера в офтальмологическом составе.
77. Способ по п. 74, в котором атропин присутствует в количестве от 0,01% масс. до 0,02% масс. от офтальмологического состава.
78. Способ по п. 74, в котором атропин присутствует в количестве, равном 0,01% масс. от офтальмологического состава.
79. Способ по п. 74, в котором регулятор тоничности представляет собой фармацевтически приемлемую соль.
80. Способ по п. 79, в котором фармацевтически приемлемая соль представляет собой хлорид натрия, и в котором соль присутствует в офтальмологической композиции атропина в количестве 0,5% масс. (+/- 0,2% масс.) от офтальмологического состава.
81. Способ по п. 74, в котором хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
82. Способ по п. 81, в котором хелатор представляет собой этилендиаминтетрауксусную кислоту (ЭДТА).
83. Способ по п. 74, в котором хелатор присутствует в количестве 0,01% масс. (+/- 20% абс.) от офтальмологического состава.
84. Способ по п. 83, в котором полимер представляет собой целлюлозный полимер.
85. Способ по п. 84, в котором целлюлозный полимер представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
86. Способ по п. 84, в котором целлюлозный полимер присутствует в количестве 0,5% масс. (+/- 0,1% масс.) от офтальмологического состава.
87. Способ по п. 74, дополнительно содержащий стадию доведения рН буферного раствора с низкой силой с низкой дозой атропина до pH от 5 до 6.
88. Способ по п. 87, в котором рН составляет от 5,5 (+/- 0,2) до 6,0.
89. Способ по п. 74, в котором способ, отличный от стерильной фильтрации, представляет собой автоклавирование.
90. Способ по п. 74, в котором стадия объединения включает смешивание стерильного буферного раствора с низкой силой с низкой дозой атропина и стерильного полимерного раствора в течение по меньшей мере 30 минут.
91. Способ по п. 90, дополнительно содержащий стадию наполнения многодозовой емкости офтальмологическим составом.
92. Способ по п. 74, в котором офтальмологический состав приготовлен таким образом, что после хранения в течение по меньшей мере двух месяцев при 25 °С и относительной влажности 60% в результате разрушения атропина образуется троповая кислота в количестве, равном или менее 0,35%.
93. Набор для лечения миопии, содержащий:
первую емкость, содержащую стабильный при хранении жидкий офтальмологический состав с низкой дозой атропина, при этом первая емкость выполнена в форме сменной одноразовой емкости или многодозовой емкости; и
вторую емкость, содержащую первую емкость;
при этом стабильный при хранении жидкий офтальмологический состав с низкой дозой атропина содержит водный раствор, содержащий буфер, регулятор тоничности, модификатор вязкости, хелатор и атропин или его фармацевтически приемлемую соль;
при этом атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, составляющем от 0,01 до 0,05% масс.;
при этом буфер имеет концентрацию, равную или менее 75 мМ, и при этом офтальмологическая композиция атропина имеет рН от 5,0 до 6,0; и
при этом офтальмологическая композиция атропина по существу не содержит консерванта.
94. Набор по п. 93, в котором первая емкость представляет собой емкость, полученную способом выдува-наполнения-запайки (BSF).
95. Набор по п. 93, в котором вторая емкость представляет собой ламинированный металлизированный пакет.
96. Набор по п. 93, в котором атропин или его фармацевтически приемлемая соль присутствует в офтальмологической композиции атропина в количестве, равном 0,01% масс.
97. Набор по п. 93, в котором буфер имеет концентрацию, равную или менее 75 мМ.
98. Набор по п. 93, в котором буфер имеет концентрацию, равную или менее 50 мМ.
99. Набор по п. 97, в котором буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
100. Набор по п. 93, в котором буфер содержит дигидрофосфат натрия и гидрофосфат натрия.
101. Набор по п. 93, в котором хелатор представляет собой хелатор иона металла.
102. Набор по п. 101, в котором хелатор выбран из группы, состоящей из бикарбоновой кислоты, трикарбоновой кислоты и аминополикарбоновой кислоты.
103. Набор по п. 101, в котором хелатор присутствует в офтальмологической композиции атропина в количестве, равном 0,01% масс.
104. Набор по п. 93, в котором офтальмологическая композиция атропина имеет рН от 5,0 до 5,2.
105. Набор по п. 93, в котором офтальмологическая композиция атропина имеет рН 5,5 (+/- 0,2).
106. Набор по п. 93, в котором офтальмологическая композиция атропина имеет рН от 5,8 до 6,0.
107. Набор по п. 93, в котором регулятор тоничности представляет собой фармацевтически приемлемую соль, и в котором соль присутствует в офтальмологической композиции атропина в количестве от 0,2% масс. до 0,8% масс.
108. Набор по п. 93, в котором модификатор вязкости представляет собой модифицированную целлюлозу.
109. Набор по п. 108, в котором модифицированная целлюлоза представляет собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу.
| US 9421199 B2, 23.09.2016 | |||
| WO 2014119642 А1, 07.08.2014 | |||
| JP 2007308398 A, 29.11.2007 | |||
| US 20070254914 A1, 01.11.2007 | |||
| US 20120028910 A1, 02.02.2012 | |||
| US 20160263023 A1, 15.09.2016 | |||
| US 5716952 A, 10.02.1998 | |||
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ТЕРАПЕВТИЧЕСКИ АКТИВНЫЕ КОМПОНЕНТЫ, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ | 2001 |
|
RU2291685C2 |
Авторы
Даты
2021-03-29—Публикация
2018-05-10—Подача