ВКЛЮЧЕННЫЕ В ВИДЕ ССЫЛКИ МАТЕРИАЛЫ, ПОДАННЫЕ В ЭЛЕКТРОННОМ ВИДЕ
[0001] Включен в виде ссылки полностью список последовательностей нуклеотидов/аминокислот в компьютерном варианте, поданный одновременно с ним, и обозначенный, как указано далее: один 70258 байт ASCII (текст) файл, наименованием ʺ723558_ST25.TXT,ʺ созданный 13 апреля 2016.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] Цитокины интерлейкин 36 (IL-36) IL-36α, IL-36β, и IL-36γ (ранее IL-1F6, IL-1F8, и IL-1F9) представляют собой члены семейства интерлейкина-1 (IL-1), которые связываются с рецептором IL-36 (IL-36R) (ранее IL-1Rrp2 или IL-1RL2) и используют акцессорный белок рецептора IL-1 (IL-1RAcP) в качестве корецептора для стимуляции внутриклеточных сигналов, сходных с таковыми, индуцированными IL-1 (Towne et al., J. Biol. Chem., 279(14): 13677-13688 (2004)). IL-1F5 представляет собой член семейства IL-1, который действует как антагонист IL-36R, и в настоящее время называется как IL-36Ra (Dinarello et al., Nat. Immunol., 11(11): 973 (2010)).
[0003] IL-36α, IL-36β, и IL-36γ высоко экспрессируются в нескольких тканях, включая внутренние эпителиальные ткани, которые подвергаются воздействию патогенов, и в коже. Экспрессия IL-36Ra и IL-36α значительно стимулируется в IL-1β/TNF-α-стимулированных человеческих кератиноцитах, и мРНК IL-36Rα и IL-36γ избыточно экспрессируются в псориатических поражениях кожи. Повышенную мРНК и белка IL-36α также наблюдали при хронической болезни почек (Ichii et al., Lab Invest., 90(3): 459-475 (2010)). Дендритные клетки из мышиного костного мозга (BMDC) и CD4+ T лимфоциты постоянно экспрессируют IL-36R и отвечают непосредственно на IL-36α, IL-36β, и IL-36γ путем продуцирования провоспалительных цитокинов (например, IL-12, IL-1β, IL-6, TNF-α, и IL-23), индуцируя более сильный стимулирующий эффект, чем другие IL-1 цитокины (Vigne et al., Blood, 118(22): 5813-5823 (2011)).
[0004] Трансгенные мыши, избыточно экспрессирующие IL-36α в кератиноцитах, демонстрируют транзиторные воспалительные заболевания кожи при рождении, которые делают мышей высоко подверженными 12-O-тетрадеканоилфорбол 13-ацетат-индуцированной кожной патологии, похожей на человеческий псориаз (Blumberg et al., J. Exp. Med., 204(11): 2603-2614 (2007); and Blumberg et al., J. Immunol., 185(7):4354-4362 (2010)). Более того, IL-36R-дефицитные мыши защищены от имиквимод-индуцированного псориазиформного дерматита (Tortola et al., J. Clin. Invest., 122(11): 3965-3976 (2012)). Такие результаты четко предполагают роль IL-36 при определенных воспалительных заболеваниях кожи.
[0005] IL-36 цитокины также вовлечены в определенные тяжелые формы псориаза, включая пустулезный псориаз, генерализованнй пустулезный псориаз (GPP), и ладонно-подошвенный пустулезный псориаз (PPP)) (см., например, Town, J.E. and Sims, J.E., Curr. Opin. Pharmacol., 12(4): 486-90 (2012); и Naik, H.B. and Cowen, E.W., Dermatol Clin., 31(3): 405-425 (2013)). Пустулезный псориаз представляет собой редкую форму псориаза, характеризуемую белыми пустулами, окруженными красной кожей. Генерализованный пустулезный псориаз представляет собой тяжелую, системную форму пустулезного псориаза, который имеет высокий риск смертельных случаев, тогда как ладонно-подошвенный пустулез представляет собой хроническую форму пустулезного псориаза, который поражает ладони и подошвы стоп. Существующее лечение пустулезного псориаза, GPP, и PPP включает пероральные ретиноиды и местные стероиды, но такое лечение демонстрирует плохую эффективность и тяжелые побочные эффекты.
[0006] Существует необходимость в антагонистах IL-36R (например, антителах), которые связываются с IL-36R с высокой афинностью и эффективно нейтрализуют активность IL-36R. Изобретение обеспечивает такие IL-36R-связывающие агенты.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает последовательность аминокислот Gln Val Gln Xaa1 Xaa2 Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Xaa3 Leu Glu Trp Met Gly Trp Ile Tyr Pro Gly Asp Xaa4 Ser Thr Lys Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Xaa5 Asp Xaa6 Ser Ala Xaa7 Thr Ala Tyr Met Glu Leu Xaa8 Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Xaa9 Cys Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 56), где (a) Xaa1 представляет собой лейцин (Leu) или фенилаланин (Phe), (b) Xaa2 представляет собой валин (Val), метионин (Met), или лейцин (Leu), (c) Xaa3 представляет собой аргинин (Arg) или глицин (Gly), (d) Xaa4 представляет собой глицин (Gly), серин (Ser), или аланин (Ala), (e) Xaa5 представляет собой аргинин (Arg) или аланин (Ala), (f) Xaa6 представляет собой треонин (Thr) или лизин (Lys), (g) Xaa7 представляет собой серин (Ser) или аспарагин (Asn), (h) Xaa8 представляет собой серин (Ser) или аланин (Ala), и (i) Xaa9 представляет собой тирозин (Tyr) или фенилаланин (Phe).
[0008] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает последовательность аминокислот Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Xaa1 Met Xaa2 Trp Val Arg Gln Ala Pro Xaa3 Gln Gly Leu Glu Trp Met Gly Met Phe Xaa4 Pro Xaa5 Xaa6 Xaa7 Val Thr Arg Leu Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 15), где (a) Xaa1 представляет собой триптофан (Trp) или тирозин (Tyr), (b) Xaa2 представляет собой гистидин (His), аспарагин (Asn), или тирозин (Tyr), (c) Xaa3 представляет собой глицин (Gly) или аргинин (Arg), (d) Xaa4 представляет собой аспарагиновую кислоту (Asp), глютаминовую кислоту (Glu), или гистидин (His), (e) Xaa5 представляет собой серин (Ser), треонин (Thr), или тирозин (Tyr), (f) Xaa6 представляет собой аспарагиназу (Asn) или глицин (Gly), и (g) Xaa7 представляет собой серин (Ser), аланин (Ala), или аспарагиновую кислоту (Asp).
[0009] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает последовательность аминокислот Xaa1 Xaa2 Gln Xaa3 Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Xaa4 Xaa5 Tyr Ser Ile Thr Xaa6 Asp Phe Ala Trp Asn Trp Ile Arg Gln Xaa7 Pro Gly Xaa8 Xaa9 Leu Glu Trp Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Xaa10 Xaa11 Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Xaa12 Tyr Xaa13 Cys Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Xaa14 (SEQ ID NO: 57), где Xaa1 представляет собой глютамин (Gln) или аспарагиновую кислоту (Asp); Xaa2 представляет собой валин (Val) или лейцин (Leu); Xaa3 представляет собой лейцин (Leu) или фенилаланин (Phe); Xaa4 представляет собой треонин (Thr) или серин (Ser); Xaa5 представляет собой глицин (Gly) или аргинин (Arg); Xaa6 серин (Ser) или аланин (Ala); Xaa7 представляет собой пролин (Pro) или фениаланин (Phe); Xaa8 представляет собой лизин (Lys) или аспарагин (Asn); Xaa9 представляет собой глицин (Gly) или лизин (Lys); Xaa10 представляет собой серин (Ser) или треонин (Thr); Xaa11 представляет собой валин (Val) или аргинин (Arg); Xaa12 представляет собой треонин (Thr) или валин (Val); Xaa13 представляет собой тирозин (Tyr) или фениаланин (Phe); и Xaa14 представляет собой аланин (Ala) или отсутствует.
[00010] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает последовательность аминокислот SEQ ID NO: 33, SEQ ID NO: 34, или SEQ ID NO: 35.
[00011] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает последовательность аминокислот Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser Asn Xaa1 Asn Thr Tyr Leu Tyr Trp Xaa2 Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Xaa3 Arg Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 36), где (a) Xaa1 представляет собой глицин (Gly) представляет собой аланин (Ala), (b) Xaa2 представляет собой фениаланин (Phe) или тирозин (Tyr), и (c) Xaa3 представляет собой тирозин (Tyr) или серин (Ser).
[00012] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает последовательность аминокислот Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Xaa1 Asn Xaa2 Ile Thr Tyr Phe Tyr Trp Tyr Leu Xaa3 Lys Pro Gly Gln Pro Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 40), (a) Xaa1 представляет собой серин (Ser) или аргинин (Arg), (b) Xaa2 представляет собой глицин (Gly) или аланин (Ala), и (c) Xaa3 представляет собой глютамин (Gln) или гистидин (His).
[00013] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает последовательность аминокислот Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Xaa1 Ile Asn Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Xaa2 Leu His Ser Gly Val Pro Ser Arg Phe Ser Xaa3 Ser Gly Ser Gly Xaa4 Asp Xaa5 Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Xaa6 Xaa7 (SEQ ID NO: 58), где (a) Xaa1 представляет собой аспарагиновую кислоту (Asp) или триптофан (Trp), (b) Xaa2 представляет собой аргинин (Arg) или метионин (Met), (c) Xaa3 представляет собой глицин (Gly), серин (Ser) или пролин (Pro), (d) Xaa4 представляет собой треонин (Thr) или аспарагины (Asn), (e) Xaa5 представляет собой фениаланин (Phe) или тирозин (Tyr), (f) Xaa6 представляет собой аргинин (Arg) или отсутствует, и (g) Xaa7 представляет собой треонин (Thr) или отсутствует.
[00014] Изобретение относится к выделенному полипептиду легких цепей иммуноглобулина, который включает последовательность аминокислот SEQ ID NO: 48, SEQ ID NO: 49, или SEQ ID NO: 50.
[00015] Кроме того, изобретение обеспечивает выделенную или очищенную последовательности аминокислот, кодирующие вышеуказанные полипептиды иммуноглобулина, векторы, включающие такие последовательности нуклеиновых кислот, IL-36R-связывающие агенты, включающие вышеуказанные полипептиды иммуноглобулина, последовательности нуклеиновых кислот, кодирующие такие IL-36R-связывающие агенты, векторы, включающие такие последовательности нуклеиновой кислоты, выделенные клетки, включающие такие векторы, композиции, включающие такие IL-36R-связывающие агенты или такие векторы с фармацевтически приемлемым носителем, и методы лечения заболевания, которое отвечает на IL-36R ингибирование, путем введения эффективных количеств таких композиций млекопитающим.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ЧЕРТЕЖЕЙ(А)
[00016] Фиг. 1A представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток hIL-36γ.
[00017] Фиг. 1B представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток hIL-36β.
[00018] Фиг. 1C представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток hIL-36α.
[00019] Фиг. 1D представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток 50 нг/мл hIL-36α.
[00020] Фиг. 1E представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток 20 нг/мл hIL-36β.
[00021] Фиг. 1F представляет собой график, изображающий результаты люциферазного репортерного анализа HEK с человеческим IL-36R/IL-8, описанного в примере 1, при стимуляции клеток 600 нг/мл hIL-36γ.
[00022] Фиг. 2A представляет собой график, изображающий результаты люциферазного репортерного анализа HEK IL-36R/IL-8 яванского макака, описанного в примере 1, при стимуляции клеток 2 мкг/мл cynoIL-36α.
[00023] Фиг. 2B представляет собой график, изображающий результаты люциферазного репортерного анализа HEK IL-36R/IL-8 яванского макака, описанного в примере 1, при стимуляции клеток 10 мкг/мл cynoIL-36β.
[00024] Фиг. 2C представляет собой график, изображающий результаты люциферазного репортерного анализа HEK IL-36R/IL-8 яванского макака, описанного в примере 1, при стимуляции клеток 300 нг/мл cynoIL-36γ.
[00025] Фиг. 3A представляет собой график, изображающий экспериментальные данные, которые иллюстрируют кривую для антитела, обозначенного APE5281, связывающегося с человеческим IL-36R, как определяют посредством анализа KINEXA™, описанного в примере 2.
[00026] Фиг. 3B представляет собой график, изображающий экспериментальные данные, которые иллюстрируют кривую для антитела, обозначенного APE6194, связывающегося с человеческим IL-36R, как определяют посредством анализа BIACORE™, описанного в примере 2.
[00027] Фиг. 3C представляет собой график, отображающий экспериментальные данные, которые иллюстрируют кривую для антитела, обозначенного APE7247, связывающегося с человеческим IL-36R, как определяют посредством анализа KINEXA™, описанного в примере 2.
[00028] Фиг. 4A представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 10 нг/мл hIL-36α.
[00029] Фиг. 4B представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 1 нг/мл hIL-36β.
[00030] Фиг. 4C представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 100 нг/мл hIL-36γ.
[00031] Фиг. 4D представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 10 нг/мл hIL-36α.
[00032] Фиг. 4E представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 1 нг/мл hIL-36β.
[00033] Фиг. 4F представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 100 нг/мл hIL-36γ.
[00034] Фиг. 4G представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 10 нг/мл hIL-36α.
[00035] Фиг. 4H представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 1 нг/мл hIL-36β.
[00036] Фиг. 4I представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 3, с использованием 100 нг/мл hIL-36γ.
[00037] Фиг. 5A представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 4, с использованием 50 нг/мл cyno IL-36α.
[00038] Фиг. 5B представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих кератиноцитах, описанного в примере 4, с использованием 10 нг/мл cyno IL-36β.
[00039] Фиг. 5C представляет собой график, изображающий результаты анализа секреции IL-8 в первичных кератиноцитах яванского макака, описанного в примере 4, с использованием 250 нг/мл cyno IL-36γ.
[00040] Фиг. 5D представляет собой график, изображающий результаты анализа секреции IL-8 в первичных кератиноцитах яванского макака, описанного в примере 4, с использованием 50 нг/мл cyno IL-36α.
[00041] Фиг. 5E представляет собой график, изображающий результаты анализа секреции IL-8 в первичных кератиноцитах яванского макака, описанного в примере 4, с использованием 10 нг/мл cyno IL-36β.
[00042] Фиг. 5F представляет собой график, изображающий результаты анализа секреции IL-8 в первичных кератиноцитах яванского макака, описанного в примере 4, с использованием 250 нг/мл cyno IL-36γ.
[00043] Фиг. 6A представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих моноцитах, описанного в примере 5, с использованием 5 нг/мл IL-36β.
[00044] Фиг.6B представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих моноцитах, описанного в примере 5, с использованием 500 нг/мл IL-36β.
[00045] Фиг. 7A представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих мононуклеарных клетках периферической крови (PBMC), описанного в примере 6, с использованием 10 нг/мл IL-36α.
[00046] Фиг. 7B представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих мононуклеарных клетках периферической крови (PBMC), описанного в примере 6 с использованием 1 нг/мл IL-36β.
[00047] Фиг. 7C представляет собой график, изображающий результаты анализа секреции IL-8 в первичных человеческих мононуклеарных клетках периферической крови (PBMCs), описанного в примере 6 с использованием 100 нг/мл IL-36γ.
[00048] Фиг. 8A представляет собой график, отображающий результаты анализа перекрестного конкурентного связывания антитело/антиген, описанного в примере 8, что определяли посредством анализа BIACORE™ с использованием APE5100 в качестве первичного антитела.
[00049] Фиг. 8B представляет собой график, отображающий результаты анализа перекрестного конкурентного связывания антитело/антиген, описанного в примере 8, что определяли посредством анализа BIACORE™ с использованием APE6155 в качестве первичного антитела.
[00050] Фиг. 9A представляет собой график, отображающий результаты анализа конкурентного связывания, описанного в примере 9, с использованием клеток CHO-K, стабильно ко-экспрессирующих человеческий IL-36R и человеческий IL-1RAcP.
[00051] Фиг. 9B представляет собой график, отображающий результаты анализа конкурентного связывания, описанного в примере 9, с использованием клеток CHO-K, стабильно ко-экспрессирующих вариант 1 IL-36R яванского макака и IL-1RAcP яванского макака.
[00052] Фиг. 10A представляет собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 2 IL-36R/IL-8 яванского макака, стимулированных 20 нг/мл cynoIL-36γ.
[00053] Фиг. 10B представляющий собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 1 IL-36R/IL-8 яванского макака, стимулированных 300 нг/мл cynoIL-36γ.
[00054] Фиг. 1C представляющий собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 3 IL-36R/IL-8 яванского макака, стимулированных 100 нг/мл cynoIL-36γ.
[00055] Фиг. 10D представляет собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 2 IL-36R/IL-8 яванского макака, стимулированных 300 нг/мл cynoIL-36γ.
[00056] Фиг. 10E представляет собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 3 IL-36R/IL-8 яванского макака, стимулированных 300 нг/мл cynoIL-36γ.
[00057] Фиг. 10F представляет собой график, отображающий результаты люциферазного репортерного анализа, описанного в примере 1 с использованием клеток HEK варианта 4 IL-36R/IL-8 яванского макака, стимулированные 300 нг/мл cynoIL-36γ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00058] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина и/или выделенный полипептид легкой цепи иммуноглобулина, или его фрагмент (например, антиген-связывающий фрагмент). Термин ʺиммуноглобулинʺ или ʺантителоʺ, как используется в настоящем описании, относится к белку, который обнаруживается в крови или других жидкостях организма позвоночных, который используется иммунной системой для идентификации и нейтрализации инородных объектов, таких как бактерии и вирусы. Полипептид является ʺвыделеннымʺ тогда, когда его выделяют из его естественного окружения. В предпочтительном варианте осуществления изобретения иммуноглобулин или антитело представляют собой белок, который включает по меньшей мере одну область, определяющую комплементарность (CDR). CDR образуют ʺгипервариабельный участокʺ антитела, который отвечает за связывание антигена (обсуждается дополнительно ниже). Целый иммуноглобулин обычно состоит из четырех полипептидов: двух идентичных копий полипептида тяжелой (H) цепи и двух идентичных копий полипептида легкой (L) цепи. Каждая из тяжелых цепей содержит один N-концевой вариабельный (VH) участок и три C-концевых постоянных (CH1, CH2, и CH3) участка, и каждая легкая цепь содержит один N-концевой вариабельный (VL) участок и один C-концевой постоянный (CL) участок. Легкие цепи антител могут быть приписаны к двум отдельным типам, или каппа (κ) или лямбда (λ), на основании последовательностей аминокислот их постоянных доменов. В типичном иммуноглобулине каждая легкая цепь связана с тяжелой цепью дисульфидными связями, и две тяжелых цепи связаны друг с другом дисульфидными связями. Вариабельный участок легкой цепи совпадает с вариабельным участком тяжелой цепи, и постоянный участок легкой цепи совпадает с первым постоянным участком тяжелой цепи. Остальные постоянные участки тяжелых цепей совпадают друг с другом.
[00059] Вариабельные участки каждой пары легкой и тяжелой цепи образуют антиген-связывающий сайт антитела. Участки VH и VL имеют одинаковую общую структуру, каждый участок включает четыре каркасных участка (FW или FR). Термин ʺкаркасный участокʺ, как используется в настоящем описании, относится к относительно консервативным последовательностям аминокислот с вариабельным участком, который располагается между гипервариабельными областями или областями, определяющими комплементарность (CDR). Существует четыре каркасные области в каждом вариабельным домене, которые обозначены FR1, FR2, FR3, и FR4. Каркасные области образуют β-листы, которые обеспечивают структурную рамку вариабельного участка (см., например, C.A. Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)).
[00060] Каркасные участки соединены тремя областями, определяющими комплементарность (CDR). Как обсуждается выше, три CDR, известные как CDR1, CDR2, и CDR3, образуют ʺгипервариабельный участокʺ антитела, который отвечает за связывание антигена. CDR образуют петлевые соединения и в некоторых случаях включают часть структуры бета листа, образованного каркасными участками. Тогда как постоянные участки легких и тяжелых цепей непосредственно не вовлечены в связывание антитела с антигеном, постоянные участки могут влиять на ориентацию вариабельных участков. Постоянные участки также проявляют различные эффекторные функции, такие как участие в антитело-зависимом опосредованном комплементом лизисе или антитело-зависимой клеточной токсичности посредством взаимодействий с эффекторными молекулами и клетками.
[00061] Выделенный полипептид тяжелой цепи иммуноглобулина и выделенный полипептид легкой цепи иммуноглобулина по изобретению желательно связываются с рецептором интерлейкина 36 (IL-36R), ранее известным как IL-1Rrp2. IL-36R представляет собой рецептор семейства IL-1R и связывается с лигандами IL-36α (ранее IL-1F6), IL-36β (ранее IL-1F8), и IL-36γ (ранее IL-1F9) (см., например, Vigne et al., Blood, 118(22): 5813-5823 (2011)). IL-36α, IL-36β, и IL-36γ представляют собой члены семейства цитокинов IL-1 и связываются с IL-36R и используют акцессорный белок рецептора IL-1 (IL-1RAcP) в качестве корецептора для стимуляции внутриклеточных сигналов, сходных с таковыми, индуцированными IL-1 (Towne et al., J. Biol. Chem., 279(14): 13677-13688 (2004)). Цитокины IL-36 и IL-36R высоко экспрессируются кератиноцитами и другими типами эпителиальных клеток, а также дендритными клетками, и наивными CD4+ T-клетками (Towne et al., выше; Vigne et al., Blood, 118(22): 5813-5823 (2011); and Vigne et al., Blood, 120(17): 3478-3487 (2012))
[00062] Выделенный полипептид тяжелой цепи иммуноглобулина по изобретению и выделенный полипептид легкой цепи иммуноглобулина по изобретению могут образовывать агент, который связывается с IL-36R и другим антигеном, давая ʺдвойной реакционноспособныйʺ связывающий агент (например, двойное реакционноспособное антитело).
[00063] Определенные другие антитела, которые связываются с IL-36R, и их компоненты, известны в области техники (см., например, патентную публикацию США 2013/0236471). Анти-IL-36R антитела также являются коммерчески доступными из источников, таких как, например, Abcam (Cambridge, MA), и R&D Systems, Inc. (Minneapolis, MN).
[00064] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит из или состоит преимущественно из последовательности аминокислот Gln Val Gln Xaa1 Xaa2 Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Xaa3 Leu Glu Trp Met Gly Trp Ile Tyr Pro Gly Asp Xaa4 Ser Thr Lys Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Xaa5 Asp Xaa6 Ser Ala Xaa7 Thr Ala Tyr Met Glu Leu Xaa8 Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Xaa9 Cys Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 56), где (a) Xaa1 представляет собой лейцин (Leu) или фениаланин (Phe), (b) Xaa2 представляет собой валин (Val), метионин (Met), или лейцин (Leu), (c) Xaa3 представляет собой аргинин (Arg) или глицин (Gly), (d) Xaa4 представляет собой глицин (Gly), серин (Ser), или аланин (Ala), (e) Xaa5 представляет собой аргинин (Arg) или аланин (Ala), (f) Xaa6 представляет собой треонин (Thr) или лизин (Lys), (g) Xaa7 представляет собой серин (Ser) или аспарагин (Asn), (h) Xaa8 представляет собой серин (Ser) или аланин (Ala), и (i) Xaa9 представляет собой тирозин (Tyr) или фенилаланин (Phe). В некоторых вариантах осуществления изобретения выделенный полипептид тяжелой цепи иммуноглобулина включает, состоит из или состоит преимущественно из последовательности аминокислот Gln Val Gln Xaa1 Xaa2 Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Xaa3 Leu Glu Trp Met Gly Trp Ile Tyr Pro Gly Asp Xaa4 Ser Thr Lys Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Xaa5 Asp Xaa6 Ser Ala Ser Thr Ala Tyr Met Glu Leu Xaa7 Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Xaa8 Cys Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser (SEQ ID NO: 1), где (a) Xaa1 представляет собой лейцин (Leu) или фениаланин (Phe), (b) Xaa2 представляет собой валин (Val), метионин (Met), или лейцин (Leu), (c) Xaa3 представляет собой аргинин (Arg) или глицин (Gly), (d) Xaa4 представляет собой глицин (Gly), серин (Ser), или аланин (Ala), (e) Xaa5 представляет собой аргинин (Arg) или аланин (Ala), (f) Xaa6 представляет собой треонин (Thr) или лизин (Lys), (g) Xaa7 представляет собой серин (Ser) или аланин (Ala), и (h) Xaa8 представляет собой тирозин (Tyr) или фенилаланин (Phe).
[00065] Полипептид тяжелой цепи по изобретению может включать, состоять из, или состоять по существу из последовательности аминокислот SEQ ID NO: 56 или SEQ ID NO: 1 с любой одной из вышеупомянутых замен аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения полипептид тяжелой цепи иммуноглобулина включает, состоит из или состоит преимущественно из последовательности аминокислот любой из SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, и SEQ ID NO: 14.
[00066] Изобретение также относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Xaa1 Met Xaa2 Trp Val Arg Gln Ala Pro Xaa3 Gln Gly Leu Glu Trp Met Gly Met Phe Xaa4 Pro Xaa5 Xaa6 Xaa7 Val Thr Arg Leu Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 15), где (a) Xaa1 представляет собой триптофан (Trp) или тирозин (Tyr), (b) Xaa2 представляет собой гистидин (His), аспарагин (Asn), или тирозин (Tyr), (c) Xaa3 представляет собой глицин (Gly) или аргинин (Arg), (d) Xaa4 представляет собой аспарагиновую кислоту (Asp), глютаминовую кислоту (Glu), или гистидин (His), (e) Xaa5 представляет собой серин (Ser), треонин (Thr), или тирозин (Tyr), (f) Xaa6 представляет собой аспарагин (Asn) или глицин (Gly), и (g) Xaa7 представляет собой серин (Ser), аланин (Ala), или аспарагиновую кислоту (Asp).
[00067] Полипептид тяжелой цепи по изобретению может включать, состоять из, или состоять по существу из последовательности аминокислот SEQ ID NO: 15 с одной из вышеуказанных замен аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения, полипептид тяжелой цепи иммуноглобулина включает, состоит из или состоит по существу из последовательности аминокислот SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, или SEQ ID NO: 24.
[00068] Изобретение также относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот Xaa1 Xaa2 Gln Xaa3 Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Xaa4 Xaa5 Tyr Ser Ile Thr Xaa6 Asp Phe Ala Trp Asn Trp Ile Arg Gln Xaa7 Pro Gly Xaa8 Xaa9 Leu Glu Trp Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Xaa10 Xaa11 Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Xaa12 Tyr Xaa13 Cys Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Xaa14 (SEQ ID NO: 57), где Xaa1 представляет собой глютамин (Gln) или аспарагиновую кислоту (Asp); Xaa2 представляет собой валин (Val) или лейцин (Leu); Xaa3 представляет собой лейцин (Leu) или фенилаланин (Phe); Xaa4 представляет собой треонин (Thr) или серин (Ser); Xaa5 представляет собой глицин (Gly) или аргинин (Arg); Xaa6 серин (Ser) или аланин (Ala); Xaa7 представляет собой пролин (Pro) или фенилаланин (Phe); Xaa8 представляет собой лизин (Lys) или аспарагин (Asn); Xaa9 представляет собой глицин (Gly) или лизин (Lys); Xaa10 представляет собой серин (Ser) или треонин (Thr); Xaa11 представляет собой валин (Val) или аргинин (Arg); Xaa12 представляет собой треонин (Thr) или валин (Val); Xaa13 представляет собой тирозин (Tyr) или фенилаланин (Phe); и Xaa14 представляет собой аланин (Ala) или отсутствует. В некоторых вариантах осуществления изобретения выделенный полипептид тяжелой цепи иммуноглобулина включает, состоит из, или состоит преимущественно из последовательности аминокислот Xaa1 Val Gln Xaa2 Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Xaa3 Gly Tyr Ser Ile Thr Ser Asp Phe Ala Trp Asn Trp Ile Arg Gln Xaa4 Pro Gly Xaa5 Xaa6 Leu Glu Trp Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Ile Xaa7 Xaa8 Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Xaa9 Cys Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 25), где (a) Xaa1 представляет собой глютамин (Gln) или аспарагиновую кислоту (Asp), (b) Xaa2 представляет собой лейцин (Leu) или фенилаланин (Phe), (c) Xaa3 представляет собой треонин (Thr) или серин (Ser), (d) Xaa4 представляет собой пролин (Pro) или фенилаланин (Phe), (e) Xaa5 представляет собой лизин (Lys) или аспарагин (Asn), (f) Xaa6 представляет собой глицин (Gly) или лизин (Lys), (g) Xaa7 представляет собой серин (Ser) или треонин (Thr), (h) Xaa8 представляет собой валин (Val) или аргинин (Arg), и (i) Xaa9 представляет собой тирозин (Tyr) или фенилаланин (Phe).
[00069] Полипептид тяжелой цепи по изобретению может включать, состоять из или состоять по существу из последовательности аминокислот SEQ ID NO: 57 или SEQ ID NO: 25 с одной или более вышеупомянутыми заменами аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения полипептид тяжелой цепи иммуноглобулина включает, состоит из или состоит по существу из последовательности аминокислот SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, или SEQ ID NO: 54.
[00070] В другом варианте осуществления Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот SEQ ID NO: 33, SEQ ID NO: 34, or SEQ ID NO: 35
[00071] Когда полипептид тяжелой цепи иммуноглобулина по изобретению состоит по существу из последовательности аминокислот любой из SEQ ID NO: 1-SEQ ID NO: 35, дополнительные компоненты могут быть включены в полипептид, которые материально не влияют на полипептид, например, путем влияния на афинность полипептида тяжелой цепи по изобретению к IL-36R. Примеры таких компонентов включают, например, белковые фрагменты, такие как биотин, который облегчает очистку или выделение, мутации пассажиры, последовательности, свободные от проблемных мест, включая свободные цистеины, дополнительные сайты гликозилирования и высоковероятные сайты деамидирования или изомеризации.
[00072] Когда полипептид тяжелой цепи иммуноглобулина по изобретению состоит из последовательности аминокислот любой из SEQ ID NO: 1-SEQ ID NO: 35, полипептид не включает каких-либо дополнительных компонентов (т.е. компонентов, которые не являются эндогенными относительно полипептида тяжелой цепи иммуноглобулина по изобретению).
[00073] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает последовательность аминокислот, которая является по меньшей мере на 90% идентичной (например, по меньшей мере, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, или 100% идентичные) любой одной из SEQ ID NO: 1-SEQ ID NO: 35. ʺИдентичностьʺ последовательности нуклеиновой кислоты или аминокислот, как описано в настоящем описании, может быть определена путем сравнения интересующей последовательности нуклеиновой кислоты или аминокислоты. Процент идентичности представляет собой количество нуклеотидов или остатков аминокислот, которые являются одинаковыми (т.е., которые являются идентичными) как между интересующей последовательностью и контрольной последовательностью, поделенные на длину самой длинной последовательности (т.е. длину или интересующей последовательности или контрольной последовательности, которая является длиннее). Ряд математических алгоритмов для получения оптимального выравнивания и расчета идентичности между двумя или более последовательностями известны и включены в ряд доступного программного обеспечения. Примеры таких программ включают CLUSTAL-W, T-Coffee, и ALIGN (для выравнивания последовательностей нуклеиновых кислот и аминокислот), программы BLAST (например, BLAST 2.1, BL2SEQ, и их более поздние версии) и программы FASTA (например, FASTA3x, FASTM, и SSEARCH) (для выравнивания последовательности и поиска сходства последовательностей). Алгоритмы выравнивания последовательностей также описаны в, например, Altschul et al., J. Molecular Biol., 215(3): 403-410 (1990), Beigert et al., Proc. Natl. Acad. Sci. USA, 106(10): 3770-3775 (2009), Durbin et al., eds., Biological Sequence Analysis: Probabalistic Models of Proteins and Nucleic Acids, Cambridge University Press, Cambridge, UK (2009), Soding, Bioinformatics, 21(7): 951-960 (2005), Altschul et al., Nucleic Acids Res., 25(17): 3389-3402 (1997), and Gusfield, Algorithms on Strings, Trees and Sequences, Cambridge University Press, Cambridge UK (1997)).
[00074] В другом варианте осуществления изобретение обеспечивает полипептид легкой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser Asn Xaa1 Asn Thr Tyr Leu Tyr Trp Xaa2 Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Xaa3 Arg Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys (SEQ ID NO: 36), где (a) Xaa1 представляет собой глицин (Gly) или аланин (Ala), (b) Xaa2 представляет собой фенилаланин (Phe) или тирозин (Tyr), и (c) Xaa3 представляет собой тирозин (Tyr) или серин (Ser).
[00075] Полипептид легкой цепи по изобретению может включать, состоять из или состоять по существу из последовательности аминокислот SEQ ID NO: 36 с одной или более вышеупомянутых замен аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения выделенный полипептид легкой цепи иммуноглобулина включает, состоит из или состоит по существу из последовательности аминокислот любой из SEQ ID NO: 37, SEQ ID NO: 38, или SEQ ID NO: 39.
[00076] Изобретение также обеспечивает полипептид легкой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Xaa1 Asn Xaa2 Ile Thr Tyr Phe Tyr Trp Tyr Leu Xaa3 Lys Pro Gly Gln Pro Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 40), (a) Xaa1 представляет собой серин (Ser) или аргинин (Arg), (b) Xaa2 представляет собой глицин (Gly) или аланин (Ala), и (c) Xaa3 представляет собой глютамин (Gln) или гистидин (His).
[00077] Полипептид легкой цепи по изобретению может включать, состоять из или состоять по существу из последовательности аминокислот SEQ ID NO: 40 с одной или более вышеупомянутых замен аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения выделенный полипептид легкой цепи иммуноглобулина включает, состоит из или состоит по существу из последовательности аминокислот любой из SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, или SEQ ID NO: 44.
[00078] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Xaa1 Ile Asn Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Xaa2 Leu His Ser Gly Val Pro Ser Arg Phe Ser Xaa3 Ser Gly Ser Gly Xaa4 Asp Xaa5 Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Xaa6 Xaa7 (SEQ ID NO: 58), где (a) Xaa1 представляет собой аспарагиновую кислоту (Asp) или триптофан (Trp), (b) Xaa2 представляет собой аргинин (Arg) или метионин (Met), (c) Xaa3 представляет собой глицин (Gly), серин (Ser) или пролин (Pro), (d) Xaa4 представляет собой треонин (Thr) или аспарагин (Asn), (e) Xaa5 представляет собой фенилаланин (Phe) или тирозин (Tyr), (f) Xaa6 представляет собой аргинин (Arg) или отсутствует, и (g) Xaa7 представляет собой треонин (Thr) или отсутствует. В некоторых вариантах осуществления изобретения полипептид легкой цепи иммуноглобулина включает, состоит из, или состоит по существу из последовательности аминокислот Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Xaa1 Ser Gly Ser Gly Thr Asp Xaa2 Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 45), где (a) Xaa1 представляет собой серин (Ser) или пролин (Pro), и (b) Xaa2 представляет собой фенилаланин (Phe) или тирозин (Tyr).
[00079] Полипептид легкой цепи по изобретению может включать, состоять из, или состоять по существу из последовательности аминокислот SEQ ID NO: 58 или SEQ ID NO: 45 с одной или более вышеупомянутых замен аминокислот в любой подходящей комбинации. В одном варианте осуществления изобретения полипептид легкой цепи иммуноглобулина включает, состоит из или состоит по существу из последовательности аминокислот любой из SEQ ID NO: 46, SEQ ID NO: 47, или SEQ ID NO: 55.
[00080] В другом варианте осуществления Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает, состоит из или состоит по существу из последовательности аминокислот SEQ ID NO: 48, SEQ ID NO: 49, или SEQ ID NO: 50
[00081] Когда полипептид легкой цепи иммуноглобулина по изобретению состоит по существу из последовательности аминокислот любой из SEQ ID NO: 36-SEQ ID NO: 50, дополнительные компоненты могут быть включены в полипептид, которые материально не влияют на полипептид, например, как описанные в настоящем описании. Когда полипептид легкой цепи иммуноглобулина по изобретению состоит из последовательности аминокислот, любой из SEQ ID NO: 36-SEQ ID NO: 50, полипептид не включает каких-либо дополнительных компонентов (т.е. компонентов, которые не являются эндогенными относительно полипептида легкой цепи иммуноглобулина по изобретению).
[00082] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает последовательность аминокислот, которая является по меньшей мере на 90% идентичной (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99%, или 100% идентичной) любой из SEQ ID NO: 36-SEQ ID NO: 50. ʺИдентичностьʺ последовательности нуклеиновой кислоты или аминокислот может быть определена с использованием способов, описанных в настоящем описании.
[00083] Одна или более аминокислот вышеупомянутых полипептидов тяжелой цепи иммуноглобулина и/или полипептидов легкой цепи, могут быть заменены или замещены различными аминокислотами. ʺЗаменаʺ или ʺзамещениеʺ аминокислот относится к замене одной аминокислоты в заданном положении или остатка другой аминокислотой в том же положении или остатке в последовательности полипептида.
[00084] Аминокислоты широко группируют как ʺароматическиеʺ или ʺалифатическиеʺ. Ароматические аминокислоты включают ароматический цикл. Примеры ʺароматическихʺ аминокислот включают гистидин (H или His), фенилаланин (F или Phe), тирозин (Y или Tyr), и триптофан (W или Trp). Неароматические аминокислоты широко группируют как ʺалифатические.ʺ Примеры ʺалифатическихʺ аминокислот включают глицин (G или Gly), аланин (A или Ala), валин (V или Val), лейцин (L или Leu), изолейцин (I или Ile), метионин (M или Met), серин (S или Ser), треонин (T или Thr), цистеин (C или Cys), пролин (P или Pro), глютаминовую кислоту (E или Glu), аспарагиновую кислоту (D или Asp), аспарагин (N или Asn), глютамин (Q или Gln), лизин (K или Lys), и аргинин (R или Arg).
[00085] Алифатические аминокислоты могут быть дополнительно поделены на четыре подгруппы. ʺКрупная алифатическая неполярная подгруппаʺ состоит из валина, лейцина, и изолейцина. ʺАлифатическая немного полярная подгруппаʺ состоит из метионина, серина, треонина, и цистеина. ʺАлифатическая полярная/заряженная подгруппаʺ состоит из глютаминовой кислоты, аспарагиновой кислоты, аспарагина, глютамина, лизина, и аргинина. ʺПодгруппа небольших остатковʺ состоит из глицина и аланина. Группа заряженных/полярных аминокислот может быть дополнительно поделена на три подгруппы: ʺположительно заряженная подгруппаʺ состоящая из лизина и аргинина, ʺотрицательно заряженная подгруппаʺ, состоящая из глютаминовой кислоты и аспарагиновой кислоты и ʺполярная подгруппаʺ, состоящая из аспарагина и глютамина.
[00086] Ароматические аминокислоты могут быть дополнительно поделены на две подгруппы: ʺподгруппа с азотным цикломʺ, состоящая из гистидина и триптофана, и ʺфенильная подгруппаʺ, состоящая из фенилаланина и тирозина.
[00087] Замена или замещение аминокислот может быть консервативной, полуконсервативной или неконсервативной. Фраза ʺконсервативная замена аминокислотыʺ или ʺконсервативная мутацияʺ относится к замене одной аминокислоты другой аминокислотой с общим свойством. Функциональным способом для определения общих свойств между отдельными аминокислотами является анализ нормализованных частот изменений аминокислот между соответствующими белками гомологичных организмов (Schulz and Schirmer, Principles of Protein Structure, Springer-Verlag, New York (1979)). В соответствии с таким анализом могут быть определены группы аминокислот, где аминокислоты внутри группы меняются предпочтительно друг с другом, и, следовательно, походят друг на друга наибольшим образом в их вкладе в общую структуру белка (Schulz and Schirmer, выше).
[00088] Примеры консервативных замен аминокислот включают замены аминокислот внутри подгрупп, описанных выше, например, лизин на аргинин и наоборот, так, чтобы можно было сохранить положительный заряд, глютаминовую кислоту на аспарагиновую кислоту и наоборот, так, чтобы сохранялся отрицательный заряд, серин на треонин так, чтобы можно было сохранить свободный -OH, и глютамин на аспарагин, так чтобы можно было сохранить свободный -NH2.
ʺ[00089] Полуконсервативные мутацииʺ включают замены аминокислот внутри тех же групп, перечисленных выше, но не внутри тех же подгрупп. Например, замена аспарагиновой кислоты на аспарагин, или аспарагина на лизин включает аминокислоты внутри одной группы, но различных подгрупп. ʺНеконсервативные мутацииʺ включают замены аминокислоты между разными группами, например, лизин на триптофан, или фенилаланин на серин, и др.
[00090] Кроме того, одна или более аминокислот могут быть вставлены в вышеупомянутые полипептиды тяжелой цепи иммуноглобулина и/или полипептиды легкой цепи. Любое количество любых подходящих аминокислот может быть вставлено в последовательность аминокислот полипептида тяжелой цепи иммуноглобулина и/или полипептида легкой цепи. В этом отношении, по меньшей мере одна аминокислота (например, 2 или более, 5 или более, или 10 или более аминокислот), но не более чем 20 аминокислот (например, 18 или менее, 15 или менее, или 12 или менее аминокислот), могут быть вставлены в последовательность аминокислот полипептида тяжелой цепи иммуноглобулина и/или легкой цепи иммуноглобулина. Предпочтительно, 1-10 аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислот) вставляют в последовательность аминокислот полипептида тяжелой цепи иммуноглобулина и/или полипептида легкой цепи. В таком отношении аминокислота(ы) может быть вставлена в любой из вышеупомянутых полипептидов тяжелой цепи иммуноглобулина и/или полипептидов легкой цепи в любом подходящем положении. Предпочтительно, аминокислоту(ы) вставляют в CDR (например, CDR1, CDR2, или CDR3) полипептида тяжелой цепи иммуноглобулина и/или полипептида легкой цепи.
[00091] Выделенный полипептид тяжелой цепи иммуноглобулина и полипептид легкой цепи по изобретению не ограничиваются полипептидами, включающими специфические последовательности аминокислот, описанные в настоящем описании. Действительно, полипептидом тяжелой цепи иммуноглобулина или полипептидом легкой цепи может быть любой полипептид тяжелой цепи или полипептид легкой цепи, которые конкурируют с полипептидом тяжелой цепи иммуноглобулина или полипептида легкой цепи по изобретению в отношении связывания с IL-36R. В этом отношении, например, полипептидом тяжелой цепи иммуноглобулина или полипептидом легкой цепи может быть любой полипептид тяжелой цепи или полипептид легкой цепи, который связывается с тем же самым эпитопом IL-36R, распознаваемым полипептидами тяжелой и легкой цепи, описанными в настоящем описании. Конкуренция антител может быть оценена с использованием рутинных конкурентных анализов пептидов, которые используют ELISA, вестерн блоттинг, или иммуногистохимические методы (см., например, патенты США 4828981 и 8568992; и Braitbard et al., Proteome Sci., 4: 12 (2006)).
[00092] Изобретение обеспечивает IL-36R-связывающий агент, включающий, состоящий по существу из или состоящий из одного или более выделенных последовательностей аминокислот по изобретению, описанных в настоящем описании. Под ʺIL-36R-связывающим агентомʺ обозначают молекулу, предпочтительно, белковоподобную молекулу, которая специфически связывается с белком IL-36R. Предпочтительно, IL-36R-связывающим агентом является антитело или его фрагмент (например, антиген-связывающий фрагмент). IL-36R-связывающий агент по изобретению включает, состоит по существу из или состоит из полипептида тяжелой цепи иммуноглобулина по изобретению и/или полипептида легкой цепи иммуноглобулина по изобретению. В одном варианте осуществления изобретения IL-36R-связывающий агент включает, состоит по существу из или состоит из полипептида тяжелой цепи иммуноглобулина по изобретению или полипептида легкой цепи иммуноглобулина по изобретению. В другом варианте осуществления изобретения, IL-36R-связывающий агент включает, состоит по существу из или состоит из полипептида тяжелой цепи иммуноглобулина по изобретению и полипептида легкой цепи иммуноглобулина по изобретению.
[00093] Любой остаток аминокислоты полипептида тяжелой цепи иммуноглобулина по изобретению и/или полипептида легкой цепи иммуноглобулина по изобретению может быть заменен, в любой комбинации, различными остаткам аминокислоты, или может быть удален или вставлен, пока биологическая активность IL-36R-связывающего агента материально не нарушается (например, усиливается или улучшается) в результате замен, вставок и/или делеций аминокислот.
ʺ[00094] Биологическая активностьʺ IL-36R-связывающего агента относится к, например, афинности связывания с определенным эпитопом IL-36R, нейтрализации или ингибирования связывания IL-36R с его рецептором(ами), нейтрализации или ингибирования активности IL-36R in vivo (например, IC50), фармакокинетики, и перекрестной реакционной способности (например, с нечеловекообразными гомологами или с другими белками или тканями). В определенных вариантах осуществления изобретения агент, связывающий рецептор интерлейкина 35 (IL-36R) по изобретению, желательно проявляет одну или более из следующих биологических активностей: (a) ингибирует взаимодействие между IL-36R и IL-36α, IL-36β, и/или IL-36γ, (b) ингибирует внутриклеточную передачу сигнала, опосредованную IL-36R, и/или (c) перекрестно реагирует с и ингибирует активность IL-36R человека и нечеловекообразных приматов (например, яванского макака). Другие биологические свойства или характеристики антиген-связывающего агента, известного в области техники, включают, например, авидность, селективность, растворимость, складчатость, иммунотоксичность, экспрессию и рецептирование. Вышеупомянутые свойства или характеристики можно наблюдать, измерить и/или оценить с использованием стандартных методик, включая, без ограничения, ELISA, конкурентный ELISA, анализ с использованием поверхностного плазмонного резонанса (BIACORE™), или KINEXA™, анализы нейтрализации in vitro или in vivo, анализы связывания рецептора-лиганда, анализы продукции и/или секреции цитокинов или факторов роста, и анализы передачи сигнала и иммуногистохимию.
[00095] Термины ʺингибируетʺ или ʺнейтрализуетʺ, как используется в настоящем описании в отношении активности IL-36R-связывающего агента, относятся к способности по существу антагонизировать, запрещать, предотвращать, ограничивать, замедлять, прерывать, изменять, устранять, останавливать или обращать прогрессирование или тяжесть, например, биологическую активность IL-36R, или заболевания или состояния, ассоциированного с IL-36R. IL-36R-связывающий агент по изобретению предпочтительно ингибирует или нейтрализует активность IL-36R на по меньшей мере около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 95%, около 100%, или диапазона, определяемого любыми двумя из вышеуказанных значений.
[00096] IL-36R-связывающий агент по изобретению может быть целым антителом, как описано в настоящем описании, или фрагментом антитела. Термины ʺфрагмент антителаʺ, ʺфрагмент антителаʺ, и ʺфункциональный фрагмент антителаʺ используют взаимозаменяемо в настоящем описании для обозначения одного или более фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (см., в общем, Holliger et al., Nat. Biotech., 23(9): 1126-1129 (2005)). IL-36R-связывающий агент может содержать любой фрагмент IL-36R-связывающего антитела. Фрагмент антитела желательно включает, например, одну или более CDR, вариабельный участок (или его части), постоянный участок (или его части), или их комбинации. Примеры фрагментов антител включают, без ограничения, (i) фрагмент Fab, который является одновалентным фрагментом, состоящим из VL, VH, CL, и CH1 доменов, (ii) фрагмент F(ab')2, который является двухвалентным фрагментом, включающим два фрагмента Fab, связанные дисульфидным мостиком в петлевом участке, (iii) фрагмент Fv, состоящий из VL и VH доменов одного плеча антитела, (iv) фрагмент Fab', который возникает в результате разрыва дисульфидного мостика фрагмента F(ab')2 с использованием мягких восстанавливающих условий, (v) дисульфид-стабилизированный Fv фрагмент (dsFv), и (vi) домен антитело (dAb), которое является одиночным вариабельным регионом доменом антитела (VH или VL) полипептидом, который специфически связывается с антигеном.
[00097] В вариантах осуществления изобретения, когда IL-36R-связывающий агент включает фрагмент полипептида тяжелой цепи или легкой цепи иммуноглобулина, фрагмент может быть любого размера, пока фрагмент связывается с и предпочтительно ингибирует активность, IL-36R. В таком отношении, фрагмент полипептида тяжелой цепи иммуноглобулина желательно включает от около 5 до 18 (например, около 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, или диапазон, ограниченный любыми двумя вышеуказанными значениями) аминокислот. Сходным образом, фрагмент полипептида легкой цепи иммуноглобулина желательно включает от около 5 до 18 (например, около 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, или диапазон, ограниченный любыми двумя вышеуказанными значениями) аминокислот.
[00098] Когда IL-36R-связывающий агент является антителом или фрагментом антитела, антитело или фрагмент антитела желательно включает постоянный участок тяжелой цепи (Fc) любого подходящего класса. Предпочтительно, антитело или фрагмент антитела включает постоянный участок тяжелой цепи, которые основан на антителах IgG1, IgG2, или IgG4 дикого типа, или их вариантах. Понимают, что каждый класс антитела, или изотип, участвует в отдельной группе эффекторных механизмов для устранения или нейтрализации антигена при распознавании. По существу в некоторых вариантах осуществления изобретения, когда IL-36R-связывающий агент является антителом или фрагментом антитела, он может проявлять одну или болеет эффекторных функций, таких как участие в антитело-зависимом комплемент опосредованном лизисе или антитело-зависимой клеточной токсичности посредством взаимодействий с эффекторными молекулами и клетками (например, активация системы комплемента).
[00099] IL-36R-связывающим агентом также может быть одноцепочечный фрагмент антитела. Примеры одноцепочечных фрагментов антитела включают, без ограничения, (i) одноцепочечный Fv (scFv), который является одновалентной молекулой, состоящей из двух доменов Fv фрагмента (т.е., VL и VH), объединенных синтетическим линкером, который позволяет синтезировать два домена в виде одной полипептидной цепи (см., например, Bird et al., Science, 242: 423-426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988); и Osbourn et al., Nat. Biotechnol., 16: 778 (1998)) и (ii) диатело, которое является димером полипептидных цепей, где каждая полипептидная цепь включает VH, соединенную с VL пептидным линкером, который является слишком коротким, чтобы позволить спаривание между VH и VL на одной полипептидной цепи, таким образом запуская спаривание между комплементарными доменами на различных полипептидных цепях VH-VL для создания димерной молекулы, имеющей два функциональных антиген-связывающих сайта. Фрагменты антител известны в области техники и описаны более подробно в, например, публикации патентной заявки США 2009/0093024 A1.
[000100] IL-36R-связывающим агентом также может быть интратело или его фрагмент. Интратело представляет собой антитело, которое экспрессируется и которое действует внутриклеточно. Интратела обычно не имеют дисульфидных связей и способны модулировать экспрессию или активность генов мишеней посредством их специфической связывающей активности. Интратела включают одиночные домены фрагменты, такие как выделенные домены VH и VL и scFvs. Интратело может включать субклеточные передающие сигналы, прикрепленные к N или C концу интратела, для возможности экспрессии в высоких концентрациях в субклеточных отделах, где располагается белок мишень. При взаимодействии с геном мишенью, интратело модулирует функцию белка-мишени и/или достигает фенотипического/функционального нокаута посредством механизмов, таких как ускорение деградации целевого белка и секвенирование целевого белка в нефизиологическом субклеточном области. Другие механизмы инактивации гена, опосредованной интрателом, могут зависеть от эпитопа, на который направлено интратело, так что связывание с каталитическим сайтом на целевом белке или с эпитопами, которые вовлечены во взаимодействия белок-белок, белок-ДНК или белок-РНК.
[000101] IL-36R-связывающим агентом также может быть конъюгат антитела. В этом отношении IL-36R-связывающим агентом может быть конъюгат (1) антитела, альтернативной складки или их фрагментов, и (2) белковый или небелковый фрагмент, включающий IL-36R-связывающий агент. Например, IL-36R-связывающим агентом может быть все или часть антитела, конъюгированная с пептидом, флуоресцентной молекулой или химиотерапевтическим средством.
[000102] IL-36R-связывающий агент может быть, или может быть получен из, человеческого антитела, нечеловеческого антитела или химерного антитела. ʺХимернымʺ антителом является антитело или его фрагмент, включающий и человеческие и нечеловеческие участки. Предпочтительно, IL-36R-связывающим агентом является гуманизированное антитело. ʺГуманизированноеʺ антитело представляет собой моноклональное антитело, включающее основу человеческого антитела и по меньшей мере одну CDR, полученную или происходящую из нечеловеческого антитела. Нечеловеческие антитела включают антитела, выделенные у любого нечеловекообразного животного, такого как, например, грызун (например, мышь или крыса). Гуманизированное антитело может включать одну, две или три CDR, полученные или происходящие из нечеловеческого антитела. В одном варианте осуществления изобретения, CDRH3 IL-36R-связывающего агента по изобретению получают или происходит из мышиного моноклонального антитела, тогда как оставшиеся вариабельные участки и постоянный участок IL-36R-связывающего агента по изобретению получают или происходят из человеческого моноклонального антитела.
[000103] Человеческое антитело, нечеловеческое антитело, химерное антитело или гуманизированное антитело могут быть получены любыми средствами, включая посредством источников in vitro (например, гибридома или клеточная линия, продуцирующая антитело рекомбинантно) и источников in vivo (например, грызунов). Способы получения антител известны в области техники и описаны, например, в Kоhler and Milstein, Eur. J. Immunol., 5: 511-519 (1976); Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988); and Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)). В определенных вариантах осуществления изобретения человеческое антитело или химерное антитело могут быть получены с использованием трансгенных животных (например, мыши), где один или более эндогенных генов иммуноглобулинов заменяют одним или более генами иммуноглобулина человека. Примеры трансгенных мышей, где гены эндогенных антител эффективно заменены генами человеческих антител, включают, без ограничения, Medarex HUMAB-MOUSE™, the Kirin TC MOUSE™, и Kyowa Kirin KM-MOUSE™ (см., например, Lonberg, Nat. Biotechnol., 23(9): 1117-25 (2005), и Lonberg, Handb. Exp. Pharmacol., 181: 69-97 (2008)). Гуманизированное антитело может быть получено с использованием любого подходящего метода, известного в области техники (см., например, An, Z. (ed.), Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley & Sons, Inc., Hoboken, New Jersey (2009)), включая, например, прививку нечеловеческих CDR на основу человеческого антитела (см., например, Kashmiri et al., Methods, 36(1): 25-34 (2005); и Hou et al., J. Biochem., 144(1): 115-120 (2008)). В одном варианте осуществления изобретения гуманизированное антитело может быть получено с использованием методов, описанных в, например, публикации патентной заявки США 2011/0287485 A1.
[000104] В одном варианте осуществления изобретения CDR (например, CDR1, CDR2, или CDR3) или вариабельный участок полипептида тяжелой цепи иммуноглобулина и/или полипептида легкой цепи иммуноглобулина, описанных в настоящем описании, могут быть трансплантированы (т.е. привиты) на другую молекулу, такую как полипептид антитела или не-антитела, с использованием или белковой химии или методики рекомбинантной ДНК. В таком отношении изобретение обеспечивает IL-36R-связывающий агент, включающий по меньшей мере одну CDR полипептида тяжелой цепи и/или легкой цепи иммуноглобулина, как описано в настоящем описании. IL-36R-связывающий агент может включать одну, две или три CDR вариабельного участка тяжелой цепи и/или легкой цепи иммуноглобулина.
[000105] В предпочтительном варианте осуществления изобретения IL-36R-связывающий агент связывается с эпитопом IL-36R, который блокирует связывание IL-36R с любым из его лигандов (например, IL-36α, IL-36β, и IL-36γ) и ингибирует IL-36R-опосредованный сигнал. Изобретение также обеспечивает выделенный или очищенный эпитоп IL-36R, который блокирует связывание IL-36R с любым из его лигандов непрямым или аллостерическим способом.
[000106] Изобретение также обеспечивает одну или более выделенных или очищенных последовательностей нуклеиновых кислот, которые кодируют полипептид тяжелой цепи иммуноглобулина по изобретению, полипептид легкой цепи иммуноглобулина и IL-36R-связывающий агент по изобретению.
[000107] Термин ʺпоследовательность нуклеиновой кислотыʺ охватывает полимер ДНК или РНК, т.е. полинуклеотид, который может быть одноцепочечным или двухцепочечным и который может содержать ненатуральные или измененные нуклеотиды. Термины ʺнуклеиновая кислотаʺ и ʺполинуклеотидʺ, как используется в настоящем описании, относятся к полимерной форме нуклеотидов любой длины, или рибонуклеотидов (РНК) или деоксирибонуклеотидов (ДНК). Эти термины относятся к первичной структуре молекулы и, следовательно, включают двух- и одноцепочечную ДНК и двух- и одноцепочечную РНК. Термины включают, в качестве эквивалентов, аналоги или РНК или ДНК, состоящие из аналогов нуклеотидов и модифицированных полинуклеотидов, таких как, без ограничения, метилированные и/или блокированные полинуклеотиды. Нуклеиновые кислоты обычно связаны посредством фосфатных связей с образованием последовательностей нуклеиновой кислоты или полинуклеотидов, хотя множество других связок известны в области техники (например, фосфоротиоаты, боранофосфаты и подобные).
[000108] Изобретение дополнительно обеспечивает вектор, включающий одну или более последовательностей нуклеиновой кислоты, кодирующих полипептид тяжелой цепи иммуноглобулина по изобретению, полипептид легкой цепи иммуноглобулина по изобретению, и/или IL-36R-связывающий агент по изобретению. Вектором может быть, например, плазмида, эписома, космида, вирусный вектор (например, ретровирусный или аденовирусный), или фаг. Подходящие векторы и методы получения векторов хорошо известны в области техники (см., например, Sambrook et al., Molecular Cloning, a Laboratory Manual, 3rd edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (2001), and Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, New York, N.Y. (1994)).
[000109] В добавление к последовательности нуклеиновой кислоты, кодирующей полипептид тяжелой цепи иммуноглобулина по изобретению, полипептид легкой цепи иммуноглобулина и/или IL-36R-связывающий агент по изобретению, вектор предпочтительно включает последовательности контроля экспрессии, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы транскрипции, сигнальные пептиды (например, сигнальный пептид остеонектин), участки внутренней посадки рибосом (IRES), и подобные, которые обеспечивают экспрессию кодирующей последовательности в клетке хозяине. Примерные последовательности контроля экспрессии известны в области техники и описаны в, например, Goeddel, Gene Expression Technology: Methods in Enzymology, Vol. 185, Academic Press, San Diego, Calif. (1990).
[000110] Большое количество промоторов, включая конститутивные, индуцибельные и репрессируемые промоторы, из множества различных источников хорошо известны в области техники. Характерные источники промоторов включают, например, вирус, млекопитающее, насекомое, растение, дрожжи и бактерии, и подходящие промоторы из этих источников легко доступны, или могут быть получены синтетически, на основании общедоступных последовательностей, например, из хранилищ, таких как ATCC, а также других коммерческих или индивидуальных источников. Промоторы могут быть однонаправленными (т.е. инициировать транскрипцию в одном направлении) или двунаправленными (т.е. инициировать транскрипцию или в 3' или в 5' направлении). Неограничивающие примеры промоторов включают, например, T7 бактериальную систему экспрессии, pBAD (araA) бактериальную систему экспрессии, цитомегаловирусный промотор (CMV), промотор SV40, и промотор RSV. Индуцибельные промоторы включают, например, систему Tet (патенты США 5464758 и 5814618), индуцибельную систему Ecdysone (No et al., Proc. Natl. Acad. Sci., 93: 3346-3351 (1996)), систему T-REX™ (Invitrogen, Carlsbad, CA), систему LACSWITCH™ (Stratagene, San Diego, CA), и Cre-ERT тамоксифен систему индуцибельной рекомбиназы (Indra et al., Nuc. Acid. Res., 27: 4324-4327 (1999); Nuc. Acid. Res., 28: e99 (2000); патент США 7112715; и Kramer & Fussenegger, Methods Mol. Biol., 308: 123-144 (2005)).
[000111] Термин ʺэнхансерʺ, как используется в настоящем описании, относится к последовательности ДНК, которая увеличивает транскрипцию, например, последовательности нуклеиновой кислоты, с которой она гибко связана. Энхансеры могут быть расположены за много тысяч пар нуклеотидов от кодирующего участка последовательности нуклеиновой кислоты и могут опосредовать связывание регуляторных факторов, вариантов метилирования ДНК или изменений в структуре ДНК. Большое количество энхансеров из множества различных источников хорошо известны в области техники и доступны в виде или внутри клонированных полинуклеотидов (от, например, хранилищ, таких как ATCC, а также других коммерческих или индивидуальных источников). Ряд полинуклеотидов, включающих промоторы (таких как обычно используемый промотор CMV) также включают последовательности энхансеров. Энхансеры могут быть расположены выше, внутри или ниже кодирующих последовательностей.
[000112] Вектор также может включать ʺселектируемый маркерный ген.ʺ Термин ʺселектируемый маркерный генʺ, как используется в настоящем описании, относится к последовательности нуклеиновой кислоты, которая позволяет селективно выбирать клетки, экспрессирующие последовательность нуклеиновой кислоты в отношении или против, в присутствии соответствующего селективного агента. Подходящие селектируемые маркерные гены известны в области техники и описаны в, например, публикациях международной патентной заявки WO 1992/008796 и WO 1994/028143; Wigler et al., Proc. Natl. Acad. Sci. USA, 77: 3567-3570 (1980); O'Hare et al., Proc. Natl. Acad. Sci. USA, 78: 1527-1531 (1981); Mulligan & Berg, Proc. Natl. Acad. Sci. USA, 78: 2072-2076 (1981); Colberre-Garapin et al., J. Mol. Biol., 150: 1-14 (1981); Santerre et al., Gene, 30: 147-156 (1984); Kent et al., Science, 237: 901-903 (1987); Wigler et al., Cell, 11: 223-232 (1977); Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA, 48: 2026-2034 (1962); Lowy et al., Cell, 22: 817-823 (1980); и патентах США 5122464 и 5770359.
[000113] В некоторых вариантах осуществления изобретения вектором является ʺэписомальный вектор экспрессииʺ или ʺэписомаʺ, который способен реплицироваться в клетке хозяине и персистировать в виде экстрахромосомного сегмента ДНК в клетке хозяине в присутствии соответствующего селективного давления (см, например., Conese et al., Gene Therapy, 11: 1735-1742 (2004)). Характерные коммерчески доступные эписомальные векторы экспрессии включают, без ограничения, эписомальные плазмиды, которые используют ядерный антиген Эпштейн-Барр 1 (EBNA1) и вирус Эпштейн-Барр (EBV) происхождения репликации (oriP). Векторы pREP4, pCEP4, pREP7, и pcDNA3.1 от Invitrogen (Carlsbad, CA) и pBK-CMV от Stratagene (La Jolla, CA) представляют собой неограничивающие примеры эписомального вектора, который использует T-антиген и SV40 происхождения репликации вместо EBNA1 и oriP.
[000114] Другие подходящие векторы включают встраивающиеся векторы экспрессии, которые могут случайно встраиваться в ДНК клетки хозяина, или могут включать рекомбинантный сайт для возможности специфической рекомбинации между вектором экспрессии и хромосомами клетки хозяина. Такие встраивающиеся векторы экспрессии могут использовать эндогенные последовательности контроля экспрессии для воздействия на экспрессию желаемого белка. Примеры векторов, которые встраиваются сайт-специфическим образом, включают, например, компоненты flp-in системы от Invitrogen (Carlsbad, CA) (например, pcDNA™5/FRT), или системы cre-lox, так как может быть обнаружено в pExchange-6 ядерных векторах от Stratagene (La Jolla, CA). Примеры векторов, которые случайно встраиваются в хромосомы клетки-хозяина, включают, например, pcDNA3.1 (когда встраивается в отсутствие T-антигена) от Life Technologies (Carlsbad, CA), UCOE от Millipore (Billerica, MA), и pCI или pFN10A (ACT) FLEXI™ от Promega (Madison, WI).
[000115] Вирусные векторы также могут быть использованы. Характерные коммерчески доступные вирусные векторы экспрессии включают, без ограничения, систему на основе аденовируса Per.C6, доступную от Crucell, Inc. (Leiden, The Netherlands), на основе лентивируса pLP1 от Invitrogen (Carlsbad, CA), и ретровирусные векторы pFB-ERV плюс pCFB-EGSH от Stratagene (La Jolla, CA).
[000116] Последовательности нуклеиновых кислот, кодирующие последовательности аминокислот по изобретению, могут быть доставлены в клетку на том же векторе (т.е., в цис). Однонаправленный промотор может быть использован для контроля экспрессии каждой последовательности нуклеиновой кислоты. В другом варианте осуществления изобретения комбинация двунаправленного и однонаправленного промоторов может быть использована для контроля экспрессии множества последовательностей нуклеиновых кислот. Последовательности нуклеиновой кислоты, кодирующие полипептиды по изобретению, альтернативно могут быть доставлены в популяцию клеток на отдельных векторах (т.е. в транс). Каждая из последовательностей нуклеиновой кислоты в каждом из отдельных векторов может включать одинаковые или различные последовательности контроля экспрессии. Отдельные векторы могут быть доставлены в клетки одновременно или последовательно.
[000117] Вектор(ы), включающие нуклеиновую кислоту(ы), кодирующую полипептиды по изобретению, могут быть введены в клетку хозяин, которая способна экспрессировать полипептиды, кодируемые ими, включая любые подходящие клетки прокариот или эукариот. По существу изобретение обеспечивает выделенную клетку, включающую вектор по изобретению. Предпочтительными клетками хозяевами являются таковые, которые можно легко и надежно выращивать, имеют достаточно быструю скорость роста, имеют хорошо описанные системы экспрессии и могут быть трансформированы или трансфицированы легко и эффективно.
[000118] Примеры подходящих клеток прокариот включают, без ограничения, клетки рода Bacillus (такие как Bacillus subtilis и Bacillus brevis), Escherichia (например, E. coli), Pseudomonas, Streptomyces, Salmonella, и Erwinia. Особенно применимые клетки прокариот включают различные штаммы Escherichia coli (например, K12, HB101 (ATCC No. 33694), DH5α, DH10, MC1061 (ATCC No. 53338), и CC102).
[000119] Предпочтительно вектор вводят в клетку эукариот. Подходящие клетки эукариот известны в области техники и включают, например, клетки дрожжей, клетки насекомых, и клетки млекопитающих. Примеры подходящих клеток дрожжей включают таковые рода Kluyveromyces, Pichia, Rhino-sporidium, Saccharomyces, и Schizosaccharomyces. Предпочтительные клетки дрожжей включают, например, Saccharomyces cerivisae и Pichia pastoris.
[000120] Подходящие клетки насекомых описаны в, например, Kitts et al., Biotechniques, 14: 810-817 (1993); Lucklow, Curr. Opin. Biotechnol., 4: 564-572 (1993); и Lucklow et al., J. Virol., 67: 4566-4579 (1993). Предпочтительные клетки насекомых включают Sf-9 и HI5 (Invitrogen, Carlsbad, CA).
[000121] Предпочтительно, клетки млекопитающих используют в изобретении. Ряд подходящих клеток хозяев млекопитающих известны в области техники и могут быть доступны от American Type Culture Collection (ATCC, Manassas, VA). Примеры подходящих клеток млекопитающих включают, без ограничения, клетки яичника китайского хомяка (CHO) (ATCC No. CCL61), клетки CHO DHFR (Urlaub et al., Proc. Natl. Acad. Sci. USA, 97: 4216-4220 (1980)), клетки почки человеческого эмбриона (HEK) 293 или 293T (ATCC No. CRL1573), и клетки 3T3 (ATCC No. CCL92). Другими подходящими клеточными линиями млекопитающих являются клеточные линии обезьян COS-1 (ATCC No. CRL1650) и COS-7 (ATCC No. CRL1651), а также клеточная линия CV-1 (ATCC No. CCL70). Дополнительные примерные клетки-хозяева млекопитающих включают клеточные линии приматов и клеточные линии грызунов. Нормальные диплоидные клетки, клеточные штаммы, полученные из in vitro культуры первичной ткани, а также первичные эксплантаты, также являются подходящими. Другие подходящие клеточные линии млекопитающих включают, без ограничения, клетки мышиной нейробластомы N2A, HeLa, мышиные клетки L-929, и клеточные линии хомяка BHK или HaK, все из которых доступны от ATCC. Способы выбора подходящих клеток хозяев млекопитающего и способы трансформации, культивирования, амплификации, скрининга и очистки клеток известны в области техники.
[000122] В одном варианте осуществления изобретения клеткой млекопитающего является клетка человека. Например, клеткой млекопитающего может быть человеческая лимфоидная или происходящая из лимфоидной клеточная линия, такая как клеточная линия пре-B лимфоцитарного происхождения. Примеры человеческих лимфоидных клеточных линий включают, без ограничения, RAMOS (CRL-1596), Daudi (CCL-213), EB-3 (CCL-85), DT40 (CRL-2111), 18-81 (Jack et al., Proc. Natl. Acad. Sci. USA, 85: 1581-1585 (1988)), клетки Raji (CCL-86), клетки PER.C6 (Crucell Holland B.V., Leiden, The Netherlands), и их производные.
[000123] Последовательность нуклеиновой кислоты, кодирующая последовательность аминокислот по изобретению, может быть внесена в клетку посредством ʺтрансфекции,ʺ ʺтрансформацииʺ, или ʺтрансдукции.ʺ ʺТрансфекция,ʺ ʺтрансформацияʺ, или ʺтрансдукцияʺ, как используется в настоящем описании, относится к внесению одного или более экзогенных полинуклеотидов в клетку-хозяин с использованием физических или химических методов. Множество методик трансфекции известны в области техники и включают, например, кальций фосфатную копреципитацию ДНК (см., например, Murray E.J. (ed.), Methods in Molecular Biology, Vol. 7, Gene Transfer and Expression Protocols, Humana Press (1991)); DEAE-декстран; электропорирование; катионную трансфекцию, опосредованную липосомами; бомбардировку микрочастицами, облегченными частицами вольфрама (Johnston, Nature, 346: 776-777 (1990)); и стронций-фосфатную ко-преципитацию ДНК (Brash et al., Mol. Cell Biol., 7: 2031-2034 (1987)). Фаги или вирусные векторы могут быть внесены в клетки хозяева после роста инфекционных частиц в подходящих упаковочных клетках, множество из которых являются коммерчески доступными.
[000124] Изобретение обеспечивает композицию, включающую эффективное количество полипептида тяжелой цепи иммуноглобулина по изобретению, полипептида легкой цепи иммуноглобулина по изобретению, IL-36R-связывающего агента по изобретению, последовательности нуклеиновой кислоты, кодирующей любое из вышеуказанного, по изобретению, или вектор по изобретению, включающий последовательность нуклеиновой кислоты по изобретению. Предпочтительно, композиция является фармацевтически приемлемой (например, физиологически приемлемой) композицией, которая включает носитель, предпочтительно фармацевтически приемлемый носитель (например, физиологически приемлемый) носитель и последовательности аминокислот по изобретению, IL-36R-связывающий агент или вектор. Любой подходящий носитель может быть использован в контексте изобретения и такие носители хорошо известны в области техники. Выбор носителя определяется, отчасти, определенным местом, в которое можно вводить композицию и определенным способом, используемым для введения композиции. Композиция необязательно может быть стерильной. Композиция может быть заморожена или лиофилизирована для хранения и восстановлена в подходящем стерильном носителе до применения. Композиции могут быть получены в соответствии с обычными методиками, описанными в, например, Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, Philadelphia, PA (2001).
[000125] Изобретение дополнительно обеспечивает способ лечения заболевания у млекопитающего, которое отвечает на ингибирование или нейтрализацию IL-36R. Способ включает введение вышеупомянутой композиции млекопитающему, имеющему заболевание, которое отвечает на ингибирование или нейтрализацию IL-36R, посредством чего у млекопитающего лечат заболевания. Заболевание, которое является ʺотвечающим на ингибирование IL-36Rʺ или ʺотвечающим на нейтрализацию IL-36Rʺ относится к любому заболеванию или расстройству, при котором снижение уровня или активности IL-36R обладает терапевтическим преимуществом у млекопитающих, предпочтительно людей, или несоответствующая экспрессия (например, избыточная экспрессия) или увеличенная активность IL-36R вызывает или участвует в патологических эффектах заболевания или расстройства. Расстройства, которые отвечают на ингибирование IL-36R, включают, например, воспалительные заболевания, аутоиммунные заболевания, респираторные заболевания, метаболические заболевания и рак.
[000126] Воспалительные заболевания включают, например, аллергическое воспаление кожи, легких и желудочно-кишечного тракта, атопический дерматит (также известный как атопическая экзема), астму (аллергическая и неаллергическая), эпителиально-опосредованное воспаление, фиброз (наример, идиопатический легочный фиброз, склеродермия, фиброз почек и рубцевание), аллергический ринит, пищевую аллергию (например, аллергию на арахис, яйца, молочные продукты, креветки, лесной орех и др.), сезонные аллергии и другие аллергии.
[000127] Метод по изобретению может быть использован для лечения любого типа аутоиммунного заболевания (т.е. заболевание или расстройство, вызванное гиперактивностью иммунной системы, при котором тело атакует и повреждает свои собственные ткани), такие как описанные в, например, MacKay I.R. and Rose N.R., eds., The Autoimmune Diseases, Fifth Edition, Academic Press, Waltham, MA (2014). Примеры аутоиммунных заболеваний, которые можно лечить методом по изобретению, включают, без ограничения, рассеянный склероз, астму, сахарный диабет 1 типа, ревматоидный артрит, склеродермия, болезнь Крона, вульгарный псориаз (обычно называемый как псориаз), пустулезный псориаз, генерализованный пустулезный псориаз (GPP), ладонно-подошвенный пустулез (PPP), воспалительные заболевания кишечника, псориатический артрит, рассеянный склероз, ревматоидный артрит, системная красная волчанка (SLE), язвенный колит и анкилозирующий спондилит. В предпочтительном варианте осуществления изобретения метод по изобретению используют для лечения пустулезного псориаза, генерализованного пустулезного псориаза, ладонно-подошвенного пустулеза (PPP), или вульгарного псориаза.
[000128] Пустулезный псориаз представляет собой редкую форму псориаза, характеризуемую белыми пустулами, окруженными красной кожей. Генерализованный пустулезный псориаз (GPP) представляет собой жизнеугрожающее заболевание, характеризующееся внезапными повторными эпизодами высокой лихорадки, генерализованной сыпи, и диссеминированными пустулами с гиперлейкоцитозом и повышенным уровнем С-реактивного белка в сыворотке, который может быть вызван дефицитом антагонистов рецептора интерлейкина-36 (интерлейкин-36Ra) (Marrakchi et al., N. Engl. J. Med., 365(7):620-628 (2011)). GPP часто присутствует у пациентов с существующим или предшествующим вульгарным псориазом (PV); однако, GPP может развиться без анамнеза PV (Sugiura et al., J. Invest. Derm., 133: 2514-2521 (2013)). Ладонно-подошвенный пустулез представляет собой хроническое воспалительное заболевание кожи, характеризуемое стерильными пустулами и красной, шелушащейся кожей на ладонях и подошвах, что существенно нарушает качество жизни пораженных лиц (de Waal, A.C. and van de Kerkhof, P.C.M., J. Dermatological Treatment, 22(2): 102-105 (2011)).
[000129] Примеры респираторных заболеваний, которые можно лечить методом по изобретению, включают, без ограничения, астму, муковисцидоз, эмфизему, хроническую обструктивную болезнь легких (ХОБЛ), и острый респираторный дистресс синдром. Примеры метаболических расстройств, которые можно лечить методом по изобретению, включают, без ограничения, ожирение, диабет 2 типа, атеросклероз и сердечно-сосудистые заболевания.
[000130] Метод по изобретению может быть использован для лечения любого типа рака, известного в области техники, включая, без ограничения, меланому, почечноклеточную карциному, рак легкого, рак мочевого пузыря, рак молочной железы, рак шейки матки, рак ободочной кишки, рак желчного пузыря, рак гортани, рак печени, рак щитовидной железы, рак желудка, рак слюнной железы, рак предстательной железы, рак поджелудочной железы, лейкоз, лимфома и клеточная карцинома Меркеля (см., например, Bhatia et al., Curr. Oncol. Rep., 13(6): 488-497 (2011)).
[000131] Введение композиции, включающей полипептид тяжелой цепи иммуноглобулина по изобретению, полипептид легкой цепи иммуноглобулина по изобретению, IL-36R-связывающий агент по изобретению, последовательность нуклеиновой кислоты по изобретению, кодирующую любое из вышеуказанного, или вектор по изобретению, включающий последовательность нуклеиновой кислоты по изобретению, индуцирует иммунный ответ у млекопитающего. ʺИммунный ответʺ может включать, например, продукцию антител и/или активацию иммунных эффекторных клеток (например, T-клеток).
[000132] Как используется в настоящем описании, термин ʺлечениеʺ, ʺтерапияʺ и подобные относятся к получению желаемого фармакологического и/или физиологического эффекта. Предпочтительно эффект является терапевтическим, т.е. эффект частично или полностью излечивает заболевание и/или нежелательный симптом, присущий заболеванию. С этой целью метод по изобретению включает введение ʺтерапевтически эффективного количестваʺ IL-36R-связывающего агента. ʺТерапевтически эффективное количествоʺ относится к количеству, эффективному в дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество может варьироваться в соответствии факторами, такими как патологическое состояние, возраст, пол и масса тела пациента и способность IL-36R-связывающего агента оказывать желаемый эффект у пациента. Например, терапевтически эффективное количество IL-36R-связывающего агента по изобретению представляет собой количество, которое снижает биоактивность IL-36R у человека.
[000133] Альтернативно, фармакологический и/или физиологический эффект может быть профилактическим, т.е. эффект полного или частичного предотвращения заболевание или его симптома. В таком отношении метод по изобретению включает введение ʺпрофилактически эффективного количестваʺ IL-36R-связывающего агента. ʺПрофилактически эффективное количествоʺ относится к количеству, эффективному в дозировках и в течение периодов времени, необходимого для достижения желаемого профилактического результата (например, профилактики развития заболевания).
[000134] Типичная доза может находиться, например, в диапазоне от 1 пг/кг до 20 мг/кг массы тела животного или человека; однако, дозы ниже или выше этого примерного диапазона находятся в рамках изобретения. Суточная парентеральная доза может составлять от около 0,00001 мкг/кг до около 20 мг/кг общей массы тела (например, около 0,001 мкг/кг, около 0,1 мкг/кг, около 1 мкг/кг, около 5 мкг/кг, около 10 мкг /кг, около 100 мкг /кг, около 500 мкг/кг, около 1 мг/кг, около 5 мг/кг, около 10 мг/кг, или диапазон, ограниченный любыми двумя из вышеуказанных значений), предпочтительно от около 0,1 мкг/кг до около 10 мг/кг общей массы тела (например, около 0,5 мкг/кг, около 1 мкг/кг, около 50 мкг/кг, около 150 мкг/кг, около 300 мкг/кг, около 750 мкг/кг, около 1,5 мг/кг, около 5 мг/кг, или диапазон, ограниченный любыми двумя вышеуказанными значениями), более предпочтительно от около 1 мкг/кг до 5 мг/кг общей массы тела (например, около 3 мкг/кг, около 15 мкг/кг, около 75 мкг/кг, около 300 мкг/кг, около 900 мкг/кг, около 2 мг/кг, около 4 мг/кг, или диапазон, ограниченный любыми двумя из вышеуказанных значений), и еще более предпочтительно от около 0,5 до 15 мг/кг массы тела в сутки (например, около 1 мг/кг, около 2,5 мг/кг, около 3 мг/кг, около 6 мг/кг, около 9 мг/кг, около 11 мг/кг, около 13 мг/кг, или диапазон, ограниченный любыми двумя из вышеуказанных значений). Терапевтическая или профилактическая эффективность может отслеживаться путем периодической оценки пациентов, получающих лечение. Для повторных ведений в течение нескольких дней или дольше, в зависимости от состояния, лечение может быть повторено до развития желаемого подавления симптомов заболевания, или альтернативно, лечение может продолжаться в течение жизни пациента. Однако другие схемы введения могут быть использованы и находятся в рамках изобретения. Желаемая дозировка может быть доставлена одиночным болюсным введением, введением множества болюсов композиции или посредством непрерывного инфузионного введения композиции.
[000135] Композиция, включающая эффективное количество полипептида тяжелой цепи иммуноглобулина по изобретению, полипептида легкой цепи иммуноглобулина по изобретению, IL-36R-связывающего агента по изобретению, последовательности нуклеиновой кислоты по изобретению, кодирующей любое из вышеуказанного, или вектора по изобретению, включающего последовательность нуклеиновой кислоты по изобретению, может быть введена млекопитающему с использованием стандартных методик введения, включая пероральное, внутривенное, интраперитонеальное, подкожное, легочное, трансдермальное, внутримышечное, интраназальное, буккальное, сублингвальное введение или суппозитории. Композиция предпочтительно является подходящей для парентерального введения. Термин ʺпарентеральныйʺ, как используется в настоящем описании, включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и интраперитонеальное введение. Более предпочтительно, композицию вводят млекопитающему с использованием периферической системной доставки путем внутривенной, интраперитонеальной или подкожной инъекции.
[000136] При введении млекопитающему (например, человеку) биологическая активность IL-36R-связывающего агента по изобретению может быть измерена любым подходящим методом, известным в области техники. Например, биологическая активность может быть оценена путем определения стабильности определенного IL-36R-связывающего агента. В одном варианте осуществления изобретения, IL-36R-связывающий агент (например, антитело) имеет период полужизни in vivo от около 30 минут до 45 дней (например, около 30 минут, около 45 минут, около 1 часа, около 2 часов, около 4 часов, около 6 часов, около 10 часов, около 12 часов, около 1 дня, около 5 дней, около 10 дней, около 15 дней, около 25 дней, около 35 дней, около 40 дней, около 45 дней, или диапазон, ограниченный любыми двумя из вышеуказанных значений). В другом варианте осуществления изобретения IL-36R-связывающий агент имеет период полужизни in vivo от около 2 часов до 20 дней (например, около 5 часов, около 10 часов, около 15 часов, около 20 часов, около 2 дней, около 3 дней, около 7 дней, около 12 дней, около 14 дней, около 17 дней, около 19 дней, или диапазон, ограниченный любыми двумя из вышеуказанных значений). В другом варианте осуществления изобретения IL-36R-связывающий агент имеет период полужизни in vivo от около 10 дней до около 40 дней (например, около 10 дней, около 13 дней, около 16 дней, около 18 дней, около 20 дней, около 23 дней, около 26 дней, около 29 дней, около 30 дней, около 33 дней, около 37 дней, около 38 дней, около 39 дней, около 40 дней, или диапазон, ограниченный любыми двумя из вышеуказанных значений).
[000137] Стабильность IL-36R-связывающего агента по изобретению может быть оценена посредством значения медианы перехода (Tm), которая представляет собой температуру, когда 50% последовательности аминокислот находится в ее нативной конформации и другие 50% денатурированы. В общем, чем выше Tm, тем более стабилен белок. В одном варианте осуществления изобретения IL-36R-связывающий агент по изобретению включает значение медианы перехода (Tm) in vitro около 60-100°C. Например, IL-36R-связывающее средство по изобретению может включать Tm in vitro около 65-80°C (например, 66°C, 68°C, 70°C, 71°C, 75°C, или 79°C), около 80-90°C (например, около 81°C, 85°C, или 89°C), или около 90-100°C (например, около 91°C, около 95°C, или около 99°C).
[000138] Стабильность IL-36R-связывающего агента по изобретению может быть измерена с использованием любого другого подходящего анализа, известного в области техники, такого как, например, измерение периода полужизни в сыворотке, дифференциальная сканирующая калориметрия (DSC), анализы теплового сдвига и анализы вытеснения метки. Другие методы оценки стабильности белка in vivo и in vitro, которые могут быть использованы в контексте изобретения, описаны в, например, Protein Stability and Folding, B.A. Shirley (ed.), Human Press, Totowa, New Jersey (1995); Protein Structure, Stability, and Interactions (Methods in Molecular Biology), Shiver J.W. (ed.), Humana Press, New York, NY (2010); и Ignatova, Microb. Cell Fact., 4: 23 (2005).
[000139] Биологическая активность определенного IL-36R-связывающего агента по изобретению также может быть оценена путем определения его аффинности связывания с IL-36R или его эпитопом. Термин ʺаффинностьʺ относится к равновесию, постоянному для обратимого связывания двух агентов и выражается как константа диссоциации (KD). Аффинность связывающего агента к лиганду, например, аффинность антитела к эпитопу, может составлять, например, от около 1 пикомоль (пM) до около 100 микромоль (мкM) (например, от около 1 пикомоль (pM) до около 1 наномоль (nM), от около 1 нМ до около 1 микромоль (мкM), или от около 1 мкМ до около 100 мкM). В одном варианте осуществления изобретения IL-36R-связывающий агент может связываться с белком IL-36R с KD менее чем или равной 1 наномоль (например, 0,9 нM, 0,8 нМ, 0,7 нМ, 0,6 нМ, 0,5 нМ, 0,4 нМ, 0,3 нМ, 0,2 нМ, 0,1 нМ, 0,05 нМ, 0,025 нМ, 0,01 нМ, 0,001 нМ, или диапазон, ограниченный любыми двумя вышеуказанными значениями). В другом варианте осуществления изобретения IL-36R-связывающий агент может связываться с IL-36R с KD менее чем или равной 200 пМ (например, 190 пМ, 175 пМ, 150 пМ, 125 пМ, 110 пМ, 100 пМ, 90 пМ, 80 пМ, 75 пМ, 60 пМ, 50 пМ, 40 пМ, 30 пМ, 25 пМ, 20 пМ, 15 пМ, 10 пМ, 5 пМ, 1 пМ, или диапазон, ограниченный любыми двумя вышеуказанными значениями). Аффинность иммуноглобулина в отношении антигена или интересующего эпитопа может быть измерена с использованием любого известного метода в области техники. Такие методы включают, например, сортировку флуоресцентно-активированных клеток (FACS), разделяемые шарики (например, магнитные шарики), поверхностный плазмонный резонанс (SPR), конкуренцию в растворенной фазе (KINEXA™), промывку антигена, анализы конкурентного связывания, и/или ELISA (см., например, Janeway et al. (eds.), Immunobiology, 5th ed., Garland Publishing, New York, NY, 2001).
[000140] IL-36R-связывающий агент по изобретению может быть введен отдельно или в комбинации с другими лекарственными средствами. Например, IL-36R-связывающий агент можно вводить в комбинации с другими агентами для лечения или профилактики заболеваний, описанных в настоящем описании, например, противовоспалительным средством, включая, например, кортикостероиды (например, преднизон и флутиказон), нестероидные противовоспалительные средства (НПВС) (например, аспирин, ибупрофен и напроксен), биопрепараты (например, инфликсимаб (REMICADE™), адалимумаб (HUMIRA™), или этарнесепт (ENBREL™)), метотрексат (MTX), пероральный ретиноид (например, ацитретин (SORIATANE™)), и местные стероиды.
[000141] В добавление к терапевтическому применению IL-36R-связывающий агент, описанный в настоящем описании, может быть использован в диагностических или исследовательских целях. В этом отношении IL-36R-связывающий агент может быть использован для диагностики расстройства или заболевания, при котором несоответствующая экспрессия (например, избыточная экспрессия) или увеличенная активность IL-36R вызывает или участвует в патологических эффектах заболевания или расстройства. Подобным образом IL-36R-связывающее средство может быть использовано в анализе для оценки уровня белка IL-36R у пациента, которого исследуют на предмет заболевания или расстройства, которое отвечает на ингибирование IL-36R. Исследовательское применение включает, например, способы, которые используют IL-36R-связывающий агент и метку для определения белка IL-36R в образце, например, в жидкости тела пациента или в экстракте клеток или ткани. IL-36R-связывающий агент может быть использован с или без модификации, такой как ковалентная или нековалентная метка детектируемым фрагментом. Например, детектируемым фрагментом может быть радиоизотоп (например, 3H, 14C, 32P, 35S, или 125I), флуоресцентное или хемилюминесцентное соединение (например, флуоресцеина изотиоцианат, родамин или люциферин), фермент (например, щелочная фосфатаза, бета-галактозидаза или пероксидаза хрена), или простетические группы. Любой метод, известный в области техники для отдельного конъюгирования антиген-связывающего агента (например, антитела) с контрастным веществом может быть использован в контексте изобретения (см., например, Hunter et al., Nature, 194: 495-496 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol. Meth., 40: 219-230 (1981); и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982)).
[000142] Уровень белка IL-36R может быть измерен с использованием IL-36R-связывающего агента по изобретению посредством любого подходящего метода, известного в области техники. Такие методы включают, например, радиоиммуноанализ (RIA), и FACS. Нормальные или стандартные значения экспрессии IL-36R могут быть установлены с использованием любой подходящей методики, например, путем комбинации образца, включающего или предположительно включающего, IL-36R с IL-36R-специфическим антителом в условиях, подходящих для образования комплекса антиген-антитело. Антитело прямо или опосредованно метят контрастным веществом для облегчения определения связанного или несвязанного антитела. Подходящие контрастные вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы (см., например, Zola, Monoclonal Antibodies: A Manual of Techniques, CRC Press, Inc. (1987)). Количество IL-36R полипептида, экспрессируемое в образце, затем сравнивали со стандартным значением.
[000143] IL-36R-связывающий агент может быть представлен в наборе, т.е. упакованной комбинации реагентов в заранее определенных количествах с инструкциями для проведения диагностического анализа. Если IL-36R-связывающее средство метят ферментом, набор желательно включает субстраты и кофакторы, требуемые для фермента (например, предшественник субстрата, который обеспечивает определяемый хромофор или фторофор). Кроме того, другие добавки могут быть включены в набор, такие как стабилизаторы, буферы (например, блокирующий буфер или литический буфер), и подобные. Относительные количества различных реагентов могут варьироваться для обеспечения концентраций в растворе реагентов, которые по существу оптимизируют чувствительность анализа. Реагенты могут быть представлены в виде сухих порошков (типично лиофилизированных), включая вспомогательные вещества, которые при растворении обеспечивают раствор реагента, имеющего соответствующую концентрацию.
[000144] Следующие примеры дополнительно иллюстрируют изобретение, но, конечно, не должны расцениваться, как каким-либо образом ограничивающие его рамки.
ПРИМЕР 1
[000145] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению могут образовывать антитела, которые связываются с и блокируют передачу сигнала человеческого IL-36R in vitro.
[000146] Клетки HEK293T/17 (ATCC CRL-11268) стабильно трансфицировали плазмидным конструктом, кодирующим или человеческий IL-36R (hIL-36R) или IL-36R яванского макака (cynoIL-36R) вместе с промотором IL-8 (Promega Corp., Madison, WI), и единственный клон клеток выбирали для всех последующих анализов.
[000147] Клетки HEK293 сеяли по 3×106 клеток/колбу на T75 колбы для культур в 10 мл DMEM+10% FBS и инкубировали в течение ночи при 37°C. На следующее утро 24 мкл FUGENE™ HD (Promega Corporation, Madison, WI) добавляли к 500 мкл среды OPTI-MEM™ (Life Technologies, Carlsbad, CA) и инкубировали при комнатной температуре в течение пяти минут. ДНК, кодирующую IL-36R (2 мкл), и ДНК, кодирующую промотор IL8 (2 мкл), добавляли к смеси и позволяли инкубироваться в течение дополнительных 25 минут при комнатной температуре. Аллельный вариант IL-36R яванского макака исследовали посредством секвенирования по Сэнгеру и четыре отдельных аллельных варианта идентифицировали в популяции яванских макак. Клеточные линии HEK, экспрессирующие каждый аллельный вариант IL-36R яванского макака, создавали отдельно. Для клеточных линий репортера IL-8 человека и яванского макака использовали HEK, эндогенно экспрессирующие человеческий IL1RAcP. Смесь ДНК/FUGENE™ аккуратно добавляли к клеткам по каплям для трансфекции и инкубировали в течение ночи при 37°C. Через 24 часа после трансфекции клетки отщепляли и помещали в DMEM+10% FBS, содержащую гигромицин и пуромицин, в течение четырех недель для селекции. Через 4 недели стабилизированные клетки сеяли по 1 клетке/ячейку на 96-луночные планшеты с прозрачным дном (5 планшетов/клеточная линия). Клоны отдельных клеток скринировали в отношении поверхностной экспрессии IL-36R и размножали, с использованием для анализа, описанного ниже, клеток с небольшим количеством пассажей (т.е., 1-3).
[000148] Стабильные клеточные линии варианта HEK293-человеческий IL36R/IL8 или HEK293-cynoIL36R/IL8 собирали с аккутазой и сеяли по 0,06×106 клеток/ячейку в 100 мкл DMEM+10% FBS на 96-луночный планшет с прозрачным дном в течение ночи при 37°C, 5% CO2. На следующее утром планшеты переворачивали в сток для удаления среды и аккуратно промакивали на бумажном полотенце для высыхания. Разведенные антитела, включающие различные комбинации полипептидов HC и LC по изобретению (см. таблицу 1), IL-36Ra (R&D Systems, Minneapolis, MN), и контрольное антитело отрицательного изотипа получали в DMEM+10% FBS (Life Technologies, Carlsbad, CA) до желаемой концентрации путем серии двухкратных разведений, немедленно добавляли в ячейки (50 мкл/ячейку), и позволяли инкубироваться в течение 20 минут при 37°C, 5% CO2.
Таблица 1
[000149] Клетки впоследствии стимулировали 50 мкл IL36α, IL36β, или IL36γ лигандов (R&D Systems, Minneapolis, MN) и позволяли инкубироваться в течение дополнительных 24 часов при 37°C, 5% CO2. EC50 каждого из отдельных цитокинов определяли эмпирически до анализа. Люциферазную активность определяли с использованием аналитической системы люциферазы STEADY-GLO™ (Promega, Cat# E2520, Madison, WI). 100 мкл смеси 1:1 субстрата анализа люциферазы: буфера добавляли в каждую ячейку, инкубировали в течение пяти минут при комнатной температуре и переносили (150 мкл) на 96-луночные планшеты с черными стенками, прозрачным дном. Планшеты считывали на счетчике планшетов ENVISION™ (PerkinElmer, Waltham, WA) для определения люминесценции (60-сек отсрочка). Данные анализировали с использованием программного обеспечения GraphPad PRISM™ 5 (GraphPad, San Diego, CA).
[000150] Результаты анализа люциферазного репортерного анализа IL-8 относительно IL-36R человека и яванского макака показаны на фиг. 1A-1F (человеческий IL-36R), фиг. 2A-2C (яванский макак IL-36R), фиг. 10A-1°C (яванский макак IL-36R), и фиг. 10D-10F (человеческий IL-36R). Измеренная эффективность (IC50) каждого из тестируемых антител представлена в таблицах 2 и 3.1 и 3.2.
Таблица 2 - IL-8 люциферазный репортерный анализ IL-36R HEK человека
hIL-36α
Таблица 3.1 - IL-8 люциферазный репортерный анализ cyno IL-36R HEK
SEQ ID NO:
SEQ ID NO:
2 мкг/мл
сIL-36α
Таблица 3.2
SEQ ID NO:
SEQ ID NO:
IL-36γ (вариант 1 cyno IL-36R)
(вариант 3 cyno IL-36R)
[000151] Результаты этого примера демонстрируют, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению могут образовывать антитела, которые связываются с и ингибируют передачу сигнала человеческого IL-36R in vitro.
ПРИМЕР 2
[000152] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению могут образовывать антитела, которые связываются с человеческим IL-36R in vitro.
[000153] Образцы ДНК, кодирующие различные полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина, как описано в настоящем описании, получали путем комбинации следующего: максимально подготовленная ДНК (содержащая 6 мкг HC плазмиды и 6 мкг LC плазмиды), 1 мл OPTIMEM™ (Life Technologies, Carlsbad, CA), и 72 мкл FUGENE™ HD реагента для трансфекции (Promega, Fitchburg, WI). Все реагенты были заранее нагреты. После тщательного перемешивания и инкубации в течение 25 минут при комнатной температуре 1 мл смеси реагент/ДНК добавляли к 8×106 клеток HEK293-c18 (ATCC CRL-10852) в каждой колбе для культивирования T225. За 18 часов до трансфекции клетки сеяли в колбы для культивирования T225 с 20 мл DMEM (Life Technologies, Carlsbad, CA) с 10% FBS (Life Technologies, Carlsbad, CA) на колбу и инкубировали при 37°C в 5% CO2 в течение ночи. После трансфекции клетки возвращали к 37°C в 5% CO2. На следующий день среду в каждой колбе заменяли 25 мл среды 293 (Life Technologies, Carlsbad, CA), и клетки перемещали в инкубатор при 8% CO2. Продукцию антител осуществляли в течение 7-12 дней. Надосадочную жидкость собирали из каждой колбы центрифугировали при 3000 об/мин в течение 10 минут и стерильно фильтровали в новые пробирки.
[000154] Для очистки антител приблизительно 20-30 мл надосадочной жидкости культур клеток, содержащей интересующие антитела, пропускали через гравитационную колонку, упакованную с 1-2 мл смолы MAB SELECT SURE™ LX (GE Healthcare, Waukesha, WI) пре-уравновешивали PBS буфером (11,9 мM фосфат, 137 мM NaCl, 2,7 мM KCl, pH 7,4) (Fisher Bioreagents, Waltham, MA). Колонку промывали пятью объемами колонки буфера PBS. Связанные антитела элюировали из смолы 5-10 объемами колонки 0,1 M глицина pH 3,0. Элюат, содержащий антитела, концентрировали до концентрации антитела приблизительно 0,1-2 мг/мл в концентраторах Amicon Ultra 10K (Millipore, Billerica, MA), и буфер заменяли три раза снова PBS буфером. Концентрацию антител определяли на спектрофотометре Nanodrop 2000c (Thermo Fisher Scientific, Waltham, MA), и чистоту оценивали посредством анализа SDS-PAGE.
[000155] Аффинность связывания различных очищенных антител, включающих полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина, описанных в настоящем описании, оценивали с использованием were анализа BIACORE™ T200 (Sapidyne Instruments, Boise, Idaho). Пробный выпуск программы BIACORE™ T200 (GE Healthcare, Buckinghamshire, United Kingdom) использовали для определения кинетики и аффинности связывания антитело-антиген. Внеклеточный домен человеческого IL-36R иммобилизовали приблизительно 100 УЕ на сенсорном чипе CM5 (GE Healthcare, Waukesha, WI) с использованием амин-связывающей химии. HBS-EP+ буфер (0,01 M HEPES, 0,15 M NaCl, 3 мM EDTA, 0,05% полисорбат, pH 7,6) (Teknova, Hollister, CA) использовали для восстановления каждого антитела в различных концентрациях. Каждую концентрацию антитела затем вводили в течение от двух до трех минут на иммобилизованный антиген со скоростью тока 30 мкл/мин, и позволяли диссоциировать в течение 15 минут. Поверхность восстанавливали 60 мкл 3 M MgCl2 после каждого цикла. Кинетические константы ассоциации и диссоциации (kon и koff) глобально калиброали с использованием модели связывания 1:1 с переносом массы с пробным выпуском программы BIACORE™ T200 с целью получения скорости ассоциации и диссоциации (ka и kd, соответственно), а также аффинности (KD).
[000156] Аффинности связывания различных очищенных антител, включающих полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина, описанные в настоящем описании, также оценивали с использованием анализа KINEXA® 3000 (Sapidyne Instruments, Boise, Idaho). Методика KINEXA® измеряет количество несвязанной/свободной молекулы антитела в растворенной фазе после инкубации с различными концентрациями антигена. Оценка связывания в растворенной фазе с микрошариками для максимального увеличения площади поверхности помогает избежать ограничений переноса массы и эффектов подвижности, присущих методам, которые оценивают связывание с твердой фазой. Для каждого эксперимента, 50 мкг растворимого внеклеточного домена IL-36R человека или яванского макака амино-связывали с 50 мг шариков UltraLink Biosupport (Thermo Fisher Scientific, Waltham, MA). Постоянную концентрацию антитела (достаточную для получения 0,8 В-1,2 В сигнала) инкубировали в течение достаточного периода времени для достижения или для получения равновесия (время инкубации варьируется для каждого антитела и зависит от аффинности) с титрованным антигеном в буфере для образца (1x PBS, pH 7,4, 0,02% NaN3, 0,1% BSA). Раствор антитела-антигена затем пропускали над антиген-связанными шариками со скоростью 0,25 мл/мин. Свободное антитело, захваченное шариками, определяли с использованием ALEXA FLUOR™ 647-конъюгированного AffiniPure Donkey Anti-Human IgG (H+L) (Jackson ImmunoResearch, West Grove, PA) (500 нг/мл). KD и/или ABC (концентрация активного связывания) антитела получали посредством нелинейного регрессионного анализа с использованием модели одностороннего гомогенного связывания в программном обеспечении KINEXA™ Pro.
[000157] Полученные значения KD анализов BIACORE™ T200 и KINEXA® 3000 представлены в таблице 4 и фиг. 3A (KinExA данные для гуманизированного 1D9), фиг. 3B (Biacore для 5D3 APE6194) и фиг. 3C (KinExA данные для гуманизированного 18D4).
Таблица 4
человеческий IL-36R
[000158] Полученные данные демонстрируют, что антитела, включающие различные комбинации полипептидов HC и LC иммуноглобулина по изобретению, описанных в настоящем описании, могут связываться с человеческим IL-36R с высокой аффинностью.
ПРИМЕР 3
[000159] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению могут образовывать антитела, которые связываются с человеческим IL-36R in vitro и ингибируют передачу сигнала в клетке и высвобождение цитокина (например, IL-8) человеческими первичными кератиноцитами, эндогенно экспрессирующими IL-36R.
[000160] Антитела, используемые в этом анализе получали, и очищали как описано выше. Нормальные человеческие эпидермальные кератиноциты (NHEK) покупали у Lonza Clonetics (кат# 00192627). Клетки культивировали и размножали с использованием рекомендованной культуральной среды (среда Lonza KBM Gold, кат# 00192151 с добавками Lonza KGM Gold SingleQuot, кат# 0092152) в 5% CO2 37°C инкубаторе. Клетки замораживали в жидком азоте на 2 пассаже во множестве аликвот для одноразового использования.
[000161] Клетки 2 пассажа оттаивали и разводили до плотности 100000 клеток на мл в вышерекомендованной культуральной среде, описанной выше, и 100 мкл клеток на ячейку сеяли в стандартных плоскодонных 96-луночных планшетах для культивирования тканей до конечной плотности клеток 10000 клеток на ячейку. Снаружи ячейки заполняли 200 мкл фосфатного буферного раствора на ячейку во избежание краевых эффектов. Клетки культивировали в течение ночи в 5% CO2 37°C инкубаторе для возможности адгезии.
[000162] На следующий день антитела добавляли в концентрациях от 10 мкг/мл или 1 мкг/мл по 0 полулогарифмическим разведениям в культуральной среде. Через 30 минут рекомбинантные лиганды человеческого IL-36 добавляли в приблизительно EC50 концентрациях (ранее определенных эмпирически для каждого лиганда) в культуральной среде. Концентрации антитела и лиганда получали в 4x желаемых финальных концентраций и 50 мкл на ячейку добавляли до конечного общего объема в каждой ячейке 200 мкл. Надосадочную жидкость удаляли приблизительно через 48 часов с последующим трехминутным центрифугированием планшетов, переносили в чистые планшеты и или тестировали немедленно или хранили при -80°С до последующего анализа.
[000163] Уровень человеческого IL-8 в надосадочной жидкости клеток оценивали посредством ELISA с использованием набора R&D Systems DUO-SET™ ELISA (кат# DY208), следуя стандартному протоколу, обеспечиваемому производителем. Данные наносили на график и значения IC50 рассчитывали с использованием программного обеспечения GraphPad PRISM™.
[000164] Результаты этого анализа показаны в таблице 5 и фиг. 4A-4I.
Таблица 5
SEQ ID NO:
SEQ ID NO:
10 нг/мл
IL-36α человека
1 нг/мл
IL-36β человека
100 нг/мл
IL-36γ человека
[000165] Результаты этого примера демонстрируют, что антитела, состоящие из комбинаций HC и LC, описанные в настоящем описании, ингибируют высвобождение воспалительных цитокинов (IL-8) из человеческих первичных кератиноцитов, экспрессирующих IL-36R, и стимулируются цитокинами IL-36α, IL-36β и IL-36γ дозо-зависимым образом.
ПРИМЕР 4
[000166] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению могут образовывать антитела, которые связываются с IL-36R яванского макака (cyno IL-36R) in vitro и ингибируют IL-36-зависимую передачу сигнала в клетках и высвобождение цитокинов (например, IL-8) первичными кератиноцитами, эндогенно экспрессирующими IL-36R.
[000167] Антитела, используемые в этом анализе, получали и очищали, как описано в примере 3. Нормальные эпидермальные кератиноциты яванского макака покупали от CellBiologics (Chicago, IL; кат# MK-6066K). Клетки культивировали и размножали с использованием рекомендуемой культуральной среды (эпителиальная среда CellBiologics, кат# M6621 с добавками к среде эпителиальных клеток CellBiologics, кат# M6621-набор) в 5% CO2 37°C инкубаторе. Клетки замораживали в жидком азоте на 2 пассаже во множестве аликвот для одноразового применения.
[000168] Клетки 2 пассажа оттаивали и разводили до плотности 100000 клеток на мл в культуральной среде, описанной выше, и 100 мкл клеток на ячейку сеяли в стандартные плоскодонные 96-луночные планшеты для культивирования тканей для конечной клеточной плотности 10000 клеток на ячейку. Снаружи ячейки заполняли 200 мкл PBS на ячейку во избежание краевых эффектов. Клетки культивировали в течение ночи в 5% CO2 37°C инкубаторе для возможности адгезии.
[000169] На следующий день антитела добавляли в концентрациях от 10 мкг/мл или 1 мкг/мл по 0 полулогарифмическим разведениям в культуральной среде. Через 30 минут рекомбинантные лиганды IL-36 яванского макака добавляли в приблизительно EC50 концентрациях (ранее определенных эмпирически для каждого лиганда) в культуральной среде. Концентрации антитела и лиганда делали в 4x желаемой конечной концентрации и 50 мкл на ячейку добавляли до конечного общего объема в каждой ячейке 200 мкл. Надосадочную жидкость удаляли приблизительно через 48 часов с последующим трехминутным центрифугированием планшетов, переносили в чистые планшеты или тестировали немедленно или хранили при -80°C до последующего анализа.
[000170] Уровень IL-8 яванского макака в надосадочной жидкости клеток оценивали посредством ELISA с использованием набора eBioscience (San Diego, CA) monkey IL-8 platinum ELISA (кат# BMS640/3), следуя стандартному протоколу, предложенному производителем. Данные были нанесены на график и значения IC50 рассчитывали с использованием программного обеспечения GraphPad PRISM™.
[000171] Результаты этого анализа показаны в таблице 6 и фиг. 5A-5F.
Таблица 6
SEQ ID NO:
SEQ ID NO:
cyno IL-36α
250 нг/мл cyno IL-36γ
[000172] Результаты этого примера демонстрируют, что антитела, состоящие из комбинаций HC и LC, описанных в настоящем описании, ингибируют высвобождение воспалительных цитокинов (IL-8) из первичных кератиноцитов яванского макака, экспрессирующих IL-36R и стимулированных цитокинами IL-36α, IL-36β и IL-36γ дозозависимым образом.
ПРИМЕР 5
[000173] Этот пример демонстрирует способность антител, состоящих из HC и LC, описанных в настоящем описании, блокировать дозозависимым образом высвобождение IL-8, опосредованного человеческим IL-36 из человеческих моноцитов, экспрессирующих IL-36R.
[000174] Блок системы восстановления лейкоцитов из блока белой крови донора получали от San Diego Blood Bank. Мононуклеарные клетки периферической крови (PBMC) получали стандартными методами с использованием разделения центрифугированием по плотности Фиколл (Sigma HISTOPAQUE™ кат# 10771). Моноциты выделяли из PBMC с помощью набора для выделения человеческих моноцитов II (Miltenyi Biotec, San Diego, CA; кат# 130-091-153).
[000175] Моноциты разводили до плотности 500000 клеток/мл в среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки и пенициллин/стрептомицин, и 100 мкл клеток сеяли в стандартных плоскодонных 96-луночных планшетах для культур тканей до конечной клеточной плотности 50000 на ячейку. Снаружи ячейки заполняли 200 мкл PBS на ячейку во избежание краевых эффектов. Посеянные клетки инкубировали в течение 2-3 часов в 5% CO2 37°C инкубаторе для возможности восстановления.
[000176] После приблизительно 2-3 часов культивирования антитела добавляли в концентрациях от 10 мкг/мл или 1 мкг/мл по 0 полулогарифмическим разведениям в культуральной среде. Через 30 минут рекомбинантные человеческие лиганды IL-36 добавляли в приблизительных концентрациях EC50 (ранее определенной эмпирически для каждого лиганда) в культуральной среде. Концентрации антител и лиганда доводили по 4x желаемых финальных концентраций и 50 мкл на ячейку добавляли до конечного общего объема 200 мкл. Надосадочную жидкость удаляли приблизительно через 48 часов с последующим трехминутным центрифугированием планшетов, переносили в чистые планшеты и или тестировали немедленно или хранили при -80°C до последующих анализов.
[000177] Уровень человеческого IL-8 в надосадочной жидкости клеток оценивали посредством ELISA с использованием набора R&D Systems DUO-SET™ ELISA (кат# DY208), следуя стандартному протоколу, обеспеченному производителем. Данные наносили на график и значения IC50 рассчитывали с использованием программного обеспечения GraphPad PRISM™.
[000178] Результаты этих экспериментов представлены в таблице 7 и фиг. 6A и 6B.
Таблица 7
SEQ ID NO:
SEQ ID NO:
IL-36α человека
человека
IL-36γ человека
[000179] Результаты этого примера демонстрируют, что антитела, состоящие из комбинаций HC и LC, описанные в настоящем описании, ингибируют высвобождение воспалительных цитокинов (IL-8) из человеческих первичных моноцитов, экспрессирующих IL-36R и стимулированных цитокинами IL-36α, IL-36β и IL-36γ дозозависимым образом.
ПРИМЕР 6
[000180] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению, описанные в настоящем описании, могут образовывать антитела, которые ингибируют IL-36-зависимое высвобождение цитокинов из человеческих первичных мононуклеарных клеток периферической крови.
[000181] Блок системы восстановления лейкоцитов, полученный из блока цельной донорской крови, получали от San Diego Blood Bank. Мононуклеарные клетки периферической крови (PBMC) получали стандартными способами с использованием разделения центрифугированием по градиенту плотности Фиколл (Sigma HISTOPAQUE™ кат# 10771).
[000182] PBMC разводили до плотности 1×106 клеток/мл в среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки и пенициллин/стрептомицин, и 100 мкл клеток на ячейку сеяли в стандартные плоскодонные 96-луночные планшеты для культивирования тканей для конечной плотности клеток 100000 на ячейку. Снаружи ячейки заполняли 200 мкл PBS на ячейку во избежание краевых эффектов. Посеянные клетки инкубировали в течение 2-3 часов в 5% CO2 37°C инкубаторе для возможности восстановления.
[000183] Через приблизительно 2-3 часа культивирования антитела добавляли в концентрациях от 10 мкг/мл или 1 мкг/мл по 0 полулогарифмическим разведениям в культуральной среде. Через 30 минут рекомбинантные лиганды человеческого IL-36 добавляли в приблизительно EC50 концентрациях (ранее определяемые эмпирически для каждого лиганда). Концентрации антитела и лиганда получали 4x желаемых финальных концентраций и 50 мкл на ячейку добавляли до конечного общего объема в каждой ячейке 200 мкл. Надосадочные жидкости удаляли приблизительно через 48 часов с последующим трехминутным центрифугированием планшетов, переносили в чистые планшеты и или тестировали немедленно или хранили при -80°C до последующих анализов.
[000184] Уровни человеческого IL-8 в надосадочной жидкости клеток оценивали посредством ELISA с использованием набора R&D Systems DUO-SET ™ ELISA (кат# DY208), следуя стандартному протоколу, обеспеченному производителем. Данные наносили на график и значения IC50 рассчитывали с использованием программного обеспечения GraphPad PRISM™.
[000185] Результаты этого анализа показаны на фиг. 7A-7C, и демонстрируют, что антитела, состоящие из комбинаций HC и LC, описанных в настоящем описании, ингибируют высвобождение воспалительных цитокинов (IL-8) из человеческих первичных мононуклеарных клеток периферической крови, экспрессирующих IL-36R и стимулированных цитокинами IL-36α, IL-36β и IL-36γ дозозависимым образом.
ПРИМЕР 7
[000186] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению, описанные в настоящем описании, могут образовывать антитела, которые ингибируют IL-36-зависимое высвобождение цитокинов из первичных мононуклеарных клеток периферической крови яванского макака.
[000187] Мононуклеарные клетки периферической крови (PBMC) подготавливали стандартными методами с использованием разделения центрифугированием по градиенту плотности Фиколл (Sigma HISTOPAQUE™; кат# 10771) из нормальной цельной крови яванского макака, полученной от Biotox Sciences (San Diego, CA).
[000188] PBMC разводили до плотности 1×106 клеток/мл в среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки и пенициллин/стрептомицин, и 100 мкл клеток сеяли в стандартные плоскодонные 96-луночные планшеты для культивирования тканей в конечной клеточной плотности 100000 на ячейку. Снаружи ячейки заполняли 200 мкл PBS на ячейку во избежание краевых эффектов. Посеянные клетки инкубировали в течение 2-3 часов в 5% CO2 37°C инкубаторе для возможности восстановления.
[000189] После приблизительно 2-3 часов культивирования антитела добавляли в концентрациях от 10 мкг/мл или 1 мкг/мл по 0 полулогарифмическим разведениям в культуральной среде. Через 30 минут рекомбинантные лиганды IL-36 яванского макака добавляли в концентрации приблизительно EC50 (ранее определенной эмпирически для каждого лиганда) в культуральной среде. Концентрации антитела и лиганда получали в 4x желаемой конечной концентрации и 50 мкл на ячейку добавляли до конечного общего объема 200 мкл. Надосадочную жидкость удаляли приблизительно через 48 часов с последующим трехминутным центрифугированием планшетов, переносили в чистые планшеты, и или тестировали немедленно или хранили при -80°C до последующего анализа.
[000190] Уровень IL-8 яванского макака в надосадочной жидкости клеток оценивали посредством ELISA с использованием набора eBioscience monkey IL-8 platinum ELISA (San Diego, CA; кат# BMS640/3), следуя стандартному протоколу, обеспеченному производителем. Данные наносили на график и значения IC50 рассчитывали с использованием программного обеспечения GraphPad PRISM™. Результаты этого анализа представлены в таблице 8.
Таблица 8
SEQ ID NO:
SEQ ID NO:
cyno IL-36α
250 нг/мл cyno IL-36γ
[000191] Результаты этого примера демонстрируют, что антитела, состоящие из комбинаций HC и LC, описанных в настоящем описании, ингибируют высвобождение воспалительных цитокинов (IL-8) из первичных мононуклеарных клеток периферической крови яванского макака, экспрессирующих IL-36R и стимулированных цитокинами IL-36α, IL-36β и IL-36γ дозозависимым образом.
ПРИМЕР 8
[000192] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению, описанные в настоящем описании, могут образовывать антитела, которые конкурируют за связывание с человеческим IL-36R.
[000193] Перекрестное конкурентное связывание целевого IL-36R антителами, включающими различные полипептиды HC и LC, описанные в настоящем описании, определяли с использованием системы BIACORE™ T200 (GE Healthcare, Little Chalfont, Buckinghamshire, UK). В каждом анализе, первичное антитело захватывали на поверхности чипа и неиспользованные места захвата впоследствии блокировали добавлением насыщающих количеств антитела отрицательного контроля, которое не связывается с человеческим IL-36R. За этой стадией следовало связывание IL-36R и последующее добавление вторичного антитела для определения будут ли антитела конкурировать за тот же сайт связывания мономера антигена. Если антитела связываются с одним эпитопом, не наблюдают вторичного связывания; если используются различные сайты связывания на IL-36R, вторичное антитело будет связываться с комплексом первичного антитела/антигена.
[000194] Античеловеческие IgG (Fc-specific; GE Healthcare, Chalfont St. Giles, United Kingdom) иммобилизовали на поверхности чипа BIACORE™ CM5 в ~8000 УЕ с использованием EDC-активированной химии связывания. Анти-IL-36R антитела, включающие различные комбинации полипептидов HC и LC по изобретению, описанных в настоящем описании (10 мкг/мл; 60 с время контакта со скоростью тока 10 мкл/мин) затем захватывали на поверхности чипа при 25°C, получая ~500 УЕ захваченного антитела. Поверхность блокировали с использованием неспецифического, подобранного по изотипу отрицательного контрольного антитела к мишени (APE4909 в 100 мкг/мл; 60 секунд времени контакта при скорости тока 10 мкл/мин). Впоследствии IL-36R (1 мкM), разведенный в подвижном буфере (HBS-EP+, pH 7,6; GE Healthcare, Chalfont St. Giles, United Kingdom) пропускали над поверхностью матрицы (300 секунд со скоростью тока 30 мкл/мин), и немедленно следовали вторичные антитела. Полученные сенсограммы, созданные посредством поверхностного плазмонного резонанса (SPR), опосредованно отслеживали изменения массы чипа, исследовали для определения перекрестной конкуренции между антителами.
[000195] Результаты анализов конкурентного связывания для анти-IL-36R антител по изобретению показаны в таблице 9 и фиг. 8A и 8B.
Таблица 9
SEQ ID NO:
SEQ ID NO:
[000196] Результаты этого примера демонстрируют, что антитела APE6155 (5D3) и APE3847 (18D4) конкурируют за связывание с одним и тем же эпитопом на человеческом IL-36R, но не конкурируют с антителом APE5100 в отношении связывания с IL-36R, предполагая, что ни APE6155 ни APE3847 не делят эпитоп с APE5100. Результаты конкуренции являются согласующимися и независимыми от порядка связывания первичного и вторичного антитела с антигеном.
ПРИМЕР 9
[000197] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению, описанные в настоящем описании, могут связываться с клетками, экспрессирующими IL-36R человека и яванского макака, с IL-1RAcP.
[000198] Исследовали связывание антител с клетками CHO-K, стабильно экспрессирующими человеческий IL-36R и человеческий IL-1RAcP. Аллельный вариант IL-36R яванского макака исследовали посредством секвенирования Сэнгера, и четыре отдельных аллельных варианта идентифицировали в популяции яванских макак. Связывание антител с клетками CHO-K, стабильно экспрессирующими вариант 1 IL-36R яванского макака и IL-1RAcP яванского макака, также исследовали в отношении APE6155 и APE7247. Каждое антитело инкубировали с клетками CHO, собранными с использованием аккутазы, промывали и сеяли по 500000 клеток на ячейку. Клетки инкубировали с антителами в концентрациях, варьирующихся от 33 нM-16 пМ в течение 30 минут при 4°C, и промывали три раза FACS окрашивающим буфером. Клетки центрифугировали и аспирировали и затем инкубировали с 100 мкл параформальдегида в течение 10 минут при комнатной температуре. Клетки снова промывали, аспирировали и окрашивали 100 мкл анти-человеческого IgG Alexa 647 в течение 20 минут при 4°С. Клетки ресуспендировали в 100 мкл аналитического буфера FACS до анализа на матрице FACS (BD Biosciences).
[000199] Результаты анализа конкурентного связывания для анти-IL-36R антител по изобретению показаны на фиг. 9A и 9B. На фиг. 9A показано связывание антител APE06155 и APE07247 с клетками CHO, стабильно экспрессирующими человеческий IL-36R и человеческий IL-36R, и на фиг. 9B показано связывание тех же антител с клетками CHO, стабильно экспрессирующими вариант 1 IL-36R и IL-1RAcP яванского макака. Данные адаптировали с использованием программного обеспечения Graphpad Prism, со значениями EC50 для APE6155 определенных как 1,5 нМ и 2,4 нМ для клеток CHO, экспрессирующих IL-36R человека и яванского макака, соответственно и 2,8 нМ и 3,3 нМ для резервного связывания Ab APE7247 с клетками CHO, экспрессирующими IL-36R человека и яванского макака, соответственно. Отрицательное, подобранное по изотипу контрольное антитело APE00422 не продемонстрировало связывания с любыми клеточными линиями.
ПРИМЕР 10
[000200] Этот пример демонстрирует, что полипептиды тяжелой цепи (HC) и легкой цепи (LC) иммуноглобулина по изобретению, описанные в настоящем описании, могут быть использованы in vivo у яванского макака с хорошими фармакокинетическими характеристиками и подкожной биодоступностью. Яванским макакам вводили ANB019 в виде однократной внутривенной (в/в) или подкожной (п/к) инъекции. Образцы крови получали от обезьян в исследовании разовой дозы от 0,5 до 672 ч (4 нед) после введения. Полученные образцы сыворотки анализировали в AnaptysBio, Inc. (San Diego, CA) с использованием фирменного метода на основе ELISA. Фармакокинетические анализы проводили на концентрации в сыворотке ANA020 относительно времени посредством AnaptysBio, Inc.
[000201] Профили концентрации в сыворотки vs. время ANB019 вели себя нормально для обоих путей введения, в/в и п/к, с уровнями, падающими быстро с Tmax в временную точку 24 ч для в/в введения, с последующим линейным снижением с ожидаемым поведением моноклонального антитела у нечеловекообразного примата. Оценку фармакокинетических параметров из значений концентрации ANB019 в сыворотке получали посредством некомпартментного анализа и они перечислены в таблице 10. Оценки параметров согласовывались с предположительной фармакокинетикой для IgG4 основного моноклонального антитела у обезьян. Период полужизни ANB019 оценивали как ~ 270 ч после в/в инъекции и ~330 ч после п/к инъекции. Биодоступность после п/к инъекции составила 60%.
Таблица 10
[000202] Все ссылки, включая публикации, патентные заявки и патенты, цитированные в настоящем описании, таким образом включены в виде ссылки в той же степени, как если каждая ссылка была бы индивидуально и специфически включена в виде ссылки и представлена полностью в настоящем описании.
[000203] Применение терминов ʺaʺ и ʺanʺ и ʺtheʺ и ʺпо меньшей мере одинʺ и сходные объекты ссылки в контексте описания изобретения (особенно в контексте следующей формулы изобретения) расцениваются как охватывающие и единственное число и множественное, если не указано иначе в настоящем описании или четко не следует из контекста. Применение термина ʺпо меньшей мереʺ с последующим списком одного или более пунктов (например, ʺпо меньшей мере один из A и Bʺ) расценивают как обозначающие один пункт, выбираемый из перечисленных пунктов (A или B) или любую комбинацию двух или более из перечисленных пунктов (A и B), если не указано иначе в настоящем описании или четко не следует из контекста. Термины ʺвключающий,ʺ ʺимеющий,ʺ ʺвключающийʺ, и ʺсодержащийʺ необходимо рассматривать как открытые термины (т.е. значение ʺвключающий, без ограничения,ʺ) если не отмечено иначе. Перечисление диапазонов значений в настоящем описании служит только как метод сокращения обозначения отдельно каждого отельного значения, попадающего в диапазон, если не указано иначе, и каждое отдельное значение включено в спецификацию, как будто оно указано отдельно. Все методы, описанные в настоящем описании, могут быть проведены в любом подходящем порядке, если не указано иначе или четко не следует из контекста. Применение любого и всех примеров, или примерного языка (например, ʺтакой какʺ) в настоящем описании предназначено только для лучшего освещения изобретения и не предполагает ограничения рамок изобретения, если не заявлено иначе. Ни одно выражение в спецификации не должно рассматриваться как указывающее какой-либо незаявленный элемент, как необходимый в осуществлении изобретения.
[000204] Предпочтительные варианты осуществления настоящего изобретения описаны в настоящем описании, включая наилучший способ, известный авторам изобретения для осуществления изобретения. Вариации таких предпочтительных вариантов осуществления изобретения могут стать очевидными обычному специалисту в области техники при чтении вышеуказанного описания. Авторы изобретения ожидают, что опытные специалисты будут применять такие вариации как необходимо, и авторы изобретения предлагают осуществлять изобретение иначе, чем специфически описано в настоящем описании. Соответственно настоящее изобретение включает все модификации и эквиваленты объекта изобретения, цитированные в приложенной формуле изобретения, как допускается применимым правом. Более того, любая комбинация вышеописанных элементов во всех их возможных вариациях охватывается изобретением, если не указано иначе или четко не противоречит контексту.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> AnaptysBio, Inc.
<120> АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА 36 (IL-36R)
<130> 723558
<150> US 62/147,824
<151> 2015-04-15
<160> 58
<170> PatentIn version 3.5
<210> 1
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa1 представляет собой лейцин (Leu) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa2 представляет собой валин (Val), метионин (Met), или лейцин (Leu)
<220>
<221> MISC_FEATURE
<222> (44)..(44)
<223> Xaa3 представляет собой аргинин (Arg) или глицин (Gly)
<220>
<221> MISC_FEATURE
<222> (56)..(56)
<223> Xaa4 представляет собой глицин (Gly), серин (Ser), или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (72)..(72)
<223> Xaa5 представляет собой аргинин (Arg) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (74)..(74)
<223> Xaa6 представляет собой треонин (Thr) или лизин (Lys)
<220>
<221> MISC_FEATURE
<222> (84)..(84)
<223> Xaa7 представляет собой серин (Ser) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (95)..(95)
<223> Xaa8 представляет собой тирозин (Tyr) или фениаланин (Phe)
<400> 1
Gln Val Gln Xaa Xaa Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Xaa Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Xaa Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Xaa Asp Xaa Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Xaa Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Xaa Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 2
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 3
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 3
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 4
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 4
Gln Val Gln Leu Met Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 5
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 5
Gln Val Gln Leu Met Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ala Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 6
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 6
Gln Val Gln Leu Met Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 7
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 7
Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 8
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 8
Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 9
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 9
Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ala Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 10
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 10
Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 11
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 11
Gln Val Gln Phe Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 12
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 12
Gln Val Gln Phe Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 13
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 13
Gln Val Gln Phe Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 14
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 14
Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Ser Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 15
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (33)..(33)
<223> Xaa1 представляет собой триптофан (Trp) или тирозин (Tyr)
<220>
<221> MISC_FEATURE
<222> (35)..(35)
<223> Xaa2 представляет собой гистидин (His), аспарагин (Asn), или тирозин (Tyr)
<220>
<221> MISC_FEATURE
<222> (42)..(42)
<223> Xaa3 представляет собой глицин (Gly) или аргинин (Arg)
<220>
<221> MISC_FEATURE
<222> (52)..(52)
<223> Xaa4 представляет собой аспарагиновую кислоту (Asp), глютаминовую кислоту (Glu), или гистидин
(His)
<220>
<221> MISC_FEATURE
<222> (54)..(54)
<223> Xaa5 представляет собой серин (Ser), треонин (Thr), или тирозин (Tyr)
<220>
<221> MISC_FEATURE
<222> (55)..(55)
<223> Xaa6 представляет собой аспарагин (Asn) или глицин (Gly)
<220>
<221> MISC_FEATURE
<222> (56)..(56)
<223> Xaa7 представляет собой серин (Ser), аланин (Ala), или аспаргиновую кислоту (Asp)
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Xaa Met Xaa Trp Val Arg Gln Ala Pro Xaa Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe Xaa Pro Xaa Xaa Xaa Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 16
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe Asp Pro Ser Asn Ser Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 17
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 17
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe Glu Pro Ser Asn Ala Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 18
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 18
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe Glu Pro Ser Asn Ala Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 19
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Ser Asn Ala Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Ser Asn Ala Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Thr Gly Asp Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 22
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Thr Gly Asp Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Tyr Gly Asp Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Arg Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Phe His Pro Tyr Gly Asp Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa1 представляет собой глютамин (Gln) или аспарагиновую кислоту (Asp)
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa2 представляет собой лейцин (Leu) или фениаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (25)..(25)
<223> Xaa3 представляет собой треонин (Thr) или серин (Ser)
<220>
<221> MISC_FEATURE
<222> (41)..(41)
<223> Xaa4 представляет собой пролин (Pro) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (44)..(44)
<223> Xaa5 представляет собой лизин (Lys) или аспарагин (Asn)
<220>
<221> MISC_FEATURE
<222> (45)..(45)
<223> Xaa6 представляет собой глицин (Gly) или лизин (Lys)
<220>
<221> MISC_FEATURE
<222> (71)..(71)
<223> Xaa7 представляет собой серин (Ser) или треонин (Thr)
<220>
<221> MISC_FEATURE
<222> (72)..(72)
<223> Xaa8 представляет собой валин (Val) или аргинин (Arg)
<220>
<221> MISC_FEATURE
<222> (95)..(95)
<223> Xaa9 представляет собой тирозин (Tyr) или фенилаланин (Phe)
<400> 25
Xaa Val Gln Xaa Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Xaa Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Xaa Pro Gly Xaa Xaa Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Xaa Xaa Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Xaa Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 26
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 27
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 27
Gln Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 28
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 29
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 29
Gln Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Asn Lys Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 30
Gln Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 31
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 31
Gln Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 32
Asp Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 33
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 33
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asn Ser Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 34
<211> 120
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 34
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Arg Met Ser Cys Lys Ala Ser Asp Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Phe Asp Pro Ser Asn Ser Val Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Asn Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Ile Gln Phe Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 35
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 35
Asp Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (34)..(34)
<223> Xaa1 представляет собой глицин (Gly) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (41)..(41)
<223> Xaa2 представляет собой фенилаланин (Phe) или тирозин (Tyr)
<220>
<221> MISC_FEATURE
<222> (54)..(54)
<223> Xaa3 представляет собой тирозин (Tyr) или серин (Ser)
<400> 36
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Xaa Asn Thr Tyr Leu Tyr Trp Xaa Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Xaa Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 37
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 37
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 38
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 38
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 39
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 39
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Ala Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 40
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (32)..(32)
<223> Xaa1 представляет собой серин (Ser) или аргинин (Arg)
<220>
<221> MISC_FEATURE
<222> (34)..(34)
<223> Xaa2 представляет собой глицин (Gly) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (43)..(43)
<223> Xaa3 представляет собой глютамин (Gln) или гистидин (His)
<400> 40
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Xaa
20 25 30
Asn Xaa Ile Thr Tyr Phe Tyr Trp Tyr Leu Xaa Lys Pro Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 41
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 41
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Phe Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 42
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 42
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Ala Ile Thr Tyr Phe Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 43
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 43
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Arg
20 25 30
Asn Ala Ile Thr Tyr Phe Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 44
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 44
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Arg
20 25 30
Asn Ala Ile Thr Tyr Phe Tyr Trp Tyr Leu His Lys Pro Gly Gln Pro
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 45
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (64)..(64)
<223> Xaa1 представляет собой серин (Ser) или пролин (Pro)
<220>
<221> MISC_FEATURE
<222> (71)..(71)
<223> Xaa2 представляет собой фенилаланин (Phe) или тирозин (Tyr)
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Xaa
50 55 60
Ser Gly Ser Gly Thr Asp Xaa Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 47
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Pro
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 48
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Val Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Ser Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 49
<211> 112
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 49
Asp Ile Val Met Thr Gln Ala Ala Phe Ser Asn Pro Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Phe Tyr Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 50
<211> 107
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 50
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Ile Arg Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Pro
50 55 60
Asn Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Asn Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 51
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 51
Asp Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 52
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 52
Asp Val Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ala Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala
115
<210> 53
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 53
Asp Leu Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ala Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala
115
<210> 54
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 54
Asp Leu Gln Phe Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Arg Tyr Ser Ile Thr Ala Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala
115
<210> 55
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 55
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Trp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Met Leu His Ser Gly Val Pro Ser Arg Phe Ser Pro
50 55 60
Ser Gly Ser Gly Asn Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105
<210> 56
<211> 116
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa1 представляет собой лейцин (Leu) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa2 представляет собой валин (Val), метионин (Met), или лейцин (Leu)
<220>
<221> MISC_FEATURE
<222> (44)..(44)
<223> Xaa3 представляет собой аргинин (Arg) или глицин (Gly)
<220>
<221> MISC_FEATURE
<222> (56)..(56)
<223> Xaa4 представляет собой глицин (Gly), серин (Ser), или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (72)..(72)
<223> Xaa5 представляет собой аргинин (Arg) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (74)..(74)
<223> Xaa6 представляет собой треонин (Thr) или лизин (Lys)
<220>
<221> MISC_FEATURE
<222> (77)..(77)
<223> Xaa7 представляет собой серин (Ser)или аспарагин (Asn)
<220>
<221> MISC_FEATURE
<222> (84)..(84)
<223> Xaa8 представляет собой серин (Ser) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (95)..(95)
<223> Xaa9 представляет собой тирозин (Tyr) или фенилаланин (Phe)
<400> 56
Gln Val Gln Xaa Xaa Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Xaa Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Xaa Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Xaa Asp Xaa Ser Ala Xaa Thr Ala Tyr
65 70 75 80
Met Glu Leu Xaa Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Xaa Cys
85 90 95
Thr Arg Ser Phe Tyr Thr Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 57
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa1 представляет собой глютамин (Gln) или аспарагиновую кислоту (Asp)
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa2 представляет собой валин (Val) или лейцин (Leu)
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa3 представляет собой лейцин (Leu) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (25)..(25)
<223> Xaa4 представляет собой треонин (Thr) или серин (Ser)
<220>
<221> MISC_FEATURE
<222> (26)..(26)
<223> Xaa5 представляет собой глицин (Gly) или аргинин (Arg)
<220>
<221> MISC_FEATURE
<222> (31)..(31)
<223> Xaa6 представляет собой серин (Ser) или аланин (Ala)
<220>
<221> MISC_FEATURE
<222> (41)..(41)
<223> Xaa7 представляет собой пролин (Pro) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (44)..(44)
<223> Xaa8 представляет собой лизин (Lys) или аспарагин (Asn)
<220>
<221> MISC_FEATURE
<222> (45)..(45)
<223> Xaa9 представляет собой глицин (Gly) или лизин (Lys)
<220>
<221> MISC_FEATURE
<222> (71)..(71)
<223> Xaa10 представляет собой серин (Ser) или треонин (Thr)
<220>
<221> MISC_FEATURE
<222> (72)..(72)
<223> Xaa11 представляет собой валин (Val) или аргинин (Arg)
<220>
<221> MISC_FEATURE
<222> (93)..(93)
<223> Xaa12 представляет собой треонин (Thr) или валин (Val)
<220>
<221> MISC_FEATURE
<222> (95)..(95)
<223> Xaa13 представляет собой тирозин (Tyr) или фенилаланин (Phe)
<220>
<221> MISC_FEATURE
<222> (118)..(118)
<223> Xaa14 представляет собой аланин (Ala) или отсутствует
<400> 57
Xaa Xaa Gln Xaa Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Xaa Xaa Tyr Ser Ile Thr Xaa Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Xaa Pro Gly Xaa Xaa Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Asp Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Xaa Xaa Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Xaa Tyr Xaa Cys
85 90 95
Ala Ile Arg Gly Pro Tyr Ser Phe Thr Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Xaa
115
<210> 58
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> MISC_FEATURE
<222> (28)..(28)
<223> Xaa1 представляет собой аспарагиновую кислоту (Asp) или триптофан (Trp)
<220>
<221> MISC_FEATURE
<222> (53)..(53)
<223> Xaa2 представляет собой аргинин (Arg) или метионин (Met)
<220>
<221> MISC_FEATURE
<222> (64)..(64)
<223> Xaa3 представляет собой глицин (Gly), серин (Ser) или пролин (Pro)
<220>
<221> MISC_FEATURE
<222> (69)..(69)
<223> Xaa4 представляет собой треонин (Thr) или аспарагин (Asn)
<220>
<221> MISC_FEATURE
<222> (71)..(71)
<223> Xaa5 представляет собой фенилаланин (Phe) или тирозин (Tyr)
<220>
<221> MISC_FEATURE
<222> (108)..(108)
<223> Xaa6 представляет собой аргинин (Arg) или отсутствует
<220>
<221> MISC_FEATURE
<222> (109)..(109)
<223> Xaa7 представляет собой треонин (Thr) или отсутствует
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Xaa Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Xaa Leu His Ser Gly Val Pro Ser Arg Phe Ser Xaa
50 55 60
Ser Gly Ser Gly Xaa Asp Xaa Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Xaa Xaa
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ИНТЕРЛЕЙКИНА-33 (IL-33) | 2015 |
|
RU2829846C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| МОДЕЛИ ЗАБОЛЕВАНИЯ DITRA НА ЖИВОТНЫХ, ОТЛИЧНЫХ ОТ ЧЕЛОВЕКА, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2804448C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| АНТИТЕЛО-ПОДОБНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ОБЛАСТЯМИ, ИМЕЮЩИЕ ОРИЕНТАЦИЮ СВЯЗЫВАЮЩИХ ОБЛАСТЕЙ КРЕСТ-НАКРЕСТ | 2012 |
|
RU2823693C2 |
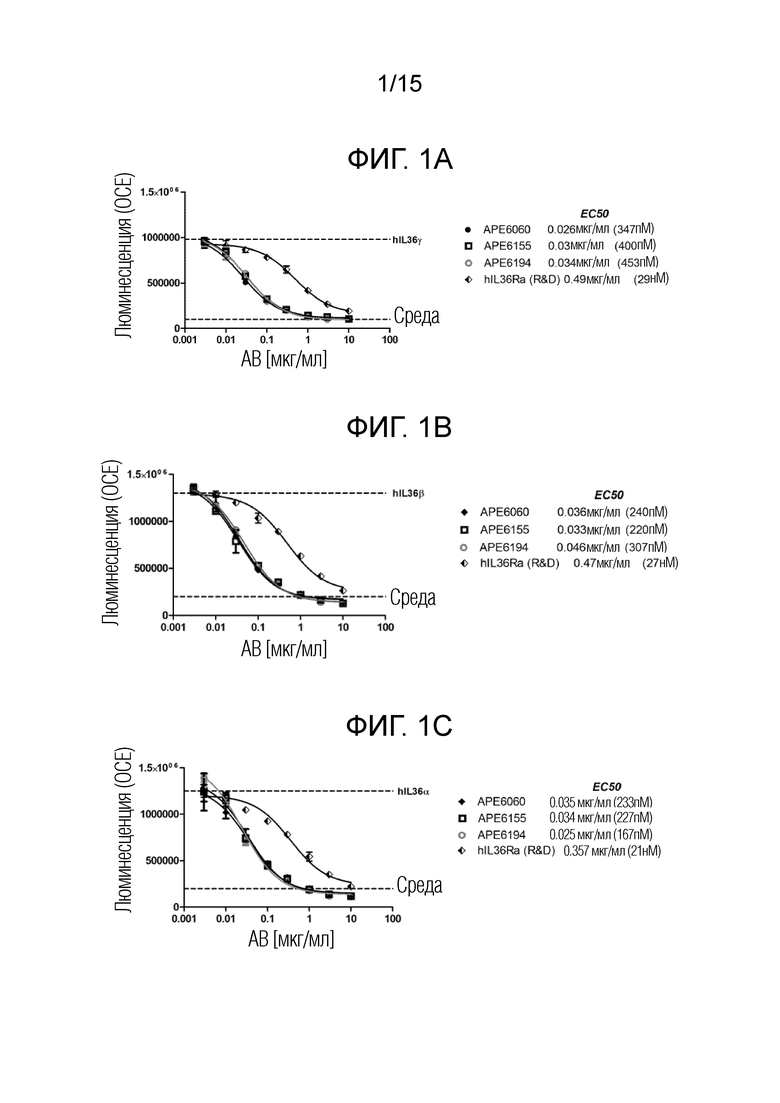

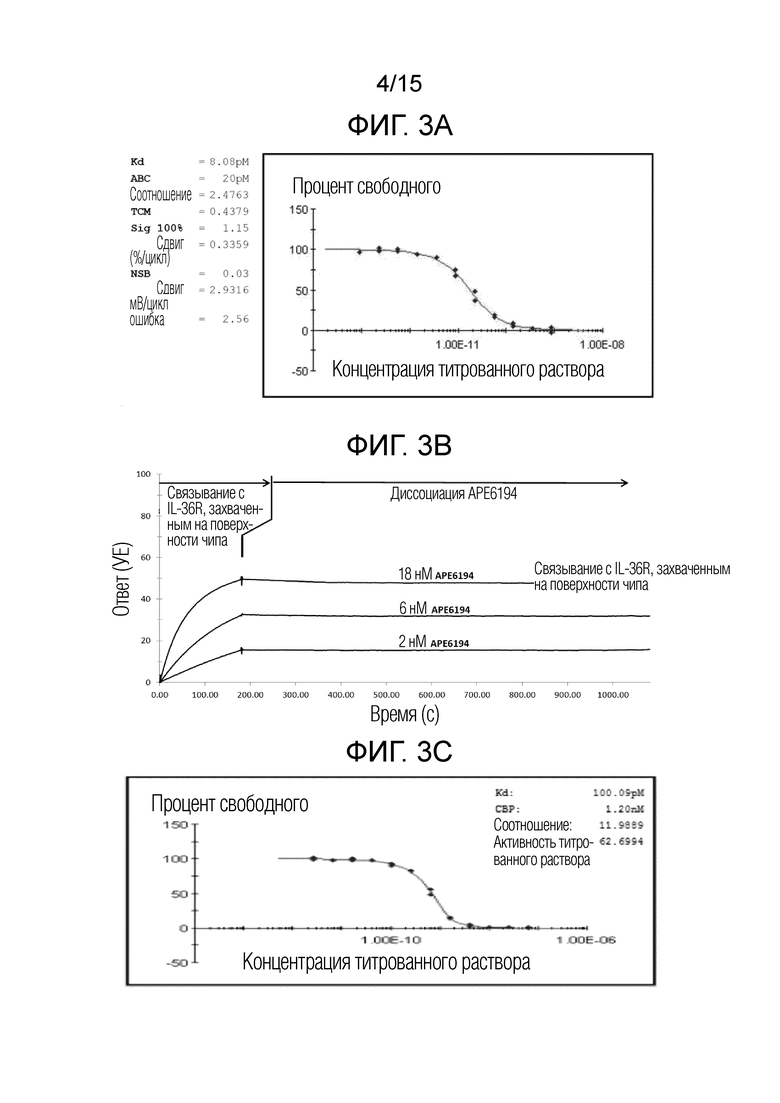

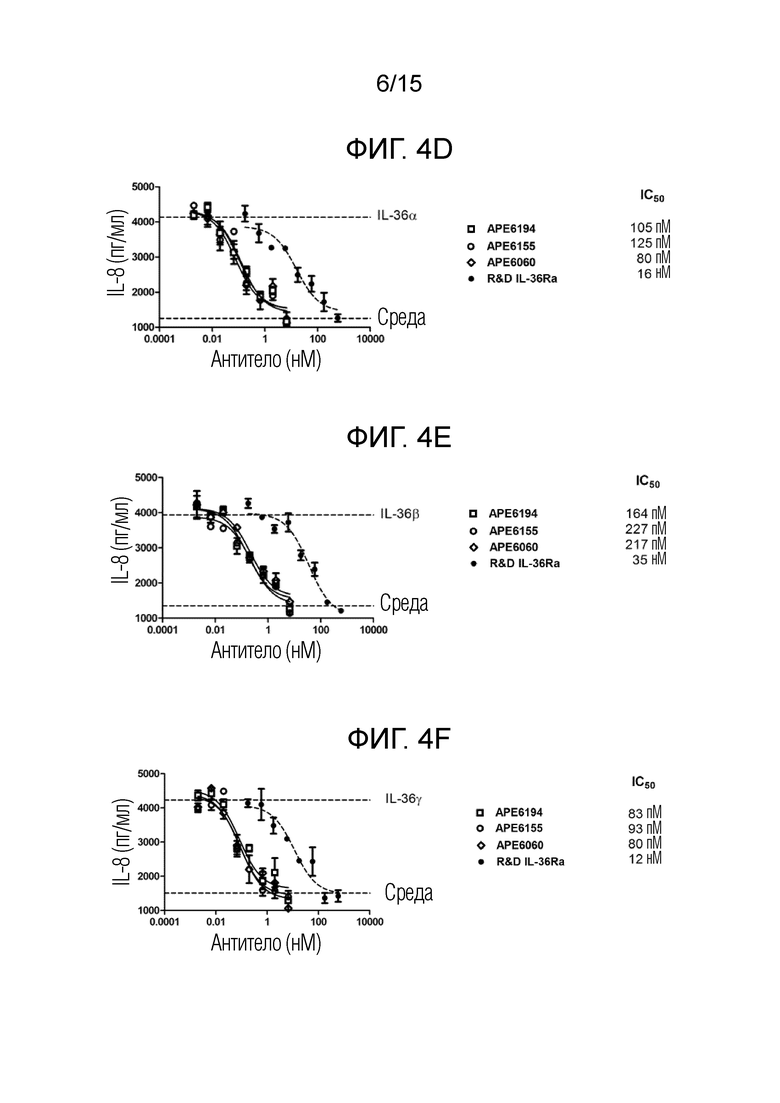



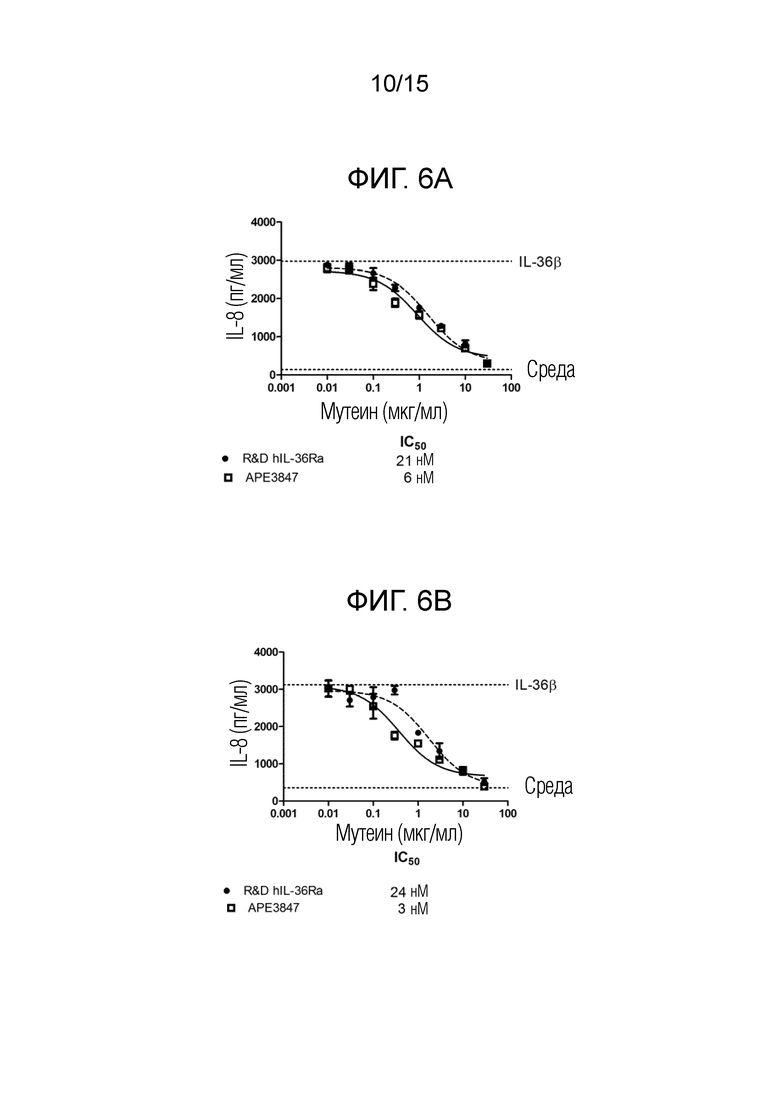

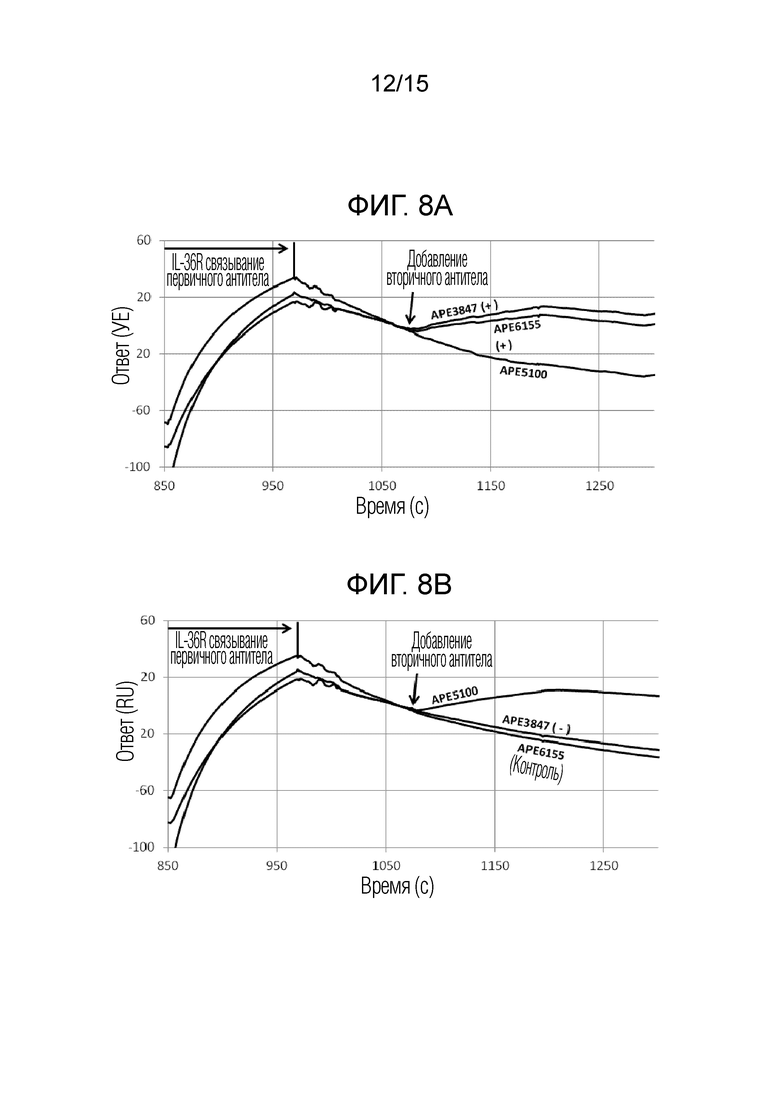
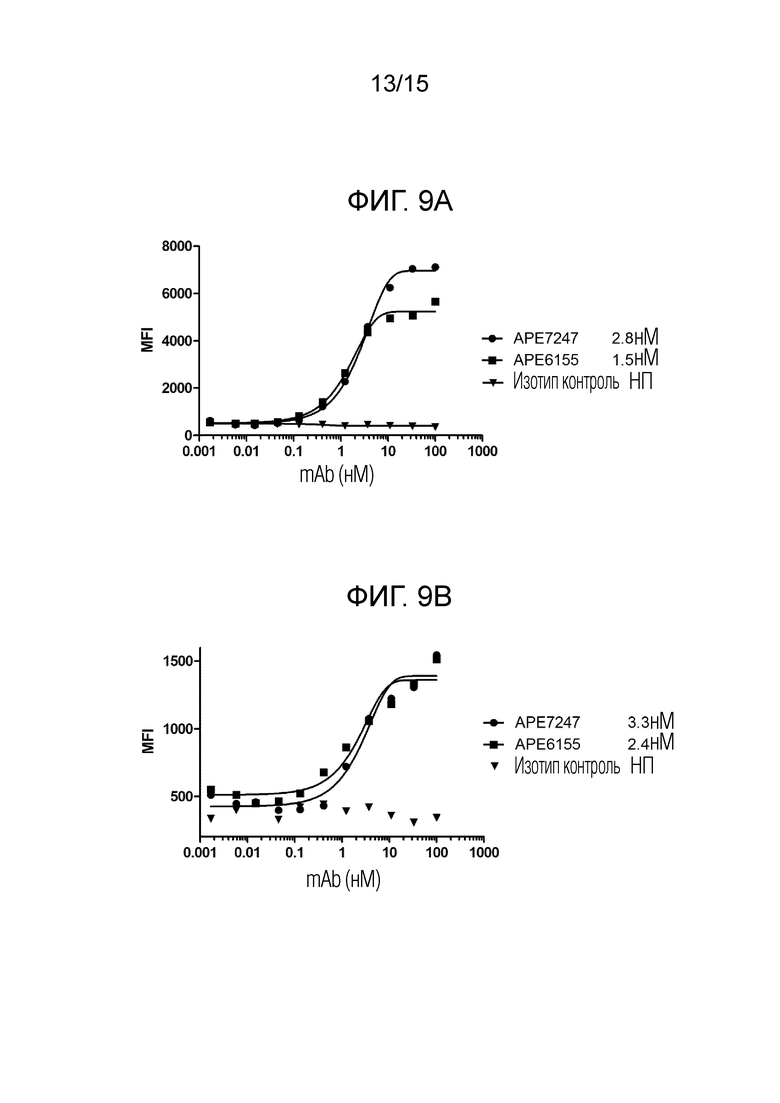
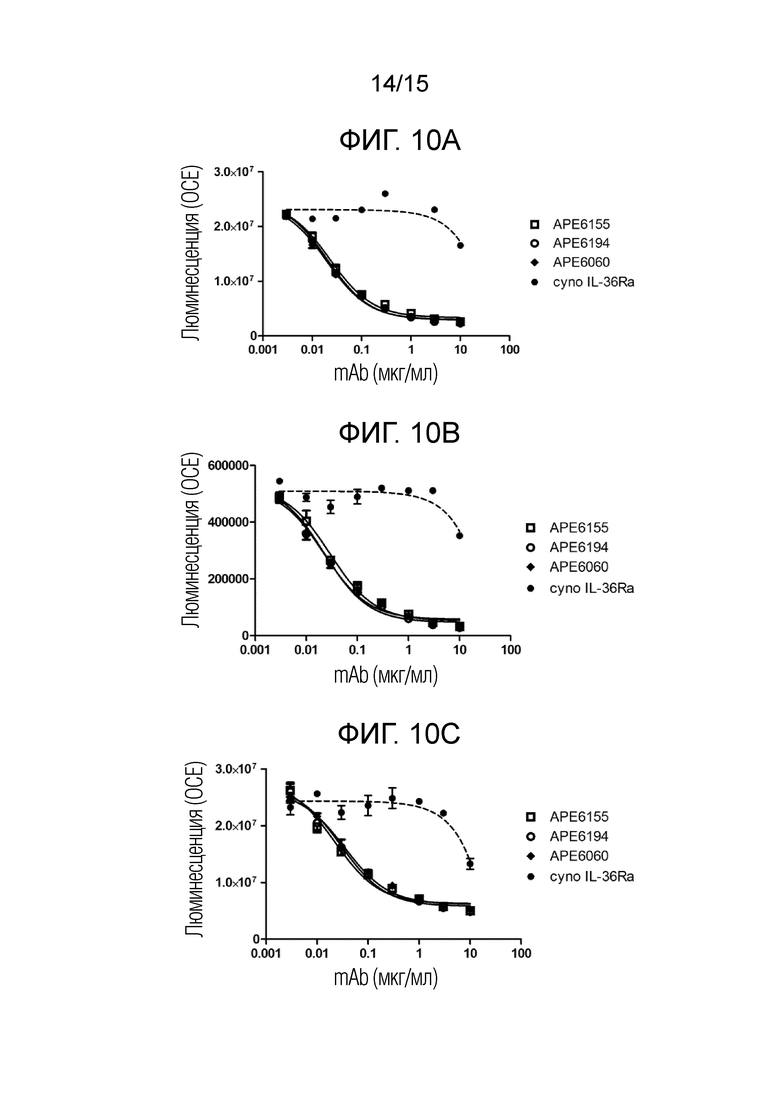

Группа изобретений относится к медицине и касается выделенного связывающего IL-36R агента, содержащего вариабельную область тяжелой цепи иммуноглобулина и вариабельную область легкой цепи иммуноглобулина. Группа изобретений также касается выделенной или очищенной нуклеиновой кислоты, кодирующей связывающий IL-36R агент; композиции, содержащей связывающий IL-36R агент и фармацевтически приемлемый носитель для применения в качестве лекарственного средства для лечения заболевания, расстройства или состояния, связанного с IL-36R; способа лечения заболевания, расстройства или состояния, связанного с IL-36R, у млекопитающего, включающего введение эффективного количества связывающего IL-36R агента или указанной композиции млекопитающему. Группа изобретений обеспечивает лечение заболевания, расстройства или состояния, связанного с IL-36R, у млекопитающего. 8 н. и 21 з.п. ф-лы, 10 пр., 10 табл., 10 ил.
1. Выделенный связывающий IL-36R агент, содержащий вариабельную область тяжелой цепи иммуноглобулина и вариабельную область легкой цепи иммуноглобулина, где:
вариабельная область тяжелой цепи иммуноглобулина содержит аминокислотную последовательность Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Xaal Met Xaa2 Trp Val Arg Gln Ala Pro Xaa3 Gln Gly Leu Glu Trp Met Gly Met Phe Xaa4 Pro Xaa5 Xaa6 Xaa7 Val Thr Arg Leu Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Thr Thr Ser Met Ile Ile Gly Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser (SEQ ID NO: 15) или по меньшей мере ее определяющие комплементарность области (CDR), где
(a) Xaa1 представляет собой триптофан (Trp) или тирозин (Tyr),
(b) Xaa2 представляет собой гистидин (His), аспарагин (Asn) или тирозин (Tyr),
(c) Xaa3 представляет собой глицин (Gly) или аргинин (Arg),
(d) Xaa4 представляет собой аспарагиновую кислоту (Asp), глутаминовую кислоту (Glu) или гистидин (His),
(e) Xaa5 представляет собой серин (Ser), треонин (Thr) или тирозин (Tyr),
(f) Xaa6 представляет собой аспарагин (Asn) или глицин (Gly), и
(g) Xaa7 представляет собой серин (Ser), аланин (Ala) или аспарагиновую кислоту (Asp);
и вариабельная область легкой цепи иммуноглобулина содержит аминокислотную последовательность Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Xaal Asn Xaa2 Ile Thr Tyr Phe Tyr Trp Tyr Leu Xaa3 Lys Pro Gly Gln Pro Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala Gln Asn Leu Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys (SEQ ID NO: 40) или по меньшей мере ее определяющие комплементарность области (CDR), где
(a) Xaa1 представляет собой cерин (Ser) или аргинин (Arg),
(b) Xaa2 представляет собой глицин (Gly) или аланин (Ala), и
(c) Xaa3 представляет собой глютамин (Gln) или гистидин (His).
2. Связывающий IL-36R агент по п.1, где полипептид тяжелой цепи иммуноглобулина содержит аминокислотную последовательность SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23 или SEQ ID NO: 24, или по меньшей мере определяющие комплементарность области (CDR).
3. Связывающий IL-36R агент по п.1, где полипептид легкой цепи иммуноглобулина содержит аминокислотную последовательность SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 44, или по меньшей мере определяющие комплементарность области (CDR).
4. Связывающий IL-36R агент по п.2, где полипептид легкой цепи иммуноглобулина содержит аминокислотную последовательность SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 или SEQ ID NO: 44, или по меньшей мере определяющие комплементарность области (CDR).
5. Связывающий IL-36R агент по п.1, содержащий полипептид тяжелой цепи иммуноглобулина с последовательностью SEQ ID NO: 22, или по крайней мере ее определяющие комплементарность области (CDR); и полипептид легкой цепи иммуноглобулина с последовательностью SEQ ID NO: 44, или по меньшей мере определяющие комплементарность области (CDR).
6. Связывающий IL-36R агент по п.1, содержащий полипептид тяжелой цепи иммуноглобулина с последовательностью SEQ ID NO: 22; и полипептид легкой цепи иммуноглобулина с последовательностью SEQ ID NO: 44.
7. Связывающий IL-36R агент по п.1, который представляет собой антитело.
8. Связывающий IL-36R агент по п.1, который представляет собой фрагмент антитела, выбранный из F(ab')2, Fab', Fab, Fv, scFv, dsFv, dAb и одноцепочечного связывающего полипептида.
9. Связывающий IL-36R агент по п.1, который представляет собой антитело IgG1.
10. Связывающий IL-36R агент по п.5, который представляет собой антитело IgG1.
11. Связывающий IL-36R агент по п.6, который представляет собой антитело IgG1.
12. Связывающий IL-36R агент по любому из пп.1-11, который связывается с IL-36R со значением KD, равным от 1 пикомоля (пM) до 1 наномоля (нM).
13. Выделенная или очищенная нуклеиновая кислота, кодирующая связывающий IL-36R агент по любому из пп.1-12.
14. Вектор экспрессии, содержащий нуклеиновую кислоту по п.13.
15. Композиция, содержащая (а) связывающий IL-36R агент по любому из пп.1-12 и (b) фармацевтически приемлемый носитель для применения в качестве лекарственного средства для лечения заболевания, расстройства или состояния, связанного с IL-36R.
16. Композиция по п.15, где расстройство представляет собой воспалительное заболевание или аутоиммунное заболевание.
17. Композиция по п.15, где расстройство представляет собой вульгарный псориаз, пустулезный псориаз, генерализованный пустулезный псориаз (GPP), ладонно-подошвенный пустулез (PPP), атипический дерматит, воспалительное заболевание кишечника, болезнь Крона или язвенный колит.
18. Композиция по любому из пп.15-17, где период полураспада связывающего IL-36R агента у млекопитающего составляет от 30 минут до 45 дней.
19. Композиция по любому из пп.15-18, где IL-36R связывающий агент связывается с IL-36R со значением KD, равным от 1 пикомоля (пM) до 1 наномоля (нM).
20. Выделенная клетка, содержащая нуклеотидные последовательности, кодирующие вариабельную область тяжелой цепи иммуноглобулина и вариабельную область легкой цепи иммуноглобулина связывающего IL-36R агента по любому из пп.1-12.
21. Способ лечения заболевания, расстройства или состояния, связанного с IL-36R, у млекопитающего, включающий введение эффективного количества связывающего IL-36R агента по любому из пп.1-12 или композиции по п.15 млекопитающему.
22. Способ по п.21, где расстройство представляет собой воспалительное заболевание или аутоиммунное заболевание.
23. Способ по п.21, где расстройство представляет собой вульгарный псориаз, пустулезный псориаз, генерализованный пустулезный псориаз (GPP), ладонно-подошвенный пустулез (PPP), атопический дерматит, воспалительное заболевание кишечника, болезнь Крона или язвенный колит.
24. Способ по п.21, где период полураспада связывающего IL-36R агента у млекопитающего составляет от 30 минут до 45 дней.
25. Способ по п.21, который связывается с IL-36R со значением KD, равным от примерно 1 пикомоля (пM) до примерно 1 наномоля (нM).
26. Гибридома или клеточная линия, которая экспрессирует связывающий IL-36R агент по любому из пп.1-12.
27. Применение связывающего агента по любому из пп.1-12 для получения лекарственного средства для лечения заболевания, расстройства или состояния, связанного с IL-36R, у млекопитающего.
28. Применение по п.27, где расстройство представляет собой воспалительное заболевание или аутоиммунное заболевание.
29. Применение по п.27, где расстройство представляет собой вульгарный псориаз, пустулезный псориаз, генерализованный пустулезный псориаз (GPP), ладонно-подошвенный пустулез (PPP), атопический дерматит, воспалительное заболевание кишечника, болезнь Крона или язвенный колит.
| WO2013074569 A1, 23.05.2013 | |||
| WOLF J., et al., Anti-IL-36R antibodies, potentially useful for the treatment of psoriasis: a patent evaluation of WO2013074569.Expert Opin Ther Pat | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| LAMACCHIA C., The severity of experimental arthritis is independent of IL-36 receptor | |||
Авторы
Даты
2021-04-02—Публикация
2016-04-15—Подача