ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[1] Для настоящей заявки испрашивается притязание на преимущества приоритета предварительной заявки на патент США № 63/130339, поданной 23 декабря 2020 г., содержание которой полностью включено в настоящее описание ссылкой.
ПРЕДСТАВЛЕНИЕ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В ФОРМАТЕ ТЕКСТОВОГО ФАЙЛА ASCII
[2] Содержание следующего представления в формате текстового файла ASCII полностью включено в настоящий документ ссылкой: машиночитаемая форма (CRF) Перечня последовательностей (название файла: 754392000640SEQLIST.TXT, дата записи: 23 декабря 2021 г., размер: 1037246 байт).
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[3] Настоящее изобретение относится к иммуноцитокинам, содержащим цитокин или его вариант, расположенный в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенный в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором или фрагментом антитела) и субъединицей Fc-домена или ее частью, способам их получения и применения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[4] Цитокины являются ключевыми регуляторами врожденной и адаптивной иммунной системы, которые позволяют иммунным клеткам взаимодействовать друг с другом. Цитокиновая терапия для активации иммунной системы больных раком остается ключевой областью клинических исследований рака. Достижение эффективного противоопухолевого ответа без развития токсичности, ограничивающей лечение, при монотерапии цитокинами представляет собой трудную задачу. Типичным примером этой проблемы является низкий показатель эффективности при печально известной токсичности терапии с использованием IL-2 и IL-12. Обнаружено, что высокие дозы IL-2 вызывают синдром сосудистого пропотевания (VLS), толерантность по отношению к опухоли, вызванную индуцированной активацией гибелью клеток (AICD), и иммуносупрессию, вызванную активацией регуляторных Т-клеток (Treg). Это тяжелое побочное действие часто ограничивает оптимальную дозировку IL-2, что ограничивает число пациентов с позитивным ответом на лечение. IL-12 продемонстрировал умеренный противоопухолевый ответ в клинических испытаниях, но часто сопровождался значительной токсичностью. (Lasek и др., Cancer Immunol Immunother., 2014). Было обнаружено, что лечение IL-12 сопровождалось системными гриппоподобными симптомами (например, лихорадкой, ознобом, утомляемостью, эритромелалгией и головной болью) и токсическим воздействием на костный мозг и печень. Исследования дозирования показали, что пациенты могли переносить IL-12 только в дозе менее 1 мкг/кг, что намного ниже терапевтически эффективной дозы. При использовании IL-12 в качестве монотерапии или в сочетании с другими агентами продемонстрировать сильное устойчивое терапевтическое действие в клинических испытаниях не удалось (Lasek и др., 2014).
[5] Было предпринято несколько попыток преодолеть проблемы, связанные с монотерапией цитокинами. Недавние исследования NKTR-214 - рекомбинантного человеческого IL-2, конъюгированного с полиэтиленгликолем (ПЭГ; «IL-2-ПЭГ») - показал многообещающие результаты на животных моделях. IL-2-ПЭГ обладает двумя преимуществами. Во-первых, стерические затруднения ПЭГ маскируют область на IL-2, которая взаимодействует с субъединицей α-рецептора IL-2 (IL-2Rα), ответственной за активацию иммуносупрессивных Treg, смещая активность в сторону уничтожения опухоли CD8+ T-клетками (Charych и др., Clin Cancer Res., 2016). Во-вторых, конъюгирование с ПЭГ значительно улучшает период полувыведения из плазмы и протеолитическую стабильность, а также снижает иммуногенность и всасывание в печени (Chaffee и др., J Clin Invest., 1992; Pyatak и др., Res Commun Chem Pathol Pharmacol., 1980). С целью преодоления побочных эффектов цитокиновой терапии нацеленная доставка цитокинов (например, IL-12) в области нахождения опухоли путем местной инъекции или с использованием иммуноцитокинов (цитокинов, слитых с антителами, фрагментами антител или составным белком лиганд/рецептор-Fc). Иммуноцитокины могут нацеливать цитокины на представляющие интерес клетки или ткани, такие как опухолевые клетки или иммунные эффекторные клетки (Klein и др., Oncoimmunology, 2017; King и др., J Clin Oncol., 2004).
[6] Раскрытия всех публикаций, патентов, патентных заявок и опубликованных патентных заявок, упомянутых в настоящем документе, настоящим полностью включены в данный документ ссылкой.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[7] В одном аспекте настоящей заявки предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело или составной белок лиганд/рецептор-Fc), специфично распознающий антиген-мишень; и b) цитокин или его вариант, причем антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь или составной полипептид лиганд/рецептор-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, фрагмент антитела, лиганд или рецептор), шарнирный участок и субъединицу Fc-домена или ее часть, а цитокин или его вариант расположен в шарнирном участке (например, на его N-конце, С-конце или внутри).
[8] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, при наличии связывания антигенсвязывающего белка (например, антитела или составного белка лиганд/рецептор-Fc) с антигеном-мишенью активность цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем на примерно 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка с антигеном-мишенью.
[9] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, в отсутствие связывания антигенсвязывающего белка (например, антитела или составного белка лиганд/рецептор-Fc) с антигеном-мишенью активность цитокина или его варианта, расположенных в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6 %, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии.
[10] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, цитокин или его вариант представляет собой вариант цитокина, и активность варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии.
[11] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, антигенсвязывающий белок (например, антитело или составной белок лиганд/рецептор-Fc) содержит два антигенсвязывающих полипептида (например, тяжелую цепь или составной полипептид лиганд/рецептор-Fc), каждый из которых содержит шарнирный участок, и только один антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке. В некоторых вариантах осуществления антигенсвязывающий белок содержит два антигенсвязывающих полипептида, каждый из которых содержит шарнирный участок, и каждый антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке.
[12] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, иммуноцитокин содержит два или более (например, 2, 3, 4 или более) цитокинов или их вариантов, и два или более цитокинов или их вариантов расположены последовательно в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи или составного полипептида лиганд/рецептор-Fc).
[13] В некоторых вариантах осуществления любого из иммуноцитокинов, описанных выше, цитокин или его вариант представляет собой мономерный цитокин или его вариант (например, IL-2, IFN-α, такой как IFN-α2b). В некоторых вариантах осуществления цитокин или его вариант представляет собой димерный цитокин или его вариант (например, IFN-γ, IL-10, IL-12 или IL-23). В некоторых вариантах осуществления обе субъединицы димерного цитокина или его варианта расположены последовательно в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи или составного полипептида лиганд/рецептор-Fc). В некоторых вариантах осуществления антигенсвязывающий белок содержит два антигенсвязывающих полипептида, каждый из которых содержит шарнирный участок, и одна субъединица димерного цитокина или его варианта расположена в шарнирном участке одного антигенсвязывающего полипептида, а другая субъединица димерного цитокина или его варианта расположена в шарнирном участке другого антигенсвязывающего полипептида.
[14] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, два или более (например, 2, 3, 4 или более) цитокина или их варианты являются одинаковыми. В некоторых вариантах осуществления два или более (например, 2, 3, 4 или более) цитокина или их варианты отличаются.
[15] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, антигенсвязывающий белок представляет собой моноспецифичный антигенсвязывающий белок (например, моноспецифичное антитело или составной белок лиганд/рецептор-Fc). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой мультиспецифичный антигенсвязывающий белок (например, мультиспецифичное антитело или составной белок лиганд/рецептор-Fc).
[16] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, антиген-мишень выбран из группы, состоящей из TIGIT, PD-1, PD-L1, PD-L2, CTLA-4, CD3, CD4, CD8, CD123, CD25 и HER2.
[17] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, цитокин или его вариант выбирают из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL -7, IL-8, IL-9, IL-10, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IL-35 , IFN-α, IFN-β, IFN-γ, TNF-α, TGF-β, VEGF, эритропоэтина, тромбопоэтина, G-CSF, M-CSF, SCF и GM-CSF. В некоторых вариантах осуществления цитокин или его вариант выбирают из группы, состоящей из IL-2, IL-10, IL-12, IL-23, IFN-α и IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-2 или его вариант. В некоторых вариантах осуществления вариант IL-2 содержит одну или несколько мутаций в положении, выбранном из группы, состоящей из L18, Q22, F24, K35, R38, F42, K43, E61, P65, Q126 и S130, и соответствующем положению в IL-2 дикого типа, содержащем последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит одну или несколько мутаций, выбранных из группы, состоящей из L18R, Q22E, F24A, R38D, K43E, E61R, P65L, Q126T и S130R, в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит мутацию R38D/K43E/E61R, мутацию L18R/Q22E/R38D/K43E/E61R, мутацию R38D/K43E/E61R/Q126T, мутацию L18R/Q22E/R38D/K43E/E61R/Q126T или мутацию L18R/Q22E/R38D/K43E/E61R/Q126T/S130R в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит любую последовательность из SEQ ID NO: 2 и 251-254. В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-α или его вариант. В некоторых вариантах осуществления вариант IFN-α содержит одну или несколько мутаций в положении, выбранном из группы, состоящей из R22, L26, F27, L30, K31, D32, R33, H34, D35, F36, S68, T79, K83, Y85, Y89, R120, K121, Y122, Q124, Y129, K131, E132, R144 и E146, и соответствующем положению в IFN-α, содержащем последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α содержит одну или несколько мутаций, выбранных из группы, состоящей из L30A, K31A, D32A, R33A, H34A и D35A, в отличие от IFN-α, содержащего последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α содержит любую последовательность из SEQ ID NO: 4-9. В некоторых вариантах осуществления вариант IFN-α содержит мутацию L30A в отличие от IFN-α, содержащего последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-γ или его вариант. В некоторых вариантах осуществления вариант IFN-γ содержит одну или несколько мутаций в одной или обеих субъединицах IFN-γ в положении, выбранном из группы, состоящей из V5, S20, D21, V22, A23, D24, N25, G26, H111 и Q115, и соответствующем положению в субъединице IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления вариант IFN-γ в одной или обеих субъединицах IFN-γ содержит одну или несколько мутаций, выбранных из группы, состоящей из S20A, D21A, D21K, V22A, A23S, A23E, A23Q, A23V, D24A, D24E, N25A, N25K и H111D, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления в одной или обеих субъединицах IFN-γ варианта IFN-γ содержится одна или несколько мутаций, выбранных из группы, состоящей из S20A/D21A, D21K, V22A/A23S, D24A/N25A, A23E/D24E/N25K, A23Q, и A23V, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат любую последовательность из SEQ ID NO: 11-17. В некоторых вариантах осуществления вариант IFN-γ содержит мутацию A23V в одной или обеих субъединицах IFN-γ, которые соотносятся с субъединицей IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления две субъединицы IFN-γ или его варианта соединены линкером. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-10 или его вариант. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10 в положении, выбранном из группы, состоящей из N21, M22, R24, D25, L26, R27, D28, A29, F30, S31, R32, H90 и S93, и соответствующем положению в субъединице IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A, L26A, R27A, D28A, A29S, F30A, S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A/L26A, R27A, D28A/A29S, F30A/S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат любую последовательность из SEQ ID NO: 21-26. В некоторых вариантах осуществления вариант IL-10 содержит мутацию R27A в одной или обеих субъединицах IL-10, которые соотносятся с субъединицей IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления две субъединицы IL-10 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-12 или его вариант. В некоторых вариантах осуществления вариант IL-12 содержит одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, и соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления вариант IL-12 содержит одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащий последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит любую последовательность из SEQ ID NO: 31-34. В некоторых вариантах осуществления вариант IL-12 содержит мутацию E59A/F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит мутацию F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 33. В некоторых вариантах осуществления субъединица р40 и субъединица р35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36, 275, 331 или 332. В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-23 или его вариант. В некоторых вариантах осуществления вариант IL-23 содержит одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, и соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления вариант IL-23 содержит одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащий последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит любую последовательность из SEQ ID NO: 31-34. В некоторых вариантах осуществления вариант IL-23 содержит мутацию E59A/F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления линкер содержит любую последовательность из SEQ ID NO: 194-242, такую как любая из SEQ ID NO: 227-229.
[18] В некоторых вариантах осуществления любого из иммуноцитокинов, описанных выше, цитокин или его вариант расположен в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи или составном полипептиде лиганд/рецептор-Fc).
[19] В некоторых вариантах осуществления любого из иммуноцитокинов, описанных выше, субъединица Fc-домена или ее часть содержит мутацию типа «выступы во впадины» (KIH).
[20] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антитело представляет собой антитело к HER2, содержащее: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 154, (i) цитокин или его вариант, представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 156; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 157; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 158; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 159; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 160; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 161. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 155. В некоторых вариантах осуществления антитело представляет собой антитело к CD3, содержащее: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 94, (i) цитокин или его вариант представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 96; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 97; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 98; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 99; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 100; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 101. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 95. В некоторых вариантах осуществления указанное антитело представляет собой антитело к PD-1, содержащее VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 106, (i) цитокин или его вариант представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 108; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 109; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 110; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 111; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 112; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 113. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 107. В некоторых вариантах осуществления антитело представляет собой антитело к CD4, содержащее: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 77, (i) цитокин или его вариант представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 79; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 80; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 81; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 82; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 83; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 84. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 78. В некоторых вариантах осуществления указанное антитело представляет собой антитело к CD8, содержащее VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 117, (i) цитокин или его вариант, представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 119; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 120; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 121; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 122; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 123; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 124. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 118. В некоторых вариантах осуществления указанное антитело представляет собой антитело к CTLA-4, содержащее VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 129, (i) цитокин или его вариант, представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 131; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 132; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 133; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 134; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 135; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 136. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 130. В некоторых вариантах осуществления антитело представляет собой антитело к PD-L1, содержащее: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 140, (i) цитокин или его вариант, представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 144; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 145; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 146; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 147; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 148; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 149. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 143. В некоторых вариантах осуществления указанное антитело представляет собой антитело к CD25, содержащее VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 165, (i) цитокин или его вариант, представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 169; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, а тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 170; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, а тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 171; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 172; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 173; или (vi) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 174. В некоторых вариантах осуществления антитело содержит вторую тяжелую цепь, не содержащую цитокин или его вариант, расположенный в шарнирном участке, причем вторая тяжелая цепь содержит последовательность SEQ ID NO: 168. В некоторых вариантах осуществления антитело представляет собой антитело к PD-1 со сниженным (сниженным по меньшей мере примерно в 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50, 100, 1000 или более раз) сродством связывания с PD-1 по сравнению с ниволумабом. В некоторых вариантах осуществления указанное антитело представляет собой антитело к PD-1, содержащее VH-CDR1, и VH-CDR2, и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103, где VH-CDR3 содержит любую из следующих мутаций в отличие от SEQ ID NO: 102: D100N, D100G, D100R, N99G, N99A или N99M. В некоторых вариантах осуществления антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 106, где цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, и где тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит любую последовательность из SEQ ID NO: 268-273.
[21] В некоторых вариантах осуществления в соответствии с любым из иммуноцитокинов, описанных выше, (i) антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом; или (ii) антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления лиганд или рецептор выбран из группы, состоящей из IL-2, IL-2Rα (CD25), PD-1, PD-L1, PD-L2, NKG2A, NKG2C, NKG2F, NKG2D, BCMA, APRIL, BAFF, IL-3, IL-13, LLT1, AICL, DNAM-1 и NKp80. В некоторых вариантах осуществления лиганд представляет собой PD-L2. В некоторых вариантах осуществления лиганд содержит последовательность SEQ ID NO: 176. В некоторых вариантах осуществления (i) цитокин или его вариант представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, а антигенсвязывающий полипептид, содержащий вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 180; (ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, и антигенсвязывающий полипептид, содержащий вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 182; (iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, и антигенсвязывающий полипептид, содержащий вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 183; (iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, а антигенсвязывающий полипептид, содержащий вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 184; (v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 186; (vi) где цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 275, и где антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 274; или (vii) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, а антигенсвязывающий полипептид, содержащий вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 187. В некоторых вариантах осуществления антигенсвязывающий белок содержит второй антигенсвязывающий полипептид, не содержащий цитокин или его вариант, расположенный в шарнирном участке, а второй антигенсвязывающий полипептид содержит любую последовательность из SEQ ID NO: 178, 179, 181 и 185. В некоторых вариантах осуществления лиганд представляет собой внеклеточный домен PD-L1 или получен из него. В некоторых вариантах осуществления лиганд PD-L1 усиливает (например, усиливает по меньшей мере примерно в 2, 3, 4, 5, 6, 10, 20, 50, 100, 100 или более раз) связывание с PD-1 по сравнению с PD-L1 дикого типа. В некоторых вариантах осуществления лиганд PD-L1 содержит любые мутации или их комбинации относительно SEQ ID NO: 249: I54Q, E58M, R113T, M115L, S117A и G119K. В некоторых вариантах осуществления лиганд PD-L1 содержит любую из следующих мутаций относительно SEQ ID NO: 249: E58M/R113T/M115L/S117A/G119K, I54Q/E58M/R113T/M115L/S117A/G119K, I54Q/R113T/M115L/S117A/G119K, I54Q/E58M/M115L/S117A/G119K, I54Q/E58M/R113T/S117A/G119K, I54Q/E58M/R113T/M115L/G119K или I54Q/E58M/R113T/M115L/S117A. В некоторых вариантах осуществления лиганд PD-L1 содержит любую последовательность из SEQ ID NO: 255-261. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, а антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 277. В некоторых вариантах осуществления антигенсвязывающий белок содержит второй антигенсвязывающий полипептид, содержащий второй цитокин или его вариант, расположенный в шарнирном участке или на C' Fc-фрагмента. В некоторых вариантах осуществления второй цитокин или вариант представляет собой любой цитокин или вариант, описанный в данном документе, такой как IL-2 или IFN-γ или их вариант. В некоторых вариантах осуществления антигенсвязывающий белок содержит второй антигенсвязывающий полипептид, содержащий второй цитокин или его вариант, расположенный в шарнирном участке, причем второй антигенсвязывающий полипептид содержит любую последовательность из SEQ ID NO: 285-288 и 327. В некоторых вариантах осуществления лиганд представляет собой внеклеточный домен PD-L2 или получен из него. В некоторых вариантах осуществления лиганд PD-L2 усиливает (например, усиливает по меньшей мере примерно в 2, 3, 4, 5, 6, 10, 20, 50, 100, 100 или более раз) связывание с PD-1 по сравнению с PD-L2 дикого типа. В некоторых вариантах осуществления лиганд PD-L2 содержит любые мутации или их комбинации относительно SEQ ID NO: 176: T56V, S58V, Q60L или T56V/S58V/Q60L. В некоторых вариантах осуществления лиганд PD-L2 содержит любую последовательность из SEQ ID NO: 262-265. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, и при этом антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 293. В некоторых вариантах осуществления антигенсвязывающий белок содержит второй антигенсвязывающий полипептид, содержащий второй цитокин или его вариант, расположенный в шарнирном участке или на C' Fc-фрагмента. В некоторых вариантах осуществления второй цитокин или вариант представляет собой любой цитокин или вариант, описанный в данном документе, такой как IL-2 или IFN-γ или их вариант. В некоторых вариантах осуществления лиганд представляет собой внеклеточный домен CD155 или получен из него. В некоторых вариантах осуществления лиганд CD155 содержит последовательность SEQ ID NO: 267.
[22] В настоящем изобретении также предложены любые антитела к PD-1, описанные в данном документе, такие как антитела е PD-1 с мутациями HC-CDR3, описанными в данном документе.
[23] В настоящем изобретении также предложены любые иммуноцитокины, описанные в данном документе, такие как любые конструкции, описанные в примерах, включая одноцепочечную вставку цитокина в шарнирном участке, двухцепочечную вставку цитокина (одинаковую или разную) в шарнирном участке, или конструкция, где один цитокин, составлен с шарнирным участком одной цепи, а другой составлен с C'-концом Fc-фрагмента другой цепи. В некоторых вариантах осуществления цитокин представляет собой любой цитокин или его вариант, описанный в данном документе, такой как IL-2, IL-12, IFN-γ и т.д.
[24] В данном документе также представлены иммуноцитокины, содержащие цитокин или его вариант, составленный с С' антигенсвязывающего белка, специфично распознающего антиген-мишень (например, с С' фрагмента Fc). В некоторых вариантах осуществления иммуноцитокин содержит: а) антигенсвязывающий белок, специфично распознающий антиген-мишень; и b) цитокин или его вариант (например, любой из описанных в данном документе), где антигенсвязывающий белок содержит антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент (например, антитело к PD-1, PD-L1 или PD-L2), шарнирный участок и субъединицу Fc-домена или ее часть, и где цитокин или его вариант расположены на C'-конце субъединицы Fc-домена или ее части.
[25] Также в данном документе предложены иммуноцитокины, включающие а) антигенсвязывающий белок, специфично распознающий антиген-мишень; b) первый цитокин (например, IL-2 или IFN-γ) или его вариант, и c) второй цитокин (например, IL-12) или его вариант, где антигенсвязывающий белок содержит первый антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть, где первый цитокин или его вариант расположен в шарнирном участке; и второй антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть, и где второй цитокин или его вариант расположен в шарнирном участке.
[26] Также в данном документе предложены иммуноцитокины, включающие а) антигенсвязывающий белок, специфично распознающий антиген-мишень; b) первый цитокин (например, IL-2 или IFN-γ) или его вариант, и c) второй цитокин (например, IL-12) или его вариант, где антигенсвязывающий белок содержит первый антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть, где первый цитокин или его вариант расположен в шарнирном участке; и второй антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть, и где второй цитокин или его вариант расположен на C'-конце Fc-домена.
[27] В другом аспекте настоящей заявки предложен способ избирательного стимулирования активности цитокина или его варианта, направленной на клетку, экспрессирующую антиген-мишень, у индивидуума, включающий введение индивидууму эффективного количества иммуноцитокина, где иммуноцитокин включает: а) антигенсвязывающий белок (например, антитело или составной белок лиганд/рецептор-Fc), специфично распознающий антиген-мишень; и b) цитокин или его вариант, причем антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь или составной полипептид лиганд/рецептор-Fc), содержащий от, N' к C': антигенсвязывающий фрагмент (например, фрагмент антитела, лиганд или рецептор), шарнирный участок и субъединицу Fc-домена или ее часть, а цитокин или его вариант расположен в шарнирном участке (например, на N-конце, на С-конце или внутри), и активность цитокина или его варианта избирательно активируется при связывании антигенсвязывающего белка с антигеном-мишенью. В некоторых вариантах осуществления настоящего изобретения предложен способ избирательного стимулирования активности цитокина или его варианта, направленной на клетку, экспрессирующую антиген-мишень, у индивидуума, включающий введение индивидууму эффективного количества любого из иммуноцитокинов, описанных выше, причем активность цитокина или его варианта избирательно стимулируется при связывании антигенсвязывающего белка с антигеном-мишенью. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка с антигеном-мишенью активность цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью при отсутствиеи связывания антигенсвязывающего белка с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка с антигеном-мишенью активность цитокина или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60 %, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина, и активность варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления (i) антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом; или (ii) антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором.
[28] Кроме того, предложены выделенные нуклеиновые кислоты, кодирующие любой из иммуноцитокинов, описанных в данном документе, векторы (например, лентивирусный вектор), содержащие такие нуклеиновые кислоты, клетки-хозяева (например, клетка СНО), содержащие такие нуклеиновые кислоты или векторы, и способы получения любого из описанных в данном документе иммуноцитокинов.
[29] Также предложены составы (например, фармацевтические составы), наборы и изделия, содержащие любой из описанных в данном документе иммуноцитокинов. Также предложены способы лечения заболевания или расстройства (например, рака, инфекции, аутоиммунного заболевания, аллергии, отторжения трансплантата или болезни трансплантат против хозяина (БТПХ)) у индивидуума с использованием эффективного количества любого из описанных в данном документе иммуноцитокинов или составов (например, фармацевтических составов), также представлены.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[30] На фигуре 1А показано строение полноразмерного антитела. На фигуре 1В показан пример строения иммуноцитокина, содержащего цитокин или его вариант, составленный с N-концом субъединицы Fc-фрагмента исходного полноразмерного антитела. На фигуре 1С показан пример строения иммуноцитокина, содержащего цитокин или его вариант, составленный с С-концом тяжелой цепи исходного полноразмерного антитела. На фигуре 1D показан пример строения иммуноцитокина, содержащего цитокин или его вариант, составленный с N-концом вариабельного домена тяжелой цепи (VH) исходного полноразмерного антитела. На фигуре 1Е показан пример строения иммуноцитокина, содержащего цитокин или его вариант, составленный с С-концом константной области легкой цепи (CL) исходного полноразмерного антитела. Каркас исходного антитела обозначен заштрихованными светло-серыми участками.
[31] На фигурах 2A-2D показаны примеры строения иммуноцитокинов настоящегоизобретения, в которых один или несколько цитокинов или их вариантов (или их субъединиц) расположены в шарнирном участке одной или обеих тяжелых цепей исходного полноразмерного антитела. На фигуре 2A изображен мономерный цитокин или его вариант (например, IL-2 или IFN-α), расположенный в шарнирном участке одной тяжелой цепи исходного полноразмерного антитела. На фигуре 2B изображен димерный (гомодимерный или гетеродимерный) цитокин или его вариант (например, IFN-γ, IL-10, IL-12 или IL-23), экспрессированный в одиночной цепи и расположенный в шарнирном участке одной тяжелой цепи исходного полноразмерного антитела. На фигуре 2C изображены два цитокина или их варианта, расположенные последовательно в шарнирном участке одной тяжелой цепи исходного полноразмерного антитела. На фигуре 2D изображены два цитокина или их варианта, каждый из которых расположен в шарнирном участке одной тяжелой цепи исходного полноразмерного антитела, или димерный (гомодимерный или гетеродимерный) цитокин или его вариант, причем каждая субъединица расположена в шарнирном участке одной тяжелой цепи исходного полноразмерного антитела. Каркас исходного антитела обозначен заштрихованными светло-серыми участками.
[32] На фигурах 3A-3C показаны альтернативные примеры строения иммуноцитокина настоящего изобретения, в которых цитокин или его вариант расположены между VH (например, внутри Fab или scFv) и субъединицей Fc-фрагмента. Каркас исходного антитела обозначен заштрихованными светло-серыми участками.
[33] На фигурах 4A-4C показаны примеры строения иммуноцитокинов настоящего изобретения, в которых один или несколько цитокинов или их вариантов (или их субъединиц) расположены в шарнирном участке одного или обоих полипептидов составного белка исходный лиганд/рецептор-шарнир-Fc. На фигуре 4A изображен мономерный цитокин или его вариант (например, IL-2 или IFN-α), расположенный в шарнирном участке одного полипептида составного белка исходный лиганд/рецептор-шарнир-Fc. На фигуре 4B изображены два цитокина или их варианты, каждый из которых расположен в шарнирном участке одного полипептида исходного составного белка лиганд/рецептор-шарнир-Fc, или димерный (гомодимерный или гетеродимерный) цитокин или его вариант, причем каждая субъединица расположена в шарнирном участке одного полипептида исходного составного белка лиганд/рецептор-шарнир-Fc. На фигуре 4С изображен димерный (гомодимерный или гетеродимерный) цитокин или его вариант (например, IFN-γ, IL-10, IL-12 или IL-23), экспрессированный в виде одной цепи, или два цитокина или их варианты, составленные последовательно и расположенные в шарнирном участке одного полипептида исходного составного белка лиганд/рецептор-шарнир-Fc. Светло-серые участки указывают на каркас исходного составного белка лиганд/рецептор-шарнир-Fc.
[34] На фигуре 5 показан объем опухоли у мышей с сингенной опухолью 4T1, обработанных иммуноцитокином IL-12(E59A/F60A)/антитело к PD-1 (№48), иммуноцитокином IL-12(E59A/F60A)/PD-L2-Fc (№29), иммуноцитокином IL-12(E59A/F60A)/IL-2(R38D/K43E/E61R)/антитело к PD-1 (№54) или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций.
[35] На фигуре 6 показан объем опухоли у мышей с сингенной опухолью EMT6, обработанных иммуноцитокином IL-12(E59A/F60A)/антитело к PD-1 (№48), иммуноцитокином IL-12(E59A/F60A)/PD-L2-Fc (№29), иммуноцитокином IL-2(R38D/K43E/E61R)/PD-L2-Fc (№11) или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций.
[36] На фигурах 7A и 7B показан объем опухоли у мышей с сингенной опухолью CT26, обработанных иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30), иммуноцитокином PD-L2-Fc/IL-12(F60A) (№34) или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций. На фигуре 7А показан средний объем опухоли для всех мышей, получавших указанный иммуноцитокин IL-12 или контроль. Средний размер опухоли (±STD) в каждой группе в момент проведения первой обработки показан в скобках. На фигуре 7B показаны объемы опухолей для отдельных мышей, получавших указанный иммуноцитокин IL-12.
[37] На фигуре 8 показаны объемы опухолей у мышей, ранее обработанных иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30) или иммуноцитокином PD-L2-Fc/IL-12(F60A) (№34) против опухоли CT26, затем повторно - заражение клетками мышиного рака толстой кишки CT26 на правом фланге и клетками мышиного рака молочной железы EMT6 на левом фланге (в качестве контроля).
[38] На фигуре 9 показан объем опухоли у мышей с сингенной опухолью CT26 на поздней стадии, обработанных иммуноцитокином IL-12(E59A/F60A)/PD-L2 Fc (№29) или иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30). Черными стрелками указаны дни инъекций. Размер опухоли каждой мыши в момент проведения первой обработки показан в скобках.
[39] На фигуре 10 показана регрессия размера опухоли в модели сингенной опухоли CT26 на поздних стадиях у мышей, получавших иммуноцитокин IL-12(F60A)/PD-L2-Fc (конструкция №30).
[40] На фигурах 11A и 11B изображены объем опухоли у сингенных мышей с опухолью молочной железы EMT6, обработанных иммуноцитокином IL-12(E59A/F60A)/PD-L2 Fc (№29), иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30), иммуноцитокином IL-12(E59A/F60A)/антитело к PD-1 (№48) или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций. На фигуре 11А показан средний объем опухоли для всех групп мышей, в скобках указан средний размер опухоли (±STD) при первой обработке. На фигуре 11В показаны объемы опухоли для каждой мыши, получавшей указанные иммуноцитокины IL-12.
[41] На фигуре 12 показаны объемы опухолей у мышей, ранее получавших иммуноцитокин IL-12(E59A/F60A)/PD-L2 Fc (№29), иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) или иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1 (№48) против опухоли EMT6, затем мышей повторно заражали клетками рака молочной железы EMT6 в правом боку и клетками рака толстой кишки мыши CT26 в левом боку (в качестве контроля).
[42] На фигуре 13 показаны опухоли мышиного рака молочной железы 4T1, иссеченные из жировой ткани молочной железы мышей, обработанных иммуноцитокином IL-12(E59A/F60A)/PD-L2-Fc (№29), IL-12(F60A)/PD-L2-Fc (№ 30), комбинацией антител к PD-1 и к CTLA-4 или PBS (отрицательный контроль).
[43] На фигуре 14 показаны клетки мышиного рака молочной железы 4T1, метастазировавшие в легкие у мышей, которым вводили клетки 4T1 в жировую ткань молочной железы и лечили иммуноцитокином IL-12(E59A/F60A)/PD-L2-Fc (№29), IL-12(F60A)/PD-L2-Fc (№30), комбинацией антител к PD-1 и к CTLA-4 или PBS (отрицательный контроль).
[44] На фигурах 15A и 15B показан объем опухоли у мышей с сингенной опухолью меланомы B16, обработанных иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30), иммуноцитокином PD-L2-Fc/IL-12(F60A) (№34) или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций. На фигуре 15А показан средний объем опухоли для всех групп мышей, в скобках указан средний размер опухоли (±STD) при первой обработке. На фигуре 15В показаны объемы опухоли для отдельной мыши, получавшей указанные иммуноцитокины IL-12.
[45] На фигурах 16A и 16B изображены объем опухоли у сингенных мышей с раком легкого LL2, обработанных иммуноцитокином IL-12(F60A)/PD-L2-Fc (№30), иммуноцитокином PD-L2-Fc/IL-12(F60A) (№34), или PBS (отрицательный контроль). Черными стрелками указаны дни инъекций. На фигуре 16А показан средний объем опухоли для всех групп мышей, при этом в скобках показан средний размер опухоли (±STD) при первой обработке. На фигуре 16В показаны объемы опухоли для каждой мыши, получавшей указанные иммуноцитокины IL-12.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[46] Цитокины являются ключевыми медиаторами врожденного и адаптивного иммунитета. Однако цитокиновая терапия (например, для лечения рака) показали ограниченный успех из-за сильной токсичности, которая ограничивает дозировку до уровня намного ниже терапевтически эффективной дозы. Иммуноцитокины, которые представляют собой конструкции с цитокинами, слитыми с антителами, антигенсвязывающими фрагментами, составным белком лиганд-Fc или составным белком рецептор-Fc (далее в совокупности именуемые «составной белок лиганд/рецептор-Fc» или «составной белок лиганд/рецептор-шарнир-Fc») может доставлять цитокины к клеткам-мишеням (например, опухолевым клеткам или иммунным эффекторным клеткам) или в ткани, что сопровождается распознаванием антигенов-мишеней антителами или антигенсвязывающими фрагментами (например, фрагментами антител, лигандами или рецепторами) в составе иммуноцитокинов, которые могут как снижать неспецифические (нецелевые) активности цитокинов и/или связанной с ними токсичности (например, токсичность в отношении здоровых клеток или тканей) и концентрировать терапевтическое действие цитокинов в целевых местоположениях (например, очагах заболевания). Активация иммуноцитокинов может происходить через транс-активацию, которая требует специфического связывания антитела или его антигенсвязывающего фрагмента с антигенами-мишенями на опухолевых клетках; или цис-активацию, которая требует специфического связывания антитела или его антигенсвязывающего фрагмента с антигенами-мишенями на иммунных клетках. Большинство иммуноцитокинов, разработанных в настоящее время, имеют цитокиновый фрагмент, составленный с N-концом или С-концом тяжелой цепи или легкой цепи полноразмерного антитела (например, Hu14.8-IL2, NHS-IL2LT, NHS-IL12, ВС1-IL12; см., например, фигуры 1C-1E) или составлены с N-концом или C-концом антигенсвязывающего фрагмента (например, диатела, scFv, таких как L19-IL2 или F16-IL2), поэтому связывание/активация цитокинового рецептора может происходить даже в отсутствие распознавания антитело-антиген, что приводит к нецелевой токсичности.
[47] Настоящее изобретение предлагает иммуноцитокины с уникальными конфигурациями, которые решают проблемы, с которыми сталкивается современная цитокиновая/иммуноцитокиновая терапия. В частности, иммуноцитокины настоящего изобретения снижают неспецифичную активность (т.е. независимое от антител или антигенсвязывающего фрагмента связывание) и увеличивают специфичную активность (т.е. зависимое от связывания антитела или антигенсвязывающего фрагмента) цитокинов путем размещения фрагмента цитокина (например, цитокина или его варианта) в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab ) и субъединицей Fc-домена или ее частью (например, фрагментом CH2-CH3, или только CH2, или только CH3), например, в шарнирном участке между scFv и субъединицей Fc-домена (например, антигенсвязывающий полипептид, содержащий VH-VL-цитокин-субъединица Fc или VL-VH-цитокин-субъединица Fc), в шарнирном участке между доменами Fab и Fc полноразмерного антитела (например, антигенсвязывающий полипептид, содержащий VH-CH1-цитокин-субъединица Fc), или в шарнирном участке между лигандом (или рецептором) и субъединицей Fc-домена (например, антигенсвязывающий полипептид, содержащий лиганд-цитокин-субъединица Fc или рецептор-цитокин-субъединица Fc). Не ограничиваясь теорией, полагают, что пространственные затруднения, создаваемые для антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) и Fc-домена или его части, снижают доступ рецептора цитокина или его варианта к цитокину или его варианту или «маскирует» цитокин или его вариант от связывания с его рецептором в отсутствие связывания антигена-мишени с антигенсвязывающим фрагментом. С другой стороны, цитокин активируется при наличии связывания антигена-мишени. Удивительно, но в отличие от других конструкций иммуноцитокинов, которые «обнажают» цитокиновый фрагмент на его N-конце или С-конце, уникальная конфигурация иммуноцитокина настоящего изобретения требует связывания антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) с его антигеном-мишенью до связывания цитокинового фрагмента с его рецептором, таким образом гарантируя, что активация цитокинового рецептора полностью зависит от (специфичного) связывания антигена-мишени. Благодаря этой конструкции с повышенной специфичностью нацеливания цитокины можно безопасно доставлять в целевые местоположения (например, опухолевые клетки или иммунные клетки) для достижения терапевтического эффекта.
[48] Кроме того, авторы заявки обнаружили, что некоторые иммуноцитокины, например, сконструированные с исходным антигенсвязывающим белком (например, антитело или его фрагмент, или составной белок рецептор-Fc или лиганд-Fc) и фрагментом цитокина с противоположным воздействием на регуляцию иммунных ответов продемонстрировал значительно лучший профиль токсичности и терапевтическую эффективность. Например, при размещении цитокина IL-12 (провоспалительного) в шарнирном участке составного белка внеклеточный домен PD-L2-шарнир-Fc полученный иммуноцитокин IL-12/PD-L2-Fc не только специфично нацеливался на активность IL-12 (например, активность связывания с рецептором IL-12 и/или провоспалительная активность IL-12) в отношении PD-1+клеток-мишеней, но также стимулировал ингибирующую PD-1 передачу сигналов иммунной контрольной точки путем связывания PD-L2-PD-1, создавая, таким образом, сигнал иммуносупрессии, который «уравновешивает» иммуностимулирующую активность IL-12 (далее также именуемый «уравновешивающим иммуноцитокином»). Любые антитела-агонисты или лиганды (например, PD-L2, PD-L1, CD80 или CD86), которые могут активировать или стимулировать иммуносупрессивный сигнальный путь (например, путем связывания с ингибирующей молекулой контрольной точки иммунного ответа, такой как PD-1 или CTLA-4), или любые антагонистические антитела, лиганды или рецепторы, которые могут понижать или блокировать иммуностимулирующий сигнальный путь (например, путем связывания со стимулирующей молекулой контрольной точки иммунного ответа, такой как CD27 или CD28, или с иммуностимулирующим рецептором, таким как IL-2R), могут использоваться в комбинации с иммуностимулирующим цитокином или его вариантом (например, IL-2, IL-12 или IL-23) для создания уравновешивающего иммуноцитокина с любой из описанных здесь конфигураций иммуноцитокина. Любые антагонистические антитела, лиганды или рецепторы, которые могут понижать или блокировать иммуносупрессивный сигнальный путь (например, путем связывания с ингибирующей молекулой контрольной точки иммунного ответа, такой как PD-1 или CTLA-4), или любые агонистические антитела или лиганды (например, CD70, CD80, CD86 или IL-2), которые могут активировать или стимулировать иммуностимулирующий сигнальный путь (например, путем связывания со стимулирующей молекулой контрольной точки иммунного ответа, такой как CD27 или CD28, или с иммуностимулирующим рецептором, таким как IL-2R), можно использовать в комбинации с иммуносупрессивным цитокином или его вариантом (например, IL-10, IL-27, IL-35, TGF-β) для конструирования уравновешивающего иммуноцитокина с любой из описанных здесь конфигураций иммуноцитокина. Такое «уравновешивание» конструкции иммунного ответа добавляет дополнительный регулирующий уровень для тонкой настройки биологической активности и токсичности иммуноцитокинов, описанных в данном документе, в дополнение к их уникальной конструкции для специфичности нацеливания.
[49] Иммуноцитокины, описанные в данном документе, можно также применять для лечения различных запущенных и/или трудно поддающихся лечению типов рака (например, ТНРМЖ, меланомы, рака легких), ингибирования метастазирования рака, лечения или замедления прогрессирования онкологических опухолей, устойчивых к современным иммунотерапевтическим средствам (например, к терапиии ингибиторами PD-1, терапии ингибиторами CTLA-4 или их комбинированной терапии) и/или продления продолжительности жизни таких пациентов. Описанные здесь иммуноцитокины обладают превосходными профилями безопасности со значительно сниженным побочным действием по сравнению с другими конфигурациями иммуноцитокинов, такими как C'-присоединение Fc.
[50] В сочетании с этой уникальной конструкцией иммуноцитокина также были созданы различные варианты цитокинов, которые были размещены в шарнирном участке, для скрининга вариантов цитокинов с невысокой или отсутствующей активностью (например, активностью связывания с рецептором цитокинов и/или биологической активностью цитокинов) в отсутствие связывания антигена-мишени, но у которых повышенная активность вновь «появляется», «восстанавливается» или «наблюдается» при наличии связывания антигена-мишени. Были получены различные иммуноцитокины, которые могут специфично нацеливать активность цитокинов (например, IFN-α2b, IL-12, IL-23, IL-10 или IFN-γ) на клетки-мишени (например, PD-1+ клетки, CD4+ T-клетки, или CD8+ Т-клетки), с минимальной или отсутствующей активностью цитокинов в отношении клеток, не являющихся мишенями (например, PD-1-клеток, CD8+ Т-клеток или CD4+ Т-клеток).
[51] Соответственно, в одном аспекте настоящей заявки предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, антиген клеточной поверхности, рецептор или лиганд); и b) цитокин или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), включающий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2 ), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри).
[52] В некоторых вариантах осуществления исходный антигенсвязывающий белок (т.е. каркас антигенсвязывающего белка, используемый для конструирования иммуноцитокина, описанного в данном документе) представляет собой антитело (например, полноразмерное антитело) или его фрагмент, специфично распознающий антиген-мишень. В некоторых вариантах осуществления антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, при этом цитокин или его вариант расположен в шарнирном участке тяжелой цепи. Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к иммуноцитокину, содержащему: а) антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень; и b) цитокин или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри). Иммуноцитокин, описанный в данном документе, в некоторых вариантах осуществления включает: (a) первый антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: первый домен VH, необязательный первый CH1, цитокиновый фрагмент в шарнирном участке и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй домен VH, необязательный второй домен CH1, шарнирный участок и вторую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); (c) третий антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: первый домен VL и необязательно первый CL; и (d) четвертый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй домен VL и необязательно второй CL; при этом первый VH и первый VL и необязательно первый CH1 и первый CL образуют первый антигенсвязывающий домен (например, Fab), специфично распознающий первый антиген-мишень; и при этом второй VH и второй VL и необязательно второй CH1 и второй CL образуют второй антигенсвязывающий домен (например, Fab), специфично распознающий второй антиген-мишень. В некоторых вариантах осуществления антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой составной полипептид scFv-шарнир-Fc. Иммуноцитокин, описанный в данном документе, в некоторых вариантах осуществления включает: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: (первый домен VH и первый домен VL) или (первый домен VL и первый домен VH), цитокиновый фрагмент в шарнирном участке и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); и (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: (второй домен VH и второй домен VL) или (второй домен VL и второй домен VH), шарнирный участок и вторую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); при этом первый VH и первый VL образуют первый антигенсвязывающий домен (например, scFv), специфично распознающий первый антиген-мишень; и при этом второй VH и второй VL образуют второй антигенсвязывающий домен (например, scFv), специфично распознающий второй антиген-мишень. В некоторых вариантах осуществления антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой составной полипептид VHH-шарнир-Fc. Иммуноцитокин, описанный в данном документе, в некоторых вариантах осуществления включает: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: первый VHH, цитокиновый фрагмент в шарнирном участке и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); и (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй VHH, шарнирный участок и вторую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); при этом первый VHH специфично распознает первый антиген-мишень; и при этом второй VHH специфично распознает второй антиген-мишень.
[53] В некоторых вариантах осуществления исходный антигенсвязывающий белок представляет собой составной белок антигенсвязывающий фрагмент-шарнир-Fc. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой scFv. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой VHH. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к иммуноцитокину, содержащему: а) составной белок антигенсвязывающий фрагмент-шарнир-Fc, специфично распознающий антиген-мишень (например, антиген клеточной поверхности, рецептор или лиганд); и b) цитокин или его вариант, где составной белок антигенсвязывающий фрагмент-шарнир-Fc содержит составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд , рецептор, VHH или scFv), шарнирный участок и субъединицу Fc-домена или ее часть, и где цитокин или его вариант расположен в шарнирном участке (например, на его N', C' или внутри его). Иммуноцитокин, описанный в данном документе, в некоторых вариантах осуществления включает: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: первый антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), цитокиновый фрагмент в шарнирном участке и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); и (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), шарнирный участок и вторую субъединицу Fc домен или ее часть (например, CH2+CH3 или только CH2); при этом первый антигенсвязывающий фрагмент специфично распознает первый антиген-мишень (например, антиген клеточной поверхности, рецептор или лиганд); и где второй антигенсвязывающий фрагмент специфично распознает второй антиген-мишень (например, антиген клеточной поверхности, рецептор или лиганд).
[54] Также предложены выделенные нуклеиновые кислоты, кодирующие такие иммуноцитокины, векторы, содержащие такие нуклеиновые кислоты, клетки-хозяева, содержащие такие нуклеиновые кислоты или векторы, способы получения таких иммуноцитокинов, фармацевтические составы и изготовленные продукты, содержащие такие иммуноцитокины, способы избирательного стимулирования активности цитокина или его варианта по отношению к клетке, экспрессирующей антиген-мишень, с помощью таких иммуноцитокинов или их фармацевтических составов, и способы лечения заболеваний (например, рака, вирусной инфекции, аутоиммунных заболеваний) с помощью таких иммуноцитокинов или содержащих их фармацевтических составов.
I. Определения
[55] В приложении на практике настоящего изобретения будут использоваться, если не указано иное, общепринятые методы вирусологии, иммунологии, микробиологии, молекулярной биологии и методы рекомбинантной ДНК, известные специалистам в данной области, многие из которых описаны ниже с целью иллюстрации. Такие методы полностью описаны в литературе. См., например, Current Protocols in Molecular Biology или Current Protocols in Immunology, John Wiley & Sons, New York, Нью-Йорк (2009); Ausubel и др., Short Protocols in Molecular Biology, 3rd ed., John Wiley & Sons, 1995; Sambrook и Russell, Molecular Cloning: A Laboratory Manual (3rd Edition, 2001); Maniatis и др., Molecular Cloning: A Laboratory Manual (1982); DNA Cloning: A Practical Approach, vol. I&II (D. Glover, ed.); Oligonucleotide Synthesis (N. Gait, ed., 1984); Nucleic Acid Hybridization (B. Hames & S. Higgins, eds., 1985); Transcription and Translation (B. Hames & S. Higgins, eds., 1984); Animal Cell Culture (R. Freshney, ed., 1986); Perbal, A Practical Guide to Molecular Cloning (1984) и другие подобные литературные источники.
[56] Термин «иммуноцитокин», используемый в данном документе, относится к формату антигенсвязывающего белка (например, антитела или антигенсвязывающего фрагмента (например, лиганда, рецептора или фрагмента антитела)), который составлен с молекулой цитокина. Конфигурация антигенсвязывающего белка (например, антитела или антигенсвязывающего фрагмента (например, лиганда, рецептора или фрагмента антитела)) может быть любой конфигурацией, описанной в данном документе, а цитокин может быть составлен непосредственно или посредством линкера или химической конъюгации с конфигурацией антигенсвязывающего белка.
[57] Термин «цитокиновый шторм», также известный как «цитокиновый каскад» или «гиперцитокинемия», представляет собой потенциально смертельную иммунную реакцию, обычно состоящую из петли положительной обратной связи между цитокинами и иммунными клетками с сильно повышенными уровнями различных цитокинов, например, IFN-γ, IL-10, IL-6, CCL2 и т.д.).
[58] В данном контексте, когда антигенсвязывающий белок (например, антитело, антигенсвязывающий фрагмент или лиганд) называют «антагонистом» антигена-мишени (например, рецептора или молекулы контрольной точки иммунной системы), это означает что при связывании антигена-мишени антигенсвязывающий белок (например, антитело, антигенсвязывающий фрагмент или лиганд) блокирует, подавляет или снижает биологическую активность антигена-мишени (например, блокирует передачу сигналов рецептора). Например, антагонистическое антитело к PD-1 представляет собой антитело, которое снижает или блокирует передачу сигналов PD-1. Когда антигенсвязывающий белок (например, антитело, антигенсвязывающий фрагмент или лиганд) называют «агонистом» антигена-мишени (например, рецептора или молекулы контрольной точки иммунного ответа), это означает, что при связывании антигена-мишени, антигенсвязывающий белок (например, антитело, антигенсвязывающий фрагмент или лиганд) стимулирует, активирует или усиливает биологическую активность антигена-мишени (например, активирует передачу сигналов рецептора). Например, лиганд PD-L2 дикого типа (например, внеклеточный домен) представляет собой агонист, который активирует передачу сигналов PD-1.
[59] Используемый здесь термин «лечение» или «проведение лечения» представляет собой подход для получения полезных или желаемых результатов, включая клинические результаты. Для целей настоящего изобретения благоприятные или желаемые клинические результаты включают, но не ограничиваются этим, одно или несколько из следующего: облегчение одного или нескольких симптомов, возникающих в результате заболевания, уменьшение степени заболевания, стабилизацию заболевания (например, предотвращение или замедление ухудшения заболевания), предотвращение или замедление распространения (например, метастазирования) заболевания, предотвращение или замедление рецидива заболевания, отсрочка или замедление прогрессирования заболевания, улучшение болезненного состояния, обеспечение ремиссии (частичной или полной) заболевания, снижение дозы одного или нескольких других препаратов, необходимых для лечения заболевания, замедление прогрессирования заболевания, повышение качества жизни и/или продление выживаемости. Под «лечением» также подразумевается уменьшение патологических последствий заболевания. Способы изобретения предусматривают любой один или несколько из этих аспектов лечения. Например, «лечение» индивидуума проходит успешно, если один или несколько симптомов, связанных с вирусной инфекцией, смягчаются или устраняются, включая, но не ограничиваясь этим, уменьшение пролиферации (или уничтожение) инфекционного вируса, уменьшение симптомов, возникающих в результате заболевания (например, цитокинового шторма), повышение качества жизни больных, снижение дозы других лекарств, необходимых для лечения заболевания, и/или продление выживаемости людей.
[60] Термин «предотвратить» и подобные слова, такие как «предотвращенный», «предотвращая» и т.д., указывают на подход для предотвращения, подавления или снижения вероятности рецидива заболевания или состояния, например, рака. Это также относится к отсрочке рецидива заболевания или состояния или отсрочке рецидива симптомов заболевания или состояния. Используемый здесь термин «предотвращение» и подобные слова также включают снижение интенсивности, эффекта, симптомов и/или бремени заболевания или состояния перед рецидивом заболевания или состояния.
[61] Используемый здесь термин «задержка» или «отсрочка» развития заболевания означает откладывать, препятствовать, замедлять, задерживать, стабилизировать и/или отдалять развитие заболевания. Эта отсрочка может быть разной продолжительности, в зависимости от истории болезни и/или индивидуума, проходящего лечение. Способ, который «задерживает» развитие заболевания, представляет собой способ, который снижает вероятность развития заболевания в заданный период времени и/или уменьшает степень заболевания в заданный период времени по сравнению с отсутствием использования этого способа. Такие сравнения обычно основаны на клинических исследованиях с участием статистически значимого числа участников. Развитие рака можно обнаружить с помощью стандартных методов, включая, помимо прочего, компьютерную аксиальную томографию (CAT сканирование), магнитно-резонансную томографию (МРТ), УЗИ брюшной полости, тесты на свертываемость крови, артериографию или биопсию. Развитие может также относиться к прогрессированию заболевания (например, рака), которое изначально не было выявлено, и включает возникновение, рецидив и начало.
[62] Используемый здесь термин «эффективное количество» относится к количеству средства или комбинации средств, достаточному для лечения определенного расстройства, состояния или заболевания, такого как облегчение, облегчение, ослабление и/или задержка одного или нескольких симптомов расстройства. Что касается рака, эффективное количество включает количество, достаточное для того, чтобы вызвать уменьшение опухоли и/или снизить скорость роста опухоли (например, для подавления роста опухоли) или для предотвращения или задержки другой нежелательной клеточной пролиферации. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для задержки развития. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для предотвращения или задержки рецидива. Эффективное количество можно вводить в ходе одного или нескольких введений. Эффективное количество лекарственного средства или состава может: (i) уменьшить количество раковых клеток; (ii) уменьшить размер опухоли; (iii) подавлять, тормозить, до некоторой степени замедлять и предпочтительно останавливать инфильтрацию раковых клеток в периферические органы; (iv) подавлять (т.е. в некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли; (v) подавлять рост опухоли; (vi) предотвратить или отсрочить появление и/или рецидив опухоли; (vii) облегчить до некоторой степени один или несколько симптомов, связанных с раком; (viii) стимулировать или активировать иммунные клетки (например, иммунные эффекторные клетки), например, для иммунного ответа, такого как продуцирование цитокина(ов), или для пролиферации и/или дифференцировки иммунных клеток; и/или (ix) предотвращать, уменьшать или устранять воспаление или аутоиммунный ответ, например, подавляя секрецию провоспалительных цитокинов. В случае вирусной инфекции эффективное количество средства может подавлять (т.е. снизить до некоторой степени и, предпочтительно, прекратить) активность вируса; контролировать, и/или ослаблять, и/или подавлять воспаление или цитокиновый шторм, индуцированный указанным вирусным патогеном; предотвращать ухудшение, останавливать и/или улучшать по меньшей мере один симптом указанной вирусной инфекции или повреждения у указанного субъекта или органа или ткани у указанного субъекта, возникающие в результате или связанные с указанной вирусной инфекцией; контролировать, уменьшать и/или подавлять некроз клеток в инфицированной и/или неинфицированной ткани и/или органе; контролировать, улучшать и/или предотвращать инфильтрацию воспалительных клеток (например, NK-клеток, цитотоксических Т-клеток, нейтрофилов) в инфицированных или неинфицированных тканях и/или органах; и/или стимулировать или активировать иммунные клетки (например, иммунные эффекторные клетки), например, для иммунного ответа, такого как продуцирования цитокина(ов), или для пролиферации и/или дифференцировки иммунных клеток.
[63] Используемый здесь термин «индивидуум» или «субъект» относится к млекопитающим, включая, но не ограничиваясь ими, человека, крупного рогатого скота, лошадь, кошку, собаку, грызуна или примата. В некоторых вариантах осуществления индивидуумом является человек.
[64] Термин «антитело» используется в самом широком смысле и охватывает различные строения антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела), полноразмерные антитела и их антигенсвязывающие фрагменты, если они обладают желаемой антигенсвязывающей активностью. Термин «антитело» включает обычные 4-цепочечные антитела, однодоменные антитела и их антигенсвязывающие фрагменты.
[65] Основная 4-цепочечная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. IgM-антитела состоят из 5 основных гетеротетрамерных звеньев вместе с дополнительным полипептидом, называемым J-цепью, и содержат 10 антигенсвязывающих участков, в то время как IgA-антитела состоят из 2-5 основных 4-цепочечных звеньев, которые могут полимеризоваться с образованием поливалентных сборок в сочетании с J-цепью. В случае IgG размер 4-цепочечная единица обычно составляет примерно 150 000 дальтон. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, тогда как две H-цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа H-цепи. Каждая цепь H и L также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая H-цепь имеет на N-конце вариабельный домен (VН), за которыми следуют три константных домена (CH) для каждой из цепей α и γ и четыре CН домена для изотипов μ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен на другом его конце. VL выравнивается с VН и СL выравнивается с первым константным доменом тяжелой цепи (CH1). Считается, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи. При спаривании вместе VH и VL образуется единый антигенсвязывающий сайт. Структуру и свойства различных классов антител см., например, в Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr и Tristram G. Parsolw (редакторы), Appleton & Lange, Norwalk, Conn., 1994, стр. 71 и Chapter 6. L-цепь любого вида позвоночных на основании аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко различающихся типов, называемых каппа и лямбда. Иммуноглобулины в зависимости от аминокислотной последовательности константного домена их тяжелых цепей (CН) можно отнести к разным классам или изотипам. Различают пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, обозначенные α, δ, ε, γ и μ, соответственно. Классы γ и α далее делятся на подклассы на основе относительно незначительных различий в CН последовательности и функции, например, у людей экспрессируются следующие подклассы: IgG1, IgG2A, IgG2B, IgG3, IgG4, IgA1 и IgA2.
[66] «Выделенное» антитело (или конструкция) - это антитело, которое было идентифицировано, отделено и/или извлечено из компонента среды, в которой оно было выработано (например, природной или рекомбинантной). Предпочтительно, чтобы выделенный полипептид не был ассоциирован со всеми другими компонентами среды, в которой оно было выработано. Загрязняющие компоненты среды, в которой антитело было выработано, такие как продукты рекомбинантных трансфецированных клеток, представляют собой материалы, которые обычно мешают исследовательскому, диагностическому или терапевтическому применению антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах полипептид очищают: (1) до содержания свыше 95% (по массе) антитела, как определено, например, методом Лоури, и в некоторых вариантах осуществления до содержания свыше 99% по массе; (2) в степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающейся чашкой; или (3) до гомогенного состояния с помощью SDS-PAGE в невосстанавливающих или восстанавливающих условиях с использованием красителя Coomassie Blue или, предпочтительно, окрашивания серебром. Выделенное антитело (или конструкция) включает антитело in situ в рекомбинантных клетках, поскольку по крайней мере один компонент природной среды антитела не будет присутствовать. Однако обычно выделенный полипептид, антитело или конструкцию получают с помощью по меньшей мере одной стадии очистки.
[67] «Вариабельный участок» или «вариабельный домен» антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Вариабельные домены тяжелой цепи и легкой цепи могут обозначаться как «VН» и «VL», соответственно. Эти домены обычно являются наиболее вариабельными частями антитела (относительно других антител того же класса) и содержат сайты связывания антигена. Только антитела с тяжелой цепью видов Camelid имеют единственную вариабельную область тяжелой цепи, которая обозначается как «VНН». Таким образом, VНH представляет собой особый тип VН.
[68] Термин «вариабельный» обозначает то, что у разных антител определенные сегменты последовательностей вариабельных доменов сильно различаются. Домен V опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако изменчивость неравномерно распределена по всей продолжительности вариабельных доменов. Вместо этого она сконцентрирована в трех сегментах, называемых участками, определяющими комплементарность (CDR), или гипервариабельными участками (HVR), как в вариабельных доменах тяжелой цепи, так и в легкой цепи. Более консервативные части вариабельных доменов называются каркасными участками (FR). Каждый из вариабельных доменов нативной тяжелой и легкой цепей содержит четыре FR-участка, в значительной степени принимающих конфигурацию бета-слоя, соединенных тремя CDR, которые образуют петли, соединяющие структуру бета-слоя и, в некоторых случаях, образующие ее часть. CDR в каждой цепи удерживаются вместе в непосредственной близости от FR-участков и вместе с CDR из другой цепи способствуют образованию антигенсвязывающего сайта антител (см. Kabat и др., Sequences oF Immunological Interest, FiFth Edition, National Institute oF Health, Bethesda, Мэриленд. (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но выполняют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной токсичности.
[69] Термин «моноклональное антитело», используемый в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны, за исключением возможных встречающихся в природе мутаций и/или посттрансляционных модификаций (например, изомеризации, амидирования), которые могут присутствовать в незначительных количествах. Моноклональные антитела обладают высокой специфичностью и направлены против одного антигенного сайта. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Помимо своей специфичности, преимущества моноклональных антител заключаются в том, что они синтезируются гибридомной культурой, незагрязненной другими иммуноглобулинами. Термин «моноклональный» указывает на то, что антитело получено из практически гомогенной популяции антител, и его не следует толковать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, можно получать разными методами, включая, например, гибридомный метод (например, Kohler и Milstein., Nature, 256:495-97 (1975); Hongo и др., Hybridoma, 14 (3): 253-260 (1995), Harlow и др., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2й изд. 1988 г.); Hammerling и др., в: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, Нью Йорк, 1981)), метод рекомбинантной ДНК (см, например, пат. США No. 4,816,567), технологии фагового дисплея (см, например, Clackson и др., Nature, 352: 624-628 (1991); Marks и др., J. Mol. Biol. 222: 581-597 (1992); Sidhu и др., J. Mol. Biol. 338(2): 299-310 (2004); Lee и др., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee и др., J. Immunol. Methods 284(1-2): 119-132 (2004), и технологии получения человеческих или человекоподобных антител у животных, которые имеют части или полные локусы или гены иммуноглобулина человека, кодирующие последовательности иммуноглобулина человека (см, например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits и др., Proc. Natl. Acad. Sci. USА 90: 2551 (1993); Jakobovits и др., Nature 362: 255-258 (1993); Bruggemann и др., Year in Immunol. 7:33 (1993); Пат. США. № 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks и др., Bio/Technology 10: 779-783 (1992); Lonberg и др., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild и др., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg и Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
[70] Термины «полноразмерное антитело», «интактное антитело» или «полное антитело» используются взаимозаменяемо для обозначения антитела в его практически интактной форме, в отличие от фрагмента антитела. В частности, полноразмерные 4-цепочечные антитела включают антитела с тяжелыми и легкими цепями, включая Fc-участок. Полноразмерные антитела, содержащего только тяжелую цепь, включают вариабельный домен тяжелой цепи (например, VНH) и Fc-участок. Константные домены могут быть константными доменами нативной последовательности (например, константные домены нативной последовательности человека) или варианты их аминокислотной последовательности. В некоторых случаях интактное антитело может иметь одну или несколько эффекторных функций. Следует понимать, что для настоящего изобретения ссылка на «полноразмерное антитело» также включает каркас полноразмерного антитела или исходное полноразмерное антитело (например, полноразмерное 4-цепочечное антитело или полноразмерное антитело, содержащее только тяжелую цепь), в шарнирном участке которого находится цитокиновый фрагмент (см., например, фигуры 2А-2D).
[71] «Фрагмент антитела», «антигенсвязывающий домен» или «антигенсвязывающий фрагмент» включают часть интактного антитела, предпочтительно антигенсвязывающий и/или вариабельный участок интактного антитела. Примеры фрагментов антител включают, но не ограничиваются ими, Fab, Fab', F(ab')2 и фрагменты Fv; диатела; линейные антитела (см. Пат. США № 5641870, Example 2; Zapata и др., Protein Eng. 8(10): 1057-1062 (1995)); молекулы одноцепочечных антител (scFv); однодоменные антитела (такие как VHH), и мультиспецифичные антитела, полученные из фрагментов антител. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых Fab-фрагментами, и остаточный Fc-фрагмент, обозначение которого отображает его способность легко кристаллизоваться. Fab-фрагмент состоит из целой L-цепи вместе с вариабельным доменом H-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый Fab-фрагмент является моновалентным в отношении связывания антигена, т.е. он содержит единственный сайт связывания антигена. Обработкой антитела пепсином получают один большой F(ab')2 фрагмент, который примерно соответствует двум Fab-фрагментам, связанным дисульфиным мостиком, которые обладают разной антигенсвязывающей активностью и по-прежнему способны к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов наличием нескольких дополнительных остатков на карбокси-конце CH1, включающем один или несколько цистеинов из шарнирного участка антитела. Fab'-SH представляет собой обозначение в данном документе для Fab', в котором цистеиновый остаток (остатки) константных доменов несет свободную тиольную группу. Фрагменты F(аb')2 антител первоначально были получены в виде пар Fab'-фрагментов, между которыми находятся шарнирные цистеины. Также известны другие химические соединения фрагментов антител. Следует понимать, что в настоящем изобретении ссылка на «антигенсвязывающий домен» или «антигенсвязывающий фрагмент» также включает лиганд, который может специфично распознавать целевой рецептор, или рецептор, который может специфично распознавать целевой лиганд.
[72] Термин «константный домен» относится к части молекулы иммуноглобулина, имеющей более консервативную аминокислотную последовательность по сравнению с другой частью иммуноглобулина - вариабельным доменом - который содержит антигенсвязывающий сайт. Константный домен содержит CH1, СH2 и СH3 домены (в совокупности - CH) тяжелой цепи и CHL (или CL) домен легкой цепи.
[73] «Тяжелая цепь» антител (иммуноглобулинов) можно разделить на три функциональные области: Fd-участок, шарнирный участок и Fc-участок (способный кристаллизоваться фрагмент). Fd-участок включает VH и CH1 и в сочетании с легкой цепью образует Fab - антигенсвязывающий фрагмент. Fc-фрагмент отвечает за эффекторные функции иммуноглобулина, которые включают, например, фиксацию комплемента и связывание с родственными Fc-рецепторами эффекторных клеток. Шарнирный участок, присущий IgG, IgA и IgD классам иммуноглобулинов, действует как гибкий спейсер, который позволяет Fab-сегменту свободно перемещаться в пространстве относительно Fc-участка. В отличие от константных участков разнообразные по своей структуре шарнирные домены варьируются как по своей последовательности, так и по своей длине внутри классов и подклассов иммуноглобулинов. Для антитела, содержащего только тяжелую цепь, «тяжелая цепь» включает вариабельный домен тяжелой цепи (такой как VНH), шарнирный участок и Fc-участок. Следует понимать, что в настоящем изобретении ссылка на «тяжелую цепь» также включает тяжелую цепь, содержащую домен VH, шарнирный участок и Fc-домен или его часть (например, субъединицу VL-VH-шарнир-Fc-домен или субъединицу VH-VL-шарнир-Fc-домен), и тяжелую цепь (например, тяжелую цепь полноразмерного 4-цепочечного антитела, антитела, содержащего VH-шарнир-Fc, или тяжелую цепь антитела, состоящего только из тяжелой цепи), содержащую цитокиновый фрагмент, расположенный в шарнирном участке (см., например, фигуры 2А-3С).
[74] «Легкие цепи» антител (иммуноглобулинов) любого вида млекопитающих на основании аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко различающихся типов, называемых каппа («κ») и лямбда («λ»).
[75] «Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. Этот фрагмент состоит из димера домена вариабельного участка одной тяжелой цепи и одной легкой цепи, прочно связанных нековалентным образом. В результате укладки этих двух доменов образуются шесть гипервариабельных петель (по 3 петли в каждой из Н- и L-цепей), которые предоставляют аминокислотные остатки для связывания антигена и придают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащих только три CDR, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низким сродством, чем сайт связывания целиком.
[76] «Одноцепочечные Fv», также сокращенно обозначаемые как «sFv» или «scFv», представляют собой фрагменты антител, которые содержат VН и VL домены антител, соединенные в единую полипептидную цепь. Предпочтительный полипептид scFv дополнительно содержит полипептидный линкер между VН и VL доменами, которые позволяют scFv образовывать желаемую структуру для связывания антигена. Обзор scFv см. у Pluckthun в The Pharmacology oF Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, стр. 269-315 (1994).
[77] Термин «диатела» относится к небольшим фрагментам антител, полученным путем конструирования фрагментов sFv (см. предыдущий абзац) с короткими линкерами (примерно 5-10 остатков) между VН и VL доменами таким образом, что достигается межцепочечное, но не внутрицепочечное спаривание доменов V, что приводит к двухвалентному фрагменту, т.е. фрагменту, имеющему два сайта связывания антигена. Биспецифичные диатела представляют собой гетеродимеры двух «перекрестных» фрагментов sFv, в которых VН и VL домены двух антител присутствуют на разных полипептидных цепях. Диатела более подробно описаны, например, в EP 404,097; WO 93/11161; Hollinger и др., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993).
[78] Моноклональные антитела в данном документе конкретно включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от определенного вида или принадлежащих к определенному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям антител, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, если они проявляют желаемую биологическая активность (пат. США № 4816567; Morrison и др., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). «Гуманизированное антитело» используется в качестве подмножестве «химерных антител».
[79] «Гуманизированные» формы нечеловеческого (например, ламы или верблюда) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. В некоторых вариантах осуществления гуманизированное антитело представляет собой иммуноглобулин человека (антитело-реципиент), в котором остатки из CDR (описанные здесь и далее) реципиента заменены остатками из CDR вида, отличающегося от человека (донорное антитело), такого как мышь, крыса , кролик, верблюд, лама, альпака или примат, не являющийся человеком, обладающими желаемой специфичностью, сродством и/или емкостью. В некоторых случаях остатки каркаса («FR») человеческого иммуноглобулина заменены соответствующими остатками нечеловеческого происхождения. Кроме того, гуманизированные антитела могут содержать остатки, которых нет в антителе-реципиенте или в донорном антителе. Эти модификации можно делать, чтобы дополнительно улучшить характеристики антител, таких как сродство связывания. Как правило, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а как правило - двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют петлям последовательности нечеловеческого иммуноглобулина, и все или по существу все FR-участки представляют собой участки последовательности иммуноглобулина человека, хотя участки FR могут включать одну или несколько замен отдельных остатков FR, которые улучшают характеристики антитела, такие как сродство связывания, изомеризация, иммуногенность и т.д. Количество таких аминокислотных замен в FR обычно не превышает 6 в H-цепи, а в L-цепи - не более 3. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константного участка иммуноглобулина (Fc), как правило, иммуноглобулина человека. Дополнительно см., например, Jones и др., Nature 321:522-525 (1986); Riechmann и др., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Также см, например, Vaswani и Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle и Gross, Curr. Op. Biotech. 5:428-433 (1994); и пат. США № 6982321 и № 7087409.
[80] «Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности аминокислот антитела, продуцируемого человеком, и/или было получено с использованием любой из описанных здесь методик получения человеческих антител. Это определение человеческого антитела специально исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки. Человеческие антитела можно получать различными методами, известными в данной области, включая библиотеки фагового дисплея. Hoogenboom и Winter, J. Mol. Biol., 227:381 (1991); Marks и др., J. Mol. Biol., 222:581 (1991). Для получения моноклональных антител человека также доступны способы, описанные в Cole. и др., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, стр. 77 (1985); Boerner и др., J. Immunol., 147(1):86-95 (1991). Также см, van Dijk и van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001). Человеческие антитела можно получать путем введения антигена трансгенному животному, которое было модифицировано для выработки таких антител в ответ на антигенную стимуляцию, но чьи эндогенные локусы были отключены, например, методом иммунизированния ксеномышей (см., например, пат. США. №№ 6,075,181 и 6,150,584 относительно технологии XENOMOUSE™). См. также, например, Li и др., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) относительно антител человека, полученных с помощью технологии гибридомы В-клеток человека.
[81] Термин «гипервариабельная область», «HVR» или «HV» в данном контексте относится к областям вариабельного домена антитела, которые являются гипервариабельными по своей последовательности и/или образуют петли с четкой структурой. Как правило, однодоменные антитела содержат три HVR (или CDR): HVR1 (или CDR1), HVR2 (или CDR2) и HVR3 (или CDR3). HVR3 (или CDR3) демонстрирует наибольшее разнообразие из трех HVR и, как полагают, играет уникальную роль в придании тонкой специфичности антителам. См., например, Hamers-Casterman и др., Nature 363:446-448 (1993); SheriFF и др, Nature Struct. Biol. 3:733-736 (1996).
[82] Термин «участок, определяющий комплементарность» или «CDR» используется для обозначения гипервариабельных участков, определенных по системе Kabat. See Kabat и др., Sequences oF Proteins oF Immunological Interest, 5th Ed. Public Health Service, National Institutes oF Health, Bethesda, Md. (1991).
[83] Настоящее описание охватывает ряд используемых здесь формирований HVR. Участки, определяющие комплементарность (CDR) по Kabat, основаны на изменчивости последовательностей и наиболее часто используются (Kabat и др., Sequences oF Proteins oF Immunological Interest, 5th Ed. Public Health Service, National Institutes oF Health, Bethesda, Md. (1991)). В отличие от этого в Chothia рассматривается расположение структурных петель (Chothia и Lesk, J. Mol. Biol. 196:901-917 (1987)). AbM HVR представляют собой компромисс между структурными петлями Kabat HVR и Chothia, они используются в программном обеспечении моделирования антител AbM OxFord Molecular. «Контактные» HVR основаны на анализе изученных сложных кристаллических структур. Остатки от каждого из этих HVR отмечены ниже в Таблице A.
[84] HVR могут включать «расширенные HVR» следующим образом: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VН. Остатки вариабельного домена пронумерованы по Kabat и др., выше, для каждого из этих определений.
[85] Выражение «нумерация остатков вариабельного домена по Kabat» или «нумерация положений аминокислот по Kabat» и их варианты относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи компиляция антител по Кабату и др., выше. При использовании этой системы нумерации реальная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставку одной аминокислоты (остаток 52а по Kabat) после остатка 52 H2 и вставленные остатки (например, остатки 82a, 82b и 82c и т.д. по Kabat) после остатка FR тяжелой цепи 82. Нумерацию остатков по Kabat можно определять для данного антитела путем выравнивания участков гомологии последовательности антитела со «стандартной» пронумерованной по Kabat последовательностью.
[86] Если здесь не указано иное, нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу ЕU по Kabat и др., выше. «Индекс ЕU по Kabat» относится к нумерации остатков человеческого антитела IgG1 EU.
[87] Остатки «каркаса» или «FR» представляют собой остатки вариабельного домена, отличающиеся от остатков HVR, как определено в данном документе.
[88] «Человеческий консенсусный каркас» или «человеческий акцепторный каркас» представляет собой каркас, который состоит из наиболее часто встречающихся аминокислотных остатков в каркасных последовательностях VL или VH ряда иммуноглобулинов человека . Как правило, последовательности VL или VH человеческого иммуноглобулина выбирают из подгруппы последовательностей вариабельных доменов. В общем случае, подгруппа последовательностей является подгруппой в соответствии с Kabat и др., Sequences oF Proteins oF Immunological Interest, 5th Ed. Public Health Service, National Institutes oF Health, Bethesda, Md. (1991). Примеры в случае VL включают такие подгруппы, как подгруппа каппа I, каппа II, каппа III или каппа IV, в соответствии с Kabat и др., выше. Кроме того, для VH подгруппа может быть подгруппой I, подгруппой II или подгруппой III в соответствии с Kabat и др. В качестве альтернативы, человеческий консенсусный каркас можно получать из указанных выше определенных остатков, например, когда человеческий каркасный остаток выбирают, основываясь на его гомологии с донорным каркасом, путем выравнивания последовательности донорного каркаса с набором различных человеческих каркасных последовательностей. Человеческий акцепторный каркас, «происходящий из» каркаса человеческого иммуноглобулина или человеческого консенсусного каркаса, может содержать ту же аминокислотную последовательность, или он может содержать уже существующие изменения в аминокислотной последовательности. В некоторых вариантах осуществления количество уже существующих аминокислотных замен составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше.
[89] Антитело с «созревшим сродством» представляет собой антитело с одним или несколькими изменениями в одной или нескольких его CDR, которые приводят к улучшению сродства антитела к антигену по сравнению с исходным антителом, которое не содержит таких изменений. В некоторых вариантах осуществления антитело с созревшим сродством имеет наномолярное или даже пикомолярное сродство к антигену-мишени. Антитела с созревшим сродством получают способами, известными в данной области. Например, Marks и др., Bio/Technology 10:779-783 (1992) описывает процесс созревания сродства с помощью перетасовки VН- и VL- доменов. Случайный мутагенез CDR и/или каркасных остатков описан, например, в: Barbas и др., Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier и др., Gene 169:147-155 (1995); Yelton и др., J. Immunol. 155:1994-2004 (1995); Jackson и др., J. Immunol. 154(7):3310-9 (1995); и Hawkins и др., J. Mol. Biol. 226:889-896 (1992).
[90] Термин «эпитоп» означает белковую детерминанту, способную специфично связываться с антителом или его антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv, Fab и т.д.). Эпитопы обычно состоят из химически активных поверхностных групп таких молекул, как аминокислоты или боковые цепи сахаров, и обычно имеют определенные трехмерные структурные характеристики, а также определенные характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первыми, но не со вторыми, нарушается в присутствии денатурирующих растворителей.
[91] Используемый здесь термин «специфично связывает», «специфично распознает» или «специфично в отношении» относится к измеримым и воспроизводимым взаимодействиям, таким как связывание между мишенью и антигенсвязывающим белком (или цитокином и цитокиновым рецептором), которое является определяющим фактором присутствия мишени (или цитокина) в присутствии гетерогенной популяции молекул, включая биологические молекулы. Например, антигенсвязывающий белок (такой как Fab), который специфично связывается с мишенью (которая может быть эпитопом), представляет собой антигенсвязывающий белок, который связывает эту мишень с более сильным сродством, авидностью, с большей готовностью и/или в течение более продолжительного периода, чем он связывает другие цели. Цитокин, который специфично связывается с цитокиновым рецептором, представляет собой цитокин, который связывает этот цитокиновый рецептор с более сильным сродством, авидностью, с большей готовностью и/или в течение более продолжительного периода, чем он связывает другие цитокиновые рецепторы. В некоторых вариантах осуществления степень связывания антигенсвязывающего белка (или цитокина) с неродственной мишенью (или неродственным цитокиновым рецептором) составляет менее примерно 10% от связывания антигенсвязывающего белка (или цитокина) с мишенью согласно измерениям (или цитокинового рецептора согласно измерениям), например, с помощью радиоиммунного анализа (РИА). В некоторых вариантах осуществления антигенсвязывающий белок, который специфично связывается с мишенью (или цитокин, который специфично связывается с цитокиновым рецептором), имеет константу диссоциации (KD) ≤10-5 М, ≤10-6 М, ≤10-7 М, ≤10-8 М, ≤10-9 М, ≤10-10 М, ≤10-11 М или ≤10-12 М. В некоторых вариантах осуществления антигенсвязывающий белок (или цитокиновый рецептор) специфично связывает эпитоп на белке (или цитокине), который является консервативным эпитопом у белков от разных видов организмов. В некоторых вариантах осуществления специфичное связывание может необязательно включать эксклюзивное связывание. Специфичность связывания антигенсвязывающего белка (или цитокина и цитокинового рецептора) можно определить экспериментально с помощью любых способов связывания белка, известных в данной области. Такие методы включают, но не ограничиваются ими, вестерн-блоты, ELISA-, RIA-, ECL-, IRMA-, EIA-, BIACORE™ -анализы и сканирование пептидов.
[92] Термин «специфичность» относится к избирательному распознаванию антигенсвязывающим белком определенного эпитопа антигена. Природные антитела являются, например, моноспецифичными. Термин «мультиспецифичный», используемый в данном документе, означает то, что антигенсвязывающий белок обладает полиэпитопной специфичностью (т.е. способен специфично связываться с двумя, тремя или более разными эпитопами на одной биологической молекуле или способен специфично связываться с эпитопами на двух, трех или более разных биологических молекулах). Термин «биспецифичный», используемый в данном документе, означает то, что антигенсвязывающий белок имеет две различные специфичности связывания антигена. Если не указано иное, порядок, в котором перечислены антигены, связанные с биспецифичным антителом, является произвольным. То есть, например, термины «антитело к CD3/HER2», «антитело к HER2/CD3», «CD3×HER2» и «HER2×CD3» могут использоваться взаимозаменяемо для обозначения биспецифичных антител, которые специфично связываются как с CD3, так и с HER2. Термин «моноспецифичный», используемый в данном документе, обозначает антигенсвязывающий белок, который имеет один или несколько сайтов связывания, каждый из которых связывает один и тот же эпитоп одного и того же антигена.
[93] Используемый здесь термин «валентный» означает наличие определенного количества сайтов связывания в антигенсвязывающем белке. Например, природное антитело или полноразмерное антитело имеет два сайта связывания и является двухвалентным. Таким образом, термины «трехвалентный», «четырехвалентный», «пятивалентный» и «шестивалентный» обозначают наличие двух сайтов связывания, трех сайтов связывания, четырех сайтов связывания, пяти сайтов связывания и шести сайтов связывания, соответственно, в антигенсвязывающем белке.
[94] «Эффекторные функции антитела» относятся к такой биологической активности, которая относится к Fc-участку (Fc-участку с нативной последовательностью или Fc-участку варианта аминокислотной последовательности) антитела и варьируется в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и зависимую от комплемента цитотоксичность; связывание рецептора Fc; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточных рецепторов); и активацию В-клеток. «Сниженная или сведенная к минимуму» эффекторная функция антитела означает, что она снижена по меньшей мере на 50 % (альтернативно - на 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 96 %, 97 %, 98% или 99%) по сравнению с диким типом или немодифицированным антителом. Эффекторная функция антитела может быть легко определена и измерена специалистом в данной области. В предпочтительном варианте осуществления затрагиваются эффекторные функции антитела по связыванию комплемента, комплементзависимой цитотоксичности и антителозависимой цитотоксичности. В некоторых вариантах осуществления эффекторная функция устраняется посредством мутации в константном участке, устраняющей гликозилирование, например, «безэффекторная мутация». В некоторых вариантах осуществления безэффекторная мутация представляет собой мутацию N297A или DANA (D265A+N297A) в CH2 участке. Shields и др., J. Biol. Chem. 276 (9): 6591-6604 (2001). В альтернативном случае дополнительные мутации, приводящие к снижению или устранению эффекторной функции, включают: K322A и L234A/L235A (LALA). В качестве альтернативы, эффекторная функция может быть снижена или устранена при изготовлении с помощью таких методик, как экспрессия в клетках-хозяевах, в которых не происходит гликозилирования (например, в E. coli.), или которые приводят к измененному профилю гликозилирования, который неэффективен или менее эффективен для стимулирования эффекторной функции (например, Shinkawa и др., J. Biol. Chem. 278(5): 3466-3473 (2003).
[95] «Антителозависимая клеточно-опосредованная цитотоксичность» или ADCC относится к форме цитотоксичности, при которой секретируемый Ig связывается с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, естественных клетках-киллерах (NK), нейтрофилах и макрофагах), и при которой эти цитотоксические эффекторные клетки способны специфично связываться с несущей антиген клеткой-мишенью и затем уничтожать клетку-мишень цитотоксинами. Следуя этому механизму, антитела «вооружают» цитотоксические клетки, и они необходимы для уничтожения клетки-мишени. Первичные клетки для опосредования ADCC - NK-клетки - экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия Fc на гемопоэтических клетках представлена в таблице 2 на стр. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Оценить активность ADCC интересующей молекулы можно с помощью анализа ADCC in vitro, такого как описан в патенте США № 5500362 или 5821337. Полезные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценить in vivo, например, в животной модели, такой как раскрыта в Clynes и др., PNAS USA 95:652-656 (1998).
[96] «Комплементзависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с родственным им антигеном. Для оценки активации комплемента используют анализ CDC, например, как описано у Gazzano-Santoro и др., J. Immunol. Methods 202: 163 (1996). Варианты антител с измененными аминокислотными последовательностями Fc-участка и повышенной или пониженной способностью связывания с C1q описаны в патенте США № 6194551В1 и WO99/51642. Содержание этих патентных публикаций специально включено в настоящее описание ссылкой. См. также Idusogie и др. J. Immunol. 164: 4178-4184 (2000).
[97] Термин «Fc-участок», «фрагмент кристаллизуемого участка», «Fc-фрагмент» или «Fc-домен» в данном документе используется для определения С-концевого участка тяжелой цепи иммуноглобулина, включая Fc-участки нативной последовательности и варианты Fc-участков. Хотя границы Fc-участка тяжелой цепи иммуноглобулина могут варьироваться, начало Fc-участка тяжелой цепи человеческого IgG обычно определяют как положение аминокислотного остатка Cys226 или Pro230, а его конец определяется карбокси-концом. С-концевой лизин (остаток 447 в соответствии с системой нумерации ЕС) Fc-участка можно удалять, например, во время получения или очистки антитела или Fc-составного белка, или путем рекомбинантной инженерии нуклеиновой кислоты, кодирующей тяжелую цепь антитела или Fc-составного белка. Соответственно, композиция интактных антител может включать популяции антител, в которых удалены все остатки K447, популяции антител без удаленных остатков K447 и популяции антител, содержащие смесь антител с остатком K447 и без него. Подходящие Fc-участки с нативной последовательностью для применения в иммуноцитокинах, описанных в данном документе, включают человеческие IgG1, IgG2 (IgG2A, IgG2B), IgG3 и IgG4.
[98] Термин «изотип» или «подкласс» IgG, используемый в данном документе, означает любой из подклассов иммуноглобулинов, которые характеризуются химическими и антигенными свойствами своих константных областей. Различают пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно подразделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, γ, ε, γ и μ, соответственно. Строения субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и описаны, например, в Abbas и др. Cellular and Mol. Immunology, 4th ed. (W.B. Saunders, Co., 2000).
[99] «Fc-рецептор» или «FcR» описывает рецептор, который связывает Fc-участок антитела или составного Fc белка. Предпочтительный FcR представляет собой человеческий FcR с нативной последовательностью. Более того, предпочтительным FcR является тот, который связывает антитело IgG (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы альтернативного сплайсинга этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор ") и FcγRIIB ("ингибирующий рецептор"), которые имеют сходные аминокислотные последовательности, отличающиеся, прежде всего, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит мотив активации иммунорецептора на основе тирозина (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный мотив ингибитора на основе тирозина (ITIM) в своем цитоплазматическом домене. (См. M. Daeron, Annu. Rev. Immunol. 15:203-234 (1997). FcR рассмотрены в Ravetch и Kinet, Annu. Rev. Immunol. 9: 457-92 (1991); Cape и др., Immunomethods 4: 25-34 (1994); и de Haas и др., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, в том числе те, которые будут идентифицированы в будущем, охвачены в данном документе термином «FcR».
[100] Термин «Fc-рецептор» или «FcR» также включает неонатальный рецептор FcRn, который отвечает за перенос материнских IgG к плоду. Guyer и др., J. Immunol. 117: 587 (1976) и Kim и др., J. Immunol. 24: 249 (1994). Известны способы измерения связывания с FcRn (см, например, Ghetie и Ward, Immunol. Today 18: (12): 592-8 (1997); Ghetie и др., Nature Biotechnology 15 (7): 637-40 (1997); Hinton и др., J. Biol. Chem. 279 (8): 6213-6 (2004 г.); WO 2004/92219 (Hinton и др.). Связывание с FcRn in vivo и период полувывежегия их сыворотки человеческих полипептидов FcRn, обладающих высоким сродством связывания, можно проанализировать, например, в трансгенных мышах или трансфицированных клеточных линиях человека, экспрессирующих человеческий FcRn, или в приматах, которым вводят полипептиды, содержащие вариант Fc-участка. WO 2004/42072 (Presta) описывает варианты антител, которые улучшают или уменьшают связывание с FcR. См. также, например, Shields и др., J. Biol. Chem. 9(2): 6591-6604 (2001).
[101] «Сродство связывания» обычно относится к силе суммы нековалентных взаимодействий между одним участком связывания молекулы (например, антитела, антигенсвязывающего фрагмента (такого как лиганд, рецептор, VHH, scFv и т.д.) или цитокина) и его партнером по связыванию (например, антигеном (таким как молекула клеточной поверхности, рецептор, лиганд и т.д.) или рецептором цитокина). Если не указано иное, используемый здесь термин «сродство связывания» относится к характеристическому сродству связывания, которое отражает взаимодействие 1:1 между участниками связываемой пары. Сродство связывания может быть обозначена как Kd, KoFF, Kon или Ка. Термин «КoFF» в данном контексте относится к константе скорости диссоциации антитела (или его антигенсвязывающего фрагмента) из комплекса антитело (или антигенсвязывающий фрагмент)/антиген (например, комплекса лиганд-рецептор), или константе скорости диссоциации цитокина из комплекса цитокин/цитокиновый рецептор, которую определяют по набору кинетических данных и описывают в единицах сек-1. Термин «Кon» данном контексте означает константу скорости связывания антитела (или его антигенсвязывающего фрагмента) с антигеном с образованием комплекса антитело (или антигенсвязывающий фрагмент)/антиген, или константу скорости связывания цитокина с рецептором цитокина с образованием комплекса цитокин/рецептор цитокина, которую выражают в единицах M-1сек-1. Термин равновесная константа диссоциации «KD» или "Кd» в данном контексте, относится к константе диссоциации взаимодействия конкретного антитела (или его антигенсвязывающего фрагмента) с антигеном (или взаимодействия цитокина с цитокиновым рецептором) и описывает концентрацию антигена (или цитокина), необходимую для того, чтобы занять половину всех антитело-связывающих доменов (или антигенсвязывающего фрагмента), присутствующими в растворе молекулами антитела (или антигенсвязывающего фрагмента) (или рецептора цитокинов) в равновесном состоянии, и равно KoFF/Кon, выраженному в единицах M. Измерение Kd предполагает, что все связывающие вещества находятся в растворе. В случае, когда антитело (или его антигенсвязывающий фрагмент) связано с клеточной стенкой, например, в системе экспрессии дрожжей, соответствующая константа скорости равновесия выражается как EC50, что дает хорошее приближение к Kd. Константа сродства - Kа - является обратной величиной константы диссоциации Kd и выражается в единицах M-1. Константа диссоциации (KD или Кd) используется в качестве индикатора, показывающего сродство антител (или их антигенсвязывающих фрагментов) к антигенам (или цитокинов к рецепторам цитокинов). Например, можно проводить простой анализ по методу Скэтчарда с использованием антител (или их антигенсвязывающих фрагментов), меченых различными маркерными агентами, или с помощью BIACORE™ X (производство Amersham Biosciences), который представляет собой продаваемый в розницу измерительный набор или аналогичный набор, в соответствии с руководством пользователя и методом проведения эксперимента, прилагаемым к набору. КD значение, которое может быть получено с использованием этих методов, выражается в единицах М (моль). Антитело или его антигенсвязывающий фрагмент (или цитокин), которое специфично связывается с мишенью (или рецептором цитокина), может иметь константу диссоциации (Kd), например, ≤10-5 М, ≤10-6 М, ≤10-7 М, ≤10-8 М, ≤10-9 М, ≤10-10 М, ≤10-11 М или ≤10-12 М.
[102] Концентрация полумаксимального ингибирования (IC50) является мерой эффективности вещества (такого как антитело или антигенсвязывающий фрагмент) в подавлении конкретной биологической или биохимической функции. Она указывает на количество конкретного лекарственного средства или другого вещества (ингибитора, такого как антитело или антигенсвязывающий фрагмент), которое необходимо для подавления данного биологического процесса наполовину. Значения обычно выражаются в виде молярной концентрации. IC50 сравнима с «EC50» для лекарственного средства-агониста или другого вещества (такого как антитело, антигенсвязывающий фрагмент или цитокин). ЕС50 также представляет собой концентрацию в плазме, необходимую для получения 50% от максимального эффекта in vivo. Используемый здесь термин «IC50» используется для обозначения эффективной концентрации антитела или антигенсвязывающего фрагмента, необходимой для нейтрализации 50% биологической активности антигена in vitro. IC50 или ЕС50 можно измерить с помощью биологических анализов, таких как ингибирование связывания лиганда с помощью анализа FACS (анализ конкурентного связывания), анализа высвобождения цитокинов на основе клеток или гомогенного анализа усиления люминесценции при сближении (AlphaLISA).
[103] «Ковалентная связь» в данном контексте относится к стабильной связи между двумя атомами, имеющими один или несколько общих электронов. Примеры ковалентных связей включают, но не ограничиваются ими, пептидные связи и дисульфидные связи. В данном контексте термин «пептидная связь» относится к ковалентной связи, образованной между карбоксильной группой аминокислоты и аминогруппой соседней аминокислоты. «Дисульфидная связь» в данном контексте относится к ковалентной связи между двумя атомами серы, такой как соединение двух Fc-фрагментов (или цитокиновых субъединиц) посредством одной или нескольких дисульфидных связей. Одна или несколько дисульфидных связей могут образоваться между двумя фрагментами при связывании тиоловых групп в двух фрагментах. В некоторых вариантах осуществления одна или несколько дисульфидных связей может быть образована между одним или несколькими цистеинами двух Fc-фрагментов. Дисульфидные связи могут образовываться при окислении двух тиоловых групп. В некоторых вариантах осуществления ковалентное связывание обусловлено непосредственно ковалентной связью. В некоторых вариантах осуществления ковалентное связывание осуществляется за счет пептидной связи или дисульфидной связи.
[104] «Процент (%) идентичности аминокислотной последовательности» и «гомология», относящиеся к последовательности пептида, полипептида или антитела определяются как процентная доля аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретном пептиде или полипептидной последовательности, после выравнивания последовательностей и, при необходимости, введения промежутков, для достижения максимальной процентной идентичности последовательности, и без учета каких-либо консервативных замен как части идентичности последовательности. Выравнивание с целью определения процентной идентичности аминокислотной последовательности может быть достигнуто различными способами, известными специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или MEGALIGN™ (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для измерения выравнивания, включая любые алгори™ы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
[105] Используемый здесь термин «С-конец» полипептида относится к последнему аминокислотному остатку полипептида, который предоставляет свою аминогруппу для образования пептидной связи с карбоксильной группой соседнего с ним аминокислотного остатка. «N-конец» полипептида, используемый здесь, относится к первой аминокислоте полипептида, которая предоставляет свою карбоксильную группу для образования пептидной связи с аминогруппой соседнего аминокислотного остатка.
[106] «Выделенная» или «изолированная» молекула нуклеиновой кислоты, кодирующая конструкцию, антитело или его антигенсвязывающий фрагмент, описанные в данном документе, представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в среде, в которой она была получена. Предпочтительно, чтобы выделенная нуклеиновая кислота не была ассоциирована с какими-либо компонентами, связанными со средой, получающейся при производстве. Выделенные молекулы нуклеиновой кислоты, кодирующие описанные здесь конструкции, полипептиды и антитела, находятся в форме, отличающейся от формы или условий, в которых они встречаются в природе. Таким образом, выделенные молекулы нуклеиновой кислоты отличаются от нуклеиновой кислоты, кодирующей конструкции, полипептиды и антитела, описанные в данном документе, существующие в природных клетках. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в хромосомном положении, которое отличается от ее природного хромосомного местоположения.
[107] Термин «контрольные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регулирующие последовательности, подходящие для прокариот, например, включают промотор, необязательно операторную последовательность и сайт связывания рибосомы. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
[108] Нуклеиновая кислота является «функционально связанной», если она введена в функциональную взаимосвязь с другой последовательностью нуклеиновой кислоты. Например, ДНК препоследовательности или секреторного лидера функционально связана с ДНК полипептида, если она экспрессируется в виде белка-предшественника, который участвует в выработке полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы обеспечить трансляцию. Как правило, «функционально связанный» означает, что связываемые последовательности ДНК являются смежными, а в случае секреторного лидера - смежными и находятся в фазе считывания. Однако энхансеры не обязательно должны быть смежными. Связывание осуществляется лигированием в удобных сайтах рестрикции. Если таких сайтов не существует, то используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с общепринятой практикой.
[109] Термин «вектор», используемый в данном документе, относится к молекуле нуклеиновой кислоты, способной к размножению другой нуклеиновой кислоты, с которой она связана. Термин включает вектор как самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он был введен. Некоторые векторы способны направлять экспрессию нуклеиновых кислот, с которыми они функционально связаны. Такие векторы называются здесь «векторами экспрессии».
[110] Используемый здесь термин «трансфицированный», или «трансформированный», или «трансдуцированный» относится к процессу, с помощью которого экзогенная нуклеиновая кислота переносится или вводится в клетку-хозяина. «Трансфицированная», или «трансформированная», или «трансдуцированная» клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку и ее потомство.
[111] Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство независимо от количества пересевов. Потомство может не быть полностью идентичным исходной клетке по содержанию нуклеиновых кислот и может содержать мутации. Мутантное потомство, обладающее той же функцией или биологической активностью, что и скринированные или отобранные в исходно трансформированной клетке, включены в настоящий документ.
[112] Термин «фармацевтическая рецептура» или «фармацевтический состав» относится к препарату, который находится в такой форме, которая обеспечивает эффективность биологической активности активного ингредиента, и который не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому будет введена эта рецептура. Такие рецептуры стерильны. «Стерильная» рецептура является асептической или свободной от всех живых микроорганизмов и их спор.
[113] Понятно, что варианты осуществления изобретения, описанные здесь, включают варианты осуществления, «состоящие» и/или «практически состоящие из».
[114] Ссылка на значение или параметр «примерно» в данном документе включает (и описывает) варианты, которые относятся к этому значению или параметру, как таковые. Например, описание, относящееся к «примерно X», включает в себя описание «X».
[115] Используемая здесь ссылка на «не» в применении к значению или параметру обычно означает и описывает «отличное от» значение или параметр. Например, способ не используется для лечения рака типа X означает, что метод используется для лечения рака других типов, кроме X.
[116] Используемый здесь термин «примерно X-Y» имеет то же значение, что и «от примерно X до примерног Y».
[117] Используемые здесь и в прилагаемой формуле изобретения формы единственного числа включают ссылки на формы множественного числа, если из контекста явно не следует иное.
II. Иммуноцитокины
[118] Настоящее изобретение в одном аспекте относится к иммуноцитокину, содержащему цитокин или его вариант, расположенный в шарнирном участке тяжелой цепи антитела или расположенный в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором или фрагментом антитела) и субъединицей Fc-домена или ее частью. Исходное антитело, которое служит каркасом для конструирования иммуноцитокинов, описанных в данном документе, может представлять собой любой вид антитела или антигенсвязывающего фрагмента, содержащий тяжелую цепь, содержащую шарнирный участок, такой как полноразмерное 4-цепочечное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент (например, scFv, Fab), составленный с субъединицей Fc-домена или ее частью (например, CH2+CH3 или только CH2) через шарнирный участок. Исходный антигенсвязывающий белок, который служит каркасом для конструирования иммуноцитокинов, описанных в данном документе, также может представлять собой составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок антигенсвязывающий фрагмент-шарнир-Fc, содержащий два составных полипептида антигенсвязывающий фрагмент-шарнир-Fc, каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, лиганд или рецептор), шарнирный участок и субъединицу Fc-домена или ее часть.
[119] В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент (например, scFv, Fab), составленное с субъединицей Fc-домена или ее частью его через шарнирный участок), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка тяжелой цепи полноразмерного антитела или между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка). В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, и при этом тяжелая цепь содержит, от N-конца к С-концу: домен VH, необязательно домен CH1, цитокин или его вариант в шарнирном участке, домен CH2 и необязательно домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: первый домен VH, необязательно первый CH1, цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN -γ, IL-10, IL-12 или IL-23) или его вариант в первом шарнирном участке (например, цитокиновый фрагмент находится между С-концом СН1 и N-концом шарнирного участка или между С-концом шарнирного участка и N-концом субъединицы Fc-домена или внутри шарнирного участка) и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй домен VH, необязательно второй домен CH1, второй шарнирный участок и вторую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); (c) третий антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: первый домен VL и необязательно первый CL; и (d) четвертый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй домен VL и необязательно второй CL; при этом первый VH и первый VL и, необязательно, первый CH1 и первый CL образуют первый антигенсвязывающий домен (например, Fab), специфично распознающий первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и при этом второй VH и второй VL и необязательно второй CH1 и второй CL образуют второй антигенсвязывающий домен (например, Fab), специфично распознающий второй антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8). В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, содержит полноразмерное исходное антитело (далее также именуемое «иммуноцитокин с полноразмерным антителом»). Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4 , CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, причем цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок антигенсвязывающий фрагмент-шарнир-Fc (соответствующий иммуноцитокин в дальнейшем также упоминается как «иммуноцитокин составного белка Fc»), такой как составной белок scFv-шарнир-Fc, составной белок VHH-шарнир-Fc, составной белок лиганд-шарнир-Fc или составной белок рецептор-шарнир-Fc. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления исходный составной белок «антигенсвязывающий фрагмент-шарнир-Fc», используемый в качестве основы для конструирования иммуноцитокина, описанного в данном документе, содержит два составных полипептида «антигенсвязывающий фрагмент-шарнир-Fc», каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), шарнирный участок и субъединицу Fc-домена или ее часть. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) составной белок антигенсвязывающий фрагмент-шарнир-Fc, специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где составной белок антигенсвязывающий фрагмент-шарнир-Fc содержит составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: первый антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант в первой шарнирном участке (например, цитокиновый фрагмент находится между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка, между С-концом шарнирного участка и N-концом субъединицы Fc-домена или внутри шарнирного участка) и первую субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH или scFv), второй шарнирный участок и вторую субъединицу Fc-домена или его часть (например, CH2+CH3 или только CH2); при этом первый антигенсвязывающий фрагмент специфично распознает первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и где второй антигенсвязывающий фрагмент специфично распознает второй антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8). В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с целевым антигеном, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (такой как не более, чем 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1 %, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина, при этом активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более чем примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления антитело (например, полноразмерное антитело или его антигенсвязывающий фрагмент, составленный с Fc-доменом или его частью) содержит две тяжелые цепи, каждая из которых содержит шарнирный участок, и только одна тяжелая цепь содержит цитокин или его вариант, расположенный в шарнирном участке. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) содержит два антигенсвязывающих полипептида (например, тяжелая цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), каждый из которых содержит шарнирный участок, и где только один антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) содержит два антигенсвязывающих полипептида (например, тяжелая цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), каждый из которых содержит шарнирный участок, и где каждый антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления антитело (например, полноразмерное антитело или его антигенсвязывающий фрагмент, составленный с Fc-доменом или его частью) содержит две тяжелые цепи, каждая из которых содержит шарнирный участок, и каждая тяжелая цепь содержит цитокин или его вариант, расположенный в шарнирном участке. В некоторых вариантах осуществления иммуноцитокин содержит два или более (например, 2, 3, 4, 5 или более) цитокина или их варианта, где два или более цитокина или их варианта расположены последовательно (например, необязательно соединены через пептидный линкер) в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи антитела или составного полипептида антигенсвязывающий фрагмент-шарнир-Fc, такого как составной полипептид лиганд/рецептор-шарнир-Fc). В некоторых вариантах осуществления цитокин или его вариант представляет собой мономерный цитокин или его вариант, такой как IL-2 или IFN-α (например, IFN-α2a, IFN-α2b, IFN-α2c). В некоторых вариантах осуществления цитокин или его вариант представляет собой димерный цитокин или его вариант. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант, такой как IL-10 или IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант, такой как IL-12 или IL-23. В некоторых вариантах осуществления обе субъединицы димерного цитокина или его варианта расположены последовательно (например, необязательно соединены через пептидный линкер) в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи антитела или составного полипептида антигенсвязывающий фрагмент-шарнир-Fc, такого как составной полипептид лиганд/рецептор-шарнир-Fc). В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) содержит два антигенсвязывающих полипептида (например, тяжелые цепи или составные полипептиды антигенсвязывающий фрагмент-шарнир-Fc, такие как составные полипептиды лиганд/рецептор-шарнир-Fc), каждый из которых содержит шарнирный участок, одна субъединица димерного цитокина или его варианта расположена в шарнирном участке одного антигенсвязывающего полипептида (например, тяжелой цепи или составного полипептида антигенсвязывающий фрагмент-шарнир-Fc, такого как составной полипептид лиганд/рецептор-шарнир-Fc), а другая субъединица димерного цитокина или его варианта расположены в шарнирном участке другого антигенсвязывающего полипептида (например, тяжелой цепи или составного полипептида антигенсвязывающий фрагмент-шарнир-Fc, такого как составной полипептид лиганд/рецептор-шарнир-Fc). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гетеродимерным. В некоторых вариантах осуществления два или более цитокина или их варианта являются одинаковыми. В некоторых вариантах осуществления два или более цитокина или их варианта различаются. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является мультиспецифичным. В некоторых вариантах осуществления цитокин или его вариант выбирают из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IL-35, IFN-α, IFN-β, IFN-γ, TNF-α, TGF-β, эритропоэтин, VEGF, тромбопоэтин, G-CSF, M-CSF, SCF и GM-CSF. В некоторых вариантах осуществления цитокин или его вариант расположены между С-концом антигенсвязывающего фрагмента (например, scFv, VHH, лиганда, рецептора) и N-концом шарнирного участка антигенсвязывающего полипептида. В некоторых вариантах осуществления тяжелая цепь антитела (например, полноразмерного антитела) содержит константный участок 1 (СН1), а цитокин или его вариант расположены между С-концом СН1 и N-концом шарнирного участка тяжелой цепи антитела. В некоторых вариантах осуществления цитокин или его вариант расположены между С-концом шарнирного участка и N-концом субъединицы Fc-домена (или ее части) антигенсвязывающего полипептида (например, тяжелой цепи антитела, или составного белка антигенсвязывающий фрагмент-шарнир-Fc). В некоторых вариантах осуществления цитокин или его вариант расположен в шарнирном участке (например, заменяют часть внутри шарнирного участка, встраиваются в шарнирный участок и вводят одну или несколько дополнительных шарнирных или линкерных аминокислот, или встраиваются в шарнирный участок без удаления аминокислоты шарнирного участка) антигенсвязывающего полипептида (например, тяжелой цепи антитела или его фрагмента, или составного белка антигенсвязывающий фрагмент-шарнир-Fc, такого как составной белок лиганд/рецептор-шарнир-Fc). В некоторых вариантах осуществления антигенсвязывающий полипептид (например, тяжелая цепь антитела или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), такой как субъединица Fc-домена или ее часть, содержит мутацию типа «выступы во впадины» (KIH) (например, каждый антигенсвязывающий полипептид (например, тяжелая цепь полноразмерного антитела) содержит мутацию KIH). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело-агонист (или его антигенсвязывающий фрагмент) или лиганд (например, PD-L2, PD-L1, CD80 или CD86), которые могут активировать или стимулировать иммуносупрессивный сигнальный путь (например, путем связывания с ингибирующей молекулой контрольной точки иммунного ответа, такой как PD-1 или CTLA-4, на клетке-мишени), а цитокин или его вариант представляет собой иммуностимулирующий цитокин или его вариант (например, IL-2, IL-12 или IL-23). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело-антагонист (или его антигенсвязывающий фрагмент), лиганд или рецептор, который может ослаблять или блокировать иммуностимулирующий сигнальный путь (например, путем связывания со стимулирующей молекулой контрольной точки иммунного ответа, такой как CD27 или CD28, или иммуностимулирующим рецептором, таким как IL-2R), а цитокин или его вариант представляет собой иммуностимулирующий цитокин или его вариант (например, IL-2, IL-12 или IL-23). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело-антагонист (или его антигенсвязывающий фрагмент), лиганд или рецептор, который может ослаблять или блокировать иммуносупрессивный сигнальный путь (например, путем связывания с ингибирующей молекулой контрольной точки иммунного ответа, такой как PD-1 или CTLA-4), а цитокин или его вариант представляет собой иммуносупрессивный цитокин или его вариант (например, IL-10, IL-27, IL-35, TGF-β). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело-агонист (или его антигенсвязывающий фрагмент) или лиганд (например, CD70, CD80, CD86 или IL-2), которые могут активировать или стимулировать иммуностимулирующий сигнальный путь (например, путем связывание со стимулирующей молекулой контрольной точки иммунного ответа, такой как CD27 или CD28, или с иммуностимулирующим рецептором, таким как IL-2R), а цитокин или его вариант представляет собой иммуносупрессивный цитокин или его вариант (например, IL-10, IL-27, IL- 35, TGF-β).
[120] В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него); и где при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH , scFv, Fab) с антигеном-мишенью, активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него); и где в отсутствии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH , scFv, Fab) с антигеном-мишенью, активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более чем примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него); где при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH , scFv, Fab) с антигеном-мишенью, активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью); и где в отсутствии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH , scFv, Fab) с антигеном-мишенью, активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более чем примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленные с субъединицей Fc-домена или его частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую шарнирный участок, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка тяжелой цепи полноразмерного антитела или между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка); и где при наличии связывания антитела (или его антигенсвязывающего фрагмента) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем на примерно 20% (например, не менее чем на примерно 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с антигеном-мишенью. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленные с субъединицей Fc-домена или его частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую шарнирный участок, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка тяжелой цепи полноразмерного антитела или между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка); и где в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенных в шарнирном участке составляет не более, чем примерно 70% (например, не более чем примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) по сравнению с активностью соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленные с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую шарнирный участок, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка тяжелой цепи полноразмерного антитела или между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка); где при наличии связывания антитела (или его антигенсвязывающего фрагмента) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем на примерно 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с антигеном-мишенью; и в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4 %, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где при наличии связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем на примерно 20% (например, не менее чем на примерно 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания полноразмерного антитела с антигеном-мишенью. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где в отсутствие связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7% , 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, причем цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; где при наличии связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания полноразмерного антитела с антигеном-мишенью; и где в отсутствие связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7% , 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина, при этом активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более чем примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом.
[121] В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит два антигенсвязывающих полипептида (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где первый цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него) первого антигенсвязывающего полипептида, и где второй цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него) второго антигенсвязывающего полипептида. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит две тяжелые цепи, каждая из которых содержит шарнирный участок, где первый цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первой тяжелой цепи антитела, и где второй цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) второй тяжелой цепи антитела. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит две тяжелые цепи, где первая тяжелая цепь содержит, от N-конца к С-концу: домен VH, необязательно домен CH1, первый цитокин или его вариант в первом шарнирном участке, домен CH2 и необязательно домен CH3; и где вторая тяжелая цепь содержит, от N-конца к С-концу: домен VH, необязательно домен CH1, второй цитокин или его вариант во втором шарнирном участке, домен CH2 и необязательно домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где первый цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первой тяжелой цепи полноразмерного антитела, где второй цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) второй тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления первая тяжелая цепь и первая легкая цепь антитела образуют первый антигенсвязывающий фрагмент (например, первый Fab), специфично распознающий первый антиген-мишень, а вторая тяжелая цепь и вторая легкая цепь антитела образует второй антигенсвязывающий фрагмент (например, второй Fab), специфично распознающий второй антиген-мишень. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH , scFv, Fab) с целевым антигеном (например, связывания первого антигенсвязывающего фрагмента, такого как Fab или лиганд, с первым целевым антигеном и/или связывания второго антигенсвязывающего фрагмента, такого как такого как Fab или лиганд, с вторым антигеном-мишенью) активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) первого и/или второго цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания антиген-связывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, V HH, scFv, Fab) с антигеном-мишенью (ни антигенсвязывающий фрагмент, такой как Fab, ни лиганд не связывается с антигеном-мишенью). В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью (например, ни антигенсвязывающий фрагмент, такой как Fab, ни лиганд не связывается с антигеном-мишенью), активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) первого и/или второго цитокина или его/их варианта(-ов), расположенного(-ых) в шарнирном участке каждого антигенсвязывающего полипептида (например, тяжелой цепи антитела или полипептида антигенсвязывающий фрагмент-шарнир-Fc), составляет не более чем примерно 70% (например, не более чем примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9% 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего первого и/или второго цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления первый и/или второй цитокин или его вариант представляют собой вариант цитокина, и при этом активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления два цитокина или их варианта являются одинаковыми. В некоторых вариантах осуществления два цитокина или их варианта различаются. В некоторых вариантах осуществления первый цитокин или его вариант представляет собой IL-2 или его вариант (например, SEQ ID NO: 2). В некоторых вариантах осуществления второй цитокин или его вариант представляет собой IL-12 или его вариант (например, SEQ ID NO: 36). В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом.
[122] В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор , VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где первый цитокин или его вариант и второй цитокин или его вариант расположены последовательно (например, соединенный через необязательный пептидный линкер) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) антигенсвязывающего полипептида. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или их вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где первый цитокин или его вариант и второй цитокин или его вариант расположены последовательно (например, соединены через необязательный пептидный линкер) в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или его частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и где антитело содержит тяжелую цепь, содержащую, от N-конца до С-конца: домен VH, необязательно домен CH1, первый цитокин или его вариант в шарнирном участке, необязательно линкер (например, пептидный линкер), второй цитокин или его вариант, домен CH2 и необязательно домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); b) первый цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и c) второй цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где первый цитокин или его вариант и второй цитокин или его вариант расположены последовательно (например, соединены через необязательный пептидный линкер) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, такого антитела, как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с целевым антигеном, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) первого и второго цитокинов или их вариантов повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (такого, как лиганд, рецептор, VHH, scFv, Fab) с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) первого и второго цитокинов или их вариантов, расположенных в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи антитела или составного белка антигенсвязывающий фрагмент-шарнир-Fc) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10% , 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2 %, 0,1% или 0%) от активности соответствующих первого и второго цитокинов или их вариантов в свободном состоянии. В некоторых вариантах осуществления первый и/или второй цитокин или его вариант представляют собой вариант цитокина, и при этом активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления два цитокина или их варианта являются одинаковыми. В некоторых вариантах осуществления два цитокина или их варианта различаются. В некоторых вариантах осуществления первый цитокин или его вариант представляет собой IL-2 или его вариант (например, SEQ ID NO: 2). В некоторых вариантах осуществления второй цитокин или его вариант представляет собой IL-12 или его вариант (например, SEQ ID NO: 36). В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом.
[123] В некоторых вариантах осуществления цитокин или его вариант представляет собой димерный цитокин или его вариант. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант, такой как IL-10 или IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант, такой как IL-12 или IL-23. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где обе субъединицы димерного цитокина или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из последовательностей SEQ ID NO: 227-229) в шарнирном участке (например, на его N'-конце, на C'-конце или внутри него) антигенсвязывающего полипептида. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где обе субъединицы димерного цитокина или их варианты расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую, от N-конца к C-концу: домен VH, необязательно домен CH1, [первую субъединицу димерного цитокина или его варианта, необязательно линкер (например, пептидный линкер), вторую субъединицу димерного цитокина или его варианта] в шарнирном участке, домен CH2 и необязательно домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где обе субъединицы димерного цитокина или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из последовательностей SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, такого антитела, как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с целевым антигеном, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) димерного цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (такого, как лиганд, рецептор, VHH, scFv, Fab) с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) димерного цитокина или его варианта, расположенного в шарнирном участке антигенсвязывающего полипептида (например, тяжелой цепи антитела или составного белка антигенсвязывающий фрагмент-шарнир-Fc) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10% , 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2 %, 0,1% или 0%) от активности соответствующего димерного цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления димерный цитокин или его вариант представляет собой вариант димерного цитокина, и активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта димерного цитокина в свободном состоянии составляет не более примерно 80% (например, не более чем примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего димерного цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант, такой как IL-10 или IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант, такой как IL-12 или IL-23. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом.
[124] В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной лиганд/рецептор-шарнир-Fc белок), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит два антигенсвязывающих полипептида (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH) , шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2); где одна субъединица димерного цитокина или его варианта расположена в шарнирном участке (например, на его N'-конце, на С'-конце или внутри него) первого антигенсвязывающего полипептида, а другая субъединица димерного цитокина или его варианта расположена в шарнирном участке (например, не его N'-конце, на C'-конце или внутри него) второго антигенсвязывающего полипептида. В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело, специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а цитокин или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит две тяжелые цепи, каждая из которых содержит шарнирный участок, при этом одна субъединица димерного цитокина или его варианта расположена в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первой тяжелой цепи, а другая субъединица димерного цитокина или его варианта расположена в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) второй тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит две тяжелые цепи, где первая тяжелая цепь включает, от N-конца к C-концу: домен VH, необязательно домен CH1, первую субъединицу димерного цитокина или его варианта в первом шарнирном участке, домен CH2 и, необязательно, домен CH3, и где вторая тяжелая цепь включает, от N-конца к С-концу: домен VH, необязательно домен CH1, вторую субъединицу димерного цитокина или его варианта во второй шарнирном участке, домен CH2 и, необязательно, домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) димерный цитокин (например, IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где одна субъединица димерного цитокина или его варианта расположена в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первой тяжелой цепи полноразмерного антитела, а другая субъединица димерного цитокина или его варианта расположена на шарнирном участке (например, между С-концом СН1 и N-концом шарнирного участка) второй тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления первая тяжелая цепь и первая легкая цепь антитела образуют первый антигенсвязывающий фрагмент (например, первый Fab), специфично распознающий первый антиген-мишень, а вторая тяжелая цепь и вторая легкая цепь антитела образует второй антигенсвязывающий фрагмент (например, второй Fab), специфично распознающий второй антиген-мишень. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с целевым антигеном (например, связывания первого антигенсвязывающего фрагмента, такого как Fab или лиганд, с первым целевым антигеном и/или связывания второго антигенсвязывающего фрагмента, такого как Fab или лиганд, с вторым антигеном-мишенью) активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) димерного цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания антиген-связывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, V HH, scFv, Fab) с антигеном-мишенью (например, ни антигенсвязывающий фрагмент, такой как Fab, ни лиганд не связывается с антигеном-мишенью). В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью (например, ни антигенсвязывающий фрагмент, такой как Fab, ни лиганд не связывается с антигеном-мишенью), активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) димерного цитокина или его варианта, если каждая субъединица расположена в шарнирном участке каждого антигенсвязывающего полипептида (например, тяжелой цепи антитела или полипептида антигенсвязывающий фрагмент-шарнир-Fc), составляет не более чем примерно 70% (например, не более чем примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9% 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего димерного цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления димерный цитокин или его вариант представляет собой вариант цитокина, и где активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта димерного цитокина в свободном состоянии составляет не более примерно 80% (например, не более чем примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего димерного цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант, такой как IL-10 или IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант, такой как IL-12 или IL-23. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом.
[125] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-2 или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где IL-2 или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а IL-2 или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок) специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) анти-IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, и где тяжелая цепь содержит, от N-конца к С-концу: домен VH, необязательно, домен CH1, IL-2 или его вариант в шарнирном участке, домен CH2 и, необязательно, домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-2, содержащий одну или несколько мутаций в положении, выбранном из группы, состоящей из L18, Q22, F24, K35, R38, F42, K43, E61 и P65, соответствующем положению в IL-2 дикого типа, содержащем последовательность SEQ ID NO: 1, где вариант IL-2 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-2, содержащий одну или несколько мутаций, выбранных из группы, состоящей из F24A, R38D, K43E, E61R и P65L, в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1, где вариант IL-2 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-2, содержащий мутацию R38D/K43E/E61R, в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1, где вариант IL-2 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-2, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-2, содержащий последовательность SEQ ID NO: 2, где вариант IL-2 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IL-2 в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IL-2 дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[126] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к HER2, содержащий: а) полноразмерное антитело, специфично распознающее HER2; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 156. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащую последовательность SEQ ID NO: 156, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[127] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD3, содержащий: а) полноразмерное антитело, специфично распознающее CD3; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 96. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 96, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[128] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к PD-1, содержащий: а) полноразмерное антитело, специфично распознающее PD-1; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 108. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 108, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[129] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD4, содержащий: а) полноразмерное антитело, специфично распознающее CD4; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 79. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 79, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[130] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD8, содержащий: а) полноразмерное антитело, специфично распознающее CD8; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 119. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 119, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[131] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CTLA-4, содержащий: а) полноразмерное антитело, специфично распознающее CTLA-4; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 131. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 131, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[132] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к PD-L1, содержащий: а) полноразмерное антитело, специфично распознающее PD-L1; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 144. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 144, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[133] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD25, содержащий: а) полноразмерное антитело, специфично распознающее CD25; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащую последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 169. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IL-2, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 169, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[134] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-2 («иммуноцитокин IL-2/PD-L2-Fc»), содержащий: а) составной полипептид PD-L2-шарнир-Fc, содержащий, от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок и субъединицу Fc-домена или ее часть; и b) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), и где IL-2 или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 180. В некоторых вариантах осуществления предложен иммуноцитокин IL-2/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-2, расположенный в шарнирном участке, содержащий последовательность SEQ ID NO: 180, и составной полипептид PD-L2-шарнир-Fc содержит последовательность SEQ ID NO: 179. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-2 или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-2 или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[135] В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-α (например, IFN-α2b) или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-α (например, IFN-α2b) или его вариант (например, любая из SEQ ID NO: 3-9), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где IFN-α или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, а IFN-α или его вариант расположен в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-α (например, IFN-α2b) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где IFN-α (например, IFN-α2b) или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD -1, CD3, CD4, CD123 или CD8); и b) IFN-α (например, IFN-α2b) или его вариант, где антитело содержит тяжелую цепь, и при этом тяжелая цепь содержит, от N-конца к C-концу: домен VH, необязательно домен CH1, IFN-α (например, IFN-α2b) или его вариант в шарнирном участке, домен CH2 и, необязательно, домен CH3. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-α (например, IFN-α2b) или его вариант, где IFN-α (например, IFN-α2b) или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-α (например, IFN-α2b), содержащий одну или несколько мутаций в положении, выбранном из группы, состоящей из R22, L26, F27, L30, K31, D32, R33, H34, D35, F36, S68, T79, K83, Y85, Y89, R120, K121, Y122, Q124, Y129, K131, E132, R144 и E146, соответствующем положению в IFN-α, содержащем последовательность SEQ ID NO: 3, где вариант IFN-α (например, IFN-α2b) расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-α (например, IFN-α2b), содержащий одну или несколько мутаций, выбранных из группы, состоящей из L30А, K31A, D32A, R33A, H34A и D35A относительно IFN-α дикого типа, содержащего последовательность SEQ ID NO: 3, где вариант IFN-α (например, IFN-α2b) расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-α (например, IFN-α2b), содержащий любую последовательность из SEQ ID NO: 4-9, где вариант IFN-α (например, IFN-α2b) расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-α (например, IFN-α2b), содержащий мутацию L30A в отличие от IFN-α, содержащего последовательность SEQ ID NO: 3, где вариант IFN-α (например, IFN-α2b) расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b), содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-α (например, IFN-α2b), содержащий последовательность SEQ ID NO: 4, где вариант IFN-α (например, IFN-α2b) расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IFN-α (например, IFN-α2b) в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IFN-α (например, IFN-α2b) дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[136] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IL-2/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к HER2, содержащий: a) полноразмерное антитело, специфично распознающее HER2; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 157. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 157, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[137] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IL-2/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD3, содержащий: a) полноразмерное антитело, специфично распознающее CD3; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 97. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 97, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[138] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α (например, IFN-α2b) или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к PD-1, содержащий: a) полноразмерное антитело, специфично распознающее PD-1; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α (например, IFN-α2b) или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α (например, IFN-α2b), расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 109. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 109, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IFN-α (например, IFN-α2b) или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[139] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD4, содержащий: a) полноразмерное антитело, специфично распознающее CD4; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 80. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 80, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α (например, IFN-α2b) или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[140] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD8, содержащий: a) полноразмерное антитело, специфично распознающее CD8; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 120. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 120, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[141] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CTLA-4, содержащий: a) полноразмерное антитело, специфично распознающее CTLA-4; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 132. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 132, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[142] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к PD-L1, содержащий: a) полноразмерное антитело, специфично распознающее PD-L1; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α (например, IFN-α2b), расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 145. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 145, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[143] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом CH1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD25, содержащий: a) полноразмерное антитело, специфично распознающее CD25; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), где IFN-α или его вариант расположен в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-α (например, IFN-α2b), расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 170. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b)/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IFN-α, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 170, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[144] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-α (например, IFN-α2b) («иммуноцитокин IFN-α/PD-L2-Fc»), содержащий: a) составной полипептид PD-L2-шарнир-Fc, содержащий, от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59) и субъединицу Fc-домена или ее часть; и b) IFN-α (например, IFN-α2b) или его вариант (например, любую из SEQ ID NO: 3-9), и где IFN-α или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления вариант IFN-α (например, IFN-α2b) содержит последовательность SEQ ID NO: 4. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IFN-α (например, IFN-α2b), расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 182. В некоторых вариантах осуществления предложен иммуноцитокин IFN-α/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IFN-α, расположенный в шарнирном участке, который содержит последовательность SEQ ID NO: 182, и составной полипептид PD-L2-шарнир-Fc, который содержит последовательность SEQ ID NO: 181. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-α (например, IFN-α2b) или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0% ) соответствующего цитокина IFN-α или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[145] В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-γ или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, и обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок) специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где указанное антитело содержит тяжелую цепь, включающую, от N-конца к С-концу: домен VH, необязательно домен CH1, [первую субъединицу IFN-γ или ее вариант (например, любую из SEQ ID NO: 10-17), необязательно линкер (например, пептидный линкер), вторую субъединицу IFN-γ или его варианта (например, любую из SEQ ID NO: 10-17)] в шарнирном участке, домен СН2 и, необязательно, домен СН3. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, содержащий одну или несколько мутаций в одной или обеих субъединицах IFN-γ в положении, выбранном из группы, состоящей из V5, S20, D21, V22, A23, D24, N25, G26, H111 и Q115, соответствующем положению в субъединице IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10, где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, содержащий одну или несколько мутаций в одной или обеих субъединицах IFN-γ, выбранных из группы, состоящей из S20A, D21A, D21K, V22A, A23S, A23E, A23Q, A23V, D24A, D24E, N25A, N25K и H111D, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10, где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, содержащий одну или несколько мутаций в одной или обеих субъединицах IFN-γ, выбранных из группы, состоящей из S20A/D21A, D21K, V22A/A23S, D24A/N25A, A23E/D24E/N25K, A23Q и A23V, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10, где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, где одна или обе субъединицы варианта IFN-γ содержат любую последовательность из SEQ ID NO: 11-17, где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, содержащий мутацию A23V в одной или обеих субъединицах IFN-γ, соотносящихся с субъединицей IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10, где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, где одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13, и где обе субъединицы варианта IFN-γ расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления две субъединицы IFN-γ или его варианта соединены линкером (например, любой из SEQ ID NO: 227-229). В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, где вариант IFN-γ расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. . В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IFN-γ в свободном состоянии составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IFN-γ дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[146] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к HER2, содержащий: а) полноразмерное антитело, специфично распознающее HER2; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 158. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 158, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[147] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD3, содержащий: а) полноразмерное антитело, специфично распознающее CD3; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 98. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 98, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[148] В некоторых вариантах осуществления антитело представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/анти-PD-1, содержащий: а) полноразмерное антитело, специфично распознающее PD-1; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 110. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 110, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[149] В некоторых вариантах осуществления антитело представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD4, содержащий: а) полноразмерное антитело, специфично распознающее CD4; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 81. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 81, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[150] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD8, содержащий: а) полноразмерное антитело, специфично распознающее CD8; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 121. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 121, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[151] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CTLA-4, содержащий: а) полноразмерное антитело, специфично распознающее CTLA-4; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 133. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 133, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[152] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к PD-L1, содержащий: а) полноразмерное антитело, специфично распознающее PD-L1; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 146. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 146, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[153] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD25, содержащий: а) полноразмерное антитело, специфично распознающее CD25; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 171. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IFN-γ, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 171, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[154] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IFN-γ («иммуноцитокин IFN-γ/PD-L2-Fc»), содержащий: а) составной полипептид PD-L2-шарнир-Fc, содержащий? от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и субъединицу Fc-домена или ее часть; и b) IFN-γ или его вариант (например, SEQ ID NO: 18 или 19), где обе субъединицы (например, любая из SEQ ID NO: 10-17) IFN-γ или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 183. В некоторых вариантах осуществления предложен иммуноцитокин IFN-γ/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IFN-γ, расположенный в шарнирном участке, который содержит последовательность SEQ ID NO: 183, и составной полипептид PD-L2-шарнир-Fc, который содержит последовательность SEQ ID NO: 181. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IFN-γ или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IFN-γ или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[155] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-10 или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, и обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок) специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где указанное антитело содержит тяжелую цепь, включающую, от N-конца к С-концу: домен VH, необязательно домен CH1, [первую субъединицу IL-10 или ее вариант (например, любую из SEQ ID NO: 20-26), необязательно линкер (например, пептидный линкер), вторую субъединицу IL-10 или его варианта (например, любую из SEQ ID NO: 20-26)] в шарнирном участке, домен СН2 и, необязательно, домен СН3. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, содержащий одну или несколько мутаций в одной или обеих субъединицах IL-10 в положении, выбранном из группы, состоящей из N21, M22, R24, D25, L26, R27, D28, A29, F30, S31, R32, H90 и S93, соответствующем положению в субъединице IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20, где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, содержащий одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A, L26A, R27A, D28A, A29S, F30A, S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20, где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, содержащий одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A/L26A, R27A, D28A/A29S, F30A/S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20, где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, где одна или обе субъединицы варианта IL-10 содержат любую последовательность из SEQ ID NO: 21-26, и где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, содержащий мутацию R27A в одной или обеих субъединицах IL-10, соотносящихся с субъединицей IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20, где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, где одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23, и где обе субъединицы варианта IL-10 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления две субъединицы IL-10 или его варианта соединены линкером. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-10, содержащий последовательность SEQ ID NO: 28, где вариант IL-10 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IL-10 в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IL-10 дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[156] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к HER2, содержащий: а) полноразмерное антитело, специфично распознающее HER2; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 159. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 159, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[157] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD3, содержащий: а) полноразмерное антитело, специфично распознающее CD3; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 99. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 99, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[158] В некоторых вариантах осуществления антитело представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10, содержащий: а) полноразмерное антитело, специфично распознающее PD-1; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 111. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 111, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[159] В некоторых вариантах осуществления антитело представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин Il-10/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD4, содержащий: а) полноразмерное антитело, специфично распознающее CD4; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 82. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 82, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[160] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD8, содержащий: а) полноразмерное антитело, специфично распознающее CD8; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 122. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 122, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[161] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин Il-10/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CTLA-4, содержащий: а) полноразмерное антитело, специфично распознающее CTLA-4; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 134. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 134, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[162] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к PD-L1, содержащий: а) полноразмерное антитело, специфично распознающее PD-L1; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 147. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 147, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[163] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD25, содержащий: а) полноразмерное антитело, специфично распознающее CD25; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 172. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IL-10, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 172, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[164] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-10 («иммуноцитокин IL-10/PD-L2-Fc»), содержащий: а) составной полипептид PD-L2-шарнир-Fc, содержащий, от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и субъединицу Fc-домена или ее часть; и b) IL-10 или его вариант (например, SEQ ID NO: 27 или 28), где обе субъединицы (например, любая из SEQ ID NO: 20-26) IL-10 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 184. В некоторых вариантах осуществления предложен иммуноцитокин IL-10/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-10, расположенный в шарнирном участке, содержащий последовательность SEQ ID NO: 184, и составной полипептид PD-L2-шарнир-Fc, содержащий последовательность SEQ ID NO: 181. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-10 или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-10 или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[165] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-12 или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' до C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где обе субъединицы p35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, и обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок) специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где обе субъединицы p35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где указанное антитело содержит тяжелую цепь, включающую, от N-конца к С-концу: домен VH, необязательно домен CH1, [первую субъединицу IL-12 или его варианта (например, р40, такой как любая из SEQ ID NO: 30-34), необязательно линкер (например, пептидный линкер), вторую субъединицу IL-12 или его варианта (например, p35, такой как SEQ ID NO: 29)] в шарнирном участке, домене СН2 и, необязательно, домене СН3. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, содержащий одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 варианта IL-12 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, содержащий одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 варианта IL-12 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, где субъединица p40 варианта IL-12 содержит любую последовательность из SEQ ID NO: 31-34, где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 варианта IL-12 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, содержащий мутацию E59A/F60A в субъединице р40, соотносящейся с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 варианта IL-12 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, где субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31, и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 варианта IL-12 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления субъединица р40 или ее вариант находятся на N-конце субъединицы р35 или ее варианта (например, р40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления предложен иммуноцитокин IL-12, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-12, содержащий последовательность SEQ ID NO: 36, где вариант IL-12 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IL-12 в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IL-12 дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[166] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к HER2, содержащий: а) полноразмерное антитело, специфично распознающее HER2; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица р40 и субъединица р35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 160. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке и содержащий последовательность SEQ ID NO: 160, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[167] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD3, содержащий: а) полноразмерное антитело, специфично распознающее CD3; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 100. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 100, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[168] В некоторых вариантах осуществления антитело представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к PD-1, содержащий: а) полноразмерное антитело, специфично распознающее PD-1; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 112. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 112, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[169] В некоторых вариантах осуществления предложен иммуноцитокин IL-12/IL-2 («иммуноцитокин IL-12/IL-2/антитело к PD-1»), содержащий: а) антигенсвязывающий белок (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36); и c) IL-2 или его вариант (например, SEQ ID NO: 1 или 2), где антигенсвязывающий белок содержит два антигенсвязывающих полипептида (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-Fc), каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, VHH, scFv или VH), шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где обе субъединицы p35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первого антигенсвязывающего полипептида (например, тяжелой цепи антитела), и где IL-2 или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) второго антигенсвязывающего полипептида (например, тяжелой цепи антитела). В некоторых вариантах осуществления предложен иммуноцитокин IL-12/IL-2/антитело к PD-1, содержащий: а) полноразмерное антитело, специфично распознающее PD-1, содержащее две тяжелые цепи; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36); и c) IL-2 или его вариант (например, SEQ ID NO: 1 или 2); при этом обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) первой тяжелой цепи полноразмерного антитела; где IL-2 или его вариант (например, SEQ ID NO: 1 или 2) расположен в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) второй тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 112. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 108. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела) или антигенсвязывающего фрагмента с PD-1 (например, связывания первого антигенсвязывающего фрагмента с PD-1 и/или связывания второго антигенсвязывающего фрагмента с PD-1) активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или IL-2 (или его варианта) повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 (например, ни один антигенсвязывающий фрагмент не связывается с PD-1). В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела) или антигенсвязывающего фрагмента с PD-1 (например, ни один из антигенсвязывающих фрагментов не связывается с PD-1), активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) IL-12 и/или IL-2 (или его варианта), расположенных в шарнирном участке каждого антигенсвязывающего полипептида (например, тяжелой цепи антитела или полипептида антигенсвязывающий фрагмент-Fc) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6 %, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-12 и/или IL-2 (или его варианта) в свободном состоянии. Исходный антигенсвязывающий белок (например, антитело) может быть моноспецифичным или мультиспецифичным (например, биспецифичным). Исходный антигенсвязывающий белок (например, антитело) может быть гомодимерным или гетеродимерным. Исходный антигенсвязывающий белок (например, антитело) может быть агонистом или антагонистом.
[170] В некоторых вариантах осуществления антитело представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD4, содержащий: а) полноразмерное антитело, специфично распознающее CD4; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 83. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 83, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[171] В некоторых вариантах осуществления антитело представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD8, содержащий: а) полноразмерное антитело, специфично распознающее CD8; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 123. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 123, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[172] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CTLA-4, содержащий: а) полноразмерное антитело, специфично распознающее CTLA-4; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 135. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 135, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[173] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к PD-L1, содержащий: а) полноразмерное антитело, специфично распознающее PD-L1; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 148. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 148, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[174] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD25, содержащий: а) полноразмерное антитело, специфично распознающее CD25; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица р40 и субъединица р35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 173. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IL-12, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 173, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[175] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-12 («иммуноцитокин IL-12/PD-L2-Fc»), содержащий: а) составной полипептид PD-L2-шарнир-Fc, содержащий, от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59) и субъединицу Fc-домена или ее часть; и b) IL-12 или его вариант (например, SEQ ID NO: 35 или 36), где обе субъединицы р35 (например, SEQ ID NO: 29) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-12 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р35 или ее варианта (например, SEQ ID NO: 29) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-р35). В некоторых вариантах осуществления субъединица р35 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р35-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица р40 и субъединица р35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 186. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-12, расположенный в шарнирном участке, содержащий последовательность SEQ ID NO: 186, и составной полипептид PD-L2-шарнир-Fc, содержащий последовательность SEQ ID NO: 185. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 33. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 275. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 274. В некоторых вариантах осуществления предложен иммуноцитокин IL-12/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-12, расположенный в шарнирном участке, содержащий последовательность SEQ ID NO: 274, и составной полипептид PD-L2-шарнир-Fc, содержащий последовательность SEQ ID NO: 185. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-12 или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-12 или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[176] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-23 или его вариант. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' до C': антигенсвязывающий фрагмент (например, лиганд, такой как внеклеточный домен PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело (например, полноразмерное антитело), специфично распознающее антиген-мишень, антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела, и обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд, а антиген-мишень представляет собой рецептор, специфично распознаваемый лигандом. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор, а антиген-мишень представляет собой лиганд, специфично распознаваемый рецептором. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок) специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где указанное антитело содержит тяжелую цепь, включающую, от N-конца к С-концу: домен VH, необязательно домен CH1, [первую субъединицу IL-23 или его варианта (например, р40, такой как любая из SEQ ID NO: 30-34), необязательно линкер (например, пептидный линкер), вторую субъединицу IL-23 или его варианта (например, p19, такой как SEQ ID NO: 37)] в шарнирном участке, СН2-домене и, необязательно, СН3-домен. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, содержащий одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 варианта IL-23 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, содержащий одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 варианта IL-23 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, где субъединица p40 варианта IL-23 содержит любую последовательность из SEQ ID NO: 31-34, где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 варианта IL-23 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, содержащий мутацию E59A/F60A в субъединице р40, соотносящейся с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30, где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 варианта IL-23 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, где субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31, и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 варианта IL-23 расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления предложен иммуноцитокин IL-23, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) вариант IL-23, содержащий последовательность SEQ ID NO: 39, где вариант IL-23 расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта IL-23 в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего IL-23 дикого типа в свободном состоянии. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело или его фрагмент, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления антигенсвязывающий белок является агонистом. В некоторых вариантах осуществления антигенсвязывающий белок является антагонистом. В некоторых вариантах осуществления шарнирный участок содержит любую последовательность из SEQ ID NO: 40-47, 50-52 и 55-59.
[177] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к HER2. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к HER2»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее HER2; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к HER2, содержащий: а) полноразмерное антитело, специфично распознающее HER2; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к HER2 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления исходное антитело к HER2 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 161. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к HER2, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 161, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 155. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с HER2. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с HER2 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[178] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD3. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к CD3»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD3; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD3, содержащий: а) полноразмерное антитело, специфично распознающее CD3; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD3 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления исходное антитело к CD3 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 101. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD3, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 101, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 95. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD3. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD3 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[179] В некоторых вариантах осуществления антитело представляет собой антитело к PD-1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к PD-1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-1; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к PD-1, содержащий: а) полноразмерное антитело, специфично распознающее PD-1; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к PD-1 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления исходное антитело к PD-1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 113. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к PD-1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 113, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[180] В некоторых вариантах осуществления антитело представляет собой антитело к CD4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к CD4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD4; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD4, содержащий: а) полноразмерное антитело, специфично распознающее CD4; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к CD4 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления исходное антитело к CD4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 84. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 84, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 78. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[181] В некоторых вариантах осуществления антитело представляет собой антитело к CD8. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к CD8»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD8; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD8, содержащий: а) полноразмерное антитело, специфично распознающее CD8; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD8 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления исходное антитело к CD8 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 124. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD8, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 124, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 118. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD8. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD8 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[182] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CTLA-4. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к CTLA-4»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CTLA-4; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CTLA-4, содержащий: а) полноразмерное антитело, специфично распознающее CTLA-4; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CTLA-4 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления исходное антитело к CTLA-4 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 124. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 136. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CTLA-4, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 129, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 136, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 130. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CTLA-4. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CTLA-4 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[183] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к PD-L1. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к PD-L1»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее PD-L1; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к PD-L1, содержащий: а) полноразмерное антитело, специфично распознающее PD-L1; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где антитело к PD-L1 содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления исходное антитело к PD-L1 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 149. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к PD-L1, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 140, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 149, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 143. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с PD-L1. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с PD-L1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным.
[184] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело к CD25. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/антитело к CD25»), содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее CD25; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где антитело содержит тяжелую цепь, содержащую шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и где обе субъединицы p19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD25, содержащий: а) полноразмерное антитело, специфично распознающее CD25; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, в любой из SEQ ID NO: 40-47, 50-52 и 55-59) (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и при этом антитело к CD25 содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 содержит VH, содержащий последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления исходное антитело к CD25 содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления тяжелая цепь, содержащая вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 174. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/антитело к CD25, содержащий: две легкие цепи, содержащие последовательность SEQ ID NO: 165, одну тяжелую цепь, содержащую вариант IL-23, расположенный в шарнирном участке, содержащем последовательность SEQ ID NO: 174, и одну тяжелую цепь, содержащую последовательность SEQ ID NO: 168. В некоторых вариантах осуществления при наличии связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антитела (или его антигенсвязывающего фрагмента) с CD25. В некоторых вариантах осуществления в отсутствие связывания антитела (или антигенсвязывающего фрагмента) с CD25 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке тяжелой цепи, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления антитело является моноспецифичным. В некоторых вариантах осуществления антитело является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления антитело является гомодимерным. В некоторых вариантах осуществления антитело является гетеродимерным. В некоторых вариантах осуществления антитело представляет собой антитело-агонист. В некоторых вариантах осуществления антитело представляет собой антитело-антагонист.
[185] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой составной белок PD-L2 (например, внеклеточный домен PD-L2)-шарнир-Fc. Таким образом, в некоторых вариантах осуществления предложен иммуноцитокин IL-23 («иммуноцитокин IL-23/PD-L2-Fc»), содержащий: а) составной полипептид PD-L2-шарнир-Fc, содержащий, от N' к C': PD-L2 (например, SEQ ID NO: 176), специфично распознающий PD-1, шарнирный участок (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и субъединицу Fc-домена или ее часть; и b) IL-23 или его вариант (например, SEQ ID NO: 38 или 39), где обе субъединицы р19 (например, SEQ ID NO: 37) и субъединица p40 (например, любая из SEQ ID NO: 30-34) IL-23 или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер, такой как любая из SEQ ID NO: 227-229) в шарнирном участке (например, внутри шарнирного участка или между С-концом PD-L2 и N-концом шарнирного участка) составного полипептида PD-L2-шарнир-Fc. В некоторых вариантах осуществления исходный составной белок PD-L2-шарнир-Fc содержит два составных полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления субъединица p40 или ее вариант (например, любая из SEQ ID NO: 30-34) находится на N-конце субъединицы р19 или ее варианта (например, SEQ ID NO: 37) (например, p40-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p19). В некоторых вариантах осуществления субъединица р19 или ее вариант находятся на N-конце субъединицы р40 или ее варианта (например, р19-необязательный линкер (например, любая из SEQ ID NO: 227-229)-p40). В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица p40 и субъединица p19 IL-23 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 187. В некоторых вариантах осуществления предложен иммуноцитокин IL-23/PD-L2-Fc, содержащий: составной полипептид PD-L2-шарнир-Fc, содержащий вариант IL-23, расположенный в шарнирном участке, содержащий последовательность SEQ ID NO: 187, и составной полипептид PD-L2-шарнир-Fc, содержащий последовательность SEQ ID NO: 185. В некоторых вариантах осуществления при наличии связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания лиганда PD-L2 с PD-1. В некоторых вариантах осуществления в отсутствие связывания лиганда PD-L2 с PD-1 активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина IL-23 или его варианта, расположенного в шарнирном участке, составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина IL-23 или его варианта в свободном состоянии. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является моноспецифичным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является мультиспецифичным (например, биспецифичным). В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гомодимерным. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc является гетеродимерным. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой агонист, который может стимулировать или усиливать передачу сигналов PD-1. В некоторых вариантах осуществления фрагмент PD-L2 представляет собой антагонист, который может снижать или блокировать передачу сигналов PD-1.
[186] В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, не содержит полноразмерное исходное антитело (в дальнейшем также называемый «иммуноцитокин с частью антитела» или «иммуноцитокин, составленный с частью Fc»). См., например, части, окрашенные светло-серым, на фигурах 3А-3С. В некоторых вариантах осуществления настоящее изобретение также относится к иммуноцитокину, содержащему: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: первый scFv (конфигурация VH-VL или VL-VH), специфично распознающий первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8), цитокин или его вариант (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) в шарнирном участке или ее части (например, в шарнирном участке или между C'-концом первого scFv и N'-концом шарнирного участка), и первую субъединицу Fc-домена (например, IgG1, IgG4 или неэффекторного IgG1) или ее части (например, CH2); и (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: второй scFv (конфигурация VH-VL или VL-VH), специфично распознающий второй антиген-мишень (например, CTLA-4, PD-L1 , PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8), шарнирный участок или его часть (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и вторую субъединицу Fc-домена или ее часть. См., например, фигуру 3А. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: (а) первый антигенсвязывающий полипептид, содержащий от N-конца к С-концу: scFv (конфигурация VH-VL или VL-VH), специфично распознающий первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8), цитокин или его вариант (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) в шарнирном участке или его части (например, в шарнирном участке или между C'-концом scFv и N'-концом шарнирного участка), и первую субъединицу Fc-домена (например, IgG1, IgG4 или неэффекторный IgG1) или ее часть (например, CH2); (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: VH, CH1, шарнирный участок или его часть (например, любую из SEQ ID NO: 40-47, 50-52 и 55-59), и вторую субъединицу Fc-домена или ее часть; и (c) третий антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: VL и CL; где VH и CH1 второго антигенсвязывающего полипептида и VL и CL третьего антигенсвязывающего полипептида образуют Fab, специфично распознающий второй антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8). См., например, фигуру 3В. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: VH, CH1, цитокин или его вариант (например, IL-2, IFN-α (например, IFN-α2b), IFN- γ, IL-10, IL-12 или IL-23) в шарнирном участке или его части (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) и первую субъединицу Fc-домена (например, IgG1, IgG4 или неэффекторный IgG1) или ее часть (например, CH2); (b) второй антигенсвязывающий полипептид, содержащий от N-конца к С-концу: VL и CL; где VH и CH1 первого антигенсвязывающего полипептида и VL и CL второго антигенсвязывающего полипептида образуют Fab, специфично распознающий первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и (c) третий антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: scFv (конфигурация VH-VL или VL-VH), специфично распознающий второй антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8), шарнирный участок или его часть и вторую субъединицу Fc-домена или ее часть. См., например, фигуру 3С. В некоторых вариантах осуществления предложен иммуноцитокин, содержащий: (а) первый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: VH, CH1, цитокин или его вариант (например, IL-2, IFN-α (например, IFN-α2b), IFN- γ, IL-10, IL-12 или IL-23) в шарнирном участке или его части (например, любой из SEQ ID NO: 40-47, 50-52 и 55-59) и часть (например, CH2) первой субъединицы Fc-домена (например, IgG1, IgG4 или неэффекторный IgG1); (b) второй антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: VL и CL; (c) третий антигенсвязывающий полипептид, содержащий, от N-конца к C-концу: VH, CH1, шарнирный участок или его часть и часть (например, CH2) второй субъединицы Fc-домена; и (d) четвертый антигенсвязывающий полипептид, содержащий, от N-конца к С-концу: VL и CL; где VH и CH1 первого антигенсвязывающего полипептида и VL и CL второго антигенсвязывающего полипептида образуют первый Fab, специфично распознающий первый антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8), и где VH и CH1 третьего антигенсвязывающего полипептида и VL и CL четвертого антигенсвязывающего полипептида образуют второй Fab, специфично распознающий второй антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8). Другие конфигурации иммуноцитокинов, в которых цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, между С-концом антигенсвязывающего фрагмента и N-концом шарнирного участка или между С-концом шарнирного участка и N-конца субъединицы Fc-домена) между антигенсвязывающим фрагментом (например, лигандом, таким как внеклеточный домен PD-L2, рецептор, фрагмент антитела, такой как VHH) и субъединицей Fc-домена, или их часть также рассматривается в данном документе. Любую часть цитокина и конфигурацию шарнира, описанные для «иммуноцитокинов полноразмерного антитела» можно применять к любому из «иммуноцитокинов с частью антитела» или «иммуноцитокинов, составленных с частью Fc», описанных в данном документе. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90% , 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка или антигенсвязывающего фрагмента с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv, or Fab) и субъединицей Fc-домена (или ее частью) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10% , 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2 %, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления только один антигенсвязывающий полипептид, содержащий субъединицу Fc-домена или ее часть, содержит цитокин или его вариант, расположенный в шарнирном участке. В некоторых вариантах осуществления каждый антигенсвязывающий полипептид, содержащий субъединицу Fc-домена или ее часть, содержит цитокин или его вариант, расположенный в шарнирном участке. В некоторых вариантах осуществления иммуноцитокин содержит два или более (например, 2, 3, 4, 5 или более) цитокина или их варианта, где два или более цитокина или их варианта расположены последовательно (например, соединены через необязательный пептидный линкер) в шарнирном участке одного антигенсвязывающего полипептида. В некоторых вариантах осуществления цитокин или его вариант представляет собой мономерный цитокин или его вариант, такой как IL-2 или IFN-α (например, IFN-α2a, IFN-α2b, IFN-α2c). В некоторых вариантах осуществления цитокин или его вариант представляет собой димерный цитокин или его вариант. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант, такой как IL-10 или IFN-γ. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант, такой как IL-12 или IL-23. В некоторых вариантах осуществления обе субъединицы димерного цитокина или его варианта расположены последовательно (например, соединены через необязательный пептидный линкер) в шарнирном участке одного антигенсвязывающего полипептида. В некоторых вариантах осуществления одна субъединица димерного цитокина или его варианта расположена в шарнирном участке одного антигенсвязывающего полипептида, а другая субъединица димерного цитокина или его варианта расположена в шарнирном участке другого антигенсвязывающего полипептида. В некоторых вариантах осуществления два или более цитокина или их варианта являются одинаковыми. В некоторых вариантах осуществления два или более цитокина или их варианта различаются. В некоторых вариантах осуществления иммуноцитокин является моноспецифичным в отношении связывания антигена-мишени. В некоторых вариантах осуществления иммуноцитокин является мультиспецифичным (например, биспецифичным) в отношении связывания антигена-мишени. В некоторых вариантах осуществления цитокин или его вариант выбирают из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IL-35, IFN-α, IFN-β, IFN-γ, TNF-α, TGF-β, эритропоэтин, тромбопоэтин, VEGF, G-CSF, M-CSF, SCF и GM-CSF. В некоторых вариантах осуществления цитокин или его вариант расположены между С-концом CH1, scFv или лиганда/рецептора и N-концом шарнирного участка. В некоторых вариантах осуществления цитокин или его вариант расположены между С-концом шарнирного участка и N-концом субъединицы Fc-домена или ее части. В некоторых вариантах осуществления цитокин или его вариант расположен в шарнирном участке (например, ими заменяют внутреннюю часть в шарнирном участке, или их вставляют в шарнирный участок без удаления аминокислоты в шарнирном участке, или вставляют в шарнирный участок и вводят одну или более аминокислот). В некоторых вариантах осуществления Fc-домен или его часть содержит мутации типа «выступы во впадины» (KIH). В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, антигенсвязывающий фрагмент или составной белок лиганд/рецептор-шарнир-Fc) является гомодимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок является гетеродимерным. В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело или составной белок лиганд-шарнир-Fc, такой как составной белок PD-L2-шарнир-Fc) является агонистом. В некоторых вариантах осуществления исходный антигенсвязывающий белок представляет собой антагонист.
Цитокины или их варианты
[187] Цитокины (также называемые взаимозаменяемо «молекулой цитокина» или «белком цитокина») представляют собой секретируемые белки, которые модулируют активность клеток иммунной системы. Примеры цитокинов включают интерлейкины, интерфероны, хемокины, лимфокины, факторы некроза опухоли, колониестимулирующие факторы для предшественников иммунных клеток и т.д. В некоторых вариантах осуществления цитокин представляет собой цитокин дикого типа. В некоторых вариантах осуществления цитокин представляет собой вариант существующих в природе видов цитокинов. В некоторых вариантах осуществления цитокин представляет собой подтип существующего в природе цитокина. «Вариант цитокина» в данном документе относится к любой молекуле цитокина, которая не существует в природе, такой как активный цитокиновый фрагмент (например, цитокиновый фрагмент, у которого сохранено по меньшей мере примерно 10% биологической активности или активности связывания цитокинового рецептора полноразмерного цитокина), мутант или его производное. «Цитокин или его вариант» также взаимозаменяемо упоминается здесь как «цитокиновый фрагмент», который может представлять собой молекулу цитокина или его видовой вариант, подтип, активный фрагмент, мутант или производное.
[188] Используемый здесь термин «гетеродимерный цитокин» или «гетеродимер цитокина» относится к цитокину, состоящему из двух отдельных белковых субъединиц. В настоящее время семейство IL-12 (включает IL-12, IL-23, IL-27 и IL-35) является единственным известным гетеродимерным семейством цитокинов, встречающихся в природе. Однако можно сконструировать искусственные гетеродимерные цитокины. Например, IL-6 и растворимый фрагмент IL-6R можно объединять с образованием гетеродимерного цитокина, как и CNTF и CNTF-R альфа (Trinchieri (1994) Blood 84:4008). «Гомодимерный цитокин» или «гомодимер цитокина» в данном контексте относится к цитокину, состоящему из двух идентичных белковых субъединиц, таких как IFN-γ или IL-10. «Мономерный цитокин» или «мономер цитокина» относится к цитокину, который состоит из одной единицы молекулы цитокина. В некоторых вариантах осуществления цитокин или его вариант представляет собой мономерный цитокин или его вариант. В некоторых вариантах осуществления цитокин или его вариант представляет собой гомодимерный цитокин или его вариант. В некоторых вариантах осуществления цитокин или его вариант представляет собой гетеродимерный цитокин или его вариант.
[189] В некоторых вариантах осуществления цитокиновый фрагмент представляет собой полноразмерную молекулу цитокина. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой функциональный фрагмент молекулы цитокина, который способен проявлять некоторую (например, не менее примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% , 90% или 95%) или полную биологическую активность и/или активность связывания цитокиновых рецепторов полноразмерной молекулы цитокина. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой молекулу-предшественник цитокина. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой молекулу зрелого цитокина (например, без сигнального пептида). В некоторых вариантах осуществления цитокиновый фрагмент представляет собой цитокин дикого типа. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой вариант существующих в природе видов цитокинов. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой подтип существующих в природе цитокинов. В некоторых вариантах осуществления цитокиновый фрагмент представляет вариант цитокина, такой как мутантный цитокин, который способен проявлять некоторую (например, не менее примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% , 90% или 95%) или полную биологическую активность и/или активность связывания цитокиновых рецепторов цитокина дикого типа. В некоторых вариантах осуществления вариант цитокина представляет собой модифицированный цитокин, такой как гликозилированный цитокин. Цитокин или его вариант, описанный в данном документе, может быть цитокином, выделенным из различных источников, например, из типов тканей человека или из другого источника, или полученным рекомбинантными или синтетическими способами. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой рекомбинантный цитокин. В некоторых вариантах осуществления цитокиновый фрагмент, описанный в данном документе, может представлять собой цитокин, полученный из любого организма, такого как млекопитающие, включая, но не ограничиваясь ими, домашний скот (например, коров, овец, коз, кошек, собак, ослов и лошадей), приматов (например, человекоподобных и нечеловекоподобных приматов, таких как обезьяны или шимпанзе), кроликов и грызунов (например, мышей, крыс, песчанок и хомяков). В некоторых вариантах осуществления цитокиновый фрагмент представляет собой человеческий цитокин, такой как рекомбинантный человеческий цитокин. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой мышиный цитокин, такой как рекомбинантный мышиный цитокин. В некоторых вариантах осуществления цитокиновый фрагмент представляет собой зрелый человеческий цитокин. В некоторых вариантах осуществления цитокиновый фрагмент содержит сигнальный пептид на N-конце молекулы цитокина, этот сигнальный пептид получен либо из другой молекулы, либо из той же молекулы цитокина.
[190] Варианты цитокинов могут быть укороченными версиями, посттрансляционно модифицированными версиями, гибридными вариантами, миметиками пептидов, биологически активными фрагментами, вариантами делеции, вариантами замены или вариантами присоединения, у которых сохранена некоторая степень (например, по меньшей мере примерно 10%) активности исходных цитокинов (активность связывания цитокиновых рецепторов и/или биологическая активность). «Исходный цитокин» или «цитокин-предшественник», описанные в данном документе, относятся к эталонной последовательности цитокина, из которой сконструирован, модифицирован или получен вариант цитокина.
[191] Если сказано, что иммуноцитокин настоящего изобретения содержит два или более различных цитокина (и необязательно включая дополнительные белковые фрагменты), это означает, что иммуноцитокин содержит две или более различные молекулы цитокина (а не две или более различные цитокиновые субъединицы). Например, гомодимерный цитокин (например, IFN-α, IFN-β, IFN-γ, IL-5, IL-8 или т.п.) обозначен в данном документе как отдельная молекула цитокина. Например, считается, что иммуноцитокин, содержащий два мономера/субъединицы IL-5 (либо на одной полипептидной цепи в виде одноцепочечного слияния, либо на разных полипептидных цепях), содержит только одну молекулу цитокина, т.е. IL-5. Точно так же гетеродимерный цитокин, такой как IL-12, хотя и содержит разные субъединицы, представляет собой один цитокин. Например, считается, что иммуноцитокин, содержащий субъединицу р35 и субъединицу р40 (либо на одной полипептидной цепи в виде одноцепочечного слияния, либо на разных полипептидных цепях), содержит только одну молекулу цитокина, т.е. IL-12. Кроме того, гетеродимерная форма обычно гомодимерных цитокинов, такая как гетеродимер MCP-1/MCP-2, или двух аллелей обычно гомодимерного цитокина (например, Zhang, J. Biol. Chem. [1994] 269:15918-24) представляет собой один цитокин. В некоторых вариантах осуществления цитокиновая субъединица (например, p35 в IL-12) в одной полипептидной цепи иммуноцитокина может димеризоваться с парной цитокиновой субъединицей (например, p40) либо в той же полипептидной цепи, либо в другой полипептидной цепи в пределах одного и того же иммуноцитокина. В некоторых вариантах осуществления цитокиновая субъединица (например, p35 IL-12) иммуноцитокина может димеризоваться с парной цитокиновой субъединицей (например, p40) близлежащего иммуноцитокина.
[192] В некоторых вариантах осуществления вариант цитокина включает мутацию или модификацию (например, посттрансляционную модификацию), которая приводит к селективности к первому типу рецептора (например, тримерному рецептору или рецептору с более высоким сродством) по сравнению со вторым типом рецептора соответствующей молекулы цитокина (например, димерным рецептором или рецептором с более слабым сродством), измеряемой как отношение активации клеток, экспрессирующих рецептор первого типа, к активации клеток, экспрессирующих рецептор второго типа. Например, в некоторых вариантах осуществления вариант цитокина представляет собой мутантный IL-2 (или посттрансляционно модифицированный IL-2), который связывает IL-2Rβγ с более высоким сродством (например, не менее чем примерно в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз более сильным сродством) по сравнению с IL-2Rαβγ, или активирует клетки, экспрессирующие IL-2Rβγ в большей степени, чем (например, активирует не менее чем примерно в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз сильнее) те, которые экспрессируют IL-2Rαβγ; обратное также верно. В некоторых вариантах осуществления, в зависимости от типа заболевания, подлежащего лечению, предпочтительные мутации или изменения увеличивают активацию фрагмента цитокина иммунных эффекторных клеток (например, CD8+ Т-клеток для лечения рака). Например, в некоторых вариантах осуществления вариант IL-2 содержит мутацию (или посттрансляционную модификацию), которая снижает активацию вариантом IL-2 клеток, экспрессирующих рецептор IL-2Rβγ, по сравнению с активацией вариантом IL-2 клеток, экспрессирующих рецептор IL-2Rαβγ.
[193] В некоторых вариантах осуществления мутация или модификация варианта цитокина приводит к различию в действии (например, такому как снижение связывания или активации клеток) по сравнению с иммуноцитокином без мутации или модификации такой части цитокина. В одном аспекте различие в действии измеряется по пролиферативному ответу клеток или клеточных линий, рост которых зависит от цитокина (например, IL-2). Этот ответ на иммуноцитокин выражается как значение EC50, которое получают путем построения кривой дозозависимого ответа и определения концентрации белка, которая приводит к полумаксимальному ответу. В некоторых вариантах осуществления сравнение отношения значений ЕС50, полученных для клеток, экспрессирующих рецептор первого типа (например, рецептор IL-2Rβγ), к клеткам, экспрессирующим рецептор второго типа (например, рецептор IL-2Rαβγ) для иммуноцитокина данного изобретения (например, иммуноцитокина варианта IL-2) с отношением значений EC50 для эталонного иммуноцитокина (например, иммуноцитокина IL-2 дикого типа той же конфигурации) дает меру в различии действия иммуноцитокина. В некоторых вариантах осуществления сравнение значения EC50, полученного для иммуноцитокина данного изобретения (например, иммуноцитокина варианта IL-2) со значением EC50 для эталонного иммуноцитокина (например, иммуноцитокина IL-2 дикого типа той же конфигурации), дает меру в различии действия иммуноцитокина.
[194] В некоторых вариантах осуществления вариант цитокина включает мутацию в одной или нескольких аминокислотах исходной молекулы цитокина (например, зрелый цитокин дикого типа). В одном варианте осуществления вариант цитокина включает аминокислотную замену в одном или нескольких аминокислотных положениях в цитокине. В другом варианте осуществления вариант цитокина включает делеции или вставки аминокислот в одном или нескольких аминокислотных положениях в цитокине. В некоторых вариантах осуществления вариант цитокина включает изменение одной или нескольких аминокислот в цитокине.
[195] В некоторых вариантах осуществления цитокин или его вариант выбирают из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IL-35, IFN-α, IFN-β, IFN-γ, TNF-α, TGF-β, эритропоэтин, тромбопоэтин, VEGF, G-CSF, M-CSF, SCF и GM-CSF, или природных вариантов или их подтипов. В некоторых вариантах осуществления цитокин или его вариант представляет собой противовоспалительный или иммуносупрессивный цитокин или его вариант, такой как IL-10, IL-27, IL-35, TGF-β и VEGF. В некоторых вариантах осуществления цитокин или его вариант представляет собой провоспалительный или иммуностимулирующий цитокин или его вариант, такой как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IFN-α, IFN-β, IFN -γ, TNF-α, эритропоэтин, тромбопоэтин, G-CSF, M-CSF, SCF и GM-CSF. В некоторых вариантах осуществления цитокин или его вариант выбирают из группы, состоящей из IL-2, IL-10, IL-12, IL-23, IFN-α (например, IFN-α2 или IFN-α2b) и IFN-γ. В некоторых вариантах осуществления цитокин представляет собой IL-12, а цитокиновые субъединицы представляют собой р35 и р40. В некоторых вариантах осуществления цитокин представляет собой IL-23, а цитокиновые субъединицы представляют собой p40 и p19. В некоторых вариантах осуществления цитокин представляет собой IL-27, а цитокиновые субъединицы представляют собой ген 3, индуцированный вирусом Эпштейна-Барр (EBI3), и IL-27p28. В некоторых вариантах осуществления цитокин представляет собой IL-35, а цитокиновые субъединицы представляют собой IL-12α (p35) и IL-27β. В некоторых вариантах осуществления вариант цитокина представляет собой составление в одну цепь двух или более субъединиц разных цитокинов.
IL-2
[196] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-2 или его вариант. Интерлейкин-2 (IL-2), также известный как фактор роста Т-клеток (TCGF), представляет собой мономерный белок с молекулярной массой 15,5 кДа, который играет ключевую роль в образовании, выживании и гомеостазе лимфоцитов. Он участвует в естественной реакции организма на микробную инфекцию и в распознавании «своих» и «чужих». IL-2 представляет собой интерлейкин, он принадлежит к семейству цитокинов, которое включает IL-4, IL-7, IL-9, IL-15 и IL-21. IL-2 опосредует свое действие путем связывания с рецепторами IL-2 (IL-2R), экспрессированными на лимфоцитах. Активированные CD4+ Т-клетки и активированные CD8+ Т-клетки являются основными источниками IL-2. Его способность увеличивать популяцию лимфоцитов и усиливать эффекторные функции этих клеток делает IL-2 привлекательным средством против рака. IL-2 был предложен для лечения острого миелоидного лейкоза (ОМЛ), неходжкинской лимфомы (НХЛ), кожной Т-клеточной лимфомы (КТКЛ), рака молочной железы и рака мочевого пузыря.
[197] Рецептор IL-2 (IL-2R) представляет собой комплекс, состоящий из трех цепей: α (CD25, p55), β (CD122, p75) и γ (CD132, p65). Цепь γ является общей для всех членов семейства цитокинов IL-2. Связывание IL-2 либо с димерным CD122/CD132 IL-2R со средним сродством (IL-2Rβγ, Kd ~ 10−9 M) или высоким сродством тримерного CD25/CD122/CD132 IL-2R (IL-2Rαβγ, Kd ~ 10−11 M) может приводить к передаче сигнала, тогда как связывание только с CD25 не в состоянии передавть сигнал. β-цепь образует комплекс с Янус-киназой 1 (JAK1). Цепь γ образует комплекс с JAK3. При связывании IL-2 с IL-2R активируются JAK1 и JAK3, которые способны добавлять фосфатные группы к молекулам, таким образом инициируя три внутриклеточные сигнальные пути: путь MAP-киназы, путь фосфоинозитид-3-киназы (PI3K) и путь JAK-STAT. Димерный IL-2Rβγ экспрессируется CD8+ Т-клетками памяти, NK-клетками и В-клетками, тогда как высокие уровни трехмерного IL-2Rαβγ экспрессируются регуляторными Т-клетками (Treg) и активированными Т-клетками.
[198] Альдеслейкин (Proleukin®), рекомбинантный человеческий IL-2, был первым средством иммунотерапии рака и одним из первых рекомбинантных белков, одобренных FDA в 1992 году. В настоящее время алдеслейкин используется для лечения метастатического почечно-клеточного рака (мПКР) и метастатической меланомы (мМ) путем внутривенной инфузии. В связи с необходимостью частых внутривенных инфузий многочисленных доз введение алдеслейкина проводят в клинических условиях. Альдеслейкин продемонстрировал полную регрессию рака примерно у 10% пациентов, получавших лечение по поводу метастатической меланомы и рака почки (Klapper и др., Рак, 2008; Cancer, 2008; Rosenberg, Sci Transl Med., 2012; Smith и др., Clin Cancer Res., 2008). Примерно 70% пациентов с полным ответом были излечены, сохраняя полную регрессию в течение более 25 лет после первоначального лечения (Atkins и др., J Clin Oncol., 1999; Klapper и др., Cancer, 2008; Rosenberg, Sci Transl Med., 2012; Rosenberg и др., Ann Surg., 1998; Smith и др., Clin Cancer Res., 2008). Однако, высокие дозы IL-2 могут вызывать синдром сосудистого пропотевания (VLS), толерантность по отношению к опухоли, вызванную индуцированной активацией гибелью клеток (AICD), и иммуносупрессию, вызванную активацией Treg. Дополнительная проблема системного лечения с использаванием IL-2 связана с серьезным побочным действием при внутривенном введении, которые включают тяжелые сердечно-сосудистые, легочные, печеночные, желудочно-кишечные (ЖКТ), неврологические и гематологические явления (Proleukin (aldesleukin) Summary oF Product Characteristics [SmPC]: http://www.medicines.org.uk/emc/medicine/19322/SPC). Тяжелое побочное действие часто ограничивает оптимальную дозировку IL-2, что ограничивает число пациентов с позитивным ответом на лечение. Для более широкого применения в будущем необходимо решить проблемы токсичности и короткого периода полувыведения IL-2.
[199] Нативный полипептид-предшественник человеческого IL-2 состоит из 153 аминокислотных остатков (аминокислоты 1-20 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 133 аминокислотных остатков (SEQ ID NO: 1). В некоторых вариантах осуществления фрагмент IL-2 представляет собой зрелый человеческий IL-2. В некоторых вариантах осуществления фрагмент IL-2 представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 1, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления фрагмент IL-2 не является гликозилированным. В некоторых вариантах осуществления фрагмент IL-2 является гликозилированным.
[200] В некоторых вариантах осуществления фрагмент IL-2 представляет собой (или практически состоит из) альдеслейкина (например, Proleukin®; см., например, https://www.drugbank.ca/drugs/DB00041). Альдеслейкин (десаланил-1, серин-125 человеческий интерлейкин-2) представляет собой противоопухолевый (противораковый) модификатор биологического ответа, одобренный FDA. Он имеет молекулярную массу примерно 15,3 кДа и является синонимом рекомбинантного интерлейкина-2 человека, интерлейкина-2 альдеслейкина, 125-L-серин-2-133-интерлейкина 2 (человеческий, восстановленный) или интерлейкина-2(2-133),125-ser. Альдеслейкин представляет собой рекомбинантный IL-2, он отличается от нативного IL-2 следующим образом: a) альдеслейкин не гликозилирован, поскольку от получен из E. coli; b) альдеслейкин не имеет N-концевого аланина (А); с) альдеслейкин содержит замену цистеина на серин в положении 125 (C125S); и d) состояние агрегации алдеслейкина, вероятно, отличается от состояния альдеслейкина нативного IL-2. Таким образом, в некоторых вариантах осуществления вариант IL-2 содержит замену цистеина на серин в положении 125 (C125S) в зрелой форме человеческого IL-2.
[201] К. Sauve и др. (Proc Natl Acad Sci USA. 1991; 88(11):4636-4640) обнаружили, что аминокислотные остатки K35, R38, F42 и K43 IL-2 дикого типа оказались ключевыми для связывания с рецептором IL-2 (IL-2Rα, форма с низким сродством), а при мутациях R38A и F24A сохранялась значительная биологическая активность IL-2. R. Vazquez-Lombardi и др. (Nat Commun. 2017;8:15373) обнаружили, что мутации R38D, K43E и E61R в IL-2 вызывают сильную экспансию CD25 цитотоксической субпопуляции с минимальной экспансией Treg по сравнению с IL-2 дикого типа. Было обнаружено, что мутация P65L в IL-2 снижает системную токсичность и повышает противоопухолевую эффективность по сравнению с IL-2 дикого типа (Chen и др., Cell Death Dis. 2018;9(10):989).
[202] В некоторых вариантах осуществления вариант IL-2 содержит одну или несколько мутаций в положении, выбранном из группы, состоящей из F24, K35, R38, F42, K43, E61 и P65, соответствующему положению в IL-2 дикого типа, содержащем последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит одну или несколько мутаций, выбранных из группы, состоящей из F24A, R38D, K43E, E61R и P65L, в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит мутацию R38D/K43E/E61R, соотносительную с IL-2 дикого типа, содержащим последовательность SEQ ID NO: 1. В некоторых вариантах осуществления вариант IL-2 содержит последовательность SEQ ID NO: 2.
IFN-α
[203] В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-α или его вариант, такой как IFN-α2 или его вариант, или IFN-α2b или его вариант. Человеческие интерфероны типа I (IFN) представляют собой большую группу IFN, которые помогают регулировать активность иммунной системы. Они связываются со специфическим комплексом рецепторов клеточной поверхности, известным как рецептор IFN-α (IFNAR), состоящим из цепей IFNAR1 и IFNAR2. IFN типа I млекопитающих содержат IFN-α, IFN-β, IFN-κ, IFN-, IFN-ε, IFN-τ, IFN-ω и IFN-ζ (также известен как лимитин).
[204] Белки IFN-α в основном продуцируются плазмоцитоидными дендритными клетками (pDC) и в основном участвуют во врожденном иммунитете против вирусной инфекции. Белки IFN-α представляют собой мономерные белки с молекулярной массой 19-26 кДа, которые широко применяют для лечения рака и вирусных заболеваний, таких как гепатит B и C. Существует 13 генов, ответственных за синтез 13 подтипов IFN-α: IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21.
[205] Человеческие IFN-α2a, IFN-α2b и IFN-α2c представляют собой аллельные варианты одного и того же гена. IFN-α2a и IFN-α2b содержат лизин и аргинин в положении 23 зрелого белка, соответственно. Человеческие IFN-α2a и IFN-α2b являются единственными подтипами IFN-α, у которых есть сайт O-гликозилирования (Th106). Интерферон альфа-2а (IFN-α2a; в продажу поступает под названием RoFeron-A® от HoFFmann-La Roche) и интерферон альфа-2b (IFN-α2b - рекомбинантная форма IFN-α2; в продажу поступает под названием Intron-A® от Schering-Plough) были одобрены для лечения волосатоклеточного лейкоза, меланомы, фолликулярной лимфомы, почечно-клеточного рака, саркомы Капоши, связанной со СПИДом, и хронического миелогенного лейкоза (M. Ferrantini и др., Biochimie. Jun-Jul 2007;89(6-7):884-893). Недавние исследования выявили новое иммуномодулирующее воздействие IFN-α, в том числе воздействие на Т-клетки и дендритные клетки, что может привести к возникновению стойкого противоопухолевого ответа. Однако использование IFN-α в клинической онкологии по-прежнему в основном основано на использовании антипролиферативной и антиангиогенной активности этих цитокинов. Полное использование роли IFN-α как регулятора иммунного ответа и противоопухолевого иммунитета потребует новых подходов к использованию этих цитокинов.
[206] hIFN-α2b представляет собой гликопротеин, состоящий из 166 аминокислот с O-гликозилированным треонином в положении 106. Каждый rhIFN-2b состоит из пяти α-спиралей (называемых спиралью A-E), соединенных петлей AB, BC, CD и DE. Остатки, которые важны для связывания с рецептором, представляют собой петлю AB (Arg22, Leu26, Phe27, Leu30, Lys31, Arg33 и His34), спираль B (Ser68), спираль C (Thr79, Lys83, Tyr85 и Tyr89), спираль D (Arg120, lys121, Gln124, Lys131 и Glu132) и спираль E (Arg144 и Glu146). Аминокислотными остатками, важными для биологической активности, являются Leu30, Lys31, Arg33, His34, Phe36, Arg120, Lys121, Gln124, Tyr122, Tyr129, Lys131, Glu132, Arg144 и Glu146 (Ratih Asmana Ningrum, ScientiFica (Cairo). 2014; 2014:970315).
[207] В некоторых вариантах осуществления фрагмент IFN-α представляет собой IFN-α2. В некоторых вариантах осуществления фрагмент IFN-α представляет собой IFN-α2a. В некоторых вариантах осуществления фрагмент IFN-α представляет собой IFN-α2b. В некоторых вариантах осуществления фрагмент IFN-α представляет собой IFN-α2c. В некоторых вариантах осуществления фрагмент IFN-α представляет собой зрелый IFN-α. Нативный полипептид-предшественник человеческого IFN-α2b состоит из 188 аминокислотных остатков (аминокислоты 1-23 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 165 аминокислотных остатков (SEQ ID NO: 3). В некоторых вариантах осуществления фрагмент IFN-α представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 3, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 3. В некоторых вариантах осуществления фрагмент IFN-α не является гликозилированным. В некоторых вариантах осуществления фрагмент IFN-α является гликозилированным.
[208] В некоторых вариантах осуществления вариант IFN-α (например, вариант IFN-α2b) содержит одну или несколько мутаций в положении, выбранном из группы, состоящей из R22, L26, F27, L30, K31, D32, R33, H34, D35, F36, S68, T79, K83, Y85, Y89, R120, K121, Y122, Q124, Y129, K131, E132, R144 и E146, и соответствующем положению в IFN-α (например, IFN-α2b), содержащем последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α (например, вариант IFN-α2b) содержит одну или несколько мутаций, выбранных из группы, состоящей из L30A, K31A, D32A, R33A, H34A и D35A, в отличие от IFN-α, содержащего последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α (например, вариант IFN-α2b) содержит любую последовательность из SEQ ID NO: 4-9. В некоторых вариантах осуществления вариант IFN-α (например, вариант IFN-α2b) содержит мутацию L30A в отличие от IFN-α, содержащего последовательность SEQ ID NO: 3. В некоторых вариантах осуществления вариант IFN-α (например, вариант IFN-α2b) содержит последовательность SEQ ID NO: 4.
IFN-γ
[209] В некоторых вариантах осуществления цитокин или его вариант представляет собой IFN-γ или его вариант. Гамма-интерферон (IFNγ) представляет собой димеризованный растворимый цитокин с дисульфидной связью, который является единственным членом класса интерферонов типа II. IFN-γ представляет собой гомодимер с ММ ~25 кДа с третичной укладкой, построенной вокруг необычного паттерна переплетающихся α-спиралей. Он продуцируется преимущественно Т-клетками и NK-клетками в ответ на различные воспалительные или иммунные стимулы. IFN-γ может служить как активатором, так и супрессором иммунной системы. Исследования показали, что иммунотерапия рака (ингибиторы контрольных точек) действует частично за счет увеличения экспрессии IFN-γ, что приводит к уничтожению раковых клеток. Устойчивость к иммунотерапии объясняется дефектами передачи сигналов IFN-γ. Однако IFN-γ также может позволить избежать онкологии, способствуя онкогенезу и ангиогенезу, вызывая экспрессию толерантных молекул, таких как PD-L1, и индуцируя программу гомеостаза. Из-за своего противоположного и конкурирующего воздействия на иммунную систему IFN-γ не был одобрен FDA для лечения онкологических больных, за исключением случаев злокачественного остеопороза (L. Ni и J. Lu, Cancer Med. 2018; 7(9):4509-4516).
[210] Мономерный пре-прополипептид нативного человеческого IFN-γ (hIFN-γ) состоит из 166 аминокислотных остатков (аминокислоты 1-23 являются сигнальным пептидом); мономерный зрелый полипептид состоит из 138 аминокислотных остатков (SEQ ID NO: 10), соответствующих аминокислотам 24-161 пре-про-полипептида; аминокислоты 162-166 представляют собой пропептидную последовательность пре-про-полипептида. В некоторых вариантах осуществления мономерный фрагмент IFN-γ представляет собой мономерный зрелый IFN-γ. В некоторых вариантах осуществления мономерный фрагмент IFN-γ представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 10, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 10. В некоторых вариантах осуществления фрагмент (или субъединица) IFN-γ не является гликозилированным. В некоторых вариантах осуществления фрагмент (или субъединица) IFN-γ является гликозилированным. В некоторых вариантах осуществления фрагмент IFN-γ содержит два идентичных мономера/субъединицы IFN-γ. В некоторых вариантах осуществления фрагмент IFN-γ содержит два разных мономера/субъединицы IFN-γ. Например, в некоторых вариантах осуществления фрагмент IFN-γ содержит один мономер IFN-γ дикого типа и один мономер варианта IFN-γ. В некоторых вариантах осуществления фрагмент IFN-γ содержит два мономера IFN-γ (например, два мономера варианта IFN-γ или IFN-γ дикого типа), связанные вместе, например, через пептидный линкер (например, любую из SEQ ID NO: 227-229) или химический линкер.
[211] Аминокислотные остатки IFN-γ S20, A23, H111 и Q115 важны для связывания с рецептором; аминокислотные остатки V5, S20, A23, G26 и H111 важны для биологической активности IFN-γ (M. Randal и A. A. KossiakoFF, Structure. 2001;9(2):155-63). Lander и др. (J Mol Biol. 2000;299(1):169-79) разработали биологически активный одноцепочечный вариант hIFN-γ (IFN-γSC1), путем связывания двух мономерных IFN-γ линкером из 7 аминокислотных остатков и замены His111 в первом мономере IFN-γ на остаток аспарагиновой кислоты. Благодаря мутации H111D IFN-γSC1 может связывать только один IFN-γRα, но при этом полностью сохраняет свою биологическую активность, касающуюся клеточной пролиферации, индукции МНС класса I и антивирусных анализов.
[212] В некоторых вариантах осуществления мономерный IFN-γ содержит последовательность SEQ ID NO: 10. В некоторых вариантах осуществления вариант IFN-γ содержит одну или несколько мутаций в одной или обеих субъединицах IFN-γ в положении, выбранном из группы, состоящей из V5, S20, D21, V22, A23, D24, N25, G26, H111 и Q115, и соответствующем положению в субъединице IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления вариант IFN-γ в одной или обеих субъединицах IFN-γ содержит одну или несколько мутаций, выбранных из группы, состоящей из S20A, D21A, D21K, V22A, A23S, A23E, A23Q, A23V, D24A, D24E, N25A, N25K и H111D, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления в одной или обеих субъединицах IFN-γ варианта IFN-γ содержится одна или несколько мутаций, выбранных из группы, состоящей из S20A/D21A, D21K, V22A/A23S, D24A/N25A, A23E/D24E/N25K, A23Q, и A23V, в отличие от субъединицы IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат любую последовательность из SEQ ID NO: 11-17. В некоторых вариантах осуществления вариант IFN-γ содержит мутацию A23V в одной или обеих субъединицах IFN-γ, которые соотносятся с субъединицей IFN-γ дикого типа, содержащей последовательность SEQ ID NO: 10. В некоторых вариантах осуществления одна или обе субъединицы варианта IFN-γ содержат последовательность SEQ ID NO: 13. В некоторых вариантах осуществления две субъединицы IFN-γ или его варианта соединены линкером (например, любой из SEQ ID NO: 227-229). В некоторых вариантах осуществления вариант IFN-γ содержит последовательность SEQ ID NO: 19. В некоторых вариантах осуществления обе субъединицы IFN-γ содержат последовательность SEQ ID NO: 10. В некоторых вариантах осуществления фрагмент IFN-γ представляет собой рекомбинантный IFN-γ «дикого типа», содержащий две субъединицы IFN-γ дикого типа, соединенные линкером (например, любой из SEQ ID NO: 227-229), который содержит последовательность SEQ ID NO: 18.
IL-10
[213] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-10 или его вариант. Интерлейкин 10 (IL-10) представляет собой α-спиральный цитокин, который экспрессируется в виде нековалентно связанного гомодимера с ММ ~ 37 кДа, также известный как фактор, ингибирующий синтез цитокинов (CSIF) человека. Он играет ключевую роль в индукции и поддержании толерантности. Сигнализация IL-10 происходит через комплекс JAK-STAT. Рецептор IL-10 (IL-10R) имеет две субъединицы: α-субъединицу, которая в основном экспрессируется на иммунных клетках с наивысшей экспрессией на моноцитах и макрофагах, и повсеместно экспрессируемую β-субъединицу. IL-10 в основном продуцируется моноцитами и, в меньшей степени - лимфоцитами, в том числе Т-хелперными клетками II типа (TH2), тучными клетками, регуляторными Т-клетками CD4+CD25+Foxp3+ и подмножествами активированных Т-клеток и В-клеток. Дендритные клетки и NK-клетки также могут продуцировать IL-10. IL-10 подавляет секрецию провоспалительных цитокинов, таких как TNFα, IL-1, IL-6, IL-12, а также цитокинов Th1, таких как IL-2 и IFN-γ, и контролирует дифференцировку и пролиферацию макрофагов, B-клеток и Т-клеток (Glocker, EO и др., Ann. N.Y. Acad. Sci. 1246, 102-107 (2011); Moore, K. W. и др., Annu. Rev. Immunol. 19, 683-765 (2001); R. de Waal MaleFyt и др., J. Exp. Med. 174, 915-924 (1991); Williams, LM и др., Immunology 113, 281-292 (2004)). Кроме того, он является мощным ингибитором презентации антигена, подавляя экспрессию MHC II, а также повышая регуляцию костимулирующих молекул CD80 и CD86 (Mosser, DM & Zhang, X. Immunological Reviews 226, 205-218 (2008)). Если IL-10 отсутствует или не функционирует, воспаление становится неконтролируемым. Это делает IL-10 привлекательным терапевтическим кандидатом для лечения аутоиммунных заболеваний. Однако клинические испытания с использованием IL-10 и разработка рекомбинантного IL-10 (илодекакин, TENOVIL®, Schering-Plough Research Institue, Kenilworth, Нью-Джерси) были прекращены из-за недостаточной эффективности. Недавние исследования пролили свет на потенциальную роль IL-10 в лечении опухолей (Fujii и др., (October 2001). «Interleukin-10 promotes the maintenance oF antitumor CD8(+) T-cell eFFector Function in situ». Blood. 98(7):2143-51).
[214] Мономерный нативный полипептид-предшественник человеческого IL-10 состоит из 178 аминокислотных остатков (аминокислоты 1-18 являются сигнальным пептидом), тогда как мономерный зрелый полипептид IL-10 состоит из 160 аминокислотных остатков (SEQ ID NO: 20). В некоторых вариантах осуществления фрагмент мономерного IL-10 представляет собой мономерный зрелый IL-10. В некоторых вариантах осуществления мономерный фрагмент IL-10 представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 20, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 20. В некоторых вариантах осуществления фрагмент (или субъединица) IL-10 не является гликозилированным. В некоторых вариантах осуществления часть (или субъединица) IL-10 является гликозилированной. В некоторых вариантах осуществления фрагмент IL-10 содержит два идентичных мономера/субъединицы IL-10. В некоторых вариантах осуществления фрагмент IL-10 содержит два разных мономера/субъединицы IL-10. Например, в некоторых вариантах осуществления фрагмент IL-10 содержит один мономер IL-10 дикого типа и один мономер варианта IL-10. В некоторых вариантах осуществления фрагмент IL-10 содержит два мономера IL-10 (например, два мономера варианта IL-10 или IL-10 дикого типа), связанные вместе, например, через пептидный линкер (например, любую из SEQ ID NO: 227-229) или химический линкер, см., например, биологически активный одноцепочечный IL-10 в US 20130316404, содержание которого полностью включено в настоящее описание ссылкой.
[215] Аминокислотные остатки IL-10 N21, M22, R24, R32, H90, S31 и S93 важны для связывания с рецептором IL-10; остаток R24 имеет решающее значение для биологической активности IL-10 (Yoon и др., J Biol Chem. 2006;281(46):35088-35096; E. S. Acuner-Ozbabacan и др. BMC Genomics. 2014;15 Suppl 4(Suppl 4):S2).
[216] В некоторых вариантах осуществления мономерный IL-10 содержит последовательность SEQ ID NO: 20. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10 в положении, выбранном из группы, состоящей из N21, M22, R24, D25, L26, R27, D28, A29, F30, S31, R32, H90 и S93, и соответствующем положению в субъединице IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A, L26A, R27A, D28A, A29S, F30A, S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления вариант IL-10 содержит одну или несколько мутаций в одной или обеих субъединицах IL-10, выбранных из группы, состоящей из R24A, D25A/L26A, R27A, D28A/29S, F30A/S31A и R32A, в отличие от субъединицы IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат любую последовательность из SEQ ID NO: 21-26. В некоторых вариантах осуществления вариант IL-10 содержит мутацию R27A в одной или обеих субъединицах IL-10, которые соотносятся с субъединицей IL-10 дикого типа, содержащей последовательность SEQ ID NO: 20. В некоторых вариантах осуществления одна или обе субъединицы варианта IL-10 содержат последовательность SEQ ID NO: 23. В некоторых вариантах осуществления две субъединицы IL-10 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-10 содержит последовательность SEQ ID NO: 28. В некоторых вариантах осуществления обе субъединицы IL-10 содержат последовательность SEQ ID NO: 20. В некоторых вариантах осуществления фрагмент IL-10 представляет собой рекомбинантный IL-10 «дикого типа», содержащий два мономера IL-10 дикого типа, соединенных линкером (например, любой из SEQ ID NO: 227-229), который содержит последовательность SEQ ID NO: 27.
IL-12
[217] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-12 или его вариант. IL-12 представляет собой гетеродимерный белок с ММ 70 кДа, состоящий из двух ковалентно связанных (дисульфидной связью) субъединиц p35 (IL-12A) и p40 (IL-12B). Субъединица P40 является общей для IL-12 и IL-23. Активный гетеродимер (обозначаемый как «р70») и гомодимер р40 образуются после синтеза белка. IL-12 представляет собой интерлейкин, принадлежащий к семейству IL-12, которое является единственным семейством, включающим гетеродимерные цитокины, такие как IL-12, IL-23, IL-27 и IL-35. IL-12 продуцируется дендритными клетками, макрофагами, нейтрофилами и В-лимфобластоидными клетками (NC-37) человека в ответ на антигенную стимуляцию. IL-12 функционирует путем связывания с рецептором IL-12 (IL-12R), который представляет собой гетеродимерный рецептор, образованный из IL-12Rβ1 и IL-12Rβ2, что, в свою очередь, приводит к активации сигнального пути JAK-STAT. IL-12 способствует развитию Th1-ответов и сильно индуцирует продуцирование IFNγ Т- и NK-клеток. Способность IL-12 активировать как врожденный (NK-клетки), так и адаптивный (цитотоксические Т-лимфоциты) иммунитеты сделала его многообещающим кандидатом для иммунотерапии рака. Несмотря на положительные результаты испытаний на животных, IL-12 продемонстрировал лишь скромный противоопухолевый ответ в клинических испытаниях и часто сопровождался значительными проблемами, вызванными токсичностью (Lasek и др., Cancer Immunol Immunother., 2014). Лечение IL-12 сопровождалось системными гриппоподобными симптомами (например, лихорадкой, ознобом, утомляемостью, эритромелалгией или головной болью) и токсическим воздействием на костный мозг и печень. Исследования дозирования показали, что пациенты могли переносить только дозы менее 1 мкг/кг, что намного ниже терапевтической дозы. В результате клинические испытания IL-12 либо в качестве монотерапии, либо в сочетании с другими средствами не продемонстрировали сильную устойчивую терапевтическую эффективность ((Lasek и др., Cancer Immunol Immunother., 2014).
[218] Нативный полипептид-предшественник человеческого р35 (IL-12A) состоит из 219 аминокислотных остатков (аминокислоты 1-22 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 197 аминокислотных остатков (SEQ ID NO: 29). Нативный полипептид-предшественник человеческого р40 (IL-12B) состоит из 328 аминокислотных остатков (аминокислоты 1-22 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 306 аминокислотных остатков (SEQ ID NO: 30). В некоторых вариантах осуществления фрагмент IL-12 (или субъединица IL-12) представляет собой зрелый IL-12 (или зрелую субъединицу). В некоторых вариантах осуществления субъединица IL-12A (p35) или ее вариант представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 29, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 29. В некоторых вариантах осуществления субъединица IL-12B (p40) или ее вариант представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 30, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 30. В некоторых вариантах осуществления IL-12 (или его субъединица) или его вариант не являются гликозилированным. В некоторых вариантах осуществления IL-12 (или его субъединица) или его вариант являются гликозилированным. В некоторых вариантах осуществления вариант IL-12 содержит одну субъединицу дикого типа (например, р35 дикого типа) и одну мутантную субъединицу (например, вариант р40). В некоторых вариантах осуществления вариант IL-12 содержит две вариантные субъединицы (вариант р35 и вариант р40). В некоторых вариантах осуществления вариант IL-12 содержит две субъединицы дикого типа (например, р35 и р40 дикого типа), которые связаны друг с другом через синтетический пептидный линкер (например, любой из SEQ ID NO: 227-229) или химический линкер.
[219] В субъединице p40 аминокислотными остатками, важными для связывания с рецептором IL-12, являются C177, E45, E59 и D62 (Luo и др. J Mol Biol. 2010;402(5):797-812). Исследования показали, что доступный N-конец субъединицы p40 важен для биологической активности IL-12. Lieschke и др. сконструировали одноцепочечный IL-12 (scIL-12) и о™етили, что порядок субъединиц влияет на биологическую активность IL-12: если субъединица p35 находилась на N-конце субъединицы p40, то активность IL-12 значительно снижалась; если субъединица p40 находилась на N-конце субъединицы p35, то биологическая активность scIL-12 была сравнима с активностью rIL-12 (Lieschke и др., Nat Biotechnol. 1997;15(1):35-40).
[220] В некоторых вариантах осуществления фрагмент IL-12 содержит субъединицу р35 дикого типа (SEQ ID NO: 29). В некоторых вариантах осуществления фрагмент IL-12 содержит субъединицу варианта p35. В некоторых вариантах осуществления фрагмент IL-12 содержит субъединицу p40 дикого типа (SEQ ID NO: 30). В некоторых вариантах осуществления фрагмент IL-12 содержит субъединицу варианта p40. В некоторых вариантах осуществления фрагмент IL-12 содержит субъединицу р35 дикого типа или его варианта и субъединицу р40 дикого типа или варианта р40, соединенные пептидным линкером (например, любой из SEQ ID NO: 227-229). В некоторых вариантах осуществления фрагмент IL-12 содержит, от N-конца к С-концу: субъединицу р40 дикого типа или варианта р40 - линкер (например, любую из SEQ ID NO: 227-229) - субъединицу р35 дикого типа или варианта р35. В некоторых вариантах осуществления фрагмент IL-12 содержит, от N-конца к С-концу: субъединицу р35 дикого типа или варианта р35 - линкер (например, любую из SEQ ID NO: 227-229) - субъединицу р40 дикого типа или варианта р40. В некоторых вариантах осуществления вариант IL-12 содержит одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, и соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления вариант IL-12 содержит одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащий последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит любую последовательность из SEQ ID NO: 31-34. В некоторых вариантах осуществления вариант IL-12 содержит мутацию E59A/F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления вариант IL-12 содержит мутацию F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 33. В некоторых вариантах осуществления субъединица p40 и субъединица p35 IL-12 или его варианта соединены линкером. В некоторых вариантах осуществления вариант IL-12 содержит последовательность SEQ ID NO: 36 или 275. В некоторых вариантах осуществления фрагмент IL-12 представляет собой рекомбинантный IL-12 «дикого типа», содержащий субъединицу р35 дикого типа и субъединицу р40 дикого типа, соединенные линкером (например, любой из SEQ ID NO: 227-229), который содержит последовательность SEQ ID NO: 35.
IL-23
[221] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-23 или его вариант. Интерлейкин-23 (IL-23) принадлежит к семейству цитокинов IL-12, и представляет собой гетеродимерный цитокин, состоящий из субъединицы IL12B (p40) (такой же, как у IL-12) и субъединицы IL23A (p19). IL-23 функционирует путем связывания с рецептором IL-23, состоящим из IL-12R β1 и IL-23R (субъединица p19 связывает IL-23R, тогда как субъединица p40 связывает IL-12Rβ1), что приводит к рекрутированию и фосфорилированию Янус-киназы 2 и тирозинкиназы 2 и фосфорилированию STAT3 и STAT4, что приводит к активации генов. STAT3 отвечает за ключевые характеристики развития Th17, такие как экспрессия RORγt или транскрипция цитокинов Th17, таких как IL-17, IL-21, IL-22 и GM-CSF, с помощью которых происходит защита от грибков и бактерий, и которые участвуют в барьерном иммунитете. IL-23 в основном секретируется активированными дендритными клетками, макрофагами или моноцитами, стимулируемыми антигенным стимулом. Рецептор IL-23 экспрессируется на клетках Th17 и NK-клетках. Было обнаружено, что аутоиммунные и раковые заболевания связаны с дисбалансом IL-23 и повышением его уровня. Наиболее важной функцией IL-23 является его роль в развитии и дифференцировке эффекторных клеток Th17. В условиях хронического воспаления активированные DC и макрофаги продуцируют IL-23, который способствует развитию клеток Th17. Недавно было обнаружено, что аутоиммунные заболевания, такие как псориаз, болезнь Крона, ревматоидный артрит или рассеянный склероз, связаны с опосредованной IL-23 передачей сигналов, стимулируемой TH-17 и другими субпопуляциями лимфоцитов, экспрессирующими рецептор IL-23.
[222] Нативный полипептид-предшественник человеческого р19 (IL-23A) состоит из 189 аминокислотных остатков (аминокислоты 1-19 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 170 аминокислотных остатков (SEQ ID NO: 37). Нативный полипептид-предшественник человеческого р40 (IL-12B) состоит из 328 аминокислотных остатков (аминокислоты 1-22 являются сигнальным пептидом), тогда как зрелый полипептид состоит из 306 аминокислотных остатков (SEQ ID NO: 30). В некоторых вариантах осуществления фрагмент IL-23 (или субъединица IL-23) представляет собой зрелый IL-23 (или зрелую субъединицу IL-23). В некоторых вариантах осуществления IL-23A (p19) или его вариант представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 37, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 37. В некоторых вариантах осуществления субъединица IL-12B (p40) или ее вариант представляет собой полипептид, практически гомологичный аминокислотной последовательности SEQ ID NO: 30, например, по меньшей мере примерно на 85% (например, по меньшей мере примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичный аминокислотной последовательности SEQ ID NO: 30. В некоторых вариантах осуществления IL-23 (или его субъединица) или его вариант не являются гликозилированным. В некоторых вариантах осуществления IL-23 (или его субъединица) или его вариант являются гликозилированным. В некоторых вариантах осуществления вариант IL-23 содержит одну субъединицу дикого типа (например, р19 дикого типа) и одну мутантную субъединицу (например, вариант р40). В некоторых вариантах осуществления вариант IL-23 содержит две вариантные субъединицы (вариант р19 и вариант р40). В некоторых вариантах осуществления вариант IL-23 содержит две субъединицы дикого типа (например, р19 и р40 дикого типа), которые связаны друг с другом через синтетический пептидный линкер (например, любой из SEQ ID NO: 227-229) или химический линкер. В субъединице p40 аминокислотными остатками, важными для связывания с рецептором IL-23, являются C177, E45, E59 и D62 (Luo и др. J Mol Biol. 2010;402(5):797-812).
[223] В некоторых вариантах осуществления фрагмент IL-23 содержит субъединицу p19 дикого типа (SEQ ID NO: 37). В некоторых вариантах осуществления фрагмент IL-23 содержит субъединицу варианта p19. В некоторых вариантах осуществления фрагмент IL-23 содержит субъединицу p40 дикого типа (SEQ ID NO: 30). В некоторых вариантах осуществления фрагмент IL-23 содержит субъединицу варианта p40. В некоторых вариантах осуществления фрагмент IL-23 содержит субъединицу р19 дикого типа или его варианта и субъединицу р40 дикого типа или варианта р40, соединенные пептидным линкером (например, любой из SEQ ID NO: 227-229). В некоторых вариантах осуществления фрагмент IL-23 содержит, от N-конца к С-концу: субъединицу р40 дикого типа или варианта р40 - линкер (например, любую из SEQ ID NO: 227-229) - субъединицу р19 дикого типа или варианта р19. В некоторых вариантах осуществления фрагмент IL-23 содержит, от N-конца к С-концу: субъединицу р19 дикого типа или варианта р19 - линкер (например, любую из SEQ ID NO: 227-229) - субъединицу р40 дикого типа или варианта р40. В некоторых вариантах осуществления вариант IL-23 содержит одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, и соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления вариант IL-23 содержит одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащий последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит любую последовательность из SEQ ID NO: 31-34. В некоторых вариантах осуществления вариант IL-23 содержит мутацию E59A/F60A в субъединице р40, соотносительной с субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30. В некоторых вариантах осуществления субъединица p40 варианта IL-23 содержит последовательность SEQ ID NO: 31. В некоторых вариантах осуществления субъединица р40 и субъединица р19 IL-23 или его варианта соединены линкером (например, любой из SEQ ID NO: 227-229). В некоторых вариантах осуществления вариант IL-23 содержит последовательность SEQ ID NO: 39. В некоторых вариантах осуществления фрагмент IL-23 представляет собой рекомбинантный IL-23 «дикого типа», содержащий субъединицу р35 дикого типа и субъединицу р40 дикого типа, соединенные линкером (например, любой из SEQ ID NO: 227-229), который содержит последовательность SEQ ID NO: 38.
IL-17
[224] В некоторых вариантах осуществления цитокин или его вариант представляет собой IL-17 или его вариант. Семейство IL-17 включает IL-17A, IL-17B, IL-17C, IL-17D, IL-17E (также известный как IL-25) и IL-17F. Интерлейкин 17A (IL-17A или IL-17) представляет собой дисульфид-связанный гомодимерный секретируемый гликопротеин с молекулярной массой примерно 35 кДа. Каждая субъединица гомодимера составляет примерно 15-20 кДа. IL-17A представляет собой провоспалительный цитокин, продуцируемый Т-хелперными клетками 17 (Th17) в ответ на их стимуляцию со стороны IL-23. IL-17 взаимодействует с IL-17R и активирует несколько сигнальных каскадов, которые, в свою очередь, приводят к индукции хемокинов. Эти хемокины действуют как хемоаттрактанты, привлекая иммунные клетки, такие как моноциты и нейтрофилы, к месту воспаления.
Активность цитокинов или их вариантов
[225] «Активность» (или «действие») цитокина или его варианта, описанного в данном документе, включает сродство связывания цитокина или его варианта с соответствующим рецептором цитокина; и/или биологическую активность (или биоактивность) цитокина или его варианта, такую как индуцирование или ингибирование передачи сигнала, индуцирование или ингибирование клеточной пролиферации, дифференцировки и/или активации, индуцирование или ингибирование секреции действующего(их) цитокина(ов) (например, провоспалительных цитокинов) и т.д. после связывания цитокина/цитокинового рецептора. Такие виды биологической активности также упоминаются в данном документе как прямая биологическая активность. В некоторых вариантах осуществления биологическая активность цитокина или его варианта также включает косвенную биологическую активность, такую как любая биологическая активность, возникающая в результате прямой биологической активности. Например, в некоторых вариантах биологическая активность также включает уничтожение раковых клеток иммунными клетками, привлеченными к месту опухоли благодаря секретируемым воздействующим цитокинам, таким как маркеры воспаления IL-6, MIP-2 (GRO-β)/CXCL2, G-CSF/CSF3, TIMP-1, KC (GRO-α)/CXCL1 и т.д.
[226] В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400 , 500% или выше) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента с антигеном-мишенью. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно в 2 раза (например, не менее чем примерно в 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 раз) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента с антигеном-мишенью.
[227] В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке антигенсвязывающего полипептида (например, расположенного в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv, или Fab) и субъединицей Fc-домена (или ее частью), см. фигуры 2A-4C) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии.
[228] В некоторых вариантах осуществления «соответствующий цитокин или его вариант» является таким же, как цитокин или его вариант, расположенный в шарнирном участке, но экспрессируемый в другом состоянии или в другом положении. Цитокин или его вариант «в свободном состоянии» в данном документе относится к цитокину или его варианту в растворимой форме, без присоединения к какой-либо части, такой как клеточная мембрана или другая молекула (например, Fc-фрагмент или N-конец или C-конец) полноразмерного антитела или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab)).
[229] В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке антигенсвязывающего полипептида (например, расположенного в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv, или Fab) и субъединицей Fc-домена (или ее частью), см. фигуры 2A-4C)) составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6% , 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности этого соответствующего цитокина или его варианта в свободном состоянии; а при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или выше) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) с антигеном-мишенью.
[230] В некоторых вариантах осуществления в отсутствие связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH полноразмерного антитела, ii) N-конце VL полноразмерного антитела, iii) C-конце тяжелой цепи полноразмерного антитела, iv) С-конце CL полноразмерного антитела и v) N-конце субъединицы Fc-домена полноразмерного антитела. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего фрагмента (например, scFv или Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, scFv или Fab) и субъединицей Fc-домена (или ее частью) (см. фигуры 3A-3C) составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH антигенсвязывающего фрагмента (например, scFv или Fab), ii) N-конце VL антигенсвязывающего фрагмента (например, scFv или Fab), iii) С-конце субъединицы Fc-домена (или ее части), iv) С-конце CL антигенсвязывающего фрагмента (Fab) и v) N-конце субъединицы Fc-домена. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора) с антигеном-мишенью активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, VHH, лигандом или рецептором) и субъединицей Fc-домена (или ее частью) (см. фигуры 4A-4C), составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора), ii) C-конце субъединицы Fc-домена (или его части) и iii) N-конце субъединицы Fc-домена.
[231] В некоторых вариантах осуществления при наличии связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела составляет не менее примерно 70% (например, не менее примерно 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 0,9%, 160%, 170%, 180%, 190%, 200%, 300%, 400%, 500% или больше) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH полноразмерного антитела, ii) N-конце VL полноразмерного антитела, iii) C-конце тяжелой цепи полноразмерного антитела, iv) С-конце CL полноразмерного антитела и v) N-конце субъединицы Fc полноразмерного антитела. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего фрагмента (например, scFv или Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, scFv или Fab) и субъединицей Fc-домена (или ее частью) (см. фигуры 3A-3C) составляет не менее примерно 70% (например, не менее примерно 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 0,9%, 160%, 170%, 180%, 190%, 200%, 300%, 400%, 500% или более) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH антигенсвязывающего фрагмента (например, scFv или Fab), ii) N-конце VL антигенсвязывающего фрагмента (например, scFv или Fab), iii) С-конце субъединицы Fc-домена (или ее части), iv) С-конце CL антигенсвязывающего фрагмента (Fab) и v) N-конце субъединицы Fc-домена. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора) с антигеном-мишенью активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, VHH, лигандом или рецептором) и субъединицей Fc-домена (или ее частью) (см. фигуры 4A-4C), составляет не менее примерно 70% (например, не более примерно 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 0,9%, 160%, 170%, 180%, 190%, 200%, 300%, 400%, 500% или более) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора), ii) C-конце субъединицы Fc-домена (или его части) и iii) N-конце субъединицы Fc-домена.
[232] В некоторых вариантах осуществления в отсутствие связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH полноразмерного антитела, ii) N-конце VL полноразмерного антитела, iii) C-конце тяжелой цепи полноразмерного антитела, iv) С-конце CL полноразмерного антитела и v) N-конце субъединицы Fc-домена полноразмерного антитела; а при наличии связывания полноразмерного антитела с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела составляет не менее примерно 70% (например, не менее примерно 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170% , 180%, 190%, 200%, 300%, 400%, 500% или более) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH полноразмерного антитела, ii) N-конце VL полноразмерного антитела, iii) C-конце тяжелой цепи полноразмерного антитела, iv) C-конце CL полноразмерного антитела и v) N-конце Fc-субъединицы полноразмерного антитела. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего фрагмента (например, scFv или Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, scFv или Fab) и субъединицей Fc-домена (или ее частью) (см. фигуры 3A-3C) составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от актисности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH антигенсвязывающего фрагмента (например, scFv или Fab), ii) N-конце VL антигенсвязывающего фрагмента (например, scFv или Fab), iii) С-конце субъединицы Fc-домена (или ее части), iv) С-конце CL антигенсвязывающего фрагмента (Fab) и v) N-конце субъединицы Fc-домена; а при наличии связывания антигенсвязывающего фрагмента (например, scFv или Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, scFv или Fab) и субъединицей Fc-домена (или ее частью) составляет не менее примерно 70% (например, не менее примерно 80%, 90%, 100%, 110% , 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 300%, 400%, 500% или более) активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце VH антигенсвязывающего фрагмента (например, scFv или Fab), ii) N-конце VL антигенсвязывающего фрагмента (например, scFv или Fab), iii) С-конце субъединицы Fc-домена (или ее части), iv) С-конце CL антигенсвязывающего фрагмента (Fab) и v) N-конце субъединицы Fc-домена. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора) с антигеном-мишенью активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, VHH, лигандом или рецептором) и субъединицей Fc-домена (или ее частью) (см. фигуры 4A-4C) составляет не более примерно 50% (например, не более примерно 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0%) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора), ii) C-конце субъединицы Fc-домена (или его части) и iii) N- конце субъединицы Fc-домена; а при наличии связывания антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, VHH, лигандом или рецептором) и субъединицей Fc-домена (или его частью) составляет не менее примерно 70% (например, не менее примерно 80%, 90% , 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200%, 300%, 400%, 500% или более) от активности соответствующего цитокина или его варианта, экспрессированного на любом из следующего: i) N-конце антигенсвязывающего фрагмента (например, VHH, лиганда или рецептора), ii) C-конце субъединицы Fc-домена (или его части), и iii) N-конце субъединицы Fc-домена.
[233] В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина. В некоторых вариантах осуществления активность (сродство связывания с соответствующим цитокиновым рецептором или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более примерно 70 %, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии такая же или примерно такая же (например, с разницей примерно в ±20%), как и активность соответствующего цитокина дикого типа в свободном состоянии.
[234] В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина, расположенного в шарнирном участке антигенсвязывающего полипептида (например, расположенного в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена (или ее частью)) составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10%, 9% , 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1 % или 0%) от активности соответствующего цитокина дикого типа (или соответствующего рекомбинантного цитокина «дикого типа», экспрессированного в том же формате, но содержащего субъединицы дикого типа), расположенного в том же участке. Например, в некоторых вариантах осуществления вариант IL-12 содержит, от N-конца к С-концу: субъединицу варианта p40 - линкер (например, любую из SEQ ID NO: 227-229) - субъединицу р35 дикого типа, а соответствующий рекомбинантный IL-12 «дикого типа» содержит, от N-конца к С-концу: субъединицу р40 дикого типа - линкер (например, любая из SEQ ID NO: 227-229) - субъединицу р35 дикого типа. В некоторых вариантах осуществления вариант цитокина представляет собой вариант IL-2, а соответствующий цитокин дикого типа представляет собой IL-2 «дикого типа».
[235] В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина, расположенного в шарнирном участке антигенсвязывающего полипептида (например, расположенного в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена (или ее частью)) составляет не менее примерно 1% (например, не менее примерно 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% , 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180 %, 190% или более) от активности соответствующего цитокина дикого типа (или соответствующего рекомбинантного цитокина «дикого типа», экспрессированного в том же формате, но содержащего субъединицы дикого типа), расположенного в том же участке.
[236] В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина, расположенного в шарнирном участке антигенсвязывающего полипептид (например, расположенный в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенный в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена (или ее частью)) составляет не более примерно 80% (например, не более примерно 70%, 60%, 50%, 40%, 30%, 20%, 10%, 9% , 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1 % или 0%) от активности соответствующего цитокина дикого типа (или соответствующего рекомбинантного цитокина «дикого типа» в том же формате, но содержащего субъединицы дикого типа), расположенного в том же участке; а при наличии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv , или Fab) иммуноцитокина, описанного в данном документе, с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина, расположенного в шарнирном участке антигенсвязывающего полипептида (например, расположенного в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенного в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена (или ее частью)) составляет не менее примерно 1% (например, не менее примерно 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 20 %, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% или более) от активности соответствующего цитокина дикого типа (или соответствующего рекомбинантного цитокина «дикого типа» в том же формате, но содержащего субъединицы дикого типа), расположенного в том же участке.
Сродство связывания
[237] Сродство связывания молекулы (например, фрагмента цитокина или иммуноцитокина, содержащего цитокиновый фрагмент) и его партнера по связыванию (например, рецептора цитокина или его субъединиц) можно определить экспериментально с помощью любых подходящих анализов связывания лиганда или анализов связывания антител/антигенов, известных в данной области техники, например, с использованием Вестерн-блотов, твердофазного иммуноферментного анализа (ELISA), электрохемилюминесценции Meso Scale Discovery (MSD), мультиплексный иммуноанализа на микрочастицах (MIA), RIA, поверхностно-плазменного резонанса (SPR), ECL, IRMA, FACS, EIA, анализа Biacore, анализа октетов, сканирования пептидов и т.д. Например, простой анализ возможен с использованием цитокина или его варианта, иммуноцитокина, содержащего цитокин или его вариант, или его соответствующего рецептора или его субъединиц, помеченных различными маркерными агентами, а также с использованием BiacoreX (производства Amersham Biosciences), который является продаваемым в розницу измерительным набором или аналогичным набором, в соответствии с руководством пользователя и методом проведения эксперимента, прилагаемым к набору.
[238] В некоторых вариантах осуществления белковый микрочип используется для анализа взаимодействия, функции и активности цитокинового фрагмента или иммуноцитокина, описанного в данном документе, с соответствующим рецептором цитокина в крупном масштабе. Белковый чип имеет подложку, на которой закреплен ряд захватывающих белков (например, цитокиновый рецептор или его субъединицы). Затем к матрице добавляют молекулы-зонды с флуоресцентной меткой (например, цитокиновый фрагмент или иммуноцитокин, описанные в данном документе), и при взаимодействии с закрепленным захватывающим белком высвобождается флуоресцентный сигнал, который считывается лазерным сканером.
[239] В некоторых вариантах осуществления сродство связывания фрагмента цитокина или иммуноцитокина, описанного в данном документе, и его соответствующего цитокинового рецептора (или его субъединицы) измеряют с использованием SPR (Biacore T-200). Например, антитело к человеческому антителу закрепляют на поверхности сенсорного чипа CM-5 (например, с использованием химического процесса EDC/NHS). Затем составной белок человеческого цитокинового рецептора-Fc (например, IL-2Rα-Fc, IL-2Rβ-Fc, IL-2Rγ-Fc) используют в качестве захваченного лиганда на этой поверхности. Серийные разведения иммуноцитокина, содержащего цитокиновый фрагмент (например, вариант IL-2), позволяют связываться с захваченными лигандами (вариант IL-2 в свободном состоянии служит контролем), а единицы ответа (RU) можно наносить на график зависимости от концентрации иммуноцитокина, чтобы определить значения EC50, или построить график зависимости от времени для отслеживания связывания и диссоциации иммуноцитокина с цитокиновым рецептором-Fc в режиме реального времени. Константу равновесной диссоциации (KD) и константу скорости диссоциации можно определить путем проведения кинетического анализа с использованием программного обеспечения Biacore. Cродство связывания каждого исследуемого иммуноцитокина с рецептором цитокина можно рассчитывать в процентах от уровня сродства соответствующего фрагмента цитокина в свободном состоянии. В некоторых вариантах осуществления клеточную линию, экспрессирующую рецептор цитокина (например, IL-2R) на клеточной поверхности, инкубируют с иммуноцитокином, содержащим цитокиновый фрагмент (например, вариант IL-2), описанный в данном документе, после культивирования клетки промывают, затем добавляют антитела к IgG, конъюгированные с флуоресцентным белком (например, APC), для определения сродства связывания иммуноцитокина с клетками, например, с помощью FACS.
[240] В некоторых вариантах осуществления KD связывания между цитокином или его вариантом в свободном состоянии и соответствующим ему цитокиновым рецептором (или его субъединицами) составляет примерно ≤ 10-5 М , ≤ 10-6 М , ≤ 10-7 М, ≤ 10-8 М, ≤ 10-9 М, ≤ 10-10 М, ≤ 10-11 М или ≤ 10-12 M. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) описанного в данном документе иммуноцитокина с целевым антигеном, KD связывания между цитокином или его вариантом, расположенным в шарнирном участке антигенсвязывающего полипептида (например, расположенным в шарнирном участке тяжелой цепи антитела (например, полноразмерного антитела) или расположенным в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена (или его частью)) и его соответствующим цитокиновым рецептором (или его субъединицами) не поддается обнаружению (например, отсутствие связывания), или КD выше, чем (т.е. связывается слабее, чем) в присутствии связывания антигенсвязывающего белка (например, антитела (например, полноразмерного антитела) или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv или Fab) описанного здесь иммуноцитокина к антигену-мишени.
Биологическая активность
[241] В данной области техники описаны различные способы определения биологической активности (или биоактивности) цитокинов или их вариантов или иммуноцитокинов, такие как биоанализы. Любые анализы цитокинов, известные в данной области, можно адаптировать для исследования биологической активности фрагментов цитокинов или иммуноцитокинов, описанных в данном документе.
[242] Биоанализ фокусируется на биологической активности цитокинов и использовании ее в качестве считываемого параметра. В биологическом анализе активность образца исследуют на чувствительной клеточной линии (например, на первичных клеточных культурах или адаптированные in vitro клеточные линии, которые зависят и/или реагируют на исследуемый образец) и результаты этой активности (например, клеточная пролиферация) сравнивают со стандартным препаратом цитокинов. Другие аспекты биологической активности цитокинов включают индукцию дальнейшей секреции цитокинов, индукцию лизинга, противовирусную активность, дегрануляцию, цитотоксичность, хемотаксис и стимулирование образования колоний. Анализы in vitro для измерения всех этих видов активности доступны. См., например, «Cytokine Bioassays» в Bioassays - BestProtocols® от eBioscience® (http://tools.thermoFisher.com/content/sFs/manuals/cytokine-bioassays.pdF), содержание которого полностью включено в настоящий документ ссылкой.
[243] Например, в анализе индуцированной цитокинами пролиферации образцы (например, фрагмент IL-2 или иммуноцитокин IL-2) и стандарт (например, IL-2 в свободном состоянии) разбавляют путем серийного разведения в планшете для анализа, заполненном культуральной средой, индикаторными клетками (например, CTLL-2 или PBMC, стимулированными антителом к CD3) промывают и повторно суспендируют в культуральной среде, затем добавляют в каждую лунку. Клетки инкубируют в течение достаточного времени (например, 24 часа или дольше) при 37°C, 5% CO2 во влажной камере. Затем в планшет можно добавить реагенты для тестирования жизнеспособности клеток (например, резазурин, реагенты для анализа МТТ) и проводить культивирование в течение достаточного периода, а затем измерять с помощью спектрофотометра. Значения EC50 (концентрация исследуемого образца, необходимая для проявления 50% максимального ответа) для клеточной пролиферации затем можно вычислить с помощью анализа нелинейной регрессии кривых зависимости эффекта от дозы. Количество клеток также можно подсчитать под микроскопом и сравнить с количеством при обработке стандартом или контролем. В качестве другого примера, в анализе продуцирования цитокинов, индуцированного цитокинами, образцы (например, фрагмент IL-12 или IL-23, или иммуноцитокин IL-12 или IL-23) и стандарт (например, IL-12 или IL-23 в свободном состоянии) разводят путем серийного разведения в планшете для анализа, заполненном культуральной средой, индикаторные клетки (например, спленоциты, активированные CD4+ Т-клетки или активированные CD8+ Т-клетки) промывают и ресуспендируют в культуральной среде, а затем добавляют в каждую лунку. Клетки культивируют в течение достаточного времени (например, 24-48 часов) при 37°С, 5% СО2 во влажной камере, затем надосадочные жидкости собирают для определения экспрессии цитокинов с помощью ELISA, следуя протоколу ELISA для интересующего целевого цитокина (например, IFN-γ). В качестве другого примера, в анализе индуцированной цитокинами экспрессии маркера клеточной поверхности образцы (например, фрагмент IFN-γ или иммуноцитокин IFN-γ) и стандарт (например, IFN-γ в свободном состоянии) разводят путем серийного разведения в планшете для анализа, заполненном культуральной средой, индикаторными клеткми (например, клетками HEK-Blue™ IFN-γ), промывают и повторно суспендируют в культуральной среде, затем вносят в каждую лунку. Клетки культивируют в течение достаточного времени (например, 24-48 часов) при 37°С, 5% СО2 во влажной камере, затем экспрессию биомаркера (например, PD-L1) на клеточной поверхности можно обнаружить (например, с использованием человекого антитела к PD-L1, конъюгированного с APC) и измерять с помощью ELISA или FACS. Иллюстративные способы см. также в примерах 1, 5 и 11.
[244] Биоактивность фрагментов цитокинов или иммуноцитокинов, описанных в данном документе, также может быть отражена в экспериментах in vivo или ex vivo, например, путем измерения пролиферации индикаторных клеток (например, пролиферации CD8+ клеток, NK-клеток или Treg после введения частей IL-2 или иммуноцитокинов IL-2); путем измерения индукции или ингибирования секреции цитокинов; путем измерения уменьшения объема опухоли у мышей с ксенотрансплантатом опухоли после инъекции фрагментов тестируемых цитокинов или иммуноцитокинов, описанных в данном документе; или путем измерения аутоиммунного балла.
[245] Исследование биологической активности фрагментов цитокинов или иммуноцитокинов, описанных в данном документе, также можно проводить с помощью анализов сигнальной системы клетки. В продаже можно приобрести различные наборы для анализа сигнальной системы клетки, например, для обнаружения аналитов, образующихся во время ферментативных реакций, участвующих в передаче сигналов, таких как АДФ, АМФ, УДФ, ВВП и факторы роста, или анализов фосфатазы для количественного определения как общего белка, так и фосфорилированных форм сигнальных белков. Например, после культивирования клеток с фрагментами цитокинов или иммуноцитокинами, описанными в данном документе, для определения активности конкретной киназы клеточный лизат подвергают воздействию известного субстрата для фермента в присутствии радиоактивного фосфата. Продукты разделяют электрофорезом (с иммунопреципитацией или без нее), затем гель подвергают воздействию рентгеновской пленки, чтобы определить, включены ли в белки изотопы. В некоторых вариантах осуществления биоактивность фрагментов цитокинов или иммуноцитокинов, описанных в данном документе, на клетках измеряют с помощью иммуногистохимии для обнаружения сигнальных белков. Например, можно использовать антитела к самим сигнальным белкам или сигнальные белки в их активированном состоянии. Эти антитела имеют распознающие эпитопы, которые включают фосфатную или другую активирующую конформацию. В некоторых вариантах осуществления перемещение специфических сигнальных белков (например, ядерную транслокацию сигнальных молекул) можно отслеживать путем внедрения гена флуоресцентного белка, например, зеленого флуоресцентного белка (GFP), в генетические векторы, кодирующие исследуемый белок. В некоторых вариантах осуществления биоактивность фрагментов цитокинов или иммуноцитокинов, описанных в данном документе, направленную на клетки исследуют с помощью вестерн-блоттинга. Например, все тирозин-фосфорилированные белки (или другие фосфорилированные аминокислоты, например, серин или треонин) можно обнаружить с помощью антитела к фосфотирозина (или антител к другим фосфорилированным аминокислотам) на вестерн-блоте клеточных лизатов, полученных после стимуляции во временной последовательности. В некоторых вариантах осуществления биоактивность фрагментов цитокинов или иммуноцитокинов, описанных в данном документе, направленную на клетки, можно измерять с помощью иммунопреципитации. Например, первичные антитела к определенному сигнальному белку или ко всем тирозин-фосфорилированным белкам перекрестно связаны с микрогранулами. Клетки после инкубирования с фрагментами цитокинов или иммуноцитокинами, описанными в данном документе, подвергают лизису в буфере, содержащем ингибиторы протеазы, а затем инкубируют с микрогранулами, покрытыми антителами. Белки разделяют с помощью электрофореза с SDS, а затем белки идентифицируют с использованием процедур, описанных для вестерн-блоттинга. В некоторых вариантах осуществления также можно использовать связывание глутатион-S-трансферазы (GST) или иммунопреципитацию, с помощью которой определяют прямые взаимодействия белок-белок (например, сигнальный белок). Также можно использовать анализы сигнальной трансдукции на основе клеток. Вкратце, репортерная клеточная линия (например, HEK-Blue™), стабильно экспрессирующая соответствующий рецептор фрагмента исследуемого цитокина или иммуноцитокина - соответствующие сигнальные факторы цитокинового сигнального пути (например, STAT, JAK), а репортер, индуцируемый цитокиновым сигнальным путем (например, флуоресцентный белок или секретируемую эмбриональную щелочную фосфатазу) можно культивировать в присутствии фрагмента тестируемого цитокина или иммуноцитокина при 37°C в CO2 камере в течение достаточного времени (например, 24-48 часов), затем репортер можно регистрировать, например, с помощью микроскопии или FACS с участием флуоресцентного белка, или путем выявления секретируемой эмбриональной щелочной фосфатазы в среде для культивирования клеток с использованием колориметрического ферментативного анализа активности щелочной фосфатазы (например, QUANTI-Blue™). Иллюстративные способы см. также в примерах 1, 4, 7, 9, 10 и 12.
[246] Используя IL-2 в качестве примера, передачу сигналов STAT5 и ERK1/2 можно измерить, чтобы отразить биологическую активность фрагмента IL-2 или иммуноцитокина, например, путем измерения фосфорилирования STAT5 и ERK1/2 с использованием любого подходящего метода, известного в данной области. Например, фосфорилирование STAT5 и ERK1/2 можно измерить с использованием антител, специфичных к фосфорилированной версии этих молекул, в сочетании с анализом проточной цитометрией. Например, свежевыделенные РВМС инкубируют при 37°C с IL-2 или его вариантом, или иммуноцитокином IL-2. После культивирования клетки немедленно фиксируют (например, с помощью буфера CytoFix) для сохранения статуса фосфорилирования и пермеабилизируют (например, с помощью буфера PhosFlow Perm III). Клетки окрашивают меченными флуорофором антителами к фосфорилированному STAT5 или ERK1/2 и анализируют с помощью проточной цитометрии. Альтернативно, исследуемые образцы (например, фрагменты цитокинов IL-2 или иммуноцитокины IL-2, описанные в данном документе) можно вводить путем инъекции внутрибрюшинно мышам, затем выделять все спленоциты, немедленно фиксировать (например, буфером PhosphoFlow™ Lyse/Fix), промывать с помощью PBS, охлажденного льдом, окрашивть с использованием антител к CD4 и CD25, а затем пермеабилизировать (например, PhosFlow Perm BuFFer III). Затем клетки промывали ледяным буфером FACS, окрашивали антителом к FoxP3, промывали ледяным буфером FACS и окрашивали антителом к фосфо-STAT5, меченным флуорофором, при комнатной температуре. Клетки промывают буфером FACS, затем данные можно получить на цитометре FACS и проанализировать. Передачу сигналов PI 3-киназы можно измерять с использованием любого подходящего метода, известного в данной области техники, который также отражает биоактивность IL-2. Например, передачу сигналов PI 3-киназы можно измерить с использованием антител, специфичных к рибосомному белку фосфо-S6, в сочетании с анализом проточной цитометрией.
[247] В некоторых вариантах осуществления цитокиновые фрагменты или иммуноцитокины, описанные в данном документе, способны активировать иммунную клетку, например, индуцировать исследуемым цитокином (например, фрагментом IL-2 или иммуноцитокином IL-2, описанным в данном документе) пролиферацию, дифференцировку и/или активациу зависимой иммунной клетки (например, РВМС, NK-клетку, CD8+ Т-клетку, клетку Th17), секрецию цитокинов, активировать передачу сигналов (например, индуцировать фосфорилирование STAT5, фосфорилирование ERK1/2 или стимулировать передачу сигналов PI-3-киназы) и/или индуцировать иммунные клетки с целью уничтожения опухолевых клеток или инфицированных клеток. В некоторых вариантах осуществления изобретения фрагменты цитокинов или иммуноцитокины, описанные в данном документе, способны подавлять иммунную клетку, например, подавлять продуцирование цитокинов (например, провоспалительных цитокинов), презентацию антигена или экспрессию молекул MHC из иммунной клетки, или подавлять или снижать сигнальную трансдукцию. В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из моноцита, дендритной клетки, макрофага, В-клетки, Т-клетки-киллера (Тс, цитотоксического Т-лимфоцита или ЦТЛ), Т-хелперной клетки (Тh), регуляторных Т-клеток (Treg), γ Т-клетки, естественных Т-клеток- киллеров (NKT) и естественных клеток-киллеров (NK).
[248] В некоторых вариантах осуществления активность в отношении активации/подавления иммунной клетки вариантом цитокина в свободном состоянии такая же или примерно такая же (например, с разницей примерно в ±20%), что и активность соответствующего цитокина дикого типа в свободном состоянии. В некоторых вариантах осуществления вариант цитокина содержит мутацию или модификацию (например, посттрансляционную модификацию), которая снижает его активность в отношении активации/подавления иммунной клетки по сравнению с цитокином дикого типа (например, она составляет не более чем примерно 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9% 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1% или 0% от биологической активности цитокина дикого типа) в свободном состоянии или в отсутствие связывания антигена-мишени и антитела описанного в данном документе иммуноцитокина. В некоторых вариантах осуществления, при наличии связывания антиген-мишени и антитела иммуноцитокина, описанного в данном документе, активность варианта цитокина в отношении активации/подавления иммунной клетки составляет не менее примерно 1% (например, не менее примерно 2%, 3 %, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200%) от активности соответствующего цитокина дикого типа.
Антигенсвязывающий белок, антигенсвязывающий полипептид, антитело и антигенсвязывающий фрагмент
[249] «Исходный» антигенсвязывающий белок, описанный в данном документе, представляет собой антигенсвязывающий белок (например, антитело, фрагмент антитела или составной белок лиганд/рецептор-шарнир-Fc), который может специфично распознавать антиген-мишень и служит основой для конструирования иммуноцитокинов, описанных в данном документе. В некоторых вариантах осуществления антигенсвязывающий белок (например, исходный антигенсвязывающий белок) содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv, Fab, VH или VL), необязательный линкер (такой как любые пептидные линкеры, описанные в данном документе), шарнирный участок и субъединицу Fc-домена или ее часть. В некоторых вариантах осуществления антигенсвязывающий белок (например, исходный антигенсвязывающий белок) содержит (например, практически состоит из или состоит из) гомодимерных антигенсвязывающих полипептидов, то есть двух идентичных антигенсвязывающих полипептидов. Например, в некоторых вариантах осуществления исходный антигенсвязывающий белок содержит (например, практически состоит из или состоит из) двух антигенсвязывающих полипептидов, каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент (например, лиганд (такой как PD-L2) или его часть, рецептор (например, PD-1) или его часть, VHH, scFv, VH или VL), необязательный линкер, шарнирный участок и субъединицу Fc-домена или ее часть. В некоторых вариантах осуществления антигенсвязывающий белок (например, исходный антигенсвязывающий белок) содержит (например, практически состоит из или состоит из) гетеродимерных антигенсвязывающих полипептидов, т.е. двух антигенсвязывающих полипептидов, отличающихся одним или несколькими антигенсвязывающими фрагментами (например, лигандом, рецептором, VHH, scFv, VH или VL), необязательным линкером, шарнирным участком и субъединицей Fc-домена или ее частью. Например, в некоторых вариантах осуществления два антигенсвязывающих полипептида содержат разные антигенсвязывающие фрагменты (например, связываются с одним и тем же эпитопом-мишенью или с разными эпитопами-мишенями). В некоторых вариантах осуществления два антигенсвязывающих полипептида содержат разных шарнирных участка и/или разные субъединицы Fc-домена или их части, например, для гетеродимерного спаривания. Например, в некоторых вариантах осуществления один антигенсвязывающий полипептид содержит шарнирный участок, содержащий последовательность SEQ ID NO: 41, а парный антигенсвязывающий полипептид содержит шарнирный участок, содержащий последовательность SEQ ID NO: 42. В некоторых вариантах осуществления один антигенсвязывающий полипептид содержит шарнирный участок, содержащий последовательность SEQ ID NO: 51, а пареный антигенсвязывающий полипептид содержит шарнирный участок, содержащий последовательность SEQ ID NO: 52. В некоторых вариантах осуществления один антигенсвязывающий полипептид содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а пареный антигенсвязывающий полипептид содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62. В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) содержит два или более антигенсвязывающих фрагмента (например, лиганд, рецептор, VHH, scFv, Fab, VH или VL). В некоторых вариантах осуществления один антигенсвязывающий полипептид содержит два или более антигенсвязывающих фрагмента (например, два или более лиганда и/или рецептора, составленных последовательно). В некоторых вариантах осуществления используют два или более одинаковых антигенсвязывающих фрагмента. В некоторых вариантах осуществления используют два или более разных антигенсвязывающих фрагмента, например, один представляет собой Fab, а другой представляет собой scFv; один - лиганд, а другой - рецептор. В некоторых вариантах осуществления исходный антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc) или два или более антигенсвязывающих фрагмента специфично распознают два или более эпитопа-мишени (на одном и том же антигене-мишени или на разных антигенах-мишенях). В некоторых вариантах осуществления исходный антигенсвязывающий белок или два или более антигенсвязывающих фрагмента специфично распознают один эпитоп-мишень. В некоторых вариантах осуществления исходный антигенсвязывающий белок, антигенсвязывающий полипептид или антигенсвязывающий домен являются моноспецифичными и поливалентными (например, двухвалентными). В некоторых вариантах осуществления исходный антигенсвязывающий белок, антигенсвязывающий полипептид или антигенсвязывающий домен являются мультиспецифичными (например, биспецифичными) и поливалентными (например, двухвалентными). В некоторых вариантах осуществления исходный антигенсвязывающий белок или антигенсвязывающий домен являются моноспецифичными и моновалентными, т.е. цитокиновый фрагмент расположен в шарнирном участке между антигенсвязывающим фрагментом (например, Fab, scFv, VHH, лигандом или рецептором) и одной субъединицей Fc-домена (или ее частью), а другая субъединица Fc-домена (или ее часть) не составлена с другим антигенсвязывающим фрагментом; или цитокиновый фрагмент расположен в шарнирном участке между одним антигенсвязывающим фрагментом (например, Fab, scFv, VHH, лигандом или рецептором) и мономерной субъединицей Fc (или ее частью).
[250] Следует понимать, что для настоящего изобретения ссылка на «антигенсвязывающий белок», «составной белок антигенсвязывающий фрагмент-шарнир-Fc», «составной белок лиганд-шарнир-Fc» или «составной белок рецептор-шарнир-Fc» включает: i) каркас антигенсвязывающего белка (например, антитело, такое как полноразмерное антитело), каркас составного белка антигенсвязывающий фрагмент-шарнир-Fc или каркас составного белка лиганд/рецептор-шарнир-Fc (см., например, фигуры 2А-4С светло-серые участки); или ii) исходный антигенсвязывающий белок, исходный составной белок исходный антигенсвязывающий фрагмент-шарнир-Fc или составной белок исходный лиганд/рецептор-шарнир-Fc, в шарнирном участке которого находится цитокиновый фрагмент (см., например, фигуры 2А-4С). Также следует понимать, что в настоящем изобретении ссылка на «составной полипептид антигенсвязывающий фрагмент-шарнир-Fc», «составной полипептид лиганд-шарнир-Fc» или «составной полипептид рецептор-шарнир-Fc» включает: i) каркас составного полипептида антигенсвязывающий фрагмент-шарнир-Fc (например, тяжелая цепь антитела) или каркас составного полипептида лиганд/рецептор-шарнир-Fc (см., например, светло-серые сегменты Fc-содержащей полипептидной цепи на фигурах 2A-4C), или ii) составной полипептид исходный антигенсвязывающий фрагмент-шарнир-Fc или составной полипептид лиганд/рецептор-шарнир-Fc, в шарнирном участке которых находится цитокиновый фрагмент (см., например, полипептид, содержащий цепь цитокин-Fc на фигурах 2А-4С).
[251] В некоторых вариантах осуществления «исходный» антигенсвязывающий белок представляет собой составной белок антигенсвязывающий фрагмент-необязательный линкер-шарнир-Fc, содержащий (например, состоящий по существу из или состоящий из) двух полипептидов антигенсвязывающий фрагмент-необязательный линкер-шарнир-Fc. В некоторых вариантах осуществления «исходный» антигенсвязывающий белок представляет собой составной белок лиганд или часть лиганда-необязательный линкер-шарнир-Fc, содержащий (например, состоящий по существу из или состоящий из) двух полипептидов лиганд или часть лиганда-необязательный линкер-шарнир-Fc (см. фигуры 4А-4С, светло-серые сегменты). В некоторых вариантах осуществления «исходный» антигенсвязывающий белок представляет собой составной белок рецептор или часть рецептора-необязательный линкер-шарнир-Fc, содержащий (например, состоящий по существу из или состоящий из) двух полипептидов рецептор или часть рецептора-необязательный линкер-шарнир-Fc. В некоторых вариантах осуществления лиганд или его рецепторная часть представляет собой внеклеточный домен лиганда или рецептора. В некоторых вариантах осуществления исходный антигенсвязывающий белок представляет собой составной белок внеклеточный домен PD-L2-необязательный линкер-шарнир-Fc. Один или несколько цитокиновых фрагментов (или цитокиновых субъединиц) расположены в шарнирном участке одного или обоих полипептидов исходный антигенсвязывающий фрагмент-шарнир-Fc (см., например, темно-серые овалы или овалы с узорным рисунком на фигурах 4А-4С). В некоторых вариантах осуществления антигенсвязывающий фрагмент может представлять собой любой лиганд или рецептор (или его часть, например, внеклеточный домен), известный в данной области, или полученный из любых подходящих лигандов или рецепторов, при условии, что связывание цитокинового фрагмента с его цитокиновым рецептором снижается в отсутствие связывания антигена-мишени с антигенсвязывающим(-ими) фрагментом(-ами), например, в отсутствие связывания антигена-мишени (например, соответствующего рецептора или лиганда), причем снижение активности (сродства связывания с цитокиновым рецептором и/или биологической активности) цитокина или его варианта, расположенного в шарнирном участке, должно составлять не более примерно 70% от активности соответствующего цитокина или его варианта в свободном состоянии. Например, лиганд или рецептор можно выбирать из любого лиганда или рецептора в приведенном ниже подразделе «Лиганд или рецептор клеточной поверхности».
[252] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело или его антигенсвязывающие фрагменты (например, фрагменты антител, такие как Fab, scFv, VHH и т. д.). «Исходное» антитело или антигенсвязывающий фрагмент, описанные в данном документе, представляют собой антитело или антигенсвязывающий фрагмент, которые служили каркасом для конструирования иммуноцитокина. В некоторых вариантах осуществления исходное антитело иммуноцитокина, описанное в данном документе, представляет собой полноразмерное антитело. См., например, заштрихованные светло-серые сегменты на фигурах 1А-2D. В некоторых вариантах осуществления исходное антитело иммуноцитокина, описанное в данном документе, представляет собой антигенсвязывающий фрагмент. См., например, светло-серые сегменты на фигурах 3А-3С. Например, в некоторых вариантах осуществления исходное антитело содержит два scFv, каждый из которых присоединен к N-концу субъединицы Fc-домена через шарнир или его часть (см. светло-серые сегменты на фигуре 3A). В некоторых вариантах осуществления исходное антитело содержит два scFv, каждый из которых присоединен к N-концу субъединицы части Fc-домена (например, CH2) через шарнир или его часть. В некоторых вариантах осуществления исходное антитело содержит два Fab, каждый из которых присоединен к N-концу субъединицы части Fc-домена (например, CH2) через шарнир или его часть. В некоторых вариантах осуществления исходное антитело содержит один scFv, который присоединен к N-концу одной субъединицы Fc-домена через шарнир или его часть, и один Fab, который присоединен к N-концу другой субъединицы Fc-домена через шарнир или его часть (см. фигуры 3B-3C светло-серые сегменты). В некоторых вариантах осуществления исходное антитело содержит один scFv, который присоединен к N-концу одной субъединицы части Fc-домена (например, CH2) через шарнир или его часть, и один Fab, который присоединен к N-концу другой субъединицы части Fc-домена (например, CH2) через шарнир или его часть. В некоторых вариантах осуществления исходное антитело содержит один VHH, который присоединен к N-концу одной субъединицы Fc-домена или его части через шарнир или его часть, и второй VHH, который присоединен к N-концу другой субъединицы Fc-домена или его части через шарнир или его часть (см. фигуры 4A-4C светло-серые сегменты, следует заменить «лиганд» или «рецептор» на VHH). Один или несколько цитокиновых фрагментов (или цитокиновых субъединиц) расположены в шарнирном участке любого исходного антитела (например, полноразмерного антитела) или антигенсвязывающего фрагмента (см., например, темно-серые овалы или овалы с узорным рисунком на фигурах 2А-4С).
[253] Антигенсвязывающий фрагмент может быть любого вида, известного в данной области, или полученный из любых подходящих антител, при условии, что связывание цитокинового фрагмента с его цитокиновым рецептором снижается в отсутствие связывания антигена-мишени с антигенсвязывающим(-ими) фрагментом(-ами), например, в отсутствие связывания антигена-мишени, причем снижение активности (сродства связывания с цитокиновым рецептором и/или биологической активности) цитокина или его варианта, расположенного в шарнирном участке, должно составлять не более примерно 70% от активности соответствующего цитокина или его варианта в свободном состоянии. Например, антигенсвязывающий фрагмент может быть выбран из scFv, VH, VL, scFv-scFv, Fv, Fab, Fab', (Fab')2, мини-антитела, диатела, варианта доменного антитела (dAb), однодоменного антитела (sdAb), такого как антитело верблюда (VHH) или VНАР, варианта домена фибронектина 3, варианта анкиринового повтора и других антиген-специфичных связывающих доменов, полученных из других белковых основ. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой scFv. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой Fab. В некоторых вариантах осуществления антигенсвязывающий фрагмент сформирован из VH первой полипептидной цепи и из VL второй полипептидной цепи. В некоторых вариантах осуществления антигенсвязывающий фрагмент является человеческим. В некоторых вариантах осуществления антигенсвязывающий фрагмент является гуманизированным. В некоторых вариантах осуществления антигенсвязывающий фрагмент является химерным. В некоторых вариантах осуществления антигенсвязывающий фрагмент получают из моноклонального антитела мыши, крысы, обезьяны или кролика и т.д.
[254] В некоторых вариантах осуществления два или более антигенсвязывающих фрагмента соединены последовательно через необязательный(е) линкер(ы). Например, в некоторых вариантах осуществления иммуноцитокин содержит, от N' к C': Fab1 - необязательный линкер1 - Fab2 - необязательный линкер2 - (необязательный шарнир или его часть - цитокиновый фрагмент - необязательный шарнир или его часть) - субъединицу Fc. Например, CH1 или CL из Fab1 связаны с VH или VL в Fab2 через необязательный линкер 1. В некоторых вариантах осуществления иммуноцитокин содержит, от N' к C': scFv1 (или sdAb1) - необязательный линкер 1 - scFv2 (или sdAb2) - необязательный линкер 2 - (необязательный шарнир или его часть - цитокиновый фрагмент - необязательный шарнир или его часть) - субъединицу Fc. В некоторых вариантах осуществления иммуноцитокин содержит, от N' до C': лиганд1 - необязательный линкер1 - лиганд2 - необязательный линкер 2 - (необязательный шарнир или его часть - цитокиновый фрагмент - необязательный шарнир или его часть) - субъединицу Fc. Цитокиновый фрагмент в скобках может отсутствовать в другой парной цепи иммуноцитокина. Например, иммуноцитокин может содержать первую полипептидную цепь, включающую, от N' до C': scFv1 (или sdAb1) - необязательный линкер1 - scFv2 (или sdAb2) - необязательный линкер2 - цитокиновый фрагмент - шарнир или его часть - субъединица1 Fc; и вторую полипептидную цепь, от N' до C': scFv3 (или sdAb3) - необязательный линкер3 - scFv4 (или sdAb4) - необязательный линкер4 - шарнир или его часть - субъединицу2 Fc.
[255] Сродство связывания антигенсвязывающего белка (например, антитела или составного белка лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, scFv, Fab, VHH, лиганда или рецептора) и его целевого антигена можно определить экспериментально с помощью любых подходящих анализов связывания антител/антигенов или других анализов связывания белков (например, связывания лиганд-рецептор), известных в данной области техники, например, вестерн-блоттинга, ELISA, электрохемилюминесценции MSD, MIA на основе микросфер, RIA, SPR, ECL, IRMA, EIA, анализа Biacore, анализа октетов, сканирования пептидов, FACS и т.д. Также см. приведенный выше подраздел «сродство связывания» для иллюстративных способов. В некоторых вариантах осуществления Kd связывания между антителом или антигенсвязывающим фрагментом и его антигеном-мишенью имеет примерно любое значение из ≤ 10-5 М, ≤ 10-6 М, ≤ 10-7 М, ≤ 10-8 М, ≤ 10-9 М, ≤ 10-10 М, ≤ 10-11 М или ≤ 10-12 М.
[256] Варианты аминокислотной последовательности антигенсвязывающего белка (например, составного белка антитело или лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента можно получать путем введения соответствующих модификаций в последовательность нуклеиновой кислоты, кодирующую антигенсвязывающий белок или антигенсвязывающий фрагмент, или с помощью пептидного синтеза. Такие модификации включают, например, делеции, и/или вставки, и/или замены остатков в аминокислотных последовательностях антитела или антигенсвязывающего фрагмента. Можно использовать любую комбинацию делеций, вставок и замен для получения конечной конструкции при условии, что конечная конструкция обладает желаемыми свойствами, например, антигенсвязывающим свойством.
[257] В некоторых вариантах осуществления антигенсвязывающий белок (например, составной белок антитело или лиганд/рецептор-шарнир-Fc) или антигенсвязывающий фрагмент (например, scFv, Fab, VHH, лиганд или рецептор) содержит одну или несколько аминокислотных замен. Сайты, представляющие интерес для заместительного мутагенеза, включают HVR (или CDR) и FR антител или антигенсвязывающих фрагментов. Консервативные замены показаны в Таблице В под заголовком «Предпочтительные замены». Более существенные изменения представлены в Таблице В под заголовком «примеры замен», а также дополнительно описаны ниже в разделе, касающемся классов боковых цепей аминокислот. Аминокислотные замены можно вводить в интересующий антигенсвязывающий фрагмент, а полученные продукты подвергать скринингу на желаемую активность, например, сохраненное/улучшенное связывания антигена, сниженную иммуногенность.
[258] Аминокислоты можно сгруппировать на основании сходства свойств, присущих боковым цепям: (1) гидрофобные: Норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислотные: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, влияющие на ориентацию цепи: Gly, Pro; и (6) ароматические: Trp, Tyr, Phe. Неконсервативные замены повлекут за собой замену аминокислоты одного из этих классов на аминокислоту из другого класса.
[259] Один тип варианта замены включает замену одного или нескольких остатков HVR исходного антитела. Как правило, у полученных вариантов, отобранных для дальнейшего исследования, будут изменены (например, улучшены) определенные биологические свойства (например, повышено сродство, снижена иммуногенность) по сравнению с исходным антителом и/или у них определенные биологические свойства исходного антитела будут сохранены. Иллюстративный вариант замены представляет собой антитело с созревшим сродством, которое можно легко получить, например, с использованием методов созревания сродства на основе фагового дисплея, таких как описаны в данном документе. Вкратце, один или несколько остатков HVR подвергают мутации, а варианты антител экспонируют на фаге и подвергают скринингу на конкретную биологическую активность (например, сродство связывания).
[260] В некоторых вариантах осуществления замены, вставки или делеции могут происходить в одном или нескольких HVR при условии, что такие изменения существенно не снижают способность антитела или антигенсвязывающего домена связывать антиген. Например, в HVR можно делать консервативные изменения (например, консервативные замены, предусмотренные в данном документе), которые существенно не снижают сродство связывания. Такие изменения могут находиться за пределами «горячих точек» HVR или CDR.
[261] Изменения (например, замены) можно сделать в HVR, например, для улучшения сродства антител. Такие изменения можно сделать в «горячих точках» HVR, т.е. в остатках, кодируемых кодонами, которые подвергают мутациям с высокой частотой в процессе соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR), при этом полученный вариант VH или VL тестируют на сродство связывания. Был описан процесс созревания сродства путем создания и повторного отбора из вторичных библиотек, например, в Hoogenboom и др. в Chowdhury, Methods Mol. Biol. 178:1-37 (O'Brien и др., ed., Human Press, Totowa, Нью Джерси, (2001)). В некоторых вариантах, относящихся к созреванию сродства, разнообразие вводят в вариабельные гены, выбранные для созревания, любым из множества способов (например, ПЦР с ошибкам, перестановко цепей или олигонуклеотид-направленным мутагенезом). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для выявления любых вариантов антител с желаемом сродством. Другой метод введения разнообразия включает подходы, направленные на HVR, в которых несколько рандомизируют остатков HVR (например, 4-6 остатков за раз). Остатки HVR, участвующие в связывании антигена, можно направленно идентифицировать, например, используя аланин-сканирующий мутагенез или моделирование. В частности, в качестве мишени часто используют CDR-H3 и CDR-L3.
[262] Удобный метод идентификации остатков или областей антитела, которые можно использовать в качестве мишеней для мутагенеза, называется «аланин-сканирующий мутагенез», как описано Cunningham и Wells (1989). Science, 244:1081-1085. В этом методе остаток или группу целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином), чтобы определить, влияет ли это на взаимодействие антитела с антигеном. Дополнительные замены можно вводить в положения аминокислот, которые проявляют функциональную чувствительность к исходным заменам. Альтернативно или дополнительно, для выявления точек контакта между антителом и антигеном кристаллическая структура комплекса антиген-антитело. Такие контактные остатки и соседние остатки можно выбирать или исключать в качестве кандидатов на замену. Варианты можно проверять с целью выявить у них желаемые свойства.
Антигены-мишени
[263] В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, содержит антигенсвязывающий белок, специфично распознающий антиген-мишень. В некоторых вариантах осуществления антигенсвязывающий белок содержит антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или Fab), шарнирный участок и субъединицу Fc-домена или ее часть. Используемый здесь термин «антиген-мишень» или «эпитоп-мишень» может относиться к любому белку или полипептиду, который может быть специфично распознан антигенсвязывающим белком, антигенсвязывающим полипептидом или антигенсвязывающим фрагментом, описанным в данном документе, такому как опухолевый антиген или эпитоп, антиген или эпитоп патогена, антиген или эпитоп, ассоциированный с аутоиммунным заболеванием, аллергей и/или отторжением трансплантата, лиганд или рецептор или его часть (например, внеклеточный домен лиганда/рецептора), антиген или эпитоп поверхности иммунной клетки и т. д. В некоторых вариантах осуществления антигенсвязывающий белок является моновалентным и моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является поливалентным (например, двухвалентным) и моноспецифичным. В некоторых вариантах осуществления антигенсвязывающий белок является мультивалентным (например, двухвалентным) и мультиспецифичным (например, биспецифичным). Валентность и специфичность антигенсвязывающего белка в данном документе относится к валентности и специфичности антигенсвязывающего фрагмента(ов) (например, лиганда, рецептора, VHH, scFv или Fab) иммуноцитокина, не включая валентность или специфичность цитокина или его варианта.
[264] В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд (например, внеклеточный домен CD155, PD-L1 или PD-L2), который специфично распознает рецептор клеточной поверхности (например, PD-1). В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой рецептор (например, внеклеточный домен TIGIT или PD-1), который специфично распознает лиганд (например, CD155, PD-L1 или PD-L2). В некоторых вариантах осуществления антигенсвязывающий белок содержит два или более (например, 2) антигенсвязывающих полипептида, каждый из которых содержит, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть. В некоторых вариантах осуществления антигенсвязывающий полипептид содержит, от N' к C': два или более антигенсвязывающих фрагмента (например, лиганд или рецептор), например, составленные последовательно, шарнирный участок и субъединицу Fc-домена или ее часть. Два или более антигенсвязывающих фрагмента могут быть одинаковыми или разными, могут специфично распознавать один и тот же эпитоп-мишень или разные эпитопы-мишени (на одном и том же антигене-мишени или на разных антигенах-мишенях). Например, в некоторых вариантах осуществления один антигенсвязывающий фрагмент получен из первого лиганда (например, внеклеточного домена первого лиганда), который специфично распознает первый рецептор или его эпитоп (например, внеклеточный домен первого рецептора), другой антигенсвязывающий фрагмент получен от второго рецептора (например, внеклеточного домена второго рецептора), который специфично распознает второй лиганд или его эпитоп (например, внеклеточный домен второго лиганда). В некоторых вариантах осуществления один антигенсвязывающий фрагмент получен из первого лиганда (например, внеклеточного домена первого лиганда), который специфично распознает первый рецептор или его эпитоп (например, внеклеточный домен первого рецептора), другой антигенсвязывающий фрагмент получен от второго лиганда (например, внеклеточного домена второго лиганда), который специфично распознает второй рецептор или его эпитоп (например, внеклеточный домен второго рецептора). Первый и второй рецепторы (или их эпитопы) могут быть одинаковыми или разными. Первый и второй лиганды (или их эпитопы) могут быть одинаковыми или разными. В некоторых вариантах осуществления первый и второй антигенсвязывающие фрагменты (лиганд или рецептор) специфично распознают один и тот же эпитоп антигена-мишени (соответствующего рецептора или лиганда, соответственно), т.е. иммуноцитокин является двухвалентным и моноспецифичным. В некоторых вариантах осуществления первый и второй антигенсвязывающие фрагменты (лиганд или рецептор) специфично распознают разные эпитопы одного и того же антигена-мишени (соответствующего рецептора или лиганда, соответственно), т.е. иммуноцитокин является двухвалентным и биспецифичным. В некоторых вариантах осуществления первый и второй антигенсвязывающие фрагменты (лиганд или рецептор) специфично распознают разные антигены-мишени (например, разные эпитопы разных антигенов-мишеней, такие как соответствующий рецептор или лиганд, соответственно), т.е. иммуноцитокин является двухвалентным и биспецифичным.
[265] В некоторых вариантах осуществления антигенсвязывающий белок представляет собой антитело или его часть. Таким образом, в некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, содержит антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее антиген-мишень. В некоторых вариантах осуществления антитело содержит два или более антигенсвязывающих фрагмента (например, VHH, scFv или Fab). Два антигенсвязывающих домена (Fab) полноразмерного антитела или два или более антигенсвязывающих фрагмента (например, VHH, scFv или Fab) антитела могут быть одинаковыми или разными, могут специфично распознавать один и тот же эпитоп-мишень или разные эпитопы-мишени (на одном и том же антигене-мишени или на разных антигенах-мишенях). В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, содержит один или несколько антигенсвязывающих доменов (например, scFv или Fab), которые специфично распознают один или несколько эпитопов-мишеней (могут быть одинаковыми или разными, могут находиться на одном и том же антигене-мишени или на разных антигенах-мишенях). В некоторых вариантах осуществления иммуноцитокин содержит первый антигенсвязывающий домен (например, VHH, scFv или Fab), специфично распознающий первый эпитоп-мишень, и второй антигенсвязывающий домен (например, VHH, scFv или Fab), специфично распознающий второй эпитоп-мишень. В некоторых вариантах осуществления первый и второй эпитопы-мишени одинаковые. В некоторых вариантах осуществления первый и второй эпитопы-мишени отличаются (например, разные эпитопы на одном и том же антигене-мишени или разные эпитопы на разных антигенах-мишенях). В некоторых вариантах осуществления первый и второй антигенсвязывающие домены специфично распознают один и тот же эпитоп антигена-мишени, т.е. иммуноцитокин является двухвалентным и моноспецифичным. В некоторых вариантах осуществления первый и второй антигенсвязывающие домены специфично распознают разные эпитопы одного и того же антигена-мишени, т.е. иммуноцитокин является двухвалентным и биспецифичным. В некоторых вариантах осуществления первый и второй антигенсвязывающие домены специфично распознают разные антигены-мишени (например, разные эпитопы разных антигенов-мишеней), т.е. иммуноцитокин является двухвалентным и биспецифичным. В некоторых вариантах осуществления первый антиген-мишень представляет собой антиген на поверхности иммунных клеток, а второй антиген-мишень представляет собой опухолевый антиген.
[266] В некоторых вариантах осуществления антиген-мишень представляет собой молекулу клеточной поверхности (например, внеклеточный домен рецептора/лиганда). В некоторых вариантах осуществления антиген-мишень действует как маркер клеточной поверхности на клетке-мишени (например, опухолевой клетке, иммунной клетке), которая ассоциируется с особым болезненным состоянием. Антигены-мишени (например, опухолевой антиген, внеклеточный домен рецептора/лиганда), специфично распознаваемый антигенсвязывающим доменом, могут представлять собой антигены на одной больной клетке или антигены, которые экспрессируются на разных клетках, каждая из которых способствует заболеванию. Антигены-мишени, специфично распознаваемые антигенсвязывающим доменом(ами), могут быть прямо или косвенно вовлечены в заболевания.
Опухолевой антиген
[267] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой опухолевый антиген или эпитоп.
[268] Опухолевые антигены представляют собой белки, продуцируемые опухолевыми клетками, которые могут вызывать иммунный ответ, особенно иммунный ответ, опосредованный Т-клетками. Выбор целевого антигена данного изобретения будет зависеть от конкретного типа рака, подлежащего лечению. Примеры опухолевых антигенов включают, например, антиген, ассоциированный с глиомой, BCMA (антиген созревания В-клеток), карциноэмбриональный антиген (СЕА), β-хорионический гонадотропин человека, альфа-фетопротеин (АФП), лектин-реактивный АФП, тиреоглобулин, RAGE-1, MN-CAIX, человеческую теломеразную обратную транскриптазу, RU1, RU2 (AS), карбоксилэстеразу кишечника, мутаци. hsp70-2, M-CSF, простазу, простатспецифический антиген (PSA), PAP, NY-ESO-1, LAGE-la, p53, простеин, PSMA, HER2/neu, сурвивин и теломеразу, опухолевый антиген-1 карциномы предстательной железы (PCTA-1), MAGE, ELF2M, нейтрофильную эластазу, эфринB2, CD22, инсулиновый фактор роста (IGF)-I , IGF-II, рецептор IGF-I и мезотелин. В некоторых вариантах осуществления опухолевый антиген содержит один или несколько антигенных раковых эпитопов, связанных со злокачественной опухолью. Злокачественные опухоли экспрессируют ряд белков, которые могут служить антигенами-мишенями для иммунной атаки. Эти молекулы включают, но не ограничиваются ими, тканеспецифические антигены, такие как MART-1, тирозиназа и gp100 при меланоме, а также простатическую кислую фосфатазу (PAP) и простатспецифический антиген (ПСА) при раке предстательной железы. Другие молекулы-мишени принадлежат к группе молекул, связанных с трансформацией, таких как онкоген HER2/Neu/ErbB-2. Еще одна группа антигенов-мишеней представляет собой онкофетальные антигены, такие как карциноэмбриональный антиген (СЕА). При В-клеточной лимфоме опухолеспецифический идиотипический иммуноглобулин представляет собой в сущности опухолеспецифический иммуноглобулиновый антиген, который уникален для каждой определенной опухоли. Антигены дифференцировки В-клеток, такие как CD19, CD20 и CD37, являются другими кандидатами на роль антигенов-мишеней при В-клеточной лимфоме.
[269] В некоторых вариантах осуществления опухолевый антиген представляет собой опухолеспецифический антиген (TSA) или опухолеассоциированный антиген (TAA). TSA присущ только опухолевым клеткам и не встречается в других клетках организма. ТАА характерен не только для опухолевых клеток, напротив - он также экспрессируется в нормальной клетке в условиях, при которых не индуцируется состояние иммунологической толерантности к антигену. Экспрессия антигена на опухоли может происходить в условиях, позволяющих иммунной системе реагировать на антиген. ТАА могут быть антигенами, которые экспрессируются на нормальных клетках во время внутриутробного развития, когда иммунная система не созрела и неспособна реагировать, или они могут быть антигенами, которые в норме присутствуют на очень низких уровнях в нормальных клетках, но которые экспрессируются на гораздо более высоких уровнях на опухолевых клетках. Неограничивающие примеры антигенов TSA или TAA включают следующее: антигены дифференцировки, такие как MART-1/MelanA (MART-I), gp 100 (Pmel 17), тирозиназу, TRP-1, TRP-2 и опухолеспецифические мультилинейные антигены, такие как MAGE-1, MAGE-3, BAGE, GAGE-1, GAGE-2, p15; сверхэкспрессированные эмбриональные антигены, такие как СЕА; сверхэкспрессированные онкогены и мутированные гены-супрессоры опухолей, такие как p53, Ras, HER2/neu; уникальные опухолевые антигены, возникающие в результате хромосомных транслокаций; такие как BCR-ABL, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR; и вирусные антигены, такие как антигены вируса Эпштейна-Барра EBVA и антигены вируса папилломы человека (HPV) E6 и E7. Другие крупные белковые антигены включают TSP-180, MAGE-4, MAGE-5, MAGE-6, RAGE, NY-ESO, pl85erbB2, pl80erbB-3, c-met, nm-23HI, ПСА, TAG-72, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, бета-катенин, CDK4, Mum-1, p 15, p 16, 43-9F, 5T4 (TPBG), 791Tgp72, альфа-фетопротеин, бета-HCG, BCA225, BTAA, CA 125, CA 15-3\CA 27,29\BCAA, CA 195, CA 242, CA-50, CAM43, CD68\P1, CO-029, FGF-5, G250, Ga733\EpCAM, HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS 1, SDCCAG16, TA-90\Mac-2 связывающий белок\циклофилин С-ассоциированный белок, TAAL6, TAG72, TLP и TPS.
[270] В некоторых вариантах осуществления опухолевый антиген выбран из группы, состоящей из FIXa, FX, DLL3, DLL4, Ang-2, нектина-4, FOLRα, GPNMB, CD56 (NCAM), TACSTD2 (TROP-2), тканевого фактора, ENPP3, P-кадгерина, STEAP1, CEACAM5, Муцина 1 (сиалогликотопа CA6), гуанилатциклазы C (GCC), SLC44A4, LIV1 (ZIP6), NaPi2b, SLITRK6, SC-16, фибронектина, экстрадомена B (EDB), рецептора эндотелия ETB, ROBO4, коллагена IV, периостина, тенасцина c, CD74, CD98, мезотелина, TSHR, CD19, CD123, CD22, CD30, CD171, CS-1, CLL-1, CD33, EGFRvIII, GD2, GD3, BCMA, Tn Ag , специфического мембранного антигена простаты (PSMA), ROR1, FLT3, FAP, TAG72, CD38, CD44v6, CEA, EPCAM, B7H3, KIT, IL-13Ra2, рецептора интерлейкина-11 a (IL-11Ra), PSCA, PRSS21, VEGFR2 ( CD309), антигена Leu, CD24, бета-рецептора тромбоцитарного фактора роста (PDGFR-бета), SSEA-4, CD20, альфа-рецептора фолиевой кислоты, ERBB2 (HER2/neu), MUC1, рецептора эпидермального фактора роста (EGFR), NCAM, Простазы, PAP, ELF2M, эфрина B2, рецептора IGF-I, CAIX, LMP2, gp100, bcr-abl, тирозиназы, EphA2, фукозила GM1, sLe, GM3, TGS5, HMWMAA, о-ацетил-GD2, бета-рецептора фолиевой кислоты, TEM1/CD248, TEM7R, CLDN6, CLDN18.2, GPRC5D, CXORF61, CD97, CD179a, ALK, полисиаловой кислоты, PLAC1, GloboH, NY -BR-1, UPK2, HAVCR1, ADRB3, PANX3, GPR20, LY6K, OR51E2, TARP, WT1, NY-ESO-1, LAGE-1a, MAGE-A1, легумаина, HPV E6,E7, MAGE A1, ETV6-AML, белка спермы 17, XAGE1, Tie 2, MAD-CT-1, MAD-CT-2, Fos-родственного антигена 1, p53, мутанта p53, простеина, сурвивина и теломеразы, PCTA-1/галектина 8, MelanA/MART1, Ras-мутанта, hTERT, точек разрыва транслокации саркомы, ML-IAP, ERG (составного гена TMPRSS2 ETS), NA17, PAX3, андрогенного рецептора, циклина B1, MYCN, RhoC, TRP-2, CYP1B1, BORIS, SART3, PAX5, OY-TES1, LCK, AKAP-4, SSX2, RAGE-1, теломеразной обратной транскриптазы человека, RU1, RU2, карбоксилэстеразы кишечника, мутации hsp70-2, CD79a, CD79b, CD72, LAIR1, FCAR, LILRA2, CD300LF, CLEC12A, BST2, EMR2, LY75, GPC3, FCRL5 и IGLL1. В некоторых вариантах осуществления опухолевый антиген выбран из группы, состоящей из BCMA, EphA2, HER2, GD2, глипикана-3, 5T4, 8H9, αvβ6 интегрина, B7-H3, B7-H6, CAIX, CA9, CD19, CD20, CD22, CD30, CD33, CD38, CD44, CD44v6, CD44v7/8, CD70 (TNFSF7), CD123, CD138, CD171, CEA, CSPG4, EGFR , EGFRvIII, EGP2, EGP40, EpCAM, ERBB3, ERBB4, ErbB3/4, FAP, FAR, FBP, фетального AchR, рецептора фолиевой кислоты a, GD2, GD3, HLA-AI MAGE A1, HLA-A2, IL11Ra, IL13Ra2, KDR, антигена Leu, MCSP, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSC1, PSMA, ROR1, SURVIVIN, TAG72, TEM1, TEM8, VEGFR2, карциноэмбрионального антигена и HMW-MAA. См. также типичные опухолевые антигены, описанные в Shim H. (Biomolecules. 2020 Mar; 10(3): 360) и Diamantis N. и Banerji U. Br J Cancer. 2016; 114(4): 362-367, содержание которых полностью включено в настоящее описание ссылкой.
[271] В некоторых вариантах осуществления опухолевый антиген представляет собой HER2. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие HER2, получают из трастузумаба (например, Herceptin®), пертузумаба (например, Perjeta®), маргетуксимаба или 7C2. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие HER2, содержат CDR тяжелой цепи, CDR легкой цепи или все 6 CDR любого из трастузумаба, пертузумаба, маргетуксимаба или 7C2. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие HER2, содержат VH и/или VL трастузумаба, пертузумаба, маргетуксимаба или 7C2. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к HER2 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 188; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 189; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 190; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 191; v) VL-CDR2, содержащий последовательность SEQ ID NO: 192; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 193. В некоторых вариантах осуществления антитело к HER2 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 150, и VL, содержащий последовательность SEQ ID NO: 151. В некоторых вариантах осуществления антитело к HER2 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 152 или 153, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 154. В некоторых вариантах осуществления антитело к HER2 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело (т.е. содержащее две идентичные тяжелые цепи и две идентичные легкие цепи). В некоторых вариантах осуществления антитело к HER2 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
Антиген возбудителя заболевания
[272] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой антиген или эпитоп возбудителя заболевания, такого как грибковый, вирусный, бактериальный, протозойный или другой паразитарный антиген или эпитоп.
[273] В некоторых вариантах осуществления грибковый антиген относится к Aspergillus или Candida. Грибковые антигены, в отношении которых можно применять составы и способы данного изобретения, включают, но не ограничиваются ими, например, компоненты антигена грибов candida; антигены грибов aspergillus; антигены грибов histoplasma, такие как белок теплового шока 60 (HSP60) и другие компоненты антигена грибов histoplasma; криптококковые антигены, такие как капсульные полисахариды и другие компоненты криптококкового антигена; антигены грибов coccidioides, такие как антигены сферул и другие компоненты антигенов грибов coccidioides; и антигены грибкового дерматомикоза, такого как трихофитин и другие компоненты антигена грибов coccidioides.
[274] Бактериальные антигены, в отношении которых можно применять раскрытый в данном документе иммуноцитокин включают, но не ограничиваются ими, например, бактериальные антигены, такие как токсин коклюша, филаментозный гемагглютинин, пертактин, FIM2, FIM3, аденилатциклазу и другие компоненты бактериального антигена коклюша; дифтерийные бактериальные антигены, такие как дифтерийный токсин или анатоксин и другие компоненты дифтерийного бактериального антигена; столбнячные бактериальные антигены, такие как столбнячный токсин или анатоксин и другие компоненты столбнячного бактериального антигена; стрептококковые бактериальные антигены, такие как М-белки и другие компоненты стрептококковых бактериальных антигенов; бактериальные антигены грамотрицательных бацилл, такие как липополисахариды и другие компоненты антигенов грамотрицательных бактерий, антигены бактерий Mycobacterium tuberculosis, такие как миколовая кислота, белок теплового шока 65 (HSP65), главный секретируемый белок 30 кДа, антиген 85А и другие компоненты микобактериального антигена; компоненты антигена бактерий Helicobacter pylori; пневмококковые бактериальные антигены, такие как пневмолизин, пневмококковые капсулярные полисахариды и другие компоненты пневмококкового бактериального антигена; антигены бактерий haemophilus inFluenzae, такие как капсульные полисахариды и другие компоненты антигена бактерий haemophilus inFluenzae; бактериальные антигены сибирской язвы, такие как защитный антиген сибирской язвы и другие компоненты бактериального антигена сибирской язвы; риккетсиозные бактериальные антигены, такие как rompA и другой компонент антигена бактерий rickettsia. В описываемые в данном документе бактериальные антигены также включены любые другие бактериальные, микобактериальные, микоплазменные, риккетсиозные или хламидийные антигены. Также можно упомянуть неполные или цельные патогены: haemophilus inFluenzae; Plasmodium Falciparum; neisseria meningitidis; streptococcus pneumoniae; neisseria gonorrhoeae; salmonella serotype typhi; shigella; vibrio cholerae; Лихорадка денге; энцефалиты; Японский энцефалит; болезнь Лайма; Yersinia pestis; вирус Западного Нила; желтая лихорадка; туляремия; гепатит (вирусный; бактериальный); РСВ (респираторно-синцитиальный вирус); вирусы парагриппа человека HPIV 1 and HPIV 3; аденовирус; оспа; аллергии и онкологические заболевания.
[275] Примеры протозойных и других паразитарных антигенов включают, но не ограничиваются ими, например, антигены plasmodium Falciparum, такие как поверхностные антигены мерозоитов, поверхностные антигены спорозоитов, антигены циркумспорозоитов, поверхностные антигены гаметоцитов/гамет, гематостадийный антиген pF 155/RESA и другие компоненты плазмодиального антигена; антигены toxoplasma, такие как SAG-1, p30 и другие компоненты токсоплазменного антигена; антигены шистосом, такие как глутатион-S-трансфераза, парамиозин и другие компоненты антигена шистосом; leishmania major и другие антигены лейшманиоза, такие как gp63, липофосфогликан и связанный с ним белок и другие компоненты антигена лейшманиоза; и антигены trypanosoma cruzi, такие как антиген 75-77 кДа, антиген 56 кДа и другие компоненты трипаносомного антигена.
[276] В некоторых вариантах осуществления вирусный антиген принадлежит вирусу простого герпеса (ВПГ), респираторно-синцитиальному вирусу (РСВ), метапневмовирусу (hMPV), риновирусу, парагриппу (PIV), вирусу Эпштейна-Барр (EBV), цитомегаловирусу (CMV), вирусу JC (вирусу Джона Каннингема), вирусу BK, ВИЧ, Зика вирусу, коронавирусу человека, норовирусу, вирусу энцефалита или лихорадки Эбола. В некоторых вариантах осуществления вирус представляет собой вирус Orthomyxoviridae, выбранный из группы, состоящей из вируса гриппа А, вируса гриппа В, вируса гриппа С и любого их подтипа или реассортантного вируса. В некоторых вариантах осуществления вирус представляет собой вирус гриппа А или любой его подтип или реассортант, такой как вирус гриппа А подтипа H1N1 (H1N1) или вирус гриппа А подтипа H5N1 (H5N1). В некоторых вариантах осуществления вирус представляет собой вирус Coronaviridae, выбранный из группы, состоящей из альфа-коронавирусов 229E (HCoV-229E), коронавируса Нью-Хейвена NL63 (HCoV-NL63), бета-коронавирусов OC43 (HCoV-OC43), коронавируса HKU1 (HCoV-HKU1), коронавируса тяжелого острого респираторного синдрома (SARS-CoV), коронавируса ближневосточного респираторного синдрома (MERS-CoV) и тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2). В некоторых вариантах осуществления вирус представляет собой SARS-CoV, MERS-CoV или SARS-CoV-2. В некоторых вариантах осуществления вирус представляет собой вирус Filoviridae, выбранный из вируса Эбола (EBOV) и вируса Марбург (MARV). В некоторых вариантах осуществления вирус представляет собой вирус Filoviridae, выбранный из группы, состоящей из Зика вируса (ZIKV), вируса Западного Нила (WNV), вируса денге (DENV) и вируса желтой лихорадки (YFV).
Антигены, участвующие в аутоиммунных заболеваниях, аллергии и отторжении трансплантата
[277] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой антиген или эпитоп, участвующий в аутоиммунных заболеваниях, аллергии и/или в отторжении трансплантата. Например, в настоящем изобретении можно использовать антиген, вовлеченный в любое одно или несколько из следующих аутоиммунных заболеваний или нарушений: диабет, сахарный диабет, артрит (включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориатический артрит), рассеянный склероз, миастению, системную красную волчанку, аутоиммунный тиреоидит, дерматит (включая атопический дерматит и экзематозный дерматит), псориаз, синдром Шегрена, в том числе сухой кератоконъюнктивит, вторичный по отношению к синдрому Шегрена, гнездную алопецию, аллергические реакции на укусы членистоногих, болезнь Крона, афтозную язву, ирит, конъюнктивит, кератоконъюнктивит, язвенный колит, астму, аллергическую астму, кожную красную волчанку, склеродермию, вагинит, проктит, лекарственную сыпь, реверсивные реакции лепры, узловатую лепрозную эритему, аутоиммунный увеит, аллергический энцефаломиелит, острую некротизирующую геморрагическую энцефалопатию, идиопатическую двустороннюю прогрессирующую нейросенсорную тугоухость, апластическую анемию, врожденную апластическую анемию, идиопатическую тромбоцитопению, полихондрит, гранулематоз Вегенера, хронический активный гепатит, синдром Стивенса-Джонсона, трофические язвы неясного происхождения, красный плоский лишай, болезнь Крона, воспалительное заболевание кишечника (ВЗК), офтальмопатию Грейвса, саркоидоз, первичный билиарный цирроз, задний увеит и интерстициальный фиброз легких. Примеры антигенов, участвующих в аутоиммунных заболеваниях, включают декарбоксилазу 65 глутаминовой кислоты (GAD 65), нативную ДНК, основной белок миелина, протеолипидный белок миелина, компоненты рецептора ацетилхолина, тиреоглобулин и рецептор тиреотропного гормона (ТТГ). Примеры антигенов, вовлеченных в аллергию, включают антигены пыльцы, такие как антигены пыльцы японского кедра, антигены пыльцы амброзии, антигены пыльцы райграса, антигены животного происхождения, такие как антигены пылевых клещей и кошачьи антигены, антигены гистосовместимости, пенициллин и другие лекарственные препараты. Примеры антигенов, участвующих в отторжении трансплантата, включают антигенные компоненты трансплантата, подлежащего трансплантации реципиенту трансплантата, такие как сердце, легкое, печень, поджелудочная железа, почка и компоненты нервного трансплантата. Антиген может быть измененным пептидным лигандом, пригодным для лечения аутоиммунного заболевания. В некоторых вариантах осуществления антиген-мишень представляет собой CD3, CD4, CD123 или CD8.
Молекула контрольной точки иммунной системы
[278] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой молекулу контрольной точки иммунной системы. Контрольные точки иммунной системы являются регуляторами иммунной системы.
[279] В некоторых вариантах осуществления молекула контрольного точки иммунной системы представляет собой стимулирующую молекулу контрольной точки иммунной системы. В некоторых вариантах осуществления стимулирующая молекула контрольной точки иммунной системы выбрана из группы, состоящей из CD27, CD28, OX40, ICOS, GITR, 4-1BB, CD27, CD40, CD3 и HVEM. Таким образом, в некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, антигенсвязывающий домен или составной белок лиганд/рецептор-Fc), описанный в данном документе, представляет собой активатор стимулирующей молекулы контрольной точки иммунной системы, которая может стимулировать, активировать или усиливать интенсивность иммунного ответа, опосредованного стимулирующей молекулой контрольного точки иммунной системы. Антитело или его антигенсвязывающий фрагмент, описанные в данном документе, можно получать из любого известного в данной области антитела, которое активирует стимулирующую молекулу контрольной точки иммунной системы. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд или рецептор стимулирующей молекулы контрольной точки иммунной системы, например, может активировать передачу сигналов, стимулирующих контрольную точку иммунной системы. В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, антигенсвязывающий домен или составной белок лиганд/рецептор-Fc), описываемый в данном документе, представляет собой антагонист стимулирующей молекулы контрольной точки иммунной системы, который может снижать или блокировать интенсивность иммунного ответа, опосредованного стимулирующей молекулой контрольной точки иммунной системы.
[280] В некоторых вариантах осуществления молекула контрольной точки иммунного ответа представляет собой ингибирующую молекулу контрольной точки иммунного ответа. В некоторых вариантах осуществления ингибирующая молекула контрольной точки иммунной системы выбрана из группы, состоящей из PD-1, PD-L1, PD-L2, CTLA-4, LAG-3, TIM-3, HHLA2, CD47, CXCR4, CD160, CD73, BLTA, B7-H4, TIGIT и VISTA. В некоторых вариантах осуществления ингибирующая молекула контрольной точки иммунной системы представляет собой PD-1, PD-L2 или PD-L1. В некоторых вариантах осуществления ингибирующая молекула контрольной точки иммунной системы представляет собой CTLA-4. В некоторых вариантах осуществления ингибирующая молекула контрольной точки иммунной системы представляет собой TIGIT. Таким образом, в некоторых вариантах осуществления описанный в данном документе антигенсвязывающий белок (например, антитело, антигенсвязывающий домен или составной белок лиганд/рецептор-Fc) представляет собой ингибитор контрольной точки иммунного ответа, который полностью или частично уменьшает, ингибирует или препятствует действию одной или нескольких ингибиторных молекул контрольных точек иммунного ответа. Антитело или антигенсвязывающий домен, описанные в данном документе, можно получать из любого известного в данной области антитела, которое служит ингибитором контрольной точки иммунного ответа. В некоторых вариантах осуществления антигенсвязывающий фрагмент представляет собой лиганд (например, CD155, PD-L2 или PD-L1) или рецептор ингибирующей молекулы контрольной точки иммунной системы (например, TIGIT или PD-1), например, может активировать или стимулировать передачу ингибирующих сигналов контрольных точек иммунной системы (например, передачу сигналов TIGIT или PD-1). В некоторых вариантах осуществления антигенсвязывающий белок (например, антитело, антигенсвязывающий домен или составной белок лиганд/рецептор-Fc), описываемый в данном документе, представляет собой агонист ингибирующей молекулы контрольной точки иммунной системы, которая может стимулировать, активировать или повышать интенсивность иммунного ответа, опосредованного ингибирующей молекулой контрольной точки иммунной системы.
[281] PD-1 (белок 1 запрограммированной гибели клеток) является частью семейства костимулирующих молекул B7/CD28, которые регулируют активацию и толерантность Т-клеток, и, таким образом, антагонистические антитела к PD-1 или составной белок лиганд PD-1-Fc могут быть полезны для преодоления толерантности. PD-1 был идентифицирован как рецептор для B7-4. B7-4 может ингибировать активацию иммунных клеток при связывании с ингибирующим рецептором на иммунной клетке. Вовлечение пути PD-1/PD-L1 приводит к ингибированию эффекторной функции Т-клеток, секреции и пролиферации цитокинов. (Turnis и др, OncoImmunology 1(7):1172-1174, 2012). Высокие уровни PD-1 связаны с истощенными или хронически стимулируемыми Т-клетками. Более того, повышенная экспрессия PD-1 коррелирует со снижением выживаемости у онкологических больных. Средства, способствующие понижающей регуляции PD-1, B7-4 и взаимодействию между B7-4 и ингибирующим сигналом PD-1 в иммунной клетке могут приводить к усилению иммунного ответа. Типичные антитела к PD-1 включают, но не ограничиваются ими, пембролизумаб (например, Keytruda®), цемиплимаб (Libtayo®) и ниволумаб (например, Opdivo®). В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие PD-1, содержат CDR тяжелой цепи, CDR легкой цепи или все шесть CDR пембролизумаба, цемиплимаба или ниволумаба. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие PD-1, содержат VH и/или VL пембролизумаба, цемиплимаба или ниволумаба. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к PD-1 (например, полноразмерное антитело). В некоторых вариантах осуществления изобретения антитело к PD-1 или его антигенсвязывающий фрагмент содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 102, и VL, содержащий последовательность SEQ ID NO: 103. В некоторых вариантах осуществления антитело к PD-1 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 104 или 105, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106. В некоторых вариантах осуществления антитело к PD-1 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к PD-1 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
[282] PD-L1 (лиганд 1 запрограммированной гибели клеток) также известен как кластер дифференцировки 274 (CD274) или гомолог 1 B7 (B7-H1). PD-L1 служит лигандом для PD-1, играя важную роль в подавлении иммунной системы во время определенных событий, таких как беременность, аллотранплантаты тканей, аутоиммунные заболевания и другие болезненные состояния, такие как гепатит и рак. Образование комплекса рецептор PD-1/лиганд PD-L1 передает ингибирующий сигнал, который снижает пролиферацию CD8+ Т-клеток в лимфатических узлах. Типичные антитела к PD-L1 включают, но не ограничиваются ими, атезолизумаб (например, Tecentriq®), авелумаб (например, Bavencio®) и дурвалумаб (например, IMFINZI™). В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие PD-L1, содержат CDR тяжелой цепи, CDR легкой цепи или все шесть CDR атезолизумаба, авелумаба или дурвалумаба. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие PD-L1, содержат VH и/или VL атезолизумаба, авелумаба или дурвалумаба. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к PD-L1 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело против PD-L1 или его антигенсвязывающий фрагмент содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 243; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 244; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 245; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 246; v) VL-CDR2, содержащий последовательность SEQ ID NO: 247; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 248. В некоторых вариантах осуществления антитело к PD-L1 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 137, и VL, содержащий последовательность SEQ ID NO: 138. В некоторых вариантах осуществления антитело к PD-L1 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 139, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 140. В некоторых вариантах осуществления антитело к PD-L1 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 141, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 142. В некоторых вариантах осуществления антитело к PD-L1 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к PD-L1 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62. В некоторых вариантах осуществления исходный антигенсвязывающий белок содержит (например, состоит в основном из или состоит из) двух антигенсвязывающих полипептидов, каждый из которых содержит (например, состоит в основном из или состоит из), от N' к C': внеклеточный домен PD-L1 или его часть - необязательный пептидный линкер - шарнирный участок - субъединица Fc-домена или ее часть. В некоторых вариантах осуществления PD-L1 содержит последовательность SEQ ID NO: 249. В некоторых вариантах осуществления внеклеточный домен PD-L1 содержит последовательность SEQ ID NO: 250. В некоторых вариантах осуществления внеклеточный домен PD-L1 или его часть получены из PD-L1 дикого типа (например, человеческого, дикого типа). В некоторых вариантах осуществления внеклеточный домен PD-L1 или его часть содержит одну или несколько мутаций (например, делецию, вставку или замену). В некоторых вариантах осуществления мутантный внеклеточный домен PD-L1 или его часть обладают повышенным сродством к PD-1 по сравнению с внеклеточным доменом PD-L1 дикого типа или его частью. В некоторых вариантах осуществления мутантный внеклеточный домен PD-L1 или его часть имеет пониженное сродство к PD-1 по сравнению с внеклеточным доменом PD-L1 дикого типа или его частью. В некоторых вариантах осуществления составной белок PD-L1-шарнир-Fc (например, исходный составной белок) представляет собой гомодимерный составной белок PD-L1-шарнир-Fc, т.е. два полипептида PD-L1-шарнир-Fc идентичны. В некоторых вариантах осуществления составной белок PD-L1-шарнир-Fc (например, исходный составной белок) представляет собой гетеродимерное полноразмерное антитело, например, один полипептид PD-L1-шарнир-Fc содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другой полипептид PD-L1-шарнир-Fc содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62. В некоторых вариантах осуществления, например, в исходном составном белке PD-L1-шарнир-Fc, PD-L1 (например, внеклеточный домен PD-L1) и шарнирный участок соединены пептидным линкером, таким как любые пептидные линкеры, описанные в данном документе. В некоторых вариантах осуществления пептидный линкер содержит последовательность SEQ ID NO: 203, 206 или 213.
[283] PD-L2 (лиганд 2 белка запрограммированной клеточной гибели 1, B7-DC, CD273) представляет собой другую контрольную точку иммунной системы - лиганд рецептора PD-1. PD-L2 играет роль в негативной регуляции ответа адаптивного иммунитета. Взаимодействие PD-1 с PD-L2 резко подавляет опосредованную Т-клеточным рецептором (TCR) пролиферацию и продуцирование цитокинов Т-клетками. При низких концентрациях антигена взаимодействия PD-L2-PD-1 ингибируют сильные сигналы B7-CD28. Напротив, при высоких концентрациях антигена взаимодействия PD-L2-PD-1 снижают продуцирование цитокинов, но не подавляют пролиферацию Т-клеток. В некоторых вариантах осуществления антигенсвязывающий белок (например, исходный антигенсвязывающий белок) представляет собой составной белок PD-L2 (например, полноразмерный белок или его часть)-шарнир-Fc. В некоторых вариантах осуществления антигенсвязывающий белок содержит (например, состоит в основном из или состоит из) двух антигенсвязывающих полипептидов, каждый из которых содержит (например, состоит в основном из или состоит из), от N' к C': внеклеточный домен PD-L2 или его часть - необязательный пептидный линкер - шарнирный участок - субъединица Fc-домена или ее часть. В некоторых вариантах осуществления PD-L2 содержит последовательность SEQ ID NO: 175. В некоторых вариантах осуществления внеклеточный домен PD-L2 содержит последовательность SEQ ID NO: 176. В некоторых вариантах осуществления внеклеточный домен PD-L2 или его часть получены из PD-L2 дикого типа (например, человеческого, дикого типа). В некоторых вариантах осуществления внеклеточный домен PD-L2 или его часть содержит одну или несколько мутаций (например, делецию, вставку или замену). В некоторых вариантах осуществления мутантный внеклеточный домен PD-L2 или его часть обладают повышенным сродством к PD-1 по сравнению с внеклеточным доменом PD-L2 дикого типа или его частью. В некоторых вариантах осуществления мутантный внеклеточный домен PD-L2 или его часть имеет пониженное сродство к PD-1 по сравнению с внеклеточным доменом PD-L2 дикого типа или его частью. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc (например, исходный составной белок) содержит два полипептида PD-L2-шарнир-Fc, каждый из которых содержит последовательность SEQ ID NO: 177. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc (например, исходный составной белок) представляет собой гомодимерный составной белок PD-L2-шарнир-Fc, т.е. два полипептида PD-L2-шарнир-Fc идентичны. В некоторых вариантах осуществления составной белок PD-L2-шарнир-Fc (например, исходный составной белок) представляет собой гетеродимерное полноразмерное антитело, например, один полипептид PD-L2-шарнир-Fc содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другой полипептид PD-L2-шарнир-Fc содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62. В некоторых вариантах осуществления, например, в исходном составном белке PD-L2-шарнир-Fc, PD-L2 (например, внеклеточный домен PD-L2) и шарнирный участок соединены пептидным линкером, таким как любые пептидные линкеры, описанные в данном документе. В некоторых вариантах осуществления пептидный линкер содержит последовательность SEQ ID NO: 203, 206 или 213.
[284] Цитотоксический белок 4, ассоциированный с Т-лимфоцитами (CTLA-4 или CD152), является гомологом CD28 и известен как ингибирующая молекула контрольной точки иммунной системы, повышающая регулация которой происходит на активированных Т-клетках. CTLA-4 также связывается с B7-1 и B7-2, но с большей сродством, чем CD28. Взаимодействие между B7 и CTLA-4 ослабляет активацию Т-клеток, которая представляет собой важный механизм, с помощью которой опухоль избегает действия иммунной системы. Терапия антителами к CTLA-4 продемонстрировала многообещающие результаты в ряде онкологических заболеваний, таких как меланома. Типичные антитела к CTLA-4 включают, но не ограничиваются ими, ипилимумаб (например, Yervoy®). В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CTLA-4, содержат CDR тяжелой цепи, CDR легкой цепи или все шесть CDR ипилимумаба. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CTLA-4, содержат VH и/или VL ипилимумаба. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к CTLA-4 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело к CTLA-4 или его антигенсвязывающий фрагмент содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 125, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 125, и VL, содержащий последовательность SEQ ID NO: 126. В некоторых вариантах осуществления антитело к CTLA-4 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 127 или 128, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 129. В некоторых вариантах осуществления антитело к CTLA-4 или его антигенсвязывающий фрагмент содержит VH тяжелой цепи, содержащий последовательность SEQ ID NO: 128, и VL легкой цепи, содержащий последовательность SEQ ID NO: 129. В некоторых вариантах осуществления антитело к CTLA-4 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к CTLA-4 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
[285] TIGIT (также называемый Т-клеточным иммунорецептором с доменами Ig и ITIM или VSTM3) представляет собой иммунный рецептор на некоторых Т-клетках и NK-клетках. Например, обнаружено, что TIGIT сверхэкспрессируется на опухолевых антиген-специфических CD8+ Т-клетках и инфильтрующих CD8+ опухоль лимфоцитах (TIL) при меланоме. Когда TIGIT связывается со своим лигандом CD155 (PVR), который экспрессируется на опухолевых клетках, дендритных клетках, макрофагах и т.д., TIGIT посылает ингибирующий сигнал на Т-клетки или NK-клетки.
Лиганд или рецептор клеточной поверхности
[286] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой лиганд или рецептор или его часть, такую как внеклеточный домен лиганда/рецептора. В некоторых вариантах осуществления лиганд или рецептор получают из молекулы, выбранной из группы, состоящей из IL-2, IL-2Rα (CD25), IL-3Rα (CD123), PD-1, PD-L1, PD-L2, CD155, NKG2A, NKG2C, NKG2F, NKG2D, BCMA, APRIL, BAFF, IL-3, IL-13, LLT1, AICL, DNAM-1 и NKp80. В некоторых вариантах осуществления лиганд берут от APRIL и/или BAFF, которые могут связываться с BCMA. В некоторых вариантах осуществления рецептор представляет собой FcR, а лиганд представляет собой молекулу, содержащую Fc. В некоторых вариантах осуществления FcR представляет собой рецептор Fcγ (FcγR). В некоторых вариантах осуществления FcγR выбран из группы, состоящей из FcγRIA (CD64A), FcγRIB (CD64B), FcγRIC (CD64C), FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16a) и FcγRIIIB (CD16b). В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой PD-1, такой как внеклеточный домен (или его часть) PD-1. В некоторых вариантах осуществления антигенсвязывающий фрагмент антигенсвязывающего полипептида представляет собой PD-L2 или PD-L1, такой как внеклеточный домен (или его часть) PD-L2 или PD-L1. В некоторых вариантах осуществления внеклеточный домен PD-L2 содержит последовательность SEQ ID NO: 176. В некоторых вариантах осуществления внеклеточный домен PD-L1 содержит последовательность SEQ ID NO: 250. В некоторых вариантах осуществления антигенсвязывающий фрагмент антигенсвязывающего полипептида представляет собой CD155, такой как внеклеточный домен (или его часть) CD155. В некоторых вариантах осуществления внеклеточный домен CD155 содержит последовательность SEQ ID NO: 267.
[287] Рецептор IL-2 - рецептор интерлейкина-2 (IL-2R) - представляет собой гетеротримерный белок, экспрессируемый на поверхности некоторых иммунных клеток, таких как лимфоциты. IL-2R имеет три формы, генерируемые различными комбинациями α-цепи (IL-2Rα, CD25, Tac антиген), β-цепи (IL-2Rβ, CD122) и γ-цепи (IL-2Rγ, γс, общая гамма-цепь или CD132). IL-2Rα связывает IL-2 с низким сродством, а комплекс IL-2Rβ и IL-2Rγ связывает IL-2 со сродством среднего уровня, прежде всего на Т-клетках памяти и NK-клетках. Комплекс всех цепей α, β и γ связывает IL-2 с высоким сродством на активированных Т-клетках и регуляторных Т-клетках (Tregs). CD25 (IL-2Rα) играет критическую роль в развитии и поддержании Treg и может играть роль в экспрессии Treg CD62L, которая необходима для проникновения Treg в лимфатические узлы (Malek и Bayer, 2004). CD25 является маркером активированных Т-клеток и Treg. Экспериментальные данные указывают на иммуносупрессивную способность антитела к CD25, которая значительно замедляет отторжение аллотрансплантатов сердца у мышей (Kirkman и др., 1985) и аллотрансплантатов почек у нечеловекообразных приматов (Reed и др., 1989). Примеры антител к CD25 включают, но не ограничиваются ими, базиликсимаб (например, Simulect®), даклизумаб (например, Zinbryta®). В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CD25, содержат CDR тяжелой цепи, CDR легкой цепи или все шесть CDR базиликсимаба или даклизумаба. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CD25, содержат VH и/или VL базиликсимаба или даклизумаба. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к CD25 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело к CD25 или его антигенсвязывающий фрагмент содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 162, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 или его антигенсвязывающий фрагмент содержит VH, содержащую последовательность SEQ ID NO: 162, и VL, содержащий последовательность SEQ ID NO: 163. В некоторых вариантах осуществления антитело к CD25 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 164, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 165. В некоторых вариантах осуществления антитело к CD25 или его антигенсвязывающий фрагмент содержит VH-CDR1, VH-CDR2 и VH-CDR3 тяжелой цепи, содержащей последовательность SEQ ID NO: 166, и VL-CDR1, VL-CDR2 и VL-CDR3 легкой цепи, содержащей последовательность SEQ ID NO: 167. В некоторых вариантах осуществления антитело к CD25 или его антигенсвязывающий фрагмент содержит VH тяжелой цепи, содержащей последовательность SEQ ID NO: 166, и VL легкой цепи, содержащий последовательность SEQ ID NO: 167. В некоторых вариантах осуществления антитело к CD25 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 166, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 167. В некоторых вариантах осуществления антитело к CD25 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к CD25 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
Антиген поверхности иммунной клетки
[288] В некоторых вариантах осуществления антиген-мишень или эпитоп представляет собой антиген или эпитоп на поверхности иммунной клетки. Иммунные клетки имеют разные молекулы клеточной поверхности. Например, CD3 представляет собой молекулу клеточной поверхности на Т-клетках, тогда как CD16, NKG2D или NKp30 представляют собой молекулы клеточной поверхности на NK-клетках, а CD3 или инвариантный Т-клеточный рецептор (TCR) представляют собой молекулы клеточной поверхности на NKT-клетках. В некоторых вариантах осуществления, где иммунная клетка представляет собой Т-клетку, активирующая молекула представляет собой одну или несколько из CD3, например, CD3ε, CD3 или CD3γ; или CD2, CD4, CD8, CD27, CD28, CD40, CD134, CD137, CD278, ингибирующие молекулы контрольных точек иммунного ответа (например, CTLA-4, PD-1, TIM3, BTLA, VISTA, LARG-3 или TIGIT) и стимулирующие молекулы контрольных точек иммунного ответа (CD27, CD28, CD137, OX40, GITR или HVEM). В некоторых вариантах осуществления, где иммунная клетка представляет собой В-клетку, молекула клеточной поверхности представляет собой CD19, CD20 или CD138. В некоторых других вариантах осуществления, где иммунная клетка представляет собой NK-клетку, молекула клеточной поверхности представляет собой CD16, CD56 (NCAM), NKp46, NKp44, CD244, CD226, TIGIT, CD96, LAG3, TIM3, PD-1, KLRG1, CD161, CD94/NKG2, KIR, NKG2D или NKp30. В некоторых вариантах осуществления, где иммунная клетка представляет собой NKT-клетку, молекула клеточной поверхности представляет собой CD3 или инвариантный TCR. В некоторых вариантах осуществления, где иммунная клетка представляет собой миелоидную дендритную клетку (mDC), молекула клеточной поверхности представляет собой CD11c, CD11b, CD13, CD45RO или CD33. В некоторых вариантах осуществления, где иммунная клетка представляет собой дендритную клетку плазмы (pDC), молекула клеточной поверхности представляет собой CD123, CD62L, CD45RA или CD36. В некоторых вариантах осуществления, где иммунная клетка представляет собой макрофаг, молекула клеточной поверхности представляет собой CD163 или CD206. В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из моноцита, дендритной клетки, макрофага, В-клетки, Т-клетки-киллера (Тс, цитотоксический Т-лимфоцит или ЦТЛ), Т-хелперной клетки (Тh), регуляторных Т-клеток (Treg), γ Т-клетки, естественных киллерных Т-клеток (NKT) и естественных киллерных (NK) клеток.
[289] В некоторых вариантах осуществления антиген на поверхности иммунной клетки выбран из группы, состоящей из CD3 (например, CD3ε, CD3, CD3γ), CD4, CD5, CD8, CD16, CD27, CD28, CD40, CD64, CD89, CD134, CD137, CD278, NKp46, NKp30, NKG2D, TCRα, TCRβ, TCRγ и TCR. В некоторых вариантах осуществления антиген на поверхности иммунной клетки представляет собой CD3, CD4 или CD8.
[290] CD3 состоит из трех различных полипептидных цепей (цепей ε, и γ), и представляет собой антиген, экспрессируемый Т-клетками, включая цитотоксические Т-клетки (необученные CD8+ Т-клетки) и Т-хелперные клетки (необученные CD4+ Т-клетки). Три полипептидные цепи CD3 связываются с TCR и ζ -цепью, образуя комплекс TCR, который выполняет функцию активации сигнальных каскадов в Т-клетках. В настоящее время многие терапевтические стратегии нацелены на трансдукцию сигнала TCR для лечения заболеваний с использованием моноклональных антител к человеческому CD3. CD3-специфичное антитело OKT3 является первым моноклональным антителом, одобренным для терапевтического применения у людей, и клинически используется в качестве иммуномодулятора для лечения отторжения аллогенного трансплантата. Отеликсизумаб (TRX4) представляет собой моноклональное антитело, специфично нацеленное на CD3ε, которое находится в стадии разработки для лечения диабета 1 типа и других аутоиммунных заболеваний. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CD3, содержат CDR тяжелой цепи, CDR легкой цепи или все шесть CDR из ОКТ3 или отеликсизумаба. В некоторых вариантах осуществления антитело или антигенсвязывающий домен, специфично распознающие CD3, содержат VH и/или VL из OKT3 или отеликсизумаба. В некоторых вариантах осуществления антитело к CD3 или его антигенсвязывающий фрагмент не конкурирует с антителом OKT3 за связывание с CD3 и неспособно активировать передачу сигнала TCR (т.е. неактивное антитело к CD3). В некоторых вариантах осуществления антитело к CD3 или его антигенсвязывающий фрагмент специфично распознает CD3ε. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к CD3 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело к CD3 (например, CD3ε) или его антигенсвязывающий фрагмент содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 85; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 86; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 87; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 88; v) VL-CDR2, содержащий последовательность SEQ ID NO: 89; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 90. В некоторых вариантах осуществления антитело к CD3 (например, CD3ε) или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 91, и VL, содержащий последовательность SEQ ID NO: 92. В некоторых вариантах осуществления антитело к CD3 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 93, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 94. В некоторых вариантах осуществления антитело к CD3 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к CD3 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
[291] CD4 представляет собой гликопротеин, экспрессируемый на поверхности иммунных клеток, таких как Т-хелперные клетки (CD4+ Т-хелперные клетки), моноциты, макрофаги и дендритные клетки. CD4 является корецептором TCR и помогает TCR связываться с антигенпрезентирующими клетками. Примеры антител к CD4 включают, но не ограничиваются ими, ибализумаб (например, Trogarzo®), MAX.16H5 и IT1208. MAX.16H5 представляет собой антитело к человеческому CD4, применяемое внутривенно в клинических испытаниях для лечения аутоиммунных заболеваний (например, ревматоидного артрита) и острого позднего отторжения после трансплантации почечного аллотрансплантата. IT1208 представляет собой дефукозилированное гуманизированное истощающее антитело к CD4, которое в настоящее время проходит клинические испытания для лечения солидных опухолей на поздних стадиях. В некоторых вариантах осуществления ибализумаб использовали в качестве исходного антитела к CD4 (например, полноразмерного антитела). Ибализумаб представляет собой неиммуносупрессивное гуманизированное моноклональное антитело, одобренное FDA для лечения ВИЧ. В некоторых вариантах осуществления антигенсвязывающий домен, специфично распознающий CD4, содержит CDR тяжелой цепи, CDR легкой цепи или все шесть CDR ибализумаба, MAX.16H5 или IT1208. В некоторых вариантах осуществления антигенсвязывающий домен, специфично распознающий CD4, содержит VH и/или VL ибализумаба, MAX.16H5 или IT1208. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к CD4 (например, полноразмерное антитело). В некоторых вариантах осуществления антитело к CD4 или его антигенсвязывающий фрагмент содержит: i) VH-CDR1, содержащий последовательность SEQ ID NO: 67; ii) VH-CDR2, содержащий последовательность SEQ ID NO: 68; iii) VH-CDR3, содержащий последовательность SEQ ID NO: 69; iv) VL-CDR1, содержащий последовательность SEQ ID NO: 70; v) VL-CDR2, содержащий последовательность SEQ ID NO: 71; и vi) VL-CDR3, содержащий последовательность SEQ ID NO: 72. В некоторых вариантах осуществления антитело к CD4 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 73, и VL, содержащий последовательность SEQ ID NO: 74. В некоторых вариантах осуществления антитело к CD4 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 75 или 76, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 77. В некоторых вариантах осуществления антитело к CD4 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к CD4 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
[292] CD8 представляет собой трансмембранный гликопротеин, который служит корецептором для TCR. CD8 связывается с белком MHC класса I и является специфичным для него. Наиболее распространенная форма CD8 состоит из цепи CD8-α и CD8-β. CD8 преимущественно экспрессируется на поверхности цитотоксических Т-клеток, но также может быть обнаружен на естественных клетках-киллерах, кортикальных тимоцитах и дендритных клетках. CD8 является маркером для популяции цитотоксических Т-клеток. CD8 экспрессируется при Т-клеточной лимфобластной лимфоме и гипопигментном грибовидном микозе. Типичные антитела к CD8 включают, но не ограничиваются ими, G10-1, OKT8, YTC182.20, 4B11 и DK25. В некоторых вариантах осуществления антигенсвязывающий домен, специфично распознающий CD8, содержит CDR тяжелой цепи, CDR легкой цепи или все шесть CDR любого из G10-1, OKT8, YTC182.20, 4B11 или DK25. В некоторых вариантах осуществления антигенсвязывающий домен, специфично распознающий CD8, содержит VH и/или VL любого из G10-1, OKT8, YTC182.20, 4B11 или DK25. В некоторых вариантах осуществления иммуноцитокин содержит исходное антитело к CD8 (например, полноразмерное антитело). В некоторых вариантах осуществления изобретения антитело к CD8 или его антигенсвязывающий фрагмент содержит VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 114, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 или его антигенсвязывающий фрагмент содержит VH, содержащий последовательность SEQ ID NO: 114, и VL, содержащий последовательность SEQ ID NO: 115. В некоторых вариантах осуществления антитело к CD8 (например, исходное полноразмерное антитело) содержит две тяжелые цепи, каждая из которых содержит последовательность SEQ ID NO: 116, и две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 117. В некоторых вариантах осуществления антитело к CD8 (например, исходное антитело) представляет собой гомодимерное полноразмерное антитело. В некоторых вариантах осуществления антитело к CD8 (например, исходное антитело) представляет собой гетеродимерное полноразмерное антитело, например, антитело KIH, например, одна тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 61, а другая тяжелая цепь содержит субъединицу Fc-домена, содержащую последовательность SEQ ID NO: 62.
Шарнир
[293] Шарнир соединяет Fd-участок (домены VН и CH1) и Fc-участок тяжелой цепи иммуноглобулина. В некоторых вариантах осуществления шарнирный участок соединяет антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или Fab) и субъединицу Fc-домена или ее часть (например, только CH2, CH3 или CH2). Шарнирный участок, присущий IgG, IgA и IgD классам иммуноглобулинов, действует как гибкий спейсер, который позволяет Fab-сегменту иммуноглобулина свободно перемещаться в пространстве относительно Fc-участка. Разнообразные по своей структуре шарнирные домены варьируются, как по своей последовательности, так и по длине внутри классов и подклассов иммуноглобулинов. В шарнирном участке тяжелые цепи соединены между собой дисульфидными связями. Согласно кристаллографическим данным шарнирный участок иммуноглобулина можно подразделить по его структуре и функциям на три области: верхний шарнир, «сердцевину» и нижний шарнир. См. Shin и др., Immunological Reviews 130:87 (1992). Верхний шарнир включает аминокислоты от карбоксильного конца CH1 до первого остатка в шарнире, который ограничивает движение, обычно первый остаток цистеина, который образует межцепочечную дисульфидную связь между двумя тяжелыми цепями. Длина верхнего шарнирного участка коррелирует с гибкостью сегментов антитела. Сердцевинный шарнирный участок содержит дисульфидные мостики, соединяющие тяжелые цепи. Нижний шарнирный участок соединен с аминным концом CH2-домена, включая в себя остатки. Id. Шарнирный участок человеческого антитела IgG1 соответствует аминокислотам 216-230 в соответствии с нумерацией ЕС согласно Kabat. Сердцевинный шарнирный участок IgG человека1 содержит последовательность Cys-Pro-Pro-Cys, которая при димеризации с образованием дисульфидной связи приводит к образованию циклического октапептида, который, как полагают, действует как центр вращения, тем самым придавая гибкость. Конформационные изменения, допускаемые структурой и гибкостью полипептидной последовательности шарнирного участка иммуноглобулина, могут влиять на эффекторные функции Fc-фрагмента антитела.
[294] В некоторых вариантах осуществления шарнирный участок может содержать один или несколько сайтов гликозилирования, которые включают ряд структурно отличающихся типов сайтов для присоединения углеводов. Например, IgA1 содержит пять сайтов гликозилирования в 17-аминокислотном сегменте шарнирного участка, что придает полипептиду шарнирного участка исключительную устойчивость к кишечным протеазам, что считается выигрышным свойством секреторного иммуноглобулина.
[295] В некоторых вариантах осуществления иммуноцитокин содержит шарнирный участок, который присутствует во встречающемся в природе исходном антителе. Например, исходное антитело представляет собой антитело IgG1, а шарнирный участок антитела или антигенсвязывающего фрагмента в иммуноцитокине, описанном в данном документе, представляет собой шарнирный участок типа IgG1. В некоторых вариантах осуществления иммуноцитокин содержит модификацию в шарнирном участке тяжелой цепи антитела. Например, шарнирный участок или его часть были модифицированы, например, путем делеции, вставки или замены, например, шарнирным участком или его частью, которые отличаются от шарнирного участка, присущего встречающемуся в природе антителу того же класса (например, IgG, IgA или IgE) и подкласса (например, IgG1, IgG2, IgG3и IgG4 и т.д.). Например, антитело IgG1, IgG2 или IgG3 может содержать шарнирный участок типа IgG4. В некоторых вариантах осуществления шарнирный участок или его часть содержит мутацию, например, делецию, вставку или замену, в одном или нескольких из верхнего шарнира, сердцевины и нижнего шарнира шарнирного участка, при условии, что межцепочечная дисульфидная связь (связи) все еще может быть образована, иммуноцитокин обладает гибкостью, чтобы обеспечить связывание целевого антигена и антигенсвязывающего фрагмента, при этом маскируя активность цитокина в отсутствие связывания целевого антигена и антитела, в то же время демаскируя активность цитокина при наличии связывания целевого антигена с антителом, тем самым обеспечивая гибкость и/или достаточное пространство между двумя цитокиновыми субъединицами или двумя фрагментами цитокина для обеспечения надлежащей активности цитокина (сродство связывания и/или биоактивность), и/или, необязательно, не прекращая эффекторную(ие) функцию(и) Fc-фрагмента. В некоторых вариантах осуществления шарнирный участок представляет собой или взят из шарнира человеческого IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления шарнирный участок представляет собой мутантный шарнир человеческого IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления одну или несколько мутаций, например делецию, вставку или замену, вводят в один или несколько из верхнего шарнира, сердцевины и нижнего шарнира шарнирного участка для снижения или устранения эффекторной функции (например, ADCC и/или CDC) Fc-домена, такие как мутации L234 и/или L235 в нижнем шарнирном участке IgG1, например, одна или две мутации L234A, L234K, L234D, L235E, L235K и L235A. В некоторых вариантах осуществления шарнирный участок содержит мутации L234K и L235K. В некоторых вариантах осуществления шарнирный участок содержит мутации L234D и L235E. В некоторых вариантах осуществления шарнирный участок укорочен или подвергался мутациям с меньшим количеством цистеинов, чтобы уменьшить неправильное спаривание дисульфидных связей во время димеризации Fc-домена. В некоторых вариантах осуществления одну или более асимметричных заряженных мутаций вводят в нижний шарнир для облегчения образования гетеродимера, например, один полипептид содержит L234K+L235K в нижнем шарнирном участке IgG1, тогда как парный полипептид содержит L234D+L235E в нижнем шарнирном участке IgG1. В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность EPKSCDKTHTCPPCPAPELLGGP (SEQ ID NO: 40). В некоторых вариантах осуществления шарнирный участок представляет собой шарнир IgG1, содержащий мутации L234K и L235K. В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность EPKSCDKTHTCPPCPAPEKKGGP (SEQ ID NO: 41). В некоторых вариантах осуществления шарнирный участок представляет собой шарнир IgG1, содержащий мутации L234D и L235E. В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность EPKSCDKTHTCPPCPAPEDEGGP (SEQ ID NO: 42). В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность ERKCCVECPPCPAPPVAGP (SEQ ID NO: 46). В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность ESKYGPPCPSCPAPEFLGGP (SEQ ID NO: 47). В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность ESKYGPCPPPCPAPEFLGGP (SEQ ID NO: 58). В некоторых вариантах осуществления шарнирный участок содержит любую из аминокислотных последовательностей EPKSCDKDKTHTCPPCPAPELLGGP (SEQ ID NO: 43), EPKSCDKDKTHTCPPCPAPEKKGGP (SEQ ID NO: 44) или EPKSCDKDKTHTCPPCPAPEDEGGP (SEQ ID NO: 45). В некоторых вариантах осуществления шарнирный участок содержит любую из аминокислотных последовательностей EPKSCDKPDKTHTCPPCPAPELLGGP (SEQ ID NO: 55), EPKSCDKPDKTHTCPPCPAPEKKGGP (SEQ ID NO: 56), EPKSCDKPDKTHTCPPCPAPEDEGGP (SEQ ID NO: 57) или EPPKSCDKTHTCPPCPAPELLGGP (SEQ ID NO: 59). В некоторых вариантах осуществления шарнирный участок, такой как N'-часть шарнира, содержит любую из аминокислотных последовательностей EPKSCDKP (SEQ ID NO: 54), EPKSCDK (SEQ ID NO: 48) или EPKSC (SEQ ID NO: 49). В некоторых вариантах осуществления шарнирный участок содержит аминокислотную последовательность DKTHT (SEQ ID NO: 53). В некоторых вариантах осуществления шарнирный участок, такой как С'-часть шарнира, содержит любую из аминокислотных последовательностей DKTHTCPPCPAPELLGGP (SEQ ID NO: 50), DKTHTCPPCPAPEKKGGP (SEQ ID NO: 51) или DKTHTCPPCPAPEDEGGP (SEQ ID NO: 52).
[296] В некоторых вариантах осуществления цитокин или его вариант, описанный в данном документе, расположен на N-конце шарнирного участка тяжелой цепи полноразмерного антитела, т.е. расположен между С-концом СН1 и N-концом шарнирного участка тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления составной полипептид тяжелой цепи содержит, от N' к C': VH-CH1-цитокиновый фрагмент-шарнир-CH2-CH3. В некоторых вариантах осуществления цитокин или его вариант расположены на N-конце шарнирного участка между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена или ее частью (например, CH2-CH3 или CH2). Например, в некоторых вариантах осуществления иммуноцитокин содержит любой из полипептидов, от N' к C': (1) VH-цитокиновый фрагмент-шарнир-CH2-CH3; (2) VL-цитокиновый фрагмент-шарнир-CH2-CH3; (3) VH-необязательный линкер-VL-цитокиновый фрагмент-шарнир-CH2-CH3; (4) VL-необязательный линкер-VH-цитокиновый фрагмент-шарнир-CH2-CH3; (5) VH-CH1-цитокиновый фрагмент-шарнир-CH2-CH3; (6) VH-цитокиновый фрагмент-шарнир-CH2; (7) VL-цитокиновый фрагмент-шарнир-CH2; (8) VH-необязательный линкер-VL-цитокиновый фрагмент-шарнир-CH2; (9) VL-необязательный линкер-VH-цитокиновый фрагмент-шарнир-CH2; (10) VH-CH1-цитокиновый фрагмент-шарнир-CH2; (11) лиганд-необязательный линкер-цитокиновый фрагмент-шарнир-CH2-CH3; (12) лиганд-необязательный линкер-цитокиновый фрагмент-шарнир-CH2; (13) рецептор-необязательный линкер-цитокиновый фрагмент-шарнир-CH2-CH3; или (14) рецептор-необязательный линкер-цитокиновый фрагмент-шарнир-CH2. В некоторых вариантах осуществления цитокин или его вариант расположены на N-конце шарнирного участка, содержащего любую из последовательностей SEQ ID NO: 50-52.
[297] В некоторых вариантах осуществления цитокин или его вариант, описанный в данном документе, расположен на С-конце шарнирного участка тяжелой цепи полноразмерного антитела, т.е. составной полипептид тяжелой цепи содержит, от N' к C': VH-CH1-шарнир-цитокиновый фрагмент-CH2-CH3. В некоторых вариантах осуществления цитокин или его вариант расположены на С-конце шарнирного участка между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена или ее частью (например, СН2). Например, в некоторых вариантах осуществления иммуноцитокин содержит любой из полипептидов, от N' к C': (1) VН-шарнир-цитокиновый фрагмент-CH2-CH3; (2) VL-шарнир-цитокиновый фрагмент-CH2-CH3; (3) VH-необязательный линкер-VL-шарнир-цитокиновый фрагмент-CH2-CH3; (4) VL-необязательный линкер-VH-шарнир-цитокиновый фрагмент-CH2-CH3; (5) VH-CH1-шарнир-цитокиновый фрагмент-CH2-CH3; (6) VH-шарнир-цитокиновый фрагмент-CH2; (7) VL-шарнир-цитокиновый фрагмент-CH2; (8) VH-необязательный линкер-VL-шарнир-цитокиновый фрагмент-CH2; (9) VL-необязательный линкер-VH-шарнир-цитокиновый фрагмент-CH2; (10) VH-CH1-шарнир-цитокиновый фрагмент-CH2; (11) лиганд-шарнир-цитокиновый фрагмент-СН2-СН3; (12) лиганд-шарнир-цитокиновый фрагмент-CH2; (13) рецептор-шарнир-цитокиновый фрагмент-CH2-CH3; или (14) рецептор-шарнир-цитокиновый фрагмент-CH2. В некоторых вариантах осуществления цитокин или его вариант расположены на С-конце шарнирного участка, содержащего любую из последовательностей SEQ ID NO: 40-47, 50-52 и 55-59.
[298] В некоторых вариантах осуществления цитокин или его вариант, описанный в данном документе, расположен в шарнирном участке тяжелой цепи полноразмерного антитела, т.е. составной полипептид тяжелой цепи содержит, от N' к C': VH-CH1-N'-часть шарнира-цитокиновый фрагмент-C'-часть шарнира-CH2-CH3. В некоторых вариантах осуществления цитокин или его вариант заменяет часть шарнирного участка. В некоторых вариантах осуществления цитокин или его вариант встроен в шарнирный участок без делеции какой-либо шарнирной аминокислоты. В некоторых вариантах осуществления цитокин или его вариант встроен в шарнирный участок, содержащий любую из последовательностей SEQ ID NO: 40-47 и 55-59. В некоторых вариантах осуществления цитокин или его вариант встроены между N'-концевой шарнирной частью, содержащей любую последовательность из SEQ ID NO: 48, 49 и 54, и C'-концевой шарнирной частью, содержащей любую из последовательностей SEQ ID NO: 50-52. В некоторых вариантах осуществления цитокин или его вариант с пептидным линкером, составленным с N'-концом цитокина или его варианта, встроен в шарнирный участок. В некоторых вариантах осуществления цитокин или его вариант с пептидным линкером, составленным с С'-концом цитокина или его варианта, встроен в шарнирный участок. Например, в некоторых вариантах осуществления часть шарнир-цитокин имеет строение, от N' к C': шарнирная N'-часть - необязательный N'-концевой пептидный линкер - цитокиновый фрагмент - необязательный C'-концевой пептидный линкер - шарнирная C'-часть. В некоторых вариантах осуществления шарнирный участок представляет собой шарнир IgG1, а цитокин или его вариант встроены между «EPKSC» (SEQ ID NO: 49) и «DKTHT» (SEQ ID NO: 53). В некоторых вариантах осуществления N'-концевой пептидный линкер содержит аминокислотную последовательность DKP (SEQ ID NO: 231) или P (SEQ ID NO: 242). Поэтому, в некоторых вариантах осуществления цитокин или его вариант встроены между дополнительно введенными последовательностями «DKP» и «DKTHT». В некоторых вариантах осуществления N'-концевой пептидный линкер содержит аминокислотную последовательность DKPGS (SEQ ID NO: 232), PGS (SEQ ID NO: 233) или GS (SEQ ID NO: 234). В некоторых вариантах осуществления N'-концевой пептидный линкер содержит аминокислотную последовательность DKPGSG (SEQ ID NO: 235), PGSG (SEQ ID NO: 236) или GSG (SEQ ID NO: 203). В некоторых вариантах осуществления N'-концевой пептидный линкер содержит аминокислотную последовательность DKPGSGS (SEQ ID NO: 237), PGSGS (SEQ ID NO: 238) или GSGS (SEQ ID NO: 239). В некоторых вариантах осуществления N'-концевой пептидный линкер содержит аминокислотную последовательность DKPGSGGGGG (SEQ ID NO: 240), PGSGGGGG (SEQ ID NO: 241), GSGGGGG (SEQ ID NO: 206). В некоторых вариантах осуществления цитокин или его вариант расположены в шарнирном участке между антигенсвязывающим фрагментом (например, лигандом, рецептором, VHH, scFv или Fab) и субъединицей Fc-домена или ее частью (например, CH2). Например, в некоторых вариантах осуществления иммуноцитокин содержит любой из полипептидов, от N' к C': (1) VH-N'-часть шарнира-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2-CH3; (2) VL-N'-часть шарнира-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-СН2-СН3; (3) VH-необязательный линкер-VL-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-СН2-СН3; (4) VL-необязательный линкер-VH-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-СН2-СН3; (5) VH-CH1-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2-CH3; (6) Vh-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (7) Vl-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (8) VH-необязательный линкер-VL-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (9) VL-необязательный линкер-VH-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (10) VH-CH1-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (11) лиганд-необязательный линкер-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2-CH3; (12) лиганд-необязательный линкер-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2; (13) рецептор-необязательный линкер-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2-CH3; или (14) рецептор-необязательный линкер-шарнирная N'-часть-необязательный N'-пептидный линкер-цитокиновый фрагмент-необязательный C'-пептидный линкер-шарнирная C'-часть-CH2.
Fc-домены
[299] Описанный здесь иммуноцитокин содержит Fc-домен или его часть на С-конце. Fc-домен включает CH2-домен и CH3-домен. В некоторых вариантах осуществления часть Fc-домена содержит (по существу состоит или состоит из) CH2-домена. В некоторых вариантах осуществления часть Fc-домена содержит (по существу состоит или состоит из) CH3-домена.
[300] В некоторых вариантах осуществления Fc-домен получен из любого из IgA, IgD, IgE, IgG и IgM и их подтипов. В некоторых вариантах осуществления Fc-домен содержит CH2 и CH3. В некоторых вариантах осуществления Fc-домен получен из IgG (например, IgG1, IgG2, IgG3 или IgG4). В некоторых вариантах осуществления Fc-домен получен из человеческого IgG. В некоторых вариантах осуществления Fc-домен получен из человеческого IgG1 или человеческого IgG4. В некоторых вариантах осуществления две субъединицы Fc-домена димеризуются с помощью одной или нескольких (например, 1, 2, 3, 4 или более) дисульфидных связей. В некоторых вариантах осуществления каждая субъединица Fc-домена содержит полноразмерную последовательность Fc. В некоторых вариантах осуществления каждая субъединица Fc-домена содержит укороченную на N-конце последовательность Fc. В некоторых вариантах осуществления Fc-домен укорочен на N-конце, например, отсутствуют первые 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот полного Fc-домена иммуноглобулина. В некоторых вариантах осуществления Fc-домен содержит любую из аминокислотных последовательностей SEQ ID NO: 60-66.
[301] Посредством Fc-домена иммуноцитокины могут активировать комплемент и взаимодействовать с рецепторами Fc. Это свойство, присущее иммуноглобулинам, считается неудачным, поскольку иммуноцитокины могут за счет этого нацеливаться на клетки, экспрессирующие Fc-рецепторы, а не на предпочтительные клетки, несущие антиген. Более того, одновременная активация рецепторов цитокинов и сигнальных путей Fc-рецепторов, приводящая к высвобождению цитокинов, особенно в сочетании с длительным периодом полувыведения составных белков иммуноглобулинов, затрудняет их применение в терапевтических условиях из-за системной токсичности. Таким образом, в некоторых вариантах осуществления Fc-домен сконструирован так, чтобы иметь измененное связывание с рецептором Fc (FcR), специфически измененное связывание с рецептором Fcγ и/или измененную эффекторную функцию, такую как измененная (например, уменьшенная или устраненная) антителозависимая клеточно-опосредованная цитотоксичность (ADCC), антителозависимый клеточный фагоцитоз (ADCP) и/или комплементзависимая цитотоксичность (CDC).
[302] Хотя наличие Fc-домена необходимо для продления периода полувыведения иммуноцитокина, в некоторых ситуациях полезно устранять эффекторные функции, связанные с вовлечением Fc-рецепторов Fc-доменом. Следовательно, в некоторых вариантах осуществления измененное связывание с Fc-рецептором и/или эффекторная функция представляет собой ослабление/уменьшение связывания и/или эффекторной функции. В некоторых вариантах осуществления Fc-домен содержит одну или несколько аминокислотных мутаций, которые ослабляют связывание Fc-домена с рецептором Fc, в частности с рецептором Fcγ (отвечающим за ADCC). Предпочтительно, чтобы такая аминокислотная мутация не ослабляла связывания с рецепторами FcRn (отвечающими за период полувыведения). В некоторых вариантах осуществления субъединица Fc-домена содержит аминокислотную последовательность SEQ ID NO: 64 или 65. В некоторых вариантах осуществления Fc-домен получен из человеческого IgG1 и содержит аминокислотную замену N295A. В некоторых вариантах осуществления Fc-домен получен из человеческого IgG4 и содержит аминокислотные замены S228P и L235E в шарнирном участке. В некоторых вариантах осуществления Fc-домен получен из человеческого IgG1 и содержит аминокислотные замены L234A и L235A ("LALA") в шарнирном участке. В некоторых вариантах осуществления Fc-домен получен из человеческого IgG1 и содержит аминокислотные замены L234A и L235A в шарнирном участке и P329G, например, в каждой из его субъединиц. См., например, Lo M. и др. J Biol Chem. 2017 Mar 3;292(9):3900-3908; Schlothauer T. и др., Protein Eng Des Sel. 2016 Oct;29(10):457-466.
[303] В некоторых вариантах осуществления Fc-домен (например, человеческого IgG1) подвергают мутации с целью удаления одной или нескольких эффекторных функций, таких как ADCC, ADCP или CDC, а именно получая «безэффекторный» или «почти безэффекторный» Fc-домен. Например, в некоторых вариантах осуществления Fc-домен представляет собой безэффекторный Fc IgG1, содержащий одну или несколько из следующих мутаций (например, в каждой из его субъединиц): L234A, L235E, G237A, A330S и P331S. Комбинации K322A, L234A и L235A в IgG1 достаточны для почти полного устранения связывания FcγR и C1q (Hezareh и др., J Virol 75, 12161-12168, 2001). В MedImmune определили, что набор из трех мутаций L234F/L235E/P331S имеет очень похожий эффект (Oganesyan и др., Acta Crystallographica 64, 700-704, 2008). В некоторых вариантах осуществления Fc-домен содержит модификацию гликозилирования N297 Fc-домена IgG1, которая, как известно, необходима для оптимального взаимодействия с FcR. Модификация Fc-домена может быть любым подходящим конструированием Fc IgG, упомянутым в Wang и др. («IgG Fc engineering to modulate antibody eFFector Functions», Protein Cell. 2018 Jan; 9(1): 63-73), содержание которого полностью включено в настоящее описание ссылкой.
[304] В некоторых вариантах осуществления Fc-домен содержит две идентичные полипептидные цепи (идентичные субъединицы Fc). Такие домены Fc здесь также называются «гомодимерными Fc-доменами». В некоторых вариантах осуществления каждая субъединица гомодимерного Fc-домена содержит любую из аминокислотных последовательностей SEQ ID NO: 60 и 63-66.
[305] В некоторых вариантах осуществления Fc-домен содержит модификацию, способствующую гетеродимеризации двух неидентичных полипептидных цепей. Такие домены Fc здесь также называются «гетеродимерными доменами Fc». В некоторых вариантах осуществления Fc-домен содержит модификацию «выступ-во-впадину» (KIH), включающую модификацию-выступ в одной из субъединиц Fc-домена и модификацию-впадину в другой из двух субъединиц Fc-домена. К иммуноцитокину, описанному в данном документе, можно применять любые подходящие модификации «выступ-во-впадину», такие как аминокислотные замены T22>Y (создание выступа) в цепи B первого CH3-домена и Y86>T (создание впадины) в цепи E партнерского CH3-домена. См. также US 20200087414, содержание которого полностью включено в настоящее описание ссылкой. В некоторых вариантах осуществления одна субъединица Fc-домена содержит одну или несколько мутаций T350V, L351Y, S400E, F405A и Y407V в отличие от Fc человеческого IgG1 дикого типа, содержащего последовательность SEQ ID NO: 60, а другая субъединица Fc-домена содержит одну или несколько мутаций T350V, T366L, N390R, K392M, T394W в отличие от Fc человеческого IgG1 дикого типа, содержащего последовательность SEQ ID NO: 60. В некоторых вариантах осуществления одна субъединица Fc-домена содержит последовательность SEQ ID NO: 61, а другая субъединица Fc-домена содержит последовательность SEQ ID NO: 62.
[306] В некоторых вариантах осуществления Fc-домен представляет собой одноцепочечный Fc-домен, как описано в WO2017134140, содержание которого полностью включено в настоящее описание ссылкой.
Линкеры
[307] В некоторых вариантах осуществления в иммуноцитокине, описанном в данном документе, между двумя или более антигенсвязывающими фрагментами, соединенными последовательно, антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или Fab) и цитокиновый фрагмент, CH1-домен и цитокиновый фрагмент, два или более фрагмента цитокина, соединенные последовательно, две или более субъединицы цитокина или его варианта, соединенные последовательно, цитокиновый фрагмент и субъединица Fc-домена или ее часть, шарнирный участок и CH1-домен, шарнирный участок и CH2-домен, шарнирный участок и цитокиновый фрагмент, субъединица Fc-домена или ее часть и антигенсвязывающий фрагмент и/или CH1-домен и субъединица Fc-домена или ее часть соединены одним или несколькими необязательными линкерами (например, пептидным линкером, непептидным линкером). В некоторых вариантах осуществления используют один или несколько одинаковых линкеров. В некоторых вариантах осуществления используют один или несколько разных линкеров (например, отличающихся друг от друга). В некоторых вариантах осуществления один или несколько линкеров представляют собой гибкие линкеры. В некоторых вариантах осуществления один или несколько линкеров являются устойчивыми линкерами. В некоторых вариантах осуществления одни линкеры являются гибкими, тогда как другие являются устойчивыми. В общем случае линкер не влияет или несущественно влияет на правильную укладку и конформацию, формируемую конфигурацией иммуноцитокина. Предпочтительно линкер предоставляет гибкость и достаточное пространство для каждой части иммуноцитокина, например, делает возможным связывание целевого антигена и фрагмента, связывающего антиген, позволяет связывание лиганд-рецептор, маскирует активность цитокина в отсутствие связывания антигена-мишени с антителом (или связывания лиганд-рецептор), при этом раскрывая активность цитокинов при наличии связывания антигена-мишени с антителом (или связывания лиганд-рецептор), обеспечивая гибкость и/или достаточное пространство между двумя субъединицами цитокинов или двумя фрагментами цитокинов, позволяя проявляться надлежащей активности цитокинов (сродство связывания и/или биоактивность), и т.д.
[308] Линкеры могут быть пептидными линкерами любой длины. В некоторых вариантах осуществления длина пептидного линкера составляет от примерно 1 аминокислоты (ак) до примерно 10 ак, от примерно 2 ак до примерно 15 ак, от примерно 3 ак до примерно 12 ак, от примерно 4 ак до примерно 10 ак, от примерно 5 ак до примерно 9 ак, от примерно 6 ак до примерно 8 ак, от примерно 1 ак до примерно 20 ак, от примерно 21 ак до примерно 30 ак, от примерно 1 ак до примерно 30 ак, от примерно 2 ак до примерно 20 ак, от примерно 10 ак до примерно 30 ак, от примерно 1 ак до примерно 50 ак, от примерно 2 ак до примерно 19 ак, от примерно 2 ак до примерно 18 ак, от примерно 2 ак до примерно 17 ак, от примерно 2 ак до примерно 16 ак, от примерно 2 ак до примерно 10 ак, от примерно 2 ак до примерно 14 ак, от примерно 2 ак до примерно 13 ак, от примерно 2 ак до примерно 12 ак, от примерно 2 ак до примерно 11 ак, от примерно 2 ак до примерно 9 ак, от примерно 2 ак до примерно 8 ак, от примерно 2 ак до примерно 7 ак, от примерно 2 ак до примерно 6 ак, от примерно 2 ак до примерно 5 ак или от примерно 6 ак до примерно 30 ак. В некоторых вариантах осуществления длина пептидного линкера может быть примерно любой из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислот. В некоторых вариантах осуществления длина пептидного линкера составляет примерно 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот. В некоторых вариантах осуществления длина пептидного линкера может быть примерно любой из 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 аминокислот. В некоторых вариантах осуществления длина линкера составляет от примерно 10 до примерно 20 аминокислот.
[309] Пептидный линкер может иметь природную последовательность или не встречающуюся в природе последовательность. Например, в качестве линкера можно использовать последовательность, полученную из шарнирного участка антитела, состоящего только из тяжелой цепи. См., например, WO1996/34103. В некоторых вариантах осуществления пептидный линкер представляет собой шарнир из человеческого IgG1, IgG2, IgG3 или IgG4 или его часть. В некоторых вариантах осуществления пептидный линкер представляет собой мутантный шарнир из человеческого IgG1, IgG2, IgG3 или IgG4 или его часть. В некоторых вариантах осуществления линкер представляет собой гибкий линкер. Примеры гибких линкеров включают, но не ограничиваются ими, глициновые полимеры (G)n (SEQ ID NO: 194), глицин-сериновые полимеры (включая, например, (GS)n (SEQ ID NO: 195), (GGS)n (SEQ ID NO: 196), (GGGS)n (SEQ ID NO: 197), (GGS)n(GGGS)n (SEQ ID NO: 198), (GSGGS)n (SEQ ID NO: 199), (GGSGS)n (SEQ ID NO: 200) или (GGGGS)n (SEQ ID NO: 201), где n представляет собой целое число, равное по крайней мере единице), глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры, известные в данной области техники. Глициновые и глицин-сериновые полимеры относительно неструктурированы и поэтому могут служить нейтральным связующим звеном между компонентами. Глицин имеет доступ к значительно большему ϕ-ψ пространству, чем даже аланин, и гораздо менее ограничен, чем остатки с более длинными боковыми цепями (см. Scheraga, Rev. Computational Chem. 11 173-142 (1992)). Примеры гибких линкеров включают, но не ограничиваются ими, GG (SEQ ID NO: 202), GSG (SEQ ID NO: 203), GGSG (SEQ ID NO: 204), GGSGG (SEQ ID NO: 205), GSGGGGG (SEQ ID NO: 206), GSGSG (SEQ ID NO: 207), GSGGG (SEQ ID NO: 208), GGGSG (SEQ ID NO: 209), GSSSG (SEQ ID NO: 210), GGSGGS (SEQ ID NO: 211), SGGGGS (SEQ ID NO: 212), GGGGS (SEQ ID NO: 213), (GA)n (SEQ ID NO: 214, n представляет собой целое число, равное по меньшей мере 1), GRAGGGGAGGGG (SEQ ID NO: 215), GRAGGG (SEQ ID NO: 216), GSGGGSGGGGSGGGGS (SEQ ID NO: 217), GGGSGGGGSGGGGS (SEQ ID NO: 218), GGGSGGSGGS (SEQ ID NO: 219), GGSGGSGGSGGSGGG (SEQ ID NO: 220), GGSGGSGGGGSGGGGS (SEQ ID NO: 221), GGSGGSGGSGGSGGSGGS (SEQ ID NO: 222), GGGGSGGGGSGGGGS (SEQ ID NO: 229), GGGGGGSGGGGSGGGGSA (SEQ ID NO: 223), GSGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 224), KTGGGSGGGS (SEQ ID NO: 225), GGPGGGGSGGGSGGGGS (SEQ ID NO: 226), GGGSGGGGSGGGGSGGGGS (SEQ ID NO: 227), GGGGSGGGGSGGGGSGGGGSG (SEQ ID NO: 228) и т.п. В некоторых вариантах осуществления линкер содержит последовательность ASTKGP (SEQ ID NO: 230). Специалисту средней квалификации в данной области известно, что конструкция иммуноцитокина может включать линкеры, гибкие полностью или частично, так что линкер может включать гибкую линкерную часть, а также одну или несколько частей, которые придают менее гибкую структуру для получения требуемого строения и функции иммуноцитокина (например, маскирование активности цитокинов в отсутствие связывания антигена-мишени с антителом, в то же время раскрытие активности цитокинов при наличии связывания антигена-мишени с антителом; или обеспечивают гибкость и/или достаточное пространство между двумя цитокиновыми субъединицами, позволяя проявляться надлежащей активности цитокинов (сродству связывания и/или биоактивности)). В некоторых вариантах осуществления пептидный линкер обогащен серин-глицином. В некоторых вариантах осуществления пептидный линкер содержит любую аминокислотную последовательность из SEQ ID NO: 194-242. В некоторых вариантах осуществления пептидный линкер содержит (или по существу состоит из или состоит из) любую аминокислотную последовательность из SEQ ID NO: 227-229. В некоторых вариантах осуществления цитокиновый фрагмент, описанный в данном документе, содержит две цитокиновые субъединицы (дикого типа или мутанта), соединенные линкером, таким как линкер, содержащий любую последовательность из SEQ ID NO: 227-229.
[310] В некоторых вариантах осуществления линкер представляет собой устойчивый линкер (например, не расщепляемый протеазой, особенно ММП).
[311] Любой один или все линкеры, описанные в данном документе, можно получать с помощью любой химической реакции, которая способна соединять антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или Fab) и шарнирный участок, шарнирный участок и цитокиновый фрагмент, CH1-домен и цитокиновый фрагмент, цитокиновые фрагменты, соединенные последовательно, цитокиновый фрагмент и субъединицу Fc-домена, две цитокиновые субъединицы, антигенсвязывающие фрагменты, антигенсвязывающий фрагмент и цитокиновый фрагмент, антигенсвязывающий фрагмент и субъединицу Fc-домена или ее часть, и/или CH1-домен и субъединицу Fc-домена или ее часть, при условии, что компоненты или фрагменты сохраняют присущую им активность, т.е. связывание с цитокиновым рецептором, связывание с антигеном(ами)-мишенью, связывание с лигандом или рецептором, связывание с FcR или ADCC. Такое образование связи может включать множество химических механизмов, например, ковалентное связывание, аффинное связывание, интеркаляцию, координационное связывание и комплексообразование. В некоторых вариантах осуществления связывание представляет собой ковалентное связывание. Ковалентное связывание может быть достигнуто либо путем прямой конденсации существующих боковых цепей, либо путем включения внешних мостиковых молекул. Многие двухвалентные или поливалентные связывающие реагенты применимы для соединения белковых молекул. Например, характерные реагенты присоединения могут включать органические соединения, такие как сложные тиоэфиры, карбодиимиды, сложные эфиры сукцинимида, диизоцианаты, глутаровый альдегид, диазобензолы и гексаметилендиамины. Этот список не является исчерпывающим для различных классов реагентов присоединения, известных в данной области техники, а скорее является примером более распространенных реагентов присоединения (см. Killen и Lindstrom, Jour. Immun. 133:1335-2549 (1984); Jansen и др., Immunological Reviews 62:185-216 (1982); и Vitetta и др., Science 238:1098 (1987)).
[312] Линкеры, которые можно применять в настоящем изобретении, описаны в литературе (см., например, Ramakrishnan, S. и др., Cancer Res. 44:201-208 (1984), описывающих применение MBS (M-малеимидобензоил-N-гидроксисукцинимидный эфир)). В некоторых вариантах осуществления непептидные линкеры, используемые в данном документе, включают: (i) EDC (1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид; (ii) SMPT (4-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-пиридил-дитио)-толуол (Pierce Chem. Co., Кат. (21558Г); (iii) SPDP (сукцинимидил-6-[3-(2-пиридилдитио)пропионамидо]гексаноат (Pierce Chem. Co., Кат. № 21651G); (iv) сульфо-LC-SPDP (сульфосукцинимидил-6-[3-(2-пиридилдитио)- пропионамид]гексаноат (Pierce Chem. Co. Кат. № 2165-Г); и (v) сульфо-NHS (N-гидроксисульфосукцинимид: Pierce Chem. Co., Кат. № 24510), конъюгированный с EDC.
[313] Описанные выше линкеры могут содержать компоненты с различными свойствами, что приводит к получению иммуноцитокинов с различными физико-химическими свойствами. Например, сульфо-NHS-эфиры алкилкарбоксилатов более стабильны, чем сульфо-NHS-эфиры ароматических карбоксилатов. Линкеры, содержащие сложные эфиры NHS, менее растворимы, чем сложные эфиры сульфо-NHS. Кроме того, линкер SMPT содержит стерически затрудненную дисульфидную связь и может образовывать гибридный белок с повышенной стабильностью. Дисульфидные связи, как правило, менее устойчивы, чем другие связи, потому что дисульфидная связь расщепляется in vitro, что приводит к меньшему количеству доступного гибридного белка. В частности, сульфо-NHS может повышать стабильность карбодиимидных сочетаний. Реагенты для карбодиимидного сочетания (такие как EDC) при использовании вместе с сульфо-NHS образуют сложные эфиры, которые более устойчивые к гидролизу, чем при реакции только с одним реагентом карбодиимидного сочетания.
[314] Другие аспекты линкера включают влияние на физические или фармакокинетические свойства полученного иммуноцитокина, такие как растворимость, липофильность, гидрофильность, гидрофобность, стабильность (умеренная стабильность в сочетании с планируемой деградацией), жесткость, гибкость, иммуногенность, модуляция цитокинового фрагмента/связывание цитокинового рецептора, модуляция связывания антигенсвязывающего домена/антигена-мишени, модуляция связывания лиганд-рецептор, способность к заключению в мицеллу или липосому и т.п.
Варианты иммуноцитокина
Варианты с модифицированным гликозилированием
[315] В некоторых вариантах осуществления иммуноцитокин изменен для увеличения или уменьшения степени гликозилирования конструкции. Добавление или удаление сайтов гликозилирования в Fc-домене можно легко осуществлять путем изменения аминокислотной последовательности так, чтобы создавать или удалять один или несколько сайтов гликозилирования.
[316] Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный биантенарный олигосахарид, который обычно присоединен N-связью к Asn297 в CН2-домене Fc-участка. См., например, Wright и др. TIBTECH 15:26-32 (1997). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стержне» биантеннарной олигосахаридной структуры. В некоторых вариантах осуществления модификации олигосахарида в домене Fc можно создавать для улучшения определенных свойств.
[317] В некоторых вариантах осуществления описанный в данном документе иммуноцитокин имеет углеводную структуру, в которой отсутствует фукоза, присоединенная (прямо или косвенно) к домену Fc. Например, доля фукозы в таком иммуноцитокине может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Долю фукозы определяют путем расчета средней доли фукозы в сахарной цепи в Asn297 по отношению к сумме всех гликоструктур, присоединенных к Asn 297 (например, сложные, гибридные строения и строения с высоким содержанием маннозы), измеренных с помощью масс-спектрометрии MALDI-TOF, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в положении 297 в домене Fc (нумерация ЕС остатков Fc-участка); однако Asn297 также может быть расположен примерно на ± 3 аминокислоты выше или ниже положения 297, т.е. между положениями 294 и 300 из-за незначительных вариаций последовательности в антителах. Такие варианты с модифицированным фукозилированием могут иметь улучшенную функцию ADCC. См., например, патентные публикации США № US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Rights Co., Ltd). Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» вариантам антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki и др. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki и др. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 CHO, дефицитные по фукозилированию белков (Ripka и др. Arch Biochem. Biophys. 249:533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams и др., особенно в примере 11), и нокаутные клеточные линии, такие как ген альфа-1,6-фукозилтрансферазы, FUT8, нокаутные клетки СНО (см., например, Yamane-Ohnuki и др. Biotech. Bioeng. 87: 614 (2004 г.); Kanda, Y. и др., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO 2003/085107).
Варианты с модицицированной эффекторной функцией
[318] В некоторых вариантах осуществления в настоящего изобретения рассматривается иммуноцитокин, который обладает некоторыми, но не всеми эффекторными функциями Fc, что делает его желательным кандидатом для применений, в которых важен период полувыведения иммуноцитокина in vivo, но некоторые эффекторные функции (такие как CDC и ADCC) не нужны или вредны. Некоторые из вариантов домена Fc обсуждались выше. Анализы цитотоксичности in vitro и/или in vivo можно проводить для подтверждения снижения/истощения активности CDC и/или ADCC. Например, можно анализировать связывание Fc-рецептора (FcR), чтобы убедиться, что антитело не связывается с FcγR (следовательно, скорее всего не обладает ADCC-активностью), но сохраняет способность связывания с FcRn. Первичные клетки для опосредования ADCC - Nk-клетки - экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в таблице 2 на стр. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры in vitro анализы для оценки ADCC-активности интересующей молекулы описаны в патенте США № 5,500,362 (см., например, Hellstrom, I. и др. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I и др., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5 821 337 (см. Bruggemann, M. и др., J. Exp. Med. 166:1351-1361 (1987)). В качестве альтернативы можно использовать нерадиоактивные методы анализа (см., например, анализ нерадиоактивной цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA; и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, Висконсин). Полезные эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (РВМС) и клетки-естественные киллеры (NK). Альтернативно или дополнительно можно оценить ADCC-активность интересующей молекулы in vivo, например, в животной модели, такой как описана у Clynes и др. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Анализы связывания C1q также можно проводить для подтверждения того, что антитело не способно связывать C1q и, следовательно, не обладает CDC-активностью. См., например, ELISA связывания C1q и C3c в WO 2006/029879 и WO 2005/100402. Оценку активации комплемента можно с помощью анализа CDC (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202:163 (1996); Cragg, M.S. и др., Blood 101:1045-1052 (2003); и Cragg, M.S. и M.J. Glennie, Blood 103:2738-2743 (2004)). Определения связывания FcRn и in vivo клиренса/периода полувыведения также можно с помощью методов, известных в данной области (см., например, Petkova, S.B. и др., Int'l. Immunol. 18(12):1759-1769 (2006)).
[319] Fc-домены со сниженной эффекторной функцией включают домены с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 в Fc-участке (патент США № 6737056). Такие Fc-мутанты включают замены в двух или более положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый Fc-мутант «DANA» с заменой остатков 265 и 297 на аланин (патент США № 7332581). Описаны некоторые варианты антител с улучшенным или пониженным связыванием с FcR (см., например, патент США № 6737056; WO 2004/056312 и Shields и до., J. Biol. Chem. 9(2): 6591-6604 (2001)). В некоторых вариантах осуществления в Fc-домен вносят изменения, которые приводят к изменению (т.е. улучшению или ослаблению) связывания C1q и/или CDC, например, как описано в патенте США № 6194551, WO 99/51642 и у Idusogie и др. J. Immunol. 164: 4178-4184 (2000).
[320] В некоторых вариантах осуществления Fc-домен содержит одну или несколько аминокислотных замен, которые продлевают период полувыведения и/или улучшают связывание с неонатальным Fc-рецептором (FcRn). Антитела с увеличенным периодом полувыведения и улучшенным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за перенос материнских IgG к плоду (Guyer и др., J. Immunol. 117:587 (1976) и Ким и др., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934A1 (Hinton и др.). Эти антитела содержат Fc-домен с одной или несколькими заменами в нем, которые улучшают связывание Fc-участка с FcRn. Такие варианты Fc включают варианты с заменами в одном или нескольких остатках Fc-участка, например, замена остатка 434 в Fc-участке (патент США № 7371826).
[321] См. также Duncan и Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; и WO 94/29351, касающиеся других примеров вариантов Fc-домена.
Варианты, модифицированные цистеином
[322] В некоторых вариантах осуществления может требоваться создание сконструированных с применением цистеина иммуноцитокинов, например, «thioMAb», в которых один или несколько остатков иммуноцитокина заменены остатками цистеина. В конкретных вариантах осуществления замещенные остатки встречаются в доступных участках иммуноцитокина. При замещении этих остатков цистеином реакционноспособные тиоловые группы располагаются в доступных участках иммуноцитокина, и их можно использовать для конъюгации иммуноцитокина с другими фрагментами, такими как фрагменты лекарственного средства или фрагменты линкер-лекарственное средство, для создания конъюгата иммуноцитокина. В некоторых вариантах осуществления любой один или несколько из следующих остатков можно заменять цистеином: A118 (нумерация ЕС) а тяжелой цепи; и S400 (нумерация ЕС) в домене Fc тяжелой цепи. Иммуноцитокины, модифицированные цистеином, можно получать, как описано выше, например, в патенте США № 7521541.
Производные иммуноцитокина
[323] В некоторых вариантах осуществления иммуноцитокины, предложенные в данном документе, могут дополнительно содержать дополнительное терапевтическое соединение, такое как любые терапевтические соединения, известные в данной области. Например, исходное антитело в некоторых вариантах осуществления может представлять собой конъюгат антитело-лекарственное средство (ADC). См., например, любой ADC, описанный у Shim H. (Biomolecules. 2020 март; 10(3): 360), и Diamantis N. и Banerji U. Br J Cancer. 2016; 114(4): 362-367, содержание которых полностью включено в настоящее описание ссылкой. В некоторых вариантах осуществления терапевтическое соединение конъюгировано с Fc-доменом или его частью. В некоторых вариантах осуществления терапевтическое соединение представляет собой цитотоксическое средство, химиотерапевтическое средство, средство, ингибирующее рост, или антибиотик.
[324] В некоторых вариантах осуществления иммуноцитокин дополнительно содержит метку, выбранную из группы, состоящей из хромофора, флуорофора (например, кумарина, ксантена, цианина, пирена, бораполиазиндацена, оксазина и их производных), флуоресцентного белка (например, GFP, фикобилипротеинов и их производных), фосфоресцирующего красителя (например, диоксетановых, ксантеновых или карбоцианиновых красителей, хелатов лантанидов), тандемнго красителя (например, цианин-фикобилипротеинового производного и ксантен-фикобилипротеинового производного), частиц (например, кластеров золота, коллоидного золота микросферы, квантовых точек), гаптена, фермента (например, пероксидазы, фосфатазы, гликозидазы, люциферазы) и радиоизотопа (например, 125I, 3H, 14С, 32P).
III. Векторы, кодирующие иммуноцитокины
[325] Настоящее изобретение также относится к выделенным нуклеиновым кислотам, кодирующим любой из иммуноцитокинов, описанных в данном документе (например, иммуноцитокин IL-2/антитело к HER2, иммуноцитокин IL-2/антитело к CD3, иммуноцитокин IL-2/антитело к PD-1, иммуноцитокин IL-2/антитело к CD4, иммуноцитокин IL-2/антитело к CD8, иммуноцитокин IL-2/антитело к CTLA-4, иммуноцитокин IL-2/антитело к PD-L1, иммуноцитокин IL-2/антитело к CD25, иммуноцитокин IL-2/PD-L2-Fc, иммуноцитокин IL-12/антитело к HER2, иммуноцитокин IL-12/антитело к CD3, иммуноцитокин IL-12/антитело к PD-1, иммуноцитокин IL-12/антитело к CD4, иммуноцитокин IL-12/антитело к CD8, иммуноцитокин IL-12/антитело к CTLA-4, иммуноцитокин IL-12/антитело к PD-L1, иммуноцитокин IL-12/антитело к CD25, иммуноцитокин IL-12/PD-L2-Fc, иммуноцитокин IL-23/антитело к HER2, иммуноцитокин IL-23/антитело к CD3, иммуноцитокин IL-23/антитело к PD-1, иммуноцитокин IL-23/антитело к CD4, иммуноцитокин IL-23/антитело к CD8, иммуноцитокин IL-23/антитело к CTLA-4, иммуноцитокин IL-23/антитело к PD-L1, иммуноцитокин IL-23/антитело к CD25, иммуноцитокин IL-23/PD-L2-Fc, иммуноцитокин IL-10/антитело к HER2, иммуноцитокин IL-10/антитело к CD3, иммуноцитокин IL-10/антитело к PD-1, иммуноцитокин Il-10/антитело к CD4, иммуноцитокин IL-10/антитело к CD8, иммуноцитокин IL-10/антитело к CTLA-4, иммуноцитокин IL-10/антитело к PD-L1, иммуноцитокин IL-10/антитело к CD25, иммуноцитокин IL-10/PD-L2-Fc, иммуноцитокин IFN-γ/антитело к HER2, иммуноцитокин IFN-γ/антитело к CD3, иммуноцитокин IFN-γ/антитело к PD-1, иммуноцитокин IFN-γ/антитело к CD4, иммуноцитокин IFN-γ/антитело к CD8, иммуноцитокин IFN-γ/антитело к CTLA-4, иммуноцитокин IFN-γ/антитело к PD-L1, иммуноцитокин IFN-γ/антитело к CD25, иммуноцитокин IFN-γ/PD-L2-Fc, иммуноцитокин IFN-α/антитело к HER2, иммуноцитокин IFN-α/антитело к CD3, иммуноцитокин IFN-α/антитело к PD-1, иммуноцитокин IFN-α/антитело к CD4, иммуноцитокин IFN-α/антитело к CD8, иммуноцитокин IFN-α/антитело к CTLA- 4, иммуноцитокин IFN-α/антитело к PD-L1, иммуноцитокин IFN-α/антитело к CD25 или иммуноцитокин IFN-α/PD-L2-Fc), векторам, содержащим нуклеиновые кислоты, кодирующие любой из описанных в данном документе иммуноцитокинов. Также предложены изолированные клетки-хозяева (например, клетки CHO, клетки HEK 293, клетки Hela, клетки COS), содержащие нуклеиновые кислоты, кодирующие любой из иммуноцитокинов, описанных в данном документе, или векторы, содержащие нуклеиновые кислоты, кодирующие любой из иммуноцитокинов, описанных в данном документе.
[326] Таким образом, в некоторых вариантах осуществления предложена выделенная нуклеиновая кислота, кодирующая иммуноцитокин, содержащий: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, такой как PD-L2, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления предложена выделенная нуклеиновая кислота, кодирующая иммуноцитокин, содержащий: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложена выделенная нуклеиновая кислота, кодирующая иммуноцитокин, содержащий: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, PD -1, CD3, CD4 или CD8); и b) и цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую, от N-конца к C-концу: домен VH, необязательно CH1-домен, цитокин или его вариант в шарнирном участке, CH2-домен и, необязательно, CH3-домен. В некоторых вариантах осуществления предложена выделенная нуклеиновая кислота, кодирующая иммуноцитокин, содержащий: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3 , CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, причем цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления каждый полипептид иммуноцитокина кодируется одной выделенной нуклеиновой кислотой. В некоторых вариантах осуществления одна выделенная нуклеиновая кислота кодирует два или более полипептида иммуноцитокина.
[327] В некоторых вариантах осуществления вектор, содержащий нуклеиновую кислоту, кодирующую любой из иммуноцитокинов, описанных в данном документе, подходит для репликации и интеграции в эукариотические клетки, такие как клетки млекопитающих (например, клетки CHO, клетки HEK 293, клетки Hela, клетки COS). В некоторых вариантах осуществления вектор представляет собой вирусный вектор. Примеры вирусных векторов включают, но не ограничиваются ими, аденовирусные векторы, аденоассоциированные вирусные векторы, лентивирусный вектор, ретровирусные векторы, вирусный вектор простого герпеса и их производные. Технология вирусных векторов хорошо известна в данной области и описана, например, в Sambrook и др. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Нью-Йорк) и в других руководствах по вирусологии и молекулярной биологии.
[328] Для переноса генов в клетки млекопитающих был разработан ряд основанных на вирусах систем. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Гетерологичную нуклеиновую кислоту можно встраивать в вектор и упаковывать в ретровирусные частицы с использованием методик, известных в данной области. Затем рекомбинантный вирус можно выделить и доставить в сконструированную клетку млекопитающего in vitro или ex vivo. В данной области известен ряд ретровирусных систем. В некоторых вариантах осуществления используются аденовирусные векторы. В данной области известен ряд аденовирусных векторов. В некоторых вариантах осуществления используются лентивирусные векторы. В некоторых вариантах осуществления используются самоинактивирующиеся лентивирусные векторы. Например, самоинактивирующиеся лентивирусные векторы, несущие кодирующую(ие) иммуноцитокин последовательность(и), можно упаковывать, следуя протоколам, известным в данной области. Полученные лентивирусные векторы можно использовать для трансдукции клетки млекопитающего с использованием методов, известных в данной области. Векторы, полученные из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долгосрочного переноса генов, поскольку они обеспечивают долгосрочную стабильную интеграцию трансгена и его размножение в клетках-потомках. Лентивирусные векторы также обладают низкой иммуногенностью и могут трансдуцировать непролиферирующие клетки.
[329] В некоторых вариантах осуществления вектор представляет собой невирусный вектор. В некоторых вариантах осуществления вектор представляет собой транспозон, такой как система транспозонов «Спящая красавица» (SB) или система транспозонов PiggyBac. В некоторых вариантах осуществления вектор представляет собой невирусный вектор на основе полимера, включая, например, поли(молочно-гликолевую кислоту) (PLGA) и полимолочную кислоту (PLA), поли(этиленимин) (PEI) и дендримеры. В некоторых вариантах осуществления вектор представляет собой невирусный вектор на основе катионного липида, такой как катионная липосома, липидная наноэмульсия и твердая липидная наночастица (SLN). В некоторых вариантах осуществления вектор представляет собой невирусный вектор на основе пептидного гена, такой как поли-L-лизин. Любой из известных невирусных векторов, подходящих для редактирования генома, можно использовать для введения нуклеиновой кислоты, кодирующей иммуноцитокин, в клетки-хозяева. См., например, Yin H. и др. Nature Rev. Genetics (2014) 15:521-555; Aronovich E.L. и др. «The Sleeping Beauty transposon system: a non-viral vector For gene therapy». Hum. Mol. Genet. (2011) R1: R14-20; и Zhao S. и др. «PiggyBac transposon vectors: the tools oF the human gene editing». Transl. Lung Cancer Res. (2016) 5(1): 120-125, которые включены в данной документе ссылкой. В некоторых вариантах осуществления любую одну или несколько нуклеиновых кислот или векторов, кодирующих иммуноцитокины, описанные в данном документе, вводят в клетки-хозяева (например, CHO, HEK 293, Hela или COS) физическим способом, включая, помимо прочего, электропорацию, сонопорацию, фотопорацию, магнитофекцию, гидропорацию.
[330] В некоторых вариантах осуществления вектор содержит селективный маркерный ген или репортерный ген для отбора клеток, экспрессирующих иммуноцитокины, описанные в данном документе, из популяции клеток-хозяев, трансфицированных векторами (например, лентивирусными векторами). Как селектируемые маркеры, так и репортерные гены можно фланкировать соответствующими регуляторными последовательностями, чтобы сделать возможной экспрессию в клетках-хозяевах. Например, вектор может содержать терминаторы транскрипции и трансляции, инициирующие последовательности и промоторы, пригодные для регуляции экспрессии последовательностей нуклеиновых кислот.
[331] В некоторых вариантах осуществления вектор (например, вирусный вектор) содержит любую из нуклеиновых кислот, кодирующих описанные здесь иммуноцитокины. Нуклеиновую кислоту можно клонировать в вектор с использованием любых известных в данной области методов молекулярного клонирования, включая, например, использование сайтов рестрикционных эндонуклеаз и одного или нескольких селектируемых маркеров. В некоторых вариантах осуществления нуклеиновая кислота функционально связана с промотором. Были исследованы различные промоторы для экспрессии генов в клетках млекопитающих, и в настоящем изобретении можно использовать любой из промоторов, известных в данной области. Промоторы можно приблизительно классифицировать как конститутивные промоторы или регулируемые промоторы, такие как индуцибельные промоторы.
[332] В некоторых вариантах осуществления нуклеиновая кислота, кодирующая иммуноцитокины, описанные в данном документе, функционально связана с конститутивным промотором. Конститутивные промоторы позволяют конститутивно экспрессировать гетерологичные гены (также называемые трансгенами) в клетках-хозяевах. Типичные промоторы, рассматриваемые в данном документе, включают, но не ограничиваются ими, немедленно-ранний промотор цитомегаловируса (CMV), человеческий фактор элонгации-1альфа (hEF1α), промотор убиквитина С (UbiC), промотор фосфоглицерокиназы (PGK), ранний промотор обезьяньего вируса 40 (SV40), куриный β-актиновый промотор в сочетании с ранним энхансером CMV (CAGG), вирус саркомы Рауса (RSV), промотор энхансера полиомы/тимидинкиназы простого герпеса (MC1), промотор бета-актина (β-ACT), промотор «энхансер вируса миелопролиферативной саркомы с удаленной областью отрицательного контроля и замещенным сайтом связывания праймера d1587rev (MND)». Огромное число исследований посвящено сравнению эффективности таких конститутивных промоторов в управлении экспрессией трансгена. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая иммуноцитокины, описанные в данном документе, функционально связана с промотором CMV.
[333] В некоторых вариантах осуществления нуклеиновая кислота, кодирующая иммуноцитокины, описанные в данном документе, функционально связана с индуцибельным промотором. Индуцибельные промоторы относятся к категории регулируемых промоторов. Индуцибельный промотор может быть индуцирован одним или несколькими условиями, такими как физическое состояние, микроокружение клеток-хозяев или физиологическое состояние клеток-хозяев, индуктором (т.е., индуцирующим агентом) или их комбинацией. В некоторых вариантах осуществления индуцирующее условие не индуцирует экспрессию эндогенных генов в клетке-хозяине. В некоторых вариантах осуществления индуцирующие условия выбирают из группы, состоящей из индуктора, облучения (например, ионизирующего излучения, света), температуры (например, тепла), окислительно-восстановительных условий и активированного состояния клетки-хозяина. В некоторых вариантах осуществления индуцибельный промотор может представлять собой промотор NFAT, промотор TETON® или промотор NFκB. В некоторых вариантах осуществления индуцибельный промотор представляет собой tet-индуцибельный промотор.
[334] В некоторых вариантах осуществления вектор содержит более одной нуклеиновой кислоты, кодирующей иммуноцитокины, описанные в данном документе, например, разные полипептиды иммуноцитокина. В некоторых вариантах осуществления каждый вектор содержит 2 нуклеиновые кислоты, кодирующие 2 полипептида иммуноцитокинов, описанных в данном документе.
[335] В некоторых вариантах осуществления две или более нуклеиновые кислоты, кодирующие описанные здесь иммуноцитокины, функционально регулируются одним и тем же промотором в векторе. В некоторых вариантах осуществления две или более нуклеиновые кислоты связаны последовательно через связывающую последовательность (например, IRES) или последовательность нуклеиновой кислоты, кодирующую саморасщепляющийся пептид 2А, такой как P2A, T2A, E2A, F2A, BmCPV 2A, BmIFV. 2А. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая два или более полипептида иммуноцитокинов, содержит связывающую(ие) последовательность(и) (например, IRES) или последовательность(и) нуклеиновой кислоты, кодирующую(ие) саморасщепляющийся(е) пептид(ы) 2А (такой как Р2А, Т2А, Е2А , F2A, BmCPV 2A, BmIFV 2A) между последовательностями, кодирующими полипептид. В некоторых вариантах осуществления две или более нуклеиновые кислоты, кодирующие описанные здесь иммуноцитокины, функционально регулируются отдельными промоторами в векторе. В некоторых вариантах осуществления с каждой нуклеиновой кислотой функционально связаны разные промоторы. В некоторых вариантах осуществления с каждой нуклеиновой кислотой функционально связаны одинаковые промоторы. В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, кодируется двумя или более векторами, например, каждый вектор кодирует одну тяжелую цепь (или один полипептид, содержащий VH и цитокиновый фрагмент) и одну парную легкую цепь, или каждый вектор кодирует один полипептид иммуноцитокина.
IV. Способы получения
[336] Также предложены способы получения иммуноцитокинов, описанных в данном документе (например, иммуноцитокин IL-2/антитело к HER2, иммуноцитокин IL-2/антитело к CD3, иммуноцитокин IL-2/антитело к PD-1, иммуноцитокин IL-2/антитело к CD4, иммуноцитокин IL-2/антитело к CD8, иммуноцитокин IL-2/антитело к CTLA-4, иммуноцитокин IL-2/антитело к PD-L1, иммуноцитокин IL-2/антитело к CD25, иммуноцитокин IL-2/PD-L2-Fc, иммуноцитокин IL-12/антитело к HER2, иммуноцитокин IL-12/антитело к CD3, иммуноцитокин IL-12/антитело к PD-1, иммуноцитокин IL-12/антитело к CD4, иммуноцитокин IL-12/антитело к CD8, иммуноцитокин IL-12/антитело к CTLA-4, иммуноцитокин IL-12/антитело к PD-L1, иммуноцитокин IL-12/антитело к CD25, иммуноцитокин IL-12/PD-L2-Fc, иммуноцитокин IL-23/антитело к HER2, иммуноцитокин IL-23/антитело к CD3, иммуноцитокин IL-23/антитело к PD-1, иммуноцитокин IL-23/антитело к CD4, иммуноцитокин IL-23/антитело к CD8, иммуноцитокин IL-23/антитело к CTLA-4, иммуноцитокин IL-23/антитело к PD-L1, иммуноцитокин IL-23/антитело к CD25, иммуноцитокин IL-23/PD-L2-Fc, иммуноцитокин IL-10/антитело к HER2, иммуноцитокин IL-10/антитело к CD3, иммуноцитокин IL-10/антитело к PD-1, иммуноцитокин Il-10/антитело к CD4, иммуноцитокин IL-10/антитело к CD8, иммуноцитокин IL-10/антитело к CTLA-4, иммуноцитокин IL-10/антитело к PD-L1, иммуноцитокин IL-10/антитело к CD25, иммуноцитокин IL-10/PD-L2-Fc, иммуноцитокин IFN-γ/антитело к HER2, иммуноцитокин IFN-γ/антитело к CD3, иммуноцитокин IFN-γ/антитело к PD-1, иммуноцитокин IFN-γ/антитело к CD4, иммуноцитокин IFN-γ/антитело к CD8, иммуноцитокин IFN-γ/антитело к CTLA-4, иммуноцитокин IFN-γ/антитело к PD-L1, иммуноцитокин IFN-γ/антитело к CD25, иммуноцитокин IFN-γ/PD-L2-Fc, иммуноцитокин IFN-α/антитело к HER2, иммуноцитокин IFN-α/антитело к CD3, иммуноцитокин IFN-α/антитело к PD-1, иммуноцитокин IFN-α/антитело к CD4, иммуноцитокин IFN-α/антитело к CD8, иммуноцитокин IFN-α/антитело к CTLA- 4, иммуноцитокин IFN-α/антитело к PD-L1, иммуноцитокин IFN-α/антитело к CD25 или иммуноцитокин IFN-α/PD-L2-Fc). Таким образом, в некоторых вариантах осуществления предложен способ получения иммуноцитокина, включающий: (a) культивирование клетки-хозяина (например, клетки CHO, клетки HEK 293, клетки Hela или клетки COS), содержащей любую из нуклеиновых кислот или векторов, кодирующих иммуноцитокины, описанные в данном документе, в условиях, эффективных для экспрессии кодируемого иммуноцитокина; и (b) получение экспрессированного иммуноцитокина из указанной клетки-хозяина. В некоторых вариантах осуществления способ на стадии (а) дополнительно включает получение клетки-хозяина, содержащей нуклеиновую кислоту или вектор, кодирующий иммуноцитокин, описанный в данном документе. Иммуноцитокин, описанный в данном документе, может быть получен с использованием любых способов, известных в данной области, или как описано в данном документе. Также см. иллюстративные способы в Примерах 1, 4, 5, 7, 9, 10 и 12. В некоторых вариантах осуществления экспрессия иммуноцитокинов происходит в эукариотических клетках, таких как клетки млекопитающих. В некоторых вариантах осуществления экспрессия иммуноцитокинов происходит в прокариотических клетках.
1. Рекомбинантное продуцирование в прокариотических клетках
а) Конструирование вектора
[337] Последовательности полинуклеиновых кислот, кодирующие иммуноцитокины настоящего изобретения, можно получать с использованием стандартных рекомбинантных методик. Требуемые последовательности полинуклеиновых кислот можно выделять и секвенировать из клеток, продуцирующих антитела или иммуноцитокины, таких как гибридомные клетки. Альтернативно, полинуклеотиды можно синтезировать, используя синтезатор нуклеотидов или методы ПЦР. После их получения последовательности, кодирующие полипептиды, встраивают в рекомбинантный вектор, способный к репликации и экспрессии гетерологичных полинуклеотидов в прокариотических хозяевах. Для целей настоящего изобретения можно использовать многие доступные и известные в данной области векторы. Выбор подходящего вектора будет зависеть главным образом от размера нуклеиновых кислот, которые необходимо вставить в вектор, и от конкретной клетки-хозяина, которую нужно трансформировать вектором. Каждый вектор содержит различные компоненты в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида или обеих функций) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно включают, но не ограничиваются ими: точку начала репликации, маркерный ген селекции, промотор, сайт связывания рибосомы (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
[338] Обычно в связи с этими хозяевами используют плазмидные векторы, содержащие репликон и контрольные последовательности, полученные от видов, совместимых с клеткой-хозяином. Вектор обычно несет сайт репликации, а также маркирующие последовательности, которые способны обеспечить фенотипическую селекцию в трансформированных клетках. Например, E. coli обычно трансформируют с использованием pBR322 - плазмиды, полученной из видов E. coli. pBR322 содержит гены, кодирующие устойчивость к ампициллину (Amp) и тетрациклину (Tet), и, таким образом, предоставляет простые средства для идентификации трансформированных клеток. pBR322, его производные или другие микробные плазмиды или бактериофаги могут также содержать или их можно модифицировать так, чтобы оин содержали промоторы, которые могут утилизироваться микробным организмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны в Carter. и др., патент США. № 5648237.
[339] Кроме того, фаговые векторы, содержащие репликон и контрольные последовательности, совместимые с микроорганизмом-хозяином, можно использовать в качестве трансформирующих векторов для этих хозяев. Например, бактериофаг, такой как GEM™-11, можно использовать для создания рекомбинантного вектора, который применим для трансформации восприимчивых клеток-хозяев, таких как E. coli LE392.
[340] Вектор экспрессии настоящего изобретения может содержать две или более пар промотор-цистрон, кодирующих каждый из полипептидных компонентов. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5') к цистрону, который изменяет ее экспрессию. Прокариотические промоторы обычно делятся на два класса: индуцибельные и конститутивные. Индуцибельный промотор - это промотор, который инициирует повышенные уровни транскрипции цистрона под его контролем в ответ на изменения в условиях культивирования, например, на присутствие или отсутствие питательных веществ или изменение температуры.
[341] Хорошо известно большое количество промоторов, распознаваемых различными потенциальными клетками-хозяевами. Выбранный промотор можно функционально связать с ДНК цистрона, кодирующей полипептид, удаляя промотор из исходной ДНК путем расщепления рестрикционными ферментами и встраивая выделенную последовательность промотора в вектор согласно настоящему изобретению. Для прямой амплификации и/или экспрессии генов-мишеней можно использовать как нативную промоторную последовательность, так и многие гетерологичные промоторы. В некоторых вариантах осуществления используются гетерологичные промоторы, поскольку они обычно обеспечивают более высокую транскрипцию и более высокие выходы экспрессированного гена-мишени по сравнению с промотором нативного полипептида-мишени.
[342] Промоторы, подходящие для использования в прокариотических хозяевах, включают промотор PhoA, промоторные системы β-галактамазы и лактозы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако также подходят и другие промоторы, функционирующие в бактериях (например, другие известные бактериальные или фаговые промоторы). Последовательности их нуклеиновых кислот опубликованы, что позволяет квалифицированному специалисту оперативно связывать их с цистронами, кодирующими целевые легкие и тяжелые цепи (Siebenlist и др. (1980) Cell 20: 269) с использованием линкеров или адаптеров для обеспечения любых необходимых сайтов рестрикции.
[343] В некоторых вариантах осуществления каждый цистрон в рекомбинантном векторе содержит компонент сигнальной последовательности секреции, который направляет перемещение экспрессируемых полипептидов через мембрану. Как правило, сигнальная последовательность может быть компонентом вектора или частью ДНК полипептида-мишени, встроенной в вектор. Сигнальная последовательность, выбранная для целей настоящего изобретения, должна распознаваться и перерабатываться (т.е. расщепляться сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не перерабатывают сигнальные последовательности, нативные для гетерологичных полипептидов, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из щелочной фосфатазы, пенициллиназы, Ipp или теплоустойчивых лидеров энтеротоксина II (STII), LamB, PhoE, PelB, OmpA и MBP. В некоторых вариантах осуществления настоящего изобретения сигнальные последовательности, используемые в обоих цистронах системы экспрессии, представляют собой сигнальные последовательности STII или их варианты.
[344] В некоторых вариантах осуществления продуцирование иммуноцитокина настоящго изобретения может происходить в цитоплазме клетки-хозяина и, следовательно, не требует присутствия сигнальных последовательностей секреции в каждом цистроне. В некоторых вариантах осуществления полипептидные компоненты экспрессируются, укладываются и собираются, образуя иммуноцитокин (или часть иммуноцитокина) в цитоплазме. Некоторые штаммы-хозяева (например, в штаммах E. coli trxB-) имеют условия цитоплазмы, благоприятные для образования дисульфидных связей, тем самым обеспечивая правильную укладку и сборку субъединиц экспрессированного белка. См. Proba и Pluckthun, Gene, 159:203 (1995).
[345] Настоящее изобретение предлагает экспрессионную систему, в которой можно изменять количественное соотношение экспрессируемых полипептидных компонентов, чтобы максимизировать выход секретируемых и надлежащим образом собранных иммуноцитокинов настоящего изобретения. Такая модуляция достижима, по крайней мере частично, путем одновременного изменения силы трансляции полипептидных компонентов. Один из методов изменения силы трансляции раскрыт у Simmons и др., патент США. № 5840523. В этом методе используются варианты участка инициации трансляции (TIR) внутри цистрона. Для данного TIR можно создать серию вариантов последовательностей аминокислот или нуклеиновых кислот с диапазоном сил трансляции, тем самым обеспечивая удобные средства для корректировки этого фактора до желаемого уровня экспрессии конкретной цепи. Варианты TIR можно получать с помощью обычных методов мутагенеза, которые приводят к изменениям кодонов, которые могут изменить аминокислотную последовательность, хотя предпочтительны молчащие изменения в последовательности нуклеиновой кислоты. Изменения в TIR могут включать, например, изменения количества или интервалов между последовательностями Шайна-Дальгарно, наряду с изменениями в сигнальной последовательности. Одним из методов создания мутантных сигнальных последовательностей является создание «банка кодонов» в начале кодирующей последовательности, который не изменяет аминокислотную последовательность сигнальной последовательности (т.е.эти изменения являются молчащими). Этого можно добиться, изменив положение третьего нуклеотида каждого кодона; кроме того, некоторые аминокислоты, такие как лейцин, серин и аргинин, имеют несколько первых и вторых позиций, что может усложнить создание банка. Этот метод мутагенеза подробно описан у Yansura и др. (1992) METHODS: A Companion to Methods in Enzymol. 4:151-158.
[346] Предпочтительно, создают набор векторов с диапазоном интенсивностей TIR для каждого цистрона в них. Этот ограниченный набор позволяет сравнивать уровни экспрессии каждой цепи, а также выход желаемых белковых продуктов при различных комбинациях силы TIR. Силу TIR можно определить путем количественного определения уровня экспрессии репортерного гена, как подробно описано у Simmons и др. Пат. США. № 5840523. На основании сравнения силы трансляции выбирают требуемые отдельные TIR, чтобы объединить их в конструкциях вектора экспрессии настоящего изобретения.
b) Прокариотические клетки-хозяева
[347] Прокариотические клетки-хозяева, подходящие для экспрессии иммуноцитокинов настоящего изобретения, включают архебактерии и эубактерии, такие как грамотрицательные или грамположительные организмы. Примеры полезных бактерий включают Escherichia (например, E. coli), Bacilli (например, B. subtilis), энтеробактерии, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescens, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Рaracoccus. В некоторых вариантах осуществления используют грамотрицательные клетки. В некоторых вариантах осуществления E. coli клетки используют в качестве хозяев согласно данному изобретению. Примеры E. coli штаммы включают штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, округ Колумбия: American Society For Microbiology, 1987), стр. 1190-1219; ATCC Deposit 27325) и их производные, включая штамм 33D3, имеющий генотип W3110 AFhuA (AtonA) ptr3 lac Iq lacL8 AompT A(nmpc-FepE) degP41 kanр (патент США. № 5639635). Также подходят и другие штаммы и их производные, такие как E. coli 294 (ATCC 31,446), E. coli B, E. coli 1776 (ATCC 31,537) и E. coli RV308 (ATCC 31,608). Эти примеры являются иллюстративными, а не ограничивающими. Способы конструирования производных любой из вышеупомянутых бактерий с определенным генотипом известны в данной области и описаны, например, у Bass и др., Proteins, 8:309-314 (1990). Как правило, необходимо выбрать подходящие бактерии с учетом воспроизводимости репликона в клетках бактерии. Например, виды E. coli, Serratia или Salmonella подходят для использования в качестве хозяина, если в качестве источника репликона используют такие хорошо известные плазмиды, как pBR322, pBR325, pACYC177 или pKN410.
[348] Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, а в клеточную культуру желательно включать дополнительные ингибиторы протеазы.
с) Продуцирование белка
[349] Клетки-хозяева трансформируют описанными выше векторами экспрессии и культивируют в обычных питательных средах, модифицированных соответствующим образом, чтобы индуцировать промоторы, отбирать трансформанты или амплифицировать гены, кодирующие требуемые последовательности. Трансформация означает введение ДНК в прокариотического хозяина таким образом, чтобы ДНК реплицировалась либо как внехромосомный элемент, либо как хромосомный интегрант. В зависимости от используемой клетки-хозяина трансформацию проводят с использованием стандартных методик, подходящих для таких клеток. Обработку кальцием с использованием хлорида кальция обычно используют в случае бактериальных клеток, у которых клеточная стенка представляет собой существенный барьер. В другом методе трансформации используется полиэтиленгликоль/ДМСО. Еще одной используемой методикой является электропорация.
[350] Клетки-хозяева трансформируют описанными выше векторами экспрессии и культивируют в обычных питательных средах, модифицированных соответствующим образом, чтобы индуцировать промоторы, отбирать трансформанты или амплифицировать гены, кодирующие требуемые последовательности. Трансформация означает введение ДНК в прокариотического хозяина таким образом, чтобы ДНК реплицировалась либо как внехромосомный элемент, либо как хромосомный интегрант. В зависимости от используемой клетки-хозяина трансформацию проводят с использованием стандартных методик, подходящих для таких клеток. Обработку кальцием с использованием хлорида кальция обычно используют в случае бактериальных клеток, у которых клеточная стенка представляет собой существенный барьер. В другом методе трансформации используется полиэтиленгликоль/ДМСО. Еще одной используемой методикой является электропорация.
[351] Прокариотические клетки, используемые для получения иммуноцитокинов настоящего изобретения, выращивают в среде, известной в данной области и подходящей для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают среду Лурия (LB) с добавкой необходимых питательных веществ. В некоторых вариантах осуществления среда также содержит селективный реагент, выбранный на основе конструкции экспрессионного вектора, чтобы избирательно стимулировать рост прокариотических клеток, содержащих вектор экспрессии. Например, ампициллин добавляют в среду для роста клеток, экспрессирующих ген устойчивости к ампициллину.
[352] Можно также вводить в соответствующих концентрациях любые необходимые добавки помимо источников углерода, азота и неорганических фосфатов, отдельно или в смеси с другой добавкой или средой, такой как комплексный источник азота. Культуральная среда необязательно может содержать один или несколько восстанавливающих реагентов, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритрита и дитиотреитола. Прокариотические клетки-хозяева культивируют при подходящих температурах. Для роста E. coli, например, предпочтительная температура находится в пределах от примерно 20°С до примерно 39°С, более предпочтительно - от примерно 25°С до примерно 37°С, еще более предпочтительно - примерно 30°С. рН среды может быть любым в пределах от примерно 5 до примерно 9, обычно это зависит от организма-хозяина. Для E. coli рН предпочтительно составляет от примерно 6,8 до примерно 7,4 и более предпочтительно - примерно 7,0.
[353] Если в векторе экспрессии настоящего изобретения используется индуцируемый промотор, то экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном аспекте настоящей заявки для контроля транскрипции полипептидов используют промоторы PhoA. Соответственно, трансформированные клетки-хозяева для целей индукции культивируют в фосфатно-лимитирующей среде. Предпочтительно фосфат-лимитирующая среда представляет собой среду C.R.A.P. (см., например, Simmons и др., J. Immunol. Methods (2002), 263:133-147). Можно использовать множество других индукторов в соответствии с используемой векторной конструкцией, как известно в данной области.
[354] Экспрессированные иммуноцитокины настоящего изобретения секретируются в периплазму клеток-хозяев и извлекаются из нее. Восстановление белка обычно включает разрушение микроорганизма, как правило, такими средствами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток клеточный детрит или целые клетки можно удалить центрифугированием или фильтрованием. Белки можно дополнительно очищать, например, с помощью хроматографии на аффинной смоле. Альтернативно, белки можно переносить в культуральную среду и выделять из нее. Клетки можно удалять из культуры, а надосадочную жидкость культуры отфильтровывать и концентрировать для дальнейшей очистки полученных белков. Экспрессированные полипептиды можно дополнительно выделять и идентифицировать, используя общеизвестные методы, такие как электрофорез в полиакриламидном геле (PAGE) и вестерн-блоттинг.
[355] В качестве альтернативы производство белка в больших количествах осуществляют, используя процесс ферментации. Для производства рекомбинантных белков применяют различные крупномасштабные процессы периодической ферментации с подпиткой. Объем крупномасштабной ферментации составляет не менее 1000 литров, предпочтительно - от 1000 до 100000 литров. В этих биореакторах используют лопастные мешалки для более равномерного распределения кислорода и питательных веществ, особенно глюкозы (предпочтительного источника углерода/энергии). Ферментация в малых масштабах обычно относится к ферментации в биореакторе, полезный объем которого составляет не более примерно 100 литров и может варьироваться от примерно 1 литра до примерно 100 литров.
[356] Во время процесса ферментации индукция экспрессии белка обычно инициируется после того, как клетки выращены в подходящих условиях до желаемой плотности, например, до OD550 примерно 180-220, на этой стадии клетки находятся в ранней стационарной фазе. В зависимости от используемой векторной конструкцией можно использовать различные индукторы, известные в данной области и описанные выше. Клетки можно выращивать в течение более коротких периодов до индукции. Клетки обычно индуцируют в течение примерно 12-50 часов, хотя можно использовать более продолжительный или менее продолжительный период индукции.
[357] Чтобы улучшить выход продуцирования и качество иммуноцитокинов настоящего изобретения, можно изменить различные условия ферментации. Например, для улучшения правильной сборки и укладки секретируемых полипептидов можно использовать дополнительные векторы, сверхэкспрессирующие белки-шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD или DsbG) или FkpA (пептидилпролил-цис, транс-изомераза с шаперонной активностью), можно использовать для совместной трансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают правильную укладку и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen и др. (1999) J Bio Chem 274:19601-19605; Georgiou и др., пат. США № 6,083,715; Georgiou и др., пат. США № 6,027,888; Bothmann и Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm и Pluckthun (2000) J. Biol. Chem. 275:17106-17113; Arie и др. (2001) Mol. Microbiol. 39:199-210.
[358] Чтобы свести к минимуму протеолиз экспрессированных гетерологичных белков (особенно тех, которые протеолитически чувствительны), для настоящего изобретения можно использовать определенные штаммы-хозяева, дефицитные в отношении протеолитических ферментов. Например, штаммы клеток-хозяев можно модифицировать для осуществления генетической мутации (мутаций) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторый штаммы E. coli с дефицитом протеазы доступны и описаны, например, в Joly и др. (1998), см. выше; Georgiou и др., патент США № 5264365; Georgiou и др., патент США № 5508192; Hara и др., Microbial Drug Resistance, 2:63-72 (1996).
[359] Штаммы E. coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, можно использовать в качестве клеток-хозяев в системе экспрессии, кодирующей иммуноцитокины настоящего изобретения.
d) Очистка белков
[360] Иммуноцитокины, полученные согласно данному документе, дополнительно очищают для получения практически гомогенных препаратов для дальнейших анализов и применения. Можно использовать стандартные методы очистки белка, известные в данной области. Следующие процедуры являются примерами подходящих процедур очистки: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на силикагеле или на катионообменной смоле, такой как DEAE, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация с использованием, например, Sephadex G-75.
[361] В некоторых вариантах осуществления белок А, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки иммуноцитокинов, содержащих Fc-участок настоящего изобретения. Белок А представляет собой поверхностный белок с молекулярной массой 42 кДа из Staphylococcus aureus, который связывается с высоким сродством с конструкциями, содержащими Fc, например, составными белками антигенсвязывающий фрагмент-шарнир-Fc, антителами или иммуноцитокинами, описанными в данном документе. Lindmark и др. (1983) J. Immunol. Meth. 62:1-13. Твердая фаза, на которой иммобилизован белок А, предпочтительно представляет собой колонку, содержащую поверхность из стекла или кремнезема, более предпочтительно - стеклянную колонку с контролируемым размером пор или колонку с кремниевой кислотой. В некоторых случаях колонку покрывают реагентом, например глицерином, чтобы предотвратить неспецифичное прилипание загрязняющих веществ. Затем твердую фазу промывают для удаления загрязняющих веществ, неспецифично связанных с твердой фазой. Наконец, представляющие интерес иммуноцитокины выделяют из твердой фазы путем элюирования.
2. Рекомбинантное продуцирование в эукариотических клетках
[362] Для эукариотической экспрессии компоненты вектора обычно включают, но не ограничиваются ими, одну или несколько из следующего: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов и энхансерный элемент, промотор и последовательность терминации транскрипции.
а) Компонент сигнальной последовательности
[363] Вектор для применения в эукариотическом хозяине может также содержать вставку, кодирующую сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность должна распознаваться и перерабатываться (т.е. расщепляться сигнальной пептидазой) клеткой-хозяином. При экспрессии в клетках млекопитающих можно применять сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, сигнальную последовательность gD простого герпеса. ДНК для такого участка-предшественника соединяют в рамке считывания с ДНК, кодирующей иммуноцитокины настоящего изобретения.
b) Начало репликации
[364] Как правило, для векторов экспрессии млекопитающих компонент начала репликации не требуется (обычно можно использовать источник SV40 только потому, что он содержит ранний промотор).
c) Компонент селективного гена
[365] Векторы экспрессии и клонирования могут содержать селективный ген, также называемый селектируемым маркером. Типичные селективные гены кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину, (b) восполняют дефицит ауксотрофов или (c) обеспечивают критически важные питательные вещества, недоступные из сложных сред, например, ген, кодирующий D-аланинрацемазу в Bacilli.
[366] В одном примере в схеме отбора используют лекарственное средство, останавливающее рост клетки-хозяина. Те клетки, которые успешно трансформировались гетерологичным геном, продуцируют белок, придающий лекарственную устойчивость, и, таким образом, выживают в условиях отбора. Примерами такой доминантного отбора являются лекарственные средства неомицин, микофеноловая кислота и гигромицин.
[367] Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются те, которые позволяют идентифицировать клетки, способные поглощать нуклеиновую кислоту, кодирующую иммуноцитокины настоящего изобретения, такие как DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозиндезаминаза, орнитиндекарбоксилаза и др.
[368] Например, клетки, трансформированные геном селекции DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является клеточная линия яичника китайского хомячка (CHO), дефицитная по активности DHFR, например, ATCC CRL-9096).
[369] Альтернативно, клетки-хозяева (особенно хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими полипептид, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащей реагент для отбора селектируемого маркера, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. пат. США. № 4965199.
d) Промоторный компонент
[370] Векторы экспрессии и клонирования обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей требуемые полипептидные последовательности. Практически все эукариотические гены имеют обогащенную АТ область, расположенную примерно на 25-30 нуклеотидов выше от сайта, где инициируется транскрипция. Другая последовательность, обнаруженная на 70-80 оснований выше начала транскрипции многих генов, представляет собой область CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства эукариот находится последовательность ААТААА, которая может быть сигналом для добавления поли-А-хвоста к 3'-концу кодирующей последовательности. Все эти последовательности можно вставлять в эукариотические векторы экспрессии. См. также подраздел «Промоутеры» в разделе «III. Векторы, кодирующие иммуноцитокины», выше.
[371] Транскрипция полипептидов из векторов в клетках-хозяевах млекопитающих контролируют, например, с помощью промоторов, полученных из геномов вирусов, таких как вирус полиомы, вирус куриной оспы, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита В и, наиболее предпочтительно, обезьяний вирус 40 (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, из промоторов ответа на тепловой шок при условии, что такие промоторы совместимы с системами клеток-хозяев.
[372] Ранние и поздние промоторы вируса SV40 удобно получать в виде рестрикционного фрагмента SV40, который также содержит точку начала репликации вируса SV40. Непосредственно ранний промотор цитомегаловируса человека удобно получать в виде рестрикционного фрагмента HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота в качестве вектора раскрыта в патенте США № 4419446. Модифицирование этой системы описано в патенте США № 4601978. См. также Reyes и др., Nature 297:598-601 (1982) об экспрессии кДНК человеческого интерферона в клетках мыши под контролем промотора тимидинкиназы вируса простого герпеса. Альтернативно, в качестве промотора можно использовать длинный терминальный повтор вируса саркомы Рауса.
e) Компонент элемента энхансера
[373] Транскрипцию ДНК, кодирующей иммуноцитокины настоящего изобретения, высшими эукариотами часто усиливают путем вставки в вектор энхансерной последовательности. В настоящее время известны многие энхансерные последовательности из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Однако обычно используют энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на участке позднего начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомы на участке позднего начала репликации и энхансеры аденовируса. См. также Yaniv, Nature 297:17-18 (1982) об элементах энхансеров для активации эукариотических промоторов. Энхансер можно сплайсировать в вектор в положении 5' или 3' по отношению к последовательности, кодирующей полипептид, но предпочтительно расположен в положении 5' по отношению к промотору.
F) Компонент терминации транскрипции
[374] Векторы экспрессии, используемые в эукариотических клетках-хозяевах (из дрожжей, грибов, насекомых, растений, животных, человека или ядросодержащих клеток других многоклеточных организмов), также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей полипептид. Одним из полезных компонентов терминации транскрипции является область полиаденилирования бычьего гормона роста. См. WO 94/11026 и раскрытый в ней вектор экспрессии.
g) Отбор и трансформация клеток-хозяев
[375] Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах, описанных в данном документе, включают клетки высших эукариот, описанные в данном документе, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (тканевой культуре) стало рутинной процедурой. Примерами пригодных линий клеток-хозяев млекопитающих являются линия CV1 почки обезьяны, трансформированная с использованием SV40 (COS-7, ATCC CRL 1651); линия эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham и др., J. Gen Virol. 36:59 (1977)); клетки почек детенышей хомячков (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub и др., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени крысы линии BuFFalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочной железы мыши (MMT 060562, ATCC CCL51); клетки TR1 (Mather и др., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2).
[376] Клетки-хозяева трансформируют описанными выше векторами экспрессии или клонирования для продуцирования иммуноцитокинов и культивируют в обычных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желаемые последовательности.
h) Культивирование клеток-хозяев
[377] Клетки-хозяева, используемые для получения иммуноцитокинов настоящего изобретения, можно культивировать в различных средах. для культивирования клеток-хозяев подходят поступающие в продажу среды, такие как Ham's F10 (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMI-1640 (Sigma) и среда Игла, модифицированная по Дульбекко ((DMEM), Sigma). Кроме того, любая из сред, описанных в Ham и др., Meth. Enz. 58:44 (1979), Barnes и др., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195; или патенте США Re. 30985, можно использовать в качестве питательной среды для клеток-хозяев. Любую из этих сред при необходимости можно дополнять гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфата), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, конечная концентрация которых обычно находится в микромолярном диапазоне) и глюкозой или эквивалентными источниками энергии. Любые другие необходимые добавки также можно включать в соответствующих концентрациях, которые известны специалистам в данной области. Для культивирования применяют условия, такие как температура, рН и т.п., которые ранее использовались для клетки-хозяина, выбранной для экспрессии, и они очевидны для специалиста средней квалификации в данной области.
i) Очистка белка
[378] При использовании рекомбинантных методов иммуноцитокин может продуцироваться внутриклеточно, в периплазматическом пространстве или вырабатываться непосредственно в среду. Если иммуноцитокин продуцируется внутриклеточно, то в качестве первого шага частицы клеточного детрита - либо клеток-хозяев, либо лизированные фрагменты - удаляют, например, центрифугированием или ультрафильтрацией. Carter и др., Bio/Technology 10:163-167 (1992) описывают процедуру выделения антител, которые вырабатываются в периплазматическое пространство E. coli. Вкратце, клеточную пасту размораживают в присутствии ацетата натрия (рН 3,5), ЭДТА и фенилметилсульфонилфторида (ФМСФ) в течение примерно 30 минут. Клеточный детрит можно удалить центрифугированием. Если иммуноцитокин вырабатывается в среду, надосадочные жидкости из таких систем экспрессии обычно сначала концентрируют с использованием имеющегося в продаже фильтра для концентрирования белков, например, устройства для ультрафильтрации Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF, можно вводить на любой из вышеперечисленных стадий для ингибирования протеолиза, а антибиотики можно вносить для предотвращения роста посторонних примесей.
[379] Белковую композицию, полученную из клеток, можно очистить, используя, например, хроматографию на гидроксиапатите, гель-электрофорез, диализ и аффинную хроматографию, при этом аффинная хроматография является предпочтительной методикой очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в иммуноцитокине. Белок А можно использовать для очистки иммуноцитокинов, составных белков антигенсвязывающего фрагмента и Fc, или антител на основе иммуноглобулинов человека, содержащих 1, 2 или 4 тяжелых цепи (Lindmark и др., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов мышей и для человеческих изотипов γ3 (Guss и др., EMBO J. 5:15671575 (1986)). Матрица, к которой присоединен аффинный лиганд, чаще всего представляет собой агарозу, но можно использовать и другие доступные матрицы. Механически стабильные матрицы, такие как стекло с регулируемыми порами или поли(стирол-дивинил)бензол, обеспечивают более высокую скорость потока и более короткое время обработки, чем скорости, которые можно достичь при использовании агарозы. Если иммуноцитокин содержит CН3, то для очистки можно использовать смолу Bakerbond ABXTM (J.T. Baker, Phillipsburg, Нью-Джерси). Можно использовать другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на силикагеле, хроматография на гепарине SEPHAROSE™, хроматография на анионообменной или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждедние сульфатом аммония, в зависимости от иммуноцитокина, который необходимо восстановить.
[380] После любой предварительной(ых) стадии(й) очистки смесь, содержащая представляющий интерес иммуноцитокин и примеси, можно подвергать хроматографии с гидрофобным взаимодействием при низком рН с использованием элюирующего буфера при рН примерно 2,5-4,5, которую предпочтительно проводят при низких концентрациях соли (например, примерно от 0-0,25 М соли).
V. Фармацевтические составы
[381] Далее предложены фармацевтические составы, содержащие любые из иммуноцитокинов, описанных в данном документе (например, иммуноцитокин IL-2/антитело к HER2, иммуноцитокин IL-2/антитело к CD3, иммуноцитокин IL-2/антитело к PD-1, иммуноцитокин IL-2/антитело к CD4, иммуноцитокин IL-2/антитело к CD8, иммуноцитокин IL-2/антитело к CTLA-4, иммуноцитокин IL-2/антитело к PD-L1, иммуноцитокин IL-2/антитело к CD25, иммуноцитокин IL-2/PD-L2-Fc, иммуноцитокин IL-12/антитело к HER2, иммуноцитокин IL-12/антитело к CD3, иммуноцитокин IL-12/антитело к PD-1, иммуноцитокин IL-12/антитело к CD4, иммуноцитокин IL-12/антитело к CD8, иммуноцитокин IL-12/антитело к CTLA-4, иммуноцитокин IL-12/антитело к PD-L1, иммуноцитокин IL-12/антитело к CD25, иммуноцитокин IL-12/PD-L2-Fc, иммуноцитокин IL-23/антитело к HER2, иммуноцитокин IL-23/антитело к CD3, иммуноцитокин IL-23/антитело к PD-1, иммуноцитокин IL-23/антитело к CD4, иммуноцитокин IL-23/антитело к CD8, иммуноцитокин IL-23/антитело к CTLA-4, иммуноцитокин IL-23/антитело к PD-L1, иммуноцитокин IL-23/антитело к CD25, иммуноцитокин IL-23/PD-L2-Fc, иммуноцитокин IL-10/антитело к HER2, иммуноцитокин IL-10/антитело к CD3, иммуноцитокин IL-10/антитело к PD-1, иммуноцитокин Il-10/антитело к CD4, иммуноцитокин IL-10/антитело к CD8, иммуноцитокин IL-10/антитело к CTLA-4, иммуноцитокин IL-10/антитело к PD-L1, иммуноцитокин IL-10/антитело к CD25, иммуноцитокин IL-10/PD-L2-Fc, иммуноцитокин IFN-γ/антитело к HER2, иммуноцитокин IFN-γ/антитело к CD3, иммуноцитокин IFN-γ/антитело к PD-1, иммуноцитокин IFN-γ/антитело к CD4, иммуноцитокин IFN-γ/антитело к CD8, иммуноцитокин IFN-γ/антитело к CTLA-4, иммуноцитокин IFN-γ/антитело к PD-L1, иммуноцитокин IFN-γ/антитело к CD25, иммуноцитокин IFN-γ/PD-L2-Fc, иммуноцитокин IFN-α/антитело к HER2, иммуноцитокин IFN-α/антитело к CD3, иммуноцитокин IFN-α/антитело к PD-1, иммуноцитокин IFN-α/антитело к CD4, иммуноцитокин IFN-α/антитело к CD8, иммуноцитокин IFN-α/антитело к CTLA-4, иммуноцитокин IFN-α/антитело к PD-L1, иммуноцитокин IFN-α/антитело к CD25 или иммуноцитокин IFN-α/PD-L2-Fc) и, необязательно, фармацевтически пригодный носитель. Фармацевтические составы можно приготовить путем смешивания описанного здесь иммуноцитокина, имеющего желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Также предложены противораковые вакцины, содержащие любой из описанных здесь иммуноцитокинов, или их фармацевтические составы.
[382] Восстановленный препарат можно приготовить путем растворения описанного здесь лиофилизированного иммуноцитокина в разбавителе таким образом, чтобы белок был диспергирован в нем. Типичные фармацевтически приемлемые (безопасные и нетоксичные для введения человеку) разбавители, подходящие для использования в настоящем изобретении, включают, но не ограничиваются ими, стерильную воду, бактериостатическую воду для инъекций (BWFI), рН-буферный раствор (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы или водные растворы солей и/или буферы.
[383] В некоторых вариантах осуществления фармацевтический состав содержит гомогенную популяцию иммуноцитокинов, описанных в данном документе. Однородная популяция означает, что иммуноцитокины полностью идентичны друг другу, например, имеют одинаковую конфигурацию иммуноцитокина, одинаковый цитокиновый фрагмент, одни и те же антигенсвязывающие фрагменты (например, лиганд, рецептор, VHH, scFv или Fab), один и тот же линкер, если таковой имеется, один и тот же шарнирный участок и один и тот же Fc-домен. В некоторых вариантах осуществления не менее примерно 70 % (например, не менее примерно 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) иммуноцитокинов в фармацевтическом составе являются однородными.
[384] Предпочтительный фармацевтический состав должен быть стабильным, при этом иммуноцитокин в нем практически полностью сохраняет свою физическую и химическую стабильность и целостность при хранении. В данной области техники доступны различные аналитические методики для измерения стабильности белка, и они рассмотрены в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, Нью-Йорк, Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерить при выбранной температуре в течение выбранного периода времени. Для ускоренного испытания препарат можно хранить при 40°С от 2 недель до 1 месяца, после чего измерять стабильность за этот период. Если препарат будет храниться при температуре 2-8°С, обычно состав должен быть стабилен при 30°С или 40°С в течение по крайней мере 1 месяца и/или стабилен при 2-8°С в течение по крайней мере 2 лет. Если препарат будет храниться при 30°С, обычно состав должен быть стабилен в течение по крайней мере 2 лет при 30°С и/или стабилен при 40°С в течение по крайней мере 6 месяцев. Например, в качестве индикатора стабильности белка при хранении можно использовать степень агрегации. В некоторых вариантах осуществления стабильный препарат иммуноцитокинов, описанный в данном документе, может содержать менее примерно 10% (предпочтительно менее примерно 5%) иммуноцитокинов, присутствующих в препарате в виде агрегата.
[385] Приемлемые носители, вспомогательные вещества или стабилизаторы нетоксичны для реципиентов в используемых дозировках и концентрациях и включают буферы, антиоксиданты, включая аскорбиновую кислоту, метионин, витамин Е, метабисульфит натрия; консерванты, изотонические вещества (например, хлорид натрия), стабилизаторы, комплексы металлов (например, Zn-белковые комплексы); хелатирующие агенты, такие как ЭДТА и/или неионогенные поверхностно-активные вещества.
[386] Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и содержащие другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония, хлорид бензетония, фенол, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол и м-крезол); низкомолекулярный (менее примерно 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; металлокомплексы (например, Zn-белковые комплексы); и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (PEG) и PLURONICS™ или полиэтиленгликоль (PEG).
[387] Буферы используются для регулирования рН в диапазоне, оптимизирующем терапевтическую эффективность, особенно если стабильность зависит от рН. Буферы предпочтительно присутствуют в концентрациях от примерно 50 мМ до примерно 250 мМ. Подходящие буферные средства для использования в настоящем изобретении включают как органические, так и неорганические кислоты и их соли. Например, цитрат, фосфат, сукцинат, тартрат, фумарат, глюконат, оксалат, лактат, ацетат. Кроме того, буферы могут содержать соли гистидина и триметиламина, такие как Tris.
[388] Консерванты добавляются для замедления роста микробов и обычно присутствуют в пределах от 0,2% до 1,0% (масса/объем). Добавление консерванта может, например, облегчить получение многоразового (многодозового) препарата. Подходящие консерванты для использования в настоящем изобретении включают хлорид октадецилдиметилбензиламмония; хлорид гексаметония; галогениды бензалкония (например, хлорид, бромид, йодид), бензетония хлорид; тимеросал, фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол, 3-пентанол и м-крезол.
[389] Средства, повышающие тоничность, иногда называемые «стабилизаторами», присутствуют для регулирования или поддержания тонуса жидкости в составе. При использовании с большими заряженными биомолекулами, такими как белки и антитела, их часто называют «стабилизаторами», поскольку они могут взаимодействовать с заряженными группами боковых цепей аминокислот, тем самым уменьшая возможность меж- и внутримолекулярных взаимодействий. Средства, повышающие тоничность, могут присутствовать в любом количестве от 0,1% до 25% по массе, предпочтительно от 1% до 5%, от содержания других ингредиентов. Предпочтительные средства, повышающие тоничность, включают многоатомные сахароспирты, предпочтительно трехатомные или более высокие сахароспирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
[390] Дополнительные вспомогательные вещества включают средства, которые могут выполнять одну или несколько из следующих функций: (1) наполнители, (2) усилители растворимости, (3) стабилизаторы и (4) и средства, предотвращающие денатурацию или прилипание к стенке контейнера. Такие вспомогательные вещества включают: многоатомные сахарные спирты (перечислены выше); аминокислоты, такие как аланин, глицин, глутамин, аспарагин, гистидин, аргинин, лизин, орнитин, лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или сахарные спирты, такие как сахароза, лактоза, лактит, трегалоза, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миониситоза, миоинизитол, галактоза, галактит, глицерин, циклиты (например, инозитол), полиэтиленгликоль; серосодержащие восстановители, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или другие иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды (например, ксилоза, манноза, фруктоза, глюкоза; дисахариды (например, лактоза, мальтоза, сахароза); трисахариды, такие как раффиноза; и полисахариды, такие как декстрин или декстран.
[391] Неионогенные поверхностно-активные вещества или детергенты (также известные как «смачивающие вещества») присутствуют, чтобы способствовать солюбилизации иммуноцитокинов, а также предотвратить агрегацию иммуноцитокинов, вызываемую перемешиванием, что также позволяет препарату подвергаться поверхностному напряжению сдвига, не вызывая денатурации активных иммуноцитокинов. Неионогенные поверхностно-активные вещества (ПАВ) присутствуют в пределах концентраций от примерно 0,05 мг/мл до примерно 1,0 мг/мл, предпочтительно - от примерно 0,07 мг/мл до примерно 0,2 мг/мл.
[392] Подходящие неионогенные ПАВ включают полисорбаты (20, 40, 60, 65, 80 и т.д.), полоксамеры (184, 188 и т.д.), полиолы PLURONIC®, TRITON®, моноэфиры полиоксиэтиленсорбитана (TWEEN®-20, TWEEN®-80 и т.д.), лауромакрогол 400, полиоксил 40 стеарат, полиоксиэтилен гидрогенизированное касторовое масло 10, 50 и 60, моностеарат глицерина, эфир сахарозы и жирной кислоты, метилцеллюлоза и карбоксиметилцеллюлоза. Анионные ПАВ, пригодные для использования, включают лаурилсульфат натрия, диоктилсульфосукцинат натрия и диоктилсульфонат натрия. Катионные ПАВ включают хлорид бензалкония или хлорид бензетония.
[393] Фармацевтические составы должны быть стерильными, чтобы их можно было применять для введения in vivo. Фармацевтический состав можно сделать стерильным с помощью фильтрации через стерилизующие фильтрационные мембраны. Фармацевтические составы настоящего изобретения обычно помещают в контейнер, имеющий стерильное отверстие для доступа, например, пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций.
[394] Можно изготавливать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антагонист, причем матрицы имеют вид формованных изделий, например, пленки или микрокапсулы. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (пат. США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной и гликолевой кислот, такие как LUPRON DEPOT™ (инъекционные микросферы, состоящие из сополимера молочной и гликолевой кислот и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота.
[395] Фармацевтические составы в данном документе могут также содержать более одного активного соединения, если это необходимо для лечения конкретного показания, предпочтительно, чтобы это были соединения с дополняющей активностью, которые не оказывают неблагоприятного воздействия друг на друга. Альтернативно или дополнительно состав может содержать цитотоксическое средство, химиотерапевтическое средство, цитокин, иммунодепрессант или средство-ингибитор роста. Такие молекулы подходящим образом присутствуют в комбинации в количествах, которые эффективны для намеченной цели.
[396] Активные ингредиенты также можно заключать в микрокапсулы, приготовленные, например, методами коацервации или межфазной полимеризации, например, гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы), микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences 18th edition.
[397] В некоторых вариантах осуществления фармацевтический состав содержится в одноразовом флаконе, таком как одноразовый запечатанный флакон. В некоторых вариантах осуществления фармацевтический состав содержится во флаконе многократного использования. В некоторых вариантах осуществления фармацевтический состав содержится в контейнере без упаковки. В некоторых вариантах осуществления фармацевтический состав криоконсервируют.
VI. Методы лечения заболеваний или направления активности цитокинов
[398] Иммуноцитокины, описанные в данном документе (например, иммуноцитокин IL-2/антитело к HER2, иммуноцитокин IL-2/антитело к CD3, иммуноцитокин IL-2/антитело к PD-1, иммуноцитокин IL-2/антитело к CD4, иммуноцитокин IL-2/антитело к CD8, иммуноцитокин IL-2/антитело к CTLA-4, иммуноцитокин IL-2/антитело к PD-L1, иммуноцитокин IL-2/антитело к CD25, иммуноцитокин IL-2/PD-L2-Fc, иммуноцитокин IL-12/антитело к HER2, иммуноцитокин IL-12/антитело к CD3, иммуноцитокин IL-12/антитело к PD-1, иммуноцитокин IL-12/антитело к CD4, иммуноцитокин IL-12/антитело к CD8, иммуноцитокин IL-12/антитело к CTLA-4, иммуноцитокин IL-12/антитело к PD-L1, иммуноцитокин IL-12/антитело к CD25, иммуноцитокин IL-12/PD-L2-Fc, иммуноцитокин IL-23/антитело к HER2, иммуноцитокин IL-23/антитело к CD3, иммуноцитокин IL-23/антитело к PD-1, иммуноцитокин IL-23/антитело к CD4, иммуноцитокин IL-23/антитело к CD8, иммуноцитокин IL-23/антитело к CTLA-4, иммуноцитокин IL-23/антитело к PD-L1, иммуноцитокин IL-23/антитело к CD25, иммуноцитокин IL-23/PD-L2-Fc, иммуноцитокин IL-10/антитело к HER2, иммуноцитокин IL-10/антитело к CD3, иммуноцитокин IL-10/антитело к PD-1, иммуноцитокин Il-10/антитело к CD4, иммуноцитокин IL-10/антитело к CD8, иммуноцитокин IL-10/антитело к CTLA-4, иммуноцитокин IL-10/антитело к PD-L1, иммуноцитокин IL-10/антитело к CD25, иммуноцитокин IL-10/PD-L2-Fc, иммуноцитокин IFN-γ/антитело к HER2, иммуноцитокин IFN-γ/антитело к CD3, иммуноцитокин IFN-γ/антитело к PD-1, иммуноцитокин IFN-γ/антитело к CD4, иммуноцитокин IFN-γ/антитело к CD8, иммуноцитокин IFN-γ/антитело к CTLA-4, иммуноцитокин IFN-γ/антитело к PD-L1, иммуноцитокин IFN-γ/антитело к CD25, иммуноцитокин IFN-γ/PD-L2-Fc, иммуноцитокин IFN-α/антитело к HER2, иммуноцитокин IFN-α/антитело к CD3, иммуноцитокин IFN-α/антитело к PD-1, иммуноцитокин IFN-α/антитело к CD4, иммуноцитокин IFN-α/антитело к CD8, иммуноцитокин IFN-α/антитело к CTLA- 4, иммуноцитокин IFN-α/антитело к PD-L1, иммуноцитокин IFN-α/антитело к CD25 или иммуноцитокин IFN-α/PD-L2-Fc) и их составы (например, фармацевтические составы) найдут различные применения, например, в диагностике, молекулярных анализах и терапии. В некоторых вариантах осуществления предложен способ лечения заболевания (например, рака, инфекции, такой как вирусная инфекция, аутоиммунного заболевания, аллергии, отторжения трансплантата или БТПХ) у индивидуума (например, человека), включающий введение индивидууму эффективного количества любого из описанных здесь иммуноцитокинов или их фармацевтических составов. В некоторых вариантах осуществления также предложен способ избирательного стимулирования активности цитокина или его варианта (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23), направленной на клетку, экспрессирующую антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8) у индивидуума (например, человека), включающий введение индивидууму эффективного количества любого из иммуноцитокинов, описанных в данном документе, или их фармацевтических составов, где активность цитокина или его варианта избирательно активируется при связывании иммуноцитокина с антигеном-мишенью. В некоторых вариантах осуществления индивидуум ранее проходил лечение любым из иммуноцитокинов, описанных в данном документе, или их фармацевтическим составом против рака, и лечение включает предотвращение рецидива рака у индивидуума. В некоторых вариантах осуществления лечение включает профилактику рака у индивидуума, независимо от того, был ли у индивидуума ранее рак или нет, проходил ли он лечение иммуноцитокинами, описанными в данном документе, или нет. В некоторых вариантах осуществления также предложен способ профилактики рака у индивидуума, включающий введение индивидууму эффективного количества любого из описанных здесь иммуноцитокинов, содержащего их фармацевтического состава или противораковой вакцины.
[399] Таким образом, в некоторых вариантах осуществления предложен способ лечения заболевания (например, рака, инфекции, такой как вирусная инфекция, аутоиммунного заболевания, аллергии, БТПХ или отторжения трансплантата) у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина, содержащего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий целевой антиген (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него); и необязательно фармацевтически приемлемый носитель. В некоторых вариантах осуществления предложен способ лечения заболевания (например, рака, инфекции, такой как вирусная инфекция, аутоиммунного заболевания, аллергии, БТПХ или отторжения трансплантата) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина, содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленное с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи; и необязательно фармацевтически приемлемый носитель. В некоторых вариантах осуществления предложен способ лечения заболевания (например, рака, инфекции, такой как вирусная инфекция, аутоиммунного заболевания, аллергии, БТПХ или отторжения трансплантата) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина, содержащего: а) антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую, от N-конца к С-концу: домен VH, необязательно CH1-домен, цитокин или его вариант в шарнирном участке, CH2-домен и необязательно CH3-домен; и необязательно фармацевтически приемлемый носитель. В некоторых вариантах осуществления предложен способ лечения заболевания (например, рака, инфекции, такой как вирусная инфекция, аутоиммунного заболевания, аллергии, БТПХ или отторжения трансплантата) у индивидуума (например, у человека), включающий введение индивидууму эффективного количество иммуноцитокина, содержащего: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8 ); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, причем цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и необязательно фармацевтически приемлемый носитель. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели.
[400] В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетки плазмы, макрофаги) у индивидуума или путем избирательного направления цитокиновой активности на раковую клетку у индивидуума, включающий введение индивидууму эффективного количества любого из иммуноцитокинов IL-2/антитело к HER2, иммуноцитокинов IL-10/антитело к HER2, иммуноцитокинов IL-12/антитело к HER2, иммуноцитокинов IL-23/антитело к HER2, иммуноцитокинов IFN-γ/антитело к HER2, иммуноцитокинов IFN-α/антитело к HER2, иммуноцитокинов IL-2/антитело к PD-1, иммуноцитокинов IL-10/антитело к PD-1, иммуноцитокинов IL-12/антитело к PD-1, иммуноцитокинов IL-23/антитело к PD-1, иммуноцитокинов IFN-γ/антитело к PD-1, иммуноцитокинов IFN-α/антитело к PD-1, иммуноцитокинов IL-2/антитело к PD-L1, иммуноцитокинов IL-10/антитело к PD-L1, иммуноцитокинов IL-12/антитело к PD-L1, иммуноцитокинов IL-23/антитело к PD-L1, иммуноцитокинов IFN-γ/антитело к PD-L1, иммуноцитокинов IF N-α/антитело к PD-L1, иммуноцитокинов IL-2/антитело к CTLA-4, иммуноцитокинов IL-10/антитело к CTLA-4, иммуноцитокинов IL-12/антитело к CTLA-4, иммуноцитокинов IL-23/антитело к CTLA-4, иммуноцитокинов IFN-γ/антитело к CTLA-4, иммуноцитокинов IFN-α/антитело к CTLA-4, иммуноцитокинов IL-2/антитело к CD3, иммуноцитокинов IL-10/антитело к CD3, иммуноцитокинов IL-12/антитело к CD3, иммуноцитокинов IL-23/антитело к CD3, иммуноцитокинов IFN-γ/антитело к CD3, иммуноцитокинов IFN-α/антитело к CD3, иммуноцитокинов IL-2/антитело к CD4, иммуноцитокинов IL-10/антитело к CD4, иммуноцитокинов IL-12/антитело к CD4, иммуноцитокинов IL-23/антитело к CD4, иммуноцитокинов IFN-γ/антитело к CD4, иммуноцитокинов IFN-α/антитело к CD4, иммуноцитокинов IL-2/антитело к CD8, иммуноцитокинов IL-10/антитело к CD8, иммуноцитокинов IL-12/антитело к CD8, иммуноцитокинов IL-23/антитело к CD8, иммуноцитокинов IFN-γ/антитело к CD8, иммуноцитокинов IFN-α/антитело к CD8, иммуноцитокинов IL-2/антитело к CD25, иммуноцитокинов IL- 10/антитело к CD25, иммуноцитокины IL-12/антитело к CD25, иммуноцитокинов IL-23/антитело к CD25, иммуноцитокинов IFN-γ/антитело к CD25, иммуноцитокинов IFN-α/антитело к CD25, иммуноцитокинов IL-2/PD-L2-Fc, иммуноцитокинов IL-10/PD-L2-Fc, иммуноцитокинов IL-12/PD-L2-Fc, иммуноцитокинов IL-23/PD-L2-Fc, иммуноцитокинов IFN-γ/PD-L2-Fc, иммуноцитокинов IFN-α/PD-L2-Fc, описанных в данном документе, или содержащего их фармацевтического состава. В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, Dc-клетку плазмы, макрофаг) у индивидуума или путем избирательного направления цитокиновой активности на раковую клетку у индивидуума, включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CTLA-4, PD-L1 , PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N', на C' или внутри него). В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума или путем избирательного направления цитокиновой активности на раковую клетку у индивидуума, включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума или путем избирательного направления цитокиновой активности на раковую клетку у индивидуума, включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, HER2, PD-1, CD123, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, причем цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления рак выбран из группы, состоящей из рака легкого, рака печени, рака почки, колоректального рака, рака яичников, рака молочной железы, рака поджелудочной железы, рака желудка, рака желчных протоков, плоскоклеточного рака, рака мочевого пузыря, рака пищевода, мезотелиомы, меланомы, рака головы и шеи, рака щитовидной железы, саркомы, рака предстательной железы, глиобластомы, рака шейки матки, карциномы тимуса, лейкемии, лимфомы, миеломы, грибовидных микозов и рака из клеток Меркеля.
[401] В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека) или способ избирательного направления цитокиновой активности на раковую клетку у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень на раковой клетке (например, любой опухолевый антиген, такой как HER2, любой лиганд или рецептор на поверхности раковой клетки, или любую молекулу контрольной точки иммунной системы, экспрессируемую на раковых клетках, такую как PD-L1 или PD-L2) из раковой клетки; и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант , где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или вариант его расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека) или способ избирательного направления цитокиновой активности на раковую клетку у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень на раковой клетке (например, любой опухолевый антиген, такой как HER2, любой лиганд или рецептор на поверхности раковой клетки, или любая молекула контрольной точки иммунной системы, экспрессируемая на раковых клетках, такая как PD-L1 или PD-L2) раковой клетки; и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и при этом цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека) или способ избирательного направления цитокиновой активности на раковую клетку у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), выбранного из группы, состоящей из: иммуноцитокина IL-2/антитело к HER2, иммуноцитокина IL-10/антитело к HER2, иммуноцитокина IL-12/антитело к HER2, иммуноцитокина IL-23/антитело к HER2, иммуноцитокина IFN-γ/антитело к HER2, иммуноцитокина IFN-α/антитело к HER2, иммуноцитокина IL-2/антитело к PD-L1, иммуноцитокина IL-10/антитело к PD-L1, иммуноцитокина IL-12/антитело к PD-L1, иммуноцитокина IL-23/антитело к PD-L1, иммуноцитокина IFN-γ/антитело к PD-L1 и иммуноцитокина IFN-α/антитело к PD-L1. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления рак выбран из группы, состоящей из рака легкого, рака печени, рака почки, колоректального рака, рака яичников, рака молочной железы, рака поджелудочной железы, рака желудка, рака желчных протоков, плоскоклеточного рака, рака мочевого пузыря, рака пищевода, мезотелиомы, меланомы, рака головы и шеи, рака щитовидной железы, саркомы, рака предстательной железы, глиобластомы, рака шейки матки, карциномы тимуса, лейкемии, лимфомы, миеломы, грибовидных микозов и рака из клеток Меркеля. В некоторых вариантах осуществления рак представляет собой HER2+ рак, такой как HER2+ рак молочной железы. В некоторых вариантах осуществления рак представляет собой рак PD-L1+ и/или PD-L2+.
[402] В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, человека) или способ избирательного направления активности цитокинов на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень на иммунной клетке (например, любой антиген на поверхности иммунной клетки, такой как CD3, CD4, CD8, CD123 или CD25, или любую молекулу контрольной точки иммунного ответа, экспрессированную на иммунных клетках, такую как PD-1 или CTLA-4); и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, человека) или способ избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего: а) антитело (например, полноразмерное антитело, антитело, содержащего только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень на иммунной клетке (например, любой иммунной антиген на поверхности клетки, такой как CD3, CD4, CD8, CD123 или CD25, или любую молекулу контрольной точки иммунного ответа, экспрессируемую на иммунных клетках, такую как PD-1 или CTLA-4); и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и при этом цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения рака у индивидуума (например, у человека) или способ избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), выбранного из группы, состоящей из: иммуноцитокина IL-2/антитело к PD-L1, иммуноцитокина IL-10/антитело к PD-L1, иммуноцитокина IL-12/антитело к PD-L1, иммуноцитокина IL-23/антитело к PD-L1, иммуноцитокина IFN-γ/антитело к PD-L1, иммуноцитокина IFN-α/антитело к PD-L1, иммуноцитокина IL-2/антитело к PD-1, иммуноцитокина IL-10/антитело к PD-1, иммуноцитокина IL-12/антитело к PD-1, иммуноцитокина IL-23/антитело к PD-1, иммуноцитокина IFN-γ/антитело к PD-1, иммуноцитокина IFN-α/антитело к PD-1, иммуноцитокина IL-2/антитело к CTLA-4, иммуноцитокина IL-10/антитело к CTLA-4, иммуноцитокина IL-12/антитело к CTLA-4, иммуноцитокина IL-23/антитело к CTLA-4, иммуноцитокина IFN-γ/антитело к CTLA-4, иммуноцитокина IFN-α/антитело к CTLA-4, иммуноцитокина IL- 2/антитело к CD3, иммуноцитокина IL-10/антитело к CD3, иммуноцитокина IL-12/антитело к CD3, иммуноцитокина IL-23/антитело к CD3, иммуноцитокина IFN-γ/антитело к CD3, иммуноцитокина IFN-α/антитело к CD3, иммуноцитокина IL-2/антитело к CD4, иммуноцитокина IL-10/антитело к CD4, иммуноцитокина IL-12/антитело к CD4, иммуноцитокина IL-23/антитело к CD4, иммуноцитокина IFN-γ/антитело к CD4, иммуноцитокина IFN-α /антитело к CD4, иммуноцитокина IL-2/антитело к CD8, иммуноцитокина IL-10/антитело к CD8, иммуноцитокина IL-12/антитело к CD8, иммуноцитокина IL-23/антитело к CD8, иммуноцитокина IFN-γ/антитело к CD8, иммуноцитокина IFN-α/антитело к CD8, иммуноцитокина IL-2/антитело к CD25, иммуноцитокина IL-10/антитело к CD25, иммуноцитокина IL-12/антитело к CD25, иммуноцитокина IL-23/антитело к CD25, иммуноцитокина IFN-γ/антитело к CD25, иммуноцитокина IFN-α/антитело к CD25, иммуноцитокина IL-2/PD -L2-Fc, иммуноцитокина IL-10/PD-L2-Fc, иммуноцитокина IL-12/PD-L2-Fc, иммуноцитокина IL-23/PD-L2-Fc, иммуноцитокина IFN-γ/PD-L2-Fc и иммуноцитокина IFN-α/PD-L2-Fc. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления рак выбран из группы, состоящей из рака легкого, рака печени, рака почки, колоректального рака, рака яичников, рака молочной железы, рака поджелудочной железы, рака желудка, рака желчных протоков, плоскоклеточного рака, рака мочевого пузыря, рака пищевода, мезотелиомы, меланомы, рака головы и шеи, рака щитовидной железы, саркомы, рака предстательной железы, глиобластомы, рака шейки матки, карциномы тимуса, лейкемии, лимфомы, миеломы, грибовидных микозов и рака из клеток Меркеля. В некоторых вариантах осуществления рак представляет собой PD-L1+ рак и/или PD-L2+ рак.
[403] В некоторых вариантах осуществления способ лечения рака обладает одним или несколькими из следующих видов биологического действия: (1) уничтожает раковые клетки; (2) подавляет пролиферацию раковых клеток; (3) индуцирует иммунный ответ в опухоли (например, индуцирует инфильтрацию иммунных эффекторных клеток в область опухоли, индуцируем пролиферацию, дифференцировку и/или активацию иммунных клеток и/или индуцирует секрецию провоспалительных цитокинов иммунными клетками); (4) уменьшает размер опухоли; (5) облегчает один или несколько симптомов у индивидуума, больного раком; (6) подавляет метастазирование опухоли; (7) продлевает выживание; (8) продлевает период до прогрессирования рака; и (9) предотвращает, ингибирует или снижает вероятностю рецидива рака. В некоторых вариантах осуществления с помощью способа уничтожения раковых клеток, опосредованного иммуноцитокином или фармацевтическим составом, описанными в данном документе, можно достичь процента о™ирания опухолевых клеток не ниже примерно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или выше. В некоторых вариантах осуществления с помощью способа уменьшения объема опухоли, опосредованного иммуноцитокином или фармацевтическим составом, описанными в данном документе, можно уменьшить объем опухоли не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90%, 80% или 100%). В некоторых вариантах осуществления с помощью способа подавления метастазирования опухоли, опосредованного иммуноцитокином или фармацевтическим составом, описанными в данном документе, можно подавить метастазирование не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90%, 80% или 100%). В некоторых вариантах осуществления способ продления жизни индивидуума (например, человека), опосредованный иммуноцитокином или фармацевтическим составом, описанными в данном документе, может продлить жизнь человека по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18 или 24 месяца. В некоторых вариантах осуществления способ продления периода до прогрессирования рака, опосредованный иммуноцитокином или фармацевтическим составом, описанными в данном документе, может продлить период до прогрессирования рака не менее чем на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель. В некоторых вариантах осуществления с помощью способа индукции иммунного ответа на опухоль можно повышать, усиливать или стимулировать иммунный ответ или иммунную функцию у субъекта. В некоторых вариантах осуществления иммунный ответ или иммунная функция повышаются, усиливаются и/или стимулируются путем активации эффекторных клеток (например, Т-клеток, например, CD8+ и/или CD4+ Т-клеток), расширения (увеличения) популяции эффекторных клеток и/или уничтожения клеток-мишеней (например, опухолевых клеток-мишеней) у субъекта. В некоторых вариантах осуществления CD4 и/или CD8 Т-клетки у индивидуума имеют повышенные или усиленные праймирование, активацию, пролиферацию, высвобождение цитокинов и/или цитолитическую активность по сравнению с предшествующим введением иммуноцитокина или фармацевтического состава, описанных в данном документе.
[404] Описанные здесь способы подходят для лечения различных видов рака, включая солидные опухоли и гемобластозы. Методы применимы к раку всех стадий, включая рак ранней стадии, неметастатический рак, первичный рак, запущенный рак, местно-распространенный рак, метастатический рак или рак в стадии ремиссии. Описанные здесь способы можно использовать в качестве терапии первой линии, терапии второй линии, терапии третьей линии или комбинированной терапии с другими видами лечения рака, известными в данной области, такими как хирургия, лучевая терапия, химиотерапия, иммунотерапия, гормональная терапия или их комбинация. В некоторых вариантах осуществления способ применяют для лечения индивидуума, который уже ранее проходил лечение. В некоторых вариантах осуществления рак был резистентным к предшествующей терапии. В некоторых вариантах осуществления способ применяют для лечения индивидуума, который ранее не проходил лечение. В некоторых вариантах осуществления рак частично устойчив к монотерапии ингибитором контрольной точки иммунного ответа (например, частично устойчивы к монотерапии антителами к PD-1 или к PD-L1).
[405] В некоторых вариантах осуществления рак представляет собой HER2-положительный рак, и способ включает введение индивидууму (например, человеку) эффективного количества любых подходящих иммуноцитокинов, описанных в данном документе, таких как любой из иммуноцитокина IL-2/антитело к HER2, иммуноцитокина IL-10/антитело к HER2, иммуноцитокина IL-23/антитело к HER2, иммуноцитокина IL-12/антитело к HER2, иммуноцитокина IFN-γ/антитело к HER2, иммуноцитокина IFN-α/антитело к HER2, иммуноцитокина IL-2/антитело к PD-1, иммуноцитокина IL-10/антитело к PD-1, иммуноцитокина IL-23/антитело к PD-1, иммуноцитокина IL-12/антитело к PD-1, иммуноцитокина IFN-γ/антитело к PD-1, иммуноцитокина IFN -α/антитело к PD-1, иммуноцитокина IL-2/антитело к PD-L1, иммуноцитокина IL-10/антитело к PD-L1, иммуноцитокина IL-12/антитело к PD-L1, иммуноцитокина IL-23/антитело к PD-L1, иммуноцитокина IFN-γ/антитело к PD-L1, иммуноцитокина IFN-α/антитело к PD-L1, иммуноцитокина IL-2/антитело к CTLA-4, иммуноцитокина IL-10/антитело к CTLA-4, иммуноцитокина IL- 12/антитело к CTLA-4, иммуноцитокина IL-23/антитело к CTLA-4, иммуноцитокина IFN-γ/антитело к CTLA-4, иммуноцитокина IFN-α/антитело к CTLA-4, иммуноцитокина IL- 2/антитело к CD3, иммуноцитокина IL-10/антитело к CD3, иммуноцитокина IL-12/антитело к CD3, иммуноцитокина IL-23/антитело к CD3, иммуноцитокина IFN-γ/антитело к CD3, иммуноцитокина IFN-α/антитело к CD3, иммуноцитокина IL-2/антитело к CD4, иммуноцитокина IL-10/антитело к CD4, иммуноцитокина IL-12/антитело к CD4, иммуноцитокина IL-23/антитело к CD4, иммуноцитокина IFN-γ/антитело к CD4, иммуноцитокина IFN-α /антитело к CD4, иммуноцитокина IL-2/антитело к CD8, иммуноцитокина IL-10/антитело к CD8, иммуноцитокина IL-12/антитело к CD8, иммуноцитокина IL-23/антитело к CD8, иммуноцитокина IFN-γ/антитело к CD8, иммуноцитокина IFN-α/антитело к CD8, иммуноцитокина IL-2/антитело к CD25, иммуноцитокина IL-10/антитело к CD25, иммуноцитокина IL-12/антитело к CD25, иммуноцитокина IL-23/антитело к CD25, иммуноцитокина IFN-γ/антитело к CD25, иммуноцитокина IFN-α/антитело к CD25, иммуноцитокина IL-2/PD-L2-Fc, иммуноцитокина IL-10/PD-L2-Fc, иммуноцитокина IL-12/PD-L2-Fc, иммуноцитокина IL-23 /PD-L2-Fc, иммуноцитокина IFN-γ/PD-L2-Fc, иммуноцитокина IFN-α/PD-L2-Fc. В некоторых вариантах осуществления HER2-положительный рак представляет собой рак молочной железы или рак желудка. В некоторых вариантах осуществления HER2-положительный рак молочной железы представляет собой рак молочной железы на ранней стадии. В некоторых вариантах осуществления HER2-положительный рак молочной железы представляет собой метастатический рак молочной железы. В некоторых вариантах осуществления HER2-положительный рак представляет собой рецидивирующий рак. В некоторых вариантах осуществления рецидивирующий рак представляет собой локально рецидивирующий рак. В некоторых вариантах осуществления HER2-положительный рак представляет собой распространенный рак. В некоторых вариантах осуществления HER2-положительный рак является нерезектабельным.
[406] В некоторых вариантах осуществления рак представляет собой рак, экспрессирующий PD-L1, и способ включает введение индивидууму (например, человеку) эффективного количества любых подходящих иммуноцитокинов, описанных в данном документе, таких как любой из иммуноцитокина IL-2/антитело к HER2, иммуноцитокина IL-10/антитело к HER2, иммуноцитокина IL-12/антитело к HER2, иммуноцитокина IL-23/антитело к HER2, иммуноцитокина IFN-γ/антитело к HER2, иммуноцитокина IFN-α/антитело к HER2, иммуноцитокина IL-2/антитело к PD-1, иммуноцитокина IL-10/антитело к PD-1, иммуноцитокина IL-12/антитело к PD-1, иммуноцитокина IL-23/антитело к PD-1, иммуноцитокина IFN-γ/антитело к PD-1, иммуноцитокина IFN -α/антитело к PD-1, иммуноцитокина IL-2/антитело к PD-L1, иммуноцитокина IL-10/антитело к PD-L1, иммуноцитокина IL-12/антитело к PD-L1, иммуноцитокина IL-23/антитело к PD-L1, иммуноцитокина IFN-γ/антитело к PD-L1, иммуноцитокина IFN-α/антитело к PD-L1, иммуноцитокина IL-2/антитело к CTLA-4, иммуноцитокина IL-10/антитело к CTLA-4, иммуноцитокина IL- 12/антитело к CTLA-4, иммуноцитокина IL-23/антитело к CTLA-4, иммуноцитокина IFN-γ/антитело к CTLA-4, иммуноцитокина IFN-α/антитело к CTLA-4, иммуноцитокина IL- 2/антитело к CD3, иммуноцитокина IL-10/антитело к CD3, иммуноцитокина IL-12/антитело к CD3, иммуноцитокина IL-23/антитело к CD3, иммуноцитокина IFN-γ/антитело к CD3, иммуноцитокина IFN-α/антитело к CD3, иммуноцитокина IL-2/антитело к CD4, иммуноцитокина IL-10/антитело к CD4, иммуноцитокина IL-12/антитело к CD4, иммуноцитокина IL-23/антитело к CD4, иммуноцитокина IFN-γ/антитело к CD4, иммуноцитокина IFN-α /антитело к CD4, иммуноцитокина IL-2/антитело к CD8, иммуноцитокина IL-10/антитело к CD8, иммуноцитокина IL-12/антитело к CD8, иммуноцитокина IL-23/антитело к CD8, иммуноцитокина IFN-γ/антитело к CD8, иммуноцитокина IFN-α/антитело к CD8, иммуноцитокина IL-2/антитело к CD25, иммуноцитокина IL-10/антитело к CD25, иммуноцитокина IL-12/антитело к CD25, иммуноцитокина IL-23/антитело к CD25, иммуноцитокина IFN-γ/антитело к CD25, иммуноцитокина IFN-α/антитело к CD25, иммуноцитокина IL-2/PD-L2-Fc, иммуноцитокина IL-10/PD-L2-Fc, иммуноцитокина IL-12/PD-L2-Fc, иммуноцитокина IL-23 /PD-L2-Fc, иммуноцитокина IFN-γ/PD-L2-Fc, иммуноцитокина IFN-α/PD-L2-Fc. В некоторых вариантах осуществления способ подходит для лечения рака с аберрантной экспрессией PD-1 или PD-L1/PD-L2 (например, HER2+ рак), активность и/или передача сигналов включают, в качестве неограничивающего примера, гематологический рак и /или солидные опухоли. Некоторые виды рака, рост которых можно подавлять с помощью иммуноцитокинов данного изобретения, включают виды рака, обычно реагирующие на иммунотерапию. Неограничивающие примеры других видов рака, подлежащих лечению, включают меланому (например, метастатическая злокачественная меланома), рак почки (например, светлоклеточный рак), рак предстательной железы (например, гормонорезистентная аденокарцинома предстательной железы), рак молочной железы, рак толстой кишки и рак легких (например, немелкоклеточный рак легкого). Кроме того, изобретение включает рефрактерные или рецидивирующие злокачественные новообразования, рост которых можно подавлять с помощью иммуноцитокинов данного изобретения. Настоящее изобретение также применимо для лечения метастатической формы рака, особенно метастатической формы рака, при которой экспрессируется PD-L1 (Iwai и др. (2005) Int. Immunol. 17:133-144). В некоторых вариантах осуществления рак с аберрантной экспрессией, активностью и/или передачей сигналов PD-1 или PD-L1/PD-L2 является частично устойчивым к блокаде PD-1 или PD-L1 (например, частично устойчивым к антителу к PD-1 или лечению антителом к PD-L1).
[407] В некоторых вариантах осуществления способы, описанные в данном документе, подходят для лечения солидного рака, выбранного из группы, состоящей из рака толстой кишки, рака прямой кишки, почечно-клеточного рака, рака печени, немелкоклеточного рака легкого, рака тонкой кишки, рака пищевода, меланомы, рака кости, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной злокачественной меланомы, рака матки, рака яичников, рака прямой кишки, рака анальной области, рака желудка, рака яичка, рака матки, рака фаллопиевых труб, рака эндометрия, рака шейки матки, рака влагалища, рака вульвы, болезни Ходжкина, неходжкинской лимфомы (НХЛ), кожной Т-клеточной лимфомы (КТКЛ), рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечников, саркомы мягких тканей, рака уретры, рака полового члена, солидных опухолей детского возраста, рака мочевого пузыря, рака почки или мочеточника, рак почечной лоханки, новообразование в центральной нервной системе (ЦНС), первичной лимфомы ЦНС, опухолевого ангиогенеза, опухоли оси позвоночника, глиомы ствола головного мозга, аденомы гипофиза, саркомы Капоши, эпидермоидного рака, плоскоклеточного рака, Т-клеточной лимфомы, рака, индуцированного окружающей средой, комбинации указанных видов рака и метастатического поражения при указанных видах рака.
[408] В некоторых вариантах осуществления способы, описанные в данном документе, подходят для лечения гематологического рака, выбранного из одного или нескольких из острого миелоидного лейкоза (ОМЛ), хронического лимфолейкоза (ХЛЛ), острых лейкозов, острого лимфолейкоза (ОЛЛ), острого В-клеточного лимфолейкоза (В-ОЛЛ), Т-клеточного острого лимфолейкоза (Т-ОЛЛ), хронического миелогенного лейкоза (ХМЛ), В-клеточного пролимфоцитарного лейкоза, бластного новообразования из плазмацитоидных дендритных клеток, лимфомы Беркитта, диффузной крупноклеточной В-клеточной лимфомы, фолликулярной лимфомы, волосатоклеточного лейкоза, мелкоклеточной или крупноклеточной фолликулярной лимфомы, злокачественных лимфопролиферативных состояний, MALT-лимфомы, мантийноклеточной лимфомы, лимфомы из клеток маргинальной зоны, множественной миеломы, миелодисплазии и миелодиспластического синдрома, неходжкинской лимфомы, ходжкинской лимфомы, плазмобластной лимфомы, плазмоцитоидного дендритноклеточного новообразования, макроглобулинемии Вальденстрема или предлейкоза.
[409] В некоторых вариантах осуществления способы, описанные в данном документе, предназначены для лечения инфекции, например, грибковой, вирусной, бактериальной, протозойной или другой паразитарной инфекции. Инфекция может быть вызвана любым возбудителем, описанным выше в подразделе «Антиген возбудителя». Таким образом, в некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества любого из иммуноцитокинов IL-2/антитело к CD8, иммуноцитокинов IL-12/антитело к CD8, иммуноцитокинов IL-10/антитело к CD8, иммуноцитокинов IL-23/антитело к CD8, иммуноцитокинво IFN-γ/антитело к CD8, иммуноцитокинов IFN-α/антитело к CD8, иммуноцитокинов IL-2/антитело к -CD3, иммуноцитокинов IL-10/антитело к CD3, иммуноцитокинов IL-12/антитело к CD3, иммуноцитокинов IL-23/антитело к CD3, иммуноцитокинов IFN-γ/антитело к CD3, иммуноцитокинов IFN-α/антитело к CD3, иммуноцитокинов IL-2/антитело к CD4, иммуноцитокинов IL-10/антитело к CD4, иммуноцитокинов IL-12/антитело к CD4, иммуноцитокинов IL-23/антитело к CD4, иммуноцитокинов IFN-γ/антитело к CD4, иммуноцитокинов IFN-α/антитело к CD4, иммуноцитокинов IL-2/антитело к CD25, иммуноцитокинов IL-10/антитело к CD25, иммуноцитокинов IL-12/антитело к CD25, иммуноцитокинов IL-23/антитело к CD25, иммуноцитокинов IFN-γ/анти-CD25 и иммуноцитокинов IFN-α/антитело к CD25, описанных в данном документе, или их фармацевтического состава. В некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека) путем избирательного направления активности цитокинов на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего: a) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, CD123, CTLA-4, PD-L1, PD-L2, CD25, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека) путем избирательного направления активности цитокинов на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, CD25, CTLA-4, PD-L1, PD-L2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека), например, путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CD25, CTLA-4, PD-L1, PD-L2, PD-1, CD3, CD4, CD123 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека), такой как избирательное направление активности цитокинов на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень на иммунной клетке (например, любой антиген на поверхности иммунной клетки, такой как CD3, CD4, CD8, CD123 или CD25, или любую молекулу контрольной точки иммунного ответа, экспрессированную на иммунных клетках, такую как PD-L1, PD-1 или CTLA-4); и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения инфекции (например, вирусной, грибковой, бактериальной, протозойной или другой паразитарной инфекции) у индивидуума (например, человека) путем избирательного направления цитокиновой активности на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или содержащего его фармацевтического состава), включающего: а) антитело (например, полноразмерное антитело, антитело, содержащего только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень на иммунной клетке (например, любой иммунной антиген на поверхности клетки, такой как CD3, CD4, CD8, CD123 или CD25, или любую молекулу контрольной точки иммунного ответа, экспрессируемую на иммунных клетках, такую как PD-L1, PD-1 или CTLA-4); и b) цитокин (например, любой цитокин, описанный в данном документе, такой как IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и при этом цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно или подкожно. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления способ лечения инфекции, описанный в данном документе, предотвращает ухудшение, купирует и/или ослабляет по меньшей мере один симптом патогенной инфекции у индивидуума, нуждающегося в этом, уменьшает количество или устраняет патоген, предотвращает повреждение указанного индивидуума или органа или ткани у указанного индивидуума и/или предотвращает смерть. В некоторых вариантах осуществления способы, описанные в данном документе, позволяют достичь одного или нескольких из следующего: (a) контролирование, улучшение состояния и/или предотвращение повреждения тканей и/или органов или недостаточности их функции, например, вызванных вирусной инфекцией; (b) контролирование, снижение и/или подавление некроза клеток (например, снижение не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90% % или 100%) некроза клеток), такого как некроз в инфицированной и/или неинфицированной ткани и/или органе; (c) контролирование и/или увеличение инфильтрации воспалительных клеток (например, NK-клеток, цитотоксических Т-клеток, нейтрофилов) в инфицированных тканях и/или органах, например увеличение не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%) воспалительной клеточной инфильтрации; (d) контролирование, ослабление и/или предотвращение воспаления в неинфицированных тканях и/или органе, системного воспаления и/или цитокинового шторма, например, подавление не мнее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%); (e) снижение уровня смертности, связанной с инфекцией патогеном, и/или предотвращение смерти, такое как снижение не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80 %, 90% или 100%) смертности; и (F) уменьшение количества или устранение патогена не менее чем примерно на 10% (включая, например, не менее чем примерно на 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%).
[410] В некоторых вариантах осуществления способы, описанные в данном документе, предназначены для лечения иммунного заболевания, такого как аутоиммунное заболевание или иммуносупрессия.
[411] В некоторых вариантах осуществления способы, описанные в данном документе, предназначены для лечения подавления иммунитета. Иммуносупрессия представляет собой снижение или полное отсутствие активации или эффективности иммунной системы, что приводит к неспособности иммунной системы бороться с болезнями, например инфекционными заболеваниями или раком. Иммуносупрессия может быть либо результатом заболеваний, либо вызвана лекарственными препаратами или инфекцией, что приводит к повышенной восприимчивости к вторичным инфекциям, вызываемым патогенами, такими как бактерии и вирусы. Для многих заболеваний характерно развитие прогрессирующей иммуносупрессии у больного. Наличие нарушенного иммунного ответа у пациентов со злокачественными новообразованиями (например, лейкемией, лимфомой, множественной миеломой) хорошо задокументировано. Прогрессирующая иммуносупрессия также наблюдалась при некоторых хронических инфекциях, таких как СПИД, сепсис, проказа, цитомегаловирусные инфекции, малярия, волчанка и т.п. Иммунодефицит также является потенциальным побочным эффектом многих терапевтических методов лечения (например, радиотерапии или химиотерапии). В качестве примера, но не ограничения, заболевания и состояния, связанных с иммунодефицитом или иммуносупрессией, включают: инфицирование вирусом иммунодефицита человека (ВИЧ) и синдром приобретенного иммунодефицита (СПИД), гипогаммаглобулинемию, гематологические виды рака, такие как лейкемия и лимфома, лимфоцитопения (лимфопения) любого происхождения, красную волчанку, кахексию, злоупотребление опиоидами, мастоцитоз, ревматизм, трипаносомоз и злоупотребление алкоголем. В некоторых вариантах осуществления иммуносупрессия связана с передачей сигналов контрольных точек иммунной системы (например, передачей сигналов PD-1 или CTLA-4). В таких непреднамеренных ситуациях иммуносупрессии пациентов обычно лечат иммуностимуляторами (например, цитокинами) для укрепления иммунной системы. Однако из-за недостаточной специфичности такие иммуностимуляторы активируют иммунную систему в целом и могут вызвать гиперактивацию иммунной системы.
[412] Таким образом, в некоторых вариантах осуществления предложен способ лечения иммуносупрессии у индивидуума (например, у человека), например, путем избирательного направления цитокиновой активности (например, иммуностимулирующей или провоспалительной цитокиновой активности) на иммунную клетку (например, T клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, Dc-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества любого из иммуноцитокина IL-2/антитело к PD-L1, иммуноцитокина IL-10/антитело к PD-L1, иммуноцитокина IL-12/антитело к PD-L1, иммуноцитокина IL-23/антитело к PD-L1, иммуноцитокина IFN-γ/антитело к PD-L1, иммуноцитокина IFN-α/антитело к PD-L1, иммуноцитокина IL-2/PD-L2-Fc, иммуноцитокина IL-10/PD-L2-Fc, иммуноцитокина IL-12/PD-L2-Fc, иммуноцитокина IL-23/PD-L2-Fc, иммуноцитокина IFN-γ/PD-L2-Fc, иммуноцитокина IFN-α/PD-L2-Fc, иммуноцитокинов IL-2/антитело к PD-1, иммуноцитокинов IL-12/антитело к PD-1, иммуноцитокинов IL-23/антитело к PD-1, иммуноцитокинов IFN-γ/антитело к PD-1, иммуноцитокинов IFN-α/антитело к PD-1, иммуноцитокинов IL-2/антитело к CTLA-4, иммуноцитокинов IL-12/антитело к CTLA-4, иммуноцитокинов IL-23/антитело к CTLA-4, иммуноцитокинов IFN-γ/антитело к CTLA-4, иммуноцитокинов IFN-α/антитело к CTLA-4, иммуноцитокинов IL-2/антитело к CD3, иммуноцитокинов IL-12/антитело к CD3, иммуноцитокинов IL-23/антитело к CD3, иммуноцитокинов IFN-γ/антитело к CD3, иммуноцитокинов IFN-α/антитело к CD3, иммуноцитокинов IL-2/антитело к CD4, иммуноцитокинов IL-12/антитело к CD4, иммуноцитокинов IL-23/антитело к CD4, иммуноцитокинов IFN-γ/антитело к CD4, иммуноцитокинов IFN-α/антитело к CD4, иммуноцитокинов IL-2/антитело к CD8, иммуноцитокинов IL-12/антитело к CD8, иммуноцитокинов IL-23/антитело к CD8, иммуноцитокинов IFN-γ/антитело к CD8, иммуноцитокинов IFN-α/антитело к CD8, иммуноцитокинов IL-2/антитело к CD25, иммуноцитокинов IL-12/антитело к CD25, иммуноцитокинов IL-23/антитело к CD25, иммуноцитокинов IFN-γ/антитело к CD25 и иммуноцитокинов IFN-α/антитело к CD25, описываемых в данном документе, или их фармацевтического состава. В некоторых вариантах осуществления предложен способ лечения иммуносупрессии у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммуностимулирующей или провоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, PD-1, PD-L1, CTLA-4, CD3, CD4, CD8, CD123 или CD25) на иммунной клетке; и b) иммуностимулирующий цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на N'-конце, на C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения иммуносупрессии у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммуностимулирующей или провоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, PD-1, PD-L1, CTLA-4, CD3, CD4, CD8, CD123 или CD25) на иммунной клетке; и b) иммуностимулирующий цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения иммуносупрессии у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммуностимулирующей или провоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, PD-1, PD-L1, CTLA-4, CD3, CD4, CD8, CD123 или CD25) на иммунной клетке; и b) иммуностимулирующий цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-12 или IL-23) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления способы лечения иммуносупрессии, описанные в данном документе, активируют или усиливают иммунный ответ, повышают соотношение CD8 и CD4, стимулируют пролиферацию и/или дифференцировку иммунных клеток, индуцируют или усиливают высвобождение цитокинов (например, IL-2, IL-6, IFN-γ), предотвращают ухудшение, останавливают и/или улучшают по меньшей мере один симптом иммуносупрессии у нуждающегося в этом индивидуума и/или предотвращают смерть.
[413] В некоторых вариантах осуществления способы, описанные в данном документе, предназначены для лечения аутоиммунных заболеваний. Аутоиммунное заболевание представляет собой заболевание, возникающее в результате иммунной реакции против собственной ткани или тканевого компонента, включая как реакцию со стороны собственных антител, так и клеточно-опосредованную реакцию. Термин «аутоиммунное заболевание», используемый в данном документе, охватывает органоспецифические аутоиммунные заболевания, при которых аутоиммунный ответ направлен против одного типа ткани, такие как сахарный диабет I типа (СД1), болезнь Крона, язвенный колит, тяжелая миастения, витилиго, болезнь Грейвса, болезнь Хашимото, болезнь Аддисона и аутоиммунный гастрит и аутоиммунный гепатит. Термин «аутоиммунное заболевание» также включает аутоиммунные заболевания, не относящиеся к органоспецифическим, при которых аутоиммунная реакция направлена против компонента, присутствующего в нескольких или многих органах по всему телу. Такие аутоиммунные заболевания включают, например, ревматоидное заболевание, системную красную волчанку, прогрессирующий системный склероз и его варианты, полимиозит и дерматомиозит. Дополнительные аутоиммунные заболевания включают пернициозную анемию, включая некоторые виды аутоиммунного гастрита, первичный билиарный цирроз, аутоиммунную тромбоцитопению, синдром Шегрена, рассеянный склероз и псориаз. В некоторых вариантах осуществления аутоиммунное заболевание выбрано из группы, состоящей из диабета, сахарного диабета, артрита (включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит, псориатический артрит), рассеянного склероза, миастении, системной красной волчанки, аутоиммунного тиреоидита, дерматита (включая атопический дерматит и экзематозный дерматит), псориаз, синдром Шегрена, включая сухой кератоконъюнктивит, вторичный по отношению к синдрому Шегрена, очаговой алопеции, аллергические реакции, вызванные укусами членистоногих, болезнь Крона, афтозную язву, ирит, конъюнктивит, кератоконъюнктивит, язвенный колит, астму, аллергическую астму, кожную красную волчанку, склеродермию, вагинит, проктит, лекарственную сыпь, обратимую лепрозную реакцию, узловатую лепрозную эритему, аутоиммунный увеит, аллергический энцефаломиелит, острую некротизирующую геморрагическую энцефалопатию, идиопатическую двустороннюю прогрессирующую нейросенсорную тугоухость, апластическую анемию, врожденную апластическую анемию, идиопатическую тромбоцитопению, полихондрит, гранулематоз Вегенера, хронический активный гепатит, синдром Стивенса-Джонсона, трофические язвы неясного происхождения, красный плоский лишай, воспалительное заболевание кишечника (ВЗК), болезнь Крона, офтальмопатию Грейвса, саркоидоз, первичный билиарный цирроз, задний увеит и интерстициальный фиброз легких. Специалисту в данной области понятно, что способы данного изобретения можно применять к этим или другим аутоиммунным заболеваниям по своему усмотрению.
[414] Таким образом, в некоторых вариантах осуществления предложен способ лечения аутоиммунного заболевания у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, T-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества любого из иммуноцитокинов IL-10/антитело к CD4, иммуноцитокинов IL-10/антитело к CD3, иммуноцитокинов IL-10/антитело к CD8, иммуноцитокинов IL-10/антитело к CD25, иммуноцитокинов IL-10/антитело к PD-1, иммуноцитокинов IL-10/антитело к PD-L1, иммуноцитокинов IL-10/антитело к CTLA-4 и иммуноцитокинов IL-10/PD-L2-Fc, описанных в данном документе, или их фармацевтического состава. В некоторых вариантах осуществления предложен способ лечения аутоиммунного заболевания у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, PD-1, PD-L1, CTLA-4, CD3, CD4, CD8 или CD25) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-27, IL-35 или TGF-β) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения аутоиммуного заболевания у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, PD-1, CTLA-4, PD-L1, CD3, CD4, CD123, CD25 или CD8) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-35, IL-23 или TGF-β) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения аутоиммунного заболевания у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидная DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-1, CD3, CD4, CD123, CD25 или CD8) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-27, IL-35 или TGF-β) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления способы лечения аутоиммунного заболевания, описанные в данном документе, предотвращают ухудшение, останавливают и/или улучшают по меньшей мере один симптом аутоиммунного заболевания у индивидуума, нуждающегося в этом, предотвращают повреждение собственных здоровых тканей или органов, контролируют, улучшают и/или предотвращают инфильтрацию иммунных клеток в здоровую ткань и/или орган, системное воспаление и/или цитокиновый шторм, и/или предотвращают смерть.
[415] В некоторых вариантах осуществления предложен способ лечения отторжения трансплантата или БТПХ у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, T-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, человека), включающий введение индивидууму эффективного количества любого из иммуноцитокинов IL-10/антитело к CD4, иммуноцитокинов IL-10/антитело к CD3, иммуноцитокинов IL-10/антитело к CD8, иммуноцитокинов IL-10/антитело к CD25, иммуноцитокинов IL-10/антитело к PD-1, иммуноцитокинов IL-10/антитело к PD-L1, иммуноцитокинов IL-10/антитело к CTLA-4 и иммуноцитокинов IL-10/PD-L2-Fc, описанных в данном документе, или их фармацевтического состава. В некоторых вариантах осуществления предложен способ лечения отторжения трансплантата или БТПХ у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающий антиген-мишень (например, PD-1, PD-L1, PD-L2, CTLA-4, CD3, CD4, CD8, CD123 или CD25) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-27, IL-35 или TGF-β) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), и где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него). В некоторых вариантах осуществления предложен способ лечения отторжения трансплантата или БТПХ у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидную DC-клетку, DС-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающее антиген-мишень (например, PD-1, PD-L1, PD-L2, CTLA-4, CD3, CD4, CD25, CD123 или CD8) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-35, IL-23 или TGF-β) или его вариант, где антитело содержит тяжелую цепь, содержащую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи. В некоторых вариантах осуществления предложен способ лечения отторжения трансплантата или БТПХ у индивидуума (например, у человека), например, путем избирательного направления активности цитокинов (например, иммунодепрессивной или противовоспалительной активности цитокинов) на иммунную клетку (например, Т-клетку, В-клетку, моноцит, NK-клетку, миелоидная DC-клетку, DC-клетку плазмы, макрофаг) у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтического состава), содержащего: а) полноразмерное антитело, специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, PD-1, CD3, CD4, CD25, CD123 или CD8) на иммунной клетке; и b) иммунодепрессивный цитокин (например, IL-10, IL-27, IL-35 или TGF-β) или его вариант, где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка, или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят внутривенно, подкожно или непосредственно в опухоль. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят один раз каждые три недели. В некоторых вариантах осуществления способы лечения отторжения трансплантата, описанные в данном документе, предотвращают ухудшение, останавливают и/или облегчают по меньшей мере один симптом отторжения трансплантата у индивидуума, нуждающегося в этом; предотвращают повреждение донорских/чужеродных тканей или органов; позволяют контролировать, ослабляют и/или предотвращают инфильтрацию иммунных клеток в донорские/чужеродные ткани или органы, системное воспаление и/или цитокиновый шторм; уменьшают активацию клеток Th17; улучшают приживаемость трансплантата; продлевают выживаемость, повышают выживаемость и/или предотвращают смерть. В некоторых вариантах осуществления способы лечения БТПХ, описанные в данном документе, предотвращают ухудшение, останавливают и/или облегчают по меньшей мере один симптом БТПХ у индивидуума, нуждающегося в этом; уменьшают активацию клеток Th17; предотвращают повреждение собственных/здоровых тканей или органов; позволяют контролировать, ослабляют и/или предотвращают инфильтрацию иммунных клеток в донорские/чужеродные ткани или органы, системное воспаление и/или цитокиновый шторм; улучшают приживаемость трансплантата; продлевают выживаемость, повышают выживаемость и/или предотвращают смерть; и/или улучшают индекс активности заболевания (см., например, P.J. Martin, Biol Blood Marrow Transplant. 2009 Jul;15(7):777-784).
[416] В некоторых вариантах осуществления предложен способ избирательного стимулирования активности (сродства связывания с соответствующим рецептором цитокина или его субъединицей и/или биологической активности) цитокина или его варианта (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23), направленной на клетку, экспрессирующую антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD123, CD25, HER2, PD-1, CD3, CD4 или CD8), у индивидуума (например, у человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтических составов), где иммуноцитокин содержит: а) антигенсвязывающий белок (например, антитело, такое как полноразмерное антитело, или составной белок антигенсвязывающий фрагмент-шарнир-Fc, такой как составной белок лиганд/рецептор-шарнир-Fc), специфично распознающее антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD123, CD25, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид (например, тяжелую цепь антитела или составной полипептид антигенсвязывающий фрагмент-шарнир-Fc, такой как составной полипептид лиганд/рецептор-шарнир-Fc), содержащий, от N' к C': антигенсвязывающий фрагмент (например, лиганд, рецептор, VHH, scFv или VH), шарнирный участок и субъединицу Fc-домена или ее часть (например, CH2+CH3 или только CH2), где цитокин или его вариант расположен в шарнирном участке (например, на его N'-конце, C'-конце или внутри него); и при этом активность цитокина или его варианта избирательно активируется при связывании антигенсвязывающего белка с антигеном-мишенью. В некоторых вариантах осуществления предложен способ избирательного стимулирования активности (сродства связывания с соответствующим рецептором цитокина или его субъединицей и/или биологической активности) цитокина или его варианта (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) направленной на клетку, экспрессирующую антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8), у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтических составов), где иммуноцитокин содержит: а) антитело (например, полноразмерное антитело, антитело, содержащее только тяжелую цепь, или антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающие антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, включающую шарнирный участок, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи; и где активность цитокина или его варианта избирательно активируется при связывании антитела с антигеном-мишенью. В некоторых вариантах осуществления предложен способ избирательного стимулирования активности (сродства связывания с соответствующим рецептором цитокина или его субъединицей и/или биологической активности) цитокина или его варианта (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23), направленной на клетку, экспрессирующую антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8), у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтических составов), где иммуноцитокин содержит: а) антитело (например, полноразмерное антитело или его антигенсвязывающий фрагмент, составленный с субъединицей Fc-домена или ее частью через шарнирный участок), специфично распознающие антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, где антитело содержит тяжелую цепь, содержащую, от N-конца к С-концу: домен VH, необязательно CH1-домен, цитокин или его вариант в шарнирном участке, CH2-домен и необязательно CH3-домен; и где активность цитокина или его варианта избирательно активируется при связывании антитела с антигеном-мишенью. В некоторых вариантах осуществления предложен способ избирательного стимулирования активности (сродства связывания с соответствующим рецептором цитокина или его субъединицей и/или биологической активности) цитокина или его варианта (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23), направленную на клетку, экспрессирующую антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8), у индивидуума (например, человека), включающий введение индивидууму эффективного количества иммуноцитокина (или его фармацевтических составов), где иммуноцитокин содержит: а) полноразмерное антитело, специфично распознающие антиген-мишень (например, CTLA-4, PD-L1, PD-L2, CD25, CD123, HER2, PD-1, CD3, CD4 или CD8); и b) цитокин (например, IL-2, IFN-α (например, IFN-α2b), IFN-γ, IL-10, IL-12 или IL-23) или его вариант, и где цитокин или его вариант расположен в шарнирном участке (например, внутри шарнирного участка или между С-концом СН1 и N-концом шарнирного участка) тяжелой цепи полноразмерного антитела; и где активность цитокина или его варианта избирательно активируется при связывании полноразмерного антитела с антигеном-мишенью. В некоторых вариантах осуществления при наличии связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка антигенсвязывающий фрагмент-шарнир-Fc, такого как составной белок лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с целевым антигеном, активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта повышается не менее чем примерно на 20% (например, не менее чем примерно на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более) по сравнению с активностью в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка антигенсвязывающий фрагмент-шарнир-Fc, такого как составной белок лиганд/рецептор-шарнир-Fc) или антигенсвязывающего фрагмента (такого, как лиганд, рецептор, VHH, scFv, Fab) с антигеном-мишенью. В некоторых вариантах осуществления в отсутствие связывания антигенсвязывающего белка (например, антитела, такого как полноразмерное антитело, или составного белка антигенсвязывающий фрагмент-шарнир-Fc, такого как составной белок лиганд/рецептор-шарнир-Fc, или антигенсвязывающего фрагмента (например, лиганда, рецептора, VHH, scFv, Fab) с антигеном-мишенью активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) цитокина или его варианта, расположенного в шарнирном участке тяжелой цепи составляет не более примерно 70% (например, не более примерно 60%, 50%, 40%, 30%, 20%, 10% , 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2 %, 0,1% или 0%) от активности соответствующего цитокина или его варианта в свободном состоянии. В некоторых вариантах осуществления цитокин или его вариант представляет собой вариант цитокина, при этом активность (сродство связывания с соответствующим рецептором цитокина или его субъединицей и/или биологическая активность) варианта цитокина в свободном состоянии составляет не более примерно 80% (например, не более чем примерно 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5%) от активности соответствующего цитокина дикого типа в свободном состоянии.
[417] Введение описанных здесь иммуноцитокинов или их фармацевтических составов можно осуществлять любым удобным способом, включая инъекцию или переливание. Путь введения соответствует известным и общепринятым способам, таким как однократный или многократный болюсное введение или вливание в течение длительного периода времени, осуществляемые подходящим образом. Иммуноцитокины или их фармацевтические составы можно вводить пациенту трансартериально, подкожно, внутрикожно, внутриопухолево, интранодально, интрамедуллярно, внутримышечно, внутривенно или внутрибрюшинно. В некоторых вариантах осуществления иммуноцитокин или его фармацевтический состав вводят системно. В некоторых вариантах осуществления иммуноцитокин или его фармацевтический состав вводят индивидууму путем вливания, такого как внутривенное вливание. Методы вливания применительно к иммунотерапии известны в данной области (см., например, Rosenberg и др., New Eng. J. oF Med. 319: 1676 (1988)). В некоторых вариантах осуществления иммуноцитокин или его фармацевтический состав индивидууму вводят путем внутрикожной или подкожной (т.е. под кожу) инъекции. В случае подкожных инъекций иммуноцитокины или фармацевтические составы можно вводить с помощью шприца. Однако пригодны и другие устройства для введения иммуноцитокинов или фармацевтических составов, такие как устройства для инъекций; инжекторные ручки; автоинъекционные устройства, безыгольные устройства; и системы подкожной доставки с помощью пластырей. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят путем внутривенной инъекции. В некоторых вариантах осуществления иммуноцитокин или его фармацевтический состав вводят непосредственно в опухоль или лимфатический узел. В некоторых вариантах осуществления иммуноцитокин или содержащий его фармацевтический состав вводят локально в участок опухоли, например, непосредственно в опухолевые клетки или в ткань, содержащую опухолевые клетки. В некоторых вариантах осуществления иммуноцитокин или его фармацевтический состав вводят с помощью средств пролонгированного или замедленного высвобождения.
[418] Дозировки и желаемая концентрация лекарственного средства в фармацевтических составах настоящего изобретения могут варьироваться в зависимости от предполагаемого конкретного применения. Определение подходящей дозировки или пути введения находится в компетенции специалиста средней квалификации. Эксперименты на животных обеспечивают надежное руководство для определения эффективных доз для лечения людей. Межвидовое масштабирование эффективных доз может быть выполнено в соответствии с принципами, изложенными в Mordenti, J. и Chappell, W. «The Use oF Interspecies Scaling in Toxicokinetics», в Toxicokinetics and New Drug Development, Yacobi и др., Eds, Pergamon Press, Нью-Йорк, 1989, стр. 42-46. В объем настоящей заявки входит то, что разные составы будут эффективны для разных видов лечения и разных расстройств, и что введение, предназначенное для лечения конкретного органа или ткани, может потребовать доставки способом, отличным от способа доставки в другой орган или ткань.
[419] При введении in vivo иммуноцитокинов, описанных в данном документе, или содержащих их фармацевтических составов, нормальные дозы могут варьироваться от примерно 1 мкг/кг до примерно 10 мг/кг массы тела млекопитающего в зависимости от пути введения и типа млекопитающего. В объем настоящей заявки входит то, что разные составы будут эффективны для разных видов лечения и разных расстройств, и что введение, предназначенное для лечения конкретного органа или ткани, может потребовать доставки способом, отличным от способа доставки в другой орган или ткань. Помимо этого, дозы можно вводить одним или несколькими отдельными введениями или путем непрерывного вливания. При повторных введениях в течение нескольких дней или дольше в зависимости от состояния лечение продолжают до тех пор, пока не произойдет желаемое подавление симптомов заболевания. Однако могут быть полезны и другие режимы дозирования. Течение такого лечения легко контролировать с помощью обычных методик и анализов. В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят в количестве от примерно 1 мкг/кг до примерно 10 мг/кг, например, в любом количестве от примерно 1 мкг/кг до примерно 500 мкг/кг, от примерно 500 мкг/кг до примерно 1 мг/кг, от примерно 1 мг/кг до примерно 10 мг/кг, от примерно 1 мкг/кг до примерно 1 мг/кг, от примерно 1 мкг/кг до примерно 200 мкг/кг, от примерно 100 мкг/кг до от примерно 500 мкг/кг, от примерно 100 мкг/кг до примерно 1 мг/кг или от примерно 500 мкг/кг до примерно 1 мг/кг.
[420] В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят (например, путем вливания) индивидууму (например, человеку) в течение периода времени, не превышающего примерно 24 часа, 20 часов, 15 часов, 10 часов, 8 часов, 6 часов, 3 часа, 2 часа, 1 час, 30 минут или короче. В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят (например, путем вливания) индивидууму (например, человеку) в течение любого периода времени от примерно 30 минут до примерно 1 часа, от примерно 1 часа до примерно 2 часов, от примерно 2 часов до примерно 4 часов, от примерно 4 часов до примерно 6 часов, от примерно 6 часов до примерно 8 часов, от примерно 8 часов до примерно 10 часов, от примерно 10 часов до примерно 12 часов, от примерно 12 часов до примерно 18 часов, от примерно 18 часов до примерно 24 часов, от примерно 30 минут до примерно 2 часов, от примерно 2 часов до примерно 5 часов, от примерно 5 часов до примерно 10 часов, от примерно 10 часов до примерно 20 часов, от примерно 30 минут до примерно 10 часов или от примерно 30 минут до примерно 24 часов.
[421] В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят однократно (например, болюсная инъекция). В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят многократно (например, 2, 3, 4, 5, 6 или более раз). При многократном введении их можно осуществлять одним и тем же или разными путями, и место введения может быть одним и тем же или другим. Введение иммуноцитокина, описанного в данном документе, или его фармацевтического состава может быть от ежедневного до одного раза в год. Интервал между введениями может составлять от 24 часов до года. Интервалы также могут быть нерегулярными (например, после прогрессирования опухоли). В некоторых вариантах осуществления график дозирования не прерывают. Специалист в области медицины может легко определить оптимальную дозировку и режим лечения для конкретного пациента, наблюдая у пациента наличие признаков заболевания и соответствующим образом корректируя лечение. В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят один раз в день (ежедневно), один раз в 2 дня, один раз в 3 дня, один раз в 4 дня, один раз в 5 дней, один раз в 6 дней, один раз в неделю, 1 раз в 10 дней, 1 раз в 2 недели, 1 раз в 3 недели, 1 раз в 4 недели, 1 раз в месяц, 1 раз в 2 месяца, 1 раз в 3 месяца, 1 раз в 4 месяца, 1 раз в 5 месяцев, 1 раз в 6 месяцев, 1 раз в 7 месяцев, один раз в 8 месяцев, один раз в 9 месяцев или один раз в год. В некоторых вариантах осуществления интервал между введениями составляет от 1 недели до 2 недель, от 2 недель до 1 месяца, от 2 недель до 2 месяцев, от 1 месяца до 2 месяцев, от 1 месяца до 3 месяцев, от 3 месяцев до 6 месяцев или от 6 месяцев до года. В некоторых вариантах осуществления иммуноцитокин, описанный в данном документе, или его фармацевтический состав вводят один раз каждые три недели.
[422] В некоторых вариантах осуществления фармацевтический состав вводят дробными дозами, такими как примерно 2, 3, 4, 5 или более доз. В некоторых вариантах осуществления дробные дозы вводят в течение примерно недели, месяца, 2 месяцев, 3 месяцев или более длительного периода. В некоторых вариантах осуществления дозу делят поровну. В некоторых вариантах осуществления дробные дозы составляют примерно 20%, примерно 30% и примерно 50% от целой дозы. В некоторых вариантах осуществления интервал между последовательными дробными дозами составляет примерно 1 день, 2 дня, 3 дня, 1 неделю, 2 недели, 3 недели, месяц или дольше. При повторных введениях в течение нескольких дней или более длительного периода в зависимости от состояния лечение продолжают до тех пор, пока не произойдет желаемое подавление симптомов заболевания. Однако могут быть полезны и другие режимы дозирования. Течение такого лечения легко контролировать с помощью обычных методик и анализов.
VII. Изделия и наборы
[423] Далее предложены наборы, стандартные дозировки и изделия, содержащие любой из описанных здесь иммуноцитокинов. В некоторых вариантах осуществления предложен набор, который содержит любую из фармацевтических составов, описанных в данном документе, и предпочтительно содержит инструкции по его применению, например, для применения в лечении расстройств, описанных в данном документе (например, рака, инфекции или аутоиммунного заболевания).
[424] Наборы согласно данному изобретению включают один или несколько контейнеров, содержащих иммуноцитокин, описанный в данном документе, для лечения заболевания. Например, инструкции содержат описание введения иммуноцитокина для лечения заболевания, такого как рак. Набор может дополнительно содержать описание выбора индивидуума (например, человека), подходящего для лечения, на основе выявления у этого индивидуума заболевания и стадии заболевания. Инструкции, относящиеся к применению иммуноцитокина, обычно включают информацию о дозировке, режиме дозирования и способе введения для предполагаемого лечения. Контейнеры могут представлять собой стандартные дозы, объемные упаковки (например, многодозовые упаковки) или частичные дозы. Инструкции, прилагаемые к наборам данного изобретения, обычно представляют собой письменные инструкции на этикетке или вкладыше в упаковку (например, лист бумаги, входящий в комплект), но также возможны и машиночитаемые инструкции (например, инструкции на магнитном или оптическом диске). Наборы настоящего изобретения содержатся в подходящей упаковке. Подходящая упаковка включает, помимо прочего, флаконы, бутылки, банки, мягкую упаковку (например, запечатанные майларовые или полиэтиленовые пакеты) и т.п. Также рассматриваются упаковки для использования в сочетании с конкретным устройством, таким как инфузионное устройство, такое как мининасос. Набор может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). По меньшей мере одно активное средство в составе представляет собой иммуноцитокин, как описано в данном документе. Контейнер может дополнительно содержать второй фармацевтически активное средство. Наборы могут необязательно содержать дополнительные компоненты, такие как буферы и разъясняющая информация. Обычно набор включает контейнер и этикетку или лист-вкладыш (вкладыши) на контейнере или вместе с ним.
[425] Таким образом, в настоящей заявке также предложены промышленные изделия, которые включают флаконы (такие как запечатанные флаконы), бутылки, банки, мягкую упаковку и т.п. Промышленное изделие может содержать контейнер и этикетку или лист-вкладыш на контейнере или вместе с ним. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластик. Как правило, контейнер содержит состав, который эффективен для лечения заболевания или расстройства (например, рака), описанного в данном документе, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или флакон с прокалываемой иглой для подкожных инъекций пробкой). На этикетке или листке-вкладыше указывается, что состав применяется для лечения конкретного состояния у индивидуума. Этикетка или вкладыш в упаковке дополнительно содержат инструкции по введению состава индивидууму. На этикетке могут быть указаны инструкции по восстановлению состава и/или его применению. Контейнер, содержащий фармацевтический состав, может быть многоразовым флаконом, что позволяет повторное введение (например, 2-6 введений) восстановленной лекарственной формы. Вкладыш в упаковке относится к инструкциям, обычно включаемым в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, противопоказаниях и/или предупреждениях относительно использования таких терапевтических продуктов. Кроме того, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Кроме того, он может включать другие материалы, желательные с коммерческой точки зрения и с точки зрения пользователя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
[426] Наборы или изделия могут включать несколько стандартных доз фармацевтического состава и инструкции по применению, расфасованные в количествах, достаточных для хранения и использования в аптеках, например, больничных аптеках и рецептурных аптеках.
ПРИМЕРЫ
[427] Приведенные ниже примеры предназначены только для иллюстрации изобретения и поэтому не должны рассматриваться как каким-либо образом ограничивающие изобретение. Следующие примеры и подробное описание прилагаются в качестве иллюстрации, а не в качестве ограничения.
Пример 1: Положение цитокина или его варианта в составе иммуноцитокина влияет на биологическую активность цитокина или его варианта.
Конструирование иммуноцитокинов IL-2/антитело к HER2 различных конфигураций
[428] Антитело к HER2, содержащее VH (SEQ ID NO: 150) и VL (SEQ ID NO: 151) из трастузумаба (Herceptin®) использовали в качестве исходного полноразмерного антитела (фигура 1А), содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 154. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок, содержащий SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Вариант IL-2, содержащий тройные мутации R38D/K43E/E61R (SEQ ID NO: 2) использовали в качестве варианта цитокина, блокирующего связывание IL-2 с IL-2Rα (CD25). При конструировании различных иммуноцитокинов IL-2/антитело к HER2 вариант IL-2 размещали в положениях, указанных ниже: i) вариант IL-2 составляли с N-концом субъединицы Fc-фрагмента (пример строения см. на фигуре 1B), именуемый в дальнейшем «мутантный IL-2-Fc-Her2 Ab»; ii) вариант IL-2 составляли с С-концом тяжелой цепи антитела к HER2 (пример строения см. на фигуре 1C), далее именуемый «Fab-Fc-мутантный IL-2-Her2 Ab»; и iii) вариант IL-2 размещали в шарнирном участке тяжелой цепи антитела к HER2 (пример строения см. на фигуре 2A), далее именуемый «Fab-мутантный IL-2-Fc-Her2 Ab». Иммуноцитокин Fab-мутантный IL-2-Fc-Her2 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 154, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 155, и одну тяжелую цепь с вариантом IL-2, расположенным в шарнирном участке, содержащую аминокислотную последовательность SEQ ID NO: 156.
[429] Нуклеиновые кислоты, кодирующие различные конфигурации иммуноцитокинов IL-2/антитело к HER2, синтезировали химическими методами, клонировали в лентивирусный вектор и трансфецировали в клетки СНО для экспрессии иммуноцитокинов. Экспрессированные иммуноцитокины собирали из надосадочной жидкости, очищали с помощью хроматографии на белке А и проверяли чистоту с помощью SDS-PAGE.
Анализ передачи сигнала IL-2
[430] Клетки HEK-Blue™ IL-2 (InvivoGen кат. № hkb-il2) и клетки HEK-PD-1-IL-2 (полученные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-2 с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IL-2 различных иммуноцитокинов IL-2/антитело к HER2 в соответствии с руководством пользователя InvivoGen (InvivoGen кат. № hkb-il2), далее именуемым «репортерный анализ HEK-IL-2» или «репортерный анализ HEK-PD-1-IL-2». Репортерные клетки HEK-Blue™ IL-2 и репортерные клетки HEK-PD-1-IL-2 стабильно экспрессируют человеческий рецептор IL-2 (человеческие IL-2Rα, IL-2Rβ и IL-2Rγ) вместе с человеческим JAK3 и STAT5 для получения полностью функционального сигнального пути IL-2. Кроме того, эти репортерные клетки также несут репортерный ген секретируемой эмбриональной щелочной фосфатазы (SEAP), индуцируемой STAT5. При стимуляции IL-2 репортерные клетки HEK-Blue™ IL-2 и репортерные клетки HEK-PD-1-IL-2 запускают активацию STAT5 и последующую секрецию SEAP, уровни которой можно контролировать с помощью колориметрического ферментного анализа QUANTI-Blue™ (InvivoGen кат. № rep-qbs) активности щелочной фосфатазы.
[431] Вкратце, клетки IL-2 HEK-Blue™ добавляли к различным иммуноцитокинам IL-2/антитела к HER2 в каждую лунку планшета (или к рекомбинантному человеческому IL-2 в лунке в качестве положительного контроля, антителу к HER2 - трастузумабу (Herceptin®) - в лунке в качестве отрицательного контроля) и инкубировали при 37°С в СО2 камере в течение 20-24 часов или в течение ночи. После инкубирования надосадочную жидкость переносили в свежие лунки планшета, добавляли раствор QUANTI-Blue™ и инкубировали при 37°C в камере в течение 30 минут-3 часов. Затем определяли уровни SEAP с помощью спектрофотометра при 620-655 нм. Активность рекомбинантного человеческого IL-2 (положительный контроль) в активации сигнального пути IL-2 измеряли как 10 единиц/нг и использовали в качестве эталона. Процент передачи сигнала IL-2 для различных иммуноцитокинов IL-2/антитело к HER2 рассчитывали путем деления полученных для иммуноцитокинов IL-2/антитело к HER2 показателей на показатели рекомбинантного человеческого IL-2.
Анализ пролиферации РВМС
[432] Биологическую активность IL-2 также можно проверить с помощью анализа пролиферации/выживаемости мононуклеарных клеток периферической крови (PBMC). IL-2 необходим для пролиферации и выживания активированных Т-клеток. РВМС человека (80 000 клеток/лунку) стимулировали антителом к CD3 (OKT3, 0,5 мкг/мл) в присутствии возрастающих концентраций рекомбинантного человеческого IL-2 («rIL-2»; 0, 0,04, 0,2, 1,0 или 5,0 нг/мл). Было определено, что 1 нг/мл rIL-2 является минимальной концентрацией, необходимой для пролиферации Т-клеток, исходя из количества клеток РВМС (<80 000 клеток/лунку) и жизнеспособности после 6-дневного культивирования. Для определения минимальной концентрации иммуноцитокина IL-2/антитело к HER2, необходимой для пролиферации Т-клеток, РВМС (80 000 клеток/лунку) стимулировали антителом к CD3 (ОКТ3, 0,5 мкг/мл) в присутствии возрастающих концентраций различных конфигураций иммуноцитокинов IL-2/антитело к HER2 (0, 0,32, 1,6, 8, 40, 200 или 1000 нг/мл). rIL-2 в свободном состоянии служил положительным контролем (0,2 или 1 нг/мл). Процент Т-клеточной пролиферации иммуноцитокина IL-2/антитело к HER2 по отношению к rIL-2 рассчитывали путем нормализации по соответствующим молекулярным массам. Молекулярная масса иммуноцитокина IL-2/антитело к HER2 и rIL-2 составляет примерно 162 кДа и 12 кДа соответственно, поэтому примерно 13 нг иммуноцитокина IL-2/антитело к HER2 эквивалентны примерно 1 нг rIL-2 при той же молярной концентрации IL-2.
[433] Как видно из таблицы 1, при составлении варианта IL-2 с N-концом субъединицы Fc-фрагмента антитела к HER2 (мутантный IL-2-Fc-Her2 Ab), такой вариант IL-2 сохранил примерно 12,0% своей биологической активности, измеренной с помощью анализа передачи сигнала IL-2, и примерно 4,3% своей биологической активности, измеренной с помощью анализа пролиферации РВМС. Если вариант IL-2 составлен с С-концом тяжелой цепи антитела к HER2 (Fab-Fc-мутантный IL-2-Her2 Ab), то такой вариант IL-2 сохранял примерно 6,3% своей биологической активности, как было измерено с помощью анализа передачи сигнала IL-2, и примерно 3,1% своей биологической активности, измеренной с помощью анализа пролиферации РВМС. Если вариант IL-2 расположен в шарнирном участке тяжелой цепи антитела к HER2 (Fab-мутантный IL-2-Fc-Her2 Ab), то такой вариант IL-2 сохранял только примерно 2,3% своей биологической активности, как было измерено с помощью анализа передачи сигнала IL-2, а согласно измерениям с помощью анализа пролиферации РВМС вся его биологическая активность была утеряна. Можно считать, что эти результаты отражают активность варианта IL-2 в отсутствие связывания антигенсвязывающего фрагмента к HER2 с HER2, поскольку клетки HEK-IL-2 и РВМС имеют минимальную экспрессию HER2 на клеточной поверхности.
[434] Следовательно, цитокин (например, вариант IL-2), расположенный в шарнирном участке тяжелой цепи полноразмерного антитела (например, антитела к HER2) в отсутствие связывания антитела с антигеном-мишенью (например, с HER2) проявляли более ограниченную биологическую активность по сравнению с тем, когда такой цитокин располагался на N-конце субъединицы Fc-фрагмента или на С-конце тяжелой цепи полноразмерного антитела, например, как было измерено с помощью анализа передачи сигнала или анализа пролиферации РВМС.
Пример 2: Иммуноцитокин с цитокином, расположенным в шарнирном участке, проявляет цитокиновую активность, зависящую от связывания с антигеном-мишенью
[435] Антитело к CD3, специфично распознающее CD3ε (собственного производства), содержащее VH (SEQ ID NO: 91) и VL (SEQ ID NO: 92) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 94. Это антитело к CD3ε не конкурирует с антителом OKT3 за связывание с CD3 и не способно активировать передачу сигнала TCR (т.е. представляет собой неактивное антитело к CD3), и, следовательно, не может стимулировать пролиферацию РВМС или Т-клеток. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок, содержащий SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Вариант IL-2, содержащий тройные мутации R38D/K43E/E61R (SEQ ID NO: 2) размещали в положениях, указанных ниже, при конструировании различных иммуноцитокинов IL-2/антитело к CD3: i) вариант IL-2 составляли с N-концом субъединицы Fc-фрагмента (пример строения см. на фигуре 1B), именуемый в дальнейшем «мутантный IL-2-Fc-CD3 Ab»; ii) вариант IL-2 составляли с С-концом тяжелой цепи антитела к CD3 (пример строения см. на фигуре 1C), далее именуемый «Fab-Fc-мутантный IL-2-CD3 Ab»; и iii) вариант IL-2 размещали в шарнирном участке тяжелой цепи антитела к CD3 (пример строения см. на фигуре 2A), далее именуемый «Fab-мутантный IL-2-Fc-CD3 Ab». Иммуноцитокин Fab-мутантный IL-2-Fc-CD3 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 94, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 95, и одну тяжелую цепь с вариантом IL-2, расположенным в шарнирном участке, содержащую аминокислотную последовательность SEQ ID NO: 96. Иммуноцитокины IL-2/антитело к CD3 конструировали, экспрессировали и очищали, как описано в примере 1. Активность связывания различных конфигураций иммуноцитокинов IL-2/антитело к CD3 с CD3+ Т-клетками была проверена с использованием FACS.
[436] Анализ передачи сигнала IL-2 с использованием клеток HEK-Blue™ IL-2 и анализ пролиферации РВМС проводили так же, как описано в примере 1, с различными конфигурациями иммуноцитокинов IL-2/антитело к CD3, rIL-2 (положительный контроль), или антитело к CD3 (собственного производства; отрицательный контроль).
[437] Поскольку клетки HEK-IL-2 не экспрессируют CD3 на клеточной поверхности, анализ передачи сигнала IL-2 с репортерными клетками HEK-IL-2 отражает активность варианта IL-2 в отсутствие связывания CD3-распознающего антигенсвязывающего фрагмента с CD3. Как видно из таблицы 2, при составлении варианта IL-2 с N-концом субъединицы Fc-фрагмента антитела CD3 (мутантантный IL-2-Fc-CD3 Ab) такой вариант IL-2 сохранял примерно 11,0% своей биологической активности; при составлении варианта IL-2 с С-концом тяжелой цепи антитела к CD3 (Fab-Fc-мутантный IL-2-CD3 Ab) такой вариант IL-2 сохранял примерно 6,7% своей биологической активности; если вариант IL-2 был расположен в шарнирном участке тяжелой цепи антитела к CD3 (Fab-мутантный IL-2-Fc-CD3 Ab), то такой вариант IL-2 сохранял лишь примерно 2,5% своей биологической активности. Этот результат согласуется с результатом, приведенным в таблице 1 для иммуноцитокинов IL-2/антитело к HER2, измеренным с помощью анализа передачи сигнала IL-2.
[438] В присутствии связывания CD3-распознающего антигенсвязывающего фрагмента с CD3 в РВМС (CD3+ Т-клетках) все иммуноцитокины IL-2/антитело к CD3 продемонстрировали гораздо более высокую биологическую активность IL-2 по сравнению с активностью без связывания с CD3. Как показано в анализе пролиферации РВМС в таблице 2, при составлении варианта IL-2 с N-концом субъединицы Fc-фрагмента антитела к CD3 (мутантный IL-2-Fc-CD3 Ab) биологическая активность варианта IL-2 повышалась примерно до 39,0% после связывания антитела к CD3 с CD3; при составлении варианта IL-2 с С-концом тяжелой цепи антитела к CD3 (Fab-Fc-мутантный IL-2-CD3 Ab) биологическая активность варианта IL-2 повышалась примерно до 52,0% после связывания антитела к CD3 с CD3. Такое увеличение биологической активности цитокинов, вероятно, было связано с тем, что связывание антиген-антитело приблизило цитокиновый фрагмент к его рецептору и увеличило вероятность связывания цитокина с рецептором, и/или происходило вследствие стабилизирующего эффекта от связывания антитела с антигеном. Неожиданно вариант IL-2, расположенный в шарнирном участке тяжелой цепи антитела к CD3, проявил биологическую активность IL-2 при связывании антитела к CD3 с CD3, которая повысилась примерно до 45,0%, что было даже сильнее, чем когда цитокин составлен с N-концом (мутантный IL-2-Fc-CD3 Ab).
[439] С учетом результатов, приведенных в таблице 1 и 2, биологическая активность цитокина (например, варианта IL-2), расположенного в шарнирном участке тяжелой цепи полноразмерного антитела, зависит от связывания с антигеном-мишенью (например, с CD3). Иммуноцитокины IL-2/антитело к HER2 независимо от конфигурации были неспособны связываться с Т-клетками или клетками HEK-IL-2. Особенно в случае иммуноцитокина, в котором цитокин расположен в шарнирном участке тяжелой цепи полноразмерного антитела, без связывания целевого антигена частью антитела, такой цитокин не может проявлять биологическую активность. См. 0,0% пролиферации РВМС в таблице 1 у Fab-мутантный IL-2-Fc-Her2 Ab. Напротив, иммуноцитокины IL-2/антитела к CD3, которые способны связываться с Т-клетками через CD3, проявляли биологическую активность цитокина, расположенного в шарнирном участке тяжелой цепи полноразмерного антитела. См. 45,0% пролиферации РВМС в таблице 2 у Fab-мутантный IL-2-Fc-CD3 Ab. Эти результаты позволяют предположить, что иммуноцитокин, содержащий цитокин, расположенный в шарнирном участке тяжелой цепи полноразмерного антитела, может обеспечивать специфичность к мишени и снижать цитокиновый шторм.
Пример 3: Иммуноцитокины с цитокином, расположенным в шарнирном участке, сначала способствуют связыванию антигена-мишени антителом (или лигандом-рецептором), а затем связыванию цитокина с цитокиновым рецептором.
[440] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок, содержащий SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Вариант IL-2, содержащий тройные мутации R38D/K43E/E61R (SEQ ID NO: 2) помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2А), чтобы сконструировать иммуноцитокин IL-2/антитело к PD-1 «Fab-мутантный IL-2-Fc-PD-1 Ab». Иммуноцитокин Fab-мутантный IL-2-Fc-PD-1 Ab (или «иммуноцитокин IL-2 (R38D/K43E/E61R)/антитело к PD-1») содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID НЕТ: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с вариантом IL-2, расположенным в шарнирном участке, содержащую аминокислотную последовательность SEQ ID NO: 108.
[441] Составной белок PD-L2-Fc (внеклеточный домен PD-L2, составленный с N-концом Fc-фрагмента через N'-усеченный шарнир IgG1 (SEQ ID NO: 50); SEQ ID NO: 177) использовали в качестве другой исходной конструкции для конструирования иммуноцитокинов, связывающих PD-1. Для конструирования гетеродимерного составного белка PD-L2-Fc использовали один составной полипептид PD-L2-Fc, содержащий шарнирный участок с SEQ ID NO: 52, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другой составной полипептид PD-L2-Fc, содержащий шарнирный участок с SEQ ID NO: 51, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Иммуноцитокин IL-2/PD-L2-Fc «лиганд-мутантный IL-2-PD-L2-Fc» или «иммуноцитокин IL-2(R38D/K43E/E61R)/PD-L2-Fc» (или «конструкция № 11») содержит один составной полипептид (SEQ ID NO: 180), от N' до С': Внеклеточный домен PD-L2 - линкер GGGGS (SEQ ID NO: 213) - вариант IL-2 (SEQ ID NO: 2) - N'-усеченный шарнир IgG1 (SEQ ID NO: 52) - Fc-фрагмент и один спаренный полипептид (SEQ ID NO: 179), содержащий от N' к C': внеклеточный домен PD-L2 - линкер GGGGS (SEQ ID NO: 213) - вариант IL-2 (SEQ ID NO: 2) - N'-усеченный шарнир IgG1 (SEQ ID NO: 51) - парный Fc-фрагмент.
[442] Fab-мутантный IL-2-Fc-PD-1 Ab и лиганд-мутантный IL-2-PD-L2-Fc были сконструированы, экспрессированы и очищены, как описано в примере 1. FACS использовали для подтверждения того, что как Fab-IL-2 мутантный Fc-PD-1 Ab, так и лиганд-мутантный IL-2-PD-L2-Fc связываются с клетками HEK-PD-1-IL-2 (созданными нами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-2 с использованием лентивирусного вектора), но не в клетках HEK-Blue™ IL-2 (InvivoGen кат. № hkb-il2).
[443] Клетки HEK-Blue™ IL-2 и клетки HEK-PD-1-IL-2 использовали для оценки активности активации сигнала IL-2 Fab-мутантный IL-2-Fc-PD-1 Ab и лиганд-мутантный IL-2-PD-L2-Fc, как описано в Примере 1. Рекомбинантный человеческий IL-2 (rIL-2) служил в качестве положительного контроля. Антитело к PD-1 - ниволумаб (Opdivo®) - и исходный составной белок PD-L2-Fc (каждая полипептидная цепь содержит SEQ ID NO: 177) служили отрицательным контролем.
[444] В соответствии с данными, приведенными в примерах 1 и 2, в отсутствие связывания антигена-мишени (PD-1) IL-2, расположенный в шарнирном участке иммуноцитокина, проявлял невысокую биологическую активность (2,1% или 2,4%) по сравнению с rIL-2 в свободном состоянии (100,0%), измеренную с помощью репортерного анализа HEK-IL-2. Сравнение результатов репортерного анализа HEK-IL-2 и репортерного анализа HEK-PD-1-IL-2 в таблице 3 показывает, что связывание антигенсвязывающего фрагмента антитела к PD-1 или внеклеточного домена PD-L2 с PD-1 на клеточной поверхности значительно облегчает взаимодействие варианта IL-2 с рецептором IL-2. Другими словами, иммуноцитокины с цитокином, расположенным в шарнирном участке, благоприятствовали сначала связыванию антигена-мишени с антителом (Fab-мутантный IL-2-Fc-PD-1 Ab, 35,2% по сравнению с 2,1%) или связыванию лиганда с рецептором (лиганд-мутантный IL-2-PD-L2-Fc, 43,5% по сравнению с 2,4%), а затем - связыванию цитокина с цитокиновым рецептором.
Пример 4: Получение вариантов IL-12 со сниженной биологической активностью в отсутствие связывания антигена-мишени иммуноцитокинами
Конструирование вариантов IL-12 и их иммуноцитокинов
[445] IL-12 представляет собой гетеродимерный цитокин, состоящий из ковалентно связанных субъединиц p35 и p40. Варианты IL-12, содержащие аминокислотную замену в субъединице p40, конструировали путем замены аминокислот в положениях 56-65 в субъединице p40 аланином или серином (см. Таблицу 4) и получали одноцепочечный вариант IL-12, от N' к C': субъединица варианта p40 - линкер (SEQ ID NO: 228) - субъединица p35 дикого типа (SEQ ID NO: 29). Одноцепочечный IL-12 «дикого типа» также был сконструирован в качестве контроля (SEQ ID NO: 35), от N' к C': субъединица p40 дикого типа - линкер (SEQ ID NO: 228) - субъединица p35 дикого типа, обозначенная как «WT» в таблице 4.
[446] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другую тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Различные одноцепочечные варианты IL-12 (или одноцепочечный контрольный IL-12 «дикого типа») помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2B), чтобы сконструировать иммуноцитокины IL-12/антитело к PD-1 «Fab-IL-12-Fc-PD-1 Ab». Например, иммуноцитокин Fab-IL-12(E59A/F60A)-Fc-PD-1 Ab (или «иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1» или «конструкция № 48»), содержащий одноцепочечный вариант IL-12 IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35), расположенный в шарнирном участке, содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IL-12(E59A/F60A) (SEQ ID NO: 36), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 112. Иммуноцитокин IL-12(G64A)/антитело к PD-1 («конструкция №47»), содержащий одноцепочечный вариант IL-12 IL-12B (p40 G64A)-линкер-IL-12A (wt p35), расположенный в шарнире, содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IL-12(G64A) (SEQ ID NO: 332), расположенным в шарнирном участке. Иммуноцитокин IL-12(E59A)/антитело к PD-1 («конструкция №46»), содержащий одноцепочечный вариант IL-12 IL-12B (p40 E59A)-линкер-IL-12A (wt p35), расположенный в шарнире, содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелая цепь с одноцепочечным вариантом IL-12(E59A) (SEQ ID NO: 331), расположенным в шарнирном участке. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
Анализ передачи сигнала IL-12
[447] Клетки HEK-Blue™ IL-12 (InvivoGen кат. № hkb-il12) и клетки HEK-PD-1-IL-12 (полученные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-12 с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IL-12 различных иммуноцитокинов Fab-IL-12-Fc-PD-1 Ab, содержащих различные фрагменты IL-12, в соответствии с руководством для пользователя InvivoGen (InvivoGen кат. № hkb-il12), далее именуемым «репортерный анализ HEK-IL-12» или «репортерный анализ HEK-PD-1-IL-12». Репортерные клетки HEK-Blue™ IL-12 и репортерные клетки HEK-PD-1-IL-12 стабильно экспрессируют рецепторный комплекс человеческого IL-12, состоящий из рецептора IL-12 β1 (IL-12Rβ1) и IL-12Rβ2, наряду с человеческим геном STAT4 для получения полностью функционального сигнального пути IL-12 (TyK2/JAK2/STAT4). Кроме того, эти репортерные клетки также несут STAT4-индуцируемый репортерный ген SEAP. При стимуляции IL-2 репортерные клетки HEK-Blue™ IL-12 и репортерные клетки HEK-PD-1-IL-12 запускают активацию STAT4 и последующую секрецию SEAP, уровни которой можно контролировать с помощью колориметрического ферментного анализа QUANTI-Blue™ (InvivoGen кат. № rep-qbs) активности щелочной фосфатазы. Экспериментальная процедура анализа передачи сигнала IL-2 была аналогична описанной в примере 1. Рекомбинантный человеческий IL-12 (rIL-12) в свободном состоянии служил в качестве положительного контроля и эталона для расчета процента активности.
[448] В репортерном анализе HEK-IL-12 антитела Fab-IL-12-Fc-PD-1 были способны связываться с клетками HEK-IL-12 только черз взаимодействие фрагмента IL-12 с рецептором IL-12. Размещение IL-12, содержащего субъединицу p40 дикого типа, в шарнирном участке антитела к PD-1 («Fab-IL-12(WT)-Fc-PD-1 Ab») снижало активность IL-12 до 50,0% в отсутствие связывания с PD-1. Как видно из табл. 4, положения 59 и 60 в субъединице р40 являются ключевыми для биологической активности IL-12. Fab-IL-12-Fc-PD-1 Ab, содержащее двойные мутации E59A/F60A в субъединице p40 IL-12 («Fab-IL-12(E59A/F60A)-Fc-PD-1 Ab»), почти полностью прекратили активность IL-12, измеренную по передаче сигнала IL-12 (0,1%).
[449] В репортерном анализе HEK-PD-1-IL-12 антитела Fab-IL-12-Fc-PD-1 были способны связываться с клетками HEK-PD-1-IL-12 как путем взаимодействия IL-12 фрагмента с рецептором IL-12, так и путем взаимодействия антигенсвязывающего фрагмента антитела к PD-1 с PD-1. Как видно из таблицы 4, биологическая активность всех вариантов IL-12 (и IL-12 дикого типа) в Fab-IL-12-Fc-PD-1 Ab увеличивалась в присутствии связывания с PD-1. В частности, активность IL-12 антитела Fab-IL-12(E59A/F60A)-Fc-PD-1 Ab была восстановлена до 5,9% за счет связывания PD-1/антитело к PD-1, что в 59 раз выше активности в отсутствие связывания PD-1/антитело к PD-1 (0,1%).
[450] Двойные мутации E59A/F60A в субъединице p40 IL-12 продемонстрировали превосходный эффект по сравнению с другими мутациями в субъединице p40 IL-12. Помещая этот вариант IL-12 E59A/F60A в шарнирный участок тяжелой цепи полноразмерного антитела к PD-1, полученный иммуноцитокин Fab-IL-12(E59A/F60A)-Fc-PD-1 Ab проявлял биологическую активность IL-12 только при наличии связывания антигена-мишени (PD-1) с антителом, но не в отсутствие связывания антигена-мишени (PD-1) с антителом, что демонстрирует направленную специфичность.
Пример 5: Получение иммуноцитокина IL-12/антитело к CD4 (Fab-IL-12-Fc-CD4 Ab) с биологической активностью IL-12, направленной на CD4+ Т-клетки
Конструирование иммуноцитокинов Fab-IL-12-Fc-CD4 Ab
[451] Антитело к CD4, содержащее ибализумаб (Trogarzo®) VH (SEQ ID NO: 73) и VL (SEQ ID NO: 74) использовали в качестве исходного полноразмерного антитела к CD4, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77. Ибализумаб представляет собой неиммуносупрессивное гуманизированное моноклональное антитело, одобренное FDA для лечения ВИЧ. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другую тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Одноцепочечный IL-12 «дикого типа» или вариант IL-12, содержащий двойную мутацию E59A, F60A или E59A/F60A в субъединице p40 (SEQ ID NO: 31-33), как описано в примере 4, помещали в шарнирный участок тяжелой цепи антитела к CD4 (пример строения см. на фигуре 2В), чтобы сконструировать иммуноцитокины IL-12/антитело к CD4 «Fab-IL-12-Fc-CD4 Ab». Например, иммуноцитокин Fab-IL-12(E59A/F60A)-Fc-CD4 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78, и одну тяжелую цепь с одноцепочечным вариантом IL-12 (SEQ ID NO: 36), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 83. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1. FACS использовали для подтверждения того, что антитела Fab-IL-12-Fc-CD4 были способны связываться с CD4+ Т-клетками, но не с CD8+ Т-клетками (данные не показаны).
Анализ высвобождения гамма-интерферона (IGRA) для измерения биологической активности IL-12 или IL-23
[452] Биологическую активность IL-12 или IL-23 можно измерить по количеству IFN-γ, высвобождаемому из активированных Т-клеток. Связывание IL-12 с его рецептором (гетеродимерным рецептором, состоящим из субъединиц IL-12R-β1 и IL-12R-β2) запускает сигнальный путь с участием TyK2 (тирозинкиназы 2), JAK2 (янускиназы 2) и STAT4 (переносчика сигнала и активатора транскрипции 4), что приводит к выработке IFN-γ. CD4+ Т-клетки или CD8+ Т-клетки выделяли из РВМС и стимулировали антителом к CD3 (1 мкг/мл OKT3) в присутствии рекомбинантного человеческого IL-2 (30 единиц/мл) в течение 5 дней. Через 5 дней активированные CD4+ или CD8+ Т-клетки (80 000 клеток/лунку) культивировали в присутствии возрастающих концентраций рекомбинантного человеческого IL-12 (rIL-12) или рекомбинантного человеческого IL-23 (rIL-23) (0, 0,62, 1,25, 2,5, 5, 10 или 20 нг/мл). На следующий день содержание IFN-γ, высвобождаемого в среду для культивирования клеток, измеряли с помощью анализа ELISA. Процент биологической активности IL-12 или IL-23 рассчитывали путем деления показаний IL-12-иммуноцитокина или IL-23-иммуноцитокина на показания rIL-12 или rIL-23.
[453] Минимальная концентрация rIL-12, необходимая для стимуляции высвобождения IFN-γ из активированных Т-клеток, составляла 2,5 нг/мл, а для rIL-23 - 5 нг/мл. Чтобы определить минимальную концентрацию IL-12-иммуноцитокина или IL-23-иммуноцитокина для наблюдения положительного биологического ответа, активированные CD4+ или CD8+ T-клетки (80 000 клеток/лунку) культивировали в течение ночи в присутствии возрастающих концентраций IL- 12-иммуноцитокинов или IL-23-иммуноцитокинов (0, 0,32, 1,6, 8, 40, 200 или 1000 нг/мл). rIL-12 (2,5 нг/мл) или rIL-23 (5 нг/мл) служили положительным контролем. Биологическую активность IL-12-иммуноцитокина или IL-23-иммуноцитокина по отношению к активности соответствующего цитокина в свободном состоянии (rIL-12 или rIL-23), выраженную в процентах, рассчитывали путем нормализации к соответствующим молекулярным массам. Молекулярные массы IL-12-иммуноцитокина и rIL-12 составляют примерно 220 кДа и примерно 70 кДа, соответственно. Молекулярные массы IL-23-иммуноцитокина и rIL-23 составляют примерно 215 кДа и примерно 65 кДа, соответственно. Следовательно, примерно 3 нг IL-12-иммуноцитокина или IL-23-иммуноцитокина эквивалентны примерно 1 нг rIL-12 или rIL-23 при той же молярной концентрации IL-12 или IL-23.
[454] Как видно из Таблицы 5, при размещении IL-12, содержащего субъединицу p40 дикого типа, в шарнирном участке все еще сохранялось примерно 25,0% активности IL-12 даже в отсутствие связывания антигена-мишени (CD4) с антителом в CD8+ T-клетках. Мутации E59A и F60A в субъединице p40 значительно снижали активность IL-12 примерно до 1,1% или 1,5% в отсутствие связывания CD4/антитело к CD4, которая повышалась примерно до 29,8% или 32,2% при наличии связывания CD4+ Т-клетка/антитело к CD4. Антитело Fab-IL-12-Fc-CD4, содержащее двойные мутации E59A/F60A в субъединице p40 IL-12 («Fab-IL-12(E59A/F60A)-Fc-CD4 Ab»), продемонстрировало биологическую активность IL-12, специфичную к CD4+ T-клетки, (8,2%), при отсутствии перекрестной реактивности с CD8+ Т-клетками (0,0%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к CD4, которые могут специфично нацеливать биологическую активность цитокинов (например, IL-12) на CD4+ Т-клетки.
Пример 6: Получение иммуноцитокина IL-12/антитело к CD8 (Fab-IL-12-Fc-CD8 Ab) с биологической активностью IL-12, направленной на CD8+ Т-клетки
[455] Антитело к CD8, содержащее клон G10-1 VH (SEQ ID NO: 114) и VL (SEQ ID NO: 115) использовали в качестве исходного полноразмерного антитела к CD8, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 117. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Одноцепочечный IL-12 «дикого типа» или вариант IL-12, содержащий двойную мутацию E59A, F60A или E59A/F60A в субъединице p40 (SEQ ID NO: 31-33), как описано в примере 4, помещали в шарнирный участок тяжелой цепи антитела к CD8 (пример строения см. на фигуре 2В), чтобы сконструировать иммуноцитокины IL-12/антитело к CD8 «Fab-IL-12-Fc-CD8 Ab». Например, иммуноцитокин Fab-IL-12(E59A/F60A)-Fc-CD8 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 117, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 118, и одну тяжелую цепь с одноцепочечным вариантом IL-12 (SEQ ID NO: 36), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 123. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1. FACS использовали для подтверждения того, что антитела Fab-IL-12-Fc-CD8 были способны связываться с CD8+ Т-клетками, но не с CD4+ Т-клетками (данные не показаны).
[456] Анализ высвобождения IFN-γ проводили подобно тому, как описано в примере 5, путем культивирования активированных CD4+ или CD8+ Т-клеток в присутствии повышающихся концентраций rIL-12 (положительный контроль) или антител Fab-IL-12-Fc-CD8. На следующий день содержание IFN-γ, высвобождаемого в среду для культивирования клеток, измеряли с помощью анализа ELISA. Биологическую активность IL-12 в процентах рассчитывали путем деления данных для Fab-IL-12-Fc-CD8 Ab на данные для rIL-12.
[457] Как видно из Таблицы 6, при размещении IL-12, содержащего субъединицу p40 дикого типа, в шарнирном участке все еще сохранялся примерно 21,0% активности IL-12 даже в отсутствие связывания антигена-мишени (CD8) с антителом в CD4+ T-клетках. Мутации E59A и F60A в субъединице p40 значительно снижали активность IL-12 примерно до 2,1% или 1,2% в отсутствие связывания CD8/антитело к CD8, которая повышалась примерно до 24,2% или 21,9% при наличии связывания CD8+ Т-клетки/антитело к CD8. Антитело Fab-IL-12-Fc-CD8, содержащее двойные мутации E59A/F60A в субъединице p40 IL-12 («Fab-IL-12(E59A/F60A)-Fc-CD8 Ab»), продемонстрировало биологическую активность IL-12, специфичную к CD8+ T-клеткам, (11,0%), при отсутствии перекрестной реактивности с CD4+ Т-клетками (0,0%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к CD8, которые могут специфично нацеливать биологическую активность цитокинов (например, IL-12) на CD8+ Т-клетки.
Пример 7: Получение иммуноцитокина IL-23/антитело к PD-1 (Fab-IL-23-Fc-PD-1 Ab) с биологической активностью IL-23, направленной на PD-1-положительные клетки
Конструирование вариантов IL-23 и их иммуноцитокинов
[458] IL-23 представляет собой гетеродимерный цитокин, состоящий из субъединицы р19 и субъединицы р40. Субъединица p40 является общей с IL-12. Варианты IL-23 конструировали подобно тому, как описано в примере 4, путем создания аминокислотных замен в общей субъединице p40 (см. Таблицу 7). Был получен одноцепочечный вариант IL-23, от N' к C': вариантная субъединица p40 (SEQ ID NO: 31-34) - линкер (SEQ ID NO: 229) - субъединица p19 дикого типа (SEQ ID NO: 37). Также конструировали одноцепочечный IL-23 «дикого типа» для использования в качестве контроля (SEQ ID NO: 38), от N' к C': субъединица p40 дикого типа - линкер (SEQ ID NO: 229) - субъединица p19 дикого типа, обозначенная как «WT» в таблице 7.
[459] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Различные одноцепочечные варианты IL-23 (или контрольный одноцепочечный IL-23 «дикого типа») помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2B), чтобы сконструировать иммуноцитокины IL-23/антитело к PD-1 «Fab-IL-23-Fc-PD-1 Ab». Например, иммуноцитокин Fab-IL-23(E59A/F60A)-Fc-PD-1 Ab, содержащий одноцепочечный вариант IL-23 IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19), размещенный в шарнирном участке, содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IL-23 (SEQ ID NO: 39), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 113. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
Анализ передачи сигнала IL-23
[460] Клетки HEK-Blue™ IL-23 (InvivoGen кат. № hkb-il23) и клетки HEK-PD-1-IL-23 (полученные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-23 с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IL-23 различных иммуноцитокинов Fab-IL-23-Fc-PD-1 Ab, содержащих различные фрагменты IL-23, в соответствии с руководством для пользователя InvivoGen (InvivoGen кат. № hkb-il23), далее именуемым «репортерный анализ HEK-IL-23» или «репортерный анализ HEK-PD-1-IL-23». Репортерные клетки HEK-Blue™ IL-23 и репортерные клетки HEK-PD-1-IL-23 стабильно экспрессируют рецепторный комплекс, состоящий из IL-12Rβ1 и рецептора IL-23 (IL-23R), вместе с человеческим геном STAT3 для получения полностью функционального сигнального пути IL-23 (TyK2/JAK2/STAT3). Кроме того, эти репортерные клетки также несут STAT3-индуцируемый репортерный ген SEAP. При стимуляции IL-2 репортерные клетки HEK-Blue™ IL-23 и репортерные клетки HEK-PD-1-IL-23 запускают активацию STAT3 и последующую секрецию SEAP, уровни которой можно контролировать с помощью колориметрического ферментного анализа QUANTI-Blue™ (InvivoGen кат. № rep-qbs) активности щелочной фосфатазы. Экспериментальная процедура анализа передачи сигнала IL-2 была аналогична описанной в примере 1. Рекомбинантный человеческий IL-23 (rIL-23) в свободном состоянии служил в качестве положительного контроля и эталона для расчета процента активности.
[461] Как видно из Таблицы 7, при размещении IL-23, содержащего субъединицу p40 дикого типа, в шарнирном участке сохранялось примерно 70,0% активности IL-23 даже в отсутствие связывания антигена-мишени (PD-1) с антителом в репортерном анализе HEK-IL-23. Мутации E59A и F60A в субъединице p40 значительно снижали активность IL-23 примерно до 6,9% или 8,2% в отсутствие связывания антител PD-1/анти-PD-1, которая повышалась примерно до 39,0% или 46,0% при наличии связывания PD-1/антитело к PD-1 в клетках HEK-PD-1-IL-23. Fab-IL-23-Fc-PD-1 Ab, содержащий двойные мутации E59A/F60A в субъединице p40 IL-23 («Fab-IL-23(E59A/F60A)-Fc-PD-1 Ab»), продемонстрировал специфическую в отношении PD-1-положительных клеток биологическую активность IL-23 (4,8%), при отсутствии перекрестной реактивности с PD-1-отрицательными клетками (0,0%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к PD-1, которые могут специфично нацеливать биологическую активность цитокинов (например, IL-23) на PD-1+ клетки.
Пример 8: Получение иммуноцитокина IL-23/антитело к CD4 (Fab-IL-23-Fc-CD4 Ab) с биологической активностью IL-23, направленной на CD4+ Т-клетки
[462] Антитело к CD4, содержащее ибализумаб (Trogarzo®) VH (SEQ ID NO: 73) и VL (SEQ ID NO: 74) использовали в качестве исходного полноразмерного антитела к CD4, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Одноцепочечный IL-23 «дикого типа» или вариант IL-23, содержащий двойную мутацию E59A, F60A или E59A/F60A в субъединице p40 (SEQ ID NO: 31-33), как описано в примере 7, помещали в шарнирный участок тяжелой цепи антитела к CD4 (пример строения см. на фигуре 2В), чтобы сконструировать иммуноцитокины IL-23/антитело к CD4 «Fab-IL-23-Fc-CD4 Ab». Например, иммуноцитокин Fab-IL-23(E59A/F60A)-Fc-CD4 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78, и одну тяжелую цепь с одноцепочечным вариантом IL-23 (SEQ ID NO: 39), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 84. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1. FACS использовали для подтверждения того, что антитела Fab-IL-23-Fc-CD4 были способны связываться с CD4+ Т-клетками, но не с CD8+ Т-клетками (данные не показаны).
[463] IL-23 может стимулировать активированные CD4+ или CD8+ Т-клетки к высвобождению IFN-γ. Биологическую активность различных антител Fab-IL-23-Fc-CD4 в отношении IL-23 измеряли с использованием анализа высвобождения IFN-γ, как описано в примере 5. rIL-23 служил в качестве положительного контроля и эталона активности в процентах.
[464] Как видно из Таблицы 8, размещение IL-23, содержащего субъединицу p40 дикого типа, в шарнирном участке по-прежнему сохраняло примерно 21,0% активности IL-23 даже в отсутствие связывания антигена-мишени (CD4) с антителом в CD8+ T-клетках. Мутации E59A и F60A в субъединице p40 значительно снижали активность IL-23 примерно до 2,0% или 1,5% в отсутствие связывания CD4/антитело к CD4, которая повышалась примерно до 24,0% или 29,0% при наличии связывания CD4+ Т-клетки/антитело к CD4. Антитело Fab-IL-23-Fc-CD4, содержащее двойные мутации E59A/F60A в субъединице p40 IL-23 («Fab-IL-23(E59A/F60A)-Fc-CD4 Ab»), продемонстрировало биологическую активность IL-23, специфичную к CD4+ T-клеткам, (6,8%), при отсутствии перекрестной реактивности с CD8+ Т-клетками (0,0%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к CD4, которые могут специфично нацеливать биологическую активность цитокинов (например, IL-23) на CD4+ Т-клетки.
Пример 9: Получение иммуноцитокина IL-10/антитело к PD-1 (Fab-IL-10-Fc-PD-1 Ab) с биологической активностью IL-10, направленной на PD-1-положительные клетки
Конструирование вариантов IL-10 и их иммуноцитокинов
[465] IL-10 естественным образом экспрессируется в виде нековалентно связанного гомодимера. Варианты IL-10 сконструировали путем замены аминокислот в положениях с 24 по 32 аланином или серином (см. Таблицу 9) и получали одноцепочечный вариант IL-10, от N' к C': субъединица варианта IL-10 (SEQ ID NO: 21-26) - линкер (SEQ ID NO: 227) - субъединица варианта IL-10. Также конструировали одноцепочечный IL-10 «дикого типа» для использования в качестве контроля (SEQ ID NO: 27), от N' к C': субъединица IL-10 дикого типа (SEQ ID NO: 20) -линкер (SEQ ID NO: 227) - субъединица IL-10 дикого типа, обозначенная как «WT» в таблице 9.
[466] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Различные одноцепочечные варианты IL-10 (или контрольный одноцепочечный IL-10 «дикого типа») помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2A), чтобы сконструировать иммуноцитокины IL-10/антитело к PD-1 «Fab-IL-10-Fc-PD-1 Ab». Например, иммуноцитокин Fab-IL-10(R27A)-Fc-PD-1 Ab, содержащий одноцепочечный вариант IL-10 IL-10(R27A)-линкер-IL-10(R27A), расположенный в шарнирном участке, содержит два легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IL-10 (SEQ ID NO: 28), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 111. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
Анализ передачи сигнала IL-10
[467] Клетки HEK-Blue™ IL-10 (InvivoGen кат. № hkb-il10) и клетки HEK-PD-1-IL-10 (полученные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-10 с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IL-10 различных Fab-IL-10-Fc-PD-1 Ab, содержащих различные фрагменты IL-10, в соответствии с руководством для пользователя InvivoGen (InvivoGen кат. № hkb-il10), далее именуемым «репортерный анализ HEK-IL-10» или «репортерный анализ HEK-PD-1-IL-10». Репортерные клетки HEK-Blue™ IL-10 и репортерные клетки HEK-PD-1-IL-10 стабильно экспрессируют цепи hIL-10Rα и hIL-10Rβ рецептора IL-10, человеческий STAT3 и STAT3-индуцируемый SEAP. Связывание IL-10 с его рецептором на поверхности клеток HEK-Blue™ IL-10 или репортерных клеток HEK-PD-1-IL-23 запускает передачу сигналов JAK1/STAT3 и последующее продуцирование SEAP, уровень которого в надосадочной жидкости клеточной культуры можно наблюдать с помощью QUANTI-Blue™ (InvivoGen кат. № rep-qbs). Экспериментальная процедура анализа передачи сигнала IL-2 была аналогична описанной в примере 1. Рекомбинантный человеческий IL-10 (rIL-10) в свободном состоянии служил в качестве положительного контроля и эталона для расчета процента активности.
[468] Как видно из таблицы 9, при размещении IL-10, содержащего субъединицу IL-10 дикого типа, в шарнирном участке все еще сохранялось примерно 26,0% активности IL-10 даже в отсутствие связывания антигена-мишени (PD-1) с антителом в клетках HEK-IL-10. Все протестированные варианты IL-10 снижали активность IL-10 в отсутствие связывания PD-1/антитело к PD-1 по сравнению с активностью IL-10 «дикого типа», и их активность IL-10 повышалась при наличии связывания PD-1/антитело к PD-1 в клетках HEK-PD-1-IL-10. Fab-IL-10-Fc-PD-1 Ab, содержащее мутацию R27A в IL-10 («Fab-IL-10(R27A)-Fc-PD-1 Ab»), продемонстрировало биологическую активность IL-10 (21,0%), специфичную в отношении PD-1-положительных клеток, с минимальной перекрестной реактивностью с PD-1-негативными клетками (<0,1%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к PD-1, которые могут специфично нацеливать биологическую активность цитокинов (например, IL-10) на PD-1-положительные клетки.
Пример 10: Получение иммуноцитокина IFN-γ/антитело к PD-1 (Fab-IFN-γ-Fc-PD-1 Ab) с биологической активностью IFN-γ, направленной на PD-1-положительные клетки
Конструирование вариантов IFN-γ и их иммуноцитокинов
[469] IFN-γ естественным образом экспрессируется в виде симметричного гомодимера. Варианты IFN-γ конструировали путем замены аминокислот в положениях с 20 по 25 на A, K, S, E, Q или V (см. Таблицу 10) и получали одноцепочечный вариант IFN-γ, от N' к C': субъединица варианта IFN-γ (SEQ ID NO: 11-17) - линкер (SEQ ID NO: 227) - субъединица варианта IFN-γ. Также конструировали одноцепочечный IFN-γ «дикого типа» для использования в качестве контроля (SEQ ID NO: 18), от N' к C': субъединица IFN-γ дикого типа (SEQ ID NO: 10)-линкер (SEQ ID NO: 227) - субъединица IFN-γ дикого типа, обозначенная как «WT» в Таблице 10.
[470] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Различные одноцепочечные варианты IFN-γ (или контрольный одноцепочечный IFN-γ «дикого типа») помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2A), чтобы сконструировать иммуноцитокины IFN-γ/антитело к PD-1 «Fab-IFN-γ-Fc-PD-1 Ab». Например, иммуноцитокин Fab-IFN-γ(A23V)-Fc-PD-1 Ab, содержащий одноцепочечный вариант IFN-γ IFN-γ(A23V)-линкер-IFN-γ(A23V), расположенный в шарнирном участке, содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IFN-γ (SEQ ID NO: 19), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 110. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
Анализ передачи сигнала IFN-γ
[471] Клетки HEK-Blue™ IFN-γ (InvivoGen кат. № hkb-iFng) и клетки HEK-PD-1-IFN-γ (полученные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IFN-γ с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IFN-γ различных Fab-IFN-γ-Fc-PD-1 Ab, содержащих различные фрагменты IFN-γ, в соответствии с руководством для пользователя InvivoGen (InvivoGen кат. № hkb-iFng), далее именуемым «репортерный анализ HEK-IFN-γ» или «репортерный анализ HEK-PD-1-IFN-γ». Репортерные клетки HEK-Blue™ IFN-γ и репортерные клетки HEK-PD-1-IFN-γ стабильно экспрессируют человеческий ген STAT1 и STAT1-индуцируемый SEAP. Другие гены сигнального пути естественно экспрессируются в достаточных количествах в репортерных клетках. Связывание IFN-γ с его гетеродимерным рецептором, состоящим из цепей IFNGR1 и IFNGR2, на поверхности клеток HEK-Blue™ IFN-γ или репортерных клеток HEK-PD-1-IFN-γ запускает передачу сигналов JAK1/JAK2/STAT1 и последующее продуцирование SEAP, уровень которого в надосадочной жидкости клеточной культуры можно наблюдать с помощью QUANTI-Blue™ (InvivoGen кат. № rep-qbs). Экспериментальная процедура анализа передачи сигнала IL-2 была аналогична описанной в примере 1. Рекомбинантный человеческий IFN-γ (rIFN-γ) в свободном состоянии служил в качестве положительного контроля и эталона для расчета процента активности.
[472] Как видно из таблицы 10, при размещении IFN-γ, содержащего субъединицу IFN-γ дикого типа, в шарнирном участке сохранялось примерно 36,0% активности IFN-γ даже в отсутствие связывания антигена-мишени (PD-1) с антителом в клетках HEK-IFN-γ. Остаток A23 представляется критическим для биологической активности IFN-γ, поскольку все варианты IFN-γ, содержащие мутацию A23, значительно снижают активность IFN-γ в отсутствие связывания PD-1/антитело к PD-1 по сравнению со связыванием IFN-γ «дикого типа», и их IFN-γ активность восстанавливалась в присутствии связывания PD-1/антитело к PD-1 в клетках HEK-PD-1-IFN-γ. Fab-IFN-γ-Fc-PD-1 Ab, содержащее мутацию A23V в IFN-γ («Fab-IFN-γ(A23V)-Fc-PD-1 Ab»), продемонстрировало биологическую активность IFN-γ (27,0%), специфичную в отношении PD-1-положительных клеток, с минимальной перекрестной реактивностью с PD-1-негативными клетками (0,6%). Fab-IFN-γ-Fc-PD-1 Ab, содержащее тройные мутации A23E/D24E/N25K в IFN-γ («Fab-IFN-γ(A23E/D24E/N25K)-Fc-PD-1 Ab»), продемонстрировало биологическую активность IFN-γ (23,0%), специфичную в отношении PD-1-положительных клеток, с минимальной перекрестной реактивностью с PD-1-негативными клетками (0,2%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к PD-1, которые могут специфично нацеливать биологическую активность цитокинов (например, IFN-γ) на PD-1-положительные клетки.
Пример 11: Получение иммуноцитокина IFN-γ/антитело к CD4 (Fab-IFN-γ-Fc-CD4 Ab) с биологической активностью IFN-γ, направленной на CD4+ Т-клетки
[473] Антитело к CD4, содержащее ибализумаб (Trogarzo®) VH (SEQ ID NO: 73) и VL (SEQ ID NO: 74) использовали в качестве исходного полноразмерного антитела к CD4, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Одноцепочечный IFN-γ «дикого типа» или вариант IFN-γ, содержащий различные мутации, как описано в примере 10, помещали в шарнирный участок тяжелой цепи антитела к CD4 (пример строения см. на фигуре 2В), чтобы сконструировать иммуноцитокины IFN-γ/антитело к CD4 «Fab-IFN-γ-Fc-CD4 Ab». Например, иммуноцитокин Fab-IFN-γ(A23V)-Fc-CD4 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 77, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 78, и одну тяжелую цепь с одноцепочечным вариантом IFN-γ (SEQ ID NO: 19), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 81. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
[474] IFN-γ может индуцировать экспрессию PD-L1 на клеточной поверхности. Для оценки биологической активности различных фрагментов IFN-γ в Fab-IFN-γ-Fc-CD4 Ab клетки HEK-CD4-IFN-γ создавали собственными силами путем сверхэкспрессии человеческого CD4 в клетках HEK-Blue™ IFN-γ (InvivoGen кат. № hkb-iFng) с использованием лентивирусного вектора. rIFN-γ служил положительным контролем. Антитело к PD-1 - ниволумаб (Opdivo®) - и отсутствие лечения с использованием IFN-γ служили в качестве отрицательного контроля. Вкратце, клетки HEK-Blue™ IFN-γ или клетки HEK-CD4-IFN-γ культивировали только в присутствии культуральной среды (без IFN-γ), rIFN-γ (20 нг/мл), антитела к PD-1 (1 мкг/мл) или различных антител Fab-IFN-γ-Fc-CD4 (1 мкг/мл) при 37°C в CO2 камере в течение ночи. На следующий день клетки окрашивали конъюгированным с аллофикоцианином (APC) антителом к PD-L1 человека (BioLegend, кат. № 374513), для выявления экспрессии PD-L1. Активность связывания различных антител Fab-IFN-γ-Fc-CD4 (или контрольных) с клетками HEK-Blue™ IFN-γ или клетками HEK-CD4-IFN-γ выражали как среднюю интенсивность флуоресценции (MFI), измеренную с использованием FACS.
[475] Как видно из Таблицы 11, обработка репортерных клеток с использованием IFN-γ или антитела к PD-1 (отрицательный контроль) не продемонстрировала начальную экспрессию PD-L1 на уровне ~15 MFI. Размещение IFN-γ «дикого типа», содержащего субъединицу IFN-γ дикого типа, в шарнирном участке антитела к CD4, сохраняло активность IFN-γ на уровне примерно 57 MFI (по сравнению с rIFN-γ в свободном состоянии - 75 MFI) в отсутствие связывания антигена-мишени антителом к CD4 в клетках HEK-IFN-γ. В соответствии с данными из примера 10 остаток A23 представляется критическим для биологической активности IFN-γ, поскольку все варианты IFN-γ, содержащие мутацию в A23, значительно снижали IFN-γ активность практически до исходного уровня (~15 MFI) в отсутствие связывания CD4 с антителом к CD4 по сравнению со связыванием IFN-γ дикого типа или варианта IFN-γ D24A/N25A, и их IFN-γ активность повышалась в присутствии связывания CD4 с антителом к CD4 в клетках HEK-CD4-IFN-γ. Fab-IFN-γ-Fc-CD4 Ab, содержащее тройные мутации A23E/D24E/N25K в IFN-γ («Fab-IFN-γ(A23E/D24E/N25K)-Fc-CD4 Ab») или мутацию A23V («Fab-IFN-γ(A23V)-Fc-CD4 Ab») продемонстрировало специфичную в отношении клеток CD4 биологическую активность IFN-γ (59 MFI или 68 MFI, соответственно) при отсутствии перекрестной реактивности или с небольшой перекрестной реактивностью с CD4-отрицательными клетками (13 MFI или 12 MFI, соответственно, на уровне или ниже исходного уровня). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к CD4, которые могут специфично нацеливать биологическую активность цитокинов (например, IFN-γ) на CD4-положительные клетки.
Пример 12: Получение иммуноцитокина IFN-α2b/антитело к PD-1 (Fab-IFN-α2b-Fc-PD-1 Ab) с биологической активностью IFN-α2b, направленной на PD-1-положительные клетки
Конструирование вариантов IFN-α2b и их иммуноцитокинов
[476] IFN-α2b (Intron-A®) представляет собой противовирусный или противоопухолевый препарат. Это рекомбинантная форма IFN-α2. Варианты IFN-α2b конструировали путем замены аминокислот в положениях 30 и 32-34 аланином (SEQ ID NO: 4, 6, 7 и 8; см. Таблицу 12). Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Различные варианты IFN-α2b (или контрольный IFN-α2b дикого типа «WT») помещали в шарнирный участок тяжелой цепи антитела к PD-1 (пример строения см. на фигуре 2A), чтобы сконструировать иммуноцитокины IFN-α2b/антитело к PD-1 «Fab-IFN-α2b-Fc-PD-1 Ab». Например, иммуноцитокин Fab-IFN-α2b(L30A)-Fc-PD-1 Ab содержит две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 107, и одну тяжелую цепь с вариантом IFN-α2b(L30A) (SEQ ID NO: 4), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 109. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
Анализ передачи сигнала IFN-α/β
[477] Клетки HEK-BlueTM IFN-α/β (InvivoGen кат. № hkb-iFnab) и клетки HEK-PD-1-IFN-α/β (созданные собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IFN-α/β с использованием лентивирусного вектора) использовали для оценки активности активации сигнала IFN-α2b различных антител Fab-IFN-α2b-Fc-PD-1, содержащих различные фрагменты IFN-α2b, в соответствии с Руководством для пользователя InvivoGen (InvivoGen кат. № hkb-iFnab), далее также именуемый «репортерным анализом НЕК-IFN-α/β» или «репортерным анализом НЕК-PD-1-IFN-α/β». Репортерные клетки HEK-Blue™ IFN-α/β и репортерные клетки HEK-PD-1-IFN-α/β получали путем стабильной трансфекции клеток HEK293 человеческими генами STAT2 и IRF9 для создания полностью активного сигнального пути IFN I типа, индуцируемого SEAP под контролем промотора ISG54, индуцируемого IFN-α/β. Другие гены сигнального пути (IFNAR1, IFNAR2, JAK1, TyK2 и STAT1) экспрессируются этими клетками естественным образом. Связывание IFN-α или IFN-β с его гетеродимерным рецептором, состоящим из цепей IFNAR1 и IFNAR2, запускает передачу сигналов JAK/STAT/ISGF3 и последующее продуцирование SEAP, за уровнем которого в надосадочной жидкости клеточной культуры можно наблюдать с помощью QUANTI-Blue™ ( InvivoGen Кат. № rep-qbs). Экспериментальная процедура анализа передачи сигнала IL-2 была аналогична описанной в примере 1. IFN-α2b в свободном состоянии служил в качестве положительного контроля и эталона для расчета процента активности.
[478] Как видно из Таблицы 12, размещение IFN-α2b дикого типа в шарнирном участке антитела к PD-1 сохраняло активность IFN-α2b примерно на 54,0% даже в отсутствие связывания целевого антигена (PD-1) с антителом в клетках HEK-IFN-α/β. Все остатки L30, D32, R33 и H34 проявили себя как критические для биологической IFN-α2b активности, поскольку все варианты IFN-α2b значительно снижают активность IFN-α2b в отсутствие связывания PD-1/антитело к PD-1 по сравнению с IFN-α2b дикого типа, и их IFN-α2b активность восстанавливалась в присутствии связывания PD-1/антитело к PD-1 в клетках HEK-PD-1-IFN-α/β. Антитело Fab-IFN-α2b-Fc-PD-1, содержащее мутацию L30A в IFN-α2b («Fab-IFN-α2b(L30A)-Fc-PD-1 Ab»), продемонстрировало биологическую специфичную в случае PD-1-положительных клеток активность IFN-α2b (110,0%) со значительно более низкой перекрестной реактивностью в случае PD-1-отрицательных клеток (15,0%). Антитело Fab-IFN-α2b-Fc-PD-1, содержащее мутацию R33A в IFN-α2b («Fab-IFN-α2b(R33A)-Fc-PD-1 Ab»), продемонстрировало биологическую специфичную в случае PD-1-положительных клеток активность IFN-α2b (25,0%) со значительно более низкой перекрестной реактивностью в случае PD-1-отрицательных клеток (5,0%). Эти данные демонстрируют успешное создание иммуноцитокинов на основе антител к PD-1, которые могут специфично нацеливать биологическую активность цитокинов (например, IFN-α2b) на PD-1-положительные клетки при сниженной биологической активности цитокинов в отношении PD-1-отрицательных клеток.
Пример 13: Размещение варианта IL-2 в шарнирном участке иммуноцитокина IL-2/PD-L2-Fc значительно снижает токсичность у мышей.
[479] Подобно тому, как описано в Примере 3, составной белок PD-L2-шарнир-Fc (два полипептида PD-L2-шарнир-Fc, каждый из которых содержит SEQ ID NO: 177) использовали в качестве исходного антигенсвязывающего белка для конструирования иммуноцитокинов, связывающихся с PD-1. Для конструирования гетеродимерного составного белка PD-L2-шарнир-Fc использовали один составной полипептид PD-L2-шарнир-Fc, содержащий шарнирный участок с SEQ ID NO: 52, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другой составной полипептид PD-L2-Fc, содержащий шарнирный участок с SEQ ID NO: 51, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Вариант IL-2 (R38D/K43E/E61R; SEQ ID NO: 2) был либо расположен в шарнирном участке одного полипептида PD-L2-шарнир-Fc (далее именуемый «иммуноцитокин IL-2 (R38D/K43E/E61R)/PD-L2-Fc» или «конструкция №11»), либо был составлен с С-концом одного полипептида PD-L2-шарнир-Fc (далее именуемый «иммуноцитокин PD-L2-Fc/IL-2(R38D/K43E/E61R»). Иммуноцитокин IL-2(R38D/K43E/E61R)/PD-L2-Fc содержит один составной полипептид IL-2, содержащий SEQ ID NO: 180, и один спаренный полипептид, содержащий SEQ ID NO: 179.
[480] 25 мышей BALB/c случайным образом распределяли в 5 групп (по 5 мышей в каждой группе), и им внутрибрюшинно вводили 200 мкг или 1000 мкг иммуноцитокина IL-2(R38D/K43E/E61R)/PD-L2-Fc, имуноцитокина PD-L2-Fc/IL-2(R38D/K43E/E61R) или исходный составной белок PD-L2-шарнир-Fc в качестве контроля. Каждая группа получала внутрибрюшинные инъекции в 1-й и 5-й день. Мышей ежедневно обследовали по четырем параметрам: i) текстуре меха, ii) снижению активности, iii) клиническим проявлениям и iv) потере веса более 10%.
[481] Как видно из таблицы 13, в случае размещения варианта IL-2 на С-конце полипептида PD-L2-шарнир-Fc, пять из пяти мышей умерли через 4-6 дней после инъекции как в группах с высокой дозой, так и в группах с низкой дозой. Напротив, в случае размещения варианта IL-2 в шарнирном участке, все мыши выживали, даже при введении высоких доз иммуноцитокинов (1000 мкг). Такая же выживаемость наблюдалась в контрольной группе (PD-L2-Fc без слияния с IL-2). Для случая иммуноцитокинов с вариантом IL-2, расположенным в шарнирном участке, токсичность, по-видимому, зависит от дозы, на что указывает повышенная потеря веса и большее снижение активности при увеличении дозы с 200 мкг до 1000 мкг.
(IL-2 расположен в шарнирном участке; конструкция №11)
(IL-2 составлен с C'-концом Fc)
Пример 14: Размещение варианта IL-12 в шарнирном участке иммуноцитокина IL-12/антитело к PD-1 значительно снижает токсичность у мышей
Конструирование вариантов IL-12 и их иммуноцитокинов
[482] Подобно тому, как описано в примере 4, были получены 3 варианта одноцепочечного IL-12. «IL-12 (F60A)» (SEQ ID NO: 275) содержит, от N' к C': субъединица варианта p40 F60A (SEQ ID NO: 33) - линкер (SEQ ID NO: 228) - субъединица p35 дикого типа (SEQ ID NO: 29). «IL-12 (G64A)» содержит, от N' к C': субъединица варианта p40 F60A (SEQ ID NO: 34) - линкер (SEQ ID NO: 228) - субъединица p35 дикого типа (SEQ ID NO: 29). «IL-12 (E59A/F60A)» (SEQ ID NO: 36) содержит, от N' к C': субъединица варианта p40 E59A/F60A (SEQ ID NO: 31) - линкер (SEQ ID NO: 228) - субъединица p35 дикого типа (SEQ ID NO: 29).
[483] Как описано в примере 4, иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1 (конструкция № 48) содержит две легкие цепи, каждая из которых содержит последовательность SEQ ID NO: 106, одну тяжелую цепь, содержащую последовательность SEQ ID NO: 107, и одну тяжелую цепь с одноцепочечным вариантом IL-12(E59A/F60A) (SEQ ID NO: 36), расположенным в шарнирном участке, содержащем аминокислотную последовательность SEQ ID NO: 112. Вариант одноцепочечного IL-12(E59A/F60A) в составе иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1 заменяли либо на одноцепочечный вариант IL-12 (F60A) (SEQ ID NO: 275), либо на вариант одноцепочечный IL-12 (G64A) (SEQ ID NO: 332) для конструирования иммуноцитокина IL-12(F60A)/антитело к PD-1 и иммуноцитокина IL-12(G64A)/антитело к PD-1, соответственно. Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
[484] 30 мышей BALB/c случайным образом распределяли в 6 групп (по 5 мышей в каждой группе), и им внутрибрюшинно вводили 200 мкг или 1000 мкг иммуноцитокина IL-12(F60A)/антитело к PD-1, иммуноцитокина IL-12(G64A)/антитело к PD-1 или иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1. Каждая группа получала внутрибрюшинные инъекции в 1-й и 5-й день. Мышей ежедневно обследовали по четырем параметрам: i) текстуре меха, ii) снижению активности, iii) клиническим проявлениям и iv) потере веса более 10%.
[485] Как видно из таблицы 14, иммуноцитокин IL-12/антетело к PD-1, содержащий вариант IL-12 (G64A), показал самую высокую токсичность, о чем свидетельствует гибель 4/5 мышей в группе с низкой дозой и гибель 5/5 мышей в группе с высокой дозой. В отличие от этого, лечение иммуноцитокином IL-12/антитело к PD-1, содержащим вариант IL-12 (F60A), вызывало только одну смерть в группе с высокой дозой (1000 мкг) и не вызывало смертей в группе с низкой дозой (200 мкг); лечение иммуноцитокином IL-12/антитело к PD-1, содержащим вариант IL-12 (E59A/F60A), не вызывало смертей ни при одной дозе. Иммуноцитокин IL-12/антитело к PD-1, содержащий двойную мутацию E59A/F60A в IL-12, также продемонстрировал уменьшенную токсичность по сравнению с иммуноцитокином, содержащим одиночную мутацию F60A в IL-12, на что указывают различия в тяжести симптомов токсичности.
(конструкция №47)
(конструкция №48)
Пример 15: Замена исходного антитела к PD-1 составным белком PD-L2-шарнир-Fc значительно снижает токсичность иммуноцитокинов IL-12
Конструирование иммуноцитокинов IL-12/PD-L2-Fc
[486] Составной белок PD-L2-шарнир-Fc (два полипептида PD-L2-шарнир-Fc, каждый из которых содержит SEQ ID NO: 177) использовали в качестве исходного антигенсвязывающего белка для конструирования иммуноцитокинов, связывающихся с PD-1. Для конструирования гетеродимерного составного белка PD-L2-шарнир-Fc использовали один составной полипептид PD-L2-шарнир-Fc, содержащий шарнирный участок с SEQ ID NO: 52, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другой составной полипептид PD-L2-Fc, содержащий шарнирный участок с SEQ ID NO: 51, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Одноцепочечный вариант IL-12 (F60A, G64A или E59A/F60A), как описано в примере 14, был расположен либо в шарнирном участке одного полипептида PD-L2-шарнир-Fc (далее именуемого «иммуноцитокин IL-12/PD-L2-Fc»), либо составлен с С-концом одного полипептида PD-L2-шарнир-Fc (далее именуемый «иммуноцитокин PD-L2-Fc/IL-12»). Например, иммуноцитокин IL-12(E59A/F60A)/PD-L2-Fc («конструкция № 29») содержит один составной полипептид IL-12, содержащий SEQ ID NO: 186 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - одноцепочечный вариант IL-12(E59A/F60A) (SEQ ID NO: 36) - шарнир (SEQ ID NO: 52) - субъединицу Fc-домена (SEQ ID NO: 61)); и один спаренный полипептид, содержащий SEQ ID NO: 185 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG - шарнир (SEQ ID NO: 51) - субъединицу Fc-домена (SEQ ID NO: 62)). Одноцепочечный вариант IL-12(E59A/F60A) в иммуноцитокине IL-12(E59A/F60A)/PD-L2-Fc заменяли любо на одноцепочечный вариант IL-12 (F60A) (SEQ ID NO: 275), либо на одноцепочечный вариант IL-12 (G64A) (SEQ ID NO: 332) для конструирования иммуноцитокина IL-12(F60A)/PD-L2-Fc («конструкция № 30») и иммуноцитокина IL-12(G64A)/PD-L2-Fc, соответственно. Например, иммуноцитокин IL-12(F60A)/PD-L2-Fc содержит один составной полипептид IL-12, содержащий SEQ ID NO: 274 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - одноцепочечный вариант IL-12(F60A) (SEQ ID NO: 275) - шарнир (SEQ ID NO: 52) - субъединицу Fc-домена (SEQ ID NO: 61)); и один парный полипептид, содержащий SEQ ID NO: 185 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - шарнир (SEQ ID NO: 51) - субъединицу Fc-домена (SEQ ID NO: 62)). Иммуноцитокин PD-L2-Fc/IL-12(F60A) («конструкция № 34») содержит один составной полипептид IL-12, содержащий SEQ ID NO: 276 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - шарнир (SEQ ID NO: 52) - субъединицу Fc-домена (SEQ ID NO: 61) - линкер GGGGSGGGGSGGGGS (SEQ ID NO: 229) - одноцепочечный вариант IL-12(F60A) (SEQ ID NO: 275)); и один парный полипептид, содержащий SEQ ID NO: 185 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - шарнир (SEQ ID NO: 51) - субъединицу Fc-домена (SEQ ID NO: 62)). Иммуноцитокины конструировали, экспрессировали и очищали, как описано в примере 1.
[487] 50 мышей BALB/c случайным образом разделяли на 10 групп (по 5 мышей в каждой группе) и им внутрибрюшинно вводили путем инъекции по 200 мкг или 1000 мкг: i) иммуноцитокина IL-12(F60A)/PD-L2-Fc, ii) иммуноцитокина IL-12 (G64A)/PD-L2-Fc, iii) иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc, iv) иммуноцитокина PD-L2-Fc/IL-12(F60A) (IL-12 на C' в Fc) или v) иммуноцитокина PD-L2-Fc/IL-12(E59A/F60A) (IL-12 на C' в Fc). Каждая группа получала внутрибрюшинные инъекции в 1-й и 5-й день. Мышей ежедневно обследовали по четырем параметрам: i) текстуре меха, ii) снижению активности, iii) клиническим проявлениям и iv) потере веса более 10%.
[488] Как видно из таблицы 15, среди иммуноцитокинов с вариантом IL-12, расположенным в шарнирном участке, иммуноцитокин IL-12/PD-L2-Fc, содержащий вариант IL-12 (G64A), показал самую высокую токсичность, о чем свидетельствует гибель 3/5 мышей в группе с низкой дозой и гибель 5/5 мышей в группе с высокой дозой. Это согласуется с самыми высокими результатами по токсичности IL-12 (G64A) среди всех вариантов IL-12 в примере 14. При размещении варианта IL-12 (F60A) на С-конце полипептида PD-L2-шарнир-Fc 2 из 5 мышей погибли в группе с высокой дозой. Напротив, когда вариант IL-12 (F60A) был размещен в шарнирном участке, все мыши выживали, даже при введении высоких доз иммуноцитокинов (1000 мкг). В соответствии с результатами в примере 14, иммуноцитокин IL-12/PD-L2-Fc, содержащий двойную мутацию IL-12 E59A/F60A, продемонстрировал токсичность меньше, чем у иммуноцитокина, содержащего одиночную мутацию IL-12 F60A, независимо от того, был ли вариант IL-12 расположен в шарнирном участке или на С-конце Fc, на что указывают различия в тяжести симптомов токсичности. Для большинства иммуноцитокинов наблюдалась дозозависимая токсичность, на что указывало усиление симптомов токсичности, таких как ухудшение структуры шерсти, повышенная потеря веса и/или большее снижение активности при увеличении дозы с 200 мкг до 1000 мкг. Иммуноцитокин IL-12(E59A/F60A)/PD-L2-Fc, содержащий вариант IL-12, расположенный в шарнирном участке, действительно продемонстрировал наименьшую токсичность in vivo среди всех иммуноцитокинов IL-12/PD-L2-Fc и PD-L2-Fc/IL-12 с нулевым уровнем смертности и отсутствием симптомов токсичности даже при введении высоких доз.
[489] Сравнивая полученные результаты в Таблице 14 и Таблице 15, можно заключить, что замена антигенсвязывающего фрагмента антитела к PD-1 лигандом PD-L2 в иммуноцитокинах на основе IL-12 может дополнительно снизить общую токсичность. Например, сравните уровень смертности 3/5 в группе низких доз иммуноцитокина IL-12(G64A)/PD-L2-Fc с уровнем смертности 4/5 в группе низких доз иммуноцитокина IL-12(G64A)/антитело к PD-1; сравните уровень смертности 0 в группе с высокой дозой иммуноцитокина IL-12(F60A)/PD-L2-Fc с уровнем смертности 1/5 в группе с высокой дозой иммуноцитокина IL-12(F60A)/антитело к PD-1. При сравнении симптомов токсичности между соответствующими иммуноцитокинами варианта IL-12 в примере 14 и примере 15 более низкая токсичность иммуноцитокинов на основе PD-L2-Fc становится еще более очевидной. Например, при введении как низкой, так и высокой дозы иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc (конструкция №29) симптомов токсичности не наблюдали в отличие от иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1 (конструкция №48); в группе как с низкой, так и с высокой дозами иммуноцитокина IL-12(F60A)/PD-L2-Fc (№30) проявлялось меньше симптомов токсичности (только текстура меха) по сравнению с иммуноцитокином IL-12(F60A)/антитело к PD-1. Снижение токсичности, наблюдаемое для иммуноцитокинов IL-12 на основе PD-L2-Fc, вероятно, было связано со стимулированной передачей сигналов ингибирующей контрольной точки иммунной системы PD-1 при связывании PD-L2-PD-1, что создавало сигнал иммуносупрессии, который «уравновешивает» иммуностимулирующую/провоспалительную активность IL-12.
(конструкция №30)
(конструкция №29)
(конструкция №34)
Пример 16: Эффективность иммуноцитокинов IL-12 in vivo в мышиной модели сингенной опухоли 4T1
Конструирование иммуноцитокина IL-12(E59A/F60A)/IL-2(R38D/K43E/E61R)/антитело к PD-1
[490] Как описано в примерах 3 и 4, антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. Для конструирования гетеродимера одна тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Вариант IL-2 R38D/K43E/E61R (SEQ ID NO: 2) был расположен в шарнирном участке одной тяжелой цепи гетеродимерного антитела к PD-1, а одноцепочечный вариант IL-12 E59A/F60A (SEQ ID NO: 36) помещали в шарнирный участок другой тяжелой цепи гетеродимерного антитела к PD-1, чтобы сконструировать «иммуноцитокин IL-12(E59A/F60A)/IL-2(R38D/K43E/E61R)/антитело к PD-1» (или «конструкцию № 54»). Иммуноцитокин экспрессировали и очищали, как описано в примере 1.
[491] Мышам (масса тела ~20 г) вводили 0,25×106 клеток 4T1 рака молочной железы мышей. Через семь дней после инокуляции раковых клеток размер опухоли составил примерно 50-150 мм3. После замеров опухоли мышам вводили 10 мг/кг (~200 мкг) иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1 (получен в примерах 4 и 14; конструкция №48 на фигуре 5), 10 мг/кг (~200 мкг) иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc (получен в примере 15; конструкция №29 на фигуре 5), 5 мг/кг (~100 мкг) иммуноцитокина IL-12(E59A/F60A)/IL-2(R38D/K43E/E61R)/антетело к PD-1 (конструкция №54 на фигуре 5) или PBS (отрицательный контроль). Всего было сделано три инъекции (10 мг/кг или 5 мг/кг на инъекцию, соответственно) на 7, 13 и 19 дни после инокуляции (обозначены черными стрелками на фигуре 5). Размер опухоли измеряли каждые 3 дня с момента первой инъекции. Мышей умерщвляли, когда размер опухоли превышал 2000 мм3.
[492] Рак молочной железы, как показано на модели мышей 4T1, обладает высокой устойчивостью к современной иммунотерапии, включая антитело к PD-1, антитело к CTLA-4 и комбинированное лечение антителами к PD-1 и к CTLA-4. Как видно из фигуры 5, все три иммуноцитокина IL-12 в значительной степени подавляли рост опухоли 4T1, демонстрируя многообещающие результаты эффективности in vivo.
[493] Кроме того, IL-12(E59A/F60A)/антитело к PD-1 (№48) и IL-12(E59A/F60A)/PD-L2-Fc (№29) продемонстрировали сходную цитотоксичность в отношении опухоли 4T1 при введении одной и той же дозы (фигура 5). В сочетании с результатами примеров 14 и 15 эти данные дополнительно демонстрируют, что по сравнению с антигенсвязывающим доменом к PD-1, который блокирует сигнал иммуносупрессии PD-1, использование внеклеточного домена PD-L2 в конструкции иммуноцитокина может не только обеспечить похожий противоопухолевый эффект, но также снижают нежелательную токсичность, вероятно, за счет уравновешивания иммуностимулирующей/провоспалительной активности цитокинов (например, IL-12) с сигналом иммуносупрессии по сигнальному пути PD-L2/PD-1.
Пример 17: Эффективность in vivo иммуноцитокинов IL-12 и иммуноцитокинов IL-2 в модели сингенных опухолей EMT6 у мышей
[494] Мышам (масса тела ~20 г) вводили 0,25×106 клеток EMT6 мышиного рака молочной железы. Через семь дней после инокуляции раковых клеток размер опухоли составил примерно 50-150 мм3. После замера размера опухоли мышам вводили по 10 мг/кг (~200 мкг) иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1 (сконструированного в примерах 4 и 14; конструкция № 48 на фигуре 6), по 10 мг/кг (~200 мкг) иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc (сконструированного в примере 15; конструкция № 29 на фигуре 6), по 10 мг/кг (~200 мкг) иммуноцитокина IL-2(R38D/K43E/E61R)/PD-L2-Fc (сконструированного в примере 3; конструкция № 11 на фигуре 6) или PBS (отрицательный контроль). Всего было сделано три инъекции (по 10 мг/кг на инъекцию) на 7, 13 и 19 дни после инокуляции (обозначены черными стрелками на фигуре 6). Размер опухоли измеряли каждые 3 дня с момента первой инъекции. Мышей умерщвляли, когда размер опухоли превышал 2000 мм3.
[495] Рост опухоли EMT6 устойчив к иммунотерапии против PD-1. Как видно из фигуры 6, все иммуноцитокины значительно подавляли рост опухоли EMT6, причем иммуноцитокины IL-12(E59A/F60A)/антитело к PD-1 и IL-2(R38D/K43E/E61R)/PD-L2-Fc продемонстрировали лучшую эффективность по сравнению с иммуноцитокином IL-12(E59A/F60A)/PD-L2-Fc. Несколько сниженная эффективность, наблюдаемая у иммуноцитокина IL-12 на основе PD-L2-Fc, вероятно, была связана со стимулированной PD-1 передачей сигналов ингибирующей контрольной точки иммунной системы при связывании PD-L2-PD-1, что создавало сигнал иммуносупрессии, который «уравновешивает» иммуностимулирующий эффект/провоспалительную активность IL-12.
Пример 18: Эффективность in vivo иммуноцитокинов IL-12 в мышиной модели сингенных опухолей CT26
[496] Мышам (масса тела ~20 г) вводили 0,25×106 клеток CT26 мышиного рака толстой кишки. Когда размер опухоли достигал примерно 100-200 мм3 (примерно на 11 день после инокуляции), мышам вводили по 10 мг/кг иммуноцитокина IL-12(F60A)/PD-L2-Fc (полученного в примере 15; конструкция № 30; 5 мышей), по 10 мг/кг иммуноцитокина PD-L2-Fc/IL-12(F60A) (полученного в примере 15, конструкция № 34; 5 мышей) или PBS (отрицательный контроль). Всего было сделано три инъекции (по 10 мг/кг на инъекцию) на 11, 14 и 18 дни после инокуляции (обозначены черными стрелками на фигурах 7А и 7В). Размер опухоли регистрировали с течением времени. Мышей умерщвляли, когда размер опухоли превышал 2000 мм3. Размер опухоли в скобках на фиг. 7А показан средний размер опухоли (± стандартное отклонение) в каждой группе при введении первой инъекции.
[497] Как видно из фигур 7A и 7B, иммуноцитокин PD-L2-Fc/IL-12(F60A) (№34) успешно подавлял рост опухоли у всех пяти мышей (показатель излечения 100%), а иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) успешно подавлял рост опухоли у четырех из пяти мышей (показатель излечения 80%). Среди вылеченных мышей эффективность ингибирования опухоли обоими иммуноцитокинами IL-12 была одинаковой, что свидетельствует об отсутствии существенной разницы в эффективности между составлением IL-12 с шарниром и присоединением к C-концу. Этот результат показывает, что оба исследованных иммуноцитокина IL-12 могут обеспечивать полную регрессию сингенных опухолей толстой кишки CT26 у мышей.
Пример 19: Эффективность in vivo иммуноцитокинов IL-12 в качестве противораковой вакцины против опухолей CT26
[498] Чтобы исследовать, могут ли иммуноцитокины, описанные в данном документе, действовать как противораковая вакцина или предотвращать рецидив рака, была проведена повторная стимуляция опухоли у всех вылеченных мышей из примера 18. Через 30 дней после последней инъекции иммуноцитокина вылеченным мышам вводили 0,25×106 клеток мышиного рака толстой кишки CT26 в правый бок и 0,25×106 клеток мышиного рака молочной железы EMT6 в левый бок (в качестве контроля). Размеры опухоли регистрировали каждые 4 дня после повторной инокуляции опухоли.
[499] Как показано на фигуре 8, все вылеченные мыши, ранее получавшие иммуноцитокины против опухоли CD26, были защищены от повторного заражения опухолью CT26, но не от EMT6. Иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) и иммуноцитокин PD-L2-Fc/IL-12(F60A) (№34) продемонстрировали аналогичную эффективность защиты от повторного заражения опухолью CT26. Эти результаты указывают на успешное создание памяти против опухоли CT26, предполагая, что описанные здесь иммуноцитокины, такие как иммуноцитокин PD-L2-Fc/IL-12(F60A) (№34) и иммуноцитокин IL-12(F60A)/PD-L2- Fc (№30) могут служить противораковой вакциной (например, против мышиного рака толстой кишки CT26) и/или могут предотвращать рецидив рака.
Пример 20: Эффективность in vivo иммуноцитокинов IL-12 в мышиной модели поздних стадий сингенных опухолей CT26
[500] Настойчивая необходимость в успешной клинической терапии поздних стадий рака по-прежнему не удовлетворена. Чтобы исследовать возможную эффективность иммуноцитокинов, описанных в данном документе, в лечении поздних стадий рака, мышам инокулировали раковые клетки, опухоли давали возможность вырасти до размера более 250 мм3, который у мышей считается неизлечимым с применением иммунотерапии. Такой объем мышиной опухоли может имитировать опухолевую массу у больных людей на поздних стадиях раком.
[501] Вкратце, мышам (масса тела ~ 20 г) вводили 0,25×106 клеток CT26 мышиного рака толстой кишки. Когда размер опухоли достигал примерно 250-400 мм3 мышам вводили по 20 мг/кг иммуноцитокина IL-12(E59A/F60A)/PD-L2 Fc (сконструированного в примере 15; конструкция № 29; 7 мышей) или по 10 мг/кг иммуноцитокина IL-12(F60A)/PD-L2-Fc (сконструированного в примере 15; конструкция № 30; 5 мышей). Всего было сделано пять инъекций на 11, 15, 20, 26 и 30 день после инокуляции мышам, получавшим обработку конструкцией № 29, или на 22, 26, 30, 34 и 38 день после инокуляции мышам, получавшим обработку конструкцией № 30 (обозначены черными стрелками на фигуре 9). Размер опухоли в скобках на фигуре 9 указывает размер опухоли каждой мыши при введении первой инъекции, который был равен или превышал 250 мм3. Размер опухоли регистрировали с течением времени.
[502] Как показано на фигуре 9, у всех мышей, получавших иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30), значительно уменьшался размер опухоли (100% уровень излечения); в то время как у 5 из 7 (71,4% излечения) мышей, получавших иммуноцитокин IL-12(E59A/F60A)/PD-L2 Fc (№ 29), размер опухоли значительно уменьшился. Это указывает на то, что оба иммуноцитокина IL-12 эффективны в лечении поздней стадии рака (например, поздней стадии рака толстой кишки). Наблюдаемая разница в эффективности была связана с более низкой эффективностью (например, способностью связываться с рецептором и/или способностью активировать сигнал) двойной мутации IL-12 (E59A/F60A) по сравнению с одиночной мутацией IL-12 (F60A). Такую разницу в эффективности можно компенсировать введением более высокой дозы (например, 20 мг/кг, а не 10 мг/кг) или увеличением числа инъекций (например, увеличением с 3 до 5 инъекций) иммуноцитокинов на основе IL-12 (E59A/F60A).
[503] На фигуре 10 показана одна типичная мышь, инокулированная опухолью CT26, первоначальный объем опухоли согласно измерению составил 290,6 мм3. Снимки были сделаны через 0, 7 и 14 дней после первоначальной инъекции иммуноцитокина IL-12(F60A)/PD-L2-Fc (№ 30), что указывает на успешную регрессию огромной опухоли (эквивалентно запущенной, поздней стадии рака человека).
Пример 21: Эффективность in vivo иммуноцитокинов IL-12 в мышиной модели сингенных опухолей EMT6
[504] Мышам (масса тела ~20 г) вводили 0,25×106 клеток мышиного рака молочной железы EMT6. При размере опухоли примерно 50-100 мм3 (~7 дней после инокуляции опухоли) мышам вводили по 10 мг/кг иммуноцитокина IL-12(E59A/F60A)/PD-L2 Fc (сконструированного в примере 15; конструкция № 29), по 10 мг/кг иммуноцитокина IL-12( F60A)/PD-L2-Fc (сконструированного в примере 15; конструкция № 30), по 10 мг/кг иммуноцитокина IL-12(E59A/F60A)/антитело к PD-1 (сконструированного в примере 4; конструкция № 48) или PBS (отрицательный контроль). Всего было сделано три инъекции (по 10 мг/кг на инъекцию) на 7, 12 и 16 дни после инокуляции (обозначены черными стрелками на фигурах 11А и 11В). Размер опухоли регистрировали с течением времени. Мышей умерщвляли, когда размер опухоли превышал 1500 мм3. Размер опухоли в скобках на фигуре 11А приведен как средний размер опухоли (± стандартное отклонение) в каждой группе при введении первой инъекции.
[505] Как видно на фигурах 11A и 11B, иммуноцитокин IL-12(E59A/F60A)/PD-L2 Fc (№29) успешно подавлял рост опухоли у 3/5 мышей (показатель излечения 60%); иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) и иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1 (№48) успешно подавляли рост опухоли у всех пяти мышей (100% показатель излечения). Начальный средний размер опухоли в группе мышей, обработанных иммуноцитокином IL-12(E59A/F60A)/антитело к PD-1 (№48), был более чем в два раза больше, чем в двух других испытуемых группах. Эти результаты показывают, что все три протестированных иммуноцитокина IL-12 могут обеспечивать полную регрессию сингенных опухолей молочной железы EMT6 у мышей, при этом иммуноцитокин на основе антитела к PD-1 обладает наибольшей эффективностью.
Пример 22: Эффективность in vivo иммуноцитокинов IL-12 в качестве противораковой вакцины против опухолей EMT6
[506] Чтобы исследовать, могут ли иммуноцитокины, описанные в данном документе, действовать как противораковая вакцина или предотвращать рецидив рака, была проведена повторная стимуляция опухоли у всех вылеченных мышей из примера 21. Через 30 дней после последней инъекции иммуноцитокина вылеченным мышам вводили 0,25×106 клеток мышиного рака молочной железы EMT6 в правый бок и 0,25×106 клеток мышиного рака толстой кишки CT26 в левый бок (в качестве контроля). Размеры опухоли регистрировали каждые 4 дня после повторной инокуляции опухоли.
[507] Как видно из фигуры 12, все вылеченные мыши, ранее получавшие иммуноцитокины против опухоли EMT6, были защищены от повторного заражения опухолью EMT6, но не от CT26. Кроме того, все три иммуноцитокина IL-12 продемонстрировали сходную эффективность защиты от повторного заражения опухолью EMT6. Эти результаты указывают на успешное создание памяти против опухоли EMT6, предполагая, что описанные здесь иммуноцитокины, такие как иммуноцитокин IL-12(E59A/F60A)/PD-L2 Fc (№29), иммуноцитокин IL-12(F60A)/PD-L2- Fc (№ 30) и иммуноцитокин IL-12 (E59A/F60A)/антитело к PD-1 (№ 48) могут служить противораковой вакциной (например, против опухолей молочной железы (таких как EMT6)) у мышей и/или могут предотвратить рецидив рака.
Пример 23: Эффективность in vivo иммуноцитокинов IL-12 в мышиной модели тройного негативного рака молочной железы 4T1 (TNBC) с ортотопической опухолью
[508] 4T1 представляет собой стандартную мышиную модель опухоли молочной железы, используемую в доклинических исследованиях метастазов рака молочной железы. 4T1 является рефрактерной моделью для иммунотерапии и не отвечает на терапию антителами к PD-1, антителами к CTLA-4 или комбинацию антител к PD-1 и к CTLA-4. Инъекция 4T1 в жировую ткань молочной железы может воспроизводимо генерировать 4T1 метастазы рака молочной железы в легкие.
[509] Для проверки терапевтической эффективности иммуноцитокинов, описанных в данном документе, в отношении устойчивых к иммунотерапии типов рака, а также метастазов рака, мышам (масса тела ~ 20 г) вводили 0,25×106 клеток мышиного рака молочной железы 4T1 в жировую подушку молочной железы № 3. Развитие опухоли наблюдали в течение примерно 21-30 дней. Через четыре дня после инокуляции опухоли мышам вводили 20 мг/кг (на инъекцию) иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc (полученного в примере 15; конструкция № 29), 20 мг/кг (на одну инъекцию) иммуноцитокина IL-12(F60A)/PD-L2-Fc (полученного в примере 15; конструкция № 30), комбинацию 10 мг/кг антитела к PD-1 и 10 мг/кг антитела к CTLA-4 (на инъекцию) или PBS (отрицательный контроль). Всего было сделано пять инъекций на каждый четвертый день. Мышей умерщвляли через четыре недели и иссекали первичную опухоль из жировой ткани молочной железы.
[510] Как видно на фигуре 13 из сравнения с контролем PBS, иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) подавлял рост 4T1 в молочной железе у всех протестированных мышей, иммуноцитокин IL-12(E59A/F60A)/PD-L2-Fc (№29) подавлял рост 4T1 в молочной железе у 1 из 3 протестированных мышей, в то время как комбинированное лечение антителами к PD-1 и к CTLA-4 не подавляло рост 4T1 в молочной железе у всех 3 протестированных мышей. Как обсуждалось выше, разница в эффективности, вероятно, была связана с более низкой эффективностью (например, способностью связываться с рецептором и/или способностью активировать сигнал) двойной мутации IL-12 (E59A/F60A) по сравнению с одиночной мутацией IL-12 (F60A). Такую разницу в эффективности можно компенсировать введением более высокой дозы (например, 40 мг/кг, а не 20 мг/кг) или увеличением числа инъекций (например, увеличением с 5 до 7 инъекций) иммуноцитокинов на основе IL-12 (E59A/F60A).
[511] Для исследования терапевтической эффективности на метастазирование рака у умерщвленных мышей иссекали легкие. Ткань легкого суспендировали в растворе коллагеназы/ДНКазы и фильтровали через клеточное сито с размером 70 мкм. Клетки промывали, используя PBS, и ресуспендировали в среде. Были сделаны четыре серийных разведения 1:10. Клетки культивировали в инкубаторе с 7% CO2 при 37°C в течение 14 дней с целью формирования колоний 4T1 клеток.
[512] Как видно из фигуры 14, иммуноцитокин IL-12(E59A/F60A)/PD-L2-Fc (№29) и иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) в значительной степени подавляли метастазирование 4T1 в легкие по сравнению с комбинацией антитела к PD-1 и антитела к CTLA-4 антител или PBS (отрицательный контроль). Эти результаты статистически значимо различались (р-значение <0,001).
[513] Эти данные свидетельствуют о перспективной эффективность иммуноцитокинов IL-12 in vivo при лечении более поздних стадий и/или трудно поддающегося лечению рака молочной железы (например, ТНРМЖ), подавлении метастазирования рака и, возможно, при лечении других типов рака, устойчивых к современным иммунотерапиям.
Пример 24: Эффективность иммуноцитокинов IL-12 in vivo в мышиной модели сингенной опухоли B16
[514] B качестве модели рака кожи человека для исследований использовали линию клеток В16 мышиной опухоли меланомы. B16 является рефрактерной моделью для иммунотерапии и не отвечает на терапию антителами к PD-1, антителами к CTLA-4 или комбинацию антител к PD-1 и к CTLA-4.
[515] Для проверки терапевтической эффективности описанных здесь иммуноцитокинов в отношении более устойчивых к иммунотерапии типов рака мышам (масса тела ~20 г) вводили 0,25×106 клеток В16 мышиной меланомы. Когда размер опухоли достигал примерно 50-100 мм3, мышам вводили 10 мг/кг иммуноцитокина IL-12(F60A)/PD-L2-Fc (полученного в примере 15; конструкция № 30), 10 мг/кг иммуноцитокина PD-L2-Fc/IL-12(F60A) (полученного в примере 15, конструкция № 34) или PBS (отрицательный контроль). Всего было сделано три инъекции (по 10 мг/кг на инъекцию) на 10, 13 и 16 дни после инокуляции (обозначены черными стрелками на фигурах 15А и 15В). Размер опухоли регистрировали с течением времени. Мышей умерщвляли, когда размер опухоли превышал 1000 мм3. Размер опухоли в скобках на фигуре 15А приведен как средний размер опухоли (± стандартное отклонение) в каждой группе при введении первой инъекции.
[516] Как видно из фигур 15A и 15B, по сравнению с группой обработки с используванием PBS, в которой опухоль B16 резко выросла с 13-го дня после инокуляции, как иммуноцитокин PD-L2-Fc/IL-12(F60A) (№34), так и иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) в значительной степени подавляли рост опухоли B16 вплоть до 24-го дня после инокуляции, что указывает на то, что оба иммуноцитокина IL-12 могут замедлять прогрессирование опухоли и/или увеличивать продолжительность жизни людей с резистентными к иммунотерапии раковыми заболеваниями (например, меланомой), демонстрируя многообещающую эффективность in vivo.
Пример 25: Эффективность иммуноцитокинов IL-12 in vivo в мышиной модели сингенной опухоли LL2
[517] Мышиная модель карциномы легкого LL2 представляет собой рефрактерную модель для иммунотерапии, которая не отвечает на терапию антителами к PD-1, антителами к CTLA-4 или комбинацией антител к PD-1 и к CTLA-4.
[518] Для проверки терапевтической эффективности описанных здесь иммуноцитокинов в отношении более устойчивых к иммунотерапии типов рака мышам (масса тела ~20 г) вводили 0,25×106 клеток LL2 мышиного рака легкого. Когда размер опухоли достигал примерно 50-100 мм3 (~16 дней после инокуляции), мышам вводили 10 мг/кг иммуноцитокина IL-12(F60A)/PD-L2-Fc (полученного в примере 15; конструкция № 30), 10 мг/кг иммуноцитокина PD-L2-Fc/IL-12(F60A) (полученного в примере 15, конструкция № 34) или PBS (отрицательный контроль). Всего было сделано три инъекции (по 10 мг/кг на инъекцию) на 16, 20 и 23 дни после инокуляции (обозначены черными стрелками на фигурах 16А и 16В). Размер опухоли регистрировали с течением времени. Мышей умерщвляли, когда размер опухоли превышал 1000 мм3. Размер опухоли в скобках на фигуре 16А приведен как средний размер опухоли (± стандартное отклонение) в каждой группе при введении первой инъекции.
[519] Как видно из фигур 16A и 16B, по сравнению с группой обработки с используванием PBS, в которой опухоль LL2 резко выросла примерно с 20-го дня после инокуляции, иммуноцитокин PD-L2-Fc/IL-12(F60A) (№34) и иммуноцитокин IL-12(F60A)/PD-L2-Fc (№30) в значительной степени подавляли рост опухоли LL2 вплоть до 32-35-го дня после инокуляции, что указывает на то, что оба иммуноцитокина IL-12 могут замедлять прогрессирование опухоли и/или увеличивать продолжительность жизни людей с резистентными к иммунотерапии раковыми заболеваниями (например, раком легкого), демонстрируя многообещающую эффективность in vivo.
[520] В итоге приведенные выше данные (например, см. примеры 23-25) демонстрируют многообещающие результаты эффективности in vivo описанных здесь иммуноцитокинов (например, иммуноцитокинов на основе IL-12/PD-L2-Fc) в лечении различных запущенных и/или трудно поддающихся лечению типов рака (например, ТНРМЖ, меланомы, рака легких), подавлении метастазирования рака, лечении или замедлении прогрессирования опухолей различных типов рака, устойчивых к современным иммунотерапевтическим средствам (например, терапии антителом к PD-1, терапии антителом к CTLA-4 или их комбинированной терапии), и/или увеличение продолжительности жизни таких пациентов.
Пример 26: Положение цитокина или его варианта в иммуноцитокине влияет на неспецифичную активность иммуноцитокина
[521] Были созданы две конструкции иммуноцитокина для проверки того, как размещение цитокина или его варианта в шарнирном участке (между антигенсвязывающим доменом и Fc-фрагментом; скрытая конфигурация) или на С-конце Fc-фрагмента (например, C'-конце тяжелой цепи антитела; открытая конфигурация) может влиять на целевую активность цитокина или его варианта. Первая конструкция включала цитокин в шарнирном участке одной тяжелой цепи антитела к PD-1: внутри шарнирного участка между СН1 и СН2 (иммуноцитокины такой конфигурации названы «IL-12/антитело к PD-1»). Во второй конструкции цитокин составлен с С-концом одной тяжелой цепи антитела к PD-1 через линкер (иммуноцитокины такой конфигурации названы «антитело к PD-1/IL-12»), что представляет собой общую конструкцию для современных иммуноцитокинов.
[522] Антитело к PD-1 человека, содержащее ниволумаб (Opdivo®) VH (SEQ ID NO: 102) и VL (SEQ ID NO: 103) использовали в качестве исходного полноразмерного антитела, содержащего две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 106. При конструировании гетеродимера используют одну тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другую тяжелую цепь, содержащую шарнирный участок с SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62.
[523] Иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1 (конструкция №48), иммуноцитокин IL-12(E59A)/антитело к PD-1 (конструкция №46) и иммуноцитокин IL-12(G64A)/антитело к PD-1 (конструкция № 47) с вариантом IL-12 (одноцепочечный, от N' к C': IL-12B (вариант p40)-линкер-IL-12A (wt p35)), расположенным в шарнирном участке одной тяжелой цепи гетеродимерного антитела к PD-1, конструировали, как описано в примерах 4 и 14.
[524] Чтобы получить составные конструкции цитокинов в положении C' тяжелой цепи, одноцепочечный вариант IL-12(E59A) (SEQ ID NO: 331), одноцепочечный вариант IL-12(G64A) (SEQ ID NO: 332) или одноцепочечный вариант IL-12 (E59A/F60A) (SEQ ID NO: 36) соединяли C'-концом одной тяжелой цепи гетеродимерного антитела к PD-1 через пептидный линкер, G/S-содержащий. Конструкции в дальнейшем обозначаются как антитело к PD-1/IL-12(E59A) (конструкция № 46HC'; составной полипептид тяжелой цепи цитокина, несоставной полипептид тяжелой цепи SEQ ID NO: 107), антитело к PD-1/IL-12(G64A) (конструкция № 47HC'; составной полипептид тяжелой цепи цитокина, несоставной полипептид тяжелой цепи SEQ ID NO: 107) и антитело к PD-1/IL-12(E59A/F60A) (конструкция № 48HC'; составной полипептид тяжелой цепи цитокина, несоставной полипептид тяжелой цепи SEQ ID NO: 107) соответственно.
[525] Анализы трансдукции сигнала IL-12 с использованием клеток HEK-Blue™ IL-12 и HEK-PD-1-IL-12 (полученных собственными силами путем сверхэкспрессии человеческого PD-1 в клетках HEK-Blue™ IL-12 с использованием лентивирусного вектора) проводили так же, как описано в примере 4, с двумя конфигурациями иммуноцитокинов, описанными выше, и rIL-12 (положительный контроль).
(конструкция №47)
(конструкция №46)
(конструкция №48)
(конструкция № 47НС')
(конструкция № 46HC')
(конструкция № 48HC')
[526] Репортерный анализ HEK-IL-12 показал, что обе конфигурации иммуноцитокина IL-12 способны связываться с клетками HEK-IL-12 путем взаимодействия фрагмента IL-12/рецептора IL-12 только, если фрагмент IL-12 был доступен (например, конфигурация присоединения к тяжелой цепи по C'). Репортерный анализ HEK-PD-1-IL-12 показал, что обе конфигурации иммуноцитокина IL-12 способны связываться с клетками HEK-PD-1-IL-12 путем взаимодействия фрагмента IL-12/рецептора IL-12 и путем взаимодействия антигенсвязывающего фрагмента антитела к PD-1 с PD-1.
[527] Как видно из Таблицы 16, конфигурация, составленная с шарниром, значительно снижала неспецифичную активность (т.е. активность цитокинов в отсутствие связывания PD-1) по сравнению с конфигурацией, где присоединение выполнено на С-конце тяжелой цепи. В PD-1-отрицательных клетках (HEK-IL-12) конструкция № 48 показала почти неопределяемый уровень активности IL-12 (<0,2%) по сравнению с 4% для конструкции № 48HC'. Аналогичные результаты наблюдали для конструкции № 47 и конструкции № 47HC' (5% по сравнению с 15%, соответственно). Двойная мутация E59A/F60A в IL-12 также значительно снижает неспецифичную активность по сравнению с одиночной мутацией E59A или G64A. В PD-1-положительных клетках (HEK-PD-1-IL-12) целевая активность IL-12 у соответствующей конфигурации, составленной с шарниром, и у конфигурации, где присоединение выполнено на C-конце тяжелой цепи, была похожа, что позволяет предположить, что конструкция, составленная с шарниром, незначительно подавляет активность IL-12 в присутствии антигенпозитивных клеток (или при наличии связывания антигена). В совокупности шарнирное расположение цитокина (особенно некоторых вариантов цитокина) может значительно снизить неспецифичную активность IL-12 в отсутствие связывания антигенсвязывающего домена.
Пример 27: Получение иммуноцитокинов IL-12/антитело к PD-1 со сниженным сродством к PD-1
Создание вариантов антител к PD-1 со сниженным сродством связывания с PD-1
[528] Из-за высокого сродства связывания ниволумаба с PD-1 иммуноцитокины IL-12/антитело к PD-1, в которых используется ниволумаб дикого типа в качестве исходного антитела, могут направлять активность IL-12 на все PD-1-положительные клетки, независимо от уровня экспрессии PD-1. Активация такой большой популяции PD-1-положительных клеток может привести к цитокиновому шторму или другим неблагоприятным побочным эффектам вследствие активации любых PD-1-положительных иммунных клеток.
[529] Для создания мутантных антител к PD-1 с пониженным сродством связывания с PD-1, которые были бы нацелены только на клетки с высокой экспрессией PD-1 (например, Т-клетки), мутации вводили в HC-CDR3 в положениях D100 или N99 ниволумаба: HC-CDR3 (D100N), HC-CDR3 (D100G), HC-CDR3 (D100R), HC-CDR3 (N99G), HC-CDR3 (N99A) и HC-CDR3 (N99M). Сродство этих антител к PD-1 измеряли с помощью Biacore и клеточных анализов, откалиброванных по сродству связывания ниволумаба дикого типа (см. Таблицу 17). «Н/О» указывает на то, что связывание с Pd-1 не обнаружено.
[530] В случае конструирования гетеродимерного антитела к PD-1 одна тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 42, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая тяжелая цепь содержит шарнирный участок, содержащий SEQ ID NO: 41, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Каждая из двух легких цепей содержит аминокислотную последовательность SEQ ID NO: 106.
Конструирование иммуноцитокинов IL-12/антитело к PD-1 со сниженным сродством к PD-1
[531] Различные иммуноцитокины IL-12/антитело к PD-1 получали, как описано в примере 4, путем размещения одноцепочечного варианта IL-12 (E59A/F60A) (SEQ ID NO: 36) в шарнирном участке одной тяжелой цепи различных мутантов антител к PD-1, описанных выше. Последовательность составного полипептида цитокина и тяжелой цепи представлена в таблице 18 для каждой из конструкций. Соответствующая парная несоставная тяжелая цепь включает, от N' к C': VH (с соответствующей мутацией HC-CDR3) - CH1 - шарнир (SEQ ID NO: 41) - субъединица Fc-домена (SEQ ID NO: 62).
Анализ передачи сигнала IL-12
[532] Анализы передачи сигнала IL-12 проводили так же, как описано в примере 4, с использованием иммуноцитокинов IL-12/антитело к PD-1(мут.) с пониженным сродством связывания с PD-1 (IL-12(E59A/F60A)/антитело к PD-1(wt) и rIL-12 служили контролем) на клетках HEK-Blue™ IL-12 и клетках HEK-PD-1-IL-12. Использовали два варианта клеток HEK-PD-1-IL-12: один с высокой экспрессией PD-1 - «HEK-IL-12-PD-1 (высокая)» (как описано в примере 4, сверхэкспрессия PD-1), и один с 30-кратно более низкой экспрессией PD-1 «HEK-IL-12-PD-1 (низкий)» (созданы собственными силами путем экспрессии меньшего количества человеческого PD-1 в клетках HEK-Blue™ IL-12 с использованием лентивирусного вектора). Клетки инкубировали с 20 нг/мл различных иммуноцитокинов IL-12/антитело к PD-1 (или контроля) в течение 24 часов.
Анализ высвобождения IFN-γ
[533] Анализы высвобождения IFN-γ проводили так же, как описано в примере 5, с использованием иммуноцитокинов IL-12(E59A/F60A)/антитело к PD-1(мут.) с пониженным сродством связывания с PD-1. IL-12(E59A/F60A)/антитело к PD-1(wt) и rIL-12 служили контролем. Вкратце, Т-клетки активировали путем инкубирования РВМС с антителом к CD3 (ОКТ3, 100 нг/мл) в течение трех дней. PBMC промывали для удаления антитела к CD3 и инкубировали с 200 нг/мл различных иммуноцитокинов IL-12(E59A/F60A)/антитело к PD-1(мут.) (или контроля) в течение 24 часов. Через один день измеряли содержание IFN-γ, высвобождаемого в культуральную среду.
(последовательность составной тяжелой цепи)
(IFN-γ нг/мл)
(конструкция № 48; SEQ ID NO: 112)
(SEQ ID NO: 268)
(SEQ ID NO: 269)
(SEQ ID NO: 270)
(SEQ ID NO: 271)
(SEQ ID NO: 272)
(SEQ ID NO: 273)
[534] Как видно из Таблицы 18, для всех исследованных иммуноцитокинов не наблюдали неспецифичной активности IL-12 в отсутствие связывания антитела к PD-1 (см. колонку HEK-IL-12). Их способность передавать сигнал IL-12 при наличии связывания PD-1, а также их способность индуцировать высвобождение IFN-γ снижается по мере снижения сродства связывания антитела к PD-1, демонстрируя антигенсвязывающую цитокиновую активность конфигурации с шарниром. Иммуноцитокины IL-12(E59A/F60A)/антитело к PD-1 с мутациями D100G, D100R или N99G в тяжелой цепи антитела к PD-1 показали заметные различия в связывании между клетками с высоким и низким уровнем экспрессии PD-1. Эти результаты показывают, что иммуноцитокины IL-12(E59A/F60A)/антитело к PD-1(мут.) с пониженным сродством к PD-1 могут быть специфично нацелены на клетки, экспрессирующие PD-1 на более высоком уровне. Выработка IFN-γ, индуцированная этими конструкциями, также была намного ниже по сравнению с контрольным иммуноцитокином IL-12/антитело к PD-1(wt) и rIL-12.
[535] Следовательно, описанные здесь иммуноцитокины IL-12(E59A/F60A)/антитело к PD-1(мут.) и, возможно, другие иммуноцитокины, сконструированные на основе антигенсвязывающего домена с пониженным сродством связывания антигена, можно использовать для специфичного нацеливания на интересующие клетки с высокой экспрессией антигена, что снизит побочные эффекты и/или цитокиновый шторм.
Пример 28: Снижение сродства связывания PD-1 у иммуноцитокинов IL-12/антитело к PD-1 снижает токсичность у мышей
[536] Гуманизированным мышам PD-1 (гуманизированным путем встраивания в локус мышиного PD-1 химерного PD-1 с человеческим внеклеточным доменом, мышиным трансмембранным доменом и мышиным внутриклеточным доменом), полученные из штамма C57 (возраст 5-6 недель, самки весом 20 г) вводили по 10 мг/кг или 50 мг/кг (на инъекцию) различных иммуноцитокинов IL-12(E59A/F60A)/антитело к PD-1(мут.), описанных в примере 27. Иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1(wt) (конструкция №48) служил в качестве контроля. Всего было сделано четыре инъекции в дни 0, 4, 8 и 12. Мышей ежедневно обследовали на смертность и четыре симптома токсичности: i) текстуру меха, ii) снижение активности, iii) клинические проявлениям и iv) потерю веса.
[537] Мыши, которым вводили иммуноцитокин IL-12(E59A/F60A)/антитело к PD-1(wt), содержащий ниволумаб дикого типа, показали наибольшую токсичность, при этом все мыши в группе умерли после получения второй или третьей инъекции, даже при более низких дозах. Напротив, у мышей, которым вводили иммуноцитокины IL-12(E59A/F60A)антитело к PD-1(мут.), содержащие антитело к PD-1 со сниженным сродством связывания с PD-1, наблюдалась сниженная токсичность, при этом смерть наблюдалась только в группе, получавшей IL-12(E59A/F60A)/антитело к PD-1(D100N). Как видно из Таблицы 19, тяжесть симптома токсичности среди конструкций снижается по мере снижения сродства связывания с PD-1 и/или по мере уменьшения дозы.
(конструкция №48)
[538] Из-за высокого сродства связывания ниволумаба дикого типа с PD-1 (Kd≈10-8-10-9 M), IL-12(E59/F60A)/антитело к PD-1(WT), скорее всего, связывает и стимулирует (через цитокиновую активность) любую PD-1-положительную клетку. Это будет включать активированные Т-клетки и NK-клетки, что приводит к синдрому высвобождения цитокинов. Напротив, иммуноцитокины на основе IL-12/антитело к PD-1 с пониженным сродством связывания с hPD-1 могут связывать только значительно меньшую популяцию PD-1-положительных клеток, особенно клеток с очень высоким уровнем экспрессии PD-1, таких как истощенные T-клетки. Приведенные здесь данные согласуются с данными из in vitro анализа РВМС высвобождения IFN-γ в примере 27. Эти результаты показывают, что снижение сродства связывания PD-1 антигенсвязывающего домена антитела к PD-1 до Kd примерно 10-6-10-7 M (см., например, D100G, D100R, N99G в тяжелой цепи антитела к PD-1) может значительно повысить безопасность иммуноцитокинов IL-12/антитело к PD-1, сохраняя при этом терапевтическую эффективность.
Пример 29: Повышение сродства связывания PD-L1 и PD-L2 не увеличивает токсичность иммуноцитокинов IL-12/PD-L1-Fc и IL-12/PD-L2-Fc.
[539] Как показано в примерах 14-17, замена антигенсвязывающего фрагмента антитела к PD-1 внеклеточным доменом PD-L2 в иммуноцитокинах IL-12 может значительно снизить токсичность, вероятно из-за стимулированной передачи сигналов ингибирующей контрольной точки PD-1 иммунной системы при связывании PD-L2-PD-1, что создает сигнал иммуносупрессии, который «уравновешивает» иммуностимулирующую/провоспалительную активность IL-12. Чтобы исследовать, можно ли дополнительно улучшить профили безопасности этих «уравновешивающих» конструкций, были сконструированы иммуноцитокины IL-12, содержащие внеклеточный домен PD-L1 или PD-L2 с повышенным сродством связывания с PD-1, чтобы усилить сигнал иммуносупрессии PD-1.
Получение вариантов PD-L1 с повышенным сродством связывания с PD-1
[540] PD-L1 дикого типа имеет сродство связывания с PD-1 примерно 10-5-10-6 М, что ниже, чем у ниволумаба (Kd≈10-8-10-9 М). Для увеличения сродства к PD-1 были созданы мутанты PD-L1. Мутации вводили во внеклеточный домен PD-L1 дикого типа с положениями аминокислот, соотносящимися с SEQ ID NO: 249. Эти мутантные внеклеточные домены PD-L1 затем составляли с Fc-фрагментом через шарнирный участок для конструирования исходных конструкций PD-L1-Fc. При конструировании гетеродимера PD-L1-Fc одна полипептидная цепь содержит шарнирный участок, содержащий SEQ ID NO: 52, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая полипептидная цепь содержит шарнирный участок, содержащий SEQ ID NO: 51, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Названия мутантных конструкций были сделаны для конфигурации PD-L1(мут.)-Fc.
[541] Описание сделанных мутаций и сродства связывания с PD-1 (измеренные для конфигурации PD-L1-Fc) показаны в таблице 20. Сродство связывания каждого PD-L1(мут.)-Fc калибровали относительно сродства связывания PD-L1(wt)-Fc. Н/О указывает на то, что связывание PD-1 не выявлено. Эти результаты показывают, что все PD-L1(мут.) позволяют достичь примерно 4-60-кратного повышения сродства связывания с PD-1 по сравнению с PD-L1 дикого типа. Среди них PD-L1(I54Q/E58M/R113T/M115L/S117A/G119K) (PD-L1(мут2)), PD-L1(I54Q/E58M/R113T/M115L/G119K) (PD-L1(мут6)) и PD-L1(I54Q/E58M/R113T/M115L/S117A) (PD-L1(мут7)) продемонстрировали максимальное кратное повышение сродства к PD-1 по сравнению с PD-L1 дикого типа.
(PD-L1(WT); SEQ ID NO: 250)
(PD-L1(мут1); SEQ ID NO: 255)
(PD-L1(мут2); SEQ ID NO: 256)
(PD-L1(мут3); SEQ ID NO: 257)
(PD-L1(мут4); SEQ ID NO: 258)
(PD-L1(мут5); SEQ ID NO: 259)
(PD-L1(мут6); SEQ ID NO: 260)
(PD-L1(мут7); SEQ ID NO: 261)
Получение вариантов PD-L2 с повышенным сродством связывания с PD-1
[542] PD-L2 имеет сродство связывания с PD-1 примерно 10-6-10-7 М, что ниже, чем у ниволумаба (Kd≈10-8-10-9 М). Для увеличения сродства к PD-1 были созданы мутанты PD-L2. Мутации вводили во внеклеточный домен PD-L2 дикого типа с положениями аминокислот, соотносящимися с SEQ ID NO: 175. Эти мутантные внеклеточные домены PD-L2 затем составляли с Fc-фрагментом через шарнирный участок при получении исходных конструкций PD-L2-Fc. При конструировании гетеродимера PD-L2-Fc одна полипептидная цепь содержит шарнирный участок, содержащий SEQ ID NO: 52, и субъединицу Fc-домена, содержащую SEQ ID NO: 61; другая полипептидная цепь содержит шарнирный участок, содержащий SEQ ID NO: 51, и субъединицу Fc-домена, содержащую SEQ ID NO: 62. Названия мутантных конструкции были сделаны для конфигурации PD-L2(мут.)-Fc.
[543] Описание сделанных мутаций и сродства связывания PD-1 (измеренные для конфигурации PD-L2-Fc) показаны в таблице 21. Сродство связывания для каждого PD-L2(мут.)-Fc калибровали относительно сродства связывания PD-L2(wt)-Fc. Эти результаты показывают, что все PD-L2(мут.) достигли примерно 2-5-кратного увеличения сродства связывания с PD-1 по сравнению с PD-L2 дикого типа. Среди них PD-L2(S58V) (PD-L2(мут2)) и PD-L2(T56V/S58V/Q60L) (PD-L2(мут4)) продемонстрировали максимальное кратное увеличение сродства к PD-1 по сравнению с PD-L2 дикого типа.
(PD-L2(WT); SEQ ID NO: 176)
(PD-L2(мут1); SEQ ID NO: 262)
(PD-L2(мут2); SEQ ID NO: 263)
(PD-L2(мут3); SEQ ID NO: 264)
(PD-L2(мут4); SEQ ID NO: 265)
Конструирование иммуноцитокинов IL-12/PD-L1-Fc и IL-12/PD-L2-Fc с повышенным сродством к PD-1
[544] Подобно тому, как описано в примере 15, гетеродимерный PD-L1(мут.)-Fc или PD-L2(мут.)-Fc, полученный в данном документе, использовали в качестве исходных антигенсвязывающих белков для конструирования иммуноцитокинов IL-12, которые связываются с PD-1. Одноцепочечный вариант IL-12(E59A/F60A) помещали в N'-конец шарнира одной полипептидной цепи в исходных гетеродимерах PD-L1(мут.)-Fc или PD-L2(мут.)-Fc.
[545] Вкратце, иммуноцитокин IL-12(E59A/F60A)/PD-L2(wt)-Fc («конструкция № 29») содержит один составной полипептид IL-12, содержащий SEQ ID NO: 186 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG (SEQ ID NO: 203) - одноцепочечный вариант IL-12(E59A/F60A) (SEQ ID NO: 36) - шарнир (SEQ ID NO: 52) - субъединица Fc-домена (SEQ ID NO: 61)); и один парный полипептид, содержащий SEQ ID NO: 185 (от N' к C': внеклеточный домен PD-L2 (SEQ ID NO: 176) - линкер GSG - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)). Иммуноцитокин IL-12(E59A/F60A)/PD-L2(мут.)-Fc содержит один составной полипептид IL-12 (от N' к C': внеклеточный домен PD-L2(мут.) - линкер GGGGSGGG (SEQ ID NO: 334) - одноцепочечный вариант IL-12(E59A/F60A) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 52) - субъединица Fc-домена (SEQ ID NO: 61)); и один спаренный полипептид (от N' к C': внеклеточный домен PD-L2(мут.) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)).
[546] Иммуноцитокин IL-12(E59A/F60A)/PD-L1(wt)-Fc содержит один составной полипептид IL-12 (от N' к C': внеклеточный домен PD-L1(WT) (SEQ ID NO: 250) - линкер GGGGSGGG (SEQ ID NO: 334) - одноцепочечный вариант IL-12(E59A/F60A) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 52) - субъединица Fc-домена (SEQ ID NO: 61)); и один спаренный полипептид (от N' к C': внеклеточный домен PD-L1(WT) (SEQ ID NO: 250) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)). Иммуноцитокин IL-12(E59A/F60A)/PD-L1(мут.)-Fc содержит один составной полипептид IL-12 (от N' к C': внеклеточный домен PD-L1(мут.) - линкер GGGGSGGG (SEQ ID NO: 334) - одноцепочечный вариант IL-12(E59A/F60A) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 52) - субъединица Fc-домена (SEQ ID NO: 61)); и один спаренный полипептид (от N' к C': внеклеточный домен PD-L1(мут.) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)).
[547] Для проверки профилей безопасности иммуноцитокинов IL-12, сконструированных так, чтобы иметь повышенное сродство к PD-1, мышам C57 дикого типа (возраст 5-6 недель, самки 20 г) вводили 10 мг/кг или 50 мг/кг (на инъекцию) иммуноцитокина IL-12(E59A/F60A)/PD-L1(mut2)-Fc или иммуноцитокина IL-12(E59A/F60A)/PD-L2(mut2)-Fc, поскольку эти две конструкции показали сходное сродство связывания с PD-1 как человека, так и мыши PD-1 (~10-7 М). В качестве контроля использовали иммуноцитокин IL-12(E59A/F60A)/PD-L1(WT)-Fc или иммуноцитокин IL-12(E59A/F60A)/PD-L2(WT)-Fc. Всего было сделано четыре инъекции в дни 0, 4, 8 и 12. Мышей ежедневно обследовали на смертность и четыре симптома токсичности: i) текстуру меха, ii) снижение активности, iii) клинические проявлениям и iv) потерю веса.
[548] Как видно из Таблицы 22, повышение сродства связывания с PD-1 не оказывает существенного влияния на профили безопасности иммуноцитокина IL-12(E59A/F60A)/PD-L1-Fc или иммуноцитокина IL-12(E59A/F60A)/PD-L2-Fc. Эти результаты показывают, что иммуноцитокины IL-12, содержащие мутантные версии PD-L1 и PD-L2 с повышенным сродством связывания с PD-1, сохраняют профиль безопасности иммуноцитокинов IL-12/PD-L1-Fc дикого типа и IL-12/PD-L2-Fc. Это также может быть применено к другим иммуноцитокинам на основе PD-L1-Fc или PD-L2-Fc для конструирования других иммуноцитокинов (например, иммуноцитокинов IL-2).
(Последовательность цитокиновой составной цепи)
(I54Q/E58M/R113T/M115L/S117A/G119K)-Fc
(«IL-12(E59A/F60A)/PD-L1
(mut2)-Fc»; SEQ ID NO: 277)
(конструкция № 29; SEQ ID NO: 186)
(IL-12(E59A/F60A)/PD-L2(mut2)-Fc; SEQ ID NO: 293)
Пример 30: Получение иммуноцитокинов IL-2/PD-L1 с биологической активностью IL-2, направленной на PD-1-положительные клетки
[549] Некоторые цитокины обладают синергетическим действием, например IL-12 и IL-2, IL-12 и IFN-γ. Для снижения токсичности IL-2 и его иммуноцитокинов были созданы два набора мутаций IL-2: мутации в домене IL-2, которые взаимодействуют с IL2Rα (CD25) (R38D/K43E/E61R), и мутации в домене IL-2, которые взаимодействует с IL2Rγ (CD132) (L18R, Q22E, Q126T, S130R или любые их комбинации). См. Таблицу 23.
[550] Гетеродимерный PD-L1(mut2)-Fc использовали в качестве исходного белка, связывающего PD-1. Первая полипептидная цепь содержит SEQ ID NO: 281 (от N' к C': внеклеточный домен PD-L1(mut2) (SEQ ID NO: 256) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 52) - субъединица Fc-домена (SEQ ID NO: 61)), вторая полипептидная цепь содержит SEQ ID NO: 283 (от N' к C': внеклеточный домен PD-L1(mut2) (SEQ ID NO: 256) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)). Для конструирования иммуноцитокинов IL-2 вариант IL-2 помещали между внеклеточным доменом PD-L1(mut2) и шарниром. Вкратце, иммуноцитокин IL-2(мут.)/PD-L1(mut2)-Fc содержит один составной полипептид IL-2 (от N' к C': внеклеточный домен PD-L1(mut2) (SEQ ID NO: 256) - линкер GGGSG (SEQ ID NO: 209) - вариант IL-2(мут.) - линкер GGGGSGGG (SEQ ID NO: 334) - шарнир (SEQ ID NO: 51) - субъединица Fc-домена (SEQ ID NO: 62)); и один парный полипептид SEQ ID NO: 281.
[551] Клетки HEK-Blue™ IL-2 и клетки HEK-PD-1-IL-2 использовали для оценки активности конструкций по активации сигнала IL-2, как описано в примерах 1-3. Как видно из таблицы 23, IL-2(R38D/K43E/E61R)/PD-L1(mut2)-Fc с мутациями IL-2 только в CD25-связывающем домене (R38D/K43E/E61R) по-прежнему сохраняли примерно 16% активности IL-2 согласно анализу HEK-IL-2 (без связывания с PD-1), в то время как иммуноцитокины IL-2, дополнительно несущие мутации IL-2 в CD132-связывающем домене, значительно снижали активность IL-2 в отсутствие связывания с PD-1 согласно анализу HEK-IL-2. Примечательно, что активность IL-2-некоторых иммуноцитокинов IL-2, дополнительно несущих мутации CD132-связывающего домена (см. конструкции, содержащие SEQ ID NO: 285, SEQ ID NO: 286 или SEQ ID NO: 287) можно частично восстановить при связывании с PD-1 (согласно анализу HEK-IL-2-PD-1). S130 может иметь решающее значение для активности IL-2, так как иммуноцитокин IL-2 дополнительно несущий мутацию S130R в CD132-связывающем домене (см. конструкцию, содержащую SEQ ID NO: 288) в сочетании с другими мутациями IL-2, не проявляет какой-либо активности IL-2 даже в присутствии связывания PD-1.
Пример 31: Получение иммуноцитокинов IL-2/IL-12/PD-L1 с биологической активностью IL-2 и IL-12, направленной на PD-1-положительные клетки
[552] Некоторые цитокины, например IL-12 и IL-2, обладают синергетическим действием. Как показано в приведенных выше примерах, иммуноцитокин IL-12(E59A/F60A)/PD-L1-Fc (шарнирный участок) проявлял активность IL-12, зависящую от связывания PD-1. Чтобы исследовать, можно ли сконструировать иммуноцитокины, в которых будет присутствовать синергическая активность IL-12 и IL-2, и при этом будет сохранена зависимая от связывания PD-1 цитокиновая активность, были сконструированы различные конфигурации иммуноцитокинов. Гетеродимерный PD-L1(мут2)-Fc использовали в качестве исходного составного белка, связывающего PD-1 (сконструирован в примере 29). Серия I: одна полипептидная цепь содержит одноцепочечный полипептид IL-12(E59A/F60A), расположенный в шарнирном участке PD-L1(мут2)-Fc (см. SEQ ID NO: 277, сконструированный в примере 29); парная полипептидная цепь не содержит фрагмент IL-2 (контроль; SEQ ID NO: 283, сконструирована в примере 29) или содержит вариант IL-2 (либо с мутацией L18R/Q22E/R38D/K43E/E61R (SEQ ID NO: 251), либо с мутацией R38D/K43E/E61R/Q126T (SEQ ID NO: 252)) расположенный в шарнирном участке PD-L1(мут2)-Fc. Иммуноцитокины такой конфигурации названы IL-2/IL-12(E59A/F60A)/PD-L1(мут2)-Fc. Серия 2: одна полипептидная цепь содержит IL-12(E59A/F60A), составленный с C'-концом PD-L1(мут2)-Fc через линкер GGGGSGGG (см. SEQ ID NO: 279); парная полипептидная цепь не содержит фрагмент IL-2 (контроль; SEQ ID NO: 283, сконструирована в примере 29), или содержит вариант IL-2 (либо с мутацией L18R/Q22E/R38D/K43E/E61R (SEQ ID NO: 251), либо с мутацией R38D/K43E/E61R/Q126T (SEQ ID NO: 252)) расположенный в шарнирном участке PD-L1(мут2)-Fc. Иммуноцитокины такой конфигурации названы IL-2/PD-L1(мут2)-Fc/IL-12(E59A/F60A), указывая на то, что фрагмент IL-12 находится на C'-конце Fc. Последовательности конструкций см. в Таблице 24.
[553] Клетки HEK-Blue™ IL-2 и клетки HEK-PD-1-IL-2 использовали для оценки активности конструкций по активации сигнала IL-2, как описано в примерах 1-3. Клетки HEK-Blue™ IL-12 и клетки HEK-PD-1-IL-12 использовали для оценки активности конструкций по активации сигнала IL-12, как описано в примере 4.
[554] Как видно из таблицы 24, IL-12(E59A/F60A)/PD-L1(мут2)-Fc (присоединение к шарниру) в отсутствие связывания с PD-1 не выявило активность IL-12, в то время как связывание с PD-1 восстанавливало активность IL-12 до 24%. Если IL-12(E59A/F60A) размещали на C'-конце Fc, как в PD-L1(мут2)-Fc/IL-12(E59A/F60A), активность IL-12 составляла примерно 1%-2% в отсутствие связывания PD-1, но активность IL-12 дополнительно восстанавливались за счет связывания с PD-1 (~ 25%) в той же степени, что и в случае присоединения IL-12 к шарниру.
[555] При добавлении IL-2 в парную цепь к шарнирному участку, в обоих конфигурациях присоединения IL-12 к шарниру и составления с C'-концом активность IL-2 составляла примерно 2-4% в отсутствие связывания с PD-1, но восстанавливалась примерно до 20%-35% за счет связывания PD-1.
[556] Эти данные указывают на то, что и IL-12, и IL-2 могут сохранять зависимую от связывания с PD-1 активность, если они включены в конфигурацию триспецифического иммуноцитокина. Кроме того, фрагменты IL-12 и IL-2 не оказывали существенного отрицательного влияния на активность друг друга.
(шарнир IL-12)
(шарнир IL-12)
(шарнир IL-12)
(IL-12 на С')
(IL-12 на С')
(IL-12 на С')
Пример 32: Размещение фрагмента IL-12 в шарнирном участке может значительно улучшить профили безопасности иммуноцитокинов IL-12/PD-L1-Fc и иммуноцитокинов IL-2/IL-12/PD-L1-Fc
[557] PD-L1(mut2)-Fc, сконструированный в примере 29, использовали в качестве исходного составного белка, связывающего PD-1, поскольку он проявлял сходное сродство связывания с PD-1 как у человека, так и у мышей.
[558] Для исследования профилей безопасности in vivo, вариант мышиного одноцепочечного IL-12 (SEQ ID NO: 330) с мутациями E59A/F60A в субъединице p40 и субъединице p35 дикого типа конструировали аналогично тому, как описано в данном документе: от N' к C': линкер p40(E59A/F60A)-GGPGGGGSGGGSGGGG (SEQ ID NO: 335)-p35(wt) (человеческий IL-12 не проявляет своих функций в организме мыши). Были сконструированы две серии составных полипептидов IL-12, аналогично примеру 31. Серия I: одна полипептидная цепь содержит одноцепочечный полипептид mIL-12(E59A/F60A), расположенный в шарнирном участке PD-L1(мут2)-Fc (см. SEQ ID NO: 328); парная полипептидная цепь не содержит фрагмент IL-2 (контроль; SEQ ID NO: 283, сконструирована в примере 29) или содержит вариант IL-2 (с мутацией R38D/K43E/E61R (SEQ ID NO: 2), с мутацией L18R/Q22E/R38D/K43E/E61R (SEQ ID NO: 251) или с мутацией R38D/K43E/E61R/Q126T (SEQ ID NO: 252)) расположенный в шарнирном участке PD-L1(мут2)-Fc. Иммуноцитокины такой конфигурации названы IL-2/IL-12(E59A/F60A)/PD-L1(мут2)-Fc. Набор 2: одна полипептидная цепь содержит одноцепочечный mIL-12(E59A/F60A), составленный с C'-концом PD-L1(мут2)-Fc через линкер GGGGSGGG (см. SEQ ID NO: 279); парная полипептидная цепь не содержит фрагмент IL-2 (контроль; SEQ ID NO: 283, сконструирована в примере 29) или содержит вариант IL-2 (с мутацией R38D/K43E/E61R (SEQ ID NO: 2), с мутацией L18R/Q22E/R38D/K43E/E61R (SEQ ID NO: 251), расположенный в шарнирном участке PD-L1(мут2)-Fc. Иммуноцитокины такой конфигурации названы IL-2/PD-L1(мут2)-Fc/IL-12(E59A/F60A), указывая на то, что фрагмент IL-12 находится на C'-конце Fc. Последовательности конструкций см. в Таблице 24. В контрольной серии не было фрагмента IL-12, составленного с PD-L1(мут2)-Fc (SEQ ID NO: 281).
[559] Для проверки профилей безопасности этих конструкций мышам C57 дикого типа (возраст 5-6 недель, вес 20 г, самки) вводили PBS (контроль) или описанные здесь иммуноцитокины (по 10 мг/кг на инъекцию). Всего было сделано 4 инъекции каждые 4 дня. Мышей обследовали на смерти и симптома токсичности, такие как текстура меха, снижение активности и потеря веса. 48 часов после 2й после инъекции брали кровь и измеряли концентрацию IFN-γ в сыворотке.
[560] Как показано в Таблице 25, иммуноцитокины, содержащие дополнительные мутации IL-2 в CD132-связывающем домене (L18R/Q22E или Q126T) в дополнение к R38D/K43E/E61R в CD25-связывающем домене, продемонстрировали гораздо более высокие профили безопасности по сравнению с таковыми без мутаций в CD132-связывающем домене (см. конструкции, содержащие SEQ ID NO: 327), независимо от того, находится ли фрагмент IL-12 в на С' или в шарнире.
[561] Иммуноцитокины с IL-12 на C'-конце Fc - IL-2(мут.)/PD-L1(мут2)-Fc/mIL-12(E59A/F60A) - показали более высокую токсичность по сравнению с IL-12, расположенным в шарнирном участке (IL -2(мут)/mIL-12(E59A/F60A)/PD-L1(мут2)-Fc). IL-2(мут.)/PD-L1(мут2)-Fc/mIL-12(E59A/F60A) также индуцировал гораздо более высокое (в 20-30 раз выше) высвобождение цитокинов (см. уровень IFN-γ) по сравнению с IL-12 конфигураций, составленной с шарниром.
[562] В совокупности полученными наши данные in vivo и in vitro, представленные в настоящем документе, свидетельствуют о том, что иммуноцитокины с цитокином (например, IL-12 или его вариантом), расположенным в шарнирном участке, могут значительно улучшить профиль безопасности, даже если в той же конструкции присутствует больше цитокинов с синергетическим действием (например, IL-2/IL-12/PD-L1-Fc). Мутации в цитокинах, снижающие их активност, и/или мутации в антигенсвязывающем домене (например, антитело к PD-1, или PD-L1, или PD-L2) могут дополнительно повысить безопасность и/или терапевтическую эффективность конструкций.
(без IL-12)
(без IL-2)
(без IL-12)
(без IL-12)
(без IL-12)
(mIL-12 на шарнире)
(без IL-2)
(mIL-12 на шарнире)
(mIL-12 на шарнире)
(mIL-12 на шарнире)
(mIL-12 на С')
(без IL-2)
(mIL-12 на С')
(mIL-12 на С')
(mIL-12 на С')
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 (зрелый человеческий IL-2 дикого типа)
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHLRPRDLISNINVIVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT
SEQ ID NO: 2 (IL-2 мутация R38D/K43E/E61R)
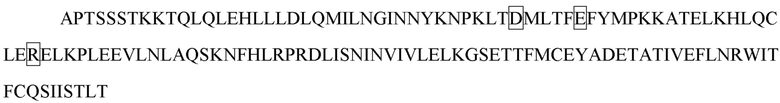
SEQ ID NO: 3 (зрелый человеческий IFN-α2b дикого типа)
CDLPQTHSLGSRRTLMLLAQMRKISLFSCLKDRHDFGFPQEEFGNQFQKAETIPVLHEMIQQIFNLFSTKDSSAAWDETLLDKFYTELYQQLNDLEACVIQGVGVTETPLMKEDSILAVRKYFQRITLYLKEKKYSPCAWEVVRAEIMRSFSLSTNLQESLRSKE
SEQ ID NO: 4 (IFN-α2b мутация L30A)

SEQ ID NO: 5 (IFN-α2b мутация K31A)

SEQ ID NO: 6 (IFN-α2b мутация D32A)

SEQ ID NO: 7 (IFN-α2b мутация R33A)

SEQ ID NO: 8 (IFN-α2b мутация H34A)

SEQ ID NO: 9 (IFN-α2b мутация D35A)

SEQ ID NO: 10 (мономер зрелого человеческого IFN-γ дикого типа)
QDPYVKEAENLKKYFNAGHSDVADNGTLFLGILKNWKEESDRKIMQSQIVSFYFKLFKNFKDDQSIQKSVETIKEDMNVKFFNSNKKKRDDFEKLTNYSVTDLNVQRKAIHELIQVMAELSPAAKTGKRKRSQMLFRG
SEQ ID NO: 11 (мономер IFN-γ мутация S20A/D21A)

SEQ ID NO: 12 (мономер IFN-γ мутация V22A/A23S)

SEQ ID NO: 13 (мономер IFN-γ мутация А23V)
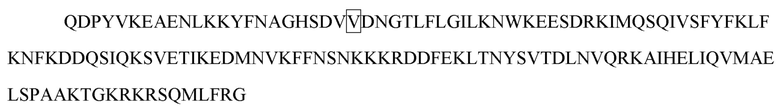
SEQ ID NO: 14 (мономер IFN-γ мутация D24A/N25A)
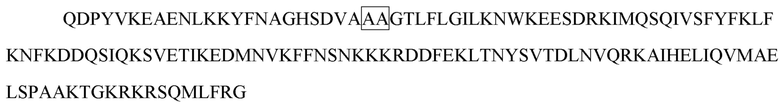
SEQ ID NO: 15 (мономер IFN-γ мутация A23E/D24E/N25K)
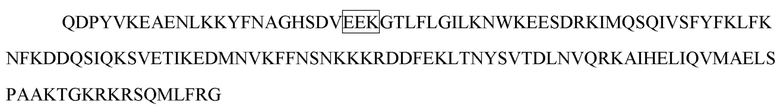
SEQ ID NO: 16 (мономер IFN-γ мутация A23Q)

SEQ ID NO: 17 (мономер IFN-γ мутация D21K)

SEQ ID NO: 18 (одноцепочечный гомодимер IFN-γ «дикого типа»; линкер выделен жирным шрифтом; мономер IFN-γ дикого типа выделен курсивом)
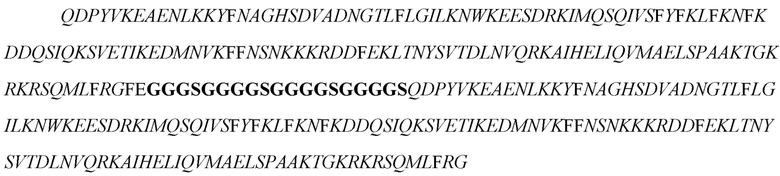
SEQ ID NO: 19 (одноцепочечный гомодимер IFN-γ мутация A23V; линкер выделен жирным шрифтом; мутантный мономер IFN-γ выделен курсивом)
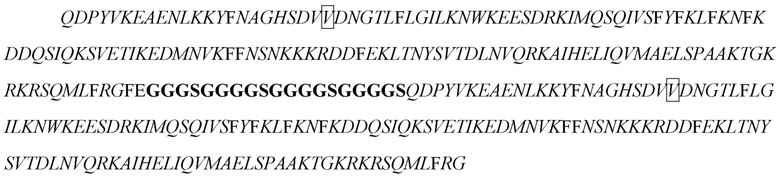
SEQ ID NO: 20 (мономер зрелого человеческого IL-10 дикого типа)
SPGQGTQSENSCTHFPGNLPNMLRDLRDAFSRVKTFFQMKDQLDNLLLKESLLEDFKGYLGCQALSEMIQFYLEEVMPQAENQDPDIKAHVNSLGENLKTLRLRLRRCHRFLPCENKSKAVEQVKNAFNKLQEKGIYKAMSEFDIFINYIEAYMTMKIRN
SEQ ID NO: 21 (мономер IL-10 мутация R24A)

SEQ ID NO: 22 (мономер IL-10 мутация D25A/L26A)

SEQ ID NO: 23 (мономер IL-10 мутация R27A)

SEQ ID NO: 24 (мономер IL-10 мутация D28A/A29S)

SEQ ID NO: 25 (мономер IL-10 мутация F30A/S31A)

SEQ ID NO: 26 (мономер IL-10 мутация R32A)

SEQ ID NO: 27 (одноцепочечный гомодимер IL-10 «дикого типа»; линкер выделен жирным шрифтом; мономер IL-10 дикого типа выделен курсивом)

SEQ ID NO: 28 (одноцепочечный гомодимер IL-10 мутация R27A; линкер выделен жирным шрифтом; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 29 (субъединица зрелого человеческого IL-12A (p35) дикого типа)
RNLPVATPDPGMFPCLHHSQNLLRAVSNMLQKARQTLEFYPCTSEEIDHEDITKDKTSTVEACLPLELTKNESCLNSRETSFITNGSCLASRKTSFMMALCLSSIYEDLKMYQVEFKTMNAKLLMDPKRQIFLDQNMLAVIDELMQALNFNSETVPQKSSLEEPDFYKTKIKLCILLHAFRIRAVTIDRVMSYLNAS
SEQ ID NO: 30 (субъединица зрелого человеческого IL-12B (p40) дикого типа)
IWELKKDVYVVELDWYPDAPGEMVVLTCDTPEEDGITWTLDQSSEVLGSGKTLTIQVKEFGDAGQYTCHKGGEVLSHSLLLLHKKEDGIWSTDILKDQKEPKNKTFLRCEAKNYSGRFTCWWLTTISTDLTFSVKSSRGSSDPQGVTCGAATLSAERVRGDNKEYEYSVECQEDSACPAAEESLPIEVMVDAVHKLKYENYTSSFFIRDIIKPDPPKNLQLKPLKNSRQVEVSWEYPDTWSTPHSYFSLTFCVQVQGKSKREKKDRVFTDKTSATVICRKNASISVRAQDRYYSSSWSEWASVPCS
SEQ ID NO: 31 (субъединица IL-12B (p40) мутация E59A/F60A)

SEQ ID NO: 32 (субъединица IL-12B (p40) мутация E59A)

SEQ ID NO: 33 (субъединица IL-12B (p40) мутация F60A)

SEQ ID NO: 34 (субъединица IL-12B (p40) мутация G64A)

SEQ ID NO: 35 (одноцепочечный гетеродимер IL-12 «дикого типа» IL-12B (p40 дикого типа) - линкер - IL-12A (p35 wt); линкер выделен жирным шрифтом)

SEQ ID NO: 36 (одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)- линкер - IL-12A (wt p35); линкер выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 37 (субъединица зрелого человеческого IL-23A (p19) дикого типа)
RAVPGGSSPAWTQCQQLSQKLCTLAWSAHPLVGHMDLREEGDEETTNDVPHIQCGDGCDPQGLRDNSQFCLQRIHQGLIFYEKLLGSDIFTGEPSLLPDSPVGQLHASLLGLSQLLQPEGHHWETQQIPSLSPSQPWQRLLLRFKILRSLQAFVAVAARVFAHGAATLSP
SEQ ID NO: 38 (одноцепочечный гетеродимер IL-23 «дикого типа» IL-12B (p40 дикого типа) - линкер - IL-23A (p19 wt); линкер выделен жирным шрифтом; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 39 (одноцепочечный IL-23 мутантный гетеродимер IL-12B (p40 E59A/F60A)- линкер - IL-23A (wt p19); линкер выделен жирным шрифтом; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 40 (шарнир)
EPKSCDKTHTCPPCPAPELLGGP
SEQ ID NO: 41 (шарнир)

SEQ ID NO: 42 (шарнир)

SEQ ID NO: 43 (шарнир)

SEQ ID NO: 44 (шарнир)

SEQ ID NO: 45 (шарнир)

SEQ ID NO: 46 (шарнир)
ERKCCVECPPCPAPPVAGP
SEQ ID NO: 47 (шарнир)
ESKYGPPCPSCPAPEFLGGP
SEQ ID NO: 48 (шарнир, например, шарнирная N'-часть)
EPKSCDK
SEQ ID NO: 49 (шарнир, например, шарнирная N'-часть)
EPKSC
SEQ ID NO: 50 (шарнир, например, шарнирная С'-часть)
DKTHTCPPCPAPELLGGP
SEQ ID NO: 51 (шарнир, например, шарнирная С'-часть)

SEQ ID NO: 52 (шарнир, например, шарнирная С'-часть)

SEQ ID NO: 53 (шарнир)
DKTHT
SEQ ID NO: 54 (шарнир, например, шарнирная N'-часть)
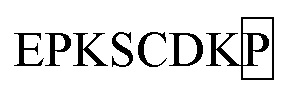
SEQ ID NO: 55 (шарнир)

SEQ ID NO: 56 (шарнир)

SEQ ID NO: 57 (шарнир)

SEQ ID NO: 58 (шарнир)
ESKYGPPCPPCPAPEFLGGP
SEQ ID NO: 59 (шарнир)

SEQ ID NO: 60 (Fc человеческого IgG1 дикого типа)
SVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 61 (IgG1 Fc мутант1 T350V/L351Y/S400E/F405A/Y407V)

SEQ ID NO: 62 (IgG1 Fc мутант2 T350V/T366L/N390R/K392M/T394W)

SEQ ID NO: 63 (Fc человеческого IgG4 дикого типа)
SVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK
SEQ ID NO: 64 (мутант Fc IgG1)

SEQ ID NO: 65 (мутант Fc IgG1)

SEQ ID NO: 66 (мутант Fc IgG1)

SEQ ID NO: 67 (ибализумаб/Trogarzo anti-CD4 Ab HC-CDR1)
GYTFTSYVIH
SEQ ID NO: 68 (ибализумаб/Trogarzo anti-CD4 Ab HC-CDR2)
YNDGTDYDEKFKG
SEQ ID NO: 69 (ибализумаб/Trogarzo anti-CD4 Ab HC-CDR3)
EKDNYATGAWFAY
SEQ ID NO: 70 (ибализумаб/Trogarzo anti-CD4 Ab LC-CDR1)
KSSQSLLYSTNQKNYLA
SEQ ID NO: 71 (ибализумаб/Trogarzo anti-CD4 Ab LC-CDR2)
WASTRES
SEQ ID NO: 72 (ибализумаб/Trogarzo anti-CD4 Ab LC-CDR3)
QQYYSYRT
SEQ ID NO: 73 (ибализумаб/Trogarzo anti-CD4 Ab VH; CDR подчеркнуты)

SEQ ID NO: 74 (ибализумаб/Trogarzo anti-CD4 Ab VL; CDR подчеркнуты)
DIVMTQSPDSLAVSLGERVTMNCKSSQSLLYSTNQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSVQAEDVAVYYCQQYYSYRTFGGGTKLEIK
SEQ ID NO: 75 (anti-CD4 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 76 (ибализумаб/Trogarzo anti-CD4 Ab HC (Fc IgG4); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 77 (ибализумаб/Trogarzo anti-CD4 Ab LC; VL подчеркнут)
DIVMTQSPDSLAVSLGERVTMNCKSSQSLLYSTNQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSVQAEDVAVYYCQQYYSYRTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 78 (anti-CD4 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 79 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-IL-2 мутация R38D/K43E/E61R- шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 80 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 81 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 82 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 83 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)
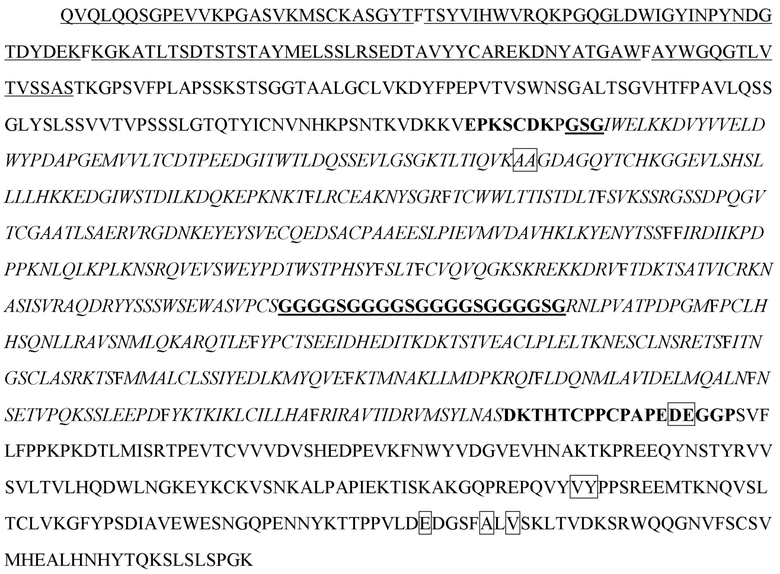
SEQ ID NO: 84 (anti-CD4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)
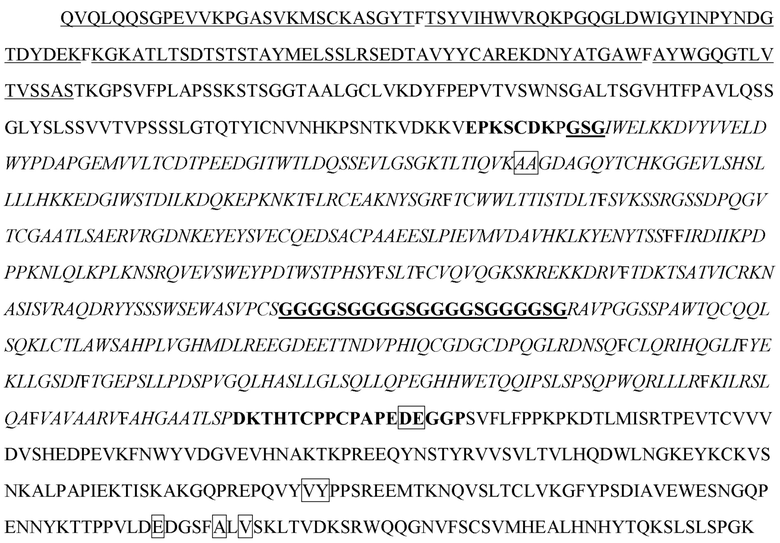
SEQ ID NO: 85 (anti-CD3ε Ab HC-CDR1)
GFTFSYFWMN
SEQ ID NO: 86 (anti-CD3ε Ab HC-CDR2)
EIRLRSDNYATHYAESVKG
SEQ ID NO: 87 (anti-CD3ε Ab HC-CDR3)
DWEFTY
SEQ ID NO: 88 (anti-CD3ε Ab LC-CDR1)
SASLSVSFMH
SEQ ID NO: 89 (anti-CD3ε Ab LC-CDR2)
RTSNLAS
SEQ ID NO: 90 (anti-CD3ε Ab LC-CDR3)
QQRSSDPP
SEQ ID NO: 91 (anti-CD3ε Ab VH; CDR подчеркнуты)
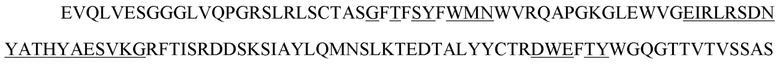
SEQ ID NO: 92 (anti-CD3ε Ab VL; CDR подчеркнуты)
EIVMTQSPGTLSLSPGESATLSCSASLSVSFMHWFQQKPGHAPRLLIYRTSNLASGVPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQRSSDPPTFGQGTRLEI
SEQ ID NO: 93 (anti-CD3ε Ab HC (мутант Fc IgG1; VH подчеркнут)

SEQ ID NO: 94 (anti-CD3ε Ab LC; VL подчеркнуто)

SEQ ID NO: 95 (anti-CD3ε Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 96 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 97 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 98 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 99 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 100 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 101 (anti-CD3ε Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 102 (ниволумаб/Опдиво anti-PD-1 Ab VH)
QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSAS
SEQ ID NO: 103 (ниволумаб/Опдиво anti-PD-1 Ab VL)
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEI
SEQ ID NO: 104 (anti-PD-1 Ab HC (мутант Fc IgG1; VH подчеркнут)

SEQ ID NO: 105 (ниволумаб/Опдиво anti-PD-1 Ab HC; VH подчеркнут; шарниры выделены жирным шрифтом)

SEQ ID NO: 106 (ниволумаб/Опдиво anti-PD-1 Ab LC; VL подчеркнут)
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 107 (anti-PD-1 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 108 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 109 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 110 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 111 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 112 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 113 (anti-PD-1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 114 (G10-1 anti-CD8 Ab VH)
EVQLQQSGPELVKPGASVKMSCKASGYTFTDYYMKWVKQSHGKSLEWIGHINPNNDDTFYTQKFKGRATLTVDKSSSTAYMQLNSLTSEDSAVYYCVRDDYDGGWFAYWGQGTLVTVSSAS
SEQ ID NO: 115 (G10-1 anti-CD8 Ab VL)
DIQMTQTTSSLSASLGDRVTISCRASQDINNYLNWYQQKSDGTIKLLIYYTSRSYSGVPSRFSGSGSGTDYSLTISNRRQEDIATYFCQQGKTLPWTFGGGTKLEI
SEQ ID NO: 116 (anti-CD8 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 117 (G10-1 anti-CD8 Ab LC; VL подчеркнут)
DIQMTQTTSSLSASLGDRVTISCRASQDINNYLNWYQQKSDGTIKLLIYYTSRSYSGVPSRFSGSGSGTDYSLTISNRRQEDIATYFCQQGKTLPWTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 118 (anti-CD8 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 119 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 120 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 121 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 122 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 123 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)
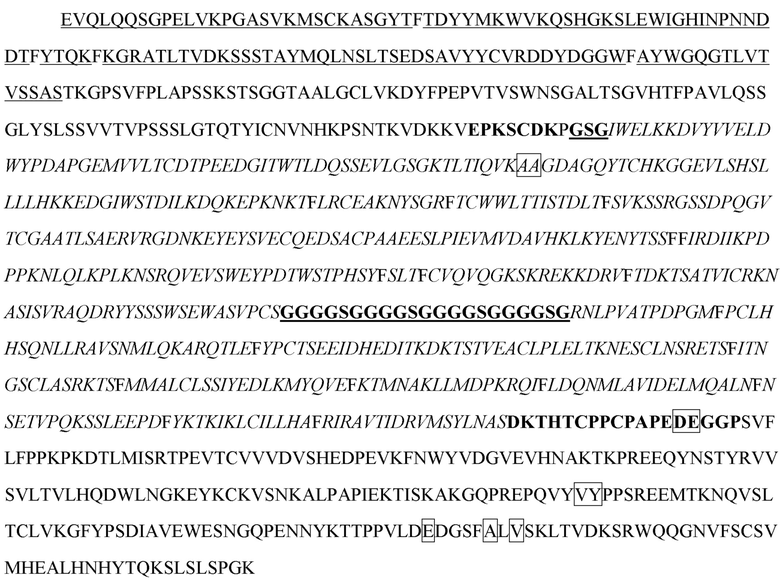
SEQ ID NO: 124 (anti-CD8 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 125 (anti-CTLA-4 Ab VH)
QVQLVESGGGVVQPGRSLRLSCAASGFTFSSYTMHWVRQAPGKGLEWVTFISYDGNNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAIYYCARTGWLGPFDYWGQGTLVTVSSAS
SEQ ID NO: 126 (ипилимумаб/Ервой anti-CTLA-4 Ab VL)
EIVLTQSPGTLSLSPGERATLSCRASQSVGSSYLAWYQQKPGQAPRLLIYGAFSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPWTFGQGTKVEI
SEQ ID NO: 127 (anti-CTLA-4 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 128 (ипилимумаб/Ервой anti-CTLA-4 Ab HC; VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 129 (ипилимумаб/Ервой anti-CTLA-4 Ab LC; VL подчеркнут)
EIVLTQSPGTLSLSPGERATLSCRASQSVGSSYLAWYQQKPGQAPRLLIYGAFSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 130 (anti-CTLA-4 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 131 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 132 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 133 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 134 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 135 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 136 (anti-CTLA-4 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 243 (anti-PD-L1 Ab HC-CDR1)
DSWIH
SEQ ID NO: 244 (anti-PD-L1 Ab HC-CDR2)
WISPYGGSSY
SEQ ID NO: 245 (anti-PD-L1 Ab HC-CDR3)
RHWPGGF
SEQ ID NO: 246 (anti-PD-L1 Ab LC-CDR1)
VTTAVA
SEQ ID NO: 247 (anti-PD-L1 Ab LC-CDR2)
SASFPY
SEQ ID NO: 248 (anti-PD-L1 Ab LC-CDR3)
QQYMYHPST
SEQ ID NO: 137 (anti-PD-L1 Ab VH; CDR подчеркнуты)
EVQLVESGGGLVQPGGSLRLSCAASYFPFSDSWIHWVRQAPGKGLEWVAWISPYGGSSYYADSVQDRFTISADTSKNTAYLQMNSLRAEDTAVYYCAKRHWPGGFDHWGQGTLVTVSSAS
SEQ ID NO: 138 (anti-PD-L1 Ab VL; CDR подчеркнуты)
DIQMTQSPSSLSASVGDRVTITCSASQDVTTAVAWYQQKPGKAPKLLIYSASFPYRGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYMYHPSTFGQGTKVEI
SEQ ID NO: 139 (anti-PD-L1 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 140 (anti-PD-L1 Ab LC; VL подчеркнут)
DIQMTQSPSSLSASVGDRVTITCSASQDVTTAVAWYQQKPGKAPKLLIYSASFPYRGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYMYHPSTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 141 (атезолизумаб/Тецентрик anti-PD-L1 Ab HC; VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 142 (атезолизумаб/Тецентрик anti-PD-L1 Ab LC; VL подчеркнуто)
DIQMTQSPSSLSASVGDRVTITCRASQDVSTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYLYHPATFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 143 (anti-PD-L1 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 144 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 145 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-линкер-мутантный IFN-α2b L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный IFN-α2b выделен курсивом)

SEQ ID NO: 146 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный мутантный гомодимер IFN-γ A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 147 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный мутантный гомодимер IL-10 R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 148 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 149 (anti-PD-L1 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)
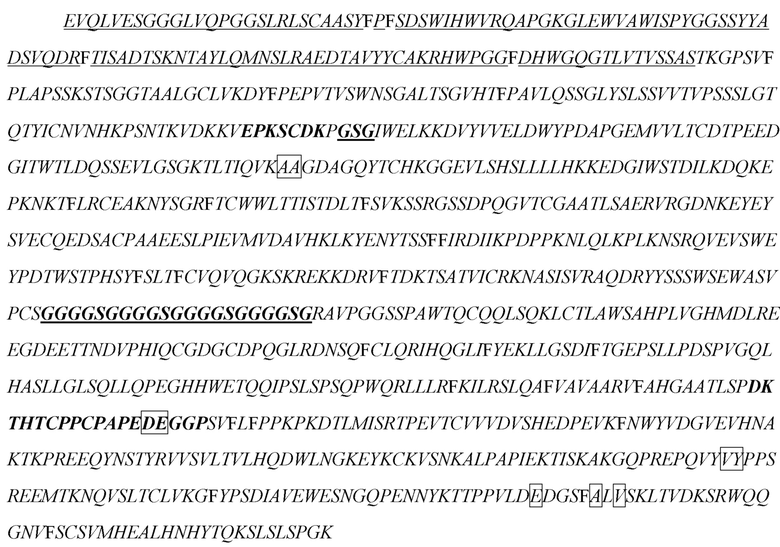
SEQ ID NO: 188 (трастузумаб/Герцептин anti-HER2 Ab HC-CDR1)
GFNIKDTYIH
SEQ ID NO: 189 (трастузумаб/Герцептин anti-HER2 Ab HC-CDR2)
RIYPTNGYTRYADSVKG
SEQ ID NO: 190 (трастузумаб/Герцептин anti-HER2 Ab HC-CDR3)
WGGDGFYAMDY
SEQ ID NO: 191 (трастузумаб/Герцептин anti-HER2 Ab LC-CDR1)
RASQDVNTAVA
SEQ ID NO: 192 (трастузумаб/Герцептин anti-HER2 Ab LC-CDR2)
SASFLYS
SEQ ID NO: 193 (трастузумаб/Герцептин anti-HER2 Ab LC-CDR3)
QQHYTTPPT
SEQ ID NO: 150 (трастузумаб/Герцептин anti-HER2 Ab VH)

SEQ ID NO: 151 (трастузумаб/Герцептин anti-HER2 Ab VL)
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQHYTTPPTFGQGTKVEI
SEQ ID NO: 152 (anti-HER2 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 153 (трастузумаб/Герцептин anti-HER2 Ab HC; VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 154 (трастузумаб/Герцептин anti-HER2 Ab LC; VL подчеркнут)

SEQ ID NO: 155 (anti-HER2 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 156 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-мутантный IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутант IL-2 выделен курсивом)

SEQ ID NO: 157 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-линкер-мутантный IFN-α2b L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 158 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный мутантный гомодимер IFN-γ A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 159 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный мунатный гомодимер IL-10 R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 160 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 161 (anti-HER2 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 162 (базиликсимаб/Симулект anti-CD25 Ab VH)
QLQQSGTVLARPGASVKMSCKASGYSFTRYWMHWIKQRPGQGLEWIGAIYPGNSDTSYNQKFEGKAKLTAVTSASTAYMELSSLTHEDSAVYYCSRDYGYYFDFWGQGTTLTVSSAS
SEQ ID NO: 163 (базиликсимаб/Симулект anti-CD25 Ab VL)
QIVSTQSPAIMSASPGEKVTMTCSASSSRSYMQWYQQKPGTSPKRWIYDTSKLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQRSSYTFGGGTKLEI
SEQ ID NO: 164 (anti-CD25 Ab HC (мутант Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 165 (базиликсимаб/Симулект anti-CD25 Ab LC; VL подчеркнут)
QIVSTQSPAIMSASPGEKVTMTCSASSSRSYMQWYQQKPGTSPKRWIYDTSKLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQRSSYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 166 (базиликсимаб/Симулект anti-CD25 Ab HC; VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 167 (базиликсимаб/Симулект anti-CD25 Ab LC; VL подчеркнут)
QIVSTQSPAIMSASPGEKVTMTCSASSSRSYMQWYQQKPGTSPKRWIYDTSKLASGVPARFSGSGSGTSYSLTISSMEAEDAATYYCHQRSSYTFGGGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGE
SEQ ID NO: 168 (anti-CD25 Ab HC (мутант2 Fc IgG1); VH подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 169 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-мутант IL-2 R38D/K43E/E61R-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; мутант IL-2 выделен курсивом)

SEQ ID NO: 170 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-линкер-IFN-α2b мутация L30A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутант IFN-α2b выделен курсивом)

SEQ ID NO: 171 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IFN-γ мутация A23V-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 172 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный гомодимер IL-10 мутация R27A-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 173 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 174 (anti-CD25 Ab VH-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-23, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 175 (человеческий PD-L2 дикого типа; сигнальный пептид выделен курсивом; внеклеточный домен подчеркнут; цитоплазматический домен выделен жирным шрифтом)
MIFLLLMLSLELQLHQIAALFTVTVPKELYIIEHGSNVTLECNFDTGSHVNLGAITASLQKVENDTSPHRERATLLEEQLPLGKASFHIPQVQVRDEGQYQCIIIYGVAWDYKYLTLKVKASYRKINTHILKVPETDEVELTCQATGYPLAEVSWPNVSVPANTSHSRTPEGLYQVTSVLRLKPPPGRNFSCVFWNTHVRELTLASIDLQSQMEPRTHPTWLLHIFIPFCIIAFIFIATVIALRKQLCQKLYSSKDTTKRPVTTTKREVNSAI
SEQ ID NO: 176 (внеклеточный домен человеческого PD-L2 дикого типа)
LFTVTVPKELYIIEHGSNVTLECNFDTGSHVNLGAITASLQKVENDTSPHRERATLLEEQLPLGKASFHIPQVQVRDEGQYQCIIIYGVAWDYKYLTLKVKASYRKINTHILKVPETDEVELTCQATGYPLAEVSWPNVSVPANTSHSRTPEGLYQVTSVLRLKPPPGRNFSCVFWNTHVRELTLASIDLQSQMEPRTHPT
SEQ ID NO: 177 (внеклеточный домен человеческого PD-L2 дикого типа-шарнир-мутантный Fc IgG1; PD-L2 подчеркнут; шарнир выделен жирным шрифтом)
LFTVTVPKELYIIEHGSNVTLECNFDTGSHVNLGAITASLQKVENDTSPHRERATLLEEQLPLGKASFHIPQVQVRDEGQYQCIIIYGVAWDYKYLTLKVKASYRKINTHILKVPETDEVELTCQATGYPLAEVSWPNVSVPANTSHSRTPEGLYQVTSVLRLKPPPGRNFSCVFWNTHVRELTLASIDLQSQMEPRTHPTDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYASTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 178 (внеклеточный домен человеческого PD-L2 дикого типа-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 179 (внеклеточный домен человеческого PD-L2 дикого типа-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 180 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-мутантный IL-2 R38D/K43E/E61R-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; мутантный IL-2 выделен курсивом)

SEQ ID NO: 181 (внеклеточный домен человекого PD-L2 дикого типа-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 182 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-мутантный IFN-α2b L30A-шарнирный мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; мутантный IFN-α2b выделен курсивом)

SEQ ID NO: 183 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-одноцепочечный мутантный гомодимер IFN-γ A23V-шарнирный-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; мутантный мономер IFN-γ выделен курсивом)

SEQ ID NO: 184 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-одноцепочечный мутантный гомодимер IL-10 R27A-шарнирный-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; мутантный мономер IL-10 выделен курсивом)

SEQ ID NO: 185 (внеклеточный домен человеческого PD-L2 дикого типа-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут)

SEQ ID NO: 186 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 187 (внеклеточный домен человеческого PD-L2 дикого типа-линкер-одноцепочечный IL-23 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-23A (wt p19)-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-23 выделены курсивом)

SEQ ID NO: 194 (линкер; n равно целому числу не меньше 1)
(G)n
SEQ ID NO: 195 (линкер; n равно целому числу не меньше 1)
(GS)n
SEQ ID NO: 196 (линкер; n равно целому числу не меньше 1)
(GGS)n
SEQ ID NO: 197 (линкер; n равно целому числу не меньше 1)
(GGGS)n
SEQ ID NO: 198 (линкер; n равно целому числу не меньше 1)
(GGS)n(GGGS)n
SEQ ID NO: 199 (линкер; n равно целому числу не меньше 1)
(GSGGS)n
SEQ ID NO: 200 (линкер; n равно целому числу не меньше 1)
(GGSGS)n
SEQ ID NO: 201 (линкер; n представляет собой целое число не менее 1)
(GGGGS)n
SEQ ID NO: 202 (линкер)
GG
SEQ ID NO: 203 (линкер)
GSG
SEQ ID NO: 204 (линкер)
GGSG
SEQ ID NO: 205 (линкер)
GGSGG
SEQ ID NO: 206 (линкер)
GSGGGGG
SEQ ID NO: 207 (линкер)
GSGSG
SEQ ID NO: 208 (линкер)
GSGGG
SEQ ID NO: 209 (линкер)
GGGSG
SEQ ID NO: 210 (линкер)
GSSSG
SEQ ID NO: 211 (линкер)
GGSGGS
SEQ ID NO: 212 (линкер)
SGGGGS
SEQ ID NO: 213 (линкер)
GGGGS
SEQ ID NO: 214 (линкер; n представляет собой целое число не менее 1)
(GA)n
SEQ ID NO: 215 (линкер)
GRAGGGGAGGGG
SEQ ID NO: 216 (линкер)
GRAGGG
SEQ ID NO: 217 (линкер)
GSGGGSGGGGSGGGGS
SEQ ID NO: 218 (линкер)
GGGSGGGGSGGGGS
SEQ ID NO: 219 (линкер)
GGGSGGSGGS
SEQ ID NO: 220 (линкер)
GGSGGSGGSGGSGGG
SEQ ID NO: 221 (линкер)
GGSGGSGGGGSGGGGS
SEQ ID NO: 222 (линкер)
GGSGGSGGSGGSGGSGGS
SEQ ID NO: 223 (линкер)
GGGGGGSGGGGSGGGGSA
SEQ ID NO: 224 (линкер)
GSGGGSGGGGSGGGGSGGGGS
SEQ ID NO: 225 (линкер)
KTGGGSGGGS
SEQ ID NO: 226 (линкер)
GGPGGGGSGGGSGGGGS
SEQ ID NO: 227 (линкер)
GGGSGGGGSGGGGSGGGGS
SEQ ID NO: 228 (линкер)
GGGGSGGGGSGGGGSGGGGSG
SEQ ID NO: 229 (линкер)
GGGGSGGGGSGGGGS
SEQ ID NO: 230 (линкер)
ASTKGP
SEQ ID NO: 231 (линкер)
DKP
SEQ ID NO: 232 (линкер)
DKPGS
SEQ ID NO: 233 (линкер)
PGS
SEQ ID NO: 234 (линкер)
GS
SEQ ID NO: 235 (линкер)
DKPGSG
SEQ ID NO: 236 (линкер)
PGSG
SEQ ID NO: 237 (линкер)
DKPGSGS
SEQ ID NO: 238 (линкер)
PGSGS
SEQ ID NO: 239 (линкер)
GSGS
SEQ ID NO: 240 (линкер)
DKPGSGGGGG
SEQ ID NO: 241 (линкер)
PGSGGGGG
SEQ ID NO: 242 (линкер)
P
SEQ ID NO: 249 (человеческий PD-L1 дикого типа; сигнальный пептид выделен курсивом; внеклеточный домен подчеркнут; цитоплазматический домен выделен жирным шрифтом)
MRIFAVFIFMTYWHLLNAFTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPYNKINQRILVVDPVTSEHELTCQAEGYPKAEVIWTSSDHQVLSGKTTTTNSKREEKLFNVTSTLRINTTTNEIFYCTFRRLDPEENHTAELVIPELPLAHPPNERTHLVILGAILLCLGVALTFIFRLRKGRMMDVKKCGIQDTNSKKQSDTHLEET
SEQ ID NO: 250 (внеклеточный домен человеческого PD-L1 дикого типа)
FTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPYNKINQRILVVDPVTSEHELTCQAEGYPKAEVIWTSSDHQVLSGKTTTTNSKREEKLFNVTSTLRINTTTNEIFYCTFRRLDPEENHTAELVIPELPLAHPPNER
SEQ ID NO: 251 (IL-2 мутации L18R/Q22E/R38D/K43E/E61R)

SEQ ID NO: 252 (IL-2 мутации R38D/K43E/E61R/Q126T)

SEQ ID NO: 253 (IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)

SEQ ID NO: 254 (IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)

SEQ ID NO: 255 (внеклеточный домен человеческого PD-L1, мутант1 E58M/R113T/M115L/S117A/G119K)

SEQ ID NO: 256 (внеклеточный домен человеческого PD-L1, мутант2 I54Q/E58M/R113T/M115L/S117A/G119K)

SEQ ID NO: 257 (внеклеточный домен человеческого PD-L1, мутант3 I54Q/R113T/M115L/S117A/G119K)

SEQ ID NO: 258 (внеклеточный домен человеческого PD-L1, мутант4 I54Q/E58M/M115L/S117A/G119K)

SEQ ID NO: 259 (внеклеточный домен человеческого PD-L1, мутант5 I54Q/E58M/R113T/S117A/G119K)

SEQ ID NO: 260 (внеклеточный домен человеческого PD-L1, мутант6 I54Q/E58M/R113T/M115L/G119K)

SEQ ID NO: 261 (внеклеточный домен человеческого PD-L1, мутант7 I54Q/E58M/R113T/M115L/S117A)

SEQ ID NO: 262 (внеклеточный домен человеческого PD-L2, мутант1 Т56В)

SEQ ID NO: 263 (внеклеточный домен человеческого PD-L2, мутант2 S58V)

SEQ ID NO: 264 (внеклеточный домен человеческого PD-L2, мутант3 Q60L)

SEQ ID NO: 265 (внеклеточный домен человеческого PD-L2, мутант4 T56V/S58V/Q60L)

SEQ ID NO: 266 (человеческий CD155 дикого типа)
MARAMAAAWPLLLVALLVLSWPPPGTGDVVVQAPTQVPGFLGDSVTLPCYLQVPNMEVTHVSQLTWARHGESGSMAVFHQTQGPSYSESKRLEFVAARLGAELRNASLRMFGLRVEDEGNYTCLFVTFPQGSRSVDIWLRVLAKPQNTAEVQKVQLTGEPVPMARCVSTGGRPPAQITWHSDLGGMPNTSQVPGFLSGTVTVTSLWILVPSSQVDGKNVTCKVEHESFEKPQLLTVNLTVYYPPEVSISGYDNNWYLGQNEATLTCDARSNPEPTGYNWSTTMGPLPPFAVAQGAQLLIRPVDKPINTTLICNVTNALGARQAELTVQVKEGPPSEHSGISRNAIIFLVLGILVFLILLGIGIYFYWSKCSREVLWHCHLCPSSTEHASASANGHVSYSAVSRENSSSQDPQTEGTR
SEQ ID NO: 267 (внеклеточный домен человеческого CD155 дикого типа)
WPPPGTGDVVVQAPTQVPGFLGDSVTLPCYLQVPNMEVTHVSQLTWARHGESGSMAVFHQ
TQGPSYSESKRLEFVAARLGAELRNASLRMFGLRVEDEGNYTCLFVTFPQGSRSVDIWLR
VLAKPQNTAEVQKVQLTGEPVPMARCVSTGGRPPAQITWHSDLGGMPNTSQVPGFLSGTV
TVTSLWILVPSSQVDGKNVTCKVEHESFEKPQLLTVNLTVYYPPEVSISGYDNNWYLGQN
EATLTCDARSNPEPTGYNWSTTMGPLPPFAVAQGAQLLIRPVDKPINTTLICNVTNALGA
RQAELTVQVKEGPPSEHSGISRN
SEQ ID NO: 268 (anti-PD-1 Ab VH-(D100N)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 269 (anti-PD-1 Ab VH-(D100G)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 270 (anti-PD-1 Ab VH-(D100R)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 271 (anti-PD-1 Ab VH-(N99G)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 272 (anti-PD-1 Ab VH-(N99A)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 273 (anti-PD-1 Ab VH-(N99M)-CH1-шарнирная N'-часть-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер-IL-12A (wt p35)-шарнирная C'-часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 274 (внеклеточный домен человеческого PD-L2 - шарнирная часть - линкер - одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 F60A) - линкер-IL-12A (wt p35)-C'-шарнирная часть-мутант1 Fc IgG1; VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 275 (одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 F60A)-линкер-IL-12A (wt p35); линкер выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 276 (внеклеточный домен человеческого PD-L2-линкер-шарнирная часть-мутант1 Fc IgG1-линкер-одноцепочечный IL-12, мутантный гетеродимер IL-12B (p40 F60A)-линкер- IL-12A (wt p35); VH подчеркнут; шарнир выделен жирным шрифтом; линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 277 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 278 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 279 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 280 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 281 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 282 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 283 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 284 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 285 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-мутант IL-2 L18R/Q22E/R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 286 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-мутант IL-2 R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 287 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 288 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 289 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 290 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-IL-2 мутации R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 291 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 292 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 291 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 292 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 293 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 294 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 295 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 296 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 297 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 298 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 299 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом;

SEQ ID NO: 300 (человеческий PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом;

SEQ ID NO: 301 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 302 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-IL-2 мутации R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 303 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 304 (внеклеточный домен человеческого PD-L2 мутант2 S58V внеклеточный домен-линкер-IL-2 мутации R38D/K43E/E61R)(L18R/Q22E/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 305 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 306 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-IL-2 мутации R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 307 (человеческий PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 308 (человеческий PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-IL-2 мутации L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 309 (внеклеточный домен человеческого CD155-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)
SEQ ID NO:310 (внеклеточный домен человеческого СD155-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); СD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)


SEQ ID NO: 311 (внеклеточный домен человеческого CD155-линкер-шарнир-мутант1 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 312 (внеклеточный домен человеческого CD155-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом)

SEQ ID NO: 313 (внеклеточный домен человеческого CD155-линкер-мутантный IL-2 L18R/Q22E/R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 314 (внеклеточный домен человеческого CD155-линкер-мутантный IL-2 R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 315 (внеклеточный домен человеческого CD155-линкер-мутантный IL-2 L18R/Q22E/R38D/K43E/E61R/Q126T)-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 316 (внеклеточный домен человеческого CD155-линкер-мутантный IL-2 L18R/Q22E/R38D/K43E/E61R/Q126T/S130R)-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер заштрихован; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 317 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир- мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 318 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 319 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер заштрихован; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 320 (внеклеточный домен человеческого PD-L1 мутант7 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 321 (внеклеточный домен человеческого PD-L2 мутант2 С58В внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 322 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер -шарнир-мутант1 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 323 (внеклеточный домен человеческого PD-L2 мутант2 С58V внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 324 (внеклеточный домен человеческого PD-L2 мутант4 T56V/S58V/Q60L внеклеточный домен-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант2 Fc IgG1; PD-L2 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 325 (внеклеточный домен человеческого CD155-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант1 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 326 (внеклеточный домен человеческого CD155-линкер-одноцепочечный мутантный гомодимер IFN-γ (A23V/A23V)-линкер-шарнир-мутант2 Fc IgG1; CD155 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; IFN-γ выделен курсивом)

SEQ ID NO: 327 (человеческий PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-мутантный IL-2 R38D/K43E/E61R)-линкер-шарнир-мутант2 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы IL-12 выделены курсивом.

SEQ ID NO: 328 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35)-шарнир-мутант1 Fc IgG1; PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы мышиного IL-12 выделены курсивом)

SEQ ID NO: 329 (внеклеточный домен человеческого PD-L1 мутант2 I54Q/E58M/R113T/M115L/S117A/G119K внеклеточный домен-линкер-шарнир-мутант1 Fc IgG1-линкер-одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A/F60A)-линкер IL-12A (wt p35); PD-L1 подчеркнут; линкер выделен жирным шрифтом и подчеркнут; шарнир выделен жирным шрифтом; субъединицы мышиного IL-12 выделены курсивом)

SEQ ID NO: 330 (мышиный IL-12 E59A/F60A; линкер выделен жирным шрифтом и подчеркнут; субъединицы мышиного IL-12 выделены курсивом)

SEQ ID NO: 331 (одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 E59A)-линкер-IL-12A (wt p35); линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 332 (одноцепочечный IL-12 мутантный гетеродимер IL-12B (p40 G64A)-линкер-IL-12A (wt p35); линкер выделен жирным шрифтом и подчеркнут; субъединицы IL-12 выделены курсивом)

SEQ ID NO: 333
GGGGSGGGSGGGG
SEQ ID NO: 334
GGGGSGGG
SEQ ID NO: 335
GGPGGGGSGGGSGGGG
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ИММУНОВЭЙК ИНК.
<120> ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ
<130> 75439-20006.40
<140> Пока еще не назначен
<141> Одновременно с этим
<150> US 63/130,339
<151> 2020-12-23
<160> 335
<170> FastSEQ для Windows версии 4.0
<210> 1
<211> 133
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 2
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 3
<211> 165
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 4
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Ala Lys Asp
20 25 30
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 5
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Ala Asp
20 25 30
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 6
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Lys Ala
20 25 30
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 7
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
Ala His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 8
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
Arg Ala Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 9
<211> 165
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
Arg His Ala Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
Leu Arg Ser Lys Glu
165
<210> 10
<211> 138
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Ala Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 11
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ala Ala Val Ala Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 12
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Ala Ser Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 13
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 13
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 14
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Ala Ala Ala Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 15
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 15
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Glu Glu Lys Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 16
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Gln Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 17
<211> 138
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Lys Val Ala Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
130 135
<210> 18
<211> 297
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Ala Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
145 150 155 160
Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala
165 170 175
Gly His Ser Asp Val Ala Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu
180 185 190
Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile
195 200 205
Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser
210 215 220
Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe
225 230 235 240
Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn
245 250 255
Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu
260 265 270
Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg
275 280 285
Lys Arg Ser Gln Met Leu Phe Arg Gly
290 295
<210> 19
<211> 297
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
1 5 10 15
Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile
20 25 30
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
35 40 45
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
50 55 60
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
65 70 75 80
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
85 90 95
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
100 105 110
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
115 120 125
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
145 150 155 160
Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala
165 170 175
Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu
180 185 190
Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile
195 200 205
Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser
210 215 220
Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe
225 230 235 240
Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn
245 250 255
Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu
260 265 270
Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg
275 280 285
Lys Arg Ser Gln Met Leu Phe Arg Gly
290 295
<210> 20
<211> 160
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 21
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Ala Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 22
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Ala Ala Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 23
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 24
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Ala Ser Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 25
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Ala Ala Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 26
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Ala
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 27
<211> 341
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 27
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
165 170 175
Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser
180 185 190
Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg
195 200 205
Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu
210 215 220
Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr
225 230 235 240
Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu
245 250 255
Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val
260 265 270
Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg
275 280 285
Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln
290 295 300
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
305 310 315 320
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
325 330 335
Met Lys Ile Arg Asn
340
<210> 28
<211> 341
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
165 170 175
Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser
180 185 190
Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala
195 200 205
Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu
210 215 220
Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr
225 230 235 240
Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu
245 250 255
Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val
260 265 270
Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg
275 280 285
Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln
290 295 300
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
305 310 315 320
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
325 330 335
Met Lys Ile Arg Asn
340
<210> 29
<211> 197
<212> БЕЛОК
<213> Homo sapiens
<400> 29
Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu
1 5 10 15
His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys
20 25 30
Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp
35 40 45
His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu
50 55 60
Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr
65 70 75 80
Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe
85 90 95
Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr
100 105 110
Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys
115 120 125
Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu
130 135 140
Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser
145 150 155 160
Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu
165 170 175
Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser
180 185 190
Tyr Leu Asn Ala Ser
195
<210> 30
<211> 306
<212> БЕЛОК
<213> Homo sapiens
<400> 30
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 31
<211> 306
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 32
<211> 306
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 33
<211> 306
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 33
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Ala Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 34
<211> 306
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 34
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Ala
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser
305
<210> 35
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 35
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
325 330 335
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
340 345 350
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
355 360 365
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
370 375 380
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
385 390 395 400
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
405 410 415
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
435 440 445
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
450 455 460
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
465 470 475 480
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
485 490 495
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
500 505 510
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
515 520
<210> 36
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 36
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
325 330 335
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
340 345 350
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
355 360 365
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
370 375 380
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
385 390 395 400
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
405 410 415
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
435 440 445
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
450 455 460
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
465 470 475 480
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
485 490 495
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
500 505 510
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
515 520
<210> 37
<211> 170
<212> БЕЛОК
<213> Homo sapiens
<400> 37
Arg Ala Val Pro Gly Gly Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln
1 5 10 15
Leu Ser Gln Lys Leu Cys Thr Leu Ala Trp Ser Ala His Pro Leu Val
20 25 30
Gly His Met Asp Leu Arg Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp
35 40 45
Val Pro His Ile Gln Cys Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg
50 55 60
Asp Asn Ser Gln Phe Cys Leu Gln Arg Ile His Gln Gly Leu Ile Phe
65 70 75 80
Tyr Glu Lys Leu Leu Gly Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu
85 90 95
Leu Pro Asp Ser Pro Val Gly Gln Leu His Ala Ser Leu Leu Gly Leu
100 105 110
Ser Gln Leu Leu Gln Pro Glu Gly His His Trp Glu Thr Gln Gln Ile
115 120 125
Pro Ser Leu Ser Pro Ser Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe
130 135 140
Lys Ile Leu Arg Ser Leu Gln Ala Phe Val Ala Val Ala Ala Arg Val
145 150 155 160
Phe Ala His Gly Ala Ala Thr Leu Ser Pro
165 170
<210> 38
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 38
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly Ser Ser Pro
325 330 335
Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr Leu Ala
340 345 350
Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg Glu Glu Gly
355 360 365
Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys Gly Asp Gly
370 375 380
Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu Gln Arg
385 390 395 400
Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser Asp Ile
405 410 415
Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val Gly Gln Leu
420 425 430
His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu Gly His
435 440 445
His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln Pro Trp
450 455 460
Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln Ala Phe
465 470 475 480
Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala Thr Leu Ser
485 490 495
Pro
<210> 39
<211> 497
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 39
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly Ser Ser Pro
325 330 335
Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr Leu Ala
340 345 350
Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg Glu Glu Gly
355 360 365
Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys Gly Asp Gly
370 375 380
Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu Gln Arg
385 390 395 400
Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser Asp Ile
405 410 415
Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val Gly Gln Leu
420 425 430
His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu Gly His
435 440 445
His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln Pro Trp
450 455 460
Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln Ala Phe
465 470 475 480
Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala Thr Leu Ser
485 490 495
Pro
<210> 40
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 40
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro
20
<210> 41
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 41
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Lys Lys Gly Gly Pro
20
<210> 42
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 42
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Asp Glu Gly Gly Pro
20
<210> 43
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 43
Glu Pro Lys Ser Cys Asp Lys Asp Lys Thr His Thr Cys Pro Pro Cys
1 5 10 15
Pro Ala Pro Glu Leu Leu Gly Gly Pro
20 25
<210> 44
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 44
Glu Pro Lys Ser Cys Asp Lys Asp Lys Thr His Thr Cys Pro Pro Cys
1 5 10 15
Pro Ala Pro Glu Lys Lys Gly Gly Pro
20 25
<210> 45
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 45
Glu Pro Lys Ser Cys Asp Lys Asp Lys Thr His Thr Cys Pro Pro Cys
1 5 10 15
Pro Ala Pro Glu Asp Glu Gly Gly Pro
20 25
<210> 46
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 46
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
Ala Gly Pro
<210> 47
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 47
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro
20
<210> 48
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 48
Glu Pro Lys Ser Cys Asp Lys
1 5
<210> 49
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 49
Glu Pro Lys Ser Cys
1 5
<210> 50
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 50
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro
<210> 51
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 51
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly
1 5 10 15
Gly Pro
<210> 52
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 52
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
1 5 10 15
Gly Pro
<210> 53
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 53
Asp Lys Thr His Thr
1 5
<210> 54
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 54
Glu Pro Lys Ser Cys Asp Lys Pro
1 5
<210> 55
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 55
Glu Pro Lys Ser Cys Asp Lys Pro Asp Lys Thr His Thr Cys Pro Pro
1 5 10 15
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
20 25
<210> 56
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 56
Glu Pro Lys Ser Cys Asp Lys Pro Asp Lys Thr His Thr Cys Pro Pro
1 5 10 15
Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
20 25
<210> 57
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 57
Glu Pro Lys Ser Cys Asp Lys Pro Asp Lys Thr His Thr Cys Pro Pro
1 5 10 15
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
20 25
<210> 58
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 58
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro
20
<210> 59
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 59
Glu Pro Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
Ala Pro Glu Leu Leu Gly Gly Pro
20
<210> 60
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 60
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 61
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 61
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
100 105 110
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 62
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 62
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
100 105 110
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 63
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 63
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
20 25 30
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
195 200 205
Lys
<210> 64
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 64
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 65
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 65
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 66
<211> 209
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 66
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
1 5 10 15
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
20 25 30
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
35 40 45
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
50 55 60
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
65 70 75 80
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
85 90 95
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
100 105 110
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
115 120 125
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
130 135 140
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
145 150 155 160
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
165 170 175
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
180 185 190
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
195 200 205
Lys
<210> 67
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 67
Gly Tyr Thr Phe Thr Ser Tyr Val Ile His
1 5 10
<210> 68
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 68
Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe Lys Gly
1 5 10
<210> 69
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 69
Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr
1 5 10
<210> 70
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 70
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Thr Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 71
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 71
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 72
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 72
Gln Gln Tyr Tyr Ser Tyr Arg Thr
1 5
<210> 73
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 73
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 74
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 74
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Thr Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 75
<211> 452
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 75
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 76
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 76
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440 445
Lys
<210> 77
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 77
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Thr Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 78
<211> 452
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 78
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 79
<211> 588
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 79
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu
225 230 235 240
Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile
245 250 255
Asn Asn Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe
260 265 270
Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu
275 280 285
Arg Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys
290 295 300
Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile
305 310 315 320
Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala
325 330 335
Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe
340 345 350
Cys Gln Ser Ile Ile Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro
355 360 365
Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe
370 375 380
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
385 390 395 400
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
405 410 415
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
420 425 430
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
435 440 445
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
450 455 460
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
465 470 475 480
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg
485 490 495
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
500 505 510
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
515 520 525
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser
530 535 540
Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
545 550 555 560
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
565 570 575
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 80
<211> 627
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 80
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Gly Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln
225 230 235 240
Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met
245 250 255
Arg Lys Ile Ser Leu Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly
260 265 270
Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile
275 280 285
Pro Val Leu His Glu Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr
290 295 300
Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr
305 310 315 320
Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln
325 330 335
Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu
340 345 350
Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys
355 360 365
Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg
370 375 380
Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu
385 390 395 400
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
405 410 415
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
420 425 430
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
435 440 445
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
450 455 460
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
465 470 475 480
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
485 490 495
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
500 505 510
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
515 520 525
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
530 535 540
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
545 550 555 560
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
565 570 575
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
580 585 590
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
595 600 605
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
610 615 620
Pro Gly Lys
625
<210> 81
<211> 755
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 81
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu
225 230 235 240
Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn
245 250 255
Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp
260 265 270
Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe
275 280 285
Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile
290 295 300
Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg
305 310 315 320
Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val
325 330 335
Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser
340 345 350
Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg
355 360 365
Gly Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
370 375 380
Ser Gly Gly Gly Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn
385 390 395 400
Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly
405 410 415
Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg
420 425 430
Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys
435 440 445
Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys
450 455 460
Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp
465 470 475 480
Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln
485 490 495
Arg Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro
500 505 510
Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly
515 520 525
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
530 535 540
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
545 550 555 560
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
565 570 575
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
580 585 590
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
595 600 605
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
610 615 620
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
625 630 635 640
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
645 650 655
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
660 665 670
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
675 680 685
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
690 695 700
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
705 710 715 720
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
725 730 735
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
740 745 750
Pro Gly Lys
755
<210> 82
<211> 799
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 82
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Gly Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu
225 230 235 240
Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp
245 250 255
Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp
260 265 270
Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys
275 280 285
Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu
290 295 300
Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala
305 310 315 320
His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu
325 330 335
Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val
340 345 350
Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr
355 360 365
Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr
370 375 380
Met Thr Met Lys Ile Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln
405 410 415
Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro
420 425 430
Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe
435 440 445
Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu
450 455 460
Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met
465 470 475 480
Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp
485 490 495
Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr
500 505 510
Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn
515 520 525
Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln
530 535 540
Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn
545 550 555 560
Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn Asp Lys Thr His
565 570 575
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
580 585 590
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
595 600 605
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
610 615 620
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
625 630 635 640
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
645 650 655
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
660 665 670
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
675 680 685
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
690 695 700
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
705 710 715 720
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
725 730 735
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
740 745 750
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
755 760 765
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
770 775 780
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790 795
<210> 83
<211> 982
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 83
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr
225 230 235 240
Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val
245 250 255
Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp
260 265 270
Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val
275 280 285
Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu
290 295 300
Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile
305 310 315 320
Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr
325 330 335
Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp
340 345 350
Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser
355 360 365
Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu
370 375 380
Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val
385 390 395 400
Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro
405 410 415
Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr
420 425 430
Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
435 440 445
Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser
450 455 460
Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu
465 470 475 480
Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp
485 490 495
Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn
500 505 510
Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp
515 520 525
Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly
530 535 540
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn
545 550 555 560
Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His
565 570 575
Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg
580 585 590
Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu
595 600 605
Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu
610 615 620
Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe
625 630 635 640
Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met
645 650 655
Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val
660 665 670
Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln
675 680 685
Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln
690 695 700
Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu
705 710 715 720
Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His
725 730 735
Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu
740 745 750
Asn Ala Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
755 760 765
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
770 775 780
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
785 790 795 800
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
805 810 815
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
820 825 830
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
835 840 845
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
850 855 860
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
865 870 875 880
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
885 890 895
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
900 905 910
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
915 920 925
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
930 935 940
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
945 950 955 960
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
965 970 975
Ser Leu Ser Pro Gly Lys
980
<210> 84
<211> 955
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 84
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Ile His Trp Val Arg Gln Lys Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Asp Tyr Asp Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Asp Asn Tyr Ala Thr Gly Ala Trp Phe Ala Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr
225 230 235 240
Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val
245 250 255
Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp
260 265 270
Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val
275 280 285
Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu
290 295 300
Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile
305 310 315 320
Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr
325 330 335
Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp
340 345 350
Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser
355 360 365
Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu
370 375 380
Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val
385 390 395 400
Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro
405 410 415
Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr
420 425 430
Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
435 440 445
Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser
450 455 460
Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu
465 470 475 480
Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp
485 490 495
Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn
500 505 510
Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp
515 520 525
Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly
530 535 540
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala
545 550 555 560
Val Pro Gly Gly Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser
565 570 575
Gln Lys Leu Cys Thr Leu Ala Trp Ser Ala His Pro Leu Val Gly His
580 585 590
Met Asp Leu Arg Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro
595 600 605
His Ile Gln Cys Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn
610 615 620
Ser Gln Phe Cys Leu Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu
625 630 635 640
Lys Leu Leu Gly Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro
645 650 655
Asp Ser Pro Val Gly Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln
660 665 670
Leu Leu Gln Pro Glu Gly His His Trp Glu Thr Gln Gln Ile Pro Ser
675 680 685
Leu Ser Pro Ser Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile
690 695 700
Leu Arg Ser Leu Gln Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala
705 710 715 720
His Gly Ala Ala Thr Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro
725 730 735
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
740 745 750
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
755 760 765
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
770 775 780
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
785 790 795 800
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
805 810 815
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
820 825 830
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
835 840 845
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
850 855 860
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
865 870 875 880
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
885 890 895
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
900 905 910
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
915 920 925
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
930 935 940
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
945 950 955
<210> 85
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 85
Gly Phe Thr Phe Ser Tyr Phe Trp Met Asn
1 5 10
<210> 86
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 86
Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 87
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 87
Asp Trp Glu Phe Thr Tyr
1 5
<210> 88
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 88
Ser Ala Ser Leu Ser Val Ser Phe Met His
1 5 10
<210> 89
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 89
Arg Thr Ser Asn Leu Ala Ser
1 5
<210> 90
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 90
Gln Gln Arg Ser Ser Asp Pro Pro
1 5
<210> 91
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 91
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser
115
<210> 92
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 92
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Ser Ala Ser Leu Ser Val Ser Phe Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly His Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Ser Asp Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Arg Leu Glu Ile
100 105
<210> 93
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 94
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 94
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Ser Ala Thr Leu Ser Cys Ser Ala Ser Leu Ser Val Ser Phe Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly His Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Ser Asp Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 95
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 95
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 96
<211> 583
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 96
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Ala
210 215 220
Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu
225 230 235 240
Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn
245 250 255
Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys
260 265 270
Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro
275 280 285
Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg
290 295 300
Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys
305 310 315 320
Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr
325 330 335
Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile
340 345 350
Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
355 360 365
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
370 375 380
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
385 390 395 400
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
405 410 415
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
420 425 430
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
435 440 445
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
450 455 460
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
465 470 475 480
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
485 490 495
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
500 505 510
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
515 520 525
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
530 535 540
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
545 550 555 560
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
565 570 575
Leu Ser Leu Ser Pro Gly Lys
580
<210> 97
<211> 622
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 97
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly
210 215 220
Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His Ser Leu Gly
225 230 235 240
Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys Ile Ser Leu
245 250 255
Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro Gln Glu Glu
260 265 270
Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val Leu His Glu
275 280 285
Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala
290 295 300
Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln
305 310 315 320
Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val Gly Val Thr
325 330 335
Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr
340 345 350
Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys
355 360 365
Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe Ser Leu Ser
370 375 380
Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr His Thr
385 390 395 400
Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe
405 410 415
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
420 425 430
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
435 440 445
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
450 455 460
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
465 470 475 480
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
485 490 495
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
500 505 510
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro
515 520 525
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
530 535 540
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
545 550 555 560
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp
565 570 575
Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
580 585 590
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
595 600 605
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 98
<211> 750
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly
210 215 220
Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr
225 230 235 240
Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu
245 250 255
Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln
260 265 270
Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp
275 280 285
Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn
290 295 300
Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys
305 310 315 320
Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile
325 330 335
His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr
340 345 350
Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly
355 360 365
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
370 375 380
Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
385 390 395 400
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
405 410 415
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
420 425 430
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
435 440 445
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
450 455 460
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
465 470 475 480
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
485 490 495
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
500 505 510
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His Thr
515 520 525
Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe
530 535 540
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
545 550 555 560
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
565 570 575
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
580 585 590
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
595 600 605
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
610 615 620
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
625 630 635 640
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro
645 650 655
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
660 665 670
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
675 680 685
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp
690 695 700
Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
705 710 715 720
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
725 730 735
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745 750
<210> 99
<211> 794
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 99
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly
210 215 220
Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His
225 230 235 240
Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe
245 250 255
Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu
260 265 270
Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys
275 280 285
Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro
290 295 300
Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu
305 310 315 320
Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg
325 330 335
Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn
340 345 350
Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu
355 360 365
Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile
370 375 380
Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu
405 410 415
Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp
420 425 430
Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp
435 440 445
Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys
450 455 460
Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu
465 470 475 480
Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala
485 490 495
His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu
500 505 510
Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val
515 520 525
Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr
530 535 540
Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr
545 550 555 560
Met Thr Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro Cys
565 570 575
Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
580 585 590
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
595 600 605
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
610 615 620
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
625 630 635 640
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
645 650 655
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
660 665 670
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
675 680 685
Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu
690 695 700
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
705 710 715 720
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
725 730 735
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala
740 745 750
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
755 760 765
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
770 775 780
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790
<210> 100
<211> 977
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 100
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly
210 215 220
Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp
225 230 235 240
Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr
245 250 255
Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val
260 265 270
Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp
275 280 285
Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser
290 295 300
Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile
305 310 315 320
Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu
325 330 335
Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile
340 345 350
Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp
355 360 365
Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val
370 375 380
Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp
385 390 395 400
Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val
405 410 415
Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe
420 425 430
Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys
435 440 445
Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp
450 455 460
Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln
465 470 475 480
Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp
485 490 495
Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val
500 505 510
Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser
515 520 525
Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
530 535 540
Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr
545 550 555 560
Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu
565 570 575
Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe
580 585 590
Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp
595 600 605
Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn
610 615 620
Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser
625 630 635 640
Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser
645 650 655
Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met
660 665 670
Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln
675 680 685
Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn
690 695 700
Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr
705 710 715 720
Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg
725 730 735
Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys
740 745 750
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
755 760 765
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
770 775 780
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
785 790 795 800
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
805 810 815
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
820 825 830
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
835 840 845
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
850 855 860
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
865 870 875 880
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
885 890 895
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
900 905 910
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
915 920 925
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
930 935 940
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
945 950 955 960
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
965 970 975
Lys
<210> 101
<211> 950
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 101
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Tyr Phe
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Leu Tyr
85 90 95
Tyr Cys Thr Arg Asp Trp Glu Phe Thr Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly
210 215 220
Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp
225 230 235 240
Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr
245 250 255
Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val
260 265 270
Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp
275 280 285
Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser
290 295 300
Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile
305 310 315 320
Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu
325 330 335
Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile
340 345 350
Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp
355 360 365
Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val
370 375 380
Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp
385 390 395 400
Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val
405 410 415
Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe
420 425 430
Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys
435 440 445
Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp
450 455 460
Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln
465 470 475 480
Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp
485 490 495
Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val
500 505 510
Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser
515 520 525
Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
530 535 540
Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly Ser
545 550 555 560
Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr
565 570 575
Leu Ala Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg Glu
580 585 590
Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys Gly
595 600 605
Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu
610 615 620
Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser
625 630 635 640
Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val Gly
645 650 655
Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu
660 665 670
Gly His His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln
675 680 685
Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln
690 695 700
Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala Thr
705 710 715 720
Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
725 730 735
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
740 745 750
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
755 760 765
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
770 775 780
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
785 790 795 800
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
805 810 815
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
820 825 830
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
835 840 845
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
850 855 860
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
865 870 875 880
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
885 890 895
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
900 905 910
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
915 920 925
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
930 935 940
Ser Leu Ser Pro Gly Lys
945 950
<210> 102
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 102
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser
115
<210> 103
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 103
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105
<210> 104
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 104
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 105
<211> 440
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 105
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 106
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 106
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 107
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 107
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 108
<211> 579
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 108
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Ala Pro Thr Ser Ser
210 215 220
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
225 230 235 240
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
245 250 255
Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
260 265 270
Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val
275 280 285
Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
290 295 300
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
305 310 315 320
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
325 330 335
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
340 345 350
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
355 360 365
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
370 375 380
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
385 390 395 400
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
405 410 415
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
420 425 430
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
435 440 445
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
450 455 460
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
465 470 475 480
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
485 490 495
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
500 505 510
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
515 520 525
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
530 535 540
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
545 550 555 560
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
565 570 575
Pro Gly Lys
<210> 109
<211> 618
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 109
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Gly Gly
210 215 220
Gly Gly Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr
225 230 235 240
Leu Met Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Ala
245 250 255
Lys Asp Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln
260 265 270
Phe Gln Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln
275 280 285
Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu
290 295 300
Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp
305 310 315 320
Leu Glu Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu
325 330 335
Met Lys Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile
340 345 350
Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val
355 360 365
Val Arg Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln
370 375 380
Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr His Thr Cys Pro Pro Cys
385 390 395 400
Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
405 410 415
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
420 425 430
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
435 440 445
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
450 455 460
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
465 470 475 480
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
485 490 495
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
500 505 510
Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu
515 520 525
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
530 535 540
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
545 550 555 560
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala
565 570 575
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
580 585 590
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
595 600 605
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615
<210> 110
<211> 746
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 110
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Gln Asp
210 215 220
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
225 230 235 240
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
245 250 255
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
260 265 270
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
275 280 285
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
290 295 300
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
305 310 315 320
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
325 330 335
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
340 345 350
Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly Gly Ser Gly Gly
355 360 365
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Pro
370 375 380
Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His
385 390 395 400
Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn
405 410 415
Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser
420 425 430
Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln
435 440 445
Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn
450 455 460
Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser
465 470 475 480
Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln
485 490 495
Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg
500 505 510
Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His Thr Cys Pro Pro Cys
515 520 525
Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
530 535 540
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
545 550 555 560
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
565 570 575
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
580 585 590
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
595 600 605
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
610 615 620
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
625 630 635 640
Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu
645 650 655
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
660 665 670
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
675 680 685
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala
690 695 700
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
705 710 715 720
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
725 730 735
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745
<210> 111
<211> 790
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 111
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ser Pro
210 215 220
Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn
225 230 235 240
Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg Val Lys
245 250 255
Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu
260 265 270
Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser
275 280 285
Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn
290 295 300
Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu
305 310 315 320
Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys
325 330 335
Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys
340 345 350
Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe
355 360 365
Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn Phe Glu
370 375 380
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
385 390 395 400
Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr
405 410 415
His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala
420 425 430
Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn
435 440 445
Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly
450 455 460
Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met
465 470 475 480
Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser
485 490 495
Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His
500 505 510
Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys
515 520 525
Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser
530 535 540
Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys
545 550 555 560
Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
565 570 575
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
580 585 590
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
595 600 605
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
610 615 620
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
625 630 635 640
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
645 650 655
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
660 665 670
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
675 680 685
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
690 695 700
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
705 710 715 720
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
725 730 735
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
740 745 750
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
755 760 765
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
770 775 780
Ser Leu Ser Pro Gly Lys
785 790
<210> 112
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 112
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 113
<211> 946
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 113
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly Ser Ser Pro Ala Trp
545 550 555 560
Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr Leu Ala Trp Ser
565 570 575
Ala His Pro Leu Val Gly His Met Asp Leu Arg Glu Glu Gly Asp Glu
580 585 590
Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys Gly Asp Gly Cys Asp
595 600 605
Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu Gln Arg Ile His
610 615 620
Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser Asp Ile Phe Thr
625 630 635 640
Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val Gly Gln Leu His Ala
645 650 655
Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu Gly His His Trp
660 665 670
Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln Pro Trp Gln Arg
675 680 685
Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln Ala Phe Val Ala
690 695 700
Val Ala Ala Arg Val Phe Ala His Gly Ala Ala Thr Leu Ser Pro Asp
705 710 715 720
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly
725 730 735
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
740 745 750
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
755 760 765
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
770 775 780
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
785 790 795 800
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
805 810 815
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
820 825 830
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
835 840 845
Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
850 855 860
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
865 870 875 880
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
885 890 895
Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
900 905 910
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
915 920 925
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
930 935 940
Gly Lys
945
<210> 114
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 114
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 115
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 115
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Ser Asp Gly Thr Ile Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Ser Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Arg Arg Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Lys Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105
<210> 116
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 116
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 117
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 117
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Ser Asp Gly Thr Ile Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Ser Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Arg Arg Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Lys Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 118
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 118
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 119
<211> 585
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 119
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser
340 345 350
Ile Ile Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro
355 360 365
Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
370 375 380
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
385 390 395 400
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
405 410 415
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
420 425 430
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
435 440 445
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
450 455 460
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
465 470 475 480
Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met
485 490 495
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
500 505 510
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
515 520 525
Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu
530 535 540
Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
545 550 555 560
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
565 570 575
Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 120
<211> 624
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 120
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Gly Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His Ser
225 230 235 240
Leu Gly Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys Ile
245 250 255
Ser Leu Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro Gln
260 265 270
Glu Glu Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val Leu
275 280 285
His Glu Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser
290 295 300
Ser Ala Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu
305 310 315 320
Tyr Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val Gly
325 330 335
Val Thr Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val Arg
340 345 350
Lys Tyr Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser
355 360 365
Pro Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe Ser
370 375 380
Leu Ser Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr
385 390 395 400
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser
405 410 415
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
420 425 430
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
435 440 445
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
450 455 460
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
465 470 475 480
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
485 490 495
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
500 505 510
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr
515 520 525
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
530 535 540
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
545 550 555 560
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
565 570 575
Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser
580 585 590
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
595 600 605
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 121
<211> 752
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 121
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys
225 230 235 240
Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu
245 250 255
Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile
260 265 270
Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe
275 280 285
Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp
290 295 300
Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe
305 310 315 320
Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys
325 330 335
Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala
340 345 350
Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu
355 360 365
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
370 375 380
Gly Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys
385 390 395 400
Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe
405 410 415
Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met
420 425 430
Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys
435 440 445
Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met
450 455 460
Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu
465 470 475 480
Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala
485 490 495
Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys
500 505 510
Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr
515 520 525
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser
530 535 540
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
545 550 555 560
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
565 570 575
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
580 585 590
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
595 600 605
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
610 615 620
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
625 630 635 640
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr
645 650 655
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
660 665 670
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
675 680 685
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
690 695 700
Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser
705 710 715 720
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
725 730 735
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745 750
<210> 122
<211> 796
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 122
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Gly Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys
225 230 235 240
Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp
245 250 255
Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp
260 265 270
Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu
275 280 285
Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val
290 295 300
Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn
305 310 315 320
Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys
325 330 335
His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val
340 345 350
Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met
355 360 365
Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met
370 375 380
Lys Ile Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
385 390 395 400
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln
405 410 415
Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu
420 425 430
Arg Asp Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met
435 440 445
Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp
450 455 460
Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe
465 470 475 480
Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile
485 490 495
Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu
500 505 510
Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys
515 520 525
Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly
530 535 540
Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu
545 550 555 560
Ala Tyr Met Thr Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro
565 570 575
Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe
580 585 590
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
595 600 605
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
610 615 620
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
625 630 635 640
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
645 650 655
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
660 665 670
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
675 680 685
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg
690 695 700
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
705 710 715 720
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
725 730 735
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser
740 745 750
Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
755 760 765
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
770 775 780
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790 795
<210> 123
<211> 979
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 123
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu
225 230 235 240
Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys
245 250 255
Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser
260 265 270
Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala
275 280 285
Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser
290 295 300
His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr
305 310 315 320
Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg
325 330 335
Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr
340 345 350
Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser
355 360 365
Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu
370 375 380
Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln
385 390 395 400
Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val
405 410 415
Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser
420 425 430
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
435 440 445
Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr
450 455 460
Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys
465 470 475 480
Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe
485 490 495
Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile
500 505 510
Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp
515 520 525
Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
530 535 540
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val
545 550 555 560
Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn
565 570 575
Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu
580 585 590
Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr
595 600 605
Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr
610 615 620
Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn
625 630 635 640
Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys
645 650 655
Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys
660 665 670
Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu
675 680 685
Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn
690 695 700
Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp
705 710 715 720
Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg
725 730 735
Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
740 745 750
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
755 760 765
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
770 775 780
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
785 790 795 800
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
805 810 815
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
820 825 830
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
835 840 845
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
850 855 860
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
865 870 875 880
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
885 890 895
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
900 905 910
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
915 920 925
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
930 935 940
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
945 950 955 960
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
965 970 975
Pro Gly Lys
<210> 124
<211> 952
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 124
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly His Ile Asn Pro Asn Asn Asp Asp Thr Phe Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Asp Tyr Asp Gly Gly Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu
225 230 235 240
Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys
245 250 255
Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser
260 265 270
Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala
275 280 285
Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser
290 295 300
His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr
305 310 315 320
Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg
325 330 335
Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr
340 345 350
Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser
355 360 365
Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu
370 375 380
Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln
385 390 395 400
Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val
405 410 415
Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser
420 425 430
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
435 440 445
Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr
450 455 460
Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys
465 470 475 480
Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe
485 490 495
Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile
500 505 510
Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp
515 520 525
Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
530 535 540
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly
545 550 555 560
Gly Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu
565 570 575
Cys Thr Leu Ala Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu
580 585 590
Arg Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln
595 600 605
Cys Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe
610 615 620
Cys Leu Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu
625 630 635 640
Gly Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro
645 650 655
Val Gly Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln
660 665 670
Pro Glu Gly His His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro
675 680 685
Ser Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser
690 695 700
Leu Gln Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala
705 710 715 720
Ala Thr Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
725 730 735
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
740 745 750
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
755 760 765
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
770 775 780
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
785 790 795 800
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
805 810 815
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
820 825 830
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
835 840 845
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
850 855 860
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
865 870 875 880
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
885 890 895
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
900 905 910
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
915 920 925
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
930 935 940
Ser Leu Ser Leu Ser Pro Gly Lys
945 950
<210> 125
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 125
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 126
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 126
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105
<210> 127
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 127
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 128
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 128
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 129
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 129
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Phe Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 130
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 130
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 131
<211> 584
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 131
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
225 230 235 240
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
245 250 255
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
260 265 270
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
275 280 285
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
290 295 300
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
305 310 315 320
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
325 330 335
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
340 345 350
Ile Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
355 360 365
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
370 375 380
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
385 390 395 400
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
405 410 415
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
420 425 430
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
435 440 445
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
450 455 460
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
465 470 475 480
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
485 490 495
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
500 505 510
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
515 520 525
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
530 535 540
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
545 550 555 560
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
565 570 575
Ser Leu Ser Leu Ser Pro Gly Lys
580
<210> 132
<211> 623
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 132
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His Ser Leu
225 230 235 240
Gly Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys Ile Ser
245 250 255
Leu Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro Gln Glu
260 265 270
Glu Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val Leu His
275 280 285
Glu Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser Ser
290 295 300
Ala Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu Tyr
305 310 315 320
Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val Gly Val
325 330 335
Thr Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val Arg Lys
340 345 350
Tyr Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser Pro
355 360 365
Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe Ser Leu
370 375 380
Ser Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr His
385 390 395 400
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
405 410 415
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
420 425 430
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
435 440 445
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
450 455 460
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
465 470 475 480
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
485 490 495
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
500 505 510
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
515 520 525
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
530 535 540
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
545 550 555 560
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
565 570 575
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
580 585 590
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
595 600 605
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 133
<211> 751
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 133
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys
225 230 235 240
Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe
245 250 255
Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met
260 265 270
Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys
275 280 285
Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met
290 295 300
Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu
305 310 315 320
Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala
325 330 335
Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys
340 345 350
Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly
355 360 365
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
370 375 380
Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr
385 390 395 400
Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu
405 410 415
Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln
420 425 430
Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp
435 440 445
Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn
450 455 460
Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys
465 470 475 480
Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile
485 490 495
His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr
500 505 510
Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His
515 520 525
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
530 535 540
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
545 550 555 560
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
565 570 575
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
580 585 590
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
595 600 605
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
610 615 620
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
625 630 635 640
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
645 650 655
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
660 665 670
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
675 680 685
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
690 695 700
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
705 710 715 720
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
725 730 735
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745 750
<210> 134
<211> 795
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 134
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr
225 230 235 240
His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala
245 250 255
Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn
260 265 270
Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly
275 280 285
Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met
290 295 300
Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser
305 310 315 320
Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His
325 330 335
Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys
340 345 350
Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser
355 360 365
Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys
370 375 380
Ile Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
385 390 395 400
Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser
405 410 415
Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg
420 425 430
Asp Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys
435 440 445
Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe
450 455 460
Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr
465 470 475 480
Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys
485 490 495
Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg
500 505 510
Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala
515 520 525
Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile
530 535 540
Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala
545 550 555 560
Tyr Met Thr Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro
565 570 575
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
580 585 590
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
595 600 605
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
610 615 620
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
625 630 635 640
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
645 650 655
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
660 665 670
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
675 680 685
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
690 695 700
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
705 710 715 720
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
725 730 735
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
740 745 750
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
755 760 765
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
770 775 780
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790 795
<210> 135
<211> 978
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 135
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu
225 230 235 240
Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp
245 250 255
Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu
260 265 270
Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly
275 280 285
Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His
290 295 300
Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp
305 310 315 320
Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys
325 330 335
Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr
340 345 350
Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser
355 360 365
Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg
370 375 380
Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu
385 390 395 400
Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met
405 410 415
Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe
420 425 430
Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu
435 440 445
Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro
450 455 460
Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val
465 470 475 480
Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr
485 490 495
Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser
500 505 510
Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala
515 520 525
Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala
545 550 555 560
Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu
565 570 575
Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu
580 585 590
Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys
595 600 605
Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys
610 615 620
Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly
625 630 635 640
Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu
645 650 655
Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr
660 665 670
Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp
675 680 685
Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe
690 695 700
Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe
705 710 715 720
Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile
725 730 735
Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp
740 745 750
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly
755 760 765
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
770 775 780
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
785 790 795 800
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
805 810 815
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
820 825 830
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
835 840 845
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
850 855 860
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
865 870 875 880
Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
885 890 895
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
900 905 910
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
915 920 925
Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
930 935 940
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
945 950 955 960
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
965 970 975
Gly Lys
<210> 136
<211> 951
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 136
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Phe Ile Ser Tyr Asp Gly Asn Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Thr Gly Trp Leu Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu
225 230 235 240
Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp
245 250 255
Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu
260 265 270
Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly
275 280 285
Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His
290 295 300
Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp
305 310 315 320
Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys
325 330 335
Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr
340 345 350
Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser
355 360 365
Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg
370 375 380
Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu
385 390 395 400
Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met
405 410 415
Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe
420 425 430
Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu
435 440 445
Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro
450 455 460
Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val
465 470 475 480
Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr
485 490 495
Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser
500 505 510
Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala
515 520 525
Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly
545 550 555 560
Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys
565 570 575
Thr Leu Ala Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg
580 585 590
Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys
595 600 605
Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys
610 615 620
Leu Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly
625 630 635 640
Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val
645 650 655
Gly Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro
660 665 670
Glu Gly His His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser
675 680 685
Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu
690 695 700
Gln Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala
705 710 715 720
Thr Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
725 730 735
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
740 745 750
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
755 760 765
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
770 775 780
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
785 790 795 800
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
805 810 815
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
820 825 830
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
835 840 845
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
850 855 860
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
865 870 875 880
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
885 890 895
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
900 905 910
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
915 920 925
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
930 935 940
Leu Ser Leu Ser Pro Gly Lys
945 950
<210> 137
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 137
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 138
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 138
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Pro Tyr Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr His Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105
<210> 139
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 139
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 140
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Val Thr Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Pro Tyr Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Met Tyr His Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 141
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 141
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 142
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 142
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 143
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 143
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 144
<211> 584
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 144
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
225 230 235 240
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
245 250 255
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
260 265 270
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
275 280 285
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
290 295 300
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
305 310 315 320
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
325 330 335
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
340 345 350
Ile Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
355 360 365
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
370 375 380
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
385 390 395 400
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
405 410 415
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
420 425 430
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
435 440 445
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
450 455 460
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
465 470 475 480
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
485 490 495
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
500 505 510
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
515 520 525
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
530 535 540
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
545 550 555 560
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
565 570 575
Ser Leu Ser Leu Ser Pro Gly Lys
580
<210> 145
<211> 623
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 145
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His Ser Leu
225 230 235 240
Gly Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys Ile Ser
245 250 255
Leu Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro Gln Glu
260 265 270
Glu Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val Leu His
275 280 285
Glu Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser Ser
290 295 300
Ala Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu Tyr
305 310 315 320
Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val Gly Val
325 330 335
Thr Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val Arg Lys
340 345 350
Tyr Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser Pro
355 360 365
Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe Ser Leu
370 375 380
Ser Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr His
385 390 395 400
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
405 410 415
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
420 425 430
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
435 440 445
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
450 455 460
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
465 470 475 480
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
485 490 495
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
500 505 510
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
515 520 525
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
530 535 540
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
545 550 555 560
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
565 570 575
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
580 585 590
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
595 600 605
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 146
<211> 751
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 146
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys
225 230 235 240
Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe
245 250 255
Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met
260 265 270
Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys
275 280 285
Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met
290 295 300
Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu
305 310 315 320
Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala
325 330 335
Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys
340 345 350
Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly
355 360 365
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
370 375 380
Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr
385 390 395 400
Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu
405 410 415
Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln
420 425 430
Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp
435 440 445
Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn
450 455 460
Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys
465 470 475 480
Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile
485 490 495
His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr
500 505 510
Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His
515 520 525
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
530 535 540
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
545 550 555 560
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
565 570 575
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
580 585 590
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
595 600 605
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
610 615 620
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
625 630 635 640
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
645 650 655
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
660 665 670
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
675 680 685
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
690 695 700
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
705 710 715 720
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
725 730 735
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745 750
<210> 147
<211> 795
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 147
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr
225 230 235 240
His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala
245 250 255
Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn
260 265 270
Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly
275 280 285
Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met
290 295 300
Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser
305 310 315 320
Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His
325 330 335
Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys
340 345 350
Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser
355 360 365
Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys
370 375 380
Ile Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
385 390 395 400
Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser
405 410 415
Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg
420 425 430
Asp Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys
435 440 445
Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe
450 455 460
Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr
465 470 475 480
Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys
485 490 495
Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg
500 505 510
Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala
515 520 525
Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile
530 535 540
Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala
545 550 555 560
Tyr Met Thr Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro
565 570 575
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
580 585 590
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
595 600 605
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
610 615 620
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
625 630 635 640
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
645 650 655
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
660 665 670
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
675 680 685
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
690 695 700
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
705 710 715 720
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
725 730 735
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
740 745 750
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
755 760 765
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
770 775 780
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790 795
<210> 148
<211> 978
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 148
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu
225 230 235 240
Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp
245 250 255
Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu
260 265 270
Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly
275 280 285
Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His
290 295 300
Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp
305 310 315 320
Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys
325 330 335
Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr
340 345 350
Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser
355 360 365
Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg
370 375 380
Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu
385 390 395 400
Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met
405 410 415
Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe
420 425 430
Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu
435 440 445
Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro
450 455 460
Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val
465 470 475 480
Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr
485 490 495
Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser
500 505 510
Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala
515 520 525
Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala
545 550 555 560
Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu
565 570 575
Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu
580 585 590
Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys
595 600 605
Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys
610 615 620
Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly
625 630 635 640
Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu
645 650 655
Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr
660 665 670
Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp
675 680 685
Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe
690 695 700
Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe
705 710 715 720
Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile
725 730 735
Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp
740 745 750
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly
755 760 765
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
770 775 780
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
785 790 795 800
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
805 810 815
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
820 825 830
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
835 840 845
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
850 855 860
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
865 870 875 880
Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
885 890 895
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
900 905 910
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
915 920 925
Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
930 935 940
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
945 950 955 960
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
965 970 975
Gly Lys
<210> 149
<211> 951
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 149
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Tyr Phe Pro Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr Tyr Ala Asp Ser Val
50 55 60
Gln Asp Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Arg His Trp Pro Gly Gly Phe Asp His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro
210 215 220
Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu
225 230 235 240
Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp
245 250 255
Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu
260 265 270
Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly
275 280 285
Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His
290 295 300
Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp
305 310 315 320
Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys
325 330 335
Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr
340 345 350
Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser
355 360 365
Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg
370 375 380
Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu
385 390 395 400
Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met
405 410 415
Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe
420 425 430
Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu
435 440 445
Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro
450 455 460
Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val
465 470 475 480
Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr
485 490 495
Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser
500 505 510
Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala
515 520 525
Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly
545 550 555 560
Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys
565 570 575
Thr Leu Ala Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg
580 585 590
Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys
595 600 605
Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys
610 615 620
Leu Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly
625 630 635 640
Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val
645 650 655
Gly Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro
660 665 670
Glu Gly His His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser
675 680 685
Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu
690 695 700
Gln Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala
705 710 715 720
Thr Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
725 730 735
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
740 745 750
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
755 760 765
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
770 775 780
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
785 790 795 800
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
805 810 815
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
820 825 830
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
835 840 845
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
850 855 860
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
865 870 875 880
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
885 890 895
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
900 905 910
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
915 920 925
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
930 935 940
Leu Ser Leu Ser Pro Gly Lys
945 950
<210> 150
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 150
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 151
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 151
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105
<210> 152
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 152
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 153
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 153
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 154
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 154
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 155
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 155
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 156
<211> 586
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 156
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu
225 230 235 240
Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn
245 250 255
Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met
260 265 270
Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu
275 280 285
Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe
290 295 300
His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu
305 310 315 320
Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu
325 330 335
Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln
340 345 350
Ser Ile Ile Ser Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys
355 360 365
Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
370 375 380
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
385 390 395 400
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
405 410 415
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
420 425 430
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
435 440 445
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
450 455 460
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
465 470 475 480
Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu
485 490 495
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
500 505 510
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
515 520 525
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala
530 535 540
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
545 550 555 560
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
565 570 575
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
580 585
<210> 157
<211> 625
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 157
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Gly Ser Gly Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His
225 230 235 240
Ser Leu Gly Ser Arg Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys
245 250 255
Ile Ser Leu Phe Ser Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro
260 265 270
Gln Glu Glu Phe Gly Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val
275 280 285
Leu His Glu Met Ile Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp
290 295 300
Ser Ser Ala Ala Trp Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu
305 310 315 320
Leu Tyr Gln Gln Leu Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val
325 330 335
Gly Val Thr Glu Thr Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val
340 345 350
Arg Lys Tyr Phe Gln Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr
355 360 365
Ser Pro Cys Ala Trp Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe
370 375 380
Ser Leu Ser Thr Asn Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys
385 390 395 400
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
405 410 415
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
420 425 430
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
435 440 445
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
450 455 460
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
465 470 475 480
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
485 490 495
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
500 505 510
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
515 520 525
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
530 535 540
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
545 550 555 560
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
565 570 575
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
580 585 590
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
595 600 605
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
610 615 620
Lys
625
<210> 158
<211> 753
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 158
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu
225 230 235 240
Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr
245 250 255
Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys
260 265 270
Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn
275 280 285
Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu
290 295 300
Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp
305 310 315 320
Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg
325 330 335
Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala
340 345 350
Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe
355 360 365
Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys
385 390 395 400
Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu
405 410 415
Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile
420 425 430
Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe
435 440 445
Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp
450 455 460
Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe
465 470 475 480
Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys
485 490 495
Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala
500 505 510
Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys
515 520 525
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
530 535 540
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
545 550 555 560
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
565 570 575
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
580 585 590
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
595 600 605
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
610 615 620
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
625 630 635 640
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
645 650 655
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
660 665 670
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
675 680 685
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
690 695 700
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
705 710 715 720
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
725 730 735
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
740 745 750
Lys
<210> 159
<211> 797
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 159
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Gly Ser Gly Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser
225 230 235 240
Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala
245 250 255
Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu
260 265 270
Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr
275 280 285
Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu
290 295 300
Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val
305 310 315 320
Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg
325 330 335
Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln
340 345 350
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
355 360 365
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
370 375 380
Met Lys Ile Arg Asn Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser
385 390 395 400
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr
405 410 415
Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met
420 425 430
Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln
435 440 445
Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu
450 455 460
Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln
465 470 475 480
Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp
485 490 495
Ile Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg
500 505 510
Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser
515 520 525
Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys
530 535 540
Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile
545 550 555 560
Glu Ala Tyr Met Thr Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys
565 570 575
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
580 585 590
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
595 600 605
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
610 615 620
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
625 630 635 640
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
645 650 655
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
660 665 670
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
675 680 685
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
690 695 700
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
705 710 715 720
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
725 730 735
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
740 745 750
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
755 760 765
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
770 775 780
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
785 790 795
<210> 160
<211> 980
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 160
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val
225 230 235 240
Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr
245 250 255
Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser
260 265 270
Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala
275 280 285
Ala Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu
290 295 300
Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser
305 310 315 320
Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu
325 330 335
Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu
340 345 350
Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly
355 360 365
Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala
370 375 380
Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys
385 390 395 400
Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu
405 410 415
Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser
420 425 430
Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu
435 440 445
Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu
450 455 460
Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe
465 470 475 480
Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val
485 490 495
Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser
500 505 510
Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu
515 520 525
Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
530 535 540
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro
545 550 555 560
Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln
565 570 575
Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr
580 585 590
Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile
595 600 605
Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu
610 615 620
Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr
625 630 635 640
Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu
645 650 655
Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe
660 665 670
Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe
675 680 685
Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu
690 695 700
Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro
705 710 715 720
Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe
725 730 735
Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala
740 745 750
Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
755 760 765
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
770 775 780
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
785 790 795 800
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
805 810 815
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
820 825 830
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
835 840 845
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
850 855 860
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
865 870 875 880
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
885 890 895
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
900 905 910
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
915 920 925
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
930 935 940
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
945 950 955 960
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
965 970 975
Ser Pro Gly Lys
980
<210> 161
<211> 953
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 161
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Pro Gly Ser Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val
225 230 235 240
Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr
245 250 255
Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser
260 265 270
Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala
275 280 285
Ala Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu
290 295 300
Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser
305 310 315 320
Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu
325 330 335
Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu
340 345 350
Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly
355 360 365
Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala
370 375 380
Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys
385 390 395 400
Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu
405 410 415
Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser
420 425 430
Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu
435 440 445
Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu
450 455 460
Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe
465 470 475 480
Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val
485 490 495
Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser
500 505 510
Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu
515 520 525
Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
530 535 540
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro
545 550 555 560
Gly Gly Ser Ser Pro Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys
565 570 575
Leu Cys Thr Leu Ala Trp Ser Ala His Pro Leu Val Gly His Met Asp
580 585 590
Leu Arg Glu Glu Gly Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile
595 600 605
Gln Cys Gly Asp Gly Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln
610 615 620
Phe Cys Leu Gln Arg Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu
625 630 635 640
Leu Gly Ser Asp Ile Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser
645 650 655
Pro Val Gly Gln Leu His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu
660 665 670
Gln Pro Glu Gly His His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser
675 680 685
Pro Ser Gln Pro Trp Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg
690 695 700
Ser Leu Gln Ala Phe Val Ala Val Ala Ala Arg Val Phe Ala His Gly
705 710 715 720
Ala Ala Thr Leu Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro
725 730 735
Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
740 745 750
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
755 760 765
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
770 775 780
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
785 790 795 800
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
805 810 815
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
820 825 830
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
835 840 845
Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met
850 855 860
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
865 870 875 880
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
885 890 895
Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu
900 905 910
Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
915 920 925
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
930 935 940
Lys Ser Leu Ser Leu Ser Pro Gly Lys
945 950
<210> 162
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 162
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser
115
<210> 163
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 163
Gln Ile Val Ser Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Arg Ser Tyr Met
20 25 30
Gln Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile
100
<210> 164
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 164
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 165
<211> 211
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 165
Gln Ile Val Ser Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Arg Ser Tyr Met
20 25 30
Gln Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu Cys
210
<210> 166
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 166
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Arg Val Glu Pro Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 167
<211> 210
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 167
Gln Ile Val Ser Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Arg Ser Tyr Met
20 25 30
Gln Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser
115 120 125
Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg
195 200 205
Gly Glu
210
<210> 168
<211> 445
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 168
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser
340 345 350
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 169
<211> 581
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 169
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Ala Pro Thr
210 215 220
Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu
225 230 235 240
Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys
245 250 255
Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr
260 265 270
Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu
275 280 285
Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg
290 295 300
Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser
305 310 315 320
Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val
325 330 335
Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr
340 345 350
Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp
355 360 365
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
370 375 380
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
385 390 395 400
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
405 410 415
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
420 425 430
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
435 440 445
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
450 455 460
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
465 470 475 480
Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
485 490 495
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
500 505 510
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
515 520 525
Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu
530 535 540
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
545 550 555 560
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
565 570 575
Leu Ser Pro Gly Lys
580
<210> 170
<211> 620
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 170
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly
210 215 220
Gly Gly Gly Gly Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg
225 230 235 240
Arg Thr Leu Met Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser
245 250 255
Cys Ala Lys Asp Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly
260 265 270
Asn Gln Phe Gln Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile
275 280 285
Gln Gln Ile Phe Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp
290 295 300
Asp Glu Thr Leu Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu
305 310 315 320
Asn Asp Leu Glu Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr
325 330 335
Pro Leu Met Lys Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln
340 345 350
Arg Ile Thr Leu Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp
355 360 365
Glu Val Val Arg Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn
370 375 380
Leu Gln Glu Ser Leu Arg Ser Lys Glu Asp Lys Thr His Thr Cys Pro
385 390 395 400
Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe
405 410 415
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
420 425 430
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
435 440 445
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
450 455 460
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
465 470 475 480
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
485 490 495
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
500 505 510
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg
515 520 525
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
530 535 540
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
545 550 555 560
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser
565 570 575
Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
580 585 590
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
595 600 605
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
610 615 620
<210> 171
<211> 748
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 171
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly
210 215 220
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
225 230 235 240
Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile
245 250 255
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
260 265 270
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
275 280 285
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
290 295 300
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
305 310 315 320
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
325 330 335
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
340 345 350
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly Gly Ser
355 360 365
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
370 375 380
Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala
385 390 395 400
Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu
405 410 415
Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile
420 425 430
Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser
435 440 445
Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe
450 455 460
Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn
465 470 475 480
Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu
485 490 495
Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg
500 505 510
Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His Thr Cys Pro
515 520 525
Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe
530 535 540
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
545 550 555 560
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
565 570 575
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
580 585 590
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
595 600 605
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
610 615 620
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
625 630 635 640
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg
645 650 655
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
660 665 670
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
675 680 685
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser
690 695 700
Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
705 710 715 720
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
725 730 735
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
740 745
<210> 172
<211> 792
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 172
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly
210 215 220
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
225 230 235 240
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg
245 250 255
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
260 265 270
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
275 280 285
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
290 295 300
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
305 310 315 320
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
325 330 335
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
340 345 350
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
355 360 365
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
370 375 380
Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
385 390 395 400
Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser
405 410 415
Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala
420 425 430
Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu
435 440 445
Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr
450 455 460
Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu
465 470 475 480
Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val
485 490 495
Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg
500 505 510
Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln
515 520 525
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
530 535 540
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
545 550 555 560
Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
565 570 575
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
580 585 590
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
595 600 605
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
610 615 620
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
625 630 635 640
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
645 650 655
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
660 665 670
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
675 680 685
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
690 695 700
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
705 710 715 720
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
725 730 735
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
740 745 750
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
755 760 765
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
770 775 780
Ser Leu Ser Leu Ser Pro Gly Lys
785 790
<210> 173
<211> 975
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 173
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly
210 215 220
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
225 230 235 240
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
245 250 255
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
260 265 270
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly
275 280 285
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
290 295 300
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
305 310 315 320
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
325 330 335
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
340 345 350
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
355 360 365
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
370 375 380
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
385 390 395 400
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
405 410 415
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
420 425 430
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
435 440 445
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
450 455 460
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
465 470 475 480
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
485 490 495
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
500 505 510
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
515 520 525
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
530 535 540
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
545 550 555 560
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
565 570 575
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
580 585 590
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
595 600 605
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
610 615 620
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
625 630 635 640
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
645 650 655
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
660 665 670
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
675 680 685
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
690 695 700
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
705 710 715 720
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
725 730 735
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His
740 745 750
Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val
755 760 765
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
770 775 780
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
785 790 795 800
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
805 810 815
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
820 825 830
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
835 840 845
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
850 855 860
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro
865 870 875 880
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
885 890 895
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
900 905 910
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu
915 920 925
Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
930 935 940
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
945 950 955 960
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970 975
<210> 174
<211> 948
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 174
Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala Ser Val
1 5 10 15
Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Arg Tyr Trp Met
20 25 30
His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
35 40 45
Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Glu Gly
50 55 60
Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr Met Glu
65 70 75 80
Leu Ser Ser Leu Thr His Glu Asp Ser Ala Val Tyr Tyr Cys Ser Arg
85 90 95
Asp Tyr Gly Tyr Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
180 185 190
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly
210 215 220
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
225 230 235 240
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
245 250 255
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
260 265 270
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly
275 280 285
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
290 295 300
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
305 310 315 320
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
325 330 335
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
340 345 350
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
355 360 365
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
370 375 380
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
385 390 395 400
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
405 410 415
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
420 425 430
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
435 440 445
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
450 455 460
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
465 470 475 480
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
485 490 495
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
500 505 510
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
515 520 525
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
530 535 540
Ser Gly Gly Gly Gly Ser Gly Arg Ala Val Pro Gly Gly Ser Ser Pro
545 550 555 560
Ala Trp Thr Gln Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr Leu Ala
565 570 575
Trp Ser Ala His Pro Leu Val Gly His Met Asp Leu Arg Glu Glu Gly
580 585 590
Asp Glu Glu Thr Thr Asn Asp Val Pro His Ile Gln Cys Gly Asp Gly
595 600 605
Cys Asp Pro Gln Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu Gln Arg
610 615 620
Ile His Gln Gly Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser Asp Ile
625 630 635 640
Phe Thr Gly Glu Pro Ser Leu Leu Pro Asp Ser Pro Val Gly Gln Leu
645 650 655
His Ala Ser Leu Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu Gly His
660 665 670
His Trp Glu Thr Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln Pro Trp
675 680 685
Gln Arg Leu Leu Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln Ala Phe
690 695 700
Val Ala Val Ala Ala Arg Val Phe Ala His Gly Ala Ala Thr Leu Ser
705 710 715 720
Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
725 730 735
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
740 745 750
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
755 760 765
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
770 775 780
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
785 790 795 800
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
805 810 815
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
820 825 830
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
835 840 845
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
850 855 860
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
865 870 875 880
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
885 890 895
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
900 905 910
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
915 920 925
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
930 935 940
Ser Pro Gly Lys
945
<210> 175
<211> 273
<212> БЕЛОК
<213> Homo sapiens
<400> 175
Met Ile Phe Leu Leu Leu Met Leu Ser Leu Glu Leu Gln Leu His Gln
1 5 10 15
Ile Ala Ala Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile
20 25 30
Glu His Gly Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser
35 40 45
His Val Asn Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn
50 55 60
Asp Thr Ser Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu
65 70 75 80
Pro Leu Gly Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp
85 90 95
Glu Gly Gln Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr
100 105 110
Lys Tyr Leu Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr
115 120 125
His Ile Leu Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln
130 135 140
Ala Thr Gly Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val
145 150 155 160
Pro Ala Asn Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val
165 170 175
Thr Ser Val Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys
180 185 190
Val Phe Trp Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp
195 200 205
Leu Gln Ser Gln Met Glu Pro Arg Thr His Pro Thr Trp Leu Leu His
210 215 220
Ile Phe Ile Pro Phe Cys Ile Ile Ala Phe Ile Phe Ile Ala Thr Val
225 230 235 240
Ile Ala Leu Arg Lys Gln Leu Cys Gln Lys Leu Tyr Ser Ser Lys Asp
245 250 255
Thr Thr Lys Arg Pro Val Thr Thr Thr Lys Arg Glu Val Asn Ser Ala
260 265 270
Ile
<210> 176
<211> 201
<212> БЕЛОК
<213> Homo sapiens
<400> 176
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 177
<211> 428
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 177
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Asp Lys Thr His Thr Cys Pro
195 200 205
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
210 215 220
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
225 230 235 240
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
245 250 255
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
260 265 270
Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr
275 280 285
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
290 295 300
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
305 310 315 320
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
325 330 335
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
340 345 350
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
355 360 365
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
370 375 380
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
385 390 395 400
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
405 410 415
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425
<210> 178
<211> 428
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 178
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Asp Lys Thr His Thr Cys Pro
195 200 205
Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe
210 215 220
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
225 230 235 240
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
245 250 255
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
260 265 270
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
275 280 285
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
290 295 300
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
305 310 315 320
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg
325 330 335
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly
340 345 350
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
355 360 365
Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser
370 375 380
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
385 390 395 400
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
405 410 415
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425
<210> 179
<211> 433
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 179
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Asp Lys
195 200 205
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
210 215 220
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
225 230 235 240
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
245 250 255
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
260 265 270
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
275 280 285
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
290 295 300
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
305 310 315 320
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
325 330 335
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
340 345 350
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
355 360 365
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
370 375 380
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
385 390 395 400
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
405 410 415
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
420 425 430
Lys
<210> 180
<211> 566
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 180
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu
210 215 220
Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser
325 330 335
Thr Leu Thr Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
340 345 350
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
355 360 365
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
370 375 380
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
385 390 395 400
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
405 410 415
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
420 425 430
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
435 440 445
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
450 455 460
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
465 470 475 480
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
485 490 495
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
500 505 510
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
515 520 525
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
530 535 540
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
545 550 555 560
Ser Leu Ser Pro Gly Lys
565
<210> 181
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 181
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Gly Gly Gly Gly
195 200 205
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly
210 215 220
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
225 230 235 240
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
245 250 255
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
260 265 270
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
275 280 285
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
325 330 335
Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
340 345 350
Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
355 360 365
Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro
370 375 380
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
385 390 395 400
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
405 410 415
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
420 425 430
Pro Gly Lys
435
<210> 182
<211> 600
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 182
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Gly Gly Gly Gly
195 200 205
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
210 215 220
Leu Leu Ala Gln Met Arg Lys Ile Ser Leu Phe Ser Cys Ala Lys Asp
225 230 235 240
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
245 250 255
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
260 265 270
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
275 280 285
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
290 295 300
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
305 310 315 320
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
325 330 335
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
340 345 350
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
355 360 365
Leu Arg Ser Lys Glu Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
370 375 380
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
385 390 395 400
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
405 410 415
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
420 425 430
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
435 440 445
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
450 455 460
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
465 470 475 480
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
485 490 495
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
500 505 510
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
515 520 525
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
530 535 540
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
545 550 555 560
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
565 570 575
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
580 585 590
Ser Leu Ser Leu Ser Pro Gly Lys
595 600
<210> 183
<211> 732
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 183
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Gly Gly Gly Gly
195 200 205
Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn
210 215 220
Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile
225 230 235 240
Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln
245 250 255
Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln
260 265 270
Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys
275 280 285
Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr
290 295 300
Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu
305 310 315 320
Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys
325 330 335
Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Phe Glu Gly Gly Gly Ser
340 345 350
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
355 360 365
Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala
370 375 380
Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu
385 390 395 400
Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile
405 410 415
Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser
420 425 430
Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe
435 440 445
Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn
450 455 460
Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu
465 470 475 480
Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg
485 490 495
Lys Arg Ser Gln Met Leu Phe Arg Gly Asp Lys Thr His Thr Cys Pro
500 505 510
Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe
515 520 525
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
530 535 540
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
545 550 555 560
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
565 570 575
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
580 585 590
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
595 600 605
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
610 615 620
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg
625 630 635 640
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
645 650 655
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
660 665 670
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser
675 680 685
Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
690 695 700
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
705 710 715 720
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
725 730
<210> 184
<211> 776
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 184
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Gly Gly Gly Gly
195 200 205
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
210 215 220
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala Asp Ala Phe Ser Arg
225 230 235 240
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
245 250 255
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
260 265 270
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
275 280 285
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
290 295 300
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
305 310 315 320
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
325 330 335
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
340 345 350
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
355 360 365
Phe Glu Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser
385 390 395 400
Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Ala
405 410 415
Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu
420 425 430
Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr
435 440 445
Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu
450 455 460
Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val
465 470 475 480
Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg
485 490 495
Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln
500 505 510
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
515 520 525
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
530 535 540
Met Lys Ile Arg Asn Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
545 550 555 560
Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
565 570 575
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
580 585 590
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
595 600 605
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
610 615 620
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
625 630 635 640
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
645 650 655
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
660 665 670
Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr
675 680 685
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
690 695 700
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
705 710 715 720
Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val
725 730 735
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
740 745 750
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
755 760 765
Ser Leu Ser Leu Ser Pro Gly Lys
770 775
<210> 185
<211> 431
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 185
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Asp Lys Thr His
195 200 205
Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val
210 215 220
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
225 230 235 240
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
245 250 255
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
260 265 270
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
275 280 285
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
290 295 300
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
305 310 315 320
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro
325 330 335
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu
340 345 350
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
355 360 365
Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser
370 375 380
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
385 390 395 400
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
405 410 415
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
420 425 430
<210> 186
<211> 955
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 186
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Ile Trp Glu Leu
195 200 205
Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro
210 215 220
Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile
225 230 235 240
Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr
245 250 255
Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys
260 265 270
His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys
275 280 285
Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu
290 295 300
Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly
305 310 315 320
Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe
325 330 335
Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys
340 345 350
Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu
355 360 365
Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala
370 375 380
Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu
385 390 395 400
Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys
405 410 415
Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg
420 425 430
Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His
435 440 445
Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys
450 455 460
Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val
465 470 475 480
Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr
485 490 495
Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly
500 505 510
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
515 520 525
Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe
530 535 540
Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met
545 550 555 560
Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu
565 570 575
Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu
580 585 590
Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser
595 600 605
Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys
610 615 620
Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu
625 630 635 640
Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met
645 650 655
Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile
660 665 670
Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln
675 680 685
Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu
690 695 700
Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg
705 710 715 720
Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys Pro Pro
725 730 735
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
740 745 750
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
755 760 765
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
770 775 780
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
785 790 795 800
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
805 810 815
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
820 825 830
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
835 840 845
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
850 855 860
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
865 870 875 880
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
885 890 895
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
900 905 910
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
915 920 925
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
930 935 940
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
945 950 955
<210> 187
<211> 928
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 187
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Ser Gly Ile Trp Glu Leu
195 200 205
Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro
210 215 220
Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile
225 230 235 240
Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr
245 250 255
Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys
260 265 270
His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys
275 280 285
Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu
290 295 300
Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly
305 310 315 320
Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe
325 330 335
Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys
340 345 350
Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu
355 360 365
Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala
370 375 380
Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu
385 390 395 400
Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys
405 410 415
Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg
420 425 430
Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His
435 440 445
Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys
450 455 460
Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val
465 470 475 480
Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr
485 490 495
Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly
500 505 510
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
515 520 525
Gly Ser Gly Arg Ala Val Pro Gly Gly Ser Ser Pro Ala Trp Thr Gln
530 535 540
Cys Gln Gln Leu Ser Gln Lys Leu Cys Thr Leu Ala Trp Ser Ala His
545 550 555 560
Pro Leu Val Gly His Met Asp Leu Arg Glu Glu Gly Asp Glu Glu Thr
565 570 575
Thr Asn Asp Val Pro His Ile Gln Cys Gly Asp Gly Cys Asp Pro Gln
580 585 590
Gly Leu Arg Asp Asn Ser Gln Phe Cys Leu Gln Arg Ile His Gln Gly
595 600 605
Leu Ile Phe Tyr Glu Lys Leu Leu Gly Ser Asp Ile Phe Thr Gly Glu
610 615 620
Pro Ser Leu Leu Pro Asp Ser Pro Val Gly Gln Leu His Ala Ser Leu
625 630 635 640
Leu Gly Leu Ser Gln Leu Leu Gln Pro Glu Gly His His Trp Glu Thr
645 650 655
Gln Gln Ile Pro Ser Leu Ser Pro Ser Gln Pro Trp Gln Arg Leu Leu
660 665 670
Leu Arg Phe Lys Ile Leu Arg Ser Leu Gln Ala Phe Val Ala Val Ala
675 680 685
Ala Arg Val Phe Ala His Gly Ala Ala Thr Leu Ser Pro Asp Lys Thr
690 695 700
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser
705 710 715 720
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
725 730 735
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
740 745 750
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
755 760 765
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
770 775 780
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
785 790 795 800
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
805 810 815
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr
820 825 830
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
835 840 845
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
850 855 860
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
865 870 875 880
Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser
885 890 895
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
900 905 910
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
915 920 925
<210> 188
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 188
Gly Phe Asn Ile Lys Asp Thr Tyr Ile His
1 5 10
<210> 189
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 189
Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 190
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 190
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 191
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 191
Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala
1 5 10
<210> 192
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 192
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 193
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 193
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 194
<211> 1
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> 1
<223> Может присутствовать в повторах любого целого числа
<400> 194
Gly
1
<210> 195
<211> 2
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(2)
<223> Может присутствовать в повторах любого целого числа
<400> 195
Gly Ser
1
<210> 196
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> Может присутствовать в повторах любого целого числа
<400> 196
Gly Gly Ser
1
<210> 197
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(4)
<223> Может присутствовать в повторах любого целого числа
<400> 197
Gly Gly Gly Ser
1
<210> 198
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(3)
<223> Может присутствовать в повторах любого целого числа
<220>
<221> ВАРИАНТ
<222> (4)..(7)
<223> Может присутствовать в повторах любого целого числа
<400> 198
Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 199
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(5)
<223> Может присутствовать в повторах любого целого числа
<400> 199
Gly Ser Gly Gly Ser
1 5
<210> 200
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(5)
<223> Может присутствовать в повторах любого целого числа
<400> 200
Gly Gly Ser Gly Ser
1 5
<210> 201
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(5)
<223> Может присутствовать в повторах любого целого числа
<400> 201
Gly Gly Gly Gly Ser
1 5
<210> 202
<211> 2
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 202
Gly Gly
1
<210> 203
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 203
Gly Ser Gly
1
<210> 204
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 204
Gly Gly Ser Gly
1
<210> 205
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 205
Gly Gly Ser Gly Gly
1 5
<210> 206
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 206
Gly Ser Gly Gly Gly Gly Gly
1 5
<210> 207
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 207
Gly Ser Gly Ser Gly
1 5
<210> 208
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 208
Gly Ser Gly Gly Gly
1 5
<210> 209
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 209
Gly Gly Gly Ser Gly
1 5
<210> 210
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 210
Gly Ser Ser Ser Gly
1 5
<210> 211
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 211
Gly Gly Ser Gly Gly Ser
1 5
<210> 212
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 212
Ser Gly Gly Gly Gly Ser
1 5
<210> 213
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 213
Gly Gly Gly Gly Ser
1 5
<210> 214
<211> 2
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> ВАРИАНТ
<222> (1)..(2)
<223> Может присутствовать в повторах любого целого числа
<400> 214
Gly Ala
1
<210> 215
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 215
Gly Arg Ala Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5 10
<210> 216
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 216
Gly Arg Ala Gly Gly Gly
1 5
<210> 217
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 217
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 218
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 218
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 219
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 219
Gly Gly Gly Ser Gly Gly Ser Gly Gly Ser
1 5 10
<210> 220
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 220
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Gly
1 5 10 15
<210> 221
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 221
Gly Gly Ser Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 222
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 222
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1 5 10 15
Gly Ser
<210> 223
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 223
Gly Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Ala
<210> 224
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 224
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Gly Ser
20
<210> 225
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 225
Lys Thr Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10
<210> 226
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 226
Gly Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser
<210> 227
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 227
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Gly Ser
<210> 228
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 228
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly
20
<210> 229
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 229
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 230
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 230
Ala Ser Thr Lys Gly Pro
1 5
<210> 231
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 231
Asp Lys Pro
1
<210> 232
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 232
Asp Lys Pro Gly Ser
1 5
<210> 233
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 233
Pro Gly Ser
1
<210> 234
<211> 2
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 234
Gly Ser
1
<210> 235
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 235
Asp Lys Pro Gly Ser Gly
1 5
<210> 236
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 236
Pro Gly Ser Gly
1
<210> 237
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 237
Asp Lys Pro Gly Ser Gly Ser
1 5
<210> 238
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 238
Pro Gly Ser Gly Ser
1 5
<210> 239
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 239
Gly Ser Gly Ser
1
<210> 240
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 240
Asp Lys Pro Gly Ser Gly Gly Gly Gly Gly
1 5 10
<210> 241
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 241
Pro Gly Ser Gly Gly Gly Gly Gly
1 5
<210> 242
<211> 1
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 242
Pro
1
<210> 243
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 243
Asp Ser Trp Ile His
1 5
<210> 244
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 244
Trp Ile Ser Pro Tyr Gly Gly Ser Ser Tyr
1 5 10
<210> 245
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 245
Arg His Trp Pro Gly Gly Phe
1 5
<210> 246
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 246
Val Thr Thr Ala Val Ala
1 5
<210> 247
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 247
Ser Ala Ser Phe Pro Tyr
1 5
<210> 248
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 248
Gln Gln Tyr Met Tyr His Pro Ser Thr
1 5
<210> 249
<211> 290
<212> БЕЛОК
<213> Homo sapiens
<400> 249
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
195 200 205
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
260 265 270
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
275 280 285
Glu Thr
290
<210> 250
<211> 220
<212> БЕЛОК
<213> Homo sapiens
<400> 250
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 251
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 251
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 252
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 252
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 253
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 253
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 254
<211> 133
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 254
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile
115 120 125
Ile Arg Thr Leu Thr
130
<210> 255
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 255
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Ile Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 256
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 256
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 257
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 257
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Glu Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 258
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 258
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Arg Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 259
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 259
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Met Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 260
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 260
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ser Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 261
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 261
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
210 215 220
<210> 262
<211> 201
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 262
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 263
<211> 201
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 263
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 264
<211> 201
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 264
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 265
<211> 201
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 265
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 266
<211> 417
<212> БЕЛОК
<213> Homo sapiens
<400> 266
Met Ala Arg Ala Met Ala Ala Ala Trp Pro Leu Leu Leu Val Ala Leu
1 5 10 15
Leu Val Leu Ser Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln
20 25 30
Ala Pro Thr Gln Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro
35 40 45
Cys Tyr Leu Gln Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu
50 55 60
Thr Trp Ala Arg His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln
65 70 75 80
Thr Gln Gly Pro Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala
85 90 95
Ala Arg Leu Gly Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly
100 105 110
Leu Arg Val Glu Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe
115 120 125
Pro Gln Gly Ser Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys
130 135 140
Pro Gln Asn Thr Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro
145 150 155 160
Val Pro Met Ala Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln
165 170 175
Ile Thr Trp His Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val
180 185 190
Pro Gly Phe Leu Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu
195 200 205
Val Pro Ser Ser Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu
210 215 220
His Glu Ser Phe Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val
225 230 235 240
Tyr Tyr Pro Pro Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr
245 250 255
Leu Gly Gln Asn Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro
260 265 270
Glu Pro Thr Gly Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro
275 280 285
Phe Ala Val Ala Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys
290 295 300
Pro Ile Asn Thr Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala
305 310 315 320
Arg Gln Ala Glu Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu
325 330 335
His Ser Gly Ile Ser Arg Asn Ala Ile Ile Phe Leu Val Leu Gly Ile
340 345 350
Leu Val Phe Leu Ile Leu Leu Gly Ile Gly Ile Tyr Phe Tyr Trp Ser
355 360 365
Lys Cys Ser Arg Glu Val Leu Trp His Cys His Leu Cys Pro Ser Ser
370 375 380
Thr Glu His Ala Ser Ala Ser Ala Asn Gly His Val Ser Tyr Ser Ala
385 390 395 400
Val Ser Arg Glu Asn Ser Ser Ser Gln Asp Pro Gln Thr Glu Gly Thr
405 410 415
Arg
<210> 267
<211> 323
<212> БЕЛОК
<213> Homo sapiens
<400> 267
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn
<210> 268
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 268
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asn Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 269
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 269
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 270
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 270
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Arg Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 271
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 271
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Gly Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 272
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 272
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ala Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 273
<211> 973
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 273
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Met Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Pro Gly Ser Gly Ile Trp
210 215 220
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
225 230 235 240
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
245 250 255
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
260 265 270
Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr
275 280 285
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
290 295 300
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
305 310 315 320
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
325 330 335
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
340 345 350
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
355 360 365
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
370 375 380
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
385 390 395 400
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
405 410 415
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
420 425 430
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
435 440 445
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
450 455 460
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
465 470 475 480
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
485 490 495
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
500 505 510
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
515 520 525
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly
545 550 555 560
Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser
565 570 575
Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr
580 585 590
Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr
595 600 605
Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu
610 615 620
Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser
625 630 635 640
Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu
645 650 655
Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu
660 665 670
Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala
675 680 685
Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val
690 695 700
Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile
705 710 715 720
Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile
725 730 735
Asp Arg Val Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys
740 745 750
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
755 760 765
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
770 775 780
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
785 790 795 800
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
805 810 815
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
820 825 830
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
835 840 845
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
850 855 860
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
865 870 875 880
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
885 890 895
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
900 905 910
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
915 920 925
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
930 935 940
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
945 950 955 960
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
965 970
<210> 274
<211> 938
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 274
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Gly Ser Gly Ile Trp Glu Leu Lys
180 185 190
Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly
195 200 205
Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr
210 215 220
Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu
225 230 235 240
Thr Ile Gln Val Lys Glu Ala Gly Asp Ala Gly Gln Tyr Thr Cys His
245 250 255
Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys
260 265 270
Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro
275 280 285
Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg
290 295 300
Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser
305 310 315 320
Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly
325 330 335
Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr
340 345 350
Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu
355 360 365
Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys
370 375 380
Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro
385 390 395 400
Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln
405 410 415
Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser
420 425 430
Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg
435 440 445
Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile
450 455 460
Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr
465 470 475 480
Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly
485 490 495
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
500 505 510
Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro
515 520 525
Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu
530 535 540
Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu
545 550 555 560
Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala
565 570 575
Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg
580 585 590
Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr
595 600 605
Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys
610 615 620
Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp
625 630 635 640
Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp
645 650 655
Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys
660 665 670
Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys
675 680 685
Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val
690 695 700
Met Ser Tyr Leu Asn Ala Ser Asp Lys Thr His Thr Cys Pro Pro Cys
705 710 715 720
Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
725 730 735
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
740 745 750
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
755 760 765
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
770 775 780
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
785 790 795 800
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
805 810 815
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
820 825 830
Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu
835 840 845
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
850 855 860
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
865 870 875 880
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala
885 890 895
Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
900 905 910
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
915 920 925
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
930 935
<210> 275
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 275
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Ala Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
325 330 335
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
340 345 350
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
355 360 365
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
370 375 380
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
385 390 395 400
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
405 410 415
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
435 440 445
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
450 455 460
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
465 470 475 480
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
485 490 495
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
500 505 510
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
515 520
<210> 276
<211> 953
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 276
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Gly Ser Gly Asp Lys Thr His Thr
180 185 190
Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe
195 200 205
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
210 215 220
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
225 230 235 240
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
245 250 255
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
260 265 270
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
275 280 285
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
290 295 300
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro
305 310 315 320
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
325 330 335
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
340 345 350
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp
355 360 365
Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
370 375 380
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
385 390 395 400
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Gly
405 410 415
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ile Trp Glu
420 425 430
Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala
435 440 445
Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly
450 455 460
Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys
465 470 475 480
Thr Leu Thr Ile Gln Val Lys Glu Ala Gly Asp Ala Gly Gln Tyr Thr
485 490 495
Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His
500 505 510
Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys
515 520 525
Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser
530 535 540
Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr
545 550 555 560
Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr
565 570 575
Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys
580 585 590
Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala
595 600 605
Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys
610 615 620
Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile
625 630 635 640
Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser
645 650 655
Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro
660 665 670
His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser
675 680 685
Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr
690 695 700
Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg
705 710 715 720
Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly
725 730 735
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
740 745 750
Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met
755 760 765
Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn
770 775 780
Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser
785 790 795 800
Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val
805 810 815
Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn
820 825 830
Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg
835 840 845
Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp
850 855 860
Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu
865 870 875 880
Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val
885 890 895
Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro
900 905 910
Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys
915 920 925
Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp
930 935 940
Arg Val Met Ser Tyr Leu Asn Ala Ser
945 950
<210> 277
<211> 980
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 277
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu
225 230 235 240
Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys
245 250 255
Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser
260 265 270
Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala
275 280 285
Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser
290 295 300
His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr
305 310 315 320
Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg
325 330 335
Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr
340 345 350
Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser
355 360 365
Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu
370 375 380
Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln
385 390 395 400
Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val
405 410 415
Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser
420 425 430
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
435 440 445
Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr
450 455 460
Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys
465 470 475 480
Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe
485 490 495
Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile
500 505 510
Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp
515 520 525
Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met
545 550 555 560
Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn
565 570 575
Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser
580 585 590
Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val
595 600 605
Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn
610 615 620
Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg
625 630 635 640
Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp
645 650 655
Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu
660 665 670
Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val
675 680 685
Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro
690 695 700
Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys
705 710 715 720
Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp
725 730 735
Arg Val Met Ser Tyr Leu Asn Ala Ser Gly Gly Gly Gly Ser Gly Gly
740 745 750
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
755 760 765
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
770 775 780
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
785 790 795 800
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
805 810 815
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
820 825 830
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
835 840 845
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
850 855 860
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
865 870 875 880
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
885 890 895
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
900 905 910
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
915 920 925
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
930 935 940
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
945 950 955 960
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
965 970 975
Ser Pro Gly Lys
980
<210> 278
<211> 980
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 278
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu
225 230 235 240
Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys
245 250 255
Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser
260 265 270
Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala
275 280 285
Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser
290 295 300
His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr
305 310 315 320
Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg
325 330 335
Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr
340 345 350
Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser
355 360 365
Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu
370 375 380
Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln
385 390 395 400
Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val
405 410 415
Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser
420 425 430
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
435 440 445
Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr
450 455 460
Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys
465 470 475 480
Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe
485 490 495
Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile
500 505 510
Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp
515 520 525
Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly
530 535 540
Gly Gly Gly Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met
545 550 555 560
Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn
565 570 575
Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser
580 585 590
Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val
595 600 605
Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn
610 615 620
Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg
625 630 635 640
Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp
645 650 655
Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu
660 665 670
Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val
675 680 685
Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro
690 695 700
Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys
705 710 715 720
Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp
725 730 735
Arg Val Met Ser Tyr Leu Asn Ala Ser Gly Gly Gly Gly Ser Gly Gly
740 745 750
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
755 760 765
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
770 775 780
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
785 790 795 800
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
805 810 815
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
820 825 830
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
835 840 845
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
850 855 860
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
865 870 875 880
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
885 890 895
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
900 905 910
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
915 920 925
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
930 935 940
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
945 950 955 960
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
965 970 975
Ser Pro Gly Lys
980
<210> 279
<211> 980
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 279
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Ile
450 455 460
Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro
465 470 475 480
Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu
485 490 495
Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser
500 505 510
Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln
515 520 525
Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu
530 535 540
Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp
545 550 555 560
Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn
565 570 575
Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp
580 585 590
Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly
595 600 605
Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp
610 615 620
Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys
625 630 635 640
Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val
645 650 655
His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp
660 665 670
Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys
675 680 685
Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser
690 695 700
Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly
705 710 715 720
Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser
725 730 735
Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln
740 745 750
Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys
755 760 765
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg
770 775 780
Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His
785 790 795 800
His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala
805 810 815
Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His
820 825 830
Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro
835 840 845
Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser
850 855 860
Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met
865 870 875 880
Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln
885 890 895
Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg
900 905 910
Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met
915 920 925
Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu
930 935 940
Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu
945 950 955 960
His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr
965 970 975
Leu Asn Ala Ser
980
<210> 280
<211> 980
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 280
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Ile
450 455 460
Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro
465 470 475 480
Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu
485 490 495
Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser
500 505 510
Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln
515 520 525
Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu
530 535 540
Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp
545 550 555 560
Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn
565 570 575
Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp
580 585 590
Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly
595 600 605
Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp
610 615 620
Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys
625 630 635 640
Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val
645 650 655
His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp
660 665 670
Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys
675 680 685
Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser
690 695 700
Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly
705 710 715 720
Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser
725 730 735
Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln
740 745 750
Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys
755 760 765
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg
770 775 780
Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His
785 790 795 800
His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala
805 810 815
Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His
820 825 830
Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro
835 840 845
Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser
850 855 860
Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met
865 870 875 880
Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln
885 890 895
Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg
900 905 910
Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met
915 920 925
Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu
930 935 940
Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu
945 950 955 960
His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr
965 970 975
Leu Asn Ala Ser
980
<210> 281
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 281
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 282
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 282
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 283
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 283
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met
385 390 395 400
Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 284
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 284
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met
385 390 395 400
Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 285
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 285
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 286
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 286
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 287
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 287
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 288
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 288
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Arg Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 289
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 289
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 290
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 290
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 291
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 291
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 292
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 292
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Arg Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser
340 345 350
Ile Ile Arg Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 293
<211> 961
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 293
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp
210 215 220
Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro
225 230 235 240
Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu
245 250 255
Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala
260 265 270
Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu
275 280 285
Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu
290 295 300
Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala
305 310 315 320
Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser
325 330 335
Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro
340 345 350
Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg
355 360 365
Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser
370 375 380
Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp
385 390 395 400
Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile
405 410 415
Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro
420 425 430
Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr
435 440 445
Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val
450 455 460
Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys
465 470 475 480
Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg
485 490 495
Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val
500 505 510
Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
515 520 525
Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys
530 535 540
Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln
545 550 555 560
Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile
565 570 575
Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys
580 585 590
Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu
595 600 605
Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser
610 615 620
Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met
625 630 635 640
Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro
645 650 655
Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu
660 665 670
Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser
675 680 685
Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile
690 695 700
Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met
705 710 715 720
Ser Tyr Leu Asn Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
725 730 735
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
740 745 750
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
755 760 765
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
770 775 780
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
785 790 795 800
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
805 810 815
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
820 825 830
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
835 840 845
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
850 855 860
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
865 870 875 880
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
885 890 895
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
900 905 910
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
915 920 925
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
930 935 940
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
945 950 955 960
Lys
<210> 294
<211> 961
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 294
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp
210 215 220
Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro
225 230 235 240
Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu
245 250 255
Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala
260 265 270
Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu
275 280 285
Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu
290 295 300
Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala
305 310 315 320
Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser
325 330 335
Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro
340 345 350
Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg
355 360 365
Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser
370 375 380
Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp
385 390 395 400
Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile
405 410 415
Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro
420 425 430
Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr
435 440 445
Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val
450 455 460
Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys
465 470 475 480
Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg
485 490 495
Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val
500 505 510
Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
515 520 525
Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys
530 535 540
Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln
545 550 555 560
Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile
565 570 575
Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys
580 585 590
Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu
595 600 605
Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser
610 615 620
Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met
625 630 635 640
Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro
645 650 655
Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu
660 665 670
Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser
675 680 685
Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile
690 695 700
Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met
705 710 715 720
Ser Tyr Leu Asn Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
725 730 735
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro
740 745 750
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
755 760 765
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
770 775 780
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
785 790 795 800
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
805 810 815
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
820 825 830
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
835 840 845
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
850 855 860
Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
865 870 875 880
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
885 890 895
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
900 905 910
Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys
915 920 925
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
930 935 940
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
945 950 955 960
Lys
<210> 295
<211> 961
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 295
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
370 375 380
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Ile Trp Glu Leu
435 440 445
Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro
450 455 460
Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile
465 470 475 480
Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr
485 490 495
Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys
500 505 510
His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys
515 520 525
Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu
530 535 540
Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly
545 550 555 560
Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe
565 570 575
Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys
580 585 590
Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu
595 600 605
Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala
610 615 620
Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu
625 630 635 640
Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys
645 650 655
Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg
660 665 670
Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His
675 680 685
Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys
690 695 700
Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val
705 710 715 720
Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr
725 730 735
Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly
740 745 750
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Asn Leu Pro
755 760 765
Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln
770 775 780
Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr
785 790 795 800
Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile
805 810 815
Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu
820 825 830
Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr
835 840 845
Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu
850 855 860
Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe
865 870 875 880
Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe
885 890 895
Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu
900 905 910
Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro
915 920 925
Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe
930 935 940
Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala
945 950 955 960
Ser
<210> 296
<211> 961
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 296
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
370 375 380
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Ile Trp Glu Leu
435 440 445
Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro
450 455 460
Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile
465 470 475 480
Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr
485 490 495
Leu Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys
500 505 510
His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys
515 520 525
Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu
530 535 540
Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly
545 550 555 560
Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe
565 570 575
Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys
580 585 590
Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu
595 600 605
Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala
610 615 620
Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu
625 630 635 640
Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys
645 650 655
Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg
660 665 670
Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His
675 680 685
Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys
690 695 700
Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val
705 710 715 720
Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr
725 730 735
Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly
740 745 750
Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Asn Leu Pro
755 760 765
Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln
770 775 780
Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr
785 790 795 800
Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile
805 810 815
Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu
820 825 830
Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr
835 840 845
Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu
850 855 860
Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe
865 870 875 880
Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe
885 890 895
Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu
900 905 910
Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro
915 920 925
Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe
930 935 940
Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala
945 950 955 960
Ser
<210> 297
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 297
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
370 375 380
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys
435
<210> 298
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 298
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
370 375 380
Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys
435
<210> 299
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 299
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro
370 375 380
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys
435
<210> 300
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 300
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys
210 215 220
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
225 230 235 240
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
245 250 255
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
260 265 270
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
275 280 285
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
290 295 300
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
305 310 315 320
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
325 330 335
Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
340 345 350
Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
355 360 365
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro
370 375 380
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
385 390 395 400
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
405 410 415
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
420 425 430
Ser Pro Gly Lys
435
<210> 301
<211> 574
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 301
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg
210 215 220
Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser
325 330 335
Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
340 345 350
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
355 360 365
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
370 375 380
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
385 390 395 400
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
405 410 415
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
420 425 430
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
435 440 445
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
450 455 460
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
465 470 475 480
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
485 490 495
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
500 505 510
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
515 520 525
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
530 535 540
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
545 550 555 560
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 302
<211> 573
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 302
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Leu
145 150 155 160
Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp Asn
165 170 175
Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser Gln
180 185 190
Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro Thr
195 200 205
Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu
210 215 220
Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys
225 230 235 240
Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr
245 250 255
Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu
260 265 270
Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg
275 280 285
Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser
290 295 300
Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val
305 310 315 320
Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser Thr
325 330 335
Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser
465 470 475 480
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 303
<211> 573
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 303
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Leu
145 150 155 160
Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp Asn
165 170 175
Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser Gln
180 185 190
Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro Thr
195 200 205
Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg Leu
210 215 220
Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys
225 230 235 240
Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr
245 250 255
Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu
260 265 270
Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg
275 280 285
Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser
290 295 300
Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val
305 310 315 320
Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser Thr
325 330 335
Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser
465 470 475 480
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 304
<211> 573
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 304
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Leu
145 150 155 160
Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp Asn
165 170 175
Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser Gln
180 185 190
Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro Thr
195 200 205
Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg Leu
210 215 220
Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys
225 230 235 240
Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr
245 250 255
Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu
260 265 270
Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg
275 280 285
Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser
290 295 300
Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val
305 310 315 320
Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Arg Thr
325 330 335
Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser
465 470 475 480
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 305
<211> 574
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 305
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg
210 215 220
Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser
325 330 335
Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
340 345 350
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
355 360 365
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
370 375 380
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
385 390 395 400
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
405 410 415
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
420 425 430
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
435 440 445
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
450 455 460
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
465 470 475 480
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
485 490 495
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
500 505 510
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
515 520 525
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
530 535 540
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
545 550 555 560
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 306
<211> 574
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 306
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu
210 215 220
Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser
325 330 335
Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
340 345 350
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
355 360 365
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
370 375 380
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
385 390 395 400
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
405 410 415
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
420 425 430
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
435 440 445
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
450 455 460
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
465 470 475 480
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
485 490 495
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
500 505 510
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
515 520 525
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
530 535 540
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
545 550 555 560
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 307
<211> 574
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 307
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg
210 215 220
Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser
325 330 335
Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
340 345 350
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
355 360 365
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
370 375 380
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
385 390 395 400
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
405 410 415
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
420 425 430
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
435 440 445
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
450 455 460
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
465 470 475 480
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
485 490 495
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
500 505 510
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
515 520 525
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
530 535 540
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
545 550 555 560
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 308
<211> 574
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 308
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Ala Pro
195 200 205
Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Arg
210 215 220
Leu Asp Leu Glu Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro
225 230 235 240
Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala
245 250 255
Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu
260 265 270
Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro
275 280 285
Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly
290 295 300
Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile
305 310 315 320
Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Thr Ser Ile Ile Arg
325 330 335
Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
340 345 350
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
355 360 365
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
370 375 380
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
385 390 395 400
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
405 410 415
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
420 425 430
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
435 440 445
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
450 455 460
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
465 470 475 480
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
485 490 495
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
500 505 510
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
515 520 525
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
530 535 540
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
545 550 555 560
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 309
<211> 1083
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 309
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Gly Ser Gly Gly Gly Ile Trp Glu Leu Lys
325 330 335
Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly
340 345 350
Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr
355 360 365
Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu
370 375 380
Thr Ile Gln Val Lys Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys His
385 390 395 400
Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys
405 410 415
Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro
420 425 430
Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg
435 440 445
Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser
450 455 460
Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly
465 470 475 480
Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr
485 490 495
Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu
500 505 510
Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys
515 520 525
Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro
530 535 540
Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln
545 550 555 560
Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser
565 570 575
Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg
580 585 590
Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile
595 600 605
Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr
610 615 620
Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Asn Leu Pro Val
645 650 655
Ala Thr Pro Asp Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn
660 665 670
Leu Leu Arg Ala Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu
675 680 685
Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr
690 695 700
Lys Asp Lys Thr Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr
705 710 715 720
Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn
725 730 735
Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys
740 745 750
Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys
755 760 765
Thr Met Asn Ala Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu
770 775 780
Asp Gln Asn Met Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn
785 790 795 800
Phe Asn Ser Glu Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp
805 810 815
Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg
820 825 830
Ile Arg Ala Val Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
835 840 845
Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
850 855 860
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
865 870 875 880
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
885 890 895
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
900 905 910
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
915 920 925
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
930 935 940
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
945 950 955 960
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
965 970 975
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
980 985 990
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
995 1000 1005
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
1010 1015 1020
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
1025 1030 1035 1040
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
1045 1050 1055
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
1060 1065 1070
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
1075 1080
<210> 310
<211> 1083
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 310
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
325 330 335
Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe
340 345 350
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
355 360 365
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
370 375 380
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
385 390 395 400
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
405 410 415
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
420 425 430
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
435 440 445
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro
450 455 460
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
465 470 475 480
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
485 490 495
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp
500 505 510
Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
515 520 525
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
530 535 540
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Gly
545 550 555 560
Gly Gly Ser Gly Gly Gly Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
565 570 575
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
580 585 590
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
595 600 605
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
610 615 620
Ala Ala Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
625 630 635 640
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
645 650 655
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
660 665 670
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
675 680 685
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
690 695 700
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
705 710 715 720
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
725 730 735
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
740 745 750
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
755 760 765
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
770 775 780
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
785 790 795 800
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
805 810 815
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
820 825 830
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
835 840 845
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
850 855 860
Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly
865 870 875 880
Ser Gly Gly Gly Gly Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro
885 890 895
Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val
900 905 910
Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys
915 920 925
Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser
930 935 940
Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys
945 950 955 960
Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala
965 970 975
Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr
980 985 990
Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys
995 1000 1005
Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu
1010 1015 1020
Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr
1025 1030 1035 1040
Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys
1045 1050 1055
Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr
1060 1065 1070
Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
1075 1080
<210> 311
<211> 557
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 311
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
325 330 335
Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe
340 345 350
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
355 360 365
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
370 375 380
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
385 390 395 400
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
405 410 415
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
420 425 430
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
435 440 445
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro
450 455 460
Ser Arg Glu Glu Met Thr Lys Asn Gln Ser Leu Thr Cys Leu Val Lys
465 470 475 480
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
485 490 495
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
500 505 510
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
515 520 525
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
530 535 540
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
545 550 555
<210> 312
<211> 558
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 312
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr
325 330 335
Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe
340 345 350
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
355 360 365
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
370 375 380
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
385 390 395 400
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
405 410 415
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
420 425 430
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
435 440 445
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
450 455 460
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
465 470 475 480
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
485 490 495
Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp
500 505 510
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
515 520 525
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
530 535 540
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
545 550 555
<210> 313
<211> 696
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 313
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Ser Gly Ala Pro Thr Ser Ser Ser Thr Lys
325 330 335
Lys Thr Gln Leu Gln Leu Glu His Leu Arg Leu Asp Leu Glu Met Ile
340 345 350
Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu
355 360 365
Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu
370 375 380
Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu
385 390 395 400
Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn
405 410 415
Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met
420 425 430
Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg
435 440 445
Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr Gly Gly Gly
450 455 460
Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
465 470 475 480
Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
485 490 495
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
500 505 510
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
515 520 525
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
530 535 540
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
545 550 555 560
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
565 570 575
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
580 585 590
Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr
595 600 605
Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser
610 615 620
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr
625 630 635 640
Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
645 650 655
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
660 665 670
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
675 680 685
Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 314
<211> 696
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 314
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Ser Gly Ala Pro Thr Ser Ser Ser Thr Lys
325 330 335
Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile
340 345 350
Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu
355 360 365
Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu
370 375 380
Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu
385 390 395 400
Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn
405 410 415
Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met
420 425 430
Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg
435 440 445
Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser Thr Leu Thr Gly Gly Gly
450 455 460
Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
465 470 475 480
Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
485 490 495
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
500 505 510
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
515 520 525
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
530 535 540
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
545 550 555 560
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
565 570 575
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
580 585 590
Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr
595 600 605
Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser
610 615 620
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr
625 630 635 640
Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
645 650 655
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
660 665 670
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
675 680 685
Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 315
<211> 696
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 315
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Ser Gly Ala Pro Thr Ser Ser Ser Thr Lys
325 330 335
Lys Thr Gln Leu Gln Leu Glu His Leu Arg Leu Asp Leu Glu Met Ile
340 345 350
Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu
355 360 365
Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu
370 375 380
Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu
385 390 395 400
Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn
405 410 415
Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met
420 425 430
Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg
435 440 445
Trp Ile Thr Phe Cys Thr Ser Ile Ile Ser Thr Leu Thr Gly Gly Gly
450 455 460
Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
465 470 475 480
Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
485 490 495
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
500 505 510
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
515 520 525
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
530 535 540
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
545 550 555 560
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
565 570 575
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
580 585 590
Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr
595 600 605
Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser
610 615 620
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr
625 630 635 640
Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
645 650 655
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
660 665 670
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
675 680 685
Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 316
<211> 696
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 316
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Ser Gly Ala Pro Thr Ser Ser Ser Thr Lys
325 330 335
Lys Thr Gln Leu Gln Leu Glu His Leu Arg Leu Asp Leu Glu Met Ile
340 345 350
Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Asp Met Leu
355 360 365
Thr Phe Glu Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu
370 375 380
Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu
385 390 395 400
Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn
405 410 415
Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met
420 425 430
Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg
435 440 445
Trp Ile Thr Phe Cys Thr Ser Ile Ile Arg Thr Leu Thr Gly Gly Gly
450 455 460
Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
465 470 475 480
Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
485 490 495
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
500 505 510
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
515 520 525
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
530 535 540
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
545 550 555 560
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
565 570 575
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
580 585 590
Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr
595 600 605
Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser
610 615 620
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr
625 630 635 640
Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
645 650 655
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
660 665 670
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
675 680 685
Ser Leu Ser Leu Ser Pro Gly Lys
690 695
<210> 317
<211> 758
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 317
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys
225 230 235 240
Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu
245 250 255
Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile
260 265 270
Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe
275 280 285
Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp
290 295 300
Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe
305 310 315 320
Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys
325 330 335
Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala
340 345 350
Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly
355 360 365
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
370 375 380
Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
385 390 395 400
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
405 410 415
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
420 425 430
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
435 440 445
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
450 455 460
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
465 470 475 480
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
485 490 495
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
500 505 510
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser
515 520 525
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
530 535 540
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
545 550 555 560
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
565 570 575
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
580 585 590
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
595 600 605
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
610 615 620
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
625 630 635 640
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
645 650 655
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
660 665 670
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
675 680 685
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
690 695 700
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
705 710 715 720
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
725 730 735
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
740 745 750
Ser Leu Ser Pro Gly Lys
755
<210> 318
<211> 758
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 318
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys
225 230 235 240
Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu
245 250 255
Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile
260 265 270
Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe
275 280 285
Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp
290 295 300
Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe
305 310 315 320
Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys
325 330 335
Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala
340 345 350
Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly
355 360 365
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
370 375 380
Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
385 390 395 400
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
405 410 415
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
420 425 430
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
435 440 445
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
450 455 460
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
465 470 475 480
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
485 490 495
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
500 505 510
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser
515 520 525
Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
530 535 540
Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
545 550 555 560
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
565 570 575
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
580 585 590
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
595 600 605
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
610 615 620
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
625 630 635 640
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
645 650 655
Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
660 665 670
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
675 680 685
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
690 695 700
Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys
705 710 715 720
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
725 730 735
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
740 745 750
Ser Leu Ser Pro Gly Lys
755
<210> 319
<211> 755
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 319
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
225 230 235 240
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
245 250 255
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
260 265 270
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
275 280 285
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
290 295 300
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
305 310 315 320
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
325 330 335
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
340 345 350
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly
355 360 365
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
370 375 380
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
385 390 395 400
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
405 410 415
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
420 425 430
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
435 440 445
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
450 455 460
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
465 470 475 480
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
485 490 495
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
500 505 510
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly
515 520 525
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly
530 535 540
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
545 550 555 560
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
565 570 575
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
580 585 590
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
595 600 605
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
610 615 620
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
625 630 635 640
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
645 650 655
Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
660 665 670
Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
675 680 685
Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro
690 695 700
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
705 710 715 720
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
725 730 735
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
740 745 750
Pro Gly Lys
755
<210> 320
<211> 755
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 320
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
225 230 235 240
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
245 250 255
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
260 265 270
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
275 280 285
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
290 295 300
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
305 310 315 320
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
325 330 335
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
340 345 350
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly
355 360 365
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
370 375 380
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
385 390 395 400
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
405 410 415
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
420 425 430
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
435 440 445
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
450 455 460
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
465 470 475 480
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
485 490 495
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
500 505 510
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly
515 520 525
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly
530 535 540
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
545 550 555 560
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
565 570 575
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
580 585 590
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
595 600 605
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
610 615 620
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
625 630 635 640
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
645 650 655
Tyr Val Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
660 665 670
Leu Leu Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
675 680 685
Trp Glu Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro
690 695 700
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
705 710 715 720
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
725 730 735
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
740 745 750
Pro Gly Lys
755
<210> 321
<211> 739
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 321
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
210 215 220
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
225 230 235 240
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
245 250 255
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
260 265 270
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
275 280 285
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
290 295 300
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
305 310 315 320
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
325 330 335
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly
340 345 350
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
355 360 365
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
370 375 380
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
385 390 395 400
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
405 410 415
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
420 425 430
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
435 440 445
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
450 455 460
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
465 470 475 480
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
485 490 495
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly
500 505 510
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
515 520 525
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
530 535 540
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
545 550 555 560
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
565 570 575
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
580 585 590
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
595 600 605
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
610 615 620
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
625 630 635 640
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
645 650 655
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
660 665 670
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
675 680 685
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
690 695 700
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
705 710 715 720
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
725 730 735
Pro Gly Lys
<210> 322
<211> 739
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 322
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Gly Ser Gly Gly
195 200 205
Gly Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe
210 215 220
Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly
225 230 235 240
Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser
245 250 255
Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp
260 265 270
Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val
275 280 285
Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu
290 295 300
Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His
305 310 315 320
Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly
325 330 335
Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly
340 345 350
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp
355 360 365
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
370 375 380
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
385 390 395 400
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
405 410 415
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
420 425 430
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
435 440 445
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
450 455 460
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
465 470 475 480
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
485 490 495
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly
500 505 510
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly
515 520 525
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
530 535 540
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
545 550 555 560
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
565 570 575
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
580 585 590
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
595 600 605
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
610 615 620
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
625 630 635 640
Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
645 650 655
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
660 665 670
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
675 680 685
Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val
690 695 700
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
705 710 715 720
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
725 730 735
Pro Gly Lys
<210> 323
<211> 736
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 323
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Val Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Gln Asp
195 200 205
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
210 215 220
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
225 230 235 240
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
245 250 255
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
260 265 270
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
275 280 285
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
290 295 300
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
305 310 315 320
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
325 330 335
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly
340 345 350
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Pro Tyr Val
355 360 365
Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp
370 375 380
Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys
385 390 395 400
Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr
405 410 415
Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser
420 425 430
Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn
435 440 445
Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr
450 455 460
Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met
465 470 475 480
Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln
485 490 495
Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr
500 505 510
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser
515 520 525
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
530 535 540
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
545 550 555 560
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
565 570 575
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
580 585 590
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
595 600 605
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
610 615 620
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu
625 630 635 640
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys
645 650 655
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
660 665 670
Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp
675 680 685
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
690 695 700
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
705 710 715 720
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
725 730 735
<210> 324
<211> 736
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 324
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Val Ala Val Leu Leu Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Gly Gly Gly Ser Gly Gln Asp
195 200 205
Pro Tyr Val Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly
210 215 220
His Ser Asp Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys
225 230 235 240
Asn Trp Lys Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val
245 250 255
Ser Phe Tyr Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile
260 265 270
Gln Lys Ser Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe
275 280 285
Asn Ser Asn Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr
290 295 300
Ser Val Thr Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile
305 310 315 320
Gln Val Met Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys
325 330 335
Arg Ser Gln Met Leu Phe Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly
340 345 350
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Pro Tyr Val
355 360 365
Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp
370 375 380
Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys
385 390 395 400
Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr
405 410 415
Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser
420 425 430
Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn
435 440 445
Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr
450 455 460
Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met
465 470 475 480
Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln
485 490 495
Met Leu Phe Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr
500 505 510
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser
515 520 525
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
530 535 540
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
545 550 555 560
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
565 570 575
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
580 585 590
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
595 600 605
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
610 615 620
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu
625 630 635 640
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys
645 650 655
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
660 665 670
Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu Asp
675 680 685
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
690 695 700
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
705 710 715 720
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
725 730 735
<210> 325
<211> 861
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 325
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Gly Ser Gly Gly Gly Gln Asp Pro Tyr Val
325 330 335
Lys Glu Ala Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp
340 345 350
Val Val Asp Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys
355 360 365
Glu Glu Ser Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr
370 375 380
Phe Lys Leu Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser
385 390 395 400
Val Glu Thr Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn
405 410 415
Lys Lys Lys Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr
420 425 430
Asp Leu Asn Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met
435 440 445
Ala Glu Leu Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln
450 455 460
Met Leu Phe Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
465 470 475 480
Gly Gly Ser Gly Gly Gly Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala
485 490 495
Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp
500 505 510
Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser
515 520 525
Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu
530 535 540
Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr
545 550 555 560
Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys
565 570 575
Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn
580 585 590
Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu
595 600 605
Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe
610 615 620
Arg Gly Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys
625 630 635 640
Pro Pro Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu
645 650 655
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
660 665 670
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
675 680 685
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
690 695 700
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
705 710 715 720
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
725 730 735
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
740 745 750
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser
755 760 765
Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
770 775 780
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
785 790 795 800
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly
805 810 815
Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
820 825 830
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
835 840 845
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
850 855 860
<210> 326
<211> 858
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 326
Trp Pro Pro Pro Gly Thr Gly Asp Val Val Val Gln Ala Pro Thr Gln
1 5 10 15
Val Pro Gly Phe Leu Gly Asp Ser Val Thr Leu Pro Cys Tyr Leu Gln
20 25 30
Val Pro Asn Met Glu Val Thr His Val Ser Gln Leu Thr Trp Ala Arg
35 40 45
His Gly Glu Ser Gly Ser Met Ala Val Phe His Gln Thr Gln Gly Pro
50 55 60
Ser Tyr Ser Glu Ser Lys Arg Leu Glu Phe Val Ala Ala Arg Leu Gly
65 70 75 80
Ala Glu Leu Arg Asn Ala Ser Leu Arg Met Phe Gly Leu Arg Val Glu
85 90 95
Asp Glu Gly Asn Tyr Thr Cys Leu Phe Val Thr Phe Pro Gln Gly Ser
100 105 110
Arg Ser Val Asp Ile Trp Leu Arg Val Leu Ala Lys Pro Gln Asn Thr
115 120 125
Ala Glu Val Gln Lys Val Gln Leu Thr Gly Glu Pro Val Pro Met Ala
130 135 140
Arg Cys Val Ser Thr Gly Gly Arg Pro Pro Ala Gln Ile Thr Trp His
145 150 155 160
Ser Asp Leu Gly Gly Met Pro Asn Thr Ser Gln Val Pro Gly Phe Leu
165 170 175
Ser Gly Thr Val Thr Val Thr Ser Leu Trp Ile Leu Val Pro Ser Ser
180 185 190
Gln Val Asp Gly Lys Asn Val Thr Cys Lys Val Glu His Glu Ser Phe
195 200 205
Glu Lys Pro Gln Leu Leu Thr Val Asn Leu Thr Val Tyr Tyr Pro Pro
210 215 220
Glu Val Ser Ile Ser Gly Tyr Asp Asn Asn Trp Tyr Leu Gly Gln Asn
225 230 235 240
Glu Ala Thr Leu Thr Cys Asp Ala Arg Ser Asn Pro Glu Pro Thr Gly
245 250 255
Tyr Asn Trp Ser Thr Thr Met Gly Pro Leu Pro Pro Phe Ala Val Ala
260 265 270
Gln Gly Ala Gln Leu Leu Ile Arg Pro Val Asp Lys Pro Ile Asn Thr
275 280 285
Thr Leu Ile Cys Asn Val Thr Asn Ala Leu Gly Ala Arg Gln Ala Glu
290 295 300
Leu Thr Val Gln Val Lys Glu Gly Pro Pro Ser Glu His Ser Gly Ile
305 310 315 320
Ser Arg Asn Gly Gly Gly Ser Gly Gln Asp Pro Tyr Val Lys Glu Ala
325 330 335
Glu Asn Leu Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp
340 345 350
Asn Gly Thr Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser
355 360 365
Asp Arg Lys Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu
370 375 380
Phe Lys Asn Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr
385 390 395 400
Ile Lys Glu Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys
405 410 415
Arg Asp Asp Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn
420 425 430
Val Gln Arg Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu
435 440 445
Ser Pro Ala Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe
450 455 460
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
465 470 475 480
Gly Gly Gly Gly Ser Gln Asp Pro Tyr Val Lys Glu Ala Glu Asn Leu
485 490 495
Lys Lys Tyr Phe Asn Ala Gly His Ser Asp Val Val Asp Asn Gly Thr
500 505 510
Leu Phe Leu Gly Ile Leu Lys Asn Trp Lys Glu Glu Ser Asp Arg Lys
515 520 525
Ile Met Gln Ser Gln Ile Val Ser Phe Tyr Phe Lys Leu Phe Lys Asn
530 535 540
Phe Lys Asp Asp Gln Ser Ile Gln Lys Ser Val Glu Thr Ile Lys Glu
545 550 555 560
Asp Met Asn Val Lys Phe Phe Asn Ser Asn Lys Lys Lys Arg Asp Asp
565 570 575
Phe Glu Lys Leu Thr Asn Tyr Ser Val Thr Asp Leu Asn Val Gln Arg
580 585 590
Lys Ala Ile His Glu Leu Ile Gln Val Met Ala Glu Leu Ser Pro Ala
595 600 605
Ala Lys Thr Gly Lys Arg Lys Arg Ser Gln Met Leu Phe Arg Gly Gly
610 615 620
Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys
625 630 635 640
Pro Ala Pro Glu Lys Lys Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
645 650 655
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
660 665 670
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
675 680 685
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
690 695 700
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
705 710 715 720
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
725 730 735
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
740 745 750
Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro Ser Arg Glu Glu
755 760 765
Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val Lys Gly Phe Tyr
770 775 780
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
785 790 795 800
Arg Tyr Met Thr Trp Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
805 810 815
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
820 825 830
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
835 840 845
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
850 855
<210> 327
<211> 593
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 327
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Ser
210 215 220
Gly Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu
225 230 235 240
His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr
245 250 255
Lys Asn Pro Lys Leu Thr Asp Met Leu Thr Phe Glu Phe Tyr Met Pro
260 265 270
Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu
275 280 285
Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His
290 295 300
Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu
305 310 315 320
Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr
325 330 335
Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser
340 345 350
Ile Ile Ser Thr Leu Thr Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys
355 360 365
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Lys Lys Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
405 410 415
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val
485 490 495
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Arg Tyr Met Thr Trp Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 328
<211> 987
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 328
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Met Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu
225 230 235 240
Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys
245 250 255
Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His
260 265 270
Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys Ala Ala
275 280 285
Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser
290 295 300
His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr
305 310 315 320
Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala
325 330 335
Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn
340 345 350
Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser
355 360 365
Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr
370 375 380
Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp
385 390 395 400
Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu
405 410 415
Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe
420 425 430
Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys
435 440 445
Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser
450 455 460
Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile
465 470 475 480
Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln
485 490 495
Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys
500 505 510
Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser
515 520 525
Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser Gly Gly Pro
530 535 540
Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg
545 550 555 560
Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn
565 570 575
Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu
580 585 590
Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr
595 600 605
Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His
610 615 620
Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg
625 630 635 640
Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys
645 650 655
Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln
660 665 670
Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile Leu
675 680 685
Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn
690 695 700
His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp
705 710 715 720
Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser
725 730 735
Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
740 745 750
Gly Gly Gly Gly Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro
755 760 765
Cys Pro Ala Pro Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro
770 775 780
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
785 790 795 800
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
805 810 815
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
820 825 830
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
835 840 845
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
850 855 860
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
865 870 875 880
Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu
885 890 895
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
900 905 910
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
915 920 925
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe
930 935 940
Ala Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
945 950 955 960
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
965 970 975
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
980 985
<210> 329
<211> 987
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 329
Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr Gly Ser
1 5 10 15
Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu Asp Leu
20 25 30
Ala Ala Leu Gln Val Tyr Trp Met Met Glu Asp Lys Asn Ile Ile Gln
35 40 45
Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser Tyr Arg
50 55 60
Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn Ala Ala
65 70 75 80
Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr Thr Cys
85 90 95
Leu Ile Ala Tyr Lys Gly Ala Asp Tyr Lys Arg Ile Thr Val Lys Val
100 105 110
Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val Asp Pro
115 120 125
Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr Pro Lys
130 135 140
Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser Gly Lys
145 150 155 160
Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn Val Thr
165 170 175
Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr Cys Thr
180 185 190
Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu Val Ile
195 200 205
Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Asp Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Glu Asp Gly Ser Phe Ala Leu Val Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Met
450 455 460
Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu Val Asp Trp Thr Pro
465 470 475 480
Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys Asp Thr Pro Glu Glu
485 490 495
Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His Gly Val Ile Gly Ser
500 505 510
Gly Lys Thr Leu Thr Ile Thr Val Lys Ala Ala Leu Asp Ala Gly Gln
515 520 525
Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser His Ser His Leu Leu
530 535 540
Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr Glu Ile Leu Lys Asn
545 550 555 560
Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala Pro Asn Tyr Ser Gly
565 570 575
Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn Met Asp Leu Lys Phe
580 585 590
Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser Arg Ala Val Thr Cys
595 600 605
Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr Leu Asp Gln Arg Asp
610 615 620
Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp Val Thr Cys Pro Thr
625 630 635 640
Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu Glu Ala Arg Gln Gln
645 650 655
Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe Ile Arg Asp Ile Ile
660 665 670
Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys Pro Leu Lys Asn Ser
675 680 685
Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser Trp Ser Thr Pro His
690 695 700
Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile Gln Arg Lys Lys Glu
705 710 715 720
Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln Lys Gly Ala Phe Leu
725 730 735
Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys Gly Gly Asn Val Cys
740 745 750
Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser Cys Ser Lys Trp Ala
755 760 765
Cys Val Pro Cys Arg Val Arg Ser Gly Gly Pro Gly Gly Gly Gly Ser
770 775 780
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Val Ile Pro Val Ser
785 790 795 800
Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr
805 810 815
Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys
820 825 830
Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser
835 840 845
Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys
850 855 860
Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro
865 870 875 880
Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr
885 890 895
Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala
900 905 910
Leu Gln Asn His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu
915 920 925
Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr
930 935 940
Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys
945 950 955 960
Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr
965 970 975
Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
980 985
<210> 330
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 330
Met Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu Val Asp Trp Thr
1 5 10 15
Pro Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His Gly Val Ile Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Thr Val Lys Ala Ala Leu Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser His Ser His Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr Glu Ile Leu Lys
85 90 95
Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala Pro Asn Tyr Ser
100 105 110
Gly Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn Met Asp Leu Lys
115 120 125
Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser Arg Ala Val Thr
130 135 140
Cys Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr Leu Asp Gln Arg
145 150 155 160
Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp Val Thr Cys Pro
165 170 175
Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu Glu Ala Arg Gln
180 185 190
Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe Ile Arg Asp Ile
195 200 205
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys Pro Leu Lys Asn
210 215 220
Ser Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser Trp Ser Thr Pro
225 230 235 240
His Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile Gln Arg Lys Lys
245 250 255
Glu Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln Lys Gly Ala Phe
260 265 270
Leu Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys Gly Gly Asn Val
275 280 285
Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser Cys Ser Lys Trp
290 295 300
Ala Cys Val Pro Cys Arg Val Arg Ser Gly Gly Pro Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg Val Ile Pro Val
325 330 335
Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr
340 345 350
Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser
355 360 365
Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr
370 375 380
Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser
385 390 395 400
Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu
405 410 415
Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala
435 440 445
Ala Leu Gln Asn His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met
450 455 460
Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu
465 470 475 480
Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val
485 490 495
Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val
500 505 510
Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
515 520
<210> 331
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 331
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Ala Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
325 330 335
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
340 345 350
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
355 360 365
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
370 375 380
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
385 390 395 400
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
405 410 415
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
435 440 445
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
450 455 460
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
465 470 475 480
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
485 490 495
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
500 505 510
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
515 520
<210> 332
<211> 524
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 332
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Ala
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Gly Gly Gly Gly Ser Gly Arg Asn Leu Pro Val Ala Thr Pro Asp
325 330 335
Pro Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala
340 345 350
Val Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro
355 360 365
Cys Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr
370 375 380
Ser Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser
385 390 395 400
Cys Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu
405 410 415
Ala Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile
420 425 430
Tyr Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala
435 440 445
Lys Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met
450 455 460
Leu Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu
465 470 475 480
Thr Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr
485 490 495
Lys Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val
500 505 510
Thr Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
515 520
<210> 333
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 333
Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10
<210> 334
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 334
Gly Gly Gly Gly Ser Gly Gly Gly
1 5
<210> 335
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 335
Gly Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| ИММУНОЦИТОКИН, ВКЛЮЧАЮЩИЙ ГЕТЕРОДИМЕРНЫЙ БЕЛКОВЫЙ КОМПЛЕКС НА ОСНОВЕ IL-15/IL-15Rα, И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2753282C2 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| PD-L1 специфические антитела | 2017 |
|
RU2756236C2 |
| КОМПОЗИЦИИ IL-12, НАЦЕЛЕННЫЕ НА EDB | 2019 |
|
RU2758143C1 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
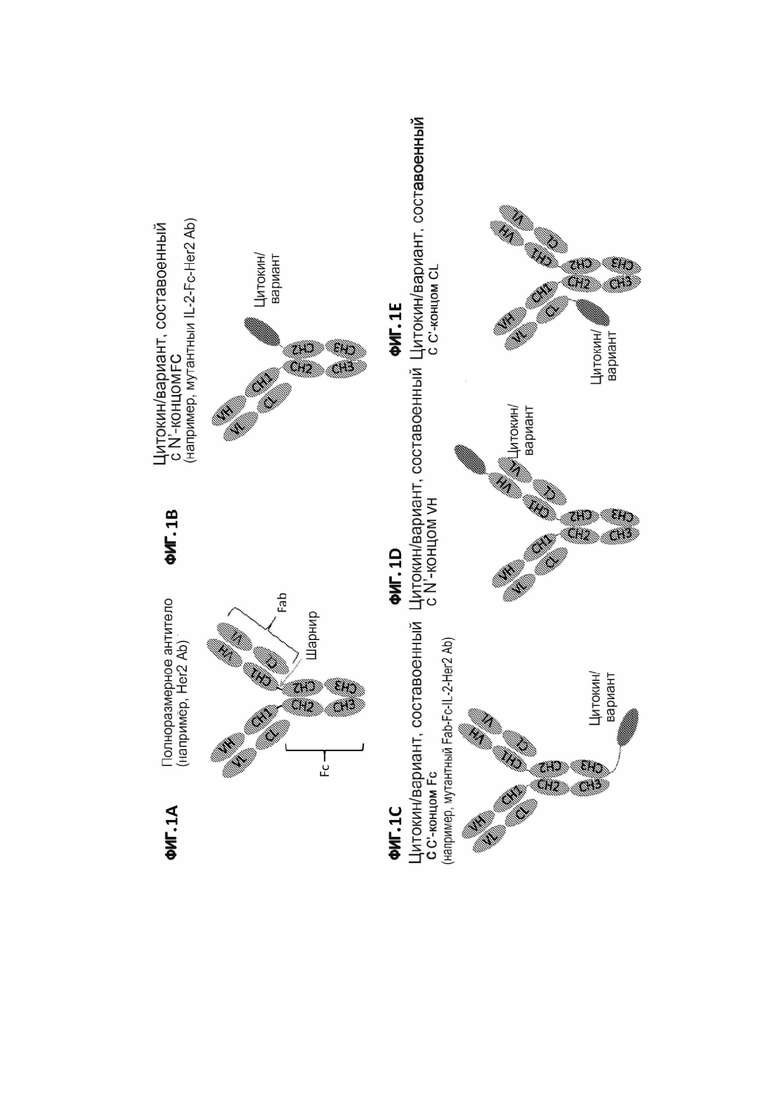
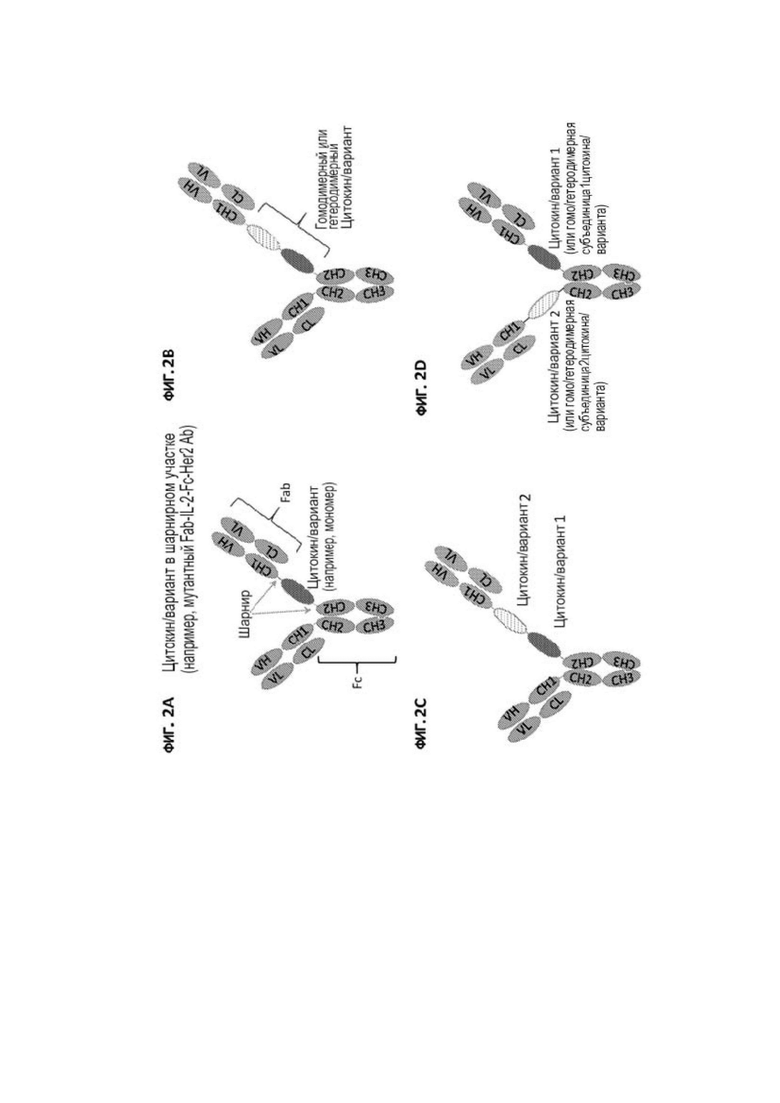
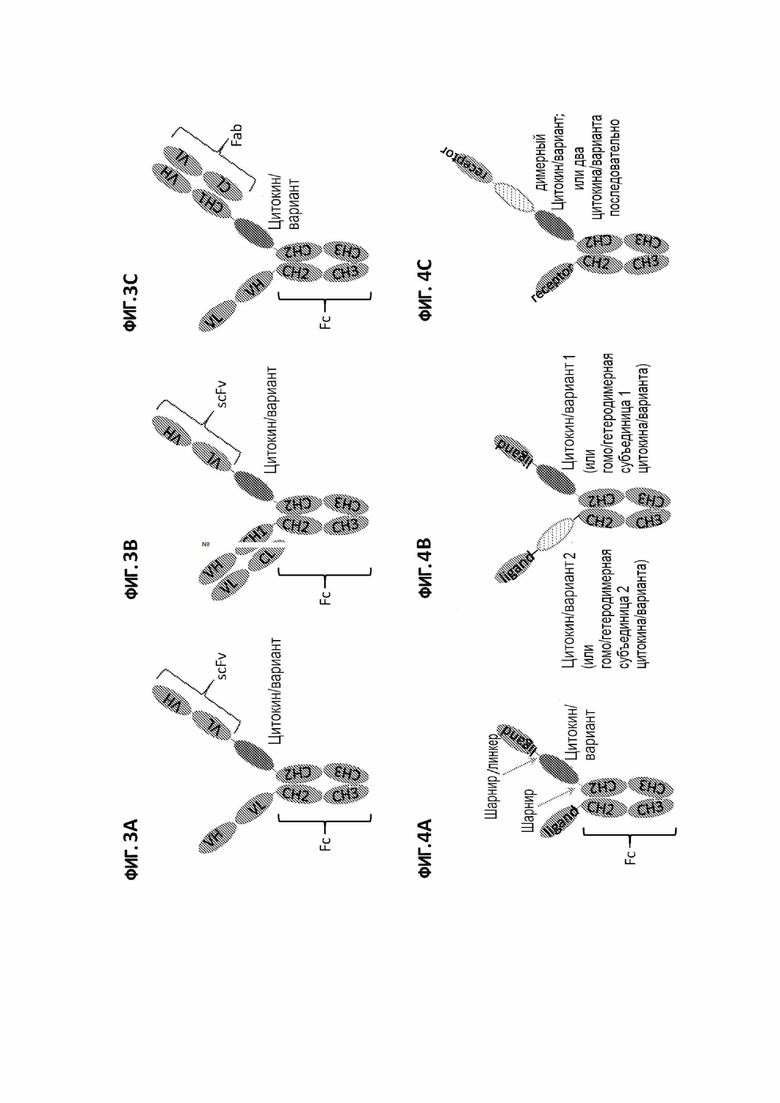
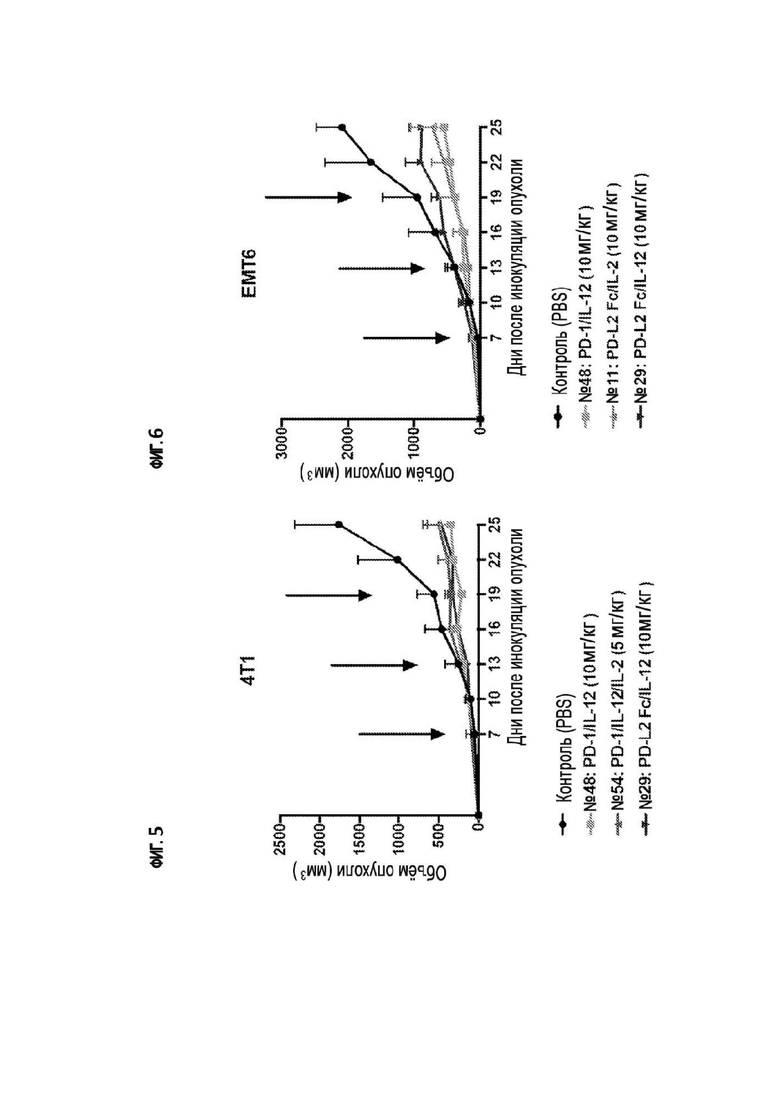
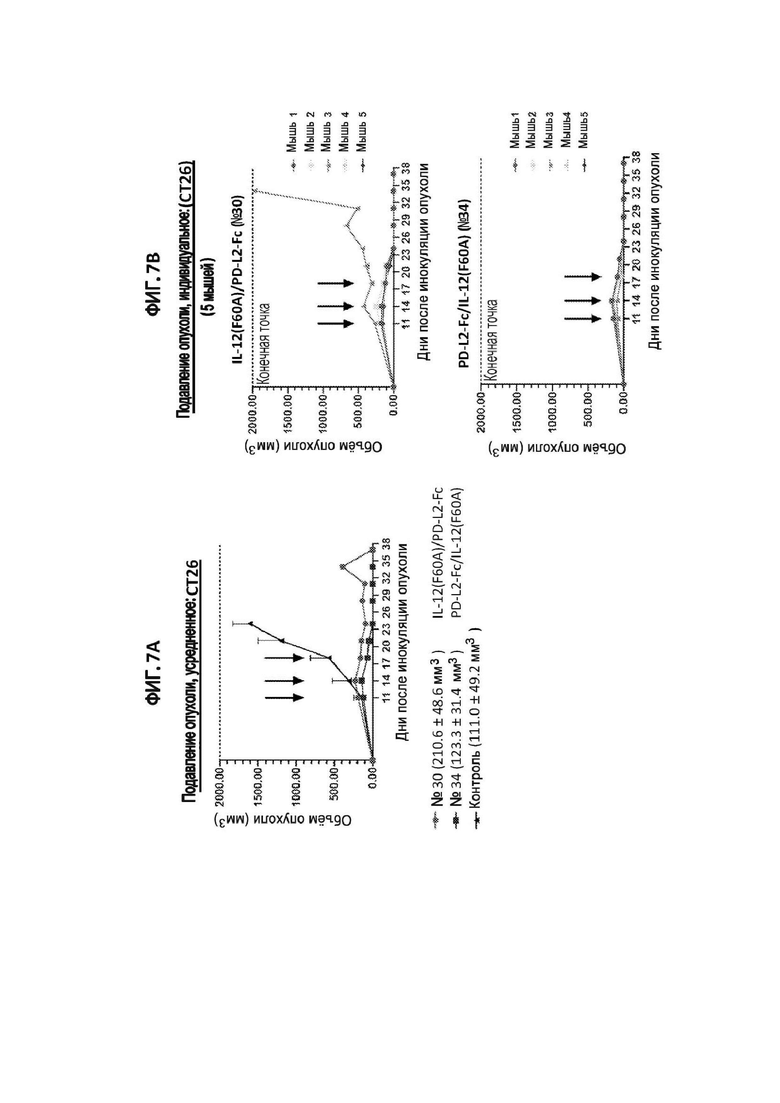
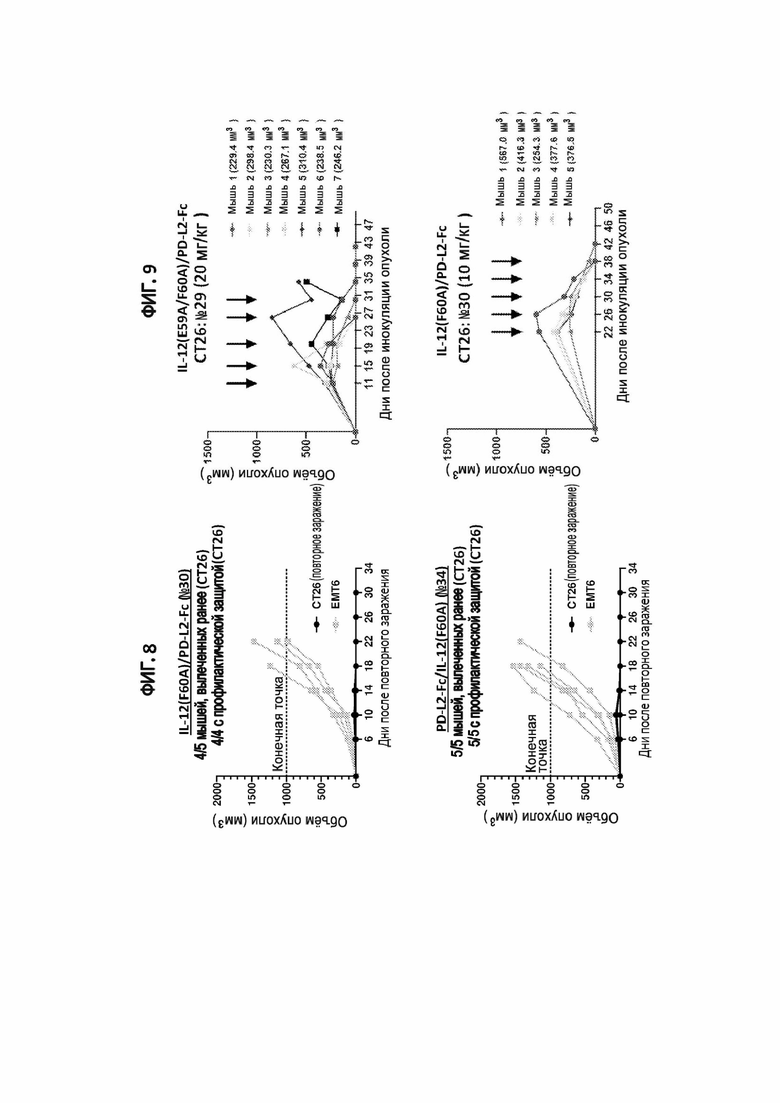
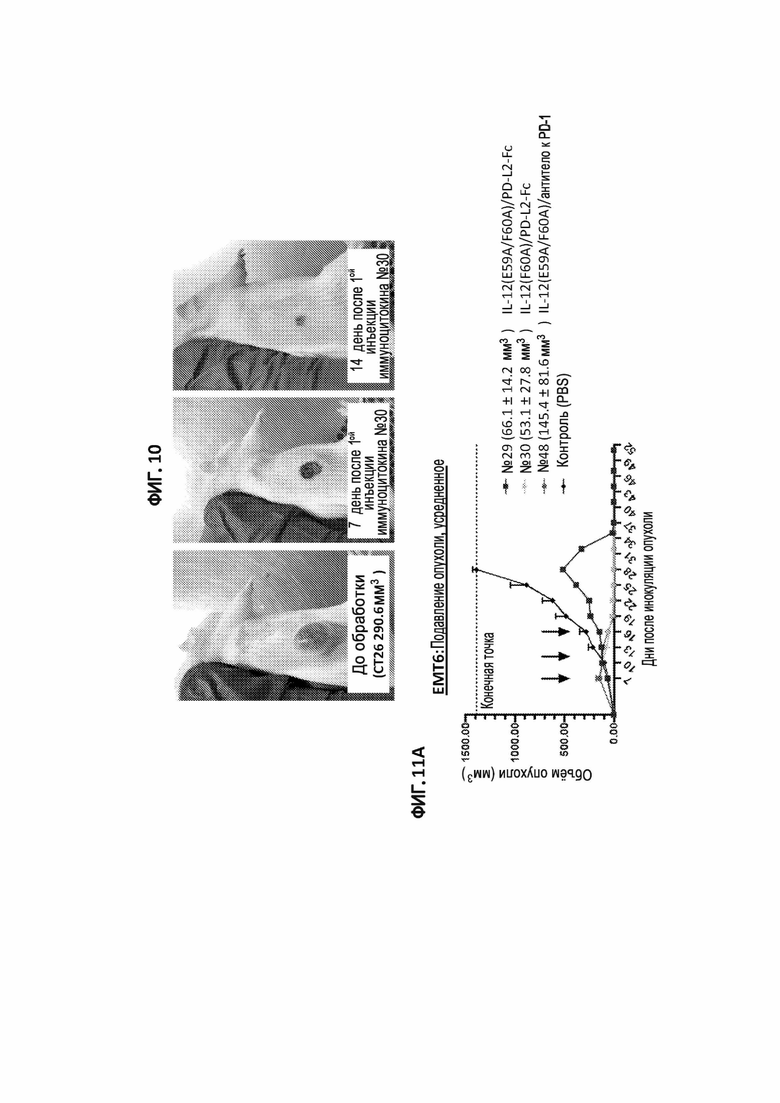
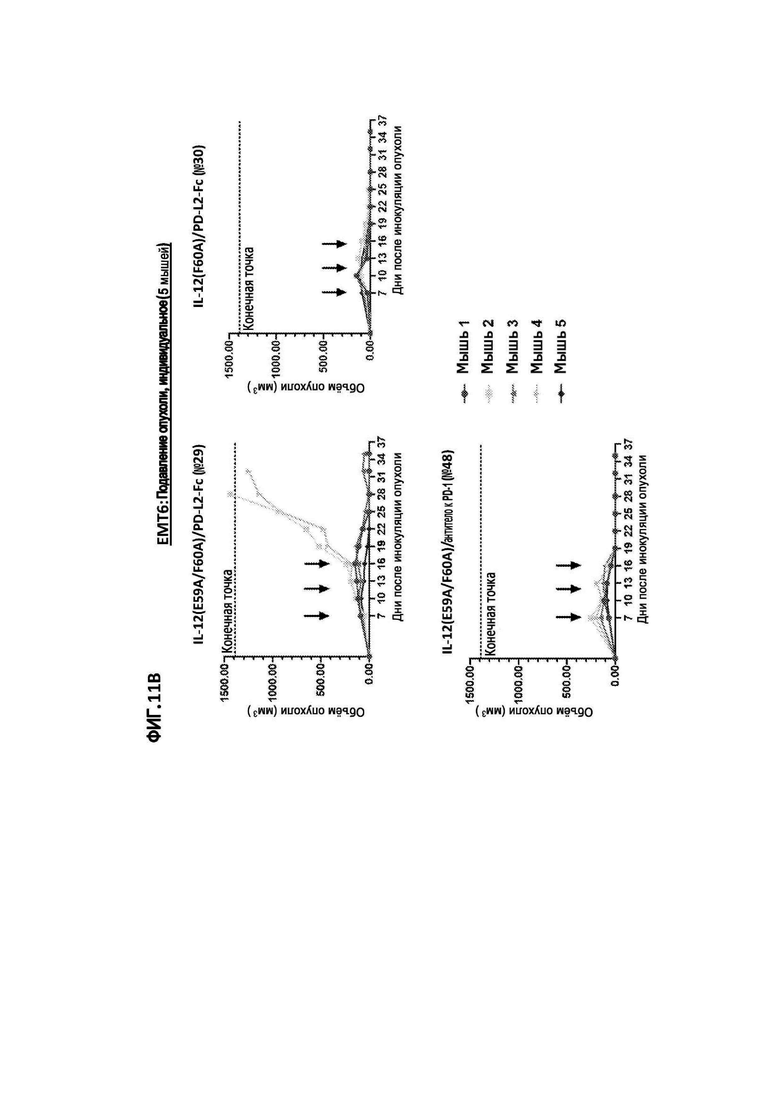
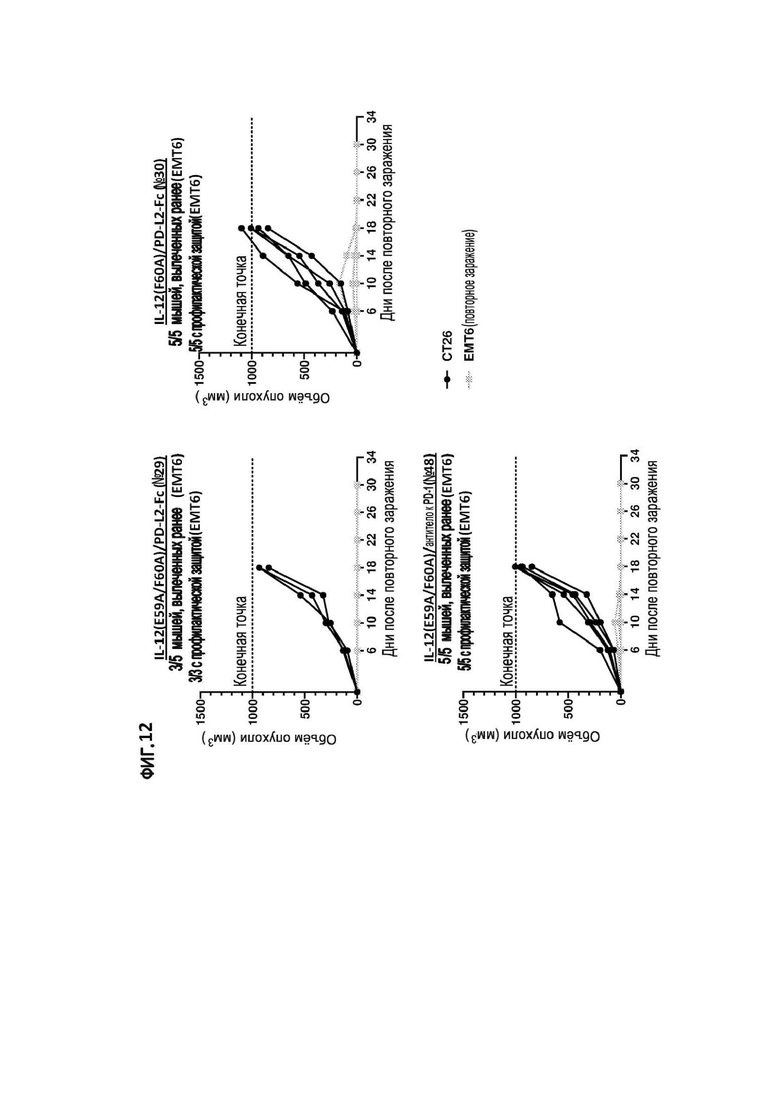
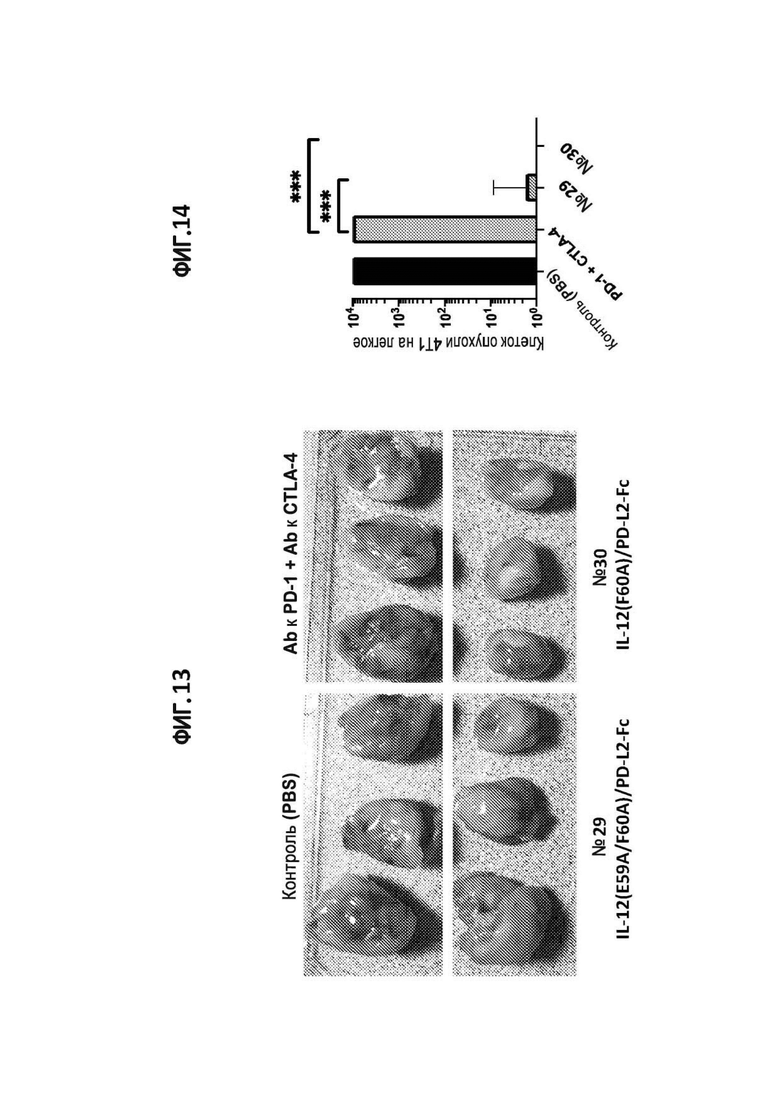
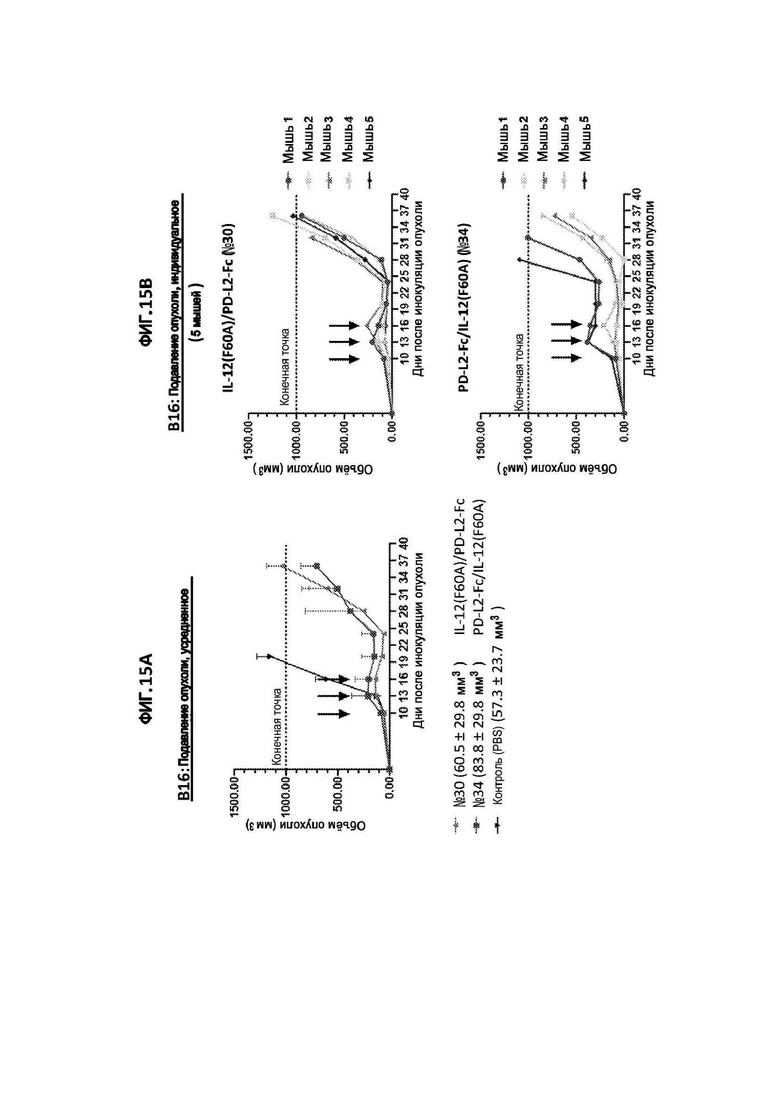
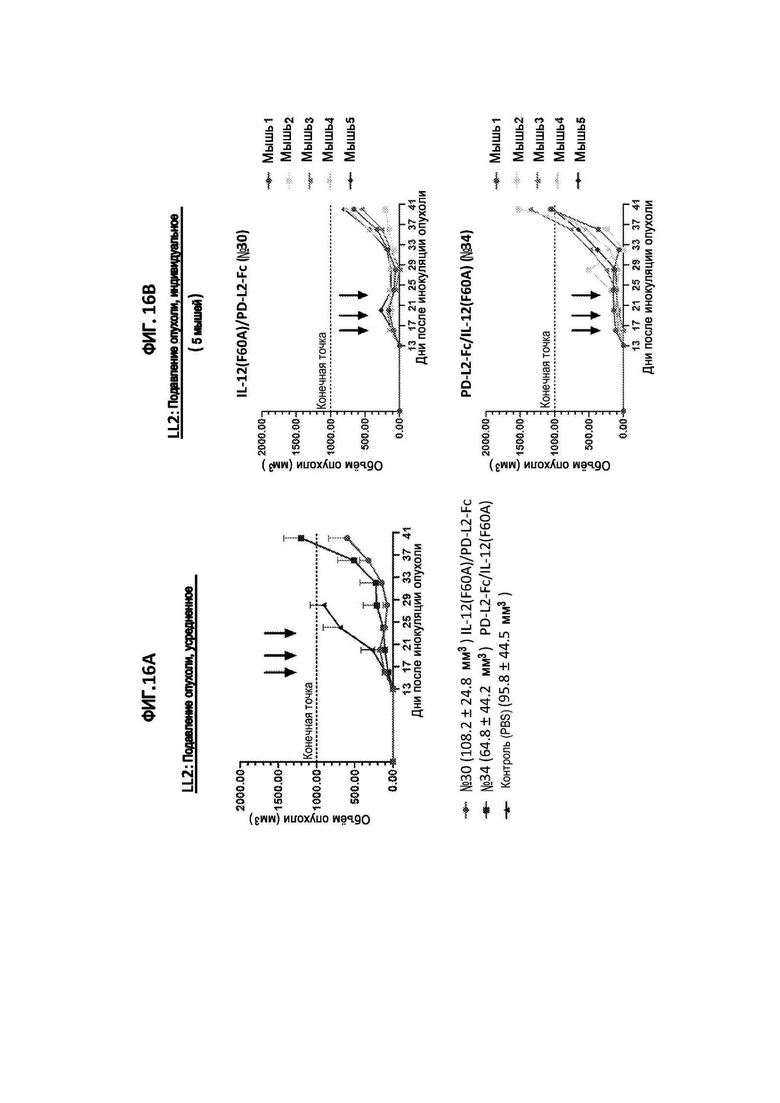
Изобретение относится к области биотехнологии, в частности к иммуноцитокинам, которые содержат цитокин или его вариант, расположенные в шарнирном участке тяжелой цепи антитела или в шарнирном участке между антигенсвязывающим фрагментом и субъединицей Fc-домена или ее частью. Также раскрыты нуклеиновая кислота, кодирующая указанный иммуноцитокин, фармацевтический состав и применение иммуноцитокина. Изобретение эффективно для регуляции иммунных ответов. 4 н. и 23 з.п. ф-лы, 16 ил., 27 табл., 32 пр.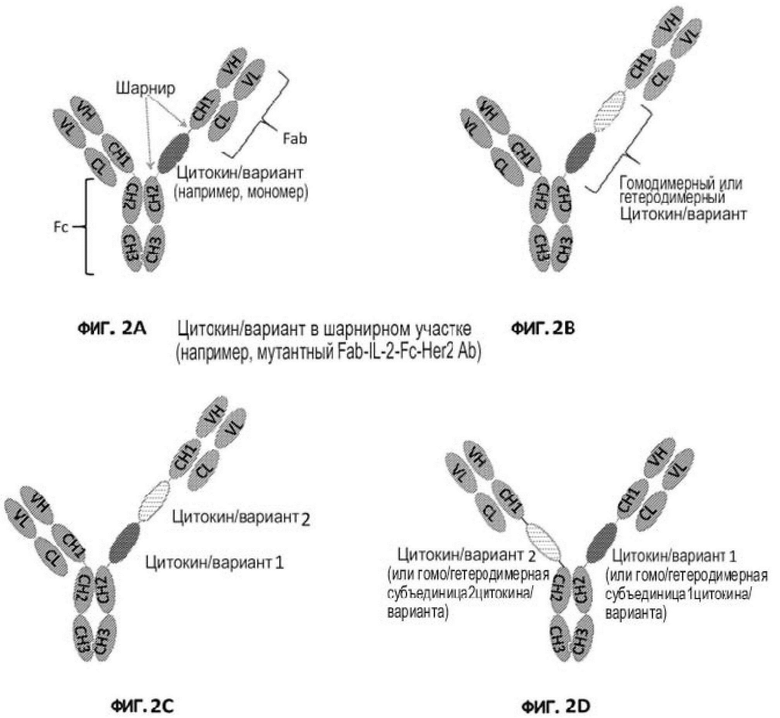
1. Иммуноцитокин для регуляции иммунных ответов, содержащий: а) антигенсвязывающий белок, специфично распознающий антиген-мишень; и b) цитокин или его вариант, где антигенсвязывающий белок содержит антигенсвязывающий полипептид, содержащий, от N' к C': антигенсвязывающий фрагмент, шарнирный участок и субъединицу Fc-домена или ее часть, и где цитокин или его вариант расположен в шарнирном участке;
и где цитокин или его вариант выбран из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12, IL-15, IL-17, IL-18, IL-21, IL-22, IL-23, IL-27, IL-35, IFN-α, IFN-β, IFN-γ, TNF-α, TGF-β, VEGF, эритропоэтина, тромбопоэтина, G-CSF, M-CSF, SCF и GM-CSF, а антиген-мишень представляет собой PD-1;
антигенсвязывающий белок специфично связывает антиген-мишень с KD в диапазоне 10-8 M ˂ KD ≤ ~10-6 M, и
активность варианта цитокина в свободном состоянии составляет не более чем 80% от активности соответствующего цитокина дикого типа в свободном состоянии.
2. Иммуноцитокин по п. 1, где антигенсвязывающий фрагмент представляет собой PD-L2 или PD-L1.
3. Иммуноцитокин по п. 1 или 2, где антигенсвязывающий белок представляет собой антитело, специфично распознающее PD-1, где антигенсвязывающий полипептид, содержащий шарнирный участок, представляет собой тяжелую цепь антитела и где цитокин или его вариант расположен в шарнирном участке тяжелой цепи.
4. Иммуноцитокин по любому из пп. 1-3, где при наличии связывания антигенсвязывающего белка с антигеном-мишенью активность цитокина или его варианта повышается по меньшей мере на 20% по сравнению с активностью в отсутствие связывания антигенсвязывающего белка с антигеном-мишенью, альтернативно, где в отсутствие связывания антигенсвязывающего белка с антигеном-мишенью активность цитокина или его варианта, расположенного в шарнирном участке, составляет не более 70% от активности соответствующего цитокина или его варианта в свободном состоянии, альтернативно, где цитокин или его вариант представляет собой вариант цитокина.
5. Иммуноцитокин по любому из пп. 1-4, где антигенсвязывающий белок содержит два антигенсвязывающих полипептида, каждый из которых содержит шарнирный участок, и где только один антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке, альтернативно, где антигенсвязывающий белок содержит два антигенсвязывающих полипептида, каждый из которых содержит шарнирный участок, и где каждый антигенсвязывающий полипептид содержит цитокин или его вариант, расположенный в шарнирном участке, и указанные два цитокина или их варианта являются одинаковыми или разными.
6. Иммуноцитокин по любому из пп. 1-5, где цитокин или его вариант представляет собой мономерный или димерный цитокин или его вариант, и когда цитокин или его вариант является димерным, обе субъединицы димерного цитокина или его варианта расположены последовательно в шарнирном участке антигенсвязывающего полипептида.
7. Иммуноцитокин по любому из пп. 1-6, где цитокин или его вариант представляет собой IL-2 или его вариант.
8. Иммуноцитокин по п. 7, где вариант IL-2 содержит одну или несколько мутаций в положении, выбранном из группы, состоящей из L18, Q22, F24, K35, R38, F42, K43, E61, P65, Q126 и S130, и соответствующем положению в IL-2 дикого типа, содержащем последовательность SEQ ID NO: 1.
9. Иммуноцитокин по п. 7, где вариант IL-2 содержит одну или несколько мутаций, выбранных из группы, состоящей из L18R, Q22E, F24A, R38D, K43E, E61R, P65L, Q126T и S130R, в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1.
10. Иммуноцитокин по п. 7, где вариант IL-2 содержит мутацию R38D/K43E/E61R, мутацию L18R/Q22E/R38D/K43E/E61R, мутацию R38D/K43E/E61R/Q126T, мутацию L18R/Q22E/R38D/K43E/E61R/Q126T или мутацию L18R/Q22E/R38D/K43E/E61R/Q126T/S130R в отличие от IL-2 дикого типа, содержащего последовательность SEQ ID NO: 1.
11. Иммуноцитокин по п. 7, где вариант IL-2 содержит любую последовательность из SEQ ID NO: 2 и 251-254.
12. Иммуноцитокин по любому из пп. 1-6, где цитокин или его вариант представляет собой IL-12 или его вариант.
13. Иммуноцитокин по п. 12, где вариант IL-12 содержит одну или несколько мутаций в субъединице p40 в положении, выбранном из группы, состоящей из E45, Q56, V57, K58, E59, F60, G61, D62, A63, G64, Q65 и C177, и соответствующем положению в субъединице p40 дикого типа, содержащей последовательность SEQ ID NO: 30.
14. Иммуноцитокин по п. 12, где вариант IL-12 содержит одну или несколько мутаций в субъединице p40, выбранных из группы, состоящей из Q56A, V57A, K58A, E59A, F60A, G61A, D62A, A63S, G64A и Q65A, в отличие от субъединицы p40 дикого типа, содержащей последовательность SEQ ID NO: 30.
15. Иммуноцитокин по п. 12, где субъединица p40 варианта IL-12 содержит любую последовательность из SEQ ID NO: 31-34.
16. Иммуноцитокин по п. 12, где вариант IL-12 содержит мутацию E59A/F60A или мутацию F60A в субъединице р40, которые соотносятся субъединицей р40 дикого типа, содержащей последовательность SEQ ID NO: 30.
17. Иммуноцитокин по п. 12, где субъединица p40 варианта IL-12 содержит последовательность SEQ ID NO: 31 или 33.
18. Иммуноцитокин по п. 12, где субъединица р40 и субъединица р35 IL-12 или его варианта соединены линкером.
19. Иммуноцитокин по п. 18, где вариант IL-12 содержит последовательность SEQ ID NO: 36, 275, 331 или 332.
20. Иммуноцитокин по п. 3, где указанное антитело представляет собой антитело к PD-1, содержащее VH-CDR1, VH-CDR2 и VH-CDR3 VH-домена, содержащего последовательность SEQ ID NO: 102, и VL-CDR1, VL-CDR2 и VL-CDR3 VL-домена, содержащего последовательность SEQ ID NO: 103, и где VH-CDR3 содержит любую из следующих мутаций в отличие от SEQ ID NO: 102: D100N, D100G, D100R, N99G, N99A или N99M.
21. Иммуноцитокин по п. 20, где указанное антитело содержит легкую цепь, содержащую последовательность SEQ ID NO: 106, где цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, и при этом тяжелая цепь, содержащая вариант IL-12, расположенный в шарнирном участке, содержит любую последовательность из SEQ ID NO: 268-273.
22. Иммуноцитокин по любому из пп. 1-21, где PD-L2 или PD-L1 содержит последовательность SEQ ID NO: 176, SEQ ID NO: 250, любую последовательность из SEQ ID NO: 255-261 или любую последовательность из SEQ ID NO: 262-265.
23. Иммуноцитокин по п. 22, где
(i) цитокин или его вариант представляет собой вариант IL-2, содержащий последовательность SEQ ID NO: 2, и где антигенсвязывающий полипептид, содержащий вариант IL-2, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 180;
(ii) цитокин или его вариант представляет собой вариант IFN-α, содержащий последовательность SEQ ID NO: 4, и где антигенсвязывающий полипептид, содержащий вариант IFN-α, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 182;
(iii) цитокин или его вариант представляет собой вариант IFN-γ, содержащий последовательность SEQ ID NO: 19, и где антигенсвязывающий полипептид, содержащий вариант IFN-γ, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 183;
(iv) цитокин или его вариант представляет собой вариант IL-10, содержащий последовательность SEQ ID NO: 28, и где антигенсвязывающий полипептид, содержащий вариант IL-10, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 184;
(v) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 36, и где антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 186;
(vi) цитокин или его вариант представляет собой вариант IL-12, содержащий последовательность SEQ ID NO: 275, и где антигенсвязывающий полипептид, содержащий вариант IL-12, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 274; или
(vii) цитокин или его вариант представляет собой вариант IL-23, содержащий последовательность SEQ ID NO: 39, и где антигенсвязывающий полипептид, содержащий вариант IL-23, расположенный в шарнирном участке, содержит последовательность SEQ ID NO: 187.
24. Иммуноцитокин по п. 22 или 23, где антигенсвязывающий белок содержит второй антигенсвязывающий полипептид, не содержащий цитокин или его вариант, расположенный в шарнирном участке, и где второй антигенсвязывающий полипептид содержит любую последовательность из SEQ ID NO: 178, 179, 181 и 185.
25. Выделенная нуклеиновая кислота, кодирующая иммуноцитокин по любому из пп. 1-24.
26. Фармацевтический состав для регуляции иммунных ответов, содержащий иммуноцитокин по любому из пп. 1-24 и фармацевтически приемлемый носитель.
27. Применение иммуноцитокина по любому из пп. 1-24 для регуляции иммунных ответов.
| US 2020308244 A1, 01.10.2020 | |||
| ANDREAS A HOMBACH et al., An Il12-Il2-Antibody Fusion Protein Targeting Hodgkin's Lymphoma Cells Potentiates Activation Of Nk And T Cells For An Anti-Tumor Attack, PLOS ONE, 2012, vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| ANDREAS A HOMBACH et al., Targeting two co-operating cytokines efficiently shapes immune responses, Oncoimmunology, | |||
Авторы
Даты
2024-05-02—Публикация
2021-12-23—Подача