Заявляемое техническое решение относится к биотехнологии в целом, в частности к генетической инженерии, и может быть использовано в медицине для определения однонуклеотидного полиморфизма rs8065080 в гене, кодирующем рецептор TRPV1 (ванилоидный рецептор 1 типа) человека. Заявленное техническое решение в целом базируется на идее применения известного метода аллель-специфической полимеразной цепной реакции с электрофоретической детекцией продуктов реакции для обеспечения возможности более точного и надёжного различения двух аллелей гена TRPV1 в образцах ДНК человека, что даёт возможность обоснованного выбора стратегии своевременной терапии при хронической и эпизодической мигрени в зависимости от генотипа пациента по мутации rs8065080.
Далее заявителем представлены термины и определения для исключения неоднозначного понимания или толкования заявочных материалов.
Полимеразная цепная реакция (далее – ПЦР) – метод молекулярной биологии, основанный на механизме репликации дезоксирибонуклеиновой кислоты (ДНК) в клетке с помощью фермента ДНК-полимеразы и позволяющий добиться значительного увеличения количества целевого фрагмента посредством многократного его удвоения.
Капсаицин – алкалоид со жгучим вкусом, содержащийся в различных видах стручкового перца, является агонистом рецепторов TRPV1 и используется в медицине как отвлекающее и обезболивающее средство.
Ген TRPV1 – ген человека, кодирующий рецептор ванилоидного типа 1 (TRPV1).
Однонуклеотидный полиморфизм (ОНП) — замена одного нуклеотида на другой в последовательности ДНК генома представителей одного вида или гомологичного участка гомологичных хромосом.
Мутация rs8065080 или 1911A>G – замена нуклеотида A на нуклеотид G в позиции 1911 последовательности гена TRPV1, приводящая к замене аминокислотного остатка изолейцина на аминокислотный остаток валина в позиции 585 аминокислотной последовательности белка TRPV1.
Аллель – здесь – вариант последовательности ДНК, отличающийся от другого варианта заменой одного нуклеотида.
Комплементарность – соответствие нуклеотидов в последовательностях двух цепей нуклеиновых кислот, приводящее к способности образования двухцепочечных комплексов (структур) благодаря формированию пар аденин-тимин и гуанин-цитозин.
Амплификация – многократное увеличение числа копий участка ДНК.
ПЦР-амплификация – многократное увеличение числа копий участка ДНК в ходе полимеразной цепной реакции (ПЦР). Матрицей для ПЦР служит кДНК или геномная ДНК.
ПЦР-продукт – фрагмент ДНК, образовавшийся в результате ПЦР-амплификации.
Аллель-специфическая ПЦР (АС-ПЦР) – разновидность ПЦР-амплификации, для проведения которой используются аллель-специфические праймеры, каждый из которых обеспечивает прохождение ПЦР на участке только одного из аллелей с селективностью 100%.
Аллель гена TRPV1 – вариант гена TRPV1, отличающийся наличием в позиции 1911 кодирующего участка последовательности ДНК нуклеотида A или G.
Олигонуклеотид (олигодезоксирибонуклеотид) – короткая одноцепочечная молекула ДНК, длина которой может составлять от нескольких единиц до нескольких десятков нуклеотидов.
Праймер – используемый для проведения ПЦР олигонуклеотид, последовательность которого комплементарна нуклеотидной последовательности участка ДНК, граничащего с целевым участком амплификации.
Прямой праймер – праймер, последовательность которого комплементарна нуклеотидной последовательности участка первой цепи двухцепочечной молекулы ДНК, граничащего с началом целевого участка амплификации.
Обратный праймер – праймер, последовательность которого комплементарна нуклеотидной последовательности участка второй цепи двухцепочечной молекулы ДНК, граничащего с концом целевого участка амплификации.
Отжиг праймера – формирование двухцепочечной структуры вследствие связывания праймера с комплементарным участком одноцепочечной молекулы ДНК.
Специфичность праймера – способность праймера образовывать двухцепочечную структуру только с комплементарным участком одноцепочечной молекулы ДНК. Чем больше нуклеотидов в последовательности праймера комплементарны нуклеотидам в последовательности ДНК, тем выше специфичность праймера. Значение идентичности нуклеотидной последовательности специфичного праймера и участка его отжига равна 100%. Чем ниже специфичность праймера, тем выше вероятность несвязывания праймера с нужным участком отжига.
Селективность праймера – способность праймера образовывать двухцепочечную структуру только с конкретным (уникальным) вариантом участка одноцепочечной молекулы ДНК.
Секвенирование – определение последовательности нуклеотидов (для нуклеиновых кислот) или аминокислот (для полипептидов).
Как известно из уровня техники, рецепторы TRPV1 являются неселективными катионными каналами, которые активируются капсаицином, протонами, нагреванием до температуры выше чем 43°C, эндогенными липидами и воспалительными медиаторами [Tominaga et al., 1998, https://doi.org/10.1016/S0896-6273(00)80564-4; Tominaga and Caterina, 2004, https://onlinelibrary.wiley.com/doi/epdf/10.1002/neu.20079]. Рецепторы TRPV1 локализуются на чувствительных нейронах системы блуждающего нерва и тройничного нерва, в симпатических нервных сплетениях кишечника, мочевого пузыря, в некоторых структурах центральной нервной системы (полосатое тело, гиппокамп, ядра мозжечка), а также в эпителиоцитах кишечника и мочевого пузыря, участвуя при этом в развитии нейрогенной боли и опосредовании хронической и механической боли [Devesa et al., 2011, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3218746/].
Рецепторы TRPV1 представляют собой интегратор разнообразных болевых стимулов, их активация приводит к выбросу главных болевых пептидов в организме человека: так называемой субстанции Р (нейропептид, отвечающий за передачу болевых импульсов в центральную нервную систему) и ключевого при мигренозной боли кальцитонин-ген-связанного пептида. Это приводит к повышению возбудимости периферических болевых рецепторов и развитию нейропатического болевого синдрома, возникающего вследствие структурных и/или функциональных изменений в нервной системе [Edvinsson et al., 1990, https://doi.org/10.1111/j.1476-5381.1990.tb15801.x; Cortright and Szallasi, 2009, https://eurekaselect.net/article/14209; Stucky et al., 2009, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2683630/].
В ряде работ было показано, что несинонимичный однонуклеотидный полиморфизм (далее – ОНП) 1911A>G (rs8065080) в гене TRPV1, ведущий к замене аминокислоты изолейцина на валин в позиции 585 полипептидной последовательности (Ile585Val), определяет функциональную активность рецепторов TRPV1, повышая или понижая болевую чувствительность и уровень риска хронизации боли при различных состояниях [Binder et al., 2011, https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0017387; Forstenpointner et al., 2017, https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0183322; Okamoto et al., 2018, https://journals.sagepub.com/doi/10.1177/1744806918804439; Yakubova et al., 2020, https://link.springer.com/article/10.1007/s12031-020-01683-9].
Генотипирование по ОНП 1911A>G (rs8065080) является перспективным методом для разделения по группам и дальнейшей стратификации пациентов в зависимости от интенсивности болевой чувствительности и его результаты могут быть использованы для выбора дальнейшей тактики терапии преимущественно в медицинских учреждениях, разработки мероприятий по профилактике и снижению уровня заболеваемости хроническими заболеваниями, сопровождающимися болевым синдромом.
Одним из наиболее часто применяемых на практике высокочувствительных и доступных методов определения ОНП является метод аллель-специфической полимеразной цепной реакции (АС-ПЦР).
Ниже приведено описание восьми существующих методов идентификации ОНП 1911A>G (rs8065080) в гене TRPV1, выявленных заявителем из исследованного уровня техники.
ДНК для генотипирования мутации rs8065080 выделяли из венозной крови, клеток слизистой оболочки полости рта, слюны и другого биологического материала пациентов и доноров контрольно группы с помощью одной из стандартных методик.
Для проведения самого генотипирования использовались методы:
1) полиморфизм длин рестриктных фрагментов продуктов ПЦР-амплификации (ПЦР-ПДРФ) участка гена, содержащего мутацию [Er et al., 2018, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5883834/]. Недостатком известного метода является необходимость проведения дополнительных этапов очистки первоначально полученного ПЦР-продукта и его расщепления специальным ферментом рестрикции Hpy99I;
2) аллель-специфическая ПЦР в реальном времени с использованием зондов TaqMan [Lopez-Valverde et al., 2019, https://www.dovepress.com/genetic-study-in-patients-operated-dentally-and-anesthetized-with-arti-peer-reviewed-fulltext-article-JPR]. Недостатком известного метода является то, что его применимость ограничивается более высокой стоимостью необходимого оборудования и специфических зондов.
3) генотипирование с помощью «KASPar SNP Genotyping System» [Valdes et al., 2011, https://ard.bmj.com/content/70/9/1556; Liviero et al., 2020, https://www.sciencedirect.com/science/article/pii/S1094553919302135?via%3Dihub];
4) секвенирование по Сэнгеру продуктов ПЦР-амплификации участка гена, содержащего мутацию [van Esch et al., 2009, https://bmcgastroenterol.biomedcentral.com/articles/10.1186/1471-230X-9-97; Okamoto et al., 2018, https://journals.sagepub.com/doi/10.1177/1744806918804439],
5) ПЦР в реальном времени с использованием технологии TaqMan-анализа [Kim et al, 2006, https://jmg.bmj.com/content/43/8/e40; Deering-Rice et al., 2016, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5122759/];
6) разделение ПЦР-продуктов методом капиллярного электрофореза с применением платформы SNPLex [Cantero-Recasens et al., 2010, https://www.jbc.org/content/285/36/27532.full];
7) секвенирование нового поколения (NGS) – в частности, пиросеквенирование на платформе PSQ HS96 [Binder et al., 2011, https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0017387; Forstenpointer et al., 2017, https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0183322] или использование специализированной панели Ion 318 Chip [Kringel et al., 2017, https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0180116];
8) определение мутации rs8065080 в РНК, выделенной из спинномозговых ганглиев человека с использованием NGS-секвенирования [Wang et al., 2016, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5512168/].
Недостатками методов генотипирования 3-8, в частности, с использованием секвенирования, являются относительно высокая стоимость реагентов, сложность и дороговизна оборудования и программного обеспечения, а также значительная трудоёмкость. Их использование может быть экономически целесообразным при проведении генотипирования одновременно по большому количеству мутаций в нескольких генах на большом количестве исследуемых образцов.
В заявленном техническом решении используется метод АС-ПЦР с электрофоретической детекцией продуктов реакции с применением комплекта аллель-специфичных праймеров, позволяющий проводить генотипирование по мутации rs8065080 с достоверностью до 100%, что и обеспечивает достижение столь высокого уровня достоверности. Для проведения АС-ПЦР параллельно проводятся две реакции амплификации, в каждой из которой прямой праймер содержит на 3᾽-конце нуклеотид, комплементарный одному из аллелей, а обратный праймер одинаков для обеих реакций.
На дату предоставления заявочных материалов заявителем не обнаружено аналогов, в том числе и отечественных, разработанного набора праймеров, а также заявленного способа для аллель-специфической ПЦР с электрофоретической детекцией продуктов реакции для генотипирования по мутации rs8065080 гена TRPV1, поэтому формула предполагаемого изобретения составлена без ограничительной части.
Задачей заявленного технического решения является устранение недостатков известных в мире методов генотипирования по мутации rs8065080, в первую очередь, связанных с высокой стоимостью оборудования и реагентов, а также с необходимостью высокой квалификации персонала, использующего эти методы. Указанные недостатки не дают возможности проведения генотипирования по данной мутации в большинстве медико-диагностических лабораторий и медицинских учреждений. Заявленное техническое решение обеспечивает проведение генотипирования по мутации rs8065080 в гене TRPV1 простым в исполнении методом без использования дорогостоящего оборудования и реагентов. Заявленное техническое решение даёт возможность получения продукта ПЦР-амплификации целевого фрагмента гена и проведения дальнейшего генетического анализа с обеспечением исключения ложноотрицательных результатов, а также достижение высокой достоверности и воспроизводимости положительных результатов ПЦР-амплификации.
Заявленное техническое решение также обеспечивает достоверную идентификацию ОНП rs8065080 гена TRPV1 у пациентов широкого ряда состояний, сопровождающихся болевыми ощущениями, таких как различные виды мигрени, остеоартроз, постгерпетическая невралгия, диабетический, посттравматический или постоперационный нейропатический болевой синдром, что даёт возможность обоснованного выбора проведения своевременной терапии, препятствующей хронизации боли у пациентов с учётом особенностей генома конкретного пациента.
Техническим результатом заявленного технического решения является разработка набора праймеров, обладающих активностью прямого (F) и обратного (R) праймеров, дающих возможность проведения селективной ПЦР-амплификации аллелей по мутации rs8065080 в гене TRPV1 человека с целью дальнейшего генотипирования, а также разработка способа генотипирования по мутации rs8065080 гена TRPV1 методом АС-ПЦР, что обеспечивает достоверность и воспроизводимость результатов ПЦР-амплификации.
Сущностью заявленного технического решения является набор из 3-х праймеров для определения ОНП rs8065080 в гене TRPV1, обладающих активностью прямых и обратного праймеров в полимеразной цепной реакции и имеющих следующую структуру
Forward1: 5̓᾽-TGTGCCGTTTCATGTTTGTCTTCG-3̓ (24 н.)
Forward2: 5’-CTGTGCCGTTTCATGTTTGTCTTCA-3’ (25 н.)
Reverse: 5’-TGAGGTAGGAGAATTGCTTGAACC-3’ (24 н.)
Способ генотипирования однонуклеотидного полиморфизма rs8065080 в гене TRPV1 1 человека, заключающийся в том, что для проведения АС-ПЦР готовят реакционные смеси 1 и 2, содержащие стандартные компоненты для проведения реакции ПЦР, далее в реакционную смесь 1 добавляют праймер Forward1 и праймер Reverse по п.1, далее в реакционную смесь 2 добавляют праймер Forward2 и праймер Reverse по п.1, далее в реакционную смесь 1 и реакционную смесь 2 добавляют анализируемую ДНК, далее для реакционной смеси 1 и реакционной смеси 2 проводят реакцию АС-ПЦР по следующей программе: 94°С – 3 мин; далее 33 цикла: 94°С – 30 сек, 64°С – 10 сек, 72°С – 20 сек; далее 72°С – 2 мин; далее 4°С – ∞, на этом реакцию АС-ПЦР завершают; далее проводят разделение продуктов амплификации методом электрофореза в 1,5% агарозном геле, далее проводят визуализацию ДНК с помощью окрашивания бромистым этидием и последующего УФ-облучения.
Заявленное техническое решение иллюстрируется Фиг.1 – Фиг.2.
На Фиг. 1 представлена схема амплификации участка генома, содержащего однонуклеотидную замену, методом АС-ПЦР.
Обозначения на Фиг.1 означают:
РС1, РС2 – реакционные смеси 1 и 2 соответственно,
→ – направление реакции АС-ПЦР,
5', 3' – концы праймеров,
For-1, For-2 – праймеры Forward1, Forward2 соответственно,
Rev – праймер Reverse,
А, G – нуклеотиды,
||| – условное обозначение образования комплементарной пары А - G,
Х – условное обозначение невозможности образования пары А - А, G – G.
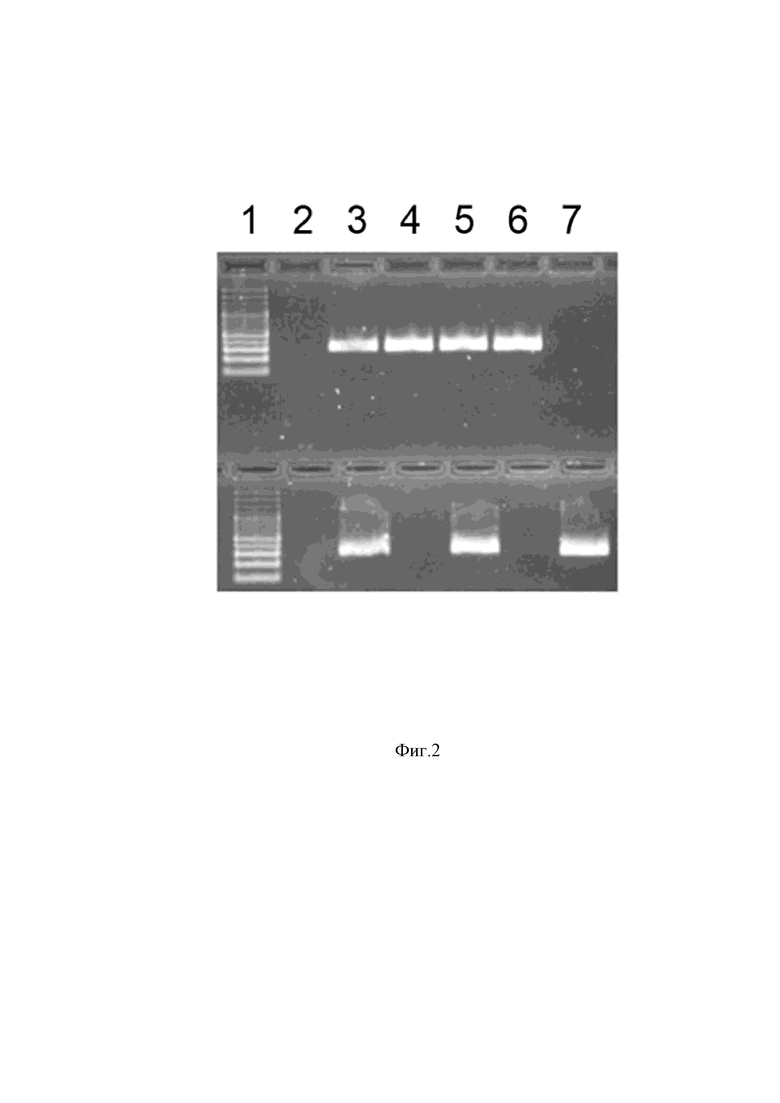
На Фиг. 2 приведены результаты электрофоретического разделения продуктов АС-ПЦР, проведённой с помощью праймеров Forward1, Forward2 и Reverse (1,5% агарозный гель).
В качестве матрицы использованы ДНК, выделенные из венозной крови пациентов с болевыми синдромами.
Позиции на Фиг.2 обозначают:
1 – маркер длин фрагментов,
2 – отрицательный контроль,
3 – ПЦР-продукт, полученный в результате ПЦР-амплификации гетерозиготы AG по мутации rs8065080 гена TRPV1,
4 – ПЦР-продукт, полученный в результате ПЦР-амплификации гомозиготы АА по мутации rs8065080 гена TRPV1,
5 – ПЦР-продукт, полученный в результате ПЦР-амплификации гетерозиготы AG по мутации rs8065080 гена TRPV1,
6 – ПЦР-продукт, полученный в результате ПЦР-амплификации гомозиготы AA по мутации rs8065080 гена TRPV1,
7 – ПЦР-продукт, полученный в результате ПЦР-амплификации гомозиготы GG по мутации rs8065080 гена TRPV1.
Далее заявителем приведён пример конкретного исполнения заявленного технического решения.
В рамках заявленного технического решения заявителем подобраны последовательности праймеров для проведения АС-ПЦР, специфичных к участкам гена TRPV1 человека, исходя из последовательности участка генома, размещённой в базе данных GenBank (Accession No NG_029716). Синтез подобранных праймеров, в соответствии с заказом заявителя выполнены в фирме Евроген (Россия).
Апробация разработанных праймеров была проведена с использованием образцов ДНК, выделенной из крови 46 пациентов с клинически верифицированными диагнозами «эпизодическая мигрень» или «хроническая мигрень» и 50 доноров контрольной группы [Yakubova et al., 2020, https://link.springer.com/article/10.1007/s12031-020-01683-9].
Характеристика набора праймеров и амплифицируемого локуса гена TRPV1.
Участки отжига праймеров Forward1 и Forward2 длиной 24 и 25 нуклеотидов, соответственно, последовательности которых различаются на одну нуклеотидную замену на 3᾽-конце, расположены на последовательности гена TRPV1 таким образом, чтобы локализация 3᾽-конечного нуклеотида праймера совпадала с локализацией мутации rs8065080 (поз. 37236-37259 и 37235-37259, соответственно, по последовательности NG_029716). Участок отжига обратного праймера (поз. 37640-37663) локализован на последовательности гена TRPV1 на расстоянии, обеспечивающем получение ПЦР-продукта длиной 428 пн и 429 пн при использовании прямых праймеров Forward1 и Forward2, соответственно (см. Таблицу).
Таблица
Структура набора заявляемых праймеров для выявления ОНП rs8065080 в гене TRPV1
п.н.
Из данных, приведенных в Таблице, можно сделать логический вывод, что заявителями разработан набор праймеров, позволяющий достоверно идентифицировать ОНП rs8065080 гена TRPV1.
Далее заявителями приведены Примеры 1-3, в которых представлен алгоритм идентификации ОНП rs8065080 в гене TRPV1 с использованием в качестве биологического материала цельной крови человека.
Пример 1. Выделение геномной ДНК из цельной крови.
Выделение геномной ДНК из цельной крови пациентов с заболеваниями, сопровождающимися болевым синдромом, склонным к хронизации, проводят по одной из стандартных методик, например, с использованием набора реактивов «ДНК-экспресс-кровь» [Литех, Россия; http://www.lytech.ru/product/genetika-cheloveka/vydelenie-dnk/dna-express-blood/] или набора «ExtractDNA Blood» [Евроген, Россия; https://evrogen.ru/products/ExtractDNAblood/ExtractDNAblood/] или аналогичного набора согласно рекомендациям производителя. Для последующего проведения реакций АС-ПЦР берут, например, 0,5 мкл ДНК на одну реакцию.
Пример 2. Проведение АС-ПЦР.
Для проведения реакции АС-ПЦР готовят реакционные смеси 1 и 2, содержащие компоненты, например, производства Евроген, Россия, для проведения реакции ПЦР которые совпадают по приведенным далее общим компонентам:
10× TaqPol буфер (Евроген, Россия) – 1,0 мкл
MgCl2, 25 мМ – 0,5 мкл
Раствор dNTPs (25 мM) – 0,4 мкл
TaqPol ДНК-полимераза (Евроген, Россия), 5 ед/мкл – 0,2 мкл (1 ед.)
H2O – до 10 мкл
При этом заявитель поясняет, что указанные компоненты производства Евроген, Россия приведены для иллюстрации осуществления заявленного технического решения. Использование компонентов от других производителей не ограничивает объем патентных притязаний, так как набор компонентов не влияет на достижение заявленного технического результата.
Реакционные смеси 1 и 2 отличаются между собой набором заявленных праймеров:
- в реакционную смесь 1 к описанным выше компонентам добавляют заявленные праймеры Forward1 и Reverse, например, в количестве 5 пмоль каждого, соответственно;
- в реакционную смесь 2 к описанным выше компонентам добавляют заявленные праймеры Forward2 и Reverse, например, в количестве 5 пмоль каждого, соответственно.
Далее в реакционную смесь 1 и реакционную смесь 2 добавляют анализируемую ДНК в количестве, например, 0,5 мкл ДНК на одну реакцию.
Далее для обеих реакционных смесей проводят реакцию АС-ПЦР, например, в термоциклере С1000 ThermalCycler (Bio-Rad, США) по следующей программе:
94°С – 3 мин
33 цикла: 94°С – 30 сек
64°С – 10 сек
72°С – 20 сек
72°С – 2 мин
4°С – ∞.
На Фиг.1 представлена схема амплификации участка генома, содержащего однонуклеотидную замену, методом АС-ПЦР.
Из приведенной на Фиг.1 схемы видно, что:
– наличие на 3'-конце праймера Forward1 нуклеотида А обеспечивает образование комплементарной пары А – G, необходимой для прохождения реакции АС-ПЦР при наличии аллеля G, и невозможности прохождения реакции при наличии аллеля А;
– наличие на 3'-конце праймера Forward2 нуклеотида G обеспечивает образование комплементарной пары А – G, необходимой для прохождения реакции АС-ПЦР при наличии аллеля А, и невозможности прохождения реакции при наличии аллеля G.
Пример 3. Детекция продуктов амплификации.
Разделение продуктов амплификации проводят методом электрофореза в 1,5% агарозном геле. Визуализацию ДНК проводят с помощью окрашивания бромистым этидием и последующего УФ-облучения с использованием, например, системы гель-документации GelDocXR+ (Bio-Rad, США).
Электрофореграмма результатов разделения продуктов ПЦР-амплификации приведена на Фиг. 2.
На Фиг.2 приведены результаты электрофоретического разделения продуктов аллель-специфической ПЦР, проведённой с помощью праймеров Forward1, Forward2 и Reverse (1,5% агарозный гель) на матрице ДНК, выделенной из крови пациентов с клинически верифицированными диагнозами «эпизодическая мигрень» или «хроническая мигрень».
Из приведенной на Фиг.2 фотографии следует, что:
– длина образовавшихся продуктов АС-ПЦР, измеренная с помощью маркера длин фрагментов 1, составляет менее 500 пар нуклеотидов;
– отрицательный контроль 2 свидетельствует об отсутствии посторонней ДНК в реакционных смесях;
– у образца 3 образуется 2 продукта, что соответствует генотипу гетерозиготы AG по мутации rs8065080 гена TRPV1;
– у образца 4 образуется продукт только в реакционной смеси 1, что соответствует генотипу гомозиготы AА по мутации rs8065080 гена TRPV1;
– у образца 5 образуется 2 продукта, что соответствует генотипу гетерозиготы AG по мутации rs8065080 гена TRPV1;
– у образца 6 образуется продукт только в реакционной смеси 1, что соответствует генотипу гомозиготы AА по мутации rs8065080 гена TRPV1;
– у образца 7 образуется продукт только в реакционной смеси 2, что соответствует генотипу гомозиготы GG по мутации rs8065080 гена TRPV1.
Таким образом, показано, что для всех исследуемых образцов получено только по одному ПЦР-продукту, длина которого соответствует ожидаемой (428 пн и 429 пн для реакций с использованием прямых праймеров Forward1 и Forward2 соответственно). Наличие продукта амплификации при использовании сочетания праймеров Forward1 и Reverse свидетельствует о наличии аллеля А в анализируемой ДНК, а наличие продукта амплификации при использовании сочетания праймеров Forward2 и Reverse свидетельствует о наличии аллеля G в анализируемой ДНК. Неспецифические продукты реакции отсутствуют, что подтверждает достижение поставленной заявителем цели – заявленный набор праймеров обладает 100% селективностью.
С целью проверки результатов АС-ПЦР для ряда образцов ДНК, полученных от пациентов с клинически верифицированными диагнозами «эпизодическая мигрень» или «хроническая мигрень», была проведена ПЦР-амплификация участка гена TRPV1 с использованием праймеров, последовательности которых приведены в источнике [van Esch et al, 2009, https://bmcgastroenterol.biomedcentral.com/articles/10.1186/1471-230X-9-97]. Далее полученные продукты ПЦР-амплификации секвенировали по Сэнгеру. Во всех случаях результаты определения методами АС-ПЦР и секвенирования совпали, что свидетельствует о 100% достоверности полученных результатов (иллюстрации заявителем не приводятся, с целью недопущения перегруженности текста излишней информацией).
Таким образом, заявителем доказано, что разработанные праймеры могут быть эффективно использованы для проведения АС-ПЦР с целью достоверного генотипирования по мутации rs8065080 в гене TRPV1 человека.
Из описанного выше можно сделать общий вывод, что заявителем достигнуты поставленные задачи и заявленные технические результаты, т.е. разработан набор праймеров, обладающих активностью прямого (F) и обратного (R) праймеров, дающих возможность проведения близкой к 100% селективной ПЦР-амплификации аллелей по мутации rs8065080 в гене TRPV1 человека с целью дальнейшего генотипирования, а также разработан способ генотипирования по мутации rs8065080 гена TRPV1 методом АС-ПЦР, что обеспечивает достоверность и воспроизводимость результатов ПЦР-амплификации.
В заявленном техническом решении устранены недостатки известных в мире методов генотипирования по мутации rs8065080, в первую очередь, связанных с высокой стоимостью оборудования и реагентов, а также с необходимостью высокой квалификации персонала, использующего эти методы. Заявленное техническое решение обеспечивает проведение генотипирования по мутации rs8065080 в гене TRPV1 простым в исполнении методом без использования дорогостоящего оборудования и реагентов. Заявленное техническое решение даёт возможность получения продукта ПЦР-амплификации целевого фрагмента гена и проведения дальнейшего генетического анализа с обеспечением исключения ложноотрицательных результатов, а также достижение высокой достоверности и воспроизводимости положительных результатов ПЦР-амплификации.
Заявленное техническое решение обеспечивает достоверную идентификацию ОНП rs8065080 гена TRPV1 у пациентов широкого ряда состояний, сопровождающихся болевыми ощущениями, таких как различные виды мигрени, остеоартроз, постгерпетическая невралгия, диабетический, посттравматический или постоперационный нейропатический болевой синдром, что даёт возможность обоснованного выбора проведения своевременной терапии, препятствующей хронизации боли у пациентов с учётом особенностей генома конкретного пациента.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение удовлетворяет критерию «изобретательский уровень», предъявляемому к изобретениям, поскольку из исследованного уровня техники заявителем не выявлены технические решения, характеризующиеся разработанным заявителями специфичным набором олигонуклеотидов, обладающих активностью прямого (F) и обратного (R) праймеров, дающих возможность проведения селективной ПЦР-амплификации аллелей по мутации rs8065080 в гене TRPV1 человека с целью дальнейшего генотипирования.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, так как заявленное техническое решение может быть осуществлено посредством применения стандартного оборудования и известных приемов.
Перечень последовательностей – Правило 13ter
--->
учреждение высшего образования "Казанский
(Приволжский) федеральный университет" (ФГАОУ
ВО КФУ)
Puumala orthohantavirus, распространённых в
Республике Татарстан
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики мутации 35delG (rs80338939) гена GJB2 | 2020 |
|
RU2739889C1 |
| Способ выявления мутации p.L265P в гене MYD88 | 2020 |
|
RU2756909C1 |
| СПОСОБ ОБНАРУЖЕНИЯ МУТАЦИИ А40Т В ГЕНЕ ВНЕКЛЕТОЧНОЙ СУПЕРОКСИДДИСМУТАЗЫ | 2006 |
|
RU2333964C1 |
| Способ диагностики мутации 167delT (rs80338942) гена GJB2 | 2020 |
|
RU2739943C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПОЛИМОРФИЗМА R287Q В 8 ЭКЗОНЕ ГЕНА ЦИТОЗОЛЬНОЙ ЭПОКСИДГИДРОЛАЗЫ У ЧЕЛОВЕКА | 2006 |
|
RU2346053C2 |
| Способ идентификации полиморфизмов Cys1079Gly и Cys1079Phe медь-транспортной АТФ-азы Вильсона | 2020 |
|
RU2756112C1 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ ИЗОЛЯТОВ NEISSERIA GONORRHOEAE НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ | 2023 |
|
RU2816767C1 |
| СПОСОБ ОДНОВРЕМЕННОГО ДНК-ТЕСТИРОВАНИЯ НА НАЛИЧИЕ ПОЛИМОРФИЗМОВ Н63D И C282Y В ГЕНЕ HFE, СВЯЗАННЫХ С НАСЛЕДСТВЕННЫМ ГЕМОХРОМАТОЗОМ | 2006 |
|
RU2304170C1 |
| Способ диагностики мутации c.-23+1G>A (rs80338940) гена GJB2 | 2020 |
|
RU2746055C1 |
| Способ генотипирования полиморфного локуса rs139794067 (G>T) гена MYL3 | 2025 |
|
RU2837876C1 |

Заявляемое техническое решение относится к области биотехнологии.
Сущностью является набор из 3-х праймеров для определения ОНП rs8065080 в гене TRPV1, обладающих активностью прямых и обратного праймеров в полимеразной цепной реакции и имеющих следующую структуру
Forward1: 5’-TGTGCCGTTTCATGTTTGTCTTCG-3̓ (24 н.)
Forward2: 5’-CTGTGCCGTTTCATGTTTGTCTTCA-3’ (25 н.)
Reverse: 5’-TGAGGTAGGAGAATTGCTTGAACC-3’ (24 н.)
Способ генотипирования однонуклеотидного полиморфизма rs8065080 в гене TRPV1 1 человека, заключающийся в том, что для проведения АС-ПЦР готовят реакционные смеси 1 и 2, содержащие компоненты для проведения реакции ПЦР, далее в реакционную смесь 1 добавляют праймер Forward1 и праймер Reverse по п.1, далее в реакционную смесь 2 добавляют праймер Forward2 и праймер Reverse по п.1, далее в реакционную смесь 1 и реакционную смесь 2 добавляют анализируемую ДНК, далее для реакционной смеси 1 и реакционной смеси 2 проводят реакцию АС-ПЦР по следующей программе: 94°С – 3 мин; далее 33 цикла: 94°С – 30 сек, 64°С – 10 сек, 72°С – 20 сек; далее 72°С – 2 мин; далее 4°С – ∞, на этом реакцию АС-ПЦР завершают; далее проводят разделение продуктов амплификации методом электрофореза в 1,5% агарозном геле, далее проводят визуализацию ДНК с помощью окрашивания бромистым этидием и последующего УФ-облучения. Идентификация однонуклеотидного полиморфизма rs8065080 в гене TRPV1 является перспективным методом для стратификации пациентов широкого ряда состояний, сопровождающихся болевыми ощущениями, таких как различные виды мигрени, остеоартроз, постгерпетическая невралгия, диабетический, посттравматический или постоперационный нейропатический болевой синдром, что даёт возможность обоснованного выбора проведения своевременной терапии, препятствующей хронизации боли у пациентов с учётом особенностей генома конкретного пациента. 2 н.п. ф-лы, 1 табл., 2 ил.
1. Набор из 3-х олигонуклеотидных праймеров для определения ОНП rs8065080 в гене TRPV1 человека, обладающих активностью прямых и обратного праймеров в полимеразной цепной реакции и имеющих следующую структуру:
Forward1: 5'-TGTGCCGTTTCATGTTTGTCTTCG-3' (24 н.)
Forward2: 5'-CTGTGCCGTTTCATGTTTGTCTTCA-3' (25 н.)
Reverse: 5'-TGAGGTAGGAGAATTGCTTGAACC-3' (24 н.).
2. Способ генотипирования однонуклеотидного полиморфизма rs8065080 в гене TRPV1 1 человека, заключающийся в том, что для проведения АС-ПЦР
готовят реакционные смеси 1 и 2, содержащие компоненты для проведения реакции ПЦР,
далее в реакционную смесь 1 добавляют праймер Forward1 и праймер Reverse по п.1,
далее в реакционную смесь 2 добавляют праймер Forward2 и праймер Reverse по п.1,
далее в реакционную смесь 1 и реакционную смесь 2 добавляют анализируемую ДНК,
далее для реакционной смеси 1 и реакционной смеси 2 проводят реакцию АС-ПЦР по следующей программе: 94°С – 3 мин; далее 33 цикла: 94°С – 30 сек, 64°С – 10 сек, 72°С – 20 сек; далее 72°С – 2 мин; далее 4°С – ∞, на этом реакцию АС-ПЦР завершают;
далее проводят разделение продуктов амплификации методом электрофореза в 1,5% агарозном геле,
далее проводят визуализацию ДНК с помощью окрашивания бромистым этидием и последующего УФ-облучения.
| СПОСОБ ПРИГОТОВЛЕНИЯ СМОЛЯНОГО БЕТОНА ДЛЯ УСТРОЙСТВА ДОРОГ | 1925 |
|
SU2565A1 |
| EDVINSSON et al., 1990, https://doi.org/10.1111/j.1476-5381.1990.tb15801.x; Cortright and Szallasi, 2009, https://eurekaselect.net/article/14209; Stucky et al., 2009, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2683630/ | |||
| ER et al., 2018, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5883834/. | |||
Авторы
Даты
2021-05-25—Публикация
2020-11-10—Подача