Настоящее изобретение относится к области молекулярной биологии и может быть использовано для выявления наследственной предрасположенности к гемохроматозу (НГХ). Предложен усовершенствованный метод одновременного генотипирования полиморфизмов H63D и C282Y в гене HFE с помощью ПЦР в реальном времени и флуоресцентной детекцией, основанной на использовании аллель-специфичных олигонуклеотидных зондов с двойной флуоресцентной меткой и 5'-экзонуклеазной активности ДНК-полимеразы.
Наследственный гемохроматоз является наиболее распространенной в Европе причиной первичной перегрузки железом, связанной с генетическими нарушениями его обмена. Болезнь развивается в связи с повышенным всасыванием железа из пищи, что ведет к его накоплению в паренхиматозных органах и их последующему повреждению. Для больных НГХ характерны поражения печени, поджелудочной железы, сердца и суставов, а также нарушения функций эндо- и экзокринных желез. В связи с тем что НГХ поражает самые разные органы и ткани, его проявления крайне разнообразны и неспецифичны и включают в себя пигментацию кожи, гепатит и цирроз печени, диабет, кардиомиопатии, импотенцию, утомляемость и поражения опорно-двигательного аппарата. В связи с этим ключевая роль в диагностике НГХ отводится лабораторным методам исследования обмена железа, а в последнее время все чаще - методам генодиагностики. За последние годы появились убедительные данные, показывающие, что НГХ в европейских популяциях в основном связан с мутациями в гене HFE. Большинство больных НГХ гомозиготны по мутации C282Y, меньшая часть, помимо мутации C282Y, имеет еще одну - H63D. У гомозиготных носителей H63D вероятность ГХ также повышена, хотя и в меньшей степени. Таким образом, генотипирование всего по двум мутациям позволяет выявлять основную долю заболеваний НГХ, что говорит о высокой эффективности генодиагностики этого заболевания и перспективности применения ДНК-тестирования на НГХ в практике здравоохранения, что, в свою очередь, требует создания высокопроизводительных и экономичных методов анализа мутаций, вызывающих НГХ.
Уровень техники
Диагностика мутаций, приводящих к НГХ, в настоящее время проводится с использованием разнообразных методов, позволяющих детектировать олигонуклеотидные полиморфизмы, в частности метода прямого секвенирования (Vizzi E. et al., Ann Hematol. 2005 Dec; 84(12):802-6.), гибридизации (Veneri D. et al., Leuk Res. 2005 Jun; 29(6):661-4.), анализа полиморфизма длин рестрикционных фрагментов (RU 2144556), аллель-специфичной ПЦР (Ingelmo M et al., J Hepatol. 2003 Jun; 38(6):745-50) и др.
Что касается методов секвенирования, то они обладают высокой точностью, однако мало пригодны для массового использования в медицинской практике, т.к. предъявляют высокие требования к качеству тестируемых образцов ДНК и требуют исключительно дорогостоящего оборудования и реагентов.
То же относится и к наиболее перспективным с точки зрения производительности вариантам гибридизационных методов. Возможность их масштабирования представляется весьма проблематичной из-за необходимости использования сложного оборудования для иммобилизации ДНК (специальные струйные принтеры, устройства для фотолитографии и др.) и дорогостоящих оптических приборов для считывания результатов (флуоресцентный микроскоп, аппаратура для измерения кинетики плавления и др.).
Хорошо разработанные и широко применяемые методы рестрикционного анализа (РА) обладают такими достоинствами, как простота и экономичность, однако во многих случаях оказываются недостаточно специфичными и дают высокий уровень ложных результатов, обычно связанных с перекрестной контаминацией образцов, которая является по существу неизбежным следствием многочисленных манипуляций (рестрикция, электрофорез), проводимых с этими образцами.
Аллель-специфичная ПЦР (АСП), в основе которой лежит применение праймеров, специфически связывающихся либо с нормальным, либо с мутантным вариантом гена, в своем классическом варианте, где продукты определяются электрофоретически, так же, как и РА, характеризуется высоким риском перекрестной контаминации.
Определенным успехом в разработке высокопроизводительного и при этом точного и сравнительно недорогого метода генотипирования полиморфизмов H63D и C282Y в гене HFE следует считать предложенный Ugozzoli L.A. et al. (Anal. Biochem. 2002 307:47-53) вариант ПЦР-анализа, использующего меченные флуоресцентным красителем аллель-специфичные олигонуклеотидные зонды, которые освобождаются из дуплекса под действием 5'-экзонуклеазной активности ДНК-полимеразы (US 5210015, 11.05.1993). Принцип этого метода связан со способностью ДНК-полимераз расщеплять за счет экзонуклеазной активности только ДНК, находящуюся в составе дуплекса, и не взаимодействовать с одноцепочечной ДНК. В основе детекции результатов лежит физическое явление миграции флуоресценции (переноса энергии): при облучении зонда происходит резонансный перенос энергии с возбужденного флуоресцентного красителя, связанного с 5'-концом зонда, на расположенный на его 3'-конце тушитель, в результате чего флуоресценция отсутствует. Последовательность нуклеотидов зонда выбирается так, чтобы он гибридизовался с внутренним районом продукта ПЦР в том участке, где расположен полиморфизм, а изменяющийся нуклеотид находился в центре зонда. В процессе репликации анализируемой молекулы ДНК (матрицы) ДНК-полимераза с 5'-экзонуклеазной активностью расщепляет связанный с матрицей зонд, вследствие чего происходит удаление друг от друга молекул красителя и тушителя, и тушение прекращается. В результате в каждом цикле ПЦР флуоресценция повышается пропорционально расщеплению зонда, или, что то же самое, пропорционально накоплению специфического продукта (фиг.1).
Если зонд полностью комплементарен последовательности образца, происходит формирование полноценного дуплекса, и в ходе амплификации зонд расщепляется, а флуоресценция возрастает. Если же нуклеотиды в образце и центральном положении зонда различаются, эффективность гибридизации снижается, зонд не расщепляется и возрастания флуоресценции не происходит. ДНК-полимераза может вытеснять не полностью комплементарный зонд из комплекса, не гидролизуя его, что также препятствует расщеплению пробы и подъему флуоресценции. Используя в одной пробе два зонда, меченные разными парами краситель/тушитель (одну комплементарную нормальному нуклеотиду, а другую - мутантному), можно по изменению флуоресценции на двух длинах волн судить о наличии в образце нормальной либо мутантной последовательности, в том числе и мутаций H63D и C282Y в гене HFE.
Способ генотипирования связанных с НГХ мутаций, описанный в работе Ugozzoli et al., является наиболее близким аналогом данного изобретения. Он совмещает в себе высокую чувствительность методов, основанных на ПЦР, и высокую эффективность, характерную для процедуры детектирования с применением нескольких флуоресцентных красителей, однако, как показали наши эксперименты по его применению, специфичность метода недостаточна для получения надежных результатов из-за существенной зависимости определяемых показателей от присутствия побочных продуктов реакции.
Раскрытие изобретения.
Задачей настоящего изобретения было повышение специфичности способа HFE-генотипирования, основанного на ПЦР-амплификации с аллель-специфичной гибридизацией нуклеотидных зондов, осуществляемой в режиме 5'-экзонуклеазного анализа, и детекцией, использующей множественное флуоресцентное окрашивание олигонуклеотидных зондов.
Решение этой задачи осуществлялось в направлении поиска возможностей для минимизации количества неспецифических флуоресцентно меченных продуктов, в частности продуктов частичной деградации меченых олигонуклеотидов, а также праймер-димеров, и реально было достигнуто за счет: а) введения стадии преинкубации реакционной смеси, не содержащей анализируемой ДНК; б) использования для запуска реакции приема «горячего старта» и в) выбора оптимальной комбинации пар флуоресцентный краситель/тушитель.
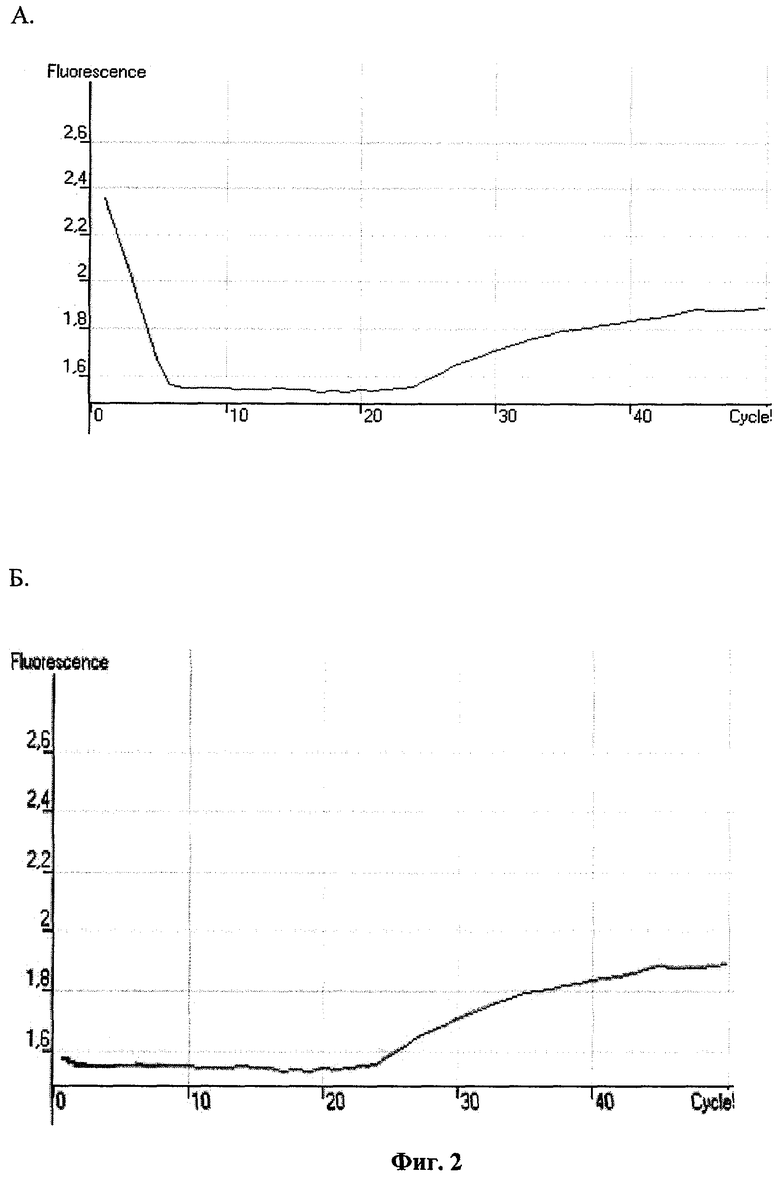
Стадия преинкубации заключается в достаточно продолжительном (не менее 1 часа) выдерживании при пониженной температуре (+4°С) подготовленной к проведению ПЦР реакционной смеси, содержащей все необходимые для этого компоненты, кроме ДНК-матрицы (анализируемой пробы). Этот прием впервые применяется в методе такого рода. Между тем, как показали наши исследования, он позволяет существенно снизить уровень неспецифической флуоресценции в начале реакции, связанной с самопроизвольным расщеплением части зондов (фиг.2).
Что касается запуска реакции с помощью «горячего старта», то он предполагает пространственное разъединение (пленкой из воска) в нагреваемой пробирке фермента и субстратов до момента достижения определенной температуры. Прием «горячего старта» достаточно широко применяется в методах, основанных на ПЦР, с целью снижения уровня неспецифической амплификации, однако, как правило, реакцию начинают добавлением фермента, а не ДНК. По нашим данным, запуск реакции добавлением ДНК, необходимость которого продиктована условиями эксперимента, приводит к аналогичным результатам, существенно подавляя процесс образования праймер-димеров (фиг.3).
В предлагаемом ДНК-анализе применяются праймеры и зонды, которые имеют последовательности, аналогичные использованным в способе-прототипе (таблица 1). Однако для флуоресцентного мечения зондов используются другие пары краситель/тушитель, которые по результатам проведенного нами предварительного отбора дали лучшие по сравнению с прототипом, результаты в плане различения сигналов от разных зондов (в табл.1 изменения по сравнению со способом-прототипом отмечены подчеркиванием).
Таким образом, сущность предлагаемого нового варианта ДНК-тестирования сразу двух полиморфизмов (H63D и C282Y), связанных с наследственным гемохроматозом, состоит в том, что анализируемую геномную ДНК подвергают ПЦР-амплификации с использованием ДНК-полимеразы, обладающей 5'-экзонуклеазной активностью; двух пар праймеров, каждая из которых ограничивает участок гена, включающий один из вариабельных нуклеотидов, и четырех аллель-специфичных олигонуклеотидных зондов, 5'- и 3'-концы каждого из которых связаны соответственно с определенными парами флуоресцентный краситель/тушитель (для зонда на нормальный вариант 63Н используют пару FAM и BHQ1; для зонда на мутантный вариант 63D - R6G и BHQ1; для зонда на нормальный вариант 282С - ROX и BHQ2 и для зонда на мутантный вариант 282Y - Су5 и BHQ3), и регистрируют процесс в реальном времени путем одновременного измерения интенсивности флуоресценции на нескольких длинах волн, сответствующих использованным красителям, причем до запуска реакции, который осуществляется с помощью приема «горячего старта», реакционную смесь, включающую все компоненты, кроме анализируемой ДНК, преинкубируют при +4°С не менее 1 часа.
Способ ДНК-тестирования по изобретению достаточно прост в исполнении, характеризуется высокой производительностью и чувствительностью и обладает более высоким по сравнению с прототипом уровнем специфичности (технический результат), вследствие чего повышается степень надежности получаемых предложенным методом результатов.
Краткое описание фигур
Фиг.1 - Схема реакции в области присоединения зондов. Обозначения: F - флуоресцентный краситель 1; V - флуоресцентный краситель 2; Т - тушитель; Taq - Taq-полимераза.
Фиг.2 - Общий вид кривой изменения флуоресценции во времени. Обозначения: по оси абсцисс - число циклов ПЦР; по оси ординат - интенсивность флуоресценции. «А» - без преинкубации реакционной смеси; «Б» - после преинкубации в течение 60 мин.
Фиг.3 - Кривая плавления продукта амплификации с интеркалирующим красителем SYBRGreen. Сплошная линия - с «горячим стартом», пунктирная - без «горячего старта». Bin A - пиковая область кривой плавления продуктов амплификации с «горячим стартом»; Bin В - пиковая область кривой плавления продуктов амплификации без «горячего старта». Применение горячего старта способствует уменьшению количества праймер-димеров и увеличению выхода специфического продукта.
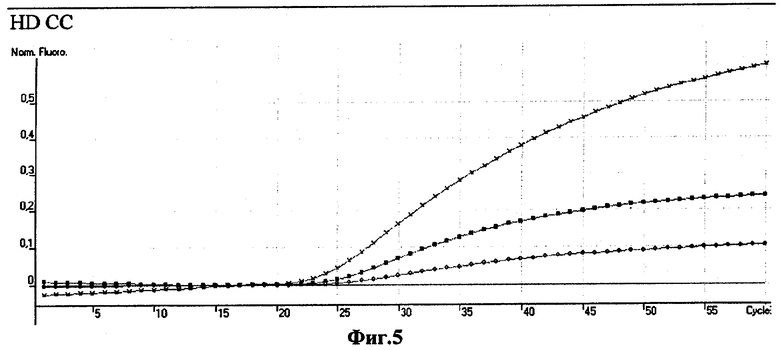
Фиг.4 - Фиг.9. - Кривые изменения флуоресценции во времени при анализе ДНК пациентов с различным генотипом. Обозначения: по оси абсцисс - число циклов ПЦР; по оси ординат - интенсивность флуоресценции.
Фиг.4 - генотип НН СС;
Фиг.5 - генотип HD СС.
Фиг.6 - генотип DD СС;
Фиг.7 - генотип НН CY.
Фиг.8 - генотип НН YY;
Фиг.9 - генотип HD CY.
Осуществление изобретения.
Пример 1. Подготовка проб для анализа.
1.1. Выделение геномной ДНК для проведения анализа.
Исследования проводили на геномной ДНК, выделенной из образцов крови, которые были получены от здоровых доноров. Выделение и очистку ДНК проводили с помощью модифицированного метода фенол-хлороформной экстракции с протеиназой К.
В 1,5 мл пробирку (Eppendorf) добавляли 700 мкл размороженной крови и 700 мкл гемолитика, перемешивали на вортексе и осаждали клетки центрифугированием в течение 3 мин при 7000 g. Затем удаляли 700 мкл супернатанта, а клеточный осадок ресуспендировали на вортексе, добавляли 750 мкл гемолитика, повторяли центрифугирование (при тех же условиях) и удаляли весь супернатант. Проделывали эти операции до тех пор, пока супернатант не становился почти бесцветным. К полученному клеточному осадку добавляли 400 мкл буфера для протеиназы К (10 мМ Трис-HCl, рН 7,4, 10 мМ ЭДТА, 150 мМ NaCl, 0,5% SDS), и протеиназу К до конечной концентрации 200 мкг/мл, ресуспендировали осадок пилотированием и инкубировали смесь 4 часа при 60°С, перемешивая на термошейкере (850 об/мин). После этого добавляли 400 мкл фенола, перемешивали на вортексе и оставляли на 5 мин при комнатной температуре, продолжая перемешивание. Разделяли фазы центрифугированием в течение 2 мин при 10000 g. Верхнюю водную фазу (350 мкл) переносили в новую пробирку, добавляли туда же 200 мкл фенола и 200 мкл смеси хлороформа и изоамилового спирта (24:1), перемешивали на вортексе и снова разделяли фазы центрифугированием (2 мин при 10000 g.). После этого верхнюю водную фазу (300 мкл) переносили в новую пробирку и добавляли 300 мкл смеси хлороформа и изоамилового спирта (24:1), перемешивали, снова оставляли на 5 мин и центрифугировали, как описано выше. 240 мкл верхней фазы отбирали в пробирку, добавляли 600 мкл этанола, охлажденного до -20°С, и 25 мкл ацетата Na, pH 5,2, оставляли на 20 мин при -20°С, после чего осаждали ДНК центрифугированием в течение 10 мин при 10000 g и удаляли супернатант. К осадку добавляли 1 мл 70% этанола, аккуратно перемешивали, центрифугировали 2 мин при 10000 g, удаляли супернатант, а осадок высушивали на термошейкере до исчезновения видимых следов этанола. Осадок растворяли в 200 мкл ТЕ-буфера при 37°С в течение 10 мин с периодическим перемешиванием.
Измерение концентрации ДНК производили на фотометре фирмы Eppendorf. Разводили полученный раствор ТЕ-буфером до концентрации ДНК 50 нг/мкл. И хранили до использования при -20°С.
1.1. Олигонуклеотидные праймеры и аллель-специфичные зонды
Праймеры и зонды для данного метода были синтезированы ЗАО «Синтол» и имели последовательности, аналогичные использованным в способе-прототипе (таблица 1). Для флуоресцентного мечения зондов использовались пары краситель/тушитель, которые по результатам проведенного нами предварительного отбора дали наилучшие результаты в плане дифференциации сигналов от различных зондов (в табл.1 изменения по сравнению со способом-прототипом отмечены подчеркиванием).
1.3. Составление и подготовка реакционной смеси для проведения ПЦР
Конечный объем реакционной смеси в микропробирке для анализа составлял 25 мкл. Она состояла из 10 мкл «нижней смеси» и 15 мкл «верхней смеси», разделенных перегородкой из воска. Каждую из смесей готовили предварительно в количестве, необходимом для анализа всех проб, исходя при этом из приведенного ниже расчета компонентов на одну пробу.
Состав нижней смеси для одной пробы (объем 10 мкл):
- 6 мкл буферного раствора, содержащего:
10 пкмоль H63D прямого праймера (HFE63forwFluo),
10 пкмоль H63D обратного праймера (HFE63revFluo),
5 пкмоль H63D зонда дикого типа (HFE63wildprobeFluo),
5 пкмоль H63D зонда мутантного типа (HFE63mutprobeFluo),
10 пкмоль C282Y прямого праймера (HFE282forwFluo),
10 пкмоль C282Y обратного праймера (HFE282revFluo),
5 пкмоль C282Y зонда дикого типа (HFE282wildprobeFluo) и
5 пкмоль C282Y зонда мутантного типа (HFE282mutprobeFluo);
- 2,5 мкл 2 мМ раствора dNTP и
- 1,5 мкл Н2О.
Состав верхней смеси для одной пробы (объем 14 мкл):
- 8,4 мкл Н2О;
- 0,6 мкл раствора Taq - полимеразы с концентрацией 5 U/мкл (3U);
- 5 мкл 5х буфера следующего состава: 67 мМ трисHCl, рН 8,3; 17 мМ (NH4)2SO4; 2,5 мМ MgCl2; 0,1% твин-20; 0,12 мг/мл BSA и 8% глицерин;
Пробирки, содержащие верхнюю и нижнюю смеси, разделенные восковой перегородкой, инкубировали 1 час при +4°С.
После завершения инкубации добавляли в каждую пробирку по 1 мкл анализируемой ДНК и пробирки помещали в термоциклер Rotor-Gene фирмы Corbett Research.
Пример 2. Проведение анализа и регистрация результатов.
2.1. Запуск реакции.
Полимеразная цепная реакция начиналась в результате объединения верхней и нижней смеси после плавления восковой перегородки при нагревании пробы на стадии начальной денатурации (прием «горячего старта»).
2.2. Условия проведения ПЦР
- Начальная денатурация - 95°С, 3 мин 30 сек;
- 60 циклов:
- денатурация - 95°С, 10 сек;
- отжиг + элонгация - 59°С, 45 сек.
2.3. Измерение флуоресценции.
ПЦР-реакцию оценивали по изменению интенсивности флуоресценции, которая регистрировалась термоциклером Rotor-Gene в реальном времени. Детекция изменений флуоресценции каждого из зондов проводилось в области максимума свечения связанного с ним красителя; результат во времени получали в виде характерной для данных условий ПЦР кривой. Анализ полученных кривых позволял получить картинку, характерную для одного из возможных генотипов тестируемого образца ДНК (фиг.4-9).
Пример 3. Анализ гомозиготных и гетерозиготных по мутантному аллелю образцов ДНК.
Для проверки чувствительности и специфичности метода использовали гомозиготные и гетерозиготные по мутантному аллелю образцы ДНК, генотип которых был предварительно установлен методом аллель-специфичной гибридизации и подтвержден методом масс-спектрометрии.
Ниже приводятся данные одной из серий экспериментов, в которой было проанализировано 6 образцов ДНК. Предварительно было установлено, что они имеют следующие генотипы: образец 1 - НН СС; образец 2 - HD СС; образец 3 - DD СС; образец 4 - НН CY; образец 5 - НН YY и образец 6 - HD CY. Ожидалось получение следующих результатов.
Образец 1: для зондов с красителем FAM и красителем ROX - увеличение интенсивности флуоресценции; для зондов с красителем JOE и красителем Су5 - отсутствие флуоресценции.
Образец 2: для зондов с красителем FAM, красителем JOE и красителем ROX - увеличение интенсивности флуоресценции; для зонда с красителем Су5 - отсутствие флуоресценции.
Образец 3: для зондов с красителем JOE и красителем ROX - увеличение интенсивности флуоресценции; для зондов с красителем FAM и красителем Су5 - отсутствие флуоресценции.
Образец 4: для зондов с красителем FAM, красителем Су5 и красителем ROX - увеличение интенсивности флуоресценции; для зонда с красителем JOE - отсутствие флуоресценции.
Образец 5: для зондов с красителем FAM и красителем Су5 - увеличение интенсивности флуоресценции; для зондов с красителем JOE и красителем ROX - отсутствие флуоресценции.
Образец 6: для зондов с красителем FAM, красителем JOE, красителем ROX и красителем Су5 - увеличение интенсивности флуоресценции.
Суммарные графики зависимости интенсивности флуоресценции от количества проведенных циклов ПЦР для 6 проанализированных проб ДНК представлены на фиг.4-9. Во всех случаях полученные результаты совпадали с ожидаемыми.
По результатам тестирования 72-х образцов ДНК разработанным нами способом процент ошибочных определений составлял 0%. При анализе тех же образцов в соответствии с методом-прототипом в 12,5% случаев были получены ошибочные (не совпадающие с эталонным определением) результаты.
Таким образом, можно заключить, что в результате создания настоящего изобретения предложен усовершенствованный способ генотипирования полиморфизмов H63D и C282Y с помощью ПЦР в реальном времени и флуоресцентной детекцией, проводимой в формате 5'-экзонуклеазного анализа, который отличается более высокой специфичностью, а следовательно, и надежностью по сравнению с ближайшим аналогом.
Промышленная применимость
Описанный в настоящем изобретении метод полностью готов к непосредственному применению в медицинской практике. С помощью этого метода нами было проведено исследование популяционной частоты полиморфизмов гена HFE в положениях 63 и 282 у здоровых доноров из числа военнослужащих. Получены следующие результаты: 6,4% являлись гетерозиготами по C282Y, а 0,2% - гомозиготами. Аллельная частота C282Y равнялась 0,035. По мутации H63D 24,6% доноров оказались гетерозиготами и 2,9% были гомозиготами. Аллельная частота H63D составила 0,152. Доля компаундных гетерозигот, несших обе мутации, равнялась 1,2%. Установленное распределение генотипов соответствовало уравнению Харди-Вайнберга.
Учитывая надежность различения с помощью нового метода гетеро- и гомозиготных состояний, данный ДНК-тест представляется весьма перспективным при установлении причин нарушений, связанных с первичной перегрузкой организма железом, выражающихся в повышении уровня насыщения трансферрина железом и/или повышении уровня ферритина сыворотки. Если после проведения предложенного способа ДНК-тестирования у больных с указанными биохимическими изменениями обнаруживаются генотипы YY, YD или DD, то аномалии обмена железа с высокой степенью вероятности можно считать результатом генетической предрасположенности. Если по данным проведенного исследования установлено наличие генотипов CY или DH, то это свидетельствует лишь о возможном вкладе генетических механизмов. Отсутствие мутантных аллелей C282Y или H63D свидетельствует о вторичном, ненаследственном генезе нарушений обмена железа.
По аналогичному алгоритму строятся рекомендации по итогам скрининга здоровой популяции на риск развития перегрузки железом и ее осложнений. Лицам, у которых данным методом выявлены генотипы YY, DD и YD, рекомендуется регулярное (раз в год) проведение биохимического анализа уровня железа. Если при этом обнаруживается отклонение содержания железа от нормы, пациентам требуется обязательная коррекция его обмена. Риск развития перегрузки железом у лиц с другими генотипами незначительно превышает средний по популяции, поэтому можно считать, что каких-либо специальных диагностических и терапевтических мер не требуется.
Источники информауии
1. Ingelmo M, Sanchez M, Villa M, Ingelmo M, Sanz С, Bruguera M, Ascaso С, Oliva R. Population screening for hemochromatosis: a study in 5370 Spanish blood donors. J Hepatol. 2003 Jun; 38(6):745-50.
2. McCune CA, Ravine D, Carter K, Jackson HA, Hutton D, Hedderich J, Krawczak M, Worwood M. Iron loading and morbidity among relatives of HFE C282Y homozygotes identified either by population genetic testing or presenting as patients. Gut. 2005 Sep 23.
3. Veneri D, Franchini M, Krampera M, de Matteis G, Solero P, Pizzolo G. Analysis of HFE and TFR2 gene mutations in patients with acute leukemia. Leuk Res. 2005 Jun; 29(6):661-4.
4. Vizzi E., Loureiro CL, Gerder M, de Las Nieves Garcia-Casal M, Rodriguez-Larralde A, Gerace L, Ludert JE, Liprandi F, Pujol FH. Mutation analysis of the HFE gene associated with hereditary hemochromatosis in a Venezuelan sample. Ann Hematol. 2005 Dec; 84(12):802-6.
5. RU 2144556.
6. Ugozzoli L.A., Chirm D., Hamby K. Fluorescent multicolor multiplex homogeneous assay for the simultaneous analysis of the two most common hemochromatosis mutations. Anal. Biochem. 2002 307:47-53.
7. US 5210015, 11.05.1993.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИДЕНТИФИКАЦИИ МУТАЦИЙ S65C, H63D, C282Y И ПОЛИМОРФИЗМА 2 EX + 4T>C В ГЕНЕ HFE | 2008 |
|
RU2396354C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАСЛЕДСТВЕННОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ПРИВЫЧНОГО НЕВЫНАШИВАНИЯ БЕРЕМЕННОСТИ | 2012 |
|
RU2532367C2 |
| ПРИМЕНЕНИЕ ДНК-ДИАГНОСТИКИ НА НАЛИЧИЕ ПОЛИМОРФИЗМА R353Q В ГЕНЕ ФАКТОРА VII СВЕРТЫВАНИЯ КРОВИ ДЛЯ ОЦЕНКИ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ПРИВЫЧНОГО НЕВЫНАШИВАНИЯ БЕРЕМЕННОСТИ И СПОСОБ ОЦЕНКИ ПРЕДРАСПОЛОЖЕННОСТИ К ЭТОМУ ЗАБОЛЕВАНИЮ ПУТЕМ АНАЛИЗА СОЧЕТАНИЯ ПОЛИМОРФИЗМОВ С677Т ГЕНА MTHFR И R353Q ГЕНА ФАКТОРА VII | 2006 |
|
RU2330071C1 |
| СПОСОБ ДЕТЕКЦИИ ДЕЛЕЦИИ У КРЫС ЛИНИИ DAT | 2023 |
|
RU2811140C1 |
| Способ диагностики точечных мутаций в нативной ДНК с применением оксида графена | 2015 |
|
RU2614111C1 |
| Способ генотипирования однонуклеотидного варианта rs3219484 (C>T) гена MUTYH человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2835215C1 |
| Способ генотипирования однонуклеотидного варианта rs2269578 (G>C) гена XBP1 человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2831205C1 |
| Способ генотипирования однонуклеотидного варианта rs6443265 (T>C) гена OGG1 человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2831204C1 |
| Способ генотипирования однонуклеотидного варианта rs13056243 (С>Т) гена ZNRF3 человека методом полимеразно-цепной реакции в режиме реального времени | 2023 |
|
RU2819836C1 |
| Способ генотипирования однонуклеотидного варианта rs2097461 (T>C) гена XBP1 человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2831202C1 |







Изобретение относится к области молекулярной биологии и может быть использовано в медицине. Предложен усовершенствованный способ одновременного генотипирования полиморфизмов H63D и C282Y в гене HFE с помощью метода ПЦР в реальном времени с флуоресцентной детекцией. Новый способ отличается высоким уровнем специфичности, который достигается благодаря минимизации количества неспецифических флуоресцентно меченных продуктов, в частности продуктов частичной деградации меченых олигонуклеотидов, а также праймер-димеров, за счет а) введения стадии преинкубации реакционной смеси, не содержащей анализируемой ДНК, при t=+4°C не менее 1 часа; б) использования для запуска реакции приема «горячего старта» и в) выбора оптимальной комбинации пар флуоресцентный краситель/тушитель; FAM и BHQ1 для зонда на нормальный вариант 63H; R6G и BHQ1 для зонда на мутантный вариант 63D; ROX и BHQ2 для зонда на нормальный вариант 282С и Сy5 и BHQ3 для зонда на мутантный вариант 282Y. Предлагаемый способ полностью адаптирован к непосредственному использованию в условиях клиники, где перспектива его применения связана с оценкой генетической предрасположенности к нарушениям обмена железа в организме. 9 ил., 2 табл.
Способ одновременного ДНК-тестирования на наличие полиморфизмов H63D и C282Y в гене HFE, связанных с наследственным гемохроматозом, предусматривающий ПЦР-амплификацию анализируемой геномной ДНК с использованием ДНК-полимеразы, обладающей 5′-экзонуклеазной активностью; двух пар праймеров, каждая из которых ограничивает участок гена, включающий один из вариабельных нуклеотидов, и четырех аллель-специфичных олигонуклеотидных зондов, 5′- и 3′-концы каждого из которых связаны соответственно с определенным флуоресцентным красителем и тушителем, и регистрацию процесса в реальном времени путем одновременного измерения интенсивности флуоресценции на нескольких длинах волн, соответствующих использованным красителям, отличающийся тем, что реакционную смесь, включающую все компоненты, кроме анализируемой ДНК, преинкубируют при +4°С не менее 1 ч, реакцию запускают с помощью приема «горячего старта», а для флуоресцентного мечения аллель-специфичных олигонуклеотидов используют следующие пары краситель/тушитель: для зонда на нормальный вариант 63Н - FAM и BHQ1; для зонда на мутантный вариант 63D - R6G и BHQ1; для зонда на нормальный вариант 282С - ROX и BHQ2 и для зонда на мутантный вариант 282Y - Сy5 и BHQ3.
| UGOZZOLI L.A | |||
| ET AL., Anal | |||
| Biochem., 2002, v.307, p.47-53 | |||
| US 6140054, 30.09.1998 | |||
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА CHLAMYDIACEAE | 2003 |
|
RU2245369C1 |
| СПОСОБЫ И НАБОРЫ РЕАГЕНТОВ ДЛЯ ГЕНАМПЛИФИКАЦИОННОЙ ДИАГНОСТИКИ МЕТОДАМИ ПЦР И РНК-ПЦР | 2000 |
|
RU2164532C1 |
Авторы
Даты
2007-08-10—Публикация
2006-02-08—Подача