Изобретение относится к молекулярной биологии, в частности, к способам загрузки (заполнения) экзосом малыми некодирующими РНК, для возможности их последующей таргетной доставки в отдельные ткани живых организмов.
Известен способ загрузки экзосом антацианидинами [патент WO 2014134132 A1 Milk-derived microvesicle compositions and related methods], где экзосомы получают из коровьего молока, далее обрабатывают их микроРНК, что в результате позволяет использовать экзосомы в качестве транспортеров микроРНК с перспективой их применения при лечении различных заболеваний. Данный метод имеет следующие недостатки: 1) в известном способе используются экзосомы из коровьего молока, что не позволит достигнуть высокой эффективности доставки в отдельные ткани человека. Ввиду различия в белковых последовательностях, коровьи экзосомы могут восприниматься человеческим организмом как чужеродные и не проникать в некоторые органы и ткани достаточно эффективно по сравнению с человеческими экзосомами. 2) в известном способе не представлены данные по максимальной эффективности загрузки молекул микроРНК, а учитывая потенциал ее дальнейшего терапевтического использования и достаточно высокую стоимость синтеза данных молекул, эффективная загрузка может быть существенным фактором для практического применения микроРНК загруженных в экзосомы.
Техническим эффектом, достигаемом при реализации заявленного способа является возможность максимальной загрузки экзосом, полученных из биологических жидкостей человека малыми некодирующими микроРНК, что в дальнейшем позволит использовать загруженные экзосомы в качестве транспортных структур для доставки терапевтических агентов в опухолевые клетки живых организмов.
Вышеприведенный технический результат достигается тем, что в забуференном фосфатом физиологическом растворе (PBS), смешивают экзосомы, полученные из мочи или периферической венозной крови человека и малую некодирующую РНК в соотношении на 1 мл раствора 1*10∧10÷5*10∧10 экзосом и 10*10∧12÷50*10∧12 копий малой некодирующей РНК, далее полученную смесь выдерживают в термостате при 35-40°С в течение 14-18 часов.
После проведения инкубирования веществ необходим этап ультрацентрифугирования с целью отделения экзосом с загруженным веществом - в процессе ультрацентрифугирования они сформируют осадок на дне пробирки - от загружаемого свободного вещества, которое в процессе ультрацентрифугирования останется в растворе (супернатанте).
Ультрацентрифугирование предпочтительно проводить в ρежиме 100000 g в течение 2-х часов, что обеспечивает максимальное осаждение содержащихся в растворе загруженных экзосомы.
Пример 1
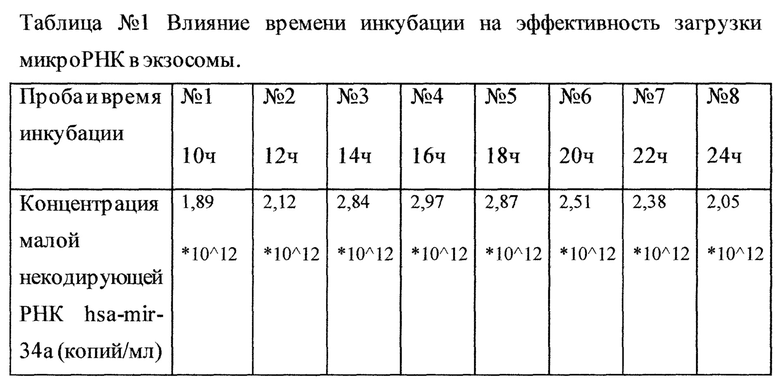
Предварительно полученные методом градиентного ультрацентрифугирования на сахарозе из мочи человека объемом 100 мл экзосомы в количестве 10*10∧10 и 80*10∧12 копий малой некодирующей РНК hsa-mir-34a были смешаны в 8 мл PBS. Полученную смесь разделили на 8 проб по 1 мл: первую пробу оставили в термостате при 40°С на 10 часов, вторую пробу оставили в термостате при 40°С на 12 часов, третью пробу оставили в термостате при 40°С на 14 часов, четвертую пробу оставили в термостате при 40°С на 16 часов, пятую пробу оставили в термостате при 40°С на 18 часов, шестую пробу оставили в термостате при 40°С на 20 часов, седьмую пробу оставили в термостате при 40°С на 22 часа и восьмую пробу оставили в термостате при 40°С на 24 часа. По истечение соответствующего времени инкубации проводили ультрацентрифугирование пробы при 100000g в течение 2 часов, после чего полученный осадок разводили в 1 мл PBS, проводили 3 цикла заморорозки-разморозки с целью разрушения экзосом и получения свободной молекулы-маркера (малая некодирующая РНК has-mir-34а) с последующей постановкой ПЦР в реальном времени. В результате, концентрация малой некодирующей РНК hsa-mir-34a в 3-ей, 4-ой и 5-ой пробах, оказалась наиболее высокой. Из таблицы №1 наглядно видно что идет плавный подъем концентрации загруженной микроРНК достигая максимальных значений в 3-ей, 4-ой и 5-ой пробах, после чего следует плавный спад, что свидетельствует о наиболее эффективном времени инкубации в интервале 14-18 часов.
Пример 2
Предварительно полученные методом градиентного
ультрацентрифугирования на сахарозе из мочи человека объемом 100 мл экзосомы в количестве 2*10∧9 и 10*10∧12 копий малой некодирующей РНК hsa-rnir-122 были смешаны в 1 мл PBS (образец №1). Также были получены образцы с концентрацией экзосом 1*10∧10 (образец №2), с концентрацией экзосом 5*10∧10 (образец №3)и с концентрацией экзосом 25*10∧10 (образец №4). Полученные образцы оставили в термостате при 40°С на 16 часов. По истечение соответствующего времени инкубации проводили ультрацентрифугирование проб при 100000 g в течение 2 часов, после чего полученный осадок разводили в 1 мл PBS, проводили 3 цикла заморорозки-разморозки с целью разрушения экзосом и получения свободной молекулы - маркера (малая некодирующая РНК hsa-mir-122) с последующей постановкой ПЦР в реальном времени. В результате, концентрация малой некодирующей РНК hsa-mir-122 во 2-ой и 3-ей пробах, оказалась наиболее высокой. Из таблицы №2 наглядно видно что идет плавный подъем концентрации загруженной микроРНК достигая максимума во 2-ой и 3-ей пробах, после чего следует плавный спад, что свидетельствует о оптимальной концентрации экзосом в интервале 1*10∧10/мл-5*10∧10/мл.

Пример 3
Предварительно полученные методом градиентного ультрацентрифугирования на сахарозе из мочи человека объемом 100 мл экзосомы в количестве 30*10∧10 и 60*10∧12 копий малой некодирующей РНК hsa-mir-16 были смешаны в 6 мл PBS. Полученную смесь разделили на 6 проб по 1 мл: первую пробу оставили в термостате при 25°С на 16 часов, вторую пробу оставили в термостате при 30°С на 16 часов, третью пробу оставили в термостате при 35°С на 16 часов, четвертую пробу оставили в термостате при 40°С на 16 часов, пятую пробу оставили в термостате при 45°С на 16 часов и шестую пробу оставили в термостате при 50°С на 16 часов.
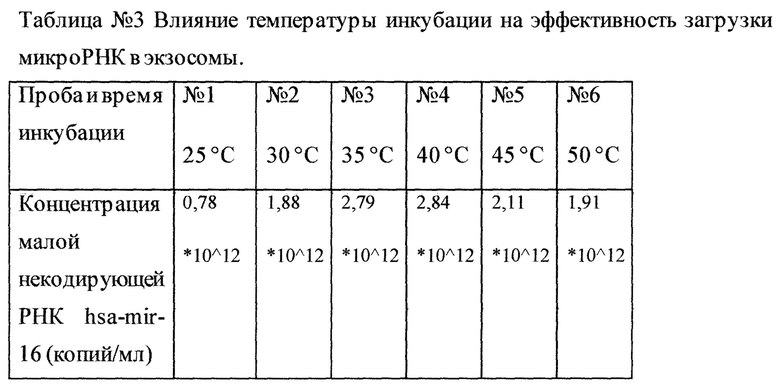
По истечение соответствующего времени инкубации проводили ультрацентрифугирование пробы при 100000 g в течение 2 часов, после чего полученный о садок разводили в 1 мл PBS, проводили 3 цикла заморорозки-разморозки с целью разрушения экзосом и получения свободной молекулы -маркера (малая некодирующая РНК has-mir-16) с последующей постановкой ПЦР в реальном времени. В результате, концентрация малой некодирующей РНК hsa-mir-16 в 3-ей и 4-ой пробах, оказалась наиболее высокой. Из таблицы №3 наглядно видно что идет плавный подъем концентрации загруженной микроРНК достигая максимума в 3-ей и 4-ой пробах, после чего следует плавный спад, что свидетельствует о наиболее эффективной температуре инкубации в интервале 35-40°С.
Пример 4
Предварительно полученные методом градиентного ультрацентрифугирования на сахарозе из мочи человека объемом 100 мл экзо сомы в количестве 5*10∧10 и 1*10∧12 копий малой некодирующей РНК hsa-mir-122 были смешаны в 1 мл PBS (образец№1). Также были получены образцы с концентрацией малой некодирующей РНК 10*10∧12 копий (образец №2), с концентрацией малой некодирующей РНК 50*10∧10 (образец №3)и с концентрацией малой некодирующей РНК 100*10∧12 (образец №4).
Полученные образцы оставили в термостате при 40°С на 16 часов. По истечение соответствующего времени инкубации проводили ультрацентрифугирование проб при 100000 g в течение 2 часов, после чего полученный о садок разводили в 1 мл PBS, проводили 3 цикла заморорозки-разморозки с целью разрушения экзосоми получения свободной молекулы -маркера(малая некодирующая РНК hsa-mir-122) с последующей постановкой ПЦР в реальном времени. В результате, процент загруженной в экзосомы малой некодирующей РНК hsa-mir-122 во 2-ой и 3-ей пробах, оказался наиболее высоким. Из таблицы №1 наглядно видно что идет плавный подъем процента загруженной микроРНК достигая максимума во 2 -ой и 3 -ей пробах, после чего следует плавный спад, что свидетельствует о оптимальной концентрации малой некодирующей РНК в интервале 10*10∧12/мл÷50*10∧12/мл.

Следует отметить что может использоваться любой тип малых некодирующих РНК, с любой нуклеотидной последовательностью, и это не влияет на качество загрузки, а конкретная микроРНК выбирается только исходя из поставленных задач.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ МИКРОРНК ИЗ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 2013 |
|
RU2548816C1 |
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ИНГАЛЯЦИИ | 2019 |
|
RU2799315C2 |
| Способ снижения уровней экспрессии генов LRNN3, GRAP, VAMP5 | 2021 |
|
RU2759806C1 |
| СПОСОБ ДИАГНОСТИКИ И МОНИТОРИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ИСПОЛЬЗОВАНИЕМ ЭКЗОСОМ КРОВИ | 2014 |
|
RU2571507C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2014 |
|
RU2556825C1 |
| ИСПОЛЬЗОВАНИЕ БИОГЕНЕЗА МИКРОРНК В ЭКЗОСОМАХ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2014 |
|
RU2644247C2 |
| Способ выделения свободных и экзосомальных микроРНК из слюны | 2018 |
|
RU2729423C2 |
| Способ подавления метастазирования опухолей | 2018 |
|
RU2678569C1 |
| СПОСОБ ИММУНОТЕРАПИИ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2707281C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КЛЕТОЧНЫЕ ВЕЗИКУЛЫ, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2824136C2 |
Настоящее изобретение относится к молекулярной биологии, в частности к способу загрузки экзосом малыми некодирующими РНК, для возможности их последующей таргетной доставки в отдельные ткани живых организмов. Для осуществления способа в забуференном фосфатом физиологическом растворе (PBS) смешивают экзосомы, полученные из мочи или периферической венозной крови человека, и малую некодирующую РНК в соотношении на 1 мл раствора 1*10∧10÷5*10∧10 экзосом и 10*10∧12÷50*10∧12 копий малой некодирующей РНК. Далее полученную смесь выдерживают в термостате при 35-40°С в течение 14-18 часов. Настоящее изобретение позволяет осуществить максимальную загрузку экзосом, полученных из биологических жидкостей человека, малыми некодирующими микроРНК, что в дальнейшем позволит использовать загруженные экзосомы в качестве транспортных структур для доставки терапевтических агентов в опухолевые клетки живых организмов. 4 табл., 4 пр.
Способ загрузки экзосом малыми некодирующими РНК, при котором в забуференном фосфатом физиологическом растворе (PBS) смешивают экзосомы, полученные из мочи или периферической венозной крови человека, и малую некодирующую РНК в соотношении на 1 мл раствора 1*10∧10÷5*10∧10 экзосом и 10*10∧12÷50*10∧12 копий малой некодирующей РНК, далее полученную смесь выдерживают в термостате при 35-40°С в течение 14-18 часов.
| WO 2014134132 A1, 04.09.2014 | |||
| СПОСОБ ВЫДЕЛЕНИЯ МИКРОРНК ИЗ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ | 2013 |
|
RU2548816C1 |
| CN 105779586 B, 07.02.2020 | |||
| ТАМКОВИЧ С.Н | |||
| и др., Экзосомы: механизмы возникновения, состав, транспорт, биологическая активность, использование в диагностике, Биологические мембраны, т.33, No.3, 2016, с.163-175. | |||
Авторы
Даты
2021-05-31—Публикация
2020-08-27—Подача