ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Исследование внеклеточных везикул, в первую очередь экзосом, быстро прогрессирует. Множество статей опубликовано о биогенезе экзосом (Kowal et al., 2014, Curr Opin Cell Biol. 29C:116-125), их диагностическом и прогностическом потенциале (Revenfeld et al., 2014, Clin Ther. 36(6):830-846), а также потенциальном терапевтическом применении в тканевой инженерии и регенеративной медицине (Lamichhane et al., 2014, Tissue Eng Part B Rev.). Такие векторы с мРНК, микроРНК, белками и липидными медиаторами способны оказывать действие на клетки-мишени, способствуя межклеточному взаимодействию и обмену функциональной генетической информацией (Simons and Raposo, 2009, Curr Opin Cell Biol. 21(4):575‐581; Stoorvogel et al., 2002, Traffic 3(5):321‐330; Nieuwland and Sturk, 2010, Thrombosis Research 125(Supplement 1):S49‐S51).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, в частности, к внеклеточным продуктам (например, везикулам, таким как микровезикулы, например, экзосомы), продуцируемым почечными клетками (такими как биоактивные почечные клетки, например, селективные почечные клетки). В конкретных вариантах осуществления такие продукты используют для лечения заболеваний почек, таких как хроническое заболевание почек. Изобретение также охватывает способы изменения компонентов (таких как микроРНК или белки) везикул, продуцируемых клетками, а также способы получения везикул, содержащих различные соединения. Также предложены способы диагностики и лечения.
Один из аспектов относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества выделенных секретированных везикул почечных клеток, при этом везикулы вводят внутривенной инъекцией или транскатетерной доставкой.
Один из аспектов настоящего изобретения относится к способу обнаружения по меньшей мере одного соединения в везикуле. В конкретных вариантах осуществления способ включает получение везикулы и определение того, присутствует ли в везикуле по меньшей мере одно соединение, при этом (i) по меньшей мере одно соединение представляет собой белок, и белок представляет собой CD9, CD81, CD146, CD326, CD40, CD42a, CD44, CD49e и/или SSEA-4; (ii) по меньшей мере одно соединение представляет собой микроРНК, при этом микроРНК включает по меньшей мере две из miR-145, miR-22, miR-7, miR-10a, miR-143 и/или let7b; и/или (iii) по меньшей мере одно соединение не экспрессируется или не продуцируется почечными клетками в естественной почке.
Один из аспектов настоящего изобретения относится к способу мониторинга лечения популяцией биоактивных почечных клеток у субъекта, которому была введена популяция биоактивных почечных клеток. В конкретных вариантах осуществления способ включает определение того, присутствует ли по меньшей мере одно соединение в везикуле от субъекта, способом, раскрытым в настоящем документе.
Один из аспектов настоящего изобретения относится к способу определения того, является ли везикула регенеративной. В конкретных вариантах осуществления способ включает (i) определение того, присутствует ли белок и/или микроРНК в везикуле, способом, раскрытым в настоящем документе; и (ii) идентификацию везикулы как регенеративной, если белок и/или микроРНК обнаружены в везикуле.
Один из аспектов настоящего изобретения относится к способу определения уровня по меньшей мере одной микроРНК в везикулах из популяции биоактивных почечных клеток. В конкретных вариантах осуществления способ включает (i) определение того, увеличено ли содержание одной или более из следующих молекул микроРНК в везикулах в сравнении с контролем: miR-1248, miR-3168, miR-7113-5p, miR-758-3p, miR-937-3p, miR-4455, miR-4521, miR-203a-3p, miR-22-3p, miR-574-3p, miR-181b-5p, miR-1260b и/или miR-181b-5p; и (ii) определение того, уменьшено ли содержание одной или более из следующих молекул микроРНК в везикулах в сравнении с контролем: miR-1-3p, miR-1-3p, miR-143-3p, miR-150-5p, miR-509-3p, miR-653-5p, miR-204-5p, miR-192-5p и/или miR-363-3p. В конкретных вариантах осуществления микроРНК представляет собой микроРНК млекопитающего, например, микроРНК человека.
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества везикул из препарата везикул, при этом везикула из препарата везикул была идентифицирована, как регенеративная, способом, раскрытым в настоящем документе.
В конкретных вариантах осуществления настоящего изобретения предложен способ лечения заболевания почек у субъекта, включающий введение субъекту эффективного количества композиции, содержащей популяцию биоактивных почечных клеток с добавлением везикул почечных клеток, которые не были секретированы популяцией биоактивных почечных клеток.
Один из аспектов настоящего изобретения относится к способу изменения уровня по меньшей мере одной микроРНК и/или белка в везикулах, продуцируемых популяцией биоактивных почечных клеток, включающему культивирование популяции в гипоксических условиях.
Один из аспектов настоящего изобретения относится к везикуле, содержащей соединение, которое не продуцируется почечными клетками в естественной почке.
Один из аспектов настоящего изобретения относится к композиции, содержащей везикулу, раскрытую в настоящем документе, и фармацевтически приемлемый носитель.
Один из аспектов настоящего изобретения относится к композиции, содержащей везикулу почечной клетки и везикулу не почечной клетки.
Один из аспектов настоящего изобретения относится к композиции, содержащей везикулу, продуцируемую первичной почечной клеткой, и везикулу, продуцируемую селективной почечной клеткой.
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества композиции, раскрытой в настоящем документе.
Один из аспектов настоящего изобретения относится к способу получения везикул (например, микровезикул, таких как экзосомы) из клеток, при этом везикулы содержат соединение, которое не продуцируется клетками. В конкретных вариантах осуществления способ включает выделение везикул из супернатанта культуры клеток, при этом супернатант культуры клеток получен от культуры клеток, которые были в контакте с соединением (например, инкубировались в среде, содержащей соединение). В конкретных вариантах осуществления способ включает выделение везикул (например, микровезикул, таких как экзосомы) из супернатанта культуры клеток, с последующим введением соединения в везикулы путем пермеабилизации мембран экзосом для облегчения проникновения соединения (например, путем обработки ультразвуком, липофекции, электропорации и так далее).
Один из аспектов настоящего изобретения относится к способу получения почечной экзосомы, при этом экзосома содержит соединение, которое не продуцируется почечными клетками в естественной почке. В конкретных вариантах осуществления способ включает выделение везикулы из супернатанта культуры почечных клеток, при этом супернатант культуры почечных клеток получен из культуры почечных клеток, содержащей популяцию биоактивных почечных клеток, которые находились в контакте с соединением.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1: Схема последовательности операций для неограничивающего примера всего процесса производства NKA.
ФИГ. 2A-D: Более подробные схемы последовательности операций для неограничивающего примера процесса, представленного на ФИГ. 1.
ФИГ. 3A-D: Схемы последовательности операций для неограничивающего примера получения NKA, дополненного экзосомами из СПК.
ФИГ. 4A-D: Графики, иллюстрирующие анализ поверхностных белков секретируемых экзосом, выделенных из TCHK0012 и TCHK0013. Анализ показал, что экспрессия CD133, CD326 и CD49e повышена в случае СПК в сравнении с БПК. При том, что точная функция CD133 остается неизвестной, было высказано предположение, что он действует в качестве организатора топологии клеточной мембраны. Молекула адгезии эпителиальных клеток (EpCAM) (также известная как CD326) представляет собой трансмембранный гликопротеин, опосредующий Ca2+-независимую однотипную межклеточную адгезию в эпителии. EpCAM также участвует в клеточной сигнализации, миграции, пролиферации и дифференциации. Известно, что помимо адгезии, интегрины, такие как CD49e, участвуют в опосредованной клеточной поверхностью сигнализации. На ФИГ. 4B-D добавлены стрелки, чтобы подчеркнуть сравнения между экзосомами из БПК-3A и СПК.
ФИГ. 5: Графики по результатам FACS-анализа слияния экзосом с клетками. Флуоресцентное мечение клеток, свидетельствующее о переносе липофильного красителя из экзосом в клеточную мембрану, приводит к смещению линии гистограммы слева направо. Экзосомы не прикрепляются и не сливаются с клеточными мембранами при 4 градусах C. Это является отрицательным контролем. Инкубация при 37 градусах C приводит к прикреплению и слиянию, и следовательно, флуоресцентному мечению клеток, за счет чего происходит сдвиг гистограммы слева направо.
ФИГ. 6: График, показывающий клеточную пролиферацию в виде среднего количества клеток (ось y) в ответ на разные дозы экзосом, происходящих из популяций почечных клеток (доза/ответ с 1X=x нг/мл экзосом).
ФИГ. 7A-C: Изображения клеток. Культуры инкубировали в течение 9 часов после обработки. A. Не содержащая сыворотку и фактор роста среда (отрицательный контроль). B. Не содержащая сыворотку и фактор роста среда с добавлением 10E10 экзосом (тестируемый препарат). C. Не содержащая сыворотку среда с добавлением факторов роста (положительный контроль).
ФИГ. 8: Группы микроРНК, имеющие значительные различия при разных экспериментальных условиях (E1 против D1) показаны на графике рассеяния для большого массива данных. График рассеяния для большого массива данных показывает распределение дифференциально экспрессированных микроРНК в соответствии с кратностью изменения (ось x) и значимостью (отрицательный логарифм P-значения на оси y). Горизонтальная пунктирная линия представляет собой пороговую величину P-значения (0,05), и вертикальные пунктирные линии представляют собой пороговую величину кратности изменения (|Log2 кратности изменения|≥1). Смотри также Таблицы 11-13.
ФИГ. 9: Группы микроРНК, имеющие значительные различия при разных экспериментальных условиях (F1 против A1) показаны на графике рассеяния для большого массива данных. Смотри также Таблицы 14-16.
ФИГ. 10: Схема последовательности операций для неограничивающего примера процесса производства экзосом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, в частности, к внеклеточным продуктам (например, везикулам, таким как микровезикулы, например, экзосомы), продуцируемым почечными клетками (такими как биоактивные почечные клетки, например, селективные почечные клетки).
Все литературные источники, цитированные в заявке, специально включены в настоящий документ посредством ссылки в полном объеме. В случае, если один или более из включенных литературных источников, патентов и аналогичных материалов отличается, или противоречит настоящей заявке, включая, но без ограничения, определенные термины, использование терминов, описанные методики, или тому подобное, настоящая заявка имеет преимущественную силу.
Определения
Если нет иных указаний, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое им обычно придают специалисты в области, к которой относится настоящее изобретение. В сборнике Principles of Tissue Engineering, 3rd Ed. (под редакцией R Lanza, R Langer, & J Vacanti), 2007, специалист в данной области может найти общее руководство для понимания многих терминов, используемых в настоящей заявке. Специалист в данной области понимает, что многие способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы при осуществлении на практике настоящего изобретения. Действительно, настоящее изобретение никоим образом не ограничено описанными способами и материалами.
При использовании в настоящем документе форма единственного числа терминов должна включать также и соответствующую форму множественного числа, если из контекста четко не следует иное. При использовании в настоящем документе термин «и/или» включает любые, и все, сочетания одного или более из связанных перечисленных объектов.
В настоящей заявке термины «содержит», «содержащий», «заключающий в себе», «имеющий», и тому подобные, могут иметь значение, приписываемое им в Патентном законодательстве США, и могут означать «включает», «включающий» и тому подобное. Аналогично, термины «состоящий преимущественно из» или «преимущественно состоит» имеют значение, приписываемое им в Патентном законодательстве США, и термин является открытым, допуская наличие не только того, что было перечислено, при условии, что основные или новые характеристики перечисленного не изменяются в результате присутствия дополнения к тому, что перечислено, за исключением вариантов осуществления предшествующего уровня техники.
Используемый в настоящем документе термин «примерно» в контексте числового значения или диапазона означает ±10% от указанного или заявленного числового значения или диапазона, если только контекст не подразумевает более ограниченный диапазон.
Используемый в настоящем документе термин «популяция клеток» означает некоторое количество клеток, полученных путем выделения непосредственно из подходящей исходной ткани, как правило, ткани млекопитающего. В конкретных вариантах осуществления выделенную популяцию клеток можно впоследствии культивировать in vitro. Специалисты в данной области понимают, что можно использовать различные способы выделения и культивирования популяций клеток, используемых по настоящему изобретению, и различное количество клеток в популяции клеток, подходящих для использования по настоящему изобретению. В конкретных вариантах осуществления популяция клеток может представлять собой не фракционированную, гетерогенную популяцию клеток или обогащенную гомогенную популяцию клеток, полученных из органа или ткани, например, из почки. В конкретных вариантах осуществления гетерогенная популяция клеток может быть выделена из биопсийного образца ткани или из ткани целого органа. В конкретных вариантах осуществления гетерогенная популяция клеток может быть получена из in vitro культур клеток млекопитающих, созданных из биопсийных образцов ткани или из ткани целого органа. Не фракционированную гетерогенную популяцию клеток также можно называть необогащенной популяцией клеток. В конкретных вариантах осуществления популяции клеток содержат биоактивные клетки. Гомогенные популяции клеток содержат большее количество клеток одного и того же клеточного типа, имеющих общий фенотип или имеющих сходные физические свойства, в сравнении с не фракционированной, гетерогенной популяцией клеток. В конкретных вариантах осуществления гомогенная популяция клеток может быть выделена, извлечена или обогащена из гетерогенной популяции почечных клеток. В конкретных вариантах осуществления гомогенную популяцию клеток получают в виде фракции клеток при разделении гетерогенной клеточной суспензии методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью. В конкретных вариантах осуществления гомогенную популяцию клеток получают в виде фракции клеток при разделении гетерогенной клеточной суспензии методом разделения в непрерывном или прерывистом (одноступенчатом или многоступенчатом) градиенте плотности. В конкретных вариантах осуществления популяция клеток может содержать 1, 2, 3, 4 или более типов почечных клеток. В конкретных вариантах осуществления гомогенную или гетерогенную популяцию клеток, полученных из почки, смешивают с гомогенной или гетерогенной популяцией клеток, полученных из ткани или органа, отличного от почки, без дополнительного ограничения.
Используемый в настоящем документе термин «биоактивные» означает «обладающие биологической активностью», например, фармакологической или терапевтической активностью. В конкретных вариантах осуществления биологическая активность представляет собой улучшение почечной функции и/или оказание влияния на почечный гомеостаз. В конкретных вариантах осуществления биологическая активность представляет собой, без ограничения, анальгетическую; противовирусную; противовоспалительную; антинеопластическую; иммуностимулирующую; иммуномодулирующую активность; повышение жизнеспособности клеток, антиоксидантную активность, способность к переносу кислорода, рекрутингу клеток, прикреплению клеток, иммуносупрессии, ангиогенезу, ранозаживляющую активность, мобилизацию стволовых клеток или клеток-предшественников хозяина, способность к пролиферации клеток, стимуляции миграции клеток к поврежденным участкам, ослаблению клеточного и тканевого фиброза, интерференции с каскадом сигнального пути эпителиально-мезенхимального перехода, секреции цитокинов, факторов роста, белков, нуклеиновых кислот, активность в отношении экзосом, микровезикул, или любое их сочетание.
Используемый в настоящем документе термин «биоактивные почечные клетки», или «БПК», означает почечные клетки, имеющие одно или более из следующих свойств при введении их в почку субъекта: способность уменьшать (например, замедлять или останавливать) ухудшение состояния или прогрессирование хронического заболевания почек или его симптома, способность улучшать почечную функцию, способность оказывать влияние на (улучшать) почечный гомеостаз и способность стимулировать заживление, восстановление и/или регенерацию почечной ткани или почки. В конкретных вариантах осуществления микровезикулы из БПК и/или БПК можно вводить пациенту, при этом гаплотип БПК отличается от гаплотипа пациента. В конкретных вариантах осуществления БПК представляют собой клетки, способные улучшать почечную функцию, оказывать влияние на (улучшать) почечный гомеостаз и/или стимулировать заживление, восстановление и/или регенерацию почечной ткани или почки без иммунологического отторжения. В конкретных вариантах осуществления эти клетки могут включать функциональные клетки почечных канальцев (например, на основании улучшения экскреции креатинина и удержания белка), гломерулярные клетки (например, на основании улучшения удержания белка), сосудистые клетки и другие клетки кортикомедуллярного соединения. В конкретных вариантах осуществления БПК оказывают регенеративный эффект на почку. В конкретных вариантах осуществления БПК включают, состоят в основном из, или состоят из селективных почечных клеток (СПК). В конкретных вариантах осуществления БПК представляют собой СПК. В конкретных вариантах осуществления БПК получают путем выделения и размножения почечных клеток из почечной ткани. В конкретных вариантах осуществления БПК получают путем выделения и размножения почечных клеток из почечной ткани с использованием способов селекции биоактивных клеток (например, клеток с регенеративной способностью).
В конкретных вариантах осуществления СПК представляют собой клетки, полученные путем выделения и размножения почечных клеток из соответствующей почечной ткани, при этом СПК содержат большую процентную долю одного или более типов клеток и лишены, или содержат более низкую процентную долю, одного или более других типов клеток, в сравнении с исходной популяцией почечных клеток. В конкретных вариантах осуществления СПК содержат повышенную процентную долю БПК в сравнении с исходной популяцией почечных клеток. В конкретных вариантах осуществления популяция СПК представляет собой выделенную популяцию почечных клеток, обогащенную по конкретным биоактивным компонентам и/или типам клеток, и/или истощенную по конкретным неактивным и/или нежелательным компонентам или типам клеток, предназначенную для использования в лечении заболевания почек, то есть, для обеспечения стабилизации и/или улучшения и/или восстановления почечной функции. В конкретных вариантах осуществления микровезикулы из СПК и/или СПК можно вводить пациенту, при этом гаплотип СПК отличается от гаплотипа пациента. В конкретных вариантах осуществления СПК способны обеспечивать стабилизацию и/или улучшение, и/или восстановление почечной функции. СПК обеспечивают превосходные терапевтические и регенеративные результаты в сравнении с исходной популяцией. В конкретных вариантах осуществления СПК получают из ткани коркового слоя почки пациента путем биопсии почки. В конкретных вариантах осуществления СПК отбирают (например, методом MACS или FACS) на основании экспрессии ими одного или более маркеров. В конкретных вариантах осуществления СПК истощают (например, методом MACS или FACS) по одному или более типам клеток на основании экспрессии одного или более маркеров на этих типах клеток. В конкретных вариантах осуществления истощение или отбор клеток включает связывание с гранулой/антителом для извлечения клеток с определенными белками на их клеточной поверхности. В конкретных вариантах осуществления СПК выбирают из популяции биоактивных почечных клеток. В конкретных вариантах осуществления СПК отбирают путем разделения в градиенте плотности размноженных почечных клеток. В конкретных вариантах осуществления СПК отбирают путем разделения размноженных почечных клеток методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью, или путем разделения в прерывистом одноступенчатом градиенте плотности. В конкретных вариантах осуществления СПК отбирают путем разделения в непрерывном или прерывистом градиенте плотности размноженных почечных клеток, которые были культивированы в гипоксических условиях. В конкретных вариантах осуществления СПК отбирают путем разделения в градиенте плотности размноженных почечных клеток, которые были культивированы в гипоксических условиях в течение по меньшей мере примерно 8, 12, 16, 20 или 24 часов. В конкретных вариантах осуществления СПК отбирают путем разделения методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью размноженных почечных клеток, которые были культивированы в гипоксических условиях. В конкретных вариантах осуществления СПК отбирают путем разделения размноженных почечных клеток, которые были культивированы в гипоксических условиях в течение по меньшей мере примерно 8, 12, 16, 20 или 24 часов, методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью (например, разделения в прерывистом одноступенчатом градиенте плотности). В конкретных вариантах осуществления СПК состоят в основном из клеток почечных канальцев. В конкретных вариантах осуществления другие паренхиматозные (например, сосудистые) и стромальные (например, собирающих протоков) клетки могут присутствовать в СПК. В конкретных вариантах осуществления менее примерно 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% клеток в популяции СПК представляют собой сосудистые клетки. В конкретных вариантах осуществления менее примерно 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% клеток в популяции СПК представляют собой клетки собирающих протоков. В конкретных вариантах осуществления менее примерно 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% клеток в популяции СПК представляют собой сосудистые клетки или клетки собирающих протоков. Способы получения СПК раскрыты, например, в примере 1 настоящего документа, а также в Presnell et al. WO/2010/056328, Ilagan et al. PCT/US2011/036347 и Jain et al. PCT/US2016/044866.
Термин «естественный орган» означает орган живого субъекта. Субъект может быть здоровым или нездоровым. Нездоровый субъект может иметь заболевание, связанное с этим конкретным органом.
Термин «естественная почка» означает почку живого субъекта. Субъект может быть здоровым или нездоровым. Нездоровый субъект может иметь заболевание почек.
Термин «регенеративный эффект» означает эффект, который приносит пользу естественному органу, такому как почка. Эффект может включать, без ограничения, уменьшение степени повреждения естественного органа, либо улучшение, восстановление или стабилизацию функции, или структуры, естественного органа. Повреждение почек может иметь форму фиброза, воспаления, гломерулярной гипертрофии, атрофии и так далее, и быть связано с заболеванием естественного органа у субъекта.
«Обогащенная» популяция клеток, или препарат, означает популяцию клеток, полученную из исходной популяции клеток органа (например, не фракционированной, гетерогенной популяции клеток из органа, такого как почка), которая содержит большую процентную долю клеток определенного типа, чем процентная доля клеток этого типа в исходной популяции. Например, исходная популяция почечных клеток может быть обогащена по первой, второй, третьей, четвертой, пятой, и так далее, интересующей популяции клеток. В настоящем документе термины «популяция клеток», «препарат клеток» и «клеточный фенотип» используют взаимозаменяемо.
Используемый в настоящем документе термин «гипоксические» условия культивирования означает условия культивирования, в которых клетки имеют доступные уровни кислорода в системе культивирования, пониженные относительно стандартных условий, в которых клетки культивируют при атмосферных уровнях кислорода (примерно 21%). В конкретных вариантах осуществления гипоксические условия культивирования являются такими условиями, в которых уровень кислорода в системе культивирования составляет менее 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1%.
Используемый в настоящем документе термин «биологический материал» означает природный или синтетический биосовместимый материал, подходящий для введения в живую ткань, поддерживающий селективные биоактивные клетки в жизнеспособном состоянии. Природный биологический материал представляет собой материал, который создан в живой системе, или происходит из нее. Синтетические биологические материалы представляют собой материалы, которые непосредственно не созданы в живой системе, или не происходят из нее, но являются синтезированными или полученными с использованием определенных химических процедур и протоколов, хорошо известных специалистам в данной области. Биологические материалы, раскрытые в настоящем документе, могут представлять собой сочетание природных и синтетических биосовместимых материалов. Описанные в настоящем документе биологические материалы включают, например, полимерные матрицы и каркасы. Специалисты в данной области понимают, что биологический материал(ы) может быть сконфигурирован в различных формах, например, в виде поропласта, гелей, жидкостей, гранул, твердых веществ, и может включать один или более природных или синтетических биосовместимых материалов. В конкретных вариантах осуществления биологический материал представляет собой раствор в жидкой форме, который способен превращаться в гидрогель.
Используемый в настоящем документе термин «гидрогель» означает вещество, образующееся, когда в органическом полимере (природном или синтетическом) происходит перекрестная сшивка за счет ковалентных, ионных или водородных связей, с образованием трехмерной структуры (например, структуры с открытой решеткой), которая захватывает воду, образуя гель. Примеры материалов, которые можно использовать для получения гидрогеля, включают полисахариды, такие как альгинат, полифосфазины и полиакрилаты, которые сшиты тонически, или блок-сополимеры, такие как плюроники™ или тетроники™, блок-сополимеры полиэтиленоксида и полипропиленгликоля, сшивки в которых образуются за счет температуры или pH, соответственно. В конкретных вариантах осуществления гидрогель представляет собой биоразлагаемый желатиновый гидрогель.
В конкретных вариантах осуществления биологические материалы включают, например, внеклеточный матрикс, полученный из почки человека или животного, при этом естественная популяция клеток была элиминирована за счет применения детергентов и/или других химических веществ, известных специалистам в данной области. В конкретных вариантах осуществления биологический материал представляет собой раствор в жидкой форме, который способен превращаться в гидрогель и образует слои с содержанием, или без содержания, определенных популяций клеток за счет применения методологии трехмерной биопечати, известной специалистам в данной области. В конкретных вариантах осуществления биологический материал сконфигурирован для имитации трехмерной фрактальной организации почки, лишенной клеток.
Термин «модифицированное высвобождение» или эквивалентные термины «контролируемое высвобождение», «отсроченное высвобождение» или «замедленное высвобождение» относятся к препаратам, которые высвобождают активное средство, такое как биоактивные клетки, на протяжении некоторого времени или в более, чем один, момент времени, после введения индивидууму. Модифицированное высвобождение активного средства, которое может происходить в течение целого ряда желаемых промежутков времени, например, минут, часов, дней, недель, или более длительных периодов времени, в зависимости от препарата, отличается от высвобождения стандартных препаратов, в которых практически вся единица дозы становится доступной непосредственно после введения. В конкретных вариантах осуществления для применения в тканевой инженерии и регенеративной медицине препараты с модифицированным высвобождением обеспечивают высвобождение активного средства в нескольких временных точках после локального введения (например, введения активного средства непосредственно в солидный орган). Например, препарат с модифицированным высвобождением биоактивных клеток обеспечивал бы первоначальное высвобождение клеток непосредственно в момент введения и последующее, второе, высвобождение клеток в более позднее время. В конкретных вариантах осуществления отсрочка по времени для второго высвобождения активного средства может составлять несколько минут, часов или дней после первоначального введения. Как правило, период времени для отсрочки высвобождения соответствует периоду времени, необходимому для того, чтобы биологический материал - носитель активного средства потерял свою структурную целостность. Отсроченное высвобождение активного средства начинается сразу после начала нарушения такой целостности и завершается к моменту времени, когда целостность нарушается полностью. Специалистам в данной области известны и другие подходящие механизмы высвобождения.
Термин «температура окружающей среды» означает температуру, при которой препараты по настоящему изобретению будут введены субъекту. Как правило, температура окружающей среды представляет собой температуру помещения с контролируемой температурой. Температура окружающей среды находится в диапазоне от примерно 18°C до примерно 30°C. В конкретных вариантах осуществления температура окружающей среды составляет примерно 18°C, примерно 19°C, примерно 20°C, примерно 21°C, примерно 22°C, примерно 23°C, примерно 24°C, примерно 25°C, примерно 26°C, примерно 27°C, примерно 28°C, примерно 29°C или примерно 30°C.
Неограничивающие примеры заболевания почек включают заболевания, ассоциированные с любой стадией или степенью тяжести острого или хронического заболевания почек, которое приводит к утрате почкой способности выполнять функцию фильтрования крови и удаления избытка жидкости, электролитов и продуктов распада из крови. В конкретных вариантах осуществления заболевание почек также может включать эндокринные дисфункции, такие как анемия (недостаток эритропоэтина) и минеральный дисбаланс (недостаток витамина D). Заболевание почек может изначально развиваться в почках, или может быть вторичным по отношению к различным состояниям, включая (но без ограничения) сердечную недостаточность, гипертензию, диабет, аутоиммунное заболевание или заболевание печени. Заболевание почек может представлять собой состояние хронического заболевания почек, которое развивается после острого повреждения почек. Например, повреждение почек вследствие ишемии и/или воздействия токсических веществ может вызывать острое заболевание почек; неполное восстановление после острого повреждения почек может приводить к развитию хронического заболевания почек.
Термин «лечение» означает как терапевтическое лечение, так и профилактические или превентивные меры в отношении заболевания почек, анемии, нарушений канальцевого транспорта или нарушений гломерулярной фильтрации, при этом целью является обращение вспять, предотвращение или замедление (облегчение) целевого заболевания. Нуждающиеся в лечении субъекты включают тех, которые уже имеют заболевание почек, анемию, нарушение канальцевого транспорта или нарушение гломерулярной фильтрации, а также тех, которые предрасположены к развитию заболевания почек, анемии, нарушения канальцевого транспорта или нарушения гломерулярной фильтрации, или тех, у кого заболевание почек, анемия, нарушение канальцевого транспорта или нарушение гломерулярной фильтрации должно быть предотвращено. Используемый в настоящем документе термин «лечение» включает стабилизацию и/или улучшение почечной функции.
Используемый в настоящем документе термин «контактирование in vivo» естественного органа с активным средством (таким как обогащенная популяция клеток и/или их продукт) означает прямой контакт in vivo между активным средством и естественным органом. Например, продукты, секретируемые обогащенной популяцией почечных клеток, могут in vivo контактировать с естественной почкой (отдельно или совместно с клетками, например, в конструкции). В конкретных вариантах осуществления прямое контактирование in vivo по своему характеру может быть паракринным, эндокринным или юкстакринным. В конкретных вариантах осуществления секретируемые продукты могут представлять собой гетерогенную популяцию разных продуктов, описанных в настоящем документе.
В конкретных вариантах осуществления настоящее изобретение относится к «конструкции», или «препарату», содержащей одну или более популяций клеток и/или один или более клеточных продуктов (таких как микровезикулы, например, экзосомы), расположенных на, или в, поверхности биологического материала (например, каркаса или матрицы из одного или более синтетических или природных биосовместимых материалов). В конкретных вариантах осуществления одна или более популяций клеток могут быть покрыты, расположены на, погружены в, присоединены к, высеяны на, или заключены в биологическом материале, выполненном из одного или более синтетических или природных биосовместимых биологических материалов, полимеров, белков или пептидов. В конкретных вариантах осуществления природный биологический материал представляет собой лишенную клеток почку человека или животного. В конкретных вариантах осуществления из биологического материала была создана структура путем трехмерной биопечати. В конкретных вариантах осуществления одна или более популяций клеток и/или клеточных продуктов могут быть объединены с биологическим материалом, либо каркасом или матрицей, in vitro или in vivo. В конкретных вариантах осуществления один или более биологических материалов, используемых для создания конструкции, или препарата, можно выбирать для управления, облегчения или создания возможности диспергирования и/или интегрирования клеточных компонентов конструкции в эндогенной ткани хозяина, или для управления, облегчения или создания возможности выживания, приживления, толерантности или функциональной активности клеточных компонентов конструкции или препарата. В конкретных вариантах осуществления один или более биосовместимых материалов, используемых для создания каркаса/биологического материала, выбирают для управления, облегчения или создания возможности образования многоклеточной трехмерной организации из по меньшей мере одной из популяций клеток, нанесенных на него. В конкретных вариантах осуществления биологические материалы управляют, стимулируют или облегчают сборку определенных трехмерных клеточных агрегатов, или органоидов, которые повторяют аспекты естественной почечной ткани, включая, но без ограничения, организационную полярность. В конкретных вариантах осуществления биологические материалы управляют сборкой определенных канальцевых структур, которые повторяют аспекты естественной почечной ткани, включая просветы. В конкретных вариантах осуществления биологические материалы стимулируют или облегчают секрецию белков, нуклеиновых кислот и микровезикул из популяций клеток. В конкретных вариантах осуществления один или более биологических материалов, используемых для создания конструкции, также могут быть выбраны для имитации или воссоздания аспектов конкретной трехмерной организации или экологической ниши внутри естественной почки или почечной паренхимы, представляющей оригинальную биологическую среду, из которой эти популяции клеток были получены. Без связи с какой-либо научной теорией, считается, что воссоздание оригинальной биологической ниши, которая служила источником этих популяций клеток, дополнительно стимулирует или способствует выживанию и активности клеток.
Термин «клеточный агрегат», или «сфероид», означает агрегат или совокупность клеток, культивируемых для достижения 3D роста, в отличие от роста в виде монослоя. Следует отметить, что термин «сфероид» не означает, что агрегат представляет собой геометрическую сферу. В конкретных вариантах осуществления агрегат может быть высокоорганизован с четко определенной морфологией и полярностью, или может представлять собой неорганизованную массу; он может включать один тип клеток или более одного типа клеток. В конкретных вариантах осуществления клетки могут представлять собой первичные изоляты или стабильную линию клеток, или сочетания обоих вариантов. Данное определение охватывает органоиды и органотипические культуры. В конкретных вариантах осуществления сфероиды (например, клеточные агрегаты или органоиды) образуются во вращающейся колбе. В конкретных вариантах осуществления сфероиды (например, клеточные агрегаты или органоиды) образуются в 3-мерной матрице.
Термин «Neo-Kidney Augment (NKA)» относится к биоактивному клеточному препарату, который представляет собой инъекционный препарат, состоящий из СПК, сформулированных в биологическом материале, состоящем из желатинового гидрогеля. Термин «прогрессивная клеточная терапия» («Advance Cell Therapy (ACT)») также используют применительно к лечению препаратом NKA. В конкретных вариантах осуществления NKA представляет собой инъекционный препарат, содержащий популяцию иммунологически совместимых почечных клеток (например, иммунологически совместимых СПК), сформулированных в биологическом материале, состоящем из желатинового гидрогеля. В конкретных вариантах осуществления NKA представляет собой инъекционный препарат, состоящий из геномно модифицированных иммунологически привилегированных, гомологичных СПК, неспособных вызывать иммунное отторжение, сформулированных в биологическом материале, состоящем из желатинового гидрогеля.
Термин «субъект» должен означать любого отдельного субъекта-человека, включая пациента, подходящего для лечения, который испытывает или испытывал один или более признаков, симптомов, или других показателей заболевания почек. Такие субъекты включают, без ограничения, субъектов, которым впервые поставлен диагноз, или которым диагноз был поставлен ранее и в настоящее время они испытывают возврат или рецидив заболевания, или имеют риск развития заболевания почек, независимо от причины. Субъект мог ранее получать лечение, или не получать лечение, от заболевания почек.
Термин «пациент» означает любое животное, более предпочтительно, млекопитающее (включая таких отличных от людей животных, как, например, собаки, кошки, лошади, кролики, животные зоопарка, коровы, свиньи, овцы и приматы), которые нуждаются в лечении. Наиболее предпочтительно, пациент по настоящему изобретению является человеком.
Термин «образец», или «образец от пациента», или «биологический образец», должен, в целом, означать любой биологический образец, полученный от субъекта или пациента, жидкость организма, ткань тела, линию клеток, культуру ткани или другой источник. Термин включает биопсийные образцы ткани, такие как, например, биопсийные образцы почки. Термин включает культивированные клетки, такие как, например, культивированные клетки почки млекопитающего. Методы получения биопсийных образцов тканей и культивированных клеток от млекопитающих хорошо известны в данной области. В зависимости от контекста, если термин «образец» используют отдельно, он все-еще должен означать, что «образец» представляет собой «биологический образец» или «образец от пациента», то есть, термины используют взаимозаменяемо.
Термин «тестируемый образец» означает образец от субъекта, обработанный способом по настоящему изобретению. Тестируемый образец может быть получен из разных источников в организме субъекта-млекопитающего, включая, без ограничения, кровь, сперму, сыворотку, мочу, костный мозг, слизистую оболочку, ткань и так далее.
Термин «контроль», или «контрольный образец», означает отрицательный или положительный контроль, для которого ожидают отрицательный или положительный результат, который можно сопоставлять с результатом тестируемого образца. Контроли, подходящие для настоящего изобретения, включают, без ограничения, образец, который, как известно, обладает признаками, характерными для нормальной функции почек, образец, полученный от субъекта, который, как известно, не страдает заболеванием почек, и образец, полученный от субъекта, который, как известно, страдает заболеванием почек. В конкретных вариантах осуществления контролем может быть образец, полученный от субъекта до лечения его способом по настоящему изобретению. В конкретных вариантах осуществления подходящим контролем может быть тестируемый образец, полученный от субъекта, который, как известно, страдает заболеванием почек любого типа или стадии, а также образец от субъекта, который, как известно, не страдает заболеванием почек какого-либо типа или стадии. Контролем может быть специально подобранный нормальный здоровый субъект. Специалистам в данной области известны и другие контроли, подходящие для использования по настоящему изобретению.
Термины «прогноз регенерации», «прогноз восстановления» или «прогноз для регенерации», как правило, относятся к прогнозу или предсказанию возможного восстановительного процесса или результата после введения или имплантации популяции клеток, клеточного продукта или конструкции, описанных в настоящем документе. В случае прогноза регенерации основанием для прогноза, или предсказания, может являться одно или более из следующего: улучшение функционирования органа (например, почки) после имплантации или введения, развитие функциональной почки после имплантации или введения, появление улучшенной функции или активности почек после имплантации или введения, а также экспрессия определенных маркеров естественной почкой после имплантации или введения.
Термин «регенерированный орган» означает естественный орган после имплантации или введения популяции клеток, клеточного продукта или конструкции, описанных в настоящем документе. В конкретных вариантах осуществления регенерированный орган характеризуется различными показателями, включая, без ограничения, развитие функции или активности в естественном органе, улучшение функции или активности в естественном органе, уменьшение определенных маркеров и физиологических показателей, ассоциированных с заболеванием, и/или экспрессия определенных маркеров в естественном органе. Специалисты в данной области понимают, что и другие показатели могут быть подходящими для характеристики регенерированного органа.
Термин «регенерированная почка» означает естественную почку после имплантации или введения популяции, смеси или конструкции клеток, описанных в настоящем документе. В конкретных вариантах осуществления регенерированная почка характеризуется различными показателями, включая, без ограничения, развитие функции или активности в естественной почке, улучшение функции или активности в естественной почке, уменьшение определенных маркеров и физиологических показателей, ассоциированных с заболеванием почек, и экспрессия определенных маркеров в естественной почке. Специалисты в данной области понимают, что и другие показатели могут быть подходящими для характеристики регенерированной почки.
«Малая молекула» представляет собой соединение, имеющее массу менее 2000 дальтон. Молекулярная масса малой молекулы предпочтительно составляет менее 1000 дальтон, более предпочтительно менее 600 дальтон, например, соединение имеет массу менее 500 дальтон, 400 дальтон, 300 дальтон, 200 дальтон, или 100 дальтон. В конкретных вариантах осуществления малая молекула представляет собой органическое соединение.
«Микровезикула» представляет собой происходящую из клетки мембранную внеклеточную везикулу диаметром от 30 до 1000 нанометров (нм). «Экзосома» представляет собой происходящую из клетки мембранную микровезикулу, имеющую диаметр примерно 30-150 нм. В конкретных вариантах осуществления экзосома представляет собой происходящую из клетки мембранную микровезикулу, имеющую диаметр примерно 50-100 нм. Дополнительные признаки, как правило, присущие экзосомам, известны в данной области. Неограничивающие описания, относящиеся к микровезикулам и экзосомам, приведены в публикации Zhang et al. (2016) Am J Physiol Renal Physiol. 311(5):F844-F851, полное содержание которой включено в настоящий документ посредством ссылки.
Используемый в настоящем документе термин «эффективное» применительно к количеству терапевтического средства (такого как микровезикулы, например, экзосомы, отдельно или в сочетании с биоактивными почечными клетками) означает количество средства, которое является достаточным для достижения желаемого терапевтического ответа без чрезмерно неблагоприятных побочных эффектов (таких как токсичность, раздражение или аллергическая реакция) с разумным соотношением польза/риск при использовании в соответствии с настоящим изобретением.
Секретируемые продукты
Настоящее изобретение относится к продуктам, секретируемым биоактивными почечными клетками (например, СПК), таким как везикулы. В конкретных вариантах осуществления везикулы представляют собой микровезикулы.
В конкретных вариантах осуществления микровезикулы имеют диаметр примерно 30-150, 30-200, 30-500, 30-1000, 500-1000, 50-1000, 50-200, 50-150, 50-100, 100-150, 100-200 или 100-300 нм.
В конкретных вариантах осуществления везикулы включают, состоят преимущественно из, или состоят из экзосом. В конкретных вариантах осуществления экзосомы имеют диаметр примерно 50-100 нм. В конкретных вариантах осуществления экзосомы имеют диаметр 30-100, 50-150, 50-100, 100-150 или 30-150 нм. В конкретных вариантах осуществления экзосомы имеют диаметр от примерно 30, 35, 40, 45, 50, 55 или 60 нм до примерно 100, 110, 120, 130, 140 или 150 нм.
В конкретных вариантах осуществления везикула содержит активное средство (например, соединение) на ее внешней поверхности, в ее липидном бислое и/или в ее просвете. В конкретных вариантах осуществления соединение ослабляет один или более клеточных путей. В конкретных вариантах осуществления соединение представляет собой белок, малую молекулу или полинуклеотид. В конкретных вариантах осуществления белок представляет собой трансмембранный белок, который находится в мембране везикул. В конкретных вариантах осуществления соединение является липофильным и находится в липидном бислое экзосомы. В конкретных вариантах осуществления полинуклеотид представляет собой молекулу микроРНК.
В конкретных вариантах осуществления соединение экспрессируется или продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение не экспрессируется или не продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение было добавлено к среде клеток, которые продуцировали везикулы (например, клетки инкубировали в среде, содержащей соединение). В конкретных вариантах осуществления соединение поступило в клетки и было включено в везикулы, которые были продуцированы клетками. В конкретных вариантах осуществления везикулы очищают или выделяют из клеток, а затем инкубируют в растворе (например, среде), содержащем соединение. В конкретных вариантах осуществления везикулы выделяют или очищают из клеток, а затем соединение вводят в везикулы методом пермеабилизации мембран везикул для облегчения проникновения соединения (например, путем обработки ультразвуком, липофекции, электропорации и так далее).
В конкретных вариантах осуществления соединение не продуцируется естественными почечными клетками. В конкретных вариантах осуществления соединение представляет собой цитокин. В конкретных вариантах осуществления соединение представляет собой искусственное соединение. В конкретных вариантах осуществления искусственное соединение представляет собой лекарственное средство. В конкретных вариантах осуществления искусственное соединение представляет собой малую молекулу. В конкретных вариантах осуществления искусственное соединение представляет собой биологическое средство. В конкретных вариантах осуществления искусственное соединение не экспрессируется или не продуцируется почечными клетками в естественной почке. В конкретных вариантах осуществления соединение представляет собой средство, сохраняющее жизнеспособность клеток. В конкретных вариантах осуществления соединение представляет собой соединение, которое используют для лечения заболевания (например, заболевания почек или какого-либо другого заболевания). В конкретных вариантах осуществления соединение является толерогенным или противовоспалительным.
В конкретных вариантах осуществления соединение одобрено Управлением по контролю за качеством пищевых продуктов и медикаментов США для введения человеку с целью лечения заболевания. В конкретных вариантах осуществления соединение используют для исцеления, облегчения, лечения или предотвращения заболевания. В конкретных вариантах осуществления соединение используют для изменения структуры или функции клетки или организма млекопитающего.
В конкретных вариантах осуществления везикулы содержат соединение, которое ослабляет сигнализацию ингибитора активации плазминогена 1 типа (PAI-1) и/или сигнализацию трансформирующего фактора роста бета (TGFβ). В конкретных вариантах осуществления везикулы содержат соединение, которое ослабляет каноническую сигнализацию Wnt. В конкретных вариантах осуществления везикулы содержат соединение, которое ослабляет неканоническую сигнализацию Wnt. В конкретных вариантах осуществления везикулы содержат соединение, которое ослабляет CXCR4-опосредуемую сигнализацию. В конкретных вариантах осуществления везикулы содержат соединение, которое снижает экспрессию воспалительного цитокина. В конкретных вариантах осуществления воспалительный цитокин представляет собой IL8. В конкретных вариантах осуществления везикулы содержат соединение, которое ослабляет сигнализацию Notch.
В конкретных вариантах осуществления соединение представляет собой молекулу клеточной поверхности, используемую для иммунофенотипирования клеток. В конкретных вариантах осуществления соединение представляет собой CD9, CD63, CD81, CD133, CD146, CD326, CD40, CD42a, CD44 или CD49e.
В конкретных вариантах осуществления соединение представляет собой белковый рецептор. В конкретных вариантах осуществления белковый рецептор представляет собой ретиноевый орфан-рецептор (ROR4).
В конкретных вариантах осуществления соединение представляет собой маркер стадии развития. В конкретных вариантах осуществления маркер стадии развития представляет собой стадиеспецифический эмбриональный антиген 4 (SSEA-4).
В конкретных вариантах осуществления соединение представляет собой стресс-протекторный белок. В конкретных вариантах осуществления стресс-протекторный белок представляет собой белок теплового шока (HSP) 70 или HSP90.
В конкретных вариантах осуществления соединение представляет собой каркасный белок. В конкретных вариантах осуществления каркасный белок представляет собой TST101.
В конкретных вариантах осуществления соединение представляет собой микроРНК и находится в просвете везикулы.
В конкретных вариантах осуществления микроРНК представляет собой регулирующую клеточный цикл микроРНК. В конкретных вариантах осуществления регулирующая клеточный цикл микроРНК представляет собой let7a, miR-143 или miR22.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую клеточное старение микроРНК. В конкретных вариантах осуществления модулирующая клеточное старение микроРНК представляет собой miR-34.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую клеточную миграцию микроРНК. В конкретных вариантах осуществления модулирующая клеточную миграцию микроРНК представляет собой miR30-C.
В конкретных вариантах осуществления микроРНК представляет собой регулирующую клеточный рост микроРНК. В конкретных вариантах осуществления регулирующая клеточный рост микроРНК представляет собой miR194-2.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую клеточную сигнализацию микроРНК. В конкретных вариантах осуществления модулирующая клеточную сигнализацию микроРНК представляет собой miR-142.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую воспаление микроРНК. В конкретных вариантах осуществления модулирующая воспаление микроРНК представляет собой miR-10a.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую ангиогенез микроРНК. В конкретных вариантах осуществления модулирующая ангиогенез микроРНК представляет собой miR-296 и/или miR-146a.
В конкретных вариантах осуществления микроРНК представляет собой модулирующую киназную активность микроРНК. В конкретных вариантах осуществления модулирующая киназную активность микроРНК представляет собой miR-83.
В конкретных вариантах осуществления соединение представляет собой микроРНК, которая ингибирует PAI-1, TGFβ, каноническую сигнализацию Wnt, неканоническую сигнализацию Wnt, CXCR4-опосредуемую сигнализацию и/или сигнализацию Notch.
В конкретных вариантах осуществления фиброз почек уменьшается или предотвращается путем ингибирования эпителиально-мезенхимального перехода (EMT).
В конкретных вариантах осуществления везикулы по настоящему изобретению содержат miR-145, miR-22, miR-7, miR-10a, miR-143 и/или let7b.
В конкретных вариантах осуществления везикулы по настоящему изобретению содержат miR-1248, miR-3168, miR-7113-5p, miR-758-3p, miR-937-3p, miR-4455, miR-4521, miR-203a-3p, miR-22-3p, miR-574-3p, miR-181b-5p, miR-1260b и/или miR-181b-5p.
В конкретных вариантах осуществления везикулы по настоящему изобретению содержат CD9, CD63, CD81, CD133, CD146, CD326, CD40, CD42a, CD44, CD49e и/или SSEA-4.
В конкретных вариантах осуществления везикулы по настоящему изобретению содержат CD63, CD9 и/или CD81 и CD63, CD9 и/или CD81, или их часть, на внешней поверхности везикул. В конкретных вариантах осуществления часть одного или более из этих белков находится на внутренней стороне везикулы.
В конкретных вариантах осуществления везикулы по настоящему изобретению содержат CD133, CD326 и/или CD49e, и CD133, CD326 и/или CD49e на внешней поверхности везикул.
В конкретных вариантах осуществления пролиферация почечных клеток, которые находились в контакте с везикулами, возрастает в сравнении с почечными клетками, которые не находились в контакте с везикулами. В конкретных вариантах осуществления образование сосудов эндотелиальными клетками, которые находились в контакте с везикулами, возрастает в сравнении с эндотелиальными клетками, которые не находились в контакте с везикулами. В конкретных вариантах осуществления образование канальцев нефрона в случае почечных клеток, которые находились в контакте с везикулами, возрастает в сравнении с почечными клетками, которые не находились в контакте с везикулами.
В конкретных вариантах осуществления везикулы содержат фосфолипид, сфинголипид, холестерин, церамид и/или фосфатидилхолин.
В конкретных вариантах осуществления везикулы находятся в композиции, которая содержит фармацевтически приемлемый носитель. В конкретных вариантах осуществления фармацевтически приемлемый носитель представляет собой водный раствор. В конкретных вариантах осуществления фармацевтически приемлемый носитель является термочувствительным. В конкретных вариантах осуществления фармацевтически приемлемый носитель представляет собой гидрогель. В конкретных вариантах осуществления фармацевтически приемлемый носитель содержит желатин.
В конкретных вариантах осуществления везикулы были продуцированы БПК, такими как первичные почечные клетки. В конкретных вариантах осуществления везикулы были продуцированы СПК. В настоящее изобретение включены композиции, содержащие везикулы из первичных почечных клеток, а также везикулы из СПК. Также предложены композиции, дополнительно содержащие везикулы, секретированные эндотелиальными клетками или мезенхимальными стволовыми клетками. В конкретных вариантах осуществления композиция по настоящему изобретению содержит везикулы не почечных клеток. В конкретных вариантах осуществления везикула не почечной клетки была секретирована не почечной эндотелиальной клеткой-предшественником, не почечной мезенхимальной стволовой клеткой или не почечной адипозной клеткой-предшественником.
Один из аспектов настоящего изобретения относится к способу обнаружения по меньшей мере одного соединения в везикуле. В конкретных вариантах осуществления способ включает получение везикулы и определение того, присутствует ли в везикуле по меньшей мере одно соединение, при этом (i) по меньшей мере одно соединение представляет собой белок, и белок представляет собой CD9, CD81, CD146, CD326, CD40, CD42a, CD44, CD49e и/или SSEA-4; (ii) по меньшей мере одно соединение представляет собой микроРНК, при этом микроРНК включает по меньшей мере две из miR-145, miR-22, miR-7, miR-10a, miR-143 и/или let7b; и/или (iii) по меньшей мере одно соединение не экспрессируется или не продуцируется почечными клетками в естественной почке.
В конкретных вариантах осуществления везикулу получают в, или из биологического образца от субъекта. В конкретных вариантах осуществления биологический образец представляет собой мочу. В конкретных вариантах осуществления везикулу получают в, или из супернатанта культуры почечных клеток. В конкретных вариантах осуществления везикула была секретирована почечной клеткой. В конкретных вариантах осуществления почечная клетка представляет собой биоактивную почечную клетку. В конкретных вариантах осуществления почечная клетка представляет собой селективную почечную клетку.
В конкретных вариантах осуществления определение того, присутствует ли белок в везикуле, включает иммуноанализ. В конкретных вариантах осуществления определение того, присутствует ли белок в везикуле, включает твердофазный иммуноферментный анализ (ELISA), иммунопреципитацию белка, иммуноэлектрофорез, вестерн-блоттинг или иммуноокрашивание белка. В конкретных вариантах осуществления определение того, присутствует ли белок в везикуле, включает спектрометрический метод. В конкретных вариантах осуществления определение того, присутствует ли белок в везикуле, включает высокоэффективную жидкостную хроматографию (ВЭЖХ) или жидкостную хроматографию-масс-спектрометрию (ЖХ/МС).
В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает полимеразную цепную реакцию (ПЦР). В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает ПЦР с обратной транскриптазой. В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает микроматричный анализ. В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает секвенирование РНК. В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает создание контакта везикулы или обработанного образца, предположительно содержащего нуклеиновые кислоты из везикулы, с зондами или праймерами, которые комплементарны микроРНК. В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, не включает микроматричный анализ. В конкретных вариантах осуществления определение того, присутствуют ли микроРНК в везикуле, включает микроматричный анализ с микрочипом, при этом микрочип содержит зонды для менее чем 1000, 500 или 100 разных микроРНК.
В конкретных вариантах осуществления соединение представляет собой малую молекулу.
В конкретных вариантах осуществления соединение экспрессируется или продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение не экспрессируется или не продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение экспрессируется или продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение не экспрессируется или не продуцируется биоактивными почечными клетками. В конкретных вариантах осуществления соединение было добавлено к среде клеток, которые продуцировали везикулы (например, клетки инкубировали в среде, содержащей соединение). В конкретных вариантах осуществления соединение поступило в клетки и было включено в везикулы, которые были продуцированы клетками. В конкретных вариантах осуществления везикулы очищают или выделяют из клеток, а затем инкубируют в растворе (например, среде), содержащем соединение. В конкретных вариантах осуществления везикулы выделяют или очищают из клеток, а затем соединение вводят в везикулы методом пермеабилизации мембран везикул для облегчения проникновения соединения (например, путем обработки ультразвуком, липофекции, электропорации и так далее).
В конкретных вариантах осуществления соединение не продуцируется естественными почечными клетками. В конкретных вариантах осуществления соединение представляет собой цитокин. В конкретных вариантах осуществления соединение представляет собой искусственное соединение. В конкретных вариантах осуществления искусственное соединение представляет собой лекарственное средство. В конкретных вариантах осуществления искусственное соединение не экспрессируется или не продуцируется почечными клетками в естественной почке. В конкретных вариантах осуществления соединение представляет собой средство, сохраняющее жизнеспособность клеток. В конкретных вариантах осуществления соединение представляет собой соединение, которое используют для лечения заболевания (например, заболевания почек или какого-либо другого заболевания). В конкретных вариантах осуществления соединение является толерогенным или противовоспалительным. В конкретных вариантах осуществления соединение одобрено Управлением по контролю за качеством пищевых продуктов и медикаментов США для введения человеку с целью лечения заболевания. В конкретных вариантах осуществления соединение используют для исцеления, облегчения, лечения или предотвращения заболевания. В конкретных вариантах осуществления соединение используют для изменения структуры или функции клетки или организма млекопитающего.
Один из аспектов настоящего изобретения относится к способу мониторинга лечения популяцией биоактивных почечных клеток у субъекта, которому была введена популяция биоактивных почечных клеток. В конкретных вариантах осуществления способ включает определение того, присутствует ли по меньшей мере одно соединение в везикуле от субъекта, способом, раскрытым в настоящем документе.
В конкретных вариантах осуществления способ включает определение того, присутствует ли по меньшей мере одно соединение в везикуле от субъекта, способом, раскрытым в настоящем документе, в первый момент времени и во второй момент времени. В конкретных вариантах осуществления первый момент времени соответствует моменту до введения субъекту популяции биоактивных почечных клеток, и второй момент времени соответствует моменту после введения субъекту популяции биоактивных почечных клеток. В конкретных вариантах осуществления первый момент времени и второй момент времени соответствуют моментам после введения субъекту популяции биоактивных почечных клеток. В конкретных вариантах осуществления способ дополнительно включает определение регенеративного эффекта у субъекта, если уровень соединения выше в первый момент времени, чем во второй момент времени.
В конкретных вариантах осуществления способ дополнительно включает определение регенеративного эффекта у субъекта, если уровень соединения выше, чем в контроле. В конкретных вариантах осуществления способ дополнительно включает контроль, представляющий собой уровень у соответствующего субъекта, которому не была введена популяция биоактивных почечных клеток.
Настоящее изобретение также относится к способу определения того, является ли везикула регенеративной. В конкретных вариантах осуществления способ включает (i) определение того, присутствует ли белок и/или микроРНК в везикуле, способом, раскрытым в настоящем документе; и (ii) идентификацию везикулы как регенеративной, если белок и/или микроРНК обнаружены в везикуле.
Один из аспектов настоящего изобретения относится к способу определения уровня по меньшей мере одной микроРНК в везикулах из популяции биоактивных почечных клеток. В конкретных вариантах осуществления способ включает (i) определение того, повышено ли содержание одной или более из следующих молекул микроРНК в везикулах в сравнении с контролем: miR-1248, miR-3168, miR-7113-5p, miR-758-3p, miR-937-3p, miR-4455, miR-4521, miR-203a-3p, miR-22-3p, miR-574-3p, miR-181b-5p, miR-1260b и/или miR-181b-5p; и/или (ii) определение того, снижено ли содержание одной или более из следующих молекул микроРНК в везикулах в сравнении с контролем: miR-1-3p, miR-1-3p, miR-143-3p, miR-150-5p, miR-509-3p, miR-653-5p, miR-204-5p, miR-192-5p и/или miR-363-3p. В конкретных вариантах осуществления биоактивная почечная клетка представляет собой селективную почечную клетку. В конкретных вариантах осуществления контроль представляет собой уровень одной или более молекул микроРНК в везикулах из популяции первичных почечных клеток. В конкретных вариантах осуществления контроль представляет собой уровень одной или более молекул микроРНК в везикулах из другой популяции биоактивных почечных клеток.
Настоящее изобретение также относится к способу изменения уровня по меньшей мере одной микроРНК и/или белка в везикулах, продуцируемых популяцией биоактивных почечных клеток, включающему культивирование популяции в гипоксических условиях. В конкретных вариантах осуществления культивирование популяции в гипоксических условиях представляет собой культивирование популяции в присутствии менее примерно 5%, 4%, 3%, 2% или 1% кислорода в течение, например, 8-72 часов. В конкретных вариантах осуществления культивирование популяции в гипоксических условиях представляет собой культивирование популяции в присутствии примерно 1-5%, 2-5%, 2-4%, 1-3% или 1,5-2,5% кислорода в течение, например, 8-72 часов. В конкретных вариантах осуществления культивирование популяции в гипоксических условиях представляет собой культивирование популяции в присутствии менее 5% кислорода в течение по меньшей мере примерно 8, 12, 16, 20, 24 или 48 часов. В конкретных вариантах осуществления культивирование популяции в гипоксических условиях представляет собой культивирование популяции в присутствии примерно 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% или 5% кислорода в течение примерно 8, 12, 16, 20, 24 или 48 часов.
В конкретных вариантах осуществления способ дополнительно включает пересев биоактивных почечных клеток по меньшей мере примерно 1, 2 или 3 раза перед культивированием популяции в гипоксических условиях.
В конкретных вариантах осуществления (a) по меньшей мере одна микроРНК представляет собой miR-145, miR-22, miR-7, miR-10a, miR-143, let7b, miR-1248, miR-3168, miR-7113-5p, miR-758-3p, miR-937-3p, miR-4455, miR-4521, miR-203a-3p, miR-22-3p, miR-574-3p, miR-181b-5p, miR-1260b и/или miR-181b-5p; и/или (b) по меньшей мере один белок представляет собой CD9, CD63, CD81, CD133, CD146, CD326, CD40, CD42a, CD44, CD49e, SSEA-4, TST101, HSP70, HSP90 и/или ROR4.
Один из аспектов настоящего изобретения относится к способу получения экзосомы из клеток, при этом экзосома содержит соединение, которое не продуцируется клетками. В конкретных вариантах осуществления способ включает выделение экзосомы из супернатанта культуры клеток, при этом супернатант культуры клеток получен от культуры клеток, которые были в контакте с соединением. Один из аспектов настоящего изобретения относится к способу получения почечной экзосомы, при этом экзосома содержит соединение, которое не продуцируется почечными клетками в естественной почке. В конкретных вариантах осуществления способ включает выделение везикулы из супернатанта культуры почечных клеток, при этом супернатант культуры почечных клеток получен от культуры почечных клеток, содержащей популяцию биоактивных почечных клеток, которые находились в контакте с соединением. В конкретных вариантах осуществления соединение представляет собой искусственное соединение. В конкретных вариантах осуществления соединение представляет собой малую молекулу. В конкретных вариантах осуществления соединение представляет собой средство, сохраняющее жизнеспособность клеток. В конкретных вариантах осуществления соединение представляет собой лекарственное средство.
Один из аспектов настоящего изобретения относится к везикуле (такой как микровезикула, например, экзосома), содержащей соединение, которое не продуцируется почечными клетками в естественной почке.
В конкретных вариантах осуществления соединение представляет собой белок, малую молекулу или полинуклеотид. В конкретных вариантах осуществления соединение не экспрессируется или не продуцируется первичными почечными клетками, которые культивируют в отсутствие соединения. В конкретных вариантах осуществления соединение представляет собой искусственное соединение.
В конкретных вариантах осуществления соединение (такое как белок или низкомолекулярное лекарственное средство) «пассивно загружают» в везикулы (например, микровезикулы, такие как экзосомы), например, путем инкубации клеток со средой, содержащей соединение, или путем инкубации очищенных везикул (например, микровезикул, таких как экзосомы) со средой, содержащей соединение. В конкретных вариантах осуществления соединение (такое как белок или низкомолекулярное лекарственное средство) «активно загружают» в очищенные или выделенные везикулы (например, микровезикулы, такие как экзосомы) путем пермеабилизации (например, путем обработки ультразвуком, липофекции, электропорации и так далее) мембраны везикулы для облегчения проникновения соединения.
В конкретных вариантах осуществления везикула находится в композиции, которая содержит клетки, продуцирующие везикулу. В конкретных вариантах осуществления везикула была выделена из клеток, которые продуцируют ее. В конкретных вариантах осуществления везикула представляет собой почечную везикулу. В конкретных вариантах осуществления везикула была продуцирована биоактивной почечной клеткой.
В конкретных вариантах осуществления композиция по настоящему изобретению содержит везикулу почечной клетки и везикулу не почечной клетки. В конкретных вариантах осуществления везикула почечной клетки была секретирована биоактивной почечной клеткой. В конкретных вариантах осуществления везикула не почечной клетки была секретирована не почечной эндотелиальной клеткой-предшественником, не почечной мезенхимальной стволовой клеткой или не почечной адипозной клеткой-предшественником.
В конкретных вариантах осуществления композиция по настоящему изобретению содержит везикулу, продуцированную первичной почечной клеткой, и везикулу, продуцированную селективной почечной клеткой.
В конкретных вариантах осуществления везикула дополнительно содержит фармацевтически приемлемый носитель.
В конкретных вариантах осуществления регенеративный эффект может быть обеспечен клетками и/или продуктами, секретированными из биоактивных почечных клеток (такими как везикулы). В конкретных вариантах осуществления регенеративный эффект может быть охарактеризован одним или более из следующих признаков: уменьшение эпителиально-мезенхимального перехода (что может происходить за счет ослабления сигнализации TGF-β); уменьшение фиброза почек; уменьшение воспаления почек; дифференциальная экспрессия маркера стволовых клеток в естественной почке; миграция имплантированных клеток и/или естественных клеток к месту повреждения почек, например, повреждения канальцев; приживление имплантированных клеток в месте повреждения почек, например, повреждения канальцев; стабилизация одного или более показателей почечной функции (как описано в настоящем документе); de novo образование S-образных телец/запятовидных телец, связанных с нефрогенезом, de novo образование почечных канальцев или нефронов, восстановление эритроидного гомеостаза (как описано в настоящем документе); а также любым их сочетанием (смотри также Basu et al., 2011. Functional evaluation of primary renal cell/biomaterial neo-kidney augment prototypes for renal tissue engineering. Cell Transplantation 20: 1771-90; Bruce et al., 2015. Selected renal cells modulate disease progression in rodent models of chronic kidney disease via NF-κB and TGF-β1 pathways. Regenerative Medicine 10: 815-839, полное содержание каждой публикации включено в настоящий документ посредством ссылки).
В конкретных вариантах осуществления в качестве альтернативы биопсии ткани регенеративный результат у субъекта, получающего лечение, можно оценивать на основании исследования телесной жидкости, например, мочи. Установлено, что микровезикулы (например, экзосомы), полученные из мочи субъекта, содержат определенные компоненты, включая, без ограничения, определенные белки и микроРНК, которые в конечном итоге происходят из популяции почечных клеток, на которые подействовало лечение. Эти компоненты могут включать, без ограничения, факторы, вовлеченные в репликацию и дифференциацию стволовых клеток, апоптоз, воспаление и иммуномодуляцию, фиброз, эпителиально-мезенхимальный переход, сигнализацию TGF-β и сигнализацию PAI-1. В конкретных вариантах осуществления временной анализ паттернов экспрессии связанных с микровезикулой (например, экзосомой) микроРНК/белка позволяет непрерывно контролировать регенеративные результаты в почках у субъектов, получающих популяции клеток, клеточные продукты или конструкции по настоящему изобретению.
В конкретных вариантах осуществления настоящее изобретение относится к способам оценки того, отвечает ли пациент с заболеванием почек (ЗП) на лечение терапевтическим препаратом. В конкретных вариантах осуществления способ может включать этап определения или обнаружения количества микровезикул (или содержимого их просветов), например, экзосом, в тестируемом образце, полученном от пациента с ЗП, получающего лечение терапевтическим препаратом, в сравнении с, или в сопоставлении с, количеством микровезикул (таких как экзосомы) в контрольном образце (например, образце, полученном от того же пациента до лечения терапевтическим средством), при этом большее или меньшее количество микровезикул (например, экзосом), или содержимого их просветов, в тестируемом образце в сравнении с количеством микровезикул (например, экзосом), или содержимого их просветов, в контрольном образце является показателем ответа получающего лечение пациента на лечение терапевтическим средством.
В конкретных вариантах осуществления полученные из почки микровезикулы (например, экзосомы), и/или содержимое просветов полученных из почки микровезикул (например, экзосом), может попадать в мочу субъекта и может быть проанализировано на биомаркеры, являющиеся показателем регенеративного результата или эффективности лечения. В конкретных вариантах осуществления неинвазивные прогностические способы, предложенные в настоящем документе, могут включать этап получения образца мочи от субъекта до и/или после введения или имплантации популяции биоактивных почечных клеток, клеточного продукта или конструкции, описанных в настоящем документе. Микровезикулы и другие секретируемые продукты могут быть выделены из образцов мочи стандартными методами, включая, без ограничения, центрифугирование для удаления нежелательного детрита (Zhou et al. 2008. Kidney Int. 74(5):613-621; Skog et al., опубликованная патентная заявка США № 20110053157, содержание которых включено в настоящий документ посредством ссылки в полном объеме), осаждение для выделения микровезикул (например, экзосом) из мочи, полимеразную цепную реакцию и секвенирование нуклеиновых кислот для идентификации конкретных нуклеиновых кислот, а также масс-спектроскопию и/или 2D электрофорез в геле для идентификации конкретных белков, связанных с регенеративным результатом.
Популяции клеток
Настоящее изобретение относится к композициям и препаратам, содержащим везикулы (например, микровезикулы, такие как экзосомы), продуцируемые популяцией почечных клеток (например, БПК, таких как первичные клетки и/или СПК). В конкретных вариантах осуществления везикулы могут быть, например, выделены из клеток или объединены с клетками, которые не продуцируют их. Неограничивающие примеры и признаки БПК, полезные для получения везикул, описаны в настоящем документе.
В конкретных вариантах осуществления терапевтическая композиция, или препарат, по настоящему изобретению содержит микровезикулы (например, экзосомы), секретируемые выделенной гетерогенной популяцией почечных клеток, которая обогащена по конкретным биоактивным компонентам или типам клеток, и/или истощена по конкретным неактивным или нежелательным компонентам, или типам клеток. В конкретных вариантах осуществления терапевтическая композиция, или препарат, по настоящему изобретению содержит, или дополнительно содержит, выделенную, гетерогенную популяцию почечных клеток, которая обогащена по конкретным биоактивным компонентам или типам клеток, и/или истощена по конкретным неактивным или нежелательным компонентам, или типам клеток. В конкретных вариантах осуществления такие композиции и препараты используют в лечении заболевания почек, например, для обеспечения стабилизации и/или улучшения, и/или восстановления почечной функции и/или структуры. В конкретных вариантах осуществления композиции содержат микровезикулы (например, экзосомы), секретируемые фракциями выделенных почечных клеток, которые лишены клеточных компонентов в сравнении с клетками здорового индивидуума, но сохраняют терапевтические свойства, например, обеспечивают стабилизацию и/или улучшение, и/или восстановление почечной функции. В конкретных вариантах осуществления композиции содержат фракции выделенных почечных клеток, которые лишены клеточных компонентов в сравнении с клетками здорового индивидуума, но сохраняют терапевтические свойства, например, обеспечивают стабилизацию и/или улучшение, и/или восстановление почечной функции. В конкретных вариантах осуществления популяции клеток, описанные в настоящем документе, могут быть получены от здоровых индивидуумов, индивидуумов с заболеванием почек или субъектов, описанных в настоящем документе.
Настоящее изобретение относится к терапевтическим композициям микровезикул (например, экзосом) и/или популяций селективных почечных клеток, которые будут введены в целевой орган, или ткань, субъекта. В конкретных вариантах осуществления настоящего изобретения предложена композиция, содержащая микровезикулы (например, экзосомы), секретируемые БПК (например, СПК). В конкретных вариантах осуществления композиция дополнительно содержит БПК (например, СПК), которые не секретируют микровезикулы (например, экзосомы). В конкретных вариантах осуществления композиция содержит NKA, в который добавлены микровезикулы (например, микровезикулы, такие как экзосомы, добавляют к NKA для получения NKA, усиленного везикулами). В конкретных вариантах осуществления БПК (например, СПК), из которых могут быть получены микровезикулы (например, экзосомы), включают, например, любые БПК (например, СПК), раскрытые в настоящем документе. В конкретных вариантах осуществления везикулы получают из СПК, полученных способами, описанными в примере 1. В конкретных вариантах осуществления препарат по настоящему изобретению представляет собой NKA, к которому были добавлены выделенные везикулы (такие как микровезикулы, например, экзосомы) (NKA был «усилен» или обогащен везикулами).
В конкретных вариантах осуществления популяция биоактивных селективных почечных клеток, как правило, представляет собой популяцию клеток, потенциально обладающих терапевтическими свойствами при введении субъекту. В конкретных вариантах осуществления при введении субъекту, который нуждается в этом, популяция биоактивных почечных клеток может обеспечивать стабилизацию и/или улучшение, и/или восстановление, и/или регенерацию почечной функции у субъекта. В конкретных вариантах осуществления терапевтические свойства могут включать восстановительный или регенеративный эффект.
В конкретных вариантах осуществления популяция почечных клеток представляет собой не фракционированную, гетерогенную популяцию клеток или обогащенную гомогенную популяцию клеток, полученных из почки. В конкретных вариантах осуществления гетерогенную популяцию клеток выделяют из биопсийного образца ткани или из ткани целого органа. В конкретных вариантах осуществления популяцию почечных клеток получают из in vitro культуры клеток млекопитающих, созданной из биопсийных образцов ткани или из ткани целого органа. В конкретных вариантах осуществления популяция почечных клеток содержит подфракции или подпопуляции гетерогенной популяции почечных клеток, обогащенные по биоактивным компонентам (например, биоактивным почечным клеткам) и истощенные по неактивным или нежелательным компонентам или клеткам.
В конкретных вариантах осуществления популяция почечных клеток экспрессирует GGT и цитокератин. В конкретных вариантах осуществления GGT имеет уровень экспрессии более примерно 10%, примерно 15%, примерно 18%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55% или примерно 60%. В конкретных вариантах осуществления GGT представляет собой GGT-1. В конкретных вариантах осуществления клетки популяции почечных клеток экспрессируют GGT-1, цитокератин, VEGF и KIM-1. В конкретных вариантах осуществления более 18% клеток в популяции почечных клеток экспрессируют GGT-1. В конкретных вариантах осуществления более 80% клеток в популяции почечных клеток экспрессируют цитокератин. В конкретных вариантах осуществления цитокератин выбирают из CK8, CK18, CK19, а также их сочетаний. В конкретных вариантах осуществления цитокератин представляет собой CK8, CK18, CK19, CK8/CK18, CK8/CK19, CK18/CK19 или CK8/CK18/CK19, при этом «/» означает сочетание записанных рядом с этим знаком цитокератинов. В конкретных вариантах осуществления цитокератин имеет уровень экспрессии более примерно 80%, примерно 85%, примерно 90% или примерно 95%. В конкретных вариантах осуществления более 80% клеток в популяции почечных клеток экспрессируют цитокератин. В конкретных вариантах осуществления клетки в популяции почечных клеток экспрессируют AQP2. В конкретных вариантах осуществления менее 40% клеток экспрессируют AQP2. В конкретных вариантах осуществления по меньшей мере 3% клеток в популяции почечных клеток экспрессируют AQP2.
В конкретных вариантах осуществления более 18% клеток в популяции клеток экспрессируют GGT-1, и более 80% клеток в популяции клеток экспрессируют цитокератин. В конкретных вариантах осуществления цитокератин представляет собой CK18. В конкретных вариантах осуществления от 4,5% до 81,2% клеток в популяции клеток экспрессируют GGT-1, от 3,0% до 53,7% клеток в популяции клеток экспрессируют AQP2, и от 81,1% до 99,7% клеток в популяции клеток экспрессируют CK18.
В конкретных вариантах осуществления популяция почечных клеток содержит клетки, которые экспрессируют один или более из любого сочетания биомаркеров, выбранных из AQP1, AQP2, AQP4, кальбиндина, кальпонина, CD117, CD133, CD146, CD24, CD31 (PECAM-1), CD54 (ICAM-1), CD73, CK18, CK19, CK7, CK8, CK8, CK18, CK19, сочетания из CK8, CK18 и CK19, коннексина 43, кубилина, CXCR4 (фузина), DBA, E-кадгерина (CD324), EPO (эритропоэтина) GGT1, GLEPP1 (белка гломерулярного эпителия 1), гаптоглобулина, Itgb1 (интегрина 01), KIM-1 (молекулы повреждения почек 1), T1M-1 (T-клеточный иммуноглобулин и муцин-содержащей молекулы), MAP-2 (связанного с микротрубочками белка 2), мегалина, N-кадгерина, нефрина, NKCC (котранспортеров Na-K-Cl), OAT-1 (транспортера органических ионов 1), остеопонтина, пан-кадгерина, PCLP1 (подокаликсин-подобной молекулы 1), подоцина, SMA (альфа-актина гладких мышц), синаптоподина, THP (белка Тамма-Хорсфолла), виментина и αGST-1 (альфа-глутатион-S-трансферазы).
В конкретных вариантах осуществления популяция почечных клеток обогащена по эпителиальным клеткам в сравнении с исходной популяцией, такой как популяция клеток в биопсийном образце ткани почки или первичной культуре клеток (например, популяция почечных клеток содержит по меньшей мере на примерно 5%, 10%, 15%, 20% или 25% больше эпителиальных клеток, чем исходная популяция). В конкретных вариантах осуществления популяция почечных клеток обогащена по клеткам почечных канальцев в сравнении с исходной популяцией, такой как популяция клеток в биопсийном образце ткани почки или первичной культуре клеток (например, популяция почечных клеток содержит по меньшей мере на примерно 5%, 10%, 15%, 20%, или 25% больше клеток почечных канальцев, чем исходная популяция). В конкретных вариантах осуществления клетки почечных канальцев включают клетки проксимальных почечных канальцев. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю клеток дистальных почечных канальцев, клеток собирающих протоков, эндокринных клеток, сосудистых клеток или клеток, подобных предшественникам, в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю клеток дистальных почечных канальцев в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю клеток собирающих протоков в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю эндокринных клеток в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю сосудистых клеток в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит меньшую относительную долю клеток, подобных предшественникам, в сравнении с исходной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит большую относительную долю клеток почечных канальцев и меньшие относительные доли EPO-продуцирующих клеток, гломерулярных клеток и сосудистых клеток в сравнении с необогащенной популяцией (например, исходной популяцией почечных клеток). В конкретных вариантах осуществления популяция почечных клеток содержит большую относительную долю клеток почечных канальцев и меньшие относительные доли EPO-продуцирующих клеток и сосудистых клеток в сравнении с необогащенной популяцией. В конкретных вариантах осуществления популяция почечных клеток содержит большую относительную долю клеток почечных канальцев и меньшие относительные доли гломерулярных клеток и сосудистых клеток в сравнении с необогащенной популяцией.
В конкретных вариантах осуществления клетки популяции почечных клеток экспрессируют гиалуроновую кислоту (HA). В конкретных вариантах осуществления диапазон размеров HA составляет от примерно 5 кДа до примерно 20000 кДа. В конкретных вариантах осуществления HA имеет молекулярную массу 5 кДа, 60 кДа, 800 кДа и/или 3000 кДа. В конкретных вариантах осуществления клетки популяции почечных клеток синтезируют и/или стимулируют синтез высокомолекулярной HA за счет экспрессии синтазы гиалуроновой кислоты 2 (HAS-2), особенно после имплантации в почку. В конкретных вариантах осуществления клетки популяции почечных клеток экспрессируют более высокомолекулярные формы HA in vitro и/или in vivo вследствие активности HAS-2. В конкретных вариантах осуществления клетки популяции почечных клеток экспрессируют более высокомолекулярные формы HA как in vitro, так и in vivo, вследствие активности HAS-2. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 100 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу от примерно 800 кДа до примерно 3500 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу от примерно 800 кДа до примерно 3000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 800 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 3000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу примерно 800 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу примерно 3000 кДа. В конкретных вариантах осуществления HAS-2 синтезирует HA с молекулярной массой от 2×105 до 2×106 Да. В конкретных вариантах осуществления образуются меньшие по размеру формы HA за счет действия деструктивных гиалуронидаз. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу от примерно 200 кДа до примерно 2000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу примерно 200 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу примерно 2000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 200 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 2000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 5000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 10000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу по меньшей мере 15000 кДа. В конкретных вариантах осуществления более высокомолекулярные формы HA представляют собой HA, имеющую молекулярную массу примерно 20000 кДа.
В конкретных вариантах осуществления популяция содержит клетки, способные к опосредованному рецептором переносу альбумина.
В конкретных вариантах осуществления клетки популяции почечных клеток являются устойчивыми к гипоксии.
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: мегалина, кубилина, N-кадгерина, E-кадгерина, аквапорина 1 и аквапорина 2.
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: мегалина, кубилина, синтазы гиалуроновой кислоты 2 (HAS2), 25-гидроксилазы витамина D3 (CYP2D25), N-кадгерина (Ncad), E-кадгерина (Ecad), аквапорина 1 (Aqp1), аквапорина 2 (Aqp2), RAB17, представителя семейства онкогенов RAS (Rab17), GATA-связывающего белка 3 (Gata3), FXYD домен-содержащего регулятора транспорта ионов 4 (Fxyd4), семейства 9 переносчиков растворенных веществ (обменивающего натрий/водород), представителя 4, (Slc9a4), семейства 3 альдегиддегидрогеназ, представителя B1 (Aldh3b1), семейства 1 альдегиддегидрогеназ, представителя A3 (Aldh1a3) и кальпаина 8 (Capn8).
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: мегалина, кубилина, синтазы гиалуроновой кислоты 2 (HAS2), 25-гидроксилазы витамина D3 (CYP2D25), N-кадгерина (Ncad), E-кадгерина (Ecad), аквапорина 1 (Aqp1), аквапорина 2 (Aqp2), RAB17, представителя семейства онкогенов RAS (Rab17), GATA-связывающего белка 3 (Gata3), FXYD домен-содержащего регулятора транспорта ионов 4 (Fxyd4), семейства 9 переносчиков растворенных веществ (обменивающего натрий/водород), представителя 4, (Slc9a4), семейства 3 альдегиддегидрогеназ, представителя B1 (Aldh3b1), семейства 1 альдегиддегидрогеназ, представителя A3 (Aldh1a3), кальпаина 8 (Capn8) и аквапорина 4 (Aqp4).
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: аквапорина 7 (Aqp7), FXYD домен-содержащего регулятора транспорта ионов 2 (Fxyd2), семейства 17 переносчиков растворенных веществ (фосфата натрия), представителя 3 (Slc17a3), семейства 3 переносчиков растворенных веществ, представителя 1 (Slc3a1), клаудина 2 (Cldn2), аспартат-пептидазы напсина A (Napsa), семейства 2 переносчиков растворенных веществ (облегчающих перенос глюкозы), представителя 2 (Slc2a2), аланинаминопептидазы (мембранной) (Anpep), трансмембранного белка 27 (Tmem27), семейства ацил-КоA-синтетаз жирных кислот со средней длиной цепи, представителя 2 (Acsm2), глутатионпероксидазы 3 (Gpx3), фруктоза-1,6-бифосфатазы 1 (Fbp1), аланин-глиоксилат аминотрансферазы 2 (Agxt2), молекулы адгезии тромбоцитов и эндотелия (Pecam) и подоцина (Podn).
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: PECAM, VEGF, KDR, HIF1a, CD31, CD146, подоцина (Podn) и нефрина (Neph), рецептора хемокина (мотив C-X-C) 4 (Cxcr4), рецептора эндотелина типа B (Ednrb), коллагена, типа V, альфа-2 (Col5a2), кадгерина 5 (Cdh5), тканевого активатора плазминогена (Plat), ангиопоэтина 2 (Angpt2), белка-рецептора, содержащего домен вставки киназы (Kdr), секретируемого кислого богатого цистеином белка (остеонектина) (Sparc), серглицина (Srgn), ингибитора 3 TIMP металлопептидазы (Timp3), белка 1 опухоли Вильмса (Wt1), семейства сайтов интеграции MMTV Wingless типа, представителя 4 (Wnt4), регулятора сигнализации G-белков 4 (Rgs4), эритропоэтина (EPO).
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: PECAM, vEGF, KDR, HIF1a, подоцина, нефрина, EPO, CK7, CK8/18/19.
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: PECAM, vEGF, KDR, HIF1a, CD31, CD146.
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: подоцина (Podn) и нефрина (Neph).
В конкретных вариантах осуществления популяция почечных клеток содержит один или более типов клеток, которые экспрессируют одно или более из любого сочетания из: PECAM, vEGF, KDR, HIF1a и EPO.
В конкретных вариантах осуществления присутствие (например, экспрессию) и/или уровень/количество различных биомаркеров в образце или популяции клеток можно анализировать с использованием ряда методов, многие из которых известны в данной области и понятны квалифицированному специалисту, включая, но без ограничения, иммуногистохимические методы («ИГХ»), вестерн-блоттинг, иммунопреципитацию, анализы молекулярного связывания, ELISA, ELIFA, активированную флуоресценцией сортировку клеток («FACS»), MassARRAY, протеомику, биохимические анализы ферментативной активности, in situ гибридизацию, саузерн-блоттинг, нозерн-блоттинг, секвенирование всего генома, полимеразную цепную реакцию («ПЦР»), в том числе количественную ПЦР в реальном времени(«кОТ-ПЦР») и другие основанные на амплификации методы обнаружения, такие как, например, анализ разветвленных ДНК, SISBA, TMA и тому подобные, РНК-секвенирование, FISH, анализ с использованием микрочипов, профилирование генной экспрессии и/или серийный анализ генной экспрессии («SAGE»), а также любой из широкого спектра анализов, которые могут быть выполнены с использованием белковых, генных и/или тканевых микропанелей. Неограничивающие примеры методов для оценки статуса генов и генных продуктов включают нозерн-блоттинг, саузерн-блоттинг, иммуноблоттинг и ПЦР-анализ. В конкретных вариантах осуществления также можно использовать мультиплексные иммуноанализы, такие как те, которые доступны от компаний Rules Based Medicine или Meso Scale Discovery. В конкретных вариантах осуществления присутствие (например, экспрессию) и/или уровень/количество различных биомаркеров в образце или популяции клеток можно анализировать с использованием ряда методов, многие из которых известны в данной области и понятны квалифицированному специалисту, включая, но без ограничения, платформы «-омика», такие как геномная транскриптомика, протеомика, секретомика, липидомика, фосфатомика, экзосомика и так далее, при этом методологии с высокой пропускной способностью объединяют с методами вычислительной биологии и биоинформатики для выяснения полной биологической сигнатуры генов, микроРНК, белков, секретируемых белков, липидов и так далее, которые экспрессируются, и не экспрессируются, изучаемой популяцией клеток.
В конкретных вариантах осуществления способ обнаружения присутствия двух или более биомаркеров в популяции почечных клеток включает создание контакта образца, содержащего популяцию, с антителом, направленным на биомаркер, в условиях, допускающих связывание антитела с его соответствующим лигандом (то есть, биомаркером), и обнаружение присутствия связанного антитела, например, путем определения того, образуется ли комплекс между антителом и биомаркером. В конкретных вариантах осуществления присутствие одного или более биомаркеров обнаруживают иммуногистохимическими методами. В конкретных вариантах осуществления способ обнаружения присутствия биомаркеров в, или на, микровезикуле (такой как экзосома) включает создание контакта образца (например, образца, который предположительно содержит или, как считают, содержит) микровезикул с антителом, направленным на биомаркер, в условиях, допускающих связывание антитела с его соответствующим лигандом (то есть, биомаркером), и обнаружение присутствия связанного антитела, например, путем определения того, образуется ли комплекс между антителом и биомаркером.
Используемый в настоящем документе термин «обнаружение» включает количественное и/или качественное обнаружение.
В конкретных вариантах осуществления биомаркер обнаруживают при помощи моноклонального или поликлонального антитела.
В конкретных вариантах осуществления популяцию почечных клеток идентифицируют при помощи одного или более реагентов, которые позволяют обнаруживать биомаркер, раскрытый в настоящем документе, такой как AQP1, AQP2, AQP4, кальбиндин, кальпонин, CD117, CD133, CD146, CD24, CD31 (PECAM-1), CD54 (ICAM-1), CD73, CK18, CK19, CK7, CK8, CK8/18, CK8/18/19, коннексин 43, кубилин, CXCR4 (фузин), DBA, E-кадгерин (CD324), EPO (эритропоэтин), GGT1, GLEPP1 (белок гломерулярного эпителия 1), гаптоглобулин, Itgbl (интегрин p), KIM-1 (молекула повреждения почек 1), T1M-1 (T-клеточный иммуноглобулин и муцин-содержащая молекула), MAP-2 (связанный с микротрубочками белок 2), мегалин, N-кадгерин, нефрин, NKCC (котранспортеры Na-K-Cl), OAT-1 (транспортер органических ионов 1), остеопонтин, пан-кадгерин, PCLP1 (подокаликсин-подобная молекула 1), подоцин, SMA (альфа-актин гладких мышц), синаптоподин, THP (белок Тамма-Хорсфолла), виментин и αGST-1 (альфа-глутатион-5-трансфераза).
В конкретных вариантах осуществления источник клеток является таким же, как и намеченный целевой орган или ткань. В конкретных вариантах осуществления БПК или СПК могут быть получены из почки и использованы в препарате, который будет введен в почку. В конкретных вариантах осуществления популяция клеток получена из биопсийного образца почки. В конкретных вариантах осуществления популяция клеток получена из ткани целой почки. В конкретных вариантах осуществления популяция клеток получена из in vitro культур клеток почки млекопитающего, полученной из биопсийных образцов почки или ткани целой почки.
В конкретных вариантах осуществления БПК или СПК содержат гетерогенные смеси или фракции биоактивных почечных клеток. В конкретных вариантах осуществления БПК или СПК могут быть получены из, или сами являются, фракций почечных клеток от здоровых индивидуумов. В конкретных вариантах осуществления изобретение относится к популяции, или фракции, почечных клеток, полученной от нездорового индивидуума, которая может быть лишена определенных типов клеток в сравнении с популяцией почечных клеток от здорового индивидуума (например, в его почке или биопсийном образце). В конкретных вариантах осуществления настоящего изобретения предложена терапевтически активная популяция клеток, лишенная некоторых типов клеток в сравнении с популяцией от здорового индивидуума, а также микровезикул (например, экзосом), секретируемых популяцией. Также предложены способы обнаружения таких клеток и микровезикул (например, экзосом). В конкретных вариантах осуществления популяцию клеток выделяют и размножают из популяции аутологичных клеток.
В конкретных вариантах осуществления СПК получают путем выделения и размножения почечных клеток из ткани коркового слоя почки пациента путем биопсии почки. В конкретных вариантах осуществления почечные клетки выделяют из почечной ткани путем ферментативного расщепления, размножают с использованием стандартных методов культивирования клеток и отбирают из размноженных почечных клеток путем центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью. В конкретных вариантах осуществления почечные клетки выделяют из почечной ткани путем ферментативного расщепления, размножают с использованием стандартных методов культивирования клеток и отбирают из размноженных почечных клеток путем центрифугирования в непрерывном или прерывистом, одноступенчатом или многоступенчатом, градиенте плотности. В конкретных вариантах осуществления СПК состоят в основном из почечных эпителиальных клеток, которые известны своим регенеративным потенциалом. В конкретных вариантах осуществления другие паренхиматозные (сосудистые) и стромальные клетки могут присутствовать в популяции аутологичных СПК.
В конкретных вариантах осуществления БПК представляют собой выделенную популяцию регенеративных почечных клеток, естественным образом вовлеченных в восстановление и регенерацию почек. В конкретных вариантах осуществления БПК получают из почечных клеток, выделенных из почечной ткани путем ферментативного расщепления, и размножают с использованием стандартных методов культивирования клеток. В конкретных вариантах осуществления среду для культивирования клеток можно выбирать таким образом, чтобы размножались биоактивные почечные клетки с регенеративной способностью. В конкретных вариантах осуществления среда для культивирования клеток не содержит какие-либо факторы дифференцировки. В конкретных вариантах осуществления размноженную гетерогенную популяцию почечных клеток культивируют в гипоксических условиях для дополнительного обогащения композиции клетками с регенеративной способностью. Без связи с конкретной теорией, это может быть связано с одним или более из следующих явлений: 1) избирательное выживание, гибель или пролиферация определенных клеточных компонентов в период культивирования в гипоксических условиях; 2) изменение гранулярности и/или размера клеток в ответ на культивирование в гипоксических условиях, что приводит к изменениям в плавучей плотности и последующей локализации при разделении в градиенте плотности; и 3) изменение генной/белковой экспрессии в клетках в ответ на культивирование в гипоксических условиях, что приводит к дифференциальным характеристикам клеток в выделенной и размноженной популяции.
В конкретных вариантах осуществления популяцию биоактивных почечных клеток получают путем выделения и размножения почечных клеток из почечной ткани (такой как ткань, полученная при биопсии) в условиях культивирования, которые приводят к обогащению клетками, способными к регенерации почки.
В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 1, 2, 3, 4, 5 или более раз для получения размноженных биоактивных почечных клеток (например, популяции клеток, обогащенной по клеткам, способным к регенерации почки). В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 1 раз для получения размноженных биоактивных почечных клеток. В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 2 раза для получения размноженных биоактивных почечных клеток. В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 3 раза для получения размноженных биоактивных почечных клеток. В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 4 раза для получения размноженных биоактивных почечных клеток. В конкретных вариантах осуществления почечные клетки из почечной ткани (такой как ткань, полученная при биопсии) пересевают 5 раз для получения размноженных биоактивных почечных клеток. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции не биоактивных почечных клеток. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток по меньшей мере одного клеточного типа. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток, имеющих плотность более 1,095 г/мл. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции мелких клеток с низкой гранулярностью. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток, имеющих меньший размер, чем эритроциты. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток с диаметром менее 6 мкм. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток с диаметром менее 2 мкм. В конкретных вариантах осуществления пересев клеток приводит к истощению популяции клеток с меньшей гранулярностью, чем эритроциты. В конкретных вариантах осуществления жизнеспособность популяции клеток возрастает после 1 или более пересевов. В конкретных вариантах осуществления описания мелких клеток и низкой гранулярности используют при анализе клеток методом активированной флуоресценцией сортировки клеток (FACS), например, с использованием осей X-Y диаграммы разброса данных, на которой показаны клетки.
В конкретных вариантах осуществления размноженные биоактивные почечные клетки выращивают в гипоксических условиях в течение по меньшей мере примерно 6, 9, 10, 12 или 24 часов, но менее 48 часов, или в течение 6-9 часов, или 6-48 часов, или от примерно 12 до примерно 15 часов, или примерно 8 часов, или примерно 12 часов, или примерно 24 часов, или примерно 36 часов, или примерно 48 часов. В конкретных вариантах осуществления клетки, выращенные в гипоксических условиях, отбирают на основании плотности. В конкретных вариантах осуществления популяция биоактивных почечных клеток представляет собой популяцию СПК, полученную после разделения размноженных почечных клеток в непрерывном или прерывистом (одноэтапном или многоэтапном) градиенте плотности (например, после пересева и/или культивирования в гипоксических условиях). В конкретных вариантах осуществления популяция биоактивных почечных клеток представляет собой популяцию СПК, полученную после разделения размноженных почечных клеток методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью (например, после пересева и/или культивирования в гипоксических условиях). В конкретных вариантах осуществления гипоксические условия культивирования представляют собой условия культивирования, в которых клетки подвергают воздействию пониженных уровней доступного кислорода в системе культивирования, в сравнении со стандартными условиями культивирования, в которых клетки культивируют при атмосферных уровнях кислорода (примерно 21%). В конкретных вариантах осуществления клетки, культивируемые в гипоксических условиях культивирования, культивируют при уровне кислорода от примерно 5% до примерно 15%, или от примерно 5% до примерно 10%, или от примерно 2% до примерно 5%, или от примерно 2% до примерно 7%, или примерно 2%, или примерно 3%, или примерно 4%, или примерно 5%. В конкретных вариантах осуществления СПК имеют плавучую плотность более примерно 1,0419 г/мл. В конкретных вариантах осуществления СПК имеют плавучую плотность более примерно 1,04 г/мл. В конкретных вариантах осуществления СПК имеют плавучую плотность более примерно 1,045 г/мл. В конкретных вариантах осуществления БПК или СПК содержат большую процентную долю одной или более популяций клеток и лишены, или содержат меньшее количество, одной или более других популяций клеток в сравнении с исходной популяцией почечных клеток.
В конкретных вариантах осуществления размноженные биоактивные почечные клетки могут быть подвергнуты разделению в градиенте плотности для получения СПК. В конкретных вариантах осуществления БПК подвергают как гипоксическим условиям культивирования, так и разделению в градиенте плотности, для получения СПК. В конкретных вариантах осуществления используют центрифугирование в непрерывном или прерывистом, одноступенчатом или многоступенчатом, градиенте плотности для разделения собранных популяций почечных клеток на основании плавучей плотности клеток. В конкретных вариантах осуществления размноженные биоактивные почечные клетки можно разделять центрифугированием через границу, барьер или интерфейс между фазами с разной плотностью для получения СПК. В конкретных вариантах осуществления центрифугирование через границу, барьер или интерфейс между фазами с разной плотностью используют для разделения собранных популяций почечных клеток на основании плавучей плотности клеток. В конкретных вариантах осуществления СПК получают с использованием, частично, среды OPTIPREP (Axis-Shield), содержащей 60% (масс/об) раствор неионного йодированного соединения йодиксанола в воде. Однако специалист в данной области понимает, что и другие среды, градиенты плотности (непрерывные или прерывистые), границы, барьеры, интерфейсы между фазами с разной плотностью, или другие методы, например, иммунологическое разделение с использованием клеточных поверхностных маркеров, известные в данной области, имеющие необходимые свойства для выделения популяций клеток, описанных в настоящем документе, можно использовать для получения биоактивных почечных клеток. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,04 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,04 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,0419 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,0419 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,045 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,045 г/мл, исключают и отбрасывают.
В конкретных вариантах осуществления плавучую плотность клеток используют для получения популяции СПК и/или определения того, является ли популяция почечных клеток популяцией биоактивных почечных клеток. В конкретных вариантах осуществления плавучую плотность клеток используют для выделения биоактивных почечных клеток. В конкретных вариантах осуществления плавучую плотность клеток определяют путем центрифугирования через одноступенчатый интерфейс плотности OptiPrep (7% йодиксанол; 60% (масс/об) в OptiMEM) (одноступенчатый прерывистый градиент плотности). Optiprep представляет собой 60% (масс/об) раствор йодиксанола в воде. При иллюстративном использовании интерфейса плотности или одноступенчатого прерывистого градиента плотности Optiprep разбавляют OptiMEM (минимальная среда для культивирования клеток) для получения конечного раствора 7% йодиксанола (в воде и OptiMEM). Состав OptiMEM представляет собой модификацию минимальной поддерживающей среды Игла, забуференную HEPES и бикарбонатом натрия, и с добавлением гипоксантина, тимидина, пирувата натрия, L-глутамина или GLUTAMAX, микроэлементов и факторов роста. Уровень белка является минимальным (15 мкг/мл), при этом единственными белковыми добавками являются инсулин и трансферрин. Феноловый красный включают при пониженной концентрации в качестве индикатора pH. В конкретных вариантах осуществления в OptiMEM можно добавлять 2-меркаптоэтанол перед использованием.
В конкретных вариантах осуществления готовят раствор OptiPrep и измеряют коэффициент преломления, в качестве показателя желаемой плотности (К.П. 1,3456 ± 0,0004), перед использованием. В конкретных вариантах осуществления почечные клетки наслаивают поверх раствора. В конкретных вариантах осуществления интерфейс между фазами с разной плотностью или одноступенчатый прерывистый градиент плотности центрифугируют при 800 g в течение 20 мин при комнатной температуре (без торможения) либо в центрифужной пробирке (например, 50-мл конической пробирке), либо в устройстве для обработки клеток (например, COBE 2991). В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,04 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,04 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,0419 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,0419 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,045 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,045 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления перед оценкой плотности клеток, или отбором на основании плотности, клетки культивируют до состояния по меньшей мере 50% конфлюэнтности и инкубируют в течение ночи (например, по меньшей мере примерно 8 или 12 часов) в гипоксических условиях в инкубаторе, установленном на уровень 2% кислорода в атмосфере с 5% CO2 при 37°C.
В конкретных вариантах осуществления клетки, полученные из образца почки, размножают, а затем обрабатывают (например, с применением гипоксии и разделения центрифугированием) для получения популяции СПК. В конкретных вариантах осуществления популяцию СПК получают с использованием реагентов и способов, описанных в настоящем документе. В конкретных вариантах осуществления образец клеток из популяции СПК тестируют на жизнеспособность перед введением клеток популяции субъекту. В конкретных вариантах осуществления образец клеток из популяции СПК тестируют на экспрессию одного или более из маркеров, раскрытых в настоящем документе, перед введением клеток популяции субъекту.
В конкретных вариантах осуществления СПК получают способом, включающим размножение первичных почечных клеток (например, путем 1, 2, 3, 4, 5 или более пересевов), культивирование размноженных почечных клеток в гипоксических условиях, с последующим созданием контакта клеток с нефротоксином (таким как йодиксанол, например, 7% йодиксанол). В конкретных вариантах осуществления СПК получают способом, включающим размножение первичных почечных клеток (например, путем 1, 2, 3, 4, 5 или более пересевов), культивирование размноженных почечных клеток в гипоксических условиях, с последующим отбором клеток при помощи градиента плотности, как описано в настоящем документе. В конкретных вариантах осуществления СПК получают способом, включающим размножение первичных почечных клеток (например, путем 1, 2, 3, 4, 5 или более пересевов), культивирование размноженных почечных клеток в гипоксических условиях, с последующим обогащением по клеткам почечных канальцев из клеток и/или истощением по сосудистым клеткам или клеткам собирающих протоков из размноженных клеток, которые были культивированы в гипоксических условиях.
Неограничивающие примеры композиций и способов для получения СПК приведены в публикации патентной заявки США № 2017/0281684 A1, полное содержание которой включено в настоящий документ посредством ссылки.
В конкретных вариантах осуществления БПК или СПК получают из естественного образца аутологичной или аллогенной почки. В конкретных вариантах осуществления БПК или СПК получают из образца не аутологичной почки. В конкретных вариантах осуществления образец может быть получен путем биопсии почки.
В конкретных вариантах осуществления выделение и размножение почечных клеток приводит к получению смеси разных типов почечных клеток, включая почечные эпителиальные клетки и стромальные клетки. В конкретных вариантах осуществления СПК получают путем разделения в непрерывном или прерывистом градиенте плотности размноженных почечных клеток. В конкретных вариантах осуществления основной тип клеток в разделенной в градиенте плотности популяции СПК имеет фенотип эпителиальных клеток почечных канальцев. В конкретных вариантах осуществления СПК получают путем разделения размноженных почечных клеток методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью. В конкретных вариантах осуществления основной тип клеток в разделенной через границу/барьер/интерфейс между фазами с разной плотностью популяции СПК имеет фенотип эпителиальных клеток почечных канальцев. В конкретных вариантах осуществления характеристики СПК, полученных в результате размножения почечных клеток, оценивают с использованием многоэтапного подхода. В конкретных вариантах осуществления клеточную морфологию, кинетику роста и жизнеспособность клеток контролируют в процессе размножения почечных клеток. В конкретных вариантах осуществления плавучую плотность и жизнеспособность СПК характеризуют методом центрифугирования на среде, или свозь среду, с градиентом плотности и методом с исключением трипанового синего. В конкретных вариантах осуществления фенотип СПК характеризуют методом проточной цитометрии, и функцию СПК определяют на основании экспрессии VEGF и KIM-1. В конкретных вариантах осуществления клеточную функцию СПК до формулирования также можно оценивать путем измерения активности двух конкретных ферментов; GGT (γ-глютамилтранспептидазы) и LAP (лейцинаминопептидазы), присутствующих в проксимальных канальцах почки.
В конкретных вариантах осуществления клеточные признаки, способствующие разделению субпопуляций клеток в плотной среде (размер и гранулярность), можно использовать для разделения субпопуляций клеток методом проточной цитометрии (прямое светорассеяние отражает размер клеток при проточной цитометрии, и боковое светорассеяние отражает гранулярность). В конкретных вариантах осуществления среда с градиентом плотности, или среда для разделения, должна иметь низкую токсичность для конкретных интересующих клеток. В конкретных вариантах осуществления, при том, что плотная среда должна иметь низкую токсичность для конкретных интересующих клеток, по настоящему изобретению предусмотрено использование сред, которые играют определенную роль в процессе отбора интересующих клеток. В конкретных вариантах осуществления, и без связи с конкретной теорией, очевидно, что популяции клеток, раскрытые в настоящем документе, которые извлекают при помощи среды, содержащей йодиксанол, являются устойчивыми к йодиксанолу, поскольку между этапами нанесения и извлечения имеет место значительная потеря клеток, это свидетельствует о том, что воздействие йодиксанола в условиях градиента плотности, или границы, барьера или интерфейса между фазами с разной плотностью, приводит к элиминации некоторых клеток. В конкретных вариантах осуществления клетки, обнаруживаемые после разделения в градиенте плотности или через интерфейс между фазами с разной плотностью йодиксанола, являются устойчивыми к любым неблагоприятным эффектам воздействия йодиксанола и/или градиента плотности или интерфейса между фазами. В конкретных вариантах осуществления контрастную среду, имеющую содержание нефротоксина от слабого до умеренного, используют для выделения и/или отбора популяции клеток, например, популяции СПК. В конкретных вариантах осуществления «слабый» нефротоксин представляет собой нефротоксин, который убивает не более 10% первичных почечных клеток, когда клетки инкубируют в стандартной среде с добавлением 7% масс/об нефротоксина в течение 12 часов, при оценке в стандартном тесте на жизнеспособность клеток с выявлением живых/мертвых клеток на основании исключения клетками красителя. В конкретных вариантах осуществления СПК являются устойчивыми к йодиксанолу. В конкретных вариантах осуществления плотная среда не должна связывать белки в человеческой плазме или отрицательно влиять на ключевые функции интересующих клеток.
В конкретных вариантах осуществления популяция клеток была обогащена и/или истощена по одному или более типам почечных клеток методом активированной флуоресценцией сортировки клеток (FACS). В конкретных вариантах осуществления типы почечных клеток могут быть обогащены и/или истощены с использованием BD FACSAria™ или эквивалента. В конкретных вариантах осуществления типы почечных клеток могут быть обогащены и/или истощены с использованием FACSAria III™ или эквивалента.
В конкретных вариантах осуществления популяция клеток была обогащена и/или истощена по одному или более типам почечных клеток с использованием магнитной сортировки клеток. В конкретных вариантах осуществления один или более типов почечных клеток могут быть обогащены и/или истощены с использованием системы Miltenyi autoMACS® или эквивалента.
В конкретных вариантах осуществления популяция почечных клеток была подвергнута трехмерному культивированию. В конкретных вариантах осуществления методы культивирования популяций клеток включают непрерывную перфузию. В конкретных вариантах осуществления популяции клеток, культивированных с использованием трехмерного культивирования и непрерывной перфузии, демонстрируют большую насыщенность клетками и межклеточное взаимодействие в сравнении с популяциями клеток, культивируемыми статическим образом. В конкретных вариантах осуществления популяции клеток, культивированных с использованием трехмерного культивирования и непрерывной перфузии, демонстрируют большую степень экспрессии EPO, а также повышенную экспрессию генов, связанных с почечными канальцами, таких как E-кадгерин, в сравнении со статическими культурами таких популяций клеток. В конкретных вариантах осуществления популяция клеток, культивированных с использованием непрерывной перфузии, демонстрирует более высокий уровень потребления глюкозы и глутамина в сравнении с популяцией клеток, культивируемых статическим образом.
В конкретных вариантах осуществления условия низкого содержания, или недостатка, кислорода можно использовать в способах для получения популяции клеток, предложенных по настоящему изобретению. В конкретных вариантах осуществления способ получения популяции клеток может быть использован без этапа культивирования при низком содержании кислорода. В конкретных вариантах осуществления могут быть использованы условия с нормальным содержанием кислорода.
В конкретных вариантах осуществления популяция почечных клеток была выделена и/или культивирована из почечной ткани. В настоящем документе приведены неограничивающие примеры способов для разделения и выделения почечных клеточных компонентов, например, обогащенных популяций клеток, которые будут использованы в препаратах для терапевтического применения, включая лечение заболевания почек, анемии, дефицита EPO, нарушения канальцевого транспорта и нарушения гломерулярной фильтрации. В конкретных вариантах осуществления популяцию клеток выделяют из свежерасщепленной, то есть, механически или ферментативно расщепленной, почечной ткани, или из гетерогенной in vitro культуры почечных клеток млекопитающего.
В конкретных вариантах осуществления популяция почечных клеток включает EPO-продуцирующие почечные клетки. В конкретных вариантах осуществления субъект имеет анемию и/или дефицит EPO. В конкретных вариантах осуществления популяции EPO-продуцирующих почечных клеток характеризуются экспрессией EPO и биологической чувствительностью к кислороду, так, что уменьшение давления кислорода в системе культивирования приводит к индукции экспрессии EPO. В конкретных вариантах осуществления популяции EPO-продуцирующих клеток обогащены по EPO-продуцирующим клеткам. В конкретных вариантах осуществления экспрессия EPO индуцируется, когда популяцию клеток культивируют в условиях, в которых клетки находятся в системе культивирования при пониженных уровнях доступного кислорода, в сравнении с популяцией клеток, культивируемых при нормальных атмосферных (примерно 21%) уровнях доступного кислорода. В конкретных вариантах осуществления EPO-продуцирующие клетки, культивируемые в условиях с пониженным содержанием кислорода, экспрессируют EPO на более высоких уровнях в сравнении с EPO-продуцирующими клетками, культивируемыми в условиях с нормальным содержанием кислорода. Как правило, культивирование клеток при пониженных уровнях доступного кислорода (также называемых гипоксическими условиями культивирования) означает, что уровень кислорода снижен в сравнении с культивированием клеток при нормальных атмосферных уровнях доступного кислорода (также называемых нормальными условиями или нормоксическими условиями). В конкретных вариантах осуществления культивирование клеток в гипоксических условиях включает культивирование клеток при менее примерно 1% кислорода, менее примерно 2% кислорода, менее примерно 3% кислорода, менее примерно 4% кислорода или менее примерно 5% кислорода. В конкретных вариантах осуществления культивирование клеток в нормальных условиях, или нормоксических условиях, включает культивирование клеток при примерно 10% кислорода, примерно 12% кислорода, примерно 13% кислорода, примерно 14% кислорода, примерно 15% кислорода, примерно 16% кислорода, примерно 17% кислорода, примерно 18% кислорода, примерно 19% кислорода, примерно 20% кислорода или примерно 21% кислорода.
В конкретных вариантах осуществления добиваются индукции, или увеличения, экспрессии EPO; ее можно наблюдать в случае культивирования клеток при менее примерно 5% доступного кислорода и сравнивать с уровнями экспрессии EPO в клетках, культивируемых при атмосферных (примерно 21%) уровнях кислорода. В конкретных вариантах осуществления индукции EPO добиваются в культуре клеток, способных экспрессировать EPO, способом, включающим первую фазу культивирования, в которой клетки культивируют при атмосферном уровне кислорода (примерно 21%) в течение некоторого периода времени, и вторую фазу культивирования, в которой уровни доступного кислорода уменьшают, и те же клетки культивируют при менее примерно 5% доступного кислорода. В конкретных вариантах осуществления экспрессия EPO, которая является чувствительной к гипоксическим условиям, регулируется HIF1α. В конкретных вариантах осуществления другие условия культивирования с манипуляциями уровнем кислорода, известные в данной области, могут быть использованы для клеток, описанных в настоящем документе.
В конкретных вариантах осуществления препарат содержит обогащенные популяции EPO-продуцирующих клеток млекопитающего, характеризующихся биологической чувствительностью (такой как, например, экспрессия EPO) к условиям перфузии. В конкретных вариантах осуществления условия перфузии включают временный, прерывистый или непрерывный поток жидкости (перфузию). В конкретных вариантах осуществления экспрессия EPO индуцируется механически, когда среда, в которой клетки культивируются, периодически или непрерывно циркулирует или перемешивается таким образом, что динамические силы передаются клеткам через поток. В конкретных вариантах осуществления клетки, подвергаемые воздействию временного, прерывистого или непрерывного потока жидкости, культивируют таким образом, что они присутствуют в виде трехмерных структур в, или на, материале, который обеспечивает каркас и/или пространство для образования таких трехмерных структур. В конкретных вариантах осуществления клетки культивируют на пористых гранулах и подвергают воздействию прерывистого или непрерывного потока жидкости за счет использования качающейся платформы, вращающейся платформы или вращающейся колбы. В конкретных вариантах осуществления клетки культивируют на трехмерном каркасе и помещают в устройство, обеспечивающее стационарное положение каркаса и протекание жидкости в направлении через, или сквозь, каркас. Специалисты в данной области понимают, что и другие условия культивирования с перфузией, известные в данной области, могут быть использованы для клеток, описанных в настоящем документе.
В конкретных вариантах осуществления популяцию клеток получают из биопсийного образца почки. В конкретных вариантах осуществления популяцию клеток получают из ткани целой почки. В конкретных вариантах осуществления популяцию клеток получают из in vitro культур клеток почки млекопитающего, полученной из биопсийных образцов почки или ткани целой почки. В конкретных вариантах осуществления популяция почечных клеток представляет собой популяцию СПК. В конкретных вариантах осуществления популяция клеток представляет собой не фракционированную популяцию клеток, также называемую в настоящем документе необогащенной популяцией клеток.
Композиции, содержащие различные активные средства (например, отличные от почечных клеток или микровезикул), входят в объем настоящего изобретения. В конкретных вариантах осуществления микровезикулы (например, экзосомы), предложенные в настоящем документе, содержат соединение, которое находилось в среде культивирования популяции почечных клеток, секретирующих микровезикулы (например, экзосомы). В конкретных вариантах осуществления микровезикулы (например, экзосомы), предложенные в настоящем документе, содержат соединение, которое находилось в популяции почечных клеток, секретирующих микровезикулы (например, экзосомы).
Неограничивающие примеры подходящих активных средств включают, без ограничения, клеточные агрегаты, бесклеточные биологические материалы, продукты, секретируемые биоактивными клетками, высокомолекулярные и низкомолекулярные терапевтические средства, а также их сочетания. Например, биоактивные клетки одного типа можно объединять с микроносителями на основе биологического материала с терапевтическими молекулами, или без них, или биоактивными клетками другого типа. В конкретных вариантах осуществления неприкрепленные клетки могут быть объединены с бесклеточными частицами.
В конкретных вариантах осуществления клетки популяции почечных клеток находятся внутри сфероидов. В конкретных вариантах осуществления популяция почечных клеток имеет форму сфероидов. В конкретных вариантах осуществления сфероиды, содержащие биоактивные почечные клетки, вводят субъекту. В конкретных вариантах осуществления сфероиды содержат по меньшей мере один тип, или популяцию, не почечных клеток. В конкретных вариантах осуществления сфероиды получают способом, включающим (i) объединение популяции биоактивных почечных клеток и популяции не почечных клеток, и (ii) культивирование популяции биоактивных почечных клеток и популяции не почечных клеток в 3-мерной системе культивирования, включающей вращающуюся колбу, до образования сфероидов.
В конкретных вариантах осуществления популяция не почечных клеток содержит популяцию эндотелиальных клеток или популяцию эндотелиальных клеток-предшественников. В конкретных вариантах осуществления популяция биоактивных клеток представляет собой популяцию эндотелиальных клеток. В конкретных вариантах осуществления популяция эндотелиальных клеток представляет собой линию клеток. В конкретных вариантах осуществления популяция эндотелиальных клеток содержит эндотелиальные клетки пуповинной крови человека (HUVEC). В конкретных вариантах осуществления популяция не почечных клеток представляет собой популяцию мезенхимальных стволовых клеток. В конкретных вариантах осуществления популяция не почечных клеток представляет собой популяцию стволовых клеток из гемопоэтического органа, молочной железы, кишечника, плаценты, легкого, костного мозга, крови, пуповины, эндотелия, пульпы зуба, жировой ткани, нервной ткани, обонятельного эпителия, нервного гребня или яичка. В конкретных вариантах осуществления популяция не почечных клеток представляет собой популяцию клеток-предшественников из жировой ткани. В конкретных вариантах осуществления популяции клеток являются ксеногенными, сингенными, аллогенными, аутологичными, или их сочетанием. В конкретных вариантах осуществления популяцию биоактивных почечных клеток и популяцию не почечных клеток культивируют в соотношении от 0,1:9,9 до 9,9:0,1. В конкретных вариантах осуществления популяцию биоактивных почечных клеток и популяцию не почечных клеток культивируют в соотношении примерно 1:1. В конкретных вариантах осуществления популяцию почечных клеток и популяцию биоактивных клеток суспендируют в ростовой среде.
Размноженные биоактивные почечные клетки затем могут быть подвергнуты разделению в среде с непрерывным или прерывистым градиентом плотности для получения СПК. В частности, используют центрифугирование в непрерывном или прерывистом, одноступенчатом или многоступенчатом, градиенте плотности для разделения собранных популяций почечных клеток в зависимости от плавучей плотности клеток. В конкретных вариантах осуществления размноженные биоактивные почечные клетки могут быть дополнительно подвергнуты разделению методом центрифугирования через границу, барьер или интерфейс между фазами с разной плотностью для получения СПК. В частности, центрифугирование через границу, барьер или интерфейс между фазами с разной плотностью используют для разделения собранных популяций почечных клеток в зависимости от плавучей плотности клеток. В конкретных вариантах осуществления СПК получают с использованием, частично, среды OPTIPREP (Axis-Shield), содержащей 60% (масс/об) раствор неионного йодированного соединения йодиксанола в воде. Однако специалист в данной области понимает, что любые среды с градиентом плотности, без ограничения по конкретным средам, или другие методы, например, иммунологического разделения с использованием клеточных поверхностных маркеров, известных в данной области, имеющие необходимые свойства для выделения популяций клеток по настоящему изобретению, могут быть использованы в соответствии с настоящим изобретением. Например, можно использовать перколл [коллоидные частицы кремнезема диаметром 15-30 нм (23% по массе в воде), покрытые поливинилпирролидоном (PVP)] или сахарозу для создания градиента плотности или границы фаз с разной плотностью. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,04 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,04 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,0419 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,0419 г/мл, исключают и отбрасывают. В конкретных вариантах осуществления фракцию клеток, имеющих плавучую плотность более примерно 1,045 г/мл, собирают после центрифугирования в виде четкого осадка клеток. В конкретных вариантах осуществления клетки, имеющие плавучую плотность менее 1,045 г/мл, исключают и отбрасывают.
В конкретных вариантах осуществления терапевтические композиции, и препараты, по настоящему изобретению могут содержать (i) выделенные гетерогенные популяции почечных клеток, обогащенные по конкретным биоактивным компонентам, или типам клеток, и/или истощенные по конкретным неактивным или нежелательным компонентам, или типам клеток, и/или (ii) микровезикулы (например, экзосомы), секретируемые такими клетками, для использования в лечении заболевания почек, то есть, обеспечения стабилизации и/или улучшения, и/или восстановления почечной функции и/или структуры. Неограничивающие примеры клеток для обеспечения такой стабилизации и/или улучшения ранее описаны в публикациях Presnell et al. U.S. 8318484 и Ilagan et al. PCT/US2011/036347, а также Jain et al. PCT/US2016/044866, полное содержание которых включено в настоящий документ посредством ссылки. В конкретных вариантах осуществления композиции, предложенные в настоящем документе, могут содержать выделенные фракции почечных клеток, которые лишены клеточных компонентов в сравнении с клетками здорового индивидуума, но сохраняют терапевтические свойства, то есть, обеспечивают стабилизацию и/или улучшение, и/или восстановление почечной функции. В конкретных вариантах осуществления популяции клеток, клеточные фракции и/или секретируемые продукты клеток, описанные в настоящем документе, могут быть получены от здоровых индивидуумов, индивидуумов с заболеванием почек или субъектов, описанных в настоящем документе.
В конкретных вариантах осуществления источник клеток является таким же, как и намеченный целевой орган или ткань. Например, БПК и/или СПК могут быть получены из почки и использованы в препарате, который будет введен в почку. В конкретных вариантах осуществления популяции клеток получены из биопсийного образца почки. В конкретных вариантах осуществления популяция клеток получена из ткани целой почки. В конкретных вариантах осуществления популяция клеток получена из in vitro культур клеток почки млекопитающего, полученных из биопсийных образцов почки или ткани целой почки. В конкретных вариантах осуществления БПК и/или СПК содержат гетерогенные смеси или фракции биоактивных почечных клеток. БПК или СПК могут быть получены из, или сами являются, фракций почечных клеток от здоровых индивидуумов. Кроме того, настоящее изобретение относится к фракциям почечных клеток, полученных от нездорового индивидуума, которые могут быть лишены определенных типов клеток в сравнении с соответствующими фракциями почечных клеток здорового индивидуума, но все еще сохраняют терапевтические свойства. Настоящее изобретение также относится к популяциям терапевтически активных клеток, лишенным некоторых клеточных компонентов в сравнении с клетками здорового индивидуума, при этом такие популяции клеток в конкретных вариантах осуществления могут быть выделены и размножены из аутологичных источников, находящихся в различных болезненных состояниях.
В конкретных вариантах осуществления СПК получают путем выделения и размножения почечных клеток из ткани коркового слоя почки пациента, полученной путем биопсии. Почечные клетки выделяют из почечной ткани путем ферментативного расщепления, размножают с использованием стандартных методов культивирования клеток и отбирают методом центрифугирования размноженных почечных клеток через границу, барьер или интерфейс между фазами с разной плотностью. В данном варианте осуществления СПК состоят в основном из эпителиальных клеток почечных канальцев, которые известны своим регенеративным потенциалом (Bonventre JV. Dedifferentiation and proliferation of surviving epithelial cells in acute renal failure. J Am Soc Nephrol. 2003;14(Suppl. 1):S55-61; Humphreys BD, Czerniak S, DiRocco DP, et al. Repair of injured proximal tubule does not involve specialized progenitors. PNAS. 2011;108:9226-31; Humphreys BD, Valerius MT, Kobayashi A, et al. Intrinsic epithelial cells repair the kidney after injury. Cell Stem Cell. 2008;2:284-91). И другие паренхиматозные (сосудистые) и стромальные клетки могут присутствовать в популяции аутологичных СПК. В конкретных вариантах осуществления почечные клетки отбирают путем центрифугирования через непрерывный или прерывистый, одноступенчатый или многоступенчатый, градиент плотности.
Настоящее изобретение охватывает терапевтические композиции, содержащие как везикулы (например, микровезикулы, такие как экзосомы), так и селективные почечные клетки. В конкретных вариантах осуществления сочетание везикул и клеток обеспечивает стабилизацию и/или улучшение, и/или восстановление, и/или регенерацию почечной функции у субъекта. Терапевтические свойства могут включать восстановительный или регенеративный эффект.
В конкретных вариантах осуществления клетки представляют собой генетически модифицированные (например, геномно модифицированные и/или модифицированные посредством РНКи) иммунологически привилегированные БПК (такие как СПК).
В конкретных вариантах осуществления везикулы получают из генетически модифицированных (например, геномно модифицированных и/или модифицированных посредством РНКи) иммунологически привилегированных БПК (таких как СПК).
В конкретных вариантах осуществления генетически модифицированные БПК представляют собой геномно модифицированные БПК (то есть, БПК с генетической модификацией в их геномах). В конкретных вариантах осуществления генетически модифицированные БПК содержат экзогенный полинуклеотид (такой как плазмида или вирусный вектор), который экспрессирует молекулу РНК-интерференции (РНКи), которая обеспечивает уменьшение экспрессии отвечающего за иммуногенность геномного гена в БПК. В конкретных вариантах осуществления молекула РНКи представляет собой молекулу короткой интерферирующей или короткой шпилечной РНК. В конкретных вариантах осуществления способ включает генетическое модифицирование отвечающего за иммуногенность геномного гена в БПК.
В конкретных вариантах осуществления ген кодирует белок в молекуле главного комплекса гистосовместимости (MHC) класса I или молекуле MHC класса II. В конкретных вариантах осуществления ген представляет собой ген бета-2-микроглобулина (B2M, также известного как β2M), человеческого лейкоцитарного антигена (HLA)-A, HLA-B, HLA-C, HLA-DRA, HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DPA1, HLA-DPA2, HLA-DQA1 или HLA-DQB1.
В конкретных вариантах осуществления ген кодирует минорный антиген гистосовместимости (MiHA или mHA). В конкретных вариантах осуществления ген представляет собой ген HA-1, HA-2, HA-8, HB-1, HY-A1, HY-A2, HY-B7, HY-B8, HY-B60 или HY-DQ5.
В конкретных вариантах осуществления любой аллельный вариант генов HLA, B2M или mHA, упомянутых в настоящем документе, может быть модифицирован (например, удален) или стать мишенью для РНК-интерференции.
В конкретных вариантах осуществления генетическое модифицирование гена представляет собой внесение мутации в ген. В конкретных вариантах осуществления внесение мутации в ген представляет собой делецию гена или его части.
В конкретных вариантах осуществления генетическое модифицирование клетки включает внесение мутации в любое сочетание двух или более из генов B2M, HLA-A, HLA-B, HLA-C, HLA-DRA, HLA-DRB1, HLA-DRB3, HLA-DRB4, HLA-DRB5, HLA-DPA1, HLA-DPA2, HLA-DQA1 и/или HLA-DQB1.
В конкретных вариантах осуществления генетически модифицированные БПК представляют собой генетически модифицированные первичные почечные клетки. В конкретных вариантах осуществления генетически модифицированные первичные почечные клетки были пересеяны по меньшей мере примерно 1, 2, 3, 4, 5, или более, раз до или после генетического модифицирования. В конкретных вариантах осуществления способ дополнительно включает получение СПК из генетически модифицированных БПК. В конкретных вариантах осуществления СПК получают, а затем генетически модифицируют.
В конкретных вариантах осуществления БПК представляют собой СПК. Различные неограничивающие примеры СПК раскрыты в настоящем документе.
В конкретных вариантах осуществления БПК генетически модифицируют, когда она находится в популяции БПК, при этом не все клетки в популяции БПК становятся генетически модифицированными. В конкретных вариантах осуществления способ дополнительно включает выделение или обогащение генетически модифицированных БПК из популяции БПК. В конкретных вариантах осуществления способ дополнительно включает выделение или обогащение генетически модифицированных СПК из популяции СПК. В конкретных вариантах осуществления популяцию БПК (например, СПК) подвергают генетической модификации для получения популяции БПК, в которой некоторые клетки генетически модифицированы, а другие клетки не модифицированы. В некоторых вариантах осуществления некоторые из генетически модифицированных клеток являются гомозиготными по модификации. В конкретных вариантах осуществления некоторые из генетически модифицированных клеток являются гетерозиготными по модификации. В конкретных вариантах осуществления клетки, которые являются гомозиготными по модификации, обогащают или отбирают. В конкретных вариантах осуществления клетки, которые являются гетерозиготными по модификации, обогащают или отбирают. В конкретных вариантах осуществления клетки, которые являются гомозиготными или гетерозиготными по модификации, обогащают или отбирают. В конкретных вариантах осуществления модификация представляет собой мутацию, которая приводит к уменьшению экспрессии белка, закодированного данным геном. В конкретных вариантах осуществления мутация приводит к уменьшению уровня белка на поверхности модифицированных клеток. В конкретных вариантах осуществления клетки, которые экспрессируют белок, истощают или исключают. В конкретных вариантах осуществления мутация приводит к уменьшению уровня молекулы MHC класса I и/или молекулы MHC класса II на поверхности клетки. В конкретных вариантах осуществления клетки с мутацией не имеют на своей поверхности молекулу MHC класса I и/или молекулу MHC класса II. В конкретных вариантах осуществления клетки, которые экспрессируют на поверхности молекулу MHC класса I, истощают или исключают. В конкретных вариантах осуществления клетки, которые экспрессируют на поверхности молекулу MHC класса II, истощают или исключают. В конкретных вариантах осуществления используют метод сортировки клеток для удаления клеток, которые экспрессируют белок молекулы MHC класса I и/или молекулы MHC класса II, из популяции. В конкретных вариантах осуществления метод сортировки клеток включает использование средства (такого как антитело), которое связывает белок молекулы MHC класса I и/или молекулы MHC класса II. В конкретных вариантах осуществления истощение или отбор клеток включает связывание с гранулой/антителом для извлечения клеток с определенными белками на их клеточной поверхности. В конкретных вариантах осуществления метод сортировки клеток представляет собой магнитную сортировку активированных клеток (MACS) или активированную флуоресценцией сортировку клеток (FACS). В конкретных вариантах осуществления ген, выбранный для генетической модификации, представляет собой ген, белок которого экспрессируется на клеточной поверхности, таким образом, технология FACS и/или MACS позволяет дифференцировать (например, на основании связывания антитела на поверхности) живые клетки. В вариантах осуществления MACS используют для удаления клеток, которые экспрессируют молекулу MHC (такую как молекула MHC класса I или молекула MHC класса II), из не экспрессирующих молекулу MHC клеток. В конкретных вариантах осуществления можно использовать интегрирующий или не интегрирующий вектор для экспрессии другого полипептидного компонента HLA с целью дальнейшей модификации или модуляции адаптивной или врожденной иммунной системы, например, для предотвращения нацеливания и лизиса клетками - естественными киллерами (NK).
В конкретных вариантах осуществления генетическое модифицирование (например, внесение мутаций) гена включает (i) экспрессию редактирующего ген белка в БПК; или (ii) доставку редактирующего ген белка через клеточную мембрану БПК. В конкретных вариантах осуществления редактирующий ген белок представляет собой нуклеазу «цинковые пальцы» (ZFN), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), мегаTAL или управляемую при помощи гид-РНК эндонуклеазу. В конкретных вариантах осуществления направляемая при помощи РНК эндонуклеаза представляет собой белок Cas. В конкретных вариантах осуществления белок Cas представляет собой белок Cas9. В конкретных вариантах осуществления генетическое модифицирование гена дополнительно включает (i) экспрессию направляющей единой гид-РНК (гРНК) в БПК; или (ii) доставку единой гид-РНК (гРНК) через клеточную мембрану БПК. В конкретных вариантах осуществления белок Cas9 и гРНК являются частью рибонуклеопротеидного комплекса.
В конкретных вариантах осуществления генетическое модифицирование гена приводит к уменьшению количества MHC класса I на поверхности клетки. В конкретных вариантах осуществления генетическое модифицирование гена приводит к уменьшению количества MHC класса II на поверхности клетки. В конкретных вариантах осуществления способ включает генетическое модифицирование двух или более генов, при этом по меньшей мере один из генов кодирует белок в молекуле MHC класса I, и по меньшей мере один из генов кодирует белок в молекуле MHC класса II. В конкретных вариантах осуществления по меньшей мере один из генов представляет собой ген HLA.
Неограничивающие описания генетически модифицированных БПК, включая способы получения, описаны в PCT заявке № PCT/US18/38801, поданной 21 июня 2018 г.
В конкретных вариантах осуществления источник клеток является таким же, как и намеченный целевой орган или ткань из того же, или другого источника. Например, БПК и/или СПК могут быть получены из почки и использованы в препарате, который будет введен в почку (совместно с везикулами, или отдельно от них). В конкретных вариантах осуществления БПК и/или СПК могут быть получены из почки с целью использования для продуцирования везикул, которые будут введены в почку. В конкретных вариантах осуществления популяции клеток получены из биопсийного образца почки. В конкретных вариантах осуществления популяции клеток получены из ткани целой почки. В конкретных вариантах осуществления популяции клеток получены из in vitro культур клеток почки млекопитающего, полученных из биопсийных образцов почки или ткани целой почки. В конкретных вариантах осуществления БПК и/или СПК содержат гетерогенные смеси или фракции генетически модифицированных (например, геномно модифицированных и/или модифицированных посредством РНКи) иммунологически привилегированных биоактивных почечных клеток. БПК или СПК могут быть получены из, или сами являются, фракций почечных клеток от здоровых индивидуумов. Кроме того, настоящее изобретение относится к фракциям почечных клеток, полученных от нездорового индивидуума, которые могут быть лишены определенных типов клеток в сравнении с соответствующими фракциями почечных клеток здорового индивидуума, но все еще сохраняют терапевтические свойства. Настоящее изобретение также относится к популяциям терапевтически активных клеток, лишенным некоторых клеточных компонентов в сравнении с клетками здорового индивидуума, при этом такие популяции клеток в одном варианте осуществления могут быть выделены и размножены из почек разных млекопитающих.
В конкретных вариантах осуществления СПК получают путем выделения и размножения почечных клеток из ткани коркового слоя почки другого пациента, полученной путем биопсии почки. В конкретных вариантах осуществления почечные клетки выделяют из почечной ткани путем ферментативного расщепления, размножают с использованием стандартных методов культивирования клеток и отбирают методом центрифугирования в градиенте плотности из размноженных почечных клеток. В конкретных вариантах осуществления СПК состоят в основном из почечных эпителиальных клеток, которые известны своей иммунологической привилегированностью и регенеративным потенциалом. И другие паренхиматозные (сосудистые) и стромальные клетки могут в небольших количествах присутствовать в популяции СПК.
Как описано в настоящем документе, настоящее изобретение основано, частично, на том удивительном факте, что некоторые подфракции гетерогенной популяции почечных клеток, обогащенные по биоактивным компонентам и истощенные по неактивным или нежелательным компонентам, обеспечивают лучшие терапевтические и регенеративные результаты, чем исходная популяция.
В конкретных вариантах осуществления при выделении и размножении почечных клеток получают смесь типов почечных клеток, включая почечные эпителиальные клетки и стромальные клетки. В конкретных вариантах осуществления СПК получают путем разделения в градиенте плотности размноженных почечных клеток. В конкретных вариантах осуществления основной тип клеток в разделенной в градиенте плотности популяции СПК имеет фенотип эпителиальных клеток почечных канальцев. В конкретных вариантах осуществления фенотип СПК характеризуют методом проточной цитометрии, и функцию СПК определяют на основании экспрессии VEGF и KIM-1.
Специалисты в данной области понимают, что и другие способы выделения и культивирования, известные в данной области, могут быть использованы для клеток, описанных в настоящем документе. Специалисты в данной области также понимают, что популяции биоактивных клеток могут быть получены из источников, отличных от тех, которые конкретно перечислены выше, включая, без ограничения, ткани и органы, отличные от почки, жидкости организма и жировую ткань.
Фенотип СПК
В конкретных вариантах осуществления микровезикулы (например, экзосомы), секретируемые СПК, и/или СПК вводят субъекту, который имеет, или имеет риск развития заболевания почек.
В конкретных вариантах осуществления фенотип клеток контролируют путем анализа экспрессии маркеров почечных клеток методом проточной цитометрии. Фенотипический анализ клеток основан на использовании антигенных маркеров, специфичных для анализируемого типа клеток. Проточно-цитометрический анализ позволяет количественно определять клетки в образце популяции, которые экспрессируют анализируемый антигенный маркер.
В литературе описаны различные маркеры, полезные для анализа фенотипических характеристик эпителиальных клеток почечных канальцев: (i) цитокератины; (ii) транспортные мембранные белки (аквапорины и кубилин); (iii) молекулы клеточного связывания (адгерины и кластер дифференцировки, и лектины); и (iv) метаболические ферменты (глутатион и гамма-глютамилтранспептидаза (GGT)). (Таблица 1). Поскольку большинство клеток, встречающихся в культурах, полученных из гидролизатов целой почки, представляют собой эпителиальные и эндотелиальные клетки, анализ маркеров направлен главным образом на экспрессию белков, характерных для этих двух групп.
Таблица 1. Фенотипические маркеры для анализа СПК
В Таблице 2 приведены выбранные маркеры, диапазон и средние значения, в процентах, для фенотипических маркеров в популяции СПК, и обоснование их выбора.
Таблица 2. Маркеры, выбранные для фенотипического анализа СПК
(n=63)
Клеточная функция
СПК активно секретируют белки, которые могут быть обнаружены при анализе кондиционированной среды. Клеточную функцию оценивают на основании способности клеток метаболизировать PrestoBlue и секретировать VEGF (фактор роста эндотелия сосудов) и KIM-1 (молекула повреждения почек 1).
В Таблице 3 приведены количества VEGF и KIM-1 в кондиционированной среде от почечных клеток и культур СПК. Почечные клетки культивировали до состояния, близкого к конфлюэнтности. Кондиционированную среду, в которой почечные клетки находились в течение ночи, тестировали на VEGF и KIM-1.
Таблица 3. Продуцирование VEGF и KIM-1 человеческими почечными клетками и СПК
(n=15)
(n=14)
Ферментативная активность СПК
Клеточную функцию СПК, до формулирования, также можно оценивать путем измерения активности двух конкретных ферментов; GGT (γ-глютамилтранспептидазы) и LAP (лейцинаминопептидазы), присутствующих в проксимальных канальцах почки.
Хотя в настоящем документе описаны композиции микровезикул (например, экзосом) и селективных почечных клеток, по настоящему изобретению предусмотрены композиции, содержащие разные другие активные средства. Другие подходящие активные средства включают, без ограничения, клеточные агрегаты, бесклеточные биологические материалы, высокомолекулярные и низкомолекулярные терапевтические средства, а также их сочетания. Например, биоактивные клетки одного типа можно объединять с микроносителями на основе биологического материала с терапевтическими молекулами, или без них, или биоактивными клетками другого типа, неприкрепленные клетки можно объединять с бесклеточными частицами.
Клеточные агрегаты
В одном из аспектов препараты по настоящему изобретению содержат клеточные агрегаты или сфероиды и/или микровезикулы (например, экзосомы), секретируемые такими агрегатами или сфероидами, и/или микровезикулы (например, экзосомы), секретируемые биоактивными клетками, которые не находятся в агрегатах или сфероидах.
В конкретных вариантах осуществления клеточный агрегат содержит популяцию биоактивных клеток, описанных в настоящем документе. В конкретных вариантах осуществления клеточный агрегат содержит биоактивные почечные клетки, такие как, например, смеси почечных клеток, обогащенные популяции почечных клеток, а также сочетания фракций почечных клеток и смесей почечных клеток с мезенхимальными стволовыми клетками, предшественниками эндотелиальных клеток, клетками, полученными из стромальной сосудистой фракции жировой ткани, или любой другой популяцией не почечных клеток, без ограничения.
В конкретных вариантах осуществления биоактивные почечные клетки по изобретению можно культивировать в 3D-форматах, как описано далее в настоящем документе. В конкретных вариантах осуществления термин «органоид» означает массу клеток с фенотипом и/или функцией, которые воспроизводят аспекты естественной почки. В конкретных вариантах осуществления органоиды содержат смешанные популяции клеток различных линий дифференцировки, которые, как правило, встречаются in vivo в определенной ткани. В конкретных вариантах осуществления органоиды по настоящему изобретению образуются in vitro, любыми способами, посредством которых клетки по изобретению образуют агрегаты, которые, в свою очередь, могут образовывать сфероиды, органоиды, или их сочетание. В некоторых вариантах осуществления такие агрегаты, сфероиды или органоиды принимают структуру, соответствующую конкретному органу. В конкретных вариантах осуществления такие агрегаты, сфероиды или органоиды экспрессируют поверхностные маркеры, которые, как правило, экспрессируются клетками конкретного органа. В конкретных вариантах осуществления такие агрегаты, сфероиды или органоиды продуцируют соединения или материалы, которые, как правило, экспрессируются клетками конкретного органа. В конкретных вариантах осуществления клетки по изобретению можно культивировать на природных субстратах, например, желатине. В конкретных вариантах осуществления клетки по изобретению можно культивировать на синтетических субстратах, например, PLGA.
Биологические материалы
Различные биологические материалы можно объединять с активным средством для получения терапевтических препаратов по настоящему изобретению. В конкретных вариантах осуществления биологические материалы могут иметь любую подходящую форму (например, гранулы) или консистенцию (например, жидкость, гель, и так далее). Подходящие биологические материалы в форме полимерных матриц описаны в Bertram et al., опубликованной патентной заявке США 20070276507 (полное содержание которой включено в настоящий документ посредством ссылки). В конкретных вариантах осуществления полимерным матрицам или каркасам можно придавать самые разные желательные конфигурации для соответствия любому количеству общих системных, геометрических или пространственных ограничений. В конкретных вариантах осуществления биологический материал имеет форму жидкой суспензии. В конкретных вариантах осуществления матрицы или каркасы по настоящему изобретению могут быть трехмерными и иметь форму, согласующуюся с размерами и формами органа или структурой ткани. Например, при использовании полимерного каркаса для лечения заболевания почек, нарушения канальцевого транспорта или нарушения гломерулярной фильтрации может быть использована трехмерная (3-D) матрица, которая воспроизводит отдельные аспекты, или полностью структуру и организацию, ткани естественной почки, а также почечной паренхимы.
Можно использовать множество имеющих разную форму 3-D каркасов. Естественно, полимерная матрица может иметь разные размеры и формы, чтобы быть подходящей для пациентов разного размера. Полимерная матрица также может быть сформирована другими способами для удовлетворения особых потребностей пациентов. В конкретных вариантах осуществления полимерная матрица или каркас может представлять собой биосовместимый материал (например, пористый полимерный каркас). Каркасы могут быть сформированы из различных синтетических или природных материалов, включая, но без ограничения, полимолочную кислоту с открытыми порами (OPLA®), эфир целлюлозы, целлюлозу, сложный эфир целлюлозы, фторсодержащий полиэтилен, фенольный полимер, поли-4-метилпентен, полиакрилoнитрил, полиамид, полиамидимид, полиакрилат, полибензоксазол, поликарбонат, полицианоариловый эфир, полиэфир, полиэфиркарбонат, полиэфир, полиэфирэфиркетон, полиэфиримид, полиэфиркетон, полиэфирсульфон, полиэтилен, полифторолефин, полиимид, полиолефин, полиоксадиазол, полифениленоксид, полифениленсульфид, полипропилен, полистирол, полисульфид, полисульфон, политетрафторэтилен, политиоэфир, политриазол, полиуретан, поливинил, поливинилиденфторид, регенерированную целлюлозу, силикон, мочевину-формальдегид, коллагены, желатин, альгинат, ламинины, фибронектин, шелк, эластин, альгинат, гиалуроновую кислоту, агарозу, либо их сополимеры или физические смеси. Конфигурации каркаса могут иметь форму от мягких пористых каркасов до жестких, сохраняющих форму, пористых каркасов. В конкретных вариантах осуществления каркас сконфигурирован в виде жидкого раствора, способного становиться гидрогелем, например, гидрогелем до температуры плавления.
В конкретных вариантах осуществления каркас получают из живой почки или другого органа человека или животного, при этом естественную популяцию клеток элиминируют за счет применения детергента и/или других химических средств, и/или других ферментативных и/или физических методов, известных специалистам в данной области. В данном варианте осуществления естественная трехмерная структура исходного органа сохраняется, наряду со всеми связанными компонентами внеклеточного матрикса, в их естественном, биоактивном контексте. В конкретных вариантах осуществления каркас представляет собой внеклеточный матрикс, полученный из почки или другого органа человека или животного. В конкретных вариантах осуществления конфигурацию собирают в тканеподобную структуру, применяя методы трехмерной биопечати. В конкретных вариантах осуществления конфигурация представляет собой раствор в жидкой форме, который способен превращаться в гидрогель.
В конкретных вариантах осуществления биологический материал представляет собой гидрогель. Гидрогели могут быть образованы из различных полимерных материалов и могут иметь различное биологическое применение. Гидрогели могут быть описаны физически, как трехмерные сети гидрофильных полимеров. В зависимости от типа, гидрогели имеют разное процентное содержание воды, но, в целом, не растворяются в воде. Несмотря на высокое содержание в них воды, гидрогели также способны связывать большие объемы жидкости благодаря наличию гидрофильных остатков. Гидрогели интенсивно набухают без изменения своей гелеобразной структуры. Основные физические признаки гидрогеля могут быть специально модифицированы, в зависимости от свойств полимеров и устройства, используемого для введения гидрогеля.
Материал гидрогеля, предпочтительно, не вызывает воспалительный ответ. Примеры других материалов, которые можно использовать для получения гидрогеля, включают (a) модифицированные альгинаты, (b) полисахариды (например, геллановую камедь и каррагинаны), которые образуют гель под воздействием одновалентных катионов, (c) полисахариды (например, гиалуроновую кислоту), которые представляют собой очень вязкие жидкости или являются тиксотропными и образуют гель с течением времени за счет медленной эволюции структуры, (d) желатин или коллаген, и (e) полимерные предшественники гидрогелей (например, блок-сополимеры полиэтиленоксид-полипропиленгликоль и белки). В патенте США № 6224893 B1 приведено подробное описание различных полимеров и химических свойств таких полимеров, которые подходят для получения гидрогелей по настоящему изобретению.
В конкретном варианте осуществления гидрогель, используемый для формулирования биологических материалов по настоящему изобретению, является желатиновым. Желатин представляет собой нетоксичный, биоразлагаемый и водорастворимый белок, получаемый из коллагена, который является основным компонентом внеклеточного матрикса (ВКМ) мезенхимальной ткани. Коллаген является основным структурным белком во внеклеточном пространстве различных соединительных тканей в телах животных. Как основной компонент соединительной ткани, он является самым распространенным белком у млекопитающих, составляющим от 25% до 35% общего содержания белка в организме. В зависимости от степени минерализации коллагеновые ткани могут быть твердыми (кости), эластичными (сухожилия), или иметь диапазон от твердого до эластичного (хрящи). Коллаген в форме продолговатых волокон преимущественно встречается в волокнистых тканях, таких как сухожилия, связки и кожа. Он также в изобилии представлен в роговице, хрящах, костях, кровеносных сосудах, пищеварительном тракте, межпозвоночных дисках и дентине зубов. В мышечной ткани он является основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани, и составляет 6% веса сильных сухожильных мышц. Коллаген встречается во многих зонах по всему организму. Однако более 90% коллагена в организме человека относится к типу I.
На сегодняшний день обнаружено и описано 28 видов коллагена. Их можно разделить на несколько групп в зависимости от структуры, которую они образуют: фибриллярный (типа I, II, III, V, XI). Не фибриллярный FACIT (связанные с волокнами коллагены с прерванными тройными спиралями) (типа IX, XII, XIV, XVI, XIX). Короткоцепочечный (типа VIII, X). Базальной мембраны (тип IV). Мультиплексин (множественные трехспиральные домены с прерываниями) (типа XV, XVIII). MACIT (связанные с мембраной коллагены с прерванными тройными спиралями) (типа XIII, XVII). Другие (типа VI, VII). Пятью наиболее распространенными типами являются: тип I: кожа, сухожилия, соединения сосудов, органы, кости (основной компонент органической части костей). Тип II: хрящ (основной коллагеновый компонент хряща). Тип III: ретикулиновый (основной компонент ретикулиновых волокон), обычно встречается вместе с типом I. Тип IV: образует базальную пластинку, эпителиально-секретирующий слой базальной мембраны. Тип V: клеточные поверхности, волосы и плацента.
Желатин сохраняет информационные сигналы, включая последовательность аргинин-глицин-аспарагиновая кислота (RGD), которая стимулирует клеточную адгезию, пролиферацию и дифференциацию стволовых клеток. Характерным свойством желатина является то, что он проявляет зависимость от верхней критической температуры растворения (UCST). В конкретных вариантах осуществления выше определенного порога температуры 40°C, желатин может растворяться в воде, образуя гибкие, случайные одиночные спирали. При охлаждении возникают водородные связи и ван-дер-ваальсовы взаимодействия, приводящие к образованию тройных спиралей. Эти коллаген-подобные тройные спирали действуют в качестве зон сочленения, инициируя таким образом переход из золя в гель. Желатин широко используют для фармацевтических и медицинских целей.
В конкретных вариантах осуществления гидрогель, используемый для формулирования инъекционных клеточных композиций по настоящему изобретению, имеет в основе свиной желатин, который может быть получен из свиной шкуры и коммерчески доступен, например, от Nitta Gelatin NA Inc. (NC, USA) или Gelita USA Inc. (IA, USA). Желатин можно растворять, например, в фосфатно-солевом буфере Дульбекко (DPBS), получая термочувствительный гидрогель, который может превращаться в гель и разжижаться при разных температурах. В конкретных вариантах осуществления гидрогель, используемый для формулирования инъекционных клеточных композиций по настоящему изобретению, имеет в основе рекомбинантный человеческий или животный желатин, экспрессированный и очищенный методами, известными специалистам в данной области. В конкретных вариантах осуществления экспрессионный вектор, содержащий всю, или часть, кДНК для человеческого коллагена типа I, альфа-1, экспрессируется в дрожжах Pichia pastoris. Другие экспрессионные векторные системы и организмы известны специалистам в данной области. В конкретном варианте осуществления желатиновый гидрогель по настоящему изобретению представляет собой жидкость при комнатной температуре (22-28°C), и выше, и образует гель при охлаждении до температуры охлаждения (2-8°C).
Специалисты в данной области понимают, что и другие типы синтетических или природных материалов, известные в данной области, можно использовать для формирования каркасов, описанных в настоящем документе.
В конкретных вариантах осуществления биологический материал, используемый по настоящему изобретению, состоит из гиалуроновой кислоты (HA) в форме гидрогеля, содержащего молекулы HA в диапазоне размеров от 5,1 кДа до >2×105 кДа. HA может стимулировать морфогенез с разветвлениями и трехмерную самоорганизацию ассоциированных популяций биоактивных клеток. В конкретных вариантах осуществления биологический материал, используемый по настоящему изобретению, состоит из гиалуроновой кислоты в форме поропласта, также содержащего молекулы HA в диапазоне размеров от 5,1 кДа до >2×105 кДа. В конкретных вариантах осуществления гидрогель получен из, или содержит внеклеточный матрикс из почки, или любой другой ткани или органа, без ограничения. В другом варианте осуществления биологический материал, используемый по настоящему изобретению, состоит из пены на основе полимолочной кислоты (PLA), имеющей структуру с открытыми порами и размер пор от примерно 50 микрон до примерно 300 микрон.
Термочувствительные биологические материалы
Биологические материалы, описанные в настоящем документе, также могут быть разработаны, или адаптированы, для реагирования на определенные внешние условия, например, in vitro или in vivo. В конкретных вариантах осуществления биологические материалы являются термочувствительными (например, либо in vitro, либо in vivo). В конкретных вариантах осуществления биологические материалы адаптированы для реакции на ферментативное расщепление (например, либо in vitro, либо in vivo). Биологические материалы, реагирующие на внешние условия, могут быть точно настроены, как описано в настоящем документе. Температурную чувствительность описанного препарата можно варьировать за счет изменения процентного содержания биологического материала в препарате. Например, процентное содержание желатина в растворе можно регулировать для модуляции температурной чувствительности желатина в конечном препарате (например, жидкости, геле, гранулах и так далее). Альтернативно, можно производить химическую сшивку биологических материалов для обеспечения большей устойчивости к ферментативному расщеплению. Например, можно использовать сшивающий реагент карбодиимид для осуществления химической сшивки желатиновых гранул, за счет этого уменьшая чувствительность к эндогенным ферментам.
В одном из аспектов препараты, описанные в настоящем документе, включают биологические материалы, имеющие свойства, которые обеспечивают благоприятную среду для активного средства, такого как микровезикулы (например, экзосомы) и/или биоактивные почечные клетки, которые будут введены субъекту. В конкретных вариантах осуществления препарат содержит первый биологический материал, который обеспечивает благоприятную среду с момента формулирования активного средства с биологическим материалом до момента введения препарата субъекту. В конкретных вариантах осуществления благоприятная среда означает наличие преимущества нахождения биоактивных клеток в суспендированном состоянии в практически твердой среде, в отличие от клеток в жидкости (как описано в настоящем документе), до введения субъекту. В конкретных вариантах осуществления первый биологический материал представляет собой термочувствительный биологический материал. Термочувствительный биологический материал может находиться в (i) практически твердом состоянии при температуре примерно 8°C, или ниже, и (ii) практически жидком состоянии при температуре окружающей среды, или выше. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре.
В конкретных вариантах осуществления биологический материал представляет собой термочувствительный биологический материал, который может поддерживать по меньшей мере две разные фазы, или состояния, в зависимости от температуры. Биологический материал способен поддерживать первое состояние при первой температуре, второе состояние при второй температуре, и/или третье состояние при третьей температуре. Первое, второе и третье состояния могут представлять собой практически твердое, практически жидкое или практически полутвердое или полужидкое состояния. В конкретных вариантах осуществления биологический материал имеет первое состояние при первой температуре и второе состояние при второй температуре, при этом первая температура является более низкой, чем вторая температура.
В конкретных вариантах осуществления состояние термочувствительного биологического материала является практически твердым состоянием при температуре примерно 8°C, или ниже. В конкретных вариантах осуществления практически твердое состояние сохраняется при температуре примерно 1°C, примерно 2°C, примерно 3°C, примерно 4°C, примерно 5°C, примерно 6°C, примерно 7°C или примерно 8°C. В конкретных вариантах осуществления практически твердое состояние имеет форму геля. В конкретных вариантах осуществления состояние термочувствительного биологического материала является практически жидким состоянием при температуре окружающей среды, или выше. В конкретных вариантах осуществления практически жидкое состояние сохраняется при температуре примерно 25°C, примерно 25,5°C, примерно 26°C, примерно 26,5°C, примерно 27°C, примерно 27,5°C, примерно 28°C, примерно 28,5°C, примерно 29°C, примерно 29,5°C, примерно 30°C, примерно 31°C, примерно 32°C, примерно 33°C, примерно 34°C, примерно 35°C, примерно 36°C или примерно 37°C. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре.
В конкретных вариантах осуществления состояние термочувствительного биологического материала является практически твердым состоянием при температуре около температуры окружающей среды, или ниже. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре. В конкретных вариантах осуществления практически твердое состояние сохраняется при температуре примерно 17°C, примерно 16°C, примерно 15°C, примерно 14°C, примерно 13°C, примерно 12°C, примерно 11°C, примерно 10°C, примерно 9°C, примерно 8°C, примерно 7°C, примерно 6°C, примерно 5°C, примерно 4°C, примерно 3°C, примерно 2°C или примерно 1°C. В конкретных вариантах осуществления практически твердое состояние имеет форму гранулы. В конкретных вариантах осуществления состояние термочувствительного биологического материала является практически жидким состоянием при температуре примерно 37°C или выше. В конкретных вариантах осуществления практически твердое состояние сохраняется при температуре примерно 37°C, примерно 38°C, примерно 39°C или примерно 40°C.
Термочувствительные биологические материалы могут быть предоставлены в форме раствора, в форме твердого вещества, в форме гранул или в других подходящих формах, описанных в настоящем документе и/или известных специалистам в данной области. Микровезикулы (например, экзосомы) и/или популяции клеток и препараты, описанные в настоящем документе, могут быть покрыты, нанесены на, погружены в, присоединены к, высеяны, суспендированы в, или заключены в термочувствительный биологический материал. В конкретных вариантах осуществления популяции клеток, описанных в настоящем документе, могут быть организованы в виде трехмерных клеточных агрегатов или органоидов, или трехмерных трубчатых структур, до образования комплекса с термочувствительным биологическим материалом, или могут быть организованы, как указано, при образовании комплекса с термочувствительным биологическим материалом. В конкретных вариантах осуществления термочувствительный биологический материал может быть предоставлен без каких-либо клеток, например, в форме разделительных гранул. В данном варианте осуществления термочувствительный биологический материал играет абсолютно пассивную роль, создавая пространство внутри органа-мишени для проявления регенеративной биологической активности, например, ангиогенеза или инфильтрации и миграции популяций клеток-хозяев.
В конкретных вариантах осуществления термочувствительный биологический материал имеет переходное состояние между первым состоянием и вторым состоянием. В конкретных вариантах осуществления переходное состояние представляет собой переходное состояние из твердого вещества в жидкость в диапазоне температур от примерно 8°C до примерно температуры окружающей среды. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре. В конкретных вариантах осуществления переходное состояние из твердого вещества в жидкость имеет место при одной или более температурах, составляющих примерно 8°C, примерно 9°C, примерно 10°C, примерно 11°C, примерно 12°C, примерно 13°C, примерно 14°C, примерно 15°C, примерно 16°C, примерно 17°C и примерно 18°C.
Термочувствительные биологические материалы имеют определенную вязкость при конкретной температуре, измеряемую в сантипуазах (сП). В конкретных вариантах осуществления биологический материал имеет вязкость при 25°C, составляющую от примерно 1 сП до примерно 5 сП, от примерно 1,1 сП до примерно 4,5 сП, от примерно 1,2 сП до примерно 4 сП, от примерно 1,3 сП до примерно 3,5 сП, от примерно 1,4 сП до примерно 3,5 сП, от примерно 1,5 сП до примерно 3 сП, от примерно 1,55 сП до примерно 2,5 сП или от примерно 1,6 сП до примерно 2 сП. В конкретных вариантах осуществления биологический материал имеет вязкость при 37°C, составляющую от примерно 1,0 сП до примерно 1,15 сП. Вязкость при 37°C может составлять примерно 1,0 сП, примерно 1,01 сП, примерно 1,02 сП, примерно 1,03 сП, примерно 1,04 сП, примерно 1,05 сП, примерно 1,06 сП, примерно 1,07 сП, примерно 1,08 сП, примерно 1,09 сП, примерно 1,10 сП, примерно 1,11 сП, примерно 1,12 сП, примерно 1,13 сП, примерно 1,14 сП или примерно 1,15 сП. В конкретных вариантах осуществления биологический материал представляет собой раствор желатина. Желатин присутствует в растворе в концентрации примерно 0,5%, примерно 0,55%, примерно 0,6%, примерно 0,65%, примерно 0,7%, примерно 0,75%, примерно 0,8%, примерно 0,85%, примерно 0,9%, примерно 0,95% или примерно 1% (масс/об). В одном примере биологический материал представляет собой 0,75% (масс/об) раствор желатина в PBS. В конкретных вариантах осуществления 0,75% (масс/об) раствор имеет вязкость при 25°C, составляющую от примерно 1,6 сП до примерно 2 сП. В конкретных вариантах осуществления 0,75% (масс/об) раствор имеет вязкость при 37°C, составляющую от примерно 1,07 сП до примерно 1,08 сП. Раствор желатина может быть получен в PBS, DMEM или другом подходящем растворителе.
В одном из аспектов препарат содержит микровезикулы (например, экзосомы) и/или биоактивные клетки в сочетании со вторым биологическим материалом, который обеспечивает благоприятную среду для объединенных с ним микровезикул (например, экзосом) и/или клеток с момента формулирования вплоть до момента после введения субъекту. В конкретных вариантах осуществления благоприятная среда, обеспечиваемая вторым биологическим материалом, означает наличия преимущества введения микровезикул (например, экзосом) и/или клеток в биологическом материале, который сохраняет структурную целостность вплоть до момента введения субъекту и в течение некоторого периода времени после введения. В конкретных вариантах осуществления структурная целостность второго биологического материала после имплантации сохраняется в течение нескольких минут, часов, дней или недель. В конкретных вариантах осуществления структурная целостность сохраняется в течение менее одного месяца, менее одной недели, менее одного дня или менее одного часа. В течение относительно короткого периода времени структурная целостность позволяет иметь препарат, который способен доставлять активное средство и биологический материал в целевой участок в ткани или органе, с контролируемой обработкой, размещением или диспергированием, не препятствуя или не мешая взаимодействию включенных элементов с тканью или органом, в который он был помещен.
В конкретных вариантах осуществления второй биологический материал представляет собой термочувствительный биологический материал, который имеет иную чувствительность, чем первый биологический материал. Второй биологический материал может иметь (i) практически твердое состояние при температуре около температуры окружающей среды, или ниже, и (ii) практически жидкое состояние при примерно 37°C, или выше. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре.
В конкретных вариантах осуществления второй биологический материал представляет собой сшитые гранулы. Сшитые гранулы могут иметь тонко настраиваемое время пребывания in vivo в зависимости от степени сшивки, как описано в настоящем документе. В конкретных вариантах осуществления сшитые гранулы содержат микровезикулы (например, экзосомы) и/или биоактивные клетки и являются устойчивыми к ферментативному расщеплению, как описано в настоящем документе. В конкретных вариантах осуществления препараты по настоящему изобретению могут включать первый биологический материал в сочетании с активным средством, например, микровезикулами (например, экзосомами) и/или биоактивными клетками, с добавлением, или без добавления, второго биологического материала в сочетании с активным средством, например, микровезикулами (например, экзосомами) и/или биоактивными клетками. В конкретных вариантах осуществления, если препарат включает второй биологический материал, тот может представлять собой термочувствительные гранулы и/или сшитые гранулы.
В одном из аспектов настоящее изобретение относится к препаратам, содержащим биологические материалы, которые распадаются в течение периода времени порядка нескольких минут, часов или дней. Это отличается от большого количества работ, направленных на имплантацию твердых материалов, которые затем медленно распадаются в течение дней, недель или месяцев. В конкретных вариантах осуществления биологический материал имеет одну или более из следующих характеристик: биологическую совместимость, биоразлагаемость/биовсасываемость, практически твердое состояние до, и в процессе, имплантации субъекту, утрату структурной целостности (практически твердого состояния) после имплантации и совместимую с клетками среду для поддержания жизнеспособности и пролиферации клеток. Способность биологического материала удерживать имплантированные частицы на расстоянии во время имплантации стимулирует врастание естественной ткани. В конкретных вариантах осуществления биологический материал также облегчает имплантацию твердых препаратов. В конкретных вариантах осуществления биологический материал обеспечивает локализацию препарата, описанного в настоящем документе, поскольку введение твердого элемента помогает предотвращать диспергирование доставляемых материалов в ткани во время имплантации. В случае клеточных препаратов твердый биологический материал также способствует повышению стабильности и жизнеспособности прикрепляющихся клеток, в сравнении клетками, суспендированными в жидкости. Однако короткий срок существования структурной целостности означает, что вскоре после имплантации биологический материал больше не создает значительный барьер для врастания ткани или интеграции доставленных клеток/материалов с тканью хозяина.
В одном из аспектов настоящее изобретение относится к препаратам, которые содержат биологические материалы, имплантируемые в практически твердой форме, а затем разжижающиеся/плавящиеся или иным образом теряющие структурную целостность после имплантации в тело. Это отличается от большого количества работ, направленных на использование материалов, которые могут быть введены в виде жидкостей, впоследствии затвердевающих в теле.
Биосовместимые гранулы
В одном из аспектов препарат включает термочувствительный биологический материал, описанный в настоящем документе, и популяцию биосовместимых гранул, содержащих биологический материал. В конкретных вариантах осуществления гранулы являются сшитыми. Сшивку можно осуществлять с использованием любого подходящего сшивающего агента, известного специалистам в данной области, такого как, например, карбодиимиды; альдегиды (например, фурфурол, акролеин, формальдегид, глутаральдегид, глицерилальдегид), сшивающие агенты на основе сукцинимида (бис(сульфосукцинимидил)суберат (BS3), дисукцинимидилглутарат (DSG), дисукцинимидилсуберат (DSS), дитиобис(сукцинимидил пропионат), этиленгликоль-бис(сульфосукцинимидилсукцинат), этиленгликоль-бис(сукцинимидилсукцинат) (EGS), бис(сульфосукцинимидил)глутарат (BS2G), дисукцинимидилтартрат (DST)); эпоксиды (диглицидный эфир этиленгликоля, диглицидный эфир 1,4-бутандиола); сахариды (сахара глюкоза и альдоза); сульфоновые кислоты и п-толуолсульфоновая кислота; карбонилдиимидазол; генипин; имины; кетоны; дифенилфосфорилазид (DDPA); терефталоил хлорид; нитрат гексагидрат церия (III); микробная трансглутаминаза и пероксид водорода. Специалистам в данной области известны и другие подходящие сшивающие агенты и методы сшивки для использования по настоящему изобретению.
В конкретных вариантах осуществления гранулы представляют собой сшитые карбодиимидом гранулы. В конкретных вариантах осуществления сшитые карбодиимидом гранулы могут быть сшиты при помощи карбодиимида, выбранного из группы, состоящей из 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорида (EDC), DCC - N, N'-дициклогексилкарбодиимида (DCC) и N, N'-диизопропилкарбодиимида (DIPC). Считается, что гранулы, обработанные EDC в более низкой концентрации, имеют большее количество свободных первичных аминов, в то время как образцы, обработанные сшивающим агентом в более высокой концентрации, будут иметь большинство первичных аминов, вовлеченных в амидные связи. Интенсивность оранжевой окраски, развивающейся при ковалентном связывании между первичным амином и пикролсульфоновой кислотой, которая может быть определена спектрофотометрическим методом при 335 нм, пропорциональна количеству первичных аминов, присутствующих в образце. При нормировании на миллиграмм белка, присутствующего в образце, можно наблюдать обратную корреляцию между количеством присутствующих свободных аминов и исходной концентрацией EDC, используемого для сшивки. Этот результат указывает на дифференциальное сшивание гранул, обусловленное количеством карбодиимида, использованного в реакции. Как правило, в сшитых гранулах наблюдается меньшее количество свободных первичных аминов в сравнении с не сшитыми гранулами.
В конкретных вариантах осуществления сшитые гранулы в меньшей степени подвержены ферментативному расщеплению в сравнении с не сшитыми биосовместимыми гранулами, что позволяет точно настраивать гранулы для времени существования in vivo. В конкретных вариантах осуществления сшитые гранулы устойчивы к эндогенным ферментам, таким как коллагеназы. В конкретных вариантах осуществления использование сшитых гранул является частью системы доставки, облегчающее одно или более из: (a) доставки прикрепленных клеток в нужные участки и создания пространства для регенерации и врастания естественной ткани и сосудистой сети; (b) возможности существования в нужном участке достаточно долго для того, чтобы клетки адаптировались, функционировали, реконструировали свою микросреду и секретировали их естественный внеклеточный матрикс (ВКМ); (c) стимуляции интеграции трансплантированных клеток с окружающей тканью; (d) возможности имплантации клеток в практически твердой форме; (e) кратковременной структурной целостности, которая не создает существенное препятствие для врастания ткани, de novo ангиогенеза или интеграции доставляемых клеток/материалов с тканью хозяина; (f) локализованной in vivo доставки в практически твердой форме, что предотвращает диспергирование клеток в ткани в процессе имплантации; (g) повышенной стабильности и жизнеспособности прикрепляющихся клеток в сравнении с клетками, суспендированными в жидкости; (h) двухфазного профиля высвобождения при доставке клеток 1) в практически твердой форме (например, прикрепленными к гранулам), и 2) в практически жидкой форме (например, суспендированными в жидкости); i) воссоздания и имитации трехмерной биологической ниши или паренхимы почки, из которой эти популяции биоактивных клеток были получены.
В конкретных вариантах осуществления настоящее изобретение относится к сшитым гранулам, содержащим желатин. В конкретных вариантах осуществления не сшитые желатиновые гранулы не подходят для препарата биоактивных клеток, поскольку они быстро утрачивают целостность, и клетки рассеиваться от участка инъекции. В конкретных вариантах осуществления желатиновые гранулы с высокой степенью сшивки могут существовать достаточно долго в участке инъекции и могут препятствовать de-novo секреции ВКМ, интеграции клеток, ангиогенезу и регенерации ткани. Настоящее изобретение позволяет точно регулировать время существования in vivo сшитых гранул. Для точного регулирования биоразлагаемости биологических материалов используют разные концентрации карбодиимида при сшивке, в то время как общие условия реакции оставляют постоянными для всех образцов. Например, чувствительность к ферментам гранул, сшитых карбодиимидом, может быть тонко настроена путем изменения концентрации сшивающего агента от примерно нуля до примерно 1 M. В конкретных вариантах осуществления концентрация составляет примерно 5 мМ, примерно 6 мМ, примерно 7 мМ, примерно 8 мМ, примерно 9 мМ, примерно 10 мМ, примерно 11 мМ, примерно 12 мМ, примерно 13 мМ, примерно 14 мМ, примерно 15 мМ, примерно 16 мМ, примерно 17 мМ, примерно 18 мМ, примерно 19 мМ, примерно 20 мМ, примерно 21 мМ, примерно 22 мМ, примерно 23 мМ, примерно 24 мМ, примерно 25 мМ, примерно 26 мМ, примерно 27 мМ, примерно 28 мМ, примерно 29 мМ, примерно 30 мМ, примерно 31 мМ, примерно 32 мМ, примерно 33 мМ, примерно 34 мМ, примерно 35 мМ, примерно 36 мМ, примерно 37 мМ, примерно 38 мМ, примерно 39 мМ, примерно 40 мМ, примерно 41 мМ, примерно 42 мМ, примерно 43 мМ, примерно 44 мМ, примерно 45 мМ, примерно 46 мМ, примерно 47 мМ, примерно 48 мМ, примерно 49 мМ, примерно 50 мМ, примерно 55 мМ, примерно 60 мМ, примерно 65 мМ, примерно 70 мМ, примерно 75 мМ, примерно 80 мМ, примерно 85 мМ, примерно 90 мМ, примерно 95 мМ или примерно 100 мМ. Концентрация сшивающего агента также может составлять примерно 0,15 M, примерно 0,2 M, примерно 0,25 M, примерно 0,3 M, примерно 0,35 M, примерно 0,4 M, примерно 0,45 M, примерно 0,5 M, примерно 0,55 M, примерно 0,6 M, примерно 0,65 M, примерно 0,7 M, примерно 0,75 M, примерно 0,8 M, примерно 0,85 M, примерно 0,9 M, примерно 0,95 M или примерно 1 M. В конкретных вариантах осуществления сшивающий агент представляет собой 1-этил-3-[3-диметиламинопропил]карбодиимид гидрохлорид (EDC). В конкретных вариантах осуществления сшитые EDC гранулы представляют собой желатиновые гранулы. Деградация (%) гранул может быть точно отрегулирована в зависимости от концентрации сшивающего агента. В конкретных вариантах осуществления желатиновые гранулы могут быть смешаны с гранулами или микрочастицами, выполненными не из желатина (например, без ограничения, альгината или HA), для дополнительного повышения эффективности доставляемой популяции биоактивных клеток.
Сшитые гранулы могут обладать определенными характеристиками, которые являются благоприятными для высевания, прикрепления или инкапсуляции популяций биоактивных клеток и/или микровезикул (например, экзосом). Например, гранулы могут иметь пористую поверхность и/или могут быть в значительной степени полыми. В конкретных вариантах осуществления наличие пор обеспечивает большую поверхность для прикрепления клеток, что делает возможным прикрепление большего количества клеток, чем в случае непористой или гладкой поверхности. Кроме того, пористая структура может способствовать интеграции ткани хозяина с пористыми гранулами, облегчая образование de novo ткани. В конкретных вариантах осуществления гранулы имеют распределение по размерам, которое может быть подогнано к графику Вейбулла, соответствующему общей схеме распределения частиц. В конкретных вариантах осуществления сшитые гранулы имеют средний диаметр менее примерно 120 мкм, примерно 115 мкм, примерно 110 мкм, примерно 109 мкм, примерно 108 мкм, примерно 107 мкм, примерно 106 мкм, примерно 105 мкм, примерно 104 мкм, примерно 103 мкм, примерно 102 мкм, примерно 101 мкм, примерно 100 мкм, примерно 99 мкм, примерно 98 мкм, примерно 97 мкм, примерно 96 мкм, примерно 95 мкм, примерно 94 мкм, примерно 93 мкм, примерно 92 мкм, примерно 91 мкм или примерно 90 мкм. В конкретных вариантах осуществления характеристики сшитых гранул варьируются в зависимости от метода изготовления. В конкретных вариантах осуществления для получения гранул, имеющих вышеуказанные характеристики, используют метод, в котором поток воздуха используют для аэрозолизации жидкого раствора желатина и распыления его в жидкий азот с помощью распылителя реагентов для тонкослойной хроматографии (ACE Glassware). Специалисты в данной области понимают, что изменение параметров метода изготовления дает возможность точно регулировать различные характеристики гранул, например, изменять распределение по размерам частиц. В конкретных вариантах осуществления микротопографию, поверхностные и внутренние характеристики гранул можно дополнительно модифицировать для облегчения прикрепления клеток.
В конкретных вариантах осуществления совместимость с клетками сшитых гранул оценивают in vitro до формулирования препарата, используя методы культивирования клеток, в которых гранулы культивируют с клетками, соответствующими конечному препарату биоактивных клеток. В конкретных вариантах осуществления гранулы культивируют с первичными почечными клетками до изготовления препарата биоактивных почечных клеток, используют анализы на живые/мертвые клетки для подтверждения совместимости с клетками. Помимо жизнеспособности клеток, определенные функциональные тесты для определения клеточной метаболической активности, секреции конкретных ключевых цитокинов, факторов роста и экзосом, а также экспрессии конкретных ключевых белковых и нуклеотидных маркеров, включая микроРНК, ассоциированные с функциональными популяциями биоактивных почечных клеток, хорошо известны специалистам в данной области и могут быть дополнительно использованы для подтверждения активности клеток в препарате со сшитыми гранулами.
В некоторых препаратах биосовместимые сшитые гранулы объединены с термочувствительным биологическим материалом в растворе с концентрацией от примерно 5% (масс/масс) до примерно 15% (масс/масс) от объема раствора. Сшитые гранулы могут присутствовать в концентрации примерно 5% (масс/масс), примерно 5,5% (масс/масс), примерно 6% (масс/масс), примерно 6,5% (масс/масс), примерно 7% (масс/масс), примерно 7,5% (масс/масс), примерно 8% (масс/масс), примерно 8,5% (масс/масс), примерно 9% (масс/масс), примерно 9,5% (масс/масс), примерно 10% (масс/масс), примерно 10,5% (масс/масс), примерно 11% (масс/масс), примерно 11,5% (масс/масс), примерно 12% (масс/масс), примерно 12,5% (масс/масс), примерно 13% (масс/масс), примерно 13,5% (масс/масс), примерно 14% (масс/масс), примерно 14,5% (масс/масс) или примерно 15% (масс/масс) от объема раствора.
В одном из аспектов настоящее изобретение относится к препаратам, содержащим биологические материалы, которые распадаются в течение периода времени порядка нескольких минут, часов или дней. Это отличается от большого количества работ, направленных на имплантацию твердых материалов, которые затем медленно распадаются в течение дней, недель или месяцев.
В одном из аспектов настоящее изобретение относится к препаратам, содержащим биосовместимые сшитые гранулы, засеянные биоактивными клетками, совместно с матрицей для доставки. В конкретных вариантах осуществления матрица для доставки имеет одну или более из следующих характеристик: биологическую совместимость, биоразлагаемость/биовсасываемость, практически твердое состояние до, и в процессе, имплантации субъекту, утрату структурной целостности (практически твердого состояния) после имплантации и совместимую с клетками среду для поддержания жизнеспособности клеток. В конкретных вариантах осуществления способность матрицы для доставки удерживать имплантированные частицы (например, сшитые гранулы) разделенными в пространстве во время имплантации стимулирует врастание естественной ткани. В конкретных вариантах осуществления в отсутствие матрицы для доставки уплотнение засеянных клетками гранул в процессе имплантации может приводить к недостатку пространства для достаточного врастания ткани. В конкретных вариантах осуществления матрица для доставки облегчает имплантацию твердых препаратов. В конкретных вариантах осуществления короткий срок существования структурной целостности означает, что вскоре после имплантации матрица больше не создает значительный барьер для врастания ткани, de novo ангиогенеза или интеграции доставленных клеток/материалов с тканью хозяина. В конкретных вариантах осуществления матрица для доставки обеспечивает локализацию препарата, описанного в настоящем документе, поскольку введение твердого элемента помогает предотвращать диспергирование доставляемых материалов в ткани во время имплантации. В конкретных вариантах осуществления применение матрицы для доставки, описанной в настоящем документе, помогает предотвращать быструю потерю имплантированных клеток при мочеиспускании после доставки в паренхиму почки. В конкретных вариантах осуществления в случае клеточных препаратов твердая матрица для доставки способствует повышению стабильности и жизнеспособности прикрепляющихся клеток в сравнении клетками, суспендированными в жидкости.
В конкретных вариантах осуществления матрица для доставки представляет собой популяцию биосовместимых гранул, не засеянных клетками. В конкретных вариантах осуществления незасеянные гранулы диспергированы по всему объему, и между отдельными засеянными клетками гранулами. В конкретных вариантах осуществления незасеянные гранулы действуют в качестве «разделительных гранул» между засеянными гранулами до, и сразу после, трансплантации. В конкретных вариантах осуществления разделительные гранулы содержат термочувствительный биологический материал, находящийся в практически твердом состоянии при первой температуре и в практически жидком состоянии при второй температуре, при этом первая температура является более низкой, чем вторая температура. Например, разделительные гранулы содержат биологический материал, находящийся в практически твердом состоянии при температуре около температуры окружающей среды, или ниже, и в практически жидком состоянии при примерно 37°C, как описано в настоящем документе. В конкретных вариантах осуществления температура окружающей среды примерно соответствует комнатной температуре. В конкретных вариантах осуществления биологический материал представляет собой раствор желатина. В конкретных вариантах осуществления раствор желатина используют в концентрации примерно 4%, примерно 4,5%, примерно 5%, примерно 5,5%, примерно 6%, примерно 6,5%, примерно 7%, примерно 7,5%, примерно 8%, примерно 8,5%, примерно 9%, примерно 9,5%, примерно 10%, примерно 10,5% или примерно 11% (масс/об). В конкретных вариантах осуществления раствор желатина может быть получен в PBS, среде для культивирования клеток (например, DMEM) или другом подходящем растворителе. В конкретных вариантах осуществления биологический материал представляет собой гиалуроновую кислоту. В конкретных вариантах осуществления биологический материал представляет собой лишенный клеток внеклеточный матрикс из почки человека или животного, который может быть в дальнейшем восстановлен в виде гидрогеля.
В одном из аспектов настоящее изобретение относится к препаратам, которые содержат биологические материалы, имплантируемые в практически твердой форме (например, разделительные гранулы), а затем разжижающиеся/плавящиеся или иным образом теряющие структурную целостность после имплантации в тело. Это отличается от большого количества работ, направленных на использование материалов, которые могут быть введены в виде жидкостей, впоследствии затвердевающих в теле.
Температурную чувствительность разделительных гранул можно оценивать in vitro до формулирования. Например, в конкретных вариантах осуществления разделительные гранулы можно метить и смешивать с немечеными не термочувствительными гранулами. Затем смесь инкубируют при 37°C, чтобы наблюдать изменения в физическом переходе между состояниями. Потерю формы термочувствительными гранулами при более высокой температуре наблюдают с течением времени. Например, термочувствительные желатиновые гранулы могут быть изготовлены с красителем альциановым синим, служащим маркером физического перехода между состояниями. Синие желатиновые гранулы смешивают со сшитыми гранулами (белыми), помещают в катетер, затем экструдируют и инкубируют в 1X PBS, pH 7,4, при 37°C. Потерю формы синими желатиновыми гранулами наблюдают под микроскопом в разные моменты времени. Изменения физического состояния синих желатиновых гранул становятся заметны через 30 мин, становясь более выраженными с увеличением времени инкубации. Гранулы не исчезают полностью из-за вязкости материала.
Препараты с модифицированным высвобождением
В одном из аспектов препараты по настоящему изобретению предоставляют в виде препаратов с модифицированным высвобождением. Как правило, модифицированное высвобождение характеризуется начальным высвобождением первого активного средства после введения, с последующим по меньшей мере одним дополнительным высвобождением второго активного средства. Первое и второе активные средства могут быть одинаковыми, или они могут быть разными. В конкретных вариантах осуществления препараты обеспечивают модифицированное высвобождение за счет наличия нескольких компонентов в одном и том же препарате. В конкретных вариантах осуществления препарат с модифицированным высвобождением содержит активное средство в виде части первого компонента, который позволяет активному средству свободно перемещаться по всему объему препарата, что приводит к немедленному высвобождению в целевом участке после введения. Первый компонент может представлять собой термочувствительный биологический материал, имеющий практически жидкую фазу и практически твердую фазу, при этом первый компонент находится в практически жидкой фазе в момент введения. В конкретных вариантах осуществления активное средство находится в практически жидкой фазе, так что оно может практически свободно перемещаться по всему объему препарата и, таким образом, немедленно высвобождается в целевом участке после введения.
В конкретных вариантах осуществления препарат с модифицированным высвобождением содержит активное средство в виде части второго компонента, при этом активное средство прикреплено, нанесено, покрыто, погружено, высеяно или заключено во втором компоненте, который сохраняется до, и после, введения в целевой участок. Второй компонент содержит структурные элементы, с которыми активное средство может связываться, что предотвращает немедленное высвобождение активного средства из второго компонента в момент введения. Например, второй компонент находится в практически твердой форме, например, в виде биосовместимых гранул, которые могут быть сшиты для предотвращения или отсрочки in vivo ферментативного расщепления. В конкретных вариантах осуществления активное средство в практически твердой фазе сохраняет свою структурную целостность в препарате до, и после, введения и, таким образом, не происходит немедленного высвобождения активного средства в целевом участке после введения. Подходящие носители для препаратов с модифицированным высвобождением описаны в настоящем документе, однако специалистам в данной области известны и другие носители, подходящие для использования по настоящему изобретению.
В конкретных вариантах осуществления препарат обеспечивает начальную быструю доставку/высвобождение доставляемых элементов, включая клетки, микровезикулы (например, экзосомы), наночастицы, терапевтические молекулы, и так далее, с последующим высвобождением элементов в более позднее время. В конкретных вариантах осуществления препарат обеспечивает начальную быструю доставку/высвобождение микровезикул (например, экзосом), микроРНК и других биоактивных молекул нуклеиновой кислоты или белка, которые являются растворимыми и секретируемыми биоактивными продуктами из почечных или других популяций клеток. Другие молекулы или лекарственные средства, связанные с регенеративной биологической активностью, известны специалистам в данной области. Препараты по настоящему изобретению могут быть спроектированы для такого двухфазного профиля высвобождения, когда доставляемое средство присутствует как в несвязанной форме (например, микровезикулы и/или клетки в растворе), так и в связанной форме (например, микровезикулы и/или клетки, связанные с гранулами или другим подходящим носителем). После начального введения несвязанное средство немедленно поступает в участок доставки, в то время как высвобождение связанного средства отсрочено до того момента, когда нарушается структурная целостность носителя (например, гранул), после чего высвобождается ранее связанное средство. Как описано ниже, и другие подходящие механизмы высвобождения известны специалистам в данной области.
В конкретных вариантах осуществления время отсрочки высвобождения можно корректировать в зависимости от природы активного средства. Например, время отсрочки высвобождения в препарате микровезикул (например, экзосом) и/или биоактивных клеток может составлять порядка нескольких секунд, минут, часов или дней. В конкретных вариантах осуществления может быть подходящей отсрочка порядка нескольких недель. В конкретных вариантах осуществления в случае других активных средств, таких как малые и большие молекулы, время отсрочки высвобождения в препарате может составлять порядка нескольких секунд, минут, часов, дней, недель или месяцев. Препарат также может содержать разные биологические материалы, которые обеспечивают профили с разной отсрочкой высвобождения. Например, первый биологический материал с первым активным средством может иметь первое время высвобождения, и второй биологический материал со вторым активным средством может иметь второе время высвобождения. Первое и второе активные средства могут быть одинаковыми или разными.
В конкретных вариантах осуществления период времени замедленного высвобождения может, в целом, соответствовать периоду времени для утраты структурной целостности биологического материала. Однако специалистам в данной области известны и другие механизмы замедленного высвобождения. Например, активное средство может непрерывно высвобождаться с течением времени независимо от времени распада какого-либо конкретного биологического материала, например, за счет диффузии лекарственного средства из полимерной матрицы. Кроме того, микровезикулы (например, экзосомы) и/или биоактивные клетки могут мигрировать из препарата, содержащего биологический материал и биоактивные клетки, в естественную ткань. В конкретных вариантах осуществления биоактивные клетки мигрируют из биологического материала, например, гранулы, в естественную ткань. В одном варианте осуществления биоактивные клетки мигрируют из биологического материала в естественную ткань и индуцируют секрецию факторов роста, цитокинов, экзосом, микроРНК, других нуклеиновых кислот и белков, связанных с регенеративной биологической активностью. В конкретных вариантах осуществления экзосомы и другие внеклеточные микровезикулы, а также микроРНК, другие биоактивные нуклеиновые кислоты и белки мигрируют из биологического материала. В конкретных вариантах осуществления биоактивные клетки мигрируют из биологического материала в естественную ткань и опосредуют мобилизацию стволовых клеток и клеток-предшественников хозяина, которые затем мигрируют, или направляются, в участок повреждения или заболевания.
В конкретных вариантах осуществления можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Пролонгированной абсорбции инъекционных препаратов можно добиваться путем включения в препарат средства, которое замедляет абсорбцию, например, солей моностеарата и желатина. Многие способы получения таких препаратов запатентованы или общеизвестны специалистам в данной области. Смотри, например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. Дополнительные способы получения полипептидных препаратов с контролируемым или пролонгированным высвобождением описаны, например, в патентах США №№ 6306406 и 6346274, а также, например, в патентных заявках США №№ US20020182254 и US20020051808, содержание всех из которых включено в настоящий документ посредством ссылки.
Иллюстративные препараты биоактивных клеток
В конкретных вариантах осуществления везикулы (такие как микровезикулы, например, экзосомы), описанные в настоящем документе, включены в препарат биоактивных клеток. Альтернативно или дополнительно, везикулы можно вводить до, одновременно с, или после препарата биоактивных клеток.
В конкретных вариантах осуществления препараты, описанные в настоящем документе, содержат имплантируемые конструкции, выполненные из вышеописанных биологических материалов, включающие биоактивные почечные клетки, описанные в настоящем документе, для лечения заболевания почек у субъекта, который нуждается в этом. В конкретных вариантах осуществления препараты биоактивных клеток, описанные в настоящем документе, дополнительно содержат везикулы (например, микровезикулы, такие как экзосомы, секретируемые биоактивными почечными клетками).
В конкретных вариантах осуществления конструкция выполнена из биосовместимого материала, или биологического материала, каркаса или матрицы из одного или более синтетических или природных биосовместимых материалов, и одной или более популяций клеток или микровезикул (например, экзосом), описанных в настоящем документе, нанесенных на, или погруженных в, поверхность каркаса за счет прикрепления и/или захвата. В конкретных вариантах осуществления конструкция выполнена из биологического материала и одной или более популяций клеток или их продуктов (таких как микровезикулы, например, экзосомы), описанных в настоящем документе, покрытых, нанесенных на, внесенных в, прикрепленных к, заключенных в, погруженных в, высеянных или объединенных с компонентом(ами) биологического материала. Любые из микровезикул (например, экзосом) и/или популяций клеток, описанных в настоящем документе, могут быть использованы в сочетании с матрицей при формировании конструкции.
В конкретных вариантах осуществления препарат биоактивных клеток представляет собой инъекционный препарат, состоящий из СПК, генетически модифицированных для снижения иммуногенности и сформулированных в биологическом материале (например, желатиновом гидрогеле). В одном из аспектов аллогенные СПК получают путем выделения и размножения почечных клеток из донорской ткани коркового слоя почки пациента, полученной при биопсии почки, генетической модификации СПК с использованием методов генного редактирования и отбора методом центрифугирования в градиенте плотности из размноженных почечных клеток. В конкретных вариантах осуществления СПК состоят в основном из почечных эпителиальных клеток, которые хорошо известны своим регенеративным потенциалом (Humphreys et al. (2008) Intrinsic epithelial cells repair the kidney after injury. Cell Stem Cell. 2(3):284-91). В конкретных вариантах осуществления и другие паренхиматозные (сосудистые) и стромальные (собирающих протоков) клетки могут в небольших количествах присутствовать в популяции СПК. Инъекция СПК в почки реципиента приводила к значительному улучшению показателей выживаемости, функций концентрирования мочи и фильтрования у животных в доклинических исследованиях. Однако СПК имеют ограниченный срок хранения и ограниченную стабильность. Формулирование СПК в биологическом материале, представляющем собой желатиновый гидрогель, обеспечивает повышенную стабильность клеток, за счет чего увеличивается срок хранения препарата, повышается стабильность при транспортировке и доставке в корковый слой почки при клиническом применении.
В одном из аспектов препараты биоактивных клеток производят, сначала получая ткань коркового слоя почки от донора с использованием стандартной клинической процедуры биопсии почки. Почечные клетки выделяют из почечной ткани путем ферментативного расщепления и размножают с использованием стандартных методов культивирования клеток. Среда для культивирования клеток разработана для размножения первичных почечных клеток, и не содержит какие-либо факторы дифференцировки. Собранные почечные клетки подвергают разделению в градиенте плотности, получая СПК. Методы генного редактирования для изменения иммуногенности СПК можно применять либо до, либо после, разделения в градиенте плотности.
В конкретных вариантах осуществления сформулированная популяция клеток и/или микровезикул (например, экзосом) может практически свободно перемещаться по всему объему биологического материала при температуре около температуры окружающей среды, или выше. Суспендирование популяции клеток в практически твердой фазе при более низкой температуре обеспечивает преимущество стабильности для клеток, таких как прикрепляющиеся клетки, в сравнении с клетками в жидкости. Более того, суспендирование микровезикул (например, экзосом) и/или клеток в практически твердом состоянии обеспечивает одно или более из следующих преимуществ: i) предотвращает оседание микровезикул и/или клеток, ii) позволяет клеткам оставаться заякоренными на биологическом материале в суспендированном состоянии; iii) позволяет микровезикулам и/или клеткам оставаться более равномерно распределенными по всему объему биологического материала; iv) предотвращает образование агрегатов микровезикул и/или клеток; и v) обеспечивает лучшую защиту микровезикул и/или клеток при хранении и транспортировке препарата. Препарат, способный сохранять такие признаки до введения субъекту, обладает по меньшей мере тем преимуществом, что клетки, в целом, будут более здоровыми в препарате, и может быть введена более однородная и воспроизводимая доза клеток.
В конкретных вариантах осуществления биологический материал в виде желатинового гидрогеля, используемый для формулирования СПК, представляет собой свиной желатин, растворенный в буфере, с образованием термочувствительного гидрогеля. В конкретных вариантах осуществления такой гидрогель является жидким при комнатной температуре, но образует гель при охлаждении до температуры охлаждения (2-8°C). В конкретных вариантах осуществления СПК формулируют с гидрогелем, переводят в гель путем охлаждения и отправляют в клинику в условиях охлаждения (2-8°C). В конкретных вариантах осуществления в клиническом центре препарат нагревают до комнатной температуры перед введением инъекцией в почку пациента. В конкретных вариантах осуществления препарат биоактивных клеток (например, с добавлением микровезикул, таких как экзосомы, из биоактивных почечных клеток) имплантируют в корковый слой почки с использованием иглы и шприца, подходящих для доставки чрескожным или лапароскопическим введением.
Описание и состав иллюстративной композиции Neo-Kidney Augment
В конкретных вариантах осуществления препарат биоактивных клеток представляет собой Neo-Kidney Augment (NKA), который представляет собой инъекционный препарат, состоящий из аутологичных, селективных почечных клеток (СПК), сформулированных в биологическом материале (желатиновом гидрогеле). В конкретных вариантах осуществления NKA является усиленным или дополненным везикулами (например, микровезикулами, такими как экзосомы, секретируемые биоактивными почечными клетками).
В одном из аспектов аутологичные СПК получают путем выделения и размножения почечных клеток из ткани коркового слоя почки пациента, полученной при биопсии почки, и отбора методом центрифугирования размноженных почечных клеток через границу, барьер или интерфейс между фазами с разной плотностью. В конкретных вариантах осуществления аутологичные СПК получают путем выделения и размножения почечных клеток из ткани коркового слоя почки пациента, полученной при биопсии почки, и отбора методом центрифугирования размноженных почечных клеток в непрерывном или прерывистом, одноступенчатом или многоступенчатом, градиенте плотности. СПК состоят в основном из эпителиальных клеток почечных канальцев, которые хорошо известны своим регенеративным потенциалом (Humphreys et al. (2008) Intrinsic epithelial cells repair the kidney after injury. Cell Stem Cell. 2(3):284-91). И другие паренхиматозные (сосудистые) и стромальные (собирающих протоков) клетки могут в небольших количествах присутствовать в популяции аутологичных СПК.
В конкретных вариантах осуществления NKA дополнен микровезикулами (например, экзосомами), продуцированными и выделенными из популяции СПК.
Инъекция СПК в почки реципиента приводила к значительному улучшению показателей выживаемости, функций концентрирования мочи и фильтрования у животных в доклинических исследованиях. Однако СПК имеют ограниченный срок хранения и ограниченную стабильность. Формулирование СПК в биологическом материале, представляющем собой желатиновый гидрогель, обеспечивает повышенную стабильность клеток, за счет чего увеличивается срок хранения препарата, повышается стабильность NKA при транспортировке и доставке NKA в корковый слой почки при клиническом применении.
В одном из аспектов NKA производят, сначала получая ткань коркового слоя почки от донора/реципиента с использованием стандартной клинической процедуры биопсии почки. В конкретных вариантах осуществления почечные клетки выделяют из почечной ткани путем ферментативного расщепления и размножают с использованием стандартных методов культивирования клеток. В конкретных вариантах осуществления среда для культивирования клеток разработана для размножения первичных почечных клеток, и не содержит какие-либо факторы дифференцировки. В конкретных вариантах осуществления собранные почечные клетки подвергают разделению через границу или интерфейс между фазами с разной плотностью, или в градиенте плотности, получая СПК. В конкретных вариантах осуществления СПК генетически модифицируют в соответствии с настоящим изобретением.
Настоящее изобретение относится к препарату, полученному из биологических материалов, разработанных или адаптированных для реагирования на внешние условия, как описано в настоящем документе. В результате, характер связи популяции биоактивных клеток и других активных средств, таких как микровезикулы (например, экзосомы), с биологическим материалом в конструкции будет меняться в зависимости от внешних условий. Например, связь популяции клеток с термочувствительным биологическим материалом меняется в зависимости от температуры. В конкретных вариантах осуществления конструкция содержит популяцию биоактивных почечных клеток и биологический материал, находящийся в практически твердом состоянии при температуре примерно 8°C, или ниже, и в практически жидком состоянии при температуре около температуры окружающей среды, или выше, при этом популяция клеток суспендирована в биологическом материале при температуре примерно 8°C, или ниже. Однако популяция клеток может практически свободно перемещаться по всему объему биологического материала при температуре около температуры окружающей среды, или выше. Суспендирование популяции клеток в практически твердой фазе при более низкой температуре обеспечивает преимущество стабильности для клеток, таких как прикрепляющиеся клетки, в сравнении с клетками в жидкости. Более того, суспендирование микровезикул (например, экзосом) и клеток в практически твердом состоянии обеспечивает одно или более из следующих преимуществ: i) предотвращает оседание микровезикул и клеток, ii) позволяет клеткам оставаться заякоренными на биологическом материале в суспендированном состоянии; iii) позволяет микровезикулам и клеткам оставаться более равномерно распределенными по всему объему биологического материала; iv) предотвращает образование агрегатов микровезикул или клеток; и v) обеспечивает лучшую защиту микровезикул и клеток при хранении и транспортировке препарата. В конкретных вариантах осуществления препарат, способный сохранять такие признаки до введения субъекту, обладает по меньшей мере тем преимуществом, что клетки, в целом, будут более здоровыми в препарате, и может быть введена более однородная и воспроизводимая доза клеток.
В конкретных вариантах осуществления биологический материал в виде желатинового гидрогеля, используемый для формулирования СПК в NKA, представляет собой свиной желатин, растворенный в буфере, с образованием термочувствительного гидрогеля. Такой гидрогель является жидким при комнатной температуре, но образует гель при охлаждении до температуры охлаждения (2-8°C). СПК формулируют с гидрогелем, получая NKA. NKA переводят в гель путем охлаждения и отправляют в клинику в условиях охлаждения (2-8°C). NKA имеет срок хранения 3 дня. В клиническом центре препарат нагревают до комнатной температуры перед введением инъекцией в почку пациента. NKA имплантируют в корковый слой почки с использованием иглы и шприца, подходящих для доставки NKA чрескожным или лапароскопическим введением. В конкретных вариантах осуществления гидрогель получают из желатина или другого рекомбинантного белка внеклеточного матрикса. В конкретных вариантах осуществления гидрогель получают из внеклеточного матрикса почки, или другой ткани или органа. В конкретных вариантах осуществления гидрогель получают из рекомбинантного белка внеклеточного матрикса. В конкретных вариантах осуществления гидрогель содержит желатин, полученный из рекомбинантного коллагена (то есть, рекомбинантный желатин).
Средства, сохраняющие жизнеспособность клеток
В одном из аспектов препарат биоактивных клеток также содержит средство, сохраняющее жизнеспособность клеток. В конкретных вариантах осуществления везикулы по настоящему изобретению содержат средства, сохраняющие жизнеспособность клеток. В конкретных вариантах осуществления средство, сохраняющее жизнеспособность клеток, выбирают из группы, состоящей из антиоксиданта, переносчика кислорода, иммуномодулирующего фактора, фактора рекрутинга клеток, фактора прикрепления клеток, противовоспалительного средства, ангиогенного фактора, матриксной металлопротеиназы, ранозаживляющего фактора и продуктов, секретируемых из биоактивных клеток.
В одном из аспектов микровезикула (такая как экзосома) содержит (например, в ее просвете, в ее липидном бислое или на ее поверхности) средство, сохраняющее жизнеспособность клеток. В конкретных вариантах осуществления микровезикула была секретирована клетками, которые культивировали в присутствии средства, сохраняющего жизнеспособность клеток.
В конкретных вариантах осуществления средство, сохраняющее жизнеспособность клеток, выбирают из группы, состоящей из антиоксиданта, переносчика кислорода, иммуномодулирующего фактора, фактора рекрутинга клеток, фактора прикрепления клеток, противовоспалительного средства, ангиогенного фактора, матриксной металлопротеиназы, ранозаживляющего фактора и продуктов, секретируемых из биоактивных клеток.
Антиоксиданты характеризуются способностью ингибировать окисление других молекул. Антиоксиданты включают, без ограничения, одно или более из 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (тролокс®), каротиноидов, флавоноидов, изофлавонов, убихинона, глутатиона, липоевой кислоты, супероксиддисмутазы, аскорбиновой кислоты, витамина E, витамина A, смешанных каротиноидов (например, бета-каротина, альфа-каротина, гамма-каротина, лютеина, ликопина, фитоина, фитофлуена и астаксантина), селена, кофермента Q10, индол-3-карбинола, проантоцианидов, ресвератрола, кверцетина, катехинов, салициловой кислоты, куркумина, билирубина, щавелевой кислоты, фитиновой кислоты, липоевой кислоты, ванильной кислоты, полифенолов, феруловой кислоты, теафлавинов, а также их производных. Специалистам в данной области известны и другие подходящие антиоксиданты, которые могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Переносчики кислорода представляют собой средства, характеризующиеся способностью переносить и высвобождать кислород. Они включают, без ограничения, перфторуглероды и фармацевтические препараты, содержащие перфторуглероды. Подходящие переносчики кислорода на основе перфторуглерода включают, без ограничения, перфтороктил бромид (C8F17Br); перфтордихоротан (C8F16C12); перфтордецил бромид; перфлуброн; перфтордекалин; перфтортрипопиламин; перфторметилциклопиперидин; флуозол® (перфтордекалин и перфтортрипопиламин); перфторан® (перфтордекалин и перфторметилциклопиперидин); оксигент® (перфтордецилбромид и перфлуброн); оксицит™ (перфтор(трет-бутилциклогексан)). Специалисты в данной области понимают, что и другие подходящие переносчики кислорода на основе перфторуглерода могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Иммуномодулирующие факторы включают, без ограничения, остеопонтин, факторы FAS-лиганда, интерлейкины, трансформирующий фактор роста бета, тромбоцитарный фактор роста, кластерин, трансферрин, белок, экспрессируемый и секретируемый нормальными T-клетками при активации (RANTES), ингибитор активатора плазминогена 1 (Pai-1), фактор некроза опухоли альфа (TNF-альфа), интерлейкин 6 (IL-6), альфа-1-микроглобулин и бета-2-микроглобулин. Специалисты в данной области понимают, что и другие подходящие иммуномодулирующие факторы могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Противовоспалительные средства или иммунодепрессанты (описанные ниже) также могут быть частью препарата. Специалисты в данной области понимают, что и другие подходящие антиоксиданты могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Факторы рекрутинга клеток включают, без ограничения, моноцитарный хемотаксический протеин 1 (MCP-1) и CXCL-1. Специалисты в данной области понимают, что и другие подходящие факторы рекрутинга клеток могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Факторы прикрепления клеток включают, без ограничения, фибронектин, проколлаген, коллаген, ICAM-1, фактор роста соединительной ткани, ламинины, протеогликаны, специфические пептиды клеточной адгезии, такие как RGD и YSIGR. Специалисты в данной области понимают, что и другие подходящие факторы прикрепления клеток могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Ангиогенные факторы включают, без ограничения, фактор роста эндотелия сосудов F (VEGF) и ангиопоэтин-2 (ANG-2). Специалисты в данной области понимают, что и другие подходящие ангиогенные факторы могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Матриксные металлопротеазы включают, без ограничения, матриксную металлопротеиназу 1 (MMP1), матриксную металлопротеиназу 2 (MMP2), матриксную металлопротеиназу 9 (MMP-9) и тканевый ингибитор металлопротеиназ 1 (TIMP-1).
Ранозаживляющие факторы включают, без ограничения, фактор роста кератиноцитов 1 (KGF-1), тканевой активатор плазминогена (tPA), кальбиндин, кластерин, цистатин C, фактор «трилистника» 3. Специалисты в данной области понимают, что и другие подходящие ранозаживляющие факторы могут быть использованы в конкретных вариантах осуществления настоящего изобретения.
Продукты, секретируемые биоактивными клетками, описанными в настоящем документе, также можно добавлять в препарат биоактивных клеток в качестве средства, сохраняющего жизнеспособность клеток.
Композиции, полученные из жидкостей организма, тканей или органов человека или животных, включая, без ограничения, человеческую плазму, лизат человеческих тромбоцитов, эмбриональную бычью сыворотку или экстракт бычьего гипофиза, также можно добавлять в препарат биоактивных клеток в качестве средства, сохраняющего жизнеспособность клеток.
Специалисты в данной области понимают, что существуют несколько подходящих способов нанесения, или иного варианта объединения популяций клеток с биологическими материалами для получения конструкции.
В конкретных вариантах осуществления БПК (такие как СПК), культивируемые в среде, содержащей средство, сохраняющее жизнеспособность клеток, продуцируют везикулы, содержащие средство, сохраняющее жизнеспособность клеток.
Способы применения
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества выделенных секретированных везикул почечных клеток (например, микровезикул, таких как экзосомы). В конкретных вариантах осуществления везикулы содержат соединение, которое не продуцируется клетками, которые создают везикулы. В конкретных вариантах осуществления везикулы находятся в композиции или препарате, раскрытых в настоящем документе.
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества везикул из препарата везикул, при этом везикула из препарата везикул была идентифицирована как регенеративная способом, раскрытым в настоящем документе.
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта. В конкретных вариантах осуществления способ включает введение субъекту эффективного количества композиции, содержащей популяцию биоактивных почечных клеток с добавлением везикул почечных клеток, которые не были секретированы популяцией биоактивных почечных клеток.
В конкретных вариантах осуществления композицию вводят внутривенной инъекцией. В конкретных вариантах осуществления композицию вводят транскатетерной доставкой. В конкретных вариантах осуществления везикулы вводят инъекцией внутривенно в периферический сосуд. В конкретных вариантах осуществления транскатетерную доставку осуществляют в левую почечную артерию или правую почечную артерию субъекта.
В конкретных вариантах осуществления субъект имеет хроническое заболевание почек. В конкретных вариантах осуществления хроническое заболевание почек представляет собой заболевание почек стадии I, II, III, IV или V.
В конкретных вариантах осуществления лечение заболевания почек включает уменьшение или предотвращение фиброза почек у субъекта.
В конкретных вариантах осуществления субъект получал диализ по меньшей мере 1, 2 или 3 раза в неделю в течение по меньшей мере 1 или 2 недель.
В конкретных вариантах осуществления субъект имеет диабет II типа.
В конкретных вариантах осуществления субъект имеет врожденные аномалии почек и мочевыводящих путей (CAKUT).
В конкретных вариантах осуществления субъект имеет скорость клубочковой фильтрации (GFR) менее 90 мл/мин/1,73 м2, микроальбуминурию или макроальбуминурию.
В конкретных вариантах осуществления клетки не вводят субъекту. В конкретных вариантах осуществления клетки (например, БПК, такие как СПК) вводят субъекту. В конкретных вариантах осуществления везикулы вводят отдельно от клеток. В конкретных вариантах осуществления везикулы вводят до, одновременно с, или после введения клеток. В конкретных вариантах осуществления выделенные везикулы вводят в композиции, которая дополнительно содержит клетки (например, клетки, отличные от клеток, из которых выделены везикулы). В конкретных вариантах осуществления везикулы почечных клеток были секретированы популяцией биоактивных почечных клеток, которая имеет то же происхождение, и/или содержит клетки тех же типов, что и популяция биоактивных почечных клеток в композиции.
В конкретных вариантах осуществления везикулы были продуцированы популяцией БПК. В конкретных вариантах осуществления популяция БПК представляет собой популяцию СПК.
В конкретных вариантах осуществления субъекту вводят везикулы, секретированные первичными почечными клетками. В конкретных вариантах осуществления субъекту вводят везикулы, секретированные первичными почечными клетками, и везикулы, секретированные СПК.
В конкретных вариантах осуществления субъекту также вводят везикулы, секретированные эндотелиальными клетками или мезенхимальными стволовыми клетками.
В конкретных вариантах осуществления субъекту также вводят везикулу не почечной клетки. В конкретных вариантах осуществления везикула не почечной клетки была секретирована не почечной эндотелиальной клеткой-предшественником, не почечной мезенхимальной стволовой клеткой или не почечной адипозной клеткой-предшественником.
В конкретных вариантах осуществления эффективное количество везикул представляет собой количество, которое является эффективным без введения биоактивных почечных клеток (например, количество, которое является достаточным для лечения без введения биоактивных почечных клеток). В конкретных вариантах осуществления эффективное количество биоактивных почечных клеток представляет собой количество, которое является эффективным без введения везикул (например, количество, которое является достаточным для лечения без введения везикул). В конкретных вариантах осуществления эффективное количество везикул представляет собой количество, которое меньше, чем количество, которое было бы эффективно без совместного введения биоактивных почечных клеток. В конкретных вариантах осуществления эффективное количество биоактивных почечных клеток представляет собой количество, которое меньше, чем количество, которое было бы эффективно без совместного введения везикул.
Микровезикулы (например, экзосомы), клетки и препараты по настоящему изобретению подходят для использования в способах применения, описанных в настоящем документе. В конкретных вариантах осуществления препараты по настоящему изобретению можно вводить для лечения заболевания почек. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или биоактивные клетки можно вводить в естественный орган в виде части препарата, описанного в настоящем документе. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или биоактивные клетки могут быть получены из естественного органа, в который производят введение, или из источника, который не является целевым естественным органом.
В конкретных вариантах осуществления настоящее изобретение относится к способам лечения заболевания почек у субъекта, который нуждается в этом, препаратами, содержащими микровезикулы (например, экзосомы) и/или популяцию биоактивных почечных клеток, как описано в настоящем документе. В конкретных вариантах осуществления препараты подходят для введения субъекту, который нуждается в улучшении почечной функции.
В одном из аспектов об эффективности лечения заболевания почек у субъекта способами по настоящему изобретению можно судить на основании различных показателей почечной функции. В конкретных вариантах осуществления показатели почечной функции включают, без ограничения, сывороточный альбумин, соотношение альбумина и глобулина (отношение A/G), сывороточный фосфор, сывороточный натрий, размер почки (определяемый при помощи ультразвука), сывороточный кальций, отношение фосфор:кальций, сывороточный калий, протеинурию, креатинин в моче, сывороточный креатинин, азот мочевины крови (BUN), уровни холестерина, уровни триглицеридов и скорость клубочковой фильтрации (GFR). Кроме того, некоторые показатели общего состояния здоровья и самочувствия включают, без ограничения, увеличение и снижение массы тела, показатель выживаемости, кровяное давление (среднее системное кровяное давление, диастолическое кровяное давление или систолическое кровяное давление) и физическую выносливость.
В одном из аспектов на эффективность лечения препаратом указывает стабилизация одного или более показателей почечной функции. В конкретных вариантах осуществления о стабилизации почечной функции можно судить на основании изменения какого-либо показателя у субъекта, получающего лечение способом по настоящему изобретению, в сравнении с тем же показателем у субъекта, который не получал лечение способом по настоящему изобретению. В конкретных вариантах осуществления о стабилизации почечной функции можно судить на основании изменения какого-либо показателя у субъекта, получающего лечение способом по настоящему изобретению, в сравнении с тем же показателем у того же субъекта до начала лечения. Изменение первого показателя может представлять собой увеличение или уменьшение значения. В конкретных вариантах осуществления лечение, предложенное по настоящему изобретению, может включать стабилизацию уровней сывороточного креатинина и/или азота мочевины крови (BUN) у субъекта, при этом уровни BUN, наблюдаемые у субъекта, являются более низкими в сравнении с уровнями у субъекта с аналогичным состоянием заболевания, который не получал лечение способами по настоящему изобретению. В конкретных вариантах осуществления лечение может включать стабилизацию уровней сывороточного креатинина у субъекта, при этом уровни сывороточного креатинина, наблюдаемые у субъекта, являются более низкими в сравнении с уровнями у субъекта с аналогичным состоянием заболевания, который не получал лечение способами по настоящему изобретению.
Специалисты в данной области понимают, что один или более дополнительных показателей, описанных в настоящем документе или известных в данной области, можно измерять для определения эффективности лечения заболевания почек у субъекта.
В конкретных вариантах осуществления на эффективное лечение препаратом указывает улучшение одного или более показателей почечной структуры и/или функции. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или биоактивные почечные клетки приводят к улучшению уровней сывороточного креатинина и/или азота мочевины крови (BUN). В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или биоактивные почечные клетки приводят к улучшению удержания белка в сыворотке. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и обогащенные биоактивные почечные клетки приводят к улучшению уровней сывороточного альбумина в сравнении с необогащенной популяцией клеток или клетками без добавленных микровезикул (например, экзосом). В конкретных вариантах осуществления микровезикулы (например, экзосомы) приводят к улучшению уровней сывороточного альбумина в сравнении с биоактивными почечными клетками. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или обогащенная популяция биоактивных почечных клеток приводят к улучшению отношения A:G в сравнении с необогащенной популяцией клеток. В конкретных вариантах осуществления популяция биоактивных почечных клеток приводит к улучшению уровней сывороточного холестерина и/или триглицеридов. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или популяция биоактивных почечных клеток приводят к улучшению уровня витамина D. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или обогащенная популяция биоактивных почечных клеток приводят к улучшению отношения фосфор:кальций в сравнении с необогащенной популяцией клеток. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или популяция биоактивных почечных клеток приводят к улучшению уровня гемоглобина в сравнении с необогащенной популяцией клеток. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или популяция биоактивных почечных клеток приводят к улучшению уровня сывороточного креатинина в сравнении с необогащенной популяцией клеток. В конкретных вариантах осуществления микровезикулы (например, экзосомы) и/или обогащенная популяция биоактивных почечных клеток приводят к улучшению уровня гематокрита в сравнении с необогащенной популяцией клеток. В конкретных вариантах осуществления улучшение одного или более из вышеуказанных показателей почечной функции является результатом лечения препаратом микровезикул (например, экзосом) и/или селективных почечных клеток. В одном из вариантов осуществления улучшение одного или более из вышеуказанных показателей почечной функции является результатом лечения препаратом микровезикул (например, экзосом) и/или селективных почечных клеток.
В одном из аспектов настоящее изобретение относится к препаратам для использования в способах регенерации естественной почки у субъекта, который нуждается в этом. В конкретных вариантах осуществления способ включает этап введения или имплантации субъекту популяции биоактивных клеток, клеточного продукта или конструкции, описанных в настоящем документе. Регенерированная естественная почка может быть охарактеризована рядом показателей, включая, без ограничения, развитие функции, или способности, в естественной почке, улучшение функции, или способности, в естественной почке и экспрессия определенных маркеров в естественной почке. В конкретных вариантах осуществления о развитии или улучшении функции, или способности, можно судить на основании различных показателей почечной функции, описанных выше. В конкретных вариантах осуществления регенерированная почка характеризуется дифференциальной экспрессией одного или более маркеров стволовых клеток. Маркер стволовых клеток может являться одним или более из следующего: SRY (определяющая пол область Y)-бокс 2 (Sox2); фактор транскрипции недифференцированных эмбриональных клеток (UTF1); мышиный лимфоузелковый гомолог (NODAL); проминин 1 (PROM1) или CD133 (CD133); CD24; а также любое их сочетание (смотри Ilagan et al. PCT/US2011/036347, полное содержание заявки включено в настоящий документ посредством ссылки), смотри также публикацию Genheimer et al., 2012. Molecular characterization of the regenerative response induced by intrarenal transplantation of selected renal cells in a rodent model of chronic kidney disease. Cells Tissue Organs 196: 374-384, включенную в настоящий документ посредством ссылки в полном объеме. В конкретных вариантах осуществления экспрессия маркера(ов) стволовых клеток повышена в сравнении с контролем.
Один из аспектов настоящего изобретения относится к способу лечения заболевания почек у субъекта, включающему введение субъекту инъекцией препарата, композиции, популяции клеток или микровезикул (например, экзосом), раскрытых в настоящем документе. В конкретных вариантах осуществления препарат, композиция, популяция клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу 18-30 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 20 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 21 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 22 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 23 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 24 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 25 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 26 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 27 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 28 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу менее чем 29 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 20 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 21 калибра.
В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 22 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 23 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 24 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 25 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 26 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 27 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 28 калибра. В конкретных вариантах осуществления препарат, композицию, популяцию клеток или клеточный продукт (такой как микровезикулы, например, экзосомы) вводят инъекцией через иглу примерно 29 калибра.
В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,84 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,61 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,51 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,41 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,33 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,25 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,20 мм. В конкретных вариантах осуществления внутренний диаметр иглы составляет менее 0,15 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 1,27 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,91 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,81 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,71 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,64 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,51 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,41 мм. В конкретных вариантах осуществления наружный диаметр иглы составляет менее 0,30 мм. В конкретных вариантах осуществления игла имеет один из размеров, приведенных в следующей таблице:
Способы и пути введения
В конкретных вариантах осуществления везикулы (например, микровезикулы, такие как почечные экзосомы) вводят без клеток (например, БПК, таких как СПК). В конкретных вариантах осуществления везикулы вводят вместе с клетками. В конкретных вариантах осуществления везикулы вводят в той же композиции, что и клетки, а также отдельно от клеток. В конкретных вариантах осуществления везикулы и клетки вводят разными путями введения. В конкретных вариантах осуществления везикулы и клетки вводят одним путем введения, и везикулы также отдельно вводят другим путем введения. В конкретных вариантах осуществления везикулы вводят более часто, чем клетки.
В конкретных вариантах осуществления везикулы вводят внутривенно. В конкретных вариантах осуществления везикулы вводят внутривенно в периферический сосуд. В конкретных вариантах осуществления везикулы вводят транскатетерной доставкой. В конкретных вариантах осуществления транскатетерную доставку осуществляют в левую почечную артерию или правую почечную артерию субъекта.
Препараты по настоящему изобретению можно вводить отдельно или в сочетании с другими биоактивными компонентами. В конкретных вариантах осуществления препараты подходят для инъекции или имплантации включенных генетически модифицированных элементов ткани в солидные органы для регенерации ткани. В конкретных вариантах осуществления препараты используют для инъекции или имплантации генетически модифицированных элементов ткани в стенку полых органов для регенерации ткани. В конкретных вариантах осуществления такие препараты вводят в сочетании с дополнительными препаратами, подходящими для системной или транскатетерной доставки.
В одном из аспектов настоящее изобретение относится к способам предоставления препарата биоактивных клеток, описанных в настоящем документе, субъекту, который нуждается в этом. В конкретных вариантах осуществления препарат биоактивных клеток дополнен везикулами. В конкретных вариантах осуществления препарат биоактивных клеток не дополнен везикулами, но субъект дополнительно получает отдельный препарат, содержащий везикулы. В конкретных вариантах осуществления источник биоактивных клеток и/или везикул может быть аллогенным или сингенным, а также любым их сочетанием. В конкретных вариантах осуществления способы могут включать введение иммунодепрессанта. (Смотри, например, патент США № 7563822).
В конкретных вариантах осуществления способы лечения по настоящему изобретению включают доставку препарата биоактивных клеток, описанных в настоящем документе. В конкретных вариантах осуществления прямое введение клеток и/или везикул в целевую зону является предпочтительным. Субъект, который нуждается в этом, также может получать лечение путем создания in vivo контакта естественной почки с препаратом биоактивных клеток, описанных в настоящем документе, наряду с продуктами, секретируемыми одной или более обогащенными популяциями почечных клеток, и/или смесью или конструкцией, содержащей их. Этап создания in vivo контакта обеспечивает регенеративный эффект для естественной почки. В конкретных вариантах осуществления выделенные везикулы (например, везикулы без клеток) вводят до, одновременно с, или после введения препарата биоактивных клеток (например, тем же, или иным, путем введения).
Различные способы введения композиций селективных почечных клеток субъектам, с учетом данной спецификации, будут очевидны для специалистов в данной области. Такие способы включают инъекцию клеток в целевую зону в теле субъекта.
Средства доставки
В конкретных вариантах осуществления клетки и/или секретируемые продукты могут быть введены в устройство или среду для доставки, которые облегчают введение субъектам путем инъекции или имплантации. В конкретных вариантах осуществления среда для доставки может включать природные материалы. В конкретных вариантах осуществления среда для доставки может включать синтетические материалы. В конкретных вариантах осуществления среда для доставки имеет структуру, имитирующую, или хорошо вписывающуюся в, архитектуру органа. В конкретных вариантах осуществления среда для доставки является жидкой по своей природе. В этих случаях устройства для доставки могут включать трубки, например, катетеры, для инъекции клеток и жидкостей в тело субъекта-реципиента. В конкретных вариантах осуществления трубки также имеют иглу, например, шприц, через который клетки по изобретению могут быть введены в нужную зону в теле субъекта. В конкретных вариантах осуществления популяции почечных клеток млекопитающих сформулированы для введения в кровеносный сосуд через катетер (при этом термин «катетер» должен охватывать любую из различных трубкообразных систем для доставки веществ в кровеносный сосуд). В конкретных вариантах осуществления клетки могут быть помещены в, или на, биологический материал или каркас, включая, но без ограничения, ткань, такую как тканая, вязаная, плетеная, сетчатая и нетканая ткань, перфорированные пленки, губки и пены, а также гранулы, такие как монолитные или пористые гранулы, микрочастицы, наночастицы и тому подобное (например, желатиновые гранулы Cultispher-S - Sigma). Клетки могут быть подготовлены для доставки в самых разных формах. В конкретных вариантах осуществления клетки могут быть суспендированы в растворе или геле. В конкретных вариантах осуществления клетки могут быть смешаны с фармацевтически приемлемым носителем или разбавителем, в котором клетки по изобретению остаются жизнеспособными.
Фармацевтически приемлемые носители и разбавители включают солевой раствор, водные растворы буферов, растворители и/или дисперсионные среды. Использование таких носителей и разбавителей хорошо известно в данной области. Раствор предпочтительно является стерильным и жидким, и часто будет изотоническим. Предпочтительно, раствор является стабильным в условиях производства и хранения, и предохраненным от загрязняющего действия микроорганизмов, таких как бактерии и грибки, за счет использования, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и тому подобного. Специалист в данной области понимает, что среда для доставки, используемая для доставки популяций клеток и их смесей по настоящему изобретению, может иметь сочетание вышеуказанных характеристик.
В конкретных вариантах осуществления субъекту вводят (i) препарат, содержащий везикулы, (ii) препарат, содержащий биоактивные почечные клетки и/или (iii) препарат, содержащий как биоактивные почечные клетки, так и везикулы.
В конкретных вариантах осуществления субъекту вводят биоактивные почечные клетки (такие как селективные почечные клетки) 1-3 раза. В конкретных вариантах осуществления субъекту вводят биоактивные почечные клетки (такие как селективные почечные клетки) 1 раз. В конкретных вариантах осуществления субъекту вводят биоактивные почечные клетки (такие как селективные почечные клетки) 2 раза. В конкретных вариантах осуществления субъекту вводят биоактивные почечные клетки (такие как селективные почечные клетки) 3 раза.
В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 1-10 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 1 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 2 раза. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 3 раза. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 4 раза. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 5 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 6 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 7 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 8 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 9 раз. В конкретных вариантах осуществления субъекту вводят почечные везикулы (например, микровезикулы, такие как экзосомы) 10 раз.
Способы введения
Способы введения препаратов включают, но без ограничения, системную, внутрипочечную (например, в паренхиму), внутривенную или внутриартериальную инъекцию, транскатетерную доставку, а также инъекцию непосредственно в ткань, в запланированную зону проявления активности. В конкретных вариантах осуществления способы введения, используемые по настоящему изобретению, включают одну или несколько инъекций путем прямой лапаротомии, путем прямой лапароскопии, трансабдоминальной или чрескожной процедуры. В конкретных вариантах осуществления способы введения, используемые по настоящему изобретению, включают, например, ретроградную и лоханочно-мочеточниковую инфузию. Хирургические способы введения включают одностадийные процедуры, такие как, но без ограничения, частичная нефрэктомия и имплантация конструкции, частичная нефрэктомия, частичная пиелэктомия, васкуляризация с сальником ± брюшина, введение при мультифокальной биопсии в пункционные каналы, конические или пирамидальные, в цилиндр, и введение путем полюсоподобной замены, а также двухстадийные процедуры, включающие, например, органоидный внутренний биореактор для пересадки. В конкретных вариантах осуществления препараты, содержащие смеси клеток и везикулы, доставляют одним и тем же путем введения в одно и то же время. В конкретных вариантах осуществления композиции клеток и композиции везикул доставляют отдельно в определенные зоны или определенными методами, либо одновременно, либо в контролируемые моменты времени, одним или более из способов, описанных в настоящем документе. В конкретных вариантах осуществления селективные почечные клетки вводят чрескожной инъекцией в корковый слой почки. В конкретных вариантах осуществления направляющую канюлю вводят чрескожно и используют для прокалывания почечной капсулы перед инъекцией композиции в почку. В конкретных вариантах осуществления везикулы вводят внутривенной инъекцией или транскатетерной доставкой.
Чтобы получить доступ к почке для инъекции сформулированной популяции БПК или СПК (например, совместно, или отдельно от везикул) можно использовать лапароскопический или чрескожный метод. Использование лапароскопического хирургического метода делает возможной непосредственную визуализацию почки, так что любое кровотечение или другие нежелательные явления могут быть замечены в процессе инъекции и меры могут быть приняты немедленно. Чрескожный подход для введения в почки используют уже более десяти лет, в основном для абляции внутрипочечных масс. Во время этих процедур электрод или криогенную иглу вводят в определенную массу в почке и оставляют в контакте с ней в течение (как правило) 10-20 минут для абляции лезии. Инструментарий для чрескожной инъекции терапевтического препарата не превосходит ни по размеру, ни по сложности это оборудование, и такой подход обладает преимуществами безопасности ввиду отсутствия хирургической операции (отсутствия колотых ран в брюшной полости и нагнетания газа) и минимального времени иммобилизации. Кроме того, во входных каналах может быть оставлен гемостатический биоразлагаемый материал для дальнейшего снижения вероятности значительного кровотечения.
В конкретных вариантах осуществления доставки путем инъекции терапевтический препарат биоактивных клеток (который может быть, или не быть, дополнен везикулами) инъецируют в корковый слой почки. В конкретных вариантах осуществления важно добиться максимального распределения терапевтического препарата в корковом слое почки, что может быть достигнуто, например, за счет входа иглы в корковый слой почки под углом, позволяющим депонировать терапевтический препарат в корковом слое почки с максимально возможным распределением. Для этого может потребоваться визуализация почки в продольной или поперечной проекции с использованием оборудования для ультразвуковой визуализации или аксиальной компьютерной томографии (КТ), в зависимости от индивидуальных характеристик пациента. В идеале инъекция будет включать несколько депонирований препарата при постепенном извлечении инъекционной иглы/канюли. Полный объем терапевтического препарата может быть депонирован в одной или нескольких точках входа. В конкретных вариантах осуществления можно использовать до двух точек входа для депонирования полного объема терапевтического препарата в почке. В конкретных вариантах осуществления инъекцию можно выполнять в одну почку с использованием одной или более точек входа, например, одной или двух точек входа. В конкретных вариантах осуществления инъекцию выполняют в обе почки, используя для каждой почки одну или более точек входа, например, одну или две точки входа.
Приведенное выше описание считается достаточным, чтобы специалист в данной области мог осуществить на практике настоящее изобретение. Следует понимать, что хотя настоящее изобретение конкретно описано с помощью предпочтительных вариантов осуществления и необязательных признаков, специалисты в данной области могут использовать модификации и вариации изложенных в настоящем документе концепций, и такие модификации и вариации должны считаться входящими в объем настоящего изобретения, определяемый прилагаемой формулой изобретения. Следующие далее примеры приведены исключительно с иллюстративными целями и не предназначены для ограничения объема настоящего изобретения каким-либо образом. Действительно, различные модификации изобретения, помимо вариантов, описанных в настоящем документе, будут очевидны для специалистов в данной области из вышеприведенного описания, и должны входить в объем прилагаемой формулы изобретения.
Все патенты, патентные заявки и литературные источники, цитированные в настоящей спецификации, включены в настоящий документ посредством ссылки в полном объеме.
ПРИМЕРЫ
Пример 1: Неограничивающие примеры способов и композиций для получения СПК
Пример 1.1 - Приготовление растворов
В данном примере приведены составы различных сред для препаратов и растворов, используемых для выделения и характеризации гетерогенной популяции почечных клеток, а также производства регенеративного терапевтического препарата.
Таблица 6: Среды для культивирования и растворы
-Канамицин: 100 мкг/мл
-5% ЭБС
-Ростовые добавки:
-HGF: 10 мг/л
-EGF: 2,5 мкг/л
-Инсулин: 10,0 мг/л,
-Трансферрин: 5,5 мг/л
-Селен: 670 мкг/л
-Канамицин: 100 мкг/мл
-Канамицин: 100 мкг/мл
-Диспаза: 5 мг/мл
-Хлорид кальция: 5 мМ
-OptiMEM
-10% ДМСО
-10% ЭБС
Для промывания клеток во всех случаях использовали фосфатно-солевой буфер Дульбекко (DPBS).
Пример 1.2 - Выделение гетерогенной не фракционированной популяции почечных клеток
В данном примере описано выделение не фракционированной (Н/ФР) гетерогенной популяции почечных клеток из человеческой почки. Была проведена начальная диссоциация ткани для получения гетерогенной клеточной суспензии из ткани человеческой почки.
Почечная ткань, полученная при биопсии почки, явилась исходным материалом для получения гетерогенной популяции почечных клеток. Можно использовать почечную ткань, содержащую одно или более из: коркового слоя, кортикомедуллярного соединения или медуллярной ткани. Предпочтительно использовать ткань кортикомедуллярного соединения. Необходимо несколько биоптатов (минимум 2), не затрагивающих рубцовую ткань, для получения образцов из почки с ХЗП. Почечную ткань получал клинический исследователь от пациента в клиническом центре примерно за 4 недели до запланированной имплантации конечного препарата NKA. Ткань перевозили в среде для транспортировки ткани, описанной в примере 1.1.
Затем ткань промывали раствором для промывания ткани, описанным в примере 1.1, для уменьшения поступающей бионагрузки перед обработкой ткани для экстракции клеток.
Почечную ткань измельчали, взвешивали и проводили диссоциацию в растворе для расщепления ткани, описанном в примере 1.1. Полученную клеточную суспензию нейтрализовали в модифицированной по способу Дульбекко среде Игла (DMEM) + 10% эмбриональной бычьей сыворотки (ЭБС) (Invitrogen, Carlsbad Calif.), промывали и ресуспендировали в бессывороточной, не содержащей добавки среде для кератиноцитов (KSFM) (Invitrogen). Затем клеточную суспензию центрифугировали через границу плотности 15% (масс/об) раствора йодиксанола (OptiPrep™, Sigma) для удаления эритроцитов и детрита, с последующим высевом для культивирования в обработанные для культивирования тканей полистирольные флаконы или планшеты при плотности 25000 клеток на см2 в ростовой среде для почечных клеток, описанной в примере 1.1. Например, клетки можно высевать во флаконы Nunc T500 при плотности 25×106 клеток/флакон в 150 мл среды 50:50.
Пример 1.3 - Размножение выделенной популяции почечных клеток
Размножение почечных клеток зависит от количества полученной ткани и от успешного выделения почечных клеток из полученной ткани. Выделенные клетки можно криоконсервировать, при необходимости (смотри ниже). Кинетика роста почечных клеток может варьироваться от образца к образцу вследствие неотъемлемой вариабельности клеток, полученных от отдельных пациентов.
Был разработан определенный способ размножения клеток, в котором учтен диапазон извлечения клеток, являющийся результатом вариабельности полученной ткани. Таблица 7. Размножение почечных клеток включает серийные пересевы в закрытых емкостях для культивирования клеток (например, T-флаконах, Cell Factories, HyperStacks®) в ростовой среде для почечных клеток из Таблицы 6 с использованием определенных методов культивирования клеток.
Не содержащая ЭБГ среда была разработана для клинических испытаний с участием людей в целях устранения характерных рисков, связанных с использованием ЭБГ. Клеточный рост, фенотип (CK18) и клеточную функцию (ферментативную активность GGT и LAP) оценивали в не содержащей ЭБГ среде и сравнивали с результатами для содержащей ЭБГ среды, которую использовали в исследованиях на животных. Рост, фенотип и функция почечных клеток были эквивалентными в двух средах. (Данные не представлены).
Таблица 7. Извлечение клеток из биопсийных образцов человеческой почки
(клетки/10 мг ткани)
После того, как рост клеток был обнаружен в исходных Т-флаконах (пересев 0), и отсутствовали видимые признаки загрязнения, культуральную среду заменяли, и впоследствии меняли каждые 2-4 дня (ФИГ. 2B). Проводили оценку клеток для подтверждения морфологии почечных клеток путем визуального анализа культур под микроскопом. Культуры, как правило, имели характерный вид плотного дорожного покрытия или крупной гальки из-за образования клетками скоплений. Эти морфологические характеристики меняются в процессе размножения и могут присутствовать не во всех пересеваемых культурах. Конфлюэнтность клеточных культур оценивали при разных уровнях конфлюэнтности в емкостях для культивирования, используемых в процессе размножения клеток.
Почечные клетки пересевали путем обработки трипсином, когда сосуды для культивирования имели конфлюэнтность по меньшей мере 50% (ФИГ. 2B). Открепившиеся клетки собирали в емкости, содержащие ростовую среду для почечных клеток, подсчитывали их количество и рассчитывали жизнеспособность клеток. При каждом пересеве клетки высевали при плотности 500-4000 клеток/см2 в достаточное количество емкостей для культивирования, с целью их размножения до количества клеток, необходимого для препарата NKA (ФИГ. 2B). Емкости для культивирования помещали в инкубатор с температурой 37°C и атмосферой с 5% CO2. Как описано выше, морфологию и конфлюэнтность клеток контролировали, и среду для культивирования клеток заменяли каждые 2-4 дня. В Таблице 8 приведены показатели жизнеспособности человеческих почечных клеток, наблюдаемые при выделении и размножении клеток из шести биопсийных образцов от людей-доноров.
Таблица 8 Жизнеспособность человеческих почечных клеток в культуре
Неотъемлемая вариабельность тканей от разных пациентов приводила к разным выходам клеток в культуре. Таким образом, нецелесообразно строго определять время для пересева клеток, или количество и тип емкостей для культивирования, необходимых при каждом пересеве, для достижения целевых количеств клеток. Как правило, почечные клетки проводят через 2 или 3 пересева; однако продолжительность культивирования и выход клеток могут варьироваться в зависимости от скорости роста клеток.
Клетки открепляли для сбора или пересева 0,25% раствором трипсина с ЭДТА (Invitrogen). Жизнеспособность оценивали методом исключения трипанового синего, и подсчет клеток производили вручную при помощи гемоцитометра или при помощи автоматизированной системы Cellometer® (Nexcelom Bioscience, Lawrence Mass.).
Пример 1.4. Криоконсервирование культивированных клеток
Размноженные почечные клетки, как правило, криоконсервировали для нивелирования неотъемлемой вариабельности скорости роста клеток от отдельных пациентов и доставки препарата по заранее определенному клиническому расписанию. Криоконсервированные клетки также являются запасным источником клеток в случае необходимости другого препарата NKA (например, в случае задержки вследствие болезни пациента, непредвиденных событий и так далее). Были разработаны условия, которые использовали для криоконсервирования клеток и восстановления жизнеспособных функциональных клеток при размораживании.
Для криоконсервирования клетки суспендировали до конечной концентрации примерно 50×106 клеток/мл в растворе для криоконсервирования (смотри пример 1.1) и разливали во флаконы. Флаконы емкостью один миллилитр, содержащие примерно 50×106 клеток/мл, помещали в морозильную камеру морозильной установки с контролируемой скоростью заморозки и замораживали с заранее установленной скоростью. После замораживания клетки переносили в емкость с жидким азотом для промежуточного хранения.
Пример 1.5. Получение клеточной популяции СПК
Селективные почечные клетки (СПК) могут быть получены из емкостей для конечного культивирования, в которых клетки растут из криоконсервированных клеток или непосредственно из размножающихся культур, в зависимости от расписания (ФИГ. 2B).
При использовании криоконсервированных клеток клетки размораживали и помещали в емкости для культивирования ткани на один конечный этап размножения. При достижении конфлюэнтности примерно 50-100% в емкостях для конечного размножения клетки были готовы для процедуры отделения СПК. При сменах среды и окончательном промывании NKA происходит разбавление любого остаточного раствора для криоконсервирования в конечном препарате.
После достижения в емкостях для конечного размножения по меньшей мере 50% конфлюэнтности клеток емкости для культивирования переносили в инкубатор с гипоксическими условиями, установленный на уровень 2% кислорода в атмосфере с 5% CO2 при 37°C (ФИГ. 2C), и культивировали в течение ночи. Клетки можно выдерживать в инкубаторе с контролируемым содержанием кислорода, составляющим 2% кислорода, до 48 часов. Воздействие более соответствующего физиологическим условиям низкого уровня кислорода (2%) повышает эффективность разделения клеток и облегчает обнаружение индуцируемых гипоксией маркеров, таких как VEGF.
После того, как клетки были подвергнуты воздействию гипоксических условий в течение достаточного времени (например, в течение ночи или до 48 часов), клетки открепляли 0,25% раствором трипсина с ЭДТА (Invitrogen). Жизнеспособность оценивали методом исключения трипанового синего, и подсчет клеток производили вручную при помощи гемоцитометра или при помощи автоматизированной системы Cellometer® (Nexcelom Bioscience, Lawrence Mass.). Клетки промывали один раз DPBS и ресуспендировали до плотности примерно 850×106 клеток/мл в DPBS.
Центрифугирование через границу/интерфейс между фазами с разной плотностью использовали для разделения собранных популяций почечных клеток на основании плавучей плотности клеток. Суспензии почечных клеток разделяли центрифугированием через 7% раствор йодиксанола (OptiPrep; 60% (масс/об) в OptiMEM; смотри пример 1.1).
Готовили 7% раствор OptiPrep с интерфейсом между фазами с разной плотностью, и перед использованием измеряли коэффициент преломления, указывающий на желаемую плотность (КП 1,3456±0,0004). Собранные почечные клетки наслаивали сверху на раствор. Центрифугирование проводили при 800 g в течение 20 мин при комнатной температуре (без торможения) либо в центрифужных пробирках, либо в устройстве для обработки клеток (например, COBE 2991). Фракцию клеток, имеющих плавучую плотность более примерно 1,045 г/мл, собирали после центрифугирования в виде четкого осадка клеток. Клетки, имеющие плавучую плотность менее 1,045 г/мл, исключали и отбрасывали.
Осадок клеток СПК ресуспендировали в DPBS (ФИГ. 2C). Перенесенное остаточное содержание OptiPrep, ЭБС, культуральной среды и вспомогательных материалов в конечном препарате доводили до минимума за счет использования 4 этапов промывания DPBS и 1 этапа промывания раствором желатина.
Пример 2: Композиции экзосом и их применение для лечения заболевания и улучшения функции почек
Пример 2.1 - Область техники
Данный пример относится к композициям экзосом почечных клеток и их получению для вариантов применения, включающих использование в тканевой инженерии и регенеративной медицине для восстановления и улучшения функции почек.
Пример 2.2 - Общие комментарии
Масштабные исследования по-прежнему сосредоточены на использовании экзосом в биологических жидкостях в качестве биомаркеров заболевания. В последнее время проводятся исследования терапевтического потенциала экзосом, большая часть из которых сосредоточена на иммунотерапии рака, разработке вакцин, лечении аутоиммунных заболеваний и доставке терапевтических средств (соединений, киРНК). В течение последних 7 лет привлекают внимание экзосомы в качестве потенциального терапевтического средства для модуляции неоваскуляризации, ключевого компонента регенерации тканей (7, 8).
Секретируемые внеклеточные везикулы (ВВ), такие как экзосомы, нагружают активными способствующими репарации белками и РНК, которые являются специфическими для типов клеток, а также дифференциально продуцируются и секретируются в зависимости от клеточного окружения. Прекрасный обзор по этой теме, имеющий непосредственное отношение к заболеванию почек, был опубликован Zhang at al. (Am J Physiol Renal Physiol. 2016 Nov 1;311 (5):F844-F851. doi: 10.1152/ajprenal.00429.2016. Epub 2016 Aug 31. Extracellular vesicles in diagnosis and therapy of kidney diseases. Zhang W, Zhou X, Zhang H, Yao Q, Liu Y, Dong Z.).
Хроническое заболевание почек (ХЗП) является глобальной проблемой здравоохранения; растущий разрыв между числом пациентов, ожидающих трансплантат, и числом фактически трансплантированных органов подчеркивает необходимость в новых методах лечения для восстановления функции почек. Регенеративная медицина является многообещающим подходом, из которого возникли и были переданы в клиники методы лечения нарушений на уровне органов. Регенеративные матрицы, состоящие из биоразлагаемого материала и аутологичных клеток, выделенных и размноженных ex vivo, стимулируют регенерацию ткани, аналогичной естественной ткани органа, после имплантации.
Недавние исследования демонстрируют все больше свидетельств роли ВВ в качестве посредника взаимодействий между клетками, или межклеточных взаимодействий (9, 10). Уникальная биологическая активность ВВ обладает полезным потенциалом для коррекции клеточной дисфункции и, следовательно, терапии заболеваний (11). ВВ также считают идеальными нановекторами для доставки биологических средств, в частности, доставки лекарственных средств в клинических условиях (12). В почках почечные ВВ продуцируются и секретируются почечными клетками, и связаны с функцией и заболеваниями почек (10).
С точки зрения механизма, в некоторых исследованиях защитный эффект ВВ при заболеваниях почек объясняется, главным образом, содержанием в них РНК, особенно микроРНК (13, 14).
Ведутся интенсивные исследования потенциала ВВ в качестве биомаркеров ХЗП. Напротив, очень мало известно о терапевтическом эффекте ВВ при ХЗП. Не будучи ограниченными какой-либо научной теорией, авторы изобретения делают логический вывод, что успех лечения ХЗП разработанными ими СПК основан, по меньшей мере частично, на гипоксической обработке СПК, приводящей к тому, что из имплантированных клеток секретируются «настроенные» ВВ, которые, в свою очередь, «спасают» пораженные болезнью клетки, улучшая их функцию.
В конкретных вариантах осуществления гипоксическая настройка селективных почечных клеток после разделения их на полосы в градиенте плотности до выделения экзосом приводит к получению ВВ с усиленными регенеративными свойствами.
Пример 2.3 - Выделение экзосом - Количественное определение и определение размера
В зависимости от используемых способов очистки (15) экзосомы были описаны, как имеющие размер в диапазоне 30-150 нм (16, 17) с примерной плотностью 1,10-1,20 г/мл (18, 19) в зависимости от материала для создания градиента плотности (сахароза или OptiPrep), используемого для анализа. Считают, что микровезикулы имеют большие размеры, чем экзосомы, и их часто описывают, как имеющие размер 100-300 нм в диаметре. Степень перекрывания размеров для этих классов ВВ варьируется в зависимости от публикации и технологии, используемой для измерения. Используемый в настоящем документе термин «микровезикула» означает происходящую из клетки мембранную внеклеточную везикулу с диаметром от 30 до 1000 нанометров (нм). Используемый в настоящем документе термин «экзосома» означает происходящую из клетки мембранную микровезикулу, имеющую диаметр примерно 30-150 нм. Таким образом, используемый в настоящем документе термин «микровезикула» охватывает экзосомы, а также более крупные везикулы. Хотя официальная позиция (20) была опубликована ключевыми специалистами в рамках Международного общества по изучению внеклеточных везикул (ISEV) в конце 2014 и 2015 г.г., все еще нет единого мнения о том, как лучше выделять, измерять и характеризовать экзосомы. Ожидается, что по мере получения новой информации, в частности, в области биологической функции, методы оптимального выделения, измерения и характеризации частиц будут зависеть от того, какой метод приводит к желаемому биологическому эффекту. В конкретных вариантах осуществления ВВ, включающие экзосомы, получают путем центрифугирования ВВ-содержащей культуральной среды при 3000 x g в течение 20 мин для осаждения клеточного детрита, с последующим ультрацентрифугированием осветленного супернатанта при 100000 x g для осаждения ВВ. Такие препараты в настоящее время демонстрируют биологическую активность (смотри анализ пролиферации и тубулогенеза, ниже).
Клетки выращивали в течение 24 час в бессывороточной среде для культивирования клеток. Среду собирали. Для выделения экзосом собранную бессывороточную кондиционированную среду центрифугировали в два этапа: 1) 3000 x g, 20 минут, для удаления клеточного детрита; 2) 100000 x g, 2 часа, для осаждения экзосом. Экзосомы ресуспендировали в DPBS и хранили при -80°C до использования.
Для определения распределения по размерам и концентрации экзосом авторы изобретения анализировали образцы настраиваемым резистивным датчиком импульсов (TRPS; (qNano, Izon Science Ltd) с использованием нанопористой мембраны NP150 при растяжении 47 мм. Концентрацию частиц стандартизировали, используя калибровку при нескольких значениях давления с 114-нм гранулами из карбоксилированного полистирола в концентрации 1,0×1013 частиц/мл. Образцы разбавляли 1:100 в DPBS непосредственно перед анализом. Результаты и полученные количества приведены в таблице, ниже (Таблица 9) для 4 разных лотов. Несмотря на наличие вариабельности в размерах и концентрации между лотами, размер частиц во всех лотах хорошо вписывается в рабочее определение экзосом (30-150 нм).
Таблица 9: Результаты и полученные количества при выделении, подсчете и определении размеров экзосом
В этом и других примерах «БПК-0» означает биоактивные почечные клетки, которые представляют собой не пересеянные первичные клетки. «БПК-1» означает биоактивные почечные клетки, которые были пересеяны один раз. «БПК-2» означает биоактивные почечные клетки, которые были пересеяны два раза. «БПК-3» означает биоактивные почечные клетки, которые были пересеяны три раза. «БПК-3A» означает биоактивные почечные клетки, которые были пересеяны три раза, а затем культивированы в гипоксических условиях (обозначает клетки после завершения культивирования в гипоксических условиях). «СПК» означает селективные почечные клетки.
Пример 2.4 - Определение характеристик микроскопических РНК (микроРНК) экзосом СПК
Поскольку содержимое нагрузки экзосом может включать несколько аналитов, в том числе белки, метаболиты и РНК, авторы изобретения охарактеризовали обнаруженную микроРНК, связанную с экзосомами из СПК. Микроскопические РНК (микроРНК) представляют собой малые не кодирующие РНК, содержащие примерно 18-23 нуклеотидов, которые связываются с 3’-нетранслируемой областью матричных РНК, подавляя трансляцию или стимулируя распад. Профили микроРНК отражают разные физиологические и патологические условия. Они экспрессируются зависимым от ткани или клеток образом. Уровни экспрессии микроРНК меняются в зависимости от разных физиологических процессов, и, как считают, большинство кодирующих белки генов человека являются мишенями для микроРНК.
При том, что их функция является, в сущности, негативной; то есть: подавление трансляции РНК, возможно, за счет конкурентного связывания, или стимуляция распада, микроРНК выполняют глобальную функцию регулирования роста и пролиферации клеток. Например, стимуляция пролиферации клеток может включать ингибирующее действие микроРНК на трансляцию и, следовательно, экспрессию подавляющего рост белка. Альтернативно, ингибирование трансляции/экспрессии стимулирующего рост белка может ингибировать пролиферацию клеток.
Следует признать, что функции этих микроРНК в значительной степени были определены путем изучения аномального роста клеток, который имеет место в раковых клетках и при других болезненных состояниях. Следовательно, экстраполяцию их функции на нормальные клетки следует оценивать с осторожностью. Например, тот факт, что содержание микроРНК, как установлено, повышено или снижено в раковой клетке, не обязательно подразумевает, что они действуют исключительно, стимулируя трансформацию клеток; баланс между пролиферацией и подавлением роста смещен в сторону пролиферации в раковой клетке. Учитывая это, неудивительно, что большинство из вышеуказанных микроРНК были идентифицированы в этих почечных клетках.
Схема эксперимента:
- микроРНК из каждого образца выделяли с использованием мини-набора miRNeasy, который позволяет очищать суммарную РНК, включающую РНК размером от примерно 18 нуклеотидов (нт) и выше. Количественное определение микроРНК проводили с использованием спектрофотометра NanoDrop.
- Предоставленная услуга секвенирования: Секвенирование малых РНК. Платформа секвенирования: Illumina NextSeq 500. Реагент платформы секвенирования: NextSeq Mid Output Kit v2. Продукт, используемый для получения библиотеки: набор для получения библиотеки малых РНК Norgen Biotek. Используемый рабочий процесс анализа данных секвенирования малых РНК: exceRpt small RNA‐seq Pipeline (v4.6.2). (Weblink: genboree.org/theCommons/projects/exrnatools‐ may2014/wiki/Small_RNA‐seq_Pipeline). Источники эталонных последовательностей малых РНК: miRNAs miRBase version 21; tRNAs gtRNAdb, piRNAs, RNAdb, Genome Gencode version 21 (hg38).
Результаты:
Компьютерный анализ полученных последовательностей показал, что следующие микроРНК дифференциально экспрессированы в экзосомах, секретируемых СПК:
- miR-145 - предположительно является супрессором опухолей
- mir-22 - может действовать в качестве супрессора опухолей
- miR-7 - высококонсервативная микроРНК, которая демонстрирует ограниченную пространственно-временную экспрессию во время развития и зрелости. Также может действовать в качестве супрессора клеточного роста/опухолей.
- miR-10a - регулирует провоспалительный фенотип, маркер повреждения почек. Экспериментально подтверждено, что miR-10a снижает экспрессию генов HOXA1 и HOXA3 человека. Контроль генов Hox со стороны miR-10 указывает на то, что эта микроРНК может играть важную роль в развитии.
- miR-143 - супрессор опухолей, ингибитор роста
- let7b - учитывая, что уровни экспрессии представителей let-7 являются в значительной степени низкими в раковых опухолях и раковых стволовых клетках человека, основной функцией генов let-7 может быть стимуляция конечной дифференцировки в развитии и подавление опухолей.
Пример 2.5 - MACSplex поверхностное мечение экзосом
Определение поверхностных маркеров экзосом проводили с использованием мультиплексного анализа, состоящего из FACS-анализа на 39 поверхностных маркеров, по сообщениям, присутствующих на ВВ.
Схема эксперимента:
- Экзосомы выделяли из кондиционированной среды культивированных клеток (БПК-0, БПК-3, БПК-3A, СПК) методом ультрацентрифугирования.
- Диаметр и концентрацию частиц оценивали настраиваемым резистивным датчиком импульсов (TRPS; (qNano, Izon Science Ltd) с использованием нанопористой мембраны NP150 при растяжении 47 мм. Концентрацию частиц стандартизировали, используя калибровку при нескольких значениях давления с 110-нм гранулами из карбоксилированного полистирола в концентрации 1,1×10E13 частиц/мл.
- 1×10E10 частиц использовали для каждого образца.
- Экзосомы выделяли иммунологическим методом с использованием коктейля из CD63, CD9 и CD81.
- Затем проводили скрининг данной популяции на экспрессию 37 разных маркеров.
Результаты: Смотри ФИГ. 4
В экзосомах, выделенных как из TCHK0012, так и из TCHK0013, наблюдали следующую повышенную регуляцию экспрессии в случае СПК в сравнении с БПК
- CD133 - При том, что точная функция остается неизвестной, было высказано предположение, что он действует в качестве организатора топологии клеточной мембраны.
- CD326 - Молекула адгезии эпителиальных клеток (EpCAM) представляет собой трансмембранный гликопротеин, опосредующий Ca2+-независимую однотипную межклеточную адгезию в эпителии. EpCAM также принимает участие в клеточной сигнализации, миграции, пролиферации и дифференциации.
- CD49e - Помимо адгезии, интегрины, как известно, принимают участие в опосредованной клеточной поверхностью сигнализации.
Пример 2.6 - Опосредованный экзосомами перенос липофильного красителя в почечные клетки
Для того, чтобы экзосомы доставляли свой груз белка или нуклеиновой кислоты, считается, что экзосомы должны прикрепляться и сливаться с мембраной клетки-реципиента. Опосредованная экзосомами доставка липофильного красителя в клеточную мембрану является одним из способов демонстрации слияния экзосом с клеткой-реципиентом (21).
Схема эксперимента:
- Перенос красителя. Для оценки способности экзосом доставлять свой груз авторы изобретения проверяли способность экзосом переносить липофильный краситель в почечные клетки в культуре методом проточной цитометрии.
- Аликвоту экзосом (БПК-0, БПК-3, СПК) метили раствором для мечения клеток Vybrant DiI в течение 20 минут при 37°C.
- После удаления избытка красителя ультрацентрифугированием, 5xE09 меченых экзосом добавляли в каждую лунку 6-луночного планшета, которая содержала примерно 250000 клеток/лунку.
- Через 4 часа инкубации либо при 4 градусах C, либо при 37 градусах C, культуры промывали для удаления любых не встроенных меченых экзосом.
- Затем клетки извлекали и анализировали методом FACS.
- Флуоресцентно меченые клетки, являющиеся показателем переноса липофильного красителя из экзосом в клеточную мембрану, приводят к смещению линии гистограммы слева направо.
Результаты: Смотри ФИГ. 5
- Как и ожидалось, никакого связывания экзосом, на что указывало отсутствие переноса липофильного красителя, не наблюдали при 4 градусах. Это поддерживает идею о том, что клетка должна быть биологически активной, чтобы поглощать экзосомы.
- Также, как и ожидалось, на контрольной гистограмме без экзосом отсутствовал сдвиг вправо в сравнении с гистограммой при 4 градусах.
- Область между гистограммами, отмеченная стрелками, указывает на популяцию клеток, которые поглотили краситель.
- Исходя из данного эксперименте, судя по всему, существует разница в связывании экзосом между БПК-0 (максимальное) и БПК-3 и СПК (примерно равная степень связывания).
Пример 2.7 - Анализ клеточной пролиферации
С точки зрения роли экзосом в восстановлении и регенерации почечной ткани можно утверждать, что было бы желательно наличие способности стимулировать пролиферацию почечных клеток.
Схема эксперимента:
- Человеческие почечные клетки высевали по 50000 клеток/лунку в 12-луночный планшет.
- Экзосомы выделяли из указанных клеточных супернатантов.
- Экзосомы в объеме 25, 50, 100 мкл (1X, 2X, 4X) добавляли в соответствующие лунки
- Образцы тестировали в двойном повторе.
- Количественное определение в планшетах проводили через 3 дня после обработки с использованием ArrayScan.
- Б/С= бессывороточная среда (отрицательный контроль).
- Ростовая среда=среда, содержащая сыворотку (положительный контроль).
Результаты: Смотри ФИГ. 6
- Обработка БПК-3 и СПК TCHK006 во всех разведениях приводила к увеличению клеточной пролиферации почти в одинаковой степени относительно отрицательного контроля.
- Обработка БПК-3 и СПК TCHK004 в разных разведениях продемонстрировала доза-подобный эффект на пролиферацию; только 4X объем СПК приводил к увеличению пролиферации относительно отрицательного контроля.
Пример 2.7 - Анализ образования канальцев/ангиогенеза
Способность стимулировать ангиогенез также считается желательной функцией для препарата тканевой инженерии/регенеративной медицины. Одним из наиболее широко используемых in vitro анализов для моделирования стадии реорганизации при ангиогенезе является анализ образования канальцев. В анализе измеряют способность эндотелиальных клеток, высеянных при субконфлюэнтной плотности с соответствующим внеклеточным поддерживающим матриксом, образовывать подобные капиллярам структуры (также известные как канальцы). Ученые, как правило, используют данный анализ для определения способности различных соединений стимулировать или ингибировать образование канальцев. После высевания эндотелиальные клетки прикрепляются и создают механические силы на окружающий внеклеточный поддерживающий матрикс, образуя дорожки, или направляющие пути, облегчающие миграцию клеток. Образовавшиеся тяжи из клеток в итоге образуют полые просветы.
Соединения, способные ингибировать образование канальцев, могут быть полезными при различных заболеваниях, таких как рак, при котором опухоли стимулируют образование новых кровеносных сосудов для получения кислорода и питательных веществ, необходимых для роста за пределы относительно небольшого размера. Напротив, соединения или биологические средства (то есть: экзосомы), которые могут стимулировать образование канальцев, могут быть полезны в области тканевой инженерии/регенеративной медицины.
Схема эксперимента:
- 50000 сосудистых эндотелиальных клеток высевали на внеклеточный матрикс (GelTrex) в 48-луночном планшете.
- Клетки инкубировали в бессывороточной ростовой среде с добавлением факторов роста в качестве положительного контроля.
- Клетки инкубировали в бессывороточной ростовой среде, не содержащей факторы роста, в качестве отрицательного контроля.
- Клетки инкубировали в бессывороточной ростовой среде, не содержащей факторы роста, с добавлением экзосом (TCHK004, СПК, 10E10 частиц) в качестве тестируемого препарата.
Результаты: Смотри ФИГ. 7
- Хотя образование канальцев происходило быстрее в положительном контроле (канальцы становились видимыми к моменту времени T=2 часа), к моменту времени T=9 часов устойчивое образование канальцев наблюдали в клетках, обработанных экзосомами.
- Экзосомы успешно заменяли определенный коктейль факторов роста, включающий hEGF, bFGF, IGF-1 и VEGF, в поддержании образования канальцев.
- Культуры инкубировали в течение 9 часов после обработки. A. Бессывороточная, не содержащая факторы роста среда (отрицательный контроль). B. Бессывороточная, не содержащая факторы роста среда с добавлением 10E10 экзосом (тестируемый препарат). C. Бессывороточная среда с добавлением факторов роста (положительный контроль).
Пример 2.8 - Литература
1. Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes. Curr Opin Cell Biol. 2014 Jun 21;29C:116-125. doi: 10.1016/j.ceb.2014.05.004. [Epub ahead of print] Review. PMID: 24959705
2. Revenfeld AL, Bæk R, Nielsen MH, Stensballe A, Varming K, Jørgensen M. Diagnostic and Prognostic Potential of Extracellular Vesicles in Peripheral Blood. Clin Ther. 2014 Jun 1;36(6):830-846. doi: 10.1016/j.clinthera.2014.05.008. Review. PMID: 24952934
3. Lamichhane TN, Sokic S, Schardt JS, Raiker RS, Lin JW, Jay SM. Emerging roles for extracellular vesicles in tissue engineering and regenerative medicine. Tissue Eng Part B Rev. 2014 Jun 23. [Epub ahead of print] PMID: 24957510
4. Simons M, Raposo G. Exosomes‐vesicular carriers for intercellular communication. Curr Opin Cell Biol 2009, Aug;21(4):575‐581. doi: 10.1016/j.ceb.2009.03.007.Epub 2009 May 11. Review. PMID: 19442504
5. Stoorvogel W, Kleijmeer MJ, Geuze HJ, Raposo G. The biogenesis and functions of exosomes. Traffic 2002, May;3(5):321‐330. PMID: 11967126
6. Nieuwland R, Sturk A. Why do cells release vesicles? Thrombosis Research 2010, 125(Supplement 1):S49‐S51. doi: 10.1016/j.thromres.2010.01.037. Epub 2010 Feb 11. Review. PMID: 20149923
7. Martinez MC, Andriantsitohaina R: Microparticles in angiogenesis: therapeutic potential. Circ Res 2011, Jun 24, 109(1):110‐119. doi: 10.1161/CIRCRESAHA.110.233049. Review. PMID: 21700952
8. Sahoo S, Klychko E, Thorne T, Misener S, Schultz KM, Millay M, Ito A, Liu T, Kamide C, Agrawal H et al: Exosomes from human CD34(+) stem cells mediate their proangiogenic paracrine activity. Circ Res 2011, Sept 16, 109(7):724‐728. doi: 10.1161/CIRCRESAHA.111.253286. Epub 2011 Aug 11. PMID: 21835908
9. Camussi G, Deregibus MC, Bruno S, Cantaluppi V, Biancone L. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney Int 78: 838-848, 2010.
10. Krause M, Samoylenko A, Vainio SJ. Exosomes as renal inductive signals in health and disease, and their application as diagnostic markers and therapeutic agents. Front Cell Dev Biol 3: 65, 2015.
11. Erdbrugger U, Le TH. Extracellular vesicles in renal diseases: More than novel biomarkers? J Am Soc Nephrol 27: 12-26, 2016.
12. Vader P, Mol EA, Pasterkamp G, Schiffelers RM. Extracellular vesicles for drug delivery. Adv Drug Deliv Rev (Epub ahead of print).
13. Chen TS, Lai RC, Lee MM, Choo AB, Lee CN, Lim SK. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Res 38: 215-224, 2010.
14. Wang B, Yao K, Huuskes BM, Shen HH, Zhuang J, Godson C, Brennan EP, Wilkinson-Berka JL, Wise AF, Ricardo SD. Mesenchymal stem cells deliver exogenous microRNA-let7c via exosomes to attenuate renal fibrosis. Mol Ther 24: 1290-1301, 2016.
15. Lane RE, Korbie D, Anderson W, Vaidyanathan R, Trau M. Analysis of exosome purification methods using a model liposome system and tunable-resistive pulse sensing. Sci Rep. 2015 Jan 6;5:7639. doi: 10.1038/srep07639
16. Dragovic RA, Gardiner C, Brooks AS, Tannetta DS, Ferguson DJ, Hole P, Carr B, Redman CW, Harris AL, Dobson PJ, Harrison P, Sargent IL. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine. 2011 Dec;7(6):780-8. doi: 10.1016/j.nano.2011.04.003. Epub 2011 May 4
17. van der Pol E, Hoekstra AG, Sturk A, Otto C, van Leeuwen TG, Nieuwland R. Optical and non-optical methods for detection and characterization of microparticles and exosomes. J Thromb Haemost. 2010 Dec;8(12):2596-607. doi: 10.1111/j.1538-7836.2010.04074.x.
18. Tauro BJ1, Greening DW, Mathias RA, Ji H, Mathivanan S, Scott AM, Simpson RJ. Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line LIM1863-derived exosomes. Methods. 2012 Feb;56(2):293-304. doi: 10.1016/j.ymeth.2012.01.002. Epub 2012 Jan 21
19. Kalra H, Adda CG, Liem M, Ang CS, Mechler A, Simpson RJ, Hulett MD, Mathivanan S. Comparative proteomics evaluation of plasma exosome isolation techniques and assessment of the stability of exosomes in normal human blood plasma. Proteomics. 2013 Nov;13(22):3354-64. doi: 10.1002/pmic.201300282. Epub 2013 Oct 18
20. Lötvall J, Hill AF, Hochberg F, Buzás EI, Di Vizio D, Gardiner C, Gho YS, Kurochkin IV, Mathivanan S, Quesenberry P, Sahoo S, Tahara H, Wauben MH, Witwer KW, Théry C. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. J Extracell Vesicles. 2014 Dec 22;3:26913. doi: 10.3402/jev.v3.26913. eCollection 2014
21. Deregibus, M.C., et al., Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizontal transfer of mRNA. Blood, 2007. 110(7): p. 2440-8.
22. Dursun I, Poyrazoglu HM, Gunduz Z, Ulger H, Yykylmaz A, Dusunsel R, Patyroglu T, Gurgoze M. The relationship between circulating endothelial microparticles and arterial stiffness and atherosclerosis in children with chronic kidney disease. Nephrol Dial Transplant 24: 2511-2518, 2009.
Пример 3: Профилирование микроРНК, присутствующих в секретируемых экзосомах и внутриклеточных везикулах человеческих СПК, БПК3/3A и БПК0
Биоинформационный анализ секретируемых СПК белков и экзосомных микроРНК позволяет определять конкретные сигнальные пути, которые при активации или дезактивации происходящими из СПК факторами могут модулировать прогрессирование ХЗП. Эти сигнальные пути могут быть использованы in vitro в качестве количественных анализов активности, связанных напрямую с предполагаемым механизмом действия СПК, и/или идентифицированные белки/микроРНК могут быть использованы в качестве косвенных показателей активности и быть оценены методами на основе ELISA/ПЦР из кондиционированной среды. Такой подход приводит к идентификации сигнальных путей, участвующих в прогрессировании заболевания почек и функции СПК через паракринные механизмы, которые усиливают активность секретируемых, биологически активных лигандов и микроРНК, передаваемых от донора клетке-хозяину за счет активности экзосом и других секретируемых микровезикулярных элементов.
МикроРНК выделяли из экзосом, очищенных из содержащей секретированные продукты среды или из внутриклеточной ниши. При использовании n=6 независимых доноров статистически точные сравнения могут быть проведены для следующего: БПК3/3A и БПК0/СПК. Были идентифицированы микроРНК, которые отличают данные промежуточные продукты производства.
Подход
1. Применение вычислительных/биоинформационных подходов к клеточному секретому
Авторы изобретения охарактеризовали секретом и профили микроРНК (внутриклеточные и экзосомные) из СПК и промежуточных продуктов производства СПК (n=6). Наборы данных постоянно анализируются методами биоинформатики для компьютерной идентификации сигнальных сетей, связанных с заболеванием и регенерацией, на которые непосредственно влияют секретируемые белки или микроРНК, продуцируемые СПК.
На сегодняшний день эти данные демонстрируют, что переход БПК3-БПК3A (гипоксический этап) индуцирует серьезные изменения в биосигнатуре популяции клеток БПК так, что конечный продукт производства (СПК) четко отличается от исходного материала (БПК0).
2. Профилирование микроРНК, присутствующих в секретируемых экзосомах и внутриклеточных везикулах человеческих СПК, БПК3/3A и БПК0
МикроРНК выделяли из экзосом, очищенных из содержащей секретированные продукты среды или из внутриклеточной ниши. При использовании n=6 независимых доноров статистически точные сравнения могут быть проведены для следующего: БПК3/3A и БПК0/СПК.
Были идентифицированы микроРНК, которые отличают данные промежуточные продукты производства.
В отличие от стандартного фенотипического описания и функционального анализа подход с анализом клеточного секретома и микроРНК СПК и БПК-0 обеспечивает не только более глубокое понимание того, каким образом СПК отличается от БПК-0, но также является уникальным и полезным подходом для оценки активности. Данные, собранные авторами изобретения позволяют четко отличать СПК от БПК-0. Без связи с какой-либо научной теорией, многие из отличий, по всей вероятности, являются следствием этапа гипоксии, поскольку также существуют отличия между БПК-3, БПК-3A и СПК.
Пример 3.1: Дизайн эксперимента
n=6, TCHK007-TCHK012
A1 Экзосомы, продуцируемые клетками БПК0.
D1 Экзосомы, продуцируемые клетками БПК3.
E1 Экзосомы, продуцируемые клетками БПК3A.
F1 Экзосомы, продуцируемые СПК.
Пример 3.2 - Дифференциально экспрессируемая микроРНК
Исходя из дизайна эксперимента, число дифференциально экспрессируемых микроРНК для каждого сравнения приведено в таблице ниже. Стандартные критерии отбора для выявления дифференциально экспрессируемых микроРНК являются следующими: | Log2 кратности изменения | ≥ 1 и P-значение <0,05.
Таблица 10: Число дифференциально экспрессируемых микроРНК
В таблицах, приведенных ниже, «hsa-» обозначает человеческую микроРНК.
Таблица 11: 10 наиболее дифференциально экспрессируемых микроРНК в E1 в сравнении с D1 (в порядке возрастания p-значений)
БПК3A/БПК3 EXO
Таблица 12: 10 микроРНК с наиболее повышенной экспрессией в E1 в сравнении с D1 (в порядке уменьшения кратности изменения)
БПК3A/БПК3 EXO
Таблица 13: 10 микроРНК с наиболее пониженной экспрессией в E1 в сравнении с D1 (в порядке увеличения кратности изменения)
БПК3A/БПК3 EXO
Таблица 14: 10 наиболее дифференциально экспрессируемых микроРНК в F1 в сравнении с A1 (в порядке увеличения p-значений)
СПК/БПК0 EXO
Таблица 15: 10 микроРНК с наиболее повышенной экспрессией в F1 в сравнении с A1 (в порядке уменьшения кратности изменения)
СПК/БПК0 EXO
Таблица 16: 10 микроРНК с наиболее пониженной экспрессией в F1 в сравнении с A1 (в порядке увеличения кратности изменения)
СПК/БПК0 EXO
Группы микроРНК, имеющие значительные различия при разных экспериментальных условиях (E1 против D1) показаны на графике рассеяния для большого массива данных на ФИГ. 8. Группы микроРНК, имеющие значительные различия при разных экспериментальных условиях (F1 против A1) показаны на графике рассеяния для большого массива данных на ФИГ. 9.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЯ ПОЧЕК У СУБЪЕКТОВ С АНОМАЛИЯМИ ПОЧЕК И/ИЛИ МОЧЕВЫВОДЯЩИХ ПУТЕЙ | 2020 |
|
RU2823980C2 |
| ИММУНОЛОГИЧЕСКИ ПРИВИЛЕГИРОВАННЫЕ БИОАКТИВНЫЕ ПОЧЕЧНЫЕ КЛЕТКИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ПОЧЕК | 2018 |
|
RU2816753C2 |
| УСТРОЙСТВО ДОСТАВКИ ФАРМАЦЕВТИЧЕСКИХ СОСТАВОВ | 2021 |
|
RU2839077C1 |
| ИСПОЛЬЗОВАНИЕ БИОГЕНЕЗА МИКРОРНК В ЭКЗОСОМАХ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2014 |
|
RU2644247C2 |
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ИНГАЛЯЦИИ | 2019 |
|
RU2799315C2 |
| ЭКЗОСОМАЛЬНЫЕ БИОМАРКЕРЫ | 2015 |
|
RU2712223C2 |
| ВЕЗИКУЛЫ, СОДЕРЖАЩИЕ ИНГИБИТОР PTEN, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2800729C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ТКАНЕЙ НА ОСНОВЕ КОМПОНЕНТОВ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2020 |
|
RU2766707C1 |
| Опухолевые внеклеточные везикулы в лечении органной недостаточности | 2022 |
|
RU2791356C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, НАБОРЫ И СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2019 |
|
RU2810906C2 |
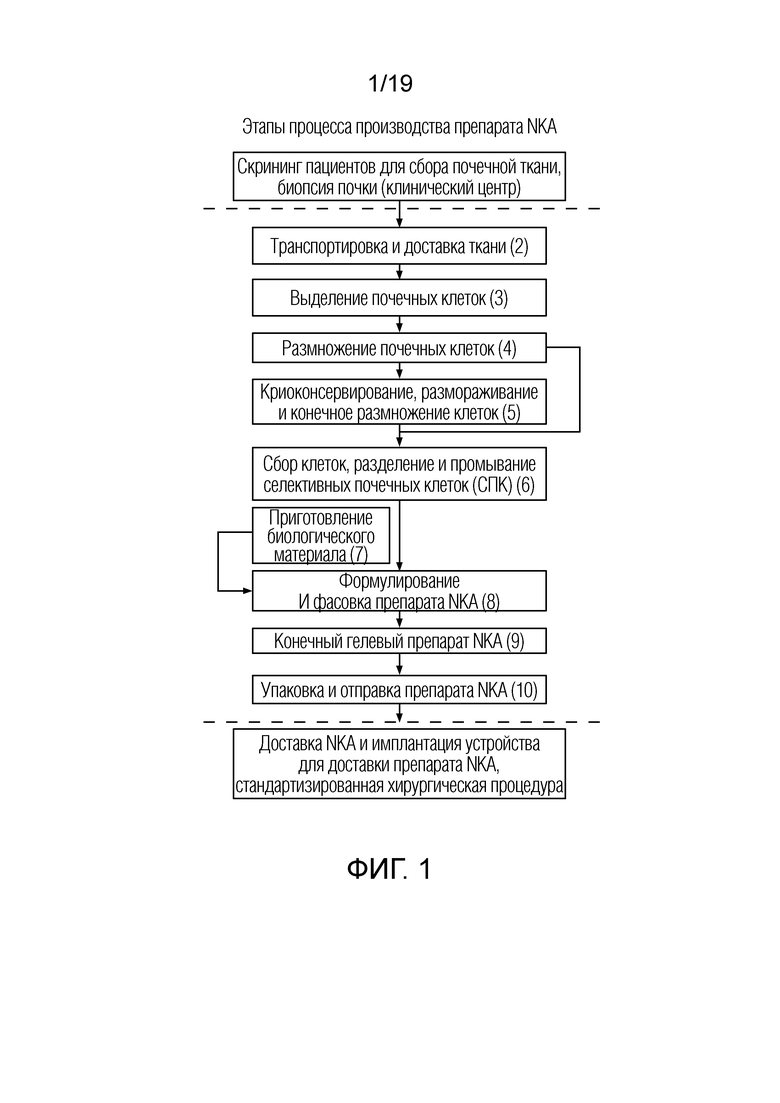
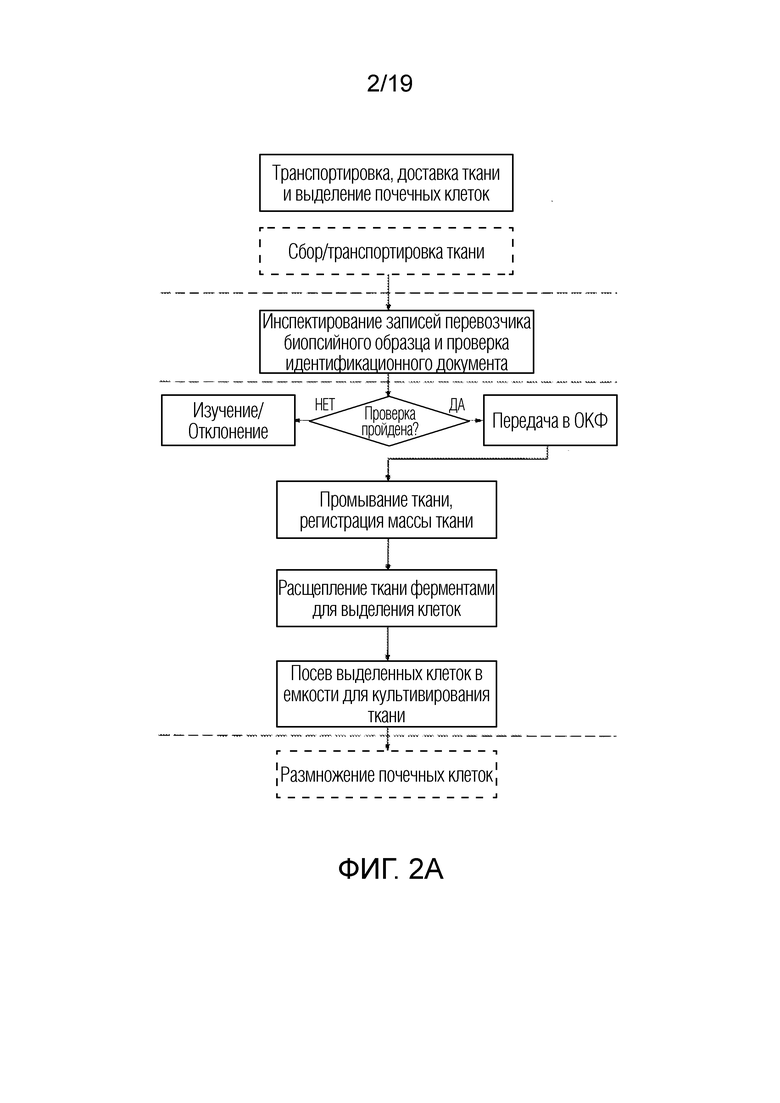
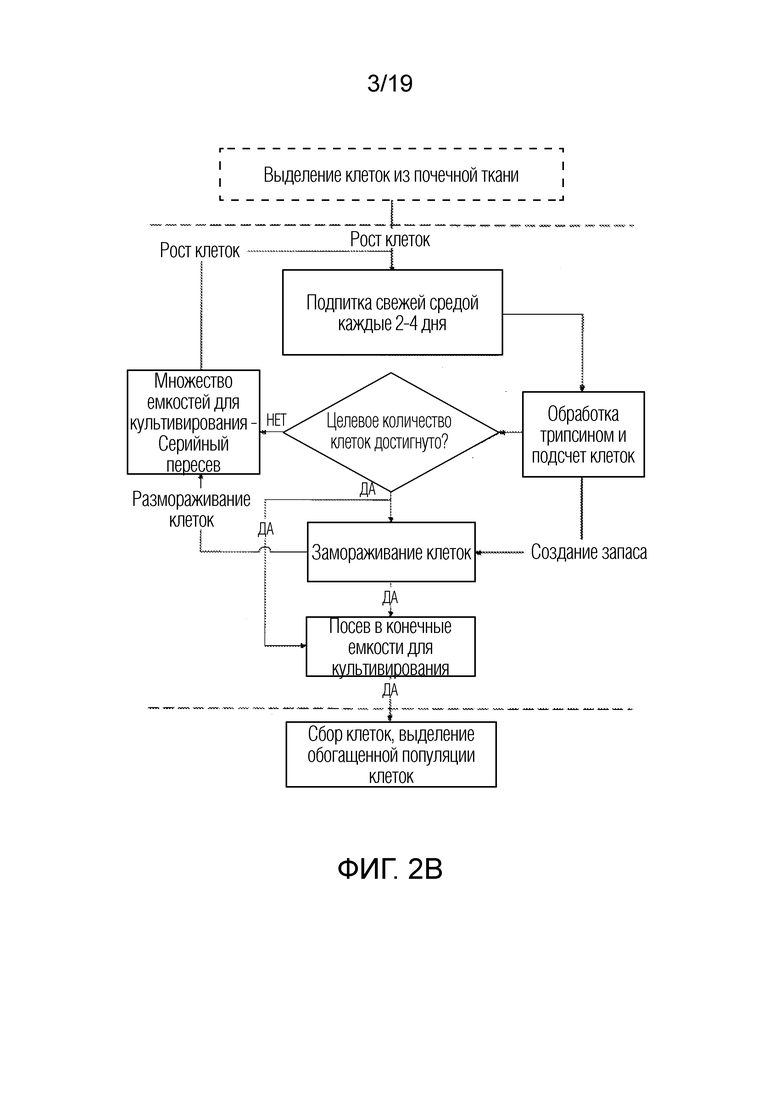
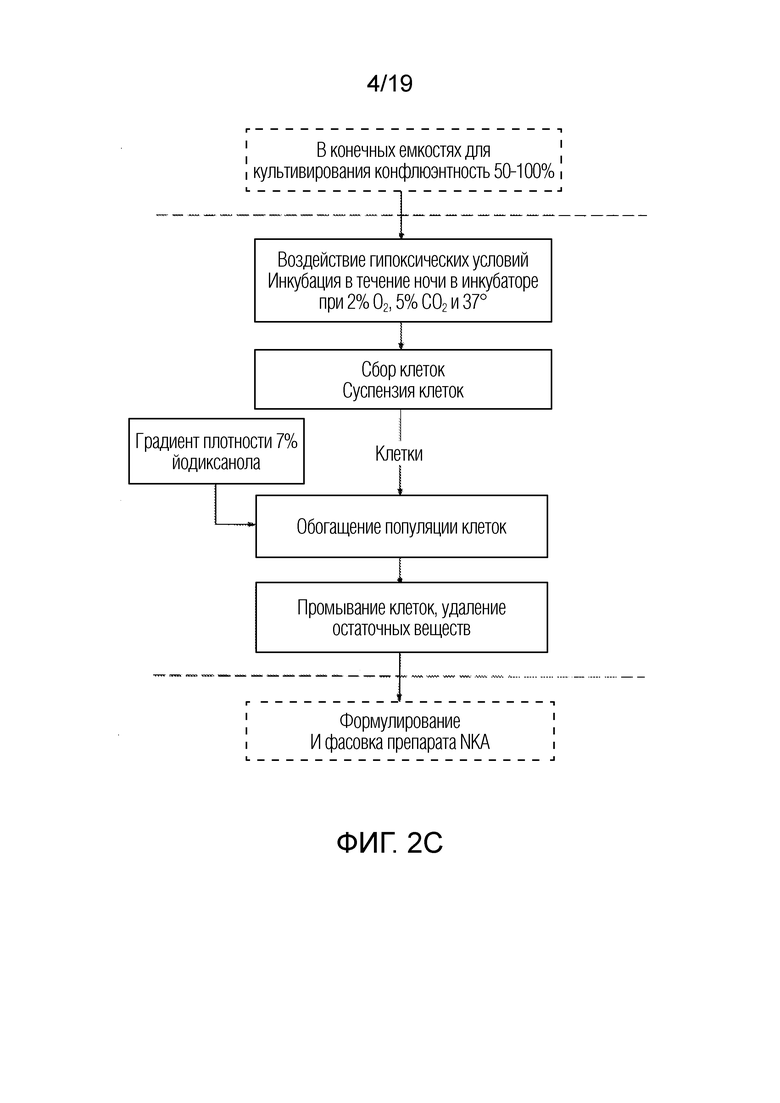
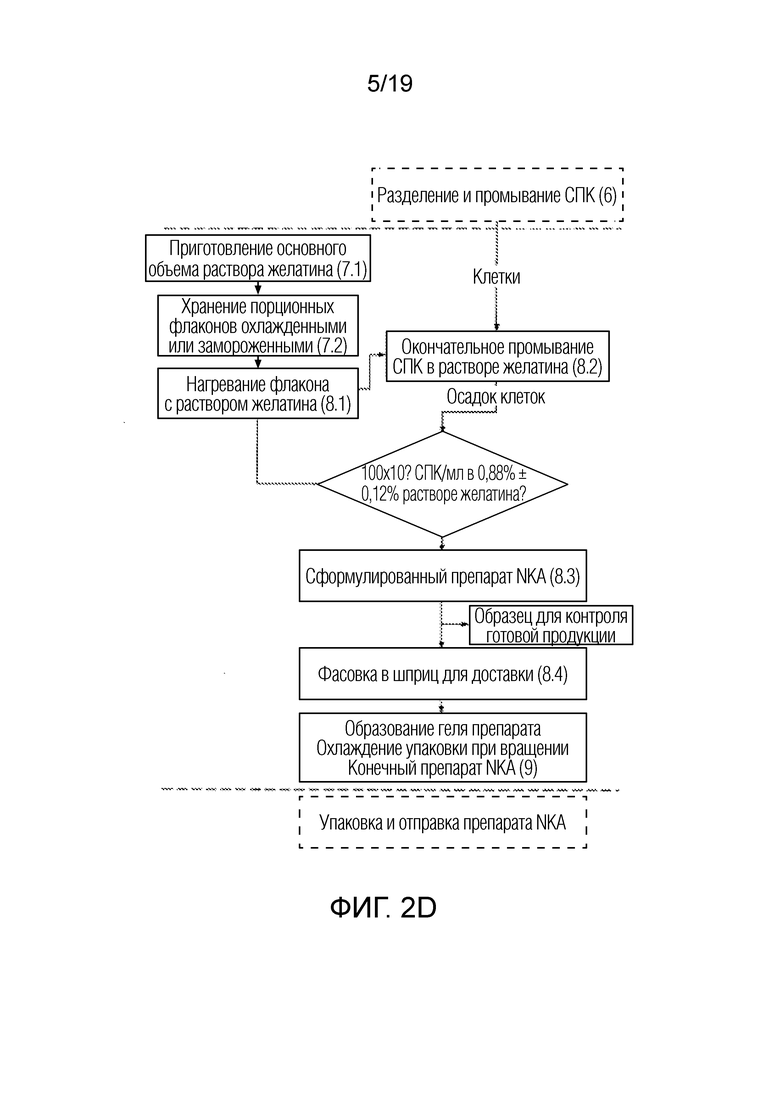
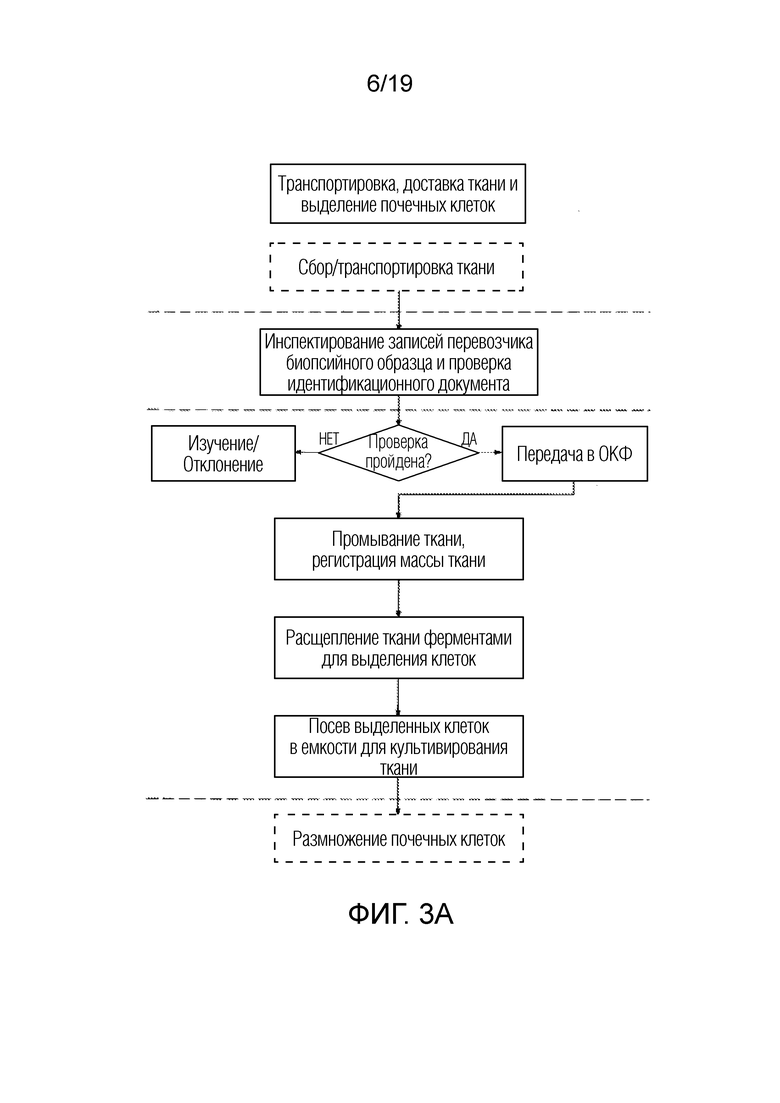
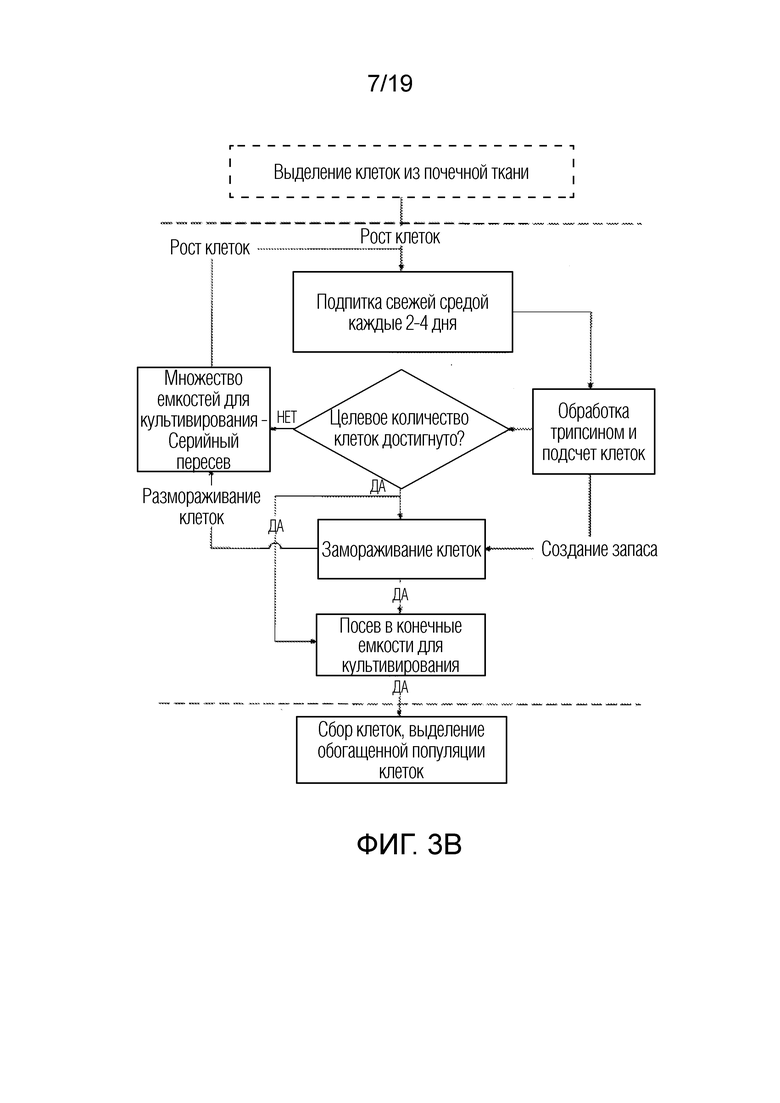
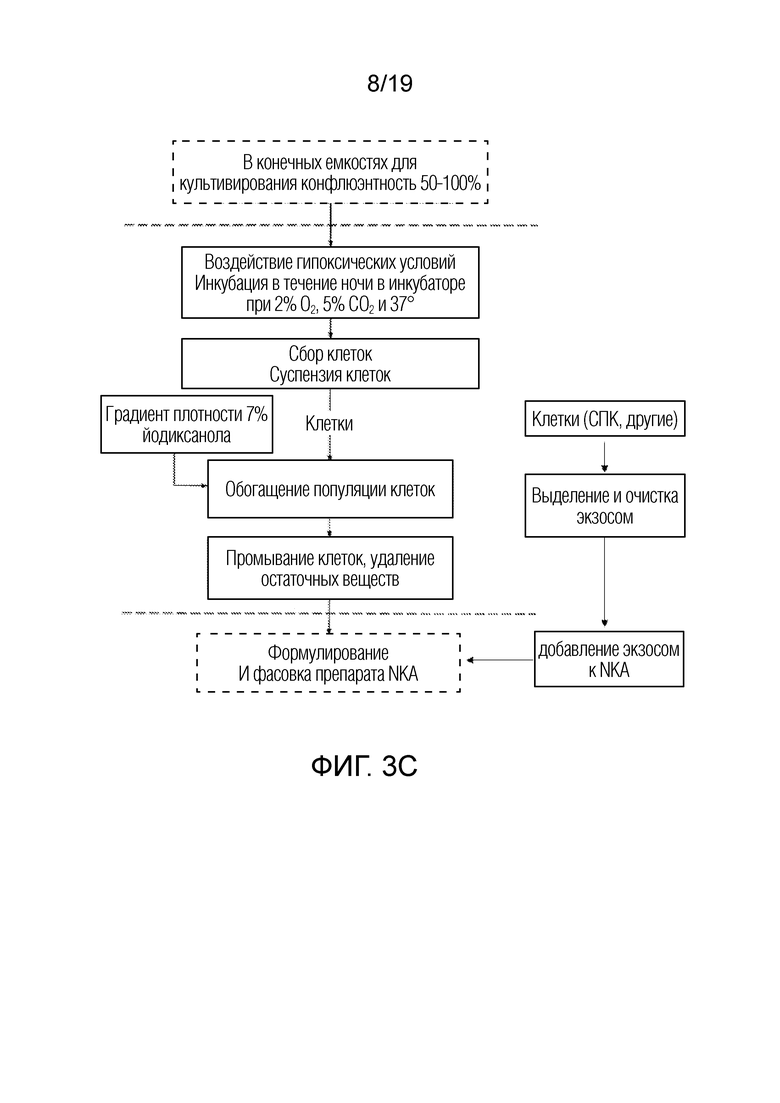
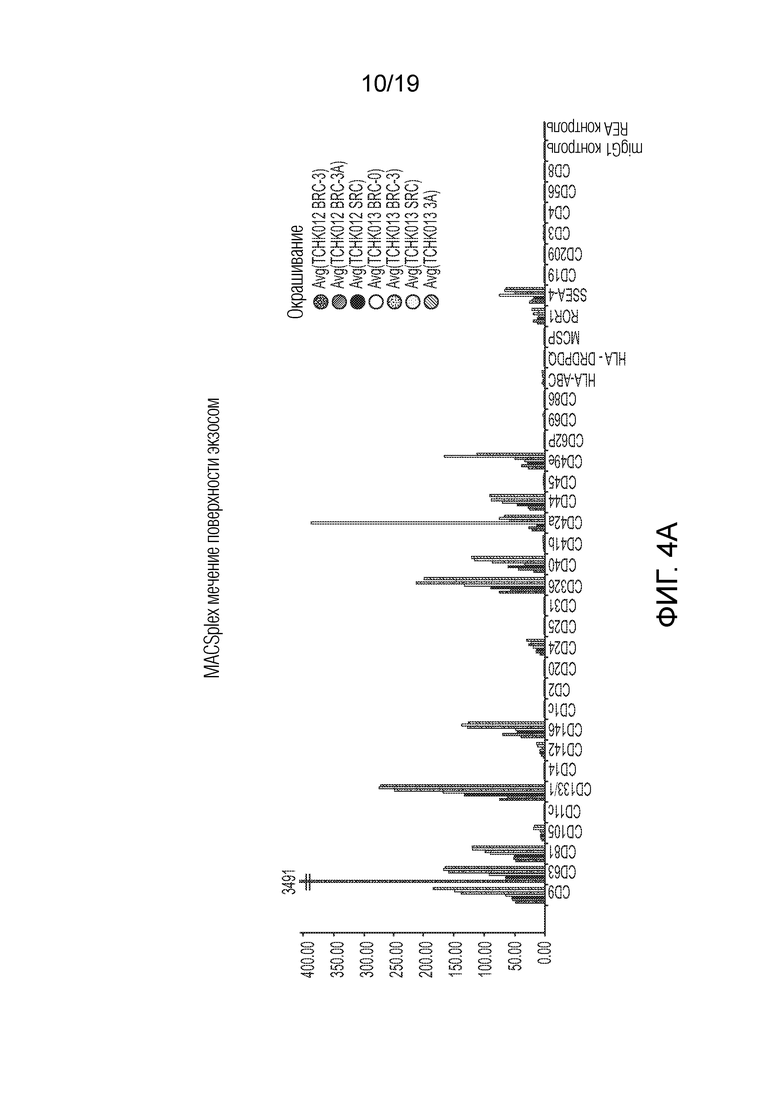
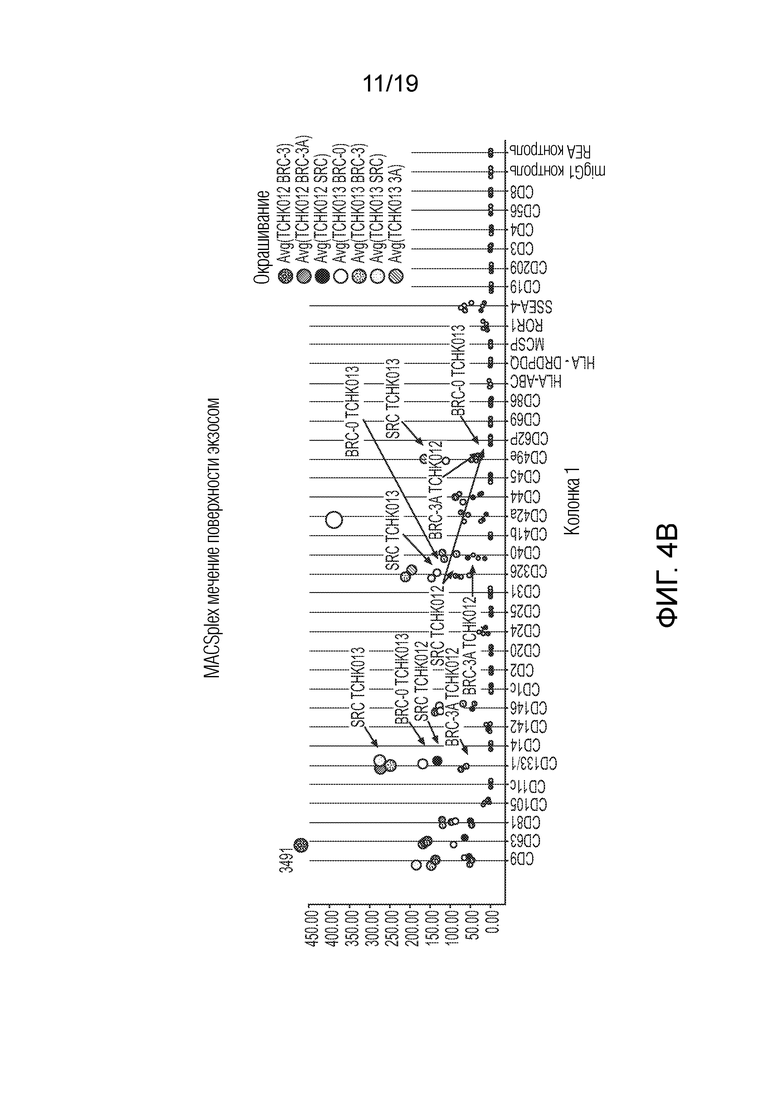
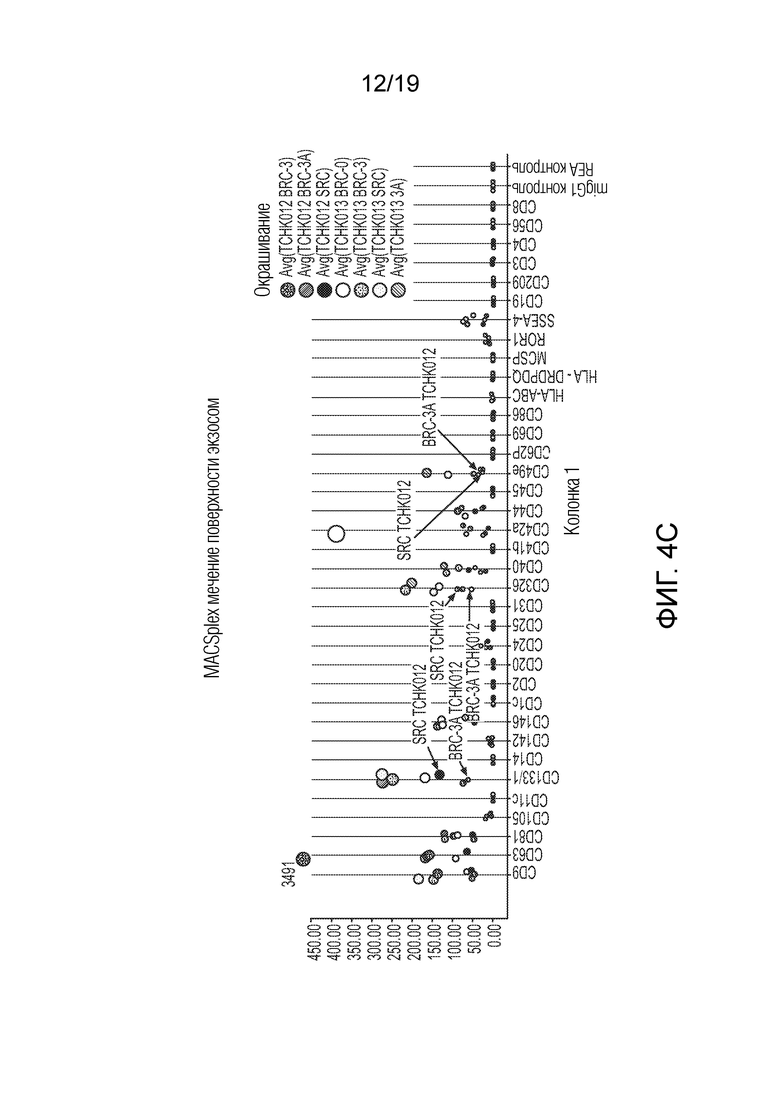
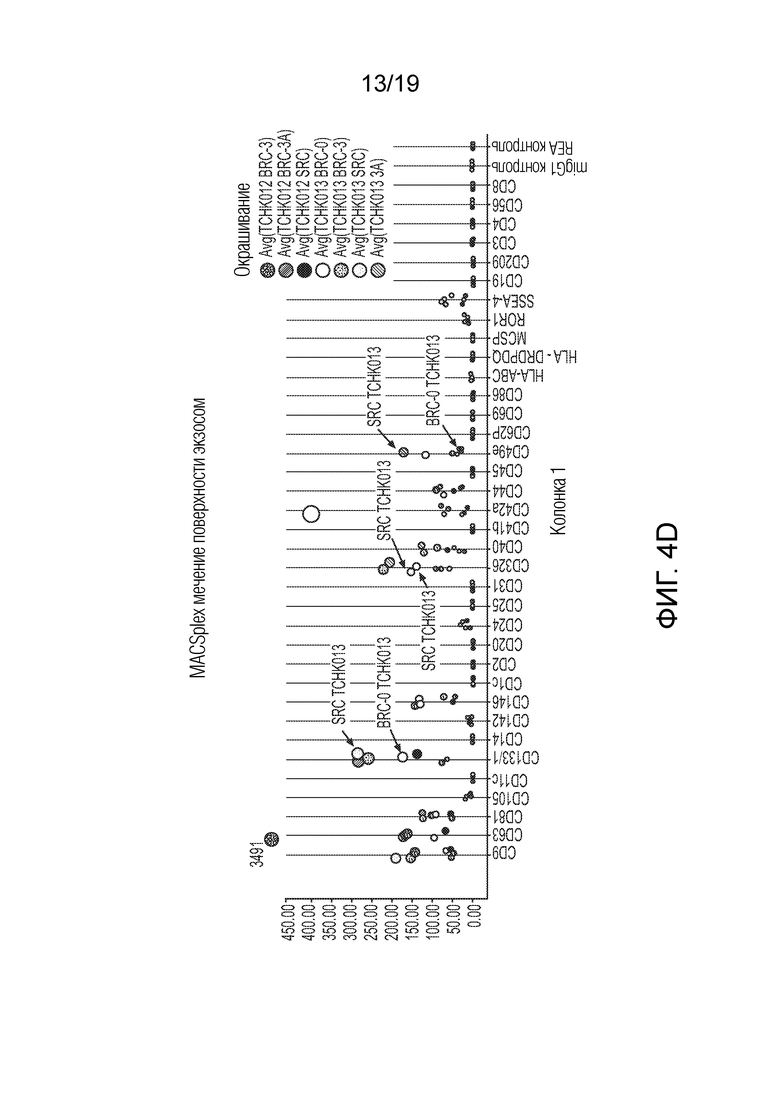
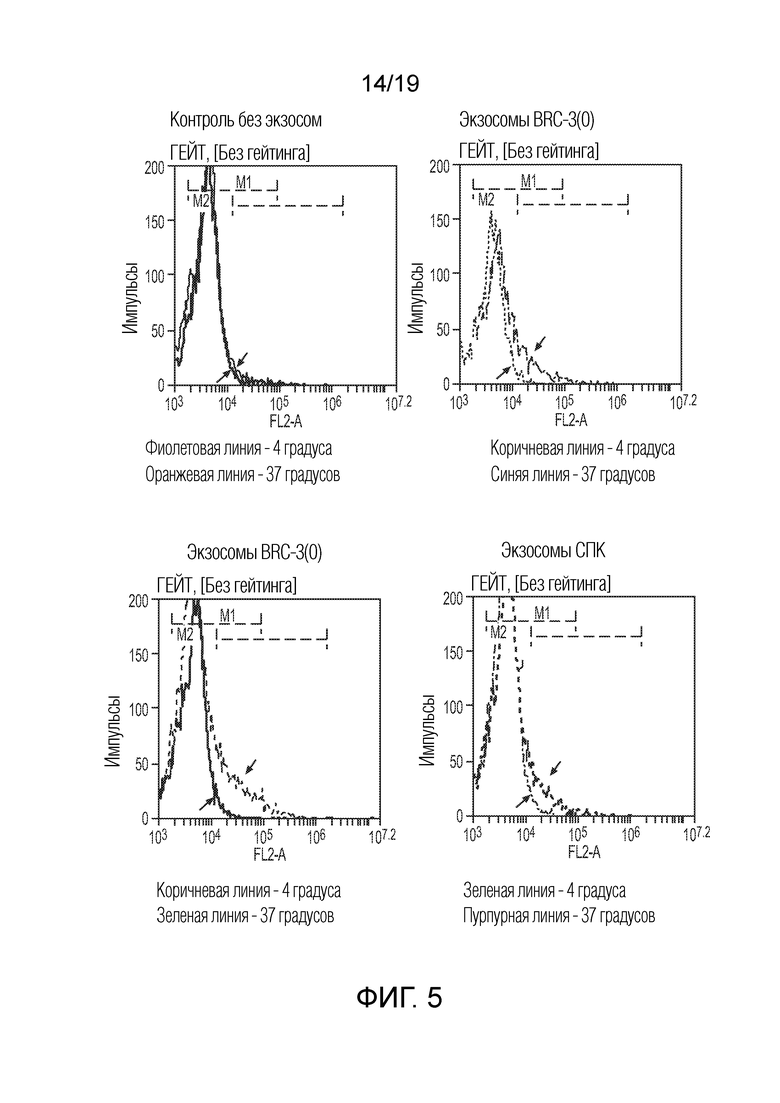
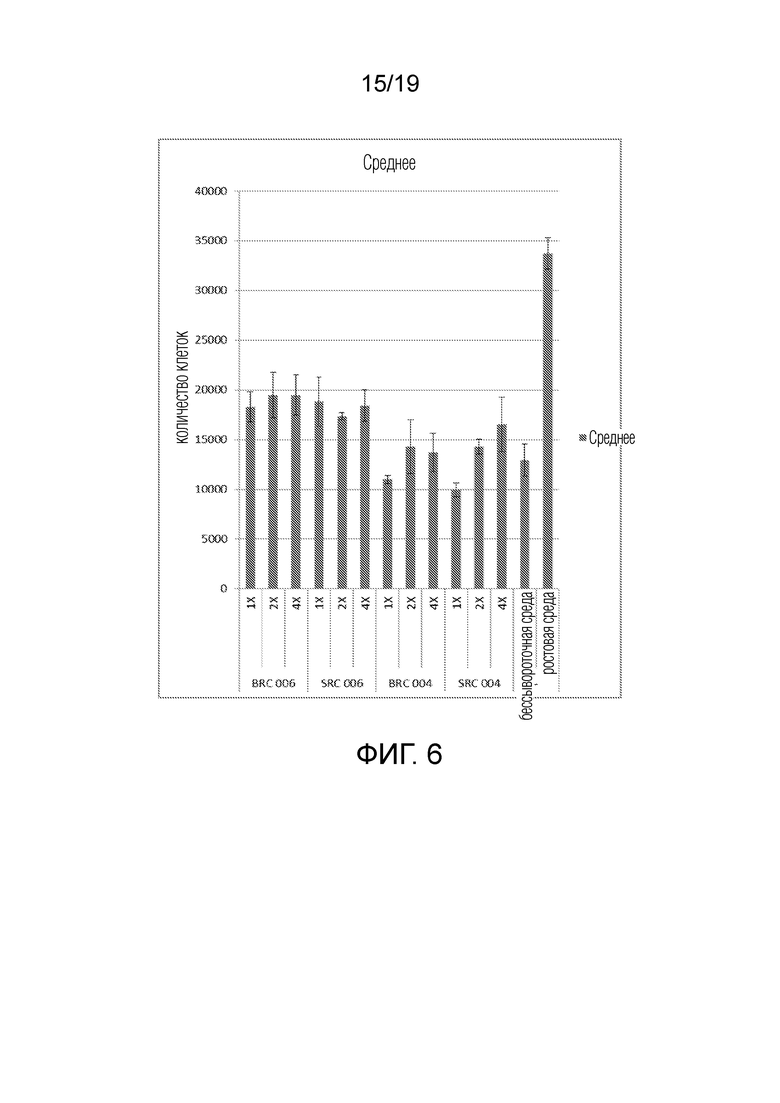
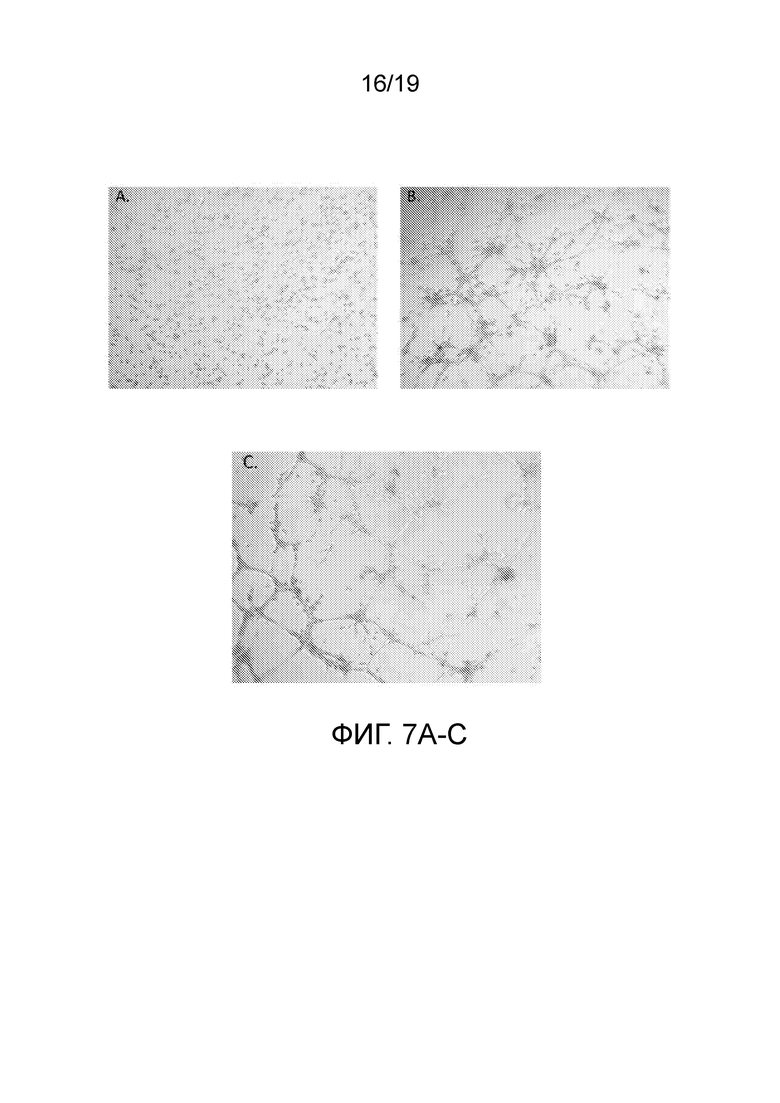
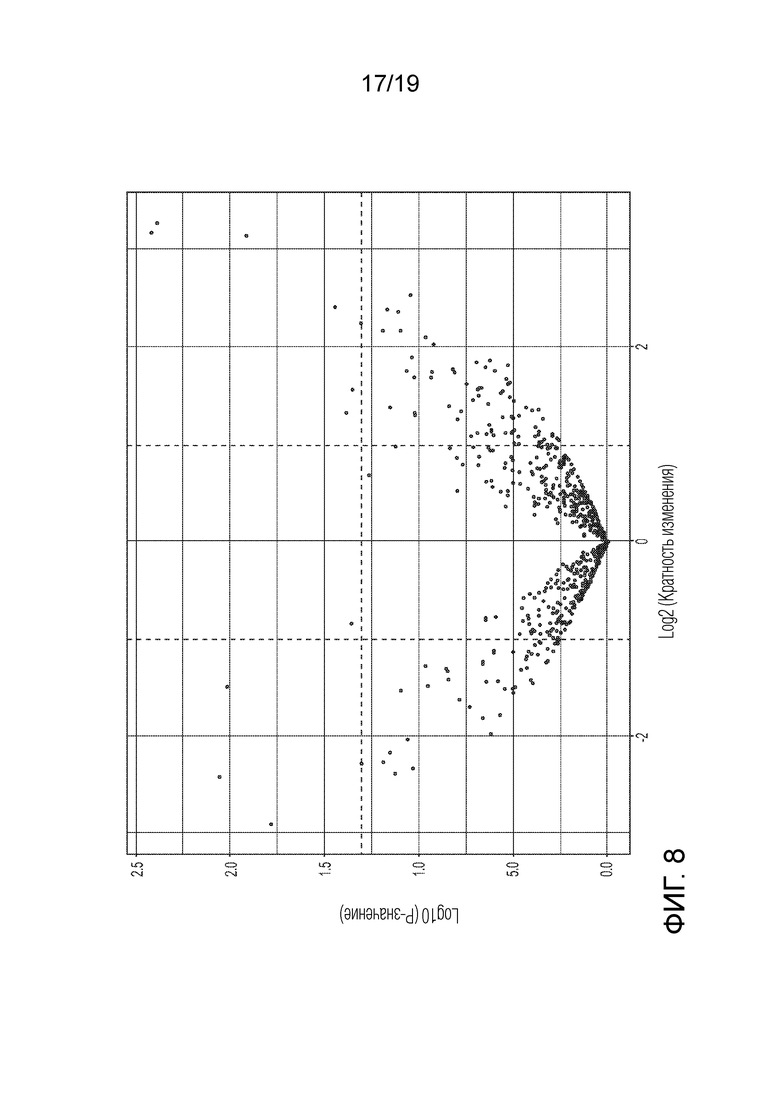
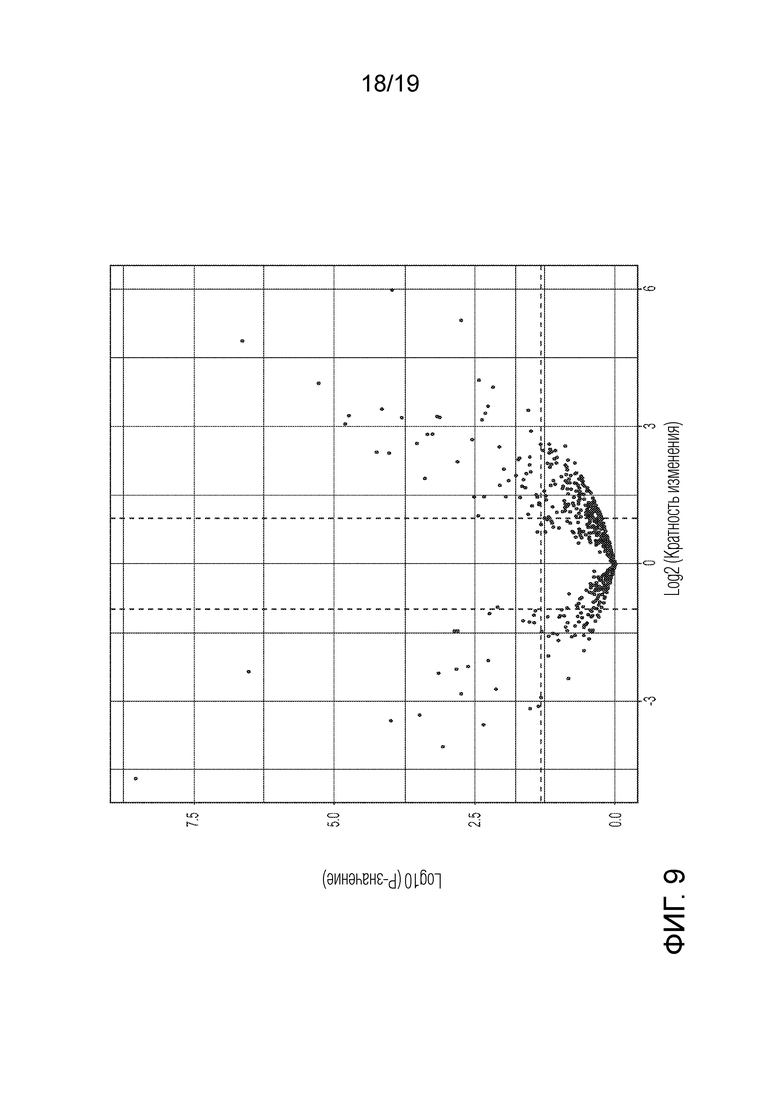
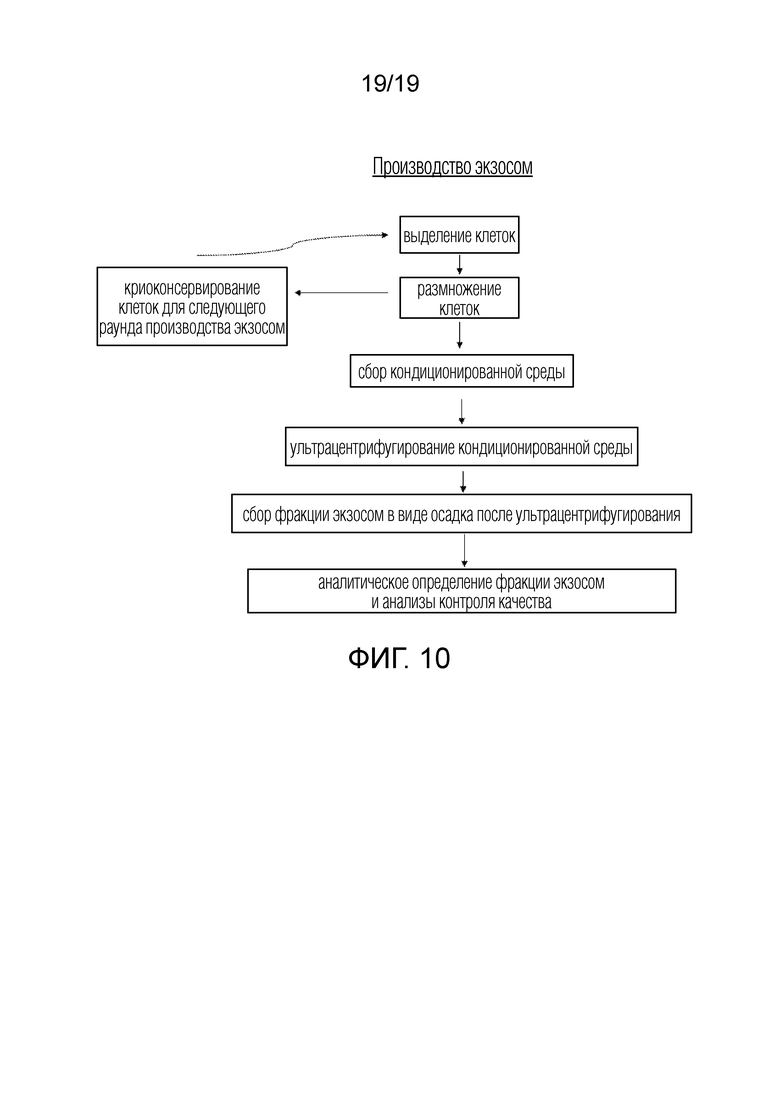
Изобретение относится к области исследований везикул почечных клеток и касается способа определения везикулы почечной клетки как регенеративной. Предлагаемый способ включает определение того, повышается или понижается экспрессия по меньшей мере одного соединения в везикулах по сравнению с везикулами, секретируемыми не пересеянными первичными почечными клетками, где по меньшей мере одно соединение содержит одно или более из CD326, CD40, CD42a, CD44, CD49e и/или SSEA-4, и определение везикулы как регенеративной, если по меньшей мере одно соединение представляет собой CD326, CD40, CD44 и/или CD49e и экспрессия по меньшей мере одного соединения в везикуле повышается и/или по меньшей мере одно соединение представляет собой CD42a и/или SSEA-4 и экспрессия по меньшей мере одного соединения в везикуле понижается. Способ позволяет определить, является ли везикула почечной клетки регенеративной. 12 з.п. ф-лы, 16 табл., 3 пр., 19 ил.
1. Способ определения везикулы почечной клетки как регенеративной, включающий:
определение того, повышается или понижается экспрессия по меньшей мере одного соединения в везикулах по сравнению с везикулами, секретируемыми не пересеянными первичными почечными клетками,
где по меньшей мере одно соединение содержит одно или более из CD326, CD40, CD42a, CD44, CD49e и/или SSEA-4; и
определение везикулы как регенеративной, если:
по меньшей мере одно соединение представляет собой CD326, CD40, CD44 и/или CD49e и экспрессия по меньшей мере одного соединения в везикуле повышается и/или
по меньшей мере одно соединение представляет собой CD42a и/или SSEA-4 и экспрессия по меньшей мере одного соединения в везикуле понижается.
2. Способ по п.1, где везикулу получают из супернатанта культуры почечных клеток.
3. Способ по п.2, где почечные клетки представляют собой клетки биоактивной популяции почечных клеток.
4. Способ по п. 3, где биоактивная почечная популяция клеток представляет собой селективную почечную популяцию клеток.
5. Способ по п. 4, где более 18% клеток селективной популяции почечных клеток экспрессируют GGT-1, более 80% клеток селективной популяции почечных клеток экспрессируют цитокератин CK18 и приблизительно от 3,0% до 53,7% клеток выделенной популяции почечных клеток экспрессируют AQP2.
6. Способ по п. 1, где везикулу получают в биологическом образце субъекта или из него.
7. Способ по п. 6, где биологический образец представляет собой мочу.
8. Способ по п. 1, 6 или 7, где обнаружение включает метод спектрометрии.
9. Способ по любому из пп. 1, 6 или 7, где обнаружение включает иммуноанализ.
10. Способ по п. 6 или 7, где субъекту вводят биоактивную популяцию почечных клеток.
11. Способ по п. 10, где популяция биоактивных почечных клеток представляет собой селективную популяцию почечных клеток.
12. Способ по любому из пп. 1-7, где по меньшей мере одно соединение представляет собой CD326 и/или CD49e.
13. Способ по любому из пп. 1-7, где определение дополнительно включает определение наличия двух или более микроРНК в везикуле, при этом две или более микроРНК включают miR-145, miR-22, miR-7, miR-10а, miR-143 и/или let7b.
| EP 3190177 A, 12.07.2017 | |||
| US 2015246073 A1, 03.09.2015 | |||
| US 9724367 B2, 08.08.2017 | |||
| MACSPlex Analysis of plasma- derived extracellular vesicles | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Найдено из Интернет: https://static.miltenyibiotec.com › asset | |||
| KENTARO JINGUSHI et al | |||
| Extracellular vesicles isolated from human renal cell | |||
Авторы
Даты
2024-08-06—Публикация
2019-08-28—Подача