Настоящее изобретение относится к производным пептидно-нуклеиновых кислот, нацеленным на пре-РНК SCN9A, для лечения боли и нарушений, опосредуемых потенциалзависимым натриевым каналом подтипа Nav1.7, и по нему испрашивается приоритет предварительной заявке США № 62/395814, поданной 16 сентября 2016 года, которая включена в настоящее описание посредством ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Потенциалзависимые натриевые каналы (VGSC) представляют собой трансмембранные белки, состоящие из субъединиц α и β. VGSC выполняют функцию ворот для прохождения ионов натрия через клеточную мембрану. Активность натриевых каналов обеспечивается α-субъединицей. Подтип VGSC определяется подтипом α-субъединицы. На сегодняшний день существует по меньшей мере 10 подтипов VGSC, т.е. Nav1.1, Nav1.2,..., Nav1.9 и Nax.
Каждый подтип VGSC имеет свою α-субъединицу, и он предназначен для выполнения биологической функции в зависимости от ткани, в которой он экспрессируется. Например, подтип Nav1.2 экспрессируется в центральных нейронах. Nav1.2, как полагают, связан с эпилепсией [Human Mol. Genet. vol 24(5), 1459-1468 (2015)]. Подтип Nav1.5 широко экспрессируется в кардиомиоцитах. Ингибирование Nav1.5 может вызвать синдром длинного QT и внезапную смерть [Handbook Exp. Pharmacol. vol 221, 137-168 (2014)]. Подтип Nav1.7 широко экспрессируется в ганглиях задних корешков. Повышение активности Nav1.7 вызывает эритромелалгию [J. Med. Genet. vol 41, 171-174 (2004)]. Между тем, люди, у которых генетически отсутствует активность Nav1.7 (каналопатии SCN9A), не испытывают тяжелые боли, хотя было обнаружено, что эти у этих индивидуумов их сенсорные функции являются нормальными [Nature vol 444, 894-898 (2006)].
Тетродотоксин (TTX) представляет собой нейтротоксин, имеющийся у иглобрюхих рыб. TTX является чрезвычайно токсичным, и его внутрибрюшинная LD50 у мышей составляет 10 мкг/кг [Toxins vol 6, 693-755 (2014)]. Пероральное употребление TTX может вызвать парестезию губ и языка, повышение слюноотделения, потоотделение, головную боль, тремор, паралич, цианоз, припадки, нарушение координации, диарею, боль в животе, гипотензию, расстройство дыхания, сердечные аритмии, кому и т.д. Известно, что TTX индуцирует такие неблагоприятные эффекты посредством неспецифического связывания с активными центрами подтипов VGSC. Таким образом, неспецифическое ингибирование подтипов VGSC считается опасной возможностью терапии, влекущей серьезные неблагоприятные явления.
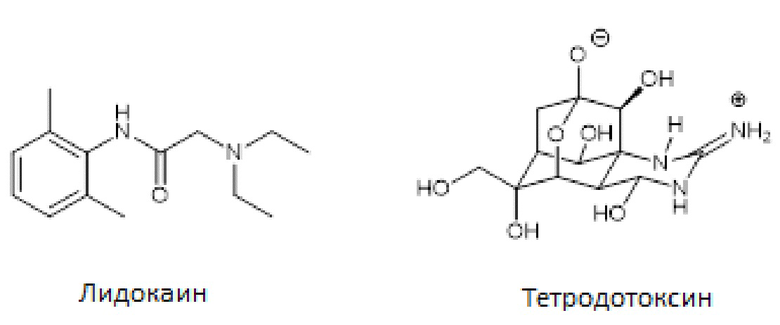
Лидокаин является неспецифическим ингибитором VGSC и его широко используют в качестве местного анестетика. При внутривенном введении лидокаин может индуцировать нежелательные побочные эффекты, такие как мышечная судорога, рвота, нерегулярное сердцебиение, сонливость и т.д. Такие побочные эффекты считаются следствием неспецифического ингибирования подтипов VGSC. Однако ингибирование Nav1.5 лидокаином может быть полезным для лечения желудочковой тахикардии. Тем не менее, системное введение лидокаина считается нежелательным для лечения хронической боли из-за неблагоприятных явлений вследствие неспецифического ингибирования подтипов натриевых каналов.
Каналопатии SCN9A: ген SCN9A (натриевый канал подтипа 9A) кодирует α-субъединицу VGSC подтипа Nav1.7. Существует чрезвычайно малое количество индивидуумов, которые не испытывают тяжелую боль, однако являются нормальными в отношении сенсорных функций. Было обнаружено, что такие индивидуумы имеют мутацию гена SCN9A, кодирующую нефункциональный подтип Nav1.7 [Nature vol 444, 894-898 (2006)]. Это называется SCN9A-каналопатиями. Поведенческие фенотипы SCN9A-каналопатий у человека довольно похоже воспроизводятся у мышей с нокаутом SCN9A [PLoS One 9(9): e105895 (2014)]. Таким образом, селективное ингибирование подтипа Nav1.7 может быть полезным для безопасного лечения хронической боли.
Селективные низкомолекулярные ингибиторы Nav1.7: Активные центры подтипов VGSC, отражающие физиологическую функцию VGSC, являются сходными в отношении их 3D-структуры. Селективное ингибирование подтипа Nav1.7 путем прямого нацеливания на активный центр посредством низкомолекулярных ингибиторов является в высокой степени проблематичным. Лидокаин и тетродотоксин являются хорошими примерами такого неселективного ингибирования подтипов VGSC.
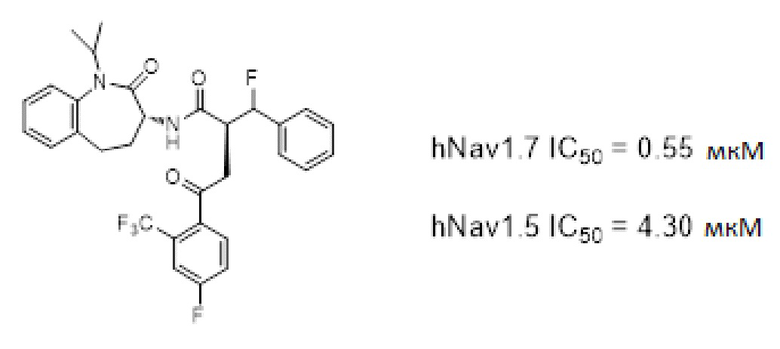
Ингибиторы Nav1.7 с умеренной селективностью относительно Nav1.5 (приблизительно в 8 раз) были идентифицировали посредством высокопроизводительного скрининга с использованием библиотеки из 200000 соединений для идентификации селективных ингибиторов Nav1.8 [J. Gen. Physiol. vol 131(5), 399-405 (2008)]. Посредством электрофизиологического анализа было обнаружено, что производное 1-бензазепин-2-она, представленное ниже, селективно ингибирует Nav1.7 относительно Nav1.5 с умеренной селективностью в отношении Nav1.7 (приблизительно в 8 раз).
На сегодняшний день описан ряд селективных низкомолекулярных ингибиторов Nav1.7 и некоторые из них были оценены у пациентов-людей. Например, фунапид (XEN-402/TV-45070) был оценен у небольшого количества пациентов с эритромелалгией [Pain vol 153, 80-85 (2012)]. Хотя фунапид показал болеутоляющую активность, фунапид продемонстрировал связанные с лечением и ограничивающие дозу неблагоприятные явления, включая головокружение и сонливость, у относительно большой части исследованных пациентов. Неблагоприятные явления в ЦНС указывают на то, что селективность фунапида в отношении Nav1.7 может не быть достаточно высокой, чтобы безопасно лечить хроническую боль.
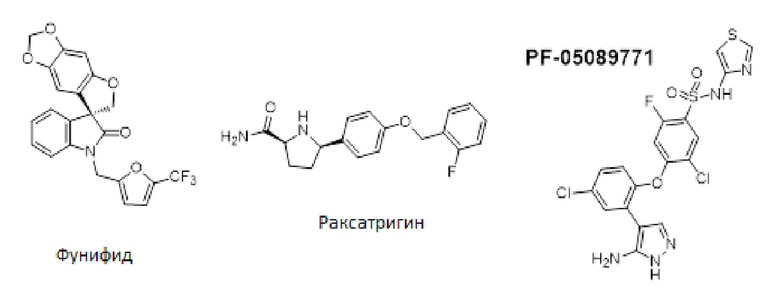
Раксатригин (CNV1014802/GSK-1014802) ингибирует Nav1.7, а также другие подтипы VGSC. Однако утверждается, что раксатригин ингибирует функциональную активность натриевых каналов посредством селективной стабилизации неактивного состояния натриевого канала. Несмотря на то, что раксатригин ингибирует натриевые каналы в ЦНС, считается, что он является хорошо переносимым в терапевтической дозе [The Pharmaceutical J. 11 Mar. 2016. Nav1,7: a new channel for pain treatment]. В клиническом испытании фазы IIa на пациентах с невралгией тройничного нерва раксатригин 150 мг TID хорошо переносился, хотя схема дозирования по существу не обеспечила достижения первичного терапевтического результата вследствие ограниченной эффективности для ряда включенных в исследование индивидуумов [J. M. Zakrzewska et al. Lancet Neurol. Published Online Feb 16, 2017, http://dx.doi.org/10,1016/S1472-4422(17) 30005-4].
PF-05089771 представляет собой селективный ингибитор Nav1.7 с IC50 11 нМ. Было описано, что PF-05089771 стабилизирует неактивную форму Nav1.7 [Biophysical J. vol 108(2) Suppl., 1573a-1574a (2015)]. Терапевтический потенциал PF-05089771 оценивали у пациентов с эритромелалгией или зубной болью после удаления зубов мудрости. Фармакокинетический анализ PF-05089771 показал, что низкая концентрация лекарственного средства в ткани-мишени при невропатической боли может быть возможным объяснением его низкой болеутоляющей активности у пациентов-людей [Clin. Pharmacokinet. vol 55(7), 875-87 (2016)].
Селективные низкомолекулярные ингибиторы Nav1.7 были рассмотрены в отношении структурных аспектов [Bioorg. Med. Chem. Lett. vol 24, 3690-3699 (2014)]. Молекулярный размер таких селективных ингибиторов Nav1.7 обычно является значительно большим, чем у лидокаина, неселективного ингибитора подтипов VGSC. Селективность в отношении Nav1.7 повышали путем увеличения молекулярного размера ингибитора. Считается, что каждый селективный ингибитор Nav1.7 связывается с определенным доменом в белке Nav1.7, и связываемый домен варьируется в зависимости от химической структуры ингибитора. Как ни странно, болеутоляющая эффективность селективность селективных ингибиторов Nav1.7 не была высокой и не удовлетворяла ожиданиям, исходя из данных у людей с SCN9A-каналопатиями [Expert Opin. Ther. Targets vol 20(8), 975-983 (2016)]
Другие типы селективных ингибиторов Nav1.7: Было обнаружено, что пептид ProTx-II яда тарантула селективно ингибирует Nav1.7 относительно других подтипов VGSC. Однако яд продемонстрировал слабую болеутоляющую активность в моделях острой воспалительной боли на животных [Mol. Pharmacol. vol 74, 1476-1484 (2008)]. Учитывая, что электрофизиологию пептида из яда оценивали в клетках HEK-293, модифицированных для высокой экспрессии каждого подтипа VGSC, возможно, что ProTx-II может не связываться с активным центром Nav1.7 в первичных нейрональных клетках, экспрессирующих Nav1.7.
Было обнаружено, что Ssm6a, 46-мерный пептид, выделенный из яда сколопендры, селективно ингибирует Nav1.7 относительно других подтипов VGSC. Было обнаружено, что в клетках HEK-293, модифицированных для сверхэкспрессии Nav1.7, IC50 для Nav1.7 составляет 0,3 нМ. Яд сколопендры продемонстрировал болеутоляющую эффективность, сравнимую с морфином, в тестах на мышах с формалином, являющихся моделью острой воспалительной боли. 46-мерный пептид также подавлял ток натрия в клетках DRG крысы. Хотя пептид яда крысы продемонстрировал высокую стабильность в сыворотке, активность обезболивания длилась только несколько часов [Proc. Nat. Acad. Sci. USA vol 110(43), 17534-17539 (2013)].
SVmab1 представляет собой моноклональное антитело, селективно нацеленное на Nav1.7 относительно других подтипов VGSC в клетках HEK-293, сверхэкспрессирующих каждый подтип VGSC. SVmab1 селективно ингибировал ток натрия, индуцируемый Nav1.7, в клетках HEK-293с IC50 30 нМ. Моноклональные антитело продемонстрировало выраженную болеутоляющую активность при внутривенном (в дозе 50 мг/кг) или интратекальном (10 мкг, т.е. приблизительно 0,5 мг/кг) введении в тесте с формалином на мышах. Исходя из отличий в эффективности этих двух путей введения в отношении обезболивания, ингибирование Nav1.7 в спинном мозге или ЦНС должно быть важным для болеутоляющей активности в тесте с формалином [Cell vol 157(6), 1393-1404 (2014)].
Синтез рибосомальных белков: Генетическая информация закодирована в ДНК (2-дезоксирибонуклеиновая кислота). ДНК транскрибируется с образованием пре-мРНК (пре-матричная рибонуклеиновая кислота) в ядре. Интроны пре-мРНК ферментативно вырезаются посредством сплайсинга с образованием мРНК (матричная рибонуклеиновая кислота), которая в свою очередь перемещается в цитозольный компартмент. В цитозоле комплекс трансляционного аппарата, называемый рибосомой, связывается с мРНК и проводит синтез белка по мере сканирования генетической информации, закодированной вдоль мРНК [Biochemistry vol 41, 4503-4510 (2002); Cancer Res. vol 48, 2659-2668 (1988)].
Антисмысловой олигонуклеотид: Олигонуклеотид, связывающийся с РНК или ДНК специфическим в отношении последовательности образом (т.е. комплементарно), называют антисмысловым олигонуклеотидом (ASO). ASO может прочно связываться с мРНК или пре-мРНК.
ASO, прочно связывающийся с мРНК, может прерывать синтез белка рибосомой вдоль мРНК в цитозоле. ASO должен присутствовать в цитозоле для ингибирования синтеза рибосомальным белком его белка-мишени.
ASO, прочно связывающийся с пре-мРНК, может препятствовать процессу сплайсинга пре-мРНК. Для изменения процесса сплайсинга и индукции в итоге пропускания экзона ASO должен находиться в ядре.
Неприродные олигонуклеотиды: ДНК- или РНК-олигонуклеотиды являются чувствительными к деградации эндогенными нуклеазами, что ограничивает их терапевтическую применимость. На сегодняшний день разработано и тщательно исследовано множество типов неприродных олигонуклеотидов [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)]. Некоторые из них демонстрируют длительную метаболическую стабильность по сравнению с ДНК или РНК. Ниже приведены химические структуры некоторых репрезентативных неприродных олигонуклеотидов. Такие олигонуклеотиды предсказуемым образом связываются с комплементарной нуклеиновой кислотой, как и ДНК или РНК.
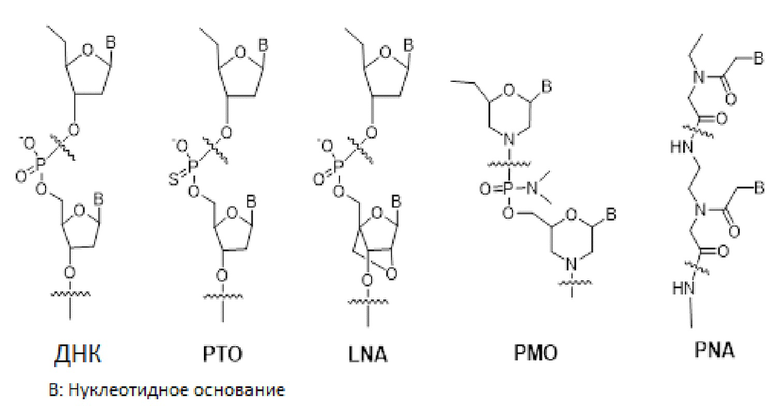
Фосфоротиоатный олигонуклеотид: Фосфоротиоатный олигонуклеотид (PTO) представляет собой аналог ДНК, в котором один из атомов кислорода фосфата остова в каждом мономере заменен атомом серы. Такое небольшое структурное изменение делает PTO сравнительно устойчивым к деградации нуклеазами [Ann. Rev. Biochem. vol 54, 367-402 (1985)].
Отражением структурного сходства остовов PTO и ДНК является то, что они оба плохо проходят через клеточную мембрану в большинстве типов клеток млекопитающих. Однако для некоторых типов клеток, широко экспрессирующих переносчик(и) для ДНК, ДНК и PTO демонстрируют хорошее проникновение в клетки. Известно, что системно вводимые PTO быстро распределяются в печень и почки [Nucleic Acid Res. vol 25, 3290-3296 (1997)].
Чтобы облегчить проникновение PTO в клетки in vitro широко практиковалась липофекция. Однако липофекция физически изменяет клеточную мембрану, потенциально вызывая цитотоксичность, и, таким образом, не является идеальной для длительно терапевтического применения.
На протяжении последних 30 лет проводили клиническую оценку антисмысловых PTO и вариантов PTO для лечения злокачественных опухолей, иммунологических нарушений, метаболических заболеваний и т.д. [Biochemistry vol 41, 4503-4510 (2002); Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)]. Многие из таких антисмысловых лекарственных средств-кандидатов не имели успеха, частично вследствие плохого проникновения PTO в клетки. Для преодоления плохого проникновения в клетки PTO необходимо вводить в высокой дозе, чтобы достигнуть терапевтической активности. Однако известно, что PTO демонстрируют ограничивающую дозу токсичность, включая увеличенное время свертывания, активацию комплемента, тубулярную нефропатию, активацию купферовых клеток и иммунную стимуляцию, включающую спленомегалию, гиперплазию лимфоидных тканей, инфильтрацию мононуклеарных клеток [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)].
Было обнаружено, что многие антисмысловые PTO демонстрируют надлежащую клиническую активность при заболеваниях, в которые значительный вклад вносит печень или почки. Мипомерсен представляет собой аналог PTO, который ингибирует синтез apoB-100, являющегося белком, вовлеченным в транспорт холестерина LDL. Мипомерсен проявлял надлежащую клиническую активность в определенной популяции пациентов с атеросклерозом, наиболее вероятно вследствие его преимущественного распределения в печени [Circulation vol 118(7), 743-753 (2008)]. ISIS-113715 представляет собой антисмысловой аналог PTO, ингибирующий синтез протеинтирозинфосфатазы 1B (PTP1B), и было обнаружено, что он демонстрирует терапевтическую активность у пациентов с диабетом типа II [Curr. Opin. Mol. Ther. vol 6, 331-336 (2004)].
Закрытая нуклеиновая кислота: в закрытой нуклеиновой кислоте (LNA), рибозное кольцо основной цепи РНК структурно ограничено для увеличения аффинности связывания с РНК или ДНК. Таким образом, LNA может считаться высокоаффинным аналогом ДНК или РНК [Biochemistry vol 45, 7347-7355 (2006)]. Однако LNA также демонстрирует низкую клеточную проницаемость.
Морфолино-фосфорoдиамидатный олигонуклеотид: в монфолино-фосфорoдиамидатном олигонуклеотиде (PMO) фосфат и 2-дезоксирибоза основной цепи ДНК заменены фосфороамидитом и морфолином, соответственно [Appl. Microbiol. Biotechnol. vol 71, 575-586 (2006)]. В то время как основная цепь ДНК является отрицательно заряженной, основная цепь PMO не является заряженной. Таким образом, связывание между PMO и мРНК свободно от электростатического отталкивания между остовами и обычно является более сильным, чем между ДНК и мРНК. Поскольку PMO структурно значительно отличается от ДНК, PMO не распознается переносчиком(ами) печени, распознающим ДНК или РНК. Однако PMO не легко проникает через мембрану клеток млекопитающих.
Пептидно-нуклеиновая кислота: пептидно-нуклеиновая кислота (PNA) представляет собой полипептид с N-(2-аминоэтил)глицином в качестве элемента основной цепи, и она была открыта Dr. Nielsen и его коллегами [Science vol 254, 1497-1500 (1991). Химическая структура и сокращенное обозначение прототипной PNA проиллюстрированы на чертеже ниже.
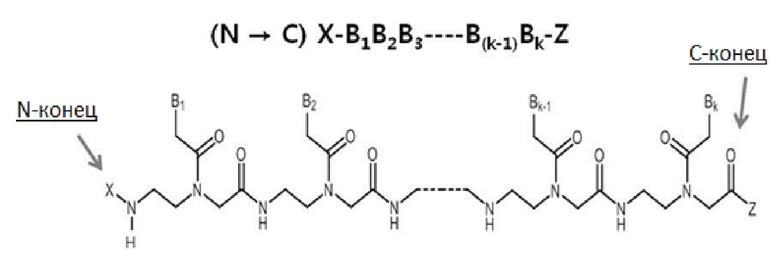
Подобно ДНК и РНК, PNA селективно связывается с комплементарной нуклеиновой кислотой [Nature (London) vol 365, 566-568 (1992)]. При связывании с комплементарной нуклеиновой кислотой N-конец PNA считается эквивалентным "5'-концу" ДНК или РНК, и C-конец PNA считается эквивалентным "3'-концу" ДНК или РНК.
Подобно PMO, остов PNA является незаряженным. Таким образом, связывание между PNA и РНК обычно является более сильным, чем между ДНК и РНК. Поскольку химическая структура PNA значительно отличается от ДНК, PNA не распознается переносчиком(ами) печени, распознающим ДНК, и демонстрирует профиль распределения в тканях, отличный от ДНК или PTO. Однако, PNA также плохо проникает через клеточную мембрану млекопитающих (Adv. Drug Delivery Rev. vol 55, 267-280, 2003).
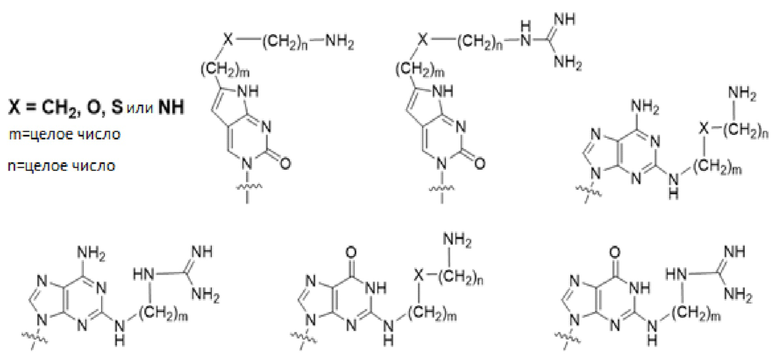
Модифицированные нуклеиновые основания для повышения способности PNA проникать через мембрану: был получен PNA с высокой проницаемостью через клеточную мембрану млекопитающих посредством вставки модифицированных нуклеиновых оснований, с которыми ковалентно связан катионный липид или его эквивалент. Химические структуры таких модифицированных нуклеиновых оснований представлены выше. Было обнаружено, что такие модифицированные нуклеиновые основания цитозина, аденина и гуанина предсказуемым образом и комплементарно гибридизуются с гуанином, тимином и цитозином, соответственно [заявка PCT № PCT/KR2009/001256; EP2268607; US8680253].
Включение таких модифицированных оснований в PNA имитирует ситуации липофекции. При липофекции олигонуклеотидные молекулы оборачиваются молекулами катионных липидов, таких как липофектамин, и такие комплексы липофектамин/олигонуклеотид обычно проникают через мембрану легче, чем голые олигонуклеотидные молекулы.
В дополнение к хорошей мембранной проницаемости, было обнаружено, что эти производные PNA демонстрируют чрезвычайно высокую аффинностью в отношении комплементарной нуклеиновой кислоты. Например, внесение от 4 до 5 модифицированных нуклеиновых оснований в 11-13-мерные производные PNA легко обеспечивали повышение Tm на 20°С или выше при образовании дуплекса с комплементарной ДНК. Такие производные PNA являются в высокой степени чувствительными к одному несоответствию оснований. Одно несоответствие оснований приводило к снижению температуры плавления (Tm) на от 11 до 22°С в зависимости от типа модифицированного основания, а также последовательности PNA.
Малая интерферирующая РНК (миРНК): малая интерферирующая РНК (миРНК) относится к двухцепочечной РНК из 20-25 пар оснований [Microbiol. Mol. Biol. Rev. vol 67(4), 657-685 (2003)]. Антисмысловая цепь миРНК некоторым образом взаимодействует с белками с образованием "РНК-индуцируемого комплекса сайленсинга" (RISC). Затем RISC связывается с определенной частью мРНК, комплементарной антисмысловой цепи миРНК. мРНК в комплексе с RISC подвергается расщеплению. Таким образом, миРНК каталитически индуцирует расщепление ее мРНК-мишени и ингибирует экспрессию белка с мРНК. RISC не всегда связывается с полностью комплементарной последовательностью в мРНК-мишени, что вызывает опасения, касающиеся неспецифических эффектов терапии миРНК [Nature Rev. Drug Discov. vol 9, 57-67 (2010)]. Подобно другим классам олигонуклеотидов с остовом ДНК или РНК, миРНК обладает низкой проницаемостью и, таким образом, обычно демонстрирует низкую терапевтическую активность in vitro или in vivo, если она не составлена надлежащим образом или не химически модифицирована для обеспечения хорошей проницаемости через мембрану.
миРНК против SCN9A: описаны миРНК уровня техники, нацеленные на 19-мерную последовательность [(5'  3') GAUUAUGGCUACACGAGCU] в экзоне 8 мРНК SCN9A человека [US8183221]. Утверждалось, что при интратекальной инфузии в моделях на животных невропатической боли и воспалительной боли миРНК демонстрируют терапевтическую активность. Утверждалось, что эти мРНК подавляют экспрессию Nav1.7 в клетках DRG крысы.
3') GAUUAUGGCUACACGAGCU] в экзоне 8 мРНК SCN9A человека [US8183221]. Утверждалось, что при интратекальной инфузии в моделях на животных невропатической боли и воспалительной боли миРНК демонстрируют терапевтическую активность. Утверждалось, что эти мРНК подавляют экспрессию Nav1.7 в клетках DRG крысы.
Сплайсинг: ДНК транскрибируется с образованием пре-мРНК (пре-матричная рибонуклеиновая кислота) в ядре. Затем пре-мРНК процессируется в мРНК после делеции интронов посредством серии комплексных реакций, в совокупности называемых "сплайсингом", как схематично представлено на диаграмме на фиг.17 [Ann. Rev. Biochem. 72(1), 291-336 (2003); Nature Rev. Mol. Cell Biol. 6(5), 386-398 (2005); Nature Rev. Mol. Cell Biol. 15(2), 108-121 (2014)].
Сплайсинг начинается образованием "комплекса E сплайсеосомы" (т.е. раннего комплекса сплайсеосомы) между пре-мРНК и адаптерными факторами сплайсинга. В "комплексе E сплайсеосомы" U1 связывается с точкой соединения экзона N и интрона N, и U2AF35 связывается с точкой соединения интрона N и экзона (N+1). Таким образом, точки соединения экзон/интрон или интрон/экзон являются ключевыми для образования раннего комплекса сплайсеосомы. "Комплекс E сплайсеосомы" преобразуется в "комплекс A сплайсеосомы" посредством дополнительного образования комплекса с U2. "Комплекс A сплайсеосомы" претерпевает серию комплексных реакций для удаления и вырезания интронов и соединения соседних экзонов.
Антисмысловое ингибирование сплайсинга: В ядре ASO может прочно связываться с определенным положением в пре-мРНК и может препятствовать процессу сплайсинга пре-мРНК в мРНК, в результате чего образуется мРНК или несколько мРНК, лишенных экзона-мишени. Такая мРНК (несколько мРНК), которую называют "вариантом(ами) сплайсинга", кодирует более короткий белок(белки), чем белок, кодируемый полноразмерной мРНК.
В принципе, сплайсинг может прерываться ингибированием образования "комплекса сплайсеосомы E". Если ASO прочно связывается с точкой соединения (5'  3') экзон-интрон, т.е. "5'-участком сплайсинга", ASO блокирует образование комплекса между пре-мРНК и фактором U1, и, таким образом, образование "комплекса E сплайсеосомы". Аналогично, "комплекс E сплайсеосомы" не может образовываться, если ASO прочно связывается с точкой соединения (5'
3') экзон-интрон, т.е. "5'-участком сплайсинга", ASO блокирует образование комплекса между пре-мРНК и фактором U1, и, таким образом, образование "комплекса E сплайсеосомы". Аналогично, "комплекс E сплайсеосомы" не может образовываться, если ASO прочно связывается с точкой соединения (5'  3') интрон-экзон, т.е. "3'-участком сплайсинга".
3') интрон-экзон, т.е. "3'-участком сплайсинга".
Антисмысловое ингибирование сплайсинга пре-мРНК SCN9A: на сегодняшний день отсутствуют описанные случаи индуцирования посредством ASO против SCN9A альтернативного сплайсинга пре-мРНК SCN9A.
Краткое описание чертежей
Фиг.1(A)-(C). Примеры природных и неприродных нуклеиновых оснований, которые могут быть выбраны для производных пептидно-нуклеиновых кислот формулы I.
Фиг.2(A)-(E). Примеры заместителей, которые могут быть выбраны для производного пептидно-нуклеиновой кислоты формулы I.
Фиг.3. Химические структуры для мономеров PNA с природным или модифицированным нуклеиновым основанием.
Фиг.4. Химические структуры для сокращенных обозначений N- или C-концевых заместителей.
Фиг.5(A). Химическая структура "(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2".
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2".
Фиг.5(B). Химическая структура "(N  C) Fethoc-AG(5)C-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2".
C) Fethoc-AG(5)C-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2".
Фиг.6. Химическая структура мономеров Fmoc-PNA, используемых для синтеза производных PNA по настоящему изобретению.
На фиг.7(A) и (B) представлены хроматограммы C18-обращенонно-фазовой ВЭЖХ для "ASO 4" до и после очистки посредством ВЭЖХ, соответственно.
Фиг.8. Спектр масс ESI-TOF для "ASO 4" после очистки посредством C18-обращено-фазовой хроматографией.
Фиг.9(A). Электрофоретический анализ продуктов гнездовой ПЦР для SCN9A из клеток PC3, которые обрабатывали "ASO 9" в количестве 0 (отрицательный контроль), 10, 100 или 1000 зМ.
Фиг.9(B). Данные секвенирования по методу Сэнгера полос продуктов ПЦР, относящихся к пропусканию "экзона 4" (сверху) и "экзонов 4-5" (снизу), соответственно.
Фиг.10(A). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 9" в количестве 0 (отрицательный контроль), 10, 100 или 1000 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.10(B). Данные анализа CoroNa, полученные для клеток PC3, обработанных "ASO 9" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
Фиг.11(A). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 4" в концентрации 0 (отрицательный контроль), 10, 100 или 1000 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.11(B). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 5" в концентрации 0 (отрицательный контроль), 10, 100 или 1000 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.11(C). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 1" в концентрации 0 (отрицательный контроль), 10, 100 или 1000 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.11(D). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 6" в концентрации 0 (отрицательный контроль), 10 или 100 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.11(E). Данные гнездовой кПЦР для SCN9A, полученные на клетках PC3, которые обрабатывали "ASO 10" в концентрации 0 (отрицательный контроль), 10 или 100 зМ (планка погрешности соответствует стандартной ошибке).
Фиг.12(A). Кривые средней внутриклеточной флуоресценции в соответствии с анализом CoroNa в клетках PC3 после инкубации в течение 30 часов с "ASO 10" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
Фиг.12(B). Кривые средней внутриклеточной флуоресценции в соответствии с анализом CoroNa в клетках PC3 после инкубации в течение 30 часов с "ASO 6" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
Фиг.12(C). Кривые средней внутриклеточной флуоресценции в соответствии с анализом CoroNa в клетках PC3 после инкубации в течение 30 часов с "ASO 4" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
Фиг.12(D). Кривые средней внутриклеточной флуоресценции в соответствии с анализом CoroNa в клетках PC3 после инкубации в течение 30 часов с "ASO 5" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
Фиг.13. Обращение вспять аллодинии, индуцированной SNL (лигирование L5 с разрезом L6) у крыс SD, которым подкожно вводили "ASO 1" в дозе 0 (отрицательный контроль), 3 или 10 пмоль/кг (планка погрешности соответствует стандартной ошибке).
Фиг.14. Обращение вспять аллодинии, индуцированной посредством DPNP у крыс, которым вводили подкожно "ASO 5" в дозе 0 (отрицательный контроль), 0,01, 0,1, 1 или 10 пмоль/кг, или перорально прегабалин в дозе 30 мг/кг (положительный контроль) (планка погрешности соответствует стандартной ошибке).
Фиг.15. Обращение вспять аллодинии, индуцированной посредством DPNP, у крыс, которым вводили подкожно "ASO 9" или "ASO 10" 100 пмоль/кг, или только носитель (планка погрешности соответствует стандартной ошибке).
Фиг.16. Обращение вспять аллодинии, индуцированной SNL (лигирование L5/L6), у крыс SD, которым подкожно вводили "ASO 9" в дозе 0 (отрицательный контроль) или 100 пмоль/кг TID (3X в сутки).
Сущность изобретения
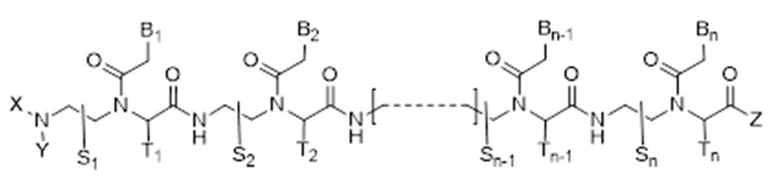
Настоящее изобретение относится производному пептидно-нуклеиновой кислоты, соответствующему формуле I, или к его фармацевтически приемлемой соли:
 Формула I
Формула I
где
n представляет собой целое число от 10 до 21;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо обозначают дейтеридо, гидридо, замещенный или незамещенный алкил, или замещенный или незамещенный арильный радикал;
X и Y независимо обозначают гидридо [H], формил [H-C(=O)-], аминокарбонил [NH2-C(=O)-], замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный арилоксикарбонил, замещенный или незамещенный алкиламинокарбонил, замещенный или незамещенный ариламинокарбонил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкил, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований с замещенным или незамещенным аминорадикалом, ковалентно связанным с частью, представляющей собой нуклеиновое основание.
Соединение формулы I индуцирует альтернативный сплайсинг пре-мРНК SCN9A человека, обеспечивает вариант(ы) сплайсинга мРНК SCN9A, лишенный "экзона 4", и является пригодным для лечения боли или состояний, вовлекающих активность Nav1.7.
Описание изобретения
Настоящее изобретение относится производному пептидно-нуклеиновой кислоты, соответствующему формуле I, или к его фармацевтически приемлемой соли:
 Формула I
Формула I
где
n представляет собой целое число от 10 до 21;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо обозначают дейтеридо, гидридо, замещенный или незамещенный алкил, или замещенный или незамещенный арил радикал;
X и Y независимо обозначают гидридо [H], формил [H-C(=O)-], аминокарбонил [NH2-C(=O)-], замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный арилоксикарбонил, замещенный или незамещенный алкиламинокарбонил, замещенный или незамещенный ариламинокарбонил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкил, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований с замещенным или незамещенным аминорадикалом, ковалентно связанным с частью, представляющей собой нуклеиновое основание.
Соединение формулы I индуцирует альтернативный сплайсинг пре-мРНК SCN9A человека, обеспечивает вариант(ы) сплайсинга мРНК SCN9A, лишенные "экзона 4", и является пригодным для лечения боли или состояний, вовлекающих активность Nav1.7.
В описании "n представляет собой целое число от 10 до 21" дословно означает, что n представляет собой целое число, которое может быть выбрано из группы целых чисел: 11, 12, 13, 14, 15, 16, 17, 18, 19 и 20.
Соединение формулы I прочно связывается с 5'-участком сплайсинга "экзона 4" пре-мРНК SCN9A человека, которая транскрибируется с гена SCN9A человека [эталонная последовательность NCBI: NC_000002.12]. 40-мерная последовательность пре-мРНК SCN9A, состоящая из 20-мера из "экзона 4" и 20-мера из "интрона 4", имеет последовательность [(5'  3') UUUGUCGUCAUUGUUUUUGC-GUAAGUACUUUCAGCUUUUU], хотя номер экзона и интрона может варьироваться в зависимости от транскриптов мРНК SCN9A. 40-мерная последовательность пре-мРНК предоставлена для однозначного соответствия 5'-области сплайсинга в пре-мРНК SCN9A человека, являющейся мишенью.
3') UUUGUCGUCAUUGUUUUUGC-GUAAGUACUUUCAGCUUUUU], хотя номер экзона и интрона может варьироваться в зависимости от транскриптов мРНК SCN9A. 40-мерная последовательность пре-мРНК предоставлена для однозначного соответствия 5'-области сплайсинга в пре-мРНК SCN9A человека, являющейся мишенью.
40-мерная последовательность пре-мРНК альтернативно может быть представлена как [(5'  3') UUUGUCGUCAUUGUUUUUGC│guaaguacuuucagcuuuuu], где последовательности экзона и интрона обозначаются "заглавными" и "маленькими" буквами, соответственно, и точка соединения между экзоном и интроном обозначена как "│". Таким образом, 14-мерная последовательность пре-мРНК [(5'
3') UUUGUCGUCAUUGUUUUUGC│guaaguacuuucagcuuuuu], где последовательности экзона и интрона обозначаются "заглавными" и "маленькими" буквами, соответственно, и точка соединения между экзоном и интроном обозначена как "│". Таким образом, 14-мерная последовательность пре-мРНК [(5'  3') UUUUUGCGUAAGUA], предназначенная для описания соединения формулы I по настоящему изобретению, альтернативно может быть обозначена как [(5'
3') UUUUUGCGUAAGUA], предназначенная для описания соединения формулы I по настоящему изобретению, альтернативно может быть обозначена как [(5'  3') UUUUUGC│guaagua].
3') UUUUUGC│guaagua].
Соединение формулы I прочно связывается с 5'-участком сплайсинга "экзона 4" в пре-мРНК SCN9A человека, являющимся мишенью, и препятствует образованию "раннего комплекса сплайсеосомы", вовлекающего экзон, являющийся мишенью соединения. Поскольку соединение по настоящему изобретению пространственно ингибирует образование "раннего комплекса сплайсеосомы", вовлекающего "экзон 4", "экзон 4" SCN9A вырезается посредством сплайсинга или удаляется с образованием варианта или вариантов сплайсинга мРНК SCN9A, лишенных "экзона 4". Следовательно, можно сказать, что соединение по настоящему изобретению индуцирует пропускание "экзона 4" SCN9A. Полученный вариант(ы) сплайсинга мРНК SCN9A кодирует белок(белки) Nav1.7, лишенный функциональной активности Nav1.7 (т.е. активности натриевых ионных каналов), которую проявляет полноразмерный белок Nav1.7.
Соединение формулы I прочно связывается с комплементарной ДНК, как проиллюстрировано в документе уровня техники [PCT/KR2009/001256]. Дуплекс между производным PNA формулы I и его полноразмерной комплементарной ДНК или РНК демонстрирует слишком высокую величину Tm, чтобы ее можно было достоверно определить в водном буфере. Буферный раствор имеет тенденцию к выкипанию в ходе определения Tm. Соединение PNA формулы I все еще имеет высокие величины Tm в случае более коротких комплементарных ДНК, например, 10-меров.
Благодаря высокой аффинности связывания, производное PNA по настоящему изобретению потенциально индуцирует пропускание "экзона 4" SCN9A в клетках даже в случае всего 11-мерного комлементарного перекрывания с 5'-участком сплайсинга "экзона 4".
Соединение формулы I обладает очень высокой аффинностью в отношении последовательности пре-мРНК SCN9A, являющейся мишенью, с полной комплементарностью. Даже в случае, если соединение формулы I имеет одно или два несоответствия оснований с последовательностью пре-мРНК SCN9A, являющейся мишенью, соединение PNA все еще может прочно связываться с последовательностью пре-мРНК, являющейся мишенью, и прерывать процесс сплайсинга, поскольку аффинность между соединением формулы I и последовательностью пре-мРНК SCN9A, являющейся мишенью, является достаточно высокой, несмотря на несоответствие(я) оснований. Например, 14-мерное производное PNA формулы I обладает только 12-мерным комплементарным перекрыванием с 14-мерной последовательностью пре-мРНК SCN9A [(5'  3') UUUUUGC│guaagua] по настоящему изобретению и индуцирует пропускание "экзона 4" SCN9A, несмотря на два несоответствия оснований с 14-мерной последовательностью. Тем не менее, нежелательно наличие слишком большого количества несоответствий оснований с последовательностью пре-мРНК, являющейся мишенью, во избежание перекрестной реактивности в отношении последовательностей пре-мРНК из другого гена(ов).
3') UUUUUGC│guaagua] по настоящему изобретению и индуцирует пропускание "экзона 4" SCN9A, несмотря на два несоответствия оснований с 14-мерной последовательностью. Тем не менее, нежелательно наличие слишком большого количества несоответствий оснований с последовательностью пре-мРНК, являющейся мишенью, во избежание перекрестной реактивности в отношении последовательностей пре-мРНК из другого гена(ов).
Химические структуры природных или неприродных нуклеиновых оснований в производном PNA формулы I проиллюстрированы на фиг.1(A)-(C). Природные (обычно называемые "встречающимися в природе") или неприродные (обычно называемые "не встречающимися в природе") нуклеиновые основания по настоящему изобретению включают, но не ограничиваются ими, нуклеиновые основания, представленные на фиг.1(A)-(C). Предоставление таких неприродных нуклеиновых оснований предназначено для иллюстрации разнообразия нуклеиновых оснований, допустимых для соединения формулы I, и, таким образом, его не следует интерпретировать как ограничение объема настоящего изобретения. Квалифицированный специалист в данной области может без труда установить, что возможны варианты неприродных нуклеиновых оснований для конкретных положений в соединении PNA формулы I при условии, что такие варианты удовлетворяют условиям комплементарности с последовательностью пре-мРНК, являющейся мишенью.
Заместители, предназначенные для описания производного PNA формулы I, проиллюстрированы на фиг.2(A)-(E). На фиг.2(A) представлены примеры замещенных или незамещенных алкильных радикалов. Замещенные или незамещенные алкилацильные и замещенные или незамещенные алкилациларилацильные радикалы проиллюстрированы на фиг.2(B). На фиг.2(C) проиллюстрированы примеры замещенных или незамещенных алкиламино, замещенных или незамещенных ариламино, замещенных или незамещенных арильных, замещенных или незамещенных алкилсульфонильных или арилсульфонильных, и замещенных или незамещенных алкилфосфонильных или арилфосфонильных радикалов. На фиг.2(D) представлены примеры замещенных или незамещенных алкилоксикарбонильных или арилоксикарбонильных, замещенных или незамещенных алкиламинокарбонильных или ариламинокарбонильных радикалов. на фиг.2(E) представлены примеры замещенных или незамещенных алкиламинотиокарбонильных, замещенных или незамещенных ариламинотиокарбонильных, замещенных или незамещенных алкилокситиокарбонильных, и замещенных или незамещенных арилокситиокарбонильных радикалов. Такие иллюстративные заместители предоставлены для иллюстрации разнообразия заместителей, допустимых для соединения формулы I, и, таким образом, их не следует интерпретировать как ограничение объема настоящего изобретения. Квалифицированной специалист в данной области может без труда понять, что олигонуклеотидная последовательность PNA является преобладающим фактором для последовательность-специфического связывания олигонуклеотида PNA с последовательностью пре-мРНК, являющейся мишенью, относительно заместителей на N-конце или C-конце.
Соединение PNA формулы I обладает высокой клеточной проницаемостью и может быть без труда доставлено в клетку при лечении "голым" олигонуклеотидом, как проиллюстрировано в документах уровня техники [PCT/KR2009/001256]. Таким образом, соединение по настоящему изобретению индуцирует пропускание "экзона 4" в пре-мРНК SCN9A с образованием варианта(ов) сплайсинга мРНК SCN9A, лишенного "экзона 4" SCN9A, в клетках, обработанных соединением формулы I в виде "голого" олигонуклеотида. Клетки, обработанные соединением формулы I в виде "голого олигонуклеотида", экспрессируют более низкий уровень полноразмерной мРНК SCN9A, и, таким образом, демонстрируют более низкую функциональную активность Nav1.7, чем клетки без обработки соединением.
Соединение формулы I не требует инвазивного состава для повышения системной доставки в ткани-мишени для предполагаемой терапевтической или биологической активности. Обычно соединение формулы I растворяют в PBS (фосфатно-солевой буфер) или солевом растворе и вводят системно для индукции требуемой терапевтической (т.е. болеутоляющей) или биологической активности в клетках-мишенях (в основном нейрональных клетках). Соединение по настоящему изобретению не должно иметь трудный или инвазивный состав для индукции системной терапевтической активности.
Соединение формулы I ингибирует экспрессию Nav1.7 в нейрональных клетках или тканях при системном введении в качестве "голого олигонуклеотида". Таким образом, соединение является пригодным для безопасного лечения боли или других нарушений, вовлекающих чрезмерную экспрессию Nav1.7.
Производное PNA формулы I может использоваться в качестве комбинации с фармацевтически приемлемой кислотой или основанием, включая, но не ограничиваясь ими, гидроксид натрия, гидроксид калия, хлористоводородную кислоту, метансульфоновую кислоту, лимонную кислоту, трифторуксусную кислоту и т.д.
Соединение PNA формулы I или его фармацевтически приемлемую соль можно вводить индивидууму в комбинации с фармацевтически приемлемым адъювантом, включая, но не ограничиваясь ими, лимонную кислоту, хлористоводородную кислоту, виннокаменную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, изопропанол, бикарбонат натрия, дистиллированную воду, консервант(ы) и т.д.
Соединение по настоящему изобретению можно системно вводить индивидууму в терапевтически или биологически эффективной дозе, составляющей 1 нмоль/кг или менее, которая может варьироваться в зависимости от схемы дозирования, состояния или ситуации индивидуума и т.д.
Предпочтительным является производное PNA формулы I, или его фармацевтически приемлемая соль:
где,
n представляет собой целое число от 10 до 21;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо обозначают радикал гидридо;
X и Y независимо обозначают гидридо [H], формил [H-C(=O)-], аминокарбонил [NH2-C(=O)-], замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный арилоксикарбонил, замещенный или незамещенный алкиламинокарбонил, замещенный или незамещенный ариламинокарбонил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкил, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере три из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV:
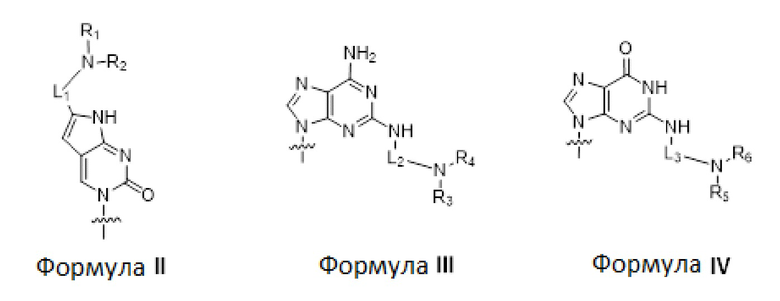
где
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо, и замещенного или незамещенного алкильного радикала; и
L1, L2 и L3 представляют собой ковалентный линкер, соответствующий формуле V, соединяющий основную аминогруппу с частью, представляющей нуклеиновое основание, ответственной за спаривание нуклеиновых оснований:
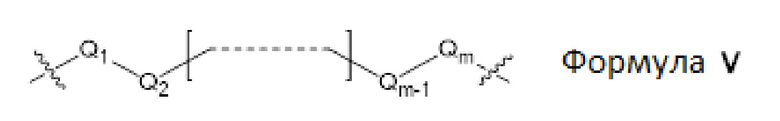
где,
Q1 и Qm представляют собой замещенный или незамещенный метиленовый (-CH2-) радикал, и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенного или незамещенного метилена, кислорода (-O-), серы (-S-), и замещенного или незамещенного аминорадикала [-N(H)- или -N(заместитель)-]; и
m представляет собой целое число от 1 до 16.
Представляет интерес олигомер PNA формулы I или его фармацевтически приемлемая соль:
где,
n представляет собой целое число от 12 до 20;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо обозначают гидридо [H], аминокарбонил [NH2-C(=O)-], замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкиламинокарбонил, или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает замещенный или незамещенный амино радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо и замещенного или незамещенного алкильного радикала;
Q1 и Qm представляют собой замещенный или незамещенный метиленовый радикал, и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенного или незамещенного метилена, кислорода и аминорадикала; и
m представляет собой целое число от 1 до 11.
Особый интерес представляет производное PNA формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число от 12 до 19;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо обозначают гидридо [H], замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, или замещенный или незамещенный алкиламинокарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо и замещенного или незамещенного алкильного радикала;
Q1 и Qm представляют собой метиленовый радикал, и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена, кислородного радикала; и,
m представляет собой целое число от 1 до 10.
Высокий интерес представляет олигомер PNA формулы I, или его фармацевтически приемлемая соль:
где
n представляет собой целое число от 12 до 18;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо обозначают гидридо [H], замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
R1, R3 и R5 представляют собой гидридорадикал, и R2, R4 и R6 независимо обозначают гидридо, или замещенный или незамещенный алкильный радикал;
Q1 и Qm представляют собой метиленовый радикал, и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена и кислородного радикала; и,
m представляет собой целое число от 1 до 10.
Более высокий интерес представляет производное PNA формулы I или фармацевтически его приемлемая соль:
где
n представляет собой целое число от 12 до 16;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо обозначают гидридо [H], замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой метиленовый радикал, и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена и кислородного радикала; и
m представляет собой целое число от 1 до 10.
Наиболее высокий интерес представляет производное PNA формулы I, или его фармацевтически приемлемая соль:
где
n представляет собой целое число от 12 до 16;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X представляет собой гидридорадикал;
Y обозначает замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
R1, R2, R3, R4, R5, и R6 представляют собой гидридорадикал;
L1 обозначает -(CH2)2-O-(CH2)2-, -CH2-O-(CH2)2-, -CH2-O-(CH2)3-, -CH2-O-(CH2)4- или -CH2-O-(CH2)5-, где правый конец прямо связан с основной аминогруппой; и
L2 и L3 независимо выбраны из -(CH2)2-O-(CH2)2-, -(CH2)3-O-(CH2)2-, -(CH2)2-O-(CH2)3-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7- и -(CH2)8-, причем правый конец прямо связан с основной аминогруппой.
Определенный интерес представляет производное PNA формулы I, которое выбрано из группы соединений, представленных ниже, или его фармацевтически приемлемая соль:
(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Piv-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Piv-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) FAM-HEX-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) FAM-HEX-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Ацетил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Ацетил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-Lys-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fethoc-Lys-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) H-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) H-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Me-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Me-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Бензил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Бензил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-Lys-NH2;
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-Lys-NH2;
(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2;
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2;
(N  C) Fethoc-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
C) Fethoc-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
(N  C) Fethoc-TA(6)C-GC(1O2)A-A(6)AA(6)-ACA(6)-A-NH2;
C) Fethoc-TA(6)C-GC(1O2)A-A(6)AA(6)-ACA(6)-A-NH2;
(N  C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2;
C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-Val-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-Val-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-Gly-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-Gly-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2;
(N  C) Piv-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
C) Piv-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
(N  C) Fethoc-Lys-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
C) Fethoc-Lys-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
(N  C) Piv-Leu-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Piv-Leu-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-A(5)GT-A(5)CT-TA(5)C-G(6)CA(5)-A-NH2;
C) Fethoc-A(5)GT-A(5)CT-TA(5)C-G(6)CA(5)-A-NH2;
(N  C) Fethoc-Lys-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
C) Fethoc-Lys-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
(N  C) Fethoc-Gly-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-Arg-NH2;
C) Fethoc-Gly-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-Arg-NH2;
(N  C) H-CTT-A(5)CG(3)- C(1O2)AA(5)-AA(5)A-C(1O3)AA(5)-NH2;
C) H-CTT-A(5)CG(3)- C(1O2)AA(5)-AA(5)A-C(1O3)AA(5)-NH2;
(N  C) Fethoc-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-NH2;
C) Fethoc-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-NH2;
(N  C) Fethoc-CTT-A(5)CG(6)-C(1O2)TA(5)-AA(5)T-C(1O2)AA(5)-NH2;
C) Fethoc-CTT-A(5)CG(6)-C(1O2)TA(5)-AA(5)T-C(1O2)AA(5)-NH2;
(N  C) бензоил-CTT-A(5)CG(2O2)-C(1O2)AA(5)-AA(5)A-C(1O5)AA(5)-NH2;
C) бензоил-CTT-A(5)CG(2O2)-C(1O2)AA(5)-AA(5)A-C(1O5)AA(5)-NH2;
(N  C) н-пропил-CTT-A(5)CG(2O3)-C(1O2)AA(3)-AA(5)A-C(2O2)AA(5)-NH2;
C) н-пропил-CTT-A(5)CG(2O3)-C(1O2)AA(3)-AA(5)A-C(2O2)AA(5)-NH2;
(N  C) п-толуолсульфонил-CTT-A(5)CG(6)-C(1O2)AA(8)-AA(5)A-C(1O2)AA(5)-NH2;
C) п-толуолсульфонил-CTT-A(5)CG(6)-C(1O2)AA(8)-AA(5)A-C(1O2)AA(5)-NH2;
(N  C) [N-(2-фенилэтил)амино]карбонил-CTT-A(5)CG(6)-C(1O2)AA(2O2)-AA(5)A-C(1O2)A A(5)-NH2;
C) [N-(2-фенилэтил)амино]карбонил-CTT-A(5)CG(6)-C(1O2)AA(2O2)-AA(5)A-C(1O2)A A(5)-NH2;
(N  C) Fethoc-Lys-Leu-CTT-A(5)CG(6)-C(1O2)AA(4)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
C) Fethoc-Lys-Leu-CTT-A(5)CG(6)-C(1O2)AA(4)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
(N  C) N-фенил-N-Me-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
C) N-фенил-N-Me-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
(N  C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-NH2; и,
C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-NH2; и,
(N  C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-Lys-NH2:
C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-Lys-NH2:
где
A, G, T и C представляют собой мономеры PNA с природным нуклеиновым основанием аденином, гуанином, тимином и цитозином, соответственно;
C(pOq), A(p), A(pOq), G(p) и G(pOq) представляют собой мономеры PNA с неприродным нуклеиновым основанием, соответствующим формуле VI, формуле VII, формуле VIII, формуле IX и формуле X, соответственно;
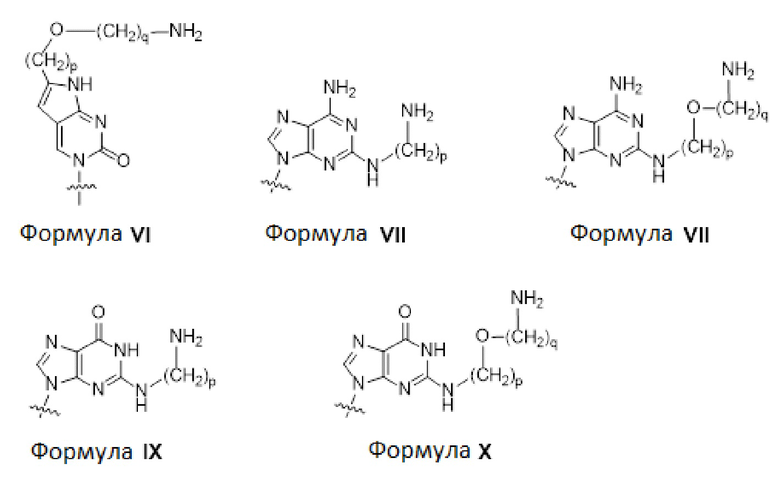
где
p и q представляют собой целые числа; и
сокращенные обозначения для N- и C-концевых заместителей, в частности, являются следующими: "Fmoc-" представляет собой сокращенное обозначение для "[(9-флуоренил)метилокси]карбонила-"; "Fethoc-" для "[2-(9-флуоренил)этил-1-окси]карбонила-"; "Ac-" для "ацетила-"; "бензоил-" для "бензолкарбонила-"; "Piv-" для "пивалила-"; "Me-" для "метила-"; "н-пропил-" для "1-(н-пропила)-"; "H-" для группы "гидридо-"; "п-толуолсульфонил" для "(4-метилбензол)-1-сульфонила-"; "-Lys-" для аминокислотного остатка "лизин"; "-Val-" для аминокислотного остатка "валин"; "-Leu-" для аминокислотного остатка "лейцин"; "-Arg-" для аминокислотного остатка "аргинин"; "-Gly-" для аминокислотного остатка "глицин"; "[N-(2-фенилэтил)амино]карбонил-" для "[N-1-(2-фенилэтил)амино]карбонила-"; "бензил-" для "1-(фенил)метила-"; "фенил-" для "фенила-"; "Me-" для "метила-"; "-HEX-" для "6-амино-1-гексаноила-", "FAM-" для "5 или 6-флуоресцеинкарбонила- (изомерная смесь)" и "-NH2" для незамещенной "-аминогруппы".
На фиг.3 в совокупности представлены химические структуры для мономеров PNA, сокращенно обозначаемых как A, G, T, C, C(pOq), A(p), A(pOq), G(p) и G(pOq). Как рассмотрено в документе уровня техники [PCT/KR2009/001256], C(pOq) считается модифицированным мономером PNA, соответствующим "цитозину" вследствие его предпочтительной гибридизации с "гуанином". A(p) и A(pOq) считаются модифицированными мономерами PNA, выступающими в качестве "аденина" вследствие их высокой аффинности в отношении "тимина". Аналогично, G(p) и G(pOq) считаются модифицированными мономерами PNA, эквивалентными "гуанину", вследствие их продуктивного спаривания оснований с "цитозином".
На фиг.4 недвусмысленно проиллюстрированы химические структуры для различных сокращенных обозначений заместителей, используемых для диверсификации N-конца или C-конца производного PNA формулы I по настоящему изобретению.
Для иллюстрации сокращенных обозначений для производных PNA по настоящему изобретению химическая структура 14-мерного производного PNA, сокращенно обозначаемая как "(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2", представлена на фиг.5(A). 14-мерная последовательность PNA эквивалентна последовательности ДНК "(5'
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2", представлена на фиг.5(A). 14-мерная последовательность PNA эквивалентна последовательности ДНК "(5'  3') TAA-ATA-CGC-AAA-AA" для комплементарного связывания с пре-мРНК SCN9A. 14-мер PNA имеет 12-мерное комплементарное перекрывание в 20-мерной последовательности [(5'
3') TAA-ATA-CGC-AAA-AA" для комплементарного связывания с пре-мРНК SCN9A. 14-мер PNA имеет 12-мерное комплементарное перекрывание в 20-мерной последовательности [(5'  3') UUGUUUUUGC│guaaguacuu], охватывающей 5'-участок сплайсинга, вовлекающий "экзон 4" в пре-мРНК SCN9A человека, причем комплементарные пары оснований обозначены "полужирным" шрифтом и "подчеркнуты", как в [(5'
3') UUGUUUUUGC│guaaguacuu], охватывающей 5'-участок сплайсинга, вовлекающий "экзон 4" в пре-мРНК SCN9A человека, причем комплементарные пары оснований обозначены "полужирным" шрифтом и "подчеркнуты", как в [(5'  3') UUGUUUUUGC│gua"ag"uacuu], а два несоответствия оснований в "интроне 4" обозначены кавычками (" "). Несмотря на два несоответствия оснований в "интроне 5", 14-мерная PNA удовлетворяет критерию комплементарного перекрывания для соединения формулы I по настоящему изобретению, т.е. критериям, описанным ниже:
3') UUGUUUUUGC│gua"ag"uacuu], а два несоответствия оснований в "интроне 4" обозначены кавычками (" "). Несмотря на два несоответствия оснований в "интроне 5", 14-мерная PNA удовлетворяет критерию комплементарного перекрывания для соединения формулы I по настоящему изобретению, т.е. критериям, описанным ниже:
"соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека, и соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований".
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека, и соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований".
В качестве другой иллюстрации химическая структура 16-мерного производного PNA, сокращенно обозначаемого как "(N  C) Fethoc-AG(5)C-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2", представлена на фиг.5(B). 16-мерная последовательность PNA эквивалентна последовательности ДНК "(5'
C) Fethoc-AG(5)C-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2", представлена на фиг.5(B). 16-мерная последовательность PNA эквивалентна последовательности ДНК "(5'  3') AGC-ACT-TAC-GCA-AAA-A" для комплементарного связывания с пре-мРНК SCN9A. 16-мерная PNA имеет 15-мерное комплементарное перекрывание с 20-мерной последовательностью пре-мРНК [(5'
3') AGC-ACT-TAC-GCA-AAA-A" для комплементарного связывания с пре-мРНК SCN9A. 16-мерная PNA имеет 15-мерное комплементарное перекрывание с 20-мерной последовательностью пре-мРНК [(5'  3') UUGUUUUUGC│guaaguacuu] в пре-мРНК SCN9A человека, причем комплементарные пары оснований обозначены "полужирным" шрифтом и "подчеркиванием" в [(5'
3') UUGUUUUUGC│guaaguacuu] в пре-мРНК SCN9A человека, причем комплементарные пары оснований обозначены "полужирным" шрифтом и "подчеркиванием" в [(5'  3') UUGUUUUUGC│guaagu"a"cuu], а одно несоответствие оснований в "интроне 4" обозначено кавычками (" "). Эта 16-мерная PNA удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению, несмотря на одно несоответствие оснований в "интроне 5".
3') UUGUUUUUGC│guaagu"a"cuu], а одно несоответствие оснований в "интроне 4" обозначено кавычками (" "). Эта 16-мерная PNA удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению, несмотря на одно несоответствие оснований в "интроне 5".
16-мерная последовательность PNA "(N  C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2" эквивалентна последовательности ДНК "(5'
C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2" эквивалентна последовательности ДНК "(5'  3') ACT-TAC-GCA-AAA-ACA-A" для комплементарного связывания с пре-мРНК SCN9A. Эта 16-мерная PNA обладает полностью (т.е. 16-мерным) комплементарным связыванием с 20-мерной последовательностью пре-мРНК SCN9A [(5'
3') ACT-TAC-GCA-AAA-ACA-A" для комплементарного связывания с пре-мРНК SCN9A. Эта 16-мерная PNA обладает полностью (т.е. 16-мерным) комплементарным связыванием с 20-мерной последовательностью пре-мРНК SCN9A [(5'  3') UUGUUUUUGC│guaaguacuu], причем комплементарные пары оснований обозначаются "полужирным шрифтом" и "подчеркиванием" в [(5'
3') UUGUUUUUGC│guaaguacuu], причем комплементарные пары оснований обозначаются "полужирным шрифтом" и "подчеркиванием" в [(5'  3') UUGUUUUUGC│guaaguacuu]. Эта 16-мерная PNA удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
3') UUGUUUUUGC│guaaguacuu]. Эта 16-мерная PNA удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
17-мерная последовательность PNA "(N  C) Fethoc-TG(6)T-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2" эквивалентна последовательности ДНК "(5'
C) Fethoc-TG(6)T-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2" эквивалентна последовательности ДНК "(5'  3') TGT-TAA-ATA-CGC-AAA-AA" для комплементарного связывания с пре-мРНК SCN9A. Эта 17-мерная PNA имеет 12-мерное комплементарное перекрывание с 20-мерной последовательностью пре-мРНК SCN9A [(5'
3') TGT-TAA-ATA-CGC-AAA-AA" для комплементарного связывания с пре-мРНК SCN9A. Эта 17-мерная PNA имеет 12-мерное комплементарное перекрывание с 20-мерной последовательностью пре-мРНК SCN9A [(5'  3') UUGUUUUUGC│guaaguacuu], причем комплементарные пары оснований обозначаются "полужирным шрифтом" и "подчеркиванием" в [(5'
3') UUGUUUUUGC│guaaguacuu], причем комплементарные пары оснований обозначаются "полужирным шрифтом" и "подчеркиванием" в [(5'  3') UUGUUUUUGC│gua"ag"ua"cuu"], а пять несоответствий оснований в "интроне 4" обозначаются кавычками (" "). Эта 17-мерная PNA не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению вследствие пяти несоответствий оснований в "интроне 5", даже несмотря на то, что эта 17-мерная PNA обладает 12-мерным комплементарным перекрыванием, подобно вышеупомянутой 14-мерной PNA. Наличие слишком большого количества несоответствий оснований на протяжении длины олигомера, как в случае этой 17-мерной PNA, потенциально может индуцировать перекрестную реактивность с пре-мРНК(несколькими пре-мРНК), отличной от пре-мРНК SCN9A, и, таким образом, его необходимо избегать из соображений безопасности.
3') UUGUUUUUGC│gua"ag"ua"cuu"], а пять несоответствий оснований в "интроне 4" обозначаются кавычками (" "). Эта 17-мерная PNA не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению вследствие пяти несоответствий оснований в "интроне 5", даже несмотря на то, что эта 17-мерная PNA обладает 12-мерным комплементарным перекрыванием, подобно вышеупомянутой 14-мерной PNA. Наличие слишком большого количества несоответствий оснований на протяжении длины олигомера, как в случае этой 17-мерной PNA, потенциально может индуцировать перекрестную реактивность с пре-мРНК(несколькими пре-мРНК), отличной от пре-мРНК SCN9A, и, таким образом, его необходимо избегать из соображений безопасности.
Подробное описание изобретения
Общие методики получения олигомеров PNA
Олигомеры PNA синтезировали твердофазным синтезом пептидов (SPPS) на основе химии Fmoc в соответствии со способом, описанным в документах уровня техники [US6133444; WO96/40685] с незначительными, однако необходимыми модификациями. Твердая подложка, использованная в этом исследовании, представляла собой H-Rink Amide-ChemMatrix, приобретенную от PCAS BioMatrix Inc. (Quebec, Канада). Мономеры Fmoc-PNA с модифицированным нуклеиновым основанием синтезировали, как описано в документе уровня техники [PCT/KR 2009/001256] или с незначительными модификациями. Такие мономеры Fmoc-PNA с модифицированным нуклеиновым основанием и мономеры Fmoc-PNA с природным нуклеиновым основанием использовали для синтеза производных PNA по настоящему изобретению. Олигомеры PNA очищали посредством C18-обращено-фазовой ВЭЖХ (вода/ацетонитрил или вода/метанол с 0,1% TFA), и их охарактеризовывали масс-спектрометрией, включая ESI/TOF/MS.
На схеме 1 проиллюстрирован типичный цикл удлинения мономеров, использованный в SPPS по настоящему изобретению, и детали синтеза представлены ниже. Однако специалист в данной области, очевидно, может осуществить множество незначительных изменений для эффективного проведения таких реакций SPPS на автоматическом устройстве для синтеза пептидов или ручном устройстве для синтеза пептидов. Каждая стадия реакции на схеме 1 вкратце осуществляется следующим образом.
Схема 1
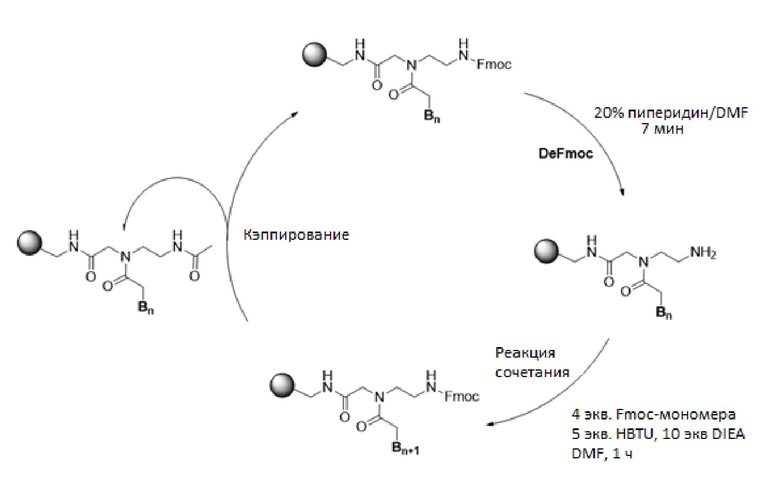
[Активация смолы H-Rink-ChemMatrix] 0,01 ммоль (приблизительно 20 мг смолы) смолы ChemMatrix в 1,5 мл 20% пиперидина/DMF встряхивали в пробирке Libra tube в течение 20 мин, и раствор DeFmoc отфильтровывали. Смолу последовательно промывали в течение 30 с каждый раз 1,5 мл метиленхлорида (MC), 1,5 мл диметилформамида (DMF), 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC. Полученные свободные амины на твердой подложке подвергали реакции сочетания либо с мономером Fmoc-PNA, либо с Fmoc-защищенным производным аминокислоты.
[DeFmoc] Смолу встряхивали в 1,5 мл смеси 20% пиперидин/DMF в течение 7 мин, и раствор DeFmoc отфильтровывали. Смолу последовательно промывали в течение 30 с каждый раз 1,5 мл MC, 1,5 мл DMF, 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC. Полученные свободные амины на твердой подложке сразу подвергали реакции сочетания с мономером Fmoc-PNA.
[Реакция сочетания с мономером Fmoc-PNA] Свободные амины на твердой подложке подвергали реакции сочетания с мономером Fmoc-PNA следующим образом. 0,04 ммоль мономера PNA, 0,05 ммоль HBTU и 10 ммоль DIEA инкубировали в течение 2 мин в 1 мл безводного DMF, и добавляли к смоле со свободными аминами. Раствор смолы встряхивали в течение 1 часа и реакционную среду отфильтровывали. Затем смолу последовательно промывали в течение 30 с в каждом случае 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC. Химические структуры мономеров Fmoc-PNA с модифицированным нуклеиновым основанием, использованным в рамках настоящего изобретения, представлены на фиг.6. Мономеры Fmoc-PNA с модифицированным нуклеиновым основанием, представленные на фиг.6, должны рассматриваться как примеры, и, таким образом, их не следуют считать ограничивающими объем настоящего изобретения. Квалифицированный специалист в данной области может без труда установить ряд вариантов мономеров Fmoc-PNA для синтеза производного PNA формулы I.
[Кэппирование] После реакции сочетания не вступившие в реакцию свободные амины кэппировали встряхиванием в течение 5 мин в 1,5 мл раствора для кэппирования (5% уксусный ангидрид и 6% 2,6-леутидин в DMF). Затем раствор для кэппирования отфильтровывали и последовательно промывали в течение 30 с каждый раз 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC.
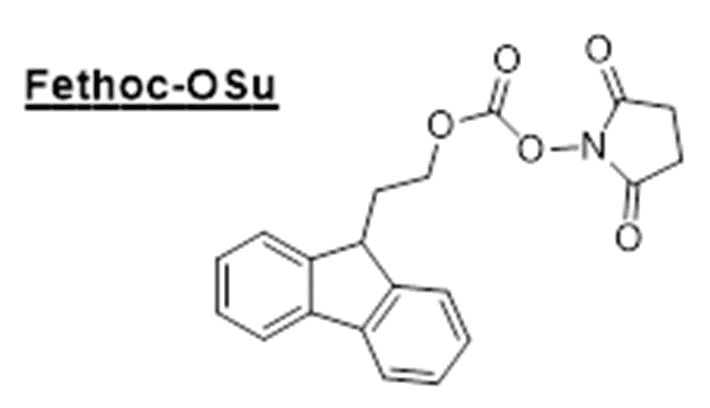
[Внесение радикала "Fethoc-" на N-конец]. Радикал "Fethoc-" вносили на N-конец посредством реакции свободного амина на смоле с "Fethoc-OSu" в основных реакциях сочетания. Химическая структура "Fethoc-OSu" [CAS № 179337-69-0, C20H17NO5, ММ 351,36] представлена ниже.
[Отщепление от смолы] Олигомеры PNA, связанные со смолой, отщепляли от смолы встряхиванием в течение 3 часов в 1,5 мл раствора для расщепления (2,5% три-изопропилсилан и 2,5% вода в трифторуксусной кислоте). Смолу отфильтровывали и фильтрат концентрировали при пониженном давлении. Полученный остаток растирали с диэтиловым эфиром и полученный преципитат собирали фильтрацией для очистки обращено-фазовой ВЭЖХ.
[Анализ и очистка посредством ВЭЖХ] После отщепления от смолы неочищенный продукт производного PNA очищали C18-обращено-фазовой ВЭЖХ с элюированием смесью вода/ацетонитрил или вода/метанол (градиентный способ), содержавшей 0,1% TFA. На фиг.7(A) и 7(B) представлены иллюстративные хроматограммы ВЭЖХ для "ASO 4" до и после очистки посредством ВЭЖХ, соответственно. Последовательность олигомера "ASO 4" является такой, как представлена в таблице 1.
Примеры синтеза производных PNA формулы I
Производные PNA по настоящему изобретению получали способами синтеза, представленными выше или с незначительными модификациями. В таблице 1 представлены примеры ASO против SCN9A, нацеленных на 5'-участок сплайсинга "экзона 4" SCN9A человека, а также данные структурной охарактеризации посредством масс-спектрометрии. ASO против SCN9A как в таблице 1 представлены для иллюстрации производного PNA формулы I, и их не следует истолковывать как ограничивающие объем настоящего изобретения.
Таблица 1. ASO против SCN9A, нацеленные на 5'-участок сплайсинга "экзона 4" в пре-мРНК SCN9A человека, а также данные структурной охарактеризации посредством масс-спектрометрии.
 C)
C)
a) теоретическая точная масса, b) наблюдаемая точная масса
На фиг.7(A) представлена хроматограмма ВЭЖХ, полученная для неочищенного продукта "ASO 4". Неочищенный продукт очищали C18-обращено-фазовой (RP) препаративной ВЭЖХ. На фиг.7(B) представлена хроматограмма ВЭЖХ для очищенного продукта "ASO 4". Чистота "ASO 4" значительно повышалась после очистки посредством препаративной ВЭЖХ. На фиг.8 представлен спектр масс ESI-TOF, полученный для очищенного продукта "ASO 4". Данные анализа для "ASO 4" представлены для иллюстрации того, как очищали и идентифицировали производные PNA формулы I по настоящему изобретению, и их не следует интерпретировать как ограничивающие объема настоящего изобретения.
Аффинность связывания с 10-мерной комплементарной ДНК
Производные PNA, приведенные в таблице 1, оценивали в отношении их аффинности связывания комплементарно с 10-мерными ДНК, нацеленными либо на N-конец, либо на C-конец. Аффинность связывания оценивали посредством величины Tm для дуплекса между PNA и 10-мерной комплементарной ДНК. Дуплекс между производными PNA, приведенными в таблице 1, и полностью комлементарными ДНК демонстрирует значения Tm, которые являются слишком высокими, чтобы их можно было достоверно определить в водном буферном растворе, поскольку буферный раствор имеет тенденцию к выкипанию в ходе измерения Tm.
Значения Tm определяли на спектрофотометре УФ/видимой области следующим образом. Смешанный раствор 4 мкМ олигомера PNA и 4 мкМ комплементарной 10-мерной ДНК в 4 мл водного буфера (pH 7,16, 10 мМ фосфат натрия, 100 мМ NaCl) в 15-мл полипропиленовой пробирке Falcon инкубировали при 90°C в течение минуты и медленно охлаждали до температуры окружающей среды. Затем раствор переносили в 3-мл кварцевую УФ-кювету, оборудованную воздухонепроницаемой крышкой, и проводили измерение Tm при 260 нм на спектрофотометре УФ/видимой области, как описано в документе уровня техники [PCT/KR2009/001256] или с незначительными модификациями. 10-мерные комплементарные ДНК для измерения Tm приобретали от Bioneer (www.bioneer.com, Dajeon, Republic of Korea) и использовали без дальнейшей очистки.
Наблюдаемые величины Tm для производных PNA формулы I являются очень высокими для комплементарного связывания с 10-мерной ДНК, и они представлены в таблице 2. Например, "ASO 10" продемонстрировал величину Tm 74,0°С для дуплекса с 10-мерной комплементарной ДНК, нацеленной на N-концевой 10-мер в PNA, обозначенный "полужирным шрифтом" и "подчеркиванием" в [(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2]. Между тем, "ASO 10" продемонстрировал Tm 68,6°С в отношении дуплекса с 10-мерной комплементарной ДНК, нацеленной на C-концевой 10-мер в PNA, обозначенный "полужирным шрифтом" и "подчеркиванием" в [(N
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2]. Между тем, "ASO 10" продемонстрировал Tm 68,6°С в отношении дуплекса с 10-мерной комплементарной ДНК, нацеленной на C-концевой 10-мер в PNA, обозначенный "полужирным шрифтом" и "подчеркиванием" в [(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2].
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2].
Таблица 2. Значения Tm между PNA в таблице и 10-мерной комплементарной ДНК, нацеленной либо на N-конец, либо на C-конец PNA.
Примеры видов биологической активности производных PNA формулы I
Производные PNA формулы I оценивали в отношении их видов биологической активности in vitro и in vivo. Биологические примеры, приведенные ниже, предоставлены в качестве примеров для иллюстрации биологических профилей таких производных PNA формулы I, и, таким образом, их не следует интерпретировать как ограничивающие объем настоящего изобретения.
Пример 1. Пропускание экзонов, индуцированное "ASO 9" в клетках PC3
"ASO 9" комплементарно связывается с 16-мерной последовательностью пре-мРНК, обозначаемой "полужирным шрифтом" и "подчеркиванием" в 30-мерной последовательности [(5'  3') CGUCAUUGUUUUUGC│guaaguacuuucagc], охватывающей точку соединений "экзона 4" и "интрон 4" в пре-мРНК SCN9A человека. "ASO 9" обладает 10-мерным перекрыванием с "экзоном 4" и 6-мерным перекрыванием с "интроном 4". Таким образом "ASO 9" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
3') CGUCAUUGUUUUUGC│guaaguacuuucagc], охватывающей точку соединений "экзона 4" и "интрон 4" в пре-мРНК SCN9A человека. "ASO 9" обладает 10-мерным перекрыванием с "экзоном 4" и 6-мерным перекрыванием с "интроном 4". Таким образом "ASO 9" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
Учитывая, что известно, что клетки PC3 в большом количестве экспрессируют мРНК SCN9A человека [Br. J. Pharmacol. vol 156, 420-431 (2009)], "ASO 9" оценивали посредством гнездовой ОТ-ПЦР для SCN9A в отношении его способности индуцировать пропускание "экзона 4" пре-мРНК SCN9A человека в клетках PC3, как описано ниже.
[Культивирование клеток и обработка ASO] Клетки PC3 (каталожный номер № CRL-1435, ATCC) выращивали в 60-мм чашке для культивирования, содержавшей 5 мл среды Хэма F-12K, дополненной 10% FBS, 1% стрептомицином/пенициллином, 1% L-глутамином и 1% пируватом натрия, в атмосфере с 5% CO2 при 37°С. Затем клетки обрабатывали "ASO 9" в концентрации 0 (отрицательный контроль), 10, 100 или 1000 зМ в течение 18 часов, а затем проводили дополнительную обработку посредством 100 мкг/мл циклогексамида в течение других 6 часов для остановки трансляции в рибосомах.
[Экстракция РНК] Тотальную РНК экстрагировали из клеток с использованием ʺуниверсального набора для экстракции РНКʺ (каталожный номер 9767, Takara) в соответствии с инструкциями изготовителя.
[Синтез кДНК посредством одностадийной ОТ-ПЦР] 200 нг РНК-матрицы использовали в реакции обратной транскрипции в объеме 25 мкл с использованием набора Super Script® One-Step RT-PCR с Taq-полимеразой Platinum® (каталожный номер 10928-042, Invitrogen) и набором ген-специфических праймеров [exon 2_forward: (5'  3') CTTTCTCCTTTCAGTCCTCT и exon 9_reverse: (5'
3') CTTTCTCCTTTCAGTCCTCT и exon 9_reverse: (5'  3') CGTCT-GTTGGTAAAGGTTTT] в соответствии со следующими условиями цикла: 50°С в течение 30 мин и 94°С в течение 2 мин, а затем 40 циклов по 30 с при 94°С, 30 с при 55°С и 2 мин при 72°С.
3') CGTCT-GTTGGTAAAGGTTTT] в соответствии со следующими условиями цикла: 50°С в течение 30 мин и 94°С в течение 2 мин, а затем 40 циклов по 30 с при 94°С, 30 с при 55°С и 2 мин при 72°С.
[Амплификация посредством гнездовой ПЦР] 1 мкл раствора кДНК (разбавленного в 100 раз) подвергали амплификации с помощью гнездовой ПЦР (каталожный номер № K2612, Bioneer) в объеме 20 мкл с набором праймеров [exon 3n_forward: (5'  3') GGACCAAAAATGTCGAGTATTT, и exon 8_reverse: (5'
3') GGACCAAAAATGTCGAGTATTT, и exon 8_reverse: (5'  3') GCTAAGAAGGCCCAGCTGAA], которые были сконструированы для определения пропускания "экзона 4". Использованные условия цикла представляли собой: 95°С в течение 5 мин, а затем 35 циклов по 30 с при 95°С, 30 с при 50°С и 1 мин при 72°С. Последовательность "exon 3n_forward" нацелена на точку соединения "экзона 3" и "экзона 5" для определения делеции "экзона 4".
3') GCTAAGAAGGCCCAGCTGAA], которые были сконструированы для определения пропускания "экзона 4". Использованные условия цикла представляли собой: 95°С в течение 5 мин, а затем 35 циклов по 30 с при 95°С, 30 с при 50°С и 1 мин при 72°С. Последовательность "exon 3n_forward" нацелена на точку соединения "экзона 3" и "экзона 5" для определения делеции "экзона 4".
[Идентификация продуктов пропускания экзонов] Продукты ПЦР подвергали электрофоретическому разделению на 2% агарозном геле. Полосы заданного размера извлекали и анализировали секвенированием по методу Сэнгера. Как можно видеть, пропускание "экзона 4" было значительным в клетках PC3, обработанных 1 аM "ASO 9", хотя пропускание "экзона 4" также было заметным при 10 и 100 зМ [см. фиг.9(A)]. Полоса пропускания "экзона 4" была однозначно подтверждена секвенированием по методу Сэнгера, как представлено на фиг.9(B).
Пример 2. кПЦР для мРНК против SCN9A в клетках PC3, обработанных "ASO 9".
"ASO 9" оценивали в отношении его способности индуцировать изменения уровня экспрессии мРНК SCN9A человека в клетках PC3 посредством кПЦР с набором экзон-специфических праймеров, охватывающих "экзоны 4-6", следующим образом.
[Культивирование клеток и обработка ASO] Клетки PC3, выращенные в 60-мм чашке для культивирования, содержавшей 5 мл среды Хэма F-12K, инкубировали с "ASO 9" в концентрации 0 (отрицательный контроль), 10, 100 или 1000 зМ в течение 24 часов (2 культуральных чашки на концентрацию ASO).
[Экстракция РНК] Тотальную РНК экстрагировали с использованием набора "MiniBEST Universal РНК Extraction Kit" (каталожный номер 9767, Takara) в соответствии с инструкциями изготовителя.
[Синтез кДНК посредством одностадийной ОТ-ПЦР] 200 нг РНК-матрицы использовали в реакции обратной транскрипции в объеме 25 мкл с использованием набора Super Script® One-Step RT-PCR с Taq-полимеразой Platinum® (каталожный номер 10928-042, Invitrogen) и набором ген-специфических праймеров [(5'  3') CTTTCTCCTTTCAGTCCTCT; и exon 9_reverse: (5'
3') CTTTCTCCTTTCAGTCCTCT; и exon 9_reverse: (5'  3') TTGCCTGGTTCTGTTCTT] в соответствии со следующими условиями цикла: 50°С в течение 30 мин и 94°С в течение 2 мин, а затем 15 циклов по 15 с при 94°С, 30 с при 55°С и 2 мин при 72°С.
3') TTGCCTGGTTCTGTTCTT] в соответствии со следующими условиями цикла: 50°С в течение 30 мин и 94°С в течение 2 мин, а затем 15 циклов по 15 с при 94°С, 30 с при 55°С и 2 мин при 72°С.
[Амплификация посредством гнездовой ПЦР] Растворы кДНК разбавляли в 50 раз. 1 мкл раствора кДНК подвергали реакции ПЦР в реальном времени в объеме 20 мкл со следующим набором экзон-специфических праймеров [exon 4_forward: (5'  3') GTACACTTT-TACTGGAATATATAC; exon 4_reverse: (5'
3') GTACACTTT-TACTGGAATATATAC; exon 4_reverse: (5'  3') AATGACGACAAAATCCAGC; exon 5_forward: (5'
3') AATGACGACAAAATCCAGC; exon 5_forward: (5'  3') GTATTTAACAGAATTTGTAAACCT; exon 5_reverse: (5'
3') GTATTTAACAGAATTTGTAAACCT; exon 5_reverse: (5'  3') CTG-GGATTACAGAAATAGTTTTCA; exon 6_forward: (5'
3') CTG-GGATTACAGAAATAGTTTTCA; exon 6_forward: (5'  3') GAAGACAATTGTAGGGGC; exon 6_reverse: (5'
3') GAAGACAATTGTAGGGGC; exon 6_reverse: (5'  3') GTCTTCTTCACTCTCTAGGG]. Реакции ПЦР проводили с использованием зонда SYBR Green (Takara, Япония) со следующими условиями цикла: 95°С в течение 30 с, а затем 40 циклов по 5 с при 95°С и 30 с при 60°С.
3') GTCTTCTTCACTCTCTAGGG]. Реакции ПЦР проводили с использованием зонда SYBR Green (Takara, Япония) со следующими условиями цикла: 95°С в течение 30 с, а затем 40 циклов по 5 с при 95°С и 30 с при 60°С.
[Результаты кПЦР] Уровень каждого экзона в клетках, обработанных ASO, приводили к уровню экзона в отрицательных контрольных клетках (т.е. без обработки ASO). На фиг.10(A) обобщенно представлены результаты кПЦР. Уровни экспрессии "экзонов 4-6" значительно снижались, приблизительно на 70%, 40% и 20~30% при концентрациях 10, 100 и 1000 зМ, соответственно. Профиль ответа на дозу может быть артефактом, возможно вследствие "экзон-интронной кольцевой РНК (EIciRNA)", накопившейся при пропускании экзона с помощью "ASO 9" [Nature Struc. Mol. Biol. vol 22(3), 256-264 (2015)].
Пример 3. Ингибирование тока натрия в клетках PC3, обработанных "ASO 9".
Ток натрия в клетках обычно измеряют с помощью метода фиксации потенциала. Когда ионы натрия входят в клетку, внутриклеточный уровень натрия возрастает. Внутриклеточный уровень натрия может быть определен с использованием красителя, чувствительного к ионам натрия. "CoroNa Green" представляет собой краситель с хелатором ионов натрия типа краун-эфира. При хелатировании иона натрия "CoroNa Green" испускает зеленую флуоресценцию. "CoroNa Green" используют для непрямого определения внутриклеточного уровня натрия. Было обнаружено, что уровень натрия, измеренный с помощью "CoroNa Green", хорошо коррелирует с током ионов натрия, определенным с помощью фиксации потенциала для ионов натрия [Proc. Natl. Acad. Sci. USA vol 106(38), 16145-16150 (2009)].
Известно, что клетки PC3 в большом количестве экспрессируют мРНК SCN9A человека, а также имеют высокий ток натрия, хотя аналогичным образом одновременно экспрессируются другие подтипы SCN [Br. J. Pharmacol. vol 156, 420-431 (2009)]. Таким образом, подавление (функционально активной) мРНК SCN9A может приводить к значительному снижению тока ионов натрия в клетках PC3, если ток ионов натрия, опосредуемый подтипом Nav1.7 натриевых каналов, составляет значительную часть общего тока натрия в клетках PC3. Следует отметить, что мРНК SCN9A кодирует подтип Nav1.7 натриевых каналов.
"ASO 9" оценивали в отношении его способности подавлять ток ионов натрия в клетках PC3 с использованием "CoroNa Green", как кратко описано ниже.
[Клеточная культура и обработка ASO] Клетки PC3 выращивали в 2 мл среды F-12K в 35-мм культуральной чашке и обрабатывали "ASO 9" в концентрации 0 зМ (отрицательный контроль), 100 зМ или 1 aM.
[Анализ CoroNa] Через 30 часов клетки промывали 2 мл HBSS (сбалансированный солевой раствор Хэнка, каталожный номер 14025-092, Life Technologies), а затем добавляли 2 мл свежего HBSS. Затем клетки обрабатывали 5 мкМ "CoroNa Green" (каталожный номер C36676, Life Technologies) при 37°С. Через 30 мин клетки промывали 2 раза 2 мл HBSS и добавляли 2 мл свежего HBSS. Культуральную чашку помещали под флуоресцентный микроскоп Olympus, оборудованный цифровой видеокамерой для непрерывного получения изображений зеленой флуоресценции клеток. Клетки кратковременно обрабатывали 100 мМ NaCl, а затем проводили цифровую регистрацию изменений изображений флуоресценции клеток в течение 3 мин. Было приблизительно 4 клетки на рамку. Интенсивность флуоресценции каждой индивидуальной клетки отслеживали с разрешением в одну секунду. Кривые интенсивности внутриклеточной флуоресценции отдельных клеток накладывали друг на друга и усредняли в каждый момент времени. Среднее значение для кривых индивидуальных клеток при каждой концентрации ASO наносили на график, как представлено на фиг.10(B), с использованием программы ImageJ (версии 1.50i, NIH). Кривая средней интенсивности флуоресценции была взята в качестве кривой индивидуальной внутриклеточной концентрации натрия для клеток, обработанных "ASO 9" в концентрации 0 (отрицательный контроль), 100 или 1000 зМ.
[Результаты анализа CoroNa] Наблюдаемые кривые внутриклеточной интенсивности флуоресценции обобщенно представлены на фиг.10(B). Кривые интенсивности флуоресценции для клеток, обработанных 1000 зМ "ASO 9", проходят ниже, чем кривые для клеток без обработки ASO. Среднюю интенсивность флуоресценции через 100 с сравнивали для оценки изменения тока натрия, индуцированного обработкой ASO. Средняя интенсивность флуоресценции клеток без обработки ASO составляла 81,86 (произвольные единицы) через 100 с. Между тем, средняя интенсивность флуоресценции клеток, обработанных 1000 зМ "ASO 9", составила 51,47 (произвольные единицы) через 100 с. Таким образом, инкубация в течение 30 часов с 1000 зМ "ASO 9" индуцировала значительное уменьшение активности натриевых каналов, составившее 37% (значение p=0,035 в соответствии с t-критерием Стьюдента) в клетках PC3. Учитывая, что клетки PC3 экспрессируют различные подтипы потенциалзависимых ионных каналов (VGSC), снижение на 37% можно считать значительным для ингибирования экспрессии Nav1.7 на "ASO 9". В клетках PC3, обработанных 100 зМ "ASO 9", отсутствовало значительное снижение тока натрия.
Пример 4. Оценка посредством кПЦР мРНК SCN9A в клетках PC3, обработанных "ASO 4".
"ASO 4" представляет собой 14-мерный ASO против SCN9A, изначально сконструированный для комплементарного нацеливания на 14-мерную последовательность, охватывающую точку соединения "экзона 4" и "экзона 5" в мРНК SCN9A человека. Однако оказалось, что "ASO 4" комплементарно перекрывается с 12-мерной последовательностью пре-мРНК, обозначенной "полужирным шрифтом" и "подчеркиванием" в 30-мерной последовательности 5'-участка сплайсинга [(5'  3') CGUCAUUGUUUUUGC│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существуют два несоответствия оснований с "интроном 5", обозначаемые кавычками (" "). "ASO 4" обладает 7-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом "ASO 4" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
3') CGUCAUUGUUUUUGC│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существуют два несоответствия оснований с "интроном 5", обозначаемые кавычками (" "). "ASO 4" обладает 7-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом "ASO 4" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
"ASO 4" оценивали в отношении его способности ингибировать экспрессию мРНК SCN9A человека посредством кПЦР с наборами экзон-специфических праймеров, охватывающих "экзоны 4-6", в соответствии с методиками, предоставленными в "пример 2", если нет иных указаний.
[Обработка ASO] Концентрация "ASO 4" в культуральной чашке составляла 0 (отрицательный контроль), 10, 100 или 1000 зМ (2 культуральных чашки на дозу).
[Результаты кПЦР] На фиг.11(A) представлены результаты qPCR, полученные для клеток PC3, обработанных "ASO 4". Уровни экспрессии "экзонов 4-6" значительно снижались, >70%, в клетках PC3, которые обрабатывали "ASO 4" в концентрации от 10 до 1000 зМ в течение 24 часов.
Пример 5. Оценка посредством кПЦР мРНК SCN9A в клетках PC3, обработанных "ASO 5".
"ASO 5" представляет собой 17-мерный ASO против SCN9A, изначально сконструированный для комплементарного нацеливания на 17-мерную последовательность, охватывающую точку соединения "экзона 4" и "экзона 5" в мРНК SCN9A человека. Однако оказалось, что "ASO 5" комплементарно перекрывается с 12-мерной последовательностью пре-мРНК, обозначенной "полужирным шрифтом" и "подчеркиванием" в 30-мерной последовательности 5'-участка сплайсинга [(5'  3') CGUCAUUGUUUUUGC│gua"ag"ua"cuu"ucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существует пять несоответствий оснований с "интроном 5", обозначенных кавычками (" "). "ASO 5" обладает 7-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом "ASO 5" не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению вследствие 5 несоответствий оснований, хотя "ASO 5" и "ASO 4" обладают одинаковой степенью комплементарного перекрывания с пре-мРНК SCN9A.
3') CGUCAUUGUUUUUGC│gua"ag"ua"cuu"ucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существует пять несоответствий оснований с "интроном 5", обозначенных кавычками (" "). "ASO 5" обладает 7-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом "ASO 5" не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению вследствие 5 несоответствий оснований, хотя "ASO 5" и "ASO 4" обладают одинаковой степенью комплементарного перекрывания с пре-мРНК SCN9A.
"ASO 5" оценивали в отношении его способности ингибировать экспрессию мРНК SCN9A человека (полноразмерного) посредством кПЦР с наборами экзон-специфических праймеров, охватывающих "экзоны 4-6", в соответствии с методиками, предоставленными в "пример 2", если нет иных указаний.
[Результаты кПЦР] На фиг.11(B) представлены результаты кПЦР, полученные для клеток PC3, обработанных "ASO 5". Уровни экспрессии "экзонов 4-6" значительно снижались, приблизительно на 80%, 50% и 70%, в клетках PC3, обработанных "ASO 5" в концентрации 10 зМ, 100 зМ и 1 aM, соответственно.
Даже несмотря на то, что "ASO 5" ингибировал экспрессию полноразмерной мРНК SCN9A при кПЦР, пять несоответствий оснований "ASO 5" с пре-мРНК SCN9A слишком много и это увеличивает возможности перекрестной реактивности с другой пре-мРНК(несколькими пре-мРНК).
Пример 6. Оценка посредством кПЦР мРНК SCN9A в клетках PC3, обработанных "ASO 1".
"ASO 1" представляет собой 14-мерный ASO против SCN9A, обладающий той же олигонуклеотидной последовательностью, что и "ASO 4", но в "ASO 1" N-концевой заместитель радикал "Fethoc-" заменен радикалом "Fmoc-". Таким образом, "ASO 1" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению настоящее изобретение.
"ASO 1" оценивали в отношении его способности ингибировать экспрессию мРНК SCN9A человека (полноразмерной) посредством кПЦР с наборами экзон-специфических праймеров, охватывающих "экзоны 4-6", в соответствии с методиками, предоставленными в "пример 2", если нет иных указаний.
[Результаты кПЦР] На фиг.11(C) представлены результаты кПЦР, полученные для клеток PC3, обработанных "ASO 1". Уровни экспрессии "экзонов 4-6" на значимом уровне (t-критерий Стьюдента) снижались, приблизительно на 85%, 50% и 60%, в клетках PC3, обработанных "ASO 1" в концентрации 10 зМ, 100 зМ и 1 aM, соответственно.
Пример 7. Оценка посредством кПЦР мРНК SCN9A в клетках PC3, обработанных "ASO 6".
"ASO 6" представляет собой 14-мерный ASO против SCN9A, обладающий 11-мерным комплементарным перекрыванием с пре-мРНК SCN9A, обозначаемым "полужирным шрифтом" и "подчеркиванием" в 30-мерной последовательности 5'-участка сплайсинга [(5'  3') CGUCAUUGUUUUU"G"C│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека. "ASO 6" обладает 6-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Поскольку "ASO 6" обладает 3 несоответствиями с пре-мРНК SCN9A человека, "ASO 6" не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
3') CGUCAUUGUUUUU"G"C│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека. "ASO 6" обладает 6-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Поскольку "ASO 6" обладает 3 несоответствиями с пре-мРНК SCN9A человека, "ASO 6" не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
"ASO 6" оценивали в отношении его способности ингибировать экспрессию мРНК SCN9A человека (полноразмерной) посредством кПЦР с наборами экзон-специфических праймеров, охватывающих "экзоны 4-6", в соответствии с методиками, предоставленными в "пример 2", если нет иных указаний. Следует отметить, что клетки PC3 инкубировали с "ASO 6" в концентрации 0 (отрицательный контроль), 10 зМ и 100 зМ.
[Результаты кПЦР] На фиг.11(D) представлены результаты кПЦР, полученные для клеток PC3, обработанных "ASO 6". Уровни экспрессии "экзонов 4-6" на значимом уровне (t-критерий Стьюдента) снижались, приблизительно на 80%, в клетках PC3, обработанных "ASO 6" в концентрации 10 зМ и 100 зМ.
Хотя "ASO 6" не удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению вследствие 3 несоответствий оснований, данные кПЦР для "ASO 6" указывают на то, что даже 11-мерное комплементарное перекрывание с пре-мРНК SCN9A все еще является достаточно эффективным для индукции пропускания экзона в клетках PC3.
Пример 8. Оценка посредством кПЦР мРНК SCN9A в клетках PC3, обработанных "ASO 10".
"ASO 10" представляет собой 17-мерный ASO против SCN9A, изначально сконструированный для комплементарного нацеливания на 17-мерную последовательность, охватывающую точку соединения "экзона 4" и "экзона 5" в мРНК SCN9A человека. Между тем, оказалось, что "ASO 10" комплементарно перекрывается с 15-мерной последовательностью пре-мРНК, обозначенной "полужирным шрифтом" и "подчеркиванием" в 30-мерной последовательности 5'-участка сплайсинга [(5'  3') CGUCAUUGUUUUUGC│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существует два несоответствия оснований с "интроном 5", обозначенных кавычками (" "). "ASO 10" обладает 10-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом, "ASO 10" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
3') CGUCAUUGUUUUUGC│gua"ag"uacuuucagc], охватывающей точку соединения "экзона 4" и "интрона 4" в пре-мРНК SCN9A человека, хотя существует два несоответствия оснований с "интроном 5", обозначенных кавычками (" "). "ASO 10" обладает 10-мерным перекрыванием с "экзоном 4" и 5-мерным перекрыванием с "интроном 4". Таким образом, "ASO 10" удовлетворяет критериям комплементарного перекрывания для соединения формулы I по настоящему изобретению.
"ASO 10" оценивали в отношении его способности ингибировать экспрессию мРНК SCN9A человека (полноразмерной) посредством кПЦР с наборами экзон-специфических праймеров, охватывающих "экзоны 4-6", в соответствии с методиками, описанными в "примере 2", если нет иных указаний. Следует отметить, что клетки PC3 инкубировали с "ASO 10" в концентрации 0 (отрицательный контроль), 10 зМ и 100 зМ.
[Результаты кПЦР] На фиг.11(E) представлены результаты кПЦР, полученные для клеток PC3, обработанных "ASO 10". Уровни экспрессии "экзонов 4-6" снижались на значимом уровне (t-критерий Стьюдента), приблизительно на 60% и 80%, в клетках PC3, обработанных "ASO 10" в концентрации 10 зМ и 100 зМ, соответственно.
Пример 9. Ингибирование тока натрия в клетках PC3, обработанных "ASO 10".
"ASO 10" оценивали в отношении его способности ингибировать ток натрия в клетках PC3 с использованием "CoroNa Green" в соответствии с методикой, описанной в "примере", если нет иных указаний.
[Результаты анализа CoroNa] Полученные кривые средней интенсивности флуоресценции клеток представлены на фиг.12(A). Кривая средней интенсивности флуоресценции для клеток, обработанных 1000 зМ "ASO 10", проходит ниже, чем кривая для клеток без обработки ASO. Средняя интенсивность флуоресценции клеток без обработки ASO составила 130,3 (произвольные единицы) через 100 с. Между тем, средняя интенсивность флуоресценции клеток, обработанных 1000 зМ "ASO 10", составила 89,7 (произвольные единицы) через 100 с. Таким образом, согласно оценкам, инкубация в течение 30 часов с 1000 зМ "ASO 10" на значимом уровне (p < 0,001) ингибировала активность натриевых каналов, на 31%, в клетках PC3. Снижение, индуцированное 100 зМ "ASO 10", составило 30% (p < 0,001).
Пример 10. Ингибирование тока натрия в клетках PC3, обработанных "ASO 6".
"ASO 6" оценивали в отношении его способности подавлять ток натрия в клетках PC3 с использованием "CoroNa Green" в соответствии с методиками, представленными в "примере 3", если нет иных указаний.
[Результаты анализа CoroNa] Полученные кривые интенсивности флуоресценции клеток представлены на фиг.12(B). Кривые интенсивности флуоресценции для клеток, обработанных 100 и 1000 зМ "ASO 6", не отличались от кривых для клеток без обработки ASO. Таким образом, инкубация в течение 30 часов с "ASO 6" не индуцировала заметного снижения активности натриевых каналов в клетках PC3.
Хотя "ASO 6" ингибировал экспрессию полноразмерной мРНК п SCN9A, как описано в "примере 7", "ASO 6" не ингибировал ток натрия в клетках PC3. Возможно, "ASO 6" не достаточно прочно связывается с 5'-участком сплайсинга "экзона 4" для индукции пропускания экзонов вследствие трех несоответствий оснований с последовательностью пре-мРНК, являющейся мишенью.
Пример 11. Ингибирование тока натрия в клетках PC3, обработанных "ASO 4".
"ASO 4" оценивали в отношении его способности подавлять ток натрия в клетках PC3 с использованием "CoroNa Green" в соответствии с методикой, представленной в "примере 3", если нет иных указаний.
[Результаты анализа CoroNa] Наблюдаемые кривые интенсивности флуоресценции клеток представлены на фиг.12(C). Кривая интенсивности флуоресценции для клеток, обработанных 100 зМ "ASO 4", проходит ниже, чем кривая для клеток без обработки ASO. Средняя интенсивность флуоресценции клеток без обработки ASO (т.е. отрицательный контроль) составила 89,3 (произвольные единицы) через 100 с. Между тем, средняя интенсивность флуоресценции клеток, обработанных 1000 зМ "ASO 10", составила 61,4 (произвольные единицы) через 100 с. Таким образом, согласно оценкам, инкубация в течение 30 часов с 1000 зМ "ASO 4" на значимом уровне (p < 0,01) снижала активность натриевых каналов, на 31%, в клетках PC3. Однако снижение, индуцированное 100 зМ "ASO 4", составляло только 18% без статистической значимости.
Пример 12. Ингибирование тока натрия в клетках PC3, обработанных "ASO 5".
"ASO 5" оценивали в отношении его способности ингибировать ток натрия в клетках PC3 с использованием "CoroNa Green" в соответствии с методиками, предоставленными в "примере 3", если нет иных указаний.
[Результаты анализа CoroNa] Наблюдаемые кривые интенсивности флуоресценции клеток обобщенно представлены на фиг.12(D). Кривая интенсивности флуоресценции для клеток, обработанных 100 зМ "ASO 5", проходит ниже, чем кривая для клеток без обработки ASO. Средняя интенсивность флуоресценции клеток без обработки ASO составила 90,6 (произвольные единицы) через 100 с. Между тем, средняя интенсивность флуоресценции клеток, обработанных 100 зМ "ASO 5", составила 60,8 (произвольные единицы) через 100 с. Таким образом, согласно оценкам, инкубация в течение 30 часов с 100 зМ "ASO 5" на значимом уровне (p < 0,01) подавляла активность натриевых каналов, на 33%, в клетках PC3.
Однако при возрастании концентрации "ASO 5" от 100 зМ до 1000 зМ средняя интенсивность флуоресценции клеток возрастала до 110,2 (произвольные единицы) через 100 с. Таким образом, согласно оценкам, инкубация в течение 30 часов с 1000 зМ "ASO 5" на значимом уровне (p < 0,05) повышала активность натриевых каналов, на 22%, в клетках PC3. Профиль ответа на дозу может быть результатом активации транскрипции, возможно вследствие "экзон-интронной кольцевой РНК (EIciRNA)", накопившейся в ходе пропускания экзонов с использованием "ASO 5". [Nature Struc. Mol. Biol. vol 22(3), 256-264 (2015)].
Пример 13. Лигирование L5 и лигирование L5/L6 спинномозговых нервов.
Лигирование спинномозговых нервов (SNL) индуцирует невропатию в DRG (ганглии задних корешков), и его широко используют в качестве модели невропатической боли [Pain vol 50(3), 355-363 (1992)]. В зависимости того, как пучок(пучки) спинномозгового нерва лигирован, может быть несколько вариантов SNL. Степень и длительность невропатии в DRG, по-видимому, варьируется в зависимости от того, как нервные пучки лигированы [Pain vol 43(2), 205-218 (1990)]. Считается, что из двух вариантов SNL, проведенных в рамках настоящего изобретения, "лигирование L5/L6" (т.е. способ B) индуцирует более тяжелую и длительную невропатию, чем "лигирование L5 с рассечением L6" (т.е. способ A).
[Способ A: лигирование L5 с рассечением L6] Самцам крыс SD давали анестезию золетил/ромпун. Пучки спинномозговых нервов L5 и L6 (слева) обнажали и туго лигировали, а затем нерв L6 рассекали. Наконец, мышцу и кожу закрывали и зажимали в соответствии с надлежащими асептическими методиками.
[Способ B: Лигирование L5/L6] Самцам крыс SD давали анестезию золетил/ромпун. Пучки спинномозговых нервов L5 и L6 (слева) обнажали и туго лигировали. Затем мышцу и кожу закрывали и зажимали в соответствии с надлежащими асептическими методиками.
Пример 14. Оценка аллодинии по фон Фрею.
[Способ A: электронная оценка по фон Фрею] Аллодинию оценивали способом фон Фрея с использованием электронного анестезиометра фон Фрея [37450, динамический подошвенный анестезиометр, Ugo Basile; или модель номер 2390, IITC Inc. Life Sciences], вкратце как описано далее: после стабилизации в течение менее чем 30 минут каждое животное в пластмассовой клетке подвергали оценке фон Фрея, подвергнутую лигированию заднюю конечность (лигированная сторона, обычно слева) каждого животного подвергали оценке фон Фрея 6 раз с интервалом в несколько минут между соседними раундами оценки. Показатели первого раунда исключали, поскольку животное в ходе первого раунда оценки считается не полностью акклиматизированным. Среди пяти остальных показателей наивысший и наиболее низкий показатели исключали в качестве выпадающих показателей. Затем среднее значение остальных трех показателей принимали в качестве показателя фон Фрея для данного животного.
[Способ B: способ Фон Фрея с микрофиламентами (Touch Test®)] Аллодинию оценивали с использованием набора микрофиламентов (Touch Test®) в соответствии со способом "Up & Down". [J Neurosci. Methods vol 53(1), 55-63 (1994)]
Пример 15. Обращение вспять аллодинии, индуцированной SNL, посредством "ASO 1".
"ASO 1" оценивали в отношении его способности обращать вспять аллодинию, индуцированную SNL, у крыс, как описано ниже.
[Операция SNL и распределение на группы] На 0 сутки 30 самцов крыс SD подвергали хирургической операции SNL, состоявшей в лигировании L5 с рассечением L6 (способ A в "примере 13"). На 15 сутки восемнадцать крыс, демонстрирующих наиболее низкие показатели фон Фрея, отбирали и случайным образом распределяли на три группы: группу отрицательного контроля (без введения ASO), "ASO 1" 3 пмоль/кг, и "ASO 1" 10 пмоль/кг (N=6 на группу).
[Дозирование ASO и оценка фон Фрея] Водный исходный раствор "ASO 1" подвергали серийному разведению до 3 нМ и 10 нМ "ASO 1" в PBS. Каждый разбавленный раствор подкожно вводили каждой крысе группы введения ASO в дозе 1 мл/кг на 16, 18, 20, 22 и 24. Оценку фон Фрея (электронный способ фон Фрея: способ A в "пример 14") проводили на 20, 22, 24, 27 и 29 сутки. ASO вводили после оценки фон Фрея на 20, 22 и 24 сутки. Показатели фон Фрея оценивали с помощью t-критерия Стьюдента в отношении статистической значимости против группы отрицательного контроля.
[Терапевтическая активность] На фиг.13 представлены наблюдаемые показатели фон Фрея. Средние показатели фон Фрея для групп введения ASO были значимо более высокими, чем в группе отрицательного контроля, на 20, 22, 24 и 27 сутки. Терапевтическая активность сохранялась в течение по меньшей мере трех суток после последнего введения ASO на 24 сутки. Таким образом, аллодиния, индуцированная "лигированием L5", в значительной степени обращалась вспять у крыс, которым подкожно вводили "ASO 1" в дозе 3 или 10 пмоль/кг.
Пример 16. Индукция индуцируемой диабетом периферической невропатической боли (DPNP).
Периферическую невропатическую боль индуцировали у крыс с диабетом типа I, как кратко описано. Стрептозотоцин, растворенный в цитратном буфере (pH 6), вводили внутрибрюшинно в дозе 60 мг/кг самцам крыс SD массой приблизительно 200 г [J. Ethnopharmacol. vol 72(1-2), 69-76 (2000)]. Степень периферической невропатии оценивали с помощью показателя фон Фрея. Животных, стабильно демонстрирующих низкие показателя фон Фрея в течение нескольких суток отбирали для оценки терапевтической активности ASO против SCN9A.
Пример 17. Обращение вспять аллодинии посредством "ASO 5" у крыс с DPNP
"ASO 5" оценивали в отношении его способности обращать вспять аллодинию, индуцированную DPNP, у крыс, как описано ниже.
[Индукция DPNP и распределение на группы] Диабет типа I индуцировали на 0 сутки путем внутрибрюшинного введения стрептозотоцина самцам крыс SD, как описано в "примере 16". На 10 сутки крыс с DPNP случайным образом распределяли на группы на основе показателей фон Фрея для индивидуальных животных на 10 сутки "способом B" в "примере 14" (группы 1-6 и N=8 на группу). Шесть групп представляли собой "группу 1", в которой вводили только носитель (отрицательный контроль), "группу 2", в которой вводили прегабалин в дозе 30 мг/кг, "группу 3", в которой вводили "ASO 5" в дозе 0,01 пмоль/кг, "группу 4", в которой вводили "ASO 5" в дозе 0,1 пмоль/кг, "группу 5", в которой вводили "ASO 5" в дозе 1 пмоль/кг, и "группу 6", в которой вводили "ASO 5" в дозе 10 пмоль/кг.
[Введение ASO и оценка способом фон Фрея] Водный исходный раствор "ASO 5" подвергали серийному разведению до 0,01, 0,1, 1 и 10 нМ "ASO 5" в DDW (деионизированная дистиллированная вода). "ASO 5" подкожно вводили на 11, 13, 15 и 17 сутки. Прегабалин в дозе 30 мг/кг перорально вводили на 11 и 17 сутки в качестве положительного контроля. Оценку фон Фрея проводили через 2 часа после дозирования на 11, 13, 15 и 17 сутки "способом B", описанным в "примере 14". Оценку фон Фрея, кроме того, проводили на 20 сутки для оценки длительности терапевтической активности после конечного дозирования. Показатели фон Фрея оценивали в отношении статистической значимости с помощью t-критерия Стьюдента против "группы 1" (только носитель, отрицательный контроль).
[Терапевтическая активность] Наблюдаемые показатели фон Фрея обобщенно представлены на фиг.14. В группах введения ASO аллодиния заметно (~80%) и в значительной степени обращалась вспять в группе 6, т.е. "ASO 5" 10 пмоль/кг. Интересно отметить, что терапевтическая активность появлялась уже через несколько часов, как наблюдали на 11 сутки. Аллодиния сравнимым образом обращалась вспять в "группе 6" ("ASO 5", 10 пмоль/кг) и "группе 2" (прегабалин, 30 мг/кг) на 17 сутки. Терапевтическая активность "группы 6" исчезала практически полностью на 20 сутки (через трое суток после последней дозы на 17 сутки).
Пример 18. Обращение вспять аллодинии посредством "ASO 9" и "ASO 10" у крыс с DPNP.
"ASO 9" и "ASO 10" оценивали в отношении их способности обращать вспять аллодинию, индуцированную DPNP, у крыс в соответствии с методиками, описанными в "примере 17", если нет иных указаний.
[Распределение на группы] На 10 сутки крыс с DPNP случайным образом распределяли на три группы: группу отрицательного контроля (только носитель/DDW), "ASO 9" в дозе 100 пмоль/кг и "ASO 10" в дозе 100 пмоль/кг (N=8-9 на группу).
[Введение ASO и оценка фон Фрея] Крысам подкожно вводили "ASO 9", "ASO 10" или носитель на 11, 13, 15, 17 и 19 сутки. Оценку фон Фрея проводили через 2 часа после дозы на 11, 13, 15, 17 и 19 сутки. Кроме того, оценку фон Фрея проводили на 21 и 23 сутки для оценки продолжительности терапевтической активности после последнего дозирования. Статистическую значимость ежедневных показателей фон Фрея оценивали с помощью t-критерия Стьюдента против группы отрицательного контроля.
[Терапевтическая активность] Наблюдаемые показатели фон Фрея обобщенно представлены на фиг.15. Аллодиния заметно и в значительной степени обращалась вспять посредством "ASO 9" и "ASO 10". "ASO 9" обращал вспять аллодинию приблизительно на 75% на 17 и 19 сутки. В случае "ASO 10" аллодиния постепенно обращалась вспять приблизительно на 60% на 19 сутки. "ASO 9" обладает более комплементарным перекрыванием с пре-мРНК SCN9A, чем "ASO 10", что может объяснить различие в терапевтической эффективности между двумя ASO. Терапевтическая активность ASO полностью исчезала на 21 сутки, т.е. через 2 суток после последнего дозирования, что указывает на более короткое фармакодинамическое время полужизни, составляющее несколько дней.
Пример 19. Обращение вспять аллодинии, индуцированной SNL, посредством "ASO 9".
"ASO 9" оценивали в отношении его способности обращать вспять аллодинию, индуцированную SNL, у крыс, как описано ниже.
[Операция SNL и распределение на группы] На 0 сутки самцов крыс SD подвергали хирургической операции SNL "лигирование L5/L6" ("способ B" в "примере 13"). На 21 сутки 12 крыс отбирали на основе показателей фон Фрея электронным способом фон Фрея ("способ A" в "примере 14"), и случайным образом распределяли на две группы: группу отрицательного контроля (без введения ASO) и "ASO 9" 100 пмоль/кг (N=6 на группу).
[Дозирование ASO и оценка фон Фрея] Водный исходный раствор "ASO 9" разбавляли до 100 нМ "ASO 9" в PBS. Раствор ASO или PBS подкожно вводили крысам в дозе 1 мл/кг три раза в стуки в 08:00, 14:00 и 21:00 на 22, 23 и 24 сутки. Оценку фон Фрея проводили в 20:00 на 22, 23 и 24 сутки "способом A", описанным в "примере 14". Показатели фон Фрея оценивали в отношении статистической значимости между двумя группами с помощью t-критерия Стьюдента.
[Терапевтическая активность] Наблюдаемые показатели фон Фрея обобщенно представлены на фиг.16. Средние показатели фон Фрея в группе введения ASO были значительно более высокими, чем в группе отрицательного контроля, на 23 и 24 сутки. Таким образом подкожное введение TID "ASO 9" в дозе 100 пмоль/кг в значительной степени обращало вспять аллодинию, индуцированную SNL (лигирование L5/L6), у крыс.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВОЕ ДЛЯ SCN9A ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО | 2018 |
|
RU2762293C2 |
| ПРОПУСК ЭКЗОНОВ С ПОМОЩЬЮ ПРОИЗВОДНЫХ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2786637C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ К HIF-1-АЛЬФА | 2017 |
|
RU2753517C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АНДРОГЕНОВОГО РЕЦЕПТОРА | 2017 |
|
RU2753966C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ДЛЯ SNAP25 | 2017 |
|
RU2766701C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ТИРОЗИНАЗЫ | 2018 |
|
RU2778786C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АЦЕТИЛ-СОА-КАРБОКСИЛАЗЫ-2 | 2019 |
|
RU2807629C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-1 | 2019 |
|
RU2802418C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ С ХОРОШЕЙ КЛЕТОЧНОЙ ПЕНЕТРАЦИЕЙ И СИЛЬНОЙ АФФИННОСТЬЮ К НУКЛЕИНОВОЙ КИСЛОТЕ | 2009 |
|
RU2564032C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ C9ORF72 | 2016 |
|
RU2736574C2 |











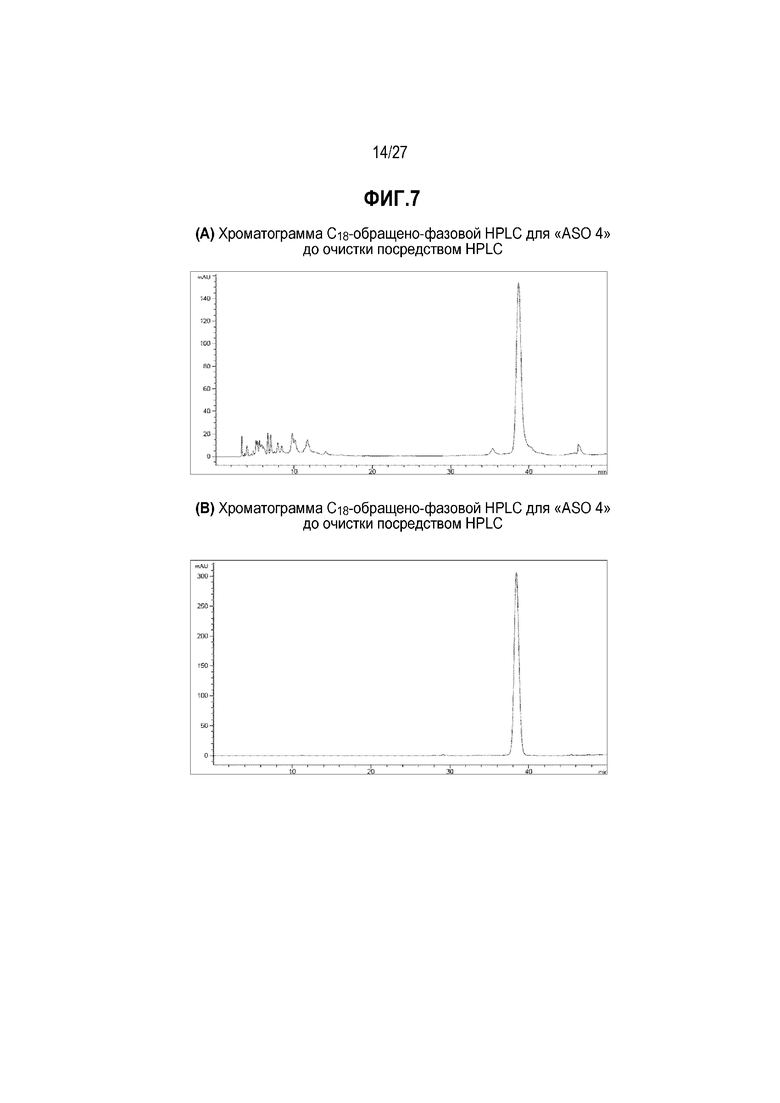
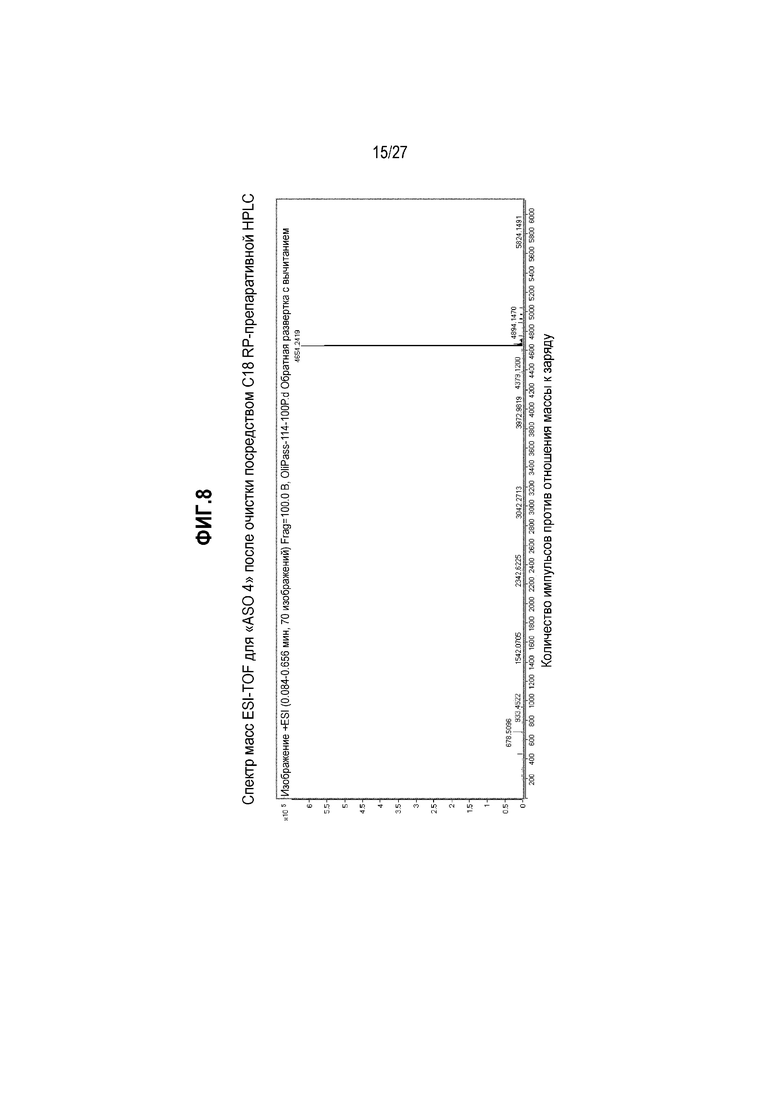

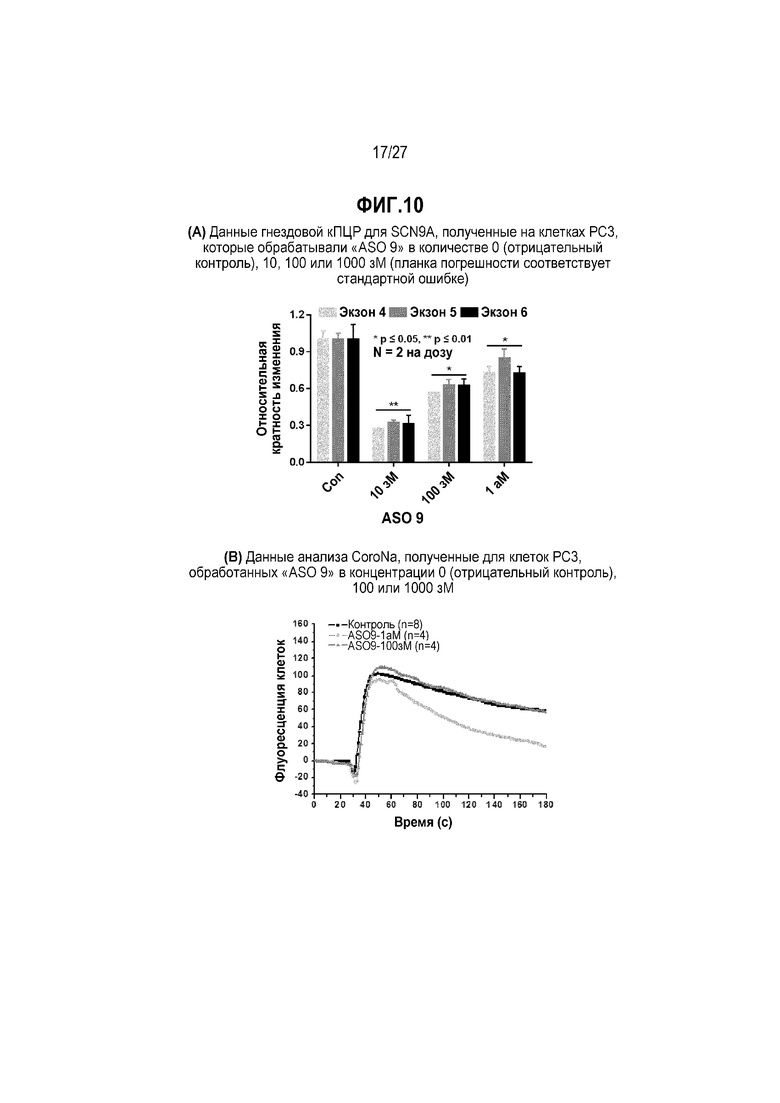
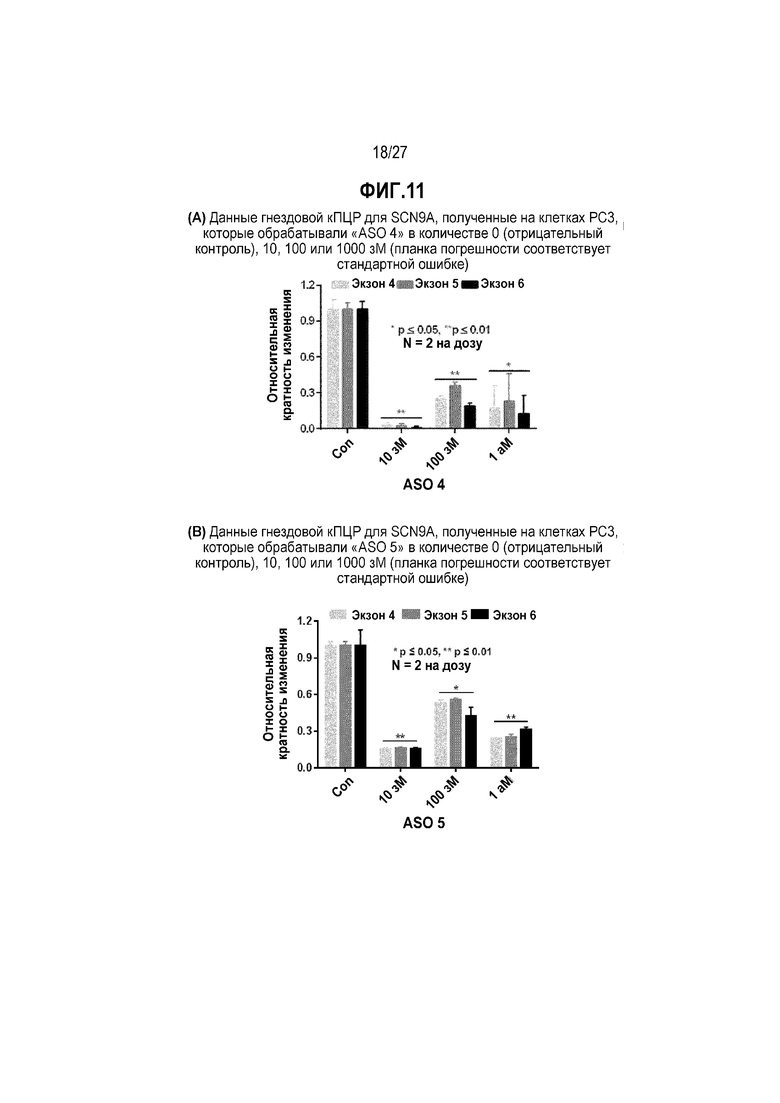
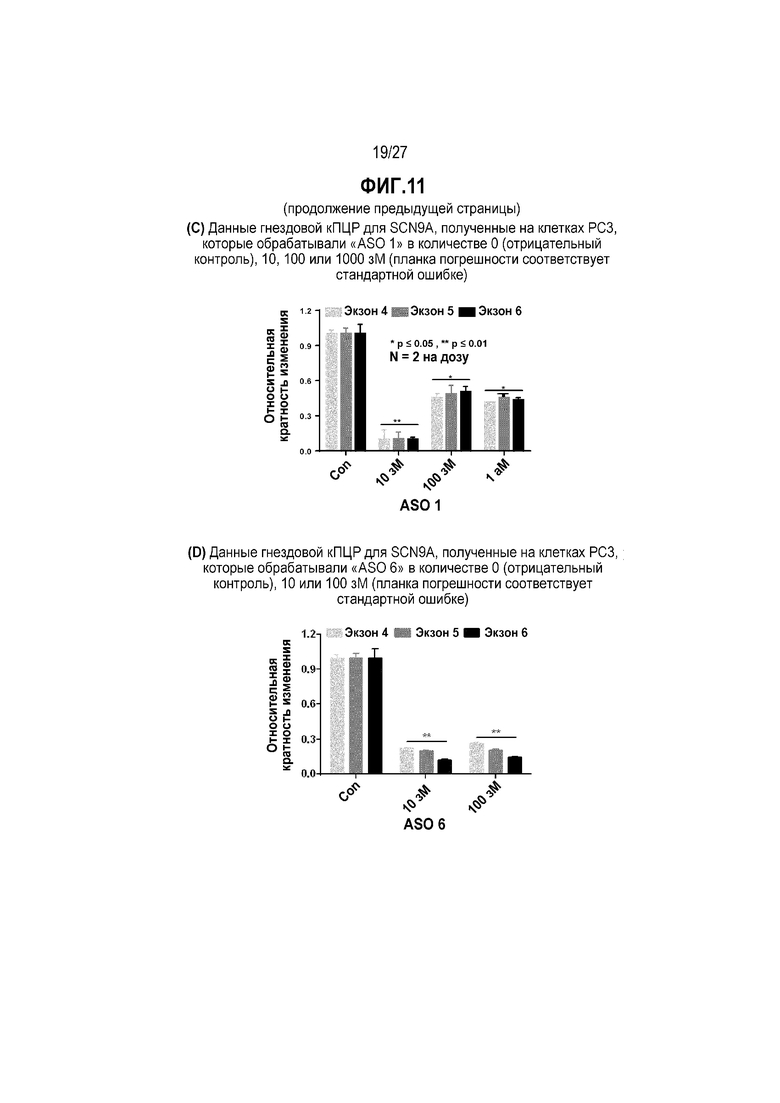

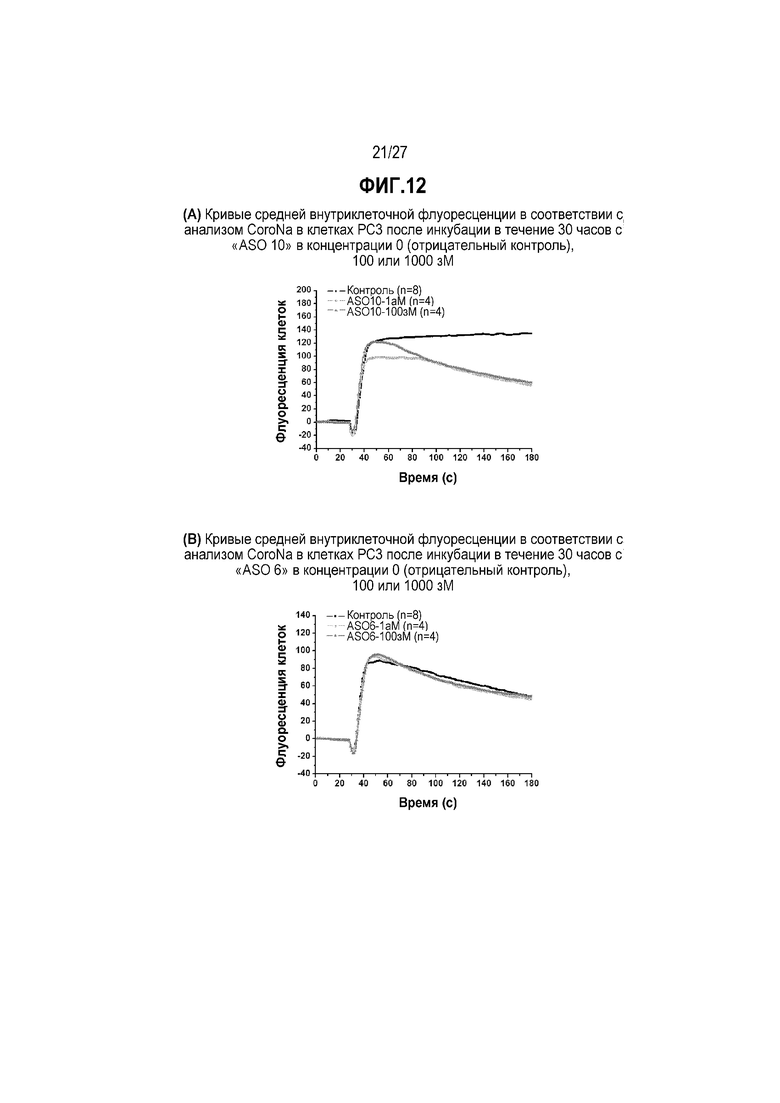
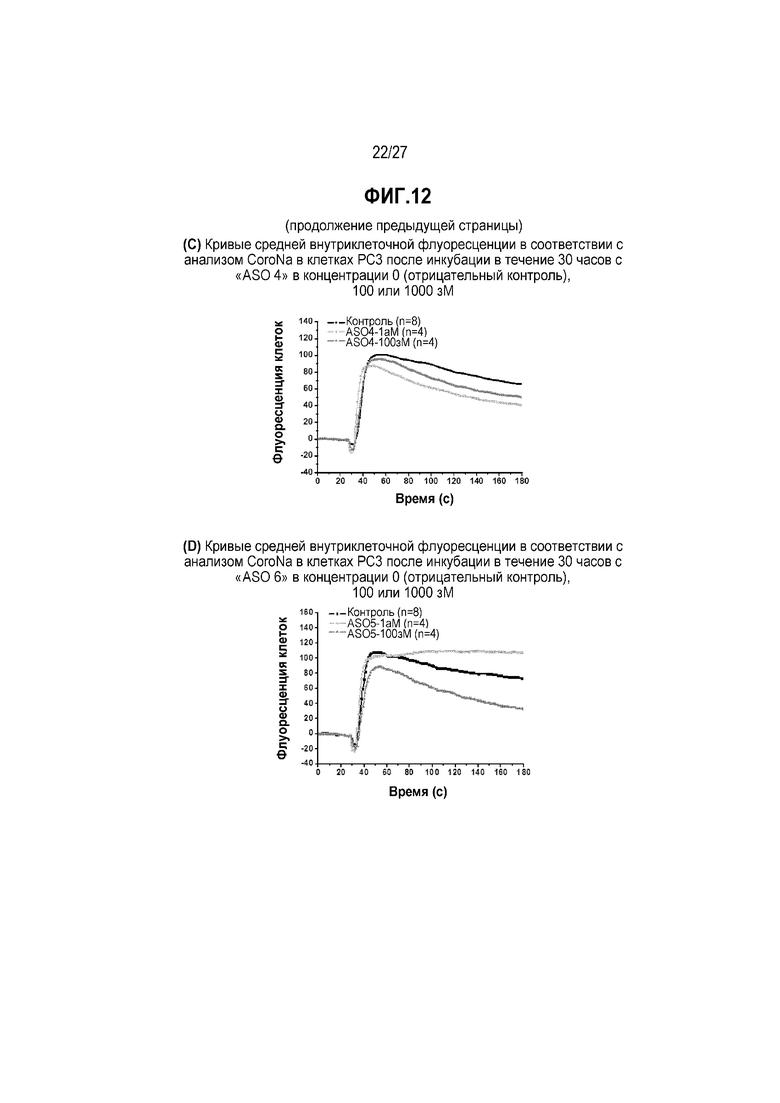
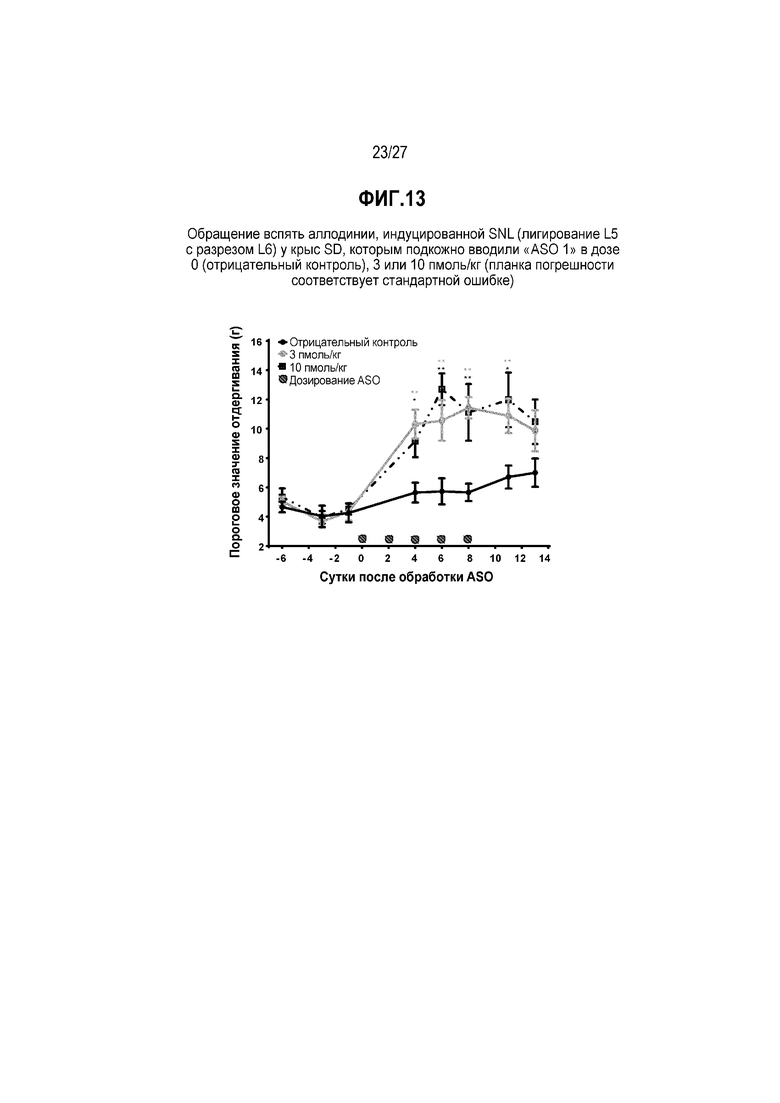
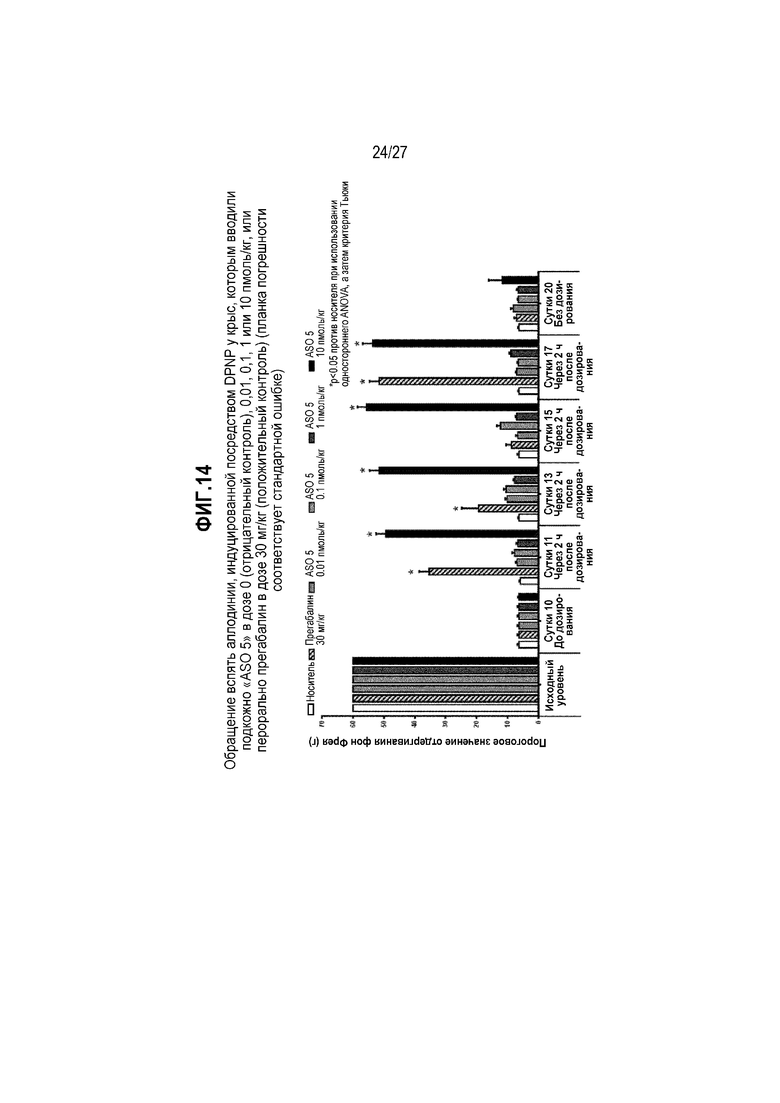
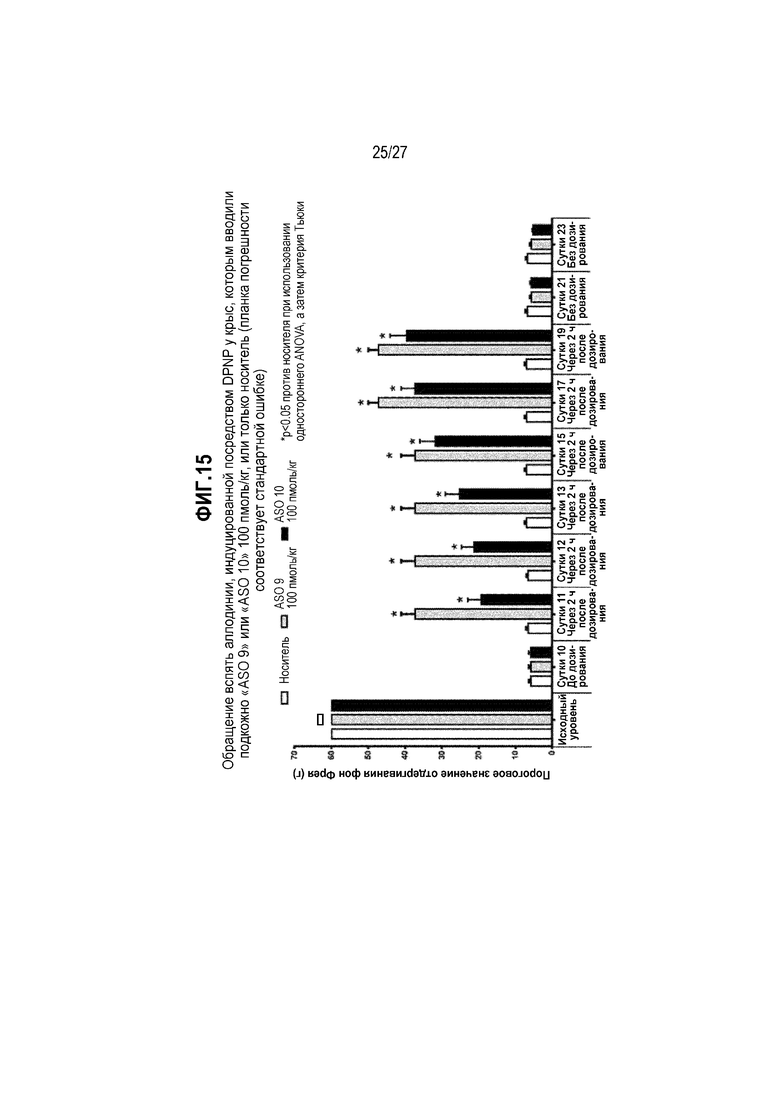
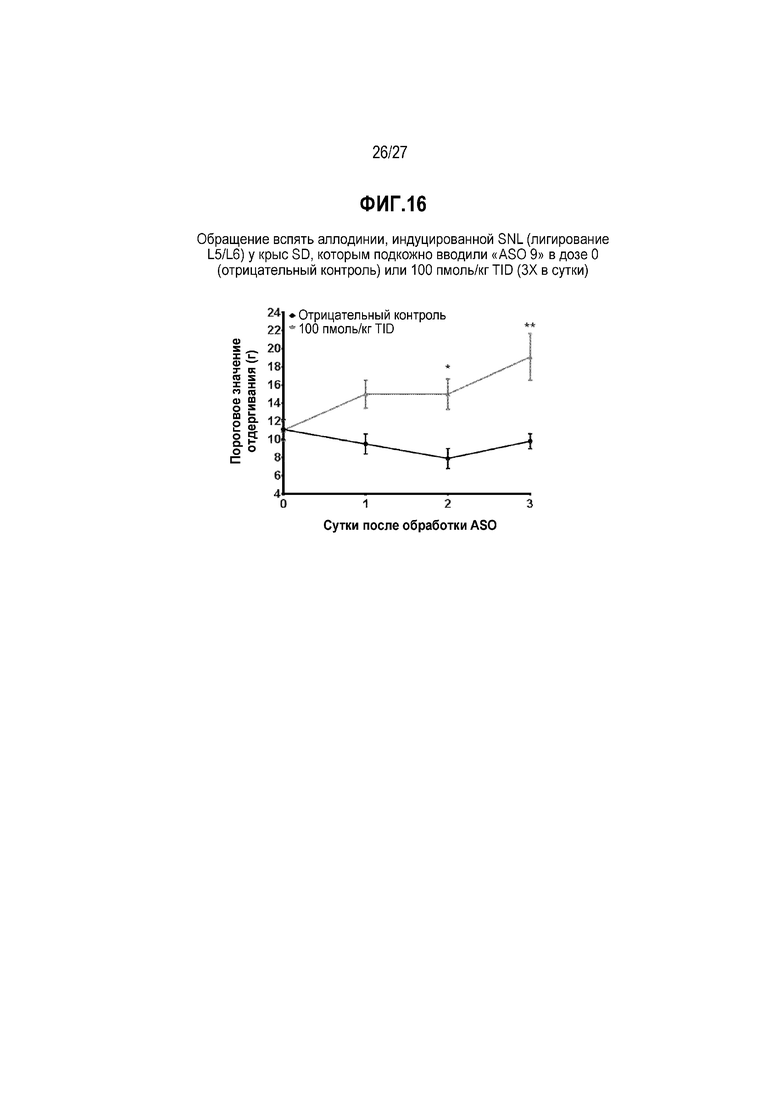
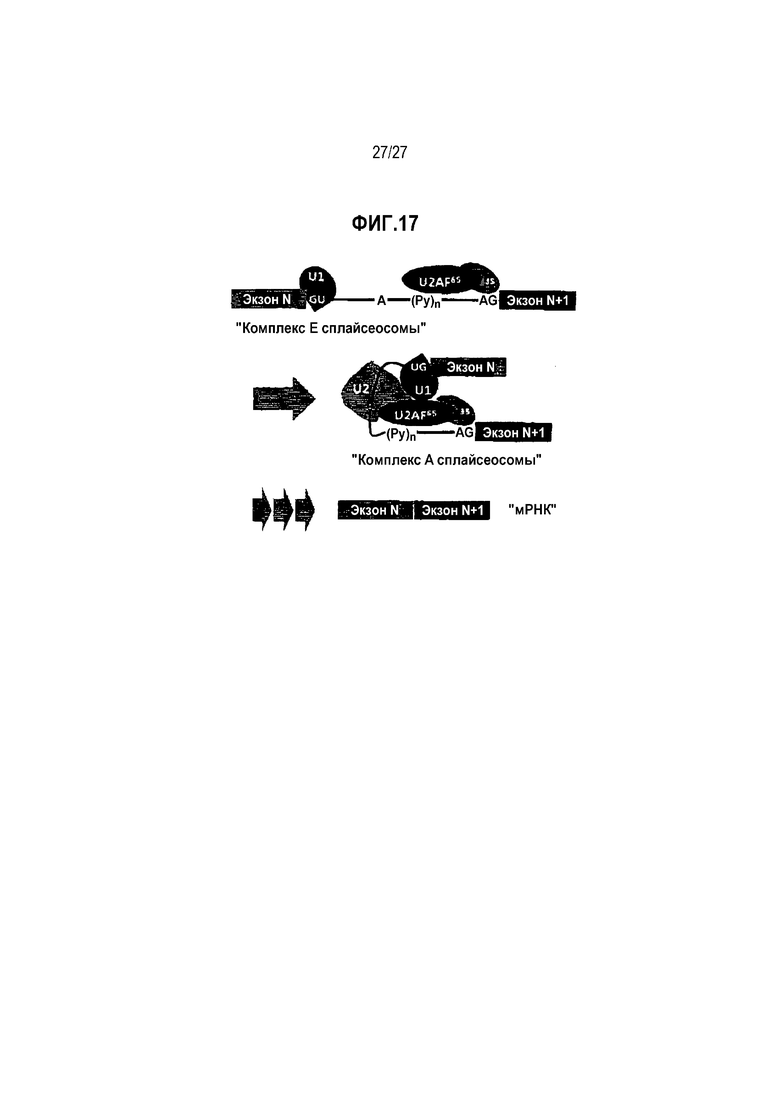
Изобретение относится к производным пептидно-нуклеиновой кислоты, нацеленным на часть пре-мРНК SCN9A человека. Производные пептидно-нуклеиновой кислоты эффективно индуцируют образование вариантов сплайсинга мРНК SCN9A в клетках и являются пригодными для безопасного лечения боли или состояний, вовлекающих активность Nav1.7. 9 н. и 5 з.п. ф-лы, 17 ил., 2 табл., 19 пр.
1. Производное пептидно-нуклеиновой кислоты, соответствующее формуле I или его фармацевтически приемлемая соль:
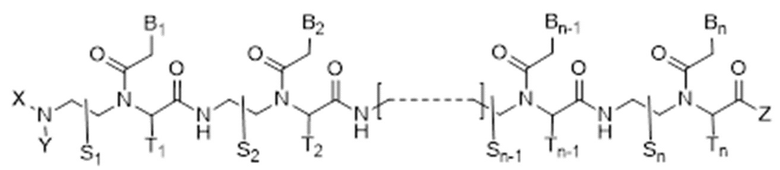
Формула I,
где n представляет собой целое число от 10 до 21;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn обозначают гидридорадикал;
X и Y независимо обозначают гидридо [H], замещенный или незамещенный алкильный радикал, замещенный или незамещенный арильный радикал, замещенный или незамещенный алкилацильный радикал, замещенный или незамещенный арилацильный радикал, замещенный или незамещенный алкилоксикарбонильный радикал, замещенный или незамещенный алкиламинокарбонильный радикал или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
где незамещенный алкильный радикал выбирают из:
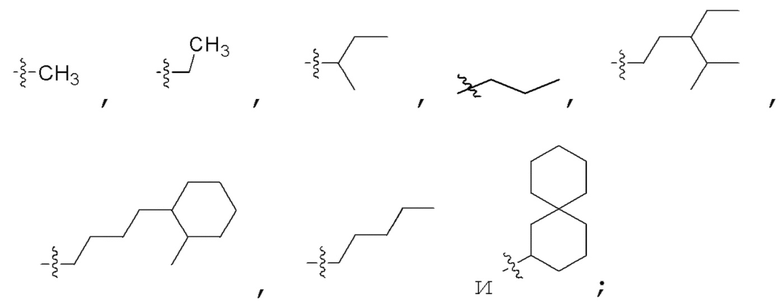
замещенный алкильный радикал выбирают из:
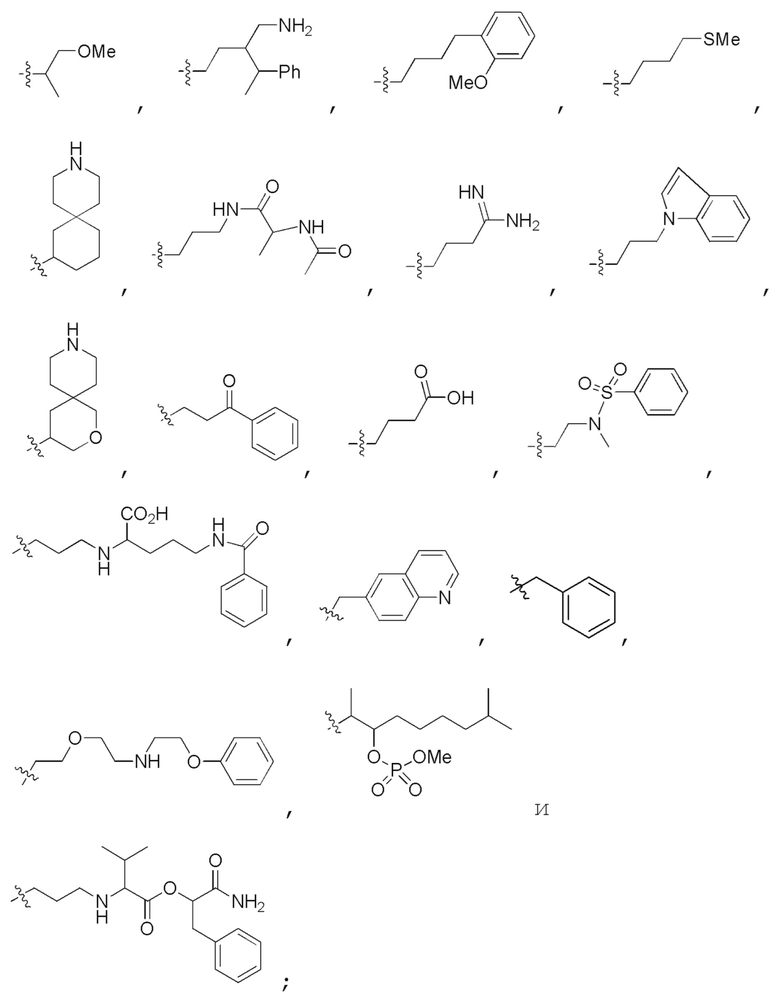
незамещенный или замещенный арильный радикал выбирают из:
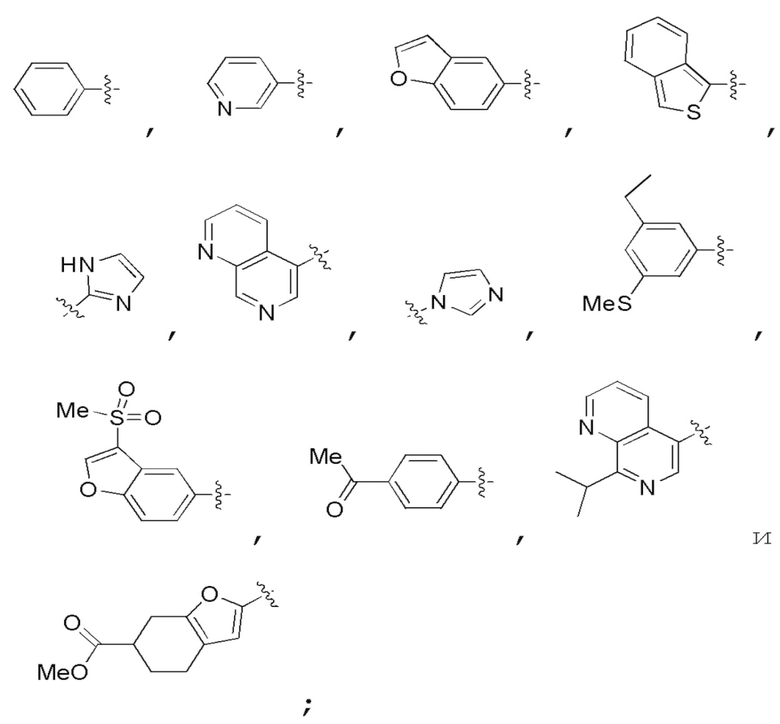
незамещенный алкилацильный радикал выбирают из:
замещенный алкилацильный радикал выбирают из:
Fethoc-Lys-Leu, Fethoc-Lys, Fethoc-Val и Fethoc-Gly;
незамещенный или замещенный арилацильный радикал выбирают из:
замещенный или незамещенный алкилоксикарбонильный радикал выбирают из:
замещенный или незамещенный алкиламинокарбонильный радикал выбирают из:
замещенный или незамещенный арилсульфонильный радикал выбирают из:
замещенный аминорадикал выбирают из:
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
по меньшей мере три из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV:
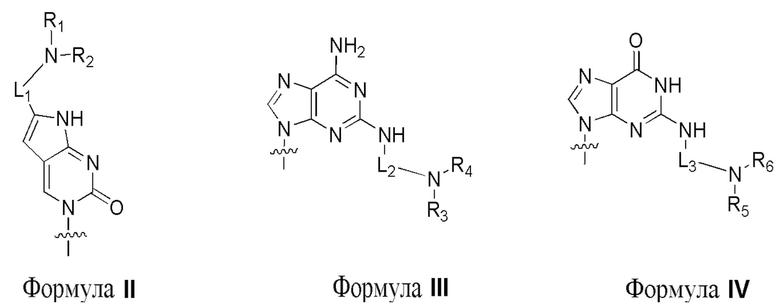
где R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал; и
L1, L2 и L3 представляют собой ковалентный линкер, соответствующий формуле V, соединяющий основную аминогруппу с частью, представляющей собой нуклеиновое основание, ответственной за спаривание нуклеиновых оснований:
 ,
,
где Q1 и Qm представляют собой незамещенный метиленовый (-CH2-) радикал и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенного или незамещенного метилена и кислородного (-O-) радикала; и
m представляет собой целое число от 1 до 16.
2. Производное пептидно-нуклеиновой кислоты по п. 1 или его фармацевтическая соль,
где n представляет собой целое число от 12 до 20;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью, или частично комплементарным последовательности пре-мРНК, являющейся мишенью, с одним или двумя несоответствиями оснований;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо обозначают гидридо, замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкиламинокарбонил или замещенный или незамещенный арилсульфонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
где R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой незамещенный метиленовый радикал и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из незамещенного метилена и кислородного радикала; и
m представляет собой целое число от 1 до 11.
3. Производное пептидно-нуклеиновой кислоты по п. 1 или его фармацевтическая соль,
где n представляет собой целое число от 12 до 19;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой радикал гидридо;
X и Y независимо обозначают гидридо, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил, замещенный или незамещенный алкилоксикарбонил или замещенный или незамещенный алкиламинокарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
где R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой метиленовый радикал и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена и кислородного радикала; и
m представляет собой целое число от 1 до 10.
4. Производное пептидно-нуклеиновой кислоты производное по п. 1 или его фармацевтическая соль,
где n представляет собой целое число от 12 до 18;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой радикал гидридо;
X и Y независимо обозначают гидридо, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
где R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой метиленовый радикал и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена и кислородного радикала; и
m представляет собой целое число от 1 до 10.
5. Производное пептидно-нуклеиновой кислоты по п. 1 или его фармацевтическая соль,
где n представляет собой целое число от 12 до 16;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой радикал гидридо;
X и Y независимо обозначают гидридо, замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
где R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой метиленовый радикал и Qm прямо связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метилена и кислородного радикала; и
m представляет собой целое число от 1 до 10.
6. Производное пептидно-нуклеиновой кислоты по п. 1, или его фармацевтическая соль,
где n представляет собой целое число от 12 до 16;
соединение формулы I имеет по меньшей мере 10-мерное комплементарное перекрывание с 14-мерной последовательностью РНК [(5'  3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
3') UUUUUGCGUAAGUA] в пре-мРНК SCN9A человека;
соединение формулы I является полностью комплементарным последовательности пре-мРНК, являющейся мишенью;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X представляет собой гидридорадикал;
Y обозначает замещенный или незамещенный алкилацил, замещенный или незамещенный арилацил или замещенный или незамещенный алкилоксикарбонильный радикал;
Z обозначает замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин и цитозин, и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, соответствующих формуле II, формуле III или формуле IV;
где R1, R2, R3, R4, R5, и R6 представляют собой радикал гидридо;
L1 обозначает -(CH2)2-O-(CH2)2-, -CH2-O-(CH2)2-, -CH2-O-(CH2)3-, -CH2-O-(CH2)4- или -CH2-O-(CH2)5-, причем правый конец прямо связан с основной аминогруппой; и
L2 и L3 независимо выбраны из -(CH2)2-O-(CH2)2-, -(CH2)3-O-(CH2)2-, -(CH2)2-O-(CH2)3-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7- и -(CH2)8-, причем правый конец прямо связан с основной аминогруппой.
7. Производное пептидно-нуклеиновой кислоты, выбранное из группы производных пептидно-нуклеиновой кислоты, представленной ниже, или его фармацевтически приемлемая соль:
(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Piv-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Piv-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) FAM-HEX-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) FAM-HEX-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Ацетил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Ацетил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-Lys-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Fethoc-Lys-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) H-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) H-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Me-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Me-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Бензил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
C) Бензил-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-NH2;
(N  C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-Lys-NH2;
C) Fethoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)A-Lys-NH2;
(N  C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2;
C) Fmoc-TA(5)A-A(5)TA(5)-CGC(1O2)-AA(5)A-A(5)AC-A(5)A-NH2;
(N  C) Fethoc-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
C) Fethoc-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
(N  C) Fethoc-TA(6)C-GC(1O2)A-A(6)AA(6)-ACA(6)-A-NH2;
C) Fethoc-TA(6)C-GC(1O2)A-A(6)AA(6)-ACA(6)-A-NH2;
(N  C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2;
C) Fethoc-AC(1O2)T-TA(5)C-G(6)CA-A(5)AA(5)-AC(1O2)A-A(5)-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-ACA(5)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-Val-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-Val-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-Gly-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Fethoc-Gly-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2;
C) Fethoc-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-Lys-NH2;
(N  C) Piv-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
C) Piv-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(5)-A-NH2;
(N  C) Fethoc-Lys-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
C) Fethoc-Lys-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
(N  C) Piv-Leu-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
C) Piv-Leu-AG(5)T-A(5)CT-TA(5)C-GC(1O2)A-A(5)AA(2O2)-A-NH2;
(N  C) Fethoc-A(5)GT-A(5)CT-TA(5)C-G(6)CA(5)-A-NH2;
C) Fethoc-A(5)GT-A(5)CT-TA(5)C-G(6)CA(5)-A-NH2;
(N  C) Fethoc-Lys-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
C) Fethoc-Lys-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-NH2;
(N  C) Fethoc-Gly-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-Arg-NH2;
C) Fethoc-Gly-A(5)TC(1O3)-A(5)CT-TA(5)C-GC(1O2)A-A(5)A-Arg-NH2;
(N  C) H-CTT-A(5)CG(3)- C(1O2)AA(5)-AA(5)A-C(1O3)AA(5)-NH2;
C) H-CTT-A(5)CG(3)- C(1O2)AA(5)-AA(5)A-C(1O3)AA(5)-NH2;
(N  C) Fethoc-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-NH2;
C) Fethoc-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-NH2;
(N  C) Fethoc-CTT-A(5)CG(6)-C(1O2)TA(5)-AA(5)T-C(1O2)AA(5)-NH2;
C) Fethoc-CTT-A(5)CG(6)-C(1O2)TA(5)-AA(5)T-C(1O2)AA(5)-NH2;
(N  C) бензоил-CTT-A(5)CG(2O2)-C(1O2)AA(5)-AA(5)A-C(1O5)AA(5)-NH2;
C) бензоил-CTT-A(5)CG(2O2)-C(1O2)AA(5)-AA(5)A-C(1O5)AA(5)-NH2;
(N  C) н-пропил-CTT-A(5)CG(2O3)-C(1O2)AA(3)-AA(5)A-C(2O2)AA(5)-NH2;
C) н-пропил-CTT-A(5)CG(2O3)-C(1O2)AA(3)-AA(5)A-C(2O2)AA(5)-NH2;
(N  C) п-толуолсульфонил-CTT-A(5)CG(6)-C(1O2)AA(8)-AA(5)A-C(1O2)AA(5)-NH2;
C) п-толуолсульфонил-CTT-A(5)CG(6)-C(1O2)AA(8)-AA(5)A-C(1O2)AA(5)-NH2;
(N  C) [N-(2-фенилэтил)амино]карбонил-CTT-A(5)CG(6)-C(1O2)AA(2O2)-AA(5)A-C(1O2)A A(5)-NH2;
C) [N-(2-фенилэтил)амино]карбонил-CTT-A(5)CG(6)-C(1O2)AA(2O2)-AA(5)A-C(1O2)A A(5)-NH2;
(N  C) Fethoc-Lys-Leu-CTT-A(5)CG(6)-C(1O2)AA(4)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
C) Fethoc-Lys-Leu-CTT-A(5)CG(6)-C(1O2)AA(4)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
(N  C) N-фенил-N-Me-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
C) N-фенил-N-Me-CTT-A(5)CG(6)-C(1O2)AA(5)-AA(5)A-C(1O2)AA(5)-Lys-NH2;
(N  C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-NH2; и,
C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-NH2; и,
(N  C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-Lys-NH2,
C) Fethoc-AA(5)G-TA(5)C-TTA(5)-CG(6)C-A(5)A-Lys-NH2,
где A, G, T и C представляют собой мономеры PNA с природным нуклеиновым основанием аденином, гуанином, тимином и цитозином соответственно;
C(pOq), A(p), A(pOq), G(p) и G(pOq) представляют собой мономеры PNA с неприродным нуклеиновым основанием, соответствующим формуле VI, формуле VII, формуле VIII, формуле IX и формуле X соответственно:
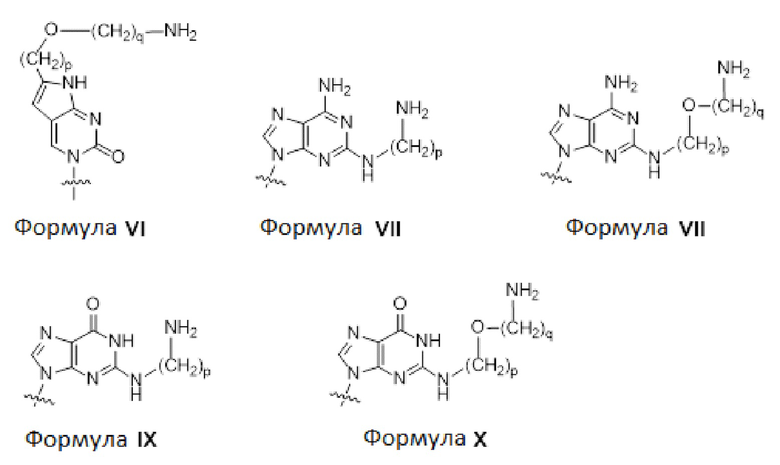
где p и q представляют собой целые числа; и
сокращенные обозначения для N- и C-концевых заместителей, в частности, являются следующими: "Fmoc-" представляет собой сокращенное обозначение для "[(9-флуоренил)метилокси]карбонила-"; "Fethoc-" для "[2-(9-флуоренил)этил-1-окси]карбонила-"; "Ac-" для "ацетила-"; "бензоил-" для "бензолкарбонила-"; "Piv-" для "пивалила-"; "Me-" для "метила-"; "н-пропил-" для "1-(н-пропила)-"; "H-" для группы "гидридо-"; "п-толуолсульфонил" для "(4-метилбензол)-1-сульфонила-"; "-Lys-" для аминокислотного остатка "лизин"; "-Val-" для аминокислотного остатка "валин"; "-Leu-" для аминокислотного остатка "лейцин"; "-Arg-" для аминокислотного остатка "аргинин"; "-Gly-" для аминокислотного остатка "глицин"; "[N-(2-фенилэтил)амино]карбонил-" для "[N-1-(2-фенилэтил)амино]карбонила-"; "бензил-" для "1-(фенил)метила-"; "фенил-" для "фенила-"; "Me-" для "метила-"; "-HEX-" для "6-амино-1-гексаноила-", "FAM-" для "5 или 6-флуоресцеинкарбонила- (изомерная смесь)" и "-NH2" для незамещенной "-аминогруппы".
8. Применение производного пептидно-нуклеиновой кислоты по любому из пп. 1-7 для лечения боли или состояний посредством подавления активности Nav1.7.
9. Применение производного пептидно-нуклеиновой кислоты по любому из пп. 1-7 для изготовления лекарственного средства для лечения хронической или невропатической боли.
10. Способ лечения боли или состояний, вовлекающих активность Nav1.7, включающий введение 1 нмоль/кг или менее водного раствора производного пептидно-нуклеиновой кислоты по любому из пп. 1-7.
11. Способ лечения боли или состояний, вовлекающих активность Nav1.7, включающий введение эффективной дозы производного пептидно-нуклеиновой кислоты по любому из пп. 1-7.
12. Способ лечения хронической или невропатической боли, включающий введение эффективной дозы производного пептидно-нуклеиновой кислоты по любому из пп. 1-7.
13. Применение производного пептидно-нуклеиновой кислоты по любому из пп. 1-7 для изготовления лекарственного средства для лечения боли или состояний, вовлекающих активность Nav1.7.
14. Применение производного пептидно-нуклеиновой кислоты по любому из пп. 1-7 для лечения хронической или невропатической боли.
| KR 2011087436 A, 03.08.2011 | |||
| ПРОИЗВОДНЫЕ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ С ХОРОШЕЙ КЛЕТОЧНОЙ ПЕНЕТРАЦИЕЙ И СИЛЬНОЙ АФФИННОСТЬЮ К НУКЛЕИНОВОЙ КИСЛОТЕ | 2009 |
|
RU2564032C2 |
Авторы
Даты
2021-05-31—Публикация
2017-05-24—Подача