Настоящее изобретение относится к производным пептидной нуклеиновой кислоты, нацеленным на пре-мРНК SNAP25 человека, для лечения дерматологических показаний или состояний, опосредованных белком SNAP25, и по нему испрашивается приоритет Предварительной заявки США No. 62/443262, поданной 06 января 2017 г., полное содержание которой приведено в настоящем документе в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ДЛЯ ИЗОБРЕТЕНИЯ
Эндоцитоз представляет собой процесс, посредством которого клетки поглощают большие молекулы внутрь клетки. В то же время, экзоцитоз представляет собой процесс, посредством которого клетки секретируют внутриклеточные материалы или содержимое из клетки. Существуют многочисленные типы клеток, сходным образом выбирающие экзоцитоз для секреции везикулярного содержимого или материалов из клетки. Нейрональные клетки эволюционировали для секреции нейротрансмиттеров посредством экзоцитоза для их намеченных физиологических ролей для коммуникации с соседними нейрональными клетками или с соседними тканями. В качестве другого примера экзоцитоза, тучные клетки высвобождают гистамин посредством экзоцитоза и в результате привлекают иммуноциты.
Секреторные везикулы содержат различные типы везикулярных материалов, которые могут меняться в зависимости от типа клеток. Например, пресинаптические везикулы в нейрональных клетках локализованы в пресинаптических нейрональных окончаниях и содержат коктейль нейротрансмиттеров. Везикулярная мембрана сливается с плазматической мембраной для высвобождения нейротрансмиттеров в область синапса для физиологического контроля или влияния на соседние клетки или ткани. β-клетки в панкреатических островках имеют везикулы, нагруженные инсулином, и везикулы подвергаются экзоцитозу, включающему слияние мембран для высвобождения инсулина в кровоток в ответ на уровень глюкозы в крови. [Cell Metabolism, vol 5, 237-252 (2007)]
Экзоцитоз представляет собой клеточный процесс, включающий слияние везикулярной мембраны с плазматической мембраной. Существует два типа экзоцитоза, т.е. «конститутивный» и «регулируемый». «Конститутивный» экзоцитоз возникает спонтанно без стимулирующего сигнала. В то же время, «регулируемый» экзоцитоз запускается специфическим стимулирующим сигналом, например, увеличением внутриклеточной концентрации иона кальция в моторно-нейрональных клетках. [Ann. Rev. Cell Dev. Biol. vol 16, 19-49 (2000)]
Экзоцитоз в синапсе: Нейрональные клетки осуществляют коммуникацию друг с другом с использованием механизма, называемого «синапсом», специализированного для нейрональных клеток. Процесс экзоцитоза, возникающий в синапсе между соседними нейрональными клетками, схематически проиллюстрирован на фигуре 1A. Сначала везикулы, содержащие частицы нейротрансмиттеров, сливаются с пресинаптической плазматической мембраной в ответ на стимулирующий сигнал, такой как изменение концентрации иона кальция, к которой чувствителен нейрональный аксон. После слияния мембран, частицы нейротрансмиттеров высвобождаются в пресинаптический стык. Затем частицы нейротрансмиттеров диффундируют и связываются с рецепторами нейротрасмиттеров, экспрессированными на дендритной мембране соседней нейрональной клетки. Наконец, рецепторы активируются после образования комплекса с молекулой нейротрасмиттера, и преобразуют нейрональный сигнал, передаваемый от аксона соседней нейрональной клетки.
Экзоцитоз в нервно-мышечном синапсе: Моторные нейроны контролируют движение мышц с использованием экзоцитоза в нервно-мышечном синапсе. В мышцах, аксон моторного нейрона разветвляется на несколько окончаний аксона для формирования синапсов с сарколеммной мембраной клеток мышц, т.е., нервно-мышечных синапсов. [Nat. Rev. Neuroscience, vol 2, 791-805 (2001)] Промежуток между окончанием нейронального аксона и мембраной клеток мышц называют синаптической щелью с размером приблизительно 30 нм.
Когда нервный импульс в форме потенциала действия достигает окончания аксона моторного нейрона, синаптическая передача начинается в нервно-мышечном синапсе. Аксон моторного нейрона высвобождает молекулы нейротрасмиттера (т.е. ацетилхолина у позвоночных) в синаптическую щель посредством экзоцитоза, и рецепторы ацетилхолина, экспрессированные на мембране мышечной клетки, активируются при образовании комплекса с ацетилхолином, что запускает сокращение мышечного волокна. Процесс экзоцитоза, происходящий в нервно-мышечном синапсе между нейрональным аксоном и мышечной клеткой, схематически проиллюстрирован на фигуре 1B.
Белки SNARE и нейрональный экзоцитоз: Слияние везикулярной мембраны и мембраны нейрональной клетки является необходимым для «регулируемого» экзоцитоза. Известно, что такой «регулируемый» экзоцитоз опосредован белками SNARE (белковыми рецепторами растворимого чувствительного к N-этилмалеинимиду фактора присоединения). [Ann. Rev. Cell Dev. Biol. vol 16, 19-49 (2000)]. В нейрональный экзоцитоз вовлечены три белка SNARE, т.е., ассоциированный с везикулами мембранный белок (VAMP2, также известный как синаптобревин), однопроходный трансмембранный белок, локализованный на везикулярной мембране (v-SNARE); ассоциированный с синаптосомой белок 25 кДа (SNAP25); и синтаксин 1A, однопроходный трансмембранный белок, находящийся в плазматической мембране нейронов (t-SNARE). Синтаксин 1A и VAMP2 имеют C-концевой трансмембранный домен для заякоривания в везикулярной мембране и плазматической мембране нейронов, соответственно. Заякориванию SNAP25 в мембране способствуют пальмитоильные группы, ковалентно присоединенные к нескольким остаткам цистеина в белке. [Am. J. Physiol. Cell Physiol. vol 285, C237-249 (2003)]
Потенциал нейронального аксона активирует потенциалзависимые кальциевые каналы и увеличивает концентрацию иона кальция в аксоне, осаждает синаптические везикулы около пресинаптической мембраны посредством образования комплексов ионов кальция с синаптотагмином. Затем это способствует слиянию мембраны синаптической везикулы с плазматической мембраной аксона, как схематически проиллюстрировано на фигуре 2A. Формирование троичного комплекса синтаксина, SNAP25 и синаптобревина ориентирует две мембраны в тесном соседстве и затем подвергает их слиянию мембран для высвобождения частиц ацетилхолина в синаптическую щель. [Toxins vol 2, 24-53 (2010)] Таким образом, формирование троичного комплекса из белков SNARE является необходимым элементом слияния мембран, вовлеченного в высвобождение нейротрансмиттеров.
Ботулинический токсин A: Ботулинический токсин (BTX) представляет собой нейротоксин, продуцируемый бактерией Clostridium botulinum. Активная форма токсина представляет собой одиночные полипептидные цепи (150 кДа), состоящие из тяжелой (100 кДа) и легкой (50 кДа) цепи, связанные друг с другом дисульфидной связью. Известно, что BTX легко поглощается нейрональной клеткой, расщепляет белки SNARE, блокирует высвобождение ацетилхолина, и в результате лишает нейрональную клетку неотъемлемого признака нейрональной клетки. Нейрональные клетки, подвергнутые воздействию BTX, не могут запускать сокращение соседних мышечных волокон.
После проникновения в нейрональную клетку, BTX расщепляется на две части, т.е. легкую и тяжелую цепь. Легкая цепь представляет собой цинковую металлопротеиназу, ответственную за роль в качестве нейротоксина. BTX подтипов A, C и E расщепляют SNAP25. В то же время, подтипы B, D, F и G вызывают деградацию VAMP, и подтип C гидролизует синтаксин. [Nature, vol 365, 160-163 (1993)].
Косметическое применение ботулинического токсина A: Ботулинический токсин A исходно разработан в Allergan для косметического применения в основном для лечения морщин на лице. Ботокс® представляет собой известное фирменное наименование, зарегистрированное Allergan, и его часто принимают в качестве синонима BTX в публичных сообществах.
Принимая во внимание его физиологическую активность, BTX A можно, в принципе, использовать для лечения ряда нарушений, включающих гиперактивные сокращения или спазмы мышц головы и шеи, века, конечностей, челюсти и голосовых связок. Кроме того, BTX можно использовать для лечения гиперсекреторных нарушений, включая гиперсаливацию и гипергидроз. [Indian J. Dermatol. vol 55, 8-14 (2010)]
Инъекция ботокса® одобрена FDA США в 2002 г. для лечения морщин на лице, и ее рассматривают как безопасную при надлежащем практическом осуществлении специалистами в области дерматологии. Однако BTX является печально известным из-за его токсичности. Определили, что, например, BTX типа A и B являются летальными для человека при внутривенной инъекции при 1,3 ~ 2,1 нг/кг. [Indian J. Dermatol. vol 55, 8-14 (2010)] Все еще существуют опасения относительно безопасности BTX для косметического применения. Паралич лица, слабость мышц и проблемы с глотанием являются наиболее распространенными неблагоприятными событиями, наблюдаемыми у субъектов, которым вводили внутримышечную инъекцию BTX. Более тяжелые побочные эффекты вызываются при системном воздействии из-за передозировки или плохой квалификации при местной внутримышечной инъекции, и включают головную боль, гриппоподобные синдромы и аллергические реакции. Известно, что повторяющиеся инъекции BTX индуцируют антигенные ответы, что ограничивает косметическое применение BTX. Побочные эффекты при терапевтическом применении могут быть более тяжелыми, чем при косметическом применении, и могут включать аритмию, сердечный приступ, судороги, остановку дыхания и смерть. [J. Am. Acad. Dermatol. vol 53, 407-415 (2005)]
Для минимизации побочных эффектов у субъектов, которым инъецируют BTX для косметического применения, локализованная или местная доставка BTX может быть очень предпочтительной вместо общепринятого способа внутримышечной местной инъекции. BTX представляет собой макромолекулу размером 150K. Все еще является необычайной проблемой местная доставка BTX глубоко в мышечный слой, расположенный ниже дермы, не основанная на инвазивных составах.
Аргирелин: Аргирелин представляет собой синтетический гексапептид, происходящий из N-конца белка SNAP25. Аргирелин представлен на рынке в форме косметических продуктов против морщин на лице. Заявлено, что этот гексапептид проявляет антагонизм к формированию комплекса SNARE с белком SNAP25. Гексапептид имитирует функцию BTX, и его можно использовать для уменьшения морщин на лице при местном введении. Опубликовано, что аргирелин уменьшает морщины на лице у субъектов-людей при местном использовании. [Am. J. Clin. Dermatol. vol 14(2), 147-153 (2013)]
Пре-мРНК: Генетическую информацию несет ДНК (2-дезоксирибонуклеиновая кислота). ДНК транскрибируется с получением пре-мРНК (прематричной рибонуклеиновой кислоты) в ядре. Пре-мРНК млекопитающих обычно состоит из экзонов и интронов, и экзон и интрон соединены друг с другом, как схематически представлено ниже. Экзоны и интроны пронумерованы, как схематически проиллюстрировано на фигуре 2B.
Сплайсинг пре-мРНК: Пре-мРНК процессируется в мРНК после делеции интронов посредством серий комплексных реакций, совместно называемых «сплайсингом», как схематически обобщено на фигуре 3A. [Ann. Rev. Biochem. 72(1), 291-336 (2003); Nature Rev. Mol. Cell Biol. 6(5), 386-398 (2005); Nature Rev. Mol. Cell Biol. 15(2), 108-121 (2014)] Сплайсинг инициируется посредством формирования «комплекса сплайсингосомы E» (т.е. раннего комплекса сплайсингосомы) между пре-мРНК и адаптерными факторами сплайсинга. В «комплексе сплайсингосомы E», U1 связывается со стыком экзона N и интрона N, и U2AF35 связывается со стыком интрона N и экзона (N+1). Таким образом, стыки экзон/интрон или интрон/экзон являются критическими для формирования раннего комплекса сплайсингосомы. «Комплекс сплайсингосомы E» эволюционирует до «комплекса сплайсингосомы A» при дополнительном образовании комплекса с U2. «Комплекс сплайсингосомы A» подвергается серии комплексных реакций для делеции или сплайсинга интрона для стыковки соседних экзонов.
Рибосомальный синтез белков: Белки кодированы посредством ДНК (2-дезоксирибонуклеиновой кислоты). В ответ на клеточную стимуляцию или спонтанно, ДНК подвергается транскрипции с получением пре-мРНК (прематричной рибонуклеиновой кислоты) в ядре. Интроны пре-мРНК подвергаются ферментному сплайсингу с получением мРНК (матричной рибонуклеиновой кислоты), которая затем подвергается транслокации в цитоплазму. В цитоплазме, комплекс аппарата трансляции, называемый рибосомой, связывает мРНК и осуществляет синтез белка, по мере того, как он сканирует генетическую информацию, кодированную на протяжении мРНК. [Biochemistry vol 41, 4503-4510 (2002); Cancer Res. vol 48, 2659-2668 (1988)]
Антисмысловой олигонуклеотид (ASO): Олигонуклеотид, связывающийся с нуклеиновой кислотой, включая ДНК, мРНК и пре-мРНК, специфическим для последовательности образом (т.е., комплементарно), называют антисмысловым олигонуклеотидом (ASO).
Если ASO тесно связывается с мРНК в цитоплазме, например, ASO может являться способным ингибировать рибосомальный синтез белка на протяжении мРНК. ASO необходимо присутствовать в цитоплазме, чтобы ингибировать рибосомальный синтез белка для своего белка-мишени.
Если ASO тесно связывается с пре-мРНК в ядре, ASO может являться способным ингибировать или модулировать сплайсинг пре-мРНК до мРНК. ASO необходимо присутствовать в ядре, чтобы ингибировать или модулировать сплайсинг пре-мРНК до мРНК. Такое антисмысловое ингибирование сплайсинга приводит к образованию одной или нескольких мРНК, лишенных экзона, на который нацелен ASO. Такую мРНК(несколько мРНК) называют «вариантом(вариантами) сплайсинга», и она кодирует белок(белки), меньшие, чем белок, кодированнный полноразмерной мРНК.
В принципе, сплайсинг можно прерывать посредством ингибирования формирования «комплекса сплайсингосомы E». Если ASO тесно связывается со стыком (5' → 3') экзон-интрон, т.е. «5'-участком сплайсинга», ASO блокирует формирование комплекса между пре-мРНК и фактором U1, и таким образом, формирование «комплекса сплайсингосомы E». Подобным образом, «комплекс сплайсингосомы E» не может быть сформирован, если ASO тесно связывается со стыком (5' → 3') интрон-экзон, т.е. «3'-участком сплайсинга». 3'-участок сплайсинга и 5'-участок сплайсинга схематически проиллюстрированы на фигуре 3B.
Неприродные олигонуклеотиды: ДНК- или РНК-олигонуклеотиды являются чувствительными к деградации эндогенными нуклеазами, ограничивающей их терапевтическую полезность. До настоящего времени, множество типов неприродных (т.е., не встречающихся в природе) олигонуклеотидов разработаны и интенсивно изучены. [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)] для некоторых из них показана усиленная устойчивость к метаболизму по сравнению с ДНК и РНК. На фигуре 4A представлены химические структуры для некоторых из репрезентативных неприродных олигонуклеотидов. Такие олигонуклеотиды предсказуемо связываются с комплементарной нуклеиновой кислотой, как связывается ДНК или РНК.
Фосфоротиоатный олигонуклеотид: Фосфоротиоатный олигонуклеотид (PTO) представляет собой аналог ДНК с одним из атомов кислорода фосфата остова, замененным на атом серы на мономер. Такое небольшое структурное изменение делает PTO сравнительно устойчивым к деградации эндогенными нуклеазами. [Ann. Rev. Biochem. vol 54, 367-402 (1985)]
Как отражение структурного сходства остова PTO и ДНК, они оба плохо проникают через мембрану клетки в большинстве типов клеток млекопитающих. Однако, для некоторых типов клеток, в большом количестве экспрессирующих транспортер(ы) ДНК, для ДНК и PTO показано хорошее проникновение в клетки. Известно, что системно введенные PTO легко распространяются в печень и почки. [Nucleic Acids Res. vol 25, 3290-3296 (1997)]
Для облегчения проникновения PTO в клетки in vitro, липофекция является общепринятой. Однако липофекция физически изменяет мембрану клетки, вызывает цитотоксичность, и таким образом, не может являться идеальной для долгосрочного терапевтического применения in vivo.
На протяжении последних 30 лет, антисмысловые PTO и варианты PTO клинически оценивали для лечения злокачественных опухолей, иммунологических нарушений, метаболических заболеваний, и т.д. [Biochemistry vol 41, 4503-4510 (2002); Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)] Множество таких антисмысловых лекарственных средств-кандидатов не были успешно разработаны, частично, из-за плохой проницаемости клеток для PTO. Для преодоления плохой проницаемости клеток, PTO необходимо вводить в высокой дозе для терапевтической активности. Однако, известно, что PTO имеют ограничивающую дозу токсичность, включая увеличенное время свертывания, активацию комплемента, тубулярную нефропатию, активацию клеток Купфера и иммуностимуляцию, включая спленомегалию, лимфоидную гиперплазию, инфильтрацию мононуклеарных клеток. [Clin. Exp. Pharmacol. Physiol. vol 33, 533-540 (2006)]
Обнаружено, что многие антисмысловые PTO имеют клиническую активность против заболеваний с значительным затрагиванием печени или почек. Мипомерсен представляет собой аналог PTO, ингибирующий синтез apoB-100, белка, вовлеченного в траспорт холестерина LDL. Мипомерсен проявлял терапевтическую активность в популяции пациентов с атеросклерозом, наиболее вероятно, из-за его предпочтительного распределения в печени. [Circulation vol 118(7), 743-753 (2008)] ISIS-113715 представляет собой антисмысловой аналог PTO, который ингибирует синтез белка тирозин-фосфатазы 1B (PTP1B) и, как обнаружено, имеет терапевтическую активность у пациентов с диабетом типа II. [Curr. Opin. Mol. Ther. vol 6, 331-336 (2004)]
Запертая нуклеиновая кислота: В запертой нуклеиновой кислоте (ЗНК), рибозное кольцо остова РНК является структурно ограниченным для увеличения аффинности связывания для РНК или ДНК. Таким образом, ЗНК можно рассматривать как высокоаффинный аналог ДНК или РНК. [Biochemistry vol 45, 7347-7355 (2006)]
Фосфородиамидатный морфолиновый олигонуклеотид: В фосфородиамидатном морфолиновом олигонуклеотиде (PMO), фосфат остова и 2-дезоксирибоза ДНК заменены на фосфорамидат и морфолин, соответственно. [Appl. Microbiol. Biotechnol. vol 71, 575-586 (2006)] В то время как остов ДНК заряжен отрицательно, остов PMO не заряжен. Таким образом, связывание между PMO и РНК является свободным от электростатического отталкивания между остовами, и имеет тенденцию являться более сильным, чем связывание между ДНК и РНК. Поскольку PMO структурно очень отличается от ДНК, PMO не могут быть узнаны печеночным транспортером(транспортерами), узнающими ДНК или РНК. Тем не менее, PMO не проникает легко через мембрану клетки.
Пептидная нуклеиновая кислота: Пептидная нуклеиновая кислота (ПНК) представляет собой полипептид с N-(2-аминоэтил)глицином в качестве остова звена, и открыта Dr. Nielsen и соавторами. [Science vol 254, 1497-1500 (1991)] Химическая структура и сокращенная номенклатура ПНК проиллюстрированы на фигуре 4B. Подобно ДНК и РНК, ПНК также избирательно связывается с комплементарной нуклеиновой кислотой. [Nature (London) vol 365, 566-568 (1992)] При связывании с комплементарной нуклеиновой кислотой, N-конец ПНК рассматривают как эквивалентный «5'-концу» ДНК или РНК, и C-конец ПНК - как эквивалентный «3'-концу» ДНК или РНК.
Подобно PMO, остов ПНК не заряжен. Таким образом, связывание между ПНК и РНК имеет тенденцию являться более сильным, чем связывание между ДНК и РНК. Поскольку ПНК заметно отличается от ДНК по химической структуре, ПНК не может быть узнана печеночным транспортером(транспортерами), узнающими ДНК, и может иметь профиль распределения в тканях, отличный от профиля ДНК или PTO. Однако, ПНК так же плохо проникает через мембрану клеток млекопитающих. (Adv. Drug Delivery Rev. vol 55, 267-280, 2003)
Модифицированные нуклеиновые основания для улучшения проницаемости мембраны для ПНК: ПНК придавали высокую интенсивность проникновения через мембрану клеток млекопитающих посредством введения модифицированных нуклеиновых оснований (т.е., оснований) с ковалентно присоединенными к ним катионным липидом или его эквивалентом, как проиллюстрировано на фигуре 4C. Обнаружено, что такие модифицированные нуклеиновые основания из цитозина, аденина и гуанина предсказуемо и комплементарно гибридизуются с гуанином, тимином и цитозином, соответственно. [PCT Appl. No. PCT/KR2009/001256; EP2268607; US8680253]
Включение таких модифицированных нуклеиновых оснований в ПНК имитирует ситуацию липофекции. Посредством липофекции, молекулы олигонуклеотида с фосфатным остовом оборачивают молекулами катионного липида, такого как липофектамин, и такой комплекс липофектамин/олигонуклеотид проявляет тенденцию к несколько более простому проникновению через мембрану клетки, по сравнению с молекулой голого олигонуклеотида.
Обнаружено, что, в дополнение к хорошей способности к проникновению через мембрану, эти производные ПНК имеют сверхсильную аффинность для комплементарной нуклеиновой кислоты. Например, введение от 4 до 5 модифицированных нуклеиновых оснований в 11- - 13-членные производные ПНК легко приводит к увеличению Tm на 20°C или выше при формировании дуплекса с комплементарной ДНК. Такие производные ПНК являются высоко чувствительными к одиночному несовпадению оснований. Одиночное несовпадение оснований приводит к уменьшению Tm на 11-22°C, в зависимости от типа модифицированного основания, так же как последовательности ПНК.
Малая интерферирующая РНК (миРНК): Малая интерферирующая РНК (миРНК) относится к двухцепочечной РНК из 20-25 пар оснований. [Microbiol. Mol. Biol. Rev. vol 67(4), 657-685 (2003)] Антисмысловая цепь миРНК некоторым образом взаимодействует с белками с формированием «индуцированного РНК комплекса молчания» (RISC). Затем RISC связывается с определенной частью мРНК, комплементарной антисмысловой цепи миРНК. мРНК в комплексе с RISC подвергается расщеплению с получением другой копии двухцепочечной миРНК. Таким образом, миРНК каталитически индуцирует расщепление своей мРНК-мишени, и следовательно, ингибирует экспрессию белка посредством мРНК. RISC не всегда связывается с полностью комплементарной последовательностью в своей мРНК-мишени, что вызывает опасения относительно неспецифических эффектов терапии миРНК. Подобно другим классам олигонуклеотидов с ДНК- или РНК-остовом, миРНК имеет плохое проникновение в клетки и таким образом, имеет тенденцию к плохой терапевтической активности in vitro или in vivo, если не будет надлежащим образом составлена или химически модифицирована, чтобы иметь хорошее проникновение через мембрану.
ASO и миРНК SNAP25: ASO и миРНК SNAP25 оценивали в первую очередь как биологический инструмент для лучшего понимания физиологических ролей белка SNAP25 в нейрональных клетках. [Nature vol 364, 445-448 (1993); Eur. J. Neurosci. vol 20(6), 1593-1603 (2004); EMBO Reports vol 14(7) 645-651 (2013); J. Biol. Chem. vol 281(38), 28174-28184 (2006)] Олигонуклеотиды, осуществляющие понижающую регуляцию активности белка SNAP25, еще необходимо исследовать для местного применения, для безопасной имитации обеспечивающих преимущества видов терапевтической активности BTX. Следует отметить, что трансдермальная доставка является огромной технической проблемой в области олигонуклеотидов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1A. Схематическая иллюстрация процесса экзоцитоза, возникающего в синапсе между двумя соседними нейрональными клетками.
Фигура 1B. Схематическая иллюстрация процесса экзоцитоза, возникающего в нервно-мышечном синапсе между нейрональным аксоном и мышечной клеткой.
Фигура 2A. Схематическая иллюстрация слияния мембраны синаптической везикулы с плазматической мембраной аксона.
Фигура 2B. Схематическая иллюстрация нумерации экзонов и интронов в пре-мРНК.
Фигура 3A. Схематическая иллюстрация процесса сплайсинга, приводящего к делеции интрона N.
Фигура 3B. Схематическая иллюстрация 3'-участка сплайсинга и 5'-участка сплайсинга, применительно к комплексу сплайсингосомы E.
Фигура 4A. Репрезентативная химическая структура ДНК и неприродных нуклеиновых кислот.
Фигура 4B. Иллюстрация химической структуры и сокращенной номенклатуры ПНК.
Фигура 4C. Примеры модифицированных нуклеиновых оснований, используемых для улучшения проницаемости клеток для пептидной нуклеиновой кислоты.
Фигура 5. Примеры природных или неприродных (модифицированных) нуклеиновых оснований, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 6A. Примеры замещенных или незамещенных алкильных радикалов, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 6B. Примеры замещенных или незамещенных алкилацильных, и замещенных или незамещенных арилацильных радикалов, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 6C. Примеры замещенных алкиламино-, замещенных ариламино-, замещенных или незамещенных арильных, замещенных или незамещенных алкилсульфонильных, замещенных или незамещенных арилсульфонильных, замещенных или незамещенных алкилфосфонильных, и замещенных или незамещенных арилфосфонильных радикалов, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 6D. Примеры замещенных или незамещенных алкилоксикарбонильных, замещенных или незамещенных арилоксикарбонильных, замещенных или незамещенных алкиламинокарбонильных и замещенных или незамещенных ариламинокарбонильных радикалов, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 6E. Примеры замещенных или незамещенных алкилокситиокарбонильных, замещенных или незамещенных алкиламинотиокарбонильных, замещенных или незамещенных ариламинотиокарбонильных и замещенных или незамещенных алкилокситиокарбонильных радикалов, которые можно выбирать для производного пептидной нуклеиновой кислоты формулы I.
Фигура 7. Химическая структура мономеров ПНК, сокращенно обозначенных как A (аденин), G (гуанин), T (тимин), C (цитозин), C(pOq), A(p), A(pOq), G(p) и G(pOq).
Фигура 8. Химическая структура для сокращенных наименований, используемых для описания заместителей для N-конца или C-конца ПНК.
Фигура 9. Химическая структура 14-членного производного ПНК, сокращенно обозначенного как «(N → C) Fethoc-GA(5)A-C(1O2)TT-A(5)TC-CTA(5)-C(1O2)T-NH2».
Фигура 10. Химическая структура 15-членного производного ПНК, сокращенно обозначенного как «(N → C) Fmoc-Val-CTC(1O2)-A(5)TC-CTA(6)-C(1O3)TT-AA(2O2)C-NH2».
Фигура 11. Химическая структура иллюстративных Fmoc-мономеров ПНК, используемых для синтеза производных ПНК по настоящему изобретению.
Фигура 12. Схематическая иллюстрация типичного цикла удлинения мономера, принятого в SPPS по настоящему изобретению.
Фигура 13A. Хроматограмма C18-обращеннофазовой HPLC для «ASO 1» до очистки посредством HPLC.
Фигура 13B. Хроматограмма C18-обращеннофазовой HPLC для «ASO 1» после очистки посредством HPLC.
Фигура 14. Данные масс-спектрометрии ES-TOF, полученные с использованием «ASO 1» после очистки посредством HPLC.
Фигура 15A. Данные электрофоретического анализа для продуктов гнездовой ПЦР в клетках PC12, обработанных с использованием 0 (отрицательный контроль), 10, 100 или 1000 зМ «ASO 3» (вверху); вместе с диаграммой, иллюстрирующей размеры ампликонов продуктов ПЦР для полноразмерной мРНК и мРНК - вариантов сплайсинга с пропуском экзонов (внизу).
Фигура 15B. Данные секвенирования по Сенджеру для продукта ПЦР, приписанного пропуску экзонов 5-7.
Фигура 16A. Изменения уровня полноразмерной мРНК SNAP25 в клетках PC12, обработанных с использованием «ASO 3» при 0 (отрицательный контроль), 10, 100 или 1000 зМ. (планки погрешностей для стандартной ошибки)
Фигура 16B. Изменения уровня полноразмерной мРНК SNAP25 в клетках PC12, обработанных с использованием «ASO 1» при 0 (отрицательный контроль), 10, 100 или 1000 зМ. (планки погрешностей для стандартной ошибки)
Фигура 17A. Данные Вестерн-блоттинга SNAP25 (верхняя диаграмма) и относительные уровни экспрессии SNAP25, нормализованные по β-актину (нижняя диаграмма) в клетках PC12 обработанных с использованием «ASO 3» в течение 48 часов при 0 зМ (отрицательный контроль), 1 зМ, 10 зМ, 30 зМ, 100 зМ, 300 зМ, 1 аМ, 3 аМ или 10 аМ.
Фигура 17B. Данные Вестерн-блоттинга SNAP25 в клетках PC12, обработанных с использованием «ASO 1» при 0 (отрицательный контроль), 100 или 1000 зМ, либо в течение 48 часов, либо в течение 72 часов.
Фигура 18. Изображения IHC SNAP25 для образцов кожи мышей, подвергнутых местному введению «ASO 1» при 0 (отрицательный контроль), 1, 10 и 100 фМ, BID в течение четырех суток.
Фигура 19A. Данные Вестерн-блоттинга SNAP25 (верхняя диаграмма) и относительные уровни экспрессии SNAP25, нормализованные по β-актину (нижняя диаграмма), в клетках SiMa, обработанных с использованием «ASO 3» в течение 48 часов при 0 зМ (отрицательный контроль), 1 зМ, 10 зМ, 100 зМ, 1 аМ, 10 аМ или 100 аМ.
Фигура 19B. Изменения уровня полноразмерной мРНК SNAP25 в клетках SiMa, обработанных с использованием «ASO 3» при 0 зМ (отрицательный контроль), 1 зМ, 10 зМ, 100 зМ, 1 аМ, 10 аМ или 100 аМ. (планки погрешностей для стандартной ошибки)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
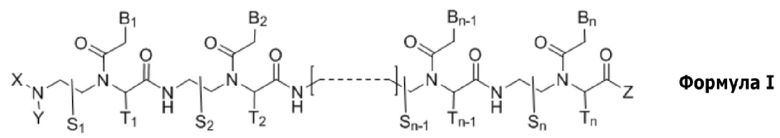
Настоящее изобретение относится к производному пептидной нуклеиновой кислоты, представленному формулой I, или его фармацевтически приемлемой соли:
 ,
,
где
n представляет собой целое число между 10 и 25;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека, или частично комплементарным пре-мРНК SNAP25 человека с одним или двумя несовпадениями;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо представляют собой дейтеридо- [D], гидридо- [H], замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо-, формильный [H-C(=O)-], аминокарбонильный [NH2-C(=O)-], аминотиокарбонильный [NH2-C(=S)-], замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкиламинотиокарбонильный, замещенный или незамещенный ариламинотиокарбонильный, замещенный или незамещенный алкилокситиокарбонильный, замещенный или незамещенный арилокситиокарбонильный, замещенный или незамещенный алкилсульфонильный, замещенный или незамещенный арилсульфонильный, замещенный или незамещенный алкилфосфонильный радикал, или замещенный или незамещенный арилфосфонильный радикал;
Z представляет собой гидридо-, гидрокси, замещенный или незамещенный алкилокси-, замещенный или незамещенный арилокси-, замещенный или незамещенный амино-, замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований с замещенным или незамещенным амино-радикалом, ковалентно связанным с группой нуклеинового основания.
Соединение формулы I индуцирует пропуск «экзона 7» в пре-мРНК SNAP25 человека, с получением варианта(вариантов) сплайсинга мРНК SNAP25 человека, лишенных «экзона 7», и таким образом, его можно использовать для ингибирования функциональной активности гена, транскрибирующего пре-мРНК SNAP25 человека.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
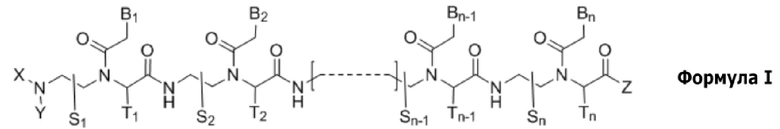
Настоящее изобретение относится к производному пептидной нуклеиновой кислоты, представленному формулой I, или его фармацевтически приемлемой соли:
 ,
,
где
n представляет собой целое число между 10 и 25;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека или частично комплементарным пре-мРНК SNAP25 человека с одним или двумя несовпадениями;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо представляют собой дейтеридо- [D], гидридо- [H], замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо-, формильный [H-C(=O)-], аминокарбонильный [NH2-C(=O)-], аминотиокарбонильный [NH2-C(=S)-], замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкиламинотиокарбонильный, замещенный или незамещенный ариламинотиокарбонильный, замещенный или незамещенный алкилокситиокарбонильный, замещенный или незамещенный арилокситиокарбонильный, замещенный или незамещенный алкилсульфонильный, замещенный или незамещенный арилсульфонильный, замещенный или незамещенный алкилфосфонильный радикал, или замещенный или незамещенный арилфосфонильный радикал;
Z представляет собой гидридо-, гидрокси-, замещенный или незамещенный алкилокси-, замещенный или незамещенный арилокси-, замещенный или незамещенный амино-, замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований с замещенным или незамещенным амино-радикалом, ковалентно связанным с группой нуклеинового основания.
Соединение формулы I индуцирует пропуск «экзона 7» в пре-мРНК SNAP25 человека, с получением варианта(вариантов) сплайсинга мРНК SNAP25 человека, лишенных «экзона 7», и таким образом, его можно использовать для ингибирования функциональной активности гена, транскрибирующего пре-мРНК SNAP25 человека.
Условие, принятое для описания соединения формулы I, что «n представляет собой целое число между 10 и 25», буквально означает, что n представляет собой целое число, которое можно выбирать из группы целых чисел из 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 и 24.
Соединение формулы I комплементарно связывается с 3'-участком сплайсинга «экзона 7» пре-мРНК SNAP25 человека, считанной с гена SNAP25 человека [доступная из NCBI эталонная последовательность: NG_029626.1]. 14-членная последовательность [(5' → 3') AUCCCAGGGUAACA], перекрывающая стык «интрона 6» и «экзона 7» в пре-мРНК SNAP25 человека, представляет собой 3'-участок сплайсинга, состоящий 7-членника из «интрона 6» и 7-членника из «экзона 7». Таким образом, 14-членную последовательность пре-мРНК можно общепринятым образом обозначать как [(5' → 3') aucccag┃GGUAACA], где последовательность интрона и экзона обозначены «строчными» и «заглавными» буквами, соответственно, и стык интрон-экзон обозначен «┃». Общепринятое обозначение пре-мРНК дополнительно проиллюстрировано 30-членной последовательностью [(5' → 3') cucuuuggaucccag┃GGUAACAAAUGAUGC], перекрывающей стык «интрона 6» и «экзона 7» в пре-мРНК SNAP25 человека. Нумерация экзонов может меняться в зависимости от опубликованных транскриптов мРНК SNAP25. Предоставление 30-членной последовательности SNAP25 предназначено для однозначной идентификации участка сплайсинга - мишени для соединения формулы I, вне зависимости от нумерации экзонов мРНК SNAP25.
Химическая структура природных (т.е., встречающихся в природе) или неприродных (т.е., не встречающихся в природе) нуклеиновых оснований в производном ПНК формулы I проиллюстрирована на фигуре 5. Природные или неприродные нуклеиновые основания по настоящему изобретению включают, но без ограничения, нуклеиновые основания, представленные на фигуре 5. Представление природных и неприродных нуклеиновых оснований предназначено для иллюстрации разнообразия допустимых нуклеиновых оснований, и таким образом, его не следует интерпретировать как ограничение объема настоящего изобретения.
Заместители, принятые для описания производного ПНК формулы I, проиллюстрированы на фигурах 6 A-E. На фигуре 6A представлены примеры замещенных или незамещенных алкильных радикалов. Замещенные или незамещенные алкилацильные и замещенные или незамещенные арилацильные радикалы проиллюстрированы на фигуре 6B. На фигуре 6C проиллюстрированы примеры замещенных алкиламино-, замещенных ариламино-, замещенных или незамещенных арильных, замещенных или незамещенных алкилсульфонильных, замещенных или незамещенных арилсульфонильных, замещенных или незамещенных алкилфосфонильных, и замещенных или незамещенных арилфосфонильных радикалов. На фигуре 6D представлены примеры замещенных или незамещенных алкилоксикарбонильных, замещенных или незамещенных арилоксикарбонильных, замещенных или незамещенных алкиламинокарбонильных, и замещенных или незамещенных ариламинокарбонильных радикалов. На фигуре 6E представлены примеры замещенных или незамещенных алкилокситиокарбонильных, замещенных или незамещенных алкиламинотиокарбонильных, замещенных или незамещенных ариламинотиокарбонильных и замещенных или незамещенных алкилокситиокарбонильных радикалов. Представление таких заместителей в качестве примеров предназначено для иллюстрации разнообразия допустимых заместителей, и таким образом, его не следует интерпретировать как ограничение объема настоящего изобретения. Специалисту в данной области хорошо понятно, что олигонуклеотидная последовательность является более важным фактором для специфического для последовательности связывания олигонуклеотида с последовательностью-мишенью пре-мРНК, чем заместители на N-конце или C-конце.
Соединение формулы I тесно связывается с комплементарной ДНК, как проиллюстрировано на предшествующем уровне техники [PCT/KR2009/001256]. Дуплекс между производным ПНК формулы I и комплементарной ему полноразмерной ДНК или РНК имеет значение Tm, слишком высокое для надежного определения в водном буфере. Для соединения ПНК формулы I получены высокие значения Tm с использованием комплементарных ДНК меньшей длины.
Соединение формулы I тесно связывается с целевым 3'-участкосм сплайсинга пре-мРНК SNAP25 человека, трнскрибированной с гена SNAP25 человека, и мешает формированию «раннего комплекса сплайсингосомы», включающего экзон-мишень для указанного соединения. Поскольку соединение по настоящему изобретению пространственно ингибирует формирование «раннего комплекса сплайсингосомы», «экзон 7» SNAP25 подвергается сплайсингу с получением варианта(вариантов) сплайсинга мРНК SNAP25, лишенных «экзона 7». Следовательно, соединение по настоящему изобретению индуцирует пропуск «экзона 7» SNAP25.
Благодаря сильной аффинности указанного соединения для комплементарной последовательности пре-мРНК, соединение по настоящему изобретению может также тесно связываться с частично комплементарной последовательностью пре-мРНК с одним или двумя несовпадениями и индуцировать пропуск экзона-мишени в пре-мРНК SNAP25.
Соединение формулы I имеет хорошую способность к проникновению в клетки, и его можно легко доставлять в клетку в форме «голого» олигонуклеотида, как проиллюстрировано на предшествующем уровне техники [PCT/KR2009/001256]. Таким образом, соединение по настоящему изобретению индуцирует пропуск «экзона 7» в пре-мРНК SNAP25 с получением варианта(вариантов) сплайсинга мРНК SNAP25, лишенных «экзона 7» SNAP25, в клетках, обработанных с использованием соединения формулы I в форме «голого» олигонуклеотида. Соединение формулы I не требует никаких средств или составов для доставки в клетку для активной индукции пропуска экзона-мишени в клетках. Соединение формулы I легко индуцирует пропуск «экзона 7» SNAP25 в клетках, обработанных с использованием соединения по настоящему изобретению в форме «голого» олигонуклеотида в субфемтомолярной концентрации.
Благодаря его хорошей способности проникать в клетку или мембрану, производное ПНК формулы I можно вводить местно в форме «голого» олигонуклеотида для индукции пропуска «экзона 7» SNAP25 в коже-мишени. Указанное соединение не требует составления для усиления трансдермальной доставки в ткань-мишень для намеченной терапевтической или биологической активности. Обычно соединение формулы I растворяют в воде и сорастворителе, и местно или трансдермально вводят в субпикомолярной концентрации для вызова желательной терапевтической или биологической активности около участка дермального введения. Соединение по настоящему изобретению не обязательно включать в концентрированный или инвазивный состав для проявления местной терапевтической активности.
Соединение формулы I можно использовать в форме комбинации с фармацевтически приемлемыми кислотой или основанием, включая, но без ограничения, гидроксид натрия, гидроксид калия, соляную кислоту, метансульфоновую кислоту, лимонную кислоту, трифторуксусную кислоту и т.д.
Производное ПНК формулы I или его фармацевтически приемлемую соль можно вводить субъекту в комбинации с фармацевтически приемлемым адъювантом, включая, но без ограничения, лимонную кислоту, соляную кислоту, виннокаменную кислоту, стеариновую кислоту, полиэтиленгликоль, полипропиленгликоль, этанол, изопропанол, бикарбонат натрия, дистиллированную воду, консервант(ы) и т.д.
Соединение по настоящему изобретению можно местно вводить субъекту в терапевтически или биологически эффективной концентрации в диапазоне от 1 аМ (т.е., 10-18 M) до более, чем 1 нМ, которая может меняться в зависимости от расписания дозирования, условий или ситуаций для субъекта и т.д.
Предпочтительным является производное ПНК формулы I или его фармацевтически приемлемая соль:
, где
n представляет собой целое число между 10 и 25;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека, или частично комплементарным пре-мРНК SNAP25 человека с одним или двумя несовпадениями;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn независимо представляют собой дейтеридо-, гидридо-, замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
X и Y независимо представляют собой гидридо-, формильный, аминокарбонильный, аминотиокарбонильный, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкиламинотиокарбонильный, замещенный или незамещенный ариламинотиокарбонильный, замещенный или незамещенный алкилокситиокарбонильный, замещенный или незамещенный арилокситиокарбонильный, замещенный или незамещенный алкилсульфонильный, замещенный или незамещенный арилсульфонильный, замещенный или незамещенный алкилфосфонильный радикал, или замещенный или незамещенный арилфосфонильный радикал;
Z представляет собой гидридо-, гидрокси, замещенный или незамещенный алкилокси, замещенный или незамещенный арилокси, замещенный или незамещенный амино, замещенный или незамещенный алкильный, или замещенный или незамещенный арильный радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и,
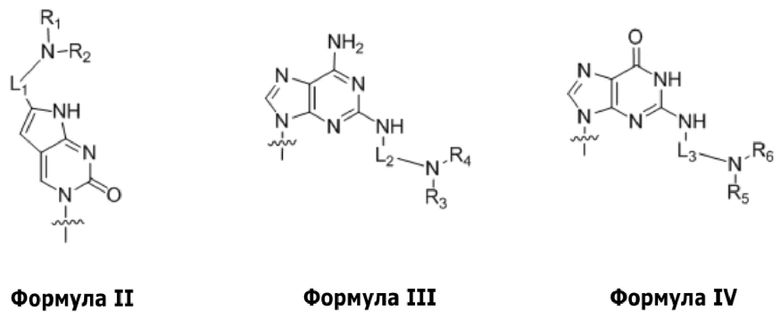
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV:
 ,
,
где
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо- и замещенного или незамещенного алкильного радикала;
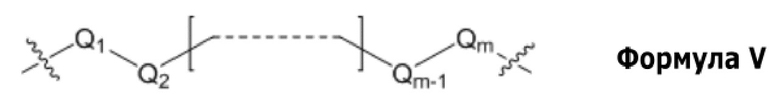
L1, L2 и L3 представляют собой ковалентный линкер, представленный формулой V, ковалентно связывающий основную аминогруппу с группой нуклеинового основания:
 ,
,
где
Q1 и Qm представляют собой замещенный или незамещенный метиленовый (-CH2-) радикал, и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенного или незамещенного метилена, кислорода (-O-), серы (-S-) и замещенного или незамещенного амино-радикала [-N(H)- или -N(заместитель)-]; и
m представляет собой целое число между 1 и 15.
Условие, принятое для описания формулы V, что «m представляет собой целое число между 1 и 15» буквально означает, что m представляет собой целое число, которое можно выбирать из группы целых чисел из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Представляет интерес олигомер ПНК формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число между 11 и 21;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека или частично комплементарным пре-мРНК SNAP25 человека с одним или двумя несовпадениями;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо-радикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный арилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный ариламинокарбонильный, замещенный или незамещенный алкилсульфонильный, или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой замещенный или незамещенный амино-радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо- и замещенного или незамещенного алкильного радикала;
Q1 и Qm представляют собой замещенный или незамещенный метиленовый радикал, и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из замещенного или незамещенного метилена, кислорода и амино-радикала; и,
m представляет собой целое число между 1 и 11.
Представляет особенный интерес производное ПНК формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число между 11 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо-радикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный, замещенный или незамещенный алкилсульфонильный, или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой замещенный или незамещенный амино-радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо- и замещенного или незамещенного алкильного радикала;
Q1 и Qm представляют собой метиленовый радикал, и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленового, кислородного и амино-радикала; и,
m представляет собой целое число между 1 и 9.
Представляет большой интерес олигомер ПНК формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число между 11 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо-радикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный амино-радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований;
по меньшей мере четыре из B1, B2, …, Bn-1, и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R3 и R5 представляют собой гидридо-радикал, и R2, R4 и R6 независимо представляют собой гидридо-, или замещенный или незамещенный алкильный радикал;
Q1 и Qm представляют собой метиленовый радикал, и Qm напрямую связан с основной аминогруппой;
Q2, Q3 … и Qm-1 независимо выбраны из метиленового, кислородного радикала; и,
m представляет собой целое число между 1 и 8.
Больший интерес представляет производное ПНК формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число между 11 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо-радикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный амино-радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 представляют собой гидридо-радикал;
Q1 и Qm представляют собой метиленовый радикал, и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленового и кислородного радикала; и,
m представляет собой целое число между 1 и 8.
Наибольший интерес представляет производное ПНК формулы I или его фармацевтически приемлемая соль:
где
n представляет собой целое число между 11 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо-радикал;
X представляет собой гидридо-радикал;
Y представляет собой замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный амино-радикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере пять из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 представляют собой гидридо-радикал;
L1 представляет собой -(CH2)2-O-(CH2)2-, -CH2-O-(CH2)2-, -CH2-O-(CH2)3-, -CH2-O-(CH2)4- или -CH2-O-(CH2)5-, с правым концом, напрямую связанным с основной аминогруппой; и,
L2 и L3 независимо выбраны из -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7-, -(CH2)8-, -(CH2)2-O-(CH2)2-, -(CH2)3-O-(CH2)2- и -(CH2)2-O-(CH2)3-, с правым концом, напрямую связанным с основной аминогруппой.
Особенный интерес представляет производное ПНК формулы I, выбранное из группы соединений, представленных ниже, или его фармацевтически приемлемая соль:
(N → C) Fethoc-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-A(6)TC-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Piv-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-A(6)TT-TG(6)T-TA(2O2)C-CC(1O2)T-GG(5)G-A(5)-NH2;
(N → C) Fmoc-Lys-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(5)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)T-A(5)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) Fethoc-Lys-Leu-TG(5)T-TA(5)C-CC(1O2)T-GG(5)G-A(2O2)T-Lys-NH2;
(N → C) H-TG(5)T-TA(5)C-CC(1O2)T-GG(3)G-A(5)T-NH2;
(N → C) Бензоил-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-Val-Lys-NH2;
(N → C) Бензоил-TG(5)T-TA(5)C-CC(1O3)T-GG(5)G-A(5)T-NH2;
(N → C) н-гексаноил-TG(5)T-TA(8)C-CC(1O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) Ac-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) [N-(2-фенилэтил)амино]карбонил-TG(5)T-TA(4)C-CC(1O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) FAM-HEX-HEX-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-Arg-NH2;
(N → C) н-бензоил-Gly-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) N-Me-N-фенил-TG(5)T-TA(5)C-CC(1O5)T-GG(5)G-A(5)T-NH2;
(N → C) п-толуолсульфонил-TG(2O3)T-TA(5)C-CC(1O2)T-GG(5)G-A(5)T-Lys-NH2
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2;
(N → C) Бензолсульфонил-TG(5)T-TA(2O3)C-CC(1O5)T-GG(5)G-A(6)T-NH2;
(N → C) Фенил-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2;
(N → C) Fethoc-TG(5)G-TA(5)C-C(1O2)CT-TG(5)G-A(5)T-NH2;
(N → C) Fethoc-TG(5)T-AA(5)C-CC(1O2)T-GG(5)T-A(5)T-NH2;
(N → C) Fethoc-TG(6)T-TA(3)C-CC(1O5)T-GG(6)G-A(3)T-NH2;
(N → C) Fethoc-G(5)TT-A(5)CC(1O2)-CTG-G(5)GA(5)-TC(1O2)-NH2;
(N → C) Бензил-G(5)TT-A(5)CC(1O2)-CTG-G(5)GA(5)-TC(1O2)-NH2;
(N → C) Fethoc-GTT-A(3)CC(1O5)-CTG(6)-GGA(3)-TC(1O5)-NH2;
(N → C) Fethoc-TA(5)C-C(1O2)CT(1O5)-GG(5)G-A(5)TC-C(1O2)A-NH2;
(N → C) Fmoc-Leu-TA(4)C-C(1O3)CT-GG(5)G-A(4)TC-C(1O3)A-NH2;
(N → C) Fethoc-C(1O2)AT-TTG(6)-TTA(5)-CCC(1O2)-TG(6)-NH2;
(N → C) Fethoc-CA(6)T-TTG(5)-TTA(5)-CCC(1O2)-TG(5)-NH2;
(N → C) Fethoc-A(6)TT-TG(5)T-TA(5)C-C(1O2)CT-G(5)-NH2;
(N → C) Fethoc-CA(6)T-CA(6)T-TTG(5)-TTA(5)-CCC(1O2)-TG(5)-NH2;
(N → C) Fethoc-A(5)TT-TG(5)T-TA(5)C-CC(1O2)T-GG(5)G-A(5)-NH2;
(N → C) Fethoc-A(6)TT-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(5)-NH2; и
(N → C) Fethoc-A(6)TT-TG(5)T-TA(6)C-C(1O2)CT-G(5)G-NH2:
где
A, G, T и C представляют собой мономеры ПНК с природным нуклеиновым основанием аденином, гуанином, тимином и цитозином, соответственно;
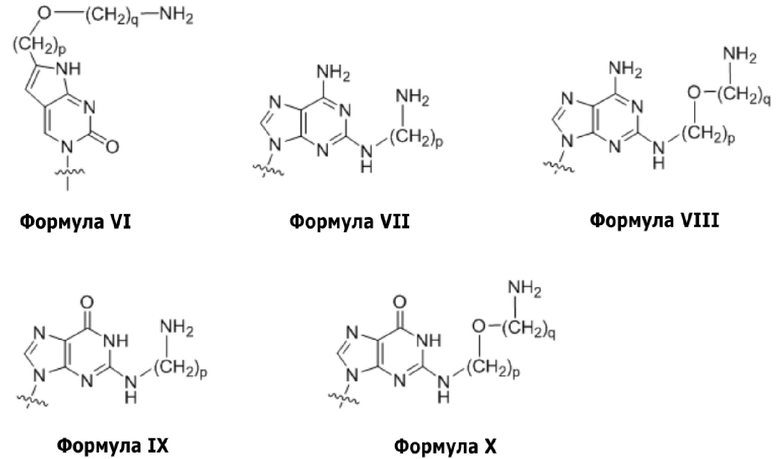
C(pOq), A(p), A(pOq), G(p) и G(pOq) представляют собой мономеры ПНК с неприродным нуклеиновым основанием, представленным формулой VI, формулой VII, формулой VIII, формулой IX и формулой X, соответственно;
 ,
,
где
p и q представляют собой целые числа; и
сокращенные наименования для N- и C-концевых заместителей конкретно определены следующим образом: «Fmoc-» представляет собой сокращенное наименование для «[(9-флуоренил)метилокси]карбонил-»; «Fethoc-» для «[2-(9-флуоренил)этил-1-окси]карбонил»; «Ac-» для «ацетил-»; «Бензоил-» для «бензолкарбонил-»; «Piv-» для «пивалил-»; «н-пропил-» для «1-(н-пропил)-»; «H-» для «гидридо-»группы; «п-толуолсульфонил» для «(4-метилбензол)-1-сульфонил-»; «-Lys-» для аминокислотного остатка «лизин»; «-Val-» для аминокислотного остатка «валин»; «-Leu-» для аминокислотного остатка «лейцин»; «-Arg-» для аминокислотного остатка «аргинин»; «-Gly-» для аминокислотного остатка «глицин»; «[N-(2-фенилэтил)амино]карбонил-» для «[N-1-(2-фенилэтил)амино]карбонил-»; «Бензил-» для «1-(фенил)метил-»; «Фенил-» для «фенил-»; «Me-» для «метил-»; «-HEX-» для «6-амино-1-гексаноил-», «FAM-» для «5, или 6-флуоресцеин-карбонил- (изомерной смеси)», и «-NH2» для незамещенной «-амино»-группы.
На фигуре 7 совместно представлена химическая структура для мономеров ПНК, сокращенно обозначенных как A, G, T, C, C(pOq), A(p), A(pOq), G(p) и G(pOq). Как обсуждали на предшествующем уровне техники [PCT/KR2009/001256], C(pOq) рассматривают как модифицированный мономер ПНК, соответствующий «цитозину» из-за его предпочтительной гибридизации с «гуанином». A(p) и A(pOq) принимают как модифицированные мономеры ПНК, действующие как «аденин», по их прочной аффинности для «тимина». Подобным образом, G(p) и G(pOq) считают модифицированными мономерами ПНК, эквивалентными «гуанину», благодаря продуктивному спариванию их оснований с «цитозином».
На фигуре 8 однозначно представлена химическая структура для множества сокращенных наименований заместителей, используемых для внесения разнообразия на N-конце или C-конце производного ПНК формулы I по настоящему изобретению.
Для иллюстрации сокращенных наименований, используемых для таких производных ПНК, химическая структура для 14-членного производного ПНК, сокращенно обозначенного как «(N → C) Fethoc-GA(5)A-C(1O2)TT-A(5)TC-CTA(5)-C(1O2)T-NH2», представлена на фигуре 9. В качестве другой иллюстрации, химическая структура для 15-членного производного ПНК, сокращенно обозначенного как «(N → C) Fmoc-Val-CTC(1O2)-A(5)TC-CTA(6)-C(1O3)TT-AA(2O2)C-NH2», представлена на фигуре 10.
16-членная последовательность ПНК «(N → C) Fethoc-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2» является эквивалентной последовательности ДНК «(5' → 3') ATT-TGT-TAC-CCT-GGG-A» для комплементарного связывания пре-мРНК. 16-членная ПНК имеет 16-членное комплементарное перекрывание с пре-мРНК SNAP25 человека, как отмечено «жирным» и «подчеркнутым» шрифтом в 30-членной последовательности пре-мРНК [(5' → 3') cucuuuggaucccag┃GGUAACAAAUGAUGC], перекрывающей стык «интрона 6» и «экзона 7» в пре-мРНК SNAP25 человека.
14-членная последовательность ПНК «(N → C) Fmoc-Leu-TA(4)C-C(1O3)CT-GG(5)G-A(4)TC-C(1O3)A-NH2» является эквивалентной последовательности ДНК «(5' → 3') TAC-CCT-GGG-ATC-CA» для комплементарного связывания с пре-мРНК. 14-членная ПНК имеет 14-членное комплементарное перекрывание с пре-мРНК SNAP25 человека, как отмечено «жирным» и «подчеркнутым» шрифтом в 30-членной последовательности пре-мРНК [(5' → 3') cucuuuggaucccag┃GGUAACAAAUGAUGC].
16-членная последовательность ПНК «(N → C) Fethoc-A(6)TC-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2» является эквивалентной последовательности ДНК «(5' → 3') ATC-TGT-TAC-CCT-GGG-A» для комплементарного связывания с пре-мРНК. 16-членная ПНК имеет 15-членное комплементарное перекрывание с 16-членной последовательностью, как отмечено «жирным» и «подчеркнутым» шрифтом в 30-членной последовательности пре-мРНК [(5' → 3') cucuuuggaucccag┃GGUAACA»A»AUGAUGC], в которой одиночное несовпадение отмечено знаком кавычек («»). 16-членная ПНК является частично комплементарной 3'-участку сплайсинга «экзона 7» SNAP25, с одиночным несовпадением с «экзоном 7».
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие способы получения олигомеров ПНК
Олигомеры ПНК синтезировали твердофазным пептидным синтезом (SPPS) на основе химических реакций Fmoc, в соответствии со способом, описанным на предшествующем уровне техники [US 6133444; WO 96/40685], с незначительными модификациями, при необходимости. Твердая подложка, используемая в этом исследовании, представляла собой H-Rink Amide-ChemMatrix, закупленную из PCAS BioMatrix Inc. (Quebec, Canada). Fmoc-мономеры ПНК с модифицированным нуклеиновым основанием синтезировали, как описано на предшествующем уровне техники [PCT/KR 2009/001256], или с незначительными модификациями. Такие Fmoc-мономеры ПНК с модифицированным нуклеиновым основанием и Fmoc-мономеры ПНК с природнным нуклеиновым основанием использовали для синтеза производных ПНК по настоящему изобретению. Fmoc-мономеры ПНК с модифицированным нуклеиновым основанием представлены на фигуре 11. Для специалиста в данной области, однако, существует множество незначительных изменений, очевидно возможных для защитных групп таких мономеров ПНК. Таким образом Fmoc-мономеры ПНК на фигуре 11 следует принимать в качестве примеров, и таким образом, не следует принимать для ограничения объема настоящего изобретения. Олигомеры ПНК очищали посредством C18-обращеннофазовой HPLC (вода/ацетонитрил или вода/метанол с 0,1% TFA) и характеризовали посредством масс-спектрометрии, включающей ESI/TOF/MS.
На фигуре 12 схематически проиллюстрирован типичный цикл удлинения мономера, принятый в SPPS из этого исследования, и детали синтеза представлены ниже. Для специалиста в данной области, однако, существует множество незначительных изменений, очевидно возможных для эффективного проведения таких реакций SPPS в автоматическом пептидном синтезаторе или в ручном пептидном синтезаторе. Каждая стадия реакции кратко представлена следующим образом.
[Активация смолы H-Rink-ChemMatrix] 0,01 ммоль (приблизительно 20 мг смолы) смолы ChemMatrix в 1,5 мл 20% пиперидине/DMF встряхивали в libra tube в течение 20 мин, и раствор для снятия защиты Fmoc отфильтровывали. Смолу промывали в течение 30 с каждый раз в сериях с использованием 1,5 мл метиленхлорида (MC), 1,5 мл диметилформамида (DMF), 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC. Полученные свободные амины на твердой подложке подвергали связыванию либо с Fmoc-мономером ПНК, или либо с Fmoc-защищенным производным аминокислоты.
[Снятие защиты Fmoc] Смолу встряхивали в 1,5 мл 20% пиперидина/DMF в течение 7 мин, и раствор для снятия защиты Fmoc отфильтровывали. Смолу промывали в течение 30 с каждый раз в сериях с использованием 1,5 мл MC, 1,5 мл DMF, 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC. Полученные свободные амины на твердой подложке немедленно подвергали связыванию с Fmoc-мономером ПНК.
[Связывание с Fmoc-мономером ПНК] Свободные амины на твердой подложке подвергали связыванию с Fmoc-мономером ПНК следующим образом. 0,04 ммоль Fmoc-мономера ПНК, 0,05 ммоль HBTU [гексафторфосфата 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония] и 10 ммоль DIEA (N,N-диизопропилэтиламин) инкубировали в течение 2 мин в 1 мл безводного DMF, и добавляли к смоле со свободными аминами. Раствор смолы встряхивали в течение 1 часа, и реакционную среду отфильтровывали. Затем смолу промывали в течение 30 с каждый раз в сериях с использованием 1,5 мл MC, 1,5 мл DMF и 1,5 мл MC.
[Кэпирование] После реакции связывания, не вступившие в реакцию свободные амины кэпировали посредством встряхивания в течение 5 мин в 1,5 мл раствора для кэпирования (5% уксусного ангидрида и 6% 2,6-лутидина в DMF). Затем раствор для кэпирования отфильтровывали, и проводили промывку в течение 30 с каждый раз в сериях с использованием 1,5 мл MC, 1,5 мл DMF, и 1,5 мл MC.
[Введение «Fethoc-»радикала на N-конце] «Fethoc-»радикал вводили на N-конце посредством реакции свободных аминов на смоле с «Fethoc-OSu» в условиях обычного связывания оснований. Химическая структура «Fethoc-OSu» [CAS No. 179337-69-0, C20H17NO5, MW 351,36] представлена следующим образом.
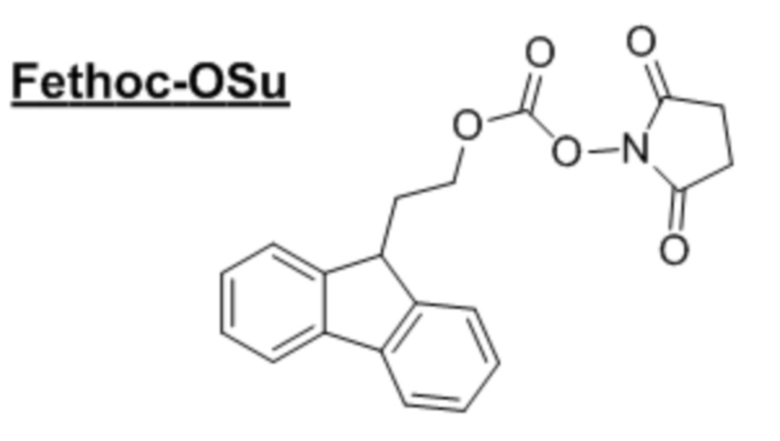
[Отщепление от смолы] Олигомеры ПНК, связанные со смолой, отщепляли от смолы посредством встряхивания в течение 3 часов в 1,5 мл раствора для отщепления (2,5% триизопропилсилана и 2,5% воды в трифторуксусной кислоте). Смолу отфильтровывали, и фильтрат концентрировали при пониженном давлении. Полученный осадок растирали в порошок с диэтилэфиром, и полученный преципитат собирали посредством фильтрации для очистки посредством обращеннофазовой HPLC.
[Анализ и очистка посредством HPLC] После отщепления от смолы, неочищенный продукт производного ПНК очищали посредством C18-обращеннофазовой HPLC с элюцией водой/ацетонитрилом или водой/метанолом (градиентный способ), содержащими 0,1% TFA. Фигуры 13A и 13B представляют собой иллюстративные хроматограммы HPLC для «ASO 1» до и после очистки посредством HPLC, соответственно. Последовательность олигомера «ASO 1» является такой, как представлено в таблице 1.
Примеры синтеза для производного ПНК формулы I
Для комплементарного нацеливания на 3'-участок сплайсинга «экзона 7» в пре-мРНК SNAP25 человека, производные ПНК по настоящему изобретению получали в соответствии со способами синтеза, представленными выше, или с незначительными модификациями. Представление таких производных ПНК, нацеленных на пре-мРНК SNAP25 человека, предназначено для иллюстрации производных ПНК формулы I, и его не следует интерпретировать для ограничения объема настоящего изобретения.
В таблице 1 представлены производные ПНК, комплементарно нацеленные на 3'-участок сплайсинга «экзона 7» в пре-мРНК SNAP25 человека, вместе с данными структурной характеризации посредством масс-спектрометрии. Представление ASO SNAP25 в таблице 1 предназначено для иллюстрации производных ПНК формулы I, и его не следует интерпретировать для ограничения объема настоящего изобретения.
Таблица 1. производные ПНК, комплементарно нацеленные на 3'-участок сплайсинга, перекрывающий стык «интрона 6» и «экзона 7» в пре-мРНК SNAP25 человека, вместе с данными структурной характеризации посредством масс-спектрометрии.
a) теоретическая точная масса, b) наблюдаемая точная масса
Фигура 13A представляет собой хроматограмму HPLC, полученную с использованием неочищенного продукта «ASO 1». Неочищенный продукт очищали посредством C18-RP препаративной HPLC. Фигура 13B представляет собой хроматограмму HPLC для очищенного продукта «ASO 1». Чистота «ASO 1» заметно улучшалась после препаративной очистки посредством HPLC. На фигуре 14 представлен масс-спектр ESI-TOF, полученный с использованием очищенного продукта «ASO 1». Предоставление данных анализа для «ASO 1» предназначено для иллюстрации того, как производные ПНК формулы I очищали и идентифицировали по настоящему изобретению, и его не следует интерпретировать для ограничения объема настоящего изобретения.
Аффинность связывания модельных производных ПНК для комплементарной ДНК
Производные ПНК в таблице 1 оценивали по их аффинности связывания для 10-членных ДНК при комплементарном нацеливании либо на N-конец, либо на C-конец. Аффинность связывания оценивали по значению Tm для дуплекса между ПНК и 10-членной комплементарной ДНК. Для дуплекса между производными ПНК в таблице 1 и полностью комплементарными ДНК показаны значения Tm, слишком высокие для надежного определения в водном буферном растворе, поскольку буферный раствор имел тенденцию к закипанию в ходе измерения Tm.
Значения Tm определяли на спектрометре УФ/видимой областей спектра в следующим образом. Смешанный раствор 4 мкМ олигомера ПНК и 4 мкМ комплементарной 10-членной ДНК в 4 мл водного буфера (pH 7,16, 10 мМ фосфат натрия, 100 мМ NaCl) в 15 мл полипропиленовой пробирке falcon инкубировали при 90°C в течение минуты и медленно охлаждали до температуры окружающей среды. Затем раствор переносили в 3 мл кварцевую кювету для УФ, оборудованную воздухонепроницаемой крышкой, и подвергали измерению Tm при 260 нм на спектрофотометре УФ/видимой областей спектра, как описано на предшествующем уровне техники [PCT/KR2009/001256], или с незначительными модификациями. 10-членные комплементарные ДНК для измерения Tm закупали из Bioneer (www.bioneer.com, Dajeon, Republic of Korea) и использовали без дополнительной очистки.
Наблюдаемые значения Tm для производных ПНК формулы I были очень высокими для комплементарного связывания с 10-членной ДНК, и представлены в таблице 2 как некорректированные. Например, для «ASO 3» показано значение Tm 77,3°C для дуплекса с 10-членной комплементарной ДНК, нацеленной на N-концевой 10-членник в ПНК, как отмечено «жирным» и «подчеркнутым» шрифтом в [(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2]. В то же время, для «ASO 3» показана Tm 88,7°C для дуплекса с 10-членной комплементарной ДНК, нацеленной на C-концевой 10-членник в ПНК, как отмечено «жирным» и «подчеркнутым» шрифтом в [(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2].
Таблица 2. Значения Tm между ПНК в таблице и 10-членной комплементарной ДНК, нацеленной либо на N-конец, либо на C-конец ПНК.
Примеры видов биологической активности производных ПНК формулы I
Производные ПНК формулы I, указанные в таблице 1, оценивали по антисмысловой активности по отношению к SNAP25 в клетках PC12 крысиного происхождения и в клетках SiMa человеческого происхождения, и по их способности ингибировать экспрессию SNAP25 в коже мышей C57BL/6 при местном введении. Биологические примеры представлена в качестве примеров для иллюстрации антисмысловой активности производных ПНК формулы I, и таким образом, их не следует интерпретировать как ограничивающие объем настоящего изобретения соединениями, перечисленными в таблице 1.
Пример 1. Пропуск экзонов, индуцированный «ASO 3».
Указанный «ASO 3» представляет собой 14-членный ASO, полностью комплементарный 14-членной последовательности в 3'-участке сплайсинга, перекрывающем стык «интрона 6» и «экзона 7» в пре-мРНК SNAP25 человека. «ASO 3» комплементарно перекрывается с 14-членной последовательность пре-мРНК, как отмечено «жирным» и «подчеркнутым» шрифтом в 30-членной последовательности пре-мРНК [(5' → 3') cucuuuggaucccag┃GGUAACAAAUGAUGC]. «ASO 3» имеет 7-членное перекрывание с «интроном 6», и другое 7-членное перекрывание с «экзоном 7».
В то же время, 14-членный ASO имеет 13-членное комплементарное перекрывание с пре-мРНК SNAP25 крысы, считанной с геномной ДНК крысы [доступная из NCBI эталонная последовательность: NC_005012], как отмечено «жирным» и «подчеркнутым» шрифтом в 25-членной последовательности пре-мРНК [(5' → 3') ugg»c»ucccag┃GGUAACAAACGAUGC], в которой одиночное несовпадение отмечено знаком кавычек («»).
«ASO 3» оценивали по его способности индуцировать пропуск экзонов в клетках PC12 (кат. номер CRL-1721, ATCC), как представлено ниже.
[Культивирование клеток и обработка ASO] клетки PC12 поддерживали в среде RPMI 1640, дополненной 5% FBS, 10% лошадиной сывороткой, 1% стрептомицином/пенициллином, 1% L-глутамином и 1% пируватом натрия в атмосфере 5% CO2 при 37°C. Клетки, выращенные в 60 мм культуральной чашке, содержащей 5 мл культуральной среды, обрабатывали «ASO 3» при 0 (отрицательный контроль), 10, 100 или 1000 зМ.
[Выделение РНК и синтез кДНК в одностадийной ПЦР] После инкубации с «ASO 3» в течение 42 часов, клетки обрабатывали с использованием 100 мкг/мл циклогексимида в течение следующих 6 часов для остановки рибосомальной трансляции. Затем тотальную РНК выделяли с использованием универсального набора для выделения РНК «Universal RNA Extraction Kit» (кат. номер 9767, Takara) в соответствии с инструкциями производителя. 200 нг РНК-матрицы подвергали реакции обратной транскрипции в объеме 25 мкл с использованием набора для одностадийной ОТ-ПЦР Super Script® с Taq-полимеразой Platinum® (кат. номер 10928-042, Invitrogen) с использованием набора специфических для экзонов праймеров [экзон 1_прямой: (5' → 3') ATGGCCGAGGACGCAGACA; и экзон 14_обратный: (5' → 3') AGCATCTTTGTTGCACGTTG] в соответствии со следующими условиями термоциклирования: 50°C в течение 30 мин и 94°C в течение 2 мин, за которыми следовали 40 циклов из 30 с при 94°C, 30 с при 50°C и 1 мин при 72°C.
[Гнездовая амплификация ПЦР] 1 мкл кДНК подвергали гнездовой реакции ПЦР в объеме 20 мкл (кат. номер K2612, Bioneer) с использованием набора специфических для экзонов праймеров [экзон 1_прямой: (5' → 3') ATGGCCGAGGACGCAGACA; экзон 14n_обратный: (5' → 3') TTGTTGGAGTCAGCGCCT] в соответствии со следующими условиями термоциклирования: 95°C в течение 2 мин, за которыми следовали 34 цикла из 30 с при 95°C, 30 с при 55°C и 1 мин при 72°C.
[Идентификация продуктов с пропуском экзонов] продукты ПЦР подвергали электрофоретическому разделению в 2% агарозном геле. Полосы целевого размера собирали и анализировали посредством секвенирования по Сенджеру.
На фигуре 15A представлены данные электрофореза продуктов ПЦР, при котором для образца после обработки 10 зМ ASO получали слабую полосу продукта ПЦР, которую можно было приписать пропуску экзонов 5-7. Даже если клетки обрабатывали циклогексимидом для дестабилизации полноразмерной мРНК посредством остановки рибосомальной трансляции, полосу с пропуском экзонов детектировали только слабо. Таким образом, вариант сплайсинга мРНК SNAP25, который можно приписать пропуску экзонов 5-7, вероятно, имеет плохую устойчивость к метаболизму в клетках по сравнению с полноразмерной мРНК. Продукт ПЦР с пропуском экзонов секвенировали с установлением пропуска экзонов 5-7, как показано на фигуре 15B. Поскольку продукт ПЦР, приписанный пропуску экзона 6, наблюдали вне зависимости от концентрации ASO, считают, что пропуск экзона 6 происходит спонтанно.
Интенсивность полноразмерной мРНК SNAP25 больше всего уменьшалась в клетках, обработанных 10 зМ «ASO 3». Интенсивность полноразмерной мРНК постепенно увеличивалась в клетках из отрицательного контроля (т.е., без обработки ASO), по мере увеличения концентрации ASO от 10 до 1000 зМ. Инвертированный паттерн зависимости ответа от дозы для данных гнездовой ПЦР мог быть обусловлен повышающей регуляцией транскрипции посредством «кольцевой РНК с экзон-интронной структурой (ЭИкРНК)», накапливаемой в ходе пропуска экзонов с использованием «ASO 3». [Nature Struc. Mol. Biol. vol 22(3), 256-264 (2015)]
Пример 2. кПЦР для мРНК SNAP25 в клетках PC12, обработанных «ASO 3».
«ASO 3» оценивали посредством гнездовой кПЦР SNAP25 по его способности индуцировать изменения уровня мРНК SNAP25 крысы в клетках PC12 следующим образом.
[Культура клеток и обработка ASO] клетки PC12, выращенные в 60 мм культуральной чашке, содержащей 5 мл культуральной среды, обрабатывали «ASO 3» при 0 (отрицательный контроль), 10, 100 или 1000 зМ. (2 культуральных чашки на концентрацию ASO)
[Выделение РНК и синтез кДНК посредством одностадийной ОТ-ПЦР] После инкубации с «SNAP-ASO 3» в течение 42 часов, клетки обрабатывали 100 мкг/мл циклогексимида в течение следующих 6 часов для остановки рибосомальной трансляции. Затем тотальную РНК выделяли с использованием универсального набора для выделения РНК «Universal RNA Extraction Kit» (кат. номер 9767, Takara), и 200 нг РНК-матрицы подвергали реакции обратной транскрипции в объеме 25 мкл с использованием набора для одностадийной ОТ-ПЦР (Invitrogen, USA) с использованием набора специфических для экзонов праймеров [экзон 1_прямой: (5' → 3') ATGGCCGAGGACGCAGACA; и экзон 14_обратный: (5' → 3') AGCATCTTTGTTGCACGTTG] в соответствии со следующими условиями термоциклирования: 50°C в течение 30 мин и 94°C в течение 2 мин, за которыми следовали 20 циклов из 30 с при 94°C, 30 с при 55°C и 1 мин при 72°C.
[Гнездовая амплификация кПЦР] 1 мкл каждого раствора кДНК, разведенного в 100X, подвергали реакции ПЦР с детекцией в реальном времени в объеме 20 мкл с использованием набора специфических для экзонов праймеров [экзон 7q_прямой: (5' → 3') ATGGATGAAAACCTAGAGC; и экзон 8q_обратный: (5' → 3') CTTCCCAGCA-TCTTTGTT] в соответствии со следующими условиями термоциклирования: 95°C для 3 мин за которыми следовали 40 циклов из 10 с при 95°C и 30 с при 60°C. Реакцию кПЦР отслеживали с использованием зонда Taqman [(5' → 3') 5,6-FAM-CAGCCTTCT-ZEN-CCATGATCCT-3IABkFQ], нацеленного на стык экзона 7 и экзона 8, для специфической количественной оценки полноразмерной мРНК SNAP25.
На фигуре 16A представлены данные кПЦР, в которой уровень полноразмерной мРНК был значимо уменьшен (t-критерий Стьюдента) в клетках, обработанных «ASO 3» при 10 зМ и 100 зМ приблизительно на 50% и 20%, соответственно. Однако, уровень полноразмерной мРНК в клетках, обработанных 1000 зМ «ASO 3» был немного выше, чем уровень в клетках без обработки ASO (т.е., для отрицательного контроля). Инвертированный паттерн зависимости ответа от дозы для данных кПЦР вполне согласуется с паттерном зависимости ответа от дозы для уровня полноразмерной мРНК, полученным в ходе пропуска экзонов, описанного в «Примере 1», что позволяет предполагать повышающую регуляцию транскрипции при увеличении дозы ASO от 10 до 1000 зМ.
Пример 3. кПЦР для мРНК SNAP25 в клетках PC12, обработанных «ASO 1».
«ASO 1», указанный в таблице 1, представляет собой 16-членный ASO, полностью комплементарный 16-членной последовательности 3'-участка сплайсинга, перекрывающей стык интрона 6 и экзона 7 в пре-мРНК SNAP25 человека. «ASO 1» комплементарно перекрывается с 16-членной последовательностью-мишенью, как отмечено «жирным» и «подчеркнутым» шрифтом в 30-членной последовательности человеческой пре-мРНК [(5' → 3') cucuuuggaucccag┃GGUAACAAAUGAUGC]. «ASO 1» имеет 6-членное перекрывание с интроном 6 и 10-членное перекрывание с экзоном 7. Однако ASO имеет одиночное несовпадение с пре-мРНК SNAP25 крысы, как отмечено «жирным» и «подчеркнутым» шрифтом в 25-членной последовательности пре-мРНК [(5' → 3') uggcucccag┃GGUAACAAA»C»GAUGC], в которой одиночное несовпадение отмечено знаком кавычек («»).
«ASO 1» оценивали посредством гнездовОЙ кПЦР SNAP25 по его способности индуцировать изменения уровня мРНК SNAP25 крысы в клетках PC12, как описано в «Примере 2», если не указано иное.
На фигуре 16B представлены данные кПЦР, в которых уровень полноразмерной мРНК был значимо уменьшен (t-критерий Стьюдента) в клетках, обработанных «SNAP-ASO 1» при 10 зМ, 100 зМ и 1000 зМ приблизительно на 50%, 40% и 70%, соответственно. Подобно случаю «ASO 3», инвертированный паттерн зависимости ответа от дозы частично воспроизводился с «ASO 1», с увеличением дозы от 10 до 100 зМ. Однако, принимая во внимание, что уровень полноразмерной мРНК далее уменьшался с увеличением концентрации ASO до 1000 зМ, эффективность пропуска экзонов для «ASO 1», по-видимому, является более высокой, чем эффективность «ASO 3».
Пример 4. Ингибирование экспрессии белка SNAP25 в клетках PC12 посредством «ASO 3»
«ASO 3» оценивали по его способности ингибировать экспрессию экспрессии белка SNAP25 в клетках PC12 следующим образом.
Клетки PC12 выращивали в 60 мм культуральной чашке, содержащей 5 мл культуральной среды, и обрабатывали «ASO 3» при 0 зМ (отрицательный контроль), 1 зМ, 10 зМ, 30 зМ, 100 зМ, 300 зМ, 1 аМ, 3 аМ или 10 аМ в течение 48 часов. Присутствовало 4 культуральных чашки отрицательного контроля для компенсации потенциальных технических артефактов в ходе анализа Вестерн-блоттинга.
[Лизис клеток] Затем клетки подвергали лизису на льду с использованием 200 мкл 1X буфера RIPA (кат. номер 9806, Cell Signaling Tech), дополненного 1% SDS и 1X коктейлем ингибиторов протеаз (cOmplete Mini, Roche). Лизаты собирали в 1,5 мл e-пробирку, смешивали с 100 мкл 5X буфера для образцов и кипятили в течение 5 мин.
[Вестерн-блоттинг] Лизаты подвергали электрофоретическому разделению в 4-15% градиентном геле для TGX-PAGE (кат. номер 456-1086, Bio-Rad) и затем переносили на 0,45 мкм PVDF мембрану. Мембрану анализировали с использованием в качестве зонда антитела против SNAP25 (кат. номер S9684, Sigma) и антитела против β-актина (кат. номер A3845, Sigma).
На фигуре 17A представлены данные Вестерн-блоттинга SNAP25, полученные с использованием лизатов клеток PC12 (верхняя диаграмма) вместе с относительными уровнями экспрессии SNAP25, нормализованными по β-актину посредством денситометрии (нижняя диаграмма). Уровень белка SNAP25 был уменьшен на 10-60% в клетках, обработанных «ASO 3». Уровень экспрессии для отрицательного контроля (т.е., 0 зМ «ASO 3») представляет собой средний уровень экспрессии из 4 образцов.
Пример 5. Ингибирование экспрессии белка SNAP25 в клетках PC12 посредством «ASO 1»
«ASO 1» оценивали по его способности ингибировать экспрессию белка SNAP25 в клетках PC12, как описано в «примере 4», если не указано иное. Клетки PC12 обрабатывали «ASO 1» при 0 (отрицательный контроль), 100 или 1000 зМ в течение либо 48 часов, либо 72 часов. (одна культуральная чашка для каждой концентрации ASO)
На фигуре 17B представлены данные Вестерн-блоттинга для обработки ASO в течение 48 часов (слева) и 72 часов (справа). «ASO 1» значительно ингибировал экспрессию белка SNAP25 в клетках PC12 в обеих временных точках.
Пример 6. Ингибирование экспрессии белка SNAP25 в коже после местного введения «ASO 1» у мышей.
«ASO 1» является полностью комплементарным 3'-участку сплайсинга «экзона 7» в пре-мРНК SNAP25 мыши. «ASO 1» оценивали по его способности ингибировать экспрессию белка SNAP25 в коже при местном введении, как описано ниже.
[Стрижка шерсти и распределение по группам] На сутки 0, 8 самок мышей C57BL/6 (в возрасте 5 недель) подвергали анестезии с использованием золетила/ромпуна, и шерсть на спине (приблизительно 3 см x 4 см) выстригали с использованием машинки. Мышей случайным образом распределяли на четыре группы, т.е., группу без обработки ASO (отрицательный контроль) и 3 группы обработки 1 фМ, 10 фМ и 100 фМ «ASO 1». (2 животных на группу)
[Местное введение] Растворы для местного введения «ASO 1» получали посредством разведения исходного водного раствора для хранения в 30% (об./об.) водном этаноле, дополненном 3% (об./об.) глицерина, до 0 (отрицательный контроль), 1, 10 и 100 фМ «ASO 1». Каждому животному местно вводили приблизительно 100 мкл раствора для местного введения 2 раза в сутки (утром и поздно вечером) на протяжении суток 0-4 на кожу спины с выстриженной шерстью с использованием ватного шарика.
[Отбор образцов кожи] Вечером на сутки 4, животных умерщвляли после анестезии с использованием золетила/ромпуна для получения образца фрагмента кожи, подвергнутого местной обработке ASO. Затем образцы кожи подвергали анализу иммуногистохимии (IHC) по белку SNAP25, как описано ниже.
[SNAP25 IHC] Получали криосрезы образцов кожи и подвергали иммунному окрашиванию в сериях с использованием первичного антитела против SNAP25 (кат. номер ab41455, Abcam) в разведении 1:200, с использованием вторичного антитела против IgG (кат. номер BA-1100, Vector) в разведении 1:200, и затем с использованием Dylight 594-стрептавидина (кат. номер SA-5594, Vector, CA, USA) в разведении 1:200 для мечения красной флуоресцентной меткой. Антитело против SNAP25 служит зондом для C-конца белка SNAP25. Изображения IHC получали на сканере для предметных стекол Zeiss для оценки изменений уровня экспрессии полноразмерного SANP25. Кроме того, проводили окрашивание DAPI для локализации микроструктуры дермы.
На фигуре 18 представлен репрезентативный набор изображений IHC SNAP25 по группам. В группе отрицательного контроля, экспрессия полноразмерного белка SNAP25 была высокой в мышечном слое, расположенном ниже дермы. Считают, что экспрессия белка SNAP25 в мышечном слое обусловлена экспрессией белка SNAP25 в аксонах моторных нейронов, погруженных в мышечный слой. Экспрессия полноразмерного белка SNAP25 в мышечном слое была заметно уменьшена в группах обработки ASO. Наиболее заметное уменьшение наблюдали в группе обработки 100 фМ «ASO 1». Степень ингибирования экспрессии полноразмерного белка SNAP25 в коже была намного сильнее степени, наблюдаемой в клетках PC12 (ср. «Пример 5»).
Принимая во внимание, что BTX является общеупотребительным для лечения морщин на лице (для антивозрастного лечения) посредством инъекции, ингибирование экспрессии белка SNAP25 в мышечном слое, расположенном ниже дермы, имеет фармакологическую и терапевтическую важность. Инъекция BTX ассоциирована с риском того, что определенная фракция материала для инъекции потенциально распространяется в тканях мышц, вызывая опасения по поводу безопасности. Если BTX, например, распространяется в тканях гладких мышц легкого, субъект подвержен высокому риску легочной недостаточности.
Активность ингибирования SNAP25 зависит от концентрации ASO в ткани-мишени. При местном введении, концентрация ASO быстро уменьшается в тканях, удаленных от слоя дермы в месте введения ASO. Является маловероятным, чтобы ткани-мишени, вызывающие опасения с точки зрения безопасности, подвергались воздействию ASO в концентрации, достаточно высокой, чтобы возникли опасения по поводу безопасности. Таким образом, производное ПНК формулы I для местного использования обеспечивает отличительные преимущества по сравнению с инъекцией BTX, применительно к безопасности, так же как к соблюдению режима субъектом.
Пример 7. Ингибирование экспрессии белка SNAP25 в клетках SiMa посредством «ASO 3».
«ASO 3» оценивали по его способности ингибировать экспрессию белка SNAP25 в клетках нейробластомы человека SiMa следующим образом.
[Культура клеток и обработка ASO] Клетки SiMa (кат. номер ACC164, DSMZ) поддерживали в среде RPMI 1640, дополненной 10% FBS, 1% стрептомицином/пенициллином, 1% L-глутамином и 1% пируватом натрия в атмосфере 5% CO2 при 37°C. Клетки SiMa выращивали в 60 мм культуральной чашке, содержащей 5 мл культуральной среды, и обрабатывали в течение 48 часов с использованием «ASO 3» при 0 зМ (отрицательный контроль), 1 зМ - 100 аМ. Присутствовало 3 культуральных чашки отрицательного контроля для компенсации потенциальных технических артефактов в ходе анализа Вестерн-блоттинга.
[Лизис] Клетки подвергали лизису на льду с использованием 200 мкл 1X буфера RIPA (кат. номер 9806, Cell Signaling Tech) дополненного 0,1% SDS и 1X коктейлем ингибиторов протеаз (cOmplete Mini, Roche). Затем лизаты собирали в 1,5 мл e- пробирку, смешивали с 100 мкл 5X буфера для образцов и кипятили в течение 5 мин.
[Вестерн-блоттинг] Лизаты подвергали электрофоретическому разделению в 12% геле для SDS-PAGE и переносили на 0,2 мкм поливинилидендифторидную (PVDF) мембранУ. Мембрану анализировали с использованием в качестве зонда антитела против SNAP25 (кат. номер ab41455, Sigma) и антитела против β-актина (кат. номер A3845, Sigma).
На фигуре 19A представлены данные Вестерн-блоттинга SNAP25, полученные с использованием лизатов клеток (верхняя диаграмма), вместе с относительными уровнями экспрессии SNAP25, нормализованными по β-актину посредством денситометрии (нижняя диаграмма). Уровень экспрессии для отрицательного контроля (т.е., 0 зМ «ASO 3») представляет собой средний уровень экспрессии из 3 образцов. Уровень белка SNAP25 был уменьшен на 40-50% в клетках, обработанных «ASO 3».
SNAP25 Пример 8. кПЦР для мРНК SNAP25 в клетках SiMa, обработанных «ASO 3».
«ASO 3» оценивали посредством гнездовой кПЦР SNAP25 по его способности индуцировать изменения уровня мРНК SNAP25 человека в клетках SiMa следующим образом.
[Культивирование клеток и обработка ASO] Клетки SiMa выращивали в 60 мм культуральной чашке, содержащей 5 мл культуральной среды, и обрабатывали «ASO 3» при 0 зМ (отрицательный контроль), 1 зМ, 10 зМ, 100 зМ или 1 аМ, 10 аМ, или 100 аМ. (2 культуральные чашки на концентрацию ASO)
[Выделение РНК и синтез кДНК] Тотальную РНК выделяли из клеток с использованием набора «RNeasy Mini Kit» (кат. номер 74106, Qiagen) в соответствии с инструкциями производителя. 200 нг РНК-матрицы подвергали реакции обратной транскрипции в объеме 25 мкл с использованием набора для синтеза 1-й цепи кДНК PrimeScript (кат. номер 6110B, Takara) с использованием случайных гексамеров.
[Амплификация кПЦР] Реакции ПЦР мониторировали с использованием зонда Taqman [(5' → 3') 56-FAM-CGGCTTCAT-ZEN-CCGCAGGGTAACAA-3IABkFQ], нацеленного на стык экзона 6 и экзона 7, с использованием набора специфических для экзонов праймеров [экзон 6_прямой: (5' → 3') GACGAAC-GGGAGCAGATG; и экзон 8_обратный(2): (5' → 3') ATCTCATTGCCCATATCCAGG]. Условия термоциклирования: 95°C в течение 3 мин, за которыми следовали 40 циклов из 15 с при 95°C, и 30 с при 60°C.
На фигуре 19B представлены данные кПЦР, в которых уровень полноразмерной мРНК SNAP25 человека был значимо уменьшен (t-критерий Стьюдента) в клетках, обработанных «ASO 3» при 1 зМ, 100 зМ, 1 аМ и 100 аМ, на 20-40%. Для клеток, обработанных ASO при 100 аМ, показано наиболее сильное ингибирование на 40%.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> OLIPASS CORPORATION
<120> АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ДЛЯ SNAP25
<130> OSH-00677 (32567-00677)
<140>
<141>
<150> PCT/IB2017/001727
<151> 2017-12-29
<150> 62/443,262
<151> 2017-01-06
<160> 16
<170> PatentIn версии 3.5
<210> 1
<211> 14
<212> РНК
<213> Homo sapiens
<400> 1
aucccagggu aaca 14
<210> 2
<211> 30
<212> РНК
<213> Homo sapiens
<400> 2
cucuuuggau cccaggguaa caaaugaugc 30
<210> 3
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 3
atttgttacc ctggga 16
<210> 4
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 4
taccctggga tcca 14
<210> 5
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 5
atctgttacc ctggga 16
<210> 6
<211> 25
<212> РНК
<213> Rattus sp.
<400> 6
uggcucccag gguaacaaac gaugc 25
<210> 7
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 7
atggccgagg acgcagaca 19
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 8
agcatctttg ttgcacgttg 20
<210> 9
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 9
ttgttggagt cagcgcct 18
<210> 10
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 10
atggatgaaa acctagagc 19
<210> 11
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 11
cttcccagca tctttgtt 18
<210> 12
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
зонд
<400> 12
ccatgatcct 10
<210> 13
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
зонд
<400> 13
ccgcagggta acaa 14
<210> 14
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 14
gacgaacggg agcagatg 18
<210> 15
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
праймер
<400> 15
atctcattgc ccatatccag g 21
<210> 16
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
олигонуклеотид
<400> 16
aaagatgctg gcatcaggac tttggttatg ttggatgagc aaggcgctga ctccaacaaa 60
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИСМЫСЛОВОЕ ДЛЯ SCN9A ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО | 2018 |
|
RU2762293C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АНДРОГЕНОВОГО РЕЦЕПТОРА | 2017 |
|
RU2753966C2 |
| ПРОПУСК ЭКЗОНОВ С ПОМОЩЬЮ ПРОИЗВОДНЫХ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2786637C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ К HIF-1-АЛЬФА | 2017 |
|
RU2753517C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ТИРОЗИНАЗЫ | 2018 |
|
RU2778786C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ ПРОТИВ SCN9A | 2017 |
|
RU2748834C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ АЦЕТИЛ-СОА-КАРБОКСИЛАЗЫ-2 | 2019 |
|
RU2807629C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-1 | 2019 |
|
RU2802418C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ С ХОРОШЕЙ КЛЕТОЧНОЙ ПЕНЕТРАЦИЕЙ И СИЛЬНОЙ АФФИННОСТЬЮ К НУКЛЕИНОВОЙ КИСЛОТЕ | 2009 |
|
RU2564032C2 |
| НОВЫЕ МОНОМЕРЫ И ОЛИГОМЕРЫ ПЕПТИДНЫХ НУКЛЕИНОВЫХ КИСЛОТ | 2015 |
|
RU2693827C2 |
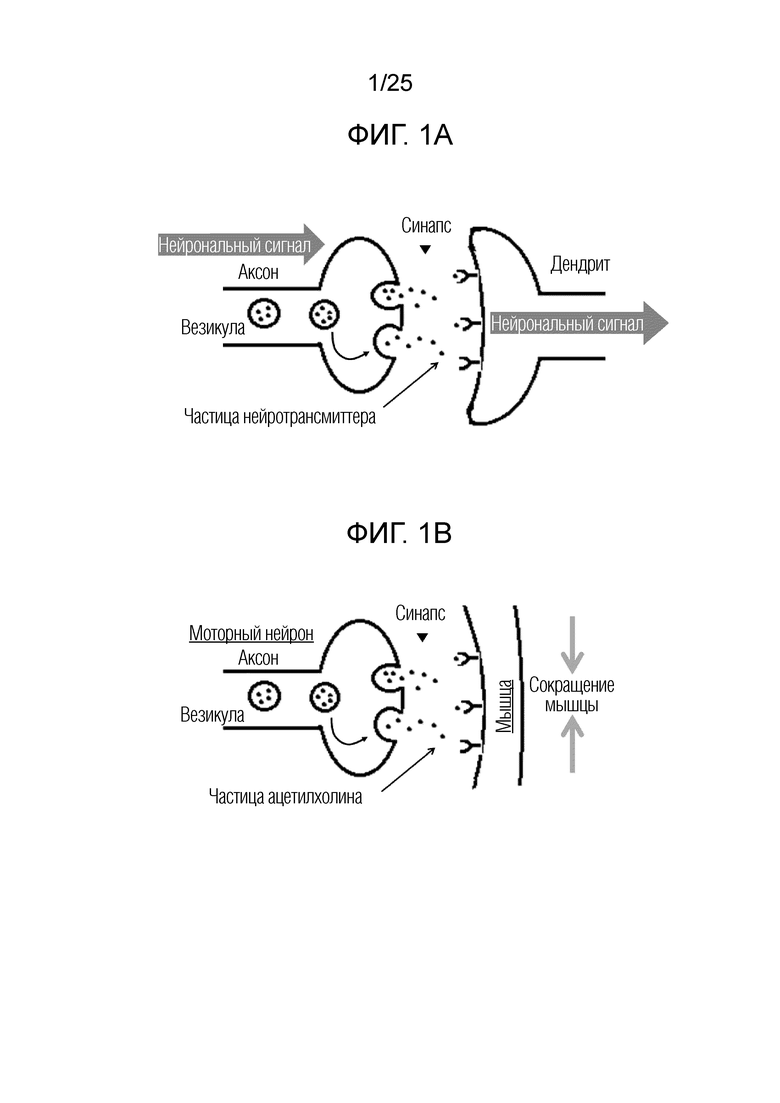
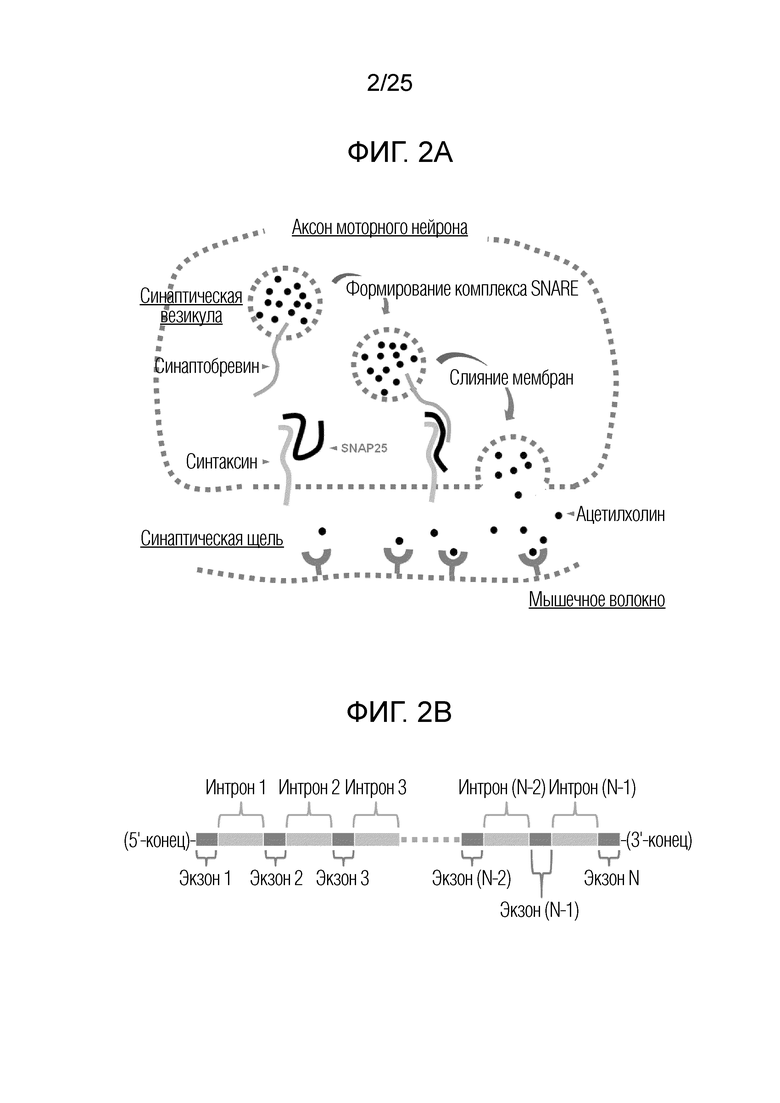
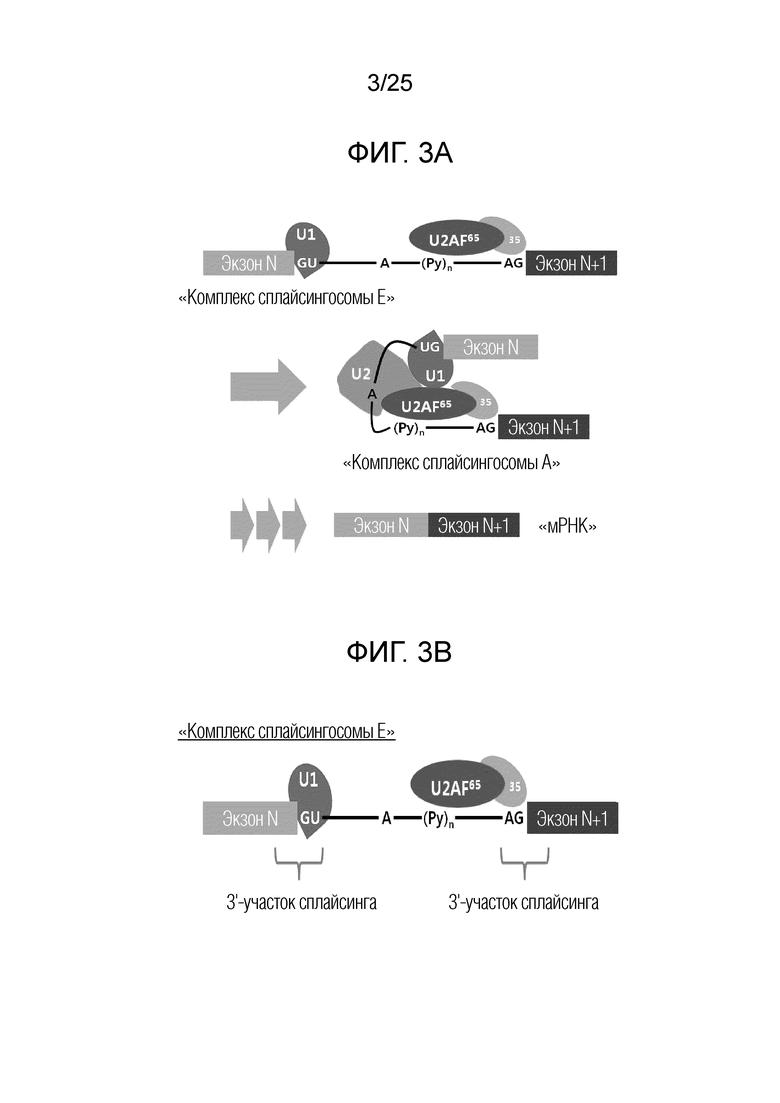
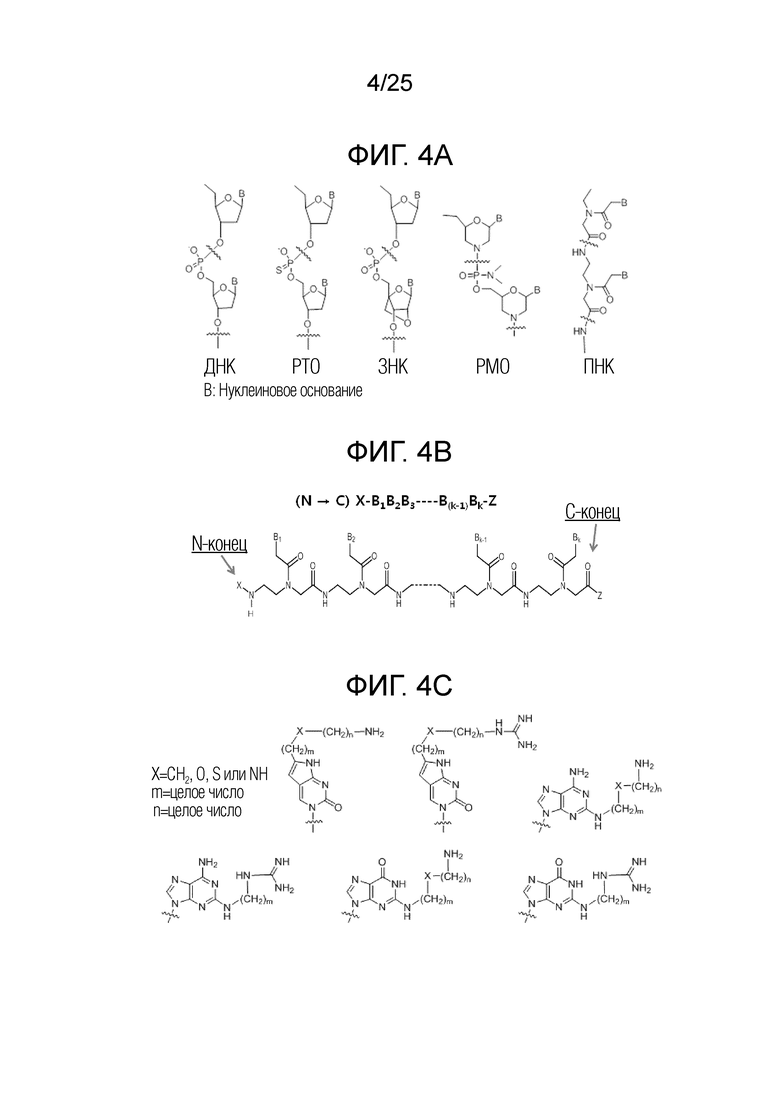
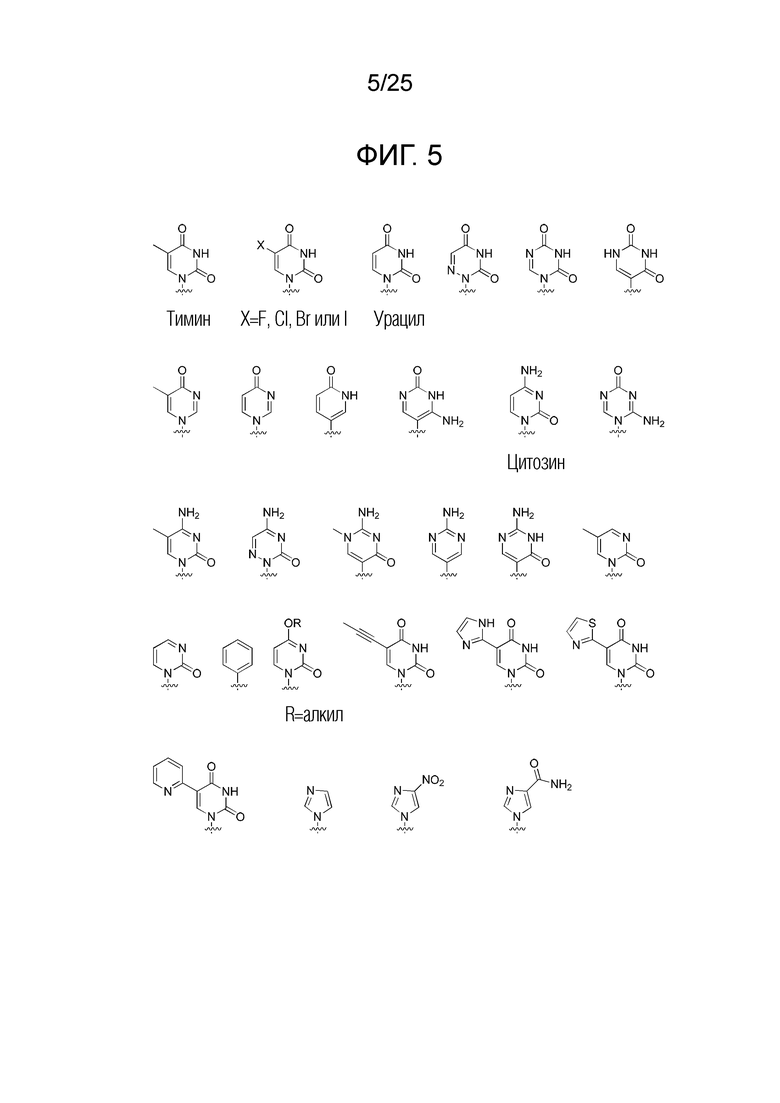
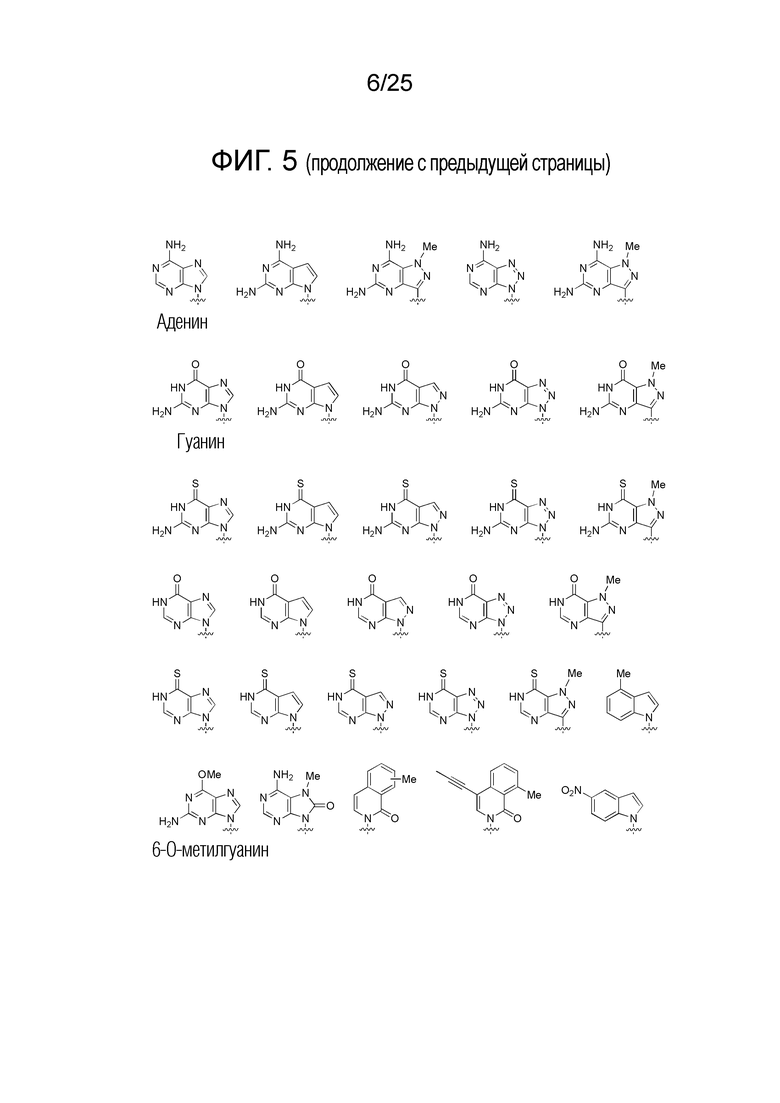
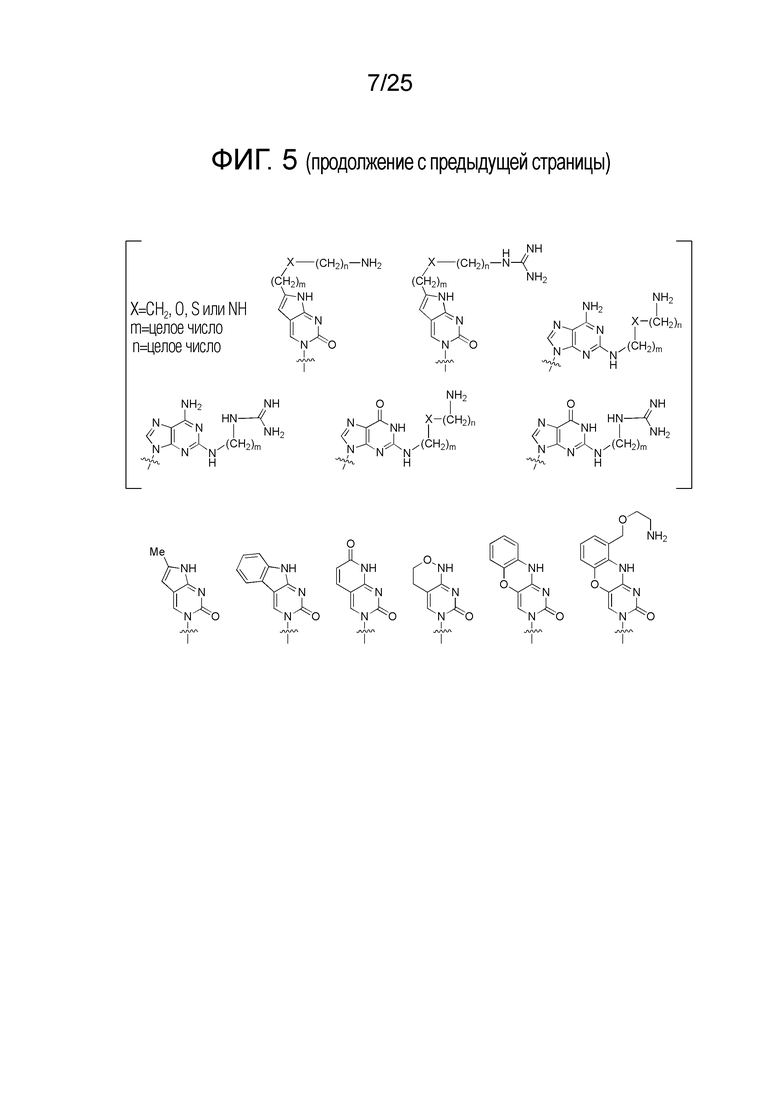
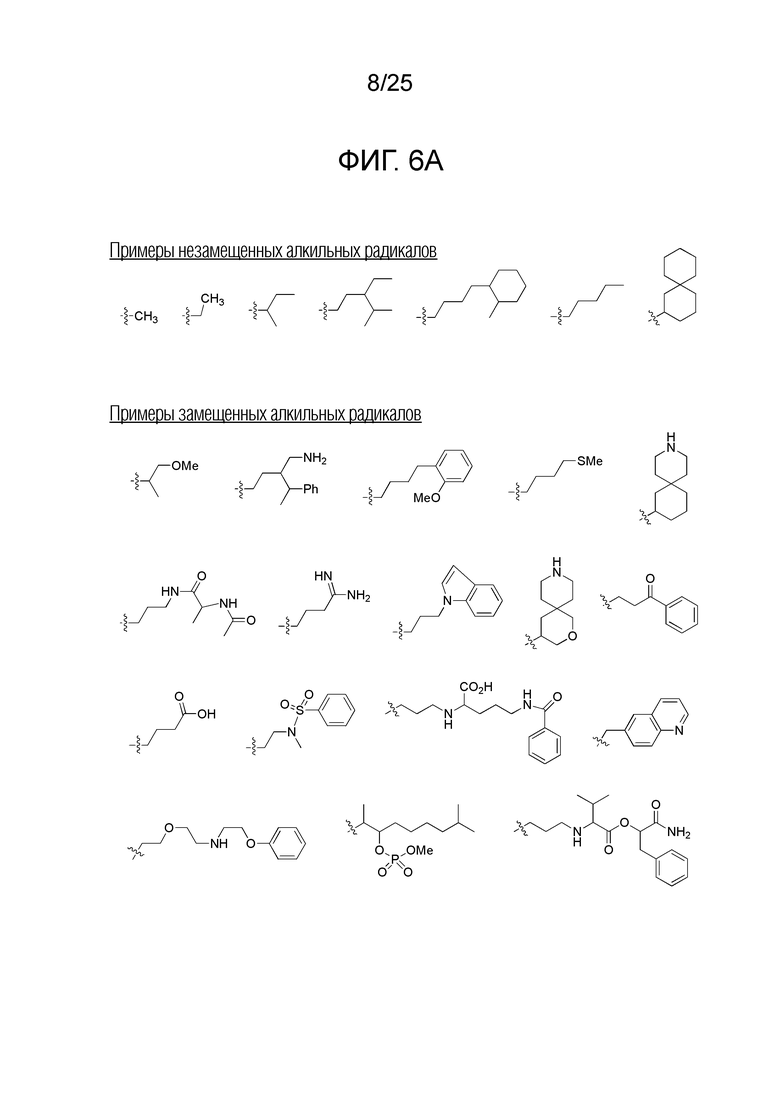
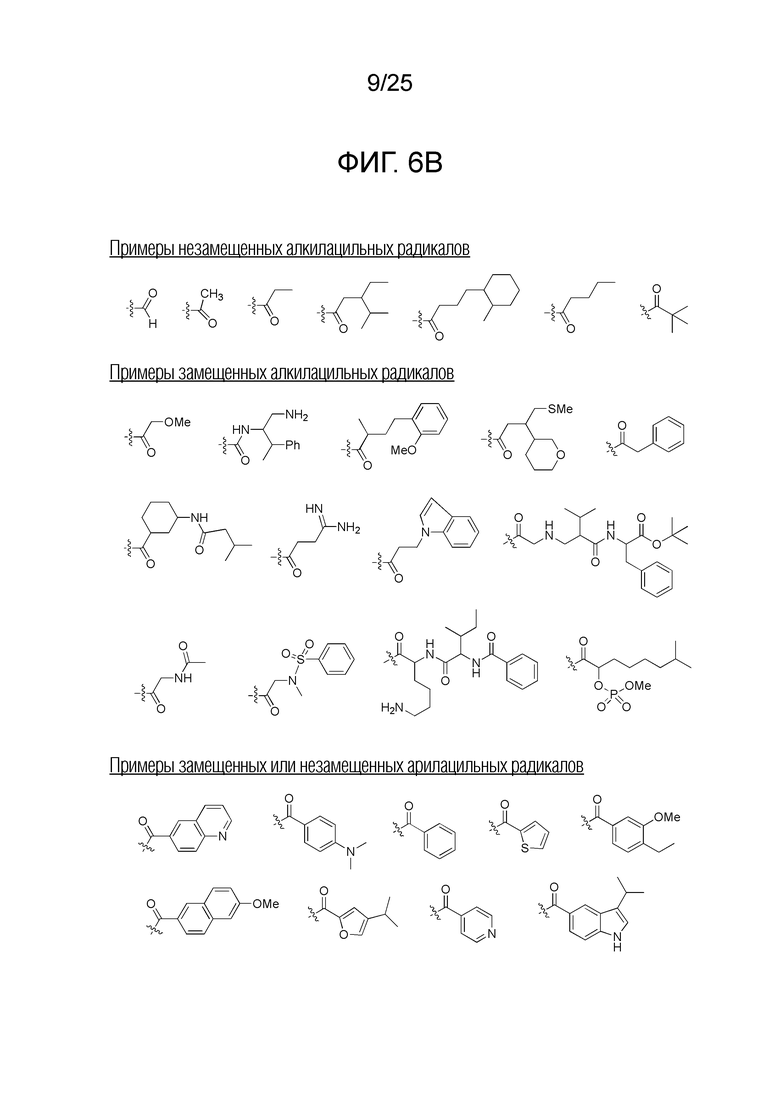
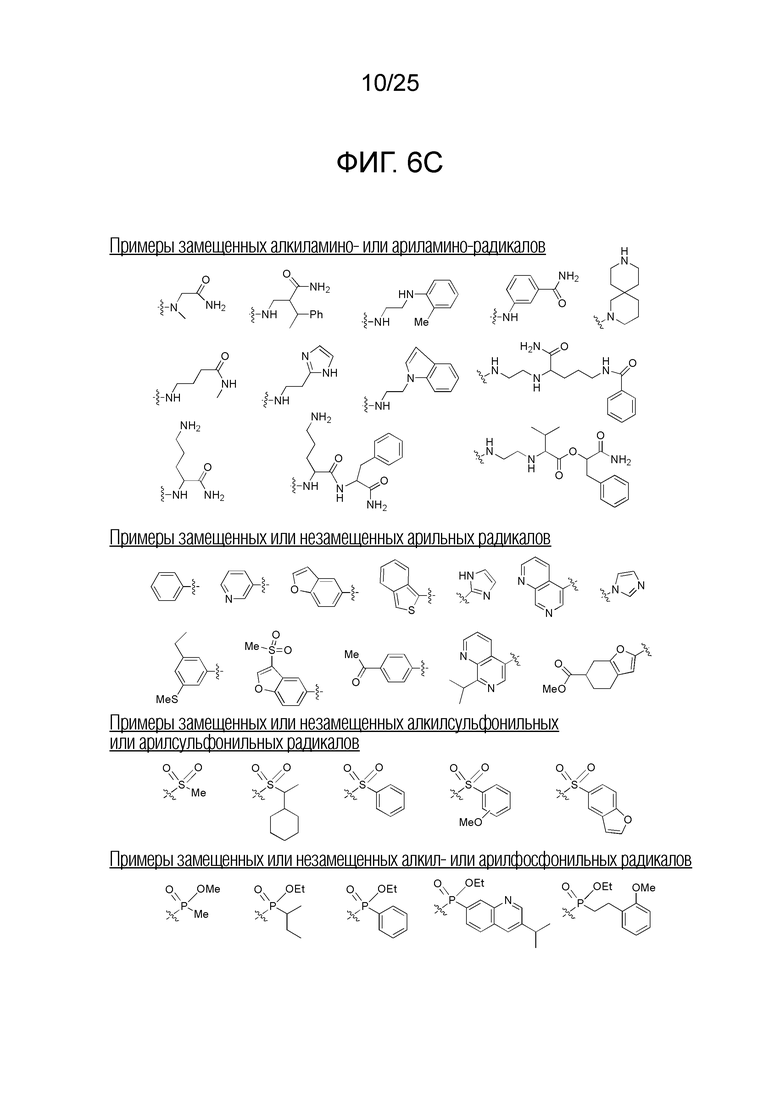
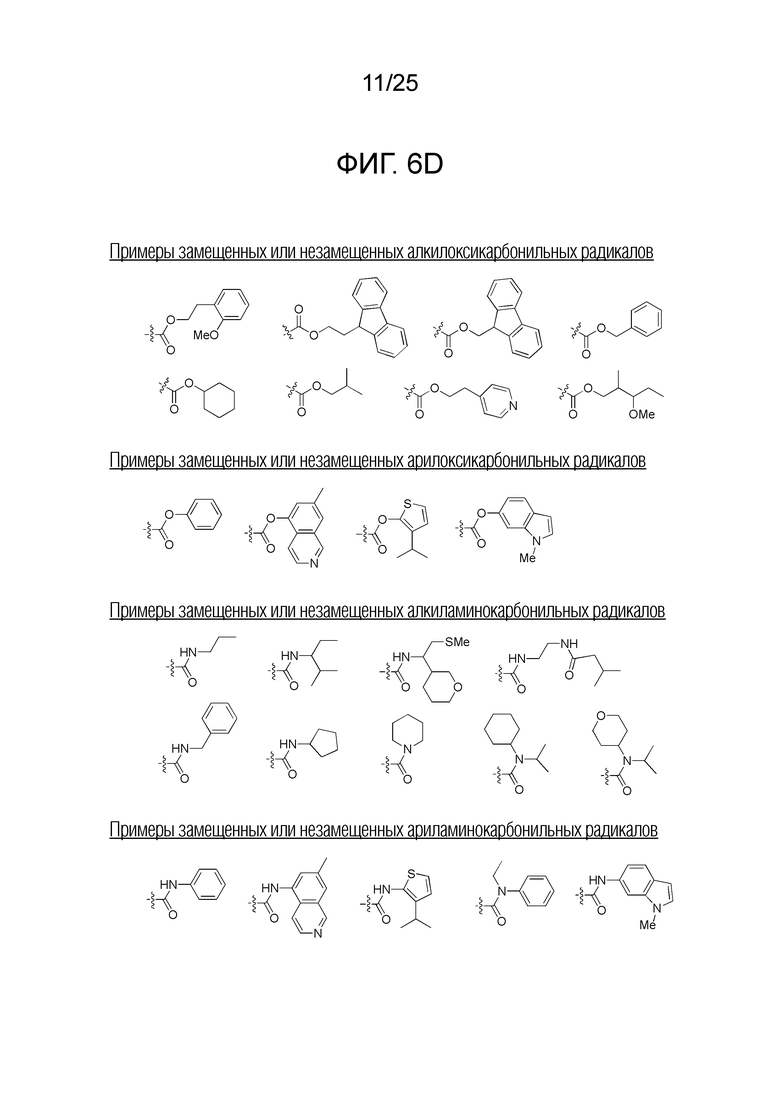
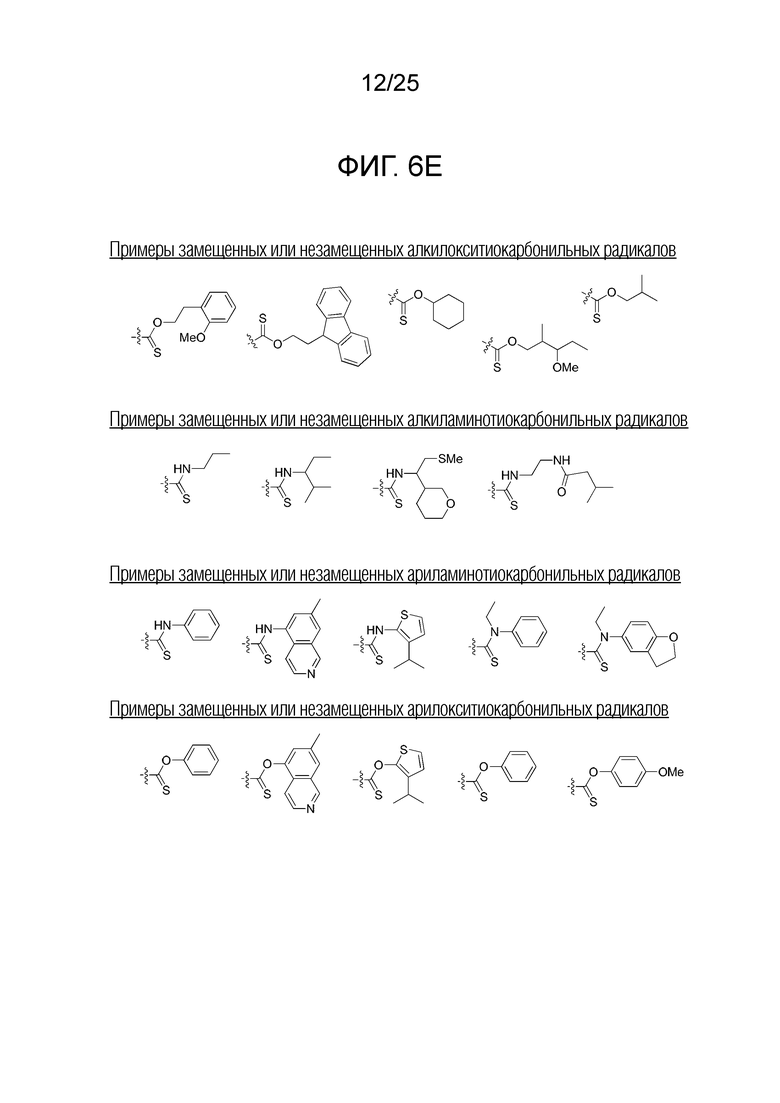
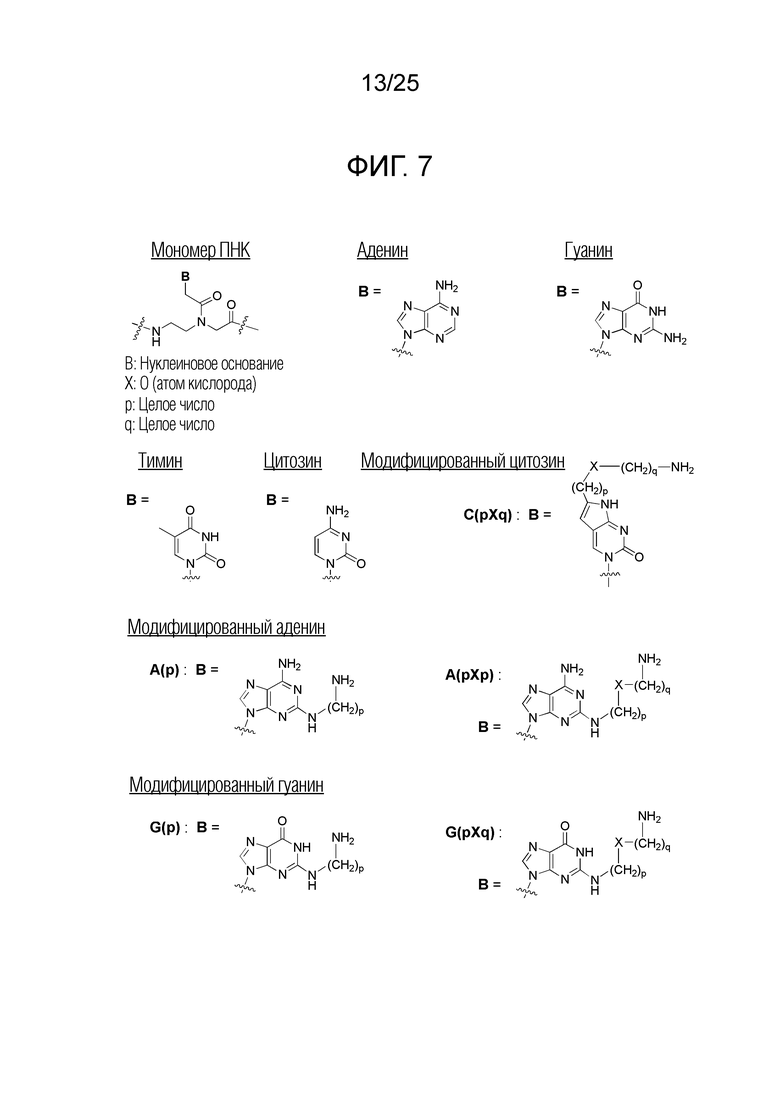
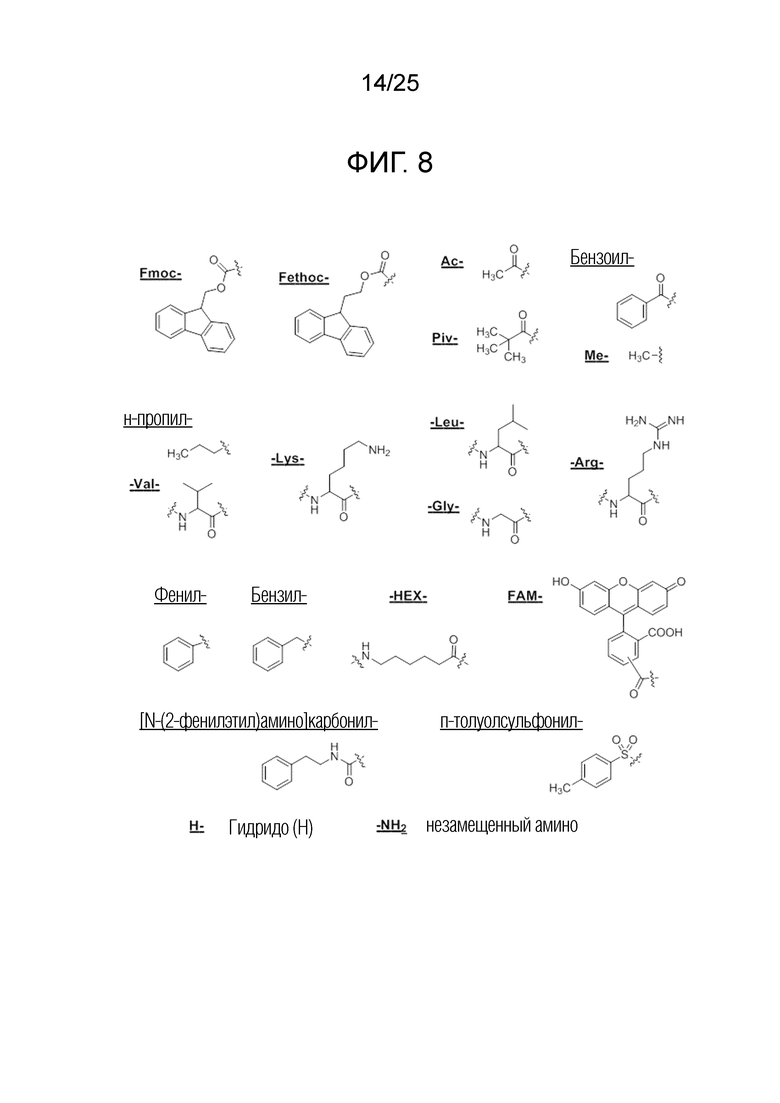
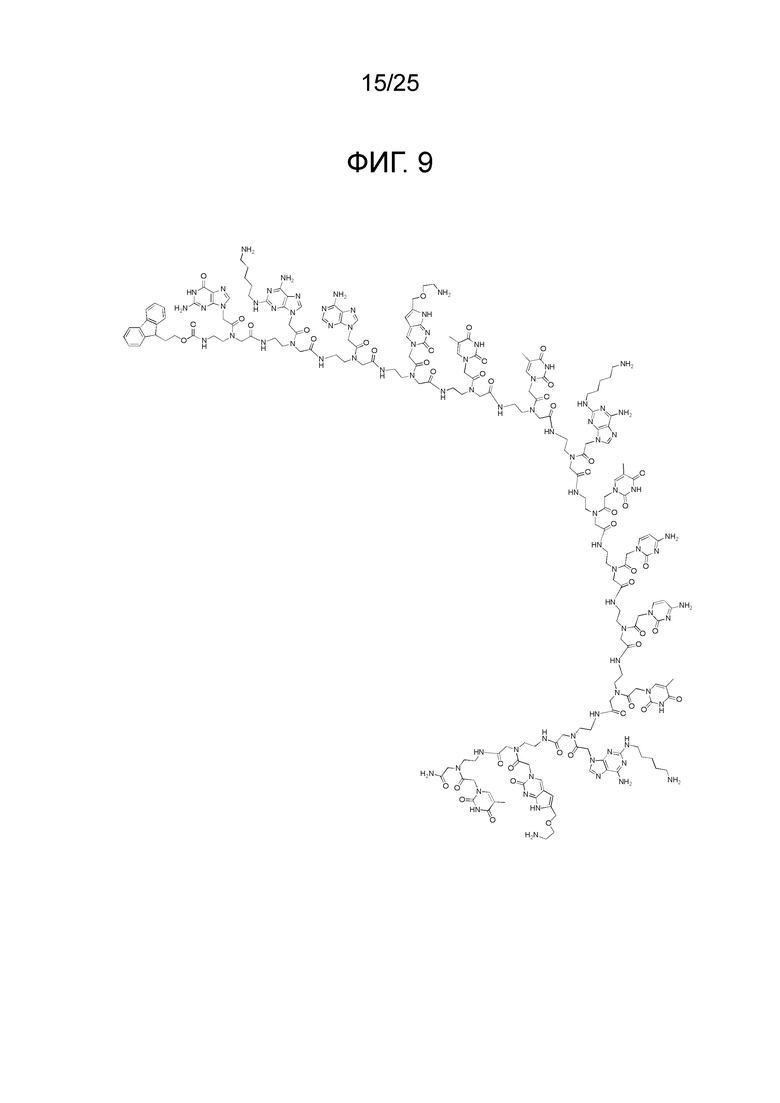
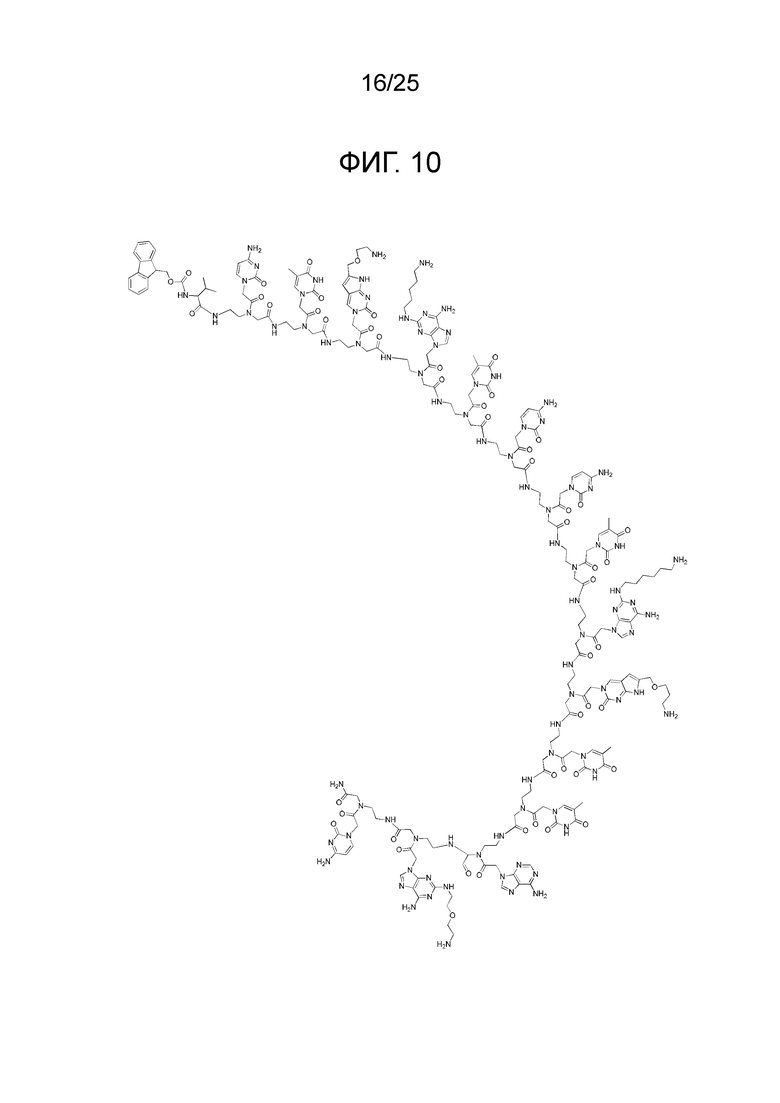
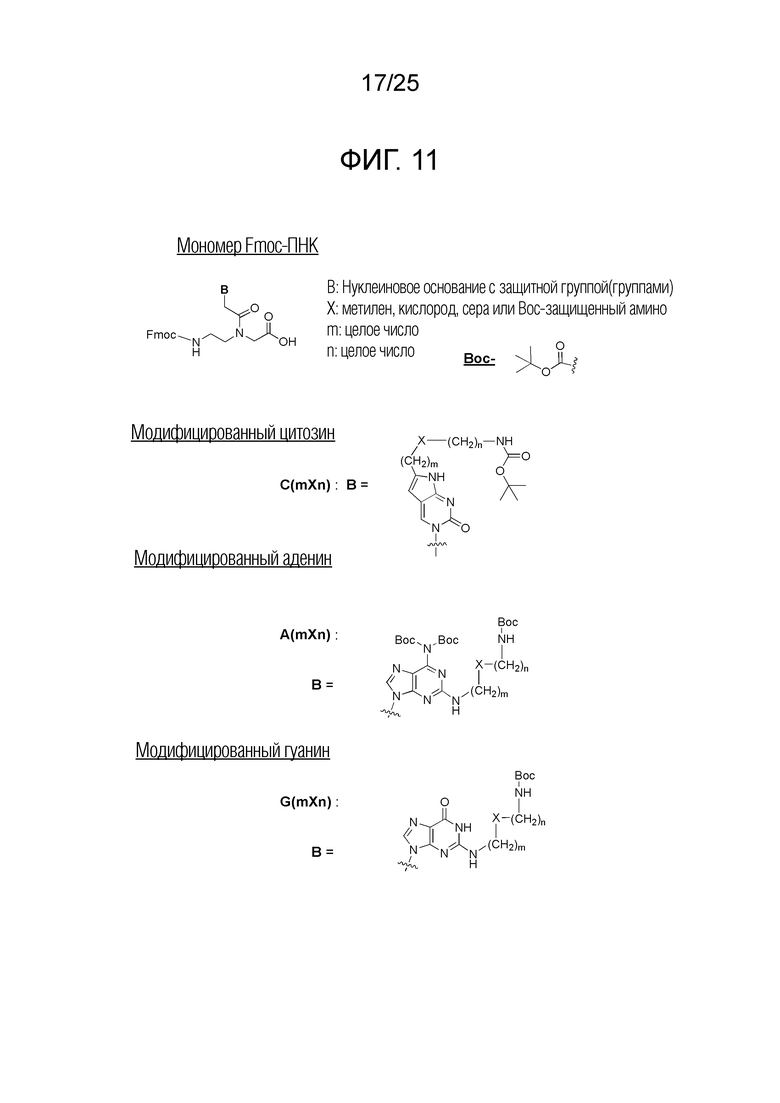
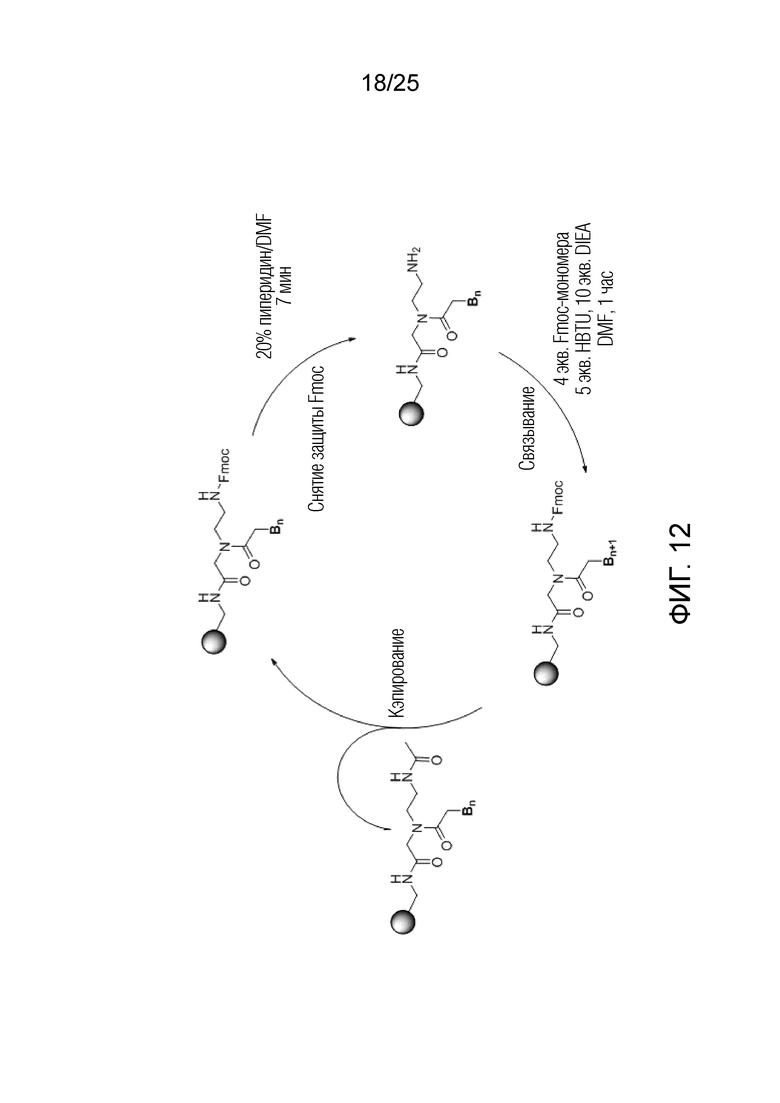
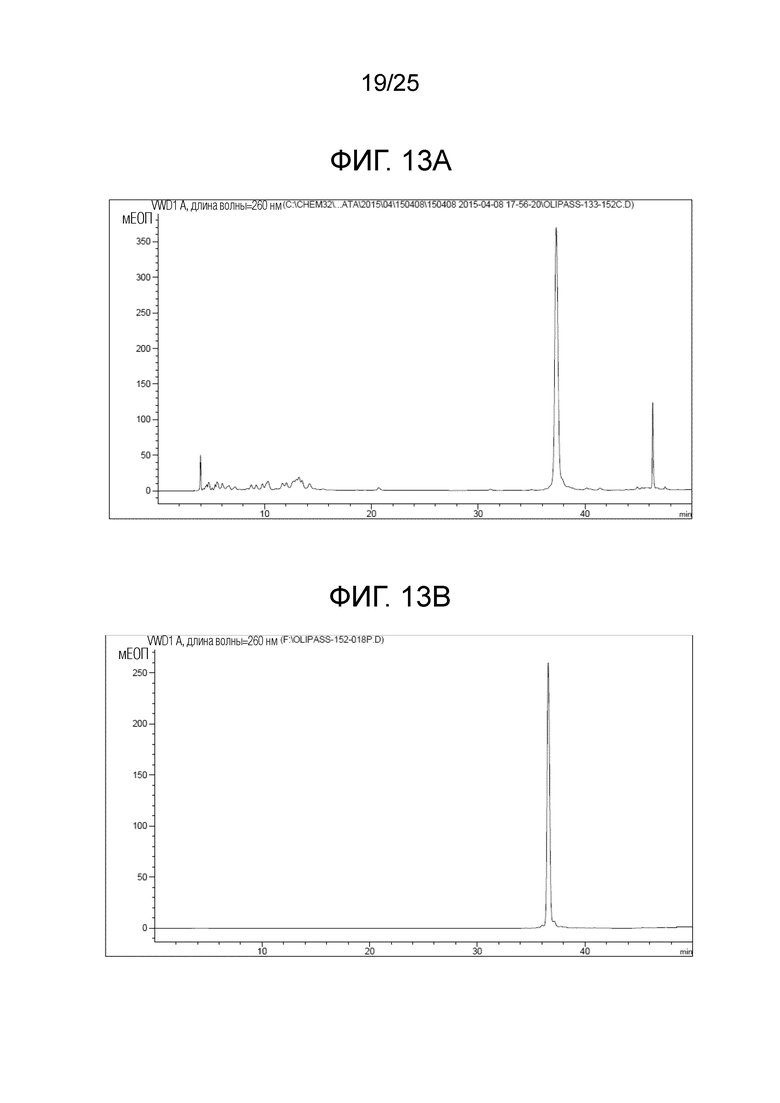

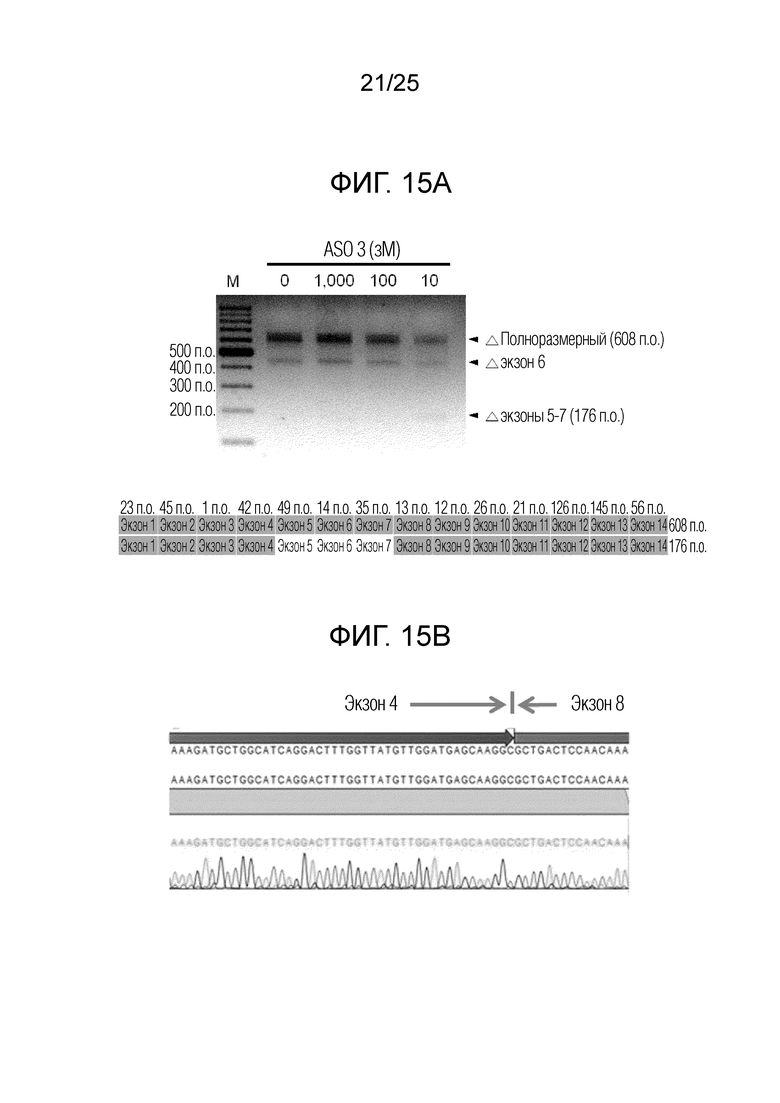
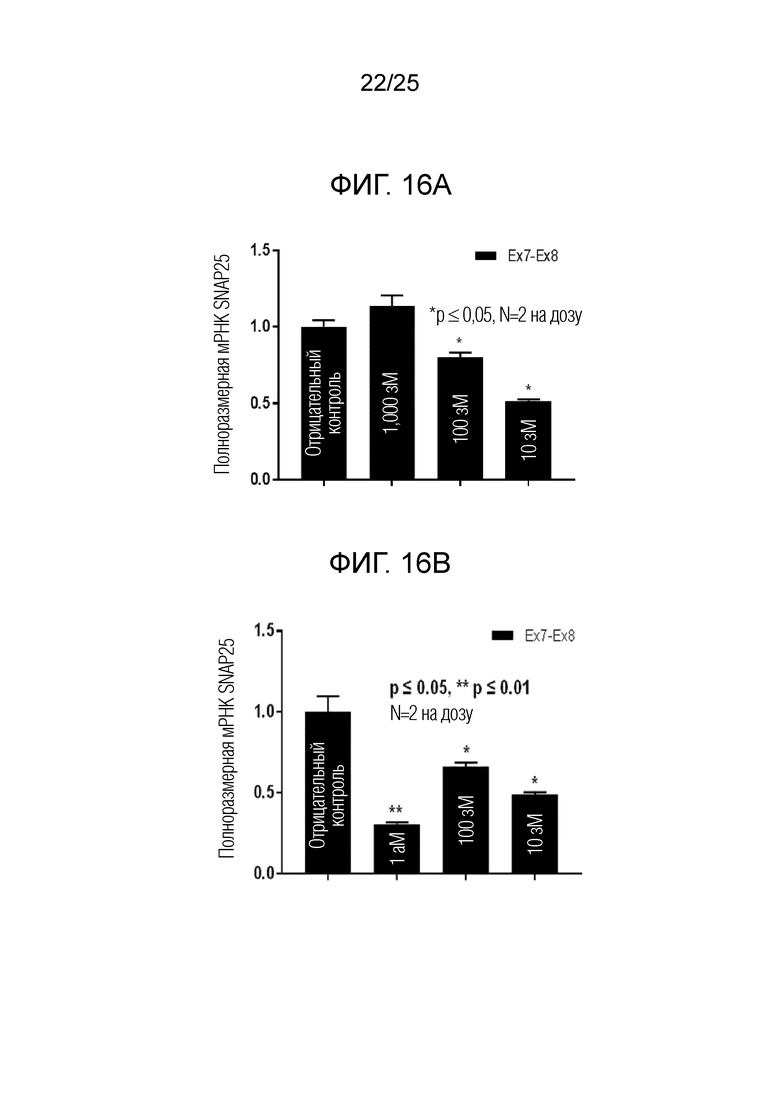
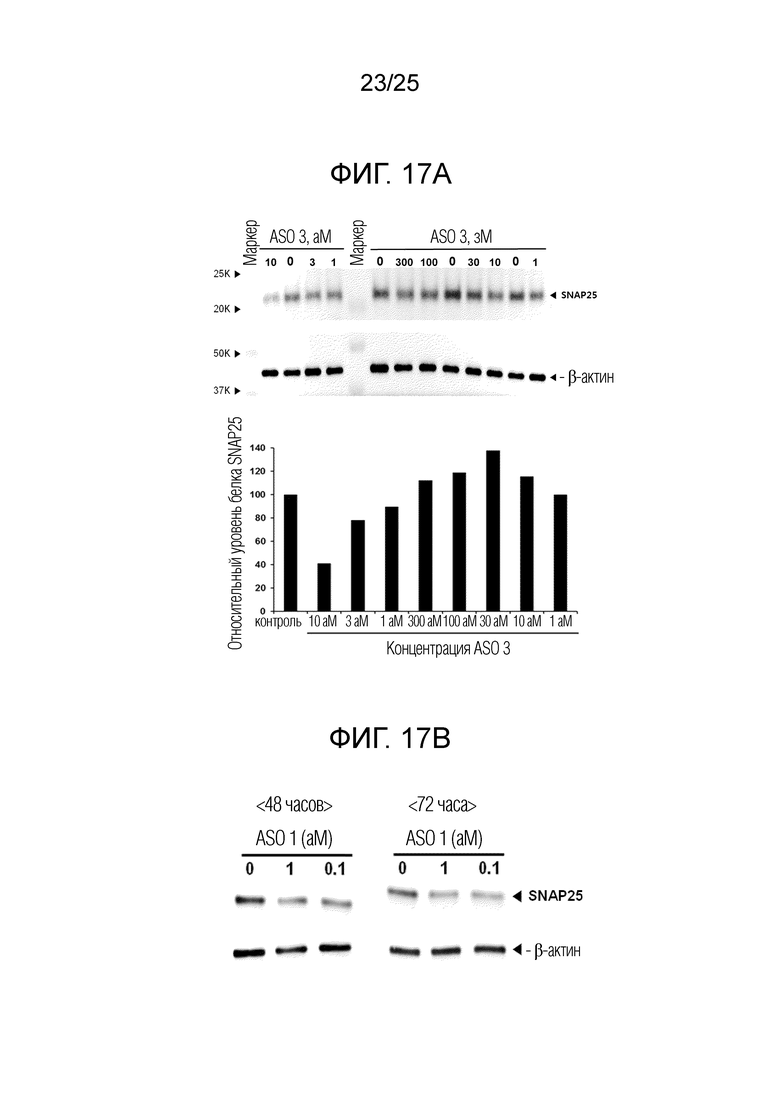
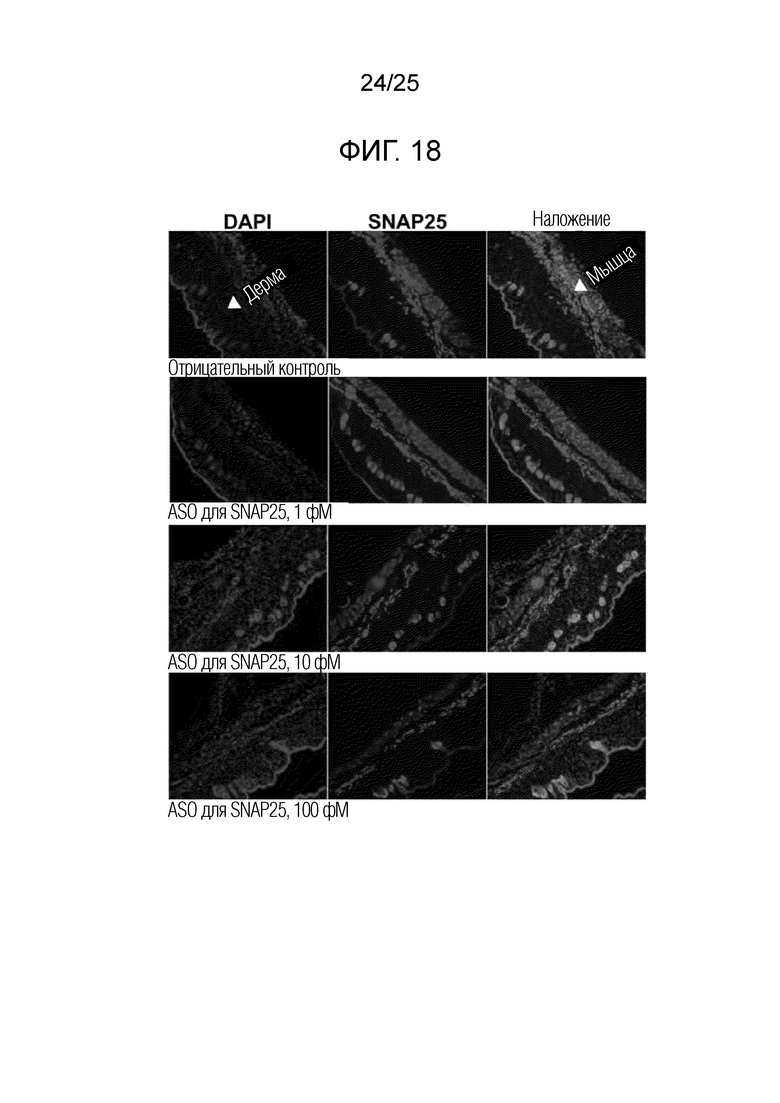
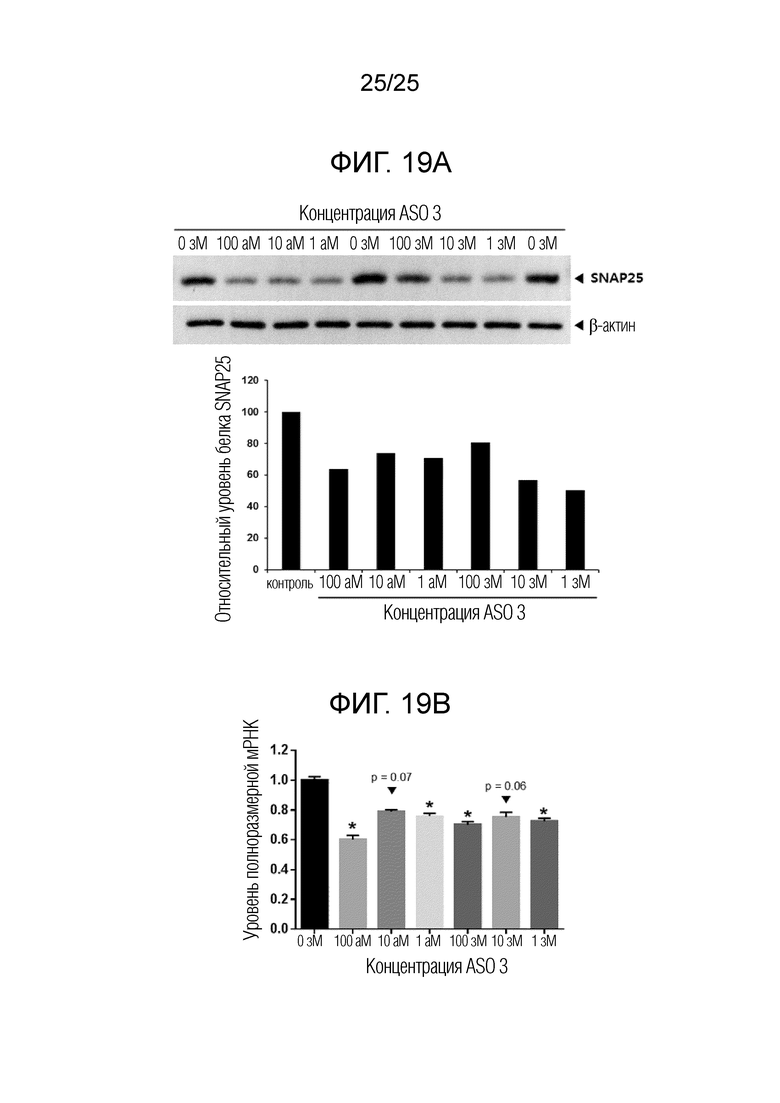
Группа изобретений относится к производным пептидной нуклеиновой кислоты, нацеленным на 3'-участок сплайсинга пре-мРНК SNAP25 человека, и их применению для лечения дерматологического показания или состояния, опосредованного высокой экспрессией гена SNAP25 человека. Производные пептидной нуклеиновой кислоты активно индуцируют по меньшей мере вариант сплайсинга SNAP25 человека мРНК в клетках и их можно использовать для безопасного лечения дерматологических показаний или состояний, включающих экспрессию белка SNAP25 человека, посредством местного введения. 4 н. и 6 з.п. ф-лы, 19 ил., 2 табл., 7 пр.
1. Производное пептидной нуклеиновой кислоты, представленное формулой I, или его фармацевтически приемлемая соль, для индуцирования пропуска экзона в пре-мРНК SNAP25 человека:
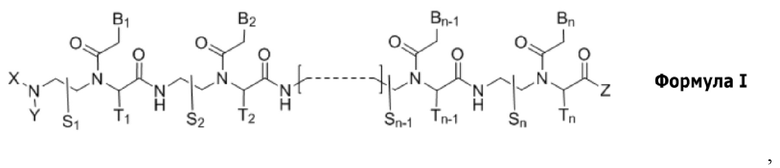
где
n представляет собой целое число между 12 и 25;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека или частично комплементарным пре-мРНК SNAP25 человека с одним или двумя несовпадениями;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридо[H]-радикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкильный, замещенный или незамещенный арильный, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный, замещенный или незамещенный алкилоксикарбонильный, замещенный или незамещенный алкиламинокарбонильный или замещенный или незамещенный арилсульфонильный радикал;
Z представляет собой замещенный или незамещенный аминорадикал;
где незамещенный алкильный радикал выбран из:
замещенный алкильный радикал выбран из:
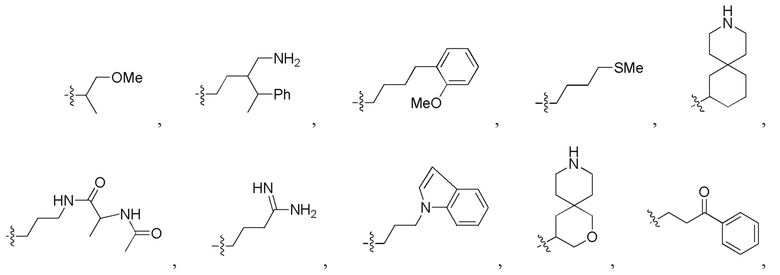
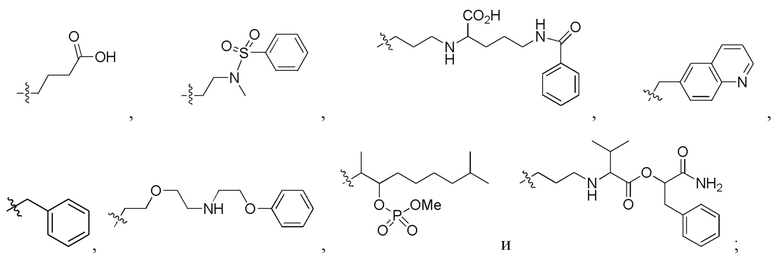
незамещенный или замещенный арильный радикал выбран из:
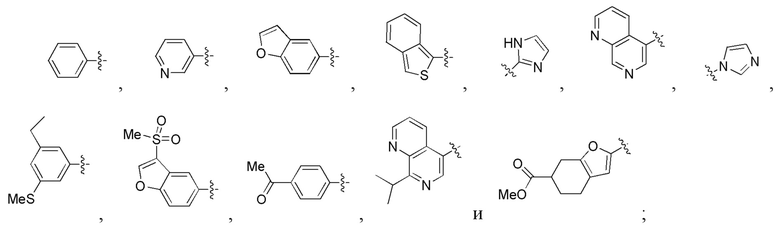
незамещенный алкилацильный радикал выбран из:
 n-гексаноил- и
n-гексаноил- и 
замещенный алкилацильный радикал выбран из:
 , Fethoc-Lys-Leu-, Fmoc-Lys-, Fmoc-Leu-, -FAM-HEX-HEX- и n-Benzoyl-Gly-;
, Fethoc-Lys-Leu-, Fmoc-Lys-, Fmoc-Leu-, -FAM-HEX-HEX- и n-Benzoyl-Gly-;
незамещенный или замещенный арилацильный радикал выбран из:
замещенный или незамещенный алкилоксикарбонильный радикал выбран из:
замещенный или незамещенный алкиламинокарбонильный радикал выбран из:
замещенный или незамещенный арилсульфонильный радикал выбран из:
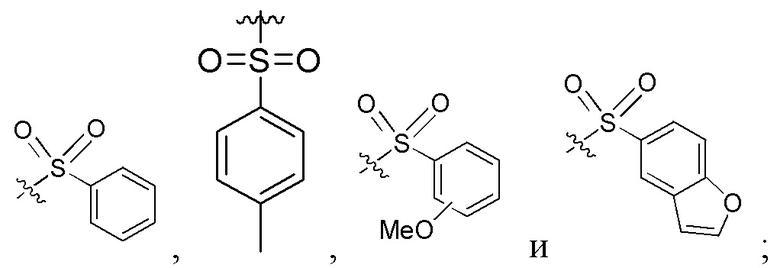
замещенный аминорадикал выбран из:
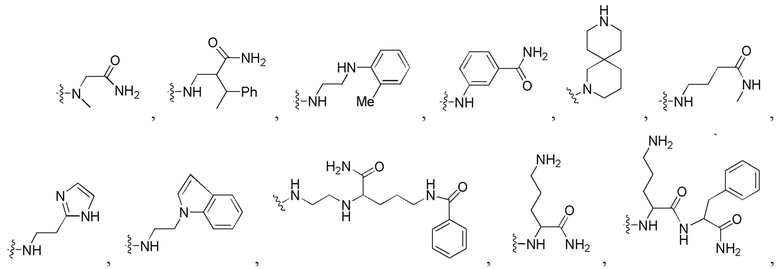
-Lys-NH2, -Arg-NH2, -Val-Lys-NH2 и 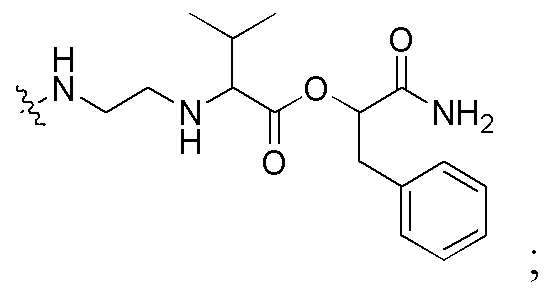
B1, B2, …, Bn-1 и Bn независимо выбраны из природных нуклеиновых оснований, включающих аденин, тимин, гуанин, цитозин и урацил, и неприродных нуклеиновых оснований; и
четыре, пять или шесть из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV:
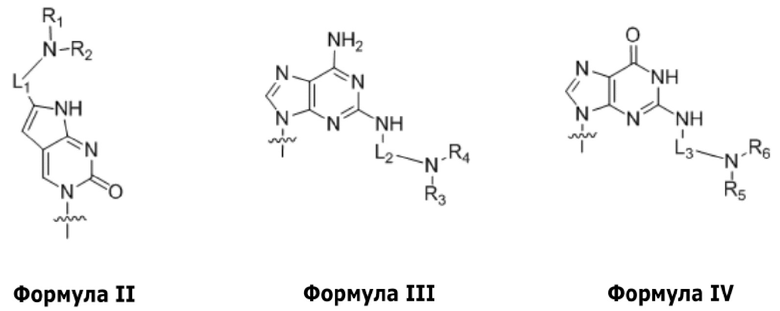 ,
,
где
R1, R2, R3, R4, R5 и R6 независимо выбраны из гидридо- и незамещенного алкильного радикала;
L1, L2 и L3 представляют собой ковалентный линкер, представленный формулой V, ковалентно связывающий основную аминогруппу с группой нуклеинового основания:
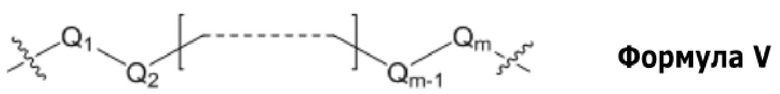 ,
,
где
Q1 и Qm представляют собой незамещенный метиленовый (-CH2-) радикал и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из незамещенного метилена, кислорода (-O-) и серы (-S-); и
m представляет собой целое число между 1 и 15.
2. Производное пептидной нуклеиновой кислоты по п. 1 или его фармацевтически приемлемая соль,
где n представляет собой целое число между 12 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X и Y независимо представляют собой гидридо-, замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
пять или шесть из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
Q1 и Qm представляют собой метиленовый радикал и Qm напрямую связан с основной аминогруппой;
Q2, Q3, … и Qm-1 независимо выбраны из метиленового и кислородного радикала; и
m представляет собой целое число между 1 и 8.
3. Производное пептидной нуклеиновой кислоты по п. 1 или его фармацевтически приемлемая соль,
где n представляет собой целое число между 12 и 19;
соединение формулы I имеет по меньшей мере 10-членное комплементарное перекрывание с 14-членной последовательностью пре-мРНК [(5' → 3') AUCCCAGGGUAACA] в пре-мРНК SNAP25 человека;
соединение формулы I является полностью комплементарным пре-мРНК SNAP25 человека;
S1, S2, …, Sn-1, Sn, T1, T2, …, Tn-1 и Tn представляют собой гидридорадикал;
X представляет собой гидридорадикал;
Y представляет собой замещенный или незамещенный алкилацильный, замещенный или незамещенный арилацильный или замещенный или незамещенный алкилоксикарбонильный радикал;
Z представляет собой замещенный или незамещенный аминорадикал;
B1, B2, …, Bn-1 и Bn независимо выбраны из аденина, тимина, гуанина, цитозина и неприродных нуклеиновых оснований;
по меньшей мере пять или шесть из B1, B2, …, Bn-1 и Bn независимо выбраны из неприродных нуклеиновых оснований, представленных формулой II, формулой III или формулой IV;
R1, R2, R3, R4, R5 и R6 представляют собой гидридорадикал;
L1 представляет собой -(CH2)2-O-(CH2)2-, -CH2-O-(CH2)2-, -CH2-O-(CH2)3-, -CH2-O-(CH2)4- или -CH2-O-(CH2)5- с правым концом, напрямую связанным с основной аминогруппой; и
L2 и L3 независимо выбраны из -(CH2)2-, -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -(CH2)7-, -(CH2)8-, -(CH2)2-O-(CH2)2-, -(CH2)3-O-(CH2)2- и -(CH2)2-O-(CH2)3- с правым концом, напрямую связанным с основной аминогруппой.
4. Производное пептидной нуклеиновой кислоты по п. 1, выбранное из группы производных пептидной нуклеиновой кислоты, представленных ниже, или его фармацевтически приемлемая соль:
(N → C) Fethoc-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-A(6)TC-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Piv-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-A(6)TT-TG(6)T-TA(2O2)C-CC(1O2)T-GG(5)G-A(5)-NH2;
(N → C) Fmoc-Lys-A(6)TT-TG(6)T-TA(6)C-CC(1O2)T-GG(6)G-A(6)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(5)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)T-A(5)-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) Fethoc-Lys-Leu-TG(5)T-TA(5)C-CC(1O2)T-GG(5)G-A(2O2)T-Lys-NH2;
(N → C) H-TG(5)T-TA(5)C-CC(1O2)T-GG(3)G-A(5)T-NH2;
(N → C) Бензоил-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-Val-Lys-NH2;
(N → C) Бензоил-TG(5)T-TA(5)C-CC(1O3)T-GG(5)G-A(5)T-NH2;
(N → C) н-гексаноил-TG(5)T-TA(8)C-CC(1O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) Ac-TG(5)T-TA(6)C-C(1O3)CT-GG(5)G-A(5)-NH2;
(N → C) [N-(2-Фенилэтил)амино]карбонил-TG(5)T-TA(4)C-CC(1O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) FAM-HEX-HEX-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) н-пропил-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-Arg-NH2;
(N → C) н-бензоил-Gly-TG(2O2)T-TA(5)C-CC(2O2)T-GG(5)G-A(5)T-NH2;
(N → C) N-Me-N-Фенил-TG(5)T-TA(5)C-CC(1O5)T-GG(5)G-A(5)T-NH2;
(N → C) п-толуолсульфонил-TG(2O3)T-TA(5)C-CC(1O2)T-GG(5)G-A(5)T-Lys-NH2;
(N → C) Fethoc-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2;
(N → C) Бензолсульфонил-TG(5)T-TA(2O3)C-CC(1O5)T-GG(5)G-A(6)T-NH2;
(N → C) Фенил-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(6)T-NH2;
(N → C) Fethoc-TG(5)G-TA(5)C-C(1O2)CT-TG(5)G-A(5)T-NH2;
(N → C) Fethoc-TG(5)T-AA(5)C-CC(1O2)T-GG(5)T-A(5)T-NH2;
(N → C) Fethoc-TG(6)T-TA(3)C-CC(1O5)T-GG(6)G-A(3)T-NH2;
(N → C) Fethoc-G(5)TT-A(5)CC(1O2)-CTG-G(5)GA(5)-TC(1O2)-NH2;
(N → C) Бензил-G(5)TT-A(5)CC(1O2)-CTG-G(5)GA(5)-TC(1O2)-NH2;
(N → C) Fethoc-GTT-A(3)CC(1O5)-CTG(6)-GGA(3)-TC(1O5)-NH2;
(N → C) Fethoc-TA(5)C-C(1O2)CT(1O5)-GG(5)G-A(5)TC-C(1O2)A-NH2;
(N → C) Fmoc-Leu-TA(4)C-C(1O3)CT-GG(5)G-A(4)TC-C(1O3)A-NH2;
(N → C) Fethoc-C(1O2)AT-TTG(6)-TTA(5)-CCC(1O2)-TG(6)-NH2;
(N → C) Fethoc-CA(6)T-TTG(5)-TTA(5)-CCC(1O2)-TG(5)-NH2;
(N → C) Fethoc-A(6)TT-TG(5)T-TA(5)C-C(1O2)CT-G(5)-NH2;
(N → C) Fethoc-CA(6)T-CA(6)T-TTG(5)-TTA(5)-CCC(1O2)-TG(5)-NH2;
(N → C) Fethoc-A(5)TT-TG(5)T-TA(5)C-CC(1O2)T-GG(5)G-A(5)-NH2;
(N → C) Fethoc-A(6)TT-TG(5)T-TA(6)C-C(1O2)CT-GG(5)G-A(5)-NH2 и
(N → C) Fethoc-A(6)TT-TG(5)T-TA(6)C-C(1O2)CT-G(5)G-NH2,
где A, G, T и C представляют собой мономеры ПНК с природнным нуклеиновым основанием аденином, гуанином, тимином и цитозином соответственно;
C(pOq), A(p), A(pOq), G(p) и G(pOq) представляют собой мономеры ПНК с неприродным нуклеиновым основанием, представленным формулой VI, формулой VII, формулой VIII, формулой IX и формулой X соответственно;
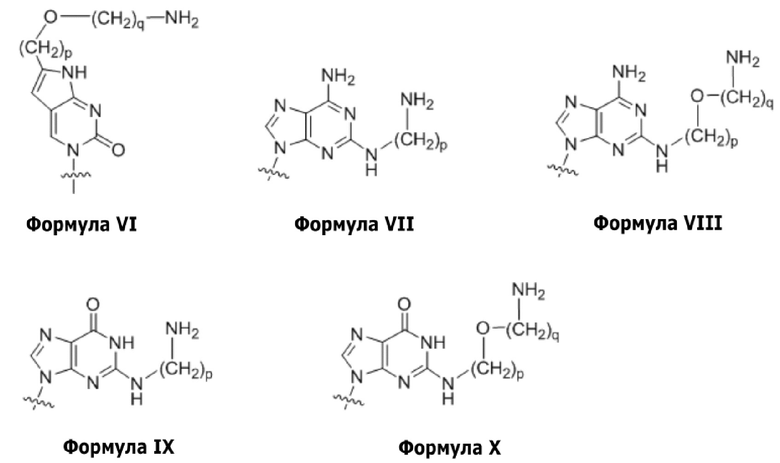 ,
,
где
p и q представляют собой целые числа; и
сокращенные наименования для N- и C-концевых заместителей конкретно определены следующим образом: «Fmoc-» представляет собой сокращенное наименование для «[(9-флуоренил)метилокси]карбонил-»; «Fethoc-» для «[2-(9-флуоренил)этил-1-окси]карбонил»; «Ac-» для «ацетил-»; «Бензоил-» для «бензолкарбонил-»; «Piv-» для «пивалил-»; «н-пропил-» для «1-(н-пропил)-»; «H-» для «гидридо-»группы; «п-толуолсульфонил» для «(4-метилбензол)-1-сульфонил-»; «-Lys-» для аминокислотного остатка «лизин»; «-Val-» для аминокислотного остатка «валин»; «-Leu-» для аминокислотного остатка «лейцин»; «-Arg-» для аминокислотного остатка «аргинин»; «-Gly-» для аминокислотного остатка «глицин»; «[N-(2-фенилэтил)амино]карбонил-» для «[N-1-(2-фенилэтил)амино]карбонил-»; «Бензил-» для «1-(фенил)метил-»; «Фенил-» для «фенил-»; «Me-» для «метил-»; «-HEX-» для «6-амино-1-гексаноил-», «FAM-» для «5 или 6-флуоресцеин-карбонил-(изомерной смеси)» и «-NH2» для незамещенной «-амино»группы.
5. Способ лечения дерматологического показания или состояния, опосредованного высокой экспрессией гена SNAP25 человека, включающий введение производного пептидной нуклеиновой кислоты по любому из пп. 1-4 субъекту-человеку.
6. Способ по п. 5, где производное пептидной нуклеиновой кислоты вводят местно.
7. Применение производного пептидной нуклеиновой кислоты по любому из пп. 1-4 для лечения дерматологического показания или состояния, опосредованного высокой экспрессией гена SNAP25 человека.
8. Применение по п. 7, где производное пептидной нуклеиновой кислоты предназначено для местного введения.
9. Применение производного пептидной нуклеиновой кислоты по любому из пп. 1-4 в производстве лекарственного средства для лечения дерматологического показания или состояния, опосредованного высокой экспрессией гена SNAP25 человека.
10. Применение по п. 9, где лекарственное средство предназначено для местного введения.
| WO 2009113828 A2, 17.09.2009 | |||
| US 6617422 B1, 09.09.2003 | |||
| OSEN-SAND, A | |||
| et al | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| 395-404, doi: 10.1038/364445a0 | |||
| ПРОИЗВОДНЫЕ ПЕПТИДО-НУКЛЕИНОВЫХ КИСЛОТ С ХОРОШЕЙ КЛЕТОЧНОЙ ПЕНЕТРАЦИЕЙ И СИЛЬНОЙ АФФИННОСТЬЮ К НУКЛЕИНОВОЙ КИСЛОТЕ | 2009 |
|
RU2564032C2 |
| SIWKOWSKI, A | |||
| M | |||
| et al., "Identification and functional validation of PNAs that inhibit murine | |||
Авторы
Даты
2022-03-15—Публикация
2017-12-29—Подача