Перекрестная ссылка на родственную заявку
Данная заявка испрашивает преимущество приоритета предварительной заявки на выдачу патента США № 62/194619, поданной 20 июля 2015 года, раскрытие которой включено в данный документ в полном объеме.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Данное изобретение относится к ингибиторам рецептора колониестимулирующего фактора-1 ("ингибиторам CSF-1R"). Ингибиторы CSF-1R по настоящему изобретению представляют собой малые молекулы, способные проникать через гематоэнцефалический барьер для достижения центральной нервной системы (ЦНС). Настоящее изобретение также относится к фармацевтическим составам, содержащим ингибиторы CSF-1R, и к применению ингибиторов CSF-1R и фармацевтических композиций, содержащих ингибиторы CSF-1R, для лечения заболевания. Настоящее изобретение также относится к применению ингибиторов CSF-1R и фармацевтических композиций, содержащих ингибиторы CSF-1R, для лечения иммуноопосредованных заболеваний, в том числе без ограничения рассеянного склероза, люпус-нефрита, ревматоидного артрита, и для лечения неврологических заболеваний, в том числе без ограничения бокового амиотрофического склероза (ALS) и болезни Хантингтона. Ингибиторы CSF-1R по настоящему изобретению можно применять для ингибирования c-FMS, клеточного рецептора для колониестимулирующего фактора-1 (CSF-1).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению, имеющего структуру формулы (I):
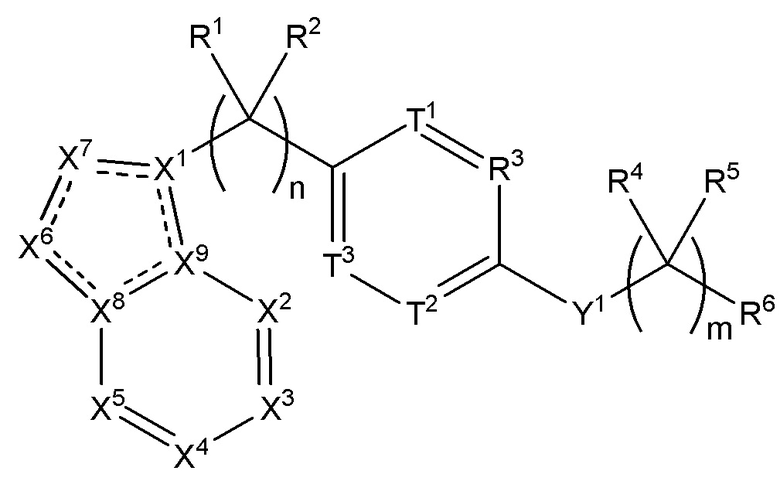 (I),
(I),
или его фармацевтически приемлемой соли, где
n равняется 0, 1, 2, 3, 4 или 5;
m равняется 1, 2, 3 или 4;
X1 представляет собой C, N или CR7,
каждый из X2, X3, X4, X5, X6 и X7 независимо выбран из N, NR7 или CR7,
где каждый R7 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R8-(C1-C10)алкил-, R8-(C3-C10)циклоалкила, R8-(C2-C9)гетероциклоалкила, R8-(C6-C14)арила, R8-(C2-C9)гетероарила, R8-(C2-C10)алкинила, R8-(C1-C10)алкиламина, R8-((C1-C10)алкил)2амина, R8-(C2-C10)алкиниламина, R8-C(O)-, R8-(C1-C10)алкил-C(O)O-, R8-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R8-(C3-C10)циклоалкил-O-, R8-(C2-C9)гетероциклоалкил-O-, R8-(C6-C14)арил-O-, R8-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R8R9N-, R8R9N(O)C-, R8(R9C(O))N-, R8R9NC(O)O-, R8C(O)-, R8R9NC(O)R8N-, (C1-C10)алкил-OC(O)R8N-, (C3-C10)циклоалкил-OC(O)R8N-, (C2-C9)гетероциклоалкил-OC(O)R8N-, (C6-C14)арил-OC(O)R8N-, (C2-C9)гетероарил-OC(O)R8N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R8R9NS(O)2-, (C1-C10)алкил-S(O)2R8N-, (C3-C10)циклоалкил-S(O)2R8N-, (C6-C14)арил-S(O)2R8N-, (C2-C9)гетероциклоалкил-SO2R8N- и (C2-C9)гетероарил-S(O)2R8N-;
где каждый из R8 и R9 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R8 и R9 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-;
каждый из X8 и X9 независимо выбран из N или C;
каждый из T1, T2 и T3 независимо выбран из N или CR10,
где каждый R10 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R10A-(C1-C10)алкил-, R10A-(C3-C10)циклоалкила, R10A-(C2-C9)гетероциклоалкила, R10A-(C6-C14)арила, R10A-(C2-C9)гетероарила, R10A-(C2-C10)алкинила, R10A-(C1-C10)алкиламина, R10A-((C1-C10)алкил)2амина, R10A-(C2-C10)алкиниламина, R10A-C(O)-, R10A-(C1-C10)алкил-C(O)O-, R10A-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R10A-(C3-C10)циклоалкил-O-, R10A-(C2-C9)гетероциклоалкил-O-, R10A-(C6-C14)арил-O-, R10A-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R10AR11N-, R10AR11N(O)C-, R10A(R11C(O))N-, R10AR11NC(O)O-, R10AC(O)-, R10AR11NC(O)R10AN-, (C1-C10)алкил-OC(O)R10AN-, (C3-C10)циклоалкил-OC(O)R10AN-, (C2-C9)гетероциклоалкил-OC(O)R10AN-, (C6-C14)арил-OC(O)R10AN-, (C2-C9)гетероарил-OC(O)R10AN-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R10AR11NS(O)2-, (C1-C10)алкил-S(O)2R10AN-, (C3-C10)циклоалкил-S(O)2R10AN-, (C6-C14)арил-S(O)2R10AN-, (C2-C9)гетероциклоалкил-SO2R10AN- и (C2-C9)гетероарил-S(O)2R10AN-;
где каждый из R10A и R11 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R10A и R11 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-,
Y1 представляет собой O, S, NR12 или CR12R13,
где R12 отсутствует, или каждый из R12 и R13 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R1 вместе с атомом углерода, к которому он прикреплен, образует карбонил, а R2 отсутствует, или каждый из R1 и R2 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R1 и R2 взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R4 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R4 и R5 могут быть взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R5 отсутствует или выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина, R14-(C2-C10)алкиниламина, R14-C(O)-, R14-(C1-C10)алкил-C(O)O-, R14-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R14-(C3-C10)циклоалкил-O-, R14-(C2-C9)гетероциклоалкил-O-, R14-(C6-C14)арил-O-, R14-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R14R15N-, R14R15N(O)C-, R14(R15C(O))N-, R14R15NC(O)O-, R14C(O)-, R14R15NC(O)R14N-, (C1-C10)алкил-OC(O)R14N-, (C3-C10)циклоалкил-OC(O)R14N-, (C2-C9)гетероциклоалкил-OC(O)R14N-, (C6-C14)арил-OC(O)R14N-, (C2-C9)гетероарил-OC(O)R14N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R14R15NS(O)2-, (C1-C10)алкил-S(O)2R14N-, (C3-C10)циклоалкил-S(O)2R14N-, (C6-C14)арил-S(O)2R14N-, (C2-C9)гетероциклоалкил-SO2R14N- и (C2-C9)гетероарил-S(O)2R14N-;
где каждый из R14 и R15 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, F2HC-O-, галогена, (CH3)2N-, H2N-, F3C-C(O)-, F3C- и F2HC-;
или R14 и R15 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-; и
R3 представляет собой N или CR16,
где R16 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или
когда m равняется 1, R16 и R4 взяты вместе с атомами углерода, к которым они прикреплены, с образованием соединения формулы (II):
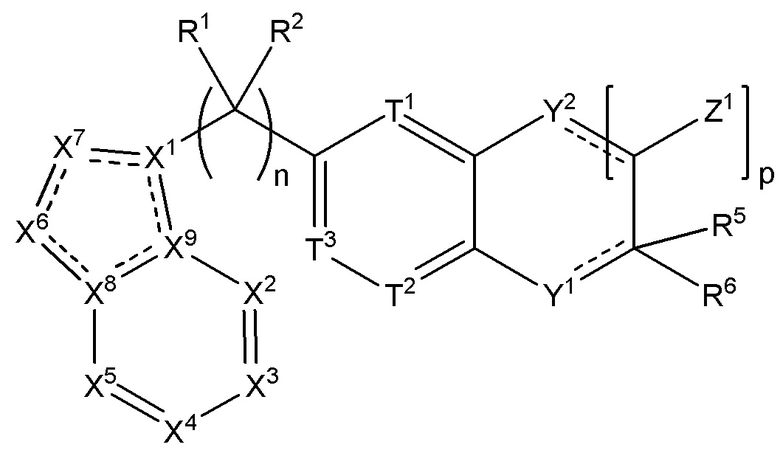 (II),
(II),
где пунктирные линии представляют необязательные двойные связи, и
p равняется 0, 1, 2, 3, 4 или 5;
каждый из Z1 независимо выбран из H, галогена, (C1-C10)алкила, (C2-C9)гетероалкила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, (C1-C10)алкокси- или H2N-;
Y2 представляет собой O, S, NR17 или CR17R18, и
где R17 отсутствует, или каждый из R17 и R18 независимо выбран из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению, имеющему структуру формулы (XIII):
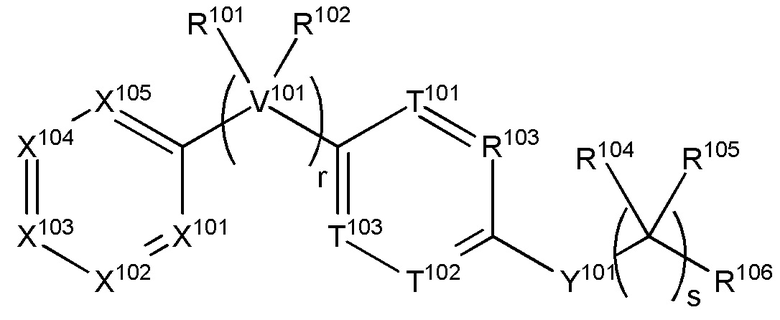 (XIII),
(XIII),
где
V101 представляет собой C, N, O или S,
r равняется 0, 1, 2, 3, 4 или 5;
где, когда V101 представляет собой C, тогда r равняется 0, 1, 2, 3, 4 или 5,
где, когда V101 представляет собой N, тогда r равняется 1, а R102 отсутствует;
где, когда V101 представляет собой O, r равняется 1, а R101 и R102 отсутствуют; и
где, когда V101 представляет собой S, r равняется 1, а R101 и R102 отсутствуют;
s равняется 1, 2, 3 или 4;
каждый из X101, X102, X103, X105 и X105 независимо выбран из N, NR107 или CR107,
где каждый R107 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R108-(C1-C10)алкил-, R108-(C3-C10)циклоалкила, R108-(C2-C9)гетероциклоалкила, R108-(C6-C14)арила, R108-(C2-C9)гетероарила, R108-(C2-C10)алкинила, R108-(C1-C10)алкиламина, R108-((C1-C10)алкил)2амина, R108-(C2-C10)алкиниламина, R108-C(O)-, R108-(C1-C10)алкил-C(O)O-, R108-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R108-(C3-C10)циклоалкил-O-, R108-(C2-C9)гетероциклоалкил-O-, R108-(C6-C14)арил-O-, R108-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R108R109N-, R108R109N(O)C-, R108(R109C(O))N-, R108R109NC(O)O-, R108C(O)-, R108R109NC(O)R108N-, (C1-C10)алкил-OC(O)R108N-, (C3-C10)циклоалкил-OC(O)R108N-, (C2-C9)гетероциклоалкил-OC(O)R108N-, (C6-C14)арил-OC(O)R108N-, (C2-C9)гетероарил-OC(O)R108N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R108R109NS(O)2-, (C1-C10)алкил-S(O)2R108N-, (C3-C10)циклоалкил-S(O)2R108N-, (C6-C14)арил-S(O)2R108N-, (C2-C9)гетероциклоалкил-SO2R108N- и (C2-C9)гетероарил-S(O)2R108N-;
где каждый из R108 и R109 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R108 и R109 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-;
каждый из T101, T102 и T103 независимо выбран из N или CR110,
где каждый R110 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R110A-(C1-C10)алкил-, R110A-(C3-C10)циклоалкила, R110A-(C2-C9)гетероциклоалкила, R110A-(C6-C14)арила, R110A-(C2-C9)гетероарила, R110A-(C2-C10)алкинила, R110A-(C1-C10)алкиламина, R110A-((C1-C10)алкил)2амина, R110A-(C2-C10)алкиниламина, R110A-C(O)-, R110A-(C1-C10)алкил-C(O)O-, R110A-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R110A-(C3-C10)циклоалкил-O-, R110A-(C2-C9)гетероциклоалкил-O-, R110A-(C6-C14)арил-O-, R110A-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R110AR111N-, R110AR111N(O)C-, R110A(R111C(O))N-, R110AR111NC(O)O-, R110AC(O)-, R110AR111NC(O)R110AN-, (C1-C10)алкил-OC(O)R110AN-, (C3-C10)циклоалкил-OC(O)R110AN-, (C2-C9)гетероциклоалкил-OC(O)R110AN-, (C6-C14)арил-OC(O)R110AN-, (C2-C9)гетероарил-OC(O)R110AN-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R110AR111NS(O)2-, (C1-C10)алкил-S(O)2R110AN-, (C3-C10)циклоалкил-S(O)2R110AN-, (C6-C14)арил-S(O)2R110AN-, (C2-C9)гетероциклоалкил-SO2R110AN- и (C2-C9)гетероарил-S(O)2R110AN-;
где каждый из R110A и R111 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R110A и R111 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-,
Y101 представляет собой O, S, NR112 или CR112R113,
где R112 отсутствует, или каждый из R112 и R113 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R101 вместе с атомом углерода, к которому он прикреплен, образует карбонил, а R102 отсутствует, или каждый из R101 и R102 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R101 и R102 взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R104 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R104 и R105 могут быть взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R105 отсутствует или выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R106 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R114-(C1-C10)алкил-, R114-(C3-C10)циклоалкила, R114-(C2-C9)гетероциклоалкила, R114-(C6-C14)арила, R114-(C2-C9)гетероарила, R114-(C2-C10)алкинила, R114-(C1-C10)алкиламина, R114-((C1-C10)алкил)2амина, R114-(C2-C10)алкиниламина, R114-C(O)-, R114-(C1-C10)алкил-C(O)O-, R114-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R114-(C3-C10)циклоалкил-O-, R114-(C2-C9)гетероциклоалкил-O-, R114-(C6-C14)арил-O-, R114-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R114R115N-, R114R115N(O)C-, R114(R115C(O))N-, R114R115NC(O)O-, R114C(O)-, R114R115NC(O)R114N-, (C1-C10)алкил-OC(O)R114N-, (C3-C10)циклоалкил-OC(O)R114N-, (C2-C9)гетероциклоалкил-OC(O)R114N-, (C6-C14)арил-OC(O)R114N-, (C2-C9)гетероарил-OC(O)R114N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R114R115NS(O)2-, (C1-C10)алкил-S(O)2R114N-, (C3-C10)циклоалкил-S(O)2R114N-, (C6-C14)арил-S(O)2R114N-, (C2-C9)гетероциклоалкил-SO2R114N- и (C2-C9)гетероарил-S(O)2R114N-;
где каждый из R114 и R115 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, F2HC-O-, галогена, (CH3)2N-, H2N-, F3C-C(O)-, F3C- и F2HC-;
или R114 и R115 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-; и
R103 представляет собой N или CR116,
где R116 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или
когда s равняется 1, R116 и R104 взяты вместе с атомами углерода, к которым они прикреплены, с образованием соединения формулы (XIV):
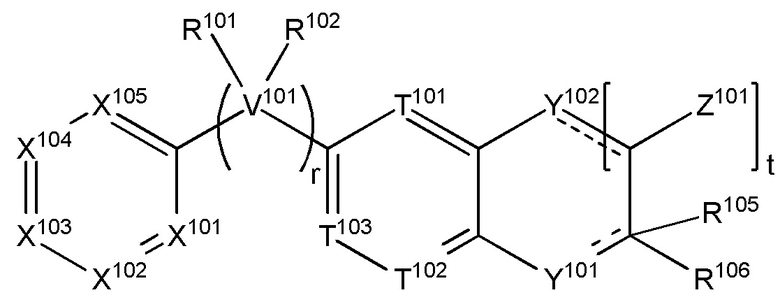 (XIV),
(XIV),
где пунктирные линии представляют необязательные двойные связи, и
t равняется 0, 1, 2, 3, 4 или 5;
каждый из Z101 независимо выбран из H, галогена, (C1-C10)алкила, (C2-C9)гетероалкила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, (C1-C10)алкокси- или H2N-;
Y102 представляет собой O, S, NR117 или CR117R118, и
где R117 отсутствует, или каждый из R117 и R118 независимо выбран из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7, а X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; а X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой N; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7, и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C; или где X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X2 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; и X7 представляет собой CH.
Соединение формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X3 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N; или где X2 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; и X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой N; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X1 представляет собой X2 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; X3 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X4 представляет собой CR7; и X5 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X3 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C; или где X2 представляет собой CH; и X4 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где X1 представляет собой C; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; X5 представляет собой N; X6 представляет собой N; X7 представляет собой N; X8 представляет собой C; и X9 представляет собой C.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где каждый из R7 независимо выбран из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R8(C1-C10)алкил-, R8(C3-C10)циклоалкила, R8(C2-C9)гетероциклоалкила, R8(C6-C14)арила, R8(C2-C9)гетероарила, R8(C2-C10)алкинила, R8(C1-C10)алкиламина, R8((C1-C10)алкил)2амина, R8(C2-C10)алкиниламина, R8C(O)-, R8(C1-C10)алкил-C(O)O-, R8(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R8(C3-C10)циклоалкил-O-, R8(C2-C9)гетероциклоалкил-O-, R8(C6-C14)арил-O-, R8(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R8R9N-, R9R9N(O)C-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC- или (CH3)2FC-,
где каждый из R8 и R9 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R8 и R9 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, H2N-, (CH3)HN-, (CH3)2N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC- или (CH3)2FC-.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где каждый из R7 независимо выбран из H, (C2-C9)гетероарила, (C2-C10)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкил-(C2-C9)гетероциклоалкила, (C2-C9)гетероциклоалкил-(C1-C10)алкокси-, (C1-C10)алкокси-(C2-C9)гетероциклоалкил-, (C2-C9)гетероалкил-C(O)- или F2HC-, где каждый (C1-C10)алкил, (C2-C9)гетероарил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где R7 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где n равняется 1, 2 или 3.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где R1 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; и R3 представляет собой CR16.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой N; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой CR16.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой N; T2 представляет собой N; T3 представляет собой CR10; а R3 представляет собой CR16.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой N; T2 представляет собой CR10; T3 представляет собой N; а R3 представляет собой CR16.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10; T2 представляет собой N; T3 представляет собой CR10; а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой N; а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10; T2 представляет собой N; T3 представляет собой N; а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой N; T2 представляет собой N; T3 представляет собой N; а R3 представляет собой CR16.
Настоящее изобретение также относится к соединению формулы (I), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (I), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (I), где R16 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (I), где R16 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (I), где каждый из R10 и R16 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси и галоген; T3 представляет собой CH; а R3 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CH; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкокси; T3 представляет собой CH, а R3 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси и галоген; T3 представляет собой CH; а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где T1 представляет собой CH; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкокси; T3 представляет собой CH, а R3 представляет собой N.
Настоящее изобретение также относится к соединению формулы (I), где Y1 представляет собой O, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (I), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (I), где Y1 представляет собой CR18R19.
Настоящее изобретение также относится к соединению формулы (I), где каждый из R18 и R19 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I), где Y1 представляет собой NR18
Настоящее изобретение также относится к соединению формулы (I), где m равняется 0, 1 или 2.
Настоящее изобретение также относится к соединению формулы (I), где m равняется 1.
Настоящее изобретение также относится к соединению формулы (I), где каждый из R4 и R5 независимо выбран из группы, состоящей из H, (C1-C10)алкила, гидрокси, галогена и амино.
Настоящее изобретение также относится к соединению формулы (I), где R4 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I), где каждый из R4 и R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (I), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (I), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (I), где R16 и R4 взяты вместе с атомами углерода, к которым они прикреплены, с образованием соединения формулы (II):
 (II).
(II).
Настоящее изобретение также относится к соединению формулы (II), где T1 представляет собой CR10; T2 представляет собой CR10; а T3 представляет собой CR10.
Настоящее изобретение также относится к соединению формулы (II), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (II), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси и галоген; а T3 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (II), где T1 представляет собой CH; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкокси; а T3 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (II), где T1 представляет собой CH; T2 представляет собой CR10, где R10 представляет собой галоген; а T3 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (II), где каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (II), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (II), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (II), где Y1 представляет собой CR18R19.
Настоящее изобретение также относится к соединению формулы (II), где каждый из R18 и R19 представляет собой H.
Настоящее изобретение также относится к соединению формулы (II), где Y2 представляет собой CR18R19.
Настоящее изобретение также относится к соединению формулы (II), где каждый из R18 и R19 представляет собой H.
Настоящее изобретение также относится к соединению формулы (II), где Y1 представляет собой S.
Настоящее изобретение также относится к соединению формулы (II), где Y2 представляет собой S.
Настоящее изобретение также относится к соединению формулы (II), где Y1 представляет собой NR18, где R18 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (II), где Y2 представляет собой NR18, где R18 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (II), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (II), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (II), где p равняется 0, 1 или 2.
Настоящее изобретение также относится к соединению формулы (II), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (II), где каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила.
Настоящее изобретение также относится к соединению формулы (II), где R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-
Настоящее изобретение также относится к соединению формулы (II), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (II), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (II), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (II), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (II), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (II), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (III):
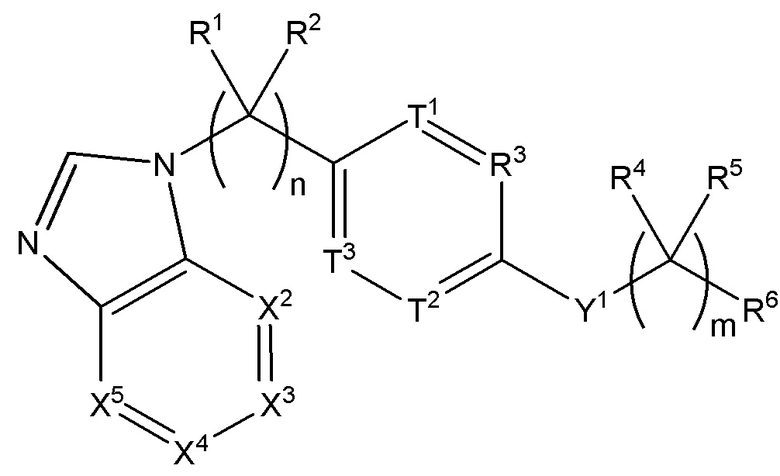 (III),
(III),
где n равняется 1, 2 или 3;
m равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой CR16 или N;
Y1 представляет собой O, NR18 или CR18R19;
каждый из R4 и R5 независимо выбран из группы, состоящей из H, (C1-C10)алкила, гидрокси, галогена и амино; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (III), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (III), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (III), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (III), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси и галоген; T3 представляет собой CH; а R3 представляет собой CH или N.
Настоящее изобретение также относится к соединению формулы (III), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (III), где m равняется 1.
Настоящее изобретение также относится к соединению формулы (III), где каждый из R4 и R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (III), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (III), где n равняется 1; m равняется 1; каждый из R1 и R2 представляет собой H; T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N; Y1 представляет собой O; каждый из R4 и R5 представляет собой H; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IV),
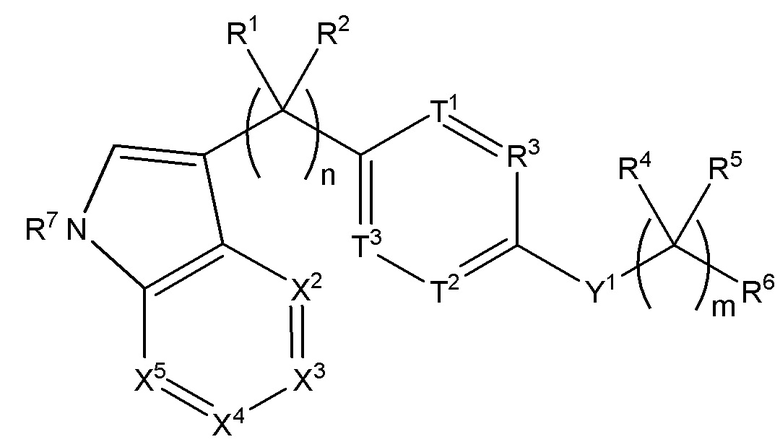 (IV),
(IV),
где n равняется 1, 2 или 3;
m равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой CR16 или N;
Y1 представляет собой O, NR18 или CR18R19;
каждый из R4 и R5 независимо выбран из группы, состоящей из H, (C1-C10)алкила, гидрокси, галогена и амино; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (IV), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (IV), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (IV), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (IV), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N.
Настоящее изобретение также относится к соединению формулы (IV), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (IV), где m равняется 1.
Настоящее изобретение также относится к соединению формулы (IV), где каждый из R4 и R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (IV), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IV), где n равняется 1; m равняется 1; каждый из R1 и R2 представляет собой H; T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N; Y1 представляет собой O; каждый из R4 и R5 представляет собой H; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (V),
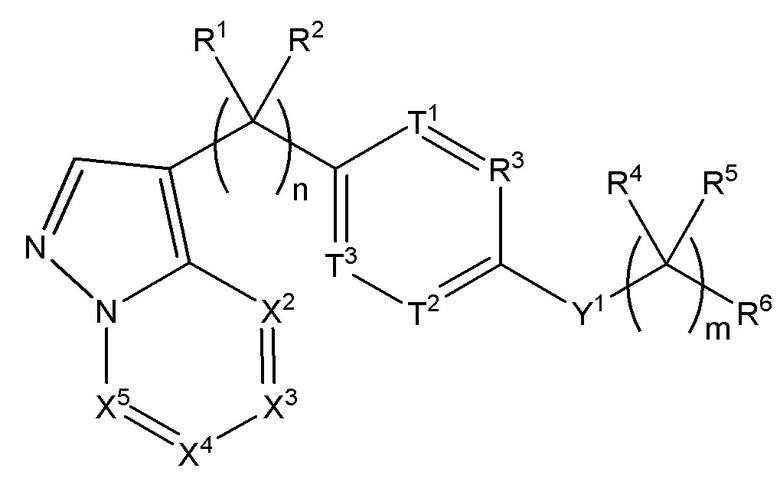 (V),
(V),
где n равняется 1, 2 или 3;
m равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой CR16 или N;
Y1 представляет собой O, NR18 или CR18R19;
каждый из R4 и R5 независимо выбран из группы, состоящей из H, (C1-C10)алкила, гидрокси, галогена и амино; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (V), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (V), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (V), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (V), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N.
Настоящее изобретение также относится к соединению формулы (V), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (V), где m равняется 1.
Настоящее изобретение также относится к соединению формулы (V), где каждый из R4 и R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (V), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (V), где n равняется 1; m равняется 1; каждый из R1 и R2 представляет собой H; T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N; Y1 представляет собой O; каждый из R4 и R5 представляет собой H; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VI),
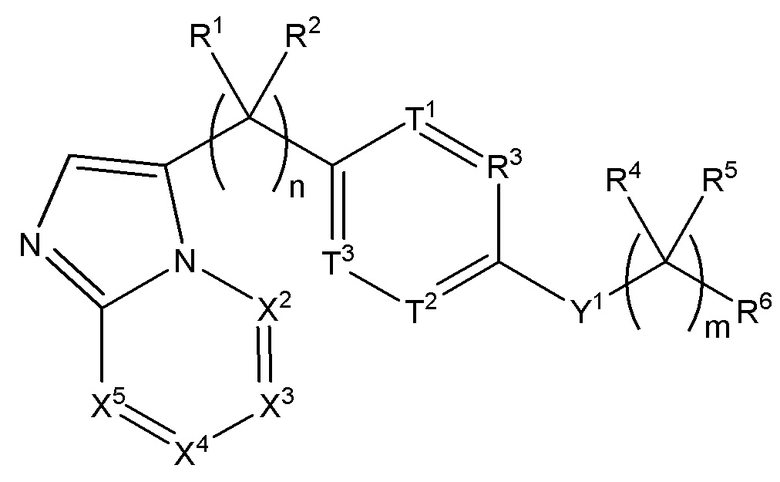 (VI),
(VI),
где n равняется 1, 2 или 3;
m равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10; а R3 представляет собой CR16 или N;
Y1 представляет собой O, NR18 или CR18R19;
каждый из R4 и R5 независимо выбран из группы, состоящей из H, (C1-C10)алкила, гидрокси, галогена и амино; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VI),
где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VI), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (VI), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VI), где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (VI), где T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N.
Настоящее изобретение также относится к соединению формулы (VI), где Y1 представляет собой O.
Настоящее изобретение также относится к соединению формулы (VI) где m равняется 1.
Настоящее изобретение также относится к соединению формулы (VI), где каждый из R4 и R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VI), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VI), где n равняется 1; m равняется 1; каждый из R1 и R2 представляет собой H; T1 представляет собой CR10, где R10 представляет собой H, (C1-C10)алкил или (C3-C10)циклоалкил; T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C1-C10)алкокси или галоген; T3 представляет собой CH; а R3 представляет собой CH или N; Y1 представляет собой O; каждый из R4 и R5 представляет собой H; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VII),
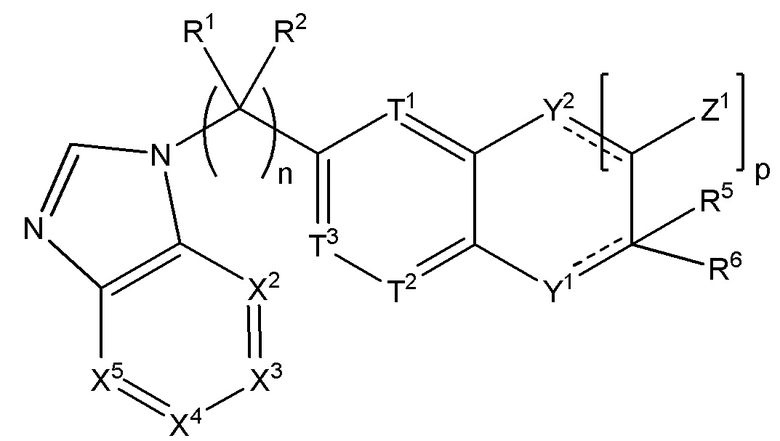 (VII),
(VII),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VII), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (VII), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VII), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (VII), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VII), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (VII), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (VII), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (VII), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (VII), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VII), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VII), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VII), где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (VIII):
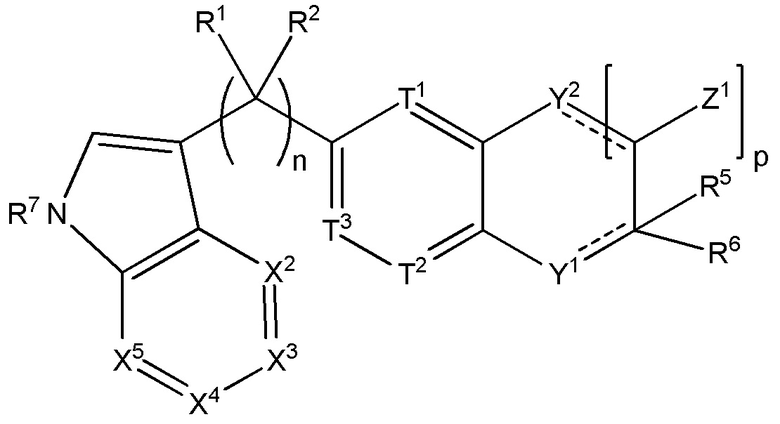 (VIII),
(VIII),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (VIII), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (VIII), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VIII), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (VIII), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VIII), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (VIII), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (VIII), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (VIII), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (VIII), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (VIII), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VIII), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (VIII), где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (IX):
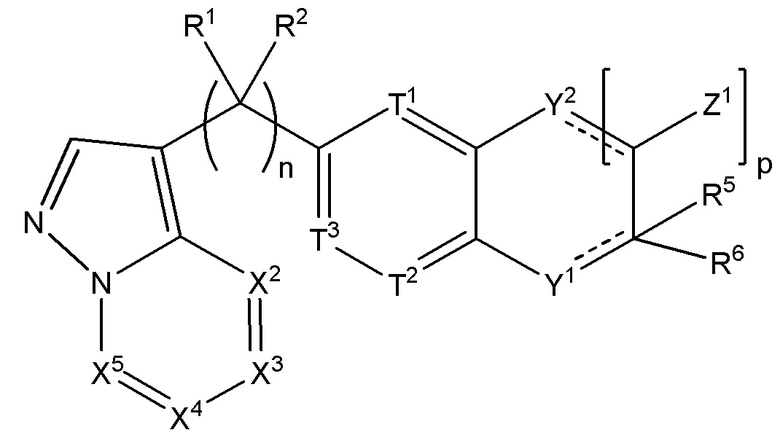 (IX),
(IX),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7. а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (IX), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (IX), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (IX), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (IX), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (IX), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (IX), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (IX), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (IX), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (IX), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (IX), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IX), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (IX),
где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (X),
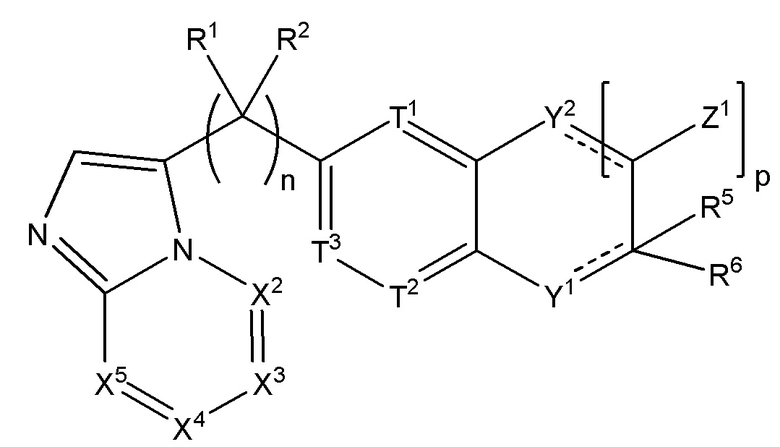 (X),
(X),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N, а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (X), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N, а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (X), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (X), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (X), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (X), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (X), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (X), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (X), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (X), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (X), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (X), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (X), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (X), где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (XI),
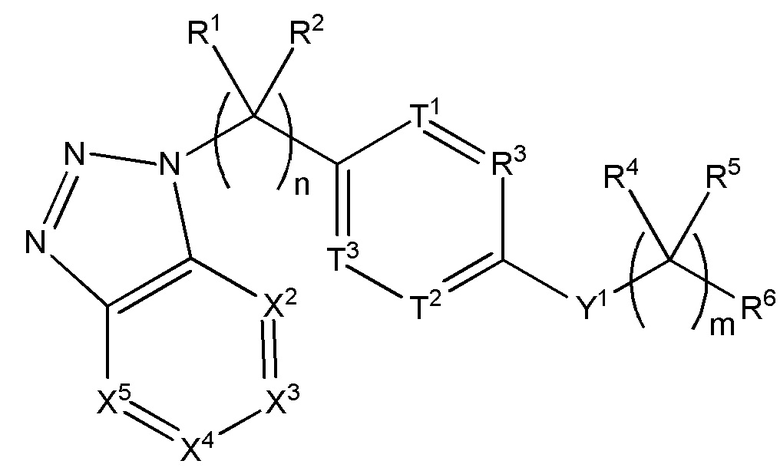 (XI),
(XI),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина и R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой CR7; а X4 представляет собой CR7; X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XI), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (XI), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XI), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (XI), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XI), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (XI), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (XI), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (XI), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (XI), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XI), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (XI), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила и R14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (XI), где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (XII),
 (XII),
(XII),
где n равняется 1, 2 или 3;
p равняется 0, 1 или 2;
каждый из R1 и R2 независимо выбран из H, (C1-C10)алкила, (C1-C10)алкиламина, (C1-C10)алкокси- или NH2;
T1 представляет собой CR10; T2 представляет собой CR10; T3 представляет собой CR10;
каждый из Y1 и Y2 независимо выбран из O, S, NR18 или CR18R19;
каждый из Z1 независимо выбран из H, галогена или (C1-C10)алкила;
R5 выбран из группы, состоящей из H, (C1-C10)алкила, HO-, галогена и H2N-; и
R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R14-(C1-C10)алкил-, R14-(C3-C10)циклоалкила, R14-(C2-C9)гетероциклоалкила, R14-(C6-C14)арила, R14-(C2-C9)гетероарила, R14-(C2-C10)алкинила, R14-(C1-C10)алкиламина, R14-((C1-C10)алкил)2амина, R14-C(O)-;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C-, F2HC-;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, H2N-.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой CR7; а X4 представляет собой CR7; X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой N; а X5 представляет собой CR7.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой N; X4 представляет собой CR7; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой N; а X5 представляет собой N.
Настоящее изобретение также относится к соединению формулы (XII), где n равняется 1.
Настоящее изобретение также относится к соединению формулы (XII), где каждый из R1 и R2 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XII), где каждый R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
Настоящее изобретение также относится к соединению формулы (XII), где каждый R10 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XII), где Y1 представляет собой O; а Y2 представляет собой O, S, NR18 или CR18R19.
Настоящее изобретение также относится к соединению формулы (XII), где Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (XII), где p равняется 1.
Настоящее изобретение также относится к соединению формулы (XII), где R5 представляет собой H или (C1-C10)алкил.
Настоящее изобретение также относится к соединению формулы (XII), где R5 представляет собой H.
Настоящее изобретение также относится к соединению формулы (XII), где R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарилR14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C-, F2HC-;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена, H2N-.
Настоящее изобретение также относится к соединению формулы (XII), где n равняется 1; p равняется 1; каждый из R1 и R2 представляет собой H; R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена; Y1 представляет собой O; Y2 представляет собой O, S, NR18 или CR18R19; R5 представляет собой H или (C1-C10)алкил; а R6 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероарила, R14-(C6-C14)арила, R14-(C2-C9)гетероарилR14-(C1-C10)алкиламина;
где каждый из R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, (C1-C10)алкокси-, HO-, F2HC-O-, F3C-C(O)-, F3C-, F2HC-;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена, H2N-.
Настоящее изобретение также относится к соединению формулы (XII), где R5 представляет собой H, а Y2 представляет собой O.
Настоящее изобретение также относится к соединению формулы (I) или формулы (II), где соединение выбрано из:
3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
(S)-4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина,
6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2R,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2S,3R)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2S,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2R,3R)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
(S)-азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
(S)-азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина;
4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина;
(R)-4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина;
(R)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина;
(S)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина;
(R)-азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона;
3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и
(R)-3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина.
Настоящее изобретение также относится к соединению формулы (XIII):
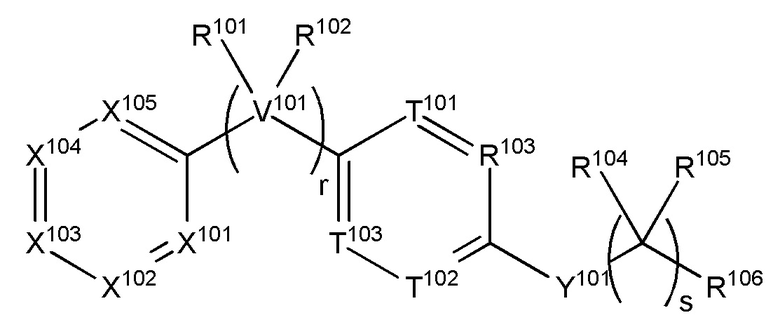 (XIII),
(XIII),
где
V101 представляет собой C, N, O или S,
r равняется 0, 1, 2, 3, 4 или 5;
где, когда V101 представляет собой C, тогда r равняется 0, 1, 2, 3, 4 или 5,
где, когда V101 представляет собой N, тогда r равняется 1, а R102 отсутствует;
где, когда V101 представляет собой O, r равняется 1, а R101 и R102 отсутствуют; и
где, когда V101 представляет собой S, r равняется 1, а R101 и R102 отсутствуют;
s равняется 1, 2, 3 или 4;
каждый из X101, X102, X103, X105 и X105 независимо выбран из N, NR107 или CR107,
где каждый R107 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R108-(C1-C10)алкил-, R108-(C3-C10)циклоалкила, R108-(C2-C9)гетероциклоалкила, R108-(C6-C14)арила, R108-(C2-C9)гетероарила, R108-(C2-C10)алкинила, R108-(C1-C10)алкиламина, R108-((C1-C10)алкил)2амина, R108-(C2-C10)алкиниламина, R108-C(O)-, R108-(C1-C10)алкил-C(O)O-, R108-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R108-(C3-C10)циклоалкил-O-, R108-(C2-C9)гетероциклоалкил-O-, R108-(C6-C14)арил-O-, R108-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R108R109N-, R108R109N(O)C-, R108(R109C(O))N-, R108R109NC(O)O-, R108C(O)-, R108R109NC(O)R108N-, (C1-C10)алкил-OC(O)R108N-, (C3-C10)циклоалкил-OC(O)R108N-, (C2-C9)гетероциклоалкил-OC(O)R108N-, (C6-C14)арил-OC(O)R108N-, (C2-C9)гетероарил-OC(O)R108N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R108R109NS(O)2-, (C1-C10)алкил-S(O)2R108N-, (C3-C10)циклоалкил-S(O)2R108N-, (C6-C14)арил-S(O)2R108N-, (C2-C9)гетероциклоалкил-SO2R108N- и (C2-C9)гетероарил-S(O)2R108N-;
где каждый из R108 и R109 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N- и H2N-;
или R108 и R109 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-;
каждый из T101, T102 и T103 независимо выбран из N или CR110,
где каждый R110 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R110A-(C1-C10)алкил-, R110A-(C3-C10)циклоалкила, R110A-(C2-C9)гетероциклоалкила, R110A-(C6-C14)арила, R110A-(C2-C9)гетероарила, R110A-(C2-C10)алкинила, R110A-(C1-C10)алкиламина, R110A-((C1-C10)алкил)2амина, R110A-(C2-C10)алкиниламина, R110A-C(O)-, R110A-(C1-C10)алкил-C(O)O-, R110A-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R110A-(C3-C10)циклоалкил-O-, R110A-(C2-C9)гетероциклоалкил-O-, R110A-(C6-C14)арил-O-, R110A-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R110AR111N-, R110AR111N(O)C-, R110A(R111C(O))N-, R110AR111NC(O)O-, R110AC(O)-, R110AR111NC(O)R110AN-, (C1-C10)алкил-OC(O)R110AN-, (C3-C10)циклоалкил-OC(O)R110AN-, (C2-C9)гетероциклоалкил-OC(O)R110AN-, (C6-C14)арил-OC(O)R110AN-, (C2-C9)гетероарил-OC(O)R110AN-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R110AR111NS(O)2-, (C1-C10)алкил-S(O)2R110AN-, (C3-C10)циклоалкил-S(O)2R110AN-, (C6-C14)арил-S(O)2R110AN-, (C2-C9)гетероциклоалкил-SO2R110AN- или (C2-C9)гетероарил-S(O)2R110AN-;
где каждый из R110A и R111 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, (CH3)2N-, H2N-;
или R110A и R111 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена, H2N-;
Y101 представляет собой O, S, NR112 или CR112R113,
где R112 отсутствует, или каждый из R112 и R113 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R101 вместе с атомом углерода, к которому он прикреплен, образует карбонил, а R102 отсутствует, или каждый из R101 и R102 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R101 и R102 взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R104 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или R104 и R105 могут быть взяты вместе с атомом углерода, к которому они прикреплены, с образованием 3-10-членного кольца;
R105 отсутствует или выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-;
R106 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C2-C10)алкинила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, C(O)-, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкил-, COOH-(C3-C10)циклоалкил-, (C1-C10)алкокси-, R114-(C1-C10)алкил-, R114-(C3-C10)циклоалкила, R114-(C2-C9)гетероциклоалкила, R114-(C6-C14)арила, R114-(C2-C9)гетероарила, R114-(C2-C10)алкинила, R114-(C1-C10)алкиламина, R114-((C1-C10)алкил)2амина, R114-(C2-C10)алкиниламина, R114-C(O)-, R114-(C1-C10)алкил-C(O)O-, R114-(C1-C10)алкокси-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R114-(C3-C10)циклоалкил-O-, R114-(C2-C9)гетероциклоалкил-O-, R114-(C6-C14)арил-O-, R114-(C2-C9)гетероарил-O-, HO-, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, R114R115N-, R114R115N(O)C-, R114(R115C(O))N-, R114R115NC(O)O-, R114C(O)-, R114R115NC(O)R114N-, (C1-C10)алкил-OC(O)R114N-, (C3-C10)циклоалкил-OC(O)R114N-, (C2-C9)гетероциклоалкил-OC(O)R114N-, (C6-C14)арил-OC(O)R114N-, (C2-C9)гетероарил-OC(O)R114N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; NC-, (C1-C10)алкил(O)P-, (C1-C10)алкил-S-, (C1-C10)алкил-S-(C1-C10)алкил-, (C3-C10)циклоалкил-S-, (C6-C14)арил-S-, (C2-C9)гетероалкил-S-, (C2-C9)гетероциклоалкил-S-, (C2-C9)гетероарил-S-, (C1-C10)алкил-S(O)-, (C3-C10)циклоалкил-S(O)-, (C6-C14)арил-S(O)-, (C2-C9)гетероциклоалкил-S(O)-, (C2-C9)гетероарил-S(O)-, (C3-C10)алкил-S(O)2-, (C3-C10)циклоалкил-S(O)2-, (C6-C14)арил-S(O)2-, (C2-C9)гетероциклоалкил-S(O)2-, (C2-C9)гетероарил-S(O)2-, R114R115NS(O)2-, (C1-C10)алкил-S(O)2R114N-, (C3-C10)циклоалкил-S(O)2R114N-, (C6-C14)арил-S(O)2R114N-, (C2-C9)гетероциклоалкил-SO2R114N- и (C2-C9)гетероарил-S(O)2R114N-;
где каждый из R114 и R115 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, F2HC-O-, галогена, (CH3)2N-, H2N-, F3C-C(O)-, F3C- и F2HC-;
или R114 и R115 взяты вместе с образованием 3-10-членного циклоалкильного, гетероциклоалкильного, арильного или гетероарильного кольца;
где каждый (C1-C10)алкил, (C6-C14)арил, (C2-C9)гетероарил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной - четырьмя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-; и
R103 представляет собой N или CR116,
где R116 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена и H2N-, или
когда s равняется 1, R116 и R104 взяты вместе с атомами углерода, к которым они прикреплены, с образованием соединения формулы (XIV):
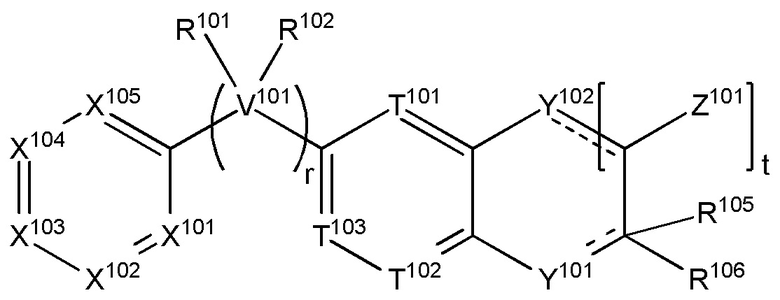 (XIV),
(XIV),
где пунктирные линии представляют необязательные двойные связи, и
t равняется 0, 1, 2, 3, 4 или 5;
каждый из Z101 независимо выбран из H, галогена, (C1-C10)алкила, (C2-C9)гетероалкила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C2-C10)алкиниламина, (C1-C10)алкокси- или H2N-;
Y102 представляет собой O, S, NR117 или CR117R118,
где R117 отсутствует, или каждый из R117 и R118 независимо выбран из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C3)алкиниламина, (C1-C10)алкил-C(O)O-, COOH-(C1-C10)алкила, COOH-(C3-C10)циклоалкила, (C1-C10)алкокси-, (C1-C10)алкокси-(C1-C10)алкил-, (C3-C10)циклоалкил-O-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, HO-, галогена или H2N-.
Настоящее изобретение также относится к соединению формулы (XIII) или формулы (XIV), где X1 представляет собой N; X2 представляет собой N; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; а X9 представляет собой C; и/или где X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; а X7 представляет собой CH.
Настоящее изобретение также относится к соединению формулы (XIII) или формулы (XIV), где X1 представляет собой N; X2 представляет собой CR7; X3 представляет собой CR7; X4 представляет собой CR7; X5 представляет собой CR7; X6 представляет собой N; X7 представляет собой CR7; X8 представляет собой C; а X9 представляет собой C; и/или где X2 представляет собой CH; X3 представляет собой CH; X4 представляет собой CR7; X5 представляет собой CH; X7 представляет собой CH.
Способ лечения заболевания или расстройства, опосредованного рецепторами колониестимулирующего фактора-1 (CSF-1R), или заболевания или расстройства, в которые вовлечен CSF-1R, у субъекта, нуждающегося в таком лечении, включающий введение субъекту эффективного количества соединения формулы (I) или формулы (II).
Способ лечения заболевания или расстройства, где заболевание или расстройство представляет собой неврологическое и иммуноопосредованное заболевания, в том числе рассеянный склероз, ALS, болезнь Хантингтона, волчанку, люпус-нефрит и ревматоидный артрит, у субъекта, нуждающегося в таком лечении, включающий введение субъекту эффективного количества соединения формулы (I) или формулы (II).
Фармацевтическая композиция, содержащая соединение формулы (I) или формулы (II).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к ингибиторам рецептора колониестимулирующего фактора-1 ("ингибиторам CSF-1R"). Ингибиторы CSF-1R по настоящему изобретению представляют собой малые молекулы, способные проникать через гематоэнцефалический барьер для достижения центральной нервной системы (ЦНС). Настоящее изобретение также относится к фармацевтическим составам, содержащим ингибиторы CSF-1R, и к применению ингибиторов CSF-1R и фармацевтических композиций, содержащих ингибиторы CSF-1R, для лечения заболевания. Настоящее изобретение также относится к применению ингибиторов CSF-1R и фармацевтических композиций, содержащих ингибиторы CSF-1R, для лечения иммуноопосредованных заболеваний, в том числе без ограничения рассеянного склероза, люпус-нефрита, ревматоидного артрита, и для лечения неврологических заболеваний, в том числе без ограничения бокового амиотрофического склероза (ALS) и болезни Хантингтона. Ингибиторы CSF-1R по настоящему изобретению можно применять для ингибирования c-FMS, клеточного рецептора для колониестимулирующего фактора-1 (CSF-1).
Рассеянный склероз представляет собой хроническое, воспалительное, демиелинизирующее заболевание ЦНС, которое вызывает чередующиеся рецидивы и прогрессирующее неврологическое ухудшение. Активированные клетки микроглии и макрофаги способствуют повреждению ЦНС и играют значительную роль в прогрессировании болезни и нейродегенерации при рассеянном склерозе. Эти активированные естественные иммунные клетки могут участвовать в презентации антигена и продуцировать воспалительные и нейротоксические медиаторы, которые являются разрушительными в отношении нейронов и олигодендроцитов. CSF-1R представляет собой рецепторную тирозинкиназу, экспрессируемую на макрофагах, моноцитах и клетках микроглии, и представляет вероятную мишень для терапевтической модуляции эффекторной функции.
Ингибиторы CSF-1R по настоящему изобретению особенно пригодны при лечении рассеянного склероза и показали в доклинических in vitro и in vivo испытаниях: снижение продуцирования воспалительных цитокинов/хемокинов и оксида азота, ингибирование распространения и активации макрофагов/клеток микроглии, сохранение фагоцитарной активности макрофагов и клеток микроглии, ингибирование инфильтрации ЦНС во множестве in vivo моделей заболевания, защиту от демиелинизации в культуре среза головного мозга крысы и терапевтический эффект на мышиных моделях заболевания. Эти данные позволяют предположить, что ингибирование эффекторных функций макрофагов/микроглии ЦНС посредством антагонизма CSF-1R обеспечивают нейропротективное действие при рассеянном склерозе путем снижения степени воспаления, демиелинизации и потерь аксонов.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей ингибиторы CSF-1R формулы (I) и формулы (II). В другом варианте осуществления настоящего изобретения фармацевтическую композицию, содержащую ингибиторы CSF-1R формулы (I) и формулы (II), вводят в эффективном количестве для достижения необходимого терапевтического эффекта. Специалист в данной области сможет определить эффективное количество фармацевтической композиции, содержащей ингибиторы CSF-1R формулы (I) и формулы (II), в зависимости от индивидуума и состояния, подлежащего лечению.
В одном варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать при лечении иммуноопосредованного заболевания. В другом варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать при лечении рассеянного склероза. В еще одном варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать при лечении люпус-нефрита.
В одном варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать при лечении неврологических заболеваний. В другом варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать при лечении ALS.
В одном варианте осуществления настоящего изобретения ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно использовать для ингибирования c-FMS, клеточного рецептора для колониестимулирующего фактора-1 (CSF-1).
Ингибиторы CSF-1R по настоящему изобретению можно вводить отдельно или в фармацевтической композиции, содержащей ингибитор CSF-1R или несколько ингибиторов CSF-1R. Подходящие фармацевтические композиции могут содержать ингибитор CSF-1R и один или несколько фармацевтически приемлемых вспомогательных веществ. Форма, в которой вводят ингибиторы CSF-1R, например порошок, таблетка, капсула, раствор, суспензия или эмульсия, зависит отчасти от пути, при помощи которого их вводят. Ингибиторы CSF-1R можно вводить, например, перорально или при помощи инъекции. Подходящие вспомогательные вещества включают без ограничения неорганические или органические материалы, такие как желатин, альбумин, лактозу, крахмал, стабилизаторы, средства для растворения, эмульгирующие средства, соли и буферы. Подходящие фармацевтически приемлемые вспомогательные вещества для внутрисуставных составов, таких как растворы или суспензии, включают без ограничения коммерчески доступные инертные гели или жидкости.
Ингибиторы CSF-1R и фармацевтические композиции, содержащие ингибиторы CSF-1R, можно вводить отдельно или в комбинации с одним или несколькими дополнительными лекарственными средствами. Дополнительные лекарственные средства, вводимые в комбинации с ингибиторами CSF-1R и фармацевтическими композициями, содержащими ингибиторы CSF-1R по настоящему изобретению, включают терапевтические препараты для лечения иммуноопосредованных и неврологических заболеваний, в том числе рассеянный склероз, люпус-нефрит и ALS. Дополнительные лекарственные средства можно вводить одновременно с ингибиторами CSF-1R и фармацевтическими композициями, содержащими ингибиторы CSF-1R. Дополнительные лекарственные средства также можно вводить последовательно с ингибиторами CSF-1R и фармацевтическими композициями, содержащими ингибиторы CSF-1R.
In vitro и in vivo эффекты ингибиторов CSF-1R и способы получения предпочтительных ингибиторов CSF-1R по настоящему изобретению описаны в примерах.
Хотя определенные варианты осуществления настоящего изобретения будут далее описаны со ссылкой на получения и схемы, следует понимать, что такие варианты осуществления представлены исключительно в качестве примера и являются лишь иллюстративными, но такое небольшое количество из множества возможных определенных вариантов осуществления может представлять пути применения принципов настоящего изобретения. Разнообразные изменения и модификации, обеспечивающие преимущества настоящего изобретения, будут очевидны специалистам в данной области и считаются находящимися в пределах сути и объема настоящего изобретения, как далее определено в прилагаемой формуле изобретения.
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно понятно специалисту в данной области, к которой относится настоящее изобретение. Хотя при осуществлении на практике или тестировании можно применять другие соединения или способы, определенные предпочтительные способы описаны далее в контексте следующих получений и схем.
Схема 1. Получение A
В реакции 1 получения A соединение A-1 (где T1, T2 и T3 являются такими, как определено выше; и где G1 представляет собой -CN, -CO2Me, -CONH2 или -CH2NHBOC, а G2 представляет собой -F, -I или -OBn; или где G1 представляет собой -Br, а G2 представляет собой -Br или -OPMB) превращают в соответствующее соединение A-2 путем осуществления реакции соединения A-1 с альфа-галогенокетоном, таким как бромкетон R6(CO)CH(Br)(Z1), в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат цезия, при комнатной температуре в течение 1-24 часов.
В реакции 2 получения A соединение A-2 (где G1 представляет собой -CN или -CONH2, а G2 представляет собой -F или -I; или где G1 представляет собой -Br, а G2 представляет собой -Br или -OPMB) превращают в соединение A-3 путем восстановления кетона A-2 в подходящем растворителе или смеси растворителей, таких как метанол или метанол/тетрагидрофуран, при помощи восстанавливающего средства, такого как борогидрид натрия, при 0°C в течение 1 часа.
В реакции 3 получения A соединение A-3 (где G1 представляет собой -CN, а G2 представляет собой -F) превращают в соединение A-5 путем циклизации соединения A-3 в полярном апротонном растворителе, таком как диметилформамид, в присутствии основания, такого как карбонат калия, при 80°C в течение 24 часов. Альтернативно, в реакции 3 получения A соединение A-3 (где G1 представляет собой -Br, а G2 представляет собой -Br) превращают в соединение A-5 путем циклизации соединения A-3 в полярном апротонном растворителе, таком как диметилформамид, в присутствии катализатора, такого как йодид меди(I), основания, такого как карбонат цезия, и лиганда, представляющего собой диамин, такого как N,N-диметилэтилендиамин, с обратным холодильником в течение 48 часов. Альтернативно, в реакции 3 получения A соединение A-3 (где G1 представляет собой -CONH2, а G2 представляет собой -I) превращают в соединение A-5 путем циклизации соединения A-3 в полярном апротонном растворителе, таком как диметилформамид, в присутствии катализатора, такого как йодид меди(I), и основания, такого как гидрид натрия, при 80°C в течение 2 часов.
В реакции 4 получения A соединение A-5 (где G1 представляет собой -CN или -CONH2) превращают в соединение A-6 путем восстановления соединения A-4 в эфирном растворителе, таком как тетрагидрофуран, в присутствии восстанавливающего средства, такого как комплекс борана-тетрагидрофурана, с обратным холодильником в течение 1-16 часов, или путем восстановления соединения A-5 в эфирном растворителе, таком как тетрагидрофуран, в присутствии восстанавливающего средства, такого как алюмогидрид лития, начиная при 0°C и нагревая до комнатной температуры в течение 1-5 часов. Альтернативно, в реакции 4 получения A соединение A-5 (где G1 представляет собой -CH2NHBOC) превращают в соединение A-6 путем снятия защитных групп с A-5 в галогенированном растворителе, таком как дихлорметан, в присутствии кислоты, такой как трифторуксусная кислота, при комнатной температуре в течение 1 часа. Альтернативно, в реакции 4 получения A соединение A-5 (где G1 представляет собой -CO2Me) превращают в соединение A-6 путем, во-первых, восстановления соединения A-4 в эфирном растворителе, таком как тетрагидрофуран, в присутствии восстанавливающего средства, такого как алюмогидрид лития, начиная при 0°C в течение 1 часа, во-вторых, превращения в азид путем осуществления реакции с фосфорилазидом, таким как дифенилфосфорилазид, и основанием, таким как 1,8-диазабициклоундец-7-ен, в эфирном растворителе, таком как тетрагидрофуран, при температуре от комнатной температуры до температуры возврата флегмы в течение 1-16 часов, и, в-третьих, восстановления при помощи фосфина, такого как связанный со смолой трифенилфосфин, в водной смеси растворителей, такой как смесь тетрагидрофурана/воды, с обратным холодильником в течение 1-3 часов.
В реакции 5 получения A соединение A-2 (где G1 представляет собой -CO2Me или -CH2NHBOC, а G2 представляет собой -OBn) превращают в соединение A-4 путем, во-первых, снятия защитных групп при условиях гидрирования в эфирном растворителе, таком как тетрагидрофуран, с помощью катализатора на твердом носителе, такого как палладий на угле, в присутствии водорода при комнатной температуре в течение 1-5 часов, и, во-вторых, восстановления восстанавливающим средством, таким как борогидрид натрия, в смеси растворителей, такой как смесь тетрагидрофурана/метанола, при 0°C в течение 30 минут. Альтернативно, в реакции 5 получения A соединение A-2 (где G1 представляет собой -Br, а G2 представляет собой -OPMB) превращают в соединение A-4 путем, во-первых, снятия защитных групп при помощи кислоты, такой как трифторуксусная кислота, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 1-5 часов и, во-вторых, восстановления восстанавливающим средством, таким как борогидрид натрия, в смеси растворителей, такой как смесь тетрагидрофурана/метанола, при 0°C в течение 30 минут.
В реакции 6 получения A соединение A-4 превращают в соединение A-5 путем осуществления реакции с фосфином, таким как связанный со смолой трифенилфосфин, четырехгалоидным углеродом, таким как тетрахлорид углерод, и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как ацетонитрил, с обратным холодильником в течение 1-15 часов. Альтернативно, в реакции 6 получения A соединение A-4 превращают в соединение A-5 путем осуществления реакции с фосфином, таким как трифенилфосфин, и азодикарбоксилатом, таким как бис(2-метоксиэтил)азодикарбоксилат, в эфирном растворителе, таком как тетрагидрофуран, при температуре от комнатной температуры до температуры возврата флегмы в течение 3-20 часов.
В реакции 7 получения A соединение A-1 (где T1, T2 и T3 являются такими, как определено выше, где G1 представляет собой -CO2Me, и где G2 представляет собой -OBn) превращают в соединение A-7 путем осуществления реакции соединения A-1 с алкилирующим реагентом, таким как п-метоксибензилхлорид, в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат калия, с обратным холодильником в течение 20 часов.
В реакции 8 получения A соединение A-7 превращают в соединение A-8 путем осуществления реакции соединения A-7, во-первых, с основанием, таким как гидроксид лития, в водной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 45 минут, во-вторых, осуществления реакции с амином или аминной солью, такой как хлорид аммония, амидным связующим реагентом, таким как 1-[бис(диметиламино)метилен-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксида гексафторфосфат, и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как диметилформамид, при 50°C в течение 20 часов, и, в-третьих, восстановления в эфирном растворителе, таком как тетрагидрофуран, в присутствии восстанавливающего средства, такого как алюмогидрид лития, начиная при 0°C до температуры возврата флегмы в течение 20 часов.
В реакции 9 получения A соединение A-5 (где G1 представляет собой -Br) превращают в соединение A-9 путем осуществления реакции соединения A-5 с органоборановым соединением, таким как 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан), в присутствии катализатора, такого как (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) хлорид, и основания, такого как ацетат калия, в эфирном растворителе, таком как 1,4-диоксан, с обратным холодильником в течение 2 часов.
В реакции 10 получения A соединение A-9 превращают в соединение A-10 путем осуществления реакции соединения A-9 с окисляющим средством, таким как перйодат натрия, в кислой водной смеси растворителей, такой как смесь тетрагидрофурана/воды/хлористоводородной кислоты, при комнатной температуре в течение 16 часов.
В реакции 11 получения A соединение A-5 (где G1 представляет собой сложный эфир, такой как -CO2Me) превращают в соединение A-11 путем гидролиза соединения A-5 с помощью основания, такого как гидроксид лития, в водной спиртовой смеси, такой как смесь метанола/воды, при комнатной температуре в течение 16 часов.
В реакции 12 получения A соединение A-11 превращают в соединение A-12 путем осуществления реакции соединения A-11, во-первых, с хлорирующим реагентом, таким как оксалилхлорид, в присутствии катализатора, такого как диметилформамид, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 1,5 часа, во-вторых, осуществления реакции с диазоалканом, таким как (триметилсилил)диазометан, в апротонном растворителе или смеси растворителей, такой как смесь тетрагидрофурана/ацетонитрила, при 0°C до комнатной температуры в течение 19 часов и, в-третьих, осуществления реакции с кислотой, такой как 48% водная бромистоводородная кислота, в апротонном растворителе или смеси растворителей, такой как смесь тетрагидрофуран/ацетонитрила, при 0°C в течение 10 минут.
В реакции 13 получения A соединение A-1 (где G1 представляет собой Br, а G2 представляет собой NH2) превращают в соединение A-13 путем осуществления реакции соединения A-1 с карбоновой кислотой, такой как R6CO2H (где R6 определен выше), амидным связующим реагентом, таким как 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксида гексафторфосфат, и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как диметилформамид, при комнатной температуре в течение 3 часов.
В реакции 14 получения A соединение A-13 превращают в соединение A-14 путем осуществления реакции соединения A-13 с азодикарбоксилатом, таким как диэтилазодикарбоксилат, и фосфином, таким как трифенилфосфин, в апротонном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 16 часов.
В реакции 15 получения A соединение A-14 превращают в соединение A-14 путем осуществления реакции соединения A-14 с солью, представляющей собой цианид, такой как цианид цинка(II), катализатором, таким как трис(дибензилиденацетон)дипалладий, и лигандом, таким как 1,1'-бис(дифенилфосфино)ферроцен, в полярном апротонном растворителе, таком как диметилсульфоксид, при 100°C в течение 3 часов.
В реакции 16 получения A соединение A-15 превращают в соединение A-16 путем осуществления реакции соединения A-15 с восстанавливающим средством, таким как никель Ренея, в присутствии аммиака и водорода и в спирте, таком как метанол, при комнатной температуре в течение 2 часов.
Схема 2. Получение B
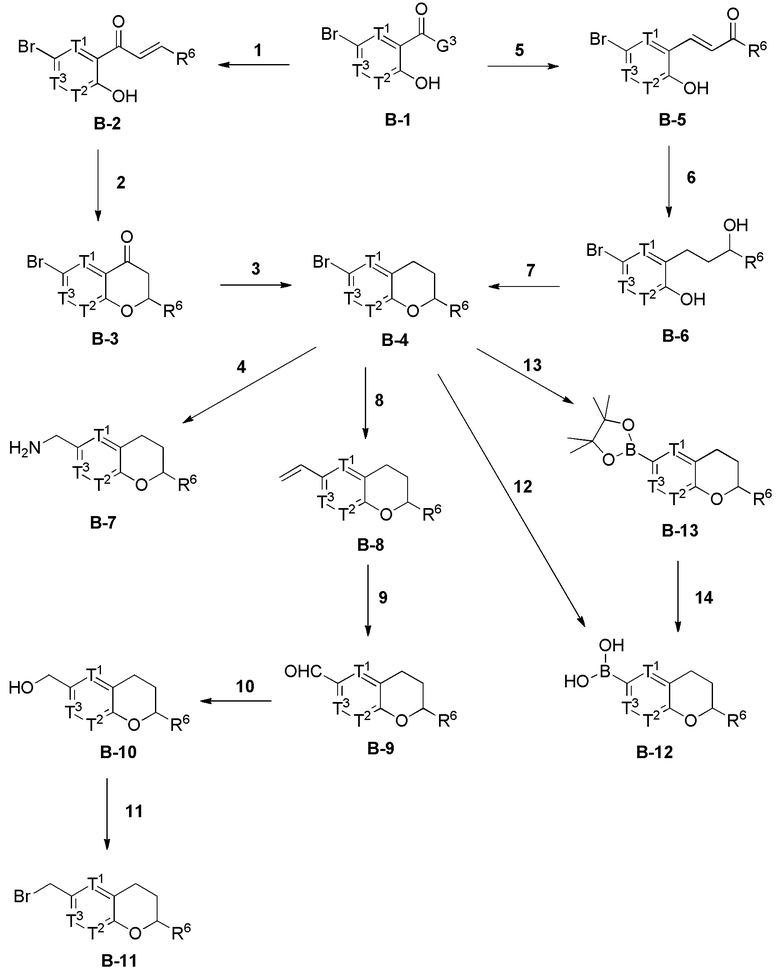
В реакции 1 получения B соединение B-1 (где T1, T2 и T3 являются такими, как определено выше, и где G3 представляет собой -CH3) превращают в соответствующее соединение B-2 путем осуществления реакции соединения B-1 с карбонильным соединением, таким как альдегид R6(CHO) (где R6 является такими, как определено выше), в водной спиртовой смеси, такой как смесь этанола/воды, в присутствии основания, такого как гидроксид калия, при комнатной температуре в течение 16 часов.
В реакции 2 получения B соединение B-2 превращают в соединение B-3 путем циклизации соединения B-2 в водной спиртовой смеси, такой как смесь этанола/воды, в присутствии основания, такого как ацетат натрия, с обратным холодильником в течение 17 часов.
В реакции 3 получения B соединение B-3 превращают в соединение B-4 путем восстановления кетона соединения B-3 органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при 65°C в течение 20 часов.
В реакции 4 получения B соединение B-4 превращают в соединение B-7 путем, во-первых, осуществления реакции с органобораном, таким как винилтрифторборат калия, катализатором, таким как хлорид палладия(II), фосфином, таким как трифенилфосфин, и основанием, таким как карбонат цезия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, с обратным холодильником, во-вторых, осуществления реакции с системой окисляющего реагента, такой как тетраоксид осмия и перйодат натрия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 1 часа, в-третьих, осуществления реакции с амином или аминной солью, такой как гидроксиламина гидрохлорид, и основанием, таким как ацетат натрия, в спиртовом растворителе, таком как метанол, с обратным холодильником в течение 2 часов, и, в-четвертых, осуществления реакции с восстанавливающим средством, таким как цинковая пыль, в кислоте, такой как уксусная кислота, при 40°C в течение 2 ч. Альтернативно, в реакции 4 получения B соединение B-4 превращают в соединение B-7 путем, во-первых, осуществления реакции с цианирующим реагентом, таким как тригидрат гексацианоферрата(II) калия, катализатором, таким как ацетат палладия(II), основанием, таким как карбонат натрия, и полярным растворителем или смесью растворителей, такой как смесь N-метил-2-пирролидона/изопропанола, при температуре от комнатной температуры до 140°C в течение 16 часов и, во-вторых, восстановления при помощи катализатора на твердом носителе, такого как палладий на угле (10%), в присутствии водорода в кислой водной спиртовой смеси, такой как метанол и концентрированная HCl, при комнатной температуре в течение 20 часов.
В реакции 5 получения B соединение B-1 (где T1, T2, T3 и Z1 являются такими, как определено выше, и где G3 представляет собой -H) превращают в соответствующее соединение B-5 путем осуществления реакции соединения B-1 с карбонильным соединением, таким как кетон R6(CO)CH3 (где R6 является такими, как определено выше) в спирте, таком как этанол, в присутствии основания, такого как 10 н. гидроксид натрия, с обратным холодильником в течение 3 часов.
В реакции 6 получения B соединение B-5 превращают в соединение B-6 путем, во-первых, осуществления реакции соединения B-5 с системой восстанавливающего реагента, такой как цинк и аммония хлорид, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 10 минут и, во-вторых, восстановления карбонильного фрагмента при помощи восстанавливающего средства, такого как борогидрид натрия, в спирте, таком как метанол, при 0°C в течение 15 минут. Альтернативно, в реакции 6 получения B соединение B-5 превращают в соединение B-6 путем осуществления реакции соединения B-5 с системой восстанавливающего реагента, такой как хлорид кобальта(II) и борогидрид натрия, в эфирном растворителе, таком как тетрагидрофуран, при температуре от 0°C до комнатной температуры в течение 2 часов.
В реакции 7 получения B соединение B-6 превращают в соединение B-7 путем циклизации соединения B-6 при помощи кислоты, такой как ледяная уксусная кислота, при 110°C в течение 45 минут. Альтернативно, в реакции 7 получения B соединение B-6 превращают в соединение B-7 путем циклизации соединения B-6 при помощи фосфина, такого как трифенилфосфин, и азодикарбоксилата, такого как бис(2-метоксиэтил) азодикарбоксилат, в эфирном растворителе, таком как тетрагидрофуран, при температуре от комнатной температуры до температуры возврата флегмы в течение 3-20 часов.
В реакции 8 получения B соединение B-4 превращают в соединение B-8 путем осуществления реакции соединения B-4 с органоборановым соединением, таким как (CH2CH)BF3K, в присутствии катализатора, такого как хлорид палладия(II), фосфина, такого как трифенилфосфин, и основания, такого как карбонат цезия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, с обратным холодильником в течение 16 часов.
В реакции 9 получения B соединение B-8 превращают в соединение B-9 путем окисления соединения B-8 при помощи системы окисляющего реагента, такой как тетраоксид осмия и перйодат натрия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 1 часа.
В реакции 10 получения B соединение B-9 превращают в соединение B-10 путем осуществления реакции соединения B-9 с восстанавливающим средством, таким как борогидрид натрия, в спирте, таком как метанол, при 0°C в течение 1 часа.
В реакции 11 получения B соединение B-10 превращают в соединение B-11 путем осуществления реакции соединения B-10 с четырехгалоидным углеродом, таким как тетрабромид углерода, в присутствии фосфина, такого как связанный со смолой трифенилфосфин, в эфирном растворителе, таком как тетрагидрофуран, с обратным холодильником в течение 2 часов.
В реакции 12 получения B соединение B-4 превращают в соединение B-12 путем осуществления реакции соединения B-4 с литийорганическим реагентом, таким как н-бутиллитий, и органоборатом, таким как триизопропоксиборат, в эфирном растворителе, таком как тетрагидрофуран, при температуре от -78°C до комнатной температуры в течение 30 минут.
В реакции 13 получения B соединение B-4 превращают в соединение B-13 путем осуществления реакции соединения B-4 с органоборановым соединением, таким как 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан), в присутствии катализатора, такого как (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) хлорид, и основания, такого как ацетат калия, в эфирном растворителе, таком как 1,4-диоксан, с обратным холодильником в течение 2 часов.
В реакции 14 получения B соединение B-13 превращают в соединение B-12 путем осуществления реакции соединения B-13 с окисляющим реагентом, таким как перйодат натрия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 16 часов.
Схема 3. Получение C
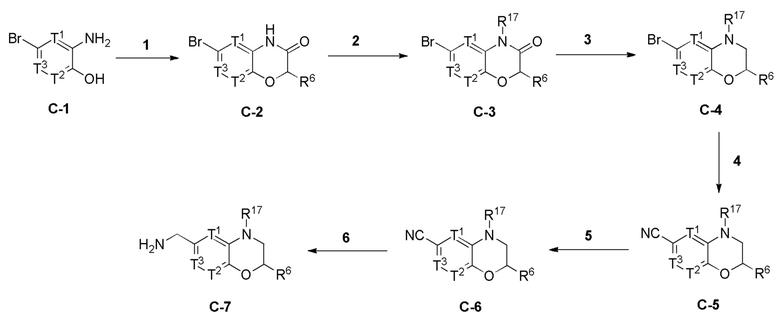
В реакции 1 получения C соединение C-1 (где T1, T2 и T3 являются такими, как определено выше) превращают в соответствующее соединение C-2 путем осуществления реакции соединения C-1 с альфа-галогензамещенным сложным эфиром, таким как бромзамещенный сложный эфир CH3O(CO)CH(Br)(R6) (где R6 является таким, как определено выше), в апротонном растворителе, таком как ацетон, в присутствии основания, такого как карбонат калия, с обратным холодильником в течение 16 часов.
В реакции 2 получения C соединение C-2 превращают в соединение C-3 (где R17 является таким, как определено выше) путем осуществления реакции соединения C-2 с алкилирующим реагентом, таким как метилйодид (например, где R17 представляет собой метил) в присутствии основания, такого как гидроксид калия, в апротонном растворителе, таком как ацетон, с обратным холодильником в течение 45 минут.
В реакции 3 получения C соединение C-3 превращают в соединение C-4 путем осуществления реакции соединения C-3 с восстанавливающим средством, таким как комплекс боран-метилсульфид, в эфирном растворителе, таком как тетрагидрофуран, при 50°C в течение 16 часов.
В реакции 4 получения C соединение C-4 превращают в соединение C-5 путем осуществления реакции соединения C-4 с солью, представляющей собой цианид, такой как цианид цинка(II), и тетракис(трифенилфосфин)палладием(0) в полярном апротонном растворителе, таком как диметилформамид, при 80°C в течение 16 часов.
В реакции 5 получения C соединение C-5 превращают в соединение C-6 путем осуществления реакции соединения C-5 с системой восстанавливающего средства, такой как гексагидрат хлорида никеля(II) и борогидрид натрия, и ди-трет-бутилдикарбонатом в спирте, таком как метанол, при 0°C до комнатной температуры в течение 4 часов.
В реакции 6 получения C соединение C-6 превращают в соединение C-7 путем осуществления реакции соединения C-6 с кислотой, такой как 4 н. хлористоводородная кислота в 1,4-диоксане, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 1 часа.
Схема 4. Получение D
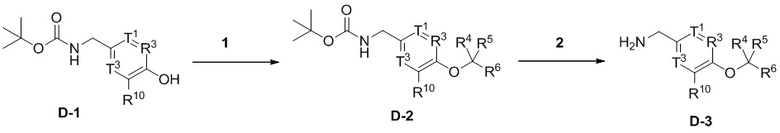
В реакции 1 получения D соединение D-1 (где T1, T3, R3 и -R10 являются такими, как определено выше, например, -R10 представляет собой -H, галоген, циано или (C1-C10)алкокси-) превращают в соединение D-2 путем осуществления реакции соединения D-1 с алкилхлоридом (R4)(R5)(R6)CCl (где R4, R5 и R6 являются такими, как определено выше) в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат калия, с обратным холодильником в течение 23 часов.
В реакции 2 получения D соединение D-2 превращают в соединение D-3 путем снятия защитных групп с D-2 при помощи кислоты, такой как трифторуксусная кислота, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 30 минут.
Схема 5. Получение E
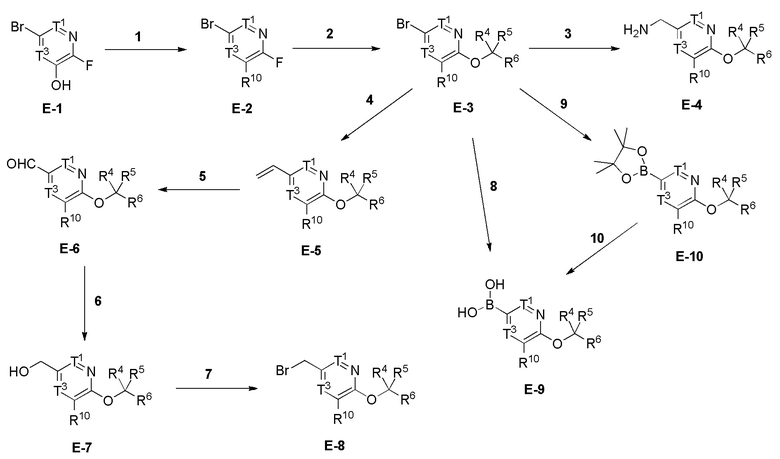
В реакции 1 получения E соединение E-1 (где T1 и T2 являются такими, как определено выше) превращают в соединение E-2 (где R10 является таким, как определено выше, например, (C1-C10)алкилокси-) путем осуществления реакции соединения E-1 с (C1-C10)алкилйодидом в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат калия, с обратным холодильником в течение 16 часов.
В реакции 2 получения E соединение E-2 (где R10 является таким, как определено выше, например, -H, галогеном, циано или (C1-C10)алкилокси-) превращают в соединение E-3 путем осуществления реакции соединения E-2 со спиртом (R4)(R5)(R6)COH (где R4, R5 и R6 являются такими, как определено выше) в полярном апротонном растворителе, таком как диметилсульфоксид, в присутствии основания, такого как гидрид натрия, при комнатной температуре в течение 2 часов.
В реакции 3 получения E соединение E-3 превращают в соединение E-4 путем осуществления реакции соединения E-3, во-первых, с борорганическим соединением, таким как (N-Boc-аминометил)трифторборат калия, катализатором, таким как прекатализатор 2-ого поколения XPhos, и основанием, таким как карбонат цезия, в двухфазной системе растворителей, такой как смесь толуола/воды, с обратным холодильником в течение 20 часов и, во-вторых, снятия защитных групп при помощи кислоты, такой как трифторуксусная кислота, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 30 минут.
В реакции 4 получения E соединение E-3 превращают в соединение E-5 путем осуществления реакции E-3 с борорганическим соединением, таким как винилтрифторборат калия, в присутствии катализатора, такого как хлорид палладия(II), фосфина, такого как трифенилфосфин, и основания, такого как карбонат цезия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, с обратным холодильником в течение 16 часов.
В реакции 5 получения E соединение E-5 превращают в соединение E-6 путем осуществления реакции соединения E-5 с системой окисляющего реагента, такого как тетраоксид осмия и перйодат натрия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 1 часа.
В реакции 6 получения E соединение E-6 превращают в соединение E-7 путем осуществления реакции соединения E-6 с восстанавливающим средством, таким как борогидрид натрия, в спирте, таком как метанол, при 0°C в течение 1 часа.
В реакции 7 получения E соединение E-7 превращают в соединение E-8 путем осуществления реакции соединения E-7 с четырехгалоидным углеродом, таким как тетрабромид углерода, в присутствии фосфина, такого как связанный со смолой трифенилфосфин, в эфирном растворителе, таком как тетрагидрофуран, с обратным холодильником в течение 2 часов.
В реакции 8 получения E соединение E-3 превращают в соединение E-9 путем осуществления реакции соединения E-3 с литийорганическим реагентом, таким как н-бутиллитий, и органоборатом, таким как триизопропоксиборат, в эфирном растворителе, таком как тетрагидрофуран, при температуре от -78°C до комнатной температуры в течение 30 минут.
В реакции 9 получения E соединение E-3 превращают в соединение E-10 путем осуществления реакции соединения E-3 с борорганическим соединением, таким как 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан), в присутствии катализатора, такого как (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) хлорид, и основания, такого как ацетат калия, в эфирном растворителе, таком как 1,4-диоксан, с обратным холодильником в течение 2 часов.
В реакции 10 получения E соединение E-10 превращают в соединение E-9 путем осуществления реакции соединения E-10 с окисляющим средством, таким как перйодат натрия, в водной эфирной смеси растворителей, такой как смесь тетрагидрофурана/воды, при комнатной температуре в течение 16 часов.
Схема 6. Получение F
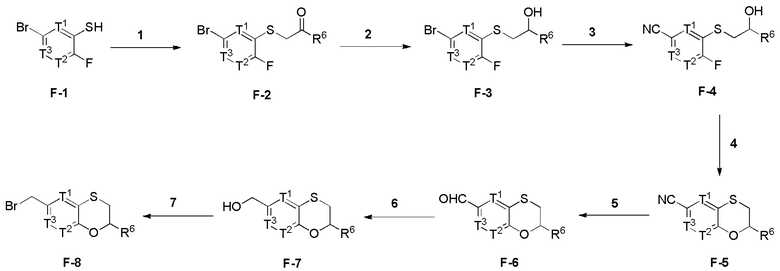
В реакции 1 получения F соединение F-1 (где T1, T2 и T3 являются такими, как определено выше) превращают в соединение F-2 путем осуществления реакции соединения F-1 с альфа-галогенокетоном, таким как бромкетон R6(CO)CH2Br (где R6 является таким, как определено выше), в присутствии основания, такого как карбонат калия, в полярном апротонном растворителе, таком как диметилформамид, при температуре от 0°C до комнатной температуры в течение 1,5 часа.
В реакции 2 получения F соединение F-2 превращают в соединение F-3 путем осуществления реакции соединения F-2 с восстанавливающим средством, таким как борогидрид натрия, в спирте, таком как метанол, при 0°C в течение 1 часа.
В реакции 3 получения F соединение F-3 превращают в соединение F-4 путем осуществления реакции соединения F-3 с солью, представляющей собой цианид, такой как цианид цинка(II), в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0), в полярном апротонном растворителе, таком как диметилформамид, при 90°C в течение 4 часов.
В реакции 4 получения F соединение F-4 превращают в соединение F-5 путем циклизации соединения F-4 в присутствии основания, такого как карбонат калия, в полярном апротонном растворителе, таком как диметилформамид, при 80°C в течение 24 часов.
В реакции 5 получения F соединение F-5 превращают в соединение F-6 путем осуществления реакции соединения F-5 с восстанавливающим средством, таким как алюмогидрид лития, в эфирном растворителе, таком как тетрагидрофуран, при 0°C в течение 1 часа.
В реакции 6 получения F соединение F-6 превращают в соединение F-7 путем осуществления реакции соединения F-6 с восстанавливающим средством, таким как борогидрид натрия, в спирте, таком как метанол, при 0°C в течение 1 часа.
В реакции 7 получения F соединение F-7 превращают в соединение F-8 путем осуществления реакции соединения F-7 с четырехгалоидным углеродом, таким как тетрабромид углерода, в присутствии фосфина, такого как связанный со смолой трифенилфосфин, в эфирном растворителе, таком как тетрагидрофуран, с обратным холодильником в течение 2 часов.
Схема 7. Получение G
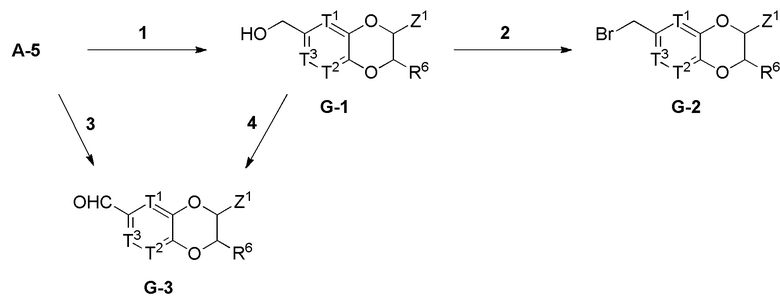
В реакции 1 получения G соединение A-5 (где T1, T2, T3, R6 и Z1 являются такими, как определено выше, и где G1 представляет собой -CO2Me) превращают в соединение G-1 путем осуществления реакции соединения A-5 с восстанавливающим средством, таким как алюмогидрид лития, в эфирном растворителе, таком как тетрагидрофуран, при 0°C в течение 1 часа.
В реакции 2 получения G соединение G-1 превращают в соединение G-2 путем осуществления реакции соединения G-1 с четырехгалоидным углеродом, таким как тетрабромид углерода, в присутствии фосфина, такого как связанный смолой трифенилфосфин, в эфирном растворителе, таком как тетрагидрофуран, с обратным холодильником в течение 2 часов.
В реакции 3 получения G соединение A-5 (где T1, T2, T3, R6 и Z1 являются такими, как определено выше, и где G1 представляет собой Br) превращают в соединение G-3 путем осуществления реакции соединения A-5 с литийорганическим реагентом, таким как н-бутиллитий, а затем диметилформамидом в эфирном растворителе, таком как тетрагидрофуран, при температуре от -78°C до комнатной температуры в течение 1 часа.
В реакции 4 получения G соединение G-1 превращают в соединение G-3 путем осуществления реакции соединения G-1 с окисляющим реагентом, таким как перйодат Десса-Мартина, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 30 минут, или, альтернативно, путем осуществления реакции G-1 с окисляющим реагентом, таким как оксид марганца(IV), в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 22 часов.
Схема 8. Получение H
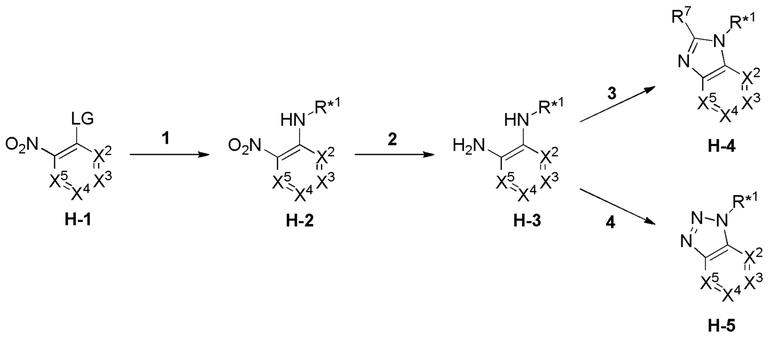
В реакции 1 получения H соединение H-1 (где X2, X3, X4 и X5 являются такими, как определено выше; и где LG представляет собой уходящую группу, такую как -F или -Cl) превращают в соединение H-2 путем осуществления реакции соединения H-1 с амином R*1NH2 (где R*1NH2 представляет собой, например, соединение A-6, A-8, B-7, C-7, D-3 или E-4, как определено выше) в присутствии основания, такого как диизопропилэтиламин, в ацетонитриле с обратным холодильником в течение 2-16 часов.
В реакции 2 получения H соединение H-2 превращают в соединение H-3 путем осуществления реакции соединения H-2 с системой восстанавливающего средства, такой как цинк и аммония хлорид, в водной смеси эфира/спирта, такой как смесь тетрагидрофурана/метанола/воды, при комнатной температуре в течение 1 часа, или, альтернативно, осуществления реакции H-2 с восстанавливающим средством, таким как железо, в кислоте, такой как уксусная кислота, при 100°C в течение 30 минут.
В реакции 3 получения H соединение H-3 превращают в соединение H-4 путем осуществления реакции соединения H-3 со сложным ортоэфиром (EtO)3CR7 (где R7 является таким, как определено выше), таким как триэтилортоформиат, в присутствии кислоты, такой как п-толуолсульфоновая кислота, в спирте, таком как этанол, с обратным холодильником в течение 1-4 часов.
В реакции 4 получения H соединение H-3 превращают в соединение H-5 путем осуществления реакции соединения H-3 с нитритом натрия в присутствии кислоты, такой как уксусная кислота, при комнатной температуре в течение 2 часов.
Схема 9. Получение I
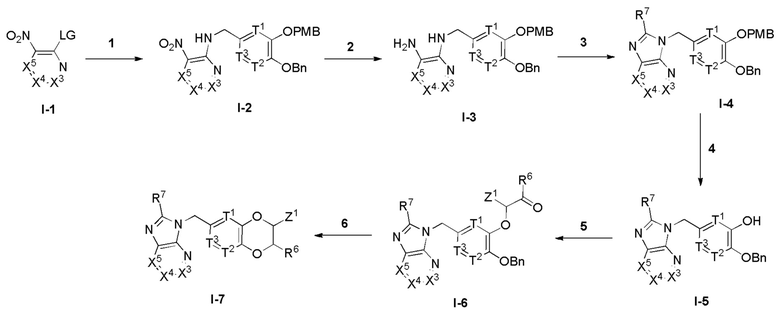
В реакции 1 получения I соединение I-1 (где X3, X4 и X5 являются такими, как определено выше) превращают в соединение I-2 (где X3, X4, X5, T1, T2 и T3 являются такими, как определено выше) путем осуществления реакции соединения I-1 с аминным соединением A-8 (где каждый из R1 и R2 независимо представляет собой H, а G2 представляет собой -OBn, являются такими, как определено выше) в присутствии основания, такого как диизопропилэтиламин, в полярном апротонном растворителе, таком как ацетонитрил, с обратным холодильником в течение 2-16 часов.
В реакции 2 получения I соединение I-2 превращают в соединение I-3 путем осуществления реакции соединения I-2 с системой восстанавливающего средства, такой как цинк и хлорид аммония, в водной смеси эфира/спирта, такой как смесь тетрагидрофурана/метанола/воды, при комнатной температуре в течение 1 часа.
В реакции 3 получения I соединение I-3 превращают в соединение I-4 путем осуществления реакции соединения I-3 со сложным ортоэфиром (EtO)3CR7 (где R7 является таким, как определено выше), таким как триэтилортоформиат, в присутствии кислоты, такой как п-толуолсульфоновая кислота, в спирте, таком как этанол, с обратным холодильником в течение 1-4 часов.
В реакции 4 получения I соединение I-4 превращают в соединение I-5 путем осуществления реакции соединения I-4 с кислотой, такой как ледяная уксусная кислота, при 110°C в течение 20 часов.
В реакции 5 получения I соединение I-5 превращают в соединение I-6 путем осуществления реакции соединения I-5 с альфа-галогенокетоном, таким как бромкетон R6(CO)CH(Br)(Z1), в полярном апротонном растворителе, таком как ацетонитрил, в присутствии основания, такого как карбонат цезия, при комнатной температуре в течение 1-24 часов.
В реакции 6 получения I соединение I-6 превращают в соединение I-7 путем, во-первых, снятия защитных групп при условиях гидрирования в эфирном растворителе, таком как тетрагидрофуран, с катализатором на твердом носителе, таком как палладий на угле, в присутствии водорода при комнатной температуре в течение 1-5 часов, и, во-вторых, восстановления восстанавливающим средством, таким как борогидрид натрия, в смеси растворителей, такой как смесь тетрагидрофурана/метанола, при 0°C в течение 30 минут, и, в-третьих, осуществления реакции с фосфином, таким как связанный смолой трифенилфосфин, четырехгалоидным углеродом, таким как тетрахлорид углерода, основанием, таким как триэтиламин, в ацетонитриле, с обратным холодильником в течение 1-15 часов.
Схема 10. Получение J

В реакции 1 получения J соединение J-1 (где X3, X4, X5, X7 и X8 являются такими, как определено выше, например, где X2 и X8 независимо представляют собой C или N, а X9 представляет собой C) превращают в соединение J-2 путем осуществления реакции соединения J-1 с реагентом формилирования, таким как оксихлорид фосфора в диметилформамиде, при температуре от 0°C до комнатной температуры в течение 16 часов.
В реакции 2 получения J соединение J-2 превращают в соединение J-3 путем осуществления реакции соединения J-2 с сульфонилгидразидом, таким как п-толуолсульфонилгидразид, в эфирном растворителе, таком как 1,4-диоксан, при 100°C в течение 2 часов.
В реакции 3 получения J соединение J-3 превращают в соединение J-4 путем осуществления реакции соединения J-3 с соединением с остатком бороновой кислоты формулы R*2B(OH)2 (где R*2B(OH)2 представляет собой, например, соединение A-10, B-12 или E-9, как определено выше) в присутствии основания, такого как карбонат калия, в эфирном растворителе, таком как 1,4-диоксан, при 100°C в течение 16 часов.
Схема 11. Получение K
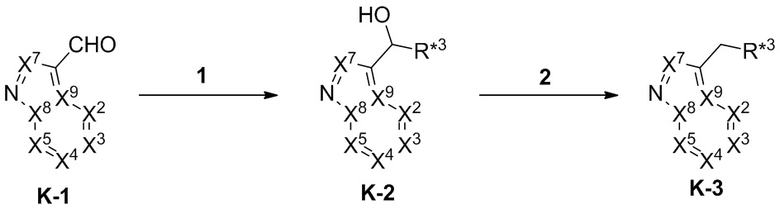
В реакции 1 получения K соединение K-1 (где X2, X3, X4, X5, X7 и X8 являются такими, как определено выше, например, где X2 и X8 независимо представляют собой C или N, а X9 представляет собой C) превращают в соединение K-2 путем осуществления реакции соединения K-1 с бромидным соединением R*3Br (где R*3Br представляет собой, например, соединение A-5 (где G1 представляет собой Br), B-4, C-4, E-2 или E-3 являются такими, как определено выше) в присутствии основания, такого как н-бутиллитий, в тетрагидрофуране при -78°C в течение 30 минут.
В реакции 2 получения K соединение K-2 превращают в соединение K-3 путем осуществления реакции соединения K-2 с органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при комнатной температуре в течение 30 минут.
Схема 12. Получение L

В реакции 1 получения L соединение L-1 (где X2, X3, X4, X5 и X7 являются такими, как определено выше, например, где X2 и X8 независимо представляют собой C, а X9 представляет собой C или N, или, например, где X2 и X8 независимо представляют собой C или N, а X9 представляет собой C) превращают в соединение L-2 путем осуществления реакции соединения L-1 с бромирующим реагентом, таким как N-бромсукцинимид, в полярном апротонном растворителе, таком как диметилформамид, при температуре от 0°C до комнатной температуры в течение 1,5 часа.
В реакции 2 получения L соединение L-2 превращают в соединение L-3 путем, во-первых, осуществления реакции соединения L-2 с металлоорганическим реагентом, таким как этилмагния бромид, в эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 30 минут, и, во-вторых, осуществления реакции с альдегидным соединением R*4CHO (где R*4CHO представляет собой, например, соединение B-9, E-6, F-6 или G-3, как определено выше) при комнатной температуре в течение 0,5-3 часов.
В реакции 3 получения L соединение L-3 превращают в соединение L-4 путем осуществления реакции соединения L-3 с органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при комнатной температуре в течение 30 минут.
Схема 13. Получение M
В реакции 1 получения M аминное соединение R*NH2 (где R*1NH2 представляет собой, например, соединение A-6, A-8, B-7, C-7, D-3 или E-4, как определено выше) превращают в соединение M-1 путем, во-первых, осуществления реакции R*1NH2 с 1,1-бис(метилтио)-2-нитроэтиленом в спирте, таком как этанол, с обратным холодильником в течение 19 часов, и, во-вторых, реакции с гидразином, таким как гидрат гидразина, в спирте, таком как этанол, с обратным холодильником в течение 2,5 часа.
В реакции 2 получения M соединение M-1 превращают в соединение M-2 (где каждый R10 независимо является таким, как определено выше) путем осуществления реакции соединения M-1 с 1,2-дикарбонильным соединением, таким как глиоксаль, в присутствии основания, такого как карбонат натрия, в водной и эфирной смеси спиртов, такой как смесь тетрагидрофурана/этанола/воды, при комнатной температуре в течение 19 часов.
В реакции 3 получения M соединение M-2 превращают в соединение M-3 путем, во-первых, осуществления реакции соединения M-1 с восстанавливающим средством, таким как железо, в кислоте, такой как ледяная уксусная кислота, при 125°C в течение 10 минут, и, во-вторых, осуществления реакции с ортоэфиром (EtO)3CR7 (где R7 является таким, как определено выше), таким как триэтилортоформиат, в присутствии кислоты, такой как п-толуолсульфоновая кислота, в спирте, таком как этанол, с обратным холодильником в течение 1 часа.
Схема 14. Получение N
В реакции 1 получения N соединение N-1 (где X2, X3 и X5 являются такими, как определено выше) превращают в соединение N-2 путем осуществления реакции соединения N-1 с альфа-бромкетоновым соединением BrCH2(CO)R*5 (где BrCH2(CO)R*5 представляет собой, например, соединение A-12, как определено выше) в полярном апротонном растворителе, таком как ацетонитрил, с обратным холодильником в течение 42 часов.
В реакции 2 получения N соединение N-2 превращают в соединение N-3 путем, во-первых, осуществления реакции соединения N-2 с восстанавливающим средством, таким как борогидрид натрия, в спирте, таком как метанол, при комнатной температуре в течение 30 минут, и, во-вторых, осуществления реакции с органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при комнатной температуре в течение 2 часов.
Схема 15. Получение O
В реакции 1 получения O соединение O-1 (где X2, X3, X4, X5 и X7 являются такими, как определено выше) превращают в соединение O-2 путем осуществления реакции соединения O-1 с азодикарбоксилатом, таким как бис(2-метоксиэтил)азодикарбоксилат, фосфином, таким как трифенилфосфин, и спиртовым соединением HOCH2R*6 (где HOCH2R*6 представляет собой, например, соединение B-10, E-7, F-7 или G-1, как определено выше) в эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 3 часов, или, альтернативно, путем осуществления реакции соединения O-1 с (трибутилфосфоранилиден)ацетонитрилом и спиртовым соединением HOCH2R*6 (где HOCH2R*6 представляет собой, например, соединение B-10, E-7, F-7 или G-1, как определено выше), в ароматическом растворителе, таком как толуол, при 100°C в течение 1 часа.
Схема 16. Получение P

В реакции 1 получения P соединение P-1 (где X101, X102, X103, X104 и X105 являются такими, как определено выше, например, где X102, X103 или X104 независимо представляют собой N; и где Hal представляет собой галоген) превращают или в соединение P-2 путем осуществления реакции соединения P-1 с катализатором, таким как прекатализатор 2ого поколения XPhos, основанием, таким как фосфат калия, и органоборатным соединением, таким как (4,4,5,5-тетраметил-1,3,2-диоксаборолил)-R*7 (где (4,4,5,5-тетраметил-1,3,2-диоксаборолил)-R*7 представляет собой, например, соединение A-9, B-13 или E-10, как определено выше) в водной смеси эфирных растворителей, такой как тетрагидрофурана/воды, при 80°C в течение 15 часов, или, альтернативно, превращают соединение P-3 путем осуществления реакции соединения P-1 с катализатором, таким как прекатализатор 2ого поколения XPhos, основанием, таким как фосфат калия, и соединением с остатком бороновой кислоты (HO)2BR*8 (где (HO)2BR*8 представляет собой, например, соединение A-10, B-12 или E-9, как определено выше, соответственно) в водной смеси эфирных растворителей, такой как смесь тетрагидрофурана/воды, при 80°C в течение 15 часов.
Схема 17. Получение Q
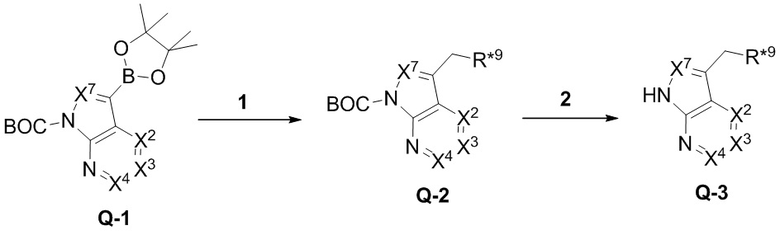
В реакции 1 получения Q соединение Q-1 (где X2, X3, X4 и X7 являются такими, как определено выше) превращают в соединение Q-2 путем осуществления реакции соединения Q-1 с катализатором, таким как ацетат палладия (II), фосфином, таким как трициклогексилфосфин, основанием, таким как фосфат калия, и бромидным соединения BrCH2R*9 (где BrCH2R*9 представляет собой, например, соединение B-11, E-8, F-8 или G-2, как определено выше) в двухфазной смеси растворителей, такой как смесь толуола/воды, с обратным холодильником в течение 18 часов.
В реакции 2 получения Q соединение Q-2 превращают в соединение Q-3 путем осуществления реакции соединения Q-2 с кислотой, такой как трифторуксусная кислота, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 30 минут.
Схема 18. Получение R
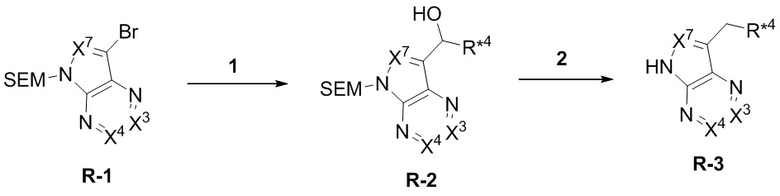
В реакции 1 получения R соединение R-1 (где X3, X4 и X7 являются такими, как определено выше) превращают в соединение R-2 путем, во-первых, осуществления реакции соединения R-1 с металлоорганическим реагентом, таким как этилмагния бромид, в эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 30 минут, и, во-вторых, осуществления реакции с альдегидным соединением R*4CHO (где R*4CHO представляет собой, например, соединение B-9, E-6, F-6 или G-3, как определено выше) при комнатной температуре в течение 0,5-3 часов.
В реакции 2 получения R соединение R-2 превращают в соединение R-3 путем осуществления реакции соединения R-2 с органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при комнатной температуре в течение 30 минут.
Схема 19. Получение S
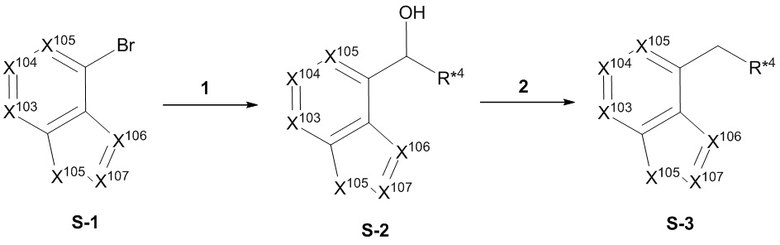
В реакции 1 получения S соединение S-1 (где X103, X104, X105, X106, X107 и X108 являются такими, как определено выше, например, где X103 представляет собой N, а X108 представляет собой NR117, например, где R117 представляет собой H) превращают в соединение S-2 путем, во-первых, осуществления реакции соединения S-1 с первым мольным эквивалентом металлоорганическим реагентом, таким как н-бутиллитий, в эфирном растворителе, таком как тетрагидрофуран, при -78°C в течение 30 минут, во-вторых, осуществления реакции со вторым мольным эквивалентом металлорганического реагента, такого как трет-бутиллитий, в эфирном растворителе, таком как тетрагидрофуран, при -78°C в течение 15 минут, и, в-третьих, осуществления реакции с альдегидным соединением R*4CHO (где R*4CHO представляет собой, например, соединение B-9, E-6, F-6 или G-3, как определено выше) при температуре от -78°C до комнатной температуры в течение 40 минут.
В реакции 2 получения S соединение S-2 превращают в соединение S-3 путем осуществления реакции соединения S-2 с органосиланом, таким как триэтилсилан, в кислоте, такой как трифторуксусная кислота, при комнатной температуре в течение 30 минут.
Схема 20. Получение T
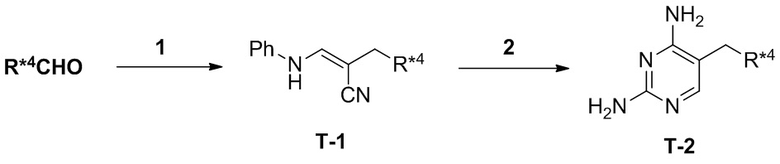
В реакции 1 получения T альдегидное соединение R*4CHO (где R*4CHO представляет собой, например, соединение B-9, E-6, F-6 или G-3, как определено выше) превращают в соединение T-1 путем осуществления реакции соединения R*4CHO с 3-(фениламино)пропаннитрилом в присутствии основания, такого как метоксид натрия, в полярном апротонном растворителе, таком как диметилсульфоксид, при 95°C в течение 1 часа.
В реакции 2 получения T соединение T-1 превращают в соединение T-2 путем осуществления реакции соединения T-2 с гуанидингидрохлоридом в присутствии основания, такого как трет-бутоксид калия, в спирте, таком как этанол, при 70°C в течение 48 часов.
Схема 21. Получение U
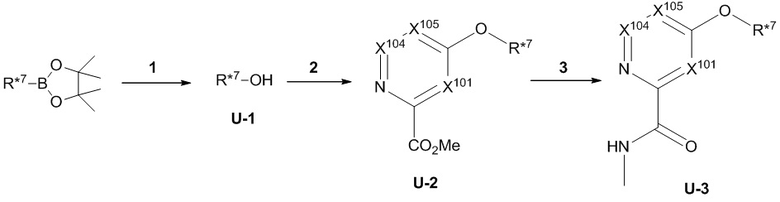
В реакции 1 получения U органоборатное соединение, такое как (4,4,5,5-тетраметил-1,3,2-диоксаборолил)-R*7 (где (4,4,5,5-тетраметил-1,3,2-диоксаборолил)-R*7 представляет собой, например, соединение A-9, B-13 или E-10, как определено выше) превращают в спиртовое соединение U-1 (R*7-OH) путем осуществления реакции соединения (4,4,5,5-тетраметил-1,3,2-диоксаборолил)-R*7 с гидратом бората натрия в смеси тетрагидрофурана/воды при комнатной температуре в течение 16 часов.
В реакции 2 получения U спиртовое соединение U-1 (R*7-OH) превращают в соединение U-2 (где X101, X104 и X105 являются такими, как определено выше) путем осуществления реакции соединения U-1 (R*7-OH) с метил-4-хлорпиколинатом в присутствии гидрида натрия в диметилсульфоксиде при температуре от комнатной температуры до 100°C в течение 5 часов.
В реакции 3 получения U соединение U-2 превращают в соединение U-3 путем осуществления реакции соединения U-2 с амином, таким как метиламин, в присутствии цианида натрия в этаноле при 125°C в течение 30 минут.
Схема 22. Получение V
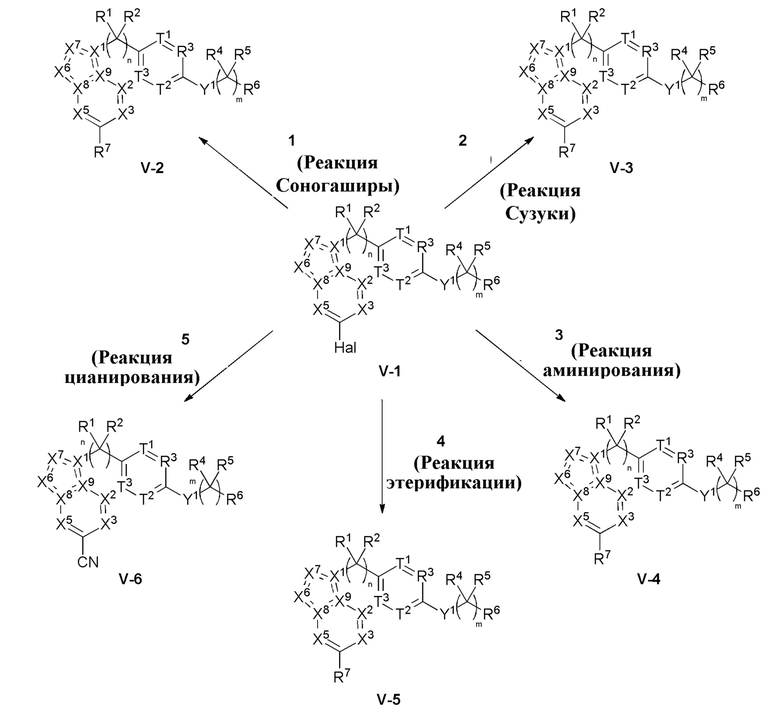
Реакция сочетания Соногаширы. В реакции 1 получения V соединение V-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше, и Hal представляет собой I, Br или Cl) превращают в соединение V-2 (где R7 представляет собой (C2-C10)алкинил, (C2-C10)алкиниламин, R8-(C2-C10)алкинил или R8-(C2-C10)алкиниламин, как определено выше) путем осуществления реакции соединения V-1 с алкином, каталитической системой, такой как йодид меди (I) и бис(трифенилфосфин)палладия(II) хлорид, и амином, таким как пиперидин, при 100°C в реакторе для обработки с помощью микроволнового излучения в течение 30 минут.
Реакция сочетания Сузуки. В реакции 2 получения V соединение V-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше, и Hal представляет собой I, Br или Cl) превращают в соединение V-3 (где R7 представляет собой (C1-C10)алкил, (C3-C10)циклоалкил, (C2-C9)гетероциклоалкил, (C6-C14)арил, (C2-C9)гетероарил, R8-(C1-C10)алкил-, R8-(C3-C10)циклоалкил, R8-(C2-C9)гетероциклоалкил, R8-(C6-C14)арил или R8-(C2-C9)гетероарил, как определено выше) путем осуществления реакции соединения V-1 с борорганическим соединением, катализатором, таким как ацетат палладия(II), лигандом, таким как трициклогексилфосфин, основанием, таким как трехосновный фосфат калия, в двухфазной смеси растворителей, такой как смесь толуола/воды, с обратным холодильником в течение 1-18 часов.
Реакция аминирования. В реакции 3 получения V соединение V-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше, и Hal представляет собой I, Br или Cl) превращают в соединение V-4 (где R7 представляет собой H2N-, (CH3)HN-, или (CH3)2N-, или R8R9N-, как определено выше) путем осуществления реакции соединения V-1 с первичным или вторичным амином, катализатором, таким как прекатализатор 3-его поколения BrettPhos, лигандом, таким как RuPhos, основанием, таким как трет-бутоксид натрия, в эфирном растворителе, таком как 1,4-диоксан, при 100°C в течение 1-16 часов, или, альтернативно, превращают в V-4 путем осуществления реакции соединения V-1 с первичным или вторичным амином, катализатором, таким как йодид меди(I), лигандом, таким как L-пролин, основанием, таким как карбонат калия, в полярном апротонном растворителе, таком как диметилсульфоксид, при 150°C в течение 1-16 часов, или, альтернативно, превращают в V-4 путем осуществления реакции соединения V-1 с ароматическим гетероциклом, таким как 1-H-имидазол, катализатором, таким как йодид меди(I), диаминовым лигандом, таким как N,N'-диметил-1,2-циклогександиамин, основанием, таким как карбонат калия, в полярном апротонном растворителе, таком как диметилформамид, при 135°C в течение 3-16 часов.
Реакция этерификации. В реакции 4 получения V соединение V-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше, и Hal представляет собой I, Br или Cl) превращают в соединение V-5 (где R7 представляет собой (C1-C10)алкокси-, R8-(C1-C10)алкокси-, (C2-C9)гетероциклоалкил-O-, (C6-C14)арил-O-, (C2-C9)гетероарил-O-, R8-(C3-C10)циклоалкил-O-, R8-(C2-C9)гетероциклоалкил-O-, R8-(C6-C14)арил-O- или R8-(C2-C9)гетероарил-O-, как определено выше) путем осуществления реакции соединения V-1 со спиртом, катализатором, таким как йодид меди(I), лигандом, таким как 1,10-фенантролин, основанием, таким как карбонат цезия, в полярном растворителе, таком как спирт или диметилсульфоксид, при 110°C в течение 1-20 часов, или, альтернативно, превращают в соединение V-5 путем осуществления реакции соединения V-1 со спиртом, катализатором, таким как катализатор 3его поколения RockPhos, основанием, таким как карбонат цезия, в неполярном растворителе, таком как толуол, при 100°C в течение 5-20 часов.
Реакция цианирования. В реакции 5 получения V соединение V-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше, и Hal представляет собой I, Br или Cl) превращают в соединение V-6 путем осуществления реакции соединения V-1 с солью, представляющей собой цианид, такой как цианид цинка (II), катализатором, таким как тетракис(трифенилфосфин)палладий(0), в полярном апротонном растворителе, таком как диметилформамид, при 100°C в течение 3 часов.
Схема 23. Получение W
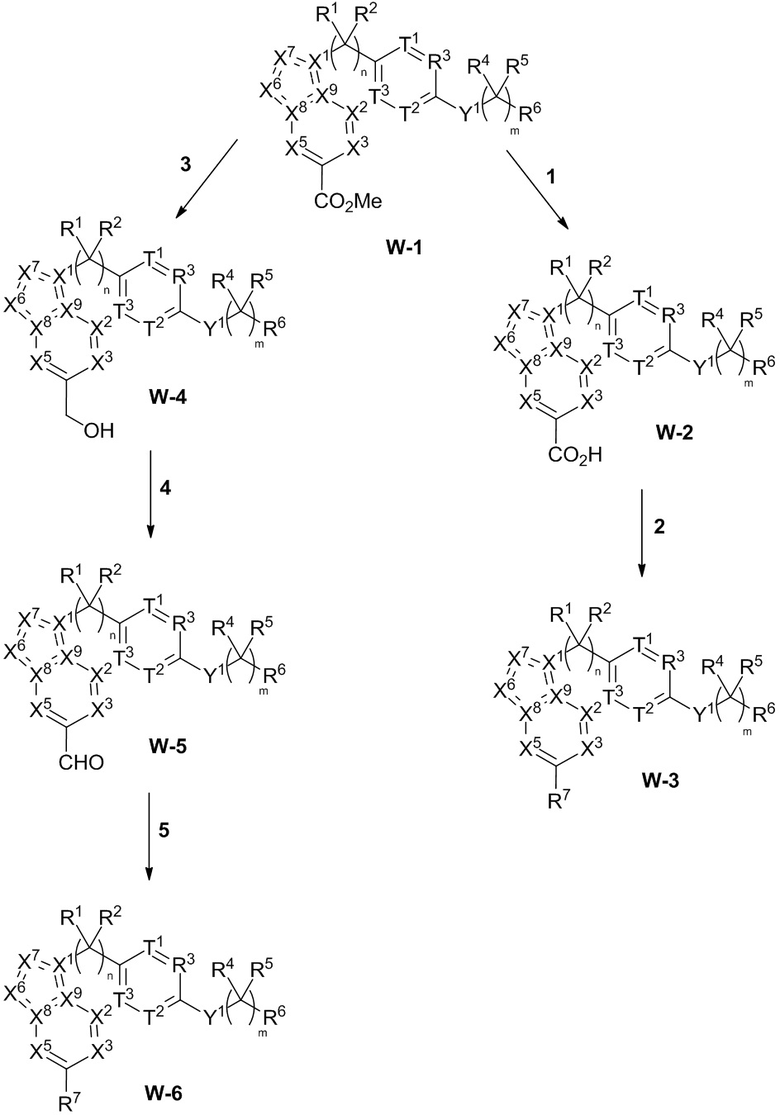
В реакции 1 получения W соединение W-1 (где X1, X2, X3, X5, X6, X7, X8, X9, R1, R2, R3, R4, R5, R6, T1, T2, T3, Y1, n и m являются такими, как определено выше) превращают в соединение W-2 путем осуществления реакции соединения W-1 с основанием, таким как моногидрат гидроксида лития, в водной и эфирной смеси спиртов, такой как смесь воды/тетрагидрофурана/метанола, при комнатной температуре в течение 1 часа.
В реакции 2 получения W соединение W-2 превращают в соединение W-3 (где R7 представляет собой R8R9N(O)C-, как определено выше) путем осуществления реакции соединения W-2 с амином, амидным реагентом сочетания, таким как O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилурония тетрафторборат, и основанием, таким как диизопропилэтиламин, в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 30 минут.
В реакции 3 получения W соединение W-1 превращают в соединение W-4 путем осуществления реакции соединения W-1 с восстанавливающим средством, таким как алюмогидрид лития, в эфирном растворителе, таком как тетрагидрофуран, при комнатной температуре в течение 30 минут.
В реакции 4 получения W соединение W-4 превращают в соединение W-5 путем осуществления реакции соединения W-4 с окисляющим реагентом, таким как оксид марганца(IV), в галогенированном растворителе, таком как дихлорметан, при комнатной температуре в течение 22 часов.
В реакции 5 получения W соединение W-5 превращают в соединение W-6 (где R7 представляет собой (C2-C9)гетероарил или R8-(C2-C9)гетероарил, как определено выше) путем осуществления реакции соединения W-5 с 1,2-дикарбониловым соединением, таким как глиоксаль, и аминной солью, такой как ацетат аммония, в полярном апротонном растворителе, таком как N-метил-2-пирролидон, при 120°C в течение 16 часов.
Применяемый в данном документе термин "амино" означает функциональную группу, содержащую атом азота и 1-2 атома водорода. "Амино", как правило, может быть использовано в данном документе для описания первичного, вторичного или третичного амина, и специалист в данной области сможет легко идентифицировать их с учетом контекста, в котором данный термин используется в настоящем изобретении. Термин "амин", или "аминогруппа", или "аммиачная группа" означает функциональную группу, содержащую атом азота, полученный из аммиака (NH3). Аминогруппы предпочтительно представляют собой первичные амины, что означает, что атом азота связан с двумя атомами водорода и одной замещающей группой, включающей замещенную или незамещенную алкильную или арильную группу или алифатическую или ароматическую группу. Аминогруппы могут представлять собой вторичные амины, что означает, что атом азота связан с одним атомом водорода и двумя замещающими группами, включающими замещенные или незамещенные алкильные или арильные группы или алифатическую или ароматическую группу, которые определены ниже. Аминогруппы могут представлять собой третичные амины, что означает, что атом азота связан с тремя замещающими группами, включающими замещенные или незамещенные алкильные или арильные группы или алифатическую или ароматическую группу. Аминогруппы также могут представлять собой четвертичные амины, что означает, что обозначенная аминогруппа связана с четвертой группой, что приводит в результате к положительно заряженной аммонийной группе.
Понимают, что любой или все из аминов в настоящем изобретении могут быть в форме свободного амина (т. е. в виде -NH2 для первичного амина) или в протонированной форме с фармацевтически приемлемым анионом (т. е. в виде -NH3+ Y- для первичного амина, где Y- представляет собой фармацевтически приемлемый анион).
Применяемый в данном документе термин "амидная группа" означает функциональную группу, содержащую карбонильную группу, связанную с атомом азота. "Карбонильная группа" означает функциональную группу, содержащую атом углерода, соединенный двойной связью с атомом кислорода, представленную в виде (C=O).
Термин "алкан" означает насыщенный углеводород, соединенный одинарными связями. Алканы могут быть линейными или разветвленными. "Циклоалканы" представляют собой насыщенные углеводородные кольца, соединенные одинарными связями.
Применяемый в данном документе термин "(C1-C10)алкил" означает насыщенный углеводород с прямой или разветвленной цепью или насыщенный циклический углеводород, состоящий, по сути, из 1-10 атомов углерода и соответствующего количества атомов водорода. Как правило, группы с прямой или разветвленной цепью содержат от одного до десяти атомов углерода или, чаще, от одного до пяти атомов углерода. Иллюстративные (C1-C10)алкильные группы включают метил (представленный в виде -CH3), этил (представленный в виде -CH2-CH3), н-пропил, изопропил, н-бутил, изобутил и т. д. Другие (C1-C10)алкильные группы будут весьма очевидны специалисту в данной области с учетом преимущества настоящего изобретения.
Применяемый в данном документе термин "(C2-C9)гетероалкил" означает насыщенный углеводород с прямой или разветвленной цепью или насыщенный циклический углеводород, состоящий, по сути, из 2-10 атомов, где 2-9 из атомов представляют собой атомы углерода и оставшийся(оставшиеся) атом(атомы) выбраны из группы, состоящей из атомов азота, серы и кислорода. Иллюстративные (C2-C9)гетероалкильные группы будут весьма очевидны специалисту в данной области с учетом преимущества настоящего изобретения.
Применяемый в данном документе термин "(C3-C10)циклоалкил" означает неароматическую насыщенную углеводородную группу, образующую по меньшей мере одно кольцо, состоящее, по сути, из 3-10 атомов углерода и соответствующего количества атомов водорода. (C3-C10)циклоалкильные группы могут быть моноциклическими или полициклическими. Отдельные кольца полициклических циклоалкильных групп могут иметь разные возможности связывания, например, слитые, соединенные мостиковой связью, спиро- и т. д., помимо замещения ковалентной связи. Иллюстративные (C3-C10)циклоалкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил, норборнанил, бициклооктанил, октагидропенталенил, спиро-деканил, циклопропил, замещенный циклобутилом, циклобутил, замещенный циклопентилом, циклогексил, замещенный циклопропилом, и т. д. Другие (C3-C10)циклоалкильные группы будут весьма очевидны специалисту в данной области с учетом преимущества настоящего изобретения.
Применяемый в данном документе термин "(C2-C9)гетероциклоалкил" означает неароматическую группу с 3-10 атомами, которые образуют по меньшей мере одно кольцо, где 2-9 из атомов кольца представляют собой атомы углерода и оставшийся(оставшиеся) атом(атомы) кольца выбраны из группы, состоящей из атомов азота, серы и кислорода. (C2-C9)гетероциклоалкильные группы могут быть моноциклическими или полициклическими. Отдельные кольца таких полициклических гетероциклоалкильных групп могут иметь разные возможности связывания, например, слитые, соединенные мостиковой связью, спиро- и т. д., помимо замещения ковалентной связи. Иллюстративные (C2-C9)гетероциклоалкильные группы включают пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидропиранил, пиранил, тиопиранил, азиридинил, азетидинил, оксиранил, метилендиоксил, хроменил, барбитурил, изоксазолидинил, 1,3-оксазолидин-3-ил, изотиазолидинил, 1,3-тиазолидин-3-ил, 1,2-пиразолидин-2-ил, 1,3-пиразолидин-1-ил, пиперидинил, тиоморфолинил, 1,2-тетрагидротиазин-2-ил, 1,3-тетрагидротиазин-3-ил, тетрагидротиадиазинил, морфолинил, 1,2-тетрагидродиазин-2-ил, 1,3-тетрагидродиазин-1-ил, тетрагидроазепинил, пиперазинил, пиперизин-2-онил, пиперизин-3-онил, хроманил, 2-пирролинил, 3-пирролинил, имидазолидинил, 2-имидазолидинил, 1,4-диоксанил, 8-азабицикло[3.2.1]октанил, 3-азабицикло[3.2.1]октанил, 3,8-диазабицикло[3.2.1]октанил, 2,5-диазабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.2]октанил, октагидро-2H-пиридо[1,2-a]пиразинил, 3-азабицикло[4.1.0]гептанил, 3-азабицикло[3.1.0]гексанил, 2-азаспиро[4.4]нонанил, 7-окса-1-аза-спиро[4.4]нонанил, 7-азабицикло[2.2.2]гептанил, октагидро-1H-индолил и т. п. (C2-C9)гетероциклоалкильная группа, как правило, присоединена к основной структуре через атом углерода или атом азота. Другие (C2-C9)гетероциклоалкильные группы будут весьма очевидны специалисту в данной области с учетом преимущества настоящего изобретения.
Термин "алифатическая группа" или "алифатический" означает неароматическую группу, состоящую из атомов углерода и водорода, и необязательно может включать одну или несколько двойных и/или тройных связей. Другими словами алифатическая группа представляет собой любую группу, состоящую из атомов углерода и водорода, которая не содержит ароматическую функциональную группу. Алифатическая группа может быть с прямой цепью, разветвленной цепью или циклической и, как правило, содержит от приблизительно одного до приблизительно 24 атомов углерода.
Термин "арильная группа" может быть использован взаимозаменяемо с терминами "арил", "арильное кольцо", "ароматический", "ароматическая группа" и "ароматическое кольцо". Арильные группы включают карбоциклические ароматические группы, как правило, с шестью - четырнадцатью атомами углерода в кольце. Арильные группы также включают гетероарильные группы, которые, как правило, содержат от пяти до четырнадцати атомов в кольце с одним или несколькими гетероатомами, выбранными из атомов азота, кислорода и серы.
Применяемый в данном документе термин "(C6-C14)арил" означает ароматическую функциональную группу с 6-14 атомами углерода, которые образуют по меньшей мере одно кольцо.
Применяемый в данном документе термин "(C2-C9)гетероарил" означает ароматическую функциональную группу с 5-10 атомами, которые образуют по меньшей мере одно кольцо, где 2-9 из атомов кольца представляют собой атомы углерода и оставшийся(оставшиеся) атом(атомы) кольца выбраны из группы, состоящей из атомов азота, серы и кислорода. (C2-C9)гетероарильные группы могут быть моноциклическими или полициклическими. Отдельные кольца таких полициклических гетероарильных групп могут иметь разные возможности связывания, например, слитые и т. д., помимо замещения ковалентной связи. Иллюстративные (C2-C9)гетероарильные группы включают фурил, тиенил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил, пирролил, триазолил, тетразолил, имидазолил, 1,3,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-оксадиазолил, 1,3,5-тиадиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, пиридил, пиримидил, пиразинил, пиридазинил, 1,2,4-триазинил, 1,2,3-триазинил, 1,3,5-триазинил, пиразоло[3,4-b]пиридинил, циннолинил, птеридинил, пуринил, 6,7-дигидро-5H-[1]пириндинил, бензо[b]тиофенил, 5,6,7,8-тетрагидро-хинолин-3-ил, бензоксазолил, бензотиазолил, бензизотиазолил, бензизоксазолил, бензимидазолил, тианафтенил, изотианафтенил, бензофуранил, изобензофуранил, изоиндолил, индолил, индолизинил, индазолил, изохинолил, хинолил, фталазинил, хиноксалинил, хиназолинил и бензоксазинил и т. п. (C2-C9)гетероарильная группа, как правило, присоединена к основной структуре через атом углерода, тем не менее, специалист в данной области поймет, когда другие определенные атомы, например гетероатомы кольца, могут быть присоединены к основной структуре. Другие (C2-C9)гетероарильные группы будут весьма очевидны специалисту в данной области с учетом преимущества настоящего изобретения.
Термин "алкинил" означает функциональную группу, содержащую соединенные тройной связью атомы углерода, представленную (C2-C10)алкинилом-.
При использовании в данном документе термин "алкиламин" означает (C1-C10)алкил, содержащий первичную, вторичную или третичную аминогруппу вместо одного атома водорода, представленный (C1-C10)алкиламином и ((C1-C10)алкил)2-амином.
Термин "алкиниламин" означает (C2-C10)группу, содержащую соединенные тройной связью атомы углерода и аминную группу, представленную (C2-C10)алкиниламином.
Термин "алкокси" означает (C1-C10)алкил, соединенный с кислородом, представленный (C1-C10)алкил-O- или (C1-C10)алкокси-. Термин "алкоксиалкил" означает (C1-C10)алкил, соединенный кислородной связью с другим (C1-C10)алкилом, представленный (C1-C10)алкил-O-(C1-C10)алкилом- или (C1-C10)алкокси-(C1-C10)алкилом-.
Термин "сложный алкиловый эфир" означает (C1-C10)алкил, содержащий сложноэфирную группу вместо одного атома водорода, представленный -O(O)C-(C1-C10)алкилом.
Термин "алкиловая кислота" означает (C1-C10)алкил, содержащий группу карбоновой кислоты вместо одного атома водорода, представленный как (C1-C10)алкил-COOH.
Термин "алифатическая кислота" означает кислоту неароматических углеводородов, представленную как (C1-C10)алкил-COOH и (C3-C10)циклоалкил-COOH.
Термин "дикарбонил" относится к органической молекуле, содержащей две или более смежных карбонильных групп. Карбонильные группы, представленные в виде C=O, могут быть, например, альдегидами, кетонами и другими группами с атомом кислорода, соединенным двойной связью с атомом углерода. Примеры включают без ограничения глиоксаль, метилглиоксаль, диметилглиоксаль и 3-дезоксиглюкозон.
Термин "галоген" или "Hal" означает ион фтора (F), хлора (Cl), брома (Br), йода (I) или астата (At).
Термин "метокси" означает (C1)алкил, содержащий атом кислорода вместо одного атома водорода, представленный как -(O)CH3.
Термин "полиол" означает спирт, содержащий несколько гидроксильных (-OH) групп.
"Замещенный" означает замещение атома углерода в алкильных, гетероциклических или арильных группах одним или несколькими отличными от углерода заместителями. Отличные от углерода заместители выбраны из атомов азота, кислорода и серы.
"Незамещенный" означает группу, состоящую только из атомов водорода и углерода.
3-10-членное кольцо означает замкнутое кольцо; 3-10-членное кольцо может быть ациклическим, ароматическим или гетероциклическим.
Термин "фармацевтически приемлемый анион" означает анион, который пригоден для фармацевтического применения. Фармацевтически приемлемые анионы включают без ограничения галогениды, карбонат, бикарбонат, сульфат, бисульфат, гидроксид, нитрат, персульфат, фосфат, сульфит, ацетат, аскорбат, бензоат, цитрат, дигидрогенцитрат, гидрогенцитрат, оксалат, сукцинат, тартрат, таурохолат, гликохолат и холат.
Все фармацевтически приемлемые соли, пролекарства, таутомеры, гидраты и сольваты соединений, раскрытых в данном документе, также находятся в пределах объема настоящего изобретения.
Раскрываемые в данном документе соединения, которые являются основными по природе, как правило, способны образовывать большое разнообразие различных солей с разнообразными неорганическими и/или органическими кислотами. Несмотря на то, что такие соли, как правило, являются фармацевтически приемлемыми для введения животным и людям, часто желательно на практике вначале выделить соединение из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в соединение в форме свободного основания путем обработки щелочным реагентом и впоследствии превратить свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений можно легко получить с применением общепринятых методик, например, путем осуществления обработки основного соединения, по сути, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как, например, метанол или этанол. При аккуратном выпаривании растворителя получают желаемую твердую соль.
Кислоты, которые можно применять для получения фармацевтически приемлемых солей присоединения кислоты основных соединений, представляют собой соли, которые могут образовывать нетоксичные соли присоединения кислоты, т. е. соли, содержащие фармакологически приемлемые анионы, такие как следующие соли: хлорид, бромид, йодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат и памоат [т. е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)].
Раскрытые в данном документе соединения, которые являются кислыми по природе, например, содержат COOH или тетразоловый фрагмент, как правило, способны образовывать широкое разнообразие различных солей с различными неорганическими и/или органическими основаниями. Несмотря на то, что такие соли, как правило, являются фармацевтически приемлемыми для введения животным и людям, часто желательно на практике вначале выделить соединение из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в соединение в форме свободной кислоты путем обработки кислотным реагентом и впоследствии превратить свободную кислоту в фармацевтически приемлемую соль присоединения основания. Эти соли присоединения основания можно легко получить с применением общепринятых методик, например, путем осуществления обработки соответствующих кислотных соединений водным раствором, содержащим необходимые фармакологически приемлемые катионы, и затем выпаривания полученного раствора до сухого состояния, предпочтительно при пониженном давлении. В качестве альтернативы, их также можно получить путем смешивания растворов кислотных соединений в низшем алифатическом спирте вместе с желаемым алкоксидом щелочного металла и затем выпаривания полученного раствора до сухого состояния таким же образом, как описано выше. В любом случае стехиометрические количества реагентов предпочтительно применяют для того чтобы обеспечить завершенность реакции и максимально увеличить выходы продукта необходимой твердой соли.
Основания, которые можно применять для получения фармацевтически приемлемых солей присоединения основания основных соединений, являются основаниями, которые могут образовывать нетоксичные соли присоединения основания, т. е. соли, содержащие фармакологически приемлемые катионы, такие как катионы щелочных металлов (например, калия и натрия), катионы щелочноземельных металлов (например, кальция и магния), соли присоединения аммония или других растворимых в воде аминов, такие как N-метилглюкамин(меглумин), низший алканоламмоний и другие такие основания органических аминов.
Изотопно меченные соединения также находятся в пределах объема настоящего изобретения. Как используется в данном документе, "изотопно меченное соединение" относится к раскрываемому в данном документе соединению, в том числе к его фармацевтически приемлемым солям и пролекарствам, каждое из которых описано в данном документе, в котором один или несколько атомов замещены атомом, имеющим атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в состав соединений, раскрываемых в данном документе, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl соответственно.
С помощью изотопного мечения раскрытых в данном документе соединений соединения могут быть применимыми в анализах распределения в тканях лекарственного средства и/или субстрата. Меченные тритием (3H) и углеродом-14 (14C) соединения являются особенно предпочтительными ввиду простоты их получения и возможности обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (2H), может обеспечивать некоторые терапевтические преимущества, которые являются результатом большей метаболической стабильности, например, увеличенного времени полураспада in vivo или сниженных потребностей в дозировке и, следовательно, могут быть предпочтительными при некоторых обстоятельствах. Изотопно-меченные соединения, раскрытые в данном документе, включая их фармацевтически приемлемые соли и пролекарства, можно получить посредством любых способов, известных из уровня техники.
Стереоизомеры (например, цис- и транс-изомеры) и все оптические изомеры раскрытого в данном документе соединения (например, R- и S-энантиомеры), а также рацемические, диастереомерные и другие смеси таких изомеров находятся в пределах объема настоящего изобретения.
Соединения, соли, пролекарства, гидраты и сольваты, раскрытые в данном документе, могут существовать в нескольких таутомерных формах, включая форму енола и имина, и кето-форму и форму енамина и их геометрические изомеры и смеси. Таутомеры существуют в виде смесей набора таутомеров в растворе. В твердой форме обычно преобладает один таутомер. Даже если может быть описан один таутомер, все таутомеры находятся в пределах объема настоящего изобретения.
Атропоизомеры также находятся в пределах объема настоящего изобретения. Атропоизомеры относятся к соединениям, которые могут быть разделены на изомеры с ограниченным вращением.
Настоящее изобретение также предусматривает фармацевтические композиции, содержащие по меньшей мере одно соединение, раскрытое в данном документе, и по меньшей мере один фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может представлять собой любой такой носитель, известный из уровня техники, включая описанные, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co., (A. R. Gennaro edit. 1985). Фармацевтические композиции соединений, раскрытых в данном документе, можно получить с помощью общепринятых способов, известных из уровня техники, включая, например, смешивание по меньшей мере одного раскрытого в данном документе соединения с фармацевтически приемлемым носителем.
Фармацевтические композиции, раскрытые в данном документе, можно применять для животных или человека. Таким образом, раскрытое в данном документе соединение может быть составлено в виде фармацевтической композиции для перорального, трансбуккального, парентерального (например, внутривенного, внутримышечного или подкожного), местного, ректального или интраназального введения или в форме, подходящей для введения с помощью ингаляции или инсуффляции.
Соединения, раскрытые в данном документе, можно также составлять для постоянной доставки согласно способам, хорошо известным специалистам в данной области. Примеры таких составов можно найти в патентах США №№ 3119742, 3492397, 3538214, 4060598 и 4173626.
Для перорального введения фармацевтической композиции можно придавать форму, например, таблетки или капсулы, например, таблетки или капсулы, полученной с помощью общепринятых способов с фармацевтически приемлемым(приемлемыми) вспомогательным веществом(вспомогательными веществами), таким(такими) как связующее вещество (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); заполнитель (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающее вещество (например, стеарат магния, тальк или кремнезем); разрыхлитель (например, картофельный крахмал или крахмалгликолят натрия); и/или смачивающее вещество (например, лаурилсульфат натрия). Таблетки могут быть покрыты посредством способов, хорошо известных из уровня техники. Жидким препаратам для перорального введения можно придавать форму, например, раствора, сиропа или суспензии или они могут быть представлены в виде сухого продукта для разведения водой или другой подходящей средой перед применением. Такие жидкие препараты можно получить с помощью общепринятых способов с фармацевтически приемлемой(приемлемыми) добавкой(добавками), такой(такими) как суспендирующее вещество (например, сорбитный сироп, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующее вещество (например, лецитин или аравийская камедь); безводная среда (например, миндальное масло, масляные сложные эфиры или этиловый спирт); и/или консервант (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).
Для трансбуккального введения композиция может принимать форму таблеток или пастилок, составленных традиционным способом.
Раскрываемые в данном документе соединения могут быть составлены для парентерального введения путем инъекции, в том числе с применением традиционных методик катетеризации, или инфузии. Составы для инъекции могут быть представлены в единичной лекарственной форме, например, в ампулах или в многодозовых контейнерах, с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных средах-носителях, и могут содержать средство для получения состава, такое как суспендирующее, стабилизирующее и/или диспергирующее средство, общепризнанное специалистами в данной области. В качестве альтернативы, активный ингредиент может быть в форме порошка для разведения с помощью подходящей среды, например, стерильной апирогенной воды, перед применением.
Для местного введения раскрываемое в данном документе соединение можно составлять в виде мази или крема.
Раскрытые в данном документе соединения можно также составлять в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие общепринятые суппозиторные основы, такие как масло какао или другие глицериды.
Для интраназального введения или введения с помощью ингаляции раскрытые в данном документе соединения можно традиционно доставлять в форме раствора или суспензии из контейнера-пульверизатора, который нажимается или нагнетается пациентом, или в виде подачи распыляемого аэрозоля из находящегося под давлением контейнера или распылителя, с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля единицу дозирования можно определить путем обеспечения клапана для доставки отмеренного количества. Находящийся под давлением контейнер или распылитель может содержать раствор или суспензию раскрываемого в данном документе соединения. Можно составить капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе, содержащие порошковую смесь раскрываемого в данном документе соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Предлагаемая доза раскрытого в данном документе соединения для перорального, парентерального или трансбуккального введения среднему взрослому человеку для лечения или предупреждения связанного с CSF-1R болезненного состояния представляет собой от приблизительно 0,1 мг до приблизительно 2000 мг. Согласно некоторым вариантам осуществления предлагаемая доза составляет от приблизительно 0,1 мг до приблизительно 200 мг активного ингредиента на разовую дозу. Независимо от количества предлагаемой дозы введение соединения может происходить, например, 1-4 раза в день.
Аэрозольные комбинированные составы для лечения или предупреждения состояний, на которые ссылаются выше, у среднего взрослого человека предпочтительно распределяют так, чтобы каждая отмеренная доза или "нажатиеʺ аэрозоля содержало от приблизительно 20 мг до приблизительно 10000 мг, предпочтительно от приблизительно 20 мг до приблизительно 1000 мг раскрытого в данном документе соединения. Общая суточная доза с аэрозолем будет находиться в диапазоне от приблизительно 100 мг до приблизительно 100 мг. В некоторых вариантах осуществления общая суточная доза с аэрозолем обычно будет находиться в диапазоне от приблизительно 100 мг до приблизительно 10 мг. Введение можно проводить несколько раз в день, например, 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз.
Аэрозольные комбинированные составы для лечения или предупреждения состояний, на которые ссылаются выше, у среднего взрослого человека предпочтительно распределяют так, чтобы каждая отмеренная доза или "нажатиеʺ аэрозоля содержало от приблизительно 0,01 мг до приблизительно 1000 мг комбинации, содержащей раскрытое в данном документе соединение. В некоторых вариантах осуществления каждая отмеренная доза или "нажатиеʺ аэрозоля содержит от приблизительно 0,01 мг до приблизительно 100 мг комбинации, содержащей раскрытое в данном документе соединение. В некоторых вариантах осуществления каждая отмеренная доза или "нажатиеʺ аэрозоля содержит от приблизительно 1 мг до приблизительно 10 мг комбинации, содержащей раскрытое в данном документе соединение. Введение можно осуществлять несколько раз в день, например, 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз.
Фармацевтические композиции и способы обработки или предупреждения, включающие введение пролекарств по меньшей мере одного раскрытого в данном документе соединения, также находятся в пределах объема настоящего изобретения.
Неограничивающие примеры подходящих ингибиторов CSF-1R формулы (I) и формулы (II) представлены в примерах ниже. Понятно, что любой или все из аминов структур, представленных в ингибиторах формулы (I) и формулы (II), представленных в примерах ниже, могут быть в виде свободного амина или в протонированной форме с фармацевтически приемлемым анионом. Предпочтительные фармацевтически приемлемые анионы включают без ограничения галогениды, карбонат, бикарбонат, сульфат, бисульфат, гидроксид, нитрат, персульфат, фосфат, сульфит, ацетат, аскорбат, бензоат, цитрат, дигидрогенцитрат, гидрогенцитрат, оксалат, сукцинат, тартрат, таурохолат, гликохолат и холат. Наиболее предпочтительные фармацевтически приемлемые анионы включают хлорид, карбонат и бикарбонат. Также понятно, что любой или все ингибиторы CSF-1R формулы (I) и формулы (II) могут быть рацематом или энантиомером рацемата.
Примеры
Пример 1: способы синтеза
Определенные варианты осуществления настоящего изобретения описаны со ссылкой на примеры получения и схемы, представленные ниже; следует понимать, что такие варианты осуществления представлены исключительно в качестве примера и являются лишь иллюстративными, но такое небольшое количество из множества возможных определенных вариантов осуществления может представлять собой пути применения принципов настоящего изобретения. Различные изменения и модификации примеров получения, схем и примеров будут очевидны специалистам в данной области, учитывая преимущество настоящего изобретения.
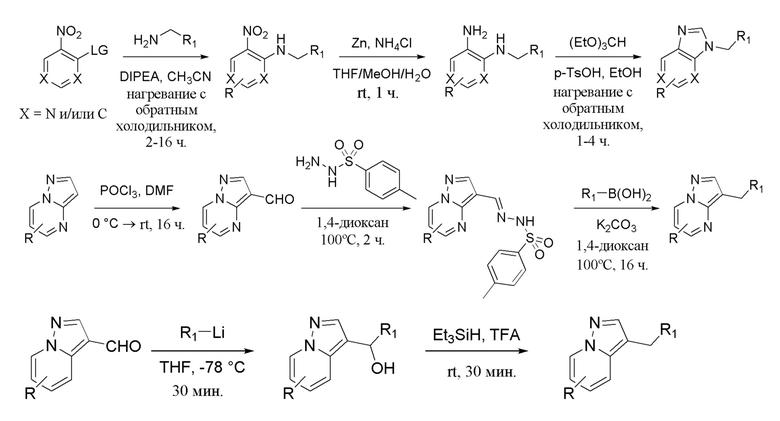
Пример 1-1-2: получение 3-(2-гидрокси-2-(4-метоксифенил)этокси)-4-йодбензамида
К перемешанному раствору 4-йод-3-(2-(4-метоксифенил)-2-оксоэтокси)бензамида (1,60 г, 3,89 ммоль) в метаноле (25 мл) при 0°C медленно добавляли борогидрид натрия (0,158 г, 4,18 ммоль). Для полученной в результате смеси обеспечивали перемешивание при 0°C. Через 1 ч. смесь разбавляли солевым раствором (50 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (силикагель, элюент: 5% метанола в дихлорметане) получали 1,50 г (94%) 3-(2-гидрокси-2-(4-метоксифенил)этокси)-4-йодбензамида в виде желтого твердого вещества.
Пример 1-1-3: получение 2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида
К перемешанному раствору 3-(2-гидрокси-2-(4-метоксифенил)этокси)-4-йодбензамида (0,78 г, 1,88 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (60% дисперсия в минеральном масле, 0,23 г, 5,75 ммоль) и йодид меди(I) (0,36 г, 1,88 ммоль). Полученную в результате смесь нагревали до 80°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали через целит. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (силикагель, элюент: 1-2% метанола в дихлорметане) получали 0,41 г (76%) 2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида в виде белого твердого вещества.
Пример 1-1-4: получение (2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
К перемешанному раствору 2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида (0,43 г, 1,51 ммоль) в тетрагидрофуране (10 мл) добавляли 1,0 M боран-тетрагидрофурановый комплекс (30 мл, 30 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее гасили медленным добавлением метанола (20 мл). Для смеси обеспечивали перемешивание при комнатной температуре. Через 2 ч. смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (силикагель, элюент: 10% метанола в дихлорметане) получали 0,32 г (75%) (2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина в виде желтого твердого вещества.
Пример 1-1-5: получение 4-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроанилина
К перемешанному раствору (2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (0,25 г, 0,92 ммоль) в ацетонитриле (25 мл) добавляли 2-фтор-4-йод-1-нитробензол (0,27 г, 1,01 ммоль) и карбонат калия (0,26 мг, 1,85 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (силикагель, элюент: 10% метанола в дихлорметане) получали 0,24 г (50%) 4-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроанилина в виде желтого твердого вещества.
Пример 1-1-6: получение 4-йод-N1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)бензол-1,2-диамина
К перемешанной суспензии 4-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроанилина (0,26 г, 0,51 ммоль) в этаноле (20 мл) и воде (5 мл) добавляли порошкообразное железо (0,14 г, 2,52 ммоль) и хлорид аммония (0,13 г, 2,52 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (нейтральный оксид алюминия, элюент: 5% метанола в дихлорметане) получали 0,23 г (91%) 4-йод-N1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)бензол-1,2-диамина в виде желтого твердого вещества.
Пример 1-1-7: получение 5-йод-1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола
К перемешанному раствору 4-йод-N1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)бензол-1,2-диамина (0,22 г, 0,42 ммоль) в N,N-диметилформамиде (30 мл) добавляли триэтилортоформиат (0,46 г, 3,09 ммоль) и п-толуолсульфоновой кислоты моногидрат (0,038 г, 0,22 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь разбавляли водой (150 мл) и полученный в результате осадок выделяли фильтрованием. При помощи хроматографической очистки неочищенного продукта (нейтральный оксид алюминия, элюент: 2% метанола в дихлорметане) получали 0,20 г (93%) 5-йод-1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола в виде желтого твердого вещества.
Пример 1-1-8: получение 4-(1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазол-5-ил)-2-метилбут-3-ин-2-амина
К перемешанному раствору 5-йод-1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола (0,17 г, 0,34 ммоль) в тетрагидрофуране (3 мл) добавляли 2-метилбут-3-ин-2-амин (0,057 г, 0,68 ммоль), йодид меди(I) (0,026 г, 0,14 ммоль), пиперидин (0,15 г, 1,70 ммоль) и бис(трифенилфосфин)палладия(II) дихлорид (0,048 г, 0,068 ммоль). Смесь нагревали до 60°C в микроволновом реакторе. Через 30 мин. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали. При помощи хроматографической очистки неочищенного продукта (препаративная HPLC) получали 0,029 г (19%) 4-(1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазол-5-ил)-2-метилбут-3-ин-2-амина в виде желтого твердого вещества: 1H ЯМР (500 МГц, CDCl3) δ 7,96 (s, 1H), 7,88 (s, 1H), 7,35-7,30 (m, 3H), 7,25 (d, J=8,5 Гц, 1H), 6,97-6,93 (m, 3H), 6,77 (d, J=2,0 Гц, 1H), 6,73 (dd, J=8,5, 2,0 Гц, 1H), 5,26 (s, 2H), 5,07-5,05 (m, 1H), 4,32-4,30 (m, 1H), 4,03-3,99 (m, 1H), 3,84 (s, 3H), 1,54 (s, 6H) ppm; (M+1)=454.
Пример 1-2: синтез 4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-2-1: получение 5-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина
К перемешанному раствору (2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (0,51 г, 1,87 ммоль, пример 1-1-4) в ацетонитриле (10 мл) добавляли 2-хлор-5-йод-3-нитропиридин (0,64 г, 2,25 ммоль) и диизопропилэтиламин (0,60 г, 4,68 ммоль). Полученную в результате ярко-желтую смесь нагревали до температуры возврата флегмы. Через 5 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (40 мл). Смесь экстрагировали этилацетатом (3×25 мл). Объединенные органические экстракты промывали солевым раствором (30 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 0-33% этилацетат/гексаны) получали 0,81 г (84%) 5-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амин в виде желтого твердого вещества.
Пример 1-2-2: получение 5-йод-N2-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина
К перемешанному раствору добавляли 5-йод-N-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амин (0,81 г, 1,57 ммоль) в уксусной кислоте (15 мл), добавляли порошкообразное железо (0,61 г, 10,96 ммоль). Смесь нагревали до 100°C и при нагревании смеси исходный ярко-желтый цвет постепенно темнел до серо-коричневого. Через 45 мин. обеспечивали охлаждение серо-коричневой суспензии до комнатной температуры и ее разбавляли этилацетатом (50 мл). Полученную в результате суспензию фильтровали через целит с помощью дополнительного количества этилацетата (30 мл). Фильтрат промывали солевым раствором (1×25 мл) и 1 н. раствором гидроксида натрия (3×25 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,77 г (100%) 5-йод-N2-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина в виде коричневого твердого вещества.
Пример 1-2-3: получение 6-йод-3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанной суспензии 5-йод-N2-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина (0,77 мг, 1,57 ммоль) в этаноле (15 мл) добавляли триэтилортоформиат (0,70 г, 4,70 ммоль) и п-толуолсульфоновой кислоты моногидрат (0,014 г, 0,078 ммоль). Смесь нагревали до температуры возврата флегмы. Через 30 мин. обеспечивали охлаждение коричневого раствора до комнатной температуры. Смесь разбавляли водой (40 мл) и экстрагировали дихлорметаном (2×30 мл). Объединенные органические фазы промывали солевым раствором (30 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 1-5% 2 М аммиак в метаноле/дихлорметане) получали 0,54 г (70%) 6-йод-3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин в виде желтовато-коричневого твердого вещества.
Пример 1-2-4: получение 4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
К перемешанному раствору 6-йод-3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,10 г, 0,20 ммоль) в пиперидине (3,5 мл) добавляли 2-метилбут-3-ин-2-амин (0,021 г, 0,24 ммоль), йодид меди(I) (0,008 г, 0,040 ммоль) и бис(трифенилфосфин)палладия(II) хлорид (0,014 г, 0,020 ммоль). Смесь нагревали до 100°C в микроволновом реакторе. Через 30 мин. реакционную смесь разбавляли 5 н. раствором гидроксида аммония (30 мл) и экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 1-5% 2 M аммиак в метаноле/дихлорметане) получали 0,060 г (66%) 4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,02 (s, 1H), 7,34-7,30 (m, 2H), 6,96-6,92 (m, 3H), 6,89 (d, J=2,0 Гц, 1H), 6,83 (dd, J=8,3, 2,1 Гц, 1H), 5,36 (s, 2H), 5,04 (dd, J=8,9, 2,3 Гц, 1H), 4,29 (dd, J=11,5, 2,4 Гц, 1H), 3,99 (dd, J=11,5, 9,0 Гц, 1H), 3,82 (s, 3H), 1,77 (br s, 2H), 1,53 (s, 6H) ppm; (M+1)=455.
Пример 1-2-5: хиральное разделение 4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Рацемический 4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амин подвергали препаративной очистке SFC (колонка 21,2×250 мм LUX-3, 50% метанола/0,2% диэтиламинового модификатора, расход 45 г/мин., давление 100 бар, концентрация образца 20 мг/мл) с получением отдельных энантиомеров (абсолютная конфигурация не определена).
Пример 1-3: Синтез 3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 6-йод-3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,19 г, 0,38 ммоль, пример 1-2-3) в диметилсульфоксиде (3,5 мл) добавляли 1-метилпиперазин (0,046 г, 0,46 ммоль), L-пролин (0,011 г, 0,091 ммоль), карбонат калия (0,18 г, 1,33 ммоль) и йодид меди(I) (0,009 г, 0,047 ммоль). Полученную в результате светло-желтую суспензию нагревали до 150°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли 3 н. раствором гидроксида аммония (15 мл). Смесь экстрагировали дихлорметаном (3×20 мл). Объединенные органические фазы промывали водой (2×15 мл) и солевым раствором (20 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 1-10% метанол/дихлорметан) получали 0,048 г (27%) 3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,26 (d, J=2,5 Гц, 1H), 7,95 (s, 1H), 7,63 (d, J=2,5 Гц, 1H), 7,33-7,29 (m, 2H), 6,79-7,00 (m, 5H), 5,33 (s, 2H), 5,03 (dd, J=9,0, 2,4 Гц, 1H), 4,29 (dd, J=11,5, 2,4 Гц, 1H), 3,99 (dd, J=11,5, 9,0 Гц, 1H), 3,82 (s, 3H), 3,19-3,33 (m, 4H), 2,57-2,70 (m, 4H), 2,38 (s, 3H) ppm (M+1)=472.
Пример 1-4: синтез 3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 6-йод-3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,15 г, 0,30 ммоль) в 1,2-диметоксиэтанe (3 мл) и воде (0,3 мл) добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (0,076 г, 0,36 ммоль), карбонат цезия (0,30 г, 0,91 ммоль), тетракис(трифенилфосфин)палладий(0) (0,035 г, 0,030 ммоль). Полученную в результате смесь нагревали до 100°C. Через 7 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом. Смесь фильтровали через целит и фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 90% этилацетат/гептан) получали бежевое масло, которое кристаллизовалось при отстаивании. Бежевое твердое вещество обрабатывали ацетонитрилом и водой и полученный в результате осадок выделяли фильтрованием с получением 0,050 г (37%) 3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (d, J=1,9 Гц, 1H), 8,56 (s, 1H), 8,29-8,19 (m, 2H), 7,97 (d, J=0,9 Гц, 1H), 7,41-7,30 (m, 2H), 7,02-6,93 (m, 3H), 6,90 (d, J=1,2 Гц, 2H), 5,39 (s, 2H), 5,12 (dd, J=8,5, 2,4 Гц, 1H), 4,33 (dd, J=11,6, 2,5 Гц, 1H), 4,04 (dd, J=11,6, 8,5 Гц, 1H), 3,88 (s, 3H), 3,75 (s, 3H).
Пример 1-5: синтез 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-5-1: получение 4-йод-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензамида
К перемешанному раствору 3-гидрокси-4-йодбензамида (1,36 г, 5,16 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (1,95 г, 14,08 ммоль) и 2-бром-1-(6-метоксипиридин-3-ил)этанон (1,08 г, 4,69 ммоль). Полученную в результате реакционную смесь нагревали до 80°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (100 мл). Смесь экстрагировали дихлорметаном (2×40 мл). Объединенные органические экстракты промывали водой (40 мл) и солевым раствором (40 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% этилацетат/гептан) получали 0,89 г (46%) 4-йод-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензамида в виде желтовато-коричневого твердого вещества.
Пример 1-5-2: получение 3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-4-йодбензамида
К перемешанному раствору 4-йод-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензамида (0,89 г, 2,15 ммоль) в тетрагидрофуране (20 мл) и воде (5 мл) добавляли борогидрид натрия (0,16 г, 4,30 ммоль). Обеспечивали перемешивание полученной в результате смеси при комнатной температуре. Через 16 ч. смесь гасили насыщенным раствором хлорида аммония (30 мл). Смесь экстрагировали этилацетатом (3×25 мл). Объединенные органические фазы промывали солевым раствором (30 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,89 г (100%) 3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-4-йодбензамида в виде грязно-белого твердого вещества.
Пример 1-5-3: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида
К перемешанному раствору 3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-4-йодбензамида (0,93 г, 2,24 ммоль) в N,N-диметилформамиде (15 мл) добавляли гидрид натрия (60% дисперсия, 0,27 г, 6,71 ммоль). Обеспечивали перемешивание реакционной смеси при комнатной температуре в течение 15 мин., а затем добавляли йодид меди(I) (0,43 г, 2,24 ммоль). Смесь нагревали до 80°C. Через 3 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (75 мл). Смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы промывали солевым раствором (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 1-10% метанол/дихлорметан) получали 0,40 г (63%) 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида в виде желтовато-коричневого твердого вещества.
Пример 1-5-4: получение (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
К перемешанному раствору 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида (0,40 г, 1,40 ммоль) в тетрагидрофуране (10 мл) добавляли 1,0 M боран-тетрагидрофурановый комплекс (5,6 мл, 5,60 ммоль). Смесь нагревали до температуры возврата флегмы. Через 2 ч. смесь охлаждали до 0°C. Метанол (5 мл) медленно добавляли до гашения реакции и полученную в результате смесь нагревали до температуры возврата флегмы. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток растворяли в тетрагидрофуране (20 мл) и 1 н. растворе хлористоводородной кислоты (10 мл). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и pH смеси доводили до ~ 7 путем добавления 1 н. раствора гидроксида натрия. Нейтральную смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы промывали солевым раствором (40 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,38 г (100%) (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина в виде масла.
Пример 1-5-5: получение 5-йод-N-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина
К перемешанному раствору (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (0,38 г, 1,40 ммоль) в ацетонитриле (10 мл) добавляли 2-хлор-5-йод-3-нитропиридин (0,48 г, 1,67 ммоль) и диизопропилэтиламин (0,54 г, 4,19 ммоль). Полученную в результате желтую смесь нагревали до температуры возврата флегмы. Через 4 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (40 мл). Смесь экстрагировали этилацетатом (3×25 мл). Объединенные органические фазы промывали солевым раствором (40 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 0-33% этилацетат/гексаны) получали 0,35 г (48%) 5-йод-N-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина в виде желтого твердого вещества.
Пример 1-5-6: получение 5-йод-N2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина
К перемешанной суспензии 5-йод-N-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина (0,35 г, 0,67 ммоль) в уксусной кислоте (8 мл) добавляли порошкообразное железо (0,26 г, 4,71 ммоль). Смесь нагревали до 100°C и при нагревании смеси исходный ярко-желтый цвет постепенно темнел до серо-коричневого. Через 45 мин. обеспечивали охлаждение серо-коричневой суспензии до комнатной температуры и ее разбавляли этилацетатом (50 мл). Полученную в результате суспензию фильтровали через целит с помощью дополнительного количества этилацетата (25 мл). Фильтрат промывали солевым раствором (1×25 мл) и 1 н. раствором гидроксида натрия (3×25 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,30 г (91%) 5-йод-N2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина в виде оранжевого твердого вещества.
Пример 1-5-7: получение 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанной суспензии 5-йод-N2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина (0,300 г, 0,61 ммоль) в этаноле (10 мл) добавляли триэтилортоформиат (0,27 г, 1,84 ммоль) и п-толуолсульфоновой кислоты моногидрат (0,006 г, 0,031 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 30 мин. обеспечивали охлаждение коричневого раствора до комнатной температуры и его разбавляли водой (40 мл). Смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические экстракты промывали солевым раствором (30 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 1-5% 2 M аммиак в метаноле/дихлорметане) получали 0,30 г (98%) 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде желтовато-коричневого твердого вещества.
Пример 1-5-8: получение 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
К перемешанному раствору 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,22 г, 0,45 ммоль) в пиперидине (3,5 мл) добавляли 2-метилбут-3-ин-2-амин (0,047 г, 0,53 ммоль), йодид меди(I) (0,017 мг, 0,089 ммоль) и бис(трифенилфосфин)палладия(II) хлорид (0,031 мг, 0,044 ммоль). Смесь нагревали до 100°C в микроволновом реакторе. Через 30 мин. реакционную смесь разбавляли 5 н. раствором гидроксида аммония (30 мл) и экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 1-5% 2 M аммиак в метаноле/дихлорметане) получали 0,16 г (79%) 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина, также известного как GENZ-882706 и RA03546849, в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,19 (d, J=2,4 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,03 (s, 1H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 6,87-6,96 (m, 2H), 6,84 (dd, J=8,3, 2,1 Гц, 1H), 6,79 (d, J=8,6 Гц, 1H), 5,36 (s, 2H), 5,07 (dd, J=8,7, 2,3 Гц, 1H), 4,30 (dd, J=11,6, 2,3 Гц, 1H), 4,02 (dd, J=11,6, 8,7 Гц, 1H), 3,95 (s, 3H), 1,80 (br s, 2H), 1,53 (s, 6H) ppm; (M+1)=456.
Пример 1-5-9: хиральное разделение 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Рацемический 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амин подвергали препаративной очистке SFC (колонка 21,2×250 мм Chiralcel OJ, 25% этанола/0,2% диэтиламинового модификатора, расход 75 г/мин.) с получением отдельных энантиомеров.
Пример 1-6: синтез 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина (пример 1-5-7) и 1-метилпиперазина, как описано в примере 1-3: 1H ЯМР (400 МГц, CDCl3) δ 8,26 (d, J=2,5 Гц, 1H), 8,19 (d, J=2,4 Гц, 1H), 7,95 (s, 1H), 7,63 (d, J=2,4 Гц, 1H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 6,87-6,95 (m, 2H), 6,84 (dd, J=8,3, 2,1 Гц, 1H), 6,79 (d, J=8,6 Гц, 1H), 5,33 (s, 2H), 5,07 (dd, J=8,8, 2,3 Гц, 1H), 4,29 (dd, J=11,6, 2,3 Гц, 1H), 4,02 (dd, J=11,6, 8,8 Гц, 1H), 3,95 (s, 3H), 3,14-3,30 (m, 4H), 2,60-2,70 (m, 4H), 2,38 (s, 3H) ppm; (M+1)=473.
Пример 1-7: Синтез 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила
Раствор 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,10 г, 0,20 ммоль, пример 1-5-7) в N,N-диметилформамиде (3 мл) дегазировали с использованием азота. Смесь обрабатывали тетракис(трифенилфосфин)палладием(0) (0,023 г, 0,019 ммоль) и цианидом цинка (0,014 г, 0,12 ммоль) и нагревали до 100°C в герметизированном сосуде. Через 3 часа обеспечивали охлаждение смеси до комнатной температуры. Смесь разбавляли этилацетатом и водой и фазы разделяли. Водную фазу экстрагировали этилацетатом. Объединенную органическую фазу промывали солевым раствором и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 70% этилацетат/гексаны), а затем растирания выделенного материала с ацетоном/гексанами получали 0,054 г (68%) 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,91-8,76 (m, 2H), 8,71 (d, J=1,8 Гц, 1H), 8,24 (d, J=2,3 Гц, 1H), 7,76 (dd, J=8,6, 2,5 Гц, 1H), 7,00 (t, J=1,2 Гц, 1H), 6,96-6,78 (m, 3H), 5,44 (s, 2H), 5,21 (dd, J=8,4, 2,4 Гц, 1H), 4,37 (dd, J=11,6, 2,5 Гц, 1H), 4,14 (dd, J=11,6, 8,4 Гц, 1H), 3,84 (s, 3H).
Пример 1-8: синтез 6-(азетидин-1-ил)-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,11 г, 0,22 ммоль, пример 1-5-7) в 1,2-диметоксиэтанe (3 мл) добавляли ацетат палладия(II) (0,003 мг, 0,013 ммоль) и (R)-1-[(SP)-2-(дициклогексилфосфино)ферроценил]этилдициклогексилфосфин (0,007 г, 0,012 ммоль). Полученный в результате желтый раствор обрабатывали азетидином (0,025 г, 0,44 ммоль) и твердым трет-бутоксидом натрия (0,042 г, 0,44 ммоль). Смесь нагревали до 100°C в герметизированном сосуде. Через 20 часов обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-5% метанол/дихлорметан) получали 0,043 г (46%) 6-(азетидин-1-ил)-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,39 (s, 1H), 8,24 (d, J=2,5 Гц, 1H), 7,75 (dd, J=8,6, 2,5 Гц, 1H), 7,68 (d, J=2,5 Гц, 1H), 7,06 (d, J=2,5 Гц, 1H), 7,00-6,76 (m, 4H), 5,30 (s, 2H), 5,20 (dd, J=8,4, 2,5 Гц, 1H), 4,36 (dd, J=11,5, 2,5 Гц, 1H), 4,13 (dd, J=11,5, 8,4 Гц, 1H), 3,92-3,74 (m, 4H), 3,32 (s, 3H), 2,37-2,27 (m, 2H) ppm; (M+1)=430.
Пример 1-9: синтез 6-циклопропил-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К смеси 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,11 г, 0,21 ммоль, пример 1-5-7), хлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (0,016 г, 0,021 ммоль), карбоната цезия (0,21 г, 0,66 ммоль) и циклопропилбороновой кислоты (0,028 г, 0,33 ммоль) добавляли 1,2-диметоксиэтан (3 мл) и воду (0,3 мл). Полученную в результате смесь нагревали до 100°C в герметизированном сосуде. Через 4 часа добавляли дополнительные порции катализатора и бороновой кислоты и смесь перемешивали. В целом через 7 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом. Смесь фильтровали через небольшую подушку из силикагеля и целита и остаток концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-5% метанол/дихлорметан), а затем препаративной HPLC (10-90% ацетонитрил/0,1% трифторуксусной кислоты в воде) получали 0,012 г (10%) 6-циклопропил-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (соль трифторуксусной кислоты) в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,80 (s, 1H), 8,33 (d, J=2,0 Гц, 1H), 8,24 (d, J=2,4 Гц, 1H), 7,76 (dd, J=8,5, 2,4 Гц, 2H), 7,00-6,98 (m, 1H), 6,92-6,90 (m, 2H), 6,86 (d, J=8,5 Гц, 1H), 5,41 (s, 2H), 5,21 (dd, J=8,3, 2,5 Гц, 1H), 4,37 (dd, J=11,6, 2,5 Гц, 1H), 4,14 (dd, J=11,6, 8,3 Гц, 1H), 3,85 (s, 3H), 2,16-2,06 (m, 1H), 1,05-0,96 (m, 2H), 0,83-0,75 (m, 2H) ppm; (M+1)=415.
Пример 1-10: синтез 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
К перемешанному раствору 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,23 г, 0,45 ммоль, пример 1-5-7) в 1,4-диоксане (3 мл) добавляли морфолин (0,062 г, 0,70 ммоль), метансульфонат [(2-дициклогексилфосфино-3,6-диметокси-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2′-амино-1,1′-бифенил)]палладия(II) (0,012 г, 0,013 ммоль), 2-дициклогексилфосфино-2',6'-ди-изо-пропокси-1,1'-бифенил (0,006 г, 0,013 ммоль) и трет-бутоксид натрия (62,38 мг, 629,64 мкмоль). Сосуд герметизировали и содержимое дегазировали под вакуумом/заполняли азотом (x 3). Затем смесь нагревали до 110°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (50 мл). Смесь экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы промывали солевым раствором (25 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,066 г (32%) 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,24 (d, J=2,5 Гц, 1H), 8,21-8,17 (m, 1H), 7,96 (s, 1H), 7,61 (d, J=2,5 Гц, 1H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 6,93-6,82 (m, 3H), 6,79 (d, J=8,6 Гц, 1H), 5,34 (s, 2H), 5,07 (dd, J=8,8, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,02 (dd, J=11,6, 8,8 Гц, 1H), 3,95 (s, 3H), 3,93-3,90 (m, 4H), 3,20-3,14 (m, 4H) ppm; (M+1)=460.
Пример 1-11: синтез 6-метокси-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,26 г, 0,52 ммоль, пример 1-5-7) в метаноле (3,0 мл) добавляли йодид меди(I) (0,010 г, 0,052 ммоль), 1,10-фенантролин (0,019 г, 0,10 ммоль) и карбонат цезия (0,34 г, 1,05 ммоль). Смесь нагревали до 110°C в герметизированном сосуде. Через 20 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли 5 н. раствором гидроксида аммония (50 мл) и дихлорметаном (50 мл). Фазы разделяли и водную фазу экстрагировали дихлорметаном (2×30 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,17 г белого твердого вещества (загрязненного 1,10-фенантролином). Материал растворяли в дихлорметане (30 мл) и промывали 1 н. раствором хлористоводородной кислоты (2×30 мл). Показатель pH объединенных водных фаз делали основным с помощью 1 н. раствора гидроксида натрия (~60 мл) и полученную в результате молочно-белую смесь экстрагировали диэтиловым эфиром (3×15 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением бесцветного масла. Материал повторно растворяли в диэтиловом эфире (15 мл) и обрабатывали ультразвуком для обеспечения осаждения. Твердые вещества отделяли путем фильтрации и высушивали с получением 0,090 г (43%) 6-метокси-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,6 Гц, 1H), 8,19 (d, J=2,4 Гц, 1H), 7,97 (s, 1H), 7,61-7,58 (m, 2H), 6,93-6,88 (m, 2H), 6,84 (dd, J=8,3, 2,2 Гц, 1H), 6,79 (d, J=8,6 Гц, 1H), 5,35 (s, 2H), 5,07 (dd, J=8,8, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,02 (dd, J=11,6, 8,8 Гц, 1H), 3,95 (s, 3H), 3,90 (s, 3H) ppm: (M+1)=405.
Пример 1-12: Синтез 4-(3-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-12-1: получение трет-бутил-(4-(бензилокси)-3-гидроксибензил)карбамата
Перемешанный раствор 3-гидрокси-4-бензилоксибензальдегида (4,05 г, 16,86 ммоль) и трет-бутилкарбамата (3,02 г, 25,29 ммоль) в ацетонитриле (100 мл) охлаждали до 0°C при добавлении триэтилсилана (5,94 г, 50,57 ммоль) и трифторуксусной кислоты (3,88 г, 33,71 ммоль). Для полученного в результате желтого раствора обеспечивали перемешивание при 0°C в течение 15 мин., а затем обеспечивали нагревание смеси до комнатной температуры. Через 3 ч. добавляли дополнительные порции трет-бутилкарбамата (1,00 г), триэтилсилана (5,94 г) и трифторуксусной кислоты (3,88 г) и обеспечивали перемешивание смеси при комнатной температуре. Через 20 ч. смесь концентрировали и остаток разбавляли насыщенным раствором бикарбоната натрия (150 мл). Смесь экстрагировали диэтиловым эфиром (3×75 мл). Объединенные органические фазы промывали 1 н. раствором гидроксида натрия (2×50 мл), 1 н. раствором хлористоводородной кислоты (2×50 мл) и солевым раствором (50 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold со 120 г силикагеля, элюент: 0-10% этилацетат/дихлорметан) получали белое твердое вещество. При помощи растирания данного материала с гептаном получали 2,25 г (41%) трет-бутил-4-(бензилокси)-3-гидроксибензилкарбамата в виде белого твердого вещества.
Пример 1-12-2: получение трет-бутил-(4-(бензилокси)-3-((1-(4-метоксифенил)-1-оксопропан-2-ил)окси)бензил)карбамата
К перемешанному раствору трет-бутил-4-(бензилокси)-3-гидроксибензилкарбамата (1,25 г, 3,79 ммоль) в ацетонитриле (40 мл) добавляли карбонат цезия (1,86 г, 5,69 ммоль) и 2-бром-1-(4-метоксифенил)пропан-1-он (0,97 г, 3,79 ммоль). Через 2 ч. смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 10-30% этилацетат/гептан) получали 1,35 г (72%) трет-бутил-4-(бензилокси)-3-((1-(4-метоксифенил)-1-оксопропан-2-ил)окси)бензилкарбамат в виде белого твердого вещества.
Пример 1-12-3: получение трет-бутил-(4-гидрокси-3-((1-гидрокси-1-(4-метоксифенил)пропан-2-ил)окси)бензил)карбамата
К перемешанному раствору трет-бутил-4-(бензилокси)-3-((1-(4-метоксифенил)-1-оксопропан-2-ил)окси)бензилкарбамата (1,35 г, 2,75 ммоль) в тетрагидрофуране (30 мл) добавляли 10% палладий на угле (влажный) (0,89 г, 0,84 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x3). После конечной откачки атмосферу заменяли водородом из баллона. Для реакционной смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. сосуд вакуумировали и атмосферу заменяли азотом. Смесь фильтровали через целит с помощью тетрагидрофурана (50 мл). Фильтрат разбавляли метанолом (10 мл) и желтый раствор обрабатывали борогидридом натрия (0,13 г, 3,43 ммоль) (отмечено выделение газа и умеренная экзотермия). Через 90 мин. смесь обрабатывали водой (2 мл) и концентрировали. Остаток растворяли в этилацетате (75 мл) и промывали насыщенным раствором бикарбоната натрия (75 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,18 г (>100%) трет-бутил-4-гидрокси-3-((1-гидрокси-1-(4-метоксифенил)пропан-2-ил)окси)бензилкарбамата в виде бесцветного масла.
Пример 1-12-4: получение трет-бутил-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата
К перемешанному раствору трет-бутил-4-гидрокси-3-((1-гидрокси-1-(4-метоксифенил)пропан-2-ил)окси)бензилкарбамата (1,11 г, 2,75 ммоль) и трифенилфосфина (0,98 г, 3,71 ммоль) в тетрагидрофуране (30 мл) добавляли раствор бис(2-метоксиэтил)азодикарбоксилата (0,90 г, 3,71 ммоль) в тетрагидрофуране (10 мл) на протяжении 3 мин. Полученный в результате желтый раствор нагревали до температуры возврата флегмы. Через 3 ч. обеспечивали охлаждение смеси до комнатной температуры и разбавляли этилацетатом (75 мл). Органическую фазу промывали водой (2×50 мл), 1 н. раствором хлористоводородной кислоты (50 мл), 1 н. раствором гидроксида натрия (50 мл) и солевым раствором (50 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 40 г силикагеля, элюент: 10-25% этилацетат/гептан) получали 0,50 г (47%) трет-бутил-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата в виде белого твердого вещества.
Пример 1-12-5: получение (2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
К перемешанному раствору трет-бутил-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата (0,50 г, 1,30 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (5,0 мл, 64,64 ммоль). Через 30 мин. раствор концентрировали и остаток растворяли в 5 н. растворе гидроксида аммония (20 мл). Основную смесь экстрагировали дихлорметаном (2×30 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,36 г (97%) (2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина в виде бесцветного масла.
Пример 1-12-6: получение 4-(3-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина, как описано в примерах от 1-5-5 до 1-5-8: 1H ЯМР (400 МГц, Хлороформ-d) δ 8,46 (d, J=1,9 Гц, 1H), 8,07 (d, J=1,9 Гц, 1H), 8,02 (s, 1H), 7,29-7,24 (m, 2H), 6,96-6,80 (m, 5H), 5,36 (s, 2H), 4,57 (d, J=8,0 Гц, 1H), 4,08 (dq, J=8,0, 6,4 Гц, 1H), 3,82 (s, 3H), 1,53 (s, 6H), 1,14 (d, J=6,4 Гц, 3H) ppm: (M+1)=469.
Пример 1-13: синтез 6-метокси-3-((2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-13-1: получение (2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе четырех стадий из 2-бром-1-(6-метоксипиридин-3-ил)пропан-1-она, как описано в примерах от 1-12-2 до 1-12-5.
Пример 1-13-2: получение 6-йод-3-((2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-5-5 до 1-5-7.
Пример 1-13-3: получение 6-метокси-3-((2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и метанола, как описано в примере 1-11: (~55:45 транс/цис) 1H ЯМР (400 МГц, Хлороформ-d) δ 8,23-8,20 (m, 1H), 8,16-8,12 (m, 1H), 8,00-7,96 (m, 1H), 7,60-7,57 (m, 1H), 7,57-7,53 (m, 1H), 6,93-6,72 (m, 4H), 5,35 (s, 2H), 5,12 (d, J=2,6 Гц, 1H, цис изомер), 4,60 (d, J=8,0 Гц, 1H, транс изомер), 4,51-4,43 (m, 1H, цис изомер), 4,13-4,04 (m, 1H, транс изомер), 3,99-3,88 (m, 9H), 1,17 (d, J=6,3 Гц, 3H, транс изомер), 1,12 (d, J=6,6 Гц, 3H, цис изомер) ppm; (M+1)=419.
Пример 1-14: Синтез 4-(3-((2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-14-1: получение 3-(2-(2,4-дихлорфенил)-2-оксоэтокси)-4-фторбензонитрила
К перемешанной и охлажденной (0°C) суспензии 4-фтор-3-гидроксибензонитрила (5,00 г, 36,47 ммоль) и карбоната калия (10,08 г, 72,93 ммоль) в N,N-диметилформамиде (80 мл) по каплям добавляли раствор 2-бром-1-(2,4-дихлорфенил)этанона (9,77 г, 36,47 ммоль) в N,N-диметилформамиде (10 мл) на протяжении 3 мин. Через 15 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 90 мин. смесь повторно охлаждали до 0°C при добавлении воды для обеспечения осаждения. Твердые вещества отделяли путем фильтрации, промывали водой, а затем гексанами и высушивали с получением 11,80 г (97%) 3-(2-(2,4-дихлорфенил)-2-оксоэтокси)-4-фторбензонитрила в виде бежевого твердого вещества.
Пример 1-14-2: получение 3-(2-(2,4-дихлорфенил)-2-гидроксиэтокси)-4-фторбензонитрила
Метанол (80 мл) охлаждали до 0°C при медленном добавлении борогидрида натрия (2,45 г, 64,76 ммоль). После завершения добавления смесь перемешивали в течение 15 мин. при 0°C перед медленным добавлением 3-(2-(2,4-дихлорфенил)-2-оксоэтокси)-4-фторбензонитрила (7,00 г, 21,60 ммоль). В конце добавления образовывался осадок, затем добавляли дополнительную порцию метанола (70 мл). Обеспечивали нагревание полученной в результате суспензии до комнатной температуры. Через 1 ч. смесь повторно охлаждали до 0°C перед добавлением 0,1 н. раствора хлористоводородной кислоты (20 мл). Смесь экстрагировали с использованием дихлорметана и объединенные органические фазы концентрировали. Неочищенное твердое вещество растирали с дихлорметаном, фильтровали, а затем промывали гексанами. При помощи второго растирания с дихлорметаном/промывания гексанами получали 5,90 г (84%) 3-(2-(2,4-дихлорфенил)-2-гидроксиэтокси)-4-фторбензонитрила в виде грязно-белого твердого вещества.
Пример 1-14-3: получение 2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила
Перемешанную суспензию карбоната калия (6,25 г, 45,22 ммоль) и 3-(2-(2,4-дихлорфенил)-2-гидроксиэтокси)-4-фторбензонитрила (5,90 г, 18,09 ммоль) в N,N-диметилформамиде (60 мл) нагревали до 80°C. Через 24 ч. обеспечивали охлаждение смеси до комнатной температуры при добавлении воды и этилацетата. Фазы разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенный материал растирали с метанолом и фильтровали с получением 2,75 г белого твердого вещества. Фильтрат концентрировали и остаток очищали (CombiFlash, колонка с силикагелем, элюент: 10-20% этилацетат/гептан) с получением дополнительных 0,73 г белого твердого вещества. Получали в общей сложности 3,48 г (63%) 2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила.
Пример 1-14-4: получение (2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
К перемешанному и охлажденному (0°C) раствору 2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила (3,48 г, 11,37 ммоль) в тетрагидрофуране (60 мл) добавляли 2,4 M раствор алюмогидрида лития в простом эфире (9,5 мл, 22,80 ммоль) посредством шприца. Обеспечивали перемешивание смеси при 0°C. Через 30 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 4 часа смесь повторно охлаждали до 0°C и разбавляли с помощью Et2O. Смесь гасили медленным добавлением воды (0,87 мл), 1 н. раствора гидроксида натрия (0,87 мл) и воды (2,6 мл). Смесь перемешивали при 0°C в течение 1 часа. Полученную в результате белую суспензию фильтровали через целит и осадок на фильтре промывали этилацетатом. Фильтрат концентрировали с получением 3,53 г (93%) (2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина в виде бесцветного масла, которое кристаллизовалось при отстаивании.
Пример 1-14-5: получение 4-(3-((2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-5-5 до 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,72 (s, 1H), 8,58 (s, 2H), 8,48 (d, J=1,8 Гц, 1H), 8,20 (d, J=1,9 Гц, 1H), 7,73 (d, J=1,6 Гц, 1H), 7,53 (d, J=2,0 Гц, 2H), 7,10-6,81 (m, 3H), 5,42 (q, J=2,6 Гц, 3H), 4,44 (dd, J=11,7, 2,4 Гц, 1H), 4,01 (dd, J=11,7, 8,2 Гц, 1H), 3,61-3,31 (m, 1H), 1,65 (s, 4H) ppm; (M+1)=493.
Пример 1-15: синтез 2,2,2-трифтор-N-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метил)ацетамида
Пример 1-15-1: получение 6-(гидроксиметил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила
Указанное в заголовке соединение получали из 6-формил-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила, как описано в примере 1-14-2.
Пример 1-15-2: получение 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила
К перемешанному раствору 6-(гидроксиметил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила (1,16 г, 6,06 ммоль) в толуоле (17 мл) добавляли 2-(трибутилфосфоранилиден)ацетонитрил (1,46 г, 6,06 ммоль). Смесь перемешивали при комнатной температуре. Через 10 мин. к смеси добавляли 6-бром-3H-имидазо[4,5-b]пиридин (1,00 г, 5,05 ммоль) и полученную в результате смесь нагревали до 90°C. Через 6 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 80% этилацетат/гексан) получали 0,82 г (44%) 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила в виде грязно-белой пены.
Пример 1-15-3: получение 6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила
Указанное в заголовке соединение получали из 6-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4.
Пример 1-15-4: (6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метанамин
Указанное в заголовке соединение получали из 6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-карбонитрила, как описано в примере 1-14-4.
Пример 1-15-5: получение 2,2,2-трифтор-N-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метил)ацетамида
К перемешанному и охлажденному (0°C) раствору (6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метанамина (0,030 г, 0,079 ммоль) в дихлорметане (2 мл) добавляли триэтиламин (0,022 мл, 0,15 ммоль), а затем трифторуксусный ангидрид (0,007 мл, 0,079 ммоль). Смесь перемешивали при 0°C. Через 15 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 1 ч. смесь разбавляли дихлорметаном (10 мл) и насыщенным раствором бикарбоната натрия. Фазы разделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 5% метанол/дихлорметан) получали 0,038 г (8%) 2,2,2-трифтор-N-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метил)ацетамида в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 9,67 (s, 1H), 8,63 (d, J=1,9 Гц, 1H), 8,53 (s, 1H), 8,30-8,17 (m, 2H), 7,96 (s, 1H), 7,00-6,77 (m, 3H), 5,36 (s, 2H), 4,38-4,20 (m, 2H), 3,94 (dd, J=11,6, 6,6 Гц, 1H), 3,87 (s, 3H), 3,45 (d, J=5,2 Гц, 2H) ppm; (M+1)=473.
Пример 1-16: синтез 6-(3-метоксиазетидин-1-ил)-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-5-7) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,19 (d, J=2,5 Гц, 1H), 7,91 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 7,15 (d, J=2,5 Гц, 1H), 6,95-6,76 (m, 4H), 5,31 (s, 2H), 5,07 (dd, J=8,8, 2,5 Гц, 1H), 4,43-4,35 (m, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,22-4,15 (m, 2H), 4,02 (dd, J=11,6, 8,8 Гц, 1H), 3,95 (s, 3H), 3,79-3,73 (m, 2H), 3,36 (s, 3H) ppm; (M+1)=460.
Пример 1-17: синтез 2-метил-4-(3-((2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе 8 стадий из 3-гидрокси-4-йодбензамида, 2-бром-1-(1-метил-1H-пиразол-4-ил)этан-1-она, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-5-1 до 1-5-8: 1H ЯМР (400 МГц, Хлороформ-d) δ 8,45 (d, J=1,8 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,01 (s, 1H), 7,52 (d, J=0,8 Гц, 1H), 7,44 (s, 1H), 6,90-6,78 (m, 3H), 5,35 (s, 2H), 5,14 (dd, J=7,9, 2,4 Гц, 1H), 4,32 (dd, J=11,4, 2,5 Гц, 1H), 4,09 (dd, J=11,4, 8,0 Гц, 1H), 3,90 (s, 3H), 1,53 (s, 6H); (M+H)=429.
Пример 1-18: синтез 4-(3-(1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-18-1: получение метил-4-(бензилокси)-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата
К перемешанному раствору метил-4-(бензилокси)-3-гидроксибензоата (3,37 г, 13,05 ммоль) в N,N-диметилформамиде (20 мл) добавляли карбонат калия (2,71 г, 19,57 ммоль) и 2-бром-1-(6-метоксипиридин-3-ил)этанон (3,00 г, 13,05 ммоль). Обеспечивали перемешивание реакционной смеси при комнатной температуре. Через 16 ч. смесь разбавляли этилацетатом и водой. Фазы разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-50% этилацетат/гептан) получали 3,81 г (72%) метил-4-(бензилокси)-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата в виде белого твердого вещества.
Пример 1-18-2: получение метил-4-(бензилокси)-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)бензоата
Указанное в заголовке соединение получали из метил-4-(бензилокси)-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата, как описано в примере 1-14-2.
Пример 1-18-3: получение метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)бензоата
К перемешанному раствору метил-4-(бензилокси)-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)бензоата (3,53 г, 8,62 ммоль) добавляли 10% палладий на угле (0,92 г, 0,86 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). После конечной откачки атмосферу заменяли водородом из баллона. Реакционную смесь нагревали до 65°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры, сосуд вакуумировали и атмосферу замещали азотом. Смесь фильтровали через целит и фильтрат концентрировали с получением 2,39 г (87%) метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)бензоата в виде белого твердого вещества.
Пример 1-18-4: получение метил-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата
Указанное в заголовке соединение получали из метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)бензоата, как описано в примере 1-12-4.
Пример 1-18-5: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоновой кислоты
К перемешанному раствору метил-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (1,69 г, 5,61 ммоль) в смеси 1:4 вода/метанол (25 мл) добавляли гидроксид лития (1,41 г, 56,10 ммоль). Обеспечивали перемешивание реакционной смеси при комнатной температуре. Через 16 ч. смесь концентрировали и остаток растворяли в воде. pH доводили до ~5 концентрированным раствором хлористоводородной кислоты с образованием в результате осадка. Смесь фильтровали и осадок на фильтре промывали водой и высушивали с получением 1,56 г (97%) 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоновой кислоты в виде белого твердого вещества.
Пример 1-18-6: получение N-метокси-2-(6-метоксипиридин-3-ил)-N-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида
К перемешанному раствору 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоновой кислоты (1,56 г, 5,43 ммоль) в N,N-диметилформамиде (15 мл) добавляли 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (4,26 г, 10,86 ммоль), N,O-диметилгидроксиламина гидрохлорид (1,08 г, 10,86 ммоль) и N,N-диизопропилэтиламин (3,86 мл, 21,70 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 5 мин. смесь разбавляли этилацетатом и водой. Фазы разделяли и водную фазу экстрагировали этилацетатом (3×50 мл). Объединенные органические фазы промывали водой (3×40 мл) и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,51 г (84%) в качестве необходимого материала N-метокси-2-(6-метоксипиридин-3-ил)-N-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида в виде бесцветного полутвердого вещества.
Пример 1-18-7: получение 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-она
К перемешанному и охлажденному (0°C) раствору N-метокси-2-(6-метоксипиридин-3-ил)-N-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксамида (1,51 г, 4,57 ммоль) в тетрагидрофуране (40 мл) добавляли 3,0 M бромид метилмагния в растворе простого эфира (3,0 мл, 9,00 ммоль). Смесь перемешивали при 0°C. Через 30 мин. смесь гасили водой и разбавляли этилацетатом. Фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,16 г (87%) 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-она в виде белого твердого вещества.
Пример 1-18-8: получение (E/Z)-1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-она оксима
К перемешанному раствору 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона (1,16 г, 4,07 ммоль) в метаноле (10 мл) добавляли ацетат натрия (1,67 г, 20,33 ммоль) и гидроксиламина гидрохлорид (0,30 г, 4,97 ммоль). Смесь нагревали до 60°C. Через 2 ч. обеспечивали охлаждение раствора до комнатной температуры и концентрировали. Остаток разбавляли водой с образованием в результате осадка. Твердые вещества отделяли путем фильтрации и осадок на фильтре высушивали с получением 1,16 г (95%) (E/Z)-1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-она оксима в виде белого твердого вещества.
Пример 1-18-9: получение 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-амина
К перемешанному раствору (E/Z)-1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона оксима (1,16 г, 3,86 ммоль) в ледяной уксусной кислоте (20 мл) добавляли порошок цинка (3,03 г, 46,4 ммоль). Реакционную смесь нагревали до 40°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и разбавляли этилацетатом и водой. Фазы разделяли (органическую фазу удаляли) и водную фазу нейтрализовали 1 н. раствором гидроксида натрия. Нейтральную водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,29 г (26%) 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-амина в виде коричневого масла.
Пример 1-18-10: получение 4-(3-(1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из 1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-амина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина как описано в примерах от 1-5-5 до 1-5-8: 1H ЯМР (400 МГц, Хлороформ-d) δ 8,43 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,08-8,02 (m, 2H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 6,96-6,83 (m, 3H), 6,79 (d, J=8,6 Гц, 1H), 5,97 (q, J=7,1 Гц, 1H), 5,08 (dt, J=8,8, 2,0 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,03 (ddd, J=11,6, 8,8, 0,9 Гц, 1H), 3,95 (s, 3H), 1,96 (d, J=7,1 Гц, 3H), 1,53 (s, 6H), 1,33-1,17 (m, 2H), 0,92-0,84 (m, 1H); (M+H)=470.
Пример 1-19: Синтез 3-((2-(4-(дифторметокси)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-19-1: получение 2-(бензилокси)-4-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола
Указанное в заголовке соединение получали в ходе трех стадий из 5-(аминометил)-2-(бензилокси)фенола и 2-хлор-3-нитропиридина, как описано в примерах от 1-2-1 до 1-2-3.
Пример 1-19-2: получение 2-(2-(бензилокси)-4-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(4-(дифторметокси)фенил)этан-1-она
Указанное в заголовке соединение получали из 2-(бензилокси)-4-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола и 2-бром-1-(4-(дифторметокси)фенил)этан-1-она, как описано в примере 1-1-1.
Пример 1-19-3: получение 2-(4-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)фенокси)-1-(4-(дифторметокси)фенил)этан-1-ола
К перемешанному раствору 2-(2-(бензилокси)-5-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(4-(дифторметокси)фенил)этанона (0,45 г, 0,70 ммоль) в тетрагидрофуране (15 мл) по каплям добавляли 2,0 M раствор алюмогидрида лития в тетрагидрофуране (0,44 мл, 0,88 ммоль). Через 25 мин. смесь разбавляли простым эфиром (50 мл) и гасили путем добавления 5 капель воды и 3 капель 50% раствора гидроксида натрия. Смесь перемешивали при комнатной температуре в течение 15 мин., а затем высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,37 г (>100%) 2-(4-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)фенокси)-1-(4-(дифторметокси)фенил)этан-1-ола в виде оранжевого масла.
Пример 1-19-4: получение 3-((2-(4-(дифторметокси)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 2-(4-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)фенокси)-1-(4-(дифторметокси)фенил)этан-1-ола (0,32 г, 0,62 ммоль) в уксусной кислоте (5 мл) добавляли 37 вес. % раствор хлористоводородной кислоты (5 мл). Полученную в результате смесь нагревали до 70°C. Через 20 мин. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой. Смесь доводили до pH ~6 путем добавления 2 н. раствора гидроксида натрия, затем ее экстрагировали этилацетатом. Органическую фазу разделяли и промывали водой и солевым раствором. Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением неочищенной смеси, которая содержала Указанное в заголовке соединение и нециклизированные промежуточные соединения. Неочищенную смесь растворяли в 1,4-диоксане (25 мл) и обрабатывали связанным смолой трифенилфосфином (0,43 г, 1,30 ммоль), N,N-диизопропилэтиламином (1,0 мл, 5,85 ммоль) и тетрахлоридом углерода (0,30 мл, 3,11 ммоль). Смесь нагревали до 120°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали с помощью дихлорметана. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали частично очищенный продукт, который дополнительно подвергали очистке с помощью HPLC с получением 0,006 г (2%) 3-((2-(4-(дифторметокси)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде масла: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (dd, J=4,8, 1,3 Гц, 1H), 8,15-8,03 (m, 2H), 7,41 (d, J=8,6 Гц, 2H), 7,32-7,23 (m, 1H), 7,21-7,13 (m, 2H), 6,98-6,82 (m, 3H), 6,52 (t, J=73,6 Гц, 1H), 5,41 (s, 2H), 5,10 (dd, J=8,8, 2,4 Гц, 1H), 4,32 (dd, J=11,6, 2,4 Гц, 1H), 3,98 (dd, J=11,6, 8,8 Гц, 1H)ppm; (M+1)=410.
Пример 1-20: синтез 6-(1,3-диметил-1H-пиразол-4-ил)-3-((2-(2-фтор-4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-20-1: получение 2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола
Указанное в заголовке соединение получали из 2-(бензилокси)-4-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-19-1) и 1,3-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4.
Пример 1-20-2: получение 2-(2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(2-фтор-4-метоксифенил)этан-1-она
Указанное в заголовке соединение получали из 2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола и 2-бром-1-(2-фтор-4-метоксифенил)этан-1-она, как описано в примере 1-1-1.
Пример 1-20-3: получение 2-(2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(2-фтор-4-метоксифенил)этан-1-ола
Указанное в заголовке соединение получали из 2-(2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(2-фтор-4-метоксифенил)этан-1-она, как описано в примере 1-5-2.
Пример 1-20-4: получение 6-(1,3-диметил-1H-пиразол-4-ил)-3-((2-(2-фтор-4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 2-(2-(бензилокси)-4-((6-(1,3-диметил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенокси)-1-(2-фтор-4-метоксифенил)этан-1-ола (0,14 г, 0,24 ммоль) в метаноле (4 мл) медленно добавляли 48% водный раствор бромистоводородной кислоты (8 мл). Реакционную смесь нагревали до 50°C. Через 25 мин. смесь разбавляли (50 мл) и дихлорметаном (50 мл). Двухфазную смесь нейтрализовали путем добавления твердого бикарбоната натрия (полученный в результате pH ~7-8). Органическую фазу отделяли. Водную фазу экстрагировали хлороформом. Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,055 г (47%) 6-(1,3-диметил-1H-пиразол-4-ил)-3-((2-(2-фтор-4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,9 Гц, 1H), 8,09-8,02 (m, 2H), 7,47 (s, 1H), 7,37-7,33 (m, 1H), 6,98-6,91 (m, 2H), 6,87 (dd, J=8,3, 2,1 Гц, 1H), 6,78-6,70 (m, 1H), 6,67-6,63 (m, 1H), 5,39 (s, 2H), 5,35 (dd, J=8,7, 2,4 Гц, 1H), 4,35 (dd, J=11,4, 2,4 Гц, 1H), 4,00 (dd, J=11,4, 8,7 Гц, 1H), 3,91 (s, 3H), 3,80 (s, 3H), 2,41 (s, 3H) ppm; (M+1)=486.
Пример 1-21: синтез 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Пример 1-21-1: получение 5-бром-2-((4-метоксибензил)окси)фенола
К перемешанному раствору 5-бром-2-((4-метоксибензил)окси)бензальдегида (1,00 г, 3,11 ммоль) в дихлорметане (30 мл) добавляли 3-хлорпероксибензойную кислоту (1,40 г, 6,23 ммоль). Через 16 ч. смесь разделяли между дихлорметаном и насыщенным раствором метабисульфита натрия. Фазы разделяли и органическую фазу промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт растворяли в метаноле (20 мл) и добавляли 1 M раствор гидроксида натрия (1 мл). Смесь сразу становилась желтой. Через 30 мин. реакционную смесь разделяли между водой и этилацетатом. Добавляли 1 M раствор хлористоводородной кислоты (2 мл) и фазы разделяли. Органическую фазу промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и получали 0,94 г (98%) 5-бром-2-((4-метоксибензил)окси)фенола в виде желтой жидкости.
Пример 1-21-2: получение 2-(5-бром-2-((4-метоксибензил)окси)фенокси)-1-(6-метоксипиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 5-бром-2-((4-метоксибензил)окси)фенола, как описано в примере 1-18-1.
Пример 1-21-3: получение 2-(5-бром-2-гидроксифенокси)-1-(6-метоксипиридин-3-ил)этан-1-она
К перемешанному раствору 2-(5-бром-2-((4-метоксибензил)окси)фенокси)-1-(6-метоксипиридин-3-ил)этанона (1,00 г, 2,18 ммоль) в дихлорметане (10 мл) добавляли трифторуксусную кислоту (5 мл). Для смеси обеспечивали перемешивание при комнатной температуре. Через 30 мин. реакционную смесь концентрировали и остаток разделяли между дихлорметаном и насыщенным раствором бикарбоната натрия. Фазы разделяли и органическую фазу промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-50% этилацетат/дихлорметан) получали 0,68 г (91%) 2-(5-бром-2-гидроксифенокси)-1-(6-метоксипиридин-3-ил)этанона в виде светло-желтой смолы.
Пример 1-21-4: получение 5-(6-бром-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
Указанное в заголовке соединение получали в ходе двух стадий из 2-(5-бром-2-гидроксифенокси)-1-(6-метоксипиридин-3-ил)этанона с использованием подобных процедур для соединений, описанных в примере 1-14-2 (восстановление кетона) и примере 1-12-4 (циклизация).
Пример 1-21-5: получение (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты
К перемешанному и охлажденному (-78°C) раствору 5-(6-бром-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (100,0 мг, 310,4 мкмоль) в тетрагидрофуране (5 мл) добавляли 2,5 M раствор н-бутиллития в гексане (0,19 мл, 0,47 ммоль). Обеспечивали перемешивание полученной в результате смеси при -78°C. Через 5 мин. добавляли триизопропилборат (0,22 мл, 0,93 ммоль). Обеспечивали медленное нагревание смеси до комнатной температуры. Через 30 мин. добавляли воду и смесь дополнительно разбавляли этилацетатом. Две фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-20% метанол/этилацетат) получали 0,053 г (60%) (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты в виде белого твердого вещества.
Пример 1-21-6: получение 6-бромпиразоло[1,5-a]пиримидин-3-карбальдегида
К перемешанному и охлажденному (0°C) раствору 6-бромпиразоло[1,5-a]пиримидина (9,00 г, 43,13 ммоль) в N,N-диметилформамиде (90 мл) по каплям добавляли оксихлорид фосфора (20,06 г, 129,53 ммоль) в течение периода 3 мин. Через 30 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 16 ч. смесь гасили медленным добавлением насыщенного раствора карбоната натрия. Полученную в результате основную смесь экстрагировали дихлорметаном (x3). Объединенные органические фазы промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Остаток суспендировали в дихлорметане и гептане и твердый материал собирали путем фильтрации и высушивали с получением 7,10 г (73%) 6-бромпиразоло[1,5-a]пиримидин-3-карбальдегида в виде желтого твердого вещества.
Пример 1-21-7: получение (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида
К перемешанному раствору 6-бромпиразоло[1,5-a]пиримидин-3-карбальдегида (7,10 г, 31,6 ммоль) в 1,4-диоксане (200 мл) добавляли 4-метилбензолсульфонилгидразид (6,10 г, 31,6 ммоль). Полученную в результате смесь нагревали до 100°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток суспендировали в этилацетате/гексанах и твердые вещества отделяли путем фильтрации и высушивали с получением 12,50 г (99%) (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида в виде оранжевого твердого вещества.
Пример 1-21-8: получение 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
К перемешанному раствору (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты (0,050 г, 0,17 ммоль) в 1,4-диоксане (10 мл) добавляли N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразид (0,069 мг, 0,17 ммоль) и карбонат калия (0,048 г, 0,34 ммоль). Полученную в результате смесь нагревали до 100°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-50% этилацетат/гексаны) получали 0,028 г (36%) 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина в виде бежевого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,76 (d, J=2,2 Гц, 1H), 8,43 (d, J=2,2 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,92 (s, 1H), 7,61 (ddd, J=8,7, 6,4, 2,5 Гц, 1H), 6,90-6,75 (m, 4H), 5,05 (td, J=9,2, 2,4 Гц, 1H), 4,29 (dt, J=11,5, 2,8 Гц, 1H), 4,10-3,92 (m, 6H) ppm; (M+1)=453.
Пример 1-22: синтез 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиридина
Пример 1-22-1: получение (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(пиразоло[1,5-a]пиридин-3-ил)метанола
К перемешанному и охлажденному (-78°C) раствору 5-(6-бром-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (0,21 г, 0,66 ммоль, пример 1-21-4) в тетрагидрофуране (3 мл) добавляли 2,5 M раствор н-бутиллития в гексане (0,29 мл, 0,73 ммоль). Через 5 мин. добавляли пиразоло[1,5-a]пиридин-3-карбальдегид (0,097 г, 0,66 ммоль) в тетрагидрофуране (1 мл). Через 30 мин. смесь гасили путем добавления насыщенного раствора хлорида аммония и обеспечивали нагревание смеси до комнатной температуры. Смесь разделяли между водой и этилацетатом. Две фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: этилацетат/дихлорметан) получали 0,068 г (26%) (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(пиразоло[1,5-a]пиридин-3-ил)метанола в виде бежевого твердого вещества.
Пример 1-22-2: получение 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиридина
К перемешанному раствору (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(пиразоло[1,5-a]пиридин-3-ил)метанола (0,065 г, 0,17 ммоль) в трифторуксусной кислоте (3 мл) добавляли триэтилсилан (0,082 мл, 0,50 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 30 мин. смесь разделяли между дихлорметаном и насыщенным раствором бикарбоната натрия. Дополнительное количество твердого бикарбоната натрия добавляли до нейтрализации смеси. Фазы разделяли и органическую фазу промывали насыщенным раствором бикарбоната натрия, водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-50% этилацетат/дихлорметан) получали 0,047 г (76%) 3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиридина в виде бесцветной клейкой смолы: 1H ЯМР (400 МГц, CDCl3) δ 8,42 (dt, J=7,0, 1,1 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,80 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,36 (dt, J=8,9, 1,3 Гц, 1H), 7,02 (ddd, J=8,9, 6,6, 1,1 Гц, 1H), 6,87 (d, J=8,2 Гц, 1H), 6,82-6,66 (m, 4H), 5,07 (dd, J=8,8, 2,4 Гц, 1H), 4,28 (dd, J=11,5, 2,4 Гц, 1H), 4,07-3,96 (m, 3H), 3,95 (s, 3H) ppm; (M+1)=374.
Пример 1-23: синтез 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Пример 1-23-1: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
К перемешанному и охлажденному (-78°C) раствору 5-(6-бром-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (0,13 г, 0,40 ммоль) в тетрагидрофуране (5 мл) добавляли 2,7 M раствор н-бутиллития в гексане (0,30 мл, 0,81 ммоль). Обеспечивали перемешивание полученной в результате смеси при -78°C. Через 15 мин. добавляли N,N-диметилформамид (0,094 мл, 1,21 ммоль) и обеспечивали перемешивание смеси при -78°C. Через 30 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 30 мин. смесь гасили путем добавления насыщенного раствора хлорида аммония (5 мл). Смесь экстрагировали диэтиловым эфиром/этилацетатом (1:1, 2×50 мл) и объединенные органические фазы промывали солевым раствором (10 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,10 г (91%) 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида в виде масла.
Пример 1-23-2: получение 3-бром-7-хлоримидазо[1,2-b]пиридазина
К перемешанному и охлажденному (0°C) раствору 7-хлоримидазо[1,2-b]пиридазина (7,30 г, 47,54 ммоль) в N,N-диметилформамиде (100 мл) добавляли N-бромсукцинимид (8,55 г, 47,54 ммоль). Обеспечивали перемешивание смеси при 0°C. Через 1 ч. обеспечивали нагревание смеси до комнатной температуры. Через 30 мин. смесь разбавляли водой и этилацетатом. Фазы разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с силикагелем, элюент: 5-40% этилацетат/дихлорметан) получали 5,32 г (48%) 3-бром-7-хлоримидазо[1,2-b]пиридазина в виде светло-желтого твердого вещества.
Пример 1-23-3: получение (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
К перемешанному раствору 3-бром-7-хлоримидазо[1,2-b]пиридазина (0,11 г, 0,46 ммоль) в тетрагидрофуране (3 мл) добавляли 3 M раствор бромида этилмагния в простом эфире (0,18 мл, 0,55 ммоль). При добавлении наблюдали умеренную экзотермию и обеспечивали перемешивание полученной в результате темной суспензии при комнатной температуре. Через 15 мин. к реакционной смеси посредством канюли добавляли раствор 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (0,10 г, 0,37 ммоль, пример 1-23-1) в тетрагидрофуране (2 мл). Через 80 мин. смесь нагревали до ~50°C. Через 15 мин. обеспечивали охлаждение смеси до комнатной температуры и ее гасили путем добавления насыщенного раствора хлорида аммония (0,020 мл). Смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,025 г (16%) (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола в виде масла.
Пример 1-23-4: получение 7-хлор-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали из (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола, как описано в примере 1-22-2.
Пример 1-23-5: получение 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Суспензию 7-хлор-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (0,020 г, 0,049 ммоль) и карбоната цезия (0,048 г, 0,15 ммоль) в ацетонитриле (5 мл) дегазировали в атмосфере азота в течение 2 мин. Смесь обрабатывали хлоридом бис(ацетонитрил)палладия(II) (0,002 г, 0,007 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенилом (0,007 г, 0,015 ммоль) и 2-метилбут-3-ин-2-амином (0,041 г, 0,49 ммоль). Смесь снова дегазировали в атмосфере азота в течение 2 мин. Затем смесь нагревали до 105°C в герметизированном сосуде. Через 45 мин. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,011 г (49%) 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина в виде твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,26 (d, J=2,0 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 7,89 (d, J=2,0 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,57 (s, 1H), 6,91-6,84 (m, 2H), 6,84-6,76 (m, 2H), 5,07 (dd, J=8,8, 2,4 Гц, 1H), 4,29 (dd, J=11,5, 2,4 Гц, 1H), 4,25 (s, 2H), 4,03 (dd, J=11,5, 8,8 Гц, 1H), 3,95 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=456.
Пример 1-24: синтез N-этил-4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида
Пример 1-24-1: получение 4-(хлорметил)-N-этилпиколинамида гидрохлорида
К перемешанному раствору N-этил-4-(гидроксиметил)пиколинамида (0,20 г, 1,11 ммоль) в дихлорметане (3 мл) добавляли тионилхлорид (0,24 мл, 3,33 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 3 ч. смесь концентрировали и остаток суспендировали в диэтиловом эфире (20 мл)/1 M хлористоводородная кислота в диэтиловом эфире (1 мл). Через 1 ч. смесь концентрировали с получением 0,25 г (96%) 4-(хлорметил)-N-этилпиколинамида гидрохлорида в виде белого твердого вещества.
Пример 1-24-2: получение 2-метокси-5-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридина
К перемешанному раствору 5-(6-бром-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (0,29 г, 0,90 ммоль, пример 1-21-4) в 1,4-диоксане (5 мл) добавляли дихлорметановый аддукт хлорида [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) (0,10 г, 0,13 ммоль), бис(пинаколато)дибор (0,47 г, 1,82 ммоль) и ацетат калия (0,29 г, 2,93 ммоль). Смесь продували азотом, сосуд герметизировали и смесь нагревали до 100°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и разбавляли этилацетатом. Смесь фильтровали через небольшой слой из силикагеля и фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-25% этилацетат/гептан) получали 0,38 г (>100%) 2-метокси-5-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридина в виде белого твердого вещества (загрязненного пинаколбораном).
Пример 1-24-3: получение N-этил-4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида
К смеси 4-(хлорметил)-N-этилпиколинамида гидрохлорида (0,13 г, 0,53 ммоль), предкатализатора XPhos 2го поколения (0,035 г, 0,044 ммоль) и трехосновного фосфата калия (0,39 г, 1,76 ммоль) добавляли раствор 2-метокси-5-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридина (0,27 г, 0,44 ммоль) в тетрагидрофуране (2 мл) и воде (2 мл). Сосуд герметизировали и смесь нагревали до 80°C. Через 17 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом (3 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2×3 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-30% этилацетат/гептан) получали загрязненное масло. Данный материал дополнительно очищали посредством HPLC с обращенной фазой (10-90% ацетонитрил/0,1% трифторуксусной кислоты в воде) с получением 0,025 г (14%) N-этил-4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида в виде клейкого бесцветного твердого вещества. 1HЯМР (400 MГц, CDCl3) δ 8,42 (dd, J=4,9, 0,8 Гц, 1H), 8,21 (d, J=2,5 Гц, 1H), 8,05 (dd, J=1,8, 0,9 Гц, 1H), 8,00 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,22 (dd, J=5,0, 1,8 Гц, 1H), 6,88 (d, J=8,2 Гц, 1H), 6,83-6,76 (m, 2H) 6,69 (dd, J=8,2, 2,1 Гц, 1H), 5,08 (dd, J=8,8, 2,5 Гц, 1H), 4,30 (dd, J=11,5, 2,5 Гц, 1H), 4,03 (dd, J=11,5, 8,8 Гц, 1H), 3,95 (s, 3H), 3,94 (s, 2H), 3,50 (qd, J=7,3, 5,9 Гц, 2H), 1,26 (t, J=7,3 Гц, 3H) ppm; (M+1)=406.
Пример 1-25: Синтез 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида
Пример 1-25-1: получение 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинонитрила
Указанное в заголовке соединение получали из 4-(хлорметил)пиколинонитрила и 2-метокси-5-(6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридина (пример 1-24-2), как описано в примере 1-24-3.
Пример 1-25-2: получение 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида
К перемешанному раствору 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинонитрила (0,030 г, 0,083 ммоль) и (E/Z)-ацетальдегида оксима (0,050 г, 0,85 ммоль) в толуоле (3 мл) добавляли хлортрис(трифенилфосфин)родий(I) (0,015 г, 0,016 ммоль). Смесь нагревали до 100°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 4 г силикагеля, элюент: 0-100% этилацетат/гептан) получали 0,024 г (76%) 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида в виде белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,51 (dd, J=5,0, 0,7 Гц, 1H), 8,27 (d, J=2,4 Гц, 1H), 8,14-8,02 (m, 1H), 7,86 (dd, J=1,7, 0,8 Гц, 1H), 7,79 (dd, J=8,6, 2,5 Гц, 1H), 7,65-7,58 (m, 1H), 7,46 (dd, J=5,0, 1,7 Гц, 1H), 6,93-6,83 (m, 3H), 6,77 (dd, J=8,3, 2,1 Гц, 1H), 5,22 (dd, J=8,5, 2,4 Гц, 1H), 4,38 (dd, J=11,5, 2,5 Гц, 1H), 4,16 (dd, J=11,5, 8,5 Гц, 1H), 3,97 (s, 2H), 3,86 (s, 3H) ppm; (M+1)=378.
Пример 1-26: синтез 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метилпиколинамида
К перемешанному раствору 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинонитрила (0,050 г, 0,14 ммоль, пример 1-25-1) в 1,4-диоксане (2 мл) добавляли триметилсиланоат калия (0,040 г, 0,28 ммоль). Полученную в результате смесь нагревали до 80°C. Через 3 ч. смесь обрабатывали йодметаном (0,18 мл, 0,35 ммоль) и обеспечивали перемешивание смеси при 80°C. Через 75 мин. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой. Смесь экстрагировали этилацетатом (3×2 мл). Объединенные органические фазы концентрировали.
При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 4 г силикагеля, элюент: 0-100% этилацетат/гептан) получали неочищенное масло. При помощи дополнительной очистки посредством HPLC с обращенной фазой (элюент: вода/ацетонитрил 10-90%, 15 мл/мин.) с последующим образованием соли с 1,0 M хлороводорода в диэтиловом эфире получали 0,028 г (47%) 4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метилпиколинамида в виде светло-желтого твердого вещества:
1H ЯМР (400 МГц, DMSO-d6) δ 8,96-8,66 (m, 1H), 8,52 (d, J=4,3 Гц, 1H), 8,26 (s, 1H), 7,91 (s, 1H), 7,79 (d, J=7,9 Гц, 1H), 7,56-7,42 (m, 1H), 6,87 (m, 3H), 6,77 (d, J=7,7 Гц, 1H), 5,21 (d, J=7,6 Гц, 1H), 4,37 (d, J=11,1 Гц, 1H), 4,15 (t, J=9,6 Гц, 1H), 3,98 (s, 2H), 3,85 (s, 3H), 2,80 (d, J=4,2 Гц, 3H) ppm; (M+1)=392.
Пример 1-27: синтез 2-(1-метил-1H-пиразол-4-ил)-4-((2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридина 2,2,2-трифторацетата
Пример 1-27-1: получение 2-(2,5-дибромфенокси)-1-(4-(трифторметил)фенил)этан-1-ола
Указанное в заголовке соединение получали в ходе двух стадий из 2,5-дибромфенола и 2-бром-1-(4-(трифторметил)фенил)этанона, как описано в примере 1-1-1 (алкилирование) и примере 1-1-2 (восстановление кетона).
Пример 1-27-2: получение 6-бром-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксина
К перемешанному раствору 2-(2,5-дибромфенокси)-1-(4-(трифторметил)фенил)этанола (4,17 г, 9,48 ммоль) в дегазированном толуоле (100 мл) добавляли йодид меди(I) (0,54 г, 2,84 ммоль), карбонат цезия (3,40 г, 10,42 ммоль) и N,N'-диметилэтилендиамин (0,52 мл, 4,74 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 20 ч. к смеси добавляли дополнительные порции йодида меди(I) и N,N'-диметилэтилендиамина. Через 48 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток разделяли между 1 M раствором бисульфата калия (100 мл) и этилацетатом (100 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2×100 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 0-10% этилацетат/гептан) получали 1,57 г (46%) 6-бром-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксина в виде белого твердого вещества.
Пример 1-27-3: получение 4,4,5,5-тетраметил-2-(2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-1,3,2-диоксаборолана
Указанное в заголовке соединение получали из 6-бром-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксина, как описано в примере 1-24-2.
Пример 1-27-4: получение метил-2-(1-метил-1H-пиразол-4-ил)изоникотината
К перемешанному раствору метил-2-хлоризоникотината (1,26 г, 7,12 ммоль) в тетрагидрофуране (20 мл) и воде (15 мл) добавляли 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (1,72 г, 7,84 ммоль), предкатализатор XPhos 2го поколения (0,11 г, 0,14 ммоль) и трехосновный фосфат калия (4,63 г, 21,37 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3), а затем обеспечивали ее перемешивание при комнатной температуре. Через 1 ч. желтый раствор разбавляли водой (75 мл). Смесь экстрагировали этилацетатом (3×75 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 1-5% метанол/дихлорметан) получали 1,28 г (83%) метил-2-(1-метил-1H-пиразол-4-ил)изоникотината в виде белого твердого вещества.
Пример 1-27-5: получение (2-(1-метил-1H-пиразол-4-ил)пиридин-4-ил)метанола
К перемешанному и охлажденному (0°C) раствору метил-2-(1-метил-1H-пиразол-4-ил)изоникотината (1,28 г, 5,89 ммоль) в тетрагидрофуране (40 мл) добавляли алюмогидрид лития (0,23 г, 6,19 ммоль) (отмечали выделение газа). Обеспечивали перемешивание полученной в результате смеси при 0°C. Через 30 мин. реакционную смесь обрабатывали водой (0,25 мл), 1 н. раствором гидроксида натрия (0,25 мл) и водой (0,75 мл). Обеспечивали перемешивание полученной в результате смеси при комнатной температуре в течение 15 мин. Смесь затем обрабатывали сульфатом магния и фильтровали через целит с помощью этилацетата (100 мл). Фильтрат концентрировали с получением 1,01 г (91%) (2-(1-метил-1H-пиразол-4-ил)пиридин-4-ил)метанола в виде бесцветного масла.
Пример 1-27-6: получение 4-(хлорметил)-2-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида
К перемешанному раствору (2-(1-метил-1H-пиразол-4-ил)пиридин-4-ил)метанола (0,19 г, 0,98 ммоль) в дихлорметане (10 мл) добавляли тионилхлорид (0,50 мл, 6,85 ммоль), с образованием в результате молочно-белой суспензии. Через 2,5 ч. смесь концентрировали с получением 0,25 г (>100%) 4-(хлорметил)-2-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида в виде светло-желтого твердого вещества.
Пример 1-27-7: получение 2-(1-метил-1H-пиразол-4-ил)-4-((2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридина 2,2,2-трифторацетата
Указанное в заголовке соединение получали из 4,4,5,5-тетраметил-2-(2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-1,3,2-диоксаборолана (пример 1-27-3) и 4-(хлорметил)-2-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида (пример 1-27-6), как описано в примере 1-24-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,50 (d, J=5,6 Гц, 1H), 8,45 (s, 1H), 8,14 (s, 1H), 7,92 (s, 1H), 7,80 (d, J=8,2 Гц, 2H), 7,70 (d, J=8,2 Гц, 2H), 7,40-7,28 (m, 1H), 7,01-6,91 (m, 2H), 6,86 (dd, J=8,2, 2,1 Гц, 1H), 5,38 (dd, J=7,9, 2,4 Гц, 1H), 4,47 (dd, J=11,6, 2,4 Гц, 1H), 4,10 (dd, J=11,6, 7,9 Гц, 1H), 3,99 (s, 2H), 3,92 (s, 3H) ppm; (M+1)=452.
Пример 1-28: синтез 5-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиримидин-2,4-диамина
Пример 1-28-1: получение 4-йод-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензальдегида
Указанное в заголовке соединение получали из 3-гидрокси-4-йодбензальдегида и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примере 1-1-1.
Пример 1-28-2: получение 2-(5-(5,5-диметил-1,3-диоксан-2-ил)-2-йодфенокси)-1-(6-метоксипиридин-3-ил)этан-1-она
К перемешанному раствору 4-йод-3-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензальдегида (0,50 г, 1,26 ммоль) и 2,2-диметилпропан-1,3-диола (0,15 г, 1,38 ммоль) в толуоле (10 мл) добавляли Amberlyst-15 (0,050 г). Полученную в результате смесь нагревали до 110°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и промывали солевым раствором (3×10 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением 0,61 г (99%) 2-(5-(5,5-диметил-1,3-диоксан-2-ил)-2-йодфенокси)-1-(6-метоксипиридин-3-ил)этан-1-она в виде бесцветного масла.
Пример 1-28-3: получение 2-(5-(5,5-диметил-1,3-диоксан-2-ил)-2-йодфенокси)-1-(6-метоксипиридин-3-ил)этан-1-ола
Указанное в заголовке соединение получали из 2-(5-(5,5-диметил-1,3-диоксан-2-ил)-2-йодфенокси)-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примере 1-1-2.
Пример 1-28-4: получение 5-(6-(5,5-диметил-1,3-диоксан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
К перемешанной суспензии 2-(5-(5,5-диметил-1,3-диоксан-2-ил)-2-йодфенокси)-1-(6-метоксипиридин-3-ил)этан-1-ола (0,44 г, 0,91 ммоль), [1,1'-бинафталин]-2,2'-диола (0,060 г, 0,20 ммоль) и карбоната цезия (0,65 г, 2,00 ммоль) в ацетонитриле (10 мл) добавляли йодид меди(I) (0,040 г, 0,20 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3), а затем ее нагревали до 110°C. Через 12 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 25% этилацетат/петролейный эфир) получали 0,16 г (49%) 5-(6-(5,5-диметил-1,3-диоксан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина в виде белого твердого вещества.
Пример 1-28-5: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
К перемешанному раствору 5-(6-(5,5-диметил-1,3-диоксан-2-ил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (0,16 г, 0,45 ммоль) в дихлорметане (4 мл) добавляли трифторуксусную кислоту (0,4 мл). Через 3 ч. смесь разбавляли дихлорметаном и нейтрализовали насыщенным раствором бикарбоната натрия (pH=7~8). Фазы разделяли и органическую фазу экстрагировали дихлорметаном (3×15 мл). Объединенные органические фазы промывали солевым раствором (15 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 25% этилацетат/петролейный эфир) получали 0,12 г (90%) 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида в виде светло-желтого твердого вещества.
Пример 1-28-6: получение (E/Z)-2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-(фениламино)акрилонитрила
К перемешанному раствору 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (0,17 г, 0,62 ммоль) и 3-(фениламино)пропаннитрила (0,10 г, 0,69 ммоль) в диметилсульфоксиде добавляли метоксид натрия (0,038 г, 0,69 ммоль). Смесь нагревали до 95°C. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и разбавляли водой (20 мл). Смесь экстрагировали дихлорметаном (3×60 мл). Объединенные органические фазы промывали солевым раствором (2×50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 50% этилацетат/петролейный эфир) получали 0,10 г (40%) (E/Z)-2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-(фениламино)акрилонитрила в виде желтого твердого вещества.
Пример 1-28-7: получение 5-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиримидин-2,4-диамина
К перемешанному раствору гуанидина гидрохлорида (0,064 г, 0,67 ммоль) в этаноле (2 мл) добавляли трет-бутоксид калия (0,081 г, 0,72 ммоль). Через 30 мин. добавляли (E/Z)-2-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-(фениламино)акрилонитрил (0,080 г, 0,20 ммоль) и полученную в результате смесь нагревали до 70°C. Через 48 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток растворяли в дихлорметане (20 мл) и промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи очистки неочищенного продукта посредством препаративной HPLC получали 0,031 г (39%) 5-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиримидин-2,4-диамина в виде белого твердого вещества: 1H ЯМР (500 МГц, CDCl3) δ 8,23 (d, J=2,5 Гц, 1H), 7,81 (s, 1H), 7,66-7,62 (m, 1H), 6,91 (d, J= 8,0 Гц, 1H), 6,82 (d, J= 8,5 Гц, 1H), 6,77 (s, 1H), 6,76-6,72 (m, 1H), 5,12-5,08 (m, 1H), 4,69 (s, 2H), 4,55 (s, 2H), 4,35-4,31 (m, 1H), 4,08-4,04 (m, 1H), 3,98 (s, 3H), 3,65 (s, 2H) ppm; (M+1)=366.
Пример 1-29: синтез 4-(3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-29-1: получение 8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила
Указанное в заголовке соединение получали в ходе трех стадий из 3,4-дифтор-5-гидроксибензонитрила и 2-бром-1-(4-(трифторметил)фенил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-3.
Пример 1-29-2: получение трет-бутил-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата
К перемешанному и охлажденному (0°C) раствору 8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила (0,40 г, 1,24 ммоль) в метаноле (20 мл) добавляли ди-трет-бутил-дикарбонат (0,54 г, 2,46 ммоль), гексагидрат хлорида никеля(II) (0,029 г, 0,12 ммоль) и борогидрид натрия (0,33 г, 8,66 ммоль). Обеспечивали нагревание полученной в результате черной смеси до комнатной температуры. Через 16 ч. смесь разбавляли водой и экстрагировали этилацетатом. Фазы разделяли и органическую фазу промывали насыщенным раствором бикарбоната натрия и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% этилацетат/дихлорметан) получали 0,50 г (95%) трет-бутил-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата в виде белого твердого вещества.
Пример 1-29-3: получение (8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина гидрохлорида
К перемешанному раствору трет-бутил-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)карбамата (0,50 г, 1,17 ммоль) в дихлорметане (20 мл) добавляли 4 н. раствор хлороводорода в диоксане (20 мл). Для реакционной смеси обеспечивали перемешивание при комнатной температуре. Через 2 ч. смесь концентрировали с получением 0,42 г (99%) (8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина гидрохлорида.
Пример 1-29-4: получение 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина гидрохлорида и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-5-5 до 1-5-7.
Пример 1-29-5: получение 4-(3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,68 (s, 1H), 8,44 (d, J=1,8 Гц, 1H), 8,13 (d, J=1,8 Гц, 1H), 7,80 (d, J=8,2 Гц, 2H), 7,69 (d, J=8,1 Гц, 2H), 6,94 (dd, J=11,2, 2,0 Гц, 1H), 6,83 (t, J=1,7 Гц, 1H), 5,45-5,41 (m, 3H), 4,52 (dd, J=11,8, 2,5 Гц, 1H), 4,19 (dd, J=11,8, 7,8 Гц, 1H), 1,47 (s, 6H) ppm; (M+1)=511.
Пример 1-30: синтез 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина 2,2,2-трифторацетата
Указанное в заголовке соединение получали из 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 1-метилпиперазина, как описано в примере 1-3: 1H ЯМР (400 МГц, DMSO-d6) δ 9,37 (s, 1H), 8,55 (d, J=2,6 Гц, 1H), 7,86-7,75 (m, 3H), 7,71 (d, J=8,2 Гц, 2H), 7,05 (dd, J=11,0, 2,1 Гц, 1H), 6,96-6,92 (m, 1H), 5,54 (s, 2H), 5,46 (dd, J=7,6, 2,4 Гц, 1H), 4,55 (dd, J=11,8, 2,4 Гц, 1H), 4,33-4,17 (m, 1H), 3,97-3,93 (m, 2H), 3,62-3,58 (m, 2H), 3,30-3,26 (m, 2H), 3,18-3,14 (m, 2H), 2,92 (s, 3H) ppm; (M+1)=528.
Пример 1-31: синтез 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина гидрохлорида
Указанное в заголовке соединение получали из 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-29-4) и 3-этинилпиперидина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 9,72-9,57 (m, 1H), 9,39-9,16 (m, 2H), 8,61 (d, J=1,4 Гц, 1H), 8,33 (s, 1H), 7,81 (d, J=8,1 Гц, 2H), 7,71 (d, J=8,0 Гц, 2H), 7,02 (dd, J=11,2, 2,0 Гц, 1H), 6,92 (d, J=2,1 Гц, 1H), 5,57-5,43 (m, 3H), 4,55 (dd, J=11,7, 2,4 Гц, 1H), 4,21 (dd, J=11,7, 7,8 Гц, 1H), 3,75-3,64 (m, 1H), 3,55-3,45 (m, 1H), 3,43-3,33 (m, 1H), 3,31-3,10 (m, 1H), 3,09-2,89 (m, 1H), 2,11-1,64 (m, 4H) ppm; (M+1)=537.
Пример 1-32: синтез 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина 2,2,2-трифторацетата
Указанное в заголовке соединение получали из 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-29-4) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4: 1H ЯМР (400 МГц, DMSO-d6) δ 8,99 (s, 1H), 8,78 (d, J=1,9 Гц, 1H), 8,34 (d, J=1,9 Гц, 1H), 8,30 (s, 1H), 8,03 (s, 1H), 7,81 (d, J=8,1 Гц, 2H), 7,70 (d, J=8,1 Гц, 2H), 7,02 (dd, J=11,1, 2,0 Гц, 1H), 6,95-6,82 (m, 1H), 5,47 (d, J=8,3 Гц, 3H), 4,54 (dd, J=11,8, 2,5 Гц, 1H), 4,20 (dd, J=11,8, 8,0 Гц, 1H), 3,90 (s, 3H) ppm; (M+1)=510.
Пример 1-33: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Пример 1-33-1: получение 2-бром-4,5-дифтор-3-гидроксибензонитрила
К перемешанному раствору 3,4-дифтор-5-гидроксибензонитрила (6,53 г, 42,10 ммоль) в уксусной кислоте (75 мл) добавляли бром (3,36 г, 21,05ммоль) в течение периода 3 ч. После завершения добавления смесь разбавляли водой и экстрагировали дихлорметаном. Фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 1% 7 н. аммиак в метаноле/дихлорметане) получали 3,52 г смеси 2-бром-4,5-дифтор-3-гидроксибензонитрила и 2,6-дибром-3,4-дифтор-5-гидроксибензонитрила. Данную смесь применяли на следующей стадии без дополнительной очистки.
Пример 1-33-2: получение 4,5-дифтор-3-гидрокси-2-метилбензонитрила
К перемешанному раствору 2-бром-4,5-дифтор-3-гидроксибензонитрила и 2,6-дибром-3,4-дифтор-5-гидроксибензонитрила (4,23 г неочищенного материала, ~ 40% 2-бром-4,5-дифтор-3-гидроксибензонитрила/~54% 2,6-дибром-3,4-дифтор-5-гидроксибензонитрила) в тетрагидрофуране (100 мл) добавляли бис(триметилалюминий)-1,4-диазабицикло[2.2.2]октановый аддукт (4,63 г, 11,08 ммоль), дициклогексил[2',4',6'-трис(1-метилэтил)[1,1'-бифенил]-2-ил]-фосфин (0,52 г, 1,08 ммоль) и трис(дибензилиденацетон)дипалладий(0) (0,50 г, 0,54 ммоль). Смесь нагревали с обратным холодильником. Через 4 ч. смесь охлаждали до 0°C и гасили путем добавления 1 н. раствора хлористоводородной кислоты. Смесь экстрагировали дихлорметаном и фазы разделяли. Органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Остаток очищали посредством препаративной HPLC с получением 1,40 г (46%) 4,5-дифтор-3-гидрокси-2-метилбензонитрила в виде белого твердого вещества. Кроме того, получали 0,68 г (21%) 3,4-дифтор-5-гидрокси-2,6-диметилбензонитрила также в виде белого твердого вещества.
Пример 1-33-3: получение (8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе четырех стадий из 4,5-дифтор-3-гидрокси-2-метилбензонитрила и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-4.
Пример 1-33-4: получение 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-5-5 до 1-5-7: 1H ЯМР (400 МГц, DMSO-d6) δ 8,61 (d, J=1,7 Гц, 1H), 8,53-8,46 (m, 2H), 8,29 (d, J=2,4 Гц, 1H), 8,14 (s, 1H), 7,81 (dd, J=8,7, 2,5 Гц, 1H), 6,90 (d, J=8,7 Гц, 1H), 5,43 (s, 2H), 5,30 (dd, J=8,4, 2,5 Гц, 1H), 4,53 (dd, J=11,5, 2,5 Гц, 1H), 4,23 (dd, J=11,7, 8,4 Гц, 1H), 3,87 (s, 3H), 2,12 (s, 3H) ppm; (M+1)=547.
Пример 1-34: Синтез 6-циклопропил-3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина 2,2,2-трифторацетата
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-33-4) и циклопропилбороновой кислоты, как описано в примере 1-9: 1H ЯМР (400 МГц, DMSO-d6) δ 9,04-8,48 (m, 2H), 8,45 (s, 1H), 8,30 (d, J=2,5 Гц, 1H), 7,81 (dd, J=8,6, 2,4 Гц, 1H), 6,90 (d, J=8,6 Гц, 1H), 6,79 (d, J=11,4 Гц, 1H), 5,55 (s, 2H), 5,29 (dd, J=8,4, 2,4 Гц, 1H), 4,68-4,39 (m, 1H), 4,27 (dd, J=11,7, 8,4 Гц, 1H), 3,88 (s, 3H), 2,25-2,10 (m, 4H), 1,10-1,02 (m, 2H), 0,88-0,78 (m, 2H) ppm; (M+1)=447.
Пример 1-35: синтез 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-33-4) и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,55 (s, 1H), 8,45 (d, J=1,8 Гц, 1H), 8,31-8,27 (m, 1H), 8,15 (d, J=1,8 Гц, 1H), 7,80 (dd, J=8,7, 2,5 Гц, 1H), 6,89 (d, J=8,7 Гц, 1H), 6,66 (dd, J=11,4, 4,9 Гц, 1H), 5,46 (s, 2H), 5,28 (dd, J=8,4, 2,5 Гц, 1H), 4,55 (dd, J=11,7, 2,5 Гц, 1H), 4,26 (dd, J=11,7, 8,4 Гц, 1H), 3,87 (s, 3H), 2,19 (s, 3H), 1,55 (s, 6H) ppm; (M+1)=488.
Пример 1-36: Синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-33-4) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4: δ 8,66 (d, J=2,0 Гц, 1H), 8,46 (s, 1H), 8,29 (d, J=2,0 Гц, 2H), 8,24 (s, 1H), 7,99 (d, J=0,8 Гц, 1H), 7,83-7,80 (m, 1H), 6,90 (dd, J=8,5, 3,0 Гц, 1H), 6,68 (dd, J=11,5, 4,5 Гц, 1H), 5,45 (s, 2H), 5,28 (dd, J=8,5, 2,5 Гц, 1H), 4,55 (dd, J=11,7, 2,5 Гц, 1H), 4,26 (dd, J=11,7, 8,5 Гц, 1H), 3,90 (s, 3H), 3,87 (s, 3H), 2,22 (s, 3H) ppm; (M+1)=487.
Пример 1-37: Синтез 3-((5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Пример 1-37-1: получение 5-бром-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила
Указанное в заголовке соединение получали в ходе трех стадий из 2-бром-4,5-дифтор-3-гидроксибензонитрил (пример 1-33-1) и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-3.
Пример 1-37-2: получение 5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила
К перемешанному раствору 5-бром-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила (0,79 г, 2,15 ммоль) в тетрагидрофуране (4 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,050 г, 0,043 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 5 мин. добавляли раствор 0,5 M бромида циклопропилцинка в тетрагидрофуране (20,1 мл, 10,05 ммоль). Смесь нагревали при 80°C в герметизированном сосуде. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры. Смесь гасили путем добавления 1 н. раствора хлористоводородной кислоты. Смесь экстрагировали дихлорметаном и фазы разделяли. Органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% этилацетат/дихлорметан) получали 0,95 г 5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила (~ 85% чистота) в виде светло-желтого твердого вещества.
Пример 1-37-3: получение (5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали из 5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила, как описано в примере 1-14-4.
Пример 1-37-4: получение 3-((5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-5-5 до 1-5-7.
Пример 1-37-5: получение 3-((5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4: 1H ЯМР (400 МГц, DMSO-d6) δ 8,56-8,52 (m, 1H), 8,40 (s, 1H), 8,29-8,10 (m, 3H), 7,90 (s, 1H), 7,81-7,67 (m, 1H), 6,87-6,77 (m, 1H), 6,41-6,30 (m, 1H), 5,62-5,49 (m, 2H), 5,25-5,16 (m, 1H), 4,49-4,39 (m, 1H), 4,12-3,97 (m,1H), 3,84-3,76 (m, 6H), 1,63-1,53 (m, 1H), 0,97-0,81 (m, 2H), 0,79-0,60 (m, 2H) ppm; (M+1)=559.
Пример 1-38: синтез 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-5,7-диметил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина 2,2,2-трифторацетата
Пример 1-38-1: (8-фтор-2-(6-метоксипиридин-3-ил)-5,7-диметил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамин
Указанное в заголовке соединение получали в ходе четырех стадий из 3,4-дифтор-5-гидрокси-2,6-диметилбензонитрила (пример 1-32-2) и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-4.
Пример 1-38-2: получение 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-5,7-диметил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина 2,2,2-трифторацетата
Указанное в заголовке соединение получали в ходе четырех стадий из (8-фтор-2-(6-метоксипиридин-3-ил)-5,7-диметил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-5-5 до 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,62 (br s, 2H), 8,52 (d, J=1,8 Гц, 1H), 8,30 (d, J=2,4 Гц, 1H), 8,28-8,16 (m, 2H), 7,81 (dd, J=8,6, 2,5 Гц, 1H), 6,91 (d, J=8,6 Гц, 1H), 5,46 (s, 2H), 5,30 (dd, J=8,3, 2,4 Гц, 1H), 4,53 (dd, J=11,7, 2,5 Гц, 1H), 4,24 (dd, J=11,7, 8,3 Гц, 1H), 3,87 (s, 3H), 2,20 (s, 3H), 2,13 (s, 3H), 1,67 (s, 6H) ppm; (M+1)=502.
Пример 1-39: синтез 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-39-1: получение (8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе четырех стадий из 3,4-дифтор-5-гидроксибензонитрила и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-4.
Пример 1-39-2: получение 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-5-5 до 1-5-7.
Пример 1-39-3: получение 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,05 (s, 1H), 7,60 (dd, J=8,6, 2,4 Гц, 1H), 6,79 (d, J=8,6 Гц, 1H), 6,64-6,75 (m, 2H), 5,34 (s, 2H), 5,10 (dd, J=8,6, 2,3 Гц, 1H), 4,34 (dd, J=11,7, 2,3 Гц, 1H), 4,07 (dd, J=11,7, 8,6 Гц, 1H), 3,94 (s, 3H), 1,75 (bs, 2H), и 1,53 (s, 6H) ppm; (M+1)=457.
Пример 1-40: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-39-2) и 3-этинилпиперидина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,47 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,10 (d, J=1,8 Гц, 1H), 8,04 (s, 1H), 7,60 (dd, J=8,6, 2,5 Гц, 1H), 6,79 (d, J=8,6 Гц, 1H), 6,63-6,73 (m, 2H), 5,34 (s, 2H), 5,09 (dd, J=8,7, 2,5 Гц, 1H), 4,34 (dd, J=11,7, 2,5 Гц, 1H), 4,06 (dd, J=11,7, 8,7 Гц, 1H), 3,94 (s, 3H), 3,21-3,19 (m, 1H), 2,61-2,98 (m, 4H), 2,08-2,04 (m, 1H), 1,77-1,73 (m, 3H), и 1,57-1,42 (m, 1H) ppm; (M+1)=500.
Пример 1-41: синтез 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-39-2) и морфолина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,24 (d, J=2,5 Гц, 1H), 8,22-8,19 (m, 1H), 7,97 (s, 1H), 7,63-7,58 (m, 2H), 6,79 (dd, J=8,5, 0,7 Гц, 1H), 6,71-6,66 (m, 2H), 5,32 (s, 2H), 5,09 (dd, J=8,6, 2,5 Гц, 1H), 4,34 (dd, J=11,7, 2,5 Гц, 1H), 4,06 (dd, J=11,7, 8,6 Гц, 1H), 3,95 (s, 3H), 3,94-3,90 (m, 4H), 3,21-3,13 (m, 4H) ppm; (M+1)=488.
Пример 1-42: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина
К перемешанной суспензии 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (0,19 г, 0,36 ммоль) в диметилсульфоксиде (1 мл) добавляли 2-метилимидазол (0,037 г, 0,45 ммоль), оксид меди(I) (0,002 г, 0,018 ммоль), 4,7-диметокси-1,10-фенантролин (0,013 г, 0,054 ммоль), карбонат цезия (0,16 г, 0,50 ммоль) и поли(этиленгликоль) (0,10 г). Сосуд герметизировали и содержимое дегазировали под вакуумом/заполняли азотом (x 3). Красно-коричневую суспензию нагревали до 110°C. Через 18 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (40 мл). Смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 12 г силикагеля, элюент: 0-5% 2 M аммиак в метаноле/дихлорметане) получали 0,095 г загрязненного белого твердого вещества. При помощи второй хроматографической очистки (CombiFlash, колонка Gold с 12 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,072 г 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина, также известного как RA10813949, в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,41 (d, J=2,1 Гц, 1H), 8,23-8,16 (m, 2H), 8,03 (s, 1H), 7,61 (dd, J=8,5, 2,4 Гц, 1H), 7,08 (d, J=12,5 Гц, 2H), 6,85-6,71 (m, 3H), 5,41 (s, 2H), 5,16-5,08 (m, 1H), 4,37 (dd, J=11,8, 2,4 Гц, 1H), 4,09 (dd, J=11,8, 8,6 Гц, 1H), 3,95 (s, 3H), и 2,38 (s, 3H) ppm; (M+1)=473.
Пример 1-43: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-метоксиимидазо[1,2-a]пиридина
Пример 1-43-1: получение 5-(6-бром-8-фтор-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-3-фтор-2-((4-метоксибензил)окси)бензальдегида и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-21-1 до 1-21-4.
Пример 1-43-2: получение 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-метоксиимидазо[1,2-a]пиридина
Указанное в заголовке соединение получали в ходе двух стадий из 5-(6-бром-8-фтор-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина и 7-метоксиимидазо[1,2-a]пиридин-3-карбальдегида, как описано в примерах от 1-22-1 до 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 8,24-8,18 (m, 1H), 7,66-7,52 (m, 2H), 7,35 (s, 1H), 6,91 (s, 1H), 6,79 (d, J=8,6 Гц, 2H), 6,64-6,44 (m, 2H), 5,09 (d, J=8,3 Гц, 1H), 4,37-4,29 (m, 1H), 4,08 (m, 3H), 3,95 (d, J=5,3 Гц, 3H), и 3,85 (s, 3H) ppm; (M+1)=422.
Пример 1-44: синтез 6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (RA10848871)
Пример 1-44-1: получение (8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты
Указанное в заголовке соединение получали из 5-(6-бром-8-фтор-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (пример 1-43-1), как описано в примере 1-21-5.
Пример 1-44-2: получение 6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из (8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты и (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида (пример 1-21-7), как описано в примере 1-21-8; 1H ЯМР (400 МГц, CDCl3) δ 8,77 (d, J=2,2 Гц, 1H), 8,44 (d, J=2,2 Гц, 1H), 8,21 (d, J=2,5 Гц, 1H), 7,93 (s, 1H), 7,63 (dd, J=8,7, 2,5 Гц, 1H), 6,80 (d, J=8,6 Гц, 1H), 6,68-6,60 (m, 2H), 5,09 (dd, J=8,5, 2,4 Гц, 1H), 4,32 (dd, J=11,8, 2,5 Гц, 1H), 4,11-4,01 (m, 3H), 3,96 (s, 3H); (M+1)=471.
Пример 1-45: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метоксипиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина и метанола, как описано в примере 1-11 с незначительными изменениями. Реакцию осуществляли путем нагревания до 130°C в микроволновом реакторе в течение 30 мин., а не при обычном нагревании до 110°C в течение 20 ч.; 1H ЯМР (400 МГц, CDCl3) δ 8,35 (d, J=2,7 Гц, 1H), 8,20 (dd, J=8,0, 2,6 Гц, 2H), 7,83 (s, 1H), 7,63 (dd, J=8,7, 2,5 Гц, 1H), 6,80 (d, J=8,6 Гц, 1H), 6,70-6,61 (m, 2H), 5,09 (dd, J=8,6, 2,4 Гц, 1H), 4,32 (dd, J=11,6, 2,4 Гц, 1H), 4,11-4,01 (m, 3H), 3,96 (s, 3H), и 3,88 (s, 3H) ppm; (M+1)=423.
Пример 1-46: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение выделяли в качестве побочного продукта из примера 1-44-3; 1H ЯМР (400 МГц, CDCl3) δ 8,64 (dd, J=7,1, 1,8 Гц, 1H), 8,47 (dd, J=4,0, 1,8 Гц, 1H), 8,21 (d, J=2,5 Гц, 1H), 7,97 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,83-6,75 (m, 2H), 6,67 (dd, J=8,9, 2,0 Гц, 2H), 5,09 (dd, J=8,8, 2,4 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,11-4,01 (m, 3H), 3,94 (s, 3H) ppm; (M+1)=393.
Пример 1-47: синтез 7-хлор-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (RA10872685)
Пример 1-47-1: получение 8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
Указанное в заголовке соединение получали из 5-(6-бром-8-фтор-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (пример 1-43-1), как описано в примере 1-23-1.
Пример 1-47-2: получение 7-хлор-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида и 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2), как описано в примерах от 1-23-3 до 1-24-4; 1H ЯМР (400 МГц, CDCl3) δ 8,29 (d, J=2,4 Гц, 1H), 8,21 (dt, J=2,5, 0,7 Гц, 1H), 7,93 (d, J=2,4 Гц, 1H), 7,66-7,56 (m, 2H), 6,79 (dd, J=8,6, 0,7 Гц, 1H), 6,70-6,62 (m, 2H), 5,10 (dd, J=8,7, 2,4 Гц, 1H), 4,33 (dd, J=11,7, 2,4 Гц, 1H), 4,21 (d, J=0,8 Гц, 2H), 4,07 (dd, J=11,7, 8,7 Гц, 1H), 3,95 (s, 3H) ppm; (M+1)=427.
Пример 1-48: синтез 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразоло[1,5-a]пиридина
Пример 1-48-1: получение (E/Z)-N'-((6-бромпиразоло[1,5-a]пиридин-3-ил)метилен)-4-метилбензолсульфоногидразида
Указанное в заголовке соединение получали из 6-бромпиразоло[1,5-a]пиридин-3-карбальдегида, как описано в примере 1-21-7.
Пример 1-48-2: получение 6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиридина
Указанное в заголовке соединение получали из (8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты (пример 1-44-1) и (E/Z)-N'-((6-бромпиразоло[1,5-a]пиридин-3-ил)метилен)-4-метилбензолсульфоногидразида, как описано в примере 1-21-8.
Пример 1-48-3: получение 3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразоло[1,5-a]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиридина и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10; 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,5 Гц, 1H), 7,67-7,58 (m, 3H), 7,19 (dd, J=9,4, 0,8 Гц, 1H), 6,79 (dd, J=8,6, 0,7 Гц, 1H), 6,62-6,53 (m, 3H), 5,09 (dd, J=8,7, 2,4 Гц, 1H), 4,40-4,28 (m, 2H), 4,13-4,01 (m, 3H), 3,96-3,92 (m, 5H), 3,71-3,63 (m, 2H), 3,34 (s, 3H); (M+1)=477.
Пример 1-49: получение 4-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-(1-метил-1H-пиразол-4-ил)пиридина
Пример 1-49-1: получение 2-(8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-5,5-диметил-1,3,2-диоксаборинана
К продуваемой азотом смеси 8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-карбонитрила (0,13 мг, 0,41 ммоль, пример 1-29-1), 1,4-диазабицикло[2.2.2]октана (0,047 г, 0,41 ммоль), бис(неопентилгликолято)дибора (0,19 г, 0,82 ммоль), димера хлор(1,5-циклооктадиен)родия(I) (0,010 г, 0,021 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,048 г, 0,082 ммоль) добавляли толуол (0,50 мл). Полученный в результате оранжевый раствор нагревали при 100°C. Через 15 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом (3 мл) и водой (2 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (3×3 мл). Объединенные органические фазы высушивали над сульфатом натрия и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 4 г силикагеля, деактивированного триэтиламином, элюент: 2-100% этилацетат/гептан) получали 0,098 г (58%) 2-(8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-5,5-диметил-1,3,2-диоксаборинана в виде грязно-белого твердого вещества.
Пример 1-49-2: получение 4-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-(1-метил-1H-пиразол-4-ил)пиридина
Указанное в заголовке соединение получали из 2-(8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-5,5-диметил-1,3,2-диоксаборинана и 4-(хлорметил)-2-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида (пример 1-27-6), как описано в примере 1-24-3: 1HNMR (400 МГц, DMSO-d6) δ 8,38 (d, J=5,1 Гц, 1H), 8,24 (s, 1H), 7,96 (s, 1H), 7,81 (d, J=8,1 Гц, 2H), 7,71 (d, J=8,1 Гц, 2H), 7,56 (s, 1H), 7,03 (dd, J=5,1, 1,6 Гц, 1H), 6,84 (dd, J=11,4, 2,1 Гц, 1H), 6,75 (d, J=2,0 Гц, 1H), 5,44 (dd, J=7,9, 2,5 Гц, 1H), 4,52 (dd, J=11,6, 2,5 Гц, 1H), 4,19 (dd, J=11,6, 7,90 Гц, 1H), 3,88 (s, 3H), и 3,85 (s, 2H) ppm; (M+1)=470.
Пример 1-50: синтез 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-4-ил)пиридина
Пример 1-50-1: получение метил-5-(1-метил-1H-пиразол-4-ил)никотината
К перемешанному раствору метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)никотината (1,00 г, 3,80 ммоль) в 1,4-диоксане (10 мл)/воде (0,50 мл) добавляли 4-бром-1-метил-1H-пиразол (0,61 г, 3,80 ммоль), тетракис(трифенилфосфин)палладий(0) (0,22 г, 0,19 ммоль) и карбонат цезия (2,48 г, 7,60 ммоль). Смесь нагревали до 100°C. Через 2,5 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом (50 мл). Смесь промывали водой (10 мл). Фазы разделяли и водную фазу экстрагировали дихлорметаном (3×20 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. Масло хроматографировали на силикагеле (40 г), элюируя с градиентом гептана и EtOAc (0-100%) при 50 мл/мин. на протяжении 20 мин., затем продували 20% 2 н. аммиака в метаноле в DCM (50 мл) с удалением продукта. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-10% 2 M аммиак в метаноле/дихлорметане) получали 0,42 г (50%) метил-5-(1-метил-1H-пиразол-4-ил)никотината в виде белого твердого вещества.
Пример 1-50-2: получение 3-(хлорметил)-5-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида
Указанное в заголовке соединение получали в ходе двух стадий из метил-5-(1-метил-1H-пиразол-4-ил)никотината, как описано в примерах от 1-27-5 до 1-27-6.
Пример 1-50-3: получение 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-4-ил)пиридина
Указанное в заголовке соединение получали из 3-(хлорметил)-5-(1-метил-1H-пиразол-4-ил)пиридина гидрохлорида и 2-(8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-5,5-диметил-1,3,2-диоксаборинана (пример 1-49-1), как описано в примере 1-24-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (d, J=2,1 Гц, 1H), 8,32 (d, J=2,0 Гц, 1H), 8,23 (s, 1H), 7,94 (s, 1H), 7,87-7,83 (m, 1H), 7,81 (d, J=8,2 Гц, 2H), 7,70 (d, J=8,2 сГц, 2H), 6,84 (dd, J=11,4, 2,0 Гц, 1H), 6,77-6,73 (m, 1H), 5,43 (dd, J=8,0, 2,4 Гц, 1H), 4,52 (dd, J=11,7, 2,4 Гц, 1H), 4,19 (dd, J=11,7, 8,0 Гц, 1H), и 3,89-3,85 (m, 5H) ppm; (M+1)=470.
Пример 1-51: синтез 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-3-ил)пиридина (RA08464874)
Пример 1-51-1: получение 3-(хлорметил)-5-(1-метил-1H-пиразол-3-ил)пиридина гидрохлорида
Указанное в заголовке соединение получали в ходе трех стадий из 3-бром-1-метил-1H-пиразола и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)никотината, как описано в примерах от 1-50-1 до 1-50-2.
Пример 1-51-2: получение 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-3-ил)пиридина
Указанное в заголовке соединение получали из 3-(хлорметил)-5-(1-метил-1H-пиразол-3-ил)пиридина гидрохлорида и 2-(8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)-5,5-диметил-1,3,2-диоксаборинана (пример 1-49-1), как описано в примере 1-24-3: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (d, J=2,1 Гц, 1H), 8,39 (d, J=2,2 Гц, 1H), 7,93 (dd, J=2,4, 1,7 Гц, 1H), 7,73-7,64 (m, 2H), 7,61-7,53 (m, 2H), 7,41 (d, J=2,3 Гц, 1H), 6,66-6,54 (m, 3H), 5,20 (dd, J=8,6, 2,4 Гц, 1H), 4,39 (dd, J=11,7, 2,4 Гц, 1H), 4,03 (dd, J=11,7, 8,6 Гц, 1H), 3,97 (s, 3H), 3,91 (s, 2H) ppm; (M+1)=470.
Пример 1-52: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-52-1: получение метил-4-(бензилокси)-3-метокси-5-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата
К перемешанному раствору метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата (16,48 г, 57,16 ммоль) в ацетонитриле (150 мл) добавляли карбонат цезия (23,30 г, 71,45 ммоль). Смесь обрабатывали 2-бром-1-(6-метоксипиридин-3-ил)этаноном (13,15 г, 57,16 ммоль) и оставляли перемешиваться при комнатной температуре. Через 1 ч. смесь разбавляли водой (500 мл) с образованием в результате осадка. Твердые вещества отделяли при помощи фильтрации и промывали водой (150 мл). Влажный осадок на фильтре растворяли в дихлорметане (250 мл). Раствор промывали солевым раствором (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 25,60 г (>100%) метил-4-(бензилокси)-3-метокси-5-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата в виде желтого твердого вещества.
Пример 1-52-2: получение метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-5-метоксибензоата
К перемешанному раствору метил-4-(бензилокси)-3-метокси-5-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата (25,00 г, 57,15 ммоль) в тетрагидрофуране (200 мл) добавляли 10% палладий на угле (влажный) (5,00 г, 4,70 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). После конечной откачки атмосферу заменяли водородом из баллона. Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. добавляли дополнительную порцию катализатора (5,00 г). Через 5 ч. сосуд вакуумировали и атмосферу заменяли азотом. Смесь фильтровали через целит с помощью тетрагидрофурана (50 мл). Фильтрат разбавляли метанолом (10 мл). Полученный в результате желтый раствор охлаждали до 0°C при добавлении борогидрида натрия (2,97 г, 76,93 ммоль) (отмечали выделение газа). Через 15 мин. смесь обрабатывали 1 н. раствором хлористоводородной кислоты (2 мл) и концентрировали. Остаток растворяли в этилацетате (100 мл) и промывали насыщенным раствором бикарбоната натрия (75 мл) и солевым раствором (75 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 18,77 г (94%) метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-5-метоксибензоата в виде белого пенистого твердого вещества.
Пример 1-52-3: получение метил-8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата
К перемешанному раствору метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)этокси)-5-метоксибензоата (18,77 г, 53,73 ммоль) в ацетонитриле (150 мл) добавляли трифенилфосфиновую смолу (27,00 г, 81,00 ммоль) и триэтиламин (16,48 г, 161,19 ммоль). Суспензию обрабатывали тетрахлоридом углерода (41,37 г, 268,65 ммоль) и нагревали до температуры возврата флегмы. Через 15 ч. обеспечивали охлаждение смеси до комнатной температуры и фильтровали через целит с помощью этилацетата (300 мл). Фильтрат промывали водой (150 мл), насыщенным раствором бикарбоната натрия (100 мл) и солевым раствором (100 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 16,44 г (92%) метил-8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата в виде коричневого масла.
Пример 1-52-4: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
К перемешанному и охлажденному (0°C) раствору метил-8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (16,44 г, 49,62 ммоль) в тетрагидрофуране (200 мл) добавляли алюмогидрид лития (2,40 г, 60,07 ммоль) несколькими порциями на протяжении 3 мин. (отмечали значительное выделение газа). Обеспечивали перемешивание полученной в результате серо-коричневой смеси при 0°C. Через 20 мин. смесь гасили медленным добавлением воды (2,4 мл), 1 н. раствора гидроксида натрия (2,4 мл) и воды (7,2 мл). Обеспечивали перемешивание полученной в результате смеси при 0°C в течение 15 мин., а затем добавляли сульфат магния. Смесь фильтровали через целит и осадок на фильтре промывали этилацетатом (300 мл). Фильтрат концентрировали с получением 13,50 г (90%) (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола в виде клейкой коричневой пены.
Пример 1-52-5: получение 5-(6-(азидометил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
К перемешанному раствору (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (13,50 г, 44,51 ммоль) в тетрагидрофуране (200 мл) добавляли дифенилфосфорилазид (17,15 г, 62,31 ммоль). Смесь обрабатывали 1,8-диазабицикло[5.4.0]ундец-7-еном (10,84 г, 71,21 ммоль) и нагревали до температуры возврата флегмы. Через 45 мин. обеспечивали охлаждение коричневой смеси до комнатной температуры и ее разбавляли этилацетатом (200 мл). Раствор промывали водой (150 мл), насыщенным раствором бикарбоната натрия (150 мл) и солевым раствором (150 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 220 г силикагелем, элюент: 15-30% этилацетат/гептан) получали 12,00 г (82%) 5-(6-(азидометил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина в виде белого твердого вещества.
Пример 1-52-6: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
К перемешанному раствору 5-(6-(азидометил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (12,00 г, 36,55 ммоль) в тетрагидрофуране (100 мл) и воде (20 мл) добавляли трифенилфосфиновую смолу (20,00 г, 60,00 ммоль). Оранжевую суспензию нагревали до температуры возврата флегмы. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и фильтровали через целит с помощью этилацетата (150 мл). Фильтрат промывали водой (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 10,19 г (92%) (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина в виде грязно-белого воскообразного твердого вещества.
Пример 1-52-7: получение 5-йод-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина
К перемешанному раствору 2-хлор-5-йод-3-нитропиридина (4,40 г, 15,00 ммоль) в ацетонитриле (150 мл) добавляли (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (4,20 г, 13,89 ммоль) и N,N-диизопропилэтиламина (2,72 г, 20,84 ммоль). Желтую смесь нагревали до температуры возврата флегмы и перемешивали. Через 15 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (200 мл) с образованием в результате осадка. Твердые вещества отделяли при помощи фильтрации и промывали водой (150 мл). Влажный осадок на фильтре растворяли в дихлорметане (150 мл). Раствор высушивали над сульфатом магния, фильтровали и концентрировали с получением 7,64 г (99%) 5-йод-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина в виде оранжевого твердого вещества.
Пример 1-52-8: получение 5-йод-N2-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина
К перемешанной суспензии 5-йод-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3-нитропиридин-2-амина (1,70 г, 3,09 ммоль) в уксусной кислоте (30 мл) добавляли порошкообразное железо (0,86 г, 15,45 ммоль). Смесь нагревали до 125°C. По мере нагревания смеси желтый цвет тускнел и образовывалась серая суспензия. Через 15 мин. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли этилацетатом (150 мл). Суспензию фильтровали через целит при помощи этилацетата (100 мл). Фильтрат промывали водой (2×30 мл), а затем концентрированным раствором гидроксида аммония (2×75 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,51 г (94%) 5-йод-N2-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина в виде коричневого твердого вещества.
Пример 1-52-9: получение 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанной суспензии 5-йод-N2-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина (1,51 г, 2,90 ммоль) в этаноле (30 мл) добавляли триэтилортоформиат (2,67 г, 17,68 ммоль) и п-толуолсульфоновой кислоты моногидрат (0,050 г, 0,26 ммоль). Смесь нагревали до температуры возврата флегмы и твердые вещества постепенно растворялись. Через 30 мин. обеспечивали охлаждение смеси до комнатной температуры, что приводило в результате к образованию осадка. Смесь фильтровали и осадок на фильтре промывали диэтиловым эфиром (30 мл) и высушивали с получением 1,12 г (73%) 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] в виде серого твердого вещества.
Пример 1-52-10: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,04 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,54-6,51 (m, 2H), 5,35 (s, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,30 (dd, J=11,6, 2,4 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,80 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=486.
Пример 1-52-11: хиральное разделение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Рацемический 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амин подвергали очистке препаративной HPLC (колонка 21,2×250 мм Chiralpak AD-H, 60% этанола/40% гептана с 0,5% диэтиламинового модификатора, расход 9 мл/мин.) с получением отдельных энантиомеров.
Пример 1-53: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4: 1H ЯМР (400 МГц, CDCl3) δ 8,58 (d, J=1,9 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,12 (d, J=1,9 Гц, 1H), 8,04 (s, 1H), 7,81 (d, J=0,9 Гц, 1H), 7,67 (d, J=0,9 Гц, 1H), 7,61 (dd, J=8,5, 2,4 Гц, 1H), 6,77 (d, J=8,5 Гц, 1H), 6,56-6,54 (m, 2H), 5,37 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,99 (s, 3H), 3,94 (s, 3H), 3,81 (s, 3H) ppm; (M+1)=485.
Пример 1-54: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и морфолина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,25 (d, J=2,5 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,97 (s, 1H), 7,64-7,57 (m, 2H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,52 (s, 2H), 5,32 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,96-3,88 (m, 7H), 3,80 (s, 3H), 3,21-3,12 (m, 4H) ppm; (M+1)=490.
Пример 1-55: синтез 6-циклопропил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,19 г, 0,36 ммоль, пример 1-52-9) в толуоле (5 мл) и воде (1 мл) добавляли циклопропилбороновую кислоту (0,078 г, 0,91 ммоль), трициклогексилфосфин (0,010 г, 0,036 ммоль) и трехосновный фосфат калия (0,26 г, 1,20 ммоль). Смесь обрабатывали ацетатом палладия(II) (0,004 г, 0,018 ммоль) и дегазировали под вакуумом/заполняли азотом (X 3). Смесь нагревали до температуры возврата флегмы. Через 18 ч. обеспечивали охлаждение желтой смеси до комнатной температуры и ее разбавляли этилацетатом (50 мл) и водой (50 мл). Фазы разделяли и органическую фазу промывали солевым раствором (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,097 г 6-циклопропил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,31 (d, J=2,0 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,98 (s, 1H), 7,71 (d, J=2,0 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,81-6,74 (m, 1H), 6,52 (s, 2H), 5,34 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,80 (s, 3H), 2,11-2,03 (m, 1H), 1,08-1,00 (m, 2H), 0,79-0,72 (m, 2H) ppm; (M+1)=445.
Пример 1-56: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-ола
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 2-метилбут-3-ин-2-ола, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,52 (s, 1H), 8,38-8,12 (m, 3H), 7,61 (dd, J=8,6, 2,4 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,55-6,51 (m, 2H), 5,35 (s, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,30 (dd, J=11,6, 2,4 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,80 (s, 3H), 1,66 (s, 6H) ppm: (M+1)=487.
Пример 1-57: синтез 6-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-окса-6-азаспиро[3.3]гептана
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 2-окса-6-азаспиро[3.3]гептана, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,20 (d, J=2,5 Гц, 1H), 7,95 (s, 1H), 7,76 (d, J=2,5 Гц, 1H), 7,60 (dd, J=8,7, 2,5 Гц, 1H), 7,14 (d, J=2,5 Гц, 1H), 6,77 (dd, J=8,7, 0,7 Гц, 1H), 6,51 (s, 2H), 5,30 (s, 2H), 5,08 (dd, J=8,3, 2,4 Гц, 1H), 4,87 (s, 4H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,10 (s, 4H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,79 (s, 3H) ppm; (M+1)=502.
Пример 1-58: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксипроп-1-ин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 3-метоксипроп-1-ина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,72 (br s, 1H), 8,50 (s, 1H), 8,25-8,23 (m, 2H), 7,74 (dd, J=8,6, 2,4 Гц, 1H), 6,91-6,81 (m, 1H), 6,75 (d, J=1,8 Гц, 1H), 6,53 (d, J=1,8 Гц, 1H), 5,38 (s, 2H), 5,15 (dd, J=8,2, 2,4 Гц, 1H), 4,41-4,27 (m, 3H), 4,13 (dd, J=11,5, 8,3 Гц, 1H), 3,85 (s, 3H), 3,72 (s, 3H), 3,36 (s, 3H) ppm; (M+1)=473.
Пример 1-59: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)изоксазола
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоксазола, как описано в примере 1-55: 1H ЯМР (400 МГц, DMSO-d6) δ 9,54 (s, 1H), 9,28 (s, 1H), 8,79 (d, J=1,9 Гц, 1H), 8,64 (s, 1H), 8,47 (d, J=1,9 Гц, 1H), 8,23 (d, J=2,5 Гц, 1H), 7,74 (dd, J=8,7, 2,5 Гц, 1H), 6,86 (d, J=8,7 Гц, 1H), 6,78 (d, J=1,9 Гц, 1H), 6,55 (d, J=1,9 Гц, 1H), 5,40 (s, 2H), 5,15 (dd, J=8,2, 2,5 Гц, 1H), 4,34 (dd, J=11,6, 2,5 Гц, 1H), 4,20-4,06 (m, 1H), 3,85 (s, 3H), 3,73 (s, 3H) ppm; (M+1)=472.
Пример 1-60: синтез 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10651967, получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,23-8,19 (m, 2H), 7,98 (s, 1H), 7,64-7,57 (m, 2H), 6,77 (dd, J=8,5, 0,7 Гц, 1H), 6,53-6,52 (m, 2H), 5,33 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,91 (s, 3H), 3,80 (s, 3H) ppm; (M+1)=435.
Пример 1-60-1: хиральное разделение 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Рацемический 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин подвергали препаративной очистке SFC (колонка 21,2×250 мм IA, 30% этанола/0,1% диэтиламинового модификатора, расход 75 г/мин.) с получением отдельных энантиомеров. (S)-6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин также известен как RA10846843.
Пример 1-61: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10680889, получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,20 (d, J=2,4 Гц, 1H), 7,92 (s, 1H), 7,78 (d, J=2,4 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,15 (d, J=2,5 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,55-6,48 (m, 2H), 5,29 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,45-4,35 (m, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,24-4,15 (m, 2H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,82-3,73 (m, 5H), 3,36 (s, 3H); (M+H)=490.
Пример 1-62: синтез 6-(азетидин-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и азетидина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,4 Гц, 1H), 8,03 (s, 1H), 7,79 (d, J=2,4 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,13 (d, J=2,5 Гц, 1H), 6,82-6,73 (m, 1H), 6,58-6,48 (m, 2H), 5,32 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,98-3,95 (m, 4H), 3,94 (s, 3H), 3,81 (s, 3H), 2,47-2,44 (m, 2H) ppm; (M+1)=460.
Пример 1-63: синтез 2-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)окси)-N,N-диметилэтан-1-амина
К 2-(диметиламино)этанолу (2 мл) добавляли 60% дисперсию гидрида натрия (0,18 г, 4,53 ммоль). Смесь перемешивали при комнатной температуре. Через 10 мин. смесь разбавляли N,N-диметилформамидом (2 мл) и йодидом меди(I) (0,065 г, 0,34 ммоль) и добавляли 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин (0,12 г, 0,23 ммоль). Смесь нагревали до 90°C в герметизированном сосуде. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (50 мл). pH смеси доводили до ~3 и кислотную смесь экстрагировали этилацетатом (x2). Органические фазы удаляли. Водную фазу делали основной и экстрагировали хлороформом (x 3). Объединенные органические фазы промывали водой, высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,032 г (24%) 2-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)окси)-N,N-диметилэтан-1-амина в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 8,24 (d, J=2,5 Гц, 1H), 8,20 (d, J=2,3 Гц, 1H), 7,98 (s, 1H), 7,63-7,58 (m, 2H), 6,77 (dd, J=8,5, 0,8 Гц, 1H), 6,55-6,52 (m, 2H), 5,32 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,15 (t, J=5,6 Гц, 2H), 4,10-4,01 (m, 1H), 3,93 (s, 3H), 3,80 (s, 3H), 2,79 (t, J=5,6 Гц, 2H), 2,37 (s, 6H) ppm; (M+1)=492.
Пример 1-64: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(оксетан-3-илокси)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и оксетан-3-ола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,26-8,18 (m, 3H), 7,61 (dd, J=8,7, 2,5 Гц, 1H), 7,34 (d, J=2,5 Гц, 1H), 6,78 (d, J=8,7 Гц, 1H), 6,61-6,53 (m, 2H), 5,37 (s, 2H), 5,33-5,23 (m, 1H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 5,06-4,99 (m, 2H), 4,81 (dd, J=7,5, 5,1 Гц, 2H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=477.
Пример 1-65: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-амина
К перемешанной суспензии 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,12 г, 0,23 ммоль, пример 1-52-9) в диметиламине (2,2 мл) добавляли 2-(ди-трет-бутилфосфино)бифенил (0,014 г, 0,045 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,011 г, 0,011 ммоль) и трет-бутоксид натрия (0,044 г, 0,045 ммоль). Смесь нагревали до 90°C в микроволновом реакторе. Через 30 мин. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,041 г (41%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-амина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,24-8,16 (m, 1H), 8,13 (d, J=2,6 Гц, 1H), 7,93 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,45 (d, J=2,6 Гц, 1H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,55-6,50 (m, 2H), 5,30 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,80 (s, 3H), 2,99 (s, 6H) ppm; (M+1)=448.
Пример 1-66: синтез 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-ола
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 3-метилазетидин-3-ола гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, ацетон-d6) δ 8,28 (dt, J=2,5, 0,7 Гц, 1H), 8,23 (s, 1H), 7,80-7,72 (m, 2H), 7,07 (d, J=2,5 Гц, 1H), 6,84-6,79 (m, 1H), 6,79 (d, J=2,0 Гц, 1H), 6,57 (d, J=2,0 Гц, 1H), 5,36 (s, 2H), 5,14 (dd, J=8,4, 2,5 Гц, 1H), 4,38 (dd, J=11,5, 2,5 Гц, 1H), 4,10 (dd, J=11,5, 8,4 Гц, 1H), 3,92 (d, J=7,6 Гц, 2H), 3,90 (s, 3H), 3,77 (s, 3H), 3,74 (d, J=7,2 Гц, 2H), 1,59 (s, 3H) ppm; (M+1)=490.
Пример 1-67: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридина
К перемешанной суспензии 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,12 г, 0,23 ммоль, пример 1-52-9) в N,N-диметилформамиде (4 мл) добавляли карбонат калия (0,095 г, 0,68 ммоль), йодид меди(I) (0,016 г, 0,084 ммоль), N,N'-диметил-1,2-циклогександиамин (0,026 г, 0,18 ммоль) и 1H-1,2,4-триазол (0,16 г, 2,26 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). Смесь нагревали до 135°C в герметизированном сосуде. Через 3 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (40 мл). pH доводили до ~7 и смесь экстрагировали хлороформом (x 2). Объединенные органические фазы промывали 1 н. раствором гидроксида аммония (x 2), высушивали над сульфатом магния, фильтровали и концентрировали. Остаток подвергали хроматографии с обращенной фазой (Biotage, колонка 50 г C18, элюент: вода/ацетонитрил/0,1% муравьиной кислоты). Фракции, содержащие необходимый продукт, объединяли и концентрировали с удалением органического растворителя. Оставшийся водный раствор экстрагировали хлороформом (x 3). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки данного материала (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,020 г (19%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,81 (d, J=2,3 Гц, 1H), 8,58 (s, 1H), 8,35 (d, J=2,3 Гц, 1H), 8,23-8,14 (m, 3H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,62-6,51 (m, 2H), 5,41 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,83 (s, 3H) ppm; (M+1)=472.
Пример 1-68: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 1H-пиразола, как описано в примере 1-67: 1H ЯМР (400 МГц, DMSO-d6) δ 8,94 (d, J=2,3 Гц, 1H), 8,69 (s, 1H), 8,58 (dd, J=2,5, 0,6 Гц, 1H), 8,51 (d, J=2,3 Гц, 1H), 8,23 (d, J=2,4 Гц, 1H), 7,80 (d, J=1,7 Гц, 1H), 7,75 (dd, J=8,6, 2,4 Гц, 1H), 6,90-6,84 (m, 1H), 6,78 (d, J=1,9 Гц, 1H), 6,62-6,48 (m, 2H), 5,41 (s, 2H), 5,15 (dd, J=8,3, 2,5 Гц, 1H), 4,35 (dd, J=11,5, 2,5 Гц, 1H), 4,14 (dd, J=11,5, 8,3 Гц, 1H), 3,85 (s, 3H), 3,73 (s, 3H) ppm; (M+1)=471.
Пример 1-69: Синтез 6-(1H-имидазол-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 1H-имидазола, как описано в примере 1-67: 1H ЯМР (400 МГц, DMSO-d6) δ 8,74-8,72 (m, 2H), 8,43 (d, J=2,4 Гц, 1H), 8,29 (t, J=1,1 Гц, 1H), 8,23 (d, J=2,4 Гц, 1H), 7,82 (t, J=1,3 Гц, 1H), 7,75 (dd, J=8,7, 2,4 Гц, 1H), 7,14 (t, J=1,1 Гц, 1H), 6,92-6,82 (m, 1H), 6,79 (d, J=1,9 Гц, 1H), 6,55 (d, J=1,9 Гц, 1H), 5,42 (s, 2H), 5,15 (dd, J=8,3, 2,5 Гц, 1H), 4,35 (dd, J=11,5, 2,5 Гц, 1H), 4,14 (dd, J=11,5, 8,3 Гц, 1H), 3,85 (s, 3H), 3,74 (s, 3H) ppm; (M+1)=471.
Пример 1-70: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 2-метил-1H-имидазола, как описано в примере 1-67: 1H ЯМР (400 МГц, CDCl3) δ 8,41 (d, J=2,2 Гц, 1H), 8,24-8,13 (m, 2H), 8,03 (d, J=2,2 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,12-7,06 (m, 2H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,60-6,56 (m, 2H), 5,41 (s, 2H), 5,11 (dd, J=8,3, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,84 (s, 3H), 2,39 (s, 3H) ppm; (M+1)=485.
Пример 1-71: синтез 6-(2,4-диметил-1H-имидазол-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 2,4-диметил-1H-имидазола, как описано в примере 1-67: 1H ЯМР (400 МГц, CDCl3) δ 8,39 (d, J=2,2 Гц, 1H), 8,24-8,19 (m, 1H), 8,16 (s, 1H), 8,00 (d, J=2,2 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,85-6,72 (m, 2H), 6,59-6,57 (m, 2H), 5,40 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,84 (s, 3H), 2,34 (s, 3H), 2,27 (s, 3H) ppm; (M+1)=499.
Пример 1-72: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина
Пример 1-72-1: получение трет-бутил-3-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)окси)азетидин-1-карбоксилата
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и трет-бутил-3-гидроксиазетидин-1-карбоксилата, как описано в примере 1-11.
Пример 1-72-2: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору трет-бутил-3-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)окси)азетидин-1-карбоксилата (0,81 г, 1,41 ммоль) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (10 мл). Для полученного в результате золотисто-желтого раствора обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь концентрировали и остаток растворяли в дихлорметане (50 мл). Раствор промывали насыщенным раствором карбоната натрия (50 мл) и солевым раствором (50 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенный материал растворяли в дихлорметане (20 мл) и обрабатывали 37% раствором формальдегида в воде (0,52 мл, 7,04 ммоль) и триацетоксиборогидридом натрия (0,77 г, 3,52 ммоль). После добавления отмечали незначительную экзотермию. Для смеси обеспечивали перемешивание при комнатной температуре. Через 15 ч. смесь разбавляли насыщенным раствором карбоната натрия (50 мл) и дихлорметаном (50 мл). Фазы разделяли и водную фазу экстрагировали дихлорметаном (30 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 40 г силикагеля, элюент: 0-5% 2 M аммиак в метаноле/дихлорметане) получали 0,20 г (29%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина, также известного как RA10848270, в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,23-8,17 (m, 1H), 8,14 (d, J=2,6 Гц, 1H), 7,98 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,41 (d, J=2,6 Гц, 1H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,53- 6,51 (m, 2H), 5,32 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,83-4,75 (m, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,89-3,83 (m, 2H), 3,80 (s, 3H), 3,22-3,12 (m, 2H), 2,43 (s, 3H) ppm; (M+1)=490.
Пример 1-73: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метил-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,29-8,24 (m, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,99 (s, 1H), 7,88 (dd, J=1,9, 0,8 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,77 (dd, J=8,6, 0,8 Гц, 1H), 6,54-6,52 (m, 2H), 5,34 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,80 (s, 3H), 2,49 (s, 3H) ppm; (M+1)=419.
Пример 1-74: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-амина
К перемешанной суспензии 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,20 г, 0,38 ммоль, пример 1-52-9) в 1,4-диоксане (5 мл) добавляли трет-бутил-N-метилкарбамат (0,10 г, 0,75 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,018 г, 0,019 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (0,044 г, 0,075 ммоль) и карбонат цезия (0,18 г, 0,57 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). Затем смесь нагревали до 115°C. Через 18 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: этилацетат/гептан) получали наполовину очищенный материал. Данный материал растворяли в дихлорметане (10 мл) и обрабатывали трифторуксусной кислотой (6 мл). Для смеси обеспечивали перемешивание при комнатной температуре. Через 15 мин. смесь концентрировали. Остаток растворяли в метаноле и нейтрализовали путем добавления твердого карбоната калия. Смесь фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-8% метанол/этилацетат) получали 0,020 г (12%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-амина в виде светло-желтого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,22-8,18 (m, 1H), 7,95 (d, J=2,5 Гц, 1H), 7,92 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,28 (d, J=2,5 Гц, 1H), 6,77 (dd, J=8,5, 0,7 Гц, 1H), 6,54-6,48 (m, 2H), 5,30 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,79 (s, 3H), 2,91 (s, 3H) ppm; (M+1)=434.
Пример 1-75: синтез 6-(1,3-диметил-1H-пиразол-4-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 1,3-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,52 (d, J=1,9 Гц, 1H), 8,24-8,15 (m, 2H), 8,10 (d, J=1,9 Гц, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,49 (s, 1H), 6,82-6,73 (m, 1H), 6,59-6,57 (m, 2H), 5,40 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,92 (s, 3H), 3,83 (s, 3H), 2,42 (s, 3H) ppm; (M+1)=499.
Пример 1-76: синтез 6-(6-фторпиридин-3-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и (6-фторпиридин-3-ил)бороновой кислоты, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,65 (d, J=2,0 Гц, 1H), 8,50-8,46 (m, 1H), 8,28-8,23 (m, 2H), 8,22-8,18 (m, 1H), 8,05-8,00 (m, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,10-7,07 (m, 1H), 6,81-6,75 (m, 1H), 6,59-6,57 (m, 2H), 5,43 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,83 (s, 3H) ppm; (M+1)=500.
Пример 1-77: синтез 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-3-ола
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и азетидин-3-ола гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CD3OD) δ 8,28 (s, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,81-7,70 (m, 2H), 7,14 (d, J=2,5 Гц, 1H), 6,82 (d, J=8,6 Гц, 1H), 6,67 (d, J=2,0 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 5,35 (s, 2H), 5,11 (dd, J=8,2, 2,5 Гц, 1H), 4,76-4,67 (m, 1H), 4,34 (dd, J=11,6, 2,5 Гц, 1H), 4,26-4,22 (m, 2H), 4,06 (dd, J=11,6, 8,2 Гц, 1H), 3,91 (s, 3H), 3,78 (s, 3H), 3,71-3,63 (m, 2H) ppm; (M+1)=476.
Пример 1-78: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 1-метилпиперазина, как описано в примере 1-10: 1H ЯМР (400 МГц, CD3OD) δ 8,33 (s, 1H), 8,27 (d, J=2,5 Гц, 1H), 8,19 (d, J=2,5 Гц, 1H), 7,73 (dd, J=8,7, 2,5 Гц, 1H), 7,64 (d, J=2,5 Гц, 1H), 6,82 (dd, J=8,7, 0,7 Гц, 1H), 6,68 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,37 (s, 2H), 5,10 (dd, J=8,3, 2,5 Гц, 1H), 4,33 (dd, J=11,5, 2,5 Гц, 1H), 4,06 (dd, J=11,5, 8,3 Гц, 1H), 3,90 (s, 3H), 3,78 (s, 3H), 3,27-3,21 (m, 4H), 2,71-2,64 (m, 4H), 2,37 (s, 3H) ppm; (M+1)=503.
Пример 1-79: синтез 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b] (пример 1-52-9) и 3-метилазетидин-3-амина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CD3OD) δ 8,29 (s, 1H), 8,19 (d, J=2,4 Гц, 1H), 7,81-7,69 (m, 2H), 7,14 (d, J=2,4 Гц, 1H), 6,82 (dd, J=8,6, 0,7 Гц, 1H), 6,67 (d, J=2,0 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 5,35 (s, 2H), 5,10 (dd, J=8,3, 2,5 Гц, 1H), 4,33 (dd, J=11,5, 2,5 Гц, 1H), 4,06 (dd, J=11,5, 8,3 Гц, 1H), 3,90 (s, 3H), 3,90-3,87 (m, 2H), 3,78 (s, 3H), 3,74-3,70 (m, 2H), 1,56 (s, 3H) ppm; (M+1)=489.
Пример 1-80: синтез 6-(3-фторазетидин-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанной и охлажденной (0°C) суспензии 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-3-ола (0,050 г, 0,11 ммоль, пример 1-77) в дихлорметане (3 мл) добавляли бис(2-метоксиэтил)аминосеры трифторид (0,029 г, 0,13 ммоль). Обеспечивали перемешивание полученной в результате красной смеси при 0°C. Через 40 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 30 мин. смесь повторно охлаждали до 0°C и добавляли дополнительную порцию бис(2-метоксиэтил)аминосеры трифторида (0,029 г, 0,13 ммоль). Через 10 мин. охлаждающую ванну удаляли и обеспечивали нагревание смеси до комнатной температуры. Через 15 мин. смесь разбавляли дихлорметаном и промывали насыщенным раствором бикарбоната натрия. Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали.
При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: этилацетат/гептан, а затем 0-5% метанол/этилацетат) получали частично очищенный материал. При помощи двух дополнительных хроматографических очисток получали 0,007 г (14%) 6-(3-фторазетидин-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,24-8,15 (m, 1H), 8,00 (s, 1H), 7,80 (d, J=2,5 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,18 (d, J=2,5 Гц, 1H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,57-6,48 (m, 2H), 5,56-5,40 (m, 1H), 5,31 (s, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,37-4,19 (m, 3H), 4,11-4,02 (m, 2H), 4,02-3,96 (m, 1H), 3,94 (s, 3H), 3,80 (s, 3H) ppm; (M+1)=478.
Пример 1-81: синтез 6-фтор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-52-6) и 2-хлор-5-фтор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,36-8,31 (m, 1H), 8,21-8,19 (m, 1H), 8,07 (s, 1H), 7,80 (dd, J=8,7, 2,6 Гц, 1H), 7,61 (dd, J=8,6, 2,6 Гц, 1H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,56-6,50 (m, 2H), 5,34 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,81 (s, 3H) ppm; (M+1)=423.
Пример 1-82: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-52-6) и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,4 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,10 (dd, J=8,1, 1,4 Гц, 1H), 8,05 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,29-7,26 (m, 1H), 6,80-6,74 (m, 1H), 6,56-6,54 (m, 2H), 5,38 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,80 (s, 3H) ppm; (M+1)=.
Пример 1-83: синтез азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона
Пример 1-83-1: получение метил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-52-6) и метил-6-хлор-5-нитроникотината, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-83-2: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты
К перемешанному раствору метил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (0,20 г, 0,43 ммоль) в смеси 1:1:1 метанол/тетрагидрофуран/вода (15 мл) добавляли гидроксид лития (0,070 г, 2,92 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь обрабатывали 2 н. раствором хлористоводородной кислоты (1,6 мл) и водой (15 мл). Кислотную смесь экстрагировали этилацетатом (x 3). Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,15 г (77%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты в виде белого твердого вещества.
Пример 1-83-3: получение азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона
К перемешанному раствору 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоновой кислоты (0,15 г, 0,33 ммоль) в дихлорметане (10 мл) добавляли 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоурония тетрафторборат (0,13 г, 0,40 ммоль), N,N-диизопропилэтиламин (0,13 г, 1,00 ммоль) и азетидин (0,029 г, 0,50 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 25 мин. смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали частично очищенный материал. Данный материал растворяли в этилацетате и промывали водой (3×30 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,050 г (31%) азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона, также известного как RA10600053, в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,80 (d, J=1,9 Гц, 1H), 8,32 (d, J=1,9 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,11 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,78 (dd, J=8,5, 0,7 Гц, 1H), 6,55-6,53 (m, 2H), 5,38 (s, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,44-4,26 (m, 5H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,81 (s, 3H), 2,46-2,33 (m, 2H) ppm; (M+1)=488.
Пример 1-83-4: хиральное разделение азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона
Рацемический 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амин подвергали препаративной очистке HPLC (колонка 21,2×250 мм Lux Cellulose-3, 80% этанола/20% гептана с 0,1% диэтиламинового модификатора, расход 7 мл/мин.) с получением отдельных энантиомеров.
Пример 1-84: синтез (3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Указанное в заголовке соединение получали из метил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата (пример 1-83-1), как описано в примере 1-52-4: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,10 (d, J=1,8 Гц, 1H), 8,05 (s, 1H), 7,61 (dd, J=8,7, 2,5 Гц, 1H), 6,80-6,75 (m, 1H), 6,54-6,52 (m, 2H), 5,37 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,87 (d, J=5,5 Гц, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,80 (s, 3H), 1,96 (t, J=5,5 Гц, 1H) ppm; (M+1)=435.
Пример 1-85: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(метоксиметил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору (3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола (0,31 г, 0,72 ммоль) и N,N-диметилформамида (10 мл) добавляли 60% дисперсию гидрида натрия (0,063 г, 1,59 ммоль). Обеспечивали перемешивание полученной в результате желтой смеси при комнатной температуре. Через 15 мин. смесь обрабатывали йодметаном (0,26 г, 1,80 ммоль) и обеспечивали перемешивание полученной в результате смеси. Через 45 мин. смесь разбавляли водой (50 мл) и ее экстрагировали диэтиловым эфиром (3×30 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,22 г (67%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(метоксиметил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,43 (d, J=1,8 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,05 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,54-6,52 (m, 2H), 5,37 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,61 (s, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,80 (s, 3H), 3,43 (s, 3H) ppm; (M+1)=449.
Пример 1-86: синтез 6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-86-1: получение 6-(метилтио)-5-нитроникотиновой кислоты
К перемешанному раствору метил-6-(метилтио)-5-нитроникотината (14,25 г, 62,44 ммоль) в тетрагидрофуране (200 мл) и воде (50 мл) добавляли гидроксида лития моногидрат (4,25 г, 99,26 ммоль). Обеспечивали перемешивание полученного в результате оранжевого раствора при комнатной температуре. Через 45 мин. смесь концентрировали с удалением тетрагидрофурана и остаточный раствор обрабатывали 1 н. раствором хлористоводородной кислоты (100 мл). Полученную в результате суспензию фильтровали и осадок на фильтре промывали водой (300 мл). Влажные твердые вещества суспендировали в этилацетате (300 мл) и метаноле (150 мл) и смесь концентрировали с получением 12,54 г (94%) 6-(метилтио)-5-нитроникотиновой кислоты в виде ярко-желтого твердого вещества.
Пример 1-86-2: получение (6-(метилтио)-5-нитропиридин-3-ил)метанола
К перемешанному раствору 6-(метилтио)-5-нитроникотиновой кислоты (2,53 г, 11,81 ммоль) в тетрагидрофуране (100 мл) добавляли 1,0 M боран-тетрагидрофурановый комплекс (29,5 мл, 29,53 ммоль) (посредством шприца в течение ~ 5 мин.). Полученную в результате смесь нагревали до ~ 50°C и перемешивали. Через 25 мин. смесь охлаждали до 0°C при добавлении метанола (10 мл). Обеспечивали перемешивание смеси в течение 10 мин., а затем ее концентрировали на силикагель. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 80 г силикагеля, элюент: от 50% этилацетат/гептан до 100% этилацетата) получали 0,95 г (40%) (6-(метилтио)-5-нитропиридин-3-ил)метанола в виде ярко-желтого твердого вещества.
Пример 1-86-3: получение 6-(метилтио)-5-нитроникотинальдегида
К перемешанному раствору (6-(метилтио)-5-нитропиридин-3-ил)метанола (1,76 г, 8,79 ммоль) в дихлорметане (50 мл) добавляли оксид марганца(IV) (5,39 г, 52,74 ммоль). Обеспечивали перемешивание полученной в результате черной суспензии при комнатной температуре. Через 22 ч. смесь фильтровали через целит с помощью хлороформа (200 мл). Фильтрат концентрировали с получением 1,23 г (71%) 6-(метилтио)-5-нитроникотинальдегида в виде желтого твердого вещества.
Пример 1-86-4: получение 5-(дифторметил)-2-(метилтио)-3-нитропиридина
К перемешанному и охлажденному (0°C) раствору 6-(метилтио)-5-нитроникотинальдегида (1,23 г, 6,21 ммоль) в дихлорметане (100 мл) добавляли бис(2-метоксиэтил)аминосеры трифторид (6,86 г, 31,03 ммоль) (посредством шприца на протяжении ~ 1 мин.). Обеспечивали медленное нагревание полученной в результате смеси до комнатной температуры. Через 4 ч. смесь разбавляли дихлорметаном (50 мл)/насыщенным раствором карбоната калия (50 мл) и оставляли перемешиваться при комнатной температуре. Через 10 мин. фазы разделяли и водную фазу экстрагировали дихлорметаном (30 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,28 г (94%) 5-(дифторметил)-2-(метилтио)-3-нитропиридина в виде желтого твердого вещества.
Пример 1-86-5: получение 5-(дифторметил)-2-(метилсульфонил)-3-нитропиридина
К перемешанному раствору 5-(дифторметил)-2-(метилтио)-3-нитропиридина (1,28 г, 5,81 ммоль) и дихлорметана (100 мл) добавляли 3-хлорпероксибензойную кислоту (10,42 г, 46,50 ммоль). Для полученного в результате желтого раствора обеспечивали перемешивание при комнатной температуре. Через 6 ч. мутную желтую суспензию разбавляли насыщенным раствором тиосульфата натрия (50 мл) и обеспечивали перемешивание двухфазной смеси при комнатной температуре. Через 10 мин. смесь дополнительно разбавляли дихлорметаном (100 мл) и водой (60 мл). Фазы разделяли и органическую фазу промывали насыщенным раствором карбоната калия (2×50 мл). Органическую фазу разделяли и высушивали над сульфатом магния, фильтровали и концентрировали с получением 1,23 г (84%) 5-(дифторметил)-2-(метилсульфонил)-3-нитропиридина в виде желтого твердого вещества.
Пример 1-86-6: получение 6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10940752, получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-52-6) и 5-(дифторметил)-2-(метилсульфонил)-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,60 (s, 1H), 8,24 (s, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,14 (s, 1H), 7,61 (dd, J=8,6, 2,4 Гц, 1H), 7,03-6,71 (m, 2H), 6,56-6,52 (m, 2H), 5,39 (s, 2H), 5,09 (dd, J=8,5, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,5 Гц, 1H), 3,94 (s, 3H), 3,81 (s, 3H) ppm; (M+1)=455.
Пример 1-86-7: хиральное разделение 6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Рацемический 6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин подвергали препаративной очистке SFC (колонка 30×250 мм IA, 45% этанола/0,1% диэтиламинового модификатора, расход 60 г/мин.) с получением отдельных энантиомеров.
Пример 1-87: синтез 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-метил-3H-имидазо[4,5-b]пиридина
Пример 1-87-1: получение 5-метокси-N2-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина
Указанное в заголовке соединение получали в ходе двух стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-52-6) и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-8 (отмечено: реакцию замещения, описанную в примере 1-52-7, осуществляли при нагревании с обратным холодильником с 1-бутанолом вместо ацетонитрила).
Пример 1-87-2: получение 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-метил-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 5-метокси-N2-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридин-2,3-диамина и триэтилортоацетата, как описано в примере 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,19 (d, J=2,5 Гц, 1H), 8,11 (d, J=2,6 Гц, 1H), 7,60 (dd, J=8,6, 2,5 Гц, 1H), 7,50 (d, J=2,6 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,44 (d, J=1,9 Гц, 1H), 6,34 (d, J=1,9 Гц, 1H), 5,33 (s, 2H), 5,07 (dd, J=8,4, 2,4 Гц, 1H), 4,27 (dd, J=11,6, 2,4 Гц, 1H), 4,04 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,90 (s, 3H), 3,76 (s, 3H), 2,56 (s, 3H) ppm; (M+1)=455.
Пример 1-88: синтез 6-(азетидин-3-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина 2,2,2-трифторацетата
Пример 1-88-1: получение (3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бороновой кислоты
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-52-9) и бис(пинаколато)дибора, как описано в примере 1-24-2 (выделенного в виде ~1:1 смеси бороновой кислоты и соответствующего сложного пинаколового эфира).
Пример 1-88-2: получение 6-(азетидин-3-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина 2,2,2-трифторацетата
Указанное в заголовке соединение получали из (3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бороновой кислоты и трет-бутил-3-(2-тозилгидразоно)азетидин-1-карбоксилата, как описано в примере 1-21-8. С продукта данной реакции снимали защиту с помощью трифторуксусной кислоты, как описано в примере 1-12-5: 1H ЯМР (400 МГц, CD3OD) δ 8,59 (s, 1H), 8,46 (d, J=2,0 Гц, 1H), 8,23-8,19 (m, 2H), 7,73 (dd, J=8,6, 2,5 Гц, 1H), 6,83 (d, J=8,6 Гц, 1H), 6,72 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,45 (s, 2H), 5,11 (dd, J=8,1, 2,4 Гц, 1H), 4,51-4,40 (m, 2H ), 4,40-4,28 (m, 4H), 4,15-4,00 (m, 1H), 3,91 (s, 3H), 3,79 (s, 3H) ppm; (M+1)=460.
Пример 1-89: синтез 5,6-диметокси-1-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола
К перемешанному раствору (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (0,028 г, 0,092 ммоль, пример 1-52-4) в толуоле (3 мл) добавляли 5,6-диметокси-1H-бензо[d]имидазол (0,019 г, 0,10 ммоль). Смесь обрабатывали цианометилентрибутилфосфораном (0,047 г, 0,18 моль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 1,5 ч. смесь нагревали до 75°C. Через 1 ч. нагревания обеспечивали охлаждение смеси до комнатной температуры и ее гасили путем добавления 2 капель насыщенного раствора бикарбоната натрия. Затем смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/этилацетат) получали
частично очищенный продукт. Данный материал растирали с 2% диэтилового эфира в гептане (x 2). Затем твердое вещество растворяли в 10% метанола в дихлорметане и раствор фильтровали и концентрировали с получением 0,021 г (49%) 5,6-диметокси-1-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,22-8,20 (m, 1H), 7,82 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,30 (s, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,76 (s, 1H), 6,44 (d, J=2,0 Гц, 1H), 6,34 (d, J=2,0 Гц, 1H), 5,21 (s, 2H), 5,10 (dd, J=8,4, 2,4 Гц, 1H), 4,31 (dd, J=11,6, 2,4 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,94 (s, 3H), 3,89 (s, 3H), 3,77 (s, 3H) ppm; (M+1)=464.
Пример 1-90: синтез 6-(1H-имидазол-2-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина формиата
Пример 1-90-1: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбальдегида
Указанное в заголовке соединение получали из (3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола (пример 1-84), как описано в примере 1-86-3.
Пример 1-90-2: получение 6-(1H-имидазол-2-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина формиата
К перемешанной суспензии 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбальдегида (0,040 г, 0,093 ммоль) в 1-метил-2-пирролидиноне (2 мл) добавляли ацетат аммония (0,072 г, 0,93 ммоль) и 40% раствор глиоксаля в воде (0,053 мл, 0,46 ммоль). Смесь нагревали до 120°C в герметизированном сосуде. Через 16 ч. обеспечивали охлаждение темно-красной смеси до комнатной температуры. При помощи хроматографической очистки неочищенной реакционной смеси (Biotage, колонка 50 г C18, элюент: 0-60% вода/метанол/0,1% муравьиная кислота) получали 0,008 г (14%) 6-(1H-имидазол-2-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина формиата в виде белого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 8,99 (d, J=1,8 Гц, 1H), 8,55-8,47 (m, 2H), 8,19 (d, J=2,4 Гц, 1H), 7,72 (dd, J=8,6, 2,5 Гц, 1H), 7,24-7,22 (m, 2H), 6,81 (d, J=8,6 Гц, 1H), 6,74 (d, J=1,9 Гц, 1H), 6,60 (d, J=1,9 Гц, 1H), 5,45 (s, 2H), 5,10 (dd, J=8,3, 2,4 Гц, 1H), 4,33 (dd, J=11,6, 2,4 Гц, 1H), 4,05 (dd, J=11,6, 8,3 Гц, 1H), 3,90 (s, 3H), 3,79 (s, 3H) ppm; (M+1)=471.
Пример 1-91: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метил-1H-имидазол-2-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбальдегида (пример 1-90-1) и 2-оксопропанaля, как описано в примере 1-90-2: 1H ЯМР (400 МГц, CDCl3) δ 9,08 (d, J=1,7 Гц, 1H), 8,55-8,50 (m, 1H), 8,18 (d, J=2,5 Гц, 1H), 8,03 (s, 1H), 7,59 (dd, J=8,6, 2,5 Гц, 1H), 6,87 (s, 1H), 6,80-6,72 (m, 1H), 6,61-6,51 (m, 2H), 5,34 (s, 2H), 5,06 (dd, J=8,4, 2,5 Гц, 1H), 4,28 (dd, J=11,6, 2,5 Гц, 1H), 4,04 (dd, J=11,6, 8,4 Гц, 1H), 3,93 (s, 3H), 3,78 (s, 3H), 2,30 (s, 3H) ppm; (M+1)=485.
Пример 1-92: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-92-1: получение метил-4-гидрокси-3-((1-гидрокси-1-(6-метоксипиридин-3-ил)пропан-2-ил)окси)-5-метоксибензоата
Указанное в заголовке соединение получали в ходе двух стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-метоксипиридин-3-ил)пропан-1-она, как описано в примерах от 1-52-1 до 1-52-2.
Пример 1-92-2: получение метил-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата
К перемешанному и охлажденному (0°C) раствору 4-гидрокси-3-((1-гидрокси-1-(6-метоксипиридин-3-ил)пропан-2-ил)окси)-5-метоксибензоата (9,11 г, 25,07 ммоль) и трифенилфосфина (9,30 г, 35,10 ммоль) в тетрагидрофуране (100 мл) добавляли раствор бис(2-метоксиэтил)азодикарбоксилата (8,56 г, 35,10 ммоль) в тетрагидрофуране (30 мл) на протяжении 5 мин. Через 1 ч. смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (Combiflash, колонка с 330 г силикагеля, элюент: 5-50% этилацетат/гептан) получали 3,68 г (43%) метил-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата в виде белого твердого вещества.
Пример 1-92-3: получение (8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе трех стадий из метил-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата, как описано в примерах от 1-52-4 до 1-52-6.
Пример 1-92-4: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,48-8,42 (m, 1H), 8,19-8,02 (m, 3H), 7,60-7,50 (m, 1H), 7,31-7,23 (m, 1H), 6,78 (d, J=8,7 Гц, 0,4H), 6,72 (d, J=8,7 Гц, 0,6H), 6,58-6,52 (m, 2H), 5,39 (d, J=2,5 Гц, 2H), 5,15 (d, J=2,6 Гц, 1H), 4,62 (d, J=7,8 Гц, 0,4H), 4,51-4,43 (m, 0,6H), 4,16-4,07 (m, 1H), 3,96-3,90 (m, 3H), 3,81-3,77 (m, 3H), 1,19-1,12 (m, 3H) ppm (в виде смеси диастереомеров); (M+1)=419.
Пример 1-92-5: хиральное разделение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение разделяли на его отдельные диастереомеры посредством хиральной хроматографии.
Разделение № 1
Колонка: Whelk-O1 21×250 мм
Подвижная фаза: 50% этанола в CO2, 0,1% диэтиламина, 70 мл/мин.
При помощи данной операции получали диастереомер A (пик 1) и диастереомер B (пик 4) в виде чистых фракций (абсолютные конфигурации неизвестны) и смеси двух оставшихся диастереомеров (пики 2 и 3).
Диастереомер A: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,13 (d, J=2,4 Гц, 1H), 8,10 (dd, J=8,1, 1,5 Гц, 1H), 8,07 (s, 1H), 7,55 (dd, J=8,6, 2,4 Гц, 1H), 7,30-7,27 (m, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,15 (d, J=2,7 Гц, 1H), 4,47 (qd, J=6,6, 2,7 Гц, 1H), 3,92 (s, 3H), 3,80 (s, 3H), 1,14 (d, J=6,6 Гц, 3H) ppm.
Диастереомер B, также известный как RA10947016: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,16 (d, J=2,5 Гц, 1H), 8,09 (dd, J=8,0, 1,5 Гц, 1H), 8,04 (s, 1H), 7,56 (dd, J=8,6, 2,5 Гц, 1H), 7,29-7,26 (m, 1H), 6,78 (d, J=8,6 Гц, 1H), 6,54-6,52 (m, 2H), 5,38 (s, 2H), 4,62 (d, J=7,8 Гц, 1H), 4,11 (dq, J=7,8, 6,3 Гц, 1H), 3,94 (s, 3H), 3,79 (s, 3H), 1,17 (d, J=6,3 Гц, 3H) ppm.
Оставшуюся смесь диастереомеров (пики 2 и 3) из первого разделения подвергали второй хроматографии.
Разделение № 2
Колонка: AD-H 21×250 мм
Подвижная фаза: 25% метанола в CO2, 0,5% диэтиламина 45 мл/мин.
При помощи данной операции получали диастереомер C (пик 1) и диастереомер D (пик 2) в виде чистых фракций (абсолютные конфигурации неизвестны).
Диастереомер C: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,13 (d, J=2,4 Гц, 1H), 8,10 (dd, J=8,1, 1,5 Гц, 1H), 8,07 (s, 1H), 7,55 (dd, J=8,6, 2,4 Гц, 1H), 7,30-7,26 (m, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,15 (d, J=2,7 Гц, 1H), 4,47 (qd, J=6,6, 2,7 Гц, 1H), 3,92 (s, 3H), 3,80 (s, 3H), 1,14 (d, J=6,6 Гц, 3H) ppm.
Диастереомер D: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,16 (d, J=2,4 Гц, 1H), 8,10 (dd, J=8,1, 1,5 Гц, 1H), 8,05 (s, 1H), 7,56 (dd, J=8,7, 2,4 Гц, 1H), 7,29-7,26 (m, 1H), 6,78 (d, J=8,6 Гц, 1H), 6,54-6,52 (m, 2H), 5,38 (s, 2H), 4,62 (d, J=7,8 Гц, 1H), 4,11 (dq, J=7,8, 6,3 Гц, 1H), 3,94 (s, 3H), 3,79 (s, 3H), 1,17 (d, J=6,3 Гц, 3H) ppm.
Пример 1-93: синтез 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-93-1: получение 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-92-3) и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-93-2: получение 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,23-8,20 (m, 1H), 8,17-8,11 (m, 1H), 8,00-7,96 (m, 1H), 7,62-7,52 (m, 2H), 6,80-6,75 (m, 1H), 6,54-6,49 (m, 2H), 5,34-5,32 (m, 2H), 5,16-5,14 (m, 0,3H, цис-диастереомеры), 4,61 (d, J=7,8 Гц, 1H, транс-диастереомеры), 4,50-4,43 (m, 0,3H, цис-диастереомеры), 4,15-4,07 (m, 1H), 3,96-3,89 (m, 6H), 3,81-3,76 (m, 3H), 1,18-1,12 (m, 3H) ppm (в виде смеси диастереомеров); (M+1)=449.
Пример 1-93-3: хиральное разделение 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение разделяли на его отдельные диастереомеры посредством хиральной хроматографии.
Разделение № 1
Колонка: Whelk-O1 21×250 мм
Подвижная фаза: 60% этанола в CO2, 0,1% диэтиламина, 55 мл/мин.
При помощи данной операции получали диастереомер A (пик 1) и диастереомер B (пик 4) в виде чистых фракций (абсолютные конфигурации неизвестны) и смеси двух оставшихся диастереомеров (пики 2 и 3).
Диастереомер A: 1H ЯМР (400 МГц, CDCl3) δ 8,22 (d, J=2,6 Гц, 1H), 8,14-8,12 (m, 1H), 8,00 (s, 1H), 7,60 (d, J=2,6 Гц, 1H), 7,54 (dd, J=8,7, 2,5 Гц, 1H), 6,72 (dd, J=8,7, 0,7 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,15 (d, J=2,6 Гц, 1H), 4,47 (qd, J=6,6, 2,6 Гц, 1H), 3,92 (s, 3H), 3,91 (s, 3H), 3,80 (s, 3H), 1,14 (d, J=6,6 Гц, 3H) ppm.
Диастереомер B: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,6 Гц, 1H), 8,16 (d, J=2,4 Гц, 1H), 7,98 (s, 1H), 7,59 (d, J=2,6 Гц, 1H), 7,56 (dd, J=8,6, 2,4 Гц, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,53-6,51 (m, 2H), 5,33 (s, 2H), 4,61 (d, J=7,8 Гц, 1H), 4,11 (dq, J=7,8, 6,5 Гц, 1H), 3,94 (s, 3H), 3,91 (s, 3H), 3,79 (s, 3H), 1,17 (d, J=6,5 Гц, 3H) ppm.
Оставшуюся смесь диастереомеров (пики 2 и 3) из первого разделения подвергали второй хроматографии.
Разделение № 2
Колонка: AD-H 21×250 мм
Подвижная фаза: 25% метанола в CO2, 0,5% диэтиламина 45 мл/мин.
При помощи данной операции получали диастереомер C (пик 1) и диастереомер D (пик 2) в виде чистых фракций (абсолютные конфигурации неизвестны)
Диастереомер C: 1H ЯМР (400 МГц, CDCl3) δ 8,22 (d, J=2,6 Гц, 1H), 8,14-8,12 (m, 1H), 8,00 (s, 1H), 7,60 (d, J=2,6 Гц, 1H), 7,54 (dd, J=8,7, 2,5 Гц, 1H), 6,72 (dd, J=8,7, 0,7 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,15 (d, J=2,6 Гц, 1H), 4,47 (qd, J=6,6, 2,6 Гц, 1H), 3,92 (s, 3H), 3,91 (s, 3H), 3,80 (s, 3H), 1,14 (d, J=6,6 Гц, 3H) ppm.
Диастереомер D: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,6 Гц, 1H), 8,16 (d, J=2,4 Гц, 1H), 7,98 (s, 1H), 7,59 (d, J=2,6 Гц, 1H), 7,56 (dd, J=8,6, 2,4 Гц, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,53-6,51 (m, 2H), 5,33 (s, 2H), 4,61 (d, J=7,8 Гц, 1H), 4,11 (dq, J=7,8, 6,5 Гц, 1H), 3,94 (s, 3H), 3,91 (s, 3H), 3,79 (s, 3H), 1,17 (d, J=6,5 Гц, 3H) ppm.
Пример 1-94: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-94-1: получение метил-4-(бензилокси)-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)пропокси)-5-метоксибензоата
К перемешанному и охлажденному (-78°C) раствору метил-4-(бензилокси)-3-метокси-5-(2-(6-метоксипиридин-3-ил)-2-оксоэтокси)бензоата (0,31 г, 0,70 ммоль, пример 1-52-1) в тетрагидрофуране (5 мл) добавляли 3,0 M раствор метилмагния бромида в диэтиловом эфире (0,29 мл, 0,87 ммоль). Обеспечивали перемешивание смеси при -78°C. Через 20 мин. к смеси добавляли дополнительную порцию 3,0 M раствора бромида метилмагния в диэтиловом эфире (0,10 мл, 0,30 ммоль). Через 55 мин. холодную смесь гасили путем добавления насыщенного раствора хлорида аммония (5 мл). Обеспечивали нагревание смеси до комнатной температуры и ее дополнительно разбавляли водой (5 мл). Смесь экстрагировали этилацетатом (x 2). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: этилацетат/гептан) получали загрязненный продукт (загрязненный исходным кетоном). Данный материал применяли в последующей реакции.
Пример 1-94-2: получение метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)пропокси)-5-метоксибензоата
К перемешанному раствору загрязненного метил-4-(бензилокси)-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)пропокси)-5-метоксибензоата (0,57 г, 0,75 ммоль) в метаноле (30 мл) добавляли 10% палладий на угле (влажный) (0,33 г, 0,31 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). После конечной откачки атмосферу заменяли водородом из баллона. Для реакционной смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. сосуд вакуумировали и атмосферу заменяли азотом. Смесь фильтровали через целит с помощью метанола и дихлорметана. Фильтрат концентрировали с получением 0,55 г метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)пропокси)-5-метоксибензоата (~33% чистоты) в виде масла.
Пример 1-94-3: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе четырех стадий из метил-4-гидрокси-3-(2-гидрокси-2-(6-метоксипиридин-3-ил)пропокси)-5-метоксибензоата, как описано в примерах от 1-52-3 до 1-52-6.
Пример 1-94-4: получение 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-57-9.
Пример 1-94-5: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8.
Пример 1-94-6: хиральное разделение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
1H ЯМР (400 МГц, CDCl3) δ 8,44 (d, J=1,7 Гц, 1H), 8,22 (dd, J=2,6, 0,8 Гц, 1H), 8,07 (d, J=1,7 Гц, 1H), 8,01 (d, J=6,7 Гц, 1H), 7,62 (dd, J=8,7, 2,6 Гц, 1H), 6,71 (dd, J=8,7, 0,8 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 6,41 (d, J=2,0 Гц, 1H), 5,30 (s, 2H), 4,32 (d, J=11,5 Гц, 1H), 4,05 (d, J=11,5 Гц, 1H), 3,90 (s, 3H), 3,83 (s, 3H), 1,64 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=500.
Пример 1-95: синтез 7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7H-имидазо[4,5-c]пиридазина
Пример 1-95-1: получение (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1-(метилтио)-2-нитроэтен-1-амина
К перемешанному раствору (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (0,73 г, 2,42 ммоль, пример 1-52-6) в этаноле (40 мл) добавляли 1,1-бис(метилтио)-2-нитроэтилен (0,63 г, 3,63 ммоль). Светло-коричневый раствор нагревали до температуры возврата флегмы и перемешивали. Через 19 ч. обеспечивали охлаждение смеси до комнатной температуры с получением в результате осадка. Смесь фильтровали и осадок на фильтре промывали этанолом (10 мл) и высушивали с получением 0,83 г (82%) (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1-(метилтио)-2-нитроэтенамина в виде желтовато-коричневого твердого вещества.
Пример 1-95-2: получение (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроацетогидразонамида
К перемешанной суспензии (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1-(метилтио)-2-нитроэтенамина (0,83 г, 1,98 ммоль) в этаноле (15 мл) добавляли гидрат гидразина (0,39 г, 7,92 ммоль). Смесь нагревали до температуры возврата флегмы. Через 2,5 ч. обеспечивали охлаждение желтовато-коричневой суспензии до комнатной температуры и ее фильтровали. Осадок на фильтре промывали небольшим количеством этанола (15 мл) и высушивали с получением 0,62 г (78%) (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроацетогидразонамида в виде желтовато-коричневого твердого вещества.
Пример 1-95-3: получение N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-4-нитропиридазин-3-амина
К перемешанному раствору 40% глиоксаля в воде (0,22 г, 1,53 ммоль) и карбоната натрия (0,20 г, 1,84 ммоль) в смеси 2:1:1 вода/этанол/тетрагидрофуран (40 мл) добавляли (E/Z)-N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-нитроацетогидразонамид (0,62 г, 1,53 ммоль) порциями на протяжении ~ 3 мин. Обеспечивали перемешивание полученной в результате желтой смеси при комнатной температуре. Через 17 ч. смесь концентрировали с удалением органического растворителя. Остаток разбавляли водой (20 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 40 г силикагеля, элюент: 30-75% этилацетат/гептан) получали 0,39 г (59%) N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-4-нитропиридазин-3-амина в виде оранжевого твердого вещества.
Пример 1-95-4: получение N3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридазин-3,4-диамина
Указанное в заголовке соединение получали из N-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-4-нитропиридазин-3-амина, как описано в примере 1-52-8.
Пример 1-95-5: получение 7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7H-имидазо[4,5-c]пиридазина
К перемешанному раствору N3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридазин-3,4-диамина (0,36 г, 0,91 ммоль) в N,N-диметилформамиде (5 мл) добавляли триэтилортоформиат (7,13 г, 47,14 ммоль). Смесь нагревали до 150°C. Через 30 мин. обеспечивали охлаждение светло-коричневого раствора до комнатной температуры и его концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,22 г (58%) 9-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-9H-имидазо[4,5-c]пиридазина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 9,18 (d, J=5,6 Гц, 1H), 8,22-8,20 (m, 2H), 7,86 (d, J=5,6 Гц, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,65-6,63 (m, 2H), 5,54 (s, 2H), 5,10 (dd, J=8,4, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,4 Гц, 1H), 3,94 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=406.
Пример 1-96: синтез 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Пример 1-96-1: получение 5-бром-3-метокси-2-((4-метоксибензил)окси)бензальдегида
К перемешанному раствору 5-бром-2-гидрокси-3-метоксибензальдегида (5,00 г, 21,64 ммоль), йодида калия (0,50 г, 3,01 ммоль) и карбоната калия (4,53 г, 32,46 ммоль) в N,N-диметилформамиде (30 мл) добавляли 4-метоксибензилхлорид (3,63 г, 22,72 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 3 смесь разделяли между водой и этилацетатом. Фазы разделяли и органическую фазу промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. Остаток перекристаллизовали из дихлорметана/гексанов с получением 6,20 г (81%) 5-бром-3-метокси-2-((4-метоксибензил)окси)бензальдегида в виде белого кристаллического твердого вещества.
Пример 1-96-2: получение 5-(6-бром-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
Указанное в заголовке соединение получали в ходе четырех стадий из 5-бром-3-метокси-2-((4-метоксибензил)окси)бензальдегида и 2-бром-1-(6-метоксипиридин-3-ил)этанона, как описано в примерах от 1-21-1 до 1-21-4.
Пример 1-96-3: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты
Указанное в заголовке соединение получали из 5-(6-бром-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина, как описано в примере 1-21-5.
Пример 1-96-4: получение (6-бромпиразоло[1,5-a]пиримидин-3-ил)(8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты и (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида (пример 1-21-7), как описано в примере 1-21-8.
Пример 1-96-5: получение 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из (6-бромпиразоло[1,5-a]пиримидин-3-ил)(8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола, как описано в примере 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 8,77 (d, J=2,2 Гц, 1H), 8,43 (d, J=2,2 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,94 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,50-6,48 (m, 2H), 5,08 (dd, J=8,3, 2,5 Гц, 1H), 4,28 (dd, J=11,5, 2,5 Гц, 1H), 4,11-4,01 (m, 3H), 3,93 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=483.
Пример 1-97: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
К перемешанному раствору 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (0,073 г, 0,15 ммоль, пример 1-96-4) в 1,4-диоксане (5 мл) добавляли триэтиламин (0,021 мл, 0,15 ммоль), муравьиную кислоту (0,007 мл, 0,15 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,018 г, 0,015 ммоль). Полученную в результате смесь нагревали до 100°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и фильтровали через целит. Фильтрат разделяли между водой и этилацетатом. Фазы разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,030 г (49%) 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,63 (dd, J=7,0, 1,8 Гц, 1H), 8,46 (dd, J=4,0, 1,8 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 7,97 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,69-6,88 (m, 2H), 6,61-6,47 (m, 2H), 5,08 (dd, J=8,4, 2,3 Гц, 1H), 4,28 (dd, J=11,5, 2,4 Гц, 1H), 4,17-4,01 (m, 3H), 3,93 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=405.
Пример 1-98: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-96-4) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) 8,20 (d, J=2,4 Гц, 1H), 8,07 (d, J=2,6 Гц, 1H), 7,84-7,73 (m, 2H), 7,62 (dd, J=8,6, 2,4 Гц, 1H), 6,82-6,71 (m, 1H), 6,62-6,45 (m, 2H), 5,08 (dd, J=8,4, 2,2 Гц, 1H), 4,46-4,34 (m, 1H), 4,32-4,23 (m, 1H), 4,22-3,99 (m, 5H), 3,93 (s, 3H), 3,82 (s, 3H), 3,75 (dd, J=8,0, 4,7 Гц, 2H), 3,36 (s, 3H) ppm; (M+1)=490.
Пример 1-99: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-96-4) и морфолина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) 8,42 (d, J=2,6 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,08 (d, J=2,6 Гц, 1H), 7,83 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,76 (d, J=8,6 Гц, 1H), 6,57-6,45 (m, 2H), 5,08 (dd, J=8,3, 2,3 Гц, 1H), 4,27 (dd, J=11,5, 2,4 Гц, 1H), 4,17-4,00 (m, 3H), 3,95-3,88 (m, 6H), 3,83-3,80 (m, 4H), 3,10 (dd, J=5,6, 3,8 Гц, 4H) ppm; (M+1)=490.
Пример 1-100: синтез 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
К перемешанной суспензии 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (0,090 г, 0,19 ммоль, пример 1-96-4) в толуоле (0,5 мл) добавляли метанол (0,075 мл, 1,86 ммоль), карбонат цезия (0,12 г, 0,37 ммоль) и [(2-ди-трет-бутилфосфино-3-метокси-6-метил-2′,4′,6′-триизопропил-1,1′-бифенил)-2-(2-аминобифенил)]палладия(II) метансульфонат. Смесь дегазировали с использованием азота, а затем ее нагревали при 100°C в герметизированном сосуде. Через 5 ч. обеспечивали охлаждение смеси до комнатной температуры. Смесь фильтровали через целит и фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 12 г силикагеля, элюент: 0-4% метанол/дихлорметан) получали 0,043 г (53%) 6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина в виде янтарного масла: 1H ЯМР (400 МГц, CDCl3) δ 8,35 (d, J=2,7 Гц, 1H), 8,20 (d, J=2,4 Гц, 1H), 8,18 (d, J=2,7 Гц, 1H), 7,84 (s, 1H), 7,62 (dd, J=8,7, 2,4 Гц, 1H), 6,77 (d, J=8,7 Гц, 1H), 6,52 (d, J=1,9 Гц, 1H), 6,50 (d, J=1,9 Гц, 1H), 5,08 (dd, J=8,4, 2,4 Гц, 1H), 4,28 (dd, J=11,5, 2,4 Гц, 1H), 4,09-4,02 (m, 3H), 3,93 (s, 3H), 3,87 (s, 3H), 3,82 (s, 3H) ppm: (M+1)=435.
Пример 1-101: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)пиразоло[1,5-a]пиримидина
Пример 1-101-1: получение трет-бутил-3-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)окси)азетидин-1-карбоксилата
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-96-4) и трет-бутил-3-гидроксиазетидин-1-карбоксилата, как описано в примере 1-100.
Пример 1-101-2: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из трет-бутил-3-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)окси)азетидин-1-карбоксилата, как описано в примере 1-72-2: 1H ЯМР (400 МГц, CDCl3) δ 8,32 (d, J=2,7 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,98 (d, J=2,7 Гц, 1H), 7,84 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 6,76 (d, J=8,6 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 6,49 (d, J=2,0 Гц, 1H), 5,08 (dd, J=8,4, 2,5 Гц, 1H), 4,74-4,68 (m, 1H), 4,27 (dd, J=11,5, 2,5 Гц, 1H), 4,09-4,02 (m, 3H), 3,93 (s, 3H), 3,86-3,80 (m, 5H), 3,24-3,17 (m, 2H), 2,43 (s, 3H) ppm; (M+1)=490.
Пример 1-102: синтез 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Пример 1-102-1: получение 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
К перемешанному раствору (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (2,30 г, 7,58 ммоль, пример 1-52-4) в дихлорметане (50 мл) добавляли периодинан Десса-Мартина (3,46 г, 7,91 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 30 мин. смесь разделяли между насыщенным раствором бикарбоната натрия и дихлорметаном. Фазы разделяли и органическую фазу промывали насыщенным раствором бикарбоната натрия (x 2), водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: от 50% этилацетат/гексаны до 100% этилацетата) получали 1,85 г (93%) 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида в виде белого твердого вещества.
Пример 1-102-2: получение 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида и 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2), как описано в примерах от 1-23-3 до 1-23-4: 1H ЯМР (400 МГц, CDCl3) δ 8,31 (d, J=2,3 Гц, 1H), 8,21 (d, J=2,4 Гц, 1H), 7,96 (d, J=2,4 Гц, 1H), 7,66-7,55 (m, 2H), 6,77 (dd, J=8,5, 0,7 Гц, 1H), 6,50-6,48 (m, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,33-4,20 (m, 3H), 4,07 (dd, J=11,5, 8,4 Гц, 1H), 3,94 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=439.
Пример 1-103: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (пример 1-102-2) и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,27 (d, J=2,0 Гц, 1H), 8,24-8,18 (m, 1H), 7,90 (d, J=2,0 Гц, 1H), 7,66-7,56 (m, 2H), 6,77 (dd, J=8,6, 0,8 Гц, 1H), 6,53-6,47 (m, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,33-4,21 (m, 3H), 4,07 (dd, J=11,5, 8,4 Гц, 1H), 3,94 (s, 3H), 3,82 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=486.
Пример 1-104: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)морфолина
К перемешанной суспензии 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (0,10 г, 0,23 ммоль, пример 1-102-2) в дегазированном толуоле (3 мл) добавляли ацетат палладия(II) (0,013 г, 0,057 ммоль), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (0,050 г, 0,10 ммоль), морфолин (0,071 мл, 0,80 ммоль) и 5,0 M раствор гидроксида калия (0,5 мл, 2,50 ммоль). Смесь нагревали до 120°C в микроволновом реакторе. Через 5 ч. смесь разделяли между водой и толуолом. Фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% смесь этилацетат/метанол/гидроксид аммония (85/10/5)/этилацетат) получали бежевый порошок. Данный порошок растирали с гексанами и твердое вещество выделяли фильтрованием и высушивали с получением 0,061 г (54%) 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)морфолина в виде бежевого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,26-8,18 (m, 2H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,37 (s, 1H), 7,08 (d, J=2,8 Гц, 1H), 6,77 (dd, J=8,5, 0,7 Гц, 1H), 6,50-6,48 (m, 2H), 5,08 (dd, J=8,4, 2,4 Гц, 1H), 4,28 (dd, J=11,5, 2,5 Гц, 1H), 4,18 (s, 2H), 4,06 (dd, J=11,5, 8,4 Гц, 1H), 3,94 (s, 3H), 3,93-3,86 (m, 4H), 3,82 (s, 3H), 3,24-3,17 (m, 4H) ppm; (M+1)=490.
Пример 1-105: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение, также известное как RA10813661, получали из 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (пример 1-102-2) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-104: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,4 Гц, 1H), 7,85 (d, J=2,7 Гц, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,31 (s, 1H), 6,77 (d, J=8,5 Гц, 1H), 6,68 (d, J=2,7 Гц, 1H), 6,52-6,44 (m, 2H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,40 (tt, J=6,1, 4,3 Гц, 1H), 4,33-4,13 (m, 5H), 4,06 (dd, J=11,5, 8,4 Гц, 1H), 3,94 (s, 3H), 3,90-3,79 (m, 5H), 3,36 (s, 3H) ppm; (M+1)=490.
Пример 1-106: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина
Пример 1-106-1: получение имидазо[1,2-a]пиридин-3-ил(8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
К перемешанному раствору 3-бромимидазо[1,2-a]пиридина (0,080 г, 0,39 ммоль) в тетрагидрофуране (4 мл) посредством шприца по каплям добавляли 3,0 M раствор бромида этилмагния в диэтиловом эфире (0,13 мл, 0,39 ммоль). Через 50 мин. светло-желтую суспензию обрабатывали раствором 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (0,10 г, 0,33 ммоль, пример 1-102-1) в тетрагидрофуране (4 мл) (добавляли посредством канюли). Обеспечивали перемешивание полученного в результате светло-зеленого раствора при комнатной температуре. Через 3,5 ч. смесь гасили путем добавления насыщенного раствора хлорида аммония (0,25 мл) и смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,085 г (61%) имидазо[1,2-a]пиридин-3-ил(8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола в виде белого твердого вещества.
Пример 1-106-2: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина
Указанное в заголовке соединение получали из имидазо[1,2-a]пиридин-3-ил(8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола, как описано в примере 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,5 Гц, 1H), 8,11 (d, J=9,1 Гц, 1H), 7,97 (d, J=6,9 Гц, 1H), 7,64-7,60 (m, 2H), 7,54-7,49 (m, 1H), 7,10-7,04 (m, 1H), 6,78 (dd, J=8,6, 0,7 Гц, 1H), 6,43 (d, J=2,0 Гц, 1H), 6,35 (d, J=2,0 Гц, 1H), 5,10 (dd, J=8,5, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,20 (s, 2H), 4,08 (dd, J=11,6, 8,5 Гц, 1H), 3,94 (s, 3H), 3,79 (s, 3H) ppm; (M+1)=404.
Пример 1-107: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (пример 1-102-1) и 3-бромимидазо[1,2-b]пиридазина, как описано в примерах от 1-106-1 до 1-106-2: 1H ЯМР (400 МГц, CDCl3) δ 8,36 (dd, J=4,4, 1,6 Гц, 1H), 8,21 (dt, J=2,5, 0,7 Гц, 1H), 8,00 (dd, J=9,2, 1,6 Гц, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,58 (s, 1H), 7,04 (dd, J=9,2, 4,4 Гц, 1H), 6,77 (dd, J=8,6, 0,7 Гц, 1H), 6,53-6,50 (m, 2H), 5,09 (dd, J=8,5, 2,4 Гц, 1H), 4,33-4,23 (m, 3H), 4,07 (dd, J=11,5, 8,5 Гц, 1H), 3,94 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=405.
Пример 1-108: синтез 7-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина
Пример 1-108-1: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(7-метоксиимидазо[1,2-a]пиридин-3-ил)метанола
К перемешанному и охлажденному (-78°C) раствору 5-(6-бром-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина (0,20 г, 0,57 ммоль, пример 1-96-2) в тетрагидрофуране (5 мл) добавляли 1,6 M раствор н-бутиллития в гексанах (0,43 мл, 0,68 ммоль). Через 5 мин. добавляли раствор 7-метоксиимидазо[1,2-a]пиридин-3-карбальдегида (0,10 г, 0,57 мкмоль) в тетрагидрофуране (2 мл). Через 30 мин. добавляли насыщенный раствор хлорида аммония и обеспечивали нагревание смеси до комнатной температуры. Смесь разделяли между водой и этилацетатом. Продукт не был растворим ни в органическом, ни в водном слоях (продукт осаждался между фазами). Органическую фазу (в том числе нерастворимый продукт) промывали солевым раствором и концентрировали. Остаток суспендировали в небольшом количестве этилацетата и белое твердое вещество собирали путем фильтрации. Твердое вещество суспендировали в дихлорметане и концентрировали до сухого состояния с получением 0,050 г (20%) (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(7-метоксиимидазо[1,2-a]пиридин-3-ил)метанола в виде белого твердого вещества.
Пример 1-108-2: получение 7-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина
Указанное в заголовке соединение получали из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(7-метоксиимидазо[1,2-a]пиридин-3-ил)метанола, как описано в примере 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,5 Гц, 1H), 7,66-7,56 (m, 2H), 7,36 (s, 1H), 6,92 (d, J=2,5 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,51-6,39 (m, 2H), 6,34 (d, J=2,1 Гц, 1H), 5,09 (dd, J=8,5, 2,5 Гц, 1H), 4,29 (dd, J=11,6, 2,5 Гц, 1H), 4,13-4,02 (m, 3H), 3,94 (s, 3H), 3,85 (s, 3H), 3,77 (s, 3H) ppm; (M+1)=434.
Пример 1-109: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Пример 1-109-1: получение 5-(6-(бромметил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина
К перемешанному раствору (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (0,30 г, 0,99 ммоль, пример 1-52-4) в тетрагидрофуране (25 мл) добавляли трифенилфосфиновую смолу (0,78 г, 2,34 ммоль). Смесь обрабатывали тетрабромидом углерода (0,33 г, 0,99 ммоль). Затем смесь нагревали до 80°C. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали через целит с помощью дихлорметана. Фильтрат концентрировали с получением неочищенного масла, которое применяли непосредственно в следующей реакции.
Пример 1-109-2: получение 3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Указанное в заголовке соединение получали из 5-(6-(бромметил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метоксипиридина и трет-бутил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин-1-карбоксилата, как описано в примере 1-55. С продукта данной реакции снимали защиту с помощью трифторуксусной кислоты, как описано в примере 1-12-5: 1H ЯМР (400 МГц, CDCl3) δ 8,71 (br s, 1H), 8,28 (d, J=3,2 Гц, 1H), 8,21 (d, J=2,2 Гц, 1H), 7,80 (d, J=7,8 Гц, 1H), 7,67-7,58 (m, 1H), 7,09 (d, J=2,2 Гц, 1H), 7,06-7,01 (m, 1H), 6,77 (d, J=8,6 Гц, 1H), 6,49 (d, J=2,1 Гц, 1H), 6,45 (d, J=2,1 Гц, 1H), 5,09 (dd, J=8,6, 2,3 Гц, 1H), 4,29 (dd, J=11,5, 2,3 Гц, 1H), 4,11-3,99 (m, 3H), 3,94 (s, 3H), 3,80 (s, 3H) ppm; (M+1)=404.
Пример 1-110: синтез 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-110-1: получение 1-(6-циклопропилпиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-бромпиридин-3-ил)этан-1-она и циклопропилбороновой кислоты, как описано в примере 1-55.
Пример 1-110-2: получение 2-бром-1-(6-циклопропилпиридин-3-ил)этан-1-она
К перемешанному раствору 33% бромистоводородной кислоты в уксусной кислоте (20 мл) добавляли 1-(6-циклопропилпиридин-3-ил)этанон (3,75 г, 23,26 ммоль). Обеспечивали перемешивание желтой суспензии при комнатной температуре. Через 20 мин. смесь обрабатывали раствором брома (4,48 г, 27,92 ммоль) в хлороформе (20 мл) (добавляли по каплям на протяжении 60 мин.). Обеспечивали перемешивание полученной в результате желто-оранжевой суспензии при комнатной температуре. Через 30 мин. (общее время реакции 120 мин.) смесь разбавляли этилацетатом (150 мл) и водой (150 мл). Кислотную двухфазную смесь нейтрализовали медленным добавлением твердого бикарбоната натрия. Сразу после достижения pH~7 фазы разделяли. Водную фазу экстрагировали этилацетатом (75 мл). Объединенные органические фазы промывали насыщенным раствором тиосульфата натрия (75 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold со 120 г силикагеля, элюент: 10-20% этилацетат/гептан) получали 4,16 г (75%) 2-бром-1-(6-циклопропилпиридин-3-ил)этанона в виде красно-коричневого масла, которое затвердевало при отстаивании.
Пример 1-110-3: получение метил-2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (A) и метил-8-метокси-2-(6-пропилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (B)
Указанное в заголовке соединение получали в ходе трех стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-циклопропилпиридин-3-ил)этанона, как описано в примерах от 1-52-1 до 1-52-3. н-Пропильный аналог также выделяли из данной последовательности.
Пример 1-110-4: получение (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе трех стадий из метил-2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата, как описано в примерах от 1-52-4 до 1-52-6.
Пример 1-110-5: получение 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10607080, получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=2,3 Гц, 1H), 8,44 (dd, J=4,8, 1,5 Гц, 1H), 8,09 (dd, J=8,0, 1,5 Гц, 1H), 8,04 (s, 1H), 7,59-7,55 (m, 1H), 7,29-7,25 (m, 1H), 7,16 (dd, J=8,2, 0,8 Гц, 1H), 6,56-6,52 (m, 2H), 5,37 (s, 2H), 5,11 (dd, J=8,3, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,3 Гц, 1H), 3,80 (s, 3H) 2,09-1,97 (m, 1H), 1,05-0,95 (m, 4H) ppm; (M+1)=415.
Пример 1-111: синтез 1-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и 1-фтор-2-нитробензола, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=2,3 Гц, 1H), 7,94 (s, 1H), 7,87-7,79 (m, 1H), 7,62-7,54 (m, 1H), 7,35-7,30 (m, 1H), 7,30-7,25 (m, 2H), 7,18-7,14 (m, 1H), 6,45 (d, J=2,0 Гц, 1H), 6,35 (d, J=2,0 Гц, 1H), 5,25 (s, 2H), 5,11 (dd, J=8,4, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,77 (s, 3H), 2,08-1,99 (m, 5,6 Гц, 1H), 1,06-0,96 (m, 4H) ppm; (M+1)=414.
Пример 1-112: синтез 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-метил-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и 2-хлор-6-метил-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,47 (d, J=2,4 Гц, 1H), 7,97-7,92 (m, 2H), 7,58 (dd, J=8,1, 2,4 Гц, 1H), 7,16 (dd, J=8,2, 0,8 Гц, 1H), 7,12 (d, J=8,2 Гц, 1H), 6,58 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,33 (s, 2H), 5,11 (dd, J=8,3, 2,5 Гц, 1H), 4,31 (dd, J=11,5, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 3,81 (s, 3H), 2,68 (s, 3H), 2,07-1,99 (m, 1H), 1,05-0,97 (m, 4H) ppm; (M+1)=429.
Пример 1-113: синтез 1-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-имидазо[4,5-c]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и 4-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, Хлороформ-d) δ 9,15 (s, 1H), 8,47 (d, J=2,3 Гц, 1H), 8,43 (d, J=5,6 Гц, 1H), 7,99 (s, 1H), 7,58 (dd, J=8,2, 2,3 Гц, 1H), 7,28 (dd, J=5,6, 0,8 Гц, 1H), 7,17 (dd, J=8,2, 0,8 Гц, 1H), 6,44 (d, J=2,0 Гц, 1H), 6,34 (d, J=2,0 Гц, 1H), 5,26 (s, 2H), 5,12 (dd, J=8,3, 2,5 Гц, 1H), 4,33 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 3,78 (s, 3H), 2,08-2,00 (m, 1H), 1,05-0,98 (m, 4H) ppm; (M+1)=415.
Пример 1-114: синтез 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиразина
Пример 1-114-1: получение 2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоновой кислоты
Указанное в заголовке соединение получали из 2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (пример 1-110-3A), как описано в примере 1-18-5.
Пример 1-114-2: получение 2-бром-1-(2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)этан-1-она
К перемешанной суспензии 2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоновой кислоты (0,48 г, 1,45 ммоль) в дихлорметане (20 мл) и N,N-диметилформамиде (0,050 мл) добавляли оксалилхлорид (0,30 мл, 3,51 ммоль). Отмечали растворение твердых веществ и быстрое выделение газа. Для смеси обеспечивали перемешивание при комнатной температуре. Через 90 мин. раствор концентрировали с получением 0,55 г 2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбонилхлорида гидрохлорида в виде белого твердого вещества. Данный материал суспендировали в смеси 1:1 тетрагидрофуран/ацетонитрил (20 мл) и добавляли по каплям на протяжении 10 мин. к перемешанной и охлажденной (0°C) смеси 2,0 M раствора (триметилсилил)диазометана в диэтиловом эфире (9,0 мл, 18,00 ммоль) и тетрагидрофуране (15 мл). Обеспечивали перемешивание полученной в результате желтой смеси при 0°C. Через 1 ч. ледяную баню удаляли и обеспечивали нагревание желтой смеси до комнатной температуры. Через 19 ч. смесь повторно охлаждали до 0°C при добавлении по каплям 48% бромистоводородной кислоты в воде (6,0 мл, 53,40 ммоль) на протяжении 5 мин. (при добавлении отмечали активное выделение газа). Через 10 мин. смесь разбавляли водой (50 мл) и pH доводили до ~ 8 путем добавления твердого бикарбоната натрия. Фазы разделяли и основную смесь экстрагировали этилацетатом (40 мл). Объединенные органические фазы промывали солевым раствором (30 мл), высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 20-50% этилацетат/гептан) получали 0,32 г (56%) 2-бром-1-(2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона в виде белого твердого вещества.
Пример 1-114-3: получение (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(имидазо[1,2-a]пиразин-3-ил)метанона
К перемешанному раствору 2-бром-1-(2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)этанона (0,32 мг, 0,80 ммоль) в ацетонитриле (25 мл) добавляли (E)-N,N-диметил-N'-(пиразин-2-ил)формимидамид (0,18 г, 1,17 ммоль). Желтый раствор нагревали до температуры возврата флегмы. Через 42 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% 2 M аммиака в метаноле/дихлорметане) получали 0,096 г (28%) (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(имидазо[1,2-a]пиразин-3-ил)метанона в виде желтовато-коричневого твердого вещества.
Пример 1-114-4: получение 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиразина
К перемешанному и охлажденному (0°C) раствору (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(имидазо[1,2-a]пиразин-3-ил)метанона (0,096 г, 0,22 ммоль) в метаноле (10 мл) добавляли борогидрид натрия (0,025 г, 0,65 ммоль). Через 30 мин. смесь обрабатывали 1 н. раствором хлористоводородной кислоты (1 мл) и концентрировали. Остаток растворяли в трифторуксусной кислоте (5 мл) и обрабатывали триэтилсиланом (0,079 г, 0,67 ммоль). Обеспечивали перемешивание полученной в результате желтой смеси при комнатной температуре. Через 30 мин. добавляли дополнительную порцию триэтилсилана (0,47 г) и обеспечивали перемешивание реакционной смеси. Через 2 ч. смесь концентрировали и остаток разделяли между хлороформом (20 мл) и насыщенным раствором бикарбоната натрия (20 мл). Фазы разделяли и водную фазу экстрагировали хлороформом (2×20 мл). Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 12 г силикагеля, элюент: 0-5% 2 M аммиак в метаноле/дихлорметане) получали 0,015 г (16%) 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиразина в виде желтого масла: 1H ЯМР (400 МГц, CDCl3) δ 9,09 (d, J=1,5 Гц, 1H), 8,47 (d, J=2,4 Гц, 1H), 7,83 (d, J=4,6 Гц, 1H), 7,75 (dd, J=4,6, 1,5 Гц, 1H), 7,68 (s, 1H), 7,58 (dd, J=8,2, 2,4 Гц, 1H), 7,16 (dd, J=8,2 Гц, 1H), 6,39 (d, J=2,0 Гц, 1H), 6,33 (d, J=2,0 Гц, 1H), 5,11 (dd, J=8,4, 2,5 Гц, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,19 (s, 2H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,78 (s, 3H), 2,07-2,00 (m, 1H), 1,06-0,94 (m, 5H) ppm; (M+1)=415.
Пример 1-115: синтез 9-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-9H-пурина
Пример 1-115-1: получение (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали из метил-2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (пример 1-110-3A), как описано в примере 1-52-4.
Пример 1-115-2: получение 9-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-9H-пурина
К перемешанному раствору (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (0,28 г, 0,89 ммоль), 9H-пурина (0,11 г, 0,89 ммоль) и трифенилфосфина (0,33 г, 1,25 ммоль) в тетрагидрофуране (15 мл) добавляли раствор (E)-бис(2-метоксиэтил)диазен-1,2-дикарбоксилата (0,29 г, 1,25 ммоль) в тетрагидрофуране (5 мл). Обеспечивали перемешивание полученной в результате желтой смеси при комнатной температуре. Через 3 ч. смесь разбавляли этилацетатом (50 мл). Органическую фазу промывали водой (50 мл) и солевым раствором (50 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 24 г силикагеля, элюент: от 100% гептана до 5% метанол/дихлорметан) получали загрязненное белое твердое вещество. При помощи второй хроматографической очистки (CombiFlash, колонка Gold с 24 г силикагеля, элюент: 0-5% метанол/дихлорметан) получали 0,075 г (20%) 9-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-9H-пурина в виде белого твердого вещества: 1H ЯМР (400 МГц, Хлороформ-d) δ 9,17 (s, 1H), 9,04 (s, 1H), 8,46 (d, J=2,2 Гц, 1H), 8,08 (s, 1H), 7,57 (dd, J=8,1, 2,2 Гц, 1H), 7,16 (d, J=8,1 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,35 (s, 2H), 5,11 (dd, J=8,3, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 3,82 (s, 3H), 2,07-2,00 (m, 1H), 1,04-0,98 (m, 4H) ppm; (M+1)=416.
Пример 1-116: синтез 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина
Пример 1-116-1: получение 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-116-2: получение 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе двух стадий из 3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и трет-бутил-3-гидроксиазетидин-1-карбоксилата, как описано в примерах от 1-72-1 до 1-72-2: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=2,4 Гц, 1H), 8,14 (d, J=2,6 Гц, 1H), 7,98 (s, 1H), 7,57 (dd, J=8,1, 2,4 Гц, 1H), 7,41 (d, J=2,6 Гц, 1H), 7,16 (d, J=8,1 Гц, 1H), 6,55-6,49 (m, 2H), 5,32 (s, 2H), 5,10 (dd, J=8,3, 2,4 Гц, 1H), 4,84-4,75 (m, 1H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,3 Гц, 1H), 3,92-3,83 (m, 2H), 3,80 (s, 3H), 3,23-3,11 (m, 2H), 2,43 (s, 3H), 2,06-1,99 (m, 1H), 1,04-0,95 (m, 4H) ppm; (M+1)=500.
Пример 1-117: синтез (3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Пример 1-117-1: получение метил-3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина (пример 1-110-4) и метил-6-хлор-5-нитроникотината, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-117-2: получение (3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Указанное в заголовке соединение получали из метил-3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата, как описано в примере 1-52-4: 1H ЯМР (400 МГц, CDCl3) δ 8,48-8,43 (m, 2H), 8,09 (d, J=1,9 Гц, 1H), 8,05 (s, 1H), 7,57 (dd, J=8,1, 2,4 Гц, 1H), 7,15 (d, J=8,1 Гц, 1H), 6,55-6,50 (m, 2H), 5,36 (s, 2H), 5,10 (dd, J=8,3, 2,5 Гц, 1H), 4,86 (s, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,05 (dd, J=11,6, 8,3 Гц, 1H), 3,80 (s, 3H), 2,19 (br s, 1H), 2,09-1,98 (m, 1H), 1,05-0,95 (m, 4H) ppm; (M+1)=445.
Пример 1-118: синтез 4-(3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-118-1: получение 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-метилпиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-118-2: получение 4-(3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,53 (d, J=2,3 Гц, 1H), 8,46 (d, J=1,8 Гц, 1H), 8,11-8,01 (m, 2H), 7,63 (dd, J=8,0, 2,4 Гц, 1H), 7,19 (d, J=8,0 Гц, 1H), 6,55-6,51 (m, 2H), 5,34 (s, 2H), 5,14 (dd, J=8,4, 2,4 Гц, 1H), 4,33 (dd, J=11,7, 2,4 Гц, 1H), 4,06 (dd, J=11,7, 8,4 Гц, 1H), 3,81 (s, 3H), 2,57 (s, 3H), 1,56 (s, 6H) ppm; (M+1)=470.
Пример 1-119: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина гидрохлорида
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 118-1-1) и 2-метил-1H-имидазола, как описано в примере 1-67: 1H ЯМР (400 МГц, DMSO-d6) δ 8,88 (s, 1H), 8,76-8,70 (m, 1H), 8,65 (d, J=2,0 Гц, 1H), 8,51 (d, J=2,3 Гц, 1H), 8,27 (d, J=8,5 Гц, 1H), 7,93 (d, J=2,0 Гц, 1H), 7,84-7,74 (m, 2H), 6,86 (d, J=1,8 Гц, 1H), 6,57 (d, J=1,8 Гц, 1H), 5,47 (s, 2H), 5,39 (d, J=7,5 Гц, 1H), 4,50-4,42 (m, 1H), 4,20 (dd, J=11,6, 7,8 Гц, 1H), 3,78 (s, 3H), 2,67 (s, 3H), 2,55 (s, 3H) ppm; (M+1)=469.
Пример 1-120: синтез 6-метокси-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 118-1-1) и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,54 (s, 1H), 8,22 (s, 1H), 8,10 (s, 1H), 7,70-7,60 (m, 2H), 7,21 (d, J=8,0 Гц, 1H), 6,55-6,51 (m, 2H), 5,34 (s, 2H), 5,17-5,13 (m, 1H), 4,33 (dd, J=11,6, 2,3 Гц, 1H), 4,07 (dd, J=11,6, 8,1 Гц, 1H), 3,91 (s, 3H), 3,81 (s, 3H), 2,59 (s, 3H) ppm; (M+1)=419.
Пример 1-120-1: хиральное разделение 6-метокси-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-121: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 118-1-1), как описано в примере 1-97: 1H ЯМР (400 МГц, CDCl3) δ 8,54 (s, 1H), 8,48-8,42 (m, 1H), 8,13-8,09 (m, 2H), 7,63 (dd, J=8,1, 2,3 Гц, 1H), 7,31-7,24 (m, 1H), 7,19 (d, J=8,0 Гц, 1H), 6,57-6,53 (m, 2H), 5,38 (s, 2H), 5,14 (dd, J=8,3, 2,5 Гц, 1H), 4,33 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 3,81 (s, 3H), 2,57 (s, 3H) ppm; (M+1)=389.
Пример 1-122: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 118-1-1) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, Хлороформ-d) δ 8,53 (d, J=2,3 Гц, 1H), 7,92 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,63 (dd, J=8,0, 2,3 Гц, 1H), 7,22-7,12 (m, 2H), 6,54-6,50 (m, 2H), 5,30 (s, 2H), 5,13 (dd, J=8,3, 2,4 Гц, 1H), 4,45-4,28 (m, 2H), 4,22-4,18 (m, 2H), 4,06 (dd, J=11,6, 8,3 Гц, 1H), 3,83-3,72 (m, 5H), 3,36 (s, 3H), 2,57 (s, 3H) ppm; (M+1)=474.
Пример 1-123: синтез 1-(3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-3-ола
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 118-1-1) и 3-гидроксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,53 (d, J=2,4 Гц, 1H), 7,93 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,63 (dd, J=8,1, 2,4 Гц, 1H), 7,19 (d, J=8,0 Гц, 1H), 7,15 (d, J=2,5 Гц, 1H), 6,54-6,50 (m, 2H), 5,30 (s, 2H), 5,13 (dd, J=8,3, 2,4 Гц, 1H), 4,83 (d, J=5,7 Гц, 1H), 4,32 (dd, J=11,6, 2,4 Гц, 1H), 4,29-4,23 (m, 2H), 4,06 (dd, J=11,6, 8,3 Гц, 1H), 3,80 (s, 3H), 3,76-3,72 (m, 2H), 2,57 (s, 3H) ppm; (M+H)=460.
Пример 1-124: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина
Пример 1-124-1: получение (8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали в ходе четырех стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-метилпиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-4.
Пример 1-124-2: получение 8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
Указанное в заголовке соединение получали из (8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола, как описано в примере 1-102-1.
Пример 1-124-3: получение 7-хлор-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида и 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2), как описано в примерах от 1-23-3 до 1-23-4.
Пример 1-124-4: получение 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение, также известное как RA10854918, получали из 7-хлор-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (пример 1-102-2) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-104: 1H ЯМР (400 МГц, CDCl3) δ 8,54 (d, J=2,2 Гц, 1H), 7,83 (d, J=2,7 Гц, 1H), 7,64 (dd, J=8,0, 2,2 Гц, 1H), 7,32 (s, 1H), 7,18 (d, J=8,0 Гц, 1H), 6,63 (d, J=2,7 Гц, 1H), 6,55-6,46 (m, 2H), 5,13 (dd, J=8,3, 2,4 Гц, 1H), 4,44-4,24 (m, 2H), 4,24-4,14 (m, 4H), 4,06 (dd, J=11,5, 8,3 Гц, 1H), 3,87-3,79 (m, 5H), 3,36 (s, 3H), 2,57 (s, 3H) ppm; (M+1)=474.
Пример 1-125: синтез 3-((8-метокси-2-(6-пропилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе шести стадий из метил-8-метокси-2-(6-пропилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбоксилата (пример 1-110-3B) и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-4 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,56 (d, J=2,3 Гц, 1H), 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,09 (dd, J=8,1, 1,5 Гц, 1H), 8,05 (s, 1H), 7,64 (dd, J=8,0, 2,3 Гц, 1H), 7,27 (dd, J=8,1, 4,8 Гц, 3H), 7,18 (d, J=8,0 Гц, 1H), 6,56-6,54 (m, 2H), 5,38 (s, 2H), 5,13 (dd, J=8,5, 2,5 Гц, 1H), 4,33 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,81 (s, 3H), 2,82-2,73 (m, 2H), 1,80-1,68 (m, 2H), 0,96 (t, J=7,3 Гц, 3H) ppm; (M+1)=417.
Пример 1-126: синтез 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-126-1: получение 2-бром-1-(6-этилпиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-этилпиридин-3-ил)этан-1-она и брома, как описано в примере 1-110-2.
Пример 1-126-2: получение (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина
Указанное в заголовке соединение получали в ходе шести стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-этилпиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-6.
Пример 1-126-3: получение 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) 8,56 (d, J=2,2 Гц, 1H), 8,45 (dd, J=4,8, 1,4 Гц, 1H), 8,10 (dd, J=8,0, 1,4 Гц, 1H), 8,05 (s, 1H), 7,66 (dd, J=8,1, 2,3 Гц, 1H), 7,33-7,24 (m, 1H), 7,20 (d, J=8,1 Гц, 1H), 6,56-6,54 (m, 2H), 5,38 (s, 2H), 5,14 (dd, J=8,3, 2,5 Гц, 1H), 4,33 (dd, J=11,6, 2,5 Гц, 1H), 4,08 (dd, J=11,6, 8,3 Гц, 1H), 3,81 (s, 3H), 2,84 (q, J=7,6 Гц, 2H), 1,30 (t, J=7,6 Гц, 3H) ppm; (M+1)=403.
Пример 1-127: синтез 4-(3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Пример 1-127-1: получение 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-127-2: получение 4-(3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и морфолина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,56 (d, J=2,2 Гц, 1H), 8,25 (d, J=2,5 Гц, 1H), 7,97 (s, 1H), 7,79-7,54 (m, 2H), 7,20 (d, J=8,1 Гц, 1H), 6,54-6,52 (m, 2H), 5,31 (s, 2H), 5,14 (dd, J=8,3, 2,4 Гц, 1H), 4,33 (dd, J=11,6, 2,4 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 4,00-3,88 (m, 4H), 3,81 (s, 3H), 3,20-3,16 (m, 4H), 2,83 (q, J=7,6 Гц, 2H), 1,30 (t, J=7,6 Гц, 3H); (M+1)=488.
Пример 1-128: синтез 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе двух стадий из 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-127-1) и трет-бутил-3-гидроксиазетидин-1-карбоксилата, как описано в примерах от 1-72-1 до 1-72-2: 1H ЯМР (400 МГц, CDCl3 δ 8,55 (d, J=1,7 Гц, 1H), 8,14 (d, J=2,5 Гц, 1H), 7,98 (s, 1H), 7,65 (dd, J=8,0, 2,1 Гц, 1H), 7,40 (d, J=2,5 Гц, 1H), 7,20 (d, J=8,1 Гц, 1H), 6,54-6,52 (m, 2H), 5,31 (s, 2H), 5,15-5,11(m, 1H), 4,86-4,74 (m, 1H), 4,33 (dd, J=11,6, 2,4 Гц, 1H), 4,07 (dd, J=11,6, 8,3 Гц, 1H), 3,99-3,73 (m, 5H), 3,18 (dd, J=8,0, 6,2 Гц, 2H), 2,83 (q, J=7,6 Гц, 2H), 2,43 (s, 3H), 1,29 (t, J=7,6 Гц, 3H); (M+1)=488.
Пример 1-129: синтез 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,57-8,55 (m, 1H), 8,21 (d, J=2,6 Гц, 1H), 7,98 (s, 1H), 7,69-7,63 (m, 1H), 7,59 (d, J=2,6 Гц, 1H), 7,20 (d, J=8,0 Гц, 1H), 6,54-6,52 (m, 2H), 5,33 (s, 2H), 4,33 (dd, J=11,6, 2,4 Гц, 1H), 4,11-4,04 (m, 2H), 3,91 (s, 3H), 3,81 (s, 3H), 2,84 (q, J=7,6 Гц, 2H), 1,30 (t, J=7,6 Гц, 3H); (M+1)=433.
Пример 1-130: синтез 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метоксипиразоло[1,5-a]пиримидина
Пример 1-130-1: получение (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-2-((4-метоксибензил)окси)фенола (пример 1-21-1) и 2-бром-1-(6-этилпиридин-3-ил)этан-1-она (пример 1-126-1), как описано в примерах от 1-21-2 до 1-21-5.
Пример 1-130-2: получение 6-бром-3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из (2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)бороновой кислоты и (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида (пример 1-21-7), как описано в примере 1-21-8.
Пример 1-130-3: получение 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метоксипиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина и метанола, как описано в примере 1-100: 1H ЯМР (400 МГц, CDCl3) δ 8,56 (d, J=2,4 Гц, 1H), 8,35 (d, J=2,7 Гц, 1H), 8,18 (d, J=2,7 Гц, 1H), 7,84 (s, 1H), 7,66 (dd, J=8,0, 2,4 Гц, 1H), 7,19 (d, J=8,0 Гц, 1H), 6,52 (d, J=1,9 Гц, 1H), 6,50 (d, J=1,9 Гц, 1H), 5,13 (dd, J=8,3, 2,5 Гц, 1H), 4,31 (dd, J=11,5, 2,5 Гц, 1H), 4,11-4,03 (m, 3H), 3,87 (s, 3H), 3,82 (s, 3H), 2,83 (q, J=7,6 Гц, 2H), 1,29 (t, J=7,6 Гц, 3H) ppm; (M+1)=433.
Пример 1-131: синтез 3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-130-2) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,56 (d, J=2,4 Гц, 1H), 8,07 (d, J=2,6 Гц, 1H), 7,79 (d, J=2,6 Гц, 1H), 7,77 (s, 1H), 7,66 (dd, J=8,1, 2,4 Гц, 1H), 7,19 (d, J=8,1 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 5,12 (dd, J=8,4, 2,5 Гц, 1H), 4,45-4,36 (m, 1H), 4,31 (dd, J=11,5, 2,5 Гц, 1H), 4,21-4,14 (m, 2H), 4,11-4,03 (m, 3H), 3,82 (s, 3H), 3,78-3,73 (m, 2H), 3,36 (s, 3H), 2,83 (q, J=7,6 Гц, 2H), 1,29 (t, J=7,6 Гц, 3H) ppm; (M+1)=488.
Пример 1-132: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(трифторметил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-метилпиридин-3-ил)этан-1-она и 2-хлор-3-нитро-5-(трифторметил)пиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,74 (s, 1H), 8,55 (s, 1H), 8,35 (s, 1H), 8,20 (s, 1H), 7,65 (d, J=8,2 Гц, 1H), 7,21 (d, J=8,2 Гц, 1H), 6,58-6,56 (m, 2H), 5,42 (s, 2H), 5,17-5,15 (m, 1H), 4,37-4,33 (m, 1H), 4,11-4,06 (m, 1H), 3,84 (s, 3H), 2,59 (s, 3H) ppm; (M+1)=457.
Пример 1-133: синтез 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Пример 1-133-1: получение 4,6-диметилникотиноилхлорида гидрохлорида
Перемешанную суспензию 4,6-диметилникотиновой кислоты (4,32 г, 28,58 ммоль) в тионилхлориде (30 мл) нагревали до температуры возврата флегмы. Через 30 мин. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали с получением 5,89 г (100%) 4,6-диметилникотиноилхлорида гидрохлорида в виде коричневого твердого вещества.
Пример 1-133-2: получение 2-бром-1-(4,6-диметилпиридин-3-ил)этан-1-она
К перемешанному и охлажденному (0°C) раствору 4,6-диметилникотиноилхлорида гидрохлорида (5,89 г, 28,58 ммоль) в ацетонитриле (50 мл) по каплям на протяжении 30 минут добавляли 2,0 M раствор триметилсилилдиазометана (в гексанах) (57,2 мл, 144,33 ммоль). После завершения добавления обеспечивали нагревание смеси до комнатной температуры. Через 3 ч. смесь обрабатывали водным 48% раствором бромистоводородной кислоты (10 мл). Через 30 мин. смесь разбавляли этилацетатом и смесь нейтрализовали путем добавления твердого бикарбоната натрия. Фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 15-70% этилацетат/гептан) получали 1,35 г (21%) 2-бром-1-(4,6-диметилпиридин-3-ил)этан-1-она в виде бежевого твердого вещества.
Пример 1-133-3: получение 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(4,6-диметилпиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-133-4: получение 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,49 (s, 1H), 8,22 (d, J=2,6 Гц, 1H), 8,02 (s, 1H), 7,61 (d, J=2,6 Гц, 1H), 7,00 (s, 1H), 6,56-6,53 (m, 2H), 5,34 (s, 2H), 5,32-5,22 (m, 1H), 4,31 (dd, J=11,7, 2,4 Гц, 1H), 4,08 (dd, J=11,7, 8,7 Гц, 1H), 3,90 (s, 3H), 3,80 (s, 3H), 2,53 (s, 3H), 2,37 (s, 3H) ppm; (M+1)=433.
Пример 1-134: синтез 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,48 (s, 1H), 7,93 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,15 (d, J=2,5 Гц, 1H), 6,98 (s, 1H), 6,54 (d, J=2,0 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 5,27 (dd, J=9,0, 2,4 Гц, 1H), 4,43-4,36 (m, 1H), 4,30 (dd, J=11,7, 2,4 Гц, 1H), 4,23-4,16 (m, 2H), 4,08 (dd, J=11,7, 8,8 Гц, 1H), 3,83-3,72 (m, 4H), 3,36 (s, 3H), 2,51 (s, 3H), 2,35 (s, 3H) ppm; (M+1)=488.
Пример 1-135: синтез 4-(3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-135-1: получение 6-йод-3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(4-метоксифенил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-135-2: получение 4-(3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,04 (s, 1H), 7,36-7,28 (m, 2H), 6,96-6,86 (m, 2H), 6,53 (d, J=2,0 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,05 (dd, J=8,7, 2,4 Гц, 1H), 4,29 (dd, J=11,6, 2,4 Гц, 1H), 4,02 (dd, J=11,6, 8,7 Гц, 1H), 3,81 (s, 3H), 3,80 (s, 3H), 1,66 (br s, 2H), 1,54 (s, 6H) ppm; (M+1)=485.
Пример 1-136: синтез 3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-имидазола, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,49 (d, J=1,8 Гц, 1H), 8,15-8,06 (m, 2H), 7,68 (s, 1H), 7,37-7,28 (m, 2H), 7,20 (s, 1H), 6,95-6,88 (m, 2H), 6,57-6,55 (m, 2H), 5,40 (s, 2H), 5,06 (dd, J=8,8, 2,5 Гц, 1H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,03 (dd, J=11,6, 8,6 Гц, 1H), 3,83 (s, 3H), 3,81 (s, 3H), 3,70 (s, 3H) ppm; (M+1)=484.
Пример 1-137: синтез 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина гидрохлорида
Пример 1-137-1: получение (2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали в ходе четырех стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(4-(дифторметокси)фенил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-4.
Пример 1-137-2: получение 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина гидрохлорида
К перемешанному раствору 6-бром-1H-имидазо[4,5-b]пиридина (0,67 г, 3,38 ммоль) и (2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (1,00 г, 2,96 ммоль) в толуоле (30 мл) добавляли цианометилентрибутилфосфоран (1,13 г, 4,43 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 1,5 ч. смесь подогревали до 60°C и продолжали перемешивание. Через 2,5 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 40 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,55 г (36%) 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества. Небольшую порцию данного материала обрабатывали избытком 4 M хлороводорода в 1,4-диоксане с получением 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина гидрохлорида в виде белого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 9,45 (s, 1H), 8,82 (d, J=2,0 Гц, 1H), 8,51 (d, J=2,0 Гц, 1H), 7,50-7,46 (m, 2H), 7,21-7,14 (m, 2H), 7,03-6,63 (m, 3H), 5,58 (s, 2H), 5,13 (dd, J=8,3, 2,5 Гц, 1H), 4,38 (dd, J=11,6, 2,5 Гц, 1H), 4,02 (dd, J=11,6, 8,3 Гц, 1H), 3,83 (s, 3H) ppm; (M+1)=518.
Пример 1-138: синтез 3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина гидрохлорида
К перемешанному раствору 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,050 г, 0,096 ммоль) в метаноле (10 мл) добавляли 10% палладий на угле (0,070 г). Суспензию дегазировали и заполняли азотом (x 3). Смесь снова дегазировали и добавляли водород из баллона. Через 40 мин. смесь фильтровали через целит с помощью дихлорметана. Фильтрат концентрировали, растворяли в дихлорметане и повторно фильтровали через 0,1-мкм TF-фильтр. Фильтрат обрабатывали избытком 4 M хлороводорода в 1,4-диоксане. Смесь концентрировали и остаток суспендировали в этилацетате. Суспензию концентрировали и остаток повторно суспендировали в этилацетате/диэтиловом эфире (~1/5). Жидкую фазу декантировали и твердые вещества промывали диэтиловым эфиром и высушивали с получением 0,020 г (44%) 3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина гидрохлорида в виде белого твердого вещества: 1H ЯМР (400 МГц, CD3OD) δ 9,49 (s, 1H), 8,75 (dd, J=4,8, 1,3 Гц, 1H), 8,29 (dd, J=8,3, 1,3 Гц, 1H), 7,68 (dd, J=8,3, 4,8 Гц, 1H), 7,52-7,44 (m, 2H), 7,22-7,12 (m, 2H), 7,03-6,63 (m, 3H), 5,62 (s, 2H), 5,13 (dd, J=8,3, 2,4 Гц, 1H), 4,38 (dd, J=11,6, 2,5 Гц, 1H), 4,02 (dd, J=11,6, 8,3 Гц, 1H), 3,83 (s, 3H) ppm; (M+1)=440.
Пример 1-139: синтез 4-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-137-2) и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,10 (d, J=1,8 Гц, 1H), 8,06 (s, 1H), 7,41 (d, J=8,6 Гц, 2H), 7,15 (d, J=8,6 Гц, 2H), 6,74-6,25 (m, 3H), 5,34 (s, 2H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,32 (dd, J=11,6, 2,4 Гц, 1H), 4,01 (dd, J=11,6, 8,5 Гц, 1H), 3,81 (s, 3H), 1,56 (s, 6H) ppm; (M+1)=522.
Пример 1-140: синтез 1-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-N,N-диметилазетидин-3-амина
Указанное в заголовке соединение получали из 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-137-2) и N,N-диметилазетидин-3-амина гидробромида, как описано в примере 1-65: 1H ЯМР (400 МГц, CDCl3) δ 7,92 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,46-7,37 (m, 2H), 7,18-7,09 (m, 3H), 6,74-6,27 (m, 3H), 5,29 (s, 2H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,31 (dd, J=11,6, 2,4 Гц, 1H), 4,13-3,97 (m, 4H), 3,80 (s, 3H), 3,74-3,68 (m, 2H), 2,23 (s, 6H) ppm; (M+1)=538.
Пример 1-141: синтез 3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-амина
Указанное в заголовке соединение получали из 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-137-2) и метиламина, как описано в примере 1-65: 1H ЯМР (400 МГц, CDCl3) δ 7,95 (d, J=2,5 Гц, 1H), 7,94-7,90 (m, 1H), 7,45-7,38 (m, 2H), 7,28 (d, J=2,5 Гц, 1H), 7,18-7,13 (m, 2H), 6,71-6,30 (m, 3H), 5,30 (s, 2H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,31 (dd, J=11,6, 2,4 Гц, 1H), 4,01 (dd, J=11,6, 8,5 Гц, 1H), 3,81 (s, 3H), 2,91 (s, 3H) ppm; (M+1)=469.
Пример 1-142: синтез 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Пример 1-142-1: получение 2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
Указанное в заголовке соединение получали из (2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола и оксида марганца(IV), как описано в примере 1-86-3.
Пример 1-142-2: получение (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали из 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2) и 2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида, как описано в примере 1-23-3.
Пример 1-142-3: получение 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали из (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола, как описано в примере 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 8,35 (d, J=2,3 Гц, 1H), 8,07 (d, J=2,4 Гц, 1H), 7,58 (s, 1H), 7,43 (d, J=8,6 Гц, 2H), 7,15 (d, J=8,6 Гц, 2H), 6,69-6,32 (m, 3H), 5,11 (dd, J=8,5, 2,4 Гц, 1H), 4,31 (dd, J=11,6, 2,4 Гц, 1H), 4,23 (s, 2H), 4,02 (dd, J=11,6, 8,5 Гц, 1H), 3,84 (s, 3H) ppm; (M+1)=474.
Пример 1-143: синтез 1-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-3-метилазетидин-3-ола
Указанное в заголовке соединение получали из 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина и 3-метилазетидин-3-ола гидрохлорида, как описано в примере 1-104: 1H ЯМР (400 МГц, CDCl3) δ 7,73 (d, J=2,8 Гц, 1H), 7,44-7,42 (m, 2H), 7,17-7,12 (m, 2H), 6,69-6,31 (m, 5H), 5,09 (dd, J=8,5, 2,4 Гц, 1H), 4,30 (dd, J=11,5, 2,4 Гц, 1H), 4,12 (s, 2H), 4,04-3,93 (m, 4H), 3,91-3,86 (m, 2H), 3,82 (s, 3H), 1,64 (s, 3H) ppm; (M+1)=525.
Пример 1-144: синтез 3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (RA10878158)
Указанное в заголовке соединение выделяли в виде побочного продукта из примера 1-143: 1H ЯМР (400 МГц, CDCl3) δ 8,34 (dd, J=4,4, 1,6 Гц, 1H), 7,94 (dd, J=9,1, 1,6 Гц, 1H), 7,58 (s, 1H), 7,42 (d, J=8,6 Гц, 2H), 7,20-7,09 (m, 2H), 7,01 (dd, J=9,1, 4,4 Гц, 1H), 6,69-6,32 (m, 3H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,30 (dd, J=11,5, 2,4 Гц, 1H), 4,27 (s, 2H), 4,01 (dd, J=11,5, 8,5 Гц, 1H), 3,83 (s, 3H) ppm; (M+1)=440.
Пример 1-145: синтез 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(метокси)метил)имидазо[1,2-b]пиридазина
К перемешанному раствору (7-хлоримидазо[1,2-b]пиридазин-3-ил)(2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (0,010 г, 0,020 ммоль, пример 1-142-3) в дихлорметане (3 мл) добавляли Deoxo-Fluor (0,007 г, 0,031 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 2 ч. смесь гасили путем добавления метанола (0,5 мл). Через 15 мин. добавляли четыре капли 2 н. раствора гидроксида калия и обеспечивали перемешивание смеси при комнатной температуре в течение ночи. Фазы разделяли и органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 4 г силикагеля, элюент: 0-10% метанол/дихлорметан) получали 0,003 г (29%) 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(метокси)метил)имидазо[1,2-b]пиридазина в виде желтой пленки: 1H ЯМР (400 МГц, CDCl3) δ 8,36 (d, J=2,3 Гц, 1H), 8,03 (d, J=2,4 Гц, 1H), 7,59 (s, 1H), 7,48-7,39 (m, 2H), 7,16 (d, J=8,5 Гц, 2H), 6,72-6,33 (m, 3H), 5,72 (s, 1H), 5,17-5,10 (m, 1H), 4,34 (dd, J=11,6, 2,5 Гц, 1H), 4,08-4,04 (m, 1H), 3,87 (s, 3H), 3,47 (s, 3H) ppm; (M+1)=504.
Пример 1-146: синтез 4-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина (пример 1-142-3) и 2-метилбут-3-ин-2-амина, как описано в примере 1-23-5: 1H ЯМР (400 МГц, CDCl3) δ 8,27 (d, J=2,0 Гц, 1H), 7,90 (d, J=2,0 Гц, 1H), 7,58 (s, 1H), 7,43 (d, J=8,6 Гц, 2H), 7,20-7,10 (m, 2H), 6,69-6,32 (m, 3H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,31 (dd, J=11,6, 2,4 Гц, 1H), 4,24 (s, 2H), 4,01 (dd, J=11,6, 8,5 Гц, 1H), 3,83 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=521.
Пример 1-147: синтез 4-(3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-147-1: получение 6-йод-3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(пиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-147-2: получение 4-(3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,69-8,66 (m, 1H), 8,62 (dd, J=4,8, 1,7 Гц, 1H), 8,46 (d, J=1,8 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,04 (s, 1H), 7,77-7,73 (m, 1H), 7,37-7,31 (m, 1H), 6,55-6,53 (m, 2H), 5,35 (s, 2H), 5,18 (dd, J=8,2, 2,5 Гц, 1H), 4,36 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,2 Гц, 1H), 3,81 (s, 3H), 1,73 (br s, 2H), 1,53 (s, 6H) ppm; (M+1)=456.
Пример 1-148: синтез 6-(1H-имидазол-1-ил)-3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-147-1) и 1H-имидазола, как описано в примере 1-67: 1H ЯМР (400 МГц, CDCl3) δ 8,68 (d, J=2,2 Гц, 1H), 8,63 (dd, J=4,8, 1,7 Гц, 1H), 8,54 (d, J=2,3 Гц, 1H), 8,17 (s, 1H), 8,09 (d, J=2,3 Гц, 1H), 7,87-7,85 (m, 1H), 7,78-7,72 (m, 1H), 7,37-7,32 (m, 1H), 7,32-7,30 (m, 1H), 7,29-7,27 (m, 1H), 6,59-6,55 (m, 2H), 5,41 (s, 2H), 5,19 (dd, J=8,2, 2,5 Гц, 1H), 4,37 (dd, J=11,6, 2,5 Гц, 1H), 4,09 (dd, J=11,6, 8,2 Гц, 1H), 3,85 (s, 3H) ppm; (M+1)=441.
Пример 1-149: синтез 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-149-1: получение 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2-метилтиазол-4-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-149-2: получение 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,02 (s, 1H), 7,20 (d, J=1,0 Гц, 1H), 6,52-6,50 (m, 2H), 5,38-5,30 (m, 3H), 4,49 (dd, J=11,4, 2,5 Гц, 1H), 4,28 (dd, J=11,4, 7,0 Гц, 1H), 3,81 (s, 3H), 2,70 (s, 3H), 1,56 (s, 6H) ppm; (M+1)=476.
Пример 1-150: синтез 4-(6-((6-(3-(1H-имидазол-1-ил)проп-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола (пример 1-149-1) и 1-(проп-2-ин-1-ил)-1H-имидазола, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,51 (d, J=1,8 Гц, 1H), 8,14 (d, J=1,8 Гц, 1H), 8,07 (s, 1H), 7,77 (s, 1H), 7,20 (dd, J=1,0 Гц, 1H), 7,16-7,14 (m, 2H), 6,55-6,48 (m, 2H), 5,38-5,30 (m, 3H), 5,04 (s, 2H), 4,49 (dd, J=11,4, 2,5 Гц, 1H), 4,28 (dd, J=11,4, 7,1 Гц, 1H), 3,82 (s, 3H), 2,70 (s, 3H) ppm; (M+1)=499.
Пример 1-151: синтез 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола (пример 1-149-1) и морфолина, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,28 (d, J=2,5 Гц, 1H), 8,06 (s, 1H), 7,63 (d, J=2,5 Гц, 1H), 7,20 (s, 1H), 6,55-6,48 (m, 2H), 5,38-5,27 (m, 3H), 4,49 (dd, J=11,4, 2,5 Гц, 1H), 4,29 (dd, J=11,4, 7,1 Гц, 1H), 3,96-3,88 (m, 4H), 3,83 (s, 3H), 3,23-3,15 (m, 4H), 2,70 (s, 3H) ppm; (M+1)=480.
Пример 1-152: синтез 4-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-циклопропилтиазола
Пример 1-152-1: получение 2-бром-1-(2-циклопропилтиазол-4-ил)этан-1-она
Указанное в заголовке соединение получали из 2-циклопропилтиазол-4-карбонилхлорида, как описано в примере 1-133-2.
Пример 1-152-2: получение 4-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-циклопропилтиазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2-циклопропилтиазол-4-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,5 Гц, 1H), 8,12-8,01 (m, 2H), 7,26 (dd, J=8,1, 4,7 Гц, 1H), 7,10 (s, 1H), 6,56-6,48 (m, 2H), 5,39-5,27 (m, 3H), 4,47 (dd, J=11,4, 2,5 Гц, 1H), 4,26 (dd, J=11,4, 7,0 Гц, 1H), 3,82 (s, 3H), 2,33-2,24 (m, 1H), 1,32-0,96 (m, 4H) ppm; (M+1)=421.
Пример 1-153: синтез 4-(3-((2-(2-циклопропилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-153-1: получение 2-циклопропил-4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)тиазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2-циклопропилтиазол-4-ил)этан-1-она (пример 1-152-1) и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-153-2: получение 4-(3-((2-(2-циклопропилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 2-циклопропил-4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)тиазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,10-8,00 (m, 2H), 7,13-7,08 (m, 1H), 6,54-6,47 (m, 2H), 5,35-5,27 (m, 3H), 4,48 (dd, J=11,4, 2,5 Гц, 1H), 4,26 (dd, J=11,4, 7,1 Гц, 1H), 3,81 (s, 3H), 2,33-2,24 (m, 1H), 1,53 (s, 6H), 1,17-1,05 (m, 2H), 1,08-0,96 (m, 2H) ppm; (M+1)=502.
Пример 1-154: синтез 2-циклопропил-4-(8-метокси-6-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)тиазола
Указанное в заголовке соединение получали из 2-циклопропил-4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)тиазола (пример 1-153-1) и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,20 (d, J=2,6 Гц, 1H), 7,97 (s, 1H), 7,59 (d, J=2,6 Гц, 1H), 7,10 (s, 1H), 6,55-6,47 (m, 2H), 5,39-5,27 (m, 3H), 4,47 (dd, J=11,4, 2,5 Гц, 1H), 4,25 (dd, J=11,4, 7,0 Гц, 1H), 3,91 (s, 3H), 3,82 (s, 3H), 2,33-2,24 (m, 1H), 1,17-0,93 (m, 4H) ppm; (M+1)=451.
Пример 1-155: синтез 4-(3-((2-(2,5-диметилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-155-1: получение 2-бром-1-(2,5-диметилтиазол-4-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 2,5-диметилтиазол-4-карбоновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-155-2: получение 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,5-диметилтиазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2,5-диметилтиазол-4-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-155-3: получение 4-(3-((2-(2,5-диметилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,5-диметилтиазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (d, J=1,7 Гц, 1H), 8,18-8,06 (m, 2H), 6,53 (d, J=2,0 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,18 (dd, J=8,8, 2,5 Гц, 1H), 4,44 (dd, J=11,6, 8,8 Гц, 1H), 4,34 (dd, J=11,6, 2,5 Гц, 1H), 3,78 (s, 3H), 2,61 (s, 3H), 2,45 (s, 3H), 1,60 (s, 6H) ppm; (M+1)=490.
Пример 1-156: синтез 4-(3-((8-метокси-2-(2-метилоксазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-156-1: получение 2-бром-1-(2-метилоксазол-4-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 2-метилоксазол-4-карбоновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-156-2: получение 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилоксазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2-метилоксазол-4-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-156-3: получение 4-(3-((8-метокси-2-(2-метилоксазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилоксазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,02 (s, 1H), 7,58 (s, 1H), 6,53-6,47 (m, 2H), 5,33 (s, 2H), 5,19 (dd, J=6,9, 2,5, 1H), 4,40 (dd, J=11,5, 2,5 Гц, 1H), 4,29 (dd, J=11,5, 6,9 Гц, 1H), 3,79 (s, 3H), 2,44 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=460.
Пример 1-157: синтез 4-(3-((2-(2,5-диметилоксазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-157-1: получение 2-бром-1-(2,5-диметилоксазол-4-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 2,5-диметилоксазол-4-карбоновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-157-2: получение 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,5-диметилоксазола
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2,5-диметилоксазол-4-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-157-3: получение 4-(3-((2-(2,5-диметилоксазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,5-диметилоксазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,10-8,00 (m, 2H), 6,54-6,46 (m, 2H), 5,33 (s, 2H), 5,05 (dd, J=7,9, 2,9 Гц, 1H), 4,42-4,27 (m, 2H), 3,78 (s, 3H), 2,38 (s, 3H), 2,31 (s, 3H), 1,53 (s, 6H) ppm; (M+1)=473.
Пример 1-158: синтез 3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-158-1: получение 2-бром-1-(6-(2-метоксиэтокси)пиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-(2-метоксиэтокси)пиридин-3-ил)этан-1-она, как описано в примере 1-110-2.
Пример 1-158-2: получение 3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(2-метоксиэтокси)пиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,4 Гц, 1H), 8,17 (d, J=2,4 Гц, 1H), 8,09 (dd, J=8,0, 1,4 Гц, 1H), 8,05 (s, 1H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 7,32-7,23 (m, 1H), 6,83 (d, J=8,6 Гц, 1H), 6,55-6,53 (m, 2H), 5,37 (s, 2H), 5,08 (dd, J=8,4, 2,4 Гц, 1H), 4,52-4,43 (m, 2H), 4,30 (dd, J=11,6, 2,4 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,80 (s, 3H), 3,76-3,71 (m, 2H), 3,43 (s, 3H) ppm; (M+1)=449.
Пример 1-159: синтез 4-(3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-159-1: получение 6-йод-3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(2-метоксиэтокси)пиридин-3-ил)этан-1-она (пример 1-158-1) и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-159-2: получение 4-(3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,17 (d, J=2,4 Гц, 1H), 8,12-7,99 (m, 2H), 7,61 (dd, J=8,6, 2,5 Гц, 1H), 6,83 (d, J=8,6 Гц, 1H), 6,54-6,52 (m, 2H), 5,34 (s, 2H), 5,08 (dd, J=8,4, 2,5 Гц, 1H), 4,55-4,42 (m, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,80 (s, 3H), 3,79-3,64 (m, 2H), 3,43 (s, 3H), 1,67 (bs, 2H), 1,53 (s, 6H) ppm; (M+1)=530.
Пример 1-160: синтез 3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-имидазола, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,49 (d, J=1,9 Гц, 1H), 8,18 (d, J=2,4 Гц, 1H), 8,15-8,05 (m, 2H), 7,69-7,53 (m, 2H), 7,18 (s, 1H), 6,84 (d, J=8,6 Гц, 1H), 6,58-6,56 (m, 2H), 5,40 (s, 2H), 5,09 (dd, J=8,4, 2,5 Гц, 1H), 4,57-4,42 (m, 2H), 4,31 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,83 (s, 3H), 3,81-3,62 (m, 5H), 3,43 (s, 3H) ppm; (M+1)=529.
Пример 1-161: синтез 6-метокси-3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(2-метоксиэтокси)пиридин-3-ил)этан-1-она (пример 1-158-1) и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,6 Гц, 1H), 8,17 (t, J=2,6 Гц, 1H), 7,98 (s, 1H), 7,67-7,53 (m, 2H), 6,89-6,76 (m, 1H), 6,54-6,52 (m, 2H), 5,33 (s, 2H), 5,08 (dd, J=8,4, 2,4 Гц, 1H), 4,51-4,42 (m, 2H), 4,29 (dd, J=11,6, 2,4 Гц, 1H), 4,05 (dd, J=11,6, 8,4 Гц, 1H), 3,91 (s, 3H), 3,80 (s, 3H), 3,76-3,66 (m, 2H), 3,43 (s, 3H) ppm; (M+1)=479.
Пример 1-162: синтез 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-162-1: получение 2-бром-1-(6-этоксипиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 6-этоксиникотиновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-162-2: получение 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-этоксипиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,4 Гц, 1H), 8,19-8,16 (m, 1H), 8,09 (dd, J=8,0, 1,4 Гц, 1H), 8,04 (s, 1H), 7,60 (dd, J=8,6, 2,5 Гц, 1H), 7,27 (dd, J=8,0, 4,8 Гц, 1H), 6,77-6,72 (m, 1H), 6,55-6,53 (m, 2H), 5,38 (s, 2H), 5,08 (dd, J=8,5, 2,5 Гц, 1H), 4,36 (q, J=7,1 Гц, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,5 Гц, 1H), 3,80 (s, 3H), 1,38 (t, J=7,1 Гц, 3H) ppm; (M+1)=419.
Пример 1-163: синтез 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-этоксипиридин-3-ил)этан-1-она (пример 1-162-1) и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,4 Гц, 1H), 8,18 (d, J=2,4 Гц, 1H), 7,98 (s, 1H), 7,64-7,56 (m, 2H), 6,74 (d, J=8,6 Гц, 1H), 6,54-6,52 (m, 2H), 5,33 (s, 2H), 5,08 (dd, J=8,4, 2,5 Гц, 1H), 4,36 (q, J=7,1 Гц, 2H), 4,30 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,4 Гц, 1H), 3,91 (s, 3H), 3,80 (s, 3H), 1,38 (t, J=7,1 Гц, 3H) ppm; (M+1)=449.
Пример 1-164: синтез (3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Пример 1-164-1: получение метил-3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-этоксипиридин-3-ил)этан-1-она (пример 1-162-1) и метил-6-хлор-5-нитроникотината, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-164-2: получение (3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Указанное в заголовке соединение получали из 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата, как описано в примере 1-117-1: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (s, 1H), 8,18 (d, J=2,4 Гц, 1H), 8,13-8,02 (m, 2H), 7,64-7,54 (m, 1H), 6,75 (d, J=8,5 Гц, 1H), 6,57-6,50 (m, 2H), 5,37 (s, 2H), 5,07 (dd, J=8,5, 2,5 Гц, 1H), 4,87 (s, 2H), 4,42-4,26 (m, 3H), 4,06 (dd, J=11,6, 8,5 Гц, 1H), 3,80 (s, 3H), 1,38 (t, J=7,0 Гц, 3H) ppm; (M+1)=449.
Пример 1-165: синтез 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Пример 1-165-1: получение (2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали в ходе четырех стадий метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-этоксипиридин-3-ил)этан-1-она (пример 1-162-1), как описано в примерах от 1-52-1 до 1-52-4.
Пример 1-165-2: получение 5-(6-(бромметил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-этоксипиридина
Указанное в заголовке соединение получали из (2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола и тетрабромида углерода, как описано в примере 1-109-1.
Пример 1-165-3: получение 3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Указанное в заголовке соединение получали из 5-(6-(бромметил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-этоксипиридина и трет-бутил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин-1-карбоксилата, как описано в примере 1-55. С продукта данной реакции снимали защиту с помощью трифторуксусной кислоты, как описано в примере 1-12-5: 1H ЯМР (400 МГц, CDCl3) δ 9,41 (s, 1H), 8,32-8,26 (m, 1H), 8,19 (d, J=2,6 Гц, 1H), 7,81 (d, J=7,9 Гц, 1H), 7,62 (dd, J=8,7, 2,6 Гц, 1H), 7,11 (s, 1H), 7,04 (dd, J=7,9, 4,6 Гц, 1H), 6,75 (d, J=8,7 Гц, 1H), 6,52-6,42 (m, 2H), 5,12-5,04 (m, 1H), 4,36 (q, J=7,1 Гц, 2H), 4,28 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,5 Гц, 1H), 4,01 (s, 2H), 3,80 (s, 3H), 1,39 (t, J=7,1 Гц, 3H) ppm; (M+1)=418.
Пример 1-166: синтез 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(дифторметокси)пиридин-3-ил)этан-1-она и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,28-8,17 (m, 2H), 8,00 (s, 1H), 7,78 (dd, J=8,5, 2,4 Гц, 1H), 7,66-7,24 (m, 2H), 6,94 (dd, J=8,5, 0,7 Гц, 1H), 6,58-6,49 (m, 2H), 5,33 (s, 2H), 5,15 (dd, J=8,1, 2,5 Гц, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,06 (dd, J=11,6, 8,1 Гц, 1H), 3,91 (s, 3H), 3,81 (s, 3H) ppm; (M+1)=471.
Пример 1-167: синтез 1-(3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-ола
Пример 1-167-1: получение 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(дифторметокси)пиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-167-2: получение 1-(3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-ола
Указанное в заголовке соединение получали из 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 3-метилазетидин-3-ола гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 8,24 (d, J=2,5 Гц, 1H), 7,92 (s, 1H), 7,78 (dd, J=8,6, 2,5 Гц, 1H), 7,73 (d, J=2,5 Гц, 1H), 7,46 (t, J=73 Гц, 1H), 7,11 (d, J=2,5 Гц, 1H), 6,93 (dd, J=8,4, 0,7 Гц, 1H), 6,55-6,47 (m, 2H), 5,28 (s, 2H), 5,14 (dd, J=8,1, 2,4 Гц, 1H), 4,32 (dd, J=11,6, 2,4 Гц, 1H), 4,05 (dd, J=11,6, 8,1 Гц, 1H), 3,96-3,88 (m, 2H), 3,80-3,77 (m, 5H), 1,64 (s, 3H) ppm; (M+1)=526.
Пример 1-168: синтез 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (0,14 г, 0,25 ммоль) в тетрагидрофуране (15 мл) добавляли 2,0 М раствор алюмогидрида лития в тетрагидрофуране (0,32 мл, 0,64 ммоль). Через 5 мин. смесь гасили путем добавления воды (5 капель) и 50% раствора гидроксида натрия (3 капель). Смесь разбавляли дихлорметаном и полученный в результате раствор высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-30% метанол/этилацетат) получали 0,064 г (59%) 3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,4 Гц, 1H), 8,24 (d, J=2,5 Гц, 1H), 8,10 (dd, J=8,1, 1,4 Гц, 1H), 8,06 (s, 1H), 7,78 (dd, J=8,5, 2,5 Гц, 1H), 7,67-7,28 (m, 1H), 7,27-7,22 (m, 1H), 6,94 (dd, J=8,5, 0,7 Гц, 1H), 6,59-6,50 (m, 2H), 5,38 (s, 2H), 5,15 (dd, J=8,1, 2,4 Гц, 1H), 4,33 (dd, J=11,6, 2,4 Гц, 1H), 4,06 (dd, J=11,6, 8,1 Гц, 1H), 3,81 (s, 3H) ppm; (M+1)=441.
Пример 1-169: синтез 3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Пример 1-169-1: получение 6-йод-3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примере 1-52-7 и примере 1-52-9.
Пример 1-169-2: получение трет-бутил-4-(4-(3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилата
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и (1-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-1H-пиразол-4-ил)бороновой кислоты, как описано в примере 1-4.
Пример 1-169-3: получение 3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору трет-бутил-4-(4-(3-((8-метокси-2,3-дигидробензо[b][1,4]диокси-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-1H-пиразол-1-ил)пиперидин-1-карбоксилата (0,12 г, 0,21 ммоль) в 1,4-диоксане (2 мл) добавляли 4,0 М хлороводород в 1,4-диоксане (2,0 мл, 8,00 ммоль). Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь разделяли между этилацетатом и водой. Водную фазу промывали этилацетатом. Водную фазу нейтрализовали насыщенным раствором бикарбоната натрия, а затем ее экстрагировали смесью 1:5 изопропанол/хлороформ. Органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,073 г (77%) 3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина в виде белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,58 (d, J=1,9 Гц, 1H), 8,12 (d, J=2,0 Гц, 1H), 8,02 (s, 1H), 7,82 (d, J=0,8 Гц, 1H), 7,73 (d, J=0,8 Гц, 1H), 6,54-6,47 (m, 2H), 5,34 (s, 2H), 4,35-4,20 (m, 4H), 4,05-3,98 (m, 1H), 3,82 (s, 3H), 3,33-3,24 (m, 2H), 2,86-2,75 (m, 2H), 2,28-2,18 (m, 2H), 2,05-1,97 (m, 2H) ppm; (M+1)=447.
Пример 1-170: синтез 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Пример 1-170-1: получение 6-йод-3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, хлорацетона и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-170-2: получение 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе двух стадий из 6-йод-3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и (1-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-1H-пиразол-4-ил)бороновой кислоты, как описано в примерах от 1-169-2 до 1-169-3: 1H ЯМР (400 МГц, CDCl3) δ 8,58 (d, J=2,0 Гц, 1H), 8,12 (d, J=2,0 Гц, 1H), 8,02 (s, 1H), 7,82 (s, 1H), 7,74 (s, 1H), 6,51-6,49 (m, 2H), 5,34 (s, 2H), 4,36-4,07 (m, 3H), 3,86-3,75 (m, 4H), 3,35-3,25 (m, 2H), 2,88-2,76 (m, 2H), 2,28-2,20 (m, 2H), 2,04-1,92 (m, 2H), 1,41 (d, J=6,4 Гц, 3H) ppm; (M+1)=461.
Пример 1-171: синтез 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридина формиата
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-170-1) и 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина, как описано в примере 1-55: 1H ЯМР (400 МГц, CD3OD) δ 8,88 (dd, J=2,4, 0,9 Гц, 1H), 8,71 (d, J=2,0 Гц, 1H), 8,57 (dd, J=4,9, 1,5 Гц, 1H), 8,51 (s, 1H), 8,32 (d, J=2,0 Гц, 1H), 8,20-8,14 (m, 1H), 8,09 (s, 1H), 7,59-7,53 (m, 1H), 6,68 (d, J=2,0 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 5,41 (s, 2H), 4,23-4,10 (m, 2H), 3,78 (s, 3H), 3,76-3,69 (m, 1H), 1,31 (d, J=6,4 Гц, 3H) ppm; (M+1)=389.
Пример 1-172: синтез 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина формиата
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-170-1) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-55: 1H ЯМР (400 МГц, CD3OD) δ 8,61 (d, J=1,9 Гц, 1H), 8,39 (s, 1H), 8,15 (d, J=1,9 Гц, 1H), 8,03 (d, J=0,8 Гц, 1H), 7,89 (d, J=0,8 Гц, 1H), 6,65 (d, J=1,9 Гц, 1H), 6,49 (d, J=1,9 Гц, 1H), 5,35 (s, 2H), 4,22-4,09 (m, 2H), 3,94 (s, 3H), 3,76 (s, 3H), 3,74-3,68 (m, 1H), 1,30 (d, J=6,4 Гц, 3H) ppm; (M+1)=392.
Пример 1-173: синтез 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Пример 1-173-1: получение 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-циклопропилэтан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-173-2: получение 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и (1-(1-(трет-бутоксикарбонил)пиперидин-4-ил)-1H-пиразол-4-ил)бороновой кислоты, как описано в примере 1-169-2 и пример 1-169-3: 1H ЯМР (400 МГц, CDCl3) δ 8,57 (d, J=1,9 Гц, 1H), 8,11 (d, J=2,0 Гц, 1H), 8,01 (s, 1H), 7,82 (d, J=0,8 Гц, 1H), 7,74 (d, J=0,8 Гц, 1H), 6,51-6,49 (m, 2H), 5,34 (s, 2H), 4,35-4,25 (m, 2H), 4,00 (dd, J=11,3, 7,7 Гц, 1H), 3,82 (s, 3H), 3,42-3,35 (m, 1H), 3,34-3,27 (m, 2H), 2,89-2,77 (m, 2H), 2,30-2,20 (m, 2H), 2,05-1,93 (m, 2H), 1,10-1,00 (m, 1H), 0,78-0,68 (m, 1H), 0,68-0,58 (m, 2H), 0,41-0,31 (m, 1H) ppm; (M+1)=487.
Пример 1-174: синтез 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-173-1) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-имидазола, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,48 (d, J=1,9 Гц, 1H), 8,12-8,05 (m, 2H), 7,59 (s, 1H), 7,21-7,14 (m, 1H), 6,56-6,48 (m, 2H), 5,37 (s, 2H), 4,29 (dd, J=11,4, 2,3 Гц, 1H), 4,01 (dd, J=11,4, 7,7 Гц, 1H), 3,84 (s, 3H), 3,68 (s, 3H), 3,45-3,35 (m, 1H), 1,33-1,22 (m, 1H), 1,10-1,02 (m, 1H), 0,80-0,56 (m, 3H), 0,40-0,32 (m, 1H) ppm; (M+1)=418.
Пример 1-175: синтез 4-(3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-173-1) и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, Хлороформ-d) δ 8,45 (d, J=1,8 Гц, 1H), 8,07 (d, J=1,8 Гц, 1H), 8,01 (s, 1H), 6,50-6,46 (m, 2H), 5,31 (s, 2H), 4,29 (dd, J=11,3, 2,3 Гц, 1H), 4,00 (dd, J=11,3, 7,7 Гц, 1H), 3,81 (s, 3H), 3,44-3,35 (m, 1H), 1,53 (s, 6H), 1,10-1,00 (m, 1H), 0,77-0,68 (m, 1H), 0,69-0,56 (m, 2H), 0,41-0,29 (m, 1H) ppm; (M+1)=419.
Пример 1-176: синтез 3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина формиата
Пример 1-176-1: получение 6-йод-3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 1-бром-3-метилбутан-2-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-176-2: получение 3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина формиата
Указанное в заголовке соединение получали из 6-йод-3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-55: 1H ЯМР (400 МГц, CD3OD) δ 8,60 (d, J=1,8 Гц, 1H), 8,38 (s, 1H), 8,14 (d, J=1,8 Гц, 1H), 8,02 (s, 1H), 7,88 (d, J=0,9 Гц, 1H), 6,64 (d, J=1,9 Гц, 1H), 6,48 (d, J=1,9 Гц, 1H), 5,34 (s, 2H), 4,22 (dd, J=11,4, 2,1 Гц, 1H), 3,94 (s, 3H), 3,86 (dd, J=11,4, 7,6 Гц, 1H), 3,77 (s, 3H), 3,72-3,67 (m, 1H), 1,94-1,83 (m, 1H), 1,04 (d, J=6,7 Гц, 3H), 0,97 (d, J=6,8 Гц, 3H) ppm; (M+1)=420.
Пример 1-177: синтез 4-(3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3,5-диметилизоксазола
Указанное в заголовке соединение получали из 6-йод-3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-176-1) и 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоксазола, как описано в примере 1-55: 1H ЯМР (400 МГц, CDCl3) δ 8,33 (d, J=1,9 Гц, 1H), 8,09 (s, 1H), 7,97 (d, J=1,9 Гц, 1H), 6,54-6,50 (m, 2H), 5,37 (s, 2H), 4,26 (dd, J=11,3, 2,2 Гц, 1H), 3,98 (dd, J=11,3, 7,2 Гц, 1H), 3,83 (s, 3H), 3,87-3,75 (m, 1H), 2,44 (s, 3H), 2,30 (s, 3H), 2,09-1,91 (m, 1H), 1,11 (d, J=6,8 Гц, 3H), 1,01 (d, J=6,8 Гц, 3H) ppm; (M+1)=435.
Пример 1-178: синтез 3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Пример 1-178-1: получение 3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-циклопропилпропан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-178-2: получение 3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-55.
Пример 1-178-3: хиральное разделение 3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение разделяли на его отдельные диастереомеры посредством хиральной хроматографии.
Разделение № 1
Колонка: Whelk-O1 21×250 мм
Подвижная фаза: 60% этанол в CO2, 0,1% диэтиламина, 55 мл/мин.
При помощи данной операции получали диастереомер A (пик 3) и диастереомер B (пик 4) в виде чистых фракций (абсолютные конфигурации неизвестны) и смесь двух оставшихся диастереомеров (пики 1 и 2).
Диастереомер A: 1H ЯМР (600 МГц, CDCl3) δ 8,57 (d, J=2,0 Гц, 1H), 8,11 (d, J=2,0 Гц, 1H), 8,01 (s, 1H), 7,80 (s, 1H), 7,67 (s, 1H), 6,52-6,46 (m, 2H), 5,33 (s, 2H), 4,10-4,05 (m, 1H), 3,99 (s, 3H), 3,81 (s, 3H), 3,01 (dd, J=9,1, 7,1 Гц, 1H), 1,43 (d, J=6,4 Гц, 3H), 1,04-0,96 (m, 1H), 0,77-0,65 (m, 2H), 0,65-0,59 (m, 1H), 0,50-0,43 (m, 1H) ppm; (M+1)=432.
Диастереомер B: 1H ЯМР (600 МГц, CDCl3) δ 8,57 (d, J=1,9 Гц, 1H), 8,11 (d, J=1,9 Гц, 1H), 8,02 (s, 1H), 7,80 (d, J=0,9 Гц, 1H), 7,67 (d, J=0,9 Гц, 1H), 6,51-6,47 (m, 2H), 5,34 (s, 2H), 4,34 (qd, J=6,6, 2,2 Гц, 1H), 3,99 (s, 3H), 3,83 (s, 3H), 3,33 (dd, J=9,6, 2,2 Гц, 1H), 1,39 (d, J=6,6 Гц, 3H), 1,08-1,02 (m, 1H), 0,70-0,60 (m, 2H), 0,60-0,53 (m, 1H), 0,37-0,30 (m, 1H) ppm; (M+1)=432.
Оставшуюся смесь диастереомеров (пики 2 и 3) из первого разделения подвергали второй хроматографии.
Разделение № 2
Колонка: AD-H 21×250 мм
Подвижная фаза: 25% метанол в CO2, 0,5% диэтиламина 45 мл/мин.
При помощи данной операции получали диастереомер C (пик 1) и диастереомер D (пик 2) в виде чистых фракций (абсолютные конфигурации неизвестны).
Диастереомер C: 1H ЯМР (600 МГц, CDCl3) δ 8,57 (d, J=2,0 Гц, 1H), 8,11 (d, J=2,0 Гц, 1H), 8,01 (s, 1H), 7,80 (s, 1H), 7,67 (s, 1H), 6,52-6,46 (m, 2H), 5,33 (s, 2H), 4,10-4,05 (m, 1H), 3,99 (s, 3H), 3,81 (s, 3H), 3,01 (dd, J=9,1, 7,1 Гц, 1H), 1,43 (d, J=6,4 Гц, 3H), 1,04-0,96 (m, 1H), 0,77-0,65 (m, 2H), 0,65-0,59 (m, 1H), 0,50-0,43 (m, 1H) ppm; (M+1)=432.
Диастереомер D: 1H ЯМР (600 МГц, CDCl3) δ 8,57 (d, J=1,9 Гц, 1H), 8,11 (d, J=1,9 Гц, 1H), 8,02 (s, 1H), 7,80 (d, J=0,9 Гц, 1H), 7,67 (d, J=0,9 Гц, 1H), 6,51-6,47 (m, 2H), 5,34 (s, 2H), 4,34 (qd, J=6,6, 2,2 Гц, 1H), 3,99 (s, 3H), 3,83 (s, 3H), 3,33 (dd, J=9,6, 2,2 Гц, 1H), 1,39 (d, J=6,6 Гц, 3H), 1,08-1,02 (m, 1H), 0,70-0,60 (m, 2H), 0,60-0,53 (m, 1H), 0,37-0,30 (m, 1H) ppm; (M+1)=432.
Пример 1-179: синтез 3-((2-(6-(дифторметил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-179-1: получение 2-бром-1-(6-(дифторметил)пиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-(дифторметил)пиридин-3-ил)этан-1-она, как описано в примере 1-110-2.
Пример 1-179-2: получение 3-((2-(6-(дифторметил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(дифторметил)пиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,71 (d, J=2,0 Гц, 1H), 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 8,05 (s, 1H), 7,92 (dd, J=8,1, 2,2 Гц, 1H), 7,68 (d, J=8,1 Гц, 1H), 7,30-7,24 (m, 1H), 6,65 (t, J=55 Гц, 1H), 6,57 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,28-5,22 (m, 1H), 4,38 (dd, J=11,6, 2,5 Гц, 1H), 4,09 (dd, J=11,6, 7,9 Гц, 1H), 3,82 (s, 3H) ppm; (M+1)=425.
Пример 1-180: синтез 3-((2-(2-циклопропилпиримидин-5-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-180-1: получение 2-бром-1-(2-циклопропилпиримидин-5-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 2-циклопропилпиримидин-5-карбоновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-180-2: получение 3-((2-(2-циклопропилпиримидин-5-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2-циклопропилпиримидин-5-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,61-8,57 (m, 2H), 8,44 (dd, J=4,8, 1,5 Гц, 1H), 8,09 (dd, J=8,0, 1,5 Гц, 1H), 8,04 (s, 1H), 7,29-7,25 (m, 1H), 6,55 (d, J=2,0 Гц, 1H), 6,54 (d, J=2,0 Гц, 1H), 5,38 (s, 2H), 5,13 (dd, J=7,8, 2,5 Гц, 1H), 4,34 (dd, J=11,6, 2,5 Гц, 1H), 4,13 (dd, J=11,6, 7,8 Гц, 1H), 3,80 (s, 3H), 2,30-2,22 (m, 1H), 1,17-1,05 (m, 4H) ppm; (M+1)=416.
Пример 1-181: синтез 3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-181-1: получение 2-бром-1-(6-метокси-2-метилпиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 6-метокси-2-метилникотиновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-181-2: получение 6-йод-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-метокси-2-метилпиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-181-3: получение 3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина, как описано в примере 1-97: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 8,05 (s, 1H), 7,61 (d, J=8,5 Гц, 1H), 7,27 (dd, J=8,0, 4,8 Гц, 1H), 6,62 (d, J=8,5 Гц, 1H), 6,56 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,24 (dd, J=8,9, 2,4 Гц, 1H), 4,28 (dd, J=11,7, 2,4 Гц, 1H), 3,98-3,89 (m, 4H), 3,80 (s, 3H), 2,50 (s, 3H) ppm; (M+1)=419.
Пример 1-182: синтез 3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-181-2) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 7,93 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,60 (d, J=8,5 Гц, 1H), 7,16 (d, J=2,5 Гц, 1H), 6,62 (d, J=8,5 Гц, 1H), 6,54 (d, J=2,0 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 5,30 (s, 2H), 5,23 (dd, J=8,9, 2,4 Гц, 1H), 4,43-4,36 (m, 1H), 4,27 (dd, J=11,7, 2,4 Гц, 1H), 4,23-4,16 (m, 2H), 3,97-3,88 (m, 4H), 3,79 (s, 3H), 3,79-3,74 (m, 2H), 3,36 (s, 3H), 2,50 (s, 3H) ppm; (M+1)=504.
Пример 1-183: синтез 6-метокси-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-181-2) и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,6 Гц, 1H), 7,99 (s, 1H), 7,63-7,58 (m, 2H), 6,62 (d, J=8,5 Гц, 1H), 6,54 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,23 (dd, J=8,9, 2,4 Гц, 1H), 4,27 (dd, J=11,6, 2,4 Гц, 1H), 3,97-3,88 (m, 7H), 3,80 (s, 3H), 2,50 (s, 3H) ppm; (M+1)=449.
Пример 1-184: синтез 3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина
Пример 1-184-1: получение (8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола
Указанное в заголовке соединение получали в ходе четырех стадий метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата и 2-бром-1-(6-метокси-2-метилпиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-4.
Пример 1-184-2: получение 8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида
К перемешанному раствору (8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метанола (0,68 г, 2,13 ммоль) в дихлорметане (30 мл) добавляли периодинан Десса-Мартина (0,93 г, 2,13 ммоль). Через 30 мин. смесь разделяли между насыщенным раствором бикарбоната натрия и дихлорметаном. Фазы разделяли и органическую фазу промывали насыщенным раствором бикарбоната натрия, водой и солевым раствором. Органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-50% этилацетат/гептан) получали 0,66 г (98%) 8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида в виде белого твердого вещества.
Пример 1-184-3: получение 7-хлор-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2) и 8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида, как описано в примере 1-23-1 (стадия 1) и примере 1-22-2 (стадия 2).
Пример 1-184-4: получение 3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали из 7-хлор-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина и 3-метоксиазетидина гидрохлорида, как описано в примере 1-104: 1H ЯМР (400 МГц, CDCl3) δ 7,91-7,87 (m, 1H), 7,62 (d, J=8,5 Гц, 1H), 7,31-7,24 (m, 1H), 6,80-6,75 (m, 1H), 6,63 (d, J=8,5 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 6,46 (d, J=2,0 Гц, 1H), 5,26-5,20 (m, 1H), 4,45-4,37 (m, 1H), 4,30-4,22 (m, 3H), 4,17-4,13 (m, 2H), 3,95-3,88 (m, 6H), 3,82 (s, 3H), 3,37 (s, 3H), 2,50 (s, 3H) ppm; (M+1)=504.
Пример 1-185: синтез 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-185-1: получение 2-бром-1-(2,6-диметоксипиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 2,6-диметоксиникотиновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-185-2: получение 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(2,6-диметоксипиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-185-3: получение 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина, как описано в примере 1-97: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (dd, J=4,9, 2,0 Гц, 1H), 8,09 (dd, J=8,0, 2,0 Гц, 1H), 8,04 (s, 1H), 7,61 (d, J=8,2 Гц, 1H), 7,30-7,24 (m, 1H), 6,56-6,51 (m, 2H), 6,34 (d, J=8,2 Гц, 1H), 5,40-5,32(m, 3H), 4,39-4,31 (m, 1H), 3,94 (s, 3H), 3,91 (s, 3H), 3,81 (s, 3H) ppm; (M+1)=435.
Пример 1-186: синтез 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-185-2) и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,23- 8,19 (m, 1H), 7,98 (s, 1H), 7,64-7,56 (m, 2H), 6,55-6,50 (m, 2H), 6,33 (dd, J=8,1, 1,8 Гц, 1H), 5,38-5,29 (m, 3H), 4,38-4,30 (m, 1H), 3,96-3,89 (m, 10H), 3,81 (s, 3H) ppm; (M+1)=465.
Пример 1-187: синтез 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-185-2) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (400 МГц, CDCl3) δ 7,92 (s, 1H), 7,78 (d, J=2,5 Гц, 1H), 7,61 (d, J=8,1 Гц, 1H), 7,15 (d, J=2,5 Гц, 1H), 6,54-6,47 (m, 2H), 6,34 (d, J=8,3 Гц, 1H), 5,38-5,32 (m, 1H), 5,29 (s, 2H), 4,45-4,30 (m, 3H), 4,20 (t, J=6,9 Гц, 2H), 3,94 (s, 3H), 3,91 (s, 3H), 3,82-3,72 (m, 5H), 3,36 (s, 3H) ppm; (M+1)=520.
Пример 1-188: синтез 3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10982908, получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(трифторметил)пиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,78 (dd, J=2,3, 0,9 Гц, 1H), 8,45 (dd, J=4,8, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 8,05 (s, 1H), 7,99-7,93 (m, 1H), 7,73 (dd, J=8,1, 0,9 Гц, 1H), 7,30-7,26 (m, 1H), 6,57 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,29 (dd, J=7,8, 2,5 Гц, 1H), 4,40 (dd, J=11,7, 2,5 Гц, 1H), 4,10 (dd, J=11,7, 7,8 Гц, 1H), 3,82 (s, 3H) ppm; (M+1)=443.
Пример 1-188-1: хиральное разделение 3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Рацемический 3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин подвергали препаративной очистке с помощью SFC (колонка Chiralpak IC 30×250 мм, 35% этанол/0,1% диэтиламинового модификатора, расход 65 г/мин.) с получением отдельных энантиомеров.
Пример 1-189: синтез 6-метокси-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-189-1: получение 2-бром-1-(6-метокси-4-метилпиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали в ходе двух стадий из 6-метокси-4-метилникотиновой кислоты, как описано в примерах от 1-133-1 до 1-133-2.
Пример 1-189-2: получение 6-йод-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-метокси-4-метилпиридин-3-ил)этан-1-она и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-189-3: получение 6-метокси-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и метанола, как описано в примере 1-11: 1H ЯМР (400 МГц, CDCl3) δ 8,21 (d, J=2,7 Гц, 1H), 8,16 (s, 1H), 7,99 (s, 1H), 7,59 (d, J=2,7 Гц, 1H), 6,57 (s, 1H), 6,55 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,1 Гц, 1H), 5,33 (s, 2H), 5,22 (dd, J=8,7, 2,4 Гц, 1H), 4,31 (dd, J=11,7, 2,4 Гц, 1H), 4,08 (dd, J=11,7, 8,7 Гц, 1H), 3,91 (s, 6H), 3,80 (s, 3H), 2,34 (s, 3H) ppm; (M+1)=449.
Пример 1-190: синтез 3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина, как описано в примере 1-97: 1H ЯМР (400 МГц, CDCl3) δ 8,48-8,42 (m, 1H), 8,16 (s, 1H), 8,10 (d, J=8,1 Гц, 1H), 8,05 (s, 1H), 7,30-7,24 (m, 1H), 6,60-6,52 (m, 3H), 5,38 (s, 2H), 5,26-5,19 (m, 1H), 4,32 (dd, J=11,6, 2,5 Гц, 1H), 4,09 (dd, J=11,6, 8,8 Гц, 1H), 3,91 (s, 3H), 3,80 (s, 3H), 2,34 (s, 3H) ppm; (M+1)=419.
Пример 1-191: синтез 5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-N,N-диэтилпиридин-2-амина
Пример 1-191-1: получение 2-бром-1-(6-(диэтиламино)пиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-(диэтиламино)пиридин-3-ил)этан-1-она и брома, как описано в примере 1-110-2.
Пример 1-191-2: получение 5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-N,N-диэтилпиридин-2-амина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(диэтиламино)пиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,4 Гц, 1H), 8,19-8,00 (m, 3H), 7,42 (dd, J=8,9, 2,5 Гц, 1H), 7,31-7,23 (m, 1H), 6,60-6,41 (m, 3H), 5,37 (s, 2H), 4,97 (dd, J=8,6, 2,4 Гц, 1H), 4,27 (dd, J=11,5, 2,4 Гц, 1H), 4,08 (dd, J=11,5, 8,6 Гц, 1H), 3,79 (s, 3H), 3,51 (q, J=7,1 Гц, 4H), 1,16 (t, J=7,0 Гц, 6H) ppm; (M+1)=446.
Пример 1-192: синтез 4-(5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридин-2-ил)морфолина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-морфолинопиридин-3-ил)этан-1-она и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,44 (dd, J=4,8, 1,4 Гц, 1H), 8,22 (d, J=2,5 Гц, 1H), 8,13-8,00 (m, 2H), 7,53 (dd, J=8,8, 2,5 Гц, 1H), 7,33-7,22 (m, 1H), 6,64 (d, J=8,8 Гц, 1H), 6,60-6,50 (m, 2H), 5,37 (s, 2H), 5,04 (dd, J=8,4, 2,5 Гц, 1H), 4,28 (dd, J=11,6, 2,5 Гц, 1H), 4,07 (dd, J=11,6, 8,4 Гц, 1H), 3,87-3,75 (m, 7H), 3,54-3,50 (m, 4H) ppm; (M+1)=460.
Пример 1-193: синтез 3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-193-1: получение метил-4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензоата
К перемешанной суспензии метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата (26,00 г, 90,20 ммоль) и карбоната калия (18,70 г, 135,30 ммоль) в ацетонитриле (200 мл) добавляли п-метоксибензилхлорид (21,20 г, 135,3 ммоль). Полученную в результате смесь нагревали до 85°C. Через 20 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток очищали посредством хроматографии на силикагеле (элюент: 0-25% этилацетат/петролейный эфир) с получением 34,00 г (92%) метил-4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензоата в виде белого твердого вещества.
Пример 1-193-2: получение 4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензойной кислоты
Указанное в заголовке соединение получали из метил-4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензоата, как описано в примере 1-86-1.
Пример 1-193-3: получение 4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензамида
К перемешанной суспензии 4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензойной кислоты (20,00 г, 50,70 ммоль), хлорида аммония (13,60 г, 250,0 ммоль) и 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфата (28,90 г, 760,0 ммоль) в N,N-диметилформамиде (200 мл) добавляли TEA (20,9 мл, 150,0 ммоль). Полученную в результате смесь нагревали до 50°C. Через 20 ч. обеспечивали охлаждение смеси до комнатной температуры и ее выливали в воду (3,0 л). Образованный осадок фильтровали и промывали водой (3×500 мл). Твердое вещество растворяли в этилацетате (2,0 л) и промывали солевым раствором (1×500 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением 12,00 г (60%) 4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензамида в виде грязно-белого твердого вещества.
Пример 1-193-4: получение (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина
К перемешанному и охлажденному (0°C) раствору 4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензамида (9,00 г, 22,90 ммоль) в тетрагидрофуране (150 мл) по каплям добавляли в течение 15 мин. 1,0 М раствор алюмогидрида лития в тетрагидрофуране (60,0 мл, 60,00 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 20 ч. смесь охлаждали до 0°C и медленно гасили путем добавления воды (2,3 мл), 15% водного раствора гидроксида натрия (2,3 мл) и воды (6,9 мл). Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь фильтровали и фильтрат концентрировали с получением 7,00 г (81%) (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина в виде светло-желтого масла.
Пример 1-193-5: получение N-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)-3-нитропиридин-2-амина
Указанное в заголовке соединение получали из (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина и 2-хлор-3-нитропиридина, как описано в примере 1-52-7.
Пример 1-193-6: получение N2-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)пиридин-2,3-диамина
К перемешанному и охлажденному (0°C) раствору N-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)-3-нитропиридин-2-амина (7,90 г, 15,70 ммоль) и хлорида аммония (8,40 г, 157,0 ммоль) в смеси 1:1:1 тетрагидрофуран/метанол/вода (150 мл) добавляли порошкообразный цинк (10,20 г, 157,0 ммоль). Обеспечивали перемешивание полученной в результате смеси при 0°C. Через 3 ч. смесь фильтровали. Фильтрат экстрагировали дихлорметаном (3×100 мл). Объединенные органические фазы промывали солевым раствором (2×50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали с получением 6,10 г (82%) N2-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)пиридин-2,3-диамина в виде темно-коричневого масла.
Пример 1-193-7: получение 3-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору N2-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)пиридин-2,3-диамина (6,10 г, 12,95 ммоль) и триэтилортоформиата (10 мл) в N,N-диметилформамиде (40 мл) добавляли 4-метилбензолсульфоновую кислоту (1,50 г, 8,70 ммоль). Через 20 ч. смесь разбавляли водой (300 мл) и экстрагировали этилацетатом (3×150 мл). Объединенные органические фазы промывали солевым раствором (2×50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (элюент: 0-100% этилацетат/петролейный эфир) с получением 5,60 г (90%) 3-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)-3H-имидазо[4,5-b]пиридина в виде темно-коричневого масла.
Пример 1-193-8: получение 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола
Перемешанный раствор 3-(4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)бензил)-3H-имидазо[4,5-b]пиридина (4,98 г, 10,34 ммоль) в уксусной кислоте (5 мл) нагревали до 110°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Остаток растворяли в дихлорметане и полученный в результате раствор промывали насыщенным раствором бикарбоната натрия (2x) и солевым раствором. Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-5% метанол/этилацетат) получали 3,00 г (80%) 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола в виде бежевой пены.
Пример 1-193-9: получение 3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола и 2-бром-1-(1-метил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,38 (dd, J=4,8, 1,2 Гц, 1H), 8,07 (dd, J=8,0, 1,2 Гц, 1H), 7,76 (s, 1H), 7,47 (s, 1H), 7,28 (d, J=8,0 Гц, 1H), 6,72 (d, J=1,8 Гц, 1H), 6,48 (d, J=1,8 Гц, 1H), 5,36 (s, 2H), 5,10-5,07 (m, 1H), 4,29-4,26 (m, 1H), 4,11-4,06 (m, 1H), 3,80 (s, 3H), 3,68 (s, 3H) ppm; (M+1)=378.
Пример 1-194: синтез 3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-194-1: получение 2-бром-1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она
К перемешанному раствору 1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она (1,00 г, 6,10 ммоль) в смеси 4:1 дихлорметан/этанол (10 мл) добавляли трибромид пиридиния (1,95 г, 6,10 ммоль). Через 3 ч. смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы промывали солевым раствором (50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (петролейный эфир/этилацетат=10/1) с получением 0,89 г (60%) 2-бром-1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она в виде желтого масла.
Пример 1-194-2: получение 3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,58 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,5, 1,5 Гц, 1H), 7,91 (s, 1H), 7,54 (s, 1H), 7,29 (dd, J=8,5, 5,0 Гц, 1H), 6,73 (d, J=1,7 Гц, 1H), 6,50 (d, J=1,7 Гц, 1H), 5,37 (s, 2H), 5,09-5,07 (m, 1H), 4,84-4,77 (m, 1H), 4,32-4,29 (m, 1H), 4,13-4,09 (m, 1H), 3,69 (s, 3H), 2,45-2,31 (m, 4H), 1,79-1,71 (m, 2H) ppm; (M+1)=418.
Пример 1-195: синтез 3-((2-(1-изопропил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(1-изопропил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,60 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,5, 1,5 Гц, 1H), 7,89 (s, 1H), 7,51 (s, 1H), 7,32-7,29 (m, 1H), 6,74 (d, J=2,0 Гц, 1H), 6,51 (d, J=2,0 Гц, 1H), 5,38 (s, 2H), 5,08-5,06 (m, 1H), 4,46 (sept, J=6,5 Гц, 1H), 4,33-4,30 (m, 1H), 4,14-4,10 (m, 1H), 3,70 (s, 3H), 1,39 (d, J=6,5 Гц, 6H) ppm; (M+1)=406.
Пример 1-196: синтез 3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-196-1: получение 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она
К перемешанному раствору 5-бром-2-(метоксиметил)пиридина (2,60 г, 12,90 ммоль) и трибутил(1-этоксивинил)станнана (5,20 г, 14,40 ммоль) в 1,4-диоксане (30 мл) добавляли хлорид (1,1'-бис(дифенилфосфино)ферроцен)палладия(II) (0,87 г, 1,19 ммоль). Полученную в результате смесь нагревали до 100°C. Через 4 ч. обеспечивали охлаждение смеси до комнатной температуры и концентрировали с получением светло-коричневого масла. Данный материал растворяли в смеси 9:1 тетрагидрофуран/вода (20 мл) и охлаждали до 0°C. Добавляли N-бромсукцинимид (1,80 г, 10,10 ммоль). обеспечивали перемешивание полученной в результате смеси при 0°C. Через 2 ч. смесь разбавляли водой (60 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические фазы промывали солевым раствором (100 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (смесь 5:1 петролейный эфир/этилацетат) с получением 2,30 г (70%) 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она в виде светло-коричневого твердого вещества.
Пример 1-196-2: получение 3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 8,58 (d, J=1,5 Гц, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,0 Гц, 1H), 7,85 (dd, J=8,0, 2,5 Гц, 1H), 7,46 (d, J=8,0 Гц, 1H), 7,30 (dd, J=8,0, 5,0 Гц, 1H), 6,79 (d, J=1,7 Гц, 1H), 6,53 (d, J=1,7 Гц, 1H), 5,39 (s, 2H), 5,26-5,24 (m, 1H), 4,51 (s, 2H), 4,42-4,39 (m, 1H), 4,17-4,12 (m, 1H), 3,74 (s, 3H), 3,36 (s, 3H) ppm; (M+1)=419.
Пример 1-197: синтез 3-((8-метокси-2-(5-метоксипиразин-2-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-197-1: получение 2-бром-1-(5-метоксипиразин-2-ил)этан-1-она
Указанное в заголовке соединение получали из 2-бром-5-метоксипиразина, трибутил(1-этоксивинил)станнана и N-бромсукцинимида, как описано в примере 1-196-1.
Пример 1-197-2: получение 3-((8-метокси-2-(5-метоксипиразин-2-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(5-метоксипиразин-2-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,38 (dd, J=4,8, 1,2 Гц, 1H), 8,32 (d, J=1,2 Гц, 1H), 8,26 (s, 1H), 8,09 (dd, J=8,0, 1,2 Гц, 1H), 7,28 (dd, J=8,0, 4,8 Гц, 1H), 6,77 (d, J=1,8 Гц, 1H), 6,48 (d, J=1,8 Гц, 1H), 5,37 (s, 2H), 5,29-5,26 (m, 1H), 4,44-4,40 (m, 1H), 4,32-4,27 (m, 1H), 3,90 (s, 3H), 3,73 (s, 3H) ppm; (M+1)=406.
Пример 1-198: синтез 3-((8-метокси-2-(2-метоксипиримидин-5-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-198-1: получение 2-бром-1-(2-метоксипиримидин-5-ил)этан-1-она
Указанное в заголовке соединение получали из 5-бром-2-метоксипиримидина, трибутил(1-этоксивинил)станнана и N-бромсукцинимида, как описано в примере 1-196-1.
Пример 1-198-2: получение 3-((8-метокси-2-(2-метоксипиримидин-5-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(2-метоксипиримидин-5-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,66 (s, 2H), 8,60 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=7,5, 1,5 Гц, 1H), 7,30 (dd, J=7,5, 5,0 Гц, 1H), 6,78 (d, J=2,0 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,23-5,21 (m, 1H), 4,41-4,37 (m, 1H), 4,25-4,20 (m, 1H), 3,92 (s, 3H), 3,73 (s, 3H) ppm; (M+1)=406.
Пример 1-199: синтез 3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-199-1: получение 6-(1,1-дифторэтил)никотинонитрила
К перемешанному раствору 6-ацетилникотинонитрила (3,28 г, 22,44 ммоль) в толуоле (25 мл) добавляли бис(2-метоксиэтил)аминосеры трифторид (19,86 г, 89,77 ммоль). Смесь нагревали до 45°C. Через 24 ч. смесь охлаждали до 0°C и гасили медленным добавлением насыщенного раствора бикарбоната натрия до достижения смесью pH ~7. Добавляли этилацетат и фазы разделяли. Органическую фазу промывали водой и солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-10% этилацетат/гептан) получали 3,09 г (82%) 6-(1,1-дифторэтил)никотинонитрила в виде желтого масла.
Пример 1-199-2: получение 1-(6-(1,1-дифторэтил)пиридин-3-ил)этан-1-она
К перемешанному и охлажденному (0°C) 6-(1,1-дифторэтил)никотинонитрилу (3,23 г, 19,21 ммоль) и бромиду меди(I) (0,10 г, 0,70 ммоль) в тетрагидрофуране (10 мл) добавляли 3,0 М раствор бромида метилмагния в диэтиловом эфире (19,2 мл, 57,63 ммоль). Через 15 мин. обеспечивали нагревание смеси до комнатной температуры. Через 30 мин. смесь повторно охлаждали до 0°C при добавлении насыщенного раствора хлорида аммония. Смесь дополнительно разбавляли этилацетатом и водой. Фазы разделяли и органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-30% этилацетат/гептан) получали 1,72 г (48%) 1-(6-(1,1-дифторэтил)пиридин-3-ил)этан-1-она (1,72 г, 9,29 ммоль, выход 48,4%) в виде желтого масла.
Пример 1-199-3: получение 2-бром-1-(6-(1,1-дифторэтил)пиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(6-(1,1-дифторэтил)пиридин-3-ил)этан-1-она и брома, как описано в примере 1-110-2.
Пример 1-199-4: получение 3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA10963700, получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(6-(1,1-дифторэтил)пиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,74 (s, 1H), 8,61 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 8,02 (dd, J=8,0, 2,5 Гц, 1H), 7,77 (d, J=8,0 Гц, 1H), 7,31 (dd, J=8,0, 5,0 Гц, 1H), 6,80 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,40 (s, 2H), 5,38-5,35 (m, 1H), 4,47-4,44 (m, 1H), 4,21-4,17 (m, 1H), 3,75 (s, 3H), 2,00 (t, J=19,5 Гц, 3H) ppm; (M+1)=439.
Пример 1-199-5: хиральное разделение 3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Рацемический 3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин подвергали препаративной очистке с помощью SFC (колонка Chiralpak AD-H 21,2×250 мм, 19% этанола/0,1% диэтиламинового модификатора, расход 48 г/мин.) с получением отдельных энантиомеров.
Пример 1-200: синтез 5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)фуро[2,3-b]пиридина
Пример 1-200-1: получение 2-бром-1-(2-(триметилсилил)фуро[2,3-b]пиридин-5-ил)этан-1-она
Указанное в заголовке соединение получали из 5-бром-2-(триметилсилил)фуро[2,3-b]пиридина, трибутил(1-этоксивинил)станнана и N-бромсукцинимида, как описано в примере 1-196-1.
Пример 1-200-2: получение 5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[-b][1,4]диоксин-2-ил)фуро[2,3-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(2-(триметилсилил)фуро[2,3-b]пиридин-5-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 8,41-8,39 (m, 2H), 8,19 (d, J=2,0 Гц, 1H), 8,16 (d, J=2,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 7,30 (dd, J=8,0, 4,5 Гц, 1H), 7,07 (d, J=2,5 Гц, 1H), 6,79 (d, J=2,0 Гц, 1H), 6,55 (d, J=2,0 Гц, 1H), 5,40 (s, 2H), 5,35-5,33 (m, 1H), 4,45-4,42 (m, 1H), 4,20-4,16 (m, 1H), 3,73 (s, 3H) ppm; (M+1)=415.
Пример 1-201: синтез 5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,3-дигидрофуро[2,3-b]пиридина
Указанное в заголовке соединение выделяли в качестве побочного продукта синтеза в примере 1-200: 1H ЯМР (500 МГц, DMSO-d6) δ 8,61 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 7,97 (s, 1H), 7,66 (s, 1H), 7,30 (dd, J=8,0, 5,0 Гц, 1H), 6,77 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,39 (s, 2H), 5,10-5,07 (m, 1H), 4,58 (t, J=8,5 Гц, 2H), 4,34-4,30 (m, 1H), 4,13-4,08 (m, 1H), 3,72 (s, 3H), 3,26-3,21 (m, 2H) ppm; (M+1)=417.
Пример 1-202: синтез 3-((2-(1-(циклопропилметил)-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(1-(циклопропилметил)-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,40 (dd, J=5,0, 1,5 Гц, 1H), 8,10 (dd, J=8,0, 1,5 Гц, 1H), 7,87 (s, 1H), 7,50 (s, 1H), 7,31 (dd, J=8,0, 5,0 Гц, 1H), 6,73 (d, J=1,5 Гц, 1H), 6,50 (d, J=1,5 Гц, 1H), 5,37 (s, 2H), 5,11-5,08 (m, 1H), 4,33-4,30 (m, 1H), 4,14-4,10 (m, 1H), 3,94 (d, J=7,0 Гц, 2H), 3,70 (s, 3H), 1,23-1,18 (m, 1H), 0,52-0,49 (m, 2H), 0,35-0,32 (m, 2H) ppm; (M+1)=418.
Пример 1-203: синтез 3-((2-(4,4-дифторциклогексил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(4,4-дифторциклогексил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,39 (dd, J=4,8, 1,2 Гц, 1H), 8,09 (dd, J=8,0, 1,2 Гц, 1H), 7,30 (dd, J=8,0, 4,8 Гц, 1H), 6,73 (d, J=1,6 Гц, 1H), 6,46 (d, J=1,6 Гц, 1H), 5,36 (s, 2H), 4,28-4,24 (m, 1H), 3,94-3,90 (m, 2H), 3,73 (s, 3H), 2,08-1,95 (m, 3H), 1,75-1,73 (m, 4H), 1,38-1,34 (m, 2H) ppm; (M+1)=416.
Пример 1-204: синтез 3-((8-метокси-2-(1-(2-метоксиэтил)-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-204-1: получение 2-бром-1-(1-(2-метоксиэтил)-1H-пиразол-4-ил)этан-1-она
Указанное в заголовке соединение получали из 1-(1-(2-метоксиэтил)-1H-пиразол-4-ил)этан-1-она и трибромида пиридиния, как описано в примере 1-194-1.
Пример 1-204-2: получение 3-((8-метокси-2-(1-(2-метоксиэтил)-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(1-(2-метоксиэтил)-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,40 (dd, J=4,5, 1,5 Гц, 1H), 8,11 (dd, J=8,5, 1,5 Гц, 1H), 7,81 (s, 1H), 7,51 (s, 1H), 7,30 (dd, J=8,5, 4,5 Гц, 1H), 6,73 (d, J=1,5 Гц, 1H), 6,50 (d, J=1,5 Гц, 1H), 5,37 (s, 2H), 5,11-5,09 (m, 1H), 4,32-4,29 (m, 1H), 4,23 (t, J=5,0 Гц, 2H), 4,14-4,10 (m, 1H), 3,70 (s, 3H), 3,66 (t, J=5,0 Гц, 2H), 3,21 (s, 3H) ppm; (M+1)=422.
Пример 1-205: синтез 3-((2-бутил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 1-бромгексан-2-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=4,8 Гц, 1H), 8,11 (d, J=8,0 Гц, 1H), 8,04 (s, 1H), 7,30-7,26 (m, 1H), 6,51 (s, 1H), 6,50 (s, 1H), 5,37 (s, 2H), 4,25 (dd, J=11,2, 1,6 Гц, 1H), 4,16-4,10 (m, 1H), 3,92-3,86 (m, 1H), 3,82 (s, 3H), 1,86-1,78 (m, 1H), 1,67-1,34 (m, 5H), 0,96 (t, J=7,2 Гц, 3H) ppm; (M+1)=354.
Пример 1-206: синтез 6-метокси-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-206-1: получение 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола
Указанное в заголовке соединение получали в ходе четырех стадий из (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина (пример 1-193-4) и 2-хлор-5-метокси-3-нитропиридина, как описано в примерах от 1-193-5 до 1-193-8.
Пример 1-206-2: получение 6-метокси-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола и 2-бром-1-(1-метил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, CD3OD) δ 8,41-8,37 (m, 1H), 8,18 (d, J=2,0 Гц, 1H), 7,70 (s, 1H), 7,65 (s, 1H), 7,55 (s, 1H), 6,68 (d, J=2,0 Гц, 1H), 6,53 (d, J=2,0 Гц, 1H), 5,38 (s, 2H), 5,16-5,13 (m, 1H), 4,35-4,31 (m, 1H), 4,14-4,10 (m, 1H), 3,93 (s, 3H), 3,88 (s, 3H), 3,78 (s, 3H) ppm; (M+1)=408.
Пример 1-207: синтез 3-((2-(1,5-диметил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 2-бром-1-(1,5-диметил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,51 (s, 1H), 8,15 (d, J=2,4 Гц,1H), 7,72 (d, J=2,4 Гц, 1H), 7,36 (s, 1H), 6,70 (d, J=1,2 Гц 1H), 6,49 (d, J=1,2 Гц, 1H), 5,33 (s, 2H), 5,05-5,02 (m, 1H), 4,26-4,23 (m, 1H), 4,19-4,13 (m, 1H), 3,85 (s, 3H), 3,71 (s, 3H), 3,69 (s, 3H), 2,25 (s, 3H) ppm; (M+1)=422.
Пример 1-208: синтез 3-((2-(1,3-диметил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 2-бром-1-(1,3-диметил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,51 (s, 1H), 8,15 (d, J=2,5 Гц, 1H), 7,72 (d, J=2,5 Гц, 1H), 7,64 (s, 1H), 6,71 (d, J=1,5 Гц, 1H), 6,49 (d, J=1,5 Гц, 1H), 5,33 (s, 2H), 5,05-5,03 (m, 1H), 4,30-4,27 (m, 1H), 4,10-4,05 (m, 1H), 3,85 (s, 3H), 3,72 (s, 3H), 3,69 (s, 3H), 2,15 (s, 3H) ppm; (M+1)=422.
Пример 1-209: синтез 3-((2-(1-(циклопропилметил)-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 2-бром-1-(1-циклопропилметил-1H-пиразол-4-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,51 (s, 1H), 8,15 (d, J=2,5 Гц, 1H), 7,88 (s, 1H), 7,72 (d, J=2,5 Гц, 1H), 7,50 (s, 1H), 6,71 (d, J=1,5 Гц, 1H), 6,48 (d, J=1,5 Гц, 1H), 5,33 (s, 2H), 5,11-5,09 (m, 1H), 4,33-4,30 (m, 1H), 4,15-4,11 (m, 1H), 3,94 (d, J=7,0 Гц, 2H), 3,86 (s, 3H), 3,70 (s, 3H), 1,24-1,18 (m, 1H), 0,52-0,49 (m, 2H), 0,36-0,33 (m, 2H) ppm; (M+1)=448.
Пример 1-210: синтез 3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 2-бром-1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она (пример 1-194-1), как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,50 (s, 1H), 8,15 (d, J=2,5 Гц, 1H), 7,91 (s, 1H), 7,72 (d, J=2,5 Гц, 1H), 7,54 (s, 1H), 6,70 (d, J=1,5 Гц, 1H), 6,47 (d, J=1,5 Гц, 1H), 5,32 (s, 2H), 5,09-5,07 (m, 1H), 4,83-4,79 (m, 1H), 4,32-4,29 (m, 1H), 4,13-4,09 (m, 1H), 3,85 (s, 3H), 3,69 (s, 3H), 2,45-2,39 (m, 2H), 2,37-2,31 (m, 2H), 1,79-1,73 (m, 2H) ppm; (M+1)=448.
Пример 1-211: синтез 6-метокси-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она (пример 1-196-1), как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (500 МГц, DMSO-d6) δ 8,59 (d, J=2,0 Гц, 1H), 8,52 (s, 1H), 8,15 (d, J=2,5 Гц, 1H), 7,85 (dd, J=8,0, 2,0 Гц, 1H), 7,73 (d, J=2,5 Гц, 1H), 7,46 (d, J=8,0 Гц, 1H), 6,76 (d, J=2,0 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 5,35 (s, 2H), 5,25 (dd, J=8,0, 2,5 Гц, 1H), 4,51 (s, 2H), 4,41 (dd, J=11,5, 2,5 Гц, 1H), 4,15 (dd, J=11,5, 8,0 Гц, 1H), 3,85 (s, 3H), 3,74 (s, 3H), 3,36 (s, 3H) ppm; (M+1)=449.
Пример 1-212: синтез 3-((2-бутил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола (пример 1-206-1) и 1-бромгексан-2-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, CDCl3) δ 8,22 (d, J=2,6 Гц, 1H), 7,98 (s, 1H), 7,60 (d, J=2,6 Гц, 1H), 6,50 (d, J=1,8 Гц, 1H), 6,48 (d, J=1,8 Гц, 1H), 5,32 (s, 2H), 4,23 (dd, J=11,2, 2,0 Гц, 1H), 4,16-4,09 (m, 1H), 3,92 (s, 3H), 3,91-3,86 (m, 1H), 3,82 (s, 3H), 1,85-1,79 (m, 1H), 1,65-1,36 (m, 5H), 0,93 (t, J=7,2 Гц, 3H) ppm; (M+1)=384.
Пример 1-213: синтез 6-(азетидин-1-ил)-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-213-1: получение 2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенола
Указанное в заголовке соединение получали в ходе четырех стадий из (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина (пример 1-193-4) и 5-бром-2-хлор-3-нитропиридина, как описано в примерах от 1-193-5 до 1-193-8.
Пример 1-213-2: получение 2-(2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенокси)-1-(1-метил-1H-пиразол-4-ил)этан-1-она
Указанное в заголовке соединение получали из 2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенола и 2-бром-1-(1-метил-1H-пиразол-4-ил)этан-1-она, как описано в примере 1-52-1.
Пример 1-213-3: получение 2-(2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенокси)-1-(1-метил-1H-пиразол-4-ил)этан-1-ола
Указанное в заголовке соединение получали из 2-(2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенокси)-1-(1-метил-1H-пиразол-4-ил)этан-1-она, как описано в примере 1-14-2.
Пример 1-213-4: получение 6-бром-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Перемешанную суспензию 2-(2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенокси)-1-(1-метил-1H-пиразол-4-ил)этан-1-ола (1,30 г, 2,30 ммоль) в 6 М растворе хлористоводородной кислоты (20 мл) нагревали до температуры возврата флегмы. Через 2 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой. Кислотный раствор нейтрализовали путем добавления твердого карбоната калия. Нейтральную смесь экстрагировали этилацетатом (x 3). Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (смесь 1:1 петролейный эфир/этилацетат) с получением 0,80 г (76%) 6-бром-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде желтовато-коричневого твердого вещества.
Пример 1-213-5: получение 6-(азетидин-1-ил)-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и азетидина, как описано в примере 1-10: 1H ЯМР (500 МГц, CDCl3) δ 7,93 (s, 1H), 7,77 (d, J=2,5 Гц, 1H), 7,54 (s, 1H), 7,47 (s, 1H), 7,14 (d, J=2,5 Гц, 1H), 6,51 (s, 1H), 6,50 (s, 1H), 5,30 (s, 2H), 5,18 (dd, J=8,0, 2,5 Гц, 1H), 4,32 (dd, J=11,5, 2,5 Гц, 1H), 4,16 (dd, J=11,5, 8,0 Гц, 1H), 3,99-3,95 (m, 4H), 3,89 (s, 3H), 3,79 (s, 3H), 2,48-2,42 (m, 2H) ppm; (M+1)=433.
Пример 1-214: синтез 3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-213-4) и 3-метоксиазетидина гидрохлорида, как описано в примере 1-10: 1H ЯМР (500 МГц, CDCl3) δ 7,94 (s, 1H), 7,80 (d, J=2,5 Гц, 1H), 7,55 (s, 1H), 7,48 (s, 1H), 7,17 (d, J=2,5 Гц, 1H), 6,52 (d, J=2,0 Гц, 1H), 6,50 (d, J=2,0 Гц, 1H), 5,31 (s, 2H), 5,20-5,17 (m, 1H), 4,44-4,40 (m, 1H), 4,33 (dd, J=11,5, 2,0 Гц, 1H), 4,24-4,20 (m, 2H), 4,17 (dd, J=11,5, 7,5 Гц, 1H), 3,89 (s, 3H), 3,80 (s, 3H), 3,79-3,77 (m, 2H), 3,38 (s, 3H) ppm; (M+1)=463.
Пример 1-215: синтез 6-циклопропил-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-213-4) и циклопропилбороновой кислоты, как описано в примере 1-9: 1H ЯМР (500 МГц, CDCl3) δ 8,32 (d, J=2,0 Гц, 1H), 8,00 (s, 1H), 7,72 (d, J=2,0 Гц, 1H), 7,55 (s, 1H), 7,48 (s, 1H), 6,54-6,50 (m, 2H), 5,35 (s, 2H), 5,19 (dd, J=7,5, 2,5 Гц, 1H), 4,32 (dd, J=11,5, 2,5 Гц, 1H), 4,17-4,12 (m, 1H), 3,89 (s, 3H), 3,80 (s, 3H), 2,10-2,06 (m, 1H), 1,08-1,03 (m, 2H), 0,79-0,75 (m, 2H) ppm; (M+1)=418.
Пример 1-216: синтез 6-циклопропил-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-216-1: получение 6-бром-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она (пример 1-196-1) и 5-бром-2-хлор-3-нитропиридина, как описано в примерах от 1-52-1 до 1-52-9.
Пример 1-216-2: получение 6-циклопропил-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и циклопропилбороновой кислоты, как описано в примере 1-9: 1H ЯМР (500 МГц, CDCl3) δ 8,61 (d, J=1,5 Гц, 1H), 8,32 (d, J=1,5 Гц, 1H), 8,01 (s, 1H), 7,78 (dd, J=8,5, 1,5 Гц, 1H), 7,72 (d, J=1,5 Гц, 1H), 7,48 (d, J=8,0 Гц, 1H), 6,55 (s, 1H), 6,53 (s, 1H), 5,36 (s, 2H), 5,19 (dd, J=8,0, 2,0 Гц, 1H), 4,61 (s, 2H), 4,35 (dd, J=11,5, 2,0 Гц, 1H), 4,08 (dd, J=11,5, 8,0 Гц, 1H), 3,82 (s, 3H), 3,48 (s, 3H), 2,10-2,06 (m, 1H), 1,07-1,04 (m, 2H), 0,78-0,75 (m, 2H) ppm; (M+1)=459.
Пример 1-217: синтез 6-(дифторметил)-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе девяти стадий из метил-4-(бензилокси)-3-гидрокси-5-метоксибензоата, 2-бром-1-(6-(метоксиметил)пиридин-3-ил)этан-1-она (пример 1-196-1) и 5-(дифторметил)-2-(метилсульфонил)-3-нитропиридина (пример 1-86-5), как описано в примерах от 1-52-1 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,64-8,60 (m, 2H), 8,26 (s, 1H), 8,16 (s, 1H), 7,78 (dd, J=8,0, 1,6 Гц, 1H), 7,49 (d, J=8,0 Гц, 1H), 6,89 (t, J=56 Гц, 1H), 6,59-6,55 (m, 2H), 5,42 (s, 2H), 5,21-5,19 (m, 1H), 4,61 (s, 2H), 4,39-4,35 (m, 1H), 4,12-4,07 (m, 1H), 3,84 (s, 3H), 3,49 (s, 3H) ppm; (M+1)=469.
Пример 1-218: синтез (3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Пример 1-218-1: получение 6-бром-3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-5-((6-бром-3H-имидазо[4,5-b]пиридин-3-ил)метил)-3-метоксифенола (пример 1-213-1) и 2-бром-1-(1-циклобутил-1H-пиразол-4-ил)этан-1-она (пример 1-194-1), как описано в примерах от 1-213-2 до 1-213-4.
Пример 1-218-2: получение метил-3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата
К перемешанной суспензии 6-бром-3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,23 г, 0,46 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,027 г, 0,046 ммоль) и триэтиламина (0,47 г, 4,63 ммоль) в смеси 1:1 метанол/N,N-диметилформамид (10 мл) добавляли ацетат палладия(II) (0,010 г, 0,046 ммоль). Смесь вакуумировали и атмосферу замещали монооксидом углерода (1 атм. посредством баллона). Смесь нагревали до 65°C. Через 48 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (элюент: 8% метанол/дихлорметан) с получением 0,10 г (45%) метил-3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата в виде светло-желтого твердого вещества.
Пример 1-218-3: получение (3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола
Указанное в заголовке соединение получали из метил-3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбоксилата, как описано в примере 1-52-4: 1H ЯМР (400 МГц, CDCl3) δ 8,45 (d, J =1,6 Гц, 1H), 8,09 (d, J =1,6 Гц, 1H), 8,05 (s, 1H), 7,57 (s, 1H), 7,55 (s, 1H), 6,53-6,51 (m, 2H), 5,36 (s, 2H), 5,17 (dd, J=7,6, 2,4 Гц, 1H), 4,86 (s, 2H), 4,75-4,72 (m, 1H), 4,32 (dd, J=11,2, 2,4 Гц, 1H), 4,14 (dd, J=11,2, 7,6 Гц, 1H), 3,80 (s, 3H), 2,56-2,42 (m, 4H), 1,91-1,79 (m, 3H) ppm; (M+1)=448.
Пример 1-219: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(трифторметил)-3H-имидазо[4,5-b]пиридина
Пример 1-219-1: получение 2-(бензилокси)-3-метокси-5-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола
Указанное в заголовке соединение получали в ходе четырех стадий из (4-(бензилокси)-3-метокси-5-((4-метоксибензил)окси)фенил)метанамина (пример 1-193-4) и 2-хлор-3-нитро-5-(трифторметил)пиридина, как описано в примерах от 1-193-5 до 1-193-8.
Пример 1-219-2: получение 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(трифторметил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 2-(бензилокси)-3-метокси-5-((6-(трифторметил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)фенола и 2-бром-1-(6-метилпиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, CDCl3) δ 8,74 (s, 1H), 8,55 (s, 1H), 8,35 (s, 1H), 8,20 (s, 1H), 7,65 (d, J=8,2 Гц, 1H), 7,21 (d, J=8,2 Гц, 1H), 6,58-6,56 (m, 2H), 5,42 (s, 2H), 5,17-5,15 (m, 1H), 4,37-4,33 (m, 1H), 4,11-4,06 (m, 1H), 3,84 (s, 3H), 2,59 (s, 3H) ppm; (M+1)=457.
Пример 1-220: синтез 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-2-она
К перемешанной суспензии 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (0,068 г, 0,13 ммоль, пример 1-52-9), карбоната цезия (0,17 г, 0,52 ммоль), бис(дифенилфосфино)-9,9-диметилксантена (0,016 г, 0,027 ммоль) и азетидин-2-она (0,026 г, 0,37 ммоль) в 1,4-диоксане (10 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (0,016 г, 0,017 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). Смесь нагревали до 105°C в герметизированном сосуде. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (Biotage, колонка с 12 г силикагеля, элюент: 0-100% этилацетат/гептан и затем 0-10% метанол/этилацетат) получали 0,017 г (28%) 1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-2-она в виде желтовато-коричневого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,68-8,66 (m, 1H), 8,24-8,16 (m, 1H), 8,05 (d, J=1,4 Гц, 1H), 8,01 (d, J=2,1 Гц, 1H), 7,63-7,59 (m, 1H), 6,77 (dd, J=8,7, 1,4 Гц, 1H), 6,55-6,53 (m, 2H), 5,34 (s, 2H), 5,11-5,07 (m, 1H), 4,32-4,28 (m, 1H), 4,11-4,02 (m, 1H), 3,94 (s, 3H), 3,80 (s, 3H), 3,76-3,72 (m, 2H), 3,23-3,19 (m, 2H) ppm; (M+1)=474.
Пример 1-221: синтез 7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5H-пирроло[2,3-b]пиразина
Пример 1-221-1: получение 7-бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразина
К перемешанной и охлажденной (0°C) суспензии 7-бром-5H-пирроло[2,3-b]пиразина (0,75 г, 3,64 ммоль) в N,N-диметилформамиде (15 мл) добавляли 60% дисперсию гидрида натрия (0,18 г, 4,54 ммоль). Через 15 мин. смесь обрабатывали 2-(триметилсилил)этоксиметилхлоридом (0,73 г, 4,36 ммоль). Обеспечивали нагревание полученной в результате мутной смеси до комнатной температуры. Через 2 ч. смесь разбавляли водой (15 мл). Затем смесь экстрагировали смесью 1:3 этилацетат/эфир (x 2). Объединенные органические фазы промывали водой, высушивали над сульфатом магния, фильтровали и концентрировали. Остаток суспендировали в диэтиловом эфире и обрабатывали ультразвуком. Жидкую фазу декантировали и способ повторяли. Объединенные жидкие фазы концентрировали с получением 1,10 г (92%) 7-бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразина в виде коричневого масла.
Пример 1-221-2: получение 7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5H-пирроло[2,3-b]пиразина
Указанное в заголовке соединение получали в ходе двух стадий из 7-бром-5-((2-(триметилсилил)этокси)метил)-5H-пирроло[2,3-b]пиразина и 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (пример 1-102-1), как описано в примерах от 1-23-3 до 1-23-4: 1H ЯМР (400 МГц, CDCl3) δ 9,65 (s, 1H), 8,48 (d, J=2,5 Гц, 1H), 8,25 (d, J=2,5 Гц, 1H), 8,21 (d, J=2,5 Гц, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,39-7,32 (m, 1H), 6,76 (d, J=8,6 Гц, 1H), 6,60 (d, J=1,9 Гц, 1H), 6,54 (d, J=1,9 Гц, 1H), 5,09 (dd, J=8,4, 2,4 Гц, 1H), 4,28 (dd, J=11,5, 2,4 Гц, 1H), 4,13 (s, 2H), 4,06 (dd, J=11,5, 8,4 Гц, 1H), 3,93 (s, 3H), 3,82 (s, 3H) ppm; (M+1)=405.
Пример 1-222: синтез 4-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Пример 1-222-1: получение (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(1H-пирроло[2,3-b]пиридин-4-ил)метанола
К перемешанному и охлажденному (-78°C) раствору 4-бром-1H-пирроло[2,3-b]пиридина (0,25 г, 1,28 ммоль) в тетрагидрофуране (5 мл) по каплям добавляли посредством шприца 2,7 М раствор н-бутиллития в гексанах (0,49 мл, 1,34 ммоль). Через 30 мин. смесь обрабатывали 1,7 М раствором трет-бутиллития в гептане (0,75 мл, 1,28 ммоль). Через 15 мин. смесь обрабатывали раствором 8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-карбальдегида (0,35 г, 1,16 ммоль, пример 1-102-1) в тетрагидрофуране (3 мл). Через 15 мин. обеспечивали нагревание смеси до комнатной температуры и ее перемешивали. Через 10 мин. при комнатной температуре смесь гасили путем добавления насыщенного раствора хлорида аммония (0,2 мл). Смесь концентрировали и остаток разделяли между дихлорметаном и водой (pH регулировали до ~ 7-8). Фазы разделяли и органическую фазу промывали водой. Органическую фазу высушивали над сульфатом натрия, фильтровали и концентрировали с получением неочищенного (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(1H-пирроло[2,3-b]пиридин-4-ил)метанола в виде масла.
Пример 1-222-2: получение 4-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина
Указанное в заголовке соединение получали из (8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)(1H-пирроло[2,3-b]пиридин-4-ил)метанола, как описано в примере 1-22-2: 1H ЯМР (400 МГц, CDCl3) δ 10,00 (s, 1H), 8,21 (d, J=2,4 Гц, 1H), 8,19 (d, J=5,2 Гц, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,35 (d, J=3,6 Гц, 1H), 6,96 (d, J=5,2 Гц, 1H), 6,78 (d, J=8,6 Гц, 1H), 6,59 (d, J=3,6 Гц, 1H), 6,47 (d, J=1,9 Гц, 1H), 6,41 (d, J=1,9 Гц, 1H), 5,10 (dd, J=8,5, 2,4 Гц, 1H), 4,30 (dd, J=11,5, 2,4 Гц, 1H), 4,20 (s, 2H), 4,07 (dd, J=11,5, 8,5 Гц, 1H), 3,94 (s, 3H), 3,80 (s, 3H) ppm; (M+1)=404.
Пример 1-223: синтез 4-(3-((2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-223-1: получение (E)-1-(5-бром-2-гидроксифенил)-3-(6-метоксипиридин-3-ил)проп-2-ен-1-она
К перемешанному раствору 1-(5-бром-2-гидроксифенил)этанона (22,35 г, 103,91 ммоль) в этаноле (225 мл) добавляли 6-метоксиникотинальдегид (15,00 г, 109,38 ммоль). Полученный в результате гомогенный раствор обрабатывали раствором гидроксида калия (13,50 г, 240,64 ммоль) в воде (75 мл) (добавляли по каплям в течение 5 мин.). Обеспечивали перемешивание смеси. Через 16 ч. смесь выливали в воду (400 мл) и нейтрализовали до pH ~7 путем медленного добавления 3 н. раствора хлористоводородной кислоты. Полученную в результате суспензию фильтровали и твердые вещества повторно суспендировали в воде (400 мл) и повторно фильтровали. Твердое вещество высушивали в вакуумном осушителе с последующей азеотропной перегонкой с толуолом с получением 27,70 г (76%) (E)-1-(5-бром-2-гидроксифенил)-3-(6-метоксипиридин-3-ил)проп-2-ен-1-она в виде желтого твердого вещества.
Пример 1-223-2: получение 6-бром-2-(6-метоксипиридин-3-ил)хроман-4-она
К перемешанной суспензии (E)-1-(5-бром-2-гидроксифенил)-3-(6-метоксипиридин-3-ил)проп-2-ен-1-она (27,70 г, 82,89 ммоль) в этаноле (500 мл) добавляли ацетат натрия (51,00 г, 621,7 ммоль). К данной смеси добавляли воду (12,5 мл) и полученную в результате желтую суспензию нагревали до температуры возврата флегмы. Через 16 ч. добавляли дополнительную порцию ацетата натрия (10,0 г) и нагревание продолжали в течение 1 ч. Затем обеспечивали охлаждение смеси до комнатной температуры и затем ее концентрировали до общего объема ~ 300 мл. Смесь экстрагировали дихлорметаном (2×250 мл). Объединенные органические фазы промывали солевым раствором, высушивали над сульфатом натрия и концентрировали. Неочищенное желтое твердое вещество растирали в диэтиловом эфире (150 мл) и суспензию нагревали с обратным холодильником в течение 30 мин. с получением 13 г продукта (~80% чистоты). Данный материал нагревали с обратным холодильником в этаноле (150 мл) в течение 20 минут и обеспечивали отстаивание суспензии в течение ночи. Смесь охлаждали на ледяной бане и твердые вещества отделяли путем фильтрации. Осадок на фильтре промывали этанолом и твердые вещества высушивали с получением 12,10 г (44%) 6-бром-2-(6-метоксипиридин-3-ил)хроман-4-она в виде желтого твердого вещества.
Пример 1-223-3: получение 5-(6-бромхроман-2-ил)-2-метоксипиридина
Указанное в заголовке соединение получали из 6-бром-2-(6-метоксипиридин-3-ил)хроман-4-она, как описано в примере 1-22-2 (примечание: реакцию осуществляли с обратным холодильником в течение 20 ч.).
Пример 1-223-4: получение 2-метокси-5-(6-винилхроман-2-ил)пиридина
К перемешанной суспензии 5-(6-бромхроман-2-ил)-2-метоксипиридина (1,60 г, 5,00 ммоль), винилтрифторбората калия (0,85 г, 6,00 ммоль), трифенилфосфина (0,13 г, 0,50 ммоль), карбоната цезия (4,88 г, 14,99 ммоль) в смеси 10:1 тетрагидрофуран/вода (30 мл) добавляли хлорид палладия(II) (0,044 г, 0,25 ммоль). Суспензию дегазировали под вакуумом/заполняли азотом (X 3) и затем нагревали при 100°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разделяли между водой (30 мл) и дихлорметаном (100 мл). Органическую фазу промывали водой и солевым раствором, высушивали над сульфатом натрия и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 40 г силикагеля, элюент: 10-20% этилацетат/гексаны) получали 0,79 г (59%) 2-метокси-5-(6-винилхроман-2-ил)пиридина в виде белого твердого вещества.
Пример 1-223-5: получение 2-(6-метоксипиридин-3-ил)хроман-6-карбальдегида
К перемешанному раствору 2-метокси-5-(6-винилхроман-2-ил)пиридина (0,79 г, 2,96 ммоль), тетрагидрофурана (20 мл) и воды (6,7 мл, 2,96 ммоль) добавляли 4% вес/вес раствор тетраоксида осмия в воде (0,36 мл, 0,059 ммоль) с образованием в результате светло-коричневого раствора. Добавляли перйодат натрия (1,58 г, 7,39 ммоль) одной порцией и отмечали умеренную экзотермию. Обеспечивали перемешивание густой смеси при комнатной температуре в течение 1 ч. Смесь обрабатывали сульфитом натрия (1,75 г) и обеспечивали ее перемешивание при комнатной температуре в течение 15 мин. На дне колбы образовывался густой вязкий материал, и прозрачную жидкость декантировали и фильтровали через целит. Подушку фильтра промывали этилацетатом (75 мл). Фильтрат разбавляли водой (15 мл) и фазы разделяли. Органическую фазу промывали 1 н. раствором гидроксида натрия (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 0,79 г (99%) 2-(6-метоксипиридин-3-ил)хроман-6-карбальдегида в виде вязкого масла светло-янтарного цвета.
Пример 1-223-6: получение (2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе двух стадий из 2-(6-метоксипиридин-3-ил)хроман-6-карбальдегида и гидроксиламина гидрохлорида, как описано в примерах от 1-18-8 до 1-18-9.
Пример 1-223-7: получение 4-(3-((2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-52-7 до 1-2-10: 1H ЯМР (400 МГц, CDCl3) δ 8,46 (d, J=1,8 Гц, 1H), 8,18 (d, J=2,5 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,03 (s, 1H), 7,62 (dd, J=8,6, 2,5 Гц, 1H), 7,14-6,99 (m, 2H), 6,84 (d, J=8,3 Гц, 1H), 6,77 (d, J=8,6 Гц, 1H), 5,36 (s, 2H), 5,01 (dd, J=10,3, 2,4 Гц, 1H), 3,94 (s, 3H), 3,01-2,88 (m, 1H), 2,80-2,70 (m, 1H), 2,24-1,82 (m, 4H), 1,53 (s, 6H) ppm; (M+1)=454.
Пример 1-224: синтез 4-(3-((8-метокси-2-(4-метоксифенил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-224-1: получение (E)-3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)проп-2-ен-1-она
К механически перемешанной суспензии 5-бром-2-гидрокси-3-метоксибензальдегида (10,00 г, 42,42 ммоль) и 4'-метоксиацетофенона (6,00 г, 39,55 ммоль) в этаноле (150 мл) добавляли 10 М раствор гидроксида натрия (13,8 мл, 138,44 ммоль). Полученную в результате густую смесь нагревали до температуры возврата флегмы (при нагревании смеси наблюдали изменение цвета до красно-оранжевого). Дополнительные порции (~ 0,5 г) альдегида добавляли через 1 ч. и 2 ч. Через 3 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (~500 мл). Основную суспензию обрабатывали концентрированным раствором хлористоводородной кислоты (~ 12 мл, pH полученного в результате раствора ~3). Для смеси обеспечивали перемешивание при комнатной температуре. Через 1 ч. смесь фильтровали и осадок на фильтре промывали водой и высушивали на воздухе с получением коричневого твердого вещества. При помощи растирания неочищенного твердого вещества с горячим этанолом (100 мл) получали 10,25 г (71%) (E)-3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)проп-2-ен-1-она в виде желтого твердого вещества.
Пример 1-224-2: получение 3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)пропан-1-она
К перемешанной суспензии (E)-3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)проп-2-ен-1-она (9,19 г, 25,30 ммоль), хлорида аммония (27,07 г, 506,1 ммоль) в тетрагидрофуране (25 мл), этаноле (15 мл) и воде (5 мл) добавляли порошкообразный цинк (6,62 г, 101,21 ммоль). Обеспечивали перемешивание полученной в результате смеси при комнатной температуре (цвет смеси постепенно изменялся до серо-зеленого при перемешивании смеси). Через 10 мин. серую суспензию фильтровали через целит и осадок на фильтре промывали этанолом (100 мл). Фильтрат концентрировали и остаток разделяли между водой (150 мл) и этилацетатом (100 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2×100 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 80 г силикагеля, элюент: 20-40% этилацетат/гептан) получали 3,41 г (37%) 3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)пропан-1-она в виде светло-желтого твердого вещества.
Пример 1-224-3: получение 4-бром-2-(3-гидрокси-3-(4-метоксифенил)пропил)-6-метоксифенола
Указанное в заголовке соединение получали из 3-(5-бром-2-гидрокси-3-метоксифенил)-1-(4-метоксифенил)пропан-1-она, как описано в примере 1-14-2.
Пример 1-224-4: получение 6-бром-8-метокси-2-(4-метоксифенил)хромана
Перемешанный раствор 4-бром-2-(3-гидрокси-3-(4-метоксифенил)пропил)-6-метоксифенола (3,43 г, 9,34 ммоль) в уксусной кислоте (25 мл) нагревали до 110°C. Через 45 мин. обеспечивали охлаждение смеси до комнатной температуры и разбавляли водой (30 мл). Смесь делали основной путем добавления концентрированного раствора гидроксида аммония (20 мл). Смесь экстрагировали дихлорметаном (3×50 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 220 г силикагеля, элюент: 10-25% этилацетат/гептан) получали 2,41 г (74%) 6-бром-8-метокси-2-(4-метоксифенил)хромана в виде белого твердого вещества.
Пример 1-224-5: получение (8-метокси-2-(4-метоксифенил)хроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе четырех стадий из 6-бром-8-метокси-2-(4-метоксифенил)хромана, винилтрифторбората калия и гидроксиламина гидрохлорида, как описано в примерах от 1-223-4 до 1-223-6.
Пример 1-224-6: получение 4-(3-((8-метокси-2-(4-метоксифенил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (8-метокси-2-(4-метоксифенил)хроман-6-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-52-7 до 1-52-10: 1H ЯМР (400 МГц, CDCl3) δ 8,47 (d, J=1,8 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 8,02 (s, 1H), 7,33-7,29 (m, 2H), 6,92-6,85 (m, 2H), 6,73 (d, J=2,0 Гц, 1H), 6,63 (d, J=2,0 Гц, 1H), 5,34 (s, 2H), 5,10 (dd, J=9,2, 2,7 Гц, 1H), 3,80 (s, 3H), 3,79 (s, 3H), 2,94-2,83 (m, 1H), 2,75-2,65 (m, 1H), 2,24-2,01 (m, 2H), 1,58 (br s, 2H), 1,53 (s, 6H) ppm; (M+1)=483.
Пример 1-225: синтез 6-фтор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-225-1: получение (E)-3-(5-бром-2-гидрокси-3-метоксифенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-она
Указанное в заголовке соединение получали из 5-бром-2-гидрокси-3-метоксибензальдегида и 1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примере 1-224-1.
Пример 1-225-2: получение 4-бром-2-(3-гидрокси-3-(6-метоксипиридин-3-ил)пропил)-6-метоксифенола
К перемешанному и охлажденному (0°C) раствору (E)-3-(5-бром-2-гидрокси-3-метоксифенил)-1-(6-метоксипиридин-3-ил)проп-2-ен-1-она (10,00 г, 27,50 ммоль) в тетрагидрофуране (100 мл) добавляли гексагидрат хлорида кобальта(II) (6,56 г, 27,50 ммоль). Через 30 мин. порциями добавляли борогидрид натрия (6,25 г, 165 ммоль). Обеспечивали медленное нагревание полученной в результате смеси до комнатной температуры. Через 2 ч. смесь гасили водой. Смесь экстрагировали этилацетатом (2×100 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством хроматографии на силикагеле (элюент: 3:1 петролейный эфир/этилацетат) с получением 5,80 г (57%) 4-бром-2-(3-гидрокси-3-(6-метоксипиридин-3-ил)пропил)-6-метоксифенола в виде желтого твердого вещества.
Пример 1-225-3: получение 5-(6-бром-8-метоксихроман-2-ил)-2-метоксипиридина
Указанное в заголовке соединение получали из 4-бром-2-(3-гидрокси-3-(6-метоксипиридин-3-ил)пропил)-6-метоксифенола, как описано в примере 1-12-4.
Пример 1-225-4: получение 8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-карбонитрила
Смесь ацетата палладия(II) (0,23 г, 1,00 ммоль) и карбоната натрия (1,06 г, 10,00 ммоль) в смеси 10:1 1-метил-2-пирролидинона и пропан-2-ола (22 мл) перемешивали при комнатной температуре в атмосфере воздуха. Через 30 мин. смесь обрабатывали тригидратом гексацианоферрата(II) калия (2,10 г, 5,00 ммоль) и 5-(6-бром-8-метоксихроман-2-ил)-2-метоксипиридином (3,50 г, 10,00 ммоль) и полученную в результате смесь нагревали до 140°C. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали через целит. Фильтрат разбавляли водой (40 мл) и экстрагировали этилацетатом (2×60 мл). Объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством хроматографии на силикагеле (элюент: 1:1 петролейный эфир/этилацетат) с получением 1,48 г (50%) 8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-карбонитрила (1,48 г, 50%) в виде белого твердого вещества.
Пример 1-225-5: получение (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина
К перемешанной суспензии 8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-карбонитрила (1,50 г, 5,10 ммоль) и концентрированного раствора хлористоводородной кислоты (0,5 мл) в метаноле (20 мл) добавляли 10% палладия на угле (0,20 г). Смесь дегазировали под вакуумом/заполняли азотом (x 3). Атмосферу замещали водородом (посредством баллона) и обеспечивали перемешивание смеси при комнатной температуре. Через 20 ч. смесь фильтровали через целит и фильтрат концентрировали с получением 1,50 г (99%) (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина в виде белого твердого вещества.
Пример 1-225-6: получение 6-фтор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина и 2-хлор-5-фтор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, DMSO-d6) δ 8,68 (s, 1H), 8,44 (s, 1H), 8,20-8,18 (m, 1H), 8,08 (dd, J=8,8, 2,4 Гц, 1H), 7,73 (dd, J=8,8, 2,4 Гц, 1H), 6,94 (s, 1H), 6,86-6,82 (m, 1H), 6,69 (s, 1H), 5,38 (s, 2H), 5,04-5,00 (m, 1H), 3,85 (s, 3H), 3,69 (s, 3H), 2,88-2,84 (m, 1H), 2,67-2,63 (m, 1H), 2,07-1,99 (m, 2H) ppm; (M+1)=421.
Пример 1-226: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-226-1: получение 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина (пример 1-225-5) и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-226-2: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-52-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,39 (d, J=1,5 Гц, 1H), 8,19 (d, J=2,0 Гц, 1H), 8,05 (d, J=1,5 Гц, 1H), 7,74-7,71 (m, 1H), 6,94 (d, J=2,0 Гц, 1H), 6,84 (d, J=8,5 Гц, 1H), 6,68 (d, J=2,0 Гц, 1H), 5,36 (s, 2H), 5,03-5,01 (m, 1H), 3,84 (s, 3H), 3,68 (s, 3H), 2,90-2,84 (m, 1H), 2,67-2,62 (m, 1H), 2,16 (br s, 2H), 2,10-2,06 (m, 1H), 2,02-1,97 (m, 1H), 1,14 (s, 6H) ppm; (M+1)=484.
Пример 1-227: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-226-1) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,45 (s, 1H), 8,24 (d, J=2,5 Гц, 1H), 8,19 (d, J=2,5 Гц, 1H), 7,73 (dd, J=8,5, 2,5 Гц, 1H), 7,62 (d, J=2,5 Гц, 1H), 6,93 (d, J=2,0 Гц, 1H), 6,84 (d, J=8,5 Гц, 1H), 6,66 (d, J=2,0 Гц, 1H), 5,32 (s, 2H), 5,02 (dd, J=10,0, 2,5 Гц, 1H), 3,85 (s, 3H), 3,80-3,76 (m, 4H), 3,69 (s, 3H), 3,15-3,11 (m, 4H), 2,88-2,85 (m, 1H), 2,67-2,62 (m, 1H), 2,09-1,98 (m, 2H) ppm; (M+1)=488.
Пример 1-228: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-226-1) и 2-метил-1H-имидазола, как описано в примере 1-42: 1H ЯМР (400 МГц, CD3OD) δ 8,63 (s, 1H), 8,51 (d, J=2,4 Гц, 1H), 8,18-8,16 (m, 2H), 7,77-7,73 (m, 1H), 7,28 (s, 1H), 7,04 (s, 1H), 6,99 (s, 1H), 6,82 (d, J=8,0 Гц, 1H), 6,81 (s, 1H), 5,50 (s, 2H), 5,08-5,05 (m, 1H), 3,92 (s, 3H), 3,79 (s, 3H), 2,97-2,92 (m, 1H), 2,76-2,72 (m, 1H), 2,35 (s, 3H), 2,21-2,16 (m, 1H), 2,08-2,03 (m, 1H) ppm; (M+1)=483.
Пример 1-229: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина (пример 1-225-5) и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, DMSO-d6) δ 8,59 (s, 1H), 8,40 (d, J=4,4 Гц, 1H), 8,19 (s, 1H), 8,09 (d, J=8,0 Гц, 1H), 7,73 (d, J=8,4 Гц, 1H), 7,32-7,28 (m, 1H), 6,96 (s, 1H), 6,84 (d, J=8,4 Гц, 1H), 6,69 (s, 1H), 5,38 (s, 2H), 5,04-5,01 (m, 1H), 3,85 (s, 3H), 3,69 (s, 3H), 2,90-2,84 (m, 1H), 2,66-2,63 (m, 1H), 2,07-1,98 (m, 2H) ppm; (M+1)=403.
Пример 1-230: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-230-1: получение 2-метокси-5-(8-метокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хроман-2-ил)пиридина
К перемешанному раствору 5-(6-бром-8-метоксихроман-2-ил)-2-метоксипиридина (1,00 г, 2,86 ммоль, пример 1-225-3), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (0,80 г, 3,15 ммоль) и ацетата калия (0,84 г, 8,60 ммоль) в 1,4-диоксане (10 мл) добавляли [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,11 г, 0,14 ммоль). Смесь нагревали до 100°C. Через 5 ч. обеспечивали охлаждение смеси до комнатной температуры и ее фильтровали. Фильтрат разбавляли водой (15 мл) и экстрагировали этилацетатом (3×20 мл). Объединенные органические фазы промывали солевым раствором (30 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством хроматографии на силикагеле (элюент: 10:1 петролейный эфир/этилацетат) с получением 1,00 г (88%) 2-метокси-5-(8-метокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хроман-2-ил)пиридина (1,0 г, 88%) в виде желтого масла.
Пример 1-230-2: получение (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)бороновой кислоты
К перемешанному раствору 2-метокси-5-(8-метокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хроман-2-ил)пиридина (1,70 г, 4,28 ммоль) в смеси 4:1 тетрагидрофуран/вода (25 мл) добавляли перйодат натрия (1,83 г, 8,56 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 16 ч. смесь обрабатывали 1,0 М раствором хлористоводородной кислоты HCl (10 мл) и смесь экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы промывали солевым раствором (50 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток очищали посредством хроматографии на силикагеле (элюент: 2% метанол в дихлорметане) с получением 1,10 г (81%) (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)бороновой кислоты в виде белого твердого вещества.
Пример 1-230-3: получение 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида (пример 1-21-7) и (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)бороновой кислоты, как описано в примере 1-21-8.
Пример 1-230-4: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидин и 2-метилбут-3-ин-2-амина, как описано в примере 1-23-5: 1H ЯМР (500 МГц, CD3OD) δ 8,93 (s, 1H), 8,46 (s, 1H), 8,18 (s, 1H), 8,03 (s, 1H), 7,78-7,76 (m, 1H), 6,83-6,78 (m, 2H), 6,62 (s, 1H), 5,05-5,04 (m, 1H), 4,05 (s, 2H), 3,92 (s, 3H), 3,77 (s, 3H), 2,97-2,92 (m, 1H), 2,74-2,69 (m, 1H), 2,19-2,16 (m, 1H), 2,08-2,02 (m, 1H), 1,49 (s, 6H) ppm; (M+1)=484.
Пример 1-231: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-230-3) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (d, J=2,5 Гц, 1H), 8,44 (d, J=2,5 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,91 (s, 1H), 7,75 (dd, J=8,5, 2,5 Гц, 1H), 6,85 (d, J=8,5 Гц, 1H), 6,76 (s, 1H), 6,55 (s, 1H), 5,01-4,99 (m, 1H), 3,95 (s, 2H), 3,86 (s, 3H), 3,80-3,76 (m, 4H), 3,67 (s, 3H), 3,14-3,10 (m, 4H), 2,88-2,85 (m, 1H), 2,65-2,62 (m, 1H), 2,08-2,01 (m, 2H) ppm; (M+1)=488.
Пример 1-232: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидина (пример 1-230-3) и 2-метил-1H-имидазола, как описано в примере 1-42: 1H ЯМР (400 МГц, CD3OD) δ 9,22 (d, J=2,0 Гц, 1H), 8,59 (d, J=2,0 Гц, 1H), 8,18 (d, J=2,0 Гц, 1H), 8,15 (s, 1H), 7,77 (dd, J=8,4, 2,0 Гц, 1H), 7,32 (d, J=1,2 Гц, 1H), 7,05 (d, J=1,2 Гц, 1H), 6,83-6,81 (m, 2H), 6,66 (s, 1H), 5,06-5,03 (m, 1H), 4,11 (s, 2H), 3,92 (s, 3H), 3,78 (s, 3H), 2,95-2,91 (m, 1H), 2,74-2,69 (m, 1H), 2,41 (s, 3H), 2,21-2,16 (m, 1H), 2,08-2,03 (m, 1H) ppm; (M+1)=483.
Пример 1-233: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-233-1: получение (E/Z)-N'-((6-бромпиразоло[1,5-a]пиридин-3-ил)метилен)-4-метилбензолсульфоногидразида
Указанное в заголовке соединение получали из 6-бромпиразоло[1,5-a]пиридин-3-карбальдегида и 4-метилбензолсульфонилгидразида, как описано в примере 1-21-7.
Пример 1-233-2: получение (6-бромпиразоло[1,5-a]пиридин-3-ил)(8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанола
Указанное в заголовке соединение получали из (E/Z)-N'-((6-бромпиразоло[1,5-a]пиридин-3-ил)метилен)-4-метилбензолсульфоногидразида и (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)бороновой кислоты (пример 1-230-2), как описано в примере 1-21-8 (примечание: в данном случае выделяли гидрокси-содержащее соединение, а не метилен-содержащее соединение).
Пример 1-233-3: получение 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридина
Указанное в заголовке соединение получали из (6-бромпиразоло[1,5-a]пиридин-3-ил)(8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанола, как описано в примере 1-22-2.
Пример 1-233-4: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиримидина и 2-метилбут-3-ин-2-амина, как описано в примере 1-23-5: 1H ЯМР (500 МГц, CDCl3) δ 8,48 (s, 1H), 8,19 (d, J=2,0 Гц, 1H), 7,81 (s, 1H), 7,66 (dd, J=8,5, 2,0 Гц, 1H), 7,25 (d, J=9,0 Гц,, 1H), 6,99 (d, J=9,0 Гц,, 1H), 6,75 (d, J=8,5 Гц,, 1H), 6,58 (s, 1H), 6,51 (s, 1H), 5,11-5,08 (m, 1H), 3,99 (s, 2H), 3,93 (s, 3H), 3,78 (s, 3H), 2,94-2,87 (m, 1H), 2,73-2,68 (m, 1H), 2,19-2,07 (m, 2H), 1,51 (s, 6H) ppm; (M+1)=483.
Пример 1-234: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридина (пример 1-233-3) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, CDCl3) δ 8,19 (d, J=2,0 Гц, 1H), 7,93 (s, 1H), 7,70 (s, 1H), 7,66 (dd, J=8,5, 2,5 Гц, 1H), 7,23 (d, J=9,5 Гц, 1H), 6,93 (dd, J=9,5, 2,0 Гц, 1H), 6,75 (d, J=8,5 Гц, 1H), 6,60 (s, 1H), 6,52 (s, 1H), 5,10-5,07 (m, 1H), 3,97 (s, 2H), 3,93 (s, 3H), 3,90-3,86 (m, 4H), 3,78 (s, 3H), 3,08-3,04 (m, 4H), 2,94-2,87 (m, 1H), 2,73-2,67 (m, 1H), 2,18-2,06 (m, 2H) ppm; (M+1)=487.
Пример 1-235: синтез 3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)пиразоло[1,5-a]пиридина
Указанное в заголовке соединение получали из 6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразоло[1,5-a]пиридина (пример 1-233-3) и 2-метил-1H-имидазола, как описано в примере 1-42: 1H ЯМР (500 МГц, CDCl3) δ 8,49 (s, 1H), 8,19 (d, J=2,5 Гц, 1H), 7,92 (s, 1H), 7,66 (dd, J=8,5, 2,5 Гц, 1H), 7,44 (d, J=9,5 Гц, 1H), 7,06 (s, 1H), 7,01 (s, 1H), 7,00 (dd, J=9,5, 2,0 Гц, 1H), 6,76 (d, J=8,5 Гц, 1H), 6,62 (s, 1H), 6,56 (s, 1H), 5,12-5,09 (m, 1H), 4,04 (s, 2H), 3,93 (s, 3H), 3,80 (s, 3H), 2,96-2,89 (m, 1H), 2,75-2,70 (m, 1H), 2,39 (s, 3H), 2,22-2,07 (m, 2H) ppm; (M+1)=482.
Пример 1-236: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Пример 1-236-1: получение 7-хлоримидазо[1,2-b]пиридазин-3-карбальдегида
Указанное в заголовке соединение получали в ходе двух стадий из 3-бром-7-хлоримидазо[1,2-b]пиридазина и винилтрифторбората калия, как описано в примерах от 1-223-4 до 1-223-5.
Пример 1-236-2: получение (E/Z)-N'-((7-хлоримидазо[1,2-b]пиридазин-3-ил)метилен)-4-метилбензолсульфоногидразида
Указанное в заголовке соединение получали из 7-хлоримидазо[1,2-b]пиридазин-3-карбальдегида и 4-метилбензолсульфонилгидразида, как описано в примере 1-21-7.
Пример 1-236-3: получение 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали из (E/Z)-N'-((7-хлоримидазо[1,2-b]пиридазин-3-ил)метилен)-4-метилбензолсульфоногидразида и (8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)бороновой кислоты (пример 1-230-2), как описано в примере 1-21-8.
Пример 1-236-4: получение 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазина и 2-метилбут-3-ин-2-амина, как описано в примере 1-23-5: 1H ЯМР (500 МГц, CDCl3) δ 8,29 (s, 1H), 8,20 (d, J=2,0 Гц, 1H), 7,92 (s, 1H), 7,66 (dd, J=8,5, 2,0 Гц, 1H), 7,58 (s, 1H), 6,76 (d, J=8,5 Гц, 1H), 6,73 (s, 1H), 6,61 (s, 1H), 5,13-5,10 (m, 1H), 4,25 (s, 2H), 3,94 (s, 3H), 3,82 (s, 3H), 2,95-2,90 (m, 1H), 2,76-2,71 (m, 1H), 2,20-2,09 (m, 2H), 1,54 (s, 6H) ppm; (M+1)=484.
Пример 1-237: синтез 4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)морфолина
Указанное в заголовке соединение получали из 7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазина (пример 1-236-3) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, CDCl3) δ 8,24 (s, 1H), 8,20 (d, J=2,5 Гц, 1H), 7,66 (dd, J=9,0, 2,5 Гц, 1H), 7,38 (s, 1H), 7,08 (s, 1H), 6,76 (d, J=9,0 Гц, 1H), 6,72 (s, 1H), 6,61 (s, 1H), 5,12-5,10 (m, 1H), 4,20 (s, 2H), 3,95 (s, 3H), 3,93-3,89 (m, 4H), 3,82 (s, 3H), 3,24-3,20 (m, 4H), 2,95-2,89 (m, 1H), 2,77-2,68 (m, 1H), 2,21-2,03 (m, 2H) ppm; (M+1)=488.
Пример 1-238: синтез 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-238-1: получение (8-фтор-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-3-фтор-2-гидроксибензальдегида и 1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-225-1 до 1-225-5.
Пример 1-238-2: получение 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (8-фтор-2-(6-метоксипиридин-3-ил)хроман-6-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-52-7 до 1-52-10: 1H ЯМР (500 МГц, CDCl3) δ 8,48 (d, J=1,5 Гц, 1H), 8,20 (d, J=2,5 Гц, 1H), 8,10 (d, J=1,5 Гц, 1H), 8,06 (s, 1H), 7,66 (dd, J=8,5, 2,5 Гц, 1H), 6,97-6,93 (m, 1H), 6,82 (s, 1H), 6,79 (d, J=8,5 Гц, 1H), 5,36 (s, 2H), 5,10-5,07 (m, 1H), 3,96 (s, 3H), 3,00-2,96 (m, 1H), 2,82-2,78 (m, 1H), 2,22-2,20 (m, 1H), 2,13-2,10 (m, 1H), 1,78-1,75 (br s, 2H), 1,55 (s, 6H) ppm; (M+1)=472.
Пример 1-239: синтез 4-(3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-239-1: получение (8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-2-гидрокси-3-метоксибензальдегида и 1-(6-метилпиридин-3-ил)этан-1-она, как описано в примерах от 1-225-1 до 1-225-5.
Пример 1-239-2: получение 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-239-3: получение 4-(3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (500 МГц, DMSO-d6) δ 8,64-8,62 (m, 1H), 8,49 (s, 1H), 8,40 (s, 1H), 8,09-8,07 (m, 1H), 7,69-7,67 (m, 1H), 7,28-7,26 (m, 1H), 6,95 (s, 1H), 6,69 (s, 1H), 5,38 (s, 2H), 5,09-5,05 (m, 1H), 3,70 (s, 3H), 2,91-2,85 (m, 1H), 2,65-2,62 (m, 1H), 2,47 (s, 3H), 2,13-2,10 (m, 1H), 2,01-1,97 (m, 1H), 1,14 (s, 6H) ppm; (M+1)=468.
Пример 1-240: синтез 4-(3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-239-2) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,47-8,45 (m, 2H), 8,24 (d, J=2,0 Гц, 1H), 7,68 (dd, J=8,5, 2,0 Гц, 1H), 7,62 (d, J=2,0 Гц, 1H), 7,26 (d, J=8,5 Гц, 1H), 6,94 (s, 1H), 6,66 (s, 1H), 5,32 (s, 2H), 5,08-5,06 (m, 1H), 3,80-3,76 (m, 4H), 3,70 (s, 3H), 3,15-3,11 (m, 4H), 2,88-2,85 (m, 1H), 2,65-2,61 (m, 1H), 2,47 (s, 3H), 2,12-2,09 (m, 1H), 2,00-1,97 (m, 1H) ppm; (M+1)=472.
Пример 1-241: синтез 3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-239-2) и 2-метил-1H-имидазола, как описано в примере 1-42: 1H ЯМР (500 МГц, CD3OD) δ 8,65 (s, 1H), 8,52 (s, 1H), 8,48 (s, 1H), 8,18 (s, 1H), 7,80 (d, J=7,5 Гц, 1H), 7,33-7,00 (m, 3H), 6,99 (s, 1H), 6,82 (s, 1H), 5,50 (s, 2H), 5,16-5,12 (m, 1H), 3,81 (s, 3H), 2,99-2,94 (m, 1H), 2,76-2,70 (m, 1H), 2,55 (s, 3H), 2,33 (s, 3H), 2,25-2,22 (m, 1H), 2,06-2,02 (m, 1H) ppm; (M+1)=467.
Пример 1-242: синтез 6-циклопропил-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-239-2) и циклопропилбороновой кислоты, как описано в примере 1-9: 1H ЯМР (500 МГц, CDCl3) δ 8,53-8,51(m, 1H), 8,33-8,31 (m, 1H), 7,99 (s, 1H), 7,73-7,71 (m, 1H), 7,65 (dd, J=8,0, 2,5 Гц, 1H), 7,16 (d, J=8,0 Гц, 1H), 6,76 (d, J=1,5 Гц, 1H), 6,63 (d, J=1,5 Гц, 1H), 5,35 (s, 2H), 5,17-5,15 (m, 1H), 3,81 (s, 3H), 2,95-2,87 (m, 1H), 2,73-2,68 (m, 1H), 2,56 (s, 3H), 2,24-2,19 (m, 1H), 2,13-2,09 (m, 2H), 1,07-1,03 (m, 2H), 0,78-0,74 (m, 2H) ppm; (M+1)=427.
Пример 1-243: синтез 4-(3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-243-1: получение (2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-2-гидрокси-3-метоксибензальдегида и 1-(6-этилпиридин-3-ил)этан-1-она, как описано в примерах от 1-225-1 до 1-225-5.
Пример 1-243-2: получение 3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-243-3: получение 4-(3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина и 2-метилбут-3-ин-2-амина, как описано в примере 1-52-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,64 (s, 1H), 8,50 (d, J=2,5 Гц, 1H), 8,40 (d, J=1,5 Гц, 1H), 8,06 (d, J=1,5 Гц, 1H), 7,71 (dd, J=8,0, 2,5 Гц, 1H), 7,29 (d, J=8,0 Гц, 1H), 6,95 (d, J=2,0 Гц, 1H), 6,69 (d, J=2,0 Гц, 1H), 5,37 (s, 2H), 5,09-5,06 (m, 1H), 3,70 (s, 3H), 2,93-2,86 (m, 1H), 2,76 (q, J=7,5 Гц, 2H), 2,68-2,61 (m, 1H), 2,16-1,96 (m, 4H), 1,41 (s, 6H), 1,22 (t, J=7,5 Гц, 3H) ppm; (M+1)=482.
Пример 1-244: синтез 4-(3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-243-2) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, DMSO-d6) δ 8,50 (d, J=2,5 Гц, 1H), 8,46 (s, 1H), 8,25 (d, J=2,5 Гц, 1H), 7,70 (dd, J=8,0, 2,5 Гц, 1H), 7,63 (d, J=2,5 Гц, 1H), 7,27 (d, J=8,0 Гц, 1H), 6,94 (d, J=1,5 Гц, 1H), 6,67 (d, J=1,5 Гц, 1H), 5,32 (s, 2H), 5,08-5,06 (m, 1H), 3,80-3,76 (m, 4H), 3,70 (s, 3H), 3,15-3,11 (m, 4H), 2,92-2,85 (m, 1H), 2,75 (q, J=7,5 Гц, 2H), 2,66-2,61 (m, 1H), 2,14-2,08 (m, 1H), 2,03-1,95 (m, 1H), 1,22 (t, J=7,5 Гц, 3H) ppm; (M+1)=486.
Пример 1-245: синтез 3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина (пример 1-243-2) и 2-метил-1H-имидазола, как описано в примере 1-42: 1H ЯМР (500 МГц, CD3OD) δ 8,63 (s, 1H), 8,52-8,50 (m, 2H), 8,18 (d, J=2,5 Гц, 1H), 7,84 (dd, J=8,0, 2,0 Гц, 1H), 7,35 (d, J=8,0 Гц, 1H), 7,29 (s, 1H), 7,04 (s, 1H), 7,00 (d, J=1,5 Гц, 1H), 6,82 (d, J=1,5 Гц, 1H), 5,51 (s, 2H), 5,17-5,14 (m, 1H), 3,82 (s, 3H), 3,02-2,95 (m, 1H), 2,84 (q, J=7,5 Гц, 2H), 2,78-2,73 (m, 1H), 2,35 (s, 3H), 2,29-2,21 (m, 1H), 2,07-2,02 (m, 1H), 1,30 (t, J=7,5 Гц, 3H) ppm; (M+1)=481.
Пример 1-246: синтез 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-246-1: получение (8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метанамина
Указанное в заголовке соединение получали в ходе пяти стадий из 5-бром-2-гидрокси-3-метоксибензальдегида и 1-(2-метилтиазол-4-ил)этан-1-она, как описано в примерах от 1-225-1 до 1-225-5.
Пример 1-246-2: получение 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метоксихроман-2-ил)-2-метилтиазола
Указанное в заголовке соединение получали в ходе трех стадий из (8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-246-3: получение 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метоксихроман-2-ил)-2-метилтиазола и 2-метилбут-3-ин-2-амина, как описано в примере 1-52-10: 1H ЯМР (500 МГц, CDCl3) δ 8,48 (d, J=1,5 Гц, 1H), 8,09 (d, J=1,5 Гц, 1H), 8,04 (s, 1H), 7,10 (s, 1H), 6,75 (d, J=1,5 Гц, 1H), 6,63 (d, J=1,5 Гц, 1H), 5,38 (dd, J=8,0, 2,5 Гц, 1H), 5,35 (s, 2H), 3,83 (s, 3H), 2,83-2,80 (m, 1H), 2,72 (s, 3H), 2,67-2,63 (m, 1H), 2,39-2,36 (m, 1H), 2,26-2,24 (m, 1H), 1,55 (s, 6H) ppm; (M+1)=474.
Пример 1-247: синтез 4-(3-((8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина
Указанное в заголовке соединение получали из 4-(6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метоксихроман-2-ил)-2-метилтиазола (пример 1-246-2) и морфолина, как описано в примере 1-10: 1H ЯМР (500 МГц, CDCl3) δ 8,28 (d, J=2,0 Гц, 1H), 7,98 (s, 1H), 7,64 (d, J=2,0 Гц, 1H), 7,10 (s, 1H), 6,75 (d, J=1,5 Гц, 1H), 6,63 (d, J=1,5 Гц, 1H), 5,38 (dd, J=8,0, 2,5 Гц, 1H), 5,33 (s, 2H), 3,96-3,92 (m, 4H), 3,84 (s, 3H), 3,21-3,17 (m, 4H), 2,87-2,81 (m, 1H), 2,72 (s, 3H), 2,67-2,61 (m, 1H), 2,39-2,34 (m, 1H), 2,27-2,22 (m, 1H) ppm; (M+1)=478.
Пример 1-248: синтез 2-метил-4-(3-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бут-3-ин-2-амина
Пример 1-248-1: получение 6-бром-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она
К перемешанной суспензии 2-амино-4-бромфенола (3,72 г, 19,81 ммоль) и карбоната калия (2,99 г, 21,61 ммоль) в ацетоне (85 мл) добавляли метил-2-бром-2-(4-(трифторметил)фенил)ацетат (5,35 г, 18,01 ммоль). Смесь нагревали до температуры возврата флегмы. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и объем снижали на половину. Оставшуюся суспензию разбавляли водой (50 мл) и EtOAc (250 мл). Фазы разделяли и органическую фазу промывали солевым раствором (3×40 мл), 1 н. раствором хлористоводородной кислоты (3×25 мл) и солевым раствором. Органическую фазу высушивали над сульфатом натрия, фильтровали и концентрировали. Твердое вещество перекристаллизовывали из горячего этилацетата и осадок выделяли посредством фильтрования и промывали гептаном. Маточный раствор концентрировали и остаток подвергали второй перекристаллизации из этилацетата. Две партии объединяли с получением 4,02 г (60%) 6-бром-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она в виде белого твердого вещества.
Пример 1-248-2: получение 6-бром-4-метил-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она
К перемешанному раствору 6-бром-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она (3,00 г, 8,06 ммоль) в ацетоне (60 мл) добавляли гидроксид калия (1,67 г, 29,83 ммоль). Смесь обрабатывали 2 М раствором йодметана (6,05 мл, 12,09 ммоль) (добавляли посредством шприца в течение 5 минут). Реакционную смесь нагревали до 60°C. Через 45 мин. смесь фильтровали и твердое вещество промывали ацетоном. Фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 80 г силикагеля, элюент: 0-6% этилацетат/гептан) получали 2,42 г (78%) 6-бром-4-метил-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она в виде белого твердого вещества.
Пример 1-248-3: получение 6-бром-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина
К перемешанному раствору 6-бром-4-метил-2-(4-(трифторметил)фенил)-2H-бензо[b][1,4]оксазин-3(4H)-она (3,13 г, 8,11 ммоль) в тетрагидрофуране (100 мл) добавляли 2 М раствор боран-диметилсульфидного комплекса в тетрагидрофуране (16,2 мл, 32,42 ммоль). Смесь нагревали при 50°C. Через 4 ч. обеспечивали охлаждение смеси до комнатной температуры и ее перемешивали в течение ночи. Через 16 ч. смесь гасили путем добавления по каплям метанола и концентрировали. Остаток повторно растворяли в метаноле (50 мл) и концентрировали (повторяли трижды). При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 80 г силикагеля, элюент: 0-10% этилацетат/гептан) получали 2,90 г (96%) 6-бром-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина в виде белого твердого вещества.
Пример 1-248-4: получение 4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-карбонитрила
К перемешанной суспензии 6-бром-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина (2,00 г, 5,37 ммоль) и цианида цинка (0,64 г, 5,37 ммоль) в дегазированном N,N-диметилформамиде (20 мл) добавляли тетракис(трифенилфосфин)палладий(0) (0,31 г, 0,27 ммоль). Смесь нагревали до 80°C в герметизированном сосуде. Через 16 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (75 мл). Полученный в результате осадок выделяли посредством фильтрования, промывали водой и гептаном и высушивали в вакууме. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 0-20% этилацетат/гептан) получали 1,29 г (75%) 4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-карбонитрила (1,29 г, 4,05 ммоль, 75,4% выход) в виде светло-желтого твердого вещества.
Пример 1-248-5: получение трет-бутил-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)карбамата
К перемешанной суспензии 4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-карбонитрила (1,19 г, 3,74 ммоль) в метаноле (80 мл) добавляли ди-трет-бутил-дикарбонат (1,63 г, 7,48 ммоль) и гексагидрат хлорида никеля(II) (0,089 г, 0,37 ммоль). Смесь охлаждали до 0°C при добавлении борогидрида натрия (0,99 г, 26,17 ммоль) небольшими порциями в течение 30 мин. Обеспечивали нагревание полученной в результате черной смеси до комнатной температуры. Через 4 ч. смесь разбавляли этилацетатом (250 мл) и промывали насыщенным раствором бикарбоната натрия (2×75 мл) и солевым раствором. Органическую фазу высушивали над сульфатом натрия, фильтровали и концентрировали. Остаток суспендировали в дихлорметане (75 мл) и фильтровали через целит с помощью дополнительного количества дихлорметана. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 40 г силикагеля, элюент: 10-30% этилацетат/гептан) получали 0,97 г (61%) трет-бутил-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)карбамата в виде белого твердого вещества.
Пример 1-248-6: получение (4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метанамина гидрохлорида
К перемешанному раствору трет-бутил-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)карбамата (0,96 г, 2,27 ммоль) в дихлорметане (20 мл) добавляли 4 н. хлороводород в 1,4-диоксане (20 мл, 80,00 ммоль). Смесь перемешивали. Через 1 ч. смесь концентрировали с получением 0,81 г (99%) (4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метанамина гидрохлорида в виде белого твердого вещества.
Пример 1-248-7: получение 6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина
Указанное в заголовке соединение получали в ходе трех стадий из (4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метанамина гидрохлорида и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-248-8: получение 2-метил-4-(3-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина и 2-метилбут-3-ин-2-амина, как описано в примере 1-52-10: 1H ЯМР (400 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,40 (d, J=1,7 Гц, 1H), 8,06 (d, J=1,7 Гц, 1H), 7,77 (d, J=8,2 Гц, 2H), 7,64 (d, J=8,2 Гц, 2H), 6,88 (d, J=2,0 Гц, 1H), 6,77 (d, J=8,0 Гц, 1H), 6,61 (dd, J=8,0, 2,0 Гц, 1H), 5,43-5,28 (m, 3H), 3,49 (dd, J=12,0, 2,7 Гц, 1H), 3,19 (dd, J=12,0, 7,9 Гц, 1H), 2,84 (s, 3H), 1,42 (s, 6H) ppm; (M+1)=506.
Пример 1-249: синтез 4-метил-6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина
Указанное в заголовке соединение получали из 6-((6-йод-3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола, как описано в примере 1-4: 1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (d, J=1,9 Гц, 1H), 8,56 (s, 1H), 8,30-8,18 (m, 2H), 7,98 (d, J=0,8 Гц, 1H), 7,77 (d, J=8,2 Гц, 2H), 7,64 (d, J=8,2 Гц, 2H), 6,90 (d, J=2,0 Гц, 1H), 6,77 (d, J=8,1 Гц, 1H), 6,63 (dd, J=8,1, 2,0 Гц, 1H), 5,42-5,29 (m, 3H), 3,89 (s, 3H), 3,49 (dd, J=12,0, 2,7 Гц, 1H), 3,19 (dd, J=12,0, 7,8 Гц, 1H), 2,85 (s, 3H) ppm; (M+1)=505.
Пример 1-250: синтез 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-250-1: получение 2-((5-бром-2-фторфенил)тио)-1-(6-метоксипиридин-3-ил)этан-1-ола
Указанное в заголовке соединение получали в ходе двух стадий из 5-бром-2-фторбензолтиола и 2-бром-1-(6-метоксипиридин-3-ил)этан-1-она, как описано в примерах от 1-14-1 до 1-14-2.
Пример 1-250-2: получение 4-фтор-3-((2-гидрокси-2-(6-метоксипиридин-3-ил)этил)тио)бензонитрила
К перемешанной суспензии 2-((5-бром-2-фторфенил)тио)-1-(6-метоксипиридин-3-ил)этан-1-ола (2,80 г, 7,81 ммоль), цианида цинка(II) (0,64 г, 5,47 ммоль) в N,N-диметилформамиде (30 мл) добавляли тетракис(трифенилфосфин)палладий(0). Смесь нагревали до 90°C. Через 4 ч. смесь охлаждали до 0°C и гасили путем добавления 1 н. раствора хлористоводородной кислоты. Смесь экстрагировали дихлорметаном и фазы разделяли. Органическую фазу промывали солевым раствором, высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% этилацетат/гексаны) получали 2,35 г (99%) 4-фтор-3-((2-гидрокси-2-(6-метоксипиридин-3-ил)этил)тио)бензонитрила в виде белого твердого вещества.
Пример 1-250-3: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-карбонитрила
Указанное в заголовке соединение получали из 4-фтор-3-((2-гидрокси-2-(6-метоксипиридин-3-ил)этил)тио)бензонитрила, как описано в примере 1-14-3.
Пример 1-250-4: получение 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-карбальдегида
К перемешанному и охлажденному (0°C) раствору 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-карбонитрила (1,30 г, 4,57 ммоль) в тетрагидрофуране (30 мл) добавляли алюмогидрид лития (0,26 г, 6,86 ммоль). Через 1 ч. смесь гасили путем медленного добавления воды (1,4 мл), 15% раствора гидроксида натрия (3,7 мл) и воды (1,4 мл). Обеспечивали перемешивание смеси при 0°C в течение еще 30 мин. и затем добавляли сульфат магния. Смесь фильтровали, твердые вещества промывали этилацетатом и фильтрат концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-20% метанол/дихлорметан (+10% 7 н. аммиака в метаноле)) получали 0,99 г (76%) 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-карбальдегида в виде светло-желтого твердого вещества.
Пример 1-250-5: получение (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метанола
Указанное в заголовке соединение получали из 2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-карбальдегида, как описано в примере 1-14-2.
Пример 1-250-6: получение 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
К перемешанному раствору (2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метанол (0,18 г, 0,60 ммоль) в толуоле (10 мл) добавляли 2-(трибутилфосфоранилиден)ацетонитрил (0,18 г, 0,75 ммоль). Через 5 мин. смесь обрабатывали 6-бром-3H-имидазо[4,5-b]пиридином (0,10 г, 0,51 ммоль). Сосуд герметизировали и содержимое нагревали 100°C. Через 1 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с силикагелем, элюент: 0-100% этилацетат/гексаны) получали 0,13 г (56%) 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридина в виде грязно-белого твердого вещества: 1H ЯМР (400 МГц, DMSO-d6) δ 8,67 (s, 1H), 8,49 (d, J=2,1 Гц, 1H), 8,39 (d, J=2,1 Гц, 1H), 8,25 (d, J=2,4 Гц, 1H), 7,77 (dd, J=8,5, 2,4 Гц, 1H), 7,20 (d, J=2,2 Гц, 1H), 7,03 (dd, J=8,5, 2,2 Гц, 1H), 6,87-6,86 (m, 1H), 6,85-6,83 (m, 1H), 5,39 (s, 2H), 5,25 (dd, J=8,9, 2,3 Гц, 1H), 3,85 (s, 3H), 3,42-3,36 (m, 1H), 3,28 (dd, J=13,2, 2,3 Гц, 1H) ppm; (M+1)=469.
Пример 1-251: синтез 4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали из 6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридина (пример 1-250-6) и 2-метилбут-3-ин-2-амина, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,66 (s, 1H), 8,40 (d, J=1,8 Гц, 1H), 8,24 (d, J=2,4 Гц, 1H), 8,08 (d, J=1,8 Гц, 1H), 7,77 (dd, J=8,7, 2,4 Гц, 1H), 7,19 (d, J=2,1 Гц, 1H), 7,03 (dd, J=8,5, 2,1 Гц, 1H), 6,86 (d, J=1,3 Гц, 1H), 6,84 (d, J=1,3 Гц, 1H), 5,39 (s, 2H), 5,25 (dd, J=9,0, 2,3 Гц, 1H), 3,85 (s, 3H), 3,39-3,33 (m, 1H), 3,28 (dd, J=13,3, 2,3 Гц, 1H), 1,45 (s, 6H) ppm; (M+1)=472.
Пример 1-252: синтез 3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина
Пример 1-252-1: получение трет-бутил-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)карбамата
К перемешанной суспензии трет-бутил-4-гидрокси-3-метоксибензилкарбамата (22,44 г, 88,59 ммоль) и карбоната калия (30,61 г, 221,5 ммоль) в ацетонитриле (250 мл), добавляли 5-(хлорметил)-2-метоксипиридина гидрохлорид (18,33 г, 94,46 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 23 ч. обеспечивали охлаждение светло-зеленой суспензии до комнатной температуры и ее разбавляли водой (600 мл), что приводило в результате к образованию осадка. Твердые вещества выделяли посредством фильтрования и промывали водой. Влажные твердые вещества растворяли в дихлорметане (300 мл) и небольшое количество воды удаляли. Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали с получением 31,92 г (96%) трет-бутил-3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензилкарбамата в виде грязно-белого твердого вещества.
Пример 1-252-2: получение (3-метокси-4-((6-метоксипиридин-3-ил)метокси)фенил)метанамина
Указанное в заголовке соединение получали из трет-бутил-3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензилкарбамата, как описано в примере 1-12-5.
Пример 1-252-3: получение 6-йод-3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из (3-метокси-4-((6-метоксипиридин-3-ил)метокси)фенил)метанамина и 2-хлор-5-йод-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9.
Пример 1-252-4: получение 3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридина и 3-этинилпиперидина гидрохлорида, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,64 (s, 1H), 8,42 (d, J=1,8 Гц, 1H), 8,21 (d, J=2,4 Гц, 1H), 8,11 (d, J=1,8 Гц, 1H), 7,74 (dd, J=8,5, 2,4 Гц, 1H), 7,12 (d, J=2,0 Гц, 1H), 7,01 (d, J=8,2 Гц, 1H), 6,86-6,81 (m, 2H), 5,41 (s, 2H), 4,97 (s, 2H), 3,84 (s, 3H), 3,72 (s, 3H), 3,26-3,16 (m, 2H), 3,09 (d, J=9,2 Гц, 1H), 2,86-2,76 (m, 1H), 2,70-2,58 (m, 2H), 2,05-1,95 (m, 1H), 1,67-1,50 (m, 2H), 1,45-1,33 (m, 1H) ppm; (M+1)=484.
Пример 1-253: синтез 3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(пирролидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали из 6-йод-3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридина (пример 1-252-3) и 3-этинилпирролидина гидрохлорида, как описано в примере 1-5-8: 1H ЯМР (400 МГц, DMSO-d6) δ 8,62 (s, 1H), 8,40 (d, J=1,9 Гц, 1H), 8,20 (dd, J=2,4 Гц, 1H), 8,09 (d, J=1,9 Гц, 1H), 7,73 (dd, J=8,5, 2,4 Гц, 1H), 7,11 (d, J=2,0 Гц, 1H), 7,00 (d, J=8,5 Гц, 1H), 6,85-6,83 (m, 1H), 6,83-6,81 (m, 1H), 5,40 (s, 2H), 4,97 (s, 2H), 3,84 (s, 3H), 3,71 (s, 3H), 3,31 (br s, 1H), 3,16 (dd, J=10,6, 7,2 Гц, 1H), 3,03-2,79 (m, 4H), 2,71 (dd, J=10,6, 7,2 Гц, 1H), 2,13 -2,03 (m, 1H), 1,79-1,69 (m, 1H) ppm; (M+1)=470.
Пример 1-254: синтез 3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение, также известное как RA08466682, получали из 6-йод-3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридина (пример 1-252-3) и 1-метилпиперазина, как описано в примере 1-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,43 (s, 1H), 8,24-8,17 (m, 2H), 7,74 (dd, J=8,5, 2,4 Гц, 1H), 7,59 (d, J=2,4 Гц, 1H), 7,10 (d, J=2,0 Гц, 1H), 6,99 (d, J=8,3 Гц, 1H), 6,84-6,78 (m, 2H), 5,34 (s, 2H), 4,96 (s, 2H), 3,84 (s, 3H), 3,72 (s, 3H), 3,16-3,10 (m, 4H), 2,52-2,46 (m, 4H), 2,23 (s, 3H) ppm; (M+1)=475.
Пример 1-255: синтез 4-(3-(3-метокси-4-((6-метилпиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-255-1: получение (3-метокси-4-((6-метилпиридин-3-ил)метокси)фенил)метанамина
Указанное в заголовке соединение получали в ходе двух стадий из трет-бутил-4-гидрокси-3-метоксибензилкарбамата и 5-(хлорметил)-2-метилпиридина гидрохлорида, как описано в примерах от 1-252-1 до 1-252-2.
Пример 1-255-2: получение 4-(3-(3-метокси-4-((6-метилпиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (3-метокси-4-((6-метилпиридин-3-ил)метокси)фенил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-52-7 до 1-52-10: 1H ЯМР (400 МГц, DMSO-d6) δ 8,63 (s, 1H), 8,49-8,44 (m, 1H), 8,38 (d, J=1,8 Гц, 1H), 8,05 (d, J=1,8 Гц, 1H), 7,69 (dd, J=8,0, 2,2 Гц, 1H), 7,25 (d, J=8,0 Гц, 1H), 7,12 (d, J=2,2 Гц, 1H), 6,99 (d, J=8,2 Гц, 1H), 6,83 (dd, J=8,2, 2,0 Гц, 1H), 5,40 (s, 2H), 5,02 (s, 2H), 3,72 (s, 3H), 2,45 (s, 3H), 2,10 (br s, 2H), 1,40 (s, 6H) ppm; (M+1)=442.
Пример 1-256: синтез 4-(3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Пример 1-256-1: получение 5-бром-3-этокси-2-фторпиридина
К перемешанной суспензии 5-бром-2-фторпиридин-3-ола (7,77 г, 40,47 ммоль) и карбоната калия (8,39 г, 60,71 ммоль) в ацетонитриле (75 мл) добавляли йодэтан (6,63 г, 42,50 ммоль). Полученную в результате смесь нагревали до температуры возврата флегмы. Через 16 ч. обеспечивали охлаждение желтовато-коричневой смеси до комнатной температуры и ее разбавляли водой (250 мл). Смесь экстрагировали диэтиловым эфиром (2×75 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали с получением 8,31 г (93%) 5-бром-3-этокси-2-фторпиридина в виде желтовато-коричневого твердого вещества.
Пример 1-256-2: получение 5-бром-3-этокси-2-((6-метилпиридин-3-ил)метокси)пиридина
К перемешанному раствору (6-метилпиридин-3-ил)метанола (2,37 г, 19,28 ммоль) в диметилсульфоксиде (50 мл) добавляли 60% дисперсию гидрида натрия (0,81 г, 20,20 ммоль) с выделением газа и умеренной экзотермией в результате. Для смеси обеспечивали перемешивание при комнатной температуре. Через 20 мин. желтую смесь обрабатывали 5-бром-3-этокси-2-фторпиридином (4,04 г, 18,36 ммоль) с умеренной экзотермией в результате. Через 1,5 ч. коричневую смесь обрабатывали водой (150 мл) с образованием в результате осадка. Твердые вещества выделяли путем фильтрования, промывали водой (100 мл) и затем гексанами (50 мл) и высушивали с получением 4,73 г (80%) 5-бром-3-этокси-2-((6-метилпиридин-3-ил)метокси)пиридина в виде желтовато-коричневого твердого вещества.
Пример 1-256-3: получение трет-бутил-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)карбамата
К перемешанной суспензии 5-бром-3-этокси-2-((6-метилпиридин-3-ил)метокси)пиридина (4,73 г, 14,64 ммоль), N-BOC-аминометилтрифторбората калия (5,08 г, 21,00 ммоль) и карбоната цезия (14,31 г, 43,91 ммоль) в смеси 4:1 толуол/вода (50 мл) добавляли хлор(2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладий(II) (1,15 г, 1,46 ммоль). Смесь дегазировали под вакуумом/заполняли азотом (x 3). Затем смесь нагревали до температуры возврата флегмы. Через 20 ч. добавляли дополнительные порции предкатализатора (0,50 г) и боратной соли (1,00 г) и нагревание продолжали. Через 43 ч. обеспечивали охлаждение черной смеси до комнатной температуры и ее разбавляли этилацетатом (100 мл) и водой (50 мл). Фазы разделяли и органическую фазу промывали солевым раствором (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали с получением 7,07 г (>100%) трет-бутил-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)карбамата в виде оранжевого масла (загрязненного непрореагировавшим исходным материалом).
Пример 1-256-4: получение (5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метанамина
Указанное в заголовке соединение получали из трет-бутил-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)карбамата, как описано в примере 1-12-5.
Пример 1-256-5: получение 4-(3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина
Указанное в заголовке соединение получали в ходе четырех стадий из (5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метанамина, 2-хлор-5-йод-3-нитропиридина и 2-метилбут-3-ин-2-амина, как описано в примерах от 1-52-7 до 1-52-10: 1H ЯМР (400 МГц, DMSO-d6) δ 8,65 (s, 1H), 8,49 (d, J=2,3 Гц, 1H), 8,39 (d, J=1,8 Гц, 1H), 8,05 (d, J=1,8 Гц, 1H), 7,76 (d, J=2,0 Гц, 1H), 7,70 (dd, J=7,9, 2,3 Гц, 1H), 7,44 (d, J=2,0 Гц, 1H), 7,23 (d, J=7,9 Гц, 1H), 5,42 (s, 2H), 5,32 (s, 2H), 4,00 (q, J=6,9 Гц, 2H), 2,44 (s, 3H), 2,11 (br s, 2H), 1,40 (s, 6H), 1,28 (t, J=6,9 Гц, 3H) ppm; (M+1)=457.
Пример 1-257: синтез 3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)пиразоло[1,5-a]пиримидина
Пример 1-257-1: получение (5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)бороновой кислоты
Указанное в заголовке соединение получали в ходе двух стадий из 5-бром-3-этокси-2-((6-метилпиридин-3-ил)метокси)пиридина (пример 1-256-2) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), как описано в примерах от 1-230-1 до 1-230-2.
Пример 1-257-2: получение 6-бром-3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из (5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)бороновой кислоты и (E/Z)-N'-((6-бромпиразоло[1,5-a]пиримидин-3-ил)метилен)-4-метилбензолсульфоногидразида (пример 1-21-7), как описано в примере 1-21-8.
Пример 1-257-3: получение 3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)пиразоло[1,5-a]пиримидина
Указанное в заголовке соединение получали из 6-бром-3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)пиразоло[1,5-a]пиримидина, как описано в примере 1-97: 1H ЯМР (400 МГц, CDCl3) δ 8,63 (dd, J=7,1, 1,8 Гц, 1H), 8,62-8,60 (m, 1H), 8,46 (dd, J=4,0, 1,8 Гц, 1H), 7,93 (s, 1H), 7,69 (dd, J=8,0, 2,3 Гц, 1H), 7,66-7,64 (m, 1H), 7,12 (d, J=8,0 Гц, 1H), 7,05 (d, J=2,0 Гц, 1H), 6,80 (dd, J=7,1, 4,0 Гц, 1H), 5,42 (s, 2H), 4,09 (s, 2H), 4,01 (q, J=7,0 Гц, 2H), 2,54 (s, 3H), 1,39 (t, J=7,0 Гц, 3H) ppm; (M+1)=376.
Пример 1-258: синтез 3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)-N,N-диметилимидазо[1,2-b]пиридазин-7-карбоксамида
Пример 1-258-1: получение 5-бром-3-этокси-2-((6-(трифторметил)пиридин-3-ил)метокси)пиридина
Указанное в заголовке соединение получали из 5-бром-3-этокси-2-фторпиридина (пример 1-256-1) и (6-(трифторметил)пиридин-3-ил)метанола, как описано в примере 1-256-2.
Пример 1-258-2: получение 5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)никотинальдегида
Указанное в заголовке соединение получали в ходе двух стадий из 5-бром-3-этокси-2-((6-(трифторметил)пиридин-3-ил)метокси)пиридина и винилтрифторбората калия, как описано в примерах от 1-223-4 до 1-223-5.
Пример 1-258-3: получение 7-хлор-3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)имидазо[1,2-b]пиридазина
Указанное в заголовке соединение получали в ходе двух стадий из 3-бром-7-хлоримидазо[1,2-b]пиридазина (пример 1-23-2) и 5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)никотинальдегида, как описано в примерах от 1-23-3 до 1-23-4.
Пример 1-258-4: получение метил-3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)имидазо[1,2-b]пиридазин-7-карбоксилата
К перемешанному раствору 7-хлор-3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)имидазо[1,2-b]пиридазина (0,23 г, 0,50 ммоль) и триэтиламина (0,15 мг, 1,50 ммоль) в смеси 1:1 метанол/N,N-диметилформамид DMF (20 мл) добавляли [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,044 г, 0,050 ммоль). Смесь вакуумировали и атмосферу замещали монооксидом углерода (1 атм. посредством баллона). Смесь нагревали до 80°C. Через 15 ч. обеспечивали охлаждение смеси до комнатной температуры и ее концентрировали. Неочищенный продукт очищали посредством хроматографии на силикагеле (элюент: 3% метанол/дихлорметан) с получением 0,15 г (61%) метил-3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)имидазо[1,2-b]пиридазин-7-карбоксилата в виде светло-желтого твердого вещества.
Пример 1-258-5: получение 3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)-N,N-диметилимидазо[1,2-b]пиридазин-7-карбоксамида
Указанное в заголовке соединение получали в ходе двух стадий из метил-3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)имидазо[1,2-b]пиридазин-7-карбоксилата и диметиламина, как описано в примерах от 1-83-2 до 1-83-3: 1H ЯМР (400 МГц, DMSO-d6) δ 8,83 (s, 1H), 8,61 (s, 1H), 8,23 (s, 1H), 8,10 (d, J=8,4 Гц, 1H), 7,92 (d, J=8,4 Гц, 1H), 7,72 (s, 1H), 7,62 (s, 1H), 7,35 (s, 1H), 5,50 (s, 2H), 4,28 (s, 2H), 4,05 (q, J=6,8 Гц, 2H), 3,03 (s, 6H), 1,31 (t, J=6,8 Гц, 3H) ppm; (M+1)=501.
Пример 1-259: синтез 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)-N-метилпиколинамида
Пример 1-259-1: получение 5-бром-2-((6-циклопропилпиридин-3-ил)метокси)-3-этоксипиридина
Указанное в заголовке соединение получали из 5-бром-3-этокси-2-фторпиридина (пример 1-256-1) и (6-циклопропилпиридин-3-ил)метанола, как описано в примере 1-256-2.
Пример 1-259-2: получение 2-((6-циклопропилпиридин-3-ил)метокси)-3-этокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина
Указанное в заголовке соединение получали из -бром-2-((6-циклопропилпиридин-3-ил)метокси)-3-этоксипиридина и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), как описано в примере 1-230-1.
Пример 1-259-3: получение метил-4-(хлорметил)пиколината гидрохлорида
Указанное в заголовке соединение получали из метил-4-(гидроксиметил)пиколината и тионилхлорида, как описано в примере 1-27-6.
Пример 1-259-4: получение метил-4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)пиколината
Указанное в заголовке соединение получали из 2-((6-циклопропилпиридин-3-ил)метокси)-3-этокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина и метил-4-(хлорметил)пиколината гидрохлорида, как описано в примере 1-24-3.
Пример 1-259-5: получение 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)-N-метилпиколинамида
К перемешанному раствору метил-4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)пиколината (0,14 г, 0,33 ммоль) в этаноле (6 мл) добавляли 33% вес/вес раствор метиламина в этаноле (5,0 мл). Сосуд герметизировали и содержимое нагревали до 125°C в микроволновом реакторе. Через 30 мин. смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 4 г силикагеля, элюент: 1-5% метанол/дихлорметан) получали 0,12 г (86%) 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)-N-метилпиколинамида в виде воскообразного белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,56 (d, J=2,2 Гц, 1H), 8,42 (d, J=5,0 Гц, 1H), 8,09-8,05 (m, 1H), 8,01 (br s, 1H), 7,66 (dd, J=8,0, 2,2 Гц, 1H), 7,57 (d, J=1,9 Гц, 1H), 7,18 (dd, J=5,0, 1,7 Гц, 1H), 7,11 (d, J=8,0 Гц, 1H), 6,79 (d, J=1,9 Гц, 1H), 5,41 (s, 2H), 3,98 (q, J=7,0 Гц, 2H), 3,93 (s, 2H), 3,03 (d, J=5,1 Гц, 3H), 2,07-1,98 (m, 1H), 1,39 (t, J=7,0 Гц, 3H), 1,04-0,94 (m, 4H) ppm; (M+1)=419.
Пример 1-260: синтез 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола
Пример 1-260-1: получение 2-амино-5-бромбензол-1,3-диола
К перемешанной и охлажденной (0°C) суспензии 4-бром-2,6-диметоксианилина (7,50 г, 32,30 ммоль) в дихлорметане (100 мл) добавляли 1,0 М раствор трибромида бора в дихлорметане (96,9 мл, 96,9 ммоль). После завершения добавления обеспечивали нагревание полученной в результате смеси до комнатной температуры. Через 1 ч. смесь гасили в насыщенном водном растворе бикарбоната натрия и экстрагировали этилацетатом (3×100 мл). Объединенные органические фазы промывали солевым раствором (100 мл), высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 33% этилацетат/петролейный эфир) получали 5,50 г (83%) 2-амино-5-бромбензол-1,3-диола в виде желтого твердого вещества.
Пример 1-260-2: получение N-(4-бром-2,6-дигидроксифенил)-2-(6-метоксипиридин-3-ил)ацетамида
К перемешанному раствору 2-амино-5-бромбензол-1,3-диола (0,50 г, 2,45 ммоль) и 2-(6-метоксипиридин-3-ил)уксусной кислоты (0,41 г, 2,45 ммоль) в N,N-диметилформамиде (5 мл) добавляли 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (0,93 г, 2,45 ммоль) и триэтиламин (0,74 г, 7,35 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 3 ч. смесь гасили водой (30 мл) и экстрагировали этилацетатом (3×30 мл). Объединенную органическую фазу промывали солевым раствором (20 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 25% этилацетат/петролейный эфир) получали 0,43 г (50%) N-(4-бром-2,6-дигидроксифенил)-2-(6-метоксипиридин-3-ил)ацетамида в виде белого твердого вещества.
Пример 1-260-3: получение N-(4-бром-2-гидрокси-6-метоксифенил)-2-(6-метоксипиридин-3-ил)ацетамида
К перемешанному раствору N-(4-бром-2,6-дигидроксифенил)-2-(6-метоксипиридин-3-ил)ацетамида (0,43 г, 1,23 ммоль) и карбоната калия (0,17 г, 1,23 ммоль) в ацетонитриле (10 мл) добавляли йодметан (0,18 г, 1,23 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 16 ч. смесь разбавляли водой (30 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические фазы высушивали над безводным сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 50% этилацетат/петролейный эфир) получали 0,38 г (85%) N-(4-бром-2-гидрокси-6-метоксифенил)-2-(6-метоксипиридин-3-ил)ацетамида в виде белого твердого вещества.
Пример 1-260-4: получение 6-бром-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола
К раствору N-(4-бром-2-гидрокси-6-метоксифенил)-2-(6-метоксипиридин-3-ил)ацетамида (0,50 г, 1,37 ммоль) и трифенилфосфина (0,72 г, 2,74 ммоль) в тетрагидрофуране (5 мл) добавляли диэтилазодикарбоксилат (0,48 г, 2,74 ммоль). Для полученной в результате смеси обеспечивали перемешивание при комнатной температуре. Через 16 ч. смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 20% этилацетат/петролейный эфир) получали 0,25 г (52%) 6-бром-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола в виде светло-желтого твердого вещества.
Пример 1-260-5: получение 4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-карбонитрила
К перемешанному раствору 6-бром-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола (0,30 г, 0,86 ммоль), трис(дибензилиденацетон)дипалладия (0,12 г, 0,13 ммоль) и 1,1'-бис(дифенилфосфино)ферроцена (0,14 г, 0,26 ммоль) в диметилсульфоксиде (5 мл) добавляли цианид цинка(II) (0,061 г, 0,52 ммоль). Полученную в результате смесь нагревали до 100°C. Через 3 ч. обеспечивали охлаждение смеси до комнатной температуры и ее разбавляли водой (50 мл) и насыщенным раствором бикарбоната аммония (5 мл). Смесь экстрагировали этилацетатом (3×50 мл). Объединенную органическую фазу высушивали над сульфатом натрия, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 20% этилацетат/петролейный эфир) получали 0,18 г (71%) 4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-карбонитрила в виде светло-желтого твердого вещества.
Пример 1-260-6: получение (4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-ил)метанамина
К перемешанному раствору 4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-карбонитрила (0,22 г, 0,74 ммоль) в 7,0 М растворе аммиака в метаноле (6 мл) добавляли никель Ренея. Обеспечивали перемешивание смеси при комнатной температуре в атмосфере водорода. Через 2 ч. смесь фильтровали и концентрировали с получением 0,20 г (90%) (4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-ил)метанамина в виде желтого твердого вещества.
Пример 1-260-7: получение 6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола
Указанное в заголовке соединение получали в ходе трех стадий из (4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазол-6-ил)метанамина и 2-хлор-3-нитропиридина, как описано в примерах от 1-52-7 до 1-52-9: 1H ЯМР (400 МГц, CDCl3) δ 8,47-8,43 (m, 1H), 8,16 (d, J=2,0 Гц, 1H), 8,11 (dd, J=8,4, 2,0 Гц, 1H), 8,07 (s, 1H), 7,59-7,57 (m, 1H), 7,31-7,27 (m, 1H), 7,01 (s, 1H), 6,80 (s, 1H), 6,70 (d, J=8,4 Гц, 1H), 5,56 (s, 2H), 4,16 (s, 2H), 3,98 (s, 3H), 3,92 (s, 3H) ppm; (M+1)=402.
Пример 1-261: синтез 3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Пример 1-261-1: получение 5-бром-2-(2-фторпропан-2-ил)пиридина
К перемешанному и охлажденному (0°C) раствору 2-(5-бромпиридин-2-ил)пропан-2-ола (3,00 г, 13,90 ммоль) в дихлорметане (30 мл) по каплям добавляли трифторид диэтиламиносеры (3,40 г, 21,10 ммоль). Через 1 ч. смесь гасили путем добавления насыщенного раствора бикарбоната натрия и экстрагировали этилацетатом (30 мл x 3). Объединенную органическую фазу промывали солевым раствором (50 мл), высушивали над безводным сульфатом натрия, фильтровали, концентрировали. При помощи хроматографической очистки неочищенного продукта (колонка с силикагелем, элюент: 10% этилацетат/петролейный эфир) получали 2,33 г (77%) 5-бром-2-(2-фторпропан-2-ил)пиридина в виде желтого масла.
Пример 1-261-2: получение 2-бром-1-(6-(2-фторпропан-2-ил)пиридин-3-ил)этан-1-она
Указанное в заголовке соединение получали из бром-2-(2-фторпропан-2-ил)пиридина и трибутил(1-этоксивинил)станнана, как описано в примере 1-196-1.
Пример 1-261-3: получение 3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина
Указанное в заголовке соединение получали в ходе трех стадий из 5-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(бензилокси)-3-метоксифенола (пример 1-193-8) и 2-бром-1-(6-(2-фторпропан-2-ил)пиридин-3-ил)этан-1-она, как описано в примерах от 1-52-1 до 1-52-3: 1H ЯМР (400 МГц, CDCl3) δ 8,60 (s, 1H), 8,47 (d, J=4,8 Гц, 1H), 8,11 (d, J=8,0 Гц, 1H), 8,07 (s, 1H), 7,79-7,77 (m, 1H), 7,61 (d, J=8,0 Гц, 1H), 7,30-7,28 (m, 1H), 6,57 (s, 2H), 5,40 (s, 2H), 5,19 (dd, J=8,4, 2,4 Гц, 1H), 4,37 (dd, J=11,6, 2,4 Гц, 1H), 4,11 (dd, J=11,6, 8,4 Гц, 1H), 3,83 (s, 3H), 1,74-1,70 (m, 6H) ppm; (M+1)=435.
Пример 1-262: синтез 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)-N-метилпиколинамида
Пример 1-262-1: получение 6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ола
К перемешанному раствору 2-((6-циклопропилпиридин-3-ил)метокси)-3-этокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (1,00 г, 2,52 ммоль, пример 1-259-2) в тетрагидрофуране (20 мл) и воде (20 мл) добавляли моногидрат пербората натрия (1,11 г, 11,10 ммоль). Обеспечивали перемешивание желтой реакционной смеси при комнатной температуре. Через 16 ч. суспензию разбавляли насыщенным раствором хлорида аммония (50 мл) и этилацетатом (50 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2×50 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. Неочищенное твердое вещество суспендировали в дихлорметане (20 мл) и фильтровали. Осадок на фильтре промывали дихлорметаном (10 мл) и высушивали с получением 0,66 г (91%) 6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ола в виде белого твердого вещества.
Пример 1-262-2: получение метил-4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)пиколината
К перемешанному раствору 6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ола (0,66 г, 2,30 ммоль) в диметилсульфоксиде (10 мл) добавляли 60% дисперсию гидрида натрия (0,10 г, 2,53 ммоль) (при добавлении отмечали выделение газа). Через 15 мин. смесь обрабатывали метил-4-хлорпиридин-2-карбоксилатом (0,42 г, 2,42 ммоль) и обеспечивали ее перемешивание при комнатной температуре. Через 2 ч. температуру смеси повышали до 100°C. В целом через 5 ч. обеспечивали охлаждение темно-коричневой смеси до комнатной температуры и ее разбавляли насыщенным раствором хлорида аммония (50 мл). Смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические фазы высушивали над сульфатом магния, фильтровали и концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка Gold с 40 г силикагеля, элюент: 1-5% метанол/дихлорметан) получали 0,35 г (36%) метил-4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)пиколината в виде оранжевого масла.
Пример 1-262-3: получение 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)-N-метилпиколинамида
К перемешанному раствору метил-4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)пиколината (0,12 г, 0,28 ммоль) и цианида натрия (0,005 г, 0,10 ммоль) в этаноле (7 мл) добавляли 33% раствор метиламина в этаноле (7 мл, 56,00 ммоль). Сосуд герметизировали и содержимое нагревали до 125°C в микроволновом реакторе. Через 30 минут смесь концентрировали. При помощи хроматографической очистки неочищенного продукта (CombiFlash, колонка с 4 г силикагеля, элюент: 1-5% метанол/дихлорметан) получали 0,069 г (59%) 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)-N-метилпиколинамида в виде желтого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,62-8,57 (m, 1H), 8,39 (d, J=5,6 Гц, 1H), 8,02-7,96 (m, 1H), 7,72-7,67 (m, 2H), 7,56 (d, J=2,3 Гц, 1H), 7,14 (dd, J=8,1, 0,9 Гц, 1H), 6,95 (dd, J=5,6, 2,5 Гц, 1H), 6,83 (d, J=2,5 Гц, 1H), 5,44 (s, 2H), 4,03 (q, J=7,0 Гц, 2H), 3,01 (d, J=5,1 Гц, 3H), 2,04 (m, 1H), 1,44 (t, J=7,0 Гц, 3H), 1,06-0,95 (m, 4H) ppm; (M+1)=421.
Пример 1-263: синтез 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-фторпиридин-3-ил)окси)-N-метилпиколинамида
Пример 1-263-1: получение 5-бром-2-((6-циклопропилпиридин-3-ил)метокси)-3-фторпиридина
Указанное в заголовке соединение получали из 5-бром-2,3-дифторпиридина и (6-циклопропилпиридин-3-ил)метанола, как описано в примере 1-256-2.
Пример 1-263-2: получение 2-((6-циклопропилпиридин-3-ил)метокси)-3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина
Указанное в заголовке соединение получали из 5-бром-2-((6-циклопропилпиридин-3-ил)метокси)-3-фторпиридина и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), как описано в примере 1-230-1.
Пример 1-263-3: получение 4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-фторпиридин-3-ил)окси)-N-метилпиколинамида
Указанное в заголовке соединение получали в ходе трех стадий из 2-((6-циклопропилпиридин-3-ил)метокси)-3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина и метил-4-хлорпиридин-2-карбоксилата, как описано в примерах от 1-262-1 до 1-262-3: 1H ЯМР (400 МГц, CDCl3) δ 8,60-8,55 (m, 1H), 8,42 (d, J=5,6 Гц, 1H), 8,03-7,95 (m, 1H), 7,82 (d, J=2,6 Гц, 1H), 7,73-7,66 (m, 2H), 7,22-7,14 (m, 2H), 6,98 (dd, J=5,6, 2,6 Гц, 1H), 5,43 (s, 2H), 3,02 (d, J=5,1 Гц, 3H), 2,09-2,01 (m, 1H), 1,07-0,96 (m, 4H) ppm; (M+1)=395.
Пример 2. Исследования in vitro
Пример 2-1. Активность c-FMS
Реагенты и расходные материалы приобретали у Sigma Aldrich, Carna Biosciences или Caliper Life Sciences. Все условия аналитических реакций для определений IC50 находились в линейной области по отношению ко времени и концентрации фермента. В 384-луночном полипропиленовом планшете c-FMS (0,14 нМ, Carna 08-155) предварительно инкубировали в 100 мМ буфера Hepes-NaOH, pH 7,5, содержащего 0,01% Triton X-100, 10 мМ MgCl2, 0,1% BSA, 1 мМ DTT, 10 мкМ ортованадата натрия, и 10 мкМ бета-глицерофосфата, и соединение с концентрацией 2,5% DMSO, в течение 15 минут при комнатной температуре. Реакцию инициировали равным объемом пептидного субстрата (Caliper Life Sciences, номер по каталогу 760430) и ATP в вышеупомянутом буфере. Конечные концентрации в реакционной смеси составляли 70 пМ c-FMS, 1,5 мкМ пептидного субстрата и 500 мкМ ATP (ATP Km). Реакционную смесь инкубировали при комнатной температуре в течение 120 минут и реакцию завершали при помощи буфера, содержащего избыток EDTA (100 мМ Hepes-NaOH, pH 7,5, 0,02% Brij, 0,1% CR-3, 0,36% DMSO и 100 мМ EDTA). Планшет прогоняли в течение одного цикла на LabChip 3000 (Caliper Life Sciences, Хопкинтон, Массачусетс) в анализе по типу анализа со сдвигом подвижности, проходящем вне чипа, с "восходящим" напряжением - 2250 вольт, "нисходящим" напряжением -500 вольт и вакууметрическим давлением -1,6 фунта/кв. дюйм (psi). При помощи LabChip 3000 разделяли и измеряли флуоресцентный сигнал меченного флуоресцеином пептидного субстрата и меченного флуоресцеином пептидного продукта, присутствующих в каждой лунке. Результаты выражали в виде процентного преобразования путем измерения высоты пиков как для субстрата, так и для продукта и деления высоты пика для продукта на сумму значений высоты пиков как для субстрата, так и для продукта. В каждом планшете для вычисления процентного ингибирования тестируемых соединений и величины Z`-фактора (Z`prime value) использовали контроли со 100% ингибированием (с насыщающей концентрацией стауроспорина) и 0% ингибированием (субстрат с ферментом и DMSO).
В таблице 1 показано значение IC50 c-FMS, клеточного рецептора колониестимулирующего фактора-1 (CSF-1), для выбранных соединений.
Пример 2-2. Активность фосфо-c-FMS
Реагенты и расходные материалы приобретали у Sigma Aldrich, Gibco LifeTechnologies, BD Biosciences, Perkin Elmer, R&D Systems, Cell Signaling, Thermo Scientific (Pierce) и Santa Cruz Biotechnology. Клетки HEK293, сверхэкспрессирующие человеческий cFMS (HEK293/hFMS), культивировали в среде RPMI в колбах T225 и разделяли дважды в неделю. Для данного эксперимента клетки трипсинизировали, подсчитывали и разбавляли не содержащей сыворотку средой Megacell (Sigma № по кат. M3817) до 600000 клеток/мл (30000 клеток/лунка). Серийное разбавление тестовых соединений получали с помощью Echo 555 (LABCYTE) с использованием планшетов Echo LDV, № кат. LP-0200; и 500 нл концентрации каждого соединения добавляли в 96-лучночный поли-д-лизиновый планшет BD Biocoat (BD № кат. 356640) в DMSO (0,5% конечная концентрация). Затем добавляли 50 мкл/лунку не содержащей сыворотку среды MegaCell для покрытия соединений перед добавлением клеток в концентрации 50 мкл клеток/лунка (30000/лунка). Планшеты подвергали осаждению в течение 1 мин. при 1000 об./мин., а затем инкубировали в настольном инкубаторе в течение 15-30 мин.; планшеты перемещали в инкубатор с CO2 при 37°C для инкубации в течение ночи. Белые 96-луночные планшеты Perkin Elmer OptiPlates (№ кат. 6005509) предварительно покрывали 50 нг/лунка (100 мкл/лунка) антителом к cFMS/CSF-1R (C-20) (Santa Cruz № кат. sc-692) в PBS, закрывали крышкой из фольги, подвергали осаждению при 1000 об./мин. в течение одной минуты и инкубировали в течение ночи при 4°C.
На следующий день предварительно покрытые планшеты OptiPlates блокировали с помощью 200 мкл/лунка 1% BSA в 1x PBST (PBS с 0,1% Triton-X) при комнатной температуре в течение 2-3 часов. Параллельно, 100 мкл/лунка 2x hCSF1 (конечная концентрация 150 нг/мл) (R&D Systems, № кат. 216-MC-025/CF) (или среда в качестве отрицательного контроля) добавляли к клеткам HEK293/hFMS (планшеты для культивирования BD) инкубировали в течение ночи с соединениями. В каждом планшете контрольные колонки со 100% реагированием (с обработкой CSF1) и 0% реагированием (без CSF1) использовали для расчета процентного ингибирования тестируемых соединений и величины Z`-фактора. Планшеты инкубировали при 37°C в течение 10 минут. Среду/hCSF1 удаляли с помощью аспиратора и клетки лизировали с помощью 100 мкл/лунка предварительно охлажденного лизирующего буфера, составленного с лизирующим буфером (Cell Signaling № кат. 9803), ингибиторами протеазы/фосфатазы (Pierce № кат. 78444) и PMSF (Sigma № кат. 93482). Планшеты встряхивали в течение 60 секунд; затем подвергали осаждению при 3200 об./мин. в течение 5 мин. при 4°C и выдерживали на льду. 90 мкл лизата переносили в предварительно покрытые/блокированные планшеты OptiPlates. Затем планшеты подвергали осаждению при 1000 об./мин. в течение 60 секунд и инкубировали в течение ночи при 4°C закупоренными.
На следующий день лизаты удаляли из планшетов и планшеты промывали с помощью 300 мкл/лунка 1xPBS 6 раз с использованием промывочного устройства Biotek. Оставшийся в планшетах PBS выкачивали. 90 мкл/лунка 1:10000 антитела к фосфо-Eu (Tyr 100) (Perkin Elmer № кат. AD0159) в 1% BSA в PBST добавляли в планшеты и планшеты инкубировали в течение одного часа при комнатной температуре закупоренными. Через час антитело удаляли и планшеты промывали 6 раз с помощью 300 мкл/лунка PBST с использованием промывочного устройства Biotek. Затем добавляли 90 мкл/лунка усиливающего раствора (Perkin Elmer № кат. 4001-0010) и планшеты закупоривали и встряхивали в течение 5 мин. Сигнал считывали сразу на Perkin Elmer Envision в отношении флуоресценции с временным разрешением с возбуждением при 320 нм и эмиссией при 615 нм.
Данные анализировали с помощью Pipeline Pilot для расчета % ингибирования и значений IC50; значения IC50 для фосфор c-FMS представлены для выбранных ингибиторов CSF-1R в таблице 1.
Таблица 1. In vitro результаты иллюстративных ингибиторов CSF-1R
[IC50 для c-FMS и фосфо-c-FMS]
(мкM)
Пример 2-3. Активность ингибиторов CSF-1R в анализе пролиферации макрофагов, полученных из костного мозга мыши
Целью анализа пролиферации макрофагов костного мозга мыши была оценка ингибиторной активности выбранных ингибиторов CSF-1R.
В день 0 клетки костного мозга собирали в стерильных условиях и культивировали в течение ночи в колбах для тканевой культуры в концентрации 1×106 клеток/мл в модифицированной по способу Дульбекко среде Игла (DMEM)/15% фетальной бычьей сыворотке (FBS)/1% пенициллина-стрептомицина/1% l-глутамина/50 нг/мл рекомбинантного колониестимулирующего фактора мыши (rmM-CSF). В день 1 колбы подвергали откачке и собирали все плавающие и слабо прикрепленные клетки. Клетки подсчитывали и ресуспендировали в свежей среде+50 нг/мл rmM-CSF в концентрации 1×106 клеток/мл и переносили в 10 см или 15 см чашки для тканевой культуры. В дни 4 и 7 среду удаляли и замещали свежей средой+50 нг/мл rmM-CSF. В день 8 прилипшие клетки промывали фосфатно-буферным солевым раствором (PBS), собирали, подсчитывали и ресуспендировали в свежей среде без rmM-CSF в концентрации 2×105 клеток/мл. В аналитические лунки затем добавляли сто микролитров клеток (2×104 клеток). После голодания без rmM-CSF в течение ночи получали серийные разбавления ингибиторов CSF-1R и добавляли в соответствующие аналитические лунки. Соединения изначально разбавляли в диметилсульфоксиде (DMSO) с получением серийных 4-кратных разбавлений в диапазоне от 1 мM до 0,46 мкM. Каждую концентрацию каждого соединения затем разбавляли 1:167 в среде с получением концентраций от 6 мкM до 0,003 мкM. Двадцать пять микролитров каждой концентрации каждого соединения затем добавляли в трех повторностях в аналитические лунки с получением конечных концентраций, составляющих от 1 мкM до 0,06 нM и 0,1% DMSO. Двадцать пять микролитров rmM-CSF также добавляли в каждую аналитическую лунку, за исключением фоновых лунок, при конечной концентрации, составляющей 5 нг/мл. В конце дня 9 1 мкКи 3H-тимидина добавляли в каждую аналитическую лунку и обеспечивали возможность инкубирования планшетов при 5% CO2 и 37°C в течение дополнительных 16 часов. В день 10 клетки собирали на фильтровальный планшет с использованием 96-луночного планшетного сборщика, а затем оставляли сушиться в течение ночи. После высыхания в каждую лунку добавляли 25 мкл сцинтилляционной жидкости Beta-Count и сигнал в планшете подсчитывали на счетчике Trilux. Результаты анализировали с использованием GraphPad Prism.
Макрофаги, полученные из костного мозга мыши (BMDM), обрабатывали ингибиторами CSF-1R и CSF-1 в течение 22 часов перед сбором. Ингибиторы CSF-1R тестировали относительно ингибиторной активности CSF-1-индуцированной пролиферации BMDM в нескольких группах:
- BMDM, группа 1: Genz-882706, RA10600053, RA10607080, RA10651967 и RA10813949 (фигура 1);
- BMDM, группа 2: Genz-882706, RA10680889, RA10813661, RA10846843 и RA10848270 (фигура 2) и
- BMDM, группа 3: RA03546849 (Genz-882706), RA10651967, RA10940752, RA10947016, RA10963700 и RA10982908 (фигура 3).
Ингибиторы CSF-1R, тестированные в данном анализе, являлись сильными ингибиторами CSF-1-индуцированной пролиферации макрофагов, полученных из костного мозга мыши с IC50 в диапазоне нM.
Пример 2-4. Эффект ингибиторов CSF-1R в отношении фагоцитарной активности макрофагов, полученных из костного мозга мыши
Целью данного анализа было определение эффекта ингибиторов CSF-1R в отношении in vitro фагоцитарной активности макрофагов, полученных из костного мозга мыши. Фагоцитоз представляет собой полезную активность макрофагов, которые должны быть сохранены в присутствии ингибиторов CSF-1R.
В день 0 клетки костного мозга собирали в стерильных условиях и культивировали в течение ночи в колбах для тканевой культуры в концентрации 1×106 клеток/мл в DMEM/15% FBS/1% пенициллина-стрептомицина/1% l-глутамина/50 нг/мл rmM-CSF. В день 1 колбы подвергали откачке и собирали все плавающие и слабо прикрепленные клетки. Клетки подсчитывали и ресуспендировали в свежей среде +50 нг/мл rmM-CSF в концентрации 1×106 клеток/мл и переносили в 15 см чашки для тканевой культуры. В дни 3 и 6 среду удаляли и замещали свежей средой +50 нг/мл rmM-CSF. В день 8 прилипшие клетки промывали PBS, собирали, подсчитывали и ресуспендировали в свежей среде без rmM-CSF в концентрации 1×106 клеток/мл. Сто микролитров клеток затем добавляли в трех повторностях в 96-луночный планшет для тканевой культуры с плоским дном. После инкубирования в течение ночи добавляли DMSO в концентрации 0,1% или ингибиторы CSF-1R в концентрации 100 нM в соответствующие лунки за 60 минут перед добавлением липополисахарида (LPS) в концентрации 10 нг/мл в качестве стимула активации. Клетки инкубировали в течение ночи и анализ фагоцитоза осуществляли на следующий день.
После 24 часов инкубации с LPS и DMSO или ингибиторами CSF-1R фагоцитарную активность макрофагов, полученных из костного мозга мыши, измеряли с использованием CytoSelect для анализа фагоцитоза на 96-луночном планшете (Cell Biolabs, Inc.). В данном колориметрическом анализе меченные частицы зимозана выступали в качестве мишени для фагоцитоза. Высеянные на планшет клетки инкубировали с частицами зимозана в течение 1 часа при 37°C, 5% CO2, а затем промывали. Клетки фиксировали в течение 5 минут, а затем снова промывали. Блокирующий реагент добавляли во все лунки с целью блокирования любых меченных частиц зимозана, связанных с внешней средой клеток, от взаимодействия с субстратом. Через 1 час инкубации клетки снова промывали. Клетки пермеабилизировали, затем инкубировали с реагентом обнаружения в течение 1 часа. Пермеабилизация клеток обеспечивает достижение колориметрическим субстратом поглощенных меченных частиц зимозана внутри клеток. После промывания буфер для обнаружения и колориметрический субстрат добавляли в каждую аналитическую лунку. Реакцию останавливали путем добавления кислоты в каждую лунку. Аналитические планшеты затем считывали с помощью считывающего устройства для планшетов Vmax ELISA (Molecular Devices) при 405 нм. Оптическая плотность (O.D.) непосредственно пропорциональна количеству клеток, которые поглощали меченные частицы зимозана.
Добавление ингибиторов CSF-1R не влияло на нестимулированные клетки по сравнению с клетками в отдельности (фигура 4). Стимулирование макрофагов, полученных из костного мозга мыши, с помощью липополисахарида (LPS) в течение 24 часов обеспечивало в результате значительное повышение фагоцитарной активности по сравнению с нестимулированными клетками в отдельности в данном эксперименте. Обработка ингибиторами CSF-1R, тестированными в данном эксперименте, значительно не влияла на фагоцитарную активность макрофагов, полученных из костного мозга мыши, после стимуляции с помощью LPS.
Каждый столбец на фигуре 4 представляет собой среднее и стандартное отклонение 3 лунок. Однофакторный дисперсионный анализ ANOVA, а затем критерий множественного сравнения Даннета выполняли для определения значимости в сравнении с контролем с DMSO. t-критерий для независимых выборок применяли для определения любой значимости между клетками в отдельности и контролем с DMSO и нестимулированными клетками и стимулированными с помощью LPS клетками.
Обработка ингибиторами CSF-1R, тестированными в данном эксперименте, значительно не влияла на фагоцитарную активность покоящихся или стимулированных макрофагов, полученных из костного мозга мыши.
Пример 2-5. Эффект ингибиторов CSF-1R в отношении фагоцитарной активности первичных мышиных клеток микроглии
Целью данного анализа было определение эффектов ингибиторов CSF-1R в отношении in vitro фагоцитарной активности первичных мышиных клеток микроглии. Фагоцитоз представляет собой полезную активность клеток микроглии, которые должны быть сохранены в присутствии ингибиторов CSF-1R.
Собирали головной мозг у каждой из семнадцати мышей C57Bl/6 возрастом 3-4 дня и объединяли в DMEM/F12-Glutamax/10% FBS/1% пен./стреп./100 мкM заменимых аминокислот/2 мM пирувата натрия ("полная DMEM/F12") и выдерживали на льду до обработки. По прибытии в лабораторию головной мозг каждой мыши переносили в теплый 0,25% трипсин (2 мл/головной мозг) и инкубировали при 37°C при вращении в течение 30 минут. Реакцию диссоциации гасили равным объемом полной DMEM/F12. Ткань центрифугировали при 300xg в течение 7 минут и надосадочную жидкость затем аккуратно удаляли. Тканевый осадок промывали 3 раза полной DMEM/F12 и центрифугировали при 300xg в течение 7 минут. Надосадочную жидкость аккуратно удаляли после каждой стадии промывки пипеткой, но не с помощью вакуумной аспирации. После конечной промывки ткань восстанавливали в полной DMEM/F12, медленно растирали до отсутствия видимых комков и фильтровали через 70 мкM сито для клеток. Полученную в результате суспензию отдельных клеток промывали полной DMEM/F12, центрифугировали при 200xg в течение 7 минут и ресуспендировали с помощью полной DMEM/F12. Клетки равномерно распределяли между колбами T150 для тканевой культуры (1 колба/мышь) и конечный объем доводили до 35 мл с помощью полной DMEM/F12. Клетки загружали в смену полной среды через 5, 8 и 11 дней.
В день 12 каждую колбу промывали с помощью 10 мл PBS. Пять миллилитров 0,25% трипсина добавляли в каждую колбу и колбы помещали на вращающуюся платформу при комнатной температуре на 15 минут. Десять миллилитров полной DMEM/F12 добавляли в каждую колбу и клетки аккуратно растирали для разрушения клеточных агрегатов. Суспензии отдельных клеток затем фильтровали через 70 мкM сито для клеток и центрифугировали при 200xg в течение 6 минут. Затем клетки объединяли, подсчитывали и ресуспендировали в концентрации 1×108 клеток/мл в PBS/2% FBS/1 мM EDTA ("разделительная среда"). Клетки переносили в 5 мл полистирольные FACS пробирки и CD11b-PE+FcR блокирующий регент, представленный в наборе для положительного отбора CD11b мыши (StemCell № по каталогу 18770), добавляли в пробирки и инкубировали при комнатной температуре в течение 15 минут. Затем в FACS пробирки добавляли селекционную смесь PE и тщательно смешивали с помощью кончика пипетки. Образец снова инкубировали в течение 15 минут при комнатной температуре. Магнитные наночастицы EasySep, представленные в наборе, аккуратно смешивали, и добавляли в пробирки, и инкубировали при комнатной температуре в течение 10 минут. Пробирки помещали в магниты EasySep (StemCell № по каталогу 18000) и оставляли осаждаться в течение 7 минут. Одним движением жидкости немеченные клетки в буфере выливали, в то время как пробирки все еще находились на магните. Затем пробирку удаляли с магнита, в пробирку добавляли разделительную среду и пробирку помещали обратно на магнит еще на 7 минут. Данный способ промывки осуществляли в целом 4 раза с удалением всех немеченных клеток. После последней промывки меченные CD11b+ клетки ресуспендировали в полной DMEM/F12, подсчитывали и ресуспендировали в концентрации 1×106 клеток/мл. Сто микролитров клеток высеивали в 96-луночные планшеты для тканевой культуры с плоским дном и оставляли отстаиваться в течение ночи.
После 24 часов инкубации с LPS и DMSO или ингибиторами CSF-1R фагоцитарная активность первичных мышиных клеток микроглии измеряли с использованием CytoSelect для анализа фагоцитоза на 96-луночном планшете (Cell Biolabs, Inc.), как описано выше.
Стимуляция первичных мышиных клеток микроглии с помощью LPS в течение 24 часов обеспечивала в результате значительное повышение фагоцитарной активности по сравнению с нестимулированными клетками микроглии в отдельности в данном эксперименте. На фигуре 5 представлено графическое представление фагоцитарной активности первичных мышиных клеток микроглии после 24 ч. инкубации с DMSO или ингибиторами CSF-1R с LPS. Каждый столбец графика представляет собой среднее и стандартное отклонение 3 лунок. Однофакторный дисперсионный анализ ANOVA, а затем критерий множественного сравнения Даннета выполняли для определения значимости в сравнении с контролем с DMSO. t-критерий для независимых выборок применяли для определения любой значимости между клетками в отдельности и контролем с DMSO и нестимулированными клетками и стимулированными с помощью LPS клетками.
Обработка ингибиторами CSF-1R, тестированными в данном эксперименте, значительно не влияла на фагоцитарную активность стимулированных первичных мышиных клеток микроглии.
Пример 2-6. Оценка ингибиторов CSF-1R в отношении фагоцитарной активности первичных мышиных клеток микроглии
Целью данного исследования было определение эффекта дополнительных ингибиторов CSF-1R в отношении in vitro фагоцитарной активности первичных мышиных клеток микроглии.
Собирали головной мозг у каждой из двадцати пяти мышей C57Bl/6 возрастом 3-4 дня и объединяли в DMEM/F12-Glutamax/10% FBS/1% пен./стреп./100 мкM заменимых аминокислот/2 мM пирувата натрия ("полная DMEM/F12") и выдерживали на льду до обработки. По прибытии в лабораторию головной мозг каждой мыши переносили в теплый 0,25% трипсин (2 мл/головной мозг) и инкубировали при 37°C при вращении в течение 30 минут. Реакцию диссоциации гасили равным объемом полной DMEM/F12. Ткань центрифугировали при 300xg в течение 7 минут и надосадочную жидкость затем аккуратно удаляли. Тканевый осадок промывали 3 раза полной DMEM/F12 и центрифугировали при 300xg в течение 7 минут. Надосадочную жидкость аккуратно удаляли после каждой стадии промывки пипеткой, но не с помощью вакуумной аспирации. После конечной промывки ткань восстанавливали в полной DMEM/F12, медленно растирали до отсутствия видимых комков и фильтровали через 70 мкM сито для клеток. Полученную в результате суспензию отдельных клеток промывали полной DMEM/F12, центрифугировали при 200xg в течение 7 минут и ресуспендировали с помощью полной DMEM/F12. Клетки равномерно распределяли между колбами T150 для тканевой культуры (1 колба/мышь) и конечный объем доводили до 35 мл с помощью полной DMEM/F12. Клетки загружали в смену полной среды через 5, 8 и 11 дней.
В день 12 каждую колбу промывали с помощью 10 мл PBS. Пять миллилитров 0,25% трипсина добавляли в каждую колбу и колбы помещали на шейкер при комнатной температуре на 15 минут. Десять миллилитров полной DMEM/F12 добавляли в каждую колбу и клетки аккуратно растирали для разрушения клеточных агрегатов. Суспензии отдельных клеток затем фильтровали через 70 мкM сито для клеток и центрифугировали при 200xg в течение 6 минут. Затем клетки объединяли, подсчитывали и ресуспендировали в концентрации 1×108 клеток/мл в PBS/2% FBS/1 мM EDTA ("разделительная среда"). Клетки переносили в 5 мл полистирольные FACS пробирки и CD11b-PE+FcR блокирующий регент, представленный в наборе для положительного отбора CD11b мыши (StemCell № по каталогу 18770), добавляли в пробирки и инкубировали при комнатной температуре в течение 15 минут. Затем в FACS пробирки добавляли селекционную смесь PE и тщательно смешивали с помощью кончика пипетки. Образец снова инкубировали в течение 15 минут при комнатной температуре. Магнитные наночастицы EasySep, представленные в наборе, аккуратно смешивали, и добавляли в пробирки, и инкубировали при комнатной температуре в течение 10 минут. Пробирки помещали в магниты EasySep (StemCell № по каталогу 18000) и оставляли осаждаться в течение 7 минут. Одним движением жидкости немеченные клетки в буфере выливали, в то время как пробирки все еще находились на магните. Затем пробирку удаляли с магнита, в пробирку добавляли разделительные среды и пробирку помещали обратно на магнит еще на 7 минут. Данный способ промывки осуществляли в целом 4 раза с удалением всех немеченных клеток. После последней промывки меченные CD11b+ клетки ресуспендировали в полной DMEM/F12, подсчитывали и ресуспендировали в концентрации 1×106 клеток/мл. Сто микролитров клеток высеивали в 96-луночные планшеты для тканевой культуры с плоским дном и оставляли отстаиваться в течение ночи.
После 24 часов инкубации с LPS и DMSO или ингибиторами CSF-1R фагоцитарная активность первичных мышиных клеток микроглии измеряли с использованием CytoSelect для анализа фагоцитоза на 96-луночном планшете (Cell Biolabs, Inc.), как описано выше.
Некоторые ингибиторы CSF-1R на самом деле имели статистически значимое влияние на фагоцитоз нестимулированными клетками микроглии по сравнению с контролем с DMSO: обработка с помощью 0,1% DMSO значительно повышала фагоцитарную активность нестимулированных клеток, но обработка ингибиторами CSF-1R обеспечивала в результате фагоцитарную активность, сопоставимую с клетками микроглии в отдельности. Стимуляция первичных мышиных клеток микроглии с помощью LPS в течение 24 часов обеспечивала в результате значительное повышение фагоцитарной активности по сравнению с нестимулированными клетками микроглии в отдельности в данном эксперименте. Ни один из ингибиторов CSF-1R не оказывал влияния на фагоцитарную активность стимулированных клеток микроглии.
Фагоцитарная активность первичных мышиных клеток микроглии после 24 часов инкубации с DMSO или ингибиторами CSF-1R с LPS показана на фигуре 6. Каждый столбец на фигуре представляет собой среднее и стандартное отклонение 3 лунок. Однофакторный дисперсионный анализ ANOVA, а затем критерий множественного сравнения Даннета выполняли для определения значимости в сравнении с контролем с DMSO. t-критерий для независимых выборок применяли для определения любой значимости между клетками в отдельности и контролем с DMSO и нестимулированными клетками и стимулированными с помощью LPS клетками.
Обработка ингибиторами CSF-1R, тестированными в данном эксперименте, значительно не влияла на фагоцитарную активность стимулированных первичных мышиных клеток микроглии.
Пример 2-7. Эффект ингибиторов CSF-1R в отношении пролиферативной реакции первичных мышиных клеток микроглии
Целями данного исследования были определение оптимальных условий для анализа пролиферации, индуцированной LPS или CSF-1, с первичными мышиными клетками микроглии и эффекта низкомолекулярных ингибиторов CSF-1R и лаквинимода (активное лекарственное средство сравнения для лечения рассеянного склероза) в отношении пролиферации первичных мышиных клеток микроглии после стимуляции с помощью LPS или CSF-1.
Собирали головной мозг у каждой из пятидесяти шести мышей C57Bl/6 возрастом 2-3 дня и объединяли в DMEM/F12-Glutamax/10% FBS/1% пен./стреп./100 мкM заменимых аминокислот/2 мM пирувата натрия ("полная DMEM/F12") и выдерживали на льду до обработки. По прибытии в лабораторию головной мозг каждой мыши переносили в теплый 0,25% трипсин (2 мл/головной мозг) и инкубировали при 37°C при вращении в течение 30 минут. Реакцию диссоциации гасили равным объемом полной DMEM/F12. Ткань центрифугировали при 300xg в течение 7 минут и надосадочную жидкость затем аккуратно удаляли. Тканевый осадок промывали 3 раза полной DMEM/F12 и центрифугировали при 300xg в течение 7 минут. Надосадочную жидкость аккуратно удаляли после каждой стадии промывки пипеткой, но не с помощью вакуумной аспирации. После конечной промывки ткань восстанавливали в полной DMEM/F12, медленно растирали до отсутствия видимых комков и фильтровали через 70 мкM сито для клеток. Полученную в результате суспензию отдельных клеток промывали полной DMEM/F12, центрифугировали при 200xg в течение 7 минут и ресуспендировали с помощью полной DMEM/F12. Клетки равномерно распределяли между колбами 15 T150 для тканевой культуры (1 колба/мышь) и конечный объем доводили до 35 мл с помощью полной DMEM/F12. Клетки загружали в смену полной среды через 5, 8 и 12 дней.
В день 13 каждую колбу промывали с помощью 10 мл PBS. Пять миллилитров 0,25% трипсина добавляли в каждую колбу и колбы помещали на вращающуюся платформу при комнатной температуре на 15 минут. Десять миллилитров полной DMEM/F12 добавляли в каждую колбу и клетки аккуратно растирали для разрушения клеточных агрегатов. Суспензии отдельных клеток затем фильтровали через 70 мкM сито для клеток и центрифугировали при 200xg в течение 6 минут. Затем клетки объединяли, подсчитывали и ресуспендировали в концентрации 1×108 клеток/мл в PBS/2% FBS/1 мM EDTA ("разделительная среда"). Клетки переносили в три 5 мл полистирольные FACS пробирки и CD11b-PE+FcR блокирующий регент, представленный в наборе для положительного отбора CD11b мыши (StemCell № по каталогу 18770), добавляли в пробирки и инкубировали при комнатной температуре в течение 15 минут. Затем в FACS пробирки добавляли селекционную смесь PE и тщательно смешивали с помощью кончика пипетки. Образец снова инкубировали в течение 15 минут при комнатной температуре. Магнитные наночастицы EasySep, представленные в наборе, аккуратно смешивали, и добавляли в пробирки, и инкубировали при комнатной температуре в течение 10 минут. Пробирки помещали в магниты EasySep (StemCell № по каталогу 18000) и оставляли осаждаться в течение 7 минут. Одним движением жидкости немеченные клетки в буфере выливали, в то время как пробирки все еще находились на магните. Затем пробирку удаляли с магнита, в пробирку добавляли разделительные среды и пробирку помещали обратно на магнит еще на 7 минут. Данный способ промывки осуществляли в целом 4 раза с удалением всех немеченных клеток. После последней промывки меченные CD11b+ клетки ресуспендировали в полной DMEM/F12, подсчитывали и ресуспендировали в концентрации 5×105 клеток/мл и 1×106 клеток/мл. Сто микролитров клеток высеивали в 96-луночные планшеты для тканевой культуры с плоским дном и оставляли отстаиваться в течение ночи.
После отстаивания в течение ночи 25 мкл DMSO разводили 1:167 в среде в отдельности или с содержанием ингибиторов CSF-1R или лаквинимода с конечной концентрацией 500 нM добавляли в соответствующие аналитические лунки. Двадцать пять микролитров среды также добавляли во все лунки, содержащие только клетки, в данный момент времени. Двадцать пять микролитров LPS в концентрации 10 нг/мл или 100 нг/мл или CSF-1 в концентрации 100 нг/мл затем добавляли в соответствующие лунки. Двадцать пять микролитров среды добавляли в лунки, не содержащие LPS или CSF-1, с получением конечного объема всех аналитических лунок, составляющего 150 мкл. Затем аналитические планшеты инкубировали при 37°C и 5% CO2 в течение не более 48 часов. Для данного эксперимента получали в общей сложности 8 аналитических планшетов. 1 мкКи/лунка 3H-тимидина добавляли в первые 2 планшета сразу после постановки анализа и собирали через 8 часов. Планшеты 3 и 4 обрабатывали импульсами в течение 8 часов после постановки анализа и собирали через 16 часов. Планшеты 5 и 6 обрабатывали импульсами в течение 24 часов после постановки анализа и собирали через 8 часов, и последние 2 планшета обрабатывали импульсами через 32 часа после постановки анализа и собирали в момент времени 48 часов. Для данного эксперимента устанавливали следующие условия анализа.
Контроли
Клетки+25 мкл сред+25 мкл среды
Клетки+25 мкл сред+25 мкл LPS или CSF-1
Клетки+25 мкл DMSO+25 мкл среды
Клетки+25 мкл DMSO+25 мкл LPS или CSF-1
Ингибиторы CSF-1R
Клетки+25 мкл 500 нM Genz-669195+25 мкл среды
Клетки+25 мкл 500 нM Genz-669195+25 мкл LPS или CSF-1
Клетки+25 мкл 500 нM Genz-666367+25 мкл среды
Клетки+25 мкл 500 нM Genz-666367+25 мкл LPS или CSF-1
Клетки+25 мкл 500 нM Genz-872171+25 мкл среды
Клетки+25 мкл 500 нM Genz-872171+25 мкл LPS или CSF-1
Клетки+25 мкл 500 нM Genz-882706+25 мкл среды
Клетки+25 мкл 500 нM Genz-882706+25 мкл LPS или CSF-1
Клетки+25 мкл 500 нM Genz-1007942+25 мкл среды
Клетки+25 мкл 500 нM Genz-1007942+25 мкл LPS или CSF-1
Клетки+25 мкл 500 нM лаквинимода+25 мкл среды
Клетки+25 мкл 500 нM лаквинимода+25 мкл LPS или CSF-1
Стимуляция LPS первичных мышиных клеток микроглии in vitro не обеспечивала в результате повышенную пролиферативную активность в любой момент времени, тестированный в данном анализе (данные не показаны). Некоторые из соединений, тестированных в данном эксперименте, Genz-872171, Genz-882706 и лаквинимод, на самом деле вызывали повышенный уровень пролиферативной активности в отношении нестимулированных клеток через 48 часов после обработки, и причина данного эффекта в настоящее время является неясной (фигура 7). Стимуляция CSF-1 первичных мышиных клеток микроглии in vitro обеспечивала в результате значительное повышение пролиферативной активности по сравнению с нестимулированными клетками через 24, 32 и 48 часов после стимуляции (фигура 8). Через 8 часов после стимуляции повышения пролиферации не было обнаружено (данные не показаны). Все низкомолекулярные тестируемые ингибиторы CSF-1R, значительно снижали пролиферацию клеток микроглии через 32 и 48 часов после стимуляции с помощью CSF-1 (фигура 8). Наоборот, лаквинимод не оказывал влияния или повышал пролиферативную активность клеток микроглии в те моменты времени, по сравнению с контролем с DMSO.
Выделенные клетки микроглии, высеянные на планшеты в концентрации 1×105 клеток/лунка, обрабатывали импульсами через 32 часа после добавления тестовых соединений и собирали через 8 часов. Колонки на фигуре 7 представляют собой среднее и SD биологических трехкратных повторений для каждого аналитического условия. Однофакторный дисперсионный анализ ANOVA, а затем критерий множественного сравнения Даннета с контролем с DMSO использовали для статистического анализа. Также выполняли t-критерии для независимых выборок для сравнения каждого тестового соединения с контролем с DMSO.
Выделенные клетки микроглии, высеянные на планшеты в концентрации 1×105 клеток/лунка, стимулировали с помощью 100 нг/мл CSF-1 и измеряли пролиферативную активность через 8, 24, 32 и 48 часов после стимуляции. Колонки на фигуре 8 представляют собой среднее и SD биологических трехкратных повторений для каждого аналитического условия. Однофакторный дисперсионный анализ ANOVA, а затем критерий множественного сравнения Даннета с контролем с DMSO использовали для статистического анализа. Также выполняли t-критерии для независимых выборок для сравнения каждого тестового соединения с контролем с DMSO.
Стимуляция с помощью LPS мышиных первичных клеток микроглии не вызывала повышения пролиферативной активности. Тем не менее, стимуляция CSF-1 вызывает значительное повышение пролиферации, и обработка низкомолекулярными тестируемыми ингибиторами CSF-1R значительно снижала пролиферативную активность клеток.
Пример 3. Исследования in vivo
Пример 3-1. Эффективность и механизм действия Genz-882706 ингибитора CSF-1R в MOG-индуцированной NOD модели прогрессивного EAE
Целью данного исследования была оценка эффективности и механизма действия Genz-882706 ингибитора CSF-1R в MOG (миелин-олигодендроцитарный гликопротеин)-индуцированной NOD модели прогрессивного EAE (экспериментального аутоиммунного энцефаломиелита) путем измерения воспалительных/нейротоксичных медиаторов в CNS посредством анализа белка в гомогенате и экспрессии генов.
Самок мышей NOD (возрастом 8 недель) распределяли в одну з трех групп обработки; тестовые образцы и вводимые дозы в каждой группе обработки показаны ниже в таблице 2.
Таблица 2. Группы обработки MOG-индуцированной NOD модели прогрессивного EAE (механизм действия)
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
Индукция EAE и подсчет баллов в отношении EAE.
Самок мышей NOD/ShlTJ иммунизировали эмульсией пептида MOG35-55 (150 мкг/мышь) в полном адъюванте Фрейнда (CFA), содержащем 0,6 мг Mycobacterium tuberculosis. Эмульсию вводили в объеме 0,2 мл на мышь путем подкожной инъекции в два участка. Токсин Bordetella pertussis (PTX) в PBS вводили в дни 0 и 2 в дозе, составляющей 150 нг/животное, посредством внутрибрюшинного (i. p.) пути. Мышей наблюдали ежедневно относительно паралитических симптомов EAE. Мышей оценивали относительно клинических симптомов с использованием прогрессивной системы подсчета баллов от 0 до 5. Балл 0: отсутствие заболевания; балл 1: вялый хвост; бал 2; слабость задних конечностей; балл 3: паралич задних конечностей; балл 4: слабость передних конечностей/частичный паралич; балл 5: смерть.
Экспрессия гена/QPCR
РНК экстрагировали с использованием набора RNeasy от Qiagen (следуя протоколу производителя), а затем транскрибировали с cDNA с использованием набора QuantiTect от Qiagen (следуя протоколу производителя). Образцы загружали (в трех повторностях) в 384-луночный планшет. Существовало 6 мишеней и один внутренний контроль. Мишени представляли собой TNFα, CSF-1R, Arg1, IL-6, Ym1 и MCP-1. RPL37A представлял собой конститутивный ген, мультиплексированный в каждой лунке. Планшеты обрабатывали в соответствии с протоколом производителя на устройстве Applied Biosystems 7900. Данные рассчитывали как относительную экспрессию по отношению к внутреннему протоколу.
Результаты
Заболевание было индуцировано в модели вторичного прогрессивного EAE у мышей NOD с помощью эмульсии MOG 35-55 и CFA. Терапевтическое лечение с помощью Genz-882706 (25 мг/кг/день) или контроля со средой-носителем начинали в день 27 после индукции заболевания, когда мыши начинали входить в прогрессирующую стадию заболевания. В группе, обработанной ингибитором CSF-1R Genz-882706, видно значительное снижение баллов заболевания по сравнению с контролем со средой-носителем в дни 32, 34 и дни 41-43 (фигура 9); данные представляют собой среднее значение ± SEM баллов заболевания. Наблюдали тенденцию к более низким баллам в целом с обработкой с помощью Genz-882706.
В данном исследовании наблюдали изменения экспрессии генов нескольких воспалительных (IL-6, MCP-1 и TNF-α) и противовоспалительных (Ym-1 и Arg-1) маркеров в спинном мозге. Спинной мозг собирали у каждой мыши через 4 недели после индукции и РНК собирали и оценивали относительно изменений экспрессии генов. Относительная экспрессия соотносится с внутренним контролем, RPL37A.
За исключением CSF1R, животные, у которых индуцировали заболевание с помощью MOG 35-55, проявляли усиление экспрессии генов во всех мишенях в ткани спинного мозга по сравнению с необработанными животными. Наблюдали тенденцию к снижению экспрессии генов Arg1, TNFα, IL-6 и MCP-1 в ткани спинного мозга животных, обработанных с помощью Genz-882706, по сравнению с контролями со средой-носителем, но она была статистически незначимой. Кроме того, тенденцию к усилению экспрессии Ym-1 наблюдали у обработанных с помощью Genz-882706 животных по сравнению с контролями, но она также не была значимой (фигура 10).
Ежедневная обработка соединением Genz-882706 ингибитором CSF-1R значительно снижала средние баллы заболевания по сравнению с обработанными средой-носителями животными. Это сопровождалось тенденцией к снижению экспрессии генов воспалительных маркеров в спинном мозге с уменьшенными уровнями mRNA MCP-1, TNFa и IL-6.
Пример 3-2. Оценка уровней цитокинов в спинном мозге после обработки ингибитором CSF-1R Genz-882706 в MOG-индуцированной NOD модели прогрессивного EAE
Целью данного исследования была оценка различий уровней цитокинов в спинном мозге мышей NOD с MOG EAE после обработки низкомолекулярным ингибитором CSF-1R, Genz-882706.
Самок мышей NOD (возрастом 8 недель) распределяли в одну з трех групп обработки; тестовые образцы и вводимые дозы в каждой группе обработки показаны ниже в таблице 3.
Таблица 3. Группы обработки MOG-индуцированной NOD модели прогрессивного EAE (уровни цитокинов)
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
Получение гомогената
Замороженные ткани спинного мозга, собранные в день 43, оттаивали и добавляли 700 мкл клеточного лизирующего буфера Bioplex (BioRad № по каталогу 171-304011), содержащего факторы 1 и 2 (ингибиторы протеазы и фосфатазы, соответственно; BioRad № по каталогу 171-304012), и ингибитор протеазы фенил-метилсульфонилфторид (PMSF, 500 мM; Sigma-Aldrich). Ткань гомогенизировали с использованием циркониевых шариков и встряхивали на Omni Bead Ruptor, а затем центрифугировали при 4°C при 6000 × g в течение 20 минут. Надосадочную жидкость удаляли и разделяли на аликвоты. Аликвоты хранили при -20°C до анализа. Содержание белка в каждом образце определяли с использованием анализа с бицинхониновой кислотой (BCA) (Pierce № по каталогу 23225, Рокфорд, Иллинойс) с бычьим сывороточным альбумином (BSA) в качестве стандарта в соответствии с протоколом производителя. Абсорбцию образцов считывали при 560 нм с использованием спектрофотометра (Molecular Devices Versa Max, Саннивейл, Калифорния). Концентрации в образцах рассчитывали как мг/мл белка. Результаты следующих анализов были нормализованы относительно концентрации белка, а уровни цитокина/хемокина были указаны как пг цитокина/мг тканевого белка.
ELISA в отношении нейротрофического фактора головного мозга мыши (BDNF)
Гомогенаты анализировали с использованием набора от Insight Genomics для ELISA в отношении BDNF мыши. Образцы разбавляли 1:5 буфером для разбавления. Сто микролитров разбавленных образцов и стандартов добавляли в предварительно покрытый 96-луночный планшет, закрывали и инкубировали при 37°C в течение 90 минут. После инкубации образцы и стандарты извлекали и планшеты аккуратно подвергали блоттингу на бумажных полотенцах. Сто микролитров рабочего раствора биотинилированного антитела к BDNF мыши добавляли в каждую лунку и инкубировали при 37°C в течение 60 минут. Затем планшет промывали 3 раза, и добавляли 100 мкл рабочего раствора ABC, и планшет инкубировали при 37°C в течение 30 минут. Затем планшет промывали 5 раз и добавляли 90 мкл субстрата TMB и предоставляли возможность планшету инкубироваться в темноте в течение 8-12 минут. Реакцию останавливали путем добавления 100 мкл стоп-раствора. Затем планшеты считывали на считывающем устройстве для планшетов при 450 нм.
ELISA в отношении TNF-α мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении TNF-α мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали пять раз с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата TNF-α мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении интерферон-гамма-индуцируемого белка (IP-10) мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении IP-10 мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата IP-10 мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении IL-10 мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении IL-10 мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата IL-10 мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении RANTES мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении RANTES мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата RANTES мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении IL-12p40 мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении IL-12p40 мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата IL-12p40 мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении IL-6 мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении IL-6 мыши Quantikine от R&D Systems. Образцы разбавляли 1:4 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата IL-6 мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении MCP-1 мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении MCP-1 мыши Quantikine от R&D Systems. Образцы разбавляли 1:5 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата MCP-1 мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении мышиного TGF-β1
Гомогенаты анализировали с помощью набора для ELISA в отношении TGF-β1 Quantikine от R&D Systems. Скрытый TGF-β1 в образцах активировали путем стадии активации кислотой и нейтрализации и разбавляли в калибровочном разбавителе с получением фактора разбавления 1:7,5. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в соответствующие лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке, и планшет закрывали клейкой лентой, и инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали 4 раза промывочным буфером. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата TGF-β1 человека добавляли в каждую лунку и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор TMB и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
ELISA в отношении IL-1β мыши
Гомогенаты анализировали с помощью набора для ELISA в отношении IL-1β мыши Quantikine от R&D Systems. Образцы разбавляли 1:3 калибровочным разбавителем. Вначале в каждую лунку добавляли пятьдесят микролитров аналитического разбавителя. Затем в лунки добавляли пятьдесят микролитров стандартов, аналитического контроля и разбавленного образца. Содержимое планшета перемешивали путем аккуратного постукивания по рамке и планшет заклеивали клейкой лентой. Планшет инкубировали в течение 2 часов при комнатной температуре. После инкубации планшет промывали с помощью около 400 мкл промывочного буфера с использованием бутылочки с пульверизатором 5 раз. После конечной промывки содержимое планшета аккуратно выстукивали на бумажные полотенца для удаления избытка влаги. Сто микролитров конъюгата IL-1β мыши добавляли в каждую лунку, покрытую новой полоской клейкой ленты, и инкубировали при комнатной температуре в течение 2 часов. После инкубации планшет промывали, как описано выше. Затем в каждую лунку добавляли субстратный раствор и инкубировали в течение 30 минут при комнатной температуре в темноте. После инкубации в каждую лунку добавляли кислотный стоп-раствор и планшет считывали на считывающем устройстве для планшетов для ELISA при 450 нм-560 нм.
Анализ уровня оксида азота (NO) у мышей
Гомогенаты анализировали с помощью набора для анализа оксида азота (нитрита/нитрата) In Vitro OxiSelect от Cell Biolabs. Образцы разбавляли 1:2 средой. Пятьдесят микролитров нитратных стандартов, образцов или холостых проб добавляли в 96-луночный микротитровальный планшет. Пятьдесят микролитров ферментативной реакционной смеси добавляли в каждую лунку (уже содержащую 50 мкл нитратного стандарта или образца). Планшеты закрывали и инкубировали при комнатной температуре в течение 1 часа на орбитальном шейкере. Пятьдесят микролитров реагента A Грисса добавляли в каждую лунку и сразу после этого 50 мкл реагента B Грисса. Планшет инкубировали в течение 10 минут, обеспечивая проявление цвета. Затем планшет считывали на считывающем устройстве для микропланшетов при 540 нм и концентрации рассчитывали путем сравнения абсорбции образцов со стандартной кривой.
Белок 3, подобный хитиназе 3/ECF-L (YM-1) мыши
Гомогенаты анализировали в наборе DuoSet Development от R&D Systems. Захватывающее антитело разбавляли до его рабочей концентрации в PBS и добавляли 100 мкл на лунку в 96-луночный микропланшет и обеспечивали возможность инкубации при комнатной температуре в течение ночи. После инкубации в течение ночи буферное покрытие извлекали и планшеты промывали трижды промывочным буфером. Избыточную влагу удаляли из лунок путем высушивания на бумажных полотенцах. Затем планшеты блокировали путем добавления 300 мкл буфера, представляющего собой реагентный разбавитель, в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. При инкубации планшетов получали образцы и стандарты. Гомогенаты разбавляли 1:50 реагентным разбавителем. Стандарт восстанавливали с помощью 0,5 мл реагентного разбавителя и оставляли осаждаться в течение минимум 15 минут перед осуществлением разбавлений. Стандартная кривая с семью точками с использованием 2-кратных серийных разбавлений была получена с использованием реагентного разбавителя с высоким стандартом, составляющего 5000 пг/мл. После блокирования в течение одного часа планшеты промывали, как описано выше. Сто микролитров образцов и стандартов добавляли в соответствующие лунки. Планшеты закрывали и обеспечивали возможность инкубации в течение 2 часов при комнатной температуре. После инкубации планшеты промывали 3 раза промывочным буфером. Сто микролитров рабочего разбавления детекторного антитела добавляли в каждую лунку. Планшеты закрывали и обеспечивали возможность инкубации в течение 2 часов при комнатной температуре. Планшеты промывали, как описано выше, после инкубации. 100 мкл рабочего разбавления стрептавидина-HRP добавляли в каждую лунку и обеспечивали возможность инкубации при комнатной температуре в течение 20 минут в темноте. Затем планшеты промывали после инкубации. Сто микролитров субстратного раствора добавляли в каждую лунку и планшеты инкубировали в темноте в течение 20 минут. Пятьдесят микролитров стоп-раствора добавляли в каждую лунку и планшеты считывали на устройстве для считывания микропланшетов при 450-560 нм.
Результаты
Обработка с помощью Genz-882706 мышей с EAE обеспечивала значительное снижение уровней MCP-1, IL-6, IL-1β и IP-10 в гомогенатах спинного мозга по сравнению с обработанными средой-носителем животными (фигура 11); колонки представляют собой среднее и SEM. T-критерии для независимых выборок между необработанными группами и группами со средой-носителем, а также группами со средой-носителем и Genz-882706 использовали для статистического анализа.
Несмотря на статистическую значимость, обработанные с помощью Genz-882706 животные с индуцированным MOG EAE показали тенденцию к сниженным уровням TGF-β. Обработка низкомолекулярным ингибитором CSF-1R Genz-882706 показала значительное повышение уровней TNF-α в спинном мозге по сравнению с группой обработки средой-носителем. Неясно, почему происходило данное повышение. Отсутствовали эффекты на уровни MCSF, RANTES или IL-12p40 после обработки низкомолекулярным ингибитором CSF-1R. Уровни IL-10 были значительно снижены у больных обработанных средой-носителем животных по сравнению с необработанными контрольными животными (фигура 12); колонки представляют собой среднее и SEM. T-критерии для независимых выборок между необработанными группами и группами со средой-носителем, а также группами со средой-носителем и Genz-882706 использовали для статистического анализа. Обработка с помощью Genz-882706 в концентрации 25 мг/кг/день показала тенденцию к повышению уровней IL-10 при сравнении с группой обработки средой-носителем. У больных животных, обработанных контролем со средой-носителем, наблюдали значительно повышенные уровни Ym-1 при сравнении либо с необработанными контролями, либо с обработанными с помощью Genz-882706 группами. Уровни BDNF не подвергались влиянию низкомолекулярного ингибитора CSF-1R. Общие уровни оксида азота невозможно измерить с помощью либо фильтрованных, либо нефильтрованных образцов.
Обработка с помощью Genz-882706 мышей с EAE обеспечивала значительное снижение уровней воспалительных цитокинов MCP-1, IL-6, IL-1β и IP-10 в спинном мозге при сравнении с обработанными средой-носителем животными. Обработка с помощью Genz-882706 показала значительное повышение уровней TNF-α в спинном мозге при сравнении с группой обработки средой-носителем. Неясно, почему происходило данное повышение. В отношении противовоспалительных цитокинов, наблюдали тенденцию к снижению уровней TGF-β после обработки низкомолекулярным ингибитором cFMS, но в то же время тенденцию к повышению уровней IL-10 по сравнению с контролем со средой-носителем. У больных животных, обработанных контролем со средой-носителем, наблюдали значительно повышенные уровни Ym-1 при сравнении либо с необработанными контролями, либо с обработанными с помощью Genz-882706 группами. В целом, оказалось, что обработка с помощью Genz-882706 имела общий противовоспалительный эффект в спинном мозге мышей NOD с EAE.
Пример 3-3. Эффект профилактического лечения с помощью Genz-882706 в модели LPS-индуцированной активации клеток микроглии
Целью данного исследования была оценка эффекта нового проникающего в ЦНС ингибитора CSF-1R, Genz-882706, на маркеры активации клеток микроглии и популяции моноцитов, макрофагов и клеток микроглии в головном мозге.
Самок мышей C57BL/6 (возрастом 7-8 недель) распределяли в одну из одиннадцати групп обработки; тестовые изделия и вводимые дозы в каждой группе обработки показаны ниже в таблице 4. Мышей заражали LPS ежедневно в течение четырех дней и вводили дозу ингибитора CSF-1R, Genz-882706, один раз в день за час до инъекции LPS. Образцы ткани ЦНС и кровь собирали в день 5, через час после последней дозы ингибитора CSF-1R.
Таблица 4. Группы обработки для модели LPS-индуцированной активации клеток микроглии (профилактическое лечение, Genz-882706)
перорально
Искусственное пероральное введение
Искусственное пероральное введение
Искусственное пероральное введение
Искусственное пероральное введение
Искусственное пероральное введение
Искусственное пероральное введение
перорально
перорально
Головной мозг и спинной мозг каждой мыши собирали при умерщвлении, объединяли и хранили в RPMI на льду до обработки. Ткани удаляли из RPMI и нарезали на кусочки ~1 мм на 1 мм с помощью лезвия бритвы. 2 мл среды для диссоциации (HBSS+2,5 мг/мл коллагеназы D+1 мг/мл DNase) добавляли в каждую емкость с образцами, тщательно смешивали и инкубировали на вращающейся платформе при 37°C в течение 45 минут. Затем каждый образец растирали стеклянными пипетками в течение около 1 минуты и переносили в 15 мл коническую пробирку. Ткань промывали с помощью PBS и центрифугировали в течение 5 минут при 2000 об./мин. 10 мл PBS добавляли к каждому полученному в результате осадку ткани, затем фильтровали через 70 мкм сито для клеток. Фильтры для клеток и суспензии клеток промывали с помощью PBS и центрифугировали при 2000 об./мин. в течение 5 минут. Надосадочные жидкости затем извлекали и клеточные осадки ресуспендировали с помощью смеси 30% перколл/HBSS комнатной температуры (4 мл/емкость с тканью) и переносили в 15 мл коническую пробирку стеклянной пипеткой. Конические пробирки центрифугировали при 700xg об./мин. в течение 10 минут при комнатной температуре в центрифуге без затормаживания. После центрифугирования миелиновый слой и перколл извлекали аспиратором и полученные в результате клеточные осадки ресуспендировали с помощью 1 мл PBS и переносили в чистые 15 мл конические пробирки стеклянной пипеткой. Клетки промывали с помощью 15 мл PBS и центрифугировали при 2000 об./мин. в течение 5 мин. Надосадочные жидкости удаляли и клеточные осадки ресуспендировали в 300 мкл PBS. 250 мкл клеток затем переносили в соответствующие лунки круглодонного 96-луночного планшета для окрашивания.
Круглодонный 96-луночный планшет, содержащий клетки, центрифугировали при 2000 об./мин. в течение 1 минуты и надосадочные жидкости извлекали. 50 мкл блокирующего антитела мыши добавляли в каждую лунку, тщательно смешивали кончиками пипеток и обеспечивали возможность инкубации в течение 10 минут при комнатной температуре. 20 мкл/образец следующей смеси антител добавляли в лунки:
CD11b-PCP Cy5,5 (BD 550993)
CD45-FITC (BD 553080)
CD80-BV421 (BD 562611)
CD86-PE (BD 553692).
В контрольные компенсационные пробирки также загружали шарики и отдельные антитела. Антитела и клетки или шарики затем инкубировали в течение 20 минут при комнатной температуре в темноте. Двести микролитров белкового блокирующего средства (PBA) добавляли к клеткам в планшете для окрашивания и планшет центрифугировали в течение 1 минуты при 2000 об./мин. Клеточные осадки ресуспендировали с помощью 230 мкл 1% не содержащего метанол формальдегида (MFF), тщательно смешивали кончиками пипеток и хранили при 4°C до применения на проточном цитометре LSR. Затем в каждую лунку с образцом добавляли двадцать мкл шариков для подсчета для количественной оценки. Компенсационные шарики затем промывали путем добавления 1 мл PBA в каждую пробирку и центрифугировали при 2400 об./мин. в течение 5 минут. Компенсационные контрольные шарики ресуспендировали с помощью 250 мкл PBA и хранили до регистрации. Сразу после окончания регистрации образцов результаты образцов анализировали с использованием аналитического программного обеспечения FlowJo FACS.
Кровь собирали при умерщвлении при помощи забора крови из ретроорбитального синуса и 100 мкл добавляли в пробирки FACS. Затем 50 мкл блокирующего антитела мыши добавляли в каждую пробирку и инкубировали в течение 10 минут при комнатной температуре. Смесь, содержащую следующие антитела в PBS/1% BSA/0,05% азида натрия (PBA), добавляли в пробирки с образцами в конечном объеме, составляющем 20 мкл/образец:
CD11b-PCP Cy5,5 (BD 550993)
CD11c-PE (BD557401)
F4/80-APC (eBioscience 17-4801-82).
Антитела инкубировали в течение 20 минут при комнатной температуре в темноте. Затем в каждую пробирку добавляли 1 мл 1X FACS лизирующего раствора для лизиса красных кровяных клеток и пробирки снова инкубировали в течение 10 минут в темноте при комнатной температуре. Пробирки с образцами центрифугировали при 2000 об./мин. в течение 1 минуты и клеточные осадки промывали путем ресуспендирования с помощью 1 мл PBA и центрифугирования при 2000 об./мин. в течение 1 минуты. Полученный в результате клеточный осадок затем ресуспендировали с помощью 200 мкл 1% не содержащего метанол формальдегида (MFF). Сразу после окончания окрашивания клеток ЦНС в 96-луночном круглодонном планшете в каждый образец крови добавляли 50 мкл шариков для подсчета и образцы переносили в пустые лунки планшета для регистрации.
Изначально, t-критерий для независимых выборок осуществляли между необработанной группой и обработанной LPS группой для определения изменений популяций клеток, индуцированных заражением LPS. t-критерий для независимых выборок между группой контроля со средой-носителем и каждой обработанной ингибитором CSF-1R группой осуществляли для определения эффекта обработки низкомолекулярным ингибитором на различные популяции клеток.
Как может быть видно на фигуре 13, значительные повышения количества клеток микроглии, моноцитов/макрофагов и лимфоцитов наблюдали в головном мозге и спинном мозге после заражения LPS. Обработка низкомолекулярным ингибитором CSF-1R Genz-882706 как при дозе, составляющей 30 мг/кг, так и при дозе, составляющей 100 мг/кг, значительно снижали количество клеток микроглии и моноцитов/макрофагов в головном мозге и спинном мозге по сравнению с контролями со средой-носителем и LPS. Эффект на количество лимфоцитов в данном исследовании после ежесуточного введения дозы не наблюдали.
В данном исследовании также оценивали маркеры активации популяций клеток микроглии и моноцитов/макрофагов. Сообщаются уровни экспрессии по значению средней интенсивности флуоресценции (MFI). Экспрессия CD80 повышалась только незначительно на популяциях как клеток микроглии, так и моноцитов/макрофагов в головном мозге и спинном мозге, соответственно, при заражении LPS (фигура 14 и фигура 15). Обработка с помощью Genz-882706 незначительно снижала экспрессию CD80 на моноцитах/макрофагах в головном мозге по сравнению с контролем со средой-носителем. Значительного эффекта на экспрессию CD86 не наблюдали. Важно отметить, что экспрессия CD80 и CD86 на клетках у необработанных мышей в этом исследовании была примерно в 2 раза выше, чем в предыдущих исследованиях.
Обработка с помощью Genz-882706 в концентрации 30 мг/кг, а не 100 мг/кг, значительно повышала количество циркулирующих моноцитов и макрофагов по сравнению с контролем со средой-носителем (фигура 16). Несмотря на статистическую незначимость, обработка дозой, составляющей 100 мг/кг Genz-882706 снижала количество циркулирующих миелоидных DC на >30%. В предыдущих исследованиях значительное снижение циркулирующих миелоидных DC последовательно происходило при введении дозы ингибиторов CSF-1R два раза в день.
Четыре дневные дозы LPS обеспечивали в результате значительное увеличение количества клеток микроглии, моноцитов/макрофагов и лимфоцитов в головном мозге и спинном мозге мышей C57Bl/6. Обработка с помощью Genz-882706 снижала количество клеток микроглии и моноцитов/макрофагов как в головном мозге, так и в спинном мозге после заражения LPS. Введение дозы Genz-882706 один раз в день также уменьшало экспрессию маркера активации CD80 в популяциях моноцитов/макрофагов в головном мозге. Никаких значительных сокращений циркулирующих моноцитов или макрофагов не наблюдали, но наблюдали уменьшение миелоидных DC при дозе, составляющей 100 мг/кг.
Пример 3-4. Оценка ингибиторов CSF-1R в MOG-индуцированной NOD модели прогрессивного EAE
Целью данного исследования была оценка влияния терапевтического лечения известным ингибитором cFMS киназы, ингибитором A (Proc Natl Acad Sci U S A. 2005 Nov 1;102(44):16078-83), и лечения с помощью Genz-882706, ингибитора CSF-1R, в NOD модели MOG прогрессивного EAE, модели вторичного прогрессивного MS человека. Оценка включала средние баллы заболевания, воспаления ЦНС, демиелинизации ЦНС и потери аксонов.
Таблица 5. Группы обработки MOG-индуцированной NOD модели прогрессивного EAE
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
Искусственное пероральное введение
(150 мкг в 2 мг/мл CFA)
(150 нг в 200 мкл PBS)
(без обработки)
Индукция EAE и подсчет баллов в отношении EAE.
Самок мышей NOD/ShlTJ иммунизировали эмульсией пептида MOG35-55 (150 мкг/мышь) в полном адъюванте Фрейнда (CFA), содержащем 0,6 мг Mycobacterium tuberculosis. Эмульсию вводили в объеме 0,2 мл на мышь путем подкожной инъекции в два участка. Токсин Bordetella pertussis (PTX) в PBS вводили в дни 0 и 2 в дозе, составляющей 150 нг/животное, посредством внутрибрюшинного (i. p.) пути. Мышей наблюдали ежедневно относительно паралитических симптомов EAE. Мышей оценивали относительно клинических симптомов с использованием системы подсчета баллов заболевания от 0 до 5. Балл 0: отсутствие заболевания; балл 1: вялый хвост; бал 2; слабость задних конечностей; балл 3: паралич задних конечностей; балл 4: слабость передних конечностей/частичный паралич; балл 5: смерть.
Гистология и иммуногистохимический анализ
В конце периода обработки (36 дней введения доз) мышей анестезировали изофлураном, перфузировали, подвергали эвтаназии с помощью СО2, а спинной мозг собирали в 10% буферном нейтральном формалине для гистопатологического анализа. Образцы спинного мозга (затылочного и грудного) были разделены на срезы и помещены на стекло в Mass Histology Labs. Срезы спинного мозга окрашивали в отношении миелина с помощью Luxol быстрым голубым (LFB) для обнаружения демиелинизации и с помощью серебряного окрашивания Bielschowsky (серебро) для обнаружения потери аксонов, SMI-32 (обнаружение нейрофиламентов) для обнаружения повреждения аксонов и Iba-1 для обнаружения макрофагов/моноцитов/клеток микроглии. Срезы тканей на стеклах оценивали с помощью световой микроскопии. Во всех оценках использовали шкалу от 0 (без изменений/обнаружения) до 5 (серьезные изменения/обнаружение).
Результаты
Вторичный прогрессивный EAE был индуцирован у мышей NOD эмульсией MOG 35-55 и CFA. Терапевтическое лечение с помощью Genz-882706 (100 мг/кг или 25 мг/кг) или контроля со средой-носителем начинали в день 26 после индукции заболевания. В день 26 у мышей начиналась прогрессивная стадия заболевания. Группа, обработанная внутренним ингибитором CSF-1R, Genz-882706, в концентрации 100 мг/кг, показала значительно сниженные баллы заболевания по сравнению с контролем со средой-носителем в день 30 и дни 37-62 (фигура 17). Более низкая доза Genz-882706 (25 мг/кг) значительно снижала баллы по сравнению со средой-носителем в дни 43-49, 57-59 и 62.
Ингибитор CSF-1R Genz-882706 при дозах, составляющих 100 мг/кг и 25 мг/кг, значительно снижал степень потери аксонов и пролиферацию/инфильтрацию макрофагов/клеток микроглии в спинном мозге по сравнению с группой контроля со средой-носителем (фигура 18). Из данных также видно снижение на >40% степени повреждения аксонов и демиелинизации в группах, обработанных ингибитором CSF-1R 882706 как в концентрации 25 мг/кг, так и в концентрации 100 мг/кг, по сравнению с группой контроля со средой-носителем.
Ежедневная обработка соединением Genz-882706 ингибитором CSF-1R значительно снижала средние баллы заболевания и степень повреждения ЦНС по сравнению с обработанными средой-носителем животными и животными без обработки.
Пример 3-5. Влияние профилактического лечения с помощью RA10651967 в модели LPS-индуцированных активации клеток микроглии/воспаления ЦНС
Целью данного исследования была оценка эффекта RA10651967, на маркеры активации клеток микроглии и популяции моноцитов, макрофагов и клеток микроглии в головном мозге и спинном мозге.
Самок мышей C57BL/6 (возрастом 7-8 недель) распределяли в одну из шести групп обработки; тестовые изделия и вводимые дозы в каждой группе обработки показаны ниже в таблице 6.
Таблица 6. Группы обработки для модели LPS-индуцированной активации клеток микроглии (профилактическое лечение, RA10651967)
перорально
Искусственное пероральное введение
Искусственное пероральное введение
Перорально
Головной мозг каждой мыши собирали при умерщвлении, объединяли и хранили в RPMI на льду до обработки. Ткани удаляли из RPMI и нарезали на кусочки ~1 мм на 1 мм с помощью лезвия бритвы. 2 мл среды для диссоциации (HBSS+2,5 мг/мл коллагеназы D+1 мг/мл DNase) добавляли в каждую емкость с образцами, тщательно смешивали и инкубировали на встряхивателе при 37°C в течение 45 минут. Затем каждый образец растирали стеклянными пипетками в течение около 1 минуты и переносили в 15 мл коническую пробирку. Ткань промывали с помощью PBS и центрифугировали в течение 5 минут при 2000 об./мин. 10 мл PBS добавляли к каждому полученному в результате осадку ткани, затем фильтровали через 70 мкм сито для клеток. Фильтры для клеток и суспензии клеток промывали с помощью PBS и центрифугировали при 2000 об./мин. в течение 5 минут. Надосадочные жидкости затем извлекали и клеточные осадки ресуспендировали с помощью смеси 30% перколл/HBSS комнатной температуры (4 мл/емкость с тканью) и переносили в 15 мл коническую пробирку стеклянной пипеткой. Конические пробирки центрифугировали при 700xg об./мин. в течение 10 минут при комнатной температуре в центрифуге без затормаживания. После центрифугирования миелиновый слой и перколл извлекали аспиратором и полученные в результате клеточные осадки ресуспендировали с помощью 1 мл PBS и переносили в чистые 15 мл конические пробирки стеклянной пипеткой. Клетки промывали с помощью 15 мл PBS и центрифугировали при 2000 об./мин. в течение 5 мин. Надосадочные жидкости удаляли и клеточные осадки ресуспендировали в 300 мкл PBS. 250 мкл клеток затем переносили в соответствующие лунки круглодонного 96-луночного планшета для окрашивания.
Круглодонный 96-луночный планшет, содержащий клетки, центрифугировали при 2000 об./мин. в течение 1 минуты и надосадочные жидкости извлекали. 50 мкл блокирующего антитела мыши добавляли в каждую лунку, тщательно смешивали кончиками пипеток и обеспечивали возможность инкубации в течение 10 минут при комнатной температуре. 20 мкл/образец следующей смеси антител добавляли в лунки:
CD11b-PCP Cy5,5 (BD 550993)
CD45-FITC (BD 553080)
CD80-BV421 (BD 562611)
В контрольные компенсационные пробирки также загружали шарики и отдельные антитела. Антитела и клетки или шарики затем инкубировали в течение 20 минут при комнатной температуре в темноте. Двести микролитров PBA добавляли к клеткам в планшете для окрашивания и планшет центрифугировали в течение 1 минуты при 2000 об./мин. Клеточные осадки ресуспендировали с помощью 230 мкл MFF, тщательно смешивали кончиками пипеток и хранили при 4°C до применения на LSR. Затем в каждую лунку с образцом добавляли 20 мкл шариков для подсчета для количественной оценки. Компенсационные шарики затем промывали путем добавления 1 мл PBA в каждую пробирку и центрифугировали при 2400 об./мин. в течение 5 минут. Компенсационные контрольные шарики ресуспендировали с помощью 250 мкл PBA и хранили до регистрации. Сразу после окончания регистрации образцов результаты образцов анализировали с использованием аналитического программного обеспечения FlowJo FACS.
Кровь собирали при умерщвлении при помощи забора крови из ретроорбитального синуса и 100 мкл добавляли в пробирки FACS. Затем 50 мкл блокирующего антитела мыши добавляли в каждую пробирку и инкубировали в течение 10 минут при комнатной температуре. Смесь, содержащую следующие антитела в PBS/1% BSA/0,05% азида натрия (PBA), добавляли в пробирки с образцами в конечном объеме, составляющем 20 мкл/образец:
CD11b-PCP Cy5,5 (BD 550993)
CD11c-PE (BD557401)
F4/80-APC (eBioscience 17-4801-82).
Антитела инкубировали в течение 20 минут при комнатной температуре в темноте. Затем в каждую пробирку добавляли 1 мл 1X FACS лизирующего раствора для лизиса красных кровяных клеток и пробирки снова инкубировали в течение 10 минут в темноте при комнатной температуре. Пробирки с образцами центрифугировали при 2000 об./мин. в течение 1 минуты и клеточные осадки промывали путем ресуспендирования с помощью 1 мл PBA и центрифугирования при 2000 об./мин. в течение 1 минуты. Полученный в результате клеточный осадок затем ресуспендировали с помощью 200 мкл 1% не содержащего метанол формальдегида (MFF). Сразу после окончания окрашивания клеток ЦНС в 96-луночном круглодонном планшете в каждый образец крови добавляли 50 мкл шариков для подсчета и образцы переносили в пустые лунки планшета для регистрации.
Изначально, t-критерий для независимых выборок осуществляли между необработанной группой и обработанной LPS группой для определения изменений популяций клеток, индуцированных заражением LPS. t-критерий для независимых выборок между группой контроля со средой-носителем и каждой обработанной ингибитором CSF-1R группой осуществляли для определения эффекта обработки низкомолекулярным ингибитором на различные популяции клеток.
Как может быть видно на фигуре 19, значительное повышение количества моноцитов/макрофагов и лимфоцитов наблюдали в головном мозге после заражения LPS. Обработка низкомолекулярным ингибитором CSF-1R RA10651967 в концентрации 25 мг/кг значительно снижала количество клеток микроглии и моноцитов/макрофагов по сравнению с контролем со средой-носителем.
В данном исследовании также оценивали маркер активации CD80 популяций клеток микроглии и моноцитов/макрофагов. На фигуре 20 показаны уровни экспрессии по значению средней интенсивности флуоресценции (MFI). Экспрессия CD80 была значительно повышена только на популяции клеток микроглии в головном мозге при заражении LPS. Обработка с помощью RA10651967 значительно повышала экспрессию CD80 на клетках микроглии на 40% по сравнению с контролем со средой-носителем. Это первый случай, когда это произошло в этой модели с низкомолекулярным ингибитором CSF-1R.
В крови введение LPS значительно снижало количество циркулирующих моноцитов, макрофагов и mDC (фигура 21). Как правило, в данной модели, после введения LPS наблюдали значительное увеличение количества mDC. RA10651967 приводил к увеличению всех анализированных популяций циркулирующих клеток по сравнению с контролем со средой-носителем.
Обработка низкомолекулярным ингибитором CSF-1R RA10651967 значительно снижала количество клеток микроглии и моноцитов/макрофагов в головном мозге после заражения LPS по сравнению с контролем со средой-носителем. Неожиданно, экспрессия маркера активации CD80 была значительно повышена на клетках микроглии после обработки данным соединением.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ КОНДЕНСИРОВАННЫХ ГЕТЕРОЦИКЛИЛ-КАРБОНОГИДРАЗОНОИЛДИЦИАНИДОВ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2826002C1 |
| ТРИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ЯНУС-КИНАЗЫ 1, ИХ КОМПОЗИЦИИ, СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2824349C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3K И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2600927C2 |
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-1Н-ИНДЕН-1-ИЛ-2,7-ДИАЗАСПИРО[3.5]НОНАНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ИЛИ ОБРАТНЫХ АГОНИСТОВ ГРЕЛИНОВОГО РЕЦЕПТОРА | 2011 |
|
RU2524341C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2687093C1 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2700004C1 |
| Производные гетероциклического пиразола как ингибиторы рецепторной тирозикиназы типа III | 2020 |
|
RU2833004C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОПИРИДИНИЛ-АМИНОПИРИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ РАКА | 2010 |
|
RU2619463C2 |
| БЕНЗОКСАЗЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2654068C1 |
| ПРОИЗВОДНЫЕ КОНДЕНСИРОВАННОГО 1,4-ДИГИДРОДИОКСИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА ТРАНСКРИПЦИИ 1 БЕЛКОВ ТЕПЛОВОГО ШОКА | 2014 |
|
RU2671979C2 |
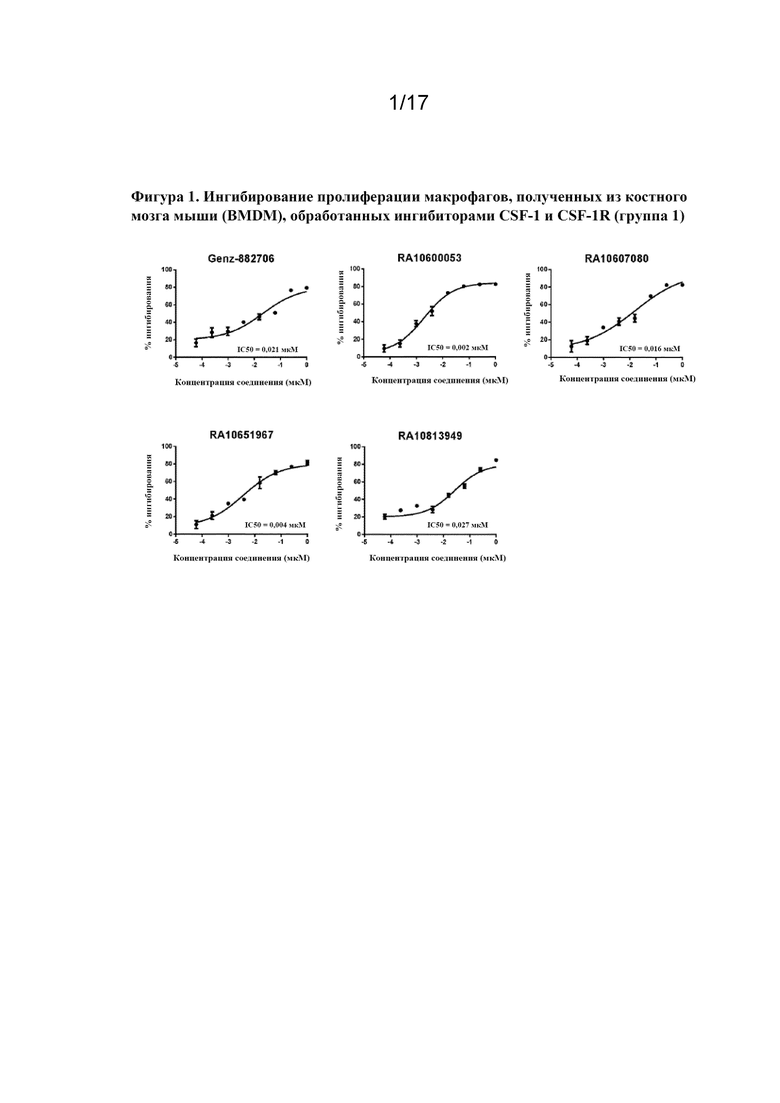
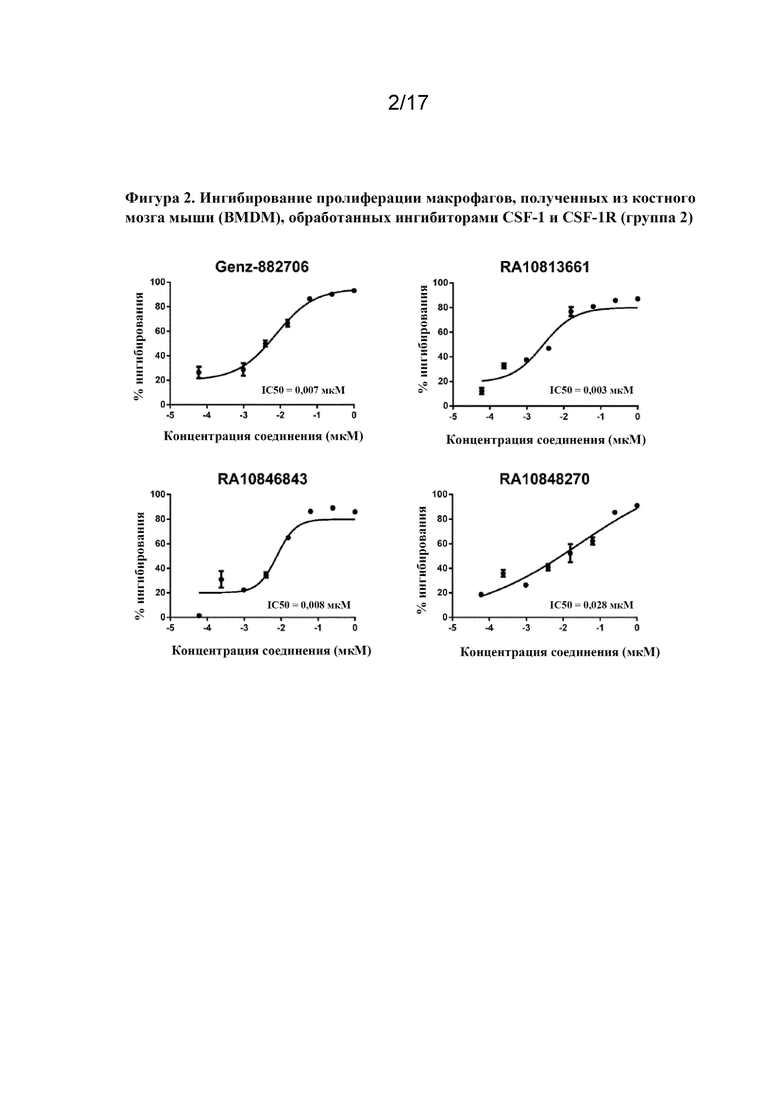
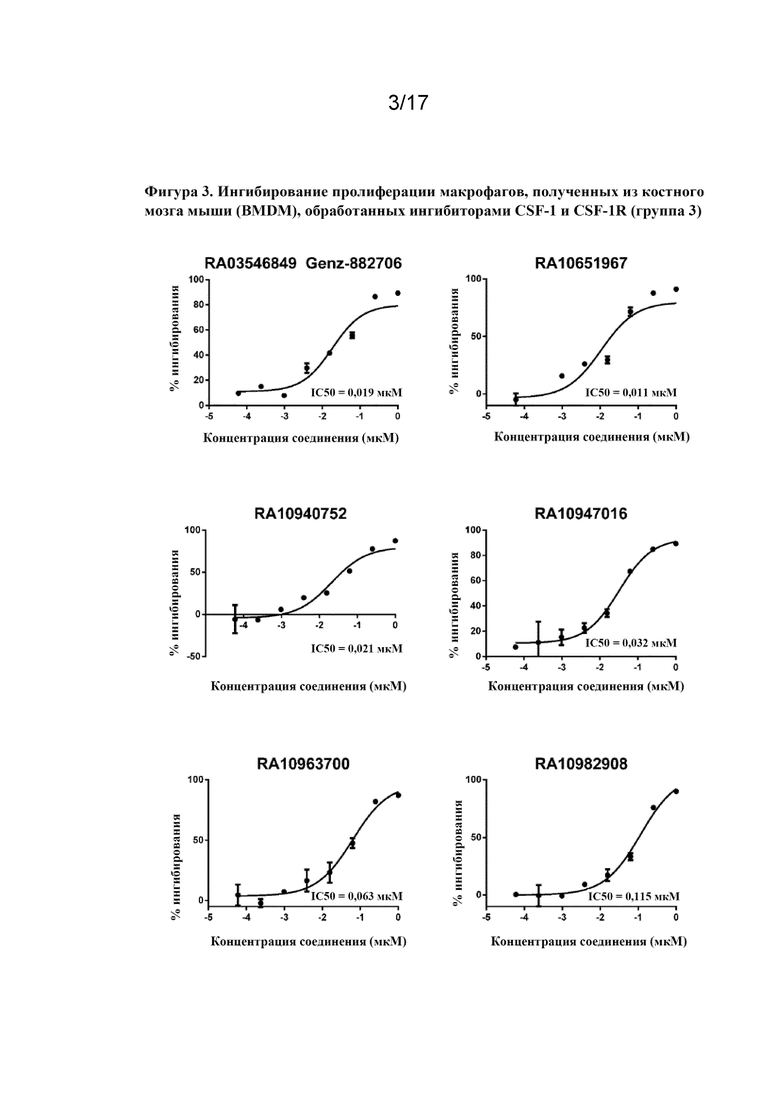
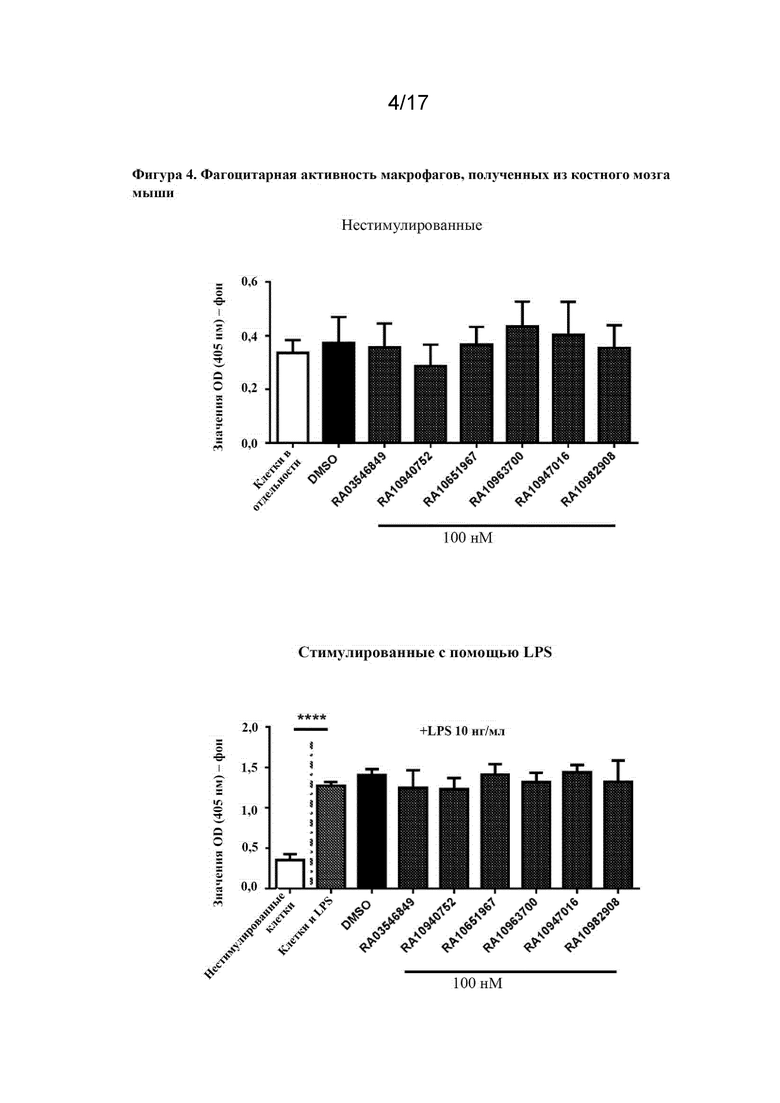
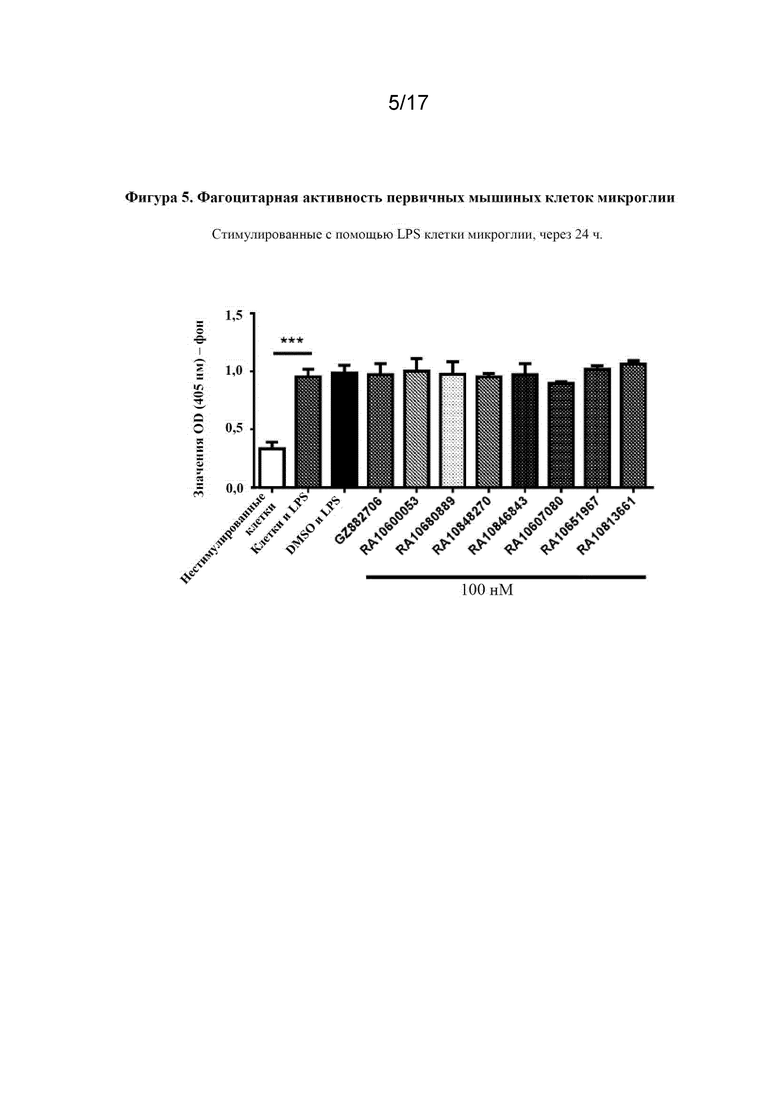
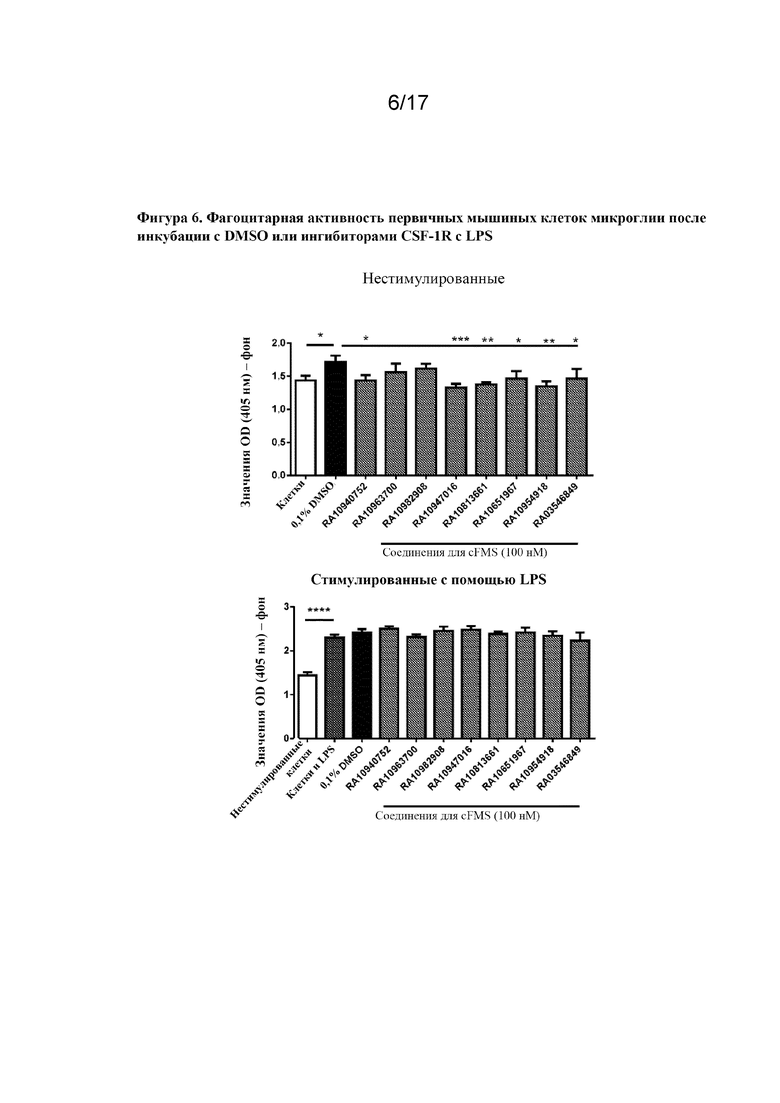
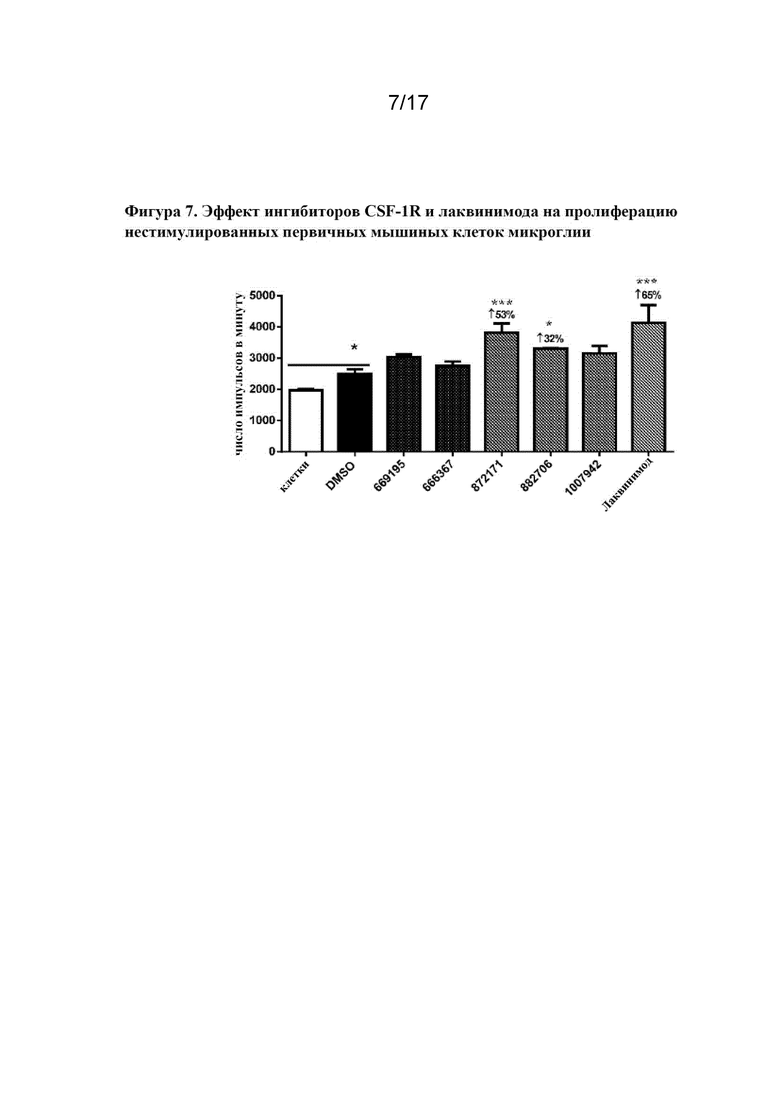

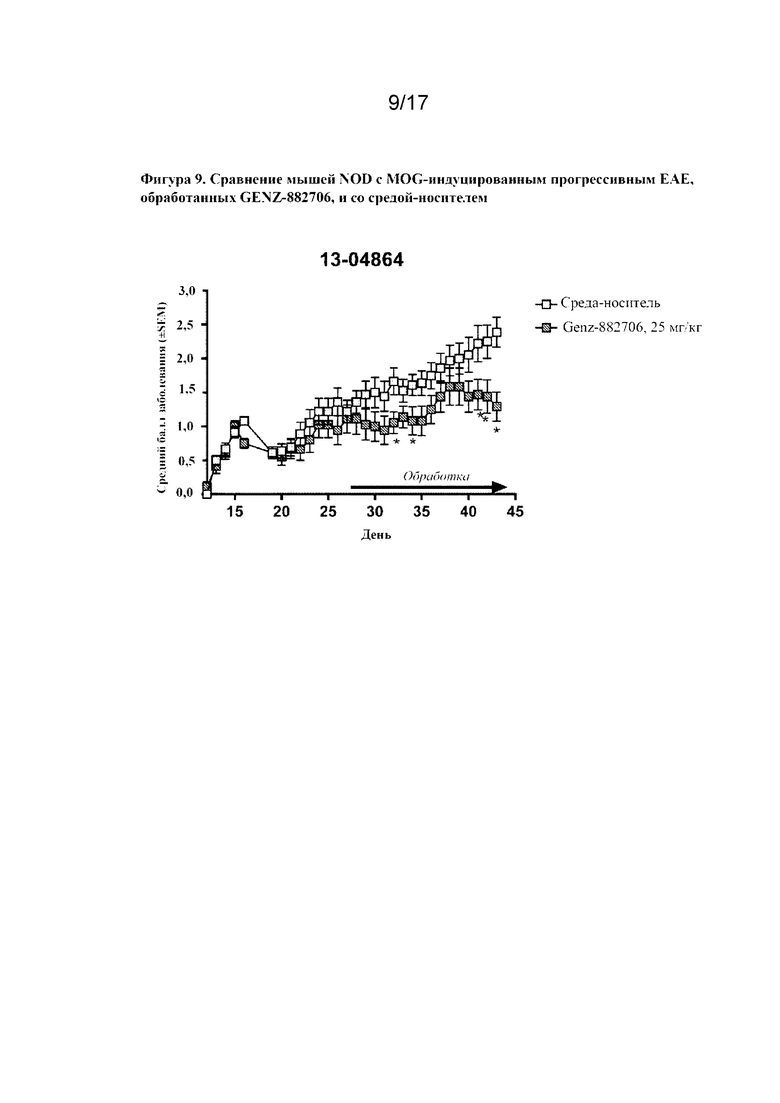
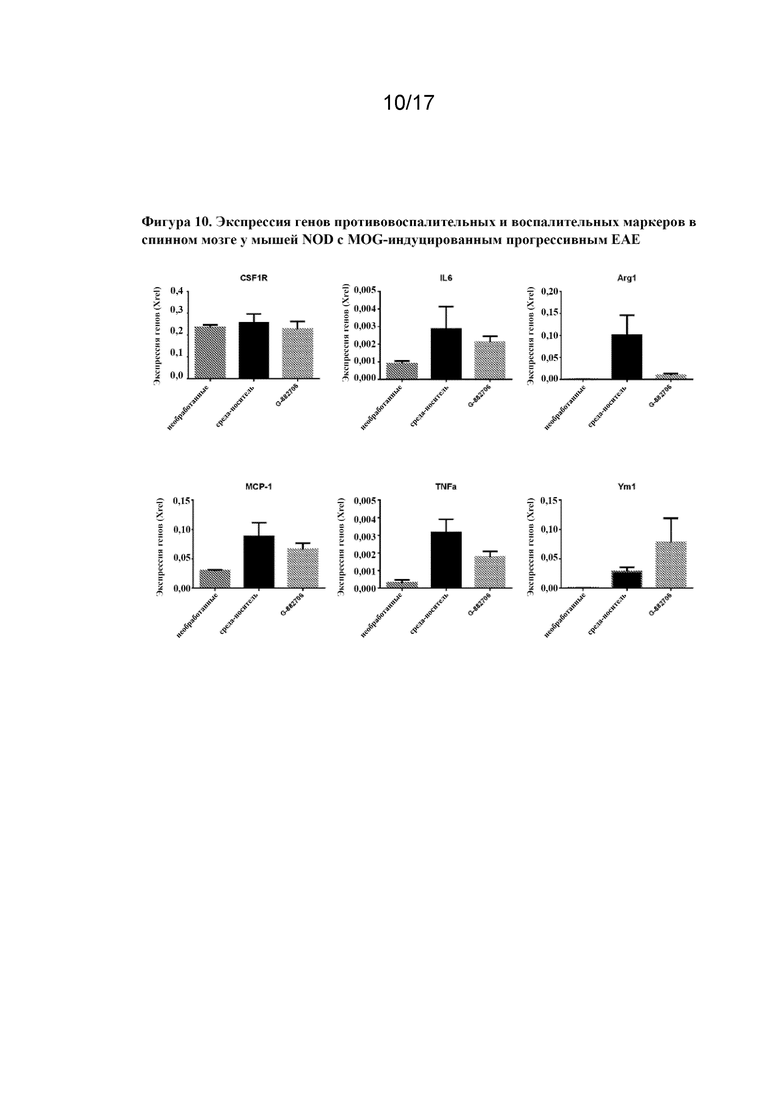
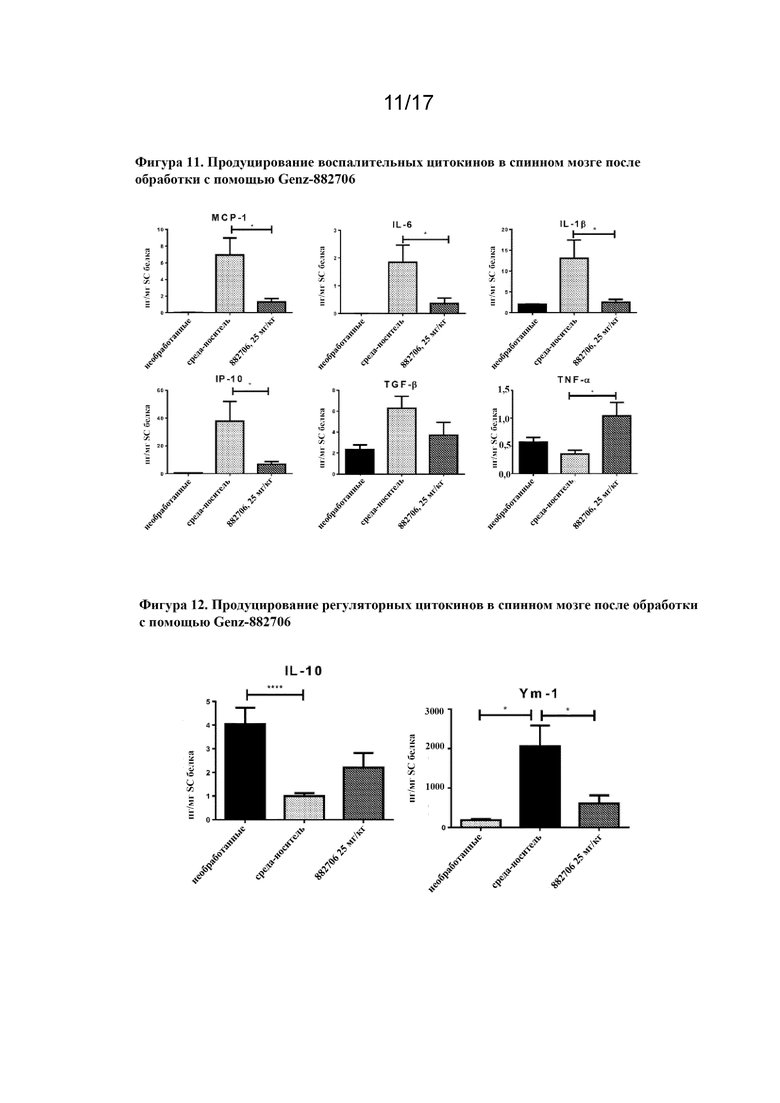
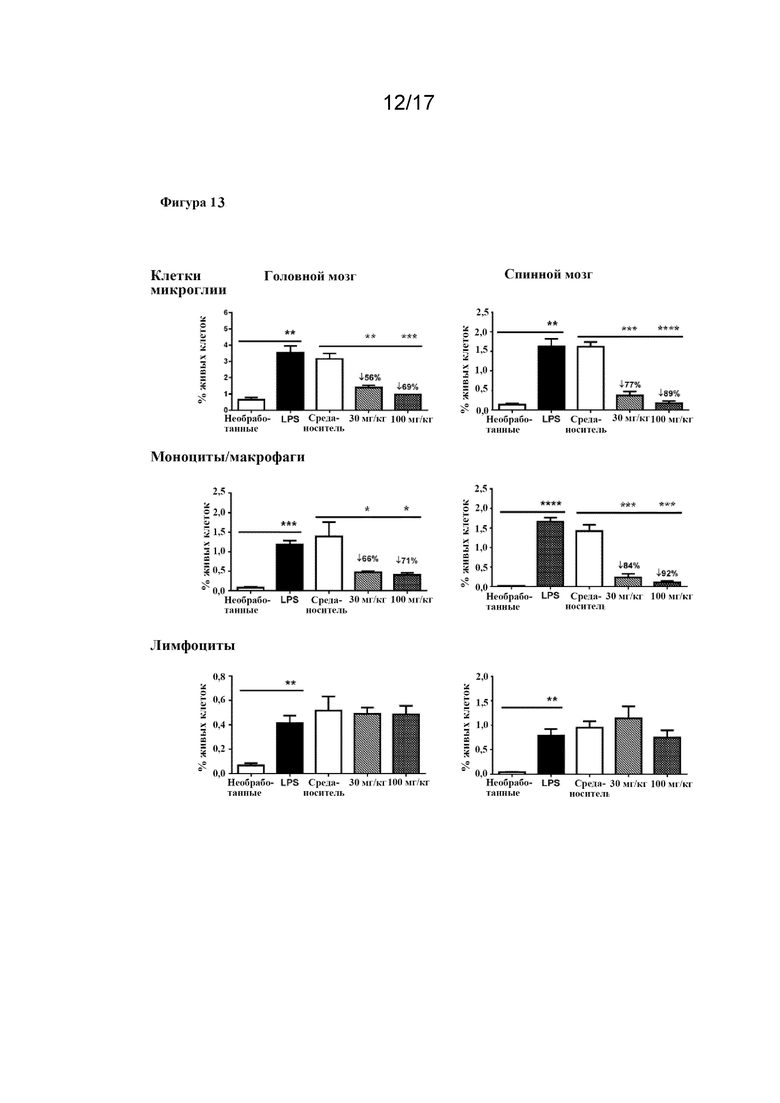

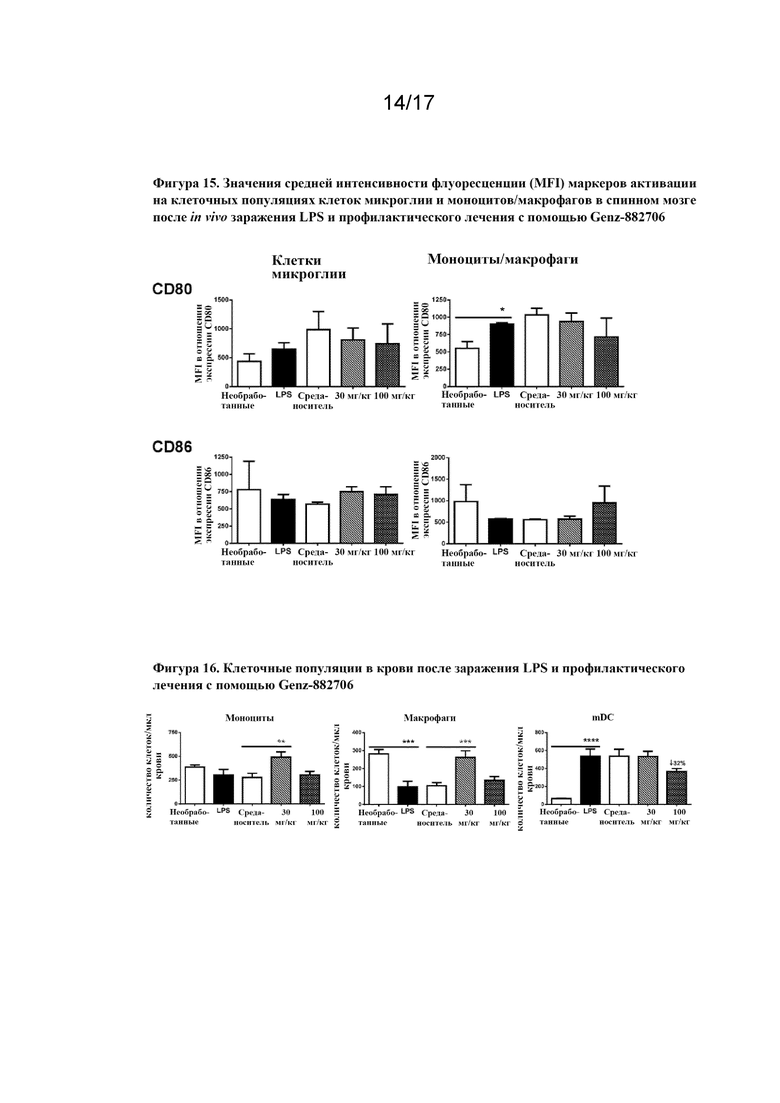
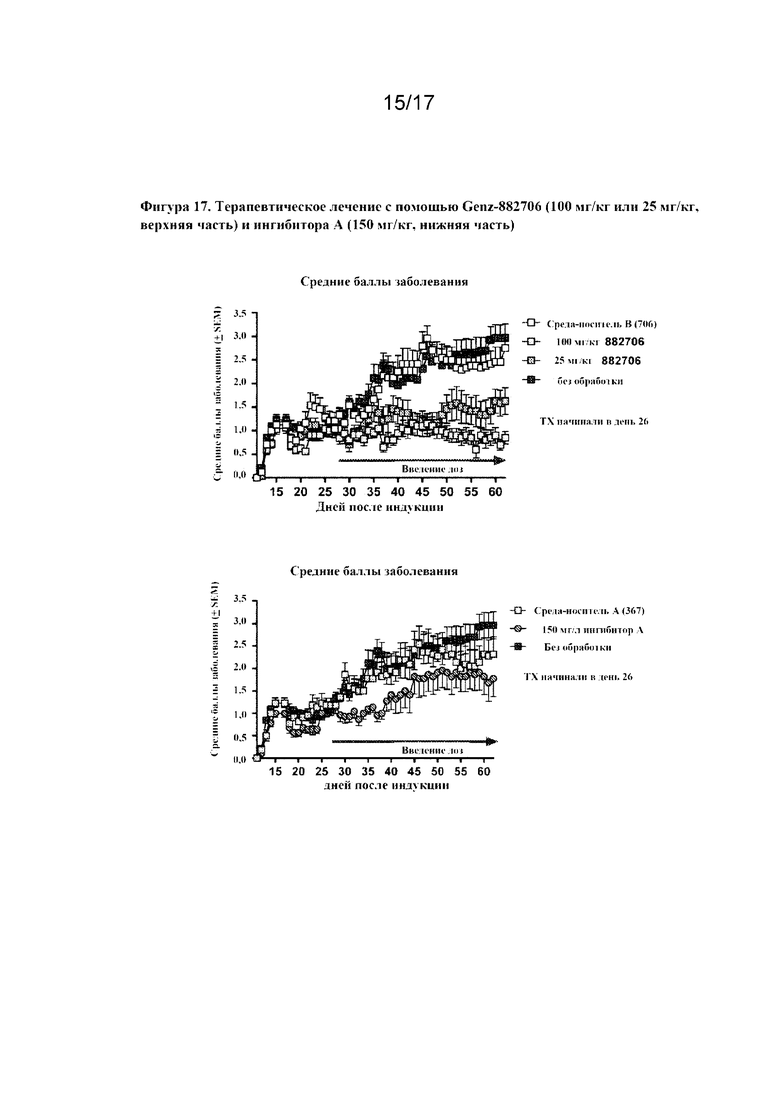
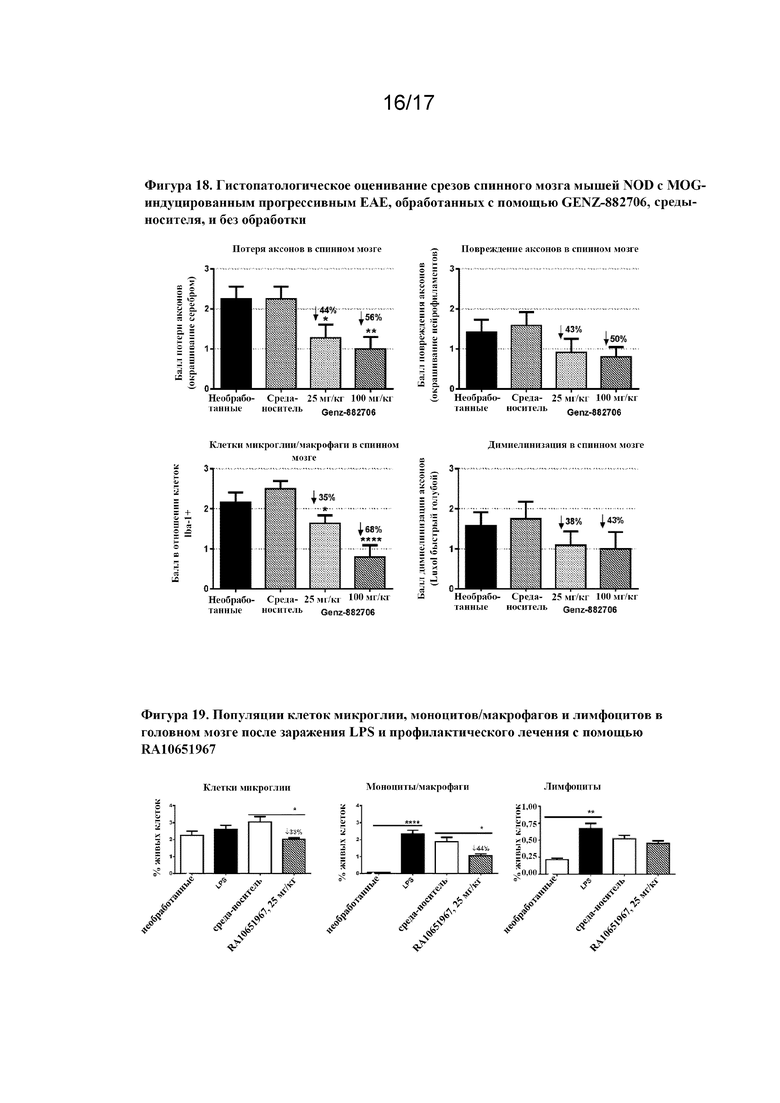
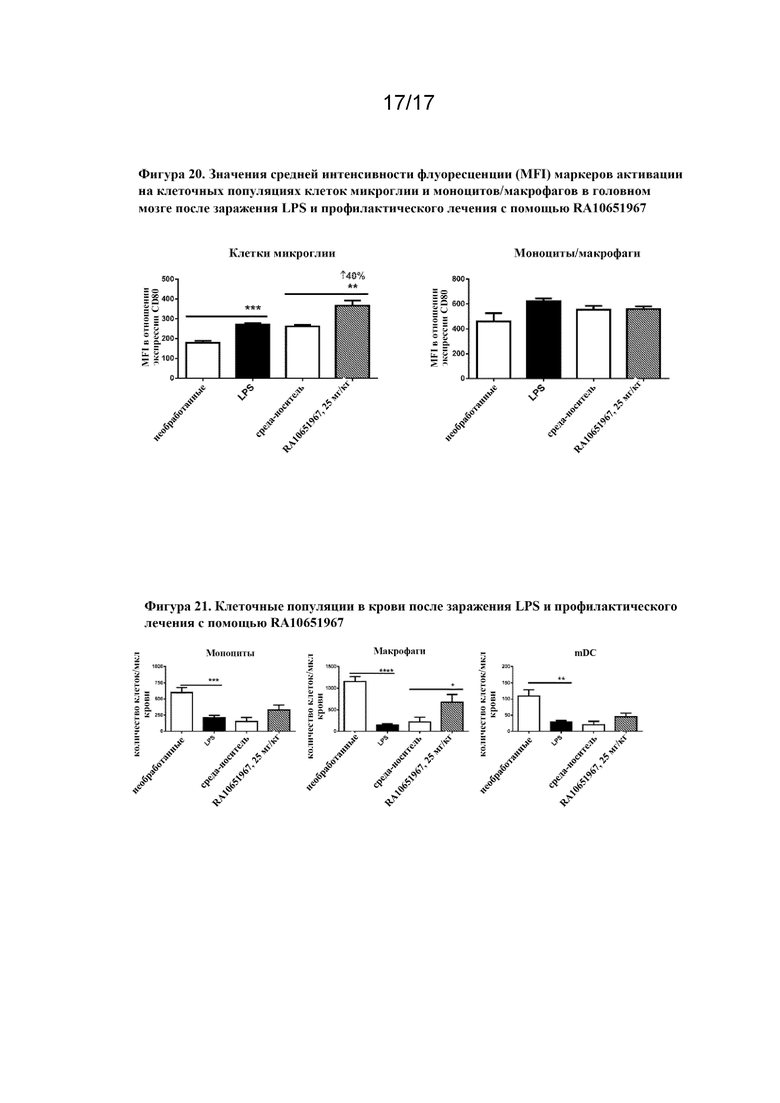
Изобретение относится к соединению, имеющему структуру формулы (VII), или к его фармацевтически приемлемой соли, где пунктирные линии представляют необязательные двойные связи и p равняется 1; n равняется 1; X2 представляет собой N; каждый из X3, X4 и X5 независимо выбран из CR7, где каждый R7 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C3-C5)гетероциклоалкила, что означает неароматическую группу с 4-7 атомами, которые образуют одно кольцо, где 3-5 атомов кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, (C2-C5)гетероарила, в котором от 1 до 3 гетероатомов выбраны из группы, состоящей из атомов азота и кислорода, (C1-C10)алкил-C(O)O-, (C1-C10)алкокси-, (C1-C10)алкокси-(C2-C9)гетероциклоалкила, R8-(C1-C10)алкила-, R8-(C3-C4)гетероциклоалкила, что означает неароматическую группу с 4-6 атомами, которые образуют одно кольцо, где 3-4 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота, моноциклического R8-(C2-C9)гетероарила, в котором 1-3 гетероатома выбраны из группы, состоящей из атомов азота и кислорода, R8-(C2-C10)алкинила, R8-C(O)-, R8-(C1-C10)алкокси-, (C3)гетероциклоалкил-O-, что означает неароматическую группу с 4 атомами, которые образуют одно кольцо, где 3 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из кислорода, R8-(C2-C9)гетероциклоалкил-O-, что означает неароматическую группу с 4 атомами, которые образуют одно кольцо, где 3 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-; где каждый R8 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C5)гетероциклоалкила, что означает неароматическую группу из 4-6 атомов, которые образуют одно кольцо, где 3-5 атомов кольца являются атомами углерода, а остальные атомы кольца выбраны из атомов азота, (C1-C10)алкил-C(O)O-, (C1-C10)алкокси-, HO-, галогена, (CH3)2N- и H2N-; где каждый (C2-C9)гетероарил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, HO-, галогена или H2N-; каждый из T1, T2 и T3 независимо выбран из CR10, где каждый R10 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси-, HO-, галогена; где каждый (C1-C10)алкил и (C3-C10)циклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси-, HO-, галогена или H2N-; Y1 представляет собой O; R1 и R2 независимо выбраны из группы, состоящей из H, (C1-C10)алкила, (C1-C10)алкокси- и HO-; R5 отсутствует или выбран из группы, состоящей из H, (C1-C10)алкила и (C3-C10)циклоалкила, при этом когда пунктирные линии на Y1 представляют собой двойную связь, то R5 отсутствует; и R6 выбран из группы, состоящей из (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, R14-(C3-C10)циклоалкила, R14-(C6)арила, R14-(C3-C7)гетероарила, в котором от 1 до 2 гетероатомов выбраны из группы, состоящей из атомов азота, серы и кислорода, и R14-(C1-C10)алкиламина; где каждый R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C6)гетероциклоалкила, что означает неароматическую группу с 6 атомами, которые образуют одно кольцо, в котором 4 атома кольца представляют собой атомы углерода, а остальные из атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкокси-, F2HC-O-, галогена, (CH3)2N-, F3C-C(O)-, F3C- и F2HC-; где каждый (C1-C10)алкил, (C6)арил или (C3-C10)циклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила или галогена; и каждый из Z1 независимо выбран из H, галогена и (C1-C10)алкила; Y2 представляет собой O, S, NR17 или CR17R18, где R17 отсутствует или каждый из R17 и R18 независимо выбран из H или (C1-C10)алкила. Изобретение также относится к фармацевтической композиции на основе указанных соединений в качестве ингибитора рецептора колониестимулирующего фактора-1 (CSF-1R. Технический результат – получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения рассеянного склероза, бокового амиотрофического склероза, болезни Хантингтона, волчанки, люпус-нефрита и ревматоидного артрита. 6 н. и 11 з.п. ф-лы, 21 ил., 6 табл., 3 пр.
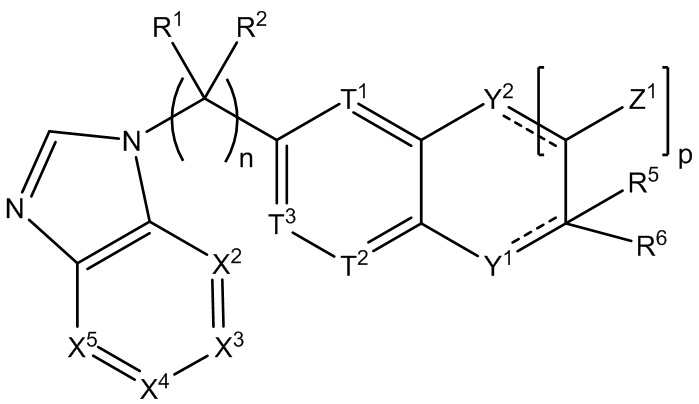 (VII)
(VII)
1. Соединение, характеризующееся структурой формулы (VII):
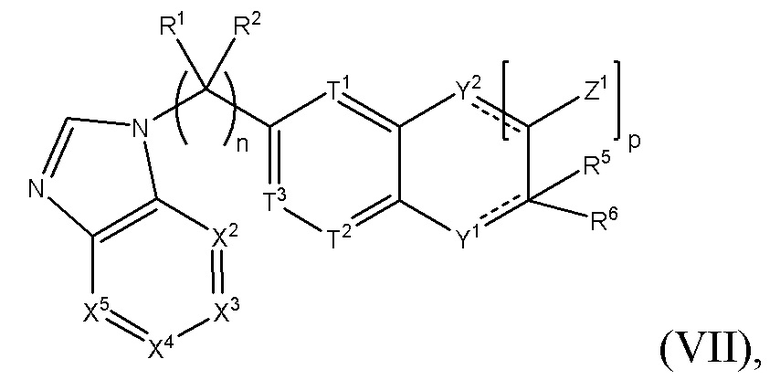
или его фармацевтически приемлемая соль, где
пунктирные линии представляют необязательные двойные связи, и
p равняется 1;
n равняется 1;
X2 представляет собой N;
каждый из X3, X4 и X5 независимо выбран из CR7,
где каждый R7 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C3-C5)гетероциклоалкила, что означает неароматическую группу с 4-7 атомами, которые образуют одно кольцо, где 3-5 атомов кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, (C2-C5)гетероарила, в котором от 1 до 3 гетероатомов выбраны из группы, состоящей из атомов азота и кислорода, (C1-C10)алкил-C(O)O-, (C1-C10)алкокси-, (C1-C10)алкокси-(C2-C9)гетероциклоалкила, R8-(C1-C10)алкила-, R8-(C3-C4)гетероциклоалкила, что означает неароматическую группу с 4-6 атомами, которые образуют одно кольцо, где 3-4 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота, моноциклического R8-(C2-C9)гетероарила, в котором 1-3 гетероатома выбраны из группы, состоящей из атомов азота и кислорода, R8-(C2-C10)алкинила, R8-C(O)-, R8-(C1-C10)алкокси-, (C3)гетероциклоалкил-O-, что означает неароматическую группу с 4 атомами, которые образуют одно кольцо, где 3 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из кислорода, R8-(C2-C9)гетероциклоалкил-O-, что означает неароматическую группу с 4 атомами, которые образуют одно кольцо, где 3 атома кольца являются атомами углерода, а остальные атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, галогена, циано, H2N-, (CH3)HN-, (CH3)2N-, F3C-, F2HC-, CH3F2C-, FH2C-, CH3FHC-, (CH3)2FC-;
где каждый R8 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C5)гетероциклоалкила, что означает неароматическую группу из 4-6 атомов, которые образуют одно кольцо, где 3-5 атомов кольца являются атомами углерода, а остальные атомы кольца выбраны из атомов азота, (C1-C10)алкил-C(O)O-, (C1-C10)алкокси-, HO-, галогена, (CH3)2N- и H2N-;
где каждый (C2-C9)гетероарил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, HO-, галогена или H2N-;
каждый из T1, T2 и T3 независимо выбран из CR10,
где каждый R10 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси-, HO-, галогена;
где каждый (C1-C10)алкил и (C3-C10)циклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси-, HO-, галогена или H2N-;
Y1 представляет собой O;
R1 и R2 независимо выбраны из группы, состоящей из H, (C1-C10)алкила, (C1-C10)алкокси- и HO-;
R5 отсутствует или выбран из группы, состоящей из H, (C1-C10)алкила и (C3-C10)циклоалкила, при этом когда пунктирные линии на Y1 представляют собой двойную связь, то R5 отсутствует; и
R6 выбран из группы, состоящей из (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, R14-(C3-C10)циклоалкила, R14-(C6)арила, R14-(C3-C7)гетероарила, в котором от 1 до 2 гетероатомов выбраны из группы, состоящей из атомов азота, серы и кислорода, и R14-(C1-C10)алкиламина;
где каждый R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C6)гетероциклоалкила, что означает неароматическую группу с 6 атомами, которые образуют одно кольцо, в котором 4 атома кольца представляют собой атомы углерода, а остальные из атомы кольца выбраны из группы, состоящей из атомов азота и кислорода, (C1-C10)алкиламина, ((C1-C10)алкил)2амина, (C1-C10)алкокси-, F2HC-O-, галогена, (CH3)2N-, F3C-C(O)-, F3C- и F2HC-;
где каждый (C1-C10)алкил, (C6)арил или (C3-C10)циклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила или галогена; и
каждый из Z1 независимо выбран из H, галогена и (C1-C10)алкила;
Y2 представляет собой O, S, NR17 или CR17R18,
где R17 отсутствует или каждый из R17 и R18 независимо выбран из H или (C1-C10)алкила.
2. Соединение по п. 1, где каждый R1 и R2 независимо выбран из H, (C1-C10)алкила и (C1-C10)алкокси-.
3. Соединение по п. 1 или 2, где Y2 представляет собой O или CR17R18.
4. Соединение по п. 1 или 2, где Y2 представляет собой O.
5. Соединение по любому из пп. 1-4, где R10 выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкокси и галогена.
6. Соединение по любому из пп. 1-3, где T1 представляет собой CR10, где R10 представляет собой H, T2 представляет собой CR10, где R10 представляет собой (C1-C10)алкил и T3 представляет собой CR10, где R10 представляет собой H.
7. Соединение по любому из пп. 1-6, где
Z1 представляет собой H, галоген или (C1-C10)алкил;
Y1 представляет собой O;
Y2 представляет собой O;
R5 представляет собой H; и
R6 представляет собой R14-(C3-C7)гетероарил.
8. Соединение по любому из пп. 1-6, где каждый Z1 независимо выбран из H и (C1-C10)алкила.
9. Соединение по любому из пп. 1-8, где каждый R7 независимо выбран из H, (C3-C5)гетероциклоалкила, (C2-C5)гетероарила, (C1-C10)алкокси-, (C2-C9)гетероциклоалкил-(C1-C10)алкокси-, (C1-C10)алкокси-(C2-C9)гетероциклоалкила- или F2HC-, где каждый (C1-C10)алкил, (C2-C9)гетероарил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила.
10. Соединение по любому из пп. 1-9, где R5 выбран из группы, состоящей из H и (C1-C10)алкила.
11. Соединение по любому из пп. 1-10, где R6 выбран из группы, состоящей из (C1-C10)алкила, (C3-C10)циклоалкила, R14-(C6)арила, R14-(C3-C7)гетероарила и R14-(C1-C10)алкиламина; где каждый R14 независимо выбран из группы, состоящей из H, (C1-C10)алкила, (C3-C10)циклоалкила, (C1-C10)алкиламина, (C1-C10)алкокси-, F2HC-O-, F3C-C(O)-, F3C- и F2HC-; и где каждый (C1-C10)алкил, (C3-C10)циклоалкил или (C2-C9)гетероциклоалкил дополнительно необязательно замещен одной-двумя группами, выбранными из (C1-C10)алкила, (C3-C10)циклоалкила, (C2-C9)гетероциклоалкила, (C6-C14)арила, (C2-C9)гетероарила, HO-, галогена или H2N-.
12. Соединение, выбранное из группы, состоящей из:
4-(1-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазол-5-ил)-2-метилбут-3-ин-2-амина,
4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(S)-4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(R)-4-(3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(S)-4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(R)-4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-карбонитрила,
6-(азетидин-1-ил)-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-циклопропил-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
6-метокси-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(4-метоксифенил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
6-метокси-3-((2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(2,4-дихлорфенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
2,2,2-трифтор-N-((6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)метил)ацетамида,
6-(3-метоксиазетидин-1-ил)-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
2-метил-4-(3-((2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бут--3-ин-2-амина,
4-(3-(1-(2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)этил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((2-(4-(дифторметокси)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-(1,3-диметил-1H-пиразол-4-ил)-3-((2-(2-фтор-4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиридина,
4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина,
N-этил-4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида,
4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиколинамида,
4-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метилпиколинамида,
2,2,2-трифторацетата 2-(1-метил-1H-пиразол-4-ил)-4-((2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиридина,
5-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиримидин-2,4-диамина,
4-(3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
гидрохлорида 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина,
2,2,2-трифторацетата 3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-йод-3H-имидазо[4,5-b]пиридина,
2,2,2-трифторацетата 6-циклопропил-3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-5-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((5-циклопропил-8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
2,2,2-трифторацетата 4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-5,7-диметил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-метоксиимидазо[1,2-a]пиридина,
6-бром-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метоксипиразолo[1,5-a]пиримидина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
7-хлор-3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина,
3-((8-фтор-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразолo[1,5-a]пиридина,
4-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-(1-метил-1H-пиразол-4-ил)пиридина,
3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-4-ил)пиридина,
3-((8-фтор-2-(4-(трифторметил)фенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-(1-метил-1H-пиразол-3-ил)пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(S)-4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
(R)-4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
6-циклопропил-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-ола,
6-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-окса-6-азаспиро[3.3]гептана,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксипроп-1-ин-1-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)изоксазола,
6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
6-(азетидин-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
2-((3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)окси)-N,N-диметилэтан-1-амина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(оксетан-3-илокси)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N,N-диметил-3H-имидазо[4,5-b]пиридин-6-амина,
1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-ола,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1H-1,2,4-триазол-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1H-пиразол-1-ил)-3H-имидазо[4,5-b]пиридина,
6-(1H-имидазол-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
6-(2,4-диметил-1H-имидазол-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метил-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-амина,
6-(1,3-диметил-1H-пиразол-4-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-(6-фторпиридин-3-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-3-ола,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-амина,
6-(3-фторазетидин-1-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-фтор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
(S)-азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
(R)-азетидин-1-ил(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанона,
(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(метоксиметил)-3H-имидазо[4,5-b]пиридина,
6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-6-(дифторметил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-2-метил-3H-имидазо[4,5-b]пиридина,
2,2,2-трифторацетата 6-(азетидин-3-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
5,6-диметокси-1-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола,
формиата 6-(1H-имидазол-2-ил)-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(4-метил-1H-имидазол-2-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2R,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2R,3R)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2S,3R)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-(((2S,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-(((2R,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7H-имидазо[4,5-c]пиридазина,
6-бром-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразолo[1,5-a]пиримидина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидин-6-ил)морфолина,
6-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)пиразолo[1,5-a]пиримидина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)пиразолo[1,5-a]пиримидина,
7-хлор-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)морфолина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина,
7-метокси-3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина,
3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
1-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-бензо[d]имидазола,
3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5-метил-3H-имидазо[4,5-b]пиридина,
1-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-имидазо[4,5-c]пиридина,
3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-a]пиразина,
9-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-9H-пурина,
3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина,
(3-((2-(6-циклопропилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола,
4-(3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
гидрохлорида 3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
1-(3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-3-ола,
3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина,
3-((8-метокси-2-(6-пропилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-((1-метилазетидин-3-ил)окси)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метоксипиразолo[1,5-a]пиримидина,
3-((2-(6-этилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)пиразолo[1,5-a]пиримидина,
3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(трифторметил)-3H-имидазо[4,5-b]пиридина,
3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(4,6-диметилпиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-метокси-2-(4-метоксифенил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина,
гидрохлорида 6-бром-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
гидрохлорида 3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
1-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-N,N-диметилазетидин-3-амина,
3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-N-метил-3H-имидазо[4,5-b]пиридин-6-амина,
7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина,
1-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-3-метилазетидин-3-ола,
3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазина,
7-хлор-3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)(метокси)метил)имидазо[1,2-b]пиридазина,
4-(3-((2-(4-(дифторметокси)фенил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
6-(1H-имидазол-1-ил)-3-((8-метокси-2-(пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(2-метилтиазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(6-((6-(3-(1H-имидазол-1-ил)проп-1-ин-1-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-метилтиазола,
4-(3-((8-метокси-2-(2-метилтиазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
4-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2-циклопропилтиазола,
4-(3-((2-(2-циклопропилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
2-циклопропил-4-(8-метокси-6-((6-метокси-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2,3-дигидробензо[b][1,4]диоксин-2-ил)тиазола,
4-(3-((2-(2,5-диметилтиазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(2-метилоксазол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((2-(2,5-диметилоксазол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-(2-метоксиэтокси)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
(3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола,
3-((2-(6-этоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина,
3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
1-(3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3-метилазетидин-3-ола,
3-((2-(6-(дифторметокси)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
формиата 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридина,
формиата 3-((8-метокси-2-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-(пиперидин-4-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-имидазол-4-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-циклопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
формиата 3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-изопропил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-3,5-диметилизоксазола,
3-((2-циклопропил-8-метокси-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-(дифторметил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(2-циклопропилпиримидин-5-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метокси-2-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-7-(3-метоксиазетидин-1-ил)имидазо[1,2-b]пиридазина,
3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(2,6-диметоксипиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-3-((8-метокси-2-(6-(трифторметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метокси-4-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-N,N-диэтилпиридин-2-амина,
4-(5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)пиридин-2-ил)морфолина,
3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(1-изопропил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(5-метоксипиразин-2-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(2-метоксипиримидин-5-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(R)-3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(S)-3-((2-(6-(1,1-дифторэтил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)фуро[2,3-b]пиридина,
5-(6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-2-ил)-2,3-дигидрофуро[2,3-b]пиридина,
3-((2-(1-(циклопропилметил)-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(4,4-дифторциклогексил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(1-(2-метоксиэтил)-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-бут-ил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-(1,5-диметил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(1,3-диметил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(1-(циклопропилметил)-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
6-метокси-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((2-бут-ил-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-метокси-3H-имидазо[4,5-b]пиридина,
6-(азетидин-1-ил)-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(3-метоксиазетидин-1-ил)-3H-имидазо[4,5-b]пиридина,
6-циклопропил-3-((8-метокси-2-(1-метил-1H-пиразол-4-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-циклопропил-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
6-(дифторметил)-3-((8-метокси-2-(6-(метоксиметил)пиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
(3-((2-(1-циклобутил-1H-пиразол-4-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)метанола,
3-((8-метокси-2-(6-метилпиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-6-(трифторметил)-3H-имидазо[4,5-b]пиридина,
1-(3-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)азетидин-2-она,
7-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-5H-пирроло[2,3-b]пиразина,
4-((8-метокси-2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-1H-пирроло[2,3-b]пиридина,
4-(3-((2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(4-метоксифенил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
6-фтор-3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразолo[1,5-a]пиримидин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразолo[1,5-a]пиримидин-6-ил)морфолина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)пиразолo[1,5-a]пиримидина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразолo[1,5-a]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)пиразолo[1,5-a]пиридин-6-ил)морфолина,
3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)пиразолo[1,5-a]пиридина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)имидазо[1,2-b]пиридазин-7-ил)морфолина,
4-(3-((8-фтор-2-(6-метоксипиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
6-циклопропил-3-((8-метокси-2-(6-метилпиридин-3-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
3-((2-(6-этилпиридин-3-ил)-8-метоксихроман-6-ил)метил)-6-(2-метил-1H-имидазол-1-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-((8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((8-метокси-2-(2-метилтиазол-4-ил)хроман-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)морфолина,
2-метил-4-(3-((4-метил-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)бут--3-ин-2-амина,
4-метил-6-((6-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-3-ил)метил)-2-(4-(трифторметил)фенил)-3,4-дигидро-2H-бензо[b][1,4]оксазина,
6-бром-3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-(3-((2-(6-метоксипиридин-3-ил)-2,3-дигидробензо[b][1,4]оксатиин-6-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(пиперидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина,
3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(пирролидин-3-илэтинил)-3H-имидазо[4,5-b]пиридина,
3-(3-метокси-4-((6-метоксипиридин-3-ил)метокси)бензил)-6-(4-метилпиперазин-1-ил)-3H-имидазо[4,5-b]пиридина,
4-(3-(3-метокси-4-((6-метилпиридин-3-ил)метокси)бензил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
4-(3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)-3H-имидазо[4,5-b]пиридин-6-ил)-2-метилбут-3-ин-2-амина,
3-((5-этокси-6-((6-метилпиридин-3-ил)метокси)пиридин-3-ил)метил)пиразолo[1,5-a]пиримидина,
3-((5-этокси-6-((6-(трифторметил)пиридин-3-ил)метокси)пиридин-3-ил)метил)-N,N-диметилимидазо[1,2-b]пиридазин-7-карбоксамида,
4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)метил)-N-метилпиколинамида,
6-((3H-имидазо[4,5-b]пиридин-3-ил)метил)-4-метокси-2-((6-метоксипиридин-3-ил)метил)бензо[d]оксазола,
3-((2-(6-(2-фторпропан-2-ил)пиридин-3-ил)-8-метокси-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина,
4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-этоксипиридин-3-ил)окси)-N-метилпиколинамида, и
4-((6-((6-циклопропилпиридин-3-ил)метокси)-5-фторпиридин-3-ил)окси)-N-метилпиколинамида.
13. Соединение, выбранное из 3-((8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридина и/или его фармацевтически приемлемых солей.
14. Соединение по п. 13, которое представляет собой 3-(((2S,3S)-8-метокси-2-(6-метоксипиридин-3-ил)-3-метил-2,3-дигидробензо[b][1,4]диоксин-6-ил)метил)-3H-имидазо[4,5-b]пиридин.
15. Фармацевтическая композиция, содержащая эффективное количество соединения и/или его фармацевтически приемлемой соли по любому из пп. 1-14 в качестве ингибитора CSF-1R и фармацевтически приемлемый наполнитель.
16. Применение соединения по любому из пп.1-14, где соединение предназначено для изготовления лекарственного средства, ингибирующего CSF-1R.
17. Применение соединения по любому из пп. 1-14, где соединение предназначено для изготовления лекарственного средства для лечения заболевания или расстройства, связанного с CSF-1R, выбранного из рассеянного склероза, бокового амиотрофического склероза (ALS), болезни Хантингтона, волчанки, люпус-нефрита и ревматоидного артрита.
| WO 2015089139 A1, 18.06.2015 | |||
| US 20030114468 A1, 19.06.2003 | |||
| WO 2011156632 A2, 15.12.2011 | |||
| US 20110166174 A1, 07.07.2011 | |||
| WO 2008130951 A1, 30.10.2008 | |||
| WO 2002092575 A1, 21.11.2002 | |||
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ КОЭФФИЦИЕНТА ДЕФОРМАТИВНОЙ УСТОЙЧИВОСТИ АСФАЛЬТОВОГО БЕТОНА | 0 |
|
SU186190A1 |
| US 6130333 A1, 10.10.2000 | |||
| АВТОМАТИЧЕСКАЯ ТЕЛЕФОННАЯ СТАНЦИЯ | 1927 |
|
SU7157A1 |
Авторы
Даты
2021-06-01—Публикация
2016-07-19—Подача